Antimon
 | |||||||||||||||||||||
| Görünüş | Gümüşi parlak gri | ||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Standart atom ağırlığı Ar, std(Sb) | 121,760(1) | ||||||||||||||||||||
| Periyodik tablodaki yeri | |||||||||||||||||||||
| |||||||||||||||||||||
| Atom numarası (Z) | 51 | ||||||||||||||||||||
| Grup | 15. grup (azot grubu) | ||||||||||||||||||||
| Periyot | 5. periyot | ||||||||||||||||||||
| Blok | p bloku | ||||||||||||||||||||
| Elektron dizilimi | [Kr] 4d10 5s2 5p3 | ||||||||||||||||||||
| Kabuk başına elektron | 2, 8, 18, 18, 5 | ||||||||||||||||||||
| Fiziksel özellikler | |||||||||||||||||||||
| Faz (SSB'de) | Katı | ||||||||||||||||||||
| Erime noktası | 903,78 K (630,63 °C, 1167,13 °F) | ||||||||||||||||||||
| Kaynama noktası | 1908 K (1635 °C; 2975 °F) | ||||||||||||||||||||
| Yoğunluk (OS) | 6,697 g/cm3 | ||||||||||||||||||||
| sıvıyken (en'de) | 6,53 g/cm3 | ||||||||||||||||||||
| Erime entalpisi | 19,79 kJ/mol | ||||||||||||||||||||
| Buharlaşma entalpisi | 193,43 kJ/mol | ||||||||||||||||||||
| Molar ısı kapasitesi | 25,23 J/(mol·K) | ||||||||||||||||||||
Buhar basıncı
| |||||||||||||||||||||
| Atom özellikleri | |||||||||||||||||||||
| Yükseltgenme durumları | -3, -2, -1, 0,[1] +1, +2, +3, +4, +5 (amfoter oksit) | ||||||||||||||||||||
| Elektronegatiflik | Pauling ölçeği: 2,05 | ||||||||||||||||||||
| İyonlaşma enerjileri |
| ||||||||||||||||||||
| Atom yarıçapı | Deneysel: 140 pm | ||||||||||||||||||||
| Kovalent yarıçapı | 139±5 pm | ||||||||||||||||||||
| Van der Waals yarıçapı | 206 pm | ||||||||||||||||||||
| Diğer özellikleri | |||||||||||||||||||||
| Kristal yapı | Rombohedral | ||||||||||||||||||||
| Ses hızı çubukta | 3420 m/s (20 °C'de) | ||||||||||||||||||||
| Genleşme | 11 µm/(m·K) (25 °C'de) | ||||||||||||||||||||
| Isı iletkenliği | 24,4 W/(m·K) | ||||||||||||||||||||
| Elektrik direnci | 417 Ω·m (20 °C'de) | ||||||||||||||||||||
| Manyetik düzen | Diyamanyetik[2] | ||||||||||||||||||||
| Manyetik alınganlık | -99,0·10-6 cm3/mol[3] | ||||||||||||||||||||
| Young modülü | 55 GPa | ||||||||||||||||||||
| Kayma modülü | 20 GPa | ||||||||||||||||||||
| Hacim modülü | 42 GPa | ||||||||||||||||||||
| Mohs sertliği | 3,0 | ||||||||||||||||||||
| Brinell sertliği | 294-384 MPa | ||||||||||||||||||||
| CAS Numarası | 7440-36-0 | ||||||||||||||||||||
| Tarihi | |||||||||||||||||||||
| Keşif | Arap simyagerler (815 öncesi) | ||||||||||||||||||||
| Ana izotopları | |||||||||||||||||||||
| |||||||||||||||||||||
Antimon, sembolü Sb (Latince: stibiumʼdan) ve atom numarası 51 olan kimyasal elementtir. Parlak gri bir metaloid, doğada esas olarak bir kükürt minerali olan stibnit (Sb2S3) olarak bulunur. Antimon bileşikleri eski zamanlardan beri bilinmektedir ve genellikle ilaç ve kozmetik olarak kullanılmak üzere toz haline getirilmiştir. Metalik antimon da biliniyordu, ancak keşfinde yanlış olarak kurşun olarak tanımlandı. Batıda metalin bilinen en eski açıklaması 1540 yılında Vannoccio Biringuccio tarafından yazılmıştır.
Bir süredir Çin, en büyük antimon ve bileşikleri üreticisi oldu ve çoğu üretim Hunan'daki Xikuangshan Madeni'nden geliyor. Antimonun rafine edilmesi için endüstriyel yöntemler, kavurma ve karbon ile indirgeme veya stibnitin demir ile doğrudan indirgenmesidir.
Metalik antimon için en büyük uygulamalar kurşun ve kalaylı bir alaşım ve kurşun-asit pillerdeki kurşun antimon plakalarıdır. Antimonlu kurşun ve kalay alaşımları, lehimler, mermiler ve kaymalı yataklar için gelişmiş özelliklere sahiptir. Antimon bileşikleri, birçok ticari ve ev ürününde bulunan klor ve brom içeren yangın geciktiriciler için önemli katkı maddeleridir. Ortaya çıkan bir uygulama, mikroelektronikte antimon kullanımıdır.
Karakteristikler
[değiştir | kaynağı değiştir]Özellikler
[değiştir | kaynağı değiştir]


Antimon, pniktojenler denilen elementlerden biri olan periyodik tablonun 15. grubunun bir üyesidir ve 2.05 elektronegatifliği vardır. Periyodik eğilimlere göre, kalay veya bizmuttan daha elektronegatif ve tellür veya arsenikten daha az elektronegatiftir. Antimon, oda sıcaklığında havada kararlıdır, ancak antimon trioksit (Sb2O3), üretmek için ısıtıldığında oksijen ile reaksiyona girer.[4]:758
Antimon, sert nesneler yapmak için fazla yumuşak olan 3 Mohs ölçeği sertliğine sahip gümüşi, parlak gri bir metaloittir. Çin'in Guizhou eyaletinde 1931'de antimon paraları üretilmeye başlandı ancak paraların çabuk yıpranması ve halkın buna alışamaması nedeniyle üretimi durduruldu.[5][6] Antimon asitlere karşı dayanıklıdır.
Dört antimon allotropu bilinmektedir: kararlı bir metalik form ve üç metastabil form (patlayıcı, siyah ve sarı). Elementel antimon, kırılgan, gümüşi-beyaz parlak bir metaloittir. Yavaşça soğutulduğunda, erimiş antimon, arseniğin gri allotropu ile izomorfik olan trigonal bir hücrede kristalleşir. Antimon triklorürün elektrolizinden nadir bir patlayıcı antimon formu oluşturulabilir. Keskin bir aletle çizildiğinde, ekzotermik bir reaksiyon meydana gelir ve beyaz dumanlar metalik antimon formları olarak verilir; bir havanda bir havan tokmağı ile ovulduğunda, güçlü bir patlama meydana gelir. Antimon buharının hızlı soğutulması üzerine siyah antimon oluşur. Kırmızı fosfor ve siyah arsenik ile aynı kristal yapıya sahiptir, havada oksitlenir ve kendiliğinden tutuşabilir. 100 °C'de yavaş yavaş kararlı forma dönüşür. Antimonun sarı allotropu en dengesizdir. Sadece stibinin (SbH3) -90 °C'de oksidasyonu ile üretilmiştir. Bu sıcaklığın üstünde ve ortam ışığında, bu metastabil allotrop daha kararlı olan siyah allotropa dönüşür.[7][8][9]
Elementel antimon, katmanların kaynaşmış, karıştırılmış, altı üyeli halkalardan oluştuğu katmanlı bir yapıya (uzay grubu R3m No. 166) sahiptir. En yakın ve en yakın komşular düzensiz bir oktahedral kompleks oluşturur ve her iki kattaki üç atom bir sonraki üç atomdan biraz daha yakındır. Bu nispeten yakın ambalajlama, 6.697 g/cm3'lük yüksek bir yoğunluğa yol açar, ancak katmanlar arasındaki zayıf bağlanma, düşük sertlik ve antimonun kırılganlığına yol açar.[4]:758
İzotoplar
[değiştir | kaynağı değiştir]Antimonun iki kararlı izotopu vardır: doğal bolluğu %57.36 olan 121Sb ve doğal bolluğu %42.64 olan 123Sb. Ayrıca 35 radyoizotopu vardır. En uzun ömüre sahip izotopu 2.75 yarı ömüre sahip 125Sb'dir. Ek olarak, 29 metastabil durum karakterize edilmiştir. Bunların en kararlısı, 5.76 günlük bir yarı ömüre sahip 120m1Sb 'dir. Kararlı 123Sb'den daha hafif olan izotoplar, bazı istisnalar dışında, β+ bozunmasıyla bozunmaya eğilimlidir ve daha ağır olanlar β− bozunmasıyla bozunmaya eğilimlidir.[10]
Oluşum
[değiştir | kaynağı değiştir]
Dünya'nın yerkabuğundaki antimon bolluğunun milyonda 0,2 ile 0,5 arasındaki kısım, milyonda 0,5 kısımda talyum ve 0,07 ppm'de gümüş ile karşılaştırılabileceği tahmin edilmektedir.[11] Bu element bol olmasa da, 100'den fazla mineral türünde bulunur. Antimon bazen doğal olarak bulunur (örneğin Antimon Zirvesi'nde), ancak daha sık olarak baskın cevher minerali olan sülfit stibnitte (Sb2S3) bulunur.[11]
Bileşikler
[değiştir | kaynağı değiştir]Antimon bileşikleri genellikle oksidasyon durumlarına göre sınıflandırılır: Sb (III) ve Sb (V).[12] +5 yükseltgenme seviyesi daha kararlıdır.
Oksitler ve Hidroksitler
[değiştir | kaynağı değiştir]Antimon trioksit, antimon havada yakıldığında oluşur.[13] Gaz fazında, bileşiğin molekülü Sb4O6'dır, fakat yoğunlaşma üzerine polimerize olur.[4]Antimon pentoksit (Sb4O10) sadece konsantre nitrik asit ile oksidasyonla oluşturulabilir.[14] Antimon ayrıca hem Sb(III) hem de Sb(V) içeren karışık değerli bir oksit, antimon tetroksit (Sb2O4) oluşturur.[14] Fosfor ve arsenik oksitlerin aksine, bu oksitler amfoteriktir, iyi tanımlanmış oksoasitler oluşturmaz ve antimon tuzları oluşturmak için asitlerle reaksiyona girer.
Antimonik asit Sb(OH)3 bilinmemektedir, fakat konjugat baz sodyum antimonit ([Na3SbO3]4), sodyum oksit ve Sb4O6 kaynaştırma üzerine oluşur.[4]:763 Geçiş metali antimonitleri de bilinmektedir.[15]:122 Antimonik asit sadece hidrat HSb(OH)6 olarak bulunur ve antimonat anyonu Sb(OH)-6 olarak tuzlar oluşturur. Bu anyonu ihtiva eden bir çözelti dehidre edildiğinde, çökelti karışık oksitler içerir.[15]:143
Birçok antimon cevheri, stibnit (Sb2S3), pirargirit (Ag3SbS3), zinkenit, jamesonit ve boulangerit dahil olmak üzere sülfitlerdir.[4]:757 Antimon pentasülfit stokiyometrik değildir ve +3 oksidasyon seviyesinde ve S-S bağlarında antimon içerir.[16] [Sb6S10]2- ve [Sb8S13]2- gibi çeşitli tioantimonidler bilinmektedir.[17]
Halojenürler
[değiştir | kaynağı değiştir]Antimon, iki halojenür serisi oluşturur: SbX3 ve SbX5. Trihalidler SbF3, SbCl3, SbBr3 ve SbI3, trigonal piramidal moleküler geometriye sahip moleküler bileşiklerdir.
Triflorür SbF3, Sb2O3'ün HF ile reaksiyonu yoluyla hazırlanır:[4]:761–762
- Sb2O3 + 6 HF → 2 SbF3 + 3 H2O
Lewis asidiktir ve SbF-4 ve SbF2−5 kompleks anyonlarını oluşturmak için florür iyonlarını kolayca kabul eder. Erimiş SbF3 zayıf bir elektriksel iletkendir. Triklorür SbCl3, Sb2S3'ün hidroklorik asit içinde çözünümü ile hazırlanır:
- Sb2S3 + 6 HCl → 2 SbCl3 + 3 H2O

Pentahalojenürler olan SbF5 ve SbCl5, gaz fazında trigonal bipiramidal moleküler geometriye sahiptir, ancak sıvı fazda SbF5 polimeriktir, oysa SbCl5 monomeriktir.[4]:761 SbF5, süperasit olan floroantimonik asit ("H2SbF7") yapmak için kullanılan güçlü bir Lewis asididir.
Oksihalojenürler antimon için arsenik ve fosfordan daha yaygındır. Antimon trioksit, konsantre asit içinde çözünerek SbOCl ve (SbO)2SO4 gibi oksoantimonil bileşiklerini oluşturur.[4]:764
Antimonitler, hidritler ve organoantimon bileşikleri
[değiştir | kaynağı değiştir]Bu sınıftaki bileşikler genellikle Sb3- türevleri olarak tarif edilir. Antimon, indiyum antimonit (InSb) ve gümüş antimonit (Ag3Sb) gibi metallerle antimonitler oluşturur.[4]:760 Na3Sb ve Zn3Sb2 gibi alkali metal ve çinko antimonitler daha reaktiftir. Bu antimonitlerin asit ile işlenmesi, oldukça kararsız stibin (SbH3) gazını üretir:[18] Sb3- + 3 H+ → SbH3
Stibin ayrıca Sb3+ tuzlarının sodyum borhidrür gibi hidrit reaktifleri ile işlenmesiyle de üretilebilir.[kaynak belirtilmeli] Stibin oda sıcaklığında kendiliğinden ayrışır. Stibin pozitif bir oluşum ısısına sahip olduğundan, termodinamik olarak kararsızdır ve bu nedenle antimon doğrudan hidrojen ile reaksiyona girmez.[12]
Organoantimon bileşikleri tipik olarak antimon halidlerin Grignard reaktifleri ile alkilasyonuyla hazırlanır.[19] Karışık kloro-organik türevler, anyonlar ve katyonlar dahil olmak üzere hem Sb (III) hem de Sb (V) merkezleri ile çok çeşitli bileşikler bilinmektedir. Örnekler arasında Sb(C6H5)3 (trifenilstibin), Sb2(C6H5)4 (bir Sb-Sb bağı ile) ve siklik [Sb(C6H5)]n bulunur. Beş eşli organoantimon bileşikleri yaygındır, örnekler Sb(C6H5)5 ve ilgili birkaç halojenürdür.
Tarihçe
[değiştir | kaynağı değiştir]
Antimon(III) sülfür, Sb2S3, predinastik Mısır'da, kozmetik palet icat edildiğinde MÖ 3100 gibi erken bir tarihte göz kozmetiği (kohl) olarak tanınmıştır.[20]
Bir vazonun parçası olduğu söylenen ve M.Ö. 3000 yılına dayanan antimondan yapılmış bir eser, Telloh, Chaldea'da (günümüzde Irak'ın bir parçası) bulundu ve Mısır'da M.Ö. 2500 ile M.Ö. 2200 yılları arasında antimon ile kaplanmış bakır bir nesne bulunmuştur.[7] Austen, 1892'de Herbert Gladstone tarafından yapılan bir konferansta, "günümüzdeki antimonun sadece yararlı bir vazoya dönüştürülemeyen son derece kırılgan ve kristal bir metal olduğunu biliyoruz ve bu nedenle bu dikkat çekici 'buluş' (yukarıda bahsedilen eser) antimonun kayıp biçimlendirebilme sanatını temsil etmelidir."[21]
İngiliz arkeolog Roger Moorey, eserin gerçekten bir vazo olduğuna ikna olmamıştı, Selimkhanov'un Tello nesnesini (1975'te yayınlandı) analiz ettikten sonra "metali Transkafkasya doğal antimonuyla ilişkilendirmeye çalıştı" ve "Transkafkasya'daki antimon nesnelerinin tümü küçük kişisel süs eşyalarıdır."[21] Bu, kaybolan bir sanatın "antimonu biçimlendirebilir kılma" kanıtını zayıflatır.[21]
Romalı bilgin Büyük Plinius, Doğa Araştırmaları (Naturalis Historia) adlı kitabında antimon sülfürü tıbbi amaçlar için hazırlamanın çeşitli yollarını tanımladı.[22] Plinius ayrıca "erkek" ve "kadın" antimon biçimleri arasında bir ayrım yaptı; erkek form muhtemelen sülfürken, üstün, daha ağır ve daha az kırılgan olan kadın formunun doğal metalik antimon olduğundan şüphelenilmektedir.[23]
Yunan doğa bilimci Pedanius Dioscorides, antimon sülfürün bir hava akımı ile ısıtılarak kavrulabileceğini belirtti. Bunun metalik antimon ürettiği düşünülmektedir.[22]

Antimonun kasti izolasyonu, MS 815'ten önce Câbir bin Hayyan tarafından tarif edilmiştir.[24] Antimonun izole edilmesi için bir prosedürün açıklaması daha sonra Vannoccio Biringuccio'nun 1540 De la pirotechnia adlı kitabında Georgius Agricola, De re metallica'nın daha ünlü 1556 kitabından önce verilmiştir. Bu bağlamda Agricola, metalik antimonun keşfiyle sıklıkla yanlış itibar görmektedir. Metalik antimonun hazırlanmasını anlatan Currus Triumphalis Antimonii (Antimon Zafer Savaş Arabası) kitabı 1604'te Almanya'da yayınlandı. 15. yüzyılda Basilius Valentinus adı altında yazılan bir Benediktin rahibi tarafından yazıldığı iddia edildi; eğer otantik olmasaydı, Biringuccio'dan önce gelirdi.[a][8][26]
Metal antimon 1615 yılında Alman kimyager Andreas Libavius tarafından biliniyordu ve erimiş antimon sülfür, tuz ve potasyum tartarat karışımına demir ilave edilerek elde edildi. Bu prosedür kristalin veya yıldızlı bir yüzeye sahip antimon üretti.[22]
Phlogiston teorisindeki zorlukların ortaya çıkmasıyla antimonun, diğer metaller gibi sülfitler, oksitler ve diğer bileşikleri oluşturan bir element olduğu kabul edildi.[22]
Yer kabuğunda doğal olarak oluşan saf antimonun ilk keşfi 1783'te İsveçli bilim adamı ve yerel maden bölgesi mühendisi Anton von Swab tarafından tanımlandı; tip-numune İsveç, Västmanland, Sala'daki Bergslagen madencilik bölgesindeki Sala Gümüş Madeninden toplanmıştır.[27][28]
Etimoloji
[değiştir | kaynağı değiştir]Modern diller ve geç Bizans Yunancası'nın isimlerini antimon olarak aldığı Orta Çağ Latin formu antimonyum'dur. Bunun kaynağı belirsizdir; tüm önerilerin hem biçim hem de yorum konusunda zorlukları vardır. Ἀντίμοναχός anti-monachos veya Fransız antimoinden popüler etimolojinin hala taraftarları vardır; bu "keşiş katili" anlamına gelir ve birçok erken simyagerin keşiş ve antimonun zehirli olmasıyla açıklanır.[25]
Bir başka popüler etimoloji, "metal olarak bulunamadı" veya "alaşımsız bulunamadı" şeklinde açıklanan, varsayımsal Yunanca ἀντίμόνος antimonos kelimesidir.[7] Lippmann, "floret" anlamına gelecek olan varsayımsal bir Yunanca kelime ανθήμόνιον anthemonion'u tahmin etti ve kimyasal veya biyolojik tozlaşmayı tanımlayan ilgili Yunanca kelimelerin (ancak bu değil) birkaç örneğini gösteriyor.[29]
Antimonyum'un ilk kullanımları, 1050–1100 yıllarında, Arapça tıbbi tedavilerin Afrikalı Constantine tarafından yapılan çevirileri içerir.[30] Birkaç otorite antimonium'un bazı Arapça formların karalama bozulması olduğuna inanıyor; Meyerhof onu ithmid'den türetmiştir;[31] diğer olasılıklar arasında athimar, metaloidin Arapça adı ve Yunancadan türeyen veya ona paralel olan varsayımsal bir as-stimmi vardır.[32]
Antimonun (Sb) standart kimyasal sembolü için kısaltmayı stibiumdan türeten Jöns Jakob Berzelius itibar görür.
Antik antimon sözleri çoğunlukla, başlıca anlamları olarak antimon sülfürü olan kohl'a sahiptir.
Mısırlılar antimona mśdmt diyorlardı;[33][34] hiyerogliflerde, ünlüler belirsizdir, ancak kelimenin Kıpti formu ⲥⲧⲏⲙ (stēm) 'dir. Yunanca kelime, στίμμι stimmi, muhtemelen Arapça veya Mısır stm'sinden alınan bir kredi kelimesidir[25]
| |
ve M.Ö. 5. yüzyılın Attik trajik şairleri tarafından kullanılır. Daha sonra Yunanlar, M.S. birinci yüzyılda Latince yazılmış Celsus ve Pliny gibi στἰβι stibi kullandılar. Pliny ayrıca stimi [sic], larbaris, alabaster ve "çok yaygın" platyoftalmi, "geniş göz" (kozmetik etkisinden) isimlerini verir. Daha sonra Latin yazarlar kelimeyi Latince stibium olarak uyarladılar. Maddenin Arapça kelimesi, kozmetikten farklı olarak, إثمد ithmid, athmoud, othmod veya uthmod olarak görünebilir. Littré, en erken olan ilk formun, stimmi için bir suçlayıcı olan stimmida'dan türediğini önerir.[35]
Üretim
[değiştir | kaynağı değiştir]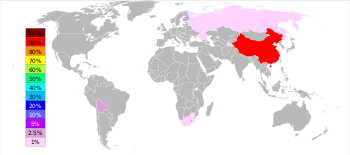
En iyi üreticiler ve üretim hacimleri
[değiştir | kaynağı değiştir]İngiliz Jeoloji Araştırması (BGS), 2005 yılında Çin'in dünya payının yaklaşık %84'ü ile en iyi antimon üreticisi olduğunu ve bunu Güney Afrika, Bolivya ve Tacikistan tarafından uzaktan takip ettiğini bildirdi. Hunan eyaletindeki Xikuangshan Madeni, tahmini 2.1 milyon metrik ton mevduat ile Çin'in en büyük mevduatına sahip.[36]
ABD Jeoloji Araştırması'na göre 2016 yılında Çin, toplam antimon üretiminin %76,9'unu oluştururken, onu %6,9 ile Rusya ve %6,2 ile Tacikistan izledi.[37]
| 100,000 | 76.9 | |
| 9,000 | 6.9 | |
| 8,000 | 6.2 | |
| 4,000 | 3.1 | |
| 3,500 | 2.7 | |
| İlk 5 | 124,500 | 95.8 |
| Dünya toplamı | 130,000 | 100.0 |
|---|
Çin'in antimon üretiminin, kirlilik kontrolünün bir parçası olarak mayınlar ve izabe tesislerinin hükûmet tarafından kapatılması nedeniyle gelecekte düşmesi bekleniyor. Özellikle 2015 yılı Ocak ayında[38] yürürlüğe giren “Stanum, Antimon ve Merkür için Emisyon Standartları” revize edilen yeni bir çevre koruma yasası nedeniyle ekonomik üretim engelleri daha fazladır. Çin Ulusal İstatistik Bürosu'na göre, Eylül 2015'e kadar Hunan eyaletindeki (Çin'de en fazla antimon rezervi bulunan eyalet) antimon üretim kapasitesinin %50'si kullanılmamıştı.[38]
Roskill'in raporuna göre, Çin'de rapor edilen antimon üretimi düştü ve önümüzdeki yıllarda artması pek olası değil. Çin'de yaklaşık on yıldır önemli bir antimon yatağı gelişmemiştir ve kalan ekonomik rezervler hızla tükenmektedir.[39]
Roskill'e göre dünyanın en büyük antimon üreticileri aşağıda listelenmiştir:
| Hsikwangshan Twinkling Star | 55,000 | |
| China Tin Group | 20,000 | |
| Hunan Chenzhou Mining | 20,000 | |
| Shenyang Huachang Antimony | 15,000 | |
| GeoProMining | 6,500 | |
| Beaver Brook | 6,000 | |
| Consolidated Murchison | 6,000 | |
| çeşitli | 6,000 | |
| Unzob | 5,500 | |
| çeşitli | 5,460 | |
| Mandalay Resources | 2,750 | |
| Cengiz & Özdemir Antimuan Madenleri | 2,400 | |
| Kazzinc | 1,000 | |
| bilinmiyor | 600 | |
| Kadamdzhai | 500 | |
| SRS | 500 | |
| US Antimony | 70 |
Rezervler
[değiştir | kaynağı değiştir]USGS istatistiklerine göre, mevcut küresel antimon rezervleri 13 yıl içinde tükenecek. Ancak USGS daha fazla kaynak bulunacağını düşünüyor.
| 950,000 | 47.81 | |
| 350,000 | 17.61 | |
| 310,000 | 15.60 | |
| 140,000 | 7.05 | |
| 60,000 | 3.02 | |
| 50,000 | 2.52 | |
| 27,000 | 1.36 | |
| Diğer ülkeler | 100,000 | 5.03 |
| Dünya toplamı | 1,987,000 | 100.0 |
|---|
Üretim süreci
[değiştir | kaynağı değiştir]Cevherlerden antimon çıkarılması, cevherin kalitesine ve bileşimine bağlıdır. Çoğu antimon sülfür olarak çıkarılır; düşük dereceli cevherler köpük yüzdürmesi ile konsantre edilirken, yüksek dereceli cevherler 500–600 °C'ye ısıtılır, stibnitin erime ve gang minerallerinden ayrıldığı sıcaklık. Antimon hurda demir ile indirgenerek ham antimon sülfürden izole edilebilir:[41] Sb2S3 + 3 Fe → 2 Sb + 3 FeS
Sülfit bir okside dönüştürülür; ürün daha sonra bazen geri kazanılan uçucu antimon(III) oksidin buharlaştırılması amacıyla kavrulur.[42] Bu malzeme genellikle doğrudan ana uygulamalar için kullanılır, safsızlıklar arsenik ve sülfürdür.[43][44] Antimon, oksitten karbotermal bir indirgeme ile izole edilir:[41][43] 2 Sb2S3 + 3 C → 4 Sb + 3 CO2
Düşük dereceli cevherler yüksek fırınlarda azalırken, yüksek dereceli cevherler yanıcı fırınlarda azalır.[41]
Arz riski ve kritik mineral sıralaması
[değiştir | kaynağı değiştir]Avrupa ve ABD risk listelerinde, mevcut ekonomiyi ve yaşam tarzını sürdürmek için gereken kimyasal elementlerin veya element gruplarının tedarikine ilişkin nispi riski gösteren elementin kritikliğine ilişkin olarak, antimon sürekli olarak üst sıralarda yer almaktadır.
Avrupa ve ABD'ye ithal edilen antimonun büyük bir kısmının Çin'den gelmesi ile Çin üretimi arz açısından kritik öneme sahiptir. Çin çevresel kontrol standartlarını gözden geçirip arttırdığı için, antimon üretimi giderek kısıtlanmaktadır. Ayrıca, Çin'in antimon ihracat kotaları son yıllarda azalmaktadır. Bu iki faktör hem Avrupa hem de ABD için arz riskini artırmaktadır.
Avrupa
[değiştir | kaynağı değiştir]2015 BGS Risk Listesine göre, antimon nispi arz riski endeksinde (en nadir toprak elementlerinden sonra) ikinci sırada yer almaktadır.[45] Bu, şu anda İngiliz ekonomisi ve yaşam tarzı için ekonomik değeri olan kimyasal elementler veya element grupları için ikinci en yüksek arz riskine sahip olduğunu göstermektedir. Ayrıca, antimon 2014 yılında yayınlanan bir raporda (2011'de yayınlanan ilk raporu revize eden) AB için 20 kritik hammaddeden biri olarak tanımlanmıştır. Şekil xxx'te görüldüğü gibi, antimon ekonomik önemine göre yüksek arz riski taşımaktadır. Antimonun %92'si, önemli ölçüde yüksek bir üretim konsantrasyonu olan Çin'den ithal edilmektedir.[46]
ABD
[değiştir | kaynağı değiştir]ABD'de hangi metallerin ülkenin güvenliği için stratejik veya kritik olarak adlandırılması gerektiğini tanımlamak için çok fazla analiz yapılmıştır. Kesin tanımlar mevcut değildir ve ABD güvenlik ayrımı için neyin stratejik veya kritik bir mineral oluşturduğuna ilişkin görüşlerdir.[47]
2015 yılında ABD'de herhangi bir antimon çıkarılmadı. Metal, yabancı ülkelerden ithal ediliyor. 2011–2014 döneminde Amerika'nın antimonunun %68'i Çin'den, %14'ü Hindistan'dan, %4'ü Meksika'dan ve %14'ü diğer kaynaklardan geldi. Halihazırda kamuya açık olarak bilinen hükûmet stoku bulunmamaktadır.
ABD "Kritik ve Stratejik Mineral Tedarik Zincirleri Alt Komitesi" 1996–2008 yılları arasında 78 mineral kaynağı taradı. Antimon da dahil olmak üzere küçük bir mineral alt kümesinin potansiyel olarak kritik mineraller kategorisine sürekli olarak düştüğü bulunmuştur. Gelecekte, önemli risklerin tanımlanması ve ABD çıkarları için kritik olması gereken minerallerin alt kümeleri hakkında ikinci bir değerlendirme yapılacaktır.[48]
Kullanımlar
[değiştir | kaynağı değiştir]
Antimonun yaklaşık %60'ı alev geciktiricilerde tüketilir ve %20'si piller, kaymalı yataklar ve lehimler için alaşımlarda kullanılır.[41]
Alev geciktiricileri
[değiştir | kaynağı değiştir]Antimon esas olarak halojen içeren polimerler hariç her zaman halojenli alev geciktiricilerle kombinasyon halinde alev geçirmez bileşikler için trioksit olarak kullanılır. Antimon trioksitin alev geciktirici etkisi,[49] hidrojen atomları ile ve muhtemelen oksijen atomları ve OH radikalleri ile reaksiyona giren ve böylece yangını önleyen halojenli antimon bileşiklerinin oluşumu ile üretilir.[50] Bu alev geciktiricilere yönelik pazarlar arasında çocuk giysileri, oyuncaklar, uçaklar ve otomobil koltuk kılıfları bulunmaktadır. Hafif uçak motor kapakları gibi maddeler için fiberglas kompozitlerdeki polyester reçinelere de eklenirler. Reçine, harici olarak oluşturulan bir alev varlığında yanar, ancak harici alev çıkarıldığında söner.[42][51]
Alaşımlar
[değiştir | kaynağı değiştir]Antimon, sertliğini ve mekanik mukavemetini artırarak kurşun ile oldukça kullanışlı bir alaşım oluşturur. Kurşun içeren çoğu uygulama için, alaşım metal olarak değişen miktarlarda antimon kullanılır. Kurşun asitli akülerde, bu ilave plaka gücünü ve şarj özelliklerini geliştirir.[42][52] Yelkenli tekneler için kurşun ağırlıkları 272 kg ile 3628 kg arasında; kurşun omurgasının sertliğini ve gerilme mukavemetini artırmak için antimon, hacimce %2 ile %5 arasında kurşun ile karıştırılır. Antimon, sürtünme önleyici alaşımlarda (Babbitt metal gibi),[53] mermilerde, elektrik kablo kılıfında, tip metalde (örneğin, linotip baskı makineleri için[54]), lehimde (bazı "kurşunsuz" lehimler %5 Sb içerir),[55] kalayda[56] ve organ borularının imalatında düşük kalay içeriğine sahip sertleşen alaşımlarda kullanılır.
Diğer kullanımlar
[değiştir | kaynağı değiştir]Diğer üç uygulama dünyanın geri kalanının neredeyse tamamını tüketmektedir.[41] Bir uygulama, polietilen tereftalat üretimi için bir dengeleyici ve katalizördür.[41] Bir diğeri, çoğunlukla TV ekranları için camdaki mikroskopik kabarcıkların çıkarılması için bir inceltici maddedir.[57] antimon iyonları oksijen ile etkileşir ve sonraki kabarcık oluşturma eğilimini bastırır.[58] Üçüncü uygulama pigmentlerdir.[41]
Biyoloji ve tıbbın antimon için az kullanımı vardır. Antimoniyel olarak bilinen antimon içeren tedaviler emetik olarak kullanılır.[59] Antimon bileşikleri antiprotozoan ilaçlar olarak kullanılır. Potasyum antimonil tartrat veya tartar emetik, bir zamanlar 1919'dan itibaren bir anti-şistozomal ilaç olarak kullanıldı. Daha sonra yerini prazikuantel aldı.[60] Antimon ve bileşikleri, gevişgetirenlerde cilt yumuşatıcı olarak antiomalin ve lityum antimon tiyomalat gibi çeşitli veteriner hazırlamalarda kullanılır.[61] Antimon, hayvanlarda keratinize dokular üzerinde besleyici veya iyileştirici bir etkiye sahiptir.
Meglumin antimoniyat gibi antimon bazlı ilaçlar da evcil hayvanlarda layşmanyaz tedavisi için tercih edilen ilaçlar olarak kabul edilir. Ne yazık ki, düşük terapötik endekslere sahip olmanın yanı sıra, ilaçlar, bazı Layşmanya amastigotlarının bulunduğu kemik iliğine çok az nüfuz eder ve hastalığı tedavi etmek – özellikle visseral form – çok zordur.[62] Bir antimon hapı olarak elementel antimon bir zamanlar ilaç olarak kullanıldı. Yutma ve eliminasyondan sonra başkaları tarafından tekrar kullanılabilir.[63]
Antimon sülfürler, otomotiv fren balatası malzemelerindeki sürtünme katsayısının dengelenmesine yardımcı olur.[64] Antimon mermi, mermi izleyicileri,[65] boya, cam sanatı ve emayede bir opaklaştırıcı olarak kullanılır. Antimon-124, nötron kaynaklarında berilyum ile birlikte kullanılır; antimon-124 tarafından yayılan gama ışınları, berilyumun fotodisintegrasyonunu başlatır.[66][67] Yayılan nötronların ortalama enerjisi 24 keV'dur.[68] Doğal antimon başlangıç nötron kaynaklarında kullanılır.
Tarihsel olarak, ezilmiş antimondan (kohl) elde edilen toz, eski bir insanın göz enfeksiyonlarını iyileştirmeye yardımcı olduğunu düşündüğü bir metal çubukla ve birinin tükürüğü ile gözlere uygulanmıştır.[69] Uygulama hala Yemen ve diğer Arap ülkelerinde görülüyor.
Önlemler
[değiştir | kaynağı değiştir]Antimon ve bileşiklerinin insan ve çevre sağlığı üzerindeki etkileri büyük farklılıklar göstermektedir. Elementel antimon metali, insan ve çevre sağlığını etkilemez. Antimon trioksitin (ve antimon tozu gibi benzer az çözünür Sb(III) toz parçacıklarının) solunması zararlı olarak kabul edilir ve kansere neden olduğundan şüphelenilir. Ancak, bu etkiler sadece dişi sıçanlarda ve yüksek toz konsantrasyonlarına uzun süre maruz kaldıktan sonra gözlenir. Etkilerin, antimon iyonlarına maruz kalmayacak şekilde bozulmuş akciğer klerensi, akciğer aşırı yüklenmesi, iltihaplanma ve sonuçta tümör oluşumuna yol açan zayıf çözünür Sb parçacıklarının solunmasına bağlandığı varsayılmaktadır (OECD, 2008). Antimon klorürler cildi aşındırır. Antimonun etkileri arsenik ile karşılaştırılamaz; bunun nedeni, alım, metabolizma ve arsenik–antimon arasındaki atılım arasındaki önemli farklılıklar olabilir.
Oral emilim için, ICRP (1994) tartar emetik için %10 ve diğer tüm antimon bileşikleri için %1 değerlerini önerdi. Metaller için deri emiliminin en fazla %1 olduğu tahmin edilmektedir (HERAG, 2007). Antimon trioksit ve diğer az çözünür Sb(III) maddelerin (antimon tozu gibi) soluk alma emilimi %6.8 (OECD, 2008) iken Sb(V) maddeleri için <%1'lik bir değer elde edilir. Antimon(V), kantitatif olarak hücrede antimon(III)'e indirgenmez ve her iki tür de aynı anda bulunur.
Antimon esas olarak idrar yoluyla insan vücudundan atılır. Antimon ve bileşikleri, layşmanyaz hastalarını tedavi etmek için kasıtlı olarak kullanılan bir ön ilaç olan antimon potasyum tartrat ("tartar emetik") hariç, akut insan sağlığı etkilerine neden olmaz.
Antimon tozuyla uzun süreli cilt teması dermatite neden olabilir. Ancak, Avrupa Birliği düzeyinde, gözlenen deri döküntülerinin maddeye özgü olmadığı, büyük olasılıkla ter kanallarının fiziksel olarak engellenmesi nedeniyle olduğu kabul edilmiştir (ECHA / PR / 09/09, Helsinki, 6 Temmuz 2009). Antimon tozu da havaya yayıldığında patlayıcı olabilir; dökme bir katı halindeyken yanıcı değildir.[70]
Antimon, güçlü asitler, halojenli asitler ve oksitleyicilerle bağdaşmaz; yeni oluşan hidrojene maruz kaldığında stibin (SbH3) oluşturabilir.[70]
8 saatlik zaman ağırlıklı ortalama (TWA), Amerikan Hükûmeti Endüstriyel Hijyenistler Konferansı ve İşyerinde yasal izin verilen maruz kalma sınırı (PEL) olarak İş Sağlığı ve Güvenliği İdaresi (OSHA) tarafından 0.5 mg/m3 olarak belirlenmiştir. Ulusal İş Sağlığı ve Güvenliği Enstitüsü (NIOSH) 8 saatlik TWA olarak önerilen maruz kalma sınırını (REL) 0.5 mg/m3 olarak belirlemiştir.[70] Antimon bileşikleri polietilen tereftalat (PET) üretimi için katalizör olarak kullanılır. Bazı çalışmalar, PET şişelerden sıvılara küçük antimon sızıntısı bildirmektedir, ancak seviyeler içme suyu kılavuzlarının altındadır. Meyve suyu konsantrelerindeki antimon konsantrasyonları biraz daha yüksekti (44.7 ug / L antimon'a kadar), ancak meyve suları içme suyu yönetmeliklerine girmiyor. İçme suyu yönergeleri:
- Dünya Sağlık Örgütü: 20 µg/L
- Japonya: 15 µg/L[71]
- ABD Çevre Koruma Ajansı, Kanada Sağlık ve Ontario Çevre Bakanlığı: 6 µg/L
- AB ve Alman Federal Çevre Bakanlığı: 5 µg/L[72]
DSÖ tarafından önerilen TDI, vücut ağırlığının kilogramı başına 6 µg antimondur.[73] Antimon için IDLH (yaşam ve sağlık için hemen tehlikeli) değeri 50 mg/m3'tür.[70]
Toksiklik
[değiştir | kaynağı değiştir]Özellikle antimon trioksit ve antimon potasyum tartarat gibi bazı antimon bileşikleri toksik olarak görünmektedir.[74] Etkiler arsenik zehirlenmesine benzer olabilir.[75] Mesleki maruziyet solunum yolu tahrişine, pnömokonyoza, ciltte antimon lekelerine, gastrointestinal belirtilere ve kardiyak aritmilere neden olabilir. Ek olarak, antimon trioksit insanlar için potansiyel olarak kanserojendir.[76]
İnsanlarda ve hayvanlarda soluma, oral veya antimon ve bileşiklerine dermal maruziyet sonrasında olumsuz sağlık etkileri gözlemlenmiştir.[74] Antimon toksisitesi tipik olarak ya mesleki maruziyete bağlı olarak, tedavi sırasında ya da kazayla yutulmasından kaynaklanır. Antimonun vücuda cilt yoluyla girip girmediği belirsizdir.[74]
Notlar
[değiştir | kaynağı değiştir]- ^ Zaten 1710 yılında Wilhelm Gottlob Freiherr von Leibniz, dikkatli bir araştırmadan sonra, çalışmanın sahte olduğu, Basilius Valentinus adında bir keşiş olmadığı ve kitabın yazarı, görünür editörü Johann Thölde (c. 1565 - c 1624) olduğu sonucuna vardı. Profesyonel tarihçiler artık Currus Triumphalis'e katılıyorlar ... 16. yüzyılın ortalarından sonra yazıldı ve Thölde muhtemelen yazarı oldu.[25]
Kaynakça
[değiştir | kaynağı değiştir]- ^ Sidiropoulos, Anastas. "Studies of N-heterocyclic Carbene (NHC) Complexes of the Main Group Elements" (PDF) (İngilizce). s. 39.
- ^ Lide, D. R., (Ed.) (2005). "Magnetic susceptibility of the elements and inorganic compounds". CRC Handbook of Chemistry and Physics (PDF) (İngilizce) (86. bas.). Boca Raton (FL): CRC Press. ISBN 0-8493-0486-5. 3 Mart 2011 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 20 Temmuz 2020.
- ^ Weast, Robert (1984). CRC, Handbook of Chemistry and Physics (İngilizce). Boca Raton: Chemical Rubber Company Publishing. s. E110. ISBN 0-8493-0464-4.
- ^ a b c d e f g h i Wiberg, Egon; Wiberg, Nils; Holleman, Arnold Frederick (2001). Inorganic chemistry. Academic Press. ISBN 978-0-12-352651-9.
- ^ "Arşivlenmiş kopya". 14 Mart 2022 tarihinde kaynağından arşivlendi. Erişim tarihi: 26 Ekim 2022.
- ^ "Metals Used in Coins and Medals". ukcoinpics.co.uk. 18 Aralık 2007 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Mayıs 2020.
- ^ a b c "Antimony" in Kirk-Othmer Encyclopedia of Chemical Technology, 5th ed. 2004. 978-0-471-48494-3
- ^ a b Wang, Chung Wu (1919). "The Chemistry of Antimony" (PDF). Antimony: Its History, Chemistry, Mineralogy, Geology, Metallurgy, Uses, Preparation, Analysis, Production and Valuation with Complete Bibliographies. London, United Kingdom: Charles Geiffin and Co. Ltd. ss. 6-33.
- ^ Norman, Nicholas C (1998). Chemistry of arsenic, antimony, and bismuth. ss. 50-51. ISBN 978-0-7514-0389-3.
- ^ Audi, Georges; Bersillon, Olivier; Blachot, Jean; Wapstra, Aaldert Hendrik (2003), "The NUBASE evaluation of nuclear and decay properties" 2 Nisan 2015 tarihinde Wayback Machine sitesinde arşivlendi., Nuclear Physics A, 729: 3–128, Bibcode:2003NuPhA.729....3A 15 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi., doi:10.1016/j.nuclphysa.2003.11.001
- ^ a b c d "Mineral Commodity Summaries: Antimony" (PDF). Amerika Birleşik Devletleri Jeoloji Araştırmaları Kurumu. 8 Şubat 2016 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 1 Ocak 2016.
- ^ a b Greenwood, N. N.; & Earnshaw, A. (1997). Chemistry of the Elements (2. bas.), Oxford: Butterworth-Heinemann. 0-7506-3365-4.
- ^ Reger, Daniel L.; Goode, Scott R.; Ball, David W. (2009). Chemistry: Principles and Practice (3. bas.). Cengage Learning. s. 883. ISBN 978-0-534-42012-3.
- ^ a b House, James E. (2008). Inorganic chemistry. Academic Press. s. 502. ISBN 978-0-12-356786-4.
- ^ a b Godfrey, S. M.; McAuliffe, C. A.; Mackie, A. G.; Pritchard, R. G. (1998). Norman, Nicholas C. (Ed.). Chemistry of arsenic, antimony, and bismuth. Springer. ISBN 978-0-7514-0389-3.
- ^ Long, G.; Stevens, J. G.; Bowen, L. H.; Ruby, S. L. (1969). "The oxidation number of antimony in antimony pentasulfide". Inorganic and Nuclear Chemistry Letters. Cilt 5. s. 21. doi:10.1016/0020-1650(69)80231-X.
- ^ Lees, R.; Powell, A.; Chippindale, A. (2007). "The synthesis and characterisation of four new antimony sulphides incorporating transition-metal complexes". Journal of Physics and Chemistry of Solids. 68 (5–6). s. 1215. Bibcode:2007JPCS...68.1215L. doi:10.1016/j.jpcs.2006.12.010.
- ^ Kahlenberg, Louis (2008). Outlines of Chemistry – A Textbook for College Students. READ BOOKS. ss. 324-325. ISBN 978-1-4097-6995-8.
- ^ Elschenbroich, C. "Organometallics" (2006) Wiley-VCH: Weinheim. 3-527-29390-6
- ^ Shortland, A. J. (2006). "Application of Lead Isotope Analysis to a Wide Range of Late Bronze Age Egyptian Materials". Archaeometry. 48 (4). s. 657. doi:10.1111/j.1475-4754.2006.00279.x.
- ^ a b c Moorey, P. R. S. (1994). Ancient Mesopotamian Materials and Industries: the Archaeological Evidence. New York: Clarendon Press. s. 241. ISBN 978-1-57506-042-2.
- ^ a b c d Mellor, Joseph William (1964). "Antimony". A comprehensive treatise on inorganic and theoretical chemistry. 9. s. 339.
- ^ Pliny, Natural history, 33.33; W.H.S. Jones, the Loeb Classical Library translator, supplies a note suggesting the identifications.
- ^ George Sarton, Introduction to the History of Science. "We find in his writings [...] preparation of various substances (e.g., basic lead carbonatic, arsenic and antimony from their sulphides)."
- ^ a b c Harper, Douglas. "antimony". Online Etymology Dictionary.
- ^ Weeks, Mary Elvira (1932). "The discovery of the elements. II. Elements known to the alchemists". Journal of Chemical Education. 9 (1). s. 11. Bibcode:1932JChEd...9...11W. doi:10.1021/ed009p11.
- ^ "Native antimony". Mindat.org. 28 Nisan 2003 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Mayıs 2020.
- ^ Klaproth, M. (1803). "XL. Extracts from the third volume of the analyses". Philosophical Magazine. Series 1. 17 (67). s. 230. doi:10.1080/14786440308676406.
- ^ Lippman, pp. 643–5
- ^ Lippman, p. 642, writing in 1919, says "zuerst".
- ^ Sarton'da alıntılandığı gibi Meyerhof, ithmid veya athmoud'ın ortaçağ "trabations barbaro-latines" te bozulduğunu ileri sürer; OED, bazı Arapça formun köken olduğunu ve eğer ithmid kökse, athimodium, atimodium, atimonium'u ara formlar olarak ortaya koyar.
- ^ Endlich, F. M. (1888). "On Some Interesting Derivations of Mineral Names". The American Naturalist. 22 (253): 21–32. doi:10.1086/274630. JSTOR 2451020 10 Mayıs 2020 tarihinde Wayback Machine sitesinde arşivlendi..
- ^ Albright, W. F. (1918). "Notes on Egypto-Semitic Etymology. II". The American Journal of Semitic Languages and Literatures. 34 (4). ss. 215-255 [230]. doi:10.1086/369866. JSTOR 528157.
- ^ Sarton, George (1935). "Review of Al-morchid fi'l-kohhl, ou Le guide d'oculistique". Isis (Fransızca). 22 (2). Translated by Max Meyerhof. ss. 539-542 [541]. doi:10.1086/346926. JSTOR 225136. quotes Meyerhof, the translator of the book he is reviewing.
- ^ LSJ, s.v., vocalisation, spelling, and declension vary; Endlich, p. 28; Celsus, 6.6.6 ff; Pliny Natural History 33.33; Lewis and Short: Latin Dictionary. OED, s. "antimony".
- ^ Peng, J.; Hu, R.-Z.; Burnard, P. G. (2003). "Samarium–neodymium isotope systematics of hydrothermal calcites from the Xikuangshan antimony deposit (Hunan, China): the potential of calcite as a geochronometer". Chemical Geology. 200 (1–2). s. 129. Bibcode:2003ChGeo.200..129P. doi:10.1016/S0009-2541(03)00187-6.
- ^ "Antimony Statistics and Information" (PDF). National Minerals Information Center. USGS. 27 Nisan 2017 tarihinde kaynağından arşivlendi (PDF).
- ^ a b "Environmental Protection Law of the People's Republic of China" (PDF). 24 Nisan 2014. 2 Haziran 2014 tarihinde kaynağından (PDF) arşivlendi.
- ^ "Study of the antimony market by Roskill Consulting Group" (PDF). 18 October 2012 tarihinde kaynağından (PDF) arşivlendi. Erişim tarihi: 9 April 2012.
- ^ a b Antimony Uses, Production and Prices Primer 25 Ekim 2012 tarihinde Wayback Machine sitesinde arşivlendi. . tri-starresources.com
- ^ a b c d e f g Butterman, C.; Carlin, Jr., J. F. (2003). "Mineral Commodity Profiles: Antimony" (PDF). United States Geological Survey. 4 Kasım 2019 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 23 Mayıs 2020.
- ^ a b c Grund, Sabina C.; Hanusch, Kunibert; Breunig, Hans J.; Wolf, Hans Uwe (2006) "Antimony and Antimony Compounds" in Ullmann's Encyclopedia of Industrial Chemistry, Wiley-VCH, Weinheim. DOI:10.1002/14356007.a03_055.pub2
- ^ a b Norman, Nicholas C (1998). Chemistry of arsenic, antimony, and bismuth. s. 45. ISBN 978-0-7514-0389-3.
- ^ Wilson, N. J.; Craw, D.; Hunter, K. (2004). "Antimony distribution and environmental mobility at an historic antimony smelter site, New Zealand". Environmental Pollution. 129 (2). ss. 257-66. doi:10.1016/j.envpol.2003.10.014. PMID 14987811.
- ^ "MineralsUK Risk List 2015". 23 Eylül 2011 tarihinde kaynağından arşivlendi.
- ^ "Review of the list of critical raw materials for the EU and the implementation of the Raw Materials Initiative". 14 Kasım 2016 tarihinde kaynağından arşivlendi.
- ^ McGroarty, Daniel; Wirtz, Sandra (6 Haziran 2012). Reviewing Risk: Critical Metals & National Security (PDF). American Resources Policy Network. 4 Kasım 2020 tarihinde kaynağından arşivlendi (PDF).
- ^ McGroarty, Daniel; Wirtz, Sandra (6 Haziran 2012). Reviewing Risk: Critical Metals & National Security (PDF). American Resources Policy Network. 4 Kasım 2020 tarihinde kaynağından arşivlendi (PDF).
- ^ Weil, Edward D.; Levchik, Sergei V. (4 Haziran 2009). "Antimony trioxide and Related Compounds". Flame retardants for plastics and textiles: Practical applications. ISBN 978-3-446-41652-9.
- ^ Hastie, John W. (1973). "Mass spectrometric studies of flame inhibition: Analysis of antimony trihalides in flames". Combustion and Flame. Cilt 21. s. 49. doi:10.1016/0010-2180(73)90006-0.
- ^ Weil, Edward D.; Levchik, Sergei V. (4 Haziran 2009). Flame retardants for plastics and textiles: Practical applications. ss. 15-16. ISBN 978-3-446-41652-9.
- ^ Kiehne, Heinz Albert (2003). "Types of Alloys". Battery Technology Handbook. CRC Press. ss. 60-61. ISBN 978-0-8247-4249-2.
- ^ Williams, Robert S. (2007). Principles of Metallography. Read books. ss. 46-47. ISBN 978-1-4067-4671-6.
- ^ Holmyard, E. J. (2008). Inorganic Chemistry – A Textbook for Colleges and Schools. Read Books. ss. 399-400. ISBN 978-1-4437-2253-7.
- ^ Ipser, H.; Flandorfer, H.; Luef, Ch.; Schmetterer, C.; Saeed, U. (2007). "Thermodynamics and phase diagrams of lead-free solder materials". Journal of Materials Science: Materials in Electronics. 18 (1–3). ss. 3-17. doi:10.1007/s10854-006-9009-3.
- ^ Hull, Charles (1992). Pewter. Osprey Publishing. ss. 1-5. ISBN 978-0-7478-0152-8.
- ^ De Jong, Bernard H. W. S.; Beerkens, Ruud G. C.; Van Nijnatten, Peter A. (2000). "Glass". Ullmann's Encyclopedia of Industrial Chemistry. doi:10.1002/14356007.a12_365. ISBN 978-3-527-30673-2.
- ^ Yamashita, H.; Yamaguchi, S.; Nishimura, R.; Maekawa, T. (2001). "Voltammetric Studies of Antimony Ions in Soda-lime-silica Glass Melts up to 1873 K" (PDF). Analytical Sciences. 17 (1). ss. 45-50. doi:10.2116/analsci.17.45. PMID 11993676. 4 Mart 2016 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 23 Mayıs 2020.
- ^ Russell, Colin A. (2000). "Antimony's Curious History". Notes and Records of the Royal Society of London. 54 (1). ss. 115-116. doi:10.1098/rsnr.2000.0101. JSTOR 532063. PMC 1064207 $2.
- ^ Harder, A. (2002). "Chemotherapeutic approaches to schistosomes: Current knowledge and outlook". Parasitology Research. 88 (5). ss. 395-7. doi:10.1007/s00436-001-0588-x. PMID 12049454.
- ^ Kassirsky, I. A.; Plotnikov, N. N. (1 Ağustos 2003). Diseases of Warm Lands: A Clinical Manual. ss. 262-265. ISBN 978-1-4102-0789-0.
- ^ Organisation Mondiale de la Santé (1995). Drugs used in parasitic diseases. ss. 19-21. ISBN 978-92-4-140104-3.
- ^ McCallum, R. I. (1999). Antimony in medical history: an account of the medical uses of antimony and its compounds since early times to the present. Pentland Press. ISBN 978-1-85821-642-3.
- ^ Jang, H; Kim, S. (2000). "The effects of antimony trisulfide Sb S and zirconium silicate in the automotive brake friction material on friction". Journal of Wear. 239 (2). s. 229. doi:10.1016/s0043-1648(00)00314-8.
- ^ Randich, Erik; Duerfeldt, Wayne; McLendon, Wade; Tobin, William (2002). "A metallurgical review of the interpretation of bullet lead compositional analysis". Forensic Science International. 127 (3). ss. 174-91. doi:10.1016/S0379-0738(02)00118-4. PMID 12175947.
- ^ Lalovic, M.; Werle, H. (1970). "The energy distribution of antimonyberyllium photoneutrons". Journal of Nuclear Energy. 24 (3). s. 123. Bibcode:1970JNuE...24..123L. doi:10.1016/0022-3107(70)90058-4.
- ^ Ahmed, Syed Naeem (2007). Physics and engineering of radiation detection. s. 51. Bibcode:2007perd.book.....A. ISBN 978-0-12-045581-2.
- ^ Schmitt, H (1960). "Determination of the energy of antimony-beryllium photoneutrons". Nuclear Physics. Cilt 20. s. 220. Bibcode:1960NucPh..20..220S. doi:10.1016/0029-5582(60)90171-1.
- ^ Rabbeinu Hananel (1995), "Rabbeinu Hananel's Commentary on Tractate Shabbat", Metzger, David (Ed.), Perushe Rabenu Ḥananʼel Bar Ḥushiʼel la-Talmud (İbranice), Kudüs: Mekhon 'Lev Sameaḥ', s. 215 (Shabbat 109a), OCLC 319767989
- ^ a b c d NIOSH Pocket Guide to Chemical Hazards. "#0036". National Institute for Occupational Safety and Health (NIOSH).
- ^ Wakayama, Hiroshi (2003) "Revision of Drinking Water Standards in Japan" 18 Kasım 2017 tarihinde Wayback Machine sitesinde arşivlendi., Ministry of Health, Labor and Welfare (Japan); Table 2, p. 84
- ^ Shotyk, W.; Krachler, M.; Chen, B. (2006). "Contamination of Canadian and European bottled waters with antimony from PET containers". Journal of Environmental Monitoring. 8 (2). ss. 288-92. doi:10.1039/b517844b. PMID 16470261.
- ^ Guidelines for Drinking-water Quality (PDF) (4. bas.). World Health Organization. 2011. s. 314. ISBN 978-92-4-154815-1. 1 Şubat 2017 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 23 Mayıs 2020.
- ^ a b c "Arşivlenmiş kopya" (PDF). 23 Temmuz 2020 tarihinde kaynağından arşivlendi (PDF). Erişim tarihi: 23 Mayıs 2020.
- ^ "Antimony poisoning". Encyclopedia Britannica. 2 Şubat 2016 tarihinde kaynağından arşivlendi. Erişim tarihi: 23 Mayıs 2020.
- ^ Sundar, S; Chakravarty, J (2010). "Antimony Toxicity". International Journal of Environmental Research and Public Health. 7 (12). ss. 4267-4277. doi:10.3390/ijerph7124267. PMC 3037053 $2. PMID 21318007.


