பிரீடல்-கிராப்ட்சு வினை
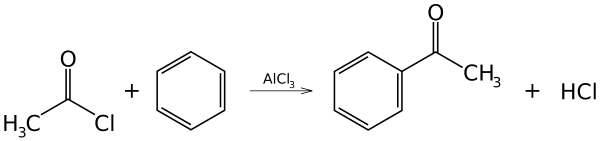
பிரீடல்-கிராப்ட்சு வினைகள் (Friedel–Crafts reactions) என்பவை 1877 ஆம் ஆண்டில் சார்லசு பிரீடல் மற்றும் யேம்சு கிராப்ட்சு என்ற இரண்டு வேதியியலர்களால் உருவாக்கப்பட்ட வினைகளின் தொகுப்பாகும். அரோமாட்டிக் வளையங்களில் பதிலிகளை பிரதியீடு செய்வதற்காக இவ்வினைகள் உருவாக்கப்பட்டன [1]. பிரீடல்-கிராப்ட்சு வினைகள் இரண்டு முக்கிய வகைகளாகப் பிரிக்கப்படுள்ளன. அவை 1. ஆல்க்கைலேற்ற பிரீடல் கிராப்ட்சு வினைகள், 2. அசைலேற்ற பிரீடல் கிராப்ட்சு வினைகள் என்பவை இவ்விரண்டு வகைகளாகும். எலக்ட்ரான்கவர் அரோமாட்டிக் பதிலீடு மூலமாகவே இவ்விரண்டு வகை வினைகளும் நிகழ்கின்றன. பிரீடல் கிராப்ட்சு வினைகளின் பொது வினைத்திட்டம் கீழே தரப்பட்டுள்ளது.
பிரீடல்-கிராப்ட்சு வினைகள் தொடர்பாக பல விமர்சனங்கள் எழுதப்பட்டன [2][3][4][5].
பிரீடல்-கிராப்ட்சு ஆல்க்கைலேற்றம்
[தொகு]வலிமையான இலூயிக் அமில வினையூக்கியின் உதவியால் அரோமாட்டிக் வளையத்துடன் ஓர் ஆல்க்கைல் ஆலைடை பதிலீடு செய்யும் வினையே பிரீடல்-கிராப்ட்சு ஆல்க்கைலேற்ற வினையாகும்[6].நீரற்ற பெர்ரிக் குளோரைடை வினையூக்கியாகப் பயன்படுத்தினால் ஆல்க்கைல் தொகுதி குளோரைடு அயனியின் முந்தைய தளத்துடன் இணைகிறது. இவ்வினையின் பொது வழிமுறை கீழே கொடுக்கப்பட்டுள்ளது[7]
ஆல்க்கைல் ஆலைடு இலூயிசு அமிலத்துடன் வினைபுரிந்து முதலில் கார்போ நேர்மின்னயனி உருவாகிறது. இலூயிசு அமிலத்திலிருந்து ஆலைடு இழக்கப்பட்டதால் ஆல்க்கைல் கார்போ நேர்மின்னயனி உருவாகிறது. அரோமாட்டிக் கார்பன் கார்பன் இரட்டைப்பிணைப்பில் உள்ள எலக்ட்ரான்கள் மின்னணு மிகுபொருளாகச் செயல்படுகின்றன. வளையயெக்சாடையீனைல் நேர்மின்னயனி இடநிலை உருவாகிறது. வினையின் இறுதிநிலையில் இரட்டைப் பிணைப்பு மறு ஆக்கம் செய்யப்பட்டு வினையூக்கியும் ஐதரசன் குளோரைடும் மீண்டும் தோன்றுகின்றன. வினைபடு பொருளைக்காட்டிலும் வினைவிளைபொருள் அதிகமான எலக்ட்ரான் கொடை பண்பைப் பெற்றிருப்பது இவ்வினையின் மிகப்பெரிய குறைபாடாகும். ஏனெனில் ஆல்க்கைல் சங்கிலி எலக்ட்ரான் கொடையளிக்கும் தன்மை கொண்டதாகும். எனவே, மற்றொரு ஐதரசன் அணு ஆல்க்கைல் தொகுதியுடன் பதிலீடு செய்யப்படுவதால் மூலக்கூறில் மிகை ஆல்கைலேற்றம் நிகழ்கிறது. ஒருவேளை குளோரின் அயனி மூன்றாம் நிலை கார்பன் அல்லது இரண்டாம் நிலை கார்பனுடன் இணைக்கப்படாமலிருந்தால், வினையில் உருவான கார்போ நேர்மின் அயனியானது (R+) கார்போ நேர்மின் அயனி மறுசீரமைப்பு வினையில் ஈடுபடுகிறது. முதன்மை கார்போ நேர்மின் அயனிகளைக் காட்டிலும் இரண்டாம் நிலை, மூன்றாம் நிலை கார்போ நேர்மின் அயனிகளின் ஒப்பீட்டளவு நிலைத்தன்மையே இவ்வினைத்திறனுக்கான காரணமாகும்[7] ஒரு மூலக்கூறினுள் உள்ள பெரிய குழுக்களின் அளவு தொடர்புடைய சிறிய குழுக்களுடன் ஒப்பிடும்போது மூலக்கூறுகளில் நடைபெறும் வேதி வினைகள் தடுக்கப்படுவது கண்டறியப்பட்டது. எனவே இடக்காரணி ஆல்க்கலேற்ற வினைகளின் எண்ணிக்கையை கட்டுபடுத்த இயலும் என கருதப்படுகிறது. ஒர் ஆல்க்கீன் மற்றும் என்-புரோமோசக்சினைமைடில் இருந்து தருவிக்கப்பட்ட மின்னணுகவரியாக புரோமோனியம் அயனி இருப்பதை ஓர் ஆய்வு தெரிவிக்கிறது :[8]
இவ்வினையின் ஆலோனியம் அயனி உருவாக்கத்தில் என்-புரோமோசக்சினைமைடு ஆலசன் கொடையாளியை, சமாரியம்(III) திரிப்லேட்டு செயலூக்குவதாகக் நம்பப்படுகிறது.
பிரீடல்-கிராப்ட்சு அசைலேற்றம்
[தொகு]ஒரு வலுவான இலூயிக் அமில வினையூக்கியைப் பயன்படுத்தி அரோமாட்டிக் வளையங்களில் அசைல் குளோரைடை அசைலேற்றம் செய்யும் வினையே பிரீடல்-கிராப்ட்சு அசைலேற்ற வினை எனப்படும். பிரீடல்-கிராப்ட்சு அசைலேற்ற வினையை அமிலநீரிலிகளைப் பயன்படுத்தியும் அசைலேற்றம் செய்ய இயலும்[9]. பிரீடல்-கிராப்ட்சு ஆல்க்கைலேற்ற வினைக்கு பரிந்துரைக்கப்படும் நிபந்தனைகள் யாவும் இவ்வினைக்கும் பொருந்தும். கார்பனைல் தொகுதியின் எலக்ட்ரான் எடுத்துக் கொள்ளும் இயல்பு காரணமாக ஆல்க்கைலேற்ற வினையைக் காட்டிலும் இவ்வினைக்கு கூடுதல் சிறப்பம்சங்கள் உண்டு. கார்பனைல் தொகுதியின் எலக்ட்ரான் எடுத்துக் கொள்ளும் இயல்பு காரணமாக விளைபொருள் கீட்டோன் எப்போதும் வினைபடு மூலக்கூறைக் காட்டிலும் குறைவான வினைத்திறனையே கொண்டுள்ளது. எனவே, பன்மடங்கு அசைலேற்ற வினை நிகழ்வதற்கு சாத்தியமில்லை.
அசைல் குளோரைடு வினைப்பொருளின் நிலைத்தன்மையே பிரீடல் கிராப்ட்சு வினையின் இயலுந்த்திறனுக்கு அடிப்படையாக உள்ளது. உதாரணமாக பார்மைல் குளோரைடு மிகவும் குறைவான நிலைத்தன்மை கொண்டது என்பதால் அதை தனித்துப்பிரித்தல் என்பது இயலாததாக உள்ளது. பிரீடல் கிராப்ட்சு வினையின் வழியாகத் தொகுப்பு முறையில் பென்சால்டிகைடு தயாரிக்கையில் பார்மைல் குளோரைடு தளத்திலேயே தயாரிக்க வேண்டியதாக உள்ளது.
காட்டர்மேன் கோச் வினையின் வழியாக இவ்வினை நிறைவேற்றப்படுகிறது. காட்டர்மேன் கோச் வினையில் பென்சீனுடன் கார்பனோராக்சைடும் ஐதரசன் குளோரைடும் உயர் அழுத்தத்தில் சூடுபடுத்தப்படுகிறது. அலுமினியம் குளோரைடும் செப்பு(I) குளோரைடும் கலந்த கலவை வினையூக்கியாகச் செயல்படுகிறது. மற்றொரு பிரீடல் கிராப்ட்சு அசைலேற்றத்தில் அசிட்டைல் குளோரைடு (எத்தனாயில் குளோரைடு) CH3COCl அசைலேற்றியாகவும், அலுமினியம் குளோரைடு (AlCl3) வினைவேக மாற்றியாகவும் பயன்படுகின்றன. இவ்வினையில் எத்தனாயில் (அசிட்டைல்) தொகுதி பென்சீனுடன் சேர்கிறது.
இவ்வினையின் வினைவழிமுறை மின்கவர் அரோமாட்டிக் பதிலீட்டுவினையாகும் அமீன்களை அமைடுகளாகவும், ஆல்ககால்களை எசுத்தர்களாகவும் அசைலேற்றம் செய்ய அசைல் ஆலைடுகள் மற்றும் கார்பாக்சிலிக் அமிலங்களின் அமில நீரிலிகள் கூட பொதுவாக அசைலேற்றிகளாகப் பயன்படுத்தப்படுவதுண்டு. அமீன்கள் மற்றும் ஆல்ககால்கள் போன்றவை மின்னணு மிகுபொருட்களாகும். எனவே இவ்வினையின் வினை வழிமுறை கருநாட்டப் பதிலீட்டு வினையாகும்.
பிரீடல்-கிராப்ட்சு ஐதராக்சி ஆல்க்கைலேற்றம்
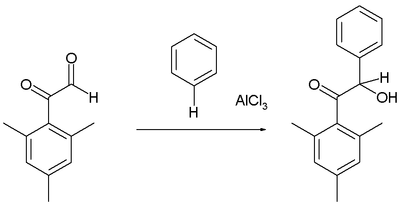
[தொகு]சில ஆல்டிகைடு மற்றும் கீட்டோன்களுடன் அரீன்கள் வினைபுரிந்து ஐதராக்சி ஆல்க்கைலேற்ற விளைபொருட்களைக் கொடுக்கின்றன. உதாரணமாக மெசிட்டைல் வழிப்பொருளான கிளையாக்சால் உடன் பென்சீன் வினைபுரிந்து பென்சோயினும் ஒரு ஆல்ககாலும் உருவாகின்றன. ஆனால் கார்பனைல் தொகுதி உருவாவதில்லை[10] to form a benzoin with an மதுசாரம் rather than a கார்பனைல் group:
பிரீடல் கிராப்ட்சு சல்போனைலேற்றம்
[தொகு]பிரீடல் கிராப்ட்சு வினை நிபந்தனைகளுக்கு உட்பட்டு அரீன்கள் சல்போனைல் ஆலைடுகள் மற்றும் சல்போனிக் அமில நீரிலிகள் போன்றவற்றுடன் வினைபுரிந்து சல்போன்களைக் கொடுக்கிறது. பொதுவாக AlCl3, FeCl3, GaCl3, BF3, SbCl5, BiCl3 and Bi(OTf)3, among others.[11][12] போன்றவை வினையூக்கிகளாகப் பயன்படுத்தப்படுகின்றன. 2-பீனைல்-1-ஈத்தேன்சல்போனைல் குளோரைடு, 3-பீனைல்-1-புரோபேன்சல்போனைல் குளோரைடு, 4- பீனைல்-1-பியூட்டேன்சல்போனைல் குளோரைடு போன்றவற்றுடன் நைட்ரோபென்சீனும் AlCl3 யும் சேர்த்து சூடுபடுத்தினால் அரீன்களின் மூலக்கூறினுள் பிரீடல் கிராப்ட்சு வளையமாதல் வினை நிகழ்கிறது[13]. சல்பீனைல் மற்றும் சல்பைனைல் குளோரைடுகளும் பிரீடல் கிராப்ட்சு வகை வினைகளில் ஈடுபட்டு முறையே சல்பைடுகள் மற்றும் சல்பாக்சைடுகளைக் கொடுக்கின்றன[14]. அரைல் சல்பீனைல் குளோரைடுகள் மற்றும் ஈரரைல் சல்பாக்சைடுகள் இரண்டையும் அரீன்களை BiCl3, Bi(OTf)3, LiClO4 அல்லது NaClO4 போன்ற வினையூக்கிகள் முன்னிலையில் தயோனைல் குளோரைடுகளுடன் வினைபுரியச் செய்து தயாரிக்கலாம்[15][16]. பிரீடல் கிராப்ட்சு வினை பல்வேறு பாரம்பரிய பெயர் வினைகளுடன் தொடர்பு கொண்டுள்ளது.
- அசைலேற்ற வினைவிளை பொருளை கிளெம்மென்சன் ஒடுக்க வினை வழியாக ஆல்க்கைலேற்ற விளைபொருளாக மாற்றலாம் [17][18][19]
- பென்சீனிலிருந்து காட்டர்மான் –கோச் வினையைப் பயன்படுத்தி பென்சால்டிகைடைத் தயாரிக்க இயலும் [20].
- அரீன்கள் ஐதரோசயனிக் அமிலத்துடன் ஈடுபடும் வினைகளை காட்டர்மான் வினை விளக்குகிறது [21].
- அரீன்கள் நைட்ரைல்களுடன் ஈடுபடும் வினைகளை அவுபென்-ஒய்சிஃசு வினை விவரிக்கிறது.
- ஒரு வினைப்பொருளாக அரோமாட்டிக் பீனைல் எசுத்தர் ஈடுபடும் வினை திருத்த வினை பிரைசு மறுசீரமைப்பு வினை என்ற பெயரால் அழைக்கப்படுகிறது.
- இரண்டு அரீன்களின் நேரடியான பிணைப்பு வினை சிகோல் வினை என்ற பெயரால் அழைக்கப்படுகிறது. சில சந்தர்ப்பங்களில் பிரீடல் கிராப்ட்சு அரைலேற்றம் என்ற பெயராலும் அழைக்கப்படுகிறது [22][23].
- சிங்கே-சூகில் வினையி பாரா கிரெசால் ஒரு சைக்ளோயெக்சாடையீனோன் உடன் டெட்ரா குளோரோ மெத்தேன் ஆக ஆல்க்கைலேற்றம் செய்யப்படுகிறது [24].
- பிளாங்க்கு குளோரோமெத்திலேற்ற வினையில் ஓர் அரீனுடன் குளோரோமெத்தில் தொகுதி சேர்க்கப்படுகிறது. அரீனுடன் பார்மால்டிகைடு, ஐதரோகுளோரிக் அமிலம் மற்றும் துத்தநாகக் குளோரைடு முதலியனவற்றை சேர்க்கும்போது இவ்வினை நிகழ்கிறது [25][26].
- போகெர்ட்டு-குக் தொகுப்பு வினையில் நீர் நீக்கமும், மாற்றியனாக்கல் வினையும் நிகழ்ந்து பினான்தரீனின் ஆக்டாஐதரோ வழிப்பொருள் உருவாகிறது [27]
- டார்சென்சு–நெனிட்செசுக்கு கீட்டோன் தொகுப்பு வினையில் சைக்ளோயெக்சீனும் அசிட்டைல் குளோரைடும் வினைபுரியும்போது அசைலேற்றம் நிகழ்ந்து மெத்தில்சைக்ளோயெக்சினைல் கீட்டோன் உருவாகிறது.
தொடர்புடைய நெனிட்செசுக்கு ஒடுக்க அசைலேற்ற வினையில் ஒரு நிறைவுற்ற ஐதரோகார்பன் சேர்க்கப்பட்டு மெத்தில்சைக்ளோயெக்சைல்கீட்டோன் உருவாகிறது.
- நெங்கி வினையில் துத்தநாகக் குளோரைடு முன்னிலையில் பீனால்களும் அமிலங்களும் வளைய அசிட்டைலேற்ற வினையில் ஈடுபடுகின்றன [28].
- பசுமை வேதியியலில் அலுமினியம் குளோரைடு வினையூக்கிக்குப் பதிலாக கிராபைட்டு ஆல்க்கைலேற்ற வினைக்கு பயன்படுத்தப்படுகிறது. இம்மாறுபாடு முதல்நிலை ஆலைடுகளுக்குப் பொருந்துவதில்லை [29].
சாயங்கள்
[தொகு]டிரையரைல்மெத்தேன் மற்றும் சாந்தீன் சாயங்கள் தயாரிக்கும் தொகுப்பு வினைகளில் பிரீடல்-கிராப்ட்சு வினைகள் பயன்படுத்தப்படுகின்றன[30]. உதாரணம்: தைமோல் மற்றும் தாலிக் நீரிலி வினையில் தைமோல்தாலின் நிறங்காட்டி தொகுக்கப்படுதல்.
துத்தநாகக் குளோரைடு முன்னிலையில் தாலிக் நீரிலியுடன் இரிசோர்சினால் வினைபுரிந்து புளோரோபோர் புளோர்சீன் உருவாகிறது. இரிசோர்சினாலுக்குப் பதிலாக என்,என்,டையெத்திலமினோபீனால் பயன்படுத்தினால் ரோடாமின் பி உருவாகிறது.
அவோர்த் வினை
[தொகு]1-டெட்ராலோன் தயாரிப்பதற்குரிய மரபுசார் முறையாக அவோர்த் வினை கருதப்படுகிறது[31]. பென்சீன் இவ்வினையில் சக்சினிக் நீரிலியுடன் வினைபுரிகிறது. இடைநிலை விளைபொருள் ஒடுக்கப்பட்டு கூடுதலாக அமிலம் சேர்க்கப்பட்டு இரண்டாவது அசைலேற்றம் நிகழ்கிறது[32]
இதேபோன்ற மற்றொரு வினையில் நாப்தலீன் மற்றும் சக்சினிக் நீரிலி இரண்டும் தொடர் வினைபுரிந்து பினாந்தரீன் தொகுக்கப்படுகிறது.
மேற்கோள்கள்
[தொகு]- ↑ Friedel, C.; Crafts, J. M. (1877) "Sur une nouvelle méthode générale de synthèse d’hydrocarbures, d’acétones, etc.," Compt. Rend., 84: 1392 & 1450.
- ↑ Price, C. C. (1946). "The Alkylation of Aromatic Compounds by the Friedel-Crafts Method". Org. React. 3: 1. doi:10.1002/0471264180.or003.01. பன்னாட்டுத் தரப்புத்தக எண்:0471264180.
- ↑ Groves, J. K. (1972). "The Friedel–Crafts acylation of alkenes". Chem. Soc. Rev. 1: 73. doi:10.1039/cs9720100073.
- ↑ Eyley, S. C. (1991). "The Aliphatic Friedel–Crafts Reaction". Comp. Org. Syn. 2: 707–731. doi:10.1016/B978-0-08-052349-1.00045-7. பன்னாட்டுத் தரப்புத்தக எண்:978-0-08-052349-1.
- ↑ Heaney, H. (1991). "The Bimolecular Aromatic Friedel–Crafts Reaction". Comp. Org. Syn. 2: 733–752. doi:10.1016/B978-0-08-052349-1.00046-9. பன்னாட்டுத் தரப்புத்தக எண்:978-0-08-052349-1.
- ↑ Rueping, M.; Nachtsheim, B. J. (2010). "A review of new developments in the Friedel–Crafts alkylation – From green chemistry to asymmetric catalysis". Beilstein J. Org. Chem. 6 (6). doi:10.3762/bjoc.6.6.
- ↑ 7.0 7.1 வார்ப்புரு:March6th
- ↑ Hajra, S.; Maji, B.; Bar, S. (2007). "Samarium Triflate-Catalyzed Halogen-Promoted Friedel–Crafts Alkylation with Alkenes". Org. Lett. 9 (15): 2783–2786. doi:10.1021/ol070813t.
- ↑ Somerville, L. F.; Allen, C. F. H. (1933). "β-Benzoylpropionic acid". Organic Syntheses 13: 12. doi:10.15227/orgsyn.013.0012.
- ↑ Fuson, R. C.; Weinstock, H. H.; Ullyot, G. E. (1935). "A New Synthesis of Benzoins. 2′,4′,6′-Trimethylbenzoin". J. Am. Chem. Soc. 57 (10): 1803–1804. doi:10.1021/ja01313a015.
- ↑ Truce, W. E.; Vriesen; C. W. (1953). "Friedel—Crafts Reactions of Methanesulfonyl Chloride with Benzene and Certain Substituted Benzenes". J. Am. Chem. Soc. 75 (20): 5032–5036. doi:10.1021/ja01116a043.
- ↑ Répichet, S.; Le Roux, C.; Hernandez, P.; Dubac, J.; Desmurs, J. R. (1999). "Bismuth(III) Trifluoromethanesulfonate: An Efficient Catalyst for the Sulfonylation of Arenes". The Journal of Organic Chemistry 64 (17): 6479–6482. doi:10.1021/jo9902603.
- ↑ Truce, W. E.; Milionis, J. P. (1952). "Friedel-Crafts Cyclization of ω-Phenylalkanesulfonyl Chlorides". J. Am. Chem. Soc. 74 (4): 974–977. doi:10.1021/ja01124a031.
- ↑ Fujisawa, T.; Kakutani, M.; Kobayashi, N. (1973). "On the Reaction of p-Toluenesulfinyl Chloride with Anisole". Bull. Chem. Soc. Jpn. 46 (11): 3615–3617. doi:10.1246/bcsj.46.3615. https://archive.org/details/sim_bulletin-of-the-chemical-society-of-japan_1973-11_46_11/page/3615.
- ↑ Le Roux, C.; Mazières, S. P.; Peyronneau, M.; Roques, N. (2003). "Catalytic Lewis Acid Activationof Thionyl Chloride: Application to the Synthesis of ArylSulfinyl Chlorides Catalyzed by Bismuth(III) Salts". Synlett (5): 0631–0634. doi:10.1055/s-2003-38358.
- ↑ Bandgar, B. P.; Makone, S. S. (2004). "Lithium/Sodium Perchlorate Catalyzed Synthesis of Symmetrical Diaryl Sulfoxides". Syn. Commun. 34 (4): 743–750. doi:10.1081/SCC-120027723.
- ↑ Clemmensen, E. (1913). "Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure". Chemische Berichte 46: 1837–1843. doi:10.1002/cber.19130460292.
- ↑ Clemmensen, E. (1914). "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe". Chemische Berichte 47: 51–63. doi:10.1002/cber.19140470108.
- ↑ Clemmensen, E. (1914). "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe. (III. Mitteilung.)". Chemische Berichte 47: 681–687. doi:10.1002/cber.191404701107.
- ↑ Gattermann, L.; Koch, J. A. (1897). "Eine Synthese aromatischer Aldehyde". Ber. 30: 1622–1624. doi:10.1002/cber.18970300288.
- ↑ L. Gattermann; W. Berchelmann (1898). "Synthese aromatischer Oxyaldehyde". Berichte der deutschen chemischen Gesellschaft 31 (2): 1765–1769. doi:10.1002/cber.18980310281.
- ↑ M B Smith, J March. March's Advanced Organic Chemistry (Wiley, 2001) (பன்னாட்டுத் தரப்புத்தக எண் 0-471-58589-0)
- ↑ Grzybowski, M.; Skonieczny, K.; Butenschön, H.; Gryko, D. T. (2013). "Comparison of Oxidative Aromatic Coupling and the Scholl Reaction". Angew. Chem. Int. Ed. 52: 9900–9930. doi:10.1002/anie.201210238.
- ↑ Zincke, Th.; Suhl. R. (1906). "Ueber die Einwirkung von Tetrachlorkohlenstoff und Aluminiumchlorid auf p-Kresol und p-Kresolderivate". Chemische Berichte 39 (4): 4148–4153. doi:10.1002/cber.190603904115.
- ↑ Gustave Louis Blanc (1923). Bulletin de la Société chimique de France [4] 33: 313–319.
- ↑ G. Grassi and C. Maselli (1898) "Su alcuni derivati clorurati de trossimetilene" (On some chlorinated derivatives of 1,3,5-trioxane), Gazzetta Chimica Italiana, 28 (part 2) : 477-500 ; see especially p. 495.
- ↑ This reaction with பாஸ்பரஸ் பென்டாக்சைடு: Kamp, J. V. D.; Mosettig, E. (1936). "Trans- and Cis-As-Octahydrophenanthrene". Journal of the American Chemical Society 58 (6): 1062–1063. doi:10.1021/ja01297a514.
- ↑ Nencki, M.; Sieber, N. (1881). "Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen". J. Prakt. Chem. 23: 147–156. doi:10.1002/prac.18810230111.
- ↑ Sereda, Grigoriy A.; Rajpara, Vikul B. (2007). "A Green Alternative to Aluminum Chloride Alkylation of Xylene". J. Chem. Educ. 2007 (84): 692. doi:10.1021/ed084p692. Bibcode: 2007JChEd..84..692S.
- ↑ McCullagh, James V.; Daggett, Kelly A. (2007). "Synthesis of Triarylmethane and Xanthene Dyes Using Electrophilic Aromatic Substitution Reactions". J. Chem. Educ. 84: 1799. doi:10.1021/ed084p1799.
- ↑ Haworth, Robert Downs (1932). "Syntheses of alkylphenanthrenes. Part I. 1-, 2-, 3-, and 4-Methylphenanthrenes". J. Chem. Soc.: 1125. doi:10.1039/JR9320001125.
- ↑ Li, Jie Jack (2003) Name Reactions: A Collection of Detailed Reaction Mechanisms, Springer, பன்னாட்டுத் தரப்புத்தக எண் 3-540-40203-9, p. 175.