ফ্রিডেল–ক্রাফট বিক্রিয়া
| ফ্রিডেল–ক্রাফটস বিক্রিয়া | |
|---|---|
| যার নামে নামকরণ হয় | চার্লস ফ্রিডেল জেমস ক্রাফ্টস |
| বিক্রিয়ার ধরন | সংযোজন বিক্রিয়া |
| শনাক্তকারী | |
| আরএসসি অন্টোলজি আইডি | RXNO:০০০০৩৬৯ (ইংরেজি) |

ফ্রিডেল–ক্রাফ্টস বিক্রিয়া ১৮৭৭ সালে চার্লস ফ্রিডেল এবং জেমস ক্রাফ্টস দ্বারা আবিষ্কৃত কয়েকটি জৈব বিক্রিয়ার সেট যা অ্যারোমেটিক রিংয়ের সাথে বিভিন্ন মূলক সংযুক্ত করে। [১] ফ্রিডেল–ক্রাফট বিক্রিয়া প্রধানত দুই ধরনের: অ্যালকাইলেশন বিক্রিয়া এবং অ্যাসিলেশন বিক্রিয়া। উভয় বিক্রিয়াই ইলেক্ট্রন-আকর্ষী অ্যারোমেটিক প্রতিস্থাপনের মাধ্যমে অগ্রসর হয়। [২][৩][৪][৫]
ফ্রিডেল–ক্রাফট অ্যালকাইলেশনস (ed)
[সম্পাদনা]| ফ্রিডেল–ক্রাফট অ্যালকাইলেশন | |
|---|---|
| যার নামে নামকরণ হয় | চার্লস ফ্রিডেল জেমস ক্রাফ্টস |
| বিক্রিয়ার ধরন | সংযোজক বিক্রিয়া |
| শনাক্তকারী | |
| অর্গানিককেমিস্ট্রি প্রবেশদ্বার | friedel-crafts-alkylation (ইংরেজি) |
| আরএসসি অন্টোলজি আইডি | RXNO:০০০০০৪৬ (ইংরেজি) |
ফ্রিডেল–ক্রাফট অ্যালকাইলেশনে একটি অ্যারোমেটিক রিং এর সাথে অ্যালকাইল হ্যালাইডের বিক্রিয়া ঘটিয়ে এতে অ্যালকাইল মূলক যুক্ত করা হয়। এ বিক্রিয়ায় অনুঘটক হিসাবে একটি শক্তিশালী লুইস অ্যাসিড যেমন: অ্যালুমিনিয়াম ক্লোরাইড, ফেরিক ক্লোরাইড বা অন্যান্য এমএক্সএন বিকারক ব্যবহার করা হয়। [৬] টারশিয়ারি অ্যালকাইল হ্যালাইডের বিক্রিয়ায় সাধারণ কৌশল নিচে দেখানো হয়েছে। [৭]
প্রাইমারি (এবং সম্ভবত সেকেন্ডারি) অ্যালকাইল হ্যালাইডের ক্ষেত্রে, মুক্ত কার্বোকেশনের চেয়ে লুইস এসিডের সাথে একটি কার্বোকেশন-সদৃশ মিশ্রণ, [R(+)---(X---MXn)(–)] গঠন করার সম্ভাবনা বেশি।
এই বিক্রিয়াটির অসুবিধা হচ্ছে, বিক্রিয়কের চেয়ে উৎপাদ বেশি নিউক্লিওফিলিক। এর কারণ অ্যালকাইল গোষ্ঠীগুলি ফ্রিডেল–ক্রাফ্টস বিক্রিয়ার সক্রিয়ক । ফলস্বরূপ, অতিরিক্ত অ্যালকাইলেশন ঘটতে পারে। ১,৪-ডাইমিথক্সিবেনজিনের টি-বিউটাইলেশনের মত এই বিক্রিয়ায় অ্যালকাইলেশনের সংখ্যা সীমিত করতে স্টেরিক বাধা সৃষ্টি হতে পারে। [৮]
অধিকন্তু, অন্তঃআণবিক দৃষ্টিকোণ থেকে এই বিক্রিয়াটি কেবলমাত্র প্রাইমারি অ্যালকাইল হ্যালাইডের জন্য কার্যকরী যখন একটি ৫ বা ৬ সদস্যযুক্ত রিং গঠিত হয়। আন্তঃআণবিক ক্ষেত্রে, বিক্রিয়াটি টারশিয়ারি অ্যালকাইলেটিং বিক্রিয়ক, কিছু সেকেন্ডারি অ্যালকাইলেটিং বিক্রিয়ক (যার জন্য কার্বোকেশনের ফলে পুনর্বিন্যাসের অবক্ষয় ঘটে), এবং যে সব অ্যালকাইলেটিং বিক্রিয়ক স্থিতিশীল কার্বোকেশন উৎপন্ন করে (যেমন, বেনজািলিক বা অ্যালাইলিক) তাদের মধ্যে সীমাবদ্ধ। প্রাথমিক অ্যালকাইল হ্যালাইডের ক্ষেত্রে, কার্বোকেশন-সদৃশ মিশ্রণটি (R(+)---X---Al(-)Cl3) একটি কার্বোকশন পুনর্বিন্যাস বিক্রিয়ার মধ্য দিয়ে যায়। এর ফলে সেকেন্ডারি বা টারশিয়ারি কার্বোকেশন থেকে সম্পূর্ণভাবে পুনর্নির্মিত একটি উৎপাদ তৈরি হয়। [৭]
অ্যালকাইলেশন কেবলমাত্র অ্যালকাইল হ্যালাইডের মধ্যে সীমাবদ্ধ নয়: ফ্রিডেল–ক্রাফট বিক্রিয়া যে কোনো অন্তর্বর্তী কার্বোক্যাটায়ন থেকেই ঘটানো সম্ভব। এসব কার্বোক্যাটায়ন বিভিন্নভাবে পাওয়া যেতে পারে যেমন, অ্যালকিন এবং প্রোটিক অ্যাসিড, লুইস অ্যাসিড, ইনোন এবং ইপোক্সাইড। এর একটি উদাহরণ হচ্ছে, বেনজিন এবং মিথঅ্যালাইল ক্লোরাইড থেকে নিওফাইল ক্লোরাইডের সংশ্লেষণ:[৯]
এক গবেষণায় ইলেক্ট্রন-আকর্ষী হচ্ছে একটি অ্যালকিন এবং এনবিএস থেকে প্রাপ্ত ব্রোমোনিয়াম আয়ন:[১০]
এই বিক্রিয়াটিতে সামারিয়াম(III) ট্রাইফ্লেট, হ্যালোনিয়াম আয়ন গঠনকালে এনবিএস হ্যালোজেন দাতাকে সক্রিয় করে বলে ধারণা করা হয়।
ফ্রিডেল–ক্রাফট ডিঅ্যালকাইলেশন
[সম্পাদনা]ফ্রিডেল–ক্রাফট বিক্রিয়া প্রতিবর্তনযোগ্য বলে ধারণা করা হয়। বিপরীতমুখী ফ্রিডেল–ক্রাফট বিক্রিয়া বা ফ্রিডেল–ক্রাফট ডিঅ্যালকাইলেশনে, প্রোটন বা অন্যান্য লুইস অ্যাসিডের উপস্থিতিতে অ্যালকাইল গ্রুপ অপসারণ করা হয়।
উদাহরণস্বরূপ, বেনজিনের সাথে ইথাইল ব্রোমাইডের একাধিক সংযোজনে, প্রথম মনো প্রতিস্থাপনের পর অ্যালকাইল কার্যকরী মূলকের উপস্থিতির কারণে অর্থো ও প্যারা প্রতিস্থাপন প্রত্যাশা করা হয়। কিন্তু, প্রকৃতপক্ষে এ বিক্রিয়ায় 1,3,5-ট্রাইইথাইলবেনজিন উৎপন্ন হয় যেখানে সকল অ্যালকাইল মূলক মেটা প্রতিস্থাপক । [১১] তাপগতীয় বিক্রিয়া নিয়ন্ত্রণের মাধ্যমে তাপগতীয়ভাবে অনুকূল মেটা প্রতিস্থাপন নিশ্চিত করা হয় ও রাসায়নিক সাম্যাবস্থার মাধ্যমে স্টেরিক বাধা হ্রাসের ফলে অর্থো-প্যারা প্রতিস্থাপন অপেক্ষাকৃত কম অনুকূল হয়ে থাকে। অর্থাৎ এই বিক্রিয়ার চূড়ান্ত উৎপাদ কয়েক ধাপে সংঘটিত অ্যালকাইলেশন ও ডিঅ্যালকাইলেশনের সমষ্টি। [১২]
ফ্রিডেল–ক্রাফট অ্যাসিলেশন
[সম্পাদনা]| ফ্রিডেল–ক্রাফট অ্যাসিলেশন | |
|---|---|
| যার নামে নামকরণ হয় | চার্লস ফ্রিডেল জেমস ক্রাফ্টস |
| বিক্রিয়ার ধরন | সংযোজক বিক্রিয়া |
| শনাক্তকারী | |
| অর্গানিককেমিস্ট্রি প্রবেশদ্বার | friedel-crafts-acylation (ইংরেজি) |
| আরএসসি অন্টোলজি আইডি | RXNO:০০০০০৪৫ (ইংরেজি) |
ফ্রিডেল–ক্রাফট অ্যাসিলেশনে অ্যারোমেটিক রিংয়ের অ্যাসিলেশন ঘটে। অ্যাসিলেশন বিকারক হিসেবে সচরাচর অ্যাসাইল ক্লোরাইড ব্যবহার করা হয়। প্রচলিত লুইস এসিড প্রভাবক হচ্ছে অ্যাসিড ও অ্যামোনিয়াম ক্লোরাইড। তবে, কিটোন উৎপাদ লুইস অ্যাসিড যেমন AlCl3 এর সাথে একটি তুলনামূলক স্থিতিশীল যৌগ গঠন করায়, প্রভাবকের পরিমাণ স্টকিওমেট্রিক বা তার বেশি হতে হবে। যা ফ্রিডেল–ক্রাফট অ্যালকাইলেশনের বিপরীত যেখানে "প্রভাবক" প্রতিনিয়ত পুনর্গঠিত হতে থাকে। ফ্রিডেল–ক্রাফট অ্যাসিলেশন অ্যাসিড অ্যানহাইড্রাইডের ক্ষেত্রেও হতে পারে। [১৩] এই বিক্রিয়ার কৌশল ফ্রিডেল–ক্রাফট অ্যালকাইলেশনের অনুরূপ। অ্যালকাইলেশন বিক্রিয়ার তুলনায় এর বেশ কয়েকটি সুবিধা রয়েছে। কার্বনাইল মূলকের ইলেকট্রন-গ্রাহী প্রভাবের কারণে, কিটোন উৎপাদটি সর্বদাই মূল অণুর থেকে কম সক্রিয় হয়, যার ফলে একাধিক অ্যাসিলেশন ঘটে না। এছাড়াও, অ্যাসিলিয়াম আয়ন একটি রেজোন্যান্স কাঠামোর দ্বারা স্থিতিশীল হয় যেখানে ধনাত্মক আধানটি অক্সিজেনে অবস্থান করে। এর ফলে কার্বোক্যাটায়ন পুনর্গঠিত হয় না।
ফ্রিডেল–ক্রাফট অ্যাসিলেশনের কার্যকারিতা নির্ভর করে অ্যাসাইল ক্লোরাইড বিকারকের স্থিতিশীলতার উপর। উদাহরণস্বরূপ, ফর্মাইল ক্লোরাইড বিচ্ছিন্ন করার জন্যে খুবই অস্থিতিশীল। তাই, ফ্রিডেল–ক্রাফট অ্যাসিলেশন পদ্ধতিতে বেনজালডিহাইড সংশ্লেষণ করতে সিটুতে ফর্মাইল ক্লোরাইডের সংশ্লেষণ প্রয়োজন। এটি গ্যাটারমান–কচ বিক্রিয়ার দ্বারা করা যায়, যেখানে উচ্চচাপে অ্যালুমিনিয়াম ক্লোরাইড কিউপ্রাস ক্লোরাইড প্রভাবকের উপস্থিতিতে বেনজিনের সাথে কার্বন মনোক্সাইড ও হাইড্রোজেন ক্লোরাইডের বিক্রিয়া ঘটানো হয়।
বিক্রিয়া কৌশল
[সম্পাদনা]এই বিক্রিয়া অ্যাসিলিয়াম কেন্দ্র গঠনের মাধ্যমে অগ্রসর হয়। AlCl4− কর্তৃক অ্যারেনিয়াম আয়নের ডিপ্রোটোনেশনের মাধ্যমে বিক্রিয়াটি সম্পূর্ণ হয়, যা AlCl3 প্রভাবককে পুনর্গঠিত করে। তা সত্ত্বেও অ্যালকাইলেশন বিক্রিয়ার বিপরীতে, উৎপন্ন কিটোন হচ্ছে একটি মাঝারি মানের নিউক্লিওফাইল যা অ্যালুমিনিয়াম ট্রাইক্লোরাইডের সাথে একটি কমপ্লেক্স গঠন করে। সাধারনত বিক্রিয়ার অবস্থায় এই কমপ্লেক্সের নির্মাণ অপরিবর্তনীয় হয়। এর ফলেNlCl3 এর স্টকিওমেট্রিক পরিমাণের প্রয়োজন। উদ্দিষ্ট কিটোন তৈরিতে প্রয়োজনীয় জলীয় ক্রিয়াকলাপের ফলে এই কমপ্লেক্সটি নষ্ট হয়ে যায়। উদাহরণস্বরূপ, ডিঅক্সিবেনজিনের মৌলিক সংশ্লেষণে সীমাবদ্ধকারী বিকারক ফিনাইল্যাসিটাইল ক্লোরাইডের ১.১ সমপরিমাণ AlCl3 প্রয়োজন। [১৪]
চাইলে, উৎপন্ন কিটোনকে অলফ–কিশনার রিডাকশন অথবা ক্লেমেনসেন রিডাকশনের মাধ্যমে ক্রমান্বয়ে সংশ্লিষ্ট অ্যালকেন উৎপাদে পরিণত করা যায়। এই বিক্রিয়ার ফলাফল ফ্রিডেল–ক্রাফটস অ্যালকাইলেশনের অনুরূপ, কেবলমাত্র এতে পুনর্বিন্যাস সম্ভব নয়। [১৫]
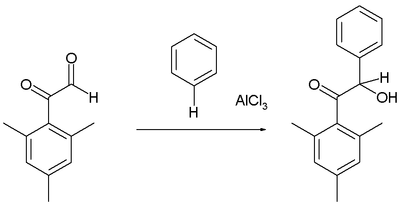
ফ্রিডেল–ক্রাফটস হাইড্রক্সিঅ্যালকাইলেশন
[সম্পাদনা]অ্যারিনসমূহ কয়েকটি অ্যালডিহাইড ও কিটোনের সাথে বিক্রিয়া করে হাইড্রক্সিঅ্যালকাইলেটেড উৎপাদ তৈরি করে। উদাহরণস্বরূপ, বেনজিনের সাথে গ্লাইয়ক্সাল শ্রেণীভুক্ত মেসিটাইলের বিক্রিয়া:[১৬]
স্বাভাবিকভাবেই, অ্যালডিহাইড মূলক ফেনোন অপেক্ষা অধিক সক্রিয় ইলেকট্রনগ্রাহী।
সুযোগ এবং বৈচিত্র্য
[সম্পাদনা]এই বিক্রিয়াটি কয়েকটি মৌলিক নামের বিক্রিয়ার সাথে সম্পর্কিত:
- ক্লেমেনসেন রিডাকশনের মাধ্যমে অ্যাসিলেটেড উৎপাদসমূহকে অ্যালকাইলেটেড উৎপাদে পরিণত করা যায়। [১৭][১৮][১৯]
- গ্যাটারমান–কচ বিক্রিয়ার দ্বারা বেনজিন থেকে বেনজালডিহাইড সংশ্লেষণ করা যায়। [২০]
- গ্যাটারমান বিক্রিয়ার দ্বারা অ্যারিনের সাথে হাইড্রোসায়ানিক অ্যাসিডের বিক্রিয়া ব্যাখ্যা করা যায়। [২১]
- হওবেন–হোয়েশ বিক্রিয়া অ্যারিনের সাথে নাইট্রাইলের বিক্রিয়া ব্যাখ্যা করে। [২২][২৩]
- অ্যারোমেটিক ফিনাইল এস্টার বিক্রিয়ক হিসেবে একটি পরিবর্তিত বিক্রিয়াকে ফ্রাইস রিঅ্যারেঞ্জমেন্ট বলা হয়।
- শোল বিক্রিয়ায় দুটি অ্যারিন একত্রে সরাসরি সংযুক্ত হয় (কখনও কখনও ফ্রিডেল–ক্রাফটস অ্যারাইলেশনও বলা হয়).[২৪][২৫]
- জিঙ্কে–সুল বিক্রিয়ার পি-ক্রেসল টেট্রাক্লোরোমিথেন এর সঙ্গে অ্যালকাইলেশনের মাধ্যমে সাইক্লোহেক্সাডিওনে পরিণত করা হয়। [২৬]
- ব্লাঞ্চ ক্লোরোমিথাইলেশনে ফর্মালডিহাইড, হাইড্রোক্লোরিক অ্যাসিড ও জিঙ্ক ক্লোরাইডের উপস্থিতিতে অ্যারিনের সাথে একটি ক্লোরোমিথাইল মূলক যুক্ত হয়। [২৭][২৮]
- বোগার্ট–কুক সংশ্লেষণে (১৯৩৩) 1-β-ফিনাইলইথাইলসাইক্লোহেক্সানলের নিরুদন আইসোমারাইজেশনের মাধ্যমে ফেনানথ্রিনের অক্টাহাইড্রো ডেরিভেটিভ তৈরি হয়। [২৯]
- কিটোনের ডারজেন্স–নেনিতজেস্কু সংশ্লেষণে (১৯১০,১৯৩৬) অ্যাসিটাইল ক্লোরাইডের সাথে সাইক্লোহেক্সিনের অ্যাসিলেশনের ফলে মিথাইলসাইক্লোহেক্সিনাইলকিটোন উৎপন্ন হয়।
- সম্পর্কিত নেনিতজেস্কু রিডাকটিভ অ্যাসিলেশনে (১৯৩৬) একটি সম্পৃক্ত হাইড্রোকার্বন যুক্ত করা হয়, যা এটিকে রিডাকটিভ অ্যাসিলেশনের মাধ্যমে মিথাইলসাইক্লোহেক্সিনাইলকিটোনে পরিণত করে।
- নেনকি বিক্রিয়ায় (১৮৮১) জিঙ্ক ক্লোরাইডের উপস্থিতিতে ফেনলের সাথে অ্যাসিডের রিং অ্যাসিটাইলেশন হয়। [৩০]
- একটি সবুজ রসায়নের সাথে সম্পর্কিত একটি পরিবর্তনে, 2-ব্রোমবিউটেনের সাথে পি-জাইলিনের অ্যালকাইলেশনে অ্যালুমিনিয়াম ক্লোরাইডের পরিবর্তে গ্রাফাইট ব্যবহার করা হয়। এই পরিবর্তনটি প্রাথমিক হ্যালাইডের জন্য কার্যকর নয়, যার ফলে কার্বকেশনের সংশ্লিষ্টতা কমে। [৩১]
রঙ
[সম্পাদনা]ফ্রিডেল–ক্রাফটস বিক্রিয়া কয়েকটি ট্রাইঅ্যারাইলমিথেন ও জ্যান্থিন রঙ সংশ্লেষণে ব্যবহৃত হয়েছে। [৩২] এর উদাহরণ হচ্ছে, সমপরিমাণ থাইমল ও ফ্যথালিক অ্যানহাইড্রাইড থেকে থাইমলফ্যথালিনের (একটি পিএইচ নির্দেশক) সংশ্লেষণ:
জিঙ্ক ক্লোরাইডের উপস্থিতিতে ফ্যথালিক অ্যানহাইড্রাইডের সাথে রিসরসিনলের বিক্রিয়ায় ফ্লুরোফোর ফ্লুরেসিন উৎপন্ন হয়। রিসরসিনলের পরিবর্তে এন,এন-ডাইইথাইলঅ্যামিনোফেনল ব্যবহার করলে রোডামিন বি পাওয়া যায়:
হাওয়ার্থ বিক্রিয়া
[সম্পাদনা]হাওয়ার্থ বিক্রিয়া 1-টেট্রালোন সংশ্লেষণের একটি মৌলিক পদ্ধতি। [৩৩] এই বিক্রিয়ায় বেনজিন সাকসিনিক অ্যানহাইড্রাইডের সাথে বিক্রিয়া করে। এই বিক্রিয়ায় মধ্যবর্তী উৎপাদ লোপ পায় এবং অ্যাসিডের সংযোজনের সাথে একটি দ্বিতীয় এফসি অ্যাসিলেশন ঘটে। [৩৪]
একটি সংশ্লিষ্ট বিক্রিয়ায়, ন্যাফথালিন ও সাকসিনিক অ্যানহাইড্রাইডের বিক্রিয়ায় ফেনানথ্রিন সংশ্লেষিত হয়। এই বিক্রিয়াটি কয়েক ধাপে সংঘটিত হয় যা এফসি অ্যাসিলেশন দ্বারা শুরু হয়।
অ্যারোমেটিক হাইড্রোকার্বনের ফ্রিডেল–ক্রাফটস পরীক্ষা
[সম্পাদনা]অ্যালুমিনিয়াম ক্লোরাইড প্রভাবকের উপস্থিতিতে ক্লোরোফর্মের সাথে অ্যারোমেটিক যৌগের বিক্রিয়ায় ট্রাইঅ্যারাইলমিথেন উৎপন্ন হয়, যা প্রায়ই ট্রাইঅ্যারাইলমিথেন রঙের ন্যায় উজ্জ্বল বর্ণবিশিষ্ট হয়। এটি অ্যারোমেটিক যৌগের একটি শুদ্ধি পরীক্ষা। [৩৫]
আরো দেখুন
[সম্পাদনা]- ইথাইলিন অক্সাইড
- ফ্রাইডেল পরিবার, ফরাসি বিজ্ঞানের একটি সমৃদ্ধ বংশ
- হাইড্রডিঅ্যালকাইলেশন
- ট্রান্সঅ্যালকাইলেশন
তথ্যসূত্র
[সম্পাদনা]- ↑ Friedel, C.; Crafts, J. M. (1877) "Sur une nouvelle méthode générale de synthèse d’hydrocarbures, d’acétones, etc.," Compt. Rend., 84: 1392 & 1450.
- ↑ Price, C. C. (১৯৪৬)। "The Alkylation of Aromatic Compounds by the Friedel-Crafts Method": 1। আইএসবিএন 0471264180। ডিওআই:10.1002/0471264180.or003.01।
- ↑ Groves, J. K. (১৯৭২)। "The Friedel–Crafts acylation of alkenes": 73। ডিওআই:10.1039/cs9720100073।
- ↑ Eyley, S. C. (১৯৯১)। "The Aliphatic Friedel–Crafts Reaction": 707–731। আইএসবিএন 978-0-08-052349-1। ডিওআই:10.1016/B978-0-08-052349-1.00045-7।
- ↑ Heaney, H. (১৯৯১)। "The Bimolecular Aromatic Friedel–Crafts Reaction": 733–752। আইএসবিএন 978-0-08-052349-1। ডিওআই:10.1016/B978-0-08-052349-1.00046-9।
- ↑ Rueping, M.; Nachtsheim, B. J. (২০১০)। "A review of new developments in the Friedel–Crafts alkylation – From green chemistry to asymmetric catalysis"। ডিওআই:10.3762/bjoc.6.6।
- ↑ ক খ টেমপ্লেট:March6th
- ↑ L., Williamson, Kenneth (২০১৬)। Macroscale and microscale organic experiments। Masters, Katherine M. (Seventh সংস্করণ)। আইএসবিএন 9781305577190। ওসিএলসি 915490547।
- ↑ Smith, W. T. Jr.; Sellas, J. T. (১৯৬৩)। "Neophyl chloride"। অর্গানিক সিন্থেসিস।
- ↑ Hajra, S.; Maji, B. (২০০৭)। "Samarium Triflate-Catalyzed Halogen-Promoted Friedel–Crafts Alkylation with Alkenes": 2783–2786। ডিওআই:10.1021/ol070813t।
- ↑ Anslyn, E.; Wallace, K. J.; Hanes, R.; Morey, J.; Kilway, K. V.; Siegel, J. (২০০৫)। "Preparation of 1,3,5-Tris(aminomethyl)-2,4,6-triethylbenzene from Two Versatile 1,3,5-Tri(halosubstituted) 2,4,6-Triethylbenzene Derivatives"। Synthesis। 2005 (12): 2080–2083। ডিওআই:10.1055/s-2005-869963।
- ↑ Norman, Richard Oswald Chandler; Coxon, James Morriss (১৯৯৩)। Principles of organic synthesis (3rd সংস্করণ)। London: Blackie Academic & Professional। আইএসবিএন 0751401269। ওসিএলসি 27813843।
- ↑ Somerville, L. F.; Allen, C. F. H. (১৯৩৩)। "β-Benzoylpropionic acid"। Organic Syntheses। 13: 12। ডিওআই:10.15227/orgsyn.013.0012।
- ↑ "Desoxybenzoin"। www.orgsyn.org (ইংরেজি ভাষায়)। সংগ্রহের তারিখ ২০১৯-০১-২৬।
- ↑ Friedel-Crafts Acylation. Organic-chemistry.org. Retrieved on 2014-01-11.
- ↑ Fuson, R. C.; Weinstock, H. H.; Ullyot, G. E. (১৯৩৫)। "A New Synthesis of Benzoins. 2′,4′,6′-Trimethylbenzoin"। J. Am. Chem. Soc.। 57 (10): 1803–1804। ডিওআই:10.1021/ja01313a015।
- ↑ Clemmensen, E. (১৯১৩)। "Reduktion von Ketonen und Aldehyden zu den entsprechenden Kohlenwasserstoffen unter Anwendung von amalgamiertem Zink und Salzsäure"। Chemische Berichte। 46: 1837–1843। ডিওআই:10.1002/cber.19130460292।
- ↑ Clemmensen, E. (১৯১৪)। "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe"। Chemische Berichte। 47: 51–63। ডিওআই:10.1002/cber.19140470108।
- ↑ Clemmensen, E. (১৯১৪)। "Über eine allgemeine Methode zur Reduktion der Carbonylgruppe in Aldehyden und Ketonen zur Methylengruppe. (III. Mitteilung.)"। Chemische Berichte। 47: 681–687। ডিওআই:10.1002/cber.191404701107।
- ↑ Gattermann, L.; Koch, J. A. (১৮৯৭)। "Eine Synthese aromatischer Aldehyde"। Ber.। 30: 1622–1624। ডিওআই:10.1002/cber.18970300288।
- ↑ L. Gattermann; W. Berchelmann (১৮৯৮)। "Synthese aromatischer Oxyaldehyde"। Berichte der deutschen chemischen Gesellschaft। 31 (2): 1765–1769। ডিওআই:10.1002/cber.18980310281।
- ↑ Hoesch, Kurt (১৯১৫)। "Eine neue Synthese aromatischer Ketone. I. Darstellung einiger Phenol-ketone"। Berichte der deutschen chemischen Gesellschaft। 48 (1): 1122–1133। ডিওআই:10.1002/cber.191504801156।
- ↑ J. Houben (1926). Über die Kern-Kondensation von Phenolen und Phenol-äthern mit Nitrilen zu Phenol- und Phenol-äther-Ketimiden und -Ketonen (I.). Berichte der deutschen chemischen Gesellschaft (A and B Series) 59 (11) 2878–2891. ডিওআই:10.1002/cber.19260591135
- ↑ M B Smith, J March. March's Advanced Organic Chemistry (Wiley, 2001) (আইএসবিএন ০-৪৭১-৫৮৫৮৯-০)
- ↑ Grzybowski, M.; Skonieczny, K.; Butenschön, H.; Gryko, D. T. (২০১৩)। "Comparison of Oxidative Aromatic Coupling and the Scholl Reaction"। Angew. Chem. Int. Ed.। 52: 9900–9930। ডিওআই:10.1002/anie.201210238।
- ↑ Zincke, Th.; Suhl. R. (১৯০৬)। "Ueber die Einwirkung von Tetrachlorkohlenstoff und Aluminiumchlorid auf p-Kresol und p-Kresolderivate"। Chemische Berichte। 39 (4): 4148–4153। ডিওআই:10.1002/cber.190603904115।
- ↑ Blanc, Gustave Louis (১৯২৩)। Bulletin de la Société chimique de France [4]। 33: 313–319।
|শিরোনাম=অনুপস্থিত বা খালি (সাহায্য) - ↑ G. Grassi and C. Maselli (1898) "Su alcuni derivati clorurati de trossimetilene" (On some chlorinated derivatives of 1,3,5-trioxane), Gazzetta Chimica Italiana, 28 (part 2) : 477-500 ; see especially p. 495.
- ↑ This reaction with phosphorus pentoxide: Kamp, J. V. D.; Mosettig, E. (১৯৩৬)। "Trans- and Cis-As-Octahydrophenanthrene"। Journal of the American Chemical Society। 58 (6): 1062–1063। ডিওআই:10.1021/ja01297a514।
- ↑ Nencki, M.; Sieber, N. (১৮৮১)। "Ueber die Verbindungen der ein- und zweibasischen Fettsäuren mit Phenolen"। J. Prakt. Chem. (German ভাষায়)। 23: 147–156। ডিওআই:10.1002/prac.18810230111।
- ↑ Sereda, Grigoriy A.; Rajpara, Vikul B. (২০০৭)। "A Green Alternative to Aluminum Chloride Alkylation of Xylene"। J. Chem. Educ.। 2007 (84): 692। ডিওআই:10.1021/ed084p692। বিবকোড:2007JChEd..84..692S।
- ↑ McCullagh, James V.; Daggett, Kelly A. (২০০৭)। "Synthesis of Triarylmethane and Xanthene Dyes Using Electrophilic Aromatic Substitution Reactions"। J. Chem. Educ.। 84: 1799। ডিওআই:10.1021/ed084p1799।
- ↑ Haworth, Robert Downs (১৯৩২)। "Syntheses of alkylphenanthrenes. Part I. 1-, 2-, 3-, and 4-Methylphenanthrenes"। J. Chem. Soc.: 1125। ডিওআই:10.1039/JR9320001125।
- ↑ Li, Jie Jack (2003) Name Reactions: A Collection of Detailed Reaction Mechanisms, Springer, আইএসবিএন ৩-৫৪০-৪০২০৩-৯, p. 175.
- ↑ John C. Gilbert., Stephen F. Martin. Experimental Organic Chemistry: A Miniscale and Microscale Approach[স্থায়ীভাবে অকার্যকর সংযোগ]. Brooks/Cole CENGAGE Learning, 2011. pp 872. 25.10 Aromatic Hydrocarbons and Aryl Halides - Classification test. আইএসবিএন ৯৭৮-১-৪৩৯০-৪৯১৪-৩
জৈব সংশ্লেষণে প্রকাশিত ফ্রিডেল–ক্রাফটস বিক্রিয়াসমূহ
[সম্পাদনা]- অ্যালকাইলেশন:
- Diphenylacetone, Organic Syntheses, Coll. Vol. 3, p. 343 (1955); Vol. 29, p. 38 (1949) Article link.
- Reaction of p-xylene with chloromethane to durene Organic Syntheses, Coll. Vol. 2, p. 248 (1943); Vol. 10, p. 32 (1930). Article link
- Synthesis of benzophenone from benzene and tetrachloromethane Organic Syntheses, Coll. Vol. 1, p. 95 (1941); Vol. 8, p. 26 (1928).Article link
- অ্যাসিলেশন:
- Dibenzoylethylene Organic Syntheses, Coll. Vol. 3, p. 248 (1955); Vol. 20, p. 29 (1940) Article link.
- reaction of acenaphthene plus succinic acid Organic Syntheses, Coll. Vol. 3, p. 6 (1955); Vol. 20, p. 1 (1940).Article link
- Desoxybenzoin Organic Syntheses, Coll. Vol. 2, p. 156 (1943); Vol. 12, p. 16 (1932). Article link
- Acylation of a phenanthrene compound Organic Syntheses, Vol. 80, p. 227 Link
- Reaction of bromobenzene with acetic anhydride Organic Syntheses, Coll. Vol. 1, p. 109 (1941); Vol. 5, p. 17 (1925). Article link
- beta-methylanthraquinone, Organic Syntheses, Coll. Vol. 1, p. 353 (1941); Vol. 4, p. 43 (1925). Article link
- Benzoylation of ferrocene Organic Syntheses, Coll. Vol. 6, p. 625 (1988); Vol. 56, p. 28 (1977). Article link