WO2024142962A1 - 腹膜播種抑制剤、腹膜播種抑制方法、腹膜播種予防方法、及び腹膜播種治療方法 - Google Patents
腹膜播種抑制剤、腹膜播種抑制方法、腹膜播種予防方法、及び腹膜播種治療方法 Download PDFInfo
- Publication number
- WO2024142962A1 WO2024142962A1 PCT/JP2023/044802 JP2023044802W WO2024142962A1 WO 2024142962 A1 WO2024142962 A1 WO 2024142962A1 JP 2023044802 W JP2023044802 W JP 2023044802W WO 2024142962 A1 WO2024142962 A1 WO 2024142962A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- peritoneal
- mir
- dissemination
- aav
- peritoneal dissemination
- Prior art date
Links
- 239000003112 inhibitor Substances 0.000 title claims abstract description 63
- 238000000034 method Methods 0.000 title claims description 42
- 230000002401 inhibitory effect Effects 0.000 title claims description 25
- 238000010899 nucleation Methods 0.000 title abstract description 26
- 108091007432 miR-29b Proteins 0.000 claims abstract description 99
- 239000013598 vector Substances 0.000 claims abstract description 59
- 241000702421 Dependoparvovirus Species 0.000 claims abstract description 55
- 210000003200 peritoneal cavity Anatomy 0.000 claims abstract description 36
- 241000282414 Homo sapiens Species 0.000 claims abstract description 24
- 241000699670 Mus sp. Species 0.000 claims abstract description 21
- 241000282412 Homo Species 0.000 claims abstract description 15
- 241000702423 Adeno-associated virus - 2 Species 0.000 claims abstract description 14
- 241001655883 Adeno-associated virus - 1 Species 0.000 claims abstract description 10
- 241001634120 Adeno-associated virus - 5 Species 0.000 claims abstract description 9
- 241000580270 Adeno-associated virus - 4 Species 0.000 claims abstract description 6
- 241000699660 Mus musculus Species 0.000 claims abstract description 3
- 210000004027 cell Anatomy 0.000 claims description 74
- 206010028980 Neoplasm Diseases 0.000 claims description 71
- 210000003245 peritoneal mesothelial cell Anatomy 0.000 claims description 50
- 239000002246 antineoplastic agent Substances 0.000 claims description 19
- 238000001356 surgical procedure Methods 0.000 claims description 18
- 230000007704 transition Effects 0.000 claims description 18
- 241001465754 Metazoa Species 0.000 claims description 10
- 229940041181 antineoplastic drug Drugs 0.000 claims description 9
- 206010034665 Peritoneal fibrosis Diseases 0.000 claims description 7
- 239000003795 chemical substances by application Substances 0.000 claims description 5
- 201000011510 cancer Diseases 0.000 description 58
- 238000002474 experimental method Methods 0.000 description 58
- 241000699666 Mus <mouse, genus> Species 0.000 description 38
- 230000014509 gene expression Effects 0.000 description 38
- 238000011282 treatment Methods 0.000 description 37
- 239000003814 drug Substances 0.000 description 33
- 210000004303 peritoneum Anatomy 0.000 description 27
- 208000005718 Stomach Neoplasms Diseases 0.000 description 25
- 206010017758 gastric cancer Diseases 0.000 description 25
- 201000011549 stomach cancer Diseases 0.000 description 25
- 229940124597 therapeutic agent Drugs 0.000 description 24
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 21
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 21
- 201000002528 pancreatic cancer Diseases 0.000 description 21
- 208000008443 pancreatic carcinoma Diseases 0.000 description 21
- 210000000713 mesentery Anatomy 0.000 description 20
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 15
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 15
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 15
- 238000010586 diagram Methods 0.000 description 14
- 230000000694 effects Effects 0.000 description 14
- 239000002679 microRNA Substances 0.000 description 14
- 230000002829 reductive effect Effects 0.000 description 14
- 239000000203 mixture Substances 0.000 description 12
- 230000015572 biosynthetic process Effects 0.000 description 11
- 230000001225 therapeutic effect Effects 0.000 description 10
- 239000013607 AAV vector Substances 0.000 description 9
- 230000005764 inhibitory process Effects 0.000 description 9
- 230000003449 preventive effect Effects 0.000 description 9
- 230000015556 catabolic process Effects 0.000 description 8
- 230000003306 cell dissemination Effects 0.000 description 8
- 238000006731 degradation reaction Methods 0.000 description 8
- 108091070501 miRNA Proteins 0.000 description 8
- 210000002747 omentum Anatomy 0.000 description 8
- 108090000623 proteins and genes Proteins 0.000 description 8
- 238000003786 synthesis reaction Methods 0.000 description 8
- 210000001519 tissue Anatomy 0.000 description 8
- 230000010415 tropism Effects 0.000 description 8
- 229930012538 Paclitaxel Natural products 0.000 description 7
- 229940079593 drug Drugs 0.000 description 7
- 229960001592 paclitaxel Drugs 0.000 description 7
- 238000004393 prognosis Methods 0.000 description 7
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 7
- 238000010361 transduction Methods 0.000 description 7
- 230000026683 transduction Effects 0.000 description 7
- 238000011814 C57BL/6N mouse Methods 0.000 description 6
- 239000013642 negative control Substances 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 5
- 108700011259 MicroRNAs Proteins 0.000 description 5
- 210000000683 abdominal cavity Anatomy 0.000 description 5
- 230000007423 decrease Effects 0.000 description 5
- 230000003278 mimic effect Effects 0.000 description 5
- 238000010837 poor prognosis Methods 0.000 description 5
- 239000002243 precursor Substances 0.000 description 5
- 230000008685 targeting Effects 0.000 description 5
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- 206010027476 Metastases Diseases 0.000 description 4
- 108010045569 atelocollagen Proteins 0.000 description 4
- 238000002512 chemotherapy Methods 0.000 description 4
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 4
- 238000001727 in vivo Methods 0.000 description 4
- 230000009401 metastasis Effects 0.000 description 4
- 108091057475 miR-29b-1 stem-loop Proteins 0.000 description 4
- 108020004707 nucleic acids Proteins 0.000 description 4
- 102000039446 nucleic acids Human genes 0.000 description 4
- 150000007523 nucleic acids Chemical class 0.000 description 4
- 239000002953 phosphate buffered saline Substances 0.000 description 4
- 239000013612 plasmid Substances 0.000 description 4
- 150000003384 small molecules Chemical class 0.000 description 4
- 238000010186 staining Methods 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 108010035532 Collagen Proteins 0.000 description 3
- 102000008186 Collagen Human genes 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102000016359 Fibronectins Human genes 0.000 description 3
- 108010067306 Fibronectins Proteins 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 102000001742 Tumor Suppressor Proteins Human genes 0.000 description 3
- 108010040002 Tumor Suppressor Proteins Proteins 0.000 description 3
- 229920001436 collagen Polymers 0.000 description 3
- 238000007847 digital PCR Methods 0.000 description 3
- 239000003937 drug carrier Substances 0.000 description 3
- 210000001035 gastrointestinal tract Anatomy 0.000 description 3
- 238000010362 genome editing Methods 0.000 description 3
- 108091007431 miR-29 Proteins 0.000 description 3
- 230000005012 migration Effects 0.000 description 3
- 238000013508 migration Methods 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 229940002612 prodrug Drugs 0.000 description 3
- 239000000651 prodrug Substances 0.000 description 3
- 230000035755 proliferation Effects 0.000 description 3
- 102000004169 proteins and genes Human genes 0.000 description 3
- 238000002560 therapeutic procedure Methods 0.000 description 3
- 206010003445 Ascites Diseases 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- 241000289695 Eutheria Species 0.000 description 2
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 2
- 206010033128 Ovarian cancer Diseases 0.000 description 2
- 206010061535 Ovarian neoplasm Diseases 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- 241000700584 Simplexvirus Species 0.000 description 2
- 102000046299 Transforming Growth Factor beta1 Human genes 0.000 description 2
- 101800002279 Transforming growth factor beta-1 Proteins 0.000 description 2
- 208000002495 Uterine Neoplasms Diseases 0.000 description 2
- 102000013127 Vimentin Human genes 0.000 description 2
- 108010065472 Vimentin Proteins 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- 230000002238 attenuated effect Effects 0.000 description 2
- 230000006696 biosynthetic metabolic pathway Effects 0.000 description 2
- 230000008859 change Effects 0.000 description 2
- 208000029742 colonic neoplasm Diseases 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 2
- 238000005516 engineering process Methods 0.000 description 2
- 239000012091 fetal bovine serum Substances 0.000 description 2
- 238000000684 flow cytometry Methods 0.000 description 2
- 230000006872 improvement Effects 0.000 description 2
- -1 infusion Substances 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 238000011462 intraperitoneal chemotherapy Methods 0.000 description 2
- 238000001990 intravenous administration Methods 0.000 description 2
- 230000009545 invasion Effects 0.000 description 2
- 230000003902 lesion Effects 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000003550 marker Substances 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 230000001394 metastastic effect Effects 0.000 description 2
- 206010061289 metastatic neoplasm Diseases 0.000 description 2
- 108091027963 non-coding RNA Proteins 0.000 description 2
- 102000042567 non-coding RNA Human genes 0.000 description 2
- 230000037361 pathway Effects 0.000 description 2
- 239000000546 pharmaceutical excipient Substances 0.000 description 2
- 238000011470 radical surgery Methods 0.000 description 2
- 150000003839 salts Chemical class 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 239000006228 supernatant Substances 0.000 description 2
- 230000008719 thickening Effects 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 206010046766 uterine cancer Diseases 0.000 description 2
- 210000005048 vimentin Anatomy 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- FWBHETKCLVMNFS-UHFFFAOYSA-N 4',6-Diamino-2-phenylindol Chemical compound C1=CC(C(=N)N)=CC=C1C1=CC2=CC=C(C(N)=N)C=C2N1 FWBHETKCLVMNFS-UHFFFAOYSA-N 0.000 description 1
- 108020004491 Antisense DNA Proteins 0.000 description 1
- 108020005544 Antisense RNA Proteins 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 206010006895 Cachexia Diseases 0.000 description 1
- 102000000905 Cadherin Human genes 0.000 description 1
- 108050007957 Cadherin Proteins 0.000 description 1
- 102000016843 Calbindin 2 Human genes 0.000 description 1
- 108010028326 Calbindin 2 Proteins 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 108090000994 Catalytic RNA Proteins 0.000 description 1
- 102000053642 Catalytic RNA Human genes 0.000 description 1
- 241000700198 Cavia Species 0.000 description 1
- 235000005956 Cosmos caudatus Nutrition 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 108010042407 Endonucleases Proteins 0.000 description 1
- 102000004533 Endonucleases Human genes 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 208000000461 Esophageal Neoplasms Diseases 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 101150066002 GFP gene Proteins 0.000 description 1
- 208000022072 Gallbladder Neoplasms Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108091068837 Homo sapiens miR-29b-1 stem-loop Proteins 0.000 description 1
- 238000012404 In vitro experiment Methods 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 206010025538 Malignant ascites Diseases 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 206010051676 Metastases to peritoneum Diseases 0.000 description 1
- 241000282339 Mustela Species 0.000 description 1
- 206010028813 Nausea Diseases 0.000 description 1
- 238000000636 Northern blotting Methods 0.000 description 1
- 108091028043 Nucleic acid sequence Proteins 0.000 description 1
- 108091005461 Nucleic proteins Proteins 0.000 description 1
- 239000004677 Nylon Substances 0.000 description 1
- 206010030155 Oesophageal carcinoma Diseases 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 241000701945 Parvoviridae Species 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 239000002202 Polyethylene glycol Substances 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 241000700159 Rattus Species 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 206010039491 Sarcoma Diseases 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 108091027967 Small hairpin RNA Proteins 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 1
- 210000003815 abdominal wall Anatomy 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 239000000654 additive Substances 0.000 description 1
- 239000000853 adhesive Substances 0.000 description 1
- 230000001070 adhesive effect Effects 0.000 description 1
- 238000011226 adjuvant chemotherapy Methods 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- 150000001413 amino acids Chemical group 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 239000004037 angiogenesis inhibitor Substances 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 229940125644 antibody drug Drugs 0.000 description 1
- 239000003816 antisense DNA Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 210000003567 ascitic fluid Anatomy 0.000 description 1
- 238000007681 bariatric surgery Methods 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- 239000000560 biocompatible material Substances 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000001851 biosynthetic effect Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 239000008280 blood Substances 0.000 description 1
- 230000037396 body weight Effects 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- AIYUHDOJVYHVIT-UHFFFAOYSA-M caesium chloride Chemical compound [Cl-].[Cs+] AIYUHDOJVYHVIT-UHFFFAOYSA-M 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 230000004712 cancer cell adhesion Effects 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 239000012829 chemotherapy agent Substances 0.000 description 1
- 239000003184 complementary RNA Substances 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 238000011254 conventional chemotherapy Methods 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000005520 cutting process Methods 0.000 description 1
- 238000002716 delivery method Methods 0.000 description 1
- 238000002298 density-gradient ultracentrifugation Methods 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000002405 diagnostic procedure Methods 0.000 description 1
- 238000000502 dialysis Methods 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 239000007884 disintegrant Substances 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 201000004101 esophageal cancer Diseases 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 230000003176 fibrotic effect Effects 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 201000010175 gallbladder cancer Diseases 0.000 description 1
- 230000002496 gastric effect Effects 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 238000001415 gene therapy Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 208000013210 hematogenous Diseases 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 238000012744 immunostaining Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 238000001802 infusion Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 208000003243 intestinal obstruction Diseases 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000006525 intracellular process Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 210000003292 kidney cell Anatomy 0.000 description 1
- 238000001638 lipofection Methods 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 231100000053 low toxicity Toxicity 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 230000003211 malignant effect Effects 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 108091048549 miR-29b stem-loop Proteins 0.000 description 1
- 108091074487 miR-34 stem-loop Proteins 0.000 description 1
- 108091092493 miR-34-1 stem-loop Proteins 0.000 description 1
- 108091059780 miR-34-2 stem-loop Proteins 0.000 description 1
- 201000011591 microinvasive gastric cancer Diseases 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 230000008693 nausea Effects 0.000 description 1
- 244000309711 non-enveloped viruses Species 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- 239000002773 nucleotide Substances 0.000 description 1
- 125000003729 nucleotide group Chemical group 0.000 description 1
- 229920001778 nylon Polymers 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000012188 paraffin wax Substances 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 210000000505 parietal peritoneum Anatomy 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007170 pathology Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 239000003330 peritoneal dialysis fluid Substances 0.000 description 1
- 239000008194 pharmaceutical composition Substances 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000002504 physiological saline solution Substances 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229920001223 polyethylene glycol Polymers 0.000 description 1
- 229920001296 polysiloxane Polymers 0.000 description 1
- 230000002980 postoperative effect Effects 0.000 description 1
- 239000003755 preservative agent Substances 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 238000003757 reverse transcription PCR Methods 0.000 description 1
- 108091092562 ribozyme Proteins 0.000 description 1
- 239000002924 silencing RNA Substances 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 239000004055 small Interfering RNA Substances 0.000 description 1
- 239000000243 solution Substances 0.000 description 1
- 239000002904 solvent Substances 0.000 description 1
- 229960002920 sorbitol Drugs 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 238000005728 strengthening Methods 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 150000005846 sugar alcohols Polymers 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 238000011521 systemic chemotherapy Methods 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 210000000115 thoracic cavity Anatomy 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 230000009261 transgenic effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000005740 tumor formation Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 108700026220 vif Genes Proteins 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/66—Microorganisms or materials therefrom
- A61K35/76—Viruses; Subviral particles; Bacteriophages
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K48/00—Medicinal preparations containing genetic material which is inserted into cells of the living body to treat genetic diseases; Gene therapy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
- C12N15/63—Introduction of foreign genetic material using vectors; Vectors; Use of hosts therefor; Regulation of expression
- C12N15/79—Vectors or expression systems specially adapted for eukaryotic hosts
- C12N15/85—Vectors or expression systems specially adapted for eukaryotic hosts for animal cells
- C12N15/86—Viral vectors
- C12N15/864—Parvoviral vectors, e.g. parvovirus, densovirus
Definitions
- the present invention particularly relates to a peritoneal dissemination inhibitor, a peritoneal dissemination inhibitor method, a peritoneal dissemination prevention method, and a peritoneal dissemination treatment method.
- Peritoneal dissemination is a frequent form of metastasis and recurrence in cancers (malignant tumors) that occur in the abdominal cavity, such as gastric cancer, pancreatic cancer, colon cancer, uterine cancer, and ovarian cancer. Peritoneal dissemination is a serious condition that creates countless small nodules in the abdominal cavity, causing ascites retention and digestive tract obstruction, which can lead to a poor prognosis.
- peritoneal dissemination there has been no effective treatment for peritoneal dissemination in the past, and no special treatment method targeting peritoneal dissemination.
- radical surgery can be performed macroscopically, there have been many cases in which peritoneal dissemination appears several months after surgery.
- Patent Document 1 there is described an attenuated herpes simplex virus that has been effective in treating cancer and a cancer treatment composition containing the same, in which an exogenous suicide gene has been incorporated into the attenuated herpes simplex virus.
- This virus attacks the cancer itself that involves peritoneal dissemination, but is unable to prevent peritoneal dissemination itself.
- the present inventors comprehensively analyzed exosomal miRNAs in ascites from gastric cancer patients with peritoneal dissemination and in peritoneal lavage fluid from patients with early gastric cancer without peritoneal dissemination, and discovered that miR-29 was significantly reduced in gastric cancer patients with peritoneal dissemination.
- the present inventors found that expression of miR-29b was significantly decreased in patients with gastric cancer whose invasion depth reached the serosa (T4) and in cases of peritoneal dissemination. They also confirmed that miR-29b is a "tumor-suppressor miRNA" that acts in a cancer-suppressing manner. For this reason, the present inventors conceived that allowing miR-29b to act on various cells in the peritoneal cavity might be a new treatment for peritoneal dissemination, and conducted intensive experiments.
- the inventors therefore came up with the idea of a treatment strategy of replenishing the peritoneal cavity with miR-29b.
- miR-29b In proceeding with experiments with miR-29b, they investigated the mechanism of action, focusing on mesothelial-mesenchymal transition (MMT), in which peritoneal mesothelium transforms into mesenchymal traits and promotes cancer progression.
- MMT mesothelial-mesenchymal transition
- miR-29b whose expression was reduced, was highly expressed in peritoneal mesothelial cells on the surface of the peritoneum, and expression was reduced by stimulation by cancer cells. Furthermore, expression was low in cancer cells and immune cells.
- miR-29b mimic which is RNA itself, was lipofected into peritoneal mesothelium stimulated with TGF- ⁇ to enhance miR-29b. This resulted in the inhibition of HPMC proliferation, and a marked decrease in the migration ability and adhesion ability of cancer cells to peritoneal mesothelial cells. Furthermore, miR-29b suppressed mesothelial-mesenchymal transition (MMT) induced by TGF- ⁇ .
- MMT mesothelial-mesenchymal transition
- the present inventors believed that it was necessary to efficiently deliver miR-29b into the peritoneal cavity, and proceeded with further experiments, during which they came up with the idea of delivering miR-29b to peritoneal mesothelial cells that compose the peritoneal cavity using an adeno-associated virus vector.
- the present inventors actually produced an adeno-associated virus vector carrying miR-29b and conducted repeated experiments.
- a serotype of an adeno-associated virus having tropism for peritoneal mesothelial cells covering the peritoneal surface was selected, and a precursor sequence of miR-29b, whose expression is reduced in the peritoneal cavity of patients with peritoneal dissemination, was inserted to produce an adeno-associated virus vector carrying miR-29b, "AAV-miR-29b," as described in Examples 1 and 2 below.
- This AAV-miR-29b was administered into the peritoneal cavity of a mouse peritoneal dissemination model using mouse gastric cancer cell line YTN16P.
- the number of peritoneal dissemination nodules on the mesentery was significantly reduced compared to the control group, and an inhibitory effect on the progression of peritoneal dissemination was observed.
- the number of peritoneal dissemination nodules was significantly reduced when the cancer cell line and AAV-miR-29b were simultaneously administered, and there was also a preventive effect.
- the present invention can correct the quantitative change in miR-29b in the host's peritoneal environment and control peritoneal dissemination. That is, by expressing miR-29b in cells constituting the host's peritoneal cavity using an adeno-associated virus vector, peritoneal dissemination can be treated and prevented.
- the present invention can provide a useful therapeutic agent and treatment method targeting peritoneal dissemination of cancer, which is an intractable pathology.
- the embodiment of the present invention will be described more specifically.
- microRNA (hereinafter also referred to as “miRNA” or “miR”) is a type of functional ncRNA (non-coding RNA) encoded on the genome, and becomes a single-stranded RNA molecule of about 20 to 25 bases (nt) in length through a multi-stage production process.
- MicroRNA is involved in regulating expression after gene transcription in eukaryotes.
- the precursor sequence of miR-29b which acts as a cancer suppressor and whose expression is reduced in the peritoneal cavity of patients with peritoneal dissemination, is introduced into the vector as the microRNA.
- SEQ ID NO: 1 An example of the sequence of miR-29b (transcribed into microRNA) common to humans and mice used in this embodiment is shown in SEQ ID NO: 1 in the sequence listing.
- the miR-29b does not necessarily have to be a precursor sequence of miR-29b DNA as shown in SEQ ID NO: 1, and may be a sequence similar to that of a miRNA gene on the genome, a sequence conforming to pre-miRNA or mature-miRNA, or a sequence that is activated by other intracellular processes to ultimately synthesize miR-29b.
- the sequence may be modified by modifying miR-29b or enhancing the inhibitory effect of mesothelial-mesenchymal transition (MMT).
- MMT mesothelial-mesenchymal transition
- adeno-associated virus (hereinafter also referred to as "AAV") is a small non-enveloped virus (about 20 nm) belonging to the genus Dependovirus in the family Parvoviridae that infects humans and primates and depends on a helper virus.
- AAV adeno-associated virus
- miR-29b is loaded into this AAV.
- AAV has the characteristics of low toxicity, low immunogenicity, and the ability to sustain expression for a certain period of time.
- AAV is a method that has actually been applied clinically in several ways and is highly safe, safety can be improved even if miR-29b is loaded into the AAV for actual clinical application.
- AAV loaded with miR-29b is also referred to as "AAV-miR-29b".
- the peritoneal dissemination inhibitor using the delivery method utilizing AAV-miR-29b according to this embodiment has an extremely high peritoneal dissemination inhibitory effect that would not be predicted by a person skilled in the art, even in in vivo experiments using a mouse peritoneal dissemination model, as shown in Examples 1 and 2 described below, and shows a remarkable effect compared to conventional techniques.
- AAV2 type vector
- AAV1, AAV2, AAV4, AAV5, AAV9, or AAV-DJ are preferred.
- AAV-DJ is particularly preferred for mice.
- AAV2-miR-29b is to be distinguished from that carried by each serotype of AAV, it will be referred to as AAV2-miR-29b, AAV-DJ-miR-29b, etc.
- the peritoneal dissemination inhibitor according to this embodiment is characterized by expressing miR-29b in cells that make up the peritoneal cavity, thereby treating or preventing peritoneal dissemination.
- AAV AAV to deliver miR-29b to cells that make up the peritoneal cavity and causing them to express it, it is possible to suppress or prevent the establishment and progression of peritoneal dissemination.
- the cells constituting the peritoneal cavity targeted by the peritoneal dissemination inhibitor of this embodiment may be, for example, various cells constituting membranous tissues covering the surfaces of body cavities such as the peritoneal cavity, thoracic cavity, and pericardial cavity.
- peritoneal mesothelial cells constituting the peritoneal mesothelium are described as the main target cells constituting the peritoneal cavity, but other cells may also be used.
- the peritoneal dissemination inhibitor according to this embodiment is characterized by suppressing mesothelial-mesenchymal transition (MMT) of cells constituting the peritoneal cavity and suppressing peritoneal fibrosis. That is, the peritoneal dissemination inhibitor according to this embodiment suppresses the occurrence of mesothelial-mesenchymal transition (MMT) in peritoneal mesothelial cells and the like due to stimulation by cancer cells, inflammatory substances, and the like. This significantly suppresses the migration ability of peritoneal mesothelial cells and the like, and suppresses peritoneal fibrosis throughout the peritoneum. Therefore, the peritoneal dissemination inhibitor according to this embodiment can reduce the adhesive ability of cancer cells to peritoneal mesothelial cells and the like, thereby treating or preventing peritoneal dissemination.
- MMT mesothelial-mesenchymal transition
- peritoneal dissemination inhibitor according to this embodiment can be administered at the time of surgery.
- the peritoneal dissemination inhibitor according to this embodiment may be administered directly into the abdominal cavity during or after the above-mentioned surgery.
- the peritoneal dissemination inhibitor of this embodiment can contribute to inhibiting or preventing the establishment and progression of peritoneal dissemination due to mesothelial-mesenchymal transition, as shown in the later-described Examples 1 and 2. That is, just as AAV was injected intraperitoneally in Examples 1 and 2, the peritoneal dissemination inhibitor of this embodiment can be directly administered into the peritoneal cavity by a means commonly known to those skilled in the art, such as injection, infusion, or spray during surgery.
- the peritoneal dissemination inhibitor according to the present embodiment can be used as a medicine such as a therapeutic agent (therapeutic composition) or a preventive agent (preventive composition) for peritoneal dissemination. That is, the peritoneal dissemination inhibitor according to the present embodiment can be used as a drug for suppressing peritoneal dissemination and preventing recurrence due to peritoneal dissemination of operable cancer.
- the use of miR-29b makes it possible to inhibit mesothelial-mesenchymal transition and suppress the establishment and progression of peritoneal dissemination. This allows miR-29b to be used as a therapeutic agent for peritoneal dissemination.
- AAV carrying miR-29b can be used as a method for suppressing and preventing peritoneal dissemination by expressing miR-29b in cells that constitute the peritoneal cavity.
- the peritoneal dissemination inhibitor of the present embodiment as a therapeutic agent or a therapeutic method, it is possible to inhibit or prevent the establishment and progression of peritoneal dissemination due to mesothelial-mesenchymal transition and to inhibit the proliferation of peritoneal dissemination with poor prognosis.
- the therapeutic agent of the present embodiment can be provided as a means for treating peritoneal dissemination due to cancer metastasis occurring in the peritoneal cavity by preventing peritoneal fibrosis.
- the nucleic acid may be an antisense DNA or RNA, siRNA, shRNA, ribozyme, or the like.
- the gene expression regulator of this embodiment can be identified from the amino acid sequence of the target protein, the mRNA sequence, the genomic DNA sequence, and the like, and produced by a method easily known to those skilled in the art.
- the peritoneal dissemination inhibitor according to this embodiment, it is also possible to use other regulators that inhibit mesothelial-mesenchymal transition in cells that constitute the peritoneal cavity.
- the therapeutic agent of this embodiment may be used in combination with various tumor adhesion inhibitors, tumor angiogenesis inhibitors, and the like to enhance the effect by suppressing adhesion of cancer cells and angiogenesis inside peritoneal dissemination.
- various medical vectors other than AAV can be used in addition to AAV.
- viral vectors examples include adenovirus vectors, lentivirus vectors, and retrovirus vectors.
- adenovirus vectors examples include adenovirus vectors, lentivirus vectors, and retrovirus vectors.
- retrovirus vectors by using vectors that can retain DNA longer than AAV, it is possible to achieve genome editing specific to the tumor to be treated, such as the original type of cancer that has disseminated peritoneally.
- the peritoneal dissemination inhibitor according to the embodiment of the present invention also includes a prodrug.
- a prodrug means a derivative that is decomposed and converted under physiological conditions after administration under specific pH conditions or the action of enzymes.
- a prodrug may be inactive when administered to a patient, but is converted into an active therapeutic agent in the body.
- the peritoneal dissemination inhibitor according to the embodiment of the present invention may contain any pharmacy-acceptable carrier, such as physiological saline, atelocollagen, other collagens, etc. Furthermore, it may be administered together with a carrier such as glucose, D-sorbitol, D-mannose, D-mannitol, ethanol, polyalcohols, such as propylene glycol, polyethylene glycol, non-ionic surfactants, etc.
- a carrier such as glucose, D-sorbitol, D-mannose, D-mannitol, ethanol, polyalcohols, such as propylene glycol, polyethylene glycol, non-ionic surfactants, etc.
- the route of administration of the pharmaceutical composition according to the embodiment of the present invention is not particularly limited, but it can be administered parenterally or orally.
- Parenteral administration includes, for example, intraperitoneal injection together with the above-mentioned carriers, peritoneal spraying during surgery, and the like, as well as intravenous, intraarterial, subcutaneous, intradermal, and intramuscular administration.
- the therapeutic agent according to the embodiment of the present invention is characterized in that it is used in combination with an anticancer agent. That is, the therapeutic agent according to the embodiment of the present invention can also be used in combination with other therapeutic compositions such as conventional chemotherapy agents and anticancer agents.
- the anticancer agent may include, for example, those used by those skilled in the art for the treatment of peritoneal dissemination, such as paclitaxel, as shown in Example 2 described below, or other types of agents may be used, or a combination (cocktail) of multiple therapeutic compositions may be used. This can be expected to have a therapeutic and preventive effect against peritoneal dissemination.
- the therapeutic agent according to this embodiment can be used even when treatment has already begun. It can also be used in combination with other cancer treatments or treatment methods such as radiation therapy, particle beam therapy, surgery, etc. This can be an effective treatment for peritoneal dissemination, which has a poor prognosis.
- the expression level of miR-29b, etc. in the peritoneum can be used as a criterion to assess the effectiveness of treatment.
- one or more refers to either one of the configurations or a combination of multiple configurations. In other words, any one of them may be used, or any combination of two to all of them may be used.
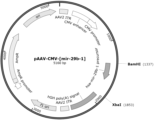
- FIG. 1A shows the structure of pAAV2-CMV-MCS
- FIG. 1B shows the structure of the prepared pAAV-CMV-[mir-29b-1] vector.
- Nomura of the University of Tokyo were seeded at 1 x 104 cells each onto a 24-well plate. After overnight culture, 1 x 105 vg (vector genome) of each AAV vector was added per well the next day. After 3 days for human peritoneal mesothelial cells and 7 days for mouse peritoneal mesothelial cells, the cells were observed under a fluorescent microscope and the proportion of GFP-expressing cells was measured by flow cytometry.
- FIG. 13B shows photographs of the mesentery of each group.
- No treatment indicates that only cancer cells, but not AAV, were administered.
- AAV-DJ-NC indicates a negative control in which only the AAV-DJ vector was administered.
- AAV-DJ-miR-29b indicates that the AAV-DJ-miR-29b of this example was administered.
- “Mock” indicates that the solvent for paclitaxel was administered.
- Each group is shown to be a combination with that administered with paclitaxel "PTX (200 ⁇ g).”
- FIG. 13C shows the results of measuring the number of mesenteric disseminated nodules 21 days later. The results showed that the number of peritoneal disseminated nodules was significantly lower in the group administered AAV-miR-29b.
- “*” indicates p ⁇ 0.05.
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Oncology (AREA)
- Virology (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Biochemistry (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
腹膜播種を効率よく抑制する腹膜播種抑制剤を提供する。腹膜播種抑制剤は、miR-29b搭載のアデノ随伴ウイルスベクターを含む。このアデノ随伴ウイルスベクターの血清型は、AAV1、AAV2、AAV4、及びAAV-DJからなる群の一種を含む。より具体的にいうと、アデノ随伴ウイルスベクターの血清型は、ヒト(Homo sapiens)では、AAV1、AAV2、AAV5、又はAAV-DJであり、マウス(Mus musculus)では、AAV1、AAV2、AAV5、AAV9、又はAAV-DJである。この腹膜播種抑制剤により、腹腔内を構成する細胞にmiR-29bを発現させ、腹膜播種を治療又は予防する。
Description
本発明は、特に腹膜播種抑制剤、腹膜播種抑制方法、腹膜播種予防方法、及び腹膜播種治療方法に関する。
腹膜播種(Peritoneal dissemination)は、胃癌、膵癌、大腸癌、子宮癌、卵巣癌等の腹腔内に発生する癌(悪性腫瘍)において、頻度の高い転移、再発形式である。腹膜播種は、腹腔内に小さな結節を無数に作り、腹水の貯留や消化管閉塞をきたし、予後不良となり得る深刻な病態である。しかしながら、従来、腹膜播種において有効な治療法はなく、腹膜播種を標的とした特別な治療方法は存在していなかった。また、肉眼的に根治手術が施行できても、手術後数ヶ月後に、腹膜播種が出現するケースも多くみられていた。このため、腹膜播種を伴う癌では、抗癌剤や分子標的薬の経静脈投与による全身への化学療法が標準治療として行われていた。しかしながら、これらの薬剤は、血中から腹腔内への移行が少なく、十分な治療効果が得られないことが多かった。このため、より効果的な治療法が求められていた。
ここで、特許文献1を参照すると、従来、癌の治療に有効な弱毒化単純ヘルペスウイルス及びこれを含有する癌治療用組成物であり、外来性の自殺遺伝子が組み込まれている弱毒化単純ヘルペスウイルスが記載されている。
このウイルスは、腹膜播種を伴う癌そのものを攻撃するもので、腹膜播種自体を防ぐことはできなかった。
このウイルスは、腹膜播種を伴う癌そのものを攻撃するもので、腹膜播種自体を防ぐことはできなかった。
このように、従来、腹膜播種を確実に制御する方法が存在しなかったため、腹膜播種再発を効率よく予防する方法を確立することが、消化器等の腹膜播種を生じる癌患者の予後を改善する上で最も重要な課題と考えられていた。
ここで、非特許文献1を参照すると、胃癌の腹膜播種症例の腹腔内で低下しているマイクロRNAであるmiR-29bの働きを検討したことが記載されている。
非特許文献1によれば、miR-29bのRNAそのものである「miR-29bミミック」が、ヒト腹膜中皮細胞(Human peritoneal mesothelial cell、HPMC)にリポフェクションによってトランスフェクトされ、影響がin vitroで評価された。トランスフォーミング増殖因子β(Transforming Growth Factor-β、以下「TGF-β」という。)で刺激したヒト腹膜中皮細胞(Human peritoneal mesothelial cell、HPMC)に対してmiR-29bを作用させると、増殖が抑制され、遊走能及び腹膜中皮細胞に対する癌細胞の接着能が著明に低下した。これにより、miR-29bは、TGF-βで誘導される中皮間葉転換(Mesothelial-mesenchymal transition、以下「MMT」という。)を抑制した。これにより、腹膜播種を抑えることができると期待された。そこで、miR-29bミミックをアテロコラーゲンと複合体を形成させてマウス腹膜播種モデルに投与したところ、大網上の腹膜播種を抑制したものの、腸間膜上の腹膜播種は抑制できなかった。
非特許文献1によれば、miR-29bのRNAそのものである「miR-29bミミック」が、ヒト腹膜中皮細胞(Human peritoneal mesothelial cell、HPMC)にリポフェクションによってトランスフェクトされ、影響がin vitroで評価された。トランスフォーミング増殖因子β(Transforming Growth Factor-β、以下「TGF-β」という。)で刺激したヒト腹膜中皮細胞(Human peritoneal mesothelial cell、HPMC)に対してmiR-29bを作用させると、増殖が抑制され、遊走能及び腹膜中皮細胞に対する癌細胞の接着能が著明に低下した。これにより、miR-29bは、TGF-βで誘導される中皮間葉転換(Mesothelial-mesenchymal transition、以下「MMT」という。)を抑制した。これにより、腹膜播種を抑えることができると期待された。そこで、miR-29bミミックをアテロコラーゲンと複合体を形成させてマウス腹膜播種モデルに投与したところ、大網上の腹膜播種を抑制したものの、腸間膜上の腹膜播種は抑制できなかった。
Kimura Y,Ohzawa H,Miyato H他、「MiR-29b may suppresses peritoneal metastases through inhibition of the mesothelial-mesenchymal transition (MMT) of human peritoneal mesothelial cells」、Scientific Reports、2022年、12(1):205
しかしながら、非特許文献1の技術(以下、「従来技術」という。)では、miR-29bを用いて、実際に、生体内で、治療剤として用いられる程度に十分な腹膜播種の抑制を行うことができなかった。
よって、miR-29bを効率よく腹膜中皮細胞に導入し、腹膜播種を抑制する腹膜播種抑制剤が求められていた。
よって、miR-29bを効率よく腹膜中皮細胞に導入し、腹膜播種を抑制する腹膜播種抑制剤が求められていた。
本発明は、このような状況に鑑みてなされたものであり、上述の問題を解消することを目的とする。
本発明の腹膜播種抑制剤は、miR-29b搭載のアデノ随伴ウイルスベクターを含むことを特徴とする。
本発明の腹膜播種抑制方法は、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。
本発明の腹膜播種予防方法は、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。
本発明の腹膜播種治療方法は、ヒト以外の動物の腹膜播種治療方法であって、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。
本発明の腹膜播種抑制方法は、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。
本発明の腹膜播種予防方法は、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。
本発明の腹膜播種治療方法は、ヒト以外の動物の腹膜播種治療方法であって、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。
本発明によれば、miR-29b搭載のアデノ随伴ウイルスベクターを含むことで、従来より効果的に、miR-29bを腹膜中皮細胞等に効率よく導入し、腹膜播種を抑制する腹膜播種抑制剤を提供することができる。
<実施の形態>
癌、特に胃癌の転移形式には、血行性、リンパ行性、播種性がある。胃の内腔の粘膜面から発生した胃癌は、深部に浸潤して漿膜側(=外側)に露出すると腹腔内に癌細胞が散布され腹膜上に腹膜播種を形成すると言われている。
腹膜播種は、癌性腹水や腸閉塞を発症しやすい病態であるため、十分な治療効果が得られないことがあり、臨床上の大きな問題点であった。また、進行癌では根治手術後に術後補助的な化学療法が行われるが、腹膜播種再発を来すこともあった。しかしながら、腹膜播種再発の高危険群において腹膜播種を予防するための治療が存在しないことも問題点であった。
癌、特に胃癌の転移形式には、血行性、リンパ行性、播種性がある。胃の内腔の粘膜面から発生した胃癌は、深部に浸潤して漿膜側(=外側)に露出すると腹腔内に癌細胞が散布され腹膜上に腹膜播種を形成すると言われている。
腹膜播種は、癌性腹水や腸閉塞を発症しやすい病態であるため、十分な治療効果が得られないことがあり、臨床上の大きな問題点であった。また、進行癌では根治手術後に術後補助的な化学療法が行われるが、腹膜播種再発を来すこともあった。しかしながら、腹膜播種再発の高危険群において腹膜播種を予防するための治療が存在しないことも問題点であった。
これに対して、本発明者らは、腹膜播種のある胃癌患者の腹水と、腹膜播種のない早期胃癌の患者の腹腔内洗浄液内のエクソソームmiRNAを網羅的に解析し、腹膜播種のある胃癌患者では、miR-29が有意に低下していることを発見した。
本発明者らは、深達度が漿膜に達する(T4)胃癌の患者で、腹膜播種のある症例ではmiR-29bの発現が有意に低下することを見いだした。そして、miR-29bは、癌抑制的に働く「Tumor-suppressor miRNA」であることを確認した。このため、本発明者らは、miR-29bを腹腔内で様々な細胞に対して作用させることが、腹膜播種の新たな治療となるのではないかと着想し、鋭意実験を進めた。
本発明者らは、深達度が漿膜に達する(T4)胃癌の患者で、腹膜播種のある症例ではmiR-29bの発現が有意に低下することを見いだした。そして、miR-29bは、癌抑制的に働く「Tumor-suppressor miRNA」であることを確認した。このため、本発明者らは、miR-29bを腹腔内で様々な細胞に対して作用させることが、腹膜播種の新たな治療となるのではないかと着想し、鋭意実験を進めた。
そして、本発明者らは、様々な細胞についてmiR-29bの発現をデジタルPCR法で調べたところ、ヒト腹膜中皮細胞(HPMC)で発現が高いことがわかった。HPMCをTGF-βで処理するとmiR-29b発現が低下することから、腹腔内でのmiR-29b低下は腹膜中皮細胞での発現低下によるものではないかと考えられた。
そこで、本発明者らは、腹腔内にmiR-29bを補充するという治療戦略を着想した。この上で、miR-29bでの実験を進めていくにあたり、腹膜中皮が間葉系の形質へと転換し癌の進展に促進的に働く中皮間葉転換(MMT)に着目して作用機序を調べた。発現が低下しているmiR-29bは、腹膜の表面にある腹膜中皮細胞で発現が高く、癌細胞による刺激で発現が低下した。また癌細胞や免疫細胞での発現は低かった。
このため、非特許文献1に記載したように、TGF-βで刺激した腹膜中皮に対して、RNAそのものであるmiR-29bミミックをリポフェクションして、miR-29bを増強させた。すると、HPMCの増殖が抑制され、遊走能及び腹膜中皮細胞に対する癌細胞の接着能が著明に低下した。さらに、miR-29bはTGF-βで誘導される中皮間葉転換(MMT)を抑制していた。
このため、本発明者らは、更なる実験を進め、同種腫瘍移植モデルを用いたmiR-29bの局所投与実験としてmiR-29bをアテロコラーゲンと混合し、3日おきにマウスの腹腔内に注射して大網上及び腸間膜上の腹膜播種結節数をカウントし評価した。ここで、マウスの腹膜播種の実験は、腸間膜上の腹膜播種結節数で評価されることが多いものの、この実験においては、腸間膜上の腹膜播種結節数は変化がなかった。一方で、マウスの大網上の腹膜播種結節数は、有意に低下していた。
しかしながら、残念なことに、miR-29bミミックでは、中皮間葉転換(MMT)の効果を持続させ、腹膜播種の治療剤として用いることができる程度の効果が得られなかった。
しかしながら、残念なことに、miR-29bミミックでは、中皮間葉転換(MMT)の効果を持続させ、腹膜播種の治療剤として用いることができる程度の効果が得られなかった。
このことから、本発明者らは、miR-29bを効率良く腹腔内に送達することが必用であると考え、更なる実験を進めた。このなかで、腹腔内を構成する腹膜中皮細胞にアデノ随伴ウイルスベクターを用いてmiR-29bを送達させることを着想した。
そして、本発明者らは、miR-29b搭載のアデノ随伴ウイルスベクターを実際に作製して、鋭意実験を繰り返した。具体的には、腹腔表面を覆う腹膜中皮細胞に対して指向性を持つアデノ随伴ウイルスの血清型を選択し、腹膜播種患者の腹腔内で発現が低下しているmiR-29bの前駆体配列を挿入し、後述する実施例1、2に記載したような、miR-29b搭載のアデノ随伴ウイルスベクター「AAV-miR-29b」を作製した。このAAV-miR-29bを、マウス胃癌細胞株YTN16Pを用いたマウス腹膜播種モデルの腹腔内に投与した。すると、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。また、癌細胞株とAAV-miR-29bの同時投与においても、腹膜播種結節数は有意に少なくなり、予防的効果もあった。
そして、本発明者らは、miR-29b搭載のアデノ随伴ウイルスベクターを実際に作製して、鋭意実験を繰り返した。具体的には、腹腔表面を覆う腹膜中皮細胞に対して指向性を持つアデノ随伴ウイルスの血清型を選択し、腹膜播種患者の腹腔内で発現が低下しているmiR-29bの前駆体配列を挿入し、後述する実施例1、2に記載したような、miR-29b搭載のアデノ随伴ウイルスベクター「AAV-miR-29b」を作製した。このAAV-miR-29bを、マウス胃癌細胞株YTN16Pを用いたマウス腹膜播種モデルの腹腔内に投与した。すると、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。また、癌細胞株とAAV-miR-29bの同時投与においても、腹膜播種結節数は有意に少なくなり、予防的効果もあった。
結果として、実際に腹膜播種の成立及び進展を抑制し、腹膜播種を抑制することができることを明らかとし、遂に本発明を完成させるに至った。
従来の癌に対する遺伝子治療の殆どは癌細胞を標的として開発されてきたが、本発明は、宿主の腹腔環境におけるmiR-29bの量的変化を修正し、腹膜播種を制御することができる。すなわち、宿主側の腹腔内を構成する細胞に、アデノ随伴ウイルスベクターを用いてmiR-29bを発現させることで、腹膜播種の治療及び予防を行うことができる。これにより、本発明により、難治性の病態である癌腹膜播種を標的とした有用な治療剤、治療方法を提供することができる。
以下、より具体的に本発明の実施の形態について説明する。
従来の癌に対する遺伝子治療の殆どは癌細胞を標的として開発されてきたが、本発明は、宿主の腹腔環境におけるmiR-29bの量的変化を修正し、腹膜播種を制御することができる。すなわち、宿主側の腹腔内を構成する細胞に、アデノ随伴ウイルスベクターを用いてmiR-29bを発現させることで、腹膜播種の治療及び予防を行うことができる。これにより、本発明により、難治性の病態である癌腹膜播種を標的とした有用な治療剤、治療方法を提供することができる。
以下、より具体的に本発明の実施の形態について説明する。
〔腹膜播種抑制剤〕
具体的には、本実施形態に係る腹膜播種抑制剤は、miR-29b搭載のアデノ随伴ウイルスベクターを含むことを特徴とする。
具体的には、本実施形態に係る腹膜播種抑制剤は、miR-29b搭載のアデノ随伴ウイルスベクターを含むことを特徴とする。
ここで、マイクロRNA(microRNA、以下「miRNA」、「miR」ともいう。)は、ゲノム上にコードされた、機能性のncRNA(non-coding RNA、ノンコーディングRNA、非コードRNA)の一種であり、多段階的な生成過程を経て、20~25塩基(nt)長程度の一本鎖RNA分子となるものである。マイクロRNAは、真核生物において遺伝子の転写後の発現調節等に関与している。
本実施形態においては、このマイクロRNAとして、癌抑制的に働き、腹膜播種患者の腹腔内で発現が低下しているmiR-29bの前駆体配列をベクターに導入する。本実施形態において用いられるヒト及びマウスで共通のmiR-29b(マイクロRNAに転写された状態)の配列の一例を、配列表の配列番号1に示す。
本実施形態においては、このマイクロRNAとして、癌抑制的に働き、腹膜播種患者の腹腔内で発現が低下しているmiR-29bの前駆体配列をベクターに導入する。本実施形態において用いられるヒト及びマウスで共通のmiR-29b(マイクロRNAに転写された状態)の配列の一例を、配列表の配列番号1に示す。
しかしながら、本実施形態に係るmiR-29bは、必ずしも配列番号1に示したようなmiR-29bのDNAによる前駆体配列でなくてもよく、ゲノム上のmiRNA遺伝子と同様の配列、pre-miRNA、mature(成熟)-miRNAに準じた配列等であってもよく、その他の細胞内の処理により活性化されてmiR-29bが最終的に合成されるような配列等であってもよい。
さらに、miR-29bを修飾したり、中皮間葉転換(MMT)の抑制効果を高めたりして修正された配列であってもよい。さらに、このmiR-29bの配列は、ヒトやマウス以外の動物種の配列、動物種に合わせて修正された配列等であってもよく、AAVに搭載されるコピー数やエンハンサー配列等も任意であってもよい。加えて、本実施形態に係るmiR-29bは、配列上に、他の遺伝子、例えば、他の癌抑制型miRNA(Tumor Suppressor miRNA)を含んでいてもよい。このような癌抑制効果のある他のmiRNAは、例えば、miR-34等であってもよい。
さらに、miR-29bを修飾したり、中皮間葉転換(MMT)の抑制効果を高めたりして修正された配列であってもよい。さらに、このmiR-29bの配列は、ヒトやマウス以外の動物種の配列、動物種に合わせて修正された配列等であってもよく、AAVに搭載されるコピー数やエンハンサー配列等も任意であってもよい。加えて、本実施形態に係るmiR-29bは、配列上に、他の遺伝子、例えば、他の癌抑制型miRNA(Tumor Suppressor miRNA)を含んでいてもよい。このような癌抑制効果のある他のmiRNAは、例えば、miR-34等であってもよい。
一方、アデノ随伴ウイルス(Adeno-associated virus、以下「AAV」ともいう。)は、ヒトや霊長目の動物に感染するパルボウイルス科ディペンドウイルス属で、ヘルパーウイルスに依存する、エンベロープを持たない小型(20nm程度)のウイルスである。
本実施形態においては、このAAVにmiR-29bを搭載させる。AAVは、毒性が低く、免疫原性が低く、期間発現を持続させることが可能であるという特徴をもつ。さらに、AAVは、実際に、いくつか臨床応用されている手法であり安全性が高いため、実際に臨床応用する上でmiR-29bを搭載しても安全性を高められる。なお、本実施形態においては、上述したように、miR-29b搭載のAAVを、「AAV-miR-29b」ともいう。
本実施形態においては、このAAVにmiR-29bを搭載させる。AAVは、毒性が低く、免疫原性が低く、期間発現を持続させることが可能であるという特徴をもつ。さらに、AAVは、実際に、いくつか臨床応用されている手法であり安全性が高いため、実際に臨床応用する上でmiR-29bを搭載しても安全性を高められる。なお、本実施形態においては、上述したように、miR-29b搭載のAAVを、「AAV-miR-29b」ともいう。
ここで、上述の非特許文献1のmiR-29bミミックのアテロコラーゲンと複合体を形成させた投与に比べて、本実施形態に係るAAV-miR-29bを利用した送達法を用いる腹膜播種抑制剤は、後述する実施例1、2に示すように、マウス腹膜播種モデルを用いたin vivo実験においても腹膜播種抑制効果が当業者に予測できない程度に極めて高く、従来技術に対して顕著な効果を示す。
また、本実施形態に係る腹膜播種抑制剤において、AAVの血清型は、AAV1、AAV2、AAV4、AAV5、AAV9、及びAAV-DJからなる群の一種を含むことを特徴とする。
特に、本実施形態に係るAAVの血清型として、ヒト(Homo sapiens)では、後述する実施例1、2で腹腔表面を覆う腹膜中皮細胞に対して指向性を持つアデノ随伴ウイルスの血清型を選択した結果を示すように、特にAAV2が好適である。すなわち、AAV2が、最も腹膜中皮細胞に対して最も指向性が高い。加えて、特に、AAV2は、当業者において、癌細胞自体に対する障害性も見いだされている。このため相乗的な効果が期待でき、このAAV2型のベクターを用いることが特に好適である。
一方、マウス(Mus musculus)では、AAV1、AAV2、AAV4、AAV5、AAV9、又はAAV-DJが好適である。このうち、特に、マウスでは、AAV-DJが好適である。
以下、AAV-miR-29bのうち、各血清型のAAVに搭載されたものを区別して示す場合、AAV2-miR-29b、AAV-DJ-miR-29b等として記載する。
特に、本実施形態に係るAAVの血清型として、ヒト(Homo sapiens)では、後述する実施例1、2で腹腔表面を覆う腹膜中皮細胞に対して指向性を持つアデノ随伴ウイルスの血清型を選択した結果を示すように、特にAAV2が好適である。すなわち、AAV2が、最も腹膜中皮細胞に対して最も指向性が高い。加えて、特に、AAV2は、当業者において、癌細胞自体に対する障害性も見いだされている。このため相乗的な効果が期待でき、このAAV2型のベクターを用いることが特に好適である。
一方、マウス(Mus musculus)では、AAV1、AAV2、AAV4、AAV5、AAV9、又はAAV-DJが好適である。このうち、特に、マウスでは、AAV-DJが好適である。
以下、AAV-miR-29bのうち、各血清型のAAVに搭載されたものを区別して示す場合、AAV2-miR-29b、AAV-DJ-miR-29b等として記載する。
より詳細について具体的に説明すると、本実施形態に係る腹膜播種抑制剤は、腹腔内を構成する細胞にmiR-29bを発現させ、腹膜播種を治療又は予防することを特徴とする。すなわち、AAVを用いてmiR-29bを、腹腔内を構成する細胞に送達させて発現させることにより、腹膜播種の成立及び進展を抑制又は予防することが可能である。
本実施形態に係る腹膜播種抑制剤が対象とする腹腔内を構成する細胞は、例えば、腹腔、胸腔、心嚢等の体腔表面を覆う膜様組織を構成する各種細胞であってもよい。このうち、本実施形態においては、特に、腹腔内を構成する細胞として、腹膜の中皮(mesothelium)を構成する腹膜中皮細胞を主な対象細胞として説明するものの、それ以外の細胞であってもよい。すなわち、本実施形態に係る腹腔内を構成する細胞は、他のmiR-29bが減少すると繊維化され、癌細胞が転移されやすくなるような膜様組織を構成する各種細胞であってもよい(以下、これらの細胞を「腹膜中皮細胞等」という。)。
さらに、本実施形態に係る腹膜播種抑制剤においては、腹腔内を構成する細胞の中皮間葉転換(MMT)を抑制し、腹膜の線維化を抑制することを特徴とする。すなわち、本実施形態の腹膜播種抑制剤は、癌細胞の刺激や炎症物質等により、腹膜中皮細胞等に中皮間葉転換(MMT)が生じるのを抑制する。これによって、腹膜中皮細胞等の遊走能を有意に抑制し、腹膜全体の腹膜の線維化を抑制する。
このため、本実施形態に係る腹膜播種抑制剤により、腹膜中皮細胞等に対する癌細胞の接着能を低下させ、腹膜播種を治療又は予防することができる。
このため、本実施形態に係る腹膜播種抑制剤により、腹膜中皮細胞等に対する癌細胞の接着能を低下させ、腹膜播種を治療又は予防することができる。
また、本発明の実施の形態に係る腹膜播種抑制剤が対象とする癌は、胃癌、膵癌、大腸癌、子宮癌、卵巣癌等の腹腔に発生する癌を含む。
なお、本発明の実施の形態に係る腹膜播種抑制剤は、他の腹膜播種を生じる可能性がある癌に適用することも可能である。たとえば、本実施形態の治療剤は、頭頸部癌、食道癌、肝臓癌、胆嚢癌、肺癌、腎癌、精巣癌、乳癌、前立腺癌、膀胱癌、皮膚癌、甲状腺癌、悪性リンパ腫、他の肉腫等の各種癌による腹膜播種に適用することも可能である。すなわち、本実施形態に係る腹膜播種抑制剤により、これらの腹膜播種の浸潤や転移による腹膜播種の発生を抑制することも可能である。
なお、本発明の実施の形態に係る腹膜播種抑制剤は、他の腹膜播種を生じる可能性がある癌に適用することも可能である。たとえば、本実施形態の治療剤は、頭頸部癌、食道癌、肝臓癌、胆嚢癌、肺癌、腎癌、精巣癌、乳癌、前立腺癌、膀胱癌、皮膚癌、甲状腺癌、悪性リンパ腫、他の肉腫等の各種癌による腹膜播種に適用することも可能である。すなわち、本実施形態に係る腹膜播種抑制剤により、これらの腹膜播種の浸潤や転移による腹膜播種の発生を抑制することも可能である。
この治療又は予防のため、本実施形態に係る腹膜播種抑制剤は、腫瘍に対する手術と同時又は後に投与されることが好適である。
本実施形態に係る腹膜播種抑制剤は、後述する実施例1で示すように、癌細胞播種後3日目に投与しても、癌細胞播種と同時に投与しても、腹膜播種結節数を抑制することができる。加えて、後述する実施例2で示すように、既に腹膜播種が発生している状態でも、腹腔内に抗癌剤と同時投与することで、腹膜播種結節数を抑制することができる。
本実施形態に係る腹膜播種抑制剤は、後述する実施例1で示すように、癌細胞播種後3日目に投与しても、癌細胞播種と同時に投与しても、腹膜播種結節数を抑制することができる。加えて、後述する実施例2で示すように、既に腹膜播種が発生している状態でも、腹腔内に抗癌剤と同時投与することで、腹膜播種結節数を抑制することができる。
このため、腹膜播種形成のごく早期での予防として、「手術時に腹膜播種がみられなかったものの通常の検査で検出困難なくらいごく少数の癌細胞が残存している状態」、例えば、T4胃癌でCY0(腹腔内洗浄細胞診陰性)のような状態において投与可能である。すなわち、このような状態で、本実施形態に係る腹膜播種抑制剤を投与することで、腹膜播種の成立及び進展を抑制することが期待できる。
または、手術時に本実施形態に係る腹膜播種抑制剤を投与することも可能である。すなわち、本発明者らが調べたところ、T4胃癌患者でmiR-29bが低い患者には腹膜播種を来すことが多いため、本実施形態に係る腹膜播種抑制剤を手術の際に投与ことによって術後の腹膜播種の発生、再発を予防可能となる。
または、手術時に本実施形態に係る腹膜播種抑制剤を投与することも可能である。すなわち、本発明者らが調べたところ、T4胃癌患者でmiR-29bが低い患者には腹膜播種を来すことが多いため、本実施形態に係る腹膜播種抑制剤を手術の際に投与ことによって術後の腹膜播種の発生、再発を予防可能となる。
この際、本実施形態に係る腹膜播種抑制剤は、上述の手術時又は後に、腹腔内に直接投与されてもよい。
このように構成することで、後述する実施例1、2で示すように、本実施形態の腹膜播種抑制剤を中皮間葉転換による腹膜播種の成立及び進展を抑制又は予防に資することができる。すなわち、実施例1、2で、AAVを腹腔内注射したように、本実施形態の腹膜播種抑制剤を腹腔内に、注射や点滴や手術時のスプレー等の当業者に一般的な手段を用いて、直接、投与することが可能である。
このように構成することで、後述する実施例1、2で示すように、本実施形態の腹膜播種抑制剤を中皮間葉転換による腹膜播種の成立及び進展を抑制又は予防に資することができる。すなわち、実施例1、2で、AAVを腹腔内注射したように、本実施形態の腹膜播種抑制剤を腹腔内に、注射や点滴や手術時のスプレー等の当業者に一般的な手段を用いて、直接、投与することが可能である。
このように、本実施形態に係る腹膜播種抑制剤は、腹膜播種の治療剤(治療用組成物)又は予防剤(予防用組成物)のような医薬として用いることが可能である。すなわち、本実施形態に係る腹膜播種抑制剤は、腹膜播種の抑制、及び手術可能な癌の腹膜播種による再発を予防する薬剤として使用可能である。
実際に、後述する実施例1、2で示すように、miR-29bを用いることで、中皮間葉転換を阻害して、腹膜播種の成立及び進展を抑えることが可能となっている。これにより、miR-29bを腹膜播種の治療剤として使用できる。
実際に、後述する実施例1、2で示すように、miR-29bを用いることで、中皮間葉転換を阻害して、腹膜播種の成立及び進展を抑えることが可能となっている。これにより、miR-29bを腹膜播種の治療剤として使用できる。
加えて、上述したように、本実施形態においては、miR-29b搭載のAAVにより、腹腔内を構成する細胞にmiR-29bを発現させることで、腹膜播種抑制方法及び腹膜播種予防方法として用いることが可能である。
このように構成し、本実施形態の腹膜播種抑制剤を治療剤として用い、又は、治療方法として用いることにより、中皮間葉転換による腹膜播種の成立及び進展を抑制又は予防し、予後不良な腹膜播種の増生も抑制することが可能となる。つまり、本実施形態の治療剤は、腹膜の線維化の防止により、腹腔内に発生する癌転移による腹膜播種の治療手段として提供することができる。
このように構成し、本実施形態の腹膜播種抑制剤を治療剤として用い、又は、治療方法として用いることにより、中皮間葉転換による腹膜播種の成立及び進展を抑制又は予防し、予後不良な腹膜播種の増生も抑制することが可能となる。つまり、本実施形態の治療剤は、腹膜の線維化の防止により、腹腔内に発生する癌転移による腹膜播種の治療手段として提供することができる。
また、本実施形態に係る腹膜播種抑制剤は、標準的な臨床用の癌治療方法に係る薬剤と組み合わせることも可能である。
すなわち、本実施形態に係る腹膜播種抑制剤は、抗癌剤と併用されてもよい。
具体的には、当業者が行う化学療法用の抗癌剤等と併用することが可能である。すなわち、本実施形態に係る腹膜播種抑制剤を腹膜播種の治療として使用されている抗癌剤と併用することで、抗癌剤単独による治療よりも腹膜播種の成立及び進展を抑制又は予防することが可能となる。
すなわち、本実施形態に係る腹膜播種抑制剤は、抗癌剤と併用されてもよい。
具体的には、当業者が行う化学療法用の抗癌剤等と併用することが可能である。すなわち、本実施形態に係る腹膜播種抑制剤を腹膜播種の治療として使用されている抗癌剤と併用することで、抗癌剤単独による治療よりも腹膜播種の成立及び進展を抑制又は予防することが可能となる。
なお、本実施形態に係る腹膜播種抑制剤は、miR-29bそのものに加え、miR-29の合成促進剤や分解阻害剤等を含んでいてもよい。すなわち、本実施形態に係る腹膜播種抑制剤は、腹腔内に発生する癌を含む腹膜播種の治療標的をmiR-29bの生合成系とし、miR-29bの合成を促進する物質である合成促進剤、miR-29bの分解を阻害する物質である分解阻害剤等を含む。
具体的には、このmiR-29bの合成促進剤や分解阻害剤は、miR-29bの遺伝子発現調節剤であってもよい。具体的には、遺伝子発現調節剤として、miR-29bの合成、分解に関する経路に対する遺伝子調整剤を各種用いることが可能である。
この遺伝子調整剤は、例えば、miR-29bの遺伝子からの生合成系の経路において転写や修飾の調整を行うDNAやRNA等の核酸(ヌクレオチド)、各酵素等のタンパク質(以下、「標的タンパク質」という。)に対する、抗体を含むペプチド、PNA、ゲノム編集に係る核酸やタンパク質等であってもよい。
このうち、核酸は、アンチセンスDNA若しくはRNA、siRNA、shRNA、リボザイム等であってもよい。
また、本実施形態の遺伝子発現調節剤は、標的タンパク質のアミノ酸配列、及びmRNA配列、ゲノムDNA配列等から同定して、当業者に容易な手法で製造することが可能である。
この遺伝子調整剤は、例えば、miR-29bの遺伝子からの生合成系の経路において転写や修飾の調整を行うDNAやRNA等の核酸(ヌクレオチド)、各酵素等のタンパク質(以下、「標的タンパク質」という。)に対する、抗体を含むペプチド、PNA、ゲノム編集に係る核酸やタンパク質等であってもよい。
このうち、核酸は、アンチセンスDNA若しくはRNA、siRNA、shRNA、リボザイム等であってもよい。
また、本実施形態の遺伝子発現調節剤は、標的タンパク質のアミノ酸配列、及びmRNA配列、ゲノムDNA配列等から同定して、当業者に容易な手法で製造することが可能である。
このように、miR-29bの合成促進剤や分解阻害剤等を含む、miR-29bの合成や分解に関する生合成経路に対する各種組成物も、腹膜播種の治療剤として提供できる。すなわち、これらを腹膜播種の成立及び進展を抑制する腹膜播種抑制剤として提供することが可能となる。
また、この他にも、本実施形態の腹膜播種抑制剤として、miR-29bによる遺伝子発現調整と同様のパスウェイをターゲットとする合成促進剤や分解阻害剤を用いることも可能である。
また、この他にも、本実施形態の腹膜播種抑制剤として、miR-29bによる遺伝子発現調整と同様のパスウェイをターゲットとする合成促進剤や分解阻害剤を用いることも可能である。
また、本実施形態の腹膜播種抑制剤は、中皮間葉転換(MMT)に関連する酵素を標的とした低分子化合物、抗体医薬、核酸、PNA等の各種医療用組成物を用いることが可能である。これらとして、例えば、低分子化合物等を合成して腹膜播種抑制剤として併用してもよい。
また、本実施形態の腹膜播種抑制剤は、癌のアポトーシスを促進したり、癌の免疫系を惹起したり、ゲノム編集等の遺伝子改変に関連する手法を実現する医療用組成物等も加えられていてもよい。
また、本実施形態の腹膜播種抑制剤は、癌のアポトーシスを促進したり、癌の免疫系を惹起したり、ゲノム編集等の遺伝子改変に関連する手法を実現する医療用組成物等も加えられていてもよい。
また、本発明の実施の形態に係る腹膜播種抑制剤が低分子化合物である場合、各種の塩として提供されてもよい。これらの塩は、低分子化合物と、医薬品の製造に使用可能である酸又は塩基とを反応させることにより製造してもよい。
なお、本実施形態に係る腹膜播種抑制剤として、手術不能の腹膜播種、すなわち高度進行例に対しては、miR-29bによる腹膜中皮の強化だけでは進展を抑えづらい可能性もあるため、アンチmiRNAやmiRNAインヒビターを発現するAAVベクターを同時に投与してもよい。
また、本実施形態に係る腹膜播種抑制剤として、腹腔内を構成する細胞に中皮間葉転換を抑止させるような他の調節剤等を加えて用いることも可能である。
また、本実施形態の治療剤は、各種の腫瘍接着防止剤、腫瘍血管新生阻害剤等を併用し、癌細胞の接着や腹膜播種の内部への血管新生を抑えることで、効果を高めてもよい。
また、本実施形態の治療剤は、各種の腫瘍接着防止剤、腫瘍血管新生阻害剤等を併用し、癌細胞の接着や腹膜播種の内部への血管新生を抑えることで、効果を高めてもよい。
さらに、AAV以外の医療用の各種ベクターをAAVに加えて用いることも可能である。このウイルスベクターとしては、例えば、アデノウイルスベクター、レンチウイルスベクター、レトロウイルスベクター等を使用可能である。このうち、AAVよりも長いDNAを保持可能なベクターを用いることで、腹膜播種の元の種類の癌等の治療対象の腫瘍に特異的なゲノム編集等を実現することも可能となる。
また、本発明の実施の形態に係る腹膜播種抑制剤は、プロドラッグも含まれる。ここで、プロドラッグは、投与後、生理条件下で、特定のpH条件や酵素の作用等で分解され変換される誘導体を意味する。また、プロドラッグは、患者に投与された際には不活性であってもよいものの、生体内では活性のある治療剤に変換される。
また、本発明の実施の形態に係る腹膜播種抑制剤は、任意の製剤上許容しうる担体として、例えば生理食塩水、アテロコラーゲン、その他のコラーゲン等を含んでいてもよい。さらに、担体として、ブドウ糖、D-ソルビトール、D-マンノース、D-マンニトール、エタノール、ポリアルコール、例えばプロピレングリコール、ポリエチレングリコール、非イオン性界面活性剤等と共に投与することができる。
また、本発明の実施の形態に係る腹膜播種抑制剤は、製剤上許容しうる担体を調製するために、適切な薬学的に許容可能なキャリアを含んでもよい。このキャリアとしては、シリコーン、コラーゲン、ゼラチン等の生体親和性材料を含んでもよい。
さらには、例えば、希釈剤、香料、防腐剤、賦形剤、崩壊剤、滑沢剤、結合剤、乳化剤、可塑剤等の製剤用添加物を含有させてもよい。また、本実施形態の治療剤は、適切な賦形剤等を含んでもよい。
また、本発明の実施の形態に係る腹膜播種抑制剤は、投与に適した投与形態においては、当該分野で周知の製剤上許容しうる担体を用いて処方され得る。
さらには、例えば、希釈剤、香料、防腐剤、賦形剤、崩壊剤、滑沢剤、結合剤、乳化剤、可塑剤等の製剤用添加物を含有させてもよい。また、本実施形態の治療剤は、適切な賦形剤等を含んでもよい。
また、本発明の実施の形態に係る腹膜播種抑制剤は、投与に適した投与形態においては、当該分野で周知の製剤上許容しうる担体を用いて処方され得る。
〔腹膜播種治療方法〕
また、本発明の実施の形態に係る治療方法は、腹膜播種の治療方法であって、上述の腹膜播種抑制剤を投与することを特徴とする。
具体的には、本実施形態に係る腹膜播種治療方法は、動物の腹膜播種治療方法であって、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。すなわち、腹膜内を構成する細胞でmiR-29を発現し、腹膜播種を生じうる動物に対して、腹膜播種の治療方法に用いることが可能である。
また、本発明の実施の形態の治療剤は、生物体、生物体の体内の一部分について、治療用の対象とすることができる。この生物体は特に限定されるものではないが、例えば、ヒト、家畜動物種、野生動物等の動物を含む。
また、本発明の実施の形態に係る治療方法は、腹膜播種の治療方法であって、上述の腹膜播種抑制剤を投与することを特徴とする。
具体的には、本実施形態に係る腹膜播種治療方法は、動物の腹膜播種治療方法であって、miR-29b搭載のアデノ随伴ウイルスベクターにより、腹腔内を構成する細胞にmiR-29bを発現させることを特徴とする。すなわち、腹膜内を構成する細胞でmiR-29を発現し、腹膜播種を生じうる動物に対して、腹膜播種の治療方法に用いることが可能である。
また、本発明の実施の形態の治療剤は、生物体、生物体の体内の一部分について、治療用の対象とすることができる。この生物体は特に限定されるものではないが、例えば、ヒト、家畜動物種、野生動物等の動物を含む。
この際、本発明の実施の形態に係る治療剤の治療対象としては、主にヒト及び、ヒト以外の各種脊椎動物に用いることができる。
このヒト以外の動物は、特に限定されるものではなく、真獣下綱(Eutheria)の有胎盤哺乳類を包括する各種哺乳類を含む。具体的には、例えば、マウス、ラット、フェレット、ハムスター、モルモット、又はウサギ等のげっ歯類、イヌ、ネコ、ヒツジ、ブタ、ウシ、ウマ、又は非ヒューマンのトランスジェニック霊長類等であってもよい。すなわち、本発明の実施の形態に係る腹膜播種治療剤は、ヒトの治療の他に、各種動物の腹膜播種の抑制又は予防のための方法にも用いることができる。
なお、ヒトの治療が産業上利用可能な(特許要件となり得る)国においては、この本発明の実施の形態に係る治療方法は、ヒトについても適用範囲となってもよい。
このヒト以外の動物は、特に限定されるものではなく、真獣下綱(Eutheria)の有胎盤哺乳類を包括する各種哺乳類を含む。具体的には、例えば、マウス、ラット、フェレット、ハムスター、モルモット、又はウサギ等のげっ歯類、イヌ、ネコ、ヒツジ、ブタ、ウシ、ウマ、又は非ヒューマンのトランスジェニック霊長類等であってもよい。すなわち、本発明の実施の形態に係る腹膜播種治療剤は、ヒトの治療の他に、各種動物の腹膜播種の抑制又は予防のための方法にも用いることができる。
なお、ヒトの治療が産業上利用可能な(特許要件となり得る)国においては、この本発明の実施の形態に係る治療方法は、ヒトについても適用範囲となってもよい。
本発明の実施の形態に係る医薬組成物の投与経路は、特に限定されないが、非経口的又は経口的に投与することが可能である。
非経口投与としては、例えば、上述の担体とともに腹腔内への注射、手術時の腹膜への散布等による投与に加え、静脈内、動脈内、皮下、真皮内、筋肉内への投与が挙げられる。
非経口投与としては、例えば、上述の担体とともに腹腔内への注射、手術時の腹膜への散布等による投与に加え、静脈内、動脈内、皮下、真皮内、筋肉内への投与が挙げられる。
また、本発明の実施の形態に係る治療剤を上述の治療に用いるために、投与間隔及び投与量は、腫瘍の状況、さらに対象の状態等の種々の条件に応じて適宜選択及び変更することが可能である。
ここで、治療する場合には、腫瘍の増生を遅くする投与用量を用いることができる。また、その他の治療剤と組み合わせて用いる場合、吐き気や重篤な副作用を抑えることで、効果的に使用可能である。
ここで、治療する場合には、腫瘍の増生を遅くする投与用量を用いることができる。また、その他の治療剤と組み合わせて用いる場合、吐き気や重篤な副作用を抑えることで、効果的に使用可能である。
本発明の実施の形態に係る治療剤は、腹膜播種を生じ得る癌患者に対しての投与量、及び投与回数を、投与の目的により、更に患者の年齢及び体重、症状及び疾患の重篤度等の種々の条件に応じて適宜選択及び変更することが可能である。
この投与回数及び期間は、状態をモニターし、その状態により再度あるいは繰り返し投与を行う。
この投与回数及び期間は、状態をモニターし、その状態により再度あるいは繰り返し投与を行う。
本発明の実施の形態に係る治療剤は、抗癌剤と併用されることを特徴とする。すなわち、本発明の実施の形態に係る治療剤は、従来の化学療法剤や抗癌剤等の他の治療用組成物等と併用することも可能である。この抗癌剤は、例えば、後述する実施例2で示す、パクリタキセルのような、腹膜播種の治療に当業者が用いるようなものを含んでいてもよく、それ以外の種類のものを用いてもよく、複数の治療用組成物の組み合わせ(カクテル)を用いてもよい。これにより、腹膜播種の治療及び予防効果が期待できる。また、既に治療が始まっている状態でも、本実施形態に係る治療剤を用いることが可能である。
また、放射線治療、粒子線治療、手術等の他の癌の治療剤や治療方式と併用することも可能である。これにより、予後の悪い腹膜播種への有効な治療法となり得る。
また、放射線治療、粒子線治療、手術等の他の癌の治療剤や治療方式と併用することも可能である。これにより、予後の悪い腹膜播種への有効な治療法となり得る。
本実施形態の治療剤に加えて、苦痛を緩和したりQOLを向上させたりするような治療用組成物を加えて治療してもよい。また、他の組成物と同時に本発明の組成物を投与してもよく、また間隔を空けて投与してもよいが、その投与順序は特に問わない。
また、本発明の実施の形態において、疾患が改善または軽減される期間は特に限定されないが、一時的な改善または軽減であってもよいし、一定期間の改善または軽減であってもよい。
また、本発明の実施の形態において、疾患が改善または軽減される期間は特に限定されないが、一時的な改善または軽減であってもよいし、一定期間の改善または軽減であってもよい。
〔発明の効果〕
従来の腹膜播種の治療は化学療法しかなく、腹膜播種を標的とした効果的な治療薬、治療方法は開発されていなかった。
これに対して、本実施形態に係る腹膜播種抑制剤により、後述する実施例1で示すように、マウス胃癌細胞株YTN16Pを用いたマウス腹膜播種モデルの腹腔内にAAV-miR-29bを投与したところ、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。また、後述する実施例2で示すように、悪性度が高い膵癌のような他の癌においても、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。すなわち、胃癌と同様かそれ以上に腹膜播種の予後が悪い膵癌においても、腹膜播種の進展を抑制することができる。
まとめると、本実施形態に係る腹膜播種抑制剤により、癌細胞ではなく、腹膜中皮細胞に作用して腫瘍形成を効率よく抑制することができる。
従来の腹膜播種の治療は化学療法しかなく、腹膜播種を標的とした効果的な治療薬、治療方法は開発されていなかった。
これに対して、本実施形態に係る腹膜播種抑制剤により、後述する実施例1で示すように、マウス胃癌細胞株YTN16Pを用いたマウス腹膜播種モデルの腹腔内にAAV-miR-29bを投与したところ、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。また、後述する実施例2で示すように、悪性度が高い膵癌のような他の癌においても、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。すなわち、胃癌と同様かそれ以上に腹膜播種の予後が悪い膵癌においても、腹膜播種の進展を抑制することができる。
まとめると、本実施形態に係る腹膜播種抑制剤により、癌細胞ではなく、腹膜中皮細胞に作用して腫瘍形成を効率よく抑制することができる。
また、癌細胞株とAAV-miR-29bの同時投与においても腹膜播種結節数は有意に少なく、予防的効果もあると考えられた。この結果から、壁深達度が高度(T4)の患者で洗浄細胞診が陰性(CYO)であるT4CYO胃癌の手術時終了時にAAV-miR29bを腹腔内に単回投与することで将来の腹膜播種再発を予防できる可能性がある。すなわち、難治性の病態である腹膜播種の予防を目指した治療を行うことが可能となる。
具体的に、治療効果や予防効果としては、腹膜播種となった癌の転移巣が腹膜を覆うように又は結節のように増殖し、消化管やその他の臓器や組織を閉塞させるのを抑えることができる。さらに、悪液質を改善し、更に、新たな腹膜播種が生じるのを防ぐことが期待できる。そして、各転移巣を化学療法、抗癌剤、又は手術により消去、除去、又は切除されることで、癌そのものが緩解することも期待できる。実際に、後述する実施例2で示すように、化学療法(抗癌剤)と併用することで、より腹膜播種の進展を抑制することが可能である。
〔他の実施の形態〕
なお、本発明の他の実施の形態に係るウイルスベクターとしては、本発明の他の実施の形態に係る腹膜播種抑制方法として、採取された腹腔内液中のmiR-29bの発現量を測定し、予後を予測することを特徴としてもよい。
このように構成し、手術や検査時に採取された腹膜の細胞サンプル中のmiR-29bの発現量を測定することにより、腹膜播種の起こりやすさ(予後の予測)及び及び治療効果の判定を行うことが可能となる。すなわち、腹膜でのmiR-29b等の測定を、予後及び治療効果の予測マーカーとして使用することが可能となる。
なお、本発明の他の実施の形態に係るウイルスベクターとしては、本発明の他の実施の形態に係る腹膜播種抑制方法として、採取された腹腔内液中のmiR-29bの発現量を測定し、予後を予測することを特徴としてもよい。
このように構成し、手術や検査時に採取された腹膜の細胞サンプル中のmiR-29bの発現量を測定することにより、腹膜播種の起こりやすさ(予後の予測)及び及び治療効果の判定を行うことが可能となる。すなわち、腹膜でのmiR-29b等の測定を、予後及び治療効果の予測マーカーとして使用することが可能となる。
具体的には、癌の手術時に取得した腹膜の細胞中のmiR-29b等の発現量をRT-PCR法、デジタルPCR法、ノーザンブロット等の各種手法で測定することで、腹膜播種の起こりやすさを判定し、予後の良否を同定することができる。これにより、miR-29b等の発現量の測定により、腫瘍の腹膜播種による転移のし易さ予後を予測し、治療法を選択可能な診断方法を提供することができる。この発現量は、絶対的な発現量でもよいし、相対的な発現量でもよく、特定の発現量幅の「レベル」を基にした濃度であってもよい。
このように構成し、予後予測方法を組み合わせて、腹膜播種の起こりやすさを調べた上で、有効に治療することが可能となる。また薬剤投与後、腹膜でのmiR-29b等の発現量を目安として治療効果の判定が可能である。
このように構成し、予後予測方法を組み合わせて、腹膜播種の起こりやすさを調べた上で、有効に治療することが可能となる。また薬剤投与後、腹膜でのmiR-29b等の発現量を目安として治療効果の判定が可能である。
なお、本実施形態において、「一種以上」とは、各構成のうち一つ又は複数の組み合わせのいずれかであることを示す。すなわち、いずれか一つを用いてもよいし、これらのうち二つ~全てについての任意の組み合わせを含んでいてもよい。
次に図面に基づき本発明を実施例によりさらに説明するが、以下の具体例は本発明を限定するものではない。
〔実験方法〕
(プラスミドDNAの構築)
pAAV-CMV-MCS(タカラバイオ株式会社製)を制限酵素BamHIとXbaIで切断し、miR-29bを発現するpLV-[hsa-mir-29b-1](Biosettia社製)からBamHIとXbaIで切断して得られたmiR-29bの前駆体配列(以下、「mir-29b-1配列」という。これを配列番号1に示す。)を含む配列を導入することでpAAV-CMV-[mir-29b-1]を作製した。
図1AにpAAV2-CMV-MCS、図1Bに作製したpAAV-CMV-[mir-29b-1]のベクターの構造を示す。
(プラスミドDNAの構築)
pAAV-CMV-MCS(タカラバイオ株式会社製)を制限酵素BamHIとXbaIで切断し、miR-29bを発現するpLV-[hsa-mir-29b-1](Biosettia社製)からBamHIとXbaIで切断して得られたmiR-29bの前駆体配列(以下、「mir-29b-1配列」という。これを配列番号1に示す。)を含む配列を導入することでpAAV-CMV-[mir-29b-1]を作製した。
図1AにpAAV2-CMV-MCS、図1Bに作製したpAAV-CMV-[mir-29b-1]のベクターの構造を示す。
(AAVベクターの回収)
HEK293(Human Embryonic Kidney cells 293)細胞を培養し、pAAV-CMV-[mir-29b-1]と、AAV1~10血清型及びAAV-DJ血清型をコードするAAVプラスミド、ヘルパープラスミド(タカラバイオ株式会社製)をリン酸カルシウム法でトランスフェクションした。72時間後にHEK293細胞を剥がして回収し、細胞を破壊してAAVベクターを遊離させ、エンドヌクレアーゼ処理を行った。遠心処理を行って上清を回収した。
回収したAAVベクター溶液に塩化セシウムを混合し密度勾配超遠心法を行いAAVベクターが含まれる分画を回収した。ベクター用の緩衝液で透析を行った後、PCR定量を行い、サンプル中のベクター濃度を確定させた。
HEK293(Human Embryonic Kidney cells 293)細胞を培養し、pAAV-CMV-[mir-29b-1]と、AAV1~10血清型及びAAV-DJ血清型をコードするAAVプラスミド、ヘルパープラスミド(タカラバイオ株式会社製)をリン酸カルシウム法でトランスフェクションした。72時間後にHEK293細胞を剥がして回収し、細胞を破壊してAAVベクターを遊離させ、エンドヌクレアーゼ処理を行った。遠心処理を行って上清を回収した。
回収したAAVベクター溶液に塩化セシウムを混合し密度勾配超遠心法を行いAAVベクターが含まれる分画を回収した。ベクター用の緩衝液で透析を行った後、PCR定量を行い、サンプル中のベクター濃度を確定させた。
(腹膜中皮細胞の分離)
ヒトの腹膜中皮細胞は、自治医科大学倫理審査委員会の承認を受け、患者本人に説明し同意を取得した上で分離培養を行った。非癌手術(肥満症手術)患者の手術時に2~4cm3の大網組織を取得し、直ちにリン酸緩衝化生理食塩水(Phosphate Bufferd Saline、PBS)で半分の濃度としたTrypLE Express (Thermo Fisher Scientific社製)に浸し、37℃で2時間培養した。上清を100μmのナイロンメッシュフィルターで濾過し、1500rpm, 4℃で5分間、遠心処理した。回収した細胞は20%FBS(Fetal Bovine Serum、Sigma社製)と100U/mlペニシリン、100mg/mlのストレプトマイシンを含むDMEM培地(コスモ・バイオ株式会社製)に再懸濁し、37℃、5%CO2のインキュベーター内で培養した。
図2に、培養されたヒト腹膜中皮細胞の様子を示す。
ヒトの腹膜中皮細胞は、自治医科大学倫理審査委員会の承認を受け、患者本人に説明し同意を取得した上で分離培養を行った。非癌手術(肥満症手術)患者の手術時に2~4cm3の大網組織を取得し、直ちにリン酸緩衝化生理食塩水(Phosphate Bufferd Saline、PBS)で半分の濃度としたTrypLE Express (Thermo Fisher Scientific社製)に浸し、37℃で2時間培養した。上清を100μmのナイロンメッシュフィルターで濾過し、1500rpm, 4℃で5分間、遠心処理した。回収した細胞は20%FBS(Fetal Bovine Serum、Sigma社製)と100U/mlペニシリン、100mg/mlのストレプトマイシンを含むDMEM培地(コスモ・バイオ株式会社製)に再懸濁し、37℃、5%CO2のインキュベーター内で培養した。
図2に、培養されたヒト腹膜中皮細胞の様子を示す。
マウスについては、C57BL/6Nマウス(株式会社クレア・ジャパン製)を犠牲死後に大網を回収し、ヒトと同様の手法で腹膜中皮細胞を分離培養した。
〔結果〕
(腹膜中皮細胞及び胃癌細胞株に対する血清型の選択実験)
まず、ヒト又はマウスの腹膜中皮細胞に対して、GFPを発現するコントロールベクターを感染させて、AAV血清型による腹膜中皮細胞への指向性を調べた。
このため、AAV1~10血清型及びAAV-DJ血清型のAAVに、リポーターとしてGFP遺伝子を組み込んだコントロールAAVベクターを用意した。これらを、以下、それぞれAAV1~10、AAV-DJベクターという。
24ウェルプレートに、ヒト及びマウスの腹膜中皮細胞、マウス胃癌細胞株YTN16P(東京大学のS.Nomura博士により提供された)を1×104個ずつ播種した。一晩培養し、翌日にそれぞれのAAVベクターを1ウェルあたり1×105vg(ベクターゲノム)ずつ添加して、ヒト腹膜中皮細胞では3日後、マウス腹膜中皮細胞では7日後に蛍光顕微鏡で観察し、フローサイトメトリーでGFP発現細胞割合を測定した。
(腹膜中皮細胞及び胃癌細胞株に対する血清型の選択実験)
まず、ヒト又はマウスの腹膜中皮細胞に対して、GFPを発現するコントロールベクターを感染させて、AAV血清型による腹膜中皮細胞への指向性を調べた。
このため、AAV1~10血清型及びAAV-DJ血清型のAAVに、リポーターとしてGFP遺伝子を組み込んだコントロールAAVベクターを用意した。これらを、以下、それぞれAAV1~10、AAV-DJベクターという。
24ウェルプレートに、ヒト及びマウスの腹膜中皮細胞、マウス胃癌細胞株YTN16P(東京大学のS.Nomura博士により提供された)を1×104個ずつ播種した。一晩培養し、翌日にそれぞれのAAVベクターを1ウェルあたり1×105vg(ベクターゲノム)ずつ添加して、ヒト腹膜中皮細胞では3日後、マウス腹膜中皮細胞では7日後に蛍光顕微鏡で観察し、フローサイトメトリーでGFP発現細胞割合を測定した。
図3A~図3Cに、このヒトの腹膜中皮細胞に対して、GFPを発現するコントロールベクターを感染させた血清型選択実験の結果を示す。図3Aは、この実験の概念図である。図3Bは、各ベクターのGFP発現を示す写真である。図3Cは、フローサイトメトリーでのGFP発現の中央値(Median Fluorescence Intensity、MFI)を示すグラフである。
結果として、AAV2ベクターが最も指向性が高いことが分かった。すなわち、ヒトでは2血清型が最も導入効率が高かった。この他にも、ヒトでは、AAV1、AAV5、又はAAV-DJも指向性があり、使用可能であった。
結果として、AAV2ベクターが最も指向性が高いことが分かった。すなわち、ヒトでは2血清型が最も導入効率が高かった。この他にも、ヒトでは、AAV1、AAV5、又はAAV-DJも指向性があり、使用可能であった。
図4A~図4Cに、マウス腹膜中皮細胞に対して、同様に血清型選択実験を行った結果を示す。
それぞれ、図4Aは実験の概念図、図4Bは各ベクターのGFP発現の写真、図4CはGFP発現のMFIのグラフである。
結果として、マウスでは、AAV-DJベクターが、最も腹膜中皮に指向性が高かった。すなわち、マウスではDJ血清型が最も導入効率が高かった。この他にも、マウスでは、AAV1、AAV2、AAV4、AAV5、又はAAV9も指向性があり、使用可能であった。
それぞれ、図4Aは実験の概念図、図4Bは各ベクターのGFP発現の写真、図4CはGFP発現のMFIのグラフである。
結果として、マウスでは、AAV-DJベクターが、最も腹膜中皮に指向性が高かった。すなわち、マウスではDJ血清型が最も導入効率が高かった。この他にも、マウスでは、AAV1、AAV2、AAV4、AAV5、又はAAV9も指向性があり、使用可能であった。
なお、本発明者らは、マウス胃癌細胞株YTN16Pに対しても同様の実験を行い、どの血清型においてもGFP発現が弱かったことを確認している。すなわち、マウス胃癌細胞株において、AAVは、血清型に関わらず、導入されにくいと考えられる。
(腹膜中皮細胞のTGF-βによる中皮間葉転換の抑制実験)
次に、トランスフォーミング増殖因子(Transforming Growth Factor-β、TGF-β)で腹膜中皮細胞が中皮間葉に形質転換されるのを、AAV2-miR-29bが抑制するかどうかを確かめた。
次に、トランスフォーミング増殖因子(Transforming Growth Factor-β、TGF-β)で腹膜中皮細胞が中皮間葉に形質転換されるのを、AAV2-miR-29bが抑制するかどうかを確かめた。
この実験では、24ウェルプレートに、ヒト腹膜中皮細胞を1×104個ずつ播種し、TGF-β(株式会社プロテインテック・ジャパン製)を10ng/mlの濃度で加えた。翌日にAAV2-miR-29bベクターを1ウェルあたり1×105vg(ベクターゲノム)ずつ添加して、3日後に蛍光免疫染色を行って上皮系及び間葉系細胞マーカーの発現を蛍光顕微鏡で観察した。
図5に、この結果を示す。「No Treat」は何も加えないコントロール、「TGF-β」はTGF-βのみを加えたコントロール、「TGF-β1+AAV2-miR-29b」は本実施例のAAV2-miR-29bベクターを加えたもの、「TGF-β1+AAV2-NC」は、pAAV2-ネガティブコントロールベクターの結果をそれぞれ示す。pAAV2-ネガティブコントロールベクターは、miR-29bの前駆体配列が入っていないプラスミドDNAベクターから作製されたAAVベクターである。いずれの列も、「Bright Field」は、顕微鏡の写真、「E-cadherin」、「Calretinin」、「Vimentin」、「Fibronectin」、「DAPI」は、上皮系及び間葉系細胞マーカーを、それぞれ示す。Fibronectinについては、非特許文献1で、miR-29bによる癌細胞接着低下機序の一つとして、Fibronectinとインテグリンを介した機構があることが示されており、確認のために加えた。
結果として、TGF-βで間葉系マーカーのVimentin発現が亢進するのを、miR-29bが抑制していることが分かった。すなわち、腹膜中皮細胞にTGF-βを加えても、AAV2-miR-29bベクターにより、中皮間葉転換するのを抑制することができた。
(マウス腹膜へのAAV導入実験)
ここで、上述のようにヒト腹膜中皮細胞を用いたin vitroの実験で中皮間葉転換するのを抑制する結果が得られたので、マウスを用いたin vivo実験を行うことにした。
まず、マウスにおいて最も導入効率が高かったAAV-DJ-miR-29bベクターを導入して、実際に腹膜でmiR-29bを発現することを確認した。
ここで、上述のようにヒト腹膜中皮細胞を用いたin vitroの実験で中皮間葉転換するのを抑制する結果が得られたので、マウスを用いたin vivo実験を行うことにした。
まず、マウスにおいて最も導入効率が高かったAAV-DJ-miR-29bベクターを導入して、実際に腹膜でmiR-29bを発現することを確認した。
この実験では、8週齢のC57BL/6Nマウスの腹腔内に5×1010vgのAAV-DJ-miR-29bと、及びコントロールベクターのAAV-DJ-GFPを注射して28日目に犠牲死させた。AAV-DJ-GFPを投与した群では腹膜中皮細胞のGFP発現を蛍光顕微鏡で観察した。また、AAV-DJ-miR-29bを投与した群では腹膜中皮細胞へのmiR-29b発現を、マウスの大網(腹膜中皮細胞の培養元)から取得した細胞について、非特許文献1と同様のデジタルPCR法(Thermo Fisher Scientific社製キット)で調べた。
図6Aは、この実験の概念図を示す。
図6Bは、AAV-DJ-GFPの腹膜上でのGFP発現量を示す。28日後においても、非投与群(No treat)はGFP発現がなく、腹膜上にコントロールベクターを投与した群(AAV-DJ-GFP群)ではGFP発現がみられる。すなわち、DJ血清型のAAVは、確かにマウスの腹膜に導入されることが分かった。
図6Cは、腹膜から取得したマウス腹膜中皮細胞(Mouse Peritoneal Mesothelial Cells、MPMC)のmiR-29b発現量(コピー数/μL)を示す。無投与のコントロール群(No treat)と、AAV-DJベクターのみ投与したネガティブコントロール群(AAV-DJ-NC)とに比べて、AAV-DJ-miR-29bを投与した群(AAV-DJ-miR-29b)では、1-way ANOVAで検定したところ、p<0.01で有意にmiR-29bの発現が高くなっていた。
図6Bは、AAV-DJ-GFPの腹膜上でのGFP発現量を示す。28日後においても、非投与群(No treat)はGFP発現がなく、腹膜上にコントロールベクターを投与した群(AAV-DJ-GFP群)ではGFP発現がみられる。すなわち、DJ血清型のAAVは、確かにマウスの腹膜に導入されることが分かった。
図6Cは、腹膜から取得したマウス腹膜中皮細胞(Mouse Peritoneal Mesothelial Cells、MPMC)のmiR-29b発現量(コピー数/μL)を示す。無投与のコントロール群(No treat)と、AAV-DJベクターのみ投与したネガティブコントロール群(AAV-DJ-NC)とに比べて、AAV-DJ-miR-29bを投与した群(AAV-DJ-miR-29b)では、1-way ANOVAで検定したところ、p<0.01で有意にmiR-29bの発現が高くなっていた。
(AAV-DJ-miR-29bによる腹膜播種抑制実験)
次に、実際にin vivoでAAV-DJ-miR-29bが腹膜播種を抑制するかどうかを3日目投与と同時投与とで投与時期を変えて調べた。
図7により、まず、この腹膜播種抑制実験(癌細胞播種後3日目で投与)の概要について説明する。ここでは、腹膜播種形成のごく早期での予防をイメージし、癌細胞を腹腔内投与して3日後にAAV-DJ-miR-29bを、リン酸緩衝生生理食塩水(PBS)にて希釈し、腹腔内注射して、大網上と腸間膜上の腹膜播種結節数をカウントし、評価した。具体的には、8週齢のC57BL/6Nマウスの腹腔内に1×105個のマウス胃癌細胞株YTN16P2を投与した。その3日後に、5×105vgのAAV-DJ-miR-29b及びAAV-DJ-GFPを腹腔内注射し、3週間後に犠牲死させた。これらについて、(1)AAVベクター無投与のコントロール群(No treat)、(2)AAV-DJ-miR-29bを投与した群(AAV-DJ-miR-29b)、(3)AAV-DJベクターのみ投与したネガティブコントロール群(AAV-DJ-NC)について、それぞれn=5で、腸間膜と大網上の腹膜播種結節数を測定した。
次に、実際にin vivoでAAV-DJ-miR-29bが腹膜播種を抑制するかどうかを3日目投与と同時投与とで投与時期を変えて調べた。
図7により、まず、この腹膜播種抑制実験(癌細胞播種後3日目で投与)の概要について説明する。ここでは、腹膜播種形成のごく早期での予防をイメージし、癌細胞を腹腔内投与して3日後にAAV-DJ-miR-29bを、リン酸緩衝生生理食塩水(PBS)にて希釈し、腹腔内注射して、大網上と腸間膜上の腹膜播種結節数をカウントし、評価した。具体的には、8週齢のC57BL/6Nマウスの腹腔内に1×105個のマウス胃癌細胞株YTN16P2を投与した。その3日後に、5×105vgのAAV-DJ-miR-29b及びAAV-DJ-GFPを腹腔内注射し、3週間後に犠牲死させた。これらについて、(1)AAVベクター無投与のコントロール群(No treat)、(2)AAV-DJ-miR-29bを投与した群(AAV-DJ-miR-29b)、(3)AAV-DJベクターのみ投与したネガティブコントロール群(AAV-DJ-NC)について、それぞれn=5で、腸間膜と大網上の腹膜播種結節数を測定した。
図8Aは、腹膜播種抑制実験(癌細胞播種後3日目で投与)の各群の腸間膜の写真を示す。
図8Bは、各群の結節数の比較であり、AAV-DJ-miR-29bを投与した群で、腸間膜上の腹膜播種結節数が有意(p<0.05)に少なかった。
すなわち、マウス腹膜播種モデルの腹腔内にAAV-miR-29bを投与したところ、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。
図8Bは、各群の結節数の比較であり、AAV-DJ-miR-29bを投与した群で、腸間膜上の腹膜播種結節数が有意(p<0.05)に少なかった。
すなわち、マウス腹膜播種モデルの腹腔内にAAV-miR-29bを投与したところ、対照群と比べて腸間膜上の腹膜播種結節が有意に減少し、腹膜播種の進展抑制効果が見られた。
図9により、腹膜播種抑制実験(癌細胞播種と同時に投与)の概要について説明する。ここでは、手術時の予防投与をイメージし、癌細胞を腹腔内投与と同時にAAV-DJ-miR-29bを投与して、腹膜播種結節数をカウントし、評価した。具体的には、上述の図8の実験例と同様に、8週齢のC57BL/6Nマウスの腹腔内に1×105個のマウス胃癌細胞株YTN16P2を投与した。同時に5×105vgのAAV-DJ-miR-29b及びAAV-DJ-GFPを腹腔内注射し、3週間後に犠牲死させて腸間膜と大網上の腹膜播種結節数を測定した。
図10Aは、腹膜播種抑制実験(癌細胞播種と同時に投与)の各群の腸間膜の写真を示す。
図10Bは、各群の結節数の比較であり、AAV-DJ-miR-29bを投与した群で、腸間膜上の腹膜播種結節数が有意(p<0.05)に少なかった。
すなわち、癌細胞株とAAV-miR-29bの同時投与においても腹膜播種結節数は有意に少なく、予防的効果もあると考えられた。
図10Bは、各群の結節数の比較であり、AAV-DJ-miR-29bを投与した群で、腸間膜上の腹膜播種結節数が有意(p<0.05)に少なかった。
すなわち、癌細胞株とAAV-miR-29bの同時投与においても腹膜播種結節数は有意に少なく、予防的効果もあると考えられた。
(AAV-DJ-miR-29bによるマウス腹膜の変化)
次に、AAV-DJ-miR-29bによるマウス腹膜の繊維化の抑制効果を確認した。
具体的には、上述の腹膜播種抑制実験時に採取したマウス腹膜組織の凍結切片を蛍光顕微鏡で観察した。また、組織切片におけるコラーゲン結合組織繊維を検出するマッソントリクローム染色を、Trichrome Stain Kit(ScyTek Laboratories社製)で行い、腹膜の厚みを測定した。
次に、AAV-DJ-miR-29bによるマウス腹膜の繊維化の抑制効果を確認した。
具体的には、上述の腹膜播種抑制実験時に採取したマウス腹膜組織の凍結切片を蛍光顕微鏡で観察した。また、組織切片におけるコラーゲン結合組織繊維を検出するマッソントリクローム染色を、Trichrome Stain Kit(ScyTek Laboratories社製)で行い、腹膜の厚みを測定した。
図11Aは、この実験のマウス腹膜に起こる変化を示す写真である。
図11Bは、各群で腹膜の厚みを比較した結果であり、AAV-DJ-miR-29bを投与した群では、腹膜の肥厚が見られなかった。すなわち、AAV-miR-29bを投与した群では、腹膜の線維化が有意(p<0.05)に抑制されていた。
図11Bは、各群で腹膜の厚みを比較した結果であり、AAV-DJ-miR-29bを投与した群では、腹膜の肥厚が見られなかった。すなわち、AAV-miR-29bを投与した群では、腹膜の線維化が有意(p<0.05)に抑制されていた。
(膵癌に対する効果)
上述の実施例1では、マウス胃癌腹膜種モデルに対する効果を示したので、異なる癌腫でも効果を確認した。
本実施例では、マウス膵癌細胞PAN02を用いた膵癌腹膜播種モデルを用いて、膵癌についての腹膜播種抑制の効果について確認した。
上述の実施例1では、マウス胃癌腹膜種モデルに対する効果を示したので、異なる癌腫でも効果を確認した。
本実施例では、マウス膵癌細胞PAN02を用いた膵癌腹膜播種モデルを用いて、膵癌についての腹膜播種抑制の効果について確認した。
図12Aに、この実験の概念図を示す。
この実験では、C57BL/6Nマウスの腹腔内にマウス膵癌細胞PAN02を5×105個投与し、同時にAAV-DJ-miR-29bを5×1010vg(vector genome)投与した。
14日後に犠牲死させて、腸間膜上の腹膜播種結節数をカウントすることで腹膜播種の形成状況を評価した。実験に用いた膵癌細胞株と胃癌細胞株で腹膜播種の形成状況が異なるので、膵癌モデルでは14日後の評価とした。
壁側腹膜は4%ホルマリンで固定後にパラフィン包埋し、4μm厚に薄切したスライドでマッソントリクローム染色を行い腹壁の厚さを測定した。
この実験では、C57BL/6Nマウスの腹腔内にマウス膵癌細胞PAN02を5×105個投与し、同時にAAV-DJ-miR-29bを5×1010vg(vector genome)投与した。
14日後に犠牲死させて、腸間膜上の腹膜播種結節数をカウントすることで腹膜播種の形成状況を評価した。実験に用いた膵癌細胞株と胃癌細胞株で腹膜播種の形成状況が異なるので、膵癌モデルでは14日後の評価とした。
壁側腹膜は4%ホルマリンで固定後にパラフィン包埋し、4μm厚に薄切したスライドでマッソントリクローム染色を行い腹壁の厚さを測定した。
図12Bは、膵癌へ各群の腸間膜の写真を示す。「No treatment」は、癌細胞のみ投与した群を示す。AAVは投与していない群を示す。「AAV-DJ-NC」はAAV-DJベクターのみ投与したネガティブコントロール群を示す。「AAV-DJ-miR-29b」が本実施例のAAV-DJ-miR-29bを投与した投与群を示す。
図12Cは、膵癌細胞とAAV-miR-29bを同時に投与し、14日目に腹膜播種の形成状況を評価した際の、腸間膜播種結節数の測定した結果を示す。
AAV-miR29b投与群では、腸間膜上での腹膜播種数は、有意に抑制されていた。図中の「***」は、p<0.01であることを示す。
図12Cは、膵癌細胞とAAV-miR-29bを同時に投与し、14日目に腹膜播種の形成状況を評価した際の、腸間膜播種結節数の測定した結果を示す。
AAV-miR29b投与群では、腸間膜上での腹膜播種数は、有意に抑制されていた。図中の「***」は、p<0.01であることを示す。
図12Dは、実施例1の胃癌モデルと同様に、腹膜の変化を腹膜組織の凍結切片を蛍光顕微鏡で観察した写真である。
図12Eは、マッソントリクローム染色により、腹膜の厚みを測定し、各群で腹膜の厚みを比較した結果である。腹膜の線維化に伴う壁肥厚を見たところ、AAV-miR-29b投与群では腹膜厚が有意に減少していた。図中の「**」は、p<0.05であることを示す。
図12Eは、マッソントリクローム染色により、腹膜の厚みを測定し、各群で腹膜の厚みを比較した結果である。腹膜の線維化に伴う壁肥厚を見たところ、AAV-miR-29b投与群では腹膜厚が有意に減少していた。図中の「**」は、p<0.05であることを示す。
このように、本実施例に係るAAV-miR-29bは、組織への浸透性が特に高く腹膜播種を生成しやすい膵癌においても、術後の腹膜播種再発の予防効果が得られると考えられる。このため、AAV-miR-29bは、他の腹膜播種を生じる癌種においても、同様の効果が期待できる。
(抗癌剤との併用による治療効果)
上述のように、胃癌と膵癌モデルで腹膜播種の予防効果を示したので、診断時に既に腹膜播種が存在する状態である腹膜播種の進行期での治療効果を確認した。
具体的には、限定された施設で臨床試験として実施されている腹腔内化学療法と、本実施例のAAV-miR29bとを併用して効果を調べた。より具体的には、胃癌及び膵癌の腹膜播種に対する腹腔内化学療法で用いる抗癌剤であるパクリタキセルと組み合わせて投与した。
上述のように、胃癌と膵癌モデルで腹膜播種の予防効果を示したので、診断時に既に腹膜播種が存在する状態である腹膜播種の進行期での治療効果を確認した。
具体的には、限定された施設で臨床試験として実施されている腹腔内化学療法と、本実施例のAAV-miR29bとを併用して効果を調べた。より具体的には、胃癌及び膵癌の腹膜播種に対する腹腔内化学療法で用いる抗癌剤であるパクリタキセルと組み合わせて投与した。
図13Aに、この実験の概念図を示す。
この実験では、C57BL/6Nマウスの腹腔内にマウス胃癌細胞YTN16Pを5×105個投与した。そして、7日目に、5×1010vgのAAV-DJ-miR-29bを投与し、同時に200μgのパクリタキセル(富士フイルム和光純薬(株)製、カタログ番号167-28166)を、通常の投与量で投与した(1回目)。14日目に、200μgのパクリタキセルを投与した(2回目)。そして、21日後に犠牲死させて、腸間膜上の腹膜播種結節数をカウントすることで腹膜播種の形成状況を評価した。すなわち、AAV-miR-29bは1回のみの投与し、パクリタキセルは複数回投与している。
この実験では、C57BL/6Nマウスの腹腔内にマウス胃癌細胞YTN16Pを5×105個投与した。そして、7日目に、5×1010vgのAAV-DJ-miR-29bを投与し、同時に200μgのパクリタキセル(富士フイルム和光純薬(株)製、カタログ番号167-28166)を、通常の投与量で投与した(1回目)。14日目に、200μgのパクリタキセルを投与した(2回目)。そして、21日後に犠牲死させて、腸間膜上の腹膜播種結節数をカウントすることで腹膜播種の形成状況を評価した。すなわち、AAV-miR-29bは1回のみの投与し、パクリタキセルは複数回投与している。
図13Bは、各群の腸間膜の写真を示す。「No treatment」は癌細胞のみ投与し、AAVは投与していないものを示す。「AAV-DJ-NC」はAAV-DJベクターのみ投与したネガティブコントロールを示す。「AAV-DJ-miR-29b」が本実施例のAAV-DJ-miR-29bを投与したものを示す。「Mock」は、パクリタキセルの溶媒を投与したものを示す。それぞれ、パクリタキセル「PTX(200μg)」を投与したものとの組み合わせを各群として示した。
図13Cは、21日後に腸間膜播種結節数を測定した結果を示す。
AAV-miR-29bを投与した群では、有意に腹膜播種結節が有意に少ないという結果が得られた。図中の「*」は、p<0.05であることを示す。
図13Cは、21日後に腸間膜播種結節数を測定した結果を示す。
AAV-miR-29bを投与した群では、有意に腹膜播種結節が有意に少ないという結果が得られた。図中の「*」は、p<0.05であることを示す。
このような結果から、本実施例に係るAAV-miR-29bは、腹膜播種の予防だけでなく、既に形成された腹膜播種への治療においても、抗癌剤と併用しても、腹膜播種の成立及び進展を抑制又は予防する効果が期待できる。
なお、上記実施の形態の構成及び動作は例であって、本発明の趣旨を逸脱しない範囲で適宜変更して実行することができることは言うまでもない。
本発明の治療剤は、予後不良の腹膜播種患者に対して単回投与で完治が望める腹膜播種抑制又は予防薬、治療剤としての腹膜播種抑制剤を提供することができ、産業上利用することができる。
Claims (12)
- miR-29b搭載のアデノ随伴ウイルスベクターを含む
ことを特徴とする腹膜播種抑制剤。 - 前記アデノ随伴ウイルスベクターの血清型は、AAV1、AAV2、AAV4、AAV5、AAV9、及びAAV-DJからなる群の一種を含む
ことを特徴とする請求項1に記載の腹膜播種抑制剤。 - 前記アデノ随伴ウイルスベクターの血清型は、
ヒト(Homo sapiens)では、AAV1、AAV2、AAV5、又はAAV-DJであり、
マウス(Mus musculus)では、AAV1、AAV2、AAV4、AAV5、AAV9、又はAAV-DJである
ことを特徴とする請求項2に記載の腹膜播種抑制剤。 - 腹腔内を構成する細胞にmiR-29bを発現させ、腹膜播種を治療又は予防する
ことを特徴とする請求項1に記載の腹膜播種抑制剤。 - 前記アデノ随伴ウイルスベクターは、
腹膜中皮細胞の中皮間葉転換を抑制し、腹膜の線維化を抑制する
ことを特徴とする請求項1に記載の腹膜播種抑制剤。 - 前記アデノ随伴ウイルスベクターは、
腫瘍に対する手術と同時又は後に投与される
ことを特徴とする請求項1に記載の腹膜播種抑制剤。 - 前記アデノ随伴ウイルスベクターは、
腹腔内に直接投与される
ことを特徴とする請求項1に記載の腹膜播種抑制剤。 - 前記アデノ随伴ウイルスベクターは、
抗癌剤と併用される
ことを特徴とする請求項1に記載の腹膜播種抑制剤。 - miR-29b搭載のアデノ随伴ウイルスベクターにより、
腹腔内を構成する細胞にmiR-29bを発現させる
ことを特徴とする腹膜播種抑制方法。 - miR-29b搭載のアデノ随伴ウイルスベクターにより、
腹腔内を構成する細胞にmiR-29bを発現させる
ことを特徴とする腹膜播種予防方法。 - 抗癌剤と併用する
ことを特徴とする請求項10に記載の腹膜播種予防方法。 - ヒト以外の動物の腹膜播種治療方法であって、
miR-29b搭載のアデノ随伴ウイルスベクターにより、
腹腔内を構成する細胞にmiR-29bを発現させる
ことを特徴とする腹膜播種治療方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2022211068 | 2022-12-28 | ||
| JP2022-211068 | 2022-12-28 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2024142962A1 true WO2024142962A1 (ja) | 2024-07-04 |
Family
ID=91717721
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2023/044802 WO2024142962A1 (ja) | 2022-12-28 | 2023-12-14 | 腹膜播種抑制剤、腹膜播種抑制方法、腹膜播種予防方法、及び腹膜播種治療方法 |
Country Status (1)
| Country | Link |
|---|---|
| WO (1) | WO2024142962A1 (ja) |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009046450A (ja) * | 2007-08-22 | 2009-03-05 | Univ Of Tokyo | 抗がん剤へのヒアルロン酸添加 |
| JP2013216627A (ja) * | 2012-04-10 | 2013-10-24 | Kyushu Univ | アポトーシス誘導剤及び癌治療薬 |
| JP2019512489A (ja) * | 2016-03-07 | 2019-05-16 | ザ ユナイテッド ステイツ オブ アメリカ, アズ リプレゼンテッド バイ ザ セクレタリー, デパートメント オブ ヘルス アンド ヒューマン サービシーズ | マイクロrnaおよびその使用方法 |
-
2023
- 2023-12-14 WO PCT/JP2023/044802 patent/WO2024142962A1/ja unknown
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2009046450A (ja) * | 2007-08-22 | 2009-03-05 | Univ Of Tokyo | 抗がん剤へのヒアルロン酸添加 |
| JP2013216627A (ja) * | 2012-04-10 | 2013-10-24 | Kyushu Univ | アポトーシス誘導剤及び癌治療薬 |
| JP2019512489A (ja) * | 2016-03-07 | 2019-05-16 | ザ ユナイテッド ステイツ オブ アメリカ, アズ リプレゼンテッド バイ ザ セクレタリー, デパートメント オブ ヘルス アンド ヒューマン サービシーズ | マイクロrnaおよびその使用方法 |
Non-Patent Citations (3)
| Title |
|---|
| CHAUDHARY KUNAL, MOORE HAROLD, TANDON ASHISH, GUPTA SUNEEL, KHANNA RAMESH, MOHAN RAJIV R.: "Nanotechnology and adeno-associated virus-based decorin gene therapy ameliorates peritoneal fibrosis", AMERICAN JOURNAL OF PHYSIOLOGY: RENAL PHYSIOLOGY, AMERICAN PHYSIOLOGICAL SOCIETY, UNITED STATES, vol. 307, no. 7, 1 October 2014 (2014-10-01), United States , pages F777 - F782, XP055913414, ISSN: 1931-857X, DOI: 10.1152/ajprenal.00653.2013 * |
| KIMURA YUKI, OHZAWA HIDEYUKI, MIYATO HIDEYO, KANEKO YUKI, SAITO AKIRA, TAKAHASHI KAZUYA, TOJO MINEYUKI, YAMAGUCHI HIRONORI, KURASH: "MiR-29b may suppresses peritoneal metastases through inhibition of the mesothelial–mesenchymal transition (MMT) of human peritoneal mesothelial cells", SCIENTIFIC REPORTS, NATURE PUBLISHING GROUP, US, vol. 12, no. 1, 1 January 2022 (2022-01-01), US , XP093188050, ISSN: 2045-2322, DOI: 10.1038/s41598-021-04065-2 * |
| SUGANO HANAKO, MATSUMOTO TAE, MIYAKE KOICHI, WATANABE ATSUSHI, NARISAWA SONOKO, MILLÁN JOSÉ L, FUKUNAGA YOSHITAKA, SHIMADA TAKASHI: "451. Fetal Gene Therapy for Lethal Murine Hypophosphatasia", MOLECULAR THERAPY, vol. 19, no. Suppl. 1, 1 May 2011 (2011-05-01), pages S174, XP093188058 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP2024041827A (ja) | メラノーマの処置および診断 | |
| JP7536049B2 (ja) | 血管新生障害の処置 | |
| Geleta et al. | Targeting Wnt/tenascin C-mediated cross talk between pancreatic cancer cells and stellate cells via activation of the metastasis suppressor NDRG1 | |
| JP7224652B2 (ja) | 膵がん細胞浸潤転移阻害剤 | |
| US20150322430A1 (en) | Treatment of b-cell lymphoma with microrna | |
| JP2016101167A (ja) | がん幹細胞を含むまたはそれに由来するがんの治療、予防および診断のための方法および組成物 | |
| WO2015133522A1 (ja) | 大腸癌の治療剤、及び大腸癌患者の予後の予測方法 | |
| JP5887413B2 (ja) | 非小細胞肺癌におけるtm4sf4の発現または活性を調節することによって癌細胞の放射線耐性ならびに増殖、転移および浸潤を低減させる方法 | |
| WO2024142962A1 (ja) | 腹膜播種抑制剤、腹膜播種抑制方法、腹膜播種予防方法、及び腹膜播種治療方法 | |
| US8357667B2 (en) | Compositions and methods for treating pancreatic cancer | |
| JP2013216627A (ja) | アポトーシス誘導剤及び癌治療薬 | |
| JPWO2010119698A1 (ja) | 頭頸部腫瘍増殖抑制剤 | |
| Xie et al. | Neuropilin-2 Inhibits Drug Resistance and Progression of Melanoma Involving the MiR-331-3p Regulated Cascade | |
| WO2023230562A2 (en) | Rna compositions and therapeutic methods thereof | |
| WO2020241816A1 (ja) | 新規な消化器がん治療剤およびそのスクリーニング方法 | |
| JP2021031484A (ja) | 膵癌細胞浸潤転移阻害剤 | |
| CN113853216A (zh) | 治疗去势抵抗性前列腺癌的方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 23911743 Country of ref document: EP Kind code of ref document: A1 |