JP7224652B2 - 膵がん細胞浸潤転移阻害剤 - Google Patents
膵がん細胞浸潤転移阻害剤 Download PDFInfo
- Publication number
- JP7224652B2 JP7224652B2 JP2020017977A JP2020017977A JP7224652B2 JP 7224652 B2 JP7224652 B2 JP 7224652B2 JP 2020017977 A JP2020017977 A JP 2020017977A JP 2020017977 A JP2020017977 A JP 2020017977A JP 7224652 B2 JP7224652 B2 JP 7224652B2
- Authority
- JP
- Japan
- Prior art keywords
- rna
- cells
- igf2bp3
- sirna
- pancreatic cancer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/7105—Natural ribonucleic acids, i.e. containing only riboses attached to adenine, guanine, cytosine or uracil and having 3'-5' phosphodiester links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/70—Carbohydrates; Sugars; Derivatives thereof
- A61K31/7088—Compounds having three or more nucleosides or nucleotides
- A61K31/713—Double-stranded nucleic acids or oligonucleotides
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Genetics & Genomics (AREA)
- Engineering & Computer Science (AREA)
- Biomedical Technology (AREA)
- Organic Chemistry (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- Epidemiology (AREA)
- Pharmacology & Pharmacy (AREA)
- Zoology (AREA)
- Biotechnology (AREA)
- General Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Microbiology (AREA)
- Plant Pathology (AREA)
- Biophysics (AREA)
- Physics & Mathematics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Description
免疫細胞化学的手法を用い、膵管腺がん(PDAC)細胞内におけるIGF2BPの所在を確認した。PDAC細胞としては、中分化PDAC細胞であるS2-013株細胞と、未分化PDAC細胞であるPANC-1株細胞の2種を用いた。
ヒトPDAC細胞SUIT-2株の亜系であるS2-013株を、宮崎大学の岩村威志先生より頂いた。また、PDAC細胞PANC-1株は、American Type Culture Collectionより購入した。これら細胞は、加熱により不活性化したウシ胎児血清(FCS)を10%含むダルベッコ改変イーグル培地(DMEM,Gibco-BRL製)中、5%CO2を含む湿潤雰囲気下で培養した。
ガラス製のカバースリップを、室温で1時間、10μg/mLのフィブロネクチン(Sigma-Aldrich製)でコートした。上記S2-013株細胞またはPANC-1株細胞を当該フィブロネクチンコートカバースリップ上に播き、5時間インキュベートした。次いで、当該細胞を4%パラホルムアルデヒドで固定し、0.1%Triton X-100で透過処理し、ブロッキング溶液(3%BSA/PBS)で被覆した後、抗IGF2BP3一次抗体等と1時間インキュベートした。さらに、ローダミンが結合したファロイジン(Cytoskeleton製)の存在下または不存在下、蛍光色素であるAlexa488-,Alexa546-,Alexa594-またはAlexa647-結合二次抗体(Cytoskeleton製)を用いた。いくつかの一次抗体には、市販の抗体標識技術(Life technologies製「Zenon(登録商標)」を用い、緑色または赤色の蛍光色素分子を結合させた。各試料は、共焦点レーザスキャン蛍光相関分光顕微鏡(Carl Zeiss製「Zeiss LSM 510 META microscope」)で可視化した。得られた顕微鏡像の写真を図1,2に示す。図1,2中、IGF2BP3は緑色色素で標識されており、アクチンフィラメントはファロイジンにより赤色で染色されている。また、矢印は、細胞膜突起中に存在しているIGF2BP3を示している。
上記S2-013株細胞をフィブロネクチン上で5時間インキュベートし、溶解用緩衝液(50mM Tris(pH7.4),150mM塩化ナトリウム,1mM塩化マグネシウム,0.5%NP-40,およびプロテアーゼインヒビターカクテル錠(Roche製))を使って溶解し、得られた溶解物を、2μg抗IGF2BP3抗体またはウサギIgGアイソタイプコントロール抗体およびダイナビーズプロテインG(Dynal製)で免疫沈降させた。内因性IGF2BP3とG3BPとの相互作用を試験するために、免疫複合体をウェスタンブロットで分析した。結果を図3に示す。
膵管腺がん細胞であるS2-013株またはPANC-1株をフィブロネクチン上で培養して細胞膜突起の形成を促進したところ、図1のとおり、IGF2BP3は、その内部にアクチンフィラメントが存在している細胞膜突起中に集積していた。また、図2のとおり、細胞膜突起に集積した顆粒中で、IGF2BP3は、ストレス顆粒のマーカータンパク質であるG3BPと共局在していることが分かった。さらに、図3のとおり、フィブロネクチン上で培養されたS2-013株細胞の抽出物を抗IGF2BP3抗体または抗G3BP抗体による免疫沈降実験に付したところ、IGF2BP3はG3BPと共沈降することが示された。
(1) IGF2BP3-RNA干渉
膵がん細胞の浸潤転移に関するIGF2BP3の影響を明らかにするために、IGF2BP3に特異的なsiRNAを発現するベクターを用いて、S2-013株細胞におけるIGF2BP3の生成が恒常的に抑制されたクローン細胞を樹立した。
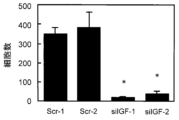
各創傷治癒アッセイでは、プラスチック製のピペットチップを用い、コンフルエントの単層細胞に創傷領域として十字型の切れ込みを入れた。観測する創傷領域にいくつかマーキングした後に、位相差顕微鏡を使って写真撮影した。マークした創傷領域に遊走する細胞を1時間から8時間観察し、写真撮影を継続的に行った。細胞の写真を図5に示す。また、遊走した細胞による創傷領域の塞がりの度合いを、遊走した細胞を計数することにより定量化した。定量値を図6に示す。図6中、「*」は、Scr-1またはScr-2に対して、t-テストにおいてp<0.001の危険率で有意差がある場合を示す。
プラスチック製ピペットチップを用い、コンフルエントのS2-013株細胞に十字型の切れ込みを入れた後、創傷領域への細胞の遊走を促進させた。4時間後、細胞を一次抗体で免疫染色し、上記実施例1と同様にして蛍光体結合二次抗体とインキュベートした。創傷領域へ遊走しはじめた細胞の運動先進部を、共焦点レーザスキャン蛍光相関分光顕微鏡(Carl Zeiss製「Zeiss LSM 510 META microscope」)で観察した。結果を図7に示す。図7のとおり、遊走を開始したS2-013株細胞の細胞先進部に形成された細胞膜突起中にIGF2BP3が集積していた。
無血清培地に懸濁した4.0×104個の細胞を、Matrigel Invasion Chamber(24ウェルプレート,孔径:8μm,Becton Dickinson製)の上部チャンバーに播種した。化学誘引物質を5%含む溶媒を下部チャンバーに添加した。細胞を上部チャンバー内で20時間インキュベートした。次いで、3つの独立した領域を顕微鏡で観察し、下部チャンバーへ浸潤した細胞を計数した。同様の実験を3回繰り返し、scrambled negative controlのsiRNAを恒常的に発現するS2-013コントロールクローン(Scr-1およびScr-2)とIGF2BP3特異的なsiRNAを恒常的に発現してIGF2BP3発現が抑制されたS2-013クローン(siIGF-1およびsiIGF-2)との間で比較した。結果を図8に示す。図8中、「*」は、Scr-1またはScr-2に対して、t-テストにおいてp<0.001の危険率で有意差がある場合を示す。
6週齢の無菌雌性無胸腺ヌードマウス(BALB/cSlc-nu/nu)を日本エスエルシー株式会社から購入し、高知大学研究機関内動物管理使用ガイドラインに従って扱った。scrambled negative controlのsiRNAを恒常的に発現するS2-013コントロールクローン(Scr-1およびScr-2)とIGF2BP3特異的なsiRNAを恒常的に発現してIGF2BP3発現が抑制されたS2-013クローン(siIGF-1およびsiIGF-2)を、それぞれ8.0×105ずつ、各マウスの膵臓へ外科的かつ同所的に移植することにより、マウス膵臓内に腫瘍を形成させた。移植から42日後にマウスを屠殺し、ヘマトキシリン-エオシン染色を行い、マウスの膵臓内に形成された腫瘍から後腹膜への浸潤の有無と、肺および肝臓への転移の有無を調べた。また、マウス膵臓内に形成された腫瘍を計量した。計量結果、および後腹膜への浸潤と遠隔転移の有無を表1に、染色写真を図11に示す。なお、図11中、「R」は腔腹膜組織を示し、「P」は筋肉組織を示し、「N」は正常組織を示す。
以上の結果は、IGF2BP3が膵がん細胞の浸潤転移を特に促進し、また、生体内における膵臓の腫瘍形成において、IGF2BP3の発現量の低減が、1)膵臓内における腫瘍の増加と、2)膵臓の隣接組織への浸潤と、3)他の組織への転移に影響を及ぼすことを示している。
共焦点顕微鏡を用い、フィブロネクチンで刺激したS2-013株細胞におけるアクチンフィラメントの重合と細胞膜突起の三次元構造を調べた。共焦点顕微鏡の詳しい条件は、上記実施例1と同様とした。結果を図12~14に示す。
(1) RNA免疫沈降、配列決定およびバイオインフォマティクス解析
S2-013株細胞をフィブロネクチン上に播種し、5時間インキュベートした。細胞をPBSで2回洗浄した後、50mM Tris(pH7.4),150mM塩化ナトリウム,1mM塩化マグネシウム,0.5%NP-40,およびRNaseインヒビター(Roche製)を含むNP2緩衝液で溶解した。抽出液を、ダイナビーズプロテインG(Dynal製)および抗IGF2BP3抗体またはウサギIgGアイソタイプコントロール抗体で4℃で2時間処理することにより、免疫沈降させた。ビーズをマグネチックラック(Dynal製)上でペレット化した。沈降複合体をプロテイナーゼKで処理し、フェノール-クロロホルム混合溶媒で抽出した後、エタノールで核酸を沈殿させた。次に、沈殿した核酸をDNaseI(Promega製)で処理し、RNeasy kit(Qiagen製)を使ってRNAを精製した。次世代シークエンサーによる得られたRNA試料の同定を北海道システム・サイエンス社に委託し、さらに、得られたデータのバイオインフォマティクス解析をWorld Fusion社に委託した。IGF2BP3免疫沈降試料またはコントロールIgG免疫沈降試料に含まれるmRNAの濃度の散布プロットを図15に示す。また、IGF2BP3免疫沈降試料とコントロールIgG免疫沈降試料との間で、リボソームRNA(rRNA)および核内低分子RNA(snRNA)の数の線形回帰図を、それぞれ図16(1)と図16(2)に示す。図16中、点線はx=yの直線を示す。
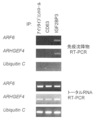
上記(1)で特定されたIGF2BP3結合mRNAの中で、ADP-ribosylation factor 6(ARF6)とRho guanine nucleotide exchange factor 4(ARHGEF4)の2つのmRNAにつき、IGF2BP3との結合性を確認した。具体的には、StrataScript reverse transcriptase(Agilent製)とオリゴd(T)12-18プライマーを用い、細胞膜突起の形成を誘導したS2-013細胞ライセートから抗IGF2BP3抗体、ウサギIgGアイソタイプコントロール抗体またはネガティブコントロール抗CD63抗体により免疫沈降したRNAを精製して、RT-PCRを行った。内部定量コントロールとしてユビキチンC mRNAを用いた。結果を図17に示す。図17のとおり、上記2つの転写産物は、抗IGF2BP3抗体と免疫沈降複合体を形成したが、アイソタイプコントロール抗体および抗CD63抗体とは形成しなかった。
細胞膜突起の形成を誘導したS2-013細胞内に存在する内在性ARF6 mRNAおよびARHGEF4 mRNAにそれぞれの配列特異的な蛍光プローブをin situハイブリダイゼーションさせるために、QuantiGene ViewRNA plate-based assay kit(Panomics製)を用いた。フィブロネクチンで刺激したS2-013株細胞を8%ホルムアルデヒドで固定化し、50%、70%および100%エタノールを使って脱水し、4℃で一晩静置した。次いで、細胞を再度脱水し、透過処理し、蛍光プローブとハイブリダイゼーションさせた。標的となるmRNAはARF6およびARHGEF4であり、対照RNAはユビキチンC mRNAとした。in situハイブリダイゼーションの後、断面をPBSで洗浄し、ヤギ血清の4%PBS溶液であるブロッキングバッファーにより1時間ブロッキングし、ブロッキングバッファー中で抗IGF2BP3抗体と3時間インキュベートした。ブロッキングバッファー中、二次抗体を室温で30分間作用させ、核をDAPIで3分間染色し、Aqua Polymount(Polysciences製)に埋め込んだ。共焦点レーザスキャン蛍光相関分光顕微鏡(Carl Zeiss製「Zeiss LSM 510 META microscope」)を用い、共焦点蛍光像を得た。結果を図18に示す。
以上の実験結果は、IGF2BP3とIGF2BP3結合mRNAを含むストレス顆粒は、細胞膜突起中に集積していることを示している。
(1)
S2-013株のコントロールRNAi細胞(Scr-1)とIGF2BP3-RNAi細胞(siIGF-1)をフィブロネクチン上でインキュベートし、抗ARF6抗体(緑色)または抗ARHGEF4抗体(緑色)で染色した。アクチンフィラメントは、ファロイジンを使って赤色で標識した。また、核をDAPIで青色に染色した。結果を図19に示す。
mycタグIGF2BP3発現回復コンストラクトベクターを、IGF2BP3-RNAi細胞(siIGF-1)に導入した。48時間後、細胞をフィブロネクチン上でインキュベートした。細胞を抗myc抗体(緑色)または抗ARF6抗体(紫色)で染色した。アクチンフィラメントは、ファロイジンを使って赤色で標識した。また、核をDAPIで青色に染色した。結果を図20に示す。
抗ARF6抗体の代わりに抗ARHGEF4抗体(紫色)を用いた以外は上記(2)と同様にして実験を行った。結果を図21に示す。
膵がん細胞におけるARF6タンパク質とARHGEF4タンパク質の機能解析を行った。それぞれARF6 RNAおよびARHGEF4 RNAの部分塩基配列に相当する配列番号1および配列番号5の塩基配列を有するRNAと、その相補的RNAからなる二本鎖RNA(以下、それぞれ「siARF6」と「siARHGEF4」という)、またはコントロールのsiRNAオリゴを、S2-013株細胞に導入した。これらの細胞をフィブロネクチン上で培養し、細胞膜突起における末梢アクチンフィラメントを解析した。ベクターを導入してから48時間後、ARF6タンパク質とARHGEF4タンパク質の生成をウェスタンブロットにより解析した。結果を図22に示す。図22中、「Scr」、「siARF6」および「siARHGEF4」は、それぞれコントロールsiRNAオリゴ、配列番号1の塩基配列を有するsiRNA、配列番号5の塩基配列を有するsiRNAを導入した細胞の結果を示す。
上記(4)と同様に、ARF6とARHGEF4のそれぞれのmRNAに特異的なsiRNAオリゴとコントロールsiRNAオリゴをS2-013株細胞とPANC-1細胞株へ一過性導入することにより、コントロールRNAi細胞、ARF6-RNAi細胞、およびARHGEF4-RNAi細胞を得た。
上記実施例5(5)の細胞を用い、上記実施例2(4)と同様にしてマトリゲル浸潤アッセイを行い、上部チャンバーから下部チャンバーへ浸潤した細胞を計数した。同様の実験を4回繰り返し、その平均値を算出した。結果を図27に示す。図27中、「*」はt-テストにおいてp<0.001の危険率で有意差がある場合を示す。
以上の実験結果により、IGF2BP3に結合しているmRNAは、細胞膜突起部で選択的に局所翻訳されてタンパク質を生成し、これらのタンパク質は、細胞膜突起形成を促進することを通して膵がん細胞の運動浸潤に関わっていることが考えられる。
(1) siRNAの細胞内への取り込み確認実験
膵がん細胞株S2-013を用いて、葉酸キトサンナノ粒子付加siRNAが細胞内に取り込まれているか否かを検討した。なお、キトサンナノ粒子は体内へ静注投与されたsiRNAの酵素分解を抑制し、葉酸はsiRNAを膵がん細胞膜表面に高発現している葉酸レセプターに結合できるようにする。
次に、CCDC88Aに対するsiRNAと、WASF2に対するsiRNAのノックダウン効果を検討した。本発明者は、最近、CCDC88AとWASF2がコードするタンパク質は、それぞれ異なるアクチン結合タンパク質と複合体を形成することにより、細胞の形態変化、運動または浸潤に関与することを明らかにしている。CCDC88A siRNAは配列番号57の塩基配列を含む。WASF2 siRNAは、配列番号73の塩基配列を含む。
葉酸キトサンナノ粒子を付加したコントロールsiRNA、CCDC88A siRNA、WASF2 siRNAのそれぞれをS2-013の培養液中に添加し、48時間後にマトリゲル浸潤アッセイを行った。マトリゲル浸潤アッセイにおいて、上部チャンバーから下部チャンバーへ移動した細胞の数を示すグラフを図30に示す。図30において、「*」はt-テストでコントロールに対してp=0.00073で有意差があったことを示し、「**」はp=0.00852で有意差があったことを示す。
6週齢のヌードマウスの膵臓にヒト膵癌細胞株S2-013を移植した膵がん浸潤転移モデルを用いた。具体的には、第1日目にイソフルランを用いた吸入麻酔により12匹のヌードマウスを麻酔し、開腹して膵臓を露出した。100万個のヒト膵癌細胞S2-013を0.1mLのPBSに懸濁し、各マウスの膵臓内に移植した。上記実施例6のIn vitro実験と同様に、siRNAはCCDC88AとWASF2に対するものと、コントロールとしてscrambled siRNAを用いた。合成した各siRNAを葉酸キトサンナノ粒子に付加した。ヒト膵癌細胞を移植した各群4匹のマウスにそれぞれの葉酸キトサンナノ粒子付加siRNAを1回/週の頻度で尾静脈へ静注投与した。マウスに全身投与されたsiRNAは、キトサンナノ粒子によりヒト膵がん組織まで受動的に送達され、葉酸が膵がん細胞上の葉酸受容体を介して効率的なエンドサイトーシスを促すことを期待できる。合計5回のsiRNA静注投与を行い、この間、第1日目にマウス膵臓内に移植したS2-013細胞は腫瘍を形成し、肝臓と肺に遠隔転移する。また、膵臓から露出した腫瘍は、腹膜播種と後腹膜浸潤を引き起こす。
Claims (4)
- 配列番号29~32、77~80から選択される1以上の塩基配列を有するRNA(1)を含むことを特徴とする膵がん細胞浸潤転移阻害剤。
- さらに、上記RNA(1)とストリンジェントな条件でハイブリダイズする配列を有するRNA(2)を含む請求項1に記載の膵がん細胞浸潤転移阻害剤。
- 上記RNA(1)と上記RNA(2)がハイブリダイズしている二本鎖RNAを含む請求項2に記載の膵がん細胞浸潤転移阻害剤。
- 上記RNA(1)、上記RNA(2)、および、当該RNA(1)と当該RNA(2)とを結合するリンカーRNAを含み、当該RNA(1)と当該RNA(2)がハイブリダイズしており、且つ当該リンカーRNAが環状構造を有する一本鎖RNAを含む請求項2に記載の膵がん細胞浸潤転移阻害剤。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2014138217 | 2014-07-04 | ||
| JP2014138217 | 2014-07-04 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016531421A Division JP6663149B2 (ja) | 2014-07-04 | 2015-07-01 | 膵がん細胞浸潤転移阻害剤 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2020079280A JP2020079280A (ja) | 2020-05-28 |
| JP7224652B2 true JP7224652B2 (ja) | 2023-02-20 |
Family
ID=55019374
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016531421A Active JP6663149B2 (ja) | 2014-07-04 | 2015-07-01 | 膵がん細胞浸潤転移阻害剤 |
| JP2020017977A Active JP7224652B2 (ja) | 2014-07-04 | 2020-02-05 | 膵がん細胞浸潤転移阻害剤 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016531421A Active JP6663149B2 (ja) | 2014-07-04 | 2015-07-01 | 膵がん細胞浸潤転移阻害剤 |
Country Status (2)
| Country | Link |
|---|---|
| JP (2) | JP6663149B2 (ja) |
| WO (1) | WO2016002844A1 (ja) |
Families Citing this family (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016214239A (ja) * | 2015-05-15 | 2016-12-22 | 国立大学法人高知大学 | 膵がんマーカー |
| CA2932910A1 (en) * | 2016-06-14 | 2017-12-14 | Entos Pharmaceuticals Inc. | Methods for diagnosing and treating metastatic cancer |
| JP2019206516A (ja) * | 2018-05-23 | 2019-12-05 | 国立大学法人高知大学 | 膵癌細胞の浸潤転移抑制剤 |
| WO2021080020A1 (ja) | 2019-10-25 | 2021-04-29 | 国立大学法人高知大学 | 核酸送達促進剤 |
| WO2021221179A1 (ja) * | 2020-04-28 | 2021-11-04 | 国立大学法人高知大学 | ヒト膵癌オルガノイドを用いたマウスモデルの樹立 |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050244851A1 (en) | 2004-01-13 | 2005-11-03 | Affymetrix, Inc. | Methods of analysis of alternative splicing in human |
| WO2007060899A1 (ja) | 2005-11-22 | 2007-05-31 | National University Corporation Nagoya University | アクチン結合タンパク質の細胞運動関連疾患への利用 |
| US20070243546A1 (en) | 2006-03-31 | 2007-10-18 | Affymetrix, Inc | Analysis of methylation using nucleic acid arrays |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7374927B2 (en) * | 2004-05-03 | 2008-05-20 | Affymetrix, Inc. | Methods of analysis of degraded nucleic acid samples |
| SG166778A1 (en) * | 2006-10-11 | 2010-12-29 | Max Planck Gesellschaft | Influenza targets |
-
2015
- 2015-07-01 WO PCT/JP2015/069013 patent/WO2016002844A1/ja active Application Filing
- 2015-07-01 JP JP2016531421A patent/JP6663149B2/ja active Active
-
2020
- 2020-02-05 JP JP2020017977A patent/JP7224652B2/ja active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20050244851A1 (en) | 2004-01-13 | 2005-11-03 | Affymetrix, Inc. | Methods of analysis of alternative splicing in human |
| WO2007060899A1 (ja) | 2005-11-22 | 2007-05-31 | National University Corporation Nagoya University | アクチン結合タンパク質の細胞運動関連疾患への利用 |
| US20070243546A1 (en) | 2006-03-31 | 2007-10-18 | Affymetrix, Inc | Analysis of methylation using nucleic acid arrays |
Non-Patent Citations (2)
| Title |
|---|
| INTERNATIONAL JOURNAL OF MOLECULAR MEDICINE,2013年,Vol.31,p.1243-1247 |
| Oncotarget,2014年,Vol.5,No.16,p6832-6845 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP6663149B2 (ja) | 2020-03-11 |
| WO2016002844A1 (ja) | 2016-01-07 |
| JPWO2016002844A1 (ja) | 2017-04-27 |
| JP2020079280A (ja) | 2020-05-28 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7224652B2 (ja) | 膵がん細胞浸潤転移阻害剤 | |
| JP6482582B2 (ja) | 肝再生および肝不全の治療のための薬剤 | |
| Jin et al. | Exosomal miRNA‐215‐5p derived from adipose‐derived stem cells attenuates epithelial–mesenchymal transition of podocytes by inhibiting ZEB2 | |
| JP7536049B2 (ja) | 血管新生障害の処置 | |
| EP3143123B1 (en) | Microrna induction of cardiac regeneration | |
| EP2717883B1 (en) | Protection against endothelial barrier dysfunction through inhibition of the tyrosine kinase abl-related gene (arg) | |
| US20150203846A1 (en) | Treatment of Myelodysplastic Syndrome by Inhibition of NR2F6 | |
| CN113350527B (zh) | 靶向lucat1的反义寡核苷酸及在癌症治疗中的应用 | |
| US11903960B2 (en) | Treatment methods for fibrosis targeting SMOC2 | |
| US20210380988A1 (en) | Reducing Prominin2-Mediated Resistance to Ferroptotic Cell Death | |
| US10260067B2 (en) | Enhancing dermal wound healing by downregulating microRNA-26a | |
| JP7454207B2 (ja) | 膵癌細胞浸潤転移阻害剤 | |
| WO2022026648A1 (en) | Inhibition of incexact1 to treat heart disease | |
| JP2015227292A (ja) | 膵がん細胞浸潤転移抑制ワクチン | |
| Clark | Effect of morpholino-mediated knockdowns of oncofetal RNA-binding proteins on cancer cell biology. | |
| JP2024019894A (ja) | ガレクチン-4陽性胃がん治療用医薬組成物 | |
| KR20220088294A (ko) | Oligodendrocyte transcription factor 2 억제제를 유효성분으로 포함하는 흑색종 치료 효과 증진용 약학적 조성물 | |
| JP2010168368A (ja) | Psma7、nedd1およびrae1遺伝子発現抑制剤の用途 | |
| EP3820483A2 (en) | Compositions and methods for treating endometriosis |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200304 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210316 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20210824 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20211108 |
|
| C60 | Trial request (containing other claim documents, opposition documents) |
Free format text: JAPANESE INTERMEDIATE CODE: C60 Effective date: 20211108 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20211108 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20211203 |
|
| C21 | Notice of transfer of a case for reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C21 Effective date: 20211207 |
|
| A912 | Re-examination (zenchi) completed and case transferred to appeal board |
Free format text: JAPANESE INTERMEDIATE CODE: A912 Effective date: 20211224 |
|
| C211 | Notice of termination of reconsideration by examiners before appeal proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C211 Effective date: 20220104 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20220118 |
|
| C27C | Written answer of applicant after an oral proceeding |
Free format text: JAPANESE INTERMEDIATE CODE: C2721 Effective date: 20220118 |
|
| C22 | Notice of designation (change) of administrative judge |
Free format text: JAPANESE INTERMEDIATE CODE: C22 Effective date: 20220412 |
|
| C23 | Notice of termination of proceedings |
Free format text: JAPANESE INTERMEDIATE CODE: C23 Effective date: 20221129 |
|
| C03 | Trial/appeal decision taken |
Free format text: JAPANESE INTERMEDIATE CODE: C03 Effective date: 20230104 |
|
| C30A | Notification sent |
Free format text: JAPANESE INTERMEDIATE CODE: C3012 Effective date: 20230104 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20230201 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7224652 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |