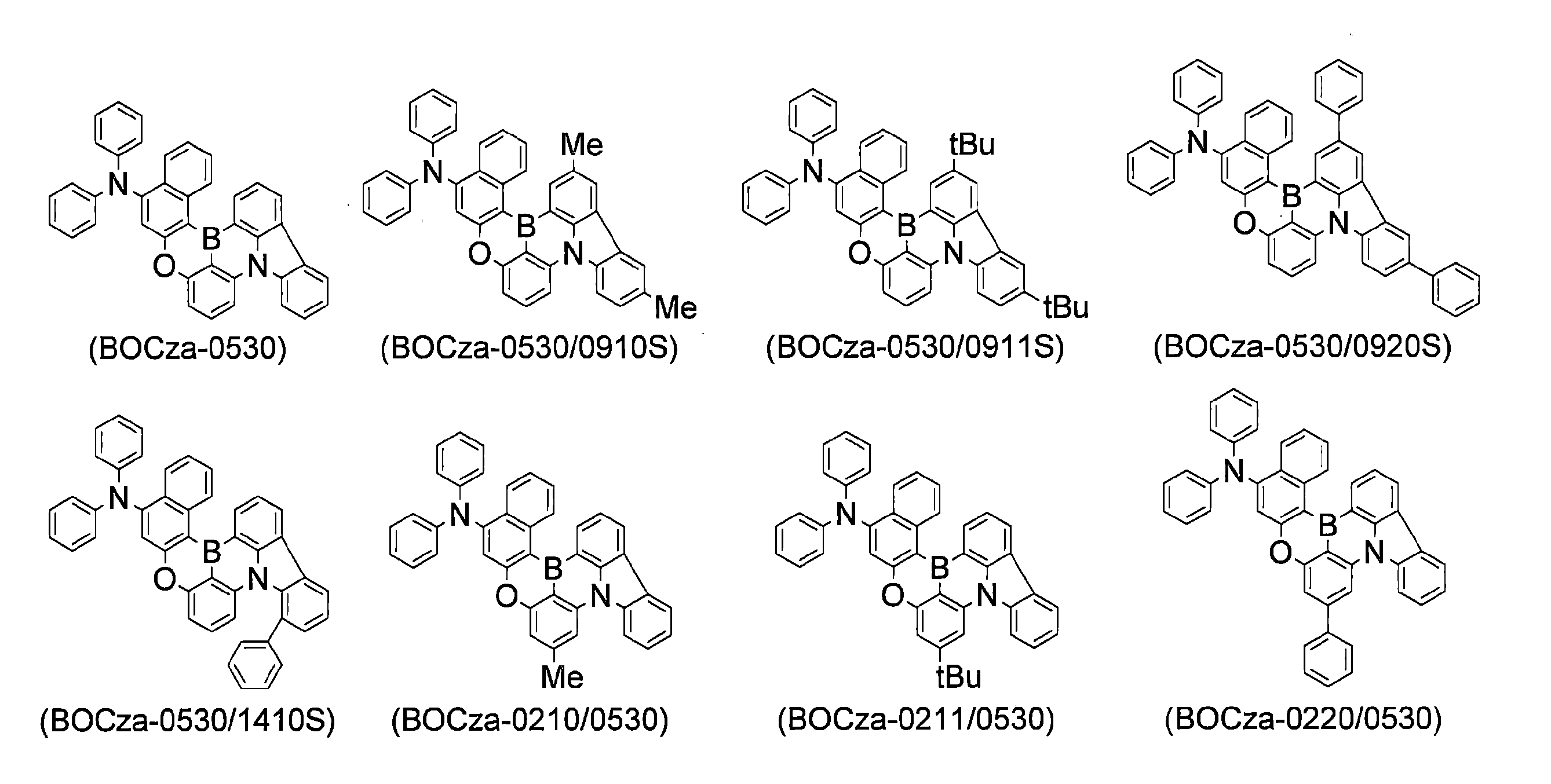
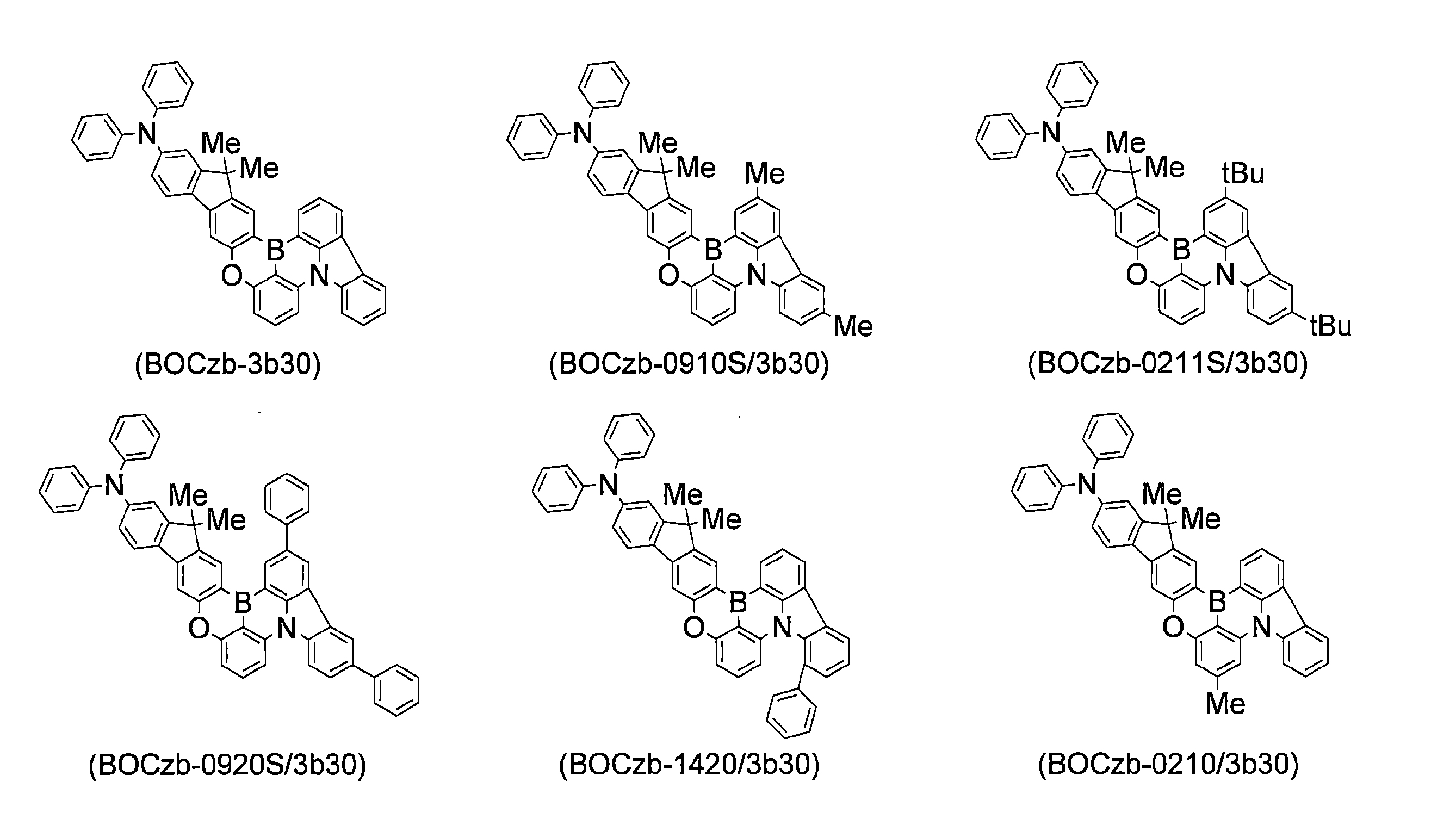
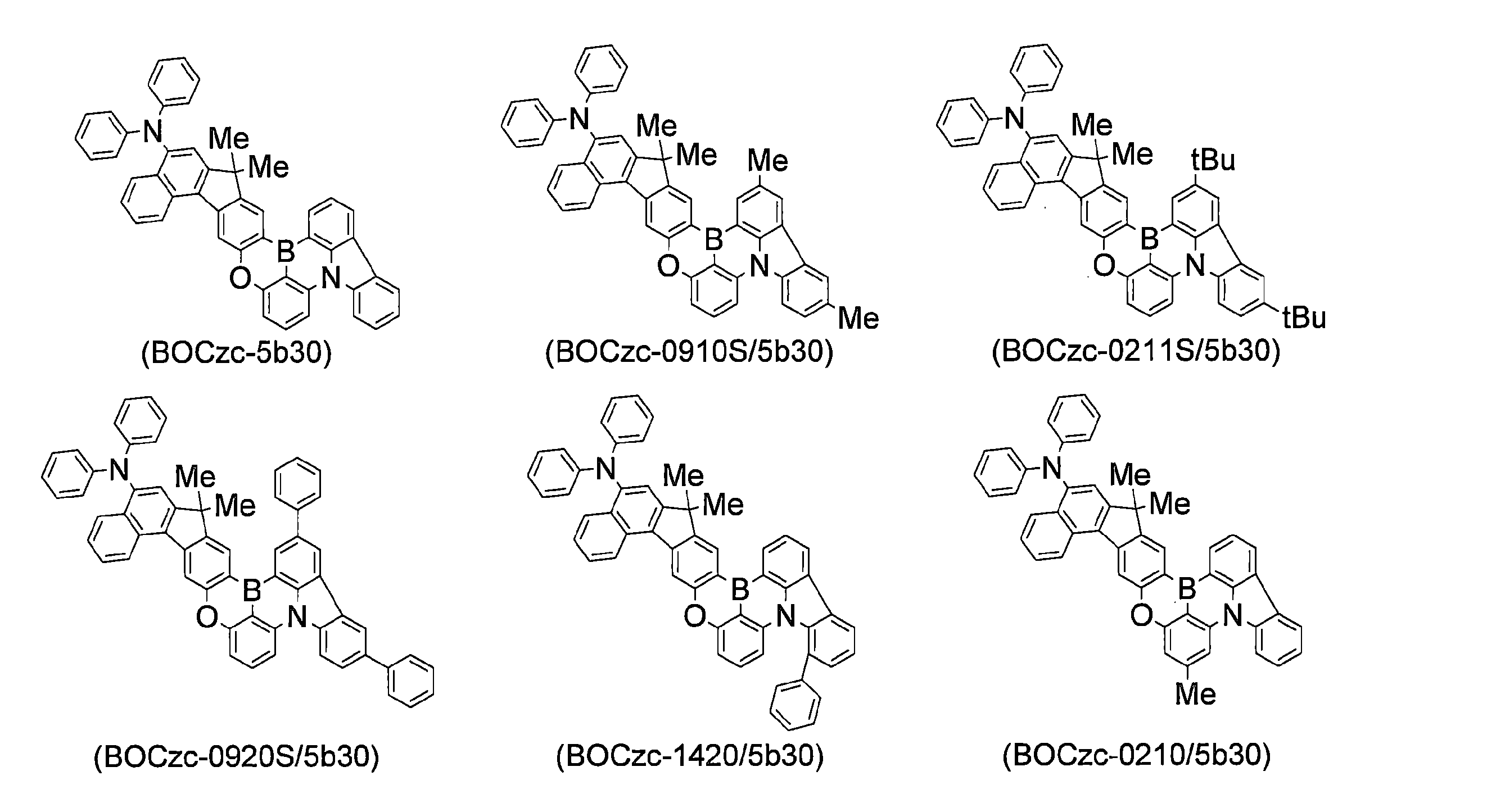
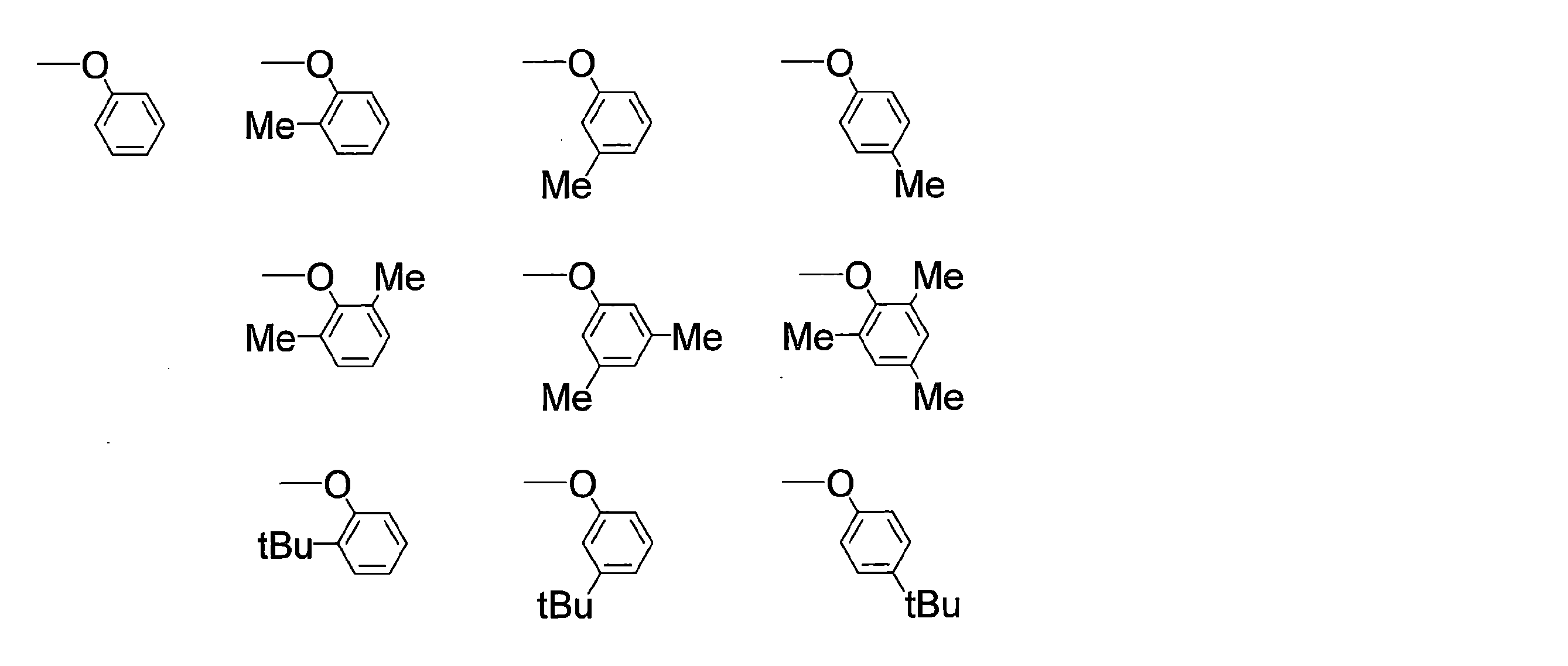
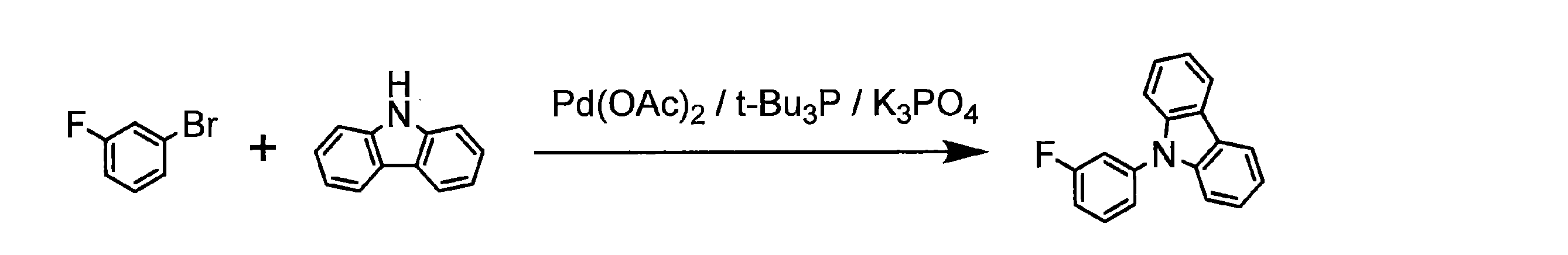WO2019240080A1 - 多環芳香族化合物およびその多量体 - Google Patents
多環芳香族化合物およびその多量体 Download PDFInfo
- Publication number
- WO2019240080A1 WO2019240080A1 PCT/JP2019/022933 JP2019022933W WO2019240080A1 WO 2019240080 A1 WO2019240080 A1 WO 2019240080A1 JP 2019022933 W JP2019022933 W JP 2019022933W WO 2019240080 A1 WO2019240080 A1 WO 2019240080A1
- Authority
- WO
- WIPO (PCT)
- Prior art keywords
- aryl
- ring
- carbon atoms
- heteroaryl
- alkyl
- Prior art date
Links
- -1 Polycyclic aromatic compound Chemical class 0.000 title claims abstract description 381
- 125000003118 aryl group Chemical group 0.000 claims abstract description 476
- 239000000463 material Substances 0.000 claims abstract description 199
- 125000004432 carbon atom Chemical group C* 0.000 claims description 372
- 150000001875 compounds Chemical class 0.000 claims description 276
- 125000000217 alkyl group Chemical group 0.000 claims description 259
- 125000001072 heteroaryl group Chemical group 0.000 claims description 244
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 226
- 229910052739 hydrogen Inorganic materials 0.000 claims description 183
- 239000001257 hydrogen Substances 0.000 claims description 183
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 102
- NPDLYUOYAGBHFB-WDSKDSINSA-N Asn-Arg Chemical compound NC(=O)C[C@H](N)C(=O)N[C@H](C(O)=O)CCCN=C(N)N NPDLYUOYAGBHFB-WDSKDSINSA-N 0.000 claims description 83
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 79
- 150000002431 hydrogen Chemical class 0.000 claims description 72
- 125000004986 diarylamino group Chemical group 0.000 claims description 69
- 238000002347 injection Methods 0.000 claims description 66
- 239000007924 injection Substances 0.000 claims description 66
- 125000005647 linker group Chemical group 0.000 claims description 55
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 54
- 238000005401 electroluminescence Methods 0.000 claims description 53
- 125000003545 alkoxy group Chemical group 0.000 claims description 49
- 229910052799 carbon Inorganic materials 0.000 claims description 44
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 42
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 claims description 39
- XEEYBQQBJWHFJM-UHFFFAOYSA-N Iron Chemical compound [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 claims description 39
- 125000004104 aryloxy group Chemical group 0.000 claims description 37
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 claims description 36
- 239000010409 thin film Substances 0.000 claims description 33
- 229910052736 halogen Inorganic materials 0.000 claims description 32
- 150000002367 halogens Chemical group 0.000 claims description 32
- 125000003983 fluorenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3CC12)* 0.000 claims description 27
- 125000001624 naphthyl group Chemical group 0.000 claims description 27
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 24
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical group [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 claims description 21
- 229910052805 deuterium Chemical group 0.000 claims description 21
- 229910052731 fluorine Inorganic materials 0.000 claims description 21
- 230000036961 partial effect Effects 0.000 claims description 21
- 239000011737 fluorine Substances 0.000 claims description 19
- 125000003785 benzimidazolyl group Chemical class N1=C(NC2=C1C=CC=C2)* 0.000 claims description 18
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 17
- 125000000732 arylene group Chemical group 0.000 claims description 16
- 125000005577 anthracene group Chemical group 0.000 claims description 14
- 125000005240 diheteroarylamino group Chemical group 0.000 claims description 14
- HKMTVMBEALTRRR-UHFFFAOYSA-N Benzo[a]fluorene Chemical class C1=CC=CC2=C3CC4=CC=CC=C4C3=CC=C21 HKMTVMBEALTRRR-UHFFFAOYSA-N 0.000 claims description 13
- YNPNZTXNASCQKK-UHFFFAOYSA-N phenanthrene Chemical group C1=CC=C2C3=CC=CC=C3C=CC2=C1 YNPNZTXNASCQKK-UHFFFAOYSA-N 0.000 claims description 13
- 229910052783 alkali metal Inorganic materials 0.000 claims description 10
- 150000001340 alkali metals Chemical class 0.000 claims description 10
- 150000001454 anthracenes Chemical class 0.000 claims description 10
- UORVGPXVDQYIDP-BJUDXGSMSA-N borane Chemical group [10BH3] UORVGPXVDQYIDP-BJUDXGSMSA-N 0.000 claims description 10
- 229910052761 rare earth metal Inorganic materials 0.000 claims description 10
- 150000002910 rare earth metals Chemical class 0.000 claims description 10
- 229910052784 alkaline earth metal Inorganic materials 0.000 claims description 9
- 150000001342 alkaline earth metals Chemical class 0.000 claims description 9
- 230000005669 field effect Effects 0.000 claims description 9
- 125000001153 fluoro group Chemical group F* 0.000 claims description 9
- 125000005549 heteroarylene group Chemical group 0.000 claims description 9
- TXCDCPKCNAJMEE-UHFFFAOYSA-N dibenzofuran Chemical group C1=CC=C2C3=CC=CC=C3OC2=C1 TXCDCPKCNAJMEE-UHFFFAOYSA-N 0.000 claims description 8
- NSMJMUQZRGZMQC-UHFFFAOYSA-N 2-naphthalen-1-yl-1H-imidazo[4,5-f][1,10]phenanthroline Chemical compound C12=CC=CN=C2C2=NC=CC=C2C2=C1NC(C=1C3=CC=CC=C3C=CC=1)=N2 NSMJMUQZRGZMQC-UHFFFAOYSA-N 0.000 claims description 7
- MPQXHAGKBWFSNV-UHFFFAOYSA-N oxidophosphanium Chemical class [PH3]=O MPQXHAGKBWFSNV-UHFFFAOYSA-N 0.000 claims description 7
- 150000003222 pyridines Chemical class 0.000 claims description 7
- 150000003918 triazines Chemical class 0.000 claims description 7
- IYYZUPMFVPLQIF-ALWQSETLSA-N dibenzothiophene Chemical group C1=CC=CC=2[34S]C3=C(C=21)C=CC=C3 IYYZUPMFVPLQIF-ALWQSETLSA-N 0.000 claims description 6
- 150000003230 pyrimidines Chemical class 0.000 claims description 6
- 150000002219 fluoranthenes Chemical class 0.000 claims description 5
- 229910001508 alkali metal halide Inorganic materials 0.000 claims description 3
- 150000008045 alkali metal halides Chemical class 0.000 claims description 3
- 229910000272 alkali metal oxide Inorganic materials 0.000 claims description 3
- 229910001404 rare earth metal oxide Inorganic materials 0.000 claims description 3
- 229910000287 alkaline earth metal oxide Inorganic materials 0.000 claims description 2
- 150000004820 halides Chemical class 0.000 claims description 2
- 238000005286 illumination Methods 0.000 claims description 2
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical group [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 abstract description 13
- 125000004433 nitrogen atom Chemical group N* 0.000 abstract description 12
- 239000010410 layer Substances 0.000 description 258
- 125000001424 substituent group Chemical group 0.000 description 197
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 102
- 229910052757 nitrogen Inorganic materials 0.000 description 80
- 239000010408 film Substances 0.000 description 71
- 239000000758 substrate Substances 0.000 description 64
- 230000032258 transport Effects 0.000 description 61
- 239000002019 doping agent Substances 0.000 description 57
- 230000015572 biosynthetic process Effects 0.000 description 49
- 230000003111 delayed effect Effects 0.000 description 48
- 238000003786 synthesis reaction Methods 0.000 description 48
- 229910052782 aluminium Inorganic materials 0.000 description 46
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 45
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical group C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 42
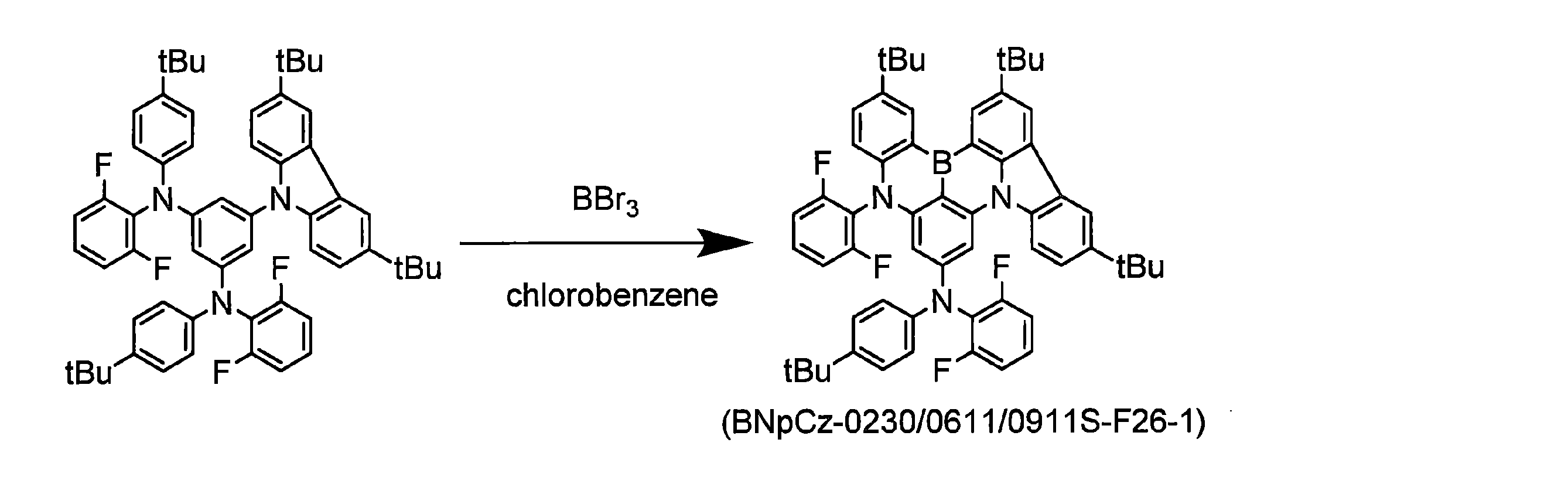
- 0 *c1cc(N(c2ccccc2B2c3c4[n]-5c(cccc6)c6c4ccc3)c(c(F)ccc3)c3F)c2c-5c1 Chemical compound *c1cc(N(c2ccccc2B2c3c4[n]-5c(cccc6)c6c4ccc3)c(c(F)ccc3)c3F)c2c-5c1 0.000 description 40
- 238000006243 chemical reaction Methods 0.000 description 37
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 32
- 238000000151 deposition Methods 0.000 description 32
- 239000000243 solution Substances 0.000 description 32
- 238000007740 vapor deposition Methods 0.000 description 31
- PQXKHYXIUOZZFA-UHFFFAOYSA-M lithium fluoride Chemical compound [Li+].[F-] PQXKHYXIUOZZFA-UHFFFAOYSA-M 0.000 description 30
- 238000000034 method Methods 0.000 description 30
- 230000008021 deposition Effects 0.000 description 28
- 229910052751 metal Inorganic materials 0.000 description 28
- 239000002184 metal Substances 0.000 description 28
- UJOBWOGCFQCDNV-UHFFFAOYSA-N 9H-carbazole Chemical group C1=CC=C2C3=CC=CC=C3NC2=C1 UJOBWOGCFQCDNV-UHFFFAOYSA-N 0.000 description 27
- 238000010521 absorption reaction Methods 0.000 description 26
- 230000005525 hole transport Effects 0.000 description 26
- MWPLVEDNUUSJAV-UHFFFAOYSA-N anthracene Natural products C1=CC=CC2=CC3=CC=CC=C3C=C21 MWPLVEDNUUSJAV-UHFFFAOYSA-N 0.000 description 25
- 238000011156 evaluation Methods 0.000 description 23
- 230000005284 excitation Effects 0.000 description 23
- 238000006467 substitution reaction Methods 0.000 description 23
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 22
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N silicon dioxide Inorganic materials O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 22
- 239000003480 eluent Substances 0.000 description 21
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 21
- 239000000126 substance Substances 0.000 description 21
- 239000012043 crude product Substances 0.000 description 20
- 230000001965 increasing effect Effects 0.000 description 20
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Chemical group COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 20
- 238000000295 emission spectrum Methods 0.000 description 19
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 18
- DMBHHRLKUKUOEG-UHFFFAOYSA-N diphenylamine Chemical compound C=1C=CC=CC=1NC1=CC=CC=C1 DMBHHRLKUKUOEG-UHFFFAOYSA-N 0.000 description 18
- 230000000694 effects Effects 0.000 description 18
- UHOVQNZJYSORNB-UHFFFAOYSA-N monobenzene Natural products C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 18
- 239000012299 nitrogen atmosphere Substances 0.000 description 18
- 239000011521 glass Substances 0.000 description 17
- 230000000704 physical effect Effects 0.000 description 17
- 230000002829 reductive effect Effects 0.000 description 17
- IOJUPLGTWVMSFF-UHFFFAOYSA-N benzothiazole Chemical group C1=CC=C2SC=NC2=C1 IOJUPLGTWVMSFF-UHFFFAOYSA-N 0.000 description 16
- 238000002189 fluorescence spectrum Methods 0.000 description 16
- 125000001644 phenoxazinyl group Chemical group C1(=CC=CC=2OC3=CC=CC=C3NC12)* 0.000 description 16
- 229910002027 silica gel Inorganic materials 0.000 description 16
- 239000000741 silica gel Substances 0.000 description 16
- 238000004364 calculation method Methods 0.000 description 15
- 125000002080 perylenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC5=CC=CC(C1=C23)=C45)* 0.000 description 15
- 239000002994 raw material Substances 0.000 description 15
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 14
- ILAHWRKJUDSMFH-UHFFFAOYSA-N boron tribromide Chemical compound BrB(Br)Br ILAHWRKJUDSMFH-UHFFFAOYSA-N 0.000 description 14
- 238000005259 measurement Methods 0.000 description 14
- 239000004065 semiconductor Substances 0.000 description 14
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 14
- 125000000623 heterocyclic group Chemical group 0.000 description 13
- 125000001828 phenalenyl group Chemical group C1(C=CC2=CC=CC3=CC=CC1=C23)* 0.000 description 13
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 13
- 239000004926 polymethyl methacrylate Substances 0.000 description 13
- 238000001308 synthesis method Methods 0.000 description 13
- 125000004429 atom Chemical group 0.000 description 12
- 229910052796 boron Inorganic materials 0.000 description 12
- 239000011159 matrix material Substances 0.000 description 12
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 12
- 125000005561 phenanthryl group Chemical group 0.000 description 12
- YCKRFDGAMUMZLT-UHFFFAOYSA-N Fluorine atom Chemical compound [F] YCKRFDGAMUMZLT-UHFFFAOYSA-N 0.000 description 11
- 238000005481 NMR spectroscopy Methods 0.000 description 11
- 125000000641 acridinyl group Chemical group C1(=CC=CC2=NC3=CC=CC=C3C=C12)* 0.000 description 11
- 230000000052 comparative effect Effects 0.000 description 11
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 11
- 239000012044 organic layer Substances 0.000 description 11
- 125000003107 substituted aryl group Chemical group 0.000 description 11
- 125000001544 thienyl group Chemical group 0.000 description 11
- 238000005160 1H NMR spectroscopy Methods 0.000 description 10
- UFWIBTONFRDIAS-UHFFFAOYSA-N Naphthalene Chemical class C1=CC=CC2=CC=CC=C21 UFWIBTONFRDIAS-UHFFFAOYSA-N 0.000 description 10
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 10
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical group C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 10
- NIHNNTQXNPWCJQ-UHFFFAOYSA-N fluorene Chemical class C1=CC=C2CC3=CC=CC=C3C2=C1 NIHNNTQXNPWCJQ-UHFFFAOYSA-N 0.000 description 10
- 125000001041 indolyl group Chemical group 0.000 description 10
- 238000004519 manufacturing process Methods 0.000 description 10
- 125000001484 phenothiazinyl group Chemical class C1(=CC=CC=2SC3=CC=CC=C3NC12)* 0.000 description 10
- 125000002294 quinazolinyl group Chemical group N1=C(N=CC2=CC=CC=C12)* 0.000 description 10
- 125000001567 quinoxalinyl group Chemical group N1=C(C=NC2=CC=CC=C12)* 0.000 description 10
- 229910052717 sulfur Inorganic materials 0.000 description 10
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 9
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 9
- 239000007983 Tris buffer Substances 0.000 description 9
- 229910052792 caesium Inorganic materials 0.000 description 9
- 230000006870 function Effects 0.000 description 9
- 238000010438 heat treatment Methods 0.000 description 9
- 125000005842 heteroatom Chemical group 0.000 description 9
- 125000002883 imidazolyl group Chemical group 0.000 description 9
- 230000003993 interaction Effects 0.000 description 9
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 9
- 239000000203 mixture Substances 0.000 description 9
- 125000002971 oxazolyl group Chemical group 0.000 description 9
- 125000001791 phenazinyl group Chemical class C1(=CC=CC2=NC3=CC=CC=C3N=C12)* 0.000 description 9
- 125000004076 pyridyl group Chemical group 0.000 description 9
- PJANXHGTPQOBST-UHFFFAOYSA-N stilbene Chemical class C=1C=CC=CC=1C=CC1=CC=CC=C1 PJANXHGTPQOBST-UHFFFAOYSA-N 0.000 description 9
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 8
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 8
- FZWLAAWBMGSTSO-UHFFFAOYSA-N Thiazole Chemical group C1=CSC=N1 FZWLAAWBMGSTSO-UHFFFAOYSA-N 0.000 description 8
- 125000004054 acenaphthylenyl group Chemical group C1(=CC2=CC=CC3=CC=CC1=C23)* 0.000 description 8
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 8
- 239000004305 biphenyl Chemical group 0.000 description 8
- 239000000460 chlorine Substances 0.000 description 8
- 229910052801 chlorine Inorganic materials 0.000 description 8
- MVPPADPHJFYWMZ-UHFFFAOYSA-N chlorobenzene Chemical compound ClC1=CC=CC=C1 MVPPADPHJFYWMZ-UHFFFAOYSA-N 0.000 description 8
- WDECIBYCCFPHNR-UHFFFAOYSA-N chrysene Chemical compound C1=CC=CC2=CC=C3C4=CC=CC=C4C=CC3=C21 WDECIBYCCFPHNR-UHFFFAOYSA-N 0.000 description 8
- 239000000470 constituent Substances 0.000 description 8
- 230000005281 excited state Effects 0.000 description 8
- 125000003838 furazanyl group Chemical group 0.000 description 8
- 125000000904 isoindolyl group Chemical group C=1(NC=C2C=CC=CC12)* 0.000 description 8
- 125000000842 isoxazolyl group Chemical group 0.000 description 8
- 229920000642 polymer Polymers 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 125000003373 pyrazinyl group Chemical group 0.000 description 8
- 125000003226 pyrazolyl group Chemical group 0.000 description 8
- BBEAQIROQSPTKN-UHFFFAOYSA-N pyrene Chemical compound C1=CC=C2C=CC3=CC=CC4=CC=C1C2=C43 BBEAQIROQSPTKN-UHFFFAOYSA-N 0.000 description 8
- 125000000714 pyrimidinyl group Chemical group 0.000 description 8
- 125000000168 pyrrolyl group Chemical group 0.000 description 8
- 238000004544 sputter deposition Methods 0.000 description 8
- 125000001935 tetracenyl group Chemical group C1(=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C12)* 0.000 description 8
- 125000005580 triphenylene group Chemical group 0.000 description 8
- 125000001931 aliphatic group Chemical group 0.000 description 7
- 150000001412 amines Chemical class 0.000 description 7
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 7
- 229910052794 bromium Inorganic materials 0.000 description 7
- ZSWFCLXCOIISFI-UHFFFAOYSA-N cyclopentadiene Chemical class C1C=CC=C1 ZSWFCLXCOIISFI-UHFFFAOYSA-N 0.000 description 7
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 7
- DKHNGUNXLDCATP-UHFFFAOYSA-N dipyrazino[2,3-f:2',3'-h]quinoxaline-2,3,6,7,10,11-hexacarbonitrile Chemical compound C12=NC(C#N)=C(C#N)N=C2C2=NC(C#N)=C(C#N)N=C2C2=C1N=C(C#N)C(C#N)=N2 DKHNGUNXLDCATP-UHFFFAOYSA-N 0.000 description 7
- 239000006185 dispersion Substances 0.000 description 7
- 125000003406 indolizinyl group Chemical group C=1(C=CN2C=CC=CC12)* 0.000 description 7
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 7
- 229910052744 lithium Inorganic materials 0.000 description 7
- 230000007246 mechanism Effects 0.000 description 7
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 7
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 7
- 229910052760 oxygen Inorganic materials 0.000 description 7
- 239000001301 oxygen Substances 0.000 description 7
- 125000001725 pyrenyl group Chemical group 0.000 description 7
- 238000010992 reflux Methods 0.000 description 7
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- 125000003960 triphenylenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C3=CC=CC=C3C12)* 0.000 description 7
- YJTKZCDBKVTVBY-UHFFFAOYSA-N 1,3-Diphenylbenzene Chemical group C1=CC=CC=C1C1=CC=CC(C=2C=CC=CC=2)=C1 YJTKZCDBKVTVBY-UHFFFAOYSA-N 0.000 description 6
- 125000001637 1-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C(*)=C([H])C([H])=C([H])C2=C1[H] 0.000 description 6
- 125000005955 1H-indazolyl group Chemical group 0.000 description 6
- YBYIRNPNPLQARY-UHFFFAOYSA-N 1H-indene Chemical class C1=CC=C2CC=CC2=C1 YBYIRNPNPLQARY-UHFFFAOYSA-N 0.000 description 6
- 125000006176 2-ethylbutyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(C([H])([H])*)C([H])([H])C([H])([H])[H] 0.000 description 6
- 125000001622 2-naphthyl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C(*)C([H])=C([H])C2=C1[H] 0.000 description 6
- 125000004920 4-methyl-2-pentyl group Chemical group CC(CC(C)*)C 0.000 description 6
- RGSFGYAAUTVSQA-UHFFFAOYSA-N Cyclopentane Chemical compound C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 6
- WHXSMMKQMYFTQS-UHFFFAOYSA-N Lithium Chemical compound [Li] WHXSMMKQMYFTQS-UHFFFAOYSA-N 0.000 description 6
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 6
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 6
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical group [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 6
- SLGBZMMZGDRARJ-UHFFFAOYSA-N Triphenylene Chemical class C1=CC=C2C3=CC=CC=C3C3=CC=CC=C3C2=C1 SLGBZMMZGDRARJ-UHFFFAOYSA-N 0.000 description 6
- 238000000862 absorption spectrum Methods 0.000 description 6
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 6
- AZDRQVAHHNSJOQ-UHFFFAOYSA-N alumane Chemical compound [AlH3] AZDRQVAHHNSJOQ-UHFFFAOYSA-N 0.000 description 6
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical group [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 6
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 6
- 125000004541 benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 6
- 229940125904 compound 1 Drugs 0.000 description 6
- 229940125782 compound 2 Drugs 0.000 description 6
- PMHQVHHXPFUNSP-UHFFFAOYSA-M copper(1+);methylsulfanylmethane;bromide Chemical compound Br[Cu].CSC PMHQVHHXPFUNSP-UHFFFAOYSA-M 0.000 description 6
- 150000004775 coumarins Chemical class 0.000 description 6
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 6
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 6
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 6
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 6
- 125000002541 furyl group Chemical group 0.000 description 6
- 125000001977 isobenzofuranyl group Chemical group C=1(OC=C2C=CC=CC12)* 0.000 description 6
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 6
- 125000001786 isothiazolyl group Chemical group 0.000 description 6
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 description 6
- 150000002739 metals Chemical class 0.000 description 6
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 6
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 6
- 125000004593 naphthyridinyl group Chemical group N1=C(C=CC2=CC=CN=C12)* 0.000 description 6
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 6
- 125000001715 oxadiazolyl group Chemical group 0.000 description 6
- 125000004592 phthalazinyl group Chemical group C1(=NN=CC2=CC=CC=C12)* 0.000 description 6
- 238000005498 polishing Methods 0.000 description 6
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 6
- 125000001042 pteridinyl group Chemical group N1=C(N=CC2=NC=CN=C12)* 0.000 description 6
- 125000000561 purinyl group Chemical group N1=C(N=C2N=CNC2=C1)* 0.000 description 6
- 125000002098 pyridazinyl group Chemical group 0.000 description 6
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 description 6
- 238000004904 shortening Methods 0.000 description 6
- 239000007787 solid Substances 0.000 description 6
- 239000011593 sulfur Chemical group 0.000 description 6
- 125000001973 tert-pentyl group Chemical group [H]C([H])([H])C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 6
- 125000003831 tetrazolyl group Chemical group 0.000 description 6
- 125000001113 thiadiazolyl group Chemical group 0.000 description 6
- 125000000335 thiazolyl group Chemical group 0.000 description 6
- 125000004306 triazinyl group Chemical group 0.000 description 6
- 125000001425 triazolyl group Chemical group 0.000 description 6
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical group C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 description 5
- FXKMXDQBHDTQII-UHFFFAOYSA-N 9-phenyl-3,6-bis(9-phenylcarbazol-3-yl)carbazole Chemical compound C1=CC=CC=C1N1C2=CC=C(C=3C=C4C5=CC(=CC=C5N(C=5C=CC=CC=5)C4=CC=3)C=3C=C4C5=CC=CC=C5N(C=5C=CC=CC=5)C4=CC=3)C=C2C2=CC=CC=C21 FXKMXDQBHDTQII-UHFFFAOYSA-N 0.000 description 5
- 238000005727 Friedel-Crafts reaction Methods 0.000 description 5
- 101100389263 Triticum aestivum EMH2 gene Proteins 0.000 description 5
- 150000004982 aromatic amines Chemical class 0.000 description 5
- 230000004888 barrier function Effects 0.000 description 5
- 125000005605 benzo group Chemical group 0.000 description 5
- WZJYKHNJTSNBHV-UHFFFAOYSA-N benzo[h]quinoline Chemical compound C1=CN=C2C3=CC=CC=C3C=CC2=C1 WZJYKHNJTSNBHV-UHFFFAOYSA-N 0.000 description 5
- 235000010290 biphenyl Nutrition 0.000 description 5
- 239000003086 colorant Substances 0.000 description 5
- 239000000539 dimer Substances 0.000 description 5
- RTZKZFJDLAIYFH-UHFFFAOYSA-N ether Substances CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 5
- GVEPBJHOBDJJJI-UHFFFAOYSA-N fluoranthrene Natural products C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=C1 GVEPBJHOBDJJJI-UHFFFAOYSA-N 0.000 description 5
- 239000012046 mixed solvent Substances 0.000 description 5
- WCPAKWJPBJAGKN-UHFFFAOYSA-N oxadiazole Chemical group C1=CON=N1 WCPAKWJPBJAGKN-UHFFFAOYSA-N 0.000 description 5
- DGBWPZSGHAXYGK-UHFFFAOYSA-N perinone Chemical class C12=NC3=CC=CC=C3N2C(=O)C2=CC=C3C4=C2C1=CC=C4C(=O)N1C2=CC=CC=C2N=C13 DGBWPZSGHAXYGK-UHFFFAOYSA-N 0.000 description 5
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 description 5
- 229910052700 potassium Inorganic materials 0.000 description 5
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical class C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 5
- 229920005989 resin Polymers 0.000 description 5
- 239000011347 resin Substances 0.000 description 5
- 239000011734 sodium Substances 0.000 description 5
- 230000003595 spectral effect Effects 0.000 description 5
- 229910052715 tantalum Inorganic materials 0.000 description 5
- GUVRBAGPIYLISA-UHFFFAOYSA-N tantalum atom Chemical compound [Ta] GUVRBAGPIYLISA-UHFFFAOYSA-N 0.000 description 5
- 150000007979 thiazole derivatives Chemical class 0.000 description 5
- JYEUMXHLPRZUAT-UHFFFAOYSA-N 1,2,3-triazine Chemical group C1=CN=NN=C1 JYEUMXHLPRZUAT-UHFFFAOYSA-N 0.000 description 4
- MMNNWKCYXNXWBG-UHFFFAOYSA-N 2,4,6-tris(3-phenylphenyl)-1,3,5-triazine Chemical compound C1=CC=CC=C1C1=CC=CC(C=2N=C(N=C(N=2)C=2C=C(C=CC=2)C=2C=CC=CC=2)C=2C=C(C=CC=2)C=2C=CC=CC=2)=C1 MMNNWKCYXNXWBG-UHFFFAOYSA-N 0.000 description 4
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 4
- IHYBAWKANLGJCW-UHFFFAOYSA-N C1=CC2=CC=CC3=CC=4C(=CC=CC4C1=C23)N Chemical compound C1=CC2=CC=CC3=CC=4C(=CC=CC4C1=C23)N IHYBAWKANLGJCW-UHFFFAOYSA-N 0.000 description 4
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 4
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical group C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 4
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 4
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 4
- 239000004793 Polystyrene Substances 0.000 description 4
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical group C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 4
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 4
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical group C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 4
- 239000000370 acceptor Substances 0.000 description 4
- 125000003342 alkenyl group Chemical group 0.000 description 4
- 125000002029 aromatic hydrocarbon group Chemical group 0.000 description 4
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 4
- 125000005013 aryl ether group Chemical group 0.000 description 4
- XJHABGPPCLHLLV-UHFFFAOYSA-N benzo[de]isoquinoline-1,3-dione Chemical class C1=CC(C(=O)NC2=O)=C3C2=CC=CC3=C1 XJHABGPPCLHLLV-UHFFFAOYSA-N 0.000 description 4
- 125000000499 benzofuranyl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 4
- 230000000903 blocking effect Effects 0.000 description 4
- 125000000259 cinnolinyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 4
- 125000005390 cinnolyl group Chemical group N1=NC(=CC2=CC=CC=C12)* 0.000 description 4
- LPIQUOYDBNQMRZ-UHFFFAOYSA-N cyclopentene Chemical compound C1CC=CC1 LPIQUOYDBNQMRZ-UHFFFAOYSA-N 0.000 description 4
- 238000011161 development Methods 0.000 description 4
- 230000005684 electric field Effects 0.000 description 4
- 239000007789 gas Substances 0.000 description 4
- 230000005283 ground state Effects 0.000 description 4
- 238000004770 highest occupied molecular orbital Methods 0.000 description 4
- 239000012212 insulator Substances 0.000 description 4
- 229910052740 iodine Inorganic materials 0.000 description 4
- 239000011630 iodine Substances 0.000 description 4
- 125000002183 isoquinolinyl group Chemical group C1(=NC=CC2=CC=CC=C12)* 0.000 description 4
- 125000005956 isoquinolyl group Chemical group 0.000 description 4
- 239000004973 liquid crystal related substance Substances 0.000 description 4
- 125000003136 n-heptyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 4
- 150000002894 organic compounds Chemical class 0.000 description 4
- 239000011368 organic material Substances 0.000 description 4
- 150000004880 oxines Chemical class 0.000 description 4
- 125000004430 oxygen atom Chemical group O* 0.000 description 4
- 125000001037 p-tolyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])([H])[H] 0.000 description 4
- 125000001792 phenanthrenyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3C=CC12)* 0.000 description 4
- 125000005954 phenoxathiinyl group Chemical group 0.000 description 4
- 239000008055 phosphate buffer solution Substances 0.000 description 4
- 238000001296 phosphorescence spectrum Methods 0.000 description 4
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 4
- 229920002223 polystyrene Polymers 0.000 description 4
- 238000006862 quantum yield reaction Methods 0.000 description 4
- 125000005493 quinolyl group Chemical group 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 238000007363 ring formation reaction Methods 0.000 description 4
- 229910052708 sodium Inorganic materials 0.000 description 4
- 125000004434 sulfur atom Chemical group 0.000 description 4
- 230000007704 transition Effects 0.000 description 4
- 125000000026 trimethylsilyl group Chemical group [H]C([H])([H])[Si]([*])(C([H])([H])[H])C([H])([H])[H] 0.000 description 4
- MDYOLVRUBBJPFM-UHFFFAOYSA-N tropolone Chemical compound OC1=CC=CC=CC1=O MDYOLVRUBBJPFM-UHFFFAOYSA-N 0.000 description 4
- NGQSLSMAEVWNPU-YTEMWHBBSA-N 1,2-bis[(e)-2-phenylethenyl]benzene Chemical class C=1C=CC=CC=1/C=C/C1=CC=CC=C1\C=C\C1=CC=CC=C1 NGQSLSMAEVWNPU-YTEMWHBBSA-N 0.000 description 3
- SXWIAEOZZQADEY-UHFFFAOYSA-N 1,3,5-triphenylbenzene Chemical group C1=CC=CC=C1C1=CC(C=2C=CC=CC=2)=CC(C=2C=CC=CC=2)=C1 SXWIAEOZZQADEY-UHFFFAOYSA-N 0.000 description 3
- KLCLIOISYBHYDZ-UHFFFAOYSA-N 1,4,4-triphenylbuta-1,3-dienylbenzene Chemical class C=1C=CC=CC=1C(C=1C=CC=CC=1)=CC=C(C=1C=CC=CC=1)C1=CC=CC=C1 KLCLIOISYBHYDZ-UHFFFAOYSA-N 0.000 description 3
- FLBAYUMRQUHISI-UHFFFAOYSA-N 1,8-naphthyridine Chemical group N1=CC=CC2=CC=CN=C21 FLBAYUMRQUHISI-UHFFFAOYSA-N 0.000 description 3
- IANQTJSKSUMEQM-UHFFFAOYSA-N 1-benzofuran Chemical group C1=CC=C2OC=CC2=C1 IANQTJSKSUMEQM-UHFFFAOYSA-N 0.000 description 3
- TZMSYXZUNZXBOL-UHFFFAOYSA-N 10H-phenoxazine Chemical compound C1=CC=C2NC3=CC=CC=C3OC2=C1 TZMSYXZUNZXBOL-UHFFFAOYSA-N 0.000 description 3
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 3
- UIGQXKJQGBIMEV-UHFFFAOYSA-N 2-[3-(3,5-dimethylphenoxy)-5-fluorophenyl]-1,3,5-trimethylbenzene Chemical group CC=1C=C(OC=2C=C(C=C(C2)F)C2=C(C=C(C=C2C)C)C)C=C(C1)C UIGQXKJQGBIMEV-UHFFFAOYSA-N 0.000 description 3
- UXGVMFHEKMGWMA-UHFFFAOYSA-N 2-benzofuran Chemical group C1=CC=CC2=COC=C21 UXGVMFHEKMGWMA-UHFFFAOYSA-N 0.000 description 3
- TUAMRELNJMMDMT-UHFFFAOYSA-N 3,5-xylenol Chemical compound CC1=CC(C)=CC(O)=C1 TUAMRELNJMMDMT-UHFFFAOYSA-N 0.000 description 3
- 125000004861 4-isopropyl phenyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1*)C([H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- YCPDJJWGODNLJK-UHFFFAOYSA-N 9-(3-fluorophenyl)carbazole Chemical compound FC1=CC=CC(N2C3=CC=CC=C3C3=CC=CC=C32)=C1 YCPDJJWGODNLJK-UHFFFAOYSA-N 0.000 description 3
- QCKSMEGXYJZTPL-UHFFFAOYSA-N 9H-carbazole N-phenylaniline Chemical group C1=CC=C2C3=CC=CC=C3NC2=C1.C=1C=CC=CC=1NC1=CC=CC=C1 QCKSMEGXYJZTPL-UHFFFAOYSA-N 0.000 description 3
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 3
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 3
- ZOKXTWBITQBERF-UHFFFAOYSA-N Molybdenum Chemical compound [Mo] ZOKXTWBITQBERF-UHFFFAOYSA-N 0.000 description 3
- NRCMAYZCPIVABH-UHFFFAOYSA-N Quinacridone Chemical class N1C2=CC=CC=C2C(=O)C2=C1C=C1C(=O)C3=CC=CC=C3NC1=C2 NRCMAYZCPIVABH-UHFFFAOYSA-N 0.000 description 3
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical group [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 3
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 3
- 150000001338 aliphatic hydrocarbons Chemical class 0.000 description 3
- 125000000304 alkynyl group Chemical group 0.000 description 3
- 229910045601 alloy Inorganic materials 0.000 description 3
- 239000000956 alloy Substances 0.000 description 3
- POEXERAQSHGAMH-UHFFFAOYSA-N ardine Natural products Cn1cc(Cc2c[nH]c3ccccc23)c2ccccc12 POEXERAQSHGAMH-UHFFFAOYSA-N 0.000 description 3
- 125000003710 aryl alkyl group Chemical group 0.000 description 3
- TVFDJXOCXUVLDH-UHFFFAOYSA-N caesium atom Chemical compound [Cs] TVFDJXOCXUVLDH-UHFFFAOYSA-N 0.000 description 3
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 3
- 229910000024 caesium carbonate Inorganic materials 0.000 description 3
- 239000011575 calcium Substances 0.000 description 3
- 150000001721 carbon Chemical group 0.000 description 3
- 239000003638 chemical reducing agent Substances 0.000 description 3
- 125000002676 chrysenyl group Chemical group C1(=CC=CC=2C3=CC=C4C=CC=CC4=C3C=CC12)* 0.000 description 3
- 238000000576 coating method Methods 0.000 description 3
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 3
- 125000005508 decahydronaphthalenyl group Chemical group 0.000 description 3
- 230000007423 decrease Effects 0.000 description 3
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 3
- 229910052737 gold Inorganic materials 0.000 description 3
- 239000010931 gold Substances 0.000 description 3
- 125000003187 heptyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 3
- 229930195733 hydrocarbon Natural products 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 229910010272 inorganic material Inorganic materials 0.000 description 3
- 239000011777 magnesium Substances 0.000 description 3
- 229910052749 magnesium Inorganic materials 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 229910052750 molybdenum Inorganic materials 0.000 description 3
- 239000011733 molybdenum Substances 0.000 description 3
- 125000003518 norbornenyl group Chemical group C12(C=CC(CC1)C2)* 0.000 description 3
- 125000003261 o-tolyl group Chemical group [H]C1=C([H])C(*)=C(C([H])=C1[H])C([H])([H])[H] 0.000 description 3
- 150000004866 oxadiazoles Chemical class 0.000 description 3
- 125000003933 pentacenyl group Chemical group C1(=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C12)* 0.000 description 3
- 125000000951 phenoxy group Chemical group [H]C1=C([H])C([H])=C(O*)C([H])=C1[H] 0.000 description 3
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical class N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 3
- 229920003227 poly(N-vinyl carbazole) Polymers 0.000 description 3
- 229920000515 polycarbonate Polymers 0.000 description 3
- 239000004417 polycarbonate Substances 0.000 description 3
- 229920005596 polymer binder Polymers 0.000 description 3
- 239000002491 polymer binding agent Substances 0.000 description 3
- 229910000027 potassium carbonate Inorganic materials 0.000 description 3
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 3
- 125000005581 pyrene group Chemical group 0.000 description 3
- 239000010453 quartz Substances 0.000 description 3
- 229910052701 rubidium Inorganic materials 0.000 description 3
- 229910052710 silicon Inorganic materials 0.000 description 3
- 229910052709 silver Inorganic materials 0.000 description 3
- 239000004332 silver Substances 0.000 description 3
- 125000003808 silyl group Chemical group [H][Si]([H])([H])[*] 0.000 description 3
- 239000001632 sodium acetate Substances 0.000 description 3
- 235000017281 sodium acetate Nutrition 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 125000005504 styryl group Chemical group 0.000 description 3
- 125000000547 substituted alkyl group Chemical group 0.000 description 3
- 125000005346 substituted cycloalkyl group Chemical group 0.000 description 3
- 125000004627 thianthrenyl group Chemical group C1(=CC=CC=2SC3=CC=CC=C3SC12)* 0.000 description 3
- 150000003577 thiophenes Chemical class 0.000 description 3
- 150000003852 triazoles Chemical group 0.000 description 3
- ODHXBMXNKOYIBV-UHFFFAOYSA-N triphenylamine Chemical compound C1=CC=CC=C1N(C=1C=CC=CC=1)C1=CC=CC=C1 ODHXBMXNKOYIBV-UHFFFAOYSA-N 0.000 description 3
- BWHDROKFUHTORW-UHFFFAOYSA-N tritert-butylphosphane Chemical compound CC(C)(C)P(C(C)(C)C)C(C)(C)C BWHDROKFUHTORW-UHFFFAOYSA-N 0.000 description 3
- 229910052725 zinc Inorganic materials 0.000 description 3
- 239000011701 zinc Substances 0.000 description 3
- UGUHFDPGDQDVGX-UHFFFAOYSA-N 1,2,3-thiadiazole Chemical group C1=CSN=N1 UGUHFDPGDQDVGX-UHFFFAOYSA-N 0.000 description 2
- BCMCBBGGLRIHSE-UHFFFAOYSA-N 1,3-benzoxazole Chemical class C1=CC=C2OC=NC2=C1 BCMCBBGGLRIHSE-UHFFFAOYSA-N 0.000 description 2
- 125000000355 1,3-benzoxazolyl group Chemical group O1C(=NC2=C1C=CC=C2)* 0.000 description 2
- ASWYHZXKFSLNLN-UHFFFAOYSA-N 1,3-dibromo-5-fluorobenzene Chemical compound FC1=CC(Br)=CC(Br)=C1 ASWYHZXKFSLNLN-UHFFFAOYSA-N 0.000 description 2
- KIIGPNDJMVHUSL-UHFFFAOYSA-N 1-phenyl-2-benzofuran Chemical compound C=12C=CC=CC2=COC=1C1=CC=CC=C1 KIIGPNDJMVHUSL-UHFFFAOYSA-N 0.000 description 2
- IVYAYAWSXINSEF-UHFFFAOYSA-N 1-tert-butylperylene Chemical group C1=CC(C=2C(C(C)(C)C)=CC=C3C=2C2=CC=C3)=C3C2=CC=CC3=C1 IVYAYAWSXINSEF-UHFFFAOYSA-N 0.000 description 2
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical class C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 2
- BAXOFTOLAUCFNW-UHFFFAOYSA-N 1H-indazole Chemical group C1=CC=C2C=NNC2=C1 BAXOFTOLAUCFNW-UHFFFAOYSA-N 0.000 description 2
- WLODWTPNUWYZKN-UHFFFAOYSA-N 1h-pyrrol-2-ol Chemical class OC1=CC=CN1 WLODWTPNUWYZKN-UHFFFAOYSA-N 0.000 description 2
- JFJNVIPVOCESGZ-UHFFFAOYSA-N 2,3-dipyridin-2-ylpyridine Chemical compound N1=CC=CC=C1C1=CC=CN=C1C1=CC=CC=N1 JFJNVIPVOCESGZ-UHFFFAOYSA-N 0.000 description 2
- 125000005810 2,5-xylyl group Chemical group [H]C1=C([H])C(=C(*)C([H])=C1C([H])([H])[H])C([H])([H])[H] 0.000 description 2
- STTGYIUESPWXOW-UHFFFAOYSA-N 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline Chemical compound C=12C=CC3=C(C=4C=CC=CC=4)C=C(C)N=C3C2=NC(C)=CC=1C1=CC=CC=C1 STTGYIUESPWXOW-UHFFFAOYSA-N 0.000 description 2
- DFRPRIUFLDNBKD-UHFFFAOYSA-N 2-(10-phenylanthracen-9-yl)naphtho[2,3-b][1]benzofuran Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(OC=2C3=CC4=CC=CC=C4C=2)C3=C1 DFRPRIUFLDNBKD-UHFFFAOYSA-N 0.000 description 2
- FZTBAQBBLSYHJZ-UHFFFAOYSA-N 2-phenyl-1,3-oxazol-4-ol Chemical class OC1=COC(C=2C=CC=CC=2)=N1 FZTBAQBBLSYHJZ-UHFFFAOYSA-N 0.000 description 2
- AMSJIGYDHCSSRE-UHFFFAOYSA-N 3,14-diazahexacyclo[11.11.0.02,10.04,9.015,24.016,21]tetracosa-1(24),2,4,6,8,10,12,14,16,18,20,22-dodecaene Chemical compound C1=CC=C2C=CC3=C4C5=NC6=CC=CC=C6C5=CC=C4N=C3C2=C1 AMSJIGYDHCSSRE-UHFFFAOYSA-N 0.000 description 2
- HNACKJNPFWWEKI-UHFFFAOYSA-N 3,6-dimethyl-9h-carbazole Chemical compound C1=C(C)C=C2C3=CC(C)=CC=C3NC2=C1 HNACKJNPFWWEKI-UHFFFAOYSA-N 0.000 description 2
- QENGPZGAWFQWCZ-UHFFFAOYSA-N 3-Methylthiophene Chemical compound CC=1C=CSC=1 QENGPZGAWFQWCZ-UHFFFAOYSA-N 0.000 description 2
- OGGKVJMNFFSDEV-UHFFFAOYSA-N 3-methyl-n-[4-[4-(n-(3-methylphenyl)anilino)phenyl]phenyl]-n-phenylaniline Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C(C)C=CC=2)=C1 OGGKVJMNFFSDEV-UHFFFAOYSA-N 0.000 description 2
- DDTHMESPCBONDT-UHFFFAOYSA-N 4-(4-oxocyclohexa-2,5-dien-1-ylidene)cyclohexa-2,5-dien-1-one Chemical compound C1=CC(=O)C=CC1=C1C=CC(=O)C=C1 DDTHMESPCBONDT-UHFFFAOYSA-N 0.000 description 2
- FKNQCJSGGFJEIZ-UHFFFAOYSA-N 4-methylpyridine Chemical compound CC1=CC=NC=C1 FKNQCJSGGFJEIZ-UHFFFAOYSA-N 0.000 description 2
- STWMMBMWRLRXOH-UHFFFAOYSA-N 5-carbazol-9-yl-1-N,1-N,3-N,3-N-tetrakis(3,5-dimethylphenyl)benzene-1,3-diamine Chemical compound CC1=CC(=CC(=C1)N(C2=CC(=CC(=C2)C)C)C3=CC(=CC(=C3)N4C5=CC=CC=C5C6=CC=CC=C64)N(C7=CC(=CC(=C7)C)C)C8=CC(=CC(=C8)C)C)C STWMMBMWRLRXOH-UHFFFAOYSA-N 0.000 description 2
- CFNMUZCFSDMZPQ-GHXNOFRVSA-N 7-[(z)-3-methyl-4-(4-methyl-5-oxo-2h-furan-2-yl)but-2-enoxy]chromen-2-one Chemical compound C=1C=C2C=CC(=O)OC2=CC=1OC/C=C(/C)CC1OC(=O)C(C)=C1 CFNMUZCFSDMZPQ-GHXNOFRVSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical group N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- GJWBRYKOJMOBHH-UHFFFAOYSA-N 9,9-dimethyl-n-[4-(9-phenylcarbazol-3-yl)phenyl]-n-(4-phenylphenyl)fluoren-2-amine Chemical compound C1=C2C(C)(C)C3=CC=CC=C3C2=CC=C1N(C=1C=CC(=CC=1)C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C(C=C1)=CC=C1C1=CC=CC=C1 GJWBRYKOJMOBHH-UHFFFAOYSA-N 0.000 description 2
- YXHXRBIAIVNCPG-UHFFFAOYSA-N 9-(3,5-dibromophenyl)carbazole Chemical compound BrC1=CC(Br)=CC(N2C3=CC=CC=C3C3=CC=CC=C32)=C1 YXHXRBIAIVNCPG-UHFFFAOYSA-N 0.000 description 2
- SKRWTSKMOHUKPD-UHFFFAOYSA-N 9-[3-(3,5-dimethylphenoxy)-5-(2,4,6-trimethylphenyl)phenyl]-3,6-dimethylcarbazole Chemical compound CC=1C=C(OC=2C=C(C=C(C2)C2=C(C=C(C=C2C)C)C)N2C3=CC=C(C=C3C=3C=C(C=CC23)C)C)C=C(C1)C SKRWTSKMOHUKPD-UHFFFAOYSA-N 0.000 description 2
- SKOGWTSNIYXEOF-UHFFFAOYSA-N BrC1=CC(=CC(=C1)F)OC1=CC(=CC(=C1)C)C Chemical compound BrC1=CC(=CC(=C1)F)OC1=CC(=CC(=C1)C)C SKOGWTSNIYXEOF-UHFFFAOYSA-N 0.000 description 2
- 239000003341 Bronsted base Substances 0.000 description 2
- HVQYTVWOXZCHLC-UHFFFAOYSA-N C1=C(N(C2=C3C(=CC(=C2)O)C=CC=C3)C2=CC=CC=C2)C=CC=C1 Chemical compound C1=C(N(C2=C3C(=CC(=C2)O)C=CC=C3)C2=CC=CC=C2)C=CC=C1 HVQYTVWOXZCHLC-UHFFFAOYSA-N 0.000 description 2
- WKDWQNNODSIFHO-UHFFFAOYSA-N CC1(C)C2=C(C=C(O)C=C2)C2=C1C=C(C=C2)N(C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound CC1(C)C2=C(C=C(O)C=C2)C2=C1C=C(C=C2)N(C1=CC=CC=C1)C1=CC=CC=C1 WKDWQNNODSIFHO-UHFFFAOYSA-N 0.000 description 2
- GHSPWQKIVYQUMQ-UHFFFAOYSA-N CCCCCCC.B(Br)(Br)Br Chemical compound CCCCCCC.B(Br)(Br)Br GHSPWQKIVYQUMQ-UHFFFAOYSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- 239000004215 Carbon black (E152) Substances 0.000 description 2
- VOZASEKFIDNVDV-UHFFFAOYSA-N Cc(cc1)cc(B2c(c3ccc4)c4-[n]4c5c2cccc5c2c4cccc2)c1N3c(c(F)ccc1)c1F Chemical compound Cc(cc1)cc(B2c(c3ccc4)c4-[n]4c5c2cccc5c2c4cccc2)c1N3c(c(F)ccc1)c1F VOZASEKFIDNVDV-UHFFFAOYSA-N 0.000 description 2
- MQJQFBWURHWYCG-UHFFFAOYSA-N Cc1cc(Oc2ccc(cccc3)c3c2B2c3c4[n]-5c6ccccc6c4ccc3)c2c-5c1 Chemical compound Cc1cc(Oc2ccc(cccc3)c3c2B2c3c4[n]-5c6ccccc6c4ccc3)c2c-5c1 MQJQFBWURHWYCG-UHFFFAOYSA-N 0.000 description 2
- VYZAMTAEIAYCRO-UHFFFAOYSA-N Chromium Chemical compound [Cr] VYZAMTAEIAYCRO-UHFFFAOYSA-N 0.000 description 2
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 description 2
- PMPVIKIVABFJJI-UHFFFAOYSA-N Cyclobutane Chemical compound C1CCC1 PMPVIKIVABFJJI-UHFFFAOYSA-N 0.000 description 2
- KWHWFTSHDPJOTG-UHFFFAOYSA-N Deazaflavin Chemical class C1=CC=C2C=C(C(=O)NC(=O)N3)C3=NC2=C1 KWHWFTSHDPJOTG-UHFFFAOYSA-N 0.000 description 2
- 238000003775 Density Functional Theory Methods 0.000 description 2
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 2
- 241000254158 Lampyridae Species 0.000 description 2
- 239000002841 Lewis acid Substances 0.000 description 2
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 2
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Chemical group C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 2
- OAICVXFJPJFONN-UHFFFAOYSA-N Phosphorus Chemical group [P] OAICVXFJPJFONN-UHFFFAOYSA-N 0.000 description 2
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical group C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- ATJFFYVFTNAWJD-UHFFFAOYSA-N Tin Chemical compound [Sn] ATJFFYVFTNAWJD-UHFFFAOYSA-N 0.000 description 2
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N Titan oxide Chemical compound O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 description 2
- 238000006887 Ullmann reaction Methods 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- DGEZNRSVGBDHLK-UHFFFAOYSA-N [1,10]phenanthroline Chemical compound C1=CN=C2C3=NC=CC=C3C=CC2=C1 DGEZNRSVGBDHLK-UHFFFAOYSA-N 0.000 description 2
- NYXIPJBBAPFGIR-UHFFFAOYSA-K [Al+3].C1(=CC=CC=C1)C=1C=C(C=CC1)[O-].C1(=CC=CC=C1)C=1C=C(C=CC1)[O-].C1(=CC=CC=C1)C=1C=C(C=CC1)[O-] Chemical compound [Al+3].C1(=CC=CC=C1)C=1C=C(C=CC1)[O-].C1(=CC=CC=C1)C=1C=C(C=CC1)[O-].C1(=CC=CC=C1)C=1C=C(C=CC1)[O-] NYXIPJBBAPFGIR-UHFFFAOYSA-K 0.000 description 2
- YRKCREAYFQTBPV-UHFFFAOYSA-N acetylacetone Chemical compound CC(=O)CC(C)=O YRKCREAYFQTBPV-UHFFFAOYSA-N 0.000 description 2
- FZEYVTFCMJSGMP-UHFFFAOYSA-N acridone Chemical class C1=CC=C2C(=O)C3=CC=CC=C3NC2=C1 FZEYVTFCMJSGMP-UHFFFAOYSA-N 0.000 description 2
- 125000003172 aldehyde group Chemical group 0.000 description 2
- 125000002723 alicyclic group Chemical group 0.000 description 2
- 125000004414 alkyl thio group Chemical group 0.000 description 2
- 125000003277 amino group Chemical group 0.000 description 2
- 125000002178 anthracenyl group Chemical group C1(=CC=CC2=CC3=CC=CC=C3C=C12)* 0.000 description 2
- PYKYMHQGRFAEBM-UHFFFAOYSA-N anthraquinone Natural products CCC(=O)c1c(O)c2C(=O)C3C(C=CC=C3O)C(=O)c2cc1CC(=O)OC PYKYMHQGRFAEBM-UHFFFAOYSA-N 0.000 description 2
- 150000004056 anthraquinones Chemical class 0.000 description 2
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 2
- 229940058303 antinematodal benzimidazole derivative Drugs 0.000 description 2
- 238000013459 approach Methods 0.000 description 2
- 150000004832 aryl thioethers Chemical group 0.000 description 2
- 125000003609 aryl vinyl group Chemical group 0.000 description 2
- 239000002585 base Substances 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- QRUDEWIWKLJBPS-UHFFFAOYSA-N benzotriazole Chemical group C1=CC=C2N[N][N]C2=C1 QRUDEWIWKLJBPS-UHFFFAOYSA-N 0.000 description 2
- 229910052790 beryllium Inorganic materials 0.000 description 2
- UORVGPXVDQYIDP-UHFFFAOYSA-N borane Chemical class B UORVGPXVDQYIDP-UHFFFAOYSA-N 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- XJHCXCQVJFPJIK-UHFFFAOYSA-M caesium fluoride Chemical compound [F-].[Cs+] XJHCXCQVJFPJIK-UHFFFAOYSA-M 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 2
- 239000000969 carrier Substances 0.000 description 2
- 229910052804 chromium Inorganic materials 0.000 description 2
- 239000011651 chromium Substances 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 230000021615 conjugation Effects 0.000 description 2
- 150000004696 coordination complex Chemical class 0.000 description 2
- 229910052802 copper Inorganic materials 0.000 description 2
- 239000010949 copper Substances 0.000 description 2
- 150000001907 coumarones Chemical class 0.000 description 2
- 230000008878 coupling Effects 0.000 description 2
- 238000010168 coupling process Methods 0.000 description 2
- 238000005859 coupling reaction Methods 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- 125000000392 cycloalkenyl group Chemical group 0.000 description 2
- 125000005366 cycloalkylthio group Chemical group 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- 125000005266 diarylamine group Chemical group 0.000 description 2
- IYYZUPMFVPLQIF-UHFFFAOYSA-N dibenzothiophene Chemical compound C1=CC=C2C3=CC=CC=C3SC2=C1 IYYZUPMFVPLQIF-UHFFFAOYSA-N 0.000 description 2
- 238000007336 electrophilic substitution reaction Methods 0.000 description 2
- 238000006266 etherification reaction Methods 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 230000008020 evaporation Effects 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 150000007946 flavonol Chemical class 0.000 description 2
- HVQAJTFOCKOKIN-UHFFFAOYSA-N flavonol Natural products O1C2=CC=CC=C2C(=O)C(O)=C1C1=CC=CC=C1 HVQAJTFOCKOKIN-UHFFFAOYSA-N 0.000 description 2
- 235000011957 flavonols Nutrition 0.000 description 2
- 125000003914 fluoranthenyl group Chemical group C1(=CC=C2C=CC=C3C4=CC=CC=C4C1=C23)* 0.000 description 2
- DMEGYFMYUHOHGS-UHFFFAOYSA-N heptamethylene Natural products C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 2
- 239000012535 impurity Substances 0.000 description 2
- 229910052738 indium Inorganic materials 0.000 description 2
- APFVFJFRJDLVQX-UHFFFAOYSA-N indium atom Chemical compound [In] APFVFJFRJDLVQX-UHFFFAOYSA-N 0.000 description 2
- VVVPGLRKXQSQSZ-UHFFFAOYSA-N indolo[3,2-c]carbazole Chemical group C1=CC=CC2=NC3=C4C5=CC=CC=C5N=C4C=CC3=C21 VVVPGLRKXQSQSZ-UHFFFAOYSA-N 0.000 description 2
- 150000002484 inorganic compounds Chemical class 0.000 description 2
- 229910052742 iron Inorganic materials 0.000 description 2
- RBTARNINKXHZNM-UHFFFAOYSA-K iron trichloride Chemical compound Cl[Fe](Cl)Cl RBTARNINKXHZNM-UHFFFAOYSA-K 0.000 description 2
- ZLTPDFXIESTBQG-UHFFFAOYSA-N isothiazole Chemical group C=1C=NSC=1 ZLTPDFXIESTBQG-UHFFFAOYSA-N 0.000 description 2
- 238000010030 laminating Methods 0.000 description 2
- 238000003475 lamination Methods 0.000 description 2
- 150000007517 lewis acids Chemical class 0.000 description 2
- 125000000040 m-tolyl group Chemical group [H]C1=C([H])C(*)=C([H])C(=C1[H])C([H])([H])[H] 0.000 description 2
- 229910044991 metal oxide Inorganic materials 0.000 description 2
- 150000004706 metal oxides Chemical class 0.000 description 2
- SKTCDJAMAYNROS-UHFFFAOYSA-N methoxycyclopentane Chemical compound COC1CCCC1 SKTCDJAMAYNROS-UHFFFAOYSA-N 0.000 description 2
- MESMXXUBQDBBSR-UHFFFAOYSA-N n,9-diphenyl-n-[4-[4-(n-(9-phenylcarbazol-3-yl)anilino)phenyl]phenyl]carbazol-3-amine Chemical compound C1=CC=CC=C1N(C=1C=C2C3=CC=CC=C3N(C=3C=CC=CC=3)C2=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C=C3C4=CC=CC=C4N(C=4C=CC=CC=4)C3=CC=2)C=C1 MESMXXUBQDBBSR-UHFFFAOYSA-N 0.000 description 2
- VTSAYWZCLNPTGP-UHFFFAOYSA-N n,n-bis(4-dibenzofuran-4-ylphenyl)-4-(4-phenylphenyl)aniline Chemical compound C1=CC=CC=C1C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC(=CC=2)C=2C=3OC4=CC=CC=C4C=3C=CC=2)C=2C=CC(=CC=2)C=2C=3OC4=CC=CC=C4C=3C=CC=2)C=C1 VTSAYWZCLNPTGP-UHFFFAOYSA-N 0.000 description 2
- IBHBKWKFFTZAHE-UHFFFAOYSA-N n-[4-[4-(n-naphthalen-1-ylanilino)phenyl]phenyl]-n-phenylnaphthalen-1-amine Chemical group C1=CC=CC=C1N(C=1C2=CC=CC=C2C=CC=1)C1=CC=C(C=2C=CC(=CC=2)N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C=CC=2)C=C1 IBHBKWKFFTZAHE-UHFFFAOYSA-N 0.000 description 2
- YTIFDAAZLZVHIX-UHFFFAOYSA-N naphtho[1,2-g][1]benzofuran Chemical group C1=CC=C2C3=CC=C4C=COC4=C3C=CC2=C1 YTIFDAAZLZVHIX-UHFFFAOYSA-N 0.000 description 2
- 125000004957 naphthylene group Chemical group 0.000 description 2
- 229910052759 nickel Inorganic materials 0.000 description 2
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 238000007122 ortho-metalation reaction Methods 0.000 description 2
- 150000004893 oxazines Chemical class 0.000 description 2
- 229910052763 palladium Inorganic materials 0.000 description 2
- 125000005582 pentacene group Chemical group 0.000 description 2
- CSHWQDPOILHKBI-UHFFFAOYSA-N peryrene Natural products C1=CC(C2=CC=CC=3C2=C2C=CC=3)=C3C2=CC=CC3=C1 CSHWQDPOILHKBI-UHFFFAOYSA-N 0.000 description 2
- 150000005041 phenanthrolines Chemical class 0.000 description 2
- GJSGGHOYGKMUPT-UHFFFAOYSA-N phenoxathiine Chemical group C1=CC=C2OC3=CC=CC=C3SC2=C1 GJSGGHOYGKMUPT-UHFFFAOYSA-N 0.000 description 2
- 229910052698 phosphorus Inorganic materials 0.000 description 2
- LFGREXWGYUGZLY-UHFFFAOYSA-N phosphoryl Chemical class [P]=O LFGREXWGYUGZLY-UHFFFAOYSA-N 0.000 description 2
- 238000005424 photoluminescence Methods 0.000 description 2
- LFSXCDWNBUNEEM-UHFFFAOYSA-N phthalazine Chemical group C1=NN=CC2=CC=CC=C21 LFSXCDWNBUNEEM-UHFFFAOYSA-N 0.000 description 2
- 239000002985 plastic film Substances 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229920000548 poly(silane) polymer Polymers 0.000 description 2
- 229920002492 poly(sulfone) Polymers 0.000 description 2
- 229920000728 polyester Polymers 0.000 description 2
- 239000011591 potassium Substances 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- CPNGPNLZQNNVQM-UHFFFAOYSA-N pteridine Chemical group N1=CN=CC2=NC=CN=C21 CPNGPNLZQNNVQM-UHFFFAOYSA-N 0.000 description 2
- 150000003219 pyrazolines Chemical class 0.000 description 2
- OWJJRQSAIMYXQJ-UHFFFAOYSA-N pyrene-1,6-diamine Chemical compound C1=C2C(N)=CC=C(C=C3)C2=C2C3=C(N)C=CC2=C1 OWJJRQSAIMYXQJ-UHFFFAOYSA-N 0.000 description 2
- 150000003220 pyrenes Chemical class 0.000 description 2
- PBMFSQRYOILNGV-UHFFFAOYSA-N pyridazine Chemical group C1=CC=NN=C1 PBMFSQRYOILNGV-UHFFFAOYSA-N 0.000 description 2
- RQGPLDBZHMVWCH-UHFFFAOYSA-N pyrrolo[3,2-b]pyrrole Chemical class C1=NC2=CC=NC2=C1 RQGPLDBZHMVWCH-UHFFFAOYSA-N 0.000 description 2
- 150000005255 pyrrolopyridines Chemical class 0.000 description 2
- 238000010791 quenching Methods 0.000 description 2
- 230000000171 quenching effect Effects 0.000 description 2
- XSCHRSMBECNVNS-UHFFFAOYSA-N quinoxaline Chemical compound N1=CC=NC2=CC=CC=C21 XSCHRSMBECNVNS-UHFFFAOYSA-N 0.000 description 2
- 230000006798 recombination Effects 0.000 description 2
- 238000005215 recombination Methods 0.000 description 2
- 230000027756 respiratory electron transport chain Effects 0.000 description 2
- 230000002441 reversible effect Effects 0.000 description 2
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical class [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 2
- YYMBJDOZVAITBP-UHFFFAOYSA-N rubrene Chemical compound C1=CC=CC=C1C(C1=C(C=2C=CC=CC=2)C2=CC=CC=C2C(C=2C=CC=CC=2)=C11)=C(C=CC=C2)C2=C1C1=CC=CC=C1 YYMBJDOZVAITBP-UHFFFAOYSA-N 0.000 description 2
- 239000010703 silicon Substances 0.000 description 2
- 239000002356 single layer Substances 0.000 description 2
- 239000005361 soda-lime glass Substances 0.000 description 2
- 238000004528 spin coating Methods 0.000 description 2
- 238000000967 suction filtration Methods 0.000 description 2
- 229920003002 synthetic resin Polymers 0.000 description 2
- 239000000057 synthetic resin Substances 0.000 description 2
- 229940042055 systemic antimycotics triazole derivative Drugs 0.000 description 2
- YTZKOQUCBOVLHL-UHFFFAOYSA-N tert-butylbenzene Chemical compound CC(C)(C)C1=CC=CC=C1 YTZKOQUCBOVLHL-UHFFFAOYSA-N 0.000 description 2
- JRMUNVKIHCOMHV-UHFFFAOYSA-M tetrabutylammonium bromide Chemical compound [Br-].CCCC[N+](CCCC)(CCCC)CCCC JRMUNVKIHCOMHV-UHFFFAOYSA-M 0.000 description 2
- IFLREYGFSNHWGE-UHFFFAOYSA-N tetracene Chemical compound C1=CC=CC2=CC3=CC4=CC=CC=C4C=C3C=C21 IFLREYGFSNHWGE-UHFFFAOYSA-N 0.000 description 2
- 150000003536 tetrazoles Chemical group 0.000 description 2
- 150000004867 thiadiazoles Chemical class 0.000 description 2
- GVIJJXMXTUZIOD-UHFFFAOYSA-N thianthrene Chemical group C1=CC=C2SC3=CC=CC=C3SC2=C1 GVIJJXMXTUZIOD-UHFFFAOYSA-N 0.000 description 2
- NZFNXWQNBYZDAQ-UHFFFAOYSA-N thioridazine hydrochloride Chemical class Cl.C12=CC(SC)=CC=C2SC2=CC=CC=C2N1CCC1CCCCN1C NZFNXWQNBYZDAQ-UHFFFAOYSA-N 0.000 description 2
- 229910052718 tin Inorganic materials 0.000 description 2
- 125000003944 tolyl group Chemical group 0.000 description 2
- FAQYAMRNWDIXMY-UHFFFAOYSA-N trichloroborane Chemical compound ClB(Cl)Cl FAQYAMRNWDIXMY-UHFFFAOYSA-N 0.000 description 2
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 description 2
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 2
- YKSGNOMLAIJTLT-UHFFFAOYSA-N violanthrone Chemical class C12=C3C4=CC=C2C2=CC=CC=C2C(=O)C1=CC=C3C1=CC=C2C(=O)C3=CC=CC=C3C3=CC=C4C1=C32 YKSGNOMLAIJTLT-UHFFFAOYSA-N 0.000 description 2
- 239000008096 xylene Substances 0.000 description 2
- IDCZNRDLRHDFHY-UHFFFAOYSA-N (10-phenylanthracen-9-yl)-bis(2,4,6-trimethylphenyl)borane Chemical compound CC1=CC(C)=CC(C)=C1B(C=1C2=CC=CC=C2C(C=2C=CC=CC=2)=C2C=CC=CC2=1)C1=C(C)C=C(C)C=C1C IDCZNRDLRHDFHY-UHFFFAOYSA-N 0.000 description 1
- BZXQRXJJJUZZAJ-UHFFFAOYSA-N (2,4,6-trimethylphenyl)boronic acid Chemical compound CC1=CC(C)=C(B(O)O)C(C)=C1 BZXQRXJJJUZZAJ-UHFFFAOYSA-N 0.000 description 1
- MGZOXZPZHVOXQB-UHFFFAOYSA-N (2-oxochromen-7-yl) acetate Chemical class C1=CC(=O)OC2=CC(OC(=O)C)=CC=C21 MGZOXZPZHVOXQB-UHFFFAOYSA-N 0.000 description 1
- KXTPESAKEXMGAZ-UHFFFAOYSA-N (4,5-diphenylanthracen-9-yl)-bis(2,4,6-trimethylphenyl)borane Chemical compound CC1=CC(C)=CC(C)=C1B(C=1C2=CC=CC(=C2C=C2C(C=3C=CC=CC=3)=CC=CC2=1)C=1C=CC=CC=1)C1=C(C)C=C(C)C=C1C KXTPESAKEXMGAZ-UHFFFAOYSA-N 0.000 description 1
- TXBFHHYSJNVGBX-UHFFFAOYSA-N (4-diphenylphosphorylphenyl)-triphenylsilane Chemical compound C=1C=CC=CC=1P(C=1C=CC(=CC=1)[Si](C=1C=CC=CC=1)(C=1C=CC=CC=1)C=1C=CC=CC=1)(=O)C1=CC=CC=C1 TXBFHHYSJNVGBX-UHFFFAOYSA-N 0.000 description 1
- 125000004642 (C1-C12) alkoxy group Chemical group 0.000 description 1
- 125000000229 (C1-C4)alkoxy group Chemical group 0.000 description 1
- TXVWTOBHDDIASC-UHFFFAOYSA-N 1,2-diphenylethene-1,2-diamine Chemical compound C=1C=CC=CC=1C(N)=C(N)C1=CC=CC=C1 TXVWTOBHDDIASC-UHFFFAOYSA-N 0.000 description 1
- LBIUMLHTGBTILM-UHFFFAOYSA-N 1,3-bis(2-methylphenyl)-2-benzofuran Chemical compound CC1=CC=CC=C1C1=C2C=CC=CC2=C(C=2C(=CC=CC=2)C)O1 LBIUMLHTGBTILM-UHFFFAOYSA-N 0.000 description 1
- JGOKQJGYALJSMZ-UHFFFAOYSA-N 1,3-bis[2-(trifluoromethyl)phenyl]-2-benzofuran Chemical compound FC(F)(F)C1=CC=CC=C1C1=C2C=CC=CC2=C(C=2C(=CC=CC=2)C(F)(F)F)O1 JGOKQJGYALJSMZ-UHFFFAOYSA-N 0.000 description 1
- WZCQRUWWHSTZEM-UHFFFAOYSA-N 1,3-phenylenediamine Chemical compound NC1=CC=CC(N)=C1 WZCQRUWWHSTZEM-UHFFFAOYSA-N 0.000 description 1
- UHXOHPVVEHBKKT-UHFFFAOYSA-N 1-(2,2-diphenylethenyl)-4-[4-(2,2-diphenylethenyl)phenyl]benzene Chemical group C=1C=C(C=2C=CC(C=C(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)C=CC=1C=C(C=1C=CC=CC=1)C1=CC=CC=C1 UHXOHPVVEHBKKT-UHFFFAOYSA-N 0.000 description 1
- MTCVUGLPXSUGEU-UHFFFAOYSA-N 1-N,6-diphenyl-1-N,6-N-bis(4-trimethylsilylphenyl)-3H-pyrene-1,6-diamine Chemical compound C1(=CC=CC=C1)C1(C=CC2=CC=C3C(=CCC4=CC=C1C2=C34)N(C1=CC=C(C=C1)[Si](C)(C)C)C1=CC=CC=C1)NC1=CC=C(C=C1)[Si](C)(C)C MTCVUGLPXSUGEU-UHFFFAOYSA-N 0.000 description 1
- AQHFAFUHJCEELC-UHFFFAOYSA-N 1-N,8-N-diphenyl-1-N,8-N-bis(4-phenylphenyl)pyrene-1,8-diamine Chemical compound C1(=CC=C(C=C1)N(C1=CC=C2C=CC3=CC=C(C4=CC=C1C2=C34)N(C1=CC=CC=C1)C1=CC=C(C=C1)C1=CC=CC=C1)C1=CC=CC=C1)C1=CC=CC=C1 AQHFAFUHJCEELC-UHFFFAOYSA-N 0.000 description 1
- PHBJYIUTTPNUBD-UHFFFAOYSA-N 1-[4-(10-naphthalen-2-ylanthracen-9-yl)phenyl]-2-phenylbenzimidazole Chemical compound C1=CC=CC=C1C1=NC2=CC=CC=C2N1C1=CC=C(C=2C3=CC=CC=C3C(C=3C=C4C=CC=CC4=CC=3)=C3C=CC=CC3=2)C=C1 PHBJYIUTTPNUBD-UHFFFAOYSA-N 0.000 description 1
- RKWWASUTWAFKHA-UHFFFAOYSA-N 1-bromo-2,3-difluorobenzene Chemical compound FC1=CC=CC(Br)=C1F RKWWASUTWAFKHA-UHFFFAOYSA-N 0.000 description 1
- JHLKSIOJYMGSMB-UHFFFAOYSA-N 1-bromo-3,5-difluorobenzene Chemical compound FC1=CC(F)=CC(Br)=C1 JHLKSIOJYMGSMB-UHFFFAOYSA-N 0.000 description 1
- QDFKKJYEIFBEFC-UHFFFAOYSA-N 1-bromo-3-fluorobenzene Chemical compound FC1=CC=CC(Br)=C1 QDFKKJYEIFBEFC-UHFFFAOYSA-N 0.000 description 1
- HAZHJPAZVPNGOJ-UHFFFAOYSA-N 1-n,1-n,6-n,6-n-tetrakis(3,4-dimethylphenyl)-3,8-diphenylpyrene-1,6-diamine Chemical compound C1=C(C)C(C)=CC=C1N(C=1C2=CC=C3C(C=4C=CC=CC=4)=CC(=C4C=CC(C2=C43)=C(C=2C=CC=CC=2)C=1)N(C=1C=C(C)C(C)=CC=1)C=1C=C(C)C(C)=CC=1)C1=CC=C(C)C(C)=C1 HAZHJPAZVPNGOJ-UHFFFAOYSA-N 0.000 description 1
- LQZLLITUEMNAAZ-UHFFFAOYSA-N 1-n,1-n,6-n,6-n-tetrakis(3,4-dimethylphenyl)pyrene-1,6-diamine Chemical compound C1=C(C)C(C)=CC=C1N(C=1C2=CC=C3C=CC(=C4C=CC(C2=C43)=CC=1)N(C=1C=C(C)C(C)=CC=1)C=1C=C(C)C(C)=CC=1)C1=CC=C(C)C(C)=C1 LQZLLITUEMNAAZ-UHFFFAOYSA-N 0.000 description 1
- UBHOJJRMAHJLMR-UHFFFAOYSA-N 1-n,1-n,6-n,6-n-tetrakis(3-methylphenyl)pyrene-1,6-diamine Chemical compound CC1=CC=CC(N(C=2C=C(C)C=CC=2)C=2C3=CC=C4C=CC(=C5C=CC(C3=C54)=CC=2)N(C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)=C1 UBHOJJRMAHJLMR-UHFFFAOYSA-N 0.000 description 1
- AXQGZVANICBQBW-UHFFFAOYSA-N 1-n,1-n,6-n,6-n-tetrakis(4-propan-2-ylphenyl)pyrene-1,6-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC=C3C=CC(=C4C=CC(C2=C43)=CC=1)N(C=1C=CC(=CC=1)C(C)C)C=1C=CC(=CC=1)C(C)C)C1=CC=C(C(C)C)C=C1 AXQGZVANICBQBW-UHFFFAOYSA-N 0.000 description 1
- WTEJYGDMCOWSLV-UHFFFAOYSA-N 1-n,1-n,6-n,6-n-tetraphenylpyrene-1,6-diamine Chemical compound C1=CC=CC=C1N(C=1C2=CC=C3C=CC(=C4C=CC(C2=C43)=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 WTEJYGDMCOWSLV-UHFFFAOYSA-N 0.000 description 1
- IYZMXHQDXZKNCY-UHFFFAOYSA-N 1-n,1-n-diphenyl-4-n,4-n-bis[4-(n-phenylanilino)phenyl]benzene-1,4-diamine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)N(C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C=1C=CC(=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 IYZMXHQDXZKNCY-UHFFFAOYSA-N 0.000 description 1
- BUENDBLPCACIGQ-UHFFFAOYSA-N 1-n,6-n-bis(4-ethylphenyl)-1-n,6-n-diphenylpyrene-1,6-diamine Chemical compound C1=CC(CC)=CC=C1N(C=1C2=CC=C3C=CC(=C4C=CC(C2=C43)=CC=1)N(C=1C=CC=CC=1)C=1C=CC(CC)=CC=1)C1=CC=CC=C1 BUENDBLPCACIGQ-UHFFFAOYSA-N 0.000 description 1
- JBUJPKHUNFHQFA-UHFFFAOYSA-N 1-n,6-n-bis(4-methylphenyl)-1-n,6-n-bis(4-propan-2-ylphenyl)pyrene-1,6-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC=C3C=CC(=C4C=CC(C2=C43)=CC=1)N(C=1C=CC(C)=CC=1)C=1C=CC(=CC=1)C(C)C)C1=CC=C(C)C=C1 JBUJPKHUNFHQFA-UHFFFAOYSA-N 0.000 description 1
- FWKFTAWTOFEJOW-UHFFFAOYSA-N 1-n,6-n-bis(4-methylphenyl)-1-n,6-n-diphenylpyrene-1,6-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C2=CC=C3C=CC(=C4C=CC(C2=C43)=CC=1)N(C=1C=CC=CC=1)C=1C=CC(C)=CC=1)C1=CC=CC=C1 FWKFTAWTOFEJOW-UHFFFAOYSA-N 0.000 description 1
- IKHFIMAZKKDZEF-UHFFFAOYSA-N 1-phenyl-2-[4-(10-phenylanthracen-9-yl)phenyl]benzimidazole Chemical compound C1=CC=CC=C1C(C1=CC=CC=C11)=C(C=CC=C2)C2=C1C1=CC=C(C=2N(C3=CC=CC=C3N=2)C=2C=CC=CC=2)C=C1 IKHFIMAZKKDZEF-UHFFFAOYSA-N 0.000 description 1
- CVBUKMMMRLOKQR-UHFFFAOYSA-N 1-phenylbutane-1,3-dione Chemical compound CC(=O)CC(=O)C1=CC=CC=C1 CVBUKMMMRLOKQR-UHFFFAOYSA-N 0.000 description 1
- KXVMTFADKIQXJR-UHFFFAOYSA-N 10-N-benzo[a]anthracen-1-ylanthracene-9,10-diamine Chemical compound C1(=CC=CC2=CC=C3C=C4C=CC=CC4=CC3=C12)NC=1C2=CC=CC=C2C(=C2C=CC=CC12)N KXVMTFADKIQXJR-UHFFFAOYSA-N 0.000 description 1
- WQWKHNYXKZPARA-UHFFFAOYSA-N 10-[4-(4-methyl-n-(4-methylphenyl)anilino)naphthalen-1-yl]-n,n-bis(4-methylphenyl)anthracen-9-amine Chemical compound C1=CC(C)=CC=C1N(C=1C2=CC=CC=C2C(C=2C3=CC=CC=C3C(N(C=3C=CC(C)=CC=3)C=3C=CC(C)=CC=3)=C3C=CC=CC3=2)=CC=1)C1=CC=C(C)C=C1 WQWKHNYXKZPARA-UHFFFAOYSA-N 0.000 description 1
- ZVFJWYZMQAEBMO-UHFFFAOYSA-N 1h-benzo[h]quinolin-10-one Chemical compound C1=CNC2=C3C(=O)C=CC=C3C=CC2=C1 ZVFJWYZMQAEBMO-UHFFFAOYSA-N 0.000 description 1
- XWIYUCRMWCHYJR-UHFFFAOYSA-N 1h-pyrrolo[3,2-b]pyridine Chemical compound C1=CC=C2NC=CC2=N1 XWIYUCRMWCHYJR-UHFFFAOYSA-N 0.000 description 1
- MVWPVABZQQJTPL-UHFFFAOYSA-N 2,3-diphenylcyclohexa-2,5-diene-1,4-dione Chemical class O=C1C=CC(=O)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 MVWPVABZQQJTPL-UHFFFAOYSA-N 0.000 description 1
- BFTIPCRZWILUIY-UHFFFAOYSA-N 2,5,8,11-tetratert-butylperylene Chemical group CC(C)(C)C1=CC(C2=CC(C(C)(C)C)=CC=3C2=C2C=C(C=3)C(C)(C)C)=C3C2=CC(C(C)(C)C)=CC3=C1 BFTIPCRZWILUIY-UHFFFAOYSA-N 0.000 description 1
- NXXYKOUNUYWIHA-UHFFFAOYSA-N 2,6-Dimethylphenol Chemical compound CC1=CC=CC(C)=C1O NXXYKOUNUYWIHA-UHFFFAOYSA-N 0.000 description 1
- KQQHMWOMQDCEMB-UHFFFAOYSA-N 2,6-ditert-butyl-9-n,10-n-bis(4-methylphenyl)-9-n,10-n-bis(4-propan-2-ylphenyl)anthracene-9,10-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC(=CC=C2C(N(C=2C=CC(C)=CC=2)C=2C=CC(=CC=2)C(C)C)=C2C=C(C=CC2=1)C(C)(C)C)C(C)(C)C)C1=CC=C(C)C=C1 KQQHMWOMQDCEMB-UHFFFAOYSA-N 0.000 description 1
- IGOGPMGAOBXQOP-UHFFFAOYSA-N 2,6-ditert-butyl-9-n,10-n-diphenyl-9-n,10-n-bis(4-propan-2-ylphenyl)anthracene-9,10-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC(=CC=C2C(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C(C)C)=C2C=C(C=CC2=1)C(C)(C)C)C(C)(C)C)C1=CC=CC=C1 IGOGPMGAOBXQOP-UHFFFAOYSA-N 0.000 description 1
- HQQDLDVQOHARFC-UHFFFAOYSA-N 2,6-ditert-butyl-9-n,9-n,10-n,10-n-tetrakis(4-methylphenyl)anthracene-9,10-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C2=CC(=CC=C2C(N(C=2C=CC(C)=CC=2)C=2C=CC(C)=CC=2)=C2C=C(C=CC2=1)C(C)(C)C)C(C)(C)C)C1=CC=C(C)C=C1 HQQDLDVQOHARFC-UHFFFAOYSA-N 0.000 description 1
- GBHMUSBVGVHVLQ-UHFFFAOYSA-N 2-(2'-benzo[h]quinolin-2-yl-9,9'-spirobi[fluorene]-2-yl)benzo[h]quinoline Chemical compound C1=CC=C2C3=NC(C4=CC=C5C=6C(C7(C8=CC(=CC=C8C8=CC=CC=C87)C=7N=C8C9=CC=CC=C9C=CC8=CC=7)C5=C4)=CC=CC=6)=CC=C3C=CC2=C1 GBHMUSBVGVHVLQ-UHFFFAOYSA-N 0.000 description 1
- TWZYORZPYCRVAX-UHFFFAOYSA-N 2-(2h-thiopyran-1-ylidene)propanedinitrile Chemical class N#CC(C#N)=S1CC=CC=C1 TWZYORZPYCRVAX-UHFFFAOYSA-N 0.000 description 1
- MTQADTZTLQGIRT-UHFFFAOYSA-N 2-(4-dinaphthalen-1-ylphosphorylphenyl)-1,8-naphthyridine Chemical compound C1=CC=C2C(P(C=3C=CC(=CC=3)C=3N=C4N=CC=CC4=CC=3)(C=3C4=CC=CC=C4C=CC=3)=O)=CC=CC2=C1 MTQADTZTLQGIRT-UHFFFAOYSA-N 0.000 description 1
- NBYLBWHHTUWMER-UHFFFAOYSA-N 2-Methylquinolin-8-ol Chemical compound C1=CC=C(O)C2=NC(C)=CC=C21 NBYLBWHHTUWMER-UHFFFAOYSA-N 0.000 description 1
- LVXKJHDSZNWVEE-UHFFFAOYSA-N 2-[10-(1,10-phenanthrolin-2-yl)anthracen-9-yl]-1,10-phenanthroline Chemical compound C1=CN=C2C3=NC(C4=C5C=CC=CC5=C(C=5N=C6C7=NC=CC=C7C=CC6=CC=5)C5=CC=CC=C54)=CC=C3C=CC2=C1 LVXKJHDSZNWVEE-UHFFFAOYSA-N 0.000 description 1
- QWKWMRMSNXMFOE-UHFFFAOYSA-N 2-[2,3-bis(1-phenylbenzimidazol-2-yl)phenyl]-1-phenylbenzimidazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2N=C1C1=CC=CC(C=2N(C3=CC=CC=C3N=2)C=2C=CC=CC=2)=C1C1=NC2=CC=CC=C2N1C1=CC=CC=C1 QWKWMRMSNXMFOE-UHFFFAOYSA-N 0.000 description 1
- YLYPIBBGWLKELC-RMKNXTFCSA-N 2-[2-[(e)-2-[4-(dimethylamino)phenyl]ethenyl]-6-methylpyran-4-ylidene]propanedinitrile Chemical compound C1=CC(N(C)C)=CC=C1\C=C\C1=CC(=C(C#N)C#N)C=C(C)O1 YLYPIBBGWLKELC-RMKNXTFCSA-N 0.000 description 1
- HFBUZPXNXFVACY-UHFFFAOYSA-N 2-[3-(10-naphthalen-2-ylanthracen-9-yl)phenyl]-1-phenylbenzimidazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2N=C1C1=CC=CC(C=2C3=CC=CC=C3C(C=3C=C4C=CC=CC4=CC=3)=C3C=CC=CC3=2)=C1 HFBUZPXNXFVACY-UHFFFAOYSA-N 0.000 description 1
- MCNJVPRHIXCHLM-UHFFFAOYSA-N 2-[4-(10-naphthalen-2-ylanthracen-9-yl)phenyl]-1-phenylbenzimidazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2N=C1C1=CC=C(C=2C3=CC=CC=C3C(C=3C=C4C=CC=CC4=CC=3)=C3C=CC=CC3=2)C=C1 MCNJVPRHIXCHLM-UHFFFAOYSA-N 0.000 description 1
- VOZBMWWMIQGZGM-UHFFFAOYSA-N 2-[4-(9,10-dinaphthalen-2-ylanthracen-2-yl)phenyl]-1-phenylbenzimidazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2N=C1C1=CC=C(C=2C=C3C(C=4C=C5C=CC=CC5=CC=4)=C4C=CC=CC4=C(C=4C=C5C=CC=CC5=CC=4)C3=CC=2)C=C1 VOZBMWWMIQGZGM-UHFFFAOYSA-N 0.000 description 1
- IXHWGNYCZPISET-UHFFFAOYSA-N 2-[4-(dicyanomethylidene)-2,3,5,6-tetrafluorocyclohexa-2,5-dien-1-ylidene]propanedinitrile Chemical compound FC1=C(F)C(=C(C#N)C#N)C(F)=C(F)C1=C(C#N)C#N IXHWGNYCZPISET-UHFFFAOYSA-N 0.000 description 1
- GYUPAYHPAZQUMB-UHFFFAOYSA-N 2-phenyl-9-[3-(9-phenyl-1,10-phenanthrolin-2-yl)phenyl]-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC=C(C=CC=2C3=NC(=CC=2)C=2C=C(C=CC=2)C=2N=C4C5=NC(=CC=C5C=CC4=CC=2)C=2C=CC=CC=2)C3=N1 GYUPAYHPAZQUMB-UHFFFAOYSA-N 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- KYGSXEYUWRFVNY-UHFFFAOYSA-N 2-pyran-2-ylidenepropanedinitrile Chemical class N#CC(C#N)=C1OC=CC=C1 KYGSXEYUWRFVNY-UHFFFAOYSA-N 0.000 description 1
- YAELXYZSNJSOCR-UHFFFAOYSA-N 2-pyridin-2-yl-5-[7-(6-pyridin-2-ylpyridin-3-yl)triphenylen-2-yl]pyridine Chemical group N1=CC=CC=C1C1=CC=C(C=2C=C3C4=CC=CC=C4C4=CC(=CC=C4C3=CC=2)C=2C=NC(=CC=2)C=2N=CC=CC=2)C=N1 YAELXYZSNJSOCR-UHFFFAOYSA-N 0.000 description 1
- OVBXOMNANIKXCY-UHFFFAOYSA-N 3,10-bis(2,4,6-trimethylphenyl)perylene Chemical group CC1=CC(C)=CC(C)=C1C1=CC=C2C3=C1C=CC=C3C(C=CC=C13)=C1C2=CC=C3C1=C(C)C=C(C)C=C1C OVBXOMNANIKXCY-UHFFFAOYSA-N 0.000 description 1
- ONPGJYGFTLAKCZ-UHFFFAOYSA-N 3,10-bis(2,6-dimethylphenyl)perylene Chemical group CC1=CC=CC(C)=C1C1=CC=C2C3=C1C=CC=C3C(C=CC=C13)=C1C2=CC=C3C1=C(C)C=CC=C1C ONPGJYGFTLAKCZ-UHFFFAOYSA-N 0.000 description 1
- XJOZODMHGRYTRA-UHFFFAOYSA-N 3,10-diphenylperylene Chemical group C1=CC=CC=C1C1=CC=C2C3=C1C=CC=C3C(C=CC=C13)=C1C2=CC=C3C1=CC=CC=C1 XJOZODMHGRYTRA-UHFFFAOYSA-N 0.000 description 1
- HEEPXBSZBHTXLG-UHFFFAOYSA-N 3,4,9,10-tetraphenylperylene Chemical group C1=CC=CC=C1C1=CC=C2C3=C1C(C=1C=CC=CC=1)=CC=C3C(C=CC(=C13)C=4C=CC=CC=4)=C1C2=CC=C3C1=CC=CC=C1 HEEPXBSZBHTXLG-UHFFFAOYSA-N 0.000 description 1
- MSQGCJJGBFKWTN-UHFFFAOYSA-N 3,4-di(carbazol-9-yl)benzonitrile Chemical compound C1=CC=CC=2C3=CC=CC=C3N(C1=2)C=1C=C(C#N)C=CC=1N1C2=CC=CC=C2C=2C=CC=CC1=2 MSQGCJJGBFKWTN-UHFFFAOYSA-N 0.000 description 1
- LINFGHPILLNINI-UHFFFAOYSA-N 3,4-diphenylperylene Chemical group C1=CC=CC=C1C1=CC=C2C3=C1C(C=1C=CC=CC=1)=CC=C3C1=C3C2=CC=CC3=CC=C1 LINFGHPILLNINI-UHFFFAOYSA-N 0.000 description 1
- JNGDCMHTNXRQQD-UHFFFAOYSA-N 3,6-dioxocyclohexa-1,4-diene-1,2,4,5-tetracarbonitrile Chemical compound O=C1C(C#N)=C(C#N)C(=O)C(C#N)=C1C#N JNGDCMHTNXRQQD-UHFFFAOYSA-N 0.000 description 1
- KMZRPGPWSFZJLB-UHFFFAOYSA-N 3-(1,3-benzothiazol-2-yl)chromen-2-one Chemical class C1=CC=C2SC(C3=CC=4C=CC=CC=4OC3=O)=NC2=C1 KMZRPGPWSFZJLB-UHFFFAOYSA-N 0.000 description 1
- MFUDSVMCOALJIR-UHFFFAOYSA-N 3-(3-carbazol-9-ylphenoxy)-N,N-diphenoxynaphthalen-1-amine Chemical compound C1=CC=CC=2C3=CC=CC=C3N(C12)C=1C=C(OC=2C=C(C3=CC=CC=C3C2)N(OC2=CC=CC=C2)OC2=CC=CC=C2)C=CC1 MFUDSVMCOALJIR-UHFFFAOYSA-N 0.000 description 1
- CBGPXLJUGZSWFN-UHFFFAOYSA-N 3-(3-carbazol-9-ylphenoxy)-N,N-diphenylnaphthalen-1-amine Chemical compound C1=CC=CC=2C3=CC=CC=C3N(C12)C=1C=C(OC=2C=C(C3=CC=CC=C3C2)N(C2=CC=CC=C2)C2=CC=CC=C2)C=CC1 CBGPXLJUGZSWFN-UHFFFAOYSA-N 0.000 description 1
- DHDHJYNTEFLIHY-UHFFFAOYSA-N 4,7-diphenyl-1,10-phenanthroline Chemical compound C1=CC=CC=C1C1=CC=NC2=C1C=CC1=C(C=3C=CC=CC=3)C=CN=C21 DHDHJYNTEFLIHY-UHFFFAOYSA-N 0.000 description 1
- HXWWMGJBPGRWRS-CMDGGOBGSA-N 4- -2-tert-butyl-6- -4h-pyran Chemical compound O1C(C(C)(C)C)=CC(=C(C#N)C#N)C=C1\C=C\C1=CC(C(CCN2CCC3(C)C)(C)C)=C2C3=C1 HXWWMGJBPGRWRS-CMDGGOBGSA-N 0.000 description 1
- GAMYYCRTACQSBR-UHFFFAOYSA-N 4-azabenzimidazole Chemical compound C1=CC=C2NC=NC2=N1 GAMYYCRTACQSBR-UHFFFAOYSA-N 0.000 description 1
- ZOKIJILZFXPFTO-UHFFFAOYSA-N 4-methyl-n-[4-[1-[4-(4-methyl-n-(4-methylphenyl)anilino)phenyl]cyclohexyl]phenyl]-n-(4-methylphenyl)aniline Chemical compound C1=CC(C)=CC=C1N(C=1C=CC(=CC=1)C1(CCCCC1)C=1C=CC(=CC=1)N(C=1C=CC(C)=CC=1)C=1C=CC(C)=CC=1)C1=CC=C(C)C=C1 ZOKIJILZFXPFTO-UHFFFAOYSA-N 0.000 description 1
- AOQKGYRILLEVJV-UHFFFAOYSA-N 4-naphthalen-1-yl-3,5-diphenyl-1,2,4-triazole Chemical compound C1=CC=CC=C1C(N1C=2C3=CC=CC=C3C=CC=2)=NN=C1C1=CC=CC=C1 AOQKGYRILLEVJV-UHFFFAOYSA-N 0.000 description 1
- FNERQQDCQZWYOC-UHFFFAOYSA-N 5-(10-naphthalen-2-ylanthracen-9-yl)-1,2-diphenylbenzimidazole Chemical compound C1=CC=CC=C1C1=NC2=CC(C=3C4=CC=CC=C4C(C=4C=C5C=CC=CC5=CC=4)=C4C=CC=CC4=3)=CC=C2N1C1=CC=CC=C1 FNERQQDCQZWYOC-UHFFFAOYSA-N 0.000 description 1
- DEYHZYIPSXJFEO-UHFFFAOYSA-N 5-[3,5-bis(1,10-phenanthrolin-5-yl)phenyl]-1,10-phenanthroline Chemical compound C12=CC=CN=C2C2=NC=CC=C2C=C1C1=CC(C=2C3=CC=CN=C3C3=NC=CC=C3C=2)=CC(C=2C3=CC=CN=C3C3=NC=CC=C3C=2)=C1 DEYHZYIPSXJFEO-UHFFFAOYSA-N 0.000 description 1
- CKOCSOGJXPVDMI-UHFFFAOYSA-N 5-[6-(1,10-phenanthrolin-5-yl)pyridin-2-yl]-1,10-phenanthroline Chemical compound C1=CC=C2C(C=3C=CC=C(N=3)C=3C4=CC=CN=C4C4=NC=CC=C4C=3)=CC3=CC=CN=C3C2=N1 CKOCSOGJXPVDMI-UHFFFAOYSA-N 0.000 description 1
- WYVAPPKNVBBQBT-UHFFFAOYSA-N 5-carbazol-9-yl-1-n,1-n,3-n,3-n-tetraphenylbenzene-1,3-diamine Chemical compound C1=CC=CC=C1N(C=1C=C(C=C(C=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)N1C2=CC=CC=C2C2=CC=CC=C21)C1=CC=CC=C1 WYVAPPKNVBBQBT-UHFFFAOYSA-N 0.000 description 1
- UIXDVMVPTIWIAV-UHFFFAOYSA-N 6-(3-carbazol-9-ylphenoxy)-9,9-dimethyl-N,N-diphenylfluoren-2-amine Chemical compound C1=CC=CC=2C3=CC=CC=C3N(C12)C=1C=C(OC=2C=C3C=4C=CC(=CC4C(C3=CC2)(C)C)N(C2=CC=CC=C2)C2=CC=CC=C2)C=CC1 UIXDVMVPTIWIAV-UHFFFAOYSA-N 0.000 description 1
- JBSGIWZNUUUNBB-UHFFFAOYSA-N 6-n,12-n-bis(4-ethylphenyl)-6-n,12-n-diphenylchrysene-6,12-diamine Chemical compound C1=CC(CC)=CC=C1N(C=1C2=CC=CC=C2C2=CC(=C3C=CC=CC3=C2C=1)N(C=1C=CC=CC=1)C=1C=CC(CC)=CC=1)C1=CC=CC=C1 JBSGIWZNUUUNBB-UHFFFAOYSA-N 0.000 description 1
- IPJHGORFBMOUGA-UHFFFAOYSA-N 6-n,12-n-bis(4-methylphenyl)-6-n,12-n-bis(4-propan-2-ylphenyl)chrysene-6,12-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC=CC=C2C2=CC(=C3C=CC=CC3=C2C=1)N(C=1C=CC(C)=CC=1)C=1C=CC(=CC=1)C(C)C)C1=CC=C(C)C=C1 IPJHGORFBMOUGA-UHFFFAOYSA-N 0.000 description 1
- HQGJBNOVSBWSFD-UHFFFAOYSA-N 6-n,12-n-bis(4-tert-butylphenyl)-6-n,12-n-diphenylchrysene-6,12-diamine Chemical compound C1=CC(C(C)(C)C)=CC=C1N(C=1C2=CC=CC=C2C2=CC(=C3C=CC=CC3=C2C=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C(C)(C)C)C1=CC=CC=C1 HQGJBNOVSBWSFD-UHFFFAOYSA-N 0.000 description 1
- ULXXGNOISOWXCJ-UHFFFAOYSA-N 6-n,12-n-diphenyl-6-n,12-n-bis(4-propan-2-ylphenyl)chrysene-6,12-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC=CC=C2C2=CC(=C3C=CC=CC3=C2C=1)N(C=1C=CC=CC=1)C=1C=CC(=CC=1)C(C)C)C1=CC=CC=C1 ULXXGNOISOWXCJ-UHFFFAOYSA-N 0.000 description 1
- MRTINRUFHXEJHO-UHFFFAOYSA-N 6-n,6-n,12-n,12-n-tetrakis(3-methylphenyl)chrysene-6,12-diamine Chemical compound CC1=CC=CC(N(C=2C=C(C)C=CC=2)C=2C3=CC=CC=C3C3=CC(=C4C=CC=CC4=C3C=2)N(C=2C=C(C)C=CC=2)C=2C=C(C)C=CC=2)=C1 MRTINRUFHXEJHO-UHFFFAOYSA-N 0.000 description 1
- PZPSURICQAGVDO-UHFFFAOYSA-N 6-n,6-n,12-n,12-n-tetrakis(4-methylphenyl)chrysene-6,12-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C2=CC=CC=C2C2=CC(=C3C=CC=CC3=C2C=1)N(C=1C=CC(C)=CC=1)C=1C=CC(C)=CC=1)C1=CC=C(C)C=C1 PZPSURICQAGVDO-UHFFFAOYSA-N 0.000 description 1
- ADPTUNPKYGZJMJ-UHFFFAOYSA-N 6-n,6-n,12-n,12-n-tetrakis(4-propan-2-ylphenyl)chrysene-6,12-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC=CC=C2C2=CC(=C3C=CC=CC3=C2C=1)N(C=1C=CC(=CC=1)C(C)C)C=1C=CC(=CC=1)C(C)C)C1=CC=C(C(C)C)C=C1 ADPTUNPKYGZJMJ-UHFFFAOYSA-N 0.000 description 1
- FYSCMYSZCIZQIY-UHFFFAOYSA-N 6-n,6-n,12-n,12-n-tetranaphthalen-2-ylchrysene-6,12-diamine Chemical compound C1=CC=CC2=CC(N(C=3C=C4C=CC=CC4=CC=3)C3=C4C=CC=CC4=C4C=C(C5=CC=CC=C5C4=C3)N(C=3C=C4C=CC=CC4=CC=3)C3=CC4=CC=CC=C4C=C3)=CC=C21 FYSCMYSZCIZQIY-UHFFFAOYSA-N 0.000 description 1
- QZMRZMUXFCMRJU-UHFFFAOYSA-N 6-n,6-n,12-n,12-n-tetraphenylchrysene-6,12-diamine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C2=CC(=C3C=CC=CC3=C2C=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 QZMRZMUXFCMRJU-UHFFFAOYSA-N 0.000 description 1
- OMIHGPLIXGGMJB-UHFFFAOYSA-N 7-oxabicyclo[4.1.0]hepta-1,3,5-triene Chemical class C1=CC=C2OC2=C1 OMIHGPLIXGGMJB-UHFFFAOYSA-N 0.000 description 1
- SZNIOXYCNCSUBC-UHFFFAOYSA-N 7-piperidin-1-ylchromen-2-one Chemical class C1=C2OC(=O)C=CC2=CC=C1N1CCCCC1 SZNIOXYCNCSUBC-UHFFFAOYSA-N 0.000 description 1
- YYBCFFUVEXWJIU-UHFFFAOYSA-N 8-N-benzo[a]anthracen-1-ylpyrene-1,8-diamine Chemical compound C1(=CC=CC2=CC=C3C=C4C=CC=CC4=CC3=C12)NC1=CC=C2C=CC3=CC=C(C4=CC=C1C2=C34)N YYBCFFUVEXWJIU-UHFFFAOYSA-N 0.000 description 1
- MQRGCMXCVJPWHI-UHFFFAOYSA-N 9,9-diphenylfluoren-2-amine Chemical compound C12=CC(N)=CC=C2C2=CC=CC=C2C1(C=1C=CC=CC=1)C1=CC=CC=C1 MQRGCMXCVJPWHI-UHFFFAOYSA-N 0.000 description 1
- CQLOSTJLLKKUQN-UHFFFAOYSA-N 9-(2-bromo-3-fluorophenyl)carbazole Chemical compound BrC1=C(C=CC=C1F)N1C2=CC=CC=C2C=2C=CC=CC1=2 CQLOSTJLLKKUQN-UHFFFAOYSA-N 0.000 description 1
- QBBKDOVWIISESV-UHFFFAOYSA-N 9-(2-bromo-3-phenoxyphenyl)carbazole Chemical compound BrC1=C(C=CC=C1OC1=CC=CC=C1)N1C2=CC=CC=C2C=2C=CC=CC12 QBBKDOVWIISESV-UHFFFAOYSA-N 0.000 description 1
- MZYDBGLUVPLRKR-UHFFFAOYSA-N 9-(3-carbazol-9-ylphenyl)carbazole Chemical compound C12=CC=CC=C2C2=CC=CC=C2N1C1=CC(N2C3=CC=CC=C3C3=CC=CC=C32)=CC=C1 MZYDBGLUVPLRKR-UHFFFAOYSA-N 0.000 description 1
- NSXJEEMTGWMJPY-UHFFFAOYSA-N 9-[3-(3-carbazol-9-ylphenyl)phenyl]carbazole Chemical group C12=CC=CC=C2C2=CC=CC=C2N1C1=CC(C=2C=CC=C(C=2)N2C3=CC=CC=C3C3=CC=CC=C32)=CC=C1 NSXJEEMTGWMJPY-UHFFFAOYSA-N 0.000 description 1
- LMTXHBDTVAIIQY-UHFFFAOYSA-N 9-n,10-n-bis(3-methylphenyl)-9-n,10-n-diphenylanthracene-9,10-diamine Chemical compound CC1=CC=CC(N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C(N(C=3C=CC=CC=3)C=3C=C(C)C=CC=3)=C3C=CC=CC3=2)=C1 LMTXHBDTVAIIQY-UHFFFAOYSA-N 0.000 description 1
- NEKCGUVVHQZBGZ-UHFFFAOYSA-N 9-n,10-n-bis(4-ethylphenyl)-9-n,10-n-diphenylanthracene-9,10-diamine Chemical compound C1=CC(CC)=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC=CC=2)C=2C=CC(CC)=CC=2)=C2C=CC=CC2=1)C1=CC=CC=C1 NEKCGUVVHQZBGZ-UHFFFAOYSA-N 0.000 description 1
- XDGZJXIRKASDIR-UHFFFAOYSA-N 9-n,10-n-bis(4-methylphenyl)-9-n,10-n-bis(4-propan-2-ylphenyl)anthracene-9,10-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC(C)=CC=2)C=2C=CC(=CC=2)C(C)C)=C2C=CC=CC2=1)C1=CC=C(C)C=C1 XDGZJXIRKASDIR-UHFFFAOYSA-N 0.000 description 1
- HTJPPQKJCPTAED-UHFFFAOYSA-N 9-n,10-n-bis(4-methylphenyl)-9-n,10-n-diphenylanthracene-9,10-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC=CC=2)C=2C=CC(C)=CC=2)=C2C=CC=CC2=1)C1=CC=CC=C1 HTJPPQKJCPTAED-UHFFFAOYSA-N 0.000 description 1
- CZBKCKYVTCQGGV-UHFFFAOYSA-N 9-n,10-n-bis(4-tert-butylphenyl)-9-n,10-n-diphenylanthracene-9,10-diamine Chemical compound C1=CC(C(C)(C)C)=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC=CC=2)C=2C=CC(=CC=2)C(C)(C)C)=C2C=CC=CC2=1)C1=CC=CC=C1 CZBKCKYVTCQGGV-UHFFFAOYSA-N 0.000 description 1
- ANWJEKBFPXUTHF-UHFFFAOYSA-N 9-n,9-n,10-n,10-n-tetrakis(3-methylphenyl)anthracene-9,10-diamine Chemical compound CC1=CC=CC(N(C=2C=C(C)C=CC=2)C=2C3=CC=CC=C3C(N(C=3C=C(C)C=CC=3)C=3C=C(C)C=CC=3)=C3C=CC=CC3=2)=C1 ANWJEKBFPXUTHF-UHFFFAOYSA-N 0.000 description 1
- FWXNJWAXBVMBGL-UHFFFAOYSA-N 9-n,9-n,10-n,10-n-tetrakis(4-methylphenyl)anthracene-9,10-diamine Chemical compound C1=CC(C)=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC(C)=CC=2)C=2C=CC(C)=CC=2)=C2C=CC=CC2=1)C1=CC=C(C)C=C1 FWXNJWAXBVMBGL-UHFFFAOYSA-N 0.000 description 1
- PLONQNQFKOWLGH-UHFFFAOYSA-N 9-n,9-n,10-n,10-n-tetrakis(4-propan-2-ylphenyl)anthracene-9,10-diamine Chemical compound C1=CC(C(C)C)=CC=C1N(C=1C2=CC=CC=C2C(N(C=2C=CC(=CC=2)C(C)C)C=2C=CC(=CC=2)C(C)C)=C2C=CC=CC2=1)C1=CC=C(C(C)C)C=C1 PLONQNQFKOWLGH-UHFFFAOYSA-N 0.000 description 1
- VIJYEGDOKCKUOL-UHFFFAOYSA-N 9-phenylcarbazole Chemical compound C1=CC=CC=C1N1C2=CC=CC=C2C2=CC=CC=C21 VIJYEGDOKCKUOL-UHFFFAOYSA-N 0.000 description 1
- PQJUJGAVDBINPI-UHFFFAOYSA-N 9H-thioxanthene Chemical group C1=CC=C2CC3=CC=CC=C3SC2=C1 PQJUJGAVDBINPI-UHFFFAOYSA-N 0.000 description 1
- 229910001316 Ag alloy Inorganic materials 0.000 description 1
- 229910001148 Al-Li alloy Inorganic materials 0.000 description 1
- ROFVEXUMMXZLPA-UHFFFAOYSA-N Bipyridyl Chemical class N1=CC=CC=C1C1=CC=CC=N1 ROFVEXUMMXZLPA-UHFFFAOYSA-N 0.000 description 1
- 238000006443 Buchwald-Hartwig cross coupling reaction Methods 0.000 description 1
- ALJVGGQTKYIEOV-UHFFFAOYSA-N C(#N)N1C=2C=3N=C(C=NC3C3=NC(=C(N=C3C2N=C(C1C#N)C#N)C#N)C#N)C#N Chemical compound C(#N)N1C=2C=3N=C(C=NC3C3=NC(=C(N=C3C2N=C(C1C#N)C#N)C#N)C#N)C#N ALJVGGQTKYIEOV-UHFFFAOYSA-N 0.000 description 1
- BMGZCNWIXVSMSZ-UHFFFAOYSA-N C(C(C1)C2)C(C3)C1CC23c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5ccccc45)c2c-3c1 Chemical compound C(C(C1)C2)C(C3)C1CC23c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5ccccc45)c2c-3c1 BMGZCNWIXVSMSZ-UHFFFAOYSA-N 0.000 description 1
- XONSNNMYLRGGRO-UHFFFAOYSA-N C(C(CC(C1)C2)C3)C1CC23c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c(cccc2)c2cc1 Chemical compound C(C(CC(C1)C2)C3)C1CC23c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c(cccc2)c2cc1 XONSNNMYLRGGRO-UHFFFAOYSA-N 0.000 description 1
- DNROZKISRZWCSO-UHFFFAOYSA-N C(C(CC(C1)C2)C3)C1CC23c(cccc1c2cccc3c22)c1[n]2-c1cccc2c1B3c1c(cccc3)c3ccc1O2 Chemical compound C(C(CC(C1)C2)C3)C1CC23c(cccc1c2cccc3c22)c1[n]2-c1cccc2c1B3c1c(cccc3)c3ccc1O2 DNROZKISRZWCSO-UHFFFAOYSA-N 0.000 description 1
- QWNGVSUNUWCCLK-UHFFFAOYSA-N C(C(CC(C1)C2)C3)C1CC23c1ccc(c2cccc3c2[n]2-c4cccc5c4B3c3c(cccc4)c4ccc3O5)c2c1 Chemical compound C(C(CC(C1)C2)C3)C1CC23c1ccc(c2cccc3c2[n]2-c4cccc5c4B3c3c(cccc4)c4ccc3O5)c2c1 QWNGVSUNUWCCLK-UHFFFAOYSA-N 0.000 description 1
- ULFHRJKZTGVEIY-UHFFFAOYSA-N C(C)(C)(C)C1=CC=C(C=C1)C1(CC(=CC(=C1)N1C2=CC=CC=C2C=2C=CC=CC12)N(C1=CC=C(C=C1)C(C)(C)C)C1=CC=C(C=C1)C(C)(C)C)NC1=CC=C(C=C1)C(C)(C)C Chemical compound C(C)(C)(C)C1=CC=C(C=C1)C1(CC(=CC(=C1)N1C2=CC=CC=C2C=2C=CC=CC12)N(C1=CC=C(C=C1)C(C)(C)C)C1=CC=C(C=C1)C(C)(C)C)NC1=CC=C(C=C1)C(C)(C)C ULFHRJKZTGVEIY-UHFFFAOYSA-N 0.000 description 1
- YVQRJRZIOJVJHA-UHFFFAOYSA-N C(C12)=C=CC=C1c(cccc13)c1N2c1cc(-c2ccccc2)cc2c1B3c(c1ccccc1cc1)c1O2 Chemical compound C(C12)=C=CC=C1c(cccc13)c1N2c1cc(-c2ccccc2)cc2c1B3c(c1ccccc1cc1)c1O2 YVQRJRZIOJVJHA-UHFFFAOYSA-N 0.000 description 1
- WFKDDTXMRZNFOX-UHFFFAOYSA-N C(C1CC2C3)C(C4)C12C34c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c5ccccc5cc2)c3c-4c1 Chemical compound C(C1CC2C3)C(C4)C12C34c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c5ccccc5cc2)c3c-4c1 WFKDDTXMRZNFOX-UHFFFAOYSA-N 0.000 description 1
- BYKDZWCUXAYBJQ-UHFFFAOYSA-N C(Cc(cc12)cc(c3cc(C4(CC(C5)C6)CC6CC5C4)ccc33)c1[n]3-c1cccc3c1B2c1c(cccc2)c2ccc1O3)C1CC(CCC2)CC2C1 Chemical compound C(Cc(cc12)cc(c3cc(C4(CC(C5)C6)CC6CC5C4)ccc33)c1[n]3-c1cccc3c1B2c1c(cccc2)c2ccc1O3)C1CC(CCC2)CC2C1 BYKDZWCUXAYBJQ-UHFFFAOYSA-N 0.000 description 1
- MLCZWYAWUXNMHF-RQQDWCQRSA-N C/C=C\C=C(/C1I)\c2cccc3c2N1c1cccc2c1B3c(cccc1)c1N2c1ccccc1 Chemical compound C/C=C\C=C(/C1I)\c2cccc3c2N1c1cccc2c1B3c(cccc1)c1N2c1ccccc1 MLCZWYAWUXNMHF-RQQDWCQRSA-N 0.000 description 1
- RFODSJHGQAHARP-UHFFFAOYSA-N C1(=CC=CC=C1)N(C1=CC=C(C=C1)C=1C2=CC=CC=C2C(=C2C=CC=CC12)C1=CC=C(C=C1)N(C1=CC=CC=C1)C1=CC=CC=C1)C1=CC=CC=C1.C1(CCCCC1)C1=CC2=C(C3=CC=C(C=C3C(=C2C=C1)N(C1=CC=C(C=C1)C(C)(C)C)C1=CC=C(C=C1)C(C)C)C1CCCCC1)N(C1=CC=C(C=C1)C(C)(C)C)C1=CC=C(C=C1)C(C)C Chemical compound C1(=CC=CC=C1)N(C1=CC=C(C=C1)C=1C2=CC=CC=C2C(=C2C=CC=CC12)C1=CC=C(C=C1)N(C1=CC=CC=C1)C1=CC=CC=C1)C1=CC=CC=C1.C1(CCCCC1)C1=CC2=C(C3=CC=C(C=C3C(=C2C=C1)N(C1=CC=C(C=C1)C(C)(C)C)C1=CC=C(C=C1)C(C)C)C1CCCCC1)N(C1=CC=C(C=C1)C(C)(C)C)C1=CC=C(C=C1)C(C)C RFODSJHGQAHARP-UHFFFAOYSA-N 0.000 description 1
- KKDLFGWWCKMRSB-UHFFFAOYSA-N C1(=CC=CC=C1)N(C1=CC=CC=C1)C1=CC=CC2=CC3=CC=CC=C3C(=C12)C1=CC2=CC=C(C=C2C=C1)N(C1=CC=CC=C1)C1=CC=CC=C1 Chemical compound C1(=CC=CC=C1)N(C1=CC=CC=C1)C1=CC=CC2=CC3=CC=CC=C3C(=C12)C1=CC2=CC=C(C=C2C=C1)N(C1=CC=CC=C1)C1=CC=CC=C1 KKDLFGWWCKMRSB-UHFFFAOYSA-N 0.000 description 1
- WHWJQGZWABLZFC-UHFFFAOYSA-N C1c(cccc2)c2N(c(cc2)cc(c3cc(N4c5ccccc5Cc5c4cccc5)cc(B4c(c(N5c6ccccc6)c6)ccc6-[n]6c7ccccc7c7c6cccc7)c33)c2[n]3-c2c4c5ccc2)c2c1cccc2 Chemical compound C1c(cccc2)c2N(c(cc2)cc(c3cc(N4c5ccccc5Cc5c4cccc5)cc(B4c(c(N5c6ccccc6)c6)ccc6-[n]6c7ccccc7c7c6cccc7)c33)c2[n]3-c2c4c5ccc2)c2c1cccc2 WHWJQGZWABLZFC-UHFFFAOYSA-N 0.000 description 1
- JFBCSXLSOADKMN-UHFFFAOYSA-N CC(C)(C)c(cc1)cc(B2c3c4cc(C)cc3-[n]3c5c2cccc5c2c3cccc2)c1N4c(c(F)ccc1)c1F Chemical compound CC(C)(C)c(cc1)cc(B2c3c4cc(C)cc3-[n]3c5c2cccc5c2c3cccc2)c1N4c(c(F)ccc1)c1F JFBCSXLSOADKMN-UHFFFAOYSA-N 0.000 description 1
- CZACQVOWPRVRCR-UHFFFAOYSA-N CC(C)(C)c1cc(N(c2ccccc2)c2c(B3c4c5[n]-6c7ccccc7c5ccc4)cccc2)c3c-6c1 Chemical compound CC(C)(C)c1cc(N(c2ccccc2)c2c(B3c4c5[n]-6c7ccccc7c5ccc4)cccc2)c3c-6c1 CZACQVOWPRVRCR-UHFFFAOYSA-N 0.000 description 1
- JKRSZFTUHFBCKO-UHFFFAOYSA-N CC(C)(C)c1cccc(c2c3c4ccc2)c1[n]3-c1cccc2c1B4c1c(cccc3)c3ccc1O2 Chemical compound CC(C)(C)c1cccc(c2c3c4ccc2)c1[n]3-c1cccc2c1B4c1c(cccc3)c3ccc1O2 JKRSZFTUHFBCKO-UHFFFAOYSA-N 0.000 description 1
- YAHDZFMGQFACKK-UHFFFAOYSA-N CC(C)(CC=C1c2ccccc22)C(B3c4c(C)cc(C)cc4N4c5ccccc5)=C1N2c1c3c4ccc1 Chemical compound CC(C)(CC=C1c2ccccc22)C(B3c4c(C)cc(C)cc4N4c5ccccc5)=C1N2c1c3c4ccc1 YAHDZFMGQFACKK-UHFFFAOYSA-N 0.000 description 1
- KOYVFOQQYXCAJY-UHFFFAOYSA-N CC(C)(c(c-1c2)cc(B3c4c5[n]-6c(cccc7)c7c5ccc4)c2Oc2c3c-6ccc2)c2c-1c(cccc1)c1c(N(c1ccccc1)c(cc1)ccc1-c1ccccc1)c2 Chemical compound CC(C)(c(c-1c2)cc(B3c4c5[n]-6c(cccc7)c7c5ccc4)c2Oc2c3c-6ccc2)c2c-1c(cccc1)c1c(N(c1ccccc1)c(cc1)ccc1-c1ccccc1)c2 KOYVFOQQYXCAJY-UHFFFAOYSA-N 0.000 description 1
- GPKCWGYBBFNDAW-UHFFFAOYSA-N CC(C)(c(c-1c2)cc(B3c4c5[n]-6c7ccccc7c5ccc4)c2Oc2c3c-6ccc2)c2c-1c(cccc1)c1c(N(c1ccccc1)c1cc(cccc3)c3cc1)c2 Chemical compound CC(C)(c(c-1c2)cc(B3c4c5[n]-6c7ccccc7c5ccc4)c2Oc2c3c-6ccc2)c2c-1c(cccc1)c1c(N(c1ccccc1)c1cc(cccc3)c3cc1)c2 GPKCWGYBBFNDAW-UHFFFAOYSA-N 0.000 description 1
- RPXPUAAMJQJKTM-UHFFFAOYSA-N CC(C)(c(cc1B2c3c4[n]-5c(cccc6)c6c4ccc3)c-3cc1Oc1c2c-5cc(C)c1)c1c-3c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 Chemical compound CC(C)(c(cc1B2c3c4[n]-5c(cccc6)c6c4ccc3)c-3cc1Oc1c2c-5cc(C)c1)c1c-3c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 RPXPUAAMJQJKTM-UHFFFAOYSA-N 0.000 description 1
- DPHCNMBZTFJEOK-UHFFFAOYSA-N CC(C)(c(cc1B2c3cccc4c3[n]-3c5ccccc45)c-4cc1Oc1c2c-3cc(C2(CC(C3)C5)CC5CC3C2)c1)c1c-4c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 Chemical compound CC(C)(c(cc1B2c3cccc4c3[n]-3c5ccccc45)c-4cc1Oc1c2c-3cc(C2(CC(C3)C5)CC5CC3C2)c1)c1c-4c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 DPHCNMBZTFJEOK-UHFFFAOYSA-N 0.000 description 1
- UYEPYFJFELGLKH-UHFFFAOYSA-N CC(C)(c1c-2cc3Oc4cc(-c5cccc6ccccc56)cc(-[n]5c6c7cccc6c6ccccc56)c4B7c3c1)c1c-2c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 Chemical compound CC(C)(c1c-2cc3Oc4cc(-c5cccc6ccccc56)cc(-[n]5c6c7cccc6c6ccccc56)c4B7c3c1)c1c-2c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 UYEPYFJFELGLKH-UHFFFAOYSA-N 0.000 description 1
- VUVTUNDQQWNGGC-UHFFFAOYSA-N CC(C)(c1c-2cc3Oc4cc(-c5ccccc5)cc(-[n]5c6c7cccc6c6ccccc56)c4B7c3c1)c1c-2c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 Chemical compound CC(C)(c1c-2cc3Oc4cc(-c5ccccc5)cc(-[n]5c6c7cccc6c6ccccc56)c4B7c3c1)c1c-2c(cccc2)c2c(N(c2ccccc2)c2ccccc2)c1 VUVTUNDQQWNGGC-UHFFFAOYSA-N 0.000 description 1
- GNYWKHHQSWVOOV-UHFFFAOYSA-N CC(C)(c1c-2cc3Oc4cccc(-[n]5c6c7cccc6c6ccccc56)c4B7c3c1)c1c-2c(cccc2)c2c(N(c(cc2)ccc2-c2ccccc2)c(cc2)ccc2-c2ccccc2)c1 Chemical compound CC(C)(c1c-2cc3Oc4cccc(-[n]5c6c7cccc6c6ccccc56)c4B7c3c1)c1c-2c(cccc2)c2c(N(c(cc2)ccc2-c2ccccc2)c(cc2)ccc2-c2ccccc2)c1 GNYWKHHQSWVOOV-UHFFFAOYSA-N 0.000 description 1
- CTZCPSMYSRPMIV-UHFFFAOYSA-N CC(C1)C=Cc(c2ccccc22)c1[n]2-c(cc1c2cc(-[n]3c4ccccc4c4c3cccc4)ccc22)cc(B3c4ccccc4O4)c1[n]2-c1c3c4cc(C)c1 Chemical compound CC(C1)C=Cc(c2ccccc22)c1[n]2-c(cc1c2cc(-[n]3c4ccccc4c4c3cccc4)ccc22)cc(B3c4ccccc4O4)c1[n]2-c1c3c4cc(C)c1 CTZCPSMYSRPMIV-UHFFFAOYSA-N 0.000 description 1
- SMNUKEMGECLTIQ-UHFFFAOYSA-N CC(CC=C1c2c(C)cccc2)C2=C1Nc1cccc3c1B2c(c(C)cc(C)c1)c1N3c1ccccc1 Chemical compound CC(CC=C1c2c(C)cccc2)C2=C1Nc1cccc3c1B2c(c(C)cc(C)c1)c1N3c1ccccc1 SMNUKEMGECLTIQ-UHFFFAOYSA-N 0.000 description 1
- IOUKGGNQOCJTEX-UHFFFAOYSA-N CC1(C)c(cc(cc2)N(c3ccccc3)c3ccccc3)c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7cc(C)c3)c4cc12 Chemical compound CC1(C)c(cc(cc2)N(c3ccccc3)c3ccccc3)c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7cc(C)c3)c4cc12 IOUKGGNQOCJTEX-UHFFFAOYSA-N 0.000 description 1
- JEJINSTWHCPIFB-UHFFFAOYSA-N CC1(C)c2cc(N(c3c(C)cc(C)cc3C)c3c(C)cc(C)cc3C)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7ccc3)c4cc12 Chemical compound CC1(C)c2cc(N(c3c(C)cc(C)cc3C)c3c(C)cc(C)cc3C)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7ccc3)c4cc12 JEJINSTWHCPIFB-UHFFFAOYSA-N 0.000 description 1
- CEXOXEJEGXHSQE-UHFFFAOYSA-N CC1(C)c2cc(N(c3cc(C)cc(C)c3)c3cc(C)cc(C)c3)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c8ccccc8c6ccc5)c-7ccc3)c4cc12 Chemical compound CC1(C)c2cc(N(c3cc(C)cc(C)c3)c3cc(C)cc(C)c3)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c8ccccc8c6ccc5)c-7ccc3)c4cc12 CEXOXEJEGXHSQE-UHFFFAOYSA-N 0.000 description 1
- ZOAADHHWNLNWMO-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccc(C)cc3)c3ccc(C)cc3)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7ccc3)c4cc12 Chemical compound CC1(C)c2cc(N(c3ccc(C)cc3)c3ccc(C)cc3)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7ccc3)c4cc12 ZOAADHHWNLNWMO-UHFFFAOYSA-N 0.000 description 1
- PMWACYGBCCCBCF-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3cccc4c3cccc4)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7ccc3)c4cc12 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3cccc4c3cccc4)c(cccc3)c3c2-c2cc(Oc3c(B4c5c6[n]-7c(cccc8)c8c6ccc5)c-7ccc3)c4cc12 PMWACYGBCCCBCF-UHFFFAOYSA-N 0.000 description 1
- XVXYLQCZWZBDPL-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)c(cccc3)c3c2-c2c1cc(B(c1cccc(c3c4cccc3)c1[n]4-c1cc(-c3cc4ccccc4cc3)c3)c1c3O1)c1c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)c(cccc3)c3c2-c2c1cc(B(c1cccc(c3c4cccc3)c1[n]4-c1cc(-c3cc4ccccc4cc3)c3)c1c3O1)c1c2 XVXYLQCZWZBDPL-UHFFFAOYSA-N 0.000 description 1
- PKNOLYNWQKTYEQ-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)c(cccc3)c3c2-c2c1cc(B1c(c(O3)cc(N(c4ccccc4)c4ccccc4)c4)c4-[n]4c5c1cccc5c1c4cccc1)c3c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)c(cccc3)c3c2-c2c1cc(B1c(c(O3)cc(N(c4ccccc4)c4ccccc4)c4)c4-[n]4c5c1cccc5c1c4cccc1)c3c2 PKNOLYNWQKTYEQ-UHFFFAOYSA-N 0.000 description 1
- SRTLZOCDYGXKMR-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3c4cccc3)c1[n]4-c1cc(C3(CC(C4)C5)CC5CC4C3)c3)c1c3O1)c1c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3c4cccc3)c1[n]4-c1cc(C3(CC(C4)C5)CC5CC4C3)c3)c1c3O1)c1c2 SRTLZOCDYGXKMR-UHFFFAOYSA-N 0.000 description 1
- MUQHETITHZPMHP-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3ccccc33)c1[n]3-c1cc(-c3cc(cccc4)c4cc3)c3)c1c3O1)c1c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3ccccc33)c1[n]3-c1cc(-c3cc(cccc4)c4cc3)c3)c1c3O1)c1c2 MUQHETITHZPMHP-UHFFFAOYSA-N 0.000 description 1
- FUUTUQMQOGNLFM-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3ccccc33)c1[n]3-c1cc(-c3ccccc3)c3)c1c3O1)c1c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3ccccc33)c1[n]3-c1cc(-c3ccccc3)c3)c1c3O1)c1c2 FUUTUQMQOGNLFM-UHFFFAOYSA-N 0.000 description 1
- CPUKDPIVMOPHQO-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3ccccc33)c1[n]3-c1cc(N(c3ccccc3)c3ccccc3)c3)c1c3O1)c1c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B(c1cccc(c3ccccc33)c1[n]3-c1cc(N(c3ccccc3)c3ccccc3)c3)c1c3O1)c1c2 CPUKDPIVMOPHQO-UHFFFAOYSA-N 0.000 description 1
- NEGALUGYYFBXST-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B1c(c(O3)cc(-[n]4c(cccc5)c5c5c4cccc5)c4)c4-[n]4c5c1cccc5c1ccccc41)c3c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B1c(c(O3)cc(-[n]4c(cccc5)c5c5c4cccc5)c4)c4-[n]4c5c1cccc5c1ccccc41)c3c2 NEGALUGYYFBXST-UHFFFAOYSA-N 0.000 description 1
- WHBOOOMVKAQTKF-UHFFFAOYSA-N CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B1c(c(O3)cc(-c4cccc5c4cccc5)c4)c4-[n]4c5c1cccc5c1c4cccc1)c3c2 Chemical compound CC1(C)c2cc(N(c3ccccc3)c3ccccc3)ccc2-c2c1cc(B1c(c(O3)cc(-c4cccc5c4cccc5)c4)c4-[n]4c5c1cccc5c1c4cccc1)c3c2 WHBOOOMVKAQTKF-UHFFFAOYSA-N 0.000 description 1
- OSJXEYQDXIEOMX-UHFFFAOYSA-N CC1C=CC(N2c3ccccc3B(c3c(C)cc4)C5=C2CCC=C5[n]2c3c4c3ccc(C)cc23)=CC1 Chemical compound CC1C=CC(N2c3ccccc3B(c3c(C)cc4)C5=C2CCC=C5[n]2c3c4c3ccc(C)cc23)=CC1 OSJXEYQDXIEOMX-UHFFFAOYSA-N 0.000 description 1
- HFTMOLAYFUWUBD-UHFFFAOYSA-N CCCC(C)c1cc(cccc2)c2c2c1Oc1cccc-3c1B2c1c2[n]-3c3ccccc3c2ccc1 Chemical compound CCCC(C)c1cc(cccc2)c2c2c1Oc1cccc-3c1B2c1c2[n]-3c3ccccc3c2ccc1 HFTMOLAYFUWUBD-UHFFFAOYSA-N 0.000 description 1
- WCTDZOAZKKZHBY-UHFFFAOYSA-N CCCC(CC)c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 Chemical compound CCCC(CC)c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 WCTDZOAZKKZHBY-UHFFFAOYSA-N 0.000 description 1
- JQBPSXAAXUWECL-UHFFFAOYSA-N CCCCCCC.[B] Chemical compound CCCCCCC.[B] JQBPSXAAXUWECL-UHFFFAOYSA-N 0.000 description 1
- BFLNPGGFYVQETR-UUWRZZSWSA-N CCCC[C@@H](C)c(cc1)cc(c2cc(C)cc(B3c(c(N4c5ccccc5)c5)c(C)cc5N(c5ccccc5)c5ccccc5)c22)c1[n]2-c1c3c4ccc1 Chemical compound CCCC[C@@H](C)c(cc1)cc(c2cc(C)cc(B3c(c(N4c5ccccc5)c5)c(C)cc5N(c5ccccc5)c5ccccc5)c22)c1[n]2-c1c3c4ccc1 BFLNPGGFYVQETR-UUWRZZSWSA-N 0.000 description 1
- ISBPTTOOUGPJKT-UHFFFAOYSA-N CCCCc1ccc(B(c2cccc(c3ccccc33)c2[n]3-c2cc(N(c3ccccc3)c3ccccc3)c3)c2c3N2c3ccccc3)c2c1 Chemical compound CCCCc1ccc(B(c2cccc(c3ccccc33)c2[n]3-c2cc(N(c3ccccc3)c3ccccc3)c3)c2c3N2c3ccccc3)c2c1 ISBPTTOOUGPJKT-UHFFFAOYSA-N 0.000 description 1
- SSETVFZNFGOFEO-UHFFFAOYSA-N Cc(cc1)cc(c2c3c4cc(C)c2)c1[n]3-c1cc(C)cc2c1S4c1ccccc1N2c(c(F)ccc1)c1F Chemical compound Cc(cc1)cc(c2c3c4cc(C)c2)c1[n]3-c1cc(C)cc2c1S4c1ccccc1N2c(c(F)ccc1)c1F SSETVFZNFGOFEO-UHFFFAOYSA-N 0.000 description 1
- ONHGXNNPBBHBDD-UHFFFAOYSA-N Cc(cc1)cc(c2cc(C)cc3c22)c1[n]2-c1cc(C)cc2c1B3c1ccccc1O2 Chemical compound Cc(cc1)cc(c2cc(C)cc3c22)c1[n]2-c1cc(C)cc2c1B3c1ccccc1O2 ONHGXNNPBBHBDD-UHFFFAOYSA-N 0.000 description 1
- KWQBUWVYZVMHNN-UHFFFAOYSA-N Cc(cc1)cc(c2cc(C)cc3c22)c1[n]2-c1cccc2c1B3c(c(C)cc(-[n]1c3ccccc3c3c1cccc3)c1)c1O2 Chemical compound Cc(cc1)cc(c2cc(C)cc3c22)c1[n]2-c1cccc2c1B3c(c(C)cc(-[n]1c3ccccc3c3c1cccc3)c1)c1O2 KWQBUWVYZVMHNN-UHFFFAOYSA-N 0.000 description 1
- KEWWYQFTBQVQGP-UHFFFAOYSA-N Cc(cc1)cc(c2cc(C)cc3c22)c1[n]2-c1cccc2c1B3c(cccc1)c1N2c(c(F)ccc1)c1F Chemical compound Cc(cc1)cc(c2cc(C)cc3c22)c1[n]2-c1cccc2c1B3c(cccc1)c1N2c(c(F)ccc1)c1F KEWWYQFTBQVQGP-UHFFFAOYSA-N 0.000 description 1
- DZIGXHSXOMMWNI-UHFFFAOYSA-N Cc(cc1)cc2c1c(cccc13)c1[n]2-c1cccc2c1B3c(c(cccc1)c1cc1)c1O2 Chemical compound Cc(cc1)cc2c1c(cccc13)c1[n]2-c1cccc2c1B3c(c(cccc1)c1cc1)c1O2 DZIGXHSXOMMWNI-UHFFFAOYSA-N 0.000 description 1
- CBQIFYRNDGIKCB-UHFFFAOYSA-N Cc(cc1)cc2c1c1ccc(C)c3c1[n]2-c1cccc2c1B3c1c(C)cc(C)cc1N2c1ccccc1 Chemical compound Cc(cc1)cc2c1c1ccc(C)c3c1[n]2-c1cccc2c1B3c1c(C)cc(C)cc1N2c1ccccc1 CBQIFYRNDGIKCB-UHFFFAOYSA-N 0.000 description 1
- XSSVOXWWPGMNMN-UHFFFAOYSA-N Cc(cc1)cc2c1c1ccc(C)c3c1[n]2-c1cccc2c1B3c1c(C)cccc1N2c1ccccc1 Chemical compound Cc(cc1)cc2c1c1ccc(C)c3c1[n]2-c1cccc2c1B3c1c(C)cccc1N2c1ccccc1 XSSVOXWWPGMNMN-UHFFFAOYSA-N 0.000 description 1
- CHLICZRVGGXEOD-UHFFFAOYSA-N Cc(cc1)ccc1OC Chemical compound Cc(cc1)ccc1OC CHLICZRVGGXEOD-UHFFFAOYSA-N 0.000 description 1
- UKWRPGBTNHZUSK-UHFFFAOYSA-N Cc(cc1-[n]2c(c3ccc4)c4c4ccccc24)cc2c1S3c1ccccc1N2c1ccccc1 Chemical compound Cc(cc1-[n]2c(c3ccc4)c4c4ccccc24)cc2c1S3c1ccccc1N2c1ccccc1 UKWRPGBTNHZUSK-UHFFFAOYSA-N 0.000 description 1
- HGIWSAYXOWVAGM-UHFFFAOYSA-N Cc(cc1B2c3c4cc(C)cc3-[n]3c5c2cccc5c2c3cccc2)ccc1N4c(c(F)ccc1)c1F Chemical compound Cc(cc1B2c3c4cc(C)cc3-[n]3c5c2cccc5c2c3cccc2)ccc1N4c(c(F)ccc1)c1F HGIWSAYXOWVAGM-UHFFFAOYSA-N 0.000 description 1
- OKYFVMRGXNUKMC-UHFFFAOYSA-N Cc(cc1C)cc(C)c1-c1cc(N(c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c(c(F)ccc4)c4F)c2c-3c1 Chemical compound Cc(cc1C)cc(C)c1-c1cc(N(c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c(c(F)ccc4)c4F)c2c-3c1 OKYFVMRGXNUKMC-UHFFFAOYSA-N 0.000 description 1
- NNVKEOMPDSKFGZ-UHFFFAOYSA-N Cc(cc1C)cc(C)c1OC Chemical compound Cc(cc1C)cc(C)c1OC NNVKEOMPDSKFGZ-UHFFFAOYSA-N 0.000 description 1
- PYSCNVILXPRODO-UHFFFAOYSA-N Cc(cc1c2c3c(B4c(c5ccccc5cc5)c5O5)cc(C)c2)ccc1[n]3-c1c4c5ccc1 Chemical compound Cc(cc1c2c3c(B4c(c5ccccc5cc5)c5O5)cc(C)c2)ccc1[n]3-c1c4c5ccc1 PYSCNVILXPRODO-UHFFFAOYSA-N 0.000 description 1
- WURYGLFSBVKBSW-UHFFFAOYSA-N Cc(cc1c2cc(C)cc3c22)ccc1[n]2-c1cccc2c1B3c(c(C)cc(N(c1ccccc1)c1ccccc1)c1)c1N2c1ccccc1 Chemical compound Cc(cc1c2cc(C)cc3c22)ccc1[n]2-c1cccc2c1B3c(c(C)cc(N(c1ccccc1)c1ccccc1)c1)c1N2c1ccccc1 WURYGLFSBVKBSW-UHFFFAOYSA-N 0.000 description 1
- ANUYCYCBKZTRGQ-UHFFFAOYSA-N Cc(ccc-1c2B3c4cccc5c4[n]-1c1c5cccc1)c2Oc1c3c2ccccc2cc1 Chemical compound Cc(ccc-1c2B3c4cccc5c4[n]-1c1c5cccc1)c2Oc1c3c2ccccc2cc1 ANUYCYCBKZTRGQ-UHFFFAOYSA-N 0.000 description 1
- DTFKRVXLBCAIOZ-UHFFFAOYSA-N Cc(cccc1)c1OC Chemical compound Cc(cccc1)c1OC DTFKRVXLBCAIOZ-UHFFFAOYSA-N 0.000 description 1
- XDVAFEFUZPNNSE-UHFFFAOYSA-N Cc(ccnc1)c1-c(cc1)ccc1-c1c(ccc(-c2ccccc2)c2)c2c(-c(cc2)ccc2-c2cnccc2C)c2ccccc12 Chemical compound Cc(ccnc1)c1-c(cc1)ccc1-c1c(ccc(-c2ccccc2)c2)c2c(-c(cc2)ccc2-c2cnccc2C)c2ccccc12 XDVAFEFUZPNNSE-UHFFFAOYSA-N 0.000 description 1
- AWFDONKSFABXDG-UHFFFAOYSA-N Cc1c(B(c(cc(cc2c3cc(-c4ccccc4)ccc33)-c4ccccc4)c2[n]3-c2ccc3)c2c3N2c3ccccc3)c2cc(N(c2ccccc2)c2ccccc2)c1 Chemical compound Cc1c(B(c(cc(cc2c3cc(-c4ccccc4)ccc33)-c4ccccc4)c2[n]3-c2ccc3)c2c3N2c3ccccc3)c2cc(N(c2ccccc2)c2ccccc2)c1 AWFDONKSFABXDG-UHFFFAOYSA-N 0.000 description 1
- CHHQEVVBVXRFRH-UHFFFAOYSA-N Cc1c(B(c(cc(cc2c3cc(-c4ccccc4)ccc33)-c4ccccc4)c2[n]3-c2ccc3)c2c3O2)c2cc(-[n]2c3ccccc3c3c2cccc3)c1 Chemical compound Cc1c(B(c(cc(cc2c3cc(-c4ccccc4)ccc33)-c4ccccc4)c2[n]3-c2ccc3)c2c3O2)c2cc(-[n]2c3ccccc3c3c2cccc3)c1 CHHQEVVBVXRFRH-UHFFFAOYSA-N 0.000 description 1
- ALDMITSTHNHNJG-UHFFFAOYSA-N Cc1c(B2c(c(N3c4ccccc4)ccc4)c4-[n](c(ccc(N(c4ccccc4)c4ccccc4)c4)c4c4c5)c4c2cc5N(c2ccccc2)c2ccccc2)c3cc(N(c2ccccc2)c2ccccc2)c1 Chemical compound Cc1c(B2c(c(N3c4ccccc4)ccc4)c4-[n](c(ccc(N(c4ccccc4)c4ccccc4)c4)c4c4c5)c4c2cc5N(c2ccccc2)c2ccccc2)c3cc(N(c2ccccc2)c2ccccc2)c1 ALDMITSTHNHNJG-UHFFFAOYSA-N 0.000 description 1
- JFXDTMOCYOVABH-UHFFFAOYSA-N Cc1cc(-[n](c(c(c2c3)c4)ccc4N(c4c(C5)cccc4)c4c5cccc4)c2c(B2c4ccccc4O4)cc3N(c3ccccc3C3)c5c3cccc5)c2c4c1 Chemical compound Cc1cc(-[n](c(c(c2c3)c4)ccc4N(c4c(C5)cccc4)c4c5cccc4)c2c(B2c4ccccc4O4)cc3N(c3ccccc3C3)c5c3cccc5)c2c4c1 JFXDTMOCYOVABH-UHFFFAOYSA-N 0.000 description 1
- QDFMSAJQBRPMGK-UHFFFAOYSA-N Cc1cc(-[n]2c3ccccc3c3c2cccc3)cc(Oc2ccc3)c1B1c2c3-[n](c(ccc(N(c2ccccc2C2)c3c2cccc3)c2)c2c2c3)c2c1cc3N1c2ccccc2Cc2c1cccc2 Chemical compound Cc1cc(-[n]2c3ccccc3c3c2cccc3)cc(Oc2ccc3)c1B1c2c3-[n](c(ccc(N(c2ccccc2C2)c3c2cccc3)c2)c2c2c3)c2c1cc3N1c2ccccc2Cc2c1cccc2 QDFMSAJQBRPMGK-UHFFFAOYSA-N 0.000 description 1
- LEPCRAUKYPZCJE-UHFFFAOYSA-N Cc1cc(N(c2cc(C)cc(C)c2)c2c(B3c4cccc5c4[n]-4c6c5cccc6)c-4cc(N(c4cc(C)cc(C)c4)c4cc(C)cc(C)c4)c2)c3cc1 Chemical compound Cc1cc(N(c2cc(C)cc(C)c2)c2c(B3c4cccc5c4[n]-4c6c5cccc6)c-4cc(N(c4cc(C)cc(C)c4)c4cc(C)cc(C)c4)c2)c3cc1 LEPCRAUKYPZCJE-UHFFFAOYSA-N 0.000 description 1
- YGOIZCRASHKDAC-UHFFFAOYSA-N Cc1cc(N(c2cccc-3c2B2c4c5[n]-3c3ccccc3c5ccc4)c(c(F)ccc3)c3F)c2cc1 Chemical compound Cc1cc(N(c2cccc-3c2B2c4c5[n]-3c3ccccc3c5ccc4)c(c(F)ccc3)c3F)c2cc1 YGOIZCRASHKDAC-UHFFFAOYSA-N 0.000 description 1
- ZZQWZTJOHDGEFK-UHFFFAOYSA-N Cc1cc(N(c2ccccc2B2c3c4[n]-5c(cccc6)c6c4ccc3)c(c(F)ccc3)c3F)c2c-5c1 Chemical compound Cc1cc(N(c2ccccc2B2c3c4[n]-5c(cccc6)c6c4ccc3)c(c(F)ccc3)c3F)c2c-5c1 ZZQWZTJOHDGEFK-UHFFFAOYSA-N 0.000 description 1
- JCHJBEZBHANKGA-UHFFFAOYSA-N Cc1cc(OC)cc(C)c1 Chemical compound Cc1cc(OC)cc(C)c1 JCHJBEZBHANKGA-UHFFFAOYSA-N 0.000 description 1
- OSIGJGFTADMDOB-UHFFFAOYSA-N Cc1cc(OC)ccc1 Chemical compound Cc1cc(OC)ccc1 OSIGJGFTADMDOB-UHFFFAOYSA-N 0.000 description 1
- JDPZLZNBYXICEQ-UHFFFAOYSA-N Cc1cc(Oc2ccccc2B2c(cc(cc3c4c5)-c6ccccc6)c3[n]-3c4ccc5-c4ccccc4)c2c-3c1 Chemical compound Cc1cc(Oc2ccccc2B2c(cc(cc3c4c5)-c6ccccc6)c3[n]-3c4ccc5-c4ccccc4)c2c-3c1 JDPZLZNBYXICEQ-UHFFFAOYSA-N 0.000 description 1
- ZGPKEVWLJYYHKB-UHFFFAOYSA-N Cc1cc(cccc2)c2c2c1Oc1cccc-3c1S2c1cccc2c1[n]-3c1ccccc21 Chemical compound Cc1cc(cccc2)c2c2c1Oc1cccc-3c1S2c1cccc2c1[n]-3c1ccccc21 ZGPKEVWLJYYHKB-UHFFFAOYSA-N 0.000 description 1
- GOCRWCYBRUCSDM-UHFFFAOYSA-N Cc1ccc(B(c2cccc(c3ccccc33)c2[n]3-c2cc(N(c3ccccc3)c3ccccc3)c3)c2c3N2c3ccccc3)c2c1 Chemical compound Cc1ccc(B(c2cccc(c3ccccc33)c2[n]3-c2cc(N(c3ccccc3)c3ccccc3)c3)c2c3N2c3ccccc3)c2c1 GOCRWCYBRUCSDM-UHFFFAOYSA-N 0.000 description 1
- HADRKHNRKFKOEC-UHFFFAOYSA-N Cc1cccc(C)c1-c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c2c-3c1 Chemical compound Cc1cccc(C)c1-c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c2c-3c1 HADRKHNRKFKOEC-UHFFFAOYSA-N 0.000 description 1
- VMBWWXCEIONLDJ-UHFFFAOYSA-N Cc1cccc(C)c1-c1cc(N(c2ccccc2B2c3cccc4c3[n]-3c5ccccc45)c(c(F)ccc4)c4F)c2c-3c1 Chemical compound Cc1cccc(C)c1-c1cc(N(c2ccccc2B2c3cccc4c3[n]-3c5ccccc45)c(c(F)ccc4)c4F)c2c-3c1 VMBWWXCEIONLDJ-UHFFFAOYSA-N 0.000 description 1
- GFNZJAUVJCGWLW-UHFFFAOYSA-N Cc1cccc(C)c1OC Chemical compound Cc1cccc(C)c1OC GFNZJAUVJCGWLW-UHFFFAOYSA-N 0.000 description 1
- ZRGWTLQWKFPWOM-UHFFFAOYSA-N Cc1cccc(c2c3c4ccc2)c1[n]3-c1cccc2c1B4c1c(cccc3)c3ccc1O2 Chemical compound Cc1cccc(c2c3c4ccc2)c1[n]3-c1cccc2c1B4c1c(cccc3)c3ccc1O2 ZRGWTLQWKFPWOM-UHFFFAOYSA-N 0.000 description 1
- GYHQEKIIYOSPHZ-UHFFFAOYSA-N Cc1ccccc1-c1cc(N(c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c(c(F)ccc4)c4F)c2c-3c1 Chemical compound Cc1ccccc1-c1cc(N(c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c(c(F)ccc4)c4F)c2c-3c1 GYHQEKIIYOSPHZ-UHFFFAOYSA-N 0.000 description 1
- 241000284156 Clerodendrum quadriloculare Species 0.000 description 1
- 238000004057 DFT-B3LYP calculation Methods 0.000 description 1
- MYMOFIZGZYHOMD-UHFFFAOYSA-N Dioxygen Chemical compound O=O MYMOFIZGZYHOMD-UHFFFAOYSA-N 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- IFEXTMFXZORTLE-UHFFFAOYSA-N Fc(cccc1F)c1N(c1c(B2c3c4[n]-5c(cccc6)c6c4ccc3)c-5ccc1)c1c2ccc(N(c2ccccc2)c2ccccc2)c1 Chemical compound Fc(cccc1F)c1N(c1c(B2c3c4[n]-5c(cccc6)c6c4ccc3)c-5ccc1)c1c2ccc(N(c2ccccc2)c2ccccc2)c1 IFEXTMFXZORTLE-UHFFFAOYSA-N 0.000 description 1
- POJDCXQRGNSATN-UHFFFAOYSA-N Fc(cccc1F)c1N(c1c(B2c3c4[n]-5c6ccccc6c4ccc3)c-5ccc1)c1c2ccc(-[n]2c3ccccc3c3c2cccc3)c1 Chemical compound Fc(cccc1F)c1N(c1c(B2c3c4[n]-5c6ccccc6c4ccc3)c-5ccc1)c1c2ccc(-[n]2c3ccccc3c3c2cccc3)c1 POJDCXQRGNSATN-UHFFFAOYSA-N 0.000 description 1
- QDLRFIWPGNZJQF-UHFFFAOYSA-N Fc(cccc1F)c1N1c2cccc(-[n]3c4c5cccc4c4c3cccc4)c2B5c2c1ccc(-[n]1c3ccccc3c3ccccc13)c2 Chemical compound Fc(cccc1F)c1N1c2cccc(-[n]3c4c5cccc4c4c3cccc4)c2B5c2c1ccc(-[n]1c3ccccc3c3ccccc13)c2 QDLRFIWPGNZJQF-UHFFFAOYSA-N 0.000 description 1
- MHDPXGSMMXFRLP-UHFFFAOYSA-N Fc1cc(F)cc(N(c2ccccc2)c2cc(N(c3ccccc3B3c4cccc5c4[n]-4c6c5cccc6)c(c(F)ccc5)c5F)c3c-4c2)c1 Chemical compound Fc1cc(F)cc(N(c2ccccc2)c2cc(N(c3ccccc3B3c4cccc5c4[n]-4c6c5cccc6)c(c(F)ccc5)c5F)c3c-4c2)c1 MHDPXGSMMXFRLP-UHFFFAOYSA-N 0.000 description 1
- RLNJSFVRCUWPQL-UHFFFAOYSA-N Fc1cccc(F)c1N(c(cc1)c(B2c3c4[n]-5c6ccccc6c4ccc3)cc1N(c1ccccc1)c1ccccc1)c1c2c-5ccc1 Chemical compound Fc1cccc(F)c1N(c(cc1)c(B2c3c4[n]-5c6ccccc6c4ccc3)cc1N(c1ccccc1)c1ccccc1)c1c2c-5ccc1 RLNJSFVRCUWPQL-UHFFFAOYSA-N 0.000 description 1
- ZOGCTBYUDDHJKI-UHFFFAOYSA-N Fc1cccc(F)c1N(c1c(B2c3c4[n]-5c(cccc6)c6c4ccc3)c-5ccc1)c1c2ccc(-c2ccccc2)c1 Chemical compound Fc1cccc(F)c1N(c1c(B2c3c4[n]-5c(cccc6)c6c4ccc3)c-5ccc1)c1c2ccc(-c2ccccc2)c1 ZOGCTBYUDDHJKI-UHFFFAOYSA-N 0.000 description 1
- ILNOXZJPQSWPQO-UHFFFAOYSA-N Fc1cccc(F)c1N(c1c(B2c3c4[n]-5c6ccccc6c4ccc3)c-5ccc1)c1c2ccc(C2(CC(C3)C4)CC4CC3C2)c1 Chemical compound Fc1cccc(F)c1N(c1c(B2c3c4[n]-5c6ccccc6c4ccc3)c-5ccc1)c1c2ccc(C2(CC(C3)C4)CC4CC3C2)c1 ILNOXZJPQSWPQO-UHFFFAOYSA-N 0.000 description 1
- HQVTWXLAPLPNAL-UHFFFAOYSA-N Fc1cccc(F)c1N(c1ccc(C2(CC(C3)C4)CC4CC3C2)cc1B1c2c3[n]-4c(cccc5)c5c3ccc2)c2c1c-4ccc2 Chemical compound Fc1cccc(F)c1N(c1ccc(C2(CC(C3)C4)CC4CC3C2)cc1B1c2c3[n]-4c(cccc5)c5c3ccc2)c2c1c-4ccc2 HQVTWXLAPLPNAL-UHFFFAOYSA-N 0.000 description 1
- MXGKIOFKDBAFEK-UHFFFAOYSA-N Fc1cccc(F)c1N(c1ccccc1B1c2cc(-c3ccccc3)cc3c2[n]-2c(cc4)c3cc4-c3ccccc3)c3c1c-2ccc3 Chemical compound Fc1cccc(F)c1N(c1ccccc1B1c2cc(-c3ccccc3)cc3c2[n]-2c(cc4)c3cc4-c3ccccc3)c3c1c-2ccc3 MXGKIOFKDBAFEK-UHFFFAOYSA-N 0.000 description 1
- LPCTYCGDRPOCNN-UHFFFAOYSA-N Fc1cccc(F)c1N(c1ccccc1B1c2cccc3c2[n]-2c4ccccc34)c3c1c-2cc(-c1ccccc1)c3 Chemical compound Fc1cccc(F)c1N(c1ccccc1B1c2cccc3c2[n]-2c4ccccc34)c3c1c-2cc(-c1ccccc1)c3 LPCTYCGDRPOCNN-UHFFFAOYSA-N 0.000 description 1
- ITVJBTIPCJGRPV-UHFFFAOYSA-N Fc1cccc(F)c1N(c1ccccc1B1c2cccc3c2[n]-2c4ccccc34)c3c1c-2cc(C1(CC(C2)C4)CC4CC2C1)c3 Chemical compound Fc1cccc(F)c1N(c1ccccc1B1c2cccc3c2[n]-2c4ccccc34)c3c1c-2cc(C1(CC(C2)C4)CC4CC2C1)c3 ITVJBTIPCJGRPV-UHFFFAOYSA-N 0.000 description 1
- YSPXOFNNZJBVGV-UHFFFAOYSA-N Fc1cccc(F)c1N1c2cc(-[n]3c4ccccc4c4ccccc34)cc(-[n]3c4c5cccc4c4ccccc34)c2B5c2ccccc12 Chemical compound Fc1cccc(F)c1N1c2cc(-[n]3c4ccccc4c4ccccc34)cc(-[n]3c4c5cccc4c4ccccc34)c2B5c2ccccc12 YSPXOFNNZJBVGV-UHFFFAOYSA-N 0.000 description 1
- HELIKTOPZMOTAY-UHFFFAOYSA-N Fc1cccc(F)c1N1c2cccc(-[n]3c4c5cccc4c4c3cccc4)c2B5c2c1ccc(-c1ccccc1)c2 Chemical compound Fc1cccc(F)c1N1c2cccc(-[n]3c4c5cccc4c4c3cccc4)c2B5c2c1ccc(-c1ccccc1)c2 HELIKTOPZMOTAY-UHFFFAOYSA-N 0.000 description 1
- XDEUBLWCJNPHGW-UHFFFAOYSA-N Fc1cccc(F)c1N1c2cccc(-[n]3c4c5cccc4c4c3cccc4)c2B5c2c1cccc2 Chemical compound Fc1cccc(F)c1N1c2cccc(-[n]3c4c5cccc4c4c3cccc4)c2B5c2c1cccc2 XDEUBLWCJNPHGW-UHFFFAOYSA-N 0.000 description 1
- 239000013032 Hydrocarbon resin Substances 0.000 description 1
- 229910000846 In alloy Inorganic materials 0.000 description 1
- 229910021578 Iron(III) chloride Inorganic materials 0.000 description 1
- 229920000877 Melamine resin Polymers 0.000 description 1
- MOBHEYNBYVITIM-UHFFFAOYSA-N N,N-diphenyl-12-oxa-18-aza-1-boraoctacyclo[15.12.1.118,25.02,11.03,8.013,30.019,24.029,31]hentriaconta-2(11),3,5,7,9,13,15,17(30),19,21,23,25,27,29(31)-tetradecaen-9-amine Chemical compound C1(=CC=CC=C1)N(C=1C=C2OC=3C=CC=C4C3B(C2=C2C1C=CC=C2)C2=CC=CC=1C=3C=CC=CC3N4C21)C2=CC=CC=C2 MOBHEYNBYVITIM-UHFFFAOYSA-N 0.000 description 1
- ZCQWOFVYLHDMMC-UHFFFAOYSA-N Oxazole Chemical compound C1=COC=N1 ZCQWOFVYLHDMMC-UHFFFAOYSA-N 0.000 description 1
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 1
- 239000004952 Polyamide Substances 0.000 description 1
- 239000005062 Polybutadiene Substances 0.000 description 1
- 239000004721 Polyphenylene oxide Substances 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 229910052581 Si3N4 Inorganic materials 0.000 description 1
- 229910004298 SiO 2 Inorganic materials 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- XBDYBAVJXHJMNQ-UHFFFAOYSA-N Tetrahydroanthracene Natural products C1=CC=C2C=C(CCCC3)C3=CC2=C1 XBDYBAVJXHJMNQ-UHFFFAOYSA-N 0.000 description 1
- 229920001807 Urea-formaldehyde Polymers 0.000 description 1
- XTXRWKRVRITETP-UHFFFAOYSA-N Vinyl acetate Chemical compound CC(=O)OC=C XTXRWKRVRITETP-UHFFFAOYSA-N 0.000 description 1
- BZHJMEDXRYGGRV-UHFFFAOYSA-N Vinyl chloride Chemical compound ClC=C BZHJMEDXRYGGRV-UHFFFAOYSA-N 0.000 description 1
- HEDOCDOUMOZTKC-UHFFFAOYSA-N [10-(4-phenylphenyl)anthracen-9-yl]-bis(2,4,6-trimethylphenyl)borane Chemical compound CC1=CC(C)=CC(C)=C1B(C=1C2=CC=CC=C2C(C=2C=CC(=CC=2)C=2C=CC=CC=2)=C2C=CC=CC2=1)C1=C(C)C=C(C)C=C1C HEDOCDOUMOZTKC-UHFFFAOYSA-N 0.000 description 1
- PYQBNSSKFSDQOT-UHFFFAOYSA-K [Al+3].C(C)(C)(C)C=1C=C(C=C(C1)C(C)(C)C)[O-].C(C)(C)(C)C=1C=C(C=C(C1)C(C)(C)C)[O-].C(C)(C)(C)C=1C=C(C=C(C1)C(C)(C)C)[O-] Chemical compound [Al+3].C(C)(C)(C)C=1C=C(C=C(C1)C(C)(C)C)[O-].C(C)(C)(C)C=1C=C(C=C(C1)C(C)(C)C)[O-].C(C)(C)(C)C=1C=C(C=C(C1)C(C)(C)C)[O-] PYQBNSSKFSDQOT-UHFFFAOYSA-K 0.000 description 1
- YTTZYYBKYGKPKU-UHFFFAOYSA-K [Al+3].CC1=C(C(=C(C(=C1)C)C)C)[O-].CC1=C(C(=C(C(=C1)C)C)C)[O-].CC1=C(C(=C(C(=C1)C)C)C)[O-] Chemical compound [Al+3].CC1=C(C(=C(C(=C1)C)C)C)[O-].CC1=C(C(=C(C(=C1)C)C)C)[O-].CC1=C(C(=C(C(=C1)C)C)C)[O-] YTTZYYBKYGKPKU-UHFFFAOYSA-K 0.000 description 1
- BCJQRIRUTCGGMB-UHFFFAOYSA-J [Al+3].CC1=C(C(=CC(=C1)C)C)[O-].CC1=NC2=C(C=CC=C2C=C1)[O-].CC1=NC2=C(C=CC=C2C=C1)[O-].[Al+3].C1(=CC=CC=C1)C1=C(C(=CC(=C1)C1=CC=CC=C1)C1=CC=CC=C1)[O-] Chemical compound [Al+3].CC1=C(C(=CC(=C1)C)C)[O-].CC1=NC2=C(C=CC=C2C=C1)[O-].CC1=NC2=C(C=CC=C2C=C1)[O-].[Al+3].C1(=CC=CC=C1)C1=C(C(=CC(=C1)C1=CC=CC=C1)C1=CC=CC=C1)[O-] BCJQRIRUTCGGMB-UHFFFAOYSA-J 0.000 description 1
- XNQHTZNYBVULHJ-UHFFFAOYSA-K [Al+3].CC=1C=C(C=CC1C)[O-].CC=1C=C(C=CC1C)[O-].CC=1C=C(C=CC1C)[O-] Chemical compound [Al+3].CC=1C=C(C=CC1C)[O-].CC=1C=C(C=CC1C)[O-].CC=1C=C(C=CC1C)[O-] XNQHTZNYBVULHJ-UHFFFAOYSA-K 0.000 description 1
- JFBZPFYRPYOZCQ-UHFFFAOYSA-N [Li].[Al] Chemical compound [Li].[Al] JFBZPFYRPYOZCQ-UHFFFAOYSA-N 0.000 description 1
- JHYLKGDXMUDNEO-UHFFFAOYSA-N [Mg].[In] Chemical compound [Mg].[In] JHYLKGDXMUDNEO-UHFFFAOYSA-N 0.000 description 1
- GPWHDDKQSYOYBF-UHFFFAOYSA-N ac1l2u0q Chemical compound Br[Br-]Br GPWHDDKQSYOYBF-UHFFFAOYSA-N 0.000 description 1
- JDPAVWAQGBGGHD-UHFFFAOYSA-N aceanthrylene Chemical group C1=CC=C2C(C=CC3=CC=C4)=C3C4=CC2=C1 JDPAVWAQGBGGHD-UHFFFAOYSA-N 0.000 description 1
- 150000001251 acridines Chemical class 0.000 description 1
- 229920000122 acrylonitrile butadiene styrene Polymers 0.000 description 1
- 230000002776 aggregation Effects 0.000 description 1
- 238000004220 aggregation Methods 0.000 description 1
- 239000003513 alkali Substances 0.000 description 1
- 229910001615 alkaline earth metal halide Inorganic materials 0.000 description 1
- 229920000180 alkyd Polymers 0.000 description 1
- 125000002947 alkylene group Chemical group 0.000 description 1
- CKRHKYHOTKICCR-UHFFFAOYSA-K aluminum;2,6-diphenylphenolate Chemical compound [Al+3].[O-]C1=C(C=2C=CC=CC=2)C=CC=C1C1=CC=CC=C1.[O-]C1=C(C=2C=CC=CC=2)C=CC=C1C1=CC=CC=C1.[O-]C1=C(C=2C=CC=CC=2)C=CC=C1C1=CC=CC=C1 CKRHKYHOTKICCR-UHFFFAOYSA-K 0.000 description 1
- BNBFVVDELYNJMK-UHFFFAOYSA-K aluminum;2-methylphenolate Chemical compound CC1=CC=CC=C1O[Al](OC=1C(=CC=CC=1)C)OC1=CC=CC=C1C BNBFVVDELYNJMK-UHFFFAOYSA-K 0.000 description 1
- PSYWRPCLOJXWEN-UHFFFAOYSA-K aluminum;2-phenylphenolate Chemical compound [Al+3].[O-]C1=CC=CC=C1C1=CC=CC=C1.[O-]C1=CC=CC=C1C1=CC=CC=C1.[O-]C1=CC=CC=C1C1=CC=CC=C1 PSYWRPCLOJXWEN-UHFFFAOYSA-K 0.000 description 1
- VZSNNUDOANMGNX-UHFFFAOYSA-K aluminum;4-phenylphenolate Chemical compound [Al+3].C1=CC([O-])=CC=C1C1=CC=CC=C1.C1=CC([O-])=CC=C1C1=CC=CC=C1.C1=CC([O-])=CC=C1C1=CC=CC=C1 VZSNNUDOANMGNX-UHFFFAOYSA-K 0.000 description 1
- VCICMBWXNBMICE-UHFFFAOYSA-N anthracen-9-yl-bis(2,4,6-trimethylphenyl)borane Chemical compound CC1=CC(C)=CC(C)=C1B(C=1C2=CC=CC=C2C=C2C=CC=CC2=1)C1=C(C)C=C(C)C=C1C VCICMBWXNBMICE-UHFFFAOYSA-N 0.000 description 1
- NDMVXIYCFFFPLE-UHFFFAOYSA-N anthracene-9,10-diamine Chemical compound C1=CC=C2C(N)=C(C=CC=C3)C3=C(N)C2=C1 NDMVXIYCFFFPLE-UHFFFAOYSA-N 0.000 description 1
- 229940054051 antipsychotic indole derivative Drugs 0.000 description 1
- 229940027998 antiseptic and disinfectant acridine derivative Drugs 0.000 description 1
- 229940027991 antiseptic and disinfectant quinoline derivative Drugs 0.000 description 1
- 150000001491 aromatic compounds Chemical class 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- 150000007980 azole derivatives Chemical class 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- RFRXIWQYSOIBDI-UHFFFAOYSA-N benzarone Chemical compound CCC=1OC2=CC=CC=C2C=1C(=O)C1=CC=C(O)C=C1 RFRXIWQYSOIBDI-UHFFFAOYSA-N 0.000 description 1
- HFACYLZERDEVSX-UHFFFAOYSA-N benzidine Chemical class C1=CC(N)=CC=C1C1=CC=C(N)C=C1 HFACYLZERDEVSX-UHFFFAOYSA-N 0.000 description 1
- ZJHMRPBTRSQNPI-UHFFFAOYSA-N benzo[b][1]benzosilole Chemical compound C1=CC=C2[Si]C3=CC=CC=C3C2=C1 ZJHMRPBTRSQNPI-UHFFFAOYSA-N 0.000 description 1
- 125000003354 benzotriazolyl group Chemical class N1N=NC2=C1C=CC=C2* 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- ATBAMAFKBVZNFJ-UHFFFAOYSA-N beryllium atom Chemical compound [Be] ATBAMAFKBVZNFJ-UHFFFAOYSA-N 0.000 description 1
- 239000011230 binding agent Substances 0.000 description 1
- LLEMOWNGBBNAJR-UHFFFAOYSA-N biphenyl-2-ol Chemical compound OC1=CC=CC=C1C1=CC=CC=C1 LLEMOWNGBBNAJR-UHFFFAOYSA-N 0.000 description 1
- 229910000085 borane Inorganic materials 0.000 description 1
- PPTSBERGOGHCHC-UHFFFAOYSA-N boron lithium Chemical compound [Li].[B] PPTSBERGOGHCHC-UHFFFAOYSA-N 0.000 description 1
- YMEKEHSRPZAOGO-UHFFFAOYSA-N boron triiodide Chemical compound IB(I)I YMEKEHSRPZAOGO-UHFFFAOYSA-N 0.000 description 1
- 125000000707 boryl group Chemical group B* 0.000 description 1
- VFEVXBKBGMAKME-UHFFFAOYSA-N butane;hydrobromide Chemical compound Br.CCCC VFEVXBKBGMAKME-UHFFFAOYSA-N 0.000 description 1
- BZDFZPOXYWINHT-UHFFFAOYSA-N c(cc1)cc(c2c3c(B4c5ccccc5O5)ccc2)c1[n]3-c1c4c5ccc1 Chemical compound c(cc1)cc(c2c3c(B4c5ccccc5O5)ccc2)c1[n]3-c1c4c5ccc1 BZDFZPOXYWINHT-UHFFFAOYSA-N 0.000 description 1
- KABKSXUBZNDFIM-UHFFFAOYSA-N c(cc1)cc(c2ccccc22)c1[n]2-c(cc1)cc2c1c1cccc3c1[n]2-c1c2S3c3c(cccc4)c4ccc3Oc2ccc1 Chemical compound c(cc1)cc(c2ccccc22)c1[n]2-c(cc1)cc2c1c1cccc3c1[n]2-c1c2S3c3c(cccc4)c4ccc3Oc2ccc1 KABKSXUBZNDFIM-UHFFFAOYSA-N 0.000 description 1
- SCUVMBRYGIBTMW-UHFFFAOYSA-N c(cc1)cc(c2ccccc22)c1[n]2-c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 Chemical compound c(cc1)cc(c2ccccc22)c1[n]2-c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 SCUVMBRYGIBTMW-UHFFFAOYSA-N 0.000 description 1
- KVMPITCFOFXTHI-UHFFFAOYSA-N c(cc1)cc(c2ccccc22)c1[n]2-c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c5ccccc5cc2)c3c-4c1 Chemical compound c(cc1)cc(c2ccccc22)c1[n]2-c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c5ccccc5cc2)c3c-4c1 KVMPITCFOFXTHI-UHFFFAOYSA-N 0.000 description 1
- YXTFKDAOVLTXJC-UHFFFAOYSA-N c(cc1)ccc1-c(cc1)cc2c1c(ccc(-c1ccccc1)c13)c1[n]2-c1cccc(N(c2ccccc2)c2ccc4)c1B3c2c4-c1ccccc1 Chemical compound c(cc1)ccc1-c(cc1)cc2c1c(ccc(-c1ccccc1)c13)c1[n]2-c1cccc(N(c2ccccc2)c2ccc4)c1B3c2c4-c1ccccc1 YXTFKDAOVLTXJC-UHFFFAOYSA-N 0.000 description 1
- DPNILHFATCGYHZ-UHFFFAOYSA-N c(cc1)ccc1-c(cc1c2cc(-c3ccccc3)cc3c22)ccc1[n]2-c1cccc2c1B3c(ccc(-[n]1c3ccccc3c3c1cccc3)c1)c1N2c1ccccc1 Chemical compound c(cc1)ccc1-c(cc1c2cc(-c3ccccc3)cc3c22)ccc1[n]2-c1cccc2c1B3c(ccc(-[n]1c3ccccc3c3c1cccc3)c1)c1N2c1ccccc1 DPNILHFATCGYHZ-UHFFFAOYSA-N 0.000 description 1
- AOERJVZWVVPEFO-UHFFFAOYSA-N c(cc1)ccc1-c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 Chemical compound c(cc1)ccc1-c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 AOERJVZWVVPEFO-UHFFFAOYSA-N 0.000 description 1
- JSIUDWQEDRJCQQ-UHFFFAOYSA-N c(cc1)ccc1-c(cccc1B2c3cccc(-c4ccccc4)c3O3)c1Oc(c(-c1ccccc1)c1)c2c3c1-c1ccccc1 Chemical compound c(cc1)ccc1-c(cccc1B2c3cccc(-c4ccccc4)c3O3)c1Oc(c(-c1ccccc1)c1)c2c3c1-c1ccccc1 JSIUDWQEDRJCQQ-UHFFFAOYSA-N 0.000 description 1
- FVFVUDCMABNYCH-UHFFFAOYSA-N c(cc1)ccc1-c(cccc1c2cccc3c22)c1[n]2-c1cccc2c1B3c1c(cccc3)c3ccc1O2 Chemical compound c(cc1)ccc1-c(cccc1c2cccc3c22)c1[n]2-c1cccc2c1B3c1c(cccc3)c3ccc1O2 FVFVUDCMABNYCH-UHFFFAOYSA-N 0.000 description 1
- JPTUPRKVTRHWCW-UHFFFAOYSA-N c(cc1)ccc1-c1cc(N(c2ccccc2)c2c(B3c4cccc5c4[n]-4c6ccccc56)c-4cc(N(c4ccccc4)c4ccccc4)c2)c3cc1 Chemical compound c(cc1)ccc1-c1cc(N(c2ccccc2)c2c(B3c4cccc5c4[n]-4c6ccccc56)c-4cc(N(c4ccccc4)c4ccccc4)c2)c3cc1 JPTUPRKVTRHWCW-UHFFFAOYSA-N 0.000 description 1
- HTCVRQNEDPLJRI-UHFFFAOYSA-N c(cc1)ccc1-c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5ccccc45)c2c-3c1 Chemical compound c(cc1)ccc1-c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5ccccc45)c2c-3c1 HTCVRQNEDPLJRI-UHFFFAOYSA-N 0.000 description 1
- MQUSNFBZAVUBKG-UHFFFAOYSA-N c(cc1)ccc1N(c1ccc2)c3cc(-[n]4c5ccccc5c5c4cccc5)ccc3B3c1c2-[n](c(ccc(-[n]1c(cccc2)c2c2ccccc12)c1)c1c1c2)c1c3cc2-[n]1c2ccccc2c2ccccc12 Chemical compound c(cc1)ccc1N(c1ccc2)c3cc(-[n]4c5ccccc5c5c4cccc5)ccc3B3c1c2-[n](c(ccc(-[n]1c(cccc2)c2c2ccccc12)c1)c1c1c2)c1c3cc2-[n]1c2ccccc2c2ccccc12 MQUSNFBZAVUBKG-UHFFFAOYSA-N 0.000 description 1
- TXLFIDRVAPYRIC-UHFFFAOYSA-N c(cc1)ccc1N(c1ccc2)c3cc(-[n]4c5ccccc5c5c4cccc5)ccc3B3c1c2-[n](c(ccc(N1c(cccc2)c2Oc2c1cccc2)c1)c1c1c2)c1c3cc2N1c(cccc2)c2Oc2c1cccc2 Chemical compound c(cc1)ccc1N(c1ccc2)c3cc(-[n]4c5ccccc5c5c4cccc5)ccc3B3c1c2-[n](c(ccc(N1c(cccc2)c2Oc2c1cccc2)c1)c1c1c2)c1c3cc2N1c(cccc2)c2Oc2c1cccc2 TXLFIDRVAPYRIC-UHFFFAOYSA-N 0.000 description 1
- WNDAVMAHGUQIJF-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c(cc1)cc2c1c1cccc3c1[n]2-c1cccc2c1B3c1c(cccc3)c3ccc1O2 Chemical compound c(cc1)ccc1N(c1ccccc1)c(cc1)cc2c1c1cccc3c1[n]2-c1cccc2c1B3c1c(cccc3)c3ccc1O2 WNDAVMAHGUQIJF-UHFFFAOYSA-N 0.000 description 1
- SDJONSFZTZBDJR-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c(cc1c2cc(N(c3ccccc3)c3ccccc3)cc(B3c4c(cccc5)c5ccc4O4)c22)ccc1[n]2-c1c3c4ccc1 Chemical compound c(cc1)ccc1N(c1ccccc1)c(cc1c2cc(N(c3ccccc3)c3ccccc3)cc(B3c4c(cccc5)c5ccc4O4)c22)ccc1[n]2-c1c3c4ccc1 SDJONSFZTZBDJR-UHFFFAOYSA-N 0.000 description 1
- NGXDNKWAAGIHCH-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 Chemical compound c(cc1)ccc1N(c1ccccc1)c(ccc-1c2B3c4cccc5c4[n]-1c1ccccc51)c2Oc1c3c2ccccc2cc1 NGXDNKWAAGIHCH-UHFFFAOYSA-N 0.000 description 1
- CNAZTBTWSSITBN-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(N(c2ccccc2)c2cc(-[n]3c(cccc4)c4c4c3cccc4)ccc2B2c3cccc4c3[n]-3c5ccccc45)c2c-3c1 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(N(c2ccccc2)c2cc(-[n]3c(cccc4)c4c4c3cccc4)ccc2B2c3cccc4c3[n]-3c5ccccc45)c2c-3c1 CNAZTBTWSSITBN-UHFFFAOYSA-N 0.000 description 1
- DULFHFPJJHVDHT-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(N(c2ccccc2)c2cc(N(c3ccccc3)c3ccccc3)cc-3c2B2c4c5[n]-3c(cccc3)c3c5ccc4)c2cc1 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(N(c2ccccc2)c2cc(N(c3ccccc3)c3ccccc3)cc-3c2B2c4c5[n]-3c(cccc3)c3c5ccc4)c2cc1 DULFHFPJJHVDHT-UHFFFAOYSA-N 0.000 description 1
- DOQRVCOTLFZEQX-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c2c-3c1 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(N(c2ccccc2)c2ccccc2B2c3cccc4c3[n]-3c5c4cccc5)c2c-3c1 DOQRVCOTLFZEQX-UHFFFAOYSA-N 0.000 description 1
- NNDLZZSOTXLMBS-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6c5cccc6)c-4cc(-[n]4c5ccccc5c5c4cccc5)c2)c3c2ccccc12 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6c5cccc6)c-4cc(-[n]4c5ccccc5c5c4cccc5)c2)c3c2ccccc12 NNDLZZSOTXLMBS-UHFFFAOYSA-N 0.000 description 1
- GZNRXRXZGZFABV-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6c5cccc6)c-4cc(-c4cccc5c4cccc5)c2)c3c2ccccc12 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6c5cccc6)c-4cc(-c4cccc5c4cccc5)c2)c3c2ccccc12 GZNRXRXZGZFABV-UHFFFAOYSA-N 0.000 description 1
- KTGZQWFDIQJTKZ-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6c5cccc6)c5ccccc5c(N(c5ccccc5)c5ccccc5)c2)c3c-4c1 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6c5cccc6)c5ccccc5c(N(c5ccccc5)c5ccccc5)c2)c3c-4c1 KTGZQWFDIQJTKZ-UHFFFAOYSA-N 0.000 description 1
- PVBGZKCSDNZKLI-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c-4cc(-c4cc(cccc5)c5cc4)c2)c3c2ccccc12 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c-4cc(-c4cc(cccc5)c5cc4)c2)c3c2ccccc12 PVBGZKCSDNZKLI-UHFFFAOYSA-N 0.000 description 1
- SZFJBIGOPQHCHW-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c5ccccc5cc2)c3c-4c1 Chemical compound c(cc1)ccc1N(c1ccccc1)c1cc(Oc2c(B3c4cccc5c4[n]-4c6ccccc56)c5ccccc5cc2)c3c-4c1 SZFJBIGOPQHCHW-UHFFFAOYSA-N 0.000 description 1
- NFAIWUQZMFZGHU-UHFFFAOYSA-N c(cc1)ccc1N(c1ccccc1B1c2cccc3c2[n]-2c4ccccc34)c3c1c-2cc(-[n]1c(cccc2)c2c2c1cccc2)c3 Chemical compound c(cc1)ccc1N(c1ccccc1B1c2cccc3c2[n]-2c4ccccc34)c3c1c-2cc(-[n]1c(cccc2)c2c2c1cccc2)c3 NFAIWUQZMFZGHU-UHFFFAOYSA-N 0.000 description 1
- KOPBYBDAPCDYFK-UHFFFAOYSA-N caesium oxide Chemical compound [O-2].[Cs+].[Cs+] KOPBYBDAPCDYFK-UHFFFAOYSA-N 0.000 description 1
- 229910001942 caesium oxide Inorganic materials 0.000 description 1
- KVUAALJSMIVURS-ZEDZUCNESA-L calcium folinate Chemical compound [Ca+2].C1NC=2NC(N)=NC(=O)C=2N(C=O)C1CNC1=CC=C(C(=O)N[C@@H](CCC([O-])=O)C([O-])=O)C=C1 KVUAALJSMIVURS-ZEDZUCNESA-L 0.000 description 1
- 239000006229 carbon black Substances 0.000 description 1
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 description 1
- 230000008859 change Effects 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- JCGRMAWAPVVHFK-UHFFFAOYSA-N chrysene-6,12-diamine Chemical compound C1=CC=C2C(N)=CC3=C(C=CC=C4)C4=C(N)C=C3C2=C1 JCGRMAWAPVVHFK-UHFFFAOYSA-N 0.000 description 1
- 238000010549 co-Evaporation Methods 0.000 description 1
- 238000004883 computer application Methods 0.000 description 1
- 238000009833 condensation Methods 0.000 description 1
- 230000005494 condensation Effects 0.000 description 1
- 229920001940 conductive polymer Polymers 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- OMZSGWSJDCOLKM-UHFFFAOYSA-N copper(II) sulfide Chemical compound [S-2].[Cu+2] OMZSGWSJDCOLKM-UHFFFAOYSA-N 0.000 description 1
- GBRBMTNGQBKBQE-UHFFFAOYSA-L copper;diiodide Chemical compound I[Cu]I GBRBMTNGQBKBQE-UHFFFAOYSA-L 0.000 description 1
- JBPCDMSEJVCNGV-UHFFFAOYSA-N coumarin 334 Chemical compound C1CCC2=C(OC(C(C(=O)C)=C3)=O)C3=CC3=C2N1CCC3 JBPCDMSEJVCNGV-UHFFFAOYSA-N 0.000 description 1
- VBVAVBCYMYWNOU-UHFFFAOYSA-N coumarin 6 Chemical compound C1=CC=C2SC(C3=CC4=CC=C(C=C4OC3=O)N(CC)CC)=NC2=C1 VBVAVBCYMYWNOU-UHFFFAOYSA-N 0.000 description 1
- 125000002592 cumenyl group Chemical group C1(=C(C=CC=C1)*)C(C)C 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000000000 cycloalkoxy group Chemical group 0.000 description 1
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 1
- 125000000058 cyclopentadienyl group Chemical group C1(=CC=CC1)* 0.000 description 1
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- JNTHRSHGARDABO-UHFFFAOYSA-N dibenzo[a,l]pyrene Chemical compound C1=CC=CC2=C3C4=CC=CC=C4C=C(C=C4)C3=C3C4=CC=CC3=C21 JNTHRSHGARDABO-UHFFFAOYSA-N 0.000 description 1
- 150000004826 dibenzofurans Chemical class 0.000 description 1
- 125000005509 dibenzothiophenyl group Chemical group 0.000 description 1
- 125000004212 difluorophenyl group Chemical group 0.000 description 1
- 230000005611 electricity Effects 0.000 description 1
- 238000005566 electron beam evaporation Methods 0.000 description 1
- 238000010894 electron beam technology Methods 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 239000000706 filtrate Substances 0.000 description 1
- 239000012467 final product Substances 0.000 description 1
- GVEPBJHOBDJJJI-RHRFEJLCSA-N fluoranthene Chemical class C1=CC(C2=CC=CC=C22)=C3C2=CC=CC3=[14CH]1 GVEPBJHOBDJJJI-RHRFEJLCSA-N 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical class O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 239000011888 foil Substances 0.000 description 1
- 150000002240 furans Chemical class 0.000 description 1
- YRTCKZIKGWZNCU-UHFFFAOYSA-N furo[3,2-b]pyridine Chemical class C1=CC=C2OC=CC2=N1 YRTCKZIKGWZNCU-UHFFFAOYSA-N 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 229910052733 gallium Inorganic materials 0.000 description 1
- 150000002258 gallium Chemical class 0.000 description 1
- 238000009499 grossing Methods 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 description 1
- RBTKNAXYKSUFRK-UHFFFAOYSA-N heliogen blue Chemical compound [Cu].[N-]1C2=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=NC([N-]1)=C(C=CC=C3)C3=C1N=C([N-]1)C3=CC=CC=C3C1=N2 RBTKNAXYKSUFRK-UHFFFAOYSA-N 0.000 description 1
- LIIALPBMIOVAHH-UHFFFAOYSA-N herniarin Chemical class C1=CC(=O)OC2=CC(OC)=CC=C21 LIIALPBMIOVAHH-UHFFFAOYSA-N 0.000 description 1
- DXVUYOAEDJXBPY-NFFDBFGFSA-N hetacillin Chemical group C1([C@@H]2C(=O)N(C(N2)(C)C)[C@H]2[C@H]3SC([C@@H](N3C2=O)C(O)=O)(C)C)=CC=CC=C1 DXVUYOAEDJXBPY-NFFDBFGFSA-N 0.000 description 1
- 125000004404 heteroalkyl group Chemical group 0.000 description 1
- 125000004446 heteroarylalkyl group Chemical group 0.000 description 1
- 150000002391 heterocyclic compounds Chemical class 0.000 description 1
- 229920006270 hydrocarbon resin Polymers 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 150000002460 imidazoles Chemical class 0.000 description 1
- YAMHXTCMCPHKLN-UHFFFAOYSA-N imidazolidin-2-one Chemical compound O=C1NCCN1 YAMHXTCMCPHKLN-UHFFFAOYSA-N 0.000 description 1
- 150000005232 imidazopyridines Chemical class 0.000 description 1
- 229910003437 indium oxide Inorganic materials 0.000 description 1
- PJXISJQVUVHSOJ-UHFFFAOYSA-N indium(iii) oxide Chemical compound [O-2].[O-2].[O-2].[In+3].[In+3] PJXISJQVUVHSOJ-UHFFFAOYSA-N 0.000 description 1
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 1
- PZOUSPYUWWUPPK-UHFFFAOYSA-N indole Natural products CC1=CC=CC2=C1C=CN2 PZOUSPYUWWUPPK-UHFFFAOYSA-N 0.000 description 1
- RKJUIXBNRJVNHR-UHFFFAOYSA-N indolenine Natural products C1=CC=C2CC=NC2=C1 RKJUIXBNRJVNHR-UHFFFAOYSA-N 0.000 description 1
- 150000002475 indoles Chemical class 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 239000011147 inorganic material Substances 0.000 description 1
- 229910017053 inorganic salt Inorganic materials 0.000 description 1
- 229940079865 intestinal antiinfectives imidazole derivative Drugs 0.000 description 1
- PNDPGZBMCMUPRI-UHFFFAOYSA-N iodine Chemical compound II PNDPGZBMCMUPRI-UHFFFAOYSA-N 0.000 description 1
- 238000007733 ion plating Methods 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 150000002576 ketones Chemical class 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 239000001989 lithium alloy Substances 0.000 description 1
- FUJCRWPEOMXPAD-UHFFFAOYSA-N lithium oxide Chemical compound [Li+].[Li+].[O-2] FUJCRWPEOMXPAD-UHFFFAOYSA-N 0.000 description 1
- 229910001947 lithium oxide Inorganic materials 0.000 description 1
- UBJFKNSINUCEAL-UHFFFAOYSA-N lithium;2-methylpropane Chemical compound [Li+].C[C-](C)C UBJFKNSINUCEAL-UHFFFAOYSA-N 0.000 description 1
- WGOPGODQLGJZGL-UHFFFAOYSA-N lithium;butane Chemical compound [Li+].CC[CH-]C WGOPGODQLGJZGL-UHFFFAOYSA-N 0.000 description 1
- SKEDXQSRJSUMRP-UHFFFAOYSA-N lithium;quinolin-8-ol Chemical compound [Li].C1=CN=C2C(O)=CC=CC2=C1 SKEDXQSRJSUMRP-UHFFFAOYSA-N 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- LBAIJNRSTQHDMR-UHFFFAOYSA-N magnesium phthalocyanine Chemical compound [Mg].C12=CC=CC=C2C(N=C2NC(C3=CC=CC=C32)=N2)=NC1=NC([C]1C=CC=CC1=1)=NC=1N=C1[C]3C=CC=CC3=C2N1 LBAIJNRSTQHDMR-UHFFFAOYSA-N 0.000 description 1
- SJCKRGFTWFGHGZ-UHFFFAOYSA-N magnesium silver Chemical compound [Mg].[Ag] SJCKRGFTWFGHGZ-UHFFFAOYSA-N 0.000 description 1
- 229910001507 metal halide Inorganic materials 0.000 description 1
- 150000005309 metal halides Chemical class 0.000 description 1
- UVEAFTFQMHUWEY-UHFFFAOYSA-N methane;1,2,4,5-tetrafluoro-3,6-dioxocyclohexane-1,2,4,5-tetracarbonitrile Chemical compound C.C.N#CC1(F)C(=O)C(F)(C#N)C(F)(C#N)C(=O)C1(F)C#N UVEAFTFQMHUWEY-UHFFFAOYSA-N 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- XNLCINMGJXZRCL-UHFFFAOYSA-N n,n-bis(4-phenylphenyl)-4-[2-[4-(4-phenyl-n-(4-phenylphenyl)anilino)phenyl]ethenyl]aniline Chemical compound C=1C=C(N(C=2C=CC(=CC=2)C=2C=CC=CC=2)C=2C=CC(=CC=2)C=2C=CC=CC=2)C=CC=1C=CC(C=C1)=CC=C1N(C=1C=CC(=CC=1)C=1C=CC=CC=1)C(C=C1)=CC=C1C1=CC=CC=C1 XNLCINMGJXZRCL-UHFFFAOYSA-N 0.000 description 1
- LKGJCLPKCSMVMU-UHFFFAOYSA-N n,n-diphenyl-10-[4-(n-phenylanilino)naphthalen-1-yl]anthracen-9-amine Chemical compound C1=CC=CC=C1N(C=1C2=CC=CC=C2C(C=2C3=CC=CC=C3C(N(C=3C=CC=CC=3)C=3C=CC=CC=3)=C3C=CC=CC3=2)=CC=1)C1=CC=CC=C1 LKGJCLPKCSMVMU-UHFFFAOYSA-N 0.000 description 1
- ZUXHZYJQZZKWHO-UHFFFAOYSA-N n,n-diphenyl-4-[4-(n-phenylanilino)phenyl]naphthalen-1-amine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)C=1C2=CC=CC=C2C(N(C=2C=CC=CC=2)C=2C=CC=CC=2)=CC=1)C1=CC=CC=C1 ZUXHZYJQZZKWHO-UHFFFAOYSA-N 0.000 description 1
- KQXGBNZZUYDUSG-UHFFFAOYSA-N n,n-diphenyl-4-[4-[4-[4-(n-phenylanilino)naphthalen-1-yl]phenyl]phenyl]naphthalen-1-amine Chemical group C1=CC=CC=C1N(C=1C2=CC=CC=C2C(C=2C=CC(=CC=2)C=2C=CC(=CC=2)C=2C3=CC=CC=C3C(N(C=3C=CC=CC=3)C=3C=CC=CC=3)=CC=2)=CC=1)C1=CC=CC=C1 KQXGBNZZUYDUSG-UHFFFAOYSA-N 0.000 description 1
- BBPWMDBTJRZHJF-UHFFFAOYSA-N n,n-diphenyl-6-[4-(n-phenylanilino)phenyl]naphthalen-2-amine Chemical compound C1=CC=CC=C1N(C=1C=CC(=CC=1)C=1C=C2C=CC(=CC2=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 BBPWMDBTJRZHJF-UHFFFAOYSA-N 0.000 description 1
- FWORJTDMYDOYQR-UHFFFAOYSA-N n,n-diphenyl-6-[4-[4-[4-[6-(n-phenylanilino)naphthalen-2-yl]phenyl]phenyl]phenyl]naphthalen-2-amine Chemical group C1=CC=CC=C1N(C=1C=C2C=CC(=CC2=CC=1)C=1C=CC(=CC=1)C=1C=CC(=CC=1)C=1C=CC(=CC=1)C=1C=C2C=CC(=CC2=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 FWORJTDMYDOYQR-UHFFFAOYSA-N 0.000 description 1
- NKECJJVYVFYJRK-UHFFFAOYSA-N n,n-diphenyl-6-[4-[4-[6-(n-phenylanilino)naphthalen-2-yl]phenyl]phenyl]naphthalen-2-amine Chemical group C1=CC=CC=C1N(C=1C=C2C=CC(=CC2=CC=1)C=1C=CC(=CC=1)C=1C=CC(=CC=1)C=1C=C2C=CC(=CC2=CC=1)N(C=1C=CC=CC=1)C=1C=CC=CC=1)C1=CC=CC=C1 NKECJJVYVFYJRK-UHFFFAOYSA-N 0.000 description 1
- VBSGDGQAFLYSEK-UHFFFAOYSA-N n-(3,5-dimethylphenyl)-3,5-dimethylaniline Chemical compound CC1=CC(C)=CC(NC=2C=C(C)C=C(C)C=2)=C1 VBSGDGQAFLYSEK-UHFFFAOYSA-N 0.000 description 1
- RHQMPGSJRXCZBK-UHFFFAOYSA-N n-[4-[2-[4-(dinaphthalen-2-ylamino)phenyl]ethenyl]phenyl]-n-naphthalen-2-ylnaphthalen-2-amine Chemical compound C1=CC=CC2=CC(N(C=3C=C4C=CC=CC4=CC=3)C3=CC=C(C=C3)C=CC=3C=CC(=CC=3)N(C=3C=C4C=CC=CC4=CC=3)C=3C=C4C=CC=CC4=CC=3)=CC=C21 RHQMPGSJRXCZBK-UHFFFAOYSA-N 0.000 description 1
- WMBKUKCCQLBJRE-UHFFFAOYSA-N n-[4-[2-[4-(n-naphthalen-2-ylanilino)phenyl]ethenyl]phenyl]-n-phenylnaphthalen-2-amine Chemical compound C=1C=C(N(C=2C=CC=CC=2)C=2C=C3C=CC=CC3=CC=2)C=CC=1C=CC(C=C1)=CC=C1N(C=1C=C2C=CC=CC2=CC=1)C1=CC=CC=C1 WMBKUKCCQLBJRE-UHFFFAOYSA-N 0.000 description 1
- ZFIQKTXFWZQWDV-UHFFFAOYSA-N n-[4-[2-[4-(n-phenanthren-9-ylanilino)phenyl]ethenyl]phenyl]-n-phenylphenanthren-9-amine Chemical compound C=1C=C(N(C=2C=CC=CC=2)C=2C3=CC=CC=C3C3=CC=CC=C3C=2)C=CC=1C=CC(C=C1)=CC=C1N(C=1C2=CC=CC=C2C2=CC=CC=C2C=1)C1=CC=CC=C1 ZFIQKTXFWZQWDV-UHFFFAOYSA-N 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 150000005054 naphthyridines Chemical class 0.000 description 1
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 1
- 125000002868 norbornyl group Chemical group C12(CCC(CC1)C2)* 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000010355 oscillation Effects 0.000 description 1
- AICOOMRHRUFYCM-ZRRPKQBOSA-N oxazine, 1 Chemical compound C([C@@H]1[C@H](C(C[C@]2(C)[C@@H]([C@H](C)N(C)C)[C@H](O)C[C@]21C)=O)CC1=CC2)C[C@H]1[C@@]1(C)[C@H]2N=C(C(C)C)OC1 AICOOMRHRUFYCM-ZRRPKQBOSA-N 0.000 description 1
- 150000002916 oxazoles Chemical class 0.000 description 1
- AUONHKJOIZSQGR-UHFFFAOYSA-N oxophosphane Chemical class P=O AUONHKJOIZSQGR-UHFFFAOYSA-N 0.000 description 1
- LXNAVEXFUKBNMK-UHFFFAOYSA-N palladium(II) acetate Substances [Pd].CC(O)=O.CC(O)=O LXNAVEXFUKBNMK-UHFFFAOYSA-N 0.000 description 1
- YJVFFLUZDVXJQI-UHFFFAOYSA-L palladium(ii) acetate Chemical compound [Pd+2].CC([O-])=O.CC([O-])=O YJVFFLUZDVXJQI-UHFFFAOYSA-L 0.000 description 1
- SLIUAWYAILUBJU-UHFFFAOYSA-N pentacene Chemical compound C1=CC=CC2=CC3=CC4=CC5=CC=CC=C5C=C4C=C3C=C21 SLIUAWYAILUBJU-UHFFFAOYSA-N 0.000 description 1
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 1
- 239000003208 petroleum Substances 0.000 description 1
- XDJOIMJURHQYDW-UHFFFAOYSA-N phenalene Chemical compound C1=CC(CC=C2)=C3C2=CC=CC3=C1 XDJOIMJURHQYDW-UHFFFAOYSA-N 0.000 description 1
- 239000005011 phenolic resin Substances 0.000 description 1
- 150000002991 phenoxazines Chemical class 0.000 description 1
- 229920006287 phenoxy resin Polymers 0.000 description 1
- 239000013034 phenoxy resin Substances 0.000 description 1
- 125000000286 phenylethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000004437 phosphorous atom Chemical group 0.000 description 1
- 239000011574 phosphorus Substances 0.000 description 1
- XKJCHHZQLQNZHY-UHFFFAOYSA-N phthalimide Chemical class C1=CC=C2C(=O)NC(=O)C2=C1 XKJCHHZQLQNZHY-UHFFFAOYSA-N 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920006255 plastic film Polymers 0.000 description 1
- 229920001490 poly(butyl methacrylate) polymer Polymers 0.000 description 1
- 229920002647 polyamide Polymers 0.000 description 1
- 229920000767 polyaniline Polymers 0.000 description 1
- 229920002857 polybutadiene Polymers 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 229920000193 polymethacrylate Polymers 0.000 description 1
- 229920006380 polyphenylene oxide Polymers 0.000 description 1
- 229920000128 polypyrrole Polymers 0.000 description 1
- 229920000123 polythiophene Polymers 0.000 description 1
- 229920005749 polyurethane resin Polymers 0.000 description 1
- 229920002451 polyvinyl alcohol Polymers 0.000 description 1
- 229920000915 polyvinyl chloride Polymers 0.000 description 1
- 239000004800 polyvinyl chloride Substances 0.000 description 1
- 150000004033 porphyrin derivatives Chemical class 0.000 description 1
- 229910000160 potassium phosphate Inorganic materials 0.000 description 1
- 235000011009 potassium phosphates Nutrition 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 1
- 238000000746 purification Methods 0.000 description 1
- 150000003216 pyrazines Chemical class 0.000 description 1
- 150000003217 pyrazoles Chemical class 0.000 description 1
- 229940083082 pyrimidine derivative acting on arteriolar smooth muscle Drugs 0.000 description 1
- 150000003233 pyrroles Chemical class 0.000 description 1
- WVIICGIFSIBFOG-UHFFFAOYSA-N pyrylium Chemical class C1=CC=[O+]C=C1 WVIICGIFSIBFOG-UHFFFAOYSA-N 0.000 description 1
- 150000004322 quinolinols Chemical class 0.000 description 1
- 150000004059 quinone derivatives Chemical class 0.000 description 1
- 230000002040 relaxant effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- UTUZBCDXWYMYGA-UHFFFAOYSA-N silafluorene Chemical group C12=CC=CC=C2CC2=C1C=CC=[Si]2 UTUZBCDXWYMYGA-UHFFFAOYSA-N 0.000 description 1
- 150000003377 silicon compounds Chemical group 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- HQVNEWCFYHHQES-UHFFFAOYSA-N silicon nitride Chemical compound N12[Si]34N5[Si]62N3[Si]51N64 HQVNEWCFYHHQES-UHFFFAOYSA-N 0.000 description 1
- 229910052814 silicon oxide Inorganic materials 0.000 description 1
- 229920002050 silicone resin Polymers 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Chemical compound [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 150000003440 styrenes Chemical class 0.000 description 1
- 238000000859 sublimation Methods 0.000 description 1
- 230000008022 sublimation Effects 0.000 description 1
- 239000002887 superconductor Substances 0.000 description 1
- 150000003518 tetracenes Chemical class 0.000 description 1
- 238000007725 thermal activation Methods 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 239000011135 tin Substances 0.000 description 1
- XOLBLPGZBRYERU-UHFFFAOYSA-N tin dioxide Chemical compound O=[Sn]=O XOLBLPGZBRYERU-UHFFFAOYSA-N 0.000 description 1
- 229910001887 tin oxide Inorganic materials 0.000 description 1
- TVIVIEFSHFOWTE-UHFFFAOYSA-K tri(quinolin-8-yloxy)alumane Chemical compound [Al+3].C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1.C1=CN=C2C([O-])=CC=CC2=C1 TVIVIEFSHFOWTE-UHFFFAOYSA-K 0.000 description 1
- 125000005259 triarylamine group Chemical group 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- PWYVVBKROXXHEB-UHFFFAOYSA-M trimethyl-[3-(1-methyl-2,3,4,5-tetraphenylsilol-1-yl)propyl]azanium;iodide Chemical compound [I-].C[N+](C)(C)CCC[Si]1(C)C(C=2C=CC=CC=2)=C(C=2C=CC=CC=2)C(C=2C=CC=CC=2)=C1C1=CC=CC=C1 PWYVVBKROXXHEB-UHFFFAOYSA-M 0.000 description 1
- OPSWAWSNPREEFQ-UHFFFAOYSA-K triphenoxyalumane Chemical compound [Al+3].[O-]C1=CC=CC=C1.[O-]C1=CC=CC=C1.[O-]C1=CC=CC=C1 OPSWAWSNPREEFQ-UHFFFAOYSA-K 0.000 description 1
- 150000001651 triphenylamine derivatives Chemical class 0.000 description 1
- 125000006617 triphenylamine group Chemical group 0.000 description 1
- WGWZJNILGYTDHU-UHFFFAOYSA-K tris(3,5-dimethylphenoxy)alumane Chemical compound CC=1C=C([O-])C=C(C1)C.[Al+3].CC=1C=C([O-])C=C(C1)C.CC=1C=C([O-])C=C(C1)C WGWZJNILGYTDHU-UHFFFAOYSA-K 0.000 description 1
- ORHBXUUXSCNDEV-UHFFFAOYSA-N umbelliferone Chemical class C1=CC(=O)OC2=CC(O)=CC=C21 ORHBXUUXSCNDEV-UHFFFAOYSA-N 0.000 description 1
- 229920006337 unsaturated polyester resin Polymers 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 125000001834 xanthenyl group Chemical class C1=CC=CC=2OC3=CC=CC=C3C(C12)* 0.000 description 1
- 125000005023 xylyl group Chemical group 0.000 description 1
- YVTHLONGBIQYBO-UHFFFAOYSA-N zinc indium(3+) oxygen(2-) Chemical compound [O--].[Zn++].[In+3] YVTHLONGBIQYBO-UHFFFAOYSA-N 0.000 description 1
Images
Classifications
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/658—Organoboranes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic Table
- C07F5/02—Boron compounds
- C07F5/027—Organoboranes and organoborohydrides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F5/00—Compounds containing elements of Groups 3 or 13 of the Periodic Table
- C07F5/02—Boron compounds
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- G—PHYSICS
- G02—OPTICS
- G02F—OPTICAL DEVICES OR ARRANGEMENTS FOR THE CONTROL OF LIGHT BY MODIFICATION OF THE OPTICAL PROPERTIES OF THE MEDIA OF THE ELEMENTS INVOLVED THEREIN; NON-LINEAR OPTICS; FREQUENCY-CHANGING OF LIGHT; OPTICAL LOGIC ELEMENTS; OPTICAL ANALOGUE/DIGITAL CONVERTERS
- G02F1/00—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics
- G02F1/01—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour
- G02F1/13—Devices or arrangements for the control of the intensity, colour, phase, polarisation or direction of light arriving from an independent light source, e.g. switching, gating or modulating; Non-linear optics for the control of the intensity, phase, polarisation or colour based on liquid crystals, e.g. single liquid crystal display cells
- G02F1/133—Constructional arrangements; Operation of liquid crystal cells; Circuit arrangements
- G02F1/136—Liquid crystal cells structurally associated with a semi-conducting layer or substrate, e.g. cells forming part of an integrated circuit
- G02F1/1362—Active matrix addressed cells
- G02F1/1368—Active matrix addressed cells in which the switching element is a three-electrode device
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/18—Metal complexes
- C09K2211/188—Metal complexes of other metals not provided for in one of the previous groups
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/11—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers
- H10K50/12—OLEDs or polymer light-emitting diodes [PLED] characterised by the electroluminescent [EL] layers comprising dopants
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/80—Constructional details
- H10K50/85—Arrangements for extracting light from the devices
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E10/00—Energy generation through renewable energy sources
- Y02E10/50—Photovoltaic [PV] energy
- Y02E10/549—Organic PV cells
Definitions
- the present invention relates to a polycyclic aromatic compound and a multimer thereof (hereinafter collectively referred to as “polycyclic aromatic compound”), an organic electroluminescent device, an organic field effect transistor, and an organic thin film solar cell using the same.
- the present invention relates to an organic device such as a battery, a display device, and a lighting device.
- the organic EL element has a structure composed of a pair of electrodes composed of an anode and a cathode, and one layer or a plurality of layers including an organic compound disposed between the pair of electrodes.
- the layer containing an organic compound include a light-emitting layer and a charge transport / injection layer that transports or injects charges such as holes and electrons.
- Various organic materials suitable for these layers have been developed.
- a benzofluorene compound has been developed (International Publication No. 2004/061047).
- a hole transport material for example, a triphenylamine compound has been developed (Japanese Patent Laid-Open No. 2001-172232).
- an anthracene compound has been developed (Japanese Patent Laid-Open No. 2005-170911).
- the charge transport property of a NO-linked compound (Compound 1 on page 63) is evaluated, but a method for producing a material other than the NO-linked compound is not described, and the element to be linked is not described. Since the electronic state of the entire compound is different if it is different, the characteristics obtained from materials other than NO-linked compounds are not yet known. Other examples of such compounds can be found (WO 2011/107186).
- a compound having a conjugated structure with a large triplet exciton energy (T1) can emit phosphorescence having a shorter wavelength, and thus is useful as a blue light-emitting layer material.
- a compound having a novel conjugated structure having a large T1 is also required as an electron transport material or a hole transport material sandwiching the light emitting layer.
- the host material of the organic EL element is generally a molecule in which a plurality of existing aromatic rings such as benzene and carbazole are connected by a single bond, phosphorus atom or silicon atom. This is because a large HOMO-LUMO gap (band gap Eg in a thin film) required for the host material is secured by connecting a large number of relatively conjugated aromatic rings. Furthermore, high triplet excitation energy (E T ) is required for a host material of an organic EL device using a phosphorescent material or a thermally activated delayed fluorescence (TADF) material, but the molecule is a donor or acceptor aromatic compound.
- E T triplet excitation energy
- Triplet excitation energy (E T ) is improved by linking rings and substituents to localize SOMO1 and SOMO2 in the triplet excited state (T1) and reducing exchange interaction between both orbitals. It becomes possible to make it.
- a small conjugated aromatic ring does not have sufficient redox stability, and a device using a molecule formed by connecting existing aromatic rings as a host material does not have a sufficient lifetime.
- polycyclic aromatic compounds having an extended ⁇ -conjugated system generally have excellent redox stability, but have a low HOMO-LUMO gap (band gap Eg in a thin film) and triplet excitation energy (E T ). It has been considered unsuitable for host materials.
- the present inventors have given a condensed structure at a specific position in a polycyclic aromatic compound in which a plurality of aromatic rings are connected by a boron atom and a nitrogen atom or an oxygen atom.
- the present inventors have found that an excellent organic EL device can be obtained by widening the plane formed by molecules and further distorting the plane formed by molecules by introducing substituents at specific positions in this compound.
- the present invention provides the following polycyclic aromatic compounds and organic device materials containing the following polycyclic aromatic compounds.
- the chemical structure or substituent may be represented by the number of carbons.
- the number of carbons in the case where a substituent is substituted on the chemical structure or the substituent is further substituted on the chemical group is the chemical structure.
- the number of carbon atoms of each substituent and does not mean the total number of carbon atoms of the chemical structure and the substituent, or the total number of carbon atoms of the substituent and the substituent.
- “substituent B of carbon number Y substituted by substituent A of carbon number X” means that “substituent B of carbon number Y” is substituted for “substituent B of carbon number Y”.
- the carbon number Y is not the total carbon number of the substituent A and the substituent B.
- substituted with substituent A means that “substituent A having no carbon number” is substituted for “substituent B having carbon number Y”.
- the carbon number Y is not the total carbon number of the substituent A and the substituent B.
- R 1 , R 2 , R 3 , R 4 , R 5 , R 6 , R 7 , R 8 , R 9 , R 10 , R 11 , R 12 , R 13 and R 14 are each independently hydrogen, Aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be linked via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryloxy, in which at least one hydrogen is Further, it may be substituted with aryl, heteroaryl, alkyl or cycloalkyl, and adjacent groups of R 1 to R 3 , R 4 to R 7 , R 8 to R 10 and R 11 to R 14 May be bonded together to form an aryl ring or a heteroaryl ring together with at least one of
- At least one hydrogen in the ring is aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be bonded via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryloxy.
- X is>O,>N—R,> S or> Se, wherein R in> N—R is aryl, heteroaryl, alkyl or cycloalkyl, wherein at least one hydrogen is aryl,
- R in> N—R is aryl, heteroaryl, alkyl or cycloalkyl, wherein at least one hydrogen is aryl,
- L is a single bond,> C (—R) 2 ,>O,> S and> N—R
- R in> C (—R) 2 and> N—R each independently represents hydrogen , Aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be linked via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryloxy, and at least one hydrogen in them May be further substituted with aryl, heteroaryl, alkyl or cycloalkyl;
- X is>O,>N—R,> S or> Se, where
- R 1 , R 2 , R 3 , R 4 , R 5 , R 6 , R 7 , R 8 , R 9 , R 10 , R 11 , R 12 , R 13 and R 14 are each independently hydrogen, Aryl having 6 to 30 carbon atoms, heteroaryl having 2 to 30 carbon atoms, diarylamino (where each aryl is aryl having 6 to 12 carbon atoms), diarylboryl (where each aryl is aryl having 6 to 12 carbon atoms, Two aryls may be bonded via a single bond or a linking group), alkyl having 1 to 12 carbons, cycloalkyl having 5 to 10 carbons, alkoxy having 1 to 12 carbons, or 6 to 30 carbons.
- At least one hydrogen is further aryl having 6 to 30 carbon atoms, heteroaryl having 2 to 30 carbon atoms, alkyl having 1 to 12 carbon atoms, or 5 to 5 carbon atoms. 0 may be substituted by cycloalkyl, also, R 1 ⁇ R 3, R 4 ⁇ a ring adjacent groups are bonded to one of R 7, R 8 ⁇ R 10 and R 11 ⁇ R 14 , B ring, c ring and d ring may form an aryl ring having 9 to 16 carbon atoms or a heteroaryl ring having 6 to 15 carbon atoms, and at least one hydrogen in the formed ring is , Aryl having 6 to 30 carbon atoms, heteroaryl having 2 to 30 carbon atoms, diarylamino (where each aryl is aryl having 6 to 12 carbon atoms), diarylboryl (where each aryl is aryl having 6 to 12 carbon atoms) Two aryls may be bonded via a single bond or a linking
- An aryl ring or heteroaryl ring formed by bonding adjacent groups of R 4 to R 7 together with the b ring is a naphthalene ring, a phenanthrene ring, an anthracene ring, a dibenzofuran ring, a carbazole ring, a dibenzothiophene ring, a sila Item 3.
- Item 4 An aryl ring or heteroaryl ring formed by bonding adjacent groups of R 4 to R 7 together with the b ring is represented by the following partial structural formula (1a), formula (1b) or formula (1c).
- Item 4. The polycyclic aromatic compound or the multimer thereof according to Item 3, which is a ring.
- R 4 , R 5 , R 7 , R 1b , R 2b , R 3b , R 4b , R 5b and R 6b are each independently hydrogen, aryl, heteroaryl, diarylamino, diarylboryl (the two aryls are Optionally bonded via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryloxy, wherein at least one hydrogen is further substituted with aryl, heteroaryl, alkyl or cycloalkyl
- X is>O,>N—R,> S or> Se, wherein R in> N—R is aryl, heteroaryl, alkyl or cycloalkyl, wherein at least one hydrogen is aryl, Optionally substituted with heteroaryl, alkyl or cycloalkyl, Z is>O,>N—R,>S,> Si (—R) 2 and> C (—R) 2 , and>N—R,> Si
- Item 5 The polycyclic aromatic compound according to any one of Items 1 to 4, wherein R of> N—R as X is aryl or heteroaryl, and at least one hydrogen in the aryl or heteroaryl is substituted with fluorine. Compound or multimer thereof.
- R is an aryl or heteroaryl as> N—R as X, and at least one hydrogen in the ortho position with respect to N in the aryl or heteroaryl is substituted with fluorine.
- Item 7. The polycyclic aromatic compound or the multimer thereof according to any one of Items 1 to 6, wherein L is a single bond,> O or> N—R.
- Item 8 The polycyclic aromatic compound or the multimer thereof according to any one of Items 1 to 6, wherein L is a single bond.
- Item 9 The polycyclic aromatic compound or the multimer thereof according to any one of Items 1 to 4, wherein X is> O and L is a single bond.
- Item 10 The polycyclic aromatic compound or the multimer thereof according to any one of Items 1 to 6, wherein X is> N—R, and L is a single bond.
- R 7 and R 8 are halogen, alkyl having 1 to 6 carbons, cycloalkyl having 3 to 14 carbons, aryl having 6 to 10 carbons or heteroaryl having 2 to 10 carbons, and the other Item 10 is hydrogen, alkyl having 1 to 6 carbons, cycloalkyl having 3 to 14 carbons, aryl having 6 to 10 carbons or heteroaryl having 2 to 10 carbons Polycyclic aromatic compounds or multimers thereof.
- R 7 and R 8 is halogen, alkyl having 1 to 4 carbons, cycloalkyl or phenyl having 5 to 10 carbons, and the other is hydrogen, alkyl having 1 to 4 carbons, or carbon 5 Item 11.
- the polycyclic aromatic compound or the multimer thereof according to any one of Items 1 to 10, which is cycloalkyl of 10 to 10 or phenyl.
- Item 13 The polycyclic aromatic according to any one of Items 1 to 10, wherein one of R 7 and R 8 is methyl, t-butyl or phenyl and the other is hydrogen, methyl, t-butyl or phenyl Compound or multimer thereof.
- Item 14 The polycyclic aromatic compound or the multimer thereof according to any one of Items 1 to 10, wherein one of R 7 and R 8 is methyl or t-butyl and the other is hydrogen or methyl.
- Item 15 When one of R 7 and R 8 is methyl, the other is hydrogen, and X is> N—R, the R of> N—R is phenyl, and at least one hydrogen in the phenyl is Any one of Items 1 to 10, optionally substituted with aryl having 6 to 12 carbon atoms, heteroaryl having 2 to 10 carbon atoms, alkyl having 1 to 6 carbon atoms, cycloalkyl having 3 to 14 carbon atoms, or fluorine A polycyclic aromatic compound or a multimer thereof according to claim 1.
- Item 16 The polycyclic aromatic compound or the multimer thereof according to item 1, represented by any one of the following formulas. (In the above formulas, “Me” is a methyl group, and “tBu” is a t-butyl group.)
- Item 17 The polycyclic aromatic compound according to Item 1, represented by any one of the following formulas. (In the above formulas, “Me” is a methyl group, and “tBu” is a t-butyl group.)
- Item 18 The polycyclic aromatic compound according to Item 1, represented by any one of the following formulas. (In the above formulas, “Me” is a methyl group, and “tBu” is a t-butyl group.)
- Item 19 An organic device material comprising the polycyclic aromatic compound or the multimer thereof according to any one of Items 1 to 18.
- Item 20 The organic device material according to Item 19, wherein the organic device material is an organic electroluminescent element material, an organic field effect transistor material, or an organic thin film solar cell material.
- Item 21 The organic device material according to Item 20, wherein the organic electroluminescent element material is a light emitting layer material.
- Item 22 An organic electroluminescent device comprising: a pair of electrodes composed of an anode and a cathode; and a light-emitting layer disposed between the pair of electrodes and containing the light-emitting layer material described in Item 21.
- Item 23 The organic electroluminescent element according to Item 22, wherein the light emitting layer further contains a compound represented by the following general formula (3) and / or a compound represented by the following general formula (4).
- L 1 is an arylene having 6 to 30 carbon atoms or a heteroarylene having 2 to 30 carbon atoms
- L 2 and L 3 are each independently aryl having 6 to 30 carbon atoms or heteroaryl having 2 to 30 carbon atoms, At least one hydrogen in the compounds represented by the above formulas may be substituted with alkyl having 1 to 6 carbons, cycloalkyl having 3 to 14 carbons, cyano, halogen or deuterium.
- Item 24 The organic electroluminescent element according to Item 22 or 23, wherein the light emitting layer further contains a compound represented by the following general formula (5).
- R 1 to R 11 are each independently hydrogen, aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino, diarylboryl (two aryls are bonded via a single bond or a linking group).
- at least one hydrogen is further aryl, heteroaryl, diarylamino, diarylboryl (the two aryls may be bonded via a single bond or a linking group).
- Adjacent groups of R 1 to R 11 may be bonded to form an aryl ring or a heteroaryl ring together with a ring, b ring or c ring, and at least one hydrogen in the formed ring is Substituted by aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino, diarylboryl (two aryls may be linked via a single bond or a linking group), alkyl or cycloalkyl At least one hydrogen in these may be further substituted with aryl, heteroaryl, diarylamino, diarylboryl (the two aryls may be linked via a single bond or a linking group), alkyl or cycloalkyl. You may, At least one hydrogen in the compound represented by the general formula (5) may be independently substituted with halogen or deuterium. )
- Item 25 An electron transport layer and / or an electron injection layer disposed between the cathode and the light emitting layer, wherein at least one of the electron transport layer and the electron injection layer is a borane derivative, a pyridine derivative, a fluoranthene derivative, BO Item 22 containing at least one selected from the group consisting of a series derivative, anthracene derivative, benzofluorene derivative, phosphine oxide derivative, pyrimidine derivative, carbazole derivative, triazine derivative, benzimidazole derivative, phenanthroline derivative, and quinolinol metal complex 25.
- the organic electroluminescence device as described in any one of 1 to 24.
- the electron transport layer and / or the electron injection layer further includes an alkali metal, an alkaline earth metal, a rare earth metal, an alkali metal oxide, an alkali metal halide, an alkaline earth metal oxide, or an alkaline earth metal.
- Item 25 contains at least one selected from the group consisting of halides, rare earth metal oxides, rare earth metal halides, alkali metal organic complexes, alkaline earth metal organic complexes, and rare earth metal organic complexes.
- Item 27 Item 27. A display device or illumination device comprising the organic electroluminescent element according to any one of Items 22 to 26.
- the organic EL characteristics such as the light emission characteristics can be further improved by using the polycyclic aromatic compound represented by the general formula (1), which has not been specifically known conventionally, or the light emitting layer.
- the choice of organic EL materials such as materials for use can be increased.
- the light emission characteristics in particular the half-value width of the emission spectrum, fluorescence quantum yield, delayed fluorescence lifetime, energy gap Eg and Delta] E ST and the like, according to a preferred embodiment of the present invention, any of these or Excellent effects are obtained in a plurality of characteristics, and when it has comprehensively excellent characteristics, it can be expected to be used as a thermally activated delayed fluorescent material.
- the polycyclic aromatic compound represented by the general formula (1) and a multimer thereof is a polycyclic aromatic compound represented by the following general formula (1) or a structure represented by the following general formula (1). Is a multimer of polycyclic aromatic compounds having a plurality of
- a light emitting material for an organic EL display three types of materials, ie, a fluorescent material, a phosphorescent material, and a thermally activated delayed fluorescence (TADF) material are used. About 5%.
- the phosphorescent material and the TADF material may have a luminous efficiency of 100%, but both have a problem of low color purity (wide emission spectrum width).
- the display expresses various colors by mixing the three primary colors of light, red, green, and blue. However, if the color purity of each color is low, colors that cannot be reproduced are produced, and the image quality of the display is reduced. Decrease significantly.
- the half-value width of the blue emission spectrum of a commercially available smartphone is about 20 to 25 nm, but the half-value width of a general fluorescent material is about 40 to 60 nm, the phosphorescent material is about 60 to 90 nm, and it is a TADF material. And about 70 to 100 nm.
- a fluorescent material it is sufficient to remove some unnecessary colors because the half width is relatively narrow.
- a phosphorescent material or a TADF material it is necessary to remove more than half. From such a background, development of a light emitting material having both luminous efficiency and color purity has been desired.
- a TADF material uses an electron-donating substituent called a donor and an electron-accepting substituent called an acceptor to localize HOMO and LUMO in the molecule, thereby efficiently performing an inverse intersystem crossing (reverse intersystem).
- a donor an electron-donating substituent
- an acceptor an electron-accepting substituent
- the use of donors and acceptors increases the structural relaxation in the excited state (in some molecules, the stable structure differs between the ground state and the excited state. If the conversion from the excited state to the excited state occurs, then the structure changes to a stable structure in the excited state), giving a broad emission spectrum with low color purity.
- Patent Document 6 International Publication No. WO 2015/1021178 proposes a new molecular design that dramatically improves the color purity of the TADF material.
- the compound (1-401) disclosed in this document by utilizing the multiple resonance effect of boron (electron-withdrawing) and nitrogen (electron-donating), three carbons on a benzene ring composed of six carbons.
- HOMO has been successfully localized in (black circle) and LUMO has been successfully localized in the remaining three carbons (white circles). Due to this efficient inverse intersystem crossing, the luminous efficiency of the compound reaches a maximum of 100%.
- boron and nitrogen of the compound (1-401) not only localize HOMO and LUMO, but also maintain a solid planar structure by condensing three benzene rings, thereby relaxing the structure in the excited state.
- the half-value width of the emission spectrum is 28 nm, which indicates a level of color purity that surpasses that of high-purity fluorescent materials that have been put into practical use.
- the dimer compound (1-422) two boron atoms and two nitrogen atoms are bonded to the central benzene ring, so that the multiple resonance effect is further enhanced in the central benzene ring. Light emission having a narrow emission peak width is possible.
- Compound (1-401) is Delta] E ST and excited singlet energy is an energy difference between the triplet energy is relatively small, high spin-orbit interaction flatness (Spin-Orbit Coupling: SOC) is less Therefore, the delayed fluorescence lifetime (Tau (Delay)) is long, and when used as a light-emitting material of an organic electroluminescence device using thermally activated delayed fluorescence (TADF), the efficiency is low or the roll-off is large. was there.
- the emission wavelength is long, away from the practical blue wavelength, and because of the high planarity, intermolecular stacking is performed. Because of this, the problem that the efficiency of the light emitting device is not sufficiently satisfactory was also born.
- the polycyclic aromatic compound represented by the general formula (1) of the present invention is represented by X 1 and X 2 as>O,>N—R,> S or>
- the electronegativity of the elements introduced into X 1 and X 2 affects the multiple resonance effect of the molecule. For example, if> O is introduced into X 1 and / or X 2 , the emission wavelength is generally shortened and the half-value width of the emission spectrum is increased compared to the introduction of> N—R.
- the polycyclic aromatic compound represented by the general formula (1) of the present invention has a linking group L that connects the c ring and the d ring.
- L conjugation extends and the planarity of the molecule increases.
- the overlap between the ground state and the excited state orbits increases, the transition probability increases, and the luminous efficiency increases.
- extending the conjugation leads to a longer emission wavelength.
- the condensed ring formed including the c ring, the d ring, and the linking group L changes in flatness and flexibility depending on the type of L. In some cases, the wavelength becomes longer. If the flexibility is high, the intermolecular stacking can be reduced, while the half-value width of the emission spectrum may be increased.
- the substituent of R 7 or R 8 is adjusted.
- the introduction of specific substituents distorts the molecule, which in turn distorts both singlet and triplet orbitals. This orbital distortion leads to a larger spin-orbit interaction, and the larger the spin-orbit interaction, the easier TADF occurs. Transition from triplet to singlet (or singlet to triplet) is accompanied by inversion of electron spin, but the change in orbital angular momentum is the same as that of electron spin between transition orbits by the law of conservation of energy and the law of conservation of angular momentum. is necessary.
- the emission wavelength and the half width of the emission spectrum are adjusted, the high emission efficiency and the short delayed fluorescence lifetime are realized, and in the device, the appropriate emission wavelength and It has become possible to realize a half width of the emission spectrum, high device efficiency, and small roll-off.
- the effect of the polycyclic aromatic compound of the present invention is not restricted by the above principle.
- R 1 to R 14 are each independently hydrogen, aryl, heteroaryl, diarylamino, diarylboryl (the two aryls are bonded via a single bond or a linking group). And at least one hydrogen in these is further aryl, heteroaryl, alkyl or cycloalkyl (above, the second substituent). ), And adjacent groups of R 1 to R 3 , R 4 to R 7 , R 8 to R 10 and R 11 to R 14 are bonded to each other to form a ring or b ring.
- C and d may form an aryl ring or a heteroaryl ring, and at least one hydrogen in the formed ring Is aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be bonded via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryloxy (above, the first substituent) May be substituted, and at least one hydrogen in these may be further substituted with aryl, heteroaryl, alkyl or cycloalkyl (or more, the second substituent), X is>O,>N—R,> S or> Se, and R in> N—R is aryl, heteroaryl, alkyl or cycloalkyl (hereinafter, the first substituent), and at least One hydrogen may be substituted with aryl, heteroaryl, alkyl or cycloalkyl (and above, the second substituent), L is a single bond,> C (—R) 2 ,>O
- the “aryl” (first substituent) such as R 1 is, for example, an aryl having 6 to 30 carbon atoms, preferably an aryl having 6 to 20 carbon atoms, more preferably an aryl having 6 to 16 carbon atoms, An aryl having 6 to 12 carbon atoms is more preferable, and an aryl having 6 to 10 carbon atoms is particularly preferable.
- aryls include monocyclic phenyl, bicyclic biphenylyl, condensed bicyclic naphthyl, tricyclic terphenylyl (m-terphenylyl, o-terphenylyl, p-terphenylyl), condensed Examples include tricyclic acenaphthylenyl, fluorenyl, phenalenyl, phenanthrenyl, fused tetracyclic triphenylenyl, pyrenyl, naphthacenyl, fused pentacyclic perylenyl, pentacenyl, and the like.
- heteroaryl (first substituent) such as R 1 is, for example, a heteroaryl having 2 to 30 carbon atoms, preferably a heteroaryl having 2 to 25 carbon atoms, more preferably a heteroaryl having 2 to 20 carbon atoms.
- heteroaryl having 2 to 15 carbon atoms is more preferable, and heteroaryl having 2 to 10 carbon atoms is particularly preferable.
- the heteroaryl is, for example, a heterocyclic ring containing 1 to 5 heteroatoms selected from oxygen, sulfur and nitrogen in addition to carbon as a ring constituent atom.
- heteroaryl includes, for example, pyrrolyl, oxazolyl, isoxazolyl, thiazolyl, isothiazolyl, imidazolyl, oxadiazolyl, thiadiazolyl, triazolyl, tetrazolyl, pyrazolyl, pyridinyl, pyrimidinyl, pyridazinyl, pyrazinyl, triazinyl, indolyl, isoindolyl, 1H-indazolyl, Benzimidazolyl, benzoxazolyl, benzothiazolyl, 1H-benzotriazolyl, quinolinyl, isoquinolinyl, cinnolinyl, quinazolinyl, quinoxalinyl, phthalazinyl, naphthyridinyl, purinyl, pteridinyl, carbazolyl, acridinyl, phenox
- aryl in the “diarylamino” (first substituent) such as R 1 and the “aryl” in the “aryloxy” (first substituent), the above description of aryl can be cited.
- alkyl (first substituent) such as R 1 may be either linear or branched, and is, for example, linear alkyl having 1 to 24 carbons or branched alkyl having 3 to 24 carbons.
- Alkyl having 1 to 18 carbons (branched alkyl having 3 to 18 carbons) is preferable, alkyl having 1 to 12 carbons (branched alkyl having 3 to 12 carbons) is more preferable, and alkyl having 1 to 6 carbons. (Branched alkyl having 3 to 6 carbon atoms) is more preferable, and alkyl having 1 to 4 carbon atoms (branched alkyl having 3 to 4 carbon atoms) is particularly preferable.
- alkyl examples include methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, s-butyl, t-butyl, n-pentyl, isopentyl, neopentyl, t-pentyl, n-hexyl, and 1-methyl.
- Pentyl 4-methyl-2-pentyl, 3,3-dimethylbutyl, 2-ethylbutyl, n-heptyl, 1-methylhexyl, n-octyl, t-octyl, 1-methylheptyl, 2-ethylhexyl, 2-propyl Pentyl, n-nonyl, 2,2-dimethylheptyl, 2,6-dimethyl-4-heptyl, 3,5,5-trimethylhexyl, n-decyl, n-undecyl, 1-methyldecyl, n-dodecyl, n- Tridecyl, 1-hexylheptyl, n-tetradecyl, n-pentadecyl, n-hexadecyl, n-hepta Sill, n- octadecyl, etc. n- eicosyl and the like.
- Cycloalkyl (the first substituent) such as R 1 is a cycloalkyl composed of one ring, a cycloalkyl composed of a plurality of rings, a cycloalkyl containing a double bond that is not conjugated within the ring, and a branch outside the ring. Any of the cycloalkyls may be included, for example, cycloalkyl having 3 to 24 carbon atoms, cycloalkyl having 3 to 20 carbon atoms, cycloalkyl having 3 to 16 carbon atoms, cycloalkyl having 3 to 14 carbon atoms, or 3 to 3 carbon atoms.
- cycloalkyl having 5 to 10 carbons, cycloalkyl having 5 to 8 carbons, cycloalkyl having 5 to 6 carbons, cycloalkyl having 5 carbons and the like.
- a cycloalkyl having 5 to 10 carbon atoms is preferred, and a cycloalkyl having 6 to 10 carbon atoms is more preferred.
- cycloalkyl examples include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl, cyclooctyl, cyclononyl, cyclodecyl, and alkyl (particularly methyl) substituents having 1 to 4 carbon atoms, norbornenyl, bicyclo [1 .0.1] butyl, bicyclo [1.1.1] pentyl, bicyclo [2.0.1] pentyl, bicyclo [1.2.1] hexyl, bicyclo [3.0.1] hexyl, bicyclo [2 1.2] heptyl, bicyclo [2.2.2] octyl, adamantyl, diamantyl, decahydronaphthalenyl, decahydroazulenyl and the like.
- Alkoxy (first substituent) such as R 1 is, for example, straight-chain alkoxy having 1 to 24 carbon atoms or branched alkoxy having 3 to 24 carbon atoms.
- C1-C18 alkoxy (C3-C18 branched alkoxy) is preferred, C1-C12 alkoxy (C3-C12 branched alkoxy) is more preferred, and C1-C6 Of alkoxy (C3-C6 branched chain alkoxy) is more preferable, and C1-C4 alkoxy (C3-C4 branched chain alkoxy) is particularly preferable.
- alkoxy examples include methoxy, ethoxy, propoxy, isopropoxy, butoxy, isobutoxy, s-butoxy, t-butoxy, pentyloxy, hexyloxy, heptyloxy, octyloxy and the like.
- aryl in the “diarylboryl” (first substituent) such as R 1
- first substituent such as R 1
- the two aryls may be bonded via a single bond or a linking group (eg,> C (—R) 2 ,>O,> S or> N—R).
- R in> C (—R) 2 and> N—R is aryl, heteroaryl, diarylamino, alkyl, cycloalkyl, alkoxy, or aryloxy (hereinafter, the first substituent), and the first At least one hydrogen in the substituent may be further substituted with aryl, heteroaryl, alkyl or cycloalkyl (hereinafter, the second substituent), and specific examples of these groups include R 1 and the like described above ( Reference may be made to the description of aryl, heteroaryl, diarylamino, alkyl, cycloalkyl, alkoxy or aryloxy as the first substituent).
- aryl, heteroaryl, alkyl or cycloalkyl (hereinafter referred to as second substituent) further substituted on R 1 etc. (first substituent), aryl, heteroaryl, alkyl or cycloalkyl as the first substituent described above Can be quoted.
- the emission wavelength can be adjusted by the steric hindrance, electron donating property, and electron withdrawing property of the structure of R 1 and the like (first substituent), preferably a group represented by the following structural formula More preferably, methyl, t-butyl, phenyl, o-tolyl, p-tolyl, 2,4-xylyl, 2,5-xylyl, 2,6-xylyl, 2,4,6-mesityl, diphenylamino , Di-p-tolylamino, bis (p- (t-butyl) phenyl) amino, carbazolyl, 3,6-dimethylcarbazolyl, 3,6-di-t-butylcarbazolyl and phenoxy, more preferably Is methyl, t-butyl, phenyl, o-tolyl, 2,6-xylyl, 2,4,6-mesityl, diphenylamino, di-p-tolylamino, bis (p)
- t-butyl, o-tolyl, p-tolyl, 2,4-xylyl, 2,5 -Xylyl, 2,6-xylyl, 2,4,6-mesityl, di-p-tolylamino, bis (p- (t-butyl) phenyl) amino, 3,6-dimethylcarbazolyl and 3,6-di- -T-Butylcarbazolyl is preferred.
- the a ′ ring, b ′ ring, c ′ ring and d ′ ring are the substituents R 1 to R 3 , substituents R 4 to R 7 , and substituents
- An aryl ring or heteroaryl ring formed by combining adjacent groups of R 8 to R 10 and substituents R 11 to R 14 together with at least one of a ring, b ring, c ring and d ring It can also be said to be a condensed ring formed by condensing another ring structure to the a-ring, b-ring, c-ring or d-ring).
- aryl ring (a ′ ring, b ′ ring, c ′ ring or d ′ ring) or “heteroaryl ring” (a ′ ring, b ′ ring, c ′ ring or d ′ ring) is A non-valent ring of aryl or heteroaryl as the first substituent.
- heteroaryl ring the total carbon of the condensed ring in which the 5-membered ring is condensed to the benzene ring Equation 6 is the lower limit carbon number.
- the compounds represented by formula (1-1) to formula (1-3) are, for example, a benzene ring, an indole ring, a pyrrole ring, a benzene ring which is a ring (b ring, c ring or d ring), A compound having an a ′ ring (b ′ ring, c ′ ring or d ′ ring) formed by condensation of a benzofuran ring or a benzothiophene ring, and the formed condensed ring a ′ (condensed ring b ′, condensed ring) c ′ or fused ring d ′) is a naphthalene ring, carbazole ring, indole ring, dibenzofuran ring or dibenzothiophene ring, respectively.
- Aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be linked via a single bond or a linking group), alkyl, substituted for at least one hydrogen in the formed aryl or heteroaryl ring , Cycloalkyl, alkoxy or aryloxy (above, the first substituent), and aryl, heteroaryl, alkyl or cycloalkyl (above, the second substituent) further substituted with at least one hydrogen in the first substituent
- the description of aryl, heteroaryl, diarylamino, diarylboryl, alkyl, cycloalkyl, alkoxy or aryloxy as R 1 or the like (first substituent) described above can be cited.
- X in the general formula (1) is> O,> N—R,> S or> Se, and preferably> O and> N—R.
- R—R of aryl, heteroaryl, alkyl or cycloalkyl (hereinafter, the first substituent), and aryl, heteroaryl, alkyl or cyclo further substituted with at least one hydrogen in the first substituent
- the alkyl the second substituent
- the description of aryl, heteroaryl, alkyl or cycloalkyl as R 1 or the like (first substituent) described above can be cited.
- L in the general formula (1) is a single bond,> C (—R) 2 ,>O,> S and> N—R, preferably a single bond,> O or> N—R, more preferably a single bond. preferable.
- the compound of the present invention does not include compounds in which X is> N—R and L is> O.
- the present invention is also a multimer of polycyclic aromatic compounds having a plurality of unit structures represented by the general formula (1).
- the multimer is preferably a dimer to hexamer, more preferably a dimer to trimer, and particularly preferably a dimer.
- the multimer may be in a form having a plurality of the unit structures in one compound.
- the unit structure is a single bond, an alkylene group having 1 to 3 carbon atoms (for example, a methylene group), a phenylene group, a naphthylene group.
- any ring (a-ring, b-ring, c-ring or d-ring) included in the unit structure is shared by a plurality of unit structures.
- the ring may be in the form of a ring (covalent ring-shaped multimer), and any ring (a ring, b ring, c ring or d ring) contained in the unit structure may be condensed with each other.
- ring-shared multimers and ring-fused multimers are preferable, and ring-shared multimers are more preferable.
- Examples of such multimers include the following general formula (1-4), formula (1-5-1), formula (1-5-2), formula (1-6-1) or formula (1- And a multimer represented by 6-2).
- the multimer represented by the following formula (1-4) has a plurality of (two in the following structural formula) general formulas so as to share a benzene ring that is a ring. It is a multimer (ring-sharing multimer) having the unit structure represented by (1) in one compound.
- the multimer represented by the following formula (1-5-1) or formula (1-5-2) may share a benzene ring which is a ring b as described in the general formula (1).
- the multimer represented by the following formula (1-6-1) or formula (1-6-2) can be described by general formula (1), for example, a ring (b ring, c Benzene ring that is a ring or d ring) and a benzene ring that is a ring (b ring, c ring or d ring) of a unit structure
- R 2 is hydrogen.
- the multimer is a multimer in which the multimerized form represented by the formula (1-4) and the multimerized form represented by the formula (1-5-1) or the formula (1-5-2) are combined.
- all or part of the hydrogen in the chemical structure of the polycyclic aromatic compound represented by the general formula (1) and its multimer may be substituted with cyano, halogen or deuterium.
- Halogen is fluorine, chlorine, bromine or iodine, preferably fluorine, chlorine or bromine, more preferably fluorine.
- one of R 7 and R 8 is halogen, alkyl having 1 to 6 carbon atoms, cycloalkyl having 3 to 14 carbon atoms, aryl having 6 to 10 carbon atoms, or 2 to
- the other is hydrogen, alkyl having 1 to 6 carbon atoms, cycloalkyl having 3 to 14 carbon atoms, aryl having 6 to 10 carbon atoms, or heteroaryl having 2 to 10 carbon atoms.
- R 7 in the b ring and R 8 in the c ring are not bonded to adjacent groups, and do not constitute a part of the formed aryl ring or heteroaryl ring.
- the “one” is preferably R 7 and the “other” is preferably R 8 .
- the characteristics of R 7 and R 8 will be described later in detail as the substituent group Z.
- the halogen of R 7 and R 8 is fluorine, chlorine, bromine or iodine. From the viewpoint of increasing the spin-orbit interaction due to the heavy atom effect, halogen having a large molecular weight is preferable, chlorine, bromine and iodine are preferable, chlorine and bromine are more preferable, and iodine is more preferable. From the viewpoint of deepening the HOMO / LUMO orbit by introducing an element having a high electronegativity, an element having a high electronegativity is preferable, fluorine, chlorine and bromine are preferable, fluorine and chlorine are more preferable, and fluorine is more preferable.
- the alkyl having 1 to 6 carbon atoms of R 7 and R 8 may be either linear or branched, and is preferably alkyl having 1 to 4 carbon atoms (branched alkyl having 3 to 4 carbon atoms). Specifically, methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, s-butyl, t-butyl, n-pentyl, isopentyl, neopentyl, t-pentyl, n-hexyl, 1-methylpentyl, 4-methyl-2-pentyl, 3,3-dimethylbutyl, 2-ethylbutyl and the like, more preferably methyl or t-butyl, and even more preferably methyl.
- R 7 and R 8 cycloalkyl having 3 to 14 carbon atoms include cycloalkyl having 5 to 10 carbon atoms, cycloalkyl having 5 to 8 carbon atoms, cycloalkyl having 5 to 6 carbon atoms, and cycloalkyl having 5 carbon atoms. Is preferred. Specifically, cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl, cyclooctyl, cyclononyl, cyclodecyl, and their alkyl (particularly methyl) substituents having 1 to 4 carbon atoms, norbornenyl, bicyclo [1.0.
- the aryl having 6 to 10 carbon atoms of R 7 and R 8 is specifically phenyl or naphthyl, and phenyl is preferable.
- R 7 and R 8 heteroaryl having 2 to 10 carbon atoms are specifically pyrrole, oxazolyl, isoxazolyl, thiazolyl, isothiazolyl, imidazolyl, oxadiazolyl, thiadiazolyl, triazolyl, tetrazolyl, pyrazolyl, pyridinyl, pyrimidinyl, pyridazinyl, pyrazinyl, Triazinyl, indolyl, isoindolyl, 1H-indazolyl, benzimidazolyl, benzoxazolyl, benzothiazolyl, 1H-benzotriazolyl, quinolinyl, isoquinolinyl, cinnolinyl, quinazolinyl, quinoxalinyl, phthalazinyl, naphthyridinyl, purinyl, pteridinyl, furinylyl Is
- R 7 and R 8, among the R 7 and R 8, one of halogen, alkyl having 1 to 4 carbon atoms, cycloalkyl or phenyl having 5 to 10 carbon atoms, and the other is hydrogen are preferably alkyl having 1 to 4 carbon atoms, cycloalkyl having 5 to 10 carbon atoms, or phenyl, and the smaller the sum of the molecular weights of R 7 and R 8 is preferable. More preferably, one is methyl, t-butyl or phenyl, and the other is hydrogen, methyl, t-butyl or phenyl. More preferably, one is methyl or t-butyl and the other is hydrogen or methyl. It is particularly preferred that one is methyl and the other is hydrogen or methyl. Most preferably, one is methyl and the other is hydrogen.
- the “one” is preferably R 7 and the “other” is preferably R 8 .
- R 5 in the symmetrical position of the R 7 is a group other than hydrogen, more preferably R 7 and R 5 are the same group.
- R 10 at the symmetrical position of R 8 is also preferably a group other than hydrogen, and R 8 and R 10 are more preferably the same group.
- the polycyclic aromatic compound and the multimer thereof according to the present invention can be used as a material for organic devices.
- an organic device an organic electroluminescent element, an organic field effect transistor, an organic thin film solar cell, etc. are mentioned, for example.
- a compound in which X is> N—R and a compound in which X is> O are preferable as a dopant material in the light emitting layer, and a compound in which X is> O as a host material in the light emitting layer.
- a compound in which X is> O as a host material in the light emitting layer.
- X in the general formula (1) is>O,>N—R,> S or> Se
- the general formula (1) is It is also described as general formula (BOL-1), formula (BNL-1), formula (BSL-1) or formula (BEL-1).
- BOL-1 general formula
- BNL-1 formula
- BSL-1 formula
- BEL-1 formula
- X is preferably> O or> N—R. More specifically,> O is preferable from the viewpoint of a short emission wavelength, and> N is preferable from the viewpoint of high luminous efficiency.
- the definitions of the symbols in the general formula representing the general structure of the compound are the same as those in the general formula (1).
- R 1 to R 14 are used for the sake of simplicity of expression. May be omitted. Such abbreviations are not used in formulas representing specific compound structures, not general formulas.
- “′” or “” ” may be added to the symbol representing the substituent or ring.
- the definition is the same as that of the general formula (1).
- R 4 in addition to “R 4 ”, “R ′ 4 ” or “R” 4 ”may be displayed.
- the definition of the symbol of is the same as the definition of R 4 in the general formula (1).
- the polycyclic aromatic compound of the general formula (1) may be a multimer sharing a to c rings, and may share one ring or plural rings. In the case of a multimer, it is preferable to share b ring or c ring, and it is more preferable to share b ring. Examples thereof include multimers of the following general formulas (20) to (25) and (30). Moreover, it is preferable that B (boron) which is a central element is a meta position mutually. From the viewpoint of synthesis, a highly symmetric structure is preferable. Specifically, multimers of the following general formulas (20), (22), (23), and (30) are preferable. From the viewpoint of characteristics, the following formula (22BOCz-0001) is preferable. When the multimeric structure has R 2 in the a ring, R ′ 2 in the a ′ ring and R ′′ 2 in the a ′′ ring, R 2 , R ′ 2 and / or R ′′ 2 is hydrogen.
- L is a single bond,> C (—R) 2 ,>O,> S and> N—R, and the general formula (BXCz-1) and the formula (BXAd-1) , (BXPx-1), (BXPt-1) and (BXPz-1).
- L is preferably a single bond and> C (—R) 2.
- L is preferably a single bond,> C (—R) 2 ,> O and> N—R. Is preferred. More specifically, the emission wavelength becomes longer due to the strong negative emission wavelength, and from the viewpoint of a shorter emission wavelength, a single bond and> C (—R) 2 are preferred.
- the formula (BXAd-1) when L is represented by> C ( ⁇ R) 2 , the formula (BXAd-1) is expressed by the formulas (BXAdM-1) and (BXAdP-1) from the viewpoint of luminous efficiency. And the formula (BXAdF-1) is preferred, and the formula (BXAdM-1) is more preferred from the viewpoint of synthesis.
- X is>O,>N—R,> S or> Se
- L is a single bond,> C (—R) 2 ,>O,> S and> N.
- -R respectively, general formula (BOCz-1), formula (BOAd-1), formula (BOPx-1), formula (BOPt-1), formula (BOPz-1), general formula (BNCz-1) , Formula (BNAd-1), Formula (BNPt-1), Formula (BNPz-1), General Formula (BSCz-1), Formula (BSAd-1), Formula (BSPx-1), Formula (BSPt-1) Formula (BSPz-1), Formula (BECz-1), Formula (BEAd-1), Formula (BEPx-1), Formula (BEPt-1), and Formula (BEPz-1).
- X is preferably> O or> N—R, and L is preferably a single bond or> C (—R) 2 .
- L is preferably a single bond,> C (—R) 2 ,> O and> N—R.
- X is preferably> O or> N—R, and L is preferably a single bond or> C (—R) 2 from the viewpoint of achieving both luminous efficiency and emission wavelength.
- the general formula (20BOCz-0001), the formula (22BOCz-0001), the formula (23BOCz-0001), the formula (30BOCz-0001), the formula (20BNCz- 0001), formula (22BNCz-0001), formula (20BOCz / NCz-0001) and formula (22BOCz / NCz-0001) are preferred.
- the formula (22BOCz-0001), the formula (22BNCz-0001) and the formula (22BOCz / NCz-0001) are preferable.
- R 1 to R 14 in the general formula (1) are each independently hydrogen, aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be bonded via a single bond or a linking group).
- At least one hydrogen in the ring formed may be aryl, heteroaryl, diarylamino, di Reylboryl (two aryls may be linked via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryloxy, wherein at least one hydrogen is further aryl, hetero It may be substituted with aryl, alkyl or cycloalkyl.
- R 1 to R 14 in the general formula (BOCz-1) have a substituent that is not hydrogen
- R 2 , R 3 , R 4 , R 5 , R 6 , R 9 , R 10 , R 11 , R 12 and R 13 can have any substituents and are synthesized.
- the substitution position is preferably R 2 , R 3 , R 4 , R 5 , R 6 , R 9 , R 12 and R 13 .
- the aromatic ring formed by the c ring, d ring and L in the general formula (1) (which can be formed as a partial structure of a carbazole ring, acridine ring, phenoxazine ring, phenothiazine ring and phenazine ring, respectively) is a ring- From the viewpoint of the difficulty of synthesis, it is preferable to have a substituent so as to be symmetric with respect to the N bond. That is, it is preferable that R 8 and R 13 , R 9 and R 12, and R 10 and R 11 have the same substituent.
- the general formula (BOCz-1) having a substituent at R 9 preferably has the same substituent at R 12 and is represented by the general formula (BOCz-09 ## S).
- a plurality of R 1 to R 14 in the general formula (1) may have a substituent.
- the substitution position is selected so that the steric hindrance is reduced.
- it may have a substituent at an adjacent position in the same ring, in this case, a group having a small steric hindrance is preferable, for example, a methyl group and a phenyl group are preferable.
- the number of substituents in R 1 to R 14 in the general formula (1) may be any number, but the total number of carbon atoms in the substituents of R 1 to R 14 is preferably 36 or less.
- R 4 to R 7 which are substituents on the b ring in the general formula (1) have a plurality of substituents, they are symmetrical with respect to the b ring-B bond or the b ring-X bond from the viewpoint of synthesis. It is preferable to have a substituent.
- R 2 in the general formula (1) has diarylamino, carbazolyl, acridinyl, phenoxazinyl, phenothiazinyl and phenazinyl, from the viewpoint of synthesis, it is adjacent to carbazolyl or the carbon atom bonded to N bonded to the a ring. These carbon atoms preferably have a substituent.
- R in N—R is preferably phenyl, biphenyl or terphenyl, more preferably phenyl.
- the general formula (BNpCz-0001) when R of> NR is phenyl, biphenyl or terphenyl, the general formula (BNpCz-0001), the formula (BNbCz-0001), the formula (BNcCz-0001), Formula (BNdCz-0001), Formula (BNeCz-0001), Formula (BNfCz-0001), Formula (BNgCz-0001), and Formula (BNhCz-0001).
- the formula (BNpCz-0001) is preferable.
- a compound having a substituent at the ortho position is preferred, and for example, the formula (BNbCz-0001), the formula (BNeCz-0001), the formula (BNfCz-0001) and the formula (BNgCz-0001) are preferred.
- R 1 to R 14 in the general formula (BNpCz-1) have a substituent that is not hydrogen
- R 2 , R 5 , R 6 , R 9 , R 10 , R 11 , R 12 and R 13 can have any substituent, and from the viewpoint of synthesis, the substitution position is R 2 , R 5 , R 6 , R 9 , R 12 and R 13 are preferred.
- the aromatic ring formed by the c ring, d ring and L in the general formula (1) (which can be formed as a partial structure of a carbazole ring, acridine ring, phenoxazine ring, phenothiazine ring and phenazine ring, respectively) is a ring- From the viewpoint of the difficulty of synthesis, it is preferable to have a substituent so as to be symmetric with respect to the N bond. That is, it is preferable that R 8 and R 13 , R 9 and R 12, and R 10 and R 11 have the same substituent.
- the general formula (BOCz-1) having a substituent at R 9 preferably has the same substituent at R 12 and is represented by the general formula (BOCz-09 ## S).
- a plurality of R 1 to R 14 in the general formula (1) may have a substituent.
- the substitution position is selected so that the steric hindrance is reduced.
- it may have a substituent at an adjacent position in the same ring, in this case, a group having a small steric hindrance is preferable, for example, a methyl group and a phenyl group are preferable.
- the number of substituents in R 1 to R 14 in the general formula (1) may be any number, but the total number of carbon atoms in the substituents of R 1 to R 14 is preferably 36 or less.
- R 4 to R 7 which are substituents on the b ring in the general formula (1) have a plurality of substituents, they are symmetrical with respect to the b ring-B bond or the b ring-X bond from the viewpoint of synthesis. It is preferable to have a substituent.
- R 2 in the general formula (1) has diarylamino, carbazolyl, acridinyl, phenoxazinyl, phenothiazinyl and phenazinyl, from the viewpoint of synthesis, it is adjacent to carbazolyl or the carbon atom bonded to N bonded to the a ring. These carbon atoms preferably have a substituent.
- a substituent which weakens a multiple resonance effect from a stability viewpoint.
- O From the viewpoint of shortening the emission wavelength, it is preferable to have a large amount of O, and from the viewpoint of increasing the wavelength, it is preferable to have a large amount of N.
- N Preferably who has many N from the viewpoint of enhancing the multi-resonance effects, generally Delta] E ST when strengthened multiple resonance effect decreases.
- O When the planarity is high, the luminous efficiency is increased.
- R 7 and / or R 8 is Z, and Z is halogen, alkyl having 1 to 6 carbons, cycloalkyl having 3 to 14 carbons, aryl having 6 to 10 carbons, or carbon Specific examples are heteroaryls of formula 2 to 10.
- both R 7 and R 8 are Z. From the viewpoint of obtaining high PLQY and the molecular stability, it is preferable that only one of R 7 and R 8 is Z. From the viewpoint of ease of synthesis, R 7 is preferably Z.
- R 7 when R 7 is Z, it is preferable to have a substituent on R 5.
- R 8 when R 8 is Z, it is preferable to have a substituent on R 10 and / or R 13.
- R 10 when R 10 is Z, it is preferable to have a substituent at R 8 and / or R 12 .
- the substituent is preferably smaller, and the above formula (m), formula (e), formula (v), formula (t), formula (h), formula (p) ), Formula (q), formula (r), formula (s), formula (j), formula (k), formula (f), formula (c), formula (b), formula (i) and formula (n) Among these, the groups of formula (m), formula (e), formula (v), formula (t), formula (p), formula (f) and formula (n) are more preferred, Groups of (m) and formula (t) are more preferred, and groups of formula (m) are most preferred.
- R 7 and / or R 8 are represented as follows.
- R 5 and / or R 13 have a substituent, particularly the same substitution as Z
- R 5 and / or R 13 it is represented as follows.
- R 5 and / or R 13 preferably have a substituent, particularly the same substitution as Z When having a group at R 5 and / or R 13 , it is represented as follows.
- general formula (BNpCz-7m-0001), formula (BNpCz-8m-0001), formula (BNpCz-12m-0001) and formula (BNpCz-21m-0001) are preferred, The general formula (BNpCz-7m-0001) and the formula (BNpCz-12m-0001) are more preferable.
- general formula (BNpCz-15m-0001), formula (BNpCz-20m-0001), formula (BNpCz-28m-0001) and formula (BNpCz-33m-0001) are preferable.
- the symmetry is high with respect to a-ring-X (here, N in N—R). That is, it is preferable to have substituents at the 3-position and 5-position with respect to N of phenyl in> N—R, specifically, it is better to have the same type of group as the substituent on the b ring. It is preferable to have a methyl group at the 3rd and 5th positions.
- R 7 preferably has a substituent on Z.
- R ′ 8 preferably has a substituent, and R 7 has a substituent on Z.
- the substituent is preferably smaller, and the above formula (m), formula (e), formula (v), formula (t), formula (h), formula (p) ), Formula (q), formula (r), formula (s), formula (j), formula (k), formula (f), formula (c), formula (b), formula (i) and formula (n)
- the groups of formula (m), formula (e), formula (v), formula (t), formula (p), formula (f) and formula (n) are more preferred, Groups of (m) and formula (t) are more preferred, and groups of formula (m) are most preferred.
- Substituent group Z may be introduced into R 8 . From the viewpoint of symmetry, R 7 preferably has a substituent.
- adjacent groups of R 1 to R 3 , R 4 to R 7 , R 8 to R 10 and R 11 to R 14 which are the following forms of the compound of the present invention, are bonded to each other.
- a polycyclic aromatic compound in which a condensed ring is formed together with a ring, b ring, c ring and / or d ring will be described.
- This compound is the compound described in the above general formula (1-1), formula (1-2) and formula (1-3). More specifically, examples thereof include compounds represented by the following general formula (1-1-1) in which adjacent groups of R 4 to R 7 are bonded to each other to form a b ′ ring together with a b ring.
- the b ′ ring is an aryl ring or a heteroaryl ring (preferably an aryl ring having 9 to 16 carbon atoms or a heteroaryl ring having 6 to 15 carbon atoms), for example, a naphthalene ring Phenanthrene ring, anthracene ring, dibenzofuran ring, carbazole ring, dibenzothiophene ring, silafluorene ring, fluorene ring, and a ring in which these rings are further condensed with a benzene ring, specifically, a ring represented by the following partial structure It is.
- * represents a bond with X and B
- Z is>O,>N—R,>S,> Si (—R) 2 or> C (—R) 2
- each ring The sign of the substituent to is omitted.
- Z is preferably>O,> N—R, and> C (—R) 2, more preferably> C (—R) 2 .
- a specific partial structure is shown below.
- Aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be linked via a single bond or a linking group), alkyl, substituted for at least one hydrogen in the formed aryl or heteroaryl ring , Cycloalkyl, alkoxy, aryloxy or R (or more, the first substituent), and aryl, heteroaryl, alkyl or cycloalkyl (or more, the second substitution) further substituting at least one hydrogen in the first substituent
- the description of aryl, heteroaryl, diarylamino, diarylboryl, alkyl, cycloalkyl, alkoxy or aryloxy as R 1 or the like (first substituent) described above can be cited.
- R of> C (—R) 2 is hydrogen, a methyl group, a phenyl group, or a phenyl group bonded to each other to form a spirofluorene group, it is represented by the following structural formula.
- the polycyclic aromatic compound represented by the general formula (1a), the formula (1b) or the formula (1c) including the ring represented by the partial structural formula (1a), the formula (1b) or the formula (1c) The multimers will be described more specifically.
- the partial structural formula (1a), formula (1b), or formula (1c) is a part of the general formula (1a), formula (1b), or formula (1c).
- the definition is the same as in general formula (1) (R 1b to R 6b are the same as the definitions of R 1 to R 14 ).
- X in the general formula (1a), the formula (1b) or the formula (1c) is>O,>N—R,> S or> Se, and the general formula (1a), the formula (1b) or the formula (1c)
- the general formula (1a), the formula (1b) or the formula (1c) is represented by the general formula (BOLa-1), the formula (BNLa-1), the formula (BSLa-1), respectively.
- Formula (BELa-1), Formula (BOLb-1), Formula (BNLb-1), Formula (BSLb-1), Formula (BELb-1), Formula (BOLc-1), Formula (BNLc-1) Are also described as formula (BSLc-1) or formula (BELc-1).
- X is preferably> O.
- R 1 to R 14 may be omitted for the sake of simplicity of expression. Such abbreviations are not used in formulas representing specific compound structures, not general formulas.
- R in> N—R is preferably phenyl, biphenyl, terphenyl, pyridine, pyrazine, pyrimidine or triazine, more preferably phenyl.
- R in> C (—R) 2 is preferably methyl, ethyl, isopropyl, t-butyl and phenyl, more preferably methyl.
- R in> C (—R) 2 may be bonded to each other to form an aryl ring, for example, spirofluorene.
- Z is> C (—R) 2 and R is a methyl group
- Z is represented by the general formula (BOLbC10-1) or formula (BOLcC10-1).
- Z is> N—R and R is a phenyl group
- Z is represented by the general formula (BOLbN20-1) or formula (BOLcN20-1).
- L is preferably a single bond.
- L is preferably a single bond,> C (—R) 2 ,> O and> N—R.
- L is preferably a single bond.
- R 1 to R 5 , R 7 to R 14 and R 1b to R 6b in the general formula (1-1-1), the formula (1a), the formula (1b), and the formula (1c), and> N—R ,> C (—R) 2 and> Si (—R) 2 are each independently hydrogen, aryl, heteroaryl, diarylamino, diarylboryl (2) as in formula (1).
- Two aryls may be linked via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryloxy, wherein at least one hydrogen is further substituted with aryl, heteroaryl, alkyl or cycloalkyl may be, also, R 1 ⁇ R 3, a ring adjacent groups are bonded to one of R 8 ⁇ R 10 and R 11 ⁇ R 14, the c ring and d ring At least one hydrogen in the ring formed may be aryl, heteroaryl, diarylamino, diarylboryl (two aryls may be a single bond or a linking group).
- Optionally substituted by alkyl, cycloalkyl, alkoxy or aryloxy, and at least one hydrogen in these may be further substituted by aryl, heteroaryl, alkyl or cycloalkyl Good.
- R 1 to R 5 , R 8 to R 14 and R b1 to R b4 are hydrogen
- R 1 to R 4 , R 7 to R 14 and R b1 to R b4 are hydrogen
- R 1 to R 4 , R 7 to R 14 and R b1 to R b6 are hydrogen
- R 1 to R 5 , R 8 to R 14, and R b1 to R b4 in the general formula (BOCza-1) have a substituent that is not hydrogen, for example, the following structural formula can be given.
- R 2 , R 3 , R 4 , R 5 , R 9 , R 10 , R 11 , R 12 , R 13 and R 14 can have any substituent, and From the viewpoint, the substitution position is preferably R 2 , R 5 , R 9 , R 10 , R 12 , R 13 and R 14 .
- the substituent is preferably a nitrogen atom.
- Specific substituents are preferably diphenylamine, carbazole and phenoxazine, more preferably diphenylamine and carbazole, and further preferably diphenylamine.
- the hydrogen atom in the diphenylamine carbazole and phenoxazine may be substituted with aryl, heteroaryl, alkyl or cycloalkyl.
- the substitution position is preferably substituted at the para position with respect to the boron atom. Specifically, R 2 , R 5 and R 10 are preferred, R 2 and R 5 are more preferred, and R 5 is more preferred.
- R 1 to R 4 , R 7 to R 14, and R b1 to R b4 in the general formula (BOCzb-1) have a substituent that is not hydrogen, for example, the following structural formula can be given.
- R 2 , R 3 , R 4 , R 9 , R 10 , R 11 , R 12 , R 13 and R 14 can have any substituent, and are substituted from the viewpoint of synthesis.
- the position is preferably R 2 , R 9 , R 12 , R 13 and R 14 .
- the substituent is preferably a nitrogen atom.
- substituents are preferably diphenylamine, carbazole and phenoxazine, more preferably diphenylamine and carbazole, and further preferably diphenylamine.
- the hydrogen atom in the diphenylamine carbazole and phenoxazine may be substituted with aryl, heteroaryl, alkyl or cycloalkyl.
- the substitution position is preferably para-position or at least one of R 1b to R 4b with respect to the boron atom.
- R 2 , R 10 , R 1b , R 2b , R 3b and R 4b is preferred, R 2 and R 3b are more preferred, and R 3b is more preferred.
- R 1 to R 4 , R 7 to R 14, and R b1 to R b6 in the general formula (BOCzc-1) have a substituent that is not hydrogen, for example, the following structural formula can be given.
- R 2 , R 3 , R 4 , R 9 , R 10 , R 11 , R 12 , R 13 and R 14 can have any substituent, and are substituted from the viewpoint of synthesis.
- the position is preferably R 2 , R 9 , R 12 , R 13 and R 14 .
- the substituent is preferably a nitrogen atom.
- Specific substituents are preferably diphenylamine, carbazole and phenoxazine, more preferably diphenylamine and carbazole, and further preferably diphenylamine.
- the hydrogen atom in the diphenylamine carbazole and phenoxazine may be substituted with aryl, heteroaryl, alkyl or cycloalkyl.
- the substitution position is preferably a para-position relative to the boron atom or R 5b or R 6b . Specifically, R 2 , R 10 and R 5b are preferred, and R 2 and R 5b are more preferred. R 5b is more preferred.
- the wavelength can be shortened by including an atom having a large electronegativity in R in> NR.
- R in the general formula (BNL-1)> N—R is aryl or heteroaryl, and the aryl or heteroaryl bonded to the nitrogen atom is an atom having a greater electronegativity than at least one carbon. Is more preferable, and at least one fluorine atom is more preferable.
- the aryl or heteroaryl bonded to the nitrogen atom connecting the a ring and the b ring has many atoms having a large electronegativity, and the nitrogen atom connecting the a ring and the b ring.
- the nitrogen atom in the partial structural formula represents a nitrogen atom connecting the a ring and the b ring.
- the effect of shortening the wavelength is greatest in the partial structural formula (Pf).
- Formula (F2), Formula (F4), Formula (F24), Formula (F26), and Formula (F246) are preferable, and Formula (F2), Formula (F24), and Formula (F26) are preferable. More preferred is formula (F26).
- R of> N—R in the general formula (BNpCz-1) is the formula (F26)
- the following structural formula can be given.
- R 2 , R 5 , R 6 , R 9 , R 10 , R 11 , R 12 and R 13 can have any substituent, and the substitution position is R from the viewpoint of synthesis. 2 , R 5 , R 6 , R 9 , R 12 and R 13 are preferred.
- R 2 , R 5 , R 6 , R 9 and R 12 must have an alkyl group or cycloalkyl group for ease of synthesis, further shortening of the emission wavelength, high luminous efficiency and high TADF activity. Is preferred.
- the above substitution can suppress aggregation of the compound by introducing a flexible substituent or a substituent having a large steric hindrance. It is preferable to have an aryl group in R 2 , R 5 , R 6 , R 9 and R 12 for ease of synthesis, longer emission wavelength, and very high emission efficiency. The introduction of an aryl group gives high luminous efficiency.
- a diarylamine group and a carbazolyl group in R 2 and R 5 for shortening the emission wavelength, very high luminous efficiency, and high TADF activity. Considering the symmetry of the molecule, the easiness of synthesis can be improved also in a diarylamine group and a carbazolyl group.
- polycyclic aromatic compound represented by the general formula (1) and its multimer are synthesized by applying the method disclosed in, for example, International Publication No. 2015/102118. be able to. That is, as shown in the following scheme, an intermediate having a linking group L is synthesized and cyclized by a tandem hetero Friedel-Crafts reaction (continuous aromatic electrophilic substitution reaction) to produce a desired polycyclic aromatic compound. Compounds and their multimers can be synthesized. In the following scheme, Y represents halogen or hydrogen, and the definitions of the other symbols are the same as those described above.
- the intermediate before cyclization in the above scheme can also be synthesized by the method shown in International Publication No. 2015/102118. That is, an intermediate having a desired substituent can be synthesized by appropriately combining Buchwald-Hartwig reaction, Suzuki coupling reaction, or etherification reaction such as nucleophilic substitution reaction or Ullmann reaction.
- the cyclization by the tandem hetero Friedel-Crafts reaction shown in the above scheme is a reaction for introducing B (boron) that binds a ring, b ring and c ring.
- B boron
- N nitrogen
- Y hydrogen atom
- boron trichloride, boron tribromide, etc. are added, and after lithium-boron metal exchange is performed, Bronsted base such as N, N-diisopropylethylamine is added to cause tandem Bora Friedel-Crafts reaction. You can get things.
- a Lewis acid such as aluminum trichloride may be added to promote the reaction.
- a halogen such as a bromine atom can be introduced at a position where lithium is to be introduced, and lithium can be introduced to the desired position by halogen-metal exchange. it can.
- cyclization by tandem hetero Friedel-Crafts reaction can be performed without going through orthometalation of Y (hydrogen atom) between X and N (nitrogen) in the above scheme.
- a Bronsted base such as N, N-diisopropylethylamine and / or a Lewis acid such as aluminum trichloride may be added to promote the reaction.
- the compound can also be synthesized by the above-described method using a raw material that matches the target product.
- “Me” in the chemical structural formulas exemplified hereinafter for organic devices represents a methyl group
- tBu represents a t-butyl group.
- the polycyclic aromatic compound according to the present invention can be used as a material for organic devices.
- an organic device an organic electroluminescent element, an organic field effect transistor, an organic thin film solar cell, etc. are mentioned, for example.
- FIG. 1 is a schematic cross-sectional view showing an organic EL element according to this embodiment.
- An organic electroluminescent device 100 shown in FIG. 1 includes a substrate 101, an anode 102 provided on the substrate 101, a hole injection layer 103 provided on the anode 102, and a hole injection layer 103.
- the cathode 108 provided on the electron injection layer 107.
- the organic electroluminescent element 100 is manufactured in the reverse order, for example, the substrate 101, the cathode 108 provided on the substrate 101, the electron injection layer 107 provided on the cathode 108, and the electron injection layer.
- a structure including the hole injection layer 103 provided above and the anode 102 provided on the hole injection layer 103 may be employed.
- each said layer may consist of a single layer, respectively, and may consist of multiple layers.
- the substrate 101 is a support for the organic electroluminescent element 100, and usually quartz, glass, metal, plastic, or the like is used.
- the substrate 101 is formed into a plate shape, a film shape, or a sheet shape according to the purpose.
- a glass plate, a metal plate, a metal foil, a plastic film, a plastic sheet, or the like is used.
- glass plates and transparent synthetic resin plates such as polyester, polymethacrylate, polycarbonate, polysulfone and the like are preferable.
- soda lime glass, non-alkali glass, or the like is used, and the thickness only needs to be sufficient to maintain the mechanical strength.
- the upper limit value of the thickness is, for example, 2 mm or less, preferably 1 mm or less.
- the glass material is preferably alkali-free glass because it is better to have less ions eluted from the glass.
- soda lime glass with a barrier coat such as SiO 2 is also commercially available, so it can be used. it can.
- the substrate 101 may be provided with a gas barrier film such as a dense silicon oxide film on at least one surface in order to improve the gas barrier property, and a synthetic resin plate, film or sheet having a low gas barrier property is used as the substrate 101. When used, it is preferable to provide a gas barrier film.
- the anode 102 serves to inject holes into the light emitting layer 105.
- the hole injection layer 103 and / or the hole transport layer 104 are provided between the anode 102 and the light emitting layer 105, holes are injected into the light emitting layer 105 through these layers. .
- Examples of the material for forming the anode 102 include inorganic compounds and organic compounds.
- Examples of inorganic compounds include metals (aluminum, gold, silver, nickel, palladium, chromium, etc.), metal oxides (indium oxide, tin oxide, indium-tin oxide (ITO), indium-zinc oxide) Products (IZO), metal halides (copper iodide, etc.), copper sulfide, carbon black, ITO glass, Nesa glass, and the like.
- Examples of the organic compound include polythiophene such as poly (3-methylthiophene), conductive polymer such as polypyrrole and polyaniline, and the like. In addition, it can select suitably from the substances currently used as an anode of an organic electroluminescent element, and can use it.
- the resistance of the transparent electrode is not limited as long as it can supply a sufficient current for light emission of the light emitting element, but is preferably low resistance from the viewpoint of power consumption of the light emitting element.
- an ITO substrate of 300 ⁇ / ⁇ or less functions as an element electrode, but at present, since it is possible to supply a substrate of about 10 ⁇ / ⁇ , for example, 100 to 5 ⁇ / ⁇ , preferably 50 to 5 ⁇ . It is particularly desirable to use a low resistance product of / ⁇ .
- the thickness of ITO can be arbitrarily selected according to the resistance value, but is usually used in a range of 50 to 300 nm.
- the hole injection layer 103 plays a role of efficiently injecting holes moving from the anode 102 into the light emitting layer 105 or the hole transport layer 104.
- the hole transport layer 104 serves to efficiently transport holes injected from the anode 102 or holes injected from the anode 102 via the hole injection layer 103 to the light emitting layer 105.
- the hole injection layer 103 and the hole transport layer 104 are each formed by laminating and mixing one kind or two or more kinds of hole injection / transport materials or a mixture of the hole injection / transport material and the polymer binder. Is done.
- an inorganic salt such as iron (III) chloride may be added to the hole injection / transport material to form a layer.
- a hole injection / transport material As a hole injection / transport material, it is necessary to efficiently inject and transport holes from the positive electrode between electrodes to which an electric field is applied. The hole injection efficiency is high, and the injected holes are transported efficiently. It is desirable to do. For this purpose, it is preferable to use a substance that has a low ionization potential, a high hole mobility, excellent stability, and is less likely to generate trapping impurities during production and use.
- a compound conventionally used as a charge transport material for holes, a p-type semiconductor, and a hole injection of an organic electroluminescent element are used. Any compound can be selected and used from known compounds used in the layer and the hole transport layer.
- carbazole derivatives N-phenylcarbazole, polyvinylcarbazole, etc.
- biscarbazole derivatives such as bis (N-arylcarbazole) or bis (N-alkylcarbazole)
- triarylamine derivatives aromatic tertiary class
- polycarbonates, styrene derivatives, polyvinylcarbazole, polysilanes, etc. having the aforementioned monomers in the side chain are preferred, but light emitting devices There is no particular limitation as long as it is a compound that can form a thin film necessary for the fabrication, inject holes from the anode, and further transport holes.
- organic semiconductors are strongly influenced by the doping.
- Such an organic semiconductor matrix material is composed of a compound having a good electron donating property or a compound having a good electron accepting property.
- Strong electron acceptors such as tetracyanoquinone dimethane (TCNQ) or 2,3,5,6-tetrafluorotetracyano-1,4-benzoquinone dimethane (F4TCNQ) are known for doping of electron donor materials.
- TCNQ tetracyanoquinone dimethane
- F4TCNQ 2,3,5,6-tetrafluorotetracyano-1,4-benzoquinone dimethane
- the light-emitting layer 105 is a layer that emits light by recombining holes injected from the anode 102 and electrons injected from the cathode 108 between electrodes to which an electric field is applied.
- the material for forming the light-emitting layer 105 may be a compound that emits light by being excited by recombination of holes and electrons (a light-emitting compound), can form a stable thin film shape, and is in a solid state It is preferable that the compound exhibits a strong light emission (fluorescence) efficiency.
- the polycyclic aromatic compound represented by the said General formula (1) can be used as a material for light emitting layers.
- the light emitting layer may be either a single layer or a plurality of layers, each formed of a light emitting layer material (host material, dopant material). Each of the host material and the dopant material may be one kind or a plurality of combinations.
- the dopant material may be included in the host material as a whole, or may be included partially.
- As a doping method it can be formed by a co-evaporation method with a host material. However, it can be formed by a wet film formation method after being pre-mixed with a host material and simultaneously vapor-depositing or pre-mixed with an organic solvent and a host material. A film may be formed.
- the amount of host material used depends on the type of host material and can be determined according to the characteristics of the host material.
- the standard of the amount of the host material used is preferably 50 to 99.999% by weight of the entire light emitting layer material, more preferably 80 to 99.95% by weight, and still more preferably 90 to 99.9% by weight. It is.
- the amount of dopant material used depends on the type of dopant material, and can be determined according to the characteristics of the dopant material.
- the standard of the amount of dopant used is preferably 0.001 to 50% by weight, more preferably 0.05 to 20% by weight, and further preferably 0.1 to 10% by weight of the entire material for the light emitting layer. is there.
- the above range is preferable in that, for example, the concentration quenching phenomenon can be prevented.
- an organic electroluminescent device using a thermally activated delayed fluorescent dopant material a lower concentration of dopant material is preferable in terms of preventing concentration quenching, but a higher amount of dopant material is used.
- the concentration is preferable from the viewpoint of the efficiency of the thermally activated delayed fluorescence mechanism.
- the dopant material is used in comparison with the amount of the assist dopant material used in terms of the efficiency of the thermally activated delayed fluorescence mechanism of the assist dopant material. It is preferable that the amount used is a low concentration.
- the indications of the host material, the assist dopant material, and the dopant material are 40 to 99.999 wt%, 59 to 1 wt%, and 20 to 20 wt% of the entire light emitting layer material, respectively. 0.001% by weight, preferably 60 to 99.99%, 39 to 5% by weight, and 10 to 0.01% by weight, and more preferably 70 to 99.95% and 29 to 10%, respectively. % By weight and 5 to 0.05% by weight.
- the compound according to the present invention and the polymer compound thereof can also be used as an assist dopant material.
- Host materials include fused ring derivatives such as anthracene and pyrene that have been known as light emitters, bisstyryl derivatives such as bisstyrylanthracene derivatives and distyrylbenzene derivatives, tetraphenylbutadiene derivatives, cyclopentadiene derivatives, fluorene derivatives, benzones Examples include fluorene derivatives.
- the T1 energy of the host material is preferably higher than the T1 energy of the dopant having the highest T1 energy in the light emitting layer or the assist dopant from the viewpoint of promoting without inhibiting the generation of TADF in the light emitting layer.
- the T1 energy of the host is preferably 0.01 eV or more, more preferably 0.03 eV or more, and further preferably 0.1 eV or more.
- a TADF active compound may be used as the host material.
- Examples of the host material include a compound represented by the following general formula (3) and a compound represented by the following general formula (4).
- it is a compound represented by General formula (3).
- L 1 is arylene having 6 to 30 carbon atoms or heteroarylene having 2 to 30 carbon atoms, preferably arylene having 6 to 24 carbon atoms, more preferably arylene having 6 to 16 carbon atoms, Arylene having 6 to 12 carbon atoms is more preferable, arylene having 6 to 10 carbon atoms is particularly preferable, heteroarylene having 2 to 25 carbon atoms is preferable, heteroarylene having 2 to 20 carbon atoms is more preferable, and carbon number 2 A heteroarylene having ⁇ 15 is more preferred, and a heteroarylene having 2 to 10 carbon atoms is particularly preferred.
- arylene examples include divalent benzene rings, biphenyl rings, naphthalene rings, terphenyl rings, acenaphthylene rings, fluorene rings, phenalene rings, phenanthrene rings, triphenylene rings, pyrene rings, naphthacene rings, perylene rings, and pentacene rings.
- the group of is mentioned.
- heteroarylene examples include pyrrole ring, oxazole ring, isoxazole ring, thiazole ring, isothiazole ring, imidazole ring, oxadiazole ring, thiadiazole ring, triazole ring, tetrazole ring, pyrazole ring, pyridine ring, Pyrimidine ring, pyridazine ring, pyrazine ring, triazine ring, indole ring, isoindole ring, 1H-indazole ring, benzimidazole ring, benzoxazole ring, benzothiazole ring, 1H-benzotriazole ring, quinoline ring, isoquinoline ring, cinnoline ring Quinazoline ring, quinoxaline ring, phthalazine ring, naphthyridine ring, purine ring, pteridine ring, carb
- L 2 and L 3 are each independently aryl having 6 to 30 carbon atoms or heteroaryl having 2 to 30 carbon atoms.
- aryl having 6 to 24 carbon atoms is preferable, aryl having 6 to 16 carbon atoms is more preferable, aryl having 6 to 12 carbon atoms is further preferable, aryl having 6 to 10 carbon atoms is particularly preferable, specifically Includes monovalent groups such as benzene ring, biphenyl ring, naphthalene ring, terphenyl ring, acenaphthylene ring, fluorene ring, phenalene ring, phenanthrene ring, triphenylene ring, pyrene ring, naphthacene ring, perylene ring, and pentacene ring.
- heteroaryl a heteroaryl having 2 to 25 carbon atoms is preferable, a heteroaryl having 2 to 20 carbon atoms is more preferable, a heteroaryl having 2 to 15 carbon atoms is more preferable, and a heteroaryl having 2 to 10 carbon atoms is particularly preferable Specifically, pyrrole ring, oxazole ring, isoxazole ring, thiazole ring, isothiazole ring, imidazole ring, oxadiazole ring, thiadiazole ring, triazole ring, tetrazole ring, pyrazole ring, pyridine ring, pyrimidine ring, Pyridazine ring, pyrazine ring, triazine ring, indole ring, isoindole ring, 1H-indazole ring, benzimidazole ring, benzoxazole ring, benzothiazole ring, 1H
- R 1 to R 11 are each independently hydrogen, aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino, diarylboryl (two aryls are bonded via a single bond or a linking group). And at least one hydrogen in these is further aryl, heteroaryl, diarylamino, diarylboryl (two aryls are a single bond or a linking group).
- R 1 to R 11 may be bonded to form an aryl ring or a heteroaryl ring together with a ring, b ring or c ring, and at least one hydrogen in the formed ring is Aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino, diarylboryl (two aryls may be linked via a single bond or a linking group), alkyl or cycloalkyl (above, first The at least one hydrogen in these may further be aryl, heteroaryl, diarylamino, diarylboryl (the two aryls may be bonded via a single bond or a linking group), May be substituted with alkyl or cycloalkyl (above, the second substituent), At least one hydrogen in the compound represented by the formula (5) may be independently substituted
- R 1 to R 11 are each independently hydrogen, aryl having 6 to 30 carbon atoms, heteroaryl having 2 to 30 carbon atoms, diarylamino (wherein aryl is aryl having 6 to 12 carbon atoms), diarylboryl (provided that Each aryl is an aryl having 6 to 12 carbon atoms, and two aryls may be bonded via a single bond or a linking group), an alkyl having 1 to 12 carbons or a cycloalkyl having 3 to 16 carbon atoms In which at least one hydrogen is further aryl having 6 to 30 carbon atoms, heteroaryl having 2 to 30 carbon atoms, diarylamino (where aryl is aryl having 6 to 12 carbon atoms), diarylboryl (where each aryl is carbon An aryl having a number of 6 to 12, and the two aryls may be bonded via a single bond or a linking group), a carbon number of 1 to May be substituted
- At least one hydrogen in the ring formed is aryl having 6 to 30 carbon atoms, heteroaryl having 2 to 30 carbon atoms, diarylamino (where aryl is aryl having 6 to 12 carbon atoms), diarylboryl (where each aryl is Is an aryl having 6 to 12 carbons, and the two aryls may be bonded via a single bond or a linking group), and substituted with an alkyl having 1 to 12 carbons or a cycloalkyl having 3 to 16 carbons And at least one hydrogen in them may further be aryl having 6 to 30 carbon atoms, heteroaryl having 2 to 30 carbon atoms, or diarylamino (provided that Is aryl having 6 to 12 carbon atoms), diarylboryl (where each aryl is aryl having 6 to 12 carbon atoms, and two aryls may be bonded via a single bond or a linking group), It may be substituted with 1 to 12 alkyl or cycloalkyl
- R 1 to R 11 are each independently hydrogen, aryl having 6 to 16 carbon atoms, heteroaryl having 2 to 15 carbon atoms, diarylamino (wherein aryl is aryl having 6 to 10 carbon atoms), diarylboryl (provided that Each aryl is an aryl having 6 to 10 carbon atoms, and two aryls may be bonded via a single bond or a linking group), an alkyl having 1 to 6 carbon atoms or a cycloalkyl having 3 to 14 carbon atoms And at least one hydrogen in these is further aryl having 6 to 16 carbon atoms, heteroaryl having 2 to 15 carbon atoms, diarylamino (where aryl is aryl having 6 to 10 carbon atoms), diarylboryl (where each aryl is carbon An aryl having a number of 6 to 10, and two aryls may be bonded via a single bond or a linking group), and a carbon number of 1 to 6
- At least one hydrogen in the ring formed is aryl having 6 to 16 carbon atoms, heteroaryl having 2 to 15 carbon atoms, diarylamino (where aryl is aryl having 6 to 10 carbon atoms), diarylboryl (where each aryl is Is an aryl having 6 to 10 carbon atoms, and the two aryls may be bonded via a single bond or a linking group), and substituted with an alkyl having 1 to 6 carbon atoms or a cycloalkyl having 3 to 14 carbon atoms And at least one hydrogen in them may further be aryl having 6 to 16 carbon atoms, heteroaryl having 2 to 15 carbon atoms, or diarylamino (but aryl Is aryl having 6 to 10 carbon atoms), diarylboryl (wherein each aryl is aryl having 6 to 10 carbon atoms, and two aryls may be bonded via a single bond or a linking group), 1 carbon atom It may be substituted with
- aryl and “heteroaryl” in aryl, heteroaryl, diarylamino, diheteroarylamino and arylheteroarylamino include the following examples.
- aryl include aryl having 6 to 30 carbon atoms, aryl having 6 to 24 carbon atoms is preferable, aryl having 6 to 20 carbon atoms is more preferable, and aryl having 6 to 16 carbon atoms is preferable. Is more preferable, aryl having 6 to 12 carbon atoms is particularly preferable, and aryl having 6 to 10 carbon atoms is most preferable.
- heteroaryl examples include heteroaryl having 2 to 30 carbon atoms, preferably heteroaryl having 2 to 25 carbon atoms, more preferably heteroaryl having 2 to 20 carbon atoms, and 2 carbon atoms.
- a heteroaryl having ⁇ 15 is more preferred, and a heteroaryl having 2 to 10 carbons is particularly preferred.
- the “alkyl” may be either a straight chain or a branched chain, for example, a straight chain alkyl having 1 to 24 carbon atoms or a branched chain alkyl having 3 to 24 carbon atoms.
- a straight chain alkyl having 1 to 24 carbon atoms or a branched chain alkyl having 3 to 24 carbon atoms Preferred are alkyl having 1 to 18 carbon atoms (branched alkyl having 3 to 18 carbon atoms), more preferred are alkyl having 1 to 12 carbon atoms (branched alkyl having 3 to 12 carbon atoms), and 1 to 1 carbon atoms are preferred.
- alkyls (branched alkyls having 3 to 6 carbon atoms) are more preferred, alkyls having 1 to 4 carbon atoms (branched alkyls having 3 to 4 carbon atoms) are particularly preferred, and methyl is most preferred.
- cycloalkyl is cycloalkyl having 3 to 24 carbon atoms, cycloalkyl having 3 to 20 carbon atoms, cycloalkyl having 3 to 16 carbon atoms, 3 to 14 cycloalkyl, cycloalkyl having 5 to 10 carbon atoms, cycloalkyl having 5 to 8 carbon atoms, cycloalkyl having 5 to 6 carbon atoms, cycloalkyl having 5 carbon atoms and the like.
- cycloalkyl examples include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, cycloheptyl, cyclooctyl, cyclononyl, cyclodecyl, and alkyl (particularly methyl) substituents having 1 to 4 carbon atoms, norbornenyl, bicyclo [1 .0.1] butyl, bicyclo [1.1.1] pentyl, bicyclo [2.0.1] pentyl, bicyclo [1.2.1] hexyl, bicyclo [3.0.1] hexyl, bicyclo [2 1.2] heptyl, bicyclo [2.2.2] octyl, adamantyl, diamantyl, decahydronaphthalenyl, decahydroazulenyl and the like.
- aryl in “diarylboryl”, the above-mentioned explanation of aryl can be cited.
- the two aryls may be bonded via a single bond or a linking group (eg,> C (—R) 2 ,>O,> S or> N—R).
- R in> C (—R) 2 and> N—R is aryl, heteroaryl, diarylamino, alkyl or cycloalkyl (hereinafter, the first substituent), and at least one of the first substituents
- Two hydrogens may be further substituted with aryl, heteroaryl, alkyl or cycloalkyl (hereinafter, the second substituent). Specific examples of these groups include the first substituent and the second substituent described above. Reference may be made to aryl, heteroaryl, diarylamino, alkyl or cycloalkyl as.
- the substitution position is preferably R 1 , R 3 , R 4 , R 5 , R 10 and R 11 , for example, substitution to R 1 and R 3, to R 5 and R 10 Of R 4 and R 11 are more preferred, and aryl is preferably a phenyl group.
- the substitution position is preferably R 1 , R 2 , R 3 , R 4 , R 5 , R 6 , R 9 , R 10 and R 11 , for example, substitution to R 1 , R 2 substitution, R 3 substitution, R 1 and R 3 substitution, R 4 and R 11 substitution, R 5 and R 10 substitution, R 6 and R 9 substitution and more.
- heteroaryl is preferably a carbazolyl group. This heteroaryl (eg, carbazolyl) may be substituted at the above position via a phenylene group.
- an a to c ring is bonded with a linking group (—O—) to produce an intermediate (first reaction), and then the a to c ring is converted to B (
- the final product can be produced by bonding with boron) (second reaction).
- first reaction for example, a general etherification reaction such as a nucleophilic substitution reaction or an Ullmann reaction can be used.
- second reaction a tandem hetero Friedel-Crafts reaction (continuous aromatic electrophilic substitution reaction) can be used.
- the details of the first and second reactions can be referred to the explanation described in International Publication No. 2015/102118.
- host materials other examples include Advanced Materials, 2017, 29, 1605444, Journal of Materials, Chemistry, C, 2016, 4, 11355-11381, Chemical, Science, 2016, 7, 7, 3355-3363, Thin Solid.
- the host materials described in Films, 2016, 619, 120-124, etc. can be used.
- the host material for the phosphorescent organic EL element described in Chemistry Society Reviews, 2011,40,2943-2970 is also a TADF organic EL. It can be used as a host material for an element.
- the host compound is a compound having at least one structure selected from the partial structure (HA) group represented by the following formula, and each of the host compounds in the partial structure (HA) group: At least one hydrogen atom in the structure may be substituted with any structure in the partial structure (HA) group or partial structure (HB) group, and at least one hydrogen in these structures is It may be substituted with deuterium, halogen, cyano, alkyl having 1 to 4 carbon atoms (for example, methyl or t-butyl), cycloalkyl having 5 to 10 carbon atoms (for example, cyclohexyl or adamantyl), trimethylsilyl or phenyl.
- HA partial structure
- HB partial structure
- the host compound is preferably a compound represented by any of the structural formulas listed below, and among these, one to three structures selected from the partial structure (HA) group are more preferable.
- a compound having one structure selected from the partial structure (HB) group more preferably a compound having a carbazole group as the partial structure (HA) group, particularly preferably Formula (3-201), Formula (3-202), Formula (3-203), Formula (3-204), Formula (3-212), Formula (3-221), Formula (3-222), Formula (3-261) or a compound represented by formula (3-262).
- At least one hydrogen is halogen, cyano, alkyl having 1 to 4 carbons (for example, methyl or t-butyl), cycloalkyl having 5 to 10 carbons (for example, cyclohexyl or adamantyl). ), Phenyl or naphthyl.
- each MU is independently at least one selected from the group consisting of divalent groups of the compounds represented by the general formulas (B-1) to (B-5).
- two hydrogens in the MU are replaced with EC or MU, each EC being independently hydrogen, aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino or aryloxy; At least one hydrogen in these may be further substituted with aryl, heteroaryl or diarylamino, and k is an integer from 2 to 50000.
- k is preferably an integer of 100 to 40000, more preferably an integer of 500 to 25000.
- the compounds represented by the general formulas (B-1) to (B-5) are the following compounds.
- Preferred are compounds represented by formulas (B-3) to (B-5).
- each Ar is independently hydrogen, aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino or aryloxy, At least one hydrogen may be further substituted with aryl, heteroaryl or diarylamino, and adjacent groups of Ar are bonded to each other, together with the mother skeleton of an anthracene ring, pyrene ring, fluorene ring or carbazole ring, respectively.
- aryl ring or a heteroaryl ring, wherein at least one hydrogen in the formed ring is substituted with aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino or aryloxy May be.
- the specific description of each group can refer to the description in the polycyclic aromatic compound of the general formula (1) or the general formula (2).
- N in each formula is an integer of 1 to 6, preferably an integer of 1 to 4, more preferably an integer of 1 to 2, and particularly preferably 1.
- R 1 to R 11 are each independently hydrogen, aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino or aryloxy, and at least one of them The hydrogen may be further substituted with aryl, heteroaryl or diarylamino; Adjacent groups of R 1 to R 11 may be bonded to form an aryl ring or a heteroaryl ring together with a ring, b ring or c ring, and at least one hydrogen in the formed ring is May be substituted with aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino or aryloxy, wherein at least one hydrogen may be further substituted with aryl, heteroaryl or diarylamino .
- the explanation in the polycyclic aromatic compound of the general formula (1) described above can be cited.
- At least one hydrogen in the compounds represented by formulas (B-1) to (B-5) is represented by a group represented by formula (FG-1) described later, a formula (FG-2) described later.
- FG-1 group represented by formula (FG-1) described later
- FG-2 formula (FG-2) described later.
- an alkyl group having 1 to 24 carbon atoms, a cycloalkyl group having 3 to 24 carbon atoms, a halogen atom or deuterium, and any —CH 2 — in the alkyl group is —O— or —.
- Any other than —CH 2 — which may be substituted with Si (CH 3 ) 2 — and is directly linked to the compounds represented by the above formulas (B-1) to (B-5) in the alkyl —CH 2 — may be substituted with arylene having 6 to 24 carbon atoms, and any hydrogen in the alkyl or cycloalkyl may be substituted with fluorine.
- At least one hydrogen in EC is a group represented by the following general formula (FG-1), a group represented by the following general formula (FG-2), or a group having 1 to 24 carbon atoms.
- alkyl, cycloalkyl having 3 to 24 carbon atoms may be substituted with a halogen or deuterium, in addition, any -CH 2 - in said alkyl - is -O- or -Si (CH 3) 2 - is replaced by Any —CH 2 — except for —CH 2 — directly bonded to EC in the formula (B-6) in the alkyl may be substituted with arylene having 6 to 24 carbon atoms; Any hydrogen in the alkyl or cycloalkyl may be substituted with fluorine.
- R is each independently fluorine, trimethylsilyl, trifluoromethyl, alkyl having 1 to 24 carbons or cycloalkyl having 3 to 24 carbons, and any —CH 2 — in the alkyl is substituted with —O—.
- Any —CH 2 — except —CH 2 — directly bonded to phenyl or phenylene in the alkyl may be substituted with arylene having 6 to 24 carbon atoms, and at least in the cycloalkyl
- One hydrogen may be substituted with alkyl having 1 to 24 carbon atoms or aryl having 6 to 12 carbon atoms, When two adjacent Rs are alkyl or cycloalkyl, these may be bonded to form a ring;
- m is each independently an integer of 0 to 4, n is an integer of 0 to 5, and p is an integer of 1 to 5.
- Each R is independently fluorine, trimethylsilyl, trifluoromethyl, alkyl having 1 to 24 carbons, cycloalkyl having 3 to 24 carbons or aryl having 6 to 12 carbons, and any —CH in the alkyl 2 — may be substituted with —O—, and any —CH 2 — other than —CH 2 — directly bonded to phenyl or phenylene in the alkyl is substituted with arylene of 6 to 24 carbon atoms.
- At least one hydrogen in the cycloalkyl may be substituted with alkyl having 1 to 24 carbon atoms or aryl having 6 to 12 carbon atoms, and at least one hydrogen in the aryl is alkyl having 1 to 24 carbon atoms. May be replaced with When two adjacent Rs are alkyl or cycloalkyl, these may be bonded to form a ring; m is an integer of 0 to 4, and n is each independently an integer of 0 to 5. )
- Examples of the MU include the following general formulas (MU-1-1) to (MU-1-12), the following general formulas (MU-2-1) to (MU-2-202), and the following general formulas ( MU-3-1) to formula (MU-3-201), the following general formula (MU-4-1) to formula (MU-4-122), and the following general formula (MU-5-1) to general formula ( And a divalent group represented by MU-5-12).
- Examples of EC include groups represented by general formulas (EC-1) to (EC-29) shown below. In these, MU binds to MU or EC at *, and EC binds to MU at *.
- the compound represented by the formula (B-6) preferably has at least one divalent group represented by the formula (B-6-X1) in the molecule from the viewpoint of charge transport. More preferably, the divalent group represented by the formula (B-6-X1) has 10% or more of the molecular weight of the compound represented by the formula (B-6).
- the divalent group represented by the formula (B-6-X1) is bonded to MU or EC at *.
- the compound represented by the formula (B-6) is an alkyl having 1 to 24 carbon atoms or a carbon number of 10 to 100% of the total number of MUs (n) in the molecule from the viewpoint of solubility and coating film-forming property. It is preferable to have 3 to 24 cycloalkyl, 30 to 100% of the MU total number (n) in the molecule is an alkyl having 1 to 18 carbon atoms (branched alkyl having 3 to 18 carbon atoms) or 3 carbon atoms.
- cycloalkyl having ⁇ 20 it is more preferable to have cycloalkyl having ⁇ 20, and 50 to 100% of the MU total number (n) in the molecule is alkyl having 1 to 12 carbons (branched alkyl having 3 to 12 carbons) or carbon 3 More preferably, it has ⁇ 16 cycloalkyl.
- 10 to 100% of the MU total number (n) in the molecule may have 7 to 24 carbon alkyls or 3 to 24 carbon cycloalkyls.
- 30 to 100% of the MU total number (n) in the molecule has alkyl having 7 to 24 carbon atoms (branched alkyl having 7 to 24 carbon atoms) or cycloalkyl having 3 to 24 carbon atoms. preferable.
- the dopant material is not particularly limited, and a known compound can be used, and can be selected from various materials according to a desired emission color.
- condensed ring derivatives such as phenanthrene, anthracene, pyrene, tetracene, pentacene, perylene, naphthopylene, dibenzopyrene, rubrene and chrysene
- benzoxazole derivatives benzothiazole derivatives, benzimidazole derivatives, benzotriazole derivatives, oxazoles Derivatives, oxadiazole derivatives, thiazole derivatives, imidazole derivatives, thiadiazole derivatives, triazole derivatives, pyrazoline derivatives, stilbene derivatives, thiophene derivatives, tetraphenylbutadiene derivatives, cyclopentadiene derivatives, bisstyrylanthracene derivatives, distyrylbenzene derivative
- blue to blue-green dopant materials include naphthalene, anthracene, phenanthrene, pyrene, triphenylene, perylene, fluorene, indene, chrysene and other aromatic hydrocarbon compounds and derivatives thereof, furan, pyrrole, thiophene, Aromatic complex such as silole, 9-silafluorene, 9,9'-spirobisilafluorene, benzothiophene, benzofuran, indole, dibenzothiophene, dibenzofuran, imidazopyridine, phenanthroline, pyrazine, naphthyridine, quinoxaline, pyrrolopyridine, thioxanthene Ring compounds and their derivatives, distyrylbenzene derivatives, tetraphenylbutadiene derivatives, stilbene derivatives, aldazine derivatives, coumarin derivatives, imidazo
- examples of the green to yellow dopant material include coumarin derivatives, phthalimide derivatives, naphthalimide derivatives, perinone derivatives, pyrrolopyrrole derivatives, cyclopentadiene derivatives, acridone derivatives, quinacridone derivatives, and naphthacene derivatives such as rubrene.
- orange to red dopant materials include naphthalimide derivatives such as bis (diisopropylphenyl) perylenetetracarboxylic imide, perinone derivatives, rare earth complexes such as Eu complexes having acetylacetone, benzoylacetone and phenanthroline as ligands, 4 -(Dicyanomethylene) -2-methyl-6- (p-dimethylaminostyryl) -4H-pyran and its analogs, metal phthalocyanine derivatives such as magnesium phthalocyanine and aluminum chlorophthalocyanine, rhodamine compounds, deazaflavin derivatives, coumarin derivatives, quinacridone Derivatives, phenoxazine derivatives, oxazine derivatives, quinazoline derivatives, pyrrolopyridine derivatives, squarylium derivatives, violanthrone derivatives, phenazine derivatives, phenoxazo Derivatives, thi
- the dopant can be appropriately selected from the compounds described in Chemical Industry, June 2004, p. 13 and the references cited therein.
- amines having a stilbene structure perylene derivatives, borane derivatives, aromatic amine derivatives, coumarin derivatives, pyran derivatives or pyrene derivatives are particularly preferable.
- the amine having a stilbene structure is represented by the following formula, for example.
- Ar 1 is an m-valent group derived from aryl having 6 to 30 carbon atoms
- Ar 2 and Ar 3 are each independently aryl having 6 to 30 carbon atoms
- Ar 1 to Ar At least one of 3 has a stilbene structure and Ar 1 to Ar 3 are aryl, heteroaryl, alkyl, cycloalkyl, trisubstituted silyl (silyl substituted with aryl, alkyl and / or cycloalkyl) or cyano
- m is an integer from 1 to 4.
- the amine having a stilbene structure is more preferably a diaminostilbene represented by the following formula.
- Ar 2 and Ar 3 are each independently aryl having 6 to 30 carbon atoms, and Ar 2 and Ar 3 are aryl, heteroaryl, alkyl, cycloalkyl, trisubstituted silyl (aryl, alkyl and And / or silyl trisubstituted with cycloalkyl) or cyano.
- aryl having 6 to 30 carbon atoms include phenyl, naphthyl, acenaphthylenyl, fluorenyl, phenalenyl, phenanthrenyl, anthryl, fluoranthenyl, triphenylenyl, pyrenyl, chrysenyl, naphthacenyl, perylenyl, stilbenyl, distyrylphenyl, distyrylbiphenylyl , Distyrylfluorenyl and the like.
- amines having a stilbene structure include N, N, N ′, N′-tetra (4-biphenylyl) -4,4′-diaminostilbene, N, N, N ′, N′-tetra (1-naphthyl) ) -4,4′-diaminostilbene, N, N, N ′, N′-tetra (2-naphthyl) -4,4′-diaminostilbene, N, N′-di (2-naphthyl) -N, N '-Diphenyl-4,4'-diaminostilbene, N, N'-di (9-phenanthryl) -N, N'-diphenyl-4,4'-diaminostilbene, 4,4'-bis [4 "-bis (Diphenylamino) styryl] -biphenyl, 1,4-bis [4′-bis (diphenylamino)
- perylene derivatives examples include 3,10-bis (2,6-dimethylphenyl) perylene, 3,10-bis (2,4,6-trimethylphenyl) perylene, 3,10-diphenylperylene, 3,4- Diphenylperylene, 2,5,8,11-tetra-t-butylperylene, 3,4,9,10-tetraphenylperylene, 3- (1'-pyrenyl) -8,11-di (t-butyl) perylene 3- (9′-anthryl) -8,11-di (t-butyl) perylene, 3,3′-bis (8,11-di (t-butyl) perylenyl), and the like.
- JP-A-11-97178, JP-A-2000-133457, JP-A-2000-26324, JP-A-2001-267079, JP-A-2001-267078, JP-A-2001-267076, Perylene derivatives described in JP-A No. 2000-34234, JP-A No. 2001-267075, JP-A No. 2001-217077 and the like may be used.
- borane derivatives examples include 1,8-diphenyl-10- (dimesitylboryl) anthracene, 9-phenyl-10- (dimesitylboryl) anthracene, 4- (9′-anthryl) dimesitylborylnaphthalene, 4- (10 ′ -Phenyl-9'-anthryl) dimesitylborylnaphthalene, 9- (dimesitylboryl) anthracene, 9- (4'-biphenylyl) -10- (dimesitylboryl) anthracene, 9- (4 '-(N-carbazolyl) phenyl) And -10- (dimesitylboryl) anthracene.
- the aromatic amine derivative is represented by the following formula, for example.
- Ar 4 is an n-valent group derived from aryl having 6 to 30 carbon atoms
- Ar 5 and Ar 6 are each independently aryl having 6 to 30 carbon atoms
- Ar 4 to Ar 6 are , Aryl, heteroaryl, alkyl, cycloalkyl, trisubstituted silyl (silyl substituted with aryl, alkyl and / or cycloalkyl) or cyano
- n is an integer from 1 to 4 is there.
- Ar 4 is a divalent group derived from anthracene, chrysene, fluorene, benzofluorene or pyrene
- Ar 5 and Ar 6 are each independently an aryl having 6 to 30 carbon atoms
- Ar 4 to Ar 6 May be substituted with aryl, heteroaryl, alkyl, cycloalkyl, tri-substituted silyl (silyl substituted with aryl, alkyl and / or cycloalkyl) or cyano
- n is 2, aromatic More preferred are group amine derivatives.
- aryl having 6 to 30 carbon atoms include phenyl, naphthyl, acenaphthylenyl, fluorenyl, phenalenyl, phenanthrenyl, anthryl, fluoranthenyl, triphenylenyl, pyrenyl, chrysenyl, naphthacenyl, perylenyl, pentacenyl and the like.
- the chrysene type includes, for example, N, N, N ′, N′-tetraphenylchrysene-6,12-diamine, N, N, N ′, N′-tetra (p-tolyl) Chrysene-6,12-diamine, N, N, N ′, N′-tetra (m-tolyl) chrysene-6,12-diamine, N, N, N ′, N′-tetrakis (4-isopropylphenyl) chrysene -6,12-diamine, N, N, N ', N'-tetra (naphthalen-2-yl) chrysene-6,12-diamine, N, N'-diphenyl-N, N'-di (p-tolyl) ) Chrysene-6,12-diamine, N, N′-diphenyl-N, N′-bis (4
- Examples of the pyrene series include N, N, N ′, N′-tetraphenylpyrene-1,6-diamine, N, N, N ′, N′-tetra (p-tolyl) pyrene-1,6.
- anthracene system examples include N, N, N, N-tetraphenylanthracene-9,10-diamine, N, N, N ′, N′-tetra (p-tolyl) anthracene-9,10-diamine.
- Examples of the coumarin derivative include coumarin-6 and coumarin-334. Moreover, you may use the coumarin derivative described in Unexamined-Japanese-Patent No. 2004-43646, Unexamined-Japanese-Patent No. 2001-76876, and Unexamined-Japanese-Patent No. 6-298758.
- Examples of the pyran derivative include the following DCM and DCJTB. Also, JP 2005-126399, JP 2005-097283, JP 2002-234892, JP 2001-220577, JP 2001-081090, and JP 2001-052869. Alternatively, pyran derivatives described in the above may be used.
- the electron injection layer 107 plays a role of efficiently injecting electrons moving from the cathode 108 into the light emitting layer 105 or the electron transport layer 106.
- the electron transport layer 106 plays a role of efficiently transporting electrons injected from the cathode 108 or electrons injected from the cathode 108 through the electron injection layer 107 to the light emitting layer 105.
- the electron transport layer 106 and the electron injection layer 107 are each formed by laminating and mixing one or more electron transport / injection materials or a mixture of the electron transport / injection material and the polymer binder.
- the electron injection / transport layer is a layer that administers electrons from the cathode and further transports electrons, and it is desirable that the electron injection efficiency is high and the injected electrons are transported efficiently.
- the electron transport capability is much higher. Even if it is not high, the effect of improving the luminous efficiency is equivalent to that of a material having a high electron transport capability. Therefore, the electron injection / transport layer in this embodiment may include a function of a layer that can efficiently block the movement of holes.
- a material (electron transport material) for forming the electron transport layer 106 or the electron injection layer 107 a compound conventionally used as an electron transport compound in a photoconductive material, used for an electron injection layer and an electron transport layer of an organic EL element It can be used by arbitrarily selecting from known compounds.
- a compound composed of an aromatic ring or a heteroaromatic ring composed of one or more atoms selected from carbon, hydrogen, oxygen, sulfur, silicon and phosphorus It is preferable to contain at least one selected from pyrrole derivatives, condensed ring derivatives thereof, and metal complexes having electron-accepting nitrogen.
- condensed ring aromatic ring derivatives such as naphthalene and anthracene, styryl aromatic aromatic derivatives represented by 4,4′-bis (diphenylethenyl) biphenyl, perinone derivatives, coumarin derivatives, naphthalimide Derivatives, quinone derivatives such as anthraquinone and diphenoquinone, phosphorus oxide derivatives, carbazole derivatives and indole derivatives.
- metal complexes having electron-accepting nitrogen include hydroxyazole complexes such as hydroxyphenyloxazole complexes, azomethine complexes, tropolone metal complexes, flavonol metal complexes, and benzoquinoline metal complexes. These materials can be used alone or in combination with different materials.
- electron transfer compounds include pyridine derivatives, naphthalene derivatives, anthracene derivatives, phenanthroline derivatives, perinone derivatives, coumarin derivatives, naphthalimide derivatives, anthraquinone derivatives, diphenoquinone derivatives, diphenylquinone derivatives, perylene derivatives, oxadiazoles.
- metal complexes having electron-accepting nitrogen can also be used, such as hydroxyazole complexes such as quinolinol-based metal complexes and hydroxyphenyloxazole complexes, azomethine complexes, tropolone metal complexes, flavonol metal complexes, and benzoquinoline metal complexes. Can be mentioned.
- the above-mentioned materials can be used alone, but they may be mixed with different materials.
- borane derivatives pyridine derivatives, fluoranthene derivatives, BO derivatives, anthracene derivatives, benzofluorene derivatives, phosphine oxide derivatives, pyrimidine derivatives, carbazole derivatives, triazine derivatives, benzimidazole derivatives, phenanthroline derivatives, and quinolinol metals Complexes are preferred.
- the borane derivative is, for example, a compound represented by the following general formula (ETM-1), and is disclosed in detail in JP-A-2007-27587.
- R 11 and R 12 are each independently hydrogen, alkyl, cycloalkyl, aryl that may be substituted, silyl that is substituted, or nitrogen that may be substituted A heterocyclic ring, or at least one of cyano
- R 13 to R 16 are each independently an optionally substituted alkyl, an optionally substituted cycloalkyl, or an optionally substituted aryl.
- X is an optionally substituted arylene
- Y is an optionally substituted aryl having 16 or less carbon atoms, a substituted boryl, or an optionally substituted carbazolyl
- n Are each independently an integer of 0 to 3.
- substituents in the case of “optionally substituted” or “substituted” include aryl, heteroaryl, alkyl, and cycloalkyl.
- R 11 and R 12 are each independently hydrogen, alkyl, cycloalkyl, aryl which may be substituted, silyl which is substituted, nitrogen which may be substituted
- a heterocycle containing at least one of cyano and R 13 to R 16 are each independently an optionally substituted alkyl, an optionally substituted cycloalkyl or an optionally substituted aryl.
- Each of R 21 and R 22 is independently hydrogen, alkyl, cycloalkyl, optionally substituted aryl, substituted silyl, optionally substituted nitrogen-containing heterocycle, or cyano; are among 1, X 1 is a substituted carbon atoms and optionally more than 20 arylene, n is an integer of 0-3 each independently, To, m are each independently an integer of 0-4.
- substituent in the case of “optionally substituted” or “substituted” include aryl, heteroaryl, alkyl, and cycloalkyl.
- R 11 and R 12 are each independently hydrogen, alkyl, cycloalkyl, aryl which may be substituted, silyl which is substituted, nitrogen which may be substituted
- a heterocycle containing at least one of cyano and R 13 to R 16 are each independently an optionally substituted alkyl, an optionally substituted cycloalkyl or an optionally substituted aryl.
- X 1 is an optionally substituted arylene having 20 or less carbon atoms, and n is each independently an integer of 0 to 3.
- substituent in the case of “optionally substituted” or “substituted” include aryl, heteroaryl, alkyl, and cycloalkyl.
- X 1 include divalent groups represented by any of the following formulas (X-1) to (X-9). (In each formula, each R a is independently an alkyl group, a cycloalkyl group, or an optionally substituted phenyl group.)
- this borane derivative include the following compounds.
- This borane derivative can be produced using a known raw material and a known synthesis method.
- the pyridine derivative is, for example, a compound represented by the following formula (ETM-2), preferably a compound represented by the formula (ETM-2-1) or the formula (ETM-2-2).
- ⁇ is an n-valent aryl ring (preferably an n-valent benzene ring, naphthalene ring, anthracene ring, fluorene ring, benzofluorene ring, phenalene ring, phenanthrene ring or triphenylene ring), and n is an integer of 1 to 4 is there.
- R 11 to R 18 are each independently hydrogen, alkyl (preferably alkyl having 1 to 24 carbons), cycloalkyl (preferably cyclohexane having 3 to 12 carbons). Alkyl) or aryl (preferably aryl having 6 to 30 carbon atoms).
- R 11 and R 12 are each independently hydrogen, alkyl (preferably alkyl having 1 to 24 carbon atoms), cycloalkyl (preferably cyclohexane having 3 to 12 carbon atoms). Alkyl) or aryl (preferably aryl having 6 to 30 carbon atoms), and R 11 and R 12 may be bonded to form a ring.
- the “pyridine substituent” is any of the following formulas (Py-1) to (Py-15), and each pyridine substituent is independently an alkyl or carbon having 1 to 4 carbon atoms. It may be substituted with cycloalkyl of several 5-10. Further, the pyridine-based substituent may be bonded to ⁇ , anthracene ring or fluorene ring in each formula through a phenylene group or a naphthylene group.
- the pyridine-based substituent is any one of the above formulas (Py-1) to (Py-15), and among these, any of the following formulas (Py-21) to (Py-44) It is preferable.
- At least one hydrogen in each pyridine derivative may be substituted with deuterium, and among the two “pyridine substituents” in the above formula (ETM-2-1) and formula (ETM-2-2) One of these may be replaced by aryl.
- Alkyl in R 11 to R 18 may be linear or branched, and examples thereof include linear alkyl having 1 to 24 carbon atoms and branched alkyl having 3 to 24 carbon atoms.
- Preferred “alkyl” is alkyl having 1 to 18 carbon atoms (branched alkyl having 3 to 18 carbon atoms). More preferable “alkyl” is alkyl having 1 to 12 carbons (branched alkyl having 3 to 12 carbons). More preferable “alkyl” is alkyl having 1 to 6 carbon atoms (branched alkyl having 3 to 6 carbon atoms). Particularly preferred “alkyl” is alkyl having 1 to 4 carbon atoms (branched alkyl having 3 to 4 carbon atoms).
- alkyl examples include methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, s-butyl, t-butyl, n-pentyl, isopentyl, neopentyl, t-pentyl, n-hexyl, 1 -Methylpentyl, 4-methyl-2-pentyl, 3,3-dimethylbutyl, 2-ethylbutyl, n-heptyl, 1-methylhexyl, n-octyl, t-octyl, 1-methylheptyl, 2-ethylhexyl, 2 -Propylpentyl, n-nonyl, 2,2-dimethylheptyl, 2,6-dimethyl-4-heptyl, 3,5,5-trimethylhexyl, n-decyl, n-undecy
- alkyl having 1 to 4 carbon atoms to be substituted on the pyridine-based substituent As the above description of alkyl can be cited.
- cycloalkyl in R 11 to R 18 examples include cycloalkyl having 3 to 12 carbon atoms. Preferred “cycloalkyl” is cycloalkyl having 3 to 10 carbon atoms. More preferred “cycloalkyl” is cycloalkyl having 3 to 8 carbon atoms. More preferred “cycloalkyl” is cycloalkyl having 3 to 6 carbon atoms. Specific examples of “cycloalkyl” include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, methylcyclopentyl, cycloheptyl, methylcyclohexyl, cyclooctyl, and dimethylcyclohexyl.
- preferred aryl is aryl having 6 to 30 carbon atoms, more preferred aryl is aryl having 6 to 18 carbon atoms, and still more preferred is aryl having 6 to 14 carbon atoms. And particularly preferred is aryl having 6 to 12 carbon atoms.
- aryl having 6 to 30 carbon atoms include phenyl as a monocyclic aryl, (1-, 2-) naphthyl as a condensed bicyclic aryl, and acenaphthylene- ( 1-, 3-, 4-, 5-) yl, fluorene- (1-, 2-, 3-, 4-, 9-) yl, phenalen- (1-, 2-) yl, (1-, 2 -, 3-, 4-, 9-) phenanthryl, condensed tetracyclic aryl triphenylene- (1-, 2-) yl, pyrene- (1-, 2-, 4-) yl, naphthacene- (1- , 2-, 5-) yl, perylene- (1-, 2-, 3-) yl which is a fused pentacyclic aryl, pentacene- (1-, 2-, 5-, 6-) yl and the like. .
- aryl having 6 to 30 carbon atoms includes phenyl, naphthyl, phenanthryl, chrysenyl, triphenylenyl and the like, more preferably phenyl, 1-naphthyl, 2-naphthyl and phenanthryl, particularly preferably phenyl, 1 -Naphthyl or 2-naphthyl.
- R 11 and R 12 in the above formula (ETM-2-2) may be bonded to form a ring.
- the 5-membered ring of the fluorene skeleton includes cyclobutane, cyclopentane, cyclopentene, cyclopentadiene, Cyclohexane, fluorene, indene and the like may be spiro-bonded.
- pyridine derivative examples include the following compounds.
- This pyridine derivative can be produced using a known raw material and a known synthesis method.
- the fluoranthene derivative is, for example, a compound represented by the following general formula (ETM-3), and is disclosed in detail in International Publication No. 2010/134352.
- X 12 to X 21 are hydrogen, halogen, linear, branched or cyclic alkyl, linear, branched or cyclic alkoxy, substituted or unsubstituted aryl, or substituted or unsubstituted Represents heteroaryl.
- substituent when substituted include aryl, heteroarylalkyl, and cycloalkyl.
- fluoranthene derivative examples include the following compounds.
- the BO derivative is, for example, a polycyclic aromatic compound represented by the following formula (ETM-4) or a multimer of polycyclic aromatic compounds having a plurality of structures represented by the following formula (ETM-4).
- R 1 to R 11 are each independently hydrogen, aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino, diarylboryl (the two aryls are bonded via a single bond or a linking group).
- alkyl, cycloalkyl, alkoxy or aryloxy, wherein at least one hydrogen may be substituted with aryl, heteroaryl, alkyl or cycloalkyl.
- adjacent groups of R 1 to R 11 may be bonded to form an aryl ring or a heteroaryl ring together with the a ring, b ring or c ring, and at least one hydrogen in the formed ring Is aryl, heteroaryl, diarylamino, diheteroarylamino, arylheteroarylamino, diarylboryl (two aryls may be linked via a single bond or a linking group), alkyl, cycloalkyl, alkoxy or aryl It may be substituted with oxy and at least one hydrogen in them may be substituted with aryl, heteroaryl, alkyl or cycloalkyl.
- At least one hydrogen in the compound or structure represented by the formula (ETM-4) may be substituted with halogen or deuterium.
- this BO derivative include the following compounds.
- This BO derivative can be produced using a known raw material and a known synthesis method.
- Anthracene derivative is a compound represented by the following formula (ETM-5-1), for example.
- Ar is each independently divalent benzene or naphthalene, and R 1 to R 4 are each independently hydrogen, alkyl having 1 to 6 carbons, cycloalkyl having 3 to 6 carbons or carbon number 6 to 20 aryls.
- Ar can be independently selected as appropriate from divalent benzene or naphthalene, and the two Ar may be different or the same, but the same from the viewpoint of the ease of synthesis of the anthracene derivative. It is preferable that Ar is bonded to pyridine to form a “part consisting of Ar and pyridine”. This part is an anthracene as a group represented by any of the following formulas (Py-1) to (Py-12), for example. Is bound to.
- a group represented by any one of the above formulas (Py-1) to (Py-9) is preferable, and any one of the above formulas (Py-1) to (Py-6) may be used. More preferred are the groups
- the two “sites consisting of Ar and pyridine” bonded to anthracene may have the same structure or different structures, but are preferably the same structure from the viewpoint of ease of synthesis of the anthracene derivative. However, from the viewpoint of device characteristics, it is preferable that the structures of the two “sites composed of Ar and pyridine” are the same or different.
- the alkyl having 1 to 6 carbon atoms in R 1 to R 4 may be linear or branched. That is, it is a linear alkyl having 1 to 6 carbon atoms or a branched alkyl having 3 to 6 carbon atoms. More preferred is alkyl having 1 to 4 carbon atoms (branched alkyl having 3 to 4 carbon atoms).
- cycloalkyl having 3 to 6 carbon atoms in R 1 to R 4 include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, methylcyclopentyl, cycloheptyl, methylcyclohexyl, cyclooctyl, and dimethylcyclohexyl.
- the aryl having 6 to 20 carbon atoms in R 1 to R 4 is preferably an aryl having 6 to 16 carbon atoms, more preferably an aryl having 6 to 12 carbon atoms, and particularly preferably an aryl having 6 to 10 carbon atoms.
- aryl having 6 to 20 carbon atoms include monocyclic aryl phenyl, (o-, m-, p-) tolyl, (2,3-, 2,4-, 2,5- , 2,6-, 3,4-, 3,5-) xylyl, mesityl (2,4,6-trimethylphenyl), (o-, m-, p-) cumenyl, bicyclic aryl (2 -, 3-, 4-) biphenylyl, (1-, 2-) naphthyl which is a condensed bicyclic aryl, terphenylyl (m-terphenyl-2'-yl, m-terphenyl-4) which is a tricyclic aryl '-Yl, m-terphenyl-5'-yl, o-terphenyl-3'-yl, o-terphenyl-4'-yl, p-terphenyl-2'-yl, m-terphenyl-2
- aryl having 6 to 20 carbon atoms is phenyl, biphenylyl, terphenylyl or naphthyl, more preferably phenyl, biphenylyl, 1-naphthyl, 2-naphthyl or m-terphenyl-5′-yl. More preferred is phenyl, biphenylyl, 1-naphthyl or 2-naphthyl, and most preferred is phenyl.
- One of the anthracene derivatives is, for example, a compound represented by the following formula (ETM-5-2).
- Ar 1 is each independently a single bond, divalent benzene, naphthalene, anthracene, fluorene, or phenalene.
- Ar 2 is independently an aryl having 6 to 20 carbon atoms, and the same description as “aryl having 6 to 20 carbon atoms” in the above formula (ETM-5-1) can be cited.
- Aryl having 6 to 16 carbon atoms is preferred, aryl having 6 to 12 carbon atoms is more preferred, and aryl having 6 to 10 carbon atoms is particularly preferred.
- Specific examples include phenyl, biphenylyl, naphthyl, terphenylyl, anthracenyl, acenaphthylenyl, fluorenyl, phenalenyl, phenanthryl, triphenylenyl, pyrenyl, tetracenyl, perylenyl and the like.
- R 1 to R 4 are each independently hydrogen, alkyl having 1 to 6 carbons, cycloalkyl having 3 to 6 carbons or aryl having 6 to 20 carbons, and the above formula (ETM-5-1) The explanation in can be cited.
- anthracene derivatives include the following compounds.
- anthracene derivatives can be produced using known raw materials and known synthesis methods.
- the benzofluorene derivative is, for example, a compound represented by the following formula (ETM-6).
- Ar 1 is independently an aryl having 6 to 20 carbon atoms, and the same description as “aryl having 6 to 20 carbon atoms” in the above formula (ETM-5-1) can be cited.
- Aryl having 6 to 16 carbon atoms is preferred, aryl having 6 to 12 carbon atoms is more preferred, and aryl having 6 to 10 carbon atoms is particularly preferred.
- Specific examples include phenyl, biphenylyl, naphthyl, terphenylyl, anthracenyl, acenaphthylenyl, fluorenyl, phenalenyl, phenanthryl, triphenylenyl, pyrenyl, tetracenyl, perylenyl and the like.
- Ar 2 is independently hydrogen, alkyl (preferably alkyl having 1 to 24 carbon atoms), cycloalkyl (preferably cycloalkyl having 3 to 12 carbon atoms) or aryl (preferably aryl having 6 to 30 carbon atoms). And two Ar 2 may be bonded to form a ring.
- Alkyl in Ar 2 may be either linear or branched, and examples thereof include linear alkyl having 1 to 24 carbon atoms and branched alkyl having 3 to 24 carbon atoms.
- Preferred “alkyl” is alkyl having 1 to 18 carbon atoms (branched alkyl having 3 to 18 carbon atoms). More preferable “alkyl” is alkyl having 1 to 12 carbons (branched alkyl having 3 to 12 carbons). More preferable “alkyl” is alkyl having 1 to 6 carbon atoms (branched alkyl having 3 to 6 carbon atoms). Particularly preferred “alkyl” is alkyl having 1 to 4 carbon atoms (branched alkyl having 3 to 4 carbon atoms).
- alkyl examples include methyl, ethyl, n-propyl, isopropyl, n-butyl, isobutyl, s-butyl, t-butyl, n-pentyl, isopentyl, neopentyl, t-pentyl, n-hexyl, 1 -Methylpentyl, 4-methyl-2-pentyl, 3,3-dimethylbutyl, 2-ethylbutyl, n-heptyl, 1-methylhexyl and the like.
- cycloalkyl in Ar 2 examples include cycloalkyl having 3 to 12 carbon atoms. Preferred “cycloalkyl” is cycloalkyl having 3 to 10 carbon atoms. More preferred “cycloalkyl” is cycloalkyl having 3 to 8 carbon atoms. More preferred “cycloalkyl” is cycloalkyl having 3 to 6 carbon atoms. Specific examples of “cycloalkyl” include cyclopropyl, cyclobutyl, cyclopentyl, cyclohexyl, methylcyclopentyl, cycloheptyl, methylcyclohexyl, cyclooctyl, and dimethylcyclohexyl.
- aryl in Ar 2 , preferred aryl is aryl having 6 to 30 carbon atoms, more preferred aryl is aryl having 6 to 18 carbon atoms, still more preferred is aryl having 6 to 14 carbon atoms, Preferred is aryl having 6 to 12 carbon atoms.
- aryl having 6 to 30 carbon atoms include phenyl, naphthyl, acenaphthylenyl, fluorenyl, phenalenyl, phenanthryl, triphenylenyl, pyrenyl, naphthacenyl, perylenyl, pentacenyl and the like.
- Two Ar 2 may be bonded to form a ring.
- cyclobutane, cyclopentane, cyclopentene, cyclopentadiene, cyclohexane, fluorene, or indene is spiro-bonded to the 5-membered ring of the fluorene skeleton. May be.
- benzofluorene derivative examples include the following compounds.
- This benzofluorene derivative can be produced using a known raw material and a known synthesis method.
- the phosphine oxide derivative is, for example, a compound represented by the following formula (ETM-7-1). Details are also described in International Publication No. 2013/079217.
- R 5 is substituted or unsubstituted alkyl having 1 to 20 carbons, cycloalkyl having 3 to 20 carbons, aryl having 6 to 20 carbons or heteroaryl having 5 to 20 carbons;
- R 6 is CN, substituted or unsubstituted alkyl having 1 to 20 carbon atoms, cycloalkyl having 3 to 20 carbon atoms, heteroalkyl having 1 to 20 carbon atoms, aryl having 6 to 20 carbon atoms, or 5 to 5 carbon atoms.
- R 7 and R 8 are each independently substituted or unsubstituted aryl having 6 to 20 carbon atoms or heteroaryl having 5 to 20 carbon atoms;
- R 9 is oxygen or sulfur;
- j is 0 or 1
- k is 0 or 1
- r is an integer of 0 to 4, and
- q is an integer of 1 to 3.
- substituent when substituted include aryl, heteroaryl, alkyl, and cycloalkyl.
- the phosphine oxide derivative may be, for example, a compound represented by the following formula (ETM-7-2).
- R 1 to R 3 may be the same or different and are hydrogen, alkyl group, cycloalkyl group, aralkyl group, alkenyl group, cycloalkenyl group, alkynyl group, alkoxy group, alkylthio group, cycloalkylthio group, aryl ether group , Arylthioether group, aryl group, heterocyclic group, halogen, cyano group, aldehyde group, carbonyl group, carboxyl group, amino group, nitro group, silyl group, and a condensed ring formed between adjacent substituents Chosen from.
- Ar 1 may be the same or different and is an arylene group or a heteroarylene group
- Ar 2 may be the same or different and is an aryl group or a heteroaryl group.
- at least one of Ar 1 and Ar 2 has a substituent, or forms a condensed ring with an adjacent substituent.
- n is an integer of 0 to 3. When n is 0, there is no unsaturated structure, and when n is 3, R 1 does not exist.
- the alkyl group represents, for example, a saturated aliphatic hydrocarbon group such as a methyl group, an ethyl group, a propyl group, or a butyl group, which may be unsubstituted or substituted.
- the substituent in the case of being substituted is not particularly limited, and examples thereof include an alkyl group, an aryl group, and a heterocyclic group, and this point is common to the following description.
- the number of carbon atoms of the alkyl group is not particularly limited, but is usually in the range of 1 to 20 from the viewpoint of availability and cost.
- cycloalkyl group represents a saturated alicyclic hydrocarbon group such as cyclopropyl, cyclohexyl, norbornyl, adamantyl and the like, which may be unsubstituted or substituted.
- the number of carbon atoms in the alkyl group moiety is not particularly limited, but is usually in the range of 3-20.
- the aralkyl group refers to an aromatic hydrocarbon group via an aliphatic hydrocarbon such as a benzyl group or a phenylethyl group, and both the aliphatic hydrocarbon and the aromatic hydrocarbon are unsubstituted or substituted. It doesn't matter.
- the number of carbon atoms in the aliphatic moiety is not particularly limited, but is usually in the range of 1-20.
- the alkenyl group refers to an unsaturated aliphatic hydrocarbon group containing a double bond such as a vinyl group, an allyl group, or a butadienyl group, which may be unsubstituted or substituted.
- the number of carbon atoms of the alkenyl group is not particularly limited, but is usually in the range of 2-20.
- the cycloalkenyl group refers to an unsaturated alicyclic hydrocarbon group containing a double bond such as a cyclopentenyl group, a cyclopentadienyl group, or a cyclohexene group, which may be unsubstituted or substituted. It doesn't matter.
- the alkynyl group represents an unsaturated aliphatic hydrocarbon group containing a triple bond such as an acetylenyl group, which may be unsubstituted or substituted.
- the number of carbon atoms of the alkynyl group is not particularly limited, but is usually in the range of 2-20.
- the alkoxy group represents an aliphatic hydrocarbon group via an ether bond such as a methoxy group, and the aliphatic hydrocarbon group may be unsubstituted or substituted.
- the number of carbon atoms of the alkoxy group is not particularly limited, but is usually in the range of 1-20.
- the alkylthio group is a group in which an oxygen atom of an ether bond of an alkoxy group is substituted with a sulfur atom.
- the cycloalkylthio group is a group in which an oxygen atom of an ether bond of a cycloalkoxy group is substituted with a sulfur atom.
- aryl ether group refers to an aromatic hydrocarbon group via an ether bond such as a phenoxy group, and the aromatic hydrocarbon group may be unsubstituted or substituted.
- the number of carbon atoms of the aryl ether group is not particularly limited, but is usually in the range of 6 to 40.
- the aryl thioether group is a group in which the oxygen atom of the ether bond of the aryl ether group is substituted with a sulfur atom.
- the aryl group represents an aromatic hydrocarbon group such as a phenyl group, a naphthyl group, a biphenylyl group, a phenanthryl group, a terphenyl group, or a pyrenyl group.
- the aryl group may be unsubstituted or substituted.
- the number of carbon atoms of the aryl group is not particularly limited, but is usually in the range of 6 to 40.
- the heterocyclic group refers to, for example, a cyclic structural group having an atom other than carbon, such as a furanyl group, a thiophenyl group, an oxazolyl group, a pyridyl group, a quinolinyl group, or a carbazolyl group, which is unsubstituted or substituted. It doesn't matter.
- the number of carbon atoms of the heterocyclic group is not particularly limited, but is usually in the range of 2-30.
- Halogen means fluorine, chlorine, bromine and iodine.
- aldehyde group, carbonyl group, and amino group can also include groups substituted with aliphatic hydrocarbons, alicyclic hydrocarbons, aromatic hydrocarbons, heterocyclic rings, and the like.
- aliphatic hydrocarbon, alicyclic hydrocarbon, aromatic hydrocarbon, and heterocyclic ring may be unsubstituted or substituted.
- the silyl group refers to, for example, a silicon compound group such as a trimethylsilyl group, which may be unsubstituted or substituted.
- the carbon number of the silyl group is not particularly limited, but is usually in the range of 3-20.
- the number of silicon is usually 1-6.
- the condensed ring formed between adjacent substituents includes, for example, Ar 1 and R 2 , Ar 1 and R 3 , Ar 2 and R 2 , Ar 2 and R 3 , R 2 and R 3 , Ar 1 and A conjugated or non-conjugated fused ring formed between Ar 2 and the like.
- n when n is 1, may be formed conjugated or non-conjugated fused ring with two of R 1 each other.
- These condensed rings may contain a nitrogen, oxygen, or sulfur atom in the ring structure, or may be further condensed with another ring.
- phosphine oxide derivative examples include the following compounds.
- This phosphine oxide derivative can be produced using a known raw material and a known synthesis method.
- the pyrimidine derivative is, for example, a compound represented by the following formula (ETM-8), and preferably a compound represented by the following formula (ETM-8-1). Details are also described in International Publication No. 2011/021689.
- Ar is each independently an optionally substituted aryl or an optionally substituted heteroaryl.
- n is an integer of 1 to 4, preferably an integer of 1 to 3, and more preferably 2 or 3.
- aryl in “optionally substituted aryl” include aryl having 6 to 30 carbon atoms, preferably aryl having 6 to 24 carbon atoms, more preferably aryl having 6 to 20 carbon atoms, More preferred is aryl having 6 to 12 carbon atoms.
- aryl include monocyclic aryl phenyl, bicyclic aryl (2-, 3-, 4-) biphenylyl, condensed bicyclic aryl (1-, 2-) naphthyl.
- Terphenylyl which is a tricyclic aryl (m-terphenyl-2'-yl, m-terphenyl-4'-yl, m-terphenyl-5'-yl, o-terphenyl-3'-yl, o -Terphenyl-4'-yl, p-terphenyl-2'-yl, m-terphenyl-2-yl, m-terphenyl-3-yl, m-terphenyl-4-yl, o-terphenyl -2-yl, o-terphenyl-3-yl, o-terphenyl-4-yl, p-terphenyl-2-yl, p-terphenyl-3-yl, o-terpheny
- Heteroaryl of “optionally substituted heteroaryl” includes, for example, heteroaryl having 2 to 30 carbon atoms, preferably heteroaryl having 2 to 25 carbon atoms, and heteroaryl having 2 to 20 carbon atoms. Aryl is more preferred, heteroaryl having 2 to 15 carbons is more preferred, and heteroaryl having 2 to 10 carbons is particularly preferred. Examples of the heteroaryl include heterocycles containing 1 to 5 heteroatoms selected from oxygen, sulfur and nitrogen in addition to carbon as ring constituent atoms.
- heteroaryl includes, for example, furyl, thienyl, pyrrolyl, oxazolyl, isoxazolyl, thiazolyl, isothiazolyl, imidazolyl, pyrazolyl, oxadiazolyl, furazanyl, thiadiazolyl, triazolyl, tetrazolyl, pyridyl, pyrimidinyl, pyridazinyl, pyrazinyl, triazinyl, benzofuranyl, Isobenzofuranyl, benzo [b] thienyl, indolyl, isoindolyl, 1H-indazolyl, benzoimidazolyl, benzoxazolyl, benzothiazolyl, 1H-benzotriazolyl, quinolyl, isoquinolyl, cinnolyl, quinazolyl, quinoxalinyl, phthalazinyl, naph
- the aryl and heteroaryl may be substituted, and may be substituted with, for example, the aryl or heteroaryl.
- this pyrimidine derivative include the following compounds.
- This pyrimidine derivative can be produced using a known raw material and a known synthesis method.
- the carbazole derivative is, for example, a compound represented by the following formula (ETM-9) or a multimer in which a plurality of such carbazole derivatives are bonded by a single bond or the like. Details are described in US Publication No. 2014/0197386.
- Ar is each independently an optionally substituted aryl or an optionally substituted heteroaryl.
- n is independently an integer of 0 to 4, preferably an integer of 0 to 3, and more preferably 0 or 1.
- aryl in “optionally substituted aryl” include aryl having 6 to 30 carbon atoms, preferably aryl having 6 to 24 carbon atoms, more preferably aryl having 6 to 20 carbon atoms, More preferred is aryl having 6 to 12 carbon atoms.
- aryl include monocyclic aryl phenyl, bicyclic aryl (2-, 3-, 4-) biphenylyl, condensed bicyclic aryl (1-, 2-) naphthyl.
- Terphenylyl which is a tricyclic aryl (m-terphenyl-2'-yl, m-terphenyl-4'-yl, m-terphenyl-5'-yl, o-terphenyl-3'-yl, o -Terphenyl-4'-yl, p-terphenyl-2'-yl, m-terphenyl-2-yl, m-terphenyl-3-yl, m-terphenyl-4-yl, o-terphenyl -2-yl, o-terphenyl-3-yl, o-terphenyl-4-yl, p-terphenyl-2-yl, p-terphenyl-3-yl, o-terpheny
- Heteroaryl of “optionally substituted heteroaryl” includes, for example, heteroaryl having 2 to 30 carbon atoms, preferably heteroaryl having 2 to 25 carbon atoms, and heteroaryl having 2 to 20 carbon atoms. Aryl is more preferred, heteroaryl having 2 to 15 carbons is more preferred, and heteroaryl having 2 to 10 carbons is particularly preferred. Examples of the heteroaryl include heterocycles containing 1 to 5 heteroatoms selected from oxygen, sulfur and nitrogen in addition to carbon as ring constituent atoms.
- heteroaryl includes, for example, furyl, thienyl, pyrrolyl, oxazolyl, isoxazolyl, thiazolyl, isothiazolyl, imidazolyl, pyrazolyl, oxadiazolyl, furazanyl, thiadiazolyl, triazolyl, tetrazolyl, pyridyl, pyrimidinyl, pyridazinyl, pyrazinyl, triazinyl, benzofuranyl, Isobenzofuranyl, benzo [b] thienyl, indolyl, isoindolyl, 1H-indazolyl, benzoimidazolyl, benzoxazolyl, benzothiazolyl, 1H-benzotriazolyl, quinolyl, isoquinolyl, cinnolyl, quinazolyl, quinoxalinyl, phthalazinyl, naph
- the aryl and heteroaryl may be substituted, and may be substituted with, for example, the aryl or heteroaryl.
- the carbazole derivative may be a multimer in which a plurality of compounds represented by the above formula (ETM-9) are bonded by a single bond or the like.
- an aryl ring preferably a polyvalent benzene ring, naphthalene ring, anthracene ring, fluorene ring, benzofluorene ring, phenalene ring, phenanthrene ring or triphenylene ring
- an aryl ring preferably a polyvalent benzene ring, naphthalene ring, anthracene ring, fluorene ring, benzofluorene ring, phenalene ring, phenanthrene ring or triphenylene ring
- carbazole derivative examples include the following compounds.
- This carbazole derivative can be produced using a known raw material and a known synthesis method.
- the triazine derivative is, for example, a compound represented by the following formula (ETM-10), and preferably a compound represented by the following formula (ETM-10-1). Details are described in US Publication No. 2011/0156013.
- Ar is each independently an optionally substituted aryl or an optionally substituted heteroaryl.
- n is an integer of 1 to 3, more preferably 2 or 3.
- aryl in “optionally substituted aryl” include aryl having 6 to 30 carbon atoms, preferably aryl having 6 to 24 carbon atoms, more preferably aryl having 6 to 20 carbon atoms, More preferred is aryl having 6 to 12 carbon atoms.
- aryl include monocyclic aryl phenyl, bicyclic aryl (2-, 3-, 4-) biphenylyl, condensed bicyclic aryl (1-, 2-) naphthyl.
- Terphenylyl which is a tricyclic aryl (m-terphenyl-2'-yl, m-terphenyl-4'-yl, m-terphenyl-5'-yl, o-terphenyl-3'-yl, o -Terphenyl-4'-yl, p-terphenyl-2'-yl, m-terphenyl-2-yl, m-terphenyl-3-yl, m-terphenyl-4-yl, o-terphenyl -2-yl, o-terphenyl-3-yl, o-terphenyl-4-yl, p-terphenyl-2-yl, p-terphenyl-3-yl, o-terpheny
- Heteroaryl of “optionally substituted heteroaryl” includes, for example, heteroaryl having 2 to 30 carbon atoms, preferably heteroaryl having 2 to 25 carbon atoms, and heteroaryl having 2 to 20 carbon atoms. Aryl is more preferred, heteroaryl having 2 to 15 carbons is more preferred, and heteroaryl having 2 to 10 carbons is particularly preferred. Examples of the heteroaryl include heterocycles containing 1 to 5 heteroatoms selected from oxygen, sulfur and nitrogen in addition to carbon as ring constituent atoms.
- heteroaryl includes, for example, furyl, thienyl, pyrrolyl, oxazolyl, isoxazolyl, thiazolyl, isothiazolyl, imidazolyl, pyrazolyl, oxadiazolyl, furazanyl, thiadiazolyl, triazolyl, tetrazolyl, pyridyl, pyrimidinyl, pyridazinyl, pyrazinyl, triazinyl, benzofuranyl, Isobenzofuranyl, benzo [b] thienyl, indolyl, isoindolyl, 1H-indazolyl, benzoimidazolyl, benzoxazolyl, benzothiazolyl, 1H-benzotriazolyl, quinolyl, isoquinolyl, cinnolyl, quinazolyl, quinoxalinyl, phthalazinyl, naph
- the aryl and heteroaryl may be substituted, and may be substituted with, for example, the aryl or heteroaryl.
- triazine derivative examples include the following compounds.
- This triazine derivative can be produced using a known raw material and a known synthesis method.
- the benzimidazole derivative is, for example, a compound represented by the following formula (ETM-11).
- ⁇ is an n-valent aryl ring (preferably an n-valent benzene ring, naphthalene ring, anthracene ring, fluorene ring, benzofluorene ring, phenalene ring, phenanthrene ring or triphenylene ring), and n is an integer of 1 to 4
- the “benzimidazole substituent” means that the pyridyl group in the “pyridine substituent” in the above formula (ETM-2), formula (ETM-2-1) and formula (ETM-2-2) is benzo It is a substituent substituted with an imidazole group, and at least one hydrogen in the benzimidazole derivative may be substituted with deuterium.
- R 11 in the benzimidazole group is hydrogen, alkyl having 1 to 24 carbon atoms, cycloalkyl having 3 to 12 carbon atoms or aryl having 6 to 30 carbon atoms, and the above formula (ETM-2-1) and the formula ( The description of R 11 in ETM-2-2) can be cited.
- ⁇ is preferably an anthracene ring or a fluorene ring, and the structure in this case can be referred to the description in the above formula (ETM-2-1) or formula (ETM-2-2), In the formula, R 11 to R 18 can be referred to the description of the above formula (ETM-2-1) or formula (ETM-2-2). Further, in the above formula (ETM-2-1) or formula (ETM-2-2), it is explained in a form in which two pyridine-based substituents are bonded.
- this benzimidazole derivative include, for example, 1-phenyl-2- (4- (10-phenylanthracen-9-yl) phenyl) -1H-benzo [d] imidazole, 2- (4- (10- ( Naphthalen-2-yl) anthracen-9-yl) phenyl) -1-phenyl-1H-benzo [d] imidazole, 2- (3- (10- (naphthalen-2-yl) anthracen-9-yl) phenyl) -1-phenyl-1H-benzo [d] imidazole, 5- (10- (naphthalen-2-yl) anthracen-9-yl) -1,2-diphenyl-1H-benzo [d] imidazole, 1- (4 -(10- (naphthalen-2-yl) anthracen-9-yl) phenyl) -2-phenyl-1H-benzo [d] imidazole, 2- (4- (9,10 Di (naphthalen-2
- This benzimidazole derivative can be produced using a known raw material and a known synthesis method.
- the phenanthroline derivative is, for example, a compound represented by the following formula (ETM-12) or formula (ETM-12-1). Details are described in International Publication No. 2006/021982.
- ⁇ is an n-valent aryl ring (preferably an n-valent benzene ring, naphthalene ring, anthracene ring, fluorene ring, benzofluorene ring, phenalene ring, phenanthrene ring or triphenylene ring), and n is an integer of 1 to 4 is there.
- R 11 to R 18 in each formula are independently hydrogen, alkyl (preferably alkyl having 1 to 24 carbon atoms), cycloalkyl (preferably cycloalkyl having 3 to 12 carbon atoms) or aryl (preferably carbon (Aryl of formula 6 to 30).
- alkyl preferably alkyl having 1 to 24 carbon atoms
- cycloalkyl preferably cycloalkyl having 3 to 12 carbon atoms
- aryl preferably carbon (Aryl of formula 6 to 30).
- any of R 11 to R 18 is bonded to ⁇ which is an aryl ring.
- At least one hydrogen in each phenanthroline derivative may be replaced with deuterium.
- Alkyl in R 11 ⁇ R 18, cycloalkyl and aryl may be cited to the description of R 11 ⁇ R 18 in the formula (ETM-2).
- ⁇ includes the following structural formula, for example.
- each R is independently hydrogen, methyl, ethyl, isopropyl, cyclohexyl, phenyl, 1-naphthyl, 2-naphthyl, biphenylyl or terphenylyl.
- this phenanthroline derivative include, for example, 4,7-diphenyl-1,10-phenanthroline, 2,9-dimethyl-4,7-diphenyl-1,10-phenanthroline, 9,10-di (1,10- Phenanthroline-2-yl) anthracene, 2,6-di (1,10-phenanthroline-5-yl) pyridine, 1,3,5-tri (1,10-phenanthroline-5-yl) benzene, 9,9 ′ -Difluoro-bis (1,10-phenanthroline-5-yl), bathocuproin, 1,3-bis (2-phenyl-1,10-phenanthroline-9-yl) benzene and the like.
- This phenanthroline derivative can be produced using a known raw material and a known synthesis method.
- the quinolinol-based metal complex is, for example, a compound represented by the following general formula (ETM-13).
- R 1 to R 6 are each independently hydrogen, fluorine, alkyl, cycloalkyl, aralkyl, alkenyl, cyano, alkoxy or aryl
- M is Li, Al, Ga, Be or Zn
- n is an integer of 1 to 3.
- quinolinol metal complexes include 8-quinolinol lithium, tris (8-quinolinolato) aluminum, tris (4-methyl-8-quinolinolato) aluminum, tris (5-methyl-8-quinolinolato) aluminum, tris (3 , 4-dimethyl-8-quinolinolato) aluminum, tris (4,5-dimethyl-8-quinolinolato) aluminum, tris (4,6-dimethyl-8-quinolinolato) aluminum, bis (2-methyl-8-quinolinolato) ( Phenolate) aluminum, bis (2-methyl-8-quinolinolato) (2-methylphenolate) aluminum, bis (2-methyl-8-quinolinolato) (3-methylphenolato) aluminum, bis (2-methyl-8- Quinolinolato) (4- Tylphenolate) aluminum, bis (2-methyl-8-quinolinolato) (2-phenylphenolate) aluminum, bis (2-methyl-8-quinolinolato) (3-phenylphenolate)
- This quinolinol-based metal complex can be produced using a known raw material and a known synthesis method.
- the thiazole derivative is, for example, a compound represented by the following formula (ETM-14-1).
- the benzothiazole derivative is, for example, a compound represented by the following formula (ETM-14-2).
- ⁇ in each formula is an n-valent aryl ring (preferably an n-valent benzene ring, naphthalene ring, anthracene ring, fluorene ring, benzofluorene ring, phenalene ring, phenanthrene ring or triphenylene ring), and n is 1 to 4
- the “thiazole-based substituent” and “benzothiazole-based substituent” are “pyridine-based” in the above formula (ETM-2), formula (ETM-2-1) and formula (ETM-2-2).
- the pyridyl group in the “substituent” is a substituent in which the following thiazole group or benzothiazole group is substituted, and at least one hydrogen in the thiazole derivative and the benzothiazole derivative may be substituted with deuterium.
- ⁇ is preferably an anthracene ring or a fluorene ring, and the structure in this case can be referred to the description in the above formula (ETM-2-1) or formula (ETM-2-2), In the formula, R 11 to R 18 can be referred to the description of the above formula (ETM-2-1) or formula (ETM-2-2). In addition, in the above formula (ETM-2-1) or formula (ETM-2-2), it is described in the form of two pyridine-based substituents bonded together.
- at least one of R 11 to R 18 in the above formula (ETM-2-1) is replaced with a thiazole substituent (or benzothiazole substituent) to replace the “pyridine substituent” with R 11 to R 18. May be replaced.
- thiazole derivatives or benzothiazole derivatives can be produced using known raw materials and known synthesis methods.
- the electron transport layer or the electron injection layer may further contain a substance capable of reducing the material forming the electron transport layer or the electron injection layer.
- a substance capable of reducing the material forming the electron transport layer or the electron injection layer various substances can be used as long as they have a certain reducing ability.
- alkali metals, alkaline earth metals, rare earth metals, alkali metal oxides, alkali metal halides, alkalis From the group consisting of earth metal oxides, alkaline earth metal halides, rare earth metal oxides, rare earth metal halides, alkali metal organic complexes, alkaline earth metal organic complexes and rare earth metal organic complexes At least one selected can be suitably used.
- Preferred reducing substances include alkali metals such as Na (work function 2.36 eV), K (2.28 eV), Rb (2.16 eV) or Cs (1.95 eV), and Ca (2. 9eV), Sr (2.0 to 2.5 eV) or Ba (2.52 eV), and alkaline earth metals such as those having a work function of 2.9 eV or less are particularly preferable.
- a more preferable reducing substance is an alkali metal of K, Rb or Cs, more preferably Rb or Cs, and most preferably Cs.
- alkali metals have particularly high reducing ability, and by adding a relatively small amount to the material forming the electron transport layer or the electron injection layer, the luminance of the organic EL element can be improved and the lifetime can be extended.
- a reducing substance having a work function of 2.9 eV or less a combination of two or more alkali metals is also preferable.
- a combination containing Cs such as Cs and Na, Cs and K, Cs and Rb, or A combination of Cs, Na and K is preferred.
- Cs such as Cs and Na, Cs and K, Cs and Rb, or A combination of Cs, Na and K is preferred.
- the cathode 108 plays a role of injecting electrons into the light emitting layer 105 through the electron injection layer 107 and the electron transport layer 106.
- the material for forming the cathode 108 is not particularly limited as long as it can efficiently inject electrons into the organic layer, but the same material as the material for forming the anode 102 can be used.
- metals such as tin, indium, calcium, aluminum, silver, copper, nickel, chromium, gold, platinum, iron, zinc, lithium, sodium, potassium, cesium and magnesium or alloys thereof (magnesium-silver alloy, magnesium -Indium alloys, aluminum-lithium alloys such as lithium fluoride / aluminum, etc.) are preferred.
- Lithium, sodium, potassium, cesium, calcium, magnesium, or alloys containing these low work function metals are effective for increasing the electron injection efficiency and improving device characteristics.
- metals such as platinum, gold, silver, copper, iron, tin, aluminum and indium, or alloys using these metals, and inorganic materials such as silica, titania and silicon nitride, polyvinyl alcohol, vinyl chloride Lamination of hydrocarbon polymer compounds and the like is a preferred example.
- the method for producing these electrodes is not particularly limited as long as conduction can be achieved, such as resistance heating, electron beam evaporation, sputtering, ion plating, and coating.
- the materials used for the hole injection layer, hole transport layer, light emitting layer, electron transport layer and electron injection layer can form each layer alone, but as a polymer binder, polyvinyl chloride, polycarbonate, Polystyrene, poly (N-vinylcarbazole), polymethyl methacrylate, polybutyl methacrylate, polyester, polysulfone, polyphenylene oxide, polybutadiene, hydrocarbon resin, ketone resin, phenoxy resin, polyamide, ethyl cellulose, vinyl acetate resin, ABS resin, polyurethane resin It can also be used by dispersing it in solvent-soluble resins such as phenol resins, xylene resins, petroleum resins, urea resins, melamine resins, unsaturated polyester resins, alkyd resins, epoxy resins, silicone resins, etc. is there.
- solvent-soluble resins such as phenol resins, xylene resins, petroleum resins, urea resins, melamine resins,
- Each layer constituting the organic electroluminescent element is formed by a method such as vapor deposition, resistance heating vapor deposition, electron beam vapor deposition, sputtering, molecular lamination method, printing method, spin coating method or cast method, coating method, etc. It can be formed by using a thin film.
- the film thickness of each layer thus formed is not particularly limited and can be appropriately set according to the properties of the material, but is usually in the range of 2 nm to 5000 nm. The film thickness can usually be measured with a crystal oscillation type film thickness measuring device or the like.
- the vapor deposition conditions vary depending on the type of material, the target crystal structure and association structure of the film, and the like.
- the deposition conditions are generally as follows: heating temperature of the deposition crucible +50 to + 400 ° C., vacuum 10 ⁇ 6 to 10 ⁇ 3 Pa, deposition rate 0.01 to 50 nm / second, substrate temperature ⁇ 150 to + 300 ° C., film thickness 2 nm It is preferable to set appropriately in the range of ⁇ 5 ⁇ m.
- the present invention can also be applied to a display device provided with an organic electroluminescent element or a lighting device provided with an organic electroluminescent element.
- a display device or an illuminating device including an organic electroluminescent element can be manufactured by a known method such as connecting the organic electroluminescent element according to the present embodiment and a known driving device, such as direct current driving, pulse driving, or alternating current. It can be driven by appropriately using a known driving method such as driving.
- Examples of the display device include a panel display such as a color flat panel display, and a flexible display such as a flexible color organic electroluminescence (EL) display (for example, JP-A-10-335066 and JP-A-2003-321546). Gazette, JP-A-2004-281086, etc.).
- Examples of the display method of the display include a matrix and / or segment method. Note that the matrix display and the segment display may coexist in the same panel.
- pixels for display are two-dimensionally arranged such as a grid or a mosaic, and characters and images are displayed using a set of pixels.
- the shape and size of the pixel are determined by the application. For example, square pixels with a side of 300 ⁇ m or less are usually used for displaying images and characters on personal computers, monitors, and televisions. Also, for large displays such as display panels, pixels with a side of the order of mm are used. become.
- monochrome display pixels of the same color may be arranged, but in color display, red, green, and blue pixels are displayed side by side. In this case, there are typically a delta type and a stripe type.
- the matrix driving method may be either a line sequential driving method or an active matrix.
- the line-sequential driving has an advantage that the structure is simple. However, the active matrix may be superior in consideration of the operation characteristics, so that it is necessary to use them depending on the application.
- a pattern is formed so as to display predetermined information, and a predetermined region is caused to emit light.
- a predetermined region is caused to emit light.
- the time and temperature display in a digital clock or a thermometer the operation state display of an audio device or an electromagnetic cooker, the panel display of an automobile, and the like can be mentioned.
- the illuminating device examples include an illuminating device such as a room illuminator, a backlight of a liquid crystal display device, and the like (for example, Japanese Patent Laid-Open Nos. 2003-257621, 2003-277741, and 2004-119211). Etc.)
- the backlight is used mainly for the purpose of improving the visibility of a display device that does not emit light, and is used for a liquid crystal display device, a clock, an audio device, an automobile panel, a display board, a sign, and the like.
- this embodiment As a backlight for a liquid crystal display device, especially a personal computer application where thinning is an issue, considering that it is difficult to thin the conventional method because it is made of a fluorescent lamp or a light guide plate, this embodiment
- the backlight using the light emitting element according to the present invention is thin and lightweight.
- the polycyclic aromatic compound according to the present invention can be used for producing an organic field effect transistor or an organic thin film solar cell in addition to the above-described organic electroluminescent element.
- An organic field effect transistor is a transistor that controls current by an electric field generated by voltage input, and a gate electrode is provided in addition to a source electrode and a drain electrode. When a voltage is applied to the gate electrode, an electric field is generated, and the current can be controlled by arbitrarily blocking the flow of electrons (or holes) flowing between the source electrode and the drain electrode.
- Field effect transistors are easier to miniaturize than simple transistors (bipolar transistors), and are often used as elements constituting integrated circuits and the like.
- the structure of the organic field effect transistor is usually provided with a source electrode and a drain electrode in contact with the organic semiconductor active layer formed using the polycyclic aromatic compound according to the present invention, and further in contact with the organic semiconductor active layer.
- the gate electrode may be provided with the insulating layer (dielectric layer) interposed therebetween. Examples of the element structure include the following structures.
- Substrate / gate electrode / insulator layer / source electrode / drain electrode / organic semiconductor active layer (2) Substrate / gate electrode / insulator layer / organic semiconductor active layer / source electrode / drain electrode (3) substrate / organic Semiconductor active layer / source electrode / drain electrode / insulator layer / gate electrode (4) substrate / source electrode / drain electrode / organic semiconductor active layer / insulator layer / gate electrode It can be applied as a pixel driving switching element for an active matrix driving type liquid crystal display or an organic electroluminescence display.
- Organic thin-film solar cells have a structure in which an anode such as ITO, a hole transport layer, a photoelectric conversion layer, an electron transport layer, and a cathode are laminated on a transparent substrate such as glass.
- the photoelectric conversion layer has a p-type semiconductor layer on the anode side and an n-type semiconductor layer on the cathode side.
- the polycyclic aromatic compound according to the present invention can be used as a material for a hole transport layer, a p-type semiconductor layer, an n-type semiconductor layer, and an electron transport layer, depending on its physical properties.
- the polycyclic aromatic compound according to the present invention can function as a hole transport material or an electron transport material in an organic thin film solar cell.
- the organic thin film solar cell may appropriately include a hole block layer, an electron block layer, an electron injection layer, a hole injection layer, a smoothing layer, and the like.
- known materials used for the organic thin film solar cell can be appropriately selected and used in combination.
- the reaction solution was cooled to room temperature, filtered through a silica gel short pass column (eluent: toluene), and the solvent was distilled off under reduced pressure to obtain a crude product.
- the obtained crude product was washed with methanol to give 5- (9H-carbazol-9-yl) -N 1 , N 1 , N 3 , N 3 -tetrakis (3,5-dimethylphenyl) benzene-1 , 3-diamine (3.66 g, 88% yield) was obtained as a white solid.
- Toluene (1.0 ml) were added boron tribromide (40.0 ⁇ l, 0.4 mmol) at room temperature under a nitrogen atmosphere. After completion of dropping, the temperature was raised to 120 ° C. and stirred for 20 hours.
- the obtained crude product was washed with hexane and then washed with acetonitrile to obtain a compound (BNpCz-0230 / 0611 / 0911S-F26-1) (12.5 mg, yield 14%).
- carbazole (1 equivalent), 1-bromo-3-fluorobenzene (1.2 equivalent), palladium (II) acetate (Pd (OAc) 2 , 0.04 equivalent), tri (t-butyl) phosphine (T-Bu 3 P, 0.12 equivalent), potassium phosphate (4 equivalent) and xylene (volume (ml): 10 times the weight of carbazole (g)) are placed in a flask and refluxed for at least 10 hours.
- the reaction solution is cooled and filtered to remove the solid, then the filtrate is concentrated under reduced pressure, and the resulting crude product is purified by a silica gel column (eluent: heptane / toluene mixed solvent). 9- (3-Fluorophenyl) -9H-carbazole is obtained. At this time, the target product is eluted by gradually increasing the ratio of toluene in the eluent.
- the obtained crude product was washed with water and then with methanol, and then purified with a silica gel column (eluent: heptane / toluene mixed solvent) to give 6- (3- (9H-carbazol-9-yl) phenoxy. ) -9,9-dimethyl-N, N-diphenyl-9H-fluoren-2-amine is obtained.
- the target product is eluted by gradually increasing the ratio of toluene in the eluent.
- 6- (3- (9H-carbazol-9-yl) phenoxy) -9,9-dimethyl-N, N-diphenyl-9H-fluoren-2-amine (1 equivalent), 1M tribromide under nitrogen atmosphere Boron heptane solution (12 eq) and aluminum chloride (1.1 eq) were added to chlorobenzene (volume (ml): 6- (3- (9H-carbazol-9-yl) phenoxy) -9,9-dimethyl-N, N -Dissolve in diphenyl-9H-fluoren-2-amine (20 times the weight (g)) and stir for 3 hours or longer under heating to reflux.
- reaction solution After completion of the reaction, the reaction solution is cooled to room temperature, and an aqueous sodium acetate solution cooled in an ice bath and then toluene are added to separate the layers.
- the organic layer is concentrated and then purified by a silica gel column (eluent: heptane / toluene mixed solvent) to obtain the compound (BOCzb-3b30).
- the target product is eluted by gradually increasing the ratio of toluene in the eluent.
- the obtained crude product was washed with water and then with methanol, and then purified with a silica gel column (eluent: heptane / toluene mixed solvent) to give 3- (3- (9H-carbazol-9-yl) phenoxy. ) -N, N-diphenylnaphthalen-1-amine is obtained.
- the target product is eluted by gradually increasing the ratio of toluene in the eluent.
- reaction solution After completion of the reaction, the reaction solution is cooled to room temperature, and an aqueous sodium acetate solution cooled in an ice bath and then toluene are added to separate the layers.
- the organic layer is concentrated and then purified by a silica gel column (eluent: heptane / toluene mixed solvent) to obtain the compound (BOCza-0530).
- the target product is eluted by gradually increasing the ratio of toluene in the eluent.
- the evaluation target compound When evaluating the absorption characteristics and light emission characteristics (fluorescence and phosphorescence) of a sample evaluation target compound, the evaluation target compound may be dissolved in a solvent and evaluated in a solvent or in a thin film state. Furthermore, when evaluating in a thin film state, depending on the mode of use of the compound to be evaluated in the organic EL device, only the compound to be evaluated is thinned and the compound to be evaluated is dispersed in an appropriate matrix material. In some cases, the film thickness may be evaluated.
- a commercially available transparent polymer such as PMMA (polymethyl methacrylate) or PSt (polystyrene) can be used.
- the thin film sample dispersed in PMMA is prepared by, for example, dissolving PMMA and a compound to be evaluated in toluene and then forming a thin film on a quartz transparent support substrate (10 mm ⁇ 10 mm) by spin coating. Can do.
- a thin film can be formed by the same procedure.
- a method for manufacturing a thin film sample when the matrix material is a host material is described below.
- a quartz transparent support substrate (10 mm x 10 mm x 1.0 mm) is fixed to a substrate holder of a commercially available vapor deposition apparatus (manufactured by Choshu Sangyo Co., Ltd.), a molybdenum vapor deposition boat containing a host material, and a dopant material. Equipped with a molybdenum evaporation boat.
- the vacuum chamber is depressurized to 5 ⁇ 10 ⁇ 4 Pa
- the vapor deposition boat containing the host material and the vapor deposition boat containing the dopant material are heated at the same time, and vapor deposition is performed to obtain an appropriate film thickness.
- a mixed thin film of material and dopant material is formed.
- the deposition rate is controlled according to the set weight ratio of the host material and the dopant material.
- the absorption spectrum of the sample was measured using an ultraviolet-visible-near-infrared spectrophotometer (Shimadzu Corporation, UV-2600).
- the fluorescence spectrum or phosphorescence spectrum of the sample was measured using a spectrofluorometer (manufactured by Hitachi High-Tech Co., Ltd., F-7000).
- photoluminescence was measured by excitation at an appropriate excitation wavelength at room temperature.
- the sample was immersed in liquid nitrogen (temperature 77K) using the attached cooling unit.
- an optical chopper was used to adjust the delay time from the excitation light irradiation to the start of measurement. Samples were excited at the appropriate excitation wavelength and photoluminescence was measured.
- the fluorescence quantum yield (PLQY) is measured using an absolute PL quantum yield measuring apparatus (C9920-02G, manufactured by Hamamatsu Photonics Co., Ltd.).
- fluorescence lifetime (delayed fluorescence) The fluorescence lifetime is measured at 300 K using a fluorescence lifetime measuring apparatus (C11367-01, manufactured by Hamamatsu Photonics Co., Ltd.). A component with a fast fluorescence lifetime and a component with a slow fluorescence lifetime (fluorescence lifetime of 0.1 ⁇ sec or more) are observed at the maximum emission wavelength measured at an appropriate excitation wavelength.
- the intensity (number of photons) of the point where the early fluorescent component (prompt) can no longer be seen is the starting point, and the point where the intensity is 1/10 of the starting point is the ending point
- the fluorescence lifetime of the slower fluorescence component is obtained.
- a fluorescence lifetime measurement of a general organic EL material that emits fluorescence at room temperature a slow component involving a triplet component derived from phosphorescence is hardly observed due to the deactivation of a triplet component due to heat. . When a slow component is observed in the compound to be evaluated, this indicates that triplet energy having a long excitation lifetime is transferred to singlet energy by thermal activation and observed as delayed fluorescence.
- E S singlet excitation energy
- E T Triplet excitation energy
- Delta] E ST is, for example, "Purely organic electroluminescent material realizing 100 % conversion from electricity to light", H. Kaji, H. Suzuki, T. Fukushima, K. Shizu, K. Katsuaki, S. Kubo, T. Komino , H. Oiwa, F. Suzuki, A. Wakamiya, Y. Murata, C. Adachi, Nat. Commun. 2015, 6, 8476.
- the compound (BOCz-0001) can be expected to be a deep blue fluorescent light-emitting material because light emission having a deep blue color and a narrow half-value width was obtained.
- Compound (BOCz-0001) is, PLQY high without decreasing the oscillator strength can be obtained, and has a small Delta] E ST, for emitting light in a narrow deep blue half width, it is suitable as dopant of the OLED.
- the compound (BNpCz-12mS-0230-1) was dissolved in toluene at a concentration of 2.0 ⁇ 10 ⁇ 5 mol / L, and an absorption spectrum and a fluorescence spectrum were measured.
- the excitation wavelength when measuring the fluorescence spectrum was arbitrarily selected so as not to overlap the fluorescence spectrum.
- the delayed fluorescence lifetime in dispersed film was measured from a thin film prepared by dispersing the compound (BNpCz-12mS-0230-1) in PMMA at a concentration of 1% by weight.
- the delayed fluorescence lifetime tau (Delay) calculated from the decay curve was 26 ⁇ sec.
- the compound (BNpCz-12mS-0230-1) has a methyl group at Z 1 of the b ring in the general formula (1), and the plane formed by the molecule is distorted, so that the spin-orbit interaction can be enhanced. , Very small delayed fluorescence lifetime is obtained. On the other hand, distorting the plane formed by molecules often reduces PLQY because the oscillator strength is reduced, but sufficient PLQY can be obtained by appropriate molecular design.
- the compound (BNpCz-12mS-0230-1) has good PLQY, very small tau (delay) and very narrow half-value width, and emits deep blue light, so it is suitable as a dopant for OLED utilizing TADF mechanism It is.
- the delayed fluorescence lifetime in dispersed film was measured from a thin film prepared by dispersing Comparative Compound 1 in PMMA at a concentration of 1% by weight.
- the delayed fluorescence lifetime tau (Delay) calculated from the decay curve was 94 ⁇ sec.
- the comparative compound 1 in which Z 1 in the general formula (1) is hydrogen can emit blue light with a narrow half-value width and has a small ⁇ E ST but a very large tau (delay), and uses TADF. It turns out that it is not preferable as a luminescent material of the OLED element. Further, since Delta] E ST is small, there is a possibility that it is possible to express the TADF by devising an element structure, are expected to roll off is increased poor performance devices.
- the delayed fluorescence lifetime in dispersed film was measured from a thin film prepared by dispersing Comparative Compound 2 in PMMA at a concentration of 1% by weight.
- the delayed fluorescence lifetime tau (Delay) calculated from the decay curve was 48 ⁇ sec.
- the comparative compound 2 in which Z 1 in the general formula (1) is hydrogen can emit blue light with a narrow half-value width and has a small ⁇ E ST but a very large tau (delay), and uses TADF. It turns out that it is unpreferable as a luminescent material of an OLED element. Further, since Delta] E ST is small, there is a possibility that it is possible to express the TADF by devising an element structure, are expected to roll off is increased poor performance devices.
- the compound (BNpCz-0230) was dissolved in toluene at a concentration of 2.0 ⁇ 10 ⁇ 5 mol / L, and an absorption spectrum and a fluorescence spectrum were measured.
- the excitation wavelength when measuring the fluorescence spectrum was arbitrarily selected so as not to overlap the fluorescence spectrum.
- the delayed fluorescence lifetime was measured from a thin film prepared by dispersing the compound (BNpCz-0230) in PMMA at a concentration of 1% by weight.
- the delayed fluorescence lifetime tau was calculated from the decay curve, the delayed fluorescence lifetime tau (Delay) was 33 ⁇ sec.
- the compound (BNpCz-0230) is expected to be a deep blue fluorescent light-emitting material because light emission having a deep blue color and a narrow half-value width was obtained.
- the compound (BNpCz-0230) has a good PLQY, a very small tau (delay), a very narrow half-value width, and emits light in deep blue. .
- the compound (BNpCz-0230 / 0611-1) was dissolved in toluene at a concentration of 2.0 ⁇ 10 ⁇ 5 mol / L, and an absorption spectrum and a fluorescence spectrum were measured.
- the excitation wavelength when measuring the fluorescence spectrum was arbitrarily selected so as not to overlap the fluorescence spectrum.
- Delayed fluorescence lifetime in dispersed film Delayed fluorescence lifetime was measured from a thin film prepared by dispersing a compound (BNpCz-0230 / 0611-1) in PMMA at a concentration of 1% by weight.
- the delayed fluorescence lifetime tau (Delay) calculated from the decay curve was 31 ⁇ sec.
- the compound (BNpCz-0230 / 0611-1) is expected to be a deep blue fluorescent light-emitting material because light emission of deep blue and narrow half-value width was obtained.
- the compound (BNpCz-0230 / 0611-1) has good PLQY, very small tau (delay) and very narrow half-value width, and emits light in deep blue. Therefore, it is a dopant for OLED using TADF mechanism. It is suitable as.
- the compound (BNpCz-0230 / 0611 / 0911S-F26-1) is expected to be a deep blue fluorescent light-emitting material because light emission of deep blue and narrow half-value width was obtained.
- the emission wavelength was shortened by the effect of the aryl substituent having a fluorine atom in the ortho position with respect to the nitrogen atom. It is clear.
- the compound of the present invention has a sufficiently good PLQY and a very small tau (delay), and emits light in a deep blue with a narrow half-value width. Therefore, the compound of the present invention is suitable as a dopant for an OLED using the TADF mechanism. is there.
- Evaluation items and evaluation methods include drive voltage (V), emission wavelength (nm), CIE chromaticity (x, y), external quantum efficiency (%), maximum wavelength (nm) of emission spectrum, half-width ( nm) and roll-off. As these evaluation items, values at appropriate light emission luminance can be used.
- the quantum efficiency of a light emitting device includes an internal quantum efficiency and an external quantum efficiency.
- the internal quantum efficiency is that the external energy injected as electrons (or holes) into the light emitting layer of the light emitting device is converted into pure photons. The ratio is shown.
- the external quantum efficiency is calculated based on the amount of photons emitted to the outside of the light emitting element, and some of the photons generated in the light emitting layer are continuously absorbed or reflected inside the light emitting element. In other words, the external quantum efficiency is lower than the internal quantum efficiency because it is not emitted to the outside of the light emitting element.
- the spectral radiance (emission spectrum) and external quantum efficiency are measured as follows. Using a voltage / current generator R6144 manufactured by Advantest Corporation, the device was caused to emit light by applying a voltage. Using a spectral radiance meter SR-3AR manufactured by TOPCON, the spectral radiance in the visible light region was measured from the direction perpendicular to the light emitting surface. Assuming that the light emitting surface is a completely diffusing surface, the value obtained by dividing the measured spectral radiance value of each wavelength component by the wavelength energy and multiplying by ⁇ is the number of photons at each wavelength.
- the value obtained by dividing the applied current value by the elementary charge is the number of carriers injected into the device, and the value obtained by dividing the total number of photons emitted from the device by the number of carriers injected into the device is the external quantum efficiency.
- the half-value width of the emission spectrum is determined as the width between the upper and lower wavelengths where the intensity is 50% around the maximum emission wavelength.
- Roll-off is a phenomenon in which when a voltage is applied to the element, the efficiency decreases as the voltage is applied, and a smaller value is preferable.
- the tau (delay) of the dopant or assist dopant when the tau (delay) of the dopant or assist dopant is large, the roll-off becomes large, and when the tau (delay) is small, the roll-off becomes small.
- evaluation can be performed by comparing the efficiency at any two points of luminance or current density. It is preferable that the efficiency is high and the roll-off is small.
- An organic EL element is produced, and voltage is applied to measure current density, luminance, chromaticity, external quantum efficiency, and the like.
- the configuration of the produced organic EL element the following three configurations A (Table 2), Configuration B (Table 3), and Configuration C (Table 4) are selected and evaluated.
- Configurations A to C are configurations suitable for the heat activated delayed fluorescence material.
- Configuration A is an element configuration that can be expected to have high efficiency as described in the literature (Adv. Mater. 2016, 28, 2777-2781).
- Configuration B is an element configuration that can be expected to have relatively high efficiency and long-term driving stability as described in the literature (Scientific Reports, 6, 2016, 22463).
- the configuration C is an element configuration in which a host material different from the configuration A shown in the literature (Thin Solid Films, 619, 2016, 120-124) is applied.
- application of the compound of the present invention is not limited to these structures, and the film thickness and constituent materials of each layer can be appropriately changed depending on the basic physical properties of the compound of the present invention.
- HI is N, N′-diphenyl-N, N′-dinaphthyl-4,4′-diaminobiphenyl
- HT is 4,4 ′, 4 ”-tris (N-carbazolyl).
- Triphenylamine “EB” is 1,3-bis (N-carbazolyl) benzene
- EH1 is 3,3′-bis (N-carbazolyl) -1,1′-biphenyl
- ET is diphenyl [4- (triphenylsilyl) phenyl] phosphine oxide. The chemical structure is shown below.
- ⁇ Example 1> Device using Compound (BNpCz-12mS-0230-1) as a dopant>
- a glass substrate manufactured by Optoscience Co., Ltd.
- This transparent support substrate is fixed to a substrate holder of a commercially available vapor deposition apparatus (manufactured by Choshu Industry Co., Ltd.), and tantalum containing HI, HT, EB, EMH1, compound (BNpCz-12mS-0230-1), and ET, respectively.
- a vapor deposition boat, and an aluminum nitride vapor deposition boat each containing LiF and aluminum are mounted.
- the following layers were sequentially formed on the ITO film of the transparent support substrate.
- the vacuum chamber is depressurized to 5 ⁇ 10 ⁇ 4 Pa, first, HI is heated and evaporated to a film thickness of 40 nm, and then HT is heated and evaporated to a film thickness of 15 nm to form two layers. A hole layer made of is formed.
- the electron blocking layer is formed by heating and depositing EB so as to have a film thickness of 15 nm.
- EMH1 and the compound (BNpCz-12mS-0230-1) are heated at the same time and evaporated to a thickness of 20 nm to form a light emitting layer.
- the deposition rate is adjusted so that the weight ratio of EMH1 to the compound (BNpCz-12mS-0230-1) is approximately 99: 1.
- ET is heated and evaporated to a film thickness of 40 nm to form an electron transport layer.
- the deposition rate of each layer is 0.01 to 1 nm / second.
- LiF is heated to deposit at a deposition rate of 0.01 to 0.1 nm / second so as to have a film thickness of 1 nm, and then aluminum is heated to deposit to a film thickness of 100 nm to form a cathode.
- the aluminum deposition rate is adjusted to 1 to 10 nm / second.
- HAT-CN is 1,4,5,8,9,12-hexaazatriphenylenehexacarbonitrile and “Tris-PCz” is 9,9 ′, 9 ′′ -triphenyl-9H, 9H ′, 9H ′′ -3,3 ′, 6 ′, 3 ′′ -tercarbazole
- T2T is 2,4,6-tri [[1,1′-biphenyl] -3-yl] -1, 3,5-triazine
- BPy-TP2 is 2,7-di ([2,2′-bipyridin] -5-yl) triphenylene.
- the chemical structure is shown below.
- ⁇ Configuration B Device using compound (BNpCz-12mS-0230-1) as dopant>
- a transparent support substrate is a 26 mm ⁇ 28 mm ⁇ 0.7 mm glass substrate (Optoscience Co., Ltd.) obtained by polishing the ITO film formed by sputtering to 50 nm.
- This transparent support substrate is fixed to a substrate holder of a commercially available vapor deposition apparatus (Changzhou Industrial Co., Ltd.), and HAT-CN, Tris-PCz, EMH1, compound (BNpCz-12mS-0230-1), T2T, and BPy-TP2
- a tantalum deposition crucible containing each of the above, and an aluminum nitride deposition crucible containing LiF and aluminum, respectively, are mounted.
- the following layers are sequentially formed on the ITO film of the transparent support substrate.
- the vacuum chamber is depressurized to 2.0 ⁇ 10 ⁇ 4 Pa, first, HAT-CN is heated and evaporated to a film thickness of 10 nm, and then Tris-PCz is heated to a film thickness of 30 nm. A hole layer composed of two layers is formed by vapor deposition.
- EMH1 and the compound (BNpCz-12mS-0230-1) are heated at the same time and evaporated to a thickness of 30 nm to form a light emitting layer.
- the deposition rate is adjusted so that the weight ratio of EMH1 to the compound (BNpCz-12mS-0230-1) is approximately 90 to 10.
- T2T is heated and evaporated to a thickness of 10 nm, and then BPy-TP2 is evaporated to a thickness of 30 nm to form a two-layer electron transport layer.
- the deposition rate of each layer is 0.01 to 1 nm / second.
- LiF is heated and deposited at a deposition rate of 0.01 to 0.1 nm / second so as to have a film thickness of 1 nm, and then aluminum is heated to 0.1 to 2 nm / second so as to have a film thickness of 100 nm.
- An organic EL element can be obtained by forming a cathode by vapor deposition at a vapor deposition rate of seconds.
- a transparent support substrate is a 26 mm ⁇ 28 mm ⁇ 0.7 mm glass substrate (Optoscience Co., Ltd.) obtained by polishing the ITO film formed by sputtering to 50 nm.
- This transparent support substrate is fixed to a substrate holder of a commercially available vapor deposition apparatus (Changzhou Industrial Co., Ltd.), HAT-CN, Tris-PCz, EB, 2CzBN, compound (BNpCz-12mS-0230-1), and BPy-TP2
- a tantalum vapor deposition crucible containing Li and aluminum nitride vapor deposition crucible containing LiF and aluminum is mounted.
- the following layers are sequentially formed on the ITO film of the transparent support substrate.
- the vacuum chamber is depressurized to 2.0 ⁇ 10 ⁇ 4 Pa, first, HAT-CN is heated and evaporated to a film thickness of 10 nm, and then Tris-PCz is heated to a film thickness of 25 nm. Evaporation is performed, and then EB is heated to be deposited to a thickness of 10 nm, thereby forming a three-layer hole layer.
- 2CzBN and a compound (BNpCz-12mS-0230-1) are heated at the same time and evaporated to a thickness of 30 nm to form a light emitting layer.
- the deposition rate is adjusted so that the weight ratio of 2CzBN to the compound (BNpCz-12mS-0230-1) is approximately 90 to 10.
- 2CzBN is heated and evaporated to a thickness of 10 nm, and then BPy-TP2 is evaporated to a thickness of 40 nm to form a two-layer electron transport layer.
- the deposition rate of each layer is 0.01 to 1 nm / second.
- LiF is heated and deposited at a deposition rate of 0.01 to 0.1 nm / second so as to have a film thickness of 1 nm, and then aluminum is heated to 0.1 to 2 nm / second so that the film thickness becomes 100 nm.
- An organic EL element can be obtained by forming a cathode by vapor deposition at a vapor deposition rate of seconds.
- Configuration D is a configuration in which the charge balance in the light emitting layer is adjusted by changing the host of configuration A, which is a configuration suitable for the thermally activated delayed fluorescence material.
- application of the compound of the present invention is not limited to these structures, and the film thickness and constituent materials of each layer can be appropriately changed depending on the basic physical properties of the compound of the present invention.
- BH1 is 3,11-di-o-tolyl-5,9-dioxa-13b-boranaft [3,2,1-de] anthracene.
- the chemical structure is shown below.
- ⁇ Configuration D Device using compound (BNpCz-12mS-0230-1) as dopant>
- a glass substrate manufactured by Optoscience Co., Ltd.
- This transparent support substrate is fixed to a substrate holder of a commercially available vapor deposition apparatus (manufactured by Choshu Industry Co., Ltd.), and tantalum containing HI, HT, EB, BH1, compound (BNpCz-12mS-0230-1), and ET, respectively.
- a vapor deposition boat, and an aluminum nitride vapor deposition boat each containing LiF and aluminum were mounted.
- the following layers were sequentially formed on the ITO film of the transparent support substrate.
- the vacuum chamber is depressurized to 5 ⁇ 10 ⁇ 4 Pa, first, HI is heated and evaporated to a film thickness of 40 nm, and then HT is heated and evaporated to a film thickness of 15 nm to form two layers.
- the hole layer which consists of was formed.
- the electron blocking layer was formed by heating and depositing EB to a thickness of 15 nm.
- BH1 and a compound (BNpCz-12mS-0230-1) were heated at the same time and evaporated to a thickness of 20 nm to form a light emitting layer.
- the deposition rate was adjusted so that the weight ratio of BH1 to the compound (BNpCz-12mS-0230-1) was approximately 99: 1.
- ET was heated and evaporated to a film thickness of 30 nm to form an electron transport layer.
- the deposition rate of each layer was 0.01 to 1 nm / second.
- LiF is heated to deposit at a deposition rate of 0.01 to 0.1 nm / second so as to have a film thickness of 1 nm, and then aluminum is heated to deposit to a film thickness of 100 nm to form a cathode.
- an organic EL element was obtained.
- the deposition rate of aluminum was adjusted to 1 to 10 nm / second.
- a direct current voltage was applied using an ITO electrode as an anode and an aluminum electrode as a cathode, and luminance, chromaticity and external quantum efficiency were measured.
- the emission spectrum at 100 cd / m 2 emission had a full width at half maximum (FWHM) of 26 nm and a peak wavelength of 467 nm, and deep blue light emission with a narrow half width was observed.
- the external quantum efficiency at 100 cd / m 2 emission was 17.8%
- the external quantum efficiency at 1000 cd / m 2 emission was 11.8%, and a high quantum efficiency was obtained.
- Configuration E is a configuration adapted to use of TTF (Triplet-Triplet Fusion: singlet generation using triplet annihilation) in the light emitting layer.
- TTF Triplet-Triplet Fusion: singlet generation using triplet annihilation
- application of the compound of the present invention is not limited to these structures, and the film thickness and constituent materials of each layer can be appropriately changed depending on the basic physical properties of the compound of the present invention.
- HI2 is N 4 , N 4 ′ -diphenyl-N 4 , N 4 ′ -bis (9-phenyl-9H-carbazol-3-yl)-[1,1′-biphenyl] -4, 4′-diamine
- HT2 is N-([1,1′-biphenyl] -4-yl) -9,9-dimethyl-N- (4- (9-phenyl-9H-carbazole-3- Yl) phenyl) -9H-fluoren-2-amine
- HT3 is N, N-bis (4- (dibenzo [b, d] furan-4-yl) phenyl)-[1,1 ′: 4 ', 1 ′′ -terphenyl] -4-amine
- EH2 is 2- (10-phenylanthracen-9-yl) naphtho [2,3-b] benzofuran
- ET2 is 4,6 , 8,10-T
- Example 5> ⁇ Device in which host is EMH2 and dopant is compound (BOCz-0001)>
- a glass substrate manufactured by Opto Science Co., Ltd.
- This transparent support substrate was fixed to a substrate holder of a commercially available vapor deposition apparatus (manufactured by Showa Vacuum Co., Ltd.), and HI2, HAT-CN, HT2, HT3, EMH2, compound (BOCz-0001), ET2 and ET3 were put therein.
- a molybdenum vapor deposition boat, an aluminum nitride vapor deposition boat each containing Liq, LiF and aluminum are mounted.
- the vacuum chamber is depressurized to 5 ⁇ 10 ⁇ 4 Pa, first, HI2 is heated and evaporated to a film thickness of 40 nm, and then HAT-CN is heated and evaporated to a film thickness of 5 nm. Next, HT2 is heated and vapor-deposited to a film thickness of 45 nm, and then HT3 is heated and vapor-deposited to a film thickness of 10 nm to form a four-layer hole layer. Next, EMH2 and the compound (BOCz-0001) are heated at the same time and evaporated to a thickness of 25 nm to form a light emitting layer.
- the deposition rate is adjusted so that the weight ratio of EMH2 to the compound (BOCz-0001) is approximately 98 to 2. Further, ET2 is heated and evaporated to a thickness of 5 nm, and then ET3 and Liq are simultaneously heated to a thickness of 25 nm to form a two-layer electronic layer. The deposition rate is adjusted so that the weight ratio of ET3 and Liq is approximately 50:50. The deposition rate of each layer is 0.01 to 1 nm / second. Thereafter, LiF is heated to deposit at a deposition rate of 0.01 to 0.1 nm / second so as to have a film thickness of 1 nm, and then aluminum is heated to deposit to a film thickness of 100 nm to form a cathode. Thus, an organic EL element can be obtained.
- Blue light emission can be obtained by applying a DC voltage using the ITO electrode as the anode and the LiF / aluminum electrode as the cathode.
- the configuration F is a configuration suitable for use of the thermally activated delayed fluorescence material as an assisting dopant.
- Configuration F is an element configuration that can be expected to have high efficiency as described in the literature (Adv. Mater. 2016, 28, 2777-2781).
- the assisting dopant is a thermally activated delayed fluorescent material and the host and emitting dopant may or may not be a thermally activated delayed fluorescent material.
- application of the compound of the present invention is not limited to these structures, and the film thickness and constituent materials of each layer can be appropriately changed depending on the basic physical properties of the compound of the present invention.
- ⁇ Configuration F Device with EMH1 as host compound, compound (2PXZ-TAZ) as assisting dopant, and compound (BNpCz-12mS-0230-1) as emitting dopant>
- a glass substrate manufactured by Optoscience Co., Ltd. having a size of 26 mm ⁇ 28 mm ⁇ 0.7 mm obtained by polishing ITO deposited to a thickness of 200 nm by sputtering to 50 nm is used as a transparent support substrate.
- This transparent support substrate is fixed to a substrate holder of a commercially available vapor deposition apparatus (manufactured by Choshu Sangyo Co., Ltd.), HI, HT, EB, EMH1, compound (2PXZ-TAZ), compound (BNpCz-12mS-0230-1), And a tantalum vapor deposition boat each containing ET and ET, and an aluminum nitride vapor deposition boat each containing LiF and aluminum.
- the following layers are sequentially formed on the ITO film of the transparent support substrate.
- the vacuum chamber is depressurized to 5 ⁇ 10 ⁇ 4 Pa, first, HI is heated and evaporated to a film thickness of 40 nm, and then HT is heated and evaporated to a film thickness of 15 nm to form two layers. A hole layer made of is formed. Next, the electron blocking layer is formed by heating and depositing EB so as to have a film thickness of 15 nm.
- EMH1 as a host, compound (2PXZ-TAZ) as an assisting dopant, and compound (BNpCz-12mS-0230-1) as an emitting dopant are simultaneously heated and co-evaporated to a thickness of 20 nm to form a light emitting layer Form.
- the deposition rate is adjusted so that the weight ratio of host, assisting dopant and emitting dopant is approximately 90 to 9 to 1.
- ET is heated and evaporated to a film thickness of 30 nm to form an electron transport layer.
- the deposition rate of each of the above layers is set to 0.01 to 1 nm / second.
- LiF is heated to deposit at a deposition rate of 0.01 to 0.1 nm / second so as to have a film thickness of 1 nm, and then aluminum is heated to deposit to a film thickness of 100 nm to form a cathode.
- the aluminum deposition rate is adjusted to 1 to 10 nm / second.
- Reference Compound 1 The singlet excitation energy of Reference Compound 1 was 2.9040 eV, which was 427 nm in terms of wavelength.
- Reference compound 1 was synthesized by the method described in Japanese Patent Application No. 2017-562549, and the emission wavelength in a 1% PSt dispersion film was measured to be 448 nm. The emission wavelength was 21 nm longer than the wavelength expected from the singlet excitation energy by calculation.
- the emission wavelength of the compound was determined on the assumption that the measured value of the molecule having the structure of the present invention has the same tendency as that of Calculation Reference Example 1. Specifically, it was assumed that the actual emission wavelength may be about 21 nm longer than the calculation result of the excited singlet energy.
- the choice of materials for organic EL elements can be increased.
- a novel polycyclic aromatic compound as a material for an organic electroluminescent element, it is possible to provide an excellent organic EL element, a display device including the same, a lighting device including the same, and the like.
Landscapes
- Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Nonlinear Science (AREA)
- Materials Engineering (AREA)
- Optics & Photonics (AREA)
- Crystallography & Structural Chemistry (AREA)
- Mathematical Physics (AREA)
- General Physics & Mathematics (AREA)
- Microelectronics & Electronic Packaging (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Electroluminescent Light Sources (AREA)
- Inorganic Chemistry (AREA)
Abstract
Description
下記一般式(1)で表される多環芳香族化合物、または下記一般式(1)で表される構造を複数有する多環芳香族化合物の多量体。
R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13およびR14は、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、また、R1~R3、R4~R7、R8~R10およびR11~R14のうちの隣接する基同士が結合してa環、b環、c環およびd環の少なくとも1つと共にアリール環またはヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシで置換されていてもよく、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Xは、>O、>N-R、>Sまたは>Seであり、前記>N-RのRは、アリール、ヘテロアリール、アルキルまたはシクロアルキルであり、これらにおける少なくとも1つの水素は、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Lは、単結合、>C(-R)2、>O、>Sおよび>N-Rであり、前記>C(-R)2および>N-RにおけるRは、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
ただし、Xが>N-Rであるとき、Lが>Oであることはなく、
多量体の場合の式(1)中のR2は水素であり、そして、
一般式(1)で表される化合物および構造における少なくとも1つの水素は、シアノ、ハロゲンまたは重水素で置換されていてもよい。)
R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13およびR14は、それぞれ独立して、水素、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただし各アリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキル、炭素数5~10のシクロアルキル、炭素数1~12のアルコキシまたは炭素数6~30のアリールオキシであり、これらにおける少なくとも1つの水素はさらに、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、また、R1~R3、R4~R7、R8~R10およびR11~R14のうちの隣接する基同士が結合してa環、b環、c環およびd環の少なくとも1つと共に炭素数9~16のアリール環または炭素数6~15のヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただし各アリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキル、炭素数5~10のシクロアルキル、炭素数1~12のアルコキシまたは炭素数6~30のアリールオキシで置換されていてもよく、これらにおける少なくとも1つの水素はさらに、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、
Xは、>O、>N-R、>Sまたは>Seであり、前記>N-RのRは、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルであり、これらにおける少なくとも1つの水素は、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、
Lは、単結合、>C(-R)2、>O、>Sおよび>N-Rであり、前記>C(-R)2および>N-RにおけるRは、それぞれ独立して、水素、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただし各アリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキル、炭素数5~10のシクロアルキル、炭素数1~12のアルコキシまたは炭素数6~30のアリールオキシであり、これらにおける少なくとも1つの水素はさらに、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、
ただし、Xが>N-Rであるとき、Lが>Oであることはなく、
多量体の場合の式(1)中のR2は水素であり、そして、
一般式(1)で表される化合物および構造における少なくとも1つの水素は、シアノ、ハロゲンまたは重水素で置換されていてもよい、
項1に記載の多環芳香族化合物またはその多量体。
R4~R7のうちの隣接する基同士が結合してb環と共に形成されたアリール環またはヘテロアリール環が、ナフタレン環、フェナントレン環、アントラセン環、ジベンゾフラン環、カルバゾール環、ジベンゾチオフェン環、シラフルオレン環、フルオレン環およびこれらの環にさらにベンゼン環が縮合した環からなる群から選択される、項1または2に記載の多環芳香族化合物またはその多量体。
R4~R7のうちの隣接する基同士が結合してb環と共に形成されたアリール環またはヘテロアリール環が、下記部分構造式(1a)、式(1b)または式(1c)で表される環である、項3に記載の多環芳香族化合物またはその多量体。
R4、R5、R7、R1b、R2b、R3b、R4b、R5bおよびR6bは、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Xは、>O、>N-R、>Sまたは>Seであり、前記>N-RのRは、アリール、ヘテロアリール、アルキルまたはシクロアルキルであり、これらにおける少なくとも1つの水素は、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Zは、>O、>N-R、>S、>Si(-R)2および>C(-R)2であり、前記>N-R、>Si(-R)2および>C(-R)2におけるRは、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよい。
前記Xとしての>N-RのRがアリールまたはヘテロアリールであり、当該アリールまたはヘテロアリールにおける少なくとも1つの水素がフッ素で置換されている、項1~4のいずれかに記載の多環芳香族化合物またはその多量体。
前記Xとしての>N-RのRがアリールまたはヘテロアリールであり、当該アリールまたはヘテロアリールにおける前記Nに対するオルト位の少なくとも1つの水素がフッ素で置換されている、項1~4のいずれかに記載の多環芳香族化合物またはその多量体。
Lが、単結合、>Oまたは>N-Rである、項1~6のいずれかに記載の多環芳香族化合物またはその多量体。
Lが、単結合である、項1~6のいずれかに記載の多環芳香族化合物またはその多量体。
Xが>Oであり、Lが単結合である、項1~4のいずれかに記載の多環芳香族化合物またはその多量体。
Xが>N-Rであり、Lが単結合である、項1~6のいずれかに記載の多環芳香族化合物またはその多量体。
R7およびR8のうち、一方が、ハロゲン、炭素数1~6のアルキル、炭素数3~14のシクロアルキル、炭素数6~10のアリールまたは炭素数2~10のヘテロアリールであり、他方が、水素、炭素数1~6のアルキル、炭素数3~14のシクロアルキル、炭素数6~10のアリールまたは炭素数2~10のヘテロアリールである、項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
R7およびR8のうち、一方が、ハロゲン、炭素数1~4のアルキル、炭素数5~10のシクロアルキルまたはフェニルであり、他方が、水素、炭素数1~4のアルキル、炭素数5~10のシクロアルキルまたはフェニルである、項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
R7およびR8のうち、一方が、メチル、t-ブチルまたはフェニルであり、他方が、水素、メチル、t-ブチルまたはフェニルである、項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
R7およびR8のうち、一方が、メチルまたはt-ブチルであり、他方が水素またはメチルである、項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
R7およびR8のうち、一方がメチルであり、他方が水素であり、Xが>N-Rの場合は、当該>N-RのRがフェニルであり、当該フェニルにおける少なくとも1つの水素は、炭素数6~12のアリール、炭素数2~10のヘテロアリール、炭素数1~6のアルキル、炭素数3~14のシクロアルキルまたはフッ素で置換されていてもよい、項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
項1~18のいずれかに記載する多環芳香族化合物またはその多量体を含有する、有機デバイス用材料。
前記有機デバイス用材料は、有機電界発光素子用材料、有機電界効果トランジスタ用材料または有機薄膜太陽電池用材料である、項19に記載する有機デバイス用材料。
前記有機電界発光素子用材料が発光層用材料である、項20に記載する有機デバイス用材料。
陽極および陰極からなる一対の電極と、該一対の電極間に配置され、項21に記載する発光層用材料を含有する発光層とを有する、有機電界発光素子。
前記発光層はさらに下記一般式(3)で表される化合物および/または下記一般式(4)で表される化合物を含有する、項22に記載の有機電界発光素子。
上記一般式(4)中、L2およびL3は、それぞれ独立して、炭素数6~30のアリールまたは炭素数2~30のヘテロアリールであり、
上記各式で表される化合物における少なくとも1つの水素は、炭素数1~6のアルキル、炭素数3~14のシクロアルキル、シアノ、ハロゲンまたは重水素で置換されていてもよい。)
前記発光層はさらに下記一般式(5)で表される化合物を含有する、項22または23に記載の有機電界発光素子。
R1~R11は、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジヘテロアリールアミノ、アリールへテロアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルで置換されていてもよく、
R1~R11のうちの隣接する基同士が結合してa環、b環またはc環と共にアリール環またはヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、アリール、ヘテロアリール、ジアリールアミノ、ジヘテロアリールアミノ、アリールヘテロアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルで置換されていてもよく、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルで置換されていてもよく、
一般式(5)で表される化合物における少なくとも1つの水素は、それぞれ独立して、ハロゲンまたは重水素で置換されてもよい。)
前記陰極と該発光層との間に配置される電子輸送層および/または電子注入層を有し、該電子輸送層および電子注入層の少なくとも1つは、ボラン誘導体、ピリジン誘導体、フルオランテン誘導体、BO系誘導体、アントラセン誘導体、ベンゾフルオレン誘導体、ホスフィンオキサイド誘導体、ピリミジン誘導体、カルバゾール誘導体、トリアジン誘導体、ベンゾイミダゾール誘導体、フェナントロリン誘導体およびキノリノール系金属錯体からなる群から選択される少なくとも1つを含有する、項22~24のいずれかに記載する有機電界発光素子。
前記電子輸送層および/または電子注入層が、さらに、アルカリ金属、アルカリ土類金属、希土類金属、アルカリ金属の酸化物、アルカリ金属のハロゲン化物、アルカリ土類金属の酸化物、アルカリ土類金属のハロゲン化物、希土類金属の酸化物、希土類金属のハロゲン化物、アルカリ金属の有機錯体、アルカリ土類金属の有機錯体および希土類金属の有機錯体からなる群から選択される少なくとも1つを含有する、項25に記載の有機電界発光素子。
項22~26のいずれかに記載する有機電界発光素子を備えた表示装置または照明装置。
R1~R14(以降、「R1等」ともいう)は、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシ(以上、第1置換基)であり、これらにおける少なくとも1つの水素はさらにアリール、ヘテロアリール、アルキルまたはシクロアルキル(以上、第2置換基)で置換されていてもよく、また、R1~R3、R4~R7、R8~R10およびR11~R14のうちの隣接する基同士が結合してa環、b環、c環およびd環の少なくとも1つと共にアリール環またはヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素はアリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシ(以上、第1置換基)で置換されていてもよく、これらにおける少なくとも1つの水素はさらにアリール、ヘテロアリール、アルキルまたはシクロアルキル(以上、第2置換基)で置換されていてもよく、
Xは、>O、>N-R、>Sまたは>Seであり、前記>N-RのRはアリール、ヘテロアリール、アルキルまたはシクロアルキル(以上、第1置換基)であり、これらにおける少なくとも1つの水素はアリール、ヘテロアリール、アルキルまたはシクロアルキル(以上、第2置換基)で置換されていてもよく、
Lは、単結合、>C(-R)2、>O、>Sおよび>N-Rであり、前記>C(-R)2および>N-RにおけるRは、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシ(以上、第1置換基)であり、これらにおける少なくとも1つの水素はさらにアリール、ヘテロアリール、アルキルまたはシクロアルキル(以上、第2置換基)で置換されていてもよく、
ただし、Xが>N-Rであるとき、Lが>Oであることはなく、
多量体の場合の式(1)中のR2は水素であり、そして、
一般式(1)で表される化合物および構造における少なくとも1つの水素はシアノ、ハロゲンまたは重水素で置換されていてもよい。
一般式(1)で表される多環芳香族化合物およびその多量体は、例えば国際公開第2015/102118号公報で開示されている方法を応用することで合成することができる。すなわち、下記スキームのように連結基Lを有する中間体を合成して、それをタンデムヘテロフリーデルクラフツ反応(連続的な芳香族求電子置換反応)で環化させることで所望の多環芳香族化合物およびその多量体を合成できる。下記スキーム中、Yはハロゲンまたは水素を表し、その他の符号の定義は上述した定義と同じである。
これ以降で例示する化学構造式中の「Me」はメチル基、「tBu」はt-ブチル基を表す。
本発明に係る多環芳香族化合物は、有機デバイス用材料として用いることができる。有機デバイスとしては、例えば、有機電界発光素子、有機電界効果トランジスタまたは有機薄膜太陽電池などが挙げられる。
本発明に係る多環芳香族化合物は、例えば、有機電界発光素子の材料として用いることができる。以下に、本実施形態に係る有機EL素子について図面に基づいて詳細に説明する。図1は、本実施形態に係る有機EL素子を示す概略断面図である。
図1に示された有機電界発光素子100は、基板101と、基板101上に設けられた陽極102と、陽極102の上に設けられた正孔注入層103と、正孔注入層103の上に設けられた正孔輸送層104と、正孔輸送層104の上に設けられた発光層105と、発光層105の上に設けられた電子輸送層106と、電子輸送層106の上に設けられた電子注入層107と、電子注入層107の上に設けられた陰極108とを有する。
基板101は、有機電界発光素子100の支持体であり、通常、石英、ガラス、金属、プラスチックなどが用いられる。基板101は、目的に応じて板状、フィルム状、またはシート状に形成され、例えば、ガラス板、金属板、金属箔、プラスチックフィルム、プラスチックシートなどが用いられる。なかでも、ガラス板、および、ポリエステル、ポリメタクリレート、ポリカーボネート、ポリスルホンなどの透明な合成樹脂製の板が好ましい。ガラス基板であれば、ソーダライムガラスや無アルカリガラスなどが用いられ、また、厚みも機械的強度を保つのに十分な厚みがあればよいので、例えば、0.2mm以上あればよい。厚さの上限値としては、例えば、2mm以下、好ましくは1mm以下である。ガラスの材質については、ガラスからの溶出イオンが少ない方がよいので無アルカリガラスの方が好ましいが、SiO2などのバリアコートを施したソーダライムガラスも市販されているのでこれを使用することができる。また、基板101には、ガスバリア性を高めるために、少なくとも片面に緻密なシリコン酸化膜などのガスバリア膜を設けてもよく、特にガスバリア性が低い合成樹脂製の板、フィルムまたはシートを基板101として用いる場合にはガスバリア膜を設けるのが好ましい。
陽極102は、発光層105へ正孔を注入する役割を果たす。なお、陽極102と発光層105との間に正孔注入層103および/または正孔輸送層104が設けられている場合には、これらを介して発光層105へ正孔を注入することになる。
正孔注入層103は、陽極102から移動してくる正孔を、効率よく発光層105内または正孔輸送層104内に注入する役割を果たす。正孔輸送層104は、陽極102から注入された正孔または陽極102から正孔注入層103を介して注入された正孔を、効率よく発光層105に輸送する役割を果たす。正孔注入層103および正孔輸送層104は、それぞれ、正孔注入・輸送材料の一種または二種以上を積層、混合するか、正孔注入・輸送材料と高分子結着剤の混合物により形成される。また、正孔注入・輸送材料に塩化鉄(III)のような無機塩を添加して層を形成してもよい。
発光層105は、電界を与えられた電極間において、陽極102から注入された正孔と、陰極108から注入された電子とを再結合させることにより発光する層である。発光層105を形成する材料としては、正孔と電子との再結合によって励起されて発光する化合物(発光性化合物)であればよく、安定な薄膜形状を形成することができ、かつ、固体状態で強い発光(蛍光)効率を示す化合物であるのが好ましい。本発明では、発光層用の材料として、上記一般式(1)で表される多環芳香族化合物を用いることができる。
上記式(4)中、L2およびL3は、それぞれ独立して、炭素数6~30のアリールまたは炭素数2~30のヘテロアリールである。アリールとしては、炭素数6~24のアリールが好ましく、炭素数6~16のアリールがより好ましく、炭素数6~12のアリールがさらに好ましく、炭素数6~10のアリールが特に好ましく、具体的には、ベンゼン環、ビフェニル環、ナフタレン環、テルフェニル環、アセナフチレン環、フルオレン環、フェナレン環、フェナントレン環、トリフェニレン環、ピレン環、ナフタセン環、ペリレン環およびペンタセン環などの一価の基が挙げられる。ヘテロアリールとしては、炭素数2~25のヘテロアリールが好ましく、炭素数2~20のヘテロアリールがより好ましく、炭素数2~15のヘテロアリールがさらに好ましく、炭素数2~10のヘテロアリールが特に好ましく、具体的には、ピロール環、オキサゾール環、イソオキサゾール環、チアゾール環、イソチアゾール環、イミダゾール環、オキサジアゾール環、チアジアゾール環、トリアゾール環、テトラゾール環、ピラゾール環、ピリジン環、ピリミジン環、ピリダジン環、ピラジン環、トリアジン環、インドール環、イソインドール環、1H-インダゾール環、ベンゾイミダゾール環、ベンゾオキサゾール環、ベンゾチアゾール環、1H-ベンゾトリアゾール環、キノリン環、イソキノリン環、シンノリン環、キナゾリン環、キノキサリン環、フタラジン環、ナフチリジン環、プリン環、プテリジン環、カルバゾール環、アクリジン環、フェノキサチイン環、フェノキサジン環、フェノチアジン環、フェナジン環、フェナザシリン環、インドリジン環、フラン環、ベンゾフラン環、イソベンゾフラン環、ジベンゾフラン環、チオフェン環、ベンゾチオフェン環、ジベンゾチオフェン環、フラザン環、オキサジアゾール環、チアントレン環、インドロカルバゾール環、ベンゾインドロカルバゾール環、ベンゾベンゾインドロカルバゾール環およびナフトベンゾフラン環などの一価の基が挙げられる。
式(3)または式(4)で表される化合物における少なくとも1つの水素は、炭素数1~6のアルキル、炭素数3~14のシクロアルキル、シアノ、ハロゲンまたは重水素で置換されていてもよい。
R1~R11は、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジヘテロアリールアミノ、アリールへテロアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキル(以上、第1置換基)であり、これらにおける少なくとも1つの水素はさらにアリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキル(以上、第2置換基)で置換されていてもよく、
R1~R11のうちの隣接する基同士が結合してa環、b環またはc環と共にアリール環またはヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、アリール、ヘテロアリール、ジアリールアミノ、ジヘテロアリールアミノ、アリールヘテロアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキル(以上、第1置換基)で置換されていてもよく、これらにおける少なくとも1つの水素はさらにアリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキル(以上、第2置換基)で置換されていてもよく、
式(5)で表される化合物における少なくとも1つの水素は、それぞれ独立して、ハロゲンまたは重水素で置換されてもよい。
R1~R11は、それぞれ独立して、水素、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキルまたは炭素数3~16のシクロアルキルであり、これらにおける少なくとも1つの水素はさらに炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキルまたは炭素数3~16のシクロアルキルで置換されていてもよく、
R1~R11のうちの隣接する基同士が結合してa環、b環またはc環と共に炭素数9~16のアリール環または炭素数6~15のヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキルまたは炭素数3~16のシクロアルキルで置換されていてもよく、これらにおける少なくとも1つの水素はさらに炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキルまたは炭素数3~16のシクロアルキルで置換されていてもよい。
R1~R11は、それぞれ独立して、水素、炭素数6~16のアリール、炭素数2~15のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~10のアリール)、ジアリールボリル(ただし各アリールは炭素数6~10のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~6のアルキルまたは炭素数3~14のシクロアルキルであり、これらにおける少なくとも1つの水素はさらに炭素数6~16のアリール、炭素数2~15のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~10のアリール)、ジアリールボリル(ただし各アリールは炭素数6~10のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~6のアルキルまたは炭素数3~14のシクロアルキルで置換されていてもよく、
R1~R11のうちの隣接する基同士が結合してa環、b環またはc環と共に炭素数9~12のアリール環または炭素数6~12のヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、炭素数6~16のアリール、炭素数2~15のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~10のアリール)、ジアリールボリル(ただし各アリールは炭素数6~10のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~6のアルキルまたは炭素数3~14のシクロアルキルで置換されていてもよく、これらにおける少なくとも1つの水素はさらに炭素数6~16のアリール、炭素数2~15のヘテロアリール、ジアリールアミノ(ただしアリールは炭素数6~10のアリール)、ジアリールボリル(ただし各アリールは炭素数6~10のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~6のアルキルまたは炭素数3~14のシクロアルキルで置換されていてもよい。
R1~R11のうちの隣接する基同士が結合してa環、b環またはc環と共にアリール環またはヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、アリール、ヘテロアリール、ジアリールアミノ、ジヘテロアリールアミノ、アリールヘテロアリールアミノまたはアリールオキシで置換されていてもよく、これらにおける少なくとも1つの水素はさらにアリール、ヘテロアリールまたはジアリールアミノで置換されていてもよい。
各基の具体的な説明は、上述した一般式(1)の多環芳香族化合物における説明を引用することができる。
Rは、それぞれ独立して、フッ素、トリメチルシリル、トリフルオロメチル、炭素数1~24のアルキルまたは炭素数3~24のシクロアルキルであり、前記アルキルにおける任意の-CH2-は-O-で置換されていてもよく、前記アルキルにおけるフェニルまたはフェニレンに直結している-CH2-を除く任意の-CH2-は炭素数6~24のアリーレンで置換されていてもよく、前記シクロアルキルにおける少なくとも1つの水素は炭素数1~24のアルキルまたは炭素数6~12のアリールで置換されていてもよく、
隣接する2つのRがアルキルまたはシクロアルキルであるとき、これらは結合して環を形成していてもよく、
mはそれぞれ独立して0~4の整数であり、nは0~5の整数であり、pは1~5の整数である。)
Rは、それぞれ独立して、フッ素、トリメチルシリル、トリフルオロメチル、炭素数1~24のアルキル、炭素数3~24のシクロアルキルまたは炭素数6~12のアリールであり、前記アルキルにおける任意の-CH2-は-O-で置換されていてもよく、前記アルキルにおけるフェニルまたはフェニレンに直結している-CH2-を除く任意の-CH2-は炭素数6~24のアリーレンで置換されていてもよく、前記シクロアルキルにおける少なくとも1つの水素は炭素数1~24のアルキルまたは炭素数6~12のアリールで置換されていてもよく、前記アリールにおける少なくとも1つの水素は炭素数1~24のアルキルで置換されていてもよく、
隣接する2つのRがアルキルまたはシクロアルキルであるとき、これらは結合して環を形成していてもよく、
mは0~4の整数であり、nはそれぞれ独立して0~5の整数である。)
また、特開2003-347056号公報、および特開2001-307884号公報などに記載されたスチルベン構造を有するアミンを用いてもよい。
また、特開平11-97178号公報、特開2000-133457号公報、特開2000-26324号公報、特開2001-267079号公報、特開2001-267078号公報、特開2001-267076号公報、特開2000-34234号公報、特開2001-267075号公報、および特開2001-217077号公報などに記載されたペリレン誘導体を用いてもよい。
また、国際公開第2000/40586号パンフレットなどに記載されたボラン誘導体を用いてもよい。
また、特開2006-156888号公報などに記載された芳香族アミン誘導体を用いてもよい。
また、特開2004-43646号公報、特開2001-76876号公報、および特開平6-298758号公報などに記載されたクマリン誘導体を用いてもよい。
電子注入層107は、陰極108から移動してくる電子を、効率よく発光層105内または電子輸送層106内に注入する役割を果たす。電子輸送層106は、陰極108から注入された電子または陰極108から電子注入層107を介して注入された電子を、効率よく発光層105に輸送する役割を果たす。電子輸送層106および電子注入層107は、それぞれ、電子輸送・注入材料の一種または二種以上を積層、混合するか、電子輸送・注入材料と高分子結着剤の混合物により形成される。
ボラン誘導体は、例えば下記一般式(ETM-1)で表される化合物であり、詳細には特開2007-27587号公報に開示されている。
具体的な「シクロアルキル」としては、シクロプロピル、シクロブチル、シクロペンチル、シクロヘキシル、メチルシクロペンチル、シクロヘプチル、メチルシクロヘキシル、シクロオクチルまたはジメチルシクロヘキシルなどが挙げられる。
ホスフィンオキサイド誘導体は、例えば下記式(ETM-7-1)で表される化合物である。詳細は国際公開第2013/079217号公報にも記載されている。
R6は、CN、置換または無置換の、炭素数1~20のアルキル、炭素数3~20のシクロアルキル、炭素数1~20のヘテロアルキル、炭素数6~20のアリール、炭素数5~20のヘテロアリール、炭素数1~20のアルコキシまたは炭素数6~20のアリールオキシであり、
R7およびR8は、それぞれ独立して、置換または無置換の、炭素数6~20のアリールまたは炭素数5~20のヘテロアリールであり、
R9は酸素または硫黄であり、
jは0または1であり、kは0または1であり、rは0~4の整数であり、qは1~3の整数である。
ここで、置換されている場合の置換基としては、アリール、ヘテロアリール、アルキルまたはシクロアルキルなどがあげられる。
ピリミジン誘導体は、例えば下記式(ETM-8)で表される化合物であり、好ましくは下記式(ETM-8-1)で表される化合物である。詳細は国際公開第2011/021689号公報にも記載されている。
カルバゾール誘導体は、例えば下記式(ETM-9)で表される化合物、またはそれが単結合などで複数結合した多量体である。詳細は米国公開公報2014/0197386号公報に記載されている。
トリアジン誘導体は、例えば下記式(ETM-10)で表される化合物であり、好ましくは下記式(ETM-10-1)で表される化合物である。詳細は米国公開公報2011/0156013号公報に記載されている。
キノリノール系金属錯体は、例えば下記一般式(ETM-13)で表される化合物である。
チアゾール誘導体は、例えば下記式(ETM-14-1)で表される化合物である。
陰極108は、電子注入層107および電子輸送層106を介して、発光層105に電子を注入する役割を果たす。
以上の正孔注入層、正孔輸送層、発光層、電子輸送層および電子注入層に用いられる材料は単独で各層を形成することができるが、高分子結着剤としてポリ塩化ビニル、ポリカーボネート、ポリスチレン、ポリ(N-ビニルカルバゾール)、ポリメチルメタクリレート、ポリブチルメタクリレート、ポリエステル、ポリスルホン、ポリフェニレンオキサイド、ポリブタジエン、炭化水素樹脂、ケトン樹脂、フェノキシ樹脂、ポリアミド、エチルセルロース、酢酸ビニル樹脂、ABS樹脂、ポリウレタン樹脂などの溶剤可溶性樹脂や、フェノール樹脂、キシレン樹脂、石油樹脂、ユリア樹脂、メラミン樹脂、不飽和ポリエステル樹脂、アルキド樹脂、エポキシ樹脂、シリコーン樹脂などの硬化性樹脂などに分散させて用いることも可能である。
有機電界発光素子を構成する各層は、各層を構成すべき材料を蒸着法、抵抗加熱蒸着、電子ビーム蒸着、スパッタリング、分子積層法、印刷法、スピンコート法またはキャスト法、コーティング法などの方法で薄膜とすることにより、形成することができる。このようにして形成された各層の膜厚については特に限定はなく、材料の性質に応じて適宜設定することができるが、通常2nm~5000nmの範囲である。膜厚は通常、水晶発振式膜厚測定装置などで測定できる。蒸着法を用いて薄膜化する場合、その蒸着条件は、材料の種類、膜の目的とする結晶構造および会合構造などにより異なる。蒸着条件は一般的に、蒸着用ルツボの加熱温度+50~+400℃、真空度10-6~10-3Pa、蒸着速度0.01~50nm/秒、基板温度-150~+300℃、膜厚2nm~5μmの範囲で適宜設定することが好ましい。
また、本発明は、有機電界発光素子を備えた表示装置または有機電界発光素子を備えた照明装置などにも応用することができる。
有機電界発光素子を備えた表示装置または照明装置は、本実施形態にかかる有機電界発光素子と公知の駆動装置とを接続するなど公知の方法によって製造することができ、直流駆動、パルス駆動、交流駆動など公知の駆動方法を適宜用いて駆動することができる。
本発明に係る多環芳香族化合物は、上述した有機電界発光素子の他に、有機電界効果トランジスタまたは有機薄膜太陽電池などの作製に用いることができる。
(1)基板/ゲート電極/絶縁体層/ソース電極・ドレイン電極/有機半導体活性層
(2)基板/ゲート電極/絶縁体層/有機半導体活性層/ソース電極・ドレイン電極
(3)基板/有機半導体活性層/ソース電極・ドレイン電極/絶縁体層/ゲート電極
(4)基板/ソース電極・ドレイン電極/有機半導体活性層/絶縁体層/ゲート電極
このように構成された有機電界効果トランジスタは、アクティブマトリックス駆動方式の液晶ディスプレイや有機エレクトロルミネッセンスディスプレイの画素駆動スイッチング素子などとして適用できる。
1H-NMR(400MHz,CDCl3):δ=7.07(d,2H)、7.30-7.36(m,4H)、7.41(t,2H)、7.51(d,1H)、8.15(d,2H).
1H-NMR(500MHz,CDCl3):δ=7.08-7.14(m,5H)、7.19(t,1H)、7.25-7.32(m,3H)、7.39-7.45(m,5H)、8.15(d,2H).
1H-NMR(500MHz,(CDCl3)):δ=7.28(d,1H)、7.37-7.45(m,2H)、7.53-7.64(m,3H)、7.68(t,1H)、7.85(t,1H)、8.17-8.20(m,2H)、8.33-8.39(dd,2H)、8.76-8.81(dd,2H).
13C-NMR(126MHz,(CDCl3)):107.7(1C)、109.6(1C)、114.4(1C)、118.0(1C)、120.9(1C)、122.1(1C)、122.4(1C)、122.8(1C)、122.9(1C)、124.0(1C)、126.9(1C)、127.0(1C)、133.1(1C)、133.3(1C)、134.1(1C)、135.0(1C)、140.0(1C)、142.5(1C)、143.3(1C)、159.3(1C)、160.0(1C).
The NMR signal of the carbon α to the boron was not observed.
化合物(BNpCz-12mS-0230-1):N,N,5-トリス(3,5-ジメチルフェニル)-1,3-ジメチル-5H-5,8b-ジアザ-15b,ボラベンゾ[a]ナフト[1,2,3-hi]アセアントリレン-7-アミンの合成
1H-NMR(400MHz,CDCl3):δ=7.29(s,2H)、7.40-7.46(m,4H)、7.70(s,2H)、7.76(s,1H)、8.12(d,2H).
1H-NMR(400MHz,CDCl3):δ=2.23(s,24H)、6.64(s,4H)、6.72(s,2H)、6.76-6.79(m,9H)、7.22(t,2H)、7.36(d,2H)、7.44(d,2H)、8.05(d,2H).
1H-NMR(500MHz,(CDCl2)2):δ=2.24(s,12H)、2.30(m,9H)、2.84(s,3H)、5.79(s,1H)、6.42(s,1H)、6.75(m,3H)、6.79-6.82(m,6H)、6.93(s,1H)、7.02(s,1H)、7.34(t,1H)、7.52(t,1H)、7.60(s,1H)、7.77(d,1H)、8.16(d,1H)、8.21(d,1H)、8.33(d,2H).
13C-NMR(126MHz,CDCl3):21.2(2C)、21.2(4C)、22.0(1C)、25.0(1C)、98.5(1C)、101.0(1C)、114.0(1C)、114.7(1C)、120.8(1C)、120.9(1C)、121.6(1C)、121.7(1C)、122.6(1C)、122.8(1C)、123.7(4C)、124.0(1C)、125.1(1C)、125.2(1C)、125.7(2C)、126.1(1C)、127.1(1C)、127.5(2C)、129.5(1C)、134.7(1C)、138.8(4C)、139.4(1C)、140.1(2C)、140.3(1C)、141.8(1C)、142.1(1C)、143.2(1C)、143.7(1C)、146.6(2C)、147.3(1C)、148.4(1C)、151.6(1C).
1H-NMR(400MHz,(CDCl3)):δ=5.90(s,1H)、6.73(d,1H)、7.10(s,2H)、7.19(d,4H)、7.26-7.33(m,9H)、7.39(d,2H)、7.48-7.52(m,2H)、7.61-7.64(m,2H)、7.70(d,1H)、8.15(d,1H)、8.28(d,1H)、8.88(d,1H)、8.97(d,1H).
化合物(BNpCz-0230/0611-1):2-(tert-ブチル)-N,N,5-トリス(4-(tert-ブチル)フェニル)-5H-5,8b-ジアザ-15b-ボラベンゾ[a]ナフト[1,2,3-hi]アセアントリレン-7-アミンの合成
1H-NMR(400MHz,(CDCl3)):δ=1.34(s,9H)、1.35(s,18H)、1.47(s,9H)、6.18(s,1H)、6.66(s,1H)、7.11(d,4H)、7.14-7.24(m,8H)、7.46-7.52(m,6H)、7.58(d,1H)、7.62(t,1H)、8.14(d,1H)、8.27(d,1H).
化合物(BNpCz-0230/0611/0911S-F26-1):2,11,14-トリ-tert-ブチル-N-(4-(tert-ブチル)フェニル)-N,5-ビス(2,6-ジフルオロフェニル)-5H-5,8b-ジアザ-15b-ボラベンゾ[a]ナフト[1,2,3-hi]アセアントリレン-7-アミンの合成
1H-NMR(500MHz,(CDCl3)):δ=1.38(s,9H)、1.44(s,9H)、1.47(s,9H)、1.61(s,9H)、5.65(s,1H)、6.70(d,1H)、6.95-6.98(m,2H)、7.01-7.05(m,2H)、7.26-7.28(m,2H)、7.30(d,2H)、7.33-7.36(m,1H)、7.38-7.40(m,3H)、7.50-7.53(m,2H)、8.15(s,1H)8.32(s,1H)、9.05(s,1H)、9.07(s,1H).
13C-NMR(127MHz,(CDCl3)):31.4(3C)、31.6(3C)、31.7(3C)、32.3(3C)、34.3(1C)、34.5(1C)、34.6(1C)、35.1(1C)、94.0(1C)、95.3(1C)、112.3(4C)、112.5(1C)、112.6(1C)、112.8(1C)、113.2(1C)、114.7(1C)、116.9(1C)、118.5(1C)、118.7(1C)、119.2(1C)、123.1(1C)、123.5(1C)、125.8(2C)、126.3(2C)、126.9(1C)、127.7(1C)、129.4(1C)、129.5(1C)、129.9(1C)、131.5(1C)、137.8(1C)、141.5(1C)、141.9(1C)、142.6(1C)、144.0(1C)、144.1(1C)、144.1(1C)、144.5(1C)、147.7(1C)、148.5(1C)、152.0(1C)、159.3(2C)、161.3(2C).
化合物(BOCz-12m-0220/0910S-1):7-メシチル-1,3,11,14-テトラメチル-5-オキサ-8b-アザ-15b-ボラベンゾ[a]ナフト[1,2,3-hi]アセアンスリレンの合成
1H-NMR(400MHz,(CDCl3)): δ=2.12(s,6H)、2.40(s,3H)、2.49(s,3H)、2.56(s,3H)、2.69(s,3H)、2.92(s,3H)、7.04(s,2H)、7.05(d,1H)、7.08(s,1H)、7.22(br,1H)、7.30(dd,1H)、7.89(d,1H)、7.98(br,1H)、8.09(d,1H)、8.13(d,1H)、8.32(br,1H).
化合物(BOCzb-3b30):14,14-ジメチル-N,N-ジフェニル-14H-8-オキサ-4b-アザ-15b-ボラベンゾ[a]インデノ[1’,2’:6,7]ナフト[1,2,3-hi]アセナフチレン-12-アミンの合成
サンプルの準備
評価対象の化合物の吸収特性と発光特性(蛍光と燐光)を評価する場合、評価対象の化合物を溶媒に溶解して溶媒中で評価する場合と薄膜状態で評価する場合がある。さらに、薄膜状態で評価する場合は、評価対象の化合物の有機EL素子における使用の態様に応じて、評価対象の化合物のみを薄膜化し評価する場合と評価対象の化合物を適切なマトリックス材料中に分散して薄膜化して評価する場合がある。
前記サンプルの吸収スペクトルの測定は、紫外可視近赤外分光光度計((株)島津製作所、UV-2600)を用いて行った。また、前記サンプルの蛍光スペクトルまたは燐光スペクトルの測定は、分光蛍光光度計(日立ハイテク(株)製、F-7000)を用いて行った。
蛍光寿命測定装置(浜松ホトニクス(株)製、C11367-01)を用いて300Kで蛍光寿命を測定する。適切な励起波長で測定される極大発光波長において蛍光寿命の早い成分と遅い成分(蛍光寿命0.1μsec以上)を観測する。早い蛍光成分(プロンプト)の見られなくなった点(目安として、早い蛍光成分の蛍光寿命の5倍)の強度(光子数)を始点、始点に対して強度が1/10になった点を終点として、単一の指数関数としてフィッティングを行い求められる時定数より、遅い蛍光成分(ディレイ)の蛍光寿命を求める。蛍光を発光する一般的な有機EL材料の室温における蛍光寿命測定では、熱による3重項成分の失活により、燐光に由来する3重項成分が関与する遅い成分が観測されることはほとんどない。評価対象の化合物において遅い成分が観測された場合は、励起寿命の長い3重項エネルギーが熱活性化により1重項エネルギーに移動して遅延蛍光として観測されたことを示すことになる。
前述の方法で得られた吸収スペクトルの長波長末端A(nm)からEg=1240/Aで算出される。
一重項励起エネルギー(ES)は、蛍光スペクトルの極大発光波長B(nm)からES=1240/Bで算出される。また、三重項励起エネルギー(ET)は、燐光スペクトルの極大発光波長C(nm)からET=1240/Cで算出される。
測定の結果、吸収ピーク波長425nm、蛍光ピーク波長447nm、77Kにおける蛍光ピーク波長450nm、77Kにおける燐光ピーク波長480nm、蛍光ピーク半値幅40nm、PLQY75%の、深い青色かつ半値幅の狭い発光が得られた。また、77Kにおける蛍光ピーク波長および77Kにおける燐光ピーク波長より、ΔESTは0.17eVと算出した。
化合物(BNpCz-12mS-0230-1)を2.0×10-5mol/Lの濃度でトルエンに溶解させ、吸収スペクトルおよび蛍光スペクトルを測定した。蛍光スペクトル測定時の励起波長は蛍光スペクトルに重ならないように任意に選んだ。
化合物(BNpCz-12mS-0230-1)の溶液中における遅延蛍光寿命を計測した。減衰カーブより算出した遅延蛍光寿命tau(Delay)は2.4μsecだった。
化合物(BNpCz-12mS-0230-1)を1重量%の濃度でPMMAに分散して作製した薄膜から吸収および発光特性を計測した。測定の結果、吸収ピーク波長446nm、蛍光ピーク波長465nm、77Kにおける蛍光ピーク波長466nm、77Kにおける燐光ピーク波長495nm、蛍光ピーク半値幅30nm、PLQY83%の、深い青色かつ半値幅の狭い発光が得られた。また蛍光ピーク波長および燐光ピーク波長よりΔESTは0.15eVと算出した。
化合物(BNpCz-12mS-0230-1)を1重量%の濃度でPMMAに分散して作製した薄膜から遅延蛍光寿命を計測した。減衰カーブより算出した遅延蛍光寿命tau(Delay)は26μsecであった。
測定の結果、吸収ピーク波長439nm、蛍光ピーク波長456nm、77Kにおける蛍光ピーク波長459nm、77Kにおける燐光ピーク波長492nm、蛍光ピーク半値幅36nm、PLQY86%の、深い青色かつ半値幅の狭い発光が得られた。また蛍光ピーク波長および燐光ピーク波長よりΔESTは0.20eVと算出した。
比較化合物1を1重量%の濃度でPMMAに分散して作製した薄膜から遅延蛍光寿命を計測した。減衰カーブより算出した遅延蛍光寿命tau(Delay)は94μsecであった。
測定の結果、吸収ピーク波長444nm、蛍光ピーク波長465nm、77Kにおける蛍光ピーク波長468nm、77Kにおける燐光ピーク波長496nm、蛍光ピーク半値幅29nm、PLQY95%の、深い青色かつ半値幅の狭い発光が得られた。また77Kにおける蛍光ピーク波長および77Kにおける燐光ピーク波長よりΔESTは0.15eVと算出した。
比較化合物2を1重量%の濃度でPMMAに分散して作製した薄膜から遅延蛍光寿命を計測した。減衰カーブより算出した遅延蛍光寿命tau(Delay)は48μsecであった。
化合物(BNpCz-0230)を2.0×10-5mol/Lの濃度でトルエンに溶解させ、吸収スペクトルおよび蛍光スペクトルを測定した。蛍光スペクトル測定時の励起波長は蛍光スペクトルに重ならないように任意に選んだ。
化合物(BNpCz-0230)を1重量%の濃度でPMMAに分散して作製した薄膜から吸収および発光特性を計測した。測定の結果、吸収ピーク波長442nm、蛍光ピーク波長461nm、77Kにおける蛍光ピーク波長461nm、77Kにおける燐光ピーク波長492nm、蛍光ピーク半値幅30nm、PLQY84%の、深い青色かつ半値幅の狭い発光が得られた。また77Kにおける蛍光ピーク波長および77Kにおける燐光ピーク波長よりΔESTは0.17eVと算出した。
化合物(BNpCz-0230)を1重量%の濃度でPMMAに分散して作製した薄膜から遅延蛍光寿命を計測した。減衰カーブより遅延蛍光寿命tau(Delay)を算出したところ、遅延蛍光寿命tau(Delay)は33μsecであった。
化合物(BNpCz-0230/0611-1)を2.0×10-5mol/Lの濃度でトルエンに溶解させ、吸収スペクトルおよび蛍光スペクトルを測定した。蛍光スペクトル測定時の励起波長は蛍光スペクトルに重ならないように任意に選んだ。
化合物(BNpCz-0230/0611-1)を1重量%の濃度でPMMAに分散して作製した薄膜から吸収および発光特性を計測した。測定の結果、吸収ピーク波長447nm、蛍光ピーク波長465nm、77Kにおける蛍光ピーク波長467nm、77Kにおける燐光ピーク波長498nm、蛍光ピーク半値幅30nm、PLQY80%の、深い青色かつ半値幅の狭い発光が得られた。また77Kにおける蛍光ピーク波長および77Kにおける燐光ピーク波長よりΔESTは0.17eVと算出した。
化合物(BNpCz-0230/0611-1)を1重量%の濃度でPMMAに分散して作製した薄膜から遅延蛍光寿命を計測した。減衰カーブより遅延蛍光寿命tau(Delay)を算出したところ、31μsecであった。
化合物(BNpCz-0230/0611/0911S-F26-1)を2.0×10-5mol/Lの濃度でトルエンに溶解させ、吸収スペクトルおよび蛍光スペクトルを測定した。蛍光スペクトル測定時の励起波長は蛍光スペクトルに重ならないように任意に選んだ。
以上のように、本発明の化合物は、十分に良好なPLQYおよび非常に小さなtau(delay)を有し、半値幅の狭い深い青色で発光するため、TADF機構を利用するOLEDのドーパントとして好適である。
評価項目としては、駆動電圧(V)、発光波長(nm)、CIE色度(x,y)、外部量子効率(%)、発光スペクトルの最大波長(nm)、半値幅(nm)およびロールオフなどがある。これらの評価項目は、適切な発光輝度時の値を用いることができる。
有機EL素子を作製し、電圧を印加して電流密度、輝度、色度および外部量子効率などを測定する。作製した有機EL素子の構成として、以下の構成A(表2)、構成B(表3)および構成C(表4)の3つを選定して評価する。構成A~Cは熱活性化型遅延蛍光用材料に適合した構成である。構成Aは文献(Adv. Mater. 2016, 28, 2777-2781)で示された高い効率を期待できる素子構成である。構成Bは文献(Scientific Reports, 6, 2016, 22463)で示された比較的高い効率と長期間の駆動安定性を期待できる素子構成である。構成Cは文献(Thin Solid Films, 619, 2016, 120-124)で示された、構成Aとは異なるホスト材料を適応した素子構成である。ただし、本発明の化合物の適用はこれらの構成に限定されず、各層の膜厚や構成材料は本発明の化合物の基礎物性によって適宜変更することができる。
<構成A:化合物(BNpCz-12mS-0230-1)をドーパントとした素子>
スパッタリングにより200nmの厚さに製膜したITOを50nmまで研磨した、26mm×28mm×0.7mmのガラス基板((株)オプトサイエンス製)を透明支持基板とする。この透明支持基板を市販の蒸着装置(長州産業(株)製)の基板ホルダーに固定し、HI、HT、EB、EMH1、化合物(BNpCz-12mS-0230-1)、およびETをそれぞれ入れたタンタル製蒸着用ボート、LiFおよびアルミニウムをそれぞれ入れた窒化アルミニウム製蒸着用ボートを装着する。
<構成B:化合物(BNpCz-12mS-0230-1)をドーパントに用いた素子>
スパッタリングにより製膜したITOを50nmまで研磨した、26mm×28mm×0.7mmのガラス基板((株)オプトサイエンス)を透明支持基板とする。この透明支持基板を市販の蒸着装置((株)長州産業)の基板ホルダーに固定し、HAT-CN、Tris-PCz、EMH1、化合物(BNpCz-12mS-0230-1)、T2T、およびBPy-TP2をそれぞれ入れたタンタル製蒸着用ルツボ、LiFおよびアルミニウムをそれぞれ入れた窒化アルミニウム製蒸着用ルツボを装着する。
<構成C:化合物(BNpCz-12mS-0230-1)をドーパントに用いた素子>
スパッタリングにより製膜したITOを50nmまで研磨した、26mm×28mm×0.7mmのガラス基板((株)オプトサイエンス)を透明支持基板とする。この透明支持基板を市販の蒸着装置((株)長州産業)の基板ホルダーに固定し、HAT-CN、Tris-PCz、EB、2CzBN、化合物(BNpCz-12mS-0230-1)、およびBPy-TP2をそれぞれ入れたタンタル製蒸着用ルツボ、LiFおよびアルミニウムを入れた窒化アルミニウム製蒸着用ルツボを装着する。
<構成D:化合物(BNpCz-12mS-0230-1)をドーパントに用いた素子>
スパッタリングにより200nmの厚さに製膜したITOを50nmまで研磨した、26mm×28mm×0.7mmのガラス基板((株)オプトサイエンス製)を透明支持基板とした。この透明支持基板を市販の蒸着装置(長州産業(株)製)の基板ホルダーに固定し、HI、HT、EB、BH1、化合物(BNpCz-12mS-0230-1)、およびETをそれぞれ入れたタンタル製蒸着用ボート、LiFおよびアルミニウムをそれぞれ入れた窒化アルミニウム製蒸着用ボートを装着した。
<構成A:比較化合物2をドーパントに用いた素子>
ドーパントを比較化合物2に変更した以外は実施例4と同様の手順および構成にてEL素子を得た。100cd/m2発光時の発光スペクトルは半値幅(FWHM)27nmでピーク波長464nmであり、半値幅の狭い深い青色の発光が見られた。一方、100cd/m2発光時の外部量子効率は13.8%、1000cd/m2発光時の外部量子効率は5.5%であり、実施例4と比べて効率が低く、ロールオフも大きかった。
<ホストがEMH2、ドーパントが化合物(BOCz-0001)の素子>
スパッタリングにより180nmの厚さに製膜したITOを150nmまで研磨した、26mm×28mm×0.7mmのガラス基板((株)オプトサイエンス製)を透明支持基板とする。この透明支持基板を市販の蒸着装置(昭和真空(株)製)の基板ホルダーに固定し、HI2、HAT-CN、HT2、HT3、EMH2、化合物(BOCz-0001)、ET2およびET3をそれぞれ入れたモリブデン製蒸着用ボート、Liq、LiFおよびアルミニウムをぞれぞれ入れた窒化アルミニウム製蒸着用ボートを装着する。
<構成F:ホスト化合物をEMH1、アシスティングドーパントを化合物(2PXZ-TAZ)、エミッティングドーパントを化合物(BNpCz-12mS-0230-1)とした素子>
スパッタリングにより200nmの厚さに製膜したITOを50nmまで研磨した、26mm×28mm×0.7mmのガラス基板((株)オプトサイエンス製)を透明支持基板とする。この透明支持基板を市販の蒸着装置(長州産業(株)製)の基板ホルダーに固定し、HI、HT、EB、EMH1、化合物(2PXZ-TAZ)、化合物(BNpCz-12mS-0230-1)、およびETをそれぞれ入れたタンタル製蒸着用ボート、LiFおよびアルミニウムをそれぞれ入れた窒化アルミニウム製蒸着用ボートを装着する。
次に、DFT計算を用いてTADF活性である発光材料の構造を設計した。B3LYP/6-31G(d)法を用いて基底状態の構造最適化を行った後、Time-dependent DFT法を用いて基底状態からの垂直励起エネルギーを計算し、一重項励起エネルギー(ES)より発光波長を見積もった。全ての計算は量子化学計算プログラムFirefly (A. A. Granovsky, Firefly version 8)を用いて行った。
参考化合物1の一重項励起エネルギーは2.9040eVであり、波長に換算すると427nmであった。参考化合物1を特願2017-562549に記載の方法で合成し、1%PSt分散膜中の発光波長を測定したところ448nmであった。計算により一重項励起エネルギーより予想される波長に比べて発光波長は21nm長波長側であった。
化合物(BOCzb-3b30)の一重項励起エネルギーは2.7943eVであり、波長に換算すると444nmであるため、予想される発光波長は465nmであった。計算結果より、化合物(BOCzb-3b30)は青色発光が得られると予想された。
化合物(BOCzb-0211S/3b30)の一重項励起エネルギーは2.8048eVであり、波長に換算すると442nmであるため、予想される発光波長は463nmであった。計算結果より、化合物(BOCzb-0211S/3b30)は青色発光が得られると予想された。
化合物(BOCza-0530)の一重項励起エネルギーは2.8146eVであり、波長に換算すると441nmであるため、予想される発光波長は462nmであった。計算結果より、化合物(BOCza-0530)は青色発光が得られると予想された。
化合物(BOCza-0530/0911S)の一重項励起エネルギーは2.8122eVであり、波長に換算すると441nmであるため、予想される発光波長は462nmであった。計算結果より、化合物(BOCza-0530/0911S)は青色発光が得られると予想された。
101 基板
102 陽極
103 正孔注入層
104 正孔輸送層
105 発光層
106 電子輸送層
107 電子注入層
108 陰極
Claims (27)
- 下記一般式(1)で表される多環芳香族化合物、または下記一般式(1)で表される構造を複数有する多環芳香族化合物の多量体。
R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13およびR14は、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、また、R1~R3、R4~R7、R8~R10およびR11~R14のうちの隣接する基同士が結合してa環、b環、c環およびd環の少なくとも1つと共にアリール環またはヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシで置換されていてもよく、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Xは、>O、>N-R、>Sまたは>Seであり、前記>N-RのRは、アリール、ヘテロアリール、アルキルまたはシクロアルキルであり、これらにおける少なくとも1つの水素は、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Lは、単結合、>C(-R)2、>O、>Sおよび>N-Rであり、前記>C(-R)2および>N-RにおけるRは、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
ただし、Xが>N-Rであるとき、Lが>Oであることはなく、
多量体の場合の式(1)中のR2は水素であり、そして、
一般式(1)で表される化合物および構造における少なくとも1つの水素は、シアノ、ハロゲンまたは重水素で置換されていてもよい。) - R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13およびR14は、それぞれ独立して、水素、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただし各アリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキル、炭素数5~10のシクロアルキル、炭素数1~12のアルコキシまたは炭素数6~30のアリールオキシであり、これらにおける少なくとも1つの水素はさらに、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、また、R1~R3、R4~R7、R8~R10およびR11~R14のうちの隣接する基同士が結合してa環、b環、c環およびd環の少なくとも1つと共に炭素数9~16のアリール環または炭素数6~15のヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただし各アリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキル、炭素数5~10のシクロアルキル、炭素数1~12のアルコキシまたは炭素数6~30のアリールオキシで置換されていてもよく、これらにおける少なくとも1つの水素はさらに、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、
Xは、>O、>N-R、>Sまたは>Seであり、前記>N-RのRは、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルであり、これらにおける少なくとも1つの水素は、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、
Lは、単結合、>C(-R)2、>O、>Sおよび>N-Rであり、前記>C(-R)2および>N-RにおけるRは、それぞれ独立して、水素、炭素数6~30のアリール、炭素数2~30のヘテロアリール、ジアリールアミノ(ただし各アリールは炭素数6~12のアリール)、ジアリールボリル(ただし各アリールは炭素数6~12のアリールであり、2つのアリールは単結合または連結基を介して結合していてもよい)、炭素数1~12のアルキル、炭素数5~10のシクロアルキル、炭素数1~12のアルコキシまたは炭素数6~30のアリールオキシであり、これらにおける少なくとも1つの水素はさらに、炭素数6~30のアリール、炭素数2~30のヘテロアリール、炭素数1~12のアルキルまたは炭素数5~10のシクロアルキルで置換されていてもよく、
ただし、Xが>N-Rであるとき、Lが>Oであることはなく、
多量体の場合の式(1)中のR2は水素であり、そして、
一般式(1)で表される化合物および構造における少なくとも1つの水素は、シアノ、ハロゲンまたは重水素で置換されていてもよい、
請求項1に記載の多環芳香族化合物またはその多量体。 - R4~R7のうちの隣接する基同士が結合してb環と共に形成されたアリール環またはヘテロアリール環が、ナフタレン環、フェナントレン環、アントラセン環、ジベンゾフラン環、カルバゾール環、ジベンゾチオフェン環、シラフルオレン環、フルオレン環およびこれらの環にさらにベンゼン環が縮合した環からなる群から選択される、請求項1または2に記載の多環芳香族化合物またはその多量体。
- R4~R7のうちの隣接する基同士が結合してb環と共に形成されたアリール環またはヘテロアリール環が、下記部分構造式(1a)、式(1b)または式(1c)で表される環である、請求項3に記載の多環芳香族化合物またはその多量体。
R4、R5、R7、R1b、R2b、R3b、R4b、R5bおよびR6bは、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Xは、>O、>N-R、>Sまたは>Seであり、前記>N-RのRは、アリール、ヘテロアリール、アルキルまたはシクロアルキルであり、これらにおける少なくとも1つの水素は、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよく、
Zは、>O、>N-R、>S、>Si(-R)2および>C(-R)2であり、前記>N-R、>Si(-R)2および>C(-R)2におけるRは、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキル、シクロアルキル、アルコキシまたはアリールオキシであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、アルキルまたはシクロアルキルで置換されていてもよい。 - 前記Xとしての>N-RのRがアリールまたはヘテロアリールであり、当該アリールまたはヘテロアリールにおける少なくとも1つの水素がフッ素で置換されている、請求項1~4のいずれかに記載の多環芳香族化合物またはその多量体。
- 前記Xとしての>N-RのRがアリールまたはヘテロアリールであり、当該アリールまたはヘテロアリールにおける前記Nに対するオルト位の少なくとも1つの水素がフッ素で置換されている、請求項1~4のいずれかに記載の多環芳香族化合物またはその多量体。
- Lが、単結合、>Oまたは>N-Rである、請求項1~6のいずれかに記載の多環芳香族化合物またはその多量体。
- Lが、単結合である、請求項1~6のいずれかに記載の多環芳香族化合物またはその多量体。
- Xが>Oであり、Lが単結合である、請求項1~4のいずれかに記載の多環芳香族化合物またはその多量体。
- Xが>N-Rであり、Lが単結合である、請求項1~6のいずれかに記載の多環芳香族化合物またはその多量体。
- R7およびR8のうち、一方が、ハロゲン、炭素数1~6のアルキル、炭素数3~14のシクロアルキル、炭素数6~10のアリールまたは炭素数2~10のヘテロアリールであり、他方が、水素、炭素数1~6のアルキル、炭素数3~14のシクロアルキル、炭素数6~10のアリールまたは炭素数2~10のヘテロアリールである、請求項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
- R7およびR8のうち、一方が、ハロゲン、炭素数1~4のアルキル、炭素数5~10のシクロアルキルまたはフェニルであり、他方が、水素、炭素数1~4のアルキル、炭素数5~10のシクロアルキルまたはフェニルである、請求項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
- R7およびR8のうち、一方が、メチル、t-ブチルまたはフェニルであり、他方が、水素、メチル、t-ブチルまたはフェニルである、請求項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
- R7およびR8のうち、一方が、メチルまたはt-ブチルであり、他方が水素またはメチルである、請求項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
- R7およびR8のうち、一方がメチルであり、他方が水素であり、Xが>N-Rの場合は、当該>N-RのRがフェニルであり、当該フェニルにおける少なくとも1つの水素は、炭素数6~12のアリール、炭素数2~10のヘテロアリール、炭素数1~6のアルキル、炭素数3~14のシクロアルキルまたはフッ素で置換されていてもよい、請求項1~10のいずれかに記載の多環芳香族化合物またはその多量体。
- 請求項1~18のいずれかに記載する多環芳香族化合物またはその多量体を含有する、有機デバイス用材料。
- 前記有機デバイス用材料は、有機電界発光素子用材料、有機電界効果トランジスタ用材料または有機薄膜太陽電池用材料である、請求項19に記載する有機デバイス用材料。
- 前記有機電界発光素子用材料が発光層用材料である、請求項20に記載する有機デバイス用材料。
- 陽極および陰極からなる一対の電極と、該一対の電極間に配置され、請求項21に記載する発光層用材料を含有する発光層とを有する、有機電界発光素子。
- 前記発光層はさらに下記一般式(5)で表される化合物を含有する、請求項22または23に記載の有機電界発光素子。
R1~R11は、それぞれ独立して、水素、アリール、ヘテロアリール、ジアリールアミノ、ジヘテロアリールアミノ、アリールへテロアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルであり、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルで置換されていてもよく、
R1~R11のうちの隣接する基同士が結合してa環、b環またはc環と共にアリール環またはヘテロアリール環を形成していてもよく、形成された環における少なくとも1つの水素は、アリール、ヘテロアリール、ジアリールアミノ、ジヘテロアリールアミノ、アリールヘテロアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルで置換されていてもよく、これらにおける少なくとも1つの水素はさらに、アリール、ヘテロアリール、ジアリールアミノ、ジアリールボリル(2つのアリールは単結合または連結基を介して結合していてもよい)、アルキルまたはシクロアルキルで置換されていてもよく、
一般式(5)で表される化合物における少なくとも1つの水素は、それぞれ独立して、ハロゲンまたは重水素で置換されてもよい。) - 前記陰極と該発光層との間に配置される電子輸送層および/または電子注入層を有し、該電子輸送層および電子注入層の少なくとも1つは、ボラン誘導体、ピリジン誘導体、フルオランテン誘導体、BO系誘導体、アントラセン誘導体、ベンゾフルオレン誘導体、ホスフィンオキサイド誘導体、ピリミジン誘導体、カルバゾール誘導体、トリアジン誘導体、ベンゾイミダゾール誘導体、フェナントロリン誘導体およびキノリノール系金属錯体からなる群から選択される少なくとも1つを含有する、請求項22~24のいずれかに記載する有機電界発光素子。
- 前記電子輸送層および/または電子注入層が、さらに、アルカリ金属、アルカリ土類金属、希土類金属、アルカリ金属の酸化物、アルカリ金属のハロゲン化物、アルカリ土類金属の酸化物、アルカリ土類金属のハロゲン化物、希土類金属の酸化物、希土類金属のハロゲン化物、アルカリ金属の有機錯体、アルカリ土類金属の有機錯体および希土類金属の有機錯体からなる群から選択される少なくとも1つを含有する、請求項25に記載の有機電界発光素子。
- 請求項22~26のいずれかに記載する有機電界発光素子を備えた表示装置または照明装置。
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201980037310.1A CN112236435A (zh) | 2018-06-11 | 2019-06-10 | 多环芳香族化合物及其多聚体 |
| KR1020207036950A KR102690280B1 (ko) | 2018-06-11 | 2019-06-10 | 다환 방향족 화합물 및 그의 다량체 |
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2018-110876 | 2018-06-11 | ||
| JP2018110876 | 2018-06-11 | ||
| JP2019047083 | 2019-03-14 | ||
| JP2019-047083 | 2019-03-14 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| WO2019240080A1 true WO2019240080A1 (ja) | 2019-12-19 |
Family
ID=68842287
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| PCT/JP2019/022933 WO2019240080A1 (ja) | 2018-06-11 | 2019-06-10 | 多環芳香族化合物およびその多量体 |
Country Status (4)
| Country | Link |
|---|---|
| KR (1) | KR102690280B1 (ja) |
| CN (1) | CN112236435A (ja) |
| TW (1) | TW202000676A (ja) |
| WO (1) | WO2019240080A1 (ja) |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3738965A1 (en) * | 2019-05-08 | 2020-11-18 | cynora GmbH | Organic molecules for optoelectronic devices |
| WO2020250700A1 (ja) * | 2019-06-11 | 2020-12-17 | 学校法人関西学院 | 多環芳香族化合物 |
| WO2021215446A1 (ja) * | 2020-04-22 | 2021-10-28 | 出光興産株式会社 | 化合物、有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子及び電子機器 |
| WO2021230658A1 (ko) * | 2020-05-12 | 2021-11-18 | 머티어리얼사이언스 주식회사 | 유기 전계 발광 소자 |
| KR20210138512A (ko) * | 2020-05-12 | 2021-11-19 | 머티어리얼사이언스 주식회사 | 유기 전계 발광 소자 |
| JP2022507224A (ja) * | 2018-11-20 | 2022-01-18 | エスエフシー カンパニー リミテッド | 新規なホウ素化合物及びこれを含む有機発光素子 |
| WO2022024664A1 (ja) * | 2020-07-28 | 2022-02-03 | 住友化学株式会社 | 組成物及び発光素子 |
| WO2022085590A1 (ja) | 2020-10-20 | 2022-04-28 | 日鉄ケミカル&マテリアル株式会社 | 発光材料、及び有機電界発光素子 |
| WO2022085714A1 (ja) * | 2020-10-23 | 2022-04-28 | 国立大学法人九州大学 | ホウ素含有化合物、発光材料およびそれを用いた発光素子 |
| WO2024101071A1 (ja) * | 2022-11-11 | 2024-05-16 | 住友化学株式会社 | 組成物及びそれを含有する発光素子、並びに化合物 |
| KR20240145991A (ko) | 2022-02-17 | 2024-10-07 | 닛테츠 케미컬 앤드 머티리얼 가부시키가이샤 | 발광 재료 및 유기 전계 발광 소자 |
Families Citing this family (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN115806563A (zh) * | 2021-09-13 | 2023-03-17 | 广东阿格蕾雅光电材料有限公司 | 一类含b-n的有机电致发光材料及其在电致发光器件中的应用 |
| CN115746031B (zh) * | 2022-02-25 | 2024-09-27 | 黑龙江大学 | 硼氮杂环的热激发延迟荧光材料及其合成方法和应用 |
| CN116514859B (zh) * | 2023-06-26 | 2023-09-26 | 浙江华显光电科技有限公司 | 一种窄发射发光化合物及在电子器件中的应用 |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015102118A1 (ja) * | 2014-02-18 | 2015-07-09 | 学校法人関西学院 | 多環芳香族化合物 |
| WO2016152544A1 (ja) * | 2015-03-24 | 2016-09-29 | 学校法人関西学院 | 有機電界発光素子 |
| WO2017188111A1 (ja) * | 2016-04-26 | 2017-11-02 | 学校法人関西学院 | 有機電界発光素子 |
| CN107417715A (zh) * | 2017-07-14 | 2017-12-01 | 瑞声科技(南京)有限公司 | 一种有机电致发光材料及其发光器件 |
| WO2018095397A1 (zh) * | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 含硼有机化合物及应用、有机混合物、有机电子器件 |
| WO2018186670A1 (ko) * | 2017-04-03 | 2018-10-11 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20180112722A (ko) * | 2017-04-03 | 2018-10-12 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| WO2018212169A1 (ja) * | 2017-05-16 | 2018-11-22 | 学校法人関西学院 | 多環芳香族化合物 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP3735703B2 (ja) | 1999-12-21 | 2006-01-18 | 大阪大学長 | エレクトロルミネッセンス素子 |
| US20040131881A1 (en) | 2002-12-31 | 2004-07-08 | Eastman Kodak Company | Complex fluorene-containing compounds for use in OLED devices |
| JP2005170911A (ja) | 2003-12-15 | 2005-06-30 | Idemitsu Kosan Co Ltd | 芳香族化合物およびそれを用いた有機エレクトロルミネッセンス素子 |
| DE102010009903A1 (de) | 2010-03-02 | 2011-09-08 | Merck Patent Gmbh | Verbindungen für elektronische Vorrichtungen |
| US20140058099A1 (en) | 2011-03-03 | 2014-02-27 | Kyushu University National University Corporation | Novel compound, charge transport material, and organic device |
-
2019
- 2019-06-10 CN CN201980037310.1A patent/CN112236435A/zh active Pending
- 2019-06-10 KR KR1020207036950A patent/KR102690280B1/ko active IP Right Grant
- 2019-06-10 WO PCT/JP2019/022933 patent/WO2019240080A1/ja active Application Filing
- 2019-06-11 TW TW108120148A patent/TW202000676A/zh unknown
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015102118A1 (ja) * | 2014-02-18 | 2015-07-09 | 学校法人関西学院 | 多環芳香族化合物 |
| WO2016152544A1 (ja) * | 2015-03-24 | 2016-09-29 | 学校法人関西学院 | 有機電界発光素子 |
| WO2017188111A1 (ja) * | 2016-04-26 | 2017-11-02 | 学校法人関西学院 | 有機電界発光素子 |
| WO2018095397A1 (zh) * | 2016-11-23 | 2018-05-31 | 广州华睿光电材料有限公司 | 含硼有机化合物及应用、有机混合物、有机电子器件 |
| WO2018186670A1 (ko) * | 2017-04-03 | 2018-10-11 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| KR20180112722A (ko) * | 2017-04-03 | 2018-10-12 | 주식회사 엘지화학 | 화합물 및 이를 포함하는 유기 발광 소자 |
| WO2018212169A1 (ja) * | 2017-05-16 | 2018-11-22 | 学校法人関西学院 | 多環芳香族化合物 |
| CN107417715A (zh) * | 2017-07-14 | 2017-12-01 | 瑞声科技(南京)有限公司 | 一种有机电致发光材料及其发光器件 |
Cited By (17)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US12030900B2 (en) | 2018-11-20 | 2024-07-09 | Sfc Co., Ltd. | Boron compound and organic light-emitting diode comprising same |
| JP2022507224A (ja) * | 2018-11-20 | 2022-01-18 | エスエフシー カンパニー リミテッド | 新規なホウ素化合物及びこれを含む有機発光素子 |
| JP7238120B2 (ja) | 2018-11-20 | 2023-03-13 | エスエフシー カンパニー リミテッド | 新規なホウ素化合物及びこれを含む有機発光素子 |
| US11472820B2 (en) | 2019-05-08 | 2022-10-18 | Samsung Display Co., Ltd. | Organic molecules for optoelectronic devices |
| EP3738965A1 (en) * | 2019-05-08 | 2020-11-18 | cynora GmbH | Organic molecules for optoelectronic devices |
| WO2020250700A1 (ja) * | 2019-06-11 | 2020-12-17 | 学校法人関西学院 | 多環芳香族化合物 |
| WO2021215446A1 (ja) * | 2020-04-22 | 2021-10-28 | 出光興産株式会社 | 化合物、有機エレクトロルミネッセンス素子用材料、有機エレクトロルミネッセンス素子及び電子機器 |
| KR102550442B1 (ko) | 2020-05-12 | 2023-07-03 | 머티어리얼사이언스 주식회사 | 유기 전계 발광 소자 |
| KR20210138512A (ko) * | 2020-05-12 | 2021-11-19 | 머티어리얼사이언스 주식회사 | 유기 전계 발광 소자 |
| WO2021230658A1 (ko) * | 2020-05-12 | 2021-11-18 | 머티어리얼사이언스 주식회사 | 유기 전계 발광 소자 |
| WO2022024664A1 (ja) * | 2020-07-28 | 2022-02-03 | 住友化学株式会社 | 組成物及び発光素子 |
| EP4190879A4 (en) * | 2020-07-28 | 2024-08-21 | Sumitomo Chemical Co | COMPOSITION AND ELECTROLUMINESCENT ELEMENT |
| WO2022085590A1 (ja) | 2020-10-20 | 2022-04-28 | 日鉄ケミカル&マテリアル株式会社 | 発光材料、及び有機電界発光素子 |
| KR20230091092A (ko) | 2020-10-20 | 2023-06-22 | 닛테츠 케미컬 앤드 머티리얼 가부시키가이샤 | 발광 재료, 및 유기 전계 발광 소자 |
| WO2022085714A1 (ja) * | 2020-10-23 | 2022-04-28 | 国立大学法人九州大学 | ホウ素含有化合物、発光材料およびそれを用いた発光素子 |
| KR20240145991A (ko) | 2022-02-17 | 2024-10-07 | 닛테츠 케미컬 앤드 머티리얼 가부시키가이샤 | 발광 재료 및 유기 전계 발광 소자 |
| WO2024101071A1 (ja) * | 2022-11-11 | 2024-05-16 | 住友化学株式会社 | 組成物及びそれを含有する発光素子、並びに化合物 |
Also Published As
| Publication number | Publication date |
|---|---|
| KR102690280B1 (ko) | 2024-07-30 |
| CN112236435A (zh) | 2021-01-15 |
| KR20210019025A (ko) | 2021-02-19 |
| TW202000676A (zh) | 2020-01-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102690280B1 (ko) | 다환 방향족 화합물 및 그의 다량체 | |
| JP6611825B2 (ja) | 多環芳香族化合物 | |
| JP5935199B2 (ja) | 多環芳香族化合物 | |
| WO2019102936A1 (ja) | 有機デバイス用材料およびそれを用いた有機電界発光素子 | |
| WO2018047639A1 (ja) | 多環芳香族化合物 | |
| TW202017225A (zh) | 有機電場發光元件、顯示裝置以及照明裝置 | |
| KR20200099107A (ko) | 다환 방향족 화합물 및 그의 다량체 | |
| JP2018043984A (ja) | 多環芳香族化合物 | |
| WO2019235402A1 (ja) | 多環芳香族化合物およびその多量体 | |
| JP6156389B2 (ja) | ベンゾフルオレン化合物、該化合物を用いた発光層用材料および有機電界発光素子 | |
| WO2018146962A1 (ja) | 有機電界発光素子 | |
| JP7083132B2 (ja) | 多環芳香族アミノ化合物 | |
| JP5949779B2 (ja) | ベンゾフルオレン化合物、該化合物を用いた発光層用材料および有機電界発光素子 | |
| WO2019151204A1 (ja) | 多環芳香族化合物の発光材料を用いた有機電界発光素子 | |
| WO2019074093A1 (ja) | 多環芳香族系二量体化合物 | |
| WO2018146894A1 (ja) | 有機電界発光素子 | |
| JP7269602B2 (ja) | 多環芳香族化合物およびその多量体 | |
| JP6750623B2 (ja) | アゾリン環含有化合物、これを含有する電子輸送/注入層用材料およびこれを用いた有機電界発光素子 | |
| JP7018171B2 (ja) | アルケニル基を有する多環芳香族化合物およびその多量体 | |
| JP6349902B2 (ja) | アントラセン誘導体および有機el素子 | |
| JP7530593B2 (ja) | アルキル置換多環芳香族化合物を含有する電子輸送材料または電子注入材料 | |
| JP2012250977A (ja) | ベンゾフルオレン化合物、該化合物を用いた発光層用材料および有機電界発光素子 | |
| JP6610447B2 (ja) | 自己組織化し得る多環式芳香族化合物およびそれを用いた有機el素子 | |
| JP2019038798A (ja) | 多環芳香族化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| 121 | Ep: the epo has been informed by wipo that ep was designated in this application |
Ref document number: 19819088 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: DE |
|
| ENP | Entry into the national phase |
Ref document number: 20207036950 Country of ref document: KR Kind code of ref document: A |
|
| 122 | Ep: pct application non-entry in european phase |
Ref document number: 19819088 Country of ref document: EP Kind code of ref document: A1 |
|
| NENP | Non-entry into the national phase |
Ref country code: JP |