TWI741478B - 作為lsd1抑制劑之環丙胺 - Google Patents
作為lsd1抑制劑之環丙胺 Download PDFInfo
- Publication number
- TWI741478B TWI741478B TW109101686A TW109101686A TWI741478B TW I741478 B TWI741478 B TW I741478B TW 109101686 A TW109101686 A TW 109101686A TW 109101686 A TW109101686 A TW 109101686A TW I741478 B TWI741478 B TW I741478B
- Authority
- TW
- Taiwan
- Prior art keywords
- alkyl
- membered
- methyl
- group
- cancer
- Prior art date
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/10—Spiro-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/397—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having four-membered rings, e.g. azetidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/438—The ring being spiro-condensed with carbocyclic or heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/4427—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems
- A61K31/4439—Non condensed pyridines; Hydrogenated derivatives thereof containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. omeprazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4468—Non condensed piperidines, e.g. piperocaine having a nitrogen directly attached in position 4, e.g. clebopride, fentanyl
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/4965—Non-condensed pyrazines
- A61K31/497—Non-condensed pyrazines containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D205/00—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom
- C07D205/02—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings
- C07D205/04—Heterocyclic compounds containing four-membered rings with one nitrogen atom as the only ring hetero atom not condensed with other rings having no double bonds between ring members or between ring members and non-ring members
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/10—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms
- C07D211/14—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms with hydrocarbon or substituted hydrocarbon radicals attached to the ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/10—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms
- C07D211/16—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with radicals containing only carbon and hydrogen atoms attached to ring carbon atoms with acylated ring nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/30—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by doubly bound oxygen or sulfur atoms or by two oxygen or sulfur atoms singly bound to the same carbon atom
- C07D211/32—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by doubly bound oxygen or sulfur atoms or by two oxygen or sulfur atoms singly bound to the same carbon atom by oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/08—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms
- C07D211/18—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D211/34—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hydrocarbon or substituted hydrocarbon radicals directly attached to ring carbon atoms with substituted hydrocarbon radicals attached to ring carbon atoms with hydrocarbon radicals, substituted by carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D211/00—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings
- C07D211/04—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D211/06—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members
- C07D211/36—Heterocyclic compounds containing hydrogenated pyridine rings, not condensed with other rings with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having no double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D211/56—Nitrogen atoms
- C07D211/58—Nitrogen atoms attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Oncology (AREA)
- Virology (AREA)
- Communicable Diseases (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Hydrogenated Pyridines (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本發明係關於環丙胺衍生物,其為適用於治療諸如癌症之疾病的LSD1抑制劑。
Description
本發明係關於選擇性調節去甲基酶的酶抑制劑及其用途。特定實施例涵蓋適合於藉由調節離胺酸特異性去甲基酶-1 (LSD1)來進行治療之化合物及疾病適應症。
表觀遺傳修飾可影響遺傳變異,但在失調時,亦可促使各種疾病產生(Portela, A.及M. Esteller,Epigenetic modifications and human disease.
Nat Biotechnol, 2010. 28(10): 第1057-68頁;Lund, A.H.及M. van Lohuizen,Epigenetics and cancer.
Genes Dev, 2004. 18(19): 第2315-35頁)。最近,深入之癌症基因組研究已發現在多種癌症中許多表觀遺傳調節基因常常發生突變或其自身之表現異常(Dawson, M.A.及T. Kouzarides,Cancer epigenetics: from mechanism to therapy.
Cell, 2012. 150(1): 第12-27頁;Waldmann, T.及R. Schneider,Targeting histone modifications--epigenetics in cancer.
Curr Opin Cell Biol, 2013. 25(2): 第184-9頁;Shen, H.及P.W. Laird,Interplay between the cancer genome and epigenome.
Cell, 2013. 153(1): 第38-55頁)。此表示表觀遺傳調節因子起癌症驅動劑的作用或容許腫瘤形成或疾病進展。因此,失調之表觀遺傳調節因子為吸引人之治療標靶。
一種與人類疾病有關之特定酶為離胺酸特異性去甲基酶-1(LSD1),即首次發現之組蛋白去甲基酶(Shi, Y.等人,Histone demethylation mediated by the nuclear amine oxidase homolog LSD1
. Cell, 2004. 119(7): 第941-53頁)。其由三個主要之結構域組成:N端SWIRM,其功能在於核小體靶向;塔形結構域(tower domain),其涉及蛋白質-蛋白質相互作用,諸如轉錄輔抑制物、RE1沈默轉錄因子之輔抑制物(CoREST);及最後之C端催化結構域,其序列及結構與黃素腺嘌呤二核苷酸(FAD)依賴性單胺氧化酶(亦即MAO-A及MAO-B)共有同源性(Forneris, F.等人,Structural basis of LSD1-CoREST selectivity in histone H3 recognition
. J Biol Chem, 2007. 282(28): 第20070-4頁;Anand, R.及R. Marmorstein,Structure and mechanism of lysine-specific demethylase enzymes
. J Biol Chem, 2007. 282(49): 第35425-9頁;Stavropoulos, P.、G. Blobel及A. Hoelz,Crystal structure and mechanism of human lysine-specific demethylase-1
. Nat Struct Mol Biol, 2006. 13(7): 第626-32頁;Chen, Y.等人,Crystal structure of human histone lysine-specific demethylase 1 (LSD1)
. Proc Natl Acad Sci U S A, 2006. 103(38): 第13956-61頁)。LSD1亦與另一種離胺酸特異性去甲基酶(LSD2)共有相當程度之同源性(Karytinos, A.等人,A novel mammalian flavin-dependent histone demethylase
. J Biol Chem, 2009. 284(26): 第17775-82頁)。雖然在兩種同功異型物中生物化學作用機制為保守的,但認為受質特異性為不同的而有相對小之重疊。LSD1及LSD2之酶反應依賴於FAD之氧化還原過程,且認為對甲基化之離胺酸中質子化氮之需要限制LSD1/2對組蛋白3之4或9之位置處(H3K4或H3K9)單甲基化及二甲基化之活性。此等機制使得LSD1/2不同於其他組蛋白去甲基酶家族(亦即含有十字形結構域(Jumonji domain)之家族),該等其他組蛋白去甲基酶家族可經由α-酮戊二酸依賴性反應來脫除單甲基化、二甲基化及三甲基化離胺酸之甲基(Kooistra, S.M.及K. Helin,Molecular mechanisms and potential functions of histone demethylases
. Nat Rev Mol Cell Biol, 2012. 13(5): 第297-311頁;Mosammaparast, N.及Y. Shi,Reversal of histone methylation: biochemical and molecular mechanisms of histone demethylases
. Annu Rev Biochem, 2010. 79: 第155-79頁)。
K3K4及H3K9上之甲基化組蛋白標記一般分別與轉錄活化及轉錄抑制相關聯。作為輔抑制物複合體(例如CoREST)的一部分,LSD1據報導可脫除H3K4的甲基且抑制轉錄,而LSD1於核激素受體複合體(例如雄激素受體)中可脫除H3K9的甲基以活化基因表現(Metzger, E.等人,LSD1 demethylates repressive histone marks to promote androgen-receptor-dependent transcription
. Nature, 2005. 437(7057): 第436-9頁;Kahl, P.等人,Androgen receptor coactivators lysine-specific histone demethylase 1 and four and a half LIM domain protein 2 predict risk of prostate cancer recurrence
. Cancer Res, 2006. 66(23): 第11341-7頁)。此表明LSD1之受質特異性可由所締合之因子決定,從而以背景依賴性方式調節替代性基因表現。除組蛋白蛋白質之外,LSD1亦可脫除非組蛋白蛋白質之甲基。此等非組蛋白蛋白質包括p53 (Huang, J.等人,p53 is regulated by the lysine demethylase LSD1
. Nature, 2007. 449(7158): 第105-8頁)、E2F (Kontaki, H.及I. Talianidis,Lysine methylation regulates E2F1-induced cell death
. Mol Cell, 2010. 39(1): 第152-60頁)、STAT3 (Yang, J.等人,Reversible methylation of promoter-bound STAT3 by histone-modifying enzymes
. Proc Natl Acad Sci U S A, 2010. 107(50): 第21499-504頁)、Tat (Sakane, N.等人,Activation of HIV transcription by the viral Tat protein requires a demethylation step mediated by lysine-specific demethylase 1 (LSD1/KDM1)
. PLoS Pathog, 2011. 7(8): 第e1002184頁)、及肌球蛋白磷酸酶靶次單位1 (myosin phosphatase target subunit 1,MYPT1)(Cho, H.S.等人,Demethylation of RB regulator MYPT1 by histone demethylase LSD1 promotes cell cycle progression in cancer cells
. Cancer Res, 2011. 71(3): 第655-60頁)。非組蛋白受質之清單隨著功能蛋白質組學研究之技術進步而不斷增長。此等表明LSD1之其他致癌作用超出調節染色質重塑以外。LSD1亦與其他表觀遺傳調節因子締合,諸如DNA甲基轉移酶1 (DNMT1)(Wang, J.等人,The lysine demethylase LSD1 (KDM1) is required for maintenance of global DNA methylation
. Nat Genet, 2009. 41(1): 第125-9頁)及組蛋白去乙醯酶(HDAC)複合體(Hakimi, M.A.等人,A core-BRAF35 complex containing histone deacetylase mediates repression of neuronal-specific genes
. Proc Natl Acad Sci U S A, 2002. 99(11): 第7420-5頁;Lee, M.G.等人,Functional interplay between histone demethylase and deacetylase enzymes
. Mol Cell Biol, 2006. 26(17): 第6395-402頁;You, A.等人,CoREST is an integral component of the CoREST- human histone deacetylase complex
. Proc Natl Acad Sci U S A, 2001. 98(4): 第1454-8頁)。此等締合增強DNMT或HDAC之活性。LSD1抑制劑因此可增強HDAC或DNMT抑制劑之作用。實際上,臨床前研究早已展示該潛能(Singh, M.M.等人,Inhibition of LSD1 sensitizes glioblastoma cells to histone deacetylase inhibitors
. Neuro Oncol, 2011. 13(8): 第894-903頁;Han, H.等人,Synergistic re-activation of epigenetically silenced genes by combinatorial inhibition of DNMTs and LSD1 in cancer cells
. PLoS One, 2013. 8(9): 第e75136頁)。
LSD1已據報導可促成多種生物過程,包括細胞增殖、上皮-間質轉化(EMT)、及幹細胞生物學(胚胎幹細胞及癌症幹細胞兩者)或體細胞之自行更新及細胞轉型(Chen, Y.等人,Lysine-specific histone demethylase 1 (LSD1): A potential molecular target for tumor therapy
. Crit Rev Eukaryot Gene Expr, 2012. 22(1): 第53-9頁;Sun, G.等人,Histone demethylase LSD1 regulates neural stem cell proliferation.
Mol Cell Biol, 2010. 30(8): 第1997-2005頁;Adamo, A.、M.J. Barrero及J.C. Izpisua Belmonte,LSD1 and pluripotency: a new player in the network
. Cell Cycle, 2011. 10(19): 第3215-6頁;Adamo, A.等人,LSD1 regulates the balance between self-renewal and differentiation in human embryonic stem cells
. Nat Cell Biol, 2011. 13(6): 第652-9頁)。詳言之,癌症幹細胞或癌症始原細胞具有一些促成癌細胞之異質性的多潛能幹細胞特性。此種特徵可導致癌細胞對諸如化學療法或放射療法之習知療法較具抗性,且接著在治療後產生復發(Clevers, H.,The cancer stem cell: premises, promises and challenges
. Nat Med, 2011. 17(3): 第313-9頁;Beck, B.及C. Blanpain,Unravelling cancer stem cell potential
. Nat Rev Cancer, 2013. 13(10): 第727-38頁)。據報導LSD1可在多種癌症中維持未分化之腫瘤始原細胞或癌症幹細胞表型(Zhang, X.等人,Pluripotent Stem Cell Protein Sox2 Confers Sensitivity to LSD1 Inhibition in Cancer Cells
. Cell Rep, 2013. 5(2): 第445-57頁;Wang, J.等人,Novel histone demethylase LSD1 inhibitors selectively target cancer cells with pluripotent stem cell properties
. Cancer Res, 2011. 71(23): 第7238-49頁)。急性骨髓性白血病(AML)為贅生性細胞之實例,該等贅生性細胞保持其一些較低程度分化之幹細胞樣表型或白血病幹細胞(LSC)潛能。包括基因表現陣列及利用新一代定序(ChIP-Seq)進行之染色質免疫沈澱的對AML細胞之分析揭露LSD1可調節涉及多個致癌程序以維持LSC之一組基因(Harris, W.J.等人,The histone demethylase KDM1A sustains the oncogenic potential of MLL-AF9 leukemia stem cells
. Cancer Cell, 2012. 21(4): 第473-87頁;Schenk, T.等人,Inhibition of the LSD1 (KDM1A) demethylase reactivates the all-trans-retinoic acid differentiation pathway in acute myeloid leukemia
. Nat Med, 2012. 18(4): 第605-11頁)。此等發現表明靶向具有幹細胞特性之癌症(諸如AML)之LSD1抑制劑的潛在治療益處。
在多種類型之癌症中頻繁地觀測到LSD1之過度表現,包括膀胱癌、NSCLC、乳癌、卵巢癌、神經膠質瘤、結腸直腸癌、肉瘤,包括軟骨肉瘤、尤文氏肉瘤(Ewing's sarcoma)、骨肉瘤及橫紋肌肉瘤;神經母細胞瘤、前列腺癌、食道鱗狀細胞癌及乳頭狀甲狀腺癌。值得注意的是,研究發現LSD1之過度表現與臨床上具有侵襲性之癌症顯著相關,該等癌症例如復發性前列腺癌、NSCLC、神經膠質瘤、乳癌、結腸癌、卵巢癌、食道鱗狀細胞癌及神經母細胞瘤。在此等研究中,使用LSD1之小分子抑制劑阻斷LSD1基因表現或治療使癌細胞增殖減少及/或誘導細胞凋亡。參見例如Hayami, S.等人,Overexpression of LSD1 contributes to human carcinogenesis through chromatin regulation in various cancers
. Int J Cancer, 2011. 128(3): 第574-86頁;Lv, T.等人,Over-expression of LSD1 promotes proliferation, migration and invasion in non-small cell lung cancer
. PLoS One, 2012. 7(4): 第e35065頁;Serce, N.等人,Elevated expression of LSD1 (Lysine-specific demethylase 1) during tumour progression from pre-invasive to invasive ductal carcinoma of the breast
. BMC Clin Pathol, 2012. 12: 第13頁;Lim, S.等人,Lysine-specific demethylase 1 (LSD1) is highly expressed in ER-negative breast cancers and a biomarker predicting aggressive biology
. Carcinogenesis, 2010. 31(3): 第512-20頁;Konovalov, S.及I. Garcia-Bassets,Analysis of the levels of lysine-specific demethylase 1 (LSD1) mRNA in human ovarian tumors and the effects of chemical LSD1 inhibitors in ovarian cancer cell lines
. J Ovarian Res, 2013. 6(1): 第75頁;Sareddy, G.R.等人,KDM1 is a novel therapeutic target for the treatment of gliomas
. Oncotarget, 2013. 4(1): 第18-28頁;Ding, J.等人,LSD1-mediated epigenetic modification contributes to proliferation and metastasis of colon cancer
. Br J Cancer, 2013. 109(4): 第994-1003頁;Bennani-Baiti, I.M.等人,Lysine-specific demethylase 1 (LSD1/KDM1A/AOF2/BHC110) is expressed and is an epigenetic drug target in chondrosarcoma, Ewing's sarcoma, osteosarcoma, and rhabdomyosarcoma
. Hum Pathol, 2012. 43(8): 第1300-7頁;Schulte, J.H.等人,Lysine-specific demethylase 1 is strongly expressed in poorly differentiated neuroblastoma: implications for therapy.
Cancer Res, 2009. 69(5): 第2065-71頁;Crea, F.等人,The emerging role of histone lysine demethylases in prostate cancer
. Mol Cancer, 2012. 11: 第52頁;Suikki, H.E.等人,Genetic alterations and changes in expression of histone demethylases in prostate cancer
. Prostate, 2010. 70(8): 第889-98頁;Yu, Y.等人,High expression of lysine-specific demethylase 1 correlates with poor prognosis of patients with esophageal squamous cell carcinoma
. Biochem Biophys Res Commun, 2013. 437(2): 第192-8頁;Kong, L.等人,Immunohistochemical expression of RBP2 and LSD1 in papillary thyroid carcinoma
. Rom J Morphol Embryol, 2013. 54(3): 第499-503頁。
最近,報導藉由抑制LSD1活性來誘導CD86表現(Lynch, J.T.等人,CD86 expression as a surrogate cellular biomarker for pharmacological inhibition of the histone demethylase lysine-specific demethylase 1
. Anal Biochem, 2013. 442(1): 第104-6頁)。CD86表現為涉及抗腫瘤免疫反應之樹狀細胞(DC)成熟之標誌。值得注意的是,CD86充當共刺激因子以活化T細胞增殖(Greaves, P.及J.G. Gribben,The role of B7 family molecules in hematologic malignancy
. Blood, 2013. 121(5): 第734-44頁;Chen, L.及D.B. Flies,Molecular mechanisms of T cell co-stimulation and co-inhibition
. Nat Rev Immunol, 2013. 13(4): 第227-42頁)。
除在癌症中起作用之外,LSD1活性亦與病毒致病有關。特定而言,LSD1活性似乎與病毒複製及病毒基因表現相關。舉例而言,LSD1充當共活化因子以誘導各種類型之皰疹病毒自病毒立即早期基因進行基因表現,該等皰疹病毒包括單純皰疹病毒(HSV)、水痘帶狀皰狀病毒(VZV)及β-皰疹病毒人類巨細胞病毒(Liang, Y.等人,Targeting the JMJD2 histone demethylases to epigenetically control herpesvirus infection and reactivation from latency
. Sci Transl Med, 2013. 5(167): 第167ra5頁;Liang, Y.等人,Inhibition of the histone demethylase LSD1 blocks alpha-herpesvirus lytic replication and reactivation from latency
. Nat Med, 2009. 15(11): 第1312-7頁)。在此配置中,LSD1抑制劑藉由阻斷病毒複製及改變病毒相關之基因表現而顯示出抗病毒活性。
新近之研究亦已顯示藉由基因缺失或藥理學干預來抑制LSD1可使類紅血球中之胎兒球蛋白基因表現增加(Shi, L.等人,Lysine-specific demethylase 1 is a therapeutic target for fetal hemoglobin induction
. Nat Med, 2013. 19(3): 第291-4頁;Xu, J.等人,Corepressor-dependent silencing of fetal hemoglobin expression by BCL11A
. Proc Natl Acad Sci U S A, 2013. 110(16): 第6518-23頁)。對胎兒球蛋白基因之誘導潛在地在治療上有益於β-球蛋白病之疾病,包括β-地中海型貧血及鐮形血球貧血症,其中正常β-球蛋白(成人血紅蛋白之組分)之產生受損(Sankaran, V.G.及S.H. Orkin,The switch from fetal to adult hemoglobin
. Cold Spring Harb Perspect Med, 2013. 3(1): 第a011643頁;Bauer, D.E.、S.C. Kamran及S.H. Orkin,Reawakening fetal hemoglobin: prospects for new therapies for the beta-globin disorders
. Blood, 2012. 120(15): 第2945-53頁)。此外,LSD1抑制作用可增強其他臨床上使用之療法,諸如羥基脲或阿紮胞苷(azacitidine)。此等藥劑可至少部分地藉由經由不同機制增加γ-球蛋白基因表現來起作用。
總之,LSD1藉由改變組蛋白及非組蛋白蛋白質上之表觀遺傳標記來促使腫瘤產生。越來越多的資料已證實LSD1之基因缺失或藥理學干預在癌細胞中使改變之基因表現正常化,從而誘導向成熟細胞類型分化之程序,減少細胞增殖,以及促進細胞凋亡。因此,LSD1抑制劑單獨或與公認之治療性藥物組合將有效治療與LSD1活性有關之疾病。
本發明進一步係關於一種醫藥組合物,其包含式I之化合物及至少一種醫藥學上可接受之載劑。
本發明進一步係關於一種抑制LSD1之方法,其包括使LSD1與式I化合物接觸。
本發明進一步係關於一種治療患者之LSD1介導之疾病的方法,其包括投與該患者治療有效量之式I化合物。
本發明尤其提供LSD1抑制性化合物,諸如式I化合物:
I
或其醫藥學上可接受之鹽,其中:
環A為C6-10
芳基或包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基;
環B為包含碳及1、2或3個選自N、O及S之雜原子的4員至10員雜環烷基;
環C為(1) C6-10
芳基、(2) C3-10
環烷基、(3)包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基、或(4)包含碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基;
其中L係取代於環B中除環B中與RZ
鍵結之成環原子之外的任何成環原子上;
L為C1-4
伸烷基、-C(=O)-、-C(=O)O-、-C(=O)NR7
-、O、NR7
、-S(O)2
-、-S(O)-或-S(O)2
NR7
-;
各R1
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、C(=NRe
)Rb
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
;
RZ
為H、鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、C(=NRe1
)Rb1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
或S(O)2
NRc1
Rd1
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
及S(O)2
NRc1
Rd1
;
各R2
係獨立地選自鹵基、C1-6
烷基、CN、ORa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
,其中該C1-6
烷基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、CN、ORa5
、SRa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、OC(O)Rb5
、OC(O)NRc5
Rd5
、C(=NRe5
)NRc5
Rd5
、NRc5
C(=NRe5
)NRc5
Rd5
、NRc5
Rd5
、NRc5
C(O)Rb5
、NRc5
C(O)ORa5
、NRc5
C(O)NRc5
Rd5
、NRc5
S(O)Rb5
、NRc5
S(O)2
Rb5
、NRc5
S(O)2
NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
;
其中各R2
係取代於環B中除環B中與RZ
鍵結之成環原子之外的任何成環原子上;
各R3
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、C(=NRe2
)Rb2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
;
R4
為鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、C(=NRe3
)Rb3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
;
R5
及R6
各自獨立地選自H、鹵基、CN、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基及-(C1-4
烷基)-ORa4
;
R7
為H、C1-4
烷基或C1-4
鹵烷基;
各Ra
、Rb
、Rc
、Rd
、Ra1
、Rb1
、Rc1
、Rd1
、Ra2
、Rb2
、Rc2
、Rd2
、Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc
及Rd
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc1
及Rd1
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、3員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc2
及Rd2
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc3
及Rd3
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
各Ra4
、Rb4
、Rc4
及Rd4
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
或任何Rc4
及Rd4
連同其所連接之N原子一起形成3員、4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-6
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re
、Re1
、Re2
、Re3
、Re4
及Re5
係獨立地選自H、C1-4
烷基及CN;
各Ra5
、Rb5
、Rc5
、Rd5
係獨立地選自H及C1-6
烷基,該C1-6
烷基視情況經1、2、3、4或5個獨立地選自以下之取代基取代:鹵基、CN、ORa6
、SRa6
、C(O)Rb6
、C(O)NRc6
Rd6
、C(O)ORa6
、OC(O)Rb6
、OC(O)NRc6
Rd6
、NRc6
Rd6
、NRc6
C(O)Rb6
、NRc6
C(O)NRc6
Rd6
、NRc6
C(O)ORa6
、C(=NRe6
)NRc6
Rd6
、NRc6
C(=NRe6
)NRc6
Rd6
、S(O)Rb6
、S(O)NRc6
Rd6
、S(O)2
Rb6
、NRc6
S(O2
Rb6
、NRc6
S(O)2
NRc6
Rd6
及S(O)2
NRc6
Rd6
;
各Ra6
、Rb6
、Rc6
及Rd6
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re6
係獨立地選自H、C1-4
烷基及CN;
m為0、1或2;
n為0、1、2或3;
p為0、1、2或3;且
q為0、1或2;
其中當環B為6員雜環烷基,q為0且L為S(O)2
時,則環C不為噻吩基。
在一些實施例中,其中當環B為5員至6員雜環烷基,A為苯基,q為1或2,且R4
為鹵基、C1-6
烷基、經取代之C1-6
烷基、C1-6
鹵烷基、5員至10員雜芳基、CN、ORa3
、C(O)NRc3
Rd3
、C(O)ORa3
、NRc3
C(O)Rb3
、NRc3
S(O)2
Rb3
或S(O)2
Rb3
時,則RZ
不為H或C(O)ORa1
。
在一些實施例中,環B為包含碳及1、2或3個選自N、O及S之雜原子的單環4員至7員雜環烷基。
在一些實施例中,環B為包含碳及1、2或3個選自N、O及S之雜原子的4員至10員雜環烷基,其中該環B包含至少一個成環N原子。
在一些實施例中,環B為包含碳及1、2或3個選自N、O及S之雜原子的4員至7員雜環烷基,其中該環B包含至少一個成環N原子。
在一些實施例中,環B為包含碳及1或2個選自N、O及S之雜原子的6員雜環烷基環,其中該環B包含至少一個成環N原子。
在一些實施例中,環B為氮雜環丁烷基或哌啶基環。
在一些實施例中,環B為氮雜環丁烷基環。
在一些實施例中,環B為哌啶環。
在一些實施例中,環C結合至環B之成環N原子。
在一些實施例中,環A為C6-10
芳基或具有碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基。
在一些實施例中,環B為具有碳及1、2或3個選自N、O及S之雜原子的4員至10員雜環烷基。
在一些實施例中,環C為(1) C6-10
芳基、(2) C3-10
環烷基、(3)具有碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基、或(4)具有碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基。
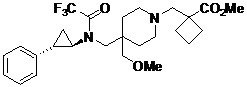
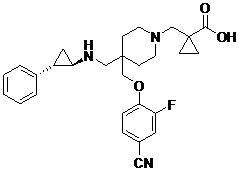
在一些實施例中,本發明之化合物包括式II之化合物:
II
或其醫藥學上可接受之鹽,其中:
環A為C6-10
芳基或包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基;
環C為(1) C6-10
芳基、(2) C3-10
環烷基、(3)包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基、或(4)包含碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基;
X為-CH2
-或-CH2
-CH2
-;
Y為-CH2
-或-CH2
-CH2
-;
L為C1-4
伸烷基、-C(=O)-、-C(=O)O-、-C(=O)NR7
-、O、NR7
、-S(O)2
-、-S(O)-或-S(O)2
NR7
-;
各R1
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、C(=NRe
)Rb
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
;
RZ
為H、鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、C(=NRe1
)Rb1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
或S(O)2
NRc1
Rd1
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
及S(O)2
NRc1
Rd1
;
各R2
係獨立地選自鹵基、C1-6
烷基、CN、ORa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
,其中該C1-6
烷基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、CN、ORa5
、SRa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、OC(O)Rb5
、OC(O)NRc5
Rd5
、C(=NRe5
)NRc5
Rd5
、NRc5
C(=NRe5
)NRc5
Rd5
、NRc5
Rd5
、NRc5
C(O)Rb5
、NRc5
C(O)ORa5
、NRc5
C(O)NRc5
Rd5
、NRc5
S(O)Rb5
、NRc5
S(O)2
Rb5
、NRc5
S(O)2
NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
;
其中各R2
係取代於式II中含有X及Y之環中除與RZ
鍵結之成環碳原子之外的任何成環碳原子上;
各R3
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、C(=NRe2
)Rb2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
;
R4
為鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、C(=NRe3
)Rb3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
;
R5
及R6
各自獨立地選自H、鹵基、CN、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基及-(C1-4
烷基)-ORa4
;
R7
為H或C1-4
烷基;
各Ra
、Rb
、Rc
、Rd
、Ra1
、Rb1
、Rc1
、Rd1
、Ra2
、Rb2
、Rc2
、Rd2
、Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc
及Rd
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc1
及Rd1
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、3員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc2
及Rd2
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc3
及Rd3
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
各Ra4
、Rb4
、Rc4
及Rd4
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
或任何Rc4
及Rd4
連同其所連接之N原子一起形成3員、4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-6
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;且
各Re
、Re1
、Re2
、Re3
、Re4
及Re5
係獨立地選自H、C1-4
烷基及CN;
各Ra5
、Rb5
、Rc5
、Rd5
係獨立地選自H及C1-6
烷基,該C1-6
烷基視情況經1、2、3、4或5個獨立地選自以下之取代基取代:鹵基、CN、ORa6
、SRa6
、C(O)Rb6
、C(O)NRc6
Rd6
、C(O)ORa6
、OC(O)Rb6
、OC(O)NRc6
Rd6
、NRc6
Rd6
、NRc6
C(O)Rb6
、NRc6
C(O)NRc6
Rd6
、NRc6
C(O)ORa6
、C(=NRe6
)NRc6
Rd6
、NRc6
C(=NRe6
)NRc6
Rd6
、S(O)Rb6
、S(O)NRc6
Rd6
、S(O)2
Rb6
、NRc6
S(O2
Rb6
、NRc6
S(O)2
NRc6
Rd6
及S(O)2
NRc6
Rd6
;
各Ra6
、Rb6
、Rc6
及Rd6
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re6
係獨立地選自H、C1-4
烷基及CN;
m為0、1或2;
n為0、1、2或3;
p為0、1、2或3;且
q為0、1或2;
其中當X及Y均為-CH2
-CH2
-,q為0,且L為S(O)2
時,則環C不為噻吩基。
在一些實施例中,其中當X及Y中之一者為-CH2
-CH2
-且X及Y中之另一者為-CH2
-,A為苯基,q為1或2,且R4
為鹵基、C1-6
烷基、經取代之C1-6
烷基、C1-6
鹵烷基、5員至10員雜芳基、CN、ORa3
、C(O)NRc3
Rd3
、C(O)ORa3
、NRc3
C(O)Rb3
、NRc3
S(O)2
Rb3
或S(O)2
Rb3
時,則RZ
不為H或C(O)ORa1
。
在一些實施例中,本發明之化合物包括式IIIa或IIIb之化合物:
IIIa
IIIb
或其醫藥學上可接受之鹽,其中:
環A為C6-10
芳基或包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基;
環C為(1) C6-10
芳基、(2) C3-10
環烷基、(3)包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基、或(4)包含碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基;
L為C1-4
伸烷基、-C(=O)-、-C(=O)O-、-C(=O)NR7
-、O、NR7
、-S(O)2
-、-S(O)-或-S(O)2
NR7
-;
各R1
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、C(=NRe
)Rb
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
;
RZ
為H、鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、C(=NRe1
)Rb1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
或S(O)2
NRc1
Rd1
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
及S(O)2
NRc1
Rd1
;
各R2
係獨立地選自鹵基、C1-6
烷基、CN、ORa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
,其中該C1-6
烷基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、CN、ORa5
、SRa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、OC(O)Rb5
、OC(O)NRc5
Rd5
、C(=NRe5
)NRc5
Rd5
、NRc5
C(=NRe5
)NRc5
Rd5
、NRc5
Rd5
、NRc5
C(O)Rb5
、NRc5
C(O)ORa5
、NRc5
C(O)NRc5
Rd5
、NRc5
S(O)Rb5
、NRc5
S(O)2
Rb5
、NRc5
S(O)2
NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
;
其中各R2
係取代於式IIIa中所描繪之氮雜環丁烷環或式IIIb中所描繪之哌啶環中除與RZ
鍵結之成環碳原子之外的任何成環碳原子上;
各R3
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、C(=NRe2
)Rb2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
;
R4
為鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、C(=NRe3
)Rb3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
;
R5
及R6
各自獨立地選自H、鹵基、CN、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基及-(C1-4
烷基)-ORa4
;
R7
為H或C1-4
烷基;
各Ra
、Rb
、Rc
、Rd
、Ra1
、Rb1
、Rc1
、Rd1
、Ra2
、Rb2
、Rc2
、Rd2
、Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc
及Rd
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc1
及Rd1
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、3員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc2
及Rd2
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc3
及Rd3
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
各Ra4
、Rb4
、Rc4
及Rd4
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
或任何Rc4
及Rd4
連同其所連接之N原子一起形成3員、4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-6
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re
、Re1
、Re2
、Re3
、Re4
及Re5
係獨立地選自H、C1-4
烷基及CN;
各Ra5
、Rb5
、Rc5
、Rd5
係獨立地選自H及C1-6
烷基,該C1-6
烷基視情況經1、2、3、4或5個獨立地選自以下之取代基取代:鹵基、CN、ORa6
、SRa6
、C(O)Rb6
、C(O)NRc6
Rd6
、C(O)ORa6
、OC(O)Rb6
、OC(O)NRc6
Rd6
、NRc6
Rd6
、NRc6
C(O)Rb6
、NRc6
C(O)NRc6
Rd6
、NRc6
C(O)ORa6
、C(=NRe6
)NRc6
Rd6
、NRc6
C(=NRe6
)NRc6
Rd6
、S(O)Rb6
、S(O)NRc6
Rd6
、S(O)2
Rb6
、NRc6
S(O2
Rb6
、NRc6
S(O)2
NRc6
Rd6
及S(O)2
NRc6
Rd6
;
各Ra6
、Rb6
、Rc6
及Rd6
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re6
係獨立地選自H、C1-4
烷基及CN;
m為0、1或2;
n為0、1、2或3;
p為0、1、2或3;且
q為0、1或2;
其中在式IIIb中,當q為0且L為S(O)2
時,則環C不為噻吩基。
在一些實施例中,在式IIIb中,當A為苯基,q為1或2且R4
為鹵基、C1-6
烷基、經取代之C1-6
烷基、C1-6
鹵烷基、5員至10員雜芳基、CN、ORa3
、C(O)NRc3
Rd3
、C(O)ORa3
、NRc3
C(O)Rb3
、NRc3
S(O)2
Rb3
或S(O)2
Rb3
時,則RZ
不為H或C(O)ORa1
。
在一些實施例中,q為0。
在一些實施例中,q為1。
在一些實施例中,環A為苯基。
在一些實施例中,n為0。
在一些實施例中,n為1。
在一些實施例中,n為2。
在一些實施例中,各R1
係獨立地選自鹵基及-O-(C1-6
烷基)。
在一些實施例中,各R1
係獨立地選自F及甲氧基。
在一些實施例中,R5
及R6
兩者均為H。
在一些實施例中,R5
及R6
各自獨立地選自H及C1-4
烷基。
在一些實施例中,R5
為H且R6
為甲基。
在一些實施例中,L為-(CH2
)r
-、-C(=O)-、-C(=O)O-、-C(=O)NR7
-或-S(O)2
-,其中r為1、2、3或4。
在一些實施例中,L為-CH2
-、-C(=O)-、-C(=O)O-、-C(=O)NH-或-S(O)2
-。
在一些實施例中,L為-(CH2
)r
-、-C(=O)-、-C(=O)NR7
-或-S(O)2
-,其中r為1、2、3或4。
在一些實施例中,L為-CH2
-、-C(=O)-、-C(=O)NH-或-S(O)2
-。
在一些實施例中,L為-CH2
-。
在一些實施例中,L為-C(=O)-。
在一些實施例中,L為-S(O)2
-。
在一些實施例中,環C為苯基。
在一些實施例中,環C為單環C3-7
環烷基。
在一些實施例中,環C為環戊基。
在一些實施例中,環C為環丁基。
在一些實施例中,環C為環丙基。
在一些實施例中,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的單環5員或6員雜芳基。
在一些實施例中,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的單環6員雜芳基。
在一些實施例中,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基。
在一些實施例中,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的4員至7員雜環烷基。
在一些實施例中,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的5員至6員雜環烷基。
在一些實施例中,R4
為C1-6
烷基、鹵基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、CN、ORa3
、NRc3
Rd3
或C(O)ORa3
,其中該C1-6
烷基、C6-10
芳基及C3-10
環烷基各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3
C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3
C(O)Rb3
、NRc3
C(O)ORa3
、NRc3
C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
。
在一些實施例中,R4
為鹵基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、CN、ORa3
或C(O)ORa3
,其中該C6-10
芳基及C3-10
環烷基各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3
C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3
C(O)Rb3
、NRc3
C(O)ORa3
、NRc3
C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
。
在一些實施例中,R4
為F、CF3
、苯基、經羥基取代之環己基、CN、OCH3
、OCF3
或COOH。
在一些實施例中,R4
為C(O)ORa3
。
在一些實施例中,各R3
係獨立地選自鹵基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、CN、ORa2
及C(O)ORa2
,其中該C6-10
芳基及C3-10
環烷基各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
。
在一些實施例中,p為0。
在一些實施例中,p為1。
在一些實施例中,RZ
為H、C1-4
烷基或C6-10
芳基-C1-4
烷基-或(5員至10員雜芳基)-C1-4
烷基-,其中該C1-4
烷基、C6-10
芳基-C1-4
烷基-及(5員至10員雜芳基)-C1-4
烷基-各自視情況經CN、鹵基、ORa1
、C(O)ORa1
或C1-4
氰基烷基取代。
在一些實施例中,RZ
為H、C1-4
烷基或C6-10
芳基-C1-4
烷基-,其中該C1-4
烷基及C6-10
芳基-C1-4
烷基-各自視情況經CN、鹵基、ORa1
或C1-4
氰基烷基取代。
在一些實施例中,RZ
為C1-4
烷基。
在一些實施例中,RZ
為經氟或氰甲基取代之C6-10
芳基-C1-4
烷基-。
在一些實施例中,RZ
為經甲氧基或CN取代之C1-4
烷基。
在一些實施例中,RZ
為經甲氧基或F取代之(5員至10員雜芳基)-C1-4
烷基-。
在一些實施例中,RZ
為H、甲基、氰甲基、甲氧基甲基、4-氟苯基甲基或4-(氰甲基)苯基甲基。
在一些實施例中,RZ
為H、甲基、氰甲基、甲氧基甲基、乙氧基甲基、4-氟苯基甲基、3-氰基苯基甲基、4-氰基苯基甲基、3-羧基苯基甲基、6-甲氧基吡啶-3-基)甲基、4-氰基-2-氟苯甲基、(苯甲氧基)甲基、(環丁基甲氧基)甲基、(環己氧基)甲基、(5-氟吡啶-2-基)甲基、4-甲氧基苯基甲基、(2-氟苯氧基)甲基、(3-氟苯氧基)甲基、(2-氰基苯氧基)甲基、(3-氰基苯氧基)甲基、(4-氰基苯氧基)甲基、(4-氰基-2-氟苯氧基)甲基、(5-氟吡啶-2-基)氧基甲基、(5-氟嘧啶-2-基)氧基甲基、(3-氟吡啶-2-基)氧基甲基、(6-(甲胺基羰基)吡啶-3-基)氧基甲基、(6-(甲胺基羰基)吡啶-2-基)氧基甲基或4-(氰甲基)苯基甲基。
在一些實施例中,RZ
為H或經CN取代之C1-4
烷基。
在一些實施例中,RZ
為氰甲基。
在一些實施例中,RZ
為甲氧基甲基。
在一些實施例中,RZ
為H。
在一些實施例中,RZ
為鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、NRc1
Rd1
、NRc1
C(O)Rb1
、NRc1
C(O)ORa1
、NRc1
C(O)NRc1
Rd1
、C(=NRe1
)Rb1
、C(=NRe1
)NRc1
Rd1
、NRc1
C(=NRe1
)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
或S(O)2
NRc1
Rd1
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、C(=NRe1
)NRc1
Rd1
、NRc1
C(=NRe1
)NRc1
Rd1
、NRc1
Rd1
、NRc1
C(O)Rb1
、NRc1
C(O)ORa1
、NRc1
C(O)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
及S(O)2
NRc1
Rd1
。
在一些實施例中,m為0。
在一些實施例中,本發明之化合物為式IIIa之化合物:
IIIa
或其醫藥學上可接受之鹽,其中:
環A為C6-10
芳基或包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基;
環C為(1) C6-10
芳基、(2) C3-10
環烷基、(3)包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基、或(4)包含碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基;
L為C1-4
伸烷基、-C(=O)-、-C(=O)O-、-C(=O)NR7
-、O、NR7
、-S(O)2
-、-S(O)-或-S(O)2
NR7
-;
各R1
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、C(=NRe
)Rb
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
;
RZ
為H、鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、C(=NRe1
)Rb1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
或S(O)2
NRc1
Rd1
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
及S(O)2
NRc1
Rd1
;
各R2
係獨立地選自鹵基、C1-6
烷基、CN、ORa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
,其中該C1-6
烷基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、CN、ORa5
、SRa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、OC(O)Rb5
、OC(O)NRc5
Rd5
、C(=NRe5
)NRc5
Rd5
、NRc5
C(=NRe5
)NRc5
Rd5
、NRc5
Rd5
、NRc5
C(O)Rb5
、NRc5
C(O)ORa5
、NRc5
C(O)NRc5
Rd5
、NRc5
S(O)Rb5
、NRc5
S(O)2
Rb5
、NRc5
S(O)2
NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
;
其中各R2
係取代於式IIIa中所描繪之氮雜環丁烷環或式IIIb中所描繪之哌啶環中除與RZ
鍵結之成環碳原子之外的任何成環碳原子上;
各R3
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、C(=NRe2
)Rb2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
;
R4
為鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、C(=NRe3
)Rb3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
;
R5
及R6
各自獨立地選自H、鹵基、CN、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基及-(C1-4
烷基)-ORa4
;
R7
為H或C1-4
烷基;
各Ra
、Rb
、Rc
、Rd
、Ra1
、Rb1
、Rc1
、Rd1
、Ra2
、Rb2
、Rc2
、Rd2
、Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc
及Rd
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc1
及Rd1
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、3員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc2
及Rd2
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc3
及Rd3
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
各Ra4
、Rb4
、Rc4
及Rd4
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
或任何Rc4
及Rd4
連同其所連接之N原子一起形成3員、4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-6
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re
、Re1
、Re2
、Re3
、Re4
及Re5
係獨立地選自H、C1-4
烷基及CN;
各Ra5
、Rb5
、Rc5
、Rd5
係獨立地選自H及C1-6
烷基,該C1-6
烷基視情況經1、2、3、4或5個獨立地選自以下之取代基取代:鹵基、CN、ORa6
、SRa6
、C(O)Rb6
、C(O)NRc6
Rd6
、C(O)ORa6
、OC(O)Rb6
、OC(O)NRc6
Rd6
、NRc6
Rd6
、NRc6
C(O)Rb6
、NRc6
C(O)NRc6
Rd6
、NRc6
C(O)ORa6
、C(=NRe6
)NRc6
Rd6
、NRc6
C(=NRe6
)NRc6
Rd6
、S(O)Rb6
、S(O)NRc6
Rd6
、S(O)2
Rb6
、NRc6
S(O2
Rb6
、NRc6
S(O)2
NRc6
Rd6
及S(O)2
NRc6
Rd6
;
各Ra6
、Rb6
、Rc6
及Rd6
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re6
係獨立地選自H、C1-4
烷基及CN;
m為0、1或2;
n為0、1、2或3;
p為0、1、2或3;且
q為0、1或2。
在一些實施例中,其中該等化合物具有式IIIa,q為1。
在一些實施例中,其中該等化合物具有式IIIa,環A為苯基。
在一些實施例中,其中該等化合物具有式IIIa,n為0。
在一些實施例中,其中該等化合物具有式IIIa,R5
及R6
兩者均為H。
在一些實施例中,其中該等化合物具有式IIIa,L為-CH2
-、-C(=O)-、-C(=O)NH-或-S(O)2
-。
在一些實施例中,其中該等化合物具有式IIIa,環C為苯基。
在一些實施例中,其中該等化合物具有式IIIa,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基。
在一些實施例中,其中該等化合物具有式IIIa,環C為苯基。
在一些實施例中,其中該等化合物具有式IIIa,R4
為C1-6
烷基、鹵基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、CN、ORa3
、NRc3
Rd3
或C(O)ORa3
,其中該C1-6
烷基、C6-10
芳基及C3-10
環烷基各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3
C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3
C(O)Rb3
、NRc3
C(O)ORa3
、NRc3
C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
。
在一些實施例中,其中該等化合物具有式IIIa,R4
為鹵基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、CN、ORa3
或C(O)ORa3
,其中該C6-10
芳基及C3-10
環烷基各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3
C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3
C(O)Rb3
、NRc3
C(O)ORa3
、NRc3
C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
。
在一些實施例中,其中該等化合物具有式IIIa,p為0。
在一些實施例中,其中該等化合物具有式IIIa,p為1。
在一些實施例中,其中該等化合物具有式IIIa,RZ
為H、C1-4
烷基或C6-10
芳基-C1-4
烷基-,其中該C1-4
烷基及C6-10
芳基-C1-4
烷基-各自視情況經CN、鹵基、ORa1
或C1-4
氰基烷基取代。
在一些實施例中,其中該等化合物具有式IIIa,RZ
為H。
在一些實施例中,其中該等化合物具有式IIIa,m為0。
在一些實施例中,本發明之化合物為式IIIb之化合物:
IIIb
或其醫藥學上可接受之鹽,其中:
環A為C6-10
芳基或包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基;
環C為(1) C6-10
芳基、(2) C3-10
環烷基、(3)包含碳及1、2、3或4個選自N、O及S之雜原子的5員至10員雜芳基、或(4)包含碳及1、2、3或4個選自N、O及S之雜原子的4員至20員雜環烷基;
L為C1-4
伸烷基、-C(=O)-、-C(=O)O-、-C(=O)NR7
-、O、NR7
、-S(O)2
-、-S(O)-或-S(O)2
NR7
-;
各R1
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、C(=NRe
)Rb
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa
、SRa
、C(O)Rb
、C(O)NRc
Rd
、C(O)ORa
、OC(O)Rb
、OC(O)NRc
Rd
、C(=NRe
)NRc
Rd
、NRc
C(=NRe
)NRc
Rd
、NRc
Rd
、NRc
C(O)Rb
、NRc
C(O)ORa
、NRc
C(O)NRc
Rd
、NRc
S(O)Rb
、NRc
S(O)2
Rb
、NRc
S(O)2
NRc
Rd
、S(O)Rb
、S(O)NRc
Rd
、S(O)2
Rb
及S(O)2
NRc
Rd
;
RZ
為鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、C(=NRe1
)Rb1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
或S(O)2
NRc1
Rd1
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa1
、SRa1
、C(O)Rb1
、C(O)NRc1
Rd1
、C(O)ORa1
、OC(O)Rb1
、OC(O)NRc1
Rd1
、C(=NRe1
)NRc1
Rd1
、NRc1C(=NRe1
)NRc1
Rd1
、NRc1
Rd1
、NRc1C(O)Rb1
、NRc1C(O)ORa1
、NRc1C(O)NRc1
Rd1
、NRc1
S(O)Rb1
、NRc1
S(O)2
Rb1
、NRc1
S(O)2
NRc1
Rd1
、S(O)Rb1
、S(O)NRc1
Rd1
、S(O)2
Rb1
及S(O)2
NRc1
Rd1
;
各R2
係獨立地選自鹵基、C1-6
烷基、CN、ORa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
,其中該C1-6
烷基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、CN、ORa5
、SRa5
、C(O)Rb5
、C(O)NRc5
Rd5
、C(O)ORa5
、OC(O)Rb5
、OC(O)NRc5
Rd5
、C(=NRe5
)NRc5
Rd5
、NRc5
C(=NRe5
)NRc5
Rd5
、NRc5
Rd5
、NRc5
C(O)Rb5
、NRc5
C(O)ORa5
、NRc5
C(O)NRc5
Rd5
、NRc5
S(O)Rb5
、NRc5
S(O)2
Rb5
、NRc5
S(O)2
NRc5
Rd5
、S(O)Rb5
、S(O)NRc5
Rd5
、S(O)2
Rb5
及S(O)2
NRc5
Rd5
;
其中各R2
係取代於式IIIa中所描繪之氮雜環丁烷環或式IIIb中所描繪之哌啶環中除與RZ
鍵結之成環碳原子之外的任何成環碳原子上;
各R3
係獨立地選自鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、C(=NRe2
)Rb2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa2
、SRa2
、C(O)Rb2
、C(O)NRc2
Rd2
、C(O)ORa2
、OC(O)Rb2
、OC(O)NRc2
Rd2
、C(=NRe2
)NRc2
Rd2
、NRc2
C(=NRe2
)NRc2
Rd2
、NRc2
Rd2
、NRc2
C(O)Rb2
、NRc2
C(O)ORa2
、NRc2
C(O)NRc2
Rd2
、NRc2
S(O)Rb2
、NRc2
S(O)2
Rb2
、NRc2
S(O)2
NRc2
Rd2
、S(O)Rb2
、S(O)NRc2
Rd2
、S(O)2
Rb2
及S(O)2
NRc2
Rd2
;
R4
為鹵基、C1-6
烷基、C2-6
烯基、C2-6
炔基、C1-6
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-、(4員至10員雜環烷基)-C1-4
烷基-、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、C(=NRe3
)Rb3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-各自視情況經1、2、3或4個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、NO2
、ORa3
、SRa3
、C(O)Rb3
、C(O)NRc3
Rd3
、C(O)ORa3
、OC(O)Rb3
、OC(O)NRc3
Rd3
、C(=NRe3
)NRc3
Rd3
、NRc3C(=NRe3
)NRc3
Rd3
、NRc3
Rd3
、NRc3C(O)Rb3
、NRc3C(O)ORa3
、NRc3C(O)NRc3
Rd3
、NRc3
S(O)Rb3
、NRc3
S(O)2
Rb3
、NRc3
S(O)2
NRc3
Rd3
、S(O)Rb3
、S(O)NRc3
Rd3
、S(O)2
Rb3
及S(O)2
NRc3
Rd3
;
R5
及R6
各自獨立地選自H、鹵基、CN、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基及-(C1-4
烷基)-ORa4
;
R7
為H或C1-4
烷基;
各Ra
、Rb
、Rc
、Rd
、Ra1
、Rb1
、Rc1
、Rd1
、Ra2
、Rb2
、Rc2
、Rd2
、Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc
及Rd
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc1
及Rd1
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、3員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc2
及Rd2
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
或任何Rc3
及Rd3
連同其所連接之N原子一起形成4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基、5員至6員雜芳基、C1-6
鹵烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
,其中該C1-6
烷基、C3-7
環烷基、4員至7員雜環烷基、C6-10
芳基及5員至6員雜芳基視情況經1、2或3個獨立地選自以下之取代基取代:鹵基、C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
;
各Ra4
、Rb4
、Rc4
及Rd4
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
或任何Rc4
及Rd4
連同其所連接之N原子一起形成3員、4員、5員、6員或7員雜環烷基,該雜環烷基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-6
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re
、Re1
、Re2
、Re3
、Re4
及Re5
係獨立地選自H、C1-4
烷基及CN;
各Ra5
、Rb5
、Rc5
、Rd5
係獨立地選自H及C1-6
烷基,該C1-6
烷基視情況經1、2、3、4或5個獨立地選自以下之取代基取代:鹵基、CN、ORa6
、SRa6
、C(O)Rb6
、C(O)NRc6
Rd6
、C(O)ORa6
、OC(O)Rb6
、OC(O)NRc6
Rd6
、NRc6
Rd6
、NRc6
C(O)Rb6
、NRc6
C(O)NRc6
Rd6
、NRc6
C(O)ORa6
、C(=NRe6
)NRc6
Rd6
、NRc6
C(=NRe6
)NRc6
Rd6
、S(O)Rb6
、S(O)NRc6
Rd6
、S(O)2
Rb6
、NRc6
S(O2
Rb6
、NRc6
S(O)2
NRc6
Rd6
及S(O)2
NRc6
Rd6
;
各Ra6
、Rb6
、Rc6
及Rd6
係獨立地選自H、C1-4
烷基、C1-4
鹵烷基、C2-4
烯基及C2-4
炔基,其中該C1-4
烷基、C2-4
烯基及C2-4
炔基視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基;
各Re6
係獨立地選自H、C1-4
烷基及CN;
m為0、1或2;
n為0、1、2或3;
p為0、1、2或3;且
q為0、1或2;
其中在式IIIb中,當q為0且L為S(O)2
時,則環C不為噻吩基。
在一些實施例中,其中該化合物具有式IIIb,q為1。
在一些實施例中,其中該化合物具有式IIIb,環A為苯基。
在一些實施例中,其中該化合物具有式IIIb,n為0。
在一些實施例中,其中該化合物具有式IIIb,n為1。
在一些實施例中,其中該化合物具有式IIIb,n為2。
在一些實施例中,其中該化合物具有式IIIb,各R1
係獨立地選自鹵基及-O-(C1-6
烷基)。
在一些實施例中,其中該化合物具有式IIIb,各R1
係獨立地選自F及甲氧基。
在一些實施例中,其中該化合物具有式IIIb,R5
及R6
兩者均為H。
在一些實施例中,其中該化合物具有式IIIb,R5
及R6
各自獨立地選自H及C1-4
烷基。
在一些實施例中,其中該化合物具有式IIIb,R5
為H且R6
為甲基。
在一些實施例中,其中該化合物具有式IIIb,L為-CH2
-。
在一些實施例中,其中該化合物具有式IIIb,L為-C(=O)-。
在一些實施例中,其中該化合物具有式IIIb,L為-S(O)2
-。
在一些實施例中,其中該化合物具有式IIIb,環C為苯基。
在一些實施例中,其中該化合物具有式IIIb,環C為單環C3-7
環烷基。
在一些實施例中,其中該化合物具有式IIIb,環C為環丙基、環丁基、環戊基或環己基。
在一些實施例中,其中該化合物具有式IIIb,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的單環5員或6員雜芳基。
在一些實施例中,其中該化合物具有式IIIb,環C為吡唑基、咪唑基、嘧啶基或嗒嗪基。
在一些實施例中,其中該化合物具有式IIIb,環C為包含碳及1、2、3或4個選自N、O及S之雜原子的4員至6員雜環烷基。
在一些實施例中,其中該化合物具有式IIIb,環C為哌啶基、吡咯啶基、氮雜環丁烷基或哌嗪基。
在一些實施例中,其中該化合物具有式IIIb,環C為哌啶基、吡咯啶基或哌嗪基。
在一些實施例中,其中該化合物具有式IIIb,R4
為C1-6
烷基、鹵基、NRc3
Rd3
、C(O)ORa3
、CN、-(C1-6
烷基)-CN、-ORa3
或-(C1-6
烷基)-ORa3
。
在一些實施例中,其中該化合物具有式IIIb,R4
為C1-6
烷基、鹵基、NRc3
Rd3
或C(O)ORa3
。
在一些實施例中,其中該化合物具有式IIIb,R4
為C(O)ORa3
。
在一些實施例中,其中該化合物具有式IIIb,p為0。
在一些實施例中,其中該化合物具有式IIIb,RZ
為C1-4
烷基、(5員至10員雜芳基)-C1-4
烷基-或C6-10
芳基-C1-4
烷基-,其中該C1-4
烷基、(5員至10員雜芳基)-C1-4
烷基-及C6-10
芳基-C1-4
烷基-各自視情況經CN、鹵基、ORa1
、C(O)ORa1
或C1-4
氰基烷基取代。
在一些實施例中,其中該化合物具有式IIIb,RZ
為C1-4
烷基或C6-10
芳基-C1-4
烷基-,其中該C1-4
烷基及C6-10
芳基-C1-4
烷基-各自視情況經CN、鹵基、ORa1
或C1-4
氰基烷基取代。
在一些實施例中,其中該化合物具有式IIIb,RZ
為C1-4烷基。
在一些實施例中,其中該化合物具有式IIIb,RZ
為經氟或氰甲基取代之C6-10
芳基-C1-4
烷基-。
在一些實施例中,其中該化合物具有式IIIb,RZ
為經甲氧基或CN取代之C1-4
烷基。
在一些實施例中,其中該化合物具有式IIIb,RZ
為經甲氧基或F取代之(5員至10員雜芳基)-C1-4
烷基-。
在一些實施例中,其中該化合物具有式IIIb,RZ
為甲基、氰甲基、甲氧基甲基、4-氟苯基甲基或4-(氰甲基)苯基甲基。
在一些實施例中,其中該化合物具有式IIIb,RZ
為甲基、氰甲基、甲氧基甲基、乙氧基甲基、4-氟苯基甲基、3-氰基苯基甲基、4-氰基苯基甲基、3-羧基苯基甲基、6-甲氧基吡啶-3-基)甲基、4-氰基-2-氟苯甲基、(苯甲氧基)甲基、(環丁基甲氧基)甲基、(環己氧基)甲基、(5-氟吡啶-2-基)甲基、4-甲氧基苯基甲基、(2-氟苯氧基)甲基、(3-氟苯氧基)甲基、(2-氰基苯氧基)甲基、(3-氰基苯氧基)甲基、(4-氰基苯氧基)甲基、(4-氰基-2-氟苯氧基)甲基、(5-氟吡啶-2-基)氧基甲基、(5-氟嘧啶-2-基)氧基甲基、(3-氟吡啶-2-基)氧基甲基、(6-(甲胺基羰基)吡啶-3-基)氧基甲基、(6-(甲胺基羰基)吡啶-2-基)氧基甲基或4-(氰甲基)苯基甲基。
在一些實施例中,其中該化合物具有式IIIb,m為0。
在一些實施例中,該化合物關於式I (或式II、IIIa及IIIb中之任一者)中所描繪之經二取代之環丙基具有反式組態。
在式I、II、IIIa或IIIb之化合物之一些實施例中,連接至環A之環丙基上之碳原子的立體組態為R
型,且連接至NH鍵聯之環丙基上之碳原子的立體組態為S
型。
在式I、II、IIIa或IIIb之化合物之一些實施例中,連接至環A之環丙基上之碳原子的立體組態為S
型,且連接至NH鍵聯之環丙基上之碳原子的立體組態為R
型。
在式I、II、IIIa或IIIb之化合物之一些實施例中,連接至環A之環丙基上之碳原子的立體組態為R
型,且連接至NH鍵聯之環丙基上之碳原子的立體組態為R
型。
在式I、II、IIIa或IIIb之化合物之一些實施例中,連接至環A之環丙基上之碳原子的立體組態為S
型,且連接至NH鍵聯之環丙基上之碳原子的立體組態為S
型。
在一些實施例中,各Ra
、Rb
、Rc
及Rd
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
。
在一些實施例中,各Ra1
、Rb1
、Rc1
及Rd1
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
。
在一些實施例中,各Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C2-6
烯基、C2-6
炔基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2、3、4或5個獨立地選自以下之取代基取代:C1-4
烷基、C1-4
鹵烷基、C1-4
氰基烷基、鹵基、CN、ORa4
、SRa4
、C(O)Rb4
、C(O)NRc4
Rd4
、C(O)ORa4
、OC(O)Rb4
、OC(O)NRc4
Rd4
、NRc4
Rd4
、NRc4
C(O)Rb4
、NRc4
C(O)NRc4
Rd4
、NRc4
C(O)ORa4
、C(=NRe4
)NRc4
Rd4
、NRc4
C(=NRe4
)NRc4
Rd4
、S(O)Rb4
、S(O)NRc4
Rd4
、S(O)2
Rb4
、NRc4
S(O)2
Rb4
、NRc4
S(O)2
NRc4
Rd4
及S(O)2
NRc4
Rd4
。
在一些實施例中,各Ra
、Rb
、Rc
及Rd
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基。
在一些實施例中,各Ra1
、Rb1
、Rc1
及Rd1
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基。
在一些實施例中,各Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H、C1-6
烷基、C1-4
鹵烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-,其中該C1-6
烷基、C6-10
芳基、C3-10
環烷基、5員至10員雜芳基、4員至10員雜環烷基、C6-10
芳基-C1-4
烷基-、C3-10
環烷基-C1-4
烷基-、(5員至10員雜芳基)-C1-4
烷基-及(4員至10員雜環烷基)-C1-4
烷基-視情況經1、2或3個獨立地選自以下之取代基取代:OH、CN、胺基、鹵基、C1-4
烷基、C1-4
烷氧基、C1-4
烷硫基、C1-4
烷基胺基、二(C1-4
烷基)胺基、C1-4
鹵烷基及C1-4
鹵烷氧基。
在一些實施例中,各Ra
、Rb
、Rc
及Rd
係獨立地選自H及C1-6
烷基。
在一些實施例中,各Ra1
、Rb1
、Rc1
及Rd1
係獨立地選自H及C1-6
烷基。
在一些實施例中,各Ra3
、Rb3
、Rc3
及Rd3
係獨立地選自H及C1-6
烷基。
應瞭解的是,為清楚起見描述於各別實施例之上下文中的本發明之某些特徵亦可以組合形式提供於單個實施例中。反之,為簡潔起見描述於單個實施例之上下文中的本發明之各種特徵亦可單獨地或以任何適合之子組合形式提供。
除非另外指示,否則本文中所描繪之任何結構或式中穿過環部分之懸浮鍵意欲展示該鍵可連接於環部分之任何成環原子。舉例而言,在式I中之環A為萘基的情況下,若存在R1
取代基,則該R1
取代基可取代於形成萘基之兩個環中之任一者上。
對於鍵聯基團L,列為L之選擇的基團並不意欲具有方向性。舉例而言,當L為-C(=O)NR7
-時,其意謂包括-C(=O)NR7
-及-NR7
C(=O)-兩者。
如本文所用之片語「視情況經取代」意謂未經取代或經取代。如本文所用之術語「經取代」意謂氫原子經移除且經取代基置換。應瞭解,在既定原子處之取代由化合價限制。在整個定義中,術語「Ci-j
」表示包括端點在內之範圍,其中i及j為整數且表示碳數。實例包括C1-4
、C1-6
及其類似表述。
術語「z員」(其中z為整數)通常描述部分中成環原子之數目,其中成環原子之數目為z。舉例而言,哌啶基為6員雜環烷基環之實例,吡唑基為5員雜芳基環之實例,吡啶基為6員雜芳基環之實例,且1,2,3,4-四氫-萘為10員環烷基之實例。
術語「碳」係指一或多個碳原子。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
烷基」係指可為直鏈或分支鏈之具有i至j個碳之飽和烴基。在一些實施例中,烷基含有1至6個碳原子或1至4個碳原子、或1至3個碳原子。烷基部分之實例包括(但不限於)諸如甲基、乙基、正丙基、異丙基、正丁基、第二丁基及第三丁基之化學基團。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
伸烷基」係指可為直鏈或分支鏈之具有i至j個碳之飽和鍵聯(例如二價)烴基。在一些實施例中,伸烷基含有1至4個碳原子、1至3個碳原子或1至2個碳原子。烷基部分之實例包括(但不限於)諸如亞甲基、伸乙基、1,1-伸乙基、1,2-伸乙基、1,3-伸丙基、1,2-伸丙基、1,1-伸丙基、伸異丙基及其類似基團之化學基團。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
烷氧基」係指式-O-烷基之基團,其中烷基具有i至j個碳。例示性烷氧基包括甲氧基、乙氧基及丙氧基(例如正丙氧基及異丙氧基)。在一些實施例中,烷基具有1至3個碳原子。
如本文所用,單獨或與其他術語組合使用之「Ci-j
烯基」係指具有一或多個碳-碳雙鍵且具有i至j個碳之不飽和烴基。在一些實施例中,烯基部分含有2至6個或2至4個碳原子。例示性烯基包括(但不限於)乙烯基、正丙烯基、異丙烯基、正丁烯基、第二丁烯基及其類似基團。
如本文所用,單獨或與其他術語組合使用之「Ci-j
炔基」係指具有一或多個碳-碳參鍵且具有i至j個碳之不飽和烴基。例示性炔基包括(但不限於)乙炔基、丙炔-1-基、丙炔-2-基及其類似基團。在一些實施例中,炔基部分含有2至6個或2至4個碳原子。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
烷胺基」係指式-NH(烷基)之基團,其中烷基具有i至j個碳原子。在一些實施例中,烷基具有1至6個或1至4個碳原子。例示性烷胺基包括甲胺基、乙胺基及其類似基團。
如本文所用,單獨或與其他術語組合使用之術語「二-Ci-j
-烷胺基」係指式-N(烷基)2
之基團,其中該兩個烷基各自獨立地具有i至j個碳原子。在一些實施例中,各烷基獨立地具有1至6個或1至4個碳原子。在一些實施例中,二烷基胺基為-N(C1-4
烷基)2
,諸如二甲胺基或二乙胺基。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
烷基硫基」係指式-S-烷基之基團,其中烷基具有i至j個碳原子。在一些實施例中,烷基具有1至6個或1至4個碳原子。在一些實施例中,烷基硫基為C1-4
烷基硫基,諸如甲硫基或乙硫基。
如本文所用,單獨或與其他術語組合使用之術語「胺基」係指式-NH2
之基團。
如本文所用,單獨或與其他術語組合使用之術語「芳基」係指單環或多環(例如具有2個稠合環)芳族烴,諸如(但不限於)苯基、1-萘基、2-萘基及其類似基團。在一些實施例中,芳基為C6-10
芳基。在一些實施例中,芳基為萘環或苯環。在一些實施例中,芳基為苯基。
如本文所用,單獨或與其他術語組合使用之術語「羰基」係指基團-C(O)-。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
氰基烷基」係指經CN基團取代之烷基。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
環烷基」係指具有i至j個成環碳原子之非芳族環狀烴部分,其可視情況含有一或多個伸烯基作為環結構之一部分。環烷基可包括單環或多環(例如具有2、3或4個稠合環)環系統。在環烷基之定義中亦包括具有一或多個與環烷基環稠合(亦即共同具有一鍵)之芳環的部分,例如環戊烷、環戊烯、環己烷之苯并衍生物及其類似物。環烷基之一或多個成環碳原子可經氧化以形成羰基鍵。在一些實施例中,環烷基為C3-10
環烷基、C3-7
環烷基或C5-6
環烷基。例示性環烷基包括環丙基、環丁基、環戊基、環己基、環庚基、環戊烯基、環己烯基、環己二烯基、環庚三烯基、降冰片烷基、降蒎基、降蒈基及其類似基團。其他例示性環烷基包括環丙基、環丁基、環戊基及環己基。
如本文所用,單獨或與其他術語組合使用之「Ci-j
鹵烷氧基」係指具有i至j個碳原子之式-O-鹵烷基之基團。例示性鹵烷氧基為OCF3
。另一例示性鹵烷氧基為OCHF2
。在一些實施例中,鹵烷氧基僅為氟化的。在一些實施例中,烷基具有1至6個或1至4個碳原子。在一些實施例中,鹵烷氧基為C1-4
鹵烷氧基。
如本文所用,單獨或與其他術語組合使用之術語「鹵基」係指選自F、Cl、I或Br之鹵素原子。在一些實施例中,「鹵基」係指選自F、Cl或Br之鹵素原子。在一些實施例中,鹵基取代基為F。
如本文所用,單獨或與其他術語組合使用之術語「Ci-j
鹵烷基」係指具有一個鹵素原子至2s+1個可相同或不同之鹵素原子之烷基,其中「s」為烷基中碳原子之數目,其中烷基具有i至j個碳原子。在一些實施例中,鹵烷基僅為氟化的。在一些實施例中,鹵烷基為氟甲基、二氟甲基或三氟甲基。在一些實施例中,鹵烷基為三氟甲基。在一些實施例中,烷基具有1至6個或1至4個碳原子。
如本文所用,單獨或與其他術語組合使用之術語「雜芳基」係指單環或多環(例如具有2、3或4個稠合環)芳族雜環部分,其具有一或多個選自氮、硫及氧之雜原子環成員。在一些實施例中,雜芳基具有1、2、3或4個雜原子環成員。在一些實施例中,雜芳基具有1、2或3個雜原子環成員。在一些實施例中,雜芳基具有1或2個雜原子環成員。在一些實施例中,雜芳基具有1個雜原子環成員。在一些實施例中,雜芳基為5員至10員或5員至6員雜芳基。在一些實施例中,雜芳基為5員雜芳基。在一些實施例中,雜芳基為6員雜芳基。當雜芳基含有多於一個雜原子環成員時,該等雜原子可相同或不同。雜芳基之環中之氮原子可經氧化以形成N-氧化物。例示性雜芳基包括(但不限於)吡啶基、嘧啶基、吡嗪基、嗒嗪基、吡咯基、吡唑基、唑基、噁唑基、異噁唑基、噻唑基、異噻唑基、咪唑基、呋喃基、噻吩基、三唑基、四唑基、噻二唑基、喹啉基、異喹啉基、吲哚基、苯并噻吩基、苯并呋喃基、苯并異噁唑基、咪唑并[1,2-b]噻唑基、嘌呤基、三嗪基及其類似基團。
5員雜芳基為具有五個成環原子之雜芳基,其中一或多個成環原子獨立地選自N、O及S。在一些實施例中,5員雜芳基具有1、2或3個雜原子環成員。在一些實施例中,5員雜芳基具有1或2個雜原子環成員。在一些實施例中,5員雜芳基具有1個雜原子環成員。例示性成環成員包括CH、N、NH、O及S。例示性五員環雜芳基為噻吩基、呋喃基、吡咯基、咪唑基、噻唑基、噁唑基、吡唑基、異噻唑基、異噁唑基、1,2,3-三唑基、四唑基、1,2,3-噻二唑基、1,2,3-噁二唑基、1,2,4-三唑基、1,2,4-噻二唑基、1,2,4-噁二唑基、1,3,4-三唑基、1,3,4-噻二唑基及1,3,4-噁二唑基。
6員雜芳基為具有六個成環原子之雜芳基,其中一或多個成環原子為N。在一些實施例中,6員雜芳基具有1、2或3個雜原子環成員。在一些實施例中,6員雜芳基具有1或2個雜原子環成員。在一些實施例中,6員雜芳基具有1個雜原子環成員。例示性成環成員包括CH及N。例示性六員環雜芳基為吡啶基、吡嗪基、嘧啶基、三嗪基及嗒嗪基。
如本文所用,單獨或與其他術語組合使用之術語「雜環烷基」係指非芳族雜環系統,其可視情況含有一或多個不飽和基團作為環結構之一部分,且其具有至少一個獨立地選自氮、硫及氧之雜原子環成員。在一些實施例中,雜環烷基具有1、2、3或4個雜原子環成員。在一些實施例中,雜環烷基具有1、2或3個雜原子環成員。在一些實施例中,雜環烷基具有1或2個雜原子環成員。在一些實施例中,雜環烷基具有1個雜原子環成員。當雜環烷基在環中含有多於一個雜原子時,該等雜原子可相同或不同。例示性成環成員包括CH、CH2
、C(O)、N、NH、O、S、S(O)及S(O)2
。雜環烷基可包括單環或多環(例如具有2、3或4個稠合環)環系統,包括螺環系統。在雜環烷基之定義中亦包括具有一或多個與非芳環稠合(亦即共同具有一鍵)之芳環的部分,例如1,2,3,4-四氫-喹啉、二氫苯并呋喃及其類似物。雜環烷基之環中之碳原子或雜原子可經氧化以形成羰基、亞磺醯基或磺醯基(或其他氧化鍵)或氮原子可經四級銨化。在一些實施例中,雜環烷基為5員至10員、4員至10員、4員至7員、5員或6員雜環烷基。雜環烷基之實例包括1,2,3,4-四氫-喹啉基、二氫苯并呋喃基、氮雜環丁烷基、氮雑環庚基、吡咯啶基、哌啶基、哌嗪基、嗎啉基、硫代嗎啉基及哌喃基。
本文所述之化合物可為不對稱的(例如具有一或多個立構中心)。除非另外指示,否則諸如對映異構體及非對映異構體之所有立體異構體皆為所欲的。含有經不對稱取代之碳原子之本發明化合物可以光學活性或外消旋形式分離。如何自光學不活性起始物質製備光學活性形式之方法在此項技術中為已知的,諸如藉由拆分外消旋混合物或藉由立體選擇性合成來製備。烯烴、C=N雙鍵及其類似物之多種幾何異構體亦可存在於本文所述之化合物中,且所有該等穩定異構體係涵蓋於本發明中。本發明化合物之順式及反式幾何異構體已有所描述且可以異構體之混合物形式或分開之異構形式分離出。
當本發明之化合物含有對掌性中心時,該等化合物可為任何可能之立體異構體。在具有單個對掌性中心之化合物中,對掌性中心之立體化學可為(R)型或(S)型。在具有兩個對掌性中心之化合物中,該等對掌性中心之立體化學可各自獨立地為(R)型或(S)型,因此該等對掌性中心之組態可為(R)型及(R)型;(R)型及(S)型;(S)型及(R)型;或(S)型及(S)型。在具有三個對掌性中心之化合物中,該三個對掌性中心各自之立體化學可各自獨立地為(R)型或(S)型,因此該等對掌性中心之組態可為(R)型、(R)型及(R)型;(R)型、(R)型及(S)型;(R)型、(S)型及(R)型;(R)型、(S)型及(S)型;(S)型、(R)型及(R)型;(S)型、(R)型及(S)型;(S)型、(S)型及(R)型;或(S)型、(S)型及(S)型。
可藉由此項技術中已知之多種方法中之任一者對化合物之外消旋混合物進行拆分。例示性方法包括使用對掌性拆分酸進行分級再結晶,該對掌性拆分酸為具有光學活性之成鹽有機酸。適用於分級再結晶法之拆分劑為例如光學活性酸,諸如酒石酸、二乙醯基酒石酸、二苯甲醯基酒石酸、扁桃酸、蘋果酸、乳酸或各種光學活性樟腦磺酸(諸如β-樟腦磺酸)之D型及L型形式。其他適用於分級結晶法之拆分劑包括α-甲基苯甲胺(例如S
型及R
型形式、或非對映異構純形式)、2-苯基甘胺醇、降麻黃鹼、麻黃鹼、N-甲基麻黃鹼、環己基乙胺、1,2-二胺基環己烷及其類似物之立體異構純形式。
亦可藉由在填充有光學活性拆分劑(例如二硝基苯甲醯基苯甘胺酸)之管柱上進行溶離來對外消旋混合物進行拆分。適合之溶離溶劑組合物可由熟習此項技術者確定。
本發明之化合物亦包括互變異構形式。互變異構形式由單鍵與相鄰雙鍵之對換以及質子之并行遷移而產生。互變異構形式包括質子轉移互變異構體,其為具有相同之實驗式及總電荷之異構質子化狀態。例示性質子轉移互變異構體包括酮-烯醇對、醯胺-醯亞胺酸對、內醯胺-內醯亞胺對、醯胺-醯亞胺酸對、烯胺-亞胺對及質子可佔據雜環系統之兩個或多於兩個位置之環狀形式,例如1H-咪唑及3H-咪唑、1H-1,2,4-三唑、2H-1,2,4-三唑及4H-1,2,4-三唑、1H-異吲哚及2H-異吲哚、以及1H-吡唑及2H-吡唑。互變異構形式可保持平衡或藉由適當取代而在空間上鎖定成一種形式。
本發明之化合物亦可包括中間物或最終化合物中存在之原子的所有同位素。同位素包括具有相同原子序,但質量數不同之彼等原子。
如本文所用之術語「化合物」意欲包括所描繪之結構的所有立體異構體、幾何異構體、互變異構體及同位素。除非另外說明,否則在本文中藉由名稱或結構識別為一種特定之互變異構形式的化合物意欲包括其他互變異構形式(例如在嘌呤環之狀況下,除非另外指示,否則當化合物名稱或結構具有9H互變異構體時,應瞭解,亦涵蓋7H互變異構體)。
所有化合物及其醫藥學上可接受之鹽可連同諸如水及溶劑之其他物質一起存在(例如水合物及溶劑合物)或可經分離。
在一些實施例中,本發明之化合物或其鹽實質上經分離。「實質上分離」意謂該化合物至少部分地或實質上自形成其或偵測到其之環境中分離。部分分離可包括例如富含本發明之化合物的組合物。實質性分離可包括含有至少約50重量%、至少約60重量%、至少約70重量%、至少約80重量%、至少約90重量%、至少約95重量%、至少約97重量%或至少約99重量%之本發明化合物或其鹽的組合物。分離化合物及其鹽之方法在此項技術中為常規的。
片語「醫藥學上可接受」在本文中用以指在合理醫學判斷之範疇內,適用於與人類及動物之組織接觸而無過度毒性、刺激性、過敏反應或其他問題或併發症,與合理利益/風險比相稱之彼等化合物、物質、組合物及/或劑型。
如本文所用之措辭「環境溫度」及「室溫」在此項技術中有所瞭解,且一般係指溫度,例如反應溫度約為進行反應之室內的溫度,例如約20℃至約30℃之溫度。
本發明亦包括本文所述之化合物的醫藥學上可接受之鹽。如本文所用之「醫藥學上可接受之鹽」係指所揭示之化合物的衍生物,其中藉由使存在之酸或鹼部分轉化成其鹽形式來修飾母化合物。醫藥學上可接受之鹽之實例包括(但不限於)諸如胺之鹼性殘基之無機酸鹽或有機酸鹽;諸如羧酸之酸性殘基之鹼鹽或有機鹽;及其類似物。本發明之醫藥學上可接受之鹽包括例如由無毒之無機酸或有機酸形成之母化合物的習知無毒鹽。本發明之醫藥學上可接受之鹽可由含有鹼性或酸性部分之母化合物,藉由習知化學方法來合成。一般而言,該等鹽可藉由使此等化合物之游離酸或鹼形式與化學計量之適當鹼或酸在水中或在有機溶劑中或在兩者之混合物中反應來製備;一般而言,非水性介質,如醚、乙酸乙酯、醇(例如甲醇、乙醇、異丙醇或丁醇)或乙腈(MeCN)較佳。適合之鹽的清單見於Remington's Pharmaceutical Sciences
, 第17版, (Mack Publishing Company, Easton, 1985), 第1418頁;Berge等人,J. Pharm. Sci.
,1977
,66
(1), 1-19;及Stahl等人,Handbook of Pharmaceutical Salts: Properties, Selection, and Use
, (Wiley, 2002)中。
在本文中可使用以下縮寫:AcOH (乙酸);Ac2
O (乙酸酐);aq. (水性);atm. (大氣壓);Boc (第三丁氧羰基);BOP (六氟磷酸(苯并三唑-1-基氧基)叁(二甲胺基)鏻);br (寬);Cbz (羧基苯甲基);calc. (計算值);d (雙峰);dd (雙二重峰);DBU (1,8-二氮雜雙環[5.4.0]十一-7-烯);DCM (二氯甲烷);DIAD (N
,N'
-二異丙基疊氮基二甲酸酯);DIEA (N,N-二異丙基乙胺);DIPEA (N
,N
-二異丙基乙胺);DMF (N
,N
-二甲基甲醯胺);EA (乙酸乙酯);Et (乙基);EtOAc (乙酸乙酯);g (公克);h (小時);HATU (六氟磷酸N
,N
,N'
,N'
-四甲基-O-(7-氮雜苯并三唑-1-基)脲鎓);HCl (鹽酸);HPLC (高效液相層析);Hz (赫茲);J (偶合常數);LCMS (液相層析-質譜分析);m (多重峰);M (莫耳濃度);m
CPBA (3-氯過氧苯甲酸);MS (質譜分析);Me (甲基);MeCN (乙腈);MeOH (甲醇);mg (毫克);min.(分鐘);mL (毫升);mmol (毫莫耳);N (當量濃度);nM (奈莫耳濃度);NMP (N-甲基吡咯啶酮);NMR (核磁共振譜法);OTf (三氟甲烷磺酸酯基);Ph (苯基);pM (皮莫耳濃度);RP-HPLC (逆相高效液相層析);s (單峰);t (三重峰或第三);TBS (第三丁基二甲基矽烷基);tert (第三);tt (參三重峰);TFA (三氟乙酸);THF (四氫呋喃);μg (微克);μL (微升);μM (微莫耳濃度);wt% (重量百分比)。合成
本發明之化合物(包括其鹽)可使用已知之有機合成技術來製備且可根據多種可能之合成途徑中之任一者來合成。
製備本發明之化合物的反應可在適合之溶劑中進行,該等適合之溶劑可容易地由熟習有機合成技術者來選擇。適合之溶劑可在進行反應之溫度下與起始物質(反應物)、中間物或產物實質上不反應,該等溫度例如可在溶劑之凝固溫度至溶劑之沸點溫度範圍內之溫度。既定反應可在一種溶劑或多於一種溶劑之混合物中進行。視特定之反應步驟而定,適用於特定反應步驟之溶劑可由熟習此項技術者來選擇。
本發明化合物之製備可涉及對各種化學基團之保護及脫除保護基。對保護及脫除保護基之需要及對適當之保護基的選擇可容易地由熟習此項技術者確定。保護基之化學可見於例如P. G. M. Wuts及T. W. Greene,Protective Groups in Organic Synthesis
, 第4版, Wiley & Sons, Inc., New York (2006)中,該出版物以全文引用之方式併入本文中。合成流程中之保護基通常由「PG」表示。
可根據此項技術中已知之任何適合之方法來監測反應。舉例而言,產物形成可藉由光譜學方式,諸如核磁共振譜法(例如1
H或13
C)、紅外光譜法、分光光度測定法(例如UV-可見光)、質譜分析,或藉由層析法,諸如高效液相層析(HPLC)、液相層析-質譜分析(LCMS)或薄層層析(TLC)來監測。化合物可由熟習此項技術者藉由多種方法來純化,該等方法包括高效液相層析(HPLC)(「Preparative LC-MS Purification: Improved Compound Specific Method Optimization
」, Karl F. Blom, Brian Glass, Richard Sparks, Andrew P. CombsJ. Combi. Chem. 2004
, 6(6), 874-883,該文獻以全文引用之方式併入本文中)及正相二氧化矽層析。
式3
之化合物可藉由流程 1
中概述之方法來製備。可在諸如DCM之適合之溶劑中,使用諸如(但不限於)三乙醯氧基硼氫化鈉之還原劑,視情況在諸如乙酸之酸存在下使式1
之化合物與式2
之醛進行還原胺化,得到式3
之化合物。若化合物1
或2
中之任何官能基經保護以避免任何副反應,則可進行後續之脫除保護基步驟以獲得式3
之最終產物。脫除保護基條件可見於文獻中或詳述於下文所述之特定實例中。式1
或2
之起始物質為市售可得的,或可如本文所述來製備,或遵循文獻中所揭示之方法來製備。流程 1
或者,可使用如流程 2
中所概述之方法,以式4
之醛為起始物來製備式3a
之化合物,該等醛為市售可得的或可如文獻或本文中所述製得。可使用與流程 1
中所述之條件相似的條件使式1
之環丙胺衍生物與醛4
進行還原胺化,產生式5
之化合物。接著可使用諸如三氟乙醯基(CF3
CO)、Cbz或烯丙氧基羰基(Alloc)的適合之保護基保護化合物5
中之游離胺基,繼而使用酸選擇性移除Boc保護基,得到式6
之化合物。可在諸如DIEA之適合之鹼存在下藉由化合物6
中之哌啶置換式7
之化合物中的離去基團Lv(Lv為Cl、OMs等),產生式8
之化合物,可脫除該等式8
化合物之保護基,得到式3a
之化合物。流程 2
式3b
之化合物可藉由流程 3
中概述之方法,以式1
化合物及式9
化合物為起始物,藉由在諸如DCM或THF之適合溶劑中,使用諸如(但不限於)三乙醯氧基硼氫化鈉之還原劑,視情況在諸如乙酸之酸存在下進行還原胺化來製備。若化合物1
或9
中之任何官能基經保護以避免任何副反應,則可進行後續之脫除保護基步驟以獲得式3b
之最終產物。流程 3
可使用如流程 4
中所概述之方法,以式10
之丙烯酸酯衍生物(R為烷基,諸如乙基)為起始物來製備式1
之環丙胺衍生物,該等丙烯酸酯衍生物為市售可得的或使用本文或文獻中之方法製得。可在標準條件(諸如科裏-柴可夫斯基反應(Corey-Chaykovsky reaction))下對化合物10
進行環丙烷化,得到式11
之環丙基衍生物。可將酯皂化,得到式12
之酸,可使該等酸經受標準庫爾提斯重排(Curtius rearrangement)條件,繼而脫除保護基,得到式1
之環丙胺衍生物。流程 4 使用方法
本發明化合物為LSD1抑制劑,且因此適用於治療與LSD1活性有關之疾病及病症。對於本文所述之用途,可使用任何本發明化合物,包括其任何實施例。
在一些實施例中,本發明之化合物對LSD1之選擇性高於對LSD2之選擇性,意謂與LSD2相比,該等化合物以較大之親和力或效力結合至或抑制LSD1。一般而言,選擇性可為至少約5倍、至少約10倍、至少約20倍、至少約50倍、至少約100倍、至少約200倍、至少約500倍或至少約1000倍。
作為LSD1之抑制劑,本發明之化合物適用於治療LSD1介導之疾病及病症。術語「LSD1介導之疾病」或「LSD1介導之病症」係指任何疾病或病狀,其中LSD1起作用或其中該疾病或病狀與LSD1之表現或活性有關。本發明之化合物因此可用於治療已知LSD1起作用之疾病及病狀或減輕其嚴重程度。
可使用本發明化合物治療之疾病及病狀一般包括癌症、發炎、自體免疫疾病、病毒誘發之發病、β-球蛋白病、及其他與LSD1活性有關之疾病。
可使用根據本發明之化合物治療之癌症包括例如血液學癌症、肉瘤、肺癌、胃腸癌、生殖泌尿道癌、肝癌、骨癌、神經系統癌、婦科癌症及皮膚癌。
例示性血液學癌症包括例如淋巴瘤及白血病,諸如急性淋巴母細胞性白血病(ALL)、急性骨髓性白血病(AML)、急性前髓細胞性白血病(APL)、慢性淋巴球性白血病(CLL)、慢性骨髓性白血病(CML)、瀰漫性大B細胞淋巴瘤(DLBCL)、套膜細胞淋巴瘤、非霍奇金淋巴瘤(Non-Hodgkin lymphoma)(包括復發型或難治型NHL及復發性濾泡性淋巴瘤)、霍奇金淋巴瘤、骨髓增生性疾病(例如原發性骨髓纖維化(PMF)、真性紅血球增多症(PV)、自發性血小板增多症(ET))、脊髓發育不良症候群(MDS)及多發性骨髓瘤。
例示性肉瘤包括例如軟骨肉瘤、尤文氏肉瘤、骨肉瘤、橫紋肌肉瘤、血管肉瘤、纖維肉瘤、脂肪肉瘤、黏液瘤、橫紋肌瘤、纖維瘤、脂肪瘤、錯構瘤及畸胎瘤。
例示性肺癌包括例如非小細胞肺癌(NSCLC)、支氣管癌(鱗狀細胞、未分化小細胞、未分化大細胞、腺癌)、肺泡(小支氣管)癌、支氣管腺瘤、軟骨錯構瘤及間皮瘤。
例示性胃腸癌包括例如食道癌(鱗狀細胞癌、腺癌、平滑肌肉瘤、淋巴瘤)、胃癌(癌瘤、淋巴瘤、平滑肌肉瘤)、胰臟癌(導管腺癌、胰島素瘤、升糖素瘤、胃泌素瘤、類癌瘤、血管活性腸肽瘤)、小腸癌(腺癌、淋巴瘤、類癌瘤、卡波西肉瘤(Kaposi's sarcoma)、平滑肌瘤、血管瘤、脂肪瘤、神經纖維瘤、纖維瘤)、大腸癌(腺癌、管狀腺瘤、絨毛狀腺瘤、錯構瘤、平滑肌瘤)及結腸直腸癌。
例示性生殖泌尿道癌包括例如腎癌(腺癌、威爾姆斯瘤(Wilm's tumor)[腎母細胞瘤])、膀胱及尿道癌(鱗狀細胞癌、移行細胞癌、腺癌)、前列腺癌(腺癌、肉瘤)及睪丸癌(精原細胞瘤、畸胎瘤、胚胎性癌、畸胎癌、絨毛膜癌、肉瘤、間質細胞癌、纖維瘤、纖維腺瘤、腺瘤樣腫瘤、脂肪瘤)。
例示性肝癌包括例如肝細胞瘤(肝細胞癌)、膽管上皮癌、肝胚細胞瘤、血管肉瘤、肝細胞性腺瘤及血管瘤。
例示性骨癌包括例如成骨肉瘤(骨肉瘤)、纖維肉瘤、惡性纖維組織細胞瘤、軟骨肉瘤、尤文氏肉瘤、惡性淋巴瘤(網狀細胞肉瘤)、多發性骨髓瘤、惡性巨細胞瘤、脊索瘤、骨軟骨纖維瘤(osteochronfroma)(骨軟骨性外生骨疣)、良性軟骨瘤、軟骨胚細胞瘤、軟骨黏液纖維瘤、骨樣骨瘤及巨細胞瘤。
例示性神經系統癌包括例如顱骨癌(骨瘤、血管瘤、肉芽腫、黃瘤、變形性骨炎)、腦膜癌(腦膜瘤、腦膜肉瘤、神經膠質瘤病)、腦癌(星形細胞瘤、神經管胚細胞瘤、神經膠質瘤、室管膜瘤、生殖細胞瘤(松果體瘤)、多形性神經膠質母細胞瘤、少突神經膠質瘤、神經鞘瘤、視網膜母細胞瘤、先天性腫瘤)及脊髓癌(神經纖維瘤、腦膜瘤、神經膠質瘤、肉瘤),以及神經母細胞瘤及萊-杜二氏病(Lhermitte-Duclos disease)。
例示性婦科癌症包括例如子宮癌(子宮內膜癌)、子宮頸癌(子宮頸癌瘤、腫瘤前子宮頸非典型增生)、卵巢癌(卵巢癌瘤(漿液性囊腺癌、黏液性囊腺癌、未分類癌瘤)、粒層-卵泡膜細胞瘤、塞-萊二氏細胞瘤(Sertoli-Leydig cell tumor)、無性細胞瘤、惡性畸胎瘤)、外陰癌(鱗狀細胞癌、上皮內癌、腺癌、纖維肉瘤、黑素瘤)、陰道癌(透明細胞癌、鱗狀細胞癌、葡萄樣肉瘤(胚胎性橫紋肌肉瘤))及輸卵管癌(癌瘤)。
例示性皮膚癌包括例如黑素瘤、基底細胞癌、鱗狀細胞癌、卡波西肉瘤、發育不良痣、脂肪瘤、血管瘤、皮膚纖維瘤及瘢痕瘤。
本發明之化合物可進一步用於治療LSD1可過度表現之癌症類型,包括例如乳癌、前列腺癌、頭頸部癌、喉癌、口腔癌及甲狀腺癌(例如乳頭狀甲狀腺癌)。
本發明之化合物可進一步用於治療遺傳性病症,諸如考登症候群(Cowden syndrome)及班-鄒二氏症候群(Bannayan-Zonana syndrome)。
本發明之化合物可進一步用於治療病毒性疾病,諸如單純皰疹病毒(HSV)、水痘帶狀皰狀病毒(VZV)、人類巨細胞病毒、B型肝炎病毒(HBV)及腺病毒。
本發明之化合物可進一步用於治療β-球蛋白病,包括例如β-地中海型貧血及鐮形血球貧血。
如本文所用之術語「接觸」係指在活體外系統或活體內系統中使所示部分彙聚在一起。舉例而言,使LSD1蛋白與本發明化合物「接觸」包括向具有LSD1蛋白之個體或患者(諸如人類)投與本發明之化合物,以及例如將本發明化合物引入含有含LSD1蛋白之細胞或純化之製品的樣品中。
如本文所用之可互換使用之術語「個體」或「患者」係指任何動物,包括哺乳動物,較佳為小鼠、大鼠、其他齧齒動物、兔、狗、貓、豬、牛、綿羊、馬或靈長類動物,且最佳為人類。
如本文所用之片語「治療有效量」係指活性化合物或醫藥藥劑引出生物或藥物反應之量,該生物或藥物反應正由研究人員、獸醫、醫學醫生或其他臨床醫師在組織、系統、動物、個體或人類中尋求。
如本文所用之術語「治療(treating)」或「治療(treatment)」係指抑制疾病;例如,抑制正遭受或表現出疾病、病狀或病症之病變或症狀之個體的疾病、病狀或病症(亦即阻止病變及/或症狀進一步發展)或改善疾病;例如,改善正遭受或表現出疾病、病狀或病症之病變或症狀之個體的疾病、病狀或病症(亦即逆轉病變及/或症狀),諸如減輕疾病之嚴重程度。
如本文所用之術語「預防(preventing)」或「預防(prevention)」係指預防疾病;例如,預防可能易患疾病、病狀或病症,但尚未遭受或表現出疾病之病變或症狀的個體患上該疾病、病狀或病症。組合療法
本發明之化合物可用於組合治療中,其中將本發明之化合物連同其他治療(諸如一或多種其他治療劑之投藥)一起投與。其他治療劑通常為通常用於治療所欲治療之特定病狀的彼等治療劑。其他治療劑可包括例如用於治療LSD1介導之疾病、病症或病狀之化學治療劑、消炎劑、類固醇、免疫抑制劑以及Bcr-Abl、Flt-3、RAF、FAK、JAK、PIM、PI3K抑制劑。該一或多種其他醫藥藥劑可同時或依序投與患者。
在一些實施例中,本發明之化合物可與靶向表觀遺傳調節因子之治療劑組合使用。表觀遺傳調節因子之實例包括組蛋白離胺酸甲基轉移酶、組蛋白精胺酸甲基轉移酶、組蛋白去甲基酶、組蛋白去乙醯酶、組蛋白乙醯酶及DNA甲基轉移酶。組蛋白去乙醯酶抑制劑包括例如伏立諾他(vorinostat)。
對於治療癌症及其他增生性疾病,本發明之化合物可與化學治療劑或其他抗增生劑組合使用。本發明之化合物亦可與醫學療法組合使用,該醫學療法諸如手術或放射療法,例如γ-放射、中子束放射療法、電子束放射療法、質子療法、近程療法及全身性放射性同位素。適合之化學治療劑之實例包括以下任一者:阿巴瑞克(abarelix)、阿地介白素(aldesleukin)、阿侖單抗(alemtuzumab)、阿利維甲酸(alitretinoin)、別嘌呤醇(allopurinol)、六甲蜜胺(altretamine)、阿那曲唑(anastrozole)、三氧化二砷、天冬醯胺酶、阿紮胞苷、苯達莫司汀(bendamustine)、貝伐單抗(bevacizumab)、蓓薩羅丁(bexarotene)、博來黴素(bleomycin)、硼替佐必(bortezombi)、硼替佐米(bortezomib)、白消安(busulfan)(靜脈內)、白消安(經口)、卡普睪酮(calusterone)、卡培他濱(capecitabine)、卡鉑(carboplatin)、卡莫司汀(carmustine)、西妥昔單抗(cetuximab)、苯丁酸氮芥(chlorambucil)、順鉑(cisplatin)、克拉屈濱(cladribine)、氯法拉濱(clofarabine)、環磷醯胺(cyclophosphamide)、阿糖胞苷(cytarabine)、達卡巴嗪(dacarbazine)、放線菌素(dactinomycin)、達肝素鈉(dalteparin sodium)、達沙替尼(dasatinib)、道諾黴素(daunorubicin)、地西他濱(decitabine)、地尼介白素(denileukin)、地尼介白素融合毒素(denileukin diftitox)、右雷佐生(dexrazoxane)、多烯紫杉醇(docetaxel)、小紅莓(doxorubicin)、丙酸屈他雄酮(dromostanolone propionate)、艾庫組單抗(eculizumab)、表柔比星(epirubicin)、埃羅替尼(erlotinib)、雌莫司汀(estramustine)、磷酸依託泊苷(etoposide phosphate)、依託泊苷、依西美坦(exemestane)、檸檬酸芬太尼(fentanyl citrate)、非格司亭(filgrastim)、氟尿苷(floxuridine)、氟達拉濱(fludarabine)、氟尿嘧啶(fluorouracil)、氟維司群(fulvestrant)、吉非替尼(gefitinib)、吉西他濱(gemcitabine)、奧吉妥珠單抗奧佐米星(gemtuzumab ozogamicin)、乙酸戈舍瑞林(goserelin acetate)、乙酸組胺瑞林(histrelin acetate)、替伊莫單抗(ibritumomab tiuxetan)、伊達比星(idarubicin)、異環磷醯胺(ifosfamide)、甲磺酸伊馬替尼(imatinib mesylate)、干擾素α2a、伊立替康(irinotecan)、二甲苯磺酸拉帕替尼(lapatinib ditosylate)、來那度胺(lenalidomide)、來曲唑(letrozole)、甲醯四氫葉酸(leucovorin)、乙酸亮丙瑞林(leuprolide acetate)、左旋咪唑(levamisole)、洛莫司汀(lomustine)、氮芥(meclorethamine)、乙酸甲地孕酮(megestrol acetate)、美法侖(melphalan)、巰基嘌呤(mercaptopurine)、胺甲喋呤(methotrexate)、甲氧沙林(methoxsalen)、絲裂黴素C (mitomycin C)、米托坦(mitotane)、米托蒽醌(mitoxantrone)、苯丙酸諾龍(nandrolone phenpropionate)、奈拉濱(nelarabine)、諾莫單抗(nofetumomab)、奧沙利鉑(oxaliplatin)、紫杉醇(paclitaxel)、帕米膦酸鹽(pamidronate)、帕尼單抗(panitumumab)、帕比司他(panobinostat)、培加帕酶(pegaspargase)、培非格司亭(pegfilgrastim)、培美曲塞二鈉(pemetrexed disodium)、噴司他丁(pentostatin)、哌泊溴烷(pipobroman)、普卡黴素(plicamycin)、丙卡巴肼(procarbazine)、奎納克林(quinacrine)、拉布立酶(rasburicase)、利妥昔單抗(rituximab)、盧佐替尼(ruxolitinib)、索拉非尼(sorafenib)、鏈脲黴素(streptozocin)、舒尼替尼(sunitinib)、順丁烯二酸舒尼替尼、他莫昔芬(tamoxifen)、替莫唑胺(temozolomide)、替尼泊甙(teniposide)、睪內酯(testolactone)、沙利度胺(thalidomide)、硫鳥嘌呤(thioguanine)、噻替派(thiotepa)、拓撲替康(topotecan)、托瑞米芬(toremifene)、托西莫單抗(tositumomab)、曲妥珠單抗(trastuzumab)、維甲酸(tretinoin)、尿嘧啶氮芥(uracil mustard)、戊柔比星(valrubicin)、長春鹼(vinblastine)、長春新鹼(vincristine)、長春瑞濱(vinorelbine)、伏立諾他及唑來膦酸鹽(zoledronate)。
對於治療癌症及其他增生性疾病,本發明之化合物可與盧佐替尼組合使用。
對於治療癌症及其他增生性疾病,本發明之化合物可與靶向療法組合使用,該等靶向療法包括JAK激酶抑制劑(盧佐替尼,JAK1選擇性)、Pim激酶抑制劑、PI3激酶抑制劑(包括PI3K-δ選擇性抑制劑及廣譜PI3K抑制劑)、MEK抑制劑、細胞週期素依賴性激酶抑制劑、b-RAF抑制劑、mTOR抑制劑、蛋白酶體抑制劑(硼替佐米、卡非佐米(Carfilzomib))、HDAC抑制劑(帕比司他、伏立諾他)、DNA甲基轉移酶抑制劑、地塞米松(dexamethasone)、溴區及額外末端(bromo and extra terminal)家族成員抑制劑及吲哚胺2,3-二氧酶抑制劑。
對於治療自體免疫或發炎性病狀,本發明之化合物可與皮質類固醇組合投與,該皮質類固醇諸如曲安西龍(triamcinolone)、地塞米松、氟輕鬆(fluocinolone)、可的松(cortisone)、普賴蘇穠(prednisolone)或氟米龍(flumetholone)。
對於治療自體免疫或發炎性病狀,本發明之化合物可與免疫抑制劑組合投與,該免疫抑制劑諸如氟西奈德(fluocinolone acetonide)(Retisert®)、利美索龍(rimexolone)(AL-2178、維克索(Vexol)、愛爾康(Alcon))或環孢素(cyclosporine)(Restasis®)。
對於治療自體免疫或發炎性病狀,本發明之化合物可與一或多種選自以下之其他藥劑組合投與:Dehydrex™(Holles Labs)、希維胺(Civamide)(Opko)、玻尿酸鈉(維斯美(Vismed),Lantibio/TRB Chemedia)、環孢素(ST-603,Sirion Therapeutics)、ARG101(T)(睪酮,Argentis)、AGR1012(P)(Argentis)、依卡倍特鈉(ecabet sodium)(Senju-Ista)、吉法酯(gefarnate)(Santen)、15-(s)-羥基二十碳四烯酸(15(S)-HETE)、西維美林(cevilemine)、多西環素(doxycycline)(ALTY-0501,Alacrity)、米諾環素(minocycline)、iDestrin™(NP50301,Nascent Pharmaceuticals)、環孢素A(Nova22007,Novagali)、土黴素(oxytetracycline)(耐久黴素(Duramycin)、MOLI1901,Lantibio)、CF101((2S,3S,4R,5R)-3,4-二羥基-5-[6-[(3-碘苯基)甲胺基]嘌呤-9-基]-N-甲基-氧雜環戊烷-2-胺甲醯基,Can-Fite Biopharma)、伏孢素(voclosporin)(LX212或LX214,Lux Biosciences)、ARG103(Agentis)、RX-10045(合成性消退素(resolvin)類似物,Resolvyx)、DYN15(Dyanmis Therapeutics)、來格列酮(rivoglitazone)(DE011,Daiichi Sanko)、TB4(RegeneRx)、OPH-01(Ophtalmis Monaco)、PCS101(Pericor Science)、REV1-31(Evolutec)、催淚蛋白(Lacritin)(Senju)、瑞巴派特(rebamipide)(Otsuka-Novartis)、OT-551(Othera)、PAI-2(賓夕法尼亞大學(University of Pennsylvania)及坦普爾大學(Temple University))、毛果芸香鹼、他克莫司(tacrolimus)、吡美莫司(pimecrolimus)(AMS981,Novartis)、氯替潑諾(loteprednol etabonate)、利妥昔單抗、地誇磷索四鈉(diquafosol tetrasodium)(INS365,Inspire)、KLS-0611(Kissei Pharmaceuticals)、去氫表雄固酮、阿那白滯素(anakinra)、依法利珠單抗(efalizumab)、黴酚酸鈉(mycophenolate sodium)、依那西普(etanercept)(Embrel®)、羥氯奎、NGX267 (TorreyPines Therapeutics)或沙利度胺。
在一些實施例中,本發明之化合物可與一或多種選自以下之藥劑組合投與:抗生素、抗病毒劑、抗真菌劑、麻醉劑、包括類固醇及非類固醇消炎劑之消炎劑及抗過敏劑。適合藥物之實例包括胺基糖苷,諸如阿米卡星(amikacin)、慶大黴素(gentamycin)、妥布黴素(tobramycin)、鏈黴素(streptomycin)、奈替米星(netilmycin)及卡那黴素(kanamycin);氟喹啉酮,諸如環丙沙星(ciprofloxacin)、諾氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、曲伐沙星(trovafloxacin)、洛美沙星(lomefloxacin)、左氧氟沙星(levofloxacin)及依諾沙星(enoxacin);口奈啶(naphthyridine);磺醯胺;多黏菌素(polymyxin);氯黴素(chloramphenicol);新黴素(neomycin);巴龍黴素(paramomycin);甲磺酸黏菌素(colistimethate);桿菌肽(bacitracin);萬古黴素(vancomycin);四環素(tetracycline);利福平(rifampin)及其衍生物(「利福平類」);環絲胺酸;β-內醯胺;頭孢菌素(cephalosporin);兩性黴素(amphotericin);氟康唑(fluconazole);氟胞嘧啶(flucytosine);納他黴素(natamycin);咪康唑(miconazole);酮康唑(ketoconazole);皮質類固醇;雙氯芬酸(diclofenac);氟比洛芬(flurbiprofen);酮咯酸(ketorolac);舒洛芬(suprofen);色甘酸(cromolyn);洛度沙胺(lodoxamide);左卡巴斯汀(levocabastin);奈甲嘧唑啉(naphazoline);安塔洛林(antazoline);苯吡胺(pheniramine);或氮雜內酯類抗生素。
藥劑之其他實例(其中一或多者亦可與所提供之化合物組合)包括:阿茲海默氏病(Alzheimer's Disease)之治療,諸如多奈哌齊(donepezil)及利斯的明(rivastigmine);帕金森氏病(Parkinson's Disease)之治療,諸如左旋多巴(L-DOPA)/卡比多巴(carbidopa)、恩他卡朋(entacapone)、羅匹尼羅(ropinirole)、普拉克索(pramipexole)、溴隱亭(bromocriptine)、培高利特(pergolide)、苯海索(trihexyphenidyl)及金剛烷胺(amantadine);治療多發性硬化(MS)之藥劑,諸如β干擾素(例如Avonex®及Rebif®)、乙酸格拉默(glatiramer acetate)及米托蒽醌;氣喘之治療,諸如沙丁胺醇(albuterol)及孟魯司特(montelukast);治療精神分裂症之藥劑,諸如再普樂(zyprexa)、利培酮(risperdal)、思瑞康(seroquel)及氟哌啶醇(haloperidol);消炎劑,諸如皮質類固醇,諸如地塞米松或普賴松(prednisone)、TNF阻斷劑、IL-1 RA、硫唑嘌呤(azathioprine)、環磷醯胺及柳氮磺胺吡啶(sulfasalazine);免疫調節劑,包括免疫抑制劑,諸如環孢菌素、他克莫司、雷帕黴素(rapamycin)、黴酚酸嗎啉乙酯(mycophenolate mofetil)、干擾素、皮質類固醇、環磷醯胺、硫唑嘌呤及柳氮磺胺吡啶;神經營養因子,諸如乙醯膽鹼酯酶抑制劑、MAO抑制劑、干擾素、抗驚厥劑、離子通道阻斷劑、利魯唑(riluzole)或抗帕金森氏病劑;治療心血管疾病之藥劑,諸如β-阻斷劑、ACE抑制劑、利尿劑、硝酸酯、鈣通道阻斷劑或他汀類(statin);治療肝病之藥劑,諸如皮質類固醇、消膽胺(cholestyramine)、干擾素及抗病毒劑;治療血液病症之藥劑,諸如皮質類固醇、抗白血病劑或生長因子;或治療免疫缺乏病症之藥劑,諸如γ球蛋白。
用作抗癌劑之生物藥物,諸如抗體及細胞介素可與本發明之化合物組合。另外,調節微環境或免疫反應之藥物可與本發明之化合物組合。該等藥物之實例為抗Her2抗體、抗CD20抗體、抗CTLA1抗體、抗PD-1抗體、抗PDL1抗體及其他免疫治療藥物。調配物、劑型及投藥
當用作藥物時,本發明之化合物可以醫藥組合物形式投與。此等組合物可以醫藥技術中熟知之方式製備,且可藉由多種途徑投與,視需要局部治療還是全身治療以及所欲治療之部位而定。投藥可為局部(包括經皮、表皮、眼科及向黏膜投藥,包括鼻內、經陰道及經直腸傳遞)、肺部(例如藉由吸入或吹入粉劑或氣溶膠,包括藉由霧化器;氣管內或鼻內)、經口或非經腸投藥。非經腸投藥包括靜脈內、動脈內、皮下、腹膜內、肌內或注射或輸注;或顱內,例如鞘內或腦室內投藥。非經腸投藥可呈單次快速注射給藥之形式,或可例如藉由連續灌注泵來進行。用於局部投藥之醫藥組合物及調配物可包括經皮貼劑、軟膏劑、洗劑、乳膏劑、凝膠劑、滴劑、栓劑、噴霧劑、液體及散劑。習知之醫藥載劑、水性、粉末或油性基質、增稠劑及其類似物可為必要的或所需的。
本發明亦包括醫藥組合物,其含有作為活性成分之本發明之化合物或其醫藥學上可接受之鹽與一或多種醫藥學上可接受之載劑(賦形劑)的組合。在一些實施例中,該組合物適用於局部投藥。在製備本發明之組合物中,通常將活性成分與賦形劑混合、由賦形劑稀釋或包封於該呈例如膠囊、小藥囊、紙材或其他容器形式之載劑內。當賦形劑用作稀釋劑時,其可為固體、半固體或液體物質,其充當活性成分之媒劑、載劑或介質。因此,該等組合物可呈錠劑、丸劑、散劑、口含錠、小藥囊、扁囊劑、酏劑、懸浮液、乳液、溶液、糖漿、氣溶膠(呈固體形式或處於液體介質中)、含有例如至多10重量%之活性化合物的軟膏劑、軟明膠膠囊及硬明膠膠囊、栓劑、無菌可注射溶液及無菌包裝之粉劑形式。
在製備調配物中,可在與其他成分組合之前將活性化合物研磨以提供適當之粒度。若活性化合物實質上不溶,則可將其研磨至小於200篩目之粒度。若活性化合物實質上可溶於水,則可藉由研磨調節粒度以在調配物中提供實質上均勻之分佈,例如約40篩目。
可使用諸如濕磨之已知研磨程序研磨本發明之化合物以獲得適於錠劑形成及其他調配物類型之粒度。本發明化合物之細粉狀(奈米顆粒狀)製劑可藉由此項技術中已知之方法來製備,例如參見國際申請案第WO 2002/000196號。
適合賦形劑之一些實例包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、澱粉、阿拉伯樹膠、磷酸鈣、藻酸鹽、黃蓍膠、明膠、矽酸鈣、微晶纖維素、聚乙烯吡咯啶酮、纖維素、水、糖漿及甲基纖維素。調配物可另外包括:潤滑劑,諸如滑石、硬脂酸鎂以及礦物油;濕潤劑;乳化劑及懸浮劑;防腐劑,諸如羥基苯甲酸甲酯及羥基苯甲酸丙酯;甜味劑;及調味劑。本發明之組合物可經調配以在藉由使用此項技術中已知之程序向患者投與後提供活性成分之快速、持續或延遲釋放。
組合物可調配成單位劑型,各劑量含有約5至約1,000 mg (1 g),更通常約100 mg至約500 mg之活性成分。術語「單位劑型」係指適合作為單位劑量用於人類受試者及其他哺乳動物之物理個別單元,各單元含有經計算可產生所需治療作用的預定量之活性物質,該活性物質與適合之醫藥賦形劑結合。
活性化合物可在廣泛之劑量範圍內具有效性且一般以醫藥學上有效之量投與。然而,將瞭解的是,實際上投與之化合物的量通常將由醫師根據相關情況來確定,該等相關情況包括所欲治療之病狀、所選擇之投藥途徑、所投與之實際化合物、個別患者之年齡、體重及反應、患者症狀之嚴重程度及其類似情況。
對於製備諸如錠劑之固體組合物,將主要活性成分與醫藥賦形劑混合以形成含有本發明化合物之均質混合物的固體預調配物組合物。當提及此等預調配物組合物為均質時,活性成分通常均勻分散於整個組合物中,以使得可容易地將組合物再分成同樣有效之單位劑型,諸如錠劑、丸劑及膠囊。接著將此固體預調配物再分成含有例如約0.1至約1000 mg之本發明之活性成分的上述類型之單位劑型。
本發明之錠劑或丸劑可經包覆或以其他方式配混以提供賦予延長作用之優勢的劑型。舉例而言,錠劑或丸劑可包含內部劑量及外部劑量組分,後者呈處於前者上之包層形式。該兩種組分可由腸溶包衣層分開,該腸溶包衣層用來抵抗在胃中之崩解且允許內部組分完整地通過到達十二指腸中或延遲釋放。多種物質可用於該等腸溶包衣層或包衣,該等物質包括多種聚合酸及聚合酸與諸如蟲膠、鯨蠟醇及乙酸纖維素之物質的混合物。
可併有本發明之化合物及組合物以用於經口或藉由注射投與之液體形式包括水溶液、適當調味之糖漿、水性或油性懸浮液及含諸如棉籽油、芝麻油、椰子油或花生油之食用油的調味乳液,以及酏劑及類似之醫藥媒劑。
用於吸入或吹入之組合物包括於醫藥學上可接受之水性或有機溶劑或其混合物中之溶液及懸浮液以及粉劑。液體或固體組合物可含有如上文所述之適合之醫藥學上可接受之賦形劑。在一些實施例中,該等組合物係藉由經口或經鼻呼吸道途徑投與以達成局部或全身作用。可藉由使用惰性氣體使組合物霧化。霧化溶液可直接自霧化裝置吸入或霧化裝置可連接至面具罩或間歇性正壓呼吸機。溶液、懸浮液或粉劑組合物可經口或經鼻由以適當方式傳遞調配物之裝置投與。
局部調配物可含有一或多種習知載劑。在一些實施例中,軟膏劑可含有水及一或多種疏水性載劑,該一或多種疏水性載劑選自例如液體石蠟、聚氧乙烯烷基醚、丙二醇、白凡士林及其類似物。乳膏劑之載劑組合物可基於水以及甘油及一或多種其他組分,例如單硬脂酸甘油酯、PEG-單硬脂酸甘油酯及鯨蠟硬脂醇。凝膠劑可使用異丙醇及水,適當地結合諸如甘油、羥乙基纖維素及其類似物之其他組分來調配。在一些實施例中,局部調配物含有至少約0.1重量%、至少約0.25重量%、至少約0.5重量%、至少約1重量%、至少約2重量%、或至少約5重量%之本發明化合物。局部調配物可適當地包裝於裝有例如100 g之管中,該等管視情況附有關於對所選之適應症(例如銀屑病或其他皮膚病狀)進行治療之說明書。
向患者投與之化合物或組合物之量將視正投與何物、投藥目的(諸如防治或治療)、患者狀況、投藥方式及其類似因素而變化。在治療應用中,可向已罹患疾病之患者投與足以治癒或至少部分抑制疾病及其併發症之症狀的量之組合物。有效劑量將視正在治療之疾病病狀而定,以及根據主治臨床醫師之判斷,視諸如以下之因素而定:疾病之嚴重程度、患者之年齡、體重及一般情況及其類似因素。
向患者投與之組合物可呈上述醫藥組合物之形式。此等組合物可藉由習知之滅菌技術來滅菌或可經無菌過濾。水溶液可經包裝以原樣使用,或可經凍乾,該凍乾製劑在投藥之前與無菌水性載劑組合。化合物製劑之pH通常將為3至11,更佳為5至9且最佳為7至8。應瞭解的是,某些上述賦形劑、載劑或穩定劑之使用將引起醫藥鹽之形成。
本發明化合物之治療劑量可根據例如進行治療之特定用途、化合物之投藥方式、患者之健康情況及病狀以及處方醫師之判斷而變化。醫藥組合物中本發明化合物之比例或濃度可視多種因素而變化,包括劑量、化學特徵(例如疏水性)及投藥途徑。舉例而言,本發明之化合物可以含有約0.1%至約10% w/v之化合物以用於非經腸投藥之生理緩衝水溶液形式提供。一些典型之劑量範圍為每天每公斤體重約1 μg至約1 g。在一些實施例中,劑量範圍為每天每公斤體重約0.01 mg至約100 mg。劑量有可能視諸如以下之變數而定:疾病或病症之類型及進展程度、特定患者之總體健康狀況、所選擇之化合物之相對生物學功效、賦形劑之調配及其投藥途徑。有效劑量可自源自於活體外或動物模型測試系統之劑量反應曲線外推得到。
本發明之組合物可進一步包括一或多種其他醫藥藥劑,諸如化學治療劑、類固醇、消炎化合物或免疫抑制劑,其實例列於上文中。
本發明之化合物可與伴隨診斷一起提供或與伴隨診斷組合使用。如本文所用之術語「伴隨診斷」係指適用於確定治療劑之安全及有效使用之診斷裝置。舉例而言,可使用伴隨診斷來制定用於既定受試者之治療劑之劑量,識別用於治療之適當子群,或識別因嚴重副作用之風險增加而不應接受特定治療之群體。
在一些實施例中,使用伴隨診斷來監測患者之治療反應。在一些實施例中,使用伴隨診斷來識別有可能得益於既定化合物或治療劑之受試者。在一些實施例中,使用伴隨診斷來識別與參考標準相比因接受治療劑投藥而有增加之不利副作用風險的受試者。在一些實施例中,伴隨診斷為選自FDA許可或批准之伴隨診斷裝置之清單的活體外診斷或成像工具。在一些實施例中,伴隨診斷係選自已由裝置與輻射健康中心(Center for Devices and Radiological Health)許可或批准之測試之清單。標記化合物及分析方法
本發明之另一態樣係關於本發明之標記化合物(放射性標記、螢光標記等),該等標記化合物不僅適用於成像技術中,而且亦適用於在活體外及活體內用於對組織樣品(包括人類)中之LSD1進行定位及定量以及用於藉由對標記化合物之結合的抑制來識別LSD1配體的分析中。因此,本發明包括含有該等標記化合物之LSD1分析。
本發明進一步包括本發明之同位素標記化合物。「同位素標記」或「放射性標記」之化合物為一或多個原子經原子質量或質量數不同於通常在自然界中存在(亦即天然存在)之原子質量或質量數之原子置換或取代的本發明化合物。可併入本發明化合物中之適合放射性核種包括(但不限於)3
H (對於氚,亦寫成T)、11
C、13
C、14
C、13
N、15
N、15
O、17
O、18
O、18
F、35
S、36
Cl、82
Br、75
Br、76
Br、77
Br、123
I、124
I、125
I及131
I。併入本發明之放射性標記之化合物中的放射性核種將視放射性標記化合物之特定應用而定。
應當瞭解的是,「放射性標記」或「標記化合物」為已併有至少一個放射性核種之化合物。在一些實施例中,放射性核種選自由3
H、14
C、125
I、35
S及82
Br組成之群。在一些實施例中,化合物併有1、2或3個氘原子。
本發明可進一步包括將放射性同位素併入本發明化合物中之合成方法。用於將放射性同位素併入有機化合物中之合成方法在此項技術中為熟知的,且一般技術者將容易地識別出適用於本發明化合物之方法。
本發明之標記化合物可用於篩選分析中以識別/評估化合物。舉例而言,經標記的新合成或識別之化合物(亦即測試化合物)結合LSD1之能力可藉由經由追蹤標記來監測其在與LSD1接觸時出現之濃度變化來評估。舉例而言,可評估測試化合物(經標記)減少已知結合LSD1之另一種化合物(亦即標準化合物)之結合的能力。因此,測試化合物與標準化合物競爭結合LSD1之能力直接與其結合親和力具有相關性。反之,在一些其他篩選分析中,標準化合物經標記且測試化合物未經標記。因此,監測標記之標準化合物之濃度以評估標準化合物與測試化合物之間的競爭,且因此確定測試化合物之相對結合親和力。
將經由特定實例更詳細地描述本發明。以下實例係出於說明性目的而提供,且不意欲以任何方式限制本發明。熟習此項技術者將容易地識別出多種非關鍵參數,該等參數可變化或改動以得到基本上相同之結果。如下文所述,發現實例之化合物為LSD1之抑制劑。實例
下文提供用於本發明化合物之實驗程序。在Waters質量定向分級分離系統上對所製備之一些化合物進行製備型LC-MS純化。用於操作此等系統之基本設備設置、方案及控制軟體已詳細描述於文獻中。參見例如「Two-Pump At Column Dilution Configuration for Preparative LC-MS」, K. Blom,J. Combi. Chem
., 4, 295 (2002
);「Optimizing Preparative LC-MS Configurations and Methods for Parallel Synthesis Purification」, K. Blom, R. Sparks, J. Doughty, G. Everlof, T. Haque, A. Combs,J. Combi. Chem
., 5, 670 (2003
);及「Preparative LC-MS Purification: Improved Compound Specific Method Optimization」, K. Blom, B. Glass, R. Sparks, A. Combs,J. Combi. Chem
., 6, 874-883 (2004
)。通常在以下條件下對所分離之化合物進行分析型液相層析-質譜分析(LCMS)以進行純度檢驗:儀器:Agilent 1100系列,LC/MSD;管柱:Waters SunfireTM
C18
5 μm粒度,2.1 × 5.0 mm;緩衝液:移動相A:含0.025% TFA之水,及移動相B:乙腈;梯度:在3分鐘內2%至80%之B,流速:2.0 mL/分鐘。
亦在製備規模上藉由逆相高效液相層析(RP-HPLC),使用如實例中所示之MS偵測器或急驟層析(矽膠)來分離所製備之一些化合物。典型之製備型逆相高效液相層析(RP-HPLC)管柱條件如下:
pH = 2純化:Waters SunfireTM
C18
5 μm粒度,19 × 100 mm管柱,使用以下來溶離:移動相A:含0.1% TFA (三氟乙酸)之水及移動相B:乙腈;流速為30 mL/分鐘,使用如文獻中所述之化合物特異性方法最佳化方案(Compound Specific Method Optimization protocol)針對各化合物使分離梯度最佳化[參見「Preparative LCMS Purification: Improved Compound Specific Method Optimization」, K. Blom, B. Glass, R. Sparks, A. Combs,J. Comb. Chem.
,6
, 874-883 (2004)]。通常,在30 × 100 mm管柱的情況下所用之流速為60 mL/分鐘。
pH = 10純化:Waters XBridge C18
5 μm粒度,19 × 100 mm管柱,使用以下來溶離:移動相A:含0.15% NH4
OH之水及移動相B:乙腈;流速為30 mL/分鐘,使用如文獻中所述之化合物特異性方法最佳化方案針對各化合物使分離梯度最佳化[參見「Preparative LCMS Purification: Improved Compound Specific Method Optimization」, K. Blom, B. Glass, R. Sparks, A. Combs,J. Comb. Chem.
,6
, 874-883 (2004)]。通常,在30 × 100 mm管柱的情況下所用之流速為60 mL/分鐘。實例 1 4-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 甲基 ] 苯甲酸 步驟 1 : 3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲酸第三丁酯
向3-甲醯基氮雜環丁烷-1-甲酸第三丁酯(556 mg,3.00 mmol,Alfa Aesar:目錄號H52794)及2-苯基環丙胺鹽酸鹽(600. mg,3.54 mmol,反式
,外消旋
,J&W PharmLab:目錄號20-0073S,批號:JW152-128A)於DCM (10 mL)中之溶液中添加乙酸(510 μL,9.0 mmol)。在室溫下將所得黃色溶液攪拌隔夜,接著添加Na(OAc)3
BH (1.9 g,9.0 mmol)。在室溫下將反應混合物攪拌1小時,接著用DCM稀釋,用飽和Na2
CO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,接著濃縮。經矽膠管柱(用0%至100%之EtOAc/己烷溶離)純化殘餘物,得到呈淡黃色油狀之所需產物(513 mg,57%)。C14
H19
N2
O2
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 247.1;實驗值247.2。步驟 2 : 3-{[( 反 -2- 苯基環丙基 )( 三氟乙醯基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲酸第三丁酯
在0℃下向3-{[(反-2-苯基環丙基)胺基]甲基}氮雜環丁烷-1-甲酸第三丁酯(187 mg,0.618 mmol)於DCM (5 mL)中之溶液中添加三乙胺(0.431 mL,3.09 mmol),繼而逐滴添加三氟乙酸酐(114 μL,0.804 mmol)。在0℃下將所得黃色溶液攪拌1小時,接著用飽和NaHCO3
溶液淬滅且用DCM萃取。經Na2
SO4
乾燥合併之萃取物,接著濃縮。經矽膠管柱(用0%至60%之EtOAc/己烷溶離)純化殘餘物,得到呈黃色油狀之所需產物(228 mg,93%)。C16
H18
F3
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 343.1;實驗值343.2。步驟 3 : N-( 氮雜環丁烷 -3- 基甲基 )-2,2,2- 三氟 -N-( 反 -2- 苯基環丙基 ) 乙醯胺
向3-{[(反-2-苯基環丙基)-(三氟乙醯基)胺基]甲基}氮雜環丁烷-1-甲酸第三丁酯(228 mg,0.572 mmol)於DCM (3 mL)中之溶液中添加TFA (3 mL)。在室溫下將所得淡黃色溶液攪拌1小時,接著濃縮。殘餘物未經進一步純化即用於下一步中。C15
H18
F3
N2
O之LC-MS計算值(M+H)+
: m/z = 299.1;實驗值299.2。步驟 4 : 4-[(3-{[( 反 -2- 苯基環丙基 )( 三氟乙醯基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 甲基 ] 苯甲酸甲酯
向N-(氮雜環丁烷-3-基甲基)-2,2,2-三氟-N-(反-2-苯基環丙基)乙醯胺(57 mg,0.19 mmol)於乙腈(3 mL)中之溶液中添加K2
CO3
(50 mg,0.38 mmol),繼而添加4-溴甲基苯甲酸甲酯(52 mg,0.23 mmol)。在室溫下將所得混合物攪拌2.5小時,接著用水稀釋且用DCM萃取。經Na2
SO4
乾燥合併之萃取物,接著濃縮。經矽膠管柱(用0%至60%之EtOAc/己烷溶離)純化殘餘物,得到呈澄清油狀之所需產物(27 mg,32%)。C24
H26
F3
N2
O3
之LC-MS計算值(M+H)+
: m/z = 447.2;實驗值447.2。步驟 5 : 4-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 甲基 ] 苯甲酸
向4-[(3-{[(反-2-苯基環丙基)-(三氟乙醯基)胺基]甲基}氮雜環丁烷-1-基)甲基]苯甲酸甲酯(27 mg,0.06 mmol)於THF (1 mL)及MeOH (1 mL)中之溶液中添加0.5 M氫氧化鈉之水溶液(1.2 mL,0.6 mmol)。使所得混合物升溫至50℃且攪拌1小時,此時LC-MS指示反應完全,得到所需產物。將反應混合物冷卻至室溫,接著用MeOH稀釋且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈白色固體狀之呈TFA鹽形式之產物。C21
H25
N2
O2
之LC-MS計算值(M+H)+
: m/z = 337.2;實驗值337.2。實例 2 N-{[1-(4- 氟苯甲基 ) 氮雜環丁烷 -3- 基 ] 甲基 }- 反 -2- 苯基環丙胺
此化合物係使用與對於實例 1
所述之程序類似之程序,在步驟 4
中用1-(氯甲基)-4-氟-苯替代4-溴甲基苯甲酸甲酯來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化產物,得到呈白色固體狀之呈TFA鹽形式之產物。C20
H24
FN2
之LC-MS計算值(M+H)+
: m/z = 311.2;實驗值311.1。實例 3 4-({4-[( 反 -2- 苯基環丙基 ) 胺基 ] 哌啶 -1- 基 } 甲基 ) 苯甲酸 步驟 1 : 4-[(4- 側氧基哌啶 -1- 基 ) 甲基 ] 苯甲酸甲酯
在室溫下將哌啶-4-酮鹽酸鹽水合物(154 mg,1.00 mmol,Aldrich,目錄號151769)、4-溴甲基苯甲酸甲酯(230 mg,1.00 mmol)及K2
CO3
(346 mg,2.51 mmol)於乙腈(2 mL)中之混合物攪拌隔夜。用水稀釋反應混合物,接著用DCM萃取。經Na2
SO4
乾燥合併之萃取物,接著濃縮,得到呈無色油狀之所需產物,該產物未經進一步純化即用於下一步中。C14
H18
NO3
之LC-MS計算值(M+H)+
: m/z = 248.1;實驗值248.1。步驟 2 : 4-({4-[( 反 -2- 苯基環丙基 ) 胺基 ] 哌啶 -1- 基 } 甲基 ) 苯甲酸甲酯
向2-苯基環丙胺鹽酸鹽(30. mg,0.17 mmol,反式
,外消旋
,Acros,目錄號130470050)及4-[(4-側氧基哌啶-1-基)甲基]苯甲酸甲酯(43 mg,0.17 mmol)於DCM (2 mL)中之溶液中添加乙酸(30 μL,0.52 mmol)。在室溫下將所得黃色溶液攪拌2小時,接著添加Na(OAc)3
BH(110 mg,0.52 mmol)。在室溫下將反應混合物攪拌1小時,接著用DCM稀釋且用飽和Na2
CO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,接著濃縮。殘餘物未經進一步純化即用於下一步中。C23
H29
N2
O2
之LC-MS計算值(M+H)+
: m/z = 365.2;實驗值365.1。步驟 3 : 4-({4-[( 反 -2- 苯基環丙基 ) 胺基 ] 哌啶 -1- 基 } 甲基 ) 苯甲酸
將來自步驟 2
之粗產物溶解於THF (1 mL)及MeOH (1 mL)中,接著添加2.0 M氫氧化鈉之水溶液(0.43 mL,0.87 mmol)。在50℃下將所得混合物攪拌1小時,此時LC-MS指示反應完全,得到所需產物。將反應混合物冷卻至室溫,接著用MeOH稀釋,且藉由製備型HPLC (pH = 10,乙腈/水+NH4
OH)純化,得到呈白色固體狀之呈銨鹽形式之產物。C22
H27
N2
O2
之LC-MS計算值(M+H)+
: m/z = 351.2;實驗值351.3。實例 4 3-({4-[( 反 -2- 苯基環丙基 ) 胺基 ] 哌啶 -1- 基 } 甲基 ) 苯甲酸
此化合物係使用與對於實例 3
所述之程序類似之程序,在步驟 1
中用3-(溴甲基)苯甲酸甲酯替代4-溴甲基苯甲酸甲酯來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化產物,得到呈白色固體狀之呈TFA鹽形式之所需產物,C22
H27
N2
O2
之LC-MS計算值(M+H)+
: m/z = 351.2;實驗值351.2。實例 5 1-(4- 氟苯甲基 )-N-( 反 -2- 苯基環丙基 ) 哌啶 -4- 胺
此化合物係使用與對於實例 3
所述之程序類似之程序,在步驟 1
中用1-(氯甲基)-4-氟-苯替代4-溴甲基苯甲酸甲酯來製備。藉由製備型HPLC (pH = 10,乙腈/水+NH4
OH)純化產物,得到呈黃色油狀之呈游離鹼形式之產物。C21
H26
FN2
之LC-MS計算值(M+H)+
: m/z = 325.2;實驗值325.2。實例 6 4-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 甲基 ] 苯甲腈
向N-(氮雜環丁烷-3-基甲基)-2,2,2-三氟-N-(反-2-苯基環丙基)乙醯胺(20 mg,0.07 mmol,如實例 1 步驟 3
中所述來製備)及4-甲醯基苯甲腈(13 mg,0.10 mmol)於THF (1.5 mL)中之溶液中添加乙酸(17 μL,0.30 mmol)。在室溫下將反應混合物攪拌隔夜,接著添加三乙醯氧基硼氫化鈉(64 mg,0.30 mmol)。在室溫下將混合物攪拌1小時,接著添加2 N NaOH之水溶液(1 mL)及MeOH (1 mL)。在40℃下將所得混合物攪拌1小時,接著冷卻至室溫,過濾且藉由製備型HPLC (pH = 10,乙腈/水+NH4
OH)純化,得到所需產物。C21
H24
N3
之LC-MS計算值(M+H)+
: m/z = 318.2;實驗值318.2。實例 7 3-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 甲基 ] 苯甲腈
此化合物係使用與對於實例 6
所述之程序類似之程序,用3-氰基苯甲醛替代4-甲醯基苯甲腈來製備。C21
H24
N3
之LC-MS計算值(M+H)+
: m/z = 318.2;實驗值318.3。實例 8 (1-(3- 氟苯甲醯基 )-4-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 哌啶 -4- 基 ) 乙腈 步驟 1 : 4-( 氰甲基 ) 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
在-40℃下向哌啶-1,4-二甲酸1-第三丁酯4-甲酯(0.97 g,4.0 mmol)於THF (20 mL)中之溶液中逐滴添加2.0 M LDA之THF溶液(2.8 mL,5.6 mmol)。在-40℃下將所得混合物攪拌30分鐘,接著添加溴乙腈(0.44 mL,6.4 mmol)。在-40℃下將反應混合物攪拌2小時,接著用水淬滅。使混合物升溫至室溫,接著用EtOAc稀釋,用水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-30%)溶離)純化殘餘物,得到所需產物。C10
H15
N2
O4
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 227.1;實驗值227.2。步驟 2 : 1-( 第三丁氧羰基 )-4-( 氰甲基 ) 哌啶 -4- 甲酸
向4-(氰甲基)哌啶-1,4-二甲酸1-第三丁酯4-甲酯(0.60 g,2.1 mmol)於THF (4.0 mL)/MeOH (4.0 mL)/水(1.0 mL)中之溶液中添加氫氧化鋰(單水合物,0.44 g,11 mmol)。在室溫下將反應混合物攪拌2小時,接著用冷1 N HCl酸化且用EtOAc萃取。用水、鹽水洗滌萃取物,經Na2
SO4
乾燥,過濾且濃縮。殘餘物未經進一步純化即用於下一步中。C9
H13
N2
O4
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 213.1;實驗值213.1。步驟 3 : 4-( 氰甲基 )-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
在0℃下向1-(第三丁氧羰基)-4-(氰甲基)哌啶-4-甲酸(0.50 g,1.9 mmol)及三乙胺(0.52 mL,3.7 mmol)於THF (6 mL)中之溶液中添加氯甲酸乙酯(0.21 mL,2.2 mmol)。將所得混合物攪拌30分鐘,接著過濾且用THF (2 mL)洗滌。將濾液冷卻至0℃,且接著添加於甲醇(1 mL)/水(1 mL)中之四氫硼酸鈉(0.14 g,3.7 mmol)。使混合物升溫至室溫,接著攪拌30分鐘。用EtOAc稀釋混合物,用飽和NaHCO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。殘餘物未經進一步純化即用於下一步中。C9
H15
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 199.1;實驗值199.1。步驟 4 : 4-( 氰甲基 )-4- 甲醯基哌啶 -1- 甲酸第三丁酯
向4-(氰甲基)-4-(羥甲基)哌啶-1-甲酸第三丁酯(400.0 mg,1.573 mmol)於DCM (8 mL)中之溶液中添加戴斯-馬丁高碘烷(Dess-Martin periodinane)(1.0 g,2.4 mmol)。在室溫下將所得混合物攪拌3小時,接著添加飽和Na2
S2
O3
水溶液且攪拌10分鐘。用DCM稀釋混合物,接著用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾,且接著濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-30%)溶離)純化殘餘物,得到所需產物。C9
H13
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 197.1;實驗值197.1。步驟 5 : 4-( 氰甲基 )-4-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
向4-(氰甲基)-4-甲醯基哌啶-1-甲酸第三丁酯(180.0 mg,0.7134 mmol)及2-苯基環丙胺(114 mg,0.856 mmol,反式
,外消旋
,J&W PharmLab:目錄號20-0073S)於DCM (3.0 mL)中之溶液中添加乙酸(0.061 mL,1.1 mmol)。在室溫下將混合物攪拌2小時,接著添加三乙醯氧基硼氫化鈉(300 mg,1.4 mmol)。在室溫下將所得混合物攪拌2小時,接著用DCM稀釋,且用飽和NaHCO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含甲醇之二氯甲烷(0-8%)溶離)純化殘餘物,得到所需產物。C22
H32
N3
O2
之LC-MS計算值(M+H)+
: m/z = 370.2;實驗值370.3。步驟 6 : 4-( 氰甲基 )-4-{[( 反 -2- 苯基環丙基 )( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
在0℃下向4-(氰甲基)-4-{[(反-2-苯基環丙基)胺基]甲基}哌啶-1-甲酸第三丁酯(0.18 g,0.49 mmol)及DIEA(0.17 mL,0.97 mmol)於DCM (2.4 mL)中之溶液中逐滴添加三氟乙酸酐(0.08 mL,0.58 mmol)。使混合物升溫至室溫且攪拌1小時,接著用DCM稀釋,用飽和NaHCO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-20%)溶離)純化殘餘物,得到所需產物。C20
H23
F3
N3
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 410.2;實驗值410.1。步驟 7 : N-{[4-( 氰甲基 ) 哌啶 -4- 基 ] 甲基 }-2,2,2- 三氟 -N-( 反 -2- 苯基環丙基 ) 乙醯胺
向4-(氰甲基)-4-{[(反-2-苯基環丙基)(三氟乙醯基)胺基]甲基}哌啶-1-甲酸第三丁酯(0.16 g,0.34 mmol)於DCM (0.2 mL)中之溶液中添加4.0 M氯化氫之二噁烷溶液(0.8 mL,3.2 mmol)。在室溫下將所得混合物攪拌30分鐘,接著濃縮。殘餘物未經進一步純化即用於下一步中。C19
H23
F3
N3
O之LC-MS計算值(M+H)+
: m/z = 366.2;實驗值366.1。步驟 8 : (1-(3- 氟苯甲醯基 )-4-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 哌啶 -4- 基 ) 乙腈
在0℃下向N
-{[4-(氰甲基)哌啶-4-基]甲基}-2,2,2-三氟-N
-(反-2-苯基環丙基)乙醯胺(15.0 mg,0.0410 mmol)及三乙胺(23 μL,0.16 mmol)於DCM (0.4 mL)中之溶液中添加3-氟苯甲醯氯(9.8 μL,0.082 mmol)。將混合物攪拌30分鐘,接著濃縮。將殘餘物溶解於甲醇(1 mL)及THF (1 mL)中,接著添加1 N NaOH (1.0 mL)。在40℃下將混合物攪拌2小時,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C24
H27
FN3
O之LC-MS計算值(M+H)+
: m/z = 392.2;實驗值392.2。實例 9 (1-(3- 氟苯甲基 )-4-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 哌啶 -4- 基 ) 乙腈
向N
-{[4-(氰甲基)哌啶-4-基]甲基}-2,2,2-三氟-N
-(反-2-苯基環丙基)乙醯胺(17.9 mg,0.0490 mmol,如實例 8 步驟 7
中所述來製備)於DCM (0.5 mL)中之溶液中添加3-氟苯甲醛(12 mg,0.098 mmol)。在室溫下將混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(21 mg,0.098 mmol)。在室溫下將反應混合物攪拌2小時,接著用DCM稀釋,且用飽和NaHCO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。將殘餘物溶解於THF (1 mL)及甲醇(1 mL)中,接著添加1 N NaOH (1 mL)。在40℃下將所得混合物攪拌4小時,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C24
H29
FN3
之LC-MS計算值(M+H)+
: m/z = 378.2;實驗值378.2。實例 10 (5R)-2-( 順 -4- 羥基環己基 )-7-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 羰基 ]-2,7- 二氮雜螺 [4.5] 癸 -1- 酮
向光氣於甲苯中之混合物(15重量%於甲苯中,60 μL,0.1 mmol,Aldrich,目錄號748684)中添加(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮(20 mg,0.1 mmol,如諸如WO 2008/157752之文獻中所揭示來製備)及三乙胺(30 μL,0.2 mmol)於THF (2 mL)中之溶液。在室溫下將所得混合物攪拌1小時,接著在減壓下濃縮。向殘餘物中添加N-(氮雜環丁烷-3-基甲基)-2,2,2-三氟-N-(反-2-苯基環丙基)乙醯胺(20 mg,0.05 mmol,如實例 1 步驟 3
中所述來製備)及三乙胺(20 μL,0.1 mmol)於乙腈(1 mL)中之溶液。在室溫下將反應混合物攪拌30分鐘,接著添加2 N NaOH之水溶液(1 mL),繼而添加MeOH (1 mL)。在30℃下將所得混合物攪拌1小時,接著冷卻至室溫且藉由製備型HPLC (pH = 10,乙腈/水+NH4
OH)純化,得到所需產物。C28
H41
N4
O3
之LC-MS計算值(M+H)+
: m/z = 481.3;實驗值481.3。實例 11 (5S)-2-( 順 -4- 羥基環己基 )-7-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 羰基 ]-2,7- 二氮雜螺 [4.5] 癸 -1- 酮
此化合物係使用與對於實例 10
之合成所述之程序類似之程序,用(5S)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮(使用如諸如WO 2008/157752之文獻中所揭示之類似方法來製備)替代(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮來製備。C28
H41
N4
O3
之LC-MS計算值(M+H)+
: m/z = 481.3;實驗值481.3。實例 12 1-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 羰基 ] 哌啶 -4- 甲腈
此化合物係使用與對於實例 10
之合成所述之程序類似之程序,用哌啶-4-甲腈替代(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮來製備。C20
H27
N4
O之LC-MS計算值(M+H)+
: m/z = 339.2;實驗值339.2。實例 13 反 -2- 苯基 -N-[(1-{[4-( 三氟甲基 ) 哌啶 -1- 基 ] 羰基 } 氮雜環丁烷 -3- 基 ) 甲基 ] 環丙胺
此化合物係使用與對於實例 10
之合成所述之程序類似之程序,用4-(三氟甲基)哌啶替代(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮來製備。C20
H27
F3
N3
O之LC-MS計算值(M+H)+
: m/z = 382.2;實驗值382.2。實例 14 N-({1-[(3- 苯氧基哌啶 -1- 基 ) 羰基 ] 氮雜環丁烷 -3- 基 } 甲基 )- 反 -2- 苯基環丙胺
此化合物係使用與對於實例 10
之合成所述之程序類似之程序,用3-苯氧基哌啶替代(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮來製備。C25
H32
N3
O2
之LC-MS計算值(M+H)+
: m/z = 406.2;實驗值406.2。實例 15 N-({1-[(3- 甲氧基哌啶 -1- 基 ) 羰基 ] 氮雜環丁烷 -3- 基 } 甲基 )- 反 -2- 苯基環丙胺
此化合物係使用與對於實例 10
之合成所述之程序類似之程序,用3-甲氧基哌啶替代(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮來製備。C20
H30
N3
O2
之LC-MS計算值(M+H)+
: m/z = 344.2;實驗值344.1。實例 16 4- 苯基 -1-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 羰基 ] 哌啶 -4- 甲腈
此化合物係使用與對於實例 10
之合成所述之程序類似之程序,用4-苯基哌啶-4-甲腈鹽酸鹽替代(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮來製備。C26
H31
N4
O之LC-MS計算值(M+H)+
: m/z = 415.2;實驗值415.2。實例 17 4- 苯基 -1-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 羰基 ] 哌啶 -4- 醇
此化合物係使用與對於實例 10
之合成所述之程序類似之程序,用4-苯基哌啶-4-醇替代(5R)-2-(順-4-羥基環己基)-2,7-二氮雜螺[4.5]癸-1-酮來製備。C25
H32
N3
O2
之LC-MS計算值(M+H)+
: m/z = 406.2;實驗值406.2。實例 18 N-({1-[(5- 氟 -1,2- 二氫 - 螺 [ 吲哚 -3,4'- 哌啶 ]-1'- 基 ) 羰基 ] 氮雜環丁烷 -3- 基 } 甲基 )- 反 -2- 苯基環丙胺
向光氣於甲苯中之混合物(15重量%於甲苯中,60 μL,0.1 mmol,Aldrich,目錄號748684)中添加5-氟螺[吲哚-3,4'-哌啶]-1(2H)-甲酸第三丁酯鹽酸鹽(30 mg,0.1 mmol,如諸如WO 2008/157752之文獻中所揭示來製備)及三乙胺(30 μL,0.2 mmol)於THF (2 mL)中之溶液。在室溫下將所得混合物攪拌1小時,接著在減壓下濃縮。向殘餘物中添加N-(氮雜環丁烷-3-基甲基)-2,2,2-三氟-N-(反-2-苯基環丙基)乙醯胺(20 mg,0.05 mmol,如實例 1 步驟 3
中所述來製備)及三乙胺(20 μL,0.1 mmol)於乙腈(1 mL)中之溶液。在室溫下將反應混合物攪拌30分鐘,接著用飽和NaHCO3
水溶液淬滅,且用EtOAc萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。將殘餘物溶解於乙腈(1 mL)中,接著添加TFA (1 mL)。在室溫下將所得混合物攪拌1小時,接著濃縮。將殘餘物溶解於THF (1 mL)及MeOH (1 mL)中,接著添加2 N NaOH水溶液(0.5 mL)。在30℃下將反應混合物攪拌1小時,接著冷卻至室溫且藉由製備型HPLC (pH = 10,乙腈/水+NH4
OH)純化,得到所需產物。C26
H32
FN4
O之LC-MS計算值(M+H)+
: m/z = 435.3;實驗值435.3。實例 19 N-(2- 氟苯基 )-3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲醯胺
向N-(氮雜環丁烷-3-基甲基)-2,2,2-三氟-N-(反-2-苯基環丙基)乙醯胺(20 mg,0.05 mmol,如實例 1 步驟 3
中所述來製備)及三乙胺(30 μL,0.2 mmol)於乙腈(1 mL)中之溶液中添加1-氟-2-異氰酸基苯(10 mg,0.1 mmol)。在室溫下將反應混合物攪拌1小時,接著添加2 N NaOH水溶液(1 mL),繼而添加MeOH (1 mL)。在30℃下將反應混合物攪拌1小時,接著冷卻至室溫,過濾且藉由製備型HPLC (pH = 10,乙腈/水+NH4
OH)純化,得到所需產物。C20
H23
FN3
O之LC-MS計算值(M+H)+
: m/z = 340.2;實驗值340.1。實例 20 N-(3- 氟苯基 )-3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲醯胺
此化合物係使用與對於實例 19
之合成所述之程序類似之程序,用1-氟-3-異氰酸基苯替代1-氟-2-異氰酸基苯來製備。C20
H23
FN3
O之LC-MS計算值(M+H)+
: m/z = 340.2;實驗值340.1。實例 21 N-(4- 氟苯基 )-3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲醯胺
此化合物係使用與對於實例 19
之合成所述之程序類似之程序,用1-氟-4-異氰酸基苯替代1-氟-2-異氰酸基苯來製備。C20
H23
FN3
O之LC-MS計算值(M+H)+
: m/z = 340.2;實驗值340.1。實例 22 N-(4- 甲氧基苯基 )-3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲醯胺
此化合物係使用與對於實例 19
之合成所述之程序類似之程序,用1-異氰酸基-4-甲氧基苯替代1-氟-2-異氰酸基苯來製備。C21
H26
N3
O2
之LC-MS計算值(M+H)+
: m/z = 352.2;實驗值352.2。實例 23 N-(3- 甲氧基苯基 )-3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲醯胺
此化合物係使用與對於實例 19
之合成所述之程序類似之程序,用1-異氰酸基-3-甲氧基苯替代1-氟-2-異氰酸基苯來製備。C21
H26
N3
O2
之LC-MS計算值(M+H)+
: m/z = 352.2;實驗值352.2。實例 24 N-(2- 甲氧基苯基 )-3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 甲醯胺
此化合物係使用與對於實例 19
之合成所述之程序類似之程序,用1-異氰酸基-2-甲氧基苯替代1-氟-2-異氰酸基苯來製備。C21
H26
N3
O2
之LC-MS計算值(M+H)+
: m/z = 352.2;實驗值352.1。實例 25 4-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 羰基 ] 苯甲腈
向N-(氮雜環丁烷-3-基甲基)-2,2,2-三氟-N-(反-2-苯基環丙基)乙醯胺(20 mg,0.05 mmol,如實例 1 步驟 3
中所述來製備)及三乙胺(30 μL,0.2 mmol)於乙腈(1 mL)中之溶液中添加4-氰基苯甲醯氯(20 mg,0.1 mmol)。在室溫下將反應混合物攪拌1小時,接著添加2 N NaOH之水溶液(1 mL),繼而添加MeOH (1 mL)。在30℃下將所得混合物攪拌1小時,接著冷卻至室溫,過濾且藉由製備型HPLC (pH = 10,乙腈/水+NH4
OH)純化,得到所需產物。C21
H22
N3
O之LC-MS計算值(M+H)+
: m/z = 332.2;實驗值332.1。實例 26 3-[(3-{[( 反 -2- 苯基環丙基 ) 胺基 ] 甲基 } 氮雜環丁烷 -1- 基 ) 羰基 ] 苯甲腈
此化合物係使用與對於實例 25
之合成所述之程序類似之程序,用3-氰基苯甲醯氯替代4-氰基苯甲醯氯來製備。C21
H22
N3
O之LC-MS計算值(M+H)+
: m/z = 332.2;實驗值332.1。實例 27 N-{[1-(3- 甲氧基苯甲醯基 ) 氮雜環丁烷 -3- 基 ] 甲基 }- 反 -2- 苯基環丙胺
此化合物係使用與對於實例 25
之合成所述之程序類似之程序,用3-甲氧基-苯甲醯氯替代4-氰基苯甲醯氯來製備。C21
H25
N2
O2
之LC-MS計算值(M+H)+
: m/z = 337.2;實驗值337.1。實例 28 N-{[1-(4- 氟苯甲醯基 ) 氮雜環丁烷 -3- 基 ] 甲基 }- 反 -2- 苯基環丙胺
此化合物係使用與對於實例 25
之合成所述之程序類似之程序,用4-氟-苯甲醯氯替代4-氰基苯甲醯氯來製備。C20
H22
FN2
O之LC-MS計算值(M+H)+
: m/z = 325.2;實驗值325.1。實例 29 N-{[1-(3- 氟苯甲醯基 ) 氮雜環丁烷 -3- 基 ] 甲基 }- 反 -2- 苯基環丙胺
此化合物係使用與對於實例 25
之合成所述之程序類似之程序,用3-氟-苯甲醯氯替代4-氰基苯甲醯氯來製備。C20
H22
FN2
O之LC-MS計算值(M+H)+
: m/z = 325.2;實驗值325.1。實例 30 反 -2- 苯基 -N-[(1-{[4-( 三氟甲氧基 ) 苯基 ] 磺醯基 } 氮雜環丁烷 -3- 基 ) 甲基 ] 環丙胺
此化合物係使用與對於實例 25
之合成所述之程序類似之程序,用4-(三氟甲氧基)苯磺醯氯替代4-氰基苯甲醯氯來製備。C20
H22
F3
N2
O3
S之LC-MS計算值(M+H)+
: m/z = 427.1;實驗值427.0。實例 31 1-{[4-(4- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-(4- 氟苯甲基 ) 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
在-78℃下向N,N-二異丙基胺(4.9 mL,35 mmol)於四氫呋喃(80 mL)中之溶液中添加正丁基鋰(2.5 M己烷溶液,14 mL,35 mmol)。使所得混合物升溫至-20℃且攪拌10分鐘,接著冷卻至-78℃且緩慢添加哌啶-1,4-二甲酸1-第三丁酯4-甲酯(AstaTech,目錄號B56857:6.08 g,25.0 mmol)於THF (10 mL)中之溶液。使反應混合物緩慢升溫至-40℃且攪拌1小時。接著將混合物冷卻至-78℃且添加α-溴-4-氟甲苯(4.9 mL,40. mmol)。在-78℃下將反應混合物攪拌1小時,接著用飽和NH4
Cl淬滅,使其升溫至室溫且用乙醚稀釋。接著用水、鹽水洗滌混合物,經Na2
SO4
乾燥,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-20%)溶離)純化殘餘物,得到所需產物(6.5 g,74%)。C15
H19
FNO4
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 296.1;實驗值296.1。步驟 2 : 4-(4- 氟苯甲基 )-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
在0℃下向4-(4-氟苯甲基)哌啶-1,4-二甲酸1-第三丁酯4-甲酯(6.5 g,18 mmol)於四氫呋喃(90 mL)中之溶液中緩慢添加LiAlH4
(1 M THF溶液,24 mL,24 mmol)。在0℃下將所得混合物攪拌30分鐘,接著添加水(0.9 mL),繼而添加NaOH (15重量%水溶液,0.9 mL)及水(0.9 mL)。將混合物攪拌20分鐘,接著過濾且用THF洗滌。濃縮濾液且殘餘物(5.8 g,97%)未經進一步純化即用於下一步中。C14
H19
FNO3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 268.1;實驗值268.1。步驟 3 : 4-(4- 氟苯甲基 )-4- 甲醯基哌啶 -1- 甲酸第三丁酯
在-78℃下經10分鐘將二甲亞碸(4.3 mL,60. mmol)於二氯甲烷(6 mL)中之溶液添加至乙二醯氯(2.6 mL,30 mmol)於二氯甲烷中之溶液中且接著經25分鐘使所得混合物升溫至-60℃。緩慢添加4-(4-氟苯甲基)-4-(羥甲基)哌啶-1-甲酸第三丁酯(5.2 g,16 mmol)於二氯甲烷(6 mL)中之溶液,且接著經30分鐘使其升溫至-45℃。接著添加N,N-二異丙基乙胺(21 mL,120 mmol)且經15分鐘使混合物升溫至0℃。將混合物傾倒於冷1 N HCl水溶液中且接著用乙醚萃取。經Na2
SO4
乾燥合併之萃取物,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-20%)溶離)純化殘餘物,得到所需產物(4.3 g,83%)。C14
H17
FNO3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 266.1;實驗值266.1。步驟 4 : 4-(4- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 甲酸第三丁酯
向4-(4-氟苯甲基)-4-甲醯基哌啶-1-甲酸第三丁酯(4.2 g,13 mmol)及(1R,2S)-2-苯基環丙胺(1.96 g,14.7 mmol)(使用如Bioorg. Med. Chem. Lett
.,2011
,21
, 4429中所述之程序來製備)於1,2-二氯乙烷(50 mL)中之溶液中添加乙酸(1.1 mL,20. mmol)。在室溫下將所得混合物攪拌2小時,接著添加三乙醯氧基硼氫化鈉(5.7 g,27 mmol)。在室溫下將反應混合物攪拌5小時,接著用二氯甲烷稀釋,用1 N NaOH水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含MeOH之DCM (0-6%)溶離)純化殘餘物,得到所需產物(5.0 g,87%)。C27
H36
FN2
O2
之LC-MS計算值(M+H)+
: m/z = 439.3;實驗值439.2。步驟 5 : 4-(4- 氟苯甲基 )-4-{[(1R,2S)-2- 苯基環丙基 -( 三氟乙醯基 ) 胺基 ]- 甲基 } 哌啶 -1- 甲酸第三丁酯
在0℃下將三氟乙酸酐(2.08 mL,14.7 mmol)添加至4-(4-氟苯甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-甲酸第三丁酯(4.3 g,9.8 mmol)及N,N-二異丙基乙胺(4.3 mL,24 mmol)於二氯甲烷(40 mL)中之溶液中。在0℃下將所得混合物攪拌1小時,接著用乙醚稀釋,且用1 N HCl、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-30%)溶離)純化殘餘物,得到所需產物(4.6 g,88%)。C25
H27
F4
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 479.2;實驗值479.2。步驟 6 : 2,2,2- 三氟 -N-{[4-(4- 氟苯甲基 ) 哌啶 -4- 基 ] 甲基 }-N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
將氯化氫(4 M之1,4-二噁烷溶液,20 mL,80 mmol)添加至4-(4-氟苯甲基)-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}-哌啶-1-甲酸第三丁酯(4.6 g,8.6 mmol)於二氯甲烷(6 mL)中之溶液中。在室溫下將所得混合物攪拌30分鐘,接著濃縮。殘餘物未經進一步純化即用於下一步中。C24
H27
F4
N2
O之LC-MS計算值(M+H)+
: m/z = 435.2;實驗值435.2。步驟 7 : 1-( 羥甲基 ) 環丙烷甲酸甲酯
在0℃下將氯甲酸異丁酯(0.61 mL,4.7 mmol)添加至1-(甲氧羰基)環丙烷甲酸(Alfa Aesar,目錄號H25828:0.57 g,3.9 mmol)及三乙胺(1.1 mL,7.8 mmol)於四氫呋喃(10 mL)中之溶液中。在0℃下將所得混合物攪拌30分鐘,接著過濾且用THF (2 mL)洗滌。將濾液冷卻至0℃,且接著添加四氫硼酸鈉(0.30 g,7.9 mmol)於水(2 mL)中之溶液。將反應混合物攪拌30分鐘,接著用乙酸乙酯稀釋,用飽和NaHCO3
水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。殘餘物(0.46 g)未經進一步純化即用於下一步中。步驟 8 : 1- 甲醯基環丙烷甲酸甲酯
在-78℃下經10分鐘將於二氯甲烷(0.8 mL)中之二甲亞碸(0.57 mL,8.0 mmol)添加至乙二醯氯(0.34 mL,4.0 mmol)於二氯甲烷(5 mL)中之溶液中。經25分鐘使所得混合物升溫至-60℃,接著緩慢添加1-(羥甲基)環丙烷甲酸甲酯(0.40 g,3.1 mmol)於二氯甲烷(5 mL)中之溶液。經30分鐘使混合物升溫至-45℃,接著添加N,N-二異丙基乙胺(2.8 mL,16 mmol)且經15分鐘使混合物升溫至0℃。將反應混合物傾倒於冷1 N HCl水溶液中且用乙醚萃取。經Na2
SO4
乾燥合併之萃取物,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-20%)溶離)純化殘餘物,得到所需產物(0.30 g,76%)。步驟 9 : 1-[(4-(4- 氟苯甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ]- 甲基 } 哌啶 -1- 基 ) 甲基 ] 環丙烷甲酸甲酯
將N,N-二異丙基乙胺(0.19 mL,1.1 mmol)添加至2,2,2-三氟-N-{[4-(4-氟苯甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(步驟 6
:400.0 mg,0.92 mmol)於二氯甲烷(4 mL)中之混合物中。將所得混合物攪拌5分鐘,且接著添加1-甲醯基環丙烷甲酸甲酯(153 mg,1.20 mmol)。在室溫下將反應混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(0.58 g,2.8 mmol)。在室溫下將混合物攪拌4小時,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含甲醇之DCM (0-6%)溶離)純化殘餘物,得到所需產物(0.45 g,89%)。C30
H35
F4
N2
O3
之LC-MS計算值(M+H)+
: m/z = 547.3;實驗值547.3。步驟 10 : 1-{[4-(4- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
將來自步驟 9
之產物溶解於MeOH/THF (1.0/0.6 mL)中,且接著添加NaOH (15重量%水溶液,3.0 mL)。在40℃下將反應混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C27
H34
FN2
O2
之LC-MS計算值(M+H)+
: m/z = 437.3;實驗值437.2。1
H NMR (500 MHz, DMSO) δ 7.35 - 7.28 (m, 2H), 7.26 - 7.20 (m, 3H), 7.20 - 7.10 (m, 4H), 3.41 - 3.29 (m, 4H), 3.28 - 3.09 (m, 4H), 2.94 (br, 1H), 2.84 (s, 2H), 2.60 - 2.51 (m, 1H), 1.84 - 1.67 (m, 4H), 1.63 - 1.52 (m, 1H), 1.37 - 1.26 (m, 3H), 1.17 - 1.09 (m, 2H)。實例 32 1-{[4-(4- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸 步驟 1 : 1- 甲醯基環丁烷甲酸甲酯
在-78℃下向環丁烷-1,1-二甲酸二甲酯(Alfa Aesar,目錄號L12250:1.0 g,6.0 mmol)於二氯甲烷(15 mL)中之溶液中添加1.0 M氫化二異丁基鋁之甲苯溶液(12.0 mL,12.0 mmol)。在-78℃下將反應混合物攪拌45分鐘,且藉由緩慢添加1 M HCl淬滅。使所得混合物升溫至室溫且再攪拌30分鐘。分離有機層,用鹽水洗滌,經Na2
SO4
乾燥且濃縮。經由管柱層析(含0%至20% EtOAc之己烷)純化粗物質,得到呈無色油狀之產物(330 mg,39%)。1
H NMR (400 MHz, CDCl3
) δ 9.78 (s, 1H), 3.79 (s, 3H), 2.48 (t,J
= 8.0 Hz, 4H), 2.13 - 1.87 (m, 2H)。步驟 2 : 1-{[4-(4- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
在室溫下將1-甲醯基環丁烷甲酸甲酯(20. mg,0.14 mmol)、乙酸(6 μL,0.10 mmol)及2,2,2-三氟-N-{[4-(4-氟苯甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 31 步驟 6
:40.0 mg,0.0921 mmol)於二氯甲烷(2 mL)中之混合物攪拌2小時且接著添加三乙醯氧基硼氫化鈉(64 mg,0.30 mmol)。在室溫下將反應混合物攪拌隔夜,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。將殘餘物溶解於MeOH/THF (0.5/0.5 mL)中且接著添加6 N NaOH (1.0 mL)。在40℃下將所得混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C28
H36
FN2
O2
之LC-MS計算值(M+H)+
: m/z = 451.3;實驗值451.3。實例 33 反 -4-{[4-(4- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 環己胺
將三乙胺(23 μL,0.16 mmol)添加至反-4-[(第三丁氧羰基)胺基]環己烷甲酸(TCI America,目錄號B3250:10.0 mg,0.0411 mmol)、2,2,2-三氟-N-{[4-(4-氟苯甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 31 步驟 6
:14 mg,0.033 mmol)及六氟磷酸苯并三唑-1-基氧基叁(二甲胺基)鏻(27 mg,0.062 mmol)於N,N-二甲基甲醯胺(0.6 mL)中之溶液中。在室溫下將所得混合物攪拌1小時,接著用乙酸乙酯稀釋,用飽和NaHCO3
水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。將殘餘物溶解於DCM (0.3 mL)中,且接著添加TFA (0.3 mL)。在室溫下將混合物攪拌1小時,接著濃縮。將殘餘物溶解於THF/MeOH (0.2 mL/0.2 mL)中,且接著添加NaOH (15重量%水溶液,0.5 mL),且在35℃下將混合物攪拌隔夜。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C29
H39
FN3
O之LC-MS計算值(M+H)+
: m/z = 464.3;實驗值464.3。實例 34 1-{[4-(4- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 環丁胺
此化合物係使用與對於實例 33
所述之程序類似之程序,用1-[(第三丁氧羰基)胺基]環丁烷甲酸(Aldrich,目錄號630802)替代反-4-[(第三丁氧羰基)胺基]環己烷甲酸來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C27
H35
FN3
O之LC-MS計算值(M+H)+
: m/z = 436.3;實驗值436.3。實例 35 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-( 甲氧基甲基 ) 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
在-40℃下向哌啶-1,4-二甲酸1-第三丁酯4-甲酯(AstaTech,目錄號B56857:2.43 g,10.0 mmol)於四氫呋喃(30 mL)中之溶液中添加二異丙胺鋰(2 M THF溶液,5.8 mL,12 mmol)。在-40℃下將所得混合物攪拌30分鐘,接著添加氯甲基甲醚(1.2 mL,16 mmol)。在-40℃下將反應混合物攪拌1小時,接著用飽和NH4
Cl水溶液淬滅,且使其升溫至室溫。用乙酸乙酯稀釋混合物,用飽和NaHCO3
水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(含0%至20% EtOAc之己烷)純化粗物質,得到所需產物(2.6 g,90%)。C9
H18
NO3
之LC-MS計算值(M-Boc+2H)+
: m/z = 188.1;實驗值188.1。 步驟 2 : 4-( 羥甲基 )-4-( 甲氧基甲基 ) 哌啶 -1- 甲酸第三丁酯
在0℃下向4-(甲氧基甲基)哌啶-1,4-二甲酸1-第三丁酯4-甲酯(2.3 g,8.0 mmol)於四氫呋喃(40 mL)中之溶液中緩慢添加LiAlH4
(1 M THF溶液,10. mL,10. mmol)。在0℃下將所得混合物攪拌30分鐘,接著藉由添加水(0.1 mL)、NaOH (15重量%水溶液,0.1 mL)及水(0.1 mL)淬滅。將混合物攪拌10分鐘,接著過濾且用THF洗滌。濃縮濾液且殘餘物未經進一步純化即用於下一步中。C9
H18
NO4
之LC-MS計算值(M-tBu+2H)+
: m/z = 204.1;實驗值204.1。步驟 3 : 4- 甲醯基 -4-( 甲氧基甲基 ) 哌啶 -1- 甲酸第三丁酯
在-78℃下經10分鐘將於二氯甲烷(2 mL)中之二甲亞碸(1.7 mL,24 mmol)添加至乙二醯氯(1.0 mL,12 mmol)於二氯甲烷(3 mL)中之溶液中。經25分鐘使所得混合物升溫至-60℃,接著緩慢添加4-(羥甲基)-4-(甲氧基甲基)哌啶-1-甲酸第三丁酯(1.6 g,6.0 mmol)於二氯甲烷(5 mL)中之溶液。經30分鐘使混合物升溫至-45℃,接著添加三乙胺(6.7 mL,48 mmol)。經15分鐘使混合物升溫至0℃。接著將反應混合物傾倒於冷1 N HCl水溶液中且用乙醚萃取。經Na2
SO4
乾燥合併之萃取物,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至20% EtOAc之己烷溶離)純化殘餘物,得到所需產物(1.3 g,84%)。C8
H16
NO2
之LC-MS計算值(M-Boc+2H)+
: m/z = 158.1;實驗值158.1。步驟 4 : 4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 )- 哌啶 -1- 甲酸第三丁酯
在室溫下將4-甲醯基-4-(甲氧基甲基)哌啶-1-甲酸第三丁酯(1.3 g,5.0 mmol)、乙酸(0.43 mL,7.5 mmol)及(1R,2S)-2-苯基環丙胺(使用如Bioorg. Med. Chem. Lett
.,2011
,21
, 4429中所述之程序來製備:699 mg,5.25 mmol)於1,2-二氯乙烷(20 mL)中之混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(2.1 g,10. mmol)。在室溫下將所得混合物攪拌2小時,接著用二氯甲烷稀釋,用飽和NaHCO3
水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至8%甲醇之DCM溶離)純化殘餘物,得到所需產物(1.7 g,91%)。C22
H35
N2
O3
之LC-MS計算值(M+H)+
: m/z = 375.3;實驗值375.2。步驟 5 : 4-( 甲氧基甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]-( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
在0℃下將三氟乙酸酐(0.96 mL,6.8 mmol)添加至4-(甲氧基甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-甲酸第三丁酯(1.7 g,4.5 mmol)及N,N-二異丙基乙胺(1.6 mL,9.1 mmol)於二氯甲烷(25 mL)中之溶液中。在室溫下將所得混合物攪拌1小時,接著用二氯甲烷稀釋,用飽和NaHCO3
水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至20% EtOAc之己烷溶離)純化殘餘物,得到所需產物(1.8 g,84%)。C19
H26
F3
N2
O2
之LC-MS計算值(M-Boc+2H)+
: m/z = 371.2;實驗值371.1。步驟 6 : 2,2,2- 三氟 -N-{[4-( 甲氧基甲基 ) 哌啶 -4- 基 ] 甲基 }-N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
將4.0 M氯化氫之二噁烷溶液(7 mL,28 mmol)添加至4-(甲氧基甲基)-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}-哌啶-1-甲酸第三丁酯(1.8 g,3.8 mmol)於二氯甲烷(4 mL)中之溶液中。在室溫下將所得混合物攪拌30分鐘,接著濃縮。殘餘物未經進一步純化即用於下一步中。C19
H26
F3
N2
O2
之LC-MS計算值(M+H)+
: m/z = 371.2;實驗值371.2。將粗產物中和,得到產物之游離鹼形式,將其用於獲得NMR數據。1
H NMR (500 MHz, CD3
OD) δ 7.31 - 7.26 (m, 2H), 7.22 - 7.17 (m, 1H), 7.12 - 7.07 (m, 2H), 3.79 - 3.58 (m, 2H), 3.35 - 3.32 (m, 2H), 3.28 - 3.22 (m, 1H), 3.19 - 2.98 (m, 7H), 2.44 - 2.34 (m, 1H), 1.84 - 1.54 (m, 5H), 1.48 - 1.37 (m, 1H);13
C NMR (126 MHz, CD3
OD) δ 161.74, 141.21, 129.63, 127.51, 126.73, 119.39, 76.75, 59.28, 53.29, 42.71, 41.54, 39.22, 30.06, 27.95, 20.10。步驟 7 : 1-[(4-( 甲氧基甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ]- 甲基 } 哌啶 -1- 基 ) 甲基 ] 環丙烷甲酸甲酯
在室溫下將1-甲醯基環丙烷甲酸甲酯(實例 31 步驟 8
:53 mg,0.41 mmol)、乙酸(17 μL,0.29 mmol)及2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(100.0 mg,0.2700 mmol)於二氯甲烷(2 mL)中之混合物攪拌2小時,接著添加三乙醯氧基硼氫化鈉(190 mg,0.88 mmol)。在室溫下將混合物攪拌2小時,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至6% MeOH之DCM溶離)純化殘餘物,得到所需產物。C25
H34
F3
N2
O4
之LC-MS計算值(M+H)+
: m/z = 483.2;實驗值483.3。步驟 8 : 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
將來自步驟 7
之產物溶解於MeOH/THF (0.5/0.5 mL)中,接著添加NaOH (15重量%水溶液,1.0 mL)。在40℃下將所得混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C22
H33
N2
O3
之LC-MS計算值(M+H)+
: m/z = 373.2;實驗值373.3。1
H NMR (500 MHz, DMSO) δ 7.33 - 7.28 (m, 2H), 7.24 - 7.19 (m, 1H), 7.19 - 7.15 (m, 2H), 3.40 (s, 2H), 3.36 - 3.31 (m, 5H), 3.30 - 3.19 (m, 4H), 3.14 (s, 2H), 2.92 - 2.83 (m, 1H), 2.47 - 2.41 (m, 1H), 1.92 - 1.71 (m, 4H), 1.54 - 1.41 (m, 1H), 1.37 - 1.30 (m, 2H), 1.29 - 1.20 (m, 1H), 1.16 - 1.09 (m, 2H)。 實例 36 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸 步驟 1 : 1-[(4-( 甲氧基甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ]- 甲基 } 哌啶 -1- 基 ) 甲基 ] 環丁烷甲酸甲酯
在室溫下將1-甲醯基環丁烷甲酸甲酯(實例 32 步驟 1
:200 mg,1.4 mmol)、乙酸(60 μL,1.1 mmol)及2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:350 mg,0.95 mmol)於二氯甲烷(7 mL)中之混合物攪拌2小時,且接著添加三乙醯氧基硼氫化鈉(650 mg,3.1 mmol)。在室溫下將所得混合物攪拌隔夜,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至6% MeOH之DCM溶離)純化殘餘物,得到所需產物。C26
H36
F3
N2
O4
之LC-MS計算值(M+H)+
: m/z = 497.3;實驗值497.3。步驟 2 : 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
將來自步驟 1
之產物溶解於MeOH/THF (2.0/2.0 mL)中,接著添加6 N NaOH (1.0 mL)。在40℃下將所得混合物攪拌36小時,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C23
H35
N2
O3
之LC-MS計算值(M+H)+
: m/z = 387.3;實驗值387.2。1
H NMR (500 MHz, CD3
CN) δ 7.35 - 7.29 (m, 2H), 7.27 - 7.21 (m, 1H), 7.19 - 7.13 (m, 2H), 3.46 (s, 2H), 3.43 (s, 2H), 3.36 (s, 3H), 3.34 - 3.12 (m, 6H), 2.94 - 2.84 (m, 1H), 2.70 - 2.60 (m, 1H), 2.56 - 2.43 (m, 2H), 2.22 - 1.96 (m, 4H), 1.93 - 1.76 (m, 4H), 1.71 - 1.59 (m, 1H), 1.33 - 1.22 (m, 1H)。 實例 37 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環戊烷甲酸 步驟 1 :環戊烷 -1,1- 二甲酸 1- 第三丁酯 1- 甲酯
將1,4-二溴丁烷(2.4 mL,20. mmol)添加至丙二酸第三丁酯甲酯(1.74 g,10.0 mmol)、碳酸銫(9.8 g,30. mmol)及四氟硼酸1-丁基-3-甲基-1H-咪唑-3-鎓(0.4 g,2 mmol)於乙腈(20 mL)中之混合物中。在室溫下將所得混合物攪拌隔夜,接著用乙醚稀釋且過濾。濃縮濾液且將殘餘物溶解於乙醚中,接著用水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至10% EtOAc之己烷溶離)純化殘餘物,得到所需產物(1.7 g,75%)。C8
H13
O4
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 173.1;實驗值173.1。步驟 2 : 1-( 第三丁氧羰基 ) 環戊烷甲酸
向環戊烷-1,1-二甲酸1-第三丁酯1-甲酯(1.7 g,7.4 mmol)於四氫呋喃(10 mL)/甲醇(5 mL)/水(5 mL)中之溶液中添加單水合氫氧化鋰(0.62 g,15 mmol)。在室溫下將所得混合物攪拌5小時,接著濃縮以移除大部分溶劑。將殘餘物溶解於水中且用乙醚洗滌。使用冷1 N HCl溶液酸化水層,接著用DCM萃取。經Na2
SO4
乾燥合併之DCM萃取物,過濾且在減壓下濃縮,得到所需化合物,其未經進一步純化即用於下一步中。C7
H11
O4
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 159.1;實驗值159.1。步驟 3 : 1-( 羥甲基 ) 環戊烷甲酸第三丁酯
在-20℃下將氯甲酸異丁酯(1.1 mL,8.2 mmol)添加至1-(第三丁氧羰基)環戊烷甲酸(1.60 g,7.47 mmol)及4-甲基嗎啉(0.9 mL,8.2 mmol)於四氫呋喃(20 mL)中之溶液中。將所得混合物攪拌30分鐘,接著過濾且用THF (4 mL)洗滌。將濾液冷卻至-20℃且接著添加於水(4 mL)中之四氫硼酸鈉(0.56 g,15 mmol)。將反應混合物攪拌30分鐘,接著用乙酸乙酯稀釋,用飽和NaHCO3
水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。殘餘物未經進一步純化即用於下一步中。C7
H13
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 145.1;實驗值145.1。步驟 4 : 1- 甲醯基環戊烷甲酸第三丁酯
在-78℃下經10分鐘將於二氯甲烷(3 mL)中之二甲亞碸(1.9 mL,26 mmol)添加至乙二醯氯(1.1 mL,13 mmol)於二氯甲烷(5 mL)中之溶液中。經25分鐘使所得混合物升溫至-60℃,接著緩慢添加1-(羥甲基)環戊烷甲酸第三丁酯(1.4 g,7.0 mmol)於二氯甲烷(5 mL)中之溶液。經30分鐘使混合物升溫至-45℃,接著添加N,N-二異丙基乙胺(9.1 mL,52 mmol)。經15分鐘使混合物升溫至0℃,接著傾倒於冷1 N HCl水溶液中且用乙醚萃取。經Na2
SO4
乾燥合併之萃取物,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至20% EtOAc之己烷溶離)純化殘餘物,得到所需產物(1.0 g,72%)。C7
H11
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 143.1;實驗值143.1。步驟 5 : 1-[(4-( 甲氧基甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 )- 胺基 ] 甲基 } 哌啶 -1- 基 ) 甲基 ] 環戊烷甲酸第三丁酯
向2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:400 mg,1.00 mmol)及N,N-二異丙基乙胺(0.28 mL,1.6 mmol)於二氯甲烷(8 mL)中之溶液中添加1-甲醯基環戊烷甲酸第三丁酯(280 mg,1.4 mmol)。在室溫下將所得混合物攪拌2小時,接著添加三乙醯氧基硼氫化鈉(690 mg,3.2 mmol)。在室溫下將反應混合物攪拌隔夜,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至6% MeOH之DCM溶離)純化殘餘物,得到所需產物(0.45 g,75%)。C30
H44
F3
N2
O4
之LC-MS計算值(M+H)+
: m/z = 553.3;實驗值553.3。步驟 6 : 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環戊烷甲酸
向1-[(4-(甲氧基甲基)-4-{[[(1R,2S)-2-苯基環丙基]-(三氟乙醯基)胺基]甲基}哌啶-1-基)甲基]環戊烷甲酸第三丁酯(450 mg,0.81 mmol)於二氯甲烷(2 mL)中之溶液中添加三氟乙酸(2.0 mL,26 mmol)。在室溫下將所得混合物攪拌4小時,接著濃縮。將殘餘物溶解於THF/甲醇(2 mL/2 mL)中,且接著添加6 N NaOH (3.0 mL)。在室溫下將所得混合物攪拌隔夜,接著藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C24
H37
N2
O3
之LC-MS計算值(M+H)+
: m/z = 401.3;實驗值401.2。實例 38 (1R,2S)-N-[(4-( 甲氧基甲基 )-1-{[(2S)-1- 甲基吡咯啶 -2- 基 ] 羰基 } 哌啶 -4- 基 ) 甲基 ]-2- 苯基環丙胺
向(2S)-1-甲基吡咯啶-2-甲酸(Chem-Impex,目錄號06356:11 mg,0.088 mmol)、2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:16 mg,0.044 mmol)及六氟磷酸(苯并三唑-1-基氧基)三吡咯啶基鏻(46 mg,0.088 mmol)於N,N-二甲基甲醯胺(1 mL)中之溶液中添加三乙胺(31 μL,0.22 mmol)。在室溫下將所得混合物攪拌4小時,接著添加NaOH (15重量%,0.5 mL)。在40℃下將混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C23
H36
N3
O2
之LC-MS計算值(M+H)+
: m/z = 386.3;實驗值386.2。實例 39 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(1- 甲基 -1H- 咪唑 -4- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
此化合物係使用與對於實例 38
所述類似之程序,用1-甲基-1H-咪唑-4-甲酸(Combi-Blocks,目錄號HI-1090)替代(2S)-1-甲基吡咯啶-2-甲酸來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C22
H31
N4
O2
之LC-MS計算值(M+H)+
: m/z = 383.2;實驗值383.2。實例 40 6-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 嗒嗪 -3- 胺
此化合物係使用與對於實例 38
所述類似之程序,用6-胺基嗒嗪-3-甲酸(Chem-Impex,目錄號19168)替代(2S)-1-甲基吡咯啶-2-甲酸來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C22
H30
N5
O2
之LC-MS計算值(M+H)+
: m/z = 396.2;實驗值396.2。1
H NMR (500 MHz, CD3
CN) δ 7.75 (d,J
= 9.5 Hz, 1H), 7.40 (d,J
= 9.5 Hz, 1H), 7.35 - 7.28 (m, 2H), 7.27 - 7.20 (m, 1H), 7.19 - 7.13 (m, 2H), 3.80 - 3.47 (m, 6H), 3.37 (s, 3H), 3.36 - 3.23 (m, 2H), 2.98 - 2.82 (m, 1H), 2.73 - 2.60 (m, 1H), 1.72 - 1.54 (m, 5H), 1.35 - 1.20 (m, 1H)。實例 41 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(1- 甲基哌啶 -4- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
此化合物係使用與對於實例 38
所述類似之程序,用1-甲基哌啶-4-甲酸(AstaTech,目錄號64217)替代(2S)-1-甲基吡咯啶-2-甲酸來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C24
H38
N3
O2
之LC-MS計算值(M+H)+
: m/z = 400.3;實驗值400.3。實例 42 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(1- 甲基 -1H- 吡唑 -3- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
在0℃下將1-甲基-1H-吡唑-3-羰基氯(Maybridge,目錄號CC48302:12 mg,0.081 mmol)添加至2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:15.0 mg,0.040 mmol)及三乙胺(22 μL,0.16 mmol)於二氯甲烷(0.5 mL)中之溶液中。在室溫下將所得混合物攪拌3小時,接著用乙酸乙酯稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。將殘餘物溶解於甲醇/THF (1/1 mL)中,且接著添加NaOH (15重量%水溶液,1.5 mL)。在40℃下將混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C22
H31
N4
O2
之LC-MS計算值(M+H)+
: m/z = 383.2;實驗值383.2。實例 43 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(4- 甲基哌 嗪 -1- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
在室溫下將4-甲基哌嗪-1-羰基氯(Aldrich,目錄號563250:99 μL,0.73 mmol)添加至2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:90.0 mg,0.243 mmol)及N,N-二異丙基乙胺(0.13 mL,0.73 mmol)於N,N-二甲基甲醯胺(0.8 mL)中之溶液中。在90℃下將所得混合物攪拌隔夜,接著冷卻至室溫且濃縮。經由矽膠管柱急驟層析(用含0%至6% MeOH之DCM溶離)純化殘餘物,得到所需中間物。向該中間物於MeOH/THF (0.5 mL/0.5 mL)中之溶液中添加NaOH (15重量%水溶液,1 mL)。在40℃下將混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C23
H37
N4
O2
之LC-MS計算值(M+H)+
: m/z = 401.3;實驗值401.3。實例 44 1-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 甲酸第三丁酯
在室溫下將4-甲醯基-4-甲基哌啶-1-甲酸第三丁酯(Synnovator,目錄號PBN2011767:2.50 g,11.0 mmol)、乙酸(0.94 mL,16 mmol)及(1R,2S)-2-苯基環丙胺(1.54 g,11.5 mmol)於1,2-二氯乙烷(40 mL)中之混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(4.7 g,22 mmol)。在室溫下將混合物攪拌2小時,接著用二氯甲烷稀釋,用飽和NaHCO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至8% MeOH之DCM溶離)純化殘餘物,得到所需產物(3.4 g,90%)。C21
H33
N2
O2
之LC-MS計算值(M+H)+
: m/z = 345.3;實驗值345.2。步驟 2 : 4- 甲基 -4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ] 甲基 }- 哌啶 -1- 甲酸第三丁酯
在0℃下將三氟乙酸酐(0.96 mL,6.8 mmol)添加至4-甲基-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-甲酸第三丁酯(1.6 g,4.5 mmol)及N,N-二異丙基乙胺(1.6 mL,9.1 mmol)於二氯甲烷(25 mL)中之溶液中。在室溫下將所得混合物攪拌1小時,接著用二氯甲烷稀釋,用飽和NaHCO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。經由矽膠管柱急驟層析(用含0%至20% EtOAc之己烷溶離)純化殘餘物,得到所需產物(1.8 g,90%)。C19
H24
F3
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 385.2;實驗值385.2。步驟 3 : 2,2,2- 三氟 -N-[(4- 甲基哌啶 -4- 基 ) 甲基 ]-N-[(1R,2S)-2- 苯基環丙基 ]- 乙醯胺
向4-甲基-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)-胺基]甲基}哌啶-1-甲酸第三丁酯(1.5 g,3.4 mmol)於二氯甲烷(3 mL)中之溶液中添加氯化氫(4 M 1,4-二噁烷溶液,6 mL,24 mmol)。在室溫下將所得混合物攪拌1小時,接著濃縮。殘餘物未經進一步純化即用於下一步中。C18
H24
F3
N2
O之LC-MS計算值(M+H)+
: m/z = 341.2;實驗值341.2。步驟 4 : 1-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
在室溫下將1-甲醯基環丙烷甲酸甲酯(實例 31 步驟 8
:10. mg,0.08 mmol)、乙酸(3.3 μL,0.059 mmol)及2,2,2-三氟-N-[(4-甲基哌啶-4-基)甲基]-N-[(1R,2S)-2-苯基環丙基]乙醯胺(20.0 mg,0.0588 mmol)於二氯甲烷(0.4 mL)中之混合物攪拌2小時,接著添加三乙醯氧基硼氫化鈉(37 mg,0.18 mmol)。在室溫下將所得混合物攪拌2小時,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。將殘餘物溶解於MeOH/THF (0.5/0.5 mL)中,且接著添加NaOH (15重量%水溶液,1.0 mL)。在40℃下將反應混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C21
H31
N2
O2
之LC-MS計算值(M+H)+
: m/z = 343.2;實驗值343.2。實例 45 1-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
在室溫下將1-甲醯基環丁烷甲酸乙酯(實例 32 步驟 1
:27.5 mg,0.176 mmol)、乙酸(15 μL,0.26 mmol)及2,2,2-三氟-N-[(4-甲基哌啶-4-基)甲基]-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 44 步驟 3
:90.0 mg,0.264 mmol)於二氯甲烷(2 mL)中之混合物攪拌2小時,接著添加三乙醯氧基硼氫化鈉(110 mg,0.53 mmol)。在室溫下將所得混合物攪拌2小時,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。將殘餘物溶解於MeOH/THF (0.5/0.5 mL)中,接著添加NaOH (15重量%水溶液,1.0 mL)。在40℃下將反應混合物攪拌2天,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C22
H33
N2
O2
之LC-MS計算值(M+H)+
: m/z = 357.3;實驗值357.2。1
H NMR (500 MHz, DMSO) δ 7.34 - 7.28 (m, 2H), 7.25 - 7.20 (m, 1H), 7.20 - 7.16 (m, 2H), 3.49 (s, 2H), 3.30 - 3.04 (m, 6H), 3.02 - 2.92 (m, 1H), 2.59 - 2.51 (m, 1H), 2.47 - 2.34 (m, 2H), 2.19 - 2.07 (m, 2H), 2.07 - 1.91 (m, 2H), 1.89 - 1.73 (m, 2H), 1.74 - 1.61 (m, 2H), 1.63 - 1.46 (m, 1H), 1.35 - 1.23 (m, 1H), 1.12 (s, 3H)。實例 46 (1R,2S)-N-({4- 甲基 -1-[(1- 甲基 -1H- 吡唑 -3- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
在0℃下將1-甲基-1H-吡唑-3-羰基氯(51 mg,0.35 mmol)添加至2,2,2-三氟-N-[(4-甲基哌啶-4-基)甲基]-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 44 步驟 3
:60.0 mg,0.176 mmol)及三乙胺(98 μL,0.70 mmol)於二氯甲烷(2 mL)中之溶液中。將所得混合物攪拌30分鐘,接著濃縮。將殘餘物溶解於甲醇/THF (0.5 mL/0.5 mL)中,接著添加1 N NaOH (1.0 mL)。在40℃下將混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C21
H29
N4
O之LC-MS計算值(M+H)+
: m/z = 353.2;實驗值353.3。1
H NMR (500 MHz, DMSO) δ 8.76 (br, 2H), 7.73 (d,J
= 2.2 Hz, 1H), 7.35 - 7.26 (m, 2H), 7.25 - 7.12 (m, 3H), 6.49 (d,J
= 2.2 Hz, 1H), 4.26 - 4.10 (m, 1H), 4.03 - 3.88 (m, 1H), 3.86 (s, 3H), 3.67 - 3.51 (m, 1H), 3.38 - 3.21 (m, 1H), 3.15 - 3.06 (m, 2H), 3.04 - 2.94 (m, 1H), 2.56 - 2.50 (m, 1H), 1.59 - 1.48 (m, 3H), 1.46 - 1.34 (m, 2H), 1.32 - 1.24 (m, 1H), 1.11 (s, 3H)。實例 47 (1R,2S)-N-({4- 甲基 -1-[(1- 甲基 -1H- 咪唑 -4- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
將三乙胺(31 μL,0.22 mmol)添加至1-甲基-1H-咪唑-4-甲酸(Combi-Blocks,目錄號HI-1090:11 mg,0.088 mmol)、2,2,2-三氟-N-[(4-甲基哌啶-4-基)甲基]-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 44 步驟 3
:15 mg,0.044 mmol)及六氟磷酸(苯并三唑-1-基氧基)三吡咯啶基鏻(46 mg,0.088 mmol)於N,N-二甲基甲醯胺(0.8 mL)中之溶液中。在室溫下將所得混合物攪拌4小時,接著添加NaOH (15重量%水溶液,0.5 mL)。在40℃下將反應混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C21
H29
N4
O之LC-MS計算值(M+H)+
: m/z = 353.2;實驗值353.2。實例 48 5-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 嘧啶 -2- 胺
此化合物係使用與對於實例 47
所述之程序類似之程序,用2-胺基嘧啶-5-甲酸(Ark Pharm,目錄號AK-17303)替代1-甲基-1H-咪唑-4-甲酸來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C21
H28
N5
O之LC-MS計算值(M+H)+
: m/z = 366.2;實驗值366.2。實例 49 6-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 嗒嗪 -3- 胺
此化合物係使用與對於實例 47
所述之程序類似之程序,用6-胺基嗒嗪-3-甲酸(Chem-Impex,目錄號19168)替代1-甲基-1H-咪唑-4-甲酸來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C21
H28
N5
O之LC-MS計算值(M+H)+
: m/z = 366.2;實驗值366.3。實例 50 4-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 }-1H- 吡唑 -3- 胺
此化合物係使用與對於實例 47
所述之程序類似之程序,用3-胺基-1H-吡唑-4-甲酸(Aldrich,目錄號A77407)替代1-甲基-1H-咪唑-4-甲酸來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C20
H28
N5
O之LC-MS計算值(M+H)+
: m/z = 354.2;實驗值354.2。實例 51 1-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 環戊胺
將三乙胺(120 μL,0.88 mmol)添加至1-[(第三丁氧羰基)胺基]環戊烷甲酸(Fluka,目錄號03583:50. mg,0.22 mmol)、2,2,2-三氟-N-[(4-甲基哌啶-4-基)甲基]-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 44 步驟 3
:60. mg,0.17 mmol)及六氟磷酸(苯并三唑-1-基氧基)三吡咯啶基鏻(140 mg,0.26 mmol)於N,N-二甲基甲醯胺(2 mL)中之溶液中。在室溫下將所得混合物攪拌1小時,接著用乙酸乙酯稀釋,用飽和NaHCO3
、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。將殘餘物溶解於CH2
Cl2
(0.3 mL)中且接著添加TFA (0.3 mL)。在室溫下將混合物攪拌1小時,接著濃縮且將殘餘物溶解於THF/MeOH (0.2 mL/0.2 mL)中且接著添加NaOH (15重量%水溶液,0.5 mL)。在35℃下將混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C22
H34
N3
O之LC-MS計算值(M+H)+
: m/z = 356.3;實驗值356.3。1
H NMR (500 MHz, DMSO) δ 8.83 (br, 2H), 8.09 (br, 3H), 7.34 - 7.27 (m, 2H), 7.26 - 7.19 (m, 1H), 7.19 - 7.14 (m, 2H), 3.82 - 3.45 (m, 2H), 3.38 - 3.23 (m, 2H), 3.17 - 3.05 (m, 2H), 3.04 - 2.93 (m, 1H), 2.57 - 2.50 (m, 1H), 2.20 - 2.03 (m, 2H), 2.01 - 1.80 (m, 6H), 1.62 - 1.46 (m, 3H), 1.45 - 1.35 (m, 2H), 1.34 - 1.25 (m, 1H), 1.10 (s, 3H)。實例 52 5-{[4- 甲基 -4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 嘧啶 -2- 胺
在室溫下將2,2,2-三氟-N-[(4-甲基哌啶-4-基)甲基]-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 44 步驟 3
:15.0 mg,0.0441 mmol)及2-胺基嘧啶-5-甲醛(Matrix Scientific,目錄號008626:11 mg,0.092 mmol)於二氯甲烷(0.5 mL)中之混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(28 mg,0.13 mmol)。在室溫下將所得混合物攪拌4小時,接著濃縮。將殘餘物溶解於甲醇/THF (0.4/0.4 mL)中,接著添加NaOH (15重量%水溶液,1.5 mL)。在40℃下將混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C21
H30
N5
之LC-MS計算值(M+H)+
: m/z = 352.2;實驗值352.3。實例 53 1-{[4-[4-( 氰甲基 ) 苯甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-[4-( 氰甲基 ) 苯甲基 ] 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
在-78℃下向N,N-二異丙基胺(1.59 mL,11.3 mmol)於四氫呋喃(55 mL)中之溶液中添加2.5 M正丁基鋰之己烷溶液(4.35 mL,10.9 mmol)。使此溶液升溫且在0℃下攪拌30分鐘,接著冷卻至-78℃,且添加哌啶-1,4-二甲酸1-第三丁酯4-甲酯(2.75 g,11.3 mmol)於四氫呋喃(5.0 mL)中之另一溶液。在-45℃下將所得溶液攪拌1小時,且冷卻回至-78℃,之後添加[4-(氯甲基)苯基]乙腈(Enamine LTD,目錄號EN300-134377:1.50 g,9.06 mmol)於四氫呋喃(5.0 mL)中之另一溶液。在-78℃下將反應混合物攪拌1.5小時,用飽和NaHCO3
溶液淬滅且用EtOAc稀釋。分離有機層,用鹽水洗滌,經Na2
SO4
乾燥且濃縮。經由管柱層析(含25%至75% EtOAc之己烷)純化粗物質,得到呈無色油狀之產物(1.31 g,39%)。C17
H21
N2
O4
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 317.1;實驗值317.2。步驟 2 : 4-[4-( 氰甲基 ) 苯甲基 ]-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
在室溫下向4-[4-(氰甲基)苯甲基]哌啶-1,4-二甲酸1-第三丁酯4-甲酯(1.04 g,2.79 mmol)於四氫呋喃(20 mL)中之溶液中添加2.0 M四氫硼酸鋰之THF溶液(2.8 mL,5.6 mmol)。接著在65℃下將反應混合物攪拌2天,冷卻至室溫,且用飽和NaHCO3
溶液淬滅。用EtOAc萃取此混合物,且用鹽水洗滌合併之有機層,經Na2
SO4
乾燥且濃縮。經由管柱層析(含0%至15% MeOH之DCM)純化粗物質,得到呈無色油狀之產物(862 mg,90%)。C16
H21
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 289.2;實驗值289.1。步驟 3 : 4-[4-( 氰甲基 ) 苯甲基 ]-4- 甲醯基哌啶 -1- 甲酸第三丁酯
首先在-78℃下向乙二醯氯(0.42 mL,5.0 mmol)於二氯甲烷(15 mL)中之溶液中逐滴添加二甲亞碸(0.71 mL,10. mmol)。在-78℃下將所得溶液攪拌30分鐘,且接著添加4-[4-(氰甲基)苯甲基]-4-(羥甲基)哌啶-1-甲酸第三丁酯(862.8 mg,2.505 mmol)於二氯甲烷(5.0 mL)中之另一溶液。攪拌反應混合物,且經1小時使其升溫至-40℃,且添加N,N-二異丙基乙胺(2.6 mL,15 mmol)。再攪拌此混合物且經1小時使其升溫至0℃,且接著用DCM稀釋,且傾倒於1 M HCl中。分離有機層,經Na2
SO4
乾燥且濃縮。經由管柱層析(含0%至50% EtOAc之己烷)純化所得殘餘物,得到呈無色油狀之產物(715 mg,84%)。C16
H19
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 287.1;實驗值287.2。步驟 4 : 4-[4-( 氰甲基 ) 苯甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 -) 哌啶 -1- 甲酸第三丁酯
在室溫下將4-[4-(氰甲基)苯甲基]-4-甲醯基哌啶-1-甲酸第三丁酯(715 mg,2.087 mmol)、乙酸(178 μL,3.13 mmol)及(1R,2S)-2-苯基環丙胺(361 mg,2.71 mmol)於1,2-二氯乙烷(12 mL)中之混合物攪拌2小時,且接著添加三乙醯氧基硼氫化鈉(880 mg,4.2 mmol)。在室溫下將反應混合物攪拌隔夜,接著用飽和NaHCO3
溶液淬滅,且用DCM稀釋。分離有機層,用鹽水洗滌,經Na2
SO4
乾燥且濃縮。經由管柱層析(含0%至30% EtOAc之DCM)純化粗物質,得到呈無色油狀之產物(659 mg,69%)。C29
H38
N3
O2
之LC-MS計算值(M+H)+
: m/z = 460.3;實驗值460.3。步驟 5 : 4-[4-( 氰甲基 ) 苯甲基 ]-4-{[[(1R,2S)-2- 苯基環丙基 ]-( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
在0℃下向4-[4-(氰甲基)苯甲基]-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-甲酸第三丁酯(659 mg,1.43 mmol)及N,N-二異丙基乙胺(0.75 mL,4.3 mmol)於二氯甲烷(13 mL)中之溶液中添加三氟乙酸酐(0.31 mL,2.2 mmol)。攪拌反應混合物且使其經2小時緩慢升溫至室溫。用飽和NaHCO3
溶液淬滅所得混合物,且用DCM稀釋。分離有機層,經Na2
SO4
乾燥且濃縮。經由管柱層析(含25%至75% EtOAc之己烷)純化粗物質,得到呈微黃色油狀之產物(760 mg,95%)。C27
H29
F3
N3
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 500.2;實驗值500.2。步驟 6 : N-({4-[4-( 氰甲基 ) 苯甲基 ] 哌啶 -4- 基 } 甲基 )-2,2,2- 三氟 -N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺鹽酸鹽
在0℃下向4-[4-(氰甲基)苯甲基]-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}哌啶-1-甲酸第三丁酯(760. mg,1.37 mmol)於二氯甲烷(10 mL)中之溶液中添加4.0 M氯化氫之1,4-二噁烷溶液(1.7 mL,6.8 mmol)。接著在室溫下將反應混合物攪拌1.5小時,接著濃縮,得到呈微黃色固體狀之粗產物(鹽酸鹽),其未經進一步純化即用於下一步中。C26
H29
F3
N3
O之LC-MS計算值(M+H)+
: m/z = 456.2;實驗值456.2。步驟 7 :環丙烷 -1,1- 二甲酸 1- 第三丁酯 1- 甲酯
向丙二酸第三丁酯甲酯(7.6 g,44 mmol)於N,N-二甲基甲醯胺(70. mL)中之溶液中添加1-溴-2-氯-乙烷(7.2 mL,87 mmol)、碳酸鉀(15 g,110 mmol)及四氟硼酸1-丁基-3-甲基-1H-咪唑-3-鎓(2 g,9 mmol)。在室溫下將所得混合物攪拌48小時,接著用水淬滅且用乙醚萃取。用水及鹽水洗滌合併之萃取物。經Na2
SO4
乾燥有機層,過濾且濃縮。殘餘物未經進一步純化即用於下一步中。步驟 8 : 1-( 第三丁氧羰基 ) 環丙烷甲酸
向環丙烷-1,1-二甲酸1-第三丁酯1-甲酯(8.6 g,43 mmol)於四氫呋喃(60 mL)、甲醇(30 mL)及水(30 mL)中之溶液中添加單水合氫氧化鋰(3.6 g,86 mmol)。在室溫下將混合物攪拌2小時,接著濃縮以移除大部分溶劑。將殘餘物溶解於水中且用乙醚萃取。棄去乙醚萃取物。用冷6 N HCl水溶液將水層酸化至pH 2,接著用DCM萃取。經Na2
SO4
乾燥合併之萃取物,過濾且在減壓下濃縮,得到所需化合物(6.5 g,81%),其未經進一步純化即用於下一步中。步驟 9 : 1-( 羥甲基 ) 環丙烷甲酸第三丁酯
在0℃下將氯甲酸異丁酯(5.9 mL,45 mmol)添加至1-(第三丁氧羰基)環丙烷甲酸(6.5 g,35 mmol)及三乙胺(9.7 mL,70. mmol)於四氫呋喃(80 mL)中之溶液中。在0℃下將所得混合物攪拌60分鐘,接著過濾且用THF (10 mL)洗滌。將濾液冷卻至0℃,且接著添加四氫硼酸鈉(2.6 g,70. mmol)於N-甲基吡咯啶酮(10 mL)中之溶液。在室溫下將反應混合物攪拌2小時,接著用乙醚稀釋,用飽和NaHCO3
水溶液、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-15%)溶離)純化殘餘物,得到所需產物(4.4 g,73%)。1
H NMR (300 MHz, CDCl3
) δ 3.56 (s, 2H), 2.39 (br, 1H), 1.44 (s, 9H), 1.23 - 1.14 (m, 2H), 0.84 - 0.75 (m, 2H)。步驟 10 : 1- 甲醯基環丙烷甲酸第三丁酯
在-78℃下經10分鐘將二甲亞碸(7.2 mL,100 mmol)添加至乙二醯氯(4.32 mL,51.1 mmol)於二氯甲烷(100 mL)中之溶液中。在-78℃下將所得混合物攪拌10分鐘,接著緩慢添加1-(羥甲基)環丙烷-甲酸第三丁酯(4.4 g,26 mmol)於二氯甲烷(40 mL)中之溶液。在-78℃下將反應混合物攪拌1小時,接著添加N,N-二異丙基乙胺(36 mL,200 mmol)且使混合物緩慢升溫至室溫。將反應混合物傾倒於飽和NaHCO3
水溶液中且用DCM萃取。用水及鹽水洗滌合併之萃取物。經Na2
SO4
乾燥有機層,過濾且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-10%)溶離)純化殘餘物,得到所需產物(3.1 g,71%)。1
H NMR (400 MHz, CDCl3
) δ 10.36 (s, 1H), 1.61 - 1.57 (m, 2H), 1.56 - 1.51 (m, 2H), 1.51 (s, 9H)。步驟 11 : 1-[(4-[4-( 氰甲基 ) 苯甲基 ]-4-{[[(1R,2S)-2- 苯基環丙基 ]-( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 基 ) 甲基 ] 環丙烷甲酸第三丁酯
在室溫下將N-({4-[4-(氰甲基)苯甲基]哌啶-4-基}甲基)-2,2,2-三氟-N-[(1R,2S)-2-苯基環丙基]乙醯胺鹽酸鹽(步驟 6
:400.0 mg,0.8130 mmol)、1-甲醯基環丙烷甲酸第三丁酯(346 mg,2.03 mmol)及乙酸(139 μL,2.44 mmol)於二氯甲烷(7.5 mL)中之混合物攪拌1.5小時,且接著添加三乙醯氧基硼氫化鈉(431 mg,2.03 mmol)。在室溫下攪拌反應混合物隔夜。用飽和NaHCO3
水溶液淬滅反應混合物,且用EtOAc萃取。經Na2
SO4
乾燥合併之有機層且濃縮。藉由矽膠管柱急驟層析(用含EtOAc之DCM (0-50%)溶離)純化殘餘物,得到呈黃色固體狀之所需產物。C35
H43
F3
N3
O3
之LC-MS計算值(M+H)+
: m/z = 610.3;實驗值610.3。步驟 12 : 1-{[4-[4-( 氰甲基 ) 苯甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
將來自步驟 11
之產物溶解於DCM (6 mL)中,接著添加TFA (3 mL)。在室溫下將反應混合物攪拌1.5小時,接著濃縮。將殘餘物溶解於THF/MeOH (1.0 mL/1.0 mL)中,接著添加1 M NaOH (1.5 mL)。在室溫下將此混合物攪拌3.5小時,接著經由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C29
H36
N3
O2
之LC-MS計算值(M+H)+
: m/z = 458.3;實驗值458.2。實例 54 1-{[4-[4-( 氰甲基 ) 苯甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
在室溫下將N-({4-[4-(氰甲基)苯甲基]哌啶-4-基}甲基)-2,2,2-三氟-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 53 步驟 6
:105 mg,0.230 mmol)、1-甲醯基環丁烷甲酸甲酯(實例 32 步驟 1
:59.6 μL,0.461 mmol)及乙酸(39 μL,0.69 mmol)於二氯甲烷(3.5 mL)中之混合物攪拌1.5小時,且接著將三乙醯氧基硼氫化鈉(122 mg,0.576 mmol)添加至反應混合物中。在室溫下將所得反應混合物攪拌隔夜,接著用飽和NaHCO3
溶液淬滅,且用DCM萃取。經Na2
SO4
乾燥合併之有機層,過濾且在真空中濃縮。經由矽膠管柱急驟層析(梯度溶離,含0%至5% MeOH之DCM)純化粗物質,得到呈黃色油狀之粗中間物1-((4-(4-(氰甲基)苯甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)哌啶-1-基)甲基)環丁烷甲酸甲酯。將該中間物溶解於MeOH/THF (1.5 mL/1.5 mL)中,且接著將6 M NaOH (1.5 mL)添加至反應混合物中。在室溫下將所得反應混合物攪拌5小時,接著用MeOH稀釋且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C30
H38
N3
O2
之LC-MS計算值(M+H)+
: m/z = 472.3;實驗值472.3。實例 55 1-{[4-(4- 氰基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 53
所述類似之程序,用對氰基苯甲基溴替代[4-(氯甲基)苯基]乙腈來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C28
H34
N3
O2
之LC-MS計算值(M+H)+
: m/z = 444.3;實驗值444.3。實例 56 1-{[4-(3- 氰基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-(3- 溴苯甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
此化合物係使用與對於實例 53 步驟 1-5
所述類似之程序,在步驟 1
中用1-溴-3-(溴甲基)苯替代[4-(氯甲基)苯基]乙腈來製備。C25
H27
BrF3
N2
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 539.1;實驗值539.1。步驟 2 : 4-(3- 氰基苯甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
用氮氣吹掃4-(3-溴苯甲基)-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}哌啶-1-甲酸第三丁酯(3.57 g,6.00 mmol)、與二氯甲烷復合之[1,1'-雙(二苯基膦基)二茂鐵]二氯鈀(II)(1:1)(1.2 g,1.44 mmol)、氰化鋅(2.25 g,19.2 mmol)及鋅(392 mg,6.00 mmol)於DMF (25 mL)中之混合物,接著在140℃下攪拌5小時。將反應混合物冷卻至室溫,用Et2
O稀釋且用水洗滌。分離各層且經Na2
SO4
乾燥有機相,過濾且在真空中濃縮。藉由矽膠管柱急驟層析(用20%-50% EtOAc/己烷溶離)純化殘餘物,得到所需產物(2.24 g,69%產率)。C26
H27
F3
N3
O3
之LC-MS計算值(M-t
Bu+2H)+
: m/z = 486.2;實驗值486.2。步驟 3 : N-{[4-(3- 氰基苯甲基 ) 哌啶 -4- 基 ] 甲基 }-2,2,2- 三氟 -N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
將4.0 M氯化氫之二噁烷溶液(3.97 mL,15.9 mmol)添加至4-(3-氰基苯甲基)-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}-哌啶-1-甲酸第三丁酯(1.23 g,2.27 mmol)於MeOH (5 mL)中之溶液中。在室溫下將所得溶液攪拌1小時,接著在減壓下濃縮。殘餘物未經進一步純化即用於下一步中。C25
H27
F3
N3
O之LC-MS計算值(M+H)+
: m/z = 442.2;實驗值442.2。步驟 4 : 1-{[4-(3- 氰基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 53 步驟 11-12
所述類似之程序,以N-{[4-(3- 氰基苯甲基 ) 哌啶 -4- 基 ] 甲基 }-2,2,2- 三氟 -N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
為起始物來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C28
H34
N3
O2
之LC-MS計算值(M+H)+
: m/z = 444.3;實驗值444.3。實例 57 1-{[4-(3- 氰基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 54
所述類似之程序,以N-{[4-(3- 氰基苯甲基 ) 哌啶 -4- 基 ] 甲基 }-2,2,2- 三氟 -N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
(實例 56 步驟 3
)為起始物來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C29
H36
N3
O2
之LC-MS計算值(M+H)+
: m/z = 458.3;實驗值458.3。實例 58 反 -4-{[4-(3- 氰基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環己烷甲酸
將乙酸(3.6 μL,0.063 mmol)添加至N-{[4-(3-氰基苯甲基)哌啶-4-基]甲基}-2,2,2-三氟-N-[(1R,2S)-2-苯基環丙基]乙醯胺鹽酸鹽(實例 56 步驟 3
:15.0 mg,0.0314 mmol)及反-4-甲醯基環己烷甲酸甲酯(Ark Pharm ,目錄號 AK-50935
:8.0 mg,0.047 mmol)於DCM (0.5 mL)中之溶液中。接著將三乙醯氧基硼氫化鈉(13 mg,0.063 mmol)添加至反應混合物中。在室溫下將所得反應混合物攪拌2小時,接著用DCM稀釋且用水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機相,過濾且在真空中濃縮。將粗中間物反-4-((4-(3-氰基苯甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)哌啶-1-基)甲基)環己烷甲酸甲酯溶解於MeOH (0.2 mL)及THF (0.2 mL)中,接著將4.0 M氫氧化鈉之水溶液(78 μL,0.31 mmol)添加至反應混合物中。在室溫下將所得反應混合物攪拌隔夜,接著用MeOH稀釋且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C31
H40
N3
O2
之LC-MS計算值(M+H)+
: m/z = 486.3;實驗值486.3。實例 59 3-{[1-(3- 甲氧基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -4- 基 ] 甲基 } 苯甲酸 步驟 1 : 4-[3-( 甲氧羰基 ) 苯甲基 ]-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
在一氧化碳之正壓下使4-(3-溴苯甲基)-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}哌啶-1-甲酸第三丁酯(實例 56 步驟 1
:399 mg,0.67 mmol)、與二氯甲烷復合之[1,1'-雙(二苯基膦基)二茂鐵]二氯鈀(II)(1:1)(82 mg,0.10 mmol)及三乙胺(0.18 mL,1.34 mmol)於甲醇(2.50 mL)中之混合物回流7小時。將所得混合物冷卻至室溫,用DCM稀釋,接著經由矽藻土墊過濾。在真空中濃縮濾液,且藉由矽膠層析(用15%-35% EtOAc/己烷溶離)純化粗殘餘物,得到所需產物(291 mg,75%產率)。C26
H30
F3
N2
O3
之LC-MS計算值[M-Boc+2H]+
: m/z = 475.2;實驗值475.2。步驟 2 : 3-[(4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -4- 基 ) 甲基 ] 苯甲酸甲酯
將氯化氫(3 M之MeOH溶液,1.35 mL,4.05 mmol)添加至4-[3-(甲氧羰基)苯甲基]-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)-胺基]甲基}哌啶-1-甲酸第三丁酯(291 mg,0.51 mmol)於MeOH (5 mL)中之溶液中。在室溫下將所得溶液攪拌1小時,且接著在真空中濃縮。粗殘餘物未經進一步純化即用於下一步中。C26
H30
F3
N2
O3
之LC-MS計算值[M+H]+
: m/z = 475.2;實驗值475.2。步驟 3 : 3-{[1-(3- 甲氧基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -4- 基 ] 甲基 } 苯甲酸
將乙酸(3.1 μL,0.055 mmol)添加至3-[(4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}哌啶-4-基)甲基]苯甲酸甲酯(14 mg,0.027 mmol)及3-甲氧基-苯甲醛(5.01 μL,0.0411 mmol)於二氯甲烷(0.3 mL)中之溶液中。接著將三乙醯氧基硼氫化鈉(12 mg,0.055 mmol)添加至反應混合物中。在室溫下將所得反應混合物攪拌2小時,接著用DCM稀釋且用水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機相,過濾且在真空中濃縮。將中間物3-((1-(3-甲氧基苯甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)哌啶-4-基)甲基)苯甲酸甲酯溶解於MeOH (0.3 mL)及THF (0.3 mL)中,接著將4.0 M氫氧化鈉之水溶液(68 μL,0.27 mmol)添加至反應混合物中。在室溫下將所得反應混合物攪拌隔夜,接著用MeOH稀釋且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C31
H37
N2
O3
之LC-MS計算值[M+H]+
: m/z = 485.3;實驗值485.3。實例 60 (3R)-1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 吡咯啶 -3- 醇 步驟 1 : 4-( 甲氧基甲基 )-4-{[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ] 甲基 } 哌啶 -1- 甲酸苯酯
在0℃下將氯甲酸苯酯(45.7 μL,0.364 mmol)添加至2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:90 mg,0.24 mmol)及三乙胺(0.10 mL,0.73 mmol)於二氯甲烷(1.0 mL)中之溶液中且將所得反應混合物攪拌1小時。用乙酸乙酯稀釋反應混合物,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由矽膠管柱急驟層析(用0%至30% EtOAc/己烷進行梯度溶離)純化粗殘餘物,得到所需產物。C26
H30
F3
N2
O4
之LC-MS計算值[M+H]+
: m/z = 491.2;實驗值491.2。步驟 2 : (3R)-1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 吡咯啶 -3- 醇
將(3R)-吡咯啶-3-醇(16 mg,0.18 mmol)添加至4-(甲氧基甲基)-4-{[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]甲基}哌啶-1-甲酸苯酯(18 mg,0.037 mmol)及三乙胺(15 μL,0.11 mmol)於二甲亞碸(0.5 mL)中之溶液中。在135℃下將所得混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需中間物2,2,2-三氟-N-((1-((R)-3-羥基吡咯啶-1-羰基)-4-(甲氧基甲基)哌啶-4-基)甲基)-N-((1S,2R)-2-苯基環丙基)乙醯胺。將該中間物溶解於MeOH/THF (0.2 mL/0.2 mL)中,且接著添加6 N NaOH (0.6 mL)。在30℃下將所得混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C22
H34
N3
O3
之LC-MS計算值[M+H]+
: m/z = 388.3;實驗值388.2。實例 61 (3S)-1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 吡咯啶 -3- 醇
此化合物係使用與對於實例 60
所述類似之程序,在步驟 2
中用(3S)-吡咯啶-3-醇替代(3R)-吡咯啶-3-醇來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C22
H34
N3
O3
之LC-MS計算值[M+H]+
: m/z = 388.3;實驗值388.2。實例 62 4-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 苯甲酸
在室溫下將4-甲氧羰基苯甲醛(20 mg,0.12 mmol)、乙酸(5 μL,0.088 mmol)及2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:30.0 mg,0.0810 mmol)於二氯甲烷(0.6 mL)中之混合物攪拌2小時,且接著將三乙醯氧基硼氫化鈉(56 mg,0.26 mmol)添加至反應混合物中。在室溫下將所得反應混合物攪拌隔夜。用二氯甲烷稀釋反應混合物,用1 N NaOH、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將粗4-((4-(甲氧基甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)哌啶-1-基)甲基)苯甲酸甲酯溶解於MeOH/THF (0.1 mL/0.1 mL)中且接著添加6 N NaOH (0.6 mL)。在40℃下將反應混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C25
H33
N2
O3
之LC-MS計算值[M+H]+
: m/z = 409.2;實驗值409.3。實例 63 1-{[4-({[(1R,2S)-2-(4- 氟苯基 ) 環丙基 ] 胺基 } 甲基 )-4-( 甲氧基甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸 步驟 1 : [4-( 甲氧基甲基 ) 哌啶 -4- 基 ] 甲醇
將4.0 M氯化氫之二噁烷溶液(4.0 mL,16 mmol)添加至4-(羥甲基)-4-(甲氧基甲基)哌啶-1-甲酸第三丁酯(實例 35 步驟 2
:1.0 g,3.8 mmol)於二氯甲烷(0.2 mL)中之溶液中。在室溫下將所得反應混合物攪拌30分鐘,且接著在真空中濃縮。粗殘餘物未經進一步純化即用於下一步中。C8
H18
NO2
之LC-MS計算值[M+H]+
: m/z = 160.1;實驗值160.2。步驟 2 : 1-{[4-( 羥甲基 )-4-( 甲氧基甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸甲酯
將N,N-二異丙基乙胺(0.82 mL,4.71 mmol)添加至[4-(甲氧基甲基)哌啶-4-基]甲醇(0.50 g,3.1 mmol)(鹽酸鹽,來自步驟 1
之粗產物)於二氯甲烷(20 mL)中之混合物中,接著添加1-甲醯基環丁烷甲酸甲酯(0.68 g,4.8 mmol)。在室溫下將所得反應混合物攪拌1小時,且接著添加三乙醯氧基硼氫化鈉(2.0 g,9.4 mmol)。在室溫下將反應混合物攪拌隔夜,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由矽膠管柱急驟層析(用0%至10% MeOH/CH2
Cl2
進行梯度溶離)純化產物,得到所需產物。C15
H28
NO4
之LC-MS計算值[M+H]+
: m/z = 286.2;實驗值286.1。步驟 3 : 1-{[4- 甲醯基 -4-( 甲氧基甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸甲酯
在-78℃下經10分鐘將於二氯甲烷(0.4 mL)中之二甲亞碸(0.28 mL,4.0 mmol)添加至乙二醯氯(0.17 mL,2.0 mmol)於二氯甲烷(0.4 mL)中之溶液中。使混合物經25分鐘升溫至-60℃,接著緩慢添加1-{[4-(羥甲基)-4-(甲氧基甲基)哌啶-1-基]甲基}環丁烷甲酸甲酯(0.29 g,1.0 mmol)於二氯甲烷(0.4 mL)中之溶液,且接著使其經30分鐘升溫至-45℃。接著添加N,N-二異丙基乙胺(1.4 mL,7.9 mmol)且使反應混合物經15分鐘升溫至0℃。將反應混合物傾倒於冷水中且用二氯甲烷萃取。經Na2
SO4
乾燥合併之萃取物,過濾且在真空中濃縮。藉由矽膠管柱急驟層析(用0%至10 % MeOH/CH2
Cl2
進行梯度溶離)純化產物,得到所需產物。C15
H26
NO4
之LC-MS計算值[M+H]+
: m/z = 284.2;實驗值284.2。步驟 4 : 1-{[4-({[(1R,2S)-2-(4- 氟苯基 ) 環丙基 ] 胺基 } 甲基 )-4-( 甲氧基甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
將N,N-二異丙基乙胺(35 μL,0.20 mmol)添加至(1R,2S)-2-(4-氟苯基)環丙胺鹽酸鹽(Enamine,目錄號 EN300-189082
:19 mg,0.10 mmol)於二氯甲烷(0.7 mL)中之混合物中,繼而添加1-{[4-甲醯基-4-(甲氧基甲基)哌啶-1-基]甲基}環丁烷甲酸甲酯(42 mg,0.15 mmol)。在室溫下將所得混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(69 mg,0.33 mmol)。在室溫下將混合物攪拌隔夜,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將中間物1-((4-((((1R,2S)-2-(4-氟苯基)環丙基)胺基)甲基)-4-(甲氧基甲基)哌啶-1-基)甲基)環丁烷甲酸甲酯溶解於MeOH/THF (0.1 mL/0.2 mL)中,接著添加6 N NaOH (0.5 mL)。在30℃下將混合物攪拌隔夜,冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C23
H34
FN2
O3
之LC-MS計算值[M+H]+
: m/z = 405.3;實驗值405.2。實例 64 1-{[4-({[(1R,2S)-2-(2- 氟苯基 ) 環丙基 ] 胺基 } 甲基 )-4-( 甲氧基甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 63
所述類似之程序,在步驟 4
中用(1R,2S)-2-(2-氟苯基)環丙胺鹽酸鹽(Enamine,目錄號 EN300-189085
)替代(1R,2S)-2-(4-氟苯基)環丙胺鹽酸鹽來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C23
H34
FN2
O3
之LC-MS計算值[M+H]+
: m/z = 405.3;實驗值405.3。實例 65 1-{[4-({[(1R,2S)-2-(3,4- 二氟苯基 ) 環丙基 ] 胺基 } 甲基 )-4-( 甲氧基甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 63
所述類似之程序,在步驟 4
中用(1R,2S)-2-(3,4-二氟苯基)環丙胺鹽酸鹽(AstaTech,目錄號 65978
)替代(1R,2S)-2-(4-氟苯基)環丙胺鹽酸鹽來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C23
H33
F2
N2
O3
之LC-MS計算值[M+H]+
: m/z = 423.2;實驗值423.2。實例 66 1-{[4-( 甲氧基甲基 )-4-({[2-(2- 甲氧基苯基 ) 環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 63
所述類似之程序,在步驟 4
中用2-(2-甲氧基苯基)環丙胺鹽酸鹽(Enamine,目錄號EN300-70572
)替代(1R,2S)-2-(4-氟苯基)環丙胺鹽酸鹽來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C24
H37
N2
O4
之LC-MS計算值[M+H]+
: m/z = 417.3;實驗值417.3。實例 67 1-{[4-( 甲氧基甲基 )-4-({[2-(4- 甲氧基苯基 ) 環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 63
所述類似之程序,在步驟 4
中用2-(4-甲氧基苯基)環丙胺鹽酸鹽(Enamine,目錄號EN300-72215
)替代(1R,2S)-2-(4-氟苯基)環丙胺鹽酸鹽來製備。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C24
H37
N2
O4
之LC-MS計算值[M+H]+
: m/z = 417.3;實驗值417.2。實例 68 1-{[4-( 甲氧基甲基 )-4-(1-{[(1R,2S)-2- 苯基環丙基 ] 胺基 } 乙基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸 步驟 1 : 4-( 甲氧基甲基 )-4-{[ 甲氧基 ( 甲基 ) 胺基 ] 羰基 } 哌啶 -1- 甲酸第三丁酯
在-30℃下將2.0 M氯化異丙基鎂之THF溶液(3.0 mL,6.0 mmol)添加至4-(甲氧基甲基)哌啶-1,4-二甲酸1-第三丁酯4-甲酯(實例 35 步驟 1
:0.86 g,3.0 mmol)及N,O-二甲基羥胺鹽酸鹽(0.44 g,4.5 mmol)於四氫呋喃(12 mL)中之混合物中。使所得混合物升溫至0℃且在該溫度下攪拌4小時。用乙酸乙酯稀釋混合物,用飽和NaHCO3
、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由矽膠管柱急驟層析(用0%至30% EtOAc/CH2
Cl2
進行梯度溶離)純化產物,得到所需產物(0.8 g,84%)。C10
H21
N2
O3
之LC-MS計算值[M-Boc+2H]+
: m/z = 217.2;實驗值217.2。步驟 2 : 4- 乙醯基 -4-( 甲氧基甲基 ) 哌啶 -1- 甲酸第三丁酯
在0℃下將溴化甲基鎂(3.0 M乙醚溶液,2.0 mL,6.0 mmol)添加至4-(甲氧基甲基)-4-{[甲氧基(甲基)胺基]羰基}哌啶-1-甲酸第三丁酯(0.95 g,3.0 mmol)於四氫呋喃(10 mL)中之溶液中。使混合物升溫至室溫且攪拌5小時。用飽和NH4
Cl溶液淬滅混合物,用乙酸乙酯稀釋,用水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由急驟層析(用0%至30% EtOAc/己烷進行梯度溶離)純化粗殘餘物,得到所需產物(0.65 g,80%)。C9
H18
NO2
之LC-MS計算值[M-Boc+2H]+
: m/z = 172.1;實驗值172.1。步驟 3 : 4-( 甲氧基甲基 )-4-(1-{[(1R,2S)-2- 苯基環丙基 ] 胺基 } 乙基 ) 哌啶 -1- 甲酸第三丁酯
在室溫下將4-乙醯基-4-(甲氧基甲基)哌啶-1-甲酸第三丁酯(0.27 g,1.0 mmol)、乙酸(85 μL,1.5 mmol)及(1R,2S)-2-苯基環丙胺(0.173 g,1.30 mmol)於二氯甲烷(4 mL)中之混合物攪拌2小時,接著將三乙醯氧基硼氫化鈉(0.64 g,3.0 mmol)添加至反應混合物中。在室溫下將所得反應混合物攪拌隔夜,接著用二氯甲烷稀釋,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由急驟層析(用0%至8% MeOH/CH2
Cl2
進行梯度溶離)純化殘餘物,得到所需產物。C23
H37
N2
O3
之LC-MS計算值[M+H]+
: m/z = 389.3;實驗值389.3。步驟 4 : 4-( 甲氧基甲基 )-4-{1-[[(1R,2S)-2- 苯基環丙基 ]( 三氟乙醯基 ) 胺基 ] 乙基 } 哌啶 -1- 甲酸第三丁酯
在0℃下將三氟乙酸酐(0.065 mL,0.46 mmol)添加至4-(甲氧基甲基)-4-(1-{[(1R,2S)-2-苯基環丙基]胺基}乙基)哌啶-1-甲酸第三丁酯(120 mg,0.31 mmol)及N,N-二異丙基乙胺(0.16 mL,0.93 mmol)於二氯甲烷(3.0 mL)中之溶液中。在室溫下將所得反應混合物攪拌1小時,接著用二氯甲烷稀釋,用飽和NaHCO3溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由矽膠管柱急驟層析(用0%至20% EtOAc/己烷進行梯度溶離)純化粗殘餘物,得到所需產物。C20
H28
F3
N2
O2
之LC-MS計算值[M-Boc+2H]+
: m/z = 385.2;實驗值385.1。步驟 5 : 2,2,2- 三氟 -N-{1-[4-( 甲氧基甲基 ) 哌啶 -4- 基 ] 乙基 }-N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
將4.0 M氯化氫之二噁烷溶液(0.5 mL,2 mmol)添加至4-(甲氧基甲基)-4-{1-[[(1R,2S)-2-苯基環丙基](三氟乙醯基)胺基]乙基}哌啶-1-甲酸第三丁酯(80.0 mg,0.165 mmol)於二氯甲烷(0.4 mL)中之溶液中。在室溫下將所得反應混合物攪拌30分鐘且接著在減壓下濃縮。粗殘餘物未經進一步純化即用於下一步中。C20
H28
F3
N2
O2
之LC-MS計算值[M+H]+
: m/z = 385.2;實驗值385.1。步驟 6 : 1-{[4-( 甲氧基甲基 )-4-(1-{[(1R,2S)-2- 苯基環丙基 ] 胺基 } 乙基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
將1-甲醯基環丁烷甲酸甲酯(實例 32 步驟 1
:22 mg,0.16 mmol)添加至2,2,2-三氟-N-{1-[4-(甲氧基甲基)哌啶-4-基]乙基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(40.0 mg,0.104 mmol)及N,N-二異丙基乙胺(27 μL,0.16 mmol)於二氯甲烷(0.8 mL)中之混合物中。在室溫下將所得混合物攪拌2小時,接著添加三乙醯氧基硼氫化鈉(72 mg,0.34 mmol)。在室溫下將混合物攪拌隔夜,接著用二氯甲烷稀釋,用1 N NaOH、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將粗中間物1-((4-(甲氧基甲基)-4-(1-(2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)乙基)-哌啶-1-基)甲基)環丁烷甲酸甲酯溶解於MeOH/THF (0.2 mL/0.2 mL)中,且接著將6 N NaOH (0.6 mL)添加至反應混合物中。在40℃下將所得反應混合物攪拌2天,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C24
H37
N2
O3
之LC-MS計算值[M+H]+
: m/z = 401.3;實驗值401.2。實例 69 1-{[4-[(6- 甲氧基吡啶 -3- 基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-[(6- 氯吡啶 -3- 基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 甲酸第三丁酯
此化合物係使用與對於實例 31 步驟 1-4
所述類似之程序,在步驟 1
中用2-氯-5-(氯甲基)吡啶(Aldrich,目錄號516910)替代α-溴-4-氟甲苯來製備。C26
H35
ClN3
O2
之LC-MS計算值[M+H]+
: m/z = 456.2;實驗值456.2。步驟 2 : 4-({[( 烯丙氧基 ) 羰基 ][(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 )-4-[(6- 氯吡啶 -3- 基 ) 甲基 ] 哌啶 -1- 甲酸第三丁酯
向4-[(6-氯吡啶-3-基)甲基]-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-甲酸第三丁酯(1.1 g,2.4 mmol)於二氯甲烷(10 mL)中之溶液中添加氯甲酸烯丙酯(0.38 mL,3.6 mmol)及N,N-二異丙基乙胺(0.84 mL,4.8 mmol)。在室溫下將所得溶液攪拌1小時,且接著在真空中濃縮。藉由矽膠管柱急驟層析(用含0%至30% EtOAc之己烷進行梯度溶離)純化粗殘餘物,得到所需產物。C26
H31
ClN3
O4
之LC-MS計算值[M-t
Bu+2H]+
: m/z = 484.2;實驗值484.2。步驟 3 : ({4-[(6- 甲氧基吡啶 -3- 基 ) 甲基 ] 哌啶 -4- 基 } 甲基 )[(1R,2S)-2- 苯基環丙基 ] 胺基甲酸烯丙酯
在80℃下將4-({[(烯丙氧基)羰基][(1R,2S)-2-苯基環丙基]胺基}甲基)-4-[(6-氯吡啶-3-基)甲基]哌啶-1-甲酸第三丁酯(350 mg,0.65 mmol)及甲醇鈉(25重量%之MeOH溶液,1.48 mL,6.48 mmol)於甲醇(0.5 mL)中之混合物攪拌6小時。將反應混合物冷卻至室溫,接著用DCM稀釋,用水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由矽膠管柱急驟層析(用含0%至30% EtOAc之己烷進行梯度溶離)純化殘餘物,得到所需中間物4-((((烯丙氧基)羰基)((1R,2S)-2-苯基環丙基)胺基)甲基)-4-((6-甲氧基吡啶-3-基)甲基)哌啶-1-甲酸第三丁酯。將該中間物溶解於DCM (2 mL)中,接著添加TFA (2 mL)。在室溫下將所得反應混合物攪拌2小時,接著濃縮且粗標題產物未經進一步純化即用於下一步中。C26
H34
N3
O3
之LC-MS計算值[M+H]+
: m/z = 436.3;實驗值436.2。步驟 4 : 1-{[4-[(6- 甲氧基吡啶 -3- 基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
在室溫下將1-甲醯基環丙烷甲酸第三丁酯(實例 53 步驟 10
:18 mg,0.10 mmol)、三乙胺(19 μL,0.14 mmol)及({4-[(6-甲氧基吡啶-3-基)甲基]哌啶-4-基}甲基)[(1R,2S)-2-苯基環丙基]胺基甲酸烯丙酯(30 mg,0.069 mmol)於二氯甲烷(0.8 mL)中之混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(29 mg,0.14 mmol)。在室溫下將所得混合物攪拌隔夜,接著用二氯甲烷稀釋,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將殘餘物溶解於THF (2 mL)中,接著添加肆(三苯基膦)鈀(0)(6 mg,0.005 mmol)及N-乙基乙胺(56 μL,0.54 mmol)。用氮氣吹掃混合物,接著在85℃下攪拌2小時。將反應混合物冷卻至室溫,過濾且在真空中濃縮,得到中間物1-((4-((6-甲氧基吡啶-3-基)甲基)-4-((((1R,2S)-2-苯基環丙基)胺基)甲基)哌啶-1-基)甲基)環丙烷甲酸第三丁酯,其未經純化即進一步使用。將該中間物溶解於DCM (1 mL)中,接著添加TFA (1 mL)。在室溫下將混合物攪拌3小時,接著在真空中濃縮且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化殘餘物,得到呈TFA鹽形式之所需產物。C27
H36
N3
O3
之LC-MS計算值[M+H]+
: m/z = 450.3;實驗值450.2。實例 70 1-{[4-( 乙氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 35
所述類似之程序,在步驟 1
中用(氯甲氧基)-乙烷替代氯甲基甲醚來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C23
H35
N2
O3
之LC-MS計算值[M+H]+
: m/z = 387.3;實驗值387.2。實例 71 1-{[4-( 乙氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 36
所述類似之程序,用(氯甲氧基)-乙烷替代氯甲基甲醚來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C24
H37
N2
O3
之LC-MS計算值[M+H]+
: m/z = 401.3;實驗值401.2。實例 72 1-{[4-[( 苯甲氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 31
所述類似之程序,在步驟 1
中用苯甲基氯甲醚替代α-溴-4-氟甲苯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C28
H37
N2
O3
之LC-MS計算值[M+H]+
: m/z = 449.3;實驗值449.3。實例 73 1-{[4-[( 苯甲氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 32
所述類似之程序,用苯甲基氯甲醚替代α-溴-4-氟甲苯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C29
H39
N2
O3
之LC-MS計算值[M+H]+
: m/z = 463.3;實驗值463.3。實例 74 1-{[4-(4- 氰基 -2- 氟苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 53
所述類似之程序,在步驟 1
中用4-(溴甲基)-3-氟苯甲腈(AstaTech,目錄號54500)替代[4-(氯甲基)苯基]乙腈來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C28
H33
FN3
O2
之LC-MS計算值[M+H]+
: m/z = 462.3;實驗值462.3。實例 75 1-{[4-[(2- 氟苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-[( 苯甲氧基 ) 甲基 ] 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
此化合物係使用與對於實例 31 步驟 1
所述類似之程序,用苯甲基氯甲醚替代α-溴-4-氟甲苯來製備。C15
H22
NO3
之LC-MS計算值[M-Boc+2H]+
: m/z = 264.2;實驗值264.2。步驟 2 : 4-( 羥甲基 ) 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
將鈀(10重量%/碳,880 mg,0.83 mmol)添加至4-[(苯甲氧基)甲基]哌啶-1,4-二甲酸1-第三丁酯4-甲酯(2.1 g,5.8 mmol)於甲醇(20 mL)中之溶液中。在氫氣之正壓下在室溫下將所得反應混合物攪拌隔夜,接著經由矽藻土過濾且用DCM洗滌。在真空中濃縮濾液且殘餘物未經進一步純化即用於下一步中。C8
H16
NO3
之LC-MS計算值[M-Boc+2H]+
: m/z = 174.1;實驗值174.2。步驟 3 : 4-[(2- 氟苯氧基 ) 甲基 ] 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
向4-(羥甲基)哌啶-1,4-二甲酸1-第三丁酯4-甲酯(555 mg,2.03 mmol)、2-氟-苯酚(Aldrich,目錄號F12804)(0.16 mL,1.8 mmol)及三苯基膦(530 mg,2.0 mmol)於四氫呋喃(4 mL)中之溶液中添加偶氮二甲酸二異丙酯(0.40 mL,2.0 mmol)。將所得反應混合物加熱至65℃且攪拌隔夜。將反應混合物冷卻至室溫且在真空中濃縮。藉由矽膠管柱層析(用0%至25% EtOAc/己烷進行梯度溶離)純化殘餘物,得到呈澄清油狀之所需產物(524 mg,77%)。C14
H19
FNO3
之LC-MS計算值[M-Boc+2H]+
: m/z = 268.1;實驗值268.2。步驟 4 : 4-[(2- 氟苯氧基 ) 甲基 ]-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
向4-[(2-氟苯氧基)甲基]哌啶-1,4-二甲酸1-第三丁酯4-甲酯(524 mg,1.43 mmol)於四氫呋喃(1.5 mL)中之溶液中添加2.0 M四氫硼酸鋰之THF溶液(1.4 mL,2.8 mmol)。將所得反應混合物加熱至70℃且攪拌6小時。將反應混合物冷卻至室溫,用水淬滅,用EtOAc稀釋且用水及鹽水洗滌有機相。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。殘餘物未經進一步純化即用於下一步中。C13
H19
FNO2
之LC-MS計算值[M-Boc+2H]+
: m/z = 240.1;實驗值240.2。步驟 5 : 2,2,2- 三氟 -N-({4-[(2- 氟苯氧基 ) 甲基 ] 哌啶 -4- 基 } 甲基 )-N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
此化合物係使用與對於實例 31 步驟 3-6
所述類似之程序,在步驟 3
中用4-[(2-氟苯氧基)甲基]-4-(羥甲基)哌啶-1-甲酸第三丁酯(來自步驟 4
)替代4-(4-氟苯甲基)-4-(羥甲基)哌啶-1-甲酸第三丁酯來製備。C24
H27
F4
N2
O2
之LC-MS計算值[M+H]+
: m/z = 451.2;實驗值451.3。步驟 6 : 1-{[4-[(2- 氟苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
向2,2,2-三氟-N-({4-[(2-氟苯氧基)甲基]哌啶-4-基}甲基)-N-[(1R,2S)-2-苯基環丙基]乙醯胺(31 mg,0.069 mmol)及1-甲醯基環丙烷甲酸第三丁酯(實例 53 步驟 10
:18 mg,0.10 mmol)於二氯甲烷(0.5 mL)中之溶液中添加乙酸(4.3 μL,0.075 mmol)。在室溫下將所得溶液攪拌2小時,繼而將三乙醯氧基硼氫化鈉(48 mg,0.23 mmol)添加至反應混合物中。在室溫下將反應混合物攪拌隔夜,接著用DCM稀釋,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將粗1-((4-((2-氟苯氧基)甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)哌啶-1-基)甲基)環丙烷甲酸第三丁酯溶解於DCM (2 mL)中,接著添加三氟乙酸(0.62 mL)。在室溫下將反應混合物攪拌1.5小時,且接著在真空中濃縮。將粗1-((4-((2-氟苯氧基)甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)-哌啶-1-基)甲基)環丙烷甲酸溶解於MeOH/THF (0.5/0.5 mL)中且接著添加1 N NaOH (0.75 mL)。在50℃下將所得反應混合物攪拌4小時,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C27
H34
FN2
O3
之LC-MS計算值[M+H]+
: m/z = 453.3;實驗值453.2。實例 76 1-{[4-[(2- 氟苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
向2,2,2-三氟-N-({4-[(2-氟苯氧基)甲基]哌啶-4-基}甲基)-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 75 步驟 5
:35 mg,0.077 mmol)及1-甲醯基環丁烷甲酸甲酯(實例 32 步驟 1
:16 mg,0.12 mmol)於二氯甲烷(0.6 mL)中之溶液中添加乙酸(4.7 μL,0.083 mmol)。在室溫下將反應混合物攪拌2小時,且接著添加三乙醯氧基硼氫化鈉(53 mg,0.25 mmol)。在室溫下將所得反應混合物攪拌隔夜,接著用DCM稀釋,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將粗1-((4-((2-氟苯氧基)甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)哌啶-1-基)甲基)環丁烷甲酸甲酯溶解於MeOH (0.5 mL)及THF (0.5 mL)中,接著添加6 N NaOH (0.5 mL)。在40℃下將所得反應混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C28
H36
FN2
O3
之LC-MS計算值[M+H]+
: m/z = 467.3;實驗值467.3。實例 77 1-{[4-[(3- 氟苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 75
所述類似之程序(在步驟 3
中使用3-氟-苯酚(Aldrich,目錄號F13002)替代2-氟-苯酚)來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C27
H34
FN2
O3
之LC-MS計算值[M+H]+
: m/z = 453.3;實驗值453.2。實例 78 1-{[4-[(3- 氟苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 76
及實例 75
所述類似之程序(在步驟3中使用3-氟-苯酚替代2-氟-苯酚)來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C28
H36
FN2
O3
之LC-MS計算值[M+H]+
: m/z = 467.3;實驗值467.3。實例 79 1-{[4-[(2- 氰基苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 75
所述類似之程序,在步驟 3
中使用2-羥基苯甲腈(Aldrich,目錄號141038)替代2-氟-苯酚來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C28
H34
N3
O3
之LC-MS計算值[M+H]+
: m/z = 460.3;實驗值460.3。實例 80 1-{[4-[(3- 氰基苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 75
所述類似之程序,在步驟 3
中使用3-羥基苯甲腈(Aldrich,目錄號C93800)替代2-氟-苯酚來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C28
H34
N3
O3
之LC-MS計算值[M+H]+
: m/z = 460.3;實驗值460.3。實例 81 1-{[4-[(4- 氰基苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 75
所述類似之程序,在步驟 3
中使用4-羥基苯甲腈(Aldrich,目錄號C94009)替代2-氟-苯酚來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C28
H34
N3
O3
之LC-MS計算值[M+H]+
: m/z = 460.3;實驗值460.2。實例 82 1-{[4-[(4- 氰基 -2- 氟苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 75
所述類似之程序,在步驟 3
中使用3-氟-4-羥基苯甲腈(Oakwood,目錄號013830)替代2-氟-苯酚來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C28
H33
FN3
O3
之LC-MS計算值[M+H]+
: m/z = 478.3;實驗值478.2。實例 83 1-{[4-[(2- 氰基苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 76
及實例 75
所述類似之程序(在步驟 3
中使用2-氰基苯酚(Aldrich,目錄號141038)替代2-氟-苯酚)來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C29
H36
N3
O3
之LC-MS計算值[M+H]+
: m/z = 474.3;實驗值474.3。實例 84 1-{[4-[(3- 氰基苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 76
及實例 75
所述類似之程序(在步驟 3
中使用3-氰基苯酚(Aldrich,目錄號C93800)替代2-氟-苯酚)來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C29
H36
N3
O3
之LC-MS計算值[M+H]+
: m/z = 474.3;實驗值474.3。實例 85 1-{[4-[(4- 氰基苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 76
及實例 75
所述類似之程序(在步驟 3
中使用4-氰基苯酚(Aldrich,目錄號C94009)替代2-氟-苯酚)來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C29
H36
N3
O3
之LC-MS計算值[M+H]+
: m/z = 474.3;實驗值474.3。實例 86 1-{[4-[(4- 氰基 -2- 氟苯氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 76
及實例 75
所述類似之程序(在步驟 3
中使用3-氟-4-羥基苯甲腈(Oakwood,目錄號013830)替代2-氟-苯酚)來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化混合物,得到呈TFA鹽形式之所需產物。C29
H35
FN3
O3
之LC-MS計算值[M+H]+
: m/z = 492.3;實驗值492.3。實例 87 1-{[4-{[(5- 氟吡啶 -2- 基 ) 氧基 ] 甲基 }-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4- 甲醯基哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
在-78℃下經20分鐘將於二氯甲烷(17 mL)中之二甲亞碸(2.5 mL,35 mmol)添加至乙二醯氯(1.5 mL,17 mmol)於二氯甲烷(17 mL)中之溶液中且接著經25分鐘使反應混合物升溫至-60℃。緩慢添加於DCM (30 mL)中之4-(羥甲基)哌啶-1,4-二甲酸1-第三丁酯4-甲酯(實例 75 步驟 2
:2.39 g,8.74 mmol)且接著使反應混合物升溫至-45℃且在該溫度下攪拌1小時。添加三乙胺(9.8 mL,70. mmol)且接著經1小時使反應混合物升溫至0℃。用飽和NaHCO3
水溶液淬滅反應混合物,且用DCM萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮,得到所需粗產物,其未經進一步純化即用於下一步中。C8
H14
NO3
之LC-MS計算值[M-Boc+2H]+
: m/z = 172.1;實驗值172.2。步驟 2 : 4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
在室溫下將(1R,2S)-2-苯基環丙胺(1.30 g,9.79 mmol)、4-甲醯基哌啶-1,4-二甲酸1-第三丁酯4-甲酯(2.37 g,8.74 mmol)及乙酸(2.0 mL,35 mmol)於二氯甲烷(50 mL)中之混合物攪拌4小時,接著冷卻至室溫且將三乙醯氧基硼氫化鈉(4.1 g,19 mmol)添加至反應混合物中。在室溫下將反應混合物攪拌2小時,接著用飽和NaHCO3
水溶液淬滅,且用DCM萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。藉由矽膠管柱急驟層析(用含0%至5% MeOH之DCM進行梯度溶離)純化殘餘物,得到所需產物。C22
H33
N2
O4
之LC-MS計算值[M+H]+
: m/z = 389.2;實驗值389.1。步驟 3 : 4-({[( 烯丙氧基 ) 羰基 ][(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1,4- 二甲酸 1- 第三丁酯 4- 甲酯
在0℃下將氯甲酸烯丙酯(1.4 mL,13 mmol)添加至來自步驟 2
之產物及三乙胺(3.0 mL,22 mmol)於四氫呋喃(30 mL)中之溶液中。使反應混合物升溫至室溫且在該溫度下攪拌隔夜。用飽和NaHCO3
淬滅反應混合物且用EtOAc萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。藉由矽膠管柱急驟層析(用含乙酸乙酯之己烷(0-25%)進行梯度溶離)純化殘餘物,得到所需產物。C21
H29
N2
O4
之LC-MS計算值[M-Boc+2H]+
: m/z = 373.2;實驗值373.2。步驟 4 : 4-({[( 烯丙氧基 ) 羰基 ][(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 )-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
在-78℃下將四氫鋁酸鋰(1 M THF溶液,4.5 mL,4.5 mmol)添加至4-({[(烯丙氧基)羰基][(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1,4-二甲酸1-第三丁酯4-甲酯(2.13 g,4.51 mmol)於四氫呋喃(40 mL)中之溶液中。使反應混合物升溫至-20℃且在該溫度下攪拌0.5小時。用NaHCO3
(水溶液)淬滅混合物,且用乙酸乙酯萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。藉由矽膠管柱急驟層析(用含EA之己烷(0-40%)進行梯度溶離)純化殘餘物,得到所需產物(1.04 g,52%)。C20
H29
N2
O3
之LC-MS計算值[M-Boc+2H]+
: m/z = 345.2;實驗值345.2。步驟 5 : 4-({[( 烯丙氧基 ) 羰基 ][(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 )-4-{[(5- 氟吡啶 -2- 基 ) 氧基 ] 甲基 } 哌啶 -1- 甲酸第三丁酯
在室溫下向4-({[(烯丙氧基)羰基][(1R,2S)-2-苯基環丙基]胺基}甲基)-4-(羥甲基)哌啶-1-甲酸第三丁酯(208 mg,0.468 mmol)、5-氟吡啶-2-醇(Aldrich,目錄號753181)(106 mg,0.936 mmol)及三苯基膦(245 mg,0.936 mmol)於甲苯(5 mL)中之溶液中逐滴添加偶氮二甲酸二異丙酯(0.19 mL,0.94 mmol)。在50℃下將所得反應混合物攪拌隔夜,接著在真空中濃縮。藉由矽膠管柱急驟層析(用含0%至35% EtOAc之己烷進行梯度溶離)純化粗殘餘物,得到所需產物(249 mg,99%)。C26
H31
FN3
O5
之LC-MS計算值[M-t
Bu+2H]+
: m/z = 484.2;實驗值484.2。步驟 6 : [(4-{[(5- 氟吡啶 -2- 基 ) 氧基 ] 甲基 } 哌啶 -4- 基 ) 甲基 ][(1R,2S)-2- 苯基環丙基 ] 胺基甲酸烯丙酯
將來自步驟 5
之產物溶解於二氯甲烷(2.0 mL)中,接著添加三氟乙酸(2.0 mL)。在室溫下將所得反應混合物攪拌1小時,接著在減壓下濃縮。將殘餘物溶解於DCM中,接著用飽和NaHCO3
水溶液中和。用鹽水洗滌有機層,接著經Na2
SO4
乾燥,過濾且在真空中濃縮。殘餘物未經進一步純化即用於下一步中。C25
H31
FN3
O3
之LC-MS計算值[M+H]+
: m/z = 440.2;實驗值440.3。步驟 7 : 1-{[4-{[(5- 氟吡啶 -2- 基 ) 氧基 ] 甲基 }-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
向1-甲醯基環丙烷甲酸第三丁酯(實例 53 步驟 10
:27 mg,0.16 mmol)及[(4-{[(5-氟吡啶-2-基)氧基]甲基}哌啶-4-基)甲基][(1R,2S)-2-苯基環丙基]胺基甲酸烯丙酯(47 mg,0.11 mmol)於二氯甲烷(1 mL)中之溶液中添加乙酸(6.6 μL,0.12 mmol)。在室溫下將反應混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(45 mg,0.21 mmol)。在室溫下將混合物攪拌2小時,接著用二氯甲烷稀釋,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將粗1-((4-((((烯丙氧基)羰基)((1R,2S)-2-苯基環丙基)胺基)甲基)-4-(((5-氟吡啶-2-基)氧基)甲基)哌啶-1-基)甲基)環丙烷甲酸第三丁酯溶解於四氫呋喃(2.0 mL)中,添加肆(三苯基膦)鈀(0)(10 mg,0.009 mmol)及N-乙基乙胺(0.06 mL,0.6 mmol)。用氮氣吹掃反應混合物,接著在85℃下攪拌2小時。將反應混合物冷卻至室溫,接著過濾且在真空中濃縮。將粗1-((4-(((5-氟吡啶-2-基)氧基)甲基)-4-((((1R,2S)-2-苯基環丙基)胺基)甲基)哌啶-1-基)甲基)環丙烷甲酸第三丁酯溶解於二氯甲烷(1.5 mL)中,且添加三氟乙酸(1.5 mL)。在室溫下將反應混合物攪拌1小時,接著濃縮且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C26
H33
FN3
O3
之LC-MS計算值[M+H]+
: m/z = 454.3;實驗值454.2。實例 88 1-{[4-{[(5- 氟嘧啶 -2- 基 ) 氧基 ] 甲基 }-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 87
所述類似之程序,在步驟 5
中用5-氟嘧啶-2-醇(Aldrich,目錄號656445)替代5-氟吡啶-2-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C25
H32
FN4
O3
之LC-MS計算值[M+H]+
: m/z = 455.2;實驗值455.3。實例 89 1-{[4-{[(3- 氟吡啶 -2- 基 ) 氧基 ] 甲基 }-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 87
所述類似之程序,在步驟 5
中用3-氟吡啶-2-醇(AstaTech,目錄號22417)替代5-氟吡啶-2-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C26
H33
FN3
O3
之LC-MS計算值[M+H]+
: m/z = 454.3;實驗值454.2。實例 90 1-{[4-[({6-[( 甲胺基 ) 羰基 ] 吡啶 -3- 基 } 氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 87
所述類似之程序,在步驟 5
中用5-羥基-N-甲基吡啶甲醯胺(AstaTech,目錄號24328)替代5-氟吡啶-2-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C28
H37
N4
O4
之LC-MS計算值[M+H]+
: m/z = 493.3;實驗值493.3。實例 91 1-{[4-[({6-[( 甲胺基 ) 羰基 ] 吡啶 -2- 基 } 氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 6- 羥基 -N- 甲基吡啶甲醯胺
在室溫下將6-羥基吡啶-2-甲酸甲酯(Aldrich ,目錄號 ANV00114
:412 mg,2.69 mmol)及甲胺(40重量%水溶液,4.0 mL,36 mmol)之混合物攪拌5天,接著濃縮。殘餘物未經進一步純化即用於下一步中。C7
H9
N2
O2
之LC-MS計算值[M+H]+
: m/z = 153.1;實驗值153.1。步驟 2 : 1-{[4-[({6-[( 甲胺基 ) 羰基 ] 吡啶 -2- 基 } 氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係根據實例 87
之程序,在步驟 5
中用6-羥基-N-甲基吡啶甲醯胺(來自步驟 1
之產物)替代5-氟吡啶-2-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C28
H37
N4
O4
之LC-MS計算值[M+H]+
: m/z = 493.3;實驗值493.3。實例 92 1-{[4-[( 環丁基甲氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-[( 苯甲氧基 ) 甲基 ]-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
在-78℃下將四氫鋁酸鋰(1 M THF溶液,28 mL,28 mmol)添加至4-[(苯甲氧基)甲基]哌啶-1,4-二甲酸1-第三丁酯4-甲酯(實例 75 步驟 1
:10.0 g,27.5 mmol)於四氫呋喃(200 mL)中之溶液中。使反應混合物升溫至-20℃且在該溫度下攪拌0.5小時。用NaHCO3
(水溶液)淬滅反應混合物,且用乙酸乙酯萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。藉由矽膠管柱急驟層析(用含EtOAc之己烷(0-40%)進行梯度溶離)純化殘餘物,得到所需產物(4.3 g,46%)。C14
H22
NO2
之LC-MS計算值[M-Boc+2H]+
: m/z = 236.2;實驗值236.1。步驟 2 : 4-[( 苯甲氧基 ) 甲基 ]-4-[( 環丁基甲氧基 ) 甲基 ] 哌啶 -1- 甲酸第三丁酯
向4-[(苯甲氧基)甲基]-4-(羥甲基)哌啶-1-甲酸第三丁酯(1.0 g,3.0 mmol)於N,N-二甲基甲醯胺(20 mL)中之溶液中添加NaH(60重量%於礦物油中,180 mg,4.5 mmol),在室溫下將溶液攪拌30分鐘,接著添加(溴甲基)環丁烷(Aldrich,目錄號441171)(670 μL,6.0 mmol)。在140℃下將所得反應混合物攪拌4天,接著冷卻至室溫且用水淬滅且用EtOAc萃取。用水及鹽水洗滌合併之萃取物。經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。藉由矽膠管柱層析(用含EtOAc之己烷(0-20%)進行梯度溶離)純化殘餘物,得到所需產物(130 mg,11%)。C19
H30
NO2
之LC-MS計算值[M-Boc+2H]+
: m/z = 304.2;實驗值304.2。步驟 3 : 4-[( 環丁基甲氧基 ) 甲基 ]-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
向4-[(苯甲氧基)甲基]-4-[(環丁基甲氧基)甲基]哌啶-1-甲酸第三丁酯(130 mg,0.32 mmol)於甲醇(4 mL)中之溶液中添加鈀/活性碳(10重量%,30 mg)。在室溫下在氫氣之正壓下將反應混合物攪拌2小時,接著經由矽藻土墊過濾且在真空中濃縮。殘餘物未經進一步純化即用於下一步中。C12
H24
NO2
之LC-MS計算值[M-Boc+2H]+
: m/z = 214.2;實驗值214.2。步驟 4 : 4-[( 環丁基甲氧基 ) 甲基 ]-4- 甲醯基哌啶 -1- 甲酸第三丁酯
在-78℃下經5分鐘將二甲亞碸(140 μL,1.9 mmol)添加至乙二醯氯(81 μL,0.96 mmol)於二氯甲烷(1 mL)中之溶液中且將所得反應混合物攪拌10分鐘,接著緩慢添加4-[(環丁基甲氧基)甲基]-4-(羥甲基)哌啶-1-甲酸第三丁酯(100 mg,0.32 mmol)於二氯甲烷(0.8 mL)中之溶液。在-75℃下將反應混合物攪拌60分鐘,接著添加N,N-二異丙基乙胺(0.67 mL,3.8 mmol)。使反應混合物緩慢升溫至室溫,接著用飽和NaHCO3
水溶液淬滅且用EtOAc萃取。用水及鹽水洗滌合併之萃取物。經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。殘餘物未經進一步純化即用於下一步中。C12
H22
NO2
之LC-MS計算值[M-Boc+2H]+
: m/z = 212.2;實驗值212.1。步驟 5 : 4-[( 環丁基甲氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 甲酸第三丁酯
在室溫下將4-[(環丁基甲氧基)甲基]-4-甲醯基哌啶-1-甲酸第三丁酯(來自步驟 4
之粗產物:100 mg,0.32 mmol)、乙酸(27 μL,0.48 mmol)及(1R,2S)-2-苯基環丙胺(52 mg,0.38 mmol)於二氯甲烷(4 mL)中之混合物攪拌1小時。接著添加三乙醯氧基硼氫化鈉(140 mg,0.64 mmol)且在室溫下將反應混合物攪拌隔夜。用二氯甲烷稀釋反應混合物,用飽和NaHCO3
溶液、1 N NaOH、水及鹽水洗滌。經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。殘餘物未經進一步純化即用於下一步中。C26
H41
N2
O3
之LC-MS計算值[M+H]+
: m/z = 429.3;實驗值429.3。步驟 6 : ({4-[( 環丁基甲氧基 ) 甲基 ] 哌啶 -4- 基 } 甲基 )[(1R,2S)-2- 苯基環丙基 ] 胺基甲酸烯丙酯
向4-[(環丁基甲氧基)甲基]-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-甲酸第三丁酯(140 mg,0.33 mmol)於二氯甲烷(2 mL)中之溶液中添加氯甲酸烯丙酯(69 μL,0.65 mmol)及N,N-二異丙基乙胺(0.11 mL,0.65 mmol)。在室溫下將所得溶液攪拌1小時,且接著在減壓下濃縮。藉由矽膠管柱層析(用含EtOAc之己烷(0-20%)進行梯度溶離)純化殘餘物,得到所需中間物(4-((((烯丙氧基)羰基)((1R,2S)-2-苯基環丙基)胺基)甲基)-4-((環丁基甲氧基)甲基)哌啶-1-甲酸第三丁酯,150 mg)。將該中間物溶解於DCM (1 mL)中,接著添加TFA (1 mL)。在室溫下將所得混合物攪拌1小時,且接著濃縮。殘餘物未經進一步純化即用於下一步中。C25
H37
N2
O3
之LC-MS計算值[M+H]+
: m/z = 413.3;實驗值413.2。步驟 7 : 1-{[4-[( 環丁基甲氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
在室溫下將1-甲醯基環丙烷甲酸第三丁酯(12 mg,0.073 mmol)、三乙胺(14 μL,0.097 mmol)及({4-[(環丁基甲氧基)甲基]哌啶-4-基}甲基)[(1R,2S)-2-苯基環丙基]胺基甲酸烯丙酯(20.0 mg,0.0485 mmol)於二氯甲烷(0.6 mL)中之混合物攪拌1小時,接著添加三乙醯氧基硼氫化鈉(20. mg,0.097 mmol)。在室溫下將反應混合物攪拌隔夜,接著用二氯甲烷稀釋,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將粗1-((4-((((烯丙氧基)羰基)((1R,2S)-2-苯基環丙基)胺基)甲基)-4-((環丁基甲氧基)甲基)哌啶-1-基)甲基)環丙烷甲酸第三丁酯溶解於THF (2 mL)中,接著添加肆(三苯基膦)鈀(0)(6 mg,0.005 mmol)及N-乙基乙胺(56 μL,0.54 mmol)。用氮氣吹掃所得反應混合物,接著在85℃下攪拌2小時。將反應混合物冷卻至室溫,過濾且在真空中濃縮。將粗1-((4-((環丁基甲氧基)甲基)-4-((((1R,2S)-2-苯基環丙基)胺基)甲基)哌啶-1-基)甲基)環丙烷甲酸第三丁酯溶解於DCM (1 mL)中,接著添加TFA (1 mL)。在室溫下將混合物攪拌3小時,且接著濃縮。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化殘餘物,得到呈TFA鹽形式之所需產物。C26
H39
N2
O3
之LC-MS計算值[M+H]+
: m/z = 427.3;實驗值427.2。實例 93 1-{[4-[( 環丁基甲氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
在室溫下將1-甲醯基環丁烷甲酸甲酯(實例 32 步驟 1
:10 mg,0.073 mmol)、三乙胺(14 μL,0.097 mmol)及({4-[(環丁基甲氧基)甲基]哌啶-4-基}甲基)[(1R,2S)-2-苯基環丙基]胺基甲酸烯丙酯(實例 92 步驟 6
:20 mg,0.049 mmol)於二氯甲烷(0.6 mL)中之混合物攪拌1小時,接著將三乙醯氧基硼氫化鈉(20 mg,0.097 mmol)添加至反應混合物中。在室溫下將反應混合物攪拌隔夜,接著用二氯甲烷稀釋,用飽和NaHCO3
溶液、水及鹽水洗滌。分離各層且經Na2
SO4
乾燥有機層,過濾且在真空中濃縮。將粗1-((4-((((烯丙氧基)羰基)((1R,2S)-2-苯基環丙基)胺基)甲基)-4-((環丁基甲氧基)甲基)哌啶-1-基)甲基)環丁烷甲酸甲酯溶解於THF (2 mL)中,接著添加肆(三苯基膦)鈀(0)(6 mg,0.005 mmol)及N-乙基乙胺(56 μL,0.54 mmol)。用氮氣吹掃所得反應混合物,接著在85℃下攪拌2小時。將混合物冷卻至室溫,過濾且在真空中濃縮。將粗1-((4-((環丁基甲氧基)甲基)-4-((((1R,2S)-2-苯基環丙基)胺基)甲基)哌啶-1-基)甲基)環丁烷甲酸甲酯溶解於THF (1 mL)及MeOH (1 mL)中,接著將於水(0.5 mL)中之單水合氫氧化鋰(20 mg)添加至所得溶液中。在40℃下將所得反應混合物攪拌5小時,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C27
H41
N2
O3
之LC-MS計算值[M+H]+
: m/z = 441.3;實驗值441.3。實例 94 1-{[4-[( 環己氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 : 4-[( 苯甲氧基 ) 甲基 ]-4-( 苯氧基甲基 ) 哌啶 -1- 甲酸第三丁酯
在室溫下向4-[(苯甲氧基)甲基]-4-(羥甲基)哌啶-1-甲酸第三丁酯(實例 53 步驟 1
:450 mg,1.34 mmol)、苯酚(252 mg,2.68 mmol)及三苯基膦(704 mg,2.68 mmol)於甲苯(10 mL)中之溶液中逐滴添加偶氮二甲酸二異丙酯(560 μL,2.7 mmol)。在65℃下將反應混合物攪拌隔夜,接著冷卻至室溫且在減壓下濃縮。藉由矽膠管柱層析(用含EtOAc之己烷(0-20%)進行梯度溶離)純化殘餘物,得到所需產物(530 mg,96%)。C20
H26
NO2
之LC-MS計算值[M-Boc+2H]+
: m/z = 312.2;實驗值312.1。步驟 2 : 4-[( 環己氧基 ) 甲基 ]-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
向4-[(苯甲氧基)甲基]-4-(苯氧基甲基)哌啶-1-甲酸第三丁酯(530 mg,1.3 mmol)於甲醇(5 mL)中之溶液中添加鈀(10重量%/活性碳,138 mg,0.13 mmol)。在室溫下在氫氣之正壓下將反應混合物攪拌2小時,接著經由矽藻土墊過濾且在減壓下濃縮。將粗4-(羥甲基)-4-(苯氧基甲基)哌啶-1-甲酸第三丁酯溶解於MeOH (20 mL)中,接著將銠(5重量%/活性碳,535 mg,0.26 mmol)添加至所得溶液中。在室溫下在45 psi氫氣下將所得反應混合物攪拌3天。經由矽藻土墊過濾混合物且在減壓下濃縮。步驟 2
之粗標題產物未經進一步純化即用於下一步中。C14
H26
NO4
之LC-MS計算值[M-t
Bu+2H]+
: m/z = 272.2;實驗值272.1。步驟 3 : 1-{[4-[( 環己氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 92 步驟 4-7
所述類似之程序,以4-[( 環己氧基 ) 甲基 ]-4-( 羥甲基 ) 哌啶 -1- 甲酸第三丁酯
為起始物來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C27
H41
N2
O3
之LC-MS計算值[M+H]+
: m/z = 441.3;實驗值441.3。實例 95 1-{[4-[( 環己氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸 步驟 1 : ({4-[( 環己氧基 ) 甲基 ] 哌啶 -4- 基 } 甲基 )[(1R,2S)-2- 苯基環丙基 ] 胺基甲酸烯丙酯
此化合物係使用與對於實例 92 步驟 4-6
所述類似之程序,以4-[(環己氧基)甲基]-4-(羥甲基)哌啶-1-甲酸第三丁酯( 實例 94 步驟 2)
為起始物替代4-[(環丁基甲氧基)甲基]-4-(羥甲基)哌啶-1-甲酸第三丁酯來製備。C26
H39
N2
O3
之LC-MS計算值[M+H]+
: m/z = 427.3;實驗值427.3。步驟 2 : 1-{[4-[( 環己氧基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 93
所述類似之程序,以({4-[(環己氧基)甲基]哌啶-4-基}甲基)[(1R,2S)-2-苯基環丙基]胺基甲酸烯丙酯為起始物替代({4-[(環丁基甲氧基)甲基]哌啶-4-基}甲基)[(1R,2S)-2-苯基環丙基]胺基甲酸烯丙酯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C28
H43
N2
O3
之LC-MS計算值[M+H]+
: m/z = 455.3;實驗值455.3。實例 96 1-{[4-[(5- 氟吡啶 -2- 基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸 步驟 1 :甲烷磺酸 (5- 氟吡啶 -2- 基 ) 甲酯
在0℃下將甲烷磺醯氯(0.91 mL,12 mmol)添加至(5-氟吡啶-2-基)甲醇(Pharmablock,目錄號PB112906)(1.00 g,7.87 mmol)及N,N-二異丙基乙胺(2.0 mL,12 mmol)於二氯甲烷(20 mL)中之混合物中。在室溫下將反應混合物攪拌隔夜,且在減壓下濃縮。藉由矽膠管柱急驟層析(用含乙酸乙酯之己烷(0-55%)進行梯度溶離)純化殘餘物,得到所需產物(0.63 g,39%)。C7
H9
FNO3
S之LC-MS計算值[M+H]+
: m/z = 206.0;實驗值206.1。步驟 2 : 1-{[4-[(5- 氟吡啶 -2- 基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 31
所述類似之程序,在步驟 1
中用甲烷磺酸(5-氟吡啶-2-基)甲酯替代α-溴-4-氟甲苯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C26
H33
FN3
O2
之LC-MS計算值[M+H]+
: m/z = 438.3;實驗值438.2。實例 97 1-{[4-[(5- 氟吡啶 -2- 基 ) 甲基 ]-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 32
及實例 31
所述類似之程序,在實例 31
之步驟 1
中用甲烷磺酸(5-氟吡啶-2-基)甲酯替代α-溴-4-氟甲苯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C27
H35
FN3
O2
之LC-MS計算值[M+H]+
: m/z = 452.3;實驗值452.2。實例 98 1-{[4-(4- 甲氧基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丙烷甲酸
此化合物係使用與對於實例 31
所述類似之程序,在步驟 1
中用對甲氧基苯甲基氯替代α-溴-4-氟甲苯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C28
H37
N2
O3
之LC-MS計算值[M+H]+
: m/z = 449.3;實驗值449.2。實例 99 1-{[4-(4- 甲氧基苯甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 甲基 } 環丁烷甲酸
此化合物係使用與對於實例 32
及實例 31
所述類似之程序,在實例 31
之步驟 1
中用對甲氧基苯甲基氯替代α-溴-4-氟甲苯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C29
H39
N2
O3
之LC-MS計算值[M+H]+
: m/z = 463.3;實驗值463.3。實例 100 ( 反 -4-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 環己基 ) 甲醇
將六氟磷酸苯并三唑-1-基氧基叁(二甲胺基)鏻(33 mg,0.075 mmol)添加至2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:20 mg,0.06 mmol)、反-4-(羥甲基)環己烷甲酸(TCI America ,目錄號 H1243
:13 mg,0.080 mmol)於乙腈(1.0 mL)中之混合物中,繼而添加三乙胺(26 μL,0.18 mmol)。在室溫下攪拌反應混合物隔夜。用飽和NaHCO3
水溶液淬滅反應混合物,且用乙酸乙酯萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。將粗2,2,2-三氟-N-((1-(4-(羥甲基)-環己烷羰基)-4-(甲氧基甲基)哌啶-4-基)甲基)-N-((1R,2S)-2-苯基環丙基)乙醯胺溶解於THF (1 mL)中,接著添加2 N NaOH (1 mL)。在60℃下將反應混合物攪拌2小時。冷卻至室溫之後,分離有機相,用TFA酸化,且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C25
H39
N2
O3
之LC-MS計算值[M+H]+
: m/z = 415.3;實驗值415.3。實例 101 ( 順 -4-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 環己基 ) 甲醇
此化合物係使用與對於實例 100
所述類似之程序,用順-4-(羥甲基)環己烷甲酸(TCI America ,目錄號 H1242
)替代反-4-(羥甲基)環己烷甲酸來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C25
H39
N2
O3
之LC-MS計算值[M+H]+
: m/z = 415.3;實驗值415.3。實例 102 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 環丙烷甲腈
此化合物係使用與對於實例 100
所述類似之程序,用1-氰基環丙烷甲酸(Aldrich ,目錄號 343390
)替代反-4-(羥甲基)環己烷甲酸來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C22
H30
N3
O2
之LC-MS計算值[M+H]+
: m/z = 368.2;實驗值368.1。實例 103 2-(4-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 }-1H- 吡唑 -1- 基 ) 乙醇 步驟 1 : 2,2,2- 三氟 -N-{[4-( 甲氧基甲基 )-1-(1H- 吡唑 -4- 基羰基 ) 哌啶 -4- 基 ] 甲基 }-N-[(1R,2S)-2- 苯基環丙基 ] 乙醯胺
將N,N-二異丙基乙胺(0.59 mL,3.4 mmol)添加至2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:0.50 g,1.3 mmol)、1H-吡唑-4-甲酸(Ark Pharm ,目錄號 AK-25877
:0.18 g,1.6 mmol)及六氟磷酸苯并三唑-1-基氧基叁(二甲胺基)鏻(0.71 g,1.6 mmol)於乙腈(5 mL)中之混合物中。在室溫下將反應混合物攪拌隔夜,且在減壓下濃縮。藉由矽膠管柱急驟層析(用含0%至5% MeOH之DCM進行梯度溶離)純化殘餘物,得到所需產物。C23
H28
F3
N4
O3
之LC-MS計算值[M+H]+
: m/z = 465.2;實驗值464.9。步驟 2 : 2-(4-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 }-1H- 吡唑 -1- 基 ) 乙醇
在100℃下加熱2,2,2-三氟-N-{[4-(甲氧基甲基)-1-(1H-吡唑-4-基羰基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(50. mg,0.11 mmol)、2-溴乙醇(30 mg,0.2 mmol)、碳酸銫(70. mg,0.22 mmol)於N,N-二甲基甲醯胺(1.5 mL)中之混合物隔夜。將反應混合物冷卻至室溫,接著用飽和NaHCO3
水溶液淬滅,且用乙酸乙酯萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。將粗2,2,2-三氟-N-((1-(1-(2-羥基乙基)-1H-吡唑-4-羰基)-4-(甲氧基甲基)哌啶-4-基)甲基)-N-((1R,2S)-2-苯基環丙基)乙醯胺溶解於THF (2 mL)中,接著添加2 N NaOH (2 mL)。在80℃下將反應混合物攪拌2小時。將反應混合物冷卻至室溫,接著用水稀釋且用乙酸乙酯萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化殘餘物,得到呈TFA鹽形式之所需產物。C23
H33
N4
O3
之LC-MS計算值[M+H]+
: m/z = 413.3;實驗值413.0。實例 104 (1R,2S)-N-{[1-{[1-(2- 甲氧基乙基 )-1H- 吡唑 -4- 基 ] 羰基 }-4-( 甲氧基甲基 ) 哌啶 -4- 基 ] 甲基 }-2- 苯基環丙胺
此化合物係使用與對於實例 103
所述類似之程序,在步驟 2
中用1-溴-2-甲氧基乙烷替代2-溴乙醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C24
H35
N4
O3
之LC-MS計算值[M+H]+
: m/z = 427.3;實驗值427.0。實例 105 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(1- 甲基 -1H- 吡唑 -4- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
此化合物係使用與對於實例 103
所述類似之程序,在步驟 2
中用碘甲烷替代2-溴乙醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C22
H31
N4
O2
之LC-MS計算值[M+H]+
: m/z = 383.2;實驗值383.2。實例 106 3-(4-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 }-1H- 吡唑 -1- 基 ) 丙腈
在80℃下將2,2,2-三氟-N-{[4-(甲氧基甲基)-1-(1H-吡唑-4-基羰基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 103 步驟 1
:30. mg,0.064 mmol)及2-丙烯腈(4.5 mg,0.084 mmol)於乙腈(1.0 mL)中之反應混合物攪拌2天。將反應混合物冷卻至室溫,用水稀釋且接著用乙酸乙酯萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。將粗N-((1-(1-(2-氰基乙基)-1H-吡唑-4-羰基)-4-(甲氧基甲基)哌啶-4-基)甲基)-2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺溶解於MeOH (1 mL)及THF (1 mL)中,接著添加單水合氫氧化鋰(0.0083 g,0.20 mmol)於水(1 mL)中之溶液。在60℃下將所得反應混合物攪拌隔夜,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C24
H32
N5
O2
之LC-MS計算值[M+H]+
: m/z = 422.3;實驗值422.2。實例 107 3-(3-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 }-1H- 吡唑 -1- 基 ) 丙腈
此化合物係使用與對於實例 106
及實例 103 步驟 1
所述類似之程序,在實例 103
之步驟 1
中用1H-吡唑-3-甲酸替代1H-吡唑-4-甲酸來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C24
H32
N5
O2
之LC-MS計算值[M+H]+
: m/z = 422.3;實驗值422.2。實例 108 2-(3-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 }-1H- 吡唑 -1- 基 ) 乙醇
此化合物係使用與對於實例 103
所述類似之程序,用1H-吡唑-3-甲酸替代1H-吡唑-4-甲酸來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C23
H33
N4
O3
之LC-MS計算值[M+H]+
: m/z = 413.3;實驗值413.2。實例 109 (3R)-1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 哌啶 -3- 醇
在0℃下將光氣(15重量%於甲苯中,80 μL,0.1 mmol)添加至2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:30 mg,0.08 mmol)及三乙胺(30 μL,0.2 mmol)於乙腈(1.2 mL)中之混合物中。在室溫下將所得反應混合物攪拌1小時,接著在減壓下濃縮。將粗4-(甲氧基甲基)-4-((2,2,2-三氟-N-((1R,2S)-2-苯基環丙基)乙醯胺基)甲基)哌啶-1-羰基氯溶解於乙腈(1 mL)中,接著添加(3R)-哌啶-3-醇(PharmaBlock ,目錄號 PB00798
:12 mg,0.12 mmol)及三乙胺(20 μL,0.2 mmol)。在室溫下將反應混合物攪拌30分鐘,接著添加2 N NaOH (1 mL)。在60℃下將反應混合物攪拌1小時,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C23
H36
N3
O3
之LC-MS計算值[M+H]+
: m/z = 402.3;實驗值402.3。實例 110 (3S)-1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 哌啶 -3- 醇
此化合物係使用與對於實例 109
所述類似之程序,用(3S)-哌啶-3-醇(PharmaBlock ,目錄號 PB00799
)替代(3R)-哌啶-3-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C23
H36
N3
O3
之LC-MS計算值[M+H]+
: m/z = 402.3;實驗值402.2。實例 111 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 氮雜環丁烷 -3- 醇
此化合物係使用與對於實例 109
所述類似之程序,用氮雜環丁烷-3-醇鹽酸鹽(Oakwood ,目錄號 013898
)替代(3R)-哌啶-3-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C21
H32
N3
O3
之LC-MS計算值[M+H]+
: m/z = 374.2;實驗值374.2。實例 112 1-{[4-( 甲氧基甲基 )-4-({[(1R,2S)-2- 苯基環丙基 ] 胺基 } 甲基 ) 哌啶 -1- 基 ] 羰基 } 哌啶 -4- 醇
此化合物係使用與對於實例 109
所述類似之程序,用4-羥基哌啶(Aldrich ,目錄號 128775
)替代(3R)-哌啶-3-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C23
H36
N3
O3
之LC-MS計算值[M+H]+
: m/z = 402.3;實驗值402.3。實例 113 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(4- 甲氧基哌啶 -1- 基 ) 羰基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
此化合物係使用與對於實例 109
所述類似之程序,用4-甲氧基哌啶(Acros Organics ,目錄號 39339
)替代(3R)-哌啶-3-醇來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C24
H38
N3
O3
之LC-MS計算值[M+H]+
: m/z = 416.3;實驗值416.3。實例 114 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(1- 甲基 -1H- 吡唑 -4- 基 ) 磺醯基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
向2,2,2-三氟-N-{[4-(甲氧基甲基)哌啶-4-基]甲基}-N-[(1R,2S)-2-苯基環丙基]乙醯胺(實例 35 步驟 6
:30 mg,0.08 mmol)及N,N-二異丙基乙胺(30 μL,0.2 mmol)於乙腈(1.0 mL)中之溶液中添加1-甲基-1H-吡唑-4-磺醯氯(ChemBridge
,目錄號 4035233
:18 mg,0.097 mmol)。在室溫下將反應混合物攪拌30分鐘,接著用飽和NaHCO3
水溶液淬滅,且用乙酸乙酯萃取。用鹽水洗滌合併之有機層,經Na2
SO4
乾燥,過濾且在減壓下濃縮。將粗2,2,2-三氟-N-((4-(甲氧基甲基)-1-((1-甲基-1H-吡唑-4-基)磺醯基)哌啶-4-基)甲基)-N-((1R,2S)-2-苯基環丙基)乙醯胺溶解於THF (1 mL)中,接著添加1.0 M氫氧化鈉之水溶液(1 mL,1 mmol)。在80℃下將反應混合物攪拌1小時,接著冷卻至室溫且藉由製備型HPLC (pH = 2,乙腈/水+TFA)純化,得到呈TFA鹽形式之所需產物。C21
H31
N4
O3
S之LC-MS計算值[M+H]+
: m/z = 419.2;實驗值419.2。實例 115 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(1- 甲基 -1H- 吡唑 -5- 基 ) 磺醯基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
此化合物係使用與對於實例 114
所述類似之程序,用1-甲基-1H-吡唑-5-磺醯氯(MayBridge ,目錄號 CC62303
)替代1-甲基-1H-吡唑-4-磺醯氯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C21
H31
N4
O3
S之LC-MS計算值[M+H]+
: m/z = 419.2;實驗值419.2。實例 116 (1R,2S)-N-({4-( 甲氧基甲基 )-1-[(1- 甲基 -1H- 吡唑 -3- 基 ) 磺醯基 ] 哌啶 -4- 基 } 甲基 )-2- 苯基環丙胺
此化合物係使用與對於實例 114
所述類似之程序,用1-甲基-1H-吡唑-3-磺醯氯(MayBridge ,目錄號 CC48303
)替代1-甲基-1H-吡唑-4-磺醯氯來製備。用製備型HPLC (pH = 2,乙腈/水+TFA)純化反應混合物,得到呈TFA鹽形式之所需產物。C21
H31
N4
O3
S之LC-MS計算值[M+H]+
: m/z = 419.2;實驗值419.1。實例 A : LSD1 組蛋白去甲基酶生物化學分析
LANCE LSD1/KDM1A去甲基酶分析:在25℃下將10 μL之於分析緩衝液(50 mM Tris (pH 7.5)、0.01% Tween-20、25 mM NaCl、5 mM DTT)中之1 nM LSD-1酶(ENZO BML-SE544-0050)與點樣於黑色384孔聚苯乙烯培養盤中之0.8 μL化合物/DMSO一起預先培育1小時。藉由添加10 μL含有0.4 μM經生物素標記之組蛋白H3肽受質之分析緩衝液來開始反應:ART-K(Me1)-QTARKSTGGKAPRKQLA-GGK(生物素)SEQ ID NO:1(AnaSpec 64355),且在25℃下培育1小時。藉由添加10 μL補充有1.5 nM Eu-抗未經修飾之H3K4抗體(PerkinElmer TRF0404)及225 nM LANCE Ultra抗生蛋白鏈菌素(PerkinElmer TRF102)以及0.9 mM反苯環丙胺(Tranylcypromine)-HCl(Millipore 616431)之1 X LANCE偵測緩衝液(PerkinElmer CR97-100)使反應停止。在停止反應後,將培養盤培育30分鐘且在PHERAstar FS培養盤讀數器(BMG Labtech)上讀數。IC50
為1 μM或小於1 μM之化合物被認為具有活性。實例化合物之IC50
數據提供於表1中(+係指IC50
≤ 100 nM;++係指IC50
> 100 nM且≤ 500 nM)。表 1
| 實例編號 | IC50 (nM) |
| 1 | ++ |
| 2 | + |
| 3 | ++ |
| 4 | ++ |
| 5 | + |
| 6 | + |
| 7 | + |
| 8 | + |
| 9 | + |
| 10 | + |
| 11 | + |
| 12 | + |
| 13 | + |
| 14 | + |
| 15 | + |
| 16 | + |
| 17 | + |
| 18 | + |
| 19 | + |
| 20 | + |
| 21 | + |
| 22 | + |
| 23 | + |
| 24 | + |
| 25 | + |
| 26 | + |
| 27 | + |
| 28 | + |
| 29 | + |
| 30 | + |
| 31 | + |
| 32 | + |
| 33 | + |
| 34 | + |
| 35 | + |
| 36 | + |
| 37 | + |
| 38 | + |
| 39 | + |
| 40 | + |
| 41 | + |
| 42 | + |
| 43 | + |
| 44 | + |
| 45 | + |
| 46 | + |
| 47 | + |
| 48 | + |
| 49 | + |
| 50 | + |
| 51 | + |
| 52 | + |
| 53 | + |
| 54 | + |
| 55 | + |
| 56 | + |
| 57 | + |
| 58 | + |
| 59 | + |
| 60 | + |
| 61 | + |
| 62 | + |
| 63 | + |
| 64 | + |
| 65 | + |
| 66 | + |
| 67 | + |
| 68 | + |
| 69 | + |
| 70 | + |
| 71 | + |
| 72 | + |
| 73 | + |
| 74 | + |
| 75 | + |
| 76 | + |
| 77 | + |
| 78 | + |
| 79 | + |
| 80 | + |
| 81 | + |
| 82 | + |
| 83 | + |
| 84 | + |
| 85 | + |
| 86 | + |
| 87 | + |
| 88 | + |
| 89 | + |
| 90 | + |
| 91 | + |
| 92 | + |
| 93 | + |
| 94 | + |
| 95 | + |
| 96 | + |
| 97 | + |
| 98 | + |
| 99 | + |
| 100 | + |
| 101 | + |
| 102 | + |
| 103 | + |
| 104 | + |
| 105 | + |
| 106 | + |
| 107 | + |
| 108 | + |
| 109 | + |
| 110 | + |
| 111 | + |
| 112 | + |
| 113 | + |
| 114 | + |
| 115 | + |
| 116 | + |
除本文所述之修改之外,對本發明之各種修改對於熟習此項技術者而言將根據上述描述而為顯而易見的。該等修改亦意欲屬於隨附申請專利範圍之範疇內。本申請案中所引用之包括所有專利、專利申請案及出版物之各參考文獻以全文引用之方式併入本文中。
Claims (55)
- 一種下式化合物或其醫藥學上可接受之鹽之用途,
- 如請求項1之用途,其中n為0。
- 如請求項1之用途,其中n為1。
- 如請求項1之用途,其中n為2。
- 如請求項1之用途,其中各R1係獨立地選自鹵基及-O-(C1-6烷基)。
- 如請求項1之用途,其中各R1係獨立地選自F及甲氧基。
- 如請求項1之用途,其中R6為H。
- 如請求項1之用途,其中R6係選自H及C1-4烷基。
- 如請求項1之用途,其中R6為甲基。
- 如請求項1之用途,其中L為-(CH2)r-,其中r為1、2或3。
- 如請求項1之用途,其中L為-CH2-。
- 如請求項1之用途,其中環C為環戊基。
- 如請求項1之用途,其中環C為環丁基。
- 如請求項1之用途,其中RZ為C1-4烷基、苯基-C1-4烷基-或(5員至6員雜芳基)-C1-4烷基-,其中該C1-4烷基、苯基-C1-4烷基-及(5員至6員雜芳基)-C1-4烷基-各自視情況經CN、鹵基、C1-6烷氧基或C1-4氰基烷基取代。
- 如請求項1之用途,其中RZ為C1-4烷基或苯基-C1-4烷基-,其中該C1-4烷基及苯基-C1-4烷基-各自視情況經CN、鹵基、C1-6烷氧基或C1-4氰基烷基取代。
- 如請求項1之用途,其中RZ為C1-4烷基。
- 如請求項1之用途,其中RZ為經氟或氰甲基取代之苯基-C1-4烷基-。
- 如請求項1之用途,其中RZ為經甲氧基或CN取代之C1-4烷基。
- 如請求項1之用途,其中RZ為經甲氧基或F取代之(5員至6員雜芳基)-C1-4烷基-。
- 如請求項1之用途,其中RZ為甲基、氰甲基、甲氧基甲基、4-氟苯基甲基或4-(氰甲基)苯基甲基。
- 如請求項1之用途,其中RZ為甲基、氰甲基、甲氧基甲基、乙氧基甲基、4-氟苯基甲基、3-氰基苯基甲基、4-氰基苯基甲基、(6-甲氧基吡啶-3-基)甲基、4-氰基-2-氟苯甲基、(5-氟吡啶-2-基)甲基、4-甲氧基苯基甲基或4-(氰甲基)苯基甲基。
- 如請求項1之用途,其中RZ為經CN取代之C1-4烷基。
- 如請求項1之用途,其中RZ為氰甲基。
- 如請求項1之用途,其中RZ為甲氧基甲基。
- 如請求項1之用途,其中該化合物具有關於請求項1中化學式I所描繪之經二取代之環丙基之反式組態。
- 如請求項1之用途,其中該化合物係選自:1-{[4-(4-氟苯甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;及1-{[4-甲基-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;或上述任一者之醫藥學上可接受之鹽。
- 如請求項1之用途,其中該化合物係選自:1-{[4-({[(1R,2S)-2-(2-氟苯基)環丙基]胺基}甲基)-4-(甲氧基甲基)哌 啶-1-基]甲基}環丁烷甲酸;1-{[4-({[(1R,2S)-2-(3,4-二氟苯基)環丙基]胺基}甲基)-4-(甲氧基甲基)哌啶-1-基]甲基}環丁烷甲酸;1-{[4-(3-氰基苯甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;1-{[4-(4-甲氧基苯甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;1-{[4-(甲氧基甲基)-4-({[2-(2-甲氧基苯基)環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;1-{[4-(甲氧基甲基)-4-({[2-(4-甲氧基苯基)環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;1-{[4-(甲氧基甲基)-4-(1-{[(1R,2S)-2-苯基環丙基]胺基}乙基)哌啶-1-基]甲基}環丁烷甲酸;1-{[4-[(5-氟吡啶-2-基)甲基]-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;及1-{[4-[4-(氰甲基)苯甲基]-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸;或上述任一者之醫藥學上可接受之鹽。
- 如請求項1之用途,其中該化合物係1-{[4-(甲氧基甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環戊烷甲酸,或其醫藥學上可接受之鹽。
- 如請求項1之用途,其中該化合物係1-{[4-(甲氧基甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環戊烷甲酸。
- 如請求項1之用途,其中該化合物係1-{[4-(甲氧基甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸,或其醫藥學上可接受之鹽。
- 如請求項1之用途,其中該化合物係1-{[4-(甲氧基甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸。
- 如請求項1之用途,其中該化合物係1-{[4-({[(1R,2S)-2-(4-氟苯基)環丙基]胺基}甲基)-4-(甲氧基甲基)哌啶-1-基]甲基}環丁烷甲酸,或其醫藥學上可接受之鹽。
- 如請求項1之用途,其中該化合物係1-{[4-({[(1R,2S)-2-(4-氟苯基)環丙基]胺基}甲基)-4-(甲氧基甲基)哌啶-1-基]甲基}環丁烷甲酸。
- 如請求項1之用途,其中該化合物係1-{[4-(乙氧基甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸,或其醫藥學上可接受之鹽。
- 如請求項1之用途,其中該化合物係1-{[4-(乙氧基甲基)-4-({[(1R,2S)-2-苯基環丙基]胺基}甲基)哌啶-1-基]甲基}環丁烷甲酸。
- 如請求項1至35中任一項之用途,其中該疾病為癌症。
- 如請求項36之用途,其中該癌症為血液學癌症。
- 如請求項37之用途,其中該血液學癌症係選自急性淋巴母細胞性白血病(ALL)、急性骨髓性白血病(AML)、急性前髓細胞性白血病(APL)、慢性淋巴球性白血病(CLL)、慢性骨髓性白血病(CML)、瀰漫性大B細胞淋巴瘤(DLBCL)、套膜細胞淋巴瘤、非霍奇金淋巴瘤(Non-Hodgkin lymphoma)、霍奇金淋巴瘤、真性紅血球增多症(PV)、自發性血小板增多症(ET)、脊髓發育不良症候群(MDS)或多發性骨髓瘤。
- 如請求項37之用途,其中該血液學癌症係復發型或難治型非霍奇金淋巴瘤或復發性濾泡性非霍奇金淋巴瘤。
- 如請求項37之用途,其中該血液學癌症係急性骨髓性白血病。
- 如請求項37之用途,其中該血液學癌症係原發性骨髓纖維化(PMF)。
- 如請求項36之用途,其中該癌症為肉瘤、肺癌、胃腸癌、生殖泌尿道癌、肝癌、骨癌、神經系統癌、婦科癌症或皮膚癌。
- 如請求項36之用途,其中該癌症為乳癌、卵巢癌或前列腺癌。
- 如請求項36之用途,其中該癌症為肺癌。
- 如請求項36之用途,其中該癌症為支氣管癌、肺泡小支氣管癌、支氣管腺瘤、軟骨錯構瘤及間皮瘤。
- 如請求項36之用途,其中該癌症為非小細胞肺癌。
- 如請求項36之用途,其中該癌症為尤文氏(Ewing's)肉瘤。
- 如請求項36之用途,其中該一或多個額外治療劑係選自由以下組成之群:化學治療劑、抗增生劑、JAK激酶抑制劑、Pim激酶抑制劑、PI3激酶抑制劑、MEK抑制劑、細胞週期素依賴性激酶抑制劑、b-RAF抑制劑、mTOR抑制劑、蛋白酶體抑制劑、HDAC抑制劑、DNA甲基轉移酶抑制劑、溴區及額外末端(bromo and extra terminal)家族成員抑制劑、吲哚胺2,3-二氧酶抑制劑、作為抗癌劑之生物藥物及調節微環境或免疫反應之藥物。
- 如請求項36之用途,其中該一或多個額外治療劑係選自由以下組成之群:阿巴瑞克(abarelix)、阿地介白素(aldesleukin)、阿侖單抗(alemtuzumab)、阿利維甲酸(alitretinoin)、別嘌呤醇(allopurinol)、六甲蜜胺(altretamine)、阿那曲唑(anastrozole)、三氧化二砷、天冬醯胺酶、 阿紮胞苷、苯達莫司汀(bendamustine)、貝伐單抗(bevacizumab)、蓓薩羅丁(bexarotene)、博來黴素(bleomycin)、硼替佐必(bortezombi)、硼替佐米(bortezomib)、白消安(busulfan)(靜脈內)、白消安(經口)、卡普睪酮(calusterone)、卡培他濱(capecitabine)、卡鉑(carboplatin)、卡莫司汀(carmustine)、西妥昔單抗(cetuximab)、苯丁酸氮芥(chlorambucil)、順鉑(cisplatin)、克拉屈濱(cladribine)、氯法拉濱(clofarabine)、環磷醯胺(cyclophosphamide)、阿糖胞苷(cytarabine)、達卡巴嗪(dacarbazine)、放線菌素(dactinomycin)、達肝素鈉(dalteparin sodium)、達沙替尼(dasatinib)、道諾黴素(daunorubicin)、地西他濱(decitabine)、地尼介白素(denileukin)、地尼介白素融合毒素(denileukin diftitox)、右雷佐生(dexrazoxane)、多烯紫杉醇(docetaxel)、小紅莓(doxorubicin)、丙酸屈他雄酮(dromostanolone propionate)、艾庫組單抗(eculizumab)、表柔比星(epirubicin)、埃羅替尼(erlotinib)、雌莫司汀(estramustine)、磷酸依託泊苷(etoposide phosphate)、依託泊苷(etoposide)、依西美坦(exemestane)、檸檬酸芬太尼(fentanyl citrate)、非格司亭(filgrastim)、氟尿苷(floxuridine)、氟達拉濱(fludarabine)、氟尿嘧啶(fluorouracil)、氟維司群(fulvestrant)、吉非替尼(gefitinib)、吉西他濱(gemcitabine)、奧吉妥珠單抗奧佐米星(gemtuzumab ozogamicin)、乙酸戈舍瑞林(goserelin acetate)、乙酸組胺瑞林(histrelin acetate)、替伊莫單抗(ibritumomab tiuxetan)、伊達比星(idarubicin)、異環磷醯胺(ifosfamide)、甲磺酸伊馬替尼(imatinib mesylate)、干擾素α2a、伊立替康(irinotecan)、二甲苯磺酸拉帕替尼(lapatinib ditosylate)、來那度胺(lenalidomide)、來曲唑(letrozole)、甲醯四氫葉酸(leucovorin)、乙酸亮丙瑞林(leuprolide acetate)、左旋咪唑(levamisole)、洛莫司汀(lomustine)、氮芥(meclorethamine)、乙酸甲地孕酮(megestrol acetate)、美法侖(melphalan)、巰基嘌呤(mercaptopurine)、胺甲喋呤(methotrexate)、甲氧沙林(methoxsalen)、絲裂黴素C(mitomycin C)、米托坦(mitotane)、米托蒽醌(mitoxantrone)、苯丙酸諾龍(nandrolone phenpropionate)、奈拉濱(nelarabine)、諾莫單抗(nofetumomab)、奧沙利鉑(oxaliplatin)、紫杉醇(paclitaxel)、帕米膦酸鹽(pamidronate)、帕尼單抗(panitumumab)、帕比司他(panobinostat)、培加帕酶(pegaspargase)、培非格司亭(pegfilgrastim)、培美曲塞二鈉(pemetrexed disodium)、噴司他丁(pentostatin)、哌泊溴烷(pipobroman)、普卡黴素(plicamycin)、丙卡巴肼(procarbazine)、奎納克林(quinacrine)、拉布立酶(rasburicase)、利妥昔單抗(rituximab)、盧佐替尼(ruxolitinib)、索拉非尼(sorafenib)、鏈脲黴素(streptozocin)、舒尼替尼(sunitinib)、順丁烯二酸舒尼替尼、他莫昔芬(tamoxifen)、替莫唑胺(temozolomide)、替尼泊甙(teniposide)、睪內酯(testolactone)、沙利度胺(thalidomide)、硫鳥嘌呤(thioguanine)、噻替派(thiotepa)、拓撲替康(topotecan)、托瑞米芬(toremifene)、托西莫單抗(tositumomab)、曲妥珠單抗(trastuzumab)、維甲酸(tretinoin)、尿嘧啶氮芥(uracil mustard)、戊柔比星(valrubicin)、長春鹼(vinblastine)、長春新鹼(vincristine)、長春瑞濱(vinorelbine)、伏立諾他(vorinostat)、唑來膦酸鹽(zoledronate)、硼替佐米、卡非佐米(Carfilzomib)、帕比司他(panobinostat)、地塞米松(dexamethasone)、PI3K-δ選擇性抑制劑及廣譜PI3K抑制劑、抗體及細胞介素。
- 如請求項36之用途,其中該一或多個額外治療劑係免疫治療藥物。
- 如請求項36之用途,其中該一或多個額外治療劑係選自由以下組成之群:抗Her2抗體、抗CD20抗體、抗CTLA1藥物、抗PD-1藥物及抗PDL1藥物。
- 如請求項1至35中任一項之用途,其中該疾病為病毒性疾病或β-球蛋白病。
- 如請求項52之用途,其中該β-球蛋白病為鐮形血球貧血。
- 如請求項52之用途,其中該一或多個額外治療劑係選自由以下組成之群:抗生素、抗病毒劑、抗真菌劑、麻醉劑、消炎劑、類固醇及非類固醇消炎劑、抗過敏劑、胺基糖苷、氟喹啉酮(fluoroquinolones)、磺醯胺、四環素(tetracycline)、利福平衍生物(「利福平類」)、β-內醯胺、頭孢菌素(cephalosporin)、兩性黴素(amphotericin)及皮質類固醇。
- 如請求項52之用途,其中該一或多個額外治療劑係選自由以下組成之群:阿米卡星(amikacin)、慶大黴素(gentamycin)、妥布黴素(tobramycin)、鏈黴素(streptomycin)、奈替米星(netilmycin)、卡那黴素(kanamycin)、環丙沙星(ciprofloxacin)、諾氟沙星(norfloxacin)、氧氟沙星(ofloxacin)、曲伐沙星(trovafloxacin)、洛美沙星(lomefloxacin)、左氧氟沙星(levofloxacin)、依諾沙星(enoxacin)、啶(naphthyridine)、多黏 菌素(polymyxin)、氯黴素(chloramphenicol)、新黴素(neomycin)、巴龍黴素(paramomycin)、甲磺酸黏菌素(colistimethate)、桿菌肽(bacitracin)、萬古黴素(vancomycin)、利福平(rifampin)、環絲胺酸、氟康唑(fluconazole)、氟胞嘧啶(flucytosine)、納他黴素(natamycin)、咪康唑(miconazole)、酮康唑(ketoconazole)、雙氯芬酸(diclofenac)、氟比洛芬(flurbiprofen)、酮咯酸(ketorolac)、舒洛芬(suprofen)、色甘酸(cromolyn)、洛度沙胺(lodoxamide)、左卡巴斯汀(levocabastin)、奈甲嘧唑啉(naphazoline)、安塔洛林(antazoline)、苯吡胺(pheniramine)及氮雜內酯類抗生素。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201461939488P | 2014-02-13 | 2014-02-13 | |
| US61/939,488 | 2014-02-13 | ||
| US201462061283P | 2014-10-08 | 2014-10-08 | |
| US62/061,283 | 2014-10-08 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| TW202033497A TW202033497A (zh) | 2020-09-16 |
| TWI741478B true TWI741478B (zh) | 2021-10-01 |
Family
ID=52589819
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW109101686A TWI741478B (zh) | 2014-02-13 | 2015-02-12 | 作為lsd1抑制劑之環丙胺 |
| TW104104827A TWI685483B (zh) | 2014-02-13 | 2015-02-12 | 作為lsd1抑制劑之環丙胺 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW104104827A TWI685483B (zh) | 2014-02-13 | 2015-02-12 | 作為lsd1抑制劑之環丙胺 |
Country Status (31)
| Country | Link |
|---|---|
| US (4) | US9670210B2 (zh) |
| EP (2) | EP3105218B1 (zh) |
| JP (2) | JP6602778B2 (zh) |
| KR (1) | KR102421235B1 (zh) |
| CN (2) | CN111454188A (zh) |
| AU (2) | AU2015217073B2 (zh) |
| CA (1) | CA2939082C (zh) |
| CL (1) | CL2016002027A1 (zh) |
| CR (2) | CR20160396A (zh) |
| CY (1) | CY1122415T1 (zh) |
| DK (1) | DK3105218T3 (zh) |
| EC (1) | ECSP16073190A (zh) |
| ES (2) | ES2760261T3 (zh) |
| HR (1) | HRP20192167T1 (zh) |
| HU (1) | HUE046273T2 (zh) |
| IL (2) | IL247134B (zh) |
| LT (1) | LT3105218T (zh) |
| ME (1) | ME03654B (zh) |
| MX (2) | MX2016010395A (zh) |
| MY (1) | MY183499A (zh) |
| PE (1) | PE20161573A1 (zh) |
| PH (1) | PH12016501601A1 (zh) |
| PL (1) | PL3105218T3 (zh) |
| PT (1) | PT3105218T (zh) |
| RS (1) | RS59559B1 (zh) |
| SG (3) | SG11201606689VA (zh) |
| SI (1) | SI3105218T1 (zh) |
| TW (2) | TWI741478B (zh) |
| UA (1) | UA126541C2 (zh) |
| WO (1) | WO2015123465A1 (zh) |
| ZA (1) | ZA201606275B (zh) |
Families Citing this family (52)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3030323B1 (en) | 2013-08-06 | 2019-04-24 | Imago Biosciences Inc. | Kdm1a inhibitors for the treatment of disease |
| TWI741478B (zh) | 2014-02-13 | 2021-10-01 | 美商英塞特控股公司 | 作為lsd1抑制劑之環丙胺 |
| US9428470B2 (en) | 2014-02-13 | 2016-08-30 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| ES2672797T3 (es) | 2014-02-13 | 2018-06-18 | Incyte Corporation | Ciclopropilaminas como inhibidores de LSD1 |
| WO2015123437A1 (en) | 2014-02-13 | 2015-08-20 | Incyte Corporation | Cyclopropylamines as lsd1 inhibitors |
| US9346776B2 (en) | 2014-02-13 | 2016-05-24 | Takeda Pharmaceutical Company Limited | Fused heterocyclic compound |
| PL3105226T3 (pl) | 2014-02-13 | 2020-03-31 | Incyte Corporation | Cyklopropyloaminy jako inhibitory LSD1 |
| TW201613925A (en) | 2014-07-10 | 2016-04-16 | Incyte Corp | Imidazopyrazines as LSD1 inhibitors |
| WO2016007731A1 (en) | 2014-07-10 | 2016-01-14 | Incyte Corporation | Imidazopyridines and imidazopyrazines as lsd1 inhibitors |
| US9695167B2 (en) | 2014-07-10 | 2017-07-04 | Incyte Corporation | Substituted triazolo[1,5-a]pyridines and triazolo[1,5-a]pyrazines as LSD1 inhibitors |
| WO2016007727A1 (en) | 2014-07-10 | 2016-01-14 | Incyte Corporation | Triazolopyridines and triazolopyrazines as lsd1 inhibitors |
| JP6727216B2 (ja) | 2015-02-12 | 2020-07-22 | イマーゴ バイオサイエンシーズ インコーポレイテッド | 疾患の治療のためのkdm1a阻害剤 |
| MA51438A (fr) | 2015-04-03 | 2021-04-14 | Incyte Corp | Composés hétérocycliques utilisés en tant qu'inhibiteurs de lsd1 |
| JP6855466B2 (ja) | 2015-06-12 | 2021-04-07 | オリゾン ジェノミックス ソシエダッド アノニマ | Lsd1阻害剤に関連するバイオマーカーおよびそれらの使用 |
| WO2017013061A1 (en) | 2015-07-17 | 2017-01-26 | Oryzon Genomics, S.A. | Biomarkers associated with lsd1 inhibitors and uses thereof |
| TWI765860B (zh) * | 2015-08-12 | 2022-06-01 | 美商英塞特公司 | Lsd1抑制劑之鹽 |
| WO2017079476A1 (en) | 2015-11-05 | 2017-05-11 | Mirati Therapeutics, Inc. | Lsd1 inhibitors |
| SG11201805645QA (en) * | 2015-12-29 | 2018-07-30 | Mirati Therapeutics Inc | Lsd1 inhibitors |
| BR112018013074A2 (pt) | 2015-12-30 | 2018-12-11 | Novartis Ag | terapias de célula efetora imune com eficácia real-çada |
| EA201892075A1 (ru) | 2016-03-15 | 2019-04-30 | Оризон Дженомикс, С.А. | Комбинации ингибиторов lsd1 для применения для лечения солидных опухолей |
| CN107200706A (zh) * | 2016-03-16 | 2017-09-26 | 中国科学院上海药物研究所 | 一类氟取代的环丙胺类化合物及其制备方法、药物组合物和用途 |
| WO2017158136A1 (en) | 2016-03-16 | 2017-09-21 | Oryzon Genomics, S.A. | Methods to determine kdm1a target engagement and chemoprobes useful therefor |
| PE20190377A1 (es) | 2016-04-22 | 2019-03-08 | Incyte Corp | Formulaciones de un inhibidor de lsd 1 |
| EP3455204A1 (en) | 2016-05-09 | 2019-03-20 | Jubilant Biosys Ltd. | Cyclopropyl-amide compounds as dual lsd1/hdac inhibitors |
| CN107459476B (zh) * | 2016-06-03 | 2022-06-24 | 中国科学院上海药物研究所 | 反吲哚啉环丙胺类化合物及其制备方法、药物组合物和用途 |
| US11390590B2 (en) | 2016-08-16 | 2022-07-19 | Imago Biosciences, Inc. | Methods and processes for the preparation of KDM1A inhibitors |
| US20190256930A1 (en) | 2016-11-03 | 2019-08-22 | Oryzon Genomics, S.A. | Biomarkers for determining responsiveness to lsd1 inhibitors |
| WO2018083138A1 (en) | 2016-11-03 | 2018-05-11 | Oryzon Genomics, S.A. | Pharmacodynamic biomarkers for personalized cancer care using epigenetic modifying agents |
| KR102576586B1 (ko) * | 2017-01-24 | 2023-09-11 | 씨에스피씨 종콰이 팔마씨우티컬 테크놀로지 (스자좡) 컴퍼니 리미티드 | Lsd1 억제제 및 그의 제조방법과 용도 |
| CN106860453A (zh) * | 2017-02-17 | 2017-06-20 | 杨燕 | 一种治疗溃疡性结肠炎的药物组合物 |
| CN110914265B (zh) | 2017-05-15 | 2022-12-23 | 密歇根大学董事会 | 作为lsd-1抑制剂的吡咯并[2,3-c]吡啶和相关类似物 |
| US20200323828A1 (en) | 2017-08-03 | 2020-10-15 | Oryzon Genomics, S.A. | Methods of treating behavior alterations |
| US11685782B2 (en) | 2017-10-23 | 2023-06-27 | Children's Medical Center Corporation | Methods of treating cancer using LSD1 inhibitors in combination with immunotherapy |
| IL279260B2 (en) | 2018-05-11 | 2024-10-01 | Imago Biosciences Inc | KDM1A inhibitors for the treatment of diseases |
| US11944614B2 (en) | 2018-05-15 | 2024-04-02 | Regents Of The University Of Michigan | Imidazo[4,5-c]pyridine compounds as LSD-1 inhibitors |
| WO2020047198A1 (en) | 2018-08-31 | 2020-03-05 | Incyte Corporation | Salts of an lsd1 inhibitor and processes for preparing the same |
| CA3121202A1 (en) | 2018-11-30 | 2020-06-04 | Nuvation Bio Inc. | Pyrrole and pyrazole compounds and methods of use thereof |
| MX2021011254A (es) | 2019-03-20 | 2021-10-01 | Oryzon Genomics Sa | Metodos de tratamiento del trastorno por deficit de atencion e hiperactividad. |
| JP7536316B2 (ja) | 2019-03-20 | 2024-08-20 | オリソン ヘノミクス,ソシエダ アノニマ | 境界性パーソナリティ障害の処置方法 |
| EP3994280A1 (en) | 2019-07-05 | 2022-05-11 | Oryzon Genomics, S.A. | Biomarkers and methods for personalized treatment of small cell lung cancer using kdm1a inhibitors |
| WO2021058024A1 (zh) * | 2019-09-29 | 2021-04-01 | 南京明德新药研发有限公司 | Lsd1抑制剂 |
| CN115720580A (zh) * | 2020-04-21 | 2023-02-28 | 伊迪恩斯股份有限公司 | 用于制备酞嗪酮衍生物和其中间体的方法 |
| US12059419B2 (en) | 2020-10-16 | 2024-08-13 | Idience Co., Ltd. | Pharmaceutical composition comprising phthalazinone derivatives |
| CA3231846A1 (en) | 2021-04-08 | 2022-10-13 | Tamara Maes | Combinations of lsd1 inhibitors for treating myeloid cancers |
| KR20240049280A (ko) | 2021-08-18 | 2024-04-16 | 케모센트릭스, 인크. | Ccr6 억제제로서의 아릴 설포닐(하이드록시) 피페리딘 |
| JP2024532119A (ja) | 2021-08-18 | 2024-09-05 | ケモセントリックス,インコーポレイティド | Ccr6阻害剤としてのアリールスルホニル化合物 |
| WO2023067058A1 (en) | 2021-10-20 | 2023-04-27 | Queen Mary University Of London | Sequential treatments and biomarkers to reverse resistance to kinase inhibitors |
| GB202115017D0 (en) | 2021-10-20 | 2021-12-01 | Univ London Queen Mary | Sequential treatments and biomarkers to reverse resistance to kinase inhibitors |
| WO2023217784A1 (en) | 2022-05-09 | 2023-11-16 | Oryzon Genomics, S.A. | Methods of treating nf1-mutant tumors using lsd1 inhibitors |
| WO2023217758A1 (en) | 2022-05-09 | 2023-11-16 | Oryzon Genomics, S.A. | Methods of treating malignant peripheral nerve sheath tumor (mpnst) using lsd1 inhibitors |
| WO2024110649A1 (en) | 2022-11-24 | 2024-05-30 | Oryzon Genomics, S.A. | Combinations of lsd1 inhibitors and menin inhibitors for treating cancer |
| CN118787751A (zh) * | 2023-04-12 | 2024-10-18 | 中国科学院上海药物研究所 | Lsd1抑制剂与药物联用治疗癌症的用途 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012135113A2 (en) * | 2011-03-25 | 2012-10-04 | Glaxosmithkline Llc | Cyclopropylamines as lsd1 inhibitors |
Family Cites Families (320)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL7013068A (zh) | 1969-09-17 | 1971-03-19 | ||
| US4537889A (en) | 1982-12-27 | 1985-08-27 | Eli Lilly And Company | Inotropic agents |
| US4625040A (en) | 1984-09-24 | 1986-11-25 | Pennwalt Corporation | N-(phenyl) or N-(phenylcyclopropyl)-2,5-dihydro-2-oxo-4[(substituted phenyl)amino]-3-furancarboxamide derivatives |
| US4614810A (en) | 1984-09-24 | 1986-09-30 | Pennwalt Corporation | 4,5-dihydro-4-oxo-2-[(2-trans-phenylcyclopropyl)amino]-3-furancarboxylic acids and derivatives thereof |
| FR2607813B1 (fr) | 1986-12-05 | 1989-03-31 | Montpellier I Universite | Alkylamino-8 imidazo (1,2-a) pyrazines et derives, leur preparation et leur application en therapeutique |
| JPH032778Y2 (zh) | 1986-12-15 | 1991-01-24 | ||
| AU622330B2 (en) | 1989-06-23 | 1992-04-02 | Takeda Chemical Industries Ltd. | Condensed heterocyclic compounds having a nitrogen atom in the bridgehead for use as fungicides |
| JP2844351B2 (ja) | 1989-07-13 | 1999-01-06 | 株式会社科薬 | 安定なポリミキシン系抗生物質水性溶液 |
| IL96432A0 (en) | 1989-11-30 | 1991-08-16 | Schering Ag | Pesticidal compositions containing pyridine derivatives and novel pyridine derivatives |
| FR2662163A1 (fr) | 1990-05-16 | 1991-11-22 | Lipha | Nouvelles 8-amino-1,2,4-triazolo(4,3-a) pyrazines, procedes de preparation et medicaments les contenant. |
| EP0649425B1 (en) | 1992-06-17 | 1999-03-10 | PHARMACIA & UPJOHN COMPANY | Pyridino-, pyrrolidino- and azepino-substituted oximes useful as anti-atherosclerosis and anti-hypercholesterolemic agents |
| JP2923139B2 (ja) | 1992-10-05 | 1999-07-26 | 三井化学株式会社 | 製 剤 |
| DE4327027A1 (de) | 1993-02-15 | 1994-08-18 | Bayer Ag | Imidazoazine |
| FR2711993B1 (fr) | 1993-11-05 | 1995-12-01 | Rhone Poulenc Rorer Sa | Médicaments contenant des dérivés de 7H-imidazol[1,2-a]pyrazine-8-one, les nouveaux composés et leur préparation. |
| US5932223A (en) | 1996-09-26 | 1999-08-03 | Merck & Co., Inc. | Rotavirus vaccine formulations |
| KR20010031983A (ko) | 1997-11-11 | 2001-04-16 | 우에노 도시오 | 축합 피라진 화합물 |
| JP2000319278A (ja) | 1999-05-11 | 2000-11-21 | Ono Pharmaceut Co Ltd | 縮合ピラジン化合物およびその化合物を有効成分とする薬剤 |
| JP2000319277A (ja) | 1999-05-11 | 2000-11-21 | Ono Pharmaceut Co Ltd | 縮合ピラジン化合物およびその化合物を有効成分とする薬剤 |
| JP4032566B2 (ja) | 1999-06-21 | 2008-01-16 | 東レ株式会社 | 発光素子 |
| JP4041624B2 (ja) | 1999-07-21 | 2008-01-30 | 三井化学株式会社 | 有機電界発光素子 |
| JP2001057292A (ja) | 1999-08-20 | 2001-02-27 | Toray Ind Inc | 発光素子 |
| ATE450865T1 (de) | 1999-09-28 | 2009-12-15 | Panacea Biotec Ltd | Zusammensetzungen mit kontrollierter freigabe enthaltend nimesulid |
| SE9903611D0 (sv) | 1999-10-06 | 1999-10-06 | Astra Ab | Novel compounds III |
| DE19948434A1 (de) | 1999-10-08 | 2001-06-07 | Gruenenthal Gmbh | Substanzbibliothek enthaltend bicyclische Imidazo-5-amine und/oder bicyclische Imidazo-3-amine |
| JP4409680B2 (ja) | 1999-10-18 | 2010-02-03 | 株式会社ヤクルト本社 | 三環性縮合イミダゾール誘導体 |
| US6403588B1 (en) | 2000-04-27 | 2002-06-11 | Yamanouchi Pharmaceutical Co., Ltd. | Imidazopyridine derivatives |
| KR100830859B1 (ko) | 2000-04-27 | 2008-05-21 | 아스텔라스세이야쿠 가부시키가이샤 | 이미다조피리딘 유도체 및 이를 함유하는 의약 조성물 |
| PL202623B1 (pl) | 2000-06-28 | 2009-07-31 | Smithkline Beecham Plc | Sposób wytwarzania drobno zmielonego preparatu substancji leczniczej, drobno zmielona substancja lecznicza wytworzona tym sposobem i zawierająca ją kompozycja farmaceutyczna |
| AR029538A1 (es) | 2000-07-06 | 2003-07-02 | Wyeth Corp | Composiciones farmaceuticas de agentes estrogenicos |
| EP1301511A2 (en) | 2000-07-14 | 2003-04-16 | Bristol-Myers Squibb Pharma Company | IMIDAZO 1,2-a]PYRAZINES FOR THE TREATMENT OF NEUROLOGICAL DISORDERS |
| DE10050663A1 (de) | 2000-10-13 | 2002-04-18 | Gruenenthal Gmbh | Verwendung von substituierten Imidazo[1,2-a]pyridin-, -pyrimidin- und pyrazin-3-yl-amin-Derivaten zur Herstellung von Medikamenten zur NOS-Inhibierung |
| WO2002034748A1 (en) | 2000-10-24 | 2002-05-02 | Sankyo Company, Limited | Imidazopyridine derivatives |
| JP2002205992A (ja) | 2000-11-08 | 2002-07-23 | Takeda Chem Ind Ltd | 二環式トリアゾロン誘導体およびそれを含有する除草剤 |
| ATE310740T1 (de) | 2000-11-10 | 2005-12-15 | Merck Sharp & Dohme | Imidazotriazin-derivate als liganden für gaba- rezeptoren |
| WO2002048146A2 (de) | 2000-12-13 | 2002-06-20 | Basf Aktiengesellschaft | Verwendung von substituierten imidazoazinen, neue imidazoazine, verfahren zu deren herstellung, sowie sie enthaltende mittel |
| EP1217000A1 (en) | 2000-12-23 | 2002-06-26 | Aventis Pharma Deutschland GmbH | Inhibitors of factor Xa and factor VIIa |
| TWI312347B (en) | 2001-02-08 | 2009-07-21 | Eisai R&D Man Co Ltd | Bicyclic nitrogen-containing condensed ring compounds |
| EP1377549A1 (en) | 2001-03-12 | 2004-01-07 | Millennium Pharmaceuticals, Inc. | Functionalized heterocycles as modulators of chemokine receptor function and methods of use therefor |
| AR035543A1 (es) | 2001-06-26 | 2004-06-16 | Japan Tobacco Inc | Agente terapeutico para la hepatitis c que comprende un compuesto de anillo condensado, compuesto de anillo condensado, composicion farmaceutica que lo comprende, compuestos de benzimidazol, tiazol y bifenilo utiles como intermediarios para producir dichos compuestos, uso del compuesto de anillo con |
| IL159811A0 (en) | 2001-07-13 | 2004-06-20 | Neurogen Corp | Heteroaryl substituted fused bicyclic heteroaryl compounds as gabaa receptor ligands |
| US6921762B2 (en) | 2001-11-16 | 2005-07-26 | Amgen Inc. | Substituted indolizine-like compounds and methods of use |
| WO2003062392A2 (en) | 2002-01-18 | 2003-07-31 | Ceretek Llc | Methods of treating conditions associated with an edg receptor |
| US20050113283A1 (en) | 2002-01-18 | 2005-05-26 | David Solow-Cordero | Methods of treating conditions associated with an EDG-4 receptor |
| WO2004017950A2 (en) | 2002-08-22 | 2004-03-04 | Piramed Limited | Phosphadidylinositol 3,5-biphosphate inhibitors as anti-viral agents |
| UA80296C2 (en) | 2002-09-06 | 2007-09-10 | Biogen Inc | Imidazolopyridines and methods of making and using the same |
| US20060276339A1 (en) | 2002-10-16 | 2006-12-07 | Windsor J B | Methods and compositions for increasing the efficacy of biologically-active ingredients |
| CA2509565A1 (en) | 2002-12-20 | 2004-07-15 | Pharmacia Corporation | Mitogen activated protein kinase-activated protein kinase-2 inhibiting compounds |
| WO2004072080A1 (en) | 2003-02-10 | 2004-08-26 | Cellular Genomics, Inc. | Certain 8-heteroaryl-6-phenyl-imidazo[1,2-a]pyrazines as modulators of hsp90 complex activity |
| GB0303910D0 (en) | 2003-02-20 | 2003-03-26 | Merck Sharp & Dohme | Therapeutic agents |
| US7157460B2 (en) | 2003-02-20 | 2007-01-02 | Sugen Inc. | Use of 8-amino-aryl-substituted imidazopyrazines as kinase inhibitors |
| US7186832B2 (en) | 2003-02-20 | 2007-03-06 | Sugen Inc. | Use of 8-amino-aryl-substituted imidazopyrazines as kinase inhibitors |
| US7910741B2 (en) | 2003-03-14 | 2011-03-22 | Ono Pharmaceutical Co., Ltd. | Nitrogen-containing heterocyclic derivatives and drugs containing the same as the active ingredient |
| DK1615647T3 (da) | 2003-04-11 | 2010-04-06 | High Point Pharmaceuticals Llc | Farmaceutisk anvendelse af kondenserede 1,2,4-triazoler |
| JP2006522750A (ja) | 2003-04-11 | 2006-10-05 | ノボ ノルディスク アクティーゼルスカブ | 代謝性症候群ならびに関連の疾患および障害を治療するために、11β−ヒドロキシステロイドデヒドロゲナーゼ1型阻害剤および抗高血圧剤を使用する併用療法 |
| CN1809354A (zh) | 2003-04-24 | 2006-07-26 | 麦克公司 | Akt活性抑制剂 |
| SE0301653D0 (sv) | 2003-06-05 | 2003-06-05 | Astrazeneca Ab | Novel compounds |
| NZ544200A (en) | 2003-07-14 | 2009-07-31 | Arena Pharm Inc | Fused-aryl and heteroaryl derivatives as modulators of metabolism and the prophylaxis and treatment of disorders related thereto |
| US7538120B2 (en) | 2003-09-03 | 2009-05-26 | Array Biopharma Inc. | Method of treating inflammatory diseases |
| US7705052B2 (en) * | 2003-09-12 | 2010-04-27 | Merck Serono Sa | Sulfonamide derivatives for the treatment of diabetes |
| JP2005089352A (ja) | 2003-09-16 | 2005-04-07 | Kissei Pharmaceut Co Ltd | 新規なイミダゾ[1,5−a]ピラジン誘導体、それを含有する医薬組成物およびそれらの用途 |
| CA2541832C (en) | 2003-10-10 | 2009-11-24 | Pfizer Products Inc. | Substituted 2h-[1,2,4]triazolo[4,3-a]pyrazines as gsk-3 inhibitors |
| US7419978B2 (en) | 2003-10-22 | 2008-09-02 | Bristol-Myers Squibb Company | Phenyl-aniline substituted bicyclic compounds useful as kinase inhibitors |
| WO2005044793A2 (en) | 2003-10-31 | 2005-05-19 | Takeda Pharmaceutical Company Limited | Nitrogen-containing fused heterocyclic compounds |
| EP1698335A4 (en) | 2003-12-26 | 2007-08-01 | Ono Pharmaceutical Co | AGENT FOR PREVENTING AND / OR TREATING DISEASES INVOLVING A MITOCHONDRIAL BENZODIAZEPINE RECEPTOR |
| US20070191395A1 (en) | 2004-02-16 | 2007-08-16 | Katsuhiro Kawakami | Heterocyclic compounds having antifungal activity |
| US7306631B2 (en) | 2004-03-30 | 2007-12-11 | The Procter & Gamble Company | Keratin dyeing compounds, keratin dyeing compositions containing them, and use thereof |
| BRPI0510319A (pt) * | 2004-04-26 | 2007-10-16 | Pfizer | inibidores da enzima integrase de hiv |
| DK1758557T3 (da) | 2004-05-11 | 2011-10-24 | Egalet Ltd | Kvældbar doseringsform omfattende gellangummi |
| WO2006131003A1 (en) | 2005-06-09 | 2006-12-14 | Oncalis Ag | Angiogenesis inhibitors |
| TW200612918A (en) | 2004-07-29 | 2006-05-01 | Threshold Pharmaceuticals Inc | Lonidamine analogs |
| WO2006018727A2 (en) | 2004-08-18 | 2006-02-23 | Pharmacia & Upjohn Company Llc | Triazolopyridine compounds useful for the treatment of inflammation |
| EP1799671A4 (en) | 2004-09-02 | 2009-06-10 | Smithkline Beecham Corp | CHEMICAL COMPOUNDS |
| EP1799680A2 (en) | 2004-10-07 | 2007-06-27 | Warner-Lambert Company LLC | Triazolopyridine derivatives as antibacterial agents |
| EP1819338A4 (en) | 2004-11-22 | 2009-11-04 | Threshold Pharmaceuticals Inc | ANTICANCER TUBULIN-BINDING AGENTS AND THEIR PRODUCTS |
| JP2008521858A (ja) | 2004-12-01 | 2008-06-26 | ラボラトワール セローノ ソシエテ アノニム | 過増殖性疾患を処置するための[1,2,4]トリアゾロ[4,3−a]ピリジン誘導体 |
| US20070293456A9 (en) | 2004-12-30 | 2007-12-20 | Anthony Hayford | Method for the synthesis of 3-substituted indolizine and benzoindolizine compounds |
| US7456289B2 (en) | 2004-12-31 | 2008-11-25 | National Health Research Institutes | Anti-tumor compounds |
| EA012615B1 (ru) | 2005-02-22 | 2009-10-30 | Пфайзер Инк. | Производные оксииндола в качестве агонистов 5-htрецептора |
| ITBO20050123A1 (it) | 2005-03-07 | 2005-06-06 | Alfa Wassermann Spa | Formulazioni farmaceutiche gastroresistenti contenenti rifaximina |
| WO2006113704A2 (en) | 2005-04-18 | 2006-10-26 | Neurogen Corporation | Subtituted heteroaryl cb1 antagonists |
| US7579360B2 (en) | 2005-06-09 | 2009-08-25 | Bristol-Myers Squibb Company | Triazolopyridine 11-beta hydroxysteroid dehydrogenase type I inhibitors |
| US7572807B2 (en) | 2005-06-09 | 2009-08-11 | Bristol-Myers Squibb Company | Heteroaryl 11-beta-hydroxysteroid dehydrogenase type I inhibitors |
| US7572808B2 (en) | 2005-06-17 | 2009-08-11 | Bristol-Myers Squibb Company | Triazolopyridine cannabinoid receptor 1 antagonists |
| US7632837B2 (en) | 2005-06-17 | 2009-12-15 | Bristol-Myers Squibb Company | Bicyclic heterocycles as cannabinoid-1 receptor modulators |
| US7452892B2 (en) | 2005-06-17 | 2008-11-18 | Bristol-Myers Squibb Company | Triazolopyrimidine cannabinoid receptor 1 antagonists |
| TWI255587B (en) | 2005-07-04 | 2006-05-21 | Quanta Comp Inc | Multi-frequency planar antenna |
| US7709468B2 (en) | 2005-09-02 | 2010-05-04 | Abbott Laboratories | Imidazo based heterocycles |
| WO2007032936A2 (en) | 2005-09-09 | 2007-03-22 | Schering Corporation | Azafused cyclin dependent kinase inhibitors |
| JP5031760B2 (ja) | 2005-11-10 | 2012-09-26 | シェーリング コーポレイション | プロテインキナーゼインヒビターとしてのイミダゾピラジン |
| JP5334588B2 (ja) | 2005-11-28 | 2013-11-06 | マリナス ファーマシューティカルズ | ガナキソロン製剤、およびその作製方法、およびその使用 |
| RU2420527C2 (ru) | 2005-12-27 | 2011-06-10 | Ф. Хоффманн-Ля Рош Аг | ПРОИЗВОДНЫЕ АРИЛ-ИЗОКСАЗОЛ-4-ИЛ-ИМИДАЗО[1,5-a]ПИРИДИНА |
| WO2007074491A1 (en) | 2005-12-28 | 2007-07-05 | Universita Degli Studi Di Siena | HETEROTRICYCLIC AMIDE DERIVATIVES AS NEUROKININ-l (NKl) RECEPTOR LIGANDS |
| PE20070978A1 (es) | 2006-02-14 | 2007-11-15 | Novartis Ag | COMPUESTOS HETEROCICLICOS COMO INHIBIDORES DE FOSFATIDILINOSITOL 3-QUINASAS (PI3Ks) |
| KR20080104351A (ko) | 2006-03-31 | 2008-12-02 | 노파르티스 아게 | 유기 화합물 |
| CA2654202A1 (en) | 2006-06-06 | 2007-12-21 | Schering Corporation | Imidazopyrazines as protein kinase inhibitors |
| US20090175852A1 (en) | 2006-06-06 | 2009-07-09 | Schering Corporation | Imidazopyrazines as protein kinase inhibitors |
| US8115000B2 (en) | 2006-06-22 | 2012-02-14 | Mallinckrodt Llc | Pyrazine derivatives and uses thereof in renal monitoring |
| EP2038261A2 (en) | 2006-06-22 | 2009-03-25 | Mallinckrodt Inc. | Pyrazine derivatives with extended conjugation and uses thereof |
| EP2032560B1 (en) | 2006-06-29 | 2013-05-01 | Merck Sharp & Dohme Corp. | Substituted bicyclic and tricyclic thrombin receptor antagonists |
| WO2008005423A1 (en) | 2006-07-03 | 2008-01-10 | Cambrex Charles City, Inc. | Improved method of making sufentanil |
| WO2008005908A2 (en) | 2006-07-07 | 2008-01-10 | Forest Laboratories Holdings Limited | Pyridoimidazole derivatives |
| US8198448B2 (en) | 2006-07-14 | 2012-06-12 | Amgen Inc. | Fused heterocyclic derivatives and methods of use |
| US8217177B2 (en) | 2006-07-14 | 2012-07-10 | Amgen Inc. | Fused heterocyclic derivatives and methods of use |
| PE20080403A1 (es) | 2006-07-14 | 2008-04-25 | Amgen Inc | Derivados heterociclicos fusionados y metodos de uso |
| CN101790527A (zh) | 2006-07-20 | 2010-07-28 | 凯利普西斯公司 | Rho激酶的苯并噻吩抑制剂 |
| WO2008027812A2 (en) | 2006-08-28 | 2008-03-06 | Forest Laboratories Holdings Limited | Imidazopyridine and imidazopyrimidine derivatives |
| DE102006041292A1 (de) | 2006-09-01 | 2008-03-06 | Henkel Kgaa | Wasserstoffperoxid-Aktivierung mit N-Heterocyclen |
| WO2008037607A1 (de) | 2006-09-25 | 2008-04-03 | Basf Se | Carbonylgruppen-enthaltende heterocyclische verbindungen und deren verwendung zur bekämpfung von phytopathogenen pilzen |
| US7700593B2 (en) | 2006-10-11 | 2010-04-20 | Amgen Inc. | Imidazo- and triazolo-pyridine compounds and methods of use thereof |
| EP2079450A2 (en) | 2006-11-08 | 2009-07-22 | Novavax, INC. | Method of preparing solid dosage forms of multi-phasic pharmaceutical compositions |
| CA2668689C (en) | 2006-11-08 | 2015-12-29 | Neurocrine Biosciences Inc. | Substituted 3-isobutyl-9,10-dimethoxy-1,3,4,6,7,11b-hexahydro-2h-pyrido[2,1-a]isoquinolin-2-ol compounds and methods relating thereto |
| WO2008056176A1 (en) | 2006-11-10 | 2008-05-15 | Scottish Biomedical Limited | Pyrazolopyrimidines as phosphodiesterase inhibitors |
| CN101641093B (zh) | 2006-11-22 | 2013-05-29 | 因塞特公司 | 作为激酶抑制剂的咪唑并三嗪和咪唑并嘧啶 |
| WO2008065198A1 (en) | 2006-12-01 | 2008-06-05 | Galapagos N.V. | Triazolopyridine compounds useful for the treatment of degenerative & inflammatory diseases |
| WO2008079404A2 (en) | 2006-12-22 | 2008-07-03 | Combinatorx, Incorporated | Pharmaceutical compositions for treatment of parkinson's disease and related disorders |
| EP2118101B1 (en) | 2007-03-09 | 2012-09-26 | Probiodrug AG | Imidazo [1,5-a] pyridine derivatives as inhibitors of glutaminyl cyclase |
| DE102007012645A1 (de) | 2007-03-16 | 2008-09-18 | Bayer Healthcare Ag | Substituierte Imidazo- und Triazolopyrimidine |
| EP1972628A1 (en) | 2007-03-21 | 2008-09-24 | Schwarz Pharma Ag | Indolizines and aza-analog derivatives thereof as CNS active compounds |
| ES2380395T3 (es) | 2007-04-16 | 2012-05-11 | Leo Pharma A/S | Triazolopiridinas como inhibidores de fosfodiesterasa para el tratamiento de enfermedades dérmicas |
| JP2010524953A (ja) | 2007-04-17 | 2010-07-22 | ブリストル−マイヤーズ スクイブ カンパニー | 縮合ヘテロ環11−β−ヒドロキシステロイドデヒドロゲナーゼI型阻害剤 |
| WO2008141239A1 (en) | 2007-05-10 | 2008-11-20 | Acadia Pharmaceuticals Inc. | Imidazol [1,2-a] pyridines and related compounds with activity at cannabinoid cb2 receptors |
| CN101848713B (zh) | 2007-05-21 | 2012-04-11 | 东丽株式会社 | 含有特定的有机酸的口服制剂以及口服制剂的溶出性和化学稳定性的改善方法 |
| US8648069B2 (en) | 2007-06-08 | 2014-02-11 | Abbvie Inc. | 5-substituted indazoles as kinase inhibitors |
| MX2009013213A (es) | 2007-06-08 | 2010-03-30 | Abbott Lab | Indazoles 5-sustituidos 5-heteroarilo como inhibidores de cinasa. |
| MX2009013729A (es) | 2007-06-14 | 2010-01-25 | Schering Corp | Imidazopirazinas como inhibidores de proteina quinasa. |
| CL2008001839A1 (es) | 2007-06-21 | 2009-01-16 | Incyte Holdings Corp | Compuestos derivados de 2,7-diazaespirociclos, inhibidores de 11-beta hidroxil esteroide deshidrogenasa tipo 1; composicion farmaceutica que comprende a dichos compuestos; utiles para tratar la obesidad, diabetes, intolerancia a la glucosa, diabetes tipo ii, entre otras enfermedades. |
| US20090004281A1 (en) | 2007-06-26 | 2009-01-01 | Biovail Laboratories International S.R.L. | Multiparticulate osmotic delivery system |
| MX2010000716A (es) | 2007-07-18 | 2010-03-26 | Novartis Ag | Compuestos de heteroarilo biciclicos y su uso como inhibidores de cinasa. |
| US20100249030A1 (en) | 2007-07-31 | 2010-09-30 | Schering Corporation | Anti-mitotic agent and aurora kinase inhibitor combination as anti-cancer treatment |
| WO2009017954A1 (en) | 2007-08-01 | 2009-02-05 | Phenomix Corporation | Inhibitors of jak2 kinase |
| EA201000201A1 (ru) | 2007-08-10 | 2010-12-30 | ГЛАКСОСМИТКЛАЙН ЭлЭлСи | Азотсодержащие бициклические химические вещества для лечения вирусных инфекций |
| US20090047336A1 (en) | 2007-08-17 | 2009-02-19 | Hong Kong Baptist University | novel formulation of dehydrated lipid vesicles for controlled release of active pharmaceutical ingredient via inhalation |
| FR2920090A1 (fr) | 2007-08-24 | 2009-02-27 | Oreal | Composition tinctoriale comprenant une base d'oxydation aminopyrazolopyridine particuliere, un coupleur et un tensioactif particulier. |
| FR2920091A1 (fr) | 2007-08-24 | 2009-02-27 | Oreal | Composition tinctoriale comprenant une base d'oxydation aminopyrazolopyridine, un coupleur et un polyol particulier. |
| KR20090022616A (ko) | 2007-08-31 | 2009-03-04 | 한올제약주식회사 | 베실산클로피도그렐 함유 경구투여용 약제 |
| US8119658B2 (en) | 2007-10-01 | 2012-02-21 | Bristol-Myers Squibb Company | Triazolopyridine 11-beta hydroxysteroid dehydrogenase type I inhibitors |
| GB0719803D0 (en) | 2007-10-10 | 2007-11-21 | Cancer Rec Tech Ltd | Therapeutic compounds and their use |
| RS53552B1 (en) | 2007-10-11 | 2015-02-27 | Astrazeneca Ab | DERIVATI PIROLO [2,3-D] PIRIMIDINA KAO INHIBITORI PROTEIN KINAZE B |
| SI2465492T1 (sl) | 2007-10-12 | 2015-12-31 | Novartis Ag | Sestavi, ki obsegajo modulatorje receptorja sfingosin 1 fosfat (S1P) |
| CA2710194C (en) | 2007-12-19 | 2014-04-22 | Amgen Inc. | Inhibitors of p13 kinase |
| ATE513832T1 (de) | 2007-12-19 | 2011-07-15 | Genentech Inc | 8-anilinoimidazopyridine und ihre verwendung als antikrebsmittel und/oder entzündungshemmende mittel |
| KR100988233B1 (ko) | 2007-12-26 | 2010-10-18 | 한미홀딩스 주식회사 | 클로피도그렐 1,5-나프탈렌 다이술폰산 염 또는 이의수화물의 약학 조성물 및 제제 |
| WO2009114512A1 (en) | 2008-03-11 | 2009-09-17 | Incyte Corporation | Azetidine and cyclobutane derivatives as jak inhibitors |
| AU2009223701B2 (en) | 2008-03-12 | 2015-04-16 | Intra-Cellular Therapies, Inc. | Substituted heterocycle fused gamma-carbolines solid |
| CA2718403A1 (en) | 2008-03-13 | 2009-09-17 | The General Hospital Corporation | Inhibitors of the bmp signaling pathway |
| JP5547099B2 (ja) | 2008-03-14 | 2014-07-09 | インテリカイン, エルエルシー | キナーゼ阻害剤および使用方法 |
| WO2009128520A1 (ja) | 2008-04-18 | 2009-10-22 | 塩野義製薬株式会社 | P13k阻害活性を有する複素環化合物 |
| DE102008023801A1 (de) | 2008-05-15 | 2009-11-19 | Bayer Schering Pharma Aktiengesellschaft | Substituierte Imidazo- und Triazolopyrimidine, Imidazo- und Pyrazolopyrazine und Imidazotriazine |
| US8349210B2 (en) | 2008-06-27 | 2013-01-08 | Transitions Optical, Inc. | Mesogenic stabilizers |
| WO2010010187A1 (en) | 2008-07-25 | 2010-01-28 | Galapagos Nv | Novel compounds useful for the treatment of degenerative and inflammatory diseases |
| WO2010010189A1 (en) | 2008-07-25 | 2010-01-28 | Galapagos Nv | Novel compounds useful for the treatment of degenerative and inflammatory diseases |
| WO2010010184A1 (en) | 2008-07-25 | 2010-01-28 | Galapagos Nv | [1, 2, 4] triazolo [1, 5-a] pyridines as jak inhibitors |
| WO2010010188A1 (en) | 2008-07-25 | 2010-01-28 | Galapagos Nv | Novel compounds useful for the treatment of degenerative and inflammatory diseases. |
| UY32049A (es) | 2008-08-14 | 2010-03-26 | Takeda Pharmaceutical | Inhibidores de cmet |
| TR200806298A2 (tr) | 2008-08-22 | 2010-03-22 | Bi̇lgi̇ç Mahmut | Farmasötik formülasyon |
| JP2010070503A (ja) | 2008-09-19 | 2010-04-02 | Daiichi Sankyo Co Ltd | 抗真菌作用2−アミノトリアゾロピリジン誘導体 |
| WO2010033906A2 (en) | 2008-09-19 | 2010-03-25 | President And Fellows Of Harvard College | Efficient induction of pluripotent stem cells using small molecule compounds |
| US8703778B2 (en) | 2008-09-26 | 2014-04-22 | Intellikine Llc | Heterocyclic kinase inhibitors |
| WO2010043721A1 (en) | 2008-10-17 | 2010-04-22 | Oryzon Genomics, S.A. | Oxidase inhibitors and their use |
| WO2010048149A2 (en) | 2008-10-20 | 2010-04-29 | Kalypsys, Inc. | Heterocyclic modulators of gpr119 for treatment of disease |
| WO2010064020A1 (en) | 2008-12-04 | 2010-06-10 | Proximagen Ltd. | Imidazopyridine compounds |
| US8450321B2 (en) | 2008-12-08 | 2013-05-28 | Gilead Connecticut, Inc. | 6-(1H-indazol-6-yl)-N-[4-(morpholin-4-yl)phenyl]imidazo-[1,2-A]pyrazin-8-amine, or a pharmaceutically acceptable salt thereof, as a SYK inhibitor |
| US8993808B2 (en) | 2009-01-21 | 2015-03-31 | Oryzon Genomics, S.A. | Phenylcyclopropylamine derivatives and their medical use |
| WO2010091067A2 (en) | 2009-02-04 | 2010-08-12 | Vitae Pharmaceuticals, Inc. | Cyclic inhibitors of 11beta-hydroxysteroid dehydrogenase 1 |
| CA2749933A1 (en) | 2009-02-04 | 2010-08-12 | Supernus Pharmaceuticals, Inc. | Formulations of desvenlafaxine |
| TR200900879A2 (tr) | 2009-02-05 | 2010-08-23 | Bi̇lgi̇ç Mahmut | Aktif maddelerin tek bir dozaj formunda kombine edildiği farmasötik bileşimler |
| TR200900878A2 (tr) | 2009-02-05 | 2010-08-23 | Bi̇lgi̇ç Mahmut | Tek bir dozaj formunda kombine edilen farmasötik formülasyonlar |
| ES2435804T3 (es) | 2009-02-13 | 2013-12-23 | Bayer Intellectual Property Gmbh | Pirimidinas condensadas como inhibidores de Akt |
| KR20100101054A (ko) | 2009-03-07 | 2010-09-16 | 주식회사 메디젠텍 | 세포핵에서 세포질로의 gsk3의 이동을 억제하는 화합물을 함유하는 세포핵에서 세포질로의 gsk3 이동에 의해 발생되는 질환의 치료 또는 예방용 약학적 조성물 |
| WO2010107404A1 (en) | 2009-03-16 | 2010-09-23 | Mahmut Bilgic | Stable pharmaceutical combinations |
| TW201035078A (en) | 2009-03-20 | 2010-10-01 | Incyte Corp | Substituted heterocyclic compounds |
| US8748452B2 (en) | 2009-03-31 | 2014-06-10 | Kissei Pharmaceutical Co., Ltd. | Indolizine derivative and use thereof for medical purposes |
| KR20120034613A (ko) | 2009-04-16 | 2012-04-12 | 센트로 내셔널 드 인베스티가시오네스 온콜로지카스 (씨엔아이오) | 키나아제 억제제로서 사용을 위한 이미다조피라진 |
| TWI461426B (zh) | 2009-05-27 | 2014-11-21 | Merck Sharp & Dohme | (二氫)咪唑並異〔5,1-a〕喹啉類 |
| AU2010258785A1 (en) | 2009-06-10 | 2012-01-19 | Sunovion Pharmaceuticals Inc. | Histamine H3 inverse agonists and antagonists and methods of use thereof |
| AU2010266040B2 (en) | 2009-06-25 | 2015-01-15 | Alkermes Pharma Ireland Limited | Prodrugs of NH-acidic compounds |
| NZ620020A (en) | 2009-08-17 | 2015-06-26 | Intellikine Llc | Heterocyclic compounds and uses thereof |
| AU2010284221B2 (en) | 2009-08-18 | 2016-09-22 | Casero, Robert A | (bis) urea and (bis) thiourea compounds as epigenic modulators of lysine-specific demethylase 1 and methods of treating disorders |
| WO2011033265A1 (en) | 2009-09-18 | 2011-03-24 | Almac Discovery Limited | Pharmaceutical compounds |
| US8859555B2 (en) | 2009-09-25 | 2014-10-14 | Oryzon Genomics S.A. | Lysine Specific Demethylase-1 inhibitors and their use |
| US8946296B2 (en) | 2009-10-09 | 2015-02-03 | Oryzon Genomics S.A. | Substituted heteroaryl- and aryl-cyclopropylamine acetamides and their use |
| WO2011050245A1 (en) | 2009-10-23 | 2011-04-28 | Yangbo Feng | Bicyclic heteroaryls as kinase inhibitors |
| US8541404B2 (en) | 2009-11-09 | 2013-09-24 | Elexopharm Gmbh | Inhibitors of the human aldosterone synthase CYP11B2 |
| US8614315B2 (en) | 2009-12-25 | 2013-12-24 | Mahmut Bilgic | Cefdinir and cefixime formulations and uses thereof |
| ES2627703T3 (es) | 2010-01-22 | 2017-07-31 | Fundación Centro Nacional De Investigaciones Oncológicas Carlos Iii | Inhibidores de PI3·quinasa |
| WO2011097607A1 (en) | 2010-02-08 | 2011-08-11 | Southern Research Institute | Anti-viral treatment and assay to screen for anti-viral agent |
| US9616058B2 (en) | 2010-02-24 | 2017-04-11 | Oryzon Genomics, S.A. | Potent selective LSD1 inhibitors and dual LSD1/MAO-B inhibitors for antiviral use |
| WO2011106573A2 (en) | 2010-02-24 | 2011-09-01 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for diseases and disorders associated with hepadnaviridae |
| TW201200518A (en) | 2010-03-10 | 2012-01-01 | Kalypsys Inc | Heterocyclic inhibitors of histamine receptors for the treatment of disease |
| US8865734B2 (en) | 2010-03-18 | 2014-10-21 | Institut Pasteur Korea | Anti-infective compounds |
| US9468642B2 (en) | 2010-03-18 | 2016-10-18 | Bayer Intellectual Property Gmbh | Imidazopyrazines |
| WO2011121137A1 (en) | 2010-04-02 | 2011-10-06 | Euroscreen S.A. | Novel nk-3 receptor selective antagonist compounds, pharmaceutical composition and methods for use in nk-3 receptors mediated disorders |
| SI2560947T1 (sl) | 2010-04-19 | 2017-01-31 | Oryzon Genomics, S.A. | Za lizin specifični zaviralci demetilaze-1 in njihova uporaba |
| JP5934184B2 (ja) | 2010-04-20 | 2016-06-15 | ウニヴェルシタ・デグリ・ストゥディ・ディ・ローマ・ラ・サピエンツァ | ヒストンデメチラーゼlsd1及び/又はlsd2の阻害剤としてのトラニルシプロミン誘導体 |
| TW201144310A (en) | 2010-04-28 | 2011-12-16 | Daiichi Sankyo Co Ltd | [5,6] heterocyclic compound |
| WO2011141713A1 (en) | 2010-05-13 | 2011-11-17 | Centro Nacional De Investigaciones Oncologicas (Cnio) | New bicyclic compounds as pi3-k and mtor inhibitors |
| AU2011253057B2 (en) | 2010-05-13 | 2014-11-20 | Amgen Inc. | Nitrogen heterocyclic compounds useful as PDE10 inhibitors |
| CN102247321A (zh) | 2010-05-20 | 2011-11-23 | 上海亚盛医药科技有限公司 | 一种阿朴棉子酚酮自乳化药物传递系统及其制备方法 |
| EP2575808A1 (en) | 2010-05-28 | 2013-04-10 | Mahmut Bilgic | Combination of antihypertensive agents |
| CN102295642B (zh) | 2010-06-25 | 2016-04-06 | 中国人民解放军军事医学科学院毒物药物研究所 | 2-芳基咪唑并[1,2-a]吡啶-3-乙酰胺衍生物、其制备方法及用途 |
| US8703759B2 (en) | 2010-07-02 | 2014-04-22 | Gilead Sciences, Inc. | Fused heterocyclic compounds as ion channel modulators |
| US8975265B2 (en) | 2010-07-12 | 2015-03-10 | Bayer Intellectual Property Gmbh | Substituted imidazo[1,2-a]pyrimidines and —pyridines |
| WO2012009475A1 (en) | 2010-07-14 | 2012-01-19 | Oregon Health & Science University | Methods of treating cancer with inhibition of lysine-specific demethylase 1 |
| CN101987081B (zh) | 2010-07-16 | 2012-08-08 | 钟术光 | 一种控释制剂 |
| CN101987082B (zh) | 2010-07-16 | 2013-04-03 | 钟术光 | 固体制剂及其制备方法 |
| MX341732B (es) | 2010-07-29 | 2016-08-30 | Oryzon Genomics S A * | Inhibidores de la demetilasa lsd1 basados en arilciclopropilamina y sus usos médicos. |
| WO2012016133A2 (en) | 2010-07-29 | 2012-02-02 | President And Fellows Of Harvard College | Ros1 kinase inhibitors for the treatment of glioblastoma and other p53-deficient cancers |
| WO2012013727A1 (en) | 2010-07-29 | 2012-02-02 | Oryzon Genomics S.A. | Cyclopropylamine derivatives useful as lsd1 inhibitors |
| CN102397552B (zh) | 2010-09-10 | 2016-06-08 | 广州自远生物科技有限公司 | 一种含喹诺酮类的药物复合制剂及其制备方法和应用 |
| WO2012034116A2 (en) | 2010-09-10 | 2012-03-15 | The Johns Hopkins University | Small molecules as epigenetic modulators of lysine-specific demethylase 1 and methods of treating disorders |
| ES2549926T3 (es) | 2010-09-29 | 2015-11-03 | Kissei Pharmaceutical Co., Ltd. | Derivados (aza)indolizínicos como inhibidores de la xantina-oxidasa |
| US20130303545A1 (en) | 2010-09-30 | 2013-11-14 | Tamara Maes | Cyclopropylamine derivatives useful as lsd1 inhibitors |
| US20120108500A1 (en) | 2010-10-07 | 2012-05-03 | Naoki Sakane | Compositions and Methods for Modulating Immunodeficiency Virus Transcription |
| AU2011318398B2 (en) | 2010-10-18 | 2015-09-10 | E. I. Du Pont De Nemours And Company | Nematocidal sulfonamides |
| CN103282365B (zh) | 2010-10-21 | 2017-12-29 | 麦迪韦逊科技有限公司 | 结晶的(8S,9R)‑5‑氟‑8‑(4‑氟苯基)‑9‑(1‑甲基‑1H‑1,2,4‑三唑‑5‑基)‑8,9‑二氢‑2H‑吡啶并[4,3,2‑de]酞嗪‑3(7H)‑酮甲苯磺酸盐 |
| WO2012052745A1 (en) | 2010-10-21 | 2012-04-26 | Centro Nacional De Investigaciones Oncológicas (Cnio) | Combinations of pi3k inhibitors with a second anti -tumor agent |
| EP2444084A1 (en) | 2010-10-21 | 2012-04-25 | Centro Nacional de Investigaciones Oncológicas (CNIO) | Use of PI3K inibitors for the treatment of obesity |
| WO2012071469A2 (en) | 2010-11-23 | 2012-05-31 | Nevada Cancer Institute | Histone demethylase inhibitors and uses thereof for treatment o f cancer |
| WO2012072713A2 (en) | 2010-11-30 | 2012-06-07 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for diseases and disorders associated with flaviviridae |
| EP2651405A2 (en) | 2010-12-14 | 2013-10-23 | Electrophoretics Limited | Casein kinase 1 (ck1 ) inhibitors |
| UY33805A (es) | 2010-12-17 | 2012-07-31 | Boehringer Ingelheim Int | ?Derivados de dihidrobenzofuranil-piperidinilo, aza-dihidrobenzofuranilpiperidinilo y diaza-dihidrobenzofuranil-piperidinilo, composiciones farmacéuticas que los contienen y usos de los mismos?. |
| CN103429591A (zh) | 2010-12-17 | 2013-12-04 | 拜耳知识产权有限责任公司 | 在治疗过度增殖性病症中用作mps-1和tkk抑制剂的6-取代的咪唑并吡嗪 |
| CA2821837A1 (en) | 2010-12-17 | 2012-06-21 | Bayer Intellectual Property Gmbh | 2-substituted imidazopyrazines for use as mps-1 and tkk inhibitors in the treatment of hyperproliferative disorders |
| CN103429592A (zh) | 2010-12-17 | 2013-12-04 | 拜耳知识产权有限责任公司 | 作为mps-1和tkk抑制剂用于治疗过度增殖性病症的6-取代的咪唑并吡嗪 |
| CN103443100B (zh) | 2010-12-17 | 2016-03-23 | 拜耳知识产权有限责任公司 | 在过度增殖性病症的治疗中用作mps-1和tkk抑制剂的取代的6-咪唑并吡嗪 |
| TWI617559B (zh) | 2010-12-22 | 2018-03-11 | 江蘇恆瑞醫藥股份有限公司 | 2-芳基咪唑并[1,2-b]嗒.2-苯基咪唑并[1,2-a]吡啶,和2-苯基咪唑并[1,2-a]吡衍生物 |
| US8987271B2 (en) | 2010-12-22 | 2015-03-24 | Eutropics Pharmaceuticals, Inc. | 2,2′-biphenazine compounds and methods useful for treating disease |
| WO2012100229A2 (en) | 2011-01-21 | 2012-07-26 | The General Hospital Corporation | Compositions and methods for cardiovascular disease |
| BRPI1100101B1 (pt) | 2011-01-28 | 2020-10-20 | Universidade De São Paulo Usp | anel oito articulado |
| EP2712316A1 (en) | 2011-02-08 | 2014-04-02 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for myeloproliferative or lymphoproliferative diseases or disorders |
| EP3981395A1 (en) | 2011-02-08 | 2022-04-13 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for myeloproliferative disorders |
| WO2012116237A2 (en) | 2011-02-23 | 2012-08-30 | Intellikine, Llc | Heterocyclic compounds and uses thereof |
| WO2012129562A2 (en) | 2011-03-24 | 2012-09-27 | The Scripps Research Institute | Compounds and methods for inducing chondrogenesis |
| WO2012147890A1 (ja) | 2011-04-27 | 2012-11-01 | 持田製薬株式会社 | 新規アゾール誘導体 |
| EP2741741A2 (en) | 2011-05-19 | 2014-06-18 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for inflammatory diseases or conditions |
| WO2012156537A2 (en) | 2011-05-19 | 2012-11-22 | Oryzon Genomics, S.A. | Lysine demethylase inhibitors for thrombosis and cardiovascular diseases |
| EP2524918A1 (en) | 2011-05-19 | 2012-11-21 | Centro Nacional de Investigaciones Oncológicas (CNIO) | Imidazopyrazines derivates as kinase inhibitors |
| RU2013156437A (ru) | 2011-06-07 | 2015-07-20 | СПАЙ Груп Лтд. | Композиция и способы улучшения стабильности и продления срока хранения чувствительных пищевых добавок и пищевых продуктов из них |
| CA2839767A1 (en) | 2011-06-20 | 2012-12-27 | Incyte Corporation | Azetidinyl phenyl, pyridyl or pyrazinyl carboxamide derivatives as jak inhibitors |
| TW201311149A (zh) | 2011-06-24 | 2013-03-16 | Ishihara Sangyo Kaisha | 有害生物防治劑 |
| EP2548877A1 (en) | 2011-07-19 | 2013-01-23 | MSD Oss B.V. | 4-(5-Membered fused pyridinyl)benzamides as BTK-inhibitors |
| UA114406C2 (uk) * | 2011-08-09 | 2017-06-12 | Такеда Фармасьютікал Компані Лімітед | Похідні циклопропанаміну як інгібітори lsd1 |
| PT2744330T (pt) | 2011-08-15 | 2020-10-01 | Univ Utah Res Found | Análogos substituídos de (e)-n'-(1-feniletilideno) benzoidrazida como inibitores de histona desmetilase |
| US9289415B2 (en) | 2011-09-01 | 2016-03-22 | The Brigham And Women's Hospital, Inc. | Treatment of cancer |
| EP2751089B1 (en) | 2011-09-02 | 2018-11-14 | Promega Corporation | Compounds and methods for assaying redox state of metabolically active cells and methods for measuring nad(p)/nad(p)h |
| JP2015531401A (ja) | 2011-10-10 | 2015-11-02 | ハー・ルンドベック・アクチエゼルスカベット | イミダゾピラジノン骨格を有するpde9i |
| CN107417549A (zh) | 2011-10-20 | 2017-12-01 | 奥莱松基因组股份有限公司 | 作为lsd1抑制剂的(杂)芳基环丙基胺化合物 |
| CL2014000988A1 (es) | 2011-10-20 | 2014-11-03 | Oryzon Genomics Sa | Compuestos derivados de (aril o heteroaril) ciclopropilamida, inhibidores de lsd1; procedimiento para prepararlos; composicion farmaceutica que los comprende; y metodo para tratar o prevenir cancer, una enfermedad neurologica, una infeccion viral y la reactivacion viral despues de la latencia. |
| CN107266345B (zh) | 2011-10-20 | 2021-08-17 | 奥瑞泽恩基因组学股份有限公司 | 作为lsd1抑制剂的(杂)芳基环丙胺化合物 |
| ITMI20111971A1 (it) | 2011-10-28 | 2013-04-29 | Mesogenics Srl | Inibitori dell'enzima lsd-1 per l'induzione del differenziamento osteogenico |
| US9266881B2 (en) | 2011-11-14 | 2016-02-23 | Merck Sharp & Dohme Corp. | Triazolopyridinone PDE10 inhibitors |
| CA2857964A1 (en) | 2011-12-05 | 2013-06-13 | Brandeis University | Treatment of amyloidosis by compounds that regulate retromer stabilization |
| EP2822948B1 (en) | 2012-03-07 | 2016-04-06 | Merck Patent GmbH | Triazolopyrazine derivatives |
| GB201205669D0 (en) | 2012-03-30 | 2012-05-16 | Agency Science Tech & Res | Bicyclic heterocyclic derivatives as mnk2 and mnk2 modulators and uses thereof |
| CN102579381B (zh) | 2012-03-30 | 2013-07-10 | 河南中帅医药科技发展有限公司 | 盐酸胍法辛缓释制剂及其制备方法 |
| CN103373996A (zh) | 2012-04-20 | 2013-10-30 | 山东亨利医药科技有限责任公司 | 作为crth2受体拮抗剂的二并环衍生物 |
| NZ702747A (en) * | 2012-06-13 | 2017-03-31 | Incyte Holdings Corp | Substituted tricyclic compounds as fgfr inhibitors |
| EP2867226B1 (en) | 2012-06-28 | 2018-11-14 | Novartis AG | Complement pathway modulators and uses thereof |
| CN102772444A (zh) | 2012-07-06 | 2012-11-14 | 周明千 | 中药超微破壁口服片剂饮片的加工方法 |
| GB201212513D0 (en) | 2012-07-13 | 2012-08-29 | Ucb Pharma Sa | Therapeutic agents |
| ES2660051T3 (es) | 2012-09-28 | 2018-03-20 | Vanderbilt University | Compuestos heterocíclicos condensados como inhibidores selectivos de BMP |
| EA201590693A1 (ru) | 2012-10-05 | 2015-08-31 | Ригель Фармасьютикалс, Инк. | Ингибиторы gdf-8 |
| US9751885B2 (en) | 2012-10-12 | 2017-09-05 | Takeda Pharmaceutical Company Limited | Cyclopropanamine compound and use thereof |
| US9757379B2 (en) | 2012-11-14 | 2017-09-12 | The Board Of Regents Of The University Of Texas System | Inhibition of HIF-2α heterodimerization with HIF1β (ARNT) |
| EP2927212A4 (en) | 2012-11-28 | 2016-06-08 | Univ Kyoto | LSD1-SELECTIVE HEMMER WITH LYSINE STRUCTURE |
| EP2925307B1 (en) | 2012-11-30 | 2020-10-28 | McCord, Darlene E. | Hydroxytyrosol and oleuropein compositions for induction of dna damage, cell death and lsd1 inhibition |
| EP2740474A1 (en) | 2012-12-05 | 2014-06-11 | Instituto Europeo di Oncologia S.r.l. | Cyclopropylamine derivatives useful as inhibitors of histone demethylases kdm1a |
| CN104994864B (zh) | 2012-12-19 | 2018-05-29 | 沃克哈特有限公司 | 包含人胰岛素或其类似物或衍生物的稳定水性组合物 |
| CN103054869A (zh) | 2013-01-18 | 2013-04-24 | 郑州大学 | 含三唑基的氨基二硫代甲酸酯化合物在制备以lsd1为靶标药物中的应用 |
| CN103933036B (zh) | 2013-01-23 | 2017-10-13 | 中国人民解放军军事医学科学院毒物药物研究所 | 2‑芳基咪唑并[1,2‑α]吡啶‑3‑乙酰胺衍生物在制备防治PTSD的药物中的用途 |
| CN105263910A (zh) | 2013-02-18 | 2016-01-20 | 斯克利普斯研究所 | 具有治疗潜力的血管加压素受体调节剂 |
| US8558008B2 (en) | 2013-02-28 | 2013-10-15 | Dermira, Inc. | Crystalline glycopyrrolate tosylate |
| WO2014164867A1 (en) | 2013-03-11 | 2014-10-09 | Imago Biosciences | Kdm1a inhibitors for the treatment of disease |
| JP2016516399A (ja) | 2013-03-13 | 2016-06-09 | オーストラリアン ニュークリア サイエンス アンド テクノロジー オーガニゼーション | 非機能性tspo遺伝子を有するトランスジェニック非ヒト生物 |
| US20140343118A1 (en) | 2013-03-14 | 2014-11-20 | Duke University | Methods of treatment using arylcyclopropylamine compounds |
| WO2014153001A1 (en) | 2013-03-14 | 2014-09-25 | Epizyme, Inc. | Combination therapy for treating cancer |
| EP3003301B1 (en) | 2013-05-30 | 2021-02-24 | Board Of Regents Of The Nevada System Of Higher Education On Behalf Of The University Of Nevada, Las Vegas | Novel suicidal lsd1 inhibitors targeting sox2-expressing cancer cells |
| KR102288648B1 (ko) | 2013-06-19 | 2021-08-12 | 유니버시티 오브 유타 리서치 파운데이션 | 히스톤 데메틸라제 억제제로서의 치환된 (e)-n′-(1-페닐에틸리덴)벤조하이드라지드 동족체 |
| CA2915967C (en) | 2013-06-21 | 2021-07-20 | MyoKardia, Inc. | Pyrimidinedione compounds against cardiac conditions |
| US9186391B2 (en) | 2013-08-29 | 2015-11-17 | Musc Foundation For Research Development | Cyclic peptide inhibitors of lysine-specific demethylase 1 |
| US9556170B2 (en) | 2013-08-30 | 2017-01-31 | University Of Utah Research Foundation | Substituted-1H-benzo[d]imidazole series compounds as lysine-specific demethylase 1 (LSD1) inhibitors |
| US9770514B2 (en) | 2013-09-03 | 2017-09-26 | ExxPharma Therapeutics LLC | Tamper-resistant pharmaceutical dosage forms |
| CN105658209A (zh) | 2013-09-13 | 2016-06-08 | 拜耳制药股份公司 | 含有瑞法美替的药物组合物 |
| KR101568724B1 (ko) | 2013-11-13 | 2015-11-12 | 서울대학교산학협력단 | 신규한 화합물, 이의 생산 방법, 및 히스톤 디메틸라제 저해제로서 이의 용도 |
| EP3080100B1 (en) | 2013-12-11 | 2022-11-30 | Celgene Quanticel Research, Inc. | Inhibitors of lysine specific demethylase-1 |
| PL3105226T3 (pl) | 2014-02-13 | 2020-03-31 | Incyte Corporation | Cyklopropyloaminy jako inhibitory LSD1 |
| US9428470B2 (en) | 2014-02-13 | 2016-08-30 | Takeda Pharmaceutical Company Limited | Heterocyclic compound |
| TWI741478B (zh) | 2014-02-13 | 2021-10-01 | 美商英塞特控股公司 | 作為lsd1抑制劑之環丙胺 |
| WO2015123437A1 (en) | 2014-02-13 | 2015-08-20 | Incyte Corporation | Cyclopropylamines as lsd1 inhibitors |
| ES2672797T3 (es) | 2014-02-13 | 2018-06-18 | Incyte Corporation | Ciclopropilaminas como inhibidores de LSD1 |
| US9346776B2 (en) | 2014-02-13 | 2016-05-24 | Takeda Pharmaceutical Company Limited | Fused heterocyclic compound |
| WO2015145145A1 (en) | 2014-03-24 | 2015-10-01 | Cipla Limited | Pharmaceutical composition comprising lapatinib |
| CN103893163B (zh) | 2014-03-28 | 2016-02-03 | 中国药科大学 | 2-([1,1′-联苯]-4-基)2-氧代乙基4-((3-氯-4-甲基苯基)氨基)-4-氧代丁酸酯在制备lsd1抑制剂药物中的应用 |
| PT3126351T (pt) | 2014-04-02 | 2018-12-04 | Bristol Myers Squibb Co | Inibidores de biaril quinase |
| WO2015155297A1 (en) | 2014-04-11 | 2015-10-15 | Sanovel Ilac Sanayi Ve Ticaret A.S. | Pharmaceutical combinations of dabigatran and h2-receptor antagonists |
| EP2933002A1 (en) | 2014-04-11 | 2015-10-21 | Sanovel Ilac Sanayi ve Ticaret A.S. | Pharmaceutical combinations of dabigatran and proton pump inhibitors |
| EP3129369A1 (en) | 2014-04-11 | 2017-02-15 | Takeda Pharmaceutical Company Limited | Cyclopropanamine compound and use thereof |
| CN103961340B (zh) | 2014-04-30 | 2019-06-25 | 南通中国科学院海洋研究所海洋科学与技术研究发展中心 | 一类lsd1抑制剂及其应用 |
| US10233165B2 (en) | 2014-05-30 | 2019-03-19 | Istituto Europeo Di Oncologia S.R.L. | Cyclopropylamine compounds as histone demethylase inhibitors |
| CN104119280B (zh) | 2014-06-27 | 2016-03-16 | 郑州大学 | 含氨基类脲与端炔结构单元的嘧啶衍生物、制备方法及应用 |
| WO2016007727A1 (en) | 2014-07-10 | 2016-01-14 | Incyte Corporation | Triazolopyridines and triazolopyrazines as lsd1 inhibitors |
| TW201613925A (en) | 2014-07-10 | 2016-04-16 | Incyte Corp | Imidazopyrazines as LSD1 inhibitors |
| WO2016007731A1 (en) | 2014-07-10 | 2016-01-14 | Incyte Corporation | Imidazopyridines and imidazopyrazines as lsd1 inhibitors |
| US9695167B2 (en) | 2014-07-10 | 2017-07-04 | Incyte Corporation | Substituted triazolo[1,5-a]pyridines and triazolo[1,5-a]pyrazines as LSD1 inhibitors |
| GB201417828D0 (en) | 2014-10-08 | 2014-11-19 | Cereno Scient Ab | New methods and compositions |
| CN104173313B (zh) | 2014-08-25 | 2017-05-17 | 杭州朱养心药业有限公司 | 利伐沙班片剂药物组合物 |
| JP6653116B2 (ja) | 2014-08-27 | 2020-02-26 | 日本ケミファ株式会社 | オルメサルタンのプロドラッグ製剤 |
| JP6613306B2 (ja) | 2014-10-08 | 2019-11-27 | エフ.ホフマン−ラ ロシュ アーゲー | アルドステロン合成酵素阻害剤としてのスピロジアミン誘導体 |
| JP2018510198A (ja) | 2015-04-03 | 2018-04-12 | ミュタビリスMutabilis | 複素環式化合物及びそれらの細菌感染症の予防または治療のための使用 |
| MA51438A (fr) | 2015-04-03 | 2021-04-14 | Incyte Corp | Composés hétérocycliques utilisés en tant qu'inhibiteurs de lsd1 |
| KR20170134981A (ko) | 2015-04-03 | 2017-12-07 | 브리스톨-마이어스 스큅 컴퍼니 | 암의 치료를 위한 인돌아민-2,3-디옥시게나제의 억제제 |
| TWI765860B (zh) | 2015-08-12 | 2022-06-01 | 美商英塞特公司 | Lsd1抑制劑之鹽 |
| CN112656772B (zh) | 2015-10-15 | 2022-05-20 | 浙江东日药业有限公司 | 利伐沙班药物组合物 |
| SG11201805645QA (en) | 2015-12-29 | 2018-07-30 | Mirati Therapeutics Inc | Lsd1 inhibitors |
| WO2017130933A1 (ja) | 2016-01-25 | 2017-08-03 | 国立大学法人熊本大学 | 神経変性疾患治療剤 |
| PE20190377A1 (es) | 2016-04-22 | 2019-03-08 | Incyte Corp | Formulaciones de un inhibidor de lsd 1 |
| EP3570843A1 (en) | 2017-01-18 | 2019-11-27 | Vanderbilt University | Fused heterocyclic compounds as selective bmp inhibitors |
| JP7111733B2 (ja) | 2017-03-16 | 2022-08-02 | 江蘇恒瑞医薬股▲ふん▼有限公司 | ヘテロアリール[4,3-c]ピリミジン-5-アミン誘導体、その製造方法、およびその医薬の使用 |
| GEP20237548B (en) | 2018-07-05 | 2023-10-10 | Incyte Corp | Fused pyrazine derivatives as a2a /a2b inhibitors |
| WO2020047198A1 (en) | 2018-08-31 | 2020-03-05 | Incyte Corporation | Salts of an lsd1 inhibitor and processes for preparing the same |
-
2015
- 2015-02-12 TW TW109101686A patent/TWI741478B/zh active
- 2015-02-12 UA UAA201609400A patent/UA126541C2/uk unknown
- 2015-02-12 PE PE2016001466A patent/PE20161573A1/es unknown
- 2015-02-12 US US14/620,903 patent/US9670210B2/en active Active
- 2015-02-12 SG SG11201606689VA patent/SG11201606689VA/en unknown
- 2015-02-12 TW TW104104827A patent/TWI685483B/zh active
- 2015-02-12 CR CR20160396A patent/CR20160396A/es unknown
- 2015-02-12 ES ES15706634T patent/ES2760261T3/es active Active
- 2015-02-12 JP JP2016551710A patent/JP6602778B2/ja active Active
- 2015-02-12 CA CA2939082A patent/CA2939082C/en active Active
- 2015-02-12 EP EP15706634.1A patent/EP3105218B1/en active Active
- 2015-02-12 SG SG10201806849WA patent/SG10201806849WA/en unknown
- 2015-02-12 MY MYPI2016001506A patent/MY183499A/en unknown
- 2015-02-12 MX MX2016010395A patent/MX2016010395A/es active IP Right Grant
- 2015-02-12 KR KR1020167025508A patent/KR102421235B1/ko active IP Right Grant
- 2015-02-12 PT PT157066341T patent/PT3105218T/pt unknown
- 2015-02-12 ES ES19190494T patent/ES2901711T3/es active Active
- 2015-02-12 HU HUE15706634A patent/HUE046273T2/hu unknown
- 2015-02-12 WO PCT/US2015/015706 patent/WO2015123465A1/en active Application Filing
- 2015-02-12 ME MEP-2019-327A patent/ME03654B/me unknown
- 2015-02-12 PL PL15706634T patent/PL3105218T3/pl unknown
- 2015-02-12 RS RS20191486A patent/RS59559B1/sr unknown
- 2015-02-12 AU AU2015217073A patent/AU2015217073B2/en active Active
- 2015-02-12 LT LT15706634T patent/LT3105218T/lt unknown
- 2015-02-12 SI SI201530920T patent/SI3105218T1/sl unknown
- 2015-02-12 EP EP19190494.5A patent/EP3626713B1/en active Active
- 2015-02-12 CR CR20200199A patent/CR20200199A/es unknown
- 2015-02-12 DK DK15706634T patent/DK3105218T3/da active
- 2015-02-12 CN CN201911356925.9A patent/CN111454188A/zh active Pending
- 2015-02-12 CN CN201580017095.0A patent/CN106164066B/zh active Active
- 2015-02-12 SG SG10201908028S patent/SG10201908028SA/en unknown
-
2016
- 2016-08-07 IL IL247134A patent/IL247134B/en active IP Right Grant
- 2016-08-10 MX MX2020012046A patent/MX2020012046A/es unknown
- 2016-08-11 PH PH12016501601A patent/PH12016501601A1/en unknown
- 2016-08-11 CL CL2016002027A patent/CL2016002027A1/es unknown
- 2016-09-09 ZA ZA2016/06275A patent/ZA201606275B/en unknown
- 2016-09-09 EC ECIEPI201673190A patent/ECSP16073190A/es unknown
-
2017
- 2017-04-26 US US15/497,887 patent/US10174030B2/en active Active
-
2018
- 2018-11-19 US US16/195,026 patent/US10717737B2/en active Active
-
2019
- 2019-08-01 AU AU2019210624A patent/AU2019210624B2/en active Active
- 2019-10-09 JP JP2019185892A patent/JP6883635B2/ja active Active
- 2019-11-29 HR HRP20192167TT patent/HRP20192167T1/hr unknown
- 2019-12-12 CY CY20191101308T patent/CY1122415T1/el unknown
-
2020
- 2020-06-09 US US16/897,051 patent/US11247992B2/en active Active
- 2020-09-06 IL IL277167A patent/IL277167B/en unknown
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2012135113A2 (en) * | 2011-03-25 | 2012-10-04 | Glaxosmithkline Llc | Cyclopropylamines as lsd1 inhibitors |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| TWI741478B (zh) | 作為lsd1抑制劑之環丙胺 | |
| US11155532B2 (en) | Cyclopropylamines as LSD1 inhibitors | |
| US10513493B2 (en) | Cyclopropylamines as LSD1 inhibitors | |
| JP2020023529A6 (ja) | Lsd1阻害剤としてのシクロプロピルアミン類 | |
| EA039196B1 (ru) | Циклопропиламины в качестве ингибиторов lsd1 | |
| BR112016018544B1 (pt) | Compostos ciclopropilaminas, composição farmacêutica que os compreende e seus usos no tratamento de câncer ou uma doença viral ou um beta-globinopatia ou para a inibição de lsd1 | |
| EA042621B1 (ru) | Циклопропиламины в качестве ингибиторов lsd1 |