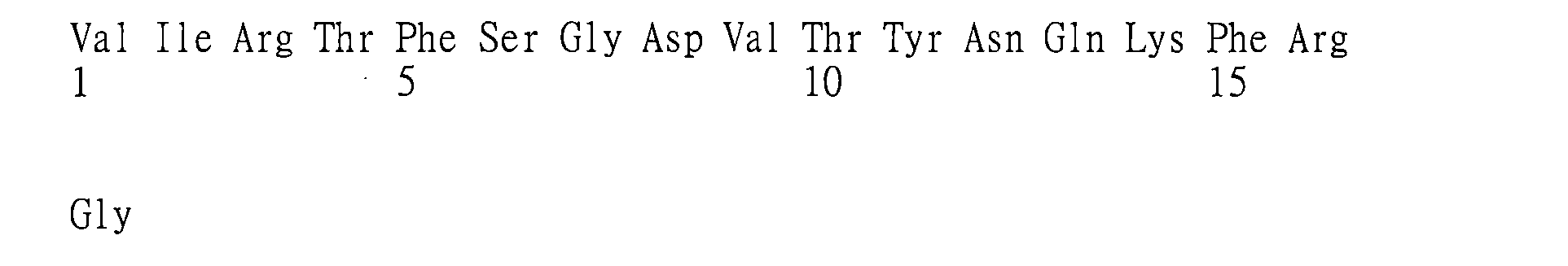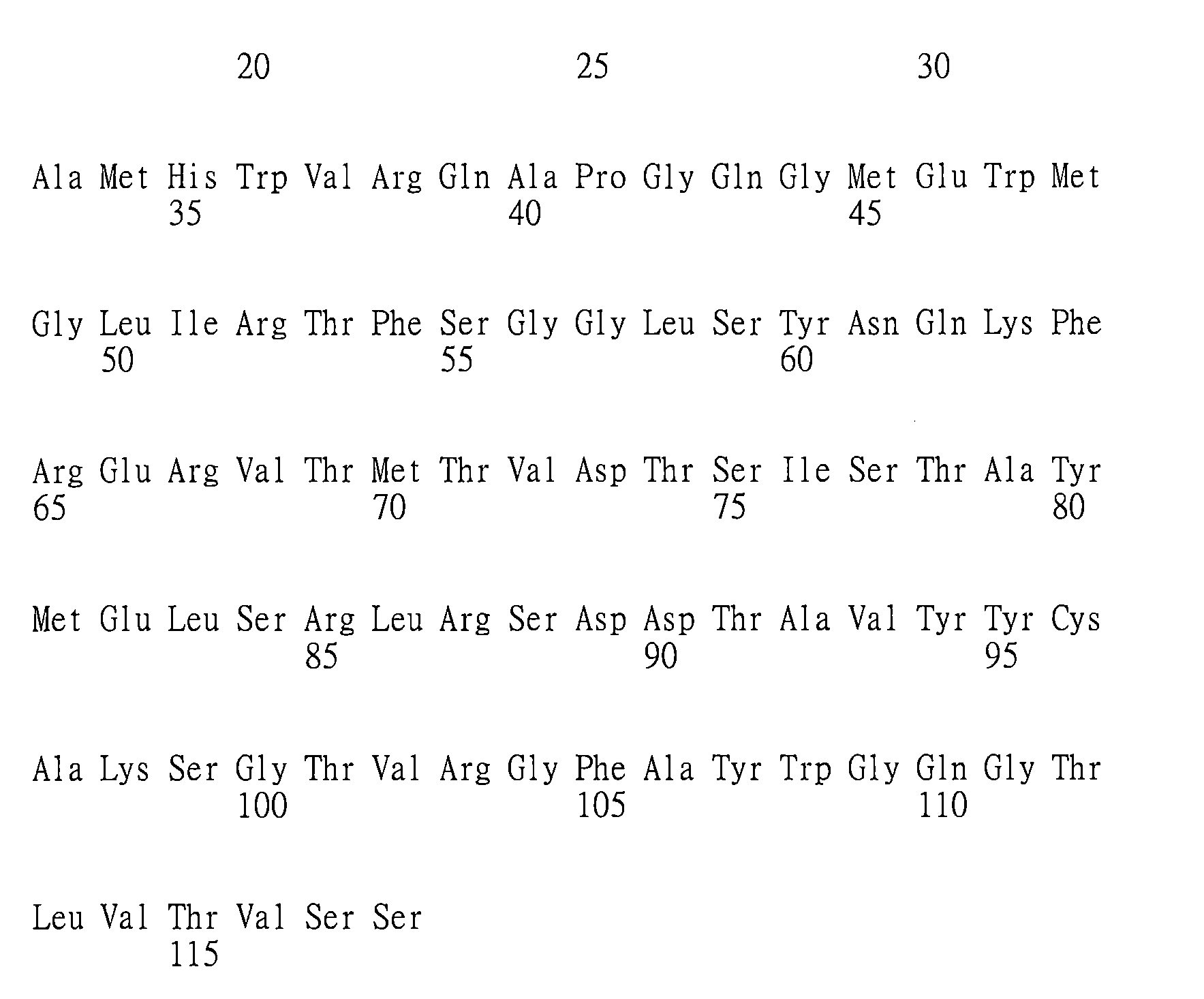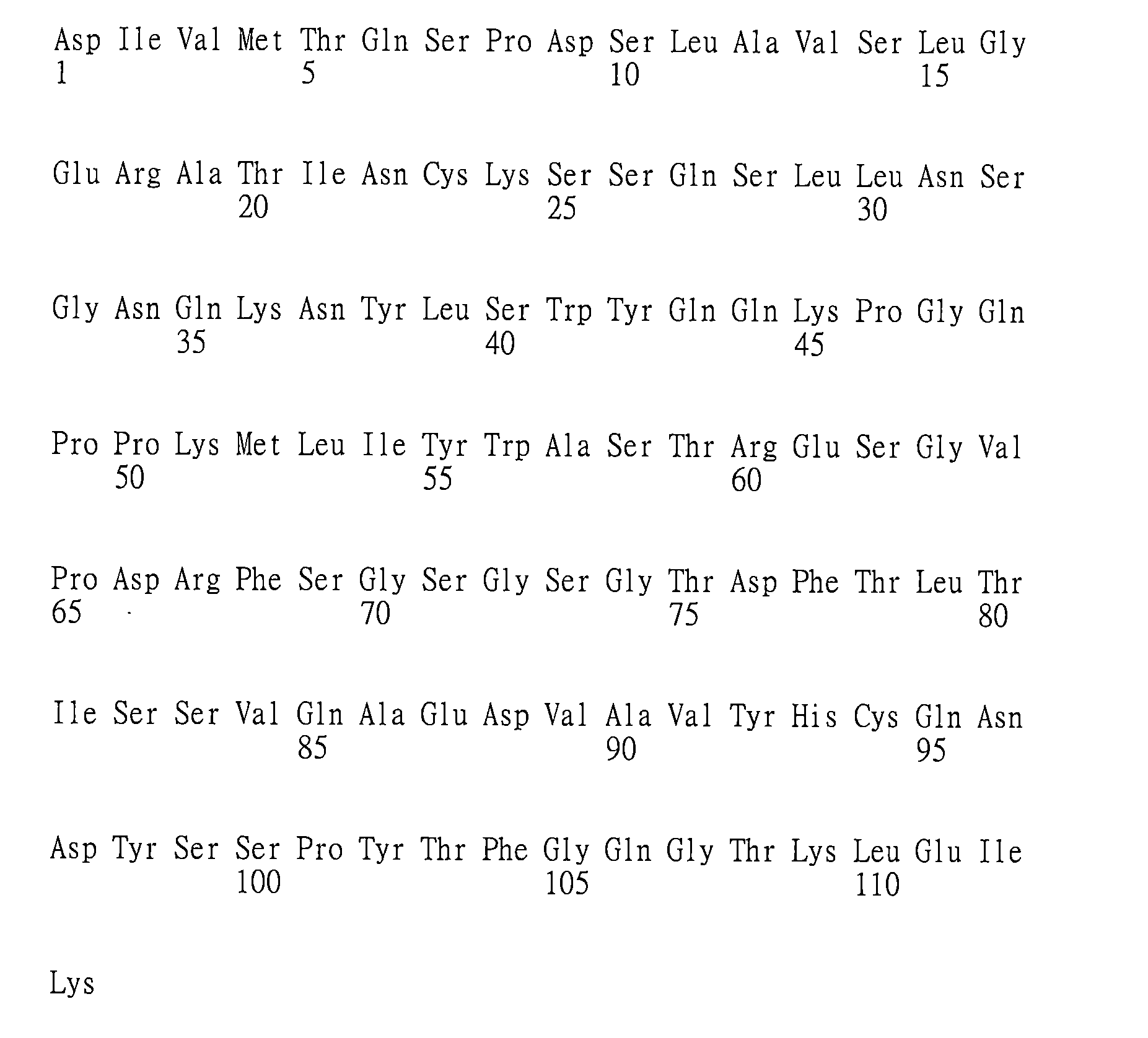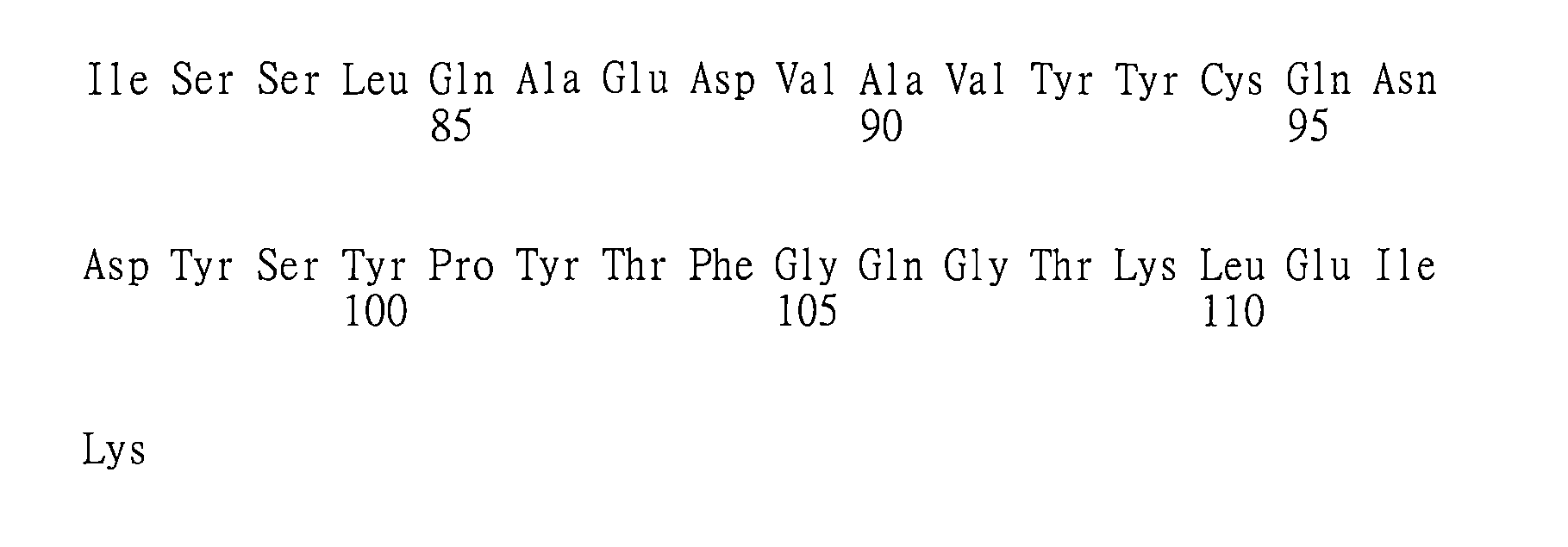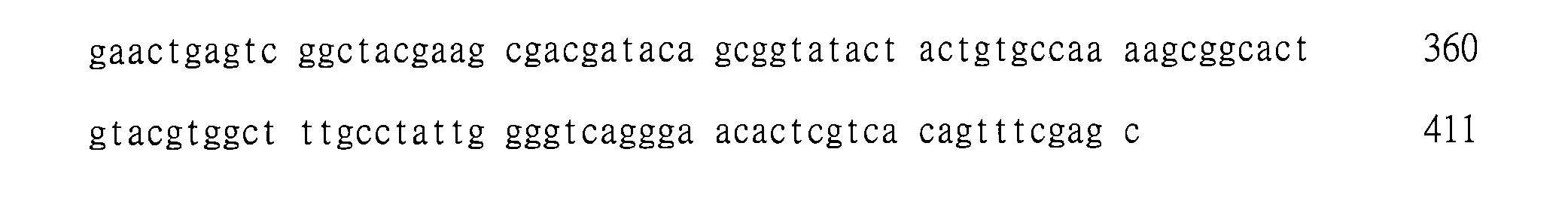TW202132337A - 抗糖皮質素誘導性tnfr家族相關性受體(gitr)抗體類及使用彼等之方法 - Google Patents
抗糖皮質素誘導性tnfr家族相關性受體(gitr)抗體類及使用彼等之方法 Download PDFInfo
- Publication number
- TW202132337A TW202132337A TW109136463A TW109136463A TW202132337A TW 202132337 A TW202132337 A TW 202132337A TW 109136463 A TW109136463 A TW 109136463A TW 109136463 A TW109136463 A TW 109136463A TW 202132337 A TW202132337 A TW 202132337A
- Authority
- TW
- Taiwan
- Prior art keywords
- antibody
- gitr
- seq
- amino acid
- human
- Prior art date
Links
- 238000000034 method Methods 0.000 title abstract description 79
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 claims abstract description 394
- 102000047758 human TNFRSF18 Human genes 0.000 claims abstract description 391
- 241000282414 Homo sapiens Species 0.000 claims abstract description 197
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 31
- 201000011510 cancer Diseases 0.000 claims abstract description 26
- 230000027455 binding Effects 0.000 claims description 612
- 101710187882 Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 claims description 463
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 311
- 229910052727 yttrium Inorganic materials 0.000 claims description 112
- 210000004027 cell Anatomy 0.000 claims description 90
- 229910052731 fluorine Inorganic materials 0.000 claims description 75
- 229910052739 hydrogen Inorganic materials 0.000 claims description 52
- 150000001413 amino acids Chemical class 0.000 claims description 48
- 229910052717 sulfur Inorganic materials 0.000 claims description 38
- 238000006467 substitution reaction Methods 0.000 claims description 33
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 30
- 150000007523 nucleic acids Chemical class 0.000 claims description 28
- 102000039446 nucleic acids Human genes 0.000 claims description 24
- 108020004707 nucleic acids Proteins 0.000 claims description 24
- 238000012258 culturing Methods 0.000 claims description 22
- 239000005557 antagonist Substances 0.000 claims description 21
- 239000008194 pharmaceutical composition Substances 0.000 claims description 21
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 claims description 20
- 108090000623 proteins and genes Proteins 0.000 claims description 20
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims description 19
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims description 19
- 239000002253 acid Substances 0.000 claims description 17
- 239000000556 agonist Substances 0.000 claims description 15
- 230000035772 mutation Effects 0.000 claims description 14
- 239000003112 inhibitor Substances 0.000 claims description 13
- 102000004169 proteins and genes Human genes 0.000 claims description 11
- 241000282693 Cercopithecidae Species 0.000 claims description 10
- 239000013598 vector Substances 0.000 claims description 10
- 239000003795 chemical substances by application Substances 0.000 claims description 9
- 230000008685 targeting Effects 0.000 claims description 9
- 208000036142 Viral infection Diseases 0.000 claims description 7
- 102220469588 Voltage-dependent L-type calcium channel subunit beta-2_D60A_mutation Human genes 0.000 claims description 7
- 150000001412 amines Chemical class 0.000 claims description 7
- 230000028993 immune response Effects 0.000 claims description 7
- 101000604674 Homo sapiens Immunoglobulin kappa variable 4-1 Proteins 0.000 claims description 6
- 102100038198 Immunoglobulin kappa variable 4-1 Human genes 0.000 claims description 6
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 238000011282 treatment Methods 0.000 claims description 6
- 230000009385 viral infection Effects 0.000 claims description 6
- 101000998953 Homo sapiens Immunoglobulin heavy variable 1-2 Proteins 0.000 claims description 5
- 102100036887 Immunoglobulin heavy variable 1-2 Human genes 0.000 claims description 5
- 239000003814 drug Substances 0.000 claims description 5
- YPBKTZBXSBLTDK-PKNBQFBNSA-N (3e)-3-[(3-bromo-4-fluoroanilino)-nitrosomethylidene]-4-[2-(sulfamoylamino)ethylamino]-1,2,5-oxadiazole Chemical compound NS(=O)(=O)NCCNC1=NON\C1=C(N=O)/NC1=CC=C(F)C(Br)=C1 YPBKTZBXSBLTDK-PKNBQFBNSA-N 0.000 claims description 4
- 229940045513 CTLA4 antagonist Drugs 0.000 claims description 4
- 101000998950 Homo sapiens Immunoglobulin heavy variable 1-18 Proteins 0.000 claims description 4
- 101000998947 Homo sapiens Immunoglobulin heavy variable 1-46 Proteins 0.000 claims description 4
- 101001037147 Homo sapiens Immunoglobulin heavy variable 1-69 Proteins 0.000 claims description 4
- 101000989065 Homo sapiens Immunoglobulin heavy variable 7-4-1 Proteins 0.000 claims description 4
- 101001047520 Homo sapiens Probable non-functional immunoglobulin kappa variable 3-7 Proteins 0.000 claims description 4
- 102100036884 Immunoglobulin heavy variable 1-18 Human genes 0.000 claims description 4
- 102100036888 Immunoglobulin heavy variable 1-46 Human genes 0.000 claims description 4
- 102100040232 Immunoglobulin heavy variable 1-69 Human genes 0.000 claims description 4
- 102100029420 Immunoglobulin heavy variable 7-4-1 Human genes 0.000 claims description 4
- 102100022959 Probable non-functional immunoglobulin kappa variable 3-7 Human genes 0.000 claims description 4
- 229950006370 epacadostat Drugs 0.000 claims description 4
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 4
- 230000002829 reductive effect Effects 0.000 claims description 4
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 4
- ZADWXFSZEAPBJS-SNVBAGLBSA-N (2r)-2-amino-3-(1-methylindol-3-yl)propanoic acid Chemical compound C1=CC=C2N(C)C=C(C[C@@H](N)C(O)=O)C2=C1 ZADWXFSZEAPBJS-SNVBAGLBSA-N 0.000 claims description 3
- 241000282412 Homo Species 0.000 claims description 3
- YGACXVRLDHEXKY-WXRXAMBDSA-N O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 Chemical compound O[C@H](C[C@H]1c2c(cccc2F)-c2cncn12)[C@H]1CC[C@H](O)CC1 YGACXVRLDHEXKY-WXRXAMBDSA-N 0.000 claims description 3
- 229940124060 PD-1 antagonist Drugs 0.000 claims description 3
- 229950009034 indoximod Drugs 0.000 claims description 3
- KRTIYQIPSAGSBP-KLAILNCOSA-N linrodostat Chemical compound C1(CCC(CC1)C1=C2C=C(F)C=CC2=NC=C1)[C@@H](C)C(=O)NC1=CC=C(Cl)C=C1 KRTIYQIPSAGSBP-KLAILNCOSA-N 0.000 claims description 3
- 201000001441 melanoma Diseases 0.000 claims description 3
- 206010014733 Endometrial cancer Diseases 0.000 claims description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 claims description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 2
- 102000017578 LAG3 Human genes 0.000 claims description 2
- 101150030213 Lag3 gene Proteins 0.000 claims description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 2
- 229940123751 PD-L1 antagonist Drugs 0.000 claims description 2
- 229940121678 PD-L2 antagonist Drugs 0.000 claims description 2
- 229940123803 TIM3 antagonist Drugs 0.000 claims description 2
- 230000001270 agonistic effect Effects 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- 201000004101 esophageal cancer Diseases 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 102000050627 Glucocorticoid-Induced TNFR-Related Human genes 0.000 claims 6
- 229940124597 therapeutic agent Drugs 0.000 claims 3
- 208000005718 Stomach Neoplasms Diseases 0.000 claims 2
- 206010017758 gastric cancer Diseases 0.000 claims 2
- 102000006639 indoleamine 2,3-dioxygenase Human genes 0.000 claims 2
- 108020004201 indoleamine 2,3-dioxygenase Proteins 0.000 claims 2
- 102220013477 rs117560775 Human genes 0.000 claims 2
- 201000011549 stomach cancer Diseases 0.000 claims 2
- 201000009030 Carcinoma Diseases 0.000 claims 1
- 208000000102 Squamous Cell Carcinoma of Head and Neck Diseases 0.000 claims 1
- 229940126547 T-cell immunoglobulin mucin-3 Drugs 0.000 claims 1
- 210000003238 esophagus Anatomy 0.000 claims 1
- 201000000459 head and neck squamous cell carcinoma Diseases 0.000 claims 1
- 210000003292 kidney cell Anatomy 0.000 claims 1
- 210000002784 stomach Anatomy 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 46
- 239000000203 mixture Substances 0.000 abstract description 7
- 208000035473 Communicable disease Diseases 0.000 abstract description 6
- 102000005962 receptors Human genes 0.000 abstract description 5
- 108020003175 receptors Proteins 0.000 abstract description 5
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 abstract description 4
- 102000003298 tumor necrosis factor receptor Human genes 0.000 abstract description 4
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 3
- 239000003862 glucocorticoid Substances 0.000 abstract 1
- 239000012634 fragment Substances 0.000 description 660
- 239000000427 antigen Substances 0.000 description 519
- 108091007433 antigens Proteins 0.000 description 519
- 102000036639 antigens Human genes 0.000 description 519
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 460
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 description 242
- 239000011324 bead Substances 0.000 description 224
- 101000597780 Mus musculus Tumor necrosis factor ligand superfamily member 18 Proteins 0.000 description 129
- 229910052721 tungsten Inorganic materials 0.000 description 110
- 229910052799 carbon Inorganic materials 0.000 description 109
- 241000288906 Primates Species 0.000 description 92
- 235000001014 amino acid Nutrition 0.000 description 92
- 210000001744 T-lymphocyte Anatomy 0.000 description 86
- 238000004458 analytical method Methods 0.000 description 82
- 101000597779 Homo sapiens Tumor necrosis factor ligand superfamily member 18 Proteins 0.000 description 77
- 102000053830 human TNFSF18 Human genes 0.000 description 74
- 101710117290 Aldo-keto reductase family 1 member C4 Proteins 0.000 description 56
- 102100024952 Protein CBFA2T1 Human genes 0.000 description 56
- 229910052740 iodine Inorganic materials 0.000 description 55
- 229910052698 phosphorus Inorganic materials 0.000 description 49
- 229940024606 amino acid Drugs 0.000 description 46
- 108091008874 T cell receptors Proteins 0.000 description 38
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 description 38
- 239000000725 suspension Substances 0.000 description 38
- 229910052720 vanadium Inorganic materials 0.000 description 37
- 239000004698 Polyethylene Substances 0.000 description 25
- 230000000638 stimulation Effects 0.000 description 21
- 108010047620 Phytohemagglutinins Proteins 0.000 description 17
- 238000002474 experimental method Methods 0.000 description 17
- 230000001885 phytohemagglutinin Effects 0.000 description 17
- 238000012360 testing method Methods 0.000 description 16
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 15
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 15
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 15
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 description 15
- 102100029193 Low affinity immunoglobulin gamma Fc region receptor III-A Human genes 0.000 description 14
- 210000004602 germ cell Anatomy 0.000 description 14
- PHEDXBVPIONUQT-RGYGYFBISA-N phorbol 13-acetate 12-myristate Chemical compound C([C@]1(O)C(=O)C(C)=C[C@H]1[C@@]1(O)[C@H](C)[C@H]2OC(=O)CCCCCCCCCCCCC)C(CO)=C[C@H]1[C@H]1[C@]2(OC(C)=O)C1(C)C PHEDXBVPIONUQT-RGYGYFBISA-N 0.000 description 14
- 239000005089 Luciferase Substances 0.000 description 13
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 12
- 125000000539 amino acid group Chemical group 0.000 description 12
- 239000012636 effector Substances 0.000 description 12
- 230000014509 gene expression Effects 0.000 description 12
- 230000001965 increasing effect Effects 0.000 description 12
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 12
- 230000002708 enhancing effect Effects 0.000 description 11
- 102000004127 Cytokines Human genes 0.000 description 10
- 108090000695 Cytokines Proteins 0.000 description 10
- 230000004913 activation Effects 0.000 description 10
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 10
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 description 9
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 9
- 108010073807 IgG Receptors Proteins 0.000 description 9
- 102000009490 IgG Receptors Human genes 0.000 description 9
- 108060003951 Immunoglobulin Proteins 0.000 description 9
- 108010057466 NF-kappa B Proteins 0.000 description 9
- 102000003945 NF-kappa B Human genes 0.000 description 9
- 102000018358 immunoglobulin Human genes 0.000 description 9
- 238000000338 in vitro Methods 0.000 description 9
- 235000018102 proteins Nutrition 0.000 description 9
- 230000004936 stimulating effect Effects 0.000 description 9
- 108060001084 Luciferase Proteins 0.000 description 8
- 108010029485 Protein Isoforms Proteins 0.000 description 8
- 102000001708 Protein Isoforms Human genes 0.000 description 8
- 230000003213 activating effect Effects 0.000 description 8
- 238000000684 flow cytometry Methods 0.000 description 8
- 108090000765 processed proteins & peptides Proteins 0.000 description 8
- 210000003289 regulatory T cell Anatomy 0.000 description 8
- 241000282552 Chlorocebus aethiops Species 0.000 description 7
- 238000010586 diagram Methods 0.000 description 7
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 6
- 230000000735 allogeneic effect Effects 0.000 description 6
- 238000012217 deletion Methods 0.000 description 6
- 230000037430 deletion Effects 0.000 description 6
- 210000003162 effector t lymphocyte Anatomy 0.000 description 6
- 230000006870 function Effects 0.000 description 6
- 238000003780 insertion Methods 0.000 description 6
- 230000037431 insertion Effects 0.000 description 6
- 229910052757 nitrogen Inorganic materials 0.000 description 6
- 229910052700 potassium Inorganic materials 0.000 description 6
- 102000004196 processed proteins & peptides Human genes 0.000 description 6
- 238000010186 staining Methods 0.000 description 6
- 229950007217 tremelimumab Drugs 0.000 description 6
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 5
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 5
- 102100035283 Tumor necrosis factor ligand superfamily member 18 Human genes 0.000 description 5
- 125000003277 amino group Chemical group 0.000 description 5
- 238000005516 engineering process Methods 0.000 description 5
- 230000001939 inductive effect Effects 0.000 description 5
- 238000013507 mapping Methods 0.000 description 5
- 238000005259 measurement Methods 0.000 description 5
- 230000035755 proliferation Effects 0.000 description 5
- 102220091023 rs377377296 Human genes 0.000 description 5
- QGVLYPPODPLXMB-UBTYZVCOSA-N (1aR,1bS,4aR,7aS,7bS,8R,9R,9aS)-4a,7b,9,9a-tetrahydroxy-3-(hydroxymethyl)-1,1,6,8-tetramethyl-1,1a,1b,4,4a,7a,7b,8,9,9a-decahydro-5H-cyclopropa[3,4]benzo[1,2-e]azulen-5-one Chemical compound C1=C(CO)C[C@]2(O)C(=O)C(C)=C[C@H]2[C@@]2(O)[C@H](C)[C@@H](O)[C@@]3(O)C(C)(C)[C@H]3[C@@H]21 QGVLYPPODPLXMB-UBTYZVCOSA-N 0.000 description 4
- 238000012413 Fluorescence activated cell sorting analysis Methods 0.000 description 4
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 4
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 4
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 4
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 4
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 description 4
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 4
- 102000003814 Interleukin-10 Human genes 0.000 description 4
- 108090000174 Interleukin-10 Proteins 0.000 description 4
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 241001529936 Murinae Species 0.000 description 4
- NFXWJYUDIOHFAW-UHFFFAOYSA-N acetic acid;tetradecanoic acid Chemical compound CC(O)=O.CCCCCCCCCCCCCC(O)=O NFXWJYUDIOHFAW-UHFFFAOYSA-N 0.000 description 4
- 238000010494 dissociation reaction Methods 0.000 description 4
- 230000005593 dissociations Effects 0.000 description 4
- 238000011156 evaluation Methods 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- QGVLYPPODPLXMB-QXYKVGAMSA-N phorbol Natural products C[C@@H]1[C@@H](O)[C@]2(O)[C@H]([C@H]3C=C(CO)C[C@@]4(O)[C@H](C=C(C)C4=O)[C@@]13O)C2(C)C QGVLYPPODPLXMB-QXYKVGAMSA-N 0.000 description 4
- 101000998952 Homo sapiens Immunoglobulin heavy variable 1-3 Proteins 0.000 description 3
- 102100036886 Immunoglobulin heavy variable 1-3 Human genes 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- 241000283984 Rodentia Species 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 238000012867 alanine scanning Methods 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 230000006690 co-activation Effects 0.000 description 3
- 230000008878 coupling Effects 0.000 description 3
- 238000010168 coupling process Methods 0.000 description 3
- 238000005859 coupling reaction Methods 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 238000003127 radioimmunoassay Methods 0.000 description 3
- 230000009870 specific binding Effects 0.000 description 3
- 210000001519 tissue Anatomy 0.000 description 3
- 208000020007 Autosomal agammaglobulinemia Diseases 0.000 description 2
- 241000283690 Bos taurus Species 0.000 description 2
- 241000282472 Canis lupus familiaris Species 0.000 description 2
- 206010009944 Colon cancer Diseases 0.000 description 2
- 108020004635 Complementary DNA Proteins 0.000 description 2
- 206010015866 Extravasation Diseases 0.000 description 2
- 241000282326 Felis catus Species 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 2
- 108010004889 Heat-Shock Proteins Proteins 0.000 description 2
- 102000002812 Heat-Shock Proteins Human genes 0.000 description 2
- 241000711549 Hepacivirus C Species 0.000 description 2
- 101100334515 Homo sapiens FCGR3A gene Proteins 0.000 description 2
- 241000701044 Human gammaherpesvirus 4 Species 0.000 description 2
- 241000701806 Human papillomavirus Species 0.000 description 2
- 108010002350 Interleukin-2 Proteins 0.000 description 2
- 102000000588 Interleukin-2 Human genes 0.000 description 2
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 2
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 2
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 2
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 2
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 230000006044 T cell activation Effects 0.000 description 2
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 2
- 239000004473 Threonine Substances 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 101710096997 Tumor necrosis factor ligand superfamily member 18 Proteins 0.000 description 2
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 2
- 238000002441 X-ray diffraction Methods 0.000 description 2
- 102220495682 Zinc finger protein 324B_S63G_mutation Human genes 0.000 description 2
- 210000000612 antigen-presenting cell Anatomy 0.000 description 2
- 230000000890 antigenic effect Effects 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000001363 autoimmune Effects 0.000 description 2
- 210000001185 bone marrow Anatomy 0.000 description 2
- 238000010804 cDNA synthesis Methods 0.000 description 2
- 229910002091 carbon monoxide Inorganic materials 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 239000000306 component Substances 0.000 description 2
- 230000004940 costimulation Effects 0.000 description 2
- 239000012228 culture supernatant Substances 0.000 description 2
- 210000004443 dendritic cell Anatomy 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 2
- 201000010099 disease Diseases 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000007717 exclusion Effects 0.000 description 2
- 230000036251 extravasation Effects 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 229960002989 glutamic acid Drugs 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- 208000014829 head and neck neoplasm Diseases 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 235000014304 histidine Nutrition 0.000 description 2
- 238000003018 immunoassay Methods 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 238000010212 intracellular staining Methods 0.000 description 2
- 229960000310 isoleucine Drugs 0.000 description 2
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- 210000004698 lymphocyte Anatomy 0.000 description 2
- 210000002540 macrophage Anatomy 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 210000004379 membrane Anatomy 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 239000000178 monomer Substances 0.000 description 2
- 210000000822 natural killer cell Anatomy 0.000 description 2
- 210000002501 natural regulatory T cell Anatomy 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 2
- 239000002953 phosphate buffered saline Substances 0.000 description 2
- 102000040430 polynucleotide Human genes 0.000 description 2
- 108091033319 polynucleotide Proteins 0.000 description 2
- 239000002157 polynucleotide Substances 0.000 description 2
- 210000001948 pro-b lymphocyte Anatomy 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 102220003294 rs267606994 Human genes 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 235000008521 threonine Nutrition 0.000 description 2
- 238000004448 titration Methods 0.000 description 2
- 239000013638 trimer Substances 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 235000002374 tyrosine Nutrition 0.000 description 2
- 229960005486 vaccine Drugs 0.000 description 2
- 239000004474 valine Substances 0.000 description 2
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 1
- ZBMRKNMTMPPMMK-UHFFFAOYSA-N 2-amino-4-[hydroxy(methyl)phosphoryl]butanoic acid;azane Chemical compound [NH4+].CP(O)(=O)CCC(N)C([O-])=O ZBMRKNMTMPPMMK-UHFFFAOYSA-N 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 101000642536 Apis mellifera Venom serine protease 34 Proteins 0.000 description 1
- 239000004475 Arginine Substances 0.000 description 1
- 108010011485 Aspartame Proteins 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 241000193830 Bacillus <bacterium> Species 0.000 description 1
- 208000035143 Bacterial infection Diseases 0.000 description 1
- 102220533151 Baculoviral IAP repeat-containing protein 5_C57A_mutation Human genes 0.000 description 1
- 102220533202 Baculoviral IAP repeat-containing protein 5_D71A_mutation Human genes 0.000 description 1
- 102220533147 Baculoviral IAP repeat-containing protein 5_E65A_mutation Human genes 0.000 description 1
- 206010004146 Basal cell carcinoma Diseases 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 206010006143 Brain stem glioma Diseases 0.000 description 1
- 206010006187 Breast cancer Diseases 0.000 description 1
- 208000026310 Breast neoplasm Diseases 0.000 description 1
- 102220586405 CDGSH iron-sulfur domain-containing protein 1_Q76A_mutation Human genes 0.000 description 1
- 102220586401 CDGSH iron-sulfur domain-containing protein 1_S68A_mutation Human genes 0.000 description 1
- 102220591067 Cellular tumor antigen p53_T55A_mutation Human genes 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 102220572027 Claudin-17_R59A_mutation Human genes 0.000 description 1
- 208000001333 Colorectal Neoplasms Diseases 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical group [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 102220486588 ESF1 homolog_W70A_mutation Human genes 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 241000588724 Escherichia coli Species 0.000 description 1
- 102000009109 Fc receptors Human genes 0.000 description 1
- 108010087819 Fc receptors Proteins 0.000 description 1
- 102100027581 Forkhead box protein P3 Human genes 0.000 description 1
- 102220646023 Galectin-10_M73A_mutation Human genes 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- UKKNTTCNGZLJEX-WHFBIAKZSA-N Gln-Ser Chemical group NC(=O)CC[C@H](N)C(=O)N[C@@H](CO)C(O)=O UKKNTTCNGZLJEX-WHFBIAKZSA-N 0.000 description 1
- 239000004471 Glycine Substances 0.000 description 1
- 241000700721 Hepatitis B virus Species 0.000 description 1
- 208000009889 Herpes Simplex Diseases 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 101000861452 Homo sapiens Forkhead box protein P3 Proteins 0.000 description 1
- 241000725303 Human immunodeficiency virus Species 0.000 description 1
- 208000005726 Inflammatory Breast Neoplasms Diseases 0.000 description 1
- 206010021980 Inflammatory carcinoma of the breast Diseases 0.000 description 1
- 102000003816 Interleukin-13 Human genes 0.000 description 1
- 108090000176 Interleukin-13 Proteins 0.000 description 1
- 102000004388 Interleukin-4 Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 108090001005 Interleukin-6 Proteins 0.000 description 1
- 102000004889 Interleukin-6 Human genes 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 1
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 1
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- RNKSNIBMTUYWSH-YFKPBYRVSA-N L-prolylglycine Chemical compound [O-]C(=O)CNC(=O)[C@@H]1CCC[NH2+]1 RNKSNIBMTUYWSH-YFKPBYRVSA-N 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 1
- 239000004472 Lysine Substances 0.000 description 1
- 230000037364 MAPK/ERK pathway Effects 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 241000712079 Measles morbillivirus Species 0.000 description 1
- 102000018697 Membrane Proteins Human genes 0.000 description 1
- 108010052285 Membrane Proteins Proteins 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100425749 Mus musculus Tnfrsf18 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 108010038807 Oligopeptides Proteins 0.000 description 1
- 102000015636 Oligopeptides Human genes 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 102220541547 PDZ domain-containing protein GIPC1_C66A_mutation Human genes 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 208000030852 Parasitic disease Diseases 0.000 description 1
- 108010089814 Plant Lectins Proteins 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 1
- 206010060862 Prostate cancer Diseases 0.000 description 1
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 102220472212 Protein Wnt-2_C67A_mutation Human genes 0.000 description 1
- 241000589516 Pseudomonas Species 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 235000014680 Saccharomyces cerevisiae Nutrition 0.000 description 1
- 208000004337 Salivary Gland Neoplasms Diseases 0.000 description 1
- 206010061934 Salivary gland cancer Diseases 0.000 description 1
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 1
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 241000187747 Streptomyces Species 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 102220617491 Syndecan-4_V75A_mutation Human genes 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 102000004398 TNF receptor-associated factor 1 Human genes 0.000 description 1
- 108090000920 TNF receptor-associated factor 1 Proteins 0.000 description 1
- 108090000925 TNF receptor-associated factor 2 Proteins 0.000 description 1
- 102000004399 TNF receptor-associated factor 3 Human genes 0.000 description 1
- 108090000922 TNF receptor-associated factor 3 Proteins 0.000 description 1
- 102000003715 TNF receptor-associated factor 4 Human genes 0.000 description 1
- 108090000008 TNF receptor-associated factor 4 Proteins 0.000 description 1
- 102000003718 TNF receptor-associated factor 5 Human genes 0.000 description 1
- 108090000001 TNF receptor-associated factor 5 Proteins 0.000 description 1
- 102100034779 TRAF family member-associated NF-kappa-B activator Human genes 0.000 description 1
- 102220607778 TYRO protein tyrosine kinase-binding protein_E64A_mutation Human genes 0.000 description 1
- 208000024313 Testicular Neoplasms Diseases 0.000 description 1
- 206010057644 Testis cancer Diseases 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- 102220481607 Tumor necrosis factor receptor superfamily member 14_Y61A_mutation Human genes 0.000 description 1
- 108091005906 Type I transmembrane proteins Proteins 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 241000700605 Viruses Species 0.000 description 1
- 102220469585 Voltage-dependent L-type calcium channel subunit beta-2_P62A_mutation Human genes 0.000 description 1
- 102220479829 Voltage-dependent L-type calcium channel subunit beta-2_R56K_mutation Human genes 0.000 description 1
- 206010047741 Vulval cancer Diseases 0.000 description 1
- 210000005006 adaptive immune system Anatomy 0.000 description 1
- 239000003443 antiviral agent Substances 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 1
- 235000009697 arginine Nutrition 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- IAOZJIPTCAWIRG-QWRGUYRKSA-N aspartame Chemical compound OC(=O)C[C@H](N)C(=O)N[C@H](C(=O)OC)CC1=CC=CC=C1 IAOZJIPTCAWIRG-QWRGUYRKSA-N 0.000 description 1
- 239000000605 aspartame Substances 0.000 description 1
- 229960003438 aspartame Drugs 0.000 description 1
- 235000010357 aspartame Nutrition 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- 230000006472 autoimmune response Effects 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 208000022362 bacterial infectious disease Diseases 0.000 description 1
- 210000003651 basophil Anatomy 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- KQNZDYYTLMIZCT-KQPMLPITSA-N brefeldin A Chemical compound O[C@@H]1\C=C\C(=O)O[C@@H](C)CCC\C=C\[C@@H]2C[C@H](O)C[C@H]21 KQNZDYYTLMIZCT-KQPMLPITSA-N 0.000 description 1
- JUMGSHROWPPKFX-UHFFFAOYSA-N brefeldin-A Natural products CC1CCCC=CC2(C)CC(O)CC2(C)C(O)C=CC(=O)O1 JUMGSHROWPPKFX-UHFFFAOYSA-N 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- 210000004970 cd4 cell Anatomy 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 230000009134 cell regulation Effects 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 230000009137 competitive binding Effects 0.000 description 1
- 210000002808 connective tissue Anatomy 0.000 description 1
- 230000000139 costimulatory effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 235000018417 cysteine Nutrition 0.000 description 1
- 230000016396 cytokine production Effects 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000002050 diffraction method Methods 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 230000002900 effect on cell Effects 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- 210000002889 endothelial cell Anatomy 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 239000013604 expression vector Substances 0.000 description 1
- 102000037865 fusion proteins Human genes 0.000 description 1
- 108020001507 fusion proteins Proteins 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 210000003128 head Anatomy 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 208000006454 hepatitis Diseases 0.000 description 1
- 231100000283 hepatitis Toxicity 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 206010020718 hyperplasia Diseases 0.000 description 1
- 230000002390 hyperplastic effect Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 201000004653 inflammatory breast carcinoma Diseases 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 230000028709 inflammatory response Effects 0.000 description 1
- 230000015788 innate immune response Effects 0.000 description 1
- 210000005007 innate immune system Anatomy 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 238000012004 kinetic exclusion assay Methods 0.000 description 1
- 210000000265 leukocyte Anatomy 0.000 description 1
- 238000002898 library design Methods 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 235000018977 lysine Nutrition 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 208000026037 malignant tumor of neck Diseases 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- MYWUZJCMWCOHBA-VIFPVBQESA-N methamphetamine Chemical compound CN[C@@H](C)CC1=CC=CC=C1 MYWUZJCMWCOHBA-VIFPVBQESA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 238000012900 molecular simulation Methods 0.000 description 1
- 201000000050 myeloid neoplasm Diseases 0.000 description 1
- 210000000581 natural killer T-cell Anatomy 0.000 description 1
- 230000000926 neurological effect Effects 0.000 description 1
- 210000000440 neutrophil Anatomy 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 239000005426 pharmaceutical component Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 239000003726 plant lectin Substances 0.000 description 1
- 210000005134 plasmacytoid dendritic cell Anatomy 0.000 description 1
- 210000004180 plasmocyte Anatomy 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 108010029020 prolylglycine Proteins 0.000 description 1
- 230000009257 reactivity Effects 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 102220277381 rs1375079282 Human genes 0.000 description 1
- 102200127268 rs137853826 Human genes 0.000 description 1
- 102220341949 rs1555450681 Human genes 0.000 description 1
- 102220044576 rs200254470 Human genes 0.000 description 1
- 102200114509 rs201382018 Human genes 0.000 description 1
- 102220133657 rs28909989 Human genes 0.000 description 1
- 102220237139 rs376184349 Human genes 0.000 description 1
- 102220085474 rs72655967 Human genes 0.000 description 1
- 102220099379 rs770702450 Human genes 0.000 description 1
- 102200109183 rs879253818 Human genes 0.000 description 1
- 230000003248 secreting effect Effects 0.000 description 1
- 230000028327 secretion Effects 0.000 description 1
- 235000004400 serine Nutrition 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- 230000019491 signal transduction Effects 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 239000007909 solid dosage form Substances 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000003826 tablet Substances 0.000 description 1
- 201000003120 testicular cancer Diseases 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 208000008732 thymoma Diseases 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 230000009466 transformation Effects 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 238000011870 unpaired t-test Methods 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 201000005102 vulva cancer Diseases 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2878—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30, CD40, CD95
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K35/00—Medicinal preparations containing materials or reaction products thereof with undetermined constitution
- A61K35/12—Materials from mammals; Compositions comprising non-specified tissues or cells; Compositions comprising non-embryonic stem cells; Genetically modified cells
- A61K35/14—Blood; Artificial blood
- A61K35/17—Lymphocytes; B-cells; T-cells; Natural killer cells; Interferon-activated or cytokine-activated lymphocytes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/461—Cellular immunotherapy characterised by the cell type used
- A61K39/4611—T-cells, e.g. tumor infiltrating lymphocytes [TIL], lymphokine-activated killer cells [LAK] or regulatory T cells [Treg]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/46—Cellular immunotherapy
- A61K39/464—Cellular immunotherapy characterised by the antigen targeted or presented
- A61K39/4643—Vertebrate antigens
- A61K39/4644—Cancer antigens
- A61K39/464402—Receptors, cell surface antigens or cell surface determinants
- A61K39/464416—Receptors for cytokines
- A61K39/464417—Receptors for tumor necrosis factors [TNF], e.g. lymphotoxin receptor [LTR], CD30
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/18—Drugs for disorders of the alimentary tract or the digestive system for pancreatic disorders, e.g. pancreatic enzymes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/08—Drugs for disorders of the urinary system of the prostate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/10—Drugs for disorders of the urinary system of the bladder
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
- A61P31/22—Antivirals for DNA viruses for herpes viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/28—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants
- C07K16/2803—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily
- C07K16/2809—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against receptors, cell surface antigens or cell surface determinants against the immunoglobulin superfamily against the T-cell receptor (TcR)-CD3 complex
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/06—Animal cells or tissues; Human cells or tissues
- C12N5/0602—Vertebrate cells
- C12N5/0634—Cells from the blood or the immune system
- C12N5/0636—T lymphocytes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/5005—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells
- G01N33/5008—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics
- G01N33/502—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving human or animal cells for testing or evaluating the effect of chemical or biological compounds, e.g. drugs, cosmetics for testing non-proliferative effects
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/31—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterized by the route of administration
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2239/00—Indexing codes associated with cellular immunotherapy of group A61K39/46
- A61K2239/38—Indexing codes associated with cellular immunotherapy of group A61K39/46 characterised by the dose, timing or administration schedule
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/34—Identification of a linear epitope shorter than 20 amino acid residues or of a conformational epitope defined by amino acid residues
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/75—Agonist effect on antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N2501/00—Active agents used in cell culture processes, e.g. differentation
- C12N2501/20—Cytokines; Chemokines
- C12N2501/25—Tumour necrosing factors [TNF]
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N2333/00—Assays involving biological materials from specific organisms or of a specific nature
- G01N2333/435—Assays involving biological materials from specific organisms or of a specific nature from animals; from humans
- G01N2333/705—Assays involving receptors, cell surface antigens or cell surface determinants
- G01N2333/70578—NGF-receptor/TNF-receptor superfamily, e.g. CD27, CD30 CD40 or CD95
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02A—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE
- Y02A50/00—TECHNOLOGIES FOR ADAPTATION TO CLIMATE CHANGE in human health protection, e.g. against extreme weather
- Y02A50/30—Against vector-borne diseases, e.g. mosquito-borne, fly-borne, tick-borne or waterborne diseases whose impact is exacerbated by climate change
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Immunology (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Engineering & Computer Science (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Virology (AREA)
- Molecular Biology (AREA)
- Oncology (AREA)
- Biomedical Technology (AREA)
- Biochemistry (AREA)
- Cell Biology (AREA)
- Communicable Diseases (AREA)
- Genetics & Genomics (AREA)
- Biotechnology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Microbiology (AREA)
- Epidemiology (AREA)
- Zoology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Mycology (AREA)
- Pathology (AREA)
- Developmental Biology & Embryology (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- General Physics & Mathematics (AREA)
Abstract
本發明提供特異性結合人類糖皮質素誘導性TNFR家族相關性受體(GITR)之抗體及包括此抗體之組成物。於一特定態樣中,該抗體特異性結合人類GITR並調節GITR活性,例如利用此抗體增強、活化或誘導GITR活性。本發明亦提供治療疾病(諸如癌症及感染性疾病)之方法,其藉由投予特異性結合人類GITR並調節GITR活性(例如增強、活化或誘導GITR活性)之抗體。
Description
〔序列表〕
本申請案包括序列表,其已以ASCII格式電子提交且其整體以引用方式併入本文。2015年5月27日所產生之該ASCII副本命為3617.009PC02_SL_PatentIn_ST25.txt且為747,129位元組大小。
本發明提供特異性結合人類糖皮質素誘導性TNFR家族相關性受體(GITR)之抗體及包括此抗體之組成物。於一特定態樣中,抗體特異性結合人類GITR並利用此抗體調節GITR活性,例如增強、活化或誘導GITR活性。本發明亦提供治療疾病(諸如癌症及感染性疾病)之方法,其係藉由投予特異性結合人類GITR並調節GITR活性(例如增強、活化或誘導GITR活性)之抗體。
糖皮質素誘導性TNFR相關性蛋白質(GITR)為TNFR超級家族之一員且表現在先天性及適應性免疫系統之許多組分並刺激後天性及先天性免疫兩者(Nocentini G et al.,(1994)PNAS 94:6216-6221;Hanabuchi S et al.,(2006)Blood 107:3617-3623;Nocentini G & Riccardi C(2005)Eur J Immunol 35:1016-1022;Nocentini G et al.,(2007)Eur J Immunol 37:1165-1169)。GITR表現在數種細胞及組織中,包括T、B、樹狀(DC)細胞及自然殺手(NK)細胞且由其配體(GITRL)活化,該配體主要表現在抗原呈現細胞(APCs)、內皮細胞及腫瘤細胞。GITR/GITRL系統參與自體免疫/發炎反應之發展且賦與對感染及腫瘤的反應。例如,GITR-Fc融合蛋白治療動物以改善自體免疫/發炎疾病,同時GITR觸發用於治療病毒、細菌及寄生蟲感染且提高免疫反應對抗腫瘤(Nocentini G et al.,(2012)Br J Pharmacol 165:2089-99)。這些效果是因為數種同時發生的機制,其包括:效應子T細胞之共活化、調控性T(Treg)細胞之抑制、NK細胞共活化、巨噬細胞之活化、樹狀細胞功能之調節及外滲過程之調控。GITR之膜表現隨著T細胞活化而增加(上述Hanabuchi S et al.,(2006);上述Nocentini G & Riccardi C)。該膜表現觸發共活化作用T淋巴球(McHugh RS et al.,(2002)Immunity 16:311-323;Shimizu J et al.,(2002)Nat Immunol 3:
135-142;Roncheti S et al.,(2004)Eur J Immunol 34:613-622;Tone M et al.,(2003)PNAS 100:15059-15064)。GITR活化增加對腫瘤及病毒感染的抗性,與自體免疫/發炎過程相關且調控白血球外滲(Nocentini G & Riccardi C(2005)supra;Cuzzocrea S et al.,(2004)J Leukoc Biol 76:933-940;Shevach EM & Stephens GL(2006)Nat Rev Immunol 6:613-618;Cuzzocrea S et al.,(2006)J Immunol 177:631-641;Cuzzocrea S et al.,(2007)FASEB J 21:117-129)。
人類GITR以非常低量表現在周邊(非活化之)T細胞。在T細胞活化之後,GITR在CD4+
及CD8+
細胞兩者中經強烈地上調控數天(Kwon B et al.,(1999)J Biol Chem 274:6056-6061;Gurney AL et al.,(1999)Curr Biol 9:215-218;上述Ronchetti S et al.,(2004);上述Shimizu J et al.,(2002);上述Ji HB et al.,(2004);Ronchetti S et al.,(2002)Blood 100:350-352;Li Z et al.,(2003)J Autoimmun 21:83-92),而CD4+
細胞比CD8+
細胞具有較高之GITR表現(Kober J et al.,(2008)Eur J Immunol 38(10):2678-88;Bianchini R et al.,(2011)Eur J Immunol 41(8):2269-78)。
考量到人類GITR在調節免疫反應的角色,本發明提供特異性結合GITR之抗體及該等抗體調節GITR活性的用途。
於一態樣中,本文提供特異性結合GITR(例如,人類GITR)之抗體及其片段。於一具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其抗原-結合片段部分地抑制GITR配體(例如,人類GITRL)結合GITR,其由發明所屬技術領域中具有通常知識者已知之方法或本文所述之方法(見以下例如章節6.2.5.2及6.2.5.4)所評估。於一特定具體實施例中,在懸浮陣列分析中,相對於無抗GITR抗體或其抗原-結合片段存在下0.5nM GITRL與濃度為5pg/ml/珠粒之該GITR偶合珠粒結合濃度為1000ng/ml之抗體或其抗原-結合片段抑制少於80%之0.5nM GITRL(例如,人類GITRL)與濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®
珠粒之人類GITR)結合抗GITR。在某些具體實施例中,抗體或其抗原-結合片段抑制40%至70%、50%至70%、50%至80%或40%至80%之GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)。在另一特定具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)之量的至少20%在分析中、抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR):(a)濃度為5pg/ml/珠粒偶合GITR(例如,人類GITR)至珠粒;(b)每孔中,將濃度為40珠粒/μl之GITR(例如,人類GITR)偶合珠粒與或不與抗體培養;(c)添加經標幟之
GITRL(例如經標幟之人類GITRL)至孔中以獲得最終濃度為0.5nM之GITRL(例如,人類GITRL)及20珠粒/μl之GITR偶合珠粒;且(d)藉由例如懸浮陣列分析,偵測結合GITR(例如,人類GITR)偶合珠粒的經標幟之GITRL(例如,人類GITRL)。在一些具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)的20%至60%、20%至50%、30%至60%或30%至50%之量在抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)。
在某些具體實施例中,抗體或其抗原-結合片段包括:
(a)重鏈可變區(VH)互補性決定區(CDR)1,其包括、由下述組成或主要由下述組成:X1
YX2
MX3
(SEQ ID NO:1)之胺基酸序列,其中
X1
為D、E、G或A;
X2
為A、V、L、I、P、F、M或Y;且
X3
為Y、G、N、Q、S、T、C、W、F或H;
(b)VH CDR2,其包括、由下述組成或主要由下述組成:X1
IX2
X3
X4
SGX5
X6
X7
YX8
QKFX9
X10
(SEQ ID NO:2)之胺基酸序列,其中
X1
為V、A、L、I、P、F、M或T;
X2
為R、K、H、Q或A;
X3
為T、G、N、Q、S、C、W、Y、V、I或P;
X4
為Y、G、N、Q、S、T、C、W、F、H或A;
X5
為D、E、G或A;
X6
為V、A、L、I、P、F、M或T;
X7
為T、G、N、Q、S、C、W、Y、V、I、P或A;
X8
為N、G、Q、S、T、C、W、Y或A;
X9
為K、R、H、Q或A;且
X10
為D、E、G或A;
(c)VH CDR3,其包括、由下述組成或主要由下述組成:SGTVRGX1
X2
X3
(SEQ ID NO:3)之胺基酸序列,其中
X1
為F、A、V、L、I、P、M、Y、W、H或S;
X2
為A或D;且
X3
為Y、G、N、Q、S、T、C、W、F、H或V;
(d)輕鏈可變區(VL)CDR1,其包括、由下述組成或主要由下述組成:KSSQSX1
X2
X3
X4
X5
X6
X7
KX8
YLX9
(SEQ ID NO:4)之胺基酸序列,其中
X1
為L、A、V、I、P、F或M;
X2
為L、A、V、I、P、F、M或S;
X3
為N、G、Q、S、T、C、W、Y或A;
X4
為S、G、N、Q、T、C、W、Y或A;
X5
為G、N、Q、S、T、C、W、Y或A;
X6
為N、G、Q、S、T、C、W、Y或A;
X7
為Q、G、N、S、T、C、W、Y或A;
X8
為N、G、Q、S、T、C、W、Y或A;且
X9
為T、G、N、Q、S、C、W、Y、V、I或A;
(e)VL CDR2,其包括、由下述組成或主要由下述組成:X1
ASTRX2
X3
(SEQ ID NO:5)之胺基酸序列,其中
X1
為W、G、N、Q、S、T、C、Y、F、H或A;
X2
為E、D或A;且
X3
為S、G、N、Q、T、C、W、Y或A;且
(f)VL CDR3,其包括、由下述組成或主要由下述組成:QX1
X2
YX3
X4
PYT(SEQ ID NO:6)之胺基酸序列,其中
X1
為N、G、Q、S、T、C、W或Y;
X2
為D、E或Y;且
X3
為S、G、N、Q、T、C、W、Y或A,以及
X4為Y、G、N、Q、S、T、C、W、F、H、L或A。
在其他具體實施例中,抗體或其抗原-結合片段包括:
(a)重鏈可變區(VH)CDR1,其包括、由下述組成或主要由下述組成:X1
YX2
MX3
(SEQ ID NO:7)之胺基酸序列,其中
X1
為D、E或G;
X2
為A或V;且
X3
為Y或H;
(b)VH CDR2,其包括、由下述組成或主要由下述組成:X1
IX2
TX3
SGX4
X5
X6
YNQKFX7
X8
(SEQ ID NO:8)之胺基酸序列,其中
X1
為V或L;
X2
為R、K或Q;
X3
為Y或F;
X4
為D、E或G;
X5
為V或L;
X6
為T或S;
X7
為K、R或Q;且
X8
為D、E或G;
(c)VH CDR3,其包括、由下述組成或主要由下述組成:SGTVRGFAY(SEQ ID NO:9)之胺基酸序列;
(d)輕鏈可變區(VL)CDR1,其包括、由下述組成或主要由下述組成:KSSQSLLNSX1
NQKNYLX2
(SEQ ID NO:10)之胺基酸序列,其中
X1
為G或S;且
X2
為T或S;
(e)VL CDR2,其包括、由下述組成或主要由下述組成:WASTRES(SEQ ID NO:11)之胺基酸序列;且
(f)VL CDR3,其包括、由下述組成或主要由下述組成:QNX1
YSX2
PYT(SEQ ID NO:12)之胺基酸序列,其中
X1
為D或E;且
X2
為Y、F或S。
在一些具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其抗原-結合片段,包
括:
(a)重鏈可變區(VH)互補性決定區(CDR)1,其包括、由下述組成或主要由下述組成:X1
YX2
MX3
(SEQ ID NO:1)之胺基酸序列,其中
X1
為D、E、G或A;
X2
為A、V、L、I、P、F、M或Y;且
X3
為Y、G、N、Q、S、T、C、W、F或H;
(b)VH CDR2,其包括、由下述組成或主要由下述組成:X1
IX2
X3
X4
SGX5
X6
X7
YX8
QKFX9
X10
(SEQ ID NO:2)之胺基酸序列,其中
X1
為V、A、L、I、P、F、M或T;
X2
為R、K、H、Q或A;
X3
為T、G、N、Q、S、C、W、Y、V、I或P;
X4
為Y、G、N、Q、S、T、C、W、F、H或A;
X5
為D、E、G或A;
X6
為V、A、L、I、P、F、M或T;
X7
為T、G、N、Q、S、C、W、Y、V、I、P或A;
X8
為N、G、Q、S、T、C、W、Y或A;
X9
為K、R、H、Q或A;且
X10
為D、E、G或A;
(c)VH CDR3,其包括、由下述組成或主要由下述組成:SGTVRGX1
X2
X3
(SEQ ID NO:3)之胺基酸序列,其中
X1
為F、A、V、L、I、P、M、Y、W、H或S;
X2
為A或D;且
X3
為Y、G、N、Q、S、T、C、W、F、H或V;
(d)輕鏈可變區(VL)CDR1,其包括、由下述組成或主要由下述組成:KSSQSX1
X2
X3
X4
X5
X6
X7
KX8
YLX9
(SEQ ID NO:4)之胺基酸序列,其中
X1
為L、A、V、I、P、F或M;
X2
為L、A、V、I、P、F、M或S;
X3
為N、G、Q、S、T、C、W、Y或A;
X4
為S、G、N、Q、T、C、W、Y或A;
X5
為G、N、Q、S、T、C、W、Y或A;
X6
為N、G、Q、S、T、C、W、Y或A;
X7
為Q、G、N、S、T、C、W、Y或A;
X8
為N、G、Q、S、T、C、W、Y或A;且
X9
為T、G、N、Q、S、C、W、Y、V、I或A;
(e)VL CDR2,其包括、由下述組成或主要由下述組成:X1
ASTRX2
X3
(SEQ ID NO:5)之胺基酸序列,其中:
X1
為W、G、N、Q、S、T、C、Y、F、H或A;
X2
為E、D或A;且
X3
為S、G、N、Q、T、C、W、Y或A;且
(f)VL CDR3,其包括、由下述組成或主要由下述組成:QX1
X2
YX3
X4
PYT(SEQ ID NO:6)之胺基酸序列,其中:
X1
為N、G、Q、S、T、C、W或Y;
X2
為D、E或Y;且
X3
為S、G、N、Q、T、C、W、Y或A,以及
X4為Y、G、N、Q、S、T、C、W、F、H、L或A。在某些具體實施例中,抗體或其抗原-結合片段包括VH CDR1,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:13、19至23及117至119。在某些具體實施例中,抗體或其抗原至結合片段包括VH CDR1,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:35及SEQ ID NO:116。在一些具體實施例中,抗體或其抗原至結合片段包括VH CDR2,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:14、24至33及120至188。在一些具體實施例中,抗體或其抗原至結合片段包括VH CDR2,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:114、115及194。在某些具體實施例中,抗體或其抗原至結合片段包括VH CDR3,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:15、34及189。在一些具體實施例中,抗體或其抗原至結合片段包括VL CDR1,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:16及101至104。在某些具體實施例中,抗體或其抗原至結合片段包括VL CDR2,其包括、由下述組成或主要由下述
組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:17及105。在一些具體實施例中,抗體或其抗原至結合片段包括VL CDR3,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:18、106至109、192及193。在特定具體實施例中,抗體或其抗原-結合片段包括表2中抗體之VH CDR1、VH CDR2及VH CDR3的胺基酸序列。在特定具體實施例中,抗體或其抗原-結合片段包括表6中抗體之VH CDR1、VH CDR2及VH CDR3的胺基酸序列。在另一特定具體實施例中,抗體或其抗原-結合片段包括表1中抗體之VL CDR1、VL CDR2及VL CDR3的胺基酸序列。於另一具體實施例中,抗體或其抗原-結合片段包括表5中抗體之VL CDR1、VL CDR2及VL CDR3的胺基酸序列。在一些具體實施例中,抗體或其抗原-結合片段部分抑制GITRL(例如,人類GITRL)結合GITR(例如,人類GITR),其藉由發明所屬技術領域中具有通常知識者已知之方法或本文所述之方法(見以下例如章節6.2.5.2及6.2.5.4)評估。在某些具體實施例中,在懸浮陣列分析中,相對於無抗GITR抗體或其抗原-結合片段存在下0.5nM GITRL與濃度為5pg/ml/珠粒之GITR偶合珠粒結合濃度為1000ng/ml之抗體或其抗原-結合片段抑制少於80%的0.5nM GITRL(例如,人類GITRL)與濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)結合。在某些具體實施例
中,抗體或其抗原-結合片段抑制40%至70%、50%至70%、50%至80%或40%至80%之GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)。在特定具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)之量的至少20%在分析中、在抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR),分析包括下述步驟:(a)濃度為5pg/ml/珠粒偶合GITR(例如,人類GITR)至珠粒;(b)每孔中,將濃度為40珠粒/μl之GITR(例如,人類GITR)偶合珠粒與或不與抗體培養;(c)添加經標幟之GITRL(例如經標幟之人類GITRL)至孔中以獲得最終濃度為0.5nM之GITRL(例如,人類GITRL)20珠粒/μl之GITR偶合珠粒;且(d)藉由例如懸浮陣列分析偵測結合GITR(例如,人類GITR)偶合珠粒的經標幟之GITRL(例如,人類GITRL)。在一些具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)的20%至60%、20%至50%、30%至60%或量之30%至50%在抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)。
於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其抗原-結合片段,包括:
(a)重鏈可變區(VH)CDR1,其包括、由下述組
成或主要由下述組成:X1
YX2
MX3
(SEQ ID NO:7)之胺基酸序列,其中
X1
為D、E或G;
X2
為A或V;且
X3
為Y或H;
(b)VH CDR2,其包括、由下述組成或主要由下述組成:X1
IX2
TX3
SGX4
X5
X6
YNQKFX7
X8
(SEQ ID NO:8)之胺基酸序列,其中
X1
為V或L;
X2
為R、K或Q;
X3
為Y或F;
X4
為D、E或G;
X5
為V或L;
X6
為T或S;
X7
為K、R或Q;且
X8
為D、E或G;
(c)VH CDR3,其包括、由下述組成或主要由下述組成:SGTVRGFAY(SEQ ID NO:9)之胺基酸序列;
(d)輕鏈可變區(VL)CDR1,其包括、由下述組成或主要由下述組成:KSSQSLLNSX1
NQKNYLX2
(SEQ ID NO:10)之胺基酸序列,其中
X1
為G或S;且
X2
為T或S;
(e)VL CDR2,其包括、由下述組成或主要由下述
組成:WASTRES(SEQ ID NO:11)之胺基酸序列;且
(f)VL CDR3,其包括、由下述組成或主要由下述組成:QNX1
YSX2
PYT(SEQ ID NO:12)之胺基酸序列,其中
X1
為D或E;且
X2
為Y、F或S。
在某些具體實施例中,抗體或其抗原-結合片段包括VH CDR1,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:13、19至23及117至119。在某些具體實施例中,抗體或其抗原-結合片段包括VH CDR1,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:35及116。在一些具體實施例中,抗體或其抗原-結合片段包括VH CDR2,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:14、24至33及120-188。在一些具體實施例中,抗體或其抗原-結合片段包括VH CDR2,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:114、115及194。在某些具體實施例中,抗體或其抗原-結合片段包括VH CDR3,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:15、34及189。在一些具體實施例中,抗體或其抗原-結合片段包括VL CDR1,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ
ID NO:16及101至104。在某些具體實施例中,抗體或其抗原-結合片段包括VL CDR2,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:17及105。在一些具體實施例中,抗體或其抗原-結合片段包括VL CDR3,其包括、由下述組成或主要由下述組成:選自下列所組成群組之胺基酸序列:SEQ ID NO:18、106至109、192及193。在特定具體實施例中,抗體或其抗原-結合片段包括表2中抗體之VH CDR1、VH CDR2及VH CDR3之胺基酸序列。在另一特定具體實施例中,抗體或其抗原-結合片段包括表1中抗體之VL CDR1、VL CDR2及VL CDR3的胺基酸序列。在一些具體實施例中,抗體或其抗原-結合片段並未避免GITRL(例如,人類GITRL)結合GITR(例如,人類GITR),其藉由發明所屬技術領域中具有通常知識者已知之方法或本文所述之方法(見以下例如章節6.2.5.2及6.2.5.4)評估。在某些具體實施例中,在懸浮陣列分析中,相對於無抗GITR抗體或其抗原-結合片段存在下0.5nM GITRL與濃度為5pg/ml/珠粒之GITR偶合珠粒結合濃度為1000ng/ml之抗體或其抗原-結合片段抑制少於80%的0.5nM GITRL(例如,人類GITRL)與濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)結合。在某些具體實施例中,抗體或其抗原-結合片段抑制40%至70%、50%至70%、50%至80%或40%至80%之GITRL(例如,人類
GITRL)結合GITR(例如,人類GITR)。在特定具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)之量的至少20%在分析中、抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR),分析包括下述步驟:(a)濃度為5pg/ml/珠粒偶合GITR(例如,人類GITR)至珠粒;(b)每孔中,將濃度為40珠粒/μl之GITR(例如,人類GITR)偶合珠粒與或不與抗體培養;(c)添加經標幟之GITRL(例如經標幟之人類GITRL)至孔中以獲得最終濃度為0.5nM之GITRL(例如,人類GITRL)及20珠粒/μl之GITR偶合珠粒;且(d)藉由例如懸浮陣列分析偵測結合GITR(例如,人類GITR)偶合珠粒的經標幟之GITRL(例如,人類GITRL)。在一些具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)的20%至60%、20%至50%、30%至60%或量之30%至50%在抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)。
於一特定具體實施例中,本文提供特異性結合人類GITR之抗體或其片段,包括:(a)重鏈可變區(VH)CDR1,其包括DYAMY(SEQ ID NO:13)之胺基酸序列;(b)VH CDR2,其包括VIRTYSGDVTYNQKFKD(SEQ ID NO:14)之胺基酸序列;(c)VH CDR3,其包括SGTVRGFAY(SEQ ID
NO:15)之胺基酸序列;(d)輕鏈可變區(VL)CDR1,其包括KSSQSLLNSGNQKNYLT(SEQ ID NO:16)之胺基酸序列;(e)VL CDR2,其包括WASTRES(SEQ ID NO:17)之胺基酸序列;且(f)VL CDR3,其包括QNDYSYPYT(SEQ ID NO:18)之胺基酸序列。於另一具體實施例中,本文提供特異性結合人類GITR之抗體或其片段,其包括表1及表2中抗體22之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR 3。在一些具體實施例中,抗體或其抗原-結合片段部分抑制GITRL(例如,人類GITRL)結合GITR(例如,人類GITR),此藉由發明所屬技術領域中具有通常知識者已知之方法或本文所述之方法(見以下例如章節6.2.5.2及6.2.5.4)評估。在某些具體實施例中,在懸浮陣列分析中,相對於無抗GITR抗體或其抗原-結合片段存在下0.5nM GITRL(例如,人類GITRL)與濃度為5pg/ml/珠粒之GITR偶合珠粒(例如,偶合至Luminex®珠粒之人類GITR)結合濃度為1000ng/ml之抗體或其抗原-結合片段抑制少於80%的濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)。在一些具體實施例中,抗體或其抗原-結合片段抑制50%至70%之人類GITRL結合人類GITR。在特定具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)之量的至少20%在分析中、抗體或其抗原-結合片段存在下結合
GITR(例如,人類GITR),分析包括下述步驟:(a)濃度為5pg/ml/珠粒偶合GITR(例如,人類GITR)至珠粒;(b)每孔中,將濃度為40珠粒/μl之GITR(例如,人類GITR)偶合珠粒與或不與抗體培養;(c)添加經標幟之GITRL(例如經標幟之人類GITRL)至孔中以獲得最終濃度為0.5nM之GITRL(例如,人類GITRL)及20珠粒/μl之GITR偶合珠粒;且(d)藉由例如懸浮陣列分析偵測結合GITR(例如,人類GITR)偶合珠粒的經標幟之GITRL(例如,人類GITRL)。在一些具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)的20%至60%、20%至50%、30%至60%或30%至50%之量在抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)。在一些具體實施例中,在無抗體或其抗原-結合片段存在下結合人類GITR的人類GITRL的30%至50%之量在抗體或其抗原-結合片段存在下結合人類GITR。在某些具體實施例中,抗體或其抗原-結合片段為促效性。
在某些具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括重鏈可變區序列,其包括SEQ ID NO:203之重鏈可變區序列的框架區之一、二、三或四。在一些具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括重鏈可變區序列的框架區之一、二、三或四,其為與選自下列所組成群組之重鏈可變區序列的框架區之一、
二、三或四至少75%、80%、85%、90%、95%或100%相同:SEQ ID NO:201、SEQ ID NO:206及SEQ ID NO:215至389。於另一具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括具有人類衍生之框架區的重鏈可變區。於另一具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其抗原-結合片段包括重鏈可變框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中胺基酸序列選自下列所組成群組:IGHV1-2*02(SEQ ID NO:601)、IGHV1-3*01(SEQ ID NO:602)、IGHV1-46*01(SEQ ID NO:603)、IGHV1-18*01(SEQ ID NO:604)、IGHV1-69*01(SEQ ID NO:605)及IGHV7-4-1*02(SEQ ID NO:606)。在特定具體實施例中,衍生自該胺基酸序列之重鏈可變框架區由該胺基酸序列組成,其具有達10個胺基酸取代、缺失及/或插入,較佳地達10個胺基酸取代。於一特別具體實施例中,衍生自該胺基酸序列之重鏈可變框架區由該胺基酸序列組成,其具有1、2、3、4、5、6、7、8、9或10個胺基酸殘基取代對應非人類重鏈可變框架區類似位置中發現之胺基酸。於一特定具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括重鏈可變框架區,其為衍生自胺基酸序列SEQ ID NO:601,其中胺基酸序列SEQ ID NO:601之至少一、二、三、四或五(在某些具體實施例中達10)胺基酸經在對應非人類重鏈可變框架區類似位置中所
發現之胺基酸取代。在某些具體實施例中,該胺基酸取代是在選自下列所組成群組之胺基酸位置:24、48、67、71、73及94,其中依據Kabat編號標誌各組員之胺基酸位置。在特定具體實施例中,該胺基酸取代選自下列所組成群組:24G、48I、67A、71V、73K及94K,其中依據Kabat編號標誌各組員之該胺基酸位置。
於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區序列,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:201、206及SEQ ID NO:215至389。於一特定具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區序列,其包括SEQ ID NO:203之胺基酸序列。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區序列,其包括SEQ ID NO:206之胺基酸序列。
於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈序列,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:553、554及567至570。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈序列,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:581及582。
於另一具體實施例中,本文提供之特異性結
合GITR(例如,人類GITR)的抗體或其片段包括輕鏈可變區序列,其包括SEQ ID NO:204或SEQ ID NO:205之輕鏈可變區序列的一、二、三或四框架區。於另一具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括輕鏈可變區序列的一、二、三或四框架區,其為與選自下列所組成群組之輕鏈可變區序列的一、二、三或四框架區至少75%、80%、85%、90%、95%或100%相同:SEQ ID NO:202、SEQ ID NO:207、SEQ ID NO:208及SEQ ID NO:400至518。於另一具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括輕鏈可變區序列的一、二、三或四框架區,其為與SEQ ID NO:519之輕鏈可變區序列的一、二、三或四框架區至少75%、80%、85%、90%、95%或100%相同。於另一具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括具有人類衍生之框架區的輕鏈可變序列。於另一具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括輕鏈可變框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中胺基酸序列選自下列所組成群組:IGKV4-1*01(SEQ ID NO:607)及IGKV3-7*02(SEQ ID NO:608)。在特定具體實施例中,衍生自該胺基酸序列之輕鏈可變框架區由該胺基酸序列組成,但存在達10胺基酸取代、缺失及/或插入,較佳地達10胺基酸取代。於一特別具體實施例中,衍生自該
胺基酸序列之輕鏈可變框架區由下述組成:具有1、2、3、4、5、6、7、8、9或10胺基酸殘基經在對應非人類輕鏈可變框架區類似位置中所發現之胺基酸取代之該胺基酸序列。於另一具體實施例中,本文提供之特異性結合GITR(例如,人類GITR)的抗體或其片段包括輕鏈可變框架區,其為或衍生自胺基酸序列SEQ ID NO:607或SEQ ID NO:608,其中胺基酸序列SEQ ID NO:607或SEQ ID NO:608至少一、二、三、四或五(在某些具體實施例中達10)胺基酸經在對應非人類輕鏈可變框架區類似位置中所發現之胺基酸取代。在某些具體實施例中,該胺基酸取代為在胺基酸位置87,其中依據Kabat編號標誌該胺基酸位置。在特定具體實施例中,該胺基酸取代為87H之胺基酸取代,其中依據Kabat編號標誌該胺基酸位置。
於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區序列,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:202、SEQ ID NO:207、SEQ ID NO:208及SEQ ID NO:400至518。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區序列,其包括SEQ ID NO:519之胺基酸序列。於一特定具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區序列,其包括SEQ ID NO:204或SEQ ID NO:
205之胺基酸序列。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區序列,其包括SEQ ID NO:207之胺基酸序列。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區序列,其包括SEQ ID NO:208之胺基酸序列。
於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈序列,其包括選自下列所組成群組之胺基酸序列::SEQ ID NO:555、556及571至576。
於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區及輕鏈可變區,其包括圖23之表或圖24A至24C中任一的抗體之胺基酸序列。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區及輕鏈可變區,其包括表17中抗體的胺基酸序列。於一特定具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括(a)重鏈可變區,其包括SEQ ID NO:206之胺基酸序列;且(b)輕鏈可變區,其包括SEQ ID NO:207之胺基酸序列。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括(a)重鏈可變區,其包括SEQ ID NO:206之胺基酸序列;且(b)輕鏈可變區,其包括SEQ ID NO:208之胺
基酸序列。
於一特定具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區(VH),其包括VH CDR1、VH CDR2、VH CDR3及衍生自人類免疫球蛋白之框架區,其中VH CDR1包括、由下述組成或主要由下述組成:DYAMY(SEQ ID NO:13)之胺基酸序列,VH CDR2包括、由下述組成或主要由下述組成:VIRTYSGDVTYNQKFKD(SEQ ID NO:14)之胺基酸序列且VH CDR3包括、由下述組成或主要由下述組成:SGTVRGFAY(SEQ ID NO:15)之胺基酸序列。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區(VL),其包括VL CDR1、VL CDR2、VL CDR3及衍生自人類免疫球蛋白之框架區,其中VL CDR1包括、由下述組成或主要由下述組成:KSSQSLLNSGNQKNYLT(SEQ ID NO:16)之胺基酸序列,VL CDR2包括、由下述組成或主要由下述組成:WASTRES(SEQ ID NO:17)之胺基酸序列且VL CDR3包括、由下述組成或主要由下述組成:QNDYSYPYT(SEQ ID NO:18)之胺基酸序列。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括包含選自下列所組成群組之胺基酸序列:SEQ ID NO:201、203、206及215至389的重鏈可變區(VH)。於另一具體實施例中,本文提供特異性結
合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區(VL),其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:202、204、205、207、208及400至518。於另一具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括輕鏈可變區(VL),其包括SEQ ID NO:519之胺基酸序列。在一些具體實施例中,抗體或其抗原-結合片段部分抑制GITRL(例如,人類GITRL)結合GITR(例如,人類GITR),其由發明所屬技術領域中具有通常知識者已知之方法或本文所述之方法(見以下例如章節6.2.5.2及6.2.5.4)所評估。在某些具體實施例中,在懸浮陣列分析中,相對於無抗GITR抗體或其抗原-結合片段存在下0.5nM GITRL與濃度為5pg/ml/珠粒之GITR偶合珠粒結合濃度為1000ng/ml之抗體或其抗原-結合片段抑制少於80%的0.5nM GITRL(例如,人類GITRL)與濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)結合。在特定具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)之量的至少20%在分析中、抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR),該分析包括下述步驟:(a)濃度為5pg/ml/珠粒偶合GITR(例如,人類GITR)至珠粒;(b)每孔中,將濃度為40珠粒/μl之GITR(例如,人類GITR)偶合珠粒與或不與抗體培養;(c)添加
經標幟之GITRL(例如經標幟之人類GITRL)至孔中以獲得最終濃度為0.5nM之GITRL(例如,人類GITRL)及20珠粒/μl之GITR偶合珠粒;且(d)藉由例如懸浮陣列分析偵測結合GITR(例如,人類GITR)偶合珠粒的經標幟之GITRL(例如,人類GITRL)。在一些具體實施例中,在無抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)的GITRL(例如,人類GITRL)的20%至60%、20%至50%、30%至60%或30%至50%之量在抗體或其抗原-結合片段存在下結合GITR(例如,人類GITR)。
於一特定具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區(VH)及輕鏈可變區(VL),其中VH及VL包括圖23或圖24A至24C中任一之抗體之胺基酸序列。於一特定具體實施例中,本文提供特異性結合GITR(例如,人類GITR)之抗體或其片段,其包括重鏈可變區(VH)及輕鏈可變區(VL),其中VH及VL包括表17中抗體之胺基酸序列。
在某些具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括重及/或輕鏈恆定區。在一些具體實施例中,重鏈恆定區選自由下列所組成之人類免疫球蛋白群組:IgG1
、IgG2、
IgG3
、IgG4、
IgA1
及IgA2
。在某些具體實施例中,輕鏈恆定區選自由下列所組成之人類免疫球蛋白群組:IgGκ及IgGλ。於一
特定具體實施例中,IgG1
為非岩藻糖基化IgG1
。在另一特定具體實施例中,抗體為包括N297A或N297Q突變之IgG1
。在另一特定具體實施例中,抗體為包括S228P突變之IgG4
。在另一特定具體實施例中,抗體為包括C127S突變之IgG2。在某些具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括重鏈恆定區,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:557至562。在某些具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括重鏈恆定區,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:583及584。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括重鏈恆定區,其包括選自下列所組成群組之胺基酸序列:具有在胺基酸位置180之N取代為A或Q之胺基酸取代的SEQ ID NO:557至560。在某些具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括輕鏈恆定區,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:588至591。在某些具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括輕鏈恆定區,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:563至566。
於一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含選自下列所組成群組:SEQ ID NO:553、554及567至
570之胺基酸序列的重鏈;且(b)包含選自下列所組成群組:SEQ ID NO:555、556及571至576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈;且(b)包含SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:554之胺基酸序列的重鏈;且(b)包含SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:581之胺基酸序列的重鏈;且(b)包含SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:582之胺基酸序列的重鏈;且(b)包含SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈;且(b)包含SEQ ID NO:555之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:554之胺基酸序列的重鏈;且(b)包含SEQ ID NO:555之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異
性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:567之胺基酸序列的重鏈;且(b)包含SEQ ID NO:573之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:567之胺基酸序列的重鏈;且(b)包含SEQ ID NO:576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:554之胺基酸序列的重鏈;且(b)包含SEQ ID NO:576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:581之胺基酸序列的重鏈;且(b)包含SEQ ID NO:576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:582之胺基酸序列的重鏈;且(b)包含SEQ ID NO:576之胺基酸序列的輕鏈。
在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈,其具有在胺基酸位置298之N取代為A或Q的胺基酸取代;且(b)包含選自下列所組成群組:SEQ ID NO:555、556及571至576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體
包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈,其具有在胺基酸位置298之N取代為A或Q的胺基酸取代;且(b)包括SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包括SEQ ID NO:553之胺基酸序列的重鏈,其具有在胺基酸位置298之N取代為A或Q的胺基酸取代;且(b)包括SEQ ID NO:555之胺基酸序列的輕鏈。
於另一具體實施例中,本文所提供為抗體或其片段如本文所述之抗體結合GITR(例如,人類GITR)的相同表位。於另一具體實施例中,本文所提供為特異性結合下述之各者的經單離之抗體:i)人類GITR,其中人類GITR包括SEQ ID NO:701之殘基26至241及ii)馬來猴(cynomolgus)GITR之變體,其包括SEQ ID NO:699之殘基26至234,其中抗體並未特異性結合包括SEQ ID NO:704之殘基26至234的馬來猴GITR。於另一具體實施例中,本文所提供為特異性結合下述之各者的經單離之抗體:i)人類GITR,其中人類GITR包括SEQ ID NO:701之殘基26至241及ii)馬來猴GITR之變體,其包括SEQ ID NO:699之殘基26至234,其中抗體並未呈現實質上結合包括SEQ ID NO:704之殘基26至234的馬來猴GITR。於另一具體實施例中,本文所提供為特異性結合人類GITR的經單離之抗體,其中人類GITR包括SEQ ID NO:701之殘基26至241,其中相對於抗體及
人類GITR之間的結合,抗體與變體GITR之間的結合為實質上經弱化,且其中除了選自下列所組成群組之胺基酸取代:D60A及G63A以外,變體GITR包括SEQ ID NO:701之殘基26至241。於一具體實施例中,取代為D60A。於另一具體實施例中,取代為G63A。於另一具體實施例中,本文所提供為特異性結合人類GITR的經單離之抗體,其中人類GITR包括SEQ ID NO:701之殘基26至241,且其中抗體結合包括SEQ ID NO:701之殘基60至63之表位。於另一具體實施例中,本文所提供為特異性結合人類GITR的經單離之抗體,其中人類GITR包括SEQ ID NO:701之殘基26至241,且其中抗體結合SEQ ID NO:701之殘基60至63所列之該胺基酸序列中至少一殘基。於一具體實施例中,抗體結合選自下列所組成群組:SEQ ID NO:701之殘基60、62及63之至少一殘基。於一具體實施例中,抗體結合選自下列所組成群組:SEQ ID NO:701之殘基62及63之至少一殘基。於一具體實施例中,抗體活化或增強人類GITR活性。於另一具體實施例中,本文所提供為特異性結合人類GITR之經單離之抗體,其中人類GITR包括SEQ ID NO:701之殘基26至241,且其中抗體結合人類GITR表位,其包括SEQ ID NO:701的殘基60或63至少一者。在另一具體實施例中,本文所提供為特異性結合人類GITR的經單離之抗體,其中相較於結合人類GITR,抗體呈現與人類GITR相同但存在D60A或G63A胺基酸取代之蛋白質降低之結
合或不結合。於一具體實施例中,該抗體誘導、活化或增強人類GITR活性。於另一具體實施例中,本文所提供為抗體或其抗原-結合片段,其與本文所述之抗體或其抗原-結合片段競爭結合GITR(例如,人類GITR)。於一特定具體實施例中,本文所提供為抗體或其抗原-結合片段,其與本文所述之抗體或其抗原-結合片段競爭結合GITR(例如,人類GITR)的程度同本文所述之抗體或其抗原-結合片段自體競爭結合GITR(例如,人類GITR)。於另一具體實施例中,本文提供為第一抗體或其抗原-結合片段,其與本文所述之抗體或其抗原-結合片段競爭結合GITR(例如,人類GITR),其中第一抗體或其抗原-結合片段在分析中競爭結合,該分析包括下述步驟:(a)以呈未經標幟之形式的第一抗體或其抗原-結合片段在容器中培養GITR轉染之細胞;(b)添加呈經標幟之形式的本文所述之抗體或其抗原-結合片段至容器中的細胞且培養容器中的細胞;且(c)偵測呈經標幟之形式的本文所述之抗體或其抗原-結合片段結合細胞。於另一具體實施例中,本文所提供為第一抗體或其抗原-結合片段與本文所述之抗體或其抗原-結合片段競爭結合GITR(例如,人類GITR),其中競爭呈現為降低第一抗體或其抗原-結合片段結合GITR(例如,人類GITR)超過80%(例如85%、90%、95%或98%或80%與85%之間、80%與90%之間、85%與90%之間或85%與95%之間)。
在某些具體實施例中,本文提供之特異性結
合GITR(例如,人類GITR)的抗體或其片段活化、誘導或增強GITR之活性(例如,人類GITR)。在特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體為擬人化抗體、鼠科抗體或嵌合抗體。在某些具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體以KD
範圍為約0.5nM至5nM結合GITR(例如,人類GITR)。在某些具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括可偵測標籤。在特定具體實施例中,本文所提供抗體經單離。
在某些具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體或片段在獨立於TCR觸發之細胞中而誘導、活化或增強人類GITR之活性。在特定具體實施例中,細胞為T細胞。在特定具體實施例中,細胞不為T細胞。在特定具體實施例中,細胞選自下列所組成群組:B細胞、漿細胞、記憶細胞、自然殺手細胞、顆粒球、嗜中性球、嗜酸性球、嗜鹼性球、肥胖細胞、單核球、樹狀細胞、漿細胞樣樹狀細胞、NKT細胞及巨噬細胞。在特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體獨立於TCR觸發而誘導、活化或增強NF-κB之活性。在某些具體實施例中,NF-κB之活性可於例如分析中評估,分析包括下述步驟:(a)在無抗CD3抗體之存在下,培養表現NF-κB-螢光素酶報告子構築體(例如GloResponse NF-κB-luc2P構
築體)及GITR(例如,人類GITR)之T細胞(例如Jurkat細胞)與本文所述之抗體或同型控制組抗體,抗體濃度為例如12.5、10、5、2.5、1.25或0.625μg/ml;且(b)使用例如EnVision多標籤讀取器2100,在例如2、5、6、8或18小時培養之後讀取螢光素酶訊號,其中相對於同型控制組抗體之正螢光素酶訊號顯示NF-κB之活性。於一特別具體實施例中,在5小時培養之後讀取螢光素酶訊號。
在某些具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體或片段增加多功能性(IFNγ+ TNFα+)T細胞之百分比。在特定具體實施例中,多功能性(IFNγ+ TNFα+)T細胞之百分比的增加可於例如分析中評估,該分析包括下述步驟:(a)以各種次優濃度(例如0.3-5μg/ml)培養,例如,人類PBMC與例如抗CD3抗體;且例如如5μg/ml之本文所述免疫特異性結合GITR(例如,人類GITR)之抗體或同型控制組抗體,在37℃及5% CO2
達例如3至4天;(b)以例如布雷非德菌素A(Brefeldin A)在37℃及5% CO2
處理細胞達例如6小時;(c)使用例如抗CD3抗體、抗CD4抗體及抗CD8α抗體染細胞表面;(d)使用例如抗IFNγ抗體及抗TNFα抗體細胞內染;且(e)測定相對於同型控制組抗體,多功能性(IFNγ+ TNFα+)T細胞之百分比。在特定具體實施例中,多功能性(IFNγ+ TNFα+)T細胞選自下列所組成群組:多功能性(IFNγ+ TNFα+)CD4+T
細胞及多功能性(IFNγ+ TNFα+)CD8+T細胞。
在特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體當結合經活化之調控性T細胞時,結合選自CD16、CD32A及CD64所組成群組之活化的Fcγ受體的程度大於(例如1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍)當結合經活化之效應子T細胞時,抗體結合選自CD16、CD32A及CD64所組成群組之活化的Fcγ受體的程度,此由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如Fcγ受體IIIA(CD16)報告子分析或如以下實施例中所述)評估。在特定具體實施例中,活化的Fcγ受體表現在選自下列所組成群組之細胞:骨髓衍生之效應子細胞及淋巴球衍生之效應子細胞。於一特別具體實施例中,活化的Fcγ受體為CD16。
在特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體當結合經活化之調控性T細胞時,導致選自下列所組成群組之活化的Fcγ受體:CD16、CD32A及CD64比當結合經活化之效應子T細胞時,抗體導致選自下列所組成群組之活化的Fcγ受體:CD16、CD32A及CD64的活化為較強之活化。於特別具體實施例中,當本文所述免疫特異性結合GITR(例如,人類GITR)之抗體結合經活化之調控性T細胞時,
活化的Fcγ受體之活化為至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍強於當本文所述免疫特異性結合GITR(例如,人類GITR)之抗體結合經活化之效應子T細胞時,活化的Fcγ受體之活化,此由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如Fcγ受體IIIA(CD16)報告子分析或如以下實施例中所述)評估。在特定具體實施例中,活化的Fcγ受體表現在選自下列所組成群組之細胞:骨髓衍生之效應子細胞及淋巴球衍生之效應子細胞。於一特別具體實施例中,活化的Fcγ受體為CD16。
在某些具體實施例中,相對於無本文所述之抗體,在活化之T細胞中OX40及/或PD-1之表面表現,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體或片段增加在活化之T細胞中OX40及/或PD-1之表面表現至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍或1000倍,其由本文所述之方法及/或發明所屬技術領域中具有通常知識者已知之方法評估。
於另一具體實施例中,本文提供核酸分子,其編碼本文所述之抗體重鏈可變區及/或輕鏈可變區,或輕鏈及/或重鏈。於一特定具體實施例中,核酸分子編碼重鏈可變區,其包括SEQ ID NO:209之核酸序列。在另一特定具體實施例中,核酸分子編碼輕鏈可變區,其包括SEQ ID NO:210或SEQ ID NO:211之核酸序列。在特定具體實施例中,核酸分子經單離。在某些具體實施例中,載體(例如經單離之載體)包括核酸分子,其編碼本文所述之抗體重鏈可變區及/或輕鏈可變區,或輕鏈及/或重鏈。在某些具體實施例中,宿主細胞包括核酸分子或載體。宿主細胞的例子包括組織培養中的大腸桿菌(E.coli)、假單孢菌屬(Pseudomonas)、芽孢桿菌屬(Bacillus)、鏈絲菌屬(Streptomyces)、酵母菌、CHO、YB/20、NS0、PER-C6、HEK-293T、NIH-3T3、HeLa、BHK、Hep G2、SP2/0、R1.1、B-W、L-M、COS 1、COS 7、BSC1、BSC40、BMT10細胞、植物細胞、昆蟲細胞及人類細胞。於一特定具體實施例中,本文提供生產特異性結合GITR(例如,人類GITR)抗體或其抗原-結合片段之方法,其包括培養宿主細胞,使得表現核酸分子並生產抗體。
於另一具體實施例中,本文提供增強T細胞之共刺激之方法,其包括活體外培養T細胞,其已經受T細胞受體(TCR)複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR
複合物刺激抗體,諸如抗CD3抗體及抗CD28抗體)、受本文所述之抗體或其抗原-結合片段刺激。於另一具體實施例中,本文提供活化T細胞方法,其包括活體外培養T細胞與本文所述之抗體或其抗原-結合片段。在一些具體實施例中,方法進一步包括在與抗GITR抗體或其抗原-結合片段培養之前、與抗GITR抗體或其抗原-結合片段培養同時或在與抗GITR抗體或其抗原-結合片段培養之後,活體外培養T細胞與TCR複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體及抗CD28抗體)。在一些具體實施例中,T細胞從個體單離。在某些具體實施例中,經刺激及/或經活化之T細胞注入個體中。在一些具體實施例中,經注入至個體中的T細胞為自體或同種異體。於一特定具體實施例中,個體為人類。於另一具體實施例中,本文提供個體中較擴張T調控性細胞優先擴張效應子T細胞之方法,其包括投予至個體有效量之本文所述之抗體或其抗原-結合片段。於一特定具體實施例中,個體為人類。
於另一具體實施例中,本文提供增強T細胞(例如CD4+
及/或CD8+
T細胞)及/或T細胞效應子功能之擴張的方法,其包括活體外培養T細胞與本文所述之抗體或其抗原-結合片段。在一些具體實施例中,方法進一步包括在培養細胞與抗體或其抗原-結合片段之前、與培養細胞與抗體或其抗原-結合片段同時或在培養細胞與抗
體或其抗原-結合片段之後,培養T細胞與T細胞受體(TCR)複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體及抗CD28抗體)。在某些具體實施例中,T細胞自個體單離。在一些具體實施例中,方法進一步包括在其擴張及/或在其效應子功能增強之後注入T細胞至個體。在某些具體實施例中,注入至個體的T細胞為自體或同種異體。於一特定具體實施例中,個體為人類。
於另一具體實施例中,本文提供增強CD8+
T細胞之擴張的方法,其包括活體外培養T細胞與本文所述之抗體或其抗原-結合片段。在一些具體實施例中,方法進一步包括在培養T細胞與抗體或其抗原-結合片段之前、與培養T細胞與抗體或其抗原-結合片段同時或在培養T細胞與抗體或其抗原-結合片段之後,培養T細胞與T細胞受體(TCR)複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)。在某些具體實施例中,T細胞自個體單離。在一些具體實施例中,方法進一步包括在其擴張及/或在其效應子功能增強之後注入T細胞至個體。在某些具體實施例中,注入至個體的T細胞為自體或同種異體。於一特定具體實施例中,個體為人類。
於另一具體實施例中,本文提供增強CD4+
T
細胞之擴張的方法,其包括活體外培養T細胞與本文所述之抗體或其抗原-結合片段。在一些具體實施例中,方法進一步包括在培養T細胞與抗體或其抗原-結合片段之前、與培養T細胞與抗體或其抗原-結合片段同時或在培養T細胞與抗體或其抗原-結合片段之後,培養T細胞與T細胞受體(TCR)複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)。在某些具體實施例中,T細胞自個體單離。在一些具體實施例中,方法進一步包括在其擴張及/或在其效應子功能增強之後注入T細胞至個體。在某些具體實施例中,注入至個體的T細胞為自體或同種異體。於一特定具體實施例中,個體為人類。
於另一具體實施例中,本文提供活化GITR或活化NF-κB之方法,其包括活體外培養T細胞(其尚未經T細胞受體(TCR)複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激)與本文所述之抗體或其抗原-結合片段。在一些具體實施例中,T細胞自個體單離。在某些具體實施例中,將經活化之T細胞注入至個體。在一些具體實施例中,注入至個體的T細胞為自體或同種異體。於一特定具體實施例中,個體為人類。
於另一具體實施例中,本文提供獨立於TCR
觸發而活化T細胞之方法,其包括接觸T細胞與本文所述之抗體或其抗原-結合片段。
於另一具體實施例中,本文提供獨立於TCR觸發而誘導、活化或增強NF-κB之活性之方法,其包括接觸T細胞與本文所述之抗體或其抗原-結合片段。
於另一具體實施例中,本文提供增加多功能性(IFNγ+ TNFα+)T細胞之百分比之方法,其包括接觸T細胞與本文所述之抗體或其抗原-結合片段。
於另一具體實施例中,本文提供增加在活化之T細胞中OX40及/或PD-1之表面表現之方法,其包括接觸T細胞與本文所述之抗體或其抗原-結合片段。
於另一具體實施例中,本文提供醫藥組成物,其包括本文所述之抗體或其抗原-結合片段、核酸分子、載體或宿主細胞與醫藥上可接受之載劑。醫藥組成物可用於調節免疫反應及/或治療及/或預防疾病,諸如癌症或感染性疾病。於一特定具體實施例中,本文提供調節個體中免疫反應之方法,其包括投予至個體有效量之本文所述醫藥組成物。於一特別具體實施例中,免疫反應經增強或誘導。於另一具體實施例中,本文提供增強個體中T細胞之擴張及/或T細胞效應子功能的方法,其包括投予至個體有效量之本文所述的醫藥組成物。於另一具體實施例中,本文提供增強個體中CD8+T細胞之擴張的方法,其包括投予至個體有效量之本文所述的醫藥組成物。在一些具體實施例中,揭露提供本文所述之抗體的用途,其用於
製造治療癌症之藥物。在某些具體實施例中,揭露提供用於治療癌症之本文所述之抗體。在某些具體實施例中,揭露提供本文所述之醫藥組成物的用途,其用於製造治療癌症之藥物。在某些具體實施例中,揭露提供用於治療癌症的本文所述之醫藥組成物。於另一特定具體實施例中,本文提供治療個體中癌症之方法,其包括投予至個體有效量之本文所述醫藥組成物。在某些具體實施例中,治療癌症的方法進一步包括投予抗癌劑至個體。可與本文所述的醫藥組成物組合投予至個體之抗癌劑的例子於以下章節5.4(例如章節5.4.1及5.4.1.1)所述。於一特定具體實施例中,抗癌劑為疫苗。於一特別具體實施例中,疫苗包括熱休克蛋白質胜肽複合物(HSPPC),其中HSPPC包括與一或多抗原性胜肽(例如腫瘤相關抗原性胜肽)複合之熱休克蛋白質(例如gp96蛋白質)。在某些具體實施例中,所治療之癌症為鱗狀細胞癌、小細胞肺癌、非小細胞肺癌、胃腸道癌、何杰金氏淋巴瘤或非何杰金氏淋巴瘤、胰腺癌、神經膠質母細胞瘤、神經膠質瘤、子宮頸癌、卵巢癌、肝癌、膀胱癌、乳癌、結腸癌、結腸直腸癌、子宮內膜癌、骨髓瘤、唾液腺癌、腎臟癌、基底細胞癌、黑色素瘤、前列腺癌、外陰癌(vulval cancer)、甲狀腺癌、睾丸癌、食道癌或一類頭或頸癌。在某些具體實施例中,所治療之癌症為結締組織增生性黑素瘤、炎性乳癌、胸腺瘤、直腸癌、肛門癌或手術可治療或非手術可治療之腦幹神經膠質瘤。於一特定具體實施例中,所治療之個體為人
類。
於另一具體實施例中,本文提供個體中獨立於TCR觸發而活化T細胞的方法,其包括投予至個體有效量之本文所述醫藥組成物。
於另一具體實施例中,本文提供個體中獨立於TCR觸發而誘導、活化或增強NF-κB之活性的方法,其包括投予至個體有效量之本文所述醫藥組成物。
於另一具體實施例中,本文提供增加個體中多功能性(IFNγ+ TNFα+)T細胞之百分比的方法,其包括投予至個體有效量之本文所述醫藥組成物。
於另一具體實施例中,本文提供增加個體活化之T細胞中OX40及/或PD-1之表面表現的方法,其包括投予至個體有效量之本文所述醫藥組成物。
本文所述之抗體可與IDO抑制劑組合使用治療癌症。於一具體實施例中,本文提供治療個體中癌症之方法,其包括投予至個體有效量之本文所述醫藥組成物,其中方法進一步包括投予至個體吲哚胺-2,3-二氧酶(IDO)之抑制劑。本文所述用於治療癌症之IDO抑制劑以醫藥組成物之固體劑型諸如錠劑、丸劑或囊劑存在,其中醫藥組成物包括IDO抑制劑及醫藥上可接受之賦形劑。因此,本文所述之抗體及本文所述之IDO抑制劑可呈分開的劑型分別、依序或同時投予。於一具體實施例中,抗體腸胃外投予而IDO抑制劑口服投予。於特別具體實施例中,該抑制劑為選自下列所組成群組:依帕卡朵
絲坦(epacadostat)(Incyte Corporation)、F001287(Flexus Biosciences)、印朵目德(indoximod)(NewLink Genetics)及NLG919(NewLink Genetics)。依帕卡朵絲坦(epacadostat)已被描述於PCT公開案第WO 2010/005958號,為了所有目的其整體以引用方式併入本文。於一具體實施例中,抑制劑為依帕卡朵絲坦(epacadostat)。於另一具體實施例中,抑制劑為F001287。於另一具體實施例中,抑制劑為印朵目德(indoximod)。於另一具體實施例中,抑制劑為NLG919。
本文所述之抗體可與查核點靶向劑組合使用治療癌症。於一具體實施例中,本文提供治療個體中癌症之方法,其包括投予至個體有效量之本文所述醫藥組成物,其中方法進一步包括投予至個體查核點靶向劑。在一些具體實施例中,查核點靶向劑選自下列所組成群組:PD-1之拮抗劑(例如拮抗劑抗PD-1抗體)、PD-L1之拮抗劑(例如拮抗劑抗PD-L1抗體)、PD-L2之拮抗劑(例如拮抗劑抗PD-L2抗體)、CTLA-4之拮抗劑(例如拮抗劑抗CTLA-4抗體)、TIM-3之拮抗劑(例如拮抗劑抗TIM-3抗體)、LAG-3之拮抗劑(例如拮抗劑抗LAG-3抗體)及OX40之促效劑(例如促效劑抗OX40抗體)。在一些具體實施例中,查核點靶向劑,例如PD-1之拮抗劑(例如拮抗劑抗PD-1抗體)或OX40之促效劑(例如促效劑抗OX40抗體)與抗GITR抗體同時投予。在一些
具體實施例中,查核點靶向劑,例如PD-1之拮抗劑(例如拮抗劑抗PD-1抗體)或OX40之促效劑(例如促效劑抗OX40抗體)在投予抗GITR抗體之前投予。在一些具體實施例中,查核點靶向劑,例如PD-1之拮抗劑(例如拮抗劑抗PD-1抗體)或OX40之促效劑(例如促效劑抗OX40抗體)在投予抗GITR抗體之後投予。
本文所述之抗體可與抗CD25抗體組合使用。在一些具體實施例中,抗CD25抗體與抗GITR抗體同時投予。在一些具體實施例中,抗CD25抗體在抗GITR抗體投予之前投予。在一些具體實施例中,抗CD25抗體在抗GITR抗體投予之後投予。
於另一具體實施例中,本文提供治療個體中癌症之方法,其包括投予拮抗劑抗PD-1抗體至有需要的個體(已接受抗GITR抗體),其中在抗GITR抗體相對於在投予之時個體中PD-1的表現,已增加個體中PD-1的表現之時投予PD-1抗體。於另一具體實施例中,本文提供治療個體中癌症之方法,其包括投予促效劑抗OX40抗體至有需要的個體(已接受抗GITR抗體),其中抗GITR抗體相對於在投予之時個體中OX40的表現,已增加個體中OX40的表現之時投予OX40抗體。在某些具體實施例中,抗GITR抗體誘導、活化或增強GITR之活性。
於另一具體實施例中,本文提供治療個體中癌症之方法,其包括投予抗GITR抗體至有需要的個體,
其中抗GITR抗體增加個體中PD-1的表現(相對於在投予之時個體中PD-1的表現),且當PD-1的表現增加時,投予拮抗劑抗PD-1抗體至個體。於另一特定具體實施例中,本文提供治療個體中癌症之方法,其包括投予抗GITR抗體至有需要的個體,其中抗GITR抗體增加個體中OX40的表現(相對於在投予之時個體中OX40的表現),且當OX40的表現增加時,投予促效劑OX40抗體至個體。在某些具體實施例中,抗GITR抗體誘導、活化或增強GITR之活性。
於另一具體實施例中,本文提供治療個體中癌症或病毒感染之方法,該方法包括下述步驟:(a)活體外培養T細胞與本文所述之抗體或其抗原-結合片段;且(b)注入T細胞至個體。於一特定具體實施例中,注入至個體之T細胞為自體或同種異體。在某些具體實施例中,T細胞自個體單離。在一些具體實施例中,T細胞不與T細胞受體(TCR)複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)培養。在某些具體實施例中,方法進一步包括在步驟(a)之前:(1)分析T細胞的GITR之細胞表面表現;且(2)若步驟(1)並未導致偵測GITR高於閾值,藉由培養T細胞與T細胞受體(TCR)複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗
體)誘導在T細胞之GITR之表面表現。在一些具體實施例中,方法進一步包括在步驟(a)之前、與步驟(a)同時或在步驟(a)之後,培養T細胞與T細胞受體(TCR)複合物刺激劑植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA),或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)。於一特定具體實施例中,所治療之個體為人類。
於另一具體實施例中,本文提供治療及/或預防個體中感染性疾病之方法,其包括投予至個體有效量之本文所述的醫藥組成物。見下述章節5.4.1.2之感染性疾病的例子。於另一特定具體實施例中,本文提供治療個體中病毒感染之方法,其包括投予至個體有效量之本文所述醫藥組成物。在某些具體實施例中,所治療之病毒感染由人類乳突病毒(HPV)、單純皰疹或其他皰疹病毒、B型肝炎病毒(HBV)、C型肝炎病毒(HCV)或其他肝炎病毒、麻疹病毒、HIV或艾司坦氏-巴爾氏病毒(Epstein Barr virus)(EBV)導致。在某些具體實施例中,治療病毒感染之方法進一步包括投予抗病毒劑至個體。於一特定具體實施例中,所治療之個體為人類。
於另一具體實施例中,本文提供識別在無TCR促效劑存在下能夠誘導、活化或增強GITR之活性的抗GITR抗體之方法,其包括在無TCR促效劑存在下接觸表現GITR之細胞與抗GITR抗體且測量GITR活性,其中相較於在無抗GITR抗體之存在下之GITR活性,所增
加之GITR活性顯示在無TCR促效劑存在下抗GITR抗體能夠誘導、活化或增強GITR之活性。在某些具體實施例中,藉由測量NF-κB活性評估GITR活性。在某些具體實施例中,藉由測量TRAF接合子(adapter)媒介之訊號途徑的活化評估GITR活性,其中TRAF接合子選自下列所組成群組:TRAF1、TRAF2、TRAF3、TRAF4及TRAF5。在某些具體實施例中,藉由測量MAPK/ERK途徑之活化評估GITR活性。在某些具體實施例中,相較於在無抗GITR抗體之存在下之GITR活性,抗GITR抗體增加GITR活性至少兩倍。在某些具體實施例中,相較於在無抗GITR抗體之存在下之GITR活性,抗GITR抗體增加GITR活性兩倍至二十倍。在某些具體實施例中,相較於在無抗GITR抗體之存在下之GITR活性,抗GITR抗體增加GITR活性兩倍至十倍。在某些具體實施例中,細胞為T細胞。在某些具體實施例中,細胞不為T細胞。
於另一具體實施例中,本文所提供為特異性結合人類GITR之抗GITR抗體,其中在無TCR觸發存在下,該抗體能夠誘導、活化或增強細胞中GITR之活性。於另一具體實施例中,本文所提供為特異性結合人類GITR之抗GITR抗體,其中在無TCR觸發存在下,該抗體誘導、活化或增強細胞中NF-κB之活性。於另一特定具體實施例中,本文提供治療癌症之方法,其包括投予至有需要的個體特異性結合人類GITR之抗GITR抗體,其中在無TCR觸發存在下,該抗體能夠誘導、活化或增強
GITR及/或NF-κB之活性。
3.1 術語
如本文所使用,術語“約”及“大約”,當用於修飾數值或數字範圍時,顯示5%至10%高於及5%至10%低於該值或範圍之偏差維持在所述值或範圍之意欲意思的範圍內。
如本文所使用,若相對於測試抗體與第二抗原之間的結合,測試抗體與第一抗原之間的結合降低至少30%、40%、50%、60%、70%或80%,則相對於測試抗體與第二抗原之間的結合,測試抗體及第一抗原之間的結合為“實質上弱化”,例如在給定的實驗中,或使用來自多個實驗的平均值,由例如分析所評估,分析包括下述步驟:(a)在細胞(例如1624-5細胞)表面表現第一抗原或第二抗原;(b)在流式細胞儀分析中使用例如2μg/ml之測試抗體或多株抗體染表現第一抗原或第二抗原之細胞,並記錄平均螢光強度(MFI)值,例如作為來自一個以上測量之平均,其中多株抗體辨識第一抗原與第二抗原兩者;(c)對表現第二抗原之細胞的測試抗體之MFI值除以對表現第二抗原之細胞的多株抗體之MFI值(MFI比2
);(d)對表現第一抗原之細胞的測試抗體之MFI值除以對表現第一抗原之細胞的多株抗體之MFI值(MFI比1
);且(e)藉由計算100%*(1-(MFI比1
/MFI比2
)),測定結合降低之百分比。
如本文所使用,假如當在流式細胞儀分析中測量時,抗體至抗原之平均螢光強度(MFI)值並未顯著高於同型控制組抗體對抗原之MFI值或在無任何抗體之存在下MFI值,則抗體並未呈現“實質上結合”至抗原。
如本文所使用,術語“抗體(antibody及antibodies)”為本領域用語且可於本文中交替使用,並意指具有特異性結合抗原之抗原結合位置的分子。
抗體可包括,例如單株抗體、重組產生之抗體、單特異性抗體、多特異性抗體(包括雙特異性抗體)、人類抗體、擬人化抗體、嵌合抗體、免疫球蛋白、合成抗體、四聚體抗體,其包括二重鏈及二輕鏈分子、抗體輕鏈單體、抗體重鏈單體、抗體輕鏈二聚體、抗體重鏈二聚體、抗體輕鏈-抗體重鏈對、胞內抗體、異共軛(heteroconjugate)抗體、單功能域抗體、單價抗體、單鏈抗體或單鏈Fvs(scFv)、駱駝化(camelized)抗體、親合體(affybody)、Fab片段、F(ab’)2
片段、二硫化物連接之Fvs(sdFv)、抗遺傳型(抗Id)抗體(包括例如抗抗Id抗體)及上述任一之抗原-結合片段。在某些具體實施例中,本文所述之抗體意指多株抗體群。抗體可為免疫球蛋白分子之任何種類(例如IgG、IgE、IgM、IgD、IgA或IgY)、類型(例如IgG1
、IgG2
、IgG3
、IgG4
、IgA1
或IgA2
)或任何次類型(例如IgG2a
或IgG2b
)。在某些具體實施例中,本文所述之抗體為IgG抗體或其類型(例如,人類IgG1
或IgG4
)或次類型。於一特定具體實
施例中,抗體為擬人化單株抗體。在另一特定具體實施例中,抗體為人類單株抗體,較佳地為免疫球蛋白。在某些具體實施例中,本文所述之抗體為IgG1
或IgG4
抗體。
如本文所使用,術語“抗原-結合功能域”、“抗原-結合區”、“抗原-結合片段”及類似用語意指抗體分子之部分,其包括賦予抗體分子其對抗原的特異性之胺基酸殘基(例如互補性決定區(CDR))。抗原-結合區可衍生自任何動物品種,諸如囓齒動物(例如小鼠、大鼠或倉鼠)及人類。
如本文所使用,術語“可變區”或“可變功能域”交替使用且為本領域中常見。可變區典型指抗體之部分,一般而言,輕鏈或重鏈之部分,典型地,成熟重鏈中約胺基末端110至120胺基酸及成熟輕鏈中約90至115胺基酸,其在抗體之間序列上廣泛地不同且對其特定抗原用於特定抗體的結合及特異性。序列的可變性集中於稱為互補性決定區(CDR)的該些區,而可變功能域中較高度保留區稱為框架區(FR)。不欲受到任何特定機制或理論所限,咸信輕及重鏈之CDR首先負責抗體與抗原之交互作用及特異性。在某些具體實施例中,可變區為人類可變區。在某些具體實施例中,可變區包括囓齒動物或鼠科CDR及人類框架區(FR)。於特別具體實施例中,可變區為靈長類(例如非人類靈長類)可變區。在某些具體實施例中,可變區包括囓齒動物或鼠科CDR及靈長類(例如非人類靈長類)框架區(FR)。
術語“VL”及“VL功能域”交替使用意指抗體的輕鏈可變區。
術語“VH”及“VH功能域”交替使用意指抗體的重鏈可變區。
術語“Kabat編號”及類似術語為本領域已知且意指抗體重及輕鏈可變區或其抗原-結合部分中編號胺基酸殘基的系統。在某些態樣中,抗體CDR可依據Kabat編號系統確定(見例如Kabat EA & Wu TT(1971)Ann NY Acad Sci 190:382-391 and Kabat EA et al.,(1991)Sequences of Proteins of Immunological Interest,Fifth Edition,U.S.Department of Health and Human Services,NIH Publication No.91-3242)。使用Kabat編號系統,抗體重鏈分子中的CDR典型存在於胺基酸位置31至35,其任意地可包括一或多個額外胺基酸在35(在Kabat編號方案(Kabat numbering scheme)中指稱為35A及35B)(CDR1)之後、胺基酸位置50至65(CDR2)及胺基酸位置95至102(CDR3)。使用Kabat編號系統,抗體輕鏈分子中的CDR典型存在於胺基酸位置24至34(CDR1)、胺基酸位置50至56(CDR2)及胺基酸位置89至97(CDR3)。於一特定具體實施例中,本文所述之抗體的CDR已依據Kabat編號方案確定。
如本文所使用,術語“恆定區”或“恆定功能域”可交替且在本領域中具有共同意義。恆定區為抗體部分,例如輕及/或重鏈之羧基端部分,其不是直接涉及抗體與
抗原結合但可呈現各種效應子功能,諸如與Fc受體之交互作用。免疫球蛋白分子之恆定區相對於免疫球蛋白可變功能域一般具有較保留胺基酸序列。
如本文所使用,當關於抗體使用術語“重鏈”時,基於恆定功能域之胺基酸序列可意指任何不同類型,例如阿法(α)、戴爾它(δ)、艾普西龍(ε)、加馬(γ)及謬(μ),其分別產生抗體的IgA、IgD、IgE、IgG及IgM類型,包含IgG之次類型,例如IgG1
、IgG2
、IgG3
及IgG4
。
如本文所使用,當關於抗體使用術語“輕鏈”時,基於恆定功能域之胺基酸序列可意指任何不同類型,例如卡帕(κ)或拉姆達(λ)。輕鏈胺基酸序列於本領域中廣知。在特定具體實施例中,輕鏈為人類輕鏈。
“結合親和性”一般指分子(例如抗體)之單一結合位置及其結合搭擋(例如抗原)之間非共價交互作用之總合強度。除非特別指出,如本文所使用,“結合親和性”指內部結合親和性,其反映出結合對(例如抗體與抗原)成員之間1:1交互作用。分子X對其搭擋Y之親和性可一般由解離常數(KD
)表示。親和性可以本領域中已知的許多方式測量及/或表示包括但不限於,平衡解離常數(KD
)及平衡締合常數(KA
)。自k關
/k開
之商數計算KD
,反之自k開
/k關
之商數計算KA
。k開
指例如抗體對抗原之締合速率常數,而k關
指例如抗體對抗原之解離。k開
及k關
可由發明所屬技術領域中具有通常知識者已知之技
術,諸如BIAcore®
或KinEXA確定。
如本文所使用,“保留性胺基酸取代”為其中胺基酸殘基經具有類似側鏈之胺基酸殘基取代者。具有側鏈之胺基酸殘基家族已於本領域中定義。該些家族包括具鹼性側鏈之胺基酸(例如離胺酸、精胺酸、組胺酸)、酸性側鏈之胺基酸(例如天冬胺酸、麩胺酸)、不帶電極性側鏈之胺基酸(例如甘胺酸、天冬醯胺、麩醯胺酸、絲胺酸、蘇胺酸、酪胺酸、半胱胺酸、色胺酸)、非極性側鏈之胺基酸(例如丙胺酸、纈胺酸、白胺酸、異白胺酸、脯胺酸、苯丙胺酸、甲硫胺酸)、β-分支側鏈之胺基酸(例如蘇胺酸、纈胺酸、異白胺酸)及芳香族側鏈之胺基酸(例如酪胺酸、苯丙胺酸、色胺酸、組胺酸)。在某些具體實施例中,在CDR中或抗體或其抗原-結合片段之框架區中之一或多胺基酸殘基可經具類似側鏈之胺基酸殘基取代。
如本文所使用,“表位”為本領域中之術語且指抗體可特異性結合之抗原局部區。表位可為,例如,多胜肽之連續胺基酸(線性或連續表位)或者表位可,例如,來自多胜肽或多胜肽群之二或更多非連續區一起(構形、非線性、間斷的或非連續表位)。在某些具體實施例中,抗體結合的表位可由例如NMR光譜術、X光繞射結晶學研究、ELISA分析、與質譜術偶合之氫/氘交換(例如液相層析電噴灑質譜術)、陣列為主之寡-胜肽掃描分析及/或突變繪圖(例如位置導向突變繪圖)確定。對於
X光結晶學,可使用本領域中已知的任一方法完成結晶化(例如Giegé R et al.,(1994)Acta Crystallogr D Biol Crystallogr 50(Pt 4):339-350;McPherson A(1990)Eur J Biochem 189:1-23;Chayen NE(1997)Structure 5:1269-1274;McPherson A(1976)J Biol Chem 251:6300-6303)。可使用廣知的X光繞射技術研究抗體:抗原晶體且可使用電腦軟體,諸如X-PLOR(Yale University,1992,distributed by Molecular Simulations,Inc.;see e.g.Meth Enzymol(1985)volumes 114 & 115,eds Wyckoff HW et al.,;U.S.2004/0014194)及BUSTER(Bricogne G(1993)Acta Crystallogr D Biol Crystallogr 49(Pt 1):37-60;Bricogne G(1997)Meth Enzymol 276A:361-423,ed Carter CW;Roversi P et al.,(2000)Acta Crystallogr D Biol Crystallogr 56(Pt 10):1316-1323)精製。突變繪圖研究可使用發明所屬技術領域中具有通常知識者已知之任一方法完成。見例如Champe M et al.,(1995)J Biol Chem 270:1388-1394 and Cunningham BC & Wells JA(1989)Science 244:1081-1085,描述突變技術,包含丙胺酸掃描突變技術。於一特定具體實施例中,抗體或其抗原-結合片段之表位使用,諸如述於以下章節6之丙胺酸掃描突變研究確定。
如本文所使用,術語“免疫特異性結合”、“免疫特異性辨識”、“特異性結合”及“特異性辨識”在抗體文中為類似術語且意指結合抗原(例如表位或免疫複合物)
之分子,而此結合為發明所屬技術領域中具有通常知識者所了解。例如,特異性結合抗原的分子一般以較低親和性可結合到其他胜肽或多胜肽群,其由例如免疫分析,BIAcore®
,KinExA 3000儀器(Sapidyne Instruments,Boise,ID)或其他本領域中已知之分析確定。於一特定具體實施例中,免疫特異性結合抗原之分子以為至少2對數、2.5對數、3對數、4對數或較高於當分子結合另一抗原時之KA
的KA
結合到抗原。
在另一特定具體實施例中,免疫特異性結合抗原的分子在類似結合條件下不與其他蛋白質交叉反應。在另一特定具體實施例中,免疫特異性結合抗原的分子不與其他非-GITR蛋白質交叉反應。於一特定具體實施例中,本文提供為以比與另一不相關抗原較高之親和性結合GITR的抗體或其片段。在某些具體實施例中,本文提供為以20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%親和性或比與另一不相關抗原較高之親和性結合GITR(例如,人類GITR)之抗體或其片段,其由例如放射性免疫分析、表面電漿共振或動力學排除分析所測量。於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段結合不相關非-GITR蛋白質的程度小於抗體與GITR蛋白質結合之10%、15%或20%,其由例如放射性免疫分析所測量。
於一特定具體實施例中,本文提供為以比與
另一種GITR較高之親合性結合人類GITR之抗體或其片段。在某些具體實施例中,本文提供為以5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%親和性或比與另一種GITR較高之親合性結合人類GITR之抗體或其片段,其由例如放射性免疫分析、表面電漿共振或動力學排除分析所測量。於一特定具體實施例中,結合人類GITR的本文所述之抗體或其片段將以小於抗體或其片段與人類GITR蛋白質結合的10%、15%或20%結合另一種GITR蛋白質,其由例如放射性免疫分析、表面電漿共振或動力學排除分析所測量。
如本文所使用,術語“糖皮質素誘導性TNFR家族相關性受體”或“GITR”或“GITR多胜肽”指GITR包括但不限於,天然GITR、GITR之異型體或GITR之種間GITR同源物。GITR為26kDa第I型跨膜蛋白質。GenBankTM
登錄號BC152381及BC152386提供例示性人類GITR核酸序列。Swiss-Prot登錄號Q9Y5U5-1(TNR18_人類;SEQ ID NO:701)及GenBankTM
登錄號NP_004186提供例示性人類GITR胺基酸序列為異型體1。此胺基酸序列為長度241個胺基酸,具有前25個胺基酸殘基編碼訊號序列。異型體1為第I型膜蛋白質。人類GITR例示性成熟胺基酸序列提供為SEQ ID NO:700。相比之下,異型體2為人類GITR之分泌型且長度為大約255個胺基酸。Swiss-Prot登錄號Q9Y5U5-2及GenBankTM
登錄號NP_683699提供例示性人類GITR胺基
酸序列為異型體2。人類GITR之異型體3長度為大約234個胺基酸。Swiss-Prot登錄號Q9Y5U5-3及GenBankTM
登錄號NP_683700(異型體3前驅物)提供例示性人類GITR胺基酸序列為異型體3。於一特定具體實施例中,GITR為人類GITR。在另一特定具體實施例中,GITR為人類GITR異型體1(SEQ ID NO:701)。在某些具體實施例中,GITR為人類異型體2(SEQ ID NO:702)或異型體3(SEQ ID NO:703)。GITR亦已知為腫瘤壞死因子受體超級家族成員18(TNFRSF18)、活化-可誘導TNFR家族受體(AITR)、GITR-D及CD357。人類GITR藉由Entrez Gene指定為GeneID:8784。
來自馬來猴例示性GITR蛋白質之未成熟型的胺基酸序列提供為SEQ ID NO:704。此例示性蛋白質之成熟型為SEQ ID NO:704之胺基酸26至234。
如本文所使用,術語“GITR配體”及“GITRL”意指糖皮質素誘導性TNFR相關性蛋白質配體。GITRL要不已知為活化-誘導性TNF-相關配體(AITRL)及腫瘤壞死因子配體超級家族成員18(TNFSF18)。GenBankTM
登錄號AF125303提供例示性人類GITRL核酸序列。GenBankTM
登錄號NP_005083及Swiss-Prot登錄號Q9UNG2提供例示性人類GITRL胺基酸序列。於一特別具體實施例中,GITRL為SEQ ID NO:716之人類GITRL。
如本文所使用,術語“宿主細胞”可為任何類
型之細胞,例如初級細胞、培養細胞或來自細胞株之細胞。在特定具體實施例中,術語“宿主細胞”指以核酸分子轉染之細胞與此種細胞的子代或可能子代。此種細胞的子代可能不會與以核酸分子轉染之母細胞相同,因為例如可能在後續世代或核酸分子整合至宿主細胞基因體發生之突變或環境影響。
如本文所使用,在投予療法至個體之文中,術語“有效量”指達到所欲預防或治療效果的療法之量。有效量的例子提供於以下章節5.4.1.3。
如本文所使用,術語“個體”及“患者”可交替使用。個體可為動物。在一些具體實施例中,個體為哺乳動物,諸如非靈長類(例如牛、豬、馬、貓、狗、大鼠)或靈長類(例如猴或人類),最佳地為人類。在某些具體實施例中,此術語意指非人類動物(例如非人類動物諸如豬、馬、牛、貓或狗)。在一些具體實施例中,此術語意指寵物或農場動物。在特定具體實施例中,此術語意指人類。
圖1為在非還原條件下顯示抗GITR抗體231-32-15相對於同型控制組之特異性的西方墨點法。對人類GITR重組蛋白質(HuGITR recomb蛋白質)、小鼠GITR重組蛋白質(MuGITR recomb蛋白質)、表現重組人類GITR之CMS5A細胞(CMS5A-huGITR)、野生型
CMS5A細胞(CMS5A-wt)、來自經CD4+
活化的細胞之蛋白質(經CD4+
活化)及未經CD4+
處理的細胞之蛋白質(未經CD4+
處理),抗體被墨點。對人類GITR、CMS5A細胞中之重組人類GITR及經活化之CD4+
細胞中之天然人類GITR見到231-32-15反應性。
圖2A及2B顯示抗GITR抗體對商用(R&D Systems)抗GITR mAb之競爭性結合的FACS分析。在圖2A,使用R&D mAb及測試抗體(抗體1042-7、抗體1039-45、抗體1333-21及抗體32-15)測試R&D Systems mAb之阻擋(blocking),如圖中所示。條件‘無抗體’顯示在無測試抗體之存在下R&D Systems mAb單獨的結合。圖2B顯示無使用mAb、R&D Systems mAb及測試抗體(抗體1042-7、抗體1039-45、抗體1333-21及抗體32-14),抗GITR抗體231-1039-45之阻擋,如圖中所示。條件‘無抗體’顯示在無測試抗體之存在下抗體231-1039-45單獨的結合。
圖3A、3B及3C:圖3A描述藉由抗體1333-21批次1、1333-21批次2及R&D抗體以各種抗體濃度染CMS5A-GITR。圖3B圖解在以抗體1042-7、32-15、1039-45、1333-21及R&D抗體染活體外PBMC CD3-CD19-GITR+及CD4+CD25+GITR+細胞之螢光強度。圖3C提供以抗體1333-21與R&D Systems抗體之CD3-CD19-GITR+及CD4+CD25+GITR+細胞的FACS分析。
圖4描述組合各種濃度之抗CD3(OKT3)抗
體,對CD4+T細胞之抗GITR抗體共刺激效果評估。在頂組中,組合降低濃度之OKT3抗體(5μg/ml、1μg/ml、0.2μg/ml、0.04μg/ml及0μg/ml),對各測試抗體(PBS控制組、R&D、1042-7、32-15、1039-45及1333-21)描繪%CFSE-低細胞。在底組中,組合降低濃度之OKT3抗體(5μg/ml、1μg/ml、0.2μg/ml、0.04μg/ml及0μg/ml),對各測試抗體(PBS控制組、R&D、1042-7、32-15、1039-45及1333-21)描繪IFNγ(pg/ml)之濃度。
圖5顯示在抗GITR抗體嵌合親代231-32-15及m6C8存在下,GITRL-PE結合GITR。另一抗體SK48E26,其辨識IL-1β,用作為陰性控制組。GITRL-PE結合之百分比在增加抗體濃度(12、37、111、333、1000、3000及9000ng/ml)存在下由懸浮陣列技術(Luminex®
200系統)測量。圖5顯示來自進行二重複此分析四次獨立重複之結果,且標準偏差由n=8確定。
圖6為與圖5所示者類似圖,其中GITRL-PE結合之百分比在增加抗體濃度(12、37、111、333、1000、3000及9000ng/ml)存在下由懸浮陣列技術(Luminex®
200系統)測量。所測試之抗GITR抗體為嵌合親代231-32-15抗體與二個擬人化變體Hum231#1及Hum231#2。此圖顯示來自進行二重複一實驗的結果。
圖7顯示在mAb存在下,由表面電漿共振(BIAcore®
T100/200)測量之GITR配體結合GITR。所
測試之抗GITR抗體為嵌合親代231-32-15、擬人化變體Hum231#1及Hum231#2及m6C8。陰性控制組為抗IL-1β抗體SK48E26。
圖8A及8B顯示次優CD3刺激分析結果的FACS圖,以評估抗GITR抗體刺激對來自兩個不同棕黃層(buffy coat)之富含CD4+
T細胞之影響。圖8A顯示來自對刺激高應答者(棕黃層(buffy coat)6)之細胞數及CD4T細胞增殖的FACS分析,反之圖8B顯示低應答者(棕黃層(buffy coat)8)之FACS分析。對10μg/ml之抗GITR抗體(嵌合親代231-32-15抗體及擬人化變體Hum231#1及Hum231#2)顯示細胞增殖(CFSE;x軸)。所使用的控制組為抗CD3/抗CD28抗體單獨或無刺激。三重複進行分析。
圖9A及9B為直方圖,顯示在次優CD3刺激分析中相較於抗體m6C8,抗GITR擬人化變體抗體Hum231#1及Hum231#2對富含CD4T細胞增殖(圖9A)及細胞數(圖9B)的影響。以濃度為10μg/ml使用抗體。末端條(純黑色填充;圖9A及9B)顯示抗CD3/抗CD28刺激而無添加任何抗GITR抗體。
圖10A、10B、10C及10D顯示在次優CD3刺激分析中,對藉由投予抗GITR抗體分別誘導之IFNγ、IL-6、IL-10及TNFα的細胞激素產生分析。所測試之抗GITR抗體為嵌合親代231-32-15及擬人化變體Hum231#1及Hum231#2,濃度為10μg/ml及5μg/ml。
圖11為直方圖,顯示抗GITR抗體之進一步滴定及其在次優CD3刺激分析中對細胞增殖的影響。使用嵌合親代231-32-15抗體及擬人化變體Hum231#1及Hum231#2,濃度為10μg/ml、5μg/ml及2.5μg/ml。
圖12A及12B顯示抗GITR抗體之進一步滴定及其在次優CD3刺激分析中對IFNγ產生的影響。使用嵌合親代231-32-15抗體及擬人化變體Hum231#1及Hum231#2,濃度為10μg/ml、5μg/ml及2.5μg/ml作為盤鍵結(圖12A)或20μg/ml、10μg/ml及5μg/ml作為可溶性抗體(圖12B)。
圖13為一組條形圖,顯示在次優CD3刺激分析中,以5μg/ml、盤鍵結之Hum231#2對由PBMC之細胞激素分泌共刺激之結果。圖13所示之數據來自二位捐贈者在第2及第4天之後刺激測試。為6種不同細胞激素(IFNγ、IL-2、TNFα、IL-10、IL-13及IL-4)描繪相較於同型控制組之最大倍數誘導。誤差槓代表對各細胞激素二複製之標準偏差。各捐贈者已經在至少三種個別實驗中測試過。
圖14A、14B及14C為細胞內細胞激素染色分析之結果,測量IFNγ及TNFα之產生(在次優CD3刺激下,由盤鍵結之Hum231#2、Hum231#2w或pab1989(Hum231#2w之IgG4對應體)誘導)。圖14A為一組流式細胞儀散布圖,顯示對CD4+及CD8+T細胞共染IFNγ及TNFα。在次優抗CD3抗體濃度範圍內,為
Hum231#2、Hum231#2w、pab1989或同型控制組描繪IFNγ+單功能性T細胞、TNFα+單功能性T細胞或IFNγ+ TNFα+多功能性T細胞之百分比(圖14B及14C)。在圖14B及14C中各點代表對所測試條件之二複製。誤差槓代表標準偏差。以濃度為5μg/ml使用抗GITR抗體。圖為使用分別來自六(圖14A及14B)與四(圖14C)個不同捐贈者之PBMC的實驗之代表。
圖15A、15B及15C為一組條形圖,顯示比較抗GITR抗體Hum231#2在不同交聯條件下之實驗結果。圖15A為條形圖,顯示使用經5μg/ml盤鍵結(PB)或可溶性Hum231#2或同型控制組共刺激之PBMC,對IFNγ+ TNFα+多功能性CD8+T細胞之百分比之始自同型控制組的最大倍數誘導。誤差槓代表標準偏差。*代表p<0.05而**代表p<0.005(未成對T-測試)。在圖15B及15C中,對盤鍵結之Hum231#2(圖15B)或抗Fc交聯之Hum231#2(圖15C),描繪六種不同細胞激素相較於同型控制組之最大倍數誘導。誤差槓代表來自對各細胞激素二複製之標準偏差。
圖16A及16B顯示抗CD3/抗CD28及抗GITR抗體對T作用性(T-eff)及T調控性細胞(Tregs)刺激的結果。圖16A顯示在以抗CD3/抗CD28單獨或聯用抗GITR抗體刺激之後,經活化之T效應子及T調控性細胞表現GITR在其細胞表面。然而,如圖16B所示,以抗GITR抗體共刺激較T調控性細胞優先擴張效應子T細
胞。在棕黃層(buffy coat)8,10μg/ml之抗GITR抗體(嵌合親代231-32-15抗體及擬人化變體Hum231#1及Hum231#2)顯示細胞擴張/增殖(CFSE;y軸)。所使用之控制組為125ng/ml之抗CD3/抗CD28抗體單獨或無刺激。
圖17A及17B顯示由所測試之抗GITR抗體對T細胞增殖之結果。在以31.25ng/ml抗CD3抗體刺激之總PBMC中,圖17A顯示CD4細胞之增殖而圖17B顯示CD8細胞之增殖。以濃度為10μg/ml測試嵌合親代231-32-15抗體及擬人化變體Hum231#1及Hum231#2。
圖18A、18B及18C為在無或有0.3μg/ml之盤鍵結之抗CD3抗體(選殖株SP34)存在下,顯示GITR NF-κB-螢光素酶報告子分析結果的圖。圖18A為顯示在抗CD3抗體之存在下,在抗GITR抗體濃度範圍於18小時之後刺激下螢光素酶相對光單位(RLU)的圖。圖18B為在無抗CD3存在下,顯示在不同抗GITR抗體濃度於5小時之後刺激下抗體螢光素酶RLU的圖。圖18C為顯示在0、2、5、6、8及18小時之後刺激下螢光素酶表現(GITR Ab/同型控制組)最高比的圖。誤差槓代表來自重複的標準偏差。所測試之抗GITR抗體為Hum231#2w及m6C8。所顯示的數據為以抗CD3抗體之四個實驗或無抗CD3抗體之二個實驗的代表。
圖19A為條形圖,顯示在經活化之nTreg、CD4+T細胞或CD8+T細胞上人類GITR之標準化受體密
度,由流式細胞儀測量。所使用之抗GITR抗體為PE-共軛之小鼠抗人類GITR抗體(Biolegend:621;311604/B171072)。誤差槓代表標準偏差。圖19B為使用Fcγ受體IIIA(CD16)報告子細胞株檢驗抗GITR抗體Hum231#2w之圖。在37℃、Hum231#2w或同型控制組存在下,具高親和性158 V/V多型性過度表現CD16A之Jurkat NFAT-螢光素酶報告子細胞與經活化之初級nTreg及T效應子細胞共培養20小時。在20小時後記錄相對光單位(RLU),代表CD16A結合。△RLU代表抗GITR抗體之RLU減同型控制組之RLU。誤差槓代表標準偏差(n=2)。所顯示的數據為使用來自三位捐贈者細胞之實驗的代表。圖19C為一組直方圖,顯示流式細胞儀所測量之GITR之表面表現。來自健康人類捐贈者(a-c,n=3)之血液或來自非小細胞肺癌患者(NSCLC)(d-f,n=3)之腫瘤組織收集樣本。細胞群被定義為Tconv(CD3+、CD4+、CD8a-、CD25低、FOXP3-)或Treg(CD3+、CD4+、CD8a-、CD25高、FOXP3+)。
圖20A、20B及20C為使用來自非洲綠猴(AGM)之PBMC的實驗結果。圖20A為使用抗GITR抗體Hum231#2及抗PD-1抗體染非洲綠猴(AGM)之經活化之CD4+及CD8+T細胞的一組流式細胞儀散布圖。健康AGM PBMC經抗CD3抗體(選殖株SP34.2)或ConA加IL-2(20U/ml)活化3天。流式細胞儀散布圖為使用來自三個不同AGM之PBMC實驗的代表。圖20B及20C為使
用AGM PBMC,CD3次刺激分析之結果。圖20B為顯示對經Hum231#2w或同型控制組共刺激之細胞共染CD8及IFNγ的流式細胞儀散布圖對。在圖20C,對不同抗GITR抗體濃度描繪IFNγ+ AGM CD8+T細胞之百分比。各點代表二孔之複製(a replicate of two wells)而誤差槓代表標準偏差。圖20B及20C所示之數據為使用來自二個AGM之PBMC實驗的代表。
圖21A及21B為以盤鍵結之0.8μg/ml的抗CD3抗體及5μg/ml的抗GITR抗體Hum231#2刺激的CD4+及CD8+T細胞上染表面OX40及PD-1的結果。圖21A為一組流式細胞儀散布圖及直方圖,顯示共染OX40及PD-1。在圖21B中,各條代表經Hum231#2(黑色條)、同型控制組(灰色條)或僅培養基(白色條)刺激之CD4+及CD8+T細胞上PD-1及OX40的MFI值。誤差槓代表標準偏差。流式細胞儀散布圖及圖為使用來自一位捐贈者之PBMC實驗的代表。
圖22A及22B顯示種系之抗體變體產生之突變庫設計。基於IGHV1-2*02 VH人類種系之庫中包含的不同框架及CDR位置示於圖22A(分別為SEQ ID NO 37至53,以出現順序)而基於IGKV4-1*01 VL人類種系之庫示於圖22B(分別為SEQ ID NO 54至71,以出現順序)。
圖23為條列17種系之抗體變體及詳述其具對應SEQ ID號碼之重及輕鏈可變區的表。該表顯示額外
種系胺基酸之數目及與嵌合親代231-32-15抗體相比,變體抗體之平均相對親和性。
圖24A至C為條列107種系之抗體變體及詳述其具對應SEQ ID號碼之重及輕鏈可變區的表。
圖25A及25B顯示在抗GITR種系之抗體變體的選擇存在下,結合GITR之GITRL-PE。GITRL-PE結合之百分比由懸浮陣列技術(Luminex®
200系統)在增加抗體濃度存在下(12、37、111、333、1000、3000及9000ng/ml)所測量。
圖26A及26B顯示在來自二棕黃層(buffy coat),BC4(圖26A)及BC9(圖26B)之富含CD4 T細胞上,與嵌合親代231-32-15抗體及擬人化變體Hum231#1及Hum231#2比較,對種系之抗體變體之細胞增殖(% CFSE低)的影響。使用125ng/ml之盤鍵結之抗CD3抗體與盤鍵結或可溶性同型控制組進行次優CD3刺激分析。以濃度為10μg/ml使用抗GITR抗體。
圖27A及27B顯示在來自棕黃層(buffy coat)BC4之富含CD4T細胞上,與嵌合親代231-32-15抗體與擬人化變體Hum231#1及Hum231#2相比,分別對種系之抗體變體的IFNγ及IL-10之細胞激素釋放的影響。使用125ng/ml之盤鍵結之抗CD3抗體與盤鍵結或可溶性同型控制組進行次優CD3刺激分析。以濃度為10μg/ml使用抗GITR抗體且在培養上清液中測量細胞激素量。
圖28A及28B顯示在來自棕黃層(buffy coat)BC9之富含CD4T細胞上,與嵌合親代231-32-15抗體與擬人化變體Hum231#1及Hum231#2相比,分別對種系之抗體變體的IFNγ及IL-10之細胞激素釋放的影響。使用125ng/ml之盤鍵結之抗CD3抗體與盤鍵結或可溶性同型控制組進行次優CD3刺激分析。以濃度為10μg/ml使用抗GITR抗體且在培養上清液中測量細胞激素量。
圖29A及29B顯示在來自二棕黃層(buffy coat)之富含CD4 T細胞上,相較於嵌合親代231-32-15抗體與擬人化變體Hum231#1及Hum231#2,種系之抗體變體的IFNγ陽性CD4+
T-細胞之百分比(以細胞內染色測量)。圖29A顯示來自棕黃層(buffy coat)13(BC13)的結果而圖29B顯示來自棕黃層(buffy coat)18(BC18)的結果。
圖30A至C為一組圖,顯示在0.3μg/ml抗CD3抗體之存在下,GITR NF-κB-螢光素酶報告子分析之結果。此分析中所測試的抗GITR抗體為Hum231#2w及20個種系變體:pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、pab2159、pab2160及pab2161。在圖30A至C,對所測試之不同抗GITR抗體濃度描繪在18小時之後刺激的螢光素酶RLU。誤差槓代
表標準偏差。圖30D至F為一組圖,顯示在無抗CD3抗體之存在下,GITR NF-κB-螢光素酶報告子分析之結果。此分析中所測試之抗GITR抗體為m6C8、Hum231#2w及20個種系變體:pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、pab2159、pab2160及pab2161。在圖30D至F,對所測試之對不同抗GITR抗體濃度描繪在6小時之後刺激的螢光素酶RLU。誤差槓代表標準偏差。圖及繪圖為來自二個實驗(圖30A至C)或一個實驗(圖30D至F)之數據代表。
圖31顯示當GITR-bio與嵌合親代231-32-15、Hum231#1或Hum231#2抗體預培養時,表現嵌合親代231-32-15抗體之1624-5前驅-B細胞結合生物素化GITR(GITR-bio)之損失。圖31右手數據圖描述表現嵌合親代231-32-15抗體之1624-5前驅-B細胞結合GITR-bio。然而,在左手數據圖,在GITR-bio與嵌合親代231-32-15、Hum231#1或Hum231#2抗體預培養之後,表現嵌合親代231-32-15抗體之1624-5細胞與GITR-bio有結合損失。
圖32顯示由表面電漿共振(BIAcore®
T100/200)測量之表位競爭分析的結果。GITR抗原經固定化於CM5感應器晶片而抗GITR抗體以濃度為300nM施用。先施用嵌合親代231-32-15抗體,之後施用鼠科抗
體6C8。
圖33A及33B為使用由易錯PCR(error prone PCR)產生之表現GITR變體的細胞庫的表位繪圖實驗結果。圖33A及33B所示為來自結合多株抗GITR抗體但不結合抗GITR嵌合親代231-32-15抗體的GITR變體之序列排列。
圖34A及B為使用丙胺酸掃描之表位繪圖實驗結果。下述在人類GITR的位置(依據SEQ ID NO:701編號)分別經突變為丙胺酸:P28A、T29A、G30A、G31A、P32A、T54A、T55A、R56A、C57A、C58A、R59A、D60A、Y61A、P62A、G63A、E64A、E65A、C66A、C67A、S68A、E69A、W70A、D71A、C72A、M73A、C74A、V75A及Q76A。圖34A所示實驗中所測試的抗體包括:單株抗GITR抗體Hum231#2、三個種系變體(pab1967、pab1975及pab1979)及m6C8抗體;且多株抗GITR抗體(AF689,R&D systems)。圖34A為總結Hum231#2、三個種系變體(pab1967、pab1975及pab1979)與參考抗體m6C8結合表現人類GITR丙胺酸突變體之1624-5細胞的表。圖34B為一組流式細胞儀散布圖,顯示使用單株抗體231-32-15、Hum231#2或m6C8或多株抗體對表現野生型人類GITR、D60A突變體或G63A突變體之1624-5細胞的染色。在各圖中標誌GITR陽性細胞之百分比。
圖35A為人類GITR、V1M馬來猴GITR及
V1M/Q62P/S63G馬來猴GITR之序列排列,強調位置62及63,在此處來自馬來猴GITR(GlnSer)之二胺基酸經人類GITR(ProGly)中對應殘基取代。圖35B為一組流式細胞儀散布圖,顯示使用單株抗體231-32-15、Hum231#2或m6C8或多株抗GITR抗體,對表現人類GITR、V1M馬來猴GITR或V1M/Q62P/S63G馬來猴GITR之1624-5細胞染色。
本文所提供為抗體(例如單株抗體)及其抗原-結合片段,其特異性結合GITR(例如,人類GITR)並調節GITR活性。舉例來說,於一態樣中,本文所提供為抗體或其片段,其特異性結合GITR且增強、誘導或增加一或多GITR活性。於一特定具體實施例中,抗體或抗原-結合片段經單離。
亦提供為經單離之核酸(多核苷酸),諸如互補DNA(cDNA),編碼此抗體及其抗原-結合片段。更提供為載體(例如表現載體)及細胞(例如宿主細胞),其包括編碼此抗體或其抗原-結合片段之核酸(多核苷酸)。亦提供為製造此抗體之方法。於其他態樣中,本文提供誘導、增加或增強GITR活性且治療某些病症,諸如癌症及感染性疾病的方法及用途。亦提供相關組成物(例如醫藥組成物)、套組及偵測方法。
5.1 抗體
於一特定態樣中,本文所提供為特異性結合GITR(例如,人類GITR)之抗體(例如單株抗體,諸如嵌合或擬人化抗體)及其片段。在一些具體實施例中,本文所述之抗體或其抗原-結合片段部分抑制GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)。在某些具體實施例中,本文所述之抗體或其抗原-結合片段抑制GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,其由發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析評估。於一特定具體實施例中,本文所述之抗體或其抗原-結合片段抑制GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,其由以下實施例2(例如以下章節6.2.5.2或6.2.5.4)所述之分析評估。在另一特定具體實施例中,濃度為1000ng/ml、950ng/ml、900ng/ml、850ng/ml、800ng/ml、750ng/ml、700ng/ml、650ng/ml、600ng/ml、550ng/ml、500ng/ml、450ng/ml、400ng/ml、350ng/ml、333ng/ml、300ng/ml、250ng/ml、200ng/ml、100ng/ml、50ng/ml或10ng/ml之本文所述之抗體或其抗原-結合片段抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、
0.5nM、0.4nM、0.3nM、0.2nM或0.1nM之經標幟之GITRL(例如GITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM之經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的GITR偶合珠粒而言。在另一特定具體實施例中,濃度為1000ng/ml至750ng/ml、1000ng/ml至500ng/ml、850ng/ml至500ng/ml、750ng/ml至500ng/ml、600ng/ml至500ng/ml、500ng/ml至400ng/ml、400ng/ml至300ng/ml或300ng/ml至200ng/ml之本文所述之抗體或其抗原-結合片段抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM、0.1nM的經標幟之GITRL(例如GITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、
35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM之經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的GITR偶合珠粒而言。在另一特定具體實施例中,在懸浮陣列分析中,相對於無抗GITR抗體或其抗原-結合片段存在下0.5nM之經標幟之GITRL與濃度為5pg/ml/珠粒之GITR偶合珠粒結合濃度為1000ng/ml之抗體或其抗原-結合片段抑制少於80%(在一些具體實施例中,40%至70%、50%、至80%或40%至80%)的0.5nM經標幟之GITRL(例如,人類GITRL)與濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)結合。
在另一特定具體實施例中,濃度為3500ng/ml、3400ng/ml、3300ng/ml、3200ng/ml、3100ng/ml、3000ng/ml、2900ng/ml、2800ng/ml、2700ng/ml、2600ng/ml、2500ng/ml、2400ng/ml、2300ng/ml、2200ng/ml、2100ng/ml、2000ng/ml、1900ng/ml、1800ng/ml、1700ng/ml、1600ng/ml、1500ng/ml、1400ng/ml、1300ng/ml、1200ng/ml或1100ng/ml之本文所述之抗體或其抗原-結合片段抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、
0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如GITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM之經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml之GITR偶合珠粒而言。在另一特定具體實施例中,濃度為3500ng/ml至3200ng/ml、3500ng/ml至3000ng/ml、3200ng/ml至2500ng/ml、3000至2200ng/ml、2500ng/ml至1800ng/ml、2000ng/ml至1500ng/ml、1700ng/ml至1200ng/ml、或1500ng/ml至1000ng/ml之本文所述之抗體或其抗原-結合片段抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如GITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)少於85%、80%、75%、70%、65%、
60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的GITR偶合珠粒而言。
在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®
珠粒)時,濃度為3000ng/ml的本文所述之抗體或其抗原-結合片段抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%或少於80%(在一些具體實施例中,60%至85%、60%至80%、70%至85%或70%至80%),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為1000ng/ml之本文所述之抗體或其抗原-結合片段抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%、少於80%或少於75%(在一些具體實施例中,60%至85%、60%至80%、70%至85%或
70%至80%),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為333ng/ml之本文所述之抗體或其抗原-結合片段抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於70%或少於65%(在一些具體實施例中,50%至70%、55%至70%、50%至65%或50%至60%),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為111ng/ml之本文所述之抗體或其抗原-結合片段抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於65%、少於60%或少於55%(在一些具體實施例中,40%至65%、40%至60%、40%至55%或30%至60%),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例
如Luminex®珠粒)時,濃度為37ng/ml的本文所述之抗體或其抗原-結合片段抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於40%(在一些具體實施例中,20%至40%、20%至30%或15%至35%),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為12ng/ml的本文所述之抗體或其抗原-結合片段抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於20%(在一些具體實施例中,10%至20%),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。
在某些具體實施例中,在本文所述之抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%之GITRL(例如,人類GITRL)結合GITR(例如,人類GITR),此由發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析所評估。於一特定具體實施例中,在本文所述之抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、
50%、55%、60%、65%、70%或75%之GITRL(例如,人類GITRL)結合GITR(例如,人類GITR),此由以下實施例2(例如以下章節6.2.5.2或6.2.5.4)所述之分析所評估。在另一特定具體實施例中,在1000ng/ml、950ng/ml、900ng/ml、850ng/ml、800ng/ml、750ng/ml、700ng/ml、650ng/ml、600ng/ml、550ng/ml、500ng/ml、450ng/ml、400ng/ml、350ng/ml、333ng/ml、300ng/ml、250ng/ml或200ng/ml之本文所述之抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、或75%之1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的GITR偶合珠粒而言。在另一特定具體實施例中,在1000ng/ml至900ng/ml、1000ng/ml至850
ng/ml、900ng/ml至800ng/ml或850ng/ml至750ng/ml或800至750ng/ml存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、或75%之1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的GITR偶合珠粒而言。在另一特定具體實施例中,在1000ng/ml之抗體或其抗原-結合片段存在下,至少20%、至少25%或至少30%之0.5nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。
在另一特定具體實施例中,在3500ng/ml、3400ng/ml、3300ng/ml、3200ng/ml、3100ng/ml、3000ng/ml、2900ng/ml、2800ng/ml、2700ng/ml、2600ng/ml、2500ng/ml、2400ng/ml、2300ng/ml、2200ng/ml、2100ng/ml、2000ng/ml、1900ng/ml、1800ng/ml、1700ng/ml、1600ng/ml、1500ng/ml、1400ng/ml、1300ng/ml、1200ng/ml、1100ng/ml或1000ng/ml之本文所述之抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、or 75% of 1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM、0.1nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的GITR偶合珠粒而言。在另一特定具體實施例中,在3500ng/ml至3200ng/ml、3500ng/ml至3000ng/ml、3200ng/ml至
2500ng/ml、3000至2200ng/ml、2500ng/ml至1800ng/ml、2000ng/ml至1500ng/ml、1700ng/ml至1200ng/ml或1500ng/ml至1000ng/ml之本文所述之抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%之1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml的GITR偶合珠粒而言。
在另一特定具體實施例中,在3000ng/ml之抗體或其抗原-結合片段存在下,至少20%、至少25%或至少30%之0.5nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析中無抗GITR抗體或其抗原
-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在另一特定具體實施例中,在1000ng/ml之抗體或其抗原-結合片段存在下,至少25%、至少30%、至少40%或至少50%(在一些具體實施例中,25%至60%、40%至60%、40%至70%或25%至50%)之0.5nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在另一特定具體實施例中,在333ng/ml之抗體或其抗原-結合片段存在下,至少30%、至少40%、至少50%或至少60%(在一些具體實施例中,30%至60%、40%至60%、40%至70%或30%至50%)之0.5nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在另一特定具體實施例中,在111ng/ml之抗體或其抗原-結合片段存在下,至少40%、至少50%、至少60%或至少65%(在一些具體實施例中,40%至70%、40%至60%、40%至65%或40%至50%)之
0.5nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在另一特定具體實施例中,在37ng/ml之抗體或其抗原-結合片段存在下,至少60%、至少70%或至少80%(在一些具體實施例中60%至80%、70%至80%或75%至85%)之0.5nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在另一特定具體實施例中,在12ng/ml之抗體或其抗原-結合片段存在下,至少80%、至少85%或至少90%(在一些具體實施例中80%至90%或85%至95%)之0.5nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合濃度為5pg/ml/珠粒之偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),此為在懸浮陣列分析中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。
在某一具體實施例中,當GITR(例如,人類
GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為3000ng/ml之本文所述之抗體或其抗原-結合片段未抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過15%或超過20%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為1000ng/ml之本文所述之抗體或其抗原-結合片段未抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過15%、超過20%或超過25%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為333ng/ml之本文所述之抗體或其抗原-結合片段未抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過30%或超過35%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR
(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為111ng/ml之本文所述之抗體或其抗原-結合片段未抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過35%、超過40%或超過45%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為37ng/ml之本文所述之抗體或其抗原-結合片段未抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過60%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某一具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,濃度為12ng/ml之本文所述之抗體或其抗原-結合片段未抑制0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過80%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。
於另一具體實施例中,在本文所述之抗體或其抗原-結合片段存在下,在方法中一定量之經標幟之GITRL(例如,人類GITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),該方法包括:(a)濃度為大約每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml偶合GITR(例如,人類GITR)至珠粒;(b)每孔中,將濃度為大約30珠粒/μl、40珠粒/μl或50珠粒/μl之GITR偶合珠粒與3000ng/ml、2500ng/ml、2000ng/ml、1500ng/ml、1000ng/ml、750ng/ml、500ng/ml、250ng/ml、100ng/ml、50ng/ml、25ng/ml或10ng/ml之本文所述之抗體或其抗原-結合片段培養第一時間期間(例如30分鐘、60分鐘、1.5小時、2小時、2.5小時或3小時);(c)添加經標幟之GITRL(例如,人類GITRL-PE)至孔中以獲得最終濃度為大約1.5nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM之經標幟之GITRL及大約15珠粒/μl、20珠粒/μl或25珠粒/μl,且培養第二時間期間(例如30分鐘、1小時、1.5小時、2小時、2.5小時或3小時);且(d)在例如懸浮陣列分析諸如Luminex® 200系統中,偵測結合GITR偶合珠粒的經標幟之GITRL。在特定具體實施例中,在抗GITR抗體或其抗原-結合片段存在下,測定經標幟之GITRL結合GITR偶合珠粒之量,其相對於在無抗GITR抗體或其抗原-結合片段存在下,經標幟之GITRL結合
GITR偶合珠粒之量。在某些具體實施例中,不存在抗GITR抗體或其抗原-結合片段意指無抗體或其抗原-結合片段存在於孔中。在其他具體實施例中,不存在抗GITR抗體或其抗原-結合片段意指未結合GITR之同型控制組抗體存在於孔中。依據這些具體實施例,在抗GITR抗體或其抗原-結合片段存在下,經標幟之GITRL結合GITR偶合珠粒之量測定為,在一些具體實施例中,在無抗GITR抗體或其抗原-結合片段存在下,結合GITR偶合珠粒的經標幟之GITRL之量的至少15%、20%、25%、30%、35%、40%、45%、50%、55%或60%或15%至60%、20%至60%、30%至70%或20%至50%。
於另一具體實施例中,在本文所述之抗體或其抗原-結合片段存在下,在方法中一定量之經標幟之GITRL(例如,人類GITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),該方法包括:(a)濃度為大約每珠粒5pg/ml偶合GITR(例如,人類GITR)至珠粒;(b)在每孔中,將濃度為大約40珠粒/μl之GITR偶合珠粒與3000ng/ml、2500ng/ml、2000ng/ml、1500ng/ml、1000ng/ml、750ng/ml、500ng/ml、250ng/ml、100ng/ml、50ng/ml或10ng/ml之本文所述之抗體或其抗原-結合片段培養第一時間期間(例如30分鐘、60分鐘、1.5小時、2小時、2.5小時或3小時);(c)添加經標幟之GITRL(例如,人類GITRL-PE)至孔中以獲得最終濃度為0.5nM之經標幟之GITRL
及大約20珠粒/μl,及培養第二時間期間(例如30分鐘、1小時、1.5小時、2小時、2.5小時或3小時);且(d)在例如懸浮陣列分析諸如Luminex® 200系統中,偵測結合GITR偶合珠粒的經標幟之GITRL。在特定具體實施例中,在抗GITR抗體或其抗原-結合片段存在下,測定經標幟之GITRL結合GITR偶合珠粒之量,其相對於在無抗GITR抗體或其抗原-結合片段存在下,經標幟之GITRL結合GITR偶合珠粒之量。在某些具體實施例中,不存在抗GITR抗體或其抗原-結合片段意指無抗體或其抗原-結合片段存在於孔中。在其他具體實施例中,不存在抗GITR抗體或其抗原-結合片段意指未結合GITR的同型控制組抗體存在於孔中。依據這些具體實施例,在抗GITR抗體或其抗原-結合片段存在下,經標幟之GITRL結合GITR偶合珠粒之量測定為,在一些具體實施例中,在無抗GITR抗體或其抗原-結合片段存在下,結合GITR偶合珠粒的經標幟之GITRL之量的至少20%、25%、30%、35%、40%、45%、50%、55%或60%或20至70%、20%至60%、30%至70%或20%至50%。
在某些具體實施例中,結合固定於晶片上(例如CM5感應器晶片)的GITR(例如,人類GITR)之濃度為150nM、145nM、140nM、135nM、130nM、125nM、120nM、115nM、110nM、105nM或100nM之本文所述之抗體或其抗原-結合片段抑制150nM、145nM、140nM、135nM、130nM、125nM、120nM、115nM、
110nM、105nM或100nM之GITRL(例如人類GITRL之非共價連接三聚體)結合固定於晶片上之GITR少於60%、少於55%、少於50%、少於45%、少於40%、少於35%、少於30%、少於25%、少於20%或少於15%。在某些具體實施例中,結合固定於晶片上(例如CM5感應器晶片)的GITR(例如,人類GITR)之濃度為125nM之本文所述之抗體或其抗原-結合片段抑制125nM之GITRL(例如人類GITRL之非共價連接三聚體)結合固定於晶片上之GITR少於60%、少於55%、少於50%、少於45%、少於40%、少於35%、少於30%、少於25%、少於20%或少於15%。
在某些具體實施例中,本文所述之抗體或其片段以8.5×10-3
s-1
或更少、3.5×10-3
s-1
或更少、5×10-3
s-1
或更少、2.5×10-3
s-1
或更少、1×10-3
s-1
或更少、8.5×10-4
s-1
或更少、5×10-4
s-1
或更少、3.5×10-4
s-1
或更少、2.5×10-4
s-1
或更少、1×10-4
s-1
或更少、8.5×10-5-
s-1
或更少、3.5×10-5-
s-1
或更少、5×10-5-
s-1
或更少、2.5×10-5-
s-1
或更少、1×10-5-
s-1
或更少、8.5×10-6-
s-1
或更少、5×10-6-
s-1
或更少、3.5×10-6-
s-1
或更少、2.5×10-6-
s-1
或更少、1×10-6-
s-1
或更少、8.5×10-7-
s-1
或更少、5×10-7-
s-1
或更少、2.5×10-7-
s-1
或更少、1×10-7-
s-1
或更少、8.5×10-8-
s-1
或更少、5×10-8-
s-1
或更少、2.5×10-8-
s-1
或更少、1×10-8-
s-1
或更少、8.5×10-9-
s-1
或更少、5×10-9
s-1
或更少、2.5×10-9-
s-1
或更少或1×10-9-
s-1
或更少之解離速率常數(k關
)結合GITR(例如,人類GITR)。在一些具體實施例中,本文所述之抗體或其片段以9.5×10-5-
s-1
至1×10-9-
s-1
、8.5×10-5-
s-1
至1×10-9-
s-1
、5×10-5-
s-1
至1×10-9-
s-1
、9.5×10-5-
s-1
至1×10-8-
s-1
、5×10-5
s-1
至1×10-8-
s-1
、9.5×10-5-
s-1
至1×10-7-
s-1
、5×10-5-
s-1
至1×10-7-
s-1
、9.5×10-5-
s-1
至5×10-6-
s-1
、9.5×10-5-
s-1
至1×10-5-
s-1
、8.5×10-3
s-1
至1×10-4
s-1
、5×10-3
s-1
至2.5×10-4
s-1
、8.5×10-3
s-1
,至1×10-5
s-1
、8.5×10-5-
s-1
至5×10-5-
s-1
之間之k關
結合GITR(例如,人類GITR)。在某些具體實施例中,使用單價抗體,諸如Fab片段,由例如BIAcore®
表面電漿共振技術測量來測定k關
。在其他具體實施例中,使用二價抗體,由例如BIAcore®
表面電漿共振技術測量來測定k關
。於一特別具體實施例中,使用以下章節6所述之分析測定k關
。
在某些具體實施例中,本文所述之抗體或其片段以至少105
M-1
s-1
、至少2.5×105
M-1
s-1
、至少3.5×105
M-1
s-1
、至少5×105
M-1
s-1
、至少106
M-1
s-1
、至少2.5×106
M-1
s-1
、至少3.5×106
M-1
s-1
、至少5×106
M-1
s-1
、至少107
M-1
s-1
、至少5×107
M-1
s-1
、至少108
M-1
s-1
、至少5108
M-1
s-1
或至少109
M-1
s-1
之締合速率常數(k開
)結合GITR(例如,人類GITR)。在一些具體實施例中,本文所述之抗體或其片段以1×105
M-1
s-1
至5×105
M-1
s-1
、1×105
M-1
s-1
至1×106
M-1
s-1
、3.5×105
M-1
s-1
至
2.5×106
M-1
s-1
、3.5×105
M-1
s-1
至3.5×106
M-1
s-1
、1×105
M-1
s-1
至5×106
M-1
s-1
、1×105
M-1
s-
至1×107
M-1
s-1
、1×105
M-1
s-1
至5×107
M-1
s-1
、1×105
M-1
s-1
至108
M-1
s-1
、1×105
M-1
s-1
至1×109
M-1
s-1
、1×106
M-1
s-
至1×107
M-1
s-1
、1×106
M-1
s-1
至1×108
M-1
s-1
、1×106
M-1
s-1
至1×109
M-1
s-1
、1×107
M-1
s-1
至1×108
M-1
s-1
、1×107
M-1
s-1
至1×109
M-1
s-1
、1×108
M-1
s-1
至1×109
M-1
s-1
之間的k開
結合GITR(例如,人類GITR)。在某些具體實施例中,使用單價抗體,諸如Fab片段,由例如BIAcore®
表面電漿共振技術測量來測定k開
。在其他具體實施例中,使用二價抗體,由例如BIAcore®
表面電漿共振技術測量來測定k開
。於一特別具體實施例中,使用以下章節6所述之分析測定k開
。
在某些具體實施例中,本文所述之抗體或其片段以少於7nM、6nM、5nM、4.5nM、4nM、3.5nM、3nM、2.5nM、2nM、1.5nM、1nM、0.75nM、0.5nM、0.25nM或0.1nM之KD
結合GITR(例如,人類GITR)。在一些具體實施例中,本文所述之抗體或其片段以約7nM、6nM、5nM、4.5nM、4nM、3.5nM、3nM、2.5nM、2nM、1.5nM、1nM、0.75nM、0.5nM、0.25nM或0.1nM之KD
結合GITR(例如,人類GITR)。在某些具體實施例中,本文所述之抗體或其片段以7nM至2nM、5nM至3nM、5nM至1nM、4nM至3nM、4nM至2nM、3nM至2nM、3nM至1nM、2
nM至1nM、3nM至0.1nM、2nM至0.1nM、1nM至0.1nM或0.5nM至0.1nM之KD
結合GITR(例如,人類GITR)。在某些具體實施例中,KD
經計算為k關
/k開
之商數,且使用單價抗體,諸如Fab片段,由例如BIAcore®表面電漿共振技術測量來測定k開
及k關
。在其他具體實施例中,KD
經計算為k關
/k開
之商數,且使用二價抗體,諸如Fab片段,由例如BIAcore®表面電漿共振技術測量來測定k開
及k關
。於一特定具體實施例中,如以下章節6實施例(例如實施例2)中所述者測定KD
。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈可變區(VL),包含:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSX1
X2
X3
X4
X5
X6
X7
KX8
YLX9
(SEQ ID NO:4),其中
X1
為L、A、V、I、P、F或M
X2
為L、A、V、I、P、F、M或S
X3
為N、G、Q、S、T、C、W、Y或A
X4
為S、G、N、Q、T、C、W、Y或A
X5
為G、N、Q、S、T、C、W、Y或A
X6
為N、G、Q、S、T、C、W、Y或A
X7
為Q、G、N、S、T、C、W、Y或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為T、G、N、Q、S、C、W、Y、V、I或A;及/
或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
ASTRX2
X3
(SEQ ID NO:5),其中
X1
為W、G、N、Q、S、T、C、Y、F、H或A
X2
為E、D或A
X3
為S、G、N、Q、T、C、W、Y或A;及/或
(c)VL CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列QX1
X2
YX3
X4
PYT(SEQ ID NO:6),其中
X1
為N、G、Q、S、T、C、W或Y
X2
為D、E或Y
X3
為S、G、N、Q、T、C、W、Y或A
X4
為Y、G、N、Q、S、T、C、W、F、H、L或A。
在特定具體實施例中,抗體或其抗原-結合片段包括上述VL CDR之一、二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR3。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR之一、二或所有三者(例如表1之一列中的VL CDR,例如,所有VL CDR來自抗體231-32-15)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VL框架區。在特定具體實施例中,
抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(FR)(例如表3之一列中框架區的一、二、三或四者)。
於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括重鏈可變區(VH),包含:
(a)VH CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:1),其中
X1
為D、E、G或A
X2
為A、V、L、I、P、F、M或Y
X3
為Y、G、N、Q、S、T、C、W、F或H;及/或
(b)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
X3
X4
SGX5
X6
X7
YX8
QKFX9
X10
(SEQ ID NO:2),其中
X1
為V、A、L、I、P、F、M或T
X2
為R、K、H、Q或A
X3
為T、G、N、Q、S、C、W、Y、V、I或P
X4
為Y、G、N、Q、S、T、C、W、F、H或A
X5
為D、E、G或A
X6
為V、A、L、I、P、F、M或T
X7
為T、G、N、Q、S、C、W、Y、V、I、P或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為K、R、H、Q或A
X10
為D、E、G或A;及/或
(c)VH CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列SGTVRGX1
X2
X3
(SEQ ID NO:3),其中
X1
為F、A、V、L、I、P、M、Y、W、H或S
X2
為A或D
X3
為Y、G、N、Q、S、T、C、W、F、H或V。
在特定具體實施例中,抗體或其抗原-結合片段包括上述VH CDR之一、二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR之一、二或所有三者(例如表2一列中的VH CDR,例如,所有VH CDR來自抗體231-32-15)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VH框架。在特定具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如表4之一列中框架區之一、二、三或四者)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈可變區(VL),包含:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSX1
X2
X3
X4
X5
X6
X7
KX8
YLX9
(SEQ ID NO:4),其中
X1
為L、A、V、I、P、F或M
X2
為L、A、V、I、P、F、M或S
X3
為N、G、Q、S、T、C、W、Y或A
X4
為S、G、N、Q、T、C、W、Y或A
X5
為G、N、Q、S、T、C、W、Y或A
X6
為N、G、Q、S、T、C、W、Y或A
X7
為Q、G、N、S、T、C、W、Y或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為T、G、N、Q、S、C、W、Y、V、I或A;及/或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
ASTRX2
X3
(SEQ ID NO:5),其中
X1
為W、G、N、Q、S、T、C、Y、F、H或A
X2
為E、D或A
X3
為S、G、N、Q、T、C、W、Y或A;及/或
(c)VL CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列QX1
X2
YX3
X4
PYT(SEQ ID NO:6),其中
X1
為N、G、Q、S、T、C、W或Y
X2
為D、E或Y
X3
為S、G、N、Q、T、C、W、Y或A
X4
為Y、G、N、Q、S、T、C、W、F、H、L或A。
在特定具體實施例中,抗體或其抗原-結合片段包括上述VL CDR之一、二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表5中抗體之一的VL CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表5中抗體之一的VL CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表5中抗體之一的VL CDR3。在某些具體實施例中,抗體或其抗原-結合片段包括表5中抗體之一的VL CDR之一、二或所有三者(例如表5的一列中之VL CDR,例如,所有VL CDR來自抗體231-32-15)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VL框架區。在特定具體實施例中,抗體或其抗原-結合片段包括表7所列之抗體的VL框架區(FR)(例如表7之一列中框架區的一、二、三或四者)。
於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括重鏈可變區(VH),包含:
(a)VH CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:1),其中
X1
為D、E、G或A
X2
為A、V、L、I、P、F、M或Y
X3
為Y、G、N、Q、S、T、C、W、F或H;及/或
(b)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
X3
X4
SGX5
X6
X7
YX8
QKFX9
X10
(SEQ ID NO:2),其中
X1
為V、A、L、I、P、F、M或T
X2
為R、K、H、Q或A
X3
為T、G、N、Q、S、C、W、Y、V、I或P
X4
為Y、G、N、Q、S、T、C、W、F、H或A
X5
為D、E、G或A
X6
為V、A、L、I、P、F、M或T
X7
為T、G、N、Q、S、C、W、Y、V、I、P或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為K、R、H、Q或A
X10
為D、E、G或A;及/或
(c)VH CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列SGTVRGX1
X2
X3
(SEQ ID NO:3),其中
X1
為F、A、V、L、I、P、M、Y、W、H或S
X2
為A或D
X3
為Y、G、N、Q、S、T、C、W、F、H或V。
在特定具體實施例中,抗體或其抗原-結合片段包括上述VH CDR之一、二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表6中抗體之一的VH CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表6中抗體之一的VH CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表6中抗體之一的VH CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表6中抗體之一的VH CDR之一、二或所有三者(例如表6之一列中的VH CDR,例如,所有VH CDR來自抗體231-32-15)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VH框架。在特定具體實施例中,抗體或其抗原-結合片段包括表8所列抗體之VH框架區(例如表8之一列中框架區的一、二、三或四者)。
於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSX1
X2
X3
X4
X5
X6
X7
KX8
YLX9
(SEQ ID NO:4),其中
X1
為L、A、V、I、P、F或M
X2
為L、A、V、I、P、F、M或S
X3
為N、G、Q、S、T、C、W、Y或A
X4
為S、G、N、Q、T、C、W、Y或A
X5
為G、N、Q、S、T、C、W、Y或A
X6
為N、G、Q、S、T、C、W、Y或A
X7
為Q、G、N、S、T、C、W、Y或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為T、G、N、Q、S、C、W、Y、V、I或A;及/或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
ASTRX2
X3
(SEQ ID NO:5),其中
X1
為W、G、N、Q、S、T、C、Y、F、H或A
X2
為E、D或A
X3
為S、G、N、Q、T、C、W、Y或A;及/或
(c)VL CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列QX1
X2
YX3
X4
PYT(SEQ ID NO:6),其中
X1
為N、G、Q、S、T、C、W或Y
X2
為D、E或Y
X3
為S、G、N、Q、T、C、W、Y或A
X4
為Y、G、N、Q、S、T、C、W、F、H、L或A;及/或
(d)VH CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:1),其中
X1
為D、E、G或A
X2
為A、V、L、I、P、F、M或Y
X3
為Y、G、N、Q、S、T、C、W、F或H;及/或
(e)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
X3
X4
SGX5
X6
X7
YX8
QKFX9
X10
(SEQ ID NO:2),其中
X1
為V、A、L、I、P、F、M或T
X2
為R、K、H、Q或A
X3
為T、G、N、Q、S、C、W、Y、V、I或P
X4
為Y、G、N、Q、S、T、C、W、F、H或A
X5
為D、E、G或A
X6
為V、A、L、I、P、F、M或T
X7
為T、G、N、Q、S、C、W、Y、V、I、P或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為K、R、H、Q或A
X10
為D、E、G或A;及/或
(f)VH CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列SGTVRGX1
X2
X3
(SEQ ID NO:3),其中
X1
為F、A、V、L、I、P、M、Y、W、H或S
X2
為A或D
X3
為Y、G、N、Q、S、T、C、W、F、H或V。
在特定具體實施例中,抗體或其抗原-結合片段包括上述CDR之一、二、三、四、五或所有六者。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之
一的VL CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR之一、二或所有三者(例如表2一列中的VH CDR,例如,所有VH CDR來自抗體231-32-15)。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR之一、二或所有三者(例如表1之一列中的VL CDR,例如,所有VL CDR來自抗體231-32-15)。
於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括輕鏈可變區(VL)及重鏈可變區(VH),其中
(i)VL包括:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSX1
X2
X3
X4
X5
X6
X7
KX8
YLX9
(SEQ ID NO:4),其中
X1
為L、A、V、I、P、F或M
X2
為L、A、V、I、P、F、M或S
X3
為N、G、Q、S、T、C、W、Y或A
X4
為S、G、N、Q、T、C、W、Y或A
X5
為G、N、Q、S、T、C、W、Y或A
X6
為N、G、Q、S、T、C、W、Y或A
X7
為Q、G、N、S、T、C、W、Y或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為T、G、N、Q、S、C、W、Y、V、I或A;及/或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
ASTRX2
X3
(SEQ ID NO:5),其中
X1
為W、G、N、Q、S、T、C、Y、F、H或A
X2
為E、D或A
X3
為S、G、N、Q、T、C、W、Y或A;及/或
(c)VL CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列QX1
X2
YX3
X4
PYT(SEQ ID NO:6),其中
X1
為N、G、Q、S、T、C、W或Y
X2
為D、E或Y
X3
為S、G、N、Q、T、C、W、Y或A
X4
為Y、G、N、Q、S、T、C、W、F、H、L或A;且
(ii)VH包括:
(a)VH CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:1),其中
X1
為D、E、G或A
X2
為A、V、L、I、P、F、M或Y
X3
為Y、G、N、Q、S、T、C、W、F或H;及/或
(b)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
X3
X4
SGX5
X6
X7
YX8
QKFX9
X10
(SEQ ID NO:2),其中
X1
為V、A、L、I、P、F、M或T
X2
為R、K、H、Q或A
X3
為T、G、N、Q、S、C、W、Y、V、I或P
X4
為Y、G、N、Q、S、T、C、W、F、H或A
X5
為D、E、G或A
X6
為V、A、L、I、P、F、M或T
X7
為T、G、N、Q、S、C、W、Y、V、I、P或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為K、R、H、Q或A
X10
為D、E、G或A;及/或
(c)VH CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列SGTVRGX1
X2
X3
(SEQ ID NO:3),其中
X1
為F、A、V、L、I、P、M、Y、W、H或S
X2
為A或D
X3
為Y、G、N、Q、S、T、C、W、F、H或V。
在特定具體實施例中,VL包括上述VL CDR之二或所有三者及/或VH包括上述VH CDR之二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表1
中抗體之一的VL CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR之一、二或所有三者(例如表2一列中的VH CDR)。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR之一、二或所有三者(例如表1之一列中的VL CDR)。
於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈可變區(VL),包含:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSLLNSX1
NQKNYLX2
(SEQ ID NO:10),其中
X1
為G或S
X2
為T或S;及/或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列WASTRES(SEQ ID NO:11);及/或
(c)VL CDR3,其包括、由下述組成或主要由下述
組成:胺基酸序列QNX1
YSX2
PYT(SEQ ID NO:12),其中
X1
為D或E
X2
為Y、F或S。
在特定具體實施例中,抗體或其抗原-結合片段包括上述VL CDR之一、二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR3。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR之一、二或所有三者(例如表1之一列中的VL CDR)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VL框架區。在特定具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(FR)(例如表3之一列中的框架區之一、二、三或四者)。
於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括重鏈可變區(VH),包含:
(a)VH CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:7),其中
X1
為D、E或G
X2
為A或V
X3
為Y或H;及/或
(b)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
TX3
SGX4
X5
X6
YNQKFX7
X8
(SEQ ID NO:8),其中
X1
為V或L
X2
為R、K或Q
X3
為Y或F
X4
為D、E或G
X5
為V或L
X6
為T或S
X7
為K、R或Q
X8
為D、E或G;及/或
(c)VH CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列SGTVRGFAY(SEQ ID NO:9)。
在特定具體實施例中,抗體或其抗原-結合片段包括上述VH CDR之一、二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR之一、二或所有三者(例如表2之一列中的VH CDR)。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR之
一、二或所有三者。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VH框架。在特定具體實施例中,抗體或其抗原-結合片段包括表4中所列之抗體的VH框架區(例如表4之一列中的框架區之一、二、三或四者)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSLLNSX1
NQKNYLX2
(SEQ ID NO:10),其中
X1
為G或S
X2
為T或S;及/或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列WASTRES(SEQ ID NO:11);及/或
(c)VL CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列QNX1
YSX2
PYT(SEQ ID NO:12),其中
X1
為D或E
X2
為Y、F或S。
(d)VH CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:7),其中
X1
為D、E或G
X2
為A或V
X3
為Y或H;及/或
(e)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
TX3
SGX4
X5
X6
YNQKFX7
X8
(SEQ ID NO:8),其中
X1
為V或L
X2
為R、K或Q
X3
為Y或F
X4
為D、E或G
X5
為V或L
X6
為T或S
X7
為K、R或Q
X8
為D、E或G;及/或
(f)VH CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列SGTVRGFAY(SEQ ID NO:9)。
在特定具體實施例中,抗體或其抗原-結合片段包括上述CDR之一、二、三、四、五或所有六者。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR2。在某些具體實施例中,抗體或其抗原-結合片段包
括表2中抗體之一的VH CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR之一、二或所有三者(例如表2之一列中的VH CDR)。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR之一、二或所有三者(例如表1之一列中的VL CDR)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈可變區(VL)及重鏈可變區(VH),其中
(i)VL包括:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSLLNSX1
NQKNYLX2
(SEQ ID NO:10),其中
X1
為G或S
X2
為T或S;及/或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列WASTRES(SEQ ID NO:11);及/或
(c)VL CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列QNX1
YSX2
PYT(SEQ ID NO:12),其中
X1
為D或E
X2
為Y、F或S;且
(ii)VH包括:
(a)VH CDR1,其包括、由下述組成或主要由下述
組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:7),其中
X1
為D、E或G
X2
為A或V
X3
為Y或H;及/或
(b)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
TX3
SGX4
X5
X6
YNQKFX7
X8
(SEQ ID NO:8),其中
X1
為V或L
X2
為R、K或Q
X3
為Y或F
X4
為D、E或G
X5
為V或L
X6
為T或S
X7
為K、R或Q
X8
為D、E或G;及/或
(c)VH CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列SGTVRGFAY(SEQ ID NO:9)。
在特定具體實施例中,VL包括上述VL CDR之二或所有三者及/或VH包括上述VH CDR之二或所有三者。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR3。在一些具體實施例中,抗體或其抗
原-結合片段包括表2中抗體之一的VH CDR1。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR2。在某些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR3。在一些具體實施例中,抗體或其抗原-結合片段包括表2中抗體之一的VH CDR之一、二或所有三者(例如表2之一列中的VH CDR)。在某些具體實施例中,抗體或其抗原-結合片段包括表1中抗體之一的VL CDR之一、二或所有三者(例如表1之一列中的VL CDR)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈可變區(VL)及重鏈可變區(VH),其中
(i)VL包括:
(a)VL CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列KSSQSLLNSX1
NQKNYLX2
(SEQ ID NO:10),其中
X1
為G或S
X2
為T或S;及/或
(b)VL CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列WASTRES(SEQ ID NO:11);及/或
(c)VL CDR3,其包括、由下述組成或主要由下述組成:胺基酸序列QNX1
YSX2
PYT(SEQ ID NO:12),其中
X1
為D或E
X2
為Y、F或S;且
(ii)VH包括:
(a)VH CDR1,其包括、由下述組成或主要由下述組成:胺基酸序列X1
YX2
MX3
(SEQ ID NO:7),其中
X1
為D、E或G
X2
為A或V
X3
為Y或H;及/或
(b)VH CDR2,其包括、由下述組成或主要由下述組成:胺基酸序列X1
IX2
TX3
SGX4
X5
X6
YNQKFX7
X8
(SEQ ID NO:8),其中
X1
為V或L
X2
為R、K或Q
X3
為Y或F
X4
為D、E或G
X5
為V或L
X6
為T或S
X7
為K、R或Q
X8
為D、E或G;及/或
(c)VH CDR3,其包括、由下述組成或主要由下述組成:SGTVRGX1
X2
X3
(SEQ ID NO:3)之胺基酸序列,其中
X1
為F、A、V、L、I、P、M、Y、W、H或S
X2
為A或D
X3
為Y、G、N、Q、S、T、C、W、F、H或V。
在某些具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括表1中抗體的輕鏈可變區(VL)互補性決定區(CDR)之一、二或三者(例如表1之一列中的VL CDR)。在一些具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括表2中抗體任一之重鏈可變區(VH)CDR之一、二或三者(例如表2之一列中的VH CDR)。
在某些具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括輕鏈可變區(VL),其包括表1中抗體的VL CDR之一、二或所有三者(例如表1之一列中的VL CDR)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VL框架區之一、二、三或所有四者。在特定具體實施例中,抗體或其抗原-結合片段包括表3所列之VL框架區(FR)之一、二、三或所有四者(例如表3之一列中的框架區的一、二、三或四者)。
在某些具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括重鏈可變區(VH),其包括表2中抗體的VH CDR之一、二或所有三者(例如表2之一列中的VH CDR)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VH框架區之一、二、三或所有四者。在特定具體實施例中,抗體或其抗原-結合片段包括表4所列之VH框架區
(FR)之一、二、三或所有四者(例如表4之一列中的框架區之一、二、三或四者)。
在某些具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括例如表1及2中所列之抗體Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之輕鏈可變區(VL)CDR及重鏈可變區(VH)CDR(例如在相同列中的VH CDR及VL CDR均來自相同抗體,如表1及2之第一欄中抗體名稱所命名,例如,分別在表1及2之第一列中的VL CDR及VH CDR全都來自抗體231-32-15)。在一些具體實施例中,抗體或其抗原-結合片段包括本文所述之VL框架區及VH框架。在特定具體實施例中,抗體或其抗原-結合片段包括表3及4中所列之VL框架區(FR)及VH框架區(例如VL FR及VH FR全都來自相同抗體)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括輕鏈可變區(VL),其包括表1中所述之VL CDR1、VL CDR2及VL CDR3,例如,抗體Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、
pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之VL CDR1、VL CDR2及VL CDR3(例如VL CDR於表1之一列中)。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如表3之一列中框架區之一、二、三或四者)。在某些具體實施例中,抗體或其抗原-結合片段包括輕鏈可變區序列,其包括SEQ ID NO:204或SEQ ID NO:205之輕鏈可變區序列的一、二、三或四框架區。在一些具體實施例中,抗體或其抗原-結合片段包括輕鏈可變區序列的框架區的一、二、三或四者,其為與選自下列所組成群組之輕鏈可變區序列的框架區之一、二、三或四者至少75%、80%、85%、90%、95%或100%相同:SEQ ID NO:202、SEQ ID NO:207、SEQ ID NO:208及SEQ ID NO:400至518。在一些具體實施例中,抗體或其抗原-結合片段包括輕鏈可變區序列之框架區的一、二、三或四者,其為與SEQ ID NO:519輕鏈可變區序列的框架區之一、二、三或四者至少75%、80%、85%、90%、95%或100%相同。在某些具體實施例中,抗體或其抗原-結合片段包括輕鏈可變框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中胺基酸序列選自下列所組成群組:IGKV4-1*01(SEQ ID NO:607)及IGKV3-7*02(SEQ ID NO:608)。在特定具體實施例中,衍生自該胺基酸序列之輕鏈可變框架區由該胺基酸序
列組成,但存在達10個胺基酸取代、缺失及/或插入,較佳地達10個胺基酸取代。於一特別具體實施例中,衍生自該胺基酸序列之輕鏈可變框架區由該胺基酸序列組成,其具有1、2、3、4、5、6、7、8、9或10個胺基酸殘基取代在對應非人類輕鏈可變框架區類似位置中所發現之胺基酸。在一些具體實施例中,抗體或其抗原-結合片段包括輕鏈可變框架區,其為衍生自胺基酸序列SEQ ID NO:607或SEQ ID NO:608,其中胺基酸序列SEQ ID NO:607或SEQ ID NO:608中至少一胺基酸在對應非人類輕鏈可變框架區之類似位置中經胺基酸取代。於一特定具體實施例中,該胺基酸取代在胺基酸位置87,其中依據Kabat編號標誌該胺基酸位置。於特別具體實施例中,該胺基酸取代為87H,其中依據Kabat編號標誌該胺基酸位置。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括Hum231#1之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列Hum231#1之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:16、17及18)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-
結合片段包括表3中所列抗體之VL框架區(例如Hum231#1之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括Hum231#2之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列Hum231#2之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:16、17及18)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科的一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如Hum231#2之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1964之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1964之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:101、105及106)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1964之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1965之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1965之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:102、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1965之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1966之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1966之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:102、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1966之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1967之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1967之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:103、105及108)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1967之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1968之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1968之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:101、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1968之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1969之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1969之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:103、105及109)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1969之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1970之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1970之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:101、105及109)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1970之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1971之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1971之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:103、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1971之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1972之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1972之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:104、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1972之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1973之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1973之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:103、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1973之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1975之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1975之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:102、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1975之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1976之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1976之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:101、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1976之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1977之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1977之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:103、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1977之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1979之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1979之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:102、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1979之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1980之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1980之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:101、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1980之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1981之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1981之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:103、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab1981之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1983之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab1983之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:102、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結
合片段包括表3中所列抗體之VL框架區(例如pab1983之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2159之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab2159之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:102、105及109)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab2159之框架區)。於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2160之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab2160之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:102、105及107)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab2160
之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2161之VL CDR1、VL CDR2及VL CDR3,例如,表1中所列pab2161之VL CDR1、VL CDR2及VL CDR3(分別為SEQ ID NO:103、105及109)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類輕鏈可變卡帕(kappa)亞科之一、二、三或所有四VL框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表3中所列抗體之VL框架區(例如pab2161之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括重鏈可變區(VH),其包括表2中所列之VH CDR1、VH CDR2及VH CDR3,例如,抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之VH CDR1、VH CDR2及VH CDR3(例如表2之一列中的VH CDR)。在一些具體實施例中,抗體或其抗原-結合片段
包括表4所列之抗體之VH框架區(例如表4之一列中的框架區之一、二、三或四者)。在某些具體實施例中,抗體或其抗原-結合片段包括SEQ ID NO:203之重鏈可變區序列之框架區的一、二、三或所有四者。在一些具體實施例中,抗體或其抗原-結合片段包括重鏈可變區序列之框架區的一、二、三或四者,其為與選自下列所組成群組之重鏈可變區序列:SEQ ID NO:201、SEQ ID NO:206及SEQ ID NO:215至389的框架區之一、二、三或四者至少75%、80%、85%、90%、95%或100%相同。在某些具體實施例中,抗體或其抗原-結合片段包括重鏈可變框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中胺基酸序列選自下列所組成群組:IGHV1-2*02(SEQ ID NO:601)、IGHV1-3*01(SEQ ID NO:602)、IGHV1-46*01(SEQ ID NO:603)、IGHV1-18*01(SEQ ID NO:604)、IGHV1-69*01(SEQ ID NO:605)及IGHV7-4-1*02(SEQ ID NO:606)。在特定具體實施例中,衍生自該胺基酸序列之重鏈可變框架區為由該胺基酸序列組成,但存在達10個胺基酸取代、缺失及/或插入,較佳地達10個胺基酸取代。於一特別具體實施例中,衍生自該胺基酸序列重鏈可變框架區為由該胺基酸序列組成,其具有1、2、3、4、5、6、7、8、9或10個胺基酸殘基取代在對應非人類重鏈可變框架區類似位置中發現之胺基酸。在特定具體實施例中,抗體或其抗原-結合片段包括重鏈可變框架區,其為衍生自胺基酸序列SEQ ID
NO:601,其中胺基酸序列SEQ ID NO:601之至少一胺基酸經在對應非人類重鏈可變框架區類似位置中之胺基酸取代。在某些具體實施例中,胺基酸取代是在選自下列所組成群組之胺基酸位置:24、48、67、71、73及94,其中依據Kabat編號標誌各組員之胺基酸位置。在特定具體實施例中,選自下列所組成群組之胺基酸取代:24G、48I、67A、71V、73K及94K,其中依據Kabat編號標誌各組員之該胺基酸位置。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括Hum231#1之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列Hum231#1之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:13、14及15)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如Hum231#1之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括Hum231#2之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列Hum231#2之VH CDR1、VH CDR2及VH
CDR3(分別為SEQ ID NO:13、14及15)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如Hum231#2之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1964之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1964之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:19、24及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1964之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1965之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1965之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:19、25及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1965之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1966之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1966之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:19、26及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1966之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1967之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1967之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:20、27及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1967之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1968之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1968之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:21、28及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1968之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1969之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1969之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:22、29及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1969之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1970之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1970之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:21、24及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1970之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1971之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1971之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:21、177及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1971之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1972之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1972之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:23、31及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1972之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1973之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1973之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:19、32及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1973之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1975之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1975之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:22、29及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1975之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1976之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1976之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:22、29及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1976之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1977之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1977之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:22、29及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1977之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1979之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1979之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:22、33及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1979之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1980之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1980之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:22、33及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1980之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1981之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1981之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:22、33及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1981之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1983之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab1983之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:19、24及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab1983之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2159之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab2159之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:19、144及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab2159之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2160之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab2160之VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:119、162及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab2160之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2161之VH CDR1、VH CDR2及VH CDR3,例如,表2中所列pab2161之VH CDR1、VH CDR2及VH CDR3
(分別為SEQ ID NO:22、121及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在特定具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類重鏈可變亞科(例如亞科1至7之一)之一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括表4所列抗體之VH框架區(例如pab2161之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其抗原-結合片段包括(i)重鏈可變區(VH),其包括表2中所列之VH CDR1、VH CDR2及VH CDR3,例如,抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之VH CDR1、VH CDR2及VH CDR3(例如,表2之一列中的VH CDR),以及(ii)輕鏈可變區(VL),其包括表1中所列之VL CDR1、VL CDR2及VL CDR3,例如,抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一
或抗體1-107或抗體pab2159、pab2160或pab2161之VL CDR1、VL CDR2及VL CDR3(例如表1之一列中的VL CDR)。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如被其名稱命名之單一抗體的框架區,例如,所有FR來自Hum231#1或Hum231#2)。
在一些具體實施例中,本文所述之抗體或其抗原-結合片段包括重鏈可變區序列的一、二、三或四框架區,其與選自下列所組成群組之重鏈可變區序列:SEQ ID NO:201、SEQ ID NO:206及SEQ ID NO:215至389的框架區之一、二、三或四者至少75%、80%、85%、90%、95%或100%相同。在某些具體實施例中,本文所述之抗體或其抗原-結合片段包括重鏈可變框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中胺基酸序列選自下列所組成群組:IGHV1-2*02(SEQ ID NO:601)、IGHV1-3*01(SEQ ID NO:602)、IGHV1-46*01(SEQ ID NO:603)、IGHV1-18*01(SEQ ID NO:604)、IGHV1-69*01(SEQ ID NO:605)及IGHV7-4-1*02(SEQ ID NO:606)。在特定具體實施例中,衍生自該胺基酸序列之重鏈可變框架區為由該胺基酸序列組成,但存在達10個胺基酸取代、缺失及/或插入,較佳地達10個胺基酸取代。於一特別具體實施例中,衍生自該胺基酸序列之重鏈可變框架區為由該胺基酸序列組成,其具有1、2、3、4、5、6、7、8、9或10個胺基酸殘基取
代在對應非人類重鏈可變框架區類似位置中發現之胺基酸。在特定具體實施例中,本文所述之抗體或其抗原-結合片段包括重鏈可變框架區,其為衍生自胺基酸序列SEQ ID NO:601,其中胺基酸序列SEQ ID NO:601中至少一胺基酸經在對應非人類輕鏈可變框架區之類似位置中之胺基酸取代。在某些具體實施例中,該胺基酸取代是在選自下列所組成群組之胺基酸位置:24、48、67、71、73及94,其中依據Kabat編號標誌各組員之該胺基酸位置。在特定具體實施例中,該胺基酸取代選自下列所組成群組:24G、48I、67A、71V、73K及94K,其中依據Kabat編號標誌各組員之該胺基酸位置。
在一些具體實施例中,本文所述之抗體或其抗原-結合片段包括表3中所列抗體之VL框架區。在某些具體實施例中,本文所述之抗體或其抗原-結合片段包括輕鏈可變區序列,其包括SEQ ID NO:204或SEQ ID NO:205之輕鏈可變區序列的框架區之一、二、三或四者。在一些具體實施例中,本文所述之抗體或其抗原-結合片段包括輕鏈可變區序列的一、二、三或四框架區,其為與選自下列所組成群組之輕鏈可變區序列的框架區之一、二、三或四者至少75%、80%、85%、90%、95%或100%相同:SEQ ID NO:202、SEQ ID NO:207、SEQ ID NO:208及SEQ ID NO:400至518。在一些具體實施例中,本文所述之抗體或其抗原-結合片段包括輕鏈可變區序列的一、二、三或四框架區,其為與SEQ ID NO:519
之輕鏈可變區序列的框架區之一、二、三或四者至少75%、80%、85%、90%、95%或100%相同。在某些具體實施例中,本文所述之抗體或其抗原-結合片段包括輕鏈可變框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中胺基酸序列選自下列所組成群組:IGKV4-1*01(SEQ ID NO:607)及IGKV3-7*02(SEQ ID NO:608)。在特定具體實施例中,衍生自該胺基酸序列之輕鏈可變框架區由該胺基酸序列組成,但存在達10個胺基酸取代、缺失及/或插入,較佳地達10個胺基酸取代。於一特別具體實施例中,衍生自該胺基酸序列之輕鏈可變框架區由該胺基酸序列組成,其具有1、2、3、4、5、6、7、8、9或10個胺基酸殘基取代在對應非人類輕鏈可變框架區類似位置中所發現之胺基酸。在一些具體實施例中,本文所述之抗體或其抗原-結合片段包括輕鏈可變框架區,其為衍生自胺基酸序列SEQ ID NO:607或SEQ ID NO:608,其中胺基酸序列SEQ ID NO:607或SEQ ID NO:608之至少一胺基酸經在對應非人類輕鏈可變框架區類似位置中之胺基酸。於一特定具體實施例中,該胺基酸取代為在胺基酸位置87,其中依據Kabat編號標誌該胺基酸位置。於特別具體實施例中,該胺基酸取代為87H,其中依據Kabat編號標誌該胺基酸位置。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括Hum231#1之VL CDR1、VL CDR2、VL CDR3、VH
CDR1、VH CDR2及VH CDR3,例如,表1及2中所列Hum231#1之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:16、17、18、13、14及15)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VH的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如Hum231#1之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括Hum231#2之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列Hum231#2之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:16、17、18、13、14及15)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如被其名稱命名之單一抗體之框架,例如,Hum231#1或Hum231#2之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1964之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1964之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為S.EQ ID NO:101、105、106、19、24及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1964之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1965之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1965之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:102、105、107、19、25及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4
中所列之抗體的VL框架區及VH框架區(例如pab1965之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1966之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1966之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:102、105、107、19、26及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1966之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1967之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1967之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:103、105、108、20、27及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗
體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1967之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1968之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1968之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:101、105、107、21、28及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1968之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1969之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1969之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:103、105、109、22、29及34)。在某些具體實施例中,抗體或抗原
-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1969之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1970之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1970之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:101、105、109、21、24及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1970之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1971之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1971之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH
CDR2及VH CDR3(分別為SEQ ID NO:103、105、107、21、177及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1971之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1972之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1972之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:104、105、107、23、31及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1972之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1973之VL CDR1、VL CDR2、VL CDR3、VH CDR1、
VH CDR2及VH CDR3,例如,表1及2中所列pab1973之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:103、105、107、19、32及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1973之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1975之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1975之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:102、105、107、22、29及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1975之框架區)。
於一特別具體實施例中,特異性結合GITR
(例如,人類GITR)之本文所述之抗體或其片段包括pab1976之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1976之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:101、105、107、22、29及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1976之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1977之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1977之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:103、105、107、22、29及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1977
之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1979之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1979之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:102、105、107、22、33及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1979之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1980之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1980之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:101、105、107、22、33及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體
實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1980之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1981之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1981之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:103、105、107、22、33及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1981之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab1983之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab1983之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:102、105、107、19、24及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的
一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab1983之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2159之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab2159之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:102、105、109、19、144及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab2159之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2160之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab2160之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:102、105、
107、119、162及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab2160之框架區)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括pab2161之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3,例如,表1及2中所列pab2161之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及VH CDR3(分別為SEQ ID NO:103、105、109、22、121及34)。在某些具體實施例中,抗體或抗原-結合片段進一步包括衍生自人類或靈長類抗體之VL的一、二、三或所有四VL框架區及衍生自人類或靈長類抗體之VH的一、二、三或所有四VH框架區。在一些具體實施例中,抗體或其抗原-結合片段包括分別為表3及4中所列之抗體的VL框架區及VH框架區(例如pab2161之框架區)。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括圖23或圖24A至24C中任一所列抗體之VL功能域之胺基酸序列(例如圖23或圖24A至24C中任一之一列中
的VL功能域)。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括表17中所列抗體之VL功能域之胺基酸序列(例如表17之一列中的VL功能域)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:207(例如抗體Hum231#1)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:208(例如抗體Hum231#2)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:435(例如抗體pab1964)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:437(例如抗體pab1965)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440(例如抗體pab1966)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:441(例如抗體pab1967)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:444(例如抗體pab1968)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,
其包括SEQ ID NO:458(例如抗體pab1969)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:459(例如抗體pab1970)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:453(例如抗體pab1971)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:463(例如抗體pab1972)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:519(例如抗體pab1973)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440(例如抗體pab1975)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:444(例如抗體pab1976)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:453(例如抗體pab1977)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440(例如抗體pab1979)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,
其包括SEQ ID NO:444(例如抗體pab1980)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:453(例如抗體pab1981)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440(例如抗體pab1983)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:408(例如抗體pab2159)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:423(例如抗體pab2160)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:486(例如抗體pab2161)。
在一些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:圖23或圖24A至24C中任一所列抗體之VL功能域之胺基酸序列(例如圖23或圖24A至24C任一之一列中的VL功能域)。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:表17中所列抗體之VL功能域之胺基酸序列(例如表17之一列中的VL功能域)。於一特定具體實施例
中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:207(例如抗體Hum231#1)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:208(例如抗體Hum231#2)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:435(例如抗體pab1964)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:437(例如抗體pab1965)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:440(例如抗體pab1966)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:441(例如抗體pab1967)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:444(例如抗體pab1968)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:458(例如抗體
pab1969)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:459(例如抗體pab1970)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:453(例如抗體pab1971)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:463(例如抗體pab1972)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:519(例如抗體pab1973)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:440(例如抗體pab1975)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:444(例如抗體pab1976)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:453(例如抗體pab1977)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下
述組成:SEQ ID NO:440(例如抗體pab1979)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:444(例如抗體pab1980)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:453(例如抗體pab1981)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:440(例如抗體pab1983)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:408(例如抗體pab2159)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:423(例如抗體pab2160)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其由下述組成或主要由下述組成:SEQ ID NO:486(例如抗體pab2161)。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括圖23或圖24A至24C中任一所列抗體之VH功能域之胺基酸序列(例如圖23或圖24A至24C任一中一列之
VH功能域)。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括表17中所列抗體之VH功能域之胺基酸序列(例如表17之一列中之VH功能域)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:206(例如抗體Hum231#1)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:206(例如抗體Hum231#2)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:249(例如抗體pab1964)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:251(例如抗體pab1965)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:254(例如抗體pab1966)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:255(例如抗體pab1967)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:259(例如抗體pab1968)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,
其包括SEQ ID NO:276(例如抗體pab1969)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:277(例如抗體pab1970)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:280(例如抗體pab1971)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:284(例如抗體pab1972)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:304(例如抗體pab1973)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:276(例如抗體pab1975)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:276(例如抗體pab1976)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:276(例如抗體pab1977)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:345(例如抗體pab1979)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,
其包括SEQ ID NO:345(例如抗體pab1980)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:345(例如抗體pab1981)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:249(例如抗體pab1983)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:224(例如抗體pab2159)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:237(例如抗體pab2160)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括SEQ ID NO:315(例如抗體pab2161)。
在一些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:圖23或圖24A至24C中任一所列抗體之VH功能域之胺基酸序列(例如圖23或圖24A至24C中任一之一列中的VH功能域)。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:表17中所列抗體之VH功能域之胺基酸序列(例如表17中之一列中的VH功能域)。於一特定具體實施例
中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:206(例如抗體Hum231#1)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:206(例如抗體Hum231#2)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:249(例如抗體pab1964)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:251(例如抗體pab1965)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:254(例如抗體pab1966)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:255(例如抗體pab1967)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:259(例如抗體pab1968)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:
276(例如抗體pab1969)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:277(例如抗體pab1970)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:280(例如抗體pab1971)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:284(例如抗體pab1972)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:304(例如抗體pab1973)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:276(例如抗體pab1975)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:276(例如抗體pab1976)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:276(例如抗體pab1977)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH
功能域,其由下述組成或主要由下述組成:SEQ ID NO:345(例如抗體pab1979)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:345(例如抗體pab1980)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:345(例如抗體pab1981)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:249(例如抗體pab1983)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:224(例如抗體pab2159)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:237(例如抗體pab2160)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其由下述組成或主要由下述組成:SEQ ID NO:315(例如抗體pab2161)。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域及VL功能域,其中VH功能域與VL功能域包括圖23或圖24A至24C中任一所列抗體之VH功能域及VL功能域之胺基
酸序列(例如圖23或圖24A至24C中任一之一列中的VH功能域及VL功能域)。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域及VL功能域,其中VH功能域與VL功能域包括表17中所列抗體之VH功能域及VL功能域之胺基酸序列(例如表17之一列中的VH功能域及VL功能域)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:207,以及VH功能域,其包括SEQ ID NO:206(例如抗體Hum231#1)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:208,以及VH功能域,其包括SEQ ID NO:206(例如抗體Hum231#2)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:435,以及VH功能域,其包括SEQ ID NO:249(例如抗體pab1964)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:437,以及VH功能域,其包括SEQ ID NO:251(例如抗體pab1965)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440,以及VH功能域,其包括SEQ ID NO:254(例如抗體pab1966)。於一特定具體實施例中,特異性結合GITR
(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:441,以及VH功能域,其包括SEQ ID NO:255(例如抗體pab1967)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:444,以及VH功能域,其包括SEQ ID NO:259(例如抗體pab1968)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:458,以及VH功能域,其包括SEQ ID NO:276(例如抗體pab1969)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:459,以及VH功能域,其包括SEQ ID NO:277(例如抗體pab1970)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:453,以及VH功能域,其包括SEQ ID NO:280(例如抗體pab1971)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:463,以及VH功能域,其包括SEQ ID NO:284(例如抗體pab1972)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:519,以及VH功能域,其包括SEQ ID NO:304(例如抗體pab1973)。於一特定具體實施例中,特異性結合GITR
(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440,以及VH功能域,其包括SEQ ID NO:276(例如抗體pab1975)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:444,以及VH功能域,其包括SEQ ID NO:276(例如抗體pab1976)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:453,以及VH功能域,其包括SEQ ID NO:276(例如抗體pab1977)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440,以及VH功能域,其包括SEQ ID NO:345(例如抗體pab1979)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:444,以及VH功能域,其包括SEQ ID NO:345(例如抗體pab1980)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:453,以及VH功能域,其包括SEQ ID NO:345(例如抗體pab1981)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:440,以及VH功能域,其包括SEQ ID NO:249(例如抗體pab1983)。於一特定具體實施例中,特異性結合GITR
(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:408,以及VH功能域,其包括SEQ ID NO:224(例如抗體pab2159)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:423,以及VH功能域,其包括SEQ ID NO:237(例如抗體pab2160)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括SEQ ID NO:486,以及VH功能域,其包括SEQ ID NO:315(例如抗體pab2161)。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域及VL功能域,其中VH功能域與VL功能域由下述組成或主要由下述組成:圖23或圖24A至24C中任一所列抗體之VH功能域及VL功能域之胺基酸序列(例如圖23或圖24A至24C中任一之一列中的VH功能域及VL功能域)。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域及VL功能域,其中VH功能域與VL功能域由下述組成或主要由下述組成:表17中所列抗體之VH功能域及VL功能域之胺基酸序列(例如表17之一列中之VH功能域及VL功能域)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID
NO:207,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:206(例如抗體Hum231#1)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:208,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:206(例如抗體Hum231#2)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:435,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:249(例如抗體pab1964)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:437,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:251(例如抗體pab1965)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:440,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:254(例如抗體pab1966)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:441,而VH功
能域由下述組成或主要由下述組成:SEQ ID NO:255(例如抗體pab1967)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:444,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:259(例如抗體pab1968)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:458,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:276(例如抗體pab1969)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:459,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:277(例如抗體pab1970)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:453,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:280(例如抗體pab1971)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:463,而VH功能域由下述組成
或主要由下述組成:SEQ ID NO:284(例如抗體pab1972)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:519,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:304(例如抗體pab1973)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:440,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:276(例如抗體pab1975)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:444,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:276(例如抗體pab1976)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:453,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:276(例如抗體pab1977)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:440,而VH功能域由下述組成或主要由
下述組成:SEQ ID NO:345(例如抗體pab1979)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:444,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:345(例如抗體pab1980)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:453,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:345(例如抗體pab1981)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:440,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:249(例如抗體pab1983)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:408,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:224(例如抗體pab2159)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:423,而VH功能域由下述組成或主要由下述組成:
SEQ ID NO:237(例如抗體pab2160)。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域及VH功能域,其中VL功能域由下述組成或主要由下述組成:SEQ ID NO:486,而VH功能域由下述組成或主要由下述組成:SEQ ID NO:315(例如抗體pab2161)。
在某些態樣中,本文所述之抗體可單獨依其VL功能域或單獨依其VH功能域或單獨依其3個VL CDR或單獨依其3個VH CDR描述。請見,例如,Rader C et al.,(1998)PNAS 95:8910-8915,其整體以引用方式併入本文,描述小鼠抗αvβ3抗體之擬人化,藉由分別從人類輕鏈或重鏈資料庫識別互補輕鏈或重鏈,造成具有親和性與原抗體親和性一樣高或高於原抗體親和性之擬人化抗體變體。亦見Clackson T et al.,(1991)Nature 352:624-628,其整體以引用方式併入本文,描述生產結合特定抗原之抗體的方法,藉由使用特定VL功能域(或VH功能域)並篩選資料庫找互補可變功能域。篩選產生針對特定VH功能域的14個新分體及針對特定VL功能域之13個新分體,其為有力之結合子,此由ELISA確定。亦見Kim SJ & Hong HJ,(2007)J Microbiol 45:572-577,其整體以引用方式併入本文,描述生產結合特定抗原之抗體的方法,藉由使用特定VH功能域並篩選資料庫(例如,人類VL資料庫)找互補VL功能域;所選擇之VL功能域依序可用於引導選擇額外之互補(例如人類)VH功能
域。
在某些態樣中,抗體之CDR可依據Chothia編號方案(Chothia numbering scheme)(指免疫球蛋白結構環之位置(見例如Chothia C & Lesk AM,(1987),J Mol Biol 196:901-917;Al-Lazikani B et al.,(1997)J Mol Biol 273:927-948;Chothia C et al.,(1992)J Mol Biol 227:799-817;Tramontano A et al.,(1990)J Mol Biol 215(1):175-82;且美國專利號7,709,226))確定。典型地,當使用Kabat編號協定,Chothia CDR-H1環存在於重鏈胺基酸26至32、33或34,Chothia CDR-H2環存在於重鏈胺基酸52至56,及Chothia CDR-H3環存在於重鏈胺基酸95至102,而Chothia CDR-L1環存在於輕鏈胺基酸24至34,Chothia CDR-L2環存在於輕鏈胺基酸50至56,及Chothia CDR-L3環存在於輕鏈胺基酸89至97。當使用Kabat編號協定編號時,Chothia CDR-HI環之末端依據環的長度在H32及H34之間變化(這是因為Kabat編號方案將插入置於H35A及H35B;若35A或35B不存在,則環在32終止;或僅35A存在,則環在33終止;若35A及35B兩者都存在,則環在34終止)。
在某些態樣中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段並包括一或多本文所述抗體任一(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、
pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15之任一或抗體1-107或抗體pab2159、pab2160或pab2161)的VL之Chothia VL CDR及/或一或多本文所述抗體任一(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161)的VH之Chothia VH CDR。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之抗體或其片段包括一或多CDR,其中Chothia與Kabat CDR具有相同胺基酸序列。在某些具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括Kabat CDR及Chothia CDR之組合。於一特別具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括本文所述抗體任一(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161)的Chothia CDR。
在某些態樣中,抗體之CDR可依據IMGT編號系統確定,如Lefranc M-P,(1999)The Immunologist
7:132-136 and Lefranc M-P et al.,(1999)Nucleic Acids Res 27:209-212所描述。依據IMGT編號方案(IMGT numbering scheme)VH-CDR1IMGT在位置26至35,VH-CDR2在位置51至57,VH-CDR3在位置93至102,VL-CDR1在位置27至32,VL-CDR2在位置50至52,及VL-CDR3在位置89至97。於一特別具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括本文所述抗體之任一(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161)之CDR,其由IMGT編號系統確定,例如,如上述Lefranc M-P(1999)及上述Lefranc M-P et al.,(1999))所述。
在某些態樣中,抗體之CDR可依據MacCallum RM et al.,(1996)J Mol Biol 262:732-745確定。亦見例如Martin A.“Protein Sequence and Structure Analysis of Antibody Variable Domains,”in Antibody Engineering,Kontermann and Dübel,eds.,Chapter 31,pp.422-439,Springer-Verlag,Berlin(2001)。於一特別具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括本文所述抗體之任一(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、
pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161)之CDR,其由MacCallum RM et al.中之方法確定。
在某些態樣中,抗體之CDR可依據AbM編號方案(AbM numbering scheme)(其意指AbM高可變區,其代表Kabat CDR與Chothia結構環之間的妥協方案且藉由Oxford Molecular's AbM抗體模型軟體(Oxford Molecular Group,Inc.)使用)確定。於一特別具體實施例中,本文提供為特異性結合GITR(例如,人類GITR)之抗體或其片段且包括本文所述抗體之任一(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161)的CDR,其由AbM編號方案確定。
於一特定具體實施例中,沿本文所述之抗體的VH(例如CDR1、CDR2或CDR3)及/或VL(例如CDR1、CDR2或CDR3)區的一或多CDR位置可一、二、三、四、五或六胺基酸位置變化,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例
如,至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。舉例來說,於一具體實施例中,定義本文所述之抗體(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161)任一之CDR的位置可藉由變換CDR之N端及/或C端邊界一、二、三、四、五或六胺基酸而變化,其相對於本文所述抗體(例如表1中所辨識之例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161)任一之CDR位置,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。於另一具體實施例中,沿本文所述抗體VH(例如CDR1、CDR2或CDR3)及/或VL(例如CDR1、CDR2或CDR3)區之一或多CDR長度可變化(例如變更短或更長)一、二、三、四、五或更多胺基酸,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少
80%、至少90%、至少95%)。
於一具體實施例中,本文所述之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及/或VH CDR3可為比本文所述之CDR(例如SEQ ID NO:1至34、101至109或114至189或SEQ ID NO:35或191至194)的一或多者短一、二、三、四、五或更多胺基酸,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。於另一具體實施例中,本文所述之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及/或VH CDR3可為比本文所述之CDR(例如SEQ ID NO:1至34、101至109或114至189或SEQ ID NO:35或191至194)的一或多者長一、二、三、四、五或更多胺基酸,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。於另一具體實施例中,本文所述之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及/或VH CDR3的胺基端可相較於本文所述之CDR(例如SEQ ID NO:1至34、101至109或114至189或SEQ ID NO:35或191至194)的一或多者延長一、二、三、四、五或更多胺基酸,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少80%、至少90%、至少
95%)。於另一具體實施例中,本文所述之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及/或VH CDR3之羧基端可相較於本文所述之CDR(例如SEQ ID NO:1至34、101至109或114至189或SEQ ID NO:35或191至194)的一或多者延長一、二、三、四、五或更多胺基酸,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。於另一具體實施例中,本文所述之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及/或VH CDR3的胺基端可相較於本文所述之CDR(例如SEQ ID NO:1至34、101至109或114至189或SEQ ID NO:35或191至194)的一或多者短一、二、三、四、五或更多胺基酸,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。於一具體實施例中,本文所述之VL CDR1、VL CDR2、VL CDR3、VH CDR1、VH CDR2及/或VH CDR3之羧基端可相較於本文所述之CDR(例如SEQ ID NO:1至34、101至109或114至189或SEQ ID NO:35或191至194)的一或多者短一、二、三、四、五或更多胺基酸,只要維持免疫特異性結合GITR(例如,人類GITR)(例如實質上維持,例如,至少50%、至少60%、至少70%、至少80%、至少90%、至少95%)。本領域中已知的任一方法可用以確認
是否維持免疫特異性結合GITR(例如,人類GITR),例如,本文所提供“實施例”章節(章節6)中所述的結合分析及條件。
於特定態樣中,本文所提供為抗體,其包括抗體輕鏈及重鏈,例如個別輕鏈及重鏈。關於輕鏈,於一特定具體實施例中,本文所述抗體之輕鏈為卡帕輕鏈。在另一特定具體實施例中,本文所述抗體的輕鏈為拉姆達(lambda)輕鏈。於又另一特定具體實施例中,本文所述抗體之輕鏈為人類卡帕(kappa)輕鏈或人類拉姆達(lambda)輕鏈。於一特別具體實施例中,免疫特異性結合GITR多胜肽(例如,人類GITR)的本文所述之抗體包括輕鏈,其中VL功能域之胺基酸序列包括本文所述之任何胺基酸序列(例如SEQ ID NO:202、204、205、207、208或400至518),且其中輕鏈之恆定區包括人類卡帕(kappa)輕鏈恆定區之胺基酸序列。於一特別具體實施例中,免疫特異性結合GITR多胜肽(例如,人類GITR)的本文所述之抗體包括輕鏈,其中VL功能域之胺基酸序列包括本文所述之任何胺基酸序列(例如SEQ ID NO:519),且其中輕鏈之恆定區包括人類卡帕(kappa)輕鏈恆定區之胺基酸序列。於另一特別具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述之抗體包括輕鏈,其中VL功能域之胺基酸序列可包括本文所述之任何胺基酸序列(例如SEQ ID NO:202、204、205、207、208或400至518),且其中輕鏈
之恆定區包括人類拉姆達(lambda)輕鏈恆定區之胺基酸序列。於另一特別具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述之抗體包括輕鏈,其中VL功能域之胺基酸序列可包括本文所述之任何胺基酸序列(例如SEQ ID NO:519),且其中輕鏈之恆定區包括人類拉姆達(lambda)輕鏈恆定區之胺基酸序列。於一特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括輕鏈,其中VL功能域之胺基酸包括(SEQ ID NO:207或208)且其中輕鏈之恆定區包括人類卡帕(kappa)或拉姆達(lambda)輕鏈恆定區之胺基酸序列。人類恆定區序列之非限制性例子已描述於本領域中,例如見U.S.專利號5,693,780及上述Kabat EA et al.,(1991)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:555、556、571至576及580。於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:571至576。
關於重鏈,於一特定具體實施例中,本文所述抗體之重鏈可為阿法(α)、戴爾它(δ)、艾普西龍(ε)、加馬(γ)或謬(μ)重鏈。在另一特定具體實施例中,所述之抗體重鏈可包括人類阿法(α)、戴爾它
(δ)、艾普西龍(ε)、加馬(γ)或謬(μ)重鏈。於一特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括重鏈,其中VH功能域之胺基酸序列可包括本文所述之任何胺基酸序列(例如SEQ ID NO:201、203、206或215至389之任一),且其中重鏈之恆定區包括人類加馬(γ)重鏈恆定區之胺基酸序列。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體包括重鏈,其中VH功能域之胺基酸序列包括選自下列所組成群組之胺基酸序列:SEQ ID NO:553、554、567至570及579,且其中重鏈之恆定區包括本文所述之或本領域中已知之人類重鏈的胺基酸。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體包括重鏈,其中VH功能域之胺基酸序列包括選自下列所組成群組之胺基酸序列:SEQ ID NO:581及582,且其中重鏈之恆定區包括本文所述之或本領域中已知之人類重鏈的胺基酸。人類恆定區序列非限制性例子已描述於本領域中,例如見U.S.專利號5,693,780及上述Kabat EA et al.,(1991)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括重鏈,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:553、554、567至570及579。於一特別具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括重鏈,其包括選自下列所組成群組之胺
基酸序列:SEQ ID NO:581及582。於一特定具體實施例中,結合GITR(例如,人類GITR)之抗體或其片段包括包含SEQ ID NO:567至570之胺基酸序列的重鏈。
於一特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括VL功能域及VH功能域,其包括本文所述之任何胺基酸序列,且其中恆定區包括IgG、IgE、IgM、IgD、IgA或IgY免疫球蛋白分子或人類IgG、IgE、IgM、IgD、IgA或IgY免疫球蛋白分子之恆定區的胺基酸序列。在另一特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括VL功能域以及VH功能域,其包括本文所述之任何胺基酸序列,且其中恆定區包括IgG、IgE、IgM、IgD、IgA或IgY免疫球蛋白分子、任何類型(例如IgG1
、IgG2
、IgG3
、IgG4
、IgA1
及IgA2
)或任何次類型(例如IgG2a
及IgG2b
)之免疫球蛋白分子之恆定區的胺基酸序列。於一特別具體實施例中,恆定區包括人類IgG、IgE、IgM、IgD、IgA或IgY免疫球蛋白分子、任何類型(例如IgG1
、IgG2
、IgG3
、IgG4
、IgA1
及IgA2
)或任何次類型(例如IgG2a
及IgG2b
)之免疫球蛋白分子之恆定區的胺基酸序列。
在另一特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括VL功能域及VH功能域,其包括本文所述之任何胺基酸序列,且其中恆定區包括人類IgG1
(例如異型G1m3、G1m17,1或
G1m17,1,2)或人類IgG4
之恆定區的胺基酸序列。於一特別具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述之抗體包括VL功能域及VH功能域,其包括本文所述之任何胺基酸序列,且其中恆定區包括人類IgG1
(異型Glm3)的恆定區之胺基酸序列。人類恆定區非限制性例子述於本領域中例如見上述Kabat EA et al.,(1991)。
於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:555、556、571至576及580,及重鏈,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:553、554、567至570及579。於另一具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述之抗體或其片段包括輕鏈,其包括SEQ ID NO:576之胺基酸序列,及重鏈,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:581及582。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)的抗體或其片段包括輕鏈,其包括SEQ ID NO:555或556之胺基酸序列,及重鏈,其包括SEQ ID NO:554之胺基酸序列。
在某些具體實施例中,一、二或更多突變(例如胺基酸取代)經導入至本文所述之抗體或其片段之Fc區(例如CH2功能域(人類IgG1
之殘基231至340)及/或CH3功能域(人類IgG1
之殘基341-447)及/或鉸鏈
區,其具有依據Kabat編號系統編號(例如Kabat中之EU索引(EU index)))以改變抗體之一或多功能特性,諸如血清半衰期、補體結合、Fc受體結合及/或抗原-依賴性細胞性細胞毒性。
在某些具體實施例中,一、二或更多突變(例如胺基酸取代)經導入至Fc區(CH1功能域)之鉸鏈區,使得鉸鏈區中半胱胺酸殘基數目改變(例如增加或減少),如例如U.S.專利號5,677,425所述。可改變CH1功能域鉸鏈區中半胱胺酸殘基數目為例如協助輕及重鏈之組合,或改變(例如增加或減少)抗體之穩定性。
在一些具體實施例中,一、二或更多突變(例如胺基酸取代)經導入至本文所述之抗體或其片段之Fc區(例如CH2功能域(人類IgG1
之殘基231至340)及/或CH3功能域(人類IgG1
之殘基)及/或鉸鏈區,其具有依據Kabat編號系統編號(例如Kabat中之EU索引(EU index)))以增加或減少抗體對效應子細胞表面上Fc受體(例如經活化之Fc受體)之親和性。增加或減少抗體對Fc受體之親和性的抗體或其片段之Fc區中之突變及導入此種突變至Fc受體或其片段的技術為發明所屬技術領域中具有通常知識者已知之方法。可做出以改變抗體對Fc受體之親和性的抗體Fc受體中突變的例子述於例如Smith P et al.,(2012)PNAS 109:6181-6186、U.S.專利號6,737,056及國際公開案號WO 02/060919;WO 98/23289;且WO 97/34631,其以引用方式併入本文。
於一特定具體實施例中,一、二或更多胺基酸突變(即取代、插入或缺失)經導入至IgG恆定功能域或其FcRn-結合片段(較佳地,Fc或鉸鏈-Fc功能域片段)以改變(例如減少或增加)活體內抗體之半衰期。見例如國際公開案號WO 02/060919;WO 98/23289;且WO 97/34631;且U.S.專利號5,869,046、6,121,022、6,277,375及6,165,745關於將改變(例如減少或增加)活體內抗體之半衰期之突變的例子。在一些具體實施例中,一、二或更多胺基酸突變(即取代、插入或缺失)經導入至IgG恆定功能域或其FcRn-結合片段(較佳地,Fc或鉸鏈-Fc功能域片段)以減少活體內抗體之半衰期。在其他具體實施例中,一、二或更多胺基酸突變(即取代、插入或缺失)經導入至IgG恆定功能域或其FcRn-結合片段(較佳地Fc或鉸鏈-Fc功能域片段)以增加活體內抗體之半衰期。於一特定具體實施例中,抗體可在第二恆定(CH2)功能域(人類IgG1
之殘基231至340)及/或第三恆定(CH3)功能域(人類IgG1
之殘基341-447)具有一或多胺基酸突變(例如取代),其依據Kabat中之EU索引(EU index)編號(上述Kabat EA et al.,(1991))。於一特定具體實施例中,本文所述之抗體或其抗原-結合片段之IgG1
的恆定區包括甲硫胺酸(M)為酪胺酸(Y)取代在位置252、絲胺酸(S)為蘇胺酸(T)取代在位置254及蘇胺酸(T)為麩胺酸(E)取代在位置256,依據Kabat中之EU索引(EU index)編
號。見U.S.專利號7,658,921,其以引用方式併入本文。此種類之突變體IgG,稱為“YTE突變體”,相較於野生型版本之相同抗體已顯示展現四倍增加之半衰期(見Dall’Acqua WF et al.,(2006)J Biol Chem 281:23514-24)。在某些具體實施例中,抗體或其抗原-結合片段包括IgG恆定功能域,其包括在位置251至257、285至290、308至314、385至389及428至436的胺基酸殘基之一、二、三或更多胺基酸取代,其依據Kabat中之EU索引(EU index)編號。
在進一步具體實施例中,一、二或更多胺基酸取代經導入至IgG恆定功能域Fc區,以改變抗體之效應子功能。舉例來說,選自胺基酸殘基234、235、236、237、297、318、320及322之一或多胺基酸(依據Kabat中之EU索引(EU index)編號)可經不同胺基酸殘基取代,使得抗體具有對作用配體(effector ligand)改變之親和性,但維持親代抗體之抗原-結合能力。親和性改變之作用配體(effector ligand)可為,例如,Fc受體或補體之C1成分。此方法進一步詳細描述於U.S.專利號5,624,821及5,648,260。在一些具體實施例中,恆定區功能域之缺失或去活化(透過點突變或其他方法)可降低循環抗體之Fc受體結,因而增加腫瘤局部化。見例如U.S.專利號5,585,097及8,591,886描述刪除或去活化恆定功能域因而增加腫瘤局部化之突變。在某些具體實施例中,一或多胺基酸取代可經導入至本文所述抗體之Fc區,以
移去Fc區上可能醣基化位置,其可減少Fc受體結合(見例如Shields RL et al.,(2001)J Biol Chem 276:6591-604)。在各種具體實施例中,可造成本文所述抗體之恆定區中一或多下述突變:N297A取代;N297Q取代;L235A取代及L237A取代;L234A取代及L235A取代;E233P取代;L234V取代;L235A取代;C236缺失;P238A取代;D265A取代;A327Q取代;或P329A取代,其依據Kabat中之EU索引(EU index)編號。
於一特定具體實施例中,本文所述抗體或其抗原-結合片段包括IgG1
之恆定功能域帶有N297Q或N297A胺基酸取代。
在某些具體實施例中,本文所述抗體之恆定區中選自胺基酸殘基329、331及322之一或多胺基酸(依據Kabat中之EU索引(EU index)編號)可經不同胺基酸殘基取代,使得抗體具有改變之C1q結合及/或降低或廢止之補體依賴性細胞毒性(CDC)。此方法進一步詳細描述於U.S.專利號6,194,551(Idusogie et al)。在一些具體實施例中,本文所述抗體CH2功能域之N端區中之胺基酸位置231至238中一或多胺基酸殘基經改變因而改變抗體固定補體之能力。此方法進一步描述於國際公開案號WO 94/29351。在某些具體實施例中,本文所述抗體之Fc區經修飾以增加抗體媒介抗體依賴性細胞性細胞毒性(ADCC)之能力及/或藉由突變下述位置之一或多胺基酸(例如導入胺基酸取代)增加抗體對Fcγ受體之親和
性:238、239、248、249、252、254、255、256、258、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、293、294、295、296、298、301、303、305、307、309、312、315、320、322、324、326、327、329、330、331、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、434、435、437、438或439,其依據Kabat中之EU索引(EU index)編號。此方法進一步描述於國際公開案號WO 00/42072。
在某些具體實施例中,本文所述抗體包括IgG4
抗體之恆定區且在重鏈胺基酸殘基228之絲胺酸(依據Kabat中之EU索引(EU index)編號)取代脯胺酸。
具有降低之岩藻糖含量的抗體經報導具有對Fc受體,諸如,例如FcγRIIIa增加之親和性。據此,在某些具體實施例中,本文所述之抗體或其抗原-結合片段具有降低之岩藻糖含量或無岩藻糖含量。此抗體可使用發明所屬技術領域中具有通常知識者已知之技術產生。例如,抗體可被表現在缺陷或缺少岩藻糖基化能力之細胞。於一特定實例中,具有剔除α1,6-岩藻糖基轉移酶之對偶基因兩者之細胞株可用以產生具有降低之岩藻糖含量的抗體。Potelligent®
系統(Lonza)為此種系統的例子,可用於生產具有降低之岩藻糖含量的抗體。或者,具有降低之岩藻糖含量或無岩藻糖含量的抗體或抗原-結合片段可由例如下述生產:(i)在避免或降低岩藻糖基化之條件下
培養細胞;(ii)轉譯後移去岩藻糖(例如以岩藻糖苷酶酵素);(iii)轉譯後加入所欲之醣,例如在重組表現非糖化之醣蛋白;或(iv)純化醣蛋白,以選擇未經岩藻糖基化之抗體或其抗原-結合片段。見例如Longmore GD & Schachter H(1982)Carbohydr Res 100:365-92 and Imai-Nishiya H et al.,(2007)BMC Biotechnol.7:84對於生產具有無岩藻糖含量或降低之岩藻糖含量之抗體或其抗原-結合片段之方法。
在某些具體實施例中,本文所述之抗體或其抗原-結合片段對CD32B(亦已知為FcγRIIB或FCGR2B)具有增加之親和性,例如當相較於具有野生型Fc區之抗體,例如IgG1 Fc時。在某些具體實施例中,相較於CD32A(FcγRIIA)及CD16(FcγRIIIA)兩者,本文所述之抗體或其抗原-結合片段對CD32B(FcγRIIB)具有選擇性增加之親和性。提供導致對CD32B增加之親和性的序列改變,例如,在Mimoto et al.,Protein Engineering,Design & Selection 10:589-598(2013),Chu et al.,Molecular Immunology 45:3926-3933(2008),及Strohl,Current Opinion in Biology 20:685-691(2009),各者整體以引用方式併入本文。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括選自由下述所組成群組的突變:G236D、P238D、S239D、S267E、L328F、L328E、在位置236之後插入精
胺酸及其組合,其依據EU索引(Kabat et al.,Sequences of Proteins of Immumological Interest,U.S.Department of Health and Human Services,Bethesda(1991))編號。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括S267E及L328F取代。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括P238D及L328E取代。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括P238D取代及選自下列所組成群組之取代:E233D、G237D、H268D、P271G、A330R及其組合。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括P238D、E233D、G237D、H268D、P271G及A330R取代。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括G236D及S267E。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括S239D及S267E。在一些具體實施例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括S267E及L328F。在一些具體實施
例中,對CD32B具有增加之親和性的抗體或抗原-結合片段包括重鏈恆定區,例如IgG1恆定區或其片段,其包括在位置236後插入精胺酸及L328R。
於另一特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括輕鏈及重鏈,其中(i)輕鏈包括VL功能域,其包括VL CDR1、VL CDR2及VL CDR3,其具有Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161(例如列於表1者)之胺基酸序列;(ii)重鏈包括VH功能域,其包括VH CDR1、VH CDR2及VH CDR3,其具有Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161(例如列於表2者)之胺基酸序列;(iii)輕鏈進一步包括恆定輕鏈功能域,其包括人類卡帕(kappa)輕鏈恆定功能域之胺基酸序列;且(iv)重鏈進一步包括恆定重鏈功能域,其包括人類IgG1
(任意地IgG1
(異型Glm3))重鏈恆定功能域之胺基酸序列。
於另一特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括輕鏈及重鏈,其中(i)輕鏈包括VL功能域,其包括抗體Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:202、204、205、207、208或400至518或SEQ ID NO:519)之胺基酸序列;(ii)重鏈包括VH功能域,其包括抗體Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:201、203、206或215至389)之胺基酸序列;(iii)輕鏈進一步包括恆定功能域,其包括人類卡帕(kappa)輕鏈恆定功能域之胺基酸序列;且(iv)重鏈進一步包括恆定功能域,其包括人類IgG1
(任意地IgG1
(異型Glm3))重鏈恆定功能域之胺基酸序列。
於另一特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括輕鏈及重鏈,其中(i)輕鏈包括VL功能域,其包括Hum231#1或
Hum231#2(例如SEQ ID NO:207或208)之胺基酸序列;(ii)重鏈包括VH功能域,其包括Hum231#1或Hum231#2(例如SEQ ID NO:206)之胺基酸序列;(iii)輕鏈進一步包括恆定功能域,其包括人類卡帕(kappa)輕鏈恆定功能域之胺基酸序列;且(iv)重鏈進一步包括恆定功能域,其包括人類IgG1
(任意地IgG1
(異型Glm3))重鏈恆定功能域之胺基酸序列。
於另一特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括輕鏈及重鏈,其中(i)輕鏈包括VL功能域,其包括VL CDR1、VL CDR2及VL CDR3,其具有本文所述抗體之任一,例如Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如列於表1者)之胺基酸序列;(ii)重鏈包括VH功能域,其包括VH CDR1、VH CDR2及VH CDR3,其具有本文所述抗體之任一,例如Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如列於表2者)之胺基酸序列;
(iii)輕鏈進一步包括恆定輕鏈功能域,其包括人類IgG4
恆定功能域之胺基酸序列;且(iv)重鏈進一步包括恆定重鏈功能域,其包括人類IgG4
重鏈恆定功能域之胺基酸序列。
於另一特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括輕鏈及重鏈,其中(i)輕鏈包括VL功能域,其包括本文所述抗體之任一,例如Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:202、204、205、207、208或400至518或SEQ ID NO:519)之胺基酸序列;(ii)重鏈包括VH功能域,其包括本文所述抗體之任一,例如Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:201、203、206或215至389)之胺基酸序列;(iii)輕鏈進一步包括恆定功能域,其包括人類IgG4
輕鏈恆定功能域之胺基酸序列;且(iv)重鏈進一步包括恆定功能域,其包括人類IgG4
重鏈恆定功能域之胺基酸
序列。
於另一特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體包括輕鏈及重鏈,其中(i)輕鏈包括VL功能域,其包括Hum231#1或Hum231#2(例如SEQ ID NO:207或208)之胺基酸序列;(ii)重鏈包括VH功能域,其包括Hum231#1或Hum231#2(例如SEQ ID NO:206)之胺基酸序列;(iii)輕鏈進一步包括恆定功能域,其包括人類IgG4
輕鏈恆定功能域之胺基酸序列;且(iv)重鏈進一步包括恆定功能域,其包括人類IgG4
重鏈恆定功能域之胺基酸序列。
於一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含選自下列所組成群組:SEQ ID NO:553、554及567至570之胺基酸序列的重鏈;且(b)包含選自下列所組成群組:SEQ ID NO:555、556及571至576之胺基酸序列的輕鏈。於一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含選自下列所組成群組之胺基酸序列的重鏈:SEQ ID NO:581或582;且(b)包括SEQ ID NO:576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈;且(b)包括SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例
中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:554之胺基酸序列的重鏈;且(b)包括SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:581之胺基酸序列的重鏈;且(b)包括SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:582之胺基酸序列的重鏈;且(b)包括SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈;且(b)包括SEQ ID NO:555之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:554之胺基酸序列的重鏈;且(b)包括SEQ ID NO:555之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:567之胺基酸序列的重鏈;且(b)包括SEQ ID NO:573之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:567之胺基酸序列的重鏈;且(b)包括SEQ ID NO:576之胺基酸序列的輕
鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:554之胺基酸序列的重鏈;且(b)包括SEQ ID NO:576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:581之胺基酸序列的重鏈;且(b)包括SEQ ID NO:576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:582之胺基酸序列的重鏈;且(b)包括SEQ ID NO:576之胺基酸序列的輕鏈。
在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈,具有在胺基酸位置298,N取代為A或Q之胺基酸取代;且(b)包含選自下列所組成群組:SEQ ID NO:555、556及571至576之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈,具有在胺基酸位置298,N取代為A或Q之胺基酸取代;且(b)包括SEQ ID NO:556之胺基酸序列的輕鏈。在另一特定具體實施例中,本文所提供之特異性結合GITR(例如,人類GITR)的抗體包括(a)包含SEQ ID NO:553之胺基酸序列的重鏈,具有在胺基酸位置298,N取
代為A或Q之胺基酸取代;且(b)包括SEQ ID NO:555之胺基酸序列的輕鏈。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括一、二、三或四VL框架區(FR),其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如見表3)本文所述之胺基酸序列。在一些具體實施例中,特異性結合GITR(例如,人類GITR)的抗體或其片段包括一、二、三或四VH框架區(FR),其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如見表4)本文所述之胺基酸序列。在某些具體實施例中,特異性結合GITR(例如,人類GITR)的抗體或其片段包括本文所述抗體(例如Hum231#1Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、
pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161)之一的FR之一、二、三、四、五、六、七或八者。在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括框架區(例如VL功能域及/或VH功能域之框架區),其為人類框架區或衍生自人類框架區。人類框架區非限制性例子述於本領域中例如見Kabat EA et al.,(1991)上述)。在某些具體實施例中,本文所述抗體包括框架區(例如VL功能域及/或VH功能域之框架區),其為靈長類(例如非人類靈長類)框架區或衍生自靈長類(例如非人類靈長類)框架區。
舉例來說,來自抗原-特異性非人類抗體,典型為囓齒動物來源(例如小鼠或大鼠),之CDR移植到同源人類或非人類靈長類接受者框架。於一具體實施例中,非人類靈長類接受者框架為來自舊世界猿(舊世界猿(Old World ape))。於一特定具體實施例中,舊世界猿(Old World ape)接受者框架來自黑猩猩(Pan troglodytes)、侏儒黑猩猩(Pan paniscus)或大猩猩(Gorilla gorilla)。於一特別具體實施例中,非人類靈長類接受者框架來自黑猩猩(chimpanzee Pan troglodytes)。於一特別具體實施例中,非人類靈長類接受者框架來自舊世界猴(Old World monkey)接受者框架。於一特定具體實施例中,舊世界猴(Old World
monkey)接受者框架來自獼猴屬(genus Macaca)。在某一具體實施例中,非人類靈長類接受者框架源自馬來猴(Macaca cynomolgus)。非人類靈長類框架序列描述於U.S.專利申請公開案號US 2005/0208625。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括一、二或更多VL框架區(FR),其具有上述表3所列抗體之任一本文所述之胺基酸序列。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括一、二或更多VH框架區(FR),其具有上述表4所列抗體之任一本文所述之胺基酸序列。在特定具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括一、二或更多VL框架區,其具有上述表3所列抗體之任一本文所述之胺基酸序列,及一、二或更多VH框架區,其具有上述表4所列抗體本文所述之胺基酸序列。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL功能域之框架區,其具有選自下列所組成群組之胺基酸序列:SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-452、454-464、467-477、481-486、488-513或515-518及/或VH功能域之框架區,其具有選自下列所組成群組之胺基酸序列:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、
267、268、271-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360、362-368、380、384或387。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL功能域之框架區,其具有選自下列所組成群組之胺基酸序列:SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-464、467-477、481-486、488-513或515-519及/或VH功能域之框架區,其具有選自下列所組成群組之胺基酸序列:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、270-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360或362-368。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL功能域的一、二、三或四框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107(例如SEQ ID NO:
202、207、208、400-411、413-416、418-421、423-448、450-452、454-464、467-477、481-486、488-513或515-518)之胺基酸序列,其帶有1、2、3、4、5、6、7、8、9或更多胺基酸突變(例如胺基酸取代,諸如保留性胺基酸取代)及/或VH功能域之框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107(例如SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、271-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360、362-368、380、384或387)之胺基酸序列。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL功能域的一、二、三或四框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ
ID NO:202、207、208、400-411、413-416、418-421、423-448、450-464、467-477、481-486、488-513或515-519)之胺基酸序列,其帶有1、2、3、4、5、6、7、8、9或更多胺基酸突變(例如胺基酸取代,諸如保留性胺基酸取代)及/或VH功能域之框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、270-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360或362-368)之胺基酸序列。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VH功能域的一、二、三或四框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160、pab2161
(例如SEQ ID NO:201、203、206或215至389)之胺基酸序列,其帶有1、2、3、4、5、6、7、8、9或更多胺基酸突變(例如胺基酸取代,諸如保留性胺基酸取代)及/或VL功能域之框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:201、203、206或215至389)之胺基酸序列。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL功能域的一、二、三或四框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107(例如SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-452、454-464、467-477、481-486、488-513或515-518)之胺基酸序列,其帶有1、2、3、4、5、6、7、8、9或更多胺基酸突變(例如胺基酸取代,諸如保留性胺基酸取代)及/或VH功能域的一、二、三或四框架區,其具有SEQ ID NO:201、203、206或215至389之胺基酸序列,其帶有
1、2、3、4、5、6、7、8、9或更多胺基酸突變(例如胺基酸取代,諸如保留性胺基酸取代)。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL功能域的一、二、三或四框架區,其具有本文所述抗體之任一,例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-464、467-477、481-486、488-513或515-519)之胺基酸序列,其帶有1、2、3、4、5、6、7、8、9或更多胺基酸突變(例如胺基酸取代,諸如保留性胺基酸取代)及/或VH功能域的一、二、三或四框架區,其具有SEQ ID NO:201、203、206或215至389之胺基酸序列,其帶有1、2、3、4、5、6、7、8、9或更多胺基酸突變(例如胺基酸取代,諸如保留性胺基酸取代)。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL框架區(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於上述本文表3所述之VL框架區。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VH框架區
(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於上述本文表4所述之VH框架區。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VH框架區(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於上述本文表4所述之VH框架區,及VL框架區(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於上述本文表3所述之VL框架區。
在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VL框架區(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如表3所列者)本文所述之VL框架區。在一些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括VH框架區(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、
pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如表4所列者)本文所述之VH框架區。在某些具體實施例中,特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段包括:(i)VL框架區(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如表3所列者)本文所述之VL框架區;且(ii)VH框架區(FR),其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161(例如表4所列者)本文所述之VH框架區。
二序列(例如胺基酸序列或核酸序列)之間確定百分比相似度亦可使用數學演算法完成。運用於比對二序列之數學演算法的特定、非限定例子為Karlin S &
Altschul SF(1990)PNAS 87:2264-2268之演算法,經修飾為Karlin S & Altschul SF(1993)PNAS 90:5873-5877中者。此演算法併入Altschul SF et al.,(1990)J Mol Biol 215:403之NBLAST及XBLAST程式。BLAST核苷酸檢索可由NBLAST核苷酸程式參數組,例如對於分數=100,字長=12,進行以獲得同源於本文所述之核酸分子之核苷酸序列。BLAST蛋白質檢索可以XBLAST程式參數組,例如對分數50,字長=3,進行以獲得同源於本文所述之蛋白質分子之胺基酸序列。為了比對目的獲得跳空排列,可如Altschul SF et al.,(1997)Nuc Acids Res 25:3389 3402中所描述運用Gapped BLAST。或者,可使用PSI BLAST進行重複檢索,其偵測分子(Id.)之間疏遠關(distant relationship)。當運用BLAST時,可使用Gapped BLAST及PSI Blast程式、個別程式的(例如XBLAST及NBLAST之)系統內定參數(default parameter)(見例如在全球資訊網ncbi.nlm.nih.gov上National Center for Biotechnology Information(NCBI))。運用於比對序列之數學演算法的另一特定、非限制例子為Myers and Miller,1988,CABIOS 4:11 17的演算法。此演算法併入ALIGN程式(第2.0版),其為GCG序列排列軟體套件之部分。當運用ALIGN程式比對胺基酸序列時,可使用PAM120權重殘基表(weight residue table)、12之缺口長度罰、與4之缺口罰。
二序列之間的百分比相似度可使用類似於上
述者之技術,在有或無容許缺口下確定。計算百分比相似度,典型僅計算完全相配者。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於抗體Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:202、204、205、207、208或400至518或SEQ ID NO:519)之VL功能域之胺基酸序列。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於抗體Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、Hum231#1、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161(例如SEQ ID NO:202、204、205、207、208或400至518或SEQ ID NO:519)之VL功能域之胺基酸序列,其中抗體或抗原-結合片段包括CDR(例如VL CDR),其與表1及/或表2
所列之抗體的CDR(例如VL CDR)相同(例如CDR為與表1及/或2按名稱所指之特別抗體的CDR相同)。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括VL框架區,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列所組成群組之框架區之胺基酸序列:SEQ ID NO:202、204、205、207、208及400至518。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VL功能域,其包括VL框架區,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於SEQ ID NO:519之胺基酸序列。於一特別具體實施例中,抗體包括相同於表1所列抗體VL CDR(例如表1之一列中的VL CDR)之VL CDR。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於SEQ ID NO:201、203、206或215至389之VH功能域之胺基酸序列。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於SEQ ID NO:201、203、206或215至389之VH功能域之胺基酸序列,其中抗體或抗原-結合片段包括CDR(例如VL
CDR),其為與表1及/或表2所列之抗體的CDR(例如VL CDR)相同(例如CDR與表1及/或2按名稱所指之特別命名抗體的CDR相同)。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括VH框架區,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列所組成群組之框架區之胺基酸序列:SEQ ID NO:201、203、206及215至389。於一特別具體實施例中,抗體包括與表2所列抗體之VH CDR(例如表2之一列中的VH CDR)相同的VH CDR。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括:(i)VL功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列所組成群組之VL功能域之胺基酸序列:SEQ ID NO:202、204、205、207、208及400至518;且(ii)VL功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於SEQ ID NO:201、203、206或215至389之VH功能域之胺基酸序列。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括:(i)VL功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於SEQ ID NO:519之胺基酸序列;且(ii)VL功能域,其具有至少80%、至少85%、至少
90%、至少95%或至少98%序列相同於SEQ ID NO:304之VH功能域之胺基酸序列。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括:(i)VL功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列所組成群組之VL功能域之胺基酸序列:SEQ ID NO:202、204、205、207、208及400至518;且(ii)VH功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列群組之VH功能域之胺基酸序列:SEQ ID NO:201、203、206及215至389,其中抗體或抗原-結合片段包括CDR(例如VL CDR),其為相同於表1及/或表2所列之抗體的CDR(例如VL CDR)(例如CDR相同於表1及/或2按名稱所指之特別抗體的CDR)。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括:(i)VL功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於SEQ ID NO:519之胺基酸序列;且(ii)VH功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於SEQ ID NO:304之胺基酸序列,其中抗體或抗原-結合片段包括CDR(例如VL CDR),其為相同於表1及/或表2所列之抗體的CDR(例如VL CDR)(例如CDR相同於表1及/或2按名稱所指之特別抗體的CDR)。
在某些具體實施例中,免疫特異性結合GITR
(例如,人類GITR)之抗體或其片段包括:(i)VL功能域,其包括VL框架區,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列所組成群組之框架區之胺基酸序列:SEQ ID NO:202、204、205、207及208;且(ii)VH功能域,其包括VH框架區,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列所組成群組之框架區之胺基酸序列:SEQ ID NO:201、203、206及215至389。於一特別具體實施例中,該抗體包括VL CDR(為相同於表3所列抗體之VL CDR)及/或VH CDR(為相同於表4所列抗體之VH CDR)。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列群組之VH功能域之胺基酸序列:SEQ ID NO:201、203、206及215至389。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列群組之VH功能域之胺基酸序列:SEQ ID NO:201、203、206及215至389,其中抗體或抗原-結合片段包括CDR(例如VL CDR),其為相同於表1及/或表2所列之抗體的CDR(例如VL CDR)(例如CDR相同於表1及/或2所指特別抗體的CDR)。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之抗體或其片段包括VH功能域,其包括VH框架區,其具有至少80%、至少85%、至少90%、至少95%或至少98%序列相同於選自下列所組成群組之框架區之胺基酸序列:SEQ ID NO:201、203、206及215至389。於一特別具體實施例中,該抗體包括VH CDR,其為相同於表2所列抗體之VH CDR(例如表2之一列中的VH CDR)。
於另一態樣中,本文提供為結合GITR之相同或重疊表位(例如人類GITR的表位)之抗體,如本文所述抗體(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107)或抗體pab2159、pab2160、pab2161或Hum231#2w。在某些具體實施例中,抗體之表位可由例如NMR光譜術、X光繞射結晶學研究、ELISA分析、偶合質譜術(例如液相層析電噴灑質譜術)之氫/氘交換、陣列為主之寡-胜肽掃描分析及/或突變繪圖(例如位置導向突變繪圖)確定。對於X光結晶學,可使用本領域中已知方法任一完成結晶化(例如Giegé R et al.,(1994)Acta Crystallogr D Biol Crystallogr 50(Pt 4):339-350;McPherson A(1990)Eur J Biochem 189:1-23;Chayen NE(1997)Structure 5:
1269-1274;McPherson A(1976)J Biol Chem 251:6300-6303)。抗體:抗原晶體可使用廣知之X光繞射技術研究且可使用電腦軟體諸如X-PLOR(Yale University,1992,distributed by Molecular Simulations,Inc.;see e.g.,Meth Enzymol(1985)volumes 114 & 115,eds Wyckoff HW et al.,;U.S.Patent Application No.2004/0014194)及BUSTER(Bricogne G(1993)Acta Crystallogr D Biol Crystallogr 49(Pt 1):37-60;Bricogne G(1997)Meth Enzymol 276A:361-423,ed Carter CW;Roversi P et al.,(2000)Acta Crystallogr D Biol Crystallogr 56(Pt 10):1316-1323)精煉。突變繪圖研究可使用發明所屬技術領域中具有通常知識者已知之任一方法完成。見例如上述Champe M et al.,(1995)及上述Cunningham BC & Wells JA(1989)關於突變技術的描述,包括丙胺酸掃描突變技術。於一特定具體實施例中,抗體之表位或其抗原-結合片段由使用丙胺酸掃描突變研究,諸如以下章節6所述確定。此外,識別且結合GITR(例如,人類GITR)之相同或重疊表位的抗體可使用常規技術諸如免疫分析法辨識,例如,藉由顯示一抗體阻擋另一抗體結合標的抗原之能力,即競爭性結合分析。亦可使用競爭結合分析確定二抗體是否對表位具有類似結合特異性。競爭性結合可在在分析中確定,其中測試下的免疫球蛋白抑制參考抗體特異性結合共同抗原,諸如GITR。已知許多類型之競爭性結合分析,例如固相直接或間接放射性免疫分析
(RIA)、固相直接或間接酵素免疫分析法(EIA)、三明治競爭分析(見Stahli C et al.,(1983)Methods Enzymol 9:242-253);固相直接生物素-抗生物素蛋白EIA(見Kirkland TN et al.,(1986)J Immunol 137:3614-9);固相直接經標幟之分析、固相直接經標幟之三明治分析(見Harlow E & Lane D,(1988)Antibodies:A Laboratory Manual,Cold Spring Harbor Press);使用I-125標籤之固相直接標籤RIA(見Morel GA et al.,(1988)Mol Immunol 25(1):7-15);固相直接生物素-抗生物素蛋白EIA(Cheung RC et al.,(1990)Virology 176:546-52);且直接經標幟之RIA(Moldenhauer G et al.,(1990)Scand J Immunol 32:77-82)。典型地,此分析涉及使用結合帶有該些未經標幟之測試免疫球蛋白及經標幟之參考免疫球蛋白任一之固體表面或細胞的純化之抗原(例如GITR,諸如人類GITR)。競爭性抑制可在測試免疫球蛋白存在下,由測定結合固體表面或細胞之標籤量而測量。通常,測試免疫球蛋白以過量存在。通常,當競爭抗體過量存在時,其將會抑制參考抗體特異性結合共同抗原至少50-55%、55-60%、60-65%、65-70% 70-75%或更多。競爭結合分析可使用經標幟之抗原或經標幟之抗體以許多不同形式配置。在此分析之共同版本中,抗原經固定化於96孔盤。未經標幟之抗體阻擋經標幟之抗體結合抗原的能力之後使用放射性或酵素標籤測量。進一步細節見,例如,Wagener C et al.,
(1983)J Immunol 130:2308-2315;Wagener C et al.,(1984)J Immunol Methods 68:269-274;Kuroki M et al.,(1990)Cancer Res 50:4872-4879;Kuroki M et al.,(1992)Immunol Invest 21:523-538;Kuroki M et al.,(1992)Hybridoma 11:391-407 and Antibodies:A Laboratory Manual,Ed Harlow E & Lane D editors supra,pp.386-389。
於一具體實施例中,使用表面電漿共振(BIAcore®
),例如藉由‘以串聯方式’諸如述於Abdiche YN et al.,(2009)Analytical Biochem 386:172-180者,進行競爭分析,於此GITR抗原經固定化於晶片表面,例如,CM5感應器晶片,且抗GITR抗體之後於晶片上跑過。為了確定抗體是否與本文所述之抗GITR抗體或其抗原-結合片段競爭,抗GITR抗體先在晶片表面跑過以達到飽和,之後潛在競爭抗體加入。相對於非競爭控制組,競爭抗體的結合可經確定且量化。
在某些態樣中,可使用競爭結合分析確定抗體是否例如以劑量依賴性方式被另一抗體競爭性阻擋,舉例而言,當二抗體在競爭結合分析諸如競爭ELISA分析中識別相同或空間重疊表位時,抗體結合與參考抗體基本上相同表位或重疊表位,其可在許多不同形式中使用經標幟之抗原或經標幟之抗體配置。於一特別具體實施例中,競爭結合分析中抗體可與本文所述抗體(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、
pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107,或抗體pab2159、pab2160、pab2161或Hum231#2w)或其嵌合或Fab抗體或包括本文所述抗體(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160、pab2161或Hum231#2w)之VH CDR及VL CDR的抗體測試。
於另一態樣中,本文提供為與本文所述抗體(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107)或抗體pab2159、pab2160、pab2161或Hum231#2w競爭(例如以劑量依賴性方式)結合GITR(例如,人類GITR)之抗體,其使用發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析(例如ELISA競爭性分析或表面電漿共振)確定。於另一態樣中,本文提供為競爭性抑制(例如以劑量依賴性方式)本文所述抗體(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、
pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160、pab2161或Hum231#2w)結合GITR(例如,人類GITR)之抗體,其使用發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析(例如述於以下實施例6之ELISA競爭性分析或懸浮陣列或表面電漿共振分析)確定。於特別具體實施例中,此競爭性阻擋抗體活化、誘導或增強一或多GITR活性。於特定態樣中,本文所提供為(例如,人類GITR)與包括本文所述之胺基酸序列(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161或Hum231#2w之VL及/或VH胺基酸序列)的抗體競爭(例如以劑量依賴性方式)特異性結合GITR之抗體,其使用發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析(例如述於以下實施例6之ELISA競爭性分析或懸浮陣列或表面電漿共振分析)確定。
在某些具體實施例中,本文所提供為與本文所述抗體競爭結合GITR(例如,人類GITR)的程度與本文所述抗體自體競爭結合GITR(例如,人類GITR)的程
度相同的抗體。在一些具體實施例中,本文提供為第一抗體,其與本文所述抗體競爭結合GITR(例如,人類GITR),其中該第一抗體在分析中競爭結合,該分析包括下述步驟:(a)以呈未經標幟之形式的第一抗體在容器中培養GITR轉染之細胞;且(b)添加呈經標幟之形式的本文所述抗體至容器中且培養容器中的細胞;且(c)偵測呈經標幟之形式的本文所述抗體結合細胞。在某些具體實施例中,本文提供為第一抗體,其與本文所述抗體競爭結合GITR(例如,人類GITR),其中競爭呈現為降低第一抗體結合GITR超過80%(例如85%、90%、95%或98%或介於80%至85%、80%至90%、85%至90%或85%至95%)。
於特定態樣中,本文所提供為與包括具有選自下列所組成群組之胺基酸序列的VL功能域:SEQ ID 202、207、208、400-411、413-416、418-421、423-448、450-452、454-464、467-477、481-486、488-513及515-518以及具有選自下列所組成群組之胺基酸序列的VH功能域:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、271-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、350、354-356、358-360、362-368、380、384及387的抗體競爭(例如以劑量依賴性方式)特異性結合GITR(例如,
人類GITR)之抗體。於特定態樣中,本文所提供為與包括具有選自下列所組成群組之胺基酸序列的VL功能域:SEQ ID 202、207、208、400-411、413-416、418-421、423-448、450-452、454-464、467-477、481-486、488-513及515-519以及具有選自下列所組成群組之胺基酸序列的VH功能域:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、270-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360及362-368之抗體競爭(例如以劑量依賴性方式)特異性結合GITR(例如,人類GITR)的抗體。
於特定態樣中,本文所提供為與包括(i)VL功能域,其包括VL CDR1、VL CDR2及VL CDR3,具有表1所列抗體之VL CDR的胺基酸序列;且(ii)VH功能域,其包括VH CDR1、VH CDR2及VH CDR3,具有表2所列抗體之CDR之胺基酸序列(例如表1按名稱所指特別抗體,諸如231-32-15、Hum231#1或Hum231#2的VH CDR)之抗體競爭(例如以劑量依賴性方式)特異性結合GITR(例如,人類GITR)的抗體。
於一特別具體實施例中,本文所提供為與包括231-32-15之VH及VL CDR(SEQ ID NO:201及202)之抗體競爭(例如以劑量依賴性方式)特異性結合
GITR(例如,人類GITR)的抗體。
於一特定具體實施例中,本文所述抗體為被下述抗體競爭性阻擋(例如以劑量依賴性方式)特異性結合GITR(例如,人類GITR)者,該抗體包括具有選自下列所組成群組之胺基酸序列的VL功能域:SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-452、454-464、467-477、481-486、488-513及515-518,以及具有選自下列所組成群組之胺基酸序列之VH功能域:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、271-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360、362-368、380、384及387。於一特定具體實施例中,本文所述抗體為被下述抗體競爭性阻擋(例如以劑量依賴性方式)特異性結合GITR(例如,人類GITR)者,該抗體包括具有選自下列所組成群組之胺基酸序列之VL功能域:SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-464、467-477、481-486、488-513及515-519,以及具有選自下列所組成群組之胺基酸序列的VH功能域:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、270-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-
306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360及362-368。
於一具體實施例中,本文所述抗體為被下述抗體競爭性阻擋特異性結合GITR(例如,人類GITR)者,該抗體包括具有SEQ ID NO:207或208之胺基酸序列的VL功能域,以及具有SEQ ID NO:206之胺基酸序列的VH功能域。
在另一特定具體實施例中,本文所述抗體為被下述抗體競爭性阻擋(例如以劑量依賴性方式)者,該抗體包括(i)VL功能域,其包括VL CDR1、VL CDR2及VL CDR3,具有表1所列抗體的CDR之胺基酸序列(例如表1按名稱所指的特別抗體的VL CDR);且(ii)VH功能域,其包括VH CDR1、VH CDR2及VH CDR3,具有表2所列抗體的CDR之胺基酸序列。
於特定態樣中,本文所提供為免疫特異性結合與包括本文所述之胺基酸序列(見例如表1至4)的抗體(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160、pab2161或Hum231#2w)相同之表位的抗體或其抗原-結合片段,以特異性結合GITR(例如,人類
GITR)。發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析(例如X光結晶學、ELISA分析等)可用於確定是否二抗體結合相同表位。
於一特定具體實施例中,本文所述抗體或其抗原-結合片段免疫特異性結合與下述抗體(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107)相同之表位,該抗體包括具有選自下列所組成群組之胺基酸序列之VL功能域:SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-452、454-464、467-477、481-486、488-513及515-518,,以及具有選自下列所組成群組之胺基酸序列之VH功能域:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、271-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360、362-368、380、384及387)。於一特定具體實施例中,本文所述抗體或其抗原-結合片段免疫特異性結合與下述抗體(例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、
pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160、pab2161或Hum231#2w)相同之表位,該抗體包括具有選自下列所組成群組之胺基酸序列的VL功能域:SEQ ID NO:202、207、208、400-411、413-416、418-421、423-448、450-464、467-477、481-486、488-513及515-519,以及具有選自下列所組成群組之胺基酸序列的VH功能域:SEQ ID NO:201、206、215、217-234、236-256、258、259、261-265、267、268、270-273、276、277、280、281、283-285、287、288、290、291、294、296-299、301、304-306、308、313-316、319、320、322-325、327、328、333、336、338-340、342、343、345、350、354-356、358-360及362-368)。
於一特定具體實施例中,本文所述抗體或其抗原-結合片段免疫特異性結合與下述抗體結合相同之表位,該抗體包括抗體Hum231#1或Hum231#2的VH功能域及VL功能域(分別為SEQ ID NO:206及207或SEQ ID NO:206及208),或結合與下述抗體表位重疊之表位,該抗體包括抗體Hum231#1或Hum231#2之VH功能域及VL功能域(分別為SEQ ID NO:206及207或SEQ ID NO:206及208)。
在另一特定具體實施例中,本文所述抗體或其抗原-結合片段免疫特異性結合與下述抗體相同之表
位,該抗體包括(i)VL功能域,其包括VL CDR1、VL CDR2及VL CDR3,具有表1所列抗體的CDR之胺基酸序列(例如表1按名稱所指特別抗體的VL CDR)及(ii)VH功能域,其包括VH CDR1、VH CDR2及VH CDR3,具有表2所列抗體的CDR之胺基酸序列(例如表2按名稱所指之特別抗體的VH CDR)。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)且競爭性阻擋(例如以劑量依賴性方式)抗體231-32-15、Hum231#1、Hum231#2或Hum231#2w結合GITR(例如,人類GITR)之本文所述抗體或其抗原-結合片段包括輕鏈可變區(VL)及重鏈可變區(VH),其中
(i)VL包括:
(a)VL CDR1,其包括胺基酸序列KSSQSX1
X2
X3
X4
X5
X6
X7
KX8
YLX9
(SEQ ID NO:4),其中
X1
為L、A、V、I、P、F或M
X2
為L、A、V、I、P、F、M或S
X3
為N、G、Q、S、T、C、W、Y或A
X4
為S、G、N、Q、T、C、W、Y或A
X5
為G、N、Q、S、T、C、W、Y或A
X6
為N、G、Q、S、T、C、W、Y或A
X7
為Q、G、N、S、T、C、W、Y或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為T、G、N、Q、S、C、W、Y、V、I或A;及/或
(b)VL CDR2,其包括胺基酸序列X1
ASTRX2
X3
(SEQ ID NO:5),其中
X1
為W、G、N、Q、S、T、C、Y、F、H或A
X2
為E、D或A
X3
為S、G、N、Q、T、C、W、Y或A;及/或
(c)VL CDR3,其包括胺基酸序列QX1
X2
YX3
X4
PYT(SEQ ID NO:6),其中
X1
為N、G、Q、S、T、C、W或Y
X2
為D、E或Y
X3
為S、G、N、Q、T、C、W、Y或A
X4
為Y、G、N、Q、S、T、C、W、F、H、L或A;且(ii)VH包括:
(a)VH CDR1,其包括胺基酸序列X1
YX2
MX3
(SEQ ID NO:1),其中
X1
為D、E、G或A
X2
為A、V、L、I、P、F、M或Y
X3
為Y、G、N、Q、S、T、C、W、F或H;及/或
(b)VH CDR2,其包括胺基酸序列X1
IX2
X3
X4
SGX5
X6
X7
YX8
QKFX9
X10
(SEQ ID NO:2),其中
X1
為V、A、L、I、P、F、M或T
X2
為R、K、H、Q或A
X3
為T、G、N、Q、S、C、W、Y、V、I或P
X4
為Y、G、N、Q、S、T、C、W、F、H或A
X5
為D、E、G或A
X6
為V、A、L、I、P、F、M或T
X7
為T、G、N、Q、S、C、W、Y、V、I、P或A
X8
為N、G、Q、S、T、C、W、Y或A
X9
為K、R、H、Q或A
X10
為D、E、G或A;及/或
(c)VH CDR3,其包括胺基酸序列SGTVRGX1
X2
X3
(SEQ ID NO:3),其中
X1
為F、A、V、L、I、P、M、Y、W、H或S
X2
為A或D
X3
為Y、G、N、Q、S、T、C、W、F、H或V。
於一特別具體實施例中,特異性結合GITR(例如,人類GITR)且競爭性阻擋(例如以劑量依賴性方式)抗體231-32-15、Hum231#1、Hum231#2或Hum231#2w結合GITR(例如,人類GITR)之本文所述抗體或其抗原-結合片段包括輕鏈可變區(VL)及重鏈可變區(VH),其中
(i)VL包括:
(a)VL CDR1,其包括胺基酸序列KSSQSLLNSX1
NQKNYLX2
(SEQ ID NO:10),其中
X1
為G或S
X2
為T或S;及/或
(b)VL CDR2,其包括胺基酸序列WASTRES(SEQ ID NO:11);及/或
(c)VL CDR3,其包括胺基酸序列QNX1
YSX2
PYT(SEQ ID NO:12),其中
X1
為D或E
X2
為Y、F或S及(ii)VH包括:
(a)VH CDR1,其包括胺基酸序列X1
YX2
MX3
(SEQ ID NO:7),其中
X1
為D、E或G
X2
為A或V
X3
為Y或H;及/或
(b)VH CDR2,其包括胺基酸序列X1
IX2
TX3
SGX4
X5
X6
YNQKFX7
X8
(SEQ ID NO:8),其中
X1
為V或L
X2
為R、K或Q
X3
為Y或F
X4
為D、E或G
X5
為V或L
X6
為T或S
X7
為K、R或Q
X8
為D、E或G;及/或
(c)VH CDR3,其包括胺基酸序列SGTVRGFAY(SEQ ID NO:9)。
在一些具體實施例中,與本文所述抗體競爭
結合以結合GITR(例如,人類GITR)或結合與本文所述抗體(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160、pab2161或Hum231#2w)之相同或重疊表位的抗體避免GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,其由發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析評估。於一特定具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其抗原-結合片段抑制GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,其由以下實施例2(例如以下章節6.2.5.2或6.2.5.4)所述之分析評估。在另一特定具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其抗原-結合片段(濃度為1000ng/ml、950ng/ml、900ng/ml、850ng/ml、800ng/ml、750ng/ml、700ng/ml、650ng/ml、600ng/ml、550ng/ml、500ng/ml、450ng/ml、400ng/ml、350ng/ml、
333ng/ml、300ng/ml、250ng/ml、200ng/ml、100ng/ml、50ng/ml或10ng/ml)抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如GITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合GITR偶合珠粒(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)而言。在另一特定具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其抗原-結合片段(濃度為1000ng/ml至750ng/ml、1000ng/ml至500ng/ml、850ng/ml至500ng/ml、750ng/ml至500ng/ml、600ng/ml至500ng/ml、500ng/ml至400ng/ml、400ng/ml至300ng/ml或300ng/ml至200ng/ml)抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM
或0.1nM的經標幟之GITRL(例如GITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合GITR偶合珠粒(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)而言。
在另一特定具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位的抗體或其抗原-結合片段(濃度為3500ng/ml、3400ng/ml、3300ng/ml、3200ng/ml、3100ng/ml、3000ng/ml、2900ng/ml、2800ng/ml、2700ng/ml、2600ng/ml、2500ng/ml、2400ng/ml、2300ng/ml、2200ng/ml、2100ng/ml、2000ng/ml、1900ng/ml、1800ng/ml、1700ng/ml、1600ng/ml、1500ng/ml、1400ng/ml、1300ng/ml、1200ng/ml或1100ng/ml)抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如GITRL-
PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)(濃度為9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml每珠粒)少於85%、80%、75%、70%、65%、60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合GITR偶合珠粒(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)而言。在另一特定具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位的抗體或其抗原-結合片段(濃度為3500ng/ml至3200ng/ml、3500ng/ml至3000ng/ml、3200ng/ml至2500ng/ml、3000至2200ng/ml、2500ng/ml至1800ng/ml、2000ng/ml至1500ng/ml、1700ng/ml至1200ng/ml或1500ng/ml至1000ng/ml)抑制1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如GITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)少於85%、80%、75%、70%、65%、
60%、55%、50%、45%、40%、35%、30%、25%、20%或10%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合GITR偶合珠粒(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)而言。
在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為3000ng/ml)避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%或少於80%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為1000ng/ml)避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於85%、少於80%或少於
75%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為333ng/ml)避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於70%或少於65%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為111ng/ml)避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於65%、少於60%或少於55%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠
粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為37ng/ml)避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於40%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為12ng/ml)避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)少於20%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。
於另一具體實施例中,在與本文所述抗體競爭結合以結合GITR或結合本文所述抗體之相同或重疊表位的抗體之存在下,一定量之經標幟之GITRL(例如,人類GITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR),其在包括下述之方法中:(a)濃度為每珠粒5pg/ml偶合GITR(例如,人類GITR)至珠粒(例如,偶合至Luminex®珠粒之人類
GITR);(b)每孔中,將濃度為40珠粒/μl之GITR偶合珠粒與3000ng/ml、2500ng/ml、2000ng/ml、1500ng/ml、1000ng/ml、750ng/ml、500ng/ml、250ng/ml、100ng/ml、50ng/ml或10ng/ml之競爭抗體或結合相同或重疊表位的抗體培養第一時間期間(例如30分鐘、60分鐘、1.5小時、2小時、2.5小時或3小時),其中孔包括700、750、800、850、900、950、1000、1100、1200、1300、1400或1500珠粒;(c)添加經標幟之GITRL(例如,人類GITRL-PE)至孔中以獲得最終濃度為1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM(在特定具體實施例中,為0.5nM)之經標幟之GITRL及20珠粒/μl之GITR偶合珠粒,並培養第二時間期間(例如30分鐘、1小時、1.5小時、2小時、2.5小時或3小時);且(d)在例如懸浮陣列分析諸如Luminex® 200系統中,偵測結合GITR偶合珠粒的經標幟之GITRL。在特定具體實施例中,在競爭抗體或結合相同或重疊表位之抗體之存在下,結合GITR偶合珠粒的經標幟之GITRL量相對於在無競爭抗體或結合相同或重疊表位之抗體之存在下結合GITR偶合珠粒的經標幟之GITRL量確定。在某些具體實施例中,不存在競爭抗體或結合相同或重疊表位之抗體意指無抗體或其抗原-結合片段存在於孔中。在其他具體實施例中,不存在競爭抗體或結合相同或重疊表位之抗體意指於孔中存在未結
合GITR的同型控制組抗體。依據這些具體實施例,在競爭抗體或結合相同或重疊表位之抗體之存在下,結合GITR偶合珠粒的經標幟之GITRL量確定為,在一些具體實施例中,在無競爭抗體或結合相同或重疊表位之抗體之存在下,結合GITR偶合珠粒的經標幟之GITRL量的至少20%、25%、30%、35%、40%、45%、50%、55%或60%或20%至60%、30%至50%或20%至70%。
在某些具體實施例中,在與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位的抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%之GITRL(例如,人類GITRL)結合GITR(例如,人類GITR),此由發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析評估。於一特定具體實施例中,在與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位的抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%之GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)其由以下實施例2(例如以下章節6.2.5.2或6.2.5.4)所述之分析評估。在另一特定具體實施例中,在1000ng/ml、950ng/ml、900ng/ml、850ng/ml、800ng/ml、750ng/ml、700ng/ml、650ng/ml、600ng/ml、550ng/ml、500
ng/ml、450ng/ml、400ng/ml、350ng/ml、333ng/ml、300ng/ml、250ng/ml、200ng/ml、100ng/ml、50ng/ml或10ng/ml的與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%之1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml),此在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合GITR偶合珠粒(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)而言。在另一特定具體實施例中,在3500ng/ml、3400ng/ml、3300ng/ml、3200ng/ml、3100ng/ml、3000ng/ml、2900ng/ml、2800ng/ml、2700ng/ml、2600ng/ml、2500ng/ml、2400ng/ml、2300ng/ml、2200ng/ml、2100ng/ml、2000ng/ml、1900ng/ml、1800ng/ml、1700
ng/ml、1600ng/ml、1500ng/ml、1400ng/ml、1300ng/ml、1200ng/ml或1100ng/ml的與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其抗原-結合片段存在下,至少10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%或75%之1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL(例如經標幟之人類GITRL,諸如hGITRL-PE)結合偶合至珠粒的GITR(例如,偶合至Luminex®珠粒之人類GITR)(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml),此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於1.5nM、1.4nM、1.3nM、1.2nM、1.1nM、1nM、0.9nM、0.8nM、0.7nM、0.6nM、0.5nM、0.4nM、0.3nM、0.2nM或0.1nM的經標幟之GITRL結合GITR偶合珠粒(濃度為每珠粒9pg/ml、8pg/ml、7pg/ml、6pg/ml、5pg/ml、4pg/ml或3pg/ml)而言。
在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為3000ng/ml)未避免0.5nM
GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過15%或超過20%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為1000ng/ml)未避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過15%、超過20%或超過25%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為333ng/ml)未避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過30%或超過35%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例
中,當GITR(例如,人類GITR)偶合至濃度為每珠粒5pg/ml的珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為111ng/ml)未避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過35%、超過40%或超過45%,此為在懸浮陣列分析(例如Luminex® 200系統)中無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為5pg/ml之珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為37ng/ml)未避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過60%,此為在懸浮陣列分析(例如Luminex® 200系統)中每珠粒無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。在某些具體實施例中,當GITR(例如,人類GITR)偶合至濃度為5pg/ml之珠粒(例如Luminex®珠粒)時,與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位的抗體(濃度為12ng/ml)未避免0.5nM GITRL(例如,人類GITRL)結合GITR(例如,人類GITR)超過85%,此為
在懸浮陣列分析(例如Luminex® 200系統)中每珠粒無抗GITR抗體或其抗原-結合片段存在下,相對於0.5nM的經標幟之GITRL結合濃度為5pg/ml/珠粒之GITR偶合珠粒而言。
在某些具體實施例中,本文所提供為與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位之抗體(以濃度為150nM、145nM、140nM、135nM、130nM、125nM、120nM、115nM、110nM、105nM或100nM結合固定於晶片(例如CM5感應器晶片)上的GITR(例如,人類GITR))抑制150nM、145nM、140nM、135nM、130nM、125nM、120nM、115nM、110nM、105nM或100nM之GITRL(例如人類GITRL之非共價連接三聚體)結合固定於晶片上之GITR少於60%、少於55%、少於50%、少於45%、少於40%、少於35%、少於30%、少於25%、少於20%或少於15%。在某些具體實施例中,本文所提供為與本文所述抗體競爭結合以結合GITR(例如,人類GITR)或結合本文所述抗體之相同或重疊表位之抗體,其中競爭抗體或結合相同或重疊表位之抗體(以濃度為125nM結合固定於晶片上(例如CM5感應器晶片)的GITR(例如,人類GITR))抑制125nM之GITRL(例如人類GITRL之非共價連接三聚體)結合固定於晶片上之GITR少於60%、少於55%、少於50%、少於45%、少於40%、少於35%、少於30%、少於25%、少於
20%或少於15%。
在某些具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其片段以解離速率常數(k關
)為8.5×10-3
s-1
或更少、3.5×10-3
s-1
或更少、5×10-3
s-1
或更少、2.5×10-3
s-1
或更少、1×10-3
s-1
或更少、8.5×10-4
s-1
或更少、5×10-4
s-1
或更少、3.5×10-4
s-1
或更少、2.5×10-4
s-1
或更少、1×10-4
s-1
或更少、8.5×10-5-
s-1
或更少、3.5×10-5-
s-1
或更少、5×10-5-
s-1
或更少、2.5×10-5-
s-1
或更少、1×10-5-
s-1
或更少、8.5×10-6-
s-1
或更少、5×10-6-
s-1
或更少、3.5×10-6-
s-1
或更少、2.5×10-6-
s-1
或更少、1×10-6-
s-1
或更少、8.5×10-7-
s-1
或更少、5×10-7-
s-1
或更少、2.5×10-7-
s-1
或更少、1×10-7-
s-1
或更少、8.5×10-8-
s-1
或更少、5×10-8-
s-1
或更少、2.5×10-8-
s-1
或更少、1×10-8-
s-1
或更少、8.5×10-9-
s-1
或更少、5×10-9
s-1
或更少、2.5×10-9-
s-1
或更少或1×10-9-
s-1
或更少結合GITR(例如,人類GITR)。在一些具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其片段以k關
為介於9.5×10-5-
s-1
至1×10-9-
s-1
、8.5×10-5-
s-1
至1×10-9-
s-1
、5×10-5-
s-1
至1×10-9-
s-1
、9.5×10-5-
s-1
至1×10-8-
s-1
、5×10-5
s-1
至1×10-8-
s-1
、9.5×10-5-
s-1
至1×10-7-
s-1
、5×10-5-
s-1
至1×10-7-
s-1
、9.5×10-5-
s-1
至5×10-6-
s-1
、9.5×10-5-
s-1
至1×10-5-
s-1
、
8.5×10-3
s-1
至1×10-4
s-1
、5×10-3
s-1
至2.5×10-4
s-1
、8.5×10-3
s-1
至1×10-5
s-1
、8.5×10-5-
s-1
至5×10-5-
s-1
之間結合GITR(例如,人類GITR)。在某些具體實施例中,使用單價抗體,諸如Fab片段、由例如BIAcore®表面電漿共振技術測量確定k關
。在其他具體實施例中,使用二價抗體由例如BIAcore®表面電漿共振技術測量確定k關
。於一特別具體實施例中,使用以下章節6所述之分析確定k關
。
在某些具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其片段以締合速率常數(k開
)為至少105
M-1
s-1
、至少2.5×105
M-1
s-1
、至少3.5×105
M-1
s-1
、至少5×105
M-1
s-1
、至少106
M-1
s-1
、至少2.5×106
M-1
s-1
、至少3.5×106
M-1
s-1
、至少5×106
M-1
s-1
、至少107
M-1
s-1
、至少5×107
M-1
s-1
、至少108
M-1
s-1
、至少5 108
M-1
s-1
或至少109
M-1
s-1
結合GITR(例如,人類GITR)。在一些具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其片段以k開
為介於1×105
M-1
s-1
至5×105
M-1
s-1
、1×105
M-1
s-1
至1×106
M-1
s-1
、3.5×105
M-1
s-1
至2.5×106
M-1
s-1
、3.5×105
M-1
s-1
至3.5×106
M-1
s-1
、1×105
M-1
s-1
至5×106
M-1
s-1
、1×105
M-1
s-
至1×107
M-1
s-1
、1×105
M-1
s-1
至5×107
M-1
s-1
、1×105
M-1
s-1
至108
M-1
s-1
、1×105
M-1
s-1
至1×109
M-1
s-1
、
1×106
M-1
s-
至1×107
M-1
s-1
、1×106
M-1
s-1
至1×108
M-1
s-1
、1×106
M-1
s-1
至1×109
M-1
s-1
、1×107
M-1
s-1
至1×108
M-1
s-1
、1×107
M-1
s-1
至1×109
M-1
s-1
、1×108
M-1
s-1
至1×109
M-1
s-1
之間結合GITR(例如,人類GITR)。在某些具體實施例中,使用單價抗體,諸如Fab片段,由例如BIAcore®表面電漿共振技術測量確定k開
。在其他具體實施例中,使用二價抗體,由例如BIAcore®表面電漿共振技術測量確定k開
。於一特別具體實施例中,使用以下章節6所述之分析確定k開
。
在某些具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其片段以KD
為少於7nM、6nM、5nM、4.5nM、4nM、3.5nM、3nM、2.5nM、2nM、1.5nM、1nM、0.75nM、0.5nM、0.25nM或0.1nM結合GITR(例如,人類GITR)。在一些具體實施例中,與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其片段以KD
為約7nM、6nM、5nM、4.5nM、4nM、3.5nM、3nM、2.5nM、2nM、1.5nM、1nM、0.75nM、0.5nM、0.25nM或0.1nM結合GITR(例如,人類GITR)。在某些具體實施例中,本文所述與本文所述抗體競爭結合GITR(例如,人類GITR)或結合與本文所述抗體相同之表位或重疊表位之抗體或其片段以KD
為7nM至4nM、7nM至5nM、6nM至4nM、5nM至3nM、5
nM至1nM、5nM至0.5nM、4nM至3nM、4nM至2nM、4nM至1nM、4nM至0.5nM、3nM至2nM、3nM至1nM、3nM至0.5nM、2nM至1nM、2nM至0.5nM、3nM至0.1nM、2nM至0.1nM、1nM至0.1nM或0.5nM至0.1nM結合GITR(例如,人類GITR)。在某些具體實施例中,KD
計算為k關
/k開
之商數,而k開
及k關
為使用單價抗體,諸如Fab片段,由例如BIAcore®表面電漿共振技術測量確定。在其他具體實施例中,KD
計算為k關
/k開
之商數,而k開
及k關
為使用二價抗體,諸如Fab片段,由例如BIAcore®表面電漿共振技術測量確定。於一特定具體實施例中,KD
如以下章節6中之實施例(例如實施例2)所列確定。
在某些具體實施例中,本文所述抗體的表位被用作為免疫原以產生抗體。見例如以下章節5.2產生抗體之方法。
於特定態樣中,特異性結合GITR(例如,人類GITR)之所述抗體或其片段在發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析中未抑制(例如以劑量依賴性方式)鼠科抗體6C8結合GITR(例如,人類GITR)。見例如U.S.專利號7,812,135描述鼠科抗體6C8。在某些具體實施例中,在特異性結合GITR(例如,人類GITR)之所述抗體或其片段存在下,至少20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多之鼠科
抗體6C8結合GITR(例如,人類GITR),其在發明所屬技術領域中具有通常知識者已知之分析或本文所述之分析中評估。於一特定具體實施例中,特異性結合GITR(例如,人類GITR)之所述抗體或其片段未抑制(例如以劑量依賴性方式)鼠科抗體6C8結合GITR(例如,人類GITR),如以下實施例6所述之分析中評估。在某些具體實施例中,在特異性結合GITR(例如,人類GITR)之所述抗體或其片段存在下,至少20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或更多之鼠科抗體6C8結合GITR(例如,人類GITR),於以下實施例6所述之分析評估。
在一些具體實施例中,本文所述抗GITR抗體可為多特異性抗體,例如雙特異性抗體。於一特別具體實施例中,本文所述抗GITR抗體為雙特異性抗體,其中抗體對至少二種不同、典型非重疊表位具有特異性。於一特別具體實施例中,雙特異性抗體包括一臂,其包括對GITR(例如,人類GITR)具有特異性的本文所述抗體,及第二臂,其包括對在GITR(例如,人類GITR)上之不同表位或在不同分子,例如PD-1、PD-L1、PD-L2、CTLA-4、TIM-3、LAG-3或OX40上之表位具有特異性的抗體。舉例來說,雙特異性抗體可包括一臂,其包括對GITR(例如,人類GITR)具有特異性之本文所述抗體,及第二臂,其包括對CTLA-4具特異性之抗體,諸如曲力
莫單抗(tremelimumab)(Pfizer)、易普利姆瑪(ipilimumab)(Yervoy®
,Bristol-Meyers Squibb)、結合與曲力莫單抗(tremelimumab)相同表位或對此重疊表位之抗體或結合與易普利姆瑪(ipilimumab)相同表位或對此重疊表位之抗體。
於特定態樣中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段作用為促效劑。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段增加GITR(例如,人類GITR)活性至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍,由本文所述之方法及/或發明所屬技術領域中具有通常知識者已知之方法,相對於在無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之GITR(例如,人類GITR)活性評估。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段增加GITR(例如,人類GITR)活性至少5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%,由本文所述之方法及/或發明所屬技術領域中
具有通常知識者已知之方法,相對於在無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之GITR(例如,人類GITR)活性評估。非限制性例子之GITR(例如,人類GITR)活性可包括細胞增殖、GITR(例如,人類GITR)傳訊、細胞存活及細胞激素產生(例如IL-2、IL-6、IL-10、TNF-α及IFN-γ)。在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段誘導或增加與GITRL(例如,人類GITRL)一起之GITR(例如,人類GITR)活性。在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段誘導、增強或增加在無GITRL(例如,人類GITRL)存在下之GITR(例如,人類GITR)活性。在特定具體實施例中,抗體或抗體-結合片段誘導、增強或增加GITR活性,且未抑制(例如未完全抑制或僅部分抑制)GITRL結合GITR。在特定具體實施例中,GITR活性增加如以下實施例中所述評估。
在某些態樣中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段誘導、增強或增加表現GITR且回應GITR傳訊之細胞(例如回應GITR刺激及GITR傳訊而增殖之細胞,諸如T細胞)的細胞性增殖。細胞增殖分析如本領域所述,諸如3
H-胸腺嘧啶核苷摻入法、BrdU摻入法或CFSE法,諸如述於實施例3,且可由發明所屬技術領域中具有通常知識者輕易進行。在
特定具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞性增殖,此相對於僅以T細胞促分裂原或T細胞受體複合物刺激劑(植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞。見以下實施例3,證實在免疫特異性結合GITR之本文所述抗體之存在下,T細胞增殖增加。
於一具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之CD8+
T細胞,在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞性增殖,此相對於僅以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞。於另一具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複
合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之CD4+
T細胞,在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞性增殖,此相對於僅以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞。於另一具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之CD4+
T細胞及CD8+
T細胞,在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞性增殖,此相對於僅以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞。在一些具體實施例中,未以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞,在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,具有增加之GITR活性及/或增加之NF-κB活性,此相對於未在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下之T細
胞。
在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段增加細胞增殖(例如T細胞,諸如CD4及CD8效應子T細胞)至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如3
H-胸腺嘧啶核苷摻入法、BrdU摻入法或CFSE法,諸如以下實施例3所述),相對於在無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之GITR(例如,人類GITR)活性評估。在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段增加細胞增殖(例如T細胞,諸如CD4及CD8效應子T細胞)至少至少約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如3
H-胸腺嘧啶核苷摻入法、BrdU摻入法或CFSE法,諸如以下實施例3所述),相對於在無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之GITR
(例如,人類GITR)活性評估。
在一些具體實施例中,以T細胞促分裂原(例如抗CD3抗體或巴豆酯)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞性增殖至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍,此相對於僅以T細胞促分裂原刺激之T細胞,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如3
H-胸腺嘧啶核苷摻入法、BrdU摻入法或CFSE法,諸如以下實施例3所述)評估。在一些具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞性增殖至少約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%,此相對於僅以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗
CD28抗體)刺激之T細胞,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如3
H-胸腺嘧啶核苷摻入法、BrdU摻入法或CFSE法,諸如以下實施例3所述)評估。於一特定具體實施例中,細胞增殖如以下實施例3所述評估。
在某些態樣中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段增加細胞(例如T細胞,諸如CD4及CD8效應子T細胞)之存活。於一特定具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加存活,此相對於僅以T細胞促分裂原刺激之T細胞。細胞存活分析如本領域中所述(例如台盼藍染色法(trypan blue exclusion assay))且可由發明所屬技術領域中具有通常知識者輕易進行。
在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段增加細胞存活(例如T細胞,諸如CD4及CD8效應子T細胞)至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、
70倍、80倍、90倍或100倍,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如台盼藍染色法(trypan blue exclusion assay)),相對於無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之細胞存活評估。在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段增加細胞存活(例如T細胞,諸如CD4及CD8效應子T細胞)至少約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如台盼藍染色法(trypan blue exclusion assay)),相對於無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之細胞存活評估。
在一些具體實施例中,以T細胞促分裂原(例如抗CD3抗體或巴豆酯)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞存活至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍,此相對於僅以T細
胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如台盼藍染色法(trypan blue exclusion assay))評估。在一些具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞存活至少約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%,此相對於僅以T細胞促分裂原刺激之T細胞,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如台盼藍染色法(trypan blue exclusion assay))評估。
在某些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段保護效應子T細胞(例如CD4+
及CD8+
效應子T細胞)免於活化-誘導性細胞死亡。在一些具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段誘導效應子T細胞(例如CD4+
及CD8+
效應子T細胞)對Treg-媒介之抑制之抗性。
在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段誘導、增強或增加細胞激素產生(例如IL-2、IL-6、IL-10、TNF-α及IFN-γ)至少約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%,此由本文所述之方法(見以下實施例,諸如實施例3)或發明所屬技術領域中具有通常知識者已知之方法,相對於在無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之細胞激素產生評估。在特定具體實施例中,免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段誘導或增強細胞激素產生(例如IL-2、IL-6、IL-10、TNF-α及IFN-γ)至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍,由本文所述之方法(見以下實施例,諸如實施例3)或發明所屬技術領域中具有通常知識者已知之方法,相對於在無任何抗體或有不相關抗體(例如不會免疫特異性結合GITR之抗體),有或無GITRL(例如,人類GITRL)刺激存在下之細胞激素產生評估。
在某些具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或
佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞激素產生(例如IL-2、IL-6、IL-10、TNF-α及IFN-γ)至少約5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、98%或99%,此相對於僅以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如ELISA分析或如以下實施例中所述)評估。在一些具體實施例中,以T細胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞(例如CD4+
或CD8+
效應子T細胞)在免疫特異性結合GITR(例如,人類GITR)之本文所述抗體或其片段存在下,已增加細胞激素產生(例如IL-2、IL-6、IL-10、TNF-α及IFN-γ)至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍,此相對於僅以T細
胞促分裂原或T細胞受體複合物刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)刺激之T細胞,由本文所述之方法或發明所屬技術領域中具有通常知識者已知之方法(例如ELISA分析或如以下實施例中所述)評估。
在某些具體實施例中,抗GITR抗體或其抗原結合片段在無TCR促效劑(例如抗CD3抗體)存在下,誘導、增強或活化GITR之活性。GITR活性可藉由測量典型及非典型NF-κB途徑之活化評估。GITR活性可藉由測量TRAF接合子媒介之訊號途徑之活化評估。TRAF接合子選自下列所組成群組:TRAF1、TRAF2、TRAF3、TRAF4及TRAF5。GITR活性可藉由測量MAPK/ERK途徑(亦稱為Ras-Raf-MEK-ERK途徑)之活化評估。“TCR促效劑”的例子包括但不限於靶向T細胞受體複合物(例如抗CD3抗體)之抗體及結合人類白血球抗原,例如第I型MHC及第II型MHC之胜肽,其中胜肽源自自身、突變之自身或病原體相關之蛋白質(例如病毒或細菌)。
抗GITR抗體或其抗原-結合片段可融合或共軛(例如共價或非共價鍵結)至可偵測標籤或物質。可偵測標籤或物質的例子包括酵素標籤,諸如葡萄糖氧化酶;放射性同位素,諸如碘(125
I、121
I)、碳(14
C)、硫(35
S)、氚(3
H)、銦(121
In)及鎝(99
Tc);發光標籤,諸如流明諾;且螢光標籤,諸如螢光素及玫瑰紅及生
物素。此經標幟之抗體或抗原-結合片段可用以偵測GITR(例如,人類GITR)蛋白質。見例如以下章節5.4.2。
5.2 抗體產生
免疫特異性結合GITR(例如,人類GITR)之抗體或其片段可由本領域已知的任何合成抗體方法產生,例如,由化學合成或由重組表現技術。本文所述之方法應用,除非另有指明,分子生物學、微生物學、遺傳分析、重組DNA、有機化學、生物化學、PCR、寡核苷酸合成及修飾、核酸雜交及技術領域中相關領域的習知技術。這些技術描述於,例如,本文引用之文獻且於文獻中完整解釋。見例如Maniatis T et al.,(1982)Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press;Sambrook J et al.,(1989),Molecular Cloning:A Laboratory Manual,Second Edition,Cold Spring Harbor Laboratory Press;Sambrook J et al.,(2001)Molecular Cloning:A Laboratory Manual,Cold Spring Harbor Laboratory Press,Cold Spring Harbor,NY;Ausubel FM et al.,Current Protocols in Molecular Biology,John Wiley & Sons(1987 and annual updates);Current Protocols in Immunology,John Wiley & Sons(1987 and annual updates)Gait(ed.)(1984)Oligonucleotide Synthesis:A Practical Approach,IRL Press;Eckstein(ed.)(1991)Oligonucleotides and Analogues:A
Practical Approach,IRL Press;Birren B et al.,(eds.)(1999)Genome Analysis:A Laboratory Manual,Cold Spring Harbor Laboratory Press。
於一特定具體實施例中,本文所述抗體為由任何涉及創造之手段,例如透過DNA序列之合成、基因工程而製備、表現、創造或單離之抗體(例如重組抗體)。在某些具體實施例中,此抗體包括未在動物或哺乳動物(例如人類)活體內之抗體種系譜中天然存在的序列(例如DNA序列或胺基酸序列)。
在某一態樣中,本文提供製造免疫特異性結合GITR(例如,人類GITR)之抗體或其抗原-結合片段之方法,其包括培養細胞或本文所述之宿主細胞。在某一態樣中,本文提供製造免疫特異性結合GITR(例如,人類GITR)之抗體或其抗原-結合片段之方法,其包括使用細胞或本文所述之宿主細胞(例如細胞或宿主細胞,其包括編碼本文所述抗體之多核苷酸)表現(例如重組表現)抗體或其抗原-結合片段。於一特別具體實施例中,細胞為經單離之細胞。於一特別具體實施例中,外源性多核苷酸已經導入至細胞中。於一特別具體實施例中,方法進一步包括純化從細胞或宿主細胞獲得之抗體或其抗原-結合片段的步驟。
產生多株抗體之方法為本領域已知(見,例如Short Protocols in Molecular Biology,(2002)5th Ed.,Ausubel FM et al.,eds.,John Wiley and Sons,New York中
第11章)。
單株抗體可使用本領域中已知的各種技術製備,包括使用融合瘤、重組及噬菌體顯示技術或其組合。舉例來說,單株抗體可使用融合瘤技術產生,包括本領域已知且教示的技術,例如,Harlow E & Lane D,Antibodies:A Laboratory Manual,(Cold Spring Harbor Laboratory Press,2nd ed.1988);Hammerling GJ et al.,in:Monoclonal Antibodies and T-細胞Hybridomas 563 681(Elsevier,N.Y.,1981)。本文所用之術語“單株抗體”不限於由融合瘤技術產生之抗體。舉例來說,單株抗體可從外源表現本文所述抗體或其片段之宿主細胞重組產生,(例如,此抗體之輕鏈及/或重鏈)。
在特定具體實施例中,如本文所使用之“單株抗體”為單一細胞(例如生產重組抗體之融合瘤或宿主細胞)所產生之抗體,其中由例如ELISA或本領域已知或本文實施例提供之其他抗原-結合或競爭性結合分析,確定抗體免疫特異性結合GITR(例如,人類GITR)。於特別具體實施例中,單株抗體可為嵌合抗體或擬人化抗體。在某些具體實施例中,單株抗體為單價抗體或多價(例如雙價)抗體。於特別具體實施例中,單株抗體為單特異性或多特異性抗體(例如雙特異性抗體)。本文所述單株抗體可例如,由Kohler G & Milstein C(1975)Nature 256:495所述之融合瘤方法製造或可例如使用例如本文所述之技術從噬菌體庫單離。其他製備選殖細胞株及從而
表現之單株抗體之方法為本領域中廣知(見,例如,上述Short Protocols in Molecular Biology,(2002)5th Ed.,Ausubel FM et al.,中第11章)。
使用融合瘤技術產生及篩選特定抗體之方法為本領域中常規且廣知。舉例來說,在融合瘤方法中,小鼠或其他適當的宿主動物,諸如綿羊、山羊、兔、大鼠、倉鼠或獼猴,經免疫以引出產生或能夠產生將特異性結合用於免疫之蛋白質(例如GITR(例如,人類GITR))的抗體之淋巴球。或者,活體外可免疫淋巴球。淋巴球之後使用適當融合劑(諸如聚乙二醇)與骨髓瘤細胞融合以形成融合瘤細胞(Goding JW(Ed),Monoclonal Antibodies:Principles及Practice,pp.59-103(Academic Press,1986))。此外,可使用RIMMS(多位點重複免疫)技術免疫動物(Kilpatrick KE et al.,(1997)Hybridoma 16:381-9,其全文以引用方式併入)。
在一些具體實施例中,小鼠(或其他動物,諸如大鼠、猴、驢、豬、綿羊、倉鼠或狗)可以抗原(例如GITR(例如,人類GITR))免疫且一旦偵測到免疫反應,例如特異性對抗原之抗體在小鼠血清中偵測到,收集小鼠脾臟且單離脾細胞。脾細胞之後以廣知的技術融合至任何適當的骨髓瘤細胞,例如來自細胞株SP20(得自American Type Culture Collection(ATCC®
)(Manassas,VA)的細胞,以形成融合瘤。以有限的稀釋選擇及選殖融合瘤。在某些具體實施例中,收集經免疫小鼠之淋巴結
且與NS0骨髓瘤細胞融合。
因而製備的融合瘤細胞種且生長在適當的培養基,其較佳地包含一或多種物質能夠抑制未融合之親代骨髓瘤細胞的生長或存活。舉例來說,若親代骨髓瘤細胞缺少酵素次黃嘌呤鳥嘌呤磷酸核糖轉移酶(HGPRT或HPRT),融合瘤之培養基典型將包括次黃嘌呤、胺喋呤及胸腺嘧啶核苷(HAT介質),該物質避免HGPRT-缺陷之細胞生長。
特定具體實施例應用有效融合之骨髓瘤細胞支持藉由所選之抗體-生產細胞穩定大量產生抗體,且對介質,諸如HAT介質敏感。在這些骨髓瘤細胞株中,鼠科骨髓瘤株,諸如NS0細胞株或源自MOPC-21及MPC-11小鼠腫瘤者得自Salk Institute細胞Distribution Center,San Diego,CA,USA,而SP-2或X63-Ag8.653細胞得自American Type Culture Collection,Rockville,MD,USA。人類骨髓瘤及小鼠-人類雜骨髓瘤細胞株亦經描述為產生人類單株抗體(Kozbor D(1984)J Immunol 133:3001-5;Brodeur et al.,Monoclonal Antibody Production技術and Applications,pp.51-63(Marcel Dekker,Inc.,New York,1987))。
為了針對GITR(例如,人類GITR)之單株抗體的產生,分析融合瘤細胞生長於其中之培養基。融合瘤細胞所產生之單株抗體的結合特異性由本領域中已知的方法確定,例如,免疫沉澱法或活體外結合分析,諸如放射
性免疫分析(RIA)或酵素-連結免疫吸附分析法(ELISA)。
在鑑定產生所欲特異性、親和性及/或活性之抗體的融合瘤細胞之後,可將選殖株藉由有限之稀釋程序次選殖且藉由標準方法(上述Goding JW(Ed),Monoclonal Antibodies:Principles and Practice)生長。針對此目的的適當培養基包括,例如,D-MEM或RPMI 1640介質。此外,融合瘤細胞可為動物中的腹水性腫瘤在活體內生長。
次選殖株所分泌之單株抗體可適當地自培養基、腹水或血清藉由習知免疫球蛋白純化程序,諸如,例如,蛋白質A-瓊脂糖、羥基磷灰石層析法、膠體電泳、透析或親和性層析法來分離。
本文所述抗體包括辨識特定GITR(例如,人類GITR)之抗體片段且可由發明所屬技術領域中具有通常知識者已知的任何技術產生。舉例來說,本文所述之Fab及F(ab’)2
片段可使用酵素諸如木瓜酵素(以產生Fab片段)或胃蛋白酶(以產生F(ab’)2
片段)由免疫球蛋白分子之蛋白酶切割產生。Fab片段對應抗體分子二相同臂之一者且包含與重鏈之VH及CH1功能域配對的完整輕鏈。F(ab’)2
片段包含抗體分子之二抗原-結合臂,由鉸鏈區中二硫化物鍵連結。
再者,本文所述抗體或其抗原-結合片段亦可使用各種本領域已知的噬菌體顯示方法產生。在噬菌體顯
示方法,功能性抗體功能域被顯示在噬菌體粒子(其攜帶編碼彼等的多核苷酸序列)表面。特別是,編碼VH及VL功能域之DNA序列自動物cDNA庫(例如,受影響組織的人類或鼠科cDNA庫)被放大。編碼VH及VL功能域之DNA藉由PCR與scFv連接子一起被重組且選殖到噬粒載體。載體經電穿孔到大腸桿菌(E.coli)且以輔助噬菌體感染大腸桿菌(E.coli)。這些方法中所使用之噬菌體典型為絲狀噬菌體,包括fd及M13,且VH及VL功能域通常重組融合至噬菌體基因III或基因VIII。表現結合特別抗原之抗原結合功能域的噬菌體可以抗原,例如使用經標幟之抗原或鍵結或捕捉至固體表面或珠粒的抗原,選擇或辨識。可使用來製造本文所述抗體之噬菌體顯示方法的例子包括描述於Brinkman U et al.,(1995)J Immunol Methods 182:41-50;Ames RS et al.,(1995)J Immunol Methods 184:177-186;Kettleborough CA et al.,(1994)Eur J Immunol 24:952-958;Persic L et al.,(1997)Gene 187:9-18;Burton DR & Barbas CF(1994)Advan Immunol 57:191-280;PCT申請案號PCT/GB91/001134;國際公開案號WO 90/02809、WO 91/10737、WO 92/01047、WO 92/18619、WO 93/1 1236、WO 95/15982、WO 95/20401及WO 97/13844;且U.S.專利號5,698,426、5,223,409、5,403,484、5,580,717、5,427,908、5,750,753、5,821,047、5,571,698、5,427,908、5,516,637、5,780,225、5,658,727、5,733,743
及5,969,108之彼等。
如上述文獻所述,噬菌體選擇之後,來自噬菌體的抗體編碼區可經經單離且用於產生整個抗體,包括人類抗體或任何其他所欲抗原結合片段,並表現在任何所欲宿主,包括哺乳動物細胞、昆蟲細胞、植物細胞、酵母菌及細菌,例如所下所述。重組產生抗體片段,諸如Fab、Fab’及F(ab’)2
片段之技術亦可使用本領域已知的方法,諸如下述揭露的彼等:PCT公開案號WO 92/22324;Mullinax RL et al.,(1992)Bio技術12(6):864-9;Sawai H et al.,(1995)Am J Reprod Immunol 34:26-34;且Better M et al.,(1988)Science 240:1041-1043運用。
於一態樣中,為了產生整個抗體,包括VH或VL核苷酸序列之PCR引子、限制位及保護限制位之毗鄰序列可用以從模板(例如scFv選殖株)放大VH或VL序列。利用發明所屬技術領域中具有通常知識者已知的選殖技術,PCR放大之VH功能域可被選殖到表現VH恆定區之載體,而PCR放大之VL功能域可被選殖到表現VL恆定區(例如,人類卡帕(kappa)或拉姆達(lambda)恆定區)之載體。VH及VL功能域亦可被選殖到表現必需恆定區的一載體。使用發明所屬技術領域中具有通常知識者已知的技術,重鏈轉化載體及輕鏈轉化載體之後被共轉染至細胞株以產生表現全長抗體,例如IgG之穩定或短暫細胞株。
嵌合抗體為分子,其中抗體不同部分源自不
同免疫球蛋白分子。舉例來說,嵌合抗體可包含小鼠或大鼠單株抗體的可變區融合至人類抗體恆定區。產生嵌合抗體之方法為本領域中已知。見例如Morrison SL(1985)Science 229:1202-7;Oi VT & Morrison SL(1986)Bio技術4:214-221;Gillies SD et al.,(1989)J Immunol Methods 125:191-202;且U.S.專利號5,807,715、4,816,567、4,816,397及6,331,415。
擬人化抗體能夠結合預確定之抗原且包括框架區,其具有實質上人類免疫球蛋白之胺基酸序列,而CDR具有實質上非人類免疫球蛋白(例如鼠科免疫球蛋白)之胺基酸序列。於特別具體實施例中,擬人化抗體亦包括至少之部分免疫球蛋白恆定區(Fc),典型為人類免疫球蛋白者。抗體亦可包括重鏈之CH1、鉸鏈、CH2、CH3及CH4區。擬人化抗體可為選自任何類型之免疫球蛋白,包括IgM、IgG、IgD、IgA及IgE及任何同型,包括IgG1
、IgG2
、IgG3
及IgG4
。擬人化抗體可使用本領域中已知各種技術產生,包括但不限於,CDR-移植(歐洲專利號EP 239400;國際公開案號WO 91/09967;且U.S.專利號5,225,539、5,530,101及5,585,089),貼面(veneering)或重鋪(resurfacing)(歐洲專利號EP 592106及EP 519596;Padlan EA(1991)Mol Immunol 28(4/5):489-498;Studnicka GM et al.,(1994)Prot Engineering 7(6):805-814;且Roguska MA et al.,(1994)PNAS 91:969-973),鏈置換(chain
shuffling)(U.S.專利號5,565,332)及揭露於例如U.S.Pat.No.6,407,213、U.S.Pat.No.5,766,886、國際公開案號WO 93/17105;Tan P et al.,(2002)J Immunol 169:1119-25;Caldas C et al.,(2000)Protein Eng.13(5):353-60;Morea V et al.,(2000)Methods 20(3):267-79;Baca M et al.,(1997)J Biol Chem 272(16):10678-84;Roguska MA et al.,(1996)Protein Eng 9(10):895 904;Couto JR et al.,(1995)Cancer Res.55(23 Supp):5973s-5977s;Couto JR et al.,(1995)Cancer Res 55(8):1717-22;Sandhu JS(1994)Gene 150(2):409-10及Pedersen JT et al.,(1994)J Mol Biol 235(3):959-73之技術。亦見U.S.申請公開案號US 2005/0042664 A1(Feb.24,2005)其整體以引用方式併入本文。
製造多特異性(例如雙特異性抗體)之方法已描述於見,例如,U.S.專利號7,951,917;7,183,076;8,227,577;5,837,242;5,989,830;5,869,620;6,132,992及8,586,713。
單功能域抗體,例如,缺少輕鏈之抗體,可由本領域中廣知的方法產生。見Riechmann L & Muyldermans S(1999)J Immunol 231:25-38;Nuttall SD et al.,(2000)Curr Pharm Biotechnol 1(3):253-263;Muyldermans S,(2001)J Biotechnol 74(4):277-302;U.S.專利號6,005,079;且國際公開案號WO
94/04678、WO 94/25591及WO 01/44301。
再者,免疫特異性結合GITR抗原之抗體可接著被用於產生“模擬”抗原之抗個體遺傳型抗體,使用發明所屬技術領域中具有通常知識者廣知的方法。(見例如Greenspan NS & Bona CA(1989)FASEB J 7(5):437-444;且Nissinoff A(1991)J Immunol 147(8):2429-2438)。
於特別具體實施例中,同本文所述抗GITR抗體,結合GITR(例如,人類GITR)的相同表位之本文所述抗體為人類抗體或其抗原-結合片段。於特別具體實施例中,競爭性阻擋(例如以劑量依賴性方式)本文所述抗體之任一(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160、pab2161或Hum231#2w)結合GITR(例如,人類GITR)之本文所述抗體為人類抗體或其抗原-結合片段。人類抗體可使用本領域中已知之任何方法產生。舉例來說,可使用基因轉殖小鼠,其不能表現功能性內源免疫球蛋白,但可表現人類免疫球蛋白基因。特別是,人類重及輕鏈免疫球蛋白基因複合物可隨機或同源重組導入小鼠胚胎幹細胞。或者,除了人類重及輕鏈基因之外,人類可變區、恆定區及多樣區可被導入小鼠胚胎幹細胞。小鼠重
及輕鏈免疫球蛋白基因可分別或與由同源重組導入人類免疫球蛋白基因座的同時變得無功能。特別是,JH區同型接合(homozygous)缺失避免內源性抗體產生。經修飾之胚胎幹細胞經擴張及顯微注射至囊胚以產生嵌合小鼠。之後飼養嵌合小鼠以產生表現人類抗體之同型接合(homozygous)後代。基因轉殖小鼠以正常方用選定之抗原,例如全部或部分抗原(例如GITR)免疫。可從經免疫、基因轉殖小鼠,使用習知融合瘤技術,獲得針對抗原之單株抗體。基因轉殖小鼠所帶有的人類免疫球蛋白轉基因在B細胞分化期間重排,且之後經歷種類轉換及體突變。因此,使用此等技術,可能產生治療有用之IgG、IgA、IgM及IgE抗體。對產生人類抗體此項技術的綜述,見Lonberg N & Huszar D(1995)Int Rev Immunol 13:65-93。對產生人類抗體與人類單株抗體此項技術及生產此抗體的程序的細節討論,見例如國際公開案號WO 98/24893、WO 96/34096及WO 96/33735;且U.S.專利號5,413,923、5,625,126、5,633,425、5,569,825、5,661,016、5,545,806、5,814,318及5,939,598。能夠產生人類抗體小鼠的例子包括XenomouseTM
(Abgenix,Inc.;U.S.專利號6,075,181及6,150,184)、HuAb-MouseTM
(Mederex,Inc./Gen Pharm;U.S.專利號5,545,806及5,569,825)、Trans Chromo MouseTM
(Kirin)及KM MouseTM
(Medarex/Kirin)。
特異性結合GITR(例如,人類GITR)之人
類抗體可由各種本領域已知的方法製造,包括上述噬菌體顯示方法,使用源自人類免疫球蛋白序列之抗體庫。亦見U.S.專利號4,444,887、4,716,111及5,885,793;且國際公開案號WO 98/46645、WO 98/50433、WO 98/24893、WO 98/16654、WO 96/34096、WO 96/33735及WO 91/10741。
在一些具體實施例中,可使用小鼠-人類融合瘤產生人類抗體。舉例而言,與艾司坦氏-巴爾氏病毒(EBV)轉形之人類周邊血淋巴球可與小鼠骨髓瘤細胞融合以產生分泌人類單株抗體之小鼠-人類融合瘤,且該些小鼠-人類融合瘤可被篩選確定分泌免疫特異性結合標的抗原(例如GITR(例如,人類GITR))之人類單株抗體者。此方法已知且述於本領域中,見例如Shinmoto H et al.,(2004)Cytotechnology 46:19-23;Naganawa Y et al.,(2005)Human Antibodies 14:27-31。
5.2.1 多核苷酸
在某些態樣中,本文提供為多核苷酸,其包括編碼免疫特異性結合GITR(例如,人類GITR)抗原之本文所述抗體或其片段(例如可變輕鏈區及/或可變重鏈區)之核苷酸序列,及載體,例如包括此多核苷酸之載體,用於在宿主細胞(例如大腸桿菌(E.coli)及哺乳動物細胞)重組表現。本文提供為多核苷酸,其包括編碼本文提供之抗體任一的核苷酸序列,以及載體,其包括此多
核苷酸序列,例如其有效表現於宿主細胞,例如哺乳動物細胞之表現載體。
如本文所使用,“經單離之”多核苷酸或核酸分子為存在於核酸分子之天然來源(例如在小鼠或人類)的其他核酸分子分離出來者。再者,“經單離之”核酸分子,諸如cDNA分子,可為實質上無其他細胞性材料或當由重組技術產生時,無培養基,或當化學合成時實質上無化學前驅物或其他化學品。舉例來說,文字“實質上無”包括製備具有少於約15%、10%、5%、2%、1%、0.5%或0.1%(特別是少於約10%)之其他材料,例如細胞性材料、培養基、其他核酸分子、化學前驅物及/或其他化學品,之多核苷酸或核酸分子。於一特定具體實施例中,編碼本文所述抗體之核酸分子(群)經單離或經純化。
在特別態樣中,本文提供為多核苷酸,其包括編碼免疫特異性結合GITR多胜肽(例如,人類GITR)且包括本文所述之胺基酸序列之抗體或其抗原-結合片段之核苷酸序列,以及抗體,其與結合GITR多胜肽(例如以劑量依賴性方式)之此抗體競爭,或與此抗體相同結合相同表位。
在某些態樣中,本文提供為多核苷酸,其包括編碼本文所述抗體輕鏈或重鏈之核苷酸序列。多核苷酸可包括編碼輕鏈(包括本文所述抗體之VL FR及CDR(見例如表1及3))之核苷酸序列。多核苷酸可包括編碼重鏈(包括本文所述抗體之VH FR及CDR(見例如表
2及4))之核苷酸序列。在特定具體實施例中,本文所述之多核苷酸編碼VL功能域,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:202、204、205、207、208及400至518。在特定具體實施例中,本文所述之多核苷酸編碼VL功能域,其包括SEQ ID NO:519之胺基酸序列。在特定具體實施例中,本文所述之多核苷酸編碼VH功能域,其包括選自下列所組成群組之胺基酸序列:SEQ ID NO:201、203、206及215至389。在特定具體實施例中,本文所述之多核苷酸編碼VL功能域,其包括抗體231-32-15、Hum231#1或Hum231#2(例如SEQ ID NO:202、207或208)任一之胺基酸序列。在特定具體實施例中,本文所述之多核苷酸編碼VH功能域,其包括抗體231-32-15、Hum231#1或Hum231#2(例如SEQ ID NO:201或206)任一之胺基酸序列。在特定具體實施例中,本文所述之多核苷酸編碼VL功能域以及VH功能域,其包括抗體231-32-15、Hum231#1或Hum231#2(例如SEQ ID NO:201-202及/或206-208)任一之胺基酸序列。
在特別具體實施例中,本文提供為多核苷酸,其包括編碼包括三個VL鏈CDR,例如包含本文所述抗體任一之VL CDR1、VL CDR2及VL CDR3(例如見表1,例如,表1之一列中的VL CDR)的抗GITR抗體之核苷酸序列。在特定具體實施例中,本文提供為多核苷酸,其包括三VH鏈CDR,例如包含本文所述抗體任一之VH
CDR1、VH CDR2及VH CDR3(例如見表2,例如,表2之一列中的VH CDR)。在特定具體實施例中,本文提供為多核苷酸,其包括編碼抗GITR抗體之核苷酸序列,該抗體包括三個VH鏈CDR,例如包含本文所述抗體任一之VL CDR1、VL CDR2及VL CDR3(例如見表1,例如表1之一列中的VL CDR)及三個VH鏈CDR,例如包含本文所述抗體任一之VH CDR1、VH CDR2及VH CDR3(例如見表2,例如表2之一列中的VH CDR)。在特定具體實施例中,本文所述之多核苷酸編碼抗體231-32-15、Hum231#1或Hum231#2(例如SEQ ID NO:16、17或18)任一之VL CDR。在特定具體實施例中,本文所述之多核苷酸編碼抗體231-32-15、Hum231#1或Hum231#2(例如SEQ ID NO:13、14或15)任一之VH CDR。在特定具體實施例中,本文所述之多核苷酸編碼抗體231-32-15、Hum231#1或Hum231#2(例如SEQ ID NO:13-18)任一之VL CDR及VH CDR。
在特別具體實施例中,本文提供為多核苷酸,其包括編碼抗GITR抗體之核苷酸序列,抗體包括VL功能域,例如包含FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,包括本文所述之胺基酸序列(例如見表1及3,例如表中按名稱所辨識特別抗體的VL CDR及VL FR)。在特定具體實施例中,本文提供為多核苷酸,其包括編碼抗GITR抗體之核苷酸序列,抗體包括VH功能域,例如包含FR1-CDR1-FR2-CDR2-FR3-CDR3-FR4,包括本文所述
之胺基酸序列(例如見表2及4,例如表中按名稱所辨識特別抗體的VH CDR及VH FR)。
在某些具體實施例中,本文所述之多核苷酸包括編碼本文提供抗體之核苷酸序列,抗體包括輕鏈可變區,其包括本文所述之胺基酸序列(例如SEQ ID NO:202、204、205、207、208及400至518或SEQ ID NO:519),其中抗體免疫特異性結合GITR(例如,人類GITR)。在某一具體實施例中,本文所述之多核苷酸包括編碼本文提供抗體Hum231#1或Hum231#2或Hum231#2w之核苷酸序列,抗體包括輕鏈可變區,其包括本文所述之胺基酸序列(例如SEQ ID NO:207或208)。
在某些具體實施例中,本文所述之多核苷酸包括編碼本文提供抗體之核苷酸序列,抗體包括重鏈可變區,其包括本文所述之胺基酸序列(例如SEQ ID NO:201、203、206及215至389),其中抗體免疫特異性結合GITR(例如,人類GITR)。在某一具體實施例中,本文所述之多核苷酸包括編碼本文提供之抗體Hum231#1,Hum231#2 or Hum231#2w之核苷酸序列,抗體包括重鏈可變區,其包括本文所述之胺基酸序列(例如SEQ ID NO:206)。
在某些態樣中,多核苷酸包括編碼本文所述抗體之核苷酸序列,抗體包括VL功能域,其包括具有本文所述之胺基酸序列(例如見表3,例如表之一列中的框
架區)之一或多VL FR,其中抗體免疫特異性結合GITR(例如,人類GITR)。在某些態樣中,多核苷酸包括編碼本文所述抗體之核苷酸序列,抗體包括VH功能域,其包括具有本文所述之胺基酸序列(例如見表4,例如表之一列中的框架區)之一或多VH FR,其中抗體免疫特異性結合GITR(例如,人類GITR)。
在特定具體實施例中,本文提供之多核苷酸包括編碼本文所述抗體之核苷酸序列,抗體包含:為人類框架區之框架區(例如VL功能域及VH功能域之框架區),其中抗體免疫特異性結合GITR(例如,人類GITR)。在某些具體實施例中,本文提供之多核苷酸包括編碼述於上述章節5.1之抗體或其片段(例如CDR或可變功能域)之核苷酸序列。
於特定態樣中,本文提供為多核苷酸,其包括編碼抗體之核苷酸序列,抗體包括輕鏈及重鏈,例如分別的輕鏈及重鏈。關於輕鏈,於一特定具體實施例中,本文提供之多核苷酸包括編碼卡帕(kappa)輕鏈之核苷酸序列。在另一特定具體實施例中,本文提供之多核苷酸包括編碼拉姆達(lambda)輕鏈之核苷酸序列。於又另一特定具體實施例中,本文提供之多核苷酸包括編碼包括人類卡帕(kappa)輕鏈或人類拉姆達(lambda)輕鏈的本文所述抗體之核苷酸序列。於一特別具體實施例中,本文提供之多核苷酸包括編碼本文所述免疫特異性結合GITR(例如,人類GITR)之抗體的核苷酸序列,其中該抗體
包括輕鏈,且其中VL功能域之胺基酸序列可包括本文所述之任何胺基酸序列(例如SEQ ID NO:202、204、205、207、208及400至518或SEQ ID NO:519),且其中輕鏈之恆定區包括人類卡帕(kappa)輕鏈恆定區之胺基酸序列。於另一特別具體實施例中,本文提供之多核苷酸包括編碼本文所述免疫特異性結合GITR(例如,人類GITR)且包括輕鏈之抗體的核苷酸序列,其中VL功能域之胺基酸序列可包括本文所述之任何胺基酸序列(例如SEQ ID NO:202、204、205、207、208及400至518或SEQ ID NO:519),且其中輕鏈之恆定區包括人類拉姆達(lambda)輕鏈恆定區之胺基酸序列。舉例而言,人類恆定區序列可為述於U.S.專利號5,693,780者。
於一特別具體實施例中,本文提供之多核苷酸包括編碼本文所述免疫特異性結合GITR(例如,人類GITR)之抗體的核苷酸序列,其中該抗體包括重鏈,其中VH功能域之胺基酸序列可包括本文所述之任何胺基酸序列(例如SEQ ID NO:201、203、206及215至389),且其中重鏈之恆定區包括人類加馬(γ)重鏈恆定區之胺基酸序列。
在某一具體實施例中,本文提供之多核苷酸包括編碼免疫特異性結合GITR(例如,人類GITR)的本文所述抗體(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、
pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107,諸如針對VH功能域,SEQ ID NO:209或800-974,或針對VL功能域,SEQ ID NO:210、211或1001-1126)之VH功能域及/或VL功能域的核苷酸序列(群)。在某一具體實施例中,本文提供之多核苷酸包括編碼免疫特異性結合GITR(例如,人類GITR)之本文所述抗體(例如Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160或pab2161,諸如針對VH功能域,SEQ ID NO:209或800-974,或針對VL功能域,SEQ ID NO:210、211或1000-1118)的VH功能域及/或VL功能域之核苷酸序列(群)。在某一具體實施例中,本文提供之多核苷酸包括編碼抗體Hum231#1或Hum231#之VH功能域及/或VL功能域(例如SEQ ID NO:209-211)之核苷酸序列(群)。
於又另一特定具體實施例中,本文提供之多核苷酸包括編碼免疫特異性結合GITR(例如,人類GITR)的本文所述抗體(或其抗原-結合片段)之核苷酸序列,其中該抗體包括包含本文所述之任何胺基酸序列的VL功能域以及VH功能域,且其中恆定區包括人類IgG1
(例如異型1、17或3)或人類IgG4
恆定區的胺基酸序
列。
於一特定具體實施例中,本文提供為多核苷酸,其包括編碼抗GITR抗體或其抗原-結合片段或功能域,如本文所指定,見例如表1-4,例如抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15或抗體1-107或抗體pab2159、pab2160、pab2161或Hum231#2w之核苷酸序列。
再者,本文提供為編碼例如由密碼子/RNA最佳化、以異源訊號序列取代及減少mRNA不穩定元素而最佳化之抗GITR抗體或其片段的多核苷酸。藉由導入密碼子改變及/或消除mRNA中抑制區而產生編碼抗GITR抗體或其片段(例如輕鏈、重鏈、VH功能域或VL功能域)重組表現最佳化之核酸的方法可因而由適用例如U.S.專利號5,965,726;6,174,666;6,291,664;6,414,132;且6,794,498所述之最佳化方法進行。舉例來說,RNA中潛在剪接位點及不穩定元素(例如A/T或A/U豐富之元素)可經突變而不會改變核酸序列編碼之胺基酸,以增加RNA穩定性重組表現。改變利用遺傳密碼之退化,例如對相同胺基酸使用替代密碼子。在一些具體實施例中,可期望改變一或多密碼子以編碼保留性突變,例如與原胺基酸具有類似化學結構及特性及/或功能之類似胺基酸。此
方法可增加抗GITR抗體或其片段表現至少1倍、2倍、3倍、4倍、5倍、10倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍或100倍或更多,此為相對於未經最佳化多核苷酸編碼之抗GITR抗體的表現。
在某些具體實施例中,編碼本文所述抗GITR抗體或其片段(例如VL功能域及/或VH功能域)之最佳化多核苷酸序列可與編碼本文所述抗GITR抗體或其片段(例如VL功能域及/或VH功能域)的未最佳化多核苷酸序列之反義(例如互補)多核苷酸雜交。在特定具體實施例中,編碼本文所述抗GITR抗體或片段之最佳化核苷酸序列在高度嚴苛條件下與編碼本文所述抗GITR抗體或其片段的未最佳化多核苷酸序列之反義多核苷酸雜交。於一特定具體實施例中,編碼本文所述抗GITR抗體或其片段之最佳化核苷酸序列在高度嚴苛、中度或較低嚴苛雜交條件下與編碼本文所述抗GITR抗體或其片段的未最佳化核苷酸序列之反義多核苷酸雜交。關於雜交條件之資訊已述於,見例如U.S.專利申請公開案號US 2005/0048549(例如第72-73段),其以引用方式併入本文。
可由本領域中已知之任何方法獲得多核苷酸,且確定多核苷酸之核苷酸序列。編碼本文所述抗體,例如表1-4所述之抗體及這些抗體之修飾版本的核苷酸序列可由領域中廣知之方法確定,即以此方法組合已知編碼特別胺基酸之核苷酸密碼子以產生編碼抗體之核酸。編碼抗體之此多核苷酸可從化學合成之寡核苷酸組合(例如如
Kutmeier G et al.,(1994),Bio技術17:242-6所述),其簡言之,涉及包含藉PCR編碼抗體、彼等寡核苷酸之退火及連接、然後放大所連結之寡核苷酸的序列部分的重疊寡核苷酸合成。
或者,編碼本文所述抗體之多核苷酸可使用本領域中廣知之方法(例如PCR及其他分子選殖方法)從適當來源(例如融合瘤)之核酸產生。舉例來說,使用與已知序列之3’及5端可雜交的合成引子之PCR放大可使用得自生產有興趣抗體之融合瘤細胞的基因體DNA進行。可使用此PCR放大方法獲得核酸,其包括編碼抗體之輕鏈及/或重鏈的序列。可使用此PCR放大方法獲得核酸,其包括編碼抗體可變輕鏈區及/或可變重鏈區之序列。可選殖放大之核酸至載體,以在宿主細胞表現及進一步選殖,例如,產生嵌合及擬人化抗體。
若包含編碼特別抗體的核酸之選殖株無法獲得,但抗體分子之序列已知,則編碼免疫球蛋白之核酸可化學合成或得自適當來源(例如抗體cDNA庫或得自下述的cDNA庫,或自下述單離之核酸,較佳地為多A+RNA:表現抗體之任何組織或細胞,諸如選擇表現本文所述抗體之融合瘤細胞),藉由PCR放大,使用可雜交至序列3’及5’端的合成引子,或藉由選殖,使用特異性針對特別基因序列之寡核苷酸探針以從cDNA庫識別,例如編碼抗體的cDNA選殖株。PCR產生的放大核酸之後可使用本領域中廣知之任何方法被選殖到可複製選殖載
體。
編碼本文所述抗GITR抗體的DNA可使用習知程序(例如藉由使用能夠特異性結合編碼抗GITR抗體重及輕鏈的基因之寡核苷酸探針)輕易單離並定序。融合瘤細胞可做為此DNA的來源。一旦經單離,DNA可被置於表現載體,其之後被轉染至不產生免疫球蛋白蛋白質的宿主細胞諸如大腸桿菌(E.coli)細胞、類人猿COS細胞、中國倉鼠卵巢(CHO)細胞(例如來自CHO GS SystemTM
(Lonza)之CHO細胞)或骨髓瘤細胞,以在重組宿主細胞中獲得合成抗GITR抗體。
產生整個抗體,包括VH或VL核苷酸序列之PCR引子、限制位及保護限制位之毗鄰序列可用以放大scFv選殖株中之VH或VL序列。利用發明所屬技術領域中具有通常知識者已知的選殖技術,PCR放大之VH功能域可被選殖到表現重鏈恆定區,例如人類伽馬(gamma)4恆定區,的載體,而PCR放大之VL功能域可被選殖到表現輕鏈恆定區,例如,人類卡帕(kappa)或拉姆達恆定區,之載體。在某些具體實施例中,表現VH或VL功能域之載體包括EF-1α啟動子、分泌訊號、可變功能域之選殖位點、恆定功能域及選擇標記諸如新黴素。VH及VL功能域亦可被選殖到表現必需恆定區的一載體。使用發明所屬技術領域中具有通常知識者已知的技術,重鏈轉化載體及輕鏈轉化載體之後被共轉染到細胞株以產生表現全長抗體,例如IgG之穩定或短暫細胞株。
DNA亦可被修飾,例如,藉由以鼠科序列取代人類重及輕鏈恆定功能域之編碼序列,或藉由共價結合免疫球蛋白編碼序列之非免疫球蛋白多胜肽全部或部分的編碼序列。
亦提供為在高度嚴苛、中度或較低嚴苛雜交條件下雜交到編碼本文所述抗體之多核苷酸的多核苷酸。在特定具體實施例中,本文所述之多核苷酸在高度嚴苛、中度或較低嚴苛雜交條件下雜交到編碼本文提供之VH功能域(例如SEQ ID NO:201、203、206及215至389)及/或VL功能域(例如202、204、205、207、208及400至518或SEQ ID NO:519)的多核苷酸。
雜交條件已述於本領域中且為發明所屬技術領域中具有通常知識者已知之方法。舉例來說,在嚴苛條件下之雜交可涉及下述:對約45℃下在6x氯化鈉/檸檬酸鈉(SSC)中之濾膜結合之DNA雜交,接著在0.2xSSC/0.1% SDS中約50-65℃下一或多次洗滌;在高度嚴苛條件下的雜交可涉及下述:對約45℃下在6xSSC中之濾膜結合之核酸雜交,接著在0.1xSSC/0.2% SDS中約68℃下一或多次洗滌。在其他嚴苛雜交條件之雜交為發明所屬技術領域中具有通常知識者已知且已被描述於,見,例如,Ausubel FM et al.,eds.,(1989)Current Protocols in Molecular Biology,Vol.I,Green Publishing Associates,Inc.and John Wiley & Sons,Inc.,New York at pages 6.3.1-6.3.6及2.10.3。
5.2.2 細胞及載體
在某些態樣中,本文提供為表現(例如重組)特異性結合GITR(例如,人類GITR)之本文所述抗體(或其抗原-結合片段)的細胞(例如宿主細胞)及相關多核苷酸及表現載體。本文提供為載體(例如表現載體),其包括多核苷酸,其包括編碼抗GITR抗體或片段之核苷酸序列以重組表現在宿主細胞中,較佳地在哺乳動物細胞中。本文亦提供為宿主細胞,其包括此載體以重組表現本文所述抗GITR抗體(例如,人類或擬人化抗體)。於一特別態樣中,本文提供為產生本文所述抗體之方法,其包括從宿主細胞表現此抗體。
特異性結合GITR(例如,人類GITR)之本文所述抗體(例如本文所述全長抗體、抗體重及/或輕鏈或單鏈抗體)的重組表現涉及建構表現載體,其包含編碼抗體的多核苷酸。一旦獲得編碼本文所述之抗體分子、抗體之重及/或輕鏈或其片段(例如重及/或輕鏈可變功能域)的多核苷酸,可使用本領域中廣知的技術藉重組DNA技術產生生產抗體分子的載體。因此,本文描述藉由表現包含抗體或抗體片段(例如輕鏈或重鏈)編碼核苷酸序列的多核苷酸製備蛋白質之方法。發明所屬技術領域中具有通常知識者廣知的方法可用以建構表現載體,其包含抗體或抗體片段(例如輕鏈或重鏈)編碼序列及適當的轉錄及轉譯控制訊號。這些方法包括,例如,活體外重組
DNA技術、合成技術及活體內基因重組。亦提供為可複製載體,其包括編碼本文所述抗體分子、抗體重或輕鏈、抗體或其片段重或輕鏈可變功能域或重或輕鏈CDR之核苷酸序列,可操作地連接至啟動子。此載體可,例如,包括編碼抗體分子恆定區之核苷酸序列(見例如國際公開案號WO 86/05807及WO 89/01036;且U.S.專利號5,122,464)且抗體可變功能域可被選殖到此載體,以表現整個重鏈、整個輕鏈或整個重及輕鏈兩者。
由習知技術可轉移表現載體到細胞(例如宿主細胞),而所得細胞之後可由習知技術培養以產生本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)或其片段。因此,本文提供為宿主細胞,其包含編碼本文所述抗體或其片段或其重或輕鏈或其片段或本文所述單鏈抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)之多核苷酸,可操作
地連接至啟動子,以表現此序列在宿主細胞。在某些具體實施例中,為了表現雙鏈抗體,分別編碼重及輕鏈兩者之載體可被共表現在宿主細胞,以表現整個免疫球蛋白分子,細節如下。在某些具體實施例中,宿主細胞包含載體,其包括編碼本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)之重鏈及輕鏈兩者,或其片段的多核苷酸。在特定具體實施例中,宿主細胞包含兩種不同載體,第一載體包括編碼本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)重鏈或重鏈可變區或其片段之多核苷酸,及第二載體包括編碼本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-
107或抗體pab2159、pab2160或pab2161之CDR的抗體)輕鏈或輕鏈可變區或其片段之多核苷酸。在其他具體實施例中,第一宿主細胞包括第一載體,其包括編碼本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)重鏈或重鏈可變區或其片段之多核苷酸,而第二宿主細胞包括第二載體,其包括編碼本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)輕鏈或輕鏈可變區之多核苷酸。在特定具體實施例中,第一細胞表現的重鏈/重鏈可變區連同第二細胞的輕鏈/輕鏈可變區形成本文所述抗GITR抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或
pab2161之CDR的抗體)或其抗原-結合片段。在某些具體實施例中,本文提供為宿主細胞群,其包括此第一宿主細胞及此第二宿主細胞。
於一特別具體實施例中,本文提供為載體群,其包括第一載體,包括編碼本文所述抗GITR抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)輕鏈/輕鏈可變區的多核苷酸,及第二載體,其包括編碼本文所述抗GITR抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)重鏈/重鏈可變區的多核苷酸。
可利用各種宿主-表現載體系統表現本文所述之抗體分子(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、
pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體(見例如U.S.專利號5,807,715)。此宿主表現系統代表載具,其中可產生有興趣之編碼序列且之後純化,亦可代表當以適當核苷酸編碼序列轉形或轉染時原位表現本文所述之抗體分子的細胞。這些包括但不限於,微生物,諸如以重組噬菌體DNA轉形之細菌(例如大腸桿菌(E.coli)及枯草芽孢桿菌(B.subtilis))、包含抗體編碼序列之質體DNA或黏粒(cosmid)DNA表現載體;以包含抗體編碼序列之重組酵母菌表現載體轉形之酵母菌(例如畢赤酵母(Saccharomyces Pichia));以包含抗體編碼序列之重組病毒表現載體(例如桿狀病毒)感染之昆蟲細胞系統;以重組病毒表現載體(例如花椰菜花葉病毒(cauliflower mosaic virus)、CaMV;煙草嵌紋病毒,TMV)感染或以包含抗體編碼序列之重組質體表現載體(例如Ti質體)轉形之植物細胞系統(例如,綠藻,諸如萊茵衣藻(Chlamydomonas reinhardtii));或哺乳動物細胞系統(例如COS(例如COS1或COS)、CHO、BHK、MDCK、HEK 293、NS0、PER.C6、VERO、CRL7O3O、HsS78Bst、HeLa及NIH 3T3、HEK-293T、HepG2、SP210、R1.1、B-W、L-M、BSC1、BSC40、YB/20及BMT10細胞),其帶有包含源自哺乳動物細胞基因體之啟動子(例如金屬硫蛋白啟動子)或源自哺乳動物病毒之啟動子(例如腺病毒晚期啟動子;牛痘病毒7.5K啟動
子)的重組表現構築體。於一特定具體實施例中,表現本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)或其抗原-結合片段之細胞為CHO細胞,例如來自CHO GS SystemTM
(Lonza)之CHO細胞。於一特別具體實施例中,表現本文所述抗體之細胞為人類細胞,例如,人類細胞株。於一特定具體實施例中,哺乳動物表現載體為pOptiVECTM
或pcDNA3.3。於一特別具體實施例中,使用細菌細胞,諸如大腸桿菌(Escherichia coli)或真核細胞(例如哺乳動物細胞),特別是表現整個重組抗體分子,於表現重組抗體分子。舉例來說,哺乳動物細胞諸如中國倉鼠卵巢(CHO)細胞聯用載體,諸如來自人類細胞巨大病毒之主要中期早期基因啟動子元素為有效之抗體表現系統(Foecking MK & Hofstetter H(1986)Gene 45:101-5;且Cockett MI et al.,(1990)Biotechnology 8(7):662-7)。在某些具體實施例中,本文所述抗體為由CHO細胞或NS0細胞產生。於一特定具體實施例中,編碼免疫特異性結合GITR(例如,人類GITR)的本文所述抗體之核苷酸序列表現由組成型啟動子、可誘導啟動子或組織特異型啟動子調控。
在細菌系統,依據表現之抗體分子所欲之用途可有利地選擇許多表現載體。舉例來說,當欲產生大量的此抗體用於產生抗體分子之醫藥組成物時,引導高水平輕易純化之融合蛋白產物的表現的載體可為理想的。此載體包括但不限於大腸桿菌(E.coli)表現載體pUR278(Ruether U & Mueller-Hill B(1983)EMBO J 2:1791-1794),其中抗體編碼序列可個別連接至載體(框入lac Z編碼區),而產生融合蛋白;pIN載體(Inouye S & Inouye M(1985)Nuc Acids Res 13:3101-3109;Van Heeke G & Schuster SM(1989)J Biol Chem 24:5503-5509);等。舉例來說,pGEX載體亦可用來表現外來多胜肽群,與麩胱甘肽5-轉移酶(GST)作為融合蛋白質。一般而言,此融和蛋白質為可溶性且可輕易地從裂解細胞藉由吸附及結合基質麩胱甘肽瓊脂糖珠粒,接著在游離麩胱甘肽存在下洗提而純化。pGEX載體設計為包括凝血酶或因子Xa蛋白酶切割位點,使得所選殖之標的基因產物可從GST部分釋出。
在昆蟲系統中,例如夜蛾(Autographa californica)核型多角體病毒(AcNPV)可用作為載體來表現外來基因。病毒生長於草地夜蛾(Spodoptera frugiperda)細胞中。抗體編碼序列可個別選殖到病毒的非必需區(例如多角體蛋白基因)且在AcNPV啟動子(例如多角體蛋白啟動子)控制下放置。
在哺乳動物宿主細胞中,可利用許多病毒-為
主之表現系統。在使用腺病毒作為表現載體之例子中,有興趣之抗體編碼序列可連接到腺病毒轉錄/轉譯控制複合物,例如晚期啟動子及三方領導序列。此嵌合基因之後可由活體外或活體內重組插入腺病毒基因體。在病毒基因體非必需區(例如區E1或E3)插入會導致可行且能夠在感染宿主中表現抗體分子之重組病毒(例如見Logan J & Shenk T(1984)PNAS 81(12):3655-9)。亦可需要特定起動訊號來有效轉譯所插入的抗體編碼序列。這些訊號包括ATG啟動密碼子及相鄰序列。再者,起動密碼子必須與所欲編碼序列之讀取框同相以確保整個插入的轉譯。這些外源性轉譯控制訊號及起動密碼子可為多種來源,天然與合成兩者。表現的效能可由包括適當的轉錄增強子元素、轉錄終止子等增強(見例如Bitter G et al.,(1987)Methods Enzymol.153:516-544)。
此外,可選擇調節插入序列表現或以所欲特定方式修飾及處理基因產物之宿主細胞株。此蛋白質產物之修飾(例如醣基化)及處理(例如切割)對蛋白質功能可為重要的。不同宿主細胞對於轉譯後處理及蛋白質及基因產物之修飾具有特徵及特定機制。可選擇適當的細胞株或宿主系統以確保正確的修飾及處理表現的外來蛋白質。為此,可使用處理細胞性機械以適當處理基因產物之初級轉錄、醣基化及磷酸化的真核宿主細胞。此哺乳動物宿主細胞包括但不限於CHO、VERO、BHK、Hela、MDCK、HEK 293、NIH 3T3、W138、BT483、Hs578T、HTB2、
BT2O及T47D、NS0(不會內源性產生任何免疫球蛋白鏈的鼠科骨髓瘤細胞株)、CRL7O3O、COS(例如COS1或COS)、PER.C6、VERO、HsS78Bst、HEK-293T、HepG2、SP210、R1.1、B-W、L-M、BSC1、BSC40、YB/20、BMT10及HsS78BsT細胞。在某些具體實施例中,本文所述抗GITR抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)在哺乳動物細胞,諸如CHO細胞產生。
於一特定具體實施例中,本文所述抗體或其抗原-結合片段具有降低之岩藻糖含量或無岩藻糖含量。使用發明所屬技術領域中具有通常知識者已知的技術可製造此抗體。舉例而言,可表現抗體在缺陷或缺少岩藻糖化能力之細胞。於一特定實例中,具有剔除α1,6-岩藻糖基轉移酶之二對偶基因的細胞株可用以產生具有降低之岩藻糖含量的抗體或其抗原-結合片段。Potelligent®
system(Lonza)為此系統的例子,可用以產生具有降低之岩藻糖含量的抗體或其抗原-結合片段。
對於長期、高產量產生重組蛋白質,可產生穩定表現細胞。舉例來說,可設計穩定表現本文所述抗GITR抗體(例如包括抗體Hum231#1、Hum231#2、
pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)或其抗原-結合片段的細胞株。在特定具體實施例中,本文提供之細胞穩定表現關於形成本文所述抗體(例如包括抗體Hum231#1、Hum231#2、pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、231-32-15任一或抗體1-107或抗體pab2159、pab2160或pab2161之CDR的抗體)或其抗原-結合片段的輕鏈/輕鏈可變功能域及重鏈/重鏈可變功能域。
在某些態樣中,不是使用含有病毒複製起點的表現載體,可以由適當表現控制元素(例如啟動子、增強子、序列、轉錄終止子、多腺核苷酸化位點等)控制的DNA及可篩選標記轉形宿主細胞。在導入外來DNA/多核苷酸之後,可使經設計的細胞在強化培養基中生長1至2天,之後轉換到選擇性培養基。重組質體中的可篩選標記賦予對選擇的抗性,及使得細胞穩定結合質體到其染色體且生長形成細胞簇(foci),接著可選殖及擴張成細胞株。此方法可有利地用於設計表現本文所述抗GITR抗體或其片段的細胞株。此經設計之細胞株可特別有用於篩選
及評直接或間接與抗體分子互動之組成物。
可使用許多選擇系統,包括但不限於,單純皰疹病毒胸腺嘧啶核苷激酶(Wigler M et al.,(1977)細胞11(1):223-32)、次黃嘌呤鳥嘌呤磷酸核糖轉移酶(Szybalska EH & Szybalski W(1962)PNAS 48(12):2026-2034)及腺嘌呤磷酸核糖轉移酶(Lowy I et al.,(1980)細胞22(3):817-23)基因可分別用在tk-、hgprt-或aprt-細胞。亦者,可使用抗代謝物抗性作為選擇下述基因的依據:dhfr,其賦予對胺甲喋呤之抗性(Wigler M et al.,(1980)PNAS 77(6):3567-70;O’Hare K et al.,(1981)PNAS 78:1527-31);gpt,其賦予對黴酚酸之抗性(Mulligan RC & Berg P(1981)PNAS 78(4):2072-6);neo,其賦予對胺基糖苷G-418之抗性(Wu GY & Wu CH(1991)Biotherapy 3:87-95;Tolstoshev P(1993)Ann Rev Pharmacol Toxicol 32:573-596;Mulligan RC(1993)Science 260:926-932;且Morgan RA & Anderson WF(1993)Ann Rev Biochem 62:191-217;Nabel GJ & Felgner PL(1993)Trends Biotechnol 11(5):211-5);且hygro,其賦予對濕黴素之抗性(Santerre RF et al.,(1984)Gene 30(1-3):147-56)。重組DNA技術本領域中常知方法可常規應用以選擇所欲重組選殖株且此方法描述於,例如,在Ausubel FM et al.,(eds.),Current Protocols in Molecular Biology,John Wiley & Sons,NY(1993);Kriegler M,Gene
Transfer及Expression,A Laboratory Manual,Stockton Press,NY(1990);且在第12及13章,Dracopoli NC et al.,(eds.),Current Protocols in Human Genetics,John Wiley & Sons,NY(1994);Colbère-Garapin F et al.,(1981)J Mol Biol 150:1-14,其整體以引用方式併入本文。
抗體分子表現量可由載體放大(回顧來看,見Bebbington CR & Hentschel CCG,The use of vectors based on gene amplification for the expression of cloned genes in mammalian cells in DNA cloning,Vol.3(Academic Press,New York,1987))增加。當標記在表現抗體的載體系統中可放大時,增加存在於宿主細胞培養的抑制劑量將增加標記基因的複製數量。因為被放大區與抗體基因相關,抗體之產生亦將增加(Crouse GF et al.,(1983)Mol Cell Biol 3:257-66)。
宿主細胞可與本文所述之二或更多表現載體(第一載體編碼重鏈衍生多胜肽與第二載體編碼輕鏈衍生多胜肽)共轉染。兩載體可包含相同可篩選標記,其使得重及輕鏈多胜肽群相等表現。宿主細胞可與不同量之二或更多表現載體共轉染。舉例來說,宿主細胞可被任一下述比例的第一表現載體及第二表現載體轉染:1:1、1:2、1:3、1:4、1:5、1:6、1:7、1:8、1:9、1:10、1:12、1:15、1:20、1:25、1:30、1:35、1:40、1:45或1:50。
或者,可使用單一載體,編碼且能夠表現重及輕鏈多胜肽群兩者。在此情況中,輕鏈應置於重鏈之前,避免過多毒性游離重鏈(Proudfoot NJ(1986)Nature 322:562-565;且Köhler G(1980)PNAS 77:2197-2199)。重及輕鏈編碼序列可包括cDNA或基因體DNA。表現載體可為單順反子(monocistronic)或多順反子(multicistronic)。多順反子核酸構築體可編碼2、3、4、5、6、7、8、9、10或更多,或者2至5、5至10或10至20個基因/核苷酸序列範圍。舉例來說,雙順反子核酸構築體可以下述順序包括啟動子、第一基因(例如本文所述抗體重鏈)及第二基因及(例如本文所述抗體輕鏈)。在此表現載體中,兩基因的轉錄可由啟動子驅動,而來自第一基因mRNA的轉譯可為藉由帽(cap)依賴性掃描機制,且來自第二基因mRNA的轉譯可為帽(cap)獨立性掃描機制,例如藉由IRES。
一旦本文所述之抗體分子由重組表現產生,其可由本領域中已知之任何方法純化以純化出免疫球蛋白分子,例如,藉層析法(例如離子交換、親和性、特別是蛋白質A之後藉由對特定抗原的親和性及分級管柱層析法)、離心、差示溶解度或藉由任何其他純化蛋白質的標準技術。再者,本文所述抗體可融合到本文所述之異源多胜肽序列或者本領域中已知者以協助純化。
在特定具體實施例中,本文所述抗體或其抗原-結合片段為經單離或經純化。一般而言,經單離之抗
體為實質上無其他具有比經單離之抗體不同抗原性特異性之抗體者。舉例來說,於一特別具體實施例中,本文所述抗體的製劑實質上無細胞性材料及/或化學前驅物。文字“實質上無細胞性材料”包括抗體製劑,其中抗體是從細胞的細胞性成分分離,從中其經單離或重組產生。因此,為實質上無細胞性材料之抗體包括具有少於約30%、20%、10%、5%、2%、1%、0.5%或0.1%(乾重)之異源蛋白質(本文亦稱為“汙染蛋白質”)及/或抗體變體(例如,不同轉譯後修飾形態的抗體或其他不同版本之抗體(例如抗體片段))之抗體製劑。當抗體重組產生時,其亦一般實質上無培養基,即培養基代表少於約20%、10%、2%、1%、0.5%或0.1%的蛋白質製劑體積。當抗體化學合成產生時,其一般實質上無化學前驅物或其他化學品,即,從涉及合成蛋白質之化學前驅物或其他化學品分離之。據此,此抗體製劑具有少於約30%、20%、10%或5%(乾重)之非有興趣抗體的化學前驅物或成分。於一特定具體實施例中,本文所述抗體經單離或經純化。
5.3 醫藥組成物
本文所提供為組成物,其包括具有所欲程度之純度的本文所述抗體或其抗原-結合片段在生理可接受之載劑、賦形劑或穩定劑(Remington’s Pharmaceutical Sciences(1990)Mack Publishing Co.,Easton,PA)中。可接受之載劑、賦形劑或穩定劑所運用之劑量及濃度為對
接受者無毒且包括緩衝液諸如磷酸鹽、檸檬酸鹽及其他有機酸;抗氧化劑,包括抗壞血酸及甲硫胺酸;防腐劑(諸如十八基二甲基苄基氯化銨;氯化六羥季銨;氯化苄烷銨、氯化本索寧(benzethonium chloride);酚、丁基或苄基醇;烷基對羥基苯甲酸酯諸如甲基或丙基對羥基苯甲酸酯;兒茶酚;間苯二酚;環己醇;3-戊醇;且間甲酚);低分子量(少於約10殘基)多胜肽群;蛋白質,諸如血清白蛋白、明膠或免疫球蛋白;親水性聚合物諸如聚乙烯吡咯啶酮;胺基酸諸如甘胺酸、麩醯胺酸、天冬醯胺、組胺酸、精胺酸或離胺酸;單醣、雙醣及其他碳水化合物,包括葡萄糖、甘露糖或糊精;螯合劑諸如EDTA;糖類諸如蔗糖、甘露醇、海藻糖或山梨糖醇;鹽形成相對離子諸如鈉;金屬錯合物(例如Zn-蛋白質錯合物);及/或非離子界面活性劑諸如TWEENTM
、PLURONICSTM
或聚乙二醇(PEG)。
於一特定具體實施例中,醫藥組成物包括本文所述抗體或其抗原-結合片段及任意地一或多額外預防或治療劑在醫藥上可接受之載劑中。於一特定具體實施例中,醫藥組成物包括有效量之本文所述抗體或其抗原-結合片段及任意地一或多額外預防之治療劑在醫藥上可接受之載劑中。見以下章節5.4,關於預防或治療劑的例子。在一些具體實施例中,抗體為包含在醫藥組成物中之唯一活性成分。本文所述的醫藥組成物可用於增強、誘導或活化GITR活性且治療病症,諸如癌症及感染性疾病。
用於腸胃外製劑之醫藥上可接受之載劑包括水性媒劑、非水性媒劑、抗微生物劑、等滲劑、緩衝液、抗氧化劑、區性麻醉劑、懸浮及分散劑、乳化劑、鉗合或螯合劑及其他醫藥上可接受之物質。水性媒劑的例子包括氯化鈉注射液、林格氏注射液(Ringers Injection)、等滲葡萄糖注射液、無菌水注射液、葡萄糖及乳酸林格氏注射液。非水性腸胃外媒劑包括蔬菜來源之固定油、棉籽油、玉米油、芝麻油及花生油。抑菌或抑真菌濃度的抗微生物劑可加到腸胃外製劑,以多劑量容器包裝,其包括酚或甲酚、汞劑、苄基醇、氯丁醇、甲基及丙基對羥苯甲酸酯、乙汞硫柳酸鈉、氯化苄烷銨及氯化本索寧。等滲劑包括氯化鈉及葡萄糖。緩衝液包括磷酸鹽及檸檬酸鹽。抗氧化劑包括硫酸氫鈉。區性麻醉劑包括普羅卡因鹽酸鹽。懸浮及分散劑包括羧甲基纖維素鈉、羥基丙基甲基纖維素及聚乙烯吡咯啶酮。乳化劑包括Polysorbate 80(TWEEN®
80)。金屬離子的鉗合或螯合劑包括EDTA。醫藥載劑亦包括乙醇、聚乙二醇及丙二醇為水可混溶媒劑;且氫氧化鈉、鹽酸、檸檬酸或乳酸為pH調整。
醫藥組成物可調配成任何投予至個體的途徑。投予途徑特定的例子包括鼻內、口內、肺部、經皮、皮內及腸胃外。腸胃外投予,特徵為皮下、肌內或靜脈內注射,亦可於本文考量。注射液可以習知形式製備,呈液態溶液或懸浮液、適於在液體之溶液或懸浮液注射之前為固態形式或呈乳液。注射液、溶液及乳液亦包含一或多賦
形劑。適當賦形劑為,例如,水、食鹽水、葡萄糖、甘油或乙醇。此外,若需要,欲投予的醫藥組成物亦可包含微量之無毒性輔助物質諸如濕潤或乳化劑、pH緩衝劑、穩定劑、溶解度增強劑及其他此等劑,諸如例如,乙酸鈉、去水山梨醇單月桂酸酯、三乙醇胺油酸酯及環糊精。
腸胃外投予抗體的製劑包括用於注射液的無菌溶液、無菌乾可溶性產物,諸如凍乾粉末,準備好在使用前與溶劑組合,包括皮下錠劑、準備好注射用的無菌懸浮液、在使用前準備好與媒劑組合的無菌乾不可溶性產物及無菌乳液。溶液可為水性或非水性。
若靜脈投予,適當載劑包括生理食鹽水或磷酸鹽緩衝食鹽水(PBS)及溶液包含增稠及助溶劑,諸如葡萄糖、聚乙二醇及聚丙二醇及其混合物。
包括抗體的局部混合物如區性及全身投予般所述製備。所得混合物可為溶液、懸浮液、乳液等且可調配成霜劑、凝膠、軟膏、乳液、溶液、酏劑、洗劑、懸浮液、酊劑、糊料、泡沫、氣溶膠、沖洗劑、噴霧劑、栓劑、繃帶、皮膚貼片或任何其他適於局部投予的調配物。
本文所述抗體或其抗原-結合片段可調配成局部施用的氣溶膠,諸如藉由吸入(見例如U.S.專利號4,044,126、4,414,209及4,364,923,其描述用於遞送有用於治療發炎疾病,特別是氣喘的類固醇之氣溶膠)。這些投予至呼吸道的調配物可呈用於噴霧器的氣溶膠或溶液形式或呈用於吸入的微細粉末,單獨或與惰性載劑(諸如乳
糖)組合。在此情形中,調配物粒於一具體實施例中將具有少於50微米之直徑,於一具體實施例中,少於10微米之直徑。
本文所述抗體或其抗原-結合片段可調配成用於區性或局部施用,諸如局部施用到皮膚及黏膜,諸如眼中,呈凝膠、霜劑及洗劑形式且用於施用在眼或腦池內或脊椎內施用。局部投予考量為經皮遞送及亦用於投予至眼睛或黏膜或用於吸入治療。亦可投予抗體之鼻溶液單獨或組合其他醫藥上可接受之賦形劑。
經皮貼片,包括離子導入及電泳裝製,為發明所屬技術領域中具有通常知識者廣知,且可用來投予抗體。舉例來說,此貼片揭露於U.S.專利號6,267,983、6,261,595、6,256,533、6,167,301、6,024,975、6,010715、5,985,317、5,983,134、5,948,433及5,860,957。
在某些具體實施例中,包括本文所述抗體或其抗原-結合片段之醫藥組成物為凍乾粉末,其可復原作為溶液、乳液及其他混合物用於投予。其亦可復原及調配為固體或凝膠。凍乾粉末將本文所述抗體或其抗原-結合片段或其醫藥上可接受之衍生物溶解於適當溶劑中製備。在一些具體實施例中,凍乾粉末為無菌。溶劑可包含改良穩定性的賦形劑或其他粉末或復原溶液之藥理成分,從粉末製備。可使用的賦形劑包括但不限於葡萄糖、山梨糖醇、果糖、玉米糖漿、木糖醇、甘油、葡萄糖、蔗糖或其
他適當劑。溶劑亦可包含緩衝液,諸如檸檬酸鹽、磷酸鈉或磷酸鉀或其他此等發明所屬技術領域中具有通常知識者已知的緩衝液,於一具體實施例中,為約中性pH。發明所屬技術領域中具有通常知識者已知的後續無菌過濾溶液接著在標準條件下凍乾提供所欲調配物。於一具體實施例中,所得溶液將分到小瓶以凍乾。各小瓶將包含化合物單一劑量或多劑量。凍乾粉末可在適當條件(諸如在約4℃至室溫)下儲存。
以用於注射的水復原此凍乾粉末提供用於腸胃外投予的調配物。對於復原,將凍乾粉末加到無菌水或其他適當載劑。精確的量有賴於所選的化合物。此量可憑經驗確定。
本文所述之抗體或其抗原-結合片段及其他本文提供之組成物亦可調配成靶向特別組織、受體或欲治療個體身體其他區域。許多此靶向方法為發明所屬技術領域中具有通常知識者廣知。所有此靶向方法於本文考量用於本組成物。非限定靶向方法的例子,見例如U.S.專利號6,316,652、6,274,552、6,271,359、6,253,872、6,139,865、6,131,570、6,120,751、6,071,495、6,060,082、6,048,736、6,039,975、6,004,534、5,985,307、5,972,366、5,900,252、5,840,674、5,759,542及5,709,874。於一特定具體實施例中,本文所述抗體或其抗原-結合片段靶向腫瘤。
欲用於活體內投予的組成物可為無菌。此可
由透過例如無菌過濾膜之過濾輕易完成。
5.4 用途及方法
5.4.1 治療用途及方法
於一態樣中,本文所呈為調節個體中一或多免疫功能或反應之方法,其包括對有需要的個體投予本文所述之抗GITR抗體或其抗原-結合片段或其組成物。於一特定態樣中,本文所呈為活化、增強或誘導個體中一或多免疫功能或反應之方法,其包括對有需要的個體投予抗GITR抗體或其抗原-結合片段或其組成物。於一特定具體實施例中,本文所呈為預防及/或治療其中期望活化或增強一或多免疫功能或反應的疾病之方法,其包括投予至有需要的個體本文所述之抗GITR抗體或其抗原-結合片段或其組成物。在其他特定具體實施例中,方法包括組合療法,其中抗GITR抗體或其抗原-結合片段組合另一療法投予至個體,諸如以下描述活化或增強一或多免疫功能或反應者。在某些具體實施例中,抗GITR抗體或其抗原-結合片段作為佐劑組合抗原性組成物投予。在某些具體實施例中,抗原性組成物包括癌症或腫瘤抗原(例如白血病中bcr/abl抗原、與子宮頸癌相關致癌病毒的HPVE6及E7抗原、在或與黑色素瘤相關之MAGE1及MZ2-E抗原或在或與乳癌相關之MVC-1及HER-2抗原)。在一些具體實施例中,抗原性組成物包括衍生自病原體(例如病毒抗原、寄生蟲抗原、細菌抗原或真菌抗原)的抗原。病毒抗
原的例子包括流感病毒核蛋白(NP)、HIV抗原(例如HIV之gag蛋白質、HIV env蛋白質(例如gp120及/或gp41)、HIV Nef蛋白質、HIV Pol蛋白質、HIV反轉錄酶或HIV蛋白酶)、Ebola病毒(EBOV)抗原(例如EBOV NP或醣蛋白)、天花抗原、肝炎A、B或C病毒抗原、人類鼻病毒抗原、單純皰疹病毒抗原、脊髓灰白質病毒抗原、口蹄疫病毒(FMDV)抗原、狂犬病病毒抗原、輪狀病毒抗原、柯薩奇病毒抗原及人類乳突病毒(HPV)抗原。細菌抗原的例子包括百日咳嗜血桿菌(Bordetella pertussis)(例如P69蛋白質及絲狀血球凝集素(FHA)抗原)、霍亂弧菌(Vibrio cholerae)、炭疽桿菌(Bacillus anthracis)及大腸桿菌(E.coli)抗原,諸如大腸桿菌(E.coli)熱不穩定毒素B次單元(LT-B)、大腸桿菌(E.coli)K88抗原及腸毒素大腸桿菌(E.coli)抗原。
如本文所使用,術語“組合”指超過一種療法(例如一或多預防及/或治療劑)的使用。術語“組合”的使用不是限制療法投予至具疾病或疾病個體之順序或投予途徑。第一療法(例如預防或治療劑)可在第二療法(例如預防或治療劑)之前(例如5分鐘、15分鐘、30分鐘、45分鐘、1小時、2小時、4小時、6小時、12小時、24小時、48小時、72小時、96小時、1週、2週、3週、4週、5週、6週、8週或12週之前)、伴隨第二療法(例如預防或治療劑)或在第二療法(例如預防或治療
劑)之後(例如5分鐘、15分鐘、30分鐘、45分鐘、1小時、2小時、4小時、6小時、12小時、24小時、48小時、72小時、96小時、1週、2週、3週、4週、5週、6週、8週或12週之後)投予至具疾病或疾病或其症狀之個體。在某些具體實施例中,療法(例如劑)組合投予抗GITR抗體或其抗原-結合片段至個體是在相同組成物(例如醫藥組成物)投予。在其他具體實施例中,療法(例如劑)組合投予抗GITR抗體或其抗原-結合片段是在不同組成物(例如二或更多醫藥組成物)投予至個體。二組成物可在相同或不同時間及/或由相同或不同投予途徑投予。於一特別具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合疫苗組成物投予至個體以誘導、活化或增強疫苗組成物引發之免疫反應。於一具體實施例中,疫苗組成物為癌症疫苗。癌症疫苗為劑、分子或免疫原,其刺激或引發個人或個體內源性免疫反應對抗一或多癌症抗原。癌症抗原可為腫瘤相關之胜肽或蛋白質,其誘導或增強免疫反應且源自腫瘤相關基因及所編碼之蛋白質,包括,例如MAGE-A1、MAGE-A2、MAGE-A3、MAGE-A4、MAGE-A5、MAGE-A6、MAGE-A7、MAGE-A8、MAGE-A9、MAGE-A10、MAGE-A11、MAGE-A12、MAGE-A13、GAGE-1、GAGE-2、GAGE-3、GAGE-4、GAGE-5、GAGE-6、GAGE-7、GAGE-8、BAGE-1、RAGE-1、LB33/MUM-1、PRAME、NAG、MAGE-Xp2(MAGE-B2)、MAGEXp3(MAGE-B3)、MAGE-Xp4
(AGE-B4)、酪胺酸酶、腦糖原磷酸化酶、Melan-A、MAGE-C1、MAGE-C2、NY-ESO-1、LAGE-1、SSX-1、SSX-2(HOM-MEL-40)、SSX-1、SSX-4、SSX-5、SCP-1、CT-7、阿法-輔肌動蛋白-4、Bcr-Abl融合蛋白、Casp-8、β-鏈蛋白、cdc27、cdk4、cdkn2a、coa-1、dek-can融合蛋白、EF2、ETV6-AML1融合蛋白、LDLR-岩藻糖基轉移酶AS融合蛋白、HLA-A2、HLA-A11、hsp70-2、KIAAO205、Mart2、Mum-2及3、neo-PAP、第I型肌凝蛋白、OS-9、pml-RARα融合蛋白、PTPRK、K-ras、N-ras、磷酸丙糖(triosephosphate)異構酶、GnTV、Herv-K-mel、Lage-1、Mage-C2、NA-88、/Lage-2、SP17及TRP2-Int2,(MART-I)、gp100(Pmel 17)、TRP-1、TRP-2、MAGE-1、MAGE-3、p15(58)、CEA、NY-ESO(LAGE)、SCP-1、Hom/Mel-40、p53、H-Ras、HER-2/neu、BCR-ABL、E2A-PRL、H4-RET、IGH-IGK、MYL-RAR、艾司坦氏-巴爾氏病毒(Epstein Barr virus)抗原、EBNA、人類乳突病毒(HPV)抗原E6及E7、TSP-180、MAGE-4、MAGE-5、MAGE-6、p185erbB2、p180erbB-3、c-met、nm-23H1、PSA、TAG-72-4、CA 19-9、CA 72-4、CAM 17.1、NuMa、K-ras、β-鏈蛋白、CDK4、Mum-1、p16、TAGE、PSMA、PSCA、CT7、端粒酶、43-9F、5T4、791Tgp72、.阿法.-胎兒蛋白、13HCG、BCA225、BTAA、CA 125、CA 15-3(CA 27.29\BCAA)、CA 195、CA 242、CA-50、CAM43、
CD68\KP1、CO-029、FGF-5、G250、Ga733(EpCAM)、HTgp-175、M344、MA-50、MG7-Ag、MOV18、NB\170K、NYCO-1、RCAS1、SDCCAG16、TA-90(Mac-2結合蛋白質\親環素(cyclophilin)C-相關蛋白質)、TAAL6、TAG72、TLP及TPS。癌症疫苗有用於增加免疫系統辨認癌症細胞或透過淋巴球活化增強抗腫瘤反應。已透過以完整腫瘤細胞或萃取物、純化原,、使用胜肽最佳化結合MHC及TcR兩者、免疫主導胜肽、編碼腫瘤抗原之DNA、編碼腫瘤抗原之重組病毒或抗原衝擊抗原呈現細胞免疫成功產生效應子T細胞。在一些具體實施例中,藉由使用共刺激劑及細胞激素、注射載體以表現細胞激素、活體外抗原-衝擊及活化之自體樹狀細胞及藉由阻擋負調節劑(例如使用免疫查核點靶向劑)及藉由消耗T調控性細胞可改良免疫識別增強及細胞擴張。
於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合熱休克蛋白質為主之腫瘤疫苗或熱休克蛋白質為主之病原體疫苗投予至個體。見以下章節5.4.1.1及5.4.1.2關於熱休克蛋白質為主之腫瘤疫苗或熱休克蛋白質為主之病原體疫苗,用於組合本文所述之抗GITR抗體或其抗原-結合片段。
於一特別具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合佐劑投予以誘導、活化或增強抗GITR抗體之促效效果。依據治療內容,可使用各種佐劑。適當佐劑非限制性例子包括,例如,弗氏完全佐劑
(Complete Freund's Adjust(CFA))、弗氏不完全佐劑(Incomplete Freund's Adjust(IFA))、motanide ISA(不完全seppic佐劑)、Ribi佐劑系統(RAS)、Titer Max、胞壁醯胜肽、Syntex佐劑調配物(SAF)、明礬(氫氧化鋁及/或磷酸鋁)、鋁鹽佐劑、Gerbu®
佐劑、硝化纖維素吸附之抗原、囊封或陷入抗原、免疫刺激錯合物諸如皂苷、Quil A、QS-21及其他。其他佐劑包括CpG寡核苷酸及雙股RNA分子,諸如多(A)、多(U)。亦可使用上述佐劑的組合。在一些具體實施例中,一或多佐劑為皂苷,諸如QS-21、QS-21及3 De-O-醯化單磷酸基脂質A(3 D-MPL)及免疫刺激性寡核苷酸及皂苷佐劑,如分別述於U.S.專利號6,645,495;7,029,678及7,858,589。
在某些具體實施例中,本文提供為之方法增強GITR-反應細胞(例如T細胞,諸如效應子T細胞)的刺激,其包括以本文所述抗體或其抗原-結合片段活體外培養GITR-反應細胞(例如T細胞)。在一些具體實施例中,以抗GITR抗體或其抗原-結合片段培養之前、同時或之後,以刺激劑(例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)培養GITR-反應細胞。在某些具體實施例中,GITR-反應細胞(例如T細胞)從個體(例如人類)單離。在一些具體實施例中,以抗GITR抗體或其抗原結合片段刺激之後,將GITR-反應細胞投予至個體(例如人類)。GITR-反應細胞(例如T細胞)可投
予至相同個體或與細胞原始單離出來不同的個體。
在一些具體實施例中,本文提供為活化GITR-反應細胞(例如T細胞)之方法,其包括以本文所述抗體或其抗原-結合片段培養GITR-反應細胞(例如T細胞)。在某些具體實施例中,在以抗GITR抗體或其抗原-結合片段培養之前、同時或之後,以刺激劑(例如T細胞受體複合物刺激劑諸如,例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)培養GITR-反應細胞。在一些具體實施例中,GITR-反應細胞(例如T細胞)自個體(例如人類)單離。在某些具體實施例中,以抗GITR抗體或其抗原-結合片段活化之後將GITR-反應細胞投予至個體(例如人類)。GITR-反應細胞(例如T細胞)可投予至相同個體或與細胞原始單離出來不同的個體。
在一些具體實施例中,對GITR反應之細胞(即GITR-反應細胞)以本文所述之抗GITR抗體或其抗原-結合片段培養在細胞培養中,且投予至個體以增強免疫功能(例如以增強GITR-反應細胞,諸如T細胞之擴張/增殖及/或增強T細胞效應子功能)及/或治療癌症及/或預防或治療感染性疾病。癌症及感染性疾病的例子為本文所提供者。見例如下述實施例7例示性方法。在特定具體實施例中,GITR-反應細胞為效應子T細胞(例如CD4+
及CD8+
)。在一些具體實施例中,GITR-反應細胞為單離自
個體。在一些具體實施例中,在以本文所述之抗GITR抗體或其抗原-結合片段培養之前,評估GITR-反應細胞之GITR表現。在某些具體實施例中,在以本文所述之抗GITR抗體或其抗原-結合片段培養之前、同時或之後,以促分裂原(例如T細胞促分裂原,諸如,例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體)培養GITR-反應細胞。GITR反應細胞可以本文所述之抗GITR抗體或其抗原-結合片段培養例如5分鐘、10分鐘、15分鐘、30分鐘、45分鐘、1小時、2小時、3小時、4小時、5小時、6小時、8小時、12小時、18小時、24小時或更久。在某些具體實施例中,投予至個體之GITR-反應細胞源自該個體(即GITR-反應細胞為自體)。在其他具體實施例中,投予至個體之GITR-反應細胞源自不同個體。以抗GITR抗體或其抗原-結合片段培養後之GITR-反應細胞藉由發明所屬技術領域中具有通常知識者任何已知之途徑(例如腸胃外投予,諸如皮下、靜脈內或肌內投予、腫瘤內投予),可區性或全身性投予至個體。在某些具體實施例中,以抗GITR抗體或其抗原-結合片段培養後,投予至個體適當劑量之GITR-反應細胞可為至少100、200、300、400、500、700、1,000、5,000、10,000、25,000、50,000、100,000、1 x 106
、1 x 107
或1 x 108
細胞。可投予以抗GITR抗體或其抗原-結合片段培養後之GITR-反應細胞1、2、3、4、5、6、7、8或更多
次。以抗GITR抗體或其抗原-結合片段培養之後,投予至個體之GITR-反應細胞的頻率及劑量依數個因素變化,包括例如患者的病症。於另一具體實施例中,本文提供增強個體中T細胞之擴張(例如CD4+
及/或CD8+
T細胞)的方法,其包括投予至個體有效量的本文所述抗體或其抗原-結合片段或本文所述的醫藥組成物。於另一具體實施例中,本文提供增強個體中CD8+
T細胞之擴張的方法,其包括投予至個體有效量的本文所述抗體或其抗原-結合片段或本文所述的醫藥組成物。於另一具體實施例中,本文提供增強個體中CD4+
T細胞擴張的方法,,其包括投予至個體有效量的本文所述抗體或其抗原-結合片段或本文所述的醫藥組成物。於一特定具體實施例中,個體為人類。
於另一具體實施例中,本文提供增強個體中T細胞(例如CD4+
及/或CD8+
T細胞)擴張及/或T細胞效應子功能的方法,其包括投予至個體有效量的本文所述抗體或其抗原-結合片段或本文所述的醫藥組成物。於另一具體實施例中,本文提供增強個體中CD8+
T細胞擴張及/或T細胞效應子功能的方法,其包括投予至個體有效量的本文所述抗體或其抗原-結合片段或本文所述的醫藥組成物。於另一具體實施例中,本文提供增強個體中CD4+
T細胞擴張及/或T細胞效應子功能的方法,其包括投予至個體有效量的本文所述抗體或其抗原-結合片段或本文所述的醫藥組成物。於一特定具體實施例中,個體為人類。
於另一具體實施例中,本文提為較擴張T調
控性細胞優先擴張效應子T細胞的方法,其包括以本文所述抗體或其抗原-結合片段活體外培養T-細胞。在某些具體實施例中,抗GITR抗體或其抗原-結合片段較T調控性細胞擴張效應子T細胞10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%或更多。在一些具體實施例中,抗GITR抗體或其抗原-結合片段較T調控性細胞擴張效應子T細胞10%至20%、15%至25%、25%至50%、30%至60%、50%至75%或65%至85%。效應子T細胞及T調控性細胞可由細胞表面標記區分彼此,諸如以下實施例中所述者。在一些具體實施例中,T-細胞單離自個體(例如人類)。在某些具體實施例中,擴張後之T-細胞投予至個體(例如人類)。
於另一具體實施例中,本文提供個體中較擴張T調控性細胞優先擴張效應子T細胞的方法,其包括投予至個體有效量的本文所述抗體或其抗原-結合片段或其組成物。在某些具體實施例中,抗GITR抗體或其抗原-結合片段較T調控性細胞擴張效應子T細胞10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%或更多。在一些具體實施例中,抗GITR抗體或其抗原-結合片段較T調控性細胞擴張效應子T細胞10%至20%、15%至25%、25%至50%、30%至60%、50%至75%或65%至85%。效應子T細胞及T調控性細胞可由細胞表面標記及/或細胞內標記區分彼此,諸如以下實施例中所述者。於一特定具體實施例中,個體為
人類。
在某些具體實施例中,以本文所述之抗GITR抗體或抗原-結合片段或其組成物治療個體達到一、二、三、四或更多下述效果:(i)減少或改善疾病或與之相關的症狀的嚴重性;(ii)減少與疾病相關症狀的持續期間;(iii)抑制疾病或與之相關的症狀發展;(iv)疾病或與之相關的症狀的復原;(v)預防與存在於患者中之疾病相關的症狀的發展或開始;(vi)抑制與疾病相關之症狀復發;(vii)減少個體住院治療;(viii)減少住院治療長度;(ix)增加帶疾病個體之存活;(x)減少與疾病相關之症狀之數量;且(xi)增強、改良、補充、互補或擴大另一療法之治療效果。於替代性具體實施例中,抗GITR抗體或其抗原-結合片段用於預防疾病,諸如感染性疾病。
在一些具體實施例中,抗GITR抗體或其抗原-結合片段或其組成物組合免疫治療劑投予至個體。本文揭露用於組合療法之免疫治療劑包括但不限於Her2/neu受體抗體諸如曲妥珠單抗(trastuzumab)(銷售為Herceptin®
)、抗CD52抗體諸如阿侖珠單抗(alemtuzumab)(銷售為Campath®
. MabCampath®
或Campath-1H)、抗CD33抗體諸如連接至卡奇黴素(calicheamicin)之吉妥珠單抗(gemtuzumab)(銷售為Mylotarg®
)、抗CD20抗體諸如利妥昔單抗(rituximab)(銷售為Rituxan®
及MabThera®
)、替坦異貝莫單抗
(Ibritumomab tiuxetan)(銷售為Zevalin®
)、抗TNFα抗體諸如英利昔單抗(infliximab)(銷售為Remicade®
)或阿達木單抗(adalimmumab)(銷售為Humira®
)、可溶性TNFR2分子諸如依那西普(etanercept)(銷售為Enbrel®
)、針對IL-2受體之CD25鏈的抗體諸如巴利昔單抗(basiliximab)(銷售為Simulect®
)、抗CD40/CD40L抗體諸如擬人化IgG1
抗人類CD40抗體(SGN-40)、Toll-樣受體促效劑諸如單磷醯基(monophosphoril)脂質A(MPL®
)、CpG、單股RNA、核苷酸、核苷酸類似物、CL087(TLR7-特異性配體)、洛索瑞拜(loxoribine)、聚肌苷酸-聚胞苷酸(polyinosinepolycytidylic acid)、鞭毛蛋白、瑞喹莫德(resiquimod)、咪喹莫特(immiquimod)、格敵喹莫德(gardiquimod)、NOD配體諸如胞壁醯二胜肽、莫拉丁酯(murabutide)、肽聚醣及胞壁醯二胜肽、CD1d促效劑,諸如α-半乳糖苷基神經醯胺(α-GalCer)及蘇糖醇醯胺(threitol ceramide)(ThrCer)、抗體諸如Fresolimumab®
(GC1008)、抗體靶向抑制TGF-β
異型體1、2或3、Fc融合、單藍特普(Dalantercept)(Alk-Fc)與小分子LY2157299(受體激酶抑制劑)。
可藉由增強免疫功能治療的疾病包括癌症及感染性疾病。各種癌症及感染性疾病於以下描述。於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段可用於治療與癌症相關之病症或因投予抗癌症療法
(諸如,例如化療或放射)之病症。於一特別具體實施例中,抗GITR抗體或其抗原-結合片段可用於治療或管理淋巴球減少症。於另一具體實施例中,抗GITR抗體或其抗原-結合片段投予至診斷具癌症的患者已增加患者中一或多免疫細胞群(例如T細胞效應子細胞,諸如CD4+
及CD8+
T細胞)的增殖及/或效應子功能。
於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段活化或增強或誘導個體中一或多免疫功能或反應至少99%、至少98%、至少95%、至少90%、至少85%、至少80%、至少75%、至少70%、至少60%、至少50%、至少45%、至少40%、至少45%、至少35%、至少30%、至少25%、至少20%或至少10%或在10%至25%、25%至50%、50%至75%或75%至95%之間的範圍,此相對於個體中未投予本文所述之抗GITR抗體或其抗原-結合片段之免疫功能而言,使用本領域中廣知的分析,例如ELISPOT、ELISA及細胞增殖分析。於一特定具體實施例中,免疫功能為細胞激素產生(例如干擾素-加馬、IL-2、IL-5、IL-10、IL-12或轉形生長因子(TGF)-阿法產生)。於另一具體實施例中,免疫功能為T細胞增殖/擴張,其可例如由流式細胞儀分析以偵測表現T細胞(例如CD3、CD4或CD8)標記的細胞數量。於另一具體實施例中,免疫功能為抗體產生,其可例如由ELISA分析。在一些具體實施例中,免疫功能為效應子功能,其可例如由細胞毒性分析或其他本領域中廣知
的分析來分析。於另一具體實施例中,免疫功能為Th1反應。於另一具體實施例中,免疫功能為Th2反應。於另一具體實施例中,免疫功能為記憶反應。
在特定具體實施例中,可被抗GITR抗體或其抗原-結合片段增強或誘導之免疫功能非限制性例子為作用淋巴球之增殖/擴張(例如增加作用T淋巴球之數量)、抑制作用淋巴球(例如作用T淋巴球)細胞凋亡及抑制Treg。於特別具體實施例中,由本文所述之抗GITR抗體或其抗原-結合片段增強或誘導之免疫功能為增殖/擴張CD4+
T細胞(例如Th1及Th2輔助T細胞)、CD8+
T細胞(例如細胞毒性T淋巴球、阿法/貝他(beta)T細胞及加馬/戴爾它(delta)T細胞)、B細胞(例如漿細胞)、記憶T細胞、記憶B細胞、腫瘤-駐留T細胞(tumor-resident T cell)、CD122+
T細胞、自然殺手(NK)細胞)、巨噬細胞、單核球、樹狀細胞、肥胖細胞、嗜酸性球、嗜鹼性球或多形核(polymorphonucleated)白血球之活化數量。於一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段活化或增強淋巴球先驅細胞(progenitor)之增殖/擴張或數量。在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段增加CD4+
T細胞(例如Th1及Th2輔助T細胞)、CD8+
T細胞(例如細胞毒性T淋巴球、阿法/貝他T細胞及加馬/戴爾它(delta)T細胞)、B細胞(例如漿細胞)、記憶T細胞、記憶B細胞、腫瘤-駐留T細
胞(tumor-resident T cell)、CD122+
T細胞、自然殺手細胞(NK細胞)、巨噬細胞、單核球、樹狀細胞s、肥胖細胞、嗜酸性球、嗜鹼性球或多形核(polymorphonucleated)白血球之數量大約至少99%、至少98%、至少95%、至少90%、至少85%、至少80%、至少75%、至少70%、至少60%、至少50%、至少45%、至少40%、至少45%、至少35%、至少30%、至少25%、至少20%或至少10%或在10%至25%、25%至50%、50%至75%或75%至95%之範圍,此相對於陰性控制組(例如未以本文所述之抗GITR抗體或其抗原-結合片段處理、培養或接觸之個別細胞數量)而言。
於特別具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體獨立於TCR觸發而誘導、活化或增強人類GITR之活性。在特定具體實施例中,本文所述免疫特異性結合GITR(例如,人類GITR)之抗體獨立於TCR觸發而誘導、活化或增強NF-κB之活性。在某些具體實施例中,NF-κB之活性可在例如分析中評估,該分析包括下述步驟:(a)在無抗CD3抗體之存在下,以本文所述抗體或同型控制組抗體(抗體濃度為例如12.5、10、5、2.5、1.25或0.625μg/ml)培養表現NF-κB-螢光素酶報告子構築體(例如GloResponse NF-κB-luc2P構築體)及GITR(例如,人類GITR)之T細胞(例如Jurkat細胞);且(b)在例如2、5、6、8或18小時培養之後使用例如EnVision多標籤讀取器2100讀
取螢光素酶訊號,其中相對於同型控制組抗體之正螢光素酶訊號表示NF-κB之活性。於一特別具體實施例中,螢光素酶訊號在5小時培養之後讀取。
於另一具體實施例中,本文提供獨立於TCR觸發而活化T細胞之方法,其包括接觸T細胞與本文所述抗體或其抗原-結合片段。在特別具體實施例中,本文提供之方法獨立於TCR觸發而誘導、活化或增強NF-κB之活性,其包括接觸T細胞與本文所述抗體或其抗原-結合片段。在某些具體實施例中,NF-κB之活性可在例如分析中評估,該分析包括下述步驟:(a)在無抗CD3抗體之存在下,以本文所述抗體或同型控制組抗體(抗體濃度為例如12.5、10、5、2.5、1.25或0.625μg/ml)培養表現NF-κB-螢光素酶報告子構築體(例如GloResponse NF-κB-luc2P構築體)及GITR(例如,人類GITR)之T細胞(例如Jurkat細胞);且(b)在例如2、5、6、8或18小時培養之後使用例如EnVision多標籤讀取器2100讀取螢光素酶訊號,其中相對於同型控制組抗體之正螢光素酶訊號表示NF-κB之活性。於一特別具體實施例中,螢光素酶訊號在5小時培養之後讀取。
在特別具體實施例中,本文提供之方法增加多功能性(IFNγ+ TNFα+)T細胞之百分比,其包括接觸T細胞與本文所述抗體或其抗原-結合片段。多功能性(IFNγ+ TNFα+)T細胞之百分比的增加可在例如分析評估,該分析包括下述步驟:(a)在37℃及5% CO2
下,
以例如各種次優濃度(例如0.3-5μg/ml)之抗CD3抗體;且例如本文所述免疫特異性結合GITR(例如,人類GITR)之抗體(例如5μg/ml)或同型控制組抗體培養,例如,人類PBMC達例如3至4天;(b)在37℃及5% CO2
下,以例如布雷非德菌素A(Brefeldin A)處理細胞達例如6小時;(c)使用例如抗CD3抗體、抗CD4抗體及抗CD8α抗體染細胞表面;(d)使用例如抗IFNγ抗體與抗TNFα抗體細胞內染色;且(e)相對於同型控制組抗體,測定多功能性(IFNγ+ TNFα+)T細胞之百分比。在特定具體實施例中,多功能性(IFNγ+ TNFα+)T細胞為選自下列所組成群組:多功能性(IFNγ+ TNFα+)CD4+T細胞及多功能性(IFNγ+ TNFα+)CD8+T細胞。
在特別具體實施例中,本文提供之方法增加OX40及PD-1在活化之T細胞中之表面表現,其包括接觸T細胞與本文所述抗體或其抗原-結合片段。可增加OX40及PD-1在活化之T細胞中之表面表現至少約1.2倍、1.3倍、1.4倍、1.5倍、2倍、2.5倍、3倍、3.5倍、4倍、4.5倍、5倍、6倍、7倍、8倍、9倍、10倍、15倍、20倍、30倍、40倍、50倍、60倍、70倍、80倍、90倍、100倍、200倍、300倍、400倍、500倍、600倍、700倍、800倍、900倍或1000倍,此由本文所述之方法及/或發明所屬技術領域中具有通常知識者已知之方法,相對於無本文所述抗體,OX40及PD-1在活化之T細胞中之表面表現來評估。
5.4.1.1 癌症
於一特定態樣中,本文所呈現為治療癌症之方法,其包括投予至有需要的個體有效量的本文所述之抗GITR抗體或其抗原-結合片段或其組成物。於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段或其組成物為投予至個體的唯一活性劑。
本文所述之抗GITR抗體或其抗原-結合片段對癌症細胞增殖的效果可由常規分析偵測,諸如由測量經放射標幟之胸腺嘧啶核苷攝入的分析。或者,細胞生存力可由測量乳酸鹽脫氫酶(LDH)、細胞裂解時釋出的穩定細胞溶質酵素或由細胞裂解時[51
Cr]的釋出之分析來測量。於一具體實施例中,由細胞攝入染料諸如中性紅、台盼藍或ALAMARTM
藍(Page B et al.,(1993)Intl J Oncology 3:473-6)之能力或無能力測量壞死。在此分析中,細胞在包含染料之介質中培養、洗滌細胞且分光光度計測量剩餘染料(反映染料之細胞性攝入)。
於另一具體實施例中,染料為磺醯羅丹明(sulforhodamine)B(SRB)、其結合蛋白質可用作為測量細胞毒性(Skehan P et al.,(1990)J Nat Cancer Inst 82:1107-12)。在又另一具體實施例中,四唑鎓鹽,諸如MTT,用於藉由偵測活的、非死的細胞,對哺乳動物細胞存活及增殖定量比色檢定(見例如Mosmann T(1983)J Immunol Methods 65:55-63)。
在其他具體實施例中,在培養物之貼附及“漂浮”小格兩者中測量細胞凋亡的細胞。移除上清液、胰蛋白酶切貼附的細胞及合併製劑接著離心洗滌步驟(10分鐘,2000rpm)收集兩小格。以舒林酸(sulindac)及相關化合物處理腫瘤細胞培養物以獲得顯著量之細胞凋亡的程序已見於文獻中(見例如Piazza GA et al.,(1995)Cancer Res 55:3110-6)。此方法的特徵包括收集漂浮與貼附細胞兩者、辨別觀察細胞凋亡之最佳處理時間與及劑量範圍及辨別最佳細胞培養條件。
於另一具體實施例中,藉由測量DNA碎片定量細胞凋亡。定量活體外測定DNA碎片之商用光度方法為可得。此分析的例子,包括TUNEL(偵測經標幟之核苷酸併入破碎之DNA)及ELISA-為主之分析,描述於Biochemica,(1999)2:34 37(Roche Molecular Biochemicals)。在又另一具體實施例中,可形態觀察細胞凋亡。
此分析可進行的癌症細胞株為發明所屬技術領域中具有通常知識者廣知。細胞凋亡、壞死及增殖分析亦可在初級細胞,例如組織移出物進行。
在特定具體實施例中,投予本文所述之抗GITR抗體或其抗原-結合片段或其組成物至帶有癌症個體(在一些具體實施例中,癌症之動物模式)達到至少一、二、三、四或更多之下述效果:(i)減少或改善癌症之一或多症狀之嚴重性;(ii)減少一或多與癌症相關症狀
之持續期間;(iii)預防與癌症相關症狀之復發;(iv)減少個體住院治療;(v)減少住院治療長度;(vi)增加個體之存活;(vii)增強或改良另一療法之治療效果;(viii)抑制一或多與癌症相關症狀的發展或開始;(ix)減少與癌症相關症狀之數量;(x)如本領域中廣知之方法所評估的改良生活品質;(x)抑制腫瘤復發;(xi)腫瘤及/或一或多與其相關之症狀的退化;(xii)抑制腫瘤及/或一或多與其相關症狀之發展;(xiii)減少腫瘤生長;(xiv)減小腫瘤尺寸(例如體積或直徑);(xv)減少新形成之腫瘤的形成;(xvi)根除、移除或控制初級、區域性及/或轉移性腫瘤;(xvii)減少轉移的量或尺寸;(xviii)減少死亡率;(xix)增加無復發的存活;(xx)在投予發明所屬技術領域中具有通常知識者可得之習知方法所估量之標準療法,諸如磁振造影(MRI)、動態對比增強MRI(DCE-MRI)、X光及電腦斷層(CT)掃描或正電子發射斷層攝影術(PET)掃描之後維持腫瘤尺寸及不增加或增加少於腫瘤的增加;及/或(xxi)增加患者中緩解的長度。
在某些具體實施例中,二或更多不同本文所述之抗GITR抗體或其抗原-結合片段投予至個體。在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合一或多其他療法,例如抗癌症劑、細胞激素、細胞性疫苗或抗荷爾蒙劑,投予至個體來治療癌症。
於一特定具體實施例中,本文所述之抗GITR
抗體或其抗原-結合片段組合放射療法投予,包括例如使用X光、加馬射線及其他放射來源來摧毀癌症細胞。在特定具體實施例中,放射治療投予為外部光束放射或遠隔治療,其中放射來自遠端來源引導。在其他具體實施例中,放射治療投予為內部療法或近程放射治療,其中放射性來源置於體內接近癌症細胞或腫瘤塊。於一態樣中,本文所述之抗GITR抗體或其抗原-結合片段可活化或增強癌症患者因抗癌症療法受損之免疫系統的免疫功能或反應。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合化療投予至個體。於一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段可在放射療法或化療之前、期間或之後使用。化學治療劑的例子包括環磷醯胺、胺甲喋呤、環孢素A、來氟米特(leflunomide)、順鉑、依弗醯胺、紫杉烷諸如紫杉醇及太平洋紫杉醇、拓樸異構酶I抑制劑(例如CPT 11、拓撲替康(topotecan)、9 AC及GG 211)、吉西他濱(gemcitabine)、長春瑞濱(vinorelbine)、奧沙利鉑(oxaliplatin)、5-氟尿嘧啶(5-FU)、甲醯四氫葉酸、長春瑞濱(vinorelbine)、temodal、細胞遲緩素B、短桿菌素D、吐根鹼、絲裂黴素、依托泊苷(etoposide)、替尼泊苷(tenoposide)、長春新鹼(vincristine)、長春花鹼(vinblastine)、秋水仙鹼(colchicin)、多柔比星(doxorubicin)、柔紅黴素(daunorubicin)、二羥基炭疽菌素二酮、米托蒽醌(mitoxantrone)、光輝黴素
(mithramycin)、放線菌素D、1二氫睪固酮(dehydrotestosterone)、醣皮質素、普羅卡因、四卡因、利多卡因、心得安(propranolol)及嘌黴素同源物及環磷醯胺(cytoxan)。
於一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組環磷醯胺,例如低劑量之環磷醯胺投予至個體。環磷醯胺(Elostan,Cytoxan)為化學治療劑,其當以低劑量使用時(例如當靜脈內投予達300mg/m2
、300mg/m2
或約300mg/m2
)具有免疫調節功能。具體而言,低劑量之環磷醯胺可降低調控性T細胞(Treg)(例如CD4+CD25+FoxP3+細胞或,或者,CD45+CD3+CD4+CD8-FOXP3+CD25hiCD127低細胞)之數量與增殖能力並調節免疫抑制網絡。在一些具體實施例中,環磷醯胺投予劑量為約50mg/m2
、100mg/m2
、200mg/m2
、300mg/m2
、500mg/m2
或更多。在一些具體實施例中,環磷醯胺投予劑量為10mg/m2
至100mg/m2
、50mg/m2
至200mg/m2
、50mg/m2
至300mg/m2
、50mg/m2
至500mg/m2
之範圍。在一些具體實施例中,環磷醯胺投予至個體在初次投予本文所述之抗GITR抗體或其抗原-結合片段之前或之後1小時、2小時、3小時、4小時、8小時、12小時、1天、5天或更多內。在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合環磷醯胺使用,例如低劑量環磷醯胺,以治療轉移性腎細胞癌(RCC)。
於一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合Treg-抑制劑投予至個體。Treg-抑制劑的例子包括Zenapax®
(賽尼哌(daclizumab))(Roche),其為人類抗CD25單株抗體,用於例如器官移植中誘導免疫抑制。賽尼哌(daclizumab)阻擋IL-2結合CD25,其亦為維持Treg之訊號。抑制Treg的另一劑為Sutent®
(舒尼替尼(Sunitinib))(Pfizer),其為小分子、多標的之酪胺酸激酶抑制劑,獲准治療腎細胞癌(RCC)及其他癌症。可抑制Treg的另一劑為1-甲基-D-色胺酸(1-MT)、吲哚胺2,3-二氧酶(IDO)之競爭性抑制劑。IDO為表現在某些正常及新生細胞之免疫抑制劑且可為與癌症患者之Treg的增加相關。額外Treg抑制劑包括阻擋Treg通往腫瘤微環境之劑。此劑可包括對某些趨化介素及趨化介素受體諸如CCL17、CCL22及CCR4之抗體。
可依照本文所述之方法使用之Treg-抑制劑進一步例子揭示於下述專利申請案,為了所有目的,其整體以引用方式併入本文:U.S.專利公開案號US 2009/0214533、US 2012/0142750、US 2011/0305713、US 2009/0004213、US 2012/0219559、US 2010/0278844、US 2013/0323283及US 2008/0152665。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段可在手術之前、期間或之後投予至個體。
在某些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合免疫調節劑或抗體投予至個體。免疫調節劑或抗體可為但不限於佐劑、抗原、抗CD3(例如OKT3)、查核點靶向劑或調節劑或介白素。術語“查核點靶向劑”或“查核點調節劑”可交替使用且意指選擇性調節免疫系統查核點之調節性分子(例如共抑制查核點分子(例如蛋白質)或共刺激查核點分子(例如蛋白質),其為例如受體或配體)的表現或活性之劑。查核點靶向劑可為選自下列所組成群組:查核點分子之促效劑、查核點分子之拮抗劑、選擇性靶向查核點分子之多胜肽(例如胜肽配體、抗體、抗體片段);選擇性靶向查核點分子之小分子;且選擇性調節查核點分子之表現或活性之調控性核酸(例如siRNA、miRNA)。於一具體實施例中,查核點靶向劑可為選自下列所組成群組:PD-1之拮抗劑、PD-L1之拮抗劑、PD-L2之拮抗劑、CTLA-4之拮抗劑、TIM-3之拮抗劑、LAG-3之拮抗劑、GITR之促效劑及OX40之促效劑。因此,在一些具體實施例中,抗GITR促效抗體(例如Hum231#1、Hum231#2或Hum231#2w)或其抗原-結合片段可組合,例如抗CTLA-4拮抗劑抗體或其抗原-結合片段或另一查核點靶向劑投予,呈單一醫藥組成物或在不同醫藥組成物一起或分別投予。
在一些具體實施例中,本文提供為治療個體中癌症之方法,其包括投予至個體抗GITR抗體或其抗原-
結合片段及OX40之促效劑及/或LAG-3、TIM-3、PD-1及/或CTLA-4之拮抗劑。在一些具體實施例中,癌症選自多形性神經膠質母細胞瘤、轉移性黑色素瘤、抗藥轉移性黑色素瘤、轉移性卵巢癌、轉移性腎細胞癌、頭及頸癌症、胃癌症、食道癌、非小細胞肺癌、小兒腦腫瘤、低級星形細胞瘤(低-grade asctrocytoma)、室管膜瘤及髓母細胞瘤(meduloblastoma)。
於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合抑制(部分地或完全地)CTLA-4訊息傳遞之劑,諸如特異性結合人類CTLA-4的抗體(例如曲力莫單抗(tremelimumab)(Pfizer);易普利姆瑪(ipilimumab)(Yervoy®
,Bristol-Myers Squibb))或CTLA-4-Ig融合蛋白,投予至個體。在一些具體實施例中,使用抗GITR抗體或其抗原-結合片段組合CTLA-4之拮抗劑(例如曲力莫單抗(tremelimumab)或易普利姆瑪(ipilimumab))治療轉移性卵巢癌。在一些具體實施例中,使用抗GITR抗體或其抗原-結合片段組合CTLA-4之拮抗劑(例如曲力莫單抗(tremelimumab)或易普利姆瑪(ipilimumab))治療轉移性卵巢癌,其對CTLA-4之拮抗劑(例如曲力莫單抗(tremelimumab)或易普利姆瑪(ipilimumab))有抗性。在一些具體實施例中,使用抗GITR抗體或其抗原-結合片段與CTLA-4之拮抗劑(例如曲力莫單抗(tremelimumab)或易普利姆瑪(ipilimumab))治療多形性神經膠質母細胞瘤。在一些
具體實施例中,多形性神經膠質母細胞瘤為復發。在一些具體實施例中,多形性神經膠質母細胞瘤為新診斷。在一些具體實施例中,多形性神經膠質母細胞瘤為個體中具有非甲基化MGMT啟動子。在一些具體實施例中,多形性神經膠質母細胞瘤為對貝伐單抗(Bevacizumab)療法有抗性。在一些具體實施例中,多形性神經膠質母細胞瘤為個體中尚未接受貝伐單抗(Bevacizumab)療法。可用在本文揭露之治療方法的抗CTLA-4抗體的例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文:國際公開案號WO 00/037504、WO 01/014424及WO 09/100140;U.S.專利號6,207,156及7,034,121。可依據本文所述之方法使用之抗CTLA-4抗體進一步例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文,U.S.專利號7,465,446、8,263,073;8,142,778及8,226,946;且U.S.申請號US 2003/086930、US 2005/226875、US 2007/243184、US 2009/123477及US 2011/044953。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合抑制(部分地或完全地)LAG-3訊息傳遞之劑投予,諸如特異性結合人類LAG-3之抗體。可用於本文所述治療方法的抗LAG-3抗體或其抗體片段的例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文:U.S.專利號6,143,273及6,197,524;U.S.專利公開案號US 2011/0150892、US
2010/0233183及US 2010/196394。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合抑制(部分地或完全地)TIM-3訊息傳遞之劑投予,諸如特異性結合人類TIM-3之抗體。可用於本文所述治療方法的抗TIM-3抗體或其抗體片段的例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文:U.S.專利號7,470,428及8,101,176;U.S.公開案號US 2013/0022623、US 2010/0100131、US 2010/0100131及US 2010/061992。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合抑制(部分地或完全地)PD-1訊息傳遞之劑投予,諸如特異性結合人類PD-1之抗體。在一些具體實施例中,抗PD-1抗體或其抗體片段投予至如本文所述個體。在一些具體實施例中,抗PD-1抗體為尼沃單抗(Nivolumab)(BMS-936558或MDX1106)或拉立珠單抗(Lambrolizumab)(MK-3475)或皮立珠單抗(Pidilizumab)(CT-011)。可用於本文揭露之治療方法的抗PD-1抗體進一步非限制性的例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文:U.S.專利號6,808,710;7,488,802;8,008,449;8,114,845及8,168,757、U.S.公開案號US 2013/0202623及PCT公開案號WO 2013/033091。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合抑制(部分地或完全地)PD-L1
活性之劑投予,諸如特異性結合人類PD-L1之抗體。在一些具體實施例中,抗PD-L1抗體為BMS-936559、MPDL3280A、MEDI4736或MSB0010718C。可用於本文揭露之治療方法的抗PD-L1抗體進一步非限制性的例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文:U.S.專利號8,168,179及U.S.公開案號US 2010/0203056及US 2003/0232323。於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合抑制(部分地或完全地)PD-L2活性之劑投予,諸如特異性結合人類PD-L2之抗體。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合活化或增強OX-40訊息傳遞之劑投予,諸如特異性結合人類OX-40之抗體。可用於本文所述治療方法的抗OX40抗體或其抗體片段的例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文:U.S.專利號7,550,140;7,807,156;8,283,450;8,614,295及7,531,170;U.S.公開案號US 2010/0196359,US 2010/0136030及US 2013/0183315。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合疫苗投予至個體,諸如本文所述者,包括上述章節5.4.1。於一特定具體實施例中,抗GITR抗體或其抗原-結合片段組合熱休克蛋白質為主之腫瘤-疫苗投予至個體。熱休克蛋白質(HSP)為橫越所有品種無所不在地發現的高度保留蛋白質家族。其表現因為熱
休克或其他型態的壓力,包括曝露於毒素、氧化壓力或葡萄糖剝奪,可經有力地誘導成高許多的量。依據分子量:HSP-110、-90、-70、-60及-28分類成五個家族。HSP通過抗原呈現細胞(APC)諸如巨噬細胞及樹狀細胞(DC)之交互呈現途徑遞送免疫原性胜肽,導致T細胞活化。HSP功能為形成能夠誘導腫瘤-特異性免疫之錯合物的腫瘤相關抗原性胜肽的伴侶載劑。一但從死掉腫瘤細胞釋出,HSP-抗原錯合物被抗原呈現細胞(APC)攝入,其中抗原被處理成結合第I型MHC及第II型分子的胜肽,導致抗腫瘤CD8+及CD4+T細胞之活化。源自腫瘤製劑的HSP錯合物引發的免疫為特異性針對各個體癌症所表現之獨特抗原性胜肽譜。
熱休克蛋白質胜肽複合物(HSPPC)為蛋白質胜肽複合物,由熱休克蛋白質非共價性複合抗原性胜肽組成。HSPPC引發先天性及適應性免疫反應兩者。於一特定具體實施例中,抗原性胜肽(群)顯示對被治療之癌症的抗原性。由通過膜受體(主要是CD91)之APC或由結合Toll-樣受體,HSPPC可有效地被抓住。HSPPC內在化導致具趨化介素及細胞激素產生之APC的功能成熟,引起自然殺手細胞(NK)、單核球及Th1及Th-2-媒介之免疫反應之活化。在一些具體實施例中,用於本文所揭露之方法之HSPPC包括一或多熱休克蛋白質,來自與抗原性胜肽複合的壓力蛋白質hsp60、hsp70或hsp90家族。在一些具體實施例中,HSPPC包括hsc70、hsp70、hsp90、
hsp110、grp170、gp96、鈣網伴護蛋白或其二或更多之組合。
於一特定具體實施例中,抗GITR抗體或其抗原-結合片段組合熱休克蛋白質胜肽複合物(HSPPC),例如熱休克蛋白質胜肽複合物-96(HSPPC-96),投予至個體來治療癌症,例如多形性神經膠質母細胞瘤。HSPPC-96包括與抗原性胜肽複合之96kDa熱休克蛋白質(Hsp),gp96。HSPPC-96為自個體的腫瘤製造的癌症免疫療法及包含癌症的抗原性“指紋”。在一些具體實施例中,此指紋包含獨特抗原,其僅存在於特別個體的特定癌症細胞,且注射疫苗意於刺激個體免疫系統辨識及攻擊具有特定癌症指紋的任何細胞。
在一些具體實施例中,HSPPC,例如HSPPC-96,從個體的腫瘤組織產生。於一特定具體實施例中,從被治療之癌症類型的腫瘤或其轉移產生HSPPC(例如HSPPC-96)。在另一特定具體實施例中,HSPPC(例如HSPPC-96)對被治療之個體為自體。在一些具體實施例中,腫瘤組織為非壞死性腫瘤組織。在一些具體實施例中,使用至少1克(例如至少1、至少2、至少3、至少4、至少5、至少6、至少7、至少8、至少9或至少10克)之非壞死性腫瘤組織以產生疫苗接種方案。在一些具體實施例中,手術切除後,在用於疫苗製劑之前冷凍非壞死性腫瘤組織。在一些具體實施例中,HSPPC,例如HSPPC-96,藉由純化技術單離自腫瘤組織、過濾及製備
成可注射疫苗。在一些具體實施例中,個體被投予6至12劑量之HSPPC,例如HSPCC-96。在此具體實施例中,HSPPC(例如HSPPC-96)劑前4劑可週投予,之後雙週投予2至8個額外劑。
在一些具體實施例中,使用抗GITR抗體或其抗原-結合片段組合HSPPC-96治療轉移性黑色素瘤(例如抗藥轉移性黑色素瘤)、轉移性卵巢癌或轉移性腎細胞癌。在一些具體實施例中,使用抗GITR抗體或其抗原-結合片段組合HSPPC-96治療多形性神經膠質母細胞瘤。在一些具體實施例中,使用抗GITR抗體或其抗原-結合片段及CTLA-4之拮抗劑組合HSPPC-96治療多形性神經膠質母細胞瘤。在一些具體實施例中,投予HSPPC之前,欲治療之個體經免疫抑制(例如因為感染,例如HIV,或因為已經過抗癌症療法(例如化療放射)。
可用於依據本文所述之方法HSPPC進一步的例子揭示於下述專利及專利申請案,為了所有目的,其整體以引用方式併入本文U.S.專利號6,391,306、6,383,492、6,403,095、6,410,026、6,436,404、6,447,780、6,447,781及6,610,659。
在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合靶向免疫調節性酵素(群),諸如IDO(吲哚胺-(2,3)-二氧酶)及TDO(色胺酸2,3-二氧酶)的化合物投予至個體。於特別具體實施例中,此化合物選自下列所組成群組:依帕卡朵絲坦(epacadostat)
(Incyte Corporation)、F001287(Flexus Biosciences)、印朵目德(indoximod)(NewLink Genetics)及NLG919(NewLink Genetics)。於一具體實施例中,化合物為依帕卡朵絲坦(epacadostat)。於另一具體實施例中,化合物為F001287。於另一具體實施例中,化合物為印朵目德(indoximod)。於另一具體實施例中,化合物為NLG919。
癌症患者中CD4+
CD25+
Treg升高之量避免宿主發動有效抗腫瘤免疫反應。此外,高Treg頻率與降低患者存活有關(Curiel TJ et al.,(2004)Nat Medicine 10(9):942-9;Woo EY et al.,(2002)J Immunol 168:4272-6)。然而,耗盡調控性T細胞之後觀察到癌症患者的PBMC中免疫活性之增加(Dannull J et al.,(2005)J Clin Invest 115(12):3623-33)。Treg在其表面表現高量之GITR可被抗GITR抗體DTA-1耗盡(Coe D et al.,(2010)Cancer Immunol Immunother 59:1367-77)。於一具體實施例中,免疫為主之策略可合併以抗GITR抗體或其抗原-結合片段活體外或或體內Treg耗盡,造成耗盡GITR-陽性Treg細胞。
在某些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合溶瘤病毒諸如Talimogene laherparepvec(OncoVEX GM-CSF)及CGTG-102(Ad5/3-D24-GMCSF)投予至個體。
在某些具體實施例中,本文所述之抗GITR抗
體或其抗原-結合片段組合有效抑制腫瘤生長/轉移之細胞激素(群)投予至個體。此細胞激素、淋巴激素或其他造血因子包括但不限於M-CSF、GM-CSF、TNF、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12、IL-13、IL-14、IL-15、IL-16、IL-17、IL-18、IFN、TNFα、TNF1、TNF2、G-CSF、Meg-CSF、GM-CSF、血小板生成素、幹細胞因子及紅血球生成素。
在某些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合受體酪胺酸激酶抑制劑(群)諸如甲磺酸伊馬替尼(imatinib mesylate)(銷售為Gleevec®
或Glivac®
)、厄洛替尼(erlotinib)(EGF受體抑制劑)現銷售為Tarveca或舒尼替尼(Sunitinib)(銷售為Sutent®
)投予至個體。
在某些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合拮抗性TGF-貝他抗體,諸如Fresolimumab®
(GC1008)、靶向及抑制TGF-貝他1、2或3異型體之抗體投予至個體。
在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段或其組成物投予至患有或診斷有癌症之個體。於一特定具體實施例中,抗GITR抗體或其組成物投予至患有或診斷有多形性神經膠質母細胞瘤之個體。在一些具體實施例中,多形性神經膠質母細胞瘤復發。在一些具體實施例中,多形性神經膠質母細胞瘤為新診斷出。在一些具體實施例中,多形性神經膠質母細胞瘤
為個體中具有非甲基化MGMT啟動子。在一些具體實施例中,多形性神經膠質母細胞瘤復發。在一些具體實施例中,多形性神經膠質母細胞瘤為新診斷出。在一些具體實施例中,多形性神經膠質母細胞瘤為個體中具有非甲基化MGMT啟動子。在一些具體實施例中,多形性神經膠質母細胞瘤對貝伐單抗(Bevacizumab)療法有抗性。在一些具體實施例中,多形性神經膠質母細胞瘤為個體中尚未接受貝伐單抗(Bevacizumab)療法。
在某些具體實施例中,依照本文所述之方法治療的患者為已經受抗生素、抗癌劑或其他生物療法/免疫療法治療的患者。儘管以現有療法管理或治療,這些患者中為難治型患者、對習知療法而言太年輕的患者及有再發生之病毒感染的患者。
在一些具體實施例中,投予本文所述之抗GITR抗體或其抗原-結合片段或其組成物的個體投予該抗體或其組成物之前尚未接受療法。在其他具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段或其組成物投予至投予該抗體或其組成物之前已接受療法的個體。
在某些具體實施例中,抗GITR抗體或其抗原-結合片段或其組成物投予至接受或從免疫抑制療法恢復之個體。在某些具體實施例中,抗GITR抗體或其組成物投予至有癌症個體,而癌症細胞表現GITRL。在一些具體實施例中,依照本文所揭露之方法欲治療的個體為經免疫抑制(例如因為感染,例如HIV,或由於經歷抗癌症療法
(例如化療放射)。
如本文所述,抗GITR抗體影響蛋白質表面表現,包括OX40、CD25及PD-1。據此,在某些具體實施例中,在投予結合OX40、CD25或PD-1的抗體或其抗原-結合片段之前投予抗GITR抗體或其抗原-結合片段或其組成物。
相對於在投予之時個體中PD-1的表現,在促效劑GITR抗體或其抗原-結合片段已增加個體中PD-1表面表現之時可投予拮抗劑PD-1抗體或其抗原-結合片段。舉例來說,在投予促效劑GITR抗體之後至少12小時、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天或至少7天可投予拮抗劑PD-1抗體或其抗原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後12小時至二週、1天至二週、2天至二週或3天至二週可投予拮抗劑PD-1抗體或其抗原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後12小時至一週、1天至一週、2天至一週或3天至一週可投予拮抗劑PD-1抗體或其抗原-結合片段。
相對於在投予之時個體中OX40的表現,在促效劑GITR抗體或其抗原-結合片段已增加個體中OX40表面表現之時可投予促效劑OX40抗體或其抗原-結合片段。舉例來說,在投予促效劑GITR抗體之後至少12小時、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天或至少7天可投予促效劑OX40抗體或其抗
原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後12小時至二週、1天至二週、2天至二週或3天至二週可投予促效劑OX40抗體或其抗原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後12小時至一週、1天至一週、2天至一週或3天至一週可投予促效劑OX40抗體或其抗原-結合片段。
相對於在投予之時個體中CD25的表現,在促效劑GITR抗體或其抗原-結合片段已增加個體中CD25表面表現之時可投予抗CD25抗體或其抗原-結合片段。舉例來說,在投予促效劑GITR抗體之後至少12小時、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天或至少7天可投予抗CD25抗體或其抗原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後12小時至二週、1天至二週、2天至二週或3天至二週可投予抗CD25抗體或其抗原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後12小時至一週、1天至一週、2天至一週或3天至一週可投予抗CD25抗體或其抗原-結合片段。
在投予促效劑GITR抗體或抗原-結合片段之後可投予拮抗劑CTLA-4抗體或其抗原-結合片段。舉例來說,在投予促效劑GITR抗體之後至少12小時、至少1天、至少2天、至少3天、至少4天、至少5天、至少6天或至少7天可投予拮抗劑CTLA-4抗體或其抗原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後
12小時至二週、1天至二週、2天至二週或3天至二週可投予拮抗劑CTLA-4抗體或其抗原-結合片段。在投予促效劑GITR抗體或其抗原-結合片段之後12小時至一週、1天至一週、2天至一週或3天至一週可投予拮抗劑CTLA-4抗體或其抗原-結合片段。
可依照本文所述之方法治療之癌症的例子包括但不限於B細胞淋巴瘤(例如B細胞慢性淋巴球性白血病、B細胞非何杰金氏(non-Hodgkin)淋巴瘤、皮膚B細胞淋巴瘤、瀰漫性大型B細胞淋巴瘤)、基底細胞癌、膀胱癌、胚細胞瘤、腦轉移、乳癌、布凱特氏(Burkitt)淋巴瘤、癌(例如腺癌(例如胃與食道的交界處之腺癌))、子宮頸癌、結腸癌、結腸直腸癌(結腸癌及直腸癌)、子宮內膜癌、食道癌、尤恩氏肉瘤(Ewing sarcoma)、濾泡淋巴瘤、胃癌、胃與食道的交界處癌、胃腸道癌、神經膠質母細胞瘤(例如多形性神經膠質母細胞瘤、例如新診斷出的或復發的)、神經膠質瘤、頭及頸癌症(例如頭及頸鱗狀細胞癌)、肝轉移、何杰金氏淋巴瘤及非何杰金氏淋巴瘤、腎臟癌(例如腎細胞癌及威爾姆氏(Wilms’)腫瘤)、喉癌、白血病(例如慢性骨髓細胞白血病、髮樣細胞白血病)、肝癌(liver cancer)(例如肝癌(hepatic carcinoma)及肝腫瘤)、肺癌(例如非小細胞肺癌及小細胞肺癌)、淋巴母細胞淋巴瘤、淋巴瘤、被套細胞淋巴瘤、轉移性腦腫瘤、轉移性癌症、骨髓瘤(例如多發性骨髓瘤)、神經胚細胞瘤、眼黑色素瘤、口
咽癌症、骨肉瘤、卵巢癌、胰腺癌(例如胰管腺癌)、前列腺癌(例如荷爾蒙抗性(例如去勢抗性)、轉移性、轉移性荷爾蒙抗性(例如去勢抗性、非雄性素依賴姓))、腎細胞癌(例如轉移性)、唾液腺癌、肉瘤(例如橫紋肌肉瘤)、皮膚癌(例如黑色素瘤(例如轉移性黑色素瘤))、軟組織肉瘤、實性瘤、鱗狀細胞癌、滑液肉瘤、睾丸癌、甲狀腺癌、移行性細胞癌症(泌尿細胞癌症)、葡萄膜黑色素瘤(例如轉移性)、疣狀癌、外陰癌(vulval cancer)及華氏巨球蛋白血症(Waldenstrom macroglobulinemia)。
在一些具體實施例中,依照本文所述之方法所治療之癌症為人類肉瘤或癌、例如纖維肉瘤、黏液肉瘤、脂肉瘤、軟骨肉瘤、骨原肉瘤、脊索瘤、血管肉瘤、內皮肉瘤(endotheliosarcoma)、淋巴管肉瘤、淋巴管內皮瘤(lymphangioendotheliosarcoma)、滑膜瘤、中皮瘤、尤恩氏(Ewing's)腫瘤、平滑肌肉瘤、橫紋肌肉瘤、結腸癌、胰腺癌、乳癌、卵巢癌、前列腺癌、鱗狀細胞癌、基底細胞癌、腺癌、汗腺癌、皮脂腺癌、乳突癌、乳突腺癌、囊腺癌、髓狀癌、支氣管癌、腎細胞癌(例如轉移性)、肝腫瘤、膽管癌、絨毛膜癌、精原細胞瘤、胚癌、威爾姆氏(Wilms’)腫瘤、子宮頸癌、睪丸腫瘤、肺癌、小細胞肺癌、膀胱癌、上皮癌、神經膠質瘤、多形性神經膠質母細胞瘤、星狀細胞瘤、神經管胚細胞瘤、顱咽管瘤、室管膜瘤、松果體瘤、血管母細胞瘤、聽神經瘤、
寡樹突細胞瘤、腦脊髓膜瘤、黑色素瘤、神經胚細胞瘤、視網膜母細胞瘤。在某些具體實施例中,依照本文所述之方法所治療之癌症為急性淋巴球性白血病或急性骨髓細胞白血病(例如骨髓母細胞性、早幼粒細胞性(promyelocytic)、骨髓單核球、單核球性及紅白血病);慢性白血病(慢性骨髓性(顆粒球性)白血病或慢性淋巴球性白血病);何杰金氏淋巴瘤疾病;非何杰金氏淋巴瘤疾病;急性骨髓樣白血病;B-細胞淋巴瘤;T-細胞淋巴瘤;退行性大型細胞淋巴瘤;眼內淋巴瘤;濾泡淋巴瘤;小腸淋巴瘤;或脾邊緣區淋巴瘤。在某些具體實施例中,依照本文所述之方法所治療之癌症為多發性骨髓瘤、華氏巨球蛋白血症(Waldenstrom's macroglobulinemia)、重鏈疾病、胃腸基質腫瘤、頭及/或頸癌症(例如下咽之鱗狀細胞癌、喉頭之鱗狀細胞癌、口咽之細胞癌或喉頭疣狀癌)、子宮內膜基質肉瘤、肥胖細胞肉瘤、成人軟組織肉瘤、子宮肉瘤、莫克爾氏(merkel)細胞癌、泌尿癌、帶腦轉移之黑色素瘤、葡萄膜黑色素瘤、帶肝轉移之葡萄膜黑色素瘤、非小細胞肺癌、直腸癌或骨髓化生不良症候群,在一些具體實施例中,依照方法所治療之癌症為轉移性。
在某些具體實施例中,依照本文所述之方法所治療之癌症包括前列腺癌、乳癌、肺癌症、結腸直腸癌、黑色素瘤、支氣管癌症、膀胱癌、腦或中樞神經系統癌症、周邊神經系統癌症、子宮或子宮內膜癌症、口內腔
或咽之癌症、非何杰金氏淋巴瘤、甲狀腺癌、腎臟癌、膽道癌症、小腸或闌尾癌症、唾液腺癌症、甲狀腺癌症、腎上腺癌症、鱗狀細胞癌、中皮瘤、骨癌、胸腺瘤(thyoma)/胸腺癌、神經膠質母細胞瘤、骨髓化生不良症候群、軟組織肉瘤、DIPG、腺癌、骨肉瘤、軟骨肉瘤、白血病或胰腺癌。在一些具體實施例中,依照本文所述之方法所治療之癌症包括癌(例如腺癌)、淋巴瘤、胚細胞瘤、黑色素瘤、肉瘤或白血病。在某些具體實施例中,依照本文所述之方法所治療之癌症包括鱗狀細胞癌、小細胞肺癌、非小細胞肺癌、胃腸道癌、何杰金氏淋巴瘤、非何杰金氏淋巴瘤、胰腺癌、神經膠質母細胞瘤、神經膠質瘤、子宮頸癌、卵巢癌、肝癌(liver cancer)(例如肝癌(hepatic carcinoma)及肝腫瘤)、膀胱癌、乳癌、炎性乳癌、莫克爾氏(merkel)細胞癌、結腸癌、結腸直腸癌、胃癌症、泌尿膀胱癌、子宮內膜癌、骨髓瘤(例如多發性骨髓瘤)、唾液腺、癌、腎臟癌(例如腎細胞癌及威爾姆氏(Wilms’)腫瘤)、基底細胞癌、黑色素瘤、前列腺癌、外陰癌(vulval cancer)、甲狀腺癌、睾丸癌、食道癌、漿液性腺癌或各種類型之頭及頸癌症。在某些具體實施例中,依照本文所述之方法所治療之癌症包括結締組織增生性黑素瘤、炎性乳癌、胸腺瘤、直腸癌、肛門癌或手術可治療或非手術可治療之腦幹神經膠質瘤。於一特定具體實施例中,癌症為實性瘤。在另一特定具體實施例中,癌症為多形性神經膠質母細胞瘤。在一些具體
實施例中,多形性神經膠質母細胞瘤復發。在一些具體實施例中,多形性神經膠質母細胞瘤為新診斷出。在一些具體實施例中,多形性神經膠質母細胞瘤為個體中具有非甲基化MGMT啟動子。在一些具體實施例中,多形性神經膠質母細胞瘤為對貝伐單抗(Bevacizumab)療法有抗性。在一些具體實施例中,多形性神經膠質母細胞瘤為在尚未接受貝伐單抗(Bevacizumab)療法之個體中。
在一些具體實施例中,依照本文所述之方法所治療之癌症為轉移性黑色素瘤(例如抗藥轉移性黑色素瘤)、轉移性卵巢癌或轉移性腎細胞癌。在某些具體實施例中,依照本文所述之方法所治療之癌症為對易普利姆瑪(ipilimumab)有抗性之黑色素瘤。在一些具體實施例中,依照本文所述之方法所治療之癌症為對尼沃單抗(Nivolumab)有抗性之黑色素瘤。在一些具體實施例中,依照本文所述之方法所治療之癌症為對易普利姆瑪(ipilimumab)及尼沃單抗(Nivolumab)有抗性之黑色素瘤。
5.4.1.2 感染性疾病
於一特定態樣中,本文所呈現為預防及/或治療感染性疾病之方法,其包括投予至有需要的個體有效量的本文所述之抗GITR抗體或其抗原-結合片段或其組成物。於一具體實施例中,本文提供為預防及/或治療感染(例如病毒感染、細菌感染、真菌感染、原蟲感染或寄生
蟲感染)之方法。依照方法所預防及/或治療之感染可由本文所辨識之感染物所造成。於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段或其組成物為唯一活性劑投予至個體。在一些具體實施例中,使用本文所述之抗GITR抗體或其抗原-結合片段或其組成物組合抗感染干擾(例如抗病毒藥、抗細菌藥、抗真菌藥或抗蠕蟲藥)治療感染性疾病。
可由本文所述之抗GITR抗體或其抗原-結合片段預防及/或治療之感染性疾病由感染物造成,其包括但不限於細菌、寄生蟲、真菌、原蟲及病毒。於一特定具體實施例中,由本文所述之抗GITR抗體或其抗原-結合片段所治療及/或預防之感染性疾病由病毒造成。依照本文所述之方法可預防及/或治療之病毒疾病或病毒感染包括但不限於由A型肝炎、B型肝炎、C型肝炎、流感(例如流感A或流感B)所造成者、水痘、腺病毒、第I型單純皰疹(HSV-I)、第II型單純皰疹(HSV-II)、牛瘟、鼻病毒、埃可病毒(echovirus)、輪狀病毒、呼吸系融合細胞病毒、乳突病毒、乳多泡病毒、細胞巨大病毒、埃可病毒(echinovirus)、節足動物攜帶性病毒、漢坦病毒(huntavirus)、柯薩奇病毒、腮腺炎病毒、麻疹病毒、德國麻疹病毒、小兒麻痺病毒、天花、艾司坦氏-巴爾氏病毒(Epstein Barr virus)、人類免疫缺乏病毒第I型(HIV-I)、人類免疫缺乏病毒第II型(HIV-II)及病毒疾病之物諸如病毒腦膜炎、腦炎、登革熱或天花。
可預防及/或治療之細菌感染包括由大腸桿菌(Escherichia coli)、克留氏肺炎桿菌(Klebsiella pneumoniae)、金黃色葡萄球菌(Staphylococcus aureus)、糞腸球菌(Enterococcus faecalis)、普通變形桿菌(Proteus vulgaris)、草綠色鏈球菌(Staphylococcus viridans)及綠膿桿菌(Pseudomonas aeruginosa)造成的感染。依照本文所述之方法可預防及/或治療之由細菌(例如大腸桿菌(Escherichia coli)、克留氏肺炎桿菌(Klebsiella pneumoniae)、金黃色葡萄球菌(Staphylococcus aureus)、糞腸球菌(Enterococcus faecalis)、普通變形桿菌(Proteus vulgaris)、草綠色鏈球菌(Staphylococcus viridans)及綠膿桿菌(Pseudomonas aeruginosa))造成的細菌疾病包括但不限於分枝桿菌立克次氏體(Mycobacteria rickettsia)、黴漿菌屬(Mycoplasma)、奈瑟菌屬(Neisseria)、肺炎鏈球菌(S.pneumonia)、伯氏疏螺旋體(Borrelia burgdorferi)(萊姆病)、炭疽桿菌(Bacillus antracis)(炭疽)、破傷風、鏈球菌屬(Streptococcus)、葡萄球菌屬(Staphylococcus)、分枝桿菌屬(mycobacterium)、百日咳、霍亂、瘟疫、白喉、披衣菌屬(chlamydia)、金黃色葡萄球菌及退伍軍人桿菌(legionella)。
依照本文所述之方法可預防及/或治療之原蟲所造成之原蟲疾病或原蟲感染包括但不限於利什曼原蟲屬
(leishmania)、球蟲症、錐蟲血吸蟲或瘧疾。依照本文所述之方法可預防及/或治療之寄生蟲造成的寄生蟲疾病或寄生蟲感染包括但不限於披衣菌屬(chlamydia)及立克次體屬(rickettsia).
依照本文所述之方法可預防及/或治療之真菌疾病或真菌感染包括但不限於由念珠菌屬(Candida)感染、接合菌(zygomycosis)、念珠菌性乳腺炎(Candida mastitis)、帶潛伏trichosporonemia之漸進散播性毛孢子菌病(trichosporonosis)、散播性念珠菌病、肺部巴西副球黴菌病、肺部麴菌病、肺胞囊蟲(Pneumocystis carinii)肺炎、隱球菌性腦膜炎、球黴菌性(coccidioidal)腦膜腦炎及腦脊血管炎、黑麴菌(Aspergillus niger)感染、鐮刀菌性角膜炎(Fusarium keratitis)、副鼻腔黴菌病、薰煙色麴菌(Aspergillus fumigatus)心內膜炎、脛骨軟骨發育不良(tibial dyschondroplasia)、光滑念珠菌(Candida glabrata)陰道炎、口咽念珠菌病、X-連接慢性肉芽腫疾病、足癬、皮膚念珠菌病、黴菌性胎盤炎、散播性毛孢子菌病(trichosporonosis)、過敏性支氣管與肺部麴菌病、黴菌性角膜炎、新隱球菌(Cryptococcus neoformans)感染、真菌腹膜炎、膝曲彎孢菌(Curvularia geniculata)感染、金黃色葡萄球菌眼內炎、孢子絲菌病及皮癬菌病所造成者。
在某些具體實施例中,投予本文所述之抗
GITR抗體或其抗原-結合片段或其組成物至個體(在一些具體實施例中,動物模式)達到一、二、三、四或更多的下述效果(i)減少或改善感染性疾病、感染或與之相關的症狀的嚴重性;(ii)減少感染性疾病、感染或與之相關的症狀之持續期間;(iii)抑制感染性疾病、感染或與之相關的症狀之發展;(iv)復原感染性疾病、感染或與之相關的症狀;(v)抑制感染性疾病、感染或與之相關的症狀之發展或開始;(vi)抑制感染性疾病或與之相關的症狀復發;(vii)減少或抑制感染物從一細胞至另一細胞、一組織至另一組織或一器官至另一器官的擴散;(viii)抑制或減少感染物從一個體至另一個體的的擴張/傳播;(ix)減少與感染性疾病相關的器官衰竭;(x)減少個體住院治療;(xi)減少住院治療長度;(xii)增加患有感染性疾病或感染的個體之存活;(xiii)排除感染性疾病或感染;(xiii)抑制或減少感染物或感染複製;(xiv)抑制或減少感染物進入細胞(群);(xv)抑制或減少感染物基因體複製;(xvi)抑制或減少感染物蛋白質合成;(xvii)抑制或減少感染物組合;(xviii)抑制或減少感染物從細胞(群)釋出;(xviii)減少感染物之數量或力價;(xix)減少與感染性疾病相關的症狀或感染之數量;(xx)增強、改良、補充、互補或擴大另一療法的預防或治療效果;及/或(xxi)避免第二與感染性疾病相關的感染開始或發展。
在某些具體實施例中,二或更多不同本文所
述之抗GITR抗體或其抗原-結合片段投予至個體。在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合一或多其他療法投予至個體。於一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合一或多抗真菌藥投予。
於一特定具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合一或多抗生素投予至個體。可組合本文所述之抗GITR抗體或其抗原-結合片段使用之抗生素的例子包括胺基糖苷抗生素、醣肽、氯黴素(amphenicol)抗生素、安沙黴素(ansamycin)抗生素、頭孢菌素(cephalosporin)、頭黴素類唑烷酮(cephamycins oxazolidinone)、青黴素、喹啉酮、鏈黴殺陽素(streptogamin)、四環素(tetracyclins)及其類似物。
於另一具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段組合一或多抗抗病毒藥投予。可組合本文所述之抗GITR抗體或其抗原-結合片段使用之抗病毒劑的例子包括非核苷反轉錄酶抑制劑、核苷反轉錄酶抑制劑、蛋白酶抑制劑及融合抑制劑。於一具體實施例中,抗病毒劑為阿曼他丁(amantadine)、奧司他偉(oseltamivir)磷酸鹽、金剛乙胺(rimantadine)及扎那米偉(zanamivir)。於另一具體實施例中,抗病毒劑為非核苷反轉錄酶抑制劑,諸如拉韋啶(delavirdine)、依非韋倫(efavirenz)或奈韋拉平(nevirapine)。於另一具
體實施例中,抗病毒劑為核苷反轉錄酶抑制劑,諸如阿巴卡韋(abacavir)、去羥肌苷(didanosine)、恩曲他濱(emtricitabine)、恩曲他濱(emtricitabine)、拉米夫定(lamivudine)、司他夫定(stavudine)、替諾福韋(tenofovir)DF、扎西他濱(zalcitabine)或齊多夫定(zidovudine)。於另一具體實施例中,抗病毒劑為蛋白酶抑制劑,諸如安普那韋(amprenavir)、阿扎那韋(atazanavir)、夫沙那韋(fosamprenav)、茚地那韋(indinavir)、洛匹那韋(lopinavir)、奈非那韋(nelfinavir)、利托那韋(ritonavir)或沙奎那韋(saquinavir)。於另一具體實施例中,抗病毒劑為融合抑制劑,諸如恩夫韋(enfuvirtide)。於另一具體實施例中,抗病毒劑為奧司他偉(oseltamivir)磷酸鹽、雙性黴素(amphotericin)B或帕利珠單抗(palivizumab)。
於一特定具體實施例中,抗GITR抗體或其抗原-結合片段組合為熱休克蛋白質製劑的疫苗投予至個體,其包括與抗原性胜肽複合之熱休克蛋白質,其包括來自病原體(例如病毒、細菌、真菌等)之抗原。在一些具體實施例中,抗GITR抗體或其抗原-結合片段投予至個體組合為熱休克蛋白質製劑之疫苗,其包括與抗原性胜肽複合之熱休克蛋白質,其包括病毒抗原(例如HSV-1或HSV-2之抗原)。在一些具體實施例中,包括與抗原性胜肽複合之熱休克蛋白質的熱休克蛋白質製劑(包括病毒抗原(例如HSV-1或HSV-2之抗原)與佐劑,諸如QS-21
組合。在一些具體實施例中,疫苗為HerpV(Agenus Inc.),其治療皰疹感染之疫苗。適當疫苗之非限制性例子揭露於Mo A.,et al.,(2011),Vaccine 29:8530-8541,其整體內容以引用方式併入本文。進一步非限制性例子揭露於U.S.專利號8,541,002,其整體內容以引用方式併入本文。
在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段或其組成物投予至患有因感染物造成之感染性疾病的個體,包括但不限於細菌、真菌、原蟲及病毒。在某些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段或其組成物投予至診斷為具有由感染物造成之感染性疾病的個體,包括但不限於細菌、真菌、原蟲及病毒。在一些具體實施例中,本文所述之抗GITR抗體或其抗原-結合片段或其組成物投予至有感染之個體。在一些具體實施例中,依照本文所述之方法治療的個體經免疫受損或免疫抑制。在某些具體實施例中,依照本文所述之方法治療的個體具有、為或將接受另一療法(例如抗病毒劑、抗生素或抗真菌劑)。
5.4.1.3 投予途徑&劑量
本文所述之抗體或其抗原-結合片段或組成物可用各種途徑遞送至個體。這些包括但不限於腸胃外、鼻內、氣管內、口內、皮內、局部、肌內、腹膜內、經皮、靜脈內、腫瘤內、結膜及皮下途徑。亦可運用肺部投予,
例如藉由使用吸入器或噴霧器及有霧化劑之調配物作為噴霧。
將有效治療及/或預防病症之抗體或其抗原-結合片段或組成物之量將依據疾病性質及由標準臨床技術確定。
運用於組成物之精確劑量亦將依據投予途徑、與感染或由其造成之疾病的嚴重度,且應依據醫師診斷及各個體環境決定。舉例來說,有效劑量可依投予方法、標的位置、患者之生理狀態(包括年紀、體重及健康)、患者是人類或動物、其他投予的藥物或治療為預防或治療而異。通常,患者為人類,但亦可治療包括基因轉殖之非人類哺乳動物。治療劑量可最佳化滴定以最佳化安全性及效力。
在某些具體實施例中,運用活體外分析以幫助識別最佳化劑量範圍。有效劑量可由源自活體外或動物模式測試系統的劑量反應曲線推斷。
以抗體(或其抗原-結合片段)被動免疫,劑量範圍為患者體重的約0.0001至100mg/kg及更通常為0.01至15mg/kg。舉例來說,劑量可為1mg/kg體重、10mg/kg體重或在1至10mg/kg之範圍,或換句話說,對70kg患者分別為70mg或700mg或在70至700mg範圍。在一些具體實施例中,投予至患者的劑量為患者體重的約1mg/kg至約20mg/kg。一般而言,人類抗體比來自其他品種的抗體在人體內具有較長半衰期,因為對外來多
胜肽群的免疫反應。因此,較可能較低劑量之人類抗體及較少頻率投予。
例示性治療方案需要投予依每二週一次或一個月一次或每3至6個月一次,達一年或超過數年的期間或超過數年間隔。在一些方法中,帶不同結合特異性之二或更多抗體或其抗原-結合片段同時投予至個體。抗體或其抗原-結合片段通常可多時機投予。單一劑量之間的間隔可為每週、每月、每3個月、每6個月或每年。
5.4.2 偵測&診斷用途
本文所述之抗GITR抗體或其抗原-結合片段(見例如章節5.1)可用於分析生物樣本中GITR蛋白質量,使用發明所屬技術領域中具有通常知識者已知的典型免疫組織學方法,包括免疫分析,諸如酵素連結免疫吸附分析(ELISA)、免疫沉澱法或西方墨點法。適當抗體分析標籤為本領域中已知且包括酵素標籤,諸如,葡萄糖氧化酶;放射性同位素,諸如碘(125
I、121
I)、碳(14
C)、硫(35
S)、氚(3
H)、銦(121
In)及鎝(99
Tc);發光標籤,諸如流明諾;且螢光標籤,諸如螢光素及玫瑰紅及生物素。此標籤可用於標記本文所述抗體或其抗原-結合片段。或者,辨識本文所述之抗GITR抗體或其抗原-結合片段之第二抗體可經標幟且組合抗GITR抗體或其抗原-結合片段使用以偵測GITR蛋白質量。
分析GITR蛋白質之表現量意於包括在第一生
物樣本中直接(例如藉由測定或估量可溶性蛋白質量)或相對(例如藉由比較第二生物樣本中疾病相關之蛋白質量)定性或定量測量或估量GITR蛋白質之量。可測量或估量且與標準GITR蛋白質量比較在第一生物樣本中GITR多胜肽表現量,標準採自得自未具有疾病的個人的第二生物樣本或由未具有疾病之個人群的平均量確定。本領域將了解,一旦已知“標準”GITR多胜肽量,可重複用作為比較的標準品。
如本文所使用,術語“生物樣本”指得自個體、細胞株、組織或其他可能表現GITR之細胞來源的任何生物樣本。獲得動物(例如人類)組織生物檢體及體液之方法為本領域中廣知。生物樣本包括周邊單核血液細胞。
本文所述之抗GITR抗體或其抗原-結合片段可用於預後、診斷、監控及篩選應用,包括本領域之人員廣知且標準且基於本描述之活體外及活體內應用。活體外評估及免疫系統狀態及/或免疫反應之評量的預後、診斷、監控及篩選分析及套組可用以預測、診斷及監控來評量患者樣本,包括已知具有或懷疑具有免疫系統-功能異常或關於預期或所欲免疫系統反應、抗原反應或疫苗反應者。免疫系統狀態及/或免疫反應之評估及評量亦用於測定患者對於藥物臨床試驗或對於投予特別化學治療劑或抗體或其抗原-結合片段,包括其組合,相對於不同劑或抗體或其抗原-結合片段的合適度。此類型的預後及診斷監
控及評估已實施中,利用對抗乳癌中HER2蛋白質的抗體(HercepTestTM
,Dako),其中該分析使用Herceptin®
亦用於評量抗體療法之患者。活體內應用包括導引細胞療法及免疫系統調節及免疫反應放射性成像。
於一具體實施例中,抗GITR抗體或其抗原-結合片段可用於生物檢體樣本之免疫組織化學。
於另一具體實施例中,抗GITR抗體或其抗原-結合片段可用以偵測GITR量或包含GITR在其膜表面之細胞量,其量之後可連結到某些疾病症狀。本文所述之抗GITR抗體或其抗原-結合片段可帶有可偵測或功能性標籤。當使用螢光標籤時,本領域中已知目前可得之顯微鏡法及經螢光-活化之細胞分選儀分析(FACS)或二方法程序之組合可運用來識別及量化特異性結合成員。本文所述之抗GITR抗體或其抗原-結合片段可帶有螢光標籤。例示性螢光標籤包括,例如,反應性及共軛之探針例如,胺基香豆素(Aminocoumarin)、螢光素(Fluorescein)及德克薩斯紅(Texas red)、Alexa Fluor染料、Cy染料及DyLight染料。抗GITR抗體或其抗原-結合片段可帶有放射性標籤,諸如同位素3
H、14
C、32
P、35
S、36
Cl、51
Cr、57
Co、58
Co、59
Fe、67
Cu、90
Y、99
Tc、111
In、117
Lu、121
I、124
I、125
I、131
I、198
Au、211
At、213
Bi、225
Ac及186
Re。當使用放射性標籤時,可運用本領域中已知目前可得之計數程序來識別及量化特異性結合抗GITR抗體或其抗原-結合片段至GITR(例如,人類GITR)。在此其中標籤為酵素
的例子,偵測可由本領域中已知目前運用之比色、分光光度、螢光光度、電流或氣體定量技術任一完成。此可由在允許抗體或其抗原-結合片段與GITR之間形成複合物之條件下,接觸樣本或控制組樣本與抗GITR抗體或其抗原-結合片段而達成。偵測抗體或其抗原-結合片段與GITR之間形成的錯合物,且比較樣本與控制組。有鑑於本文所述抗體對GITR之特定結合,抗體或其抗原-結合片段可用以特異性偵測細胞表面之GITR表現。本文所述之抗體或其抗原-結合片段經由免疫親和純化亦可用以純化GITR。
本文亦包括為分析系統,其可以測試套組形式製備以定量分析例如GITR或GITR/GITRL錯合物之存在程度。系統或測試套組可包括經標幟之成分,例如經標幟之抗體及一或多額外免疫化學試劑。見例如以下章節5.5對套組更多描述。
5.5.套組
本文所提供為套組,其包括一或多本文所述抗體或其抗原-結合片段或其共軛物。於一特定具體實施例中,本文提供為醫藥包裝或套組,其包括填有一或多本文所述的醫藥組成物之成分的一或多容器,諸如一或多本文提供之抗體或其抗原-結合片段。在一些具體實施例中,套組包含本文所述的醫藥組成物及任一預防或治療劑,諸如本文所述者。在某些具體實施例中,套組可包含T細胞促分裂原,諸如,例如植物凝集素(PHA)及/或佛
波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗CD28抗體。任意地與此容器相關者可為通知單,以政府機構(規定醫藥品或生物產品之製造、用途或銷售)規定的形式,通知單反映出製造、用途或銷售之機構獲准人類投予。
本文提供亦為可用於上述方法之套組。於一具體實施例中,套組包括本文所述抗體,較佳地經純化之抗體,在一或多容器中。於一特定具體實施例中,本文所述之套組包含實質上經單離之GITR抗原(例如,人類GITR)作為控制組。在另一特定具體實施例中,本文所述之套組進一步包括控制組抗體,其不與GITR抗原反應。在另一特定具體實施例中,本文所述之套組包含一或多偵測抗體結合GITR抗原之元件(例如抗體可共軛至可偵測基質諸如螢光化合物、酵素基質、放射性化合物或發光化合物,或第二抗體,其辨識第一抗體可共軛至可偵測基質)。在特定具體實施例中,本文提供套組可包括重組產生或化學合成之GITR抗原。套組提供的GITR抗原亦可貼附於固體支撐物。在一更特定具體實施例中,上述套組的偵測工具包括GITR抗原貼附之固體支撐物。此套組亦可包括未貼附之報告子-經標幟之抗人類抗體或抗小鼠/大鼠抗體。於此具體實施例中,抗體結合GITR抗原可藉由報告子-經標幟之抗體之結合偵測。
說明而非限制地提供下述實施例。
6.實施例
說明而非限制地提供此章節(即章節6)實施例。
6.1 實施例1:產生對抗人類GITR之新穎抗體
此實施例描述結合人類GITR之鼠科抗體的產生及特徵。特別是,此實施例描述特異性結合人類GITR之鼠科抗體的產生及呈現共刺激性影響CD4+
T細胞。
為了產生新穎GITR抗體,在BALB/c小鼠使用轉染人類GITR之小鼠CMS5a細胞作為免疫原,組合佐劑(單磷酸基脂質A(MPL)、海藻糖二黴菌酸酯(TDM)、胞壁醯二胜肽(MDP)及弗氏佐劑(FA))。來自經免疫之小鼠的脾細胞與小鼠骨髓瘤細胞株SP2/0融合。在混合血球吸附分析對hGITR轉染之CMS5a及野生型CMS5a細胞篩選新產生之選殖株上清液。所選之上清液進一步以ELISA測試對重組hGITR蛋白質(HGITR-Fc,Sigma)。藉由MHA及ELISA,融合#231產生四個融合瘤(231-32-15、231-1039-45、231-1042-7及231-1333-21),對人類GITR(本文中有時稱為hGITR或huGITR)具選擇反應性。抗體(所有IgG1
)由蛋白質G親和性層析法純化用以進一步測試。
抗GITR-抗體之特異性以西方墨點法對純化之重組人類GITR、重組小鼠GITR、人類GITR轉染之CMS5a細胞、野生型CMS5a細胞、經活化之CD4+
T細胞
及未經處理之CD4+
T細胞測試。西方墨點法,在非還原條件下,繪於圖1。抗GITR抗體與純化之重組人類GITR反應、不與重組小鼠GITR反應、與CMS5a細胞中重組人類GITR反應及與在經活化之CD4+
T細胞中之天然人類GITR反應。
以表面電漿共振進行配體(GITR-L)與單株抗體結合經固定化huGITR的分析且在BIAcore®
測量。使用標準胺偶合GITR(~1100RU)固定在CM5感應器晶片。以流速為5μl/min分析物注射在經固定化GITR 15分鐘,接著10分鐘解離時間。進行動力運行之後,親和性及解離常數由BiaEvaluation®
軟體(Biacore Life Sciences)同時計算。12.5至200nM濃度範圍分析人類GITR-L之結合及濃度為6.25至100nM分析鼠科抗GITR單株抗體。抗體未結合經固定化小鼠GITR。抗體親和性及解離常數製表如下表9中。
融合瘤231-32-15、231-1039-45、231-1042-7及231-1333-21經定序且發現具有相同cDNA及蛋白質序
列。VH及VL蛋白質序列由N端蛋白質定序及胰蛋白酶切割物之質譜術(MS)確認。抗GITR抗體之可變重鏈序列為SEQ ID NO:201而抗GITR抗體之可變輕鏈序列為SEQ ID NO:202。重鏈可變區(VH)互補性決定區(CDR)序列VH CDR1、VH CDR2及VH CDR3分別具有SEQ ID NO:13、14及15及輕鏈可變區(VL)CDR序列VL CDR1、VL CDR2及VL CDR3分別具有SEQ ID NO:16、17及18。
新231-GITR抗體之競爭性結合與商業上可獲得之抗GITR單株抗體(R&D系統mAb689選殖株110416)比較。使用GITR轉染之CMS5a細胞且與未經標幟之抗GITR mAb培養,接著加入PE-共軛之R&D mAb或Alexa 488-共軛之231-1039-45或213-1333-21抗體(Alexa 448-共軛之213-1333-21抗體數據未顯示),結果由FACS分析評估。R&D系統抗GITR mAb之阻擋研究繪於圖2A而231抗體(1039-45)阻擋研究繪於圖2B。這些研究中,無抗體、未經標幟之R&D抗體或未經標幟之測試抗體(抗體1042-7、1039-45、1331-21或32-15)先加入且與M5Sa-GITR轉染之細胞培養。此之後加入經標幟之R&D系統抗體(圖2A)或經標幟之231-抗GITR抗體1039-45(圖2B)。新231抗體(1042-7、1039-45、1333-21或32-15)僅部分地阻擋R&D抗體之結合,可能是因為空間位阻(圖2A)。圖2B顯示R&D抗體未阻擋231-1039-45抗體之結合。1039-45之結合被231抗
體(即被1042-7、1039-45、1333-21或32-15)任一抑制。
231-GITR抗體結合特徵由FACS分析且結果繪於圖3A-C。圖3A顯示以來自二不同批次(1及2)之抗人類GITR IgG1
1333-21抗體與R&D系統抗體染CMS5a-GITR細胞。在圖3B中,一旦以1042-7、32-15、1039-45、1333-21及R&D系統抗體染色,顯示活體外PMBC衍生之CD3-
CD19-
GITR+
及CD4+
CD25+
GITR+
的螢光強度。在1333-21或R&D系統抗體(mAb689選殖株110416)結合之後,這些活體內PBMC衍生之細胞之FACS分析顯示於圖3C。
接著,進行研究評估抗GITR抗體組合抗CD3(OKT3)抗體對CD4+
T細胞共刺激效果效果。由組合抗GITR抗體(231-1042-7、231-32-15、231-1039-45、231-1333-21)與次優濃度(0.2μg/ml)之OKT3觀察到最顯著相對共刺激效果。抗GITR抗體(5μg/ml)及各種濃度之OKT-3抗體結合組織培養盤,之後與CSFE-經標幟之CD4+
細胞培養。IL-2(10U/ml)加至介質而細胞及抗體再培養5天。5天後尾聲,以具有低CFSE強度之分離細胞評量CFSE強度。亦測量IFNγ。抗GITR抗體之結果繪於圖4。在次優濃度之OKT3抗體(0.2μg/ml),抗GITR抗體對CD4+
細胞之增殖具有顯著相對效果。在抗GITR抗體之存在下組合所有量之測試OKT3,見到相較於控制組IFNγ增加,在0.2μg/ml及0.04μg/ml觀察到具有
最顯著影響。測試抗體間之變化可歸因於分析間可變性及各抗體製劑(例如,分開製劑)之間的天然可變性。值得注意的是,在無OKT3存在下,無因抗GITR抗體之刺激。抗GITR抗體與OKT3之共刺激效果為對抗GITR抗體之量劑量依賴性(數據未顯示)。
結論,已單離對人類GITR特異且辨識重組與天然GITR的新抗GITR抗體。這些抗體在2.5至5ng/ml結合表現在hGITR轉染之CMS5a細胞的hGITR及由FACS分析顯示良好結合。抗體亦結合人類PBMC,包括表現天然hGITR之T細胞。由BIAcore®
,其對GITR親和性為KA
(1/m)大約4.2×108
、KD
(m)2.4×10-9
(對GITRL(配體)KA
之1.8×108
及KD
5.5×10-9
)。相對商業上可獲得之GITR mAb(R&D),抗體結合hGITR上不同位置。
已證實抗GITR單株抗體與具次優濃度(0.2μg/ml及0.04μg/ml)的抗CD3 mAb(OKT3)對CD4+
T細胞共刺激效果。儘管T調控性細胞存在富含CD4+
T細胞群中,抗GITR抗體增強CD4T細胞活性。
6.2 實施例2:擬人化小鼠單株抗體231-32-15
此實施例描述擬人化鼠科抗體231-32-15與特徵化擬人化抗體。
6.2.1 擬人化鼠科抗體231-32-15
抗人類GITR小鼠抗體231-32-15擬人化包括選擇人類接受者框架如本文所述。
6.2.2 嵌合鼠科抗體231-32-15
分別來自具有SEQ ID NO:201及202之鼠科231-32-15的鼠科VH及VL(卡帕)可變區由GeneArt®
(Life TechnologiesTM
)合成。包含來自原鼠科可變功能域之天然領導序列連同具限制位之接合子,使得這些可變區直接選殖到標準內部人類IgG1
Vh載體(CH1-2-3功能域)及Vk載體(Ck1),以創造具鼠科Vh或Vk之嵌合基因,以及人類恆定區。嵌合重及輕鏈表現載體之後共轉染到懸浮液中的CHO細胞,以產生嵌合抗體蛋白質用於下述進行的分析。此嵌合抗體在章節6實施例中指為“嵌合親代231-32-15抗體”。此嵌合親代231-32-15抗體包含T109S取代(即相對於野生型Fc序列在位置109以絲胺酸取代蘇胺酸),編號依據Kabat,在輕鏈恆定功能域,其協助可變區框入選殖到恆定區。此突變為不影響抗體結合或功能之保留性修飾。
使用同源匹配選擇人類接受者框架來移植抗體231-32-15的CDR。數據庫,例如來自人類及小鼠免疫球蛋白基因座之種系可變基因數據庫(IMGT數據庫(the international ImMunoGeneTics information system®
;Lefranc MP et al.,(1999)Nucleic acids Res 27(1):209-12;Ruiz M et al.,(2000)Nucleic acids Res 28
(1):219-21;Lefranc MP(2001)Nucleic acids Res 29(1):207-9;Lefranc MP(2003)Nucleic acids Res 31(1):307-10;Lefranc MP et al.,(2005)Dev Compo Immunol 29(3):185-203;Kaas Q et al.,(2007)Briefings in Functional Genomics & Proteomics 6(4):253-64)或VBASE2(Retter I et al.,(2005)Nucleic acids Res 33,Database issue D671-D674)或Kabat數據庫(Johnson G et al.,(2000)Nucleic acids Res 28:214-218))或刊物(例如上述Kabat EA et al.)可用以識別鼠科重及輕鏈可變區所屬之人類亞科及確定最適合人類種系框架用作為接受者分子。在這些欲作為接受者之亞科中選擇重及輕鏈可變區序列(VH及VL)可基於序列同源及/或CDR1及CDR2區之結構匹配,以幫助在移植之後保留適當相關呈現六個CDR。
使用IgBLAST(可在NCBI網站獲得)檢索IMGT數據庫顯示231-32-15重鏈可變區框架及人類重鏈可變區亞科1及7成員之間良好同源性。對下述種系序列觀察到CDR及框架序列兩者最高同源性及相同性:IGHV1-2*02(亦知為DP75;SEQ ID NO:601)(59.2%相同性;98中之58個胺基酸殘基)、IGHV1-3*01(SEQ ID NO:602)(58.2%相同性;57/98)、IGHV1-46*01(SEQ ID NO:603)(57.1%相同性;56/98)、IGHV1-18*01(SEQ ID NO:604)及IGHV1-69*01(SEQ ID NO:605)(兩者56.1%相同性;55/98)及IGHV7-4-
1*02(SEQ ID NO:606)(54.1%相同性;53/98)。
使用相同方法,231-32-15輕鏈可變功能域序列對人類輕鏈可變功能域卡帕亞科3及4成員顯示良好同源性。對下述種系序列觀察到CDR及框架序列兩者最高同源性及相同性:IGKV4-1*01(SEQ ID NO:607)(79.2%相同性;101中之80個胺基酸殘基)及IGKV3-7*02(SEQ ID NO:608)(64.4%相同性;65/101)。
作為擬人化方法之起始點,使用人類IGHV1-2*02作為人類框架接受者產生小鼠231-32-15 VH的CDR移植之版本。許多回復突變在殘基部分(可能影響CDR構形或可變功能域內包裝,因而可能對維持抗體完整活性為結構上重要)造成。在框架1中,殘基Kabat H24維持為小鼠,因為其為CDR1典型殘基(Kabat定義之5個胺基酸殘基長的環)。其為鼠科序列之Gly而人類種系中的Ala。在框架2,殘基Kabat H48維持小鼠,因為其已知為Vernier殘基(即接近CDR)。其為鼠科序列中的Ile而人類種系中的Met。框架3,為Vernier殘基之殘基Kabat H67及73維持小鼠。H67在鼠科序列中為Ala而在人類IGHV1-2*02種系中為Val。H73在鼠科序列為Lys而在人類IGHV1-2*02種系中為Thr。對CDR2為重要典型殘基之殘基H71已維持小鼠(其在人類種系為Arg而在鼠科序列為Val)。對CDR1為典型殘基之殘基Kabat H94已維持小鼠(其在人類種系為Arg而在鼠科序列為Lys)。最終擬人化序列命名為Version VH A(SEQ ID
NO:206)且與IGHV1-2*02人類種系具有79.6%相同性(98中之78個胺基酸殘基)。
使用人類IGKV3-7*02作為人類框架接受者產生小鼠231-32-15 VL之第一CDR移植之版本。在各種殘基部分考慮回復突變及因此,在框架3,殘基Kabat L87維持小鼠,因為其在VH/VL介面可能扮演重要角色。L87在鼠科序列為His及在IGKV3-7*02人類種系為Tyr。最終擬人化序列命名為Version VK A1(SEQ ID NO:207)且與IGKV3-7*02人類種系具有81.2%相同性(101中之82個胺基酸殘基)。
使用人類IGKV4-1*01作為人類框架接受者產生小鼠231-32-15 VL之第二CDR移植之版本。在各種殘基部分考慮回復突變及因此,在框架3,殘基Kabat L87維持為小鼠,因為其在VH/VL介面可能扮演重要角色。L87在鼠科序列為His及在IGKV4-1*01人類種系為Tyr。最終擬人化序列命名為Version VK A2(SEQ ID NO:208)且與IGKV4-1*01人類種系具有91.1%相同性(92個胺基酸殘基101)。
表10顯示殘基(Kabat編號)在上述小鼠231-32-15 VH及VL之CDR移植之版本中小鼠與人類抗體框架之間的不同。
6.2.3 表現擬人化變體
IGHV1-2*02、IGK4-1*01及IGK3-7*02之可變區由Life TechnologiesTM
合成且如下所述選殖到標準表現載體(pPEP)。這些構築體接著用於轉染CHO細胞且使用懸浮陣列技術(Luminex®
200系統,Millipore)及表面電漿共振(BIAcore®
,GE Healthcare)如下所述測試表現之抗體。此實施例中術語“可變區”意指對重鏈IGHV1-2*02VDJ重排基因對輕鏈IGK4-1*01及IGK3-7*02及VJ重排基因。表現載體包含CMV啟動子、免疫球蛋白恆定區、WPRE元素(轉錄後反應元素)及BGH多腺核苷酸化訊號。使用三個不同表現載體變體選殖可變區IGHV1-2*02。二個表現載體變體包含不同免疫球蛋白恆定區-
IGHG1及IGHG4而第三表現載體變體包含IGHG1之片段以產生抗體Fab片段。輕鏈IGK4-1*01及IGK3-7*02之可變區選殖到包含IGKC免疫球蛋白恆定區之表現載體。
6.2.3.1 用於CHO細胞轉染之表現載體選殖
合成的可變區選殖到包含適當免疫球蛋白恆定區之pPEP表現載體。對於選殖IGHV1-2*02之重鏈可變區,構築體3592(pPEP-InsX-Cg(iso3)、4192(pPEP-InsX-IgG4
)及4215(pPEP-InsX-Fab-Xa-6xHis)("6xHis"揭露為SEQ ID NO:36)以HindIII/Eco47IIIat在37℃切割4小時。切割之後,膠體-純化具有4952bp、4952bp及4313bp尺寸之帶(Macherey & Nagel,NucleoSpin Gel and PCR cleanup)。卡帕(kappa)輕鏈可變區IGK4-1*01及IGK3-7*02之選殖,構築體3593(pPEP-Ins-Ck)以HindIII/Eco47III在37℃切割4小時且具有4474bp尺寸之帶經膠體-純化。合成的抗體可變區以HindIII/Eco47III在37℃切割4小時且具有422bp(IGHV1-2*02)及411bp(IGK4-1*01及IGK3-7*02)尺寸之帶經膠體-純化。
切割及純化之可變抗體區(IGHV1-2*02、IGK4-1*01、IGK3-7*02)經框入連接至包含適當免疫球蛋白恆定區之pPEP載體(50ng)。在16℃以載體對插入比為1:3進行連接過夜。之後,1μl之連接反應經電穿孔到DH10B細胞(大腸桿菌(E.coli)ElectroMax DH10B
電勝任細胞,Invitrogen)(1900V/5ms)。之後5-50μl之電穿孔細菌劃盤在LB-agar+100μg/ml安比西林(ampicillin)盤上。從各構築體,挑出約2至3個菌落及生長過夜。
從各選殖株,進行小規模DNA質體製劑(Macherey & Nagel,NucleoSpin Plasmid)。驗證所選殖之插入的存在與正確尺寸的切割以HindIII/Eco47III(H/E)進行而使用ApaLI(A)切割以驗證正確載體骨架。分離未切之質體DNA測試載體完整性。從各陽性選殖株及DNA,按比例放大、控制切割及使用引子892-Je(序列:5’ gaccaatagaaactgggcttgtc 3’;SEQ ID NO:705)定序製劑。各構築體收到構築體編號作為獨特識別碼及製備甘油存貨。
6.2.3.2 反轉錄病毒表現載體中之選殖
由Life TechnologeisTM
合成IGHV1-2*02、
IGK3-7*02及IGK4-1*01之可變區及轉殖到反轉錄病毒表現載體(pCMA)。之後使用這些構築體轉導preB細胞及使用Retrocyte Display®
技術在表面表現抗體。反轉錄病毒表現載體包含MSCV為主之5'
及3'
LTR'
、免疫球蛋白恆定區(IGHG1或IGKC),其包括膜錨部分(IGHG1)及CD8表面標記基因。
合成之可變區轉殖到包含適當免疫球蛋白恆定區之反轉錄病毒表現載體。對於選殖重鏈可變區,構築體3956(pCMA-InsX Cg(iso3)loxP2-I-tr_huCD8-loxP)以HindIII/Eco47III在37℃切割4小時且膠體-純化7616bp尺寸之帶。對於選殖卡帕(kappa)輕鏈可變區,構築體3957(pCMA-InsX Ck-I-tr_huCD8)以HindIII/Eco47III在37℃切割4小時且膠體-純化6718bp尺寸的帶。合成的抗體可變區如上述章節6.2.1所述切割。
切割及純化之可變抗體區經框入連接至包含適當免疫球蛋白恆定區之反轉錄病毒表現載體(50ng)。連接、轉形及選殖株驗證的進行如上述章節6.2.3.1所述。使用引子327-Je(序列:5’ ctcgatcctccctttatccag 3’;SEQ ID NO:706)定序按比例放大之DNA質體製劑。各構築體收到構築體編號作為獨特識別碼及製備甘油存貨。
6.2.4 重組抗體之表現
短暫轉染懸浮液中之FreeStyleCHO-S細胞(Invitrogen,R800-07)表現重組抗體。簡言之,細胞密度調整到8×106
細胞/ml在PowerCHO2介質(Lonza,12-771Q)中,補充4mM L-麩醯胺酸(Biochrom,K 0283)及1X HT補充物(GIBCO,11067-030)。輕微攪拌下,將對應抗體輕鏈(2.5μg/ml)及重鏈(2.5μg/ml)之DNA加到細胞懸浮液。DNA加入之後,細胞懸浮液補充10μl/ml之TransIT-Pro轉染試劑(MIRUS,MIR5700)及0.5mM(最終濃度)丙戊酸(Sigma-Aldrich,P4543)。31℃,8% CO2
下振動(200rpm)培養細胞懸浮液6天。
離心(9000g,10分鐘,在10℃)收集培養上清液且通過0.45μm過濾器過濾。使用Vivaspin 20超過濾裝置(Sartorius,VS2032,MWCO 50kDa)在1000g,10℃大約60分鐘濃縮上清液成最終體積0.6ml。對了純化重組抗體,以結合緩衝液(20mM磷酸鹽緩衝
液pH 7.0)平衡蛋白質A HP Spin Trap管柱(GE Healthcare,28-9031-32)且載入0.6ml之濃縮物。以蓋子密封管柱及在室溫培養在直立圓筒混合機(end-over-end mixer)。30分鐘之後,施用600μl結合緩衝液洗滌管柱2x及之後在100g離心1分鐘。添加400μl洗提緩衝液(100mM甘胺酸,pH 2.0)從離心管柱洗提結合之重組抗體並在100g離心1分鐘。洗出物立刻以40μl之中和緩衝液(1M Tris-HCl,pH 9.0)中和。純化之重組抗體4℃下儲存在蛋白質LoBind管(Eppendorf,0030 108.116)直到進一步處理用於特徵化研究。
為了量化,細胞培養上清液及包含人類IgG之純化樣本以分析緩衝液(Roche,11112589001)稀釋並一式兩份在96半孔盤(Corning,3884)評估稀釋物。簡言之,25μl樣本在黑暗(20℃,650rpm)與5μl包含1200 Luminex-COOH-珠粒(載有偶合山羊抗人類IgG,F(ab')2
片段特異性之胺(Jackson ImmunoResearch,109-006-09))培養1小時。使用重複25μl之1:3稀釋系列(0.08-60ng/ml)之ChromPure人類IgG全分子(Jackson ImmunoResearch,009-000-003)產生標準曲線。藉由添加標幟有R-PE之30μl抗人類IgG,Fc-特異性(5μg/ml;Jackson ImmunoResearch,109-116-098)進行偵測且進一步培養1h。讀取盤及使用Luminex®
200儀器(Millipore)使用下述設定:100珠粒,50μl樣本尺寸分析。
品管純化樣本由SDS-PAGE及在HPLC之粒徑篩析層析法(SEC)分析。SDS-PAGE分析在還原與非還原條件分別在12%及8%聚丙烯醯胺凝膠進行,接著Laemmli之程序(Laemmli UK(1970)Nature,227(5259):680-5)。聚丙烯醯胺凝膠以Commassie亮藍溶液染色而可見。在配備有二元泵、脫氣單元、自動採樣單元及UV二極管陣列偵測器的Agilent Infinity 1260 system(Agilent Technologies)進行SEC。為了分離,使用Zenix-C 300管柱(3μm粒徑,4.5×300mm,Sepax,233300-4630)。載入3μg的各樣本及以0.3 5ml/分鐘分離在100mM磷酸鹽緩衝液pH 7.0(補充有150mM NaCl)15分鐘及在220nm偵測。
6.2.5 擬人化變體特徵化
擬人化變體(Hum231#1:IGHV1-2*02及IGK3-7*02;Hum231#2:IGHV1-2*02及IGK4-1*01)兩者及嵌合親代抗體231-32-15的結合特性在如下所述許多分析中特徵化。
6.2.5.1 由懸浮陣列技術定量及結合分析
擬人化變體兩者與嵌合親代抗體231-32-15之純化材料以分析緩衝液(Roche 11112589001)1:10,000及1:100,000稀釋。簡言之,25μl的各稀釋液以1500 Luminex®
珠粒(在5μl分析緩衝液)在96半孔過濾盤
(Millipore,MABVN1250)黑暗中培養(20℃,650rpm)1小時。Luminex®
珠粒(Luminex Corp,# 5 LC10005-01及# 14 LC10014-01)偶合經由胺偶合COOH珠粒表面與抗人類IgG(F(ab)2
-特異性,JIR,105-006-097)偶合或與GITR抗原(R&D系統,二-硫化物-連接同型二聚體;689-GR)。對IgG1
版本,使用重複25μl的1:3稀釋系列(0.08-540ng/ml)之ChromPure IgG全分子(JIR,009-000-003)產生標準曲線。對於呈IgG4
形式之抗體,使用不同標準-純化之免疫球蛋白(Sigma,I4639)。使用60μl之標幟有R-PE的山羊抗人類IgG F(ab)2
(2.5μg/ml;JIR 109-116-098,AbDSerotec Rapid RPE Antibody Conjugation Kit,LNK022RPE)進行偵測且1小時培養時間(20℃,650rpm)。使用Luminex®
200系統(Millipore)分析盤。每孔在48μl樣本體積計數許多100珠粒。相對於嵌合親代231-32-15抗體之MFI值(設為100%結合),計算相對親和性且依據IgG存在於樣本的值。二個擬人化變體顯示相對親和性接近100%。
6.2.5.2 使用懸浮陣列技術之配體阻擋活性
測定抗GITR抗體是否阻擋配體(GITRL)結合GITR,使用懸浮陣列技術進行排名分析設置。在5μl分析緩衝液(Luminex Corp,#14 LC10014-01)之1200 Luminex®
珠粒加到96-孔半區盤(Corning,Inc.,3884)之每孔。經由胺偶合COOH珠粒表面,珠粒偶合GITR抗
原(R&D系統,二-硫化物-連接同型二聚體;689-GR)。使用50μg/ml之GITR抗原及每ml有1x107
Luminex珠粒進行偶合反應。使用標準NHS酯化學在抗原初級胺基團與珠粒表面上之羧基之間形成碳二亞胺鍵(Luminex Xmap cookbook chapter 3)。
對蛋白質抗原偶合為簡單二步驟碳二亞胺程序,於期間微球體羧基先以EDC(1-乙基-3-[3-二甲基胺基丙基]碳二亞胺鹽酸鹽)試劑在Sulfo-NHS(N-羥基磺基琥珀醯亞胺)存在下活化以形成磺基-NHS-酯中間物。反應性中間物之後被與標的分子(抗體、蛋白質或胜肽)初級胺反應取代以形成共價醯胺鍵。20℃及650rpm下,偶合珠粒與不同濃度之抗GITR抗體(濃度為9000ng/ml至12ng/ml,在每孔25μl分析緩衝液)培養1h。之後,30μl之R-PE經標幟之GITR-配體(濃度1nM;單體,R&D系統694-GF/CF)加至每孔,給予總孔體積60μl(每孔1200珠粒且最終濃度為0.5nM的經標幟之GITRL)。使用R-PE標籤套組(AbDSerotec,LYNX Rapid RPE Antibody Conjugation Kit,LNK023RPE)依據製造商程序內部完成配體之標籤。使用Luminex®
200系統(Millipore)分析盤。在50μl樣本體積中每孔計數許多100珠粒。使用配體僅控制組非競爭訊號(100%結合)MFI值計算配體阻擋潛力。PE可偵測訊號顯示配體結合抗原。
在第一分析中,測試抗GITR抗體嵌合親代
231-32-15及m6C8(WO 06/105021)以及辨識IL-1β之控制組抗體(SK48E26;國際公開案號WO 95/001997)。抗體m6C8為依據WO 06/105021(herein incorporated by reference)提供之抗體6C8之可變區產生之IgG1抗體。m6C8之重鏈包括SEQ ID NO:585之胺基酸序列。m6C8之輕鏈包括SEQ ID NO:586之胺基酸序列。此分析結果顯示於圖5,其中其可觀察到在高於333ng/ml的6C8抗體濃度,無偵測到PE訊號,而因此無GITRL結合GITR發生。相比之下,對於嵌合親代231-32-15抗體,在所有測試濃度,偵測到PE訊號,顯示當嵌合親代231-32-15抗體亦結合GITR時,GITRL仍能夠結合到至GITR。圖5所示數據來自此分析的4次重複,一式兩份進行,對n=8計算標準偏差。
在第二分析中,在嵌合親代231-32-15抗GITR抗體與擬人化變體Hum231#1及Hum231#2存在下,測試GITRL-PE結合GITR。圖6顯示此三抗GITR抗體當結合GITR時,仍使得GITRL結合GITR且所有三抗體顯示可比較之配體阻擋活性。
6.2.5.3 由表面電漿共振之動力學分析
使用表面電漿共振測定擬人化變體與嵌合親代231-32-15抗體(BIAcore®
T100/T200敏感性增強系統(GE Healthcare)及Fab-捕捉分析)之親和性。在25℃使用1xDPBS(PAA,H15-002)加P20(0.05%,Pierce,
28320)作為電泳緩衝液分析所有交互作用。經由經固定化抗人類Fab抗體(GE Healthcare,Fab Capture Kit,28958325),抗GITR抗體(8μg/ml在電泳緩衝液)被捕捉到CM5感應器晶片之晶片表面(GE Healthcare,Series S CM5,BR-1005-30)。偵測GITR抗原非特異性交互作用,抗體捕捉僅在流動細胞2進行,反之在流動細胞1中,僅捕捉抗體經固定化。此外,非相關抗體(抗IL-1β;SK48E26;國際公開案號WO 95/001997)用來評估GITR結合之特異性。在捕捉抗GITR抗體之後,對各抗體GITR抗原(R&D系統,二-硫化物-連接同型二聚體;689-GR)以不同量(40nM、10nM及2.5nM)跑過流動細胞兩者。同樣,空白曲線(僅跑緩衝液)包含在每次進行中。以流速為10μl/min,締合跑90s而解離跑600s。每次進行之後,以10mM甘胺酸pH2.0(GE Healthcare,BR-1003-55)30μl/min進行再生步驟60s。使用BIAcore®
T200評量軟體2.0.1版應用Langmuir 1:1模式與Rmax全球擬合評估結合曲線。
從這些值中,計算親和性值(KD
(M))而值顯示在下面表13中。擬人化變體Hum231#1及Hum123#2顯示改良之結合速率但降低之分離速率導致分別為0.7nM及0.6nM之KD
值。嵌合親代231-32-15抗體具有親和性2nM。
6.2.5.4 由表面電漿共振之配體阻擋分析
預期擬人化變體Hum231#1及Hum231#2兩者顯示與嵌合親代231-32-15抗體相同之配體阻擋動力學。此使用配體阻擋分析,由表面電漿共振(BIAcore®
T100/T200敏感性增強系統(GE Healthcare))測量確認。
在第一實驗,評量GITR配體結合經固定之GITR抗原。GITR抗原(R&D系統,二硫化物連接之同型二聚體;689-GR)以高密度(4371RU)經固定化在CM5感應器晶片(GE Healthcare,Series S CM5,BR-1005-30)。在另一流動細胞,卵白蛋白(1289RU,Pierce ThermoFisher 77120)經固定化作為參考。固定依據製造商(GE Healthcare)之標準程序,對胺偶合(以0.4M EDC及0.1M NHS活化表面,GE Healthcare Amine coupling kit,BR-1000-50)進行。未反應之基團為以1M乙醇-胺-HCl pH 8.5去活化。之後,二GITR配體(單體R&D,694-GL及非共價鍵結之同型三聚體R&D,6987)以不同量(500nM、250nM及125nM)跑過晶面表面以測
定飽和條件。以流速為5μl/min使用締合時間240s及解離時間300s。以10μl/min使用10mM甘胺酸pH2.0完成晶片表面再生(GE Healthcare,BR-1003-55)60s。以125nM GITR三聚配體達到最理想飽合條件而此設置因而以相同量抗GITR抗體使用。在另一實驗中,使用反向設置,使得抗GITR抗體(125nM)先結合晶片上之GITR抗原,且之後加入GITR配體(非共價連接的三聚體125nM)。
如圖7所示,當GITR抗原經固定於晶片上且在抗GITR抗體嵌合231-32-15抗體、Hum231#1及Hum231#2存在下添加GITRL時,觀察到GITRL之結合。相比之下,在抗GITR抗體m6C8存在下,未觀察到GITRL之結合。這些數據顯示嵌合231-32-15抗體、Hum231#1及Hum231#2不會抑制人類GITR結合GITRL。
6.3 實施例3:擬人化抗體之功能性特徵化
此實施例證實如上所述之方法產生之擬人化抗GITR抗體作為GITR之促效劑之能力。抗GITR抗體Hum231#2包括包含SEQ ID NO:567之胺基酸序列的重鏈及包含SEQ ID NO:587之胺基酸序列的輕鏈。抗體Hum231#2為包含在輕鏈恆定功能域T109S取代之人類IgG1抗體(即相對於野生型Fc序列,在位置109以絲胺酸取代蘇胺酸),依據Kabat編號,其協助可變區框入選殖到恆定區。此突變為不會影響抗體結合或功能之保留性
修飾。亦產生野生型對應體,命名為Hum231#2w,其在位置109包含蘇胺酸,依據Kabat編號。抗體Hum231#2w為人類IgG1抗體,其包括SEQ ID NO:567之重鏈及SEQ ID NO:576之輕鏈。
亦分析這些抗GITR抗體以測定其共刺激初級人類CD4+
或CD8+
T-細胞之能力。此工作如以下章節6.3.1至6.3.3及6.3.7所述以多位捐贈者之材料進行。用於篩選及測試候選抗體之人類白血球購自New York Blood Center(New York City)。
在富含CD4陽性(又名CD4+
)T細胞、CD8陽性(又名CD8+
)T細胞及PBMC證實抗GITR抗體之功能活性。對於人類T-細胞增殖研究,使用無菌組織培養技術收集及處理新鮮製備的捐贈者包裝白血球。由密度梯度(Lymphocyte Separation Media,Corning)處理白血球來收集單核免疫細胞(PBMC)。PBMC位於Ficol密度梯度之棕黃層(buffy coat layer)。
從PBMC藉由負向選擇使用RosetteSep®
Human CD4+
T Cell Enrichment Cocktail(Stemcell Technologies,Vancouver,BC Canada)製備富含CD4細胞。從紅血球細胞藉密度離心在淋巴球分離介質(Corning)分離富含CD4+
T-細胞製劑。洗滌及分量所收集之細胞以儲存在液態氮。考量對刺激捐贈者反應可變性,使用各種濃度之抗CD3以調整對反應之捐贈者-特異性耐受力。因此,在篩選抗GITR抗體之前,以滴定量之
抗CD3(選殖株SP34;BD Pharmingen;濃度範圍31.5ng/ml至250ng/ml),在有或無參考抗GITR嵌合親代231-32-15抗體以建立基準線T-細胞增殖及其細胞激素產生及測定對各捐贈者棕黃層(buffy coat)之適當刺激條件,評估棕黃層(buffy coat)響應CD3刺激對細胞激素釋出及增殖之能力。
6.3.1 促效抗GITR抗體對抗CD3刺激之CD4+T細胞增殖的效果
藉由其共刺激CD4+T細胞評估抗GITR抗體促效劑活性。嵌合親代231-32-15抗體之促效活性與二擬人化版本:Hum231#1及Hum231#2比較。共刺激分析如下進行:對盤鍵結之刺激條件,抗CD3抗體、抗GITR抗體及所標誌之同型控制組塗佈在平坦底部或圓形底部無菌組織培養盤二小時及透過洗滌移除過多抗體。對於可溶性共刺激條件,塗佈抗CD3抗體在盤上同時提供抗GITR抗體共刺激在溶液中。所測試抗GITR抗體為Hum231#1及Hum231#2、嵌合親代231-32-15抗體(又名REF-231)或陰性同型控制組(pAB1915)。此外,對於盤鍵結且可溶性共刺激條件,亦提供抗CD28抗體(125ng/ml;BD Pharmingen)及10U IL-2在溶液中。
監控羧基螢光素二乙酸酯琥珀醯亞胺酯(CFSE)染料之稀釋在分離之細胞確定細胞性增殖(Quah BJ et al.,(2007)Nat Protoc,2(9):2049-
56)。以1-2μM CFSE標幟富含CD4+
T細胞。洗滌CFSE-經標幟之CD4+
富含T細胞,之後以盤鍵結之抗CD3(125ng/ml)、可溶性抗-CD28(125ng/ml)及10U IL-2、連同5μg/ml或10μg/ml盤鍵結之抗GITR抗體或無抗體刺激。在培養37℃下,依各捐贈者細胞最佳化活化,使細胞分離3至6天,其中點培養上清液及細胞從該盤收集。
圖8A及8B顯示CD4+
T細胞增殖之代表性FACS分析,其經以抗GITR抗體一式三份分別在棕黃層(buffy coat)6及棕黃層(buffy coat)8進行共刺激誘導。這些圖顯示由CFSE經標幟之CD4+
T細胞之細胞數(Y軸)及所發出螢光量(X軸)。使用10μg/ml抗GITR抗體(嵌合親代231-32-15(REF 231-32-15)、Hum231#1及Hum231#2)。細胞(具有降低量之CFSE所發出螢光(CFSE低))增加百分比顯示富含CD4+
T細胞增殖。圖8A及8B說明當加到以次優濃度之抗CD3抗體活化之細胞時,抗GITR抗體(嵌合親代231-32-15(REF 231-32-15)、Hum231#1及Hum231#2)對高反應細胞(棕黃層(buffy coat)6,圖8A)與甚至對低反應細胞(棕黃層(buffy coat)8;圖8B)證實促效活性。
圖9A及9B為對濃度為10μg/ml盤鍵結之抗GITR抗體(嵌合親代231-32-15抗體、Hum231#1、Hum231#2及m6C8)來自上述研究代表性結果之直方圖。在圖9A所示之實施例,以Hum231#1或Hum231#2
共刺激誘導性CD4+T細胞增殖10μg/ml。當以10μg/mlHum231#1或Hum231#2共刺激時,大約大於50%之CD4+
T細胞增殖(CFSE低細胞)。相比之下,在抗CD3/抗CD28刺激而無抗GITR抗體-媒介之共刺激下,僅大約35%至CD4+
T細胞增殖(CFSE低細胞)。圖9B說明添加抗GITR共刺激至抗CD3/抗CD28-媒介之刺激在培養超過5天亦造成CD4+
T細胞絕對數之增加,其相較於單獨以抗CD3/抗CD28刺激而言。舉例來說,以抗CD3/抗CD28刺激聯用10μg/ml抗體嵌合親代231-32-15抗體(REF 231)造成CD4+
T細胞數之GITR共刺激誘導性擴張從7.5×104
至12.0×104
。
此外,10μg/ml之Hum231#1-媒介之共刺激亦誘導性擴張CD4+
T細胞從7.5×104
至11.5×104
。在10μg/ml濃度之抗體,Hum231#2共刺激亦誘導性增殖CD4+
T細胞從7.5×104
至10.6×104
。值得注意的是,CD4+
T-細胞與10μg/ml之m6C8(國際公開案號:WO 06/105021)共刺激培養5天之後未造成在單獨以抗CD3/抗CD28刺激見過之額外增加細胞絕對數。
6.3.2 促效抗GITR抗體對抗CD3誘導性CD4+ T-細胞細胞激素產生的效果
作為對抗GITR抗體之促效共刺激活性進一步證據,CD4+T細胞釋出之細胞激素(IFNγ、IL-6、TNFα及IL-10)以多樣ELISA(Flowcytomix,FACS珠粒為主
之細胞激素ELISA,eBioscience)測量。收集從增殖分析收集之上清液且用於細胞激素分析。圖10A至10D顯示10μg/ml或5μg/ml之嵌合親代231-32-15、Hum231#1或Hum231#2抗GITR抗體對人類CD4+
T細胞產生之細胞激素的效果。當相較於單獨以抗CD3/抗CD28刺激物,添加10μg/ml或5μg/ml之嵌合親代231-32-15抗體、Hum231#1或Hum231#2至抗CD3/抗CD28刺激之T-細胞顯著增加產生IFNγ、TNFα、IL-10及IL-6。在無抗CD3/抗CD28刺激物存在下,對促效抗GITR抗體觀察到無共刺激活性。
6.3.3 擬人化231-32-15選殖株之滴定
評估誘導T-細胞增殖及細胞激素產生之抗GITR抗體濃度範圍,以125ng/ml抗CD3/抗CD28刺激及以滴定、盤鍵結之嵌合親代231-32-15、Hum231#1或Hum231#2抗GITR抗體共刺激富含CD4+
T-細胞。圖11所示之結果顯示濃度為10μg/ml、5μg/ml或2.5μg/ml之嵌合親代231-32-15、Hum231#1及Hum231#2共刺激誘導T細胞增殖,由CFSE稀釋監控。再者,在無任何抗CD3/抗CD28刺激物存在下,抗GITR抗體未刺激CD4+
T細胞增殖。
圖12A顯示抗CD3/抗CD28刺激及以抗GITR抗體(嵌合親代231-32-15、Hum231#1或Hum231#2)超過濃度範圍(10μg/ml、5μg/ml或
2.5μg/ml)共刺激增強CD4+
T-細胞IFNγ
產生。值得注意的是,在無抗CD3/抗CD28刺激存在下,抗GITR抗體(嵌合親代231-32-15、Hum231#1或Hum231#2)未誘導IFNγ
產生。
進一步檢驗嵌合親代231-32-15、Hum231#1或Hum231#2抗GITR抗體在溶液之功能活性,以125ng/ml抗CD3/抗CD28刺激及以滴定可溶性抗GITR抗體共刺激富含CD4+
T細胞。可溶性Hum231#1或Hum231#2抗GITR抗體亦共刺激CD4+
T細胞IFNγ產生,如圖12B所示。
6.3.4 促效抗GITR抗體對抗CD3誘導性PBMC細胞激素產生之效果
在此實施例中,使用PBMC檢驗以抗GITR抗體Hum231#2共刺激誘導之細胞激素產生。透過聚蔗糖梯度從健康捐贈者棕黃層(buffy coat)(Research Blood Components,LLC)單離之PBMC儲存在液態氮及在實驗日解凍。細胞再懸浮於細胞培養基(RPMI+10% FBS+20U/ml之IL-2)且加到96-孔培養盤,其包含盤鍵結之各種次優濃度(0.3-5μg/ml)抗CD3抗體及5μg/ml之盤鍵結抗GITR抗體或同型控制組IgG1抗體。在37℃及5% CO2
培養樣本4天及在第2天及第4天收集細胞培養上清液。依據製造商之指示使用V-PLEX Proinflammatory Panel1(人類)Kit(Meso Scale Discovery)測試樣本來
測量分泌之細胞激素(IFNγ、IL-2、TNFα、IL-10、IL-13及IL-4)。
如繪於圖13,以盤鍵結抗GITR抗體Hum231#2共刺激誘導來自二不同捐贈者之PBMC中多種細胞激素分泌。
6.3.5 促效抗GITR抗體對細胞內細胞激素染色所測量之細胞激素產生的效果
Hum231#2對細胞激素產生之促效活性進一步由細胞內細胞激素染色分析。透過聚蔗糖梯度從健康捐贈者棕黃層(buffy coat)(Research Blood Components,LLC)單離之PBMC儲存在液態氮及在實驗日解凍。細胞再懸浮於細胞培養基(RPMI+10% FBS+20U/ml之IL-2)且加到96-孔培養盤,其包含盤鍵結之各種次優濃度(0.3-5μg/ml)抗CD3抗體及5μg/ml之盤鍵結抗GITR抗體或同型控制組IgG1抗體。在37℃及5% CO2
培養樣本3至4天。活化後,為了抑制細胞內蛋白質運送,以布雷非德菌素A(Brefeldin A)(BD Biosciences)依據製造商之指示處理細胞且在37℃及5% CO2
培養樣本6小時。培養之後,以FITC生存力胺染劑(Life technologies)染細胞來染死細胞。以冷FACS緩衝液(1×PBS+2% FBS,pH7.2)洗滌之後,以冷FACS緩衝液稀釋之包含對抗CD3(APC Cy7,SP34.2)、CD4(PercP Cy5.5,L200)及CD8a(PE Cy7,SK1)之抗體的抗體雞尾
酒加到各樣本且4℃培養10分鐘。固定細胞及以Cytofix-Cytoperm(BD Biosciences)依據製造商之指示透化細胞來細胞內染色。PBMC以對抗IFNγ(Alexa647,B27)及TNFα(PE,Mab11)之抗體染色且培養在室溫10分鐘。使用1×Perm-洗滌緩衝液(BD Biosciences)洗滌樣本且使用FACScanto流式細胞儀(BD Biosciences)獲得。使用Flojo軟體分析流式細胞儀散布圖。流式細胞儀散布圖及圖形為使用來自六位不同捐贈者之PBMC實驗的代表。
在次優抗CD3抗體濃度範圍,證實GITR抗體Hum231#2對人類T細胞共刺激活性,誘導IFNγ+單功能性T細胞、TNFα+單功能性T細胞以及IFNγ+ TNFα+多功能性T細胞(圖14A及14B)。
接著,為人類IgG1抗體之Hum231#2w轉化成人類IgG4抗體,命為pab1989。抗體pab1989共有與Hum231#2w相同之重鏈可變區及相同輕鏈,但包括人類IgG4恆定區。抗體pab1989包括SEQ ID NO:554之重鏈序列及SEQ ID NO:576之輕鏈序列。
在上述細胞內細胞激素染色實驗中,以IgG1抗體Hum231#2w並行測試IgG4抗體pab1989。以0.7、0.8及0.9μg/ml使用抗CD3抗體及以5μg/ml使用抗GITR抗體。在37℃及5% CO2
培養樣本3至4天。如圖14C所示,pab1989同Hum231#2w呈現類似促效活性,誘導IFNγ+ TNFα+多功能性CD4+T細胞及TNFα+單功能性
CD4+T細胞。圖形為使用來自四位不同捐贈者之PBMC實驗的代表。
6.3.6 交聯對抗GITR抗體之促效活性的效果
使用抗CD3刺激之PBMC檢驗交聯對抗GITR抗體Hum231#2之功能活性的效果。
測試盤鍵結或可溶性Hum231#2對於在次優CD3刺激分析中誘導IFNγ+ TNFα+多功能性T細胞,如章節6.3.5所述。如圖15A所示,與同型控制組相比,僅盤鍵結但無可溶性Hum231#2增加IFNγ+ TNFα+多功能性CD8+T細胞之百分比。
對盤鍵結之Hum231#2或與抗Fc抗體交聯之Hum231#2重複如章節6.3.4所述PBMC細胞激素分泌分析。收集培養上清液在第4天來測量分泌之細胞激素(IFNγ、IL-2、TNFα、IL-10、IL-13及IL-4)。以盤鍵結(圖15B)或以抗Fc交聯之(圖15C)Hum231#2共刺激誘導細胞激素分泌。
6.3.7 擬人化231-32-15選殖株在棕黃層(buffy coat)8(BC8)之活性及測量效應子T細胞或T調控性細胞
在此實施例中,監控其增殖來測量促效抗GITR抗體對CD4+
T作用或CD4+
T調控性細胞之效果。富含CD4+
T-細胞以CFSE標幟及以125ng/ml盤鍵結之抗CD3抗體刺激。5天後在培養中由CFSE稀釋監控增殖
的富含CD4+
T-細胞。
圖16A及16B所示在富含CD4+
T細胞群中之CD4+
T作用或T調控性細胞群藉其細胞表面標記染色以流式細胞儀辨識。經活化之CD4+
T效應子細胞經特徵化為CD25+
、CD45RA-
、CD127中/低
及Foxp3陰/低
。CD4+
T調控性細胞經特徵化為CD4+
、CD25+
、CD45RA-、CD127低
及Foxp3高
。依據下表14進行FACS染色:
刺激分析結果顯示於圖16A及16B之FACS圖。圈選在CD4+
Treg(CD4+
、CD25+
、CD45RA-
、CD127低
及Foxp3高
)或經活化之CD4+
T效應子細胞(CD25+
、CD45RA-
、CD127中/低
及Foxp3陰/低
)顯示125ng/ml抗CD3/抗CD28單獨刺激及聯用抗GITR共刺激在T作用及T調控性細胞上調控GITR表現。
圖16A描述T效應子及T調控性細胞之FACS分析。在以抗CD3單獨或聯用抗GITR抗體刺激之
後,二細胞類型表現GITR在其細胞表面。然而,以抗GITR抗體共刺激較T調控性細胞優先擴張T-效應子細胞,導致增加Teff/Treg比(圖16B)。
作為抗GITR抗體在細胞性免疫背景中對T-細胞之促效活性的進一步證據,評量PBMC刺激之後的T細胞反應。
調整對PBMC抗CD3-誘導性增殖滴定PBMC刺激。說明在圖17A及17B為以31.25ng/ml之盤鍵結之抗CD3/抗CD28聯用盤鍵結之抗GITR抗體或同型控制組刺激CFSE-經標幟之PBMC。作為抗GITR抗體活性之正控制組,使用相同刺激條件刺激富含CD4+
T細胞(數據未顯示)。
以抗CD3及抗CD4或抗CD3及抗CD8由其染色辨識在PBMC群中之CD4+
或CD8+
T-細胞。圈選在CD4+
CD3+
T細胞或CD8+
CD3+
T細胞所獲得之FACS樣本的FloJo(Tree Star,Inc.)分析顯示抗GITR嵌合親代231-32-15(REF 231)、Hum231#1及Hum231#2抗體刺激之T細胞增殖(% CFSE低)。特別是圖17B所繪之實驗顯示抗GITR嵌合親代231-32-15(REF 231)、Hum231#1及Hum231#2抗體在CD8+
T細胞具有活性。
6.3.8 促效抗GITR抗體對GITR NF-κB-螢光素酶報告子細胞株之效果
設計人類GITR NF-κB-螢光素酶報告子細胞
株(Promega)探索抗GITR促效抗體之共刺激活性。因抗GITR促效抗體或GITR配體之GITR活化已報導活化NF-κB(Snell LM et al.,(2010)J Immunol 185:7223-7234;Bulliard Y et al.,(2013)J Exp Med 210:1685-1693;Yu KY et al.,(2003)Biochem Biophys Res Commun 310:433-438)。據此,基因修飾Jurkat細胞以穩定表現GloResponse NF-κB-luc2P構築體及人類GITR。報告子細胞再懸浮在分析介質(RPMI+1% FBS)中且與各種濃度(12.5、10、5、2.5、1.25及0.625μg/ml)之盤鍵結抗GITR抗體Hum231#2w、m6C8或IgG1同型控制組在無或有0.3μg/ml之盤鍵結之抗CD3抗體(選殖株SP34)存在下培養。6或18小時培養後,讀取以抗CD3抗體培養之盤。2、5、6、8或18小時培養後,讀取無抗CD3抗體之盤。培養之後,室溫平衡盤及之後加入室溫Bio-Glo試劑(Promega)之等體積。使用EnVision多標籤讀取器2100讀取發光。
對於以抗CD3抗體之分析,對各測試抗體濃度描繪18-小時後-刺激之螢光素酶RLU(圖18A)。同樣地,對於無抗CD3抗體之分析,圖18B為在5-小時後-刺激對所測試各種抗體濃度顯示螢光素酶相對光單元(RLU)的圖。在圖18C,在數個所測試抗體濃度中,在0、2、5、6、8及18小時後-刺激,顯示螢光素酶表現(GITR Ab/同型控制組)無抗CD3抗體之最高比。所示數據為有抗CD3抗體之四個實驗或無抗CD3抗體之二個
實驗之代表。
在抗CD3抗體之存在下,雖然m6C8在6小時顯示較強促效活性(數據未顯示),但18-小時後-刺激,Hum231#2w及m6C8誘導類似GITR報告子細胞株之活化(圖18A)。然而,在無抗CD3抗體之存在下,僅Hum231#2w但無m6C8誘導GITR報告子細胞株之活化(圖18B)。
6.3.9 促效抗GITR抗體對Fcγ受體IIIA(CD16)報告子細胞株之效果
在此實施例中,檢驗由活化之nTreg細胞及T效應子細胞的人類GITR表現。使用磁性為主之分離技術,從健康捐贈者單離之PBMC為富含CD3+T細胞(Teff)或CD4+CD25+CD45RA+T細胞(nTreg)。T淋巴球之後以CD3-CD28擴張珠粒以500U rIL-2活化4天及以50U rIL-2額外5天。以流式細胞儀圈選在CD4+及CD8+ Teff對nTreg來確定GITR受體定量。同時跑Quantibrite珠粒(BD Biosciences)及用以量化GITR受體表面密度。
如圖19A所示,第9天(且評量所有時間點)在經活化之nTreg細胞上人類GITR之表面表現高於在經活化之CD4+或CD8+ T效應子細胞者。
接著,使用表現Fcγ受體IIIA(CD16)之報告子細胞株連同經活化之T作用(Teff)或nTreg細胞,
如所述產生,評量共接合GITR及由活化的Fcγ受體傳訊號之抗GITR抗體Hum231#2w的能力。擴張之Teff或nTreg細胞與不同劑量之Hum231#2w或IgG1同型控制組培養。過度表現CD16之Jurkat NFAT-螢光素酶報告子細胞(158 V/V多型性)加到樣本。抗體/抗原複合物結合,其中抗原位於細胞表面,至CD16傳訊號至啟動子/報告子構築體且導致螢光素酶基因轉錄。在37℃及5% CO2
培養盤20小時。此培養之後,室溫解凍Bio-Glo Luciferase Assay Reagent(Promega)及加入75μl至96-孔白分析盤各孔。在5-10分鐘內,測量發光。從各樣本讀值減去背景發光且紀錄經調整之相對光單位(RLU)。△ RLU代表抗GITR抗體之RLU減去同型控制組者。
符合經活化之nTreg及經活化之CD4+或CD8+T效應子細胞(圖19A)之間的差異表面GITR表現,當結合經活化之nTreg細胞時,抗GITR抗體Hum231#2w優先活化CD16(圖19B)。
評量GITR過度表現是否為位於腫瘤微環境內之調控性T細胞的特徵,比較健康人類捐贈者血液單離之T細胞(圖19C,a-c,n=3)或從非小細胞肺癌(NSCLC)患者之腫瘤組織(圖19C,d-f,n=3)上GITR表現。減去抗體對免疫群之背景結合,在加入細胞-表面及細胞內抗體之前,以純化之CD16/32抗體(10μg/ml,室溫20分鐘)培養所有細胞。接著FcR-阻擋,以APC-共軛之抗GITR抗體(選殖株110416,R&D系統)或同型控制組及
細胞-表面抗體系譜-雞尾酒(CD3-FITC、CD25-PECy7、CD4-BV650及CD8a-PE)冰上培養所有樣本45分鐘(各1μg/ml)、以FACS緩衝液(PBS,EDTA及0.5% BSA)洗滌三次,接著固定/透化及以太平洋藍-共軛之FOXP3培養(固定/透化及培養各45分鐘在冰上,1μg/ml)。之後使用LSRFortessa流式細胞儀(BD Biosciences)分析染色之樣本。圖19C中之細胞群定義為:Tconv(CD3+、CD4+、CD8a-、CD25低、FOXP3-)或Treg(CD3+、CD4+、CD8a-、CD25高、FOXP3+)。
如圖19C所證實,GITR表面表現在單離自NSCLC患者腫瘤組織的調控性T細胞為最高,來自健康捐贈者之Treg或習知T細胞則為少或無可偵測量。
6.3.10 促效抗GITR抗體對非洲綠猴之T細胞的細胞激素產生之效果
測試品種交互-反應性,評量Hum231#2對於其結合非洲綠猴(AGM)之GITR。簡言之,解凍及計數AGM PBMC(Worldwide Primates)。PBMC再懸浮於細胞培養基(RPMI+10% FBS)且在37℃及5% CO2以抗CD3抗體(選殖株SP34.2,BD)或ConA(Sigma)加IL-2(20U/ml)刺激3天。活化後,以胺染劑FITC(Life technologies)室溫染色細胞15分鐘。以冷FACS緩衝液(1XPBS+2% FBS,pH7.2)洗滌細胞且將以冷FACS緩衝液稀釋之包含對抗CD3(APC Cy7,SP34.2)、CD4
(PercP,L200)、CD8(PE Cy7,SK1)及PD-1(PE,EH12.2H7)之抗體的抗體雞尾酒加入及4℃培養10分鐘。洗滌細胞及與2.5μg每孔之Hum231#2或IgG1同型控制組4℃培養10分鐘。洗滌細胞及之後以與Alexa647共軛之二次抗Fc F(ab’)2
抗體4℃染色10分鐘。使用FACSCanto流式細胞儀(BD Biosciences)獲得之前,洗滌細胞及以1.6%聚甲醛固定。使用FACS DIVA軟體分析FACS檔案。
如圖20A所示,抗GITR抗體Hum231#2結合活化之AGM CD4+及CD8+T細胞。來自AGM未刺激之T細胞未表現GITR之基準線量且一旦T細胞活化,在細胞表面之GITR量經上調控。圖20A所示之散布圖為使用三個不同AGM之PBMC的實驗的代表。
接著,使用非洲綠猴(AGM)之PBMC進行CD3次刺激分析以檢驗Hum231#2w之促效活性。從健康捐贈者透過聚蔗糖梯度單離人類(Research Blood Components,LLC)或AGM PBMC(Worldwide Primates)及儲存在液態氮及在實驗日解凍。細胞再懸浮於細胞培養基(RPMI+10% FBS+20U/ml之IL-2)且加到96-孔培養盤,其包含盤鍵結之抗CD3抗體(0.8μg/ml)及各種濃度(2、4、5、6及9μg/ml)之盤鍵結抗GITR抗體或同型控制組IgG1抗體。在37℃及5% CO2
培養樣本4天。活化後,抑制細胞內蛋白質運送,以布雷非德菌素A(Brefeldin A)(BD Biosciences)依據製造商之指示處
理細胞且在37℃及5% CO2
培養樣本6小時。培養之後,以FITC生存力胺染劑(Life technologies)染色細胞來染死細胞。以冷FACS緩衝液(1×PBS+2% FBS,pH7.2)洗滌之後,包含對抗CD3(APC Cy7,SP34.2)、CD4(PercP Cy5.5,L200)及CD8a(PE Cy7,SK1)之抗體以冷FACS緩衝液稀釋之抗體雞尾酒加到各樣本且4℃培養10分鐘。固定細胞及以Cytofix-Cytoperm(BD Biosciences)依據製造商之指示透化來細胞內染色。以對抗IFNγ(Alexa647,B27)及TNFα(PE,Mab11,僅針對人類PBMC)之抗體染PBMC且在室溫培養10分鐘。使用1×Perm-洗滌緩衝液(BD Biosciences)洗滌樣本且使用使用FACScanto流式細胞儀(BD Biosciences)獲得。使用Flojo軟體分析流式細胞儀散布圖。
如圖20B及20C所示,以抗GITR抗體Hum231#2w共刺激誘導CD8+ AGM T細胞之IFNγ產生。流式細胞儀散布圖及圖形為使用來自AGM之PBMC的實驗之代表。
6.3.11 重組人類GITR配體及擬人化231-32-15選殖株同時結合對抗CD3刺激之CD4+T細胞的效果
不會避免GITR結合GITR配體(GITRL)之促效抗GITR抗體造成增強之免疫反應,其特徵在於增強增殖及/或T效應子細胞之效應子功能及/或下調控T調控性細胞之抑制功能。
測試抗GITR抗體,單獨或組合重組人類GITRL,其對CD4+
T細胞之促效活性。富含CD4+
T細胞經1-2μM CFSE標幟、洗滌之後以盤鍵結之抗CD3(125ng/ml)、可溶性抗-CD28(125ng/ml)及10U IL-2、連同10μg/ml嵌合親代231-32-15抗體、10μg/ml Hum231#1、10μg/ml Hum231#2、10μg/ml GITRL、10μg/ml嵌合親代231-32-15抗體與10μg/ml GITRL之組合、10μg/ml Hum231#1與10μg/ml GITRL之組合或10μg/ml Hum231#2與10μg/ml GITRL之組合37℃刺激3至6天。之後從盤收集培養上清液及細胞。分別如章節6.3.1及6.3.2所述檢驗細胞增殖及細胞激素釋放。抗GITR抗體及GITRL同時結合對CD4+
T效應子細胞或CD4+
T調控性細胞之效果可如章節6.3.7所述進一步測試。此研究可顯示GITRL與抗GITR抗體(嵌合親代231-32-15、Hum231#1及Hum231#2)之間在增強免疫反應之協同或加成效果。
作為使用可溶性重組人類GITRL組合本文所述抗GITR抗體測試共促效劑活性的替代方案,可能使用被誘導表現GITRL之抗原呈現細胞。此經誘導之APC可如上所述在有或無抗GITR抗體之存在下與CD4+
T效應子細胞或CD4+
T調控性細胞培養且評估T細胞之功能。誘導GITRL表現,抗原呈現細胞諸如巨噬細胞或樹狀細胞與TLR4配體(例如LPS)培養1、2、4、6或12小時,如例如在Tone M et al.,(2003)PNAS 100:15059-
15064所述;或與純化自啤酒酵母菌(Saccharomyces cerevisiae)細胞壁的全β-聚醣粒子(WGP)培養6、12、24、48或72小時,如例如在Tian J et al.,(2012)PLoS One,7(10):e46936所述。
6.3.12 促效抗GITR抗體對T細胞上OX40及PD-1表面表現之效果
在此實施例中,評量促效抗GITR抗體其對T細胞上OX40及PD-1表面表現的影響。透過聚蔗糖梯度從健康捐贈者棕黃層(buffy coat)(Research Blood Components,LLC)單離之PBMC儲存在液態氮及在實驗日解凍。細胞再懸浮於細胞培養基(RPMI+10% FBS+20U/ml之IL-2)且加到96-孔培養盤,其包含盤鍵結之各種次優濃度(0、0.7、0.8及0.9μg/ml)的抗CD3抗體(選殖株SP34)及5μg/ml之盤鍵結抗GITR抗體Hum231#2或同型控制組IgG1抗體。在37℃及5% CO2
培養樣本4天。培養之後,以FITC生存力胺染劑(Life technologies)染色細胞來染死細胞。以冷FACS緩衝液(1×PBS+2% FBS,pH7.2)洗滌之後,加入抗OX40抗體且4℃培養10分鐘。洗滌細胞及加入抗人類FcF(ab’)2
Alexa647且4℃培養10分鐘。離心及洗滌步驟之後,以冷FACS緩衝液稀釋包含對抗CD3(APC Cy7,SP34.2)、CD4(PercP Cy5.5,L200)、CD8a(PE Cy7,SK1)及PD-1(PE,EH12.2H7)的抗體之抗體雞尾酒加到
各樣本及4℃培養10分鐘。在使用FACScanto流式細胞儀(BD Biosciences)獲得之前,洗滌樣本及再懸浮於200μl之1.6%聚甲醛。使用Flojo軟體分析FACS圖。流式細胞儀散布圖及圖形為使用來自一位捐贈者之PBMC的實驗之代表。
如圖21所示,以抗GITR抗體Hum231#2共刺激增加人類CD4+及CD8+T細胞上OX40及PD-1表面表現。
6.4. 實施例4:擬人化變體之種系
此實施例描述種系之產生,擬人化變體。
6.4.1 庫設計
以增加之人類種系內容藉由透過簡併性密碼子至重及輕鏈可變區導入定點突變,使用庫方法產生擬人化變體。以2至4個胺基酸取代17個胺基酸位置突變VH鏈之可變區,導致1.3E+06之最終多樣性。在9個胺基酸位置(每位置2至3個胺基酸)突變輕鏈之可變區,導致7.7E+02之最終多樣性。該庫所含的不同框架及CDR位置顯示於圖22。使用IGHV1-2*02 VH人類種系(圖22A)及IGKV4-1*01 VL人類種系(圖22B)設計庫。
6.4.2 庫產生
將突變之擬人化可變區轉殖到反轉錄病毒表
現載體(pCMA)。這些構築體之後使用Retrocyte Display®
技術用於轉導preB細胞及表現抗體在表面。反轉錄病毒表現載體包含MSCV為主之5'
及3'
LTR'
、免疫球蛋白恆定區(IGHG1或IGKC)(包括膜錨部分(IGHG1))及CD4表面標記基因。以RES(內部核糖體進入位)偶合表面標記及免疫球蛋白。此實施例中之術語“可變區”意指重鏈之VDJ重排基因與輕鏈之VJ重排基因。
6.4.2.1 擬人化重鏈庫的產生
合成之擬人化可變重鏈區(Eurofins MWG GmbH)轉殖到包含免疫球蛋白恆定區(IGHG1)(包括膜錨部分)之反-病毒表現載體。使用typeIIS限制酵素LguI及T4-DNA連接酶在37℃一步驟及一管中進行切割及連接1小時。合成的擬人化重鏈庫材料(128.7ng)以載體對插入比為1:3經框入連接到pCMA反轉錄病毒表現載體(1μg)。之後沉澱及濃縮(8.3-倍)連接反應到最終DNA濃度為94ng/μl。
全(3×4μl)濃縮之連接反應被電穿孔到80μl之DH10B細胞(大腸桿菌(E.coli)ElectroMax DH10B電勝任細胞,Invitrogen,Cat No 12033-015)(1900V/5ms)。1000μl SOC介質(Invitrogen,Cat No 15544-034)加入與在37℃復原轉形的DH10B細胞1小時。進行1:1000稀釋來測定庫複雜性。全轉形反應劃盤在LB-
agar+100μg/ml安比西林(ampicillin)盤及在37℃培養過夜。擬人化VH鏈庫複雜性確定為7.3E+07,因此取得全庫多樣性。
所有電穿孔細菌從盤刮下且製備2甘油存貨在-80℃長期儲存。進行大規模DNA質體製劑(Macherey & Nagel,NucleoBond Xtra Maxi Plus Kit)。以HindIII/Eco47III(H/E)進行切割以驗證所選殖插入之擬人化VH鏈庫材料之存在與正確尺寸。驗證正確之載體骨架,使用KpnI/BsrGI(K/B)切割。作為控制組,以LguI切割擬人化VH鏈庫質體DNA來驗證無插入擬人化VH鏈之載體量而由分離未切之質體DNA測試載體完整性。
選取96個單一選殖株且寄去定序,使用引子89-AL(序列:5’ gcctccgcctcctcttcctccatcc 3’;SEQ ID NO:707)測定最終庫多樣性。在品管中無辨識到多餘序列。理論多樣性為1.3E+06不同變體,因此各獨特序列的覆蓋範圍為約50倍。35%之庫-選殖株具有所欲突變模式(=2.5E+07)且所有所欲變體存在於該庫中。
6.4.2.2 擬人化輕鏈庫之產生
合成之擬人化可變輕鏈區(Eurofins MWG GmbH)轉殖到包含免疫球蛋白恆定區(IGKC)之反轉錄病毒表現載體。如章節6.4.2.1所述進行切割及連接。合成的擬人化輕鏈庫材料(227.9ng)以載體對插入比為1:
10框入連接到pCMA反-病毒表現載體(0.5μg)。之後,沉澱連接反應及3.6-倍濃縮到最終DNA濃度為52ng/μl。
如述於上述章節6.4.2.1進行轉形,2×4μl濃縮之連接反應被電穿孔到80μl之DH10B細胞(大腸桿菌(E.coli)ElectroMax DH10B電勝任細胞,Invitrogen,Cat No 12033-015)(1900V/5ms)。擬人化VL鏈庫之複雜性確定為4.6E+07,因此取得全庫多樣性。庫質體DNA製劑與驗證質體DNA如述於章節6.4.2.1進行。品管中僅辨識一多餘序列。理論多樣性為7.7E+02不同變體,因此各獨特序列之覆蓋範圍為約60000倍。65%之庫-選殖株具有所欲突變模式且所有所欲變體存在於該庫中。
6.4.3 從預選擇之preB細胞選殖株恢復種系重及輕鏈
如上所述(章節6.4.2.1及6.4.2.2)產生之擬人化庫材料用在親和性成熟Retrocyte Display®
篩選以識別具高種系基因內容及改良之生物及生化特性之抗體。從二96孔盤,包含80及96個預選擇之preB細胞選殖株,恢復重及輕鏈。裂解細胞(Phusion Human Specimen Direct PCR Kit,Thermo Scientific/Finnzymes Cat.No.F-150)及直接由PCR放大可變區(見表15)。以特定5’正向及3’反項引子進行PCR(見表16)。作為PCR模板,使用2μl preB細胞裂解物。純化放大之可變區(NucleoFast 96 PCR(Macherey-Nagel))且轉殖到包含免疫球蛋白恆定區(IGHG1,IGKC)之CHO表現載體
(pPEP)。
選殖預選擇之種系重及輕鏈可變區,在一步驟及一管中使用typeIIS限制酵素LguI及T4-DNA連接酶在37℃進行切割及連接1h及最後步驟在80℃10分鐘,且預選擇之種系之重或輕鏈可變區(~60ng)框內連接至pPEP表現載體(50μg)。使用載體對插入比為1:12。
2μl預選擇之種系之重鏈連接反應及6μl預選
擇之種系之卡帕輕鏈連接反應藉熱休克轉形共轉形在化學勝任DH10B細胞(30μl)。加入1000μl SOC介質(Invitrogen,Cat No 15544-034)且在37℃恢復轉形之DH10B細胞1小時。最後,加入1000μl LB-介質+安比西林(ampicillin)(最終濃度:100μg/ml)且轉形之大腸桿菌(E.coli)細胞在37℃培養過夜。進行小規模之DNA質體製劑(Macherey & Nagel,NucleoSpin 96 Plasmid)及以HindIII/NotI(VH chains)及NcoI(VK chains)進行切割驗證所選殖的可變區之存在與正確尺寸。由分離未切之質體DNA測試載體完整性。之後使用DNA質體製劑轉染CHO細胞與使用懸浮陣列技術及由Octet在動力學分析測試所表現之抗體。PCR驗證抗體序列。
6.4.4 種系變體之選擇
基於Octet測量(Octet RED 96 system;ForteBioTM
Inc.,Menlo Park,CA)確定之結合動力學選擇數百個種系之抗體。依據儀器說明書配製實驗程序。生物素-GITR結合鏈親和素生物感測器(SA)且PBS(pH 7.4)用作為空白控制組。簡言之,在30℃電泳緩衝液(PBS,0.05% Tween,pH7.4)中進行交互作用分析。在使用之前馬上以運行緩衝液預濕感測器尖端10分鐘且用於Octet之微孔盤每孔以200μl之樣本或緩衝液填充及800rpm攪拌。對於實驗,使用商業上可獲得之預塗佈SA管
(tip)。生物素化GITR載於在PBS pH7.4之ForteBio SA纖維10分鐘及洗滌4分鐘。對於締合相,浸泡配體-塗佈之SA管在細胞培養上清液(在測量之前以運行緩衝液1:10稀釋)中5分鐘。在單獨包含Octet緩衝液之孔中測量抗體-抗原複合物之解離5分鐘。各次之後,以甘胺酸(10mM,pH 2.0)再生管。以Octet評量軟體v6.3使用1:1結合模式與區性全擬合確定親和性,K開
及K關
。表17列出56個選擇種系變體之重鏈可變區及輕鏈可變區之構成與其親和性,K開
及K關
值,由Octet所測量。
這些抗體中,依據進一步Octet值及其種系同源性,選擇一些作為後續分析。從這些中,如下所述更詳細特徵化抗體之樣本,其在T細胞分析中全為促效性(數據未顯示)。圖23描述這些所選之種系變體的重及輕鏈可變區之構成。圖24A、24B及24C描述其他選擇實際或預測之種系變體的重及輕鏈區之構成。
6.4.5 種系變體之動力學分析
依照如述於章節6.2.5.1之方法,使用懸浮陣列技術確定抗GITR種系變體抗體之定量及結合分析。相較於嵌合親代231-32-15抗體,種系變體之平均相對親和性示於圖23。
此外,亦依據實施例6.2.5.2所述之方法進行使用懸浮陣列技術評估配體阻擋活性。如圖25A及25B可見,在種系變體抗體選擇存在下,GITRL-PE結合GITR
對所測試抗體依循非常類似之模式。
如下實施例5所述在功能分析中進一步特徵化這些種系變體抗體。
6.5 實施例5:種系變體之功能活性
6.5.1 種系變體對抗CD3刺激之CD4+T細胞增殖及細胞激素產生的效果
為了評估如述於實施例4所產生之新種系變體活性,這些變體相較於擬人化抗體Hum231#1及Hum231#2與嵌合親代231-32-15抗體對來自四棕黃層(buffy coat)製劑BC4、BC9、BC13及BC18之富含CD4 T細胞。
如以上述於章節6.3.1進行次優CD3刺激分析,在進行刺激分析後以細胞內細胞激素染色(BC13及BC18)、細胞激素釋出(BC4及BC9)及CFSE稀釋(BC4及BC9)測量5天。盤鍵結之抗CD3及可溶性抗CD28抗體與盤鍵結之抗GITR抗體、無抗體(CD3單獨)及同型控制組(抗體MSC8)使用。抗GITR抗體使用濃度為10μg/ml。對於棕黃層(buffy coat)4及9,抗CD3抗體使用濃度為125ng/ml,抗CD28抗體濃度為125ng/ml及10U IL-2。對於棕黃層(buffy coat)13,抗CD3抗體使用濃度為500ng/ml及抗CD28抗體濃度為100ng/ml。對於棕黃層(buffy coat)18,抗CD3抗體使用濃度為31.25ng/ml及抗CD28抗體濃度為100ng/ml。
對於棕黃層(buffy coat)製劑BC4及BC9,在5天培養後自盤中收集上清液及細胞。細胞增殖確定且顯示為百分比CFSE低(圖26A及26B)並使用上清液於細胞激素分析(IFNγ及IL-10)。圖27A及27B顯示對BC4細胞激素釋出及圖28A及28B顯示對BC9細胞激素釋出。
對棕黃層(buffy coat)製劑BC13及BC18,5天培養之後,添加莫能菌素(monensin)(eBioscience)至所有樣本6小時,使得IFNγ細胞內保留。樣本之後針對IFNγ-PE(eBioscience)使用BD Cytofix/Cytoperm套組(BD Biosciences)細胞內染色,接著以流式細胞儀在BD FACSAria I(BD Biosciences)偵測並使用FlowJo軟體(Tree Star)分析。種系之變體對來自BC13及BC18之IFNγ陽性CD4T細胞之百分比的效果結果分別顯示於圖29A及29B。與種系變體、嵌合親代231-32-15抗體或擬人化變體Hum231#1及Hum231#2接觸之後,這些抗GITR抗體誘導之IFNγ陽性CD4 T-細胞之百分比為可比較。然而,如所預期,捐贈者之間有一些輕微變異。
6.5.2 種系變體對GITR NF-κB-螢光素酶報告子細胞株之效果
在此實施例中,使用章節6.3.8所述之GITR NF-κB-螢光素酶報告子細胞株(Promega)測試如述於實
施例4產生之種系變體。
依據製造商的指示報告子細胞株(Promega)維持在培養。實驗當天,將細胞在懸浮於分析介質(RPMI+1% FBS)中。細胞(每孔100,000顆細胞)加到96孔盤,其包含盤鍵結之抗CD3抗體(選殖株SP34,0.3μg/ml)及各種濃度(12.5、10、5、2.5、1.25、0.625及0μg/ml)之盤鍵結抗GITR抗體。在37℃及5% CO2
培養報告子細胞18小時。培養之後,使用Bio-Glo(Promega)及EnVision多標籤讀取器2100偵測螢光素酶表現。
在此分析中測試的抗GITR抗體為Hum231#2w及20個種系變體:pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、pab2159、pab2160及pab2161。如圖30A-C所示,在GITRNF-κB-螢光素酶報告子分析中,所有種系變體顯示促效活性。
亦測試種系變體在無抗CD3抗體之存在下之促效活性。在實驗當天,GITRNF-κB-螢光素酶報告子細胞(Promega)再懸浮於分析介質(RPMI+1% FBS)中。細胞(每孔100,000顆細胞)加到96孔盤,其包含各種濃度(12.5、10、5、2.5、1.25及0.625μg/ml)之盤鍵結抗GITR抗體。在37℃及5% CO2
培養報告子細胞6
小時。培養之後,使用Bio-Glo(Promega)及EnVision多標籤讀取器2100偵測螢光素酶表現。
此分析中測試的抗GITR抗體為m6C8、Hum231#2w及20個種系變體:pab1964、pab1965、pab1966、pab1967、pab1968、pab1969、pab1970、pab1971、pab1972、pab1973、pab1975、pab1976、pab1977、pab1979、pab1980、pab1981、pab1983、pab2159、pab2160及pab2161。所有種系變體在無抗CD3抗體之存在下誘導報告子細胞株劑量依賴性活化(圖30D-F)。
6.6 實施例6:抗GITR抗體之表位特徵
為了特徵化嵌合親代231-32-15抗體與擬人化抗GITR抗體辨識之在人類GITR之表位,如下所述進行進一步研究。
6.6.1 表位競爭-細胞結合分析
為了確認擬人化變體抗體保留親代嵌合231-32-15抗體之表位特異性,進行細胞結合分析。收集表現嵌合親代231-32-15抗體之1624-5前驅-B細胞且再懸浮1x106
細胞在200μl FACS緩衝液加上:i)生物素化GITR(GITR-bio)(1:1000),與2μg嵌合親代231-32-15抗體預培養15min;ii)GITR-bio(1:1000),與2μg Hum231#1預培養15min;iii)GITR-bio(1:
1000),與2μg Hum231#2預培養15min;或iv)GITR-bio(1:1000)。4℃培養細胞20min且之後以4ml FACS緩衝液洗滌並300g 4℃離心5min。細胞沉澱再懸浮於200μl FACS緩衝液加上鏈親和素-PE(1:1000)且之後如前培養及洗滌。使用FACS-AriaII(BD Biosciences)細胞之後再懸浮在200μl FACS緩衝液用於分析。
圖31顯示擬人化變體抗體保留嵌合親代231-32-15抗體之表位特異性。右手數據圖顯示GITR-bio結合表現嵌合親代231-32-25抗體之1624-5前驅-B細胞。然而,當GITR-bio與嵌合親代231-32-15、Hum231#1或Hum231#2抗體預培養,損失GITR-bio結合1624-5細胞(左手數據圖)。重疊FACS圖顯示擬人化變體亦顯示彼此及與嵌合親代231-32-15抗體非常類似GITR結合特性。
6.6.2 表位競爭-懸浮陣列技術
抗GITR抗體(25μl)在分析緩衝液(Roche 11112589001)中稀釋成2μg/ml且與偶合抗人類IgG(F(ab)2
-特異性,JIR,105-006-097)之1500 Luminex®
珠粒(5μl,Luminex Corp,no 5 LC10005-01)在0.5ml LoBind管(Eppendorf,0030108.116)中、振動條件下、黑暗中培養隔夜。之後轉移此混合物到預濕潤之96-孔過濾盤(Millipore,MABVN1250)。以200μl/孔PBS洗滌盤
二次以移除未結合之抗體。在相同時間,20μg/ml之相同抗GITR抗體、不同抗GITR抗體或分析緩衝液與20μl(1μg/ml)R-PE經標幟之GITR抗原(R&D系統,二-硫化物-連接同型二聚體;689-GR;內部與AbDSerotec LYNX Kit標幟,LNK022RPE)黑暗中650rpm下培養1h。珠粒混合物與抗原/抗體混合物混合1:1(自各者20μl)且在振動條件下(20℃,650rpm)培養額外一小時。直接在測量之前,40μl之分析緩衝液加到各孔及使用Luminex®
200系統(Millipore)且在48μl樣本體積中100珠粒之讀出進行分析。使用非競爭控制組(100%結合,僅分析緩衝液作為競爭化合物)之MFI值確定結合。
當使用嵌合親代231-32-15抗體作為捕捉抗體時,與二擬人化變體觀察到全結合競爭。當使用抗GITR抗體m6C8作為捕捉抗體時,與嵌合親代231-32-15抗體或二擬人化變體未觀察到結合競爭(數據未顯示)。這些結果顯示m6C8及本文所述抗GITR抗體辨識人類GITR上不同表位。
6.6.3 表位競爭-表面電漿共振
對於表位分揀(epitope binning),使用表面電漿共振“以串聯方式”(Abdiche YN et al.,(2009)Analytical Biochemistry,386:172-180)。對於該目的,在CM5感應器晶片(GE Healthcare,Series S CM5,BR-1005-30)上使用固定化不同密度之GITR抗原(R&D系
統,二硫化物連接之同型二聚體;689-GR)產生不同晶片表面。流動細胞2包含低密度(667RU)之GITR抗原,在流動細胞3(1595RU)評估介質密度及在流動細胞4,達到高密度(4371RU)。在流動細胞1,卵白蛋白(1289 RU,Pierce ThermoFisher 77120)經固定化作為參考。依據來自製造商(GE Healthcare)對於胺偶合(以0.4M EDC及0.1M NHS表面活化,GE Healthcare Amine偶合套組,BR-1000-50)之標準程序進行固定化。未反應之基團以1M乙醇-胺-HCl pH8.5去活化。之後,濃度為300nM(45μg/ml)之抗GITR抗體以5μl/分鐘跑過不同表面240s。使用這些條件,應已達到GITR表面飽合。在was included before在添加競爭抗體(300nM,5μl/min)之前包含解離時間60s。使用10mM甘胺酸pH2.0(GE Healthcare,BR-1003-55)以10μl/分鐘進行晶片表現再生60s。使用非競爭控制組(100%結合,飽合條件)的反應單元(RU)進行分揀。
如圖32所示,當嵌合親代231-32-15抗體先結合GITR時,此抗體無進一步結合發生。然而,當嵌合親代231-32-15抗體先結合GITR且應用抗體m6C8時,此抗體仍能夠結合GITR。
6.6.4 抗GITR抗體之表位繪圖
為了繪圖本文所述抗GITR抗體結合之GITR上之表位,使用易錯PCR(error prone PCR)產生人類
GITR抗原變體。於細胞庫,表現變體GITR蛋白質在細胞表面及篩選這些細胞對於抗GITR抗體之結合。作為正控制組,使用多株抗GITR抗體確認GITR蛋白質之適當摺疊。對於減少或無抗體結合發生之人類GITR抗原之變體,進行丙胺酸掃描突變誘發以確定需要用於與本文所述抗GITR抗體結合之精確表位殘基。
6.6.4.1 人類GITR變體之產生
使用易錯PCR突變產生人類GITR之變體,細胞外功能域中具有隨機突變。對於易錯PCR(error prone PCR),依據製造商之指示使用GeneMorphII Random Mutagenesis Kit(Stratagene)。簡言之,使用內部構築體(13ng,構築體編號4377 pMA-T-huGITR)作為模板、0.05U/μl Mutazyme II DNA聚合酶、1x Mutazyme II反應緩衝液、0.2μM之各引子(1152-Je(序列5’ gagctcctcgaggccaccatg 3’;SEQ ID NO:712)及1204-Je(序列5’ cgcggccgcgaattctta 3’;SEQ ID NO:713))及0.2mM之各去氧核苷-三磷酸鹽(dATP、dCTP、dGTP及dTTP)在體積50μl進行20個PCR循環。以PCR(Eppendorf,Germany)使下述程式:95℃達2min;20循環之95℃達30sec、56℃達30sec、72℃達1min;且最終延長步驟之72℃達10min放大樣本。使用1%瓊脂糖膠膠體純化PCR產物,將對應720bp預期尺寸之DNA帶切下及使用自Macherey&Nagel之
NucleoSpin Gel及PCR清除套組依據產品說明進行膠體萃取。由XhoI/EcoRI位點使用T4 DNA連接酶及比例1:3(載體:插入)將純化之DNA連接到內部表現載體。2小時後以65℃熱變性步驟10min停止連接(25℃)。自連接反應之DNA使用酵母菌t-RNA經EtOH沉澱。使用標準切割及連接技術。連接反應為電穿孔到DH10B細胞(大腸桿菌(E.coli)ElectroMax DH10B電勝任細胞,Invitrogen;1900V/5ms)。電穿孔細菌劃盤在LB-agar+100μg/ml安比西林(ampicillin)盤及獲得大約1.9x108
菌落。
之後從盤刮下所有電穿孔細菌及用於大規模DNA質體製劑(Macherey&Nagel,NucleoBond Xtra Maxi Plus Kit),依據製造商之指示產生DNA庫。進行以XhoI/EcoRI及BsrGI/EcoRI限制酵素切割以品質控管庫。挑出單一選殖株及寄去定序以使用引子1155-Je(fwd;序列5’ ccttgaacctcctcgttcg 3’;SEQ ID NO:714)確定最終庫多樣性。
6.6.4.2 以人類GITR變體產生細胞庫
使用標準轉染技術之後轉導以表現人類GITR突變體在1624-5細胞之表面。對於產生反轉錄病毒粒子,使用X-tremeGENE 9 DNA轉染試劑(Roche Diagnostics GmbH,Germany),DNA庫及表現反轉錄病毒蛋白質Gag、Pol及Env之載體轉染至轉錄病毒包裝細
胞株(HEK細胞)。所得之反轉錄病毒粒子累積在反轉錄病毒包裝細胞之細胞培養上清液中。轉染後二天,收集含無細胞-病毒載體粒子之上清液且經1624-5細胞之自旋-感染。獲得粗約4%之轉導效能(%人類GITR表現細胞)。於繼續培養至少額外一天,使用嘌黴素(1.5μg/ml)選擇細胞。未轉導之細胞作為陰性控制組(NC)。抗生素選擇之後,大多數T細胞穩定表現人類GITR抗原庫在細胞表面。透過Ficoll分離步驟移除未存活細胞。
使用FACS使用多株抗GITR抗體選擇表現正確摺疊之人類GITR突變體的T細胞及後續選擇表現未結合到抗GITR嵌合親代231-32-15抗體之人類GITR變體的個別細胞。簡言之,以FACS分析抗體結合細胞及自未結合細胞群藉由預備、高速FACS(FACSAriaII,BD Biosciences)分離呈現特異性抗體結合之細胞。抗體反應性或非反應性細胞庫在組織培養中再次擴張且,因為穩定表現反轉錄病毒轉導之細胞表現型,抗體-導向之細胞分選及組織培養擴張之循環重複,直到獲得清楚可偵測到之抗GITR抗體(嵌合親代231-32-15)非反應性細胞群。此抗GITR抗體(嵌合親代231-32-15)非反應性細胞群經過最終、單一細胞分選步驟。數天之細胞擴張之後,單一細胞所分選之細胞再次測試對於非結合抗GITR嵌合親代231-32-15抗體及結合多株抗GITR抗體,其在FACSCalibur(BD Biosciences)使用96孔盤分析。
6.6.4.3 表位分析
為了連接表現型(多株抗GITR+,嵌合親代231-32-15-)與基因型,進行單一細胞分選之huGITR變體定序。圖33顯示從這些變體之序列排列。圖33之胺基酸殘基依據人類GITR(SEQ ID NO:701)之未成熟胺基酸序列編號。定序辨識具有增加之突變或“熱點”(例如P62及G63)之區,提供抗GITR嵌合親代231-32-15抗體辨認的人類GITR表位的指標。
為了確認涉及結合抗GITR抗體之人類GITR精確胺基酸,進行熱點胺基酸之丙胺酸取代。下述位置(依據SEQ ID NO:701編號)分別突變成丙胺酸:P28A、T29A、G30A、G31A、P32A、T54A、T55A、R56A、C57A、C58A、R59A、D60A、Y61A、P62A、G63A、E64A、E65A、C66A、C67A、S68A、E69A、W70A、D71A、C72A、M73A、C74A、V75A及Q76A。使用轉染標準技術之後轉導表現這些人類GITR丙胺酸突變體在1624-5細胞表面。
最終,在流式細胞儀(FACSCalibur;BD Biosciences)中測試表現在1624-5細胞之丙胺酸突變體對於抗GITR擬人化變體Hum231#2、三種系變體(pab1967、pab1975及pab1979)及參考抗體m6C8之結合。簡言之,表現個體人類GITR丙胺酸突變體的1624-5細胞與2μg/ml之單株抗GITR抗體Hum231#2、三種系變
體(pab1967、pab1975及pab1979)或m6C8抗體;或與APC共軛之多株抗GITR抗體(AF689,R&D系統)及以100μl FACS緩衝液(PBS+2% FCS)稀釋之Fc受體阻擋(1:200;BD Cat no.553142)4℃培養20分鐘。洗滌之後,若需要細胞與以100μl FACS緩衝液(PBS+2% FCS)稀釋之二次抗IgG抗體4℃培養20分鐘以偵測(APC共軛;BD Cat no.109-136-097)。之後洗滌細胞及使用流式細胞儀(BD Biosciences)獲得。所測試單株抗體之平均螢光強度(MFI)值以多株抗體之MFI值除,產生針對個別GITR丙胺酸突變體之MFI比(單株抗體/多株抗體)。依據對所有突變體之個別MFI比計算平均MFI比(“AMFI比”)。圖34A為總覽Hum231#2、三種系變體(pab1967、pab1975及pab1979)與參考抗體m6C8結合表現人類GITR丙胺酸突變體之1624-5細胞的表。高於60%之AMFI比的個別MFI比被認為顯示類似,正規化後,多株抗體者之結合及在圖34A由“+”表示。30%及60%之間的AMFI比之個別MFI比在圖34A由“+/-”表示。低於30%之AMFI比的個別MFI比在圖34A由“-”表示。
如圖34A所示,D60A突變體與G63A突變體,依據SEQ ID NO:701編號,特異性中斷或弱化抗GITR擬人化變體Hum231#2與三種系變體(pab1967、pab1975及pab1979)之結合,但非參考抗體m6C8者。C58A突變體中斷所有五抗體之結合及可能為結構突變而
非表位-特異者。C74A突變體具有弱表現及不能用於結合比較。
再者,比較抗GITR抗體231-32-15、Hum231#2及m6C8對於其結合野生型與突變人類GITR。簡言之,野生型人類GITR及二GITR丙胺酸突變體(D60A突變體與G63A突變體,依據SEQ ID NO:701編號)如上所述表現在1624-5細胞之表面及如上所述在流式細胞儀分析中測試,其中細胞先使用2μg/ml之單株抗體231-32-15、Hum231#2及m6C8或APC共軛之多株抗體染色,且之後如需要用於偵測使用二次抗IgG抗體染色(APC共軛;1:1000;BD Cat No.109-136-097)。計算所有平均螢光強度(MFI)值作為二測量的平均。對特別細胞類型所測試之單株抗體的MFI值除以對相同細胞類型多株抗體之MFI值,產生總數9個MFI比(單株抗體/多株抗體):MFI比231-32-15,WT
、MFI比Hum231#2,WT
、MFI比m6C8,WT
、MFI比231-32-15,D60A
、MFI比Hum231#2,D60A
、MFI比m6C8,D60A
、MFI比231-32-15,G63A
、MFI比Hum231#2,G63A
及MFI比m6C8,G63A
。計算相對於野生型GITR,抗體對GITR丙胺酸突變體結合之百分比,由對GITR丙胺酸突變體特別之MFI比除以對野生型對應之MFI比(例如以MFI比Hum231#2,WT
除MFI比Hum231#2,D60A
)。結合減少之百分比由計算例如100%*(1-(MFI比Hum231#2,D60A
/MFI比Hum231#2,WT
))確定。
如圖34B所示,D60A突變體與G63A突變體
特異性中斷或弱化231-32-15及Hum231#2之結合,但非m6C8者。各散佈圖中,圖34B所示之百分比為GITR陽性細胞之百分比。當使用表現GITR D60A之細胞測試時,分別對231-32-15及Hum231#2降低抗體結合82%及88%,相較於對m6C8為10%減少。相同地,當使用表現GITR G63A之細胞測試時,231-32-15及Hum231#2之結合分別降低37%及59%,反之m6C8之結合增加62%。
對於抗GITR抗體結合特徵之進一步證據,比較抗體對馬來猴GITR之結合。馬來猴GITR未成熟蛋白質包括SEQ ID NO:704之胺基酸序列。為了增加蛋白質表現,馬來猴GITR訊號胜肽之第一殘基被甲硫胺酸取代,產生V1M馬來猴GITR。之後產生突變體馬來猴GITR V1M/Q62P/S63G,其中依據SEQ ID NO:704編號,胺基酸殘基在位置62及63(GlnSer)被人類GITR(ProGly)對應殘基取代。圖35A為人類GITR、V1M馬來猴GITR及V1M/Q62P/S63G馬來猴GITR之間序列排列。圖35A所示之三蛋白質如上所述表現在1624-5細胞之表面且如上所述以流式細胞儀分析測試,其中細胞先使用2μg/ml之單株抗體231-32-15、Hum231#2及m6C8或APC共軛之多株抗體染色,之後使用二次抗IgG抗體(APC共軛;1:1000;BD Cat no.109-136-097)染色。
如圖35B所示,抗GITR抗體231-32-15及Hum231#2顯示僅結合表現V1M/Q62P/S63G馬來猴GITR之細胞,但無表現V1M馬來猴GITR之細胞。
6.7 實施例7:以促效抗GITR抗體接著T細胞注入活體外T細胞治療
在注入個體,例如具有癌症之人類個體之前,表現GITR之T細胞,顯示活化之狀態,若與GITR促效抗體,例如Hum231#1、Hum231#2、Hum231#2w或另一本文所述GITR促效抗體培養,可進一步活化以殺死標的細胞,諸如腫瘤細胞。
以標準技術,例如FACS分析評估單離自個體,例如人類個體之T細胞上GITR表現量。T細胞來源為例如周邊血、排出腫瘤位置之淋巴結的生物檢體/手術樣本或其中T細胞可已滲透之腫瘤本身的生物檢體/手術樣本。由標準技術T細胞經單離,例如從總PBMC、淋巴組織或腫瘤組織。若觀察到GITR表現在T細胞表面,細胞可與GITR促效抗體,例如Hum231#1、Hum231#2、Hum231#2w或另一本文所述GITR促效劑抗體培養,其濃度範圍為例如1μg/ml至1mg/ml,達例如30分鐘、1小時、2小時、3小時、4小時、6小時、12小時、24小時、36小時、48小時或72小時,接著例如靜脈內注入T細胞至個體。
若未觀察到GITR表現在單離自個體的T細胞,其表現可為共培養T細胞與TCR複合物刺激劑,諸如例如植物凝集素(PHA)及/或佛波醇肉豆蔻酸乙酸酯(PMA)或TCR複合物刺激抗體,諸如抗CD3抗體與抗
CD28抗體(濃度範圍例如1μg/ml至1mg/ml,達例如30分鐘、1小時、2小時、3小時、4小時、6小時、12小時、24小時、36小時、48小時,或72小時)而誘導。或者,可較佳先培養T細胞與抗CD3抗體單獨,接著添加促效GITR抗體30分鐘、1小時、2小時、3小時、4小時、6小時、12小時、24小時、36小時、48小時或72小時之後。亦可希望在抗原呈現細胞存在下以腫瘤抗原,例如呈胜肽或蛋白質形式刺激T細胞,以活化及擴張腫瘤-特異性T細胞。在抗原刺激之後,T細胞可與GITR促效抗體培養以在注入之前增強其活化狀態。
T細胞可在一段期間例如30分鐘、1小時、2小時、3小時、4小時、6小時、12小時或24小時注入至個體,及可注入至個體一、二、三、四或更多次,例如1、2、3或4週或1、2、3、4、5或6個月分開。所注入T細胞之數量可由標準實驗方法確定及可包括例如1×106
細胞、1×107
細胞、1×108
細胞、1×109
細胞或更多。
在一些具體實施例中,在以GITR促效抗體治×療之前、期間或之後,T細胞可與劑諸如促分裂原(例如PHA)或細胞激素(例如IL-2)接觸以非特異性擴張T細胞群。
在一些具體實施例中,T細胞可與除了GITR促效抗體之外另一促效劑,例如OX40促效抗體接觸。
本發明不由本文所述之特定具體實施例限制範圍。確實,除所描述者以外,從上述描述及伴隨之圖
式,發明之各種修飾對於發明所屬技術領域中具有通常知識者而言將為顯而易見。此修飾意於落入隨附之申請專利範圍之範疇中。
本文引用之所有參考文獻(例如刊物或專利案或專利申請案)其整體以引用方式併入本文且為了所有目的,就相同程度,如同特定及個別指出的各個別文獻(例如刊物或專利案或專利申請案)為了所有目的其整體以引用方式併入本文。其他具體實施例落於下述申請專利範圍中。
<110> 美商艾吉納斯公司(Agenus Inc.) 紀念斯隆凱特琳癌症中心(Memorial Sloan-Kettering Cancer Center) 盧德威格癌症研究協會(Ludwig Institute for Cancer Research Ltd.)
<120> 抗糖皮質素誘導性TNFR家族相關性受體(GITR)抗體類及使用彼等之方法
<140> TW 109136463
<141> 2015-05-28
<150> US 62/004,071
<151> 2014-05-28
<150> US 62/161,250
<151> 2015-05-13
<160> 1118
<170> PatentIn版本3.5
<210> 1
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> HCDR1資料庫一致
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 可為天冬胺酸、麩胺酸、甘胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> 可為丙胺酸、纈胺酸、白胺酸、異白胺酸、脯胺酸、苯丙胺酸、甲硫胺酸、或酪胺酸
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> 可為酪胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、苯丙胺酸、或組胺酸
<400> 1
<210> 2
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2資料庫一致
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 可為纈胺酸、丙胺酸、白胺酸、異白胺酸、脯胺酸、苯丙胺酸、甲硫胺酸、或蘇胺酸
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> 可為精胺酸、離胺酸、組胺酸、麩醯胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (4)..(4)
<223> 可為蘇胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、半胱胺酸、色胺酸、酪胺酸、纈胺酸、異白胺酸或脯胺酸
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> 可為酪胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、苯丙胺酸、組胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> 可為天冬胺酸、麩胺酸、甘胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> 可為纈胺酸、丙胺酸、白胺酸、異白胺酸、脯胺酸、苯丙胺酸、甲硫胺酸、蘇胺酸
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> 可為蘇胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、半胱胺酸、色胺酸、酪胺酸、纈胺酸、異白胺酸、脯胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (12)..(12)
<223> 可為天冬醯胺,甘胺酸、麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、酪胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (16)..(16)
<223> 可為離胺酸、精胺酸、組胺酸、麩醯胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (17)..(17)
<223> 可為天冬胺酸、麩胺酸、甘胺酸或丙胺酸
<400> 2
<210> 3
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> HCDR3資料庫一致
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> 可為苯丙胺酸、丙胺酸、纈胺酸、白胺酸、異白胺酸、脯胺酸、甲硫胺酸、酪胺酸、色胺酸、組胺酸或絲胺酸
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> 可為丙胺酸或天冬胺酸
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> 可為酪胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、苯丙胺酸、組胺酸、或纈胺酸
<400> 3
<210> 4
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> LCDR1資料庫一致
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> 可為白胺酸、丙胺酸、纈胺酸、異白胺酸、脯胺酸、苯丙胺酸或甲硫胺酸
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> 可為白胺酸、丙胺酸、纈胺酸、異白胺酸、脯胺酸、苯丙胺酸、甲硫胺酸、或絲胺酸
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> 可為天冬醯胺,甘胺酸、麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、酪胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> 可為絲胺酸、甘胺酸、天冬醯胺,麩醯胺酸、蘇胺酸、半胱胺酸、色胺酸、酪胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> 可為甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、酪胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (11)..(11)
<223> 可為天冬醯胺,甘胺酸、麩醯胺酸、絲胺酸、蘇胺酸、
半胱胺酸、色胺酸、酪胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (12)..(12)
<223> 可為麩醯胺酸、甘胺酸、天冬醯胺,絲胺酸、蘇胺酸、
半胱胺酸、色胺酸、酪胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (14)..(14)
<223> 可為天冬醯胺,甘胺酸、麩醯胺酸、絲胺酸、蘇胺酸、
半胱胺酸、色胺酸、酪胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (17)..(17)
<223> 可為蘇胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、
半胱胺酸、色胺酸、酪胺酸、纈胺酸、異白胺酸或丙胺酸
<400> 4
<210> 5
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> LCDR2資料庫一致
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 可為色胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、酪胺酸、苯丙胺酸、組胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> 可為麩胺酸、天冬胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> 可為絲胺酸、甘胺酸、天冬醯胺,麩醯胺酸、蘇胺酸、
半胱胺酸、色胺酸、酪胺酸或丙胺酸
<400> 5
<210> 6
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> LCDR3資料庫一致
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> 可為天冬醯胺,甘胺酸、麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、或酪胺酸
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> 可為天冬胺酸、麩胺酸、或酪胺酸
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> 可為絲胺酸、甘胺酸、天冬醯胺,麩醯胺酸、蘇胺酸、半胱胺酸、色胺酸、酪胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> 可為酪胺酸、甘胺酸、天冬醯胺,麩醯胺酸、絲胺酸、蘇胺酸、半胱胺酸、色胺酸、苯丙胺酸、組胺酸、白胺酸、或丙胺酸
<400> 6
<210> 7
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> HCDR1資料庫一致
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 可為天冬胺酸、麩胺酸、或甘胺酸
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> 可為丙胺酸或纈胺酸
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> 可為酪胺酸或組胺酸
<400> 7
<210> 8
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2資料庫一致
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 可為纈胺酸或白胺酸
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> 可為精胺酸、離胺酸、或麩醯胺酸
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> 可為酪胺酸或苯丙胺酸
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> 可為天冬胺酸、麩胺酸、或甘胺酸
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> 可為纈胺酸或白胺酸
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> 可為蘇胺酸或絲胺酸
<220>
<221> MISC_FEATURE
<222> (16)..(16)
<223> 可為離胺酸、精胺酸、或麩醯胺酸
<220>
<221> MISC_FEATURE
<222> (17)..(17)
<223> 可為天冬胺酸、麩胺酸、或甘胺酸
<400> 8
<210> 9
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> HCDR3資料庫一致
<400> 9
<210> 10
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> LCDR1資料庫一致
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> 可為甘胺酸或絲胺酸
<220>
<221> MISC_FEATURE
<222> (17)..(17)
<223> 可為蘇胺酸或絲胺酸
<400> 10
<210> 11
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> LCDR2資料庫一致
<400> 11
<210> 12
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> LCDR3資料庫一致
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> 可為天冬胺酸或麩胺酸
<220>
<221> MISC_FEATURE
<222> (6)..(6)
<223> 可為酪胺酸、苯丙胺酸或絲胺酸
<400> 12
<210> 13
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> HCDR1
<400> 13
<210> 14
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 14
<210> 15
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> HCDR3
<400> 15
<210> 16
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> LCDR1
<400> 16
<210> 17
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> LCDR2
<400> 17
<210> 18
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> LCDR3
<400> 18
<210> 19
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR1
<400> 19
<210> 20
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR1
<400> 20
<210> 21
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR1
<400> 21
<210> 22
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR1
<400> 22
<210> 23
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR1
<400> 23
<210> 24
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 24
<210> 25
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 25
<210> 26
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 26
<210> 27
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 27
<210> 28
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 28
<210> 29
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 29
<210> 30
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 30
<210> 31
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 31
<210> 32
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 32
<210> 33
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR2
<400> 33
<210> 34
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR3
<400> 34
<210> 35
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之HCDR1
<400> 35
<210> 36
<211> 6
<212> PRT
<213> 人工序列
<220>
<223> 6xHis標籤
<400> 36
<210> 37
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> hum231-32-15VH
<400> 37
<210> 38
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> ML38之設計
<220>
<221> MISC_FEATURE
<222> (1)..(1)
<223> 可為Ala或Thr
<220>
<221> MISC_FEATURE
<222> (2)..(2)
<223> 可為Gly或Ala
<220>
<221> MISC_FEATURE
<222> (3)..(3)
<223> 可為Asp、Glu或Gly
<220>
<221> MISC_FEATURE
<222> (5)..(5)
<223> 可為Ala或Val
<220>
<221> MISC_FEATURE
<222> (7)..(7)
<223> 可為Tyr或His
<220>
<221> MISC_FEATURE
<222> (8)..(8)
<223> 可為Leu或Met
<220>
<221> MISC_FEATURE
<222> (9)..(9)
<223> 可為Ile或Met
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> 可為Val或Leu
<220>
<221> MISC_FEATURE
<222> (12)..(12)
<223> 可為Arg、Lys或Gln
<220>
<221> MISC_FEATURE
<222> (14)..(14)
<223> 可為Tyr或Phe
<220>
<221> MISC_FEATURE
<222> (17)..(17)
<223> 可為Asp、Glu或Gly
<220>
<221> MISC_FEATURE
<222> (18)..(18)
<223> 可為Val或Leu
<220>
<221> MISC_FEATURE
<222> (19)..(19)
<223> 可為Thr或Ser
<220>
<221> MISC_FEATURE
<222> (25)..(25)
<223> 可為Lys、Arg或Gln
<220>
<221> MISC_FEATURE
<222> (26)..(26)
<223> 可為Asp、Glu或Gly
<220>
<221> MISC_FEATURE
<222> (27)..(27)
<223> 可為Ala或Val
<220>
<221> MISC_FEATURE
<222> (28)..(28)
<223> 可為Lys或Thr
<400> 38
<210> 39
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> D03
<400> 39
<210> 40
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> D05
<400> 40
<210> 41
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> D07
<400> 41
<210> 42
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> D08
<400> 42
<210> 43
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> D09
<400> 43
<210> 44
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> E01
<400> 44
<210> 45
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> F09
<400> 45
<210> 46
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> F10
<400> 46
<210> 47
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> G01
<400> 47
<210> 48
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> G05
<400> 48
<210> 49
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> B07
<400> 49
<210> 50
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> C03
<400> 50
<210> 51
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> F07
<400> 51
<210> 52
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> D11
<400> 52
<210> 53
<211> 28
<212> PRT
<213> 人工序列
<220>
<223> 變體F08
<400> 53
<210> 54
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> hum231-32-15VK
<400> 54
<210> 55
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> ML39之設計
<220>
<221> MISC_FEATURE
<222> (10)..(10)
<223> Gly或Ser
<220>
<221> MISC_FEATURE
<222> (17)..(17)
<223> Thr或Ser
<220>
<221> MISC_FEATURE
<222> (19)..(19)
<223> Gln或His
<220>
<221> MISC_FEATURE
<222> (21)..(21)
<223> Leu或Met
<220>
<221> MISC_FEATURE
<222> (29)..(29)
<223> Ser或Thr
<220>
<221> MISC_FEATURE
<222> (31)..(31)
<223> Leu或Val
<220>
<221> MISC_FEATURE
<222> (33)..(33)
<223> His或Tyr
<220>
<221> MISC_FEATURE
<222> (36)..(36)
<223> Asp或Glu
<220>
<221> MISC_FEATURE
<222> (39)..(39)
<223> Tyr、Phe或Ser
<400> 55
<210> 56
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> D03
<400> 56
<210> 57
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> D05
<400> 57
<210> 58
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> D07
<400> 58
<210> 59
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> D08
<400> 59
<210> 60
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> D09
<400> 60
<210> 61
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> E01
<400> 61
<210> 62
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> F09
<400> 62
<210> 63
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> F10
<400> 63
<210> 64
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> G05
<400> 64
<210> 65
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> n/a
<400> 65
<210> 66
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> G09
<400> 66
<210> 67
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> C11
<400> 67
<210> 68
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> F02
<400> 68
<210> 69
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> F03
<400> 69
<210> 70
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> D07
<400> 70
<210> 71
<211> 42
<212> PRT
<213> 人工序列
<220>
<223> 變體F05
<400> 71
<210> 72
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> 表位
<400> 72
<210> 73
<400> 73
000
<210> 74
<400> 74
000
<210> 75
<400> 75
000
<210> 76
<400> 76
000
<210> 77
<400> 77
000
<210> 78
<400> 78
000
<210> 79
<400> 79
000
<210> 80
<400> 80
000
<210> 81
<400> 81
000
<210> 82
<400> 82
000
<210> 83
<400> 83
000
<210> 84
<400> 84
000
<210> 85
<400> 85
000
<210> 86
<400> 86
000
<210> 87
<400> 87
000
<210> 88
<400> 88
000
<210> 89
<400> 89
000
<210> 90
<400> 90
000
<210> 91
<400> 91
000
<210> 92
<400> 92
000
<210> 93
<400> 93
000
<210> 94
<400> 94
000
<210> 95
<400> 95
000
<210> 96
<400> 96
000
<210> 97
<400> 97
000
<210> 98
<400> 98
000
<210> 99
<400> 99
000
<210> 100
<400> 100
000
<210> 101
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR1
<400> 101
<210> 102
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR1
<400> 102
<210> 103
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR1
<400> 103
<210> 104
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR1
<400> 104
<210> 105
<211> 7
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR2
<400> 105
<210> 106
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR3
<400> 106
<210> 107
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR3
<400> 107
<210> 108
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR3
<400> 108
<210> 109
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> 來自GL變體之LCDR3
<400> 109
<210> 110
<400> 110
000
<210> 111
<400> 111
000
<210> 112
<400> 112
000
<210> 113
<400> 113
000
<210> 114
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 114
<210> 115
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 115
<210> 116
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> HCDR1
<400> 116
<210> 117
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> HCDR1
<400> 117
<210> 118
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> HCDR1
<400> 118
<210> 119
<211> 5
<212> PRT
<213> 人工序列
<220>
<223> HCDR1
<400> 119
<210> 120
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 120
<210> 121
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 121
<210> 122
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 122
<210> 123
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 123
<210> 124
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 124
<210> 125
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 125
<210> 126
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 126
<210> 127
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 127
<210> 128
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 128
<210> 129
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 129
<210> 130
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 130
<210> 131
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 131
<210> 132
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 132
<210> 133
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 133
<210> 134
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 134
<210> 135
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 135
<210> 136
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 136
<210> 137
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 137
<210> 138
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 138
<210> 139
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 139
<210> 140
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 140
<210> 141
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 141
<210> 142
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 142
<210> 143
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 143
<210> 144
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 144
<210> 145
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 145
<210> 146
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 146
<210> 147
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 147
<210> 148
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 148
<210> 149
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 149
<210> 150
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 150
<210> 151
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 151
<210> 152
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 152
<210> 153
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 153
<210> 154
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 154
<210> 155
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 155
<210> 156
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 156
<210> 157
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 157
<210> 158
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 158
<210> 159
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 159
<210> 160
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 160
<210> 161
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 161
<210> 162
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 162
<210> 163
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 163
<210> 164
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 164
<210> 165
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 165
<210> 166
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 166
<210> 167
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 167
<210> 168
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 168
<210> 169
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 169
<210> 170
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 170
<210> 171
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 171
<210> 172
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 172
<210> 173
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 173
<210> 174
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 174
<210> 175
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 175
<210> 176
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 176
<210> 177
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 177
<210> 178
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 178
<210> 179
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 179
<210> 180
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 180
<210> 181
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 181
<210> 182
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 182
<210> 183
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 183
<210> 184
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 184
<210> 185
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 185
<210> 186
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 186
<210> 187
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 187
<210> 188
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 188
<210> 189
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> HCDR3
<400> 189
<210> 190
<400> 190
000
<210> 191
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> LCDR3
<400> 191
<210> 192
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> LCDR3
<400> 192
<210> 193
<211> 9
<212> PRT
<213> 人工序列
<220>
<223> LCDR3
<400> 193
<210> 194
<211> 17
<212> PRT
<213> 人工序列
<220>
<223> HCDR2
<400> 194
<210> 195
<400> 195
000
<210> 196
<400> 196
000
<210> 197
<400> 197
000
<210> 198
<400> 198
000
<210> 199
<400> 199
000
<210> 200
<400> 200
000
<210> 201
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 小鼠VH
<400> 201
<210> 202
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 小鼠VL
<400> 202
<220>
<221> MISC_FEATURE
<222> (31)..(31)
<223> 可為天冬胺酸、麩胺酸、或甘胺酸
<220>
<221> MISC_FEATURE
<222> (33)..(33)
<223> 可為丙胺酸或纈胺酸
<220>
<221> MISC_FEATURE
<210> 203
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 擬人化VH一致序列
<222> (35)..(35)
<223> 可為酪胺酸或組胺酸
<220>
<221> MISC_FEATURE
<222> (50)..(50)
<223> 可為纈胺酸或白胺酸
<220>
<221> MISC_FEATURE
<222> (52)..(52)
<223> 可為精胺酸、離胺酸、或麩醯胺酸
<220>
<221> MISC_FEATURE
<222> (54)..(54)
<223> 可為酪胺酸或苯丙胺酸
<220>
<221> misc_feature
<222> (57)..(57)
<223> 可為天冬胺酸、麩胺酸、或甘胺酸
<220>
<221> MISC_FEATURE
<222> (58)..(58)
<223> 可為纈胺酸或白胺酸
<220>
<221> MISC_FEATURE
<222> (59)..(59)
<223> 可為蘇胺酸或絲胺酸
<220>
<221> MISC_FEATURE
<222> (65)..(65)
<223> 可為離胺酸、精胺酸或麩醯胺酸
<220>
<221> MISC_FEATURE
<222> (66)..(66)
<223> 可為天冬胺酸、麩胺酸、或甘胺酸
<400> 203
<210> 204
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 擬人化VK A1一致seq
<220>
<221> MISC_FEATURE
<222> (29)..(29)
<223> 可為白胺酸或纈胺酸
<220>
<221> MISC_FEATURE
<222> (30)..(30)
<223> 可為白胺酸、異白胺酸、絲胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (31)..(31)
<223> 可為天冬醯胺、麩醯胺酸、絲胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (32)..(32)
<223> 可為絲胺酸、蘇胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (34)..(34)
<223> 可為天冬醯胺或麩醯胺酸
<220>
<221> MISC_FEATURE
<222> (37)..(37)
<223> 可為天冬醯胺或麩醯胺酸
<220>
<221> MISC_FEATURE
<222> (40)..(40)
<223> 可為蘇胺酸、絲胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (56)..(56)
<223> 可為色胺酸、酪胺酸、苯丙胺酸、甘胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (61)..(61)
<223> 可為麩胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (62)..(62)
<223> 可為絲胺酸、蘇胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (96)..(96)
<223> 可為天冬醯胺或麩醯胺酸
<220>
<221> MISC_FEATURE
<222> (99)..(99)
<223> 可為絲胺酸、蘇胺酸、或丙胺酸
<220>
<221> MISC_FEATURE
<222> (100)..(100)
<223> 可為酪胺酸、苯丙胺酸、白胺酸、或丙胺酸
<400> 204
<210> 205
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 擬人化VK A2一致seq
<220>
<221> MISC_FEATURE
<222> (33)..(33)
<223> 可為甘胺酸或絲胺酸
<220>
<221> MISC_FEATURE
<222> (40)..(40)
<223> 可為蘇胺酸或絲胺酸
<220>
<221> MISC_FEATURE
<222> (97)..(97)
<223> 可為天冬胺酸或麩胺酸
<220>
<221> MISC_FEATURE
<222> (100)..(100)
<223> 可為酪胺酸、苯丙胺酸、或絲胺酸
<400> 205
<210> 206
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 擬人化版本VH
<400> 206
<210> 207
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 擬人化版本VK A1
<400> 207
<210> 208
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 擬人化版本VK A2
<400> 208
<210> 209
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 擬人化版本VH A
<400> 209
<210> 210
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 擬人化版本VK A1
<400> 210
<210> 211
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 擬人化版本VK A2
<400> 211
<210> 212
<400> 212
000
<210> 213
<400> 213
000
<210> 214
<400> 214
000
<210> 215
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 來自種系變體之VH區
<400> 215
<210> 216
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 來自種系變體之VH區
<400> 216
<210> 217
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體2
<400> 217
<210> 218
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體3
<400> 218
<210> 219
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體4
<400> 219
<210> 220
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體5
<400> 220
<210> 221
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體6
<400> 221
<210> 222
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體7
<400> 222
<210> 223
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體8
<400> 223
<210> 224
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體9
<400> 224
<210> 225
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體10
<400> 225
<210> 226
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體11
<400> 226
<210> 227
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體12
<400> 227
<210> 228
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體13
<400> 228
<210> 229
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體14
<400> 229
<210> 230
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體15
<400> 230
<210> 231
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體16
<400> 231
<210> 232
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體17
<400> 232
<210> 233
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體18
<400> 233
<210> 234
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體19
<400> 234
<210> 235
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 235
<210> 236
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體20
<400> 236
<210> 237
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體21
<400> 237
<210> 238
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體22
<400> 238
<210> 239
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體23
<400> 239
<210> 240
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體24
<400> 240
<210> 241
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體25
<400> 241
<210> 242
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體26
<400> 242
<210> 243
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體27
<400> 243
<210> 244
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體28
<400> 244
<210> 245
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體29
<400> 245
<210> 246
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體30
<400> 246
<210> 247
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體31
<400> 247
<210> 248
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體32
<400> 248
<210> 249
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體33
<400> 249
<210> 250
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體34
<400> 250
<210> 251
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體35
<400> 251
<210> 252
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體36
<400> 252
<210> 253
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體37
<400> 253
<210> 254
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體38
<400> 254
<210> 255
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體39
<400> 255
<210> 256
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體40
<400> 256
<210> 257
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 257
<210> 258
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體41
<400> 258
<210> 259
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體42
<400> 259
<210> 260
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 260
<210> 261
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體43
<400> 261
<210> 262
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體44
<400> 262
<210> 263
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體45
<400> 263
<210> 264
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體46
<400> 264
<210> 265
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體47
<400> 265
<210> 266
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 266
<210> 267
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體48
<400> 267
<210> 268
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體49
<400> 268
<210> 269
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 269
<210> 270
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體50
<400> 270
<210> 271
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體51
<400> 271
<210> 272
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體52
<400> 272
<210> 273
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體53
<400> 273
<210> 274
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 274
<210> 275
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 275
<210> 276
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體54
<400> 276
<210> 277
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體55
<400> 277
<210> 278
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 278
<210> 279
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 279
<210> 280
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體56
<400> 280
<210> 281
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體57
<400> 281
<210> 282
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 282
<210> 283
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體58
<400> 283
<210> 284
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體59
<400> 284
<210> 285
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體60
<400> 285
<210> 286
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 286
<210> 287
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體61
<400> 287
<210> 288
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體62
<400> 288
<210> 289
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 289
<210> 290
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體63
<400> 290
<210> 291
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體64
<400> 291
<210> 292
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 292
<210> 293
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 293
<210> 294
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 294
<210> 295
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 295
<210> 296
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體66
<400> 296
<210> 297
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體67
<400> 297
<210> 298
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體68
<400> 298
<210> 299
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體69
<400> 299
<210> 300
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 300
<210> 301
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體70
<400> 301
<210> 302
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 302
<210> 303
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 303
<210> 304
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體71
<400> 304
<210> 305
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 抗體72
<400> 305
<210> 306
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體73
<400> 306
<210> 307
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 307
<210> 308
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體74
<400> 308
<210> 309
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 309
<210> 310
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 310
<210> 311
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 311
<210> 312
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 312
<210> 313
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體75
<400> 313
<210> 314
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體76
<400> 314
<210> 315
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體77
<400> 315
<210> 316
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體78
<400> 316
<210> 317
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 317
<210> 318
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 318
<210> 319
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體79
<400> 319
<210> 320
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體80
<400> 320
<210> 321
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 321
<210> 322
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體81
<400> 322
<210> 323
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體82
<400> 323
<210> 324
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> 抗體83
<400> 324
<210> 325
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體84
<400> 325
<210> 326
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 326
<210> 327
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體85
<400> 327
<210> 328
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體86
<400> 328
<210> 329
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 329
<210> 330
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 330
<210> 331
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 331
<210> 332
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 332
<210> 333
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體87
<400> 333
<210> 334
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 334
<210> 335
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 335
<210> 336
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體88
<400> 336
<210> 337
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 337
<210> 338
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體89
<400> 338
<210> 339
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體90
<400> 339
<210> 340
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體91
<400> 340
<210> 341
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 341
<210> 342
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體92
<400> 342
<210> 343
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體93
<400> 343
<210> 344
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 344
<210> 345
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> pab1979,VH;pab1980,VH;pab1981,VH
<400> 345
<210> 346
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 346
<210> 347
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 347
<210> 348
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 348
<210> 349
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 349
<210> 350
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體94
<400> 350
<210> 351
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 351
<210> 352
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 352
<210> 353
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 353
<210> 354
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體95
<400> 354
<210> 355
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體96
<400> 355
<210> 356
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體97
<400> 356
<210> 357
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 357
<210> 358
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體98
<400> 358
<210> 359
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體99
<400> 359
<210> 360
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體100
<400> 360
<210> 361
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 361
<210> 362
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體101
<400> 362
<210> 363
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體102
<400> 363
<210> 364
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體103
<400> 364
<210> 365
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體104
<400> 365
<210> 366
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體105
<400> 366
<210> 367
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體106
<400> 367
<210> 368
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH抗體107
<400> 368
<210> 369
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 369
<210> 370
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 370
<210> 371
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 371
<210> 372
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 372
<210> 373
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 373
<210> 374
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 374
<210> 375
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 375
<210> 376
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 376
<210> 377
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 377
<210> 378
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 378
<210> 379
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 379
<210> 380
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 380
<210> 381
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 381
<210> 382
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 382
<210> 383
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 383
<210> 384
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 384
<210> 385
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 385
<210> 386
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 386
<210> 387
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 387
<210> 388
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 388
<210> 389
<211> 118
<212> PRT
<213> 人工序列
<220>
<223> VH
<400> 389
<210> 390
<400> 390
000
<210> 391
<400> 391
000
<210> 392
<400> 392
000
<210> 393
<400> 393
000
<210> 394
<400> 394
000
<210> 395
<400> 395
000
<210> 396
<400> 396
000
<210> 397
<400> 397
000
<210> 398
<400> 398
000
<210> 399
<400> 399
000
<210> 400
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體1
<400> 400
<210> 401
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體2
<400> 401
<210> 402
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體3
<400> 402
<210> 403
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體4
<400> 403
<210> 404
<211> 112
<212> PRT
<213> 人工序列
<220>
<223> VL抗體5
<400> 404
<210> 405
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體6
<400> 405
<210> 406
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體7
<400> 406
<210> 407
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 抗體8
<400> 407
<210> 408
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體9
<400> 408
<210> 409
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體10
<400> 409
<210> 410
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體11
<400> 410
<210> 411
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體12
<400> 411
<210> 412
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 412
<210> 413
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體13
<400> 413
<210> 414
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體14
<400> 414
<210> 415
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體15
<400> 415
<210> 416
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體16
<400> 416
<210> 417
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 417
<210> 418
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體17
<400> 418
<210> 419
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體18
<400> 419
<210> 420
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體19
<400> 420
<210> 421
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體20
<400> 421
<210> 422
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 422
<210> 423
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體21
<400> 423
<210> 424
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體22
<400> 424
<210> 425
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體23
<400> 425
<210> 426
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體24
<400> 426
<210> 427
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體25
<400> 427
<210> 428
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體26
<400> 428
<210> 429
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體27
<400> 429
<210> 430
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體28
<400> 430
<210> 431
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體29
<400> 431
<210> 432
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體30
<400> 432
<210> 433
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體31
<400> 433
<210> 434
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體32
<400> 434
<210> 435
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體33
<400> 435
<210> 436
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體34
<400> 436
<210> 437
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體35
<400> 437
<210> 438
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體36
<400> 438
<210> 439
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體37
<400> 439
<210> 440
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體38
<400> 440
<210> 441
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體39
<400> 441
<210> 442
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體40
<400> 442
<210> 443
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體41
<400> 443
<210> 444
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體42
<400> 444
<210> 445
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體43
<400> 445
<210> 446
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體44
<400> 446
<210> 447
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體45
<400> 447
<210> 448
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體46
<400> 448
<210> 449
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 449
<210> 450
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體47
<400> 450
<210> 451
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體48
<400> 451
<210> 452
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體49
<400> 452
<210> 453
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 合成的胜肽
<400> 453
<210> 454
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體50
<400> 454
<210> 455
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體51
<400> 455
<210> 456
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體52
<400> 456
<210> 457
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體53
<400> 457
<210> 458
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體54
<400> 458
<210> 459
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體55
<400> 459
<210> 460
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體56
<400> 460
<210> 461
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體57
<400> 461
<210> 462
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體58
<400> 462
<210> 463
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體59
<400> 463
<210> 464
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體60
<400> 464
<210> 465
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 465
<210> 466
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 466
<210> 467
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體61
<400> 467
<210> 468
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體62
<400> 468
<210> 469
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體63
<400> 469
<210> 470
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體64
<400> 470
<210> 471
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體65
<400> 471
<210> 472
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 抗體66
<400> 472
<210> 473
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體67
<400> 473
<210> 474
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體68
<400> 474
<210> 475
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體69
<400> 475
<210> 476
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體70
<400> 476
<210> 477
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體71
<400> 477
<210> 478
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 478
<210> 479
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 479
<210> 480
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 480
<210> 481
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體72
<400> 481
<210> 482
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體73
<400> 482
<210> 483
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體74
<400> 483
<210> 484
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體75
<400> 484
<210> 485
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體76
<400> 485
<210> 486
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體77
<400> 486
<210> 487
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 487
<210> 488
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體78
<400> 488
<210> 489
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體79
<400> 489
<210> 490
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體80
<400> 490
<210> 491
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體81
<400> 491
<210> 492
<400> 492
000
<210> 493
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體83
<400> 493
<210> 494
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體84
<400> 494
<210> 495
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體85
<400> 495
<210> 496
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體86
<400> 496
<210> 497
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體87
<400> 497
<210> 498
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體88
<400> 498
<210> 499
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體89
<400> 499
<210> 500
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體90
<400> 500
<210> 501
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體91
<400> 501
<210> 502
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體92
<400> 502
<210> 503
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體93
<400> 503
<210> 504
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體94
<400> 504
<210> 505
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體95
<400> 505
<210> 506
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體96
<400> 506
<210> 507
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體97
<400> 507
<210> 508
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體98
<400> 508
<210> 509
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體99
<400> 509
<210> 510
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體100
<400> 510
<210> 511
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 抗體101
<400> 511
<210> 512
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體102
<400> 512
<210> 513
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體103
<400> 513
<210> 514
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL
<400> 514
<210> 515
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體104
<400> 515
<210> 516
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體105
<400> 516
<210> 517
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> 抗體106
<400> 517
<210> 518
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> VL抗體107
<400> 518
<210> 519
<211> 113
<212> PRT
<213> 人工序列
<220>
<223> pab1973,VL
<400> 519
<210> 520
<400> 520
000
<210> 521
<400> 521
000
<210> 522
<400> 522
000
<210> 523
<400> 523
000
<210> 524
<400> 524
000
<210> 525
<400> 525
000
<210> 526
<400> 526
000
<210> 527
<400> 527
000
<210> 528
<400> 528
000
<210> 529
<400> 529
000
<210> 530
<400> 530
000
<210> 531
<400> 531
000
<210> 532
<400> 532
000
<210> 533
<400> 533
000
<210> 534
<400> 534
000
<210> 535
<400> 535
000
<210> 536
<400> 536
000
<210> 537
<400> 537
000
<210> 538
<400> 538
000
<210> 539
<400> 539
000
<210> 540
<400> 540
000
<210> 541
<400> 541
000
<210> 542
<400> 542
000
<210> 543
<400> 543
000
<210> 544
<400> 544
000
<210> 545
<400> 545
000
<210> 546
<400> 546
000
<210> 547
<400> 547
000
<210> 548
<400> 548
000
<210> 549
<400> 549
000
<210> 550
<400> 550
000
<210> 551
<400> 551
000
<210> 552
<400> 552
000
<210> 553
<211> 448
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<220>
<221> MISC_FEATURE
<222> (215)..(215)
<223> 可為離胺酸或精胺酸
<220>
<221> MISC_FEATURE
<222> (357)..(357)
<223> 可為天冬胺酸或麩胺酸
<220>
<221> MISC_FEATURE
<222> (359)..(359)
<223> 可為白胺酸或甲硫胺酸
<220>
<221> MISC_FEATURE
<222> (432)..(432)
<223> 可為甘胺酸或丙胺酸
<400> 553
<210> 554
<211> 445
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<400> 554
<210> 555
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化輕鏈
<220>
<221> MISC_FEATURE
<222> (159)..(159)
<223> 可為纈胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (197)..(197)
<223> 可為白胺酸或纈胺酸
<400> 555
<210> 556
<211> 220
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<222> (1)..(220)
<223> 全長擬人化輕鏈
<220>
<221> MISC_FEATURE
<222> (159)..(159)
<223> 可為纈胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (197)..(197)
<223> 可為白胺酸或纈胺酸
<400> 556
<210> 557
<211> 330
<212> PRT
<213> 人工序列
<220>
<223> 人類IgG1恆定區一致序列
<220>
<221> MISC_FEATURE
<222> (97)..(97)
<223> 可為離胺酸或精胺酸
<220>
<221> MISC_FEATURE
<222> (239)..(239)
<223> 可為天冬胺酸或麩胺酸
<220>
<221> MISC_FEATURE
<222> (241)..(241)
<223> 可為白胺酸或甲硫胺酸
<220>
<221> MISC_FEATURE
<222> (314)..(314)
<223> 可為甘胺酸或丙胺酸
<400> 557
<210> 558
<211> 330
<212> PRT
<213> 人工序列
<220>
<223> 人類IgG1 G1m3異型
<400> 558
<210> 559
<211> 330
<212> PRT
<213> 人工序列
<220>
<223> 人類IgG1 G1m17,1異型
<400> 559
<210> 560
<211> 330
<212> PRT
<213> 人工序列
<220>
<223> 人類IgG1,G1m17,1,2異型
<400> 560
<210> 561
<211> 327
<212> PRT
<213> 人工序列
<220>
<223> 人類IgG4 wt恆定區
<400> 561
<210> 562
<211> 327
<212> PRT
<213> 人工序列
<220>
<223> IgG4恆定區S228P修飾
<400> 562
<210> 563
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區一致序列
<220>
<221> MISC_FEATURE
<222> (45)..(45)
<223> 可為V或A
<220>
<221> MISC_FEATURE
<222> (83)..(83)
<223> 可為L或V
<400> 563
<210> 564
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區IGKC*06 Km1異型
<400> 564
<210> 565
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區IGKC*04 Km1,2異型
<400> 565
<210> 566
<211> 106
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區IGKC*01 Km3異型
<400> 566
<210> 567
<211> 448
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<400> 567
<210> 568
<211> 448
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<400> 568
<210> 569
<211> 448
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<400> 569
<210> 570
<211> 445
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<400> 570
<210> 571
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化輕鏈
<400> 571
<210> 572
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化輕鏈
<400> 572
<210> 573
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化輕鏈
<400> 573
<210> 574
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化輕鏈
<400> 574
<210> 575
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化輕鏈
<400> 575
<210> 576
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化輕鏈
<400> 576
<210> 577
<211> 463
<212> PRT
<213> 人工序列
<220>
<223> 合成的胜肽
<400> 577
<210> 578
<211> 240
<212> PRT
<213> 人工序列
<220>
<223> 合成的胜肽
<400> 578
<210> 579
<211> 448
<212> PRT
<213> 人工序列
<220>
<223> 全長重鏈
<400> 579
<210> 580
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 全長輕鏈
<400> 580
<210> 581
<211> 444
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<400> 581
<210> 582
<211> 444
<212> PRT
<213> 人工序列
<220>
<223> 全長擬人化重鏈
<400> 582
<210> 583
<211> 326
<212> PRT
<213> 人工序列
<220>
<223> 人類IgG2恆定區
<400> 583
<210> 584
<211> 326
<212> PRT
<213> 人工序列
<220>
<223> IgG2恆定區C127S修飾
<400> 584
<210> 585
<211> 449
<212> PRT
<213> 人工序列
<220>
<223> m6C8全長重鏈
<400> 585
<210> 586
<211> 214
<212> PRT
<213> 人工序列
<220>
<223> m6C8全長輕鏈
<400> 586
<210> 587
<211> 220
<212> PRT
<213> 人工序列
<220>
<223> 含有T至S突變之全長擬人化輕鏈
<400> 587
<210> 588
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區
<220>
<221> MISC_FEATURE
<222> (1)..(107)
<223> 一致序列
<220>
<221> MISC_FEATURE
<222> (46)..(46)
<223> 可為纈胺酸或丙胺酸
<220>
<221> MISC_FEATURE
<222> (84)..(84)
<223> 可為纈胺酸或白胺酸
<400> 588
<210> 589
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區IGKC*06 Km1異型
<400> 589
<210> 590
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區IGKC*04 Km1,2異型
<400> 590
<210> 591
<211> 107
<212> PRT
<213> 人工序列
<220>
<223> 卡帕(Kappa)輕鏈恆定區IGKC*01 Km3異型
<400> 591
<210> 592
<400> 592
000
<210> 593
<400> 593
000
<210> 594
<400> 594
000
<210> 595
<400> 595
000
<210> 596
<400> 596
000
<210> 597
<400> 597
000
<210> 598
<400> 598
000
<210> 599
<400> 599
000
<210> 600
<400> 600
000
<210> 601
<211> 98
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGHV1-2*02(DP75)
<400> 601
<210> 602
<211> 98
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGHGV1-3*01
<400> 602
<210> 603
<211> 98
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGHV1-46*01
<400> 603
<210> 604
<211> 98
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGHV1-18*01
<400> 604
<210> 605
<211> 98
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGHV1-69*01
<400> 605
<210> 606
<211> 98
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGHV7-4-1*02
<400> 606
<210> 607
<211> 100
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGKV4-1*01
<400> 607
<210> 608
<211> 95
<212> PRT
<213> 人工序列
<220>
<223> 種系序列:IGKV3-7*02
<400> 608
<210> 609
<400> 609
000
<210> 610
<211> 22
<212> PRT
<213> 人工序列
<220>
<223> VL FR1
<400> 610
<210> 611
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> VL FR1
<400> 611
<210> 612
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> VL FR1
<400> 612
<210> 613
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> VL FR1
<400> 613
<210> 614
<400> 614
000
<210> 615
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> VL FR1
<400> 615
<210> 616
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> VL FR1
<400> 616
<210> 617
<211> 23
<212> PRT
<213> 人工序列
<220>
<223> VL FR2
<400> 617
<210> 618
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> VL FR2
<400> 618
<210> 619
<211> 4
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 619
<210> 620
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR1
<400> 620
<210> 621
<400> 621
000
<210> 622
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> VL FR2
<400> 622
<210> 623
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> VL FR2
<400> 623
<210> 624
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> VL FR2
<400> 624
<210> 625
<211> 15
<212> PRT
<213> 人工序列
<220>
<223> VL FR2
<400> 625
<210> 626
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 626
<210> 627
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 627
<210> 628
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 628
<210> 629
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 629
<210> 630
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 630
<210> 631
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 631
<210> 632
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 632
<210> 633
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 633
<210> 634
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 634
<210> 635
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 635
<210> 636
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 636
<210> 637
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 637
<210> 638
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 638
<210> 639
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 639
<210> 640
<400> 640
000
<210> 641
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> VL FR4
<400> 641
<210> 642
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VL FR3
<400> 642
<210> 643
<211> 10
<212> PRT
<213> 人工序列
<220>
<223> VL FR4
<400> 643
<210> 644
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 644
<210> 645
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 645
<210> 646
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 646
<210> 647
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 647
<210> 648
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 648
<210> 649
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 649
<210> 650
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 650
<210> 651
<211> 30
<212> PRT
<213> 人工序列
<220>
<223> VH FR1
<400> 651
<210> 652
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> VH FR2
<400> 652
<210> 653
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> VH FR2
<400> 653
<210> 654
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> VH FR2
<400> 654
<210> 655
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> VH FR2
<400> 655
<210> 656
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> VH FR2
<400> 656
<210> 657
<211> 14
<212> PRT
<213> 人工序列
<220>
<223> VH FR2
<400> 657
<210> 658
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VH FR3
<400> 658
<210> 659
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VH FR3
<400> 659
<210> 660
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VH FR3
<400> 660
<210> 661
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VH FR3
<400> 661
<210> 662
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VH FR3
<400> 662
<210> 663
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VH FR3
<400> 663
<210> 664
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> VH FR4
<400> 664
<210> 665
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> VH FR4
<400> 665
<210> 666
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> VH FR4
<400> 666
<210> 667
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> VH FR4
<400> 667
<210> 668
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> VH FR4
<400> 668
<210> 669
<211> 11
<212> PRT
<213> 人工序列
<220>
<223> VH FR4
<400> 669
<210> 670
<211> 32
<212> PRT
<213> 人工序列
<220>
<223> VH FR3
<400> 670
<210> 671
<400> 671
000
<210> 672
<400> 672
000
<210> 673
<400> 673
000
<210> 674
<400> 674
000
<210> 675
<400> 675
000
<210> 676
<400> 676
000
<210> 677
<400> 677
000
<210> 678
<400> 678
000
<210> 679
<400> 679
000
<210> 680
<400> 680
000
<210> 681
<400> 681
000
<210> 682
<400> 682
000
<210> 683
<400> 683
000
<210> 684
<400> 684
000
<210> 685
<400> 685
000
<210> 686
<400> 686
000
<210> 687
<400> 687
000
<210> 688
<400> 688
000
<210> 689
<400> 689
000
<210> 690
<400> 690
000
<210> 691
<400> 691
000
<210> 692
<400> 692
000
<210> 693
<400> 693
000
<210> 694
<400> 694
000
<210> 695
<400> 695
000
<210> 696
<400> 696
000
<210> 697
<400> 697
000
<210> 698
<211> 234
<212> PRT
<213> 人工序列
<220>
<223> V1M馬來猴GITR不成熟蛋白質
<400> 698
<210> 699
<211> 234
<212> PRT
<213> 人工序列
<220>
<223> V1M/Q62P/S63G馬來猴GITR不成熟蛋白質
<400> 699
<210> 700
<211> 216
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<222> (1)..(216)
<223> 人類GITR成熟蛋白質
<400> 700
<210> 701
<211> 241
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<222> (1)..(241)
<223> 人類GITR(異型體1)
<400> 701
<210> 702
<211> 255
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<222> (1)..(255)
<223> 人類GITR(異型體2)
<400> 702
<210> 703
<211> 234
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<222> (1)..(234)
<223> 人類GITR(異型體3)
<400> 703
<210> 704
<211> 234
<212> PRT
<213> 人工序列
<220>
<223> 馬來猴GITR不成熟蛋白質
<400> 704
<210> 705
<211> 23
<212> DNA
<213> 人工序列
<220>
<223> 引子892-Je
<400> 705
<210> 706
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引子327-Je
<400> 706
<210> 707
<211> 25
<212> DNA
<213> 人工序列
<220>
<223> 引子89-AL
<400> 707
<210> 708
<211> 41
<212> DNA
<213> 人工序列
<220>
<223> 引子1192-Je
<400> 708
<210> 709
<211> 35
<212> DNA
<213> 人工序列
<220>
<223> 引子1193-Je
<400> 709
<210> 710
<211> 29
<212> DNA
<213> 人工序列
<220>
<223> 引子1060-Je
<400> 710
<210> 711
<211> 28
<212> DNA
<213> 人工序列
<220>
<223> 引子1065-Je
<400> 711
<210> 712
<211> 21
<212> DNA
<213> 人工序列
<220>
<223> 引子1152-Je
<400> 712
<210> 713
<211> 18
<212> DNA
<213> 人工序列
<220>
<223> 引子1204-Je
<400> 713
<210> 714
<211> 19
<212> DNA
<213> 人工序列
<220>
<223> 引子1155-Je
<400> 714
<210> 715
<211> 198
<212> PRT
<213> 人工序列
<220>
<223> 合成的胜肽
<400> 715
<210> 716
<211> 199
<212> PRT
<213> 智人
<220>
<221> MISC_FEATURE
<222> (1)..(199)
<223> 人類GITRL蛋白質序列
<400> 716
<210> 717
<400> 717
000
<210> 718
<400> 718
000
<210> 719
<400> 719
000
<210> 720
<400> 720
000
<210> 721
<400> 721
000
<210> 722
<400> 722
000
<210> 723
<400> 723
000
<210> 724
<400> 724
000
<210> 725
<400> 725
000
<210> 726
<400> 726
000
<210> 727
<400> 727
000
<210> 728
<400> 728
000
<210> 729
<400> 729
000
<210> 730
<400> 730
000
<210> 731
<400> 731
000
<210> 732
<400> 732
000
<210> 733
<400> 733
000
<210> 734
<400> 734
000
<210> 735
<400> 735
000
<210> 736
<400> 736
000
<210> 737
<400> 737
000
<210> 738
<400> 738
000
<210> 739
<400> 739
000
<210> 740
<400> 740
000
<210> 741
<400> 741
000
<210> 742
<400> 742
000
<210> 743
<400> 743
000
<210> 744
<400> 744
000
<210> 745
<400> 745
000
<210> 746
<400> 746
000
<210> 747
<400> 747
000
<210> 748
<400> 748
000
<210> 749
<400> 749
000
<210> 750
<400> 750
000
<210> 751
<400> 751
000
<210> 752
<400> 752
000
<210> 753
<400> 753
000
<210> 754
<400> 754
000
<210> 755
<400> 755
000
<210> 756
<400> 756
000
<210> 757
<400> 757
000
<210> 758
<400> 758
000
<210> 759
<400> 759
000
<210> 760
<400> 760
000
<210> 761
<400> 761
000
<210> 762
<400> 762
000
<210> 763
<400> 763
000
<210> 764
<400> 764
000
<210> 765
<400> 765
000
<210> 766
<400> 766
000
<210> 767
<400> 767
000
<210> 768
<400> 768
000
<210> 769
<400> 769
000
<210> 770
<400> 770
000
<210> 771
<400> 771
000
<210> 772
<400> 772
000
<210> 773
<400> 773
000
<210> 774
<400> 774
000
<210> 775
<400> 775
000
<210> 776
<400> 776
000
<210> 777
<400> 777
000
<210> 778
<400> 778
000
<210> 779
<400> 779
000
<210> 780
<400> 780
000
<210> 781
<400> 781
000
<210> 782
<400> 782
000
<210> 783
<400> 783
000
<210> 784
<400> 784
000
<210> 785
<400> 785
000
<210> 786
<400> 786
000
<210> 787
<400> 787
000
<210> 788
<400> 788
000
<210> 789
<400> 789
000
<210> 790
<400> 790
000
<210> 791
<400> 791
000
<210> 792
<400> 792
000
<210> 793
<400> 793
000
<210> 794
<400> 794
000
<210> 795
<400> 795
000
<210> 796
<400> 796
000
<210> 797
<400> 797
000
<210> 798
<400> 798
000
<210> 799
<400> 799
000
<210> 800
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 800
<210> 801
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 801
<210> 802
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 802
<210> 803
<211> 412
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 803
<210> 804
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 804
<210> 805
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 805
<210> 806
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 806
<210> 807
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 807
<210> 808
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 808
<210> 809
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 809
<210> 810
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 810
<210> 811
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 811
<210> 812
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 812
<210> 813
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 813
<210> 814
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 814
<210> 815
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 815
<210> 816
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 816
<210> 817
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 817
<210> 818
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 818
<210> 819
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 819
<210> 820
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 820
<210> 821
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 821
<210> 822
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 822
<210> 823
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 823
<210> 824
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 824
<210> 825
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 825
<210> 826
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 826
<210> 827
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 827
<210> 828
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 828
<210> 829
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 829
<210> 830
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 830
<210> 831
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 831
<210> 832
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 832
<210> 833
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 833
<210> 834
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 834
<210> 835
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 835
<210> 836
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 836
<210> 837
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 837
<210> 838
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 838
<210> 839
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 839
<210> 840
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 840
<210> 841
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 841
<210> 842
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 842
<210> 843
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 843
<210> 844
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 844
<210> 845
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 845
<210> 846
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 846
<210> 847
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 847
<210> 848
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 848
<210> 849
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 849
<210> 850
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 850
<210> 851
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 851
<210> 852
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 852
<210> 853
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 853
<210> 854
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 854
<210> 855
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 855
<210> 856
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 856
<210> 857
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 857
<210> 858
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 858
<210> 859
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 859
<210> 860
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 860
<210> 861
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 861
<210> 862
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 862
<210> 863
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 863
<210> 864
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 864
<210> 865
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 865
<210> 866
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 866
<210> 867
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 867
<210> 868
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 868
<210> 869
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 869
<210> 870
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 870
<210> 871
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 871
<210> 872
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 872
<210> 873
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 873
<210> 874
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 874
<210> 875
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 875
<210> 876
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 876
<210> 877
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 877
<210> 878
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 878
<210> 879
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 879
<210> 880
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 880
<210> 881
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 881
<210> 882
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 882
<210> 883
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 883
<210> 884
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 884
<210> 885
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 885
<210> 886
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 886
<210> 887
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 887
<210> 888
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 888
<210> 889
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 889
<210> 890
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 890
<210> 891
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 891
<210> 892
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 892
<210> 893
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 893
<210> 894
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 894
<210> 895
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 895
<210> 896
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 896
<210> 897
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 897
<210> 898
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 898
<210> 899
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 899
<210> 900
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 900
<210> 901
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 901
<210> 902
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 902
<210> 903
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 903
<210> 904
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 904
<210> 905
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 905
<210> 906
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 906
<210> 907
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 907
<210> 908
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 908
<210> 909
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 909
<210> 910
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 910
<210> 911
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 911
<210> 912
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 912
<210> 913
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 913
<210> 914
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 914
<210> 915
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 915
<210> 916
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 916
<210> 917
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 917
<210> 918
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 918
<210> 919
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 919
<210> 920
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 920
<210> 921
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 921
<210> 922
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 922
<210> 923
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 923
<210> 924
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 924
<210> 925
<211> 411
<712> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 925
<210> 926
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 926
<210> 927
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 927
<210> 928
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 928
<210> 929
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 929
<210> 930
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 930
<210> 931
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 931
<210> 932
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 932
<210> 933
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 933
<210> 934
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 934
<210> 935
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 935
<210> 936
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 936
<210> 937
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 937
<210> 938
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 938
<210> 939
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 939
<210> 940
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 940
<210> 941
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 941
<210> 942
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 942
<210> 943
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 943
<210> 944
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 944
<210> 945
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 945
<210> 946
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 946
<210> 947
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 947
<210> 948
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 948
<210> 949
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 949
<210> 950
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 950
<210> 951
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 951
<210> 952
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 952
<210> 953
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 953
<210> 954
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 954
<210> 955
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 955
<210> 956
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 956
<210> 957
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 957
<210> 958
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 958
<210> 959
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 959
<210> 960
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 960
<210> 961
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 961
<210> 962
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 962
<210> 963
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 963
<210> 964
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 964
<210> 965
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 965
<210> 966
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 966
<210> 967
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 967
<210> 968
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 968
<210> 969
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 969
<210> 970
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 970
<210> 971
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 971
<210> 972
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 972
<210> 973
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 973
<210> 974
<211> 411
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VH區
<400> 974
<210> 975
<400> 975
000
<210> 976
<400> 976
000
<210> 977
<400> 977
000
<210> 978
<400> 978
000
<210> 979
<400> 979
000
<210> 980
<400> 980
000
<210> 981
<400> 981
000
<210> 982
<400> 982
000
<210> 983
<400> 983
000
<210> 984
<400> 984
000
<210> 985
<400> 985
000
<210> 986
<400> 986
000
<210> 987
<400> 987
000
<210> 988
<400> 988
000
<210> 989
<400> 989
000
<210> 990
<400> 990
000
<210> 991
<400> 991
000
<210> 992
<400> 992
000
<210> 993
<400> 993
000
<210> 994
<400> 994
000
<210> 995
<400> 995
000
<210> 996
<400> 996
000
<210> 997
<400> 997
000
<210> 998
<400> 998
000
<210> 999
<400> 999
000
<210> 1000
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1000
<210> 1001
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1001
<210> 1002
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1002
<210> 1003
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1003
<210> 1004
<211> 396
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1004
<210> 1005
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1005
<210> 1006
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1006
<210> 1007
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1007
<210> 1008
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1008
<210> 1009
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1009
<210> 1010
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1010
<210> 1011
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1011
<210> 1012
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1012
<210> 1013
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1013
<210> 1014
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1014
<210> 1015
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1015
<210> 1016
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1016
<210> 1017
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1017
<210> 1018
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1018
<210> 1019
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1019
<210> 1020
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1020
<210> 1021
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1021
<210> 1022
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1022
<210> 1023
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1023
<210> 1024
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1024
<210> 1025
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1025
<210> 1026
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1026
<210> 1027
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1027
<210> 1028
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1028
<210> 1029
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1029
<210> 1030
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1030
<210> 1031
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1031
<210> 1032
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1032
<210> 1033
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1033
<210> 1034
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1034
<210> 1035
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1035
<210> 1036
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1036
<210> 1037
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1037
<210> 1038
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1038
<210> 1039
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1039
<210> 1040
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1040
<210> 1041
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1041
<210> 1042
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1042
<210> 1043
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1043
<210> 1044
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1044
<210> 1045
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1045
<210> 1046
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1046
<210> 1047
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1047
<210> 1048
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1048
<210> 1049
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1049
<210> 1050
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1050
<210> 1051
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1051
<210> 1052
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1052
<210> 1053
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1053
<210> 1054
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1054
<210> 1055
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1055
<210> 1056
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1056
<210> 1057
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1057
<210> 1058
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1058
<210> 1059
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1059
<210> 1060
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1060
<210> 1061
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1061
<210> 1062
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1062
<210> 1063
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1063
<210> 1064
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1064
<210> 1065
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1065
<210> 1066
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1066
<210> 1067
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1067
<210> 1068
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1068
<210> 1069
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1069
<210> 1070
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1070
<210> 1071
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1071
<210> 1072
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1072
<210> 1073
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1073
<210> 1074
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1074
<210> 1075
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1075
<210> 1076
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1076
<210> 1077
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1077
<210> 1078
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1078
<210> 1079
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1079
<210> 1080
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1080
<210> 1081
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1081
<210> 1082
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1082
<210> 1083
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1083
<210> 1084
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1084
<210> 1085
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1085
<210> 1086
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1086
<210> 1087
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1087
<210> 1088
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1088
<210> 1089
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1089
<210> 1090
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1090
<210> 1091
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1091
<210> 1092
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1092
<210> 1093
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1093
<210> 1094
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1094
<210> 1095
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1095
<210> 1096
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1096
<210> 1097
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1097
<210> 1098
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1098
<210> 1099
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1099
<210> 1100
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1100
<210> 1101
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1101
<210> 1102
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1102
<210> 1103
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1103
<210> 1104
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1104
<210> 1105
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1105
<210> 1106
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1106
<210> 1107
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1107
<210> 1108
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1108
<210> 1109
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1109
<210> 1110
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1110
<210> 1111
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1111
<210> 1112
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1112
<210> 1113
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1113
<210> 1114
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1114
<210> 1115
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1115
<210> 1116
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1116
<210> 1117
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1117
<210> 1118
<211> 399
<212> DNA
<213> 人工序列
<220>
<223> 來自種系變體之額外VK區
<400> 1118
Claims (18)
- 一種經單離之抗體,其特異性結合人類糖皮質素誘導性TNFR相關性蛋白質(GITR),該抗體包括:(a)重鏈可變區(VH)互補性決定區(CDR)1,其包括X1 YX2 MX3 (SEQ ID NO:7)之胺基酸序列,其中X1 為D、E或G;X2 為A或V;且X3 為Y或H;(b)VH CDR2,其包括X1 IX2 TX3 SGX4 X5 X6 YNQKFX7 X8 (SEQ ID NO:8)之胺基酸序列,其中X1 為V或L;X2 為R、K或Q;X3 為Y或F;X4 為D、E或G;X5 為V或L;X6 為T或S;X7 為K、R或Q;且X8 為D、E或G;(c)VH CDR3,其包括SEQ ID NO:9之胺基酸序列;(d)輕鏈可變區(VL)CDR1,其包括KSSQSLLNSX1 NQ KNYLX2 (SEQ ID NO:10)之胺基酸序列,其中X1 為G或S;且X2 為T或S;(e)VL CDR2,其包括SEQ ID NO:11之胺基酸序列;及(f)VL CDR3,其包括QNX1 YSX2 PYT(SEQ ID NO:12)之胺基酸序列,其中X1 為D或E;且X2 為Y、F或S,其中該VH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及VL CDR3分別不包括SEQ ID NO:13、14、15、16、17及18之胺基酸序列。
- 如請求項1之抗體,其中:(a)該VH CDR1包括選自下列所組成群組之胺基酸序列:SEQ ID NO:13、19至23、35及116至119;(b)該VH CDR2包括選自下列所組成群組之胺基酸序列:SEQ ID NO:14、24至33、114、115、120至188及194;(c)該VH CDR3包括選自下列所組成群組之胺基酸序列:SEQ ID NO:15及34;(d)該VL CDR1包括選自下列所組成群組之胺基酸序列:SEQ ID NO:16及101至104;(e)該VL CDR2包括選自下列所組成群組之胺基酸序列:SEQ ID NO:17及105;及/或(f)該VL CDR3包括選自下列所組成群組之胺基酸序列:SEQ ID NO:18、106至109、192及193。
- 一種經單離之抗體,其特異性結合人類 GITR,該抗體包括:(a)VH CDR1、VH CDR2及VH CDR3,彼等分別包括表2所列之抗體的VH CDR1、VH CDR2及VH CDR3之胺基酸序列;及(b)VL CDR1、VL CDR2及VL CDR3,彼等分別包括表1所列之抗體的VL CDR1、VL CDR2及VL CDR3之胺基酸序列,其中該VH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及VL CDR3各別源自相同抗體且分別不包括SEQ ID NO:13、14、15、16、17及18之胺基酸序列。
- 如前述請求項中任一項之抗體,其中該抗體呈促效性。
- 如前述請求項中任一項之抗體,其中該抗體包括:(a)VH,該VH具有人類衍生之框架區;(b)VH框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中該胺基酸序列選自下列所組成群組:IGHV1-2*02(SEQ ID NO:601)、IGHV1-3*01(SEQ ID NO:602)、IGHV1-46*01(SEQ ID NO:603)、IGHV1-18*01(SEQ ID NO:604)、IGHV1-69*01(SEQ ID NO:605)及IGHV7-4-1*02(SEQ ID NO:606);(c)VH框架區,其為衍生自胺基酸序列SEQ ID NO:601且其中胺基酸序列SEQ ID NO:601中至少一胺基酸在 對應非人類重鏈可變框架區之類似位置經胺基酸取代,任意地其中該胺基酸取代為在選自下列所組成群組之依據Kabat編號的胺基酸位置:24、48、67、71、73及94;(d)VL,該VL具有人類衍生之框架區;(e)VL框架區,其為或衍生自由人類基因編碼之胺基酸序列,其中該胺基酸序列選自下列所組成群組:IGKV4-1*01(SEQ ID NO:607)及IGKV3-7*02(SEQ ID NO:608);及/或(f)VL框架區,其為衍生自選自下列所組成群組之胺基酸序列:IGKV4-1*01(SEQ ID NO:607)及IGKV3-7*02(SEQ ID NO:608)且胺基酸序列SEQ ID NO:607或SEQ ID NO:608中至少一胺基酸在對應非人類輕鏈可變框架區之類似位置經胺基酸取代,任意地其中該胺基酸取代在依據Kabat編號的胺基酸位置87。
- 如前述請求項中任一項之抗體,其進一步包括重鏈及/或輕鏈恆定區,其中:(a)該重鏈恆定區為人類IgG1 、IgG2 、IgG3 、IgG4 、IgA1 或IgA2 恆定區,任意地其中(i)該IgG1 恆定區為非岩藻糖基化;(ii)該IgG1 恆定區之胺基酸序列包括N297A或N297Q突變;(iii)該IgG4 恆定區之胺基酸序列包括S228P突變;或(iv)該IgG2 恆定區之胺基酸序列包括C127S突 變;及/或(b)該輕鏈恆定區為人類κ輕鏈恆定區或人類λ輕鏈恆定區,任意地其中該重鏈恆定區包括選自下列所組成群組之胺基酸序列:SEQ ID NO:557至562、583及584,及/或該輕鏈恆定區包括選自下列所組成群組之胺基酸序列:SEQ ID NO:563至566及588至591。
- 如前述請求項中任一項之抗體,其中該抗體包括:(a)重鏈,該重鏈包括選自下列所組成群組之胺基酸序列:SEQ ID NO:553、554、568至570、581及582;及/或(b)輕鏈,該輕鏈包括選自下列所組成群組之胺基酸序列:SEQ ID NO:555、556及571至575。
- 一種經單離之抗體,其特異性結合人類GITR,該抗體包括:(a)VH,該VH包括選自下列所組成群組之胺基酸序列:SEQ ID NO:201、203及215至389;及/或(b)VL,該VL包括選自下列所組成群組之胺基酸序列:SEQ ID NO:202、204、205、207及400至519,其中該VH和VL分別不包括SEQ ID NO:206及208之胺基酸序列。
- 如請求項8之抗體,該抗體包括:(a)VH和VL,該VH和VL分別包括圖23、圖24A、圖 24B或圖24C之表所示的抗體之VH胺基酸序列和VL胺基酸序列;及/或(b)VH和VL,該VH和VL分別包括表17所示的抗體之VH胺基酸序列和VL胺基酸序列。
- 如請求項8或9之抗體,該抗體包括:(a)重鏈,該重鏈包括選自下列所組成群組之胺基酸序列:SEQ ID NO:553、554、568至570、581及582;(b)輕鏈,該輕鏈包括選自下列所組成群組之胺基酸序列:SEQ ID NO:555、556及571至575;及/或(c)重鏈和輕鏈,該重鏈和輕鏈分別包括SEQ ID NO:553和556、554和556、581和556、582和556、553和555、或554和555之胺基酸序列。
- 一種經單離之抗體,其特異性結合人類GITR,其中:(a)該抗體同如前述請求項中任一項之抗體結合人類GITR的相同表位;(b)該抗體與如前述請求項中任一項之抗體競爭結合人類GITR的程度同如前述請求項中任一項之抗體自體競爭結合人類GITR;或(c)該抗體與如前述請求項中任一項之抗體競爭結合人類GITR,其中該競爭呈現為降低該第一抗體結合人類GITR達超過80%。
- 一種經單離之抗體,其特異性結合人類GITR,其中:(a)該人類GITR包括SEQ ID NO:701之殘基26至241,其中相對於該抗體與該人類GITR之間的結合,該抗體與變體GITR之間的結合為實質上經弱化,且其中除了選自下列所組成群組之胺基酸取代:D60A及G63A以外,該變體GITR包括SEQ ID NO:701之殘基26至241;(b)該人類GITR包括SEQ ID NO:701之殘基26至241,且其中該抗體結合包括SEQ ID NO:701之殘基60至63的表位;(c)該人類GITR包括SEQ ID NO:701之殘基26至241,且其中該抗體結合包括SEQ ID NO:701之殘基60至63的至少一者之該人類GITR的表位;(d)該抗體特異性結合下述各者:i)人類GITR,其中該人類GITR包括SEQ ID NO:701之殘基26至241以及ii)馬來猴(cynomolgus)GITR之變體,該變體包括SEQ ID NO:699之殘基26至234,其中該抗體未特異性結合包括SEQ ID NO:704之殘基26至234之馬來猴GITR;或(e)該抗體特異性結合人類GITR,其中相較於結合人類GITR,該抗體呈現與人類GITR相同但存在D60A或G63A胺基酸取代之蛋白質降低之結合或不結合,其中該抗體之VH CDR1、VH CDR2、VH CDR3、VL CDR1、VL CDR2及VL CDR3分別不包括SEQ ID NO:13、14、15、16、17及18之胺基酸序列。
- 一種經單離之核酸分子,其編碼如前述請求項中任一項之抗體的VH或重鏈及/或如前述請求項中 任一項之抗體的VL或輕鏈。
- 一種經單離之載體,其包括如請求項13之核酸分子。
- 一種宿主細胞,其包括:(a)如請求項13之核酸分子;(b)如請求項14之載體;(c)第一核酸分子和第二核酸分子,該第一核酸分子編碼如請求項1至12中任一項之抗體的VH或重鏈且該第二核酸分子編碼如請求項1至12中任一項之抗體的VL或輕鏈;或(d)第一載體和第二載體,該第一載體包括編碼如請求項1至12中任一項之抗體的VH或重鏈之核酸分子且該第二載體包括編碼如請求項1至12中任一項之抗體的VL或輕鏈之核酸分子。
- 一種生產結合人類GITR的抗體的方法,其包括培養如請求項15之宿主細胞,使得表現該核酸分子且生產該抗體。
- 一種醫藥組成物,其包括如請求項1至12中任一項之抗體及醫藥上可接受之載劑或賦形劑。
- 如請求項1至12中任一項之抗體或如請求項17之醫藥組成物,其係用於:(a)調節個體的免疫反應,任意地增強或誘導該免疫反應;(b)治療病毒感染;或(c)治療癌症,任意地其中該癌症為子宮內膜癌、胃癌、胃癌症、食道癌、胃與食道的交界處癌、頭及頸鱗狀細胞癌、黑色素瘤、非小細胞肺癌或腎細胞癌,任意地進一步包括對該個體投予另一治療劑,任意地其中(i)該另一治療劑為吲哚胺-2,3-二氧酶(IDO)之抑制劑,任意地其中該抑制劑選自下列所組成群組:依帕卡朵絲坦(epacadostat)、F001287、印朵目德(indoximod)及NLG919;或(ii)該另一治療劑為查核點靶向劑,任意地其中(1)該查核點靶向劑選自下列所組成群組:PD-1之拮抗劑、PD-L1之拮抗劑、PD-L2之拮抗劑、CTLA-4之拮抗劑、TIM-3之拮抗劑、LAG-3之拮抗劑及OX40之促效劑;或(2)該查核點靶向劑選自下列所組成群組:拮抗劑抗PD-1抗體、拮抗劑抗PD-L1抗體、拮抗劑抗PD-L2抗體、拮抗劑抗CTLA-4抗體、拮抗劑抗TIM-3抗體、拮抗劑抗LAG-3抗體及促效劑抗OX40抗體。
Applications Claiming Priority (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201462004071P | 2014-05-28 | 2014-05-28 | |
| US62/004,071 | 2014-05-28 | ||
| US201562161250P | 2015-05-13 | 2015-05-13 | |
| US62/161,250 | 2015-05-13 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| TW202132337A true TW202132337A (zh) | 2021-09-01 |
Family
ID=53433276
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW104117180A TWI709573B (zh) | 2014-05-28 | 2015-05-28 | 抗糖皮質素誘導性tnfr家族相關性受體(gitr)抗體類及使用彼等之方法 |
| TW109136463A TW202132337A (zh) | 2014-05-28 | 2015-05-28 | 抗糖皮質素誘導性tnfr家族相關性受體(gitr)抗體類及使用彼等之方法 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW104117180A TWI709573B (zh) | 2014-05-28 | 2015-05-28 | 抗糖皮質素誘導性tnfr家族相關性受體(gitr)抗體類及使用彼等之方法 |
Country Status (26)
| Country | Link |
|---|---|
| US (9) | US10155818B2 (zh) |
| EP (2) | EP3148579B1 (zh) |
| JP (3) | JP6847666B2 (zh) |
| KR (2) | KR102433464B1 (zh) |
| CN (2) | CN115925946A (zh) |
| AU (3) | AU2015266958A1 (zh) |
| CA (1) | CA2949998A1 (zh) |
| CY (1) | CY1124787T1 (zh) |
| DK (1) | DK3148579T3 (zh) |
| EA (1) | EA201692458A1 (zh) |
| ES (1) | ES2860751T3 (zh) |
| HR (1) | HRP20210364T1 (zh) |
| HU (1) | HUE053857T2 (zh) |
| IL (3) | IL293212B2 (zh) |
| LT (1) | LT3148579T (zh) |
| MA (2) | MA40041B1 (zh) |
| MX (2) | MX2016015614A (zh) |
| NZ (1) | NZ726513A (zh) |
| PH (1) | PH12016502345A1 (zh) |
| PL (1) | PL3148579T3 (zh) |
| PT (1) | PT3148579T (zh) |
| RS (1) | RS61678B1 (zh) |
| SG (2) | SG10201912986PA (zh) |
| SI (1) | SI3148579T1 (zh) |
| TW (2) | TWI709573B (zh) |
| WO (1) | WO2015184099A1 (zh) |
Families Citing this family (137)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| RU2636503C2 (ru) | 2011-09-08 | 2017-11-23 | Иеда Рисеч Энд Девелопмент Ко. Лтд. | Т-клетки центральной памяти против третьей стороны, способы их получения и их применение в трансплантации и лечении заболеваний |
| KR101566538B1 (ko) | 2012-06-08 | 2015-11-05 | 국립암센터 | 신규한 Th17 세포 전환용 에피토프 및 이의 용도 |
| WO2015184099A1 (en) | 2014-05-28 | 2015-12-03 | 4-Antibody Ag | Anti-gitr antibodies and methods of use thereof |
| KR101923326B1 (ko) | 2014-06-06 | 2018-11-29 | 브리스톨-마이어스 스큅 컴퍼니 | 글루코코르티코이드-유도 종양 괴사 인자 수용체 (gitr)에 대한 항체 및 그의 용도 |
| CN107205970A (zh) | 2014-11-05 | 2017-09-26 | 弗莱塞斯生物科学公司 | 免疫调节剂 |
| UY36390A (es) * | 2014-11-05 | 2016-06-01 | Flexus Biosciences Inc | Compuestos moduladores de la enzima indolamina 2,3-dioxigenasa (ido), sus métodos de síntesis y composiciones farmacéuticas que los contienen |
| SI3218005T1 (sl) | 2014-11-12 | 2023-06-30 | Seagen Inc. | Z glikanom delujoče spojine, in postopki uporabe |
| PT3283107T (pt) | 2015-04-17 | 2020-08-31 | Bristol Myers Squibb Co | Composições compreendendo uma combinação de ipilimumab e nivolumab |
| EP3297672B1 (en) | 2015-05-21 | 2021-09-01 | Harpoon Therapeutics, Inc. | Trispecific binding proteins and methods of use |
| WO2016196792A1 (en) | 2015-06-03 | 2016-12-08 | Bristol-Myers Squibb Company | Anti-gitr antibodies for cancer diagnostics |
| AU2016291825B2 (en) * | 2015-07-16 | 2022-08-11 | Yeda Research And Development Co. Ltd. | Genetically modified anti-third party central memory T cells and use of same in immunotherapy |
| WO2017015623A2 (en) | 2015-07-23 | 2017-01-26 | Inhibrx Lp | Multivalent and multispecific gitr-binding fusion proteins |
| EP3365371A1 (en) * | 2015-10-22 | 2018-08-29 | Ablynx NV | Gitr agonists |
| US11028181B2 (en) | 2015-11-12 | 2021-06-08 | Seagen Inc. | Glycan-interacting compounds and methods of use |
| SG11201803817PA (en) | 2015-11-19 | 2018-06-28 | Bristol Myers Squibb Co | Antibodies against glucocorticoid-induced tumor necrosis factor receptor (gitr) and uses thereof |
| AU2016364889B2 (en) * | 2015-12-02 | 2024-01-04 | Agenus Inc. | Antibodies and methods of use thereof |
| MA43387A (fr) * | 2015-12-02 | 2018-10-10 | Agenus Inc | Anticorps anti-gitr et leurs méthodes d'utilisation |
| WO2017096276A1 (en) * | 2015-12-02 | 2017-06-08 | Agenus Inc. | Anti-gitr antibodies and methods of use thereof |
| WO2017156058A1 (en) | 2016-03-08 | 2017-09-14 | Janssen Biotech, Inc. | Gitr antibodies, methods, and uses |
| TW202408578A (zh) | 2016-05-13 | 2024-03-01 | 美商再生元醫藥公司 | 藉由投予pd-1抑制劑治療皮膚癌之方法 |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| US20190175731A1 (en) | 2016-05-20 | 2019-06-13 | Biohaven Pharmaceutical Holding Company Ltd. | Use of glutamate modulating agents with immunotherapies to treat cancer |
| US11090344B2 (en) | 2016-05-27 | 2021-08-17 | Dnatrix, Inc. | Adenovirus and immunomodulator combination therapy |
| EP3464360A1 (en) | 2016-05-27 | 2019-04-10 | Agenus Inc. | Anti-tim-3 antibodies and methods of use thereof |
| WO2017211321A1 (zh) * | 2016-06-08 | 2017-12-14 | 上海交通大学医学院 | 增强激动型抗体活性的抗体重链恒定区序列 |
| BR112018075434A2 (pt) | 2016-06-10 | 2019-03-19 | Regeneron Pharmaceuticals, Inc. | anticorpo isolado ou fragmento de ligação de antígeno do mesmo, composição farmacêutica, e, métodos para tratar câncer e para modular resposta imune antitumor. |
| CN116903741A (zh) | 2016-06-20 | 2023-10-20 | 科马布有限公司 | 特异性结合于pd-l1的抗体或其抗原结合片段及其用途 |
| EP3478721A1 (en) | 2016-07-01 | 2019-05-08 | Five Prime Therapeutics, Inc. | Combined anti tumor therapy with a gitr agonist and cpg |
| SG11201900026TA (en) | 2016-07-14 | 2019-01-30 | Bristol Myers Squibb Co | Antibodies against tim3 and uses thereof |
| AU2017300647A1 (en) * | 2016-07-20 | 2019-02-07 | Igm Biosciences, Inc. | Multimeric GITR binding molecules and uses thereof |
| JP7082967B2 (ja) | 2016-07-22 | 2022-06-09 | デイナ ファーバー キャンサー インスティチュート,インコーポレイテッド | グルココルチコイド誘導性腫瘍壊死因子受容体(gitr)抗体及びその使用方法 |
| CA3041340A1 (en) | 2016-11-09 | 2018-05-17 | Agenus Inc. | Anti-ox40 antibodies, anti-gitr antibodies, and methods of use thereof |
| EP3541847A4 (en) | 2016-11-17 | 2020-07-08 | Seattle Genetics, Inc. | COMPOUNDS INTERACTING WITH GLYCANE AND METHODS OF USE |
| US20200247902A1 (en) * | 2016-11-17 | 2020-08-06 | Seattle Genetics, Inc. | Compositions and methods for treating cancer |
| JOP20190100A1 (ar) * | 2016-11-19 | 2019-05-01 | Potenza Therapeutics Inc | بروتينات ربط مولد ضد مضاد لـ gitr وطرق استخدامها |
| US11555178B2 (en) | 2017-01-18 | 2023-01-17 | Yeda Research And Development Co. Ltd. | Genetically modified veto cells and use of same in immunotherapy |
| US10751368B2 (en) | 2017-01-18 | 2020-08-25 | Yeda Research And Development Co. Ltd. | Methods of transplantation and disease treatment |
| EP3574013A1 (en) * | 2017-01-27 | 2019-12-04 | Ultrahuman One Limited | Binding agents |
| SG11201907242TA (en) * | 2017-02-10 | 2019-09-27 | Eutilex Co Ltd | IFN-γ-INDUCIBLE REGULATORY T CELL CONVERTIBLE ANTI-CANCER (IRTCA) ANTIBODY AND USES THEREOF |
| MA47604A (fr) | 2017-02-21 | 2020-01-01 | Regeneron Pharma | Anticorps anti-pd-1 pour le traitement du cancer du poumon |
| BR112019018043A2 (pt) | 2017-03-03 | 2020-04-07 | Seattle Genetics Inc | método de tratamento de câncer, e, conjugado de anticorpo-fármaco |
| MA50056A (fr) | 2017-03-31 | 2020-02-05 | Bristol Myers Squibb Co | Procédés de traitement de tumeur |
| WO2018185618A1 (en) | 2017-04-03 | 2018-10-11 | Novartis Ag | Anti-cdh6 antibody drug conjugates and anti-gitr antibody combinations and methods of treatment |
| AR111651A1 (es) | 2017-04-28 | 2019-08-07 | Novartis Ag | Conjugados de anticuerpos que comprenden agonistas del receptor de tipo toll y terapias de combinación |
| BR112019023855B1 (pt) | 2017-05-12 | 2021-11-30 | Harpoon Therapeutics, Inc | Proteínas de ligação à mesotelina |
| WO2018213297A1 (en) | 2017-05-16 | 2018-11-22 | Bristol-Myers Squibb Company | Treatment of cancer with anti-gitr agonist antibodies |
| WO2018229715A1 (en) | 2017-06-16 | 2018-12-20 | Novartis Ag | Compositions comprising anti-cd32b antibodies and methods of use thereof |
| CN109136275B (zh) | 2017-06-19 | 2021-03-16 | 百奥赛图(北京)医药科技股份有限公司 | 人源化gitr基因改造动物模型的制备方法及应用 |
| KR20200019865A (ko) | 2017-06-22 | 2020-02-25 | 노파르티스 아게 | 암 치료에 사용하기 위한 il-1베타 결합 항체 |
| WO2018235056A1 (en) | 2017-06-22 | 2018-12-27 | Novartis Ag | IL-1BETA BINDING ANTIBODIES FOR USE IN THE TREATMENT OF CANCER |
| WO2018237173A1 (en) | 2017-06-22 | 2018-12-27 | Novartis Ag | ANTIBODY MOLECULES DIRECTED AGAINST CD73 AND CORRESPONDING USES |
| MX2019015885A (es) | 2017-06-22 | 2020-09-10 | Novartis Ag | Moleculas de anticuerpo que se unen a cd73 y usos de las mismas. |
| CN111050791A (zh) | 2017-06-27 | 2020-04-21 | 诺华股份有限公司 | 用于抗tim-3抗体的给药方案及其用途 |
| US20200131263A1 (en) * | 2017-06-30 | 2020-04-30 | Jiangsu Hengrui Medicine Co., Ltd. | Anti-gitr antibody, antigen-binding fragment thereof, and pharmaceutical use thereof |
| SG11201911936YA (en) * | 2017-06-30 | 2020-01-30 | Bristol Myers Squibb Co | Substituted quinolinycyclohexylpropanamide compounds and improved methods for their preparation |
| AU2018302283A1 (en) | 2017-07-20 | 2020-02-06 | Novartis Ag | Dosage regimens of anti-LAG-3 antibodies and uses thereof |
| CA3074111A1 (en) * | 2017-08-28 | 2019-03-07 | Angiex, Inc. | Anti-tm4sf1 antibodies and methods of using same |
| CN111465612B (zh) | 2017-10-13 | 2024-08-27 | 哈普恩治疗公司 | B细胞成熟抗原结合蛋白 |
| EP3694884A1 (en) | 2017-10-15 | 2020-08-19 | Bristol-Myers Squibb Company | Methods of treating tumor |
| US20210040205A1 (en) | 2017-10-25 | 2021-02-11 | Novartis Ag | Antibodies targeting cd32b and methods of use thereof |
| RU2020119578A (ru) | 2017-11-16 | 2021-12-17 | Новартис Аг | Комбинированные терапии |
| US12129297B2 (en) | 2018-01-12 | 2024-10-29 | Bristol-Myers Squibb Company | Antibodies against TIM3 and uses thereof |
| SG11202007055QA (en) * | 2018-03-08 | 2020-09-29 | Phanes Therapeutics Inc | Anti-claudin 18.2 antibodies and uses thereof |
| WO2019183040A1 (en) | 2018-03-21 | 2019-09-26 | Five Prime Therapeutics, Inc. | ANTIBODIES BINDING TO VISTA AT ACIDIC pH |
| AU2019236865A1 (en) | 2018-03-23 | 2020-10-01 | Bristol-Myers Squibb Company | Antibodies against MICA and/or MICB and uses thereof |
| KR20200136454A (ko) | 2018-03-27 | 2020-12-07 | 브리스톨-마이어스 스큅 컴퍼니 | 자외선 신호를 사용한 단백질 농도의 실시간 모니터링 |
| CN111971306A (zh) | 2018-03-30 | 2020-11-20 | 百时美施贵宝公司 | 治疗肿瘤的方法 |
| US20210147547A1 (en) | 2018-04-13 | 2021-05-20 | Novartis Ag | Dosage Regimens For Anti-Pd-L1 Antibodies And Uses Thereof |
| TW202015726A (zh) | 2018-05-30 | 2020-05-01 | 瑞士商諾華公司 | Entpd2抗體、組合療法、及使用該等抗體和組合療法之方法 |
| WO2019232244A2 (en) | 2018-05-31 | 2019-12-05 | Novartis Ag | Antibody molecules to cd73 and uses thereof |
| CA3103629A1 (en) | 2018-06-15 | 2019-12-19 | Flagship Pioneering Innovations V, Inc. | Increasing immune activity through modulation of postcellular signaling factors |
| CN113056483A (zh) | 2018-07-09 | 2021-06-29 | 戊瑞治疗有限公司 | 结合到ilt4的抗体 |
| AR116109A1 (es) | 2018-07-10 | 2021-03-31 | Novartis Ag | Derivados de 3-(5-amino-1-oxoisoindolin-2-il)piperidina-2,6-diona y usos de los mismos |
| BR112020026947B1 (pt) | 2018-07-10 | 2022-11-22 | Novartis Ag | Derivados de 3-(5-hidróxi-1-oxoisoindolin-2-il)piperidina-2,6-diona, e composição farmacêutica |
| AU2019301120A1 (en) | 2018-07-11 | 2021-02-25 | Bristol-Myers Squibb Company | Antibodies binding to VISTA at acidic pH |
| WO2020021465A1 (en) | 2018-07-25 | 2020-01-30 | Advanced Accelerator Applications (Italy) S.R.L. | Method of treatment of neuroendocrine tumors |
| US20210299176A1 (en) * | 2018-08-08 | 2021-09-30 | Cedars-Sinai Medical Center | Compositions and methods for treating cancer and autoimmune diseases |
| EP3856771A4 (en) | 2018-09-25 | 2022-06-29 | Harpoon Therapeutics, Inc. | Dll3 binding proteins and methods of use |
| EP3873532A1 (en) | 2018-10-31 | 2021-09-08 | Novartis AG | Dc-sign antibody drug conjugates |
| EP3897637A1 (en) | 2018-12-20 | 2021-10-27 | Novartis AG | Dosing regimen and pharmaceutical combination comprising 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives |
| AU2019409139A1 (en) | 2018-12-21 | 2021-06-03 | Novartis Ag | Use of IL-1β binding antibodies |
| EP3897613A1 (en) | 2018-12-21 | 2021-10-27 | Novartis AG | Use of il-1beta binding antibodies |
| WO2020128637A1 (en) | 2018-12-21 | 2020-06-25 | Novartis Ag | Use of il-1 binding antibodies in the treatment of a msi-h cancer |
| CA3119584A1 (en) | 2018-12-21 | 2020-06-25 | Novartis Ag | Use of il-1 beta antibodies in the treatment or prevention of myelodysplastic syndrome |
| US20220144798A1 (en) | 2019-02-15 | 2022-05-12 | Novartis Ag | Substituted 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| EP3924054A1 (en) | 2019-02-15 | 2021-12-22 | Novartis AG | 3-(1-oxo-5-(piperidin-4-yl)isoindolin-2-yl)piperidine-2,6-dione derivatives and uses thereof |
| US20220135619A1 (en) | 2019-02-24 | 2022-05-05 | Bristol-Myers Squibb Company | Methods of isolating a protein |
| RU2734432C1 (ru) * | 2019-04-23 | 2020-10-16 | Закрытое Акционерное Общество "Биокад" | Моноклональное антитело, которое специфически связывается с GITR |
| MA55805A (fr) | 2019-05-03 | 2022-03-09 | Flagship Pioneering Innovations V Inc | Métodes de modulation de l'activité immunitaire |
| CN114245869A (zh) | 2019-05-23 | 2022-03-25 | 百时美施贵宝公司 | 监测细胞培养基的方法 |
| EP3976832A1 (en) | 2019-05-30 | 2022-04-06 | Bristol-Myers Squibb Company | Methods of identifying a subject suitable for an immuno-oncology (i-o) therapy |
| US20220233691A1 (en) | 2019-05-30 | 2022-07-28 | Bristol-Myers Squibb Company | Cell localization signature and combination therapy |
| WO2020243563A1 (en) | 2019-05-30 | 2020-12-03 | Bristol-Myers Squibb Company | Multi-tumor gene signatures for suitability to immuno-oncology therapy |
| CA3150273A1 (en) * | 2019-08-08 | 2021-02-11 | Cedars-Sinai Medical Center | Method of generating activated t cells for cancer therapy |
| JP2022548881A (ja) | 2019-09-18 | 2022-11-22 | ノバルティス アーゲー | Entpd2抗体、組合せ療法並びに抗体及び組合せ療法を使用する方法 |
| MX2022003204A (es) | 2019-09-19 | 2022-04-18 | Bristol Myers Squibb Co | Anticuerpos de union al supresor de activacion de linfocitos t que contiene inmunoglobulina con dominio v (vista) a ph acido. |
| KR20220087498A (ko) | 2019-10-21 | 2022-06-24 | 노파르티스 아게 | Tim-3 억제제 및 그의 용도 |
| KR20220103947A (ko) | 2019-10-21 | 2022-07-25 | 노파르티스 아게 | 베네토클락스 및 tim-3 억제제를 사용한 조합 요법 |
| JP2023509359A (ja) | 2019-12-17 | 2023-03-08 | フラグシップ パイオニアリング イノベーションズ ブイ,インコーポレーテッド | 鉄依存性細胞分解の誘導物質との併用抗癌療法 |
| KR20220116257A (ko) | 2019-12-20 | 2022-08-22 | 노파르티스 아게 | 골수섬유증 및 골수이형성 증후군을 치료하기 위한, 데시타빈 또는 항 pd-1 항체 스파르탈리주맙을 포함하거나 또는 포함하지 않는, 항 tim-3 항체 mbg453 및 항 tgf-베타 항체 nis793의 조합물 |
| WO2021144657A1 (en) | 2020-01-17 | 2021-07-22 | Novartis Ag | Combination comprising a tim-3 inhibitor and a hypomethylating agent for use in treating myelodysplastic syndrome or chronic myelomonocytic leukemia |
| MX2022010910A (es) | 2020-03-06 | 2022-10-07 | Regeneron Pharma | Anticuerpos anti-gitr y usos de estos. |
| WO2021225159A1 (ja) * | 2020-05-08 | 2021-11-11 | 国立大学法人三重大学 | Gitr結合性分子 |
| KR20230024967A (ko) | 2020-06-11 | 2023-02-21 | 노파르티스 아게 | Zbtb32 억제제 및 이의 용도 |
| WO2021260528A1 (en) | 2020-06-23 | 2021-12-30 | Novartis Ag | Dosing regimen comprising 3-(1-oxoisoindolin-2-yl)piperidine-2,6-dione derivatives |
| EP4172323A1 (en) | 2020-06-29 | 2023-05-03 | Flagship Pioneering Innovations V, Inc. | Viruses engineered to promote thanotransmission and their use in treating cancer |
| CN116134027A (zh) | 2020-08-03 | 2023-05-16 | 诺华股份有限公司 | 杂芳基取代的3-(1-氧代异吲哚啉-2-基)哌啶-2,6-二酮衍生物及其用途 |
| WO2022043558A1 (en) | 2020-08-31 | 2022-03-03 | Advanced Accelerator Applications International Sa | Method of treating psma-expressing cancers |
| KR20230061430A (ko) | 2020-08-31 | 2023-05-08 | 브리스톨-마이어스 스큅 컴퍼니 | 세포 국재화 시그너쳐 및 면역요법 |
| WO2022043557A1 (en) | 2020-08-31 | 2022-03-03 | Advanced Accelerator Applications International Sa | Method of treating psma-expressing cancers |
| US20230374064A1 (en) | 2020-10-05 | 2023-11-23 | Bristol-Myers Squibb Company | Methods for concentrating proteins |
| EP4255929A2 (en) | 2020-12-02 | 2023-10-11 | Vib Vzw | An ltbr agonist in combination therapy against cancer |
| WO2022120179A1 (en) | 2020-12-03 | 2022-06-09 | Bristol-Myers Squibb Company | Multi-tumor gene signatures and uses thereof |
| AU2021416156A1 (en) | 2020-12-28 | 2023-06-22 | Bristol-Myers Squibb Company | Methods of treating tumors |
| JP2024503265A (ja) | 2020-12-28 | 2024-01-25 | ブリストル-マイヤーズ スクイブ カンパニー | 抗体組成物およびその使用の方法 |
| MX2023007901A (es) | 2020-12-31 | 2023-07-11 | Sanofi Sa | Acopladores de celulas asesinas naturales (nk) multifuncionales que se unen a nkp46 y a cd123. |
| EP4281112A1 (en) * | 2021-01-21 | 2023-11-29 | Twist Bioscience Corporation | Methods and compositions relating to adenosine receptors |
| TW202246334A (zh) | 2021-02-02 | 2022-12-01 | 美商美國禮來大藥廠 | Gitr拮抗劑及其使用方法 |
| AU2022246895A1 (en) | 2021-03-31 | 2023-10-19 | Flagship Pioneering Innovations V, Inc. | Thanotransmission polypeptides and their use in treating cancer |
| CN113035298B (zh) * | 2021-04-02 | 2023-06-20 | 南京信息工程大学 | 递归生成大阶数行限制覆盖阵列的药物临床试验设计方法 |
| JP2024514530A (ja) | 2021-04-02 | 2024-04-02 | ザ リージェンツ オブ ザ ユニバーシティ オブ カリフォルニア | 切断型cdcp1に対する抗体およびその使用 |
| TW202304979A (zh) | 2021-04-07 | 2023-02-01 | 瑞士商諾華公司 | 抗TGFβ抗體及其他治療劑用於治療增殖性疾病之用途 |
| WO2022240161A1 (ko) * | 2021-05-10 | 2022-11-17 | 메디맵바이오 주식회사 | 항-gitr 항체 및 이의 용도 |
| AR125874A1 (es) | 2021-05-18 | 2023-08-23 | Novartis Ag | Terapias de combinación |
| JP2024525475A (ja) | 2021-06-29 | 2024-07-12 | フラグシップ パイオニアリング イノベーションズ ブイ,インコーポレーテッド | タノトランスミッションを促進するように操作された免疫細胞及びその使用 |
| KR20240156411A (ko) | 2022-03-09 | 2024-10-29 | 브리스톨-마이어스 스큅 컴퍼니 | 치료 단백질의 일시적 발현 |
| WO2023175614A1 (en) | 2022-03-15 | 2023-09-21 | Yeda Research And Development Co. Ltd. | Anti glucocorticoid-induced tnfr-related (gitr) protein antibodies and uses thereof |
| WO2023178192A1 (en) | 2022-03-15 | 2023-09-21 | Compugen Ltd. | Il-18bp antagonist antibodies and their use in monotherapy and combination therapy in the treatment of cancer |
| WO2023178329A1 (en) | 2022-03-18 | 2023-09-21 | Bristol-Myers Squibb Company | Methods of isolating polypeptides |
| WO2023235847A1 (en) | 2022-06-02 | 2023-12-07 | Bristol-Myers Squibb Company | Antibody compositions and methods of use thereof |
| WO2024058404A1 (ko) | 2022-09-15 | 2024-03-21 | 주식회사 엘지에너지솔루션 | 배터리 관리 시스템, 배터리 팩, 전기 차량 및 배터리 충전 시간 예측 방법 |
| US20240174732A1 (en) | 2022-10-05 | 2024-05-30 | Flagship Pioneering Innovations V, Inc. | Nucleic acid molecules encoding trif and additional polypeptides and their use in treating cancer |
| TW202421194A (zh) * | 2022-11-03 | 2024-06-01 | 美商英塞特公司 | 包含抗gitr抗體之用於治療癌症的組合療法 |
| WO2024151687A1 (en) | 2023-01-09 | 2024-07-18 | Flagship Pioneering Innovations V, Inc. | Genetic switches and their use in treating cancer |
| WO2024194605A1 (en) | 2023-03-17 | 2024-09-26 | Quell Therapeutics Limited | Treg therapy |
| CN117777306B (zh) * | 2023-07-04 | 2024-08-20 | 深圳豪石生物科技有限公司 | 一种靶向cldn18.2的增强型嵌合抗原受体及其用途 |
| CN117777307B (zh) * | 2023-09-26 | 2024-08-20 | 深圳豪石生物科技有限公司 | 一种cldn18.2特异性嵌合t细胞受体、嵌合t细胞受体免疫细胞及其应用 |
Family Cites Families (239)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4044126A (en) | 1972-04-20 | 1977-08-23 | Allen & Hanburys Limited | Steroidal aerosol compositions and process for the preparation thereof |
| GB1429184A (en) | 1972-04-20 | 1976-03-24 | Allen & Hanburys Ltd | Physically anti-inflammatory steroids for use in aerosols |
| US4444887A (en) | 1979-12-10 | 1984-04-24 | Sloan-Kettering Institute | Process for making human antibody producing B-lymphocytes |
| US4716111A (en) | 1982-08-11 | 1987-12-29 | Trustees Of Boston University | Process for producing human antibodies |
| GB8308235D0 (en) | 1983-03-25 | 1983-05-05 | Celltech Ltd | Polypeptides |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| CA1319120C (en) | 1985-04-01 | 1993-06-15 | John Henry Kenten | Transformed myeloma cell-line and a process for the expression of a gene coding for a eukaryotic polypeptide employing same |
| GB8601597D0 (en) | 1986-01-23 | 1986-02-26 | Wilson R H | Nucleotide sequences |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US5869620A (en) | 1986-09-02 | 1999-02-09 | Enzon, Inc. | Multivalent antigen-binding proteins |
| DE3883899T3 (de) | 1987-03-18 | 1999-04-22 | Sb2, Inc., Danville, Calif. | Geänderte antikörper. |
| GB8717430D0 (en) | 1987-07-23 | 1987-08-26 | Celltech Ltd | Recombinant dna product |
| US5677425A (en) | 1987-09-04 | 1997-10-14 | Celltech Therapeutics Limited | Recombinant antibody |
| CA1340288C (en) | 1988-09-02 | 1998-12-29 | Robert Charles Ladner | Generation and selection of novel binding proteins |
| US5223409A (en) | 1988-09-02 | 1993-06-29 | Protein Engineering Corp. | Directed evolution of novel binding proteins |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5413923A (en) | 1989-07-25 | 1995-05-09 | Cell Genesys, Inc. | Homologous recombination for universal donor cells and chimeric mammalian hosts |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5585112A (en) | 1989-12-22 | 1996-12-17 | Imarx Pharmaceutical Corp. | Method of preparing gas and gaseous precursor-filled microspheres |
| WO1991010737A1 (en) | 1990-01-11 | 1991-07-25 | Molecular Affinities Corporation | Production of antibodies using gene libraries |
| US5780225A (en) | 1990-01-12 | 1998-07-14 | Stratagene | Method for generating libaries of antibody genes comprising amplification of diverse antibody DNAs and methods for using these libraries for the production of diverse antigen combining molecules |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| DE69120146T2 (de) | 1990-01-12 | 1996-12-12 | Cell Genesys Inc | Erzeugung xenogener antikörper |
| IT1246382B (it) | 1990-04-17 | 1994-11-18 | Eurand Int | Metodo per la cessione mirata e controllata di farmaci nell'intestino e particolarmente nel colon |
| US5427908A (en) | 1990-05-01 | 1995-06-27 | Affymax Technologies N.V. | Recombinant library screening methods |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| US5625126A (en) | 1990-08-29 | 1997-04-29 | Genpharm International, Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5814318A (en) | 1990-08-29 | 1998-09-29 | Genpharm International Inc. | Transgenic non-human animals for producing heterologous antibodies |
| US5545806A (en) | 1990-08-29 | 1996-08-13 | Genpharm International, Inc. | Ransgenic non-human animals for producing heterologous antibodies |
| US5633425A (en) | 1990-08-29 | 1997-05-27 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| US5661016A (en) | 1990-08-29 | 1997-08-26 | Genpharm International Inc. | Transgenic non-human animals capable of producing heterologous antibodies of various isotypes |
| DK0546073T3 (da) | 1990-08-29 | 1998-02-02 | Genpharm Int | Frembringelse og anvendelse af transgene, ikke-humane dyr, der er i stand til at danne heterologe antistoffer |
| US5698426A (en) | 1990-09-28 | 1997-12-16 | Ixsys, Incorporated | Surface expression libraries of heteromeric receptors |
| US5543390A (en) | 1990-11-01 | 1996-08-06 | State Of Oregon, Acting By And Through The Oregon State Board Of Higher Education, Acting For And On Behalf Of The Oregon Health Sciences University | Covalent microparticle-drug conjugates for biological targeting |
| WO1992009690A2 (en) | 1990-12-03 | 1992-06-11 | Genentech, Inc. | Enrichment method for variant proteins with altered binding properties |
| AU662148B2 (en) | 1991-04-10 | 1995-08-24 | Scripps Research Institute, The | Heterodimeric receptor libraries using phagemids |
| DE69233482T2 (de) | 1991-05-17 | 2006-01-12 | Merck & Co., Inc. | Verfahren zur Verminderung der Immunogenität der variablen Antikörperdomänen |
| EP0590058B1 (en) | 1991-06-14 | 2003-11-26 | Genentech, Inc. | HUMANIZED Heregulin ANTIBODy |
| WO1992022324A1 (en) | 1991-06-14 | 1992-12-23 | Xoma Corporation | Microbially-produced antibody fragments and their conjugates |
| US5637481A (en) | 1993-02-01 | 1997-06-10 | Bristol-Myers Squibb Company | Expression vectors encoding bispecific fusion proteins and methods of producing biologically active bispecific fusion proteins in a mammalian cell |
| MX9204374A (es) | 1991-07-25 | 1993-03-01 | Idec Pharma Corp | Anticuerpo recombinante y metodo para su produccion. |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| ES2227512T3 (es) | 1991-12-02 | 2005-04-01 | Medical Research Council | Produccion de anticuerpos contra auto-antigenos a partir de repertorios de segmentos de anticuerpos fijados en un fago. |
| US5766886A (en) | 1991-12-13 | 1998-06-16 | Xoma Corporation | Modified antibody variable domains |
| GB9203459D0 (en) | 1992-02-19 | 1992-04-08 | Scotgen Ltd | Antibodies with germ-line variable regions |
| US5733743A (en) | 1992-03-24 | 1998-03-31 | Cambridge Antibody Technology Limited | Methods for producing members of specific binding pairs |
| GB9206422D0 (en) | 1992-03-24 | 1992-05-06 | Bolt Sarah L | Antibody preparation |
| US6174666B1 (en) | 1992-03-27 | 2001-01-16 | The United States Of America As Represented By The Department Of Health And Human Services | Method of eliminating inhibitory/instability regions from mRNA |
| US6010715A (en) | 1992-04-01 | 2000-01-04 | Bertek, Inc. | Transdermal patch incorporating a polymer film incorporated with an active agent |
| US6024975A (en) | 1992-04-08 | 2000-02-15 | Americare International Diagnostics, Inc. | Method of transdermally administering high molecular weight drugs with a polymer skin enhancer |
| EP0640094A1 (en) | 1992-04-24 | 1995-03-01 | The Board Of Regents, The University Of Texas System | Recombinant production of immunoglobulin-like domains in prokaryotic cells |
| EP1087013B1 (en) | 1992-08-21 | 2009-01-07 | Vrije Universiteit Brussel | Immunoglobulins devoid of light chains |
| US6005079A (en) | 1992-08-21 | 1999-12-21 | Vrije Universiteit Brussels | Immunoglobulins devoid of light chains |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| JP3720353B2 (ja) | 1992-12-04 | 2005-11-24 | メディカル リサーチ カウンシル | 多価および多重特異性の結合タンパク質、それらの製造および使用 |
| US6274552B1 (en) | 1993-03-18 | 2001-08-14 | Cytimmune Sciences, Inc. | Composition and method for delivery of biologically-active factors |
| US5523092A (en) | 1993-04-14 | 1996-06-04 | Emory University | Device for local drug delivery and methods for using the same |
| US5985307A (en) | 1993-04-14 | 1999-11-16 | Emory University | Device and method for non-occlusive localized drug delivery |
| DE69427974T2 (de) | 1993-04-29 | 2001-12-06 | Unilever N.V., Rotterdam | Herstellung von antikörpern oder funktionstüchtig gemachten teilen davon, abgeleitet von schweren ketten von immunglobulinen von camelidae |
| WO1994029351A2 (en) | 1993-06-16 | 1994-12-22 | Celltech Limited | Antibodies |
| WO1995001997A1 (en) | 1993-07-09 | 1995-01-19 | Smithkline Beecham Corporation | RECOMBINANT AND HUMANIZED IL-1β ANTIBODIES FOR TREATMENT OF IL-1 MEDIATED INFLAMMATORY DISORDERS IN MAN |
| US6004534A (en) | 1993-07-23 | 1999-12-21 | Massachusetts Institute Of Technology | Targeted polymerized liposomes for improved drug delivery |
| WO1995015982A2 (en) | 1993-12-08 | 1995-06-15 | Genzyme Corporation | Process for generating specific antibodies |
| GB9326253D0 (en) | 1993-12-23 | 1994-02-23 | Smithkline Beecham Biolog | Vaccines |
| US5997873A (en) | 1994-01-13 | 1999-12-07 | Mount Sinai School Of Medicine Of The City University Of New York | Method of preparation of heat shock protein 70-peptide complexes |
| WO1995020401A1 (en) | 1994-01-31 | 1995-08-03 | Trustees Of Boston University | Polyclonal antibody libraries |
| WO1995030750A2 (fr) | 1994-05-06 | 1995-11-16 | Institut Gustave Roussy | Fractions polypeptidiques solubles de la proteine lag-3; procede de production; composition therapeutique; anticorps anti-idiotype |
| US5516637A (en) | 1994-06-10 | 1996-05-14 | Dade International Inc. | Method involving display of protein binding pairs on the surface of bacterial pili and bacteriophage |
| US5759542A (en) | 1994-08-05 | 1998-06-02 | New England Deaconess Hospital Corporation | Compositions and methods for the delivery of drugs by platelets for the treatment of cardiovascular and other diseases |
| US5660854A (en) | 1994-11-28 | 1997-08-26 | Haynes; Duncan H | Drug releasing surgical implant or dressing material |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US6121022A (en) | 1995-04-14 | 2000-09-19 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5983134A (en) | 1995-04-23 | 1999-11-09 | Electromagnetic Bracing Systems Inc. | Electrophoretic cuff apparatus drug delivery system |
| AU5632296A (en) | 1995-04-27 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| AU2466895A (en) | 1995-04-28 | 1996-11-18 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6316652B1 (en) | 1995-06-06 | 2001-11-13 | Kosta Steliou | Drug mitochondrial targeting agents |
| ES2186797T3 (es) | 1995-07-21 | 2003-05-16 | Applied Research Systems | Metodo para detectar, identificar, aislar y marcar selectivamente, y direccionar linfocitos th1 por medio de la proteina lag-3. |
| US6167301A (en) | 1995-08-29 | 2000-12-26 | Flower; Ronald J. | Iontophoretic drug delivery device having high-efficiency DC-to-DC energy conversion circuit |
| US5935576A (en) | 1995-09-13 | 1999-08-10 | Fordham University | Compositions and methods for the treatment and prevention of neoplastic diseases using heat shock proteins complexed with exogenous antigens |
| GB9601081D0 (en) | 1995-10-06 | 1996-03-20 | Cambridge Antibody Tech | Specific binding members for human transforming growth factor beta;materials and methods |
| WO1997014719A1 (en) | 1995-10-16 | 1997-04-24 | Unilever N.V. | A bifunctional or bivalent antibody fragment analogue |
| US6039975A (en) | 1995-10-17 | 2000-03-21 | Hoffman-La Roche Inc. | Colon targeted delivery system |
| JP2978435B2 (ja) | 1996-01-24 | 1999-11-15 | チッソ株式会社 | アクリロキシプロピルシランの製造方法 |
| EP0904107B1 (en) | 1996-03-18 | 2004-10-20 | Board Of Regents, The University Of Texas System | Immunoglobin-like domains with increased half lives |
| TW345603B (en) | 1996-05-29 | 1998-11-21 | Gmundner Fertigteile Gmbh | A noise control device for tracks |
| US6111090A (en) | 1996-08-16 | 2000-08-29 | Schering Corporation | Mammalian cell surface antigens; related reagents |
| US6027947A (en) | 1996-08-20 | 2000-02-22 | Ramtron International Corporation | Partially or completely encapsulated top electrode of a ferroelectric capacitor |
| US5985317A (en) | 1996-09-06 | 1999-11-16 | Theratech, Inc. | Pressure sensitive adhesive matrix patches for transdermal delivery of salts of pharmaceutical agents |
| NZ334914A (en) | 1996-10-01 | 2000-09-29 | Stanford Res Inst Int | Taste-masked microcapsule compositions and methods of manufacture using a phase seperation-coacervation technique |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| US6131570A (en) | 1998-06-30 | 2000-10-17 | Aradigm Corporation | Temperature controlling device for aerosol drug delivery |
| WO1998023289A1 (en) | 1996-11-27 | 1998-06-04 | The General Hospital Corporation | MODULATION OF IgG BINDING TO FcRn |
| ATE387495T1 (de) | 1996-12-03 | 2008-03-15 | Amgen Fremont Inc | Vollkommen humane antikörper die egfr binden |
| US5860957A (en) | 1997-02-07 | 1999-01-19 | Sarcos, Inc. | Multipathway electronically-controlled drug delivery system |
| US6017540A (en) | 1997-02-07 | 2000-01-25 | Fordham University | Prevention and treatment of primary and metastatic neoplastic diseases and infectious diseases with heat shock/stress protein-peptide complexes |
| US6277375B1 (en) | 1997-03-03 | 2001-08-21 | Board Of Regents, The University Of Texas System | Immunoglobulin-like domains with increased half-lives |
| WO1998042752A1 (en) | 1997-03-21 | 1998-10-01 | Brigham And Women's Hospital Inc. | Immunotherapeutic ctla-4 binding peptides |
| US6120751A (en) | 1997-03-21 | 2000-09-19 | Imarx Pharmaceutical Corp. | Charged lipids and uses for the same |
| US7227002B1 (en) | 1997-04-14 | 2007-06-05 | Micromet Ag | Human antibodies that bind human 17-A1/EpCAM tumor antigen |
| US6060082A (en) | 1997-04-18 | 2000-05-09 | Massachusetts Institute Of Technology | Polymerized liposomes targeted to M cells and useful for oral or mucosal drug delivery |
| US7951917B1 (en) | 1997-05-02 | 2011-05-31 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| US20020062010A1 (en) | 1997-05-02 | 2002-05-23 | Genentech, Inc. | Method for making multispecific antibodies having heteromultimeric and common components |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| US5948433A (en) | 1997-08-21 | 1999-09-07 | Bertek, Inc. | Transdermal patch |
| EP2050465B1 (en) | 1997-08-29 | 2014-06-11 | Antigenics Inc. | Compositions comprising the adjuvant QS-21 and polysorbate or cyclodextrin as excipient |
| US6503184B1 (en) | 1997-10-21 | 2003-01-07 | Human Genome Sciences, Inc. | Human tumor necrosis factor receptor-like proteins TR11, TR11SV1 and TR11SV2 |
| EP1025228A4 (en) | 1997-10-21 | 2002-09-18 | Human Genome Sciences Inc | HUMAN PROTEIN TR11, TR11SV1 AND TR11SV2 SIMILAR TO THE TUMOR NECROSIS FACTOR RECEPTOR |
| DE69839179T2 (de) | 1997-10-28 | 2009-02-19 | Bando Chemical Industries, Ltd., Kobe | Dermatologisches pflaster und verfahren zur herstellung seiner basisschicht |
| US5948646A (en) | 1997-12-11 | 1999-09-07 | Fordham University | Methods for preparation of vaccines against cancer comprising heat shock protein-peptide complexes |
| EP1053321A1 (en) | 1998-02-09 | 2000-11-22 | Genentech, Inc. | Novel tumor necrosis factor receptor homolog and nucleic acids encoding the same |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| DE69920897T2 (de) | 1998-04-28 | 2005-10-13 | Smithkline Beecham Corp. | Monoklonale antikörper mit verringerter immunisierungsfähigkeit |
| US6048736A (en) | 1998-04-29 | 2000-04-11 | Kosak; Kenneth M. | Cyclodextrin polymers for carrying and releasing drugs |
| AU773204C (en) | 1998-08-10 | 2005-05-19 | Antigenics Llc | Compositions of CPG and saponin adjuvants and methods thereof |
| CN1328571B (zh) | 1998-12-23 | 2016-08-31 | 辉瑞大药厂 | 抗ctla-4的人单克隆抗体 |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| EP1141024B1 (en) | 1999-01-15 | 2018-08-08 | Genentech, Inc. | POLYPEPTIDE COMPRISING A VARIANT HUMAN IgG1 Fc REGION |
| US6271359B1 (en) | 1999-04-14 | 2001-08-07 | Musc Foundation For Research Development | Tissue-specific and pathogen-specific toxic agents and ribozymes |
| US6256533B1 (en) | 1999-06-09 | 2001-07-03 | The Procter & Gamble Company | Apparatus and method for using an intracutaneous microneedle array |
| WO2001014557A1 (en) | 1999-08-23 | 2001-03-01 | Dana-Farber Cancer Institute, Inc. | Pd-1, a receptor for b7-4, and uses therefor |
| AU784012B2 (en) | 1999-08-24 | 2006-01-12 | E. R. Squibb & Sons, L.L.C. | Human CTLA-4 antibodies and their uses |
| AU2161501A (en) | 1999-11-29 | 2001-06-25 | Unilever Plc | Immobilized single domain antigen-binding molecules |
| AU2001233027A1 (en) | 2000-01-27 | 2001-08-07 | Genetics Institute, Llc | Antibodies against ctla4 (cd152), conjugates comprising same, and uses thereof |
| US6261595B1 (en) | 2000-02-29 | 2001-07-17 | Zars, Inc. | Transdermal drug patch with attached pocket for controlled heating device |
| US20020004587A1 (en) | 2000-04-11 | 2002-01-10 | Genentech, Inc. | Multivalent antibodies and uses therefor |
| ES2649037T3 (es) | 2000-12-12 | 2018-01-09 | Medimmune, Llc | Moléculas con semividas prolongadas, composiciones y usos de las mismas |
| US7658921B2 (en) | 2000-12-12 | 2010-02-09 | Medimmune, Llc | Molecules with extended half-lives, compositions and uses thereof |
| IL149701A0 (en) | 2001-05-23 | 2002-11-10 | Pfizer Prod Inc | Use of anti-ctla-4 antibodies |
| JP2005538706A (ja) | 2001-07-12 | 2005-12-22 | ジェファーソン フーテ, | スーパーヒト化抗体 |
| WO2003006058A1 (en) | 2001-07-12 | 2003-01-23 | Wyeth | Cd25+ differential markers and uses thereof |
| CA2466279A1 (en) | 2001-11-13 | 2003-05-22 | Dana-Farber Cancer Institute, Inc. | Agents that modulate immune cell activation and methods of use thereof |
| CA2474497C (en) | 2002-01-30 | 2013-12-03 | The Brigham And Women's Hospital, Inc. | Compositions and methods related to tim-3, a th1-specific cell surface molecule |
| AUPS054702A0 (en) | 2002-02-14 | 2002-03-07 | Immunaid Pty Ltd | Cancer therapy |
| US20040014194A1 (en) | 2002-03-27 | 2004-01-22 | Schering Corporation | Beta-secretase crystals and methods for preparing and using the same |
| AU2003234736B2 (en) | 2002-04-12 | 2008-09-25 | E. R. Squibb & Sons, L.L.C. | Methods of treatment using CTLA-4 antibodies |
| WO2003106498A2 (en) | 2002-06-13 | 2003-12-24 | Crucell Holland, B.V. | Agonistic binding molecules to the human ox40 receptor |
| ES2654064T3 (es) | 2002-07-03 | 2024-03-13 | Ono Pharmaceutical Co | Composiciones inmunopotenciadoras que comprenden anticuerpos anti-PD-L1 |
| US7291331B1 (en) | 2002-09-11 | 2007-11-06 | La Jolla Institute For Allergy And Immunology | Methods of treating OX40 medicated recall immune responses |
| CA2508660C (en) | 2002-12-23 | 2013-08-20 | Wyeth | Antibodies against pd-1 and uses therefor |
| US9068234B2 (en) | 2003-01-21 | 2015-06-30 | Ptc Therapeutics, Inc. | Methods and agents for screening for compounds capable of modulating gene expression |
| EP1897548B2 (en) | 2003-02-28 | 2024-05-22 | The Johns Hopkins University | T cell regulation |
| AU2004244626A1 (en) | 2003-05-23 | 2004-12-09 | The Government Of The United States Of America As Represented By The Secretary, Department Of Health And Human Services | GITR ligand and GITR ligand-related molecules and antibodies and uses thereof |
| US7465446B2 (en) | 2003-05-30 | 2008-12-16 | Medarex, Inc. | Surrogate therapeutic endpoint for anti-CTLA4-based immunotherapy of disease |
| US20050048054A1 (en) | 2003-07-11 | 2005-03-03 | Shino Hanabuchi | Lymphocytes; methods |
| US20050042664A1 (en) | 2003-08-22 | 2005-02-24 | Medimmune, Inc. | Humanization of antibodies |
| JP2007505147A (ja) | 2003-09-12 | 2007-03-08 | アンティジェニクス インコーポレーテッド | 単純ヘルペスウイルス感染の治療および予防用ワクチン |
| PL1692516T3 (pl) | 2003-10-24 | 2011-05-31 | Immunaid Pty Ltd | Sposób terapii |
| JP2007530588A (ja) | 2004-03-23 | 2007-11-01 | バイオジェン・アイデック・エムエイ・インコーポレイテッド | レセプターカップリング剤およびその治療用途 |
| EP1732600A2 (en) | 2004-03-26 | 2006-12-20 | Pfizer Products Incorporated | Uses of anti-ctla-4 antibodies |
| DE102004063494A1 (de) | 2004-12-23 | 2006-07-13 | Tegenero Ag | Antikörper |
| EP1866339B8 (en) | 2005-03-25 | 2021-12-01 | GITR, Inc. | Gitr binding molecules and uses therefor |
| JP4361545B2 (ja) | 2005-05-09 | 2009-11-11 | 小野薬品工業株式会社 | ProgrammedDeath1(PD−1)に対するヒトモノクローナル抗体および抗PD−1抗体単独または他の免疫療法と併用した癌治療方法 |
| US20110305713A1 (en) | 2005-10-21 | 2011-12-15 | Medical College Of Georgia Research Institute, Inc | Methods and compositions to enhance vaccine efficacy by reprogramming regulatory t cells |
| TW200732350A (en) | 2005-10-21 | 2007-09-01 | Amgen Inc | Methods for generating monovalent IgG |
| WO2007081878A2 (en) | 2006-01-07 | 2007-07-19 | Medical College Of Georgia Research Institute, Inc. | Indoleamine 2,3-dioxygenase pathways in the generation of regulatory t cells |
| WO2007056539A2 (en) | 2005-11-08 | 2007-05-18 | Medarex, Inc. | Prophylaxis and treatment of enterocolitis associated with anti-ctla-4 antibody therapy |
| WO2007060918A1 (ja) | 2005-11-24 | 2007-05-31 | Dainippon Sumitomo Pharma Co., Ltd. | 新規なメモリーctl誘導増強剤 |
| TWI461436B (zh) | 2005-11-25 | 2014-11-21 | Kyowa Hakko Kirin Co Ltd | 人類cd134(ox40)之人類單株抗體及其製造及使用方法 |
| WO2007133822A1 (en) | 2006-01-19 | 2007-11-22 | Genzyme Corporation | Gitr antibodies for the treatment of cancer |
| GB0603081D0 (en) | 2006-02-15 | 2006-03-29 | Dynal Biotech Asa Oslo | Method |
| US9868961B2 (en) | 2006-03-30 | 2018-01-16 | The Regents Of The University Of California | Methods and compositions for localized secretion of anti-CTLA-4 antibodies |
| CN105837690A (zh) | 2006-06-12 | 2016-08-10 | 新兴产品开发西雅图有限公司 | 具有效应功能的单链多价结合蛋白 |
| WO2008073160A2 (en) | 2006-08-17 | 2008-06-19 | The Trustees Of Columbia University In The City Of New York | Methods for converting or inducing protective immunity |
| EP1894941A1 (en) | 2006-09-01 | 2008-03-05 | Institut Pasteur | Treatment of cervical carcinoma with a recombinant adenylate cyclase carrying HPV antigens |
| WO2008060617A2 (en) | 2006-11-15 | 2008-05-22 | The Brigham And Women's Hospital, Inc. | Therapeutic uses of tim-3 modulators |
| BRPI0807269A2 (pt) | 2007-02-27 | 2014-04-29 | Genentech Inc | "anticorpo antagonista isolado, molécula de ácido nucléico isolada, vetor, célula hospedeira, composição, método de tratamento, método para tratamento, método para reduzir a severidade da asma, método para produzir um anticorpo, hibridoma, uso do anitocrpo, método para detectar ox40, kits e aparelhos médicos" |
| US20090004213A1 (en) | 2007-03-26 | 2009-01-01 | Immatics Biotechnologies Gmbh | Combination therapy using active immunotherapy |
| EP1987839A1 (en) | 2007-04-30 | 2008-11-05 | I.N.S.E.R.M. Institut National de la Sante et de la Recherche Medicale | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| JP2008278814A (ja) * | 2007-05-11 | 2008-11-20 | Igaku Seibutsugaku Kenkyusho:Kk | アゴニスティック抗ヒトgitr抗体による免疫制御の解除とその応用 |
| JP5932217B2 (ja) | 2007-07-12 | 2016-06-08 | ジーアイティーアール, インコーポレイテッド | Gitr結合分子を使用する併用療法 |
| GB0718167D0 (en) | 2007-09-18 | 2007-10-31 | Cancer Rec Tech Ltd | Cancer marker and therapeutic target |
| US20100285001A1 (en) | 2007-10-02 | 2010-11-11 | University Of Rochester | Method and Compositions Related to Synergistic Responses to Oncogenic Mutations |
| US8227577B2 (en) | 2007-12-21 | 2012-07-24 | Hoffman-La Roche Inc. | Bivalent, bispecific antibodies |
| EP2240204A1 (en) | 2008-02-04 | 2010-10-20 | Medarex, Inc. | Anti-clta-4 antibodies with reduced blocking of binding of ctla-4 to b7 and uses thereof |
| WO2009114335A2 (en) | 2008-03-12 | 2009-09-17 | Merck & Co., Inc. | Pd-1 binding proteins |
| KR101649548B1 (ko) | 2008-07-08 | 2016-08-19 | 인사이트 홀딩스 코포레이션 | 인돌아민 2,3-디옥시게나아제의 억제제로서의 1,2,5-옥사디아졸 |
| US7993640B2 (en) | 2008-08-06 | 2011-08-09 | Light Sciences Oncology, Inc. | Enhancement of light activated therapy by immune augmentation using anti-CTLA-4 antibody |
| AR072999A1 (es) | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| EA201500417A1 (ru) | 2008-08-25 | 2015-11-30 | Эмплиммьюн, Инк. | Композиции антагонистов pd-1 и способы применения |
| US9301785B2 (en) | 2008-10-21 | 2016-04-05 | K2M, Inc. | Spinal buttress plate |
| HRP20240240T1 (hr) | 2008-12-09 | 2024-04-26 | F. Hoffmann - La Roche Ag | Protutijela anti-pd-l1 i njihova uporaba za poboljšanje funkcije t-stanice |
| US8614295B2 (en) | 2009-02-17 | 2013-12-24 | Ucb Pharma S.A. | Antibody molecules having specificity for human OX40 |
| CN104558179A (zh) | 2009-04-27 | 2015-04-29 | 协和发酵麒麟株式会社 | 用于治疗血液肿瘤的抗IL-3Rα抗体 |
| US20120141501A1 (en) | 2009-05-29 | 2012-06-07 | Forerunner Pharma Research Co. Ltd | Pharmaceutical Composition Containing Antagonist of EGF Family Ligand as Component |
| US8586713B2 (en) | 2009-06-26 | 2013-11-19 | Regeneron Pharmaceuticals, Inc. | Readily isolated bispecific antibodies with native immunoglobulin format |
| JP5883384B2 (ja) | 2009-08-13 | 2016-03-15 | ザ ジョンズ ホプキンス ユニバーシティー | 免疫機能を調節する方法 |
| LT3023438T (lt) | 2009-09-03 | 2020-05-11 | Merck Sharp & Dohme Corp. | Anti-gitr antikūnai |
| MX346912B (es) | 2009-12-07 | 2017-04-05 | Univ Leland Stanford Junior | Metodos para mejorar terapia con anticuerpos antitumor. |
| US20130202623A1 (en) | 2010-02-16 | 2013-08-08 | Nicolas Chomont | Pd-1 modulation and uses thereof for modulating hiv replication |
| DK2542590T4 (da) | 2010-03-05 | 2020-07-13 | Univ Johns Hopkins | Sammensætninger og fremgangsmåde til målrettede immunomodulatoriske antistof-fer og fusionproteiner |
| US20120014947A1 (en) | 2010-07-16 | 2012-01-19 | The University Of Chicago | Methods and compositions to reduce liver damage associated with conditions or therapies that affect the immune system |
| WO2012064760A2 (en) | 2010-11-08 | 2012-05-18 | Biovest International, Inc. | Materials and methods for directing an immune response to an epitope |
| WO2012075291A1 (en) | 2010-12-01 | 2012-06-07 | The Children's Hospital Of Philadelphia | Compositions and methods for treating foxp3+ treg related diseases |
| CN103842383B (zh) | 2011-05-16 | 2017-11-03 | 健能隆医药技术(上海)有限公司 | 多特异性fab融合蛋白及其使用方法 |
| CN103857699B (zh) | 2011-05-24 | 2016-08-31 | 泽恩格尼亚股份有限公司 | 多价和单价多特异性复合物及其用途 |
| WO2013006490A2 (en) | 2011-07-01 | 2013-01-10 | Cellerant Therapeutics, Inc. | Antibodies that specifically bind to tim3 |
| CA2840460C (en) | 2011-07-11 | 2022-08-16 | Glenmark Pharmaceuticals S.A. | Antibodies that bind to ox40 and their uses |
| US8920075B2 (en) | 2011-09-01 | 2014-12-30 | Halo Maritime Defense Systems, Inc. | Marine barrier and gate |
| WO2013039954A1 (en) | 2011-09-14 | 2013-03-21 | Sanofi | Anti-gitr antibodies |
| US9382319B2 (en) | 2011-09-26 | 2016-07-05 | Jn Biosciences Llc | Hybrid constant regions |
| WO2013049307A2 (en) | 2011-09-30 | 2013-04-04 | University Of Miami | Enhanced immune memory development by aptamer targeted mtor inhibition of t cells |
| US20130177579A1 (en) | 2012-01-06 | 2013-07-11 | Bioalliance C.V. | Anti-transferrin receptor antibodies and methods using same |
| JP2015509592A (ja) | 2012-02-23 | 2015-03-30 | スローン − ケッタリング インスティチュート フォー キャンサー リサーチ | 免疫調節治療剤を用いた処置に対する反応性の予測及びこのような処置の間のアブスコパル効果をモニターする方法 |
| US20150086584A1 (en) | 2012-03-22 | 2015-03-26 | University Of Miami | Multi-specific binding agents |
| KR101566538B1 (ko) | 2012-06-08 | 2015-11-05 | 국립암센터 | 신규한 Th17 세포 전환용 에피토프 및 이의 용도 |
| CN112587658A (zh) | 2012-07-18 | 2021-04-02 | 博笛生物科技有限公司 | 癌症的靶向免疫治疗 |
| CA2879814A1 (en) | 2012-08-02 | 2014-02-06 | Jn Biosciences Llc | Antibodies or fusion proteins multimerized via cysteine mutation and a mu tailpiece |
| HUE043903T2 (hu) | 2012-12-03 | 2019-09-30 | Bristol Myers Squibb Co | Immunmodulációs FC fúziós proteinek rákellenes aktivitásának javítása |
| US9834610B2 (en) | 2013-01-31 | 2017-12-05 | Thomas Jefferson University | Fusion proteins for modulating regulatory and effector T cells |
| WO2014121099A1 (en) | 2013-01-31 | 2014-08-07 | Thomas Jefferson University | Agonist fusion protein for cd40 ox40 and uses thereof |
| DK2970486T3 (en) | 2013-03-15 | 2018-08-06 | Xencor Inc | MODULATION OF T-CELLS WITH BISPECIFIC ANTIBODIES AND FC-FUSIONS |
| CA2904528C (en) | 2013-03-15 | 2021-01-19 | Abbvie Biotherapeutics Inc. | Fc variants |
| FR3008408B1 (fr) | 2013-07-11 | 2018-03-09 | Mc Saf | Nouveaux conjugues anticorps-medicament et leur utilisation en therapie |
| AU2014290069B2 (en) | 2013-07-16 | 2019-01-03 | Genentech, Inc. | Methods of treating cancer using PD-1 axis binding antagonists and TIGIT inhibitors |
| US20150038682A1 (en) | 2013-08-02 | 2015-02-05 | Jn Biosciences Llc | Antibodies or fusion proteins multimerized via homomultimerizing peptide |
| AR097306A1 (es) | 2013-08-20 | 2016-03-02 | Merck Sharp & Dohme | Modulación de la inmunidad tumoral |
| TW201605896A (zh) | 2013-08-30 | 2016-02-16 | 安美基股份有限公司 | Gitr抗原結合蛋白 |
| US11452768B2 (en) | 2013-12-20 | 2022-09-27 | The Broad Institute, Inc. | Combination therapy with neoantigen vaccine |
| EP3122779B1 (en) | 2014-03-24 | 2019-05-22 | Cancer Research Technology Limited | Modified antibodies containing modified igg2 domains which elicit agonist or antagonistic properties and use thereof |
| US20150307620A1 (en) | 2014-04-16 | 2015-10-29 | University Of Connecticut | Linked immunotherapeutic agonists that costimulate multiple pathways |
| WO2015184099A1 (en) | 2014-05-28 | 2015-12-03 | 4-Antibody Ag | Anti-gitr antibodies and methods of use thereof |
| KR101923326B1 (ko) | 2014-06-06 | 2018-11-29 | 브리스톨-마이어스 스큅 컴퍼니 | 글루코코르티코이드-유도 종양 괴사 인자 수용체 (gitr)에 대한 항체 및 그의 용도 |
| AP2017009765A0 (en) | 2014-08-19 | 2017-02-28 | Merck Sharp & Dohme | Anti-tigit antibodies |
| JO3663B1 (ar) | 2014-08-19 | 2020-08-27 | Merck Sharp & Dohme | الأجسام المضادة لمضاد lag3 وأجزاء ربط الأنتيجين |
| JP2017531427A (ja) | 2014-10-03 | 2017-10-26 | デイナ ファーバー キャンサー インスティチュート,インコーポレイテッド | グルココルチコイド誘導腫瘍壊死因子受容体(gitr)抗体およびその使用法 |
| MA41044A (fr) | 2014-10-08 | 2017-08-15 | Novartis Ag | Compositions et procédés d'utilisation pour une réponse immunitaire accrue et traitement contre le cancer |
| MX2017006323A (es) | 2014-11-21 | 2017-08-21 | Bristol Myers Squibb Co | Anticuerpos que comprenden regiones constantes pesadas modificadas. |
| EP3226900A4 (en) | 2014-12-05 | 2018-09-19 | Immunext, Inc. | Identification of vsig8 as the putative vista receptor and its use thereof to produce vista/vsig8 modulators |
| TWI595006B (zh) | 2014-12-09 | 2017-08-11 | 禮納特神經系統科學公司 | 抗pd-1抗體類和使用彼等之方法 |
| AU2015364245B2 (en) | 2014-12-19 | 2020-04-02 | Dana-Farber Cancer Institute, Inc. | Chimeric antigen receptors and methods of use thereof |
| GB201500319D0 (en) | 2015-01-09 | 2015-02-25 | Agency Science Tech & Res | Anti-PD-L1 antibodies |
| BR112017020491A2 (pt) | 2015-03-25 | 2018-07-17 | The Regents Of The University Of Michigan | composições e métodos para distribuição de agentes de biomacromolécula. |
| PT3283107T (pt) | 2015-04-17 | 2020-08-31 | Bristol Myers Squibb Co | Composições compreendendo uma combinação de ipilimumab e nivolumab |
| AU2016364889B2 (en) | 2015-12-02 | 2024-01-04 | Agenus Inc. | Antibodies and methods of use thereof |
| MA43387A (fr) | 2015-12-02 | 2018-10-10 | Agenus Inc | Anticorps anti-gitr et leurs méthodes d'utilisation |
| WO2017096276A1 (en) | 2015-12-02 | 2017-06-08 | Agenus Inc. | Anti-gitr antibodies and methods of use thereof |
| CA3041340A1 (en) | 2016-11-09 | 2018-05-17 | Agenus Inc. | Anti-ox40 antibodies, anti-gitr antibodies, and methods of use thereof |
-
2015
- 2015-05-28 WO PCT/US2015/032895 patent/WO2015184099A1/en active Application Filing
- 2015-05-28 IL IL293212A patent/IL293212B2/en unknown
- 2015-05-28 MA MA40041A patent/MA40041B1/fr unknown
- 2015-05-28 CN CN202211180038.2A patent/CN115925946A/zh active Pending
- 2015-05-28 MX MX2016015614A patent/MX2016015614A/es unknown
- 2015-05-28 ES ES15729987T patent/ES2860751T3/es active Active
- 2015-05-28 SI SI201531531T patent/SI3148579T1/sl unknown
- 2015-05-28 KR KR1020167036746A patent/KR102433464B1/ko active IP Right Grant
- 2015-05-28 SG SG10201912986PA patent/SG10201912986PA/en unknown
- 2015-05-28 SG SG11201609721WA patent/SG11201609721WA/en unknown
- 2015-05-28 IL IL249092A patent/IL249092B/en unknown
- 2015-05-28 HU HUE15729987A patent/HUE053857T2/hu unknown
- 2015-05-28 JP JP2016569715A patent/JP6847666B2/ja active Active
- 2015-05-28 PT PT157299876T patent/PT3148579T/pt unknown
- 2015-05-28 AU AU2015266958A patent/AU2015266958A1/en not_active Abandoned
- 2015-05-28 NZ NZ726513A patent/NZ726513A/en unknown
- 2015-05-28 KR KR1020227027870A patent/KR20220116578A/ko active IP Right Grant
- 2015-05-28 CN CN201580041149.7A patent/CN108064242B/zh active Active
- 2015-05-28 MA MA047849A patent/MA47849A/fr unknown
- 2015-05-28 EA EA201692458A patent/EA201692458A1/ru unknown
- 2015-05-28 EP EP15729987.6A patent/EP3148579B1/en active Active
- 2015-05-28 CA CA2949998A patent/CA2949998A1/en active Pending
- 2015-05-28 PL PL15729987T patent/PL3148579T3/pl unknown
- 2015-05-28 TW TW104117180A patent/TWI709573B/zh active
- 2015-05-28 LT LTEP15729987.6T patent/LT3148579T/lt unknown
- 2015-05-28 RS RS20210303A patent/RS61678B1/sr unknown
- 2015-05-28 US US14/724,452 patent/US10155818B2/en active Active
- 2015-05-28 DK DK15729987.6T patent/DK3148579T3/da active
- 2015-05-28 EP EP18204948.6A patent/EP3498295A1/en active Pending
- 2015-05-28 TW TW109136463A patent/TW202132337A/zh unknown
-
2016
- 2016-11-25 PH PH12016502345A patent/PH12016502345A1/en unknown
- 2016-11-28 MX MX2020013062A patent/MX2020013062A/es unknown
-
2018
- 2018-04-25 US US15/962,752 patent/US10800849B2/en active Active
- 2018-04-25 US US15/962,667 patent/US20180244793A1/en not_active Abandoned
- 2018-04-25 US US15/962,673 patent/US10577426B2/en active Active
- 2018-10-30 US US16/175,453 patent/US10280226B2/en active Active
-
2019
- 2019-03-15 US US16/355,268 patent/US10829559B2/en active Active
- 2019-12-27 JP JP2019238784A patent/JP2020048584A/ja active Pending
-
2020
- 2020-01-15 US US16/744,163 patent/US11401335B2/en active Active
- 2020-08-21 US US16/999,374 patent/US11897962B2/en active Active
-
2021
- 2021-01-29 AU AU2021200582A patent/AU2021200582B2/en active Active
- 2021-03-03 HR HRP20210364TT patent/HRP20210364T1/hr unknown
- 2021-03-12 CY CY20211100215T patent/CY1124787T1/el unknown
-
2022
- 2022-06-22 US US17/808,248 patent/US20230039577A1/en active Pending
- 2022-08-12 AU AU2022215304A patent/AU2022215304A1/en active Pending
- 2022-12-19 JP JP2022202168A patent/JP2023021446A/ja active Pending
-
2023
- 2023-07-02 IL IL304178A patent/IL304178A/en unknown
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11897962B2 (en) | Anti-GITR antibodies and methods of use thereof | |
| EP3334763B1 (en) | Novel anti-pd-1 antibodies | |
| JP2020500538A (ja) | 抗ctla−4抗体およびそれらの使用方法 | |
| EP3303394A1 (en) | Anti-ctla-4 antibodies and methods of use thereof | |
| EA040077B1 (ru) | Анти-gitr антитела и способы их применения |