TW202035445A - 抗lap抗體變異體及其用途 - Google Patents
抗lap抗體變異體及其用途 Download PDFInfo
- Publication number
- TW202035445A TW202035445A TW108136746A TW108136746A TW202035445A TW 202035445 A TW202035445 A TW 202035445A TW 108136746 A TW108136746 A TW 108136746A TW 108136746 A TW108136746 A TW 108136746A TW 202035445 A TW202035445 A TW 202035445A
- Authority
- TW
- Taiwan
- Prior art keywords
- antibody
- seq
- lap
- antigen
- amino acid
- Prior art date
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/22—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against growth factors ; against growth regulators
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/574—Immunoassay; Biospecific binding assay; Materials therefor for cancer
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/68—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing involving proteins, peptides or amino acids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
- A61K2039/507—Comprising a combination of two or more separate antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/33—Crossreactivity, e.g. for species or epitope, or lack of said crossreactivity
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/52—Constant or Fc region; Isotype
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/70—Immunoglobulins specific features characterized by effect upon binding to a cell or to an antigen
- C07K2317/76—Antagonist effect on antigen, e.g. neutralization or inhibition of binding
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/90—Immunoglobulins specific features characterized by (pharmaco)kinetic aspects or by stability of the immunoglobulin
- C07K2317/92—Affinity (KD), association rate (Ka), dissociation rate (Kd) or EC50 value
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Immunology (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Hematology (AREA)
- Urology & Nephrology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Oncology (AREA)
- Physics & Mathematics (AREA)
- Cell Biology (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- General Physics & Mathematics (AREA)
- Food Science & Technology (AREA)
- Biotechnology (AREA)
- Analytical Chemistry (AREA)
- Biophysics (AREA)
- Genetics & Genomics (AREA)
- Hospice & Palliative Care (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Peptides Or Proteins (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本文中提供抗LAP抗體(例如重組型人類化、嵌合及人類抗LAP抗體)或其抗原結合片段,其具有治療學上有利的特性,諸如特異性結合於細胞上之LAP-TGFβ1,但不結合於細胞外基質中之LAP-TGFβ1,及包括該等抗體或其抗原結合片段之組合物。亦提供此等抗體或抗原結合片段於治療性應用(諸如癌症之治療)與診斷性應用上之用途。
Description
本發明係關於抗LAP抗體或其抗原結合片段。本發明之另一態樣係關於包含抗LAP抗體或抗原結合片段之組合物及套組。本發明之另一態樣係關於藉由投與抗體或抗原結合片段來治療疾病(例如癌症)之方法。
以原蛋白質複合物形式合成轉型生長因子β1 (TGFβ1),其中成熟細胞介素封閉於LAP (潛在相關肽),LAP為TGFβ1之潛在相關肽。LAP-TGFβ1複合物藉由二硫鍵結合於五種當前已知的錨蛋白質中之一者:醣蛋白A重複主導序列(GARP)、富含白胺酸之含有重複之蛋白質33 (LRRC33)、潛在轉型生長因子β-結合蛋白質1 (LTBP1)、潛在轉型生長因子β-結合蛋白質3 (LTBP3)及潛在轉型生長因子β-結合蛋白質4 (LTBP4)。此等錨蛋白質將潛在TGFβ1定位於身體內之特定位點中及特定細胞上:
GARP,亦稱為富含白胺酸之重複蛋白質32或LRRC32,為跨膜蛋白,其將LAP-TGFβ1錨定至淋巴細胞(最值得注意的是,調節性T細胞)之表面。GARP亦表現於血小板、B細胞、NK細胞、纖維母細胞、間質基質細胞、間葉幹細胞及內皮細胞上且亦控管此等細胞類型上之LAP-TGFβ1表現。LRRC33為跨膜蛋白,其報導為將LAP-TGFβ1錨定至骨髓細胞(最值得注意的是,巨噬細胞、樹突狀細胞及骨髓衍生之抑制性細胞(MDSC))之表面。LTBP1、LTBP3及LTBP4為所分泌之分子,其將LAP-TGFβ1錨定至細胞外基質(ECM)中。
儘管此項技術中已使用LAP結合劑作為用於鑑別某些細胞群體之工具,但對LAP在疾病病況中之相關性所知甚少。
LAP-TGFβ1複合物之位置具有顯著的生物學及臨床重要性,因為在成熟TGFβ1細胞介素(其在溶液中具有短半衰期)被釋放之後,其以自分泌或近旁分泌方式局部起作用。因此,錨蛋白質為用於將特定位置中之潛在TGFβ1階段化之主要機制,該位置在等待釋放強效成熟細胞介素以對局部組織起作用。
當在不同位置中表現時,LAP-TGFβ1具有不同功能。舉例而言,細胞外基質中由LTBP錨定之LAP-TGFβ1對組織內穩定具有首要重要性。在此方面,Xu等人(Bone Research
2018;6:2)注意到「TGF-β複合物更類似於分子感測器,其經由釋放在細胞層面上發揮生理學作用之活性配位體來即刻回應於ECM擾動,因此保證正常組織內穩定」。
已知併入細胞外基質中之LAP-TGFβ1中之變化可引起人類疾病。舉例而言,小鼠及人類中之LTBP-3之缺失可引起骨骼及牙齒形成之類似缺陷。LTBP-3缺陷亦與在馬凡氏症候群(Marfan syndrome)中發現之主動脈擴張相關聯(Rifkin等人, Matrix Biol 2018;71-72:90-99)。咸信此等作用係歸因於TGFβ1在局部細胞外基質中之異常引導作用(Xu等人, Bone Research 2018;6:2)。
與將LAP-TGFβ1定位至細胞外基質之錨蛋白質相比,由GARP錨定之LAP-TGFβ1對於調節性T細胞(Edwards等人,Eur J Immunol
2016;46:1480-9)及抑制性B細胞亞群(Wallace等人, JCI Insight 2018;3:e99863)之免疫抑制功能具有主要重要性。亦證實一些腫瘤表現GARP,允許其局部表現TGFβ且直接抑制腫瘤微環境中之免疫系統及支持其自身生長(Metelli等人, Journal of Hematology & Oncology 2018;11:24)。
錨定至骨髓細胞之LAP-TGFβ1對於MDSC (Zhang H等人,Frontiers in Immunology
2017;8:1-15)及M2巨噬細胞(Zhang等人, Oncotarget 2017;8:99801-15)之免疫抑制功能具有主要重要性。根據當前研究,已證實骨髓細胞使用錨蛋白質LRRC33將潛在TGFβ錨定至細胞表面(Qin等人,Cell
2018;174:1-16)。
癌症療法之當前研究集中於藉由例如耗竭之免疫細胞群體之活化、疫苗接種及移除免疫抑制性細胞群體來利用患者之免疫系統。鑒於持續需要經改良之靶向(及診斷)疾病(諸如癌症)之策略,需要適用於此等目的之新穎試劑及方法。
本文中提供之本發明之一個態樣為包含本文中所描述之序列(例如在諸如表34之表中發現之胺基酸序列)中之任一者之構築體(例如聚核苷酸、表現載體及宿主細胞)、蛋白質或肽。本文中提供結合LAP之抗體及其抗原結合片段,其包含下文指定之結構及功能特徵(例如表34中之SEQ ID NO:16-197、214、216-240、242-245、248、249及255之胺基酸序列中之任一者)。舉例而言,抗體及抗原結合片段包含本文中之表中描述之胺基酸序列,例如SEQ ID NO:16-197、214及216-255。在各種實施例中,LAP包含有包含LAP及TGFβ (例如TGFβ1)之複合物及/或抗原決定基。在各種實施例中,抗原決定基描述於本文中之實例,例如實例19-23中。
本發明之一個態樣提供經分離之單株抗體(例如重組型人類化、嵌合及人類抗體),其與先前抗LAP抗體相比呈現治療學上有利的結合於LAP-TGFβ1(例如人類LAP-TGFβ1)之模式及功能特性。在一個實施例中,抗LAP抗體選擇性結合於細胞(例如免疫細胞及其他免疫抑制性細胞)上之LAP-TGFβ1,但不結合於細胞外基質中之LAP-TGFβ1,且因此能夠靶向許多臨床相關細胞類型,同時避免細胞外基質中之LAP-TGFβ1之天然功能/活化。因為TGFβ以自分泌或近旁分泌方式起作用,選擇性結合於特異性細胞群體將引起抑制在緊靠所指示之細胞群體之位置處產生成熟TGFβ。因此,本文中所描述之抗體提供抑制TGFβ活化及以高選擇性、細胞特異性方式釋放成熟細胞介素之臨床益處。在一些實施例中,抗LAP抗體為具有活性效應功能之同型,且特異性抗LAP抗體與既定細胞群體之增強之結合將引起由ADCC或CDC消耗之該細胞群體增加。因此,本文中所揭示之抗LAP抗體可理想地以單藥療法及與其他免疫調節劑或治療劑(例如免疫檢查點抑制劑)之組合之形式用於治療多種疾病,包括癌症及其他涉及免疫抑制性細胞之疾病。
在本發明之另一態樣中,本文中提供特異性結合於LAP之抗體(例如重組型人類化、嵌合、結構域或人類抗體)或其抗原結合片段,其包含:
(a) 重鏈可變區,其包含有分別包含SEQ ID NO:16、26及18之胺基酸序列之互補決定區(CDR)1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域;
(b) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(c) 重鏈可變區,其包含有分別包含SEQ ID NO:54、66及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(d) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及68之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(e) 重鏈可變區,其包含有分別包含SEQ ID NO:54、66及68之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(f) 重鏈可變區,其包含有分別包含SEQ ID NO:110、111及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;或
(g) 重鏈可變區,其包含有分別包含SEQ ID NO:110、120及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域。
在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
在各種實施例中,用抗體進行投與步驟(例如在治療或診斷個體之方法中)。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。在各種實施例中,LAP為人類LAP、食蟹獼猴(cynomolgus monkey/cyno)LAP、大鼠LAP及/或小鼠LAP。在各種實施例中,用抗原結合片段進行投與步驟(例如在治療或診斷個體之方法中)。
在各種實施例中,抗體之恆定區為人類IgG1恆定區。舉例而言,IgG1恆定區包含本文中所揭示之表(例如表34)中所闡述之胺基酸序列。舉例而言,IgG1恆定區包含SEQ ID NO:196、244或245中所闡述之胺基酸序列。在各種實施例中,抗體之恆定區為人類IgG4恆定區。舉例而言,人類IgG4恆定區包含SEQ ID NO:197中所闡述之胺基酸序列。
在本發明之另一態樣中,本文中提供經分離之抗體或抗原結合片段,其特異性結合於人類LAP且包含重鏈及輕鏈可變區序列,該重鏈及輕鏈可變區序列與選自由以下組成之群之胺基酸序列至少80%、85%、90%、95%、98%、99%或100%一致:(a)分別SEQ ID NO:42及52;(b)分別SEQ ID NO:101及104;(c)分別SEQ ID NO:98及104;(d)分別SEQ ID NO:133及154;及(e)分別SEQ ID NO:218及154。
在本發明之另一態樣中,本文中提供經分離之抗體或抗原結合片段,其特異性結合於人類LAP且包含有包含SEQ ID NO:218之胺基酸序列之重鏈可變區或包含具有1、2或3個胺基酸取代之SEQ ID NO:218之胺基酸序列之重鏈可變區;及包含SEQ ID NO:154之胺基酸序列之輕鏈可變區或包含具有1、2或3個胺基酸取代之SEQ ID NO:154之胺基酸序列之輕鏈可變區。在各種實施例中,至少一個取代位於CDR內。在各種實施例中,至少一個取代位於構架區內。在各種實施例中,至少一個取代位於至少一個CDR及至少一個構架區內。在各種實施例中,該至少一個取代中之任一個及/或所有係位於及/或發現於構架區內。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。本文中提供之本發明之另一態樣為經分離之抗體或抗原結合片段,其特異性結合於人類LAP且包含有包含SEQ ID NO:218之胺基酸序列之重鏈可變區或包含具有1-5、5-10、10-15、15-20或20-25個胺基酸取代之SEQ ID NO:218之胺基酸序列之重鏈可變區;及包含SEQ ID NO:154之胺基酸序列之輕鏈可變區或包含具有1-5、5-10、10-15、15-20或20-25個胺基酸取代之SEQ ID NO:154之胺基酸序列之輕鏈可變區。舉例而言,至少一個取代位於至少一個CDR區域中。在各種實施例中,至少一個取代位於多個CDR內。在各種實施例中,至少一個取代位於至少一個構架區內。在各種實施例中,至少一個取代位於至少一個CDR及至少一個構架區內。在各種實施例中,該至少一個取代中之任一個及/或所有係位於及/或發現於構架區內。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
本文中提供之本發明之另一態樣為經分離之抗體或抗原結合片段,其特異性結合於人類LAP,其中抗體或抗原結合片段包含有包含SEQ ID NO:218之胺基酸序列之重鏈可變區,其中抗體或抗原結合片段包含有包含SEQ ID NO:154之胺基酸序列之輕鏈可變區。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
本文中提供之本發明之另一態樣為經分離之抗體或抗原結合片段,其特異性結合於人類LAP,其中抗體或抗原結合片段包含由SEQ ID NO:218之胺基酸序列組成之重鏈可變區,其中抗體或抗原結合片段包含由SEQ ID NO:154之胺基酸序列組成之輕鏈可變區。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
本文中提供之本發明之另一態樣為經分離之抗體或抗原結合片段,其特異性結合於人類LAP,其中抗體或抗原結合片段包含有包含SEQ ID NO:219之胺基酸序列之重鏈,其中抗體或抗原結合片段包含有包含SEQ ID NO:155之胺基酸序列之輕鏈。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
本文中提供之本發明之另一態樣為經分離之抗體或抗原結合片段,其特異性結合於人類LAP,其中抗體或抗原結合片段包含由SEQ ID NO:219之胺基酸序列組成之重鏈,其中抗體或抗原結合片段包含由SEQ ID NO:155之胺基酸序列組成之輕鏈。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。在本發明之另一態樣中,本文中提供經分離之抗體或抗原結合片段,其特異性結合於人類LAP且包含重鏈及輕鏈序列,該重鏈及輕鏈序列與選自由以下組成之群之胺基酸序列至少80%、85%、90%、95%、98%、99%或100%一致:(a)分別SEQ ID NO:43及53;(b)分別SEQ ID NO:45及53;(c)分別SEQ ID NO:102及105;(d)分別SEQ ID NO:103及105;(e)分別SEQ ID NO:99及105;(f)分別SEQ ID NO:100及105;(g)分別SEQ ID NO:134及155;(h)分別SEQ ID NO:135及155;(i)分別SEQ ID NO:219及155;及(j)分別SEQ ID NO:220及155。舉例而言,至少一個取代位於至少一個CDR區域中。在各種實施例中,至少一個取代位於多個CDR內。在各種實施例中,至少一個取代位於至少一個構架區內。在各種實施例中,至少一個取代位於至少一個CDR及至少一個構架區內。在各種實施例中,該至少一個取代中之任一個及/或所有係位於及/或發現於構架區內。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
在本發明之另一態樣中,本文中提供經分離之抗體或抗原結合片段,其結合於人類LAP且包含重鏈可變區,其包含有分別包含SEQ ID NO:110、120及112之胺基酸序列之CDR1、CDR2及CDR3區,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區,其中抗體進一步包含人類IgG1恆定區。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
在本發明之另一態樣中,本文中提供經分離之抗體或抗原結合片段,其結合於人類LAP且包含重鏈可變區,其包含有分別包含與SEQ ID NO:110、120及112之胺基酸序列至少80%、85%、90%、95%、98%、99%或100%一致的胺基酸序列之CDR1、CDR2及CDR3區,及輕鏈可變區,其包含有分別包含與SEQ ID NO:113、114及115之胺基酸序列至少80%、85%、90%、95%、98%、99%或100%一致的胺基酸序列之CDR1、CDR2及CDR3區,其中抗體進一步包含人類IgG1恆定區。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
在本發明之另一態樣中,本文中提供經分離之抗體或抗原結合片段,其結合於人類LAP且包含重鏈可變區,其包含有分別包含SEQ ID NO:110、120及112之胺基酸序列之CDR1、CDR2及CDR3區,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區,其中抗體進一步包含突變型人類IgG4恆定區,其包含SEQ ID NO:197之胺基酸序列。在各種實施例中,抗體為人類化抗體、嵌合抗體或人類抗體。
本發明之一個態樣提供本文中所描述之抗LAP抗體或其抗原結合片段(例如表34中所描述之20E6及其人類化版本),其與包含有包含SEQ ID NO:240之胺基酸序列之免疫球蛋白重鏈及包含SEQ ID NO:241之胺基酸序列之免疫球蛋白輕鏈之經分離之抗體結合。
本發明之一個態樣提供本文中所描述之抗LAP抗體或其抗原結合片段(例如表34中所描述之20E6及其人類化版本),其與包含有包含SEQ ID NO:246之胺基酸序列之免疫球蛋白重鏈及包含SEQ ID NO:247之胺基酸序列之免疫球蛋白輕鏈之經分離之抗體結合。
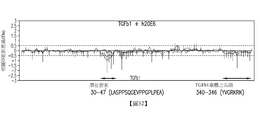
在本發明之另一態樣中,本文中提供經分離之抗體或抗原結合片段,其與本文中所描述之抗LAP抗體或抗原結合片段結合於LAP上之相同抗原決定基。在另一態樣中,本文中提供經分離之抗體或抗原結合片段,其與本文中所描述之抗LAP抗體或抗原結合片段結合於LAP上之相同胺基酸或胺基酸組。舉例而言,抗原決定基(例如LAP及包含LAP及TBFβ1之LAP複合物)、抗體或抗原結合片段具有本文中,諸如表25、26、27、28、29及/或30中所描述之特徵。在一些實施例中,抗LAP抗體結合於人類LAP之特定胺基酸,例如人類LAP-TGFβ1 (SEQ ID NO:1)之胺基酸31-40、274-280及340-343,例如由至少一種結構分析方法(諸如結晶學及/或低溫EM)評估。在一些實施例中,抗LAP抗原結合片段結合於人類LAP之特定胺基酸,例如人類LAP-TGFβ1 (SEQ ID NO:1)之胺基酸31-40、274-280及340-343,例如由至少一種結構分析方法(諸如結晶學及/或低溫EM)評估。在各種實施例中,抗體或抗原結合片段結合於所述胺基酸內之一或多個胺基酸,亦即,人類LAP-TGFβ1 (SEQ ID NO:1)之胺基酸31-40、274-280及340-343內之一或多個胺基酸。在一些實施例中,經分離之抗體或抗原結合片段結合於人類LAP-TGFβ1 (SEQ ID NO:1)之殘基31-40、274-280及340-343中之一或多個殘基,或結合於人類LAP-TGFβ1 (SEQ ID NO:1)之殘基31-43、272-283及340-344中之一或多個殘基。在一些實施例中,抗LAP抗體或其抗原結合片段結合於LAP-TGFβ1之特定區域,例如圖34中所繪示之區域1、區域2、區域3及/或區域4,例如由至少一種結構分析方法(諸如HDX-MS)評估。
在一些實施例中,抗體或抗原結合片段結合於人類LAP (例如以約11 nm之KD
、以11 nM或更低之KD
或以10 nM或更低之KD
)。在各種實施例中,抗體或抗原結合片段以60 nM或更低、50 nM或更低、40 nM或更低、30 nM或更低、20 nM或更低或10 nM或更低之KD
結合於LAP (例如人類、食蟹獼猴、大鼠或小鼠)。在一些實施例中,抗體或抗原結合片段結合於人類LAP (例如以小於60 nM、50 nm、40 nM、30 nM、20 nM或10 nM之KD
)。在一些實施例中,抗體或抗原結合片段以約40-60 nM或約50-60 nM之KD
結合於人類LAP。在各種實施例中,藉由Octet結合分析來測定KD
。在各種實施例中,藉由BIACORE®表面電漿子共振(可互換地稱為「BiaCore」及「BIACore」)結合分析來測定KD
。在各種實施例中,抗體或抗原結合片段具有本文中,例如表31-32中所描述之結合親和力。在一些實施例中,抗體或抗原結合片段抑制TGFβ1活化。在各種實施例中,抗體或抗原結合片段抑制TGFβ之整合素活化及/或LAP-TGFβ1複合物之人類LAP之釋放。在一些實施例中,抗體或抗原結合片段結合於人類及鼠類LAP。在一些實施例中,抗體或抗原結合片段在不存在錨蛋白質之情況下結合於人類LAP。在一些實施例中,抗體或抗原結合片段結合於或測定為結合於免疫抑制性細胞上與錨蛋白質(例如GARP、LRRC33)複合之LAP-TGFβ1,但不結合於錨蛋白質或由LAP-TGFβ及錨蛋白質之殘基構成之抗原決定基。免疫抑制性細胞包括例如抑制性T細胞(例如調節性T細胞、經活化之T細胞)、癌症相關纖維母細胞、M2巨噬細胞、表現LAP-TGFβ1之癌細胞及/或單核球性骨髓衍生之抑制細胞。在一些實施例中,抗體或抗原結合片段不結合游離TGFβ1或空LAP。在一些實施例中,抗體或抗原結合片段不結合於細胞外基質中之LAP。在一些實施例中,抗體或抗原結合片段不結合於或測定為不結合於與LTBP1、LTBP3及/或LTBP4複合之LAP。在一些實施例中,抗體或抗原結合片段結合於或測定為結合於包含K27C及Y75C突變及/或人類LAP-TGFβ1 (SEQ ID NO:1)之殘基82-130之全部或一部分(例如在該等殘基內)之人類LAP-TGFβ1,但不結合於包含Y74T突變之人類LAP-TGFβ1。
在一些實施例中,抗體或抗原結合片段結合於或測定為結合於GARP陽性免疫抑制性細胞及GARP陰性免疫抑制性細胞兩者。在一些實施例中,抗體或抗原結合片段結合於或測定為結合於血小板,但不引起血小板凝集或血小板去顆粒。
在一些實施例中,抗體為IgG1、IgG2、IgG3、IgG4、IgD、IgA、IgE或IgM抗體,或其變異體。在一些實施例中,抗體為嵌合、結構域、人類化或人類抗體。
在以上提及之實施例中之任一者中,抗體或其抗原結合片段可包含本文中所描述之可變輕鏈及本文中所描述之輕鏈恆定域(例如人類輕鏈恆定域)中之任一者。舉例而言,輕鏈恆定域敍述於表34中。在一個實施例中,抗體或其抗原結合片段包含人類κ輕鏈恆定域或其變異體。在各種實施例中,變異體包含至多1-25個經修飾之胺基酸取代(例如20個取代)。在另一實施例中,抗體或其抗原結合片段包含人類λ輕鏈恆定域或其變異體。在各種實施例中,變異體包含至多1-25個經修飾之胺基酸取代(例如20個取代)。在一個實施例中,抗體或其抗原結合片段包含人類κ輕鏈恆定域,其包含SEQ ID NO:256之胺基酸序列。
在本發明之另一態樣中,本文中提供雙特異性抗體,其包含本文中所描述之抗LAP抗體之對LAP具有特異性之第一結合區,及結合於另一抗原(例如腫瘤相關抗原、CD4、CD8、CD45、CD56、CD14、CD16、CD19、CD11b、CD25、CD20、CD22、CD30、CD38、CD114、CD23、CD73、CD163、CD206、CD203、CD200R或CD39)之第二結合區或治療劑。在各種實施例中,第二結合區或治療劑結合於受體蛋白。
在本發明之另一態樣中,本文中提供免疫結合物,其包含與可偵測部分、結合部分、標記部分及/或生物活性部分(例如雙特異性分子及/或雙功能分子)連接之本文中所描述之抗LAP抗體或抗原結合片段。舉例而言,生物活性部分包含受體陷阱構築體。
在本發明之另一態樣中,本文中提供核酸(一或多種核酸),其包含編碼本文中所描述之抗LAP抗體或抗原結合片段之重鏈及/或輕鏈可變區之核苷酸序列,以及包含其之表現載體,及經該(該等)表現載體轉型之細胞。在另一態樣中,本文中提供核酸(一或多種核酸),其包含編碼本文中所描述之抗LAP抗體或抗原結合片段之重鏈及/或輕鏈之核苷酸序列,以及包含其之表現載體,及經該(該等)表現載體轉型之細胞。
在本發明之另一態樣中,本文中提供醫藥組合物,其包含本文中所描述之抗LAP抗體或抗原結合片段及醫藥學上可接受之載劑。在一些實施例中,組合物包含一或多種其他治療劑,諸如抗癌劑、化學治療劑、免疫調節劑(例如免疫刺激劑或免疫抑制劑)、消炎劑及/或免疫檢查點阻斷劑(例如抗PD-1抗體、抗PD-L1抗體、抗LAG-3抗體、抗CTLA-4抗體、抗TIGIT抗體及抗TIM3抗體)。舉例而言,PD-1抗體為派立珠單抗(pembrolizumab)。
在一個實施例中,本文中所描述之抗LAP抗體或其抗原結合片段(例如表34中所描述之20E6及其人類化版本)與經分離之抗體結合,該經分離之抗體包含有包含SEQ ID NO:240之胺基酸序列之免疫球蛋白重鏈及包含SEQ ID NO:241之胺基酸序列之免疫球蛋白輕鏈。SEQ ID NO:240及241對應於派立珠單抗之重鏈及輕鏈序列。
在一個實施例中,本文中所描述之抗LAP抗體或其抗原結合片段(例如表34中所描述之20E6及其人類化版本)與經分離之抗體結合,該經分離之抗體包含有包含SEQ ID NO:246之胺基酸序列之免疫球蛋白重鏈及包含SEQ ID NO:247之胺基酸序列之免疫球蛋白輕鏈。SEQ ID NO:246及247對應於派立珠單抗之重鏈及輕鏈序列。
在本發明之另一態樣中,本文中提供套組,其包含本文中所描述之抗LAP抗體或抗原結合片段及使用說明書。
在本發明之另一態樣中,本文中提供製備特異性結合於LAP之抗體之方法,其包含:(a)用包含由28G11識別之人類LAP上之抗原決定基之多肽使動物免疫,(b)自經免疫之動物選擇與28G11結合於相同抗原決定基之抗體,及(c)分離自步驟(b)選擇之抗體。在一些實施例中,抗體結合於包含TGFβ1之人類LAP複合物。在一些實施例中,抗體結合於人類LAP之所有或一部分殘基82-130 (例如在該等殘基內)。
在本發明之另一態樣中,本文中提供一種方法,其選擇性抑制細胞(例如免疫抑制性細胞,諸如抑制性T細胞(例如調節性T細胞、經活化之T細胞)、M2巨噬細胞、表現LAP-TGFβ1之癌細胞、癌症相關纖維母細胞、間質基質細胞、間葉幹細胞及/或單核球性骨髓衍生之抑制細胞)上之TGFβ1活化,但不抑制細胞外基質上之TGFβ1活化,該方法包含向個體投與本文中所描述之任何抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物。
在本發明之另一態樣中,本文中提供治療癌症之方法,其包含向有需要之個體投與治療有效量之本文中所描述之任何抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物。
在一些實施例中,癌症之特徵在於異常TGFβ活性。在一些實施例中,癌症與分化叢集4 (CD4)+調節性T細胞、分化叢集8 (CD8)+調節性T細胞、調節性B細胞、骨髓衍生之抑制細胞、腫瘤相關巨噬細胞、癌症相關纖維母細胞及/或先天性淋巴細胞之浸潤相關聯。
在一些實施例中,癌症為乳癌、膀胱癌、子宮/子宮頸癌、卵巢癌、前列腺癌、睪丸癌、食道癌、胃腸癌、胰臟癌、結腸直腸癌、結腸癌、腎癌、頭頸癌、肺癌、胃癌、生殖細胞癌、骨癌、肝癌、甲狀腺癌、皮膚癌、中樞神經系統之贅瘤、淋巴瘤、白血病、骨髓瘤、肉瘤或骨髓發育不良症候群。
在上文所描述之方法之一些實施例中,投與一或多種其他療法,例如放射療法、化學療法、免疫檢查點抑制劑(例如抗PD-1抗體、抗PD-L1抗體、抗LAG-3抗體、抗CTLA-4抗體、抗TIGIT抗體及抗TIM3抗體)、免疫刺激性療法、免疫抑制性療法、細胞療法及治療劑(例如抗癌劑、化學治療劑、免疫抑制劑、免疫調節劑及消炎劑)。
在本發明之另一態樣中,本文中提供偵測LAP之方法,其包含使樣本(例如生物樣本)與本文中所描述之任何抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物接觸,及偵測複合物。
在本發明之另一態樣中,本文中提供診斷與調節性T細胞浸潤相關聯之癌症之方法,其包含使來自罹患癌症之患者之生物樣本與本文中所描述之任何抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物接觸,其中抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物之陽性染色指示癌症與調節性T細胞浸潤相關聯。
在本發明之另一態樣中,本文中提供診斷與GARP陰性抑制性細胞相關聯之癌症之方法,其包含使來自罹患癌症之患者之生物樣本與本文中所描述之結合於GARP陰性抑制性細胞之任何抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物接觸,其中抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物之陽性染色以及抗GARP抗體之陰性染色指示癌症與GARP陰性抑制性細胞相關聯。
在本發明之另一態樣中,本文中提供選擇罹患癌症之患者以用本文中所描述之抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物治療之方法,其包含使來自患者之生物樣本與抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物接觸,其中抗體或抗原結合片段之陽性染色指示癌症能夠用抗體治療。
在本發明之另一態樣中,本文中提供測定罹患癌症之患者對用本文中所描述之抗LAP抗體或抗原結合片段進行的治療之反應之方法,其包含使來自患者之生物樣本與抗體或抗原結合片段接觸,其中抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物之染色減少指示癌症對用抗體進行之治療起反應。
在本發明之另一態樣中,本文中提供製備特異性結合於由28G11識別之人類LAP上的相同抗原決定基之抗體之方法,其包含用包含肽之免疫原使動物免疫,其中該肽包含由28G11識別之抗原決定基;自經免疫之動物選擇與28G11結合於相同抗原決定基之抗體;及獲得與28G11結合於相同抗原決定基之抗體。在各種實施例中,人類LAP包含有包含人類LAP及TGFβ1之複合物。
本發明之另一態樣為本文中所描述之抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物中之任一者之用途,其係用於選擇性抑制免疫抑制性細胞上之TGFβ1活化,但不抑制細胞外基質上之TGFβ1活化;治療癌症;診斷癌症(例如與調節性T細胞浸潤或GARP陰性抑制性細胞相關聯之癌症);選擇罹患癌症之患者;及測定罹患癌症之患者對用本文中所描述之抗LAP抗體進行之治療之反應。亦提供本文中所描述之抗LAP抗體或抗原結合片段、雙特異性分子、免疫結合物及/或醫藥組合物中之任一者之用途,其係用於製備藥劑,該藥劑係用於選擇性抑制免疫抑制性細胞上之TGFβ1活化,但不抑制細胞外基質上之TGFβ1活化,及治療癌症。
相關申請案
本申請案主張2018年10月10日提交之美國臨時專利申請案第62/744,045號、2018年10月24日提交之美國臨時專利申請案第62/750,065號及2018年11月8日提交之美國臨時專利申請案第62/757,519號之權利,其各自以全文引用之方式併入本文中。
定義
為了使以下詳細說明更易於理解,首先定義某些術語。通篇提供其他定義。
在分子之活性、含量或表現之情形下,「異常」意謂活性、含量或表現不屬於該分子之正常活性、含量或表現。在活性、含量或表現之情形下,「正常」係指在健康、性別匹配及年齡匹配之個體群體中發現的蛋白質之活性、含量或表現之範圍。可使用標準統計學量度來測定此健康群體之最小尺寸,例如醫師可考慮一般群體中疾病之發病率及結果中所需的統計確定性程度。較佳地,由個體群體(例如至少五名、十名或二十名個體),更佳由至少四十或八十名個體之群體且甚至更佳由超過100名個體測定生物標記之活性、含量或表現之正常範圍。
如本文中所使用,「潛在相關肽」或「LAP」係指人類TGFβ1前驅肽之胺基端結構域且具有SEQ ID NO:2中所闡述之胺基酸序列。「LAP-TGFβ1」及「LAP/TGFβ1」在本文中可互換地用於指人類TGFβ1前驅肽(其包括TGFβ1細胞介素)且包括SEQ ID NO:1之胺基酸序列(移除信號序列之Uniprot sp|P01137|TGFB1_HUMAN)。
LAP亦可指人類TGFβ2前驅肽(LAP區域:SEQ ID NO:4,LAP-TGFβ2:SEQ ID NO:3)及人類TGFβ3前驅肽(LAP區域:SEQ ID NO:6,LAP-TGFβ2:SEQ ID NO:5)之胺基端結構域,以及其來自其他物種之對應物(例如小鼠TGFβ1前驅肽(小鼠LAP區域:SEQ ID NO:8;小鼠LAP-TGFβ1:SEQ ID NO:7)、小鼠TGFβ2前驅肽(小鼠LAP區域:SEQ ID NO:10;小鼠LAP-TGFβ2:SEQ ID NO:9),及小鼠TGFβ3前驅肽(小鼠LAP區域:SEQ ID NO:12;小鼠LAP-TGFβ3:SEQ ID NO:11))以及其他天然存在之對偶基因、剪接變異體及其經處理之形式。LAP係以與TGFβ之複合物形式合成。在不存在成熟TGFβ之情況下,LAP稱為「空LAP」。除非另外說明,否則如本文中所使用之「空LAP」係指來源於人類TGFβ1之N端結構域之LAP。除LAP上之殘基以外,本文中所描述之抗LAP抗體亦可結合於LAP-TGFβ1複合物內之成熟TGFβ之殘基。但在所有情況下,抗體至少結合於複合物之LAP部分中之殘基。
如本文中所使用,「自由TGFβ1」係指成熟TGFβ1細胞介素,亦即,不與LAP複合之TGFβ1。
如本文中所使用,「錨蛋白質」係指將LAP-TGFβ錨定至細胞表面或細胞外基質之蛋白質。例示性錨蛋白質包括GARP、LRRC33、LTBP1、LTBP3及LTBP4。GARP及LRRC33為將LAP-TGFβ錨定至細胞表面之蛋白質,且LTBP1、LTBP3及LTBP4為將LAP-TGFβ錨定至細胞外基質之蛋白質。
如本文中所使用,術語「抗體」包括完全抗體及其任何抗原結合片段(亦即,「抗原結合部分」)或單鏈。在一個實施例中,「抗體」係指包含藉由二硫鍵互連之至少兩個重(H)鏈及兩個輕(L)鏈之醣蛋白,或其抗原結合部分。各重鏈包含重鏈可變區(本文中縮寫為VH
)及重鏈恆定區。在某些天然存在之抗體中,重鏈恆定區包含三個結構域,即CH1、CH2及CH3。在某些天然存在之抗體中,各輕鏈包含輕鏈可變區(本文中縮寫為VL
)及輕鏈恆定區。輕鏈恆定區包含一個結構域,即CL。VH
及VL
區可進一步細分成高變區,稱為互補決定區(CDR),穿插有稱為構架區(FR)之保守性更高的區域。各VH
及VL
由自胺基端至羧基端按以下順序排列之三個CDR及四個FR組成:FR1、CDR1、FR2、CDR2、FR3、CDR3、FR4。重鏈及輕鏈之可變區含有與抗原相互作用之結合域。抗體之恆定區可介導免疫球蛋白結合於宿主組織或因子,包括免疫系統之多種細胞(例如效應細胞)及經典補體系統之第一組分(C1q)。
如本文中所使用,「同型」係指由重鏈恆定區基因編碼之抗體類別(例如IgG1、IgG2、IgG3、IgG4、IgM、IgA1、IgA2、IgD及IgE抗體)。
抗體通常以高親和力特異性結合於其同源抗原,該高親和力由解離常數(KD
)為10-5
至10-11
M或更小反映。任何大於約10-4
M之KD
通常被視為指示非特異性結合。如本文中所使用,「特異性結合」於抗原之抗體係指以高親和力結合於抗原及實質上一致之抗原,但不以高親和力結合於不相關抗原的抗體,高親和力意謂KD
為10-7
M或更低,較佳為10-8
M或更低,甚至更佳為5×10-9
M或更低,且最佳在10-8
M與10-10
M之間或更低。
如本文中所使用,片語抗體之「抗原結合部分」係指抗體中保留特異性結合於抗原(例如人類及/或小鼠LAP)之能力之一或多個片段。已證實,抗體之抗原結合功能可由全長抗體之片段執行。抗體之結合片段之實例包括(i)Fab片段,一種由VL
、VH
、CL及CH1結構域組成之單價片段;(ii)F(ab')2
片段,一種包含由鉸鏈區處之二硫橋鍵連接之兩個Fab片段之二價片段;(iii)Fd片段,其由VH
及CH1結構域組成;(iv)Fv片段,其由抗體之單臂之VL
及VH
結構域組成,(v)dAb片段(Ward等人, (1989)Nature
341:544-546),其由VH
結構域組成;及(vi)經分離之互補決定區(CDR)或(vii)兩個或更多個經分離之CDR (其可視情況由合成連接子接合)之組合。此外,儘管Fv片段之兩個結構域VL
及VH
由單獨的基因編碼,但其可使用重組方法藉由合成連接子接合,該合成連接子使其可製成單一蛋白質鏈,其中VL
及VH
區配對以形成單價分子(稱為單鏈Fv (scFv);參見例如Bird等人, (1988)Science
242:423-426;及Huston等人, (1988)Proc. Natl. Acad. Sci. USA
85:5879-5883)。此類單鏈抗體亦意欲涵蓋於術語抗體之「抗原結合部分」內。此等抗體片段係使用熟習此項技術者已知之習知技術獲得,且以與完整抗體相同之方式針對效用來篩選片段。抗原結合部分可藉由重組型DNA技術,或藉由完整免疫球蛋白之酶促或化學裂解來產生。
本發明之範疇內之抗體片段亦包括F(ab')2片段,其可藉由IgG之由例如胃蛋白酶進行之酶促裂解產生。Fab片段可藉由例如用二硫蘇糖醇或巰基乙胺還原F(ab')2來產生。Fab片段為藉由二硫橋鍵附接至VH-CH1鏈之VL-CL鏈。F(ab')2片段為兩個Fab片段,其又由兩個二硫橋鍵附接。F(ab')2分子之Fab部分包括二硫橋鍵位於其間之Fc區之一部分。
術語「受體人類構架」係指包含來源於人類免疫球蛋白構架或人類保守性構架之輕鏈可變域(VL
)構架或重鏈可變域(VH
)構架之胺基酸序列之構架。「來源於」人類免疫球蛋白構架或人類保守性構架之受體人類構架可與天然存在之人類免疫球蛋白構架或人類共同構架具有相同的胺基酸序列,或其與野生型天然存在之人類免疫球蛋白構架或人類共同構架相比可具有胺基酸序列變化。在一些實施例中,胺基酸變化之數目為10、9、8、7、6、5、4、3或2或1。在一些實施例中,VL
受體人類構架與VL
人類免疫球蛋白構架序列或人類共同構架序列在序列上一致。
「多特異性抗體」為識別兩種或更多種不同抗原或抗原決定基之抗體(例如雙特異性抗體、三特異性抗體)。
如本文中所使用,術語「結合蛋白」亦指特異性結合於至少一個目標抗原之非天然存在之(或重組型)蛋白質。
「雙特異性」或「雙功能抗體」為具有兩個不同重鏈/輕鏈對及兩個不同結合位點之人工雜交抗體。雙特異性抗體可藉由包括融合瘤融合或Fab'片段連接之多種方法產生。參見例如Songsivilai及Lachmann,Clin. Exp. Immunol.
79:315-321 (1990);Kostelny等人,J. Immunol.
148, 1547-1553 (1992)。雙功能抗體包括例如雜二聚抗體結合物(例如接合在一起的兩個抗體或抗體片段,其各自具有不同特異性)、抗體/細胞表面結合分子結合物(例如與非抗體分子(諸如受體)結合之抗體)及雜交抗體(例如具有針對兩個不同抗原之結合位點之抗體)。
術語「重組型抗體」係指藉由重組型手段製備、表現、產生或分離之抗體,諸如(a)自免疫球蛋白基因(例如人類免疫球蛋白基因)為轉殖基因或轉殖染色體的動物(例如小鼠)或自其製備之融合瘤分離之抗體;(b)自經轉型以表現抗體之宿主細胞(例如自轉染瘤)分離之抗體;(c)使用噬菌體呈現自重組型組合抗體文庫(例如含有人類抗體序列)分離之抗體;及(d)藉由涉及免疫球蛋白基因序列(例如人類免疫球蛋白基因)與其他DNA序列拼接的任何其他方式製備、表現、產生或分離之抗體。此類重組型抗體可具有來源於人類生殖系免疫球蛋白序列之可變區及恆定區。然而,在某些實施例中,此類重組型人類抗體可經歷活體外突變誘發且因此,重組型抗體之VH
及VL
區的胺基酸序列為雖然來源於人類生殖系VH
及VL
序列且與其相關,但可能並非天然地活體內存在於人類抗體生殖系譜系中的序列。
「人類」抗體係指具有其中構架區及CDR區皆來源於人類生殖系免疫球蛋白序列之可變區的抗體。此外,若抗體含有恆定區,則恆定區亦來源於人類生殖系免疫球蛋白序列。亦涵蓋為來源於人類生殖系免疫球蛋白序列之抗體,其包括相對於野生型生殖系免疫球蛋白序列改變生殖系免疫球蛋白序列之正常體細胞超突變。
「人類化」抗體係指其中非人類抗體之CDR結構域外的一些、大部分或所有胺基酸由來源於人類免疫球蛋白之相應胺基酸置換之抗體。在抗體之人類化形式之一個實施例中,CDR結構域外的一些、大部分或所有胺基酸由來自人類免疫球蛋白之胺基酸置換,而一或多個CDR區內之一些、大部分或所有胺基酸不變。胺基酸之任何添加、缺失、插入、取代或修飾為容許的,只要其不消除抗體結合於特定抗原之能力即可。「人類化」抗體保留類似於原始抗體之抗原特異性。
「嵌合抗體」係指其中可變區來源於一或多個物種且恆定區來源於另一物種之抗體,諸如其中可變區來源於小鼠抗體且恆定區來源於人類抗體之抗體。參見美國專利案第4,816,567號;及Morrison等人, (1984)Proc. Natl. Acad Sci. USA
81: 6851-6855。
如本文中所使用,術語「單株抗體」係指自實質上均質的抗體之群體獲得之抗體,亦即,除可能在單株抗體產生期間產生之可能的變異體(此類變異體通常以少量存在)以外,該群體中之個別抗體實質上類似且結合相同抗原決定基(例如,抗體顯示單一結合特異性及親和力)。
「單株」指示自實質上均質的抗體群體獲得之抗體之特徵,且無需藉由任何特定方法產生抗體。
如本文中所使用,術語「單株抗體」係指對特定抗原決定基顯示單一結合特異性及親和力之抗體或其中所有抗體對特定抗原決定基顯示單一結合特異性及親和力之抗體組合物。舉例而言,欲根據本發明使用之單株抗體可藉由Kohler等人 (1975)Nature
256: 495首先描述的融合瘤方法製得,或可藉由重組型DNA方法(參見例如美國專利案第4,816,567號)製得。「單株抗體」亦可使用Clackson等人 (1991)Nature
352: 624-628及Marks等人 (1991)J. Mol. Biol.
222: 581-597中描述之技術自噬菌體抗體文庫分離。
如本文中所使用之術語「單株抗體」亦涵蓋此類免疫球蛋白之抗原結合片段(包括scFv)。單株抗體針對單一抗原位點具有高特異性。此外,與通常包括針對抗原上之不同抗原決定基之不同抗體的習知(多株)抗體製劑相比,各單株抗體係針對單一抗原決定基。單株抗體可使用此項技術中認可之任何技術及本文中所描述之技術製備,諸如融合瘤方法、基因轉殖動物、重組型DNA方法(參見例如美國專利案第4,816,567號),或使用噬菌體抗體文庫,使用例如美國專利案第7,388,088號及PCT公開案第WO 00/31246號中所描述的技術。單株抗體包括嵌合抗體、人類抗體及人類化抗體,且可天然地存在或以重組方式產生。
「結構域抗體」為僅含有重鏈可變區或輕鏈可變區之免疫功能性免疫球蛋白片段。在一些情況下,兩個或更多個VH
區與肽連接子共價接合以產生二價結構域抗體。二價結構域抗體之兩個VH
區可靶向相同或不同抗原。
「二價抗體」包含兩個抗原結合位點。在一些情況下,兩個結合位點具有相同抗原特異性。然而,二價抗體可為雙特異性(參見下文)。
如本文中所使用,術語「單鏈Fv」或「scFv」抗體係指包含抗體之VH
及VL
結構域之抗體片段,其中此等結構域存在於單一多肽鏈中。通常,Fv多肽進一步包含多肽連接子。關於sFv之綜述,參見Pluckthun (1994) THE PHARMACOLOGY OF MONOCLONAL ANTIBODIES, 第113卷, Rosenburg及Moore編 Springer-Verlag, New York, 第269-315頁。
本文中之單株抗體亦包括駱駝化單結構域抗體。參見例如Muyldermans等人 (2001)Trends Biochem. Sci
. 26:230;Reichmann等人 (1999)J. Immunol. Methods
231:25;WO 94/04678;WO 94/25591;美國專利案第6,005,079號,其以全文引用之方式併入本文中。在一個實施例中,本發明提供包含兩個VH
結構域之單結構域抗體,該兩個VH
結構域具有修飾使得形成單結構域抗體。
如本文中所使用,術語「雙功能抗體」係指具有兩個抗原結合位點之小型抗體片段,該等片段包含連接至同一多肽鏈(VH
-VL
或VL
-VH
)中之輕鏈可變域(VL
)的重鏈可變域(VH
)。藉由使用過短以使得同一鏈上之兩個結構域之間不能配對的連接子,迫使結構域與另一條鏈之互補結構域配對,且產生兩個抗原結合位點。雙功能抗體更全面地描述於例如EP 404,097;WO 93/11161;及Holliger等人, (1993)Proc. Natl. Acad. Sci. USA
90: 6444-6448中。關於經工程改造之抗體變異體之綜述,通常參見Holliger及Hudson (2005)Nat. Biotechnol.
23:1126-1136。
本發明之抗體亦包括具有經修飾(或經阻斷)之Fc區以提供改變之效應功能之抗體。參見例如美國專利案第5,624,821號;WO2003/086310;WO2005/120571;WO2006/0057702;Presta (2006)Adv. Drug Delivery Rev.
58:640-656。此類修飾可用於增強或抑制免疫系統之各種反應,在診斷及療法中可能具有有益作用。Fc區之變化包括胺基酸變化,諸如取代、缺失及插入、糖基化或去糖基化,及添加多個Fc。Fc之變化可用於改變治療性抗體中之抗體之半衰期,且更長的半衰期將引起更不頻繁的給藥,以及隨之而來的增加的便利性及降低的物質用量。參見Presta (2005)J. Allergy Clin. Immunol.
116:731, 734-35。
術語「完全人類抗體」係指僅包含人類免疫球蛋白序列之抗體。若產生於小鼠中、小鼠細胞中或來源於小鼠細胞之融合瘤中,則完全人類抗體可含有鼠類碳水化合物鏈。類似地,「小鼠抗體」係指僅包含小鼠免疫球蛋白序列之抗體。
如本文中所使用,術語「高變區」(有時稱為「可變區」)係指負責抗原結合之抗體之胺基酸殘基。高變區包含來自「互補決定區」或「CDR」之胺基酸殘基(例如輕鏈可變域中之殘基24-34 (CDRL1)、50-56 (CDRL2)及89-97 (CDRL3)以及重鏈可變域中之殘基31-35 (CDRH1)、50-65 (CDRH2)及95-102 (CDRH3);Kabat等人, (1991) Sequences of Proteins of Immunological Interest, 第5版 Public Health Service, National Institutes of Health, Bethesda, Md.)及/或來自「高變環」之殘基(亦即輕鏈可變域中之殘基26-32 (L1)、50-52 (L2)及91-96 (L3)以及重鏈可變域中之26-32 (H1)、53-55 (H2)及96-101 (H3);Chothia及Lesk, (1987)J. Mol. Biol.
196: 901-917)。
如本文中所使用,術語「構架」或「FR」殘基係指除在本文中定義為CDR殘基之高變區殘基以外的可變域殘基。以上殘基編號係關於Kabat編號系統且未必詳細對應於隨附序列表中之序列編號。抗體中之胺基酸殘基亦可使用其他編號系統定義,諸如Chothia、增強型Chothia、IMGT、Kabat/Chothia複合系統、Honegger (AHo)、Contact或任何其他習知的抗體編號流程。
如本文中所使用,「經分離之抗體」意指一種抗體,其實質上不含其他具有不同抗原特異性之抗體。
如本文中所使用,「同型」係指由抗體之重鏈恆定區基因編碼之抗體類別(例如IgG (包括IgG1、IgG2、IgG3及IgG4)、IgM、IgA (包括IgA1及IgA2)、IgD及IgE抗體)。
「效應功能」係指抗體Fc區與Fc受體或配位體之相互作用,或由其產生之生物化學事件。例示性「效應功能」包括Clq結合、補體依賴性細胞毒性(CDC)、Fc受體結合、FcγR介導之效應功能,諸如ADCC,及抗體依賴性細胞介導之吞噬(ADCP),及細胞表面受體(例如B細胞受體;BCR)之下調。此類效應功能通常需要Fc區與結合域(例如抗體可變域)組合。
「Fc區」、「Fc結構域」或「Fc」係指抗體重鏈之C端區域。因此,Fc區包含除第一恆定區免疫球蛋白結構域(例如CH1或CL)以外之抗體之恆定區。
術語「抗原決定基」或「抗原決定子」係指免疫球蛋白或抗體特異性結合之抗原(例如人類LAP-TGFβ1)上之位點。抗原決定基可由相鄰胺基酸(通常為線形抗原決定基)或藉由蛋白質之三級摺疊而並列之非相鄰胺基酸(通常為構形抗原決定基)兩者形成。由相鄰胺基酸形成之抗原決定基通常(但不始終)在暴露於變性溶劑後保留,而藉由三級摺疊形成之抗原決定基通常在變性溶劑處理後消失。抗原決定基典型地在獨特空間構形中包括至少3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21或22個胺基酸。
術語「抗原決定基定位」係指用於鑑別涉及抗體-抗原識別之抗原上的分子決定子之方法。用於測定既定抗體結合哪些抗原決定基之方法為此項技術中熟知的且包括例如免疫墨點法及免疫沈澱分析法,其中測試來自例如LAP-TGFβ1之重疊或相鄰肽與既定抗體(例如抗LAP抗體)之反應性;X射線結晶學;抗原突變分析、二維核磁共振;酵母呈現;及氫/氘交換-質譜法(HDX-MS)(參見例如Epitope Mapping Protocols in Methods in Molecular Biology
, 第66卷, G. E. Morris編, (1996))。亦參見Champe等人 (1995)J. Biol. Chem
. 270:1388-1394。
關於兩種或更多種抗體之術語「結合於相同抗原決定基」意謂該等抗體結合於胺基酸殘基之同一區段或相同區段,如藉由既定方法所測定。用於測定抗體是否與本文中所描述之抗體結合於「LAP-TGFβ1上之相同抗原決定基」的技術包括例如抗原決定基定位法,諸如抗原:抗體複合物之晶體之x射線分析,其提供抗原決定基之原子解析度,及HDX-MS。其他方法監測抗體與抗原片段(例如蛋白水解片段)或抗原之突變型變化形式之結合,其中由抗原序列內胺基酸殘基之修飾引起之結合之減少通常視為抗原決定基組分之指示,諸如丙胺酸掃描突變誘發(Cunningham及Wells (1985)Science
244:1081)、突變型目標序列變異體之酵母呈現或嵌合體之分析(例如實例2及3中所描述)。此外,亦可使用抗原決定基定位之計算組合方法。此等方法依賴於相關抗體自組合噬菌體呈現肽文庫親和分離特定短肽之能力。預期具有相同VH
及VL
或相同CDR1、2及3序列之抗體結合於相同抗原決定基。
「與另一抗體競爭結合於目標」之抗體係指抑制(部分或完全)另一抗體與目標之結合之抗體。兩種抗體是否彼此競爭結合於目標,亦即一種抗體是否抑制另一抗體與目標之結合及其抑制程度可使用已知的結合競爭實驗(例如BIACORE®
表面電漿子共振(SPR)分析)來測定。在某些實施例中,抗體與另一抗體競爭且抑制其與目標之結合達至少50%、60%、70%、80%、90%或100%。視何種抗體為「阻斷抗體」(亦即,在與抗原組合時阻斷該抗原之另一種免疫反應之抗體)而定,抑制或競爭程度可不同。競爭分析法可如例如Ed Harlow及David Lane, Cold Spring Harb. Protoc. 2006; doi:10.1101/pdb.prot4277或Ed Harlow及David Lane編輯之「Using Antibodies」中之第11章, Cold Spring Harbor Laboratory Press, Cold Spring Harbor, NY, USA 1999中所描述來進行。競爭抗體結合於相同抗原決定基、重疊抗原決定基或相鄰抗原決定基(例如由位阻所證明)。若抗體彼此雙向阻斷至少50%,則兩種抗體「交叉競爭」,亦即與在競爭實驗中一種抗體或另一種抗體是否首先與抗原接觸無關。
用於測定兩種抗體是否競爭或交叉競爭結合之競爭性結合分析法包括關於結合於表現LAP-TGFβ1之細胞之競爭,例如藉由流式細胞測量術。其他方法包括:表面電漿子共振(SPR)(例如BIACORE®
)、固相直接或間接放射免疫分析法(RIA)、固相直接或間接酶免疫分析法(EIA)、夾心競爭分析法(參見Stahli等人,Methods in Enzymology
9:242 (1983));固相直接生物素-抗生物素蛋白EIA (參見Kirkland等人,J. Immunol.
137:3614 (1986));固相直接標記分析法、固相直接標記夾心分析法(參見Harlow及Lane, Antibodies: A Laboratory Manual, Cold Spring Harbor Press (1988));使用I-125標記之固相直接標記RIA (參見Morel等人,Mol. Immunol.
25(1):7 (1988));固相直接生物素-抗生物素蛋白EIA (Cheung等人,Virology
176:546 (1990));及直接標記RIA. (Moldenhauer等人,Scand. J. Immunol.
32:77 (1990))。
如本文中所使用,術語「特異性結合(specific binding/specifically binds)」及「選擇性結合(selective binding/selectively binds)」係指抗體結合於預定抗原上之抗原決定基。通常,抗體(i)在藉由例如使用預定抗原作為分析物且使用抗體作為配位體之表面電漿子共振(SPR)或抗體與抗原陽性細胞之結合之史卡查分析(Scatchard analysis)測定時,以約小於10-7
M (諸如約小於10-8
M、10-9
M或10-10
M或甚至更低)之平衡解離常數(KD
)結合,及(ii)以比前結合於除預定抗原或緊密相關抗原以外的非特異性抗原(例如BSA、酪蛋白)之親和力大至少兩倍的親和力結合於預定抗原。任何大於約10-4
M之KD
通常被視為指示非特異性結合。
如本文中所使用之術語「kassoc
」或「ka
」係指特定抗體-抗原相互作用之結合速率,而如本文中所使用之術語「kdis
」或「kd
」意指特定抗體-抗原相互作用之解離速率。如本文中所使用,術語「KD
」意指解離常數,其獲自kd
與ka
之比率(亦即,kd
/ka
)且以莫耳濃度(M)表示。抗體之KD
值可使用此項技術中公認之方法測定。用於測定抗體之KD
之較佳方法係使用表面電漿子共振,較佳使用生物感測器系統,諸如Biacore®系統或流式細胞測量術及史卡查分析,或生物層干涉術。
在使用抗體之活體外或活體內分析法之情形下,術語「EC50」係指誘導最大反應之50%之反應,亦即最大反應與基線之間的一半的抗體之濃度。
如本文中所使用,術語「交叉反應」係指本文中所描述之抗體結合於來自不同物種之LAP-TGFβ1之能力。舉例而言,本文中所描述之結合人類LAP-TGFβ1之抗體亦可結合另一物種之LAP-TGFβ1(例如鼠類LAP-TGFβ1、大鼠LAP-TGFβ1或食蟹獼猴LAP-TGFβ1)。可藉由在結合分析法(例如SPR、ELISA、生物層干涉術)中偵測與經純化之抗原之特定反應性或與生理學上表現LAP-TGFβ1之細胞(例如過表現LAP-TGFβ1之HT1080細胞)之結合或其他功能性相互作用來量測交叉反應性。用於測定交叉反應性之方法包括如本文中所描述之標準結合分析法,例如藉由生物層干涉術或流動式細胞測量技術。
如本文中所使用,術語「連接」係指兩個或更多個分子之結合。連接可為共價或非共價的。連接亦可為遺傳的(亦即,以重組方式融合)。此類連接可使用諸如化學結合及重組型蛋白質產生之廣泛多種之此項技術中公認之技術來達成。
如本文中所使用,術語「核酸分子」意欲包括DNA分子及RNA分子。核酸分子可為單股或雙股,但較佳為雙股DNA。
如本文中關於編碼抗體或抗體片段(例如VH
、VL
、CDR3)之核酸所使用,術語「經分離之核酸分子」意指一種核酸分子,其中核苷酸序列基本上不含其他基因組核苷酸序列,例如編碼結合除LAP以外之抗原之抗體的核酸分子,該等其他序列可天然地側接人類基因組DNA中之核酸。
如本文中所使用,術語「載體」意指能夠運輸其已連接之另一核酸的核酸分子。一種載體為「質體」,其係指可與其他DNA區段接合之環形雙股DNA環。另一種載體為病毒載體,其中其他DNA區段可與病毒基因組接合。某些載體能夠在其所引入之宿主細胞中自主複製(例如具有細菌複製起點之細菌載體及游離型哺乳動物載體)。其他載體(例如非游離型哺乳動物載體)可在引入宿主細胞中時整合至宿主細胞之基因組中,且藉此與宿主基因組一起複製。此外,某些載體能夠引導與其操作性連接之基因之表現。此類載體在本文中稱為「重組型表現載體」(或簡稱為「表現載體」)。一般而言,在重組型DNA技術中有用之表現載體通常呈質體形式。在本發明書中,由於質體為最常用之載體形式,因此「質體」與「載體」可互換使用。然而,亦包括提供同等功能之其他表現載體形式,諸如病毒載體(例如複製缺陷反轉錄病毒、腺病毒及腺相關病毒)。
亦提供本文中所闡述之序列之「保守性序列修飾」,亦即,不會消除由核苷酸序列編碼或含有胺基酸序列之抗體與抗原之結合之胺基酸序列修飾。此類保守性序列修飾包括保守性核苷酸及胺基酸取代,以及核苷酸及胺基酸添加及缺失。舉例而言,可藉由此項技術中已知的標準技術(諸如定點突變誘發及PCR介導之突變誘發)將修飾引入本文中之表(例如表 34
)中之序列中。保守性胺基酸取代包括胺基酸殘基由具有類似側鏈之胺基酸殘基置換。此項技術中已定義具有類似側鏈之胺基酸殘基家族。此等家族包括具有鹼性側鏈(例如離胺酸、精胺酸、組胺酸)、酸性側鏈(例如天冬胺酸、麩胺酸)、不帶電極性側鏈(例如甘胺酸、天冬醯胺、麩醯胺酸、絲胺酸、蘇胺酸、酪胺酸、半胱胺酸、色胺酸)、非極性側鏈(例如丙胺酸、纈胺酸、白胺酸、異白胺酸、脯胺酸、苯丙胺酸、甲硫胺酸)、β-分支鏈側鏈(例如蘇胺酸、纈胺酸、異白胺酸)及芳族側鏈(例如酪胺酸、苯丙胺酸、色胺酸、組胺酸)之胺基酸。因此,抗LAP抗體中之所預測的非必需胺基酸殘基較佳由來自相同側鏈家族之另一胺基酸殘基置換。鑑別不會消除抗原結合之核苷酸及胺基酸保守性取代之方法為此項技術中熟知的(參見例如Brummell等人,Biochem.
32:1180-1187 (1993);Kobayashi等人Protein Eng.
12(10):879-884 (1999);及Burks等人Proc. Natl. Acad. Sci. USA
94:412-417 (1997))。或者,在另一實施例中,突變可沿全部或一部分抗LAP抗體編碼序列隨機引入,諸如藉由飽和突變誘發,且可針對結合活性來篩選所得經修飾之抗LAP抗體。
關於核酸,術語「實質同源性」指示兩個核酸或其指定序列在進行最佳比對及比較時,至少約80%之核苷酸,通常至少約80%至85%、85%至90%或90%至95%且更佳至少約98%至99.5%之核苷酸為一致的,其中具有適當的核苷酸插入或缺失。或者,當區段在選擇性雜交條件下將與股之互補序列雜交時,存在實質同源性。關於多肽,術語「實質同源性」表示兩個多肽或其指示序列在進行最佳比對及比較時,至少約80%之胺基酸,通常至少約80%至85%、85%至90%、90%至95%且更佳至少約98%至99.5%之胺基酸為一致的,其中具有適當的核苷酸插入或缺失。
在考慮到需要引入以用於兩個序列之最佳比對的間隙之數目及各間隙之長度的情況下,兩個序列之間的一致性百分比為由該等序列共有之相同位置之數目的函數(亦即,同源性% = 相同位置數/位置總數×100)。序列之比較及兩個序列之間的一致性百分比之測定可使用數學演算法實現,如下文中之非限制性實例中所述。兩個核苷酸序列之間的一致性百分比可使用GCG套裝軟體(可在https://www.gcg.com獲得)中之GAP程式,使用NWSgapdna.CMP矩陣及間隙權數40、50、60、70或80及長度權數1、2、3、4、5或6來測定。亦可使用E. Meyers及W. Miller (CABIOS, 4:11-17 (1989))之演算法(其已併入ALIGN程式(2.0版)中),使用PAM120權數殘基表、間隙長度罰分12之及間隙罰分4來測定兩個核苷酸或兩個胺基酸序列之間的一致性百分比。此外,兩個胺基酸序列之間的一致性百分比可使用Needleman及Wunsch (J. Mol. Biol.
(48):444-453 (1970))演算法(其已併入GCG套裝軟體(可在www.gcg.com獲得)中之GAP程式中),使用Blossom 62矩陣或PAM250矩陣,及間隙權數16、14、12、10、8、6或4及長度權數1、2、3、4、5或6來測定。
本文中所描述之核酸及蛋白質序列可進一步用作「查詢序列」以針對公共資料庫進行搜尋,以例如鑑別相關序列。此類搜尋可使用Altschul等人 (1990)J. Mol. Biol.
215:403-10中之NBLAST及XBLAST程式(2.0版)進行。BLAST核苷酸搜尋可用NBLAST程式,分數=100,字長=12來進行以獲得與本文中所描述之核酸分子同源之核苷酸序列。BLAST蛋白質搜尋可用XBLAST程式,分數=50,字長=3來進行以獲得與本文中所描述之蛋白質分子同源之胺基酸序列。為使間隙式比對達成比較目的,可如Altschul等人, (1997)Nucleic Acids Res.
25(17):3389-3402中所描述使用間隙式BLAST。當使用BLAST及間隙式BLAST程式時,可使用各別程式(例如XBLAST及NBLAST)之預設參數。參見www.ncbi.nlm.nih.gov。
如本文中所使用,術語「重組型宿主細胞」(或簡稱為「宿主細胞」)意指包含不天然存在於細胞中之核酸的細胞,且可為已引入重組型表現載體之細胞。應理解,此類術語不僅意指特定個體細胞,而且意指此類細胞之後代。因為某些修飾可能因突變或環境影響而於後代中發生,所以此類後代可能實際上與親本細胞不一致,但仍包括於如本文中所使用之術語「宿主細胞」之範疇內。
如本文中所使用,術語「抑制」係指生物活性的任何統計顯著降低,包括活性之部分及完全阻斷。舉例而言,「抑制」可指生物活性出現約10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、96%、97%、98%、99%或100%的統計顯著降低。
如本文中所使用,「TGFβ1活化」係指自由LAP及TGFβ1組成之潛在複合物釋放成熟細胞介素TGFβ1。存在許多已知可誘導TGFβ1活化之機制(參見Robertson IB, Rifkin DB. Unchaining the beast; insights from structural and evolutionary studies on TGFβ1 secretion, sequestration, and activation. Cytokine Growth Factor Rev. 2013年8月;24(4):355-72)。可使用特定ELISA或類似偵測方法或經由使用表現TGFβ受體之報導體細胞株來偵測成熟細胞介素。
舉例而言,如本文中所使用,術語「抑制TGFβ1活化」包括TGFβ1活化之任何可量測之降低,例如與對照物(例如對照抗體)相比抑制TGFβ1活化達至少約10%,例如至少約20%、至少約30%、至少約40%、至少約50%、至少約60%、至少約70%、至少約80%、至少約90%、至少約99%或約100%。抑制可對單一TGFβ1活化機制具有特異性或可對所有TGFβ1活化機制普遍適用。如本文中所使用,術語「抑制TGFβ1活化」包括抑制至少一種活化機制。
如本文中所使用,術語「治療(treat/treating/treatment)」係指本文中所描述之治療性或預防性措施。「治療」方法使用向患有腫瘤或癌症之個體或易患此類疾病或病症之個體投與本文中所描述之抗LAP抗體(例如抗人類LAP抗體),以預防、治癒、延緩或改善疾病或病症或復發性疾病或病症之一或多種症狀、降低其嚴重程度,或以延長個體之存活時間使其超過在不存在此類治療之情況下預期之存活時間。
「免疫療法」係指藉由包含誘導、增強、抑制或以其他方式改變免疫反應的方法治療罹患疾病或具有感染或經歷疾病復發之風險的個體。
「免疫刺激療法」或「免疫刺激性療法」係指引起個體之免疫反應增加(誘導或增強)的療法,例如以治療癌症。
如本文中所使用,「免疫細胞」係指稱為白血球之血球之子集,其包括單核細胞,諸如淋巴細胞、單核球、巨噬細胞及粒細胞。
如本文中所使用,「免疫抑制性細胞」係指有助於或促進免疫抑制性腫瘤微環境之細胞。腫瘤微環境中存在免疫抑制性細胞群體可增加腫瘤對免疫反應之抗性,引起腫瘤保護、腫瘤逃逸及/或腫瘤轉移。除非以某種方式對抗,否則此等免疫抑制性細胞可降低免疫介導之抗癌治療之功效。例示性免疫抑制性細胞包括癌症相關纖維母細胞、骨髓衍生之抑制性細胞、調節性T細胞(Treg)、表現LAP之腫瘤細胞及免疫抑制性巨噬細胞。此等細胞類型可由熟習此項技術者使用例如用於鑑別Treg (例如CD4、FoxP3、CD127及CD25)、巨噬細胞(例如CSF-IR、CD203、CD206、CD163、IL-10及TGFβ)、癌症相關纖維母細胞(例如α平滑肌肌動蛋白、纖維母細胞活化蛋白、腱生蛋白-C、骨膜蛋白、NG2、波形蛋白、結蛋白、PDGFRα及β、FSP-1、ASPN及STC1)及骨髓衍生之抑制性細胞(例如CD11b、CD33、CD14或CD15,及少量HLA DR)之標記之流式細胞測量術鑑別。應理解,免疫抑制性細胞在抑制其他疾病病況中之免疫系統方面亦可為重要的。
如本文中所使用,「抑制性T細胞」係指有助於或促進免疫抑制性微環境之T細胞。例示性抑制性T細胞包括CD4+調節性T細胞及CD8+調節性T細胞。此類細胞可由熟習此項技術者使用例如用於鑑別諸如FoxP3、LAP或Helios之標記之流式細胞測量術鑑別。
如本文中所使用,「調節性T細胞」或「Treg」係指通常抑制或下調效應T細胞之誘導及增殖之免疫抑制性細胞。Treg通常表現生物標記CD4、FOXP3及CD25且認為係來源於與原生CD4細胞相同之譜系。
「T效應」(「Teff
」)細胞係指具有細胞溶解活性之T細胞(例如CD4+及CD8+ T細胞)以及分泌發炎性細胞介素且活化及引導其他免疫細胞之T輔助(Th)細胞,但不包括調節性T細胞(Treg細胞)。
如本文中所使用,「投與」係指使用熟習此項技術者已知之各種方法及遞送系統中之任一者,將分子(例如結合LAP之抗體或抗原結合片段)或包含治療劑(例如抗LAP抗體或抗原結合片段)之組合物以物理方式引入個體。本文中所描述之抗體的較佳投藥途徑包括靜脈內、腹膜內、肌肉內、皮下、脊椎或其他非經腸投藥途徑,例如藉由注射或輸注。如本文中所使用,片語「非經腸投藥」意謂除經腸及局部投藥以外之投藥模式,通常藉由注射進行,且包括(但不限於)靜脈內、腹膜內、肌肉內、動脈內、鞘內、淋巴管內、病灶內、囊內、眶內、心內、皮內、經氣管、皮下、表皮下、關節內、囊下、蛛膜下、脊椎內、硬膜外及胸骨內注射及輸注,以及活體內電致孔。或者,本文中所描述之抗體可經由除非經腸以外的途徑投與,諸如局部、表皮或黏膜投藥途徑,例如鼻內、經口、經陰道、經直腸、舌下或局部。投與亦可例如進行一次、複數次及/或經一或多個延長之週期。如本文中所使用,「癌症」係指特徵為異常細胞在體內不受控生長之一組廣泛疾病。不受調控之細胞分裂可引起惡性腫瘤或細胞之形成,該等腫瘤或細胞侵襲相鄰組織且可經由淋巴系統或血流轉移至身體之遠端部分。
如本文中所使用,「自體免疫疾病」描述使個體之身體產生針對個體之自身身體組分之功能障礙性免疫反應及副作用之疾病病況或症候群。
如本文中所使用,「纖維化」係指由細胞外基質之異常沈積引起或伴有細胞外基質之異常沈積之病症或疾病病況(亦即,並非正常器官及組織中纖維組織之形成)。纖維化之特徵在於受影響之組織中細胞外基質之過度積聚,其通常引起破壞該組織之正常架構且引起嚴重的器官功能障礙。儘管各種器官中之纖維化病狀具有不同病源學,但纖維化通常由多種刺激(諸如慢性感染、局部缺血、過敏性及自體免疫性反應、化學損傷或放射損傷)誘導之慢性持續性發炎引起(來自Biernacka, 2011 Growth Factors. 2011年10月;29(5):196-202. doi: 10.3109/08977194.2011.595714. 電子版2011年7月11日)。纖維化可影響心臟、肝、腎臟、肺及皮膚且亦為許多癌症之重要特徵。
如本文中所使用,「細胞療法」係指涉及活細胞(例如CAR T細胞及NK細胞)投藥之治療方法。
如本文中所使用,術語「治療(treat/treating/treatment)」係指對個體進行之任何類型的介入或方法,或向個體投與活性劑(例如抗LAP抗體或抗原結合片段),其目的在於逆轉、緩解、改善、抑制或減緩或預防症狀、併發症、病狀或與疾病相關聯之生物化學標誌之進程、發展、嚴重程度或復發。治療可為治療患有疾病之個體或未患有疾病之個體(例如用於預防)。
如本文中所使用,「輔助」或「組合」投藥(共同投藥)包括相同或不同劑型中之藥劑及/或化合物之同時投藥,或化合物之單獨投藥(例如依序投藥)。舉例而言,至少一種藥劑包含抗LAP抗體或抗原結合片段。因此,可在單一調配物中同時投與第一抗體或抗原結合片段(例如抗LAP抗體或抗原結合片段)及第二、第三或更多的抗體或抗原結合片段。或者,第一及第二(或更多的)抗體或抗原結合片段可經調配以用於單獨投藥且係同時或依序投與。
如本文中所使用,「組合」療法意謂以協同方式投與兩種或更多種治療劑,且包括(但不限於)並行給藥。特定言之,組合療法涵蓋共同投藥(例如,投與共同調配物或同時投與單獨的治療性組合物)及連續或依序投藥,其限制條件為在投與一種治療劑時以某種方式調節另一種治療劑之投藥。舉例而言,一種治療劑可僅在已投與不同治療劑之後投與且使其在指定時間段內起作用。(參見例如Kohrt等人 (2011)Blood
117:2423)。舉例而言,可首先投與抗LAP抗體,接著(例如緊接著)投與第二抗體(例如抗PD-1抗體)或抗原結合片段,或反之亦然。在一個實施例中,在投與第二抗體或抗原結合片段之前投與抗LAP抗體或抗原結合片段。在另一實施例中,與第二抗體或抗原結合片段間隔例如幾分鐘(例如在約30分鐘內)或至少一小時投與抗LAP抗體或抗原結合片段。此類並行或依序投藥較佳引起兩種抗體或抗原結合片段同時存在於所治療之患者中。
術語「有效劑量」或「有效用量」定義為足以達成或至少部分達成所需作用之量。藥物(例如抗LAP抗體或抗原結合片段)之「治療有效量」或「治療有效劑量」為當單獨或與另一種治療劑組合使用時,促進疾病消退(由疾病症狀之嚴重程度之降低、無疾病症狀時段之出現率及持續時間之增加或預防由疾病病痛引起之損傷或功能障礙證明)之藥物或治療劑之任何量。藥物或治療劑之治療有效量或劑量包括「預防有效量」或「預防有效劑量」,其為當單獨或與另一種治療劑組合向具有產生疾病或罹患疾病復發之風險的個體投與時,抑制該疾病之發展或復發的藥物或治療劑之任何量。治療劑促進疾病消退或抑制疾病發展或復發之能力可使用熟習此項技術者已知之各種方法(諸如在臨床試驗期間在人類個體中、在預測於人類中之功效的動物模型系統中,或藉由在活體外分析法中分析藥劑之活性)來評估。
根據本文中所提供之方法中之任一者的有效量之單獨的抗LAP抗體或抗原結合片段或抗LAP抗體或抗原結合片段與另一種化合物或藥劑(例如免疫檢查點阻斷劑,諸如抗PD-1抗體)之組合之投藥可產生至少一種治療作用,包括例如降低腫瘤生長或尺寸、降低隨時間推移而呈現之癌症標誌(例如轉移性病灶)之數目、完全緩解、部分緩解或穩定疾病。舉例而言,治療方法產生比在不投與抗LAP抗體或抗原結合片段之情況下所實現或比在投與組合抗體中之任一者之情況下所實現更好的類似臨床效益率(CBR=完全緩解(CR) + 部分緩解(PR) + 穩定疾病(SD)持續≥6個月),例如臨床效益率之改良為約20%、30%、40%、50%、60%、70%、80%或更多。
作為實例,對於腫瘤之治療,與未經治療之個體相比,藥物或治療劑(例如抗LAP抗體或抗原結合片段)之治療有效量或劑量抑制腫瘤細胞生長達至少約20%、至少約30%、至少約40%、至少約50%、至少約60%、至少超過70%、至少約80%或至少約90%。在一些實施例中,藥物或治療劑之治療有效量或劑量完全抑制細胞生長或腫瘤生長,亦即,抑制細胞生長或腫瘤生長達100%。可使用本文中所描述之分析法評估化合物或治療劑(包括抗體)抑制腫瘤生長之能力。或者,可藉由檢驗組合物抑制細胞生長之能力來評估包含化合物或治療劑之組合物之此特性;此類抑制可藉由熟習此項技術者已知的分析法活體外量測。
術語「患者」包括接受預防性或治療性治療之人類及其他哺乳動物個體。
如本文中所使用,術語「個體」包括任何人類或非人類動物。舉例而言,本文中所描述之方法及組合物可用於治療患有癌症之個體。術語「非人類動物」包括所有脊椎動物,例如哺乳動物及非哺乳動物,諸如非人類靈長類動物、羊、貓、犬、牛、雞、兩棲動物、爬行動物等。
術語「樣本」係指自患者或個體獲得之組織、體液或細胞(或前述中之任一者之一部分)。通常,將自患者移出組織或細胞,但亦涵蓋活體內診斷。在實體腫瘤之情況下,組織樣本可獲自以手術方式移除的腫瘤且藉由習知技術準備用於測試。在淋巴瘤及白血病之情況下,可獲得且適當地製備淋巴細胞、白血病細胞或淋巴組織(例如來自血液之白血病細胞)。其他樣本,包括尿液、淚液、血清、血漿、腦脊髓液、糞便、痰、細胞提取物等亦可適用於特定癌症。
如本文中所使用,「包含」與「包括」、「含有」或「特徵在於」同義,且為包括性或開放性的,且不排除其他未列出之要素或方法步驟。如本文中所使用,「由……組成」排除所主張要素中未規定之任何要素、步驟或成分。如本文中所使用,「基本上由……組成」不排除不會實質上影響申請專利範圍之基本及新穎特徵之材料或步驟。在本文中之各種情形下,術語「包含」、「基本上由……組成」及「由……組成」中之任一者可視情況由另兩個術語中之任一者置換,因此描述標的物之範疇之替代性態樣。本文中所說明性地描述之本發明可在不存在本文中未特定揭示之任何元件或多個元件、限制或多個限制之情況下適合地實踐。
如本文中所使用,除非上下文以其他方式明確規定,否則單數形式「一(a/an)」及「該(the)」包括複數個指示物。除非另外陳述,否則「或」或「及」之使用意謂「及/或」。此外,術語「包括(including)」以及其他形式(諸如「包括(include)」、「包括(includes)」及「包括(included)」)之使用不具有限制性。
如本文中所使用,當指代可量測之值(諸如量、時距及其類似物)時,術語「約」涵蓋自指定值之至多±10%之偏差。除非另有指示,否則本文中使用之所有表示成分、特性(諸如分子量、反應條件等)之量的數值應理解為由術語「約」修飾。
如本文中所使用,「及/或」應視為兩種指定特徵或組分中之每一者在存在或不存在另一者之情況下之特定揭示。因此,如在諸如「A及/或B」之片語中所使用,術語「及/或」包括「A及B」、「A或B」、「單獨的A」及「單獨的B」。類似地,如在諸如「A、B及/或C」之片語中所使用,術語「及/或」涵蓋以下中之每一者:A、B及C;A、B或C;A或C;A或B;B或C;A及C;A及B;B及C;單獨的A;單獨的B;及單獨的C。
如本文所使用,術語「ug」及「uM」可分別與「μg」及「μΜ」互換使用。
在以下子部分中進一步詳細描述本文所描述之各種態樣。
I. 抗 LAP 抗體
在一個態樣中,本文中提供經分離之抗LAP抗體(亦即,結合LAP之抗體)或其抗原結合片段。
在一個態樣中,本文中提供經分離之抗LAP抗體(例如,重組型人類化、嵌合或人類抗體)或其抗原結合片段,其包含:
(a) 重鏈可變區,其包含有分別包含SEQ ID NO:16、26及18之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域;
(b) 重鏈可變區,其包含有分別包含SEQ ID NO:16、27及18之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域;
(c) 重鏈可變區,其包含有分別包含SEQ ID NO:16、28及18之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域;
(d) 重鏈可變區,其包含有分別包含SEQ ID NO:16、29及18之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域;
(e) 重鏈可變區,其包含有分別包含SEQ ID NO:16、30及18之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域;
(f) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(g) 重鏈可變區,其包含有分別包含SEQ ID NO:54、64及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(h) 重鏈可變區,其包含有分別包含SEQ ID NO:54、65及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(i) 重鏈可變區,其包含有分別包含SEQ ID NO:54、66及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(j) 重鏈可變區,其包含有分別包含SEQ ID NO:54、67及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(k) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及68之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(l) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及69之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(m) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及70之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(n) 重鏈可變區,其包含有分別包含SEQ ID NO:54、66及68之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;
(o) 重鏈可變區,其包含有分別包含SEQ ID NO:110、111及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(p) 重鏈可變區,其包含有分別包含SEQ ID NO:110、120及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(q) 重鏈可變區,其包含有分別包含SEQ ID NO:110、121及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(r) 重鏈可變區,其包含有分別包含SEQ ID NO:110、122及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(s) 重鏈可變區,其包含有分別包含SEQ ID NO:110、123及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(t) 重鏈可變區,其包含有分別包含SEQ ID NO:110、124及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(u) 重鏈可變區,其包含有分別包含SEQ ID NO:110、125及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(v) 重鏈可變區,其包含有分別包含SEQ ID NO:110、126及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域;
(w) 重鏈可變區,其包含有分別包含SEQ ID NO:162、163及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(x) 重鏈可變區,其包含有分別包含SEQ ID NO:162、172及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(y) 重鏈可變區,其包含有分別包含SEQ ID NO:162、173及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(z) 重鏈可變區,其包含有分別包含SEQ ID NO:162、174及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(aa) 重鏈可變區,其包含有分別包含SEQ ID NO:162、174及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(ab) 重鏈可變區,其包含有分別包含SEQ ID NO:162、176及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(ac) 重鏈可變區,其包含有分別包含SEQ ID NO:162、177及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(ad) 重鏈可變區,其包含有分別包含SEQ ID NO:162、178及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域;
(ae) 重鏈可變區,其包含有分別包含SEQ ID NO:179、180及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;或
(af) 重鏈可變區,其包含有分別包含SEQ ID NO:179、189及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;
(ag) 重鏈可變區,其包含有分別包含SEQ ID NO:179、190及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;
(ah) 重鏈可變區,其包含有分別包含SEQ ID NO:179、191及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;
(ai) 重鏈可變區,其包含有分別包含SEQ ID NO:179、192及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;
(aj) 重鏈可變區,其包含有分別包含SEQ ID NO:179、193及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;
(ak) 重鏈可變區,其包含有分別包含SEQ ID NO:179、194及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;
(al) 重鏈可變區,其包含有分別包含SEQ ID NO:179、195及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域;
(am) 重鏈可變區,其包含有分別包含SEQ ID NO:225、226及227之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:228、229及230之胺基酸序列之CDR1、CDR2及CDR3區域;
(an) 重鏈可變區,其包含有分別包含SEQ ID NO:225、231及227之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:228、229及230之胺基酸序列之CDR1、CDR2及CDR3區域;
(ao) 重鏈可變區,其包含有分別包含SEQ ID NO:225、232及227之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:228、229及230之胺基酸序列之CDR1、CDR2及CDR3區域;或
(ap) 重鏈可變區,其包含有分別包含SEQ ID NO:225、233及227之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:228、229及230之胺基酸序列之CDR1、CDR2及CDR3區域。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)或抗原結合片段包含重鏈可變區,其包含有分別包含SEQ ID NO:16、17及18之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置56 (對應於SEQ ID NO:17之位置7)為除N以外的胺基酸(例如Q、S、H、L、D)或經除N以外的胺基酸殘基(例如Q、S、H、L、D)取代。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)或抗原結合片段包含重鏈可變區,其包含有分別包含SEQ ID NO:54、55及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置54 (對應於SEQ ID NO:55之位置5)為除N以外的胺基酸(例如Q、A、H、S)或經除N以外的胺基酸殘基(例如Q、A、H、S)取代。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)或抗原結合片段包含重鏈可變區,其包含有分別包含SEQ ID NO:54、55及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置102 (對應於SEQ ID NO:56之位置4)為除D以外的胺基酸(例如A、E、G)或經除D以外的胺基酸殘基(例如A、E、G)取代。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)或抗原結合片段包含重鏈可變區,其包含有分別包含SEQ ID NO:54、55及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置54 (對應於SEQ ID NO:55之位置5)為除N以外的胺基酸(例如Q、A、H、S)或經除N以外的胺基酸殘基(例如Q、A、H、S)取代,且其中重鏈可變區之位置102 (對應於SEQ ID NO:56之位置4)為除D以外的胺基酸(例如A、E、G)或經除D以外的胺基酸殘基(例如A、E、G)取代。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)或抗原結合片段包含重鏈可變區,其包含有分別包含SEQ ID NO:110、111及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置54 (對應於SEQ ID NO:111之位置5)為除N以外的胺基酸(例如Q、G、A、S、H、L、D)或經除N以外的胺基酸殘基(例如Q、G、A、S、H、L、D)取代。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)或抗原結合片段包含重鏈可變區,其包含有分別包含SEQ ID NO:162、163及164之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:165、166及167之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置56 (對應於SEQ ID NO:163之位置7)為除N以外的胺基酸(例如Q、G、A、S、H、L、D)或經除N以外的胺基酸殘基(Q、G、A、S、H、L、D)取代。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)或抗原結合片段包含重鏈可變區,其包含有分別包含SEQ ID NO:179、180及181之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:182、183及184之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置55 (對應於SEQ ID NO:180之位置6)為除N以外的胺基酸(例如Q、G、A、S、H、L、D)或經除N以外的胺基酸殘基(例如Q、G、A、S、H、L、D)取代。
在一些實施例中,抗LAP抗體(例如重組型人類化、嵌合或人類抗體)包含重鏈可變區,其包含有分別包含SEQ ID NO:225、226及227之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:228、229及230之胺基酸序列之CDR1、CDR2及CDR3區域,但其中重鏈可變區之位置55 (對應於SEQ ID NO:226之位置5)為除D以外的胺基酸(例如G、A、E)或經除D以外的胺基酸殘基(例如G、A、E)取代。
在一些實施例中,抗LAP抗體包含以上子任一個部分(a)-(ap)之重鏈CDR序列,及恆定區,例如人類IgG恆定區(例如IgG1、IgG2、IgG3或IgG4,或其變異體)。在一些實施例中,恆定區為包含SEQ ID NO:196中所闡述之胺基酸序列之人類IgG1恆定區。在一些實施例中,恆定區為包含SEQ ID NO:197中所闡述之胺基酸序列之變異型人類IgG4恆定區。在一些實施例中,包含以上任一個子部分(a)-(ap)之重鏈CDR序列之重鏈可變區可連接至恆定域以形成重鏈(例如全長重鏈)。類似地,包含以上任一個子部分(a)-(ap)之輕鏈CDR序列之輕鏈可變區可連接至恆定區以形成輕鏈(例如全長輕鏈)。全長重鏈(除C端離胺酸(K)以外或除C端甘胺酸及離胺酸(GK)以外,其可能不存在或被移除)及全長輕鏈組合以形成全長抗體。
在另一態樣中,本文中提供經分離之抗LAP抗體,其包含:
(a) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:42及52;
(b) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:40及52;
(c) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:35及46;
(d) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:35及50;
(e) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:101及104;
(f) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:98及104;
(g) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:92及104;
(h) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:92及106;
(i) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:95及104;
(j) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:77及104;
(k) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:82及104;
(l) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:87及104;
(m) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:133及154;
(n) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:130及154;
(o) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:127及154;
(p) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:144及154;
(q) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:146及154;
(r) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:148及154;
(s) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:150及154;或
(t) 重鏈及輕鏈可變區序列,其分別包含SEQ ID NO:218及154。
在一些實施例中,抗LAP抗體具有其中移除潛在責任位點(例如去醯胺化位點及/或異構化位點)之可變區序列。
因此,在一些實施例中,抗LAP抗體包含以上任一個子部分(a)-(d)之重鏈及輕鏈可變區序列,但其中重鏈可變區之位置56為除N以外的胺基酸(例如Q、S、H、L、D)或經除N以外的胺基酸殘基(例如Q、S、H、L、D)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(e)-(l)之重鏈及輕鏈可變區序列,但其中重鏈可變區之位置54為除N以外的胺基酸(例如Q、A、H、S)或經除N以外的胺基酸殘基(例如Q、A、H、S)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(e)-(l)之重鏈及輕鏈可變區序列,但其中重鏈可變區之位置102為除D以外的胺基酸(例如A、E、G)或經除D以外的胺基酸殘基(例如A、E、G)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(e)-(l)之重鏈及輕鏈可變區序列,但其中重鏈可變區之位置54為除N以外的胺基酸(例如Q、A、H、S)或經除N以外的胺基酸殘基(例如Q、A、H、S)取代,且其中重鏈可變區之位置102為除D以外的胺基酸(例如A、E、G)經除D以外的胺基酸殘基(例如A、E、G)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(m)-(t)之重鏈及輕鏈可變區序列,但其中重鏈可變區之位置54為除N以外的胺基酸(例如Q、G、A、S、H、L、D)或經除N以外的胺基酸殘基(例如Q、G、A、S、H、L、D)取代。
在一些實施例中,抗LAP抗體包含重鏈及/或輕鏈可變區序列,其與以上任一個子部分(a)-(t)之重鏈及/或輕鏈可變區至少80%、85%、90%、95%、96%、97%、98%或99%一致。在一些實施例中,以上任一個子部分(a)-(t)之重鏈及/或輕鏈可變區具有1、2、3、4、5、1-2、1-3、1-4或1-5個胺基酸取代(例如保守性胺基酸取代)。在一些實施例中,抗LAP抗體不具有分別與SEQ ID NO:22及23;分別與SEQ ID NO:60及61;分別與SEQ ID NO:116及117;分別與SEQ ID NO:168及169;或分別與SEQ ID NO:185及186一致之重鏈及輕鏈可變區序列。可使用本文中(例如在實例中)所描述之分析法及動物模型測試此等抗包圍抗體之臨床上有利的各種特性(例如與LAP-TGFβ1結合、抑制TGFβ1之活化、與各種細胞(例如免疫細胞)群體結合、活體內抑制腫瘤生長)。
在一些實施例中,抗LAP抗體包含以上任一個子部分(a)-(t)之重鏈可變區序列,及恆定區,例如人類IgG恆定區(例如IgG1、IgG2、IgG3或IgG4,或其變異體)。在一些實施例中,恆定區為包含SEQ ID NO:196中所闡述之胺基酸序列之人類IgG1恆定區。在一些實施例中,恆定區為包含SEQ ID NO:197中所闡述之胺基酸序列之變異型人類IgG4恆定區。在一些實施例中,以上任一個子部分(a)-(t)之重鏈可變區可連接至恆定域以形成重鏈(例如全長重鏈)。類似地,以上任一個子部分(a)-(t)之輕鏈可變區序列可連接至恆定區以形成輕鏈(例如全長輕鏈)。全長重鏈(除C端離胺酸(K)以外或除C端甘胺酸及離胺酸(GK)以外,其可能不存在或被移除)及全長輕鏈組合以形成全長抗體。
因此,在一些實施例中,本文中提供抗LAP抗體,其包含(a)分別包含SEQ ID NO:225、231及227之重鏈CDR1-3序列,及分別包含SEQ ID NO:228、229及230之輕鏈CDR1-3序列,(b)分別包含SEQ ID NO:225、232及227之重鏈CDR1-3序列,及分別包含SEQ ID NO:228、229及230之輕鏈CDR1-3序列,或(c)分別包含SEQ ID NO:225、233及227之重鏈CDR1-3序列,及分別包含SEQ ID NO:228、229及230之輕鏈CDR1-3序列。
在一些實施例中,本文中提供一種抗體,其包含有分別包含(a)SEQ ID NO:234及224,(b)SEQ ID NO:235及224,或(c)SEQ ID NO:236及224之重鏈及輕鏈可變區序列。
在一些實施例中,本文中提供抗LAP抗體,其包含有分別包含(a)SEQ ID NO:237及222,(b)SEQ ID NO:238及222,或(c)SEQ ID NO:239及222之重鏈及輕鏈序列。
在另一態樣中,本文中提供經分離之抗LAP抗體,其包含:
(a) 重鏈及輕鏈序列,其分別包含SEQ ID NO:43及53;
(b) 重鏈及輕鏈序列,其分別包含SEQ ID NO:45及53;
(c) 重鏈及輕鏈序列,其分別包含SEQ ID NO:41及53;
(d) 重鏈及輕鏈序列,其分別包含SEQ ID NO:36及47;
(e) 重鏈及輕鏈序列,其分別包含SEQ ID NO:37及47;
(f) 重鏈及輕鏈序列,其分別包含SEQ ID NO:36及51;
(g) 重鏈及輕鏈序列,其分別包含SEQ ID NO:37及51;
(h) 重鏈及輕鏈序列,其分別包含SEQ ID NO:102及105;
(i) 重鏈及輕鏈序列,其分別包含SEQ ID NO:103及105;
(j) 重鏈及輕鏈序列,其分別包含SEQ ID NO:99及105;
(k) 重鏈及輕鏈序列,其分別包含SEQ ID NO:100及105;
(l) 重鏈及輕鏈序列,其分別包含SEQ ID NO:93及105;
(m) 重鏈及輕鏈序列,其分別包含SEQ ID NO:94及105;
(n) 重鏈及輕鏈序列,其分別包含SEQ ID NO:93及107;
(o) 重鏈及輕鏈序列,其分別包含SEQ ID NO:94及107;
(p) 重鏈及輕鏈序列,其分別包含SEQ ID NO:96及105;
(q) 重鏈及輕鏈序列,其分別包含SEQ ID NO:97及105;
(r) 重鏈及輕鏈序列,其分別包含SEQ ID NO:78及105;
(s) 重鏈及輕鏈序列,其分別包含SEQ ID NO:79及105;
(t) 重鏈及輕鏈序列,其分別包含SEQ ID NO:83及105;
(u) 重鏈及輕鏈序列,其分別包含SEQ ID NO:84及105;
(v) 重鏈及輕鏈序列,其分別包含SEQ ID NO:88及105;
(w) 重鏈及輕鏈序列,其分別包含SEQ ID NO:89及105;
(x) 重鏈及輕鏈序列,其分別包含SEQ ID NO:134及155;
(y) 重鏈及輕鏈序列,其分別包含SEQ ID NO:135及155;
(z) 重鏈及輕鏈序列,其分別包含SEQ ID NO:131及155;
(aa) 重鏈及輕鏈序列,其分別包含SEQ ID NO:132及155;
(ab) 重鏈及輕鏈序列,其分別包含SEQ ID NO:128及155;
(ac) 重鏈及輕鏈序列,其分別包含SEQ ID NO:129及155;
(ad) 重鏈及輕鏈序列,其分別包含SEQ ID NO:145及155;
(ae) 重鏈及輕鏈序列,其分別包含SEQ ID NO:147及155;
(af) 重鏈及輕鏈序列,其分別包含SEQ ID NO:149及155;
(ag) 重鏈及輕鏈序列,其分別包含SEQ ID NO:151及155;
(ah) 重鏈及輕鏈序列,其分別包含SEQ ID NO:219及155;或
(ai) 重鏈及輕鏈序列,其分別包含SEQ ID NO:220及155。
在一些實施例中,全長重鏈不具有C端離胺酸殘基(其可能不存在或被移除)。
在一些實施例中,抗LAP抗體具有其中移除潛在責任位點(例如去醯胺化位點及/或異構化位點)之重鏈及輕鏈序列。因此,在一些實施例中,抗LAP抗體包含以上任一個子部分(a)-(g)之重鏈及輕鏈序列,但其中重鏈之位置56為除N以外的胺基酸(例如Q、S、H、L、D)或經除N以外的胺基酸殘基(例如Q、S、H、L、D)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(h)-(w)之重鏈及輕鏈序列,但其中重鏈之位置54為除N以外的胺基酸(例如Q、A、H、S)或經除N、H或S以外的胺基酸殘基(例如Q及A)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(h)-(w)之重鏈及輕鏈序列,但其中重鏈可變區之位置102為除D以外的胺基酸(例如A、E、G)或經除D以外的胺基酸殘基(例如A、E、G)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(h)-(w)之重鏈及輕鏈序列,但其中重鏈之位置54為除N以外的胺基酸(例如Q、A、H、S)或經除N、H或S以外的胺基酸殘基(例如Q及A)取代,且其中重鏈可變區之位置102為除D以外的胺基酸(例如A、E、G)經除D以外的胺基酸殘基(例如A、E、G)取代。
在一些實施例中,抗LAP抗體包含以上任一個子部分(x)-(ai)之重鏈及輕鏈序列,但其中重鏈可變區之位置54為除N以外的胺基酸(例如Q、G、A、S、H、L、D)或經除N以外的胺基酸殘基(例如Q、G、A、S、H、L、D)取代。
在一些實施例中,抗LAP抗體包含與以上任一個子部分(a)-(ai)之重鏈及/或輕鏈序列至少80%、85%、90%、95%、96%、97%、98%、99%、99.5%或99.7%一致的重鏈及/或輕鏈序列。在一些實施例中,以上任一個子部分(a)-(ai)之重鏈及/或輕鏈序列具有1、2、3、4、5、1-2、1-3、1-4或1-5個胺基酸取代(例如保守性胺基酸取代)。在一些實施例中,抗LAP抗體不具有分別與SEQ ID NO:24及25一致;分別與SEQ ID NO:62及63一致;或分別與SEQ ID NO:118及119一致的重鏈及/或輕鏈可變區序列。可使用本文中(例如在實例中)所描述之分析法及動物模型測試此等抗包圍抗體之臨床上有利的各種特性(例如與LAP-TGFβ1結合、抑制TGFβ1之活化、與各種細胞(例如免疫細胞)群體結合、活體內抑制腫瘤生長)。
在一些實施例中,包含對應的SEQ ID NO:110、120及113之VHCDR1-3序列及對應的SEQ ID NO:113、114及115之VLCDR1-3序列之抗LAP抗體或抗原結合片段在CDR或可變區中具有一或多個胺基酸取代。舉例而言,在一些實施例中,在六個重鏈及輕鏈CDR (總共)或兩個重鏈及輕鏈可變區(總共)中不超過3個胺基酸(亦即,1、2或3個胺基酸)經取代。
在一些實施例中,抗LAP抗體或抗原結合片段包含VHCDR1,其與GYTFTSYWMH (SEQ ID NO:110)相比具有1、2、3、4、5、6、7、8、9或10個胺基酸取代,例如保守性胺基酸取代。
在一些實施例中,抗LAP抗體或抗原結合片段包含VHCDR2,其與RIDPQSGGIK (SEQ ID NO:120)相比具有1、2、3、4、5、6、7、8、9或10個胺基酸取代,例如保守性胺基酸取代。在一些實施例中,VHCDR2包含序列:RX1
X2
X3
X4
X5
X6
X7
X8
X9
,其中X1
-X9
可為任何胺基酸。在一些實施例中,X1
-X9
中僅1個位置相對於SEQ ID NO:120之胺基酸序列經取代。
在一些實施例中,抗LAP抗體或抗原結合片段包含VHCDR3,其相對於WDYGGYFDV (SEQ ID NO:112)包含1、2、3、4、5、6、7、8或9個胺基酸取代,例如保守性胺基酸取代。在一些實施例中,VHCDR3包含序列:WX1
YGGYFX2
X3
(SEQ ID NO:242),其中X1
-X3
可為任何胺基酸。在一些實施例中,X1
-X3
中僅1個位置相對於SEQ ID NO:112之胺基酸序列經取代。
在一些實施例中,抗LAP抗體或抗原結合片段包含VLCDR1,其相對於RASQDITNYLN (SEQ ID NO:113)包含1、2、3、4、5、6、7、8、9、10或11個胺基酸取代,例如保守性胺基酸取代。在一些實施例中,VLCDR1可包含序列:RX1
X2
X3
DIX4
X5
YX6
X7
,其中X1
-X7
為任何胺基酸。在一些實施例中,X1
-X7
中僅1個位置相對於SEQ ID NO:113之胺基酸序列經取代。
在一些實施例中,抗LAP抗體或抗原結合片段包含VLCDR2,其相對於YTSRLHS (SEQ ID NO:114)包含1、2、3、4、5、6或7個胺基酸取代,例如保守性胺基酸取代。在一些實施例中,VLCDR2包含序列:YX1
X2
RX3
X4
X5
,其中X1
-X5
為任何胺基酸。在一些實施例中,X1
-X5
中僅1個位置相對於SEQ ID NO:114之胺基酸序列經取代。
在一些實施例中,抗LAP抗體或抗原結合片段包含VLCDR3,其相對於QQGDTLPWT (SEQ ID NO:115)包含1、2、3、4、5、6、7、8或9個胺基酸取代,例如保守性胺基酸取代。在一些實施例中,VLCDR3可包含序列:QQGDX1
LPWT (SEQ ID NO:243),其中X1
為任何胺基酸。
本文中提供之抗LAP抗體或抗原結合片段之功能特徵更詳細描述地於下文中。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段在不存在錨蛋白質之情況下結合於LAP-TGFβ1 (例如人類LAP-TGFβ1)。舉例而言,在不包括錨蛋白質之分析法中,本文中所描述之抗LAP抗體或抗原結合片段結合於重組型人類LAP-TGFβ1。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段以100 nM或更低,諸如90 nM或更低、80 nM或更低、70 nM或更低、60 nM或更低、50 nM或更低,諸如40 nM或更低、30 nM或更低、20 nM或更低、10 nM或更低、5 nM或更低、3 nM或更低、1 nM或更低、0.9 nM或更低、0.8 nM或更低、0.7 nM或更低、0.6 nM或更低、0.5 nM或更低、0.4 nM或更低、0.3 nM或更低、0.2 nM或更低、0.1 nM或更低、10 nM至0.1 nM、5 nM至0.1 nM、3 nM至0.1 nM、1 nM至0.1 nM、0.8 nM至0.1 nM、0.5 nM至0.1 nM、10 nM至0.5 nM、10 nM至0.8 nM、10 nM至1 nM、1 nM至0.5 nM或1 nM至0.8 nM之KD
結合於LAP-TGFβ1 (例如可溶性LAP-TGFβ1),如藉由例如生物層干涉術(例如實例1中所描述)評估或如藉由Octet或BIACore所測定。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段以本文中之實例中之KD
結合於LAP-TGFβ1 (例如人類、食蟹獼猴及大鼠)。在各種實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於人類LAP-TGFβ1、大鼠LAP-TGFβ1、食蟹獼猴LAP-TGFβ1及/或鼠類LAP-TGFβ1。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於與免疫抑制性細胞上之錨蛋白質複合之LAP-TGFβ1,但不結合於錨蛋白質。在一些實施例中,錨蛋白質為GARP或LRRC33。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段選擇性抑制免疫抑制性細胞上之TGFβ1活化,但不抑制細胞外基質上之TGFβ1活化。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段不結合於與LTBP1、LTBP3及/或LTBP4複合之LAP。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段不結合於LAP-TGFβ2 (例如人類LAP-TGFβ2)及LAP-TGFβ3 (例如人類LAP-TGFβ3),如藉由例如使用過表現TGFβ2或TGFβ3之細胞之流式細胞測量術或用重組型LAP-TGFβ2或LAP-TGFβ3進行之生物層干涉術評估。舉例而言,在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段以不顯著高於在對照抗體(例如同型對照)情況下發現之信號或在不存在抗LAP抗體之情況下(例如實例2中所描述)發現之信號的信號或親和力結合於LAP-TGFβ2或LAP-TGFβ3。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段抑制TGFβ1活化,如藉由例如過表現LAP-TGFβ1之P3U1細胞之培養物中自由TGFβ1之ELISA偵測。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段抑制(或測定為抑制)TGFβ1活化達約50%或更多,例如約60%或更多、約70%或更多、約80%或更多或約90%或更多,如藉由ELISA (例如過表現LAP-TGFβ1之P3U1細胞之培養物中自由TGFβ1之ELISA偵測(例如實例4中所描述))評估。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於小鼠及人類LAP-TGFβ1,如藉由例如經活化之免疫細胞群體之流式細胞測量術評估。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段不結合於自由TGFβ1 (亦即,不具有LAP之TGFβ1),如藉由例如ELISA評估。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段不結合於空LAP (亦即,未與TGFβ1複合之LAP),如藉由例如生物層干涉術評估。舉例而言,在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段以不顯著高於在對照抗體(例如同型對照)之情況下發現之信號或在不存在抗LAP抗體之情況下發現之信號(例如實例2中所描述)的信號或親和力結合於自由TGFβ1或空。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於包含K27C及Y75C突變之人類LAP-TGFβ1 (SEQ ID NO:12)。在另一實施例中,本文中所描述之抗LAP抗體或抗原結合片段不結合於(或測定為不結合於)包含Y74T突變之人類LAP-TGFβ1 (SEQ ID NO:13)。在另一實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於(或測定為結合於)包含K27C及Y75C突變之人類LAP-TGFβ1,但不結合於包含Y74T突變之LAP-TGFβ1。
在一些實施例中,抗LAP抗體結合於人類LAP-TGFβ1(SEQ ID NO:1)之殘基82-130之全部或一部分。
在一些實施例中,抗LAP抗體在人類LAP-TGFβ1 (SEQ ID NO:1)之殘基82-130內結合。在一些實施例中,抗LAP抗體或抗原結合片段結合於人類LAP-TGFβ1 (SEQ ID NO:1)上之一或多個包含胺基酸31-40、274-280及340-343或由其組成之區域。在一些實施例中,抗LAP抗體或抗原結合片段結合於人類LAP-TGFβ1 (SEQ ID NO:1)之胺基酸31-40、274-280及340-343。在一些實施例中,藉由低溫EM測定抗原決定基。
在一些實施例中,抗LAP抗體或抗原結合片段結合於人類LAP-TGFβ1 (SEQ ID NO:1)上之一或多個包含胺基酸31-38、278-281及342-344或由其組成之區域。在一些實施例中,抗LAP抗體結合於人類LAP-TGFβ1 (SEQ ID NO:1)之胺基酸31-38、278-281及342-344。在一些實施例中,藉由低溫EM測定抗原決定基。在一些實施例中,抗LAP抗體或抗原結合片段結合於人類LAP-TGFβ1 (SEQ ID NO:1)上之一或多個包含胺基酸35-43、272-275、280-283及340或由其組成之區域(SEQ ID NO:1)。在一些實施例中,抗LAP抗體或抗原結合片段結合於人類LAP-TGFβ1 (SEQ ID NO:1)之胺基酸35-43、272-275、280-283及340。在一些實施例中,藉由低溫EM測定抗原決定基。
如上文所論述,本文中所描述之抗LAP抗體或抗原結合片段結合於細胞(諸如免疫細胞,例如免疫抑制性細胞)上之LAP-TGFβ1。免疫抑制性細胞包括(但不限於)抑制性T細胞(例如調節性T細胞、經活化之T細胞、抑制性CD8+ T細胞)、M1巨噬細胞、M2巨噬細胞、樹突狀細胞、調節性B細胞、粒細胞性MDSC及/或單核球性MDSC,如例如藉由流式細胞測量術評估。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於除免疫細胞以外的細胞,諸如腫瘤細胞、纖維母細胞(包括癌症相關纖維母細胞)、間質基質細胞、間葉幹細胞、造血性幹細胞、非髓鞘再生神經鞘細胞、肌成纖維細胞、內皮細胞、血小板、巨核細胞、外被細胞及/或肝星形細胞。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於免疫細胞(例如免疫抑制性細胞)及非免疫細胞上之LAP-TGFβ1。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於GARP陽性細胞(例如GARP陽性免疫抑制性細胞)上之LAP-TGFβ1。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於(或測定為結合於)GARP陰性細胞(例如GARP陰性免疫抑制性細胞)上之LAP-TGFβ1。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於GARP陽性及GARP陰性細胞上之LAP-TGFβ1,如例如藉由流式細胞測量術評估。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段降低CD73之內源性表現。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段抑制由治療(例如放射)引起之CD73表現之增加。可使用此項技術中已知的標準方法測定CD73表現(例如實例16中所描述)。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段以1000 ng/ml或更低、500 ng/ml或更低、200 ng/ml或更低、150 ng/ml或更低、100 ng/ml或更低、50 ng/ml或更低、25 ng/ml或更低、10 ng/ml或更低、5 ng/ml或更低、2 ng/ml或更低、1 ng/ml至200 ng/ml、1 ng/ml至150 ng/ml、1 ng/ml至100 ng/ml、1 ng/ml至50 ng/ml、1 ng/ml至25 ng/ml、1 ng/ml至10 ng/ml或1 ng/ml至5 ng/ml之EC50
結合於表現於細胞上之LAP-TGFβ1 (例如表現於例如P3U1細胞上之人類或小鼠LAP-TGFβ1),如藉由流式細胞測量術所量測(例如實例2中所描述)。
亦可藉由流式細胞測量術使用定量免疫螢光來定義抗LAP抗體或抗原結合片段與LAP-TGFβ1之結合,其實現以每個細胞計之所結合之抗體分子數目之定量。因此,在一些實施例中,結合於亦表現GARP之細胞之抗LAP抗體之數目可等於結合於該細胞之抗GARP抗體之數目,或可為結合於該細胞之抗GARP抗體之數目之至少80%、至少50%、至少20%、至少10%、至少5%、至少1%或至少0.1%。在一些實施例中,可使用偵測大部分LAP分子之群中之抗LAP抗體,使用定量免疫螢光來定量以每個細胞計之經表現之LAP-TGFβ1分子之數目;此類抗體之實例包括2F8、2C9、16B4及抗LAP單株抗體#27232 (R&D Systems)。在一些實施例中,結合於細胞之抗LAP抗體之數目可等於細胞上LAP分子之數目,或可為表現於該細胞上之LAP分子之數目之至少80%、至少50%、至少20%、至少10%、至少5%、至少1%或至少0.1%。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段與對照物(例如對照抗體)相比抑制TGFβ1活化達例如10%或更多,例如20%或更多、30%或更多、40%或更多、50%或更多、60%或更多、70%或更多、80%或更多、90%或更多或95%或更多,如藉由ELISA所量測(例如實例4中所描述)。
較佳地,本文中所描述之抗LAP抗體或抗原結合片段以高親和力,例如以10-7
M或更低、10-8
M或更低、10-9
M或更低、10-10
M或更低、10-11
M或更低、10-12
M或更低、10-12
M至10-7
M、10-11
M至10-7
M、10-10
M至10-7
M或10-9
M至10-7
M之KD
結合於可溶性LAP-TGFβ1,如藉由生物層干涉術所量測(例如實例1中所描述)。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段不結合於細胞外基質中之LAP-TGFβ1。舉例而言,本文中所描述之抗LAP抗體或抗原結合片段不結合於細胞外基質中之LAP-TGFβ1,如藉由ELISA評估,其中抗體或抗原結合片段結合之O.D.信號不顯著高於在不存在本文中所描述之抗LAP抗體或抗原結合片段之情況下發現之信號或在對照抗體(例如同型對照)情況下發現之信號(例如實例5中所描述)。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段不抑制ECM中之TGFβ活化,如藉由例如在組合ECM中之LAP-TGFβ1之來源(例如實例5中所描述)與MMP-2、MMP-9、凝血栓蛋白或表現αVβ6或αVβ8整合素之細胞之分析法中的自由TGFβ1之ELISA偵測所評估。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於血小板上之LAP-TGFβ1。舉例而言,在一些實施例中,可藉由流式細胞測量術,藉由抗LAP抗體之結合(例如以比在同型對照抗體情況下所發現更高的程度顯示信號)來偵測至少5%、至少10%、至少20%或至少50%之血小板(例如實例6中所描述)。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於血小板,但不引起血小板凝集或血小板去顆粒。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於免疫細胞,例如抑制性T細胞(例如調節性T細胞)、M2巨噬細胞、單核球性MDSC、CD11b陽性細胞及/或樹突狀細胞。舉例而言,在一些實施例中,可藉由流式細胞測量術,藉由抗LAP抗體之結合(例如以比在同型對照抗體之情況下所發現更高的程度顯示信號)來偵測至少0.5%、至少1%、至少2%、至少5%、至少7%、至少10%、至少20%或至少50%之此等細胞類型(例如實例7中所描述)。在一些實施例中,若本文中所描述之抗LAP抗體或抗原結合片段之結合比同型對照高≥2倍標準差,則視為其結合於此等細胞類型。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段結合於GARP陰性白血球。舉例而言,在一些實施例中,可藉由流式細胞測量術,藉由抗LAP抗體之結合(例如以比在同型對照抗體之情況下所發現更高的程度顯示信號)來偵測至少0.5%、至少1%、至少2%、至少5%、至少7%、至少10%、至少20%或至少50%之GARP陰性白血球(例如實例7中所描述)。
呈現上文所描述之功能特性中之一或多者(例如生物化學、免疫化學、細胞、生理學或其他生物活性)之抗體或抗原結合片段,如使用此項技術中已知及本文中所描述之方法測定,將視為與在不存在抗體之情況下(例如,或當存在具有無關特異性之對照抗體時)所發現相比之特定活性之統計顯著差異相關。較佳地,抗LAP抗體誘導的所量測之參數之增加可實現所量測之參數之至少10%,更佳至少20%、30%、40%、50%、60%、70%、80%、90%、95%或100% (亦即2倍)、3倍、5倍或10倍的統計顯著增加。相反,抗LAP抗體誘導之所量測之參數(例如TGFβ1活化)之降低可實現至少10%、20%、30%、40%、50%、60%、70%、80%、90%、95%、97%、98%、99%或100%之統計顯著降低。
本文中亦提供與本文中所描述之任何抗LAP抗體結合於人類LAP-TGFβ1上之相同抗原決定基之抗LAP抗體。此等抗體具有與本文中所描述之任何抗LAP抗體交叉競爭結合於人類LAP-TGFβ1之能力。在一些實施例中,抗LAP抗體結合人類LAP-TGFβ1 (SEQ ID NO:1)之殘基82-130內之一或多個胺基酸。
本文中所揭示之抗體包括所有已知的抗體形式及具有抗體類似特性的其他蛋白質骨架。舉例而言,抗體可為人類抗體、人類化抗體、雙特異性抗體、免疫結合物、嵌合抗體,或具有抗體類似特性的蛋白質骨架,諸如纖維結合蛋白或錨蛋白重複。
在一些實施例中,抗體為雙特異性抗體,其包含第一及第二結合區,其中第一結合區包含本文中所描述之抗LAP抗體之結合特異性(例如抗原結合區),且第二結合區不結合於LAP。在一些實施例中,第二結合區結合於不表現於血小板上之蛋白質。
抗體亦可為Fab、F(ab')2
、scFv、親和抗體、高親和性多聚體、奈米抗體、單鏈抗體或結構域抗體。抗體亦可具有任何同型,包括以下同型中之任一者:IgG1、IgG2、IgG3、IgG4、IgM、IgA1、IgA2、IgAsec、IgD及IgE。全長抗體可使用標準重組型DNA技術及核酸由VH
及VL
序列製備,該核酸編碼可操作地連接至可變區序列之所需恆定區序列。
在某些實施例中,本文中所描述之抗體可具有效應功能,或可具有降低之效應功能或不具有效應功能。在某些實施例中,抗LAP抗體包含效應子較少型或大部分效應子較少型Fc,例如IgG2或IgG4。通常,本文中所描述之可變區可連接至包含一或多種修飾之Fc,典型地改變抗體之一或多種功能特性,諸如血清半衰期、補體結合、Fc受體結合,及/或抗原依賴性細胞的細胞毒性。此外,本文中所描述之抗體可經化學修飾(例如一或多個化學部分可連接至抗體)或經修飾以改變其糖基化,以更改抗體之一或多種功能特性。此等實施例中之每一者進一步詳細描述於下文中。Fc區中之殘基之編號為Kabat之EU索引之編號。
在一些實施例中,Fc區為變異型Fc區,例如與親本Fc序列(例如未經修飾之Fc多肽,其接著經修飾以產生變異體)相比經修飾(例如藉由胺基酸取代、缺失及/或插入)之Fc序列,以提供所需結構特徵及/或生物活性。舉例而言,可在Fc區中進行修飾以產生滿足以下條件之Fc變異體:(a)具有增加或降低之抗體依賴性細胞介導之細胞毒性(ADCC),(b)增加或降低之補體介導之細胞毒性(CDC),(c)具有增加或降低之對C1q之親和力及/或(d)與親本Fc相比具有增加或降低之對Fc受體之親和力。此類Fc區變異體將通常在Fc區中包含至少一個胺基酸修飾。認為組合胺基酸修飾為尤其合乎需要的。舉例而言,變異型Fc區可在其中包括例如本文中鑑別之特定Fc區位置的兩個、三個、四個、五個等取代。
變異型Fc區亦可包含其中涉及二硫鍵形成之胺基酸經移除或經其他胺基酸置換的序列變化。此類移除可避免與用於產生本文中所描述之抗體之宿主細胞中存在的其他含有半胱胺酸之蛋白質之反應。即使當移除半胱胺酸殘基時,單鏈Fc結構域仍可形成非共價地保持在一起之二聚Fc結構域。在其他實施例中,Fc區可經修飾以使其與所選擇之宿主細胞更相容。舉例而言,可移除典型原生Fc區之N端附近的PA序列,該序列可由大腸桿菌中之消化酶(諸如脯胺酸亞胺基肽酶)識別。在其他實施例中,可移除Fc結構域內之一或多個糖基化位點。通常經糖基化之殘基(例如天冬醯胺酸)可賦予細胞溶解反應。可刪除此類殘基或經未糖基化之殘基(例如丙胺酸)取代。在其他實施例中,可自Fc區移除涉及與補體之相互相用之位點,諸如C1q結合位點。舉例而言,可刪除或取代人類IgG1之EKK序列。在某些實施例中,可移除影響結合於Fc受體之位點,較佳除救助受體結合位點以外之位點。在其他實施例中,可修飾Fc區以移除ADCC位點。ADCC位點為此項技術中已知的;關於IgG1中之ADCC位點,參見例如Molec. Immunol. 29 (5): 633-9 (1992)。變異型Fc結構域之特定實例揭示於例如PCT公開案第WO 97/34631號及第WO 96/32478號中。
在一個實施例中,Fc之鉸鏈區經修飾使得鉸鏈區中之半胱胺酸殘基之數目改變,例如增加或減少。此方法進一步描述於Bodmer等人之美國專利案第5,677,425號中。更特定言之,將一或多個胺基酸突變引入Fc鉸鏈片段之CH2-CH3結構域界面區域中,使得抗體對葡萄球菌蛋白質A (SpA)的結合相對於原生Fc鉸鏈域SpA結合而言減弱。此方法進一步詳細描述於Ward等人之美國專利案第6,165,745號中。
在其他實施例中,Fc區藉由用不同胺基酸殘基置換至少一個胺基酸殘基來改變,以改變抗體之效應功能。舉例而言,一或多個選自胺基酸殘基234、235、236、237、297、318、320及322之胺基酸可由不同胺基酸殘基置換使得抗體對效應子配位體具有改變之親和力,但保持親本抗體之抗原結合能力。親和力改變之效應子配位體可為例如Fc受體或補體之C1組分。此方法進一步詳細描述於Winter等人之美國專利案第5,624,821號及第5,648,260號中。在另一實例中,選自胺基酸殘基329、331及322之一或多個胺基酸可經不同胺基酸殘基置換,使得抗體具有改變之C1q結合及/或降低或消除之補體依賴性細胞毒性(CDC)。此方法進一步詳細描述於Idusogie等人之美國專利案第6,194,551號中。在另一實例中,改變胺基酸位置231及239內之一或多個胺基酸殘基,藉此改變抗體固定補體之能力。此方法進一步描述於例如Bodmer等人之PCT公開案第WO 94/29351號中。
在另一實例中,Fc區可藉由修飾以下位置處之一或多個胺基酸而經修飾以增加抗體依賴性細胞毒性(ADCC)及/或提高對Fcγ受體之親和力:234、235、236、238、239、240、241、243、244、245、247、248、249、252、254、255、256、258、262、263、264、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、293、294、295、296、298、299、301、303、305、307、309、312、313、315、320、322、324、325、326、327、329、330、331、332、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、433、434、435、436、437、438或439。例示性取代包括236A、239D、239E、268D、267E、268E、268F、324T、332D及332E。例示性變異體包括239D/332E、236A/332E、236A/239D/332E、268F/324T、267E/268F、267E/324T及267E/268F/324T。用於增強FcyR及補體相互作用之其他修飾包括(但不限於)取代298A、333A、334A、326A、247I、339D、339Q、280H、290S、298D、298V、243L、292P、300L、396L、305I及396L。此等及其他修飾評述於Strohl, 2009, Current Opinion in Biotechnology 20:685-691中。
增加與Fcγ受體之結合之Fc修飾包括Fc區之以下胺基酸位置中之任一或多者處之胺基酸修飾:238、239、248、249、252、254、255、256、258、265、267、268、269、270、272、279、280、283、285、298、289、290、292、293、294、295、296、298、301、303、305、307、312、315、324、327、329、330、335、337、3338、340、360、373、376、379、382、388、389、398、414、416、419、430、434、435、437、438或439,其中Fc區中之殘基之編號為如Kabat (PCT專利公開案第WO00/42072號)中之EU索引之編號。
可對Fc進行之其他Fc修飾為降低或消除與FcγR及/或補體蛋白質之結合之修飾,藉此降低或消除Fc介導之效應功能,諸如ADCC、ADCP及CDC。例示性修飾包括(但不限於)位置234、235、236、237、267、269、325及328處之取代、插入及缺失,其中編號係根據EU索引進行。例示性取代包括(但不限於) 234G、235G、236R、237K、267R、269R、325L及328R,其中編號係根據EU索引進行。Fc變異體可包含236R/328R。用於降低FcγR與補體相互作用之其他修飾包括取代297A、234A、235A、237A、318A、228P、236E、268Q、309L、330S、331S、220S、226S、229S、238S、233P及234V,以及位置297處之糖基化藉由突變或酶方式移除或藉由在不使蛋白質糖基化之生物體(諸如細菌)中產生來移除。此等及其他修飾評述於Strohl, 2009, Current Opinion in Biotechnology 20:685-691中。
視情況地,Fc區可在熟習此項技術者已知的其他及/或替代性位置處包含非天然存在之胺基酸殘基(參見例如美國專利案第5,624,821號;第6,277,375號;第6,737,056號;第6,194,551號;第7,317,091號;第8,101,720號;PCT專利公開案第WO 00/42072號;第WO 01/58957號;第WO 02/06919號;第WO 04/016750號;第WO 04/029207號;第WO 04/035752號;第WO 04/074455號;第WO 04/099249號;第WO 04/063351號;第WO 05/070963號;第WO 05/040217號;第WO 05/092925號及第WO 06/020114號)。
亦可使用增強對抑制性受體FcyRIIb之親和力之Fc變異體。此類變異體可提供具有與FcyRIIb+
細胞,包括例如B細胞及單核球相關之免疫調節活性之Fc融合蛋白質。在一個實施例中,與一或多種活化受體相比,Fc變異體提供選擇性增強之對FcyRIIb之親和力。用於改變與FcyRIIb之結合之修飾包括一或多個在選自由以下組成之群的根據EU索引之位置處之修飾:234、235、236、237、239、266、267、268、325、326、327、328及332。用於增強FcyRIIb親和力之例示性取代包括(但不限於) 234D、234E、234F、234W、235D、235F、235R、235Y、236D、236N、237D、237N、239D、239E、266M、267D、267E、268D、268E、327D、327E、328F、328W、328Y及332E。例示性取代包括235Y、236D、239D、266M、267E、268D、268E、328F、328W及328Y。用於增強與FcyRIIb之結合之其他Fc變異體包括235Y/267E、236D/267E、239D/268D、239D/267E、267E/268D、267E/268E及267E/328F。
在某些實施例中,抗體經修飾以延長其生物半衰期。各種方法皆為可能的。舉例而言,此可藉由增加Fc區對FcRn之結合親和力來進行。舉例而言,可使以下殘基中之一或多者突變:252、254、256、433、435、436,如美國專利案第6,277,375號中所描述。特定例示性取代包括以下中之一或多者:T252L、T254S及/或T256F。或者,為了延長生物半衰期,可在CH1或CL區域內改變抗體以含有救助受體,其結合獲自IgG之Fc區之CH2結構域之兩個環之抗原決定基,如Presta等人之美國專利案第5,869,046號及第6,121,022號中所描述。增加與FcRn之結合及/或改良藥物動力學特性之其他例示性變異體包括在位置259、308、428及434處進行之取代,包括例如259I、308F、428L、428M、434S、434H、434F、434Y及434M。增加Fc與FcRn之結合的其他變異體包括:250E、250Q、428L、428F、250Q/428L (Hinton等人 2004, J. Biol. Chem. 279(8): 6213-6216,Hinton等人 2006 Journal of Immunology 176:346-356)、256A、272A、286A、305A、307A、307Q、311A、312A、376A、378Q、380A、382A、434A (Shields等人, Journal of Biological Chemistry, 2001, 276(9):6591-6604)、252F、252T、252Y、252W、254T、256S、256R、256Q、256E、256D、256T、309P、311S、433R、433S、433I、433P、433Q、434H、434F、434Y、252Y/254T/256E、433K/434F/436H、308T/309P/311S (Dall Acqua等人 Journal of Immunology, 2002, 169:5171-5180,Dall'Acqua等人, 2006, Journal of Biological Chemistry 281:23514-23524)。用於調節FcRn結合之其他修飾描述於Yeung等人, 2010, J Immunol, 182:7663-7671中。在某些實施例中,可使用具有特定生物學特徵之雜交IgG同型。舉例而言,IgG1/IgG3雜交變異體可藉由用IgG3中兩種同型不同之位置處的胺基酸取代IgG1之CH2及/或CH3區中之位置來構築。因此,可構築包含一或多個取代(例如274Q、276K、300F、339T、356E、358M、384S、392N、397M、4221、435R及436F)之雜交變異型IgG抗體。在本文中所描述之其他實施例中,IgG1/IgG2雜交變異體可藉由用IgG1中兩種同型不同之位置處的胺基酸取代IgG2之CH2及/或CH3區中之位置來構築。因此,可構築包含一或多個取代,例如以下胺基酸取代中之一或多者的雜交變異型IgG抗體:233E、234L、235L、-236G(指位置236處之甘胺酸之插入)及327A。
此外,人類IgG1上之針對FcγRI、FcγRII、FcγRIII及FcRn之結合位點已經定位且已描述具有改良之結合的變異體(參見Shields R.L.等人,J. Biol. Chem. 276
:6591-6604, 2001)。證實位置256、290、298、333、334及339處之特異性突變會改良與FcγRIII之結合。此外,證實以下組合突變體會改良FcγRIII結合:T256A/S298A、S298A/E333A、S298A/K224A及S298A/E333A/K334A,已證實其呈現增強之FcγRIIIa結合及ADCC活性(Shields等人, 2001)。已鑑別顯著增強與FcγRIIIa之結合的其他IgG1變異體,包括具有S239D/I332E及S239D/I332E/A330L突變之變異體,其展示對FcγRIIIa之親和力的最大增加、FcγRIIb結合之降低及在食蟹獼猴中之強細胞毒性活性(Lazar等人, 2006)。將三重突變引入諸如阿侖單抗(alemtuzumab)(CD52特異性)、曲妥珠單抗(trastuzumab)(HER2/neu特異性)、利妥昔單抗(rituximab)(CD20特異性)及西妥昔單抗(cetuximab)(EGFR特異性)之抗體中可轉譯成活體外ADCC活性極大增強,且S239D/I332E變異體展示猴中耗乏B細胞之能力增強(Lazar等人, 2006)。此外,已鑑別在B細胞惡性病及乳癌之模型中在表現人類FcγRIIIa之基因轉殖小鼠中的含有L235V、F243L、R292P、Y300L及P396L突變之IgG1突變體,其呈現與FcγRIIIa之增強結合及伴隨之增強的ADCC活性(Stavenhagen等人,2007;Nordstrom等人, 2011)。可使用之其他Fc突變體包括:S298A/E333A/L334A、S239D/I332E、S239D/I332E/A330L、L235V/F243L/R292P/Y300L/P396L及M428L/N434S。
當使用IgG4恆定域時,其通常較佳包括取代S228P,其模擬IgG1中之鉸鏈序列且藉此使IgG4分子穩定。
在另一實施例中,抗體之糖基化經修飾。舉例而言,可產生非糖基化抗體(亦即,未經糖基化之抗體)。糖基化可經改變以例如提高抗體對抗原之親和力。此類碳水化合物修飾可藉由例如改變抗體序列內之一或多個糖基化位點來完成。舉例而言,可進行一或多個胺基酸取代,其引起消除一或多個可變區構架糖基化位點,藉此消除該位點處之糖基化。此類非糖基化可提高抗體對抗原之親和力。此類方法進一步詳細描述於Co等人之美國專利案第5,714,350號及第6,350,861號中。N297上恆定區之糖基化可藉由使N297殘基突變為另一殘基,例如N297A,及/或藉由使例如298之相鄰胺基酸突變來阻止,藉此降低N297上之糖基化。
或者或另外,可產生糖基化類型改變之抗體,諸如海藻糖基殘基量減少之低海藻糖基化抗體或二等分GlcNac結構增加之抗體。已證明此類改變之糖基化模式會提高抗體之ADCC能力。此類碳水化合物修飾可藉由例如在具有改變之糖基化機構之宿主細胞中表現抗體來實現。具有經改變之糖基化機構之細胞已描述於此項技術中,且可用作表現本文中所描述之重組型抗體以由此產生具有經改變之糖基化之抗體的宿主細胞。舉例而言,Hanai等人之EP 1,176,195描述一種細胞株,其中編碼海藻糖基轉移酶之FUT8基因在功能上被破壞,使得此類細胞株中所表現之抗體呈現低海藻糖基化。Presta之PCT公開案第WO 03/035835號描述變異型CHO細胞株Lec13細胞,其具有降低之使海藻糖連接至Asn(297)-連接之碳水化合物之能力,亦引起表現於該宿主細胞中之抗體之低海藻糖基化(亦參見Shields, R.L.等人 (2002) J. Biol. Chem.277
:26733-26740)。Umana等人之PCT公開案WO 99/54342描述經工程改造以表現醣蛋白修飾型醣基轉移酶(例如β(1,4)-N-乙醯基葡糖胺轉移酶III (GnTIII))的細胞株,使得表現於經工程改造之細胞株內之抗體呈現增加之二分GlcNac結構,其引起抗體之ADCC活性增加(亦參見Umana等人(1999) Nat. Biotech.17
:176-180)。
本文中所描述之抗體之另一修飾為聚乙二醇化。抗體可經聚乙二醇化以例如延長抗體之生物(例如血清)半衰期。為使抗體發生聚乙二醇化,典型地使抗體或其片段與聚乙二醇(PEG)(諸如PEG之反應性酯或醛衍生物)在使一或多個PEG基團變成連接至抗體或抗體片段之條件下反應。較佳地,聚乙二醇化經由與反應性PEG分子(或類似的反應性水溶性聚合物)之醯化反應或烷基化反應來進行。如本文中所使用,術語「聚乙二醇」意欲涵蓋已用於衍生其他蛋白質之任一種PEG形式,諸如單(C1-C10)烷氧基或芳氧基-聚乙二醇或聚乙二醇-順丁烯二醯亞胺。在某些實施例中,待聚乙二醇化之抗體為去糖基化抗體。用於蛋白質聚乙二醇化之方法為此項技術中已知的且可應用於本文中所描述之抗體。參見例如Nishimura等人之歐洲專利案第EP 0 154 316號及Ishikawa等人之歐洲專利案第EP 0 401 384號。
Fc區對其配位體之親和力及結合特性可藉由此項技術中已知之多種活體外分析方法(基於生物化學或免疫之分析)來測定,該等方法包括(但不限於)平衡方法(例如酶聯結免疫吸附分析法(ELISA),或放射免疫分析法(RIA)),或動力學(例如BIACORE分析)及其他方法,諸如間接結合分析法、競爭性抑制分析法、螢光共振能量轉移(FRET)、凝膠電泳及層析(例如凝膠過濾)。此等及其他方法可利用所檢驗之組分中之一或多者上的標記及/或使用多種偵測方法,包括(但不限於)發色、螢光、發光或同位素標記。結合親和力及動力學之詳細說明可見於Paul, W. E.編, Fundamental Immunology, 第4版, Lippincott-Raven, Philadelphia (1999),其聚焦於抗體-免疫原相互作用。
II. 與抗 LAP 抗體結合於相同抗原決定基或與抗 LAP 抗體交叉競爭之抗體
可使用免疫接種方案產生與本文中所揭示之抗體結合於相同或類似抗原決定基(且因此亦與本文中所揭示之抗體交叉競爭)之抗LAP抗體。可針對與人類LAP-TGFβ1之高親和力結合來篩選所得抗體。接著,可例如在其中在酵母細胞表面上存在LAP-TGFβ1之序列變異體的酵母呈現分析法中或藉由氫-氘交換實驗來研究所選擇之抗體,以測定由抗體結合之確切抗原決定基。
亦可使用嵌合構築體,例如LAP-TGFβ1之雞-人類嵌合體產生與本文中所描述之抗LAP抗體結合於相同抗原決定基之抗體。因為可組合人類及雞序列以得到正確摺疊之LAP-TGFβ1蛋白質(如實例2中所描述),因此該方法可用於產生針對LAP-TGFβ1上之相關特異性抗原決定基之免疫原。藉由此策略,將自雞LAP-TGFβ1獲得大部分序列,及插入於含有所需抗原決定基之區域中之人類LAP-TGFβ1之小型區段。可使用此策略靶向之LAP-TGFβ1上之例示性抗原決定基包括例如LAP-TGFβ1之下臂、LAP-TGFβ1之潛在環或包含人類LAP-TGFβ1之胺基酸82-130之抗原決定基。例示性雞-人類嵌合體構築體描述於實例3中。此嵌合蛋白可用於使雞免疫以得到單株抗體。因為雞LAP-TGFβ1將被識別為自體性,因此免疫反應將集中於人類序列。可使用此項技術中已知的標準方法,例如本文中所描述之方法測試使用此方法產生之抗體之各種功能/特性(例如與LAP-TGFβ1之結合、抑制TGFβ1活化、與ECM之結合、與細胞(諸如免疫抑制性細胞)之結合)。
可使用此項技術中公認的方法測定與抗體結合之抗原決定基。若抗LAP抗體例如滿足以下條件,則認為其與參考抗LAP抗體結合於相同抗原決定基:與參考抗體接觸人類LAP-TGFβ1上之一或多個相同殘基;與參考抗體接觸人類LAP-TGFβ1之至少一個區域內之一或多個相同殘基;與參考抗體接觸人類LAP-TGFβ1之至少一個區域內之大部分殘基;與參考抗體接觸人類LAP-TGFβ1之各區域內之大部分相同殘基;與參考抗體接觸沿人類LAP-TGFβ1之整個長度之大部分相同殘基;與參考抗體接觸人類LAP-TGFβ1之所有相同的獨特區域;與參考抗體接觸人類LAP-TGFβ1上之任一個區域處之所有相同殘基;或與參考抗體接觸人類LAP-TGFβ1之所有相同區域處之所有相同殘基。
用於測定與本文中所描述之抗LAP抗體結合於「人類LAP-TGFβ1上之相同抗原決定基」的抗體之技術包括抗原:抗體複合物之晶體之x射線分析,其提供抗原決定基之原子解析。其他方法監測抗體與抗原片段或抗原之突變型變化形式之結合,其中由抗原序列內之胺基酸修飾引起之結合之損失指示抗原決定基組分。方法亦可依賴於相關抗體自組合性噬菌體呈現肽文庫或自目標蛋白之蛋白酶消化,親和分離特定短肽(呈天然三維形式或呈變性形式)的能力。因此將肽視為與用於篩選肽文庫之抗體對應之抗原決定基之定義的榜樣。關於抗原決定基定位,亦已開發已證實可定位構形非連續抗原決定基的計算演算法。
抗原決定基或包含抗原決定基之區域亦可藉由針對結合於一系列跨越人類LAP-TGFβ1之重疊肽進行篩選來鑑別。或者,可使用Jespers等人 (1994) Biotechnology 12:899之方法指導具有與本文中所描述之抗LAP抗體相同之抗原決定基且因此具有與本文中所描述之抗LAP抗體類似之特性之抗體的選擇。使用噬菌體呈現,首先抗LAP抗體之重鏈與(例如人類)輕鏈之譜系配對以選擇LAP結合抗體,且接著新的輕鏈與(例如人類)重鏈譜系配對以選擇具有與本文中所描述之抗LAP抗體相同之抗原決定基或抗原決定基區域的(例如人類)LAP結合抗體。或者,可藉由編碼抗體之重鏈及輕鏈的cDNA序列之突變誘發來獲得本文中所描述之抗體之變異體。
亦可採用丙胺酸掃描突變誘發,如:Cunningham及Wells (1989)Science
244: 1081所描述,或LAP-TGFβ1中之胺基酸殘基之某些其他點突變誘發形式,來決定抗LAP抗體之功能性抗原決定基。
亦可藉由評估抗體與包含LAP-TGFβ1片段之肽的結合性來決定與特異性抗體結合之抗原決定基或抗原決定基區域(「抗原決定基區域」為包含抗原決定基或與抗原決定基重疊之區域)。可合成一系列涵蓋LAP-TGFβ1序列之重疊肽,且例如在直接ELISA、競爭性ELISA (其中評估肽阻止抗體與結合於微量滴定盤之孔的LAP-TGFβ1結合之能力)中或在晶片上篩選其結合性。此類肽篩選方法可能無法偵測一些非連續功能性抗原決定基。
亦可藉由基於MS之蛋白質足跡法(諸如HDX-MS及蛋白質之快速光化學氧化(Fast Photochemical Oxidation of Proteins;FPOP))、結構方法(諸如X射線晶體結構測定)、分子模型化及核磁共振光譜法來鑑別抗原決定基。
亦可使用單一粒子低溫電子顯微法(SP-Cryo-EM)鑑別與抗體結合之抗原決定基。SP-Cryo-EM為用於巨分子結構分析之技術,其使用高強度電子束,在低溫下,在生物樣本之原生環境中對其進行成像。近年來,SP-Cryo-EM已成為結晶學及NMR之補充技術,用於測定適用於藥物研發應用之近原子級結構(Renaud等人Nat Rev Drug Discov
2018;17:471-92;Scapin等人Cell Chem Biol
2018;25:1318-25;Ceska等人Biochemical Society Transactions
2019: 第BST20180267頁)。除高解析度資訊以外,SP-Cryo-EM具有允許進入更大及更複雜的生物系統之額外優點,以及表徵來自相同樣本之多重構形或組成解析狀態之可能性,提供對更多的大分子之生物相關狀態之洞察。進行成像時,將小體積之樣本(例如3 µl等分試樣)施加於網格上且在液態乙烷浴中急驟冷凍。接著,將冷凍網格裝載至顯微鏡中且收集網格之不同區域之數百至數千個影像。此等影像含有生物學大分子(粒子)之二維投影:使用數學工具及GPU驅動之演算法,鑑別、提取粒子且進行分類;在後續步驟中,使用不同類別計算一或多個3D重構,若其等共存於相同樣本中時,則對應於不同構形、寡聚或結合狀態。接著,可將個別重構精算至高解析度。
III. 核酸分子
本文中亦提供編碼本文中所描述之抗LAP抗體或抗原結合片段之核酸分子。核酸可存在於完全細胞、細胞溶解物中或以部分純化或基本上純的形式存在。本文中所描述之核酸可為例如DNA或RNA且可含有或可不含有內含子序列。在某些實施例中,核酸為cDNA分子。本文中所描述之核酸可使用標準分子生物學技術獲得。對於藉由融合瘤(例如由攜帶人類免疫球蛋白基因之基因轉殖小鼠製備之融合瘤,如下文中進一步描述)表現之抗體,編碼藉由融合瘤製備之抗體之輕鏈及重鏈的cDNA可藉由標準PCR擴增或cDNA選殖技術獲得。對於自免疫球蛋白基因文庫獲得(例如使用噬菌體呈現技術)之抗體,可自文庫回收編碼抗體之核酸。
在一些實施例中,本文中提供編碼本文中所描述之抗LAP抗體或抗原結合片段中之任一者之VH及/或VL序列或重鏈及/或輕鏈序列之核酸分子。本文中涵蓋包含本文中所描述之核苷酸序列(例如核酸分子)之宿主細胞。在獲得編碼VH及VL區段之DNA片段之後,此等DNA片段可藉由標準重組型DNA技術進一步操作,例如以將可變區基因轉化成全長抗體鏈基因、Fab片段基因或scFv基因。在此等操作中,編碼VL或VH之DNA片段可操作地連接至編碼另一蛋白質(諸如抗體恆定區或可撓性連接子)之另一DNA片段。如此上下文中所使用之術語「可操作地連接」意欲意謂兩個DNA片段連接以使得由兩個DNA片段編碼之胺基酸序列保持在框內。
編碼VH區之經分離之DNA可藉由將編碼VH之DNA可操作地連接至編碼重鏈恆定區(鉸鏈、CH1、CH2及/或CH3)之另一DNA分子而轉化成全長重鏈基因。人類重鏈恆定區基因之序列為此項技術中已知的(參見例如Kabat, E. A.等人(1991) Sequences of Proteins of Immunological Interest, 第五版, U.S. Department of Health and Human Services, NIH公開案第91-3242號),且涵蓋此等區域之DNA片段可藉由標準PCR擴增來獲得。
編碼VL區之經分離之DNA可藉由將編碼VL之DNA可操作地連接至編碼輕鏈恆定區CL之另一DNA分子來轉化成全長輕鏈基因(以及Fab輕鏈基因)。人類輕鏈恆定區基因之序列在此項技術中已知(參見例如Kabat, E. A.等人, (1991) Sequences of Proteins of Immunological Interest, 第五版,U.S. Department of Health and Human Services,NIH公開案第91-3242號)且涵蓋此等區域之DNA片段可藉由標準PCR擴增來獲得。輕鏈恆定區可為κ或λ恆定區。
本文中亦提供具有保守性取代之核酸分子,該等保守性取代在核酸分子之轉譯時不改變所得胺基酸序列。
IV. 製備方法
單株抗體可使用此項技術中已知之多種技術來製備,包括使用融合瘤、重組型及噬菌體呈現技術或其組合。
此項技術中可使用多種用於製備本文中所描述之單株抗體之方法。舉例而言,可使用由Kohler等人, Nature, 256:495 (1975)首先描述之融合瘤方法或其任何改進版本或藉由重組型DNA方法(美國專利案第4,816,567號)來製備單株抗體。舉例而言,可使用融合瘤技術產生單株抗體,包括此項技術中已知及例如Harlow等人, Antibodies: A Laboratory Manual, (Cold Spring Harbor Laboratory Press, 第2版 1988);Hammer-ling等人, Monoclonal Antibodies and T-Cell Hybridomas 563-681 (Elsevier, N.Y., 1981) (該等參考文獻以全文引用之方式併入)中所教示之融合瘤技術。用於使用融合瘤技術產生及篩選特異性抗體之方法為此項技術中常規且熟知的。在另一實例中,適用於本文中所描述之方法及組合物中之抗體亦可使用此項技術中已知之各種噬菌體呈現方法產生,諸如自使用McCafferty等人, Nature, 348:552-554 (1990)中所描述之技術產生的抗體噬菌體文庫分離。Clackson等人, Nature, 352:624-628 (1991)及Marks等人, J. Mol. Biol, 222:581-597 (1991)分別描述使用噬菌體文庫分離鼠類及人類抗體。後續公開案描述藉由鏈改組產生高親和力(例如nM範圍)人類抗體(Marks等人, Bio/Technology, 10:779-783 (1992)),以及作為用於構築極大型噬菌體文庫之策略之組合感染及活體內重組(Waterhouse等人, Nuc. Acids. Res., 21 :2265-2266 (1993))。因此,此等技術為用於分離單株抗體之傳統單株抗體融合瘤技術之可行替代物。
人類抗體可藉由此項技術中已知的各種方法製得,包括上文所述的噬菌體呈現方法,其使用來源於人類免疫球蛋白序列之抗體文庫。亦參見美國專利案第4,444,887號及第4,716,111號;及PCT公開案第WO 98/46645號、第WO 98/50433號、第WO 98/24893號、第WO 98/16654號、第WO 96/34096號、第WO 96/33735號及第WO 91/10741號,其內容以全文引用之方式併入本文中。人類抗體亦可使用基因轉殖小鼠產生,該基因轉殖小鼠表現人類免疫球蛋白基因且在免疫接種時能夠在不存在內源性免疫球蛋白產生之情況下產生人類抗體之完全譜系。關於用於產生人類抗體之此技術之綜述,參見Lonberg及Huszar, 1995, Int. Rev. Immunol. 13:65-93。亦可使用噬菌體呈現技術(McCafferty等人,Nature 348:552-553, (1990))由來自未經免疫之供體之免疫球蛋白可變(V)域基因譜系活體外產生人類抗體及抗體片段。亦可藉由活體外經活化之B細胞產生人類抗體(參見美國專利案第5,567,610號及第5,229,275號,其內容以全文引用之方式併入本文中)。識別所選擇之抗原決定基之完全人類抗體可使用稱為「導向選擇(guided selection)」之技術產生。在此方法中,所選擇的非人類單株抗體,例如小鼠抗體,用於指導識別相同抗原決定基之完全人類抗體之選擇(Jespers等人, 1994, Bio/technology 12:899-903)。
可基於鼠類單株抗體之序列製備嵌合抗體。編碼重鏈及輕鏈免疫球蛋白之DNA可使用標準分子生物學技術自相關鼠類融合瘤獲得且經工程改造以含有非鼠類(例如人類)免疫球蛋白序列。舉例而言,為產生嵌合抗體,可使用此項技術中已知的方法使鼠類可變區與人類恆定區連接(參見例如Cabilly等人之美國專利案第4,816,567號)。
抗LAP抗體之人類化形式(例如小鼠抗LAP抗體之人類化形式)為含有來源於非人類免疫球蛋白之最小序列之嵌合抗體。人類化抗體通常為人類免疫球蛋白(受體抗體),其中來自受體的CDR或高變區之殘基經來自諸如具有所需特異性、親和力及能力之小鼠、大鼠、兔或非人類靈長類動物之非人類物種(供體抗體)的CDR或高變區之殘基置換。在一些情況下,人類免疫球蛋白之Fv構架區(FR)殘基由相應非人類殘基置換。人類化抗體可包含在受體抗體或供體抗體中未發現之殘基。進行此等修飾以進一步優化抗體效能。一般而言,人類化抗體將包含實質上全部至少一個且通常兩個可變域,其中全部或實質上全部高變環對應於非人類免疫球蛋白之高變環且全部或實質上全部FR區域為人類免疫球蛋白共同序列之FR區域。人類化抗體視情況亦將包含免疫球蛋白恆定區(Fc)之至少一部分,典型地,人類免疫球蛋白之至少一部分。關於其他細節,參見Jones等人, Nature 321 :522-525 (1986);Riechmann等人, Nature 332:323-329 (1988);及Presta, Curr. Op. Struct. Biol. 2:593-596 (1992)。
人類化抗體之構架區及CDR區不必精確對應於親本序列,例如供體抗體CDR或共同構架可藉由至少一個胺基酸殘基之取代、插入及/或缺失來進行突變誘發,使得該位點處之CDR或構架殘基無法剛好對應於供體抗體或共同構架。如本文中所使用,術語「共同構架」係指共同免疫球蛋白序列中之構架區。如本文中所使用,術語「共同免疫球蛋白序列」係指由相關免疫球蛋白序列家族中最頻繁出現之胺基酸(或核苷酸)形成的序列(參見例如Winnaker, From Genes to Clones (Verlagsgesellschaft, Weinheim, Germany 1987))。在免疫球蛋白家族中,共同序列中之各位置由該家族中最頻繁出現於該位置之胺基酸佔據。若兩個胺基酸同樣頻繁地出現,則共有序列中可包括任一個。如本文中所使用,「維尼爾區(Vernier zone)」係指如Foote及Winter (1992, J. Mol. Biol. 224:487-499,其以引用之方式併入本文中)所描述,可調節CDR結構且微調與抗原之配合度的構架殘基之子集。維尼爾區殘基形成在CDR下面且可影響CDR結構及抗體親和力之層。可用作受體之人類免疫球蛋白(Ig)序列為此項技術中熟知的。
人類構架區中之構架殘基可經來自CDR供體抗體之相應殘基取代,以改變,較佳改良抗原結合。此等構架取代係藉由此項技術中熟知之方法鑑別,例如藉由使CDR與構架殘基之相互作用模型化以鑑別對於抗原結合而言重要之構架殘基,且進行序列比較以鑑別特定位置處的異常構架殘基。(參見例如Queen等人, 美國專利案第5,585,089號;Riechmann等人, Nature 332:323 (1988),其以全文引用之方式併入本文中)。通常可獲得三維免疫球蛋白模型且為熟習此項技術者所熟悉。可使用說明且顯示所選擇之候選免疫球蛋白序列的可能三維構形結構之電腦程式。測試此等顯示使得可分析殘基在候選免疫球蛋白序列的功能中之可能作用,亦即,分析影響候選免疫球蛋白結合其抗原之能力之殘基。以此方式,可自共有序列及導入序列選擇及組合FR殘基以達成所需抗體特徵,諸如對目標抗原之親和力增加。通常,CDR殘基直接且最實質性涉及影響抗原結合。可使用此項技術中已知的多種技術使抗體人類化,包括(但不限於)以下文獻中描述之技術:Jones等人, Nature 321 :522 (1986);Verhoeyen等人, Science 239: 1534 (1988);Sims等人, J. Immunol. 151 : 2296 (1993);Chothia及Lesk, J. Mol. Biol. 196:901 (1987);Carter等人, Proc. Natl. Acad. Sci. U.S.A. 89:4285 (1992);Presta等人, J. Immunol. 151 :2623 (1993);Padlan, Molecular Immunology 28(4/5):489-498 (1991);Studnicka等人, Protein Engineering 7(6):805-814 (1994);Roguska.等人, PNAS 91 :969-973 (1994);PCT公開案第WO 91/09967號、PCT/:US98/16280、US96/18978、US91/09630、US91/05939、US94/01234、GB89/01334、GB91/01134、GB92/01755;WO90/14443、WO90/14424、WO90/14430、EP 229246、EP 592,106;EP 519,596、EP 239,400、美國專利案第5,565,332號、第5,723,323號、第5,976,862號、第5,824,514號、第5,817,483號、第5,814,476號、第5,763,192號、第5,723,323號、第5,766,886號、第5,714,352號、第6,204,023號、第6,180,370號、第5,693,762號、第5,530,101號、第5,585,089號、第5,225,539號、第4,816,567號,其各自以全文引用之方式併入本文中。
可使用此項技術中已知及實例中描述之方法(例如此項技術中公認的蛋白質-蛋白質結合分析法、生物化學篩選分析法、免疫分析法及基於細胞之分析法),使用上文所描述之方法測試所產生之抗LAP抗體之所需功能,諸如特定結合特異性、結合親和力、目標細胞群體。本發明之一個態樣提供一種分子,其可用於篩選結合LAP、包含LAP之複合物及/或包含LAP-TGFβ1之複合物之抗體或抗原結合片段。舉例而言,表4中之分子(亦即,具有SEQ ID NO:1及198-210中之任一者之胺基酸序列之分子)係用於篩選或測定至少一種結合蛋白質之結合。在各種實施例中,表4 (亦即,具有SEQ ID NO:1及198-210中之任一者之胺基酸序列之分子)及表6 (亦即,具有SEQ ID NO:211-213中之任一者之胺基酸序列之分子)中之至少一個分子係用於篩選或測定至少一種抗體或抗原結合片段之結合。
例示性分析法包括(但不限於)免疫沈澱或活體外結合分析法,諸如放射免疫分析法(RIA)、FACS、酶聯結免疫吸附分析法(ELISA)、生物層干涉術(例如ForteBio分析法)及史卡查分析(Scatchard analysis)。
抗體工程改造
亦包括其中抗LAP抗體或其抗原結合片段為經工程改造之抗體以包括對親本單株抗體之可變域內的構架殘基之修飾(例如,以改良抗體或片段之特性)之實施例。通常,進行此類構架修飾以降低抗體或片段之免疫原性。此通常藉由以下實現:將親本(例如嚙齒動物)抗體或片段中之可變域中之非CDR殘基(亦即,構架殘基)替換為來自待使用抗體之物種之免疫組庫(immune repertoire)之類似殘基,例如在人類治療劑之情況下係人類殘基。此類抗體或片段稱為「人類化」抗體或片段。在一些情況下,需要增加經工程改造(例如人類化)之抗體之親和力或改變特異性。一種方法為使一或多個構架殘基「回復突變(backmutate)」成相應生殖系序列。更特定言之,已進行體細胞突變之抗體可含有不同於獲得抗體之生殖系序列的構架殘基。此類殘基可藉由比較抗體或片段構架序列與抗體或片段所來源於之生殖系序列來鑑別。另一種方法為在經工程改造之(例如人類化)抗體之一或多個位置處恢復成原始親本(例如嚙齒動物)殘基,例如恢復可能在置換構架殘基之過程中喪失的結合親和力。(參見例如美國專利案第5,693,762號、美國專利案第5,585,089號及美國專利案第5,530,101號)。
在某些實施例中,抗LAP抗體及其抗原結合片段經工程改造(例如人類化)以在構架及/或CDR中包括用於改良其特性之修飾。此類工程改造變化可基於分子模型化。可構築親本(非人類)抗體序列之可變區的分子模型以理解抗體之結構特徵且用於鑑別可與抗原相互作用之抗體上的潛在區域。習知CDR係基於免疫球蛋白序列與鑑別可變區之比對。Kabat等人, (1991) Sequences of Proteins of Immunological Interest;Kabat等人, National Institutes of Health, Bethesda, Md., 第5版;NIH公開案第91-3242號;Kabat (1978)Adv. Prot. Chem.
32:1-75;Kabat,等人, (1977)J. Biol. Chem.
252:6609-6616。Chothia及同事小心地檢驗抗體晶體結構中環之構形且提出高變環。Chothia,等人, (1987)J Mol. Biol.
196:901-917或Chothia,等人, (1989)Nature
342:878-883。歸類為「CDR」及「高變環」之區域之間存在變化。隨後的研究(Raghunathan等人, (2012)J. Mol Recog.
25, 3, 103-113)分析若干抗體-抗原晶體複合物且發現抗體中之抗原結合區未必嚴格地符合「CDR」殘基或「高變」環。非人類抗體之可變區的分子模型可用於引導可潛在結合於抗原之區域的選擇。實際上,基於模型之潛在抗原結合區不同於習知「CDR」或「高變」環。諸如MOE (Chemical Computing Group)之商業科學軟體可用於分子模型化。人類構架可基於構架與CDR中與非人類序列之最佳匹配來選擇。對於VH中之FR4 (構架4),將人類生殖系之VJ區與對應非人類區域相比較。在VL中之FR4 (構架4)之情況下,將人類生殖系序列之J-κ及J-λ區與對應非人類相比較。一旦鑑別適合之人類構架,即可將CDR移植至所選人類構架中。在一些情況下,VL-VH界面中之某些殘基可在非人類(親本)序列中保留。分子模型亦可用於鑑別可潛在地改變CDR構形且因此改變與抗原之結合的殘基。在一些情況下,此等殘基係如非人類(親本)序列中保留。分子模型亦可用於鑑別溶劑暴露之可引起諸如糖基化、去醯胺化及氧化之不合需要之作用的胺基酸。可在設計階段較早引入可展性過濾器以消除此等潛在問題/將其最小化。
構架修飾之另一類型涉及使構架區內,或甚至一或多個CDR區內之一或多個殘基突變,以移除T細胞抗原決定基,藉此降低抗體之潛在免疫原性。此方法亦稱為「去免疫」,且進一步詳細地描述於美國專利案第7,125,689號中。
在特定實施例中,需要將某些含有暴露側鏈之胺基酸變成另一胺基酸殘基,以提供最終抗體之較高化學穩定性,以避免去醯胺化或異構化。天冬醯胺之去醯胺化可在NG、DG、NG、NS、NA、NT、QG或QS序列上發生且引起產生異天冬胺酸殘基,其將扭接引入多肽鏈且降低其穩定性(異天冬胺酸作用)。異構化可在DG、DS、DA或DT序列進行。在某些實施例中,本發明之抗體不含去醯胺化或天冬醯胺異構位點。舉例而言,天冬醯胺(Asn)殘基可變成Gln或Ala以降低任何Asn-Gly序列處,尤其CDR內形成異天冬胺酸之可能性。
類似問題可在Asp-Gly序列處出現。Reissner及Aswad (2003)Cell. Mol. Life Sci.
60:1281。異天冬胺酸形成可減弱或完全消除抗體與其目標抗原之結合。參見Presta (2005)J. Allergy Clin. Immunol
. 116:731至734。
在多種實施例中,天冬醯胺變成麩醯胺酸(Gln)。亦可能需要改變與天冬醯胺(Asn)或麩醯胺酸(Gln)殘基相鄰之胺基酸以降低去醯胺化之可能性,當小型胺基酸與天冬醯胺或麩醯胺酸相鄰出現時去醯胺化以更大速率發生。參見Bischoff及Kolbe (1994)J. Chromatog
. 662:261。此外,CDR中任何甲硫胺酸殘基(通常溶劑暴露之Met)可變成Lys、Leu、Ala或Phe或其他胺基酸以降低甲硫胺酸之硫氧化之可能性,此可降低抗原結合親和力且亦有助於最終抗體製備中之分子異質性。同上。此外,為預防潛在易裂開之Asn-Pro肽鍵或將其降至最低,可能需要將在CDR中發現之任何Asn-Pro組合變成Gln-Pro、Ala-Pro或Asn-Ala。接著,篩選具有此類取代之抗體以確保取代不降低抗體對LAP之親和力或特異性或其他所需生物活性至不可接受之程度。關於例示性穩定化CDR變異體,參見表1A。表 1A. 例示性穩定化 CDR 變異體
| CDR 殘基 | 穩定化變異體序列 |
| Asn-Gly (N-G) | Gln-Gly、Ala-Gly或Asn-Ala (Q-G)、(A-G)或(N-A) |
| Asp-Gly (D-G) | Glu-Gly、Ala-Gly或Asp-Ala (E-G)、(A-G)或(D-A) |
| Met (M) | Lys、Leu、Ala或Phe (K)、(L)、(A)或(F) |
| Asn (N) | Gln或Ala (Q)或(A) |
| Asn-Pro (N-P) | Gln-Pro、Ala-Pro或Asn-Ala (Q-P)、(A-P)或(N-A) |
Fc 區 之抗體工程改造
本文中所揭示之抗體(例如人類化抗體)及其抗原結合片段(例如抗體20E6及其人類化版本以及抗體28G11及其人類化版本)亦可經工程改造以在Fc區內包括修飾,通常以改變抗體之一或多種特性,諸如血清半衰期、補體結合、Fc受體結合及/或效應功能(例如抗原依賴性細胞毒性)。此外,本文中所揭示之抗體及其抗原結合片段(例如抗體20E6及其人類化版本)可經化學修飾(例如一或多個化學部分可連接至抗體)或經修飾以改變其糖基化,再次改變抗體或片段之一或多種特性。此等實施例中之每一者進一步詳細描述於下文中。Fc區中之殘基之編號為Kabat之EU索引之編號。
本文中所揭示之抗體及其抗原結合片段(例如抗體20E6及其人類化版本)亦包括具有經修飾(或阻斷)之Fc區以提供改變之效應功能的抗體及片段。參見例如美國專利案第5,624,821號;及PCT公開案第WO2003/086310號;第WO2005/120571號;第WO2006/0057702號。此類修飾可用於增強或抑制免疫系統之各種反應,在診斷及療法中可能具有有益作用。Fc區之變化包括胺基酸變化(取代、缺失及插入)、糖基化或去糖基化及添加多個Fc區。Fc之變化亦可改變治療性抗體中抗體之半衰期,實現較不頻繁之給藥且因此增加便利性且降低物質之用量。參見Presta (2005)J. Allergy Clin. Immunol
. 116:731, 734-35。
在一個實施例中,本發明之抗體或抗原結合片段(例如抗體20E6及其人類化版本)為在重鏈恆定區之鉸鏈區中對應於位置228之位置處包含絲胺酸至脯胺酸突變(S228P;EU索引)之IgG4同型抗體或片段。已報導此突變消除鉸鏈區中重鏈間二硫橋鍵之異質性(Angal等人, 見上文;位置241係基於Kabat編號系統)。
在本發明之一個實施例中,CH1之鉸鏈區經修飾使得鉸鏈區中之半胱胺酸殘基之數目增加或減少。此方法進一步描述於美國專利案第5,677,425號中。改變CH1鉸鏈區中之半胱胺酸殘基之數目以例如促進輕鏈及重鏈之組裝或提高或降低抗體之穩定性。
在另一實施例中,使本發明之抗體或抗原結合片段(例如抗體20E6及其人類化版本以及抗體22F9及其人類化版本)之Fc鉸鏈區突變以縮短抗體或片段之生物半衰期。更特定言之,將一或多個胺基酸突變引入Fc鉸鏈片段之CH2-CH3結構域界面區域中,使得抗體或片段對葡萄球菌蛋白質A (SpA)的結合相對於原生Fc鉸鏈域SpA結合而言減弱。此方法進一步詳細描述於美國專利案第6,165,745號中。
在另一實施例中,本發明之抗體或抗原結合片段(例如抗體20E6及其人類化版本以及抗體20E6及其人類化版本)經修飾以延長其生物半衰期。各種方法為可能的。舉例而言,可引入以下突變中之一或多者:T252L、T254S、T256F,如美國專利案第6,277,375號中所述。或者,為了延長生物半衰期,抗體可在CH1或CL區內改變以含有自IgG之Fc區之CH2結構域之兩個環獲得之救助受體結合抗原決定基,如美國專利案第5,869,046號及第6,121,022號中所述。
在其他實施例中,藉由將至少一個胺基酸殘基替換為不同胺基酸殘基來改變Fc區,以改變抗體或抗原結合片段之效應功能。舉例而言,一或多個選自胺基酸殘基234、235、236、237、297、318、320及322之胺基酸可由不同胺基酸殘基置換使得抗體對效應子配位體具有改變之親和力,且保持親本抗體之抗原結合能力。親和力改變之效應子配位體可為例如Fc受體或補體之C1組分。此方法進一步詳細地描述於美國專利案第5,624,821號及第5,648,260號中。
在另一實例中,選自胺基酸殘基329、331及322之一或多個胺基酸可經不同胺基酸殘基置換,使得抗體具有改變之C1q結合及/或降低或消除之補體依賴性細胞毒性(CDC)。此方法進一步詳細描述於美國專利案第6,194,551號中。
在另一實例中,改變胺基酸位置231及239內之一或多個胺基酸殘基,藉此改變抗體固定補體之能力。此方法進一步描述於PCT公開案第WO 94/29351號中。
在另一實例中,藉由修飾以下位置處之一或多個胺基酸來修飾Fc區以降低本發明之抗體或抗原結合片段(例如抗體20E6及其人類化版本以及抗體20E6及其人類化版本)介導抗體依賴性細胞毒性(ADCC)之能力及/或降低抗體或片段對Fcγ受體之親和力:238、239、243、248、249、252、254、255、256、258、264、265、267、268、269、270、272、276、278、280、283、285、286、289、290、292、293、294、295、296、298、301、303、305、307、309、312、315、320、322、324、326、327、329、330、331、333、334、335、337、338、340、360、373、376、378、382、388、389、398、414、416、419、430、434、435、437、438或439。此方法進一步描述於PCT公開案第WO 00/42072號中。此外,人類IgG1上之針對FcγRI、FcγRII、FcγRIII及FcRn之結合位點已經定位且已描述具有改良之結合的變異體(參見Shields等人, (2001) J. Biol. Chem.276
:6591-6604)。
在本發明之一個實施例中,Fc區藉由修飾殘基243及264而經修飾以降低本發明之抗體(例如抗體20E6及其人類化版本)介導效應功能之能力及/或提高消炎特性。在一個實施例中,抗體或片段之Fc區藉由將位置243及264處之殘基變成丙胺酸來修飾。在一個實施例中,Fc區藉由修飾殘基243、264、267及328而經修飾以降低抗體或片段介導效應功能之能力及/或提高消炎特性。
改變之效應功能
在一些實施例中,抗LAP抗體之Fc區經修飾以增加或降低抗體或抗原結合片段介導效應功能之能力及/或增加/降低其與Fcγ受體(FcγR)之結合。
咸信抗原結合蛋白之恆定區與包括FcγRI (CD64)、FcγRII (CD32)及FcγRIII (CD16)之各種Fc受體(FcR)之間的相互作用介導抗原結合蛋白之效應功能,諸如ADCC及CDC。Fc受體對抗體交聯而言亦為重要的,抗體交聯對抗腫瘤免疫性而言可為重要的。
效應功能可以多種方式,包括例如經由FcγRIII與自然殺手細胞之結合或經由FcγRI與單核球/巨噬細胞之結合量測以量測ADCC效應功能。舉例而言,可在自然殺手細胞分析法中評估本發明之抗原結合蛋白的ADCC效應功能。此類分析法之實例可見於Shields等人, 2001J. Biol. Chem.
, 第276卷, 第6591-6604頁;Chappel等人, 1993 J. Biol. Chem., 第268卷, 第25124-25131頁;Lazar等人, 2006 PNAS, 103; 4005-4010中。
已證實在殘基Asn297上含有特定突變或改變之糖基化的人類IgG1恆定區可降低與Fc受體之結合。在其他情況下,亦證實此等突變可增強ADCC及CDC (Lazar等人 PNAS 2006, 103; 4005-4010;Shields等人 J Biol Chem 2001, 276; 6591-6604;Nechansky等人 Mol Immunol, 2007, 44; 1815-1817)。
在本發明之一個實施例中,此類突變在選自239、332及330 (IgG1)之一或多個位置中,或其他IgG同型中之同等位置中。適合的突變之實例為S239D及I332E及A330L。在一個實施例中,本文所描述之本發明之抗原結合蛋白在位置239及332處突變,例如S239D及I332E,或在另一實施例中,其在選自239及332及330之三個或更多個位置處突變,例如S239D及I332E及A330L (EU索引編號)。
在本發明之一個替代實施例中,提供一種抗體,其包含具有改變之糖基化概況的重鏈恆定區,使得該抗原結合蛋白具有增強之效應功能。舉例而言,其中抗體具有增強之ADCC或增強之CDC或其中其具有增強之ADCC及CDC效應功能。適用於產生具有改變之糖基化概況之抗原結合蛋白的方法之實例描述於PCT公開案第WO2003011878號及第WO2006014679號以及歐洲專利案第EP1229125號中。
在另一態樣中,本發明提供「非海藻糖基化」或「去海藻糖基化」抗體。非海藻糖基化抗體具有無海藻糖殘基的Fc之複合型N-聚糖之三甘露糖基核心結構。歸因於FcγRIIIa結合能力之增強,此等不具有來自Fc N-聚糖之核心海藻糖殘基的經糖基工程改造之抗體可呈現比海藻糖基化等效物更強的ADCC。
本發明亦提供一種產生根據本發明之抗體的方法,其包含以下步驟:a)培養包含表現載體之重組型宿主細胞,該表現載體包含如本文中所描述之經分離之核酸,其中該重組型宿主細胞不包含α-1,6-海藻糖基轉移酶;及b)回收抗原結合蛋白。重組型宿主細胞通常可不含有編碼α-1,6-海藻糖基轉移酶之基因(例如,酵母宿主細胞,諸如畢赤酵母屬(Pichia sp.))或可經遺傳修飾以不活化α-1,6-海藻糖基轉移酶。可獲得已經遺傳修飾以不活化編碼α-1,6-海藻糖基轉移酶之FUT8基因的重組型宿主細胞。參見例如可獲自BioWa, Inc.(Princeton,N.J.)之POTELLIGENT™技術系統,其中不具有FUT8基因之功能複本的CHOK1SV細胞產生具有增強之抗體依賴性細胞介導之細胞毒性(ADCC)活性的單株抗體,該ADCC活性相對於在具有功能性FUT8基因之細胞中產生的相同單株抗體增加。POTELLIGENT™技術系統之態樣描述於美國專利案第US7214775號及第US6946292號以及PCT公開案第WO0061739號及第WO0231240號中。一般熟習此項技術者亦將認識到其他適合的系統。
熟習此項技術者將顯而易見,此類修飾並非僅可單獨使用,而是可彼此組合使用以進一步增強或降低效應功能。
製備具有經修飾之糖基化之抗體
在另一實施例中本發明之抗體或抗原結合片段(例如抗體20E6及其人類化版本)包含特定糖基化模式。舉例而言,可製備去海藻糖基化或去糖基化抗體或片段(亦即,分別為不具有海藻糖或糖基化之抗體)。可改變抗體或片段之糖基化模式以例如增加抗體或片段對LAP抗原之親和力或親合力。此類修飾可藉由例如改變抗體或片段序列內之一或多個糖基化位點來實現。舉例而言,可進行一或多個胺基酸取代,從而移除一或多個可變區構架糖基化位點,藉此消除該位點處之糖基化。此類去糖基化可增加抗體或片段對抗原之親和力或親合力。參見例如美國專利案第5,714,350號及第6,350,861號。
本文中所揭示之抗體及抗原結合片段(例如抗體20E6及其人類化版本以及抗體28G11及其人類化版本)可進一步包括在低級真核生物宿主細胞,尤其諸如酵母之真菌宿主細胞中產生之抗體及抗原結合片段,且絲狀真菌已經基因工程改造以產生具有哺乳動物或人類樣糖基化模式之醣蛋白(參見例如Choi等人, (2003)Proc. Natl. Acad. Sci.
100: 5022-5027;Hamilton等人, (2003)Scienc
e 301: 1244-1246;Hamilton等人, (2006)Science
313: 1441- 1443;Nett等人,Yeast
28(3):237-52 (2011);Hamilton等人,Curr Opin Biotechnol
. Oct;18(5):387-92 (2007))。此等經遺傳修飾之宿主細胞優於當前使用之哺乳動物細胞株的一個特定優勢為能夠控制在細胞中產生之醣蛋白之糖基化概況,使得可產生其中特定N-聚糖結構佔優勢之醣蛋白組合物(參見例如美國專利案第7,029,872號及美國專利案第7,449,308號)。此等經遺傳修飾之宿主細胞已用於產生主要具有特定N
-聚糖結構之抗體(參見例如Li等人, (2006)Nat. Biotechnol
. 24: 210-215)。
在特定實施例中,本文中所揭示之抗體及其抗原結合片段(例如抗體20E6及其人類化版本)進一步包括在低級真核宿主細胞中產生且包含海藻糖基化及非海藻糖基化雜交及複合N
-聚糖之抗體及其抗原結合片段,包括二等分(bisected)及多觸角(multiantennary)物種,包括(但不限於)N
-聚糖,諸如GlcNAc(1-4)
Man3
GlcNAc2
;Gal(1-4)
GlcNAc(1-
4)Man3
GlcNAc2
;NANA(1-4)
Gal(1-4)
GlcNAc(1-4)
Man3
GlcNAc2
。
在特定實施例中,本文中提供之抗體及其抗原結合片段(例如抗體20E6及其人類化版本)可包含具有至少一種選自由以下組成之群之雜交N
-聚糖的抗體或片段:GlcNAcMan5
GlcNAc2
;GalGlcNAcMan5
GlcNAc2
;及NANAGalGlcNAcMan5
GlcNAc2
。在特定態樣中,雜交N
-聚糖為組合物中之主要N
-聚糖物質。
在特定實施例中,本文中提供之抗體及其抗原結合片段(例如抗體20E6及其人類化版本以及抗體28G11及其人類化版本)包含具有至少一種選自由以下組成之群之複合N-
聚糖之抗體及片段:GlcNAcMan3
GlcNAc2
;GalGlcNAcMan3
GlcNAc2
;NANAGalGlcNAcMan3
GlcNAc2
;GlcNAc2
Man3
GlcNAc2
;GalGlcNAc2
Man3
GlcNAc2
;Gal2
GlcNAc2
Man3
GlcNAc2
;NANAGal2
GlcNAc2
Man3
GlcNAc2
;及NANA2
Gal2
GlcNAc2
Man3
GlcNAc2
。在特定態樣中,複合N
-聚糖為組合物中之主要N
-聚糖物質。在其他態樣中,複合N
-聚糖為特定N
-聚糖物種,其占組合物中之N
-聚糖之約30%、40%、50%、60%、70%、80%、90%、95%、97%、98%、99%或100%。在一個實施例中,本文中提供之抗體及其抗原結合片段包含複合N-聚糖,其中至少50%、60%、70%、80%、90%、95%、97%、98%、99%或100%之複合N
-聚糖包含結構NANA2
Gal2
GlcNAc2
Man3
GlcNAc2
,其中此類結構為去海藻糖基化的。此類結構可例如在經工程改造之甲醇酵母(Pichia pastoris
)宿主細胞中產生。
在特定實施例中,N
-聚糖經海藻糖基化。一般而言,海藻糖在N
-聚糖之還原端與GlcNAc之α1,3-連接中、在N
-聚糖之還原端與GlcNAc之α1,6-連接中、在N
-聚糖之非還原端與Gal之α1,2-連接中、在N
-聚糖之非還原端與GlcNac之α1,3-連接中,或在N
-聚糖之非還原端與GlcNac之α1,4-連接中。因此,在以上醣蛋白組合物之特定態樣中,糖型呈α1,3-連接或α1,6-連接海藻糖形式以產生選自由以下組成之群的糖型:Man5
GlcNAc2
(Fuc)、GlcNAcMan5
GlcNAc2
(Fuc)、Man3
GlcNAc2
(Fuc)、GlcNAcMan3
GlcNAc2
(Fuc)、GlcNAc2
Man3
GlcNAc2
(Fuc)、GalGlcNAc2
Man3
GlcNAc2
(Fuc)、Gal2
GlcNAc2
Man3
GlcNAc2
(Fuc)、NANAGal2
GlcNAc2
Man3
GlcNAc2
(Fuc)及NANA2
Gal2
GlcNAc2
Man3
GlcNAc2
(Fuc);呈α1,3-連接或α1,4-連接海藻糖形式以產生選自由以下組成之群的糖型:GlcNAc(Fuc)Man5
GlcNAc2
、GlcNAc(Fuc)Man3
GlcNAc2
、GlcNAc2
(Fuc1-2
)Man3
GlcNAc2
、GalGlcNAc2
(Fuc1-2
)Man3
GlcNAc2
、Gal2
GlcNAc2
(Fuc1-2)Man3GlcNAc2、NANAGal2GlcNAc2(Fuc1-2
)Man3
GlcNAc2
及NANA2
Gal2
GlcNAc2
(Fuc1-2
) Man3
GlcNAc2
;或呈α1,2-連接海藻糖形式以產生選自由以下組成之群的糖型:Gal(Fuc)GlcNAc2
Man3
GlcNAc2
、Gal2
(Fuc1-2
)GlcNAc2
Man3
GlcNAc2
、NANAGal2
(Fuc1-
2)GlcNAc2
Man3
GlcNAc2
及NANA2
Gal2
(Fuc1-2
) GlcNAc2
Man3
GlcNAc2
。
在其他態樣中,抗體(例如人類化抗體)或其抗原結合片段包含高甘露糖N
-聚糖,包括(但不限於)Man8
GlcNAc2
、Man7
GlcNAc2
、Man6
GlcNAc2
、Man5
GlcNAc2
、Man4
GlcNAc2
或由Man3GlcNAc2 N
-聚糖結構組成之N
-聚糖。
在上述其他態樣中,複合N
-聚糖進一步包括海藻糖基化及非海藻糖基化二等分及多觸角物質。
如本文所使用,術語「N
-聚糖」及「糖型」可互換使用且係指N
-連接寡糖,例如由天冬醯胺-N-乙醯基葡糖胺鍵連接至多肽之天冬醯胺殘基的寡糖。N
-連接醣蛋白含有連接至蛋白質中之天冬醯胺殘基之醯胺氮的N
-乙醯基葡糖胺殘基。在醣蛋白上發現之主要糖為葡萄糖、半乳糖、甘露糖、海藻糖、N
-乙醯基半乳胺糖(GalNAc)、N
-乙醯基葡糖胺(GlcNAc)及唾液酸(例如N
-乙醯基-神經胺酸(NANA))。對於N連接醣蛋白,糖基團之處理與轉譯同時在ER之內腔中發生,且在轉譯後在高爾基體(Golgi apparatus)中繼續進行。N
-聚糖具有Man3
GlcNAc2
之常用五碳醣核心(「Man」係指甘露糖;「Glc」係指葡萄糖;且「NAc」係指N
-乙醯基;GlcNAc係指N
-乙醯基葡糖胺)。通常,N
-聚糖結構以非還原端在左邊且還原端在右邊來呈現。N
-聚糖之還原端為連接至蛋白質上包含糖基化位點之Asn殘基的末端。N
-聚糖在包含添加至Man3
GlcNAc2
(「Man3」)核心結構(其亦稱為「三甘露糖核心」、「五碳糖核心」或「寡甘露糖」核心)之周圍糖(例如GlcNAc、半乳糖、海藻糖及唾液酸)的分枝(觸角)數目方面不同。N-聚糖根據其分枝組分(例如高甘露糖、複合物或雜交)分類。「高甘露糖」型N
-聚糖具有五個或更多個甘露糖殘基。「複合」型N
-聚糖通常具有至少一個連接至「三甘露糖」核心之1,3甘露糖臂之GlcNAc及至少一個連接至1,6甘露糖臂之GlcNAc。複合N
-聚糖亦可具有視情況經唾液酸或衍生物(例如「NANA」或「NeuAc」,其中「Neu」係指神經胺酸且「Ac」係指乙醯基)修飾之半乳糖(「Gal」)或N
-乙醯基半乳胺糖(「GalNAc」)殘基。複合N
-聚糖亦可具有包含「二等分」GlcNAc及核心海藻糖(「Fuc」)之鏈內取代。複合N
-聚糖亦可在「三甘露糖核心」上具有多個觸角,通常稱為「多觸角聚糖」。「雜交」N-聚糖在三甘露糖核心之1,3甘露糖臂之末端上具有至少一個GlcNAc且在三甘露糖核心之1,6甘露糖臂上具有零或更多個甘露糖。各種N-聚糖亦稱為「糖型」。
關於複合N
-聚糖,術語「G-2」、「G-1」、「G0」、「G1」、「G2」、「A1」及「A2」意謂如下。「G-2」係指可表徵為Man3
GlcNAc2
之N
-聚糖結構;術語「G-1」係指可表徵為GlcNAcMan3
GlcNAc2
之N
-聚糖結構;術語「G0」係指可表徵為GlcNAc2
Man3
GlcNAc2
之N
-聚糖結構;術語「G1」係指可表徵為GalGlcNAc2
Man3
GlcNAc2
之N
-聚糖結構;術語「G2」係指可表徵為Gal2
GlcNAc2
Man3
GlcNAc2
之N
-聚糖結構;術語「A1」係指可表徵為NANAGal2
GlcNAc2
Man3
GlcNAc2
之N
-聚糖結構;且術語「A2」係指可表徵為NANA2
Gal2
GlcNAc2
Man3
GlcNAc2
之N
-聚糖結構。除非另有指示,否則術語「G-2」、「G-1」、「G0」、「G1」、「G2」、「A1」及「A2」係指不具有連接至N
-聚糖之還原端處之GlcNAc殘基之海藻糖的N
-聚糖物質。當術語包括「F」時,「F」指示N
-聚糖物質在N
-聚糖之還原端的GlcNAc殘基上含有海藻糖殘基。舉例而言,G0F、G1F、G2F、A1F及A2F皆指示N
-聚糖進一步包括在N
-聚糖之還原端連接至GlcNAc殘基的海藻糖殘基。諸如酵母及絲狀真菌之低級真核生物通常不產生可產生海藻糖之N
-聚糖。
關於多觸角N
-聚糖,術語「多觸角N
-聚糖」係指在組成N
-聚糖之1,6臂或1,3臂之非還原端的甘露糖殘基上進一步包含GlcNAc殘基或在組成N
-聚糖之1,6臂及1,3臂之非還原端的各甘露糖殘基上包含GlcNAc殘基的N
-聚糖。因此,多觸角N
-聚糖可由以下式表徵:GlcNAc(2-4)
Man3
GlcNAc2
、Gal(1-4)
GlcNAc(2-4)
Man3
GlcNAc2
或NANA(1-4)
Gal(1-4)
GlcNAc(2-4)
Man3
GlcNAc2
。術語「1-4」係指1、2、3或4個殘基。關於二等分N
-聚糖,術語「二等分N
-聚糖」係指其中GlcNAc殘基在N
-聚糖之還原端處連接至甘露糖殘基之N
-聚糖。二等分N
-聚糖可由式GlcNAc3
Man3
GlcNAc2
表徵,其中各甘露糖殘基在其非還原端處連接至GlcNAc殘基。相比之下,當多觸角N
-聚糖表徵為GlcNAc3
Man3
GlcNAc2
時,該式指示兩個GlcNAc殘基在N
-聚糖之兩個臂之一的還原端處連接至甘露糖殘基,且一個GlcNAc殘基在N
-聚糖之另一個臂之非還原端處連接至甘露糖殘基。
抗體生理特性
本文中所揭示之抗體及其抗原結合片段(例如抗體20E6及其人類化版本)可在輕鏈或重鏈免疫球蛋白可變區中進一步含有一或多個糖基化位點。此類糖基化位點可引起抗體或片段之免疫原性增加,或歸因於抗原結合改變之抗體之pK之變化(Marshall等人
(1972)Annu Rev Biochem
41:673-702;Gala及Morrison (2004)J Immunol
172:5489-94;Wallick等人
(1988)J Exp Med
168:1099-109;Spiro (2002)Glycobiology
12:43R-56R;Parekh等人
(1985)Nature
316:452-7;Mimura等人
(2000)Mol Immunol
37:697-706)。已知糖基化在含有N-X-S/T序列之基元處進行。
各抗體或抗原結合片段(例如20E6或其人類化版本)將具有獨特的等電點(pI),其通常在6與9.5之間的pH值範圍內。IgG1抗體之pI通常在7-9.5之pH值範圍內且IgG4抗體之pI通常在6-8之pH值範圍內。
各抗體或抗原結合片段(例如20E6或其人類化版本)將具有特徵熔融溫度,其中更高的熔融溫度指示更高的活體內整體穩定性(Krishnamurthy R及Manning MC (2002)Curr Pharm Biotechnol 3
:361-71)。通常,TM1
(初始去摺疊溫度)可大於60℃、大於65℃或大於70℃。抗體或片段之熔點可使用差示掃描熱量測定(Chen等人 (2003)Pharm Res 20
:1952-60;Ghirlando等人 (1999)Immunol Lett 68
:47-52)或圓二色性(Murray等人 (2002)J. Chromatogr Sci 40
:343-9)量測。在另一個實施例中,選擇不會快速降解之抗體及其抗原結合片段(例如抗體20E6及其人類化版本)。抗體或片段之降解可使用毛細電泳法(CE)及MALDI-MS (Alexander AJ及Hughes DE (1995)Anal Chem 67
:3626-32)量測。
在另一實施例中,選擇具有最小聚集作用之抗體(例如抗體20E6及其人類化版本)及其抗原結合片段,聚集作用可引起不合需要之免疫反應之觸發及/或改變或不利的藥物動力學特性。通常,聚集度為25%或更低、20%或更低、15%或更低、10%或更低或5%或更低之抗體及片段為可接受的。可藉由若干技術來量測聚集,包括尺寸排阻管柱(SEC)、高效液相層析(HPLC)及光散射。
V. 多特異性抗體
本文中提供之多特異性抗體(例如雙特異性抗體)包括至少一個針對如本文中所描述之LAP-TGFβ1 (例如人類LAP-TGFβ1)上之特定抗原決定基之結合區及至少另一個結合區(例如癌症抗原)。多特異性抗體可製備為全長抗體或抗體片段(例如F(ab')2
抗體)。
用於製備多特異性抗體之方法為此項技術中熟知的(參見例如PCT公開案第WO 05117973號及第WO 06091209號)。舉例而言,全長多特異性抗體之產生可基於兩條成對免疫球蛋白重鏈-輕鏈之共表現,其中兩條鏈具有不同特異性。亦已描述多種用於自重組型細胞培養物直接製備及分離多特異性抗體片段之技術。舉例而言,可使用白胺酸拉鏈產生多特異性抗體。亦已報導另一種用於使用單鏈Fv (sFv)二聚體製備多特異性抗體片段之策略。
適合的多特異性分子平台之實例包括(但不限於)雙重靶向(DT)-Ig (GSK/Domantis)、二合一抗體(Genentech)、交聯Mab (Karmanos Cancer Center)、Fcab及mAb2
(F-Star)、CovX體(CovX/Pfizer)、雙重可變域(DVD)-Ig (Abbott)、IgG樣雙特異性(ImClone/Eli Lilly)、Ts2Ab (Medlmmune/AZ)及BsAb (Zymogenetics)、HERCULES (Biogen Idee)、TvAb (Roche)、ScFv/Fc融合物、SCORPION (Emergent BioSolutions/Trubion、Zymogenetics/BMS)、雙重親和力再靶向技術(Fc-DART)(MacroGenics)、雙重(ScFv)2-Fab (National Research Center for Antibody Medicine - China)、F(ab)2 (Medarex/AMGEN)、雙重作用或雙Fab (Genentech)、鎖鑰(DNL)(ImmunoMedics)、二價雙特異性(Biotecnol)、SEED (EMD Serono)、mAb2
(F-star)、Fab-Fv (UCB-Celltech)、雙特異性T細胞接合子(BiTE)(Micromet)、串聯雙功能抗體(Tandab)(Affimed)、雙重親和力再靶向技術(DART)(MacroGenics)、單鏈雙功能抗體(Academic)、TCR樣抗體(AIT,ReceptorLogics)、COMBODY (Epigen Biotech)、雙重靶向奈米抗體(Ablynx)及Fc工程改造之IgGl (Xencor)。
在特定實施例中,多特異性抗體包含結合於LAP-TGFβ1衍生之或連接至另一功能性分子(例如另一個肽或蛋白質(例如受體之另一個抗體或配位體))的第一抗體(或其結合部分),以產生結合於LAP-TGFβ1及非LAP目標分子之多特異性分子。抗體可衍生或連接至超過一種其他功能分子,以產生結合於超過兩個不同結合位點及/或目標分子之多特異性分子。為產生多特異性分子,本文中所揭示之抗體可在功能上連接(例如藉由化學偶合、基因融合、非共價結合或其他方式)至一或多個其他結合分子,諸如另一抗體、抗體片段、肽、受體或結合模擬劑,使得產生多特異性分子。
因此,涵蓋包含至少一種針對LAP-TGFβ1 (例如人類LAP-TGFβ1)上之特定抗原決定基之第一結合特異性及針對第二目標之第二結合特異性之多特異性分子,例如雙特異性抗體及雙功能抗體。在一些實施例中,第二目標為特異性結合於腫瘤相關抗原之第二結合區。腫瘤相關抗原為此項技術中熟知的。例示性腫瘤相關抗原包括(但不限於)AFP、ALK、BAGE蛋白質、β-連環蛋白、brc-abl、BRCA1、BORIS、CA9、碳酸酐酶IX、卡斯蛋白酶(caspase)-8、CCR5、CD19、CD20、CD30、CDK4、CEA、細胞週期素-B1、CYP1B1、EGFR、EGFRvIII、ErbB2/Her2、ErbB3、ErbB4、ETV6-AML、EpCAM、EphA2、Fra-1、FOLR1、GAGE蛋白質(例如GAGE-1、GAGE-2)、GD2、GD3、GloboH、磷脂肌醇蛋白聚醣-3、GM3、gp100、Her2、HLA/B-raf、HLA/K-ras、HLA/MAGE-A3、hTERT、LMP2、MAGE蛋白質(例如MAGE-1、MAGE-2、MAGE-3、MAGE-4、MAGE-6及MAGE-12)、MART-1、間皮素、ML-IAP、Muc1、Muc2、Muc3、Muc4、Muc5、Muc16(CA-125)、MUM1、NA17、NY-BR1、NY-BR62、NY-BR85、NY-ESO1、OX40、p15、p53、PAP、PAX3、PAX5、PCTA-1、PLAC1、PRLR、PRAME、PSMA (FOLH1)、RAGE蛋白質、Ras、RGS5、Rho、SART-1、SART-3、Steap-1、Steap-2、STn、存活素、TAG-72、TGF-β、TMPRSS2、Tn、TRP-1、TRP-2、酪胺酸酶及尿溶蛋白-3。
在一些實施例中,雙特異性抗體之第二結合區特異性結合於CD4、CD8、CD45、CD56、CD14、CD16、CD19、CD20、CD25、CD38、CD11b、CD22、CD30、CD39、CD114、CD23、CD73、CD163、CD206、CD203、CD200R、PD-1、PD-L1、PD-L2、CTLA-4、IDO、TIM-3、LAG-3、TIGIT、PVR、PVRL2、B7H3、B7H4、CSF-1R、VISTA、KIR、OX-40、GITR、4-1BB、CD40、CD40L、CD27/CD70、CD28、ICOS、CD3、CD56、NKG2DA、NKG2DB、NKG2DC、NKG2DD、NKG2DF、NKG2DH、CD94、NKP46、NKP30、CD33、CD73、CD47、LILRB1、CD91、鈣網蛋白、CD122、GARP、LRRC33、LAP2、LAP3、TGFβ1、TGFβ2、TGFβ3、FAP、鈣黏素11及斯鈣素(stanniocalcin)1。在一些實施例中,當結合於目標(例如TNF家族成員促效劑、OX40配位體、CD137配位體、CD137促效劑、STING促效劑、GITR促效劑、ICOS促效劑及CD28促效劑)時,第二結合區具有促效特性。
在一些實施例中,抗體為包含第一、第二及第三結合區之三特異性抗體,其中第一結合區包含本文中所描述之抗LAP抗體之結合特異性(例如抗原結合區),且第二及第三結合區結合於兩個不同目標(或同一個目標上之不同抗原決定基),例如上文所描述之目標。
在一些實施例中,抗體為雙功能抗體,其包含本文中所描述之抗LAP抗體及受體分子(亦即,受體陷阱構築體,諸如TGFβ超家族配位體受體(例如ActRIIB及其變異體)或VEGFR)。
在一個實施例中,多特異性分子包含至少一種抗體或其抗體片段作為結合特異性,包括例如Fab、Fab'、F(ab')2
、Fv或單鏈Fv。抗體亦可為輕鏈或重鏈二聚體或其任何最小片段,諸如Fv或單鏈構築體,如Ladner等人之美國專利案第4,946,778號中所描述。
多特異性分子可藉由使用此項技術中已知之方法使組成性結合特異性(例如抗FcR與抗LAP結合特異性)結合而製備。舉例而言,多特異性分子之各結合特異性可分別產生,且接著彼此結合。當結合特異性為蛋白質或肽時,各種偶合劑或交聯劑可用於共價結合。交聯劑之實例包括蛋白質A、碳化二亞胺、N-丁二醯亞胺基-S-乙醯基-硫乙酸酯(SATA)、5,5'-二硫基雙(2-硝基苯甲酸)(DTNB)、鄰伸苯基二順丁烯二醯亞胺(oPDM)、N-丁二醯亞胺基-3-(2-吡啶基二硫基)丙酸酯(SPDP)及磺基丁二醯亞胺基4-(N-順丁烯二醯亞胺基甲基)環己烷-1-甲酸酯(磺基-SMCC)。較佳結合劑為SATA及磺基-SMCC,其皆可自Pierce Chemical Co. (Rockford, IL)購得。
當結合特異性為抗體時,其可經由兩個重鏈之C端鉸鏈區之硫氫基鍵結來結合。在尤其較佳實施例中,在結合之前,鉸鏈區經修飾以含有奇數個硫氫基殘基,較佳為一個。
或者,兩種結合特異性可在同一載體中編碼,且在同一宿主細胞中表現及組裝。此方法尤其適用於其中多特異性分子為mAb×mAb、mAb×Fab、Fab×F(ab')2
或配位體×Fab融合蛋白質之情況。多特異性分子可為包含一個單鏈抗體及一個結合決定子之單鏈分子,或包含兩個結合決定子之單鏈雙特異性分子。多特異性分子可包含至少兩個單鏈分子。用於製備多特異性分子之方法描述於例如美國專利案5,260,203號;美國專利第案5,455,030號;美國專利案第4,881,175號;美國專利案第5,132,405號;美國專利案第5,091,513號;美國專利案第5,476,786號;美國專利案第5,013,653號;美國專利案第5,258,498號;及美國專利案第5,482,858號中。
多特異性分子與其特異性目標之結合可藉由例如酶聯結免疫吸附分析法(ELISA)、放射免疫分析法(RIA)、FACS分析、生物分析法(例如生長抑制)或西方墨點分析法來確認。此等分析法中之每一者通常藉由使用對相關複合物具有特異性之標記試劑(例如抗體)來偵測特定相關蛋白質-抗體複合物的存在。舉例而言,FcR-抗體複合物可使用例如識別且特異性結合於抗體-FcR複合物的酶聯結抗體或抗體片段來偵測。或者,可使用多種其他免疫分析法中之任一者偵測複合物。舉例而言,抗體可經放射性標記且在放射免疫分析法(RIA)中使用。放射性同位素可藉由諸如使用αγ-β計數器或閃爍計數器之手段或藉由自動放射照像術來偵測。
VI. 免疫結合物
可藉由使抗體與另一治療劑結合以形成例如抗體-藥物結合物(ADC)來形成包含本文中所描述之抗LAP抗體或其抗原結合片段之免疫結合物。適合的藥劑包括例如細胞毒性劑(例如化學治療劑)、毒素(例如細菌、真菌、植物或動物來源之酶活性毒素,或其片段),及/或放射性同位素(亦即,放射性結合物)。其他適合的藥劑包括抗代謝物、烷基化劑、DNA小溝結合劑、DNA嵌入劑、DNA交聯劑、組蛋白脫乙醯基酶抑制劑、核輸出抑制劑、蛋白酶體抑制劑、拓樸異構酶I或II抑制劑、熱休克蛋白抑制劑、酪胺酸激酶抑制劑、抗生素及抗有絲分裂劑。在一些實施例中,具有結合於免疫抑制性細胞(例如調節性T細胞)之本文中所描述之抗LAP抗體或其抗原結合片段之ADC (例如與細胞毒性劑結合)可用於消耗來自例如腫瘤微環境之免疫抑制性細胞。
可使用之酶活性毒素及其片段包括例如白喉A鏈、白喉毒素之非結合活性片段、外毒素A鏈(來自綠膿桿菌(Pseudomonas aeruginosa))、篦麻毒素A鏈、相思子毒素A鏈、莫迪素A鏈(modeccin A chain)、α-帚麴菌素(alpha-sarcin)、油桐(Aleurites fordii)蛋白質、康乃馨(dianthin)蛋白質、美洲商陸(Phytolaca americana)蛋白質(PAPI、PAPII及PAP-S)、苦瓜(momordica charantia)抑制劑、麻瘋樹毒蛋白(curcin)、巴豆毒素(crotin)、肥皂草(sapaonaria officinalis)抑制劑、白樹素(gelonin)、有絲分裂素(mitogellin)、侷限麴菌素(restrictocin)、酚黴素(phenomycin)、新黴素(neomycin)及黴菌毒素(tricothecene)。細胞毒素或細胞毒性劑之其他實例包括例如紫杉醇(taxol)、細胞鬆弛素B (cytochalasin B)、短桿菌素D (gramicidin D)、溴化乙錠(ethidium bromide)、吐根素(emetine)、絲裂黴素(mitomycin)、依託泊苷(etoposide)、替尼泊苷(tenoposide)、長春新鹼(vincristine)、長春鹼(vinblastine)、秋水仙鹼(colchicin)、小紅莓(doxorubicin)、道諾黴素(daunorubicin)、二羥基炭疽菌素二酮(dihydroxy anthracin dione)、米托蒽醌(mitoxantrone)、光神黴素(mithramycin)、放線菌素D (actinomycin D)、1-去氫睪固酮(1-dihydrotestosterone)、糖皮質激素、普魯卡因(procaine)、四卡因(tetracaine)、利多卡因(lidocaine)、普萘洛爾(propranolol)及嘌呤黴素(puromycin)及其類似物或同源物。治療劑包括(但不限於)抗代謝物(例如甲胺喋呤(methotrexate)、6-巰基嘌呤、6-硫鳥嘌呤、阿糖胞苷(cytarabine)、5-氟尿嘧啶(5-fluorouracil)、達卡巴嗪(decarbazine))、烷基化劑(例如氮芥(mechlorethamine)、噻替派苯丁酸氮芥(thioepa chlorambucil)、美法侖(melphalan)、卡莫司汀(carmustine)(BSNU)及洛莫司汀(lomustine)(CCNU)、環硫磷醯胺(cyclothosphamide)、白消安(busulfan)、二溴甘露醇(dibromomannitol)、鏈佐黴素(streptozotocin)、絲裂黴素C (mitomycin C),及順-二氯二胺鉑(II)(DDP)順鉑)、蒽環黴素(anthracyclines)(例如道諾黴素(daunorubicin)(先前為柔紅黴素(daunomycin))及小紅莓)、抗生素(例如放線菌素D (先前為放線菌素)、博萊黴素(bleomycin)、光神黴素及安麯黴素(anthramycin)(AMC)),及抗有絲分裂劑(例如長春新鹼及長春鹼)。
在ADC中,抗體及治療劑較佳經由可裂解連接子,諸如肽基、二硫鍵或腙連接子結合。更佳地,連接子為肽基連接子,諸如Val-Cit、Ala-Val、Val-Ala-Val、Lys-Lys、Pro-Val-Gly-Val-Val (SEQ ID NO:214)、Ala-Asn-Val、Val-Leu-Lys、Ala-Ala-Asn、Cit-Cit、Val-Lys、Lys、Cit、Ser或Glu。可如以下文獻中所描述來製備ADC:美國專利案第7,087,600號;第6,989,452號;及第7,129,261號;PCT公開案第WO 02/096910號;第WO 07/038658號;第WO 07/051081號;第WO 07/059404號;第WO 08/083312號;及第WO 08/103693號;美國專利公開案第20060024317號;第20060004081號;及第20060247295號;其揭示內容以引用之方式併入本文中。
多種放射性核種可用於產生放射性結合之抗LAP抗體。實例包括212
Bi、131
I、131
In、90
Y及186
Re。
免疫結合物亦可用於修改既定生物反應,且藥物部分不應理解為侷限於經典的化學治療劑。舉例而言,藥物部分可為具有所需生物活性之蛋白質或多肽(例如淋巴因子、腫瘤壞死因子、IFNγ、生長因子)。
免疫結合物可使用多種雙功能蛋白質偶合劑來製備,諸如N-丁二醯亞胺基-3-(2-吡啶基二硫醇)丙酸酯(SPDP)、亞胺基硫雜環戊烷(IT)、醯亞胺酯之雙功能衍生物(諸如己二醯亞胺酸二甲酯鹽酸鹽)、活性酯(諸如辛二酸二丁二醯亞胺酯)、醛(諸如戊二醛)、雙疊氮基化合物(諸如雙(對疊氮基苯甲醯基)己二胺)、雙重氮鎓衍生物(諸如雙-(對重氮鎓苯甲醯基)-乙二胺)、二異氰酸酯(諸如2,6-二異氰酸甲苯酯)及雙活性氟化合物(諸如1,5-二氟-2,4-二硝基苯)。經碳14標記之1-異硫氰酸基苯甲基-3-甲基二伸乙三胺五乙酸(MX-DTPA)為用於放射性核苷酸與抗體之結合之例示性螯合劑(參見例如PCT公開案第WO94/11026號)。
用於使此類治療部分與抗體結合的技術為熟知的,參見例如Arnon等人, "Monoclonal Antibodies For Immunotargeting Of Drugs In Cancer Therapy", Monoclonal Antibodies And Cancer Therapy, Reisfeld等人(編), 第243-56頁 (Alan R. Liss, Inc. 1985);Hellstrom等人, "Antibodies For Drug Delivery", Controlled Drug Delivery (第2版), Robinson等人(編), 第623-53頁 (Marcel Dekker, Inc. 1987);Thorpe, "Antibody Carriers Of Cytotoxic Agents In Cancer Therapy: A Review", Monoclonal Antibodies '84: Biological And Clinical Applications, Pinchera等人(編), 第475-506頁 (1985);"Analysis, Results, And Future Prospective Of The Therapeutic Use Of Radiolabeled Antibody In Cancer Therapy", Monoclonal Antibodies For Cancer Detection And Therapy, Baldwin等人(編), 第303-16頁 (Academic Press 1985),及Thorpe等人, "The Preparation And Cytotoxic Properties Of Antibody-Toxin Conjugates", Immunol. Rev., 62:119-58 (1982)。
本文中所描述之抗LAP抗體或抗原結合片段亦用於診斷目的。此類抗體或抗原結合片段可與適合的可偵測試劑結合以形成免疫結合物。出於診斷目的,對於全身成像,適合的藥劑為包括放射性同位素之可偵測標記,且對於樣本測試,適合的藥劑為放射性同位素、酶、螢光標記及其他適合的抗體標籤。
可偵測標記可為活體外診斷學領域中當前使用之各種類型中之任一者,包括粒子標記、同位素、發色團、螢光標記物、發光標記物、金屬標記(例如用於CyTOF,成像質譜流式技術)、磷光標記物及其類似物,以及使既定受質轉化成可偵測標記物之酶標記,及在擴增(諸如藉由聚合酶鏈反應)之後顯示之聚核苷酸標籤。適合的酶標記包括辣根過氧化酶、鹼性磷酸酶及其類似物。舉例而言,標記可為酶鹼性磷酸酶,藉由量測在1,2二氧雜環丁烷受質(諸如金剛烷基甲氧基磷醯基氧基苯基二氧雜環丁烷(AMPPD)、3-(4-(甲氧基螺{1,2-二氧雜環丁烷-3,2'-(5'-氯)三環{3.3.1.13,7}癸}-4-基)苯基磷酸二鈉(CSPD),以及CDP及CDP-star®或在此項技術中熟知的其他發光受質,例如適合的鑭系元素(諸如鋱(III)及銪(III))之螯合物)之轉化後的化學發光之存在或形成來偵測。偵測手段由所選擇之標記決定。標記或其反應產物之外觀可在標記為微粒且以適合的含量積聚之情況下使用肉眼來達成,或使用全部根據標準實踐之諸如分光光度計、光度計、螢光計及其類似儀器之儀器來達成。
較佳地,結合方法產生實質上(或幾乎)非免疫原性連接,例如肽-(亦即醯胺-)、硫鍵-、(位阻)、二硫鍵-、腙-及醚連接。此等連接為幾乎非免疫原性且在血清內展示合理的穩定性(參見例如Senter, P. D., Curr. Opin. Chem. Biol. 13 (2009) 235-244;及PCT公開案第WO 2009/059278號及第WO 95/17886號)。
視部分及抗體之生物化學性質而定,可使用不同結合策略。在部分為具有50至500個胺基酸之天然存在之或重組型部分的情況下,在課本中存在描述用於合成蛋白質結合物之化學方法的標準程序,其可由熟練技術人員容易地遵循(參見例如Hackenberger, C. P. R.及Schwarzer, D., Angew. Chem. Int. Ed. Engl. 47 (2008) 10030-10074)。在一個實施例中,使用順丁烯二醯亞胺基部分與抗體或部分內之半胱胺酸殘基之反應。此在例如使用抗體之Fab或Fab'片段之情況下為尤其適合的偶合化學物質。或者,在一個實施例中,進行與抗體或部分之C端之偶合。舉例而言,對蛋白質(例如Fab片段)之C端修飾可如所描述執行(Sunbul, M.及Yin, J., Org. Biomol. Chem. 7 (2009) 3361-3371)。
一般而言,位點特異性反應及共價偶合係基於將天然胺基酸轉型成具有與所存在之其他官能基之反應性正交之反應性的胺基酸。舉例而言,罕見序列情形內之特定半胱胺酸可以酶促方式轉化成醛(參見Frese, M. A.及Dierks, T., ChemBioChem. 10 (2009) 425-427)。亦有可能藉由利用某些酶在既定序列情形下與天然胺基酸之特異性酶反應性來獲得所需胺基酸修飾(參見例如Taki, M.等人, Prot. Eng. Des. Sel. 17 (2004) 119-126;Gautier, A.等人 Chem. Biol. 15 (2008) 128-136;且C--N鍵之蛋白酶催化形成由Bordusa, F., Highlights in Bioorganic Chemistry (2004) 389-403使用)。位點特異性反應及共價偶合亦可藉由末端胺基酸與適合的修飾試劑之選擇性反應來達成。N端半胱胺酸與苯甲腈之反應性(參見Ren, H.等人, Angew. Chem. Int. Ed. Engl. 48 (2009) 9658-9662)可用於達成位點特異性共價偶合。原生化學接合亦可依賴於C端半胱胺酸殘基(Taylor, E. Vogel; Imperiali, B, Nucleic Acids and Molecular Biology (2009), 22 (Protein Engineering), 65-96)。
該部分亦可為合成肽或肽模擬物。在化學合成多肽之情況下,可在此類合成期間併入具有正交化學反應性之胺基酸(參見例如de Graaf, A. J.等人, Bioconjug. Chem. 20 (2009) 1281-1295)。因為多種正交官能基至關重要且可引入合成肽中,因此此類肽與連接子之結合為標準化學。
在一些實施例中,連接至抗LAP抗體或抗原結合片段之部分係選自由以下組成之群:可偵測部分、結合部分、標記部分及生物活性部分。
VII. 分析法
可使用此項技術中已知的多種分析法測試本文中所揭示之抗LAP抗體或抗原結合片段之所需特性,例如本文中所描述之所需特性。
在一個實施例中,測試抗體或抗原結合片段與LAP-TGFβ1 (例如人類LAP-TGFβ1)之特異性結合。用於分析多種抗LAP抗體或抗原結合片段之結合親和力、交叉反應性及結合動力學的方法包括此項技術中已知的標準分析法,例如使用BiacoreTM
2000 SPR儀器之BiacoreTM
表面電漿子共振(SPR)分析(Biacore AB, Uppsala, Sweden)或生物層干涉術(例如ForteBio分析法),如實例中所描述。在一些實施例中,結合分析法中使用之LAP與TGFβ1複合。在一些實施例中,結合分析法中使用之LAP不與TGFβ1複合。在一些實施例中,結合分析法中使用之LAP與TGFβ1及GARP或GARP或LRRC33之片段或LRRC33之片段複合。在某些實施例中,結合分析法中使用之LAP與TGFβ1及LTBP (例如LTBP1、LTBP3或LTBP4)或LTBP之片段複合。
在一個實施例中,測試抗體或抗原結合片段結合經LAP-TGFβ1轉染之細胞之能力。在某些實施例中,細胞亦經GARP或LRRC33轉染。
在一個實施例中,針對結合經LAP塗佈之珠粒之表面的能力來篩選抗體或抗原結合片段。
在一個實施例中,針對結合表現硫酸肝素醣蛋白(諸如多配體蛋白聚糖-4)之細胞上的LAP之能力來篩選抗體或抗原結合片段。舉例而言,將表現硫酸肝素醣蛋白之細胞與LAP或LAP與LTBP (例如LTBP1、LTBP3或LTBP4)之複合物一起培育且藉由流式細胞測量術針對結合來篩選抗體。
在一個實施例中,測試抗體或抗原結合片段結合或影響TGFβ1之能力。在一個實施例中,針對結合或影響TGFβ2之能力來篩選抗體。在一個實施例中,測試抗體結合或影響TGFβ3之能力。
在另一實施例中,測試抗體或抗原結合片段對TGFβ活化之作用(例如抑制、刺激或無作用)。在一些實施例中,TGFβ1活化係由整合素(包括(但不限於)aVb6、αvβ8、αvβ3或αvβ1)之結合介導。在一些實施例中,TGFβ1活化係由基質金屬蛋白酶(包括(但不限於)MMP2及MMP9)介導。在一些實施例中,TGFβ1活化係由凝血栓蛋白介導。在一些實施例中,TGFβ1活化係由血清蛋白酶介導。在一些實施例中,TGFβ1活化係由熱、剪切力、pH值之變化或電離放射介導。在一些實施例中,TGFβ1活化係由反應性氧物質(ROS)介導。活化分析法中之LAP之來源可為經轉染之細胞株之表面上之LAP、內源性或回應於特異性刺激而表現LAP之細胞群體之表面上之LAP、結合於細胞外基質之LAP、溶液中之LAP(例如重組型LAP,與TGFβ1複合或不與TGFβ1複合或與TGFβ1及錨蛋白質(諸如GARP、LRRC33、LTBP1、LTBP3或LTBP4)複合)。LAP-TGFβ1可購自R&D Systems或可自細胞上清液分離。可例如使用在不同條件下(例如在存在或不存在抗體之情況下)量測活性TGFβ1之含量的ELISA (例如實例4中所描述)來測定抗體對TGFβ1活化之作用。亦可使用表現TGFβ受體且對成熟TGFβ起反應之報導子細胞株來測定抗體對LAP-TGFβ1活化之作用。
在另一實施例中,測試抗體或抗原結合片段結合細胞外基質中之LAP之能力。適用於測定抗體是否結合於細胞外基質中之LAP之方法包括活體外分析法,其中在培養盤上培養細胞(例如經LAP-TGFβ轉染之P3U1細胞)以浸沒ECM且接著移除,且測試經標記之抗體結合培養盤表面上剩餘的LAP及ECM之能力(例如實例5中所描述)。可使用成纖維細胞株或其他已知分泌LAP-TGFβ及細胞外基質組分之細胞進行類似分析法。在一些實施例中,可藉由ELISA測定抗LAP抗體是否結合於或不結合於ECM,其中已使用可商購的抗體證實ECM表現潛在TGFβ。
在另一實施例中,測試抗體或抗原結合片段結合特定細胞類型(例如免疫細胞(例如免疫抑制性細胞、白血球)或血小板)之能力。可使用流式細胞測量術測定抗體或抗原結合片段與某些白細胞群體(例如Treg、巨噬細胞、MDSC、GARP陰性細胞)之結合,例如實例7中所描述。
亦可使用此項技術中公認的方法(例如3H-胸苷併入、用增殖標記物進行之免疫組織化學、動物癌症模型)來測試抗體或抗原結合片段抑制細胞(諸如腫瘤細胞)之增殖或存活(活體內或活體外)之能力。
亦可使用在此項技術中熟知的同基因型腫瘤模型(諸如CT26結腸直腸腫瘤模型、EMT6乳癌模型及4T1乳癌腫瘤轉移模型)測試抗體或抗原結合片段之活體內抗腫瘤活性(例如以單藥療法或組合療法形式)。亦可在已知由抗TGFβ抗體抑制之腫瘤異種移植模型(例如Detroit 562腫瘤異種移植模型)中測試抗LAP抗體。用抗LAP抗體處理此等模型之例示性方法描述於例如實例12-16中。
用於測定抗LAP抗體或抗原結合片段是否呈現某些特性(例如結合、抑制活化、活化)之例示性準則展示於表 1B
中。表 1B.
| 抗體特性 | 陽性 |
| 與細胞或ECM之結合,如藉由ELISA評估 | 比陰性對照之平均值高2倍SD |
| 與細胞類型之結合,如藉由流式細胞測量術評估 | 比陰性對照之平均值(對均質細胞株或細胞群體之MFI)高2倍SD |
| 藉由結合分析法(例如生物層干涉術)進行之與TGFβ之結合 | 與陰性對照相比之親和力差異≥100倍 |
| TGFβ1活化之抑制 | 當在8 μg/mL之抗體濃度下測試時,與陰性對照相比,活體外培養物中之成熟TGFβ1含量降低≥50% |
| TGFβ1之活化 | 當在8 μg/mL之抗體濃度下測試時,與陰性對照相比,活體外培養物中之成熟TGFβ1含量中≥2倍 |
VIII. 組合物
本文中亦提供一種組合物(例如醫藥組合物),其包含本文中所描述之抗LAP抗體或抗原結合片段、包含其之免疫結合物或包含其之雙特異性抗體及載劑(例如醫藥學上可接受之載劑)。此類組合物適用於各種治療性應用。
在一些實施例中,本文所揭示之醫藥組合物可包括其他用於治療各種疾病(例如癌症、纖維化、自體免疫性疾病)之化合物、藥物及/或藥劑。此類化合物、藥物及/或藥劑可包括例如抗癌劑、化學治療劑、免疫抑制劑、免疫刺激劑、免疫檢查點抑制劑及/或消炎劑。可與本文中所描述之抗LAP抗體或抗原結合片段共同或分開調配之例示性化合物、藥物及藥劑描述於後續章節(亦即,章節IX;用途及方法)中。
如本文中所使用,「醫藥學上可接受之載劑」包括生理學上相容之任何及所有溶劑、分散介質、包衣、抗細菌劑及抗真菌劑、等張劑及吸收延遲劑以及其類似物。較佳地,載劑適用於靜脈內、肌肉內、皮下、非經腸、脊椎或表皮投藥(例如藉由注射或輸注)。視投藥途徑而定,活性化合物(亦即抗體、免疫結合物或雙特異性分子)可包裹於材料中以保護化合物避免酸作用及其他可不活化化合物之天然條件影響。
本文中所描述之醫藥化合物可包括一或多種醫藥學上可接受之鹽。「醫藥學上可接受之鹽」係指保留母體化合物之所需生物活性且不賦予任何不合需要之毒理作用的鹽(參見例如Berge, S.M.等人 (1977)J. Pharm. Sci. 66
:1-19)。此類鹽之實例包括酸加成鹽及鹼加成鹽。酸加成鹽包括來源於無毒無機酸之鹽,該等無機酸諸如鹽酸、硝酸、磷酸、硫酸、氫溴酸、氫碘酸、亞磷酸及其類似物;以及來源於無毒有機酸之鹽,該等有機酸諸如脂族單甲酸及脂族二甲酸、經苯基取代之烷酸、羥基烷酸、芳族酸、脂族及芳族磺酸及其類似物。鹼加成鹽包括來源於鹼土金屬(諸如鈉、鉀、鎂、鈣及其類似物)以及來源於無毒有機胺(諸如N,N'-二苯甲基乙二胺、N-甲基葡糖胺、氯普魯卡因(chloroprocaine)、膽鹼、二乙醇胺、乙二胺、普魯卡因及其類似物)之鹽。
本文中所描述之醫藥組合物亦可包括醫藥學上可接受之抗氧化劑。醫藥學上可接受之抗氧化劑之實例包括:(1)水溶性抗氧化劑,諸如抗壞血酸、半胱胺酸鹽酸鹽、硫酸氫鈉、偏亞硫酸氫鈉、亞硫酸鈉及其類似物;(2)油溶性抗氧化劑,諸如抗壞血酸棕櫚酸酯、丁基化羥基大茴香醚(BHA)、丁基化羥基甲苯(BHT)、卵磷脂、沒食子酸丙酯、α-生育酚及其類似物;及(3)金屬螯合劑,諸如檸檬酸、乙二胺四乙酸(EDTA)、山梨糖醇、酒石酸、磷酸及其類似物。
可在本文中所描述之醫藥組合物中使用的適合的水性及非水性載劑之實例包括水、乙醇、多元醇(諸如丙三醇、丙二醇、聚乙二醇及其類似物)及其適合的混合物、植物油(諸如橄欖油)及可注射有機酯(諸如油酸乙酯)。此等組成物亦可含有佐劑,諸如防腐劑、濕潤劑、乳化劑及分散劑。預防微生物之存在可藉由滅菌程序(見上文)及藉由包括各種抗細菌及抗真菌劑(例如對羥基苯甲酸酯、氯丁醇、苯酚山梨酸及其類似物)來確保。亦可能需要在組合物中包括等張劑,諸如糖、氯化鈉及其類似物。此外,可注射之醫藥形式之延長吸收可藉由包含延遲吸收之藥劑(諸如單硬脂酸鋁及明膠)來達成。
醫藥學上可接受之載劑包括無菌水溶液或分散液及用於臨時製備無菌可注射溶液或分散液之無菌散劑。此類介質及藥劑用於醫藥學上活性之物質的用途為此項技術中已知的。除非任何習知培養基或試劑與活性化合物不相容,否則涵蓋將其用於本文中所描述之醫藥組合物中。醫藥組合物可包含防腐劑或可不含防腐劑。可將補充活性化合物併入組合物中。
治療性組合物通常必須在製造及儲存條件下為無菌且穩定的。組合物可調配為溶液、微乳液、脂質體或其他適合於高藥物濃度之有序結構。載劑可為含有例如水、乙醇、多元醇(例如甘油、丙二醇及液體聚乙二醇及其類似物)、其適合的混合物之溶劑或分散介質。可例如藉由使用諸如卵磷脂之包衣、在分散液之情況下藉由維持所需粒度及藉由使用界面活性劑來維持適當流動性。在許多情況下,組合物中將較佳包括等張劑(例如糖)、多元醇(諸如甘露醇、山梨糖醇)及氯化鈉。可注射組合物之延長吸收可藉由在組合物中包括延遲吸收劑(例如單硬脂酸鹽及明膠)來達成。
無菌可注射溶液可藉由視需要將所需量的活性化合物與上文所列之一種成分或成分組合併入適當溶劑中,接著進行滅菌微過濾來製備。通常,分散液係藉由將活性化合物併入含有鹼性分散介質及來自本文中列舉之成分的其他所需成分之無菌媒劑中來製備。在無菌粉末用於製備無菌可注射溶液之情況下,較佳製備方法為真空乾燥及冷凍乾燥(凍乾),其自其預先無菌過濾溶液產生活性成分之粉末加任何其他所需成分。
可與載劑物質組合以產生單一劑型的活性成分之量將視所治療之個體及特定投藥模式而變化。可與載劑物質組合以產生單一劑型的活性成分之量通常為產生治療作用之組合物的量。通常,以百分之一百計,此量將在約0.01%至約百分之九十九之活性成分,較佳約0.1%至約70%,最佳約1%至約30%範圍內之活性成分與醫藥學上可接受之載劑之組合。
調節劑量方案以得到最佳所需反應(例如治療反應)。舉例而言,可單次投與大丸劑,可隨時間分若干次投與多次劑量,或可如治療情況之緊急需要所指示而按比例減少或增加劑量。就投藥之簡便性及劑量之均一性而言,將非經腸組合物調配成單位劑型尤其有利。如本文中所使用之單位劑型係指適合作為單個劑量用於待治療之個體的實體上離散之單位;各單位含有與所需醫藥載劑結合,經計算以產生所需治療作用的預定量之活性化合物。本文中所描述之單位劑型之規格係藉由下列情況指定且直接取決於下列情況:(a)活性化合物之獨特特徵及所欲獲得之特定治療作用,及(b)混配此類用於治療個體敏感性之活性化合物之技術中的固有限制。
對於投與抗體或抗原結合片段,劑量在每公斤宿主體重約0.0001至100毫克且更通常0.01至5或10毫克範圍內。例示性治療方案需要每週一次、每兩週一次、每三週一次、每四週一次、每月一次、每3個月一次或每三至6個月一次投與。
抗體可以持續釋放調配物之形式投與,在此情況下,需要降低投藥頻率。劑量及頻率視患者中之抗體之半衰期而變化。一般而言,人類抗體展示最長半衰期,繼而為人類化抗體、嵌合抗體及非人類抗體。投藥劑量及頻率可視治療為預防性或治療性而變化。在預防性應用中,在長時間段內,在相對不頻繁之間隔時間投與相對低之劑量。一些患者在其餘生中繼續接受治療。在治療性應用中,有時需要以相對短時間間隔投與相對高劑量,直至疾病之進程降低或終止,且較佳直至患者展示疾病之症狀之部分或完全改善。隨後,可向患者投與預防性方案。
本文中所描述之醫藥組合物中的活性成分之實際劑量水準可變化,以便獲得可有效實現特定患者、組合物及投藥模式之所需治療反應且對患者無毒性的活性成分之量。所選擇之劑量水準將視多種藥物動力學因素而定,包括所使用之本文中所描述之特定組合物或其酯、鹽或醯胺之活性、投藥途徑、投藥時間、所使用之特定化合物之排泄速率、治療持續時間、與所使用之特定化合物組合使用之其他藥物、化合物及/或物質、所治療之患者之年齡、性別、體重、病狀、一般健康狀況及先前病史,以及醫學技術中熟知之類似因素。
在各種實施例中,抗LAP抗體或抗原結合片段之治療有效劑量引起疾病症狀之嚴重程度降低、無疾病症狀期之出現率及持續時間增加或防止由疾病病痛引起之損傷或功能障礙。在癌症之情形下,治療有效劑量較佳引起存活期延長,及/或防止與癌症相關之身體症狀之進一步惡化。治療有效劑量可預防或延遲癌症發作,諸如當存在疾病之早期或初始病徵時可能需要。
本文中所描述之組合物可經由一或多種投藥途徑,使用此項技術中已知之多種方法中的一或多者來投與。如熟習此項技術者將瞭解,投藥途徑及/或模式將視所需結果而變化。本文中所描述之抗體的較佳投藥途徑包括靜脈內、肌肉內、皮內、腹膜內、皮下、脊椎或其他非經腸投藥途徑,例如藉由注射或輸注。如本文中所使用之片語「非經腸投藥」意謂通常藉由注射之除經腸及局部投藥以外的投藥模式,且包括(但不限於)靜脈內、肌肉內、動脈內、鞘內、囊內、眶內、心內、皮內、腹膜內、經氣管、皮下、表皮下、關節內、囊下、蛛膜下、脊柱內、硬膜外及胸骨內注射及輸注。
或者,本文中所描述之抗體或抗原結合片段可經由除非經腸以外的途徑投與,諸如局部、表皮或黏膜投藥途徑,例如鼻內、經口、經陰道、經直腸、舌下或局部。
活性化合物可與將保護化合物免於快速釋放之載劑一起製備,該等載劑諸如控制釋放調配物,包括植入物、經皮貼劑及微膠囊化遞送系統。可使用生物可降解、生物相容性聚合物,諸如乙烯乙酸乙烯酯、聚酸酐、聚乙醇酸、膠原蛋白、聚原酸酯及聚乳酸。用於製備此類調配物之許多方法已獲得專利或通常為熟習此項技術者已知的。參見例如Sustained and Controlled Release Drug Delivery Systems
, J.R. Robinson編, Marcel Dekker, Inc., New York, 1978。
亦可用此項技術中已知之醫學裝置投與治療性組合物。舉例而言,在較佳實施例中,本文中所描述之治療性組合物可用無針皮下注射裝置投與,諸如美國專利案第5,399,163號、第5,383,851號、第5,312,335號、第5,064,413號、第4,941,880號、第4,790,824號或第4,596,556號中所揭示之裝置。與本文中所描述之抗LAP抗體一起使用的熟知植入物及模組之實例包括:美國專利案第4,487,603號,其揭示以控制速率施配藥物之植入式微量輸注泵;美國專利案第4,486,194號,其揭示經由皮膚投與藥劑之治療裝置;美國專利案第4,447,233號,其揭示用於以精確輸注速率遞送藥物之藥物輸注泵;美國專利案第4,447,224號,其揭示用於連續藥物遞送之可變流量植入式輸注設備;美國專利案第4,439,196號,其揭示具有多腔室隔室之滲透性藥物遞送系統;以及美國專利案第4,475,196號,其揭示滲透性藥物遞送系統。此等專利案以引用之方式併入本文中。許多其他此類植入物、遞送系統及模組為熟習此項技術者已知的。
在某些實施例中,本文中所描述之抗LAP抗體或抗原結合片段可經調配以確保適當的活體內分佈。舉例而言,血腦障壁(BBB)排除多種高度親水性化合物。為確保本文中所描述之治療性化合物穿過BBB (視需要,例如用於腦癌),可使其例如於脂質體中進行調配。關於製造脂質體之方法,參見例如美國專利案4,522,811;5,374,548;及5,399,331。脂質體可包含選擇性輸送至特異性細胞或器官中之一或多個部分,因此增強靶向藥物遞送(參見例如V.V. Ranade, 1989,J. Clin. Pharmacol.
29:685)。例示性靶向部分包括葉酸或生物素(參見例如Low等人之美國專利案5,416,016);甘露糖苷(Umezawa等人, (1988)Biochem. Biophys. Res. Commun.
153:1038);抗體(P.G. Bloeman等人 (1995)FEBS Lett.
357:140;M. Owais等人 (1995)Antimicrob. Agents Chemother.
39:180);界面活性劑蛋白質A受體(Briscoe等人 (1995)Am. J. Physiol.
1233:134);p120 (Schreier等人 (1994)J. Biol. Chem.
269:9090);亦參見K. Keinanen; M.L. Laukkanen (1994)FEBS Lett.
346:123;J.J. Killion; I.J. Fidler (1994) Immunomethods 4:273。
IX. 用途及方法
本文中所描述之抗體、抗體組合物及方法具有大量活體外及活體內效用。
舉例而言,本文中提供一種用於治療癌症之方法,其包含向有需要之個體投與本文中所描述之抗LAP抗體或抗原結合片段使得個體得到治療,例如使得抑制或降低癌性腫瘤之生長及/或實現腫瘤消退及/或長期存活。
在一個實施例中,本文中提供一種用於治療癌症之方法,其包含向有需要之個體投與有效量(例如治療有效量)之本文中所描述之抗LAP抗體(或雙特異性抗體或包含該抗體之免疫結合物)。在一些實施例中,向個體投與其他治療劑。在一些實施例中,其他治療劑選自由以下組成之群:抗PD-1抗體或其抗原結合片段、抗LAG3抗體或其抗原結合部分、抗VISTA抗體或其抗原結合片段、抗BTLA抗體或其抗原結合片段、抗TIM3抗體或其抗原結合片段、抗CTLA4抗體或其抗原結合片段、抗HVEM抗體或其抗原結合片段、抗CD27抗體或其抗原結合片段、抗CD137抗體或其抗原結合片段、抗OX40抗體或其抗原結合片段、抗CD28抗體或其抗原結合片段、抗PDL1抗體或其抗原結合片段、抗PDL2抗體或其抗原結合片段、抗GITR抗體或其抗原結合片段、抗ICOS抗體或其抗原結合片段、抗SIRPα抗體或其抗原結合片段、抗ILT2抗體或其抗原結合片段、抗ILT3抗體或其抗原結合片段、抗ILT4抗體或其抗原結合片段、抗ILT5抗體或其抗原結合片段及抗4-1BB抗體或其抗原結合片段。在一些實施例中,抗PD1抗體或其抗原結合片段為派立珠單抗或其抗原結合片段。派立珠單抗之重鏈及輕鏈序列分別闡述於SEQ ID NO:240及241中。在一些實施例中,其他治療劑為尼沃單抗(nivolumab)。在各種實施例中,尼沃單抗之重鏈及輕鏈序列闡述於SEQ ID NO:246及247中。
在一些實施例中,癌症之特徵在於異常TGFβ活性。在一些實施例中,癌症與纖維化相關聯。在一些實施例中,癌症與CD4+調節性T細胞之浸潤相關聯。在一些實施例中,癌症與CD8+調節性T細胞之浸潤相關聯。在一些實施例中,癌症為與調節性B細胞之浸潤相關聯。在一些實施例中,癌症與骨髓衍生之抑制性細胞之浸潤相關聯。在一些實施例中,癌症與腫瘤相關巨噬細胞之浸潤相關聯。在一些實施例中,癌症與先天性淋巴細胞之浸潤相關聯。在一些實施例中,癌症與癌症相關纖維母細胞之浸潤相關聯。在一些實施例中,癌症與上述細胞類型之放射相關增加相關聯。
在一些實施例中,癌症與TGFβ1活化標籤增加相關聯。在某些實施例中,癌症與EMT或EMT標籤相關聯。在某些實施例中,癌症與呈現EMT或EMT標籤及免疫浸潤之腫瘤相關聯。在某些實施例中,癌症與免疫排斥之腫瘤概況相關聯。在一些實施例中,癌症與LAP表現增加相關聯。在一些實施例中,癌症與GARP表現增加相關聯。在一些實施例中,癌症與LRRC33表現增加相關聯。
可使用本文中所描述之抗LAP抗體抑制生長之癌症包括(但不限於)癌瘤、淋巴瘤、母細胞瘤、肉瘤及白血病。此類癌症之更特定言實例包括(但不限於)基底細胞癌;膽道癌;膀胱癌;骨癌;腦癌及CNS癌症;乳癌(例如雌激素受體陽性乳癌HER2陽性乳癌;三陰性乳癌);腹膜癌;子宮頸癌;膽管癌;絨毛膜癌;結腸及直腸癌症;結締組織癌;消化系統癌症;子宮內膜癌;食道癌;眼癌;頭頸癌;胃癌(包括胃腸癌);神經膠母細胞瘤;肝癌(例如肝細胞癌;肝腫瘤);上皮內贅瘤;腎臟癌或腎癌;喉癌;白血病;肺癌(例如小細胞肺癌、非小細胞肺癌、肺腺癌及肺鱗狀癌瘤);淋巴瘤,包括霍奇金氏(Hodgkin's)及非霍奇金氏淋巴瘤;黑素瘤;骨髓瘤;神經母細胞瘤;口腔癌(例如嘴唇、舌部、口部及咽喉);卵巢癌;胰臟癌;前列腺癌;視網膜母細胞瘤;橫紋肌肉瘤;直腸癌;呼吸系統癌症;唾液腺癌瘤;肉瘤;皮膚癌;鱗狀細胞癌;畸胎上皮癌;睪丸癌;甲狀腺癌;子宮或子宮內膜癌;泌尿系統癌症;外陰癌;以及其他癌瘤及肉瘤;以及B細胞淋巴瘤(包括低級/濾泡性非霍奇金氏淋巴瘤(NHL);小型淋巴球性(SL)NHL;中級/濾泡性NHL;中級彌漫性NHL;高級免疫母細胞NHL;高級淋巴母細胞NHL;高級小型非裂解型細胞NHL;巨大腫塊NHL;套細胞淋巴瘤;AIDS相關淋巴瘤;及瓦爾登斯特倫氏巨球蛋白血症(Waldenstrom's Macroglobulinemia));慢性淋巴細胞性白血病(CLL);急性淋巴母細胞性白血病(ALL);毛細胞白血病;慢性骨髓母細胞白血病;及移植後淋巴增生性病症(PTLD),以及與母斑(細胞)病相關聯之血管增殖異常、水腫(諸如與腦瘤相關聯之水腫)、原發性腫瘤及梅格斯氏症候群(Meigs' syndrome)。
可使用本文中所描述之抗LAP抗體或抗原結合片段治療之其他癌症包括轉移性胰臟癌、轉移性胰臟之腺癌、胃癌、纖維化癌症、神經膠質瘤、惡性神經膠質瘤、擴散型內因性腦橋神經膠質瘤、復發性兒童腦部贅瘤腎細胞癌、透明細胞轉移性腎細胞癌、轉移性耐去勢性前列腺癌、IV階段前列腺癌、轉移性黑素瘤、惡性黑色素瘤、復發性皮膚黑素瘤、黑素瘤腦轉移瘤、頭部及頸部之惡性黑色素瘤、鱗狀細胞非小細胞肺癌、轉移性乳癌、濾泡性淋巴瘤、晚期B細胞NHL、包括彌漫性大型B細胞淋巴瘤(DLBCL)之HL、多發性骨髓瘤、慢性骨髓白血病、成年人急性骨髓性白血病緩解期、伴有Inv(16)(p13.1q22)之成年人急性骨髓性白血病、CBFB-MYH11、伴有t(16:16) (p13.1:q22)之成年人急性骨髓性白血病、CBFB-MYH11、伴有t(8:21)(d22:q22)之成年人急性骨髓性白血病、RUNX1-RUNX1T1、伴有t(9:11)(p22:q23)之成年人急性骨髓性白血病、MLLT3-MLL、伴有tO15:17)(q22:q12)之成年人急性前髓細胞性白血病、PML-RARA、烷基化劑相關急性骨髓性白血病、李希特氏症候群(Richter's syndrome)、成年人神經膠母細胞瘤、成年人神經膠質肉瘤、復發性神經膠母細胞瘤、復發性兒童橫紋肌肉瘤、復發性尤文氏肉瘤/周邊原始神經外胚層瘤、復發性神經母細胞瘤、復發性骨肉瘤、結腸直腸癌、MSI陽性結腸直腸癌、MSI陰性結腸直腸癌、鼻咽非角化性癌瘤、復發性鼻咽未分化性癌瘤、子宮頸腺癌、子宮頸腺鱗癌瘤;子宮頸鱗狀細胞癌、復發性子宮頸癌、肛管鱗狀細胞癌、轉移性肛管癌瘤、復發性肛管癌瘤、復發性頭頸癌、頭部及頸部之鱗狀細胞、頭頸部鱗狀細胞癌(HNSCC)、卵巢癌、結腸癌、晚期GI癌症、胃腺癌、胃食道接合點腺癌、骨贅瘤、軟組織肉瘤、骨肉瘤、胸腺癌、尿道上皮癌、梅克爾細胞癌(merkel cell carcinoma)、復發性梅克爾細胞癌、蕈樣黴菌病、塞紮萊氏症候群(Sezary syndrome)、神經內分泌癌症、鼻咽癌、基細胞皮膚癌鱗狀細胞皮膚癌、皮膚纖維肉瘤、神經膠質瘤、間皮瘤、骨髓發育不良症候群(MDS)、骨髓纖維化(MF)、骨髓增生性贅瘤及急性骨髓性白血病(AML)。
癌症可為轉移性或可為原發性癌症。癌症可為促結締組織增生性或非促結締組織增生性。癌症可為復發性癌症。
在一些實施例中,使用本文中所描述之抗LAP抗體或抗原結合片段治療骨髓發育不良症候群(MDS)。MDS為由造血不足及產生發育不良之細胞引起之由骨髓衰竭表徵之多種惡性病症之群。TGFβ為MDS之主要驅動因素(Geyh等人, Haematologica 2018;103:1462-71)且已提出將抑制TGFβ功能之藥劑作為治療劑(Mies等人, Curr Hematol Malig Rep 2016;11:416-24)。此外,已知MDSC在MDS中失調(Chen等人, JCI 2013;123:4595-611)且降低骨髓中之MDSC含量之藥劑為潛在治療劑。
在一些實施例中,使用本文中所描述之抗包圍抗體或抗原結合片段治療骨髓纖維化,其為另一種骨髓惡性疾病,其中TGFβ1起關鍵作用(Mascarenhas等人, Leukemia & Lymphoma 2014;55:450-2)。
在一些實施例中,癌症對檢查點抑制劑具有抗性。在一些實施例中,癌症本質上為難治性或耐藥性(例如對PD-1路徑抑制劑、PD-1路徑抑制劑或CTLA-4路徑抑制劑具有抗性)。在一些實施例中,癌症之抗性或難治性狀態為後天性的。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段可與檢查點抑制劑組合使用以克服癌症對檢查點抑制劑之抗性。在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段可與檢查點抑制劑組合或與誘導間葉細胞表型之藥劑(諸如MAPK路徑抑制劑)依序共同用於治療具有間葉細胞及/或EMT標籤之腫瘤。
在一些實施例中,使用本文中所描述之抗LAP抗體或抗原結合片段增強免疫細胞之離體存活率,例如在授受性NK細胞轉移中。因此,在一些實施例中,抗LAP抗體與授受性轉移之NK細胞組合用於治療癌症。
在一些實施例中,本文中所描述之抗LAP抗體或抗原結合片段用於治療具有MHC損失或MHC下調之腫瘤,以單藥療法或與NK活化或增強治療之組合形式。在一些實施例中,使用本文中所描述之抗LAP抗體與NK活化或增強治療之組合治療抗檢查點抑制劑性腫瘤。
本文中亦提供用於治療與循環血小板之數目增加或血小板與淋巴細胞之比率增加相關聯之癌症之方法,其包含向有需要之個體投與有效量之特異性結合於LAP之抗體或抗原結合片段,其中該抗體結合於血小板但不會引起血小板凝集或血小板去顆粒。
可在可預測在人類腫瘤中之功效的動物模型系統中評估化合物抑制癌症之能力。或者,組合物之此性質可藉由使用熟習此項技術者已知的活體外分析法檢驗化合物之抑制能力來評估。治療有效量之治療性化合物可減小腫瘤尺寸,或以其他方式改善個體之症狀。一般熟習此項技術者將能夠基於諸如個體尺寸、個體症狀之嚴重程度及所選擇的特定組合物或投藥途徑之因素來確定此類量。
亦涵蓋用於偵測樣本(例如腫瘤活檢樣本)中是否存在LAP-TGFβ1或量測樣本中之LAP-TGFβ1之量之方法,其包含使樣本(例如腫瘤組織)及對照樣本(例如對應的健康組織)與特異性結合於LAP-TGFβ1之抗體(例如單株抗體)或抗原結合片段在允許抗體或其部分與LAP-TGFβ1之間形成複合物之條件下接觸。接著偵測複合物之形成,其中樣本與對照樣本相比的複合物形成差異指示樣本中存在LAP-TGFβ1。本文中所描述之抗LAP抗體或抗原結合片段亦可用於經由免疫親和力純化來純化LAP-TGFβ1。
亦涵蓋本文中所描述之抗LAP抗體之診斷性應用。
在一個實施例中,本文中提供一種用於診斷與調節性T細胞浸潤相關聯之癌症之方法,其包含使來自罹患癌症之患者之生物樣本與本文中所描述之結合於調節性T細胞之抗LAP抗體或抗原結合片段接觸,其中抗體之陽性染色指示癌症與調節性T細胞浸潤相關聯。
在另一實施例中,本文中提供一種診斷與GARP陰性抑制性細胞相關聯之癌症之方法,其包含使來自罹患癌症之患者之生物樣本與本文中所描述之結合於GARP陰性抑制性細胞之抗LAP抗體或抗原結合片段接觸,其中抗體之陽性染色及抗GARP抗體之陰性染色指示癌症與GARP陰性抑制性細胞相關聯。
在另一實施例中,本文中提供一種選擇罹患癌症之患者以用本文中所描述之抗LAP抗體或抗原結合片段治療之方法,其包含使來自患者之生物樣本與抗體接觸,其中抗體之陽性染色指示癌症可用抗體治療。
在另一實施例中,本文中提供一種測定罹患癌症之患者對用本文中所描述之抗LAP抗體或抗原結合片段進行之治療的反應之方法,其包含使來自患者之生物樣本與抗體接觸,其中抗體之染色減少指示癌症對用抗體進行之治療起反應。
在另一實施例中,本文中提供一種測定患者中之癌症是否轉移之方法,其包含(a)鑑別患者患有癌症,(b)向患者投與經標記(例如經放射性標記)之本文中所描述之抗LAP抗體或抗原結合片段及測定經標記之抗LAP抗體之生物分佈,及(c)週期性重複步驟(b)以測定經標記之抗LAP抗體之生物分佈是否變化,其中經標記之抗LAP抗體之生物分佈之變化指示癌症已轉移。
亦提供用本文中所描述之抗LAP抗體治療纖維化之方法。在一個實施例中,本文中提供一種治療纖維化之方法,其包含向有需要之個體投與有效量之本文中所描述之抗體或抗原結合片段。在一些實施例中,纖維化與癌症相關聯。在一些實施例中,纖維化與骨髓衍生之抑制性細胞之含量增加相關聯(例如Fernandez等人, Eur Respir J 2016;48:1171-83)。
可用本文中所描述之抗LAP抗體或抗原結合片段中之任一者治療之例示性纖維化病症包括(但不限於)心臟纖維化、肌肉纖維化、皮膚纖維化、肝纖維化、軟組織(例如縱隔或腹膜後腔)纖維化、腎纖維化、骨髓纖維化、腸纖維化、關節(例如膝部、肩部或其他關節)纖維化、肺纖維化、特發性肺纖維化、囊腫性纖維化、心內膜心肌纖維化、縱隔纖維化、骨髓纖維化、腹膜後纖維化、進行性大規模纖維化、管狀器官纖維化、腎源性全身性纖維化、克羅恩氏病(Crohn's disease)、瘢痕瘤、老齡心肌梗塞、硬皮病/全身性硬化症、上皮下纖維化、關節纖維化、黏著性囊炎之一些形式、增生性纖維化、病毒性肝炎誘導之纖維化、藥物誘導之纖維化、放射誘導之纖維化及與癌症相關聯之纖維化。
本文中亦提供在移植之前、期間或之後降低患者中之免疫抑制性細胞之數目之方法,其包含在進行移植之前、在移植期間及/或在移植之後向患者投與有效量之本文中所描述之抗LAP抗體或抗原結合片段中之任一者。在一些實施例中,抗LAP抗體或抗原結合片段改良移植物存活率。
已在急性肝疾病之模型(對乙醯胺基酚損傷小鼠模型)中證實抑制TGFβ可藉由減少老化及增強肝再生來使再生性衰竭恢復(Bird等人, Sci Transl Med 2018;10:eaan1230)。因此,本文中亦提供增加急性器官損傷(例如急性肝損傷)中之再生性反應之方法,其包含向患有急性器官損傷之個體投與有效量之本文中所描述之抗LAP抗體或抗原結合片段。
已證實TGFβ之異常活化可引起顳下頜關節骨關節炎之發作(Zheng等人, Bone Res 2018;6:26)。因此,本文中亦提供治療顳下頜關節骨關節炎患者之方法,其包含向患者投與有效量之本文中所描述之抗LAP抗體或抗原結合片段以治療顳下頜關節骨關節炎。
亦證實在HIV-1感染期間,LAP-TGFβ1介導CD4+效應細胞分化至產生性及潛伏性感染之中樞記憶體T細胞中(Cheung等人, J Viol 2018;92:e01510-17)。因此,本文中亦提供治療HIV-1感染患者(或具有產生HIV-1感染之風險之患者)之方法,其包含向患者投與有效量之本文中所描述之抗LAP抗體或抗原結合片段以治療HIV-1感染(例如抑制CD4+效應細胞分化至產生性及潛伏性感染之中樞記憶體T細胞中)。
已證實子宮內膜異位患者之腹膜液中的表現TGFβ之巨噬細胞及抑制性調節性T細胞發生變化(Hanada等人, Reprod Biol Endocrinol 2018;16:9),表明靶向表現於此等細胞上之LAP-TGFb1可有利於治療病症。因此,本文中亦提供治療子宮內膜異位患者之方法,其包含向患者投與有效量之本文中所描述之抗LAP抗體或抗原結合片段以治療子宮內膜異位。
已證實攜帶多重耐藥性結核分支桿菌(Mycobacterium tuberculosis
)之患者中之表現LAP-TGFβ1之CD4+ T細胞及CD14+單核球以及巨噬細胞增加(Basile等人, Clin Exp Immunol 2016;187:160),表明靶向表現於此等細胞上之LAP-TGFβ1可有利於治療感染。因此,本文中亦提供治療多重耐藥性結核分支桿菌患者之方法,其包含向患者投與有效量之本文中所描述之抗LAP抗體或抗原結合片段(例如抑制LAP-TGFβ1活化之抗LAP抗體)以治療感染。
在一些實施例中,使用本文中所描述之抗LAP抗體或抗原結合片段治療β-地中海型貧血,一種其中TGFβ超家族成員涉及紅血球生成不足之病症(Dussiot等人 Nat Med 2014;20:398-407)。
在某些實施例中,可使用抗LAP抗體或抗原結合片段作為單藥療法以治療疾病或病症(例如癌症)。或者,抗LAP抗體或抗原結合片段可與另一種藥劑或療法(例如抗癌劑、化學治療劑、免疫抑制劑、免疫刺激劑、免疫檢查點抑制劑、消炎劑或細胞療法)結合使用,如下文更詳細地描述。
組合療法
本文中所描述之抗LAP抗體或抗原結合片段可與此項技術中已知的各種治療或藥劑(或在多特異性抗體或雙功能搭配物之情形下)組合使用,以用於治療癌症,如下文所描述。
適於與本文中所描述之抗LAP抗體或抗原結合片段以組合療法形式使用之抗癌劑包括(但不限於)手術、化學治療劑、生長抑制劑、細胞毒性劑、放射療法及放射療法中使用之藥劑、抗血管生成劑、細胞凋亡劑、抗微管蛋白劑及其他用於治療癌症之藥劑,諸如抗HER-2抗體(例如HERCEPTIN®)、抗CD20抗體、表皮生長因子受體(EGFR)拮抗劑(例如酪胺酸激酶抑制劑)、HER1/EGFR抑制劑(例如埃羅替尼(erlotinib)(TARCEVA®))、血小板衍生之生長因子抑制劑(例如GLEEVEC (甲磺酸伊馬替尼(Imatinib Mesylate)))、COX-2抑制劑(例如塞內昔布(celecoxib))、干擾素、細胞介素、結合於以下目標中之一或多者之拮抗劑(例如中和抗體):PD1、PDL1、PDL2 (例如派立珠單抗;尼沃單抗;MK-3475;AMP-224;MPDL3280A;MEDI0680;MSB0010718C;及/或MEDI4736);CTLA4 (例如曲美木單抗(tremelimumab)(PFIZER)及伊派利單抗(ipilimumab));LAG3 (例如BMS-986016);CD 103;TIM-3及/或其他TIM家族成員;CEACAM-1及/或其他CEACAM家族成員、ErbB2、ErbB3、ErbB4、PDGFR-β、BlyS、APRIL、BCMA或VEGF受體、TRAIL/Apo2、PARP抑制劑(例如AZD-2281、Lynparza Olaparib、Rubraca Rucaparib;(Zejula)尼拉帕尼(niraparib))、DNA損傷修復抑制劑(例如ATMi、ATRi、DNAPKi)及其他生物活性及有機化學藥劑。亦特定涵蓋其組合用於本文中所描述之方法中。
適於與本文中所描述之抗LAP抗體或抗原結合片段以組合療法形式使用之化學治療劑包括(但不限於)烷基化劑,諸如噻替派及CYTOXAN®環磷醯胺;替莫唑胺(temozolomide);磺酸烷基酯,諸如白消安(busulfan)、英丙舒凡(improsulfan)及哌泊舒凡(piposulfan);氮丙啶,諸如苯唑多巴(benzodopa)、卡波醌(carboquone)、米特多巴(meturedopa)及尤利多巴(uredopa);伸乙亞胺及甲基三聚氰胺,包括六甲蜜胺(altretamine)、三伸乙基三聚氰胺、三伸乙基磷醯胺、三伸乙基硫代磷醯胺及三甲基三聚氰胺;多聚乙醯(尤其布拉他辛(bullatacin)及布拉他辛酮(bullatacinone));喜樹鹼(包括合成類似物拓朴替康(topotecan));苔蘚蟲素;海洋抑素;CC-1065 (包括其阿多來新(adozelesin)、卡折來新(carzelesin)及比折來新(bizelesin)合成類似物);念珠藻環肽(尤其克瑞托欣(cryptophycin)1及克瑞托欣8);海兔毒素(dolastatin);倍癌黴素(duocarmycin)(包括合成類似物KW-2189及CB1-TM1);艾榴塞洛素(eleutherobin);盤克斯達汀(pancratistatin);匍枝珊瑚醇(sarcodictyin);海綿抑素(spongistatin);氮芥(nitrogen mustard),諸如苯丁酸氮芥、萘氮芥、氯磷醯胺、雌氮芥、異環磷醯胺、甲氮芥、氧化氮芥鹽酸鹽、美法侖(melphalan)、新恩比興(novembichin)、苯芥膽甾醇(phenesterine)、潑尼莫司汀(prednimustine)、曲磷胺(trofosfamide)、尿嘧啶氮芥;亞硝基脲,諸如卡莫司汀(carmustine)、氯脲菌素(chlorozotocin)、福莫司汀(fotemustine)、洛莫司汀(lomustine)、尼莫司汀(nimustine)及雷莫司汀(ranimnustine);抗生素,諸如烯二炔抗生素(例如卡奇黴素(calicheamicin),尤其卡奇黴素γ11及卡奇黴素ω11 (參見例如Agnew, Chem. Intl. Ed. Engl., 33 : 183-186 ( 1994));達米辛(dynemicin),包括達米辛A;雙膦酸鹽,諸如氯屈膦酸鹽(clodronate);埃斯培拉黴素(esperamicin);以及新抑癌蛋白發色團及相關色蛋白烯二炔抗生素發色團)、阿克拉黴素(aclacinomysins)、放射菌素、安麯黴素(authramycin)、偶氮絲胺酸、博來黴素(bleomycins)、放線菌素C (cactinomycin)、卡拉比辛(carabicin)、洋紅黴素(caminomycin)、嗜癌菌素(carzinophilin)、色黴素(chromomycinis)、放線菌素D、道諾黴素(daunorubicin)、地托比星(detorubicin)、6-重氮-5-側氧基-L-正白胺酸、ADRIAMYCIN®小紅莓(ADRIAMYCIN® doxorubicin)(包括(N-嗎啉基)-小紅莓、氰基(N-嗎啉基)-小紅莓、2-吡咯啉基-小紅莓及去氧小紅莓)、表柔比星(epirubicin)、依索比星(esorubicin)、伊達比星(idarubicin)、麻西羅黴素(marcellomycin)、絲裂黴素(mitomycins)(諸如絲裂黴素C)、黴酚酸、諾加黴素(nogalamycin)、橄欖黴素(olivomycins)、培洛黴素(peplomycin)、潑非黴素(potfiromycin)、嘌呤黴素(puromycin)、奎那黴素(quelamycin)、羅多比星(rodorubicin)、鏈黑菌素(streptonigrin)、鏈脲菌素(streptozocin)、殺結核菌素(tubercidin)、烏苯美司(ubenimex)、淨司他丁(zinostatin)、左柔比星(zorubicin);抗代謝物,諸如甲胺喋呤(methotrexate)及5-氟尿嘧啶(5-FU);葉酸類似物,諸如迪諾特寧(denopterin)、甲胺喋呤、蝶羅呤(pteropterin)、曲美沙特(trimetrexate);嘌呤類似物,諸如氟達拉濱(fludarabine)、6-巰基嘌呤、硫咪嘌呤(thiamiprine)、硫鳥嘌呤(thioguanine);嘧啶類似物,諸如安西他濱(ancitabine)、阿紮胞苷(azacitidine)、6-氮雜尿苷、卡莫氟(carmofur)、阿糖胞苷、二去氧尿苷、去氧氟尿苷、依諾他濱(enocitabine)、氟尿苷;雄激素,諸如卡魯睾酮(calusterone)、丙酸屈他雄酮(dromostanolone propionate)、環硫雄醇(epitiostanol)、美雄烷(mepitiostane)、睾內酯(testolactone);抗腎上腺劑,諸如胺魯米特(aminoglutethimide)、米托坦(mitotane)、曲洛司坦(trilostane);葉酸補充劑,諸如亞葉酸;乙醯葡醛酯;醛磷醯胺糖苷;胺基乙醯丙酸;恩尿嘧啶(eniluracil);安吖啶(amsacrine);貝斯布西(bestrabucil);比山群(bisantrene);艾達曲克(edatraxate);得弗伐胺(defofamine);地美可辛(demecolcine);地吖醌(diaziquone);艾福米辛(elformithine);依利醋銨(elliptinium acetate);埃坡黴素(epothilone);依託格魯(etoglucid);硝酸鎵;羥基脲;香菇多醣(lentinan);氯尼達明(lonidainine);類美登素,諸如美登素及安絲菌素(ansamitocin);米托胍腙(mitoguazone);米托蒽醌(mitoxantrone);莫比達摩(mopidanmol);二胺硝吖啶(nitraerine);噴司他汀(pentostatin);凡那明(phenamet);吡柔比星(pirarubicin);洛索蒽醌(losoxantrone);鬼臼酸;2-乙基醯肼;丙卡巴肼(procarbazine);PSK®多醣複合物(JHS Natural Products, Eugene, Oreg.);雷佐生(razoxane);根瘤菌素(rhizoxin);西佐喃(sizofuran);鍺螺胺(spirogermanium);細交鏈孢菌酮酸;三亞胺醌(triaziquone);2,2',2"-三氯三乙胺;單端孢黴烯(trichothecenes),尤其T-2毒素、弗納庫林A (verracurin A)、桿孢菌素A (roridin A)及蛇形菌素(anguidine));尿烷;長春地辛(vindesine);達卡巴嗪(dacarbazine);甘露醇氮芥(mannomustine);二溴甘露醇(mitobronitol);二溴衛矛醇(mitolactol);哌泊溴烷(pipobroman);加西托星(gacytosine);阿拉伯糖苷(「Ara-C」);環磷醯胺;噻替派;類紫杉醇,例如TAXOL®太平洋紫杉醇(Bristol-Myers Squibb Oncology, Princeton, N.J.)、ABRAXANE® (太平洋紫杉醇之不含十六醇聚氧乙烯醚、經白蛋白工程改造之奈米粒子調配物)(American Pharmaceutical Partners, Schaumberg,111
.)及TAXOTERE®多西他賽(TAXOTERE® doxetaxel)(Rhone- Poulenc Rorer, Antony, France);苯丁酸氮芥;GEMZAR®吉西他濱(GEMZAR® gemcitabine);6-硫代鳥嘌呤;巰基嘌呤;甲胺喋呤;鉑類似物,諸如順鉑(cisplatin)、奧沙利鉑(oxaliplatin)及卡鉑(carboplatin)、長春鹼;鉑;依託泊苷(etoposide)(VP-16);異環磷醯胺;米托蒽醌;長春新鹼;NAVELBINE、長春瑞賓;米托蒽醌;替尼泊苷(teniposide);依達曲沙(edatrexate);柔紅黴素(daunomycin);胺基喋呤(aminopterin);截瘤達(xeloda);伊班膦酸鹽(ibandronate);伊立替康(irinotecan)(Camptosar,CPT-11)(包括伊立替康與5-FU及甲醯四氫葉酸(leucovorin)之治療方案);拓樸異構酶抑制劑RFS 2000;二氟甲基鳥胺酸(DMFO);類視黃素,諸如視黃酸;卡培他濱(capecitabine);康柏斯達汀(combretastatin);甲醯四氫葉酸(leucovorin;LV);奧沙利鉑(oxaliplatin),包括奧沙利鉑治療方案(FOLFOX);拉帕替尼(lapatinib)(TYKERB);PKC-α、Raf、H-Ras、EGFR之抑制劑(例如埃羅替尼(erlotinib)(TARCEVA®))及減少細胞增殖之VEGF-A,及以上中之任一者之醫藥學上可接受之鹽、酸或衍生物。
亦適於與本文中所描述之抗LAP抗體或抗原結合片段組合使用的為靶向表觀遺傳調節劑之藥物,諸如HDAC抑制劑、溴結構域抑制劑及E3連接酶(例如塞勒布隆(cereblon))抑制劑(例如來那度胺(lenalidomide)、泊利度胺(pomalidomide)及沙力度胺(thalidomide))。
適於與本文中所描述之抗LAP抗體或抗原結合片段以組合療法形式使用之消炎劑包括(但不限於)阿司匹林(aspirin)及其他水楊酸鹽、Cox-2抑制劑(例如羅非考昔(rofecoxib)及塞內昔布)、NSAID (諸如布洛芬(ibuprofen)、非諾洛芬(fenoprofen)、萘普生(naproxen)、舒林酸(sulindac)、雙氯芬酸(diclofenac)、吡羅昔康(piroxicam)、酮基布洛芬(ketoprofen)、二氟尼柳(diflunisal)、萘丁美酮(nabumetone)、依託度酸(etodolac)、奧沙普嗪(oxaprozin)及吲哚美辛(indomethacin))、抗IL6R抗體、抗IL8抗體、抗IL15抗體、抗IL15R抗體、抗CD4抗體、抗CD11a抗體(例如艾法珠單抗(efalizumab))、抗α-4/β-1整合素(VLA4)抗體(例如那他珠單抗(natalizumab))、用於治療發炎性疾病之CTLA4-Ig、潑尼松龍(prednisolone)、潑尼松(prednisone)、疾病改善抗風濕藥物(DMARD)(諸如甲胺喋呤)、羥基氯奎(hydroxychloroquine)、柳氮磺胺吡啶(sulfasalazine)、嘧啶合成抑制劑(例如來氟米特(leflunomide))、IL-1受體阻斷劑(例如阿那白滯素(anakinra))、TNF-α阻斷劑(例如依那西普(etanercept)、英利昔單抗(infliximab)及阿達木單抗(adalimumab))及其類似物。
適合的免疫調節劑(例如免疫刺激劑及免疫抑制劑)包括(但不限於)環孢黴素(cyclosporine);硫唑嘌呤(azathioprine);黴酚酸;黴酚酸嗎啉乙酯(mycophenolate mofetil);皮質類固醇(諸如潑尼松);甲胺喋呤;金鹽;柳氮磺胺吡啶;抗瘧疾藥;布喹那(brequinar);來氟米特;咪唑立賓(mizoribine);15-去氧史帕胍淋(15-deoxyspergualine);6-巰基嘌呤;環磷醯胺;雷帕黴素(rapamycin);他克莫司(tacrolimus)(FK-506);OKT3;抗胸腺細胞球蛋白;胸腺五肽;胸腺素-α;結合於IL-2受體之p75之抗體;結合於MHC、CD2、CD3、CD4、CD7、CD28、B7、CD40、CD45、IFN-γ、TNF-α、IL-4、IL-5、IL-6R、IL-6、IGF、IGFR1、IL-7、IL-8、IL-10、CD11a或CD58之抗體;或結合於其配位體可溶性IL-15R、IL-10、B7分子(B7-1、B7-2、其變異體及其片段)、ICOS、OX40之抗體;陰性T細胞調節劑之抑制劑(諸如針對CTLA4之抗體)及其類似物。
其他免疫抑制劑包括例如抗TNF劑,諸如依那西普、阿達木單抗及英利昔單抗,及類固醇。特定天然及合成類固醇之實例包括例如:醛固酮、倍氯米松(beclomethasone)、倍他米松(betamethasone)、布地奈德(budesonide)、氯潑尼醇(cloprednol)、可的松(cortisone)、可的伐唑(cortivazol)、脫氧皮質酮(deoxycortone)、地奈德(desonide)、去羥米松(desoximetasone)、地塞米松(dexamethasone)、二氟可龍(difluorocortolone)、氟氯奈德(fluclorolone)、氟米松(flumethasone)、氟尼縮松(flunisolide)、膚輕松(fluocinolone)、氟西奈德(fluocinonide)、丁基氟可丁(fluocortin butyl)、氟可的松(fluorocortisone)、氟可龍(fluorocortolone)、氟米龍(fluorometholone)、氟氫縮松(flurandrenolone)、氟替卡松(fluticasone)、哈西奈德(halcinonide)、氫化可的松(hydrocortisone)、艾可米松(icomethasone)、甲潑尼松(meprednisone)、甲基潑尼松龍(methylprednisolone)、帕拉米松(paramethasone)、潑尼松龍(prednisolone)、潑尼松(prednisone)、替可的松(tixocortol)及曲安西龍(triamcinolone)。
適於與本文中所描述之抗LAP抗體或抗原結合片段以組合療法形式使用之免疫刺激劑包括例如能夠刺激抗原呈現細胞(APC)(諸如樹突狀細胞(DC)及巨噬細胞)之化合物。舉例而言,之適合的免疫刺激劑能夠刺激APC,使得APC之成熟過程加速、APC之增殖增加及/或共刺激分子(例如CD80、CD86、ICAM-1、MHC分子及CCR7)及促炎性細胞介素(例如IL-1β、IL-6、IL-12、IL-15及IFN-γ)之募集或釋放上調。適合的免疫刺激劑亦能夠增加T細胞增殖。此類免疫刺激劑包括(但不限於)CD40配位體;FLT 3配位體;細胞介素,諸如IFN-α、IFN-β、IFN-γ及IL-2;群落刺激因子,諸如G-CSF (顆粒球群落刺激因子)及GM-CSF (粒細胞-巨噬細胞群落刺激因子);抗CTLA-4抗體、抗PD1抗體、抗41BB抗體或抗OX-40抗體;LPS (內毒素);ssRNA;dsRNA;卡介苗(Bacille Calmette-Guerin;BCG);鹽酸左旋咪唑(Levamisole hydrochloride);及靜脈內免疫球蛋白。在一個實施例中,免疫刺激劑可為Toll樣受體(TLR)促效劑。舉例而言,免疫刺激劑可為TLR3促效劑,諸如雙股肌苷:胞嘧啶聚核苷酸(Poly I:C,例如可自Hemispherx Bipharma, PA, US以AmpligenTM獲得,或來自Oncovir之Poly IC:LC)或Poly A:U;TLR4促效劑,諸如單磷醯基脂質A (MPL)或RC-529 (例如可自GSK, UK購得);TLR5促效劑,諸如鞭毛蛋白;TLR7或TLR8促效劑,諸如咪唑并喹啉TLR7或TLR8促效劑,例如咪喹莫特(imiquimod)(例如AldaraTM)或雷西莫特(resiquimod)及相關咪唑并喹啉藥劑(例如可自3M Corporation購得);或TLR9促效劑,諸如具有未甲基化之CpG基元之去氧核苷酸(「CpG」,例如可自Coley Pharmaceutical購得)。在另一實施例中,免疫刺激性分子為STING促效劑。此類免疫刺激劑可與本文中所描述之抗LAP抗體或抗原結合片段同時、分開或依序投與。
適合的免疫檢查點阻斷劑包括(但不限於)結合於PD-1、PD-L1、PD-L2、LAG-3、CTLA4、TIGIT、ICOS、OX40、PVR、PVRIG、VISTA及TIM3之藥劑(例如抗體)。結合於PD-L、PD-L1及PD-L2之抗體之非限制性實例包括派立珠單抗;尼沃單抗;MK-3475;MPDL32;MEDI0680;MEDI4736;AMP-224;及MSB0010718C。
在一些實施例中,抗LAP抗體與靶向刺激性或抑制性分子之藥劑一起投與,該分子為免疫球蛋白超家族(IgSF)之成員。舉例而言,本文中所描述之抗LAP抗體或抗原結合片段可與靶向IgSF家族之成員之藥劑一起投與個體以提高免疫反應。舉例而言,抗LAP抗體或抗原結合片段可與靶向膜結合之配位體之B7家族(其包括B7-1、B7-2、B7-H1 (PD-L1)、B7-DC (PD-L2)、B7-H2 (ICOS-L)、B7-H3、B7-H4、B7-H5 (VISTA)及B7-H6)之成員或特異性結合於B7家族成員之共刺激性或共抑制性受體之藥劑一起投與。
抗LAP抗體或抗原結合片段亦可與靶向分子(配位體或受體)之TNF及TNFR家族之成員(諸如CD40及CD40L、OX-40、OX-40L、CD70、CD27L、CD30、CD30L、4-1BBL、CD137、TRAIL/Apo2-L、TRAILR1/DR4、TRAILR2/DR5、TRAILR3、TRAILR4、OPG、RANK、RANKL、TWEAKR/Fn14、TWEAK、BAFFR、EDAR、XEDAR、TACI、APRIL、BCMA、LTβR、LIGHT、DcR3、HVEM、VEGI/TL1A、TRAMP/DR3、EDA1、EDA2、TNFR1、淋巴毒素α/TNFβ、TNFR2、TNFα、LTβR、淋巴毒素α1β2、FAS、FASL、RELT、DR6、TROY及NGFR)之藥劑一起投與(參見例如Tansey (2009) Drug Discovery Today 00:1)。
可藉由本文中所描述之抗LAP抗體或抗原結合片段與以下藥劑中之一或多者之組合來刺激T細胞反應:
(1) 抑制T細胞活化之蛋白質之拮抗劑(抑制劑或阻斷劑)(例如免疫檢查點抑制劑),該蛋白質諸如CTLA-4、PD-1、PD-L1、PD-L2及LAG-3,如上文所描述,及以下蛋白質中之任一者:TIM-3、半乳糖凝集素9、CEACAM-1、BTLA、CD69、半乳糖凝集素-1、TIGIT、CD113、CD155、GPR56、VISTA、B7-H3、B7-H4、2B4、CD48、GARP、PD1H、LAIR1、TIM-1及TIM-4;及/或
(2) 刺激T細胞活化之蛋白質之促效劑,該蛋白質諸如B7-1、B7-2、CD28、4-1BB (CD137)、4-1BBL、GITR、ICOS、ICOS-L、OX40、OX40L、CD70、CD27、CD40、DR3及CD28H。
調節以上蛋白質且可與本文中所描述之抗LAP抗體或抗原結合片段組合用於治療癌症之例示性藥劑包括:YervoyTM
(伊派利單抗)或曲美木單抗(針對CTLA-4)、加利昔單抗(galiximab)(針對B7.1)、BMS-936558 (針對PD-1)、MK-3475 (針對PD-1)、AMP224 (針對B7DC)、BMS-936559 (針對B7-H1)、MPDL3280A (針對B7-H1)、MEDI-570 (針對ICOS)、AMG557 (針對B7H2)、MGA271 (針對B7H3)、IMP321 (針對LAG-3)、BMS-663513 (針對CD137)、PF-05082566 (針對CD137)、CDX-1127 (針對CD27)、抗OX40 (Providence Health Services)、huMAbOX40L (針對OX40L)、阿塞西普(Atacicept)(針對TACI)、CP-870893 (針對CD40)、魯卡木單抗(Lucatumumab)(針對CD40)、達西珠單抗(Dacetuzumab)(針對CD40)、莫羅單抗(Muromonab)-CD3 (針對CD3)、易普單抗(Ipilumumab)(針對CTLA-4)。
可與抗LAP抗體或抗原結合片段組合用於治療癌症之其他分子包括NK細胞上之抑制性受體之拮抗劑或NK細胞上之活化受體之促效劑。舉例而言,抗LAP抗體或抗原結合片段可與KIR之拮抗劑(例如利瑞路單抗(lirilumab))組合。
T細胞活化亦由可溶性細胞介素調節,且抗LAP抗體可與抑制T細胞活化之細胞介素的拮抗劑或刺激T細胞活化之細胞介素的促效劑一起向例如患有癌症之個體投與。
在某些實施例中,抗LAP抗體或抗原結合片段可與以下組合使用:(i)抑制T細胞活化之IgSF家族或B7家族或TNF家族之蛋白質之拮抗劑(或抑制劑或阻斷劑),或抑制T細胞活化之細胞介素(例如IL-6、IL-10、TGF-β、VEGF;「免疫抑制性細胞介素」)之拮抗劑,及/或(ii)、IgSF家族、B7家族或TNF家族或刺激T細胞活化之細胞介素之刺激性受體之促效劑,以用於刺激免疫反應,例如用於治療增生性疾病,諸如癌症。
其他用於組合療法之藥劑包括抑制或消耗巨噬細胞或單核球之藥劑,包括(但不限於)CSF-1R拮抗劑,諸如CSF-1R拮抗劑抗體,包括RG7155 (參見PCT公開案第WO11/70024號、第WO11/107553號、第WO11/131407號、第WO13/87699號、第WO13/119716號及第WO13/132044號)或FPA-008 (參見PCT公開案第WO11/140249;WO13169264;及WO14/036357)。
可與抗LAP抗體或抗原結合片段組合之其他藥劑包括增強腫瘤抗原呈現之藥劑,例如樹突狀細胞疫苗、GM-CSF分泌細胞疫苗、CpG寡核苷酸及咪喹莫特,或增強腫瘤細胞之免疫原性之療法(例如蒽環黴素)。
另一種可與抗LAP抗體組合之療法為抑制新陳代謝酶(諸如吲哚胺雙加氧酶(IDO)、色胺酸-2,3-雙加氧酶、雙加氧酶、精胺酸酶或氧化氮合成酶)之療法。
另一種可與抗LAP抗體一起使用之藥劑包括抑制腺苷形成或抑制腺苷A2A受體之藥劑,例如抗CD73抗體、抗CD39抗體及腺苷A2A/A2b抑制劑。
其他可與抗LAP抗體或抗原結合片段組合用於治療癌症之療法包括逆轉/防止T細胞失能或耗竭之療法,及引起腫瘤位點處之先天性免疫活化及/或發炎之療法。
抗LAP抗體或抗原結合片段可與靶向免疫路徑之多個元件的組合方法組合,諸如以下中之一或多者:增強腫瘤抗原呈現之療法(例如樹突狀細胞疫苗、GM-CSF分泌性細胞疫苗、CpG寡核苷酸、咪喹莫特);抑制負向免疫調控之療法,例如藉由抑制CTLA-4及/或PD1/PD-L1/PD-L2路徑及/或消耗或阻斷調節性T細胞或其他免疫抑制細胞;刺激正向免疫調節之療法,例如使用刺激CD-137及/或GITR路徑及/或刺激T細胞效應功能之促效劑;全身性地增加抗腫瘤T細胞之出現率的療法;使用CD25拮抗劑(例如達利珠單抗(daclizumab))或藉由離體抗CD25珠粒消耗進行之消耗或抑制調節性T細胞的療法;影響腫瘤中之抑制性骨髓細胞之功能的療法;增強腫瘤細胞之免疫原性之療法(例如蒽環黴素);用授受性T細胞或NK細胞轉移進行之細胞療法,包括經基因修飾之細胞,例如經嵌合抗原受體修飾之細胞(CAR-T療法);抑制新陳代謝酶(諸如吲哚胺雙加氧酶(IDO)、雙加氧酶、精胺酸酶或氧化氮合成酶)之療法;逆轉/防止T細胞失能或耗竭之療法;引起腫瘤位點處之先天性免疫活化及/或發炎之療法;投與免疫刺激性細胞介素;或阻斷免疫抑制性或免疫抑止性細胞介素。
本文中所描述之抗LAP抗體或抗原結合片段可與促炎性細胞介素(例如IL-12及IL-2)組合。此等細胞介素可經修飾以增強半衰期及腫瘤靶向。
本文中所描述之抗LAP抗體或抗原結合片段可與免疫細胞接合分子(諸如NK細胞接合分子或T細胞接合分子)組合。
本文中所描述之抗LAP抗體或抗原結合片段可與吲哚胺雙加氧酶(IDO)抑制劑、色胺酸-2,3-雙加氧酶(TDO)抑制劑及雙重IDO/TDO抑制劑組合。
本文中所描述之抗LAP抗體或抗原結合片段可與犬尿鹼抑制劑組合。
本文中所描述之抗LAP抗體或抗原結合片段可與CD47及/或SIRPa阻斷療法組合。
本文中所描述之抗LAP抗體或抗原結合片段可與JAK抑制劑及JAK路徑抑制劑(例如STAT3抑制劑)組合,例如以用於治療骨髓纖維化及骨髓增生性贅瘤。
本文中所描述之抗LAP抗體或抗原結合片段可與DNA損傷修復抑制劑組合。
本文中所描述之抗LAP抗體或抗原結合片段可與紅細胞生成素及刺激造血之藥物組合。
本文中所描述之抗LAP抗體或抗原結合片段可與血管生成抑制劑組合。
本文中所描述之抗LAP抗體或抗原結合片段可與抗病毒藥(諸如神經醯胺酶抑制劑)組合。
雙特異性抗體可與至少一種其他抗癌劑(例如放射、化學治療劑、生物製劑、疫苗)組合使用以抑制腫瘤生長,該等雙特異性抗體具有第一結合區,其具有本文中所描述之抗LAP抗體或抗原結合片段之特異性,及第二結合區,其結合於免疫檢查點阻斷劑(例如PD-1、PD-L1)。
本文中所描述之抗LAP抗體或抗原結合片段可與一或多種免疫刺激性抗體(諸如抗PD-1拮抗劑抗體、抗PD-L1拮抗劑抗體、拮抗劑抗CTLA-4抗體、拮抗性抗TIM3抗體及/或抗LAG3拮抗劑抗體)組合,使得刺激個體中之免疫反應,例如以抑制腫瘤生長。
例示性抗PD-1抗體包括WO2012/145493中所描述之尼沃單抗、派立珠單抗(亦稱為MK-3475,拉立珠單抗(Lambrolizumab));WO 2012/145493中所描述之AMP-514,以及WO 2009/014708、WO 03/099196、WO 2009/114335、WO 2011/066389、WO 2011/161699、WO 2012/145493、美國專利案第7,635,757號及第8,217,149號以及美國專利公開案第2009/0317368號中所描述之PD-1抗體及其他PD-1抑制劑。
例示性抗PD-L1抗體包括MEDI4736 (亦稱為抗B7-H1)、MPDL3280A (亦稱為RG7446)、MSB0010718C (WO2013/79174)、rHigM12B7,以及WO2013/173223、WO2011/066389、WO2012/145493、美國專利案第7,635,757號及第8,217,149號以及美國公開案第2009/145493號中所揭示之抗PD-L1抗體中之任一者。
例示性抗CTLA-4抗體包括YervoyTM
(伊派利單抗)、曲美木單抗(先前為替西單抗(ticilimumab),CP-675,206),或以下公開案中之任一者中所描述之抗CTLA-4抗體:WO 98/42752;WO 00/37504;美國專利案第6,207,156號;Hurwitz等人 (1998)Proc. Natl. Acad. Sci. USA
95(17):10067-10071;Camacho等人 (2004)J. Clin. Oncology
22(145): Abstract第2505號 (抗體CP-675206);及Mokyr等人 (1998)Cancer Res.
58:5301-5304。
例示性抗LAG3抗體包括美國公開案第2011/007023號及PCT公開案第WO08/132601號及第WO09/44273號中所描述之IMP731及IMP-321,以及美國專利公開案第US2011/0150892號以及國際專利公開案第WO10/19570號及第WO2014/008218號中所描述之抗體。
抗LAP抗體或抗原結合片段亦可與以下組合:免疫腫瘤學藥劑,諸如CD137 (4-1BB)促效劑(例如促效性CD137抗體,諸如優瑞路單抗(urelumab)或PF-05082566 (參見PCT公開案第WO12/32433號));GITR促效劑(例如促效性抗GITR抗體)、CD40促效劑(例如促效性CD40抗體);CD40拮抗劑(例如拮抗性CD40抗體,諸如魯卡木單抗(HCD122)、達西珠單抗(SGN-40)、CP-870,893或Chi Lob 7/4);CD27促效劑(例如促效性CD27抗體,諸如瓦里木單抗(varlilumab)(CDX-1127))、MGA271 (針對B7H3)(WO11/109400));KIR拮抗劑(例如利瑞路單抗);IDO拮抗劑(例如INCB-024360 (WO2006/122150、WO07/75598、WO08/36653、WO08/36642)、因多莫得(indoximod)、NLG-919 (WO09/73620、WO09/1156652、WO11/56652、WO12/142237)或F001287);類鐸受體促效劑(例如TLR2/4促效劑(例如卡介苗);TLR7促效劑(例如希托洛(Hiltonol)或咪喹莫特);TLR7/8促效劑(例如雷西莫特);或TLR9促效劑(例如CpG7909));及TGF-β抑制劑(例如GC1008、LY2157299、TEW7197或IMC-TR1)。
本文中所描述之抗LAP抗體或抗原結合片段亦可與免疫原性藥劑組合,諸如癌性細胞、經純化之腫瘤抗原(包括重組型蛋白質、肽及碳水化合物分子)、細胞及經編碼免疫刺激性細胞介素之基因轉染之細胞(He等人 (2004)J. Immunol.
173:4919-28)。可使用之腫瘤疫苗之非限制性實例包括黑素瘤抗原之肽,諸如gp100、MAGE抗原、Trp-2、MART1及/或酪胺酸酶之肽,或經轉染以表現細胞介素GM-CSF之腫瘤細胞(下文中進一步論述)。
本文中所描述之抗LAP抗體或抗原結合片段亦可與抗贅生性抗體組合,諸如Rituxan® (利妥昔單抗)、Herceptin® (曲妥珠單抗)、Bexxar® (托西莫單抗(tositumomab))、Zevalin® (異貝莫單抗(ibritumomab))、Campath® (阿侖單抗)、Lymphocide® (依帕珠單抗(eprtuzumab))、Avastin® (貝伐珠單抗(bevacizumab))及Tarceva® (埃羅替尼)及其類似物。
若干實驗性治療方案涉及抗原特異性T細胞之離體活化及擴增及將此等細胞授受性轉移至受體中以產生針對腫瘤之抗原特異性T細胞(Greenberg及Riddell, 見上文)。預期在存在本文中所描述之抗LAP抗體之情況下,在存在或不存在其他免疫刺激療法(例如免疫檢查點阻斷劑)之情況下的離體活化可提高授受性轉移之T細胞之出現率及活性。
抗LAP抗體或抗原結合片段亦可與護理標準治療或另一種治療(諸如放射、手術或化學療法)一起投與。抗LAP抗體或抗原結合片段可與疫苗接種方案組合。已設計許多用於針對腫瘤之疫苗接種的實驗策略(參見Rosenberg, S., 2000, Development of Cancer Vaccines, ASCO Educational Book Spring: 60-62;Logothetis, C., 2000, ASCO Educational Book Spring: 300-302;Khayat, D. 2000, ASCO Educational Book Spring: 414-428;Foon, K. 2000, ASCO Educational Book Spring: 730-738;亦參見Restifo, N.及Sznol, M., Cancer Vaccines, 第61章, 第3023-3043頁, DeVita, 等人 (編), 1997, Cancer: Principles and Practice of Oncology, 第五版)。在此等策略中之一者中,使用自體或同種異體腫瘤細胞製備疫苗。已證實此等細胞疫苗在腫瘤細胞經轉導以表現GM-CSF時最有效。已證實GM-CSF為用於腫瘤疫苗接種之抗原呈現之強效活化劑(Dranoff 等人 (1993)Proc. Natl. Acad. Sci. U.S.A.
90: 3539-43)。
樹突狀細胞(DC)為可用於引發抗原特異性反應之強效抗原呈現細胞。DC可離體產生且負載有各種蛋白質及肽抗原以及腫瘤細胞提取物(Nestle, F.等人(1998)Nature Medicine
4:328-332)。DC亦可藉由基因方法轉導以亦表現此等腫瘤抗原。DC亦直接融合至腫瘤細胞以用於免疫接種之目的(Kugler等人(2000)Nature Medicine
6:332-336)。作為疫苗接種之方法,DC免疫接種可與本文中所描述之抗LAP抗體或抗原結合片段有效地組合以活化更強效的抗腫瘤反應。
在一些實施例中,本文中所論述之治療性抗體之組合可在醫藥學上可接受之載劑中以單一組合物形式投與,或作為單獨的組合物在醫藥學上可接受之載劑中與各抗體同時投與。在另一實施例中,可依序投與治療性抗體之組合。
X. 套組
亦提供套組,其包含本文中所揭示之抗LAP抗體或抗原結合片段、多特異性分子或免疫結合物(視情況包含於單一小瓶或容器中),且包括例如用於治療或診斷疾病(例如癌症)之使用說明書。套組可包括指示套組內容物之預期用途的標籤。術語標籤包括套組上所提供或隨套組一起提供或以其他方式伴隨套組的任何書面市場材料或記錄材料。此類套組可包含抗體、多特異性分子或免疫結合物之單位劑型,諸如單次劑量小瓶或單次劑量預裝藥型注射器。
藉由以下實例進一步說明本發明,該等實例不應視為進一步限制。所有圖式及在整個本申請案中所引用之所有參考文獻、Genbank序列、專利案及公開專利申請案的內容明確地以引用之方式併入本文中。
實例
除非另有指示,否則以下實例中提及之可商購的試劑係根據製造商說明使用。除非另外說明,否則本發明使用重組型DNA技術之標準程序,諸如上文及以下教科書中所述之程序:Sambrook等人, 見上文;Ausubel等人,Current Protocols in Molecular Biology
(Green Publishing Associates and Wiley Interscience, N.Y., 1989);Innis等人,PCR Protocols: A Guide to Methods and Applications
(Academic Press, Inc.: N.Y., 1990);Harlow等人,Antibodies: A Laboratory Manual
(Cold Spring Harbor Press: Cold Spring Harbor, 1988);Gait,Oligonucleotide Synthesis
(IRL Press: Oxford, 1984);Freshney,Animal Cell Culture
, 1987;Coligan等人,Current Protocols in Immunology
, 1991。
以下實例描述抗LAP抗體28G11、22F9、20E6 (亦稱為26E10)、17G8及24E3之表徵,該等抗體係藉由用小鼠TGFβ1使TGFβ1基因敲除小鼠免疫而產生,如Oida等人(PLoS One
2010;5(11):e15523)中所描述。抗LAP抗體28G11、22F9、20E6、17G8及24E3之CDR序列、可變區序列以及全長重鏈及輕鏈序列提供於表 34
中。此等抗體係以具有mIgG2a恆定區之鼠類抗體格式、具有人類IgG恆定區之嵌合格式及/或人類化格式製備。
為產生具有mIgG2a恆定區之抗體,各抗體之可變區序列與鼠類IgG2a恆定區融合。使用重疊延伸PCR,使鼠類VH結構域與鼠類IgG2a恆定域之密碼子優化基因(UniProt寄存編號#P01863)融合。使用重疊延伸PCR,使鼠類VL結構域與鼠類κ恆定域之密碼子優化基因(寄存編號#P01837)融合。將完整的重鏈及輕鏈序列個別地TOPO-TA選殖至pcDNA3.4中以用於ExpiCHO細胞中之表現。
為產生嵌合格式之抗體,使鼠類親本純系之可變區序列與人類IgG1恆定區序列融合。使用重疊延伸PCR,使鼠類VH結構域與人類IgG1恆定域之密碼子優化基因(UniProt寄存編號#P01857)融合。使用重疊延伸PCR,使鼠類VL結構域與人類κ恆定域之密碼子優化基因(寄存編號#P01834)融合。將完整的重鏈及輕鏈序列個別地TOPO-TA選殖至pcDNA3.4中以用於ExpiCHO細胞中之表現。
關於抗體之人類化之細節描述於實例8-11中。
抗體之名稱將遵循表 2
中描述之格式。表 2
.
| 名稱 | 說明 |
| Antibody clone_(hyb) (例如28G11_(hyb)) | 親本鼠類抗體 |
| Antibody_mIgG2a (例如28G11_IgG2a) | 與鼠類IgG2a恆定區融合之親本抗體之鼠類可變區 |
| Antibody_hIgG1 (例如28G11_hIgG1) | 具有親本抗體之鼠類可變區及人類IgG1恆定區之嵌合抗體 |
| Antibody_H(X)L(Y) (例如28G11_H2L3) | 人類化抗體,其中X係指特定人類化重鏈且Y係指特定人類化輕鏈 |
實例 1 : 抗 LAP 抗體與人類及鼠類 LAP-TGFβ1 之結合
此實例使用生物層干涉術描述抗LAP抗體28G11_hIgG1、22F9_hIgG1及20E6_hIgG1結合於人類及鼠類LAP-TGFβ1之能力。
嵌合抗體使用EZ-Link SulfoNHS-LC-Biotin (ThermoFisher)進行生物素標記。抗生蛋白鏈菌素官能化之探針在結合緩衝液(10 mM磷酸鈉、150 mM氯化鈉、1% (w/v)牛血清白蛋白、0.05% (w/v)疊氮化鈉,pH 7.4)中平衡。探針在10 µg/mL之經生物素標記之嵌合抗LAP於結合緩衝液中之溶液中浸漬15秒,以將抗體裝載至探針。接著,在結合緩衝液中洗滌裝載有抗體之探針且置放於含有0-24 nM LAP-TGFβ1 (含有與人類LAP-TGFβ1融合之人類IgG1 Fc結構域之融合蛋白質或具有C端聚組胺酸純化標籤之鼠類LAP-TGFβ1)之溶液中。使抗原結合於抗體保持5分鐘(締合期)且接著將探針移至結合緩衝液中(解離期)。針對1:1結合模型擬合締合及解離期以測定結合率常數。
如表 3
中所示,28G11_hIgG1、22F9_hIgG1及20E6_hIgG1以次奈莫耳親和力結合於人類及鼠類LAP-TGFβ1。此等資料說明抗體在不存在錨蛋白質之情況下結合於人類及鼠類LAP-TGFβ1。表 3
.
| 小鼠LAP-TGFβ1 | |||
| 抗體 | kon (×106 M-1 s-1 | koff (×104 s-1 ) | KD (nM) |
| 28G11_hIgG1 | 0.84 | 1.58 | 0.19 |
| 22F9_hIgG1 | 1.21 | 4.44 | 0.37 |
| 20E6_hIgG1 | 1.39 | 5.01 | 0.36 |
| 人類LAP-TGFβ1 | |||
| 28G11_hIgG1 | 0.54 | 3.60 | 0.67 |
| 22F9_hIgG1 | 1.01 | 7.68 | 0.76 |
| 20E6_hIgG1 | 1.04 | 6.06 | 0.58 |
實例 2 : 抗 LAP 抗體與 LAP-TGFβ 同功異型物及 LAP-TGFβ 變異體之結合
此實例描述抗LAP抗體與LAP-TGFβ同功異型物及LAP-TGFβ變異體之結合。除抗體28G11_hIgG1、22F9_hIgG1及20E6_hIgG1以外,在此實驗中亦測試抗LAP抗體17G8_hIgG1、24E3_hIgG1及2C9_(hyb)。簡言之,在96孔板中培養4×105
個以下細胞中之每一者:(a)HT1080細胞,(b)過表現人類LAP-TGFβ1之HT1080細胞,(c)過表現人類LAP-TGFβ2之HT1080細胞,(d)過表現人類LAP-TGFβ3之HT1080細胞,(e)過表現鼠類LAP-TGFβ1之HT1080細胞,(f)P3U1細胞,(g)過表現LAP-TGFβ1及GARP之P3U1細胞,及(h)過表現LAP-TGFβ1及LRRC33之P3U1細胞。盤在1,500 rpm下離心5分鐘,移除液體,且用200 μL FACS緩衝液使細胞再懸浮。再離心盤,將經稀釋之初級抗體添加至各孔中且在冰上培育盤20分鐘,接著進行離心。使細胞再懸浮於200 μL FACS緩衝液中,再次離心且再懸浮於50 μL經稀釋之二級抗體(Alexa647-抗人類IgG或APC-抗小鼠IgG)中。盤在黑暗中,在冰上培育20分鐘,用200 μL FACS緩衝液洗滌兩次且用Attune NXT儀器讀段來自各孔之細胞(於200 μL FACS緩衝液中)。
如圖 1A-1F
中所示,所有所測試之抗體結合於過表現人類LAP-TGFβ1之HT1080細胞株,但不結合於對照性HT1080細胞或過表現人類LAP-TGFβ2或LAP-TGFβ3之細胞。所有所測試之抗體結合於P3U1-hTGFβ1細胞,且結合在共表現人類GARP或LRRC33時增強。抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1結合於過表現小鼠LAP-TGFβ1之HT1080細胞,但2C9_(hyb)不結合於該等細胞。此等結果指示抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1特異性結合於TGFβ之LAP-TGFβ1同功異型物。
測試抗LAP抗體結合以下之能力:防止由整合素進行之TGFβ1活化(「封閉」構形)或促進釋放(「開放」構形)之TGFβ1變異體、含有來自雞TGFβ1之嵌合TGFβ1序列及僅含有LAP之TGFβ1變異體(亦即,不含有成熟細胞介素之人類TGFβ1變異體)。
簡言之,在96孔板中培養4×105
個以下細胞中之每一者:(a)HT1080細胞,(b)過表現人類LAP-TGFβ1之HT1080細胞,(c)過表現具有K27C及Y75C突變之LAP-TGFβ1之HT1080細胞,(d)過表現具有Y74T突變之LAP-TGFβ1之HT1080細胞,(e)過表現嵌合LAP-TGFβ1之HT1080細胞,其中人類LAP-TGFβ1之外顯子2.3 (殘基131-164)已由來自雞LAP-TGFβ1 (UniProt寄存編號#H9CX01)之相應殘基置換,(f)過表現嵌合LAP-TGFβ1之HT1080細胞,其中人類LAP-TGFβ1之外顯子4 (殘基183-208)已由來自雞LAP-TGFβ1之外顯子4置換,(g)過表現嵌合LAP-TGFβ1之HT1080細胞,其中人類LAP-TGFβ1之外顯子2.2 (殘基108-130)已由來自雞LAP-TGFβ1之外顯子2.2置換,及(h)過表現僅含有LAP之變異體之HT1080細胞(亦即,「空LAP」)。以上文關於異構體特異性結合實驗所描述相同之方式處理細胞以用於流式細胞測量術。
如圖 2A-2F
中所示,儘管所測試之抗LAP抗體皆不結合於未經轉導之HT1080細胞,但所有所測試之抗體結合於過表現野生型人類LAP-TGFβ1之HT1080細胞。抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1結合於K27C/Y75C (「封閉」)LAP-TGFβ1變異體,但不結合於Y74T (「開放」)LAP-TGFβ1變異體。相比之下,抗體2C9_(hyb)結合於K27C/Y75C及Y74T LAP-TGFβ1變異體。抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1而非2C9_(hyb)結合於含有雞外顯子#2.3及#4之嵌合LAP-TGFβ1。此外,如圖 3A-3F
中所示,儘管所有所測試之抗體結合於過表現野生型人類LAP-TGFβ1之HT1080細胞,但抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1不結合於僅含有LAP之變異體或含有雞外顯子#2.2之嵌合LAP-TGFβ1。
為測定抗LAP抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1是否結合於自由人類TGFβ1 (亦即,不具有LAP之成熟TGFβ1),評估抗體抑制抗TGFβ ELISA之能力。簡言之,成熟TGFβ1 (1000 pg)與10 μg/mL之所指示之抗LAP抗體、作為陰性對照物之同型對照抗體或作為陽性對照物之可商購的抗TGFβ抗體1D11一起在冰上培育10分鐘。舉例而言,1D11抗體可自多個銷售商購得,例如Bio x Cell Inc. (West Lebanon, NH)。根據製造商說明在TGFβ1 ELISA(R&D Systems)中分析上清液以量測自由TGFβ1。如圖 4
中所示,抗TGFβ抗體1D11結合於成熟TGFβ且抑制ELISA,但在28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1之情況下未發現抑制作用。此等資料表明28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1抗體不結合於不具有LAP之成熟TGFβ1。應注意,圖式及圖在本申請案中可互換地使用。
總而言之,此等結果表明抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1共有相關抗原決定基。所有所測試之抗LAP抗體皆結合於過表現野生型人類LAP-TGFβ1之HT1080細胞(HT1080-hβ1),但不結合於未經轉導之HT1080細胞。抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1不結合於僅含有LAP之構築體或含有雞外顯子#2.2之嵌合體。抗體2C9_(hyb)結合於僅含有LAP之構築體,但不結合於外顯子#2.2嵌合體。此資料之彙編表明抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1僅結合於含有成熟細胞介素之LAP,且此由圖 4
中展示之結果支持。然而,具有雞外顯子#6及#7之嵌合體(其涵蓋成熟細胞介素)由28G11_hIgG1結合(資料未展示),最初表明28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1不直接結合成熟細胞介素,而實際上對由存在或不存在成熟細胞介素誘導之LAP區域中之構形變化具有敏感性。相比之下,2C9結合於LAP之所有變異體,包括「開放」及「封閉」構形變異體,以及在存在或不存在成熟細胞介素之情況下之LAP。
使用流式細胞測量術,藉由評估細胞表面嵌合人類/雞LAP-TGFβ1分子之結合來定位28G11之結合抗原決定基。使用此等結合資料測定抗原決定基係基於以下假設:
1. 抗LAP抗體不結合於雞LAP-TGFβ序列。
2. 在細胞表面上適當地表現及呈現人類/雞嵌合體。
3. 若抗LAP抗體結合於嵌合體,則該外顯子中之殘基皆不為抗原決定基之一部分。
4. 若抗LAP抗體不結合於嵌合體,則該外顯子中之至少一個殘基為抗原決定基之一部分,或該外顯子中存在雞序列會引起LAP-TGFβ之另一部分中之破壞抗原決定基之構形變化。
藉由用同源雞LAP-TGFβ1序列置換人類LAP-TGFβ1中之個別外顯子來製備嵌合LAP-TGFβ1分子(表 4
)。人類及雞LAP-TGFβ1共有約50%序列一致性。所測試之LAP-TGFβ1序列之胺基酸序列展示於表 34
中。表 4
. 用於抗原決定基定位之LAP-TGFβ1序列
| SEQ ID | 名稱 | 說明 |
| 1 | 人類LAP-TGFβ1 (huB1) | 野生型人類LAP-TGFβ1序列 |
| 198 | 雞LAP-TGFβ1 (chB1) | 野生型雞LAP-TGFβ1序列 |
| 199 | 嵌合體#1 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子1 (殘基1-89)已由來自雞LAP-TGFβ1之外顯子1置換 |
| 200 | 嵌合體#1.2 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子1.2 (殘基30-50)已由來自雞LAP-TGFβ1之外顯子1.2置換。 |
| 201 | 嵌合體#1.3 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子1.3 (殘基51-81)已由來自雞LAP-TGFβ1之外顯子1.3置換 |
| 202 | 嵌合體#2 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子2 (殘基90-143)已由來自雞LAP-TGFβ1之外顯子2置換 |
| 203 | 嵌合體#2.1 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子2.1 (殘基82-107)已由來自雞LAP-TGFβ1之外顯子2.1置換 |
| 204 | 嵌合體#2.2 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子2.2 (殘基108-130)已由來自雞LAP-TGFβ1之外顯子2.2置換 |
| 205 | 嵌合體#2.3 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子2.3 (殘基131-164)已由來自雞LAP-TGFβ1之相應殘基置換 |
| 206 | 嵌合體#3 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子3 (殘基144-182)已由來自雞LAP-TGFβ1之相應殘基置換 |
| 207 | 嵌合體#4 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子4 (殘基183-208)已由來自雞LAP-TGFβ1之外顯子4置換 |
| 208 | 嵌合體#5 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子5 (殘基209-257)已由來自雞LAP-TGFβ1之相應殘基置換 |
| 209 | 嵌合體#6 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子6 (殘基258-309)已由來自雞LAP-TGFβ1之相應殘基置換 |
| 210 | 嵌合體#7 | 嵌合LAP-TGFβ1,其中人類LAP-TGFβ1之外顯子7 (殘基310-361)已由來自雞LAP-TGFβ1之相應殘基置換 |
將此等構築體次選殖至慢病毒中且轉導至HT1080細胞中。藉由綠色螢光蛋白(GFP)報導基因之表現來確認成功基因整合。使用針對來自成熟細胞介素(殘基250-361)結構域之肽(Abcam目錄號ab179695)產生之兔單株抗體(Rmab),即28G11_(hyb)及2C9_(hyb),藉由流式細胞測量術評估LAP-TGFβ1表現。簡言之,在96孔板中培養4×105
個以下細胞中之每一者:(a)HT1080細胞,(b)過表現人類LAP-TGFβ1之HT1080細胞,(c)過表現雞LAP-TGFβ1之HT1080細胞,及(d)過表現人類/雞嵌合體#1-#7之HT1080細胞。盤在1,500 rpm下離心5分鐘,移除液體,且用200 μL FACS緩衝液使細胞再懸浮。再離心盤,將經稀釋之初級抗體添加至各孔中且在冰上培育盤20分鐘,接著進行離心。使細胞再懸浮於200 μL FACS緩衝液中,再次離心且再懸浮於50 μL經稀釋之二級抗體(APC-抗小鼠IgG)中。盤在黑暗中,在冰上培育20分鐘,用200 μL FACS緩衝液洗滌兩次且用Attune NXT儀器讀段來自各孔之細胞(於200 μL FACS緩衝液中)。若>10%的細胞為GFP+/APC+且GFP與別藻藍蛋白(APC)信號之間存在明顯相關性,則抗體視為結合(表 5
)。表 5.
藉由流式細胞測量術分析之GFP+/APC+細胞百分比
| HT1080 變異體 | Rmab | 28G11 (hyb) | 2C9 (hyb) |
| 空 | 0.7% | 0.0% | 0.0% |
| huB1 | 68.9% | 98.3% | 72.4% |
| chB1 | 0.5% | 0.3% | 1.1% |
| 嵌合體#1 | 7.5% | 0.2% | 7.6% |
| 嵌合體#1.2 | 78.3% | 84.1% | 81.8% |
| 嵌合體#1.3 | 65.2% | 83.0% | 82.6% |
| 嵌合體#2 | 1.5% | 0.2% | 4.1% |
| 嵌合體#2.1 | 79.1% | 3.5% | 5.6% |
| 嵌合體#2.2 | 47.2% | 0.5% | 0.2% |
| 嵌合體#2.3 | ND | 94.7% | 0.3% |
| 嵌合體#3 | 46.3% | 32.2% | 34.0% |
| 嵌合體#4 | 56.2% | 76.2% | 2.8% |
| 嵌合體#5 | 11.9% | 41.7% | 4.0% |
| 嵌合體#6 | 76.7% | 84.9% | 87.6% |
| 嵌合體#7 | 0.6% | 44.4% | 63.9% |
所有三種抗體皆結合於過表現人類LAP-TGFβ1之陽性對照性HT1080細胞株。在陰性對照菌株(HT1080-空)下未觀測到結合。抗體皆不結合雞LAP-TGFβ1,表明人類與雞同源物之間的序列差異足以破壞由此等抗體識別之抗原決定基。嵌合體#1及#2未被任何抗體識別,表明此等構築體未有效表現。為測試此假設,將較小部分之雞序列插入人類序列中之外顯子#1或#2 (嵌合體#1.2、1.3、2.1、2.2及2.3)中。具有此等較小置換之構築體由Rmab抗體識別,表明其在HT1080細胞中穩定表現。嵌合體#7未由Rmab抗體結合,但由28G11_(hyb)及2C9_(hyb)識別,表明此構築體在細胞表面上表現,且Rmab之抗原決定基可能位於蛋白質之此區域中。
28G11_(hyb)抗體結合於嵌合體#1.2、1.3、2.3、3、4、5、6及7,表明此等區域與此抗體之抗原決定基無關。相比之下,嵌合體#2.1及#2.2未由28G11(hyb)結合,表明此抗體在序列VLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAE (SEQ ID NO:215)內結合於人類LAP-TGFβ1。
嵌合體#2.1、2.2、2.3、4及5中之雞殘基破壞2C9_(hyb)結合。此表明此抗體結合於非連續抗原決定基,該抗原決定基合併有此等插入物中之每一者之位於序列之遠端,但與抗原之三維結構相鄰之部分。
實例 3. 產生結合於 LAP-TGFβ1 上之相關特異性抗原決定基之抗體
如實例2中所描述,具有人類及雞序列之組合之構築體能夠摺疊成正確結構。因此,可產生其他嵌合體,其可用作免疫原以靶向LAP-TGFβ1上之相關特異性抗原決定基。此等構築體將為實例2中所描述之構築體之反轉型。亦即,將自雞LAP-TGFβ1獲得大部分序列,及插入於含有所需抗原決定基之區域中之人類LAP-TGFβ1之小型區段。可使用此策略靶向之LAP-TGFβ1上之例示性抗原決定基包括例如包含人類LAP-TGFβ1之胺基酸82-130之抗原決定基、LAP-TGFβ1之下臂或LAP-TGFβ1之潛在環。此嵌合蛋白可用於使雞免疫以得到單株抗體。因為雞LAP-TGFβ1將被識別為自體性,因此免疫反應將集中於人類序列。可用於使雞免疫之例示性雞-人類嵌合體展示於表 6
中。此等嵌合體之序列提供於表 34
中。可使用本文中所描述之方法測試以此方式產生之抗LAP抗體之各種功能(例如與人類LAP-TGFβ1之結合、TGFβ1活化之抑制、與免疫細胞之結合)。表 6
. 用於免疫接種之雞-人類嵌合體
| SEQ ID | 名稱 | 說明 |
| 211 | chB1ex2.1_2.2 | 嵌合LAP-TGFβ1,其中雞LAP-TGFβ1之外顯子2.1及2.2 (殘基83-128)已由來自人類LAP-TGFβ1之外顯子2.1及2.2置換。此嵌合體可用於產生靶向人類LAP-TGFβ1之胺基酸殘基82-130之抗體。 |
| 212 | chB1ex1.3 | 嵌合LAP-TGFβ1,其中雞LAP-TGFβ1之外顯子1.3 (殘基50-82)已由來自人類LAP-TGFβ1之外顯子1.3置換。此嵌合體可用於產生靶向人類LAP-TGFβ1之胺基酸殘基50-81之抗體 |
| 213 | chB1_ex1.2 | 嵌合LAP-TGFβ1,其中雞LAP-TGFβ1之外顯子1.2 (殘基30-50)已由來自人類LAP-TGFβ1之外顯子1.2置換。此嵌合體可用於產生靶向人類LAP-TGFβ1之胺基酸殘基30-50之抗體 |
實例 4 : 抗 LAP 抗體對 TGFβ1 活化之作用
此實例描述抗LAP抗體28G11_hIgG1、28G11_mIgG2a、17G8_hIgG1、24E3_hIgG1、22F9_hIgG1、22F9_mIgG2a、20E6_hIgG1及20E6_mIgG2a抗體對TGFβ1活化之作用。
簡言之,表現人類LAP-TGFβ1之P3U1細胞或表現鼠類LAP-TGFβ1之P3U1細胞在圓底組織培養盤中,在不含血清之高級DMEM中培養隔夜,且第二天用抗LAP抗體(以20 μg/ml之高濃度起始之2倍連續稀釋物)處理24小時。藉由利用可商購的人類TGFβ1 ELISA套組(R&D Systems),根據製造商說明在細胞培養之上清液中偵測活性TGFβ1。
圖 5A
及5B
展示28G11_hIgG1抑制表現人類LAP-TGFβ1 (IC50=1.4 μg/ml)及鼠類LAP-TGFβ (IC50=1 μg/ml)之P3U1細胞中之TGFβ1活化。
與圖 5
中使用28G11之實驗相同,所測試之抗體抑制表現人類LAP-TGFβ1之P3U1細胞中之TGFβ1活化。資料展示於以下圖式中;IC50值係如關於抗體17G8 (圖 6A
為人類TGFβ1 (IC50=1.5 μg/ml)且6B
為小鼠TGFβ1 (IC50=0.59 μg/ml))、抗體24E3 (圖 6C
為人類TGFβ1 (IC50=2.6 μg/ml)且6D
為小鼠TGFβ1 (IC50=0.76 μg/ml))、抗體22F9 (圖 6E
為人類TGFβ1 (IC50=1.8 μg/ml))及抗體20E6 (圖 6F
為人類TGFβ1 (IC50=1.08 μg/ml))所展示。
進行其他實驗以進一步證實抗體抑制表現人類LAP-TGFβ1之P3U1細胞或表現鼠類LAP-TGFβ1之P3U1細胞中之活化。資料展示於以下圖式中;IC50值係如以下所示:抗體28G11_mIgG2a (圖 6G
:IC50=1.6 μg/ml (人類TGFβ1)及0.8 μg/ml (小鼠TGFβ1))、抗體20E6_mIgG2a (圖 6H
:IC50=1.4 μg/ml (人類TGFβ1)及1.0 μg/ml (小鼠TGFβ1))、抗體22F9_mIgG2a (圖 6I
:IC50=1.8 μg/ml (人類TGFβ1)及1.0 μg/ml (小鼠TGFβ1))、抗體24E3_hIgG1 (圖 6J
:IC50=2.5 μg/ml (人類TGFβ1)及1.1 μg/ml (小鼠TGFβ1))、抗體17G8_hIgG1 (圖 6K
:IC50=1.0 μg/ml (人類TGFβ1)及1.4 μg/ml (小鼠TGFβ1))、抗體20E6_H0.2aL1 (圖 6L
:IC50=1.3 μg/ml (人類TGFβ1)及1.7 μg/ml (小鼠TGFβ1))。
與以上結果一致,在使用基於P3U1細胞之分析法之單獨實驗中,28G11_hIgG1、22F9_hIgG1及20E6_hIgG1有效抑制人類TGFβ1活化(表 7
)。 表 7
.
| 人類TGFβ1 活化之抑制(IC50 ) | ||
| 28G11_hIgG1 | 22F9_hIgG1 | 20E6_hIgG1 |
| 2.3 µg/mL | 3.9 µg/mL | 4.7 µg/mL |
因此,此實例中描述之多個實驗證實本文中所描述之抗LAP抗體對TGFβ1活化具有抑制作用。
實例 5 : 抗 LAP 抗體與細胞外基質之結合
此實例描述28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、2C9_mIgG2a、16B4_mIgG2a、17G8_hIgG1及24E3_hIgG1抗體結合ECM中之LAP-TGFβ1之能力。
簡言之,為評估結合於ECM之抗體,P3U1細胞在圓底組織培養盤中培育48小時。接著移除細胞,在盤表面上留下ECM。比較三個不同的組:(a)表現人類LAP-TGFβ1之P3U1細胞,(b)表現鼠類LAP-TGFβ1之P3U1細胞,及(c)不具有LAP-TGFβ1之P3U1細胞(空細胞)。接著,在與抗生蛋白鏈菌素辣根過氧化酶(HRP)及3',5,5'-四甲基聯苯胺(TMB)受質一起培育之後,使用經生物素標記之抗LAP抗體測定抗體與LAP-TGFβ1/ECM之結合。
如圖 7
中所示,28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1抗體不結合於LAP-TGFβ1/ECM。相比之下,抗LAP抗體16B4展示與LAP-TGFβ1/ECM中之鼠類LAP-TGFβ1之強結合,且抗LAP抗體2C9展示與LAP-TGFβ1/ECM中之人類LAP-TGFβ1之強結合。此結果表明,儘管28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1及24E3_hIgG1強結合於表現鼠類或人類LAP-TGFβ1之細胞,但其不結合於ECM中之鼠類或人類LAP-TGFβ1。
實例 6 :抗 LAP 抗體與血小板之結合
此實例描述抗LAP抗體與血小板之結合及其對血小板去顆粒之作用。
簡言之,藉由流式細胞測量術進行直接血小板結合分析法。經稀釋之完全人類血液與所指示之濃度之直接結合型抗LAP抗體(28G11_(hyb)、20E6_mIgG2a、22F9_mIgG2a、17G8_hIgG1及24E3_hIgG1)一起培育15分鐘。接著,反應物再與可商購之針對CD61之直接結合型抗體(BioLegend)一起培育15分鐘,且藉由流式細胞測量術進行分析。資料表示CD61陽性血小板之抗LAP平均螢光強度。如圖 8
中所示,抗LAP抗體28G11、20E6、22F9、17G8及24E3以劑量-反應方式展示與血小板之結合。
針對血小板去顆粒進一步測試此等抗LAP抗體。簡言之,經稀釋之完全人類血液與所指示之濃度之抗LAP抗體或作為陽性對照物之二磷酸腺苷(ADP)一起培育15分鐘。接著,反應物再與針對CD61 (用於偵測全血血小板)及CD62P (用於偵測去顆粒之血小板)之直接結合型抗體(BioLegend)一起培育15分鐘。藉由流式細胞測量術分析樣本以測定CD62P+血小板之百分比。
如圖 9A-9E
中所示,所測試之抗體,亦即,28G11、20E6、22F9、17G8及24E3,即使在最高測試劑量下亦皆不誘導顯著血小板去顆粒。
實例 7 : 抗 LAP 抗體與免疫細胞之差異結合
此實例描述抗LAP抗體與不同類型的免疫細胞之結合。
測試抗LAP抗體結合於THP-1細胞(來源於急性單核球性白血病患者之細胞株,報導其表現LRRC33)之能力。THP-1細胞與FACS緩衝液及人類Fc嵌段一起培育,接著與不同濃度之Alexa 647結合之28G11_(hyb)、22F9_mIgG2a、20E6_mIgG2a、17G8_hIgG1、24E3_hIgG1、2C9_mIgG2a或mIgG2a同型對照物一起培育。藉由流式細胞測量術分析細胞且以陽性THP-1細胞百分比或抗LAP結合之中值螢光強度(MFI)作圖。如圖10A
及10B
中所示,抗體22F9、17G8、24E3、20E6及2C9顯示與THP-1細胞之強結合。未發現抗LAP抗體28G11之高於背景之結合。在另一個實驗中,使用上文所描述之方法比較20E6 mIgG2a及7H4 hyb與THP-1細胞之結合。如圖 10C
中所示且與圖 10A
及10B
一致,20E6展示與THP-1細胞之強結合,而7H4未展示結合。在單獨的實驗中,THP-1細胞與FACS緩衝液及人類Fc嵌段一起培育,接著與5 μg/ml之Alexa 647結合之28G11_hyb、22F9_mIgG2a、20E6_mIgG2a、2C9_mIgG2a或IgG2a同型對照物一起培育。藉由流式細胞測量術分析細胞且以單個細胞形式圈選。代表性點狀圖展示於圖 10D
中;在此等圖中,抗體為5 μg/ml。
測試抗LAP抗體結合於U937細胞(來源於組織細胞淋巴瘤患者之骨髓細胞株)之能力。U937細胞與FACS緩衝液及人類Fc嵌段一起培育,接著與不同濃度之Alexa 647結合之28G11_hyb、22F9_mIgG2a或20E6_mIgG2a一起培育。在單獨的實驗中,U937細胞與FACS緩衝液及人類Fc嵌段一起培育,接著與10 μg/ml之Alexa 647結合之28G11_hyb、22F9_mIgG2a、20E6_mIgG2a或mIgG2a同型對照物一起培育(圖 10E
及10F
)。代表性點狀圖展示於圖 10G
中;在此等圖中,抗體為10 μg/ml。藉由MFI及結合之劑量反應,證實抗LAP抗體28G11、22F9及20E6類似地結合於U937細胞。
此等資料說明抗LAP抗體28G11、22F9及20E6顯示與一種LAP+骨髓細胞株之類似結合,但與另一種LAP+骨髓細胞株之結合於顯著不同。進行以下實驗以測定是否可在未經轉型之細胞群體中觀測到相同的差異結合。
測試抗LAP抗體結合於自攜帶CT26腫瘤之小鼠分離之免疫細胞之能力。簡言之,將1×106
個CT26細胞注射至6隻雄性Balb/C小鼠之側腹區域中。當平均腫瘤體積達到約80 mm3
時,小鼠用10 mg/kg之IgG2a或IgG1同型對照抗體處理(此為實驗之最初部分,其中用治療性抗體處理小鼠且此等動物意欲充當對照物)。在3天後再次處理小鼠且在第一次注射後第7天進行收集。腫瘤組織在GentlMACS解離劑中解離且用膠原蛋白酶IV/DNase1消化,經由70 µm細胞過濾器過濾且進行計數。藉由穿過70 µm細胞過濾器來解離脾組織且進行計數。使用以下流程藉由流式細胞測量術分析細胞:活細胞上之圈選→單細胞上之圈選→CD45+細胞上之圈選→CD41群體上之圈選→適合的免疫細胞子集上之圈選如下:
● CD4 T細胞 - CD45+、CD3+、CD4+
● 調節性T細胞 - CD45+、CD3+、CD4+、Foxp3+
● CD8 T細胞 - CD45+、CD3+、CD8+
● CD11b - CD45+、CD11b+
● M2巨噬細胞 - CD45+、CD11b+、F4/80+、CD206+
● 樹突狀細胞 - CD45+、F4/80-、CD11c+
● M-MDSC - CD45+、CD11b+、F4/80-、Ly6G-、Ly6C high
● G-MDSC - CD45+、CD11b+、F4/80-、Ly6G+
● M1巨噬細胞 - CD45+、CD11b+、F4/80+、MHC II high、CD206-
● NK細胞 - CD45+、CD49b+
使用Alexa 647標記之28G11-IgG2a、22F9-IgG2a及20E6-IgG2a分析抗LAP抗體之結合。資料之概述展示於表 8
及圖 11
中。三種抗LAP抗體28G11、22F9及20E6對腫瘤組織中之臨床相關免疫細胞子集顯示顯著不同的結合概況。最值得注意的是,與28G11相比,22F9及20E6結合於更高百分比之調節性T細胞、M2巨噬細胞及M-MDSC。此等資料表明,儘管此等三種抗體在其結合及功能特性方面皆具有類似性(參見實例1、2及4-6),但抗體在其與已知在免疫抑制性腫瘤微環境中重要的細胞群體之結合方面顯示明顯差異。舉例而言,與28G11相比,22F9及20E6結合更高百分比之調節性T細胞、M2巨噬細胞及M-MDSC。此支持在調節腫瘤中之此等重要的免疫抑制性細胞群體方面,22F9及20E6相比於28G11之優越性。此外,22F9及20E6之結合差異支持取決於浸潤白細胞群體之組成,在既定腫瘤中可能優先使用一種或另一種抗體。表 8
. 與腫瘤中之免疫細胞之結合(表示為6隻個別小鼠之陽性百分比±SEM)
| 免疫細胞類型 | 28G11 | 22F9 | 20E6 |
| CD4 | 5.1 ± 1.0 | 44.2 ± 2.0 | 66.8 ± 2.4 |
| 調節性T細胞 | 24.8 ± 3.0 | 46.7 ± 2.2 | 75.8 ± 3.9 |
| CD8 | 0.5 ± 0.1 | 29.8 ± 7.4 | 3.4 ± 0.9 |
| CD11b | 16.8 ± 2.3 | 70.2 ± 3.2 | 50.7 ± 5.6 |
| M2巨噬細胞 | 8.0 ± 1.4 | 92.5 ± 0.5 | 47.2 ± 4.5 |
| 樹突狀細胞 | 7.8 ± 1.3 | 50.4 ± 4.0 | 27.6 ± 4.5 |
| M-MDSC | 6.9 ± 0.8 | 64.0 ± 3.2 | 30.3 ± 4.9 |
| G-MDSC | 2.4 ± 0.6 | 21.9 ± 2.1 | 7.0 ± 1.9 |
藉由流式細胞測量術與腫瘤組織同時分析來自相同小鼠之脾細胞。如表 9
中所示,與來自此等相同小鼠之腫瘤之免疫細胞相比,抗體28G11、22F9及20E6結合較低百分比之腫瘤攜帶小鼠之脾中之免疫細胞(表 8
)。此等資料說明所有三種抗體之腫瘤選擇性。觀測到抗體之間的一些差異,其中22F9呈現脾中之最強結合。此支持20E6在偏好腫瘤環境之最大選擇性之情形中之優越性。表 9
. 與脾中之免疫細胞之結合(表示為6隻個別小鼠之陽性百分比±SEM)
| 免疫細胞類型 | 28G11 | 22F9 | 20E6 |
| CD4 | 1.6 ± 0.05 | 2.9 ± 0.06 | 1.7 ± 0.06 |
| 調節性T細胞 | 4.0 ± 0.4 | 6.1 ± 0.5 | 3.6 ± 0.3 |
| CD8 | 0.9 ± 0.02 | 1.9 ± 0.1 | 0.9 ± 0.05 |
| CD11b | 4.0 ± 0.5 | 17.2 ± 1.1 | 4.2 ± 0.2 |
| M2巨噬細胞 | 1.8 ± 0.6 | 11.3 ± 1.7 | 2.6 ± 0.5 |
| 樹突狀細胞 | 4.9 ± 0.5 | 21.5 ± 1.1 | 6.3 ± 0.5 |
| M-MDSC | 8.2 ± 0.6 | 21.7 ± 2.2 | 4.9 ± 0.3 |
| G-MDSC | 1.6 ± 0.4 | 8.0 ± 0.4 | 2.1 ± 0.2 |
| M1巨噬細胞 | 1.0 ± 0.3 | 11.7 ± 1.3 | 1.7 ± 0.4 |
| NK細胞 | 3.0 ± 0.2 | 13.4 ± 1.2 | 4.5 ± 0.2 |
亦檢驗抗體28G11、22F9、20E6、17G8、24E3及2F8結合於人類巨噬細胞子集之能力。簡言之,自StemExpress獲得CD14+細胞,其中其係經由磁性陰性選擇自供體之全血分離。細胞在具有以下添加物之Immunocult巨噬細胞培養基(StemCell tech) + M-CSF (50 ng/ml)中培養6天以使細胞轉變成特異性巨噬細胞亞型(M1巨噬細胞:50 ng/ml之h-IFN-γ + 10 ng/ml之LPS;M2a巨噬細胞:10 ng/ml之h-IL4;M2b巨噬細胞:固定IgG + 100 ng/ml之LPS;M2c巨噬細胞:10 ng/ml之IL10 + 20 ng/ml之TGFβ)。細胞用CD14及Alexa 647標記之抗LAP抗體28G11_mIgG2a、22F9_mIgG2a、20E6_mIgG2a、17G8_hIgG1、24E3_hIgG1、2F8_(hyb)、mIgG2a同型對照物或hIgG1同型對照物染色。在分析之前,細胞圈選為活的單個細胞。
如表 10
中所示,抗LAP抗體對經分離之人類巨噬細胞子集顯示顯著不同的結合模式。值得注意的是,與28G11或20E6相比,22F9結合顯著更高的百分比之所有巨噬細胞亞群。與28G11相比,20E6結合更高百分比之M1巨噬細胞。表 10.
與來自健康供體之免疫細胞之結合(表示為陽性百分比)
| 免疫細胞類型 | 28G11 | 22F9 | 20E6 | 17G8 | 24E3 | 2F8 | 同型對照物 |
| 巨噬細胞 | 55.8% | 85.0% | 51.8% | 24.8% | 50.8% | 40.0% | 1.04% |
| M1巨噬細胞 | 15.2% | 86.4% | 46.1% | 52.2% | 50.1% | 0.91% | 2.34% |
| M2a巨噬細胞 | 55.6% | 85.0% | 51.5% | 20.6% | 34.3% | 29.1% | 3.53% |
| M2b巨噬細胞 | 24.5% | 90.8% | 20.4% | 50.7% | 66.7% | 26.9% | 2.14% |
| M2c巨噬細胞 | 29.1% | 99.1% | 28.2% | 72.8% | 84.5% | 5.1% | 1.26% |
在單獨的實驗中,亦評估抗LAP抗體與經活化之人類CD4+ T細胞群體之結合。根據製造商(StemCell Tech)提供之說明,使用磁性陰性選擇自PBMC分離CD4+細胞。細胞使用1:1比率之Dynabeads (Thermo):細胞活化且在高級RPMI + 10% FBS + 30 U/ml之人類IL2中培養48小時。細胞用活/死染料染色,接著針對LAP表現用CD4、CD25及28G11-IgG2a、22F9-IgG2a、20E6-gG2a、17G8-hIgG1、24E3-hIgG1、2F8_(hyb)、IgG1同型對照物或IgG2a同型對照物染色。根據製造商建議(Ebiosciences)固定及滲透細胞以用於Foxp3染色,且針對Foxp3進行染色。在分析之前,細胞圈選為活的單個細胞CD4+及CD25+。與其他所測試之抗LAP抗體相比,發現22F9結合更高百分比之經活化之CD4+細胞。
與特異性細胞群體之結合性提高,預期係與直接臨床益處相關聯。本文所描述之抗體抑制TGFβ活化及成熟細胞介素之釋放。因為TGFβ以自分泌或近旁分泌方式產生作用,與特異性細胞群體選擇性結合將會在緊鄰所指示之細胞群體之位置處抑制產生成熟TGFβ。因此,舉例而言,當預期抗LAP抗體20E6與調節性T細胞之結合性比抗體28G11提高時,將會在彼等相同調節性T細胞之表面處造成選擇性降低之TGFβ含量。鑒於TGFβ為產生調節性T細胞之主要驅動因素,預期此會在腫瘤微環境中造成調節性T細胞之數目降低,及20E6比28G11提高之臨床功效。在第二實例中,當預期抗LAP抗體22F9與巨噬細胞子集之結合性比抗體28G11提高時,將會在彼等相同巨噬細胞之表面處造成選擇性降低之TGFβ含量。鑒於TGFβ為效應T細胞功能依賴細胞接觸來抑制巨噬細胞之主要機制,預期此會在腫瘤微環境中造成巨噬細胞所介導之抑制性降低及提高效應T細胞功能,及20E6比28G11提高之臨床功效。
在一些實施例中,抗LAP抗體為具有活性效應功能之同型,且加強特異性抗LAP抗體與特定細胞群體之結合性將會造成被ADCC或CDC消耗之細胞群體增加。因此,舉例而言,當預期抗LAP抗體20E6與調節性T細胞之結合性比抗體28G11提高時,將會在腫瘤微環境中造成ADCC或CDC所介導消耗之彼等調節性T細胞增加,及20E6比28G11提高之臨床功效。在第二實例中,當預期抗LAP抗體22F9與巨噬細胞子集之結合性比抗體28G11提高時,將會在腫瘤微環境中造成ADCC或CDC所介導消耗之彼等巨噬細胞子集增加,及22F9比28G11提高之臨床功效。
此實例中呈現之數據證實,可在鼠類及人類系統中以及初生細胞群體及經轉型之細胞株中證明本文所描述之抗LAP抗體以不同方式結合於免疫細胞亞群之發現結果。
實例 8 : 產生人類化抗 LAP 抗體
此實例描述抗LAP抗體28G11、22F9及20E6之人類化。
使用Modeller (使用多個結構模板以組裝結構模型之程式)構建28G11、22F9及26E10 (亦稱為20E6)可變區之模型。選擇PDB碼3dv6作為28G11重鏈(與28G11 VH結構域具有86%序列一致性)之模板,且選擇2zjs作為28G11輕鏈(與28G11 VL結構域具有97%序列一致性)之模板。選擇PDB碼1a6v作為22F9重鏈(與22F9 V區具有89%序列一致性)之模板,且選擇PDB碼2xqy作為22F9輕鏈(與22F9 V區具有94%一致性)之模板。選擇PDB碼1a6v作為26E10 (20E6)重鏈(與26E10 (20E6) V區具有93%序列一致性)之模板,且選擇PDB碼1jv5作為26E10 (20E6)輕鏈(與26E10 V區具有96%一致性)之模板。組裝可變域之結構模型且用Modeller優化。
為選擇輕鏈及重鏈之抗體受體架構序列,使用抗體序列資料庫及查詢工具鑑別在標準、界面及游標區殘基方面與鼠類28G11、22F9及26E10 (20E6)序列具有最高類似性之適合的模板;相同長度的CDR(若有可能)(除CDR-H3以外);及最小所需數目之回復突變(亦即,人類受體與成熟鼠類抗體相比之構架殘基類型之變化)。亦考慮填充有FR4構架區中之人類保守性殘基之人類生殖系序列。
基於以上分析,將28G11之CDR序列移植至IGHV3-72*01(H0)及IGKV1-27*01(L0)生殖系上。關於22F9之人類化,將22F9之CDR序列移植至IGHV1-46*01(H0)及IGKV1-39*01(L0)生殖系上。關於20E6之人類化,將20E6之CDR序列移植至人類IGHV1-2*05(H0)及IGKV1-33*01(L0)生殖系上。基於同源性模型之分析來引入對此等人類化抗體之重鏈及/或輕鏈中之小鼠序列之回復取代。亦引入取代(如以下實例中所論述)以移除潛在去醯胺化及異構化位點。測試此等候選物中之每一者之各種功能,包括與過表現LAP-TGFβ1之細胞之結合,如以下實例中所描述。
實例 9 : 人類化 28G11 候選物及責任位點移除之 28G11 變異體之表徵
在此實例中,檢驗各種人類化28G11候選物之特徵以鑑別保持親本抗體之功能(例如與TGFβ1之結合)之人類化抗體。亦檢驗移除去醯胺化/異構化位點之28G11變異體。表 11
概述此實例中使用之各種人類化28G11構築體(重鏈及輕鏈序列)。此等構築體之序列提供於表 34
中。表 11. 例示性 28G11 抗體及抗原結合片段
| SEQ ID | 名稱 | 說明 |
| 32 | 28G11_H0 | 人類化28G11重鏈序列,其中來自親本鼠類抗體之CDR1、CDR2及CDR3序列插入具有保守性構架4序列之人類IGHV3-72*01生殖系中 |
| 34 | 28G11_H1 | 人類化28G11_H0重鏈序列,其包括胺基取代S30T及V48L |
| 36 | 28G11_H2 | 人類化28G11_H0重鏈序列,其包括胺基取代S30T、V48L、D73N、K75Q、N76S及V109L |
| 39 | 28G11_H2.1 | 人類化28G11_H2重鏈序列,其包括胺基取代N56Q |
| 41 | 28G11_H2a | 人類化28G11_H0重鏈序列,其包括胺基取代S30T及D73N |
| 43 | 28G11_H2b | 人類化28G11_H0重鏈序列,其包括胺基取代S30T、N56Q及D73N |
| 45 | 28G11_H2b _hIgG4mut | 具有變異型人類IgG4恆定區之H2b重鏈;變異型人類IgG4恆定區具有SEQ ID NO:197之序列 |
| 217 | 28G11_L0 | 人類化28G11輕鏈序列,其中來自親本鼠類抗體之CDR1、CDR2及CDR3序列插入具有huIGKJ2構架4序列之人類IGKV1-27*01生殖系中 |
| 47 | 28G11_L1 | 人類化28G11_L0輕鏈序列,其包括胺基取代F71Y及Y87F |
| 49 | 28G11_L2 | 人類化28G11_L0輕鏈序列,其包括胺基取代V43T、P44V、F71Y及Y87F |
| 51 | 28G11_L3 | 人類化28G11_L0輕鏈序列,其包括胺基取代V19L、T22S、V43T、P44V、F71Y及Y87F |
| 53 | 28G11_L3a | 人類化28G11_L0輕鏈序列,其包括胺基取代V19L、T22S、P44V及F71Y |
在第一實驗中,在流式細胞測量術分析法中,藉由與生物素-28G11競爭來測試各種人類化28G11候選物與人類LAP-TGFβ1之結合之保持性。
將過表現人類GARP及LAP-TGFβ1之P3U1細胞以40,000個細胞/孔之密度置放於圓底96孔盤中。用FACS緩衝液(含25 mM HEPES、2 mM EDTA、2%胎牛血清之漢克氏平衡鹽溶液(Hank's Balanced Salt Solution))洗滌細胞。將50 µL以1:200稀釋之TruStain Mouse FcX (BioLegend)添加至各孔中,接著添加50 µL之100 ng/µL之人類化28G11構築體(H0L0、H0L1、H0L2、H0L3、H1L0、H1L1、H1L2、H1L3、H2L0、H2L1、H2L2、H2L3)。參見表34。使抗體結合10分鐘。向各孔中添加50 µL之6.2 ng/µL之經生物素標記之鼠類融合瘤28G11_(hyb)。使經生物素標記之抗體結合10分鐘,且接著用FACS緩衝液洗滌細胞兩次。細胞用鐵皮石斛-抗生蛋白鏈菌素(BioLegend)標記15分鐘,用FACS緩衝液洗滌兩次且藉由流式細胞測量術分析。
如圖 12
中所示,所有具有H0、H1或L0之構築體未能阻斷生物素-28G11與人類LAP-TGFβ1之結合,表明此等人類化構架未能使CDR環具有用於緊密LAP-TGFβ1結合之正確結構。28G11_H2L1、28G11_H2L2及28G11_H2L3與親本鼠類抗體競爭。此等構築體經生物素標記以確認特異性結合。
接著,測試人類化28G11變異體與過表現人類GARP及LAP-TGFβ1之P3U1細胞之直接結合。簡言之,如上文所描述塗佈、洗滌及FcX處理過表現人類GARP及LAP-TGFβ1之P3U1細胞。細胞與10 µg/mL之經生物素標記之28G11_H0L3、28G11_H2L0、28G11_H2L1、28G11_H2L2或28G11_H2L3一起在4℃下培育20分鐘。洗滌細胞,用APC-抗生蛋白鏈菌素染色,再次洗滌且如上文所描述藉由流式細胞測量術進行分析。與競爭實驗一致,28G11_H0L3及28G11_H2L0不結合,但28G11_H2L1、28G11_H2L2及28G11_H2L3展示與人類LAP-TGFβ1之強效結合(圖 13
)。
在基於ELISA之分析法中測試28G11_H2L1、28G11_H2L2及28G11_H2L3 (其在上文所描述之研究中所測試的人類化28G11變異體中展示最強效結合)抑制TGFβ1活化之能力。簡言之,表現人類TGFβ之P3U1細胞在圓底組織培養盤中,在不含血清之高級培養基中培養隔夜,且第二天用人類化28G11變異體(以20 μg/ml起始之2倍連續稀釋物)處理24小時。藉由利用可商購的人類TGFβ1 ELISA套組(R&D Systems),根據製造商說明在細胞培養之上清液中偵測活性TGFβ1。如圖 14A-14D
中所示,28G11_(hyb)、28G11_H2L1及28G11_H2L3但非28G11_H2L2抑制TGFβ1活化。
使用28G11_H2L3作為添加個別回復取代之基礎,以測定哪些回復突變位置可容許人類殘基。圖 15A
及15B
展示回復成人類殘基之逆轉之各種組合對與過表現人類LAP-TGFβ1之HT1080細胞之結合之作用。舉例而言,HC_N73D + LC_Y71F之組合消除結合,且HC_T30S + LC_V44P之組合具有降低之結合。LC_L19V構築體弱表現。由圖 15A
中之資料得出以下結論:重鏈上可容許L48V、Q75K、S76N及L109V取代(產生序列28G11_H2a)且輕鏈上可容許T43V及F87Y (產生序列28G11_L3a)。測試28G11_H2aL3a與過表現人類LAP-TGFβ1之HT1080細胞之結合。參見表12及表34。如圖 15B
中所示,此構築體以及含有親本鼠類28G11抗體之原始可變區結構域之小鼠-人類嵌合體結合。
在CDR2區中含有『NG』二肽之28G11_H2L3序列可經歷去醯胺化反應,以在天冬醯胺殘基之位置處產生天冬胺酸或異天冬胺酸。為防止此情況發生,將N56Q取代引入序列(28G11_H2.1L3)。與原始序列相比,此抗體略微更好地結合HT1080-huB1細胞(圖 15B
)。
實例 10 : 人類化 22F9 候選物及責任位點移除之 22F9 變異體之表徵
在此實例中,檢驗各種人類化22F9候選物之特徵以鑑別保持親本抗體之功能(例如與TGFβ1之結合)之人類化抗體。亦檢驗去醯胺化/異構化位點移除之22F9變異體。表 12
概述此實例中使用之各種22F9變異體。此等構築體之序列提供於表 34
中。表 12
.例示性 22F9 抗體及抗原結合片段
| SEQ ID | 名稱 | 說明 |
| 72 | 22F9_H0 | 人類化22F9重鏈序列,其中親本鼠類抗體之CDR1、CDR2及CDR3序列插入具有保守性構架4序列之IGHV1-46*01生殖系中 |
| 74 | 22F9_H0.1 | 人類化22F9_H0重鏈序列,其包括胺基取代S7P、K12V、V20L、R38K、A40R、N54Q、R66K、V67A、M69L、T73K、T75S、V78A及D102A |
| 76 | 22F9_H1 | 人類化22F9_H0重鏈序列,其包括胺基取代M48I、R71V及R94Y |
| 78 | 22F9_H1.1 | 人類化22F9_H0重鏈序列,其包括胺基取代S7P、K12V、V20L、R38K、A40R、M48I、N54Q、R66K、V67A、R71V、T73K、T75S、R94Y及D102A |
| 81 | 22F9_H2 | 人類化22F9_H0重鏈序列,其包括胺基取代M48I、M69L、R71V、V78A及R94Y |
| 83 | 22F9_H2.1 | 人類化22F9_H0重鏈序列,其包括胺基取代S7P、K12V、V20L、R38K、A40R、M48I、N54Q、R66K、V67A、M69L、R71V、T73K、V78A、R94Y及D102A |
| 86 | 22F9_H3 | 人類化22F9_H0重鏈序列,其包括胺基取代M48I、M69L、R71V、T73K、T75S、V78A及R94Y |
| 88 | 22F9_H3.1 | 人類化22F9_H0重鏈序列,其包括胺基取代S7P、K12V、V20L、M48I、N54Q、M69L、R71V、T73K、T75S、V78A、R94Y及D102A |
| 91 | 22F9_H4 | 人類化22F9_H0重鏈序列,其包括胺基取代R38K、A40R、M48I、R66K、V67A、M69L、R71V、T73K、T75S、V78A及R94Y |
| 93 | 22F9_H5 | 人類化22F9_H0重鏈序列,其包括胺基取代S7P、K12V、V20L、R38K、A40R、M48I、R66K、V67A、M69L、R71V、T73K、T75S、V78A及R94Y |
| 96 | 22F9_H5.2 | 人類化22F9_H0重鏈序列,其包括胺基取代S7P、K12V、V20L、R38K、A40R、M48I、N54Q、R66K、V67A、M69L、R71V、T73K、T75S、V78A、R94Y及D102A |
| 99 | 22F9_H7 | 人類化22F9_H0重鏈序列,其包括胺基取代S7P、K12V、V20L、M48I、N54Q、R71V、T73K、R94Y及D102A |
| 100 | 22F9_H7 _hIgG4mut | 具有變異型人類IgG4恆定區之22F9_H7重鏈;變異型人類IgG4恆定區具有SEQ ID NO:197之序列 |
| 102 | 22F9_H7a | 人類化22F9_H0重鏈序列,其包括胺基取代Q1E、S7P、K12V、V20L、M48I、N54Q、R71V、T73K、R94Y及D102A |
| 103 | 22F9_H7a _hIgG4mut | 具有變異型人類IgG4恆定區之22F9_H7a重鏈;變異型人類IgG4恆定區具有SEQ ID NO:197之序列 |
| 105 | 22F9_L0 | 人類化22F9輕鏈序列,其中親本鼠類抗體之CDR1、CDR2及CDR3序列插入具有IGKJ4構架4序列之IGKV1-39x01生殖系中 |
| 107 | 22F9_L1 | 人類化22F9_L0輕鏈序列,其包括胺基酸取代A43P及D70H |
| 109 | 22F9_L2 | 人類化22F9_L0輕鏈序列,其包括胺基酸取代A13V、V19A、A43P、D70H、L78V及V104L |
首先,藉由流式細胞測量術測試22F9_H0L0、H1L0、H2L0、H3L0、H4L0、H5L0、H0L1、H1L1、H2L1、H3L1、H4L1、H5L1、H0L2、H1L2、H2L2、H3L3、H4L2及H5L2結合於過表現人類TGFβ1之HT1080細胞之能力。將過表現人類LAP-TGFβ1之HT1080細胞以40,000個細胞/孔之密度置放於圓底96孔盤中。用FACS緩衝液(含25 mM HEPES、2 mM EDTA、2%胎牛血清之漢克氏平衡鹽溶液)洗滌細胞。向各孔中添加50 µL以1:200經稀釋之TruStain Human FcX (BioLegend),接著添加50 µL之100 ng/µL之人類化22F9構築體。使抗體結合20分鐘。用FACS緩衝液洗滌細胞兩次。細胞用Alexa647-抗人類IgG (Jackson Immunoresearch)標記15分鐘,用FACS緩衝液洗滌兩次且藉由流式細胞測量術進行分析。如圖 16
中所示,22F9_H2L0、H3L0、H4L0、H5L0、H2L1、H3L1、H4L1、H5L1及H4L2展示一些與對照性HT1080細胞及22F9_H0L0相關之結合。在含有H5重鏈序列之抗體下觀測到最強結合。
亦藉由生物層干涉術(Octet)測試與候選物之子集之人類TGFβ1之結合。經抗生蛋白鏈菌素塗佈之探針在結合緩衝液(10 mM磷酸鈉、150 mM氯化鈉、1%牛血清白蛋白、0.05%疊氮化鈉)中平衡60秒。接著,探針浸漬於含10 µg/mL之經生物素標記之抗體之結合緩衝液中。在15秒之後,探針在結合緩衝液中洗滌60秒,且接著浸漬於0-24 nM Fc-人類LAP中。量測分析物締合作用5分鐘。將探針轉移至單獨的結合緩衝液,且量測分析物解離作用5分鐘。針對1:1結合模型擬合締合及解離資料。如表 13
中所示,在所測試之候選物中,22F9_H5L0展示最高的結合信號變化,且22F9_H4L0展示最強親和力。表 13
. 22F9抗體及抗原結合片段之結合資料
| 抗體 | kon (×105 M-1 s-1 ) | koff (×10-3 s-1 ) | KD (nM) | 負載(nm) | 結合(nm) |
| 22F9_hIgG1 | 4.50 | 1.68 | 3.74 | 1.13 | 0.27 |
| 22F9_H3L0 | 7.78 | 2.14 | 2.75 | 0.99 | 0.023 |
| 22F9_H4L0 | 8.10 | 1.32 | 1.63 | 0.90 | 0.057 |
| 22F9_H4L2 | 5.98 | 1.37 | 2.30 | 1.17 | 0.07 |
| 22F9_H5L0 | 5.10 | 1.7 | 3.35 | 1.22 | 0.13 |
| 22F9_H5L1 | 5.19 | 1.22 | 2.34 | 1.29 | 0.08 |
| 22F9_H5L2 | 6.29 | 2.46 | 3.91 | 1.25 | 0.06 |
在另一個實驗中,使用尺寸排阻層析(SEC)評估候選物之聚集。各蛋白質在磷酸鹽緩衝生理食鹽水,pH 7.4中稀釋至1 mg/mL。Sepax SEC-300管柱用10 mM磷酸鈉、150 mM氯化鈉、0.05% (v/v)疊氮化鈉,pH 7.4平衡。將10 µL之1 mg/mL之抗體注射至管柱上。藉由在280 nm下之吸光度來偵測溶離之蛋白質。藉由針對一組凝膠-過濾分子量標準(Bio-Rad)比較IgG單體峰之滯留時間來鑑別IgG單體峰。結果展示於表 14
中。表 14. 22F9 層析資料
| 抗體 | RT (min) | 面積(mAU×s) | 單體百分比 |
| 22F9_mIgG2a | 7.956 | 341 | >99% |
| 22F9_hIgG1 | 8.035 | 259 | >99% |
| 22F9_H0L0 | 7.93 | 160 | 77% |
| 22F9_H4L0 | 8.083 | 168 | >99% |
| 22F9_H4L1 | 8.178 | 180 | >99% |
| 22F9_H4L2 | 8.161 | 214 | >99% |
| 22F9_H5L0 | 8.02 | 220 | >99% |
| 22F9_H5L1 | 8.106 | 219 | >99% |
| 22F9_H5L2 | 8.11 | 206 | >99% |
大部分所測試之候選物展示極少的聚集,如高單體百分比(>99%)反映。具有低於預期Octet結合信號之信號的候選物亦具有較小SEC峰。22F9_H4L0之顯著更小的總面積暗示聚集體太大而不能進入管柱,而所有22F9_H5構築體表現良好。圖 17A
展示22F9_hIgG1、22F9_H0L0及22F9_H4L0之尺寸排阻-高效液相層析(SE-HPLC)結果,且圖 17B
展示22F9_H5L0、H5L1及H5L2之結果。
藉由借助於單點取代使鼠類殘基回復成相應人類殘基來進一步表徵H5L0候選物(其序列提供於下文中),以測定其必需的鼠類殘基。進行其他取代以移除潛在去醯胺化位點(N54S、N54H、N54A、N54Q)及異構化位點(D102E、D102A、D102G)。
如圖 18A
中所示,所有使鼠類構架殘基回復成人類之單位點取代皆實質上降低與LAP-TGFβ1之結合。如圖 18B
中所示,N54Q及D102A取代保持此等位置處之所有取代之大部分結合活性,且雙重N54Q/D102A變異體(22F9_H5.2)具有此分析法中之所有所測試之抗體之最強結合信號。亦參見表12及表34。
因為單一的變異體不引起鼠類殘基數目之任何降低,使用替代性策略進行各組中之胺基酸取代。如上文所描述,針對與過表現人類LAP-TGFβ1之HT1080細胞之結合來分析此等構築體,即經標記之22F9_H0.1、22F9_H1.1、22F9_H2.1及22F9_H3.1。如圖 18C
中所示,22F9_H0.1變異體不結合人類LAP-TGFβ1,而22F9_H1.1、22F9_H2.1及22F9_H3.1變異體結合人類LAP-TGFβ1。
實例 11 : 人類化 20E6 候選物及責任位點移除之 20E6 變異體之表徵
在此實例中,檢驗各種人類化20E6候選物之特徵以鑑別保持親本抗體之功能(例如與TGFβ1之結合)之人類化抗體。亦檢驗去醯胺化/異構化位點移除之20E6變異體。表 15
概述此實例中使用之各種20E6變異體。此等構築體之序列提供於表 34
中。值得注意的是,L1包括3個鼠類回復取代,亦即,P44V (其位於VH/VL界面處且可潛在地影響結構域配對及穩定性)、F71Y (典型殘基,其可潛在地影響CDR L2之結構)及Y87F (其位於VH/VL界面處且可潛在地影響結構域配對及穩定性)。表 15
.例示性 20E6 抗體及抗原結合片段
| SEQ ID | 名稱 | 說明 |
| 128 | 20E6_H0 | 人類化20E6重鏈序列,其中親本鼠類抗體之CDR1、CDR2 (延伸定義)及CDR3序列插入具有保守性構架4序列之IGHV1-2*02生殖系中 |
| 131 | 20E6_H0.1 | 人類化20E6重鏈序列,其中親本鼠類抗體之CDR1、CDR2及CDR3序列插入具有保守性構架4序列之IGHV1-2*02生殖系中 |
| 134 | 20E6_H0.2 | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代N54Q |
| 219 | 20E6_H0.2a | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代Q1E及N54Q |
| 136 | 20E6_H0.3 | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代N54G |
| 137 | 20E6_H0.4 | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代N54A |
| 138 | 20E6_H0.5 | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代N54S |
| 139 | 20E6_H0.6 | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代N54H |
| 140 | 20E6_H0.7 | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代N54L |
| 141 | 20E6_H0.8 | 人類化20E6_H0.1重鏈序列,其包括胺基酸取代N54D |
| 135 | 20E6_H0.2_hIgG4 mut | 具有變異型人類IgG4恆定區之20E6_H0.2重鏈;變異型人類IgG4恆定區具有SEQ ID NO:197之序列 |
| 220 | 20E6_H0.2a_hIgG4 mut | 具有變異型人類IgG4恆定區之20E6_H0.2a重鏈;變異型人類IgG4恆定區具有SEQ ID NO:197之序列 |
| 145 | 20E6_H1 | 人類化20E6_H0重鏈序列,其包括胺基酸取代M48I、M69L、R71V |
| 147 | 20E6_H2 | 人類化20E6_H0重鏈序列,其包括胺基酸取代M48I、M69L、R71V、T73K、T75S |
| 149 | 20E6_H3 | 人類化20E6_H0重鏈序列,其包括胺基酸取代R38K、A40R、M48I、R66K、V67A、M69L、R71V、T73K、T75S |
| 151 | 20E6_H4 | 人類化20E6_H0重鏈序列,其包括胺基酸取代S7P、K12V、V20L、R38K、A40R、M48I、R66K、V67A、M69L、R71V、T73K、T75S |
| 153 | 20E6_L0 | 人類化20E6輕鏈序列,其中親本鼠類抗體之CDR1、CDR2及CDR3序列插入具有IGKJ2構架4序列之IGKV1-39*01生殖系中 |
| 155 | 20E6_L1 | 人類化20E6_L0輕鏈序列,其包括胺基酸取代P44V、F71Y、Y87F |
| 157 | 20E6_L0_P44V | 20E6_L0,其在位置44處具有P至V突變 |
| 159 | 20E6_L0_F71Y | 20E6_L0,其在位置71處具有F至Y突變 |
| 161 | 20E6_L0_Y87F | 20E6_L0,其在位置87處具有Y至F突變 |
首先,藉由流式細胞測量術測試人類化20E6候選物結合於過表現人類TGFβ1之HT1080細胞之能力。將過表現人類LAP-TGFβ1之HT1080細胞以40,000個細胞/孔之密度置放於圓底96孔盤中。用FACS緩衝液(含25 mM HEPES、2 mM EDTA、2%胎牛血清之漢克氏平衡鹽溶液)洗滌細胞。向各孔中添加某一體積(50 µL)之以1:200稀釋之TruStain Human FcX (BioLegend),接著添加50 µL之100 ng/µL之人類化20E6抗體構築體。使抗體結合20分鐘。用FACS緩衝液洗滌細胞兩次。細胞用Alexa647-抗人類IgG (Jackson Immunoresearch)標記15分鐘,用FACS緩衝液洗滌兩次且藉由流式細胞測量術進行分析。如圖 19A
及19B
中所示,與對照性HT1080細胞相比,包括L1輕鏈之候選物展示更大的與HT1080-huβ1細胞之結合。
亦藉由生物層干涉術(Octet)測試人類化20E6候選物與人類LAP-TGFβ1之結合。如表 16
中所示,20E6_H(0-4)L1具有類似的結合動力學,與流式細胞測量術結果一致。表 16
. 20E6之Octet結合資料
| 抗體 | kon (×105 M-1 s-1 ) | koff (×10-3 s-1 ) | KD (nM) |
| 20E6_hIgG1 | 0.98 | 9.97 | 1.02 |
| 20E6_H0L1 | 1.59 | 8.14 | 0.51 |
| 20E6_H1L1 | 1.41 | 6.77 | 0.48 |
| 20E6_H2L1 | 1.57 | 7.47 | 0.48 |
| 20E6_H3L1 | 1.48 | 7.02 | 0.47 |
| 20E6_H4L1 | 1.56 | 7.29 | 0.47 |
如上文所論述,L1輕鏈具有3個鼠類回復取代,亦即P44V、F71Y及Y87F。為測定所有三個此等鼠類回復取代是否為與LAP-TGFβ1之結合所必需的,將各取代個別地引入L0輕鏈且與20E6_H0L1進行比較。如圖 20A
中所示,所有三個鼠類回復取代為與過表現LAP-TGFβ1之HT1080細胞之結合所必需的。
用於產生20E6_H0序列之CDR移植使用重鏈CDR2之延伸定義,其引起在20E6_H0中併入其他鼠類殘基。為降低免疫原性之風險,用重鏈CDR2之傳統(Kabat)定義製備20E6_H0之變異體。此構築體20E6_H0.1以及20E6_H0結合於人類LAP-TGFβ1,表明無需此等鼠類殘基(圖 20B
)。
實例 12 : 抗 LAP 抗體與人類 LAP-TGFβ1 、 2 及 3 之結合
此實例描述使用生物層干涉術測試人類化20E6 (20E6_H0.2aL1_IgG1)抗體結合於人類LAP-TGFβ同功異型物1、2及3之特異性,該抗體具有SEQ ID NO:219及155之對應重鏈及輕鏈序列)。
使用EZ-Link SulfoNHS-LC-Biotin (ThermoFisher)對20E6_H0.2aL1_IgG1抗體進行生物素標記。抗生蛋白鏈菌素官能化探針在結合緩衝液(10 mm磷酸鈉、150 mM氯化鈉、1% (w/v)牛血清白蛋白、0.05% (w/v)疊氮化鈉,pH 7.4)中平衡,且在10 µg/mL之經生物素標記之抗LAP於結合緩衝液中之溶液中浸漬30秒以將抗體裝載至探針。接著,裝載有抗體之探針在結合緩衝液中洗滌且置放於含有0-24 nM融合蛋白質之溶液中,該融合蛋白質具有與人類LAP-TGFβ1、人類LAP-TGFβ2或人類LAP-TGFβ3融合之人類IgG1 Fc結構域。使抗原結合於抗體保持5分鐘(締合期)且接著將探針移至結合緩衝液中(解離期)。針對2:1異源配位體結合模型擬合締合及解離期以測定結合率常數。如圖 21A
及表 17
中所示,20E6_H0.2aL1_IgG1以次奈莫耳親和力結合於人類LAP-TGFβ1,但不結合於人類LAP-TGFβ2 (圖 21B
)或LAP-TGFβ3 (圖 21C
)。此等資料表明20E6_H0.2aL1_IgG1抗體特異性結合於人類LAP-TGFβ1且不結合於LAP-TGFβ2及LAP-TGFβ3。表 17
. 抗LAP抗體20E6_H0.2aL1_IgG1與人類LAP-TGFβ1、2及3之結合
| 樣本ID | kon (×106 M-1 s-1 ) | koff (×10-4 s-1 ) | KD (nM) | kon,2 (×106 M-1 s-1 ) | koff,2 (×10-4 s-1 ) | KD,2 (nM) |
| Fc-huB1 | 3.24 | 369 | 11.4 | 1.18 | 4.09 | 0.35 |
| Fc-huB2 | - | - | - | - | - | - |
| Fc-huB3 | - | - | - | - | - | - |
實例 13 :抗 LAP 抗體與小鼠、大鼠、食蟹獼猴及人類 LAP-TGFβ1 之結合
此實例描述使用生物層干涉術測試20E6_H0.2aL1_hIgG1抗體及20E6_H0.2aL1_hIgG4mut抗體(其具有SEQ ID NO:220及155之對應重鏈及輕鏈序列)結合於來自若干物種之LAP-TGFβ1之物種特異性。
除了將裝載有抗體之探針置放於含有0-24 nM具有與小鼠、大鼠、食蟹獼猴或人類LAP-TGFβ1融合之人類IgG1 Fc結構域之融合蛋白質之溶液中以外,使用實例12實例描述之方法,藉由生物層干涉術檢驗20E6_H0.2aL1_IgG1抗體及20E6_H0.2aL1_hIgG4mut抗體與各種物種之LAP-TGFβ1之結合。分別如表 18
及19
中所示,20E6_H0.2aL1_hIgG1抗體及20E6_H0.2aL1_hIgG4mut抗體以奈莫耳親和力結合於來自所有所測試之物種之LAP-TGFβ1。表 18. 20E6_H0.2aL1_IgG1 抗體與各種物種之 LAP-TGFβ1 之結合資料
表 19. 20E6_H0.2aL1_hIgG4mut 抗體與各種物種 LAP-TGFβ1 之 LAP-TGFβ1 之結合資料
| LAP -TGFβ1 | KD (nM) | kon (×106 M-1 s-1 ) | koff (×10-4 s-1 ) | KD,2 (nM) | kon,2 (×106 M-1 s-1 ) | koff,2 (×10-4 s-1 ) |
| 人類 | 16.51 ± 0.01a | 2.15 ± 0.18 | 355 ± 14 | 0.97 ± 0.10 | 0.68 ± 0.02 | 6.57 ± 0.67 |
| 食蟹獼猴 | 15.85 ± 0.01 | 2.49 ± 0.30 | 394 ± 22 | 0.71 ± 0.13 | 1.03 ± 0.06 | 7.28 ± 1.24 |
| 大鼠 | 13.38 ± 0.01 | 3.30 ± 0.25 | 441 ± 16 | 0.68 ± 0.07 | 1.14 ± 0.05 | 7.68 ± 0.77 |
| 小鼠 | 14.19 ± 0.01 | 2.42 ± 0.26 | 343 ± 19 | 0.56 ± 0.14 | 0.70 ± 0.04 | 3.90 ± 0.98 |
| a 所有所報導之值為來自一式三份量測值之平均值±標準差 |
| KD (nM) | kon (×106 M-1 s-1 ) | koff (×10-4 s-1 ) | KD,2 (nM) | kon,2 (×106 M-1 s-1 ) | koff,2 (×10-4 s-1 ) | |
| 人類 | 10.72 ± 0.01 | 2.8 ± 0.3 | 303 ± 16 | 0.51 ± 0.12 | 0.70 ± 0.03 | 3.6 ± 0.8 |
| 食蟹獼猴 | 26.14 ± 0.05 | 2.0 ± 0.4 | 524 ± 36 | 1.53 ± 0.18 | 0.94 ± 0.06 | 14.3 ± 1.4 |
| 大鼠 | 11.14 ± 0.01 | 3.6 ± 0.4 | 406 ± 20 | 0.51 ± 0.06 | 1.70 ± 0.08 | 8.7 ± 0.9 |
| 小鼠 | 16.88 ± 0.02 | 2.8 ± 0.4 | 478 ± 27 | 1.31 ± 0.11 | 0.84 ± 0.04 | 11.0 ± 0.8 |
| a 所有所報導之值為來自一式三份量測值之平均值±標準差 |
實例 14 :人類化 20E6 中之 CDR 之丙胺酸掃描突變誘發
此實例描述使用生物層干涉術測試人類LAP-TGFβ1與20E6_H0.2aL1_IgG1抗體之變異體之結合。
在抗體之重鏈及輕鏈CDR中進行總共49個單一丙胺酸取代以鑑別對人類LAP-TGFβ1結合而言重要之殘基。此外,用甘胺酸取代輕鏈中之殘基A25。在24孔板上以及在不含DNA之孔(陰性對照)及經野生型抗體之DNA轉染之孔(陽性對照)中,將此等變異體之質體DNA轉染至1 mL培養物中之ExpiCHO細胞中。藉由與蛋白質A官能化之探針之結合來測定各孔中之IgG濃度。探針浸漬於含有來自各培養物之上清液之孔中。藉由針對在ExpiCHO培養基中稀釋之經純化之20E6_H0.2aL1_hIgG1抗體之標準曲線的信號變化率,比較各孔之信號變化率來測定IgG濃度。CHO上清液在培養基中稀釋至0.6 μg/mL。抗生蛋白鏈菌素官能化之探針在結合緩衝液(10 mM磷酸鈉、150 mM氯化鈉、1% (w/v)牛血清白蛋白、0.05% (w/v)疊氮化鈉,pH 7.4)中平衡,且接著在5 µg/mL之經生物素標記之人類LAP-TGFβ1於結合緩衝液中之溶液中浸漬60秒以將抗原裝載至探針。接著,裝載有抗原之探針在結合緩衝液中洗滌且置放於經稀釋之CHO上清液中。使抗原結合於抗體保持5分鐘(締合期)且接著將探針移至結合緩衝液中(解離期)。針對1:1結合模型擬合締合及解離期以測定結合率常數。
如圖 22A-D
及表 20
中所示,重鏈中之位置50、99、101、102、103、104、105以及輕鏈中之位置24、28、29、32、50、53、89、90、91、92、94、95、96及97處之丙胺酸取代對結合親和力具有中度至重度影響,表明此等殘基涉及與人類LAP-TGFβ1之結合。
實例 15 : 抗 LAP 抗體與人類 LAP-TGFβ1 之單價結合與雙價結合之比較
此實例比較20E6_H0.2aL1_hIgG1抗體與人類LAP-TGFβ1之單價結合與二價結合。
用FragIT套組(Genovis)根據製造商說明產生20E6_H0.2aL1_hIgG1抗體之F(ab')2
片段。接著,用10 mM 2-巰基乙胺-HCl(2-MEA)處理F(ab')2
以產生Fab'片段。為測試與過表現人類LAP-TGFβ1之細胞之結合,在96孔板中培養4×105
個以下細胞中之每一者:(a)P3U1細胞及(b)過表現人類GARP及人類LAP-TGFβ1之P3U1細胞。盤在1,500 rpm下離心5分鐘,移除液體,且用200 μL FACS緩衝液使細胞再懸浮。再離心盤,將經稀釋之初級抗體添加至各孔中且在冰上培育盤20分鐘,接著進行離心。使細胞再懸浮於200 μL FACS緩衝液中,再次離心且再懸浮於50 μL經稀釋之二級抗體(Alexa647-抗人類IgG)中。盤在黑暗中,在冰上培育20分鐘,用200 μL FACS緩衝液洗滌兩次且用Attune NXT儀器讀段來自各孔之細胞(於200 μL FACS緩衝液中)。如圖 23A
及23B
中所示,所有三種構築體皆結合過表現GARP及LAP-TGFβ1之P3U1細胞。
實例 16 : 在存在錨蛋白質之情況下 , 抗 LAP 抗體與人類 LAP-TGFβ1 之結合
此實例描述測試在存在錨蛋白質之情況下,20E6_H0.2aL1_hIgG1抗體與人類LAP-TGFβ1之結合。
將LAP-TGFβ經由LTBP錨定至細胞外基質,且經由GARP或LRRC33錨定至免疫抑制性細胞之表面。製備人類LTBP1及GARP之可溶形式以評估錨蛋白質對抗LAP抗體結合之影響。ECR3E片段(描述於Annes等人JCB
2004;165:723)由人類LTBP1之第三富含半胱胺酸之結構域組成,由EGFR樣結構域側接。此構築體含有共價連接至LAP-TGFβ (形成可溶性複合物)所需之所有元件。藉由共表現人類LAP-TGFβ1及包含人類GARP之細胞外域之嵌合體來製備可溶性GARP-LAP-TGFβ複合物,該人類GARP具有跨膜肽酶α之跨膜及胞漿結構域(描述於Fridrich等人PLoS ONE.
2016;11(4): e0153290)。
抗生蛋白鏈菌素官能化之探針在結合緩衝液(10 mM磷酸鈉、150 mM氯化鈉、1% (w/v)牛血清白蛋白、0.05% (w/v)疊氮化鈉,pH 7.4)中平衡且在5 µg/mL之經生物素標記之抗體(亦即,20E6_H0.2aL1_hIgG1、鼠類16F4或MHG8,Lienart等人Science
2018;362:952-956中所描述之GARP特異性鼠類IgG2a)於結合緩衝液中之溶液中浸漬30秒,以將抗體裝載至探針。接著,裝載有抗體之探針在結合緩衝液中洗滌且置放於含有0-24 nM含有與任一種人類LAP-TGFβ1融合之人類IgG1 Fc結構域之融合蛋白質、可溶性GARP-LAP-TGFβ1複合物或可溶性ECR3E-LAP-TGFβ1複合物之溶液中。使抗原結合於抗體保持5分鐘(締合期)且接著將探針移至結合緩衝液中(解離期)。藉由1:1結合模型良好擬合16F4及MHG8之結合及解離資料。針對2:1異源配位體結合模型擬合20E6_H0.2aL1_hIgG1抗體之締合及解離期以測定結合率常數。
如圖 24
及表 21
中所示,20E6_H0.2aL1_hIgG1抗體以奈莫耳親和力結合於自由LAP-TGFβ1及可溶性GARP-LAP-TGFβ1複合物,但不結合於ECR3E-LAP-TGFβ1複合物。如所預期,抗GARP抗體(MHG8)結合於GARP-LAP-TGFβ1複合物,但不結合於自由LAP-TGFβ1或ECR3E-LAP-TGFβ1複合物。16F4緊密結合所有三種構築體。表 20. 20E6_H0.2aL1_hIgG1 中 CDR 取代之人類 LAP-TGFb1 結合作用
表 21. 20E6_H0.2aL1_hIgG1 抗體對自由 LAP-TGFβ1 複合物、可溶性 GARP-LAP-TGFβ1 複合物及 ECR3E-LAP-TGFβ1 複合物之結合親和力
| 變異體 | KD,WT /KD,Ala | 變異體 | KD,WT /KD,Ala | 變異體 | KD,WT /KD,Ala | 變異體 | KD,WT /KD,Ala |
| WT #4 | 1.00 | WT #1 | 0.90 | WT #2 | 1.21 | WT #3 | 0.94 |
| VH_G26A | 1.40 | VH_S31A | 0.60 | VH_Y101A | 0.00 | VL_N34A | 0.07 |
| VH_Y27A | 1.29 | VH_Y32A | 1.00 | VH_G102A | 0.00 | VL_Y50A | 0.00 |
| VH_T28A | 0.97 | VH_W33A | 0.12 | VH_G103A | 0.00 | VL_T51A | 0.80 |
| VH_F29A | 1.16 | VH_M34A | 0.84 | VH_Y104A | 0.00 | VL_S52A | 0.12 |
| VH_T30A | 0.94 | VH_H35A | 2.07 | VH_F105A | 0.00 | VL_R53A | 0.02 |
| VH_R50A | 0.00 | VH_D106A | 0.24 | VL_L54A | 0.10 | ||
| VH_I51A | 0.73 | VH_V107A | 1.08 | VL_H55A | 0.33 | ||
| VH_D52A | 0.71 | VL_R24A | 0.01 | VL_Q89A | 0.01 | ||
| VH_P53A | 0.87 | VL_A25G | 0.09 | VL_Q90A | 0.00 | ||
| VH_Q54A | 0.67 | VL_S26S | 0.36 | VL_G91A | 0.00 | ||
| VH_S55A | 0.96 | VL_Q27A | 0.03 | VL_D92A | 0.00 | ||
| VH_G56A | 1.62 | VL_D28A | 0.00 | VL_T93A | 0.64 | ||
| VH_G57A | 0.37 | VL_I29A | 0.02 | VL_L94A | 0.00 | ||
| VH_I58A | 0.52 | VL_T30A | 1.00 | VL_P95A | 0.00 | ||
| VH_K59A | 0.69 | VL_N31A | 0.48 | VL_W96A | 0.00 | ||
| VH_W99A | 0.00 | VL_Y32A | 0.00 | VL_T97A | 0.01 | ||
| VH_D100A | 0.28 | VL_L33A | 0.08 |
| 樣本 | KD,1 (nM) | kon,1 (×106 M-1 s-1 ) | koff,1 (×10-3 s-1 ) | KD,2 (nM) | kon,2 (×106 M-1 s-1 ) | koff,2 (×10-3 s-1 ) |
| Fc-LAP | 16.16 ± 0.01 | 2.51 ± 0.25 | 40.58 ± 1.81 | 0.96 ± 0.09 | 0.96 ± 0.04 | 0.92 ± 0.07 |
| ECR3E-LAP | 無結合 | - | - | - | - | - |
| sGARP-LAP | 18.71 ± 0.05 | 2.77 ± 1.01 | 51.81 ± 6.84 | - | - | - |
實例 17 :人類化 20E6 與 其他抗 LAP 抗體之間關於結合於可溶性人類 GARP-LAP-TGFβ1 複合物之競爭
鼠類28G11、16F4及MHG8抗體緊密結合於由人類GARP及人類LAP-TGFβ1之細胞外結構域組成之可溶性複合物(sGARP-LAP-TGFβ1)。觀測到20E6_H0.2aL1_hIgG1抗體亦緊密結合於此複合物。如圖 25
中所示,進行競爭實驗以比較此等四種抗體之結合抗原決定基。
抗生蛋白鏈菌素官能化之探針在結合緩衝液(10 mM磷酸鈉、150 mM氯化鈉、1% (w/v)牛血清白蛋白、0.05% (w/v)疊氮化鈉,pH 7.4)中平衡且在5 µg/mL之經生物素標記之抗體(亦即,20E6_H0.2aL1_hIgG1抗體、鼠類16F4抗體、鼠類28G11抗體或MHG8抗體)於結合緩衝液中之溶液中浸漬30秒,以將抗體裝載至探針。接著,裝載有抗體之探針在結合緩衝液中洗滌且置放於含有24 nM sGARP-LAP-TGFβ1複合物之溶液中。使抗原結合於抗體保持5分鐘(締合期),且接著將探針移動至含有單獨的結合緩衝液或24 nM未經修飾之抗體之孔中。在培育5分鐘之後,藉由信號變化評估第二、未經修飾之抗體之結合。
如表 22
中所示,如所預期,所有四種抗體皆阻斷相同抗體之結合。20E6_H0.2aL1_hIgG1 (h12_hIgG1)抗體與28G11抗體,但不與16F4抗體或MHG8抗體競爭結合。表 22
.抗 LAP 抗體與可溶性人類 GARP-LAP-TGFβ1 複合物之競爭結合資料
| MHG8 | 16F4 | h12_hIgG1 | 28G11 | |
| MHG8 | 0.00 | 0.30 | 0.25 | 0.28 |
| 16F4 | 0.46 | 0.00 | 0.43 | 0.43 |
| h12_hIgG1 | 0.07 | 0.08 | 0.00 | 0.00 |
| 28G11 | 0.29 | 0.20 | -0.01 | 0.00 |
實例 18 :最佳化 7H4 變異型抗體
此實例描述抗體7H4之最佳化(例如移除重鏈中之潛在責任位點)。特定言之,7H4之重鏈中之位置55 (其位於CDR2中)為潛在異構化位點。為移除此潛在責任位點,使位置55處之天冬胺酸突變成除天冬胺酸以外的胺基酸,例如甘胺酸、丙胺酸或麩胺酸,如表 23
中所描述。序列提供於表 34
中。
可使用本文中所描述之方法測試此等7H4變異型抗體之各種功能(例如與人類LAP-TGFβ1之結合、TGFβ1活化之抑制、與免疫細胞之結合)。表 23. 7H4 抗體序列及抗原結合片段之多重變異體
| SEQ ID | 名稱 | 說明 |
| 221 | 7H4_HC (hyb) | 鼠類7H4重鏈序列 |
| 222 | 7H4_LC (hyb) | 鼠類7H4輕鏈序列 |
| 231 | 7H4_HCDR2 (D55G) | 移除潛在異構化位點(D55G)之鼠類7H4重鏈CDR2 |
| 232 | 7H4_HCDR2 (D55A) | 移除潛在異構化位點(D55A)之鼠類7H4重鏈CDR2 |
| 233 | 7H4_HCDR2 (D55E) | 移除潛在異構化位點(D55E)之鼠類7H4重鏈CDR2 |
| 234 | 7H4_VHmut#1 (D55G) | 移除潛在異構化位點(D55G)之鼠類7H4重鏈可變區 |
| 235 | 7H4_VHmut#2 (D55A) | 移除潛在異構化位點(D55A)之鼠類7H4重鏈可變區 |
| 236 | 7H4_VHmut#3 (D55E) | 移除潛在異構化位點(D55E)之鼠類7H4重鏈可變區 |
| 224 | 7H4_VL | 鼠類7H4輕鏈可變區序列 |
| 237 | 7H4_HCmut#1 (D55G) | 移除潛在異構化位點(D55G)之鼠類7H4重鏈 |
| 238 | 7H4_HCmut#2 (D55A) | 移除潛在異構化位點(D55A)之鼠類7H4重鏈 |
| 239 | 7H4_HCmut#3 (D55E) | 移除潛在異構化位點(D55E)之鼠類7H4重鏈 |
實例 19 :具有 LAP-TGFβ1 之 複合物中人類化 20E6 之低溫 -EM 結構
此實例描述藉由單一粒子低溫電子顯微法(SP-Cryo-EM)鑑別與人類化20E6結合之LAP-TGFβ1上之抗原決定基,以及人類化20E6之互補位。
樣本及柵格製備。
如實例11中所描述產生人類化20E6 mAb (20E6_H0.2aL1_hIgG1)及Fab。如實例16中所描述產生人類經生物素標記之LAP-TGFβ1-Fc及GARP LAP-TGFβ1。自R&D購得人類LAP-TGFβ1且在含有50%甘油之磷酸鹽緩衝生理食鹽水(PBS)緩衝液(10 mM磷酸鈉、150 mM氯化鈉,pH 7.4)中供應。用不同蛋白質以不同濃度、比率及培育時間製備若干不同樣本。使用以下五種樣本產生最終重構:
1) 樣本A:將20微升(亦稱為µl或ul)LAP-TGFβ1-Fc (10.3微莫耳(µM或uM)於PBS (10 mM磷酸鈉、150 mM氯化鈉,pH 7.4)中)與4 μl人類化20E6 (26 µM於PBS中)混合以得到4.25 µM LAP-TGFβ1-Fc及4.3 µM人類化20E6-Mab之最終溶液(以二聚體比率計,1份Mab);混合物保持在冰上45分鐘且接著用於製備柵格。
2) 樣本B:樣本A之1:5稀釋物:4 µl樣本A + 16 µl HEPES緩衝生理食鹽水(HBS;20 mM Hepes、150 mM NaCl,pH 7.0)。
3) 樣本C:將8 µl LAP-TGFβ1-Fc (10.3 µM於PBS中)與8 µl人類化20E6 (8.6 µM於PBS中)混合以得到2.34 µM LAP-TGFβ1-Fc及4.7 µM人類化20E6-Fab之最終溶液;混合物保持在冰上30分鐘,接著用HBS以1:1稀釋。
4) 樣本D:含LAP-TGFβ1之具有50%甘油之PBS緩衝液交換至不含甘油之緩衝液(亦即,PBS)中,且與人類化20E6-Mab以2份二聚體:1份Mab比率複合,接著濃縮至30 µM (用於HDX研究)。對於低溫EM研究,樣本用PBS稀釋10倍。
5) 樣本E:將1.2 µl GARP-LAP-TGFβ1 (19.3 µM於PBS中)與1.3 µl人類化20E6-Fab (8.6 µM於PBS中)及2.6 µl HBS緩衝液混合以得到4.4 µM GARP-LAP-TGFβ1及2.2 µM人類化20E6-Fab之最終溶液(以2份GARP-LAP-TGFβ1之二聚體計,1份Fab)。混合物保持在冰上30-60分鐘且用HBS緩衝液以1:10稀釋。
使用標準程序,使用Vitrobot Mark 4 (ThermoFisher)製備柵格(C-flat碳/金,300號篩網,1.3/1.2):柵格使用Pelco easyGlow單元(Ted Pella, Inc.)在工廠推薦用於血漿清潔之值進行輝光放電(0.39 mbar,較低水準15 mA,保持10",輝光30")。Vitrobot集合為腔室濕度在90-100%之間;腔室溫度為4℃;點漬時間為3秒;等待時間為0秒;點漬力為0。將三(3)µl樣本施用於柵格,點漬且接著置放於液態乙烷浴中;接著,將冷凍之柵格轉移至液氮(LN2)中且保持在LN2溫度下以用於所有後續步驟(截割、轉移至顯微鏡卡匣中及資料收集)。
資料收集及結構測定。
用配備有Gatan K3 Direct電子偵測器之ThermoFisher Titan Krios G3收集所有資料集。使用Gatan Latitude軟體進行資料收集。收集五個資料集(每個所製備之樣本一個)。表24
概述用於資料收集之顯微鏡及相機參數,及各樣本之所收集之影片之總數。整個資料收集(針對5個樣本)跨越兩週。表 24
.20E6 人類化抗體及 Fab 之 低溫 EM 細節
| 樣本 | 影片數 | 電壓 | 放大 倍數 | 偵測器像素尺寸(Å) | 劑量 (e- /Å2 ) | 散焦(μm) |
| A) LAP-TGFβ1-FC + 人類化20E6-Mab,1份Mab/二聚體 | 2690 | 300 | 81,000 | 1.07 | 62.5 | -0.8至-1.8 |
| B) LAP-TGFβ1-FC + 人類化20E6-Mab,1份Mab/二聚體(1:5稀釋) | 1994 | 300 | 81,000 | 1.07 | 62.5 | -1.2至-1.6 |
| C) LAP-TGFβ1-FC + 人類化20E6-Fab,2份Fab/二聚體 | 2647 | 300 | 81,000 | 1.07 | 62.5 | -1.2至-1.6 |
| D) LAP-TGFβ1 + 人類化20E6-Mab (1:10稀釋) | 4545 | 300 | 81,000 | 1.07 | 62.5 | -0.8至-1.8 |
| E) GARP-LAP-TGFβ1 + 人類化20E6-Fab (1份Fab/1份二聚體),1:10稀釋 | 9366 | 300 | 81,000 | 1.07 | 62.5 | -0.8至-1.8 |
資料處理及定位重構。
用Cryosparc V2 (Structura Biotechnology Inc., Toronto, Canada;Punjani等人Nature Methods
2017;14:290-6;Brubaker等人IEEE Trans Pattern Anal Mach Intell
2017;39:706-18)進行整個資料處理及定位重構。個別地進行各資料集之處理管線之初始階段(影片比對、CTF評估、粒子挑選及2D等級測定)。在三個階段中將來自個別資料集之經清洗之粒子合併在一起。
1) 合併來自前三個資料集(樣本A-C)之粒子且共同處理,但最佳定位僅為在5 Å處。
2) 使用來自樣本D之粒子,有可能產生3.8 Ang定位。接著,使用來自樣本D之模板進行樣本A-C之新穎粒子挑選。接著,所選擇之粒子經歷一輪2D分類且與來自樣本D之最佳粒子合併在一起,總共533,297個粒子。在一輪2D分類之後,使用最佳等級(436,918個粒子)進行均質優化工作。所得定位經歷一輪不均勻優化(NU優化),其產生解析度為3.5 Å之定位。
3) 來自樣本E之約1.2M個粒子之集合與來自2之最後一個(最佳)集合合併。在2輪2D分類之後,使用最佳2D等級(864,958個粒子)計算具有3.4 Å之標稱解析度之定位(在NU優化之後)。
接著,對於864,958個粒子再進行2輪2D分類以產生含有802,256個粒子之集合及3.3 Å處之不均勻(NU)優化定位。在整個方法中,使用所得定位之目視檢查(密度改良、密度連續性、不具有(或減少)較佳定向假影)來決定後續步驟。最後一個定位明確指出以下事實:儘管存在兩個Fab/LAP-TGFβ1二聚體,但一個比另一個明顯更好地定義(圖 26A
),且因此應用粒子差分及局部優化程序。所得最終定位之標稱解析度為3.1 Å。使用此定位構建及優化最終模型。圖 26B
及26C
展示最終定位之FSC曲線及Guinier曲線。
模型構建及優化。
使用COOT (Emsley等人Acta Crystallogr D-Biological Crystallography
2010;66:486-501)及PHENIX (Afonine等人Acta Crystallogr D Struct Biol
2018;74 6:531-44)進行所有模型構建及優化。自PDB條目3RJR獲得LAP-TGFβ1座標,且自使用MOE 2019.0101 (Chemical Computing Group ULC)產生之同源模型獲得Fab座標。使用COOT將LAP/TGFβ1及Fab模型最初安置在定位中作為剛性體,且使用密度重建一些環及分配正確序列。進行PHENIX真實空間優化模組以最佳化模型幾何結構。表 25
概述模型優化及統計:表 25. 人類化 20E6 Fab 及 LAP-TGFβ1 之低溫 EM 之模型優化及統計
| 外加對稱性 | C1 |
| 所使用之粒子 | 802,256 |
| 定位解析度(Å) | 3.1 |
| FSC臨界值 | 0.143 |
| 定位解析度範圍(Å) | 3-19 |
| 優化 | |
| 定位銳化B-因子(Å2 ) | 87.5 |
| 模型組成 | |
| 非氫原子 | 8,757 |
| 蛋白質殘基 | 1,110 |
| CC_mask: | 0.655 |
| CC_volume: | 0.638 |
| CC_peaks: | 0.525 |
| rmsd (鍵) (Å): | 0.01 |
| rmsd (角度) (o ): | 0.98 |
| 所有原子衝突評分 | 5.41 |
| 拉馬錢德蘭曲線(Ramachandran plot): | |
| 離群: | 0.00% |
| 允許: | 7.16% |
| 有利: | 92.84% |
| 旋轉異構體離群值: | 0.20% |
最終模型含有LAP-TGFβ1二聚體之兩個鏈(鏈A及B,各自含有殘基1-61 + 70-208 + 216-241 + 250-361;抗原之編號假設不存在信號肽,亦即,Leu 1=完整序列中之Leu 30);人類化20E6-Fab之兩個鏈(重鏈(VH),殘基1-221及輕鏈(VL),殘基2-214)。一個糖部分(NAG)在一個糖基化位點(Asn A53)處模型化;對於所有其他可能的糖基化位置(A107、A147、B53、B107及B147),密度不足以保證糖添加。
結構分析。
測定具有人類化20E6-Fab之複合物中之LAP-TGFβ1二聚體之結構為3.1 Å解析度。低溫EM定位之品質使得抗原及Fab之側鏈之分配為明確的。在抗原-抗體界面處,定位之品質與在類似解析度下計算之x射線衍生之電子密度定位類似(圖 27A
:在3.1 Å解析度下之低溫EM定位;圖 27B
:在2.9 Å解析度下之蛋白質資料組(Protein Data Bank;PDB)條目5jxe之電子密度)。
歸因於低溫EM定位之內源性特徵(Cardone G等人, J Struct Biol. 2013; 184:226-236),在LAP-TGFβ1:Fab界面與分子之其餘部分之間存在明確梯度。存在第二、對稱結合之Fab之較低水準密度,其可對接至最終定位中(圖 26A
)。
包含相互作用界面之人類化20E6-Fab互補位及LAP-TGFβ1抗原決定基殘基展示於圖 28A
及28B
中,且概述於表 26
中。界面由凡得瓦爾力(van der Waals)及靜電相互作用組成,且對應於約800 Å2
之內埋表面,如藉由蛋白質界面、表面及組件(PISA)計算(Krissinel等人,J Mol Biol
2007;372:774-97)。抗原決定基係由來自鏈A之殘基A31-P40 (LAP殘基)以及來自鏈B之Y340-R343及R274-K280 (TGFβ1殘基)形成。與人類化20E6-Fab之相互作用需要LAP及TGFβ1殘基之事實解釋了抗體為何對LAP-TGFβ1複合物之封閉形式具有特異性且不結合於空LAP或成熟TGFβ1。互補位係由輕鏈(VL)殘基T30、Y32、Y49-Y50、R53、G91-L94、W96及重鏈(VH)殘基W33、R50、I58-K59、W99及Y101-G103形成。由低溫EM分析測定之抗原決定基與實例22中描述之氫氘交換質譜(HDX-MS)分析一致。互補位與藉由實例14中描述之丙胺酸掃描實驗鑑別之殘基一致。亦參見圖28C-D。表 26 :
LAP-TGFβ1及人類化20E6-Fab*之抗原決定基及互補位
*指示來自人類化20E6-Fab VH或VL之與LAP-TGFβ1殘基相互作用之殘基。氫鍵相互作用以粗體指示(相互相用截止值設定為4.5 Å;氫鍵相互作用截止值設定為3.5 Å)。
| VH | TGFβ1 | VL |
| R274 | T30 | |
| G278 | T30 | |
| W279 | Y50、Y50 | |
| K280 | D92 | |
| Y101 | V341 | |
| Y101、W33 | G342 | |
| VH | LAP | VL |
| A31 | Y49、R53 | |
| Y104、Y104 | S32 | Y49、Y50 |
| G102 | P33 | Y32 |
| P34 | Y32 | |
| G102、W99 | S35 | G91、Y32 |
| Q36 | D92 | |
| G37 | L94、D92 | |
| R50 、K59、W33 | E38 | L94、W96 |
實例 20 : 具有 LAP-TGFβ1 之 複合物中之人類化 28G11 之低溫 EM 結構
藉由低溫EM測定具有人類LAP-TGFβ1之複合物中之人類化28G11 Fab之結構,以鑑別與抗體結合之LAP-TGFβ1上之抗原決定基,及人類化28G11-Fab之互補位。
樣本及柵格製備。
如實例9及16中所描述產生人類化28G11 mAb (28G11_H2bL3a_hIgG1,其具有SEQ ID NO:43及53之對應重鏈及輕鏈可變區序列)及GARP-LAP-TGFβ1,且在PBS緩衝液(10 mM磷酸鈉、150 mM氯化鈉,pH 7.4)中供應。藉由混合2.0 μl GARP-LAP-TGFβ1 (38.7 μM)、0.5 μl人類化28G11 (77.3 μM)及17.5 μl HBS緩衝液(20 mM Hepes、150 mM NaCl,pH 7.0)達到以下最終濃度來製備用於低溫EM實驗之樣本:GARP-LAP-TGFβ1為3.87 μM且人類化28G11為1.95 μM。在製備柵格之前,用HBS以1:1進一步稀釋樣本。使用含有GARP (而非單獨的LAP-TGFβ1)之複合物破壞在自人類化28G11:LAP-TGFβ1之樣本收集之資料中觀測到的較佳定向問題。
使用標準程序,使用Vitrobot Mark 4 (ThermoFisher)製備柵格(C-flat碳/金,300號篩網,1.3/1.2)。柵格使用Pelco easyGlow單元(Ted Pella, Inc.)在工廠推薦之用於血漿清潔之值下輝光放電(0.39 mbar,較低水準15 mA,保持10",輝光30")。Vitrobot集合為腔室濕度在90-100%之間;腔室溫度為4℃;點漬時間為3秒;等待時間為0秒;點漬力為0。將三(3)µl樣本施用於柵格,點漬且接著置放於液態乙烷浴中;接著,將冷凍之柵格轉移至液氮(LN2)中且保持在LN2溫度下以用於所有後續步驟(截割、轉移至顯微鏡卡匣中及資料收集)。
資料收集及結構測定。
用配備有ThermoFisher Falcon 3 Direct電子偵測器之ThermoFisher 300 KeV Titan Krios G3收集資料集。使用ThermoFisher EPU軟體進行資料收集。在75,000x之標稱放大倍數下收集4267個影片;散焦範圍設定在-1.4與-2.0 μm之間。偵測器像素尺寸為1.06 Å且劑量為37.74 e-
/Å2
。
資料處理及定位重構。
用Cryosparc V2進行整個資料處理及定位重構。初始粒子挑選鑑別2.9M個粒子。在兩次2D分類工作之後,使用約620K個粒子計算初始定位(標稱解析度為3.81 Ang)。再使用兩次2D分類進一步清潔粒子堆疊,且使用所得粒子集合(505,582個粒子)產生定位,其在NU優化之後具有3.48 Ang之標稱解析度。接著,使用局部(遮蔽)優化改良抗原決定基-互補位界面處之解析度。局部優化之結果(在粒子差分之後)為3.38 Ang定位,其中界面處之細節得到顯著改良。使用此定位構建模型。
模型構建及優化。
使用COOT進行所有模型構建及優化。使用LAP-TGFβ1與人類化20E6 Fab之間的複合物作為起始模型;使用COOT將LAP-TGFβ1及人類化28G11-Fab初始安置在定位中作為剛性體,且使用密度重建一些環及分配正確序列。進行PHENIX真實空間優化模組以最佳化模型幾何結構。表 27
概述模型優化及統計:表 27. 人類化 28G11-Fab 及 LAP-TGFβ1 之模型優化及統計
| 外加對稱性 | C1 |
| 所使用之粒子 | 505,582 |
| 定位解析度(Å) | 3.4 |
| FSC臨界值 | 0.143 |
| 定位解析度範圍(Å) | 3.0 - 14.0 |
| 優化 | |
| 定位銳化B-因子(Å2 ) | 105.6 |
| 模型組成 | |
| 非氫原子 | 8,960 |
| 蛋白質殘基 | 1,113 |
| CC_mask: | 0.716 |
| CC_volume: | 0.702 |
| CC_peaks: | 0.628 |
| rmsd (鍵) (Å): | 0.007 |
| rmsd (角度) (o ): | 0.81 |
| 所有原子衝突評分 | 19.8 |
| 拉馬錢德蘭曲線: | |
| 離群: | 0.00 % |
| 允許: | 15.58 % |
| 有利: | 84.42 % |
| 旋轉異構體離群值: | 0.20 % |
最終模型含有LAP-TGFβ1二聚體之兩個鏈(鏈A及B,各自含有殘基1-61 + 70-208 + 216-241 + 250-361;抗原之編號假設不存在信號肽,亦即,Leu 1=完整序列中之Leu 30)及人類化28G11-Fab之一個分子(重鏈(VH),殘基1-221及輕鏈(VL),殘基2-214)。一個糖部分(NAG)在一個糖基化位點(Asn A53)處模型化;對於所有其他可能的糖基化位置(Asn A107、Asn A147、Asn B53、Asn B107及Asn B147),密度不足以保證糖添加。
結構分析。
具有人類化28G11-Fab之複合物中之LAP-TGFβ1二聚體之結構測定為3.4 Å解析度。低溫EM定位之品質使得抗原及Fab之側鏈之分配為明確的。
包含相互作用界面之人類化28G11-Fab互補位及LAP-TGFβ1抗原決定基殘基展示於圖 29A
及29B
中,且概述於表 28
中。亦參見圖29C-E。界面由凡得瓦爾力及靜電相互作用組成,且對應於約800 Å2
內埋表面,如藉由PISA計算。抗原決定基由來自鏈A之殘基A31-E38 (LAP殘基)以及來自鏈B之G342-K344及G278-W281 (TGFβ1殘基)形成。與h20E6-Fab之相互作用需要LAP及TGFβ1殘基之事實解釋了抗體為何對LAP-TGFβ1複合物之封閉形式具有特異性且不結合於空LAP或成熟TGFβ1。互補位由輕鏈(VL)殘基Y32、Y49-Y50、R53及G91-L94以及重鏈(VH)殘基W33、F50-N53、Q56及Y101-Y106形成。
表28
:LAP-TGFβ1
及28G11-Fab*
之抗原決定基及互補位
*指示來自28G11-Fab VH或VL之與LAP-TGFβ1殘基相互作用之殘基。氫鍵相互作用以粗體指示(相互相用截止值設定為4.5 Å;氫鍵相互作用截止值設定為3.5 Å)。
| VH | TGFβ1 | VL |
| G278 | S30 | |
| W279 | Y50 | |
| K280 | D92 | |
| W281 | Y32 | |
| Q56、W33 | G342 | |
| R52、Q56 | R343 | |
| Q56 | K344 | |
| VH | LAP | VL |
| A31 | Y49、R53 | |
| Y106、Y106 | S32 | Y49、Y50、R53 |
| G104 | P33 | Y32、Y50 |
| P34 | Y32、Y32 | |
| Y101 、G104 | S35 | Y32、G91 |
| Q36 | D92 | |
| G37 | D92 、 T93、L94 | |
| F50、 R52 、R52、Y33、Y33 | E38 | L94 |
實例 21 :具有 LAP-TGFβ1 之 複合物中之鼠類 22F9 之低溫 EM 結構
藉由SP-Cryo-EM測定具有人類LAP-TGFβ1之複合物中之鼠類22F9-Fab (在實例中稱為22F9)之結構,以鑑別與抗體結合之LAP-TGFβ1上之抗原決定基,及22F9-Fab之互補位。
樣本及柵格製備。
此實驗中使用之鼠類22F9 mAb為22F9_N54Q_D102A_mIgG2a,其具有SEQ ID NO:248及249之對應重鏈及輕鏈可變區序列。自R&D購得人類LAP-TGFβ1且在含有50%甘油之PBS緩衝液(10 mM磷酸鈉、150 mM氯化鈉,pH 7.4)中供應。如下製備樣本:將含LAP-TGFβ1之具有50%甘油之PBS緩衝液交換至不含甘油之緩衝液(亦即,PBS)中,且與22F9-Mab以1份二聚體:1份Mab比率複合,接著用PBS稀釋10倍。
使用標準程序,使用Vitrobot Mark 4 (ThermoFisher)製備柵格(C-flat碳/金,300號篩網,1.3/1.2)。特定言之,柵格使用Pelco easyGlow單元(Ted Pella, Inc.)在工廠推薦之用於血漿清潔之值下輝光放電(0.39 mbar,較低水準15 mA,保持10",輝光30")。Vitrobot集合為腔室濕度在90-100%之間;腔室溫度為4℃;點漬時間為3秒;等待時間為0秒;點漬力為0。將三(3)µl樣本施用於柵格,點漬且接著置放於液態乙烷浴中。接著,將冷凍之柵格轉移至液氮(LN2)中且保持在LN2溫度下以用於所有後續步驟(截割、轉移至顯微鏡卡匣中及資料收集)。
資料收集及結構測定。
用配備有Gatan K3 Direct電子偵測器之ThermoFisher 300 KeV Titan Krios G3收集資料集。使用Gatan Latitude軟體進行資料收集。在81,000x之標稱放大倍數下收集3741個影片;散焦範圍設定在-0.8與-1.8 μm之間。偵測器像素尺寸為1.07 Å且劑量為62.5 e-
/Å2
。
資料處理及定位重構。
用Cryosparc V2進行整個資料處理及定位重構。初始處理鑑別2.9M個粒子。進行若干2D分類工作以淨化粒子堆疊及移除離群值。最終,在均質優化工作中使用522,208個粒子,其產生3.68 Ang定位。非均勻優化產生3.43 Ang定位,其用於構建模型。2D等級明確證實存在2Mab:2TGFβ1複合物,確認由SEC-MAL實驗提出之化學計量(圖 30A
及30B
)。
模型構建及優化。
使用COOT及PHENIX進行所有模型構建及優化(Afonine等人Acta Crystallogr D Struct Biol
2018;74 6:531-44)。使用LAP/TGFβ1與人類化20E6之間的複合物作為起始模型;使用COOT將LAP-TGFβ1及人類化20E6-Fab初始安置在定位中作為剛性體,且使用密度重建一些環及分配正確序列。進行PHENIX真實空間優化模組以最佳化模型幾何結構。表 29
概述模型優化及統計:表 29
.人類化 22F9-Fab 及 LAP-TGFβ1 之模型優化及統計
| 外加對稱性 | C2 |
| 所使用之粒子 | 522,208 |
| 定位解析度(Å) | 3.4 |
| FSC臨界值 | 0.143 |
| 定位解析度範圍(Å) | 3-14 |
| 優化 | |
| 定位銳化B-因子(Å2 ) | 116.0 |
| 模型組成 | |
| 非氫原子 | 11926 |
| 蛋白質殘基 | 1530 |
| CC_mask: | 0.689 |
| CC_volume: | 0.680 |
| CC_peaks: | 0.615 |
| rmsd (鍵) (Å): | 0.007 |
| rmsd (角度) (o ): | 0.91 |
| 所有原子衝突評分 | 25.1 |
| 拉馬錢德蘭曲線: | |
| 離群: | 0.40 % |
| 允許: | 18.1 % |
| 有利: | 81.5 % |
| 旋轉異構體離群值: | 1.95 % |
最終模型含有LAP-TGFβ1二聚體之兩個鏈(鏈A及B,各自含有殘基1-61 + 70-208 + 216-241 + 250-361;抗原之編號假設不存在信號肽,亦即,Leu 1=完整序列中之Leu 30);22F9-Fab之兩個鏈(重鏈(VH),殘基1-221及輕鏈(VL),殘基2-214)。一個糖部分(NAG)在糖基化位點Asn A53及Asn B53處模型化;密度不足以保證所有其他可能的糖基化位置(A107、A147、B107及B147)之糖添加。
結構分析。
具有22F9-Fab之複合物中之LAP-TGFβ1二聚體之結構測定為3.4 A解析度。低溫EM定位之品質使得抗原及Fab之側鏈之分配為明確的。
包含相互作用界面之22F9-Fab互補位及LAP-TGFβ1抗原決定基殘基展示於圖 31A
及31B
中且概述於表 30
中。
界面由凡得瓦爾力及靜電相互作用組成,且對應於約900 Å2
內埋表面,如藉由PISA計算。抗原決定基由來自鏈A之殘基S35-P43以及來自鏈B之D272-K275、K280-H283及Y340 (TGFβ1殘基)形成。
22F9互補位由輕鏈(VL)殘基Y36、Y53、L58-S60及R98-Y100以及重鏈(VH)殘基S31-W33、H52及Y98-D106形成。參見圖31C-E。表 30 : LAP-TGFβ1 及 22F9-Fab* 之抗原決定基及互補位
*指示來自22F9-Fab VH或VL之與LAP-TGFβ1殘基相互作用之殘基。氫鍵相互作用由粗體類型指示(相互相用截止值設定為4.5 Å;氫鍵相互作用截止值設定為3.5 Å)。
| VH | TGFβ1 | VL |
| D272 | Y53 | |
| D100、Y104、D106 | R274 | Y53、E59 |
| K275 | Y53、L58、E59、S60 | |
| Y32、Y98、Y99、D100、Y101、D106 | K280 | |
| Y101 | W281 | |
| Y101 | H283 | |
| Y101 | Y340 | |
| VH | LAP | VL |
| S31、Y32 | S35 | |
| W33、W33 、Y32、H52 Y99、Y99 | Q36 | |
| W33、W33 | G37 | |
| E38 | ||
| M50、Y101、Y99 | V39 | |
| Y99 | P41 | Y100、R96、E97、L98 |
| G42 | R96、R96 、Y36、Y36 | |
| P43 | T31、Y36、R96 |
實例 22 :藉由氫氘交換質譜進行之人類化 20E6 抗體之分析
藉由氫氘交換質譜(HDX-MS)測定人類化抗LAP抗體20E6_H0.2_hIgG4mut (在此實例中稱為「人類化20E6」)與人類LAP-TGFβ1之間的接觸面積。HDX-MS量測氘與氫交換至蛋白質之醯胺主鏈。影響交換率之一個因素為氫對溶劑之暴露。當抗體結合時,抗原中交換程度之比較可鑑別其中結合抗體之蛋白質區域。
材料
● 人類LAP-TGFβ1蛋白質係購自R&D Systems且由N端249 aa潛在相關肽(LAP)及C端112 aa成熟TGFβ1蛋白質組成。蛋白質在10 mM磷酸鈉、150 mM氯化鈉,pH 7.4中進行緩衝液交換且濃縮至40 µM。
● 如實例11中所描述產生人類化抗LAP-TGFβ1抗體(20E6_H0.2_hIgG4mut)。抗體自7.1 mg/mL稀釋至5.8 mg/mL,等效於40 µM。
液相層析 - 質譜法
使用Waters Synapt G2Si Quadrupole Time-of-flight (TOF)質譜儀。對於經氘標記之樣本之肽鑑別及量測,設定質譜儀以僅TOF模式獲取一份完整掃描MS資料(低能)及一份MS(e)資料(高能)。掃描時間設定為0.4秒。勻變陷阱碰撞能量為15至45伏。
對於樣本消化及裝載,液相層析系統為用於分析型管柱梯度及輔助泵之Waters nanoAcquity二元泵。對於樣本消化及裝載,所使用之緩衝液為100%水及0.1%甲酸,流動速率為100微升/分鐘。對於分析梯度,緩衝液為緩衝液A (含0.1%甲酸之水)及緩衝液B (含0.1%甲酸之乙腈)。
梯度為在9分鐘內以40 µL/分鐘自5% B至35% B,接著在一分鐘內勻變至85% B,洗滌85% B一分鐘,及在5% B下再平衡一分鐘。接著,藉由在5%與95% B之間循環梯度來洗滌管柱,進行四次,其中在各步驟下一分鐘,接著在5% B下最終平衡一分鐘。捕集管柱為Waters Vanguard BEH C18 1.7 µm Guard Column且分析管柱為Waters BEH C18,1.7 µm,1×50 mm管柱。
藉由由Leaptec H/D-X PAL系統及用於管柱冷卻之Waters HDX腔室組成之Waters HDX單元進行氘標記之樣本操作。標記樣本盤設定為10℃之溫度,淬滅盤設定為1.5℃,且捕集器及分析管柱腔室設定為1.5℃。來自NovaBioassays之經固定之XIII型蛋白酶/胃蛋白酶管柱(w/w,1:1)在酶管柱腔室中保持在20℃下。
氘標記
將人類LAP-TGFβ1與人類化20E6混合達到以下濃度:人類LAP-TGFβ1為20 µM且人類化20E6為10 µM。藉由在10 mM磷酸鈉、150 mM氯化鈉,pH 7.4中培育人類LAP-TGFβ1來製備未結合之對照物。抗體結合樣本及未結合之對照物在室溫下培育一小時,隨後開始標記實驗。
對於經氘標記之樣本,將6 µL樣本與54 µL之含10 mM磷酸鈉、150 mM氯化鈉之氧化氘pD 7.4混合。標記時間點為0、10、60、600、6000及14,400秒。在各時間點之後,向50 µL冷淬滅緩衝液(含500 mM參(2-羧基乙基)膦(TCEP)之磷酸鹽緩衝液,pH 2.5)中添加50 µL標記混合物。在混合一次之後,接著將90 µL注射至管柱冷卻腔室中,其中樣本通過XIII型蛋白酶/胃蛋白酶管柱且將所得肽裝載至捕集管柱上。在4分鐘之後,閥門切換使XIII型蛋白酶/胃蛋白酶管柱不在一條線上。接著,捕集器在管線內與分析管柱切換且開始分析梯度及質譜儀資料收集。一式兩份地獲取各時間點。
資料分析
一式四份地獲取未經標記之結合及未結合樣本之液相層析-串聯質譜(LC-MS/MS)資料,且用ProteinLynx Global Server 3.0 (Waters Corporation)進行資料庫搜尋以驗證蛋白質之成功消化及產生來自雙重酶消化之肽清單。所使用之蛋白質資料庫為人類LAP-TGFβ1與隨機人類LAP-TGFβ1序列之組合,以減少假鑑別。
藉由DynamX (3.0.0版,Waters Corporation)處理來自氘標記實驗之質譜(MS)資料。對於各肽,人工檢驗由軟體選擇之質量、滯留時間及帶電狀態。
結果
由人類化20E6保護之人類LAP-TGFβ1肽展示於H/D差異曲線中(圖 32
)。
實例 23 :藉由 HDX-MS 進行之 鼠類 28G11 、 22F9 、 20E6 及 2F8 抗體之抗原決定基定位
如下文所描述,藉由HDX-MS測定鼠類抗LAP-TGFβ1抗體28G11、22F9、20E6及2F8與人類LAP-TGFβ1之間的接觸面積。
方法
所使用之材料如下:
● 人類LAP-TGFβ1蛋白質係購自R&D Systems且由N端249 aa潛在相關肽(LAP)及C端112 aa成熟TGFβ1蛋白質組成。蛋白質在10 mM磷酸鈉、150 mM氯化鈉,pH 7.4中進行緩衝液交換且濃縮至40 µM。
● 鼠類28G11_mIgG2a、鼠類22F9_mIgG2a及鼠類20E6_mIgG2a稀釋至40 µM。28G11(hyb)、22F9(hyb)及20E6(hyb)之重鏈及輕鏈可變區序列(提供於表 34
中)與購自BioLegend之mIgG2a恆定鼠類2F8 (IgG1)融合,且自0.5 mg/mL濃縮至40 µM。
除了在氘標記之樣本操作中,標記樣本盤設定為25℃而非10℃之溫度以外,以實例22中所描述之方式進行液相層析-質譜法。除了將人類LAP-TGFb1與抗體混合達到以下最終濃度以外,亦如實例22中所描述進行氘標記:人類LAP-TGFβ1為20 µM且抗體為20 µM。如實例22中所描述進行資料分析。
結果
由抗體保護之人類LAP-TGFβ1肽說明於圖 33
中展示之H/D差異曲線中。28G11、22F9及20E6之結合抗原決定基覆蓋LAP-TGFβ1蛋白質中之四個區域:胺基酸殘基14-25 (RKRIEAIRGQIL,區域1;SEQ ID NO:250)、30-39 (LASPPSQGEV,區域2;SEQ ID NO:251)、278-286 (GWKWIHEPK,區域3;SEQ ID NO:252)及340-346 (YVGRKPK,區域4;SEQ ID NO:253)。區域1及2位於LAP結構域中,且區域3及4位於成熟TGFβ1結構域中。
在抗體中偵測氘交換保護程度之差異。舉例而言,在比較20E6與28G11及22F9時,20E6在區域1處未展示氘交換保護,而28G11及22F9在抗體結合時具有可偵測之變化(分別為約1.3及1.9 Da)。亦觀測到區域2及3之氘交換之微小差異。特定言之,在區域2中,偵測到20E6之6 Da差異,但28G11之差異僅為4 Da。在區域3中,偵測到20E6之4 Da差異,但僅偵測到28G11之2 Da差異。值得注意的是,在低溫EM結構中未觀測到藉由HDX偵測之區域1處之相互相用,表明區域1處之氘交換保護並非由直接抗體:抗原結合引起,而是由此等抗體與LAP-TGFβ1之間的略微不同的結合相互作用引起之局部溶液動力學變化引起。總而言之,HDX資料與低溫EM結構一致。
觀測到抗體2F8結合於殘基205-225 (胺基酸VDINGFTTGRRGDLATIHGMN;SEQ ID NO:254)。
鼠類及人類LAP-TGFβ1之胺基酸序列為89%一致。所鑑別之抗原決定基皆位於同源區域中(圖 34
)。
實例 24 : 藉由尺寸排阻層析及多角度光散射獲得之與人類化 20E6 抗體複合的人類 LAP-TGFβ1 或 GARP-LAP-TGFβ1 之結合化學計量
藉由尺寸排阻層析及多角度光散射(SEC-MALS)測定與20E6_H0.2_hIgG4mut複合的人類LAP-TGFβ1或GARP-LAP-TGFβ1之結合化學計量。歸因於尺寸差異,單獨的人類LAP-TGFβ1、單獨的20E6_H0.2_hIgG4mut及複合物在SEC層析時在不同時間溶離。MALS偵測器幫助測定每個所偵測之峰之分子量。基於個別蛋白質及蛋白質複合物之分子量,可測定結合化學計量。
材料
● 人類LAP/TGFβ1蛋白質係購自R&D Systems且由N端249 aa潛在相關肽(LAP)及C端112 aa成熟TGFβ1蛋白質組成。蛋白質在10 mM磷酸鈉、150 mM氯化鈉,pH 7.4中進行緩衝液交換且濃縮至40 µM。
● 如實例16中所描述產生人類GARP-LAP-TGFβ1。
● 如實例11中所描述產生抗人類LAP-TGFβ1抗體(20E6_H0.2_hIgG4mut)。抗體自7.1 mg/mL稀釋至5.8 mg/mL,等效於40 µM。
尺寸排阻層析 - 多角度光散射
使用連接至光電二極體陣列偵測器及Wyatt光散射偵測器之Agilent 1200 HPLC進行尺寸排阻層析。在等度梯度下,使用10 mM磷酸鈉、150 mM氯化鈉,pH 7.4緩衝液,Superdex 200 Increase 5/150 GL管柱在0.2毫升/分鐘流動速率下運行。
將人類LAP-TGFβ1與抗體20E6_H0.2_hIgG4mut混合達到以下最終濃度:人類LAP-TGFβ1為5 µM且抗體20E6_H0.2_hIgG4mut為2.5 µM。使用包括凝膠過濾標準及牛血清白蛋白標準之SEC-MALS系統分析三十微升之5 µM單獨的人類LAP/TGFβ1、單獨的5 µM 20E6_H0.2_hIgG4mut及LAP-TGFβ1:20E6複合物。亦分析以下樣本:30 µL之單獨的7.5 µM人類LAP-TGFβ1、7.5 µM之單獨的抗體20E6_H0.2_hIgG4mut及GARP-LAP-TGFβ1:20E6_H0.2_hIgG4mut複合物。
資料分析
使用ChemStation (A.01.08.108版,Agilent Technologies)在280 nM UV吸光度下標繪所有層析圖。使用ASTRA (6.1.2.84版,Wyatt Technologies)分析光散射資料。所有峰為在半高下之整合式交叉全寬。
結果
LAP-TGFβ1:20E6_H0.2_hIgG4mut複合物及GARP-LAP-TGFβ1複合物之SEC-MALS分析分別展示於圖 35A
及35B
中。基於各蛋白質及蛋白質複合物之分子量,LAP-TGFβ1複合物之結合化學計量為2:2莫耳比,亦即,兩個LAP-TGFβ1二聚體複本結合於兩個20E6_H0.2_hIgG4mut抗體複本;GARP-LAP-TGFβ1複合物之結合化學計量為2:1莫耳比。在存在GARP之情況下,LAP-TGFβ1二聚體中僅一個結合位點能夠與抗體相互作用。
實例 25 : CT26 同基因型模型中抗 LAP 抗體之功效
此實例描述在CT26結腸直腸癌腫瘤模型(癌症之同基因型模型)中,抗包圍抗體與抗PD-1抗體之組合之功效。在此實驗中,使用抗LAP抗體之變異體,其中抗體之Fc部分為IgG2a同型而非在親本融合瘤中發現之同型。
簡言之,將3×105
個CT26結腸直腸癌細胞皮下植入6-8週齡Balb/c小鼠中。腫瘤生長至48 mm2
之平均尺寸,此時將攜帶腫瘤之動物隨機分組,每組10隻動物。
第0、3、6、9及12天,向一組動物腹膜內投與3 mg/kg之大鼠抗PD-1純系RMP1-14-IgG2a或10 mg/kg之抗PD-1與抗體28G11-IgG2a之組合。亦向各動物組投與同型對照抗體(大鼠IgG2a及/或小鼠IgG2a,未圖示)。
在第0、3、6、9及12天,向另一組動物腹膜內投與3 mg/kg之大鼠抗PD-1純系RMP1-14-IgG2a、10 mg/kg之抗體16B4-IgG2a或10 mg/kg之抗PD-1與抗體16B4-IgG2a之組合。亦向各動物組投與同型對照抗體(大鼠IgG2a及/或小鼠IgG2a,未圖示)。
每天評估存活率且藉由測徑規使用式V=W2×L/2每週量測腫瘤體積3次。在給藥後隨訪動物53天。
如圖 36A
及36B
中所示,與單獨的抗PD-1相比,用抗體28G11處理此同基因型模型引起完全反應率增加5倍。相比之下,如圖 36C-36F
中所示,用抗體16B4處理動物對腫瘤生長無作用。實情為,用16B4與抗PD-1之組合處理動物引起在單獨的抗PD-1抗體情況下發現之反應率降低。此等資料表明兩種抗LAP抗體28G11及16B4在小鼠腫瘤模型中具有不同功能特性。
實例 26 : 抗 LAP 抗體在 EMT6 同基因型模型中之功效
此實例描述在癌症之另一種同基因型模型,亦即,EMT6乳癌腫瘤模型中,抗LAP抗體與抗PD-1抗體之組合之功效。
簡言之,將3×105
個EMT6乳癌細胞皮下植入6-8週齡Balb/c小鼠之右後側腹中。腫瘤生長至75 mm2
之平均尺寸,此時將攜帶腫瘤之動物隨機分成10個組,每組10隻動物,且第0、3、6、9、12、15、18及21天根據以下方案腹膜內給藥:表 31
.EMT6 同基因型模型之抗體及給藥資訊
| 組 | 說明 | 劑量 |
| 1 | 大鼠IgG2a 小鼠IgG2a | 5 mg/kg 15 mg/kg |
| 2 | 大鼠抗PD-1 RMP1-14-IgG2a 小鼠IgG2a | 5 mg/kg 15 mg/kg |
| 3 | 28G11_IgG2a 大鼠IgG2a | 10 mg/kg 5 mg/kg |
| 4 | 大鼠抗PD-1 RMP1-14-IgG2a 28G11_IgG2a | 5 mg/kg 10 mg/kg |
| 5 | 22F9_IgG2a 大鼠IgG2a | 10 mg/kg 5 mg/kg |
| 6 | 22F9_IgG2a | 15 mg/kg |
| 7 | 大鼠抗PD-1 RMP1-14-IgG2a 22F9_IgG2a | 5 mg/kg 10 mg/kg |
| 8 | 大鼠抗PD-1 RMP1-14-IgG2a 22F9_IgG2a | 5 mg/kg 15 mg/kg |
| 9 | 20E6_IgG2a 大鼠IgG2a | 10 mg/kg 5 mg/kg |
| 10 | 大鼠抗PD-1 RMP1-14-IgG2a 20E6_IgG2a | 5 mg/kg 10 mg/kg |
每天評估存活率且藉由測徑規使用式V=W2×L/2每週量測腫瘤體積3次。在給藥後隨訪動物28天。資料以平均腫瘤體積+/-SEM形式圖示。
如圖 37
中所示,與單獨的同型對照抗體或抗PD-1相比,用抗體28G11 (單獨或與抗PD-1之組合)處理動物引起腫瘤生長之統計顯著降低。類似地,與單獨的同型對照抗體或抗PD-1相比,用抗體22F9(圖 38
)及20E6(圖 39
) (單獨或與抗PD-1之組合)處理動物引起腫瘤生長之統計顯著降低。此等資料表明在EMT6小鼠模型中,28G11、22F9及20E6與抗PD-1抗體之組合皆具有活性。
實例 27 : 抗 LAP 抗體在 4T1 乳癌腫瘤轉移模型中之功效
此實例描述在腫瘤轉移模型,亦即,4T1乳癌腫瘤轉移模型中,作為單藥療法之抗LAP抗體之功效。
簡言之,將1×105
個4T1乳癌細胞植入6-8週齡Balb/c小鼠之乳房脂肪墊中。在植入之後第一天,將動物隨機分組,每組7隻動物。向動物投與小鼠IgG1同型對照抗體、小鼠IgG2a對照抗體、抗TGFβ純系1D11-IgG1以及抗LAP抗體28G11及16B4。在第0、3、6、9及12天以10 mg/kg向所有動物腹膜內給藥。在給藥後第29天,處死動物且對轉移性肺腫瘤節結進行計數。資料圖示平均肺節結計數±SEM。
如圖 40
中所示,與用同型對照抗體處理之動物相比,用抗TGFβ抗體1D11及28G11 (但非16B4)處理動物引起轉移性肺節結之統計顯著降低(p<0.05,不成對T測試,接著移除離群值)。此等資料表明兩種抗LAP抗體28G11及16B4在腫瘤轉移之小鼠模型中具有不同功能作用。28G11具有與抗TGFβ抗體1D11類似之功效之發現結果與28G11之作用係歸因於對TGFβ路徑之作用一致。
實例 28 : 抗 LAP 抗體與放射之組合在 CT26 同基因型模型中之功效
此實例描述抗LAP抗體與放射之組合在同基因型CT26腫瘤模型中之功效。
簡言之,將1×106
個CT26結腸直腸癌細胞植入6-8週齡Balb/c小鼠中。在植入後第八天,當平均腫瘤體積為300 mm2
時(第0天),將動物隨機分成6個組,每組16隻動物。自第0天開始,向動物投與小鼠IgG2a同型對照抗體(第1組)、抗LAP抗體28G11-IgG2a (第2組)、12 Gy放射療法及小鼠IgG2a同型對照抗體(第3組)、20 Gy放射療法及小鼠IgG2a同型對照抗體(第4組)、12 Gy放射療法及抗LAP抗體28G11-IgG2a (第5組)或20 Gy放射療法及抗LAP抗體28G11-IgG2a (第6組)。所有抗體皆以10 mg/kg腹膜內給藥。第1組及第2組在第0、3及6天接受總共3次抗體給藥,且在第7天由於大腫瘤負荷而處死此等動物。第3-6組在第0、3、6、9及12天接受總共5次抗體給藥。亦在第7天處死來自第3-6組之三隻隨機動物且隨訪其餘動物至第19天。在所有其中動物接受放射療法之情況下,僅在第0天進行一次放射。每天評估存活率且藉由測徑規使用式V=W2×L/2每週量測腫瘤體積3次。資料呈現為存活動物之平均腫瘤體積+/-SEM。
如圖 41A
及41B
中所示,用單獨的12或20 Gy放射處理動物引起腫瘤生長之延緩。與單獨的放射治療相比,在12 Gy放射劑量下共同投與28G11引起腫瘤生長之統計顯著降低(****P<0.0001,***P=0.0004,2向ANOVA)。與單獨的放射治療相比,在20 Gy放射劑量下共同投與28G11亦引起降低,且作用亦為統計顯著的。
實例 29 : 抗 LAP 抗體對 CD73 表現 之作用
在此實例中,檢驗抗LAP抗體對腫瘤微環境中之CD73表現之作用。CD73為將單磷酸腺苷(AMP)加工成腺苷之細胞表面酶,腺苷為在腫瘤微環境中具有已知的免疫抑制性作用之分子。
CT26腫瘤在Balb/c小鼠中生長至300 mm2
(稱為第0天),且在第0、3及6天以10 mg/kg投與抗體28G11。在第0天,小鼠用單次劑量之靶向放射(12 Gy或20 Gy)處理。在放射之後第7天藉由流式細胞測量術檢驗單核球性骨髓衍生之抑制細胞(mMDSC)、M2巨噬細胞及樹突狀細胞上之CD73表現。分組如下:
第1組:同型對照,無放射(n=5)
第2組:28G11,無放射(n=5)
第3組:同型對照,12 Gy放射(N=3)
第4組:同型對照,20 Gy放射(N=3)
第5組:28G11,12 Gy放射(N=2)
第6組:28G11,20 Gy放射(N=3)
如圖 42A-42C
中所示,兩種劑量(12 Gy及20 Gy)之放射皆誘導mMDSC、M2巨噬細胞及樹突狀細胞上之CD73表現。此CD73表現之增加由用28G11處理減弱。此外,28G11使CD73表現降低至低於未用放射處理之小鼠之mMDSC中之基線含量(圖 42A
)。此等結果表明,抗LAP抗體處理降低抑制性細胞群體之數目及免疫抑制性能力,如在降低之比例之CD73陽性mMDSC、M2巨噬細胞及樹突狀細胞中反映。
實例 30 : 抗 LAP 抗體之生物分佈
在此實例中,檢驗攜帶腫瘤之小鼠中之抗LAP抗體之生物分佈。
簡言之,將1×106
個CT26細胞植入3隻Balb/C小鼠中且使腫瘤生長直至其達成150 mm3
之平均腫瘤體積。以10 mg/kg向動物投與28G11_hIgG1之單次注射。在注射後第三天,處死動物且收集血液。用PBS灌注小鼠且收集心臟、肝、腎臟、骨骼、結腸、肺及脾組織。將組織置放於10%中性緩衝福爾馬林(Neutral buffered formalin)中,在4℃下儲存隔夜且轉移至80%乙醇中。將組織樣本切片且用抗人類IgG1染色以鑑別動物內28G11之位置。在大部分組織中觀測到最小染色,其中在腫瘤組織中觀測到最強染色。
實例 31. 20E6 及 28G11 ( 單獨及與抗 PD-1 之組合 ) 在 癌症之動物模型中之功效
此實例描述在EMT6小鼠乳癌腫瘤模型中測試20E6及28G11抗體(單獨及與抗PD-1之組合)之功效。所使用之抗體列舉如下:
o 小鼠 x [LAP-TGFb1_H] mAb (28G11_VH_N56Q) mIgG2a/κ(CX): 28G11_mIgG2a
o 小鼠 x [LAP-TGFb1_H] mAb (20E6_Q1E_N54Q) IgG2a/κ(CX): 20E6_mIgG2a
o 小鼠 x [HEXON_Ad] mAb (TC31.27F11.C2) IgG2a/κ(CC):同型對照抗體
簡言之,將0.3×106
個EMT6小鼠乳癌細胞皮下接種至6-8週齡Balb/c小鼠中。當腫瘤生長至約85 mm3
之平均尺寸時,將分成6個處理組,每組10隻動物,此時開始處理。腹膜內投與所有抗體。抗體20E6及28G11係每週兩次以10 mg/kg投與,而抗PD1係每5天一次以5 mg/kg投與。媒劑對照組由以5 mg/kg投與之鼠類IgG1同型對照物及以10 mg/kg投與之鼠類IgG2a同型對照物組成。每週量測腫瘤2-3次且使用下式計算腫瘤體積:V=(腫瘤寬度)2
×(腫瘤長度)/2。觀測到與用同型對照抗體處理之個體相比,用單獨的抗體20E6及抗體28G11處理個體引起顯著腫瘤生長抑制。此外,抗體20E6或抗體28G11與抗PD-1抗體之組合處理引起6個完全反應,其中動物不具有任何殘餘腫瘤。參見圖 43A-43H
。觀測到所有處理具有良好耐受性且未引起任何體重損失。
實例 32 : 抗 LAP F(ab') 與 人類 LAP-TGFβ 同功異型物 1 、 2 及 3 之結合
為避免親和力量測中親合力之干擾,此實例分析20E6 F(ab')結合蛋白質與人類LAP-TGFβ之結合動力學。此實例使用表面電漿子共振描述人類化20E6 F(ab')結合蛋白質結合於人類LAP-TGFβ同功異型物1、2及3之同功異型物特異性。
在具有1x HBS-EP+之Biacore T200儀器(Teknova,目錄號H8022)上,根據套組方案(GE Healthcare,目錄號BR100839)固定S系列CM4感測器晶片(GE Healthcare,目錄號BR100534)及抗人類Fc捕捉抗體。在25℃下,在具有0.1mg/mL之BSA之1x HBS-EP+ (Jackson Immunoresearch,目錄號001-000-162)中進行人類LAP-TGFβ同功異型物1、2及3與人類化20E6 F(ab')之間的動力學結合相互作用。將約50-65 RU人類LAP-TGFβ-Fc同功異型物捕捉至抗人類Fc表面,接著注射以1:3連續稀釋之人類化20E6 F(ab'),自3000 nM至1.37 nM且包括0 nM F(ab')。藉由自參考(僅捕捉表面)流動細胞之信號減去0 nM F(ab')注射來雙重參考結合資料。藉由以1:1結合模型擬合資料來測定結合率常數(GE Healthcare Biacore T200 Evaluation軟體2.0)。
如圖式及表32中所示,當捕捉至抗人類Fc捕捉感測器晶片時,由於IgG1及由LAP-TGFβ1分子呈現之二價抗原決定基之二價性質,人類化20E6 IgG1抗體呈現非1:1結合概況。參見圖 44A
。亦觀測到單價人類化20E6 F(ab')以奈莫耳親和力結合於人類LAP-TGFβ1 (圖 44B
),但在人類LAP-TGFβ2 (圖 44C
)或LAP-TGFβ3 (圖 44D
)之情況下未觀測到顯著信號增加。此等資料說明人類化20E6 F(ab')特異性結合於人類LAP-TGFβ1。表 32. 結合於人類 TGFβ 同功異型物之人類化 20E6 F(ab') 之 結合參數
| 同功異型物 | kon (×106 M-1 s-1 ) | koff (×10-2 s-1 ) | KD (nM) |
| LAP-TGFβ1 | 1.96 | 8.00 | 40.8 |
| LAP-TGFβ2 | - | - | - |
| LAP-TGFβ3 | - | - | - |
實例 33 :抗 LAP F(ab') 與 人類、食蟹獼猴、大鼠及小鼠 LAP-TGFβ1 之結合
此實例使用表面電漿子共振描述人類化20E6 F(ab')結合蛋白質結合於來自若干物種之LAP-TGFβ1之物種特異性。
在具有1x HBS-EP+之Biacore T200儀器(Teknova,目錄號H8022)上,根據套組方案(GE Healthcare,目錄號BR100839)固定S系列CM4感測器晶片(GE Healthcare,目錄號BR100534)及抗人類Fc捕捉抗體。在25℃下,在具有0.1 mg/mL之BSA之1x HBS-EP+ (Jackson Immunoresearch,目錄號001-000-162)中進行人類、食蟹獼猴、大鼠及小鼠LAP-TGFβ1與人類化20E6 F(ab')之間的動力學結合相互作用。將約60-95 RU人類、食蟹獼猴、大鼠及小鼠LAP-TGFβ-Fc捕捉至抗人類Fc表面,接著注射以1:3連續稀釋之人類化20E6 F(ab'),自3000 nM至1.37 nM且包括0 nM F(ab')。藉由自參考(僅捕捉表面)流動細胞之信號減去0 nM F(ab')注射來雙重參考結合資料。藉由以1:1結合模型擬合資料來測定結合率常數(GE Healthcare Biacore T200 Evaluation軟體2.0)。
如圖式及表33中所示,人類化20E6 F(ab')以奈莫耳親和力結合於人類LAP-TGFβ1 (圖 45A
)、食蟹獼猴LAP-TGFβ1 (圖 45B
)、大鼠LAP-TGFβ1 (圖 45C
)及小鼠LAP-TGFβ1 (圖 45D
)。表 33. 人類化 20E6 F(ab') 結合於來自多個物種之 LAP-TGFβ1 之 結合參數
| 物種 | kon (×106 M-1 s-1 ) | koff (×10-2 s-1 ) | KD (nM) |
| 人類 | 1.91 ± 0.53 | 9.39 ± 2.35 | 49.5 ± 1.4 |
| 食蟹獼猴 | 1.58 ± 0.03 | 9.50 ± 0.12 | 60.3 ± 0.9 |
| 大鼠 | 1.79 ± 0.42 | 10.6 ± 2.57 | 59.4 ± 0.7 |
| 小鼠 | 1.64 ± 0.04 | 7.90 ± 0.11 | 48.3 ± 0.9 |
| 所有所報導之值為來自一式三份量測值之平均值±標準差 |
實例 34 : LAP-TGFb1 之整合素 (avb6) 活化之抑制
此實例檢驗使用LAP抗體20E6_mIgG2a進行之LAP-TGFb1之整合素(avb6)活化之抑制。在37C下,將重組型人類αvβ6整合素(R&D Systems;目錄號3817-AV)在不含血清之RPMI中以2 μg/ml塗佈於96孔平底組織培養盤中歷時2小時。用20E6_mIgG2a、同型對照物或抗αVβ6 (10D5;可自Millipore Sigma購得)之3倍連續稀釋物(高達30 μg/ml)處理各孔。在處理之後,立即向盤中相繼添加表現人類LAP-TGFβ1之P3U1細胞(5×104
個/孔)及HEK-Blue TGFβ (2×104
個/孔)細胞(HEK-BlueTGFβ細胞含有SMAD結合元件反應性SEAP報導子,其在生物活性TGFβ結合於受體時引起分泌SEAP)。接著,盤在37℃下培育隔夜且在第二天,收集125 μL上清液且塗佈於96孔v形底部盤中且在500 G下再旋轉5分鐘以移除細胞。利用Great EscAPe Chemiluminescence套組2.0 (Takara Bio;目錄號631736)根據製造商方案偵測上清液(25 μL)中之所分泌之鹼性磷酸酶(SEAP)。資料表明與同型對照抗體及抗αVβ6 (10D5)抗體相比,20E6_mIgG2a有效抑制LAP-TGFb1之整合素avb6活化(圖 46
)。表 34.
序列表概述
| SEQ ID | 說明 | 序列 |
| 蛋白質序列 | ||
| 1 | 人類LAP-TGFβ1 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 2 | 人類LAP-TGFβ1之LAP區域 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHR |
| 3 | 人類LAP-TGFβ2 | LSTCSTLDMDQFMRKRIEAIRGQILSKLKLTSPPEDYPEPEEVPPEVISIYNSTRDLLQEKASRRAAACERERSDEEYYAKEVYKIDMPPFFPSENAIPPTFYRPYFRIVRFDVSAMEKNASNLVKAEFRVFRLQNPKARVPEQRIELYQILKSKDLTSPTQRYIDSKVVKTRAEGEWLSFDVTDAVHEWLHHKDRNLGFKISLHCPCCTFVPSNNYIIPNKSEELEARFAGIDGTSTYTSGDQKTIKSTRKKNSGKTPHLLLMLLPSYRLESQQTNRRKKRALDAAYCFRNVQDNCCLRPLYIDFKRDLGWKWIHEPKGYNANFCAGACPYLWSSDTQHSRVLSLYNTINPEASASPCCVSQDLEPLTILYYIGKTPKIEQLSNMIVKSCKCS |
| 4 | 人類LAP-TGFβ2之LAP區域 | LSTCSTLDMDQFMRKRIEAIRGQILSKLKLTSPPEDYPEPEEVPPEVISIYNSTRDLLQEKASRRAAACERERSDEEYYAKEVYKIDMPPFFPSENAIPPTFYRPYFRIVRFDVSAMEKNASNLVKAEFRVFRLQNPKARVPEQRIELYQILKSKDLTSPTQRYIDSKVVKTRAEGEWLSFDVTDAVHEWLHHKDRNLGFKISLHCPCCTFVPSNNYIIPNKSEELEARFAGIDGTSTYTSGDQKTIKSTRK KNSGKTPHLLLMLLPSYRLESQQTNRRKKR |
| 5 | 人類LAP-TGFβ3 | LSTCTTLDFGHIKKKRVEAIRGQILSKLRLTSPPEPTVMTHVPYQVLALYNSTRELLEEMHGEREEGCTQENTESEYYAKEIHKFDMIQGLAEHNELAVCPKGITSKVFRFNVSSVEKNRTNLFRAEFRVLRVPNPSSKRNEQRIELFQILRPDEHIAKQRYIGGKNLPTRGTAEWLSFDVTDTVREWLLRRESNLGLEISIHCPCHTFQPNGDILENIHEVMEIKFKGVDNEDDHGRGDLGRLKKQKDHHNPHLILMMIPPHRLDNPGQGGQRKKRALDTNYCFRNLEENCCVRPLYIDFRQDLGWKWVHEPKGYYANFCSGPCPYLRSADTTHSTVLGLYNTLNPEASASPCCVPQDLEPLTILYYVGRTPKVEQLSNMVVKSCKCS |
| 6 | 人類LAP-TGFβ3之LAP區域 | LSTCTTLDFGHIKKKRVEAIRGQILSKLRLTSPPEPTVMTHVPYQVLALYNSTRELLEEMHGEREEGCTQENTESEYYAKEIHKFDMIQGLAEHNELAVCPKGITSKVFRFNVSSVEKNRTNLFRAEFRVLRVPNPSSKRNEQRIELFQILRPDEHIAKQRYIGGKNLPTRGTAEWLSFDVTDTVREWLLRRESNLGLEISIHCPCHTFQPNGDILENIHEVMEIKFKGVDNEDDHGRGDLGRLKKQKDHHNPHLILMMIPPHRLDNPGQGGQRKKR |
| 7 | 小鼠LAP-TGFβ1 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESADPEPEPEADYYAKEVTRVLMVDRNNAIYEKTKDISHSIYMFFNTSDIREAVPEPPLLSRAELRLQRLKSSVEQHVELYQKYSNNSWRYLGNRLLTPTDTPEWLSFDVTGVVRQWLNQGDGIQGFRFSAHCSCDSKDNKLHVEINGISPKRRGDLGTIHDMNRPFLLLMATPLERAQHLHSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASASPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 8 | 小鼠LAP-TGFβ1之LAP區域 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESADPEPEPEADYYAKEVTRVLMVDRNNAIYEKTKDISHSIYMFFNTSDIREAVPEPPLLSRAELRLQRLKSSVEQHVELYQKYSNSWRYLGNRLLTPTDTPEWLSFDVTGVVRQWLNQGDGIQGFRFSAHCSCDSKDNKLHVEINGISPKRRGDLGTIHDMNRPFLLLMATPLERAQHLHSSRHRR |
| 9 | 小鼠LAP-TGFβ2 | LSTCSTLDMDQFMRKRIEAIRGQILSKLKLTSPPEDYPEPDEVPPEVISIYNSTRDLLQEKASRRAAACERERSDEEYYAKEVYKIDMPSHLPSENAIPPTFYRPYFRIVRFDVSTMEKNASNLVKAEFRVFRLQNPKARVAEQRIELYQILKSKDLTSPTQRYIDSKVVKTRAEGEWLSFDVTDAVQEWLHHKDRNLGFKISLHCPCCTFVPSNNYIIPNKSEELEARFAGIDGTSTYASGDQKTIKSTRKKTSGKTPHLLLMLLPSYRLESQQSSRRKKRALDAAYCFRNVQDNCCLRPLYIDFKRDLGWKWIHEPKGYNANFCAGACPYLWSSDTQHTKVLSLYNTINPEASASPCCVSQDLEPLTILYYIGNTPKIEQLSNMIVKSCKCS |
| 10 | 小鼠LAP-TGFβ2之LAP區域 | LSTCSTLDMDQFMRKRIEAIRGQILSKLKLTSPPEDYPEPDEVPPEVISIYNSTRDLLQEKASRRAAACERERSDEEYYAKEVYKIDMPSHLPSENAIPPTFYRPYFRIVRFDVSTMEKNASNLVKAEFRVFRLQNPKARVAEQRIELYQILKSKDLTSPTQRYIDSKVVKTRAEGEWLSFDVTDAVQEWLHHKDRNLGFKISLHCPCCTFVPSNNYIIPNKSEELEARFAGIDGTSTYASGDQKTIKSTRKKTSGKTPHLLLMLLPSYRLESQQSSRRKKR |
| 11 | 小鼠LAP-TGFβ3 | LSTCTTLDFGHIKKKRVEAIRGQILSKLRLTSPPEPSVMTHVPYQVLALYNSTRELLEEMHGEREEGCTQETSESEYYAKEIHKFDMIQGLAEHNELAVCPKGITSKVFRFNVSSVEKNGTNLFRAEFRVLRVPNPSSKRTEQRIELFQILRPDEHIAKQRYIGGKNLPTRGTAEWLSFDVTDTVREWLLRRESNLGLEISIHCPCHTFQPNGDILENVHEVMEIKFKGVDNEDDHGRGDLGRLKKQKDHHNPHLILMMIPPHRLDSPGQGSQRKKRALDTNYCFRNLEENCCVRPLYIDFRQDLGWKWVHEPKGYYANFCSGPCPYLRSADTTHSTVLGLYNTLNPEASASPCCVPQDLEPLTILYYVGRTPKVEQLSNMVVKSCKCS |
| 12 | 小鼠LAP-TGFβ3之LAP區域 | LSTCTTLDFGHIKKKRVEAIRGQILSKLRLTSPPEPSVMTHVPYQVLALYNSTRELLEEMHGEREEGCTQETSESEYYAKEIHKFDMIQGLAEHNELAVCPKGITSKVFRFNVSSVEKNGTNLFRAEFRVLRVPNPSSKRTEQRIELFQILRPDEHIAKQRYIGGKNLPTRGTAEWLSFDVTDTVREWLLRRESNLGLEISIHCPCHTFQPNGDILENVHEVMEIKFKGVDNEDDHGRGDLGRLKKQKDHHNPHLILMMIPPHRLDSPGQGSQRKKR |
| 13 | 人類LAP-TGFβ1,「開放構形」 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADTYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 14 | 人類LAP-TGFβ1,「封閉構形」 | LSTCKTIDMELVKRKRIEAIRGQILSCLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYCAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 15 | 人類自由TGFβ1 (不具有之成熟TGFβ1) | ALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 257 | 圖34中之人類LAP-TGFβ1 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINAGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 結合蛋白質、抗體及抗原結合片段 | ||
| 16 | 28G11(hyb)VHCDR1 | DYYMS |
| 17 | 28G11(hyb)VHCDR2 (用於人類化之VHCDR2之延伸定義) | FIRNKPNGYTTE |
| 18 | 28G11(hyb)VHCDR3 | YTGGGYFDY |
| 19 | 28G11(hyb)VLCDR1 | RASQDISNYLN |
| 20 | 28G11(hyb)VLCDR2 | YTSRLHS |
| 21 | 28G11(hyb)VLCDR3 | QQGDTLPWT |
| 22 | 28G11(hyb) VH | EVKLVESGGGLVQPGGSLSLSCAASGFTFT DYYMS WVRQPPGKALEWLG FIRNKPNGYTTE YSASVKGRFTISRDNSQSILYLQMNVLRAEDSATYYCAR YTGGGYFDY WGQGTTLTVSS |
| 23 | 28G11(hyb) VL | DIQMTQTTSSLSASLGDRLTISC RASQDISNYLN WYQQKPDGTVKLLIY YTSRLHS GVPSRFSGSGSGTDYSLTISNLEQADIATYFC QQGDTLPWT FGGGTKLEIK |
| 24 | 28G11(hyb)重鏈 | EVKLVESGGGLVQPGGSLSLSCAASGFTFTDYYMSWVRQPPGKALEWLGFIRNKPNGYTTEYSASVKGRFTISRDNSQSILYLQMNVLRAEDSATYYCARYTGGGYFDYWGQGTTLTVSSAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK |
| 25 | 28G11(hyb)輕鏈 | DIQMTQTTSSLSASLGDRLTISCRASQDISNYLNWYQQKPDGTVKLLIYYTSRLHSGVPSRFSGSGSGTDYSLTISNLEQADIATYFCQQGDTLPWTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC |
| 26 | 28G11 VHCDR2 N56Q | FIRNKPQGYTTE |
| 27 | 28G11 VHCDR2 N56S | FIRNKPSGYTTE |
| 28 | 28G11 VHCDR2 N56H | FIRNKPHGYTTE |
| 29 | 28G11 VHCDR2 N56L | FIRNKPLGYTTE |
| 30 | 28G11 VHCDR2 N56D | FIRNKPDGYTTE |
| 31 | 28G11_H0 VH | EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYYMS WVRQAPGKGLEWVGFIRNKPNGYTTE YSASVKGRFTISRDDSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSS |
| 32 | 28G11_H0_IgG1 | EVQLVESGGGLVQPGGSLRLSCAASGFTFSDYYMS WVRQAPGKGLEWVGFIRNKPNGYTTE YSASVKGRFTISRDDSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 33 | 28G11_H1 VH | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWLGFIRNKPNGYTTE YSASVKGRFTISRDDSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSS |
| 34 | 28G11_H1_IgG1 | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWLGFIRNKPNGYTTE YSASVKGRFTISRDDSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 35 | 28G11_H2 VH | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWLGFIRNKPNGYTTE YSASVKGRFTISRDNSQSSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLLTVSS |
| 36 | 28G11_H2_IgG1 | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWLGFIRNKPNGYTTE YSASVKGRFTISRDNSQSSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLLTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 37 | 28G11_H2_IgG4mut | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWLGFIRNKPNGYTTE YSASVKGRFTISRDNSQSSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLLTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 38 | 28G11_H2.1 VH | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWLGFIRNKPQGYTTE YSASVKGRFTISRDNSQSSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLLTVSS |
| 39 | 28G11_H2.1_IgG1 | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWLGFIRNKPQGYTTE YSASVKGRFTISRDNSQSSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLLTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 40 | 28G11_H2a VH | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWVGFIRNKPNGYTTE YSASVKGRFTISRDNSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSS |
| 41 | 28G11_H2a_IgG1 | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWVGFIRNKPNGYTTE YSASVKGRFTISRDNSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 42 | 28G11_H2b VH | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWVGFIRNKPQGYTTE YSASVKGRFTISRDNSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSS |
| 43 | 28G11_H2b_IgG1 | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWVGFIRNKPQGYTTE YSASVKGRFTISRDNSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 44 | 28G11_H2b_hIgG4mut VH | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWVGFIRNKPQGYTTE YSASVKGRFTISRDNSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSS |
| 45 | 28G11_H2b_hIgG4mut | EVQLVESGGGLVQPGGSLRLSCAASGFTFTDYYMS WVRQAPGKGLEWVGFIRNKPQGYTTE YSASVKGRFTISRDNSKNSLYLQMNSLKTEDTAVYYCARYTGGGYFDY WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 46 | 28G11_L1 VL | DIQMTQSPSSLSASVGDRVTITCRASQDISNYLN WYQQKPGKVPKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYFCQQGDTLPWT FGQGTKLEIK |
| 47 | 28G11_L1 | DIQMTQSPSSLSASVGDRVTITCRASQDISNYLN WYQQKPGKVPKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYFCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 48 | 28G11_L2 VL | DIQMTQSPSSLSASVGDRVTITCRASQDISNYLN WYQQKPGKTVKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYFCQQGDTLPWT FGQGTKLEIK |
| 49 | 28G11_L2 | DIQMTQSPSSLSASVGDRVTITCRASQDISNYLN WYQQKPGKTVKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYFCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 50 | 28G11_L3 VL | DIQMTQSPSSLSASVGDRLTISCRASQDISNYLN WYQQKPGKTVKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYFCQQGDTLPWT FGQGTKLEIK |
| 51 | 28G11_L3 | DIQMTQSPSSLSASVGDRLTISCRASQDISNYLN WYQQKPGKTVKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYFCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 52 | 28G11_L3a VL | DIQMTQSPSSLSASVGDRLTISCRASQDISNYL NWYQQKPGKVVKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYYCQQGDTLPWT FGQGTKLEIK |
| 53 | 28G11_L3a | DIQMTQSPSSLSASVGDRLTISCRASQDISNYL NWYQQKPGKVVKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDVATYYCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 54 | 22F9(hyb)VHCDR1 | GYTFTSYWMH |
| 55 | 22F9(hyb)VHCDR2 | MIHPNSGSTN |
| 56 | 22F9(hyb)VHCDR3 | YDYDGFFDV |
| 57 | 22F9(hyb)VLCDR1 | RASKSVSTSGYSYMH |
| 58 | 22F9(hyb)VLCDR2 | LASNLES |
| 59 | 22F9(hyb)VLCDR3 | QHSRELPYT |
| 60 | 22F9(hyb)VH | QVQLQQPGAELVKPGASVKLSCKASGYTFTSYWMH WVKQRPGQGLEWIGMIHPNSGSTN YNEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCAYYDYDGFFDV WGTGTTVTVSS |
| 61 | 22F9(hyb) VL | DIVLTQSPASLDVSLGQRATISCRASKSVSTSGYSYMH WYQQKSGQPPKLLIYLASNLES GVPARFSGSGSGTHFTLNIHPVEEEDAATYYCQHSRELPYT FGGGTKLEIK |
| 62 | 22F9(hyb)重鏈 | QVQLQQPGAELVKPGASVKLSCKASGYTFTSYWMH WVKQRPGQGLEWIGMIHPNSGSTN YNEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCAYYDYDGFFDV WGTGTTVTVSSAKTTPPSVYPLAPGSAAQTNSMVTLGCLVKGYFPEPVTVTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVPSSPRPSETVTCNVAHPASSTKVDKKIVPRDCGCKPCICTVPEVSSVFIFPPKPKDVLTITLTPKVTCVVVDISKDDPEVQFSWFVDDVEVHTAQTQPREEQFNSTFRSVSELPIMHQDWLNGKEFKCRVNSAAFPAPIEKTISKTKGRPKAPQVYTIPPPKEQMAKDKVSLTCMITDFFPEDITVEWQWNGQPAENYKNTQPIMNTNGSYFVYSKLNVQKSNWEAGNTFTCSVLHEGLHNHHTEKSLSHSPGK |
| 63 | 22F9(hyb)輕鏈 | DIVLTQSPASLDVSLGQRATISCRASKSVSTSGYSYMH WYQQKSGQPPKLLIYLASNLES GVPARFSGSGSGTHFTLNIHPVEEEDAATYYCQHSRELPYT FGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC |
| 64 | 22F9 VHCDR2 N54A | MIHPASGSTN |
| 65 | 22F9 VHCDR2 N54H | MIHPHSGSTN |
| 66 | 22F9 VHCDR2 N54Q | MIHPQSGSTN |
| 67 | 22F9 VHCDR2 N54S | MIHPSSGSTN |
| 68 | 22F9 VHCDR3 D102A | YDYAGFFDV |
| 69 | 22F9 VHCDR3 D102E | YDYEGFFDV |
| 70 | 22F9 VHCDR3 D102G | YDYGGFFDV |
| 71 | 22F9_H0 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGMIHPNSGSTN YNEKFKSRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARYDYDGFFDV WGQGTLVTVSS |
| 72 | 22F9_H0_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGMIHPNSGSTN YNEKFKSRVTMTRDTSTSTVYMELSSLRSEDTAVYYCARYDYDGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 73 | 22F9_H0.1 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWMGMIHPqSGSTN YNEKFKSkaTlTRDkSsSTaYMELSSLRSEDTAVYYCARYDYaGFFDV WGQGTLVTVSS |
| 74 | 22F9_H0.1_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWMGMIHPqSGSTN YNEKFKSkaTlTRDkSsSTaYMELSSLRSEDTAVYYCARYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 75 | 22F9_H1 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPNSGSTN YNEKFKSRVTMTvDTSTSTVYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSS |
| 76 | 22F9_H1_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPNSGSTN YNEKFKSRVTMTvDTSTSTVYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 77 | 22F9_H1.1 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWIGMIHPqSGSTN YNEKFKSkaTMTVDkSsSTVYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSS |
| 78 | 22F9_H1.1_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWIGMIHPqSGSTN YNEKFKSkaTMTVDkSsSTVYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 79 | 22F9_H1.1_IgG4mut | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWIGMIHPqSGSTN YNEKFKSkaTMTVDkSsSTVYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 80 | 22F9_H2 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPNSGSTN YNEKFKSRVTlTvDTSTSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSS |
| 81 | 22F9_H2_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPNSGSTN YNEKFKSRVTlTvDTSTSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 82 | 22F9_H2.1 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWIGMIHPqSGSTN YNEKFKSkaTLTVDkSTSTAYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSS |
| 83 | 22F9_H2.1_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWIGMIHPqSGSTN YNEKFKSkaTLTVDkSTSTAYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 84 | 22F9_H2.1_IgG4mut | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWIGMIHPqSGSTN YNEKFKSkaTLTVDkSTSTAYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 85 | 22F9_H3 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPNSGSTN YNEKFKSRVTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSS |
| 86 | 22F9_H3_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPNSGSTN YNEKFKSRVTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 87 | 22F9_H3.1 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWIGMIHPqSGSTN YNEKFKSRVTLTVDKSSSTAYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSS |
| 88 | 22F9_H3.1_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWIGMIHPqSGSTN YNEKFKSRVTLTVDKSSSTAYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 89 | 22F9_H3.1_IgG4mut | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWIGMIHPqSGSTN YNEKFKSRVTLTVDKSSSTAYMELSSLRSEDTAVYYCAYYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 90 | 22F9_H4 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPNSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSS |
| 91 | 22F9_H4_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPNSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 92 | 22F9_H5 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPNSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSS |
| 93 | 22F9_H5_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPNSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 94 | 22F9_H5_IgG4mut | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPNSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYDGFFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 95 | 22F9_H5.2 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPQSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYAGFFDV WGQGTLVTVSS |
| 96 | 22F9_H5.2_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPQSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYAGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 97 | 22F9_H5.2_IgG4mut | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGMIHPQSGSTN YNEKFKSkaTlTvDkSsSTaYMELSSLRSEDTAVYYCAyYDYAGFFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 98 | 22F9_H7 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPqSGSTN YAQKFQGRVTMTvDkSTSTVYMELSSLRSEDTAVYYCAyYDYaGFFDV WGQGTLVTVSS |
| 99 | 22F9_H7_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPqSGSTN YAQKFQGRVTMTvDkSTSTVYMELSSLRSEDTAVYYCAyYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 100 | 22F9_H7_IgG4mut | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPqSGSTN YAQKFQGRVTMTvDkSTSTVYMELSSLRSEDTAVYYCAyYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 101 | 22F9_H7a VH | EVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPqSGSTN YAQKFQGRVTMTvDkSTSTVYMELSSLRSEDTAVYYCAyYDYaGFFDV WGQGTLVTVSS |
| 102 | 22F9_H7a_IgG1 | EVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPqSGSTN YAQKFQGRVTMTvDkSTSTVYMELSSLRSEDTAVYYCAyYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 103 | 22F9_H7a_IgG4mut | EVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVRQAPGQGLEWiGMIHPqSGSTN YAQKFQGRVTMTvDkSTSTVYMELSSLRSEDTAVYYCAyYDYaGFFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 104 | 22F9_L0 VL | DIQLTQSPSSLSASVGDRVTITCRASKSVSTSGYSYMH WYQQKPGKAPKLLIYLASNLES GVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQHSRELPYT FGGGTKVEIK |
| 105 | 22F9_L0 | DIQLTQSPSSLSASVGDRVTITCRASKSVSTSGYSYMH WYQQKPGKAPKLLIYLASNLES GVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQHSRELPYT FGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 106 | 22F9_L1 VL | DIQLTQSPSSLSASVGDRVTITCRASKSVSTSGYSYMH WYQQKPGKpPKLLIYLASNLES GVPSRFSGSGSGThFTLTISSLQPEDFATYYCQHSRELPYT FGGGTKVEIK |
| 107 | 22F9_L1 | DIQLTQSPSSLSASVGDRVTITCRASKSVSTSGYSYMH WYQQKPGKpPKLLIYLASNLES GVPSRFSGSGSGThFTLTISSLQPEDFATYYCQHSRELPYT FGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 108 | 22F9_L2 VL | DIQLTQSPSSLSvSVGDRaTITCRASKSVSTSGYSYMH WYQQKPGKpPKLLIYLASNLES GVPSRFSGSGSGThFTLTISSvQPEDFATYYCQHSRELPYT FGGGTKlEIK |
| 109 | 22F9_L2 | DIQLTQSPSSLSvSVGDRaTITCRASKSVSTSGYSYMH WYQQKPGKpPKLLIYLASNLES GVPSRFSGSGSGThFTLTISSvQPEDFATYYCQHSRELPYT FGGGTKlEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 110 | 20E6(hyb)VHCDR1 | GYTFTSYWMH |
| 111 | 20E6(hyb)VHCDR2 | RIDPNSGGIK |
| 112 | 20E6(hyb)VHCDR3 | WDYGGYFDV |
| 113 | 20E6(hyb)VLCDR1 | RASQDITNYLN |
| 114 | 20E6(hyb)VLCDR2 | YTSRLHS |
| 115 | 20E6(hyb)VLCDR3 | QQGDTLPWT |
| 116 | 20E6(hyb) VH | QVQLQQPGAELVKPGASVKLSCKASGYTFTSYWMH WVKQRPGRGLEWIGRIDPNSGGIK YNEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCARWDYGGYFDV WGTGTTVTVSS |
| 117 | 20E6(hyb) VL | DIQMTQTTSSLSASLGDRVTISCRASQDITNYLN WYQQKPDGAVKLLIYYTSRLHS GVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGDTLPWT FGGGTKLEIK |
| 118 | 20E6(hyb)重鏈 | QVQLQQPGAELVKPGASVKLSCKASGYTFTSYWMH WVKQRPGRGLEWIGRIDPNSGGIK YNEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCARWDYGGYFDV WGTGTTVTVSSSQSFPNVFPLVSCESPLSDKNLVAMGCLARDFLPSTISFTWNYQNNTEVIQGIRTFPTLRTGGKYLATSQVLLSPKSILEGSDEYLVCKIHYGGKNRDLHVPIPAVAEMNPNVNVFVPPRDGFSGPAPRKSKLICEATNFTPKPITVSWLKDGKLVESGFTTDPVTIENKGSTPQTYKVISTLTISEIDWLNLNVYTCRVDHRGLTFLKNVSSTCAASPSTDILTFTIPPSFADIFLSKSANLTCLVSNLATYETLNISWASQSGEPLETKIKIMESHPNGTFSAKGVASVCVEDWNNRKEFVCTVTHRDLPSPQKKFISKPNEVHKHPPAVYLLPPAREQLNLRESATVTCLVKGFSPADISVQWLQRGQLLPQEKYVTSAPMPEPGAPGFYFTHSILTVTEEEWNSGETYTCVVGHEALPHLVTERTVDKSTGKPTLYNVSLIMSDTGGTCY |
| 119 | 20E6(hyb)輕鏈 | DIQMTQTTSSLSASLGDRVTISCRASQDITNYLN WYQQKPDGAVKLLIYYTSRLHS GVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGDTLPWT FGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC |
| 120 | 20E6(hyb)VHCDR2 N54Q | RIDPQSGGIK |
| 121 | 20E6(hyb)VHCDR2 N54G | RIDPGSGGIK |
| 122 | 20E6(hyb)VHCDR2 N54A | RIDPASGGIK |
| 123 | 20E6(hyb)VHCDR2 N54S | RIDPSSGGIK |
| 124 | 20E6(hyb)VHCDR2 N54H | RIDPHSGGIK |
| 125 | 20E6(hyb)VHCDR2 N54L | RIDPLSGGIK |
| 126 | 20E6(hyb)VHCDR2 N54D | RIDPDSGGIK |
| 127 | 20E6_H0 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPNSGGIK YNEKFKSRVTMTRDTSISTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 128 | 20E6_H0_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPNSGGIK YNEKFKSRVTMTRDTSISTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 129 | 20E6_H0_IgG4mut | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPNSGGIK YNEKFKSRVTMTRDTSISTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 130 | 20E6_H0.1 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPNSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 131 | 20E6_H0.1_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPNSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 132 | 20E6_H0.1_IgG4mut | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPNSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 133 | 20E6_H0.2 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 134 | 20E6_H0.2_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 135 | 20E6_H0.2_IgG4mut | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 136 | 20E6_H0.3_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPgSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 137 | 20E6_H0.4_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPaSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 138 | 20E6_H0.5_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPsSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 139 | 20E6_H0.6_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPhSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 140 | 20E6_H0.7_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPlSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 141 | 20E6_H0.8_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPdSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 142 | 20E6_H0.2_ hIgG4mut VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 143 | 20E6_H0.2_ hIgG4mut | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 144 | 20E6_H1 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGRIDPNSGGIK YNEKFKSRVTlTvDTSISTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 145 | 20E6_H1_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGRIDPNSGGIK YNEKFKSRVTlTvDTSISTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 146 | 20E6_H2 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGRIDPNSGGIK YNEKFKSRVTlTvDkSsSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 147 | 20E6_H2_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWiGRIDPNSGGIK YNEKFKSRVTlTvDkSsSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 148 | 20E6_H3 VH | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVkQrPGQGLEWiGRIDPNSGGIK YNEKFKSkaTlTvDkSsSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 149 | 20E6_H3_IgG1 | QVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVkQrPGQGLEWiGRIDPNSGGIK YNEKFKSkaTlTvDkSsSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 150 | 20E6_H4 VH | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGRIDPNSGGIK YNEKFKSkaTlTvDkSsSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 151 | 20E6_H4_IgG1 | QVQLVQpGAEVvKPGASVKlSCKASGYTFTSYWMH WVkQrPGQGLEWiGRIDPNSGGIK YNEKFKSkaTlTvDkSsSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 152 | 20E6_L0 VL | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAPKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGDTLPWT FGQGTKLEIK |
| 153 | 20E6_L0 | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAPKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 154 | 20E6_L1 VL | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAvKLLIYYTSRLHS GVPSRFSGSGSGTDyTLTISSLQPEDFATYfCQQGDTLPWT FGQGTKLEIK |
| 155 | 20E6_L1 | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAvKLLIYYTSRLHS GVPSRFSGSGSGTDyTLTISSLQPEDFATYfCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 156 | 20E6_L0_P44V VL | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAVKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGDTLPWT FGQGTKLEIK |
| 157 | 20E6_L0_P44V | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAVKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDFATYYCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 158 | 20E6_L0_F71Y VL | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAPKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGDTLPWT FGQGTKLEIK |
| 159 | 20E6_L0_F71Y | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAPKLLIYYTSRLHS GVPSRFSGSGSGTDYTLTISSLQPEDFATYYCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 160 | 20E6_L0_Y87F VL | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAPKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQGDTLPWT FGQGTKLEIK |
| 161 | 20E6_L0_Y87F | DIQMTQSPSSLSASVGDRVTITCRASQDITNYLN WYQQKPGKAPKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDFATYFCQQGDTLPWT FGQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 162 | 17G8(hyb)VHCDR1 | GFTFTDYYMS |
| 163 | 17G8(hyb)VHCDR2 | FIRNKANGYTTE |
| 164 | 17G8(hyb)VHCDR3 | YKLGGYFDV |
| 165 | 17G8(hyb)VLCDR1 | RASQDISNYLN |
| 166 | 17G8(hyb)VLCDR2 | YTSRLHS |
| 167 | 17G8(hyb)VLCDR3 | QQGNTLPWT |
| 168 | 17G8(hyb )VH | EVKLVESGGGLVQPGGSLSLSCAASGFTFTDYYMS WVRQPPGKALEWLGFIRNKANGYTTE YSASVKGRFTISRDNSQSILYLQMNALRAEDSATYYCARYKLGGYFDV WGTGTTVTVSS |
| 169 | 17G8(hyb) VL | DIQMTQTTSSLSASLGDRVTISCRASQDISNYLN WYQQKPDGTVKLLIYYTSRLHS GVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGNTLPWT FGGGTKLEIK |
| 170 | 17G8(hyb)重鏈 | EVKLVESGGGLVQPGGSLSLSCAASGFTFTDYYMS WVRQPPGKALEWLGFIRNKANGYTTE YSASVKGRFTISRDNSQSILYLQMNALRAEDSATYYCARYKLGGYFDV WGTGTTVTVSSSQSFPNVFPLVSCESPLSDKNLVAMGCLARDFLPSTISFTWNYQNNTEVIQGIRTFPTLRTGGKYLATSQVLLSPKSILEGSDEYLVCKIHYGGKNRDLHVPIPAVAEMNPNVNVFVPPRDGFSGPAPRKSKLICEATNFTPKPITVSWLKDGKLVESGFTTDPVTIENKGSTPQTYKVISTLTISEIDWLNLNVYTCRVDHRGLTFLKNVSSTCAASPSTDILTFTIPPSFADIFLSKSANLTCLVSNLATYETLNISWASQSGEPLETKIKIMESHPNGTFSAKGVASVCVEDWNNRKEFVCTVTHRDLPSPQKKFISKPNEVHKHPPAVYLLPPAREQLNLRESATVTCLVKGFSPADISVQWLQRGQLLPQEKYVTSAPMPEPGAPGFYFTHSILTVTEEEWNSGETYTCVVGHEALPHLVTERTVDKSTGKPTLYNVSLIMSDTGGTCY |
| 171 | 17G8(hyb)輕鏈 | DIQMTQTTSSLSASLGDRVTISCRASQDISNYLN WYQQKPDGTVKLLIYYTSRLHS GVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGNTLPWT FGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC |
| 172 | 17G8(hyb)VHCDR2 N54Q | FIRNKAQGYTTE |
| 173 | 17G8(hyb)VHCDR2 N54G | FIRNKAGGYTTE |
| 174 | 17G8(hyb)VHCDR2 N54A | FIRNKAAGYTTE |
| 175 | 17G8(hyb)VHCDR2 N54S | FIRNKASGYTTE |
| 176 | 17G8(hyb)VHCDR2 N54H | FIRNKAHGYTTE |
| 177 | 17G8(hyb)VHCDR2 N54L | FIRNKALGYTTE |
| 178 | 17G8(hyb)VHCDR2 N54D | FIRNKADGYTTE |
| 179 | 24E3(hyb)VHCDR1 | GYTFTSYNMH |
| 180 | 24E3(hyb)VHCDR2 | AIYPGNGDTS |
| 181 | 24E3(hyb)VHCDR3 | WDWGGYFDV |
| 182 | 24E3(hyb)VLCDR1 | RASQDISNYLN |
| 183 | 24E3(hyb)VLCDR2 | YTSRLHS |
| 184 | 24E3(hyb)VLCDR3 | QQGDTLPWTF |
| 185 | 24E3(hyb)VH | QAYLQQSGAELVRPGASVKMSCKASGYTFTSYNMH WVKQTPRQGLEWIGAIYPGNGDTS YNPKFKGKATLTVDKSSSTAYMQLSSLTSEDSAVYFCTRWDWGGYFDV WGTGTTVTVSS |
| 186 | 24E3(hyb) VL | DIQMTQTTSSLSASLGDRVTISCRASQDISNYLN WYQQKPDGTVKLLIYYTSRLHS GVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGDTLPWTF GGGTKLGIK |
| 187 | 24E3(hyb)重鏈 | QAYLQQSGAELVRPGASVKMSCKASGYTFTSYNMH WVKQTPRQGLEWIGAIYPGNGDTS YNPKFKGKATLTVDKSSSTAYMQLSSLTSEDSAVYFCTRWDWGGYFDV WGTGTTVTVSSSQSFPNVFPLVSCESPLSDKNLVAMGCLARDFLPSTISFTWNYQNNTEVIQGIRTFPTLRTGGKYLATSQVLLSPKSILEGSDEYLVCKIHYGGKNRDLHVPIPAVAEMNPNVNVFVPPRDGFSGPAPRKSKLICEATNFTPKPITVSWLKDGKLVESGFTTDPVTIENKGSTPQTYKVISTLTISEIDWLNLNVYTCRVDHRGLTFLKNVSSTCAASPSTDILTFTIPPSFADIFLSKSANLTCLVSNLATYETLNISWASQSGEPLETKIKIMESHPNGTFSAKGVASVCVEDWNNRKEFVCTVTHRDLPSPQKKFISKPNEVHKHPPAVYLLPPAREQLNLRESATVTCLVKGFSPADISVQWLQRGQLLPQEKYVTSAPMPEPGAPGFYFTHSILTVTEEEWNSGETYTCVVGHEALPHLVTERTVDKSTGKPTLYNVSLIMSDTGGTCY |
| 188 | 24E3(hyb)輕鏈 | DIQMTQTTSSLSASLGDRVTISCRASQDISNYLN WYQQKPDGTVKLLIYYTSRLHS GVPSRFSGSGSGTDYSLTISNLEQEDIATYFCQQGDTLPWTF GGGTKLGIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC |
| 189 | 24E3(hyb)VHCDR2 N54Q | AIYPGQGDTS |
| 190 | 24E3(hyb)VHCDR2 N54G | AIYPGGGDTS |
| 191 | 24E3(hyb)VHCDR2 N54A | AIYPGAGDTS |
| 192 | 24E3(hyb)VHCDR2 N54S | AIYPGSGDTS |
| 193 | 24E3(hyb)VHCDR2 N54H | AIYPGHGDTS |
| 194 | 24E3(hyb)VHCDR2 N54L | AIYPGLGDTS |
| 195 | 24E3(hyb)VHCDR2 N54D | AIYPGDGDTS |
| 196 | 人類IgG1恆定區 | ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 197 | 人類IgG4變異型恆定區(亦稱為「IgG4mut」) | ASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 198 | 雞LAP-TGFβ1 | LSTCQRLDLEAAKKKRIEAVRGQILSKLRLTAPPPASETPPRPLPDDVRALYNSTQELLKQRARLRPPPDGPDEYWAKELRRIPMETTWDGPMEHWQPQSHSIFFVFNVSRVRAEVGGRALLHRAELRMLRQKAAADSAGTEQRLELYQGYGNASWRYLHGRSVRATADDEWLSFDVTDAVHQWLSGSELLGVFKLSVHCPCEMGPGHADEMRISIEGFEQQRGDMQSIAKKHRRVPYVLAMALPAERANELHSARRRRDLDTDYCFGPGTDEKNCCVRPLYIDFRKDLQWKWIHEPKGYMANFCMGPCPYIWSADTQYTKVLALYNQHNPGASAAPCCVPQTLDPLPIIYYVGRNVRVEQLSNMVVRACKCS |
| 199 | 人類-雞LAP-TGFβ1嵌合體#1 | LSTCQRLDLEAAKKKRIEAVRGQILSKLRLTAPPPASETPPRPLPDDVRALYNSTQELLKQRARLRPPPDGPDEYWAKELRRIPMETTWDEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 200 | 人類-雞LAP-TGFβ1嵌合體#1.2 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLTAPPPASETPPRPLPDDVRALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 201 | 人類-雞LAP-TGFβ1嵌合體#1.3 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTQELLKQRARLRPPPDGPDEYWAKELRRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 202 | 人類-雞LAP-TGFβ1嵌合體#2 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNGPMEHWQPQSHSIFFVFNVSRVRAEVGGRALLHRAELRMLRQKAAADSAGTEQRLELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 203 | 人類-雞LAP-TGFβ1嵌合體#2.1 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRIPMETTWDGPMEHWQPQSHSIFFVFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 204 | 人類-雞LAP-TGFβ1嵌合體#2.2 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNVSRVRAEVGGRALLHRAELRMLRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 205 | 人類-雞LAP-TGFβ1嵌合體#2.3 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRMLRQKAAADSAGTEQRLELYQGYGNASWRYLHGRSVRATADDEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 206 | 人類-雞LAP-TGFβ1嵌合體#3 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQGYGNASWRYLHGRSVRATADDEWLSFDVTDAVHQWLSGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 207 | 人類-雞LAP-TGFβ1嵌合體#4 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGSELLGVFKLSVHCPCEMGPGHADEMRISIEGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 208 | 人類-雞LAP-TGFβ1嵌合體#5 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFEQQRGDMQSIAKKHRRVPYVLAMALPAERANELHSARRRRDLDTDYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 209 | 人類-雞LAP-TGFβ1嵌合體#6 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFGPGTDEKNCCVRPLYIDFRKDLQWKWIHEPKGYMANFCMGPCPYIWSADTQYTKVLALYNQHNPGASAAPCCVPQALEPLPIVYYVGRKPKVEQLSNMIVRSCKCS |
| 210 | 人類-雞LAP-TGFβ1嵌合體#7 | LSTCKTIDMELVKRKRIEAIRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTRDRVAGESAEPEPEPEADYYAKEVTRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYSNNSWRYLSNRLLAPSDSPEWLSFDVTGVVRQWLSRGGEIEGFRLSAHCSCDSRDNTLQVDINGFTTGRRGDLATIHGMNRPFLLLMATPLERAQHLQSSRHRRALDTNYCFSSTEKNCCVRQLYIDFRKDLGWKWIHEPKGYHANFCLGPCPYIWSLDTQYSKVLALYNQHNPGASAAPCCVPQTLDPLPIIYYVGRNVRVEQLSNMVVRACKCS |
| 211 | 雞-人類LAP-TGFβ1嵌合體chB1ex2.1_2.2 | LSTSQRLDLEAAKKKRIEAVRGQILSKLRLTAPPPASETPPRPLPDDVRALYNSTQELLKQRARLRPPPDGPDEYWAKELRRVLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAELRLLRLKLKVEQHVELYQKYGNASWRYLHGRSVRATADDEWLSFDVTDAVHQWLSGSELLGVFKLSVHCPCEMGPGHADEMRISIEGFEQQRGDMQSIAKKHRRVPYVLAMALPAERANELHSARRRRDLDTDYCFGPGTDEKNCCVRPLYIDFRKDLQWKWIHEPKGYMANFCMGPCPYIWSADTQYTKVLALYNQHNPGASAAPCCVPQTLDPLPIIYYVGRNVRVEQLSNMVVRACKCS |
| 212 | 雞-人類LAP-TGFβ1嵌合體chB1ex1.3 | LSTSQRLDLEAAKKKRIEAVRGQILSKLRLTAPPPASETPPRPLPDDVRALYNSTRDRVAGESAEPEPEPEADYYAKEVTRIPMETTWDGPMEHWQPQSHSIFFVFNVSRVRAEVGGRALLHRAELRMLRQKAAADSAGTEQRLELYQGYGNASWRYLHGRSVRATADDEWLSFDVTDAVHQWLSGSELLGVFKLSVHCPCEMGPGHADEMRISIEGFEQQRGDMQSIAKKHRRVPYVLAMALPAERANELHSARRRRDLDTDYCFGPGTDEKNCCVRPLYIDFRKDLQWKWIHEPKGYMANFCMGPCPYIWSADTQYTKVLALYNQHNPGASAAPCCVPQTLDPLPIIYYVGRNVRVEQLSNMVVRACKCS |
| 213 | 雞-人類LAP-TGFβ1嵌合體chB1_ex1.2 | LSTSQRLDLEAAKKKRIEAVRGQILSKLRLASPPSQGEVPPGPLPEAVLALYNSTQELLKQRARLRPPPDGPDEYWAKELRRIPMETTWDGPMEHWQPQSHSIFFVFNVSRVRAEVGGRALLHRAELRMLRQKAAADSAGTEQRLELYQGYGNASWRYLHGRSVRATADDEWLSFDVTDAVHQWLSGSELLGVFKLSVHCPCEMGPGHADEMRISIEGFEQQRGDMQSIAKKHRRVPYVLAMALPAERANELHSARRRRDLDTDYCFGPGTDEKNCCVRPLYIDFRKDLQWKWIHEPKGYMANFCMGPCPYIWSADTQYTKVLALYNQHNPGASAAPCCVPQTLDPLPIIYYVGRNVRVEQLSNMVVRACKCS |
| 214 | 連接子 | PVGVV |
| 215 | LAP-TGFβ1抗原決定基 | VLMVETHNEIYDKFKQSTHSIYMFFNTSELREAVPEPVLLSRAE |
| 216 | 28G11_L0 VL | DIQMTQSPSSLSASVGDRVTITCRASQDISNYLN WYQQKPGKVPKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGDTLPWTF GQGTKLEIK |
| 217 | 28G11_L0 | DIQMTQSPSSLSASVGDRVTITCRASQDISNYLN WYQQKPGKVPKLLIYYTSRLHS GVPSRFSGSGSGTDFTLTISSLQPEDVATYYCQQGDTLPWTF GQGTKLEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 218 | 20E6_H0.2a VH | EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSS |
| 219 | 20E6_H0.2a_IgG1 | EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPELLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 220 | 20E6_H0.2a_IgG4mut | EVQLVQSGAEVKKPGASVKVSCKASGYTFTSYWMH WVRQAPGQGLEWMGRIDPQSGGIK YAQKFQGRATLTVDTSTSTAYMELSRLRSDDTAVYYCARWDYGGYFDV WGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEAAGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 221 | 7H4_HC (hyb) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYDGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSSAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK |
| 222 | 7H4_LC (hyb) | DIQMTQSPSSLSASLGGKVTITC KASQDIDKYIA WYQHKPGKGPRLLIH YTSTLQP GIPSRFSGSGSGRDYSFNISNLEPEDIATYYC LQYDNLRT FGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC |
| 223 | 7H4_VH | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYDGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSS |
| 224 | 7H4_VL | DIQMTQSPSSLSASLGGKVTITC KASQDIDKYIA WYQHKPGKGPRLLIH YTSTLQP GIPSRFSGSGSGRDYSFNISNLEPEDIATYYC LQYDNLRT FGGGTKLEIK |
| 225 | 7H4_HCDR1 | GYSIT SGYYWN |
| 226 | 7H4_HCDR2 | YISYDGTNNYNPSLKN |
| 227 | 7H4_HCDR3 | SFYNNYFDF |
| 228 | 7H4_LCDR1 | KASQDIDKYIA |
| 229 | 7H4_LCDR2 | YTSTLQP |
| 230 | 7H4_LCDR3 | LQYDNLRT |
| 231 | 7H4_HCDR2 (D55G) | YISYG GTNNYNPSLKN |
| 232 | 7H4_HCDR2 (D55A) | YISYAGTNNYNPSLKN |
| 233 | 7H4_HCDR2 (D55E) | YISYEGTNNYNPSLKN |
| 234 | 7H4_VHmut#1 (D55G) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYGGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSS |
| 235 | 7H4_VHmut#2 (D55A) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYAGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSS |
| 236 | 7H4_VHmut#3 (D55E) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYEGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSS |
| 237 | 7H4_HCmut#1 (D55G) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYGGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSSAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK |
| 238 | 7H4_HCmut#2 (D55A) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYAGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSSAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK |
| 239 | 7H4_HCmut#3 (D55E) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYEGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSSAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK |
| 240 | 派立珠單抗重鏈 | QVQLVQSGVEVKKPGASVKVSCKASGYTFTNYYMYWVRQAPGQGLEWMGGINPSNGGTNFNEKFKNRVTLTTDSSTTTAYMELKSLQFDDTAVYYCARRDYRFDMGFDYWGQGTTVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 241 | 派立珠單抗輕鏈 | EIVLTQSPATLSLSPGERATLSCRASKGVSTSGYSYLHWYQQKPGQAPRLLIYLASYLESGVPARFSGSGSGTDFTLTISSLEPEDFAVYYCQHSRDLPLTFGGGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 242 | 保守性20E6 VHCDR3 | WX1 YGGYFX2 X3 (X1 -X3 可為任何胺基酸 ) |
| 243 | 保守性20E6 VLCDR3 | QQGDX1 LPWT (X1 可為任何胺基酸 ) |
| 244 | Human_IgG1_P01857_L234A_L235A | ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEaaGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 245 | Human_IgG1_P01857_L234A_L235A_D265S | ASTKGPSVFPLAPSSKSTSGGTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTQTYICNVNHKPSNTKVDKKVEPKSCDKTHTCPPCPAPEaaGGPSVFLFPPKPKDTLMISRTPEVTCVVVsVSHEDPEVKFNWYVDGVEVHNAKTKPREEQYNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKALPAPIEKTISKAKGQPREPQVYTLPPSRDELTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSKLTVDKSRWQQGNVFSCSVMHEALHNHYTQKSLSLSPGK |
| 246 | 尼沃單抗重鏈 | QVQLVESGGGVVQPGRSLRLDCKASGITFSNSGMHWVRQAPGKGLEWVAVIWYDGSKRYYADSVKGRFTISRDNSKNTLFLQMNSLRAEDTAVYYCATNDDYWGQGTLVTVSSASTKGPSVFPLAPCSRSTSESTAALGCLVKDYFPEPVTVSWNSGALTSGVHTFPAVLQSSGLYSLSSVVTVPSSSLGTKTYTCNVDHKPSNTKVDKRVESKYGPPCPPCPAPEFLGGPSVFLFPPKPKDTLMISRTPEVTCVVVDVSQEDPEVQFNWYVDGVEVHNAKTKPREEQFNSTYRVVSVLTVLHQDWLNGKEYKCKVSNKGLPSSIEKTISKAKGQPREPQVYTLPPSQEEMTKNQVSLTCLVKGFYPSDIAVEWESNGQPENNYKTTPPVLDSDGSFFLYSRLTVDKSRWQEGNVFSCSVMHEALHNHYTQKSLSLSLGK |
| 247 | 尼沃單抗輕鏈 | EIVLTQSPATLSLSPGERATLSCRASQSVSSYLAWYQQKPGQAPRLLIYDASNRATGIPARFSGSGSGTDFTLTISSLEPEDFAVYYCQQSSNWPRTFGQGTKVEIKRTVAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
| 248 | 22F9_N54Q_D102A重鏈 | QVQLQQPGAELVKPGASVKLSCKASGYTFTSYWMHWVKQRPGQGLEWIGMIHPQSGSTNYNEKFKSKATLTVDKSSSTAYMQLSSLTSEDSAVYYCAYYDYAGFFDVWGTGTTVTVSSAKTTAPSVYPLAPVCGDTTGSSVTLGCLVKGYFPEPVTLTWNSGSLSSGVHTFPAVLQSDLYTLSSSVTVTSSTWPSQSITCNVAHPASSTKVDKKIEPRGPTIKPCPPCKCPAPNLLGGPSVFIFPPKIKDVLMISLSPIVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTLRVVSALPIQHQDWMSGKEFKCKVNNKDLPAPIERTISKPKGSVRAPQVYVLPPPEEEMTKKQVTLTCMVTDFMPEDIYVEWTNNGKTELNYKNTEPVLDSDGSYFMYSKLRVEKKNWVERNSYSCSVVHEGLHNHHTTKSFSRTPGK |
| 249 | 22F9_N54Q_D102A輕鏈 | DIVLTQSPASLDVSLGQRATISCRASKSVSTSGYSYMHWYQQKSGQPPKLLIYLASNLESGVPARFSGSGSGTHFTLNIHPVEEEDAATYYCQHSRELPYTFGGGTKLEIKRADAAPTVSIFPPSSEQLTSGGASVVCFLNNFYPKDINVKWKIDGSERQNGVLNSWTDQDSKDSTYSMSSTLTLTKDEYERHNSYTCEATHKTSTSPIVKSFNRNEC |
| 250 | LAP-TGFβ1之區域1 | RKRIEAIRGQIL |
| 251 | LAP-TGFβ1之區域2 | LASPPSQGEV |
| 252 | LAP-TGFβ1之區域3 | GWKWIHEPK |
| 253 | LAP-TGFβ1之區域4 | YVGRKPK |
| 254 | 2F8結合區 | VDINGFTTGRRGDLATIHGMN |
| 255 | 7H4_HCmut #3 (D55G) | DVQLQESGPGLVKPSQSLSLTCSVTGYSIT SGYYWN WIRQFPGNKLEWMG YISYGGTNNYNPSLKN RISITRDTSKHQFFLKLNSVTTEDTATYYCAR SFYNNYFDF WGQGTTLTVSSAKTTPPSVYPLAPGCGDTTGSSVTLGCLVKGYFPESVTVTWNSGSLSSSVHTFPALLQSGLYTMSSSVTVPSSTWPSQTVTCSVAHPASSTTVDKKLEPSGPISTINPCPPCKECHKCPAPNLEGGPSVFIFPPNIKDVLMISLTPKVTCVVVDVSEDDPDVQISWFVNNVEVHTAQTQTHREDYNSTIRVVSTLPIQHQDWMSGKEFKCKVNNKDLPSPIERTISKIKGLVRAPQVYILPPPAEQLSRKDVSLTCLVVGFNPGDISVEWTSNGHTEENYKDTAPVLDSDGSYFIYSKLNMKTSKWEKTDSFSCNVRHEGLKNYYLKKTISRSPGK |
| 256 | κ輕鏈恆定域 | VAAPSVFIFPPSDEQLKSGTASVVCLLNNFYPREAKVQWKVDNALQSGNSQESVTEQDSKDSTYSLSSTLTLSKADYEKHKVYACEVTHQGLSSPVTKSFNRGEC |
在此表及先前各表中,除非另外指明,否則應理解,加下劃線指示結合蛋白質(例如抗體或其抗原結合片段)中之CDR。應注意,可藉由本文中所描述之方法及系統中之任一者(例如Chothia、Kabat及IMGT)定義及鑑別CDR。
等效物:
熟習此項技術者最多使用常規實驗將識別或能夠確定本文中所揭示之特定實施例的許多等效物。此類等效物意欲由隨附申請專利範圍涵蓋。
圖 1A-1F
為展示未經轉染之HT1080細胞(HT 1080-裸)及過表現人類LAP-TGFβ1之HT1080細胞(HT1080-huB1)、人類LAP-TGFβ2 (HT1080-huB2)、人類LAP-TGFβ3 (HT1080-huB3)及鼠類LAP-TGFβ1 (HT1080-muB1)上抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1、24E3_hIgG1及2C9_(hyb)之結合之曲線。[TGFβ2轉型生長因子β-2;TGFβ3=轉型生長因子β-3]圖 2A-2F
為展示抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1、24E3_hIgG1及2C9_(hyb)與所指示之LAP-TGFβ變異體之結合之曲線。黑色柱對應於結合於過表現人類LAP-TGFβ1之HT1080細胞之所指示之抗體。灰色柱對應於其中未添加抗LAP抗體之陰性對照樣本。HT1080-huB1:過表現LAP-TGFβ1之HT1080細胞;HT1080-K27C_Y75C:過表現具有K27C及Y75C突變(防止由整合素進行之TGFβ1活化之突變;「封閉構形」)之LAP-TGFβ1之HT1080細胞;HT1080-Y74T:過表現具有Y74T突變(有利於TGFβ1之自發性釋放之突變(「開放構形」))之LAP-TGFβ1之HT1080細胞;HT1080-ch2.3:過表現其中人類LAP-TGFβ1之外顯子2.3 (殘基131-164)已由來自雞LAP-TGFβ1 (UniProt寄存編號#H9CX01)之相應殘基置換的嵌合LAP-TGFβ1之HT1080細胞;HT1080-ch4:過表現其中人類LAP-TGFβ1之外顯子4 (殘基183-208)已由來自雞LAP-TGFβ1之外顯子4置換的嵌合LAP-TGFβ1之HT1080細胞。圖 3A-3F
為展示抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1、24E3_hIgG1及2C9_(hyb)與所指示之LAP-TGFβ變異體之結合之曲線。黑色柱對應於結合於過表現人類LAP-TGFβ1之HT1080細胞之所指示之抗體。灰色柱對應於其中未添加抗LAP抗體之陰性對照樣本。HT1080-huB1:過表現LAP-TGFβ1之HT1080細胞;HT1080-空LAP:過表現不包括成熟TGFβ1細胞介素之LAP之HT1080細胞;HT1080-ch2.2:過表現其中人類LAP-TGFβ1之外顯子2.2 (殘基108-130)已由來自雞LAP-TGFβ1之外顯子2.2置換的嵌合LAP-TGFβ1之HT1080細胞。圖 4
為展示抗體28G11_hIgG1、22F9_hIgG1、20E6_hIgG1、17G8_hIgG1、24E3_hIgG1及1D11與成熟TGFβ (亦即,無LAP之TGFβ)之結合之圖,如藉由其中信號之抑制反映與成熟TGFβ之結合之ELISA分析法所量測。圖 5A
及5B
為展示在表現人類LAP-TGFβ1 (圖 5A
)及鼠類LAP-TGFβ1 (圖 5B
)之P3U1細胞中,28G11對TGFβ1活化之作用之曲線集合。圖 6A-6F
為展示在表現人類或小鼠LAP-TGFβ1之P3U1細胞中,抗體17G8 (圖 6A
係關於人類LAP-TGFβ1且圖 6B
係關於小鼠LAP-TGFβ1)、24E3 (圖 6C
係關於人類LAP-TGFβ1且圖 6D
係關於鼠類LAP-TGFβ1)、22F9 (圖 6E
係關於人類LAP-TGFβ1)、20E6 (圖 6F
係關於人類LAP-TGFβ1)對TGFβ1活化之作用之曲線。圖 6G-6L
為展示在表現人類或小鼠LAP-TGFβ1之P3U1細胞中,28G11_IgG2a (圖 6G
)、20E6_IgG2a (圖 6H
)、22F9_IgG2a (圖 6I
)、24E3_hIgG1 (圖 6J
)、17G8_hIgG1 (圖 6K
)及20E6_H0.2aL1_hIgG1 (圖 6L)
對TGFβ1活化之作用之曲線。圖 7
為展示所指示之抗LAP抗體與由P3U1細胞保藏之細胞外基質(ECM)之結合之圖。測試三種細胞類型:無LAP-TGFβ之P3U1細胞、表現人類LAP-TGFβ1之P3U1細胞及表現鼠類LAP-TGFβ1之P3U1細胞。以2 µg/mL之濃度使用抗體。圖 8
為展示所指示之抗LAP抗體(亦即,抗體28G11、22F9、20E6、17G8及24E3)與人類血小板之結合之劑量-反應關係之圖。圖 9A-9E
為展示抗LAP抗體28G11_hyb (圖 9A
)、20E6_IgG2a (圖 9B
)、22F9_IgG2a (圖 9C
)、17G8_hIgG1 (圖 9D
)及24E3_hIgG1 (圖 9E
)對人類血小板去顆粒之作用之曲線。圖 10A
及10B
為展示所指示之抗LAP抗體與THP-1細胞之結合之曲線。THP細胞結合在圖 10A
中表示為LAP+細胞之百分比(%)且在圖 10B
中表示為中值螢光強度(MFI)。圖 10C
為展示所指示之抗LAP抗體與THP-1細胞之結合之圖。THP細胞結合表示為LAP+細胞之百分比。圖 10D
展示所指示之抗LAP抗體與THP-1細胞之結合之點狀圖。圖 10E
及10F
為展示所指示之抗LAP抗體與U937細胞之結合之曲線。U937細胞結合在圖 10E
中表示為LAP+細胞之百分比且在圖 10F
中表示為MFI。圖 10G
展示所指示之抗LAP抗體與U937細胞之結合之點狀圖。圖 11
為展示抗LAP抗體28G11、22F9及20E6與調節性T細胞、CD8細胞、M2巨噬細胞及來自CT26 TIL之M-MDSC之結合(表示為陽性細胞之百分比)之圖。圖 12
為展示人類化28G11變異體與鼠類28G11親本抗體競爭結合於過表現人類GARP及LAP-TGFβ1之P3U1細胞之能力之圖。H0-H2為變異型人類化重鏈,且L0-L3為變異型人類化輕鏈。圖 13
為展示所指示之人類化28G11變異體與過表現人類GARP及LAP-TGFβ1之P3U1細胞之結合之圖。圖 14A-14D
為展示藉由ELISA測定之所指示之人類化28G11變異體對TGFβ1活化之抑制之曲線。圖 15A
為展示人類化28G11_H2L3變異體中之各種回復成人類殘基之逆轉之組合對與過表現人類LAP-TGFβ1之HT1080細胞之結合的作用之圖。所測試之各種抗體列舉為HC variant_LC變異體。圖 15B
為展示28G11_H2.1L3及28G11_H2aL3a變異體對與過表現人類LAP-TGFβ1之HT1080細胞之結合的作用之圖。黑色柱對應於結合於過表現人類LAP-TGFβ1之HT1080細胞之抗體。灰色柱對應於結合於不過表現人類LAP-TGFβ1之對照性HT1080細胞之抗體。圖 16
為展示所指示之人類化22F9變異體與過表現人類LAP-TGFβ1之HT1080細胞之結合之圖。黑色柱對應於結合於過表現人類LAP-TGFβ1之HT1080細胞之抗體。灰色柱對應於結合於不過表現人類LAP-TGFβ1之對照性HT1080細胞之抗體。圖 17A
及17B
為所指示之抗體22F9及變異體之尺寸排阻高效液相層析(SE-HPLC)之層析圖。圖 18A
為展示使22F9_H5L0之重鏈中之鼠類殘基回復成相應人類殘基對與過表現人類LAP-TGFβ1之HT1080細胞之結合的作用之圖。圖 18B
為展示用於移除22F9_H5L0中之潛在的去醯胺化及/或異構化位點之取代對與過表現人類LAP-TGFβ1之HT1080細胞之結合的作用之圖。22F9_H5.2L0對應於具有雙重N54Q/D102A突變之22F9_H5L0。圖 18C
為展示22F9_H0.1、22F9_H1.1、22F9_H2.1及22F9_H3.1變異體與過表現人類LAP-TGFβ1之HT1080細胞之結合之圖。黑色柱對應於結合於過表現人類LAP-TGFβ1之HT1080細胞之抗體。灰色柱對應於結合於不過表現人類LAP-TGFβ1之對照性HT1080細胞之抗體。圖 19A
及19B
為展示所指示之人類化20E6變異體與人類LAP-TGFβ1之結合之曲線。黑色柱對應於結合於過表現人類LAP-TGFβ1之HT1080細胞之抗體。灰色柱對應於結合於不過表現人類LAP-TGFβ1之對照性HT1080細胞之抗體。圖 20A
為展示20E6之L1輕鏈之鼠類回復取代對與人類LAP-TGFβ1之結合的作用之圖。圖 20B
為展示具有降低之免疫原性之20E6_H0重鏈變異體之結合對與人類LAP-TGFβ1之結合的作用之圖。黑色柱對應於結合於過表現人類LAP-TGFβ1之HT1080細胞之抗體。灰色柱對應於結合於不過表現人類LAP-TGFβ1之對照性HT1080細胞之抗體。圖 21A-21C
為展示20E6_H0.2aL1_hIgG1抗體與包含人類LAP-TGFβ1、LAP-TGFβ2或LAP-TGFβ3之Fc融合物之結合之生物層干涉術曲線。圖 22A-22D
為展示20E6_H0.2aL1_hIgG1抗體之多個重鏈及輕鏈CDR變異體與人類LAP-TGFβ1之結合之曲線。圖 23A
及23B
為展示20E6_H0.2aL1_hIgG1之F(ab')2片段及Fab'片段與過表現GARP及LAP-TGFβ1之P3U1細胞之結合之曲線。圖 24
為一系列展示MHG8 (GARP特異性鼠類IgG2a)抗體、16F4 (抗LAP)抗體及人類化20E6抗體與可溶性LAP-TGFβ1、sGARP-LAP-TGFβ1及ECR3E-LAP-TGFβ1複合物之結合之生物層干涉術曲線。圖 25
為如實例17中所描述之用於比較鼠類28G11、16F4及MHG8之結合抗原決定基之競爭實驗之示意圖。圖 26A
展示用於建立人類化20E6-Fab/LAP-TGFβ1模型之低溫EM圖之實例。圖 26B
為FSC曲線與解析度之關係曲線。圖 26C
為使用紀尼埃曲線(Guinier plot)之B因子評估。圖 27A
為在3.1 Å解析度下,與LAP-TGFβ1複合之人類化20E6抗體之低溫EM圖。圖 27B
展示在2.9 Å解析度下,PDB條目5jxe之電子密度。圖 28A
展示LAP與人類化20E6 Fab之VL及VH之間的相互作用。圖 28B
展示TGFβ1與Fab之人類化20E6 VL及VH部分之間的相互作用。圖 28C
及圖 28D
展示LAP-TGFβ1與20E6 Fab之20E6 VL部分之間的其他相互作用。構築體及相互作用以灰度展示。圖 29A
展示LAP與28G11人類化Fab之VL及VH之間的相互作用。圖 29B
展示TGFβ1與Fab之人類化28G11 VL及VH部分之間的相互作用。圖 29C
展示人類化28G11及人類化20E6中CDR之再定位。圖 29D
展示人類化28G11中之Q56為與跨越殘基V342-K344之TGFβ1環之相互作用之理想位置。圖 29E
展示在人類化28G11中,Tyr殘基由Gly置換,引起與V341之側鏈之相互作用減小。構築體及相互作用以灰度展示。圖 30A
展示在低溫EM中鑑別之2Mab:2TGFβ1複合物(Mab係指22F9 Fab)。構築體:LAP-TGFβ1二聚體;22F9-Fab;22F9-Fc。圖 30B
提供2D類別之實例。構築體及相互作用以灰度展示。圖 31A
展示LAP與22F9 Fab之VL及VH部分之間的相互作用。圖 31B
展示TGFβ與22F9 VL及VH之間的相互作用。圖 31C
展示22F9-Fab + LAP-TGFβ1複合物及人類化20E6-Fab + LAP-TGFβ1 (Fab)之重疊以及人類化20E6-Fab及22F9-Fab在抗原方面之不同定向。圖 31D
及圖 31E
展示LAP-TGFβ1與20E6 Fab之各部分之間的其他相互作用。構築體及相互作用以灰度展示。圖 32
為展示在人類化20E6抗體結合於人類LAP-TGFβ1蛋白質時的氘吸收保護之H/D差異曲線。圖 33
為展示在抗體結合於人類LAP-TGFβ1蛋白質時的氘吸收保護之H/D差異曲線。圖 34
為人類LAP-TGFβ1與小鼠LAP-TGFβ1之間的序列比對。所鑑別之抗原決定基皆位於在人類與小鼠LAP-TGFβ1之間同源的區域中。圖中之人類LAP-TGFβ1序列對應於SEQ ID NO:257。圖中之小鼠LAP-TGFβ1序列對應於SEQ ID NO:7。圖 35A
及35B
為人類LAP-TGFβ1、GARP-LAP-TGFβ1、人類化20E6及複合物之尺寸排阻層析圖。各樣本之溶離時間符合凝膠過濾標準。由光散射偵測器測定所報導之分子量。圖 36A-36F
為一系列展示在同基因型CT26結腸直腸癌腫瘤模型中,抗LAP抗體28G11及16B4與抗PD-1抗體之組合對腫瘤體積之作用之曲線。圖中展示之資料為:圖 36A
(單獨的抗PD-1抗體)、圖 36B
(28G11_IgG2a + 抗PD-1抗體)、圖 36C
(IgG2a同型對照物)、圖 36D
(單獨的抗PD-1抗體)、圖 36E
(單獨的16B4_IgG2a)及圖 36F
(16B4_IgG2a + 抗PD-1抗體)。抗PD-1抗體為大鼠抗PD-1 (純系RMP1-14)-IgG2a抗體。圖 37
為展示在同基因型EMT6乳癌腫瘤模型中,抗LAP抗體28G11與抗PD-1抗體之組合對腫瘤體積之作用之圖。抗PD-1抗體為大鼠抗PD-1 (純系RMP1-14)-IgG2a抗體。所使用之統計測試為雙向ANOVA。圖 38
為展示在同基因型EMT6乳癌腫瘤模型中,抗LAP抗體22F9與抗PD-1抗體之組合對腫瘤體積之作用之圖。抗PD-1抗體為大鼠抗PD-1 (純系RMP1-14)-IgG2a抗體。所使用之統計測試為雙向ANOVA。圖 39
為展示在同基因型EMT6乳癌腫瘤模型中,抗LAP抗體20E6與抗PD-1抗體之組合對腫瘤體積之作用之圖。抗PD-1抗體為大鼠抗PD-1 (純系RMP1-14)-IgG2a抗體。所使用之統計測試為雙向ANOVA。圖 40
為展示在4T1乳癌腫瘤轉移模型中,抗LAP抗體28G11_IgG2a及16B4_IgG2a以及抗TGFβ抗體1D11_IgG1 (以單藥療法形式)對肺節結計數之作用之圖(p<0.05,不成對T測試,隨後移除離群值)。圖 41A
及41B
為展示在同基因型CT26腫瘤模型中,抗LAP抗體28G11_IgG2a與12 Gy (圖 41A
)及20 Gy (圖 41B
)放射之組合對腫瘤體積之作用之曲線。所使用之統計測試為2向ANOVA。**** P<0.0001,*** P=0.0004圖 42A-42C
為展示在存在或不存在12 Gy或20 Gy放射之情況下,抗LAP抗體28G11_IgG2a對M-MDSC (圖 42A
)、M2巨噬細胞(圖 42B
)及樹突狀細胞(圖 42C
)中的CD73表現之作用之曲線。圖 43A-43H
為一系列展示在同基因型EMT6小鼠乳癌腫瘤模型中,單獨的抗LAP抗體28G11-mIgG2a及20E6-mIgG2a以及其與抗PD-1抗體之組合對腫瘤體積之作用之曲線。圖中展示之資料為:圖43A為28G11-mIgG2a之功效之概述圖且圖43B為20E6-mIgG2a之功效之概述圖。亦展示對照抗體(圖43C)、抗體20E6-mIgG2a (圖43D)、抗體28G11-mIgG2a (圖43E)、抗PD-1抗體(圖43F)、抗體20E6-mIgG2a與抗PD-1抗體之組合(圖43G)以及抗體28G11-mIgG2a及抗PD-1抗體之組合(圖43H)之腫瘤體積資料。圖 44A-44D
為一系列展示抗LAP F(ab')與人類LAP-TGFβ同功異型物1、2及3之結合之Biacore曲線。圖 45A-45D
為一系列展示抗LAP F(ab')與人類、食蟹獼猴、大鼠及小鼠LAP-TGFβ1之結合之Biacore曲線。圖 46
為展示使用20E6_mIgG2a抗體、同型對照抗體或抗αVβ6 (10D5)抗體之LAP-TGFb1之整合素(avb6)活化之抑制之圖。
Claims (54)
- 一種特異性結合於LAP之經分離之抗體或其抗原結合片段,其包含: (a) 重鏈可變區,其包含有分別包含SEQ ID NO:110、120及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域; (b) 重鏈可變區,其包含有分別包含SEQ ID NO:110、111及112之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域; (c) 重鏈可變區,其包含有分別包含SEQ ID NO:16、26及18之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:19、20及21之胺基酸序列之CDR1、CDR2及CDR3區域; (d) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域; (e) 重鏈可變區,其包含有分別包含SEQ ID NO:54、66及56之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域; (f) 重鏈可變區,其包含有分別包含SEQ ID NO:54、55及68之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域;或 (g) 重鏈可變區,其包含有分別包含SEQ ID NO:54、66及68之胺基酸序列之CDR1、CDR2及CDR3區域,及輕鏈可變區,其包含有分別包含SEQ ID NO:57、58及59之胺基酸序列之CDR1、CDR2及CDR3區域。
- 如請求項1之抗體或其抗原結合片段,其包含重鏈及輕鏈可變區序列,該等重鏈及輕鏈可變區序列與選自由以下組成之群之胺基酸序列至少85%、90%、95%、98%或99%一致:(a)分別地,SEQ ID NO:218及154;(b)分別地,SEQ ID NO:133及154;(c)分別地,SEQ ID NO:42及52;(d)分別地,SEQ ID NO:101及104;及(e)分別地,SEQ ID NO:98及104。
- 如請求項1之抗體或其抗原結合片段,其包含有包含SEQ ID NO:218之胺基酸序列之重鏈可變區,或包含具有1-5、5-10、10-15、15-20或20-25個胺基酸取代之SEQ ID NO:218之胺基酸序列之重鏈可變區;及包含SEQ ID NO:154之胺基酸序列之輕鏈可變區,或包含具有1-5、5-10、10-15、15-20或20-25個胺基酸取代之SEQ ID NO:154之胺基酸序列之輕鏈可變區。
- 如請求項1之抗體或其抗原結合片段,其包含重鏈及輕鏈可變區序列,該等重鏈及輕鏈可變區序列係選自由以下組成之群:(a)分別地,SEQ ID NO:218及154,(b)SEQ ID NO:133及154,(c)分別地,SEQ ID NO:42及52;(d)分別地,SEQ ID NO:101及104;及(e)分別地,SEQ ID NO:98及104。
- 如請求項1之抗體或其抗原結合片段,其包含重鏈及輕鏈序列,該等重鏈及輕鏈序列與選自由以下組成之群之胺基酸序列至少85%、90%、95%、98%或99%一致:(a)分別地,SEQ ID NO:219及155;(b)分別地,SEQ ID NO:220及155;(c)分別地,SEQ ID NO:134及155;(d)分別地,SEQ ID NO:135及155;(e)分別地,SEQ ID NO:43及53;(f)分別地,SEQ ID NO:45及53;(g)分別地,SEQ ID NO:102及105;(h)分別地,SEQ ID NO:103及105;(i)分別地,SEQ ID NO:99及105;及(j)分別地,SEQ ID NO:100及105。
- 如請求項1之抗體或其抗原結合片段,其包含選自由以下組成之群之重鏈及輕鏈序列:(a)分別地,SEQ ID NO:219及155;(b)分別地,SEQ ID NO:220及155;(c)分別地,SEQ ID NO:134及155;(d)分別地,SEQ ID NO:135及155;(e)分別地,SEQ ID NO:43及53;(f)分別地,SEQ ID NO:45及53;(g)分別地,SEQ ID NO:102及105;(h)分別地,SEQ ID NO:103及105;(i)分別地,SEQ ID NO:99及105;及(j)分別地,SEQ ID NO:100及105。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體結合於人類LAP、食蟹獼猴LAP、大鼠LAP及/或鼠類LAP。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體抑制TGFβ1活化。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體以60 nM或更低、50 nM或更低、40 nM或更低、30 nM或更低、20 nM或更低或10 nM或更低之KD 結合於人類LAP。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體在不存在錨蛋白質之情況下結合於人類LAP。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體結合於免疫抑制性細胞。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體結合於免疫抑制性細胞上之與錨蛋白質複合之LAP,但不結合於該錨蛋白質或由LAP及該錨蛋白質兩者之殘基構成之抗原決定基。
- 如請求項12之抗體或抗原結合片段,其中該錨蛋白質為GARP或LRRC33。
- 如請求項11至13中任一項之抗體或抗原結合片段,其中該等免疫抑制性細胞為調節性T細胞、M2巨噬細胞、表現LAP之癌細胞及/或骨髓衍生之抑制性細胞。
- 如請求項11至14中任一項之抗體或抗原結合片段,其中該抗體或抗原結合片段結合於GARP陽性免疫抑制性細胞及GARP陰性免疫抑制性細胞兩者。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體或抗原結合片段不結合於細胞外基質上之LAP。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體或抗原結合片段不結合於與LTBP1、LTBP3及/或LTBP4複合之LAP。
- 如前述請求項中任一項之抗體,其中該抗體包含IgG恆定區或其變異體。
- 如前述請求項中任一項之抗體,其中該抗體為嵌合、人類或人類化抗體。
- 一種經分離之抗體,其與如請求項1至19中任一項之抗體結合於LAP上之相同抗原決定基。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體或抗原結合片段結合於LAP之抗原決定基。
- 如前述請求項中任一項之抗體或抗原結合片段,其中該抗體或抗原結合片段不結合於包含Y74T突變之人類LAP,或結合於包含K27C及Y75C突變之人類LAP。
- 一種經分離之抗體,其結合於人類LAP-TGFβ1 (SEQ ID NO:1)之殘基31-40、274-280及340-343中之一或多個殘基,或結合於人類LAP-TGFβ1 (SEQ ID NO:1)之殘基31-43、272-283及340-344中之一或多個殘基。
- 一種經分離之抗體,其結合於人類LAP且包含重鏈可變區及輕鏈可變區,該重鏈可變區包含有分別包含SEQ ID NO:110、120及112之胺基酸序列之CDR1、CDR2及CDR3區域,且該輕鏈可變區包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域,其中該抗體進一步包含人類IgG1恆定區。
- 一種經分離之抗體,其結合於人類LAP且包含重鏈可變區及輕鏈可變區,該重鏈可變區包含有分別包含SEQ ID NO:110、120及112之胺基酸序列之CDR1、CDR2及CDR3區域且該輕鏈可變區包含有分別包含SEQ ID NO:113、114及115之胺基酸序列之CDR1、CDR2及CDR3區域,其中該抗體進一步包含有包含SEQ ID NO:197之胺基酸序列之突變型人類IgG4恆定區。
- 如請求項24或25之抗體,其中該抗體包含有分別包含SEQ ID NO:218及154之胺基酸序列之重鏈及輕鏈可變區。
- 一種雙特異性分子,其包含如前述請求項中任一項之抗體或抗原結合片段,該抗體或抗原結合片段連接至具有第二結合區之分子。
- 如請求項27之雙特異性分子,其中該第二結合區結合於腫瘤相關抗原。
- 如請求項27之雙特異性分子,其中該第二結合區結合於CD4、CD8、CD45、CD56、CD14、CD16、CD19、CD11b、CD25、CD20、CD22、CD30、CD38、CD114、CD23、CD73、CD163、CD206、CD203、CD200R或CD39。
- 一種免疫結合物,其包含如請求項1至26中任一項之抗體或抗原結合片段,該抗體或抗原結合片段連接至可偵測部分、結合部分、標記部分或生物活性部分。
- 一種核酸,其包含編碼如請求項1至26中任一項之抗體或抗原結合片段之重鏈及/或輕鏈可變區之核苷酸序列。
- 一種表現載體,其包含如請求項31之核酸。
- 一種細胞,其經如請求項32之表現載體轉型。
- 一種醫藥組合物,其包含如請求項1至30中任一項之抗體或抗原結合片段、雙特異性分子或免疫結合物及醫藥學上可接受之載劑。
- 如請求項34之醫藥組合物,其進一步包含一或多種其他治療劑。
- 如請求項35之醫藥組合物,其中該一或多種其他治療劑係選自由以下組成之群:抗癌劑、化學治療劑、免疫抑制劑、免疫刺激劑、消炎劑及免疫檢查點抑制劑。
- 如請求項36之醫藥組合物,其中免疫檢查點阻斷劑係選自由以下組成之群:抗PD1抗體、抗PD-L1抗體、抗LAG-3抗體、抗CTLA-4抗體、抗TIGIT抗體及抗TIM3抗體。
- 一種套組,其包含如請求項1至30中任一項之抗體或抗原結合片段、雙特異性分子或免疫結合物,及使用說明書。
- 一種製備抗LAP抗體之方法,其包含在如請求項33之細胞中表現該抗體或抗原結合片段,及自該細胞分離該抗體或抗原結合片段。
- 一種在表現LAP之細胞上選擇性抑制TGFβ1活化,但不抑制細胞外基質上之TGFβ1活化之方法,其包含向個體投與如請求項1至26中任一項之抗體或抗原結合片段、如請求項27至29中任一項之雙特異性分子、如請求項30之免疫結合物或如請求項34至37中任一項之醫藥組合物。
- 如請求項40之方法,其中該細胞為免疫抑制性細胞。
- 如請求項41之方法,其中該免疫抑制性細胞係選自由以下組成之群:抑制性T細胞、M2巨噬細胞、表現LAP-TGFβ1之癌細胞及單核球性骨髓衍生之抑制性細胞。
- 一種治療癌症之方法,其包含向有需要之個體投與治療有效量之如請求項1至30中任一項之抗體或抗原結合片段、雙特異性分子或免疫結合物。
- 如請求項43之方法,其中該癌症之特徵在於異常TGFβ活性。
- 如請求項43或44之方法,其中該癌症與CD4+調節性T細胞、CD8+調節性T細胞、調節性B細胞、骨髓衍生之抑制性細胞、腫瘤相關巨噬細胞、癌症相關纖維母細胞及/或先天性淋巴細胞之浸潤相關聯。
- 如請求項43至45中任一項之方法,其中該癌症係選自由以下組成之群:乳癌、膀胱癌、子宮/子宮頸癌、卵巢癌、前列腺癌、睪丸癌、食道癌、胃腸癌、胰臟癌、結腸直腸癌、結腸癌、腎癌、頭頸癌、肺癌、胃癌、生殖細胞癌、骨癌、肝癌、甲狀腺癌、皮膚癌、中樞神經系統之贅瘤、淋巴瘤、白血病、骨髓瘤、肉瘤及骨髓發育不良症候群。
- 如請求項43至46中任一項之方法,其進一步包含投與一或多種其他療法。
- 如請求項47之方法,其中該一或多種其他療法係選自放射療法、化學療法、免疫檢查點抑制劑、免疫抑制性療法、免疫刺激性療法、細胞療法及治療劑。
- 如請求項48之方法,其中該免疫檢查點抑制劑為抗PD1抗體、抗PD-L1抗體、抗LAG-3抗體、抗CTLA-4抗體、抗TIGIT抗體或抗TIM3抗體。
- 一種偵測樣本中是否存在LAP之方法,其包含使該樣本與如請求項1至26中任一項之抗體或抗原結合片段在允許該抗體與LAP之間形成複合物之條件下接觸,及偵測該複合物之形成。
- 一種診斷與調節性T細胞浸潤相關聯之癌症之方法,其包含使來自罹患該癌症之患者之生物樣本與如請求項1至26中任一項之抗體或抗原結合片段接觸,其中該抗體之陽性染色表示該癌症與調節性T細胞浸潤相關聯。
- 一種診斷與GARP陰性抑制性細胞相關聯之癌症之方法,其包含使來自罹患該癌症之患者之生物樣本與如請求項1至26中任一項之抗體或抗原結合片段接觸,其中該抗體之陽性染色及抗GARP抗體之陰性染色表示該癌症與GARP陰性抑制性細胞相關聯。
- 一種選擇罹患癌症之患者以接受如請求項1至26中任一項之抗體治療之方法,其包含使來自該患者之生物樣本與該抗體或抗原結合片段接觸,其中該抗體之陽性染色表示該癌症可使用該抗體治療。
- 一種測定罹患癌症之患者對接受如請求項1至26中任一項之抗體治療的反應之方法,其包含使來自該患者之生物樣本與該抗體或抗原結合片段接觸,其中該抗體之染色減少時,表示該癌症對使用該抗體之治療有反應。
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862744045P | 2018-10-10 | 2018-10-10 | |
| US62/744,045 | 2018-10-10 | ||
| US201862750065P | 2018-10-24 | 2018-10-24 | |
| US62/750,065 | 2018-10-24 | ||
| US201862757519P | 2018-11-08 | 2018-11-08 | |
| US62/757,519 | 2018-11-08 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| TW202035445A true TW202035445A (zh) | 2020-10-01 |
Family
ID=68425274
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| TW108136746A TW202035445A (zh) | 2018-10-10 | 2019-10-09 | 抗lap抗體變異體及其用途 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US11130802B2 (zh) |
| EP (1) | EP3863722A2 (zh) |
| JP (1) | JP2022504839A (zh) |
| CN (1) | CN113164780A (zh) |
| TW (1) | TW202035445A (zh) |
| WO (1) | WO2020076969A2 (zh) |
Families Citing this family (9)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7350242B2 (ja) * | 2019-07-19 | 2023-09-26 | 国立研究開発法人理化学研究所 | ヒトTGF-βのLAP断片に対する抗体及びその利用 |
| WO2021207449A1 (en) | 2020-04-09 | 2021-10-14 | Merck Sharp & Dohme Corp. | Affinity matured anti-lap antibodies and uses thereof |
| CN112500491B (zh) | 2020-12-18 | 2022-04-08 | 深圳市迈加瑞生物技术有限公司 | 一种特异性中和辅助性T细胞TGF-β信号的双特异性抗体、其药物组合及其用途 |
| CN113402607B (zh) * | 2021-06-15 | 2022-05-10 | 北京东方百泰生物科技股份有限公司 | 一种抗lap单克隆抗体、其抗原结合片段及其应用 |
| CN115521378B (zh) * | 2021-07-23 | 2023-12-22 | 南京吉盛澳玛生物医药有限公司 | Pd-l1抗体及其用途 |
| CN114805579B (zh) * | 2022-06-08 | 2023-06-06 | 郑州大学 | 一种抗人ace2蛋白单克隆抗体、核酸分子及应用 |
| GB202216449D0 (en) * | 2022-11-04 | 2022-12-21 | Io Biotech Aps | TGF-BETA1 vaccine |
| US12091454B2 (en) | 2022-12-28 | 2024-09-17 | Development Center For Biotechnology | Humanized anti-human neurotensin receptor 1 antibodies and their uses |
| WO2024144803A1 (en) * | 2022-12-28 | 2024-07-04 | Development Center For Biotechnology | Humanized anti-human neurotensin receptor 1 antibodies and their uses |
Family Cites Families (201)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4444887A (en) | 1979-12-10 | 1984-04-24 | Sloan-Kettering Institute | Process for making human antibody producing B-lymphocytes |
| US4475196A (en) | 1981-03-06 | 1984-10-02 | Zor Clair G | Instrument for locating faults in aircraft passenger reading light and attendant call control system |
| US4447233A (en) | 1981-04-10 | 1984-05-08 | Parker-Hannifin Corporation | Medication infusion pump |
| US4439196A (en) | 1982-03-18 | 1984-03-27 | Merck & Co., Inc. | Osmotic drug delivery system |
| US4522811A (en) | 1982-07-08 | 1985-06-11 | Syntex (U.S.A.) Inc. | Serial injection of muramyldipeptides and liposomes enhances the anti-infective activity of muramyldipeptides |
| US4716111A (en) | 1982-08-11 | 1987-12-29 | Trustees Of Boston University | Process for producing human antibodies |
| US4447224A (en) | 1982-09-20 | 1984-05-08 | Infusaid Corporation | Variable flow implantable infusion apparatus |
| US4487603A (en) | 1982-11-26 | 1984-12-11 | Cordis Corporation | Implantable microinfusion pump system |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US4486194A (en) | 1983-06-08 | 1984-12-04 | James Ferrara | Therapeutic device for administering medicaments through the skin |
| DE3572982D1 (en) | 1984-03-06 | 1989-10-19 | Takeda Chemical Industries Ltd | Chemically modified lymphokine and production thereof |
| US4596556A (en) | 1985-03-25 | 1986-06-24 | Bioject, Inc. | Hypodermic injection apparatus |
| DE3590766C2 (zh) | 1985-03-30 | 1991-01-10 | Marc Genf/Geneve Ch Ballivet | |
| US6492107B1 (en) | 1986-11-20 | 2002-12-10 | Stuart Kauffman | Process for obtaining DNA, RNA, peptides, polypeptides, or protein, by recombinant DNA technique |
| US5374548A (en) | 1986-05-02 | 1994-12-20 | Genentech, Inc. | Methods and compositions for the attachment of proteins to liposomes using a glycophospholipid anchor |
| MX9203291A (es) | 1985-06-26 | 1992-08-01 | Liposome Co Inc | Metodo para acoplamiento de liposomas. |
| US5618920A (en) | 1985-11-01 | 1997-04-08 | Xoma Corporation | Modular assembly of antibody genes, antibodies prepared thereby and use |
| DE3600905A1 (de) | 1986-01-15 | 1987-07-16 | Ant Nachrichtentech | Verfahren zum dekodieren von binaersignalen sowie viterbi-dekoder und anwendungen |
| GB8607679D0 (en) | 1986-03-27 | 1986-04-30 | Winter G P | Recombinant dna product |
| US5225539A (en) | 1986-03-27 | 1993-07-06 | Medical Research Council | Recombinant altered antibodies and methods of making altered antibodies |
| US4881175A (en) | 1986-09-02 | 1989-11-14 | Genex Corporation | Computer based system and method for determining and displaying possible chemical structures for converting double- or multiple-chain polypeptides to single-chain polypeptides |
| US4946778A (en) | 1987-09-21 | 1990-08-07 | Genex Corporation | Single polypeptide chain binding molecules |
| US5260203A (en) | 1986-09-02 | 1993-11-09 | Enzon, Inc. | Single polypeptide chain binding molecules |
| US5567610A (en) | 1986-09-04 | 1996-10-22 | Bioinvent International Ab | Method of producing human monoclonal antibodies and kit therefor |
| EP0307434B2 (en) | 1987-03-18 | 1998-07-29 | Scotgen Biopharmaceuticals, Inc. | Altered antibodies |
| US5013653A (en) | 1987-03-20 | 1991-05-07 | Creative Biomolecules, Inc. | Product and process for introduction of a hinge region into a fusion protein to facilitate cleavage |
| US5258498A (en) | 1987-05-21 | 1993-11-02 | Creative Biomolecules, Inc. | Polypeptide linkers for production of biosynthetic proteins |
| DE3856559T2 (de) | 1987-05-21 | 2004-04-29 | Micromet Ag | Multifunktionelle Proteine mit vorbestimmter Zielsetzung |
| US5132405A (en) | 1987-05-21 | 1992-07-21 | Creative Biomolecules, Inc. | Biosynthetic antibody binding sites |
| US5091513A (en) | 1987-05-21 | 1992-02-25 | Creative Biomolecules, Inc. | Biosynthetic antibody binding sites |
| US4790824A (en) | 1987-06-19 | 1988-12-13 | Bioject, Inc. | Non-invasive hypodermic injection device |
| US4941880A (en) | 1987-06-19 | 1990-07-17 | Bioject, Inc. | Pre-filled ampule and non-invasive hypodermic injection device assembly |
| US5677425A (en) | 1987-09-04 | 1997-10-14 | Celltech Therapeutics Limited | Recombinant antibody |
| WO1990006952A1 (en) | 1988-12-22 | 1990-06-28 | Kirin-Amgen, Inc. | Chemically modified granulocyte colony stimulating factor |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5108921A (en) | 1989-04-03 | 1992-04-28 | Purdue Research Foundation | Method for enhanced transmembrane transport of exogenous molecules |
| EP0478627A4 (en) | 1989-05-16 | 1992-08-19 | William D. Huse | Co-expression of heteromeric receptors |
| CA2016842A1 (en) | 1989-05-16 | 1990-11-16 | Richard A. Lerner | Method for tapping the immunological repertoire |
| CA2016841C (en) | 1989-05-16 | 1999-09-21 | William D. Huse | A method for producing polymers having a preselected activity |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| US5312335A (en) | 1989-11-09 | 1994-05-17 | Bioject Inc. | Needleless hypodermic injection device |
| US5064413A (en) | 1989-11-09 | 1991-11-12 | Bioject, Inc. | Needleless hypodermic injection device |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| ATE356869T1 (de) | 1990-01-12 | 2007-04-15 | Amgen Fremont Inc | Bildung von xenogenen antikörpern |
| US5229275A (en) | 1990-04-26 | 1993-07-20 | Akzo N.V. | In-vitro method for producing antigen-specific human monoclonal antibodies |
| GB9015198D0 (en) | 1990-07-10 | 1990-08-29 | Brien Caroline J O | Binding substance |
| JP3306063B2 (ja) | 1990-08-24 | 2002-07-24 | イグジス, インコーポレイテッド | ランダムコドンを有するオリゴヌクレオチドを合成する方法 |
| IL100460A (en) | 1990-12-20 | 1997-06-10 | Ixsys | Method for optimization of binding proteins and nucleic acids encoding a binding protein produced thereby |
| EP0519596B1 (en) | 1991-05-17 | 2005-02-23 | Merck & Co. Inc. | A method for reducing the immunogenicity of antibody variable domains |
| ES2136092T3 (es) | 1991-09-23 | 1999-11-16 | Medical Res Council | Procedimientos para la produccion de anticuerpos humanizados. |
| DE69229477T2 (de) | 1991-09-23 | 1999-12-09 | Cambridge Antibody Technology Ltd., Melbourn | Methoden zur Herstellung humanisierter Antikörper |
| DK1136556T3 (da) | 1991-11-25 | 2005-10-03 | Enzon Inc | Fremgangsmåde til fremstilling af multivalente antigen-bindende proteiner |
| CA2507749C (en) | 1991-12-13 | 2010-08-24 | Xoma Corporation | Methods and materials for preparation of modified antibody variable domains and therapeutic uses thereof |
| US5714350A (en) | 1992-03-09 | 1998-02-03 | Protein Design Labs, Inc. | Increasing antibody affinity by altering glycosylation in the immunoglobulin variable region |
| CA2118508A1 (en) | 1992-04-24 | 1993-11-11 | Elizabeth S. Ward | Recombinant production of immunoglobulin-like domains in prokaryotic cells |
| US5383851A (en) | 1992-07-24 | 1995-01-24 | Bioject Inc. | Needleless hypodermic injection device |
| US6005079A (en) | 1992-08-21 | 1999-12-21 | Vrije Universiteit Brussels | Immunoglobulins devoid of light chains |
| ES2338791T3 (es) | 1992-08-21 | 2010-05-12 | Vrije Universiteit Brussel | Inmunoglobulinas desprovistas de cadenas ligeras. |
| US5639641A (en) | 1992-09-09 | 1997-06-17 | Immunogen Inc. | Resurfacing of rodent antibodies |
| EP0752248B1 (en) | 1992-11-13 | 2000-09-27 | Idec Pharmaceuticals Corporation | Therapeutic application of chimeric and radiolabeled antibodies to human B lymphocyte restricted differentiation antigen for treatment of B cell lymphoma |
| AU6132994A (en) | 1993-02-02 | 1994-08-29 | Scripps Research Institute, The | Methods for producing antibody libraries using universal or randomized immunoglobulin light chains |
| WO1994025591A1 (en) | 1993-04-29 | 1994-11-10 | Unilever N.V. | PRODUCTION OF ANTIBODIES OR (FUNCTIONALIZED) FRAGMENTS THEREOF DERIVED FROM HEAVY CHAIN IMMUNOGLOBULINS OF $i(CAMELIDAE) |
| WO1994029351A2 (en) | 1993-06-16 | 1994-12-22 | Celltech Limited | Antibodies |
| JPH08507549A (ja) | 1993-12-27 | 1996-08-13 | バクスター、インターナショナル、インコーポレイテッド | 水溶性の非免疫原性ポリアミド架橋剤 |
| US6121022A (en) | 1995-04-14 | 2000-09-19 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US6096871A (en) | 1995-04-14 | 2000-08-01 | Genentech, Inc. | Polypeptides altered to contain an epitope from the Fc region of an IgG molecule for increased half-life |
| EP0822830B1 (en) | 1995-04-27 | 2008-04-02 | Amgen Fremont Inc. | Human anti-IL-8 antibodies, derived from immunized xenomice |
| WO1996034096A1 (en) | 1995-04-28 | 1996-10-31 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| CA2245835A1 (en) | 1995-06-14 | 1997-01-03 | The Regents Of The University Of California | Novel high affinity human antibodies to tumor antigens |
| US6331431B1 (en) | 1995-11-28 | 2001-12-18 | Ixsys, Inc. | Vacuum device and method for isolating periplasmic fraction from cells |
| JP4046354B2 (ja) | 1996-03-18 | 2008-02-13 | ボード オブ リージェンツ,ザ ユニバーシティ オブ テキサス システム | 増大した半減期を有する免疫グロブリン様ドメイン |
| US5714352A (en) | 1996-03-20 | 1998-02-03 | Xenotech Incorporated | Directed switch-mediated DNA recombination |
| US5916771A (en) | 1996-10-11 | 1999-06-29 | Abgenix, Inc. | Production of a multimeric protein by cell fusion method |
| PT1500329E (pt) | 1996-12-03 | 2012-06-18 | Amgen Fremont Inc | Anticorpos humanos que se ligam especificamente ao tnf alfa humano |
| US6277375B1 (en) | 1997-03-03 | 2001-08-21 | Board Of Regents, The University Of Texas System | Immunoglobulin-like domains with increased half-lives |
| AU6703198A (en) | 1997-03-21 | 1998-10-20 | Brigham And Women's Hospital | Immunotherapeutic ctla-4 binding peptides |
| JP3876002B2 (ja) | 1997-04-14 | 2007-01-31 | ミクロメート・アクチエンゲゼルシャフト | 抗ヒト抗原受容体を産生するための斬新な方法およびそれらの使用 |
| US6235883B1 (en) | 1997-05-05 | 2001-05-22 | Abgenix, Inc. | Human monoclonal antibodies to epidermal growth factor receptor |
| GB2339430A (en) | 1997-05-21 | 2000-01-26 | Biovation Ltd | Method for the production of non-immunogenic proteins |
| US6891082B2 (en) | 1997-08-01 | 2005-05-10 | The Johns Hopkins University School Of Medicine | Transgenic non-human animals expressing a truncated activintype II receptor |
| EP1007967A2 (en) | 1997-08-04 | 2000-06-14 | Ixsys, Incorporated | Methods for identifying ligand specific binding molecules |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| WO1999052552A1 (en) | 1998-04-15 | 1999-10-21 | Brigham & Women's Hospital, Inc. | T cell inhibitory receptor compositions and uses thereof |
| DE69942021D1 (de) | 1998-04-20 | 2010-04-01 | Glycart Biotechnology Ag | Glykosylierungs-engineering von antikörpern zur verbesserung der antikörperabhängigen zellvermittelten zytotoxizität |
| IT1303776B1 (it) | 1998-11-19 | 2001-02-23 | S I S S A Scuola Internaz Supe | Processo per la preparazione di genoteche, di polipeptidi utilizzandodette genoteche e i polipepti ottenuti. |
| CN1328571B (zh) | 1998-12-23 | 2016-08-31 | 辉瑞大药厂 | 抗ctla-4的人单克隆抗体 |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| KR20060067983A (ko) | 1999-01-15 | 2006-06-20 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| DK2270147T4 (da) | 1999-04-09 | 2020-08-31 | Kyowa Kirin Co Ltd | Fremgangsmåde til at kontrollere aktiviteten af immunologisk funktionelt molekyle |
| PL362804A1 (en) | 1999-08-23 | 2004-11-02 | Dana-Farber Cancer Institute | Novel b7-4 molecules and uses therefor |
| JP4668498B2 (ja) | 1999-10-19 | 2011-04-13 | 協和発酵キリン株式会社 | ポリペプチドの製造方法 |
| ES2629683T3 (es) | 1999-11-30 | 2017-08-14 | Mayo Foundation For Medical Education And Research | B7-H1, una nueva molécula inmunorreguladora |
| DK1252192T3 (da) | 2000-02-11 | 2006-11-20 | Merck Patent Gmbh | Forbedring af antistofbaserede fusionsproteiners serumhalveringstid |
| EP1297172B1 (en) | 2000-06-28 | 2005-11-09 | Glycofi, Inc. | Methods for producing modified glycoproteins |
| US7449308B2 (en) | 2000-06-28 | 2008-11-11 | Glycofi, Inc. | Combinatorial DNA library for producing modified N-glycans in lower eukaryotes |
| US6725230B2 (en) | 2000-07-18 | 2004-04-20 | Aegis Analytical Corporation | System, method and computer program for assembling process data of multi-database origins using a hierarchical display |
| US6946292B2 (en) | 2000-10-06 | 2005-09-20 | Kyowa Hakko Kogyo Co., Ltd. | Cells producing antibody compositions with increased antibody dependent cytotoxic activity |
| US6374470B1 (en) | 2000-10-06 | 2002-04-23 | Milliken & Company | Face plate for spun-like textured yarn |
| CA2448319C (en) | 2001-05-31 | 2010-07-27 | Medarex, Inc. | Cytotoxins, prodrugs, linkers and stabilizers useful therefor |
| US6884619B2 (en) | 2001-07-17 | 2005-04-26 | Yale University | Inhibition of BEHAB cleavage and primary central nervous system (CNS) tumors |
| KR20100018071A (ko) | 2001-08-03 | 2010-02-16 | 글리카트 바이오테크놀로지 아게 | 항체 의존적 세포 독성이 증가된 항체 글리코실화 변이체 |
| EP1443961B1 (en) | 2001-10-25 | 2009-05-06 | Genentech, Inc. | Glycoprotein compositions |
| US20040002587A1 (en) | 2002-02-20 | 2004-01-01 | Watkins Jeffry D. | Fc region variants |
| US7317091B2 (en) | 2002-03-01 | 2008-01-08 | Xencor, Inc. | Optimized Fc variants |
| US20040132101A1 (en) | 2002-09-27 | 2004-07-08 | Xencor | Optimized Fc variants and methods for their generation |
| AU2003226356A1 (en) | 2002-04-12 | 2003-10-27 | Ramot At Tel Aviv University Ltd. | Prevention of brain inflammation as a result of induced autoimmune response |
| IL149820A0 (en) | 2002-05-23 | 2002-11-10 | Curetech Ltd | Humanized immunomodulatory monoclonal antibodies for the treatment of neoplastic disease or immunodeficiency |
| PT1534335E (pt) | 2002-08-14 | 2012-02-28 | Macrogenics Inc | Anticorpos específicos de fcγriib e processos para a sua utilização |
| EP3502133A1 (en) | 2002-09-27 | 2019-06-26 | Xencor, Inc. | Optimized fc variants and methods for their generation |
| PT1562972E (pt) | 2002-10-15 | 2010-11-10 | Facet Biotech Corp | Alteração de afinidades de ligação ao fcrn ou semi-vidas séricas de anticorpos por mutagénese |
| EP1587540B1 (en) | 2003-01-09 | 2021-09-15 | MacroGenics, Inc. | IDENTIFICATION AND ENGINEERING OF ANTIBODIES WITH VARIANT Fc REGIONS AND METHODS OF USING SAME |
| US7410483B2 (en) | 2003-05-23 | 2008-08-12 | Novare Surgical Systems, Inc. | Hand-actuated device for remote manipulation of a grasping tool |
| US20080206219A1 (en) | 2003-08-08 | 2008-08-28 | The Regencts Of The University Of California | Novel Indications for Transforming Growth Factor-Beta Regulators |
| EP1674480A4 (en) | 2003-09-04 | 2007-06-20 | Riken | ANTIBODY RECOGNIZING THE REGIONAL SECTION CONTROLLING TGF-BETA ACTIVATION |
| US8101720B2 (en) | 2004-10-21 | 2012-01-24 | Xencor, Inc. | Immunoglobulin insertions, deletions and substitutions |
| GB0324368D0 (en) | 2003-10-17 | 2003-11-19 | Univ Cambridge Tech | Polypeptides including modified constant regions |
| CA2552788C (en) | 2004-01-12 | 2013-09-24 | Applied Molecular Evolution, Inc. | Fc region variants |
| AU2005227326B2 (en) | 2004-03-24 | 2009-12-03 | Xencor, Inc. | Immunoglobulin variants outside the Fc region |
| RU2386638C2 (ru) | 2004-03-31 | 2010-04-20 | Дженентек, Инк. | Гуманизированные анти-тфр-бета-антитела |
| CN1997382A (zh) | 2004-05-05 | 2007-07-11 | 梅里麦克制药股份有限公司 | 调节生物活性的双特异性结合剂 |
| US7691962B2 (en) | 2004-05-19 | 2010-04-06 | Medarex, Inc. | Chemical linkers and conjugates thereof |
| EP1747021B1 (en) | 2004-05-19 | 2015-09-09 | E. R. Squibb & Sons, L.L.C. | Self-immolative linkers and drug conjugates |
| CN102973947A (zh) | 2004-06-01 | 2013-03-20 | 健泰科生物技术公司 | 抗体-药物偶联物和方法 |
| US20110142858A1 (en) | 2004-06-07 | 2011-06-16 | Ramot At Tel Aviv University Ltd. | Method of Passsive Immunization Against Disease or Disorder Charcterized by Amyloid Aggregation with Diminished Risk of Neuroinflammation |
| EP1776385A1 (en) | 2004-07-21 | 2007-04-25 | Glycofi, Inc. | Immunoglobulins comprising predominantly a glcnac2man3glcnac2 glycoform |
| US7740847B2 (en) | 2004-08-04 | 2010-06-22 | Applied Molecular Evolution, Inc. | Variant Fc regions |
| US20090145493A1 (en) | 2004-11-23 | 2009-06-11 | Pip Co., Ltd. | Built-in wall water service box |
| CN101163502A (zh) | 2005-02-08 | 2008-04-16 | 根茨美公司 | 针对TGFβ的抗体 |
| KR20070114765A (ko) | 2005-02-23 | 2007-12-04 | 메리맥 파마슈티컬즈, 인크. | 생물학적 활성을 조절하기 위한 이특이성 결합제 |
| US7714016B2 (en) | 2005-04-08 | 2010-05-11 | Medarex, Inc. | Cytotoxic compounds and conjugates with cleavable substrates |
| PT1874818E (pt) | 2005-04-22 | 2011-05-05 | Lilly Co Eli | Anticorpos espec?ficos contra tgf beta 1 |
| ME02461B (me) | 2005-05-10 | 2017-02-20 | Incyte Holdings Corp | Modulatori indoleamina 2,3-dioksigenaze i metode za upotrebu istih |
| NZ566982A (en) | 2005-09-26 | 2011-06-30 | Medarex Inc | Duocarmycin drug conjugates |
| RS52100B (en) | 2005-10-26 | 2012-06-30 | Medarex, Inc. | PROCEDURES AND UNITS FOR PREPARING ANALOG CC-1065 |
| WO2007059404A2 (en) | 2005-11-10 | 2007-05-24 | Medarex, Inc. | Duocarmycin derivatives as novel cytotoxic compounds and conjugates |
| ES2540561T3 (es) | 2005-12-20 | 2015-07-10 | Incyte Corporation | N-hidroxiamidinoheterociclos como moduladores de indolamina 2,3-dioxigenasa |
| CL2007002650A1 (es) | 2006-09-19 | 2008-02-08 | Incyte Corp | Compuestos derivados de heterociclo n-hidroxiamino; composicion farmaceutica, util para tratar cancer, infecciones virales y desordenes neurodegenerativos entre otras. |
| EP2064207B1 (en) | 2006-09-19 | 2013-11-06 | Incyte Corporation | N-hydroxyamidinoheterocycles as modulators of indoleamine 2,3-dioxygenase |
| US20080227704A1 (en) | 2006-12-21 | 2008-09-18 | Kamens Joanne S | CXCL13 binding proteins |
| TWI412367B (zh) | 2006-12-28 | 2013-10-21 | Medarex Llc | 化學鏈接劑與可裂解基質以及其之綴合物 |
| AU2008218766A1 (en) | 2007-02-21 | 2008-08-28 | Medarex, Inc. | Chemical linkers with single amino acids and conjugates thereof |
| CN101525373A (zh) | 2007-03-08 | 2009-09-09 | 独立行政法人理化学研究所 | TGF-β活化反应阻碍物质 |
| EP1987839A1 (en) | 2007-04-30 | 2008-11-05 | I.N.S.E.R.M. Institut National de la Sante et de la Recherche Medicale | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| US9244059B2 (en) | 2007-04-30 | 2016-01-26 | Immutep Parc Club Orsay | Cytotoxic anti-LAG-3 monoclonal antibody and its use in the treatment or prevention of organ transplant rejection and autoimmune disease |
| US20090028857A1 (en) | 2007-07-23 | 2009-01-29 | Cell Genesys, Inc. | Pd-1 antibodies in combination with a cytokine-secreting cell and methods of use thereof |
| EP2044949A1 (en) | 2007-10-05 | 2009-04-08 | Immutep | Use of recombinant lag-3 or the derivatives thereof for eliciting monocyte immune response |
| US20090181037A1 (en) | 2007-11-02 | 2009-07-16 | George Heavner | Semi-Synthetic GLP-1 Peptide-FC Fusion Constructs, Methods and Uses |
| CN101932325B (zh) | 2007-11-30 | 2014-05-28 | 新联基因公司 | Ido抑制剂 |
| JP5470817B2 (ja) | 2008-03-10 | 2014-04-16 | 日産自動車株式会社 | 電池用電極およびこれを用いた電池、並びにその製造方法 |
| WO2009114335A2 (en) | 2008-03-12 | 2009-09-17 | Merck & Co., Inc. | Pd-1 binding proteins |
| JP5483023B2 (ja) | 2008-03-27 | 2014-05-07 | 国立大学法人東北大学 | がん細胞運動およびがん細胞浸潤抑制剤 |
| AR072999A1 (es) | 2008-08-11 | 2010-10-06 | Medarex Inc | Anticuerpos humanos que se unen al gen 3 de activacion linfocitaria (lag-3) y los usos de estos |
| KR20200047793A (ko) | 2008-12-09 | 2020-05-07 | 제넨테크, 인크. | 항-pd-l1 항체 및 t 세포 기능을 향상시키기 위한 그의 용도 |
| EP2421559B1 (en) | 2009-04-24 | 2016-07-20 | Vanderbilt University | Anti-tgf-beta induction of bone growth |
| US20110007023A1 (en) | 2009-07-09 | 2011-01-13 | Sony Ericsson Mobile Communications Ab | Display device, touch screen device comprising the display device, mobile device and method for sensing a force on a display device |
| EP2478110B1 (en) | 2009-09-16 | 2016-01-06 | Immunomedics, Inc. | Class i anti-cea antibodies and uses thereof |
| WO2011056652A1 (en) | 2009-10-28 | 2011-05-12 | Newlink Genetics | Imidazole derivatives as ido inhibitors |
| PL3279215T3 (pl) | 2009-11-24 | 2020-06-29 | Medimmune Limited | Ukierunkowane środki wiążące przeciwko B7-H1 |
| PE20121398A1 (es) | 2009-12-10 | 2012-10-26 | Hoffmann La Roche | Anticuerpos ligantes preferentemente al dominio extracelular 4 de csf1r humano |
| WO2011102483A1 (ja) | 2010-02-19 | 2011-08-25 | 独立行政法人理化学研究所 | ヒトTGF-βのLAPに結合する抗体 |
| PT2542256T (pt) | 2010-03-04 | 2019-09-05 | Macrogenics Inc | Anticorpos reativos com b7-h3, fragmentos imunologicamente ativos dos mesmos e sua utilização |
| RU2617966C2 (ru) | 2010-03-05 | 2017-04-28 | Ф.Хоффманн-Ля Рош Аг | Антитела против csf-1r человека и их применение |
| CN102918060B (zh) | 2010-03-05 | 2016-04-06 | 霍夫曼-拉罗奇有限公司 | 抗人csf-1r抗体及其用途 |
| NZ712765A (en) | 2010-05-04 | 2017-01-27 | Five Prime Therapeutics Inc | Antibodies that bind csf1r |
| US8907053B2 (en) | 2010-06-25 | 2014-12-09 | Aurigene Discovery Technologies Limited | Immunosuppression modulating compounds |
| US8951521B2 (en) | 2010-08-30 | 2015-02-10 | Riken | Compounds having activity of suppressing activation of TGF-β receptor, method for screening of the compounds, and composition for preventing or treating disease caused by hepatitis C virus |
| HUE041958T2 (hu) | 2010-09-09 | 2019-06-28 | Pfizer | 4-IBB-t kötõ molekulák |
| NO2694640T3 (zh) | 2011-04-15 | 2018-03-17 | ||
| HUE037651T2 (hu) | 2011-04-20 | 2018-09-28 | Medimmune Llc | B7-Hl-et és PD-l-et kötõ ellenanyagok és más molekulák |
| CA2843200A1 (en) | 2011-07-27 | 2013-01-31 | Baylor Research Institute | Dendritic cell (dc)-vaccine therapy for pancreatic cancer |
| WO2013043569A1 (en) | 2011-09-20 | 2013-03-28 | Vical Incorporated | Synergistic anti-tumor efficacy using alloantigen combination immunotherapy |
| WO2013078286A1 (en) | 2011-11-22 | 2013-05-30 | Cornell University | Methods for stimulating hematopoietic recovery by inhibiting tgf beta signaling |
| RS61033B1 (sr) | 2011-11-28 | 2020-12-31 | Merck Patent Gmbh | Antitela na pd-l1 i njihova upotreba |
| CA2853889A1 (en) | 2011-12-15 | 2013-06-20 | F. Hoffmann-La Roche Ag | Antibodies against human csf-1r and uses thereof |
| CA2861122A1 (en) | 2012-02-06 | 2013-08-15 | Genentech, Inc. | Compositions and methods for using csf1r inhibitors |
| AR090263A1 (es) | 2012-03-08 | 2014-10-29 | Hoffmann La Roche | Terapia combinada de anticuerpos contra el csf-1r humano y las utilizaciones de la misma |
| US9518112B2 (en) | 2012-03-08 | 2016-12-13 | Ludwig Institute For Cancer Research Ltd | TGF-β1 specific antibodies and methods and uses thereof |
| RU2670743C9 (ru) | 2012-05-11 | 2018-12-19 | Файв Прайм Терапьютикс, Инк. | Способы лечения состояний антителами, которые связывают рецептор колониестимулирующего фактора 1 (csf1r) |
| CA3213528A1 (en) | 2012-05-15 | 2013-11-21 | Bristol-Myers Squibb Company | Cancer immunotherapy by disrupting pd-1/pd-l1 signaling |
| AR091649A1 (es) | 2012-07-02 | 2015-02-18 | Bristol Myers Squibb Co | Optimizacion de anticuerpos que se fijan al gen de activacion de linfocitos 3 (lag-3) y sus usos |
| KR20200140400A (ko) | 2012-08-31 | 2020-12-15 | 파이브 프라임 테라퓨틱스, 인크. | 집락 자극 인자 1 수용체(csf1r)에 결합하는 항체로 질환을 치료하는 방법 |
| EP3679950A1 (en) | 2012-10-12 | 2020-07-15 | The Brigham and Women's Hospital, Inc. | Enhancement of the immune response |
| CA3023553A1 (en) | 2012-11-06 | 2014-05-15 | Scholar Rock, Inc. | Compositions and methods for modulating cell signaling |
| JP6136279B2 (ja) | 2013-01-15 | 2017-05-31 | 株式会社ジェイテクト | 転がり軸受装置 |
| TWI503850B (zh) | 2013-03-22 | 2015-10-11 | Polytronics Technology Corp | 過電流保護元件 |
| SG10201913751RA (en) | 2013-05-06 | 2020-03-30 | Scholar Rock Inc | Compositions and methods for growth factor modulation |
| US9574476B2 (en) | 2013-08-01 | 2017-02-21 | Elwha Llc | Systems, methods, and apparatuses related to vehicles with reduced emissions |
| TWI510996B (zh) | 2013-10-03 | 2015-12-01 | Acer Inc | 控制觸控面板的方法以及使用該方法的可攜式電腦 |
| EP2878308B1 (en) | 2013-12-02 | 2018-10-31 | Thomas Harder | Agents and methods for the suppression of T cell activation |
| EP3139957A4 (en) | 2014-05-06 | 2018-04-25 | Scholar Rock, Inc. | Compositions and methods for growth factor modulation |
| EP3244926B8 (en) | 2015-01-14 | 2024-08-21 | The Brigham and Women's Hospital, Inc. | Treatment of cancer with anti-lap monoclonal antibodies |
| US10167334B2 (en) | 2015-04-03 | 2019-01-01 | Xoma Technology Ltd. | Treatment of cancer using anti-TGF-BETA and PD-1 antibodies |
| PT3365368T (pt) | 2016-03-11 | 2023-08-17 | Scholar Rock Inc | Imunoglobulinas de ligação a tgfbeta1 e sua utilização |
| SG11201900200XA (en) | 2016-07-14 | 2019-02-27 | Scholar Rock Inc | Tgfb antibodies, methods, and uses |
| TW201811827A (zh) | 2016-09-05 | 2018-04-01 | 日商中外製藥股份有限公司 | 抗TGF-β1抗體及使用方法 |
| US9816280B1 (en) | 2016-11-02 | 2017-11-14 | Matthew Reitnauer | Portable floor |
| WO2018129329A1 (en) | 2017-01-06 | 2018-07-12 | Scholar Rock, Inc. | ISOFORM-SPECIFIC, CONTEXT-PERMISSIVE TGFβ1 INHIBITORS AND USE THEREOF |
| AU2018266784C9 (en) | 2017-05-09 | 2024-10-03 | Scholar Rock, Inc. | LRRC33 inhibitors and use thereof |
| CA3071427A1 (en) | 2017-07-28 | 2019-01-31 | Scholar Rock, Inc. | Ltbp complex-specific inhibitors of tgf-beta 1 and uses thereof |
| WO2019075090A1 (en) | 2017-10-10 | 2019-04-18 | Tilos Therapeutics, Inc. | ANTI-LAP ANTIBODIES AND USES THEREOF |
-
2019
- 2019-10-09 JP JP2021520307A patent/JP2022504839A/ja active Pending
- 2019-10-09 CN CN201980081592.5A patent/CN113164780A/zh active Pending
- 2019-10-09 EP EP19797430.6A patent/EP3863722A2/en active Pending
- 2019-10-09 WO PCT/US2019/055426 patent/WO2020076969A2/en unknown
- 2019-10-09 US US16/597,593 patent/US11130802B2/en active Active
- 2019-10-09 TW TW108136746A patent/TW202035445A/zh unknown
-
2021
- 2021-09-02 US US17/465,247 patent/US20220017612A1/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| EP3863722A2 (en) | 2021-08-18 |
| US20220017612A1 (en) | 2022-01-20 |
| US20200140530A1 (en) | 2020-05-07 |
| JP2022504839A (ja) | 2022-01-13 |
| WO2020076969A3 (en) | 2020-07-23 |
| WO2020076969A2 (en) | 2020-04-16 |
| US11130802B2 (en) | 2021-09-28 |
| CN113164780A (zh) | 2021-07-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US11130802B2 (en) | Anti-lap antibody variants | |
| TWI816396B (zh) | 特異性針對gucy2c之抗體及其用途 | |
| US11230601B2 (en) | Methods of using anti-lap antibodies | |
| JP7068275B2 (ja) | 抗tigit抗体、抗pvrig抗体およびそれらの組み合せ | |
| CN109862915B (zh) | 针对信号调控蛋白α的抗体和使用方法 | |
| CN107530428B (zh) | Icos的抗体 | |
| KR20200054133A (ko) | Ig 및 itim 도메인을 갖는 t 세포 면역 수용체 (tigit)에 대한 항체 및 이것의 사용 | |
| JP2020504171A (ja) | 抗PD−1抗体との組み合わせのための抗Tim−3抗体 | |
| JP2018522541A (ja) | 抗cll−1抗体及び使用方法 | |
| CA3000400A1 (en) | Agonistic antibodies specifically binding human cd40 and methods of use | |
| CN109790223A (zh) | 用于治疗癌症的抗siglec-7抗体 | |
| EP3561057A1 (en) | Anti-cd3 antibody, and molecule containing said antibody | |
| TW202317620A (zh) | 抗SIRPα抗體 | |
| CN112566937A (zh) | 对cd3特异性的抗体及其用途 | |
| JP2023093694A (ja) | 抗cd147抗体 | |
| US20230272056A1 (en) | Affinity matured anti-lap antibodies and uses thereof | |
| RU2812113C2 (ru) | Антитела против gucy2c и их применение | |
| JP2024509946A (ja) | 抗ヒトcxcr5抗体及びその使用 |