RU2745678C2 - Способы лечения рака - Google Patents
Способы лечения рака Download PDFInfo
- Publication number
- RU2745678C2 RU2745678C2 RU2017140676A RU2017140676A RU2745678C2 RU 2745678 C2 RU2745678 C2 RU 2745678C2 RU 2017140676 A RU2017140676 A RU 2017140676A RU 2017140676 A RU2017140676 A RU 2017140676A RU 2745678 C2 RU2745678 C2 RU 2745678C2
- Authority
- RU
- Russia
- Prior art keywords
- rad1901
- everolimus
- dose
- treatment
- tumor
- Prior art date
Links
- 206010028980 Neoplasm Diseases 0.000 title claims abstract description 198
- 238000000034 method Methods 0.000 title claims abstract description 82
- 201000011510 cancer Diseases 0.000 title claims description 36
- SIFNOOUKXBRGGB-AREMUKBSSA-N (6r)-6-[2-[ethyl-[[4-[2-(ethylamino)ethyl]phenyl]methyl]amino]-4-methoxyphenyl]-5,6,7,8-tetrahydronaphthalen-2-ol Chemical compound C1=CC(CCNCC)=CC=C1CN(CC)C1=CC(OC)=CC=C1[C@H]1CC2=CC=C(O)C=C2CC1 SIFNOOUKXBRGGB-AREMUKBSSA-N 0.000 claims abstract description 365
- 229960005167 everolimus Drugs 0.000 claims abstract description 170
- 108010038795 estrogen receptors Proteins 0.000 claims abstract description 151
- 239000003814 drug Substances 0.000 claims abstract description 142
- HKVAMNSJSFKALM-GKUWKFKPSA-N Everolimus Chemical compound C1C[C@@H](OCCO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 HKVAMNSJSFKALM-GKUWKFKPSA-N 0.000 claims abstract description 137
- 206010006187 Breast cancer Diseases 0.000 claims abstract description 50
- 208000026310 Breast neoplasm Diseases 0.000 claims abstract description 46
- 239000000262 estrogen Substances 0.000 claims abstract description 24
- 229940079593 drug Drugs 0.000 claims abstract description 18
- 238000011282 treatment Methods 0.000 claims description 170
- 102100038595 Estrogen receptor Human genes 0.000 claims description 162
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 claims description 120
- 229960002258 fulvestrant Drugs 0.000 claims description 116
- 150000003839 salts Chemical class 0.000 claims description 91
- 239000012453 solvate Substances 0.000 claims description 82
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 claims description 55
- -1 SEBPA Proteins 0.000 claims description 51
- 230000014509 gene expression Effects 0.000 claims description 44
- 229960001603 tamoxifen Drugs 0.000 claims description 27
- 238000004458 analytical method Methods 0.000 claims description 21
- 108090000623 proteins and genes Proteins 0.000 claims description 18
- 102000005962 receptors Human genes 0.000 claims description 16
- 108020003175 receptors Proteins 0.000 claims description 16
- 102100033810 RAC-alpha serine/threonine-protein kinase Human genes 0.000 claims description 11
- 239000003886 aromatase inhibitor Substances 0.000 claims description 9
- 238000002560 therapeutic procedure Methods 0.000 claims description 9
- 101000882584 Homo sapiens Estrogen receptor Proteins 0.000 claims description 8
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 7
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 7
- 229960003881 letrozole Drugs 0.000 claims description 6
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 claims description 6
- 108010025464 Cyclin-Dependent Kinase 4 Proteins 0.000 claims description 5
- 102100036252 Cyclin-dependent kinase 4 Human genes 0.000 claims description 5
- 229960002932 anastrozole Drugs 0.000 claims description 5
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 claims description 5
- 229940046844 aromatase inhibitors Drugs 0.000 claims description 5
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 claims description 5
- 229960005026 toremifene Drugs 0.000 claims description 5
- 229940122815 Aromatase inhibitor Drugs 0.000 claims description 4
- 108090000461 Aurora Kinase A Proteins 0.000 claims description 4
- 102000004000 Aurora Kinase A Human genes 0.000 claims description 4
- 229940046836 anti-estrogen Drugs 0.000 claims description 4
- 230000001833 anti-estrogenic effect Effects 0.000 claims description 4
- 239000000328 estrogen antagonist Substances 0.000 claims description 4
- 108010025468 Cyclin-Dependent Kinase 6 Proteins 0.000 claims description 3
- 102100026804 Cyclin-dependent kinase 6 Human genes 0.000 claims description 3
- 101001120056 Homo sapiens Phosphatidylinositol 3-kinase regulatory subunit alpha Proteins 0.000 claims description 3
- 101000605639 Homo sapiens Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform Proteins 0.000 claims description 3
- 101000779418 Homo sapiens RAC-alpha serine/threonine-protein kinase Proteins 0.000 claims description 3
- 101000798015 Homo sapiens RAC-beta serine/threonine-protein kinase Proteins 0.000 claims description 3
- 101000984753 Homo sapiens Serine/threonine-protein kinase B-raf Proteins 0.000 claims description 3
- 101150097381 Mtor gene Proteins 0.000 claims description 3
- 102100026169 Phosphatidylinositol 3-kinase regulatory subunit alpha Human genes 0.000 claims description 3
- 102100038332 Phosphatidylinositol 4,5-bisphosphate 3-kinase catalytic subunit alpha isoform Human genes 0.000 claims description 3
- 102100032315 RAC-beta serine/threonine-protein kinase Human genes 0.000 claims description 3
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 claims description 3
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 claims description 3
- 102100027103 Serine/threonine-protein kinase B-raf Human genes 0.000 claims description 3
- 102100023085 Serine/threonine-protein kinase mTOR Human genes 0.000 claims description 3
- 102100033793 ALK tyrosine kinase receptor Human genes 0.000 claims description 2
- 102100034580 AT-rich interactive domain-containing protein 1A Human genes 0.000 claims description 2
- 102000000872 ATM Human genes 0.000 claims description 2
- 102100034540 Adenomatous polyposis coli protein Human genes 0.000 claims description 2
- 108010004586 Ataxia Telangiectasia Mutated Proteins Proteins 0.000 claims description 2
- 108700020463 BRCA1 Proteins 0.000 claims description 2
- 102000036365 BRCA1 Human genes 0.000 claims description 2
- 101150072950 BRCA1 gene Proteins 0.000 claims description 2
- 102000052609 BRCA2 Human genes 0.000 claims description 2
- 108700020462 BRCA2 Proteins 0.000 claims description 2
- 108010040168 Bcl-2-Like Protein 11 Proteins 0.000 claims description 2
- 102000001765 Bcl-2-Like Protein 11 Human genes 0.000 claims description 2
- 101150008921 Brca2 gene Proteins 0.000 claims description 2
- 102100026008 Breakpoint cluster region protein Human genes 0.000 claims description 2
- 108091007854 Cdh1/Fizzy-related Proteins 0.000 claims description 2
- 102100025064 Cellular tumor antigen p53 Human genes 0.000 claims description 2
- 108010043471 Core Binding Factor Alpha 2 Subunit Proteins 0.000 claims description 2
- 108010058546 Cyclin D1 Proteins 0.000 claims description 2
- 108010009356 Cyclin-Dependent Kinase Inhibitor p15 Proteins 0.000 claims description 2
- 102000009512 Cyclin-Dependent Kinase Inhibitor p15 Human genes 0.000 claims description 2
- 108010009392 Cyclin-Dependent Kinase Inhibitor p16 Proteins 0.000 claims description 2
- 108010016777 Cyclin-Dependent Kinase Inhibitor p27 Proteins 0.000 claims description 2
- 102000000577 Cyclin-Dependent Kinase Inhibitor p27 Human genes 0.000 claims description 2
- 102100021147 DNA mismatch repair protein Msh6 Human genes 0.000 claims description 2
- 102100023274 Dual specificity mitogen-activated protein kinase kinase 4 Human genes 0.000 claims description 2
- 108050002772 E3 ubiquitin-protein ligase Mdm2 Proteins 0.000 claims description 2
- 102000012199 E3 ubiquitin-protein ligase Mdm2 Human genes 0.000 claims description 2
- 101710105178 F-box/WD repeat-containing protein 7 Proteins 0.000 claims description 2
- 102100028138 F-box/WD repeat-containing protein 7 Human genes 0.000 claims description 2
- 102100028072 Fibroblast growth factor 4 Human genes 0.000 claims description 2
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 claims description 2
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 claims description 2
- 102100040859 Fizzy-related protein homolog Human genes 0.000 claims description 2
- 102100024165 G1/S-specific cyclin-D1 Human genes 0.000 claims description 2
- 102100024185 G1/S-specific cyclin-D2 Human genes 0.000 claims description 2
- 102100037859 G1/S-specific cyclin-D3 Human genes 0.000 claims description 2
- 102100037858 G1/S-specific cyclin-E1 Human genes 0.000 claims description 2
- 102100039788 GTPase NRas Human genes 0.000 claims description 2
- 102100022103 Histone-lysine N-methyltransferase 2A Human genes 0.000 claims description 2
- 101000779641 Homo sapiens ALK tyrosine kinase receptor Proteins 0.000 claims description 2
- 101000924266 Homo sapiens AT-rich interactive domain-containing protein 1A Proteins 0.000 claims description 2
- 101000924577 Homo sapiens Adenomatous polyposis coli protein Proteins 0.000 claims description 2
- 101000933320 Homo sapiens Breakpoint cluster region protein Proteins 0.000 claims description 2
- 101000968658 Homo sapiens DNA mismatch repair protein Msh6 Proteins 0.000 claims description 2
- 101001115395 Homo sapiens Dual specificity mitogen-activated protein kinase kinase 4 Proteins 0.000 claims description 2
- 101001095815 Homo sapiens E3 ubiquitin-protein ligase RING2 Proteins 0.000 claims description 2
- 101001060274 Homo sapiens Fibroblast growth factor 4 Proteins 0.000 claims description 2
- 101000980741 Homo sapiens G1/S-specific cyclin-D2 Proteins 0.000 claims description 2
- 101000738559 Homo sapiens G1/S-specific cyclin-D3 Proteins 0.000 claims description 2
- 101000738568 Homo sapiens G1/S-specific cyclin-E1 Proteins 0.000 claims description 2
- 101000744505 Homo sapiens GTPase NRas Proteins 0.000 claims description 2
- 101001056180 Homo sapiens Induced myeloid leukemia cell differentiation protein Mcl-1 Proteins 0.000 claims description 2
- 101001034652 Homo sapiens Insulin-like growth factor 1 receptor Proteins 0.000 claims description 2
- 101000599886 Homo sapiens Isocitrate dehydrogenase [NADP], mitochondrial Proteins 0.000 claims description 2
- 101001057193 Homo sapiens Membrane-associated guanylate kinase, WW and PDZ domain-containing protein 1 Proteins 0.000 claims description 2
- 101000653374 Homo sapiens Methylcytosine dioxygenase TET2 Proteins 0.000 claims description 2
- 101001126417 Homo sapiens Platelet-derived growth factor receptor alpha Proteins 0.000 claims description 2
- 101000728236 Homo sapiens Polycomb group protein ASXL1 Proteins 0.000 claims description 2
- 101000573199 Homo sapiens Protein PML Proteins 0.000 claims description 2
- 101000686031 Homo sapiens Proto-oncogene tyrosine-protein kinase ROS Proteins 0.000 claims description 2
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 claims description 2
- 101100087590 Homo sapiens RICTOR gene Proteins 0.000 claims description 2
- 101000606537 Homo sapiens Receptor-type tyrosine-protein phosphatase delta Proteins 0.000 claims description 2
- 101000628562 Homo sapiens Serine/threonine-protein kinase STK11 Proteins 0.000 claims description 2
- 101000702545 Homo sapiens Transcription activator BRG1 Proteins 0.000 claims description 2
- 101000687905 Homo sapiens Transcription factor SOX-2 Proteins 0.000 claims description 2
- 101000823316 Homo sapiens Tyrosine-protein kinase ABL1 Proteins 0.000 claims description 2
- 101000997832 Homo sapiens Tyrosine-protein kinase JAK2 Proteins 0.000 claims description 2
- 101000740048 Homo sapiens Ubiquitin carboxyl-terminal hydrolase BAP1 Proteins 0.000 claims description 2
- 102100026539 Induced myeloid leukemia cell differentiation protein Mcl-1 Human genes 0.000 claims description 2
- 102100039688 Insulin-like growth factor 1 receptor Human genes 0.000 claims description 2
- 102100037845 Isocitrate dehydrogenase [NADP], mitochondrial Human genes 0.000 claims description 2
- 101000740049 Latilactobacillus curvatus Bioactive peptide 1 Proteins 0.000 claims description 2
- 102000017274 MDM4 Human genes 0.000 claims description 2
- 108050005300 MDM4 Proteins 0.000 claims description 2
- 102100025825 Methylated-DNA-protein-cysteine methyltransferase Human genes 0.000 claims description 2
- 102100030803 Methylcytosine dioxygenase TET2 Human genes 0.000 claims description 2
- 102100025725 Mothers against decapentaplegic homolog 4 Human genes 0.000 claims description 2
- 101710143112 Mothers against decapentaplegic homolog 4 Proteins 0.000 claims description 2
- 102100038895 Myc proto-oncogene protein Human genes 0.000 claims description 2
- 102000007530 Neurofibromin 1 Human genes 0.000 claims description 2
- 108010085793 Neurofibromin 1 Proteins 0.000 claims description 2
- 102100027096 Nucleotide exchange factor SIL1 Human genes 0.000 claims description 2
- 108010011536 PTEN Phosphohydrolase Proteins 0.000 claims description 2
- 102000014160 PTEN Phosphohydrolase Human genes 0.000 claims description 2
- 102100030485 Platelet-derived growth factor receptor alpha Human genes 0.000 claims description 2
- 102100029799 Polycomb group protein ASXL1 Human genes 0.000 claims description 2
- 102100026375 Protein PML Human genes 0.000 claims description 2
- 102100023347 Proto-oncogene tyrosine-protein kinase ROS Human genes 0.000 claims description 2
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 claims description 2
- 108090000740 RNA-binding protein EWS Proteins 0.000 claims description 2
- 102000004229 RNA-binding protein EWS Human genes 0.000 claims description 2
- 108700019586 Rapamycin-Insensitive Companion of mTOR Proteins 0.000 claims description 2
- 102000046941 Rapamycin-Insensitive Companion of mTOR Human genes 0.000 claims description 2
- 102100039666 Receptor-type tyrosine-protein phosphatase delta Human genes 0.000 claims description 2
- 108010029031 Regulatory-Associated Protein of mTOR Proteins 0.000 claims description 2
- 102100040969 Regulatory-associated protein of mTOR Human genes 0.000 claims description 2
- 102100025373 Runt-related transcription factor 1 Human genes 0.000 claims description 2
- 102100026715 Serine/threonine-protein kinase STK11 Human genes 0.000 claims description 2
- 101710145783 TATA-box-binding protein Proteins 0.000 claims description 2
- 102100034196 Thrombopoietin receptor Human genes 0.000 claims description 2
- 102100031027 Transcription activator BRG1 Human genes 0.000 claims description 2
- 102100024270 Transcription factor SOX-2 Human genes 0.000 claims description 2
- 108010078814 Tumor Suppressor Protein p53 Proteins 0.000 claims description 2
- 102100022596 Tyrosine-protein kinase ABL1 Human genes 0.000 claims description 2
- 102100033444 Tyrosine-protein kinase JAK2 Human genes 0.000 claims description 2
- 108040008770 methylated-DNA-[protein]-cysteine S-methyltransferase activity proteins Proteins 0.000 claims description 2
- 101001042041 Bos taurus Isocitrate dehydrogenase [NAD] subunit beta, mitochondrial Proteins 0.000 claims 1
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 claims 1
- 102000009508 Cyclin-Dependent Kinase Inhibitor p16 Human genes 0.000 claims 1
- 108010016788 Cyclin-Dependent Kinase Inhibitor p21 Proteins 0.000 claims 1
- 102100024456 Cyclin-dependent kinase 8 Human genes 0.000 claims 1
- 102100033270 Cyclin-dependent kinase inhibitor 1 Human genes 0.000 claims 1
- 102100037964 E3 ubiquitin-protein ligase RING2 Human genes 0.000 claims 1
- 101150097734 EPHB2 gene Proteins 0.000 claims 1
- 102100031968 Ephrin type-B receptor 2 Human genes 0.000 claims 1
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 claims 1
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 claims 1
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 claims 1
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 claims 1
- 102100021066 Fibroblast growth factor receptor substrate 2 Human genes 0.000 claims 1
- 102100029974 GTPase HRas Human genes 0.000 claims 1
- 102100038353 Gremlin-2 Human genes 0.000 claims 1
- 102100031561 Hamartin Human genes 0.000 claims 1
- 102100027893 Homeobox protein Nkx-2.1 Human genes 0.000 claims 1
- 101000980937 Homo sapiens Cyclin-dependent kinase 8 Proteins 0.000 claims 1
- 101000818410 Homo sapiens Fibroblast growth factor receptor substrate 2 Proteins 0.000 claims 1
- 101000584633 Homo sapiens GTPase HRas Proteins 0.000 claims 1
- 101001032861 Homo sapiens Gremlin-2 Proteins 0.000 claims 1
- 101000795643 Homo sapiens Hamartin Proteins 0.000 claims 1
- 101000632178 Homo sapiens Homeobox protein Nkx-2.1 Proteins 0.000 claims 1
- 101001046870 Homo sapiens Hypoxia-inducible factor 1-alpha Proteins 0.000 claims 1
- 101000960234 Homo sapiens Isocitrate dehydrogenase [NADP] cytoplasmic Proteins 0.000 claims 1
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 claims 1
- 101000742859 Homo sapiens Retinoblastoma-associated protein Proteins 0.000 claims 1
- 101000795659 Homo sapiens Tuberin Proteins 0.000 claims 1
- 102100022875 Hypoxia-inducible factor 1-alpha Human genes 0.000 claims 1
- 102100039905 Isocitrate dehydrogenase [NADP] cytoplasmic Human genes 0.000 claims 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 claims 1
- 102100038042 Retinoblastoma-associated protein Human genes 0.000 claims 1
- 102100031638 Tuberin Human genes 0.000 claims 1
- 102000003702 retinoic acid receptors Human genes 0.000 claims 1
- 108090000064 retinoic acid receptors Proteins 0.000 claims 1
- 230000000694 effects Effects 0.000 abstract description 47
- 230000002401 inhibitory effect Effects 0.000 abstract description 29
- 229940011871 estrogen Drugs 0.000 abstract description 19
- 230000012010 growth Effects 0.000 abstract description 4
- 239000000126 substance Substances 0.000 abstract description 3
- 102000015694 estrogen receptors Human genes 0.000 abstract description 2
- 230000002195 synergetic effect Effects 0.000 abstract description 2
- 229940124597 therapeutic agent Drugs 0.000 description 119
- 108010007005 Estrogen Receptor alpha Proteins 0.000 description 118
- 102000007594 Estrogen Receptor alpha Human genes 0.000 description 115
- 230000004614 tumor growth Effects 0.000 description 67
- VOXZDWNPVJITMN-ZBRFXRBCSA-N 17β-estradiol Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 VOXZDWNPVJITMN-ZBRFXRBCSA-N 0.000 description 66
- 150000001875 compounds Chemical class 0.000 description 60
- 230000027455 binding Effects 0.000 description 56
- 102000003998 progesterone receptors Human genes 0.000 description 43
- 108090000468 progesterone receptors Proteins 0.000 description 43
- 210000004291 uterus Anatomy 0.000 description 43
- 229960005309 estradiol Drugs 0.000 description 41
- 210000004027 cell Anatomy 0.000 description 36
- 230000003993 interaction Effects 0.000 description 36
- 210000000988 bone and bone Anatomy 0.000 description 34
- 230000005764 inhibitory process Effects 0.000 description 34
- 239000000203 mixture Substances 0.000 description 34
- 210000001519 tissue Anatomy 0.000 description 34
- 108010031616 deoxyribonuclease gamma Proteins 0.000 description 33
- 230000035772 mutation Effects 0.000 description 33
- 239000003981 vehicle Substances 0.000 description 32
- 230000007423 decrease Effects 0.000 description 27
- 239000003446 ligand Substances 0.000 description 26
- 241000700159 Rattus Species 0.000 description 24
- 241001465754 Metazoa Species 0.000 description 21
- 238000012636 positron electron tomography Methods 0.000 description 21
- 238000009097 single-agent therapy Methods 0.000 description 21
- 238000009472 formulation Methods 0.000 description 20
- 239000001257 hydrogen Substances 0.000 description 20
- 229910052739 hydrogen Inorganic materials 0.000 description 20
- 241000699670 Mus sp. Species 0.000 description 18
- 229940124302 mTOR inhibitor Drugs 0.000 description 18
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 description 18
- 101150029707 ERBB2 gene Proteins 0.000 description 17
- 239000003795 chemical substances by application Substances 0.000 description 16
- 229930182833 estradiol Natural products 0.000 description 16
- 230000011664 signaling Effects 0.000 description 16
- 108091007960 PI3Ks Proteins 0.000 description 15
- 108090000430 Phosphatidylinositol 3-kinases Proteins 0.000 description 15
- 102000003993 Phosphatidylinositol 3-kinases Human genes 0.000 description 15
- 230000015556 catabolic process Effects 0.000 description 14
- 238000006731 degradation reaction Methods 0.000 description 14
- 230000002411 adverse Effects 0.000 description 13
- 238000009261 endocrine therapy Methods 0.000 description 13
- 210000003205 muscle Anatomy 0.000 description 13
- 238000009806 oophorectomy Methods 0.000 description 13
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 12
- 239000005557 antagonist Substances 0.000 description 12
- 238000001727 in vivo Methods 0.000 description 12
- 238000003032 molecular docking Methods 0.000 description 12
- 230000037361 pathway Effects 0.000 description 12
- 230000035755 proliferation Effects 0.000 description 12
- 229960004622 raloxifene Drugs 0.000 description 12
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 12
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 description 11
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 description 11
- 210000004556 brain Anatomy 0.000 description 11
- 238000002512 chemotherapy Methods 0.000 description 11
- 229940034984 endocrine therapy antineoplastic and immunomodulating agent Drugs 0.000 description 11
- 238000011156 evaluation Methods 0.000 description 11
- 229910052757 nitrogen Inorganic materials 0.000 description 11
- 150000001413 amino acids Chemical group 0.000 description 10
- 230000008859 change Effects 0.000 description 10
- 210000000056 organ Anatomy 0.000 description 10
- 238000004088 simulation Methods 0.000 description 10
- 229910052717 sulfur Inorganic materials 0.000 description 10
- 206010062767 Hypophysitis Diseases 0.000 description 9
- 206010033128 Ovarian cancer Diseases 0.000 description 9
- 206010061535 Ovarian neoplasm Diseases 0.000 description 9
- 230000008499 blood brain barrier function Effects 0.000 description 9
- 210000001218 blood-brain barrier Anatomy 0.000 description 9
- 239000003112 inhibitor Substances 0.000 description 9
- 238000002347 injection Methods 0.000 description 9
- 239000007924 injection Substances 0.000 description 9
- 231100000682 maximum tolerated dose Toxicity 0.000 description 9
- 206010061289 metastatic neoplasm Diseases 0.000 description 9
- 239000001369 metatartaric acid Substances 0.000 description 9
- 235000011042 metatartaric acid Nutrition 0.000 description 9
- 210000003635 pituitary gland Anatomy 0.000 description 9
- 206010068975 Bone atrophy Diseases 0.000 description 8
- 208000003174 Brain Neoplasms Diseases 0.000 description 8
- 108091008611 Protein Kinase B Proteins 0.000 description 8
- 230000008901 benefit Effects 0.000 description 8
- 231100000371 dose-limiting toxicity Toxicity 0.000 description 8
- 230000002829 reductive effect Effects 0.000 description 8
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 8
- 208000002495 Uterine Neoplasms Diseases 0.000 description 7
- 229910052799 carbon Inorganic materials 0.000 description 7
- 230000002124 endocrine Effects 0.000 description 7
- 239000000945 filler Substances 0.000 description 7
- 150000004677 hydrates Chemical class 0.000 description 7
- 230000001976 improved effect Effects 0.000 description 7
- 229910052500 inorganic mineral Inorganic materials 0.000 description 7
- 235000010755 mineral Nutrition 0.000 description 7
- 239000011707 mineral Substances 0.000 description 7
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 7
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 7
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 7
- 239000000333 selective estrogen receptor modulator Substances 0.000 description 7
- QFJCIRLUMZQUOT-HPLJOQBZSA-N sirolimus Chemical class C1C[C@@H](O)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 QFJCIRLUMZQUOT-HPLJOQBZSA-N 0.000 description 7
- 230000004083 survival effect Effects 0.000 description 7
- 230000001225 therapeutic effect Effects 0.000 description 7
- 210000000689 upper leg Anatomy 0.000 description 7
- 206010046766 uterine cancer Diseases 0.000 description 7
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 6
- 239000002136 L01XE07 - Lapatinib Substances 0.000 description 6
- XNRVGTHNYCNCFF-UHFFFAOYSA-N Lapatinib ditosylate monohydrate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1.CC1=CC=C(S(O)(=O)=O)C=C1.O1C(CNCCS(=O)(=O)C)=CC=C1C1=CC=C(N=CN=C2NC=3C=C(Cl)C(OCC=4C=C(F)C=CC=4)=CC=3)C2=C1 XNRVGTHNYCNCFF-UHFFFAOYSA-N 0.000 description 6
- 229930012538 Paclitaxel Natural products 0.000 description 6
- 229940024606 amino acid Drugs 0.000 description 6
- 239000003937 drug carrier Substances 0.000 description 6
- 230000002357 endometrial effect Effects 0.000 description 6
- 210000000981 epithelium Anatomy 0.000 description 6
- 238000007917 intracranial administration Methods 0.000 description 6
- 229960004891 lapatinib Drugs 0.000 description 6
- 108020001756 ligand binding domains Proteins 0.000 description 6
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 6
- 229960001592 paclitaxel Drugs 0.000 description 6
- 230000036470 plasma concentration Effects 0.000 description 6
- 239000000843 powder Substances 0.000 description 6
- 239000000523 sample Substances 0.000 description 6
- 230000008685 targeting Effects 0.000 description 6
- 238000012360 testing method Methods 0.000 description 6
- 229960000575 trastuzumab Drugs 0.000 description 6
- HJQQVNIORAQATK-DDJBQNAASA-N (e)-3-[4-[(z)-1,2-diphenylbut-1-enyl]phenyl]prop-2-enoic acid Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(\C=C\C(O)=O)=CC=1)/C1=CC=CC=C1 HJQQVNIORAQATK-DDJBQNAASA-N 0.000 description 5
- 208000001132 Osteoporosis Diseases 0.000 description 5
- 238000012879 PET imaging Methods 0.000 description 5
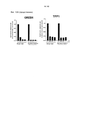
- 102220497176 Small vasohibin-binding protein_T47D_mutation Human genes 0.000 description 5
- 229960000397 bevacizumab Drugs 0.000 description 5
- 210000000481 breast Anatomy 0.000 description 5
- 238000002648 combination therapy Methods 0.000 description 5
- 230000001419 dependent effect Effects 0.000 description 5
- 239000002552 dosage form Substances 0.000 description 5
- 231100000673 dose–response relationship Toxicity 0.000 description 5
- 229940088597 hormone Drugs 0.000 description 5
- 239000005556 hormone Substances 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 239000003550 marker Substances 0.000 description 5
- 230000001404 mediated effect Effects 0.000 description 5
- 230000001394 metastastic effect Effects 0.000 description 5
- 230000002611 ovarian Effects 0.000 description 5
- 230000004044 response Effects 0.000 description 5
- 238000007920 subcutaneous administration Methods 0.000 description 5
- 238000001356 surgical procedure Methods 0.000 description 5
- 210000004881 tumor cell Anatomy 0.000 description 5
- 230000003442 weekly effect Effects 0.000 description 5
- 238000001262 western blot Methods 0.000 description 5
- KJAAPZIFCQQQKX-NDEPHWFRSA-N (2s)-2-[4-[2-[3-(fluoromethyl)azetidin-1-yl]ethoxy]phenyl]-3-(3-hydroxyphenyl)-4-methyl-2h-chromen-6-ol Chemical compound C1=CC([C@H]2C(=C(C3=CC(O)=CC=C3O2)C)C=2C=C(O)C=CC=2)=CC=C1OCCN1CC(CF)C1 KJAAPZIFCQQQKX-NDEPHWFRSA-N 0.000 description 4
- DFBDRVGWBHBJNR-BBNFHIFMSA-N (e)-3-[3,5-difluoro-4-[(1r,3r)-2-(2-fluoro-2-methylpropyl)-3-methyl-1,3,4,9-tetrahydropyrido[3,4-b]indol-1-yl]phenyl]prop-2-enoic acid Chemical compound C1([C@@H]2C3=C(C4=CC=CC=C4N3)C[C@H](N2CC(C)(C)F)C)=C(F)C=C(\C=C\C(O)=O)C=C1F DFBDRVGWBHBJNR-BBNFHIFMSA-N 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 4
- JUSFANSTBFGBAF-IRXDYDNUSA-N 3-[2,4-bis[(3s)-3-methylmorpholin-4-yl]pyrido[2,3-d]pyrimidin-7-yl]-n-methylbenzamide Chemical compound CNC(=O)C1=CC=CC(C=2N=C3N=C(N=C(C3=CC=2)N2[C@H](COCC2)C)N2[C@H](COCC2)C)=C1 JUSFANSTBFGBAF-IRXDYDNUSA-N 0.000 description 4
- GYLDXIAOMVERTK-UHFFFAOYSA-N 5-(4-amino-1-propan-2-yl-3-pyrazolo[3,4-d]pyrimidinyl)-1,3-benzoxazol-2-amine Chemical compound C12=C(N)N=CN=C2N(C(C)C)N=C1C1=CC=C(OC(N)=N2)C2=C1 GYLDXIAOMVERTK-UHFFFAOYSA-N 0.000 description 4
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 4
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 4
- 206010055113 Breast cancer metastatic Diseases 0.000 description 4
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 4
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 4
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerol Natural products OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 4
- 229940125497 HER2 kinase inhibitor Drugs 0.000 description 4
- 102000003964 Histone deacetylase Human genes 0.000 description 4
- 108090000353 Histone deacetylase Proteins 0.000 description 4
- 206010059282 Metastases to central nervous system Diseases 0.000 description 4
- 239000012823 PI3K/mTOR inhibitor Substances 0.000 description 4
- 102000001708 Protein Isoforms Human genes 0.000 description 4
- 108010029485 Protein Isoforms Proteins 0.000 description 4
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 229960005561 TAS-108 Drugs 0.000 description 4
- 102000008817 Trefoil Factor-1 Human genes 0.000 description 4
- 108010088412 Trefoil Factor-1 Proteins 0.000 description 4
- 238000009825 accumulation Methods 0.000 description 4
- DUYNJNWVGIWJRI-LJAQVGFWSA-N acolbifene Chemical compound C1=CC([C@H]2C(=C(C3=CC=C(O)C=C3O2)C)C=2C=CC(O)=CC=2)=CC=C1OCCN1CCCCC1 DUYNJNWVGIWJRI-LJAQVGFWSA-N 0.000 description 4
- 238000003556 assay Methods 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 238000002591 computed tomography Methods 0.000 description 4
- 238000005094 computer simulation Methods 0.000 description 4
- 235000014113 dietary fatty acids Nutrition 0.000 description 4
- 239000003085 diluting agent Substances 0.000 description 4
- 230000009977 dual effect Effects 0.000 description 4
- 229960000255 exemestane Drugs 0.000 description 4
- 239000000194 fatty acid Substances 0.000 description 4
- 229930195729 fatty acid Natural products 0.000 description 4
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 4
- 238000002513 implantation Methods 0.000 description 4
- 229960002367 lasofoxifene Drugs 0.000 description 4
- GXESHMAMLJKROZ-IAPPQJPRSA-N lasofoxifene Chemical compound C1([C@@H]2[C@@H](C3=CC=C(C=C3CC2)O)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1 GXESHMAMLJKROZ-IAPPQJPRSA-N 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 229920000609 methyl cellulose Polymers 0.000 description 4
- 235000010981 methylcellulose Nutrition 0.000 description 4
- 239000001923 methylcellulose Substances 0.000 description 4
- 239000000041 non-steroidal anti-inflammatory agent Substances 0.000 description 4
- 229940021182 non-steroidal anti-inflammatory drug Drugs 0.000 description 4
- 210000001672 ovary Anatomy 0.000 description 4
- 229960002087 pertuzumab Drugs 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 238000003753 real-time PCR Methods 0.000 description 4
- 229960004641 rituximab Drugs 0.000 description 4
- 229950009216 sapanisertib Drugs 0.000 description 4
- 229940095743 selective estrogen receptor modulator Drugs 0.000 description 4
- 230000019491 signal transduction Effects 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- VOHOCSJONOJOSD-SCIDSJFVSA-N tas-108 Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O.COC1=CC(CN(CC)CC)=CC=C1OCC[C@@H]1[C@@]2(C)CC[C@@H]3C4=CC=C(O)C=C4C[C@@H](C)[C@H]3[C@@H]2CC1 VOHOCSJONOJOSD-SCIDSJFVSA-N 0.000 description 4
- YOVVNQKCSKSHKT-HNNXBMFYSA-N (2s)-1-[4-[[2-(2-aminopyrimidin-5-yl)-7-methyl-4-morpholin-4-ylthieno[3,2-d]pyrimidin-6-yl]methyl]piperazin-1-yl]-2-hydroxypropan-1-one Chemical compound C1CN(C(=O)[C@@H](O)C)CCN1CC1=C(C)C2=NC(C=3C=NC(N)=NC=3)=NC(N3CCOCC3)=C2S1 YOVVNQKCSKSHKT-HNNXBMFYSA-N 0.000 description 3
- JDUBGYFRJFOXQC-KRWDZBQOSA-N 4-amino-n-[(1s)-1-(4-chlorophenyl)-3-hydroxypropyl]-1-(7h-pyrrolo[2,3-d]pyrimidin-4-yl)piperidine-4-carboxamide Chemical compound C1([C@H](CCO)NC(=O)C2(CCN(CC2)C=2C=3C=CNC=3N=CN=2)N)=CC=C(Cl)C=C1 JDUBGYFRJFOXQC-KRWDZBQOSA-N 0.000 description 3
- 101150071258 C3 gene Proteins 0.000 description 3
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 3
- BURHGPHDEVGCEZ-UHFFFAOYSA-N ClC1=C(C=CC(=C1)F)C(=C(C=1C=C2C=NNC2=CC=1)C1=CC=C(C=C1)C=CC(=O)O)CC Chemical compound ClC1=C(C=CC(=C1)F)C(=C(C=1C=C2C=NNC2=CC=1)C1=CC=C(C=C1)C=CC(=O)O)CC BURHGPHDEVGCEZ-UHFFFAOYSA-N 0.000 description 3
- 206010014733 Endometrial cancer Diseases 0.000 description 3
- 206010014759 Endometrial neoplasm Diseases 0.000 description 3
- 108010041356 Estrogen Receptor beta Proteins 0.000 description 3
- 101710196141 Estrogen receptor Proteins 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 102000016251 GREB1 Human genes 0.000 description 3
- 108050004787 GREB1 Proteins 0.000 description 3
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 3
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 3
- 229940124640 MK-2206 Drugs 0.000 description 3
- ULDXWLCXEDXJGE-UHFFFAOYSA-N MK-2206 Chemical compound C=1C=C(C=2C(=CC=3C=4N(C(NN=4)=O)C=CC=3N=2)C=2C=CC=CC=2)C=CC=1C1(N)CCC1 ULDXWLCXEDXJGE-UHFFFAOYSA-N 0.000 description 3
- 206010027476 Metastases Diseases 0.000 description 3
- 241000699666 Mus <mouse, genus> Species 0.000 description 3
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 3
- 206010028813 Nausea Diseases 0.000 description 3
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 3
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 3
- 239000004743 Polypropylene Substances 0.000 description 3
- DNIAPMSPPWPWGF-UHFFFAOYSA-N Propylene glycol Chemical compound CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 3
- 206010060862 Prostate cancer Diseases 0.000 description 3
- 208000000236 Prostatic Neoplasms Diseases 0.000 description 3
- SDCUWFRXMLQNCS-LFAPAAFUSA-N RU 58668 Chemical compound C1([C@H]2C[C@]3([C@H]([C@H]4[C@H]2C2=CC=C(O)C=C2CC4)CC[C@@H]3O)C)=CC=C(OCCCCCS(=O)(=O)CCCC(F)(F)C(F)(F)F)C=C1 SDCUWFRXMLQNCS-LFAPAAFUSA-N 0.000 description 3
- 229930006000 Sucrose Natural products 0.000 description 3
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 3
- CBPNZQVSJQDFBE-FUXHJELOSA-N Temsirolimus Chemical compound C1C[C@@H](OC(=O)C(C)(CO)CO)[C@H](OC)C[C@@H]1C[C@@H](C)[C@H]1OC(=O)[C@@H]2CCCCN2C(=O)C(=O)[C@](O)(O2)[C@H](C)CC[C@H]2C[C@H](OC)/C(C)=C/C=C/C=C/[C@@H](C)C[C@@H](C)C(=O)[C@H](OC)[C@H](O)/C(C)=C/[C@@H](C)C(=O)C1 CBPNZQVSJQDFBE-FUXHJELOSA-N 0.000 description 3
- 239000013543 active substance Substances 0.000 description 3
- 239000000556 agonist Substances 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 230000000259 anti-tumor effect Effects 0.000 description 3
- 239000002246 antineoplastic agent Substances 0.000 description 3
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 3
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 230000037182 bone density Effects 0.000 description 3
- 201000008274 breast adenocarcinoma Diseases 0.000 description 3
- 229960004562 carboplatin Drugs 0.000 description 3
- 239000000969 carrier Substances 0.000 description 3
- 210000003169 central nervous system Anatomy 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 210000002808 connective tissue Anatomy 0.000 description 3
- 238000007796 conventional method Methods 0.000 description 3
- 239000013078 crystal Substances 0.000 description 3
- 229950006418 dactolisib Drugs 0.000 description 3
- JOGKUKXHTYWRGZ-UHFFFAOYSA-N dactolisib Chemical compound O=C1N(C)C2=CN=C3C=CC(C=4C=C5C=CC=CC5=NC=4)=CC3=C2N1C1=CC=C(C(C)(C)C#N)C=C1 JOGKUKXHTYWRGZ-UHFFFAOYSA-N 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- 231100000517 death Toxicity 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 230000003149 estradiol stimulation Effects 0.000 description 3
- 238000002474 experimental method Methods 0.000 description 3
- 239000012894 fetal calf serum Substances 0.000 description 3
- 229960002949 fluorouracil Drugs 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 238000001990 intravenous administration Methods 0.000 description 3
- 238000004519 manufacturing process Methods 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000009245 menopause Effects 0.000 description 3
- 229960000485 methotrexate Drugs 0.000 description 3
- 230000008693 nausea Effects 0.000 description 3
- 230000002018 overexpression Effects 0.000 description 3
- 239000012188 paraffin wax Substances 0.000 description 3
- 239000008194 pharmaceutical composition Substances 0.000 description 3
- 239000000546 pharmaceutical excipient Substances 0.000 description 3
- LHNIIDJUOCFXAP-UHFFFAOYSA-N pictrelisib Chemical compound C1CN(S(=O)(=O)C)CCN1CC1=CC2=NC(C=3C=4C=NNC=4C=CC=3)=NC(N3CCOCC3)=C2S1 LHNIIDJUOCFXAP-UHFFFAOYSA-N 0.000 description 3
- 229920001223 polyethylene glycol Polymers 0.000 description 3
- 229920001155 polypropylene Polymers 0.000 description 3
- 230000003389 potentiating effect Effects 0.000 description 3
- 239000000955 prescription drug Substances 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 238000011002 quantification Methods 0.000 description 3
- ZAHRKKWIAAJSAO-UHFFFAOYSA-N rapamycin Natural products COCC(O)C(=C/C(C)C(=O)CC(OC(=O)C1CCCCN1C(=O)C(=O)C2(O)OC(CC(OC)C(=CC=CC=CC(C)CC(C)C(=O)C)C)CCC2C)C(C)CC3CCC(O)C(C3)OC)C ZAHRKKWIAAJSAO-UHFFFAOYSA-N 0.000 description 3
- 235000012239 silicon dioxide Nutrition 0.000 description 3
- 229960002930 sirolimus Drugs 0.000 description 3
- 238000003860 storage Methods 0.000 description 3
- 238000010254 subcutaneous injection Methods 0.000 description 3
- 239000007929 subcutaneous injection Substances 0.000 description 3
- 229960004793 sucrose Drugs 0.000 description 3
- 239000003826 tablet Substances 0.000 description 3
- 229960000235 temsirolimus Drugs 0.000 description 3
- 108010075758 trebananib Proteins 0.000 description 3
- 230000001836 utereotrophic effect Effects 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- GRZXWCHAXNAUHY-NSISKUIASA-N (2S)-2-(4-chlorophenyl)-1-[4-[(5R,7R)-7-hydroxy-5-methyl-6,7-dihydro-5H-cyclopenta[d]pyrimidin-4-yl]-1-piperazinyl]-3-(propan-2-ylamino)-1-propanone Chemical compound C1([C@H](C(=O)N2CCN(CC2)C=2C=3[C@H](C)C[C@@H](O)C=3N=CN=2)CNC(C)C)=CC=C(Cl)C=C1 GRZXWCHAXNAUHY-NSISKUIASA-N 0.000 description 2
- STUWGJZDJHPWGZ-LBPRGKRZSA-N (2S)-N1-[4-methyl-5-[2-(1,1,1-trifluoro-2-methylpropan-2-yl)-4-pyridinyl]-2-thiazolyl]pyrrolidine-1,2-dicarboxamide Chemical compound S1C(C=2C=C(N=CC=2)C(C)(C)C(F)(F)F)=C(C)N=C1NC(=O)N1CCC[C@H]1C(N)=O STUWGJZDJHPWGZ-LBPRGKRZSA-N 0.000 description 2
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 description 2
- 108020004463 18S ribosomal RNA Proteins 0.000 description 2
- BEUQXVWXFDOSAQ-UHFFFAOYSA-N 2-methyl-2-[4-[2-(5-methyl-2-propan-2-yl-1,2,4-triazol-3-yl)-5,6-dihydroimidazo[1,2-d][1,4]benzoxazepin-9-yl]pyrazol-1-yl]propanamide Chemical compound CC(C)N1N=C(C)N=C1C1=CN(CCOC=2C3=CC=C(C=2)C2=CN(N=C2)C(C)(C)C(N)=O)C3=N1 BEUQXVWXFDOSAQ-UHFFFAOYSA-N 0.000 description 2
- OZPFIJIOIVJZMN-SFHVURJKSA-N 6-[(7s)-7-hydroxy-5,6-dihydropyrrolo[1,2-c]imidazol-7-yl]-n-methylnaphthalene-2-carboxamide Chemical compound C1=CC2=CC(C(=O)NC)=CC=C2C=C1[C@]1(O)C2=CN=CN2CC1 OZPFIJIOIVJZMN-SFHVURJKSA-N 0.000 description 2
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 2
- RZVAJINKPMORJF-UHFFFAOYSA-N Acetaminophen Chemical compound CC(=O)NC1=CC=C(O)C=C1 RZVAJINKPMORJF-UHFFFAOYSA-N 0.000 description 2
- 206010069754 Acquired gene mutation Diseases 0.000 description 2
- 206010067484 Adverse reaction Diseases 0.000 description 2
- 108010012934 Albumin-Bound Paclitaxel Proteins 0.000 description 2
- 201000000736 Amenorrhea Diseases 0.000 description 2
- 206010001928 Amenorrhoea Diseases 0.000 description 2
- 206010002091 Anaesthesia Diseases 0.000 description 2
- 108010078554 Aromatase Proteins 0.000 description 2
- 102000014654 Aromatase Human genes 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 206010003571 Astrocytoma Diseases 0.000 description 2
- 206010065869 Astrocytoma, low grade Diseases 0.000 description 2
- 238000011729 BALB/c nude mouse Methods 0.000 description 2
- UFKLYTOEMRFKAD-SHTZXODSSA-N C1C[C@@H](OC)CC[C@@H]1N1C2=NC(C=3C=NC(=CC=3)C(C)(C)O)=CN=C2NCC1=O Chemical compound C1C[C@@H](OC)CC[C@@H]1N1C2=NC(C=3C=NC(=CC=3)C(C)(C)O)=CN=C2NCC1=O UFKLYTOEMRFKAD-SHTZXODSSA-N 0.000 description 2
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 2
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 2
- 102000016918 Complement C3 Human genes 0.000 description 2
- 108010028780 Complement C3 Proteins 0.000 description 2
- 229920002261 Corn starch Polymers 0.000 description 2
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 2
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 2
- FBPFZTCFMRRESA-JGWLITMVSA-N D-glucitol Chemical compound OC[C@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-JGWLITMVSA-N 0.000 description 2
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 2
- 102000000509 Estrogen Receptor beta Human genes 0.000 description 2
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 description 2
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- 108010069236 Goserelin Proteins 0.000 description 2
- JJKOTMDDZAJTGQ-DQSJHHFOSA-N Idoxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN2CCCC2)=CC=1)/C1=CC=C(I)C=C1 JJKOTMDDZAJTGQ-DQSJHHFOSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 2
- 229930195725 Mannitol Natural products 0.000 description 2
- 102000008135 Mechanistic Target of Rapamycin Complex 1 Human genes 0.000 description 2
- 108010035196 Mechanistic Target of Rapamycin Complex 1 Proteins 0.000 description 2
- 102000009308 Mechanistic Target of Rapamycin Complex 2 Human genes 0.000 description 2
- 108010034057 Mechanistic Target of Rapamycin Complex 2 Proteins 0.000 description 2
- 229930192392 Mitomycin Natural products 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- AFJRDFWMXUECEW-LBPRGKRZSA-N N-[(2S)-1-amino-3-(3-fluorophenyl)propan-2-yl]-5-chloro-4-(4-chloro-2-methyl-3-pyrazolyl)-2-thiophenecarboxamide Chemical compound CN1N=CC(Cl)=C1C1=C(Cl)SC(C(=O)N[C@H](CN)CC=2C=C(F)C=CC=2)=C1 AFJRDFWMXUECEW-LBPRGKRZSA-N 0.000 description 2
- 101100519293 Neurospora crassa (strain ATCC 24698 / 74-OR23-1A / CBS 708.71 / DSM 1257 / FGSC 987) pdx-1 gene Proteins 0.000 description 2
- 239000000020 Nitrocellulose Substances 0.000 description 2
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- 208000007913 Pituitary Neoplasms Diseases 0.000 description 2
- 229920003171 Poly (ethylene oxide) Polymers 0.000 description 2
- 239000002202 Polyethylene glycol Substances 0.000 description 2
- RJKFOVLPORLFTN-LEKSSAKUSA-N Progesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H](C(=O)C)[C@@]1(C)CC2 RJKFOVLPORLFTN-LEKSSAKUSA-N 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 239000012083 RIPA buffer Substances 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 229920002125 Sokalan® Polymers 0.000 description 2
- 229920002472 Starch Polymers 0.000 description 2
- 208000006011 Stroke Diseases 0.000 description 2
- 238000000692 Student's t-test Methods 0.000 description 2
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 2
- FOCVUCIESVLUNU-UHFFFAOYSA-N Thiotepa Chemical compound C1CN1P(N1CC1)(=S)N1CC1 FOCVUCIESVLUNU-UHFFFAOYSA-N 0.000 description 2
- 208000026911 Tuberous sclerosis complex Diseases 0.000 description 2
- 229940028652 abraxane Drugs 0.000 description 2
- 159000000021 acetate salts Chemical class 0.000 description 2
- 230000003213 activating effect Effects 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 239000000654 additive Substances 0.000 description 2
- 239000002671 adjuvant Substances 0.000 description 2
- 230000006838 adverse reaction Effects 0.000 description 2
- 229950010482 alpelisib Drugs 0.000 description 2
- 231100000540 amenorrhea Toxicity 0.000 description 2
- 230000037005 anaesthesia Effects 0.000 description 2
- 239000004037 angiogenesis inhibitor Substances 0.000 description 2
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 2
- 230000002280 anti-androgenic effect Effects 0.000 description 2
- 239000000051 antiandrogen Substances 0.000 description 2
- 238000011319 anticancer therapy Methods 0.000 description 2
- 239000003963 antioxidant agent Substances 0.000 description 2
- 235000006708 antioxidants Nutrition 0.000 description 2
- MCGDSOGUHLTADD-UHFFFAOYSA-N arzoxifene Chemical compound C1=CC(OC)=CC=C1C1=C(OC=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 MCGDSOGUHLTADD-UHFFFAOYSA-N 0.000 description 2
- 229950005529 arzoxifene Drugs 0.000 description 2
- 239000011324 bead Substances 0.000 description 2
- 239000011230 binding agent Substances 0.000 description 2
- 239000011575 calcium Substances 0.000 description 2
- 229910052791 calcium Inorganic materials 0.000 description 2
- 229910000019 calcium carbonate Inorganic materials 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 229960004117 capecitabine Drugs 0.000 description 2
- 239000001569 carbon dioxide Substances 0.000 description 2
- 229910002092 carbon dioxide Inorganic materials 0.000 description 2
- 230000005754 cellular signaling Effects 0.000 description 2
- 235000010980 cellulose Nutrition 0.000 description 2
- 229920002678 cellulose Polymers 0.000 description 2
- 239000001913 cellulose Substances 0.000 description 2
- 238000004587 chromatography analysis Methods 0.000 description 2
- 230000000052 comparative effect Effects 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000037011 constitutive activity Effects 0.000 description 2
- 239000008120 corn starch Substances 0.000 description 2
- 229940127089 cytotoxic agent Drugs 0.000 description 2
- YKGMKSIHIVVYKY-UHFFFAOYSA-N dabrafenib mesylate Chemical compound CS(O)(=O)=O.S1C(C(C)(C)C)=NC(C=2C(=C(NS(=O)(=O)C=3C(=CC=CC=3F)F)C=CC=2)F)=C1C1=CC=NC(N)=N1 YKGMKSIHIVVYKY-UHFFFAOYSA-N 0.000 description 2
- 229960000975 daunorubicin Drugs 0.000 description 2
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 2
- 230000003247 decreasing effect Effects 0.000 description 2
- 230000003111 delayed effect Effects 0.000 description 2
- 239000007884 disintegrant Substances 0.000 description 2
- NOPFSRXAKWQILS-UHFFFAOYSA-N docosan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCCCCCO NOPFSRXAKWQILS-UHFFFAOYSA-N 0.000 description 2
- 229940115080 doxil Drugs 0.000 description 2
- 239000008298 dragée Substances 0.000 description 2
- 229950004203 droloxifene Drugs 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 230000008030 elimination Effects 0.000 description 2
- 238000003379 elimination reaction Methods 0.000 description 2
- 239000003995 emulsifying agent Substances 0.000 description 2
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 2
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 2
- 229960003649 eribulin Drugs 0.000 description 2
- UFNVPOGXISZXJD-XJPMSQCNSA-N eribulin Chemical compound C([C@H]1CC[C@@H]2O[C@@H]3[C@H]4O[C@H]5C[C@](O[C@H]4[C@H]2O1)(O[C@@H]53)CC[C@@H]1O[C@H](C(C1)=C)CC1)C(=O)C[C@@H]2[C@@H](OC)[C@@H](C[C@H](O)CN)O[C@H]2C[C@@H]2C(=C)[C@H](C)C[C@H]1O2 UFNVPOGXISZXJD-XJPMSQCNSA-N 0.000 description 2
- 229940087861 faslodex Drugs 0.000 description 2
- 238000002875 fluorescence polarization Methods 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 238000003304 gavage Methods 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229940014259 gelatin Drugs 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 229960005277 gemcitabine Drugs 0.000 description 2
- 229940020967 gemzar Drugs 0.000 description 2
- 238000011223 gene expression profiling Methods 0.000 description 2
- 239000008103 glucose Substances 0.000 description 2
- 235000011187 glycerol Nutrition 0.000 description 2
- 239000008187 granular material Substances 0.000 description 2
- 231100000226 haematotoxicity Toxicity 0.000 description 2
- 125000001165 hydrophobic group Chemical group 0.000 description 2
- 229950002248 idoxifene Drugs 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- 239000007972 injectable composition Substances 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 238000007912 intraperitoneal administration Methods 0.000 description 2
- 230000001788 irregular Effects 0.000 description 2
- 239000008101 lactose Substances 0.000 description 2
- XZEUAXYWNKYKPL-WDYNHAJCSA-N levormeloxifene Chemical compound C1([C@H]2[C@@H](C3=CC=C(C=C3OC2(C)C)OC)C=2C=CC(OCCN3CCCC3)=CC=2)=CC=CC=C1 XZEUAXYWNKYKPL-WDYNHAJCSA-N 0.000 description 2
- 229950002728 levormeloxifene Drugs 0.000 description 2
- 230000000670 limiting effect Effects 0.000 description 2
- 230000033001 locomotion Effects 0.000 description 2
- 239000000314 lubricant Substances 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- 210000005075 mammary gland Anatomy 0.000 description 2
- 239000000594 mannitol Substances 0.000 description 2
- 235000010355 mannitol Nutrition 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- 238000002483 medication Methods 0.000 description 2
- 239000002609 medium Substances 0.000 description 2
- 239000012528 membrane Substances 0.000 description 2
- 229960005558 mertansine Drugs 0.000 description 2
- 230000009401 metastasis Effects 0.000 description 2
- 238000010603 microCT Methods 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- APLJSSOXDWUNGV-GOSISDBHSA-N n-[(1r)-3-(4-hydroxyphenyl)-1-methylpropyl]-2-(2-phenyl-1h-indol-3-yl)acetamide Chemical compound C([C@@H](C)NC(=O)CC=1C2=CC=CC=C2NC=1C=1C=CC=CC=1)CC1=CC=C(O)C=C1 APLJSSOXDWUNGV-GOSISDBHSA-N 0.000 description 2
- AXTAPYRUEKNRBA-JTQLQIEISA-N n-[(2s)-1-amino-3-(3,4-difluorophenyl)propan-2-yl]-5-chloro-4-(4-chloro-2-methylpyrazol-3-yl)furan-2-carboxamide Chemical compound CN1N=CC(Cl)=C1C1=C(Cl)OC(C(=O)N[C@H](CN)CC=2C=C(F)C(F)=CC=2)=C1 AXTAPYRUEKNRBA-JTQLQIEISA-N 0.000 description 2
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 2
- 229940086322 navelbine Drugs 0.000 description 2
- 239000013642 negative control Substances 0.000 description 2
- 230000017066 negative regulation of growth Effects 0.000 description 2
- 229920001220 nitrocellulos Polymers 0.000 description 2
- 238000011580 nude mouse model Methods 0.000 description 2
- 238000001543 one-way ANOVA Methods 0.000 description 2
- 230000003287 optical effect Effects 0.000 description 2
- 229950004023 orteronel Drugs 0.000 description 2
- 108010046239 paclitaxel-Angiopep-2 conjugate Proteins 0.000 description 2
- 229960005489 paracetamol Drugs 0.000 description 2
- 230000036961 partial effect Effects 0.000 description 2
- 230000007170 pathology Effects 0.000 description 2
- CUIHSIWYWATEQL-UHFFFAOYSA-N pazopanib Chemical compound C1=CC2=C(C)N(C)N=C2C=C1N(C)C(N=1)=CC=NC=1NC1=CC=C(C)C(S(N)(=O)=O)=C1 CUIHSIWYWATEQL-UHFFFAOYSA-N 0.000 description 2
- 230000026731 phosphorylation Effects 0.000 description 2
- 238000006366 phosphorylation reaction Methods 0.000 description 2
- 201000002511 pituitary cancer Diseases 0.000 description 2
- 230000001817 pituitary effect Effects 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 238000004321 preservation Methods 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 229940002612 prodrug Drugs 0.000 description 2
- 239000000651 prodrug Substances 0.000 description 2
- 238000000159 protein binding assay Methods 0.000 description 2
- 239000003197 protein kinase B inhibitor Substances 0.000 description 2
- 208000016691 refractory malignant neoplasm Diseases 0.000 description 2
- 230000001105 regulatory effect Effects 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000003757 reverse transcription PCR Methods 0.000 description 2
- 229960001302 ridaforolimus Drugs 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- DAEPDZWVDSPTHF-UHFFFAOYSA-M sodium pyruvate Chemical compound [Na+].CC(=O)C([O-])=O DAEPDZWVDSPTHF-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 239000000243 solution Substances 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 230000037439 somatic mutation Effects 0.000 description 2
- 239000000600 sorbitol Substances 0.000 description 2
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N squalane Chemical compound CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 2
- 238000010561 standard procedure Methods 0.000 description 2
- 239000008107 starch Substances 0.000 description 2
- 235000019698 starch Nutrition 0.000 description 2
- 238000007619 statistical method Methods 0.000 description 2
- 201000004059 subependymal giant cell astrocytoma Diseases 0.000 description 2
- 238000006467 substitution reaction Methods 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 239000004094 surface-active agent Substances 0.000 description 2
- 230000002459 sustained effect Effects 0.000 description 2
- 230000009885 systemic effect Effects 0.000 description 2
- 239000000454 talc Substances 0.000 description 2
- 229910052623 talc Inorganic materials 0.000 description 2
- 238000002626 targeted therapy Methods 0.000 description 2
- 229950001269 taselisib Drugs 0.000 description 2
- 229940063683 taxotere Drugs 0.000 description 2
- 229960004964 temozolomide Drugs 0.000 description 2
- 229960001196 thiotepa Drugs 0.000 description 2
- HNONEKILPDHFOL-UHFFFAOYSA-M tolonium chloride Chemical compound [Cl-].C1=C(C)C(N)=CC2=[S+]C3=CC(N(C)C)=CC=C3N=C21 HNONEKILPDHFOL-UHFFFAOYSA-M 0.000 description 2
- 238000011200 topical administration Methods 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 238000013518 transcription Methods 0.000 description 2
- 230000035897 transcription Effects 0.000 description 2
- 229960001612 trastuzumab emtansine Drugs 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 208000009999 tuberous sclerosis Diseases 0.000 description 2
- 231100000588 tumorigenic Toxicity 0.000 description 2
- 230000000381 tumorigenic effect Effects 0.000 description 2
- 229950011257 veliparib Drugs 0.000 description 2
- JNAHVYVRKWKWKQ-CYBMUJFWSA-N veliparib Chemical compound N=1C2=CC=CC(C(N)=O)=C2NC=1[C@@]1(C)CCCN1 JNAHVYVRKWKWKQ-CYBMUJFWSA-N 0.000 description 2
- 208000004043 venous thromboembolism Diseases 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 2
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 2
- GBABOYUKABKIAF-IELIFDKJSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-IELIFDKJSA-N 0.000 description 2
- 229960002066 vinorelbine Drugs 0.000 description 2
- CILBMBUYJCWATM-PYGJLNRPSA-N vinorelbine ditartrate Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.OC(=O)[C@H](O)[C@@H](O)C(O)=O.C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC CILBMBUYJCWATM-PYGJLNRPSA-N 0.000 description 2
- 229940053867 xeloda Drugs 0.000 description 2
- NOOLISFMXDJSKH-UTLUCORTSA-N (+)-Neomenthol Chemical compound CC(C)[C@@H]1CC[C@@H](C)C[C@@H]1O NOOLISFMXDJSKH-UTLUCORTSA-N 0.000 description 1
- SVNJBEMPMKWDCO-KCHLEUMXSA-N (2s)-2-[[(2s)-3-carboxy-2-[[2-[[(2s)-5-(diaminomethylideneamino)-2-[[4-oxo-4-[[4-(4-oxo-8-phenylchromen-2-yl)morpholin-4-ium-4-yl]methoxy]butanoyl]amino]pentanoyl]amino]acetyl]amino]propanoyl]amino]-3-hydroxypropanoate Chemical compound C=1C(=O)C2=CC=CC(C=3C=CC=CC=3)=C2OC=1[N+]1(COC(=O)CCC(=O)N[C@@H](CCCNC(=N)N)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CO)C([O-])=O)CCOCC1 SVNJBEMPMKWDCO-KCHLEUMXSA-N 0.000 description 1
- XOYSDPUJMJWCBH-VKHMYHEASA-N (3s)-3,5-diamino-5-oxopentanoic acid Chemical compound NC(=O)C[C@H](N)CC(O)=O XOYSDPUJMJWCBH-VKHMYHEASA-N 0.000 description 1
- MWTUOSWPJOUADP-XDJHFCHBSA-N (5z)-5-(4-hydroxy-6-oxo-3-propan-2-ylcyclohexa-2,4-dien-1-ylidene)-4-(1-methylindol-5-yl)-1,2,4-triazolidin-3-one Chemical compound O=C1C=C(O)C(C(C)C)=C\C1=C\1N(C=2C=C3C=CN(C)C3=CC=2)C(=O)NN/1 MWTUOSWPJOUADP-XDJHFCHBSA-N 0.000 description 1
- SADXACCFNXBCFY-IYNHSRRRSA-N (e)-n-[4-[3-chloro-4-(pyridin-2-ylmethoxy)anilino]-3-cyano-7-ethoxyquinolin-6-yl]-3-[(2r)-1-methylpyrrolidin-2-yl]prop-2-enamide Chemical compound C=12C=C(NC(=O)\C=C\[C@@H]3N(CCC3)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 SADXACCFNXBCFY-IYNHSRRRSA-N 0.000 description 1
- JRMGHBVACUJCRP-BTJKTKAUSA-N (z)-but-2-enedioic acid;4-[(4-fluoro-2-methyl-1h-indol-5-yl)oxy]-6-methoxy-7-(3-pyrrolidin-1-ylpropoxy)quinazoline Chemical compound OC(=O)\C=C/C(O)=O.COC1=CC2=C(OC=3C(=C4C=C(C)NC4=CC=3)F)N=CN=C2C=C1OCCCN1CCCC1 JRMGHBVACUJCRP-BTJKTKAUSA-N 0.000 description 1
- WEEMDRWIKYCTQM-UHFFFAOYSA-N 2,6-dimethoxybenzenecarbothioamide Chemical compound COC1=CC=CC(OC)=C1C(N)=S WEEMDRWIKYCTQM-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- TWJNQYPJQDRXPH-UHFFFAOYSA-N 2-cyanobenzohydrazide Chemical compound NNC(=O)C1=CC=CC=C1C#N TWJNQYPJQDRXPH-UHFFFAOYSA-N 0.000 description 1
- CKPOABDCSSXDCY-UHFFFAOYSA-N 2-propan-2-yltetradecanoic acid Chemical compound CCCCCCCCCCCCC(C(C)C)C(O)=O CKPOABDCSSXDCY-UHFFFAOYSA-N 0.000 description 1
- UFKLYTOEMRFKAD-UHFFFAOYSA-N 3-[6-(2-hydroxypropan-2-yl)pyridin-3-yl]-5-(4-methoxycyclohexyl)-7,8-dihydropyrazino[2,3-b]pyrazin-6-one Chemical compound C1CC(OC)CCC1N1C2=NC(C=3C=NC(=CC=3)C(C)(C)O)=CN=C2NCC1=O UFKLYTOEMRFKAD-UHFFFAOYSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- DODQJNMQWMSYGS-QPLCGJKRSA-N 4-[(z)-1-[4-[2-(dimethylamino)ethoxy]phenyl]-1-phenylbut-1-en-2-yl]phenol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 DODQJNMQWMSYGS-QPLCGJKRSA-N 0.000 description 1
- QCQCHGYLTSGIGX-GHXANHINSA-N 4-[[(3ar,5ar,5br,7ar,9s,11ar,11br,13as)-5a,5b,8,8,11a-pentamethyl-3a-[(5-methylpyridine-3-carbonyl)amino]-2-oxo-1-propan-2-yl-4,5,6,7,7a,9,10,11,11b,12,13,13a-dodecahydro-3h-cyclopenta[a]chrysen-9-yl]oxy]-2,2-dimethyl-4-oxobutanoic acid Chemical compound N([C@@]12CC[C@@]3(C)[C@]4(C)CC[C@H]5C(C)(C)[C@@H](OC(=O)CC(C)(C)C(O)=O)CC[C@]5(C)[C@H]4CC[C@@H]3C1=C(C(C2)=O)C(C)C)C(=O)C1=CN=CC(C)=C1 QCQCHGYLTSGIGX-GHXANHINSA-N 0.000 description 1
- ZLHFILGSQDJULK-UHFFFAOYSA-N 4-[[9-chloro-7-(2-fluoro-6-methoxyphenyl)-5H-pyrimido[5,4-d][2]benzazepin-2-yl]amino]-2-methoxybenzoic acid Chemical compound C1=C(C(O)=O)C(OC)=CC(NC=2N=C3C4=CC=C(Cl)C=C4C(=NCC3=CN=2)C=2C(=CC=CC=2F)OC)=C1 ZLHFILGSQDJULK-UHFFFAOYSA-N 0.000 description 1
- NMUSYJAQQFHJEW-KVTDHHQDSA-N 5-azacytidine Chemical compound O=C1N=C(N)N=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](CO)O1 NMUSYJAQQFHJEW-KVTDHHQDSA-N 0.000 description 1
- DSLPMJSGSBLWRE-UHFFFAOYSA-N 6-oxo-8,9,10,11-tetrahydro-7h-cyclohepta[c][1]benzopyran-3-o-sulfamate Chemical compound C1CCCCC2=C1C1=CC=C(OS(=O)(=O)N)C=C1OC2=O DSLPMJSGSBLWRE-UHFFFAOYSA-N 0.000 description 1
- ACCFLVVUVBJNGT-AWEZNQCLSA-N 8-[5-(2-hydroxypropan-2-yl)pyridin-3-yl]-1-[(2s)-2-methoxypropyl]-3-methylimidazo[4,5-c]quinolin-2-one Chemical compound CN1C(=O)N(C[C@H](C)OC)C(C2=C3)=C1C=NC2=CC=C3C1=CN=CC(C(C)(C)O)=C1 ACCFLVVUVBJNGT-AWEZNQCLSA-N 0.000 description 1
- KVLFRAWTRWDEDF-IRXDYDNUSA-N AZD-8055 Chemical compound C1=C(CO)C(OC)=CC=C1C1=CC=C(C(=NC(=N2)N3[C@H](COCC3)C)N3[C@H](COCC3)C)C2=N1 KVLFRAWTRWDEDF-IRXDYDNUSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- 229920001817 Agar Polymers 0.000 description 1
- 201000004384 Alopecia Diseases 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- 102100032187 Androgen receptor Human genes 0.000 description 1
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 1
- 101100402572 Arabidopsis thaliana MS5 gene Proteins 0.000 description 1
- 241000416162 Astragalus gummifer Species 0.000 description 1
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 1
- 108091012583 BCL2 Proteins 0.000 description 1
- YUXMAKUNSXIEKN-BTJKTKAUSA-N BGT226 Chemical compound OC(=O)\C=C/C(O)=O.C1=NC(OC)=CC=C1C1=CC=C(N=CC2=C3N(C=4C=C(C(N5CCNCC5)=CC=4)C(F)(F)F)C(=O)N2C)C3=C1 YUXMAKUNSXIEKN-BTJKTKAUSA-N 0.000 description 1
- CWHUFRVAEUJCEF-UHFFFAOYSA-N BKM120 Chemical compound C1=NC(N)=CC(C(F)(F)F)=C1C1=CC(N2CCOCC2)=NC(N2CCOCC2)=N1 CWHUFRVAEUJCEF-UHFFFAOYSA-N 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-M Bicarbonate Chemical compound OC([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-M 0.000 description 1
- 208000010392 Bone Fractures Diseases 0.000 description 1
- 101001011741 Bos taurus Insulin Proteins 0.000 description 1
- 206010057654 Breast cancer female Diseases 0.000 description 1
- 239000004215 Carbon black (E152) Substances 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 102000052052 Casein Kinase II Human genes 0.000 description 1
- 108010010919 Casein Kinase II Proteins 0.000 description 1
- 102100028914 Catenin beta-1 Human genes 0.000 description 1
- 101150015280 Cel gene Proteins 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 244000223760 Cinnamomum zeylanicum Species 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 206010010774 Constipation Diseases 0.000 description 1
- 102100032857 Cyclin-dependent kinase 1 Human genes 0.000 description 1
- 101710106279 Cyclin-dependent kinase 1 Proteins 0.000 description 1
- 102100024458 Cyclin-dependent kinase inhibitor 2A Human genes 0.000 description 1
- NOOLISFMXDJSKH-UHFFFAOYSA-N DL-menthol Natural products CC(C)C1CCC(C)CC1O NOOLISFMXDJSKH-UHFFFAOYSA-N 0.000 description 1
- 108020004414 DNA Proteins 0.000 description 1
- 102100024812 DNA (cytosine-5)-methyltransferase 3A Human genes 0.000 description 1
- 108010024491 DNA Methyltransferase 3A Proteins 0.000 description 1
- 230000004568 DNA-binding Effects 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 206010012735 Diarrhoea Diseases 0.000 description 1
- LCGLNKUTAGEVQW-UHFFFAOYSA-N Dimethyl ether Chemical group COC LCGLNKUTAGEVQW-UHFFFAOYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 1
- CUDVHEFYRIWYQD-UHFFFAOYSA-N E-3810 free base Chemical compound C=1C=C2C(C(=O)NC)=CC=CC2=CC=1OC(C1=CC=2OC)=CC=NC1=CC=2OCC1(N)CC1 CUDVHEFYRIWYQD-UHFFFAOYSA-N 0.000 description 1
- 101150064205 ESR1 gene Proteins 0.000 description 1
- 102100027100 Echinoderm microtubule-associated protein-like 4 Human genes 0.000 description 1
- 101001003194 Eleusine coracana Alpha-amylase/trypsin inhibitor Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 102100029951 Estrogen receptor beta Human genes 0.000 description 1
- 239000001856 Ethyl cellulose Substances 0.000 description 1
- ZZSNKZQZMQGXPY-UHFFFAOYSA-N Ethyl cellulose Chemical compound CCOCC1OC(OC)C(OCC)C(OCC)C1OC1C(O)C(O)C(OC)C(CO)O1 ZZSNKZQZMQGXPY-UHFFFAOYSA-N 0.000 description 1
- 102000003971 Fibroblast Growth Factor 1 Human genes 0.000 description 1
- 108090000386 Fibroblast Growth Factor 1 Proteins 0.000 description 1
- 108090000379 Fibroblast growth factor 2 Proteins 0.000 description 1
- 102000003974 Fibroblast growth factor 2 Human genes 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical class OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- KGPGFQWBCSZGEL-ZDUSSCGKSA-N GSK690693 Chemical compound C=12N(CC)C(C=3C(=NON=3)N)=NC2=C(C#CC(C)(C)O)N=CC=1OC[C@H]1CCCNC1 KGPGFQWBCSZGEL-ZDUSSCGKSA-N 0.000 description 1
- 102100030708 GTPase KRas Human genes 0.000 description 1
- 229930182566 Gentamicin Natural products 0.000 description 1
- CEAZRRDELHUEMR-URQXQFDESA-N Gentamicin Chemical compound O1[C@H](C(C)NC)CC[C@@H](N)[C@H]1O[C@H]1[C@H](O)[C@@H](O[C@@H]2[C@@H]([C@@H](NC)[C@@](C)(O)CO2)O)[C@H](N)C[C@@H]1N CEAZRRDELHUEMR-URQXQFDESA-N 0.000 description 1
- NMJREATYWWNIKX-UHFFFAOYSA-N GnRH Chemical compound C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CC(C)C)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 NMJREATYWWNIKX-UHFFFAOYSA-N 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 239000007995 HEPES buffer Substances 0.000 description 1
- 101710113864 Heat shock protein 90 Proteins 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000916173 Homo sapiens Catenin beta-1 Proteins 0.000 description 1
- 101000845618 Homo sapiens Deoxyribonuclease gamma Proteins 0.000 description 1
- 101001057929 Homo sapiens Echinoderm microtubule-associated protein-like 4 Proteins 0.000 description 1
- 101000584612 Homo sapiens GTPase KRas Proteins 0.000 description 1
- 101001016865 Homo sapiens Heat shock protein HSP 90-alpha Proteins 0.000 description 1
- 101001045846 Homo sapiens Histone-lysine N-methyltransferase 2A Proteins 0.000 description 1
- 101001050559 Homo sapiens Kinesin-1 heavy chain Proteins 0.000 description 1
- 101000984620 Homo sapiens Low-density lipoprotein receptor-related protein 1B Proteins 0.000 description 1
- 101001025967 Homo sapiens Lysine-specific demethylase 6A Proteins 0.000 description 1
- 101001030211 Homo sapiens Myc proto-oncogene protein Proteins 0.000 description 1
- 101001112293 Homo sapiens Retinoic acid receptor alpha Proteins 0.000 description 1
- 101000799466 Homo sapiens Thrombopoietin receptor Proteins 0.000 description 1
- 101000904150 Homo sapiens Transcription factor E2F3 Proteins 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- 239000004354 Hydroxyethyl cellulose Substances 0.000 description 1
- 229920000663 Hydroxyethyl cellulose Polymers 0.000 description 1
- 229920002153 Hydroxypropyl cellulose Polymers 0.000 description 1
- 206010020751 Hypersensitivity Diseases 0.000 description 1
- 102100023915 Insulin Human genes 0.000 description 1
- 108090001061 Insulin Proteins 0.000 description 1
- PIWKPBJCKXDKJR-UHFFFAOYSA-N Isoflurane Chemical compound FC(F)OC(Cl)C(F)(F)F PIWKPBJCKXDKJR-UHFFFAOYSA-N 0.000 description 1
- 229940121730 Janus kinase 2 inhibitor Drugs 0.000 description 1
- 238000010824 Kaplan-Meier survival analysis Methods 0.000 description 1
- 102100023422 Kinesin-1 heavy chain Human genes 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical class OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 1
- 239000003798 L01XE11 - Pazopanib Substances 0.000 description 1
- 239000002144 L01XE18 - Ruxolitinib Substances 0.000 description 1
- XXYGTCZJJLTAGH-UHFFFAOYSA-N LGK974 Chemical compound C1=NC(C)=CC(C=2C(=CC(CC(=O)NC=3N=CC(=CC=3)C=3N=CC=NC=3)=CN=2)C)=C1 XXYGTCZJJLTAGH-UHFFFAOYSA-N 0.000 description 1
- 102100027121 Low-density lipoprotein receptor-related protein 1B Human genes 0.000 description 1
- 102100037462 Lysine-specific demethylase 6A Human genes 0.000 description 1
- 108010068342 MAP Kinase Kinase 1 Proteins 0.000 description 1
- 241000124008 Mammalia Species 0.000 description 1
- 102100027240 Membrane-associated guanylate kinase, WW and PDZ domain-containing protein 1 Human genes 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 108091022875 Microtubule Proteins 0.000 description 1
- 102000029749 Microtubule Human genes 0.000 description 1
- 229920000881 Modified starch Polymers 0.000 description 1
- 102000008300 Mutant Proteins Human genes 0.000 description 1
- 108010021466 Mutant Proteins Proteins 0.000 description 1
- 235000021360 Myristic acid Nutrition 0.000 description 1
- TUNFSRHWOTWDNC-UHFFFAOYSA-N Myristic acid Natural products CCCCCCCCCCCCCC(O)=O TUNFSRHWOTWDNC-UHFFFAOYSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 206010067482 No adverse event Diseases 0.000 description 1
- 239000012828 PI3K inhibitor Substances 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 229930040373 Paraformaldehyde Natural products 0.000 description 1
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 description 1
- 229920002319 Poly(methyl acrylate) Polymers 0.000 description 1
- 229920001214 Polysorbate 60 Polymers 0.000 description 1
- 239000004372 Polyvinyl alcohol Substances 0.000 description 1
- 206010057846 Primitive neuroectodermal tumour Diseases 0.000 description 1
- 102100036828 Protein GREB1 Human genes 0.000 description 1
- 101710112198 Protein GREB1 Proteins 0.000 description 1
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 1
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 1
- 101150040459 RAS gene Proteins 0.000 description 1
- 101150076031 RAS1 gene Proteins 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 102100023606 Retinoic acid receptor alpha Human genes 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- UIIMBOGNXHQVGW-DEQYMQKBSA-M Sodium bicarbonate-14C Chemical compound [Na+].O[14C]([O-])=O UIIMBOGNXHQVGW-DEQYMQKBSA-M 0.000 description 1
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 1
- 101000611441 Solanum lycopersicum Pathogenesis-related leaf protein 6 Proteins 0.000 description 1
- 240000006394 Sorghum bicolor Species 0.000 description 1
- 101000857870 Squalus acanthias Gonadoliberin Proteins 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 108010076818 TEV protease Proteins 0.000 description 1
- 229940124615 TLR 7 agonist Drugs 0.000 description 1
- 229940123237 Taxane Drugs 0.000 description 1
- 244000299461 Theobroma cacao Species 0.000 description 1
- 235000009470 Theobroma cacao Nutrition 0.000 description 1
- 102100036407 Thioredoxin Human genes 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 102100024027 Transcription factor E2F3 Human genes 0.000 description 1
- 102000009618 Transforming Growth Factors Human genes 0.000 description 1
- 108010009583 Transforming Growth Factors Proteins 0.000 description 1
- 102000007641 Trefoil Factors Human genes 0.000 description 1
- 108010007389 Trefoil Factors Proteins 0.000 description 1
- 108010050144 Triptorelin Pamoate Proteins 0.000 description 1
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 1
- 102000003970 Vinculin Human genes 0.000 description 1
- 108090000384 Vinculin Proteins 0.000 description 1
- 206010047700 Vomiting Diseases 0.000 description 1
- HJSSPYJVWLTYHG-UHFFFAOYSA-N XL765 Chemical compound COC1=CC(OC)=CC(NC=2C(=NC3=CC=CC=C3N=2)NS(=O)(=O)C=2C=CC(NC(=O)C=3C=C(OC)C(C)=CC=3)=CC=2)=C1 HJSSPYJVWLTYHG-UHFFFAOYSA-N 0.000 description 1
- IEDXPSOJFSVCKU-HOKPPMCLSA-N [4-[[(2S)-5-(carbamoylamino)-2-[[(2S)-2-[6-(2,5-dioxopyrrolidin-1-yl)hexanoylamino]-3-methylbutanoyl]amino]pentanoyl]amino]phenyl]methyl N-[(2S)-1-[[(2S)-1-[[(3R,4S,5S)-1-[(2S)-2-[(1R,2R)-3-[[(1S,2R)-1-hydroxy-1-phenylpropan-2-yl]amino]-1-methoxy-2-methyl-3-oxopropyl]pyrrolidin-1-yl]-3-methoxy-5-methyl-1-oxoheptan-4-yl]-methylamino]-3-methyl-1-oxobutan-2-yl]amino]-3-methyl-1-oxobutan-2-yl]-N-methylcarbamate Chemical compound CC[C@H](C)[C@@H]([C@@H](CC(=O)N1CCC[C@H]1[C@H](OC)[C@@H](C)C(=O)N[C@H](C)[C@@H](O)c1ccccc1)OC)N(C)C(=O)[C@@H](NC(=O)[C@H](C(C)C)N(C)C(=O)OCc1ccc(NC(=O)[C@H](CCCNC(N)=O)NC(=O)[C@@H](NC(=O)CCCCCN2C(=O)CCC2=O)C(C)C)cc1)C(C)C IEDXPSOJFSVCKU-HOKPPMCLSA-N 0.000 description 1
- YKTSYUJCYHOUJP-UHFFFAOYSA-N [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] Chemical compound [O--].[Al+3].[Al+3].[O-][Si]([O-])([O-])[O-] YKTSYUJCYHOUJP-UHFFFAOYSA-N 0.000 description 1
- 229960004103 abiraterone acetate Drugs 0.000 description 1
- UVIQSJCZCSLXRZ-UBUQANBQSA-N abiraterone acetate Chemical compound C([C@@H]1[C@]2(C)CC[C@@H]3[C@@]4(C)CC[C@@H](CC4=CC[C@H]31)OC(=O)C)C=C2C1=CC=CN=C1 UVIQSJCZCSLXRZ-UBUQANBQSA-N 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 231100000230 acceptable toxicity Toxicity 0.000 description 1
- 238000009098 adjuvant therapy Methods 0.000 description 1
- 229940009456 adriamycin Drugs 0.000 description 1
- 229960001686 afatinib Drugs 0.000 description 1
- ULXXDDBFHOBEHA-CWDCEQMOSA-N afatinib Chemical compound N1=CN=C2C=C(O[C@@H]3COCC3)C(NC(=O)/C=C/CN(C)C)=CC2=C1NC1=CC=C(F)C(Cl)=C1 ULXXDDBFHOBEHA-CWDCEQMOSA-N 0.000 description 1
- 229940042992 afinitor Drugs 0.000 description 1
- 239000008272 agar Substances 0.000 description 1
- 235000010419 agar Nutrition 0.000 description 1
- 229950009447 alisertib Drugs 0.000 description 1
- 229910052783 alkali metal Inorganic materials 0.000 description 1
- 229910052784 alkaline earth metal Inorganic materials 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 230000003281 allosteric effect Effects 0.000 description 1
- 229940125528 allosteric inhibitor Drugs 0.000 description 1
- 231100000360 alopecia Toxicity 0.000 description 1
- 230000004075 alteration Effects 0.000 description 1
- SNAAJJQQZSMGQD-UHFFFAOYSA-N aluminum magnesium Chemical compound [Mg].[Al] SNAAJJQQZSMGQD-UHFFFAOYSA-N 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 238000000540 analysis of variance Methods 0.000 description 1
- 239000003098 androgen Substances 0.000 description 1
- 108010080146 androgen receptors Proteins 0.000 description 1
- 230000033115 angiogenesis Effects 0.000 description 1
- 230000003042 antagnostic effect Effects 0.000 description 1
- 238000011394 anticancer treatment Methods 0.000 description 1
- 239000003146 anticoagulant agent Substances 0.000 description 1
- 229940127219 anticoagulant drug Drugs 0.000 description 1
- 229960003965 antiepileptics Drugs 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 229940041181 antineoplastic drug Drugs 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 238000011717 athymic nude mouse Methods 0.000 description 1
- 125000004429 atom Chemical group 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 229960002756 azacitidine Drugs 0.000 description 1
- 239000002585 base Substances 0.000 description 1
- 229960000817 bazedoxifene Drugs 0.000 description 1
- UCJGJABZCDBEDK-UHFFFAOYSA-N bazedoxifene Chemical compound C=1C=C(OCCN2CCCCCC2)C=CC=1CN1C2=CC=C(O)C=C2C(C)=C1C1=CC=C(O)C=C1 UCJGJABZCDBEDK-UHFFFAOYSA-N 0.000 description 1
- 235000015278 beef Nutrition 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-N benzenesulfonic acid Chemical class OS(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-N 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 229920001400 block copolymer Polymers 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- IXIBAKNTJSCKJM-BUBXBXGNSA-N bovine insulin Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@H]1CSSC[C@H]2C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@H](C(=O)N[C@H](C(N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=3C=CC(O)=CC=3)C(=O)N[C@@H](CSSC[C@H](NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3C=CC(O)=CC=3)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC=3NC=NC=3)NC(=O)[C@H](CO)NC(=O)CNC1=O)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](C)C(O)=O)C(=O)N[C@@H](CC(N)=O)C(O)=O)=O)CSSC[C@@H](C(N2)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C(C)C)NC(=O)[C@@H](NC(=O)CN)[C@@H](C)CC)C(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(N)=O)NC(=O)[C@@H](NC(=O)[C@@H](N)CC=1C=CC=CC=1)C(C)C)C1=CN=CN1 IXIBAKNTJSCKJM-BUBXBXGNSA-N 0.000 description 1
- 235000021152 breakfast Nutrition 0.000 description 1
- 208000024119 breast tumor luminal A or B Diseases 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 229950003628 buparlisib Drugs 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 229960001573 cabazitaxel Drugs 0.000 description 1
- BMQGVNUXMIRLCK-OAGWZNDDSA-N cabazitaxel Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3C[C@@H]([C@]2(C(=O)[C@H](OC)C2=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=3C=CC=CC=3)C[C@]1(O)C2(C)C)C)OC)C(=O)C1=CC=CC=C1 BMQGVNUXMIRLCK-OAGWZNDDSA-N 0.000 description 1
- 235000001465 calcium Nutrition 0.000 description 1
- 235000010216 calcium carbonate Nutrition 0.000 description 1
- FNAQSUUGMSOBHW-UHFFFAOYSA-H calcium citrate Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O.[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O FNAQSUUGMSOBHW-UHFFFAOYSA-H 0.000 description 1
- 239000001354 calcium citrate Substances 0.000 description 1
- 159000000007 calcium salts Chemical class 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical class C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 230000009702 cancer cell proliferation Effects 0.000 description 1
- 239000002775 capsule Substances 0.000 description 1
- CVXBEEMKQHEXEN-UHFFFAOYSA-N carbaryl Chemical compound C1=CC=C2C(OC(=O)NC)=CC=CC2=C1 CVXBEEMKQHEXEN-UHFFFAOYSA-N 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 238000012754 cardiac puncture Methods 0.000 description 1
- 239000004359 castor oil Substances 0.000 description 1
- 235000019438 castor oil Nutrition 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000022131 cell cycle Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 229940082500 cetostearyl alcohol Drugs 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- GBVKRUOMSUTVPW-AHNVSIPUSA-N chembl1089636 Chemical compound N([C@H]([C@@H](OC(=O)CCC(=O)N[C@@H](C(O)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)NCC(=O)NCC(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)NCC(=O)N[C@@H](CCCCNC(=O)CCC(=O)O[C@H]([C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)C(=O)O[C@@H]1C(=C2[C@@H](OC(C)=O)C(=O)[C@]3(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]3[C@H](OC(=O)C=3C=CC=CC=3)[C@](C2(C)C)(O)C1)OC(C)=O)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCCNC(=O)CCC(=O)O[C@H]([C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)C(=O)O[C@@H]1C(=C2[C@@H](OC(C)=O)C(=O)[C@]3(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]3[C@H](OC(=O)C=3C=CC=CC=3)[C@](C2(C)C)(O)C1)OC(C)=O)C)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)C(=O)O[C@@H]1C(=C2[C@@H](OC(C)=O)C(=O)[C@]3(C)[C@@H](O)C[C@H]4OC[C@]4([C@H]3[C@H](OC(=O)C=3C=CC=CC=3)[C@](C2(C)C)(O)C1)OC(C)=O)C)C=1C=CC=CC=1)C(=O)C1=CC=CC=C1 GBVKRUOMSUTVPW-AHNVSIPUSA-N 0.000 description 1
- JROFGZPOBKIAEW-HAQNSBGRSA-N chembl3120215 Chemical compound N1C=2C(OC)=CC=CC=2C=C1C(=C1C(N)=NC=NN11)N=C1[C@H]1CC[C@H](C(O)=O)CC1 JROFGZPOBKIAEW-HAQNSBGRSA-N 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 238000009104 chemotherapy regimen Methods 0.000 description 1
- 235000017803 cinnamon Nutrition 0.000 description 1
- 230000002060 circadian Effects 0.000 description 1
- 229960004316 cisplatin Drugs 0.000 description 1
- DQLATGHUWYMOKM-UHFFFAOYSA-L cisplatin Chemical compound N[Pt](N)(Cl)Cl DQLATGHUWYMOKM-UHFFFAOYSA-L 0.000 description 1
- 150000001860 citric acid derivatives Chemical class 0.000 description 1
- 230000003081 coactivator Effects 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 239000003086 colorant Substances 0.000 description 1
- 238000004440 column chromatography Methods 0.000 description 1
- 238000009096 combination chemotherapy Methods 0.000 description 1
- 238000011284 combination treatment Methods 0.000 description 1
- 230000002860 competitive effect Effects 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- 230000006552 constitutive activation Effects 0.000 description 1
- 238000013270 controlled release Methods 0.000 description 1
- 230000001351 cycling effect Effects 0.000 description 1
- 230000009089 cytolysis Effects 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 238000012217 deletion Methods 0.000 description 1
- 230000037430 deletion Effects 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 239000010432 diamond Substances 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 1
- SZXQTJUDPRGNJN-UHFFFAOYSA-N dipropylene glycol Chemical compound OCCCOCCCO SZXQTJUDPRGNJN-UHFFFAOYSA-N 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 201000010099 disease Diseases 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 238000002224 dissection Methods 0.000 description 1
- 229960003668 docetaxel Drugs 0.000 description 1
- 229960000735 docosanol Drugs 0.000 description 1
- 239000003651 drinking water Substances 0.000 description 1
- 235000020188 drinking water Nutrition 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 201000006549 dyspepsia Diseases 0.000 description 1
- 230000008482 dysregulation Effects 0.000 description 1
- 239000003221 ear drop Substances 0.000 description 1
- 229940047652 ear drops Drugs 0.000 description 1
- 230000002828 effect on organs or tissue Effects 0.000 description 1
- 238000003003 empirical scoring function Methods 0.000 description 1
- INVTYAOGFAGBOE-UHFFFAOYSA-N entinostat Chemical compound NC1=CC=CC=C1NC(=O)C(C=C1)=CC=C1CNC(=O)OCC1=CC=CN=C1 INVTYAOGFAGBOE-UHFFFAOYSA-N 0.000 description 1
- 229950005837 entinostat Drugs 0.000 description 1
- 229960004671 enzalutamide Drugs 0.000 description 1
- WXCXUHSOUPDCQV-UHFFFAOYSA-N enzalutamide Chemical compound C1=C(F)C(C(=O)NC)=CC=C1N1C(C)(C)C(=O)N(C=2C=C(C(C#N)=CC=2)C(F)(F)F)C1=S WXCXUHSOUPDCQV-UHFFFAOYSA-N 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 229930013356 epothilone Natural products 0.000 description 1
- 150000003883 epothilone derivatives Chemical class 0.000 description 1
- 239000010696 ester oil Substances 0.000 description 1
- 201000007281 estrogen-receptor positive breast cancer Diseases 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-N ethanesulfonic acid Chemical class CCS(O)(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-N 0.000 description 1
- 235000019325 ethyl cellulose Nutrition 0.000 description 1
- 229920001249 ethyl cellulose Polymers 0.000 description 1
- 210000000416 exudates and transudate Anatomy 0.000 description 1
- 239000003889 eye drop Substances 0.000 description 1
- 229940012356 eye drops Drugs 0.000 description 1
- 239000003885 eye ointment Substances 0.000 description 1
- 239000012091 fetal bovine serum Substances 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- FRIPRWYKBIOZJU-UHFFFAOYSA-N fluorone Chemical compound C1=CC=C2OC3=CC(=O)C=CC3=CC2=C1 FRIPRWYKBIOZJU-UHFFFAOYSA-N 0.000 description 1
- 229940028334 follicle stimulating hormone Drugs 0.000 description 1
- 235000013305 food Nutrition 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 239000003205 fragrance Substances 0.000 description 1
- 229950004003 fresolimumab Drugs 0.000 description 1
- 239000012520 frozen sample Substances 0.000 description 1
- 229950004161 ganetespib Drugs 0.000 description 1
- 229950004896 ganitumab Drugs 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 229960002518 gentamicin Drugs 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 229950000918 glembatumumab Drugs 0.000 description 1
- 150000002306 glutamic acid derivatives Chemical class 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 125000005456 glyceride group Chemical group 0.000 description 1
- ZEMPKEQAKRGZGQ-XOQCFJPHSA-N glycerol triricinoleate Natural products CCCCCC[C@@H](O)CC=CCCCCCCCC(=O)OC[C@@H](COC(=O)CCCCCCCC=CC[C@@H](O)CCCCCC)OC(=O)CCCCCCCC=CC[C@H](O)CCCCCC ZEMPKEQAKRGZGQ-XOQCFJPHSA-N 0.000 description 1
- XLXSAKCOAKORKW-UHFFFAOYSA-N gonadorelin Chemical class C1CCC(C(=O)NCC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)CNC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 XLXSAKCOAKORKW-UHFFFAOYSA-N 0.000 description 1
- XLXSAKCOAKORKW-AQJXLSMYSA-N gonadorelin Chemical compound C([C@@H](C(=O)NCC(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 XLXSAKCOAKORKW-AQJXLSMYSA-N 0.000 description 1
- 229960003690 goserelin acetate Drugs 0.000 description 1
- 230000009036 growth inhibition Effects 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 108091008039 hormone receptors Proteins 0.000 description 1
- 238000001794 hormone therapy Methods 0.000 description 1
- 102000054371 human DNASE1L3 Human genes 0.000 description 1
- 229930195733 hydrocarbon Natural products 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 1
- 239000012433 hydrogen halide Substances 0.000 description 1
- 229910000039 hydrogen halide Inorganic materials 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 239000008172 hydrogenated vegetable oil Substances 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 230000002209 hydrophobic effect Effects 0.000 description 1
- 235000019447 hydroxyethyl cellulose Nutrition 0.000 description 1
- 235000010977 hydroxypropyl cellulose Nutrition 0.000 description 1
- 239000001863 hydroxypropyl cellulose Substances 0.000 description 1
- 235000010979 hydroxypropyl methyl cellulose Nutrition 0.000 description 1
- 239000001866 hydroxypropyl methyl cellulose Substances 0.000 description 1
- 229920003088 hydroxypropyl methyl cellulose Polymers 0.000 description 1
- UFVKGYZPFZQRLF-UHFFFAOYSA-N hydroxypropyl methyl cellulose Chemical compound OC1C(O)C(OC)OC(CO)C1OC1C(O)C(O)C(OC2C(C(O)C(OC3C(C(O)C(O)C(CO)O3)O)C(CO)O2)O)C(CO)O1 UFVKGYZPFZQRLF-UHFFFAOYSA-N 0.000 description 1
- 229940071676 hydroxypropylcellulose Drugs 0.000 description 1
- 238000003384 imaging method Methods 0.000 description 1
- 238000011532 immunohistochemical staining Methods 0.000 description 1
- 238000003364 immunohistochemistry Methods 0.000 description 1
- 101150030475 impact gene Proteins 0.000 description 1
- 230000001771 impaired effect Effects 0.000 description 1
- 238000011221 initial treatment Methods 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 230000009545 invasion Effects 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 229950001217 irosustat Drugs 0.000 description 1
- 229960002725 isoflurane Drugs 0.000 description 1
- 229960002014 ixabepilone Drugs 0.000 description 1
- FABUFPQFXZVHFB-CFWQTKTJSA-N ixabepilone Chemical compound C/C([C@@H]1C[C@@H]2O[C@]2(C)CCC[C@@H]([C@@H]([C@H](C)C(=O)C(C)(C)[C@H](O)CC(=O)N1)O)C)=C\C1=CSC(C)=N1 FABUFPQFXZVHFB-CFWQTKTJSA-N 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 230000003902 lesion Effects 0.000 description 1
- 229940057995 liquid paraffin Drugs 0.000 description 1
- 230000007774 longterm Effects 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 229950004231 lucitanib Drugs 0.000 description 1
- 210000004705 lumbosacral region Anatomy 0.000 description 1
- YDDMIZRDDREKEP-HWTBNCOESA-N lurbinectedin Chemical compound C([C@@]1(C(OC2)=O)NCCC3=C1NC1=CC=C(C=C13)OC)S[C@@H]1C3=C(OC(C)=O)C(C)=C4OCOC4=C3[C@H]2N2[C@@H](O)[C@H](CC=3C4=C(O)C(OC)=C(C)C=3)N(C)[C@H]4[C@@H]21 YDDMIZRDDREKEP-HWTBNCOESA-N 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 239000000395 magnesium oxide Substances 0.000 description 1
- CPLXHLVBOLITMK-UHFFFAOYSA-N magnesium oxide Inorganic materials [Mg]=O CPLXHLVBOLITMK-UHFFFAOYSA-N 0.000 description 1
- 159000000003 magnesium salts Chemical class 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- AXZKOIWUVFPNLO-UHFFFAOYSA-N magnesium;oxygen(2-) Chemical compound [O-2].[Mg+2] AXZKOIWUVFPNLO-UHFFFAOYSA-N 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 150000004701 malic acid derivatives Chemical class 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 239000001525 mentha piperita l. herb oil Substances 0.000 description 1
- 229940041616 menthol Drugs 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- 208000037819 metastatic cancer Diseases 0.000 description 1
- 208000011575 metastatic malignant neoplasm Diseases 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 210000004688 microtubule Anatomy 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 230000003278 mimic effect Effects 0.000 description 1
- 238000012544 monitoring process Methods 0.000 description 1
- 230000003562 morphometric effect Effects 0.000 description 1
- 238000013425 morphometry Methods 0.000 description 1
- 238000010172 mouse model Methods 0.000 description 1
- JXTPJDDICSTXJX-UHFFFAOYSA-N n-Triacontane Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCC JXTPJDDICSTXJX-UHFFFAOYSA-N 0.000 description 1
- BLCLNMBMMGCOAS-UHFFFAOYSA-N n-[1-[[1-[[1-[[1-[[1-[[1-[[1-[2-[(carbamoylamino)carbamoyl]pyrrolidin-1-yl]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-4-methyl-1-oxopentan-2-yl]amino]-3-[(2-methylpropan-2-yl)oxy]-1-oxopropan-2-yl]amino]-3-(4-hydroxyphenyl)-1-oxopropan-2-yl]amin Chemical compound C1CCC(C(=O)NNC(N)=O)N1C(=O)C(CCCN=C(N)N)NC(=O)C(CC(C)C)NC(=O)C(COC(C)(C)C)NC(=O)C(NC(=O)C(CO)NC(=O)C(CC=1C2=CC=CC=C2NC=1)NC(=O)C(CC=1NC=NC=1)NC(=O)C1NC(=O)CC1)CC1=CC=C(O)C=C1 BLCLNMBMMGCOAS-UHFFFAOYSA-N 0.000 description 1
- 239000007923 nasal drop Substances 0.000 description 1
- 229940100662 nasal drops Drugs 0.000 description 1
- 229950008835 neratinib Drugs 0.000 description 1
- ZNHPZUKZSNBOSQ-BQYQJAHWSA-N neratinib Chemical compound C=12C=C(NC\C=C\CN(C)C)C(OCC)=CC2=NC=C(C#N)C=1NC(C=C1Cl)=CC=C1OCC1=CC=CC=N1 ZNHPZUKZSNBOSQ-BQYQJAHWSA-N 0.000 description 1
- 230000007935 neutral effect Effects 0.000 description 1
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 1
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen group Chemical group [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 1
- 102000042567 non-coding RNA Human genes 0.000 description 1
- 239000002777 nucleoside Substances 0.000 description 1
- 150000003833 nucleoside derivatives Chemical class 0.000 description 1
- GLDOVTGHNKAZLK-UHFFFAOYSA-N octadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCCCO GLDOVTGHNKAZLK-UHFFFAOYSA-N 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 239000002674 ointment Substances 0.000 description 1
- 229940069265 ophthalmic ointment Drugs 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 239000003002 pH adjusting agent Substances 0.000 description 1
- 229950004122 paclitaxel trevatide Drugs 0.000 description 1
- 229920002866 paraformaldehyde Polymers 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 229960000639 pazopanib Drugs 0.000 description 1
- 235000010987 pectin Nutrition 0.000 description 1
- 239000001814 pectin Substances 0.000 description 1
- 229920001277 pectin Polymers 0.000 description 1
- 229960002621 pembrolizumab Drugs 0.000 description 1
- 229940056360 penicillin g Drugs 0.000 description 1
- 235000019477 peppermint oil Nutrition 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-M perchlorate Inorganic materials [O-]Cl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-M 0.000 description 1
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 1
- 230000002093 peripheral effect Effects 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 239000008024 pharmaceutical diluent Substances 0.000 description 1
- 229940124531 pharmaceutical excipient Drugs 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 239000002953 phosphate buffered saline Substances 0.000 description 1
- 229940043441 phosphoinositide 3-kinase inhibitor Drugs 0.000 description 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 description 1
- 239000006187 pill Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 210000003281 pleural cavity Anatomy 0.000 description 1
- 239000004584 polyacrylic acid Substances 0.000 description 1
- 229920002503 polyoxyethylene-polyoxypropylene Polymers 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 229920001289 polyvinyl ether Polymers 0.000 description 1
- 230000023603 positive regulation of transcription initiation, DNA-dependent Effects 0.000 description 1
- 238000002600 positron emission tomography Methods 0.000 description 1
- XAEFZNCEHLXOMS-UHFFFAOYSA-M potassium benzoate Chemical compound [K+].[O-]C(=O)C1=CC=CC=C1 XAEFZNCEHLXOMS-UHFFFAOYSA-M 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 208000029340 primitive neuroectodermal tumor Diseases 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 229960003387 progesterone Drugs 0.000 description 1
- 239000000186 progesterone Substances 0.000 description 1
- 239000008213 purified water Substances 0.000 description 1
- 229940075576 pyrotinib Drugs 0.000 description 1
- 150000003242 quaternary ammonium salts Chemical class 0.000 description 1
- 229940099538 rapamune Drugs 0.000 description 1
- 102000016914 ras Proteins Human genes 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000026267 regulation of growth Effects 0.000 description 1
- 230000029058 respiratory gaseous exchange Effects 0.000 description 1
- 230000004043 responsiveness Effects 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 229960003452 romidepsin Drugs 0.000 description 1
- OHRURASPPZQGQM-GCCNXGTGSA-N romidepsin Chemical compound O1C(=O)[C@H](C(C)C)NC(=O)C(=C/C)/NC(=O)[C@H]2CSSCC\C=C\[C@@H]1CC(=O)N[C@H](C(C)C)C(=O)N2 OHRURASPPZQGQM-GCCNXGTGSA-N 0.000 description 1
- OHRURASPPZQGQM-UHFFFAOYSA-N romidepsin Natural products O1C(=O)C(C(C)C)NC(=O)C(=CC)NC(=O)C2CSSCCC=CC1CC(=O)NC(C(C)C)C(=O)N2 OHRURASPPZQGQM-UHFFFAOYSA-N 0.000 description 1
- 108010091666 romidepsin Proteins 0.000 description 1
- HFNKQEVNSGCOJV-OAHLLOKOSA-N ruxolitinib Chemical compound C1([C@@H](CC#N)N2N=CC(=C2)C=2C=3C=CNC=3N=CN=2)CCCC1 HFNKQEVNSGCOJV-OAHLLOKOSA-N 0.000 description 1
- 229960000215 ruxolitinib Drugs 0.000 description 1
- 238000005070 sampling Methods 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 229920002545 silicone oil Polymers 0.000 description 1
- 229920002050 silicone resin Polymers 0.000 description 1
- 238000005549 size reduction Methods 0.000 description 1
- 230000008410 smoothened signaling pathway Effects 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 229940054269 sodium pyruvate Drugs 0.000 description 1
- 159000000000 sodium salts Chemical class 0.000 description 1
- 210000004872 soft tissue Anatomy 0.000 description 1
- VZZJRYRQSPEMTK-CALCHBBNSA-N sonidegib Chemical compound C1[C@@H](C)O[C@@H](C)CN1C(N=C1)=CC=C1NC(=O)C1=CC=CC(C=2C=CC(OC(F)(F)F)=CC=2)=C1C VZZJRYRQSPEMTK-CALCHBBNSA-N 0.000 description 1
- 229960003787 sorafenib Drugs 0.000 description 1
- 235000012424 soybean oil Nutrition 0.000 description 1
- 239000003549 soybean oil Substances 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 229940032094 squalane Drugs 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 238000010186 staining Methods 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 150000003431 steroids Chemical class 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 229960002385 streptomycin sulfate Drugs 0.000 description 1
- 150000008054 sulfonate salts Chemical class 0.000 description 1
- 150000003467 sulfuric acid derivatives Chemical class 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- 239000000829 suppository Substances 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 239000003760 tallow Substances 0.000 description 1
- 150000003892 tartrate salts Chemical class 0.000 description 1
- DKPFODGZWDEEBT-QFIAKTPHSA-N taxane Chemical class C([C@]1(C)CCC[C@@H](C)[C@H]1C1)C[C@H]2[C@H](C)CC[C@@H]1C2(C)C DKPFODGZWDEEBT-QFIAKTPHSA-N 0.000 description 1
- 150000004579 taxol derivatives Chemical class 0.000 description 1
- QFJCIRLUMZQUOT-UHFFFAOYSA-N temsirolimus Natural products C1CC(O)C(OC)CC1CC(C)C1OC(=O)C2CCCCN2C(=O)C(=O)C(O)(O2)C(C)CCC2CC(OC)C(C)=CC=CC=CC(C)CC(C)C(=O)C(OC)C(O)C(C)=CC(C)C(=O)C1 QFJCIRLUMZQUOT-UHFFFAOYSA-N 0.000 description 1
- MODVSQKJJIBWPZ-VLLPJHQWSA-N tesetaxel Chemical compound O([C@H]1[C@@H]2[C@]3(OC(C)=O)CO[C@@H]3CC[C@@]2(C)[C@H]2[C@@H](C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C(=CC=CN=4)F)C[C@]1(O)C3(C)C)O[C@H](O2)CN(C)C)C(=O)C1=CC=CC=C1 MODVSQKJJIBWPZ-VLLPJHQWSA-N 0.000 description 1
- 229950009016 tesetaxel Drugs 0.000 description 1
- CXWXQJXEFPUFDZ-UHFFFAOYSA-N tetralin Chemical compound C1=CC=C2CCCCC2=C1 CXWXQJXEFPUFDZ-UHFFFAOYSA-N 0.000 description 1
- CXVCSRUYMINUSF-UHFFFAOYSA-N tetrathiomolybdate(2-) Chemical compound [S-][Mo]([S-])(=S)=S CXVCSRUYMINUSF-UHFFFAOYSA-N 0.000 description 1
- OULAJFUGPPVRBK-UHFFFAOYSA-N tetratriacontyl alcohol Natural products CCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCCO OULAJFUGPPVRBK-UHFFFAOYSA-N 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- 108060008226 thioredoxin Proteins 0.000 description 1
- 229940094937 thioredoxin Drugs 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M toluenesulfonate group Chemical class C=1(C(=CC=CC1)S(=O)(=O)[O-])C LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- FDTAUJJRHBRHIJ-FDJAAIFISA-N tpi-287 Chemical compound O([C@@H]1[C@]2(O)C[C@@H](C(=C([C@H](OC(C)=O)[C@@H]3OC(O[C@H]4C[C@H]5OC[C@]5([C@@H]1[C@]34C)OC(C)=O)C=C)C2(C)C)C)OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)CC(C)C)C(=O)C1=CC=CC=C1 FDTAUJJRHBRHIJ-FDJAAIFISA-N 0.000 description 1
- 229960004066 trametinib Drugs 0.000 description 1
- LIRYPHYGHXZJBZ-UHFFFAOYSA-N trametinib Chemical compound CC(=O)NC1=CC=CC(N2C(N(C3CC3)C(=O)C3=C(NC=4C(=CC(I)=CC=4)F)N(C)C(=O)C(C)=C32)=O)=C1 LIRYPHYGHXZJBZ-UHFFFAOYSA-N 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 229950001210 trebananib Drugs 0.000 description 1
- 239000001393 triammonium citrate Substances 0.000 description 1
- 235000013337 tricalcium citrate Nutrition 0.000 description 1
- VXKHXGOKWPXYNA-PGBVPBMZSA-N triptorelin Chemical compound C([C@@H](C(=O)N[C@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N1[C@@H](CCC1)C(=O)NCC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1N=CNC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 VXKHXGOKWPXYNA-PGBVPBMZSA-N 0.000 description 1
- 229960004824 triptorelin Drugs 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 150000004917 tyrosine kinase inhibitor derivatives Chemical class 0.000 description 1
- 230000000007 visual effect Effects 0.000 description 1
- 230000008673 vomiting Effects 0.000 description 1
- WAEXFXRVDQXREF-UHFFFAOYSA-N vorinostat Chemical compound ONC(=O)CCCCCCC(=O)NC1=CC=CC=C1 WAEXFXRVDQXREF-UHFFFAOYSA-N 0.000 description 1
- 229960000237 vorinostat Drugs 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
- 238000009736 wetting Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940033942 zoladex Drugs 0.000 description 1
- XRASPMIURGNCCH-UHFFFAOYSA-N zoledronic acid Chemical compound OP(=O)(O)C(P(O)(O)=O)(O)CN1C=CN=C1 XRASPMIURGNCCH-UHFFFAOYSA-N 0.000 description 1
- 229960004276 zoledronic acid Drugs 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/137—Arylalkylamines, e.g. amphetamine, epinephrine, salbutamol, ephedrine or methadone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/13—Amines
- A61K31/135—Amines having aromatic rings, e.g. ketamine, nortriptyline
- A61K31/138—Aryloxyalkylamines, e.g. propranolol, tamoxifen, phenoxybenzamine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/436—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a six-membered ring having oxygen as a ring hetero atom, e.g. rapamycin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/56—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids
- A61K31/565—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol
- A61K31/568—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol substituted in positions 10 and 13 by a chain having at least one carbon atom, e.g. androstanes, e.g. testosterone
- A61K31/5685—Compounds containing cyclopenta[a]hydrophenanthrene ring systems; Derivatives thereof, e.g. steroids not substituted in position 17 beta by a carbon atom, e.g. estrane, estradiol substituted in positions 10 and 13 by a chain having at least one carbon atom, e.g. androstanes, e.g. testosterone having an oxo group in position 17, e.g. androsterone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/675—Phosphorus compounds having nitrogen as a ring hetero atom, e.g. pyridoxal phosphate
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/66—Phosphorus compounds
- A61K31/683—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols
- A61K31/685—Diesters of a phosphorus acid with two hydroxy compounds, e.g. phosphatidylinositols one of the hydroxy compounds having nitrogen atoms, e.g. phosphatidylserine, lecithin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K2300/00—Mixtures or combinations of active ingredients, wherein at least one active ingredient is fully defined in groups A61K31/00 - A61K41/00
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Chemical & Material Sciences (AREA)
- Epidemiology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Emergency Medicine (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Acyclic And Carbocyclic Compounds In Medicinal Compositions (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Steroid Compounds (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Изобретение относится к медицине, а именно к онкологии, и может быть использовано для лечения рака молочной железы (РМЖ). Способ по изобретению включает введение субъекту, страдающему от РМЖ, положительного по рецептору эстрогенов альфа, который устойчив к лекарственным препаратам и/или содержит мутантный рецептор эстрогенов альфа, терапевтически эффективного количества комбинации эверолимуса и RAD1901. Использование изобретения позволяет ингибировать рост и достичь регрессии опухоли за счет синергетического действия комбинации. 17 з.п. ф-лы, 36 ил., 14 табл., 5 пр.
Description
ПЕРЕКРЕСТНАЯ ССЫЛКА НА РОДСТВЕННЫЕ ЗАЯВКИ
[0001] Настоящая заявка испрашивает приоритет на основании предварительной заявки на патент США №62/154,699, поданной 29 апреля 2015 года, предварительной заявки США №62/155,451, поданной 30 апреля 2015 года, предварительной заявки США №62/252,085, поданной 6 ноября 2015, предварительной заявки США №62/265,696, поданной 10 декабря 2015 года, предварительной заявки США №62/158,469, поданной 7 мая 2015, предварительной заявки США №62/252,916, поданной 9 ноября 2015 года, предварительной заявки США №62/265,774, поданной 10 декабря 2015 года, предварительной заявки США №62/192,940, поданной 15 июля 2015 года, предварительной заявки США №62/265,658, поданной 10 декабря 2015 года, предварительной заявки США №62/323,572, поданной 15 апреля 2016 года, предварительной заявки США №62/192,944, поданной 15 июля 2015 года, предварительной заявки США №62/265,663, поданной 10 декабря 2015 года, и предварительной заявки США №62/323,576, поданной 15 апреля 2016 года, каждая из которых полностью включена в настоящую заявку посредством ссылки.
УРОВЕНЬ ТЕХНИКИ
[0002] Рак молочной железы подразделяют на три подтипа на основании экспрессии трех рецепторов: рецептора эстрогенов (estrogen receptor, ER), рецептора прогестеронов (progesterone receptor, PR) и рецептора эпидермального фактора роста-2 человека (human epidermal growth factor receptor-2, Her2). Сверхэкспрессия ER обнаружена у многих пациентов, страдающих от рака молочной железы. На ER-положительные (ER+) варианты рака молочной железы приходится две трети всех вариантов рака молочной железы. Помимо рака молочной железы эстроген и ER связаны, например, с раком яичников, раком толстой кишки, раком предстательной железы и раком эндометрия.
[0003] ER могут активироваться эстрогеном и транслоцироваться в ядро для связывания с ДНК, посредством чего регулируется активность различных генов. См., например, публикации Marino et al., "Estrogen Signaling Multiple Pathways to Impact Gene Transcription," Curr. Genomics 7(8): 497-508 (2006), и Heldring et al., "Estrogen Receptors: How Do They Signal and What Are Their Targets," Physiol. Rev. 87(3): 905-931 (2007).
[0004] Средства, которые ингибируют выработку эстрогена, такие как ингибиторы ароматазы (ИА, например, летрозол, анастрозол и аромазин), или которые блокируют непосредственно активность ER, такие как селективные модуляторы рецептора эстрогенов (СМРЭ, например, тамоксифен, торемифен, дролоксифен, идоксифен, ралоксифен, лазофоксифен, арзоксифен, мипроксифен, левормелоксифен и ЕМ-652 (SCH 57068)) и селективные супрессоры рецептора эстрогенов (ССРЭ, например, фулвестрант, TAS-108 (SR16234), ZK191703, RU58668, GDC-0810 (ARN-810), GW5638/DPC974, SRN-927, ICI182782 и AZD9496), ранее применялись для лечения ER-положительных вариантов рака молочной железы либо разрабатываются для данных целей.
[0005] СМРЭ (например, тамоксифен) и ИА часто применяют в качестве системной адъювантной терапии первой линии для ER-положительного рака молочной железы. Тамоксифен широко применяется для лечения ER-положительного рака молочной железы. ИА подавляют наработку эстрогена в периферических тканях посредством блокирования активности ароматазы, которая в организме превращает андроген в эстроген. Однако ИА не могут остановить выработку эстрогена яичниками. Таким образом, ИА применяют, главным образом, для лечения женщин в постменопаузальном периоде. Более того, поскольку ИА являются гораздо более эффективными, чем тамоксифен, и характеризуются меньшим количеством серьезных побочных эффектов, ИА можно также применять для лечения женщин в пременопаузальном периоде с подавленной функцией яичников. См., например, публикацию Francis et al., "Adjuvant Ovarian Suppression in Premenopausal Breast Cancer," N. Engl. J. Med., 372:436-446(2015).
[0006] В то время как начальное лечение данными средствами может быть успешным, у многих пациентов в конечном итоге случается рецидив устойчивых к лекарственным препаратам вариантов рака молочной железы. Мутации, поражающие ER, были признаны одним из потенциальных механизмов развития такой устойчивости. См., например, публикацию Robinson et al., "Activating ESR1 mutations in hormone-resistant metastatic breast cancer," Nat Genet. 45:1446-51 (2013). Мутации в лиганд-связывающем домене (ЛСД) ER обнаружены в 21% образцов метастазирующей ER-положительной опухоли молочной железы от пациентов, проходивших по меньшей мере один курс эндокринного лечения. Jeselsohn, et al., "ESR1 mutations - a mechanism for acquired endocrine resistance in breast cancer," Nat. Rev. Clin. Oncol, 12:573-83 (2015).
[0007] На сегодняшний день фулвестрант является единственным ССРЭ, одобренным для лечения ER-положительных метастазирующих вариантов рака молочной железы с прогрессированием заболевания после антиэстрогеновой терапии. Несмотря на клиническую эффективность данного средства, практическая ценность фулвестранта ограничена количеством лекарственного препарата, которое можно ввести за одну инъекцию, а также сниженной биодоступностью. Визуализирующие методы исследования с применением позитронно-эмиссионной томографии на основе 18F-фторэстрадиола (ФЭС-ПЭТ) свидетельствуют о том, что даже при дозировке 500 мг у некоторых пациентов не достигается полное ингибирование ER, и недостаточное введение доз может стать причиной неудачной терапии.
[0008] Другой проблемой, связанной с направленными на эстроген видами терапии, является то, что такие виды терапии могут оказывать нежелательное воздействие на матку, кости и другие ткани. ER направляет транскрипцию эстроген-чувствительных генов в широком спектре типов тканей и клеток. Данные эффекты могут быть в особенности выраженными в виде эндогенных уровней эстрогена и других гормонов яичников, которые снижаются в течение менопаузы. Например, тамоксифен может вызывать истончение костей у женщин в пременопаузальном периоде и увеличивать риск рака эндометрия, поскольку данное средство выступает в качестве частичного агониста в отношении эндометрия. У женщин в постменопаузальном периоде лечение с помощью ИА может вызывать более серьезную атрофию костной ткани и большее количество переломов костей, чем в случае применения тамоксифена. Пациенты, которые получали лечение фулвестрантом, также подвержены риску развития остеопороза в связи с механизмом действия данного средства.
[0009] Путь фосфоинозитид 3-киназы (PI3K)/протеинкиназы В (AKT)/мишени рапамицина млекопитающих (mTOR) представляет собой внутриклеточный путь передачи сигналов, важный для регуляции клеточного цикла. Частая активация пути PI3K/AKT/mTOR при раке и его ключевая роль в росте и выживаемости клеток обуславливают проблему обнаружения соответствующего уровня пролиферации по сравнению с дифференциацией для применения данного равновесия при разработке различных вариантов терапии. См., например, публикацию Gitto et al., "Recent insights into the pathophysiology of mTOR pathway dysregulation," Res. Rep. Bio., 2:1-16 (2015).
[0010] Ингибиторы пути PI3K оказались наиболее многообещающими при введении в комбинации с другими вариантами терапии. Например, эверолимус, аллостерический ингибитор mTOR, был одобрен в 2012 году для применения в комбинации с ИА эксеместаном для лечения женщин в постменопаузальном периоде, страдающих от запущенного рецептор гормона - положительного (HR+), HER2- рака молочной железы (исследование BOLERO-2). Средства, нацеленные на другие компоненты пути PI3K, разрабатываются для лечения HR+рака, например, АТФ-конкурентные двойные ингибиторы PI3K и mTOR (например, BEZ235, GDC-0980), пан-Р13К ингибиторы, которые ингибируют все четыре изоформы PI3K класса I (например, ВКМ120, GDC-0941), специфичные к изоформам ингибиторы различных изоформ PI3K (например, BYL719, GDC-0032), аллостерические и каталитические ингибиторы AKT (MK2206, GDC-0068, GSK2110183, GSK2141795, AZD5363) и АТФ-конкурентные ингибиторы исключительно mTOR (AZD2014, MLN0128 и СС-223). Dienstmann et al., "Picking the point of inhibition: a comparative review of PI3K/AKT/mTOR pathway inhibitors," Mol. Cancer Ther., 13(5):1021-31 (2014).
[0011] Несмотря на огромный потенциал ингибиторов mTOR, нежелательные побочные эффекты, связанные с данными средствами, препятствовали разработке данных соединений в качестве эффективных вариантов противораковой терапии. Kaplan et al., "Strategies for the management of adverse events associated with mTOR inhibitors," Transplant Rev (Orlando), 28(3):126-133 (2014); и Pallet et al., "Adverse events associated with mTOR inhibitors," Expert Opin. Drug Saf. 12(2):177-186 (2013).
[0012] Сохраняется потребность в более долговременных и эффективных вариантах терапии, нацеленных на ER, которые могут преодолеть проблемы, связанные с применяемыми на сегодняшний день вариантами эндокринной терапии, одновременно обеспечивая дополнительную пользу посредством сочетания со вторыми терапевтическими средствами (например, эверолимусом и другими средствами, нацеленными на путь передачи сигналов PI3K/AKT/mTOR) для борьбы с раком на запущенной стадии и/или с устойчивостью к предшествующим вариантам лечения.
КРАТКОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0013] Один аспект настоящего изобретения относится к способу лечения одного или нескольких вариантов рака и/или опухолей у субъекта, причем указанный способ включает введение субъекту терапевтически эффективного количества комбинации RAD1901 или сольватов (например, гидрата) или солей указанного соединения и одного или нескольких вторых терапевтических средств (например, эверолимуса), описанных в настоящей заявке.
[0014] Согласно некоторым вариантам реализации настоящего изобретения рак представляет собой эстроген-зависимый рак, такой как рак молочной железы, рак яичников, рак прямой кишки, рак эндометрия или рак предстательной железы. Согласно некоторым вариантам реализации настоящего изобретения рак представляет собой ER-положительный рак молочной железы.
[0015] RAD 1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) вводят в комбинации субъекту, который нуждается в таком введении. Фраза «в комбинации» означает, что RAD1901 или его сольваты (например, гидрат) или соли можно вводить до, в течение или после введения второго терапевтического средства или средств (например, эверолимуса). Например, RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства можно вводить с интервалом приблизительно одну неделю, с интервалом приблизительно 6 дней, с интервалом приблизительно 5 дней, с интервалом приблизительно 4 дня, с интервалом приблизительно 3 дня, с интервалом приблизительно 2 дня, с интервалом приблизительно 24 часа, с интервалом приблизительно 23 часа, с интервалом приблизительно 22 часа, с интервалом приблизительно 21 час, с интервалом приблизительно 20 часов, с интервалом приблизительно 19 часов, с интервалом приблизительно 18 часов, с интервалом приблизительно 17 часов, с интервалом приблизительно 16 часов, с интервалом приблизительно 15 часов, с интервалом приблизительно 14 часов, с интервалом приблизительно 13 часов, с интервалом приблизительно 12 часов, с интервалом приблизительно 11 часов, с интервалом приблизительно 10 часов, с интервалом приблизительно 9 часов, с интервалом приблизительно 8 часов, с интервалом приблизительно 7 часов, с интервалом приблизительно 6 часов, с интервалом приблизительно 5 часов, с интервалом приблизительно 4 часа, с интервалом приблизительно 3 часа, с интервалом приблизительно 2 часа, с интервалом приблизительно 1 час, с интервалом приблизительно 55 минут, с интервалом приблизительно 50 минут, с интервалом приблизительно 45 минут, с интервалом приблизительно 40 минут, с интервалом приблизительно 35 минут, с интервалом приблизительно 30 минут, с интервалом приблизительно 25 минут, с интервалом приблизительно 20 минут, с интервалом приблизительно 15 минут, с интервалом приблизительно 10 минут или с интервалом приблизительно 5 минут. Согласно другим вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства вводят субъекту одновременно или по существу одновременно. Согласно определенным из данных вариантов реализации настоящего изобретения соединения можно вводить в качестве части одного состава.
[0016] Согласно некоторым вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства вводят в отдельных составах. Согласно определенным из данных вариантов реализации настоящего изобретения составы могут относиться к одному типу. Например, оба состава могут быть разработаны для перорального введения (например, посредством двух отдельных драже) или для инъекции (например, посредством двух отдельных инъекционных составов). Согласно другим вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства могут быть приготовлены в состав в различных типах составов. Например, одно соединение может находиться в составе, разработанном для перорального введения, в то время как другое находится в составе, разработанном для инъекции.
[0017] Согласно другим вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства вводят в качестве части единого состава. Например, RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства приготовлены в состав в одном драже для перорального введения или в разовой дозе для инъекции. Соответственно, согласно определенным вариантам реализации настоящего изобретения в настоящей заявке предложены составы, содержащие RAD1901 или его сольваты (например, гидрат) или соли и одно или несколько вторых терапевтических средств.
[0018] Пути введения RAD1901 или сольватов (например, гидрата) или солей указанного соединения и/или второго терапевтического средства или средств включают, но не ограничиваются ими, местное введение, пероральное введение, внутрикожное введение, внутримышечное введение, интраперитонеальное введение, внутривенное введение, внутрипузырную инфузию, подкожное введение, трансдермальное введение и чресслизистое введение.
КРАТКОЕ ОПИСАНИЕ ЧЕРТЕЖЕЙ И ТАБЛИЦ
[0019] Фиг. 1. RAD1901 ингибировал рост опухоли на различных полученных от пациента ксенотрансплантатных (patient-derived xenograft, PDx) моделях вне зависимости от статуса ESR1 и предшествующей эндокринной терапии. Показан процент ингибирования роста опухоли (ИРО) на PDx моделях, получавших лечение RAD1901.
[0020] Фиг. 2: Комбинация RAD1901 и эверолимуса продемонстрировала ингибирование роста и регрессию опухоли на ксенотрансплантатных моделях MCF-7 с ERα дикого типа (ДТ) (PR+, HER2-). (А): Рост опухоли ксенотрансплантатных моделей MCF-7, получавших лечение контролем - наполнителем, эверолимусом (2,5 мг/кг, п.о. (перорально), о.р.д. (один раз в день)), фулвестрантом (3 мг/дозу, п.к. (подкожно), о.р.н. (один раз в неделю)), комбинацией фулвестранта (3 мг/дозу, п.к., о.р.н.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.), RAD1901 (60 мг/кг, п.о., о.р.д.) и комбинацией RAD1901 (60 мг/кг, п.о., о.р.д.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.). Однофакторный дисперсионный анализ ANOVA, «НЗ» означает «не значимо», *р-значение<0,05, и ***p-значение<0,001; (В): Изменение объема индивидуальной опухоли по сравнению с исходным уровнем до окончания исследования ксенотрансплантатных моделей MCF-7, получавших лечение контролем - наполнителем, эверолимусом (2,5 мг/кг, п.о., о.р.д.), фулвестрантом (3 мг/дозу, п.к., о.р.н.), комбинацией фулвестранта (3 мг/дозу, п.к., о.р.н.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.), RAD1901 (60 мг/кг, п.о., о.р.д.) и комбинациями RAD1901 (60 мг/кг, п.о., о.р.д.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.) (С): Рост опухоли ксенотрансплантатных моделей MCF-7, получавших лечение контролем - наполнителем, эверолимусом (2,5 мг/кг, п.о., о.р.д.), фулвестрантом (3 мг/дозу, п.к., о.р.н.), комбинацией фулвестранта (3 мг/дозу, п.к., о.р.н.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.), RAD1901 (30 или 60 мг/кг, п.о., о.р.д.) и комбинацией RAD1901 (30 или 60 мг/кг, п.о., о.р.д.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.).
[0021] Фиг. 3: Комбинация RAD1901 и эверолимуса продемонстрировала ингибирование роста опухоли и регрессию опухоли на PDx-11 моделях с ERα ДТ (PR+, Her2+, ранее получавшие лечение ингибитором ароматазы, фулвестрантом и химиотерапией). (А): Рост опухоли PDx-11 моделей, получавших лечение контролем - наполнителем, фулвестрантом (3 мг/дозу, п.к., о.р.н.), эверолимусом (2,5 мг/кг, п.о., о.р.д.), RAD1901 (60 мг/кг, п.о., о.р.д.) и комбинацией RAD1901 (60 мг/кг, п.о., о.р.д.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.); (В): Изменение объема индивидуальной опухоли по сравнению с исходным уровнем до окончания исследования на моделях PDx-11, получавших лечение контролем - наполнителем, фулвестрантом (3 мг/дозу, п.к., о.р.н.), RAD1901 (60 мг/кг, п.о., о.р.д.) и комбинацией RAD1901 (60 мг/кг, п.о., о.р.д.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.). n=8-10/группу.
[0022] Фиг. 4: Комбинация RAD1901 и эверолимуса продемонстрировала ингибирование роста опухоли и регрессию опухоли на PDx-2 моделях с ER+ДТ (PR+, Her2+, не получавшие лечения). (А) Рост опухоли PDx-2 моделей, получавших лечение контролем - наполнителем, RAD1901 (60 мг/кг, п.о., о.р.д.), фулвестрантом (3 мг/дозу, п.к., о.р.н.) и комбинацией RAD1901 (60 мг/кг, п.о., о.р.д.) и фулвестранта (3 мг/дозу, п.к., о.р.н.). (В): Рост опухоли PDx-2 моделей, получавших лечение контролем - наполнителем, эверолимусом (2,5 мг/кг, п.о., о.р.д.), RAD1901 (60 мг/кг, п.о., о.р.д.) и комбинацией RAD1901 (60 мг/кг, п.о., о.р.д.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.). n=8-10/группу.
[0023] Фиг. 5: Эффективность RAD 1901 сохранялась в течение по меньшей мере двух месяцев после окончания лечения RAD1901, в то время как лечение эстрадиолом продолжали, на PDx-4 моделях с ERα ДТ (PR+, Her2+, не получавшие лечения).
[0024] Фиг. 6: Комбинация RAD1901 и эверолимуса продемонстрировала ингибирование роста опухоли на PDx-5 моделях с мутантным (Y537S) ERα (PR+, Her2+, ранее получавшие лечение ингибиторами ароматазы). (А): Рост опухоли PDx-5 моделей, получавших лечение контролем - наполнителем, RAD1901 (60 мг/кг п.о., о.р.д.) и фулвестрантом (3 мг/дозу, п.к., о.р.н.); (В): Рост опухоли PDx-5 моделей, получавших лечение контролем - наполнителем, RAD1901 (60 мг/кг п.о., о.р.д.), эверолимусом (2,5 мг/кг, п.о., о.р.д.) и комбинацией RAD1901 (60 мг/кг п.о., о.р.д.) и эверолимуса (2,5 мг/кг, п.о., о.р.д.). n=8-10/группу.
[0025] Фиг. 7: Фармакокинетический анализ фулвестранта на бестимусных мышах. Показана концентрация в плазме фулвестранта в концентрации 1 мг/дозу (закрашенный ромб), 3 мг/дозу (закрашенный круг) и 5 мг/дозу (закрашенный треугольник). Бестимусным мышам вводили подкожно фулвестрант в день 1 и вторую дозу в день 8. Концентрацию фулвестранта в плазме контролировали в указанные временные точки в течение до 168 часов после введения второй дозы.
[0026] Фиг. 8: Эффект RAD1901 и фулвестранта (Фаслодекса) в отношении выживаемости мыши на внутричерепной модели MCF-7 на мышах.
[0027] Фиг. 9: Иллюстративное изображение скана ФЭС-ПЭТ матки субъекта, получавшего лечение 200 и 500 мг RAD1901 п.о., о.р.д., и изменение занятости ER после вариантов лечения RAD1901. (А): Поперечный вид скана КТ матки до (а) и после (с) лечения 200 мг RAD1901, и поперечный вид скана ФЭС-ПЭТ матки до (b) и после (d) лечения RAD 1901; (В): Сагиттальный вид скана КТ матки до (верхний чертеж (а)) и после (нижний чертеж (а)) лечения 500 мг RAD1901, сагиттальный вид скана ФЭС-ПЭТ матки до (верхний чертеж (b)) и после (нижний чертеж (b)) лечения RAD1901, поперечный вид скана КТ матки до (верхний чертеж (с)) и после (нижний чертеж (с)) лечения RAD1901, поперечный вид скана ФЭС-ПЭТ матки до (верхний чертеж (d)) и после (нижний чертеж (d)) лечения RAD1901; (С): % изменения занятости ER после вариантов лечения RAD1901 субъектов 1-3 (200 мг) и субъектов 4-7 (500 мг) по сравнению с исходным уровнем (перед лечением RAD1901).
[0028] Фиг. 10: Иллюстративное изображение скана ФЭС-ПЭТ матки (А) и гипофиза (В) перед (На исходном уровне) и после (После лечения) лечения RAD1901 (500 мг). (а) Боковое поперечное сечение; (b) продольное поперечное сечение; и (с) продольное поперечное сечение.
[0029] Фиг. 11: Экспрессия PR и ER на ксенотрансплантатных моделях MCF-7, получавших лечение контролем - наполнителем, RAD1901, эверолимусом, комбинацией RAD1901 и эверолимуса, фулвестрантом и комбинацией фулвестранта и эверолимуса.
[0030] Фиг. 12: Лечение RAD1901 привело к полной деградации ER и ингибировало передачу сигналов посредством ER на линиях клеток MCF-7 (А) и линиях клеток T47D (В) in vitro. Экспрессия ER была показана на обеих линиях клеток, получавших лечение RAD1901 и фулвестрантом, при различных концентрациях 0,001 мкМ, 0,01 мкМ, 0,1 мкМ и 1 мкМ, соответственно. Передача сигналов посредством ER была показана тремя генами-мишенями ER, исследование которых проводили: PGR, GREB1 и TFF1.
[0031] Фиг. 13: Лечение RAD1901 привело к деградации ER и отмене передачи сигналов посредством ER на ксенотрансплантатных моделях MCF-7. (А): Вестернблоттинг, демонстрирующий экспрессию PR и ER на ксенотрансплантатных моделях MCF-7, получавших лечение контролем - наполнителем, RAD1901 в дозе 30 и 60 мг/кг и фулвестрантом 3 мг/дозу, через 2 часа или через 8 часов после введения последней дозы; (В): экспрессия белка ER на ксенотрансплантатных моделях MCF-7, получавших лечение контролем - наполнителем, RAD1901 в дозе 30 и 60 мг/кг и фулвестрантом 3 мг/дозу, через 2 часа после введения последней дозы; (С): экспрессия белка PR на ксенотрансплантатных моделях MCF-7, получавших лечение контролем - наполнителем, RAD 1901 в дозе 30 и 60 мг/кг и фулвестрантом 3 мг/дозу, через 8 часов после введения последней дозы.
[0032] Фиг. 14: Лечение RAD1901 привело к быстрому снижению уровня PR на ксенотрансплантатных моделях MCF-7. (А): Вестернблоттинг, демонстрирующий экспрессию PR на ксенотрансплантатных моделях MCF-7, получавших лечение контролем - наполнителем и RAD1901 в дозе 30, 60 и 90 мг/кг, через 8 часов или через 12 часов после введения однократной дозы; (В): Вестернблоттинг, демонстрирующий экспрессию PR на ксенотрансплантатных моделях MCF-7, получавших лечение контролем - наполнителем и RAD1901 в дозе 30, 60 и 90 мг/кг, через 4 часа или через 24 часа после введения 7-ой дозы; (С): Дозозависимое уменьшение экспрессии PR на ксенотрансплантатных моделях MCF-7, получавших лечение RAD1901 в дозе 30, 60 и 90 мг/кг.
[0033] Фиг. 15: Лечение RAD1901 привело к быстрому уменьшению пролиферации на ксенотрансплантатных моделях MCF-7. (А): Иллюстративная фотография рассеченной опухоли, взятой у ксенотрансплантатных моделей MCF-7, получавших лечение контролем -наполнителем и RAD1901 в дозе 90 мг/кг, через 8 часов после введения однократной дозы и через 24 часа после введения 4-ой дозы, и окрашенной в отношении маркера пролиферации Ki-67; (В): Гистограмма, демонстрирующая снижение уровня маркера пролиферации Ki-67 на ксенотрансплантатных моделях MCF-7, получавших лечение контролем - наполнителем и RAD1901 в дозе 90 мг/кг, через 8 часов после введения однократной дозы и через 24 часа после введения 4-ой дозы.
[0034] Фиг. 16: Лечение RAD1901 в дозе 30, 60 и 120 мг/кг уменьшало уровень Ki67 более значительно, чем фулвестрант (1 мг/животное), в конце исследования опухолей PDx-4 моделей через четыре часа в последний день исследования эффективности длительностью 56 дней.
[0035] Фиг. 17: Лечение RAD1901 в дозе 60 и 120 мг/кг привело к уменьшению передачи сигналов посредством ER in vivo на PDx-5 моделях с уменьшенной экспрессией PR.
[0036] Фиг. 18: Эффект RAD1901 в отношении ткани матки на недавно отлученных от матери самках крыс Спрег-Доули. (А): Чистая масса матки крыс, которым проводили эвтаназию через 24 часа после введения последней дозы; (В): высота эпителия на срезах тканей матки; (С): Иллюстративные срезы ткани матки, окрашенные толуидиновым синим О, при 400х увеличении, стрелками показан эпителий матки; (D): Суммарная РНК, выделенная из ткани матки и проанализированная методом количественной ОТ-ПЦР (полимеразной цепной реакции с обратной транскрипцией) для определения уровня экспрессии комплемента С3 относительно гена домашнего хозяйства 18S рибосомальной РНК.
[0037] Фиг. 19: Результаты определения фармакокинетики RAD1901 в плазме в дозе 200, 500, 750 и 1000 мг/кг после введения в день 7.
[0038] Фиг. 20: 3ERT (I).
[0039] Фиг. 21: 3ERT (II).
[0040] Фиг. 22: Наложения комплексов ЛСД ERα - антагонист, обобщенных в таблице 11.
[0041] Фиг. 23: Моделирование (A) RAD1901-1R5K; и (В) GW5-1R5K.
[0042] Фиг. 24: Моделирование (A) RAD1901-1SJ0; и (В) E4D-1SJ0.
[0043] Фиг. 25: Моделирование (A) RAD1901-2JFA; и (В) RAL-2JFA.
[0044] Фиг. 26: Моделирование (A) RAD1901-2BJ4; и (В) ОНТ-2BJ4.
[0045] Фиг. 27: Моделирование (A) RAD1901-2IOK; и (В) IOK-2IOK.
[0046] Фиг. 28: Наложения конформаций RAD1901, полученных в результате анализа ДИС (докинг индуцированного соответствия) 1R5K и 2OUZ.
[0047] Фиг. 29: Наложения конформаций RAD1901, полученных в результате анализа ДИС 2BJ4 и 2JFA.
[0048] Фиг. 30: Наложения конформаций RAD1901, полученных в результате анализа ДИС 2BJ4, 2JFA и 1SJ0.
[0049] Фиг. 31: ДИС RAD1901 с 2BJ4.
[0050] Фиг. 32: Взаимодействия поверхности белка RAD1901, состыкованного в 2BJ4 посредством ДИС.
[0051] Фиг. 33: ДИС фулвестранта с 2BJ4.
[0052] Фиг. 34: ДИС фулвестранта и RAD1901 с 2BJ4.
[0053] Фиг. 35: Наложения ДИС фулвестранта и RAD1901 с 2BJ4.
[0054] Фиг. 36: Анализ связывания RAD1901 с конструкциями ERα ДТ и мутантным ЛСД in vitro.
[0055] Таблица 1. Уровни RAD1901 в плазме, опухоли и головном мозге мышей, которым имплантировали клетки MCF7, после лечения в течение 40 дней. НПКО: ниже предела количественного определения.
[0056] Таблица 2. СУН (стандартизированные уровни накопления) для матки, мышц и костей для субъекта-человека, получавшего лечение дозой 200 мг п.о., один раз/день в течение шести дней.
[0057] Таблица 3. СУН для матки, мышц и костей для субъектов-людей (n=4), получавших лечение дозой 500 мг п.о., один раз/день в течение шести дней.
[0058] Таблица 4. Эффект RAD1901 в отношении МПК (минеральной плотности костей) на крысах после овариоэктомии. Взрослым самкам крыс проводили симуляцию или хирургическое вмешательство - овариоэктомию перед началом лечения наполнителем, Е2 (0,01 мг/кг) или RAD1901 (3 мг/кг) один раз в день (n=20 на группу лечения). МПК измеряли посредством двухэмиссионной рентгеновской абсорбциометрии на исходном уровне и после 4 недель лечения. Данные выражены в виде среднего значения ±СО (стандартное отклонение). *Р<0,05 по сравнению с соответствующим случаем OVX (овариоэктомия) + Контроль наполн. МПК, минеральная плотность костей; Е2, бета-эстрадиол; OVX, после овариоэктомии; Наполн, наполнитель.
[0059] Таблица 5. Эффект RAD1901 в отношении микроархитектуры бедренной кости на крысах после овариоэктомии. Взрослым самкам крыс проводили симуляцию или хирургическое вмешательство - овариоэктомию перед началом лечения наполнителем, Е2 (0,01 мг/кг) или RAD1901 (3 мг/кг) один раз в день (n=20 на группу лечения). Через 4 недели микроархитектуру кости оценивали с применением компьютерной микротомографии. Данные выражены в виде среднего значения ±СО. *Р<0,05 по сравнению с соответствующим случаем OVX + Контроль наполн. КПК, кажущаяся плотность костей; ОК/ОО, плотность объема костей; ПлотнСоед, плотность соединительной ткани; Е2, бета-эстрадиол; OVX, после овариоэктомии; ЧТ, число трабекул; ТТ, толщина трабекул; РМТ, расстояние между трабекулами; Наполн, наполнитель.
[0060] Таблица 6. Ключевые демографические характеристики на исходном уровне исследования 1 фазы с увеличением дозы RAD1901.
[0061] Таблица 7. Наиболее частые (>10%) связанные с лечением НЯ (нежелательные явления) в исследовании 1 фазы с увеличением дозы RAD1901. НЯ классифицировали согласно СТСАЕ v4.0 (Common Terminology Criteria for Adverse Events, общей терминологии критериев нежелательных явлений). Любого пациента с несколькими сценариями одного и того же предпочтительного термина подсчитывали только один раз и относили к наиболее тяжелой степени. *>10% пациентов в суммарной активной группе, у которых наблюдались любые связанные с лечением НЯПНЛ (нежелательные явления, возникшие после начала лечения). N = количество субъектов с по меньшей мере одним связанным с лечением НЯ в данной категории.
[0062] Таблица 8. Фармакокинетические параметры в исследовании 1 фазы с увеличением дозы RAD1901 (день 7).
[0063] Таблица 9. Частота мутаций ЛСД.
[0064] Таблица 10. Различия комплексов ЛСД ER-α - антагонист в положениях остатков по сравнению с 3ERT.
[0065] Таблица 11. Оценка наложения структур комплексов ЛСД ER-α - антагонист посредством расчетов СКО (среднего квадратичного отклонения). [0066] Таблица 12. Анализ связывания лиганда в комплексах ЛСД ER-α - антагонист.
[0067] Таблица 13. Оценка модели для докинга RAD1901.
[0068] Таблица 14. Показатель докинга индуцированного соответствия RAD1901 с 1R5K, 1SJ0, 2IFA, 2BJ4 и 2OUZ.
ПОДРОБНОЕ ОПИСАНИЕ ИЗОБРЕТЕНИЯ
[0069] Как изложено в разделе примеров ниже, комбинация RAD1901 и эверолимуса (комбинация РАО1901-эверолимус) (структуры ниже) продемонстрировала большее ингибирование роста опухоли, чем RAD1901 в монотерапии, на нескольких ксенотрансплантатных моделях рака молочной железы, включая ксенотрансплантатную модель MCF-7 с ERα дикого типа (ДТ) (фиг. 2А-С), PDx-2 (фиг. 4А-В) и PDx-11 модели (фиг. 3А-В) с ERα ДТ и PDx-5 модель с мутантным ERα (например, Y537S) (фиг. 6А-В), вне зависимости от ESR1 статуса и предшествующей эндокринной терапии, как описано в примере I(A)). PDx-2, PDx-5 и PDx-11 модели содержали опухоль, экспрессирующую ДТ или мутантный (например, Y537S) ERα, с экспрессией PR, с высоким или низким уровнем экспрессии Her2, и с предшествующей эндокринной терапией (например, ИА, фулвестрантом) и/или химиотерапией (химио) или без таковой (фиг. 1). RAD1901 в монотерапии также ингибировал рост опухоли на всех других PDx моделях, перечисленных на фиг. 1, которые содержали опухоль, экспрессирующую ДТ или мутантный (например, Y537S) ERα, с экспрессией PR, с высоким или низким уровнем экспрессии Her2, и с предшествующей эндокринной терапией или без таковой (например, тамоксифеном (там), ИА, фулвестрантом), химиотерапией (химио), ингибиторами Her2 (Her2 и, например, трастузумабом, лапатинибом), бевацизумабом и/или ритуксимабом.
[0070] PDx модели с ER ДТ и PDx модели с мутантным ER могут характеризоваться различным уровнем восприимчивости к лечению фулвестрантом в монотерапии, эверолимусом в монотерапии и/или комбинацией фулвестранта и эверолимуса (комбинация фул-эверолимус). Однако комбинации РАО1901-эверолимус продемонстрировали улучшенное ингибирование роста опухоли и/или регрессию опухоли по сравнению с лечением RAD1901 в монотерапии или эверолимусом в монотерапии вне зависимости от того, отвечали ли PDx модели на лечение фулвестрантом и/или лечение комбинацией фул-эверолимус. Другими словами, комбинация RAD1901-эверолимус может ингибировать рост опухоли и/или обеспечивать регрессию опухоли на вариантах рака, устойчивых к фулвестранту.
[0071] Лечение комбинацией RAD1901-эверолимус продемонстрировало улучшенное ингибирование роста опухоли и/или регрессию опухоли по сравнению с лечением фулвестрантом в монотерапии или комбинацией фул-эверолимус. Например, комбинация RAD1901-эверолимус вызвала более значительную регрессию опухоли на большинстве ER + ДТ ксенотрансплантатных моделях, чем лечение фулвестрантом в монотерапии, RAD1901 в монотерапии или эверолимусом в монотерапии, несмотря на то, что данные ксенотрансплантатные модели демонстрировали различную восприимчивость к лечению фулвестрантом (например, ксенотрансплантатная модель на основе линии клеток MCF-7, восприимчивая к лечению фулвестрантом (фиг. 2); PDx-11 модель, восприимчивая к лечению фулвестрантом (фиг. 3); и PDx-2 модель, в меньшей степени восприимчивая к лечению фулвестрантом (фиг. 4)). Комбинация RAD1901-эверолимус также вызвала более значительную регрессию опухоли на большинстве ER + ДТ ксенотрансплантатных моделях на основе линии клеток MCF-7 и PDx-11 моделях, чем лечение комбинацией фул-эверолимус (фиг. 2 и 3). Комбинация RAD1901-эверолимус обеспечивала аналогичные эффекты, как и RAD1901 в дозе 30 мг/кг или 60 мг/кг, несмотря на то, что RAD1901 в монотерапии в дозе 30 мг/кг являлся не настолько эффективным, как RAD1901 в монотерапии в дозе 60 мг/кг при ингибировании роста опухоли (фиг. 2С). Данные результаты свидетельствуют, что комбинации RAD1901-эверолимус с меньшей дозой RAD1901 (например, 30 мг/кг) было достаточно, чтобы увеличить до максимума эффекты ингибирования роста опухоли/регрессии опухоли на указанных ксенотрансплантатных моделях.
[0072] Комбинация RAD1901-эверолимус продемонстрировала регрессию опухоли или улучшенное ингибирование роста опухоли на PDx моделях с мутантным ER+ (например, Y537S), слабо восприимчивых к лечению фулвестрантом (фиг. 6А). Например, PDx-5 представляет собой PDx модель с мутантным ER Y537S (PR+, Her2-, предшествующее лечение ИА), слабо восприимчивую к лечению фулвестрантом. Комбинация RAD1901-эверолимус продемонстрировала регрессию опухоли на PDx-5 модели, в то время как эверолимус в монотерапии или RAD1901 в монотерапии исключительно ингибировали рост опухоли, не вызывая регрессии опухоли (фиг. 6В). Комбинация RAD1901-эверолимус вызвала более значительное ингибирование роста опухоли, чем RAD1901 в монотерапии, эверолимус в монотерапии, фулвестрант в монотерапии на мутантных PDx-5 моделях (фиг. 6В). Таким образом, добавление эверолимуса обеспечило пользу в отношении PDx-5 моделей при применении в комбинации с RAD1901. Таким образом, комбинации RAD1901-эверолимус обеспечивали мощную противоопухолевую терапию ER+ рака молочной железы, экспрессирующего ER ДТ или мутантный ER, с экспрессией PR, с высоким или низким уровнем экспрессии Her2 и с устойчивостью к фулвестранту или без таковой.
[0073] Результаты, представленные в настоящей заявке, также продемонстрировали, что RAD1901 может быть доставлен в головной мозг (пример II), и что указанная доставка улучшала выживаемость мыши на внутричерепной модели на мышах, экспрессирующих ERα дикого типа (ксенотрансплантатная модель MCF-7, пример I(B)). Эверолимус был одобрен для лечения субэпендимальной гигантоклеточной астроцитомы (СГКА), опухоли головного мозга, наблюдаемой с туберозным склерозом (ТС). Таким образом, оба компонента комбинации RAD1901-эверолимус, вероятно, способны пересекать гематоэнцефалический барьер и лечить ER+ опухоли в головном мозге. Данное свойство представляет собой дополнительное преимущество по сравнению с комбинацией фул-эверолимус для лечения ER+ опухолей в головном мозге, поскольку фулвестрант не может пересекать гематоэнцефалический барьер (Vergotel et al., "Fulvestrant, a new treatment option for advanced breast cancer: tolerability versus existing agents," Ann. Oncol., 17(2):200-204 (2006)). Комбинация RAD1901 с другим вторым терапевтическим средством или средствами, которые способны пересекать гематоэнцефалический барьер (например, ингибиторами mTOR, такими как аналоги рапамицина (Geoerger et al., "Antitumor activity of the rapamycin analog CCI-779 in human primitive neuroectodermal tumor/medulloblastoma models as single agent and in combination chemotherapy," Cancer Res. 61:1527-1532 (2001)), может также оказывать аналогичные терапевтическое воздействие на ER+ опухоли в головном мозге.
[0074] RAD1901 продемонстрировал устойчивую эффективность при ингибировании роста опухоли после окончания лечения RAD1901, в то время как лечение эстрадиолом продолжали (например, PDx-4 модель). Таким образом, комбинация RAD1901-эверолимус, вероятно, обеспечивает пользу пациентам посредством ингибирования роста опухоли после окончания лечения, в особенности, когда лечение вторым терапевтическим средством или средствами могут прекращать (например, 29% в случае эверолимуса) или снижать или отсрочивать (70% в случае пациентов, получавших лечение эверолимусом) в связи с нежелательными реакциями. https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm488028.htm.
[0075] Комбинация RAD1901-эверолимус, вероятно, характеризуется более редкими и/или менее тяжелыми побочными эффектами, чем лечение эверолимусом в монотерапии или комбинацией эверолимуса с другими вариантами гормональной терапии (например, ИА, такими как летрозол, и ССРЭ, такими как фулвестрант). Например, как ИА, так и фулвестрант могут вызывать атрофию костной ткани у пациентов, получавших лечение. Маловероятно, что RAD1901 будет оказывать аналогичные побочные эффекты. Было обнаружено, что RAD1901, предпочтительно, накапливается в опухоли, причем уровень RAD1901 в опухоли по сравнению с уровнем RAD1901 в плазме (соотношение О/П) составляет до приблизительно 35 (пример II). Стандартизированные уровни накопления (СУН) для матки, мышц и костей рассчитывали для субъектов-людей, получавших лечение RAD1901 в ежедневной дозе от приблизительно 200 мг до приблизительно 500 мг (пример III(A)). После введения доз сигналы для матки были близки к уровням из «тканей, отличных от тканей-мишеней» (тканей, которые не экспрессируют рецептор эстрогенов), что свидетельствует о полном затухании накопления ФЭС-ПЭТ после лечения RAD1901. Практически не наблюдалось изменений на сканах ПЭТ перед лечением по сравнению со сканами после лечения в тканях, которые по существу не экспрессировали рецептор эстрогенов (например, мышцы, кости) (пример IIIA). Наконец, варианты лечения RAD1901 выступали в качестве антагонистов стимуляции эстрадиолом тканей матки у крыс после овариоэктомии (OVX) (пример IV(A)), и в значительной степени сохраняли качество костей субъектов, получавших лечение. Например, у крыс OVX, получавших лечение RAD1901, наблюдалось сохранение МПК и микроархитектуры бедренной кости (пример IV(A)). Таким образом, комбинация RAD1901-эверолимус может быть в особенности пригодной для пациентов, страдающих от остеопороза, или подверженных более высокому риску остеопороза.
[0076] Более того, сообщалось, что профилирование экспрессии генов является эффективным для обнаружения пациентов, восприимчивых к лечению эверолимусом. Yoon et al., "Gene expression profiling identifies responsive patients with cancer of unknown primary treated with carboplatin, paclitaxel, and everolimus: NCCTG N0871 (alliance)," Ann. Oncol, 27(2):339-44 (2016). В исследовании NCT00805129 было установлено, что эверолимус является более эффективным у пациентов, у которых присутствуют соматические мутации в TSC1, поскольку указанные мутации приводят к увеличению времени возникновения рецидива и к увеличению времени ответа на эверолимус. Таким образом, способы, раскрытые в настоящей заявке, могут также включать профилирование генов субъектов, лечение которых проводят, с целью обнаружения субъектов с большим ответом и/или более длительным временем ответа.
[0077] Более того, было обнаружено, что RAD1901 вызывает деградацию ERα дикого типа и отменяет передачу сигналов посредством ER in vivo на ксенотрансплантатных моделях на основе линии клеток MCF-7, и вызывает дозозависимое уменьшение уровня PR на данных ксенотрансплантатных моделях на основе линии клеток MCF-7 (пример III(B)). RAD1901 уменьшает пролиферацию на ксенотрансплантатных моделях на основе линии клеток MCF-7 и на PDx-4 моделях, что подтверждается снижением уровня маркера пролиферации Ki67 в опухолях, взятых у субъектов, получавших лечение. RAD1901 также уменьшает передачу сигналов посредством ER in vivo на PDx модели с мутантным ER, которая была слабо восприимчива к лечению фулвестрантом (пример III(B)).
[0078] Неожиданная эффективность комбинации RAD1901-эверолимус в отношении лечения опухолей, слабо восприимчивых к лечению фулвестрантом, и в отношении опухолей, экспрессирующих мутантный ERα, может быть обусловлена уникальными взаимодействиями между RAD1901 и ERα. Структурные модели ERα, присоединенного к RAD1901 и другим соединениям, связывающим ERα, анализировали для получения информации о специфичных взаимодействиях связывания (пример V). Компьютерное моделирование продемонстрировало, что взаимодействия RAD1901 - ERα, вероятно, не нарушаются мутациями в ЛСД ERα, например, мутантом Y537X, где X представлял собой S, N или С; D538G; и S463P, на который приходится приблизительно 81,7% мутаций ЛСД, обнаруженных в недавнем исследовании метастазирующих ER-положительных образцов опухоли молочной железы от пациентов, которые получали по меньшей мере одну линию эндокринного лечения (таблица 9, пример V). Таким образом, комбинация одного или нескольких вторых терапевтических средств (например, эверолимуса) и RAD1901 или его соли или сольвата (например, гидрата), вероятно, обладает терапевтическими эффектами с относительно низким уровнем побочных эффектов, аналогично комбинациям RAD1901-эверолимус, описанным в настоящей заявке. Компьютерное моделирование позволило обнаружить специфичные основания в С-концевых лиганд-связывающих доменах ERα, которые имеют определяющее значение для связывания; данную информацию можно использовать для разработки соединений, которые связываются не только с ERα дикого типа, но также с определенными мутантами и вариантами указанного рецептора, которые в сочетании со вторым терапевтическим средством (например, эверолимусом) могут обеспечить мощную противоопухолевую терапию с относительно низким уровнем побочных эффектов, аналогично комбинациям RAD1901-эверолимус, раскрытым в настоящей заявке.
[0079] На основании результатов, представленных в настоящей заявке, предложены способы ингибирования роста или обеспечения регрессии ERα-положительной опухоли у субъекта, который нуждается в таком ингибировании или регрессии, посредством введения субъекту терапевтически эффективного количества комбинации RAD1901 или сольватов (например, гидратов) или солей указанного соединения, и одного или нескольких вторых терапевтических средств, описанных в настоящей заявке (например, эверолимуса).
[0080] Согласно определенным вариантам реализации настоящего изобретения введение RAD1901 или его соли или сольвата (например, гидрата) обладает дополнительной терапевтической пользой дополнительно к ингибированию роста опухоли, включая, например, ингибирование пролиферации раковых клеток или ингибирование активности ERα (например, посредством ингибирования связывания эстрадиола или посредством деградации ERα). Согласно определенным вариантам реализации настоящего изобретения способ вызывает незначительное количество отрицательных эффектов или не вызывает отрицательных эффектов в отношении тканей, отличных от тканей-мишеней (например, мышц, костей).
[0081] Согласно определенным вариантам реализации настоящего изобретения RAD1901 или его соль или сольват (например, гидрат) модулируют и/или вызывают разложение ERα и мутантного ERα.
[0082] Согласно определенным вариантам реализации в настоящей заявке представлены способы ингибирования роста опухоли или регрессии опухоли, способы, которые обеспечивают ингибирование роста или обеспечивают регрессию ERα-положительной опухоли у субъекта, который нуждается в таком ингибировании или регрессии, посредством введения субъекту терапевтически эффективного количества комбинации RAD1901 или сольвата (например, гидрата) или соли и одного или нескольких вторых терапевтических средств, описанных в настоящей заявке. Согласно определенным из данных вариантов реализации настоящего изобретения соль указанного соединения представляет собой дигидрохлорид RAD1901, имеющий структуру:
дигидрохлорид RAD1901.
Вторые терапевтические средства
[0083] Второе терапевтическое средство для применения в способах, представленных в настоящей заявке, может представлять собой химиотерапевтическое средство или ингибитор AKT, рецептора андрогенов, ангиогенеза, ароматазы, киназы аврора A, BCL2, EGFR, пути эстрогена, пути передачи сигналов посредством эстрогена, рецептора эстрогенов, HER2, HER3, белка теплового шока 90 (Hsp90), пути передачи сигналов посредством hedgehog (Hh), гистондеацетилазы (HDAC), путей KIT, mTOR (например, TORC1 и/или TORC2), микротрубочек, МУС, метаболизма нуклеозидов, PARP, пан-PI3K, PI3K, протеинкиназы CK2, пути RAS, фосфатазы стероидов (STS), TK, Тор2А, тирозинкиназы, рецепторной тирозинкиназы VEGF или любые комбинации указанных средств. Второе терапевтическое средство может также представлять собой антитело, такое как антитело против ТФР (трансформирующего фактора роста) бета, антитело против рецептора инсулиноподобного фактора роста типа 1, антитело против антигена TROP-2, антитело против HER3, антитело против PD1 или конъюгат указанных антител с лекарственным препаратом.
[0084] Другие примеры вторых терапевтических средств включают, без ограничения, абиратерона ацетат, ADI-PEG 20, адотрастузумаб эмтанзин, афатиниб, алисертиб, анастрозол, паклитаксел и производные паклитаксела (например, ANG1005, полимерные мицеллы паклитаксела), ARN-810, азацитидин, AZD2014, AZD5363, бевацизумаб, ВР-С1, бупарлисиб (ВКМ120), BYL719, капецитабин, карбоплатин, цедираниба малеат, цетуксимаб, цисплатин/АС4-СООР4, CR1447, СХ-4945, дазатиниб, деносумаб, доцетаксел, доксорубицин, энилурацил, энтиностат, энзалутамид, эпирубицин, эрибулин, эксеместан, эверолимус, фторурацил, фулвестрант, фрезолимумаб, ганетеспиб, ганитумаб, GDC-0032, GDC-0941, гемцитабин, глембатумумаб ведотин, агонист GnRH (например, гозерелина ацетат), GRN1005, GSK 2141795, ибандронат, IMMU-132, иринотекан, иросустат, эпотилон (например, иксабепилон), лапатиниб, сонидегиб (LDE225), летрозол, LGK974, LJM716, луцитаниб, метотрексат, MK-2206, MK-3475, MLN0128, ММ-302, нератиниб, нирапариб, олапариб, антиандроген (например, ортеронел), оксалиплатин, пазопаниб, пертузумаб, PF-05280014, РМ01183, прогестерон, пиротиниб, ромидепсин, руксолитиниб, сорафениб, сунитиниб, талазопариб, тамоксифен, таксан, T-DM1, телапристон (CDB-4124), темозоломид, темсиролимус, тетратиомолибдат, тезетаксел, агонист TLR 7, TPI 287, траметиниб, трастузумаб, TRC105, требананиб (AMG 386), трипторелин, велипариб, винфлюнин, винорелбин, вориностат, золадекс и золедроновую кислоту, включая сольваты (например, гидраты) и соли указанных соединений.
[0085] Согласно определенным вариантам реализации настоящего изобретения вторые терапевтические средства выбраны из группы, состоящей из адотрастузумаба эмтанзина, ингибиторов киназы аврора А (например, алисертиба), ИА (например, анастрозола; эксеместана, летрозола), ARN-810, ингибиторов mTOR (например, эверолимуса, AZD2014, BEZ235, GDC-0980, СС-223, MLN0128), ингибиторов AKT (например, AZD5363, GDC-0068, GSK2110183, GSK2141795, GSK690693, МК2206), ингибиторов PI3K (например, ВКМ120, BYL719, GDC-0032, GDC-0941), селективных ингибиторов гистондеацетилазы (histone deacetylase, HDAC) (например, энтиностата), агониста GnRH (например, гозерелина ацетата), GRN1005 и комбинаций указанных соединений с трастузумабом, лапатинибом, ингибитором тирозинкиназы (например, луцитанибом, нератинибом), антиандрогеном (например, ортеронелом), пертузумабом, темозоломидом и антителами (например, кейтрудой и BYM338). [0086] Согласно определенным вариантам реализации настоящего изобретения второе терапевтическое средство может представлять собой ИА (например, анастрозол, аромазин, и летрозол), другой СМРЭ (например, арзоксифен, дролоксифен, ЕМ-652 (SCH 57068), идоксифен, лазофоксифен, левормелоксифен, мипроксифен, тамоксифен и торемифен) или другой ССРЭ (например, фулвестрант, GDC-0810 (ARN-810), GW5638/DPC974, ICI182782, RU58668, SRN-927, TAS-108 (SR16234) и ZK191703), включая сольваты (например, гидраты) и соли указанных соединений.
[0087] Другие примеры вторых терапевтических средств включают, без ограничения, абраксан, AMG 386, кабазитаксел, келикс, капецитабин, доцетаксел, эрибулин, гемцитабин, герцептин, нератиниб, пазопаниб (GW786034), рапалоги (рапамицин и его аналоги), таксол (включая аналоги/альтернативные составы), TDM1, темозоламид, тайкерб, велипариб (АВТ-888) и винорелбин, включая сольваты (например, гидраты) и соли указанных соединений. Второе терапевтическое средство, нацеленное на путь PI3K/AKT/mTOR
[0088] Согласно некоторым вариантам реализации настоящего изобретения второе терапевтическое средство нацелено на путь PI3K/AKT/mTOR и может представлять собой ингибитор mTOR, двойной ингибитор mTOR, ингибитор PI3K/mTOR. Согласно некоторым вариантам реализации настоящего изобретения второе терапевтическое средство представляет собой производное рапамицина (иначе называемое рапалог), такое как рапамицин (сиролимус или рапамун, Pfizer), эверолимус (Афинитор или RAD001, Novartis), ридафоролимус (АР23573 или МК-8669, Merck и ARIAD Pharmaceuticals), темсиролимус (Торизел или CCI779, Pfizer), включая сольваты (например, гидраты) и соли указанных соединений. Согласно некоторым вариантам реализации настоящего изобретения второе терапевтическое средство представляет собой двойной ингибитор mTOR, который ингибирует как mTORC1, так и mTORC2, такой как MLN0128 (кастрационно-резистентный рак предстательной железы (castration-resistant prostate cancer, CRPC), Мемориальный онкологический центр им. Слоуна-Кеттеринга), СС115 и СС223 (Celgene), OSI-027 (OSI Pharmaceuticals) и AZD8055 и AZD2014 (AstraZeneca), включая сольваты (например, гидраты) и соли указанных соединений. Согласно некоторым вариантам реализации настоящего изобретения второе терапевтическое средство представляет собой ингибитор PI3K/mTOR, такой как GDC-0980, SAR245409 (XL765), LY3023414 (Eli Lilly), NVP-BEZ235 (Novartis), NVP-BGT226 (Novartis), SF1126 и PKI-587 (Pfizer), включая сольваты (например, гидраты) и соли указанных соединений.
[0089] Согласно определенным вариантам реализации настоящего изобретения более чем одно второе терапевтическое средство, описанное выше, можно применять в комбинации с RAD1901 или его сольватами (например, гидратом) или солями. Например, ингибитор mTOR можно использовать вместе с другим ингибитором mTOR или с ингибитором PI3K/mTOR. Также в данной области техники известно, что вторые терапевтические средства, описанные выше, включая ингибиторы mTOR, двойные ингибиторы mTOR и ингибиторы PI3K/mTOR, можно вводить с другими активными средствами для усиления эффективности лечения. Например, ингибитор mTOR можно применять в комбинации с ингибиторами JAK2 (Bogani et al., PLOS One, 8(1): e54826 (2013)), химиотерапевтическими средствами (Yardley, Breast Cancer (Auckl) 7: 7-22 (2013)), или вариантами эндокринной терапии, такими как тамоксифен или эксеместан (Vinayak et al., "mTOR inhibitors in the treatment of breast cancer," Oncology, опубликована 15 января 2013 года (https://www.cancernetwork.com/breast-cancer/mtor-inhibitors-treatment-breast-cancer)). Соответственно, вторые терапевтические средства также включают данные вспомогательные активные средства.
Комбинированная терапия
(1) Комбинация RAD1901 или его сольватов (например, гидрата) или солей и одного или нескольких вторых терапевтических средств
[0090] Как RAD1901 или его сольваты (например, гидрат) или соли, так и второе терапевтическое средство или средства (например, эверолимус) при введении субъекту в монотерапии обладают терапевтическим эффектом в отношении одного или нескольких вариантов рака или опухолей (примеры I(A) и I(B)). Неожиданно было обнаружено, что RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) при введении в комбинации субъекту обладают в значительной степени улучшенным эффектом в отношении вариантов рака/опухолей (примеры 1(A) и 1(B)).
[0091] «Ингибирование роста» ERα-положительной опухоли в настоящей заявке может означать замедление скорости роста опухоли или полное прекращение роста опухоли.
[0092] «Регрессия опухоли» или «регрессия» ERα-положительной опухоли в настоящей заявке может означать уменьшение максимального размера опухоли. Согласно определенным вариантам реализации настоящего изобретения введение комбинации одного или нескольких вторых терапевтических средств (например, эверолимуса), описанных в настоящей заявке (например, рибоциклиба, абемациклиба и эверолимуса), и RAD1901 или сольвата (например, гидрата) или соли может привести к уменьшению размера опухоли по сравнению с исходным уровнем (т.е. размером до начала лечения) или даже к устранению или частичному устранению опухоли. Соответственно, согласно определенным вариантам реализации способы регрессии опухоли, представленные в настоящей заявке, можно в качестве альтернативы охарактеризовать как способы уменьшения размера опухоли по сравнению с исходным уровнем.
[0093] «Опухоль» в настоящей заявке представляет собой злокачественную опухоль и употребляется взаимозаменяемо с «раком».
[0094] Ингибирование роста или регрессия опухоли могут локализоваться в одной опухоли или в ряде опухолей в пределах специфичной ткани или органа или могут являться системными (т.е. могут поражать опухоли во всех тканях или органах).
[0095] Поскольку RAD1901, как известно, предпочтительно, связывается с ERα по сравнению с рецептором эстрогенов бета (ERβ), если не указано обратное, рецептор эстрогенов, рецептор эстрогенов альфа, ERα, ER, ERα дикого типа и ESR1 употребляются в настоящей заявке взаимозаменяемо. «Рецептор эстрогенов альфа» или «ERα» в настоящей заявке означает полипептид, содержащий аминокислотную последовательность ERα дикого типа, которая кодируется геном ESR1, или состоящий или состоящий по существу из указанной аминокислотной последовательности. Опухоль, которая является «положительной в отношении рецептора эстрогенов альфа», «ERα-положительной», «ER+» или «ERα+» в настоящей заявке означает опухоль, в которой одна или несколько клеток экспрессируют по меньшей мере одну изоформу ERα. Согласно определенным вариантам реализации настоящего изобретения данные клетки сверхэкспрессируют ERα. Согласно определенным вариантам реализации настоящего изобретения пациент содержит одну или несколько клеток в опухоли, экспрессирующих одну или несколько форм ERβ. Согласно определенным вариантам реализации настоящего изобретения ERα-положительная опухоль и/или рак связаны с раком молочной железы, матки, яичников или гипофиза. Согласно определенным из данных вариантов реализации настоящего изобретения пациент имеет опухоль, расположенную в ткани молочной железы, матки, яичников или гипофиза. Согласно вариантам реализации настоящего изобретения, в которых пациент имеет опухоль, расположенную в молочной железе, опухоль может быть связанной с люминальным раком молочной железы, который может являться или может не являться положительным в отношении HER2, и в случае HER2+ опухолей, опухоли могут экспрессировать высокий или низкий уровень HER2 (например, фиг. 1). Согласно другим вариантам реализации настоящего изобретения пациент имеет опухоль, расположенную в другой ткани или органе (например, костях, мышцах, головном мозге), но, тем не менее, связанную с раком молочной железы, матки, яичников или гипофиза (например, опухоли, образованные в результате миграции или метастаза рака молочной железы, матки, яичников или гипофиза). Соответственно, согласно определенным вариантам реализации способов ингибирования роста опухоли или регрессии опухоли, представленных в настоящей заявке, опухоль, которая является мишенью, представляет собой метастазирующую опухоль и/или опухоль, которая характеризуется сверхэкспрессией ER в других органах (например, костях и/или мышцах). Согласно определенным вариантам реализации настоящего изобретения опухоль, которая является мишенью, представляет собой опухоль и/или рак головного мозга. Согласно определенным вариантам реализации настоящего изобретения опухоль, которая является мишенью, является более чувствительной к лечению RAD1901 и вторым терапевтическим средством, как раскрыто в настоящей заявке, чем к лечению другим ССРЭ (например, фулвестрантом, TAS-108 (SR16234), ZK191703, RU58668, GDC-0810 (ARN-810), GW5638/DPC974, SRN-927, ICI182782 и AZD9496), ингибиторами Her2 (например, трастузумабом, лапатинибом, аботрастузумабом эмтанзином и/или пертузумабом), химиотерапией (например, абраксаном, адриамицином, карбоплатином, цитоксаном, даунорубицином, доксилом, элленсом, фторурацилом, гемзаром, хелавеном, икземпрой, метотрексатом, митомицином, микоксантроном, навельбином, таксолом, таксотером, тиотепой, винкристином и кселодой), ингибитором ароматазы (например, анастрозолом, эксеместаном и летрозолом), селективными модуляторами рецептора эстрогенов (например, тамоксифеном, ралоксифеном, лазофоксифеном и/или торемифеном), ингибитором ангиогенеза (например, бевацизумабом) и/или ритуксимабом.
[0096] Согласно определенным вариантам реализации способов ингибирования роста опухоли или регрессии опухоли, представленных в настоящей заявке, указанные способы также включают этап определения у пациента опухоли, экспрессирующей ERα, перед введением комбинации RAD1901 или его сольватов (например, гидрата) или солей и одного или нескольких вторых терапевтических средств (например, эверолимуса). Согласно определенным вариантам реализации способов ингибирования роста опухоли или регрессии опухоли, представленных в настоящей заявке, способы также включают этап определения наличия у пациента опухоли, экспрессирующей мутантный ERα, перед введением комбинации RAD1901 или его сольватов (например, гидрата) или солей и одного или нескольких вторых терапевтических средств (например, эверолимуса). Согласно определенным вариантам реализации способов ингибирования роста опухоли или регрессии опухоли, представленных в настоящей заявке, указанные способы также включают этап определения наличия у пациента опухоли, экспрессирующей ERα, которая является восприимчивой или невосприимчивой к лечению фулвестрантом, перед введением комбинации RAD1901 или его сольватов (например, гидрата) или солей и одного или нескольких вторых терапевтических средств (например, эверолимуса). Данные определения можно провести с применением любого способа обнаружения экспрессии, известного в данной области техники, при этом их можно осуществить in vitro с применением образца опухоли или ткани, взятого у субъекта.
[0097] Помимо демонстрации способности RAD1901 ингибировать рост опухоли в опухолях, экспрессирующих ERα дикого типа, результаты, представленные в настоящей заявке, продемонстрировали, что RAD1901 демонстрирует неожиданную способность ингибировать рост опухолей, экспрессирующих мутантную форму ERα, а именно Y537S ERα (пример 1(A)). Оценки примеров мутаций ERα методом компьютерного моделирования продемонстрировали, что ни одна из данных мутаций, как предполагают, не влияет на ЛСД или специфично не препятствует связыванию RAD1901 (пример V(A)), например, ERα, содержащий один или несколько мутантов, которые выбраны из группы, состоящей из ERα с мутантным Y537X, где X представляет собой S, N или С, ERα с мутантным D538G, и ERα с мутантным S463P. На основании данных результатов в настоящей заявке представлены способы ингибирования роста или способы, обеспечивающие регрессию опухоли, которая является положительной в отношении ERα, содержащего один или несколько мутантов в лиганд-связывающем домене (ЛСД), которые выбраны из группы, состоящей из Y537X1, где X1 представляет собой S, N или С, D538G, L536X2, где Х2 представляет собой R или Q, Р535Н, V534E, S463P, V392I, E380Q, в особенности, Y537S ERα, у субъекта, страдающего от рака, посредством введения субъекту терапевтически эффективного количества комбинации одного или нескольких одного или нескольких вторых терапевтических средств (например, эверолимуса), и RAD1901 или его сольватов (например, гидрата) или солей. «Мутант ERα» в настоящей заявке означает ERα, с одной или несколькими заменами или делециями, и варианты указанного рецептора, содержащие аминокислотную последовательность с по меньшей мере 80%, по меньшей мере 85%, по меньшей мере 90%, по меньшей мере 95%, по меньшей мере 97%, по меньшей мере 98%, по меньшей мере 99% или по меньшей мере 99,5% идентичностью аминокислотной последовательности ERα, или состоящие или состоящие по существу из указанной аминокислотной последовательности.
[0098] Помимо ингибирования роста опухоли рака молочной железы на ксенотрансплантатной модели на животных результаты, раскрытые в настоящей заявке, продемонстрировали, что RAD1901 демонстрирует значительное накопление в клетках опухоли и способен проникать через гематоэнцефалический барьер (пример II). Способность проникать через гематоэнцефалический барьер подтверждали посредством демонстрации того, что введение RAD1901 в значительной степени увеличивало выживаемость на ксенотрансплантатной модели метастазов головного мозга (пример I(B)). Соответственно, согласно определенным вариантам реализации способов ингибирования роста опухоли или регрессии опухоли, представленных в настоящей заявке, ERα-положительная опухоль, которая является мишенью, расположена в головном мозге или в другом месте в центральной нервной системе. Согласно определенным из данных вариантов реализации настоящего изобретения ERα-положительная опухоль представляет собой рак, первично связанный с головным мозгом. Согласно другим вариантам реализации настоящего изобретения ERα-положительная опухоль представляет собой метастазирующую опухоль, которая первично связана с другим типом рака, таким как рак молочной железы, матки, яичников или гипофиза, или опухоль, которая мигрировала из другой ткани или органа. Согласно определенным из данных вариантов реализации настоящего изобретения опухоль представляет собой метастазы в головном мозге, такие как метастазы рака молочной железы в головном мозге (breast cancer brain metastases, BCBM). Согласно определенным вариантам реализации способов, раскрытых в настоящей заявке, RAD1901 или его сольваты (например, гидрат) или соли накапливаются в одной или нескольких клетках в опухоли-мишени.
[0099] Согласно определенным вариантам реализации способов, раскрытых в настоящей заявке, RAD1901 или его сольваты (например, гидрат) или соли указанного соединения, предпочтительно, накапливаются в опухоли при соотношении О/П (концентрация RAD1901 в опухоли/концентрация RAD1901 в плазме), составляющем приблизительно 15 или выше, приблизительно 18 или выше, приблизительно 19 или выше, приблизительно 20 или выше, приблизительно 25 или выше, приблизительно 28 или выше, приблизительно 30 или выше, приблизительно 33 или выше, приблизительно 35 или выше или приблизительно 40 или выше. [00100] Результаты, представленные в настоящей заявке, продемонстрировали, что введение RAD1901 защищает от атрофии костной ткани у крыс после овариоэктомии (пример IV(A)). Соответственно, согласно определенным вариантам реализации способов ингибирования роста опухоли или регрессии опухоли, представленных в настоящей заявке, введение комбинации одного или нескольких вторых терапевтических средств (например, эверолимуса) и RAD1901 или сольватов (например, гидрата) или солей не оказывает нежелательных эффектов в отношении костей, включая, например, нежелательные эффекты в отношении плотности объема костей, плотности поверхности костей, минеральной плотности костей, числа трабекул, толщины трабекул, расстояния между трабекулами, плотности соединительной ткани и/или кажущейся плотности костей субъекта, который получает лечение. Поскольку тамоксифен может быть связан с атрофией костной ткани у женщин в пременопаузальном периоде, и фулвестрант может нарушать структуру костей в связи с механизмом действия данного средства, комбинация одного или нескольких одного или нескольких вторых терапевтических средств (например, эверолимуса) и RAD1901 или его сольватов (например, гидрата) или солей может быть наиболее полезной для женщин в пременопаузальном периоде, лечения опухолей, устойчивых к тамоксифену или антиэстрогеновой терапии, и для пациентов, страдающих от остеопороза или подверженных высокому риску остеопороза.
[00101] Результаты, представленные в настоящей заявке, продемонстрировали, что RAD1901 выступал антагонистом стимуляции эстрадиолом тканей матки у крыс после овариоэктомии (пример IV(A)). Более того, у субъектов-людей, получавших лечение RAD1901 в ежедневной дозе 200 мг или до 500 мг, почти не наблюдалось изменений сигналов стандартизированного объема накопления (СУН) для тканей матки, мышц и костей, которые по существу не экспрессировали ER, до и после лечения (пример III(A)). Соответственно, согласно определенным вариантам реализации настоящего изобретения такое введение также не приводит к нежелательным эффектам в отношении других тканей, включая, например, ткани матки, мышц или молочной железы.
[00102] RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) вводят в комбинации субъекту, который нуждается в таком введении. Фраза «в комбинации» означает, что RAD1901 или его сольваты (например, гидрат) или соли можно вводить до, в течение или после введения второго терапевтического средства или средств (например, эверолимуса). Например, RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) можно вводить с интервалом приблизительно одну неделю, с интервалом приблизительно 6 дней, с интервалом приблизительно 5 дней, с интервалом приблизительно 4 дня, с интервалом приблизительно 3 дня, с интервалом приблизительно 2 дня, с интервалом приблизительно 24 часа, с интервалом приблизительно 23 часа, с интервалом приблизительно 22 часа, с интервалом приблизительно 21 час, с интервалом приблизительно 20 часов, с интервалом приблизительно 19 часов, с интервалом приблизительно 18 часов, с интервалом приблизительно 17 часов, с интервалом приблизительно 16 часов, с интервалом приблизительно 15 часов, с интервалом приблизительно 14 часов, с интервалом приблизительно 13 часов, с интервалом приблизительно 12 часов, с интервалом приблизительно 11 часов, с интервалом приблизительно 10 часов, с интервалом приблизительно 9 часов, с интервалом приблизительно 8 часов, с интервалом приблизительно 7 часов, с интервалом приблизительно 6 часов, с интервалом приблизительно 5 часов, с интервалом приблизительно 4 часа, с интервалом приблизительно 3 часа, с интервалом приблизительно 2 часа, с интервалом приблизительно 1 час, с интервалом приблизительно 55 минут, с интервалом приблизительно 50 минут, с интервалом приблизительно 45 минут, с интервалом приблизительно 40 минут, с интервалом приблизительно 35 минут, с интервалом приблизительно 30 минут, с интервалом приблизительно 25 минут, с интервалом приблизительно 20 минут, с интервалом приблизительно 15 минут, с интервалом приблизительно 10 минут или с интервалом приблизительно 5 минут. Согласно другим вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) вводят субъекту одновременно или по существу одновременно. Согласно определенным из данных вариантов реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) можно вводить в качестве части одного состава.
[00103] Согласно некоторым вариантам реализации настоящего изобретения субъекту вводят комбинацию RAD1901 или его сольватов (например, гидрата) или солей и одно второе терапевтическое средство (например, эверолимус). Согласно другим вариантам реализации настоящего изобретения субъекту вводят комбинацию RAD1901 или его сольватов (например, гидрата) или солей и более одного второго терапевтического средства (например, эверолимус). Например, RAD1901 или его сольваты (например, гидрат) или соли можно сочетать с двумя или более вторыми терапевтическими средствами (например, эверолимусом) для лечения вариантов рака/опухолей. (2) Доза
[00104] Терапевтически эффективное количество комбинации RAD1901 или его сольватов (например, гидрата) или солей и одного или нескольких вторых терапевтических средств (например, эверолимуса) для применения в способах, раскрытых в настоящей заявке, представляет собой количество, которое при введении в течение определенного периода времени приводит к достижению одного или нескольких терапевтических сравнительных критериев (например, замедления или прекращения роста опухоли, которое приводит к регрессии опухоли, прекращения симптомов и т.д.). Комбинацию для применения в способах, раскрытых в настоящей заявке, можно вводить субъекту один раз или несколько раз. Согласно вариантам реализации настоящего изобретения, в которых соединения вводят несколько раз, данные соединения можно вводить с заданным интервалом, например, ежедневно, через день, еженедельно или ежемесячно. В качестве альтернативы, данные соединения можно вводить с нерегулярными интервалами, например, по мере необходимости в зависимости от симптомов, здоровья пациента и т.п. Терапевтически эффективное количество комбинации можно вводить ежедневно в течение одного дня, по меньшей мере 2 дней, по меньшей мере 3 дней, по меньшей мере 4 дней, по меньшей мере 5 дней, по меньшей мере 6 дней, по меньшей мере 7 дней, по меньшей мере 10 дней или по меньшей мере 15 дней. Необязательно статус рака или регрессию опухоли контролируют в течение или после лечения, например, посредством сканирования субъекта методом ФЭС-ПЭТ. Дозу комбинации, которую вводят субъекту, можно увеличить или уменьшить в зависимости от установленного статуса рака или регрессии опухоли.
[00105] В идеальном случае терапевтически эффективное количество не превышает максимально переносимую дозу, при которой 50% или более субъектов, получающих лечение, испытывают тошноту или другие реакции токсичности, которые предотвращают последующие введения лекарственных препаратов. Терапевтически эффективное количество для субъекта может варьировать в зависимости от множества факторов, включая множество и степень симптомов, пол, возраст, массу тела или общее состояние здоровья субъекта, способ введения и тип соли или сольвата, различия в восприимчивости к лекарственному препарату, конкретный тип заболевания и т.п.
[00106] Примеры терапевтически эффективных количеств RAD1901 или сольватов (например, гидрата) или солей указанного соединения для применения в способах, раскрытых в настоящей заявке, включают, без ограничения, ежедневные дозы от приблизительно 150 до приблизительно 1500 мг, от приблизительно 200 до приблизительно 1500 мг, от приблизительно 250 до приблизительно 1500 мг или от приблизительно 300 до приблизительно 1500 мг в случае субъектов, которые страдают от устойчивых ER-зависимых опухолей или вариантов рака; ежедневные дозы от приблизительно 150 до приблизительно 1500 мг, от приблизительно 200 до приблизительно 1000 мг или от приблизительно 250 до приблизительно 1000 мг или от приблизительно 300 до приблизительно 1000 мг в случае субъектов, которые страдают от ER дикого типа-зависимых опухолей и/или вариантов рака и устойчивых опухолей и/или вариантов рака; и ежедневные дозы от приблизительно 300 до приблизительно 500 мг, от приблизительно 300 до приблизительно 550 мг, от приблизительно 300 до приблизительно 600 мг, от приблизительно 250 до приблизительно 500 мг, от приблизительно 250 до приблизительно 550 мг, от приблизительно 250 до приблизительно 600 мг, от приблизительно 200 до приблизительно 500 мг, от приблизительно 200 до приблизительно 550 мг, от приблизительно 200 до приблизительно 600 мг, от приблизительно 150 до приблизительно 500 мг, от приблизительно 150 до приблизительно 550 мг или от приблизительно 150 до приблизительно 600 мг в случае субъектов, страдающих от, в большинстве своем, ER дикого типа-зависимых опухолей и/или вариантов рака.
[00107] Терапевтически эффективное количество или доза второго терапевтического средства (например, эверолимуса) зависит от конкретного типа указанного средства. Как правило, ежедневная доза второго терапевтического средства (например, эверолимуса) варьирует от приблизительно 1 мг до приблизительно 1500 мг, от приблизительно 1 мг до приблизительно 1200 мг, от приблизительно 1 мг до приблизительно 1000 мг, от приблизительно 1 мг до приблизительно 800 мг, от приблизительно 1 мг до приблизительно 600 мг, от приблизительно 1 мг до приблизительно 500 мг, от приблизительно 1 мг до приблизительно 200 мг, от приблизительно 1 мг до приблизительно 100 мг, от приблизительно 1 мг до приблизительно 50 мг, от приблизительно 1 мг до приблизительно 30 мг, от приблизительно 1 мг до приблизительно 20 мг, от приблизительно 1 мг до приблизительно 10 мг, от приблизительно 1 мг до приблизительно 5 мг, от приблизительно 50 мг до приблизительно 1500 мг, от приблизительно 100 мг до приблизительно 1200 мг, от приблизительно 150 мг до приблизительно 1000 мг, от приблизительно 200 мг до приблизительно 800 мг, от приблизительно 300 мг до приблизительно 600 мг, от приблизительно 350 мг до приблизительно 500 мг. Ежедневная доза второго терапевтического средства (например, эверолимуса) может варьировать от приблизительно 1 до приблизительно 100 мг/кг, от приблизительно 1 до приблизительно 75 мг/кг, от приблизительно 1 до приблизительно 50 мг/кг, от приблизительно 1 до приблизительно 45 мг/кг, от приблизительно 1 до приблизительно 40 мг/кг, от приблизительно 1 до приблизительно 30 мг/кг, от приблизительно
1 до приблизительно 20 мг/кг, от приблизительно 1 до приблизительно 10 мг/кг, от приблизительно 2 до приблизительно 100 мг/кг, от приблизительно 2 до приблизительно 75 мг/кг, от приблизительно 2 до приблизительно 50 мг/кг, от приблизительно 2 до приблизительно 45 мг/кг, от приблизительно 2 до приблизительно 40 мг/кг, от приблизительно
2 до приблизительно 30 мг/кг, от приблизительно 2 до приблизительно 20 мг/кг, от приблизительно 2 до приблизительно 10 мг/кг, от приблизительно 2,5 до приблизительно 100 мг/кг, от приблизительно 2,5 до приблизительно 75 мг/кг, от приблизительно 2,5 до приблизительно 50 мг/кг, от приблизительно 2,5 до приблизительно 45 мг/кг, от приблизительно 2,5 до приблизительно 40 мг/кг, от приблизительно 2,5 до приблизительно 30 мг/кг, от приблизительно 2,5 до приблизительно 20 мг/кг или от приблизительно 2,5 до приблизительно 10 мг/кг.
[00108] Согласно определенным вариантам реализации настоящего изобретения в терапевтически эффективном количестве комбинации можно использовать терапевтически эффективное количество любого соединения, вводимого в монотерапии. Согласно другим вариантам реализации настоящего изобретения в связи со значительно улучшенным синергическим терапевтическим эффектом, который обеспечивает комбинация, терапевтически эффективные количества RAD1901 или его сольватов (например, гидрата) или солей и второго терапевтического средства или средств (например, эверолимуса) при введении в комбинации могут являться меньшими, чем терапевтически эффективные количества RAD1901 или его сольватов (например, гидрата) или солей и второго терапевтического средства или средств (например, эверолимуса), требуемые при введении в монотерапии; и одно или оба соединения можно вводить в дозе, меньшей, чем доза, при которой данные соединения будут в норме вводить при раздельном введении. Не опираясь на какую-либо конкретную теорию, считают, что комбинированная терапия обеспечивает значительно улучшенный эффект посредством уменьшения дозы по меньшей мере одного или всех RAD1901 или его сольватов (например, гидрата) или солей и второго терапевтического средства или средств (например, эверолимуса), посредством этого устраняя или облегчая нежелательные токсичные побочные эффекты.
[00109] Согласно некоторым вариантам реализации настоящего изобретения терапевтически эффективное количество RAD1901 или его сольватов (например, гидрата) или солей при введении в качестве части комбинации составляет от приблизительно 30% до приблизительно 200%, от приблизительно 40% до приблизительно 200%, от приблизительно 50% до приблизительно 200%, от приблизительно 60% до приблизительно 200%, от приблизительно 70% до приблизительно 200%, от приблизительно 80% до приблизительно 200%, от приблизительно 90% до приблизительно 200%, от приблизительно 100% до приблизительно 200%, от 30% до приблизительно 150%, от приблизительно 40% до приблизительно 150%, от приблизительно 50% до приблизительно 150%, от приблизительно 60% до приблизительно 150%, от приблизительно 70% до приблизительно 150%, от приблизительно 80% до приблизительно 150%, от приблизительно 90% до приблизительно 150%, от приблизительно 100% до приблизительно 150%, от приблизительно 30% до приблизительно 120%, от приблизительно 40% до приблизительно 120%, от приблизительно 50% до приблизительно 120%, от приблизительно 60% до приблизительно 120%, от приблизительно 70% до приблизительно 120%, от приблизительно 80% до приблизительно 120%, от приблизительно 90% до приблизительно 120%, от приблизительно 100% до приблизительно 120%, от 30% до приблизительно 110%, от приблизительно 40% до приблизительно 110%, от приблизительно 50% до приблизительно 110%, от приблизительно 60% до приблизительно 110%, от приблизительно 70% до приблизительно 110%, от приблизительно 80% до приблизительно 110%, от приблизительно 90% до приблизительно 110% или от приблизительно 100% до приблизительно 110% от терапевтически эффективного количества RAD1901 или его сольватов (например, гидрата) или солей при введении в качестве монотерапии. Согласно некоторым вариантам реализации настоящего изобретения терапевтически эффективное количество второго терапевтического средства или средств (например, эверолимуса) при введении в качестве части комбинации составляет от приблизительно 30% до приблизительно 200%, от приблизительно 40% до приблизительно 200%, от приблизительно 50% до приблизительно 200%, от приблизительно 60% до приблизительно 200%, от приблизительно 70% до приблизительно 200%, от приблизительно 80% до приблизительно 200%, от приблизительно 90% до приблизительно 200%, от приблизительно 100% до приблизительно 200%, от 30% до приблизительно 150%, от приблизительно 40% до приблизительно 150%, от приблизительно 50% до приблизительно 150%, от приблизительно 60% до приблизительно 150%, от приблизительно 70% до приблизительно 150%, от приблизительно 80% до приблизительно 150%, от приблизительно 90% до приблизительно 150%, от приблизительно 100% до приблизительно 150%, от приблизительно 30% до приблизительно 120%, от приблизительно 40% до приблизительно 120%, от приблизительно 50% до приблизительно 120%, от приблизительно 60% до приблизительно 120%, от приблизительно 70% до приблизительно 120%, от приблизительно 80% до приблизительно 120%, от приблизительно 90% до приблизительно 120%, от приблизительно 100% до приблизительно 120%, от 30% до приблизительно 110%, от приблизительно 40% до приблизительно 110%, от приблизительно 50% до приблизительно 110%, от приблизительно 60% до приблизительно 110%, от приблизительно 70% до приблизительно 110%, от приблизительно 80% до приблизительно 110%, от приблизительно 90% до приблизительно 110% или от приблизительно 100% до приблизительно 110% от терапевтически эффективного количества второго терапевтического средства или средств (например, эверолимуса) при введении в монотерапии.
[00110] Согласно определенным вариантам реализации настоящего изобретения варианты рака или опухоли являются устойчивыми ER-зависимыми вариантами рака или опухолями (например, содержащими мутантные домены связывания ER (например, ERα, с одной или несколькими мутациями, включая, но не ограничиваясь указанными, Y537X1, где X1 представляет собой S, N или С, D538G, L536X2, где Х2 представляет собой R или Q, Р535Н, V534E, S463P, V392I, E380Q и комбинации указанных мутаций), варианты рака или опухоли, сверхэкспрессирующие ER, или случаи, в которых пролиферация опухоли и/или рака становится лиганд-независимой, или опухоли и/или варианты рака, которые прогрессируют при лечении другим ССРЭ (например, фулвестрантом, TAS-108 (SR16234), ZK191703, RU58668, GDC-0810 (ARN-810), GW5638/DPC974, SRN-927, ICI182782 и AZD9496), ингибиторами Her2 (например, трастузумабом, лапатинибом, аботрастузумабом эмтанзином и/или пертузумабом), химиотерапией (например, абраксаном, адриамицином, карбоплатином, цитоксаном, даунорубицином, доксилом, элленсом, фторурацилом, гемзаром, хелавеном, икземпрой, метотрексатом, митомицином, микоксантроном, навельбином, таксолом, таксотером, тиотепой, винкристином и кселодой), ингибитором ароматазы (например, анастрозолом, эксеместаном и летрозолом), селективными модуляторами рецептора эстрогенов (например, тамоксифеном, ралоксифеном, лазофоксифеном и/или торемифеном), ингибитором ангиогенеза (например, бевацизумабом) и/или ритуксимабом.
[00111] Согласно определенным вариантам реализации настоящего изобретения доза RAD1901 или его сольватов (например, гидрата) или солей в комбинации с вторым терапевтическим средством (например, эверолимусом), описанным в настоящей заявке (например, рибоциклибом, абемациклибом и эверолимусом), для применения в способах, раскрытых в настоящей заявке, общепринятая для взрослого субъекта, может составлять от приблизительно 30 мкг до 2000 мг, от 100 мкг до 1500 мг или от 150 мг до 1500 мг в день посредством перорального введения. Данной ежедневной дозы можно достичь посредством однократного введения или нескольких введений.
[00112] Комбинацию одного или нескольких вторых терапевтических средств (например, эверолимуса) и RAD1901 или его сольватов (например, гидрата) или солей можно вводить субъекту один раз или несколько раз. Согласно вариантам реализации настоящего изобретения, в которых соединения вводят несколько раз, данные соединения можно вводить с заданным интервалом, например, ежедневно, через день, еженедельно или ежемесячно. В качестве альтернативы, данные соединения можно вводить с нерегулярными интервалами, например, по мере необходимости в зависимости от симптомов, здоровья пациента и т.п.
(3) Состав
[00113] Согласно некоторым вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) вводят в отдельных составах. Согласно определенным из данных вариантов реализации настоящего изобретения составы могут относиться к одному типу. Например, оба состава могут быть разработаны для перорального введения (например, посредством двух отдельных драже) или для инъекции (например, посредством двух отдельных инъекционных составов). Согласно другим вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) могут быть приготовлены в состав в различных типах составов. Например, одно соединение может находиться в составе, разработанном для перорального введения, в то время как другое находится в составе, разработанном для инъекции.
[00114] Согласно другим вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус), описанные в настоящей заявке, вводят в качестве части единого состава. Например, RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) приготовлены в состав в одном драже для перорального введения или в разовой дозе для инъекции. Согласно определенным вариантам реализации настоящего изобретения в настоящей заявке предложены комбинированные составы, содержащие RAD1901 или его сольваты (например, гидрат) или соли и одно или несколько вторых терапевтических средств (например, эверолимус). Согласно определенным вариантам реализации настоящего изобретения введение соединений в одном составе улучшает соблюдение больным режима и схемы лечения.
[00115] Терапевтически эффективное количество каждого соединения при введении в комбинации может являться меньшим, чем терапевтически эффективное количество каждого соединения, вводимого в монотерапии.
[00116] Согласно некоторым вариантам реализации настоящего изобретения состав, содержащий RAD1901 или его сольваты (например, гидрат) или соли, одно или несколько вторых терапевтических средств (например, эверолимус) или как RAD1901 или его сольваты (например, гидрат) или соли, так и одно или несколько вторых терапевтических средств (например, эверолимус), может также содержать одно или несколько фармацевтических вспомогательных веществ, носителей, вспомогательных средств и/или консервантов.
[00117] RAD1901 или его сольваты (например, гидрат) или соли и второе терапевтическое средство или средства (например, эверолимус) для применения в способах, раскрытых в настоящей заявке, можно приготовить в состав в единичных лекарственных формах, которые означают физически обособленные единицы, подходящие в качестве однократных доз для субъектов, лечение которых проводят, причем каждая единица содержит заранее определенное количество активного вещества, рассчитанное для получения желаемого терапевтического эффекта, необязательно в сочетании с подходящим фармацевтическим носителем. Единичная дозированная форма может предназначаться для однократной ежедневной дозы или одной из множества ежедневных доз (например, приблизительно от 1 до 4 или более раз в день). Когда используют несколько ежедневных доз, единичная дозированная форма для каждой дозы может являться одинаковой или разной. Согласно определенным вариантам реализации настоящего изобретения соединения могут быть приготовлены в состав для контролируемого высвобождения.
[00118] Состав RAD1901 или его сольвата (например, гидрат) или соли и второго терапевтического средства или средства (например, эверолимус) для применения в описанных в настоящем изобретении способах можно приготовить согласно любому доступному общепринятому способу. Примеры предпочтительных лекарственных форм включают таблетку, порошок, измельченную гранулу, гранулу, покрытую таблетку, капсулу, сироп, пастилку, лекарственную форму для ингаляции, суппозиторий, инъекционное вещество, мазь, офтальмологическую мазь, глазные капли, назальные капли, ушные капли, горячий компресс, лосьон и т.п. В составе можно использовать обычно применяемые добавки, такие как разбавитель, связывающее вещество, разрыхляющее вещество, смазывающее вещество, красящее вещество, ароматизирующее вещество и, в случае необходимости, стабилизатор, эмульгирующее вещество, вещество, способствующее всасыванию, поверхностно-активное вещество, регулятор рН, антисептическое вещество, антиоксидант и т.п. Помимо этого, приготовление в состав также проводят посредством объединения композиций, которые, как правило, используют в качестве исходного материала для приготовления фармацевтических составов согласно общепринятым способам. Примеры данных композиций включают, например, (1) масло, такое как соевое масло, говяжье сало и синтетический глицерид; (2) углеводород, такой как жидкий парафин, сквалан и твердый парафин; (3) сложноэфирное масло, такое как октилдодецил миристиновая кислота и изопропил миристиновая кислота; (4) высший спирт, такой как цетостеариловый спирт и бегениловый спирт; (5) кремнийорганическую смолу; (6) кремнийорганическое масло; (7) поверхностно-активное вещество, такое как полиоксиэтиленовый эфир жирной кислоты, сорбитановый эфир жирной кислоты, глицериновый эфир жирной кислоты, полиоксиэтиленовый сорбитановый эфир жирной кислоты, твердое полиоксиэтиленовое касторовое масло и полиоксиэтиленовый полиоксипропиленовый блок-сополимер; (8) водорастворимую макромолекулу, такую как гидроксиэтилцеллюлоза, полиакриловая кислота, карбоксивиниловый полимер, полиэтиленгликоль, поливинилпирролидон и метилцеллюлоза; (9) низший спирт, такой как этанол и изопропанол; (10) многовалентный спирт, такой как глицерин, пропиленгликоль, дипропиленгликоль и сорбитол; (11) сахар, такой как глюкоза и тростниковый сахар; (12) неорганический порошок, такой как безводная кремниевая кислота, магний-алюминий силикат и силикат алюминия; (13) очищенную воду и т.п. Добавки для применения в вышеуказанных составах могут включать в качестве разбавителя, например, 1) лактозу, кукурузный крахмал, сахарозу, глюкозу, маннитол, сорбитол, кристаллическую целлюлозу, диоксид кремния; 2) в качестве связывающего вещества - поливиниловый спирт, поливиниловый эфир, метилцеллюлозу, этилцеллюлозу, аравийскую камедь, трагакантовую камедь, желатин, шеллак, гидроксипропилцеллюлозу, гидроксипропилметилцеллюлозу, поливинилпирролидон, блок-сополимер полипропиленгликоль-полиоксиэтилен, меглумин, цитрат кальция, декстрин, пектин и т.п.; 3) в качестве разрыхлителей - крахмал, агар, желатиновый порошок, кристаллическую целлюлозу, карбонат кальция, бикарбонат натрия, цитрат кальция, декстрин, пектин, карбоксиметилцеллюлозу/кальций и т.п.; 4) в качестве смазывающего вещества -стеарат магния, тальк, полиэтиленгликоль, диоксид кремния, гидрогенированное растительное масло и т.п.; 5) любые красители, добавление которых является фармацевтически приемлемым, являются подходящими в качестве красителей; 6) в качестве ароматизирующего вещества - какао-порошок, ментол, ароматизатор, масло перечной мяты, порошок корицы; 7) антиоксиданты, добавление которых является фармацевтически приемлемым, такие как аскорбиновая кислота или альфа-тофенол.
[00119] RAD1901 или его сольваты (например, гидрат) или соли и одно или несколько вторых терапевтических средств (например, эверолимус) для применения в раскрытых в настоящей заявке способах можно приготовить в состав в фармацевтической композиции в виде любого одного или нескольких из активных соединений, описанных в настоящей заявке, и физиологически приемлемого носителя (также обозначаемый фармацевтически приемлемый носитель или раствор, или разбавитель). Такие носители и растворы включают фармацевтически приемлемые соли и сольваты соединений, используемые в способах согласно настоящему изобретению, и смеси, содержащие два или более таких соединений, фармацевтически приемлемые соли соединений и фармацевтически приемлемые сольваты соединений. Такие композиции получают в соответствии с приемлемыми фармацевтическими процедурами, описанными в руководстве Remington's Pharmaceutical Sciences, 18th edition, ed. Alfonso R. Gennaro, Mack Printing Company, Eaton, Pa. (1990), которое включено в настоящую заявку посредством ссылки.
[00120] Термин «фармацевтически приемлемый носитель» означает носитель, который не вызывает аллергической реакции или другого нежелательного эффекта в отношении пациентов, которым его вводят, и является совместимым с другими компонентами в составе. Фармацевтически приемлемые носители включают, например, фармацевтические разбавители, вспомогательные вещества или носители, соответствующим способом выбранные в соответствии с предполагаемой формой введения и с учетом общепринятых фармацевтических практик. Например, твердые носители/разбавители включают, но не ограничиваются ими, камедь, крахмал (например, кукурузный крахмал, прежелатинизированный крахмал), сахар (например, лактозу, маннитол, сахарозу, декстрозу), целлюлозное вещество (например, микрокристаллическую целлюлозу), акрилат (например, полиметилакрилат), карбонат кальция, оксид магния, тальк или смеси указанных веществ. Фармацевтически приемлемые носители могут также включать незначительные количества вспомогательных веществ, таких как смачивающие или эмульгирующие вещества, консерванты или буферы, которые увеличивают срок годности или эффективность терапевтического средства.
[00121] Одно или несколько вторых терапевтических средств (например, эверолимус) и RAD1901 или его сольваты (например, гидрат) или соли в свободной форме могут превращаться в соль общепринятыми способами. Термин «соль», используемый в настоящей заявке, не ограничен, при условии, что соль образована с RAD1901 или его сольватами (например, гидратом) или солями и является фармакологически приемлемой; предпочтительные примеры солей включают галоидоводородную соль (например, гидрохлорид, гидробромид, гидроиодид и т.п.), неорганическую кислую соль (например, сульфат, нитрат, перхлорат, фосфат, карбонат, бикарбонат и т.п.), органическую карбоксилатную соль (например, ацетатную соль, малатную соль, тартратную соль, фумаратную соль, цитратную соль и т.п.), органическую сульфонатную соль (например, метансульфонатную соль, этансульфонатную соль, бензолсульфонатную соль, толуенсульфонатную соль, камфорсульфонатную соль и т.п.), соль аминокислоты (например, аспартатную соль, глутаматную соль и т.п.), четвертичную аммониевую соль, соль щелочного металла (например, натриевую соль, калиевую соль и т.п.), соль щелочноземельного металла (магниевую соль, кальциевую соль и т.п.) и т.п. Помимо этого, гидрохлоридная соль, сульфатная соль, метансульфонатная соль, ацетатная соль и т.п.являются предпочтительными в качестве «фармакологически приемлемых солей» соединения согласно настоящему изобретению.
[00122] Изомеры RAD1901 или его сольватов (например, гидрата) или солей и/или второго терапевтического средства или средств (например, эверолимуса) (например, геометрические изомеры, оптические изомеры, ротамеры, таутомеры и т.п.), можно очистить с применением общеизвестных средств разделения, включая, например, перекристаллизацию, оптическое разрешение, такое как метод на основе диастереомерной соли, метод фракционирования ферментов, различные варианты хроматографии (например, тонкослойная хроматография, колоночная хроматография, хроматография на стекле и т.п.) с получением отдельного изомера. Термин «отдельный изомер» в настоящей заявке включает не только изомер, который характеризуется чистотой 100%, но также изомер, содержащий изомер, отличный от целевого, который существует даже после общепринятого процесса очистки. Иногда существует кристаллический полиморф RAD1901 или его сольватов (например, гидрата) или солей и/или второго терапевтического средства или средств (например, эверолимуса), и все кристаллические полиморфы указанного соединения включены в настоящее изобретение. Кристаллический полиморф иногда является отдельным, а иногда представляет собой смесь, и оба указанных варианта включены в настоящую заявку.
[00123] Согласно определенным вариантам реализации настоящего изобретения RAD1901 или его сольваты (например, гидрат) или соли и/или второе терапевтическое средство или средства (например, эверолимус) могут находиться в форме пролекарства; это означает, что данное соединение должно подвергнуться некоторому изменению (например, окислению или гидролизу) для достижения своей активной формы. В качестве альтернативы, RAD1901 или его сольваты (например, гидрат) или соли и/или второе терапевтическое средство или средства (например, эверолимус) может представлять собой соединение, полученное посредством преобразования родительского пролекарства в его активную форму.
(4) Способ введения
[00124] Способы введения RAD1901 или его сольватов (например, гидрата) или солей и/или второго терапевтического средства или средств (например, эверолимуса) включают, но не ограничиваются ими, местное введение, пероральное введение, внутрикожное введение, внутримышечное введение, интраперитонеальное введение, внутривенное введение, внутрипузырную инфузию, подкожное введение, трансдермальное введение и чресслизистое введение.
(5) Профилирование генов
[00125] Согласно определенным вариантам реализации настоящего изобретения способы ингибирования роста опухоли или регрессии опухоли, представленные в настоящей заявке, также включают профилирование гена субъекта, причем ген, профиль которого получают, представляет собой один или несколько генов, которые выбраны из группы, состоящей из ABL1, AKT1, AKT2, ALK, АРС, AR, ARID1A, ASXL1, ATM, AURKA, ВАР, ВАР1, BCL2L11, BCR, BRAF, BRCA1, BRCA2, CCND1, CCND2, CCND3, CCNE1, CDH1, CDK4, CDK6, CDK8, CDKN1A, CDKN1B, CDKN2A, CDKN2B, СЕВРА, CTNNB1, DDR2, DNMT3A, E2F3, EGFR, EML4, ЕРНВ2, ERBB2, ERBB3, ESR1, EWSR1, FBXW7, FGF4, FGFR1, FGFR2, FGFR3, FLT3, FRS2, HIF1A, HRAS, IDH1, IDH2, IGF1R, JAK2, KDM6A, KDR, KIF5B, KIT, KRAS, LRP1B, MAP2K1, MAP2K4, MCL1, MDM2, MDM4, MET, MGMT, MLL, MPL, MSH6, MTOR, MYC, NF1, NF2, NKX2-1, NOTCH1, NPM, NRAS, PDGFRA, PIK3CA, PIK3R1, PML, PTEN, PTPRD, RARA, RBI, RET, RICTOR, ROS1, RPTOR, RUNX1, SMAD4, SMARCA4, SOX2, STK11, TET2, TP53, TSC1, TSC2 и VHL.
[00126] Согласно некоторым вариантам реализации настоящего изобретения второе средство представляет собой эверолимус, и у субъектов присутствуют соматические мутации в TSC1.
[00127] Согласно некоторым вариантам реализации в настоящем изобретении предложен способ лечения субпопуляции пациентов, страдающих от рака молочной железы, причем указанная субпопуляция характеризуется увеличенной экспрессией одного или нескольких из следующих генов, и лечение указанной субпопуляции эффективной дозой комбинации RAD1901 или его сольватов (например, гидрата) или солей и одного или нескольких вторых терапевтических средств (например, эверолимуса), описанных в настоящей заявке, согласно вариантам реализации введения доз, описанным в настоящем изобретении. (6) Корректировка дозы
[00128] Помимо установления способности RAD1901 ингибировать рост опухоли результаты, представленные в настоящей заявке, продемонстрировали, что RAD1901 ингибирует связывание эстрадиола с ER в матке и гипофизе (пример III(A)). В данных экспериментах связывание эстрадиола с ER в ткани матки и гипофиза оценивали посредством визуализации ФЭС-ПЭТ. После лечения RAD1901 наблюдаемый уровень связывания ER находился на фоновых уровнях или ниже фоновых уровней. Данные результаты позволили установить, что антагонистический эффект RAD1901 в отношении активности ER можно оценивать с применением сканирования в реальном времени. На основании данных результатов в настоящей заявке представлены способы мониторинга эффективности лечения RAD1901 или сольватами (например, гидратом) или солями указанного соединения в комбинированной терапии, раскрытой в настоящей заявке, посредством измерения связывания эстрадиола с ER в одной или нескольких тканях-мишенях, причем уменьшение или исчезновение связывания означает эффективность.
[00129] Также предложены способы корректировки дозы RAD1901 или его сольватов (например, гидрата) или солей в комбинированной терапии, раскрытой в настоящей заявке, на основании связывания эстрадиола с ER. Согласно определенным вариантам реализации данных способов связывание измеряют в определенной точке после одного или нескольких введений первой дозы соединения. Если воздействие на связывание эстрадиола с ER отсутствует или демонстрирует уменьшение ниже заранее определенного порога (например, уменьшение связывания по сравнению с исходным уровнем составляет менее 5%, менее 10%, менее 20%, менее 30% или менее 50%), первую дозу считают слишком низкой. Согласно определенным вариантам реализации настоящего изобретения данные способы включают дополнительный этап введения увеличенной второй дозы соединения. Данные этапы можно повторить с дозой, которую периодически увеличивают до достижения желаемого уменьшения связывания эстрадиола с ER. Согласно определенным вариантам реализации настоящего изобретения данные этапы можно включить в способы ингибирования роста опухоли, представленные в настоящей заявке. В данных способах связывание эстрадиола с ER может выступать в качестве посредника для ингибирования роста опухоли или в качестве дополнительного средства оценки ингибирования роста. Согласно другим вариантам реализации настоящего изобретения данные способы можно использовать в сочетании с введением RAD1901 или его сольватов (например, гидрата) или солей для целей, отличных от ингибирования роста опухоли, включая, например, ингибирование пролиферации раковых клеток.
[00130] Согласно определенным вариантам реализации настоящего изобретения в настоящей заявке представлены способы корректировки дозы RAD1901 или его сольватов (например, гидрата) или солей в комбинированной терапии, причем указанный способ включает:
(1) введение первой дозы RAD1901 или его сольватов (например, гидрата) или солей (например, от приблизительно 350 до приблизительно 500 мг/день) в течение 3, 4, 5, 6 или 7 дней;
(2) обнаружение активности связывания эстрадиола с ER, например, с применением визуализации ФЭС-ПЭТ, как раскрыто в настоящей заявке; причем:
(i) если активность связывания ER является необнаруживаемой или находится ниже уровня заранее определенного порога, продолжение введения первой дозы (т.е. сохранение уровня дозы); или
(ii) если активность связывания ER является обнаруживаемой или находится выше уровня заранее определенного порога, введение второй дозы, которая является большей, чем первая доза (например, первая доза плюс от приблизительно 50 до приблизительно 200 мг) в течение 3, 4, 5, 6 или 7 дней, затем переход к этапу (3);
(3) обнаружение активности связывания эстрадиола с ER, например, с применением визуализации ФЭС-ПЭТ, как раскрыто в настоящей заявке; причем
(i) если активность связывания ER является необнаруживаемой или находится ниже уровня заранее определенного порога, продолжение введения второй дозы (т.е. сохранение уровня дозы); или
(ii) если активность связывания ER является обнаруживаемой или находится выше уровня заранее определенного порога, введение третьей дозы, которая является большей, чем вторая доза (например, второй дозы плюс от приблизительно 50 до приблизительно 200 мг) в течение 3, 4, 5, 6 или 7 дней, затем переход к этапу (4);
(4) повторение вышеуказанных этапов с использованием четвертой дозы, пятой дозы и т.д. до тех пор, пока не будет обнаруживаться какая-либо активность связывания ER.
[00131] Согласно определенным вариантам реализации настоящее изобретение включает применение визуализации ПЭТ для обнаружения и/или лечения дозами вариантов рака, чувствительных к ER или устойчивых к ER.
(7) Комбинации для способов, раскрытых в настоящем изобретении
[00132] Согласно другому аспекту настоящее изобретение относится к фармацевтической композиции, содержащей один или несколько RAD1901 или его сольватов (например, гидрата) или солей и/или второе терапевтическое средство или средства (например, эверолимус), раскрытые в настоящей заявке, в терапевтически эффективном количестве, как раскрыто в настоящей заявке, для комбинированных способов, изложенных в настоящей заявке.
Взаимодействия RAD1901-ERα
(1) Мутантный ERα в ER-положительных образцах опухоли молочной железы от пациентов, которые получали по меньшей мере одну линию эндокринного лечения
[00133] В пяти исследованиях, о которых сообщалось в последние два года, секвенировали в совокупности 187 метастазирующих ER-положительных образцов опухоли молочной железы от пациентов, которые получали по меньшей мере одну линию эндокринного лечения, и у 39 пациентов (21%) были обнаружены мутации ЛСД ER (Jeselsohn). Шесть наиболее частых мутаций ЛСД среди 39 пациентов показаны на схеме 1 по материалам публикации Jeselsohn.
Схема 1. Расположение иллюстративных мутаций ERα и их частота
[00134] Частота всех мутаций ЛСД обобщена в таблице 9.
[00135] Компьютерное моделирование продемонстрировало, что взаимодействия RAD1901-ERα, вероятно, не нарушаются у мутантов ЛСД ERα, например, у мутанта Y537X, где X представлял собой S, N или С; D538G; и S463P, на который приходится приблизительно 81,7% мутаций ЛСД, обнаруженных в недавнем исследовании метастазирующих ER-положительных образцов опухоли молочной железы от пациентов, которые получали по меньшей мере одну линию эндокринного лечения (таблица 10, пример V).
[00136] В настоящей заявке представлены комплексы и кристаллы RAD1901, присоединенного к ERα и/или мутантному ERα, причем мутантный ERα содержит одну или несколько мутаций, включая, но не ограничиваясь указанными, Y537X1, где X1 представляет собой S, N или С, D538G, L536X2, где Х2 представляет собой R или Q, Р535Н, V534E, S463P, V392I, E380Q, и их комбинации.
[00137] Согласно определенным вариантам реализации способов, представленных в настоящей заявке, ЛСД ERα и мутантный ERα содержит AF-2. Согласно другим вариантам реализации настоящего изобретения ЛСД содержит аминокислоты 299-554 ERα или состоит или состоит по существу из указанных аминокислот. Согласно определенным вариантам реализации настоящего изобретения ЛСД мутантного ERα содержит одну или несколько мутаций, включая, но не ограничиваясь указанными, Y537X1, где X1 представляет собой S, N или С, D538G, L536X2, где Х2 представляет собой R или Q, Р535Н, V534E, S463P, V392I, E380Q, и комбинации указанных вариантов. Термин «и/или» в настоящей заявке включает как случай «и», так и случай «или».
[00138] Согласно определенным вариантам реализации настоящего изобретения в настоящей заявке представлены способы лечения состояния, связанного с активностью или экспрессией ERα и/или мутантного ERα у субъекта, который нуждается в таком лечении, причем указанные способы включают введение субъекту комбинации одного или нескольких вторых терапевтических средств (например, эверолимуса) и одного или нескольких соединений, способных к связыванию с ERα и/или мутантным ERα посредством ЛСД. Согласно определенным вариантам реализации настоящего изобретения субъект представляет собой млекопитающее, и согласно определенным из данных вариантов реализации указанный субъект представляет собой человека. Согласно определенным вариантам реализации настоящего изобретения состояние представляет собой опухоль и/или рак, включая, но не ограничиваясь ими, ER положительную опухоль и/или рак, как описано в настоящей заявке.
[00139] Согласно определенным вариантам реализации соединений и способов, представленных в настоящей заявке, ЛСД ERα и мутантного ERα содержит AF-2. Согласно другим вариантам реализации настоящего изобретения ЛСД содержит аминокислоты 299-554 ERα или состоит или состоит по существу из указанных аминокислот. Согласно определенным вариантам реализации настоящего изобретения ЛСД мутантного ERα содержит одну или несколько мутаций, включая, но не ограничиваясь ими, Y537X1, где X1 представляет собой S, N или С, D538G, L536X2, где Х2 представляет собой R или Q, Р535Н, V534E, S463P, V392I, E380Q, и их комбинации.
[00140] Согласно определенным вариантам реализации соединений и способов, представленных в настоящей заявке, соединение, способное к связыванию с ERα и/или мутантным ERα посредством ЛСД, представляет собой селективный супрессор рецептора эстрогенов (ССРЭ) или селективный модулятор рецептора эстрогенов (СМРЭ). Согласно определенным вариантам реализации настоящего изобретения соединение, способное к связыванию с ERα и/или мутантным ERα посредством ЛСД, осуществляет данное связывание посредством одного или нескольких взаимодействий, которые выбраны из группы, состоящей из взаимодействий водородной связи с остатками Е353, D351, R349 и/или L536 и пи-взаимодействий с остатком F404 ERα и/или мутантного ERα. Примером такого соединения является RAD1901.
[00141] Согласно определенным вариантам реализации настоящего изобретения в настоящей заявке представлены способы лечения состояния, связанного с активностью или экспрессией мутантного ERα, содержащего одну или несколько мутаций, включая, но не ограничиваясь указанными, Y537X1, где X1 представляет собой S, N или С, D538G, L536X2, где Х2 представляет собой R или Q, Р535Н, V534E, S463P, V392I, E380Q и их комбинаций, причем указанный способ включает введение субъекту комбинации одного или нескольких вторых терапевтических средств (например, эверолимуса) и одного или нескольких соединений, способных к связыванию с ERα посредством ЛСД. Согласно определенным вариантам реализации настоящего изобретения состояние представляет собой рак, включая, но не ограничиваясь ими, ER положительный рак, рак молочной железы, ER положительный рак молочной железы и метастазирующий рак молочной железы, и согласно определенным вариантам реализации настоящего изобретения соединение представляет собой RAD1901 или его фармацевтически приемлемый сольват (например, гидрат) или фармацевтически приемлемую соль.
[00142] Следующие примеры приведены для лучшей иллюстрации заявленного изобретения, и их не следует истолковывать как ограничивающие объем настоящего изобретения. В тех случаях, когда упоминаются конкретные материалы, данные упоминания приведены исключительно для целей иллюстрации и не предназначены для ограничения настоящего изобретения. Специалист в данной области техники может разработать эквивалентные способы или реактивы без приложения изобретательских усилий и не выходя за пределы объема настоящего изобретения. Следует понимать, что в процедуры, описанные в настоящей заявке, могут быть внесены многочисленные вариации без отклонения от объема настоящего изобретения. Авторы настоящего изобретения считают, что такие вариации включены в объем настоящего изобретения.
Примеры
Материалы и методы
Исследуемые соединения
[00143] RAD1901, использованный в примерах ниже, представляет собой дигидрохлорид (6R)-6-(2-(N-(4-(2-(этиламино)этил)бензил)-N-этиламино)-4-метоксифенил)-5,6,7,8-тетрагидронафтален-2-ола, произведенный компанией IRIX Pharmaceuticals, Inc. (Флоренция, Южная Каролина). RAD1901 хранили в виде сухого порошка, приготовленного в состав для применения в виде гомогенной суспензии в 0,5% (масс/об.) метилцеллюлозы в деионизированной воде, и в случае моделей на животных вводили через желудочный зонд. Тамоксифен, ралоксифен и эстрадиол (Е2) получали в компании Sigma-Aldrich (Сент-Луис, Миссури), и вводили посредством подкожной инъекции. Фулвестрант получали в компании Tocris Biosciences (Миннеаполис, Миннесота) и вводили посредством подкожной инъекции. Другие лабораторные реактивы заказывали в компании Sigma-Aldrich, если не указано обратное.
Линии клеток
[00144] Клетки MCF-7 (метастазирующей аденокарциномы молочной железы человека) заказывали в Американской коллекции типовых клеточных культур (Роквилл, Мэриленд) и общепринятым способом поддерживали в не содержащей феноловый красный минимальной питательной среде (minimal essential medium, MEM), содержащей 2 мМ L-глутамина и ССР (сбалансированный солевой раствор) Эрла, 0,1 мМ заменимых аминокислот и 1 мМ пирувата натрия с добавлением 0,01 мг/мл инсулина быка и 10% эмбриональной телячьей сыворотки (Invitrogen, Карлсбад, Калифорния) при содержании СО2 5%.
[00145] Клетки T47D культивировали в СО2-инкубаторе при содержании СО2 5% в чашках размером 10 см до конфлюэнтности, составляющей приблизительно 75%, в среде роста RPMI с добавлением 10% ЭТС (эмбриональной телячьей сыворотки) и 5 мкг/мл инсулина человека.
Ксенотрансплантатные модели in vivo
[00146] Всех мышей содержали в стерильных условиях в индивидуально вентилируемых клетках со стерилизованным и не содержащим пыли наполнителем, с доступом к стерилизованной пище и воде без ограничения, при цикле темноты/света (циркадный цикл искусственного света 12-14 часов) и при контролируемой комнатной температуре и влажности. Опухоли измеряли два раза в неделю с помощью штангенциркуля с нониусом, и объемы рассчитывали с применением формулы: (L*W2)*0,52.
PDx модели
[00147] Некоторые примеры полученных от пациентов ксенотрансплантатных моделей (PDx моделей) показаны на фиг. 1. PDx модели с полученной от пациента опухолью рака молочной железы устанавливали из жизнеспособной ткани опухоли человека или жидкости, которую перевивали сериями в животных (бестимусные мыши (Nu (NCF)-Foxn 1 nu)) ограниченное количество раз для поддержания гетерогенности опухоли. Перед проведением исследования регистрировали объемы опухолей для каждого эксперимента, начиная приблизительно за одну неделю до предполагаемой даты начала. Когда опухоли достигали соответствующего диапазона исходного объема опухоли (ИОО) (150-250 мм3), животных рандомизировали на группы лечения и контроля и начинали введение доз (день 0,8-10 субъектов в каждой группе); животных во всех исследованиях отслеживали индивидуально в течение всего эксперимента. Изначальное введение доз начинали в день 0; животным во всех группах вводили дозы по массе (0,01 мл на грамм; 10 мл/кг). Каждая группа получала лечение наполнителем (контроль, п.о./о.р.д. до конечного критерия оценки), тамоксифеном (1 мг/субъекта, п.к./о.р.д.д. (один раз в два дня) до конечного критерия оценки), фулвестрантом (Фаслодекс®; 1 мг/субъекта или 3 мг/субъекта при необходимости, п.к./еженедельно. X 5 и увеличивали при необходимости) или RAD1901 (30, 60 или 120 мг/кг субъекта, п.о./о.р.д. до конечного критерия оценки), как указано, с дня 0. Период лечения длился в течение 56-60 дней в зависимости от моделей. В питьевую воду для данных PDx моделей добавляли 17β-эстрадиол. Эффективность средства
[00148] Для всех исследований, начиная с дня 0, размеры опухоли измеряли цифровым штангенциркулем, и данные, включая отдельные и средние расчетные объемы опухолей (средний ОО (объем опухоли) ± СОС, стандартная ошибка среднего), записывали для каждой группы; объем опухоли рассчитывали с применением формулы из публикации (Yasui et al. Invasion Metastasis 17:259-269 (1997)), которая включена в настоящую заявку посредством ссылки): ОО = ширина2 x длина x 0,52. Анализ каждой группы или исследование прекращали, когда расчетный средний объем опухоли группы достигал конечной точки объема опухоли (ОО) (конечная точка времени составляла 60 дней; и конечная точка объема составляла среднее значение для группы, составляющее 2 см3); отдельных мышей, объем опухоли которых достигал 2 см3 или более, исключали из исследования, а итоговое измерение включали в среднее значение для группы до тех пор, пока среднее значение не достигало конечной точки объема, или исследование не достигало конечной точки времени.
Расчеты эффективности и статистический анализ
[00149] Значения % ингибирования роста опухоли (%ИРО) рассчитывали в одной временной точке (когда контрольная группа достигала конечной точки объема опухоли или конечной точки времени) и приводили для каждой группы лечения (Т) по сравнению с контролем (С) с применением исходных (i) и конечных (f) измерений опухоли по формуле (In vivo methods for screening and preclinical testing. In: Teicher B, ed., Anticancer Drug Development Guide. Totowa, NJ: Humana. 2004:99-123): %ИРО=1- Tf-Ti / Cf-Ci.
Статистический анализ
[00150] Исследования ИРО - однофакторный дисперсионный анализ ANOVA + критерий множественного сравнения Даннета (Corbett ТН et al).
Отбор образца
[00151] Опухоли отбирали в конечной точке. Один фрагмент быстро замораживали, тогда как другой фрагмент помещали в 10% ФЗН (формалин забуференный нейтральный) по меньшей мере на 24 часа и фиксировали формалином и заливали парафином (ФФЗП). Быстро замороженные образцы хранили при температуре -80°С; блоки ФФЗП хранили при комнатной температуре.
Вестернблоттинг
[00152] Клетки собирали, и экспрессию белка анализировали с применением стандартной методики. Опухоли собирали в указанные временные точки после последнего дня введения дозы, гомогенизировали в буфере RIPA с ингибиторами протеазы и фосфатазы с применением гомогенизатора Tissuelyser (Qiagen). Равные объемы белка разделяли в зависимости от молекулярной массы, переносили на нитроцеллюлозные мембраны и получали отпечаток промоканием со следующими антителами с применением стандартной методики:
Рецептор эстрогенов (Santa Cruz (НС-20); sc-543)
Рецептор прогестеронов (Cell Signaling Technologies; 3153)
Винкулин (Sigma-Aldrich, v9131)
[00153] Анализы методом кПЦР (количественной полимеразной цепной реакции) проводили следующим образом: клетки собирали, экстрагировали мРНК, и равные объемы использовали для синтеза кДНК и кПЦР с праймерами, специфичными для рецептора прогестеронов, GREB1 и TFF1 (LifeTech). Полосы количественно определяли с применением программного обеспечения ID Quant (GE).
Иммуногистохимия
[00154] Опухоли собирали, фиксировали формалином, заливали парафином. Залитые опухоли разрезали (6 мкМ) и окрашивали антителами, специфичными в отношении ER, PR и Her2. Количественное определение проводили следующим образом: пять полей подсчитывали в отношении положительных клеток (0-100%) и интенсивности окрашивания (0-3+). Показатели по Н-шкале (0-300) рассчитывали с применением следующей формулы: % положительности * интенсивность.
[00155] Пример I. Комбинации КАБ1901-эверолимус обеспечивали усиленное ингибирование роста опухоли в опухоли и/или раке, которые экспрессировали ER ДТ или мутантный ER (например, Y537S), при различной предшествующей эндокринной терапии.
[00156] 1(A). Эффективность RAD1901 на ксенотрансплантатных моделях на животных
[00157] I(A)(i) RAD1901 ингибировал рост опухоли на PDx моделях (от PDx-1 до PDx-12) вне зависимости от ER статуса и предшествующей эндокринной терапии
[00158] Фиг. 1 демонстрирует эффекты ингибирования роста опухоли на различных PDx моделях для мышей, получавших лечение RAD1901 в монотерапии. Проводили скрининг двенадцати полученных от пациентов ксенотрансплантатных моделей для исследования ответа на RAD1901 при множестве генетических фонов с варьирующими уровнями ER, PR и Her2. Полное исследование эффективности проводили для PDx моделей, помеченных «*» (от PDx-1 до PDx-4 и PDx-12), с n=8-10. Скрининговое исследование проводили для других PDx моделей (от PDx-5 до PDx-11), с n=3. PDx модели получали лечение наполнителем (отрицательный контроль) или RAD1901 в дозе 60 мг/кг в течение 60 дней п.о., о.р.д.. Как продемонстрировано на фиг. 1, PDx модели, в которых рост запускался ER и дополнительным движущим механизмом (например, PR+ и/или Her2+), получали пользу от вариантов лечения RAD1901. RAD1901 являлся эффективным при ингибировании роста опухоли на моделях с мутациями ER и/или с высоким уровнем экспрессии Her2 (PDx) вне зависимости от предшествующего лечения: для не получавших лечения (не получавшие рецептурных ЛП, лекарственных препаратов) или получавших лечение ингибитором ароматазы, тамоксифеном (там), химиотерапией (химио), ингибиторами Her2 (Her2 и, например, трастузумабом, лапатинибом), бевацизумабом, фулвестрантом и/или ритуксимабом.
[00159] I(A)(ii) Комбинация RAD1901-эверолимус запускает большую регрессию, чем RAD1901 в монотерапии, на ксенотрансплантатных моделях, экспрессирующих ER ДТ
[00160] I(A)(ii)(1) RAD1901-эверолимус запускает большую регрессию, чем RAD1901 в монотерапии, на ксенотрансплантатах MCF-7, которые являлись восприимчивыми к вариантам лечения фулвестрантом. Ксенотрансплантатная модель MCF-7
[00161] За два дня до имплантации клеток мышам Balb/C-Nude инокулировали гранулы 17β-эстрадиола 0,18/высвобождение в течение 90 дней. Собирали клетки MCF-7 (PR+, Her2-), и 1×107 клеток имплантировали подкожно в правый бок мышей Balb/C-Nude. Когда средний размер опухоли достигал 200 мм3, мышей рандомизировали на группы лечения в зависимости от объема опухоли, и проводили лечение исследуемыми соединениями. Каждая группа получала лечение наполнителем (контроль, п.о., о.р.д., до конечного критерия оценки), фулвестрантом (Фаслодекс®; 3 мг/субъекта, п.к., о.р.н., X 5 и продолжали в случае необходимости), RAD1901 (30 мг/кг или 60 мг/кг субъекта, п.о., о.р.д., до конечного критерия оценки), эверолимусом (2,5 мг/кг п.о., до конечного критерия оценки) или комбинацией RAD1901-эверолимус в дозах, как указано с дня 0. Период лечения длился в течение 28 дней.
[00162] Проводили лечение ксенотрансплантатных мышей MCF-7 наполнителем (отрицательный контроль), RAD1901 (60 мг/кг, п.о., ежедневно), эверолимусом (2,5 мг/кг, п.о.), комбинацией RAD1901 (30 или 60 мг/кг, п.о., ежедневно) и эверолимуса (2,5 мг/кг, п.о.), фулвестрантом (3 мг/дозу, п.к., еженедельно) или комбинацией фулвестранта (3 мг/дозу, п.к., еженедельно) и эверолимуса (2,5 мг/кг, п.о.). Размер опухоли измеряли в различные временные точки в течение 27 дней.
[00163] Результаты представлены на фиг. 2А-2В. Лечение комбинацией RAD1901 (60 мг/кг) и эверолимуса (2,5 мг/кг) вновь привело к значительной регрессии опухоли, с результатами, превосходящими лечение RAD1901, эверолимусом или фулвестрантом в монотерапии, или комбинацией фулвестранта и эверолимуса (фиг. 2В).
[00164] Фиг. 2С демонстрирует, что комбинации RAD1901-эверолимус с RAD1901 в дозе 30 мг/кг или 60 мг/кг обеспечивали аналогичные эффекты, несмотря на то, что RAD1901 в монотерапии в дозе 30 мг/кг являлся не настолько эффективным, как RAD1901 в монотерапии в дозе 60 мг/кг, в отношении ингибирования роста опухоли. Указанные результаты свидетельствуют о том, что комбинации RAD1901-эверолимус с меньшей дозой RAD1901 (например, 30 мг/кг) было достаточно для увеличения до максимума эффектов в отношении ингибирования роста опухоли/регрессии опухоли на указанных ксенотрансплантатных моделях.
[00165] Лечение комбинацией RAD1901 и эверолимуса также являлось более эффективным в отношении уменьшения экспрессии ER и PR in vivo на ксенотрансплантатных моделях MCF-7, чем лечение RAD1901, эверолимусом или фулвестрантом в монотерапии или лечение комбинацией фулвестранта и эверолимуса (фиг. 11); опухоли собирали через два часа после последнего введения дозы).
[00166] I(A)(ii)(2) RAD1901-эверолимус запускали большую регрессию, чем RAD1901 в монотерапии, на PDx-11 и PDx-2 моделях, которые являлись восприимчивыми к вариантам лечения фулвестрантом.
[00167] PDx модели с ER ДТ PDx-2 (PR+, Her2+, не получавшие лечения) и PDx-11 (PR+, Her2+, получавшие лечение ИА, фулвестрантом и химио) продемонстрировали различные чувствительности к фулвестранту (3 мг/дозу, о.р.н., п.к.). PDx-2 и PDx-11 модели получали лечение комбинацией RAD1901 (60 мг/кг, о.р.д., п.о.) и эверолимуса (2,5 мг/кг, п.о.), RAD1901 в монотерапии (60 мг/кг, о.р.д., п.о.), эверолимусом в монотерапии (2,5 мг/кг, п.о.) или фулвестрантом в монотерапии (3 мг/дозу, о.р.н., п.к.).
[00168] На PDx-11 моделях введение фулвестранта или эверолимуса в монотерапии в значительной степени ингибировало рост опухоли, причем у мышей, получавших лечение фулвестрантом, наблюдались лучшие эффекты в отношении ингибирования роста опухоли. Лечение фулвестрантом продемонстрировало незначительную регрессию опухоли (фиг. 3В). Неожиданно было установлено, что введение RAD1901 в монотерапии или в комбинации с эверолимусом привело к значительной регрессии опухоли, причем комбинация обеспечила еще более значительные эффекты в отношении регрессии опухоли на PDx моделях с ESR1 дикого типа (фиг. 3В)).
[00169] На PDx-2 моделях пероральное введение RAD1901 в монотерапии обеспечило лучшие эффекты ингибирования роста опухоли по сравнению с инъекцией фулвестранта в монотерапии (фиг. 4А). Более того, введение RAD1901 или эверолимуса в монотерапии в значительной степени ингибировало рост опухоли. Неожиданно было установлено, что введение RAD1901 в комбинации с эверолимусом привело к еще более усиленному эффекту в отношении ингибирования роста опухоли (фиг. 4В)).
[00170] Более того, на PDx-4 модели, которая являлась восприимчивой к лечению фулвестрантом (1 мг/дозу, п.к., о.р.н.), RAD1901-опосредованное ингибирование роста опухоли поддерживалось при отсутствии лечения по меньшей мере в течение двух месяцев после окончания периода лечения RAD1901 (30 мг/кг, п.о., о.р.д.), в то время как лечение эстрадиолом продолжали (фиг. 5).
[00171] Таким образом, комбинация одного или нескольких вторых терапевтических средств с RAD1901, вероятно, приносит пользу пациенту при ингибировании роста опухоли после окончания лечения, в особенности, когда одно или несколько вторых терапевтических средств (например, эверолимус) необходимо снижать или отсрочивать в связи с нежелательными реакциями https://www.fda.gov/Drugs/InformationOnDrugs/ApprovedDrugs/ucm488028.htrn..
[00172] I(A)(iii) RAD1901-эверолимус запускает большую регрессию, чем RAD1901 в монотерапии, на ксенотрансплантатных моделях, экспрессирующих мутантный ER (ERα Y537S)
[00173] I(A)(iii)(1) RAD1901-эверолимус запускает большую регрессию, чем RAD1901 в монотерапии, на моделях PDx-5, которые являлись слабо восприимчивыми к вариантам лечения фулвестрантом.
[00174] PDx-5 модели получали согласно аналогичному протоколу, как описано выше для PDx моделей. Размеры опухоли каждой группы введения доз измеряли два раза в неделю с помощью штангенциркуля с нониусом, и объемы рассчитывали с применением формулы (L*W2)*0,52.
[00175] Ингибирование роста опухоли RAD1901 (60 мг/кг, о.р.д., п.о.), эверолимусом (2,5 мг/кг, п.о.) и RAD1901 (60 мг/кг, о.р.д., п.о.) в комбинации с эверолимусом (2,5 мг/кг, п.о.) на PDx-5 моделях (PDx модели с полученной от пациента опухолью рака молочной железы, содержащей мутацию рецептора эстрогенов Y537S, PR+, Her2+, предшествующее лечение ингибитором ароматазы) оценивали с применением способа, описанного в настоящей заявке. В случае опухолей, экспрессирующих определенные мутации ERα (например, Y537S), комбинированное лечение RAD1901 и эверолимусом являлось более эффективным в отношении ингибирования роста опухоли, чем лечение каждым средством в монотерапии (фиг. 6В)). Данные PDx модели являлись слабо восприимчивыми к фулвестранту (3 мг/дозу). Комбинированное лечение RAD1901 и эверолимусом являлось более эффективным, чем лечение каждым средством в монотерапии, в отношении ингибирования роста опухоли на PDx-5 моделях (фиг. 6В).
[00176] Таким образом, результаты продемонстрировали, что RAD1901 являлся эффективной эндокринной основой, которая потенцировала ингибирование роста опухоли средствами направленного действия. Более того, RAD1901 продемонстрировал мощную противоопухолевую активность на PDx моделях, полученных от пациентов, которые проходили множество предшествующих вариантов эндокринной терапии, включая таковых, которые являлись нечувствительными к фулвестранту.
[00177] I(A)(iv) Оценка фармакокинетики вариантов лечения фулвестрантом в отношении мышей, не несущих опухоль.
[00178] Мышам вводили различные дозы фулвестранта; наблюдалась значительная экспозиция дозы в отношении субъектов (фиг. 7).
[00179] Фулвестрант вводили бестимусным мышам в количестве 1,3 или 5 мг/дозу подкожно в день 1 (Д1 рецептурных ЛП) и день 8 (Д8 рецептурных ЛП, n=4/уровень дозы). Кровь собирали в указанные временные точки в течение 168 часов после введения второй дозы, центрифугировали, и плазму анализировали методом жидкостной хроматографии - масс-спектрометрии.
[00180] 1(B) RAD1901 стимулировал выживаемость на ксенотрансплантатной модели метастазов головного мозга на мышах (внутричерепные модели MCF-7).
[00181] Затем потенциальную способность RAD1901 пересекать гематоэнцефалический барьер и ингибировать рост опухоли оценивали с применением ксенотрансплантатной модели внутричерепной опухоли MCF-7.
[00182] Самок бестимусных голых мышей (Crl:NU(NCr)-Foxn1nu) использовали для исследований ксенотрансплантатов опухоли. За три дня до имплантации опухолевых клеток всем исследованным животным подкожно между лопатками имплантировали гранулы эстрогена (0,36 мг Е2, высвобождение в течение 60 дней, Innovative Research of America, Сарасота, Флорида) с применением стерилизованного троакара. Клетки аденокарциномы молочной железы человека MCF-7 культивировали до середины фазы логарифмического роста в среде RPMI-1640, содержащей 10% эмбриональную телячью сыворотку, 100 единиц/мл пенициллина G, 100 мкг/мл стрептомицина сульфата, 2 мМ глутамина, 10 мМ HEPES, 0,075% бикарбоната натрия и 25 г/мл гентамицина. В день имплантации опухолевых клеток клетки трипсинизировали, осаждали центрифугированием и ресуспендировали в фосфатно-буферном солевом растворе при концентрации 5×107 клеток/мл. Каждая исследуемая мышь получала 1×106 клеток MCF-7, которые имплантировали внутричерепным способом.
[00183] Через пять дней после имплантации опухолевых клеток (обозначен как день 1 исследования) мышей рандомизировали на три группы по 12 животных в каждой, и проводили лечение наполнителем, фулвестрантом (0,5 мг/животное, ежедневно) или RAD1901 (120 мг/кг, ежедневно), как описано выше.
[00184] Конечная точка была определена как смертность или 3Х выживаемость контрольной группы в зависимости от того, какое событие наступит первым. Переносимость лечения оценивали посредством измерений массы тела и частых наблюдений клинических признаков нежелательных эффектов, вызванных лечением. Животным со снижением массы тела, превосходящим 30% для одного измерения, или превосходящим 25% для трех измерений, из соображений гуманности проводили эвтаназию, и данное событие классифицировали как смерть, связанную с лечением. Приемлемую токсичность определяли как среднее снижение массы тела в группе, составляющее менее 20% в течение исследования, и не более одной смерти, связанной с лечением, на десять животных, получивших лечение, или 10%. В конце исследования животным проводили эвтаназию посредством итоговой пункции сердца с анестезией изофлураном. Концентрацию RAD1901 и фулвестранта в плазме и опухоли определяли с применением ЖХ-МС/МС (жидкостной хроматографии - масс-спектрометрии).
[00185] Анализ выживаемости Каплан-Мейер продемонстрировал, что RAD1901 значительно увеличивал выживаемость по сравнению с фулвестрантом (Р<0,0001; фиг. 8). Ни одно из животных в контрольной группе или группе фулвестранта не выжило к дню 20 и дню 34, соответственно, тогда как 41% (5/12) животных, получавших лечение RAD1901, выжили до конца исследования в день 54.
[00186] Концентрация RAD1901 в плазме составила 738±471 нг/мл, а во внутричерепной опухоли составила 462±105 нг/г, что подтверждает гипотезу, согласно которой RAD1901 способен эффективно пересекать гематоэнцефалический барьер. Напротив, концентрации фулвестранта являлись по существу более низкими в плазме (21±10 нг/мл) и во внутричерепной опухоли (8,3±0,8 нг/г).
[00187] I(C). Исследование 1 фазы лечения RAD1901 ER+ запущенного рака молочной железы.
[00188] В исследовании 1 фазы оценивали безопасность, переносимость и фармакокинетику на 44 здоровых женщинах в постменопаузальном периоде. Дозолимитирующая токсичность не наблюдалась, максимально переносимая доза (МПД) не была установлена. Экспозиция в плазме увеличивалась более чем пропорционально дозе в исследованном диапазоне доз.
Субъекты
[00189] 8 женщин в постменопаузальном периоде с запущенной аденокарциномой молочной железы (ER+ опухоль с не менее 1% окрашиванием ИГХ, HER2-отрицательная опухоль с общим состоянием по шкале ECOG (Eastern Cooperative Oncology Group, восточная объединенная группа онкологов) 0 или 1) включали в качестве субъектов в данное исследование 1 фазы. Субъекты должны были получать следующие предшествующие варианты лечения:
не более 2 предшествующих режимов химиотерапии в условиях запущенного/метастазирующего заболевания
6 месяцев предшествующей эндокринной терапии и прогрессирование, наблюдавшееся при предшествующей эндокринной терапии
Исключали субъектов с нелечеными или симптоматическими метастазами в ЦНС (центральной нервной системе) или с предшествующим противораковым лечением в пределах следующих окон:
Тамоксифен < 14 дней до первой дозы исследуемого лечения
Фулвестрант < 90 дней до первой дозы исследуемого лечения
Химиотерапия < 28 дней до первой дозы исследуемого лечения
Аналог РФЛГ (релизинг-фактора лютеинизирующего гормона) < 12 месяцев до первой дозы исследуемого лечения
Критерии ДЛТ
Любая степень негематологической токсичности не менее 3 (исключая алопецию и тошноту, рвоту или диарею, которые не подвергали лечению оптимальным лекарственным препаратом)
Любая степень гематологической токсичности не менее 3
Любая степень токсичности, которая приводит к прекращению приема лекарственного препарата в течение > 7 дней
Период наблюдения дозолимитирующей токсичности представляет собой дни 1-28 цикла 1
Нежелательные явления, возникшие после начала лечения (НЯПНЛ)
[00190] НЯПНЛ регистрировали в течение всего исследования. Предварительные данные обобщены в таблице 12. «n» представляет собой количество субъектов с по меньшей мере одним связанным с лечением НЯ в данной категории, НЯ классифицировали согласно общей терминологии критериев нежелательных явлений (Common Terminology Criteria for Adverse Events, CTCAE) v4.0, и любого пациента с несколькими сценариями одного и того же предпочтительного термина подсчитывали только один раз и относили к наиболее тяжелой степени. Смертей или дозолимитирующих токсичностей не наблюдалось, максимально переносимая доза (МПД) не была установлена. Большинство НЯ относились к степени 1 или 2. Наиболее распространенными связанными с лечением НЯ являлись диспепсия (5/8 пациентов) и тошнота (3/8 пациентов). Наблюдались два серьезных НЯ (СНЯ), первое -констипация 3 степени, связанная с лечением, второе - затруднение дыхания (экссудат в плевральной полости), не связанное с лечением.
[00191] Тяжело лечившиеся ранее субъекты данного исследования 1 фазы включали субъектов, ранее получавших лечение несколькими эндокринными средствами и средствами направленного действия, например, ингибиторами CDK4/6, PI3K и mTOR. После лечения RAD1901 в ежедневной дозе 200 мг, вводимой пероральным способом, до 6 месяцев и в ежедневной дозе 400 мг, вводимой пероральным способом, в течение до двух месяцев дозолимитирующих токсичностей не наблюдалось. Таким образом, RAD1901 продемонстрировал потенциал лечения ER+ запущенного рака молочной железы, в особенности у субъектов, ранее получавших лечение эндокринными средствами и/или средствами направленного действия, такими как ингибиторы CDK4/6, PI3K и mTOR.
[00192] Пример II. RAD1901, предпочтительно, накапливается в опухоли и может быть доставлен в головной мозг.
[00193] На ксенотрансплантатах MCF-7, описанных в примере I(A)(i), также оценивали концентрацию RAD1901 в плазме и опухоли с применением ЖХ-МС/МС. В конце исследования концентрация RAD1901 в плазме составляла 344±117 нг/мл, а в опухоли - 11118±3801 нг/мл для уровня дозы 60 мг/кг. Аналогичное соотношение концентрации в опухоли к концентрации в плазме также наблюдалось для меньших уровней доз, когда концентрации в опухоли являлись приблизительно в 20-30 раз более высокими, чем в плазме. Уровни RAD1901 в плазме, опухоли и головном мозге для мышей, получавших лечение в течение 40 дней, обобщены в таблице 1. Значительное количество RAD1901 доставлялось в головной мозг получавших лечение мышей (например, см. соотношение ГМ/П (концентрация RAD1901 в головном мозге/концентрация RAD1901 в плазме)); это свидетельствует, что RAD1901 был способен пересекать гематоэнцефалический барьер (ГЭБ). Неожиданно было установлено, что RAD1901, предпочтительно, накапливается в опухоли. См., например, соотношение О/П (концентрация RAD1901 в опухоли/ концентрация RAD1901 в плазме), представленное в таблице 1.
[00194] Пример III. RAD1901 ингибировал путь передачи сигналов посредством ER и вызывал деградацию ER.
[00195] III(A). RAD1901 уменьшал занятость ER в матке и гипофизе у здоровых субъектов-людей женского пола в постменопаузальном периоде.
[00196] Субъекты характеризовались продолжительностью аменореи по меньшей мере 12 месяцев и уровнем ФСГ (фолликулостимулирующего гормона) в сыворотке, который соответствовал менопаузе. Возраст субъектов составлял 40-75 лет с ИМТ (индексом массы тела) 18,0-30 кг/м2. Матка субъектов являлась целостной. Исключали субъектов, у которых наблюдались доказательства клинически значимой патологии, увеличенный риск инсульта или венозное тромбоэмболическое событие в анамнезе, или которые использовали сопутствующие лекарственные препараты менее чем за 14 дней до поступления в клинический исследовательский центр (прием парацетамола был разрешен в течение до 3 дней до поступления).
[00197] ФЭС-ПЭТ проводили на исходном уровне и после 6 дней воздействия RAD1901 для оценки занятости ER в матке. RAD1901 оккупировал 83% и 92% ER в матке при уровнях дозы 200 мг (7 субъектов) и 500 мг (6 субъектов), соответственно.
[00198] Визуализация ФЭС-ПЭТ продемонстрировала значительное уменьшение связывания меченного эстрадиола как с маткой, так и с гипофизом после лечения RAD1901 200 мг или 500 мг (один раз/день, п.о., 6 дней).
[00199] В связи с высокой экспрессией ER в матке наблюдался мощный сигнал ФЭС-ПЭТ на исходном уровне до лечения RAD1901 (фиг. 9А, поперечный вид скана ФЭС-ПЭТ матки субъекта 3, получавшего лечение уровнем дозы 200 мг, на исходном уровне; фиг. 9В, сагиттальный вид и поперечный вид скана ФЭС-ПЭТ матки, соответственно, субъекта 7, получавшего лечение уровнем дозы 500 мг, на исходном уровне). Однако при сканировании через четыре часа после введения дозы в день 6 исследования матка была слабо заметна (на уровне фонового сигнала или близко к фоновому сигналу ФЭС-ПЭТ (фиг. 9А), поперечный вид скана матки субъекта 3 в день 6; и фиг. 9В, сагиттальный вид и поперечный вид скана матки, соответственно, субъекта 7 в день 6). Эти данные согласовывались с деградацией ER и/или конкуренцией за связывание с рецептором. Фиг. 9А и 9В также включают скан КТ матки, которой был получен в результате сканирования ФЭС-ПЭТ и который демонстрирует присутствие матки до и после лечения RAD1901.
[00200] Затем количественно определяли результаты сканирования ФЭС-ПЭТ матки, чтобы продемонстрировать изменение связывания ER после введения доз по сравнению с исходным уровнем для 7 субъектов (фиг. 9С). Представлены данные субъектов 1-3 и субъектов 4-7 в качестве примеров группы дозы 200 мг и группы дозы 500 мг, соответственно. RAD1901 продемонстрировал устойчивую занятость ER при более низких уровнях дозы (200 мг).
[00201] На фиг. 10А-В продемонстрировано иллюстративное изображение скана ФЭС-ПЭТ матки (А) и гипофиза (В) перед (На исходном уровне) и после (После лечения) лечения RAD1901 в дозе 500 мг п.о., один раз в день через шесть дней. На фиг. 10А продемонстрирован скан ФЭС-ПЭТ матки при (а) боковом поперечном сечении; (b) продольном поперечном сечении; и (с) продольном поперечном сечении.
[00202] На скане ФЭС-ПЭТ матки и гипофиза субъекта после введения доз наблюдалось отсутствие заметного сигнала связывания ER в матке (фиг. 10А, После лечения) и гипофизе (фиг. 10В, После лечения), соответственно.
[00203] Таким образом, результаты продемонстрировали, что RAD1901 эффективно вызывал деградацию/деактивацию ER у человека в дозе 200 и 500 мг п.о., один раз/день через шесть дней.
[00204] Стандартный уровень накопления (СУН) для матки, мышц и костей рассчитывали и обобщали для вариантов лечения RAD1901 в дозе 200 мг и 500 мг п.о. ежедневно в таблицах 2 и 3, соответственно. После введения доз сигналы в матке были близки уровням от «тканей, отличных от тканей-мишеней», что свидетельствует о полном затухании накопления ФЭС-ПЭТ после лечения RAD1901. В тканях, которые в значительной степени не экспрессируют рецептор эстрогенов, практически не наблюдалось изменений на сканах ПЭТ до лечения по сравнению со сканами после лечения.
[00205] Таким образом, RAD1901 или соль или сольват (например, гидрат) указанного соединения можно использовать при лечении раковых и/или опухолевых клеток характеризующихся сверхэкспрессией ER (например, рака молочной железы, рака матки и рака яичников), без оказания отрицательных эффектов на другие органы (например, кости, мышцы). RAD1901 или соль или сольват (например, гидрат) указанного соединения может быть в особенности пригодным при лечении метастазирующих вариантов рака и/или опухолей, которые характеризуются сверхэкспрессией ER, в других органах, например, исходного рака молочной железы, рака матки и/или рака яичников, который мигрировал в другие органы (например, кости, мышцы), для лечения поражений рака молочной железы, рака матки и/или рака яичников в других органах (например, костях, мышцах) без оказания отрицательных эффектов на указанные органы.
[00206] III(B). RAD1901 уменьшал экспрессию ER и ингибировал путь передачи сигналов посредством ER.
[00207] III(B)(i)(1) Комбинация RAD1901-эверолимус являлась более эффективной в отношении уменьшения экспрессии ER и PR на ксенотрансплантатных моделях MCF-7, чем лечение RAD1901, эверолимусом или фулвестрантом в монотерапии или комбинацией фул-эверолимус.
[00208] Лечение комбинацией RAD1901 и эверолимуса являлось также более эффективным в отношении уменьшения экспрессии ER и PR in vivo на ксенотрансплантатных моделях MCF-7 (как описано в примере I(A)(ii)), чем лечение RAD1901, эверолимусом или фулвестрантом в монотерапии или лечение комбинацией фулвестранта и эверолимуса (фиг. 11); опухоли собирали через два часа после последнего введения дозы).
[00209] III(B)(i)(2) Сравнение RAD1901 и фулвестранта на линиях клеток MCF-7 и T47D.
[00210] Эффекты RAD1901 и фулвестранта сравнивали с применением линий клеток MCF-7 и T47D, обе из которых представляют собой линии клеток рака молочной железы человека, при различных концентрациях, 0,01 мкМ, 0,1 мкМ и 1 мкМ (фиг. 12А для анализов линии клеток MCF-7; и фиг. 12В для анализов линий клеток T47D). В качестве маркеров использовали три гена-мишени ER, рецептора прогестеронов (PgR), регуляции роста эстрогеном в раке молочной железы 1 (growth regulation by estrogen in breast cancer, GREB1) и фактора «трилистника» 1 (trefoil factor, TFF1). RAD1901 вызывал практически полную деградацию ER и ингибировал передачу сигналов посредством ER (фиг. 12А-В). В особенности в случае линий клеток MCF-7 фулвестрант продемонстрировал сравнимую или даже незначительно более высокую эффективность в отношении ингибирования передачи сигналов посредством ER при введении в одинаковой концентрации. Неожиданно было установлено, что RAD1901 являлся сравнимым или более эффективным, чем фулвестрант, при ингибировании роста опухоли и запускал регрессию опухоли, как раскрыто выше в примере I(A) и примере I(B).
[00211] III(B)(i)(3) Лечение RAD1901 привело к деградации ER и отмене передачи сигналов посредством ER на ксенотрансплантатной модели MCF-7, описанной выше в примере I(A)(ii)(1).
[00212] Лечение RAD1901 привело к деградации ER in vivo (фиг. 13А и 13В, t-критерий Стьюдента: *р-значение <0,05, **р-значение <0,01) и ингибировало передачу сигналов посредством ER in vivo (фиг. 13А и 13С, t-критерий Стьюдента: *р-значение <0,05, **р-значение <0,01).
[00213] В опухоли, которую отбирали от ксенотрансплантата MCF-7 через 2 часа после введения последней дозы RAD1901 (30 мг/кг, 60 мг/кг, п.о., о.р.д.) или фулвестранта (3 мг/дозу, п.к., о.р.н.), наблюдалось значительное уменьшение экспрессии ER и PR (фиг. 13А-В). В опухоли, взятой у ксенотрансплантата MCF-7 через 8 часов после введения последней дозы лечения фулвестрантом, наблюдалась увеличенная экспрессия PR и ER. Однако в опухоли, взятой у ксенотрансплантата MCF-7 через 8 часов после введения последней дозы лечения RAD1901, наблюдалась уменьшенная экспрессия PR и ER (фиг. 13А и 13С).
[00214] В опухоли, взятой у ксенотрансплантата MCF-7 через 8 часов или через 12 часов после введения однократной дозы RAD1901 (30 мг/кг, 60 мг/кг или 90 мг/кг, п.о., о.р.д.), наблюдалось быстрое уменьшение экспрессии PR (фиг. 14А-С). В опухоли, взятой у ксенотрансплантата MCF-7 через 4 часа или через 24 часа после введения 7-ой дозы RAD1901 (30 мг/кг, 60 мг/кг или 90 мг/кг, п.о., о.р.д.), наблюдалось стойкое и стабильное ингибирование передачи сигналов посредством ER (фиг. 14В). Количественное определение анализов вестернблоттинга опухоли, взятой у ксенотрансплантата MCF-7 в различные временные точки в течение лечения RAD1901 (30 мг/кг, 60 мг/кг или 90 мг/кг, п.о., о.р.д.), продемонстрировало дозозависимое уменьшение PR (фиг. 14С).
[00215] Лечение RAD1901 вызвало быстрое уменьшение пролиферации на ксенотрансплантатных моделях MCF-7. Например, опухоль, взятую у ксенотрансплантатных моделей MCF-7 через 8 часов после введения однократной дозы RAD1901 (90 мг/кг, п.о., о.р.д.) и через 24 часа после введения 4-ой дозы RAD1901 (90 мг/кг, п.о., о.р.д.), разрезали на срезы и окрашивали, чтобы продемонстрировать быстрое уменьшение уровня маркера пролиферации Ki67 (фиг. 15Аи 15В).
[00216] Данные результаты свидетельствуют, что лечение RAD1901 приводит к деградации ER и ингибированию передачи сигналов посредством ER на ксенотрансплантатах ER ДТ in vivo.
[00217] III(B)(i)(4) Лечение RAD1901 привело к деградации ER и к отмене передачи сигналов посредством ER на PDx-4 моделях, описанных выше в примере I(A)(ii).
[00218] Лечение RAD1901 вызвало быстрое уменьшение пролиферации на PDx-4 моделях. Например, через четыре часа после введения последней дозы в последний день исследования эффективности в течение 56 дней в опухоли, взятой у PDx-4 моделей, получавших лечение RAD1901 (30, 60 или 120 мг/кг, п.о., о.р.д.) или фулвестрантом (1 мг/животное, о.р.н.), которые разрезали на срезы, наблюдалось быстрое уменьшение уровня маркера пролиферации Ki67 по сравнению с PDx-4 моделями, получавшими лечение фулвестрантом (фиг. 16).
[00219] Данные результаты свидетельствуют, что лечение RAD1901 приводит к деградации ER и ингибированию передачи сигналов посредством ER на ксенотрансплантатах ER ДТ in vivo.
[00220] III(B)(ii) Лечение RAD1901 привело к уменьшению передачи сигналов посредством ER на PDx-5 моделях с мутантным ER, описанных выше в примере 1(А)(Ш)(1).
[00221] Опухоли собирали в указанные временные точки после последнего дня введения дозы (если не указано обратное), гомогенизировали в буфере RIPA с ингибиторами протеазы и фосфатазы с применением гомогенизатора Tissuelyser (Qiagen). Равные объемы белка разделяли в зависимости от молекулярной массы, переносили на нитроцеллюлозные мембраны и получали отпечаток промоканием со следующим антителом, описанным в разделе «Материалы и методы»: рецептор прогестеронов (PR, Cell Signaling Technologies; 3153).
[00222] Проводили количественное определение полос с применением программного обеспечения ID Quant (GE), и показатели ИГХ PR по шкале Оллреда, полученные на PDx-5 моделях, описанных в примере I(A)(iii)(1), показаны на фиг. 17. Фулвестрант оказывал незначительное влияние на экспрессию PR, тогда как RAD1901 продемонстрировал эффективность в дозах как 60 мг/кг, так и 120 мг/кг (о.р.д., п.о., фиг. 17).
[00223] Данные результаты свидетельствуют, что в случае опухолей, экспрессирующих определенные мутации ERα (например, Y537S), RAD1901 являлся более эффективным, чем фулвестрант, при ингибировании роста опухоли, в особенности эффективным при ингибировании роста опухолей, которые являлись слабо восприимчивыми к лечению фулвестрантом (например, в дозе 3 мг/дозу, о.р.н., п.к., фиг. 6А, PDx-5). Более того, в случае опухолей, которые не отвечали хорошо на лечение фулвестрантом (например, PDx-5), RAD1901 являлся эффективным для уменьшения экспрессии PR in vivo, в то время как фулвестрант не являлся эффективным (фиг. 17).
[00224] Пример IV. Влияние лечения RAD1901 на ткани матки и/или МПК
[00225] IV(A(1)): RAD1901 выступал в качестве антагониста стимуляции ткани матки эстрадиолом.
[00226] Утеротропные эффекты RAD1901 исследовали посредством оценки изменений массы матки, гистологии и экспрессии гена С3 у неполовозрелых крыс. Результаты репрезентативного исследования представлены на фиг. 18A-D. Оценка утеротропной активности
[00227] Детенышей крыс Спрег-Доули отлучали от матери на 19 день жизни, рандомизировали в группы (n=4) и вводили наполнитель (водную метилцеллюлозу), Е2 (0,01 мг/кг), ралоксифен (3 мг/кг), тамоксифен (1 мг/кг), RAD1901 в монотерапии (от 0,3 до 100 мг/кг) или RAD1901 (от 0,01 до 10 мг/кг) в комбинации с Е2 (0,01 мг/кг), посредством подкожной инъекции или через желудочный зонд в установленном порядке (см. раздел «Реактивы», выше), один раз в день в течение 3 последовательных дней. Через двадцать четыре часа после введения последней дозы всем животным проводили эвтаназию посредством ингаляции диоксида углерода. Для каждого животного регистрировали массу тела и чистую массу матки. Аналогичные анализы также проводили с RAD1901 (от 0,03 до 100 мг/кг) на крысах и мышах (Charles River Laboratories, Монреаль, Квебек).
[00228] Свежую ткань матки от каждой крысы фиксировали в 4% параформальдегиде, обезвоживали этанолом и заливали в пластичный полимер JB4. Получали срезы толщиной 8 мкм и окрашивали 0,1% толуидиновым синим О. Толщину эпителия эндометрия измеряли с помощью микроскопа Zeiss Axioskop 40 с применением программы Spot Advanced; рассчитывали среднее из 9 измерений на образец.
Экспрессия гена компонента 3 (С3) комплемента в матке
[00229] Для определения относительных уровней экспрессии С3 в получавшей лечение ткани матки экстрагировали РНК из оставшейся ткани с применением набора для очистки РНК Micro to Midi Total RNA Purification Kit (Invitrogen, Карлсбад, Калифорния) согласно инструкциям производителя. РНК количественно определяли, и проводили обратную транскрипцию равных объемов с применением набора High Capacity cDNA Archive Kit (Applied Biosystems, Фостер-Сити).
[00230] Количественную ПЦР проводили с применением системы ABI Prism 7300 (Applied Biosystems). ПЦР проводили с применением мастер-микс Taqman Universal с наборами зондов для С3 и для 18S рибосомальной РНК в качестве эталонного гена. Условия циклического температурного воздействия включали исходный этап денатурации при температуре 95°С в течение 10 мин., после чего следовали 40 циклов при температуре 95°С в течение 15 секунд и при температуре 60°С в течение 1 минуты.
[00231] Относительную экспрессию гена определяли посредством нормирования каждого образца к эндогенному контролю (18S) и сравнения с калибратором (наполнитель). Относительную экспрессию гена определяли с применением следующего уравнения: 2-ΔΔCt (где Ct = пороговый цикл или номер цикла, на котором продукт ПЦР был впервые обнаружен, ΔCt = нормированное значение образца, и ΔΔCt = нормированная разность между субъектом, получавшим дозу, и наполнителем). Определения экспрессии гена в пяти повторах проводили для каждой дозы во время каждого исследования.
[00232] Лечение Е2 (0,01 мг/кг), ралоксифеном (РАЛ, 3 мг/кг) или тамоксифеном (ТАМ, 1 мг/кг) привело к значительному увеличению чистой массы матки по сравнению с наполнителем в монотерапии, тогда как лечение RAD1901 в диапазоне доз от 0,3 до 100 мг/кг значительно не влияло на чистую массу матки (фиг. 18А). Представленные данные (фиг. 18А) представляют собой средние значения (± СОС); n=4 крыс на группу; Р по сравнению с наполнителем: * < 0,05; по сравнению с Е2: < 0,05. Также при введении в комбинации с Е2 (0,01 мг/кг) RAD1901 выступал в качестве антагониста Е2-опосредованной стимуляции матки дозозависимым способом, демонстрируя значительное ингибирование утеротропной активности в дозе 0,1 мг/кг и более и полное ингибирование в дозе 3 мг/кг. ЕС50 для RAD1901 составляла приблизительно 0,3 мг/кг. Аналогичные результаты были получены на мышах, когда дозы RAD1901 от 0,03 до 100 мг/кг также не оказывали эффекта в отношении чистой массы матки или толщины эпителия (данные не показаны).
[00233] Затем связанные с лечением изменения ткани матки исследовали посредством количественной микроскопической гистологии. Наблюдалось статистически значимое увеличение толщины эндометриального эпителия после лечения Е2 в дозах 0,01 и 0,3 мг/кг (фиг. 18В). Значительное увеличение толщины эпителия также наблюдалось после лечения тамоксифеном (1 мг/кг) или ралоксифеном (3 мг/кг). Напротив, лечение RAD1901 не вызвало увеличения толщины эндометриального эпителия до наивысшей исследованной дозы 100 мг/кг. Иллюстративные изображения эпителия эндометрия представлены на фиг. 18С.
[00234] В соответствии с изменениями массы матки и толщины эндометриального эпителия Е2, тамоксифен и ралоксифен значительно повышали экспрессию гена регулируемого эстрогеном комплемента, С3 (фиг. 18D). Напротив, RAD1901 не повышал экспрессию гена С3 ни в одной из исследованных доз (от 0,3 до 100 мг/кг). Более того, RAD1901 в дозах 1, 3 и 10 мг/кг значительно подавлял стимулированную Е2 экспрессию гена С3.
RAD1901 не стимулирует матку неполовозрелых самок крыс
[00235] Неполовозрелым самкам крыс вводили (перорально) один раз в день в течение 3 последовательных дней наполнитель (НАПОЛН), эстрадиол (Е2), Ралоксифен (РАЛ), Тамоксифен (ТАМ), RAD1901 или RAD1901+E2. Измеряли чистую массу матки. Представленные данные (фиг. 18) представляют собой средние значения (± СОС); n=4 крыс на группу; Р по сравнению с наполнителем: * < 0,05; по сравнению с Е2: < 0,05.
Пример II(A)(2). Лечение RAD1901 защищало от атрофии костной ткани у крыс после овариоэктомии
[00236] Специфичные в отношении костей эффекты RAD1901 исследовали на крысах после овариоэктомии.
[00237] Для получения модели постменопаузальной атрофии костной ткани проводили овариоэктомию на взрослых самках крыс Спрег-Доули при анестезии с симуляцией хирургического вмешательства в качестве контроля. После хирургического вмешательства крысы после овариоэктомии получали лечение один раз в день в течение 4 недель наполнителем, Е2 (0,01 мг/кг) или RAD1901 (0,1, 0,3, 1, 3 мг/кг), которые вводили, как описано выше; группы включали по 20 животных. Животные в группе симуляции хирургического вмешательства получали лечение наполнителем. Всем животным проводили эвтаназию посредством ингаляции диоксида углерода через 24 часа после введения последней дозы. Минеральную плотность костей оценивали на исходном уровне и снова через 4 недели лечения с применением двухэмиссионной рентгеновской абсорбциометрии PIXImus.
[00238] При вскрытии левую бедренную кость каждого животного отбирали, рассекали без присутствия мягких тканей и хранили в 70% этаноле перед проведением анализа. Подробную качественную и количественную 3-D оценку проводили с применением системы micro-CT40 (Scanco Systems, Уэйн, Пенсильвания). Для каждого образца получали 250 изображений срезов метафиза дистальной бедренной кости. Морфометрические параметры определяли с применением прямого 3-D подхода в предварительно выбранных областях для анализа. Параметры, которые определяли в трабекулярной кости, включали плотность объема костей, плотность поверхности костей, число трабекул, толщину трабекул, расстояние между трабекулами, плотность соединительной ткани и кажущуюся плотность костей.
[00239] После овариоэктомии у не получавших лечение (получавших контроль -наполнитель) крыс наблюдалось уменьшение минеральной плотности костей как во всей полной бедренной кости, так и в поясничном отделе по сравнению с исходным уровнем (таблица 4). Лечение Е2 было связано с предотвращением атрофии костной ткани как в бедренной кости, так и в спинном хребте. Лечение RAD1901 привело к дозозависимому и статистически значимому подавлению вызванной овариоэктомией атрофии костной ткани (данные представлены для группы лечения 3 мг/кг). В дозах от 0,1 мг/кг до 3 мг/кг минеральная плотность костей у получавших лечение RAD1901 крыс была полной при отсутствии статистически значимых различий по сравнению с группой, получавшей лечение Е2.
[00240] Анализ дистальной бедренной кости методом микро-КТ (таблица 5) продемонстрировал, что овариоэктомия вызвала значительные изменения количества ключевых параметров микроархитектуры по сравнению с животными с симуляцией хирургической операции. Данные изменения согласовывались с уменьшением массы костей и включали уменьшение объема костей, уменьшение числа трабекул, толщины и плотности и увеличение разделения трабекул. В соответствии с сохранением минеральной плотности костей, которое наблюдалось после лечения RAD1901, в ключевых микроструктурных параметрах наблюдалось значительное сохранение архитектуры трабекул (таблица 5).
[00241] Пример IV(B): Исследование 1 фазы с увеличением дозы RAD101 у здоровых женщин в постменопаузальном периоде
[00242] В исследовании 1 фазы оценивали безопасность, переносимость и фармакокинетику на 44 здоровых женщинах в постменопаузальном периоде. Дозолимитирующие токсичности (ДЛТ) не наблюдались, максимально переносимая доза (МПД) не была установлена. Экспозиция в плазме увеличивалась более чем пропорционально дозе в исследованном диапазоне доз.
Субъекты
[00243] 44 здоровых женщин в постменопаузальном периоде включали в качестве субъектов в данное исследование 1 фазы. Субъекты характеризовались продолжительностью аменореи по меньшей мере 12 месяцев и уровнем ФСГ в сыворотке, который соответствовал менопаузе. Возраст субъектов составлял 40-75 лет с ИМТ 18,0-30 кг/м2. Исключали субъектов, у которых наблюдались доказательства клинически значимой патологии, увеличенный риск инсульта или венозное тромбоэмболическое событие в анамнезе, или которые использовали сопутствующие лекарственные препараты менее чем за 14 дней до поступления в клинический исследовательский центр (прием парацетамола был разрешен в течение до 3 дней до поступления).
Введение доз
[00244] Субъекты получали лечение плацебо или по меньшей мере одну дозу, вводимую пероральным способом, ежедневно после легкого завтрака в течение 7 дней при уровнях дозы 200 мг, 500 мг, 750 мг и 1000 мг, соответственно. Ключевые демографические показатели на исходном уровне 44 здоровых женщин в постменопаузальном периоде, включенных в исследование 1 фазы, обобщены в таблице 6.
Нежелательные явления, возникшие после начала лечения (НЯПНЛ)
[00245] Регистрировали НЯПНЛ, и наиболее частые (>10% пациентов в суммарной активной группе, у которых наблюдались любые связанные НЯПНЛ) нежелательные явления (НЯ) обобщены в таблице 7, «n» представляет собой количество субъектов с по меньшей мере одним связанным с лечением НЯ в данной категории, НЯ классифицировали согласно общей терминологии критериев нежелательных явлений (СТСАЕ) v4.0, и любого пациента с несколькими сценариями одного и того же предпочтительного термина подсчитывали только один раз и относили к наиболее тяжелой степени. Дозолимитирующая токсичность не наблюдалась, максимально переносимая доза (МПД) не была установлена. Оценка фармакокинетики
[00246] Серии образцов крови отбирали в течение исследования для анализа RAD1901 в плазме. Образцы крови объемом по 5 мл каждый отбирали посредством баллонного внутривенного катетера или посредством прямой венопункции в пробирки, содержащие K3-EDTA в качестве антикоагулянта. Устойчивого состояния достигали на день 5 лечения. Оценивали геометрическое среднее (Geo-Mean) профилей RAD1901 концентрация в плазме -время. Результаты определения фармакокинетики в плазме групп, получавших лечение RAD1901 (200, 500, 750 или 1000 мг), в день 7 (N=35) исследования представлены в таблице 8 и на фиг. 19 в качестве примера. Медиана находилась в диапазоне между 37,5 и 42,3 часов (таблица 8). После введения нескольких доз RAD1901 медиана tmax варьировала в диапазоне между 3 и 4 часами после введения доз.
[00247] Пример V(A)-1. Моделирование связывания RAD1901-ERα с применением избранных опубликованных структур ER.
[00248] Если не указано обратное, когда структуры представлены реберной моделью, каждый конец связи окрашен тем же цветом, что и атом, к которому присоединена данная связь, где серый цвет представляет собой углерод, красный - кислород, синий - азот и белый - водород.
[00249] Четырнадцать опубликованных структур (т.е. моделей) лиганд-связывающего домена (ЛСД) ERα, образовавших комплексы с различными лигандами ER, выбирали из 96 опубликованных моделей посредством тщательной оценки. Одна из данных четырнадцати моделей представляла собой 3ERT (ЛСД ERα человека, присоединенный к 4-гидрокситамоксифену (ОНТ)). ОНТ представляет собой активный метаболит тамоксифена и СМРЭ первого поколения, который действует в качестве антагониста в ткани молочной железы.
[00250] В 3ERT (фиг. 20 и 21) сайт связывания ERα принимает вид трехслойного «сэндвича из спиралей», образующего гидрофобный карман, который содержит спираль 3 (Н3), спираль 5 (Н5) и спираль 11 (Н11) (фиг. 20). Пунктирный ящик на фиг. 21 представляет собой сайт связывания и остатки в сайте связывания, которые являются важными или осуществляются в результате связывания ОНТ. ОНТ выступает в качестве антагониста посредством вытеснения Н12 в сайт, в котором связывается коактиватор (или коактиваторы) LXXLL. ОНТ оккупирует пространство, в норме заполненное L540, и модифицирует конформацию четырех остатков на С-конце спирали 11 (G521, Н524, L525 и М528). ОНТ также образует соляной мостик с D351, что приводит к нейтрализации заряда.
[00251] Другие тринадцать моделей ЛСД ERα-лиганд ER сравнивали с 3ERT. Различия в положениях остатков данных моделей обобщены в таблице 10. Наложение структур ERα четырнадцати моделей (фиг. 22) демонстрирует, что данные структуры значительно отличаются в остатках Е380, М421, G521, М522, Н524, Y526, S527, М528, Р535, Y537, L540 и различных комбинациях указанных остатков.
[00252] Расчеты среднего квадратичного отклонения (СКО) для любой пары четырнадцати моделей обобщены в таблице 11. Структуры считали перекрывающимися, когда СКО структур составляло <2. Таблица 11 демонстрирует, что все четырнадцать моделей характеризуются СКО <1,5 . Применение анализа условного форматирования свидетельствует, что 1R5K и 3UUC являлись наименее подобными другим моделям (анализ не показан). Вследствие этого 1R5K и 3UUC считали уникальным, отдельным структурным кластером для исследования.
[00253] Остатки ERα, связанные лигандом на четырнадцати моделях, обобщены в таблице 12. В таблице 12 также представлена ЕС50 в комплексах ЛСД ERα - антагонист. Из четырнадцати моделей в тринадцати наблюдались взаимодействия водородной связи между лигандом и Е353; в двенадцати наблюдались пи-взаимодействия между лигандом и F404; в пяти наблюдались взаимодействия водородной связи между лигандом и D351; в шести наблюдались взаимодействия водородной связи между лигандом и Н524; в четырех наблюдались взаимодействия водородной связи между лигандом и R394; и в одной (3UUC) наблюдались взаимодействия между лигандом и Т347.
[00254] Каждую из четырнадцати моделей использовали для докинга случайной библиотеки из 1000 соединений плюс лиганд, с которым была опубликована модель (известный антагонист), для определения того, может ли модель обнаружить и отдавать предпочтение известному антагонисту. Если модель способна обнаружить известный антагонист, модель определяли как способную предсказывать положение ее собственного опубликованного лиганда. Затем рассчитывали EF50 для количественного определения силы модели, чтобы увидеть, насколько данная модель превосходила случайный выбор. RAD1901 состыковывали в выбранных моделях (например, фиг. 23А и В - 27А и В). Определяли показатели докинга опубликованного лиганда и RAD1901 в моделях. Также определяли ЕС50. Визуальное изучение RAD1901 продемонстрировало, что данное соединение «подчинялось» взаимодействию, представленному с опубликованными лигандами в 1R5K, 1SJ0, 2JFA, 2BJ4 и 2OUZ. Пространственные конфликты не были отмечены. Согласно определенным вариантам реализации настоящего изобретения, например, в 1R5k и 2BJ4, RAD1901 обладал более высоким показателем докинга, чем опубликованный лиганд.
[00255] Результаты оценки девяти моделей (1ERR, 3ERT, 3UCC, 2IOK, 1R5K, 1SJ0, 2JFA, 2BJ4 и 2OUZ) обобщены в таблице 13.
[00256] 1ERR и 3ERT не могли предсказать верное положение своего кристаллизованного лиганда. RAD1901 не состыковывался в 3UCC. Тетрагидронафтален связывался в 2IOK-RAD1901 нетрадиционным способом.
[00257] Основные различия между моделями 1R5K, 1SJ0, 2JFA, 2BJ4 и 2OUZ наблюдались в остатках в С-конце спирали 11 (G521-M528).
[00258] На фиг. 23А и В представлено моделирование RAD1901-1R5K (А) и GW5-1R5K (В). RAD1901 связывался посредством взаимодействия водородной связи с Е353, R394 и L536; и посредством пи-взаимодействия с F404.
[00259] На фиг. 24А и В представлено моделирование RAD1901-1SJ0 (А) и E4D-1SJ0 (В). RAD1901 связывался посредством взаимодействия водородной связи с Е353 и D351; и посредством пи-взаимодействия с F404.
[00260] На фиг. 25А и В представлено моделирование RAD1901-2JFA (А) и RAL-2JFA (В). RAD1901 связывался посредством пи-взаимодействия с F404.
[00261] На фиг. 26А и В представлено моделирование RAD1901-2BJ4 (А) и OHT-2BJ4 (В). RAD1901 связывался посредством взаимодействия водородной связи с Е353 и R394; и посредством пи-взаимодействия с F404.
[00262] На фиг. 27А и В представлено моделирование RAD1901-2IOK (А) и IOK-2IOK (В). RAD1901 связывался посредством взаимодействия водородной связи с Е353, R394 и D351; и посредством пи-взаимодействия с F404.
[00263] Опубликованные лиганды в моделях имеют следующие структуры:
GW5, (2Е)-3-{4-[(1Е)-1,2-ДИФЕНИЛБУТ-1-ЕНИЛ]ФЕНИЛ}АКРИЛОВАЯ КИСЛОТА
E4D, (2S,3R)-2-(4-(2-(ПИПЕРИДИН-1-ИЛ)ЭТОКСИ)ФЕНИЛ)-2,3-ДИГИДРО-3-(4-ГИДРОКСИФЕНИЛ)БЕНЗО[В][1,4]ОКСАТИИН-6-ОЛ
ОНТ, 4-ГИДРОКСИТАМОКСИФЕН
IOK, N-[(1R)-3-(4-ГИДРОКСИФЕНИЛ)-1-МЕТИЛПРОПИЛ]-2-(2-ФЕНИЛ-1Н-ИНДОЛ-3-ИЛ)АЦЕТАМИД
[00264] Пример V(A)-2. Докинг индуцированного соответствия (ДИС) ERα с RAD1901 и фулвестрантом
[00265] Конформацию связывания RAD1901 в ERα дополнительно оптимизировали посредством анализа ДИС пяти кристаллических структур ERα: 1R5K, 1SJ0, 2JFA, 2BJ4 и 2OUZ. В анализе ДИС учитывали гибкость рецептора (после связывания лиганда) для аккомодации его правильной конформаций связывания.
[00266] Библиотеку различных конформаций для каждого лиганда (например, RAD1901 и фулвестранта) получали посредством поиска локальных минимумов как функции вращений относительно вращающихся связей. Библиотека для RAD1901 содержала 25 различных конформаций.
[00267] Пять кристаллических структур ERα получали и минимизировали. Соответствующий лиганд в опубликованных рентгеновских структурах использовали для определения кармана связывания ERα.
[00268] Конформаций RAD1901 состыковывали в полученные структуры ERα, где данным конформациям позволяли вызывать движения боковой цепи или остова к остаткам, расположенным в кармане связывания. Данные движения позволяли ERα изменять сайт связывания, так что он приобретал более близкую конформацию к форме и способу связывания конформаций RAD1901. В некоторых примерах при анализе ДИС допускали небольшие релаксации остова в структуре рецептора и значительные изменения конформаций боковой цепи.
[00269] Эмпирическую оценочную функцию использовали для приближения свободной энергии связывания лиганда с целью получения показателя докинга, или Gscore. Gscore также известен как GlideScore, и в данном примере данный термин можно использовать взаимозаменяемо с показателем докинга. Показатель докинга представлял собой оценку аффинности связывания. Вследствие этого чем ниже значение показателя докинга, тем «лучше» лиганд присоединяется к своему рецептору. Показатель докинга от -13 до -14 соответствовал очень хорошему взаимодействию связывания.
[00270] Конформаций RAD1901, полученные в результате анализа ДИС с 1R5K, 1SJ0, 2JFA, 2BJ4 и 2OUZ, соответственно, накладывали, чтобы продемонстрировать различия между ними (фиг. 28-30А и В, показаны на реберной модели). Все связи в каждой конформаций RAD1901 на фиг. 28, 29 и 30А представлены одинаковым цветом.
[00271] Конформаций RAD1901, полученные в результате анализа с 1R5K (синий) и 2OUZ (желтый), содержали группу RAD1901 N-бензил-N-этиланилин на передней стороне (фиг. 28). Конформаций RAD1901, полученные в результате анализа с 2BJ4 (зеленый) и 2JFA (розовый), содержали группу RAD1901 N-бензил-N-этиланилин на задней стороне (фиг. 29). Конформаций RAD1901, полученные в результате анализа с 2BJ4 (зеленый), 2JFA (розовый) и 1SJ0 (коричневый), являлись вполне аналогичными, что демонстрируется наложениями данных конформаций (фиг. 30А и 30В). Показатели докинга ДИС RAD1901 обобщены в таблице 14.
[00272] ДИС RAD1901 с 2BJ4 продемонстрировал взаимодействия водородной связи с Е353 и D351 и пи-взаимодействия с F404 (фиг. 31А-31С). На фиг. 31А представлены области в сайте связывания, подходящие для акцепторной группы водородной связи (красный), донорной группы водородной связи (синий) и гидрофобной группы (желтый). На фиг. 31А и 31В светло-синий цвет означает углерод для RAD1901. На фиг. 32А-32С представлены взаимодействия белок-поверхность ДИС RAD1901 с 2BJ4. Фиг. 32А и 32В представляют собой вид спереди, и фиг. 32С представляет собой вид сбоку. Молекулярная поверхность RAD1901 окрашена синим цветом на фиг. 32А и зеленым - на фиг. 32С. Фиг. 32В и 32С представляет собой электростатическое представление доступной для растворителя поверхности ERα, где красный цвет представляет собой электроотрицательную, и синий представляет собой электроположительную поверхность.
[00273] Аналогичный анализ ДИС проводили для фулвестранта с 2BJ4, как описано выше. ДИС фулвестрант-2BJ4 привел к получению Gscore, который составлял -14,945, и продемонстрировал взаимодействия водородной связи с Е353, Y526 и Н524 и пи-взаимодействия с F404 (фиг. 33А-33С). На фиг. 33А представлены области в сайте связывания, подходящие для акцепторной группы водородной связи (красный), донорной группы водородной связи (синий) и гидрофобной группы (желтый). На фиг. 33А светло-синий цвет означает углерод для RAD1901.
[00274] На фиг. 34А и 34В представлены RAD1901 и фулвестрант, состыкованный в 2BJ4 посредством ДИС, оба из которых образовывали пи-взаимодействия с F404 и взаимодействия водородной связи с Е353. Более того, RAD1901 содержал взаимодействие водородной связи с D351 (синий цвет представляет молекулярную поверхность RAD1901, фиг. 34В, в то время как фулвестрант содержал взаимодействие водородной связи с Y526 и Н524 (зеленый цвет представляет молекулярную поверхность фулвестранта, фиг. 34С. Наложения 2BJ4, состыкованного с RAD1901 и фулвестрантом, показаны на фиг. 35А и 35В. На фиг. 35А зеленый цвет представляет собой молекулярную поверхность фулвестранта, и синий цвет представляет собой молекулярную поверхность RAD1901. На фиг. 35В коричневая структура представляет собой фулвестрант, и синяя структура представляет собой RAD1901.
[00275] Пример V(A)-3. Оценка моделирования избранных мутаций ERα.
[00276] Оценивали эффекты различных мутаций ERα в отношении С-конца лиганд-связывающего домена. Конкретные мутации ERα, оценку которых проводили, представляли собой мутант Y537X, где X представлял собой S, N или С; D538G; и S463P.
[00277] Y537 расположен в спирали 12. Данный остаток может регулировать связывание лиганда, гомодимеризацию и связывание ДНК, когда является фосфорилированным, и может позволить ERα избежать опосредованных фосфорилированием контролей и обеспечить клетке потенциальное селективное опухолегенное преимущество. Помимо этого, данный остаток может вызывать конформационные изменения, которые приводят к постоянной активации рецептора.
[00278] Мутация Y537S способствует транскрипционно активной закрытой конформаций кармана независимо от того, занят карман лигандом или нет. Закрытый, но не занятый карман может обуславливать конститутивную активность ERα (Carlson et al. Biochemistry 36:14897-14905 (1997)). Ser537 устанавливает взаимодействие водородной связи с Asp351, которое приводит к изменению конформаций спирали петли 11-12 и к заглублению Leu536 в недоступное для растворителя положение. Данное событие может способствовать конститутивной активности мутантного белка Y537S. Мутация поверхности Y537S не оказывает влияния на структуру кармана ЛСД.
[00279] Y537N распространен в ERα-отрицательном метастазирующем раке молочной железы. Мутация в данном сайте может позволить ERα избежать опосредованных фосфорилированием контролей и обеспечить клетке потенциальное селективное опухолегенное преимущество. В частности, замена Y537N вызывает конформационные изменения в ERα, которые могут имитировать связывание гормона, не нарушая способности рецептора димеризоваться, но предоставляя рецептору функцию конститутивной трансактивации (Zhang et al. Cancer Res 57:1244-1249 (1997)).
[00280] Y537C оказывает аналогичный эффект в отношении Y537N.
[00281] D538G может сдвигать весь энергетический ландшафт посредством стабилизации как активной, так и неактивной конформаций, несмотря на то, что более предпочтительной является активная конформация. Данное событие может приводить к конститутивной активности данного мутанта при отсутствии гормонов, как наблюдалось на устойчивых к гормонам вариантах рака молочной железы (Huang et al., "A newfound cancer activating mutation reshapes the energy landscape of estrogen-binding domain," J.Chem. Theory Comput. 10:2897-2900 (2014)).
[00282] Ни одна из данных мутаций, как ожидается, не оказывает влияния на лиганд-связывающий домен и специфично не препятствует связыванию RAD1901. Y537 и D538 могут вызывать конформационные изменения, которые приводят к конститутивной активации рецептора вне зависимости от связывания лиганда.
[00283] Пример V(B). Анализ связывания конструкций ERα дикого типа и мутанта ЛСД с RAD1901 и другими соединениями in vitro
[00284] Анализ связывания конструкций ERα дикого типа (ДТ) и мутантного ЛСД с RAD1901 in vitro продемонстрировал, что RAD1901 присоединяется к мутантному ERα с аналогичной аффинностью, что и к ERα ДТ.
[00285] Конструкции ERα ДТ и мутантного ЛСД получали посредством экспрессии и очистки соответствующих остатков ЛСД 302-552 с N-концевым тиоредоксином и метками 6xHis, которые отщеплялись протеазой TEV.
[00286] Метод флуоресцентной поляризации (ФП) использовали для определения связывания исследуемых соединений (RAD1901, фулвестранта, базедоксифена, ралоксифена, тамоксифена и AZD9496) с ERα согласно инструкциям производителя (Polar Screen, Invitrogen) с 2 нМ фторомона, 100 нМ конструкции ERα ДТ или мутантного ЛСД. Каждую серию проводили в двух повторах, и анализировали одно исследуемое соединение для определения IC50 для различных конструкций ERα (фиг. 36 для анализа связывания RAD1901).
[00287] Как указано выше, вышеизложенное описание предназначено исключительно для иллюстрации различных вариантов реализации настоящего изобретения. Специфичные модификации, которые обсуждаются выше, не следует истолковывать как ограничения объема настоящего изобретения. Специалисту в данной области техники очевидно, что можно получить различные эквиваленты, изменения и модификации без отклонения от объема настоящего изобретения, и следует понимать, что такие эквивалентные варианты реализации включены в настоящую заявку. Все источники, ссылки на которые содержатся в настоящей заявке, включены посредством ссылки в той же мере, как если бы указанные источники были полностью изложены в настоящей заявке.
Claims (20)
1. Способ лечения рака молочной железы у субъекта, страдающего от рака, положительного по рецептору эстрогенов альфа, который имеет мутантный рецептор эстрогенов альфа, включающий введение указанному субъекту терапевтически эффективного количества комбинации эверолимуса и RAD1901 следующей структуры:
или его соли или сольвата.
2. Способ по п. 1, отличающийся тем, что указанный рак молочной железы является устойчивым к лекарственным препаратам раком молочной железы и является также устойчивым к одному или более вариантам антиэстрогеновой терапии и/или терапии ингибитором ароматазы.
3. Способ по п. 2, отличающийся тем, что указанный один или более антиэстрогенов выбраны из группы, состоящей из тамоксифена, торемифена и фулвестранта, и указанный один или более ингибиторов ароматазы выбраны из группы, состоящей из аромазина, летрозола и анастрозола.
4. Способ по п. 1, отличающийся тем, что у указанного субъекта экспрессируется по меньшей мере один мутантный рецептор эстрогенов альфа, выбранный из группы, состоящей из D538G, Y537S, Y537N, Y537C, E380Q, S463P, L536R, L536Q, Р535Н, V392I и V534E.
5. Способ по п. 4, отличающийся тем, что указанный мутантный рецептор эстрогенов альфа выбран из группы, состоящей из Y537S, Y537N, Y537C, D538G, L536R, S463P и E380Q.
6. Способ по п. 4, отличающийся тем, что указанный мутантный рецептор альфа представляет собой Y537S.
7. Способ по п. 1, отличающийся тем, что указанный RAD1901 вводят в общей суточной дозе от 100 мг до 1000 мг.
8. Способ по п. 7, отличающийся тем, что указанный RAD1901 вводят в общей суточной дозе 100 мг, 200 мг, 300 мг, 400 мг, 500 мг, 600 мг, 700 мг, 800 мг, 900 мг или 1000 мг.
9. Способ по п. 4, отличающийся тем, что указанная суточная доза доставляется в виде двух отдельных доз.
10. Способ по п. 9, отличающийся тем, что указанные отдельные дозы представляют собой одинаковые дозы.
11. Способ по п. 1, отличающийся тем, что указанный субъект представляет собой женщину в постменопаузальном периоде.
12. Способ по любому из пп. 1-11, отличающийся тем, что для указанного субъекта впервые установлена необходимость лечения в результате анализа на предмет повышенной экспрессии одного или более генов, выбранных из ABL1, AKT1, AKT2, ALK, АРС, AR, ARID1A, ASXL1, АТМ, AURKA, ВАР, ВАР1, BCL2L11, BCR, BRAF, BRCA1, BRCA2, CCND1, CCND2, CCND3, CCNE1, CDH1, CDK4, CDK6, CDK8, CDKN1A, CDKN1B, CDKN2A, CDKN2B, СЕВРА, CTNNB1, DDR2, DNMT3A, E2F3, EGFR, EML4, ЕРНВ2, ERBB2, ERBB3, ESR1, EWSR1, FBXW7, FGF4, FGFR1, FGFR2, FGFR3, FLT3, FRS2, HIF1A, HRAS, IDH1, IDH2, IGF1R, JAK2, KDM6A, KDR, KIF5B, KIT, KRAS, LRP1B, MAP2K1, MAP2K4, MCL1, MDM2, MDM4, МЕТ, MGMT, MLL, MPL, MSH6, MTOR, MYC, NF1, NF2, NKX2-1, NOTCH1, NPM, NRAS, PDGFRA, PIK3CA, PIK3R1, PML, PTEN, PTPRD, RARA, RB1, RET, RICTOR, ROS1, RPTOR, RUNX1, SMAD4, SMARCA4, SOX2, STK11, ТЕТ2, ТР53, TSC1, TSC2 и VHL.
13. Способ по п. 12, отличающийся тем, что указанный один или более генов выбраны из AKT1, AKT2, BRAF, CDK4, CDK6, PIK3CA, PIK3R1 и MTOR.
14. Способ по п. 1, отличающийся тем, что указанный эверолимус вводят в дозе от 1 мг до 500 мг в сутки.
15. Способ по п. 14, отличающийся тем, что указанный эверолимус вводят в дозе от 5 мг до 100 мг в сутки.
16. Способ по п. 1, отличающийся тем, что указанный эверолимус вводят в суточной дозе 10 мг.
17. Способ по п. 1, отличающийся тем, что указанный эверолимус вводят в суточной дозе от 2,5 мг до 7,5 мг.
18. Способ по п. 1, отличающийся тем, что указанный эверолимус вводят один раз в день.
Applications Claiming Priority (27)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562154699P | 2015-04-29 | 2015-04-29 | |
| US62/154,699 | 2015-04-29 | ||
| US201562155451P | 2015-04-30 | 2015-04-30 | |
| US62/155,451 | 2015-04-30 | ||
| US201562158469P | 2015-05-07 | 2015-05-07 | |
| US62/158,469 | 2015-05-07 | ||
| US201562192944P | 2015-07-15 | 2015-07-15 | |
| US201562192940P | 2015-07-15 | 2015-07-15 | |
| US62/192,944 | 2015-07-15 | ||
| US62/192,940 | 2015-07-15 | ||
| US201562252085P | 2015-11-06 | 2015-11-06 | |
| US62/252,085 | 2015-11-06 | ||
| US201562252916P | 2015-11-09 | 2015-11-09 | |
| US62/252,916 | 2015-11-09 | ||
| US201562265696P | 2015-12-10 | 2015-12-10 | |
| US201562265774P | 2015-12-10 | 2015-12-10 | |
| US201562265663P | 2015-12-10 | 2015-12-10 | |
| US201562265658P | 2015-12-10 | 2015-12-10 | |
| US62/265,658 | 2015-12-10 | ||
| US62/265,696 | 2015-12-10 | ||
| US62/265,774 | 2015-12-10 | ||
| US62/265,663 | 2015-12-10 | ||
| US201662323576P | 2016-04-15 | 2016-04-15 | |
| US201662323572P | 2016-04-15 | 2016-04-15 | |
| US62/323,576 | 2016-04-15 | ||
| US62/323,572 | 2016-04-15 | ||
| PCT/US2016/030316 WO2016176664A1 (en) | 2015-04-29 | 2016-04-29 | Methods for treating cancer |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2017140676A RU2017140676A (ru) | 2019-05-29 |
| RU2017140676A3 RU2017140676A3 (ru) | 2019-09-27 |
| RU2745678C2 true RU2745678C2 (ru) | 2021-03-30 |
Family
ID=57198783
Family Applications (3)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017140674A RU2737496C2 (ru) | 2015-04-29 | 2016-04-29 | Способы лечения рака |
| RU2017140675A RU2747228C2 (ru) | 2015-04-29 | 2016-04-29 | Способы лечения рака |
| RU2017140676A RU2745678C2 (ru) | 2015-04-29 | 2016-04-29 | Способы лечения рака |
Family Applications Before (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2017140674A RU2737496C2 (ru) | 2015-04-29 | 2016-04-29 | Способы лечения рака |
| RU2017140675A RU2747228C2 (ru) | 2015-04-29 | 2016-04-29 | Способы лечения рака |
Country Status (14)
| Country | Link |
|---|---|
| US (10) | US20180214393A1 (ru) |
| EP (4) | EP3288382A4 (ru) |
| JP (8) | JP7019422B2 (ru) |
| KR (6) | KR20240110098A (ru) |
| CN (5) | CN108024541B (ru) |
| AU (3) | AU2016256471B2 (ru) |
| BR (3) | BR112017023269A2 (ru) |
| CA (3) | CA2984195C (ru) |
| HK (3) | HK1251408A1 (ru) |
| IL (7) | IL255261B2 (ru) |
| MX (6) | MX2017013802A (ru) |
| RU (3) | RU2737496C2 (ru) |
| SG (4) | SG10202104177VA (ru) |
| WO (3) | WO2016176666A1 (ru) |
Families Citing this family (32)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9421264B2 (en) | 2014-03-28 | 2016-08-23 | Duke University | Method of treating cancer using selective estrogen receptor modulators |
| HRP20230365T1 (hr) | 2014-03-28 | 2023-06-23 | Duke University | Liječenje raka dojke uporabom selektivnih modulatora receptora estrogena |
| IL255261B2 (en) * | 2015-04-29 | 2024-03-01 | Radius Pharmaceuticals Inc | A combination of an m-TOR inhibitor and RAD1901 for use in a method to inhibit cancer growth or to produce tumor regression in patients with resistance to the drug and/or patients with cancer positive for an estrogen receptor alpha mutation |
| PT3416962T (pt) | 2016-02-15 | 2021-07-23 | Sanofi Sa | Derivados de 6,7-di-hidro-5h-benzo[7]anuleno como moduladores do recetor de estrogénio |
| TWI808055B (zh) | 2016-05-11 | 2023-07-11 | 美商滬亞生物國際有限公司 | Hdac 抑制劑與 pd-1 抑制劑之組合治療 |
| TWI794171B (zh) | 2016-05-11 | 2023-03-01 | 美商滬亞生物國際有限公司 | Hdac抑制劑與pd-l1抑制劑之組合治療 |
| KR20230152814A (ko) * | 2016-09-27 | 2023-11-03 | 래디어스 파마슈티컬스, 인코포레이티드 | 난소암을 치료하기 위한 방법 |
| KR102462433B1 (ko) * | 2016-10-11 | 2022-11-03 | 듀크 유니버시티 | Er+ 유방암의 라소폭시펜 치료 |
| SG11201903908PA (en) | 2016-11-17 | 2019-05-30 | Sanofi Sa | Novel substituted n-(3-fluoropropyl)-pyrrolidine compounds, processes for their preparation and therapeutic uses thereof |
| EP4374925A2 (en) * | 2017-01-05 | 2024-05-29 | Radius Pharmaceuticals, Inc. | Polymorphic forms of rad1901-2hcl |
| MA47776A (fr) * | 2017-03-16 | 2020-01-22 | Eisai R&D Man Co Ltd | Polythérapies pour le traitement du cancer du sein |
| US12012421B2 (en) | 2017-07-07 | 2024-06-18 | Hoffmann-La Roche Inc. | Solid forms of [(1S)-1-[(2S,4R,5R)-5-(5-amino-2-oxo-thiazolo[4,5-d]pyrimidin-3-yl)-4-hydroxy-tetrahydrofuran-2-yl]propyl] acetate |
| EP3434272A1 (en) | 2017-07-25 | 2019-01-30 | Sanofi | Combination comprising palbociclib and 6-(2,4-dichlorophenyl)-5-[4-[(3s)-1-(3-fluoropropyl)pyrrolidin-3-yl]oxyphenyl]-8,9-dihydro-7h-benzo[7]annulene-2-carboxylic acid |
| EP3709997A1 (en) | 2017-11-16 | 2020-09-23 | Novartis AG | Pharmaceutical combination comprising lsz102 and ribociclib |
| US12012420B2 (en) | 2017-11-21 | 2024-06-18 | Hoffmann-La Roche, Inc. | Solid forms of [(1S)-1-[(2S,4R,5R)-5-(5-amino-2-oxo-thiazolo[4,5-d]pyrimidin-3-yl)-4-hydroxy-tetrahydrofuran-2-yl]propyl] acetate |
| EP3716969A1 (en) | 2017-12-01 | 2020-10-07 | Novartis AG | Pharmaceutical combination comprising lsz102 and alpelisib |
| EP3773524A4 (en) | 2018-04-10 | 2021-12-22 | Duke University | TREATMENT OF BREAST CANCER WITH LASOFOXIFEN |
| CN110585429B (zh) * | 2018-06-12 | 2022-10-21 | 江苏恒瑞医药股份有限公司 | 酪氨酸激酶抑制剂联合单克隆抗体以及紫杉醇类药物治疗肿瘤疾病的用途 |
| AU2019297421B2 (en) | 2018-07-04 | 2024-08-29 | Radius Pharmaceuticals, Inc. | Polymorphic forms of RAD 1901-2HCL |
| IL281191B (en) | 2018-09-07 | 2022-07-01 | Sanofi Sa | Salts of methyl 6-(4,2-dichlorophenyl)-5-[4-[(s3)-1-(3-fluoropropyl)pyrrolidine-3-yl]oxyphenyl]-9,8-dihydro-h7-benzo[7 ]anolane-2-carboxylate and processes for their preparation |
| WO2020112765A1 (en) * | 2018-11-30 | 2020-06-04 | Radius Pharmaceuticals, Inc. | Elacestrant in combination with abemaciclib in women with breast cancer |
| JP7504097B2 (ja) * | 2018-12-06 | 2024-06-21 | ラジウス ファーマシューティカルズ,インコーポレイテッド | Cdk4/6阻害剤に耐性の癌を治療するための方法 |
| SG11202105915UA (en) * | 2018-12-06 | 2021-07-29 | Radius Pharmaceuticals Inc | Methods for treating cancer in models harboring esr1 mutations |
| US11464786B2 (en) * | 2018-12-12 | 2022-10-11 | Chemocentryx, Inc. | CXCR7 inhibitors for the treatment of cancer |
| KR102341347B1 (ko) * | 2019-11-28 | 2021-12-20 | 의료법인 성광의료재단 | 암 치료제에 대한 내성 암의 진단을 위한 조성물, 키트 및 방법 |
| JP2023516291A (ja) * | 2020-03-06 | 2023-04-19 | オレマ ファーマシューティカルズ インク. | エストロゲン受容体関連疾患の治療方法 |
| IL298071A (en) * | 2020-05-12 | 2023-01-01 | Genentech Inc | Treatment of breast cancer using combination therapies including gdc-9545 and a cdk4/6 inhibitor |
| CN113662942B (zh) * | 2021-08-19 | 2023-02-07 | 中国人民解放军陆军军医大学第一附属医院 | 药物组合物及其在smo突变性髓母细胞瘤中的应用 |
| WO2023064519A1 (en) | 2021-10-14 | 2023-04-20 | Teva Pharmaceuticals International Gmbh | Solid state forms of elacestrant and processes for preparation thereof |
| GB202116903D0 (en) | 2021-11-18 | 2022-01-05 | Sermonix Pharmaceuticals Inc | Lasofoxifene treatment of aromatase-resistant er+ cancer |
| WO2024104268A1 (zh) * | 2022-11-15 | 2024-05-23 | 苏州科睿思制药有限公司 | 艾拉司群二盐酸盐的共晶及其制备方法和用途 |
| KR20240105964A (ko) * | 2022-12-29 | 2024-07-08 | 주식회사 삼양홀딩스 | 약동학적 특성이 우수한 풀베스트란트의 약학 조성물 및 그 제조 방법 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110124617A1 (en) * | 2008-05-09 | 2011-05-26 | Lyttle C Richard | Combination Therapy for BreastCancer Comprising an Antiestrogenic Agent |
| WO2014203129A1 (en) * | 2013-06-19 | 2014-12-24 | Olema Pharmaceuticals, Inc. | Combinations of benzopyran compounds, compositions and uses thereof |
Family Cites Families (158)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE3939346A1 (de) | 1989-11-29 | 1991-06-06 | Behringwerke Ag | Arzneimitel zur subkutanen oder intramuskulaeren applikation enthaltend polypeptide |
| US5977070A (en) | 1992-07-14 | 1999-11-02 | Piazza; Christin Teresa | Pharmaceutical compositions for the nasal delivery of compounds useful for the treatment of osteoporosis |
| US5589452A (en) | 1992-07-14 | 1996-12-31 | Syntex (U.S.A.) Inc. | Analogs of parathyroid hormone and parathyroid hormone related peptide: synthesis and use for the treatment of osteoporosis |
| US5821225A (en) | 1992-07-14 | 1998-10-13 | Syntex (U.S.A.) Inc. | Method for the treatment of corticosteroid induced osteopenia comprising administration of modified PTH or PTHrp |
| DE19517430A1 (de) | 1995-05-12 | 1996-11-14 | Boehringer Mannheim Gmbh | Pharmazeutische Darreichungsform von Parathormon mit einer zwei- bis sechsstündigen Wirkstoff-Freisetzungsperiode |
| IT1285405B1 (it) | 1995-06-06 | 1998-06-03 | Alza Corp | Modificazione di farmaci polipeptidici per accrescere il flusso per elettrotrasporto. |
| US5969095A (en) | 1995-07-13 | 1999-10-19 | Biomeasure, Inc. | Analogs of parathyroid hormone |
| US7410948B2 (en) | 1995-07-13 | 2008-08-12 | Societe De Conseils De Recherches Et D'applications Scientifiques, Sas | Analogs of parathyroid hormone |
| US6544949B1 (en) | 1995-07-13 | 2003-04-08 | Societe De Conseils De Recherches Et D'applications Scientifiques, S.A.S. | Analogs of parathyroid hormone |
| US5723577A (en) | 1995-07-13 | 1998-03-03 | Biomeasure Inc. | Analogs of parathyroid hormone |
| US5955574A (en) | 1995-07-13 | 1999-09-21 | Societe De Conseils De Recherches Et D'applications Scientifiques, S.A. | Analogs of parathyroid hormone |
| DE19538687A1 (de) | 1995-10-17 | 1997-04-24 | Boehringer Mannheim Gmbh | Stabile pharmazeutische Darreichungsformen enthaltend Parathormon |
| DE19539574A1 (de) | 1995-10-25 | 1997-04-30 | Boehringer Mannheim Gmbh | Zubereitungen und Verfahren zur Stabilisierung biologischer Materialien mittels Trocknungsverfahren ohne Einfrieren |
| TW518219B (en) | 1996-04-26 | 2003-01-21 | Chugai Pharmaceutical Co Ltd | Erythropoietin solution preparation |
| TW505654B (en) | 1996-07-30 | 2002-10-11 | Hoffmann La Roche | Synthesis of analogs of PTH and PTHrP |
| PT951551E (pt) | 1996-12-23 | 2008-10-28 | Immunex Corp | Ligando para receptor activador de nf-kb, ligando membro da superfamília de tnf |
| US6136784A (en) | 1997-01-08 | 2000-10-24 | Amylin Pharmaceuticals, Inc. | Amylin agonist pharmaceutical compositions containing insulin |
| US6316408B1 (en) | 1997-04-16 | 2001-11-13 | Amgen Inc. | Methods of use for osetoprotegerin binding protein receptors |
| DE69830591T2 (de) | 1997-09-09 | 2006-05-04 | F. Hoffmann-La Roche Ag | HEILUNG VON BRUCHVERLETZUNGEN UNTER VERWENDUNG VON PTHrP ANALOGEN |
| US6770623B1 (en) | 1997-12-09 | 2004-08-03 | Eli Lilly And Company | Stabilized teriparatide solutions |
| ZA9811127B (en) | 1997-12-09 | 2000-07-11 | Lilly Co Eli | Stabilized teriparatide solutions. |
| AU757192B2 (en) | 1997-12-11 | 2003-02-06 | Alza Corporation | Device for enhancing transdermal agent flux |
| US6050988A (en) | 1997-12-11 | 2000-04-18 | Alza Corporation | Device for enhancing transdermal agent flux |
| EP0922467A3 (en) | 1997-12-12 | 2000-05-24 | Takeda Chemical Industries, Ltd. | Iontophoretic drug delivery |
| JP4154017B2 (ja) | 1997-12-30 | 2008-09-24 | 久光製薬株式会社 | イオントフォレーシス装置および薬物ユニット |
| US6091975A (en) | 1998-04-01 | 2000-07-18 | Alza Corporation | Minimally invasive detecting device |
| SE9801495D0 (sv) | 1998-04-28 | 1998-04-28 | Astra Ab | Protein formulationa |
| US6316410B1 (en) | 1999-09-22 | 2001-11-13 | National Research Council Of Canada | Parathyroid hormone analogues for the treatment of osteoporosis |
| WO2001036039A2 (en) | 1999-11-17 | 2001-05-25 | Novartis Ag | Iontophoretic transdermal delivery of peptides |
| GB9930882D0 (en) | 1999-12-30 | 2000-02-23 | Nps Allelix Corp | GLP-2 formulations |
| US20010044431A1 (en) | 2000-03-21 | 2001-11-22 | Rodriguez Gustavo C. | Prevention of ovarian cancer by administration of products that induce biologic effects in the ovarian epithelium |
| US20050124537A1 (en) | 2000-04-27 | 2005-06-09 | Amgen Inc. | Modulators of receptors for parathyroid hormone and parathyroid hormone-related protein |
| US6756480B2 (en) | 2000-04-27 | 2004-06-29 | Amgen Inc. | Modulators of receptors for parathyroid hormone and parathyroid hormone-related protein |
| ES2283425T3 (es) | 2000-08-03 | 2007-11-01 | Antares Pharma Ipl Ag | Nueva composicion para la administracion transdermica y/o transmucosa de compuestos activos que asegura niveles terapeutiocos adecuados. |
| CZ2003514A3 (cs) | 2000-08-23 | 2003-10-15 | Akzo Nobel N. V. | Fluorenové deriváty a jejich analogy |
| US7371721B2 (en) | 2000-09-18 | 2008-05-13 | Sanos Bioscience A/S | Use of GLP-2 and related compounds for the treatment, prevention, diagnosis, and prognosis of bone-related disorders and calcium homeostasis related syndromes |
| US7186683B2 (en) | 2000-09-18 | 2007-03-06 | Sanos Bioscience A/S | Use of GLP for the treatment, prevention, diagnosis, and prognosis of bone-related and nutrition-related disorders |
| MXPA03003815A (es) | 2000-10-26 | 2004-08-12 | Johnson & Johnson | Dispositivos de suministro transdermico de farmaco que tienen microrresaltos recubiertos. |
| CN100349632C (zh) | 2001-04-20 | 2007-11-21 | 阿尔扎公司 | 具有包含有益药剂的涂层的微小突出物阵列 |
| NZ530765A (en) | 2001-06-26 | 2006-11-30 | Amgen Fremont Inc | Antibodies that bind OPGL and compositions and methods for the treatment of bone diseases |
| US6881203B2 (en) | 2001-09-05 | 2005-04-19 | 3M Innovative Properties Company | Microneedle arrays and methods of manufacturing the same |
| US8853266B2 (en) | 2001-12-06 | 2014-10-07 | University Of Tennessee Research Foundation | Selective androgen receptor modulators for treating diabetes |
| DE60223844T2 (de) | 2001-12-20 | 2008-08-28 | Alza Corp., Mountain View | Mikrovorsprünge zum durchstechen der haut mit stechtiefensteuerung |
| WO2003063859A1 (en) | 2002-01-14 | 2003-08-07 | Nordic Bioscience A/S | Suppression of cartilage degradation via the estrogen receptor |
| AU2003219787A1 (en) | 2002-02-14 | 2003-09-04 | Bayer Pharmaceuticals Corporation | Formulation strategies in stabilizing peptides in organic solvents and in dried states |
| AU2003239869A1 (en) | 2002-05-23 | 2003-12-12 | Michael Holick | Use of a parathyroid hormone peptide analogs for the treatment of vaginal atrophy |
| TW200307553A (en) | 2002-05-24 | 2003-12-16 | Akzo Nobel Nv | Treatment of post-menopausal complaints in breast cancer patients |
| US7799757B2 (en) | 2002-06-13 | 2010-09-21 | Michael Chorev | Analogs of parathyroid hormone and PTH-related protein as bone anabolic agents |
| US20050276823A1 (en) | 2002-07-12 | 2005-12-15 | Cini John K | Methods and compositions for preventing oxidative degradation of proteins |
| AU2003251831B2 (en) | 2002-07-19 | 2009-06-11 | 3M Innovative Properties Company | Microneedle devices and microneedle delivery apparatus |
| US7411039B2 (en) | 2002-10-14 | 2008-08-12 | Novo Nordisk A/S | GLP-2 compounds, formulations, and uses thereof |
| KR20050059258A (ko) | 2002-10-14 | 2005-06-17 | 노보 노르디스크 에이/에스 | Glp-2 화합물, 제제, 및 그것의 사용 |
| US8133505B2 (en) | 2002-10-31 | 2012-03-13 | Transpharma Medical Ltd. | Transdermal delivery system for dried particulate or lyophilized medications |
| US7383084B2 (en) | 2002-10-31 | 2008-06-03 | Transpharma Medical Ltd. | Transdermal delivery system for dried particulate or lyophilized medications |
| IL152574A (en) | 2002-10-31 | 2009-09-22 | Transpharma Medical Ltd | A system for passing through the skin of dry items or dried medicines |
| US7662404B2 (en) | 2002-10-31 | 2010-02-16 | Transpharma Medical Ltd. | Transdermal delivery system for dried particulate or lyophilized peptides and polypeptides |
| WO2004060386A1 (en) | 2002-11-01 | 2004-07-22 | Amgen, Inc. | Modulators of receptors for parathyrois hormone and parathyroid hormone-related protein |
| WO2004058682A1 (ja) * | 2002-12-26 | 2004-07-15 | Eisai Co., Ltd. | 選択的エストロゲン受容体モジュレーター |
| JP2007505164A (ja) | 2003-06-10 | 2007-03-08 | スミスクライン ビーチャム コーポレーション | アンドロゲン、グルココルチコイド、ミネラルコルチコイドおよびプロゲステロン受容体のモジュレーターとしての1−アミノナフタレン類 |
| WO2005000795A2 (en) | 2003-06-10 | 2005-01-06 | Smithkline Beecham Corporation | Aniline derivatived androgen-, glucocorticoid-, mineralcorticoid- and progesterone- receptor modulators |
| WO2005000309A2 (en) | 2003-06-27 | 2005-01-06 | Ionix Pharmaceuticals Limited | Chemical compounds |
| PL1638468T3 (pl) | 2003-06-30 | 2008-01-31 | Alza Corp | Sposób powlekania mikrowystępów do przekłuwania skóry |
| CN1842320B (zh) | 2003-06-30 | 2013-06-19 | 阿尔扎公司 | 含有不挥发性平衡离子的用于经涂覆的微突出物的制剂 |
| WO2005014034A1 (en) | 2003-07-14 | 2005-02-17 | Nps Allelix Corp. | Stabilized formulation of parathyroid hormone |
| US7141544B2 (en) | 2003-10-10 | 2006-11-28 | Baxter International, Inc. | Stabilization of pharmaceutical protein formulations with small peptides |
| GB0324551D0 (en) | 2003-10-21 | 2003-11-26 | Karobio Ab | Novel compounds |
| US20050124625A1 (en) | 2003-10-21 | 2005-06-09 | Salvati Mark E. | Piperazine derivatives and their use as modulators of nuclear hormone receptor function |
| BRPI0415967A (pt) | 2003-10-28 | 2007-01-23 | Alza Corp | aplicação de conjugados de polìmero de peptìdeos e proteìnas terapêuticos através de microprojeções revestidas |
| CA2543641A1 (en) | 2003-10-31 | 2005-05-19 | Alza Corporation | Self-actuating applicator for microprojection array |
| AU2004292954A1 (en) | 2003-11-13 | 2005-06-09 | Alza Corporation | Composition and apparatus for transdermal delivery |
| EP1687274A1 (en) | 2003-11-20 | 2006-08-09 | Warner-Lambert Company LLC | Androgen receptor modulators |
| US20050112135A1 (en) | 2003-11-21 | 2005-05-26 | Cormier Michel J. | Ultrasound assisted transdermal vaccine delivery method and system |
| IL159273A0 (en) | 2003-12-09 | 2004-06-01 | Transpharma Medical Ltd | Transdermal delivery system for sustained release of polypeptides |
| AU2003297904A1 (en) | 2003-12-12 | 2005-07-14 | University Of Maryland, Baltimore | Immunomodulatory compounds that target and inhibit the py+3 binding site of tyrosene kinase p56 lck sh2 domain |
| AU2005203922A1 (en) | 2004-01-07 | 2005-07-21 | Endorecherche, Inc. | Helix 12 directed steroidal pharmaceutical products |
| IL160033A0 (en) | 2004-01-25 | 2004-06-20 | Transpharma Medical Ltd | Transdermal delivery system for polynucleotides |
| TWI359026B (en) | 2004-02-12 | 2012-03-01 | Sankyo Co | Pharmaceutical composition for the osteoclast rela |
| GB0405033D0 (en) | 2004-03-05 | 2004-04-07 | Karobio Ab | Novel pharmaceutical compositions |
| CN1942187A (zh) | 2004-04-08 | 2007-04-04 | 默克公司 | 作为雄激素受体调节剂的17β-乙酰胺-4-氮杂甾体化合物 |
| CN101151048A (zh) | 2004-05-10 | 2008-03-26 | 纳斯泰克制药公司 | 增强甲状旁腺激素粘膜递送的组合物和方法 |
| CA2565544A1 (en) | 2004-05-11 | 2005-11-17 | Pfizer Products Inc. | Benzonitrile derivatives to treat musculoskeletal frailty |
| MXPA06013168A (es) | 2004-05-13 | 2007-05-15 | Johnson & Johnson | Aparato y metodo para el suministro transdermico de agentes de la hormona paratiroidea. |
| WO2005113008A1 (en) | 2004-05-21 | 2005-12-01 | Mediplex Corp. | Delivery agents for enhancing mucosal absorption of therapeutic agents |
| US7906137B2 (en) | 2004-05-21 | 2011-03-15 | Mediplex Corporation, Korea | Delivery agents for enhancing mucosal absorption of therapeutic agents |
| US20090069226A1 (en) | 2004-05-28 | 2009-03-12 | Amylin Pharmaceuticals, Inc. | Transmucosal delivery of peptides and proteins |
| TW200621282A (en) | 2004-08-13 | 2006-07-01 | Wyeth Corp | Stabilizing formulations |
| AU2005310238A1 (en) | 2004-10-29 | 2006-06-08 | Merck Sharp & Dohme Corp. | N-(pyridin-3-yl)-2-phenylbutanamides as androgen receptor modulators |
| US8057842B2 (en) | 2004-11-18 | 2011-11-15 | 3M Innovative Properties Company | Method of contact coating a microneedle array |
| US7846488B2 (en) | 2004-11-18 | 2010-12-07 | 3M Innovative Properties Company | Masking method for coating a microneedle array |
| JP2008520331A (ja) | 2004-11-18 | 2008-06-19 | トランスファーマ メディカル リミテッド | 薬剤の経皮的送達のためのマイクロチャネル形成とイオントフォレーシスの組合せ |
| JP2008528509A (ja) | 2005-01-21 | 2008-07-31 | アルザ コーポレイション | 少なくとも1つの対イオンを含む、向上した安定性でマイクロニードルをコーティングするための治療用ペプチド製剤 |
| EP1871379A4 (en) | 2005-04-15 | 2010-06-02 | Glaxosmithkline Llc | CYANOARYLAMINE |
| KR100700869B1 (ko) | 2005-06-03 | 2007-03-29 | 재단법인 목암생명공학연구소 | Pth, 완충제 및 안정제를 포함하는 안정한 pth조성물 |
| US20090170907A1 (en) | 2005-06-06 | 2009-07-02 | Smithkline Beecham Corporation | Chemical Compounds |
| US20090227571A1 (en) | 2005-07-01 | 2009-09-10 | Ligand Pharmaceuticals Incorporated | Androgen Receptor Modulator Compounds and Methods |
| US20070021216A1 (en) | 2005-07-19 | 2007-01-25 | Sony Ericsson Mobile Communications Ab | Seamless gaming method and apparatus |
| JP2008303145A (ja) | 2005-09-22 | 2008-12-18 | Takeda Chem Ind Ltd | Grk阻害剤からなる強心薬 |
| WO2007061781A1 (en) | 2005-11-18 | 2007-05-31 | 3M Innovative Properties Company | Coatable compositions, coatings derived therefrom and microarrays having such coatings |
| WO2007084247A2 (en) | 2005-12-28 | 2007-07-26 | Alza Corporation | Stable therapeutic formulations |
| EP2001453A4 (en) | 2006-03-15 | 2012-09-12 | Alza Corp | APPARATUS AND METHOD FOR TRANSDERMAL DELIVERY OF PARATHYROID HORMONE AGENTS FOR TREATING OR PREVENTING OSTEOPENIA |
| US9119945B2 (en) | 2006-04-20 | 2015-09-01 | 3M Innovative Properties Company | Device for applying a microneedle array |
| WO2007124409A2 (en) | 2006-04-20 | 2007-11-01 | Velocys, Inc. | Process for treating and/or forming a non-newtonian fluid using microchannel process technology |
| WO2007124465A2 (en) | 2006-04-20 | 2007-11-01 | Amgen Inc. | Stable emulsion formulations |
| CN101085743B (zh) | 2006-06-06 | 2012-02-15 | 浙江大德药业集团有限公司 | 含氟烷氧基康普立停衍生物及制法和用途 |
| CA2656067C (en) | 2006-06-23 | 2014-08-12 | Radius Health, Inc. | Treatment of vasomotor symptoms with selective estrogen receptor modulators |
| JP5215300B2 (ja) | 2006-07-12 | 2013-06-19 | ユニバーシティ オブ テネシー リサーチ ファウンデーション | 置換アシルアニリドおよびそれらの使用方法 |
| CN103251579B (zh) | 2006-08-24 | 2016-12-28 | 田纳西大学研究基金会 | 取代的n-酰基苯胺及其使用方法 |
| JP5815206B2 (ja) | 2006-08-25 | 2015-11-17 | アレス トレーディング ソシエテ アノニム | Fgf−18を用いた軟骨障害の治療 |
| CN1927815A (zh) | 2006-09-25 | 2007-03-14 | 天津理工大学 | 邻苄胺基苯基醚化合物、化合物的衍生物及其制备方法与用途 |
| WO2008063279A2 (en) | 2006-10-03 | 2008-05-29 | Radius Health, Inc. | A stable composition comprising a bone anabolic protein, namely a pthrp analogue, and uses thereof |
| US7803770B2 (en) | 2006-10-03 | 2010-09-28 | Radius Health, Inc. | Method of treating osteoporosis comprising administration of PTHrP analog |
| WO2008044033A1 (en) | 2006-10-11 | 2008-04-17 | Astrazeneca Ab | Amide derivatives |
| EP2119469B1 (en) | 2007-02-06 | 2014-05-14 | Hisamitsu Pharmaceutical Co., Inc. | Microneedle device for diagnosis of allergy |
| WO2008121602A1 (en) | 2007-03-29 | 2008-10-09 | Smithkline Beecham Corporation | Chemical compounds |
| WO2008124000A2 (en) | 2007-04-02 | 2008-10-16 | Ligand Pharmaceuticals Incorporated | Thiazole derivatives as androgen receptor modulator compounds |
| AU2008241470B2 (en) | 2007-04-16 | 2013-11-07 | Corium Pharma Solutions, Inc. | Solvent-cast microneedle arrays containing active |
| GB0707938D0 (en) | 2007-04-25 | 2007-05-30 | Univ Strathclyde | Precipitation stabilising compositions |
| EP2155905A1 (en) | 2007-05-31 | 2010-02-24 | Dako Denmark A/S | Methods for utilizing esr copy number changes in breast cancer treatments and prognoses |
| EP2171447A1 (en) | 2007-06-12 | 2010-04-07 | Schering Corporation | Histone h2ax (hh2ax) biomarker for fti sensitivity |
| US8450481B2 (en) | 2007-06-14 | 2013-05-28 | The Regents Of The University Of California | Compounds for inhibiting protein aggregation, and methods for making and using them |
| US20120150023A1 (en) | 2007-08-06 | 2012-06-14 | Kaspar Roger L | Microneedle arrays for active agent delivery |
| JP5559054B2 (ja) | 2007-09-28 | 2014-07-23 | ザ クイーンズ ユニヴァーシティ オブ ベルファスト | 送達装置および方法 |
| US20090117158A1 (en) | 2007-10-23 | 2009-05-07 | Mahmoud Ameri | Transdermal sustained release drug delivery |
| EP2052736A1 (en) | 2007-10-26 | 2009-04-29 | Nycomed Danmark ApS | Parathyroid hormone formulations und uses thereof |
| CN101795680A (zh) | 2007-11-16 | 2010-08-04 | 波苏蛋白试剂公司 | 稳定蛋白质的辅剂 |
| WO2009133861A1 (ja) | 2008-04-28 | 2009-11-05 | 武田薬品工業株式会社 | 環状アミン化合物 |
| WO2010022176A1 (en) | 2008-08-19 | 2010-02-25 | Ferring International Center S.A. | Methods of treatment for skeletal conditons |
| CN102281865B (zh) | 2008-10-15 | 2017-04-05 | 精达制药公司 | 高浓缩药物颗粒、制剂、混悬剂及其应用 |
| WO2010052879A1 (ja) | 2008-11-04 | 2010-05-14 | あすか製薬株式会社 | 卵胞刺激ホルモン含有水性組成物 |
| RU2494769C2 (ru) | 2008-11-18 | 2013-10-10 | 3М Инновейтив Пропертиз Компани | Массив полых микроигл и способ его использования |
| EP2383013A4 (en) | 2008-12-26 | 2012-11-28 | Hisamitsu Pharmaceutical Co | MICRO NEEDLE DEVICE |
| US20100203014A1 (en) | 2009-02-04 | 2010-08-12 | Aegis Therapeutics Llc | Zwitterionic buffered acidic peptide and protein formulations |
| US20100226966A1 (en) | 2009-03-03 | 2010-09-09 | Daddona Peter E | Method for transdermal controlled release drug delivery |
| WO2010118287A1 (en) | 2009-04-10 | 2010-10-14 | Radius Health, Inc. | Selective androgen receptor modulators |
| ES2634667T3 (es) | 2009-04-24 | 2017-09-28 | Corium International, Inc. | Métodos para fabricar conjuntos de microproyección |
| BR112012001685B8 (pt) | 2009-07-31 | 2021-06-22 | 3M Innovative Properties Co | conjuntos de microagulhas ocas |
| EP2496262A2 (en) | 2009-11-02 | 2012-09-12 | Université de Genève | Stabilized protein formulations and use thereof |
| US20110172609A1 (en) | 2010-01-08 | 2011-07-14 | Ratio, Inc. | Microneedle component assembly for drug delivery device |
| CN101912600B (zh) | 2010-01-11 | 2014-01-29 | 杨国汉 | 改善胰岛素在溶液中稳定性的方法 |
| IE20100174A1 (en) | 2010-03-25 | 2012-02-29 | Trinity College Dublin | Transdermal administration of peptides |
| EP2566501B1 (en) | 2010-05-04 | 2019-03-13 | Corium International, Inc. | Method and device for transdermal delivery of parathyroid hormone using a microprojection array |
| EP2575845B1 (en) | 2010-05-28 | 2017-02-15 | 3M Innovative Properties Company | Aqueous formulations for coating microneedle arrays |
| EA026675B1 (ru) * | 2010-06-16 | 2017-05-31 | Эндорешерш, Инк. | Способы лечения или предотвращения эстрогензависимых заболеваний |
| WO2012075375A1 (en) | 2010-12-02 | 2012-06-07 | Lanco Biosciences, Inc. | Delivery of parathyroid hormones by microinjection systems |
| WO2012119004A2 (en) | 2011-03-01 | 2012-09-07 | Sloan-Kettering Institute For Cancer Research | Parathyroid hormone analogs, compositions and uses thereof |
| RU2013151314A (ru) | 2011-04-22 | 2015-05-27 | Радиус Хэлс, Инк. | СПОСОБ ДОСТАВКИ ЛЕКАРСТВЕННЫХ СРЕДСТВ ДЛЯ РТН, РТНrР И РОДСТВЕННЫХ ПЕПТИДОВ |
| BR112014013151B1 (pt) | 2011-11-30 | 2022-02-08 | 3M Innovative Properties Company | Dispositivo médico compreendendo microagulhas incluindo um agente terapêutico peptídeo e um aminoácido, métodos para produzir o dispositivo e método para estabilizar um agente terapêutico peptídeo |
| GB201217439D0 (en) | 2012-09-28 | 2012-11-14 | Topotarget As | Combination therapy |
| BR112015030595A2 (pt) | 2013-06-19 | 2017-07-25 | Seragon Pharmaceuticals Inc | moduladores de receptor de estrogênio de azetidina e usos dos mesmos |
| CN104436194B (zh) | 2013-09-18 | 2018-03-30 | 北京大学 | 具有协同增效作用的抗癌组合物 |
| EP3099305A4 (en) * | 2014-01-27 | 2017-12-06 | DNA-Seq, Inc. | Methods and systems for determination of an effective therapeutic regimen and drug discovery |
| US20150258080A1 (en) | 2014-03-13 | 2015-09-17 | Genentech, Inc. | Therapeutic combinations with estrogen receptor modulators |
| HRP20230365T1 (hr) * | 2014-03-28 | 2023-06-23 | Duke University | Liječenje raka dojke uporabom selektivnih modulatora receptora estrogena |
| US9421264B2 (en) | 2014-03-28 | 2016-08-23 | Duke University | Method of treating cancer using selective estrogen receptor modulators |
| WO2015160986A2 (en) | 2014-04-16 | 2015-10-22 | Infinity Pharmaceuticals, Inc. | Combination therapies |
| CN107406424B (zh) | 2014-12-18 | 2020-08-25 | 豪夫迈·罗氏有限公司 | 雌激素受体调节剂及其用途 |
| AR104068A1 (es) * | 2015-03-26 | 2017-06-21 | Hoffmann La Roche | Combinaciones de un compuesto inhibidor de fosfoinosítido 3-cinasa y un compuesto inhibidor de cdk4/6 para el tratamiento del cáncer |
| IL255261B2 (en) | 2015-04-29 | 2024-03-01 | Radius Pharmaceuticals Inc | A combination of an m-TOR inhibitor and RAD1901 for use in a method to inhibit cancer growth or to produce tumor regression in patients with resistance to the drug and/or patients with cancer positive for an estrogen receptor alpha mutation |
-
2016
- 2016-04-29 IL IL255261A patent/IL255261B2/en unknown
- 2016-04-29 KR KR1020247022060A patent/KR20240110098A/ko not_active Application Discontinuation
- 2016-04-29 SG SG10202104177VA patent/SG10202104177VA/en unknown
- 2016-04-29 JP JP2017556627A patent/JP7019422B2/ja active Active
- 2016-04-29 CA CA2984195A patent/CA2984195C/en active Active
- 2016-04-29 CN CN201680039059.9A patent/CN108024541B/zh active Active
- 2016-04-29 KR KR1020177034606A patent/KR102682763B1/ko active IP Right Grant
- 2016-04-29 MX MX2017013802A patent/MX2017013802A/es unknown
- 2016-04-29 BR BR112017023269A patent/BR112017023269A2/pt not_active Application Discontinuation
- 2016-04-29 AU AU2016256471A patent/AU2016256471B2/en active Active
- 2016-04-29 JP JP2018509731A patent/JP6926065B2/ja active Active
- 2016-04-29 SG SG11201708858WA patent/SG11201708858WA/en unknown
- 2016-04-29 IL IL255189A patent/IL255189B2/en unknown
- 2016-04-29 MX MX2021005561A patent/MX2021005561A/es unknown
- 2016-04-29 BR BR112017023233A patent/BR112017023233A2/pt not_active Application Discontinuation
- 2016-04-29 MX MX2017013794A patent/MX2017013794A/es unknown
- 2016-04-29 RU RU2017140674A patent/RU2737496C2/ru active
- 2016-04-29 EP EP16787289.4A patent/EP3288382A4/en active Pending
- 2016-04-29 WO PCT/US2016/030321 patent/WO2016176666A1/en active Application Filing
- 2016-04-29 AU AU2016256469A patent/AU2016256469B2/en active Active
- 2016-04-29 CA CA2984200A patent/CA2984200C/en active Active
- 2016-04-29 EP EP22155988.3A patent/EP4039253A1/en active Pending
- 2016-04-29 WO PCT/US2016/030316 patent/WO2016176664A1/en active Application Filing
- 2016-04-29 JP JP2018509732A patent/JP6926066B2/ja active Active
- 2016-04-29 IL IL255148A patent/IL255148B2/en unknown
- 2016-04-29 IL IL307983A patent/IL307983A/en unknown
- 2016-04-29 KR KR1020247019929A patent/KR20240095372A/ko not_active Application Discontinuation
- 2016-04-29 IL IL307981A patent/IL307981A/en unknown
- 2016-04-29 MX MX2017013801A patent/MX2017013801A/es unknown
- 2016-04-29 SG SG11201708861VA patent/SG11201708861VA/en unknown
- 2016-04-29 CA CA2984357A patent/CA2984357A1/en active Pending
- 2016-04-29 CN CN201680038908.9A patent/CN108135177B/zh active Active
- 2016-04-29 CN CN201680038907.4A patent/CN108024540B/zh active Active
- 2016-04-29 BR BR112017023228A patent/BR112017023228A2/pt not_active Application Discontinuation
- 2016-04-29 KR KR1020247019989A patent/KR20240097966A/ko not_active Application Discontinuation
- 2016-04-29 EP EP16787290.2A patent/EP3294065A4/en active Pending
- 2016-04-29 IL IL310069A patent/IL310069A/en unknown
- 2016-04-29 KR KR1020177034608A patent/KR102676705B1/ko active IP Right Grant
- 2016-04-29 RU RU2017140675A patent/RU2747228C2/ru active
- 2016-04-29 RU RU2017140676A patent/RU2745678C2/ru active
- 2016-04-29 SG SG11201708860SA patent/SG11201708860SA/en unknown
- 2016-04-29 KR KR1020177034603A patent/KR102676629B1/ko active IP Right Grant
- 2016-04-29 IL IL297369A patent/IL297369B2/en unknown
- 2016-04-29 CN CN202110579478.4A patent/CN113288887A/zh active Pending
- 2016-04-29 WO PCT/US2016/030317 patent/WO2016176665A1/en active Application Filing
- 2016-04-29 CN CN202110933929.XA patent/CN113750091A/zh active Pending
- 2016-04-29 AU AU2016256470A patent/AU2016256470B2/en active Active
- 2016-04-29 EP EP16787291.0A patent/EP3288383A4/en active Pending
-
2017
- 2017-10-26 MX MX2021003389A patent/MX2021003389A/es unknown
- 2017-10-26 MX MX2021004881A patent/MX2021004881A/es unknown
- 2017-10-26 US US15/794,910 patent/US20180214393A1/en not_active Abandoned
- 2017-10-26 US US15/794,861 patent/US20180169101A1/en not_active Abandoned
- 2017-10-26 US US15/794,774 patent/US20180153828A1/en not_active Abandoned
-
2018
- 2018-08-24 HK HK18110956.1A patent/HK1251408A1/zh unknown
- 2018-08-24 HK HK18110957.0A patent/HK1251409A1/zh unknown
- 2018-08-24 HK HK18110955.2A patent/HK1251407A1/zh unknown
-
2019
- 2019-08-20 US US16/545,859 patent/US20200046655A1/en not_active Abandoned
- 2019-09-24 US US16/580,914 patent/US11413258B2/en active Active
-
2020
- 2020-08-04 US US16/985,021 patent/US11819480B2/en active Active
-
2021
- 2021-03-25 JP JP2021052305A patent/JP7146992B2/ja active Active
- 2021-04-23 JP JP2021073337A patent/JP7262508B2/ja active Active
- 2021-10-25 US US17/510,050 patent/US20220110890A1/en active Granted
-
2022
- 2022-06-29 US US17/852,673 patent/US20220339126A1/en active Pending
- 2022-09-21 JP JP2022150560A patent/JP7516472B2/ja active Active
-
2023
- 2023-01-25 JP JP2023009598A patent/JP2023052631A/ja active Pending
- 2023-09-12 US US18/367,103 patent/US20240099996A1/en active Pending
- 2023-11-16 US US18/511,036 patent/US20240091177A1/en active Pending
-
2024
- 2024-07-03 JP JP2024107407A patent/JP2024120996A/ja active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20110124617A1 (en) * | 2008-05-09 | 2011-05-26 | Lyttle C Richard | Combination Therapy for BreastCancer Comprising an Antiestrogenic Agent |
| WO2014203129A1 (en) * | 2013-06-19 | 2014-12-24 | Olema Pharmaceuticals, Inc. | Combinations of benzopyran compounds, compositions and uses thereof |
Non-Patent Citations (2)
| Title |
|---|
| ALLURI P.G. et al. Estrogen receptor mutations and their role in breast cancer progression//Breast Cancer Res. 2014 Dec 12;16(6):494. doi: 10.1186/s13058-014-0494-7, . * |
| ALLURI P.G. et al. Estrogen receptor mutations and their role in breast cancer progression//Breast Cancer Res. 2014 Dec 12;16(6):494. doi: 10.1186/s13058-014-0494-7, реферат. * |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2745678C2 (ru) | Способы лечения рака |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner |