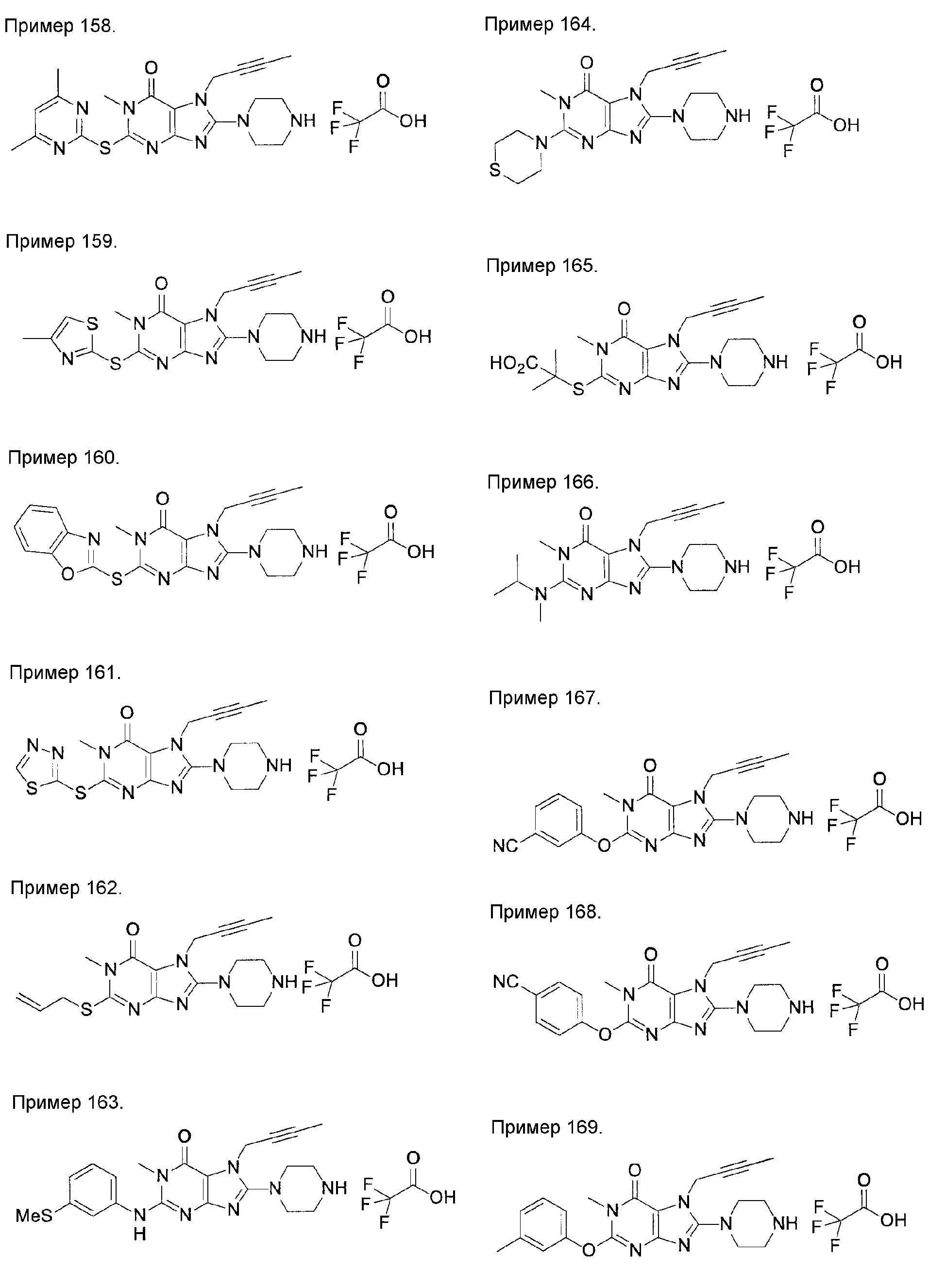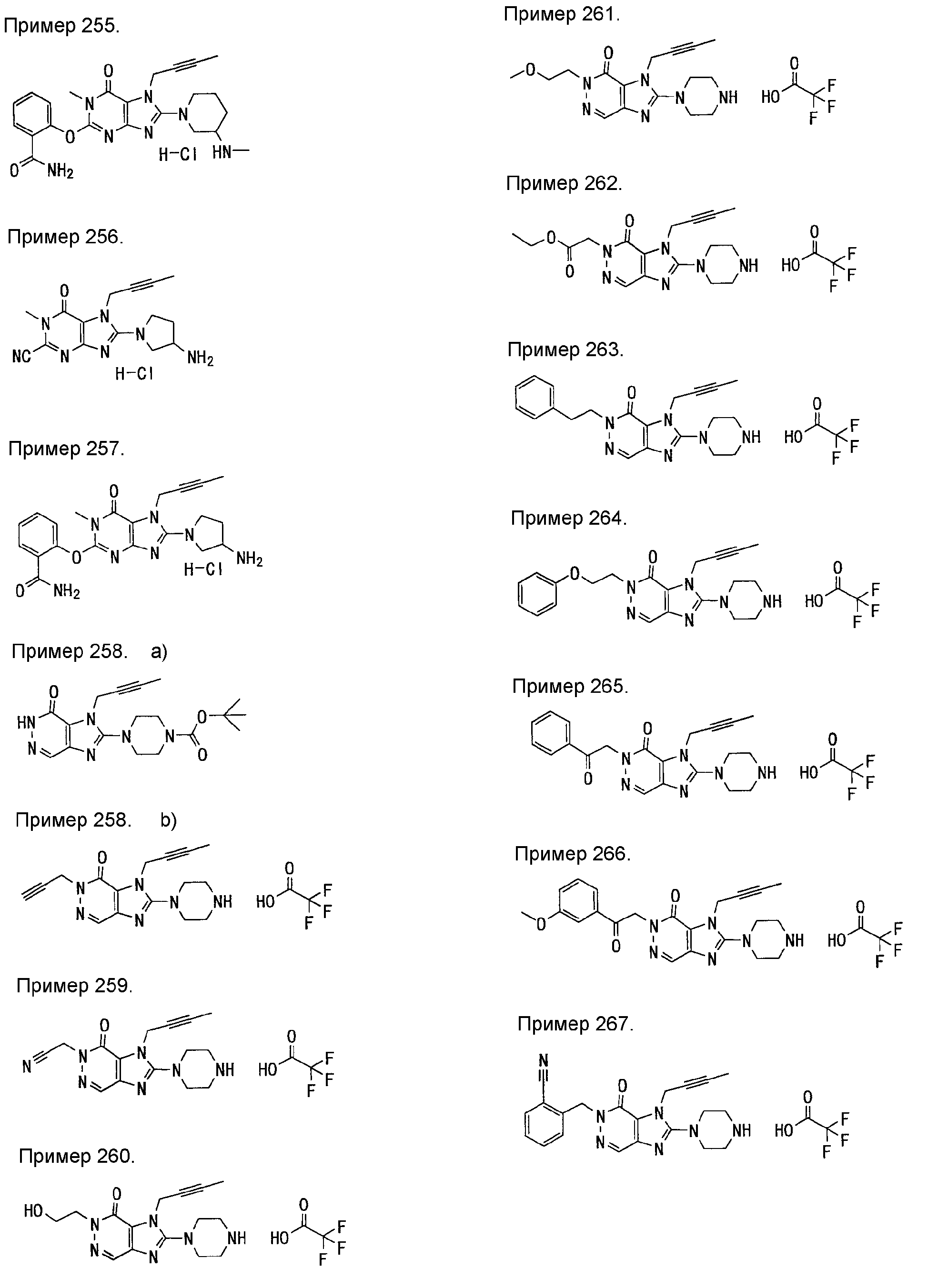RU2297418C9 - Новые конденсированные производные имидазола, ингибитор дипептидилпептидазы iv, фармацевтическая композиция, способ лечения и применение на их основе - Google Patents
Новые конденсированные производные имидазола, ингибитор дипептидилпептидазы iv, фармацевтическая композиция, способ лечения и применение на их основе Download PDFInfo
- Publication number
- RU2297418C9 RU2297418C9 RU2004139111/04A RU2004139111A RU2297418C9 RU 2297418 C9 RU2297418 C9 RU 2297418C9 RU 2004139111/04 A RU2004139111/04 A RU 2004139111/04A RU 2004139111 A RU2004139111 A RU 2004139111A RU 2297418 C9 RU2297418 C9 RU 2297418C9
- Authority
- RU
- Russia
- Prior art keywords
- group
- formula
- compound
- represented
- methyl
- Prior art date
Links
- 0 C*N[C@](CCCC1)[C@@]1N Chemical compound C*N[C@](CCCC1)[C@@]1N 0.000 description 8
- UZFSSDLWBZWJRU-UHFFFAOYSA-N CNC(CCCC1)C1N Chemical compound CNC(CCCC1)C1N UZFSSDLWBZWJRU-UHFFFAOYSA-N 0.000 description 1
- UZFSSDLWBZWJRU-RQJHMYQMSA-N CN[C@@H](CCCC1)[C@@H]1N Chemical compound CN[C@@H](CCCC1)[C@@H]1N UZFSSDLWBZWJRU-RQJHMYQMSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/28—Oxygen atom
- C07D473/30—Oxygen atom attached in position 6, e.g. hypoxanthine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
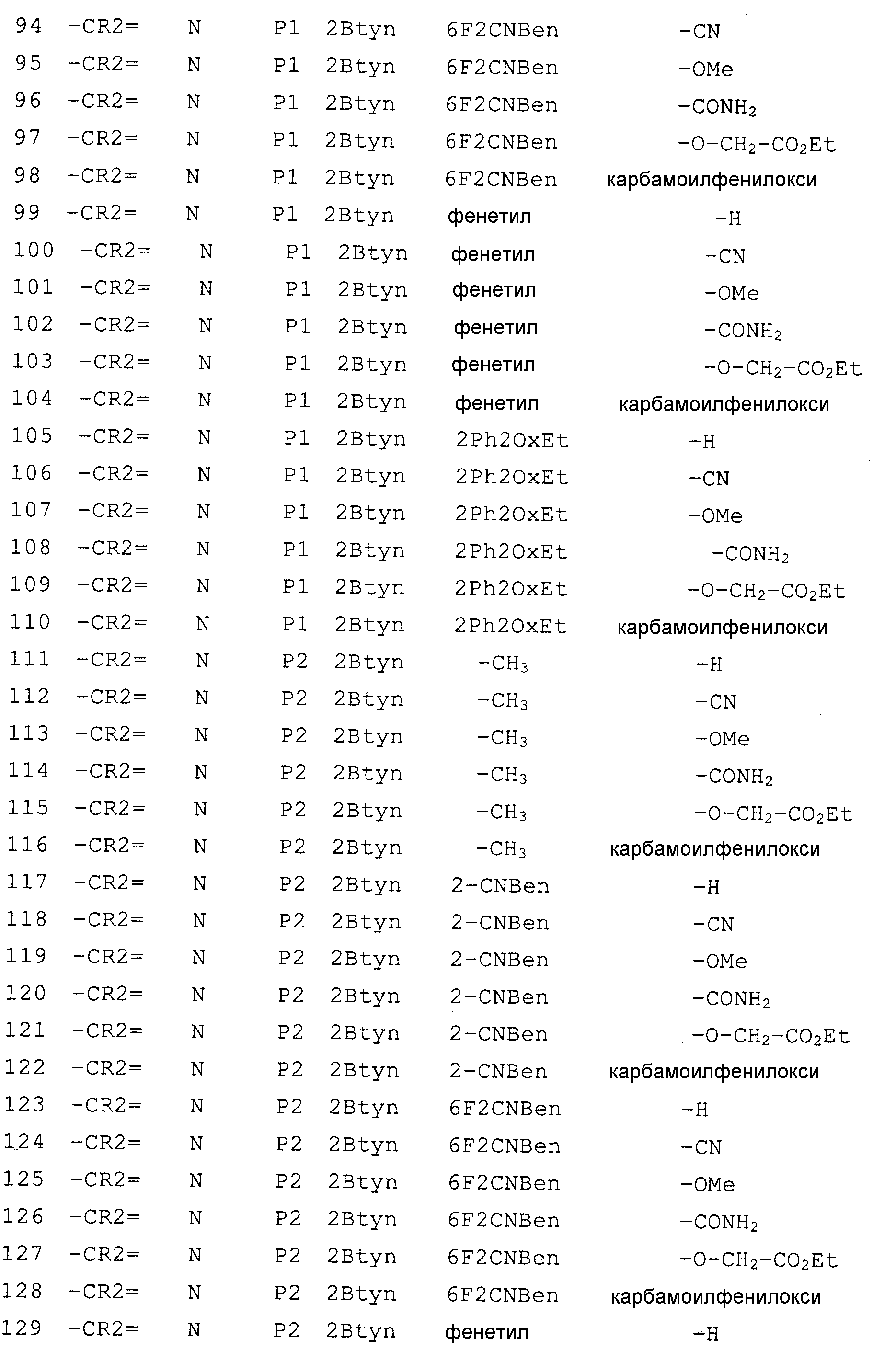
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/04—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/04—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms
- C07D473/06—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms with radicals containing only hydrogen and carbon atoms, attached in position 1 or 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/18—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 one oxygen and one nitrogen atom, e.g. guanine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/36—Sulfur atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/40—Heterocyclic compounds containing purine ring systems with halogen atoms or perhalogeno-alkyl radicals directly attached in position 2 or 6
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/12—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains three hetero rings
- C07D491/14—Ortho-condensed systems
Landscapes
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Rheumatology (AREA)
- Obesity (AREA)
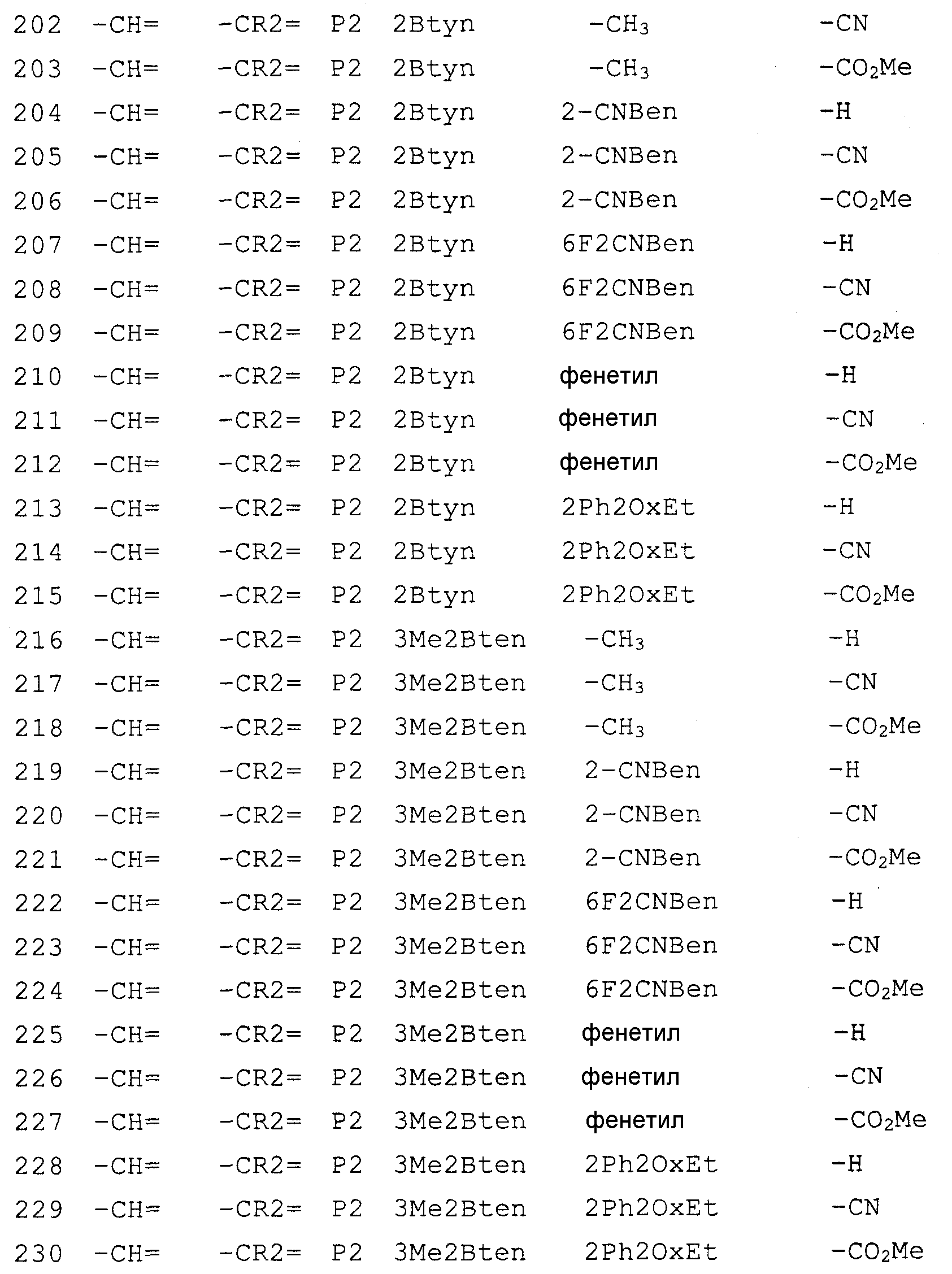
- Physical Education & Sports Medicine (AREA)
- Endocrinology (AREA)
- Reproductive Health (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Virology (AREA)
- Pulmonology (AREA)
- Oncology (AREA)
- AIDS & HIV (AREA)
- Tropical Medicine & Parasitology (AREA)
- Molecular Biology (AREA)
- Child & Adolescent Psychology (AREA)
- Communicable Diseases (AREA)
- Pain & Pain Management (AREA)
- Emergency Medicine (AREA)
- Cardiology (AREA)
- Gynecology & Obstetrics (AREA)
- Pregnancy & Childbirth (AREA)
- Heart & Thoracic Surgery (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
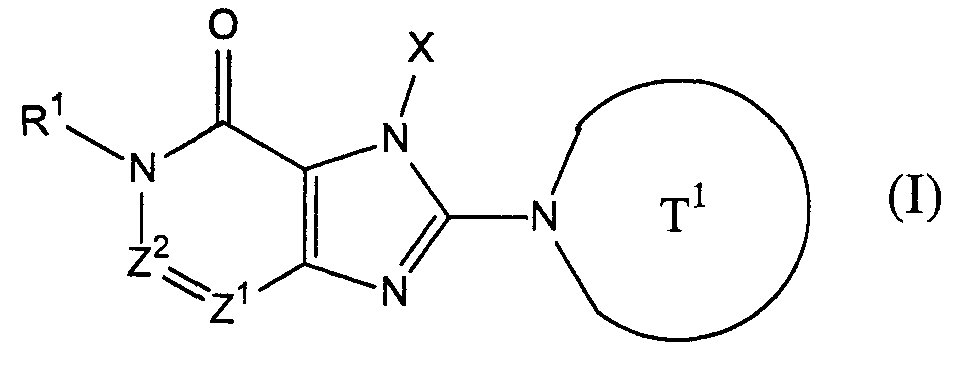
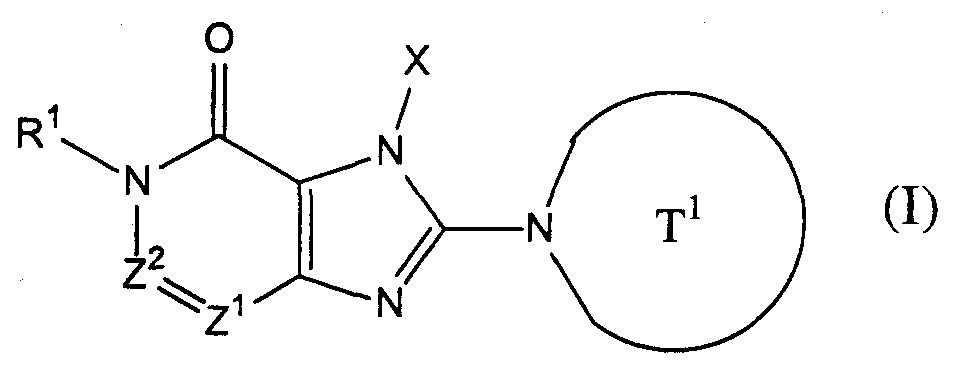
Настоящее изобретение относится к новым конденсированным производным имидазола, являющимся ингибиторами дипептидилпептидазы IV. Описывается соединение, представленное следующей формулой, или его соль, или гидрат
где Т1 представляет собой моноциклическую 5-6-членную гетероциклическую группу, содержащую один или два атома азота в кольце, и которая может иметь одну или более аминогруппу в качестве заместителей; Х представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, фенильную группу, которая может иметь один или несколько заместителей, выбранных из алкильной группы, или галогена, или фенил C1-6 алкильной группы; Z1 и Z2, каждый независимо, представляют собой атом азота или группу формулы -CR2=; R1 и R2, каждый независимо, представляют собой группу формулы -А0-А1-А2 (где А0 представляет собой одинарную связь или С1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранных из группы В, состоящей из указанных ниже заместителей; А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -O-СО-, группу, представленную формулой -СО-O-, группу, представленную формулой -NRA, группу, представленную формулой -CO-NRA, группу, представленную формулой -NRACO-, группу, представленную формулой -SO2-NRA, или группу, представленную формулой -NRA-SO2-; А2 и RA, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил C1-6 алкильную группу, С6-10 арил C1-6 алкильную группу, или С2-7 алкилкарбонильную группу, причем А2 и RA, каждый независимо, могут иметь 1-3 заместителя, выбранных из указанной ниже группы заместителей В, когда Z2 представляет собой группу формулы -CR2=, R1 и R2 могут вместе образовывать 5-7-членное кольцо, за исключением случаев, когда [1] R1 представляет собой атом водорода, Z1 представляет собой атом азота и Z2 представляет собой группу -СН=; [2] Z1 представляет собой атом азота и Z2 представляет собой группу -С(ОН)=; <Группа заместителей В> группа заместителей В представляет собой группу, включающую гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1CO-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -CO-RB3 (где RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -CO-RB4-RB5, и группу, представленную формулой -СН2-СО-RB4-RВ5 (где RВ4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRB6-; RB5 и RB6, каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членный гетероцикл C1-6 алкильную группу, С6-10 арил C1-6 алкильную группу или 5-10-членный гетероарил C1-6 алкильную группу)). Также описывается ингибитор, фармацевтическая композиция, способ лечения и применение на их основе. Технический результат - описаны новые соединения, обладающие полезными биологическими свойствами. 6 н. и 27 з.п. ф-лы, 4 табл.
Description
Настоящее изобретение относится к новым конденсированным имидазольным производным, являющимся ценными ингибиторами дипептидилпептидизы-IV (DPPIV), и к их применению.
Описание уровня техники
Дипептидилпептидиза IV (DPPIV) представляет собой сериновую протеазу, которая специфически гидролизует дипептид - Х-Pro (X = произвольная аминокислота) на свободном N-конце полипептидной цепи.
Гормоны, стимулирующие глюкозазависимую секрецию инсулина, известные как инкретины (GLP-1: глюкагонподобный пептид-1 и GIP: глюкозазависимый инсулинотропный полипептид), выделяющиеся в пищеварительном тракте после приема пищи, быстро гидролизуются и инактивируются под действием DPPIV. При подавлении гидролиза под действием DPPIV воздействие инкретина (GLP-1 или GIP) усиливается, что в свою очередь повышает глюкозастимулируемую секрецию инсулина из β-клеток поджелудочной железы. Было показано, что это приводит к улучшению гипергликемии в пероральном тесте на толерантность к глюкозе (см. Diabetologia 1999 Nov, 42(11), 1324-31). Кроме этого известно, что GLP-1 участвует в процессах, способствующих уменьшению аппетита и подавляющих желание к приему пищи. Также сообщается о том, что GLP-1 влияет на защитные функции β-клеток поджелудочной железы, усиливая их дифференцировку и пролиферацию. Таким образом, ингибитор DPPVI может служить полезным терапевтическим и профилактическим агентом в лечении таких заболеваний, связанных с действием GLP-1 и/или GIP, как ожирение и сахарный диабет.
Кроме этого, имеется много сообщений, подтверждающих взаимосвязь между дипептидилпептидазой IV и различными заболеваниями, описанными далее. Таким образом, ингибитор DPPIV может служить терапевтическим средством при заболеваниях, таких как
(1) профилактические и терапевтические средства для лечения СПИД (см. Science 1993, 262, 2045-2050),
(2) профилактические и терапевтические средства для лечения остеопороза (см. Clinical Chemistry 1988, 34, 2499-2501),
(3) профилактические и терапевтические средства для лечения желудочно-кишечных нарушений (см. Endocrinology 2000, 141, 4013-4020),
(4) профилактические и терапевтические средства для лечения сахарного диабета, ожирения и гиперлипидемии (см. Diabetes 1998, 47, 1663-1670, и Life Sci 2000, 66(2), 91-103),
(5) профилактические и терапевтические средства для лечения ангиогенеза (см. Agents and Action 1991, 32, 125-127),
(6) профилактические и терапевтические средства для лечения бесплодия (см. International Publication WO 00/56296),
(7) профилактические и терапевтические средства для лечения воспалительных состояний, аутоиммунных заболеваний и хронических ревматоидных артритов (см. The Journal of Immunology 2001, 166, 2041-2048) и
(8) профилактические и терапевтические средства для лечения рака (см. Br. J. Cancer 1999, март, 79 (7-8), 1042-8, и J. Androl 2000 март-апрель, 21(2), 220-6).
Некоторые DPPIV ингибиторы описаны в публикации патента США No. 2002/0161001; международной публикации WO 03/004496 и в публикации патента США No. 2002/0198205. Однако нет данных об ингибиторе DPPIV с гипоксантиновой или имидазопиридазиноновой структурой.
Как следует из изложенного выше, были предприняты многочисленные попытки поиска соединений, обладающих DPPIV-ингибирующей активностью, которые могли бы использоваться в качестве терапевтических средств. Однако до настоящего времени не обнаружено соединение, сочетающее высокую DPPIV-ингибирующую активность с высокой клинической эффективностью. Цель настоящего изобретения состоит в разработке соединений с DPPIV-ингибирующей активностью, которые могли бы использоваться в качестве профилактических, терапевтических и успокаивающих средств при лечении сахарного диабета и родственных заболеваний.
Сущность изобретения
Авторы настоящего изобретения провели широкие исследования в указанной выше области. Результатом этих исследований стал синтез новых конденсированных производных имидазола, включая производные гипоксантина и имидазопиридазинона. При осуществлении настоящего изобретения авторы также обнаружили, что полученные соединения обладают отличной DPPIV-ингибирующей активностью. Настоящее изобретение охватывает
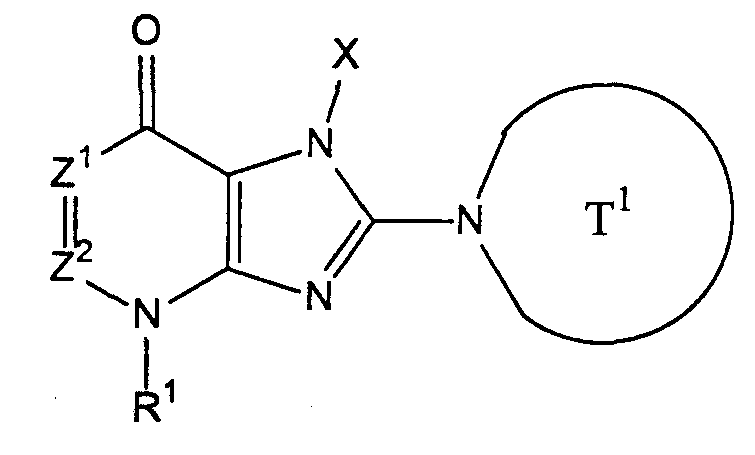
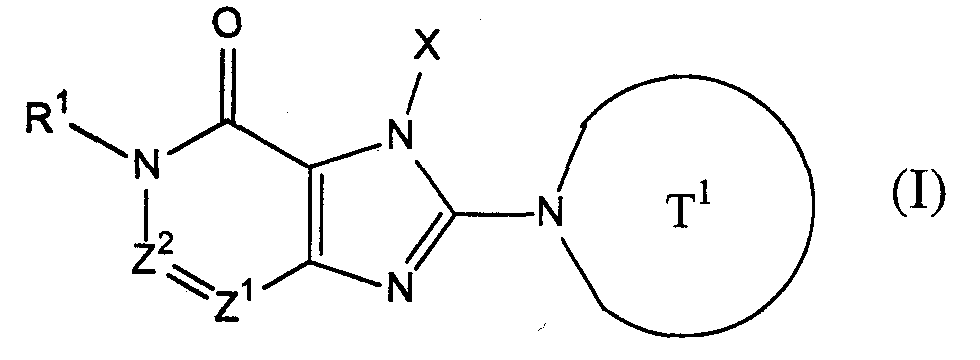
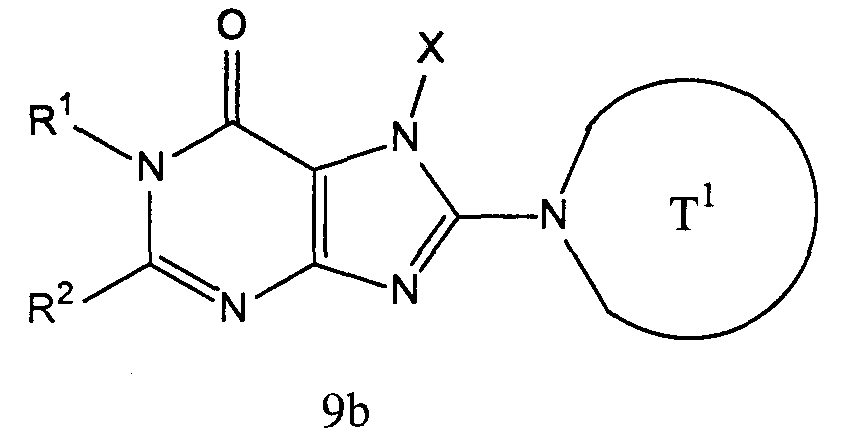
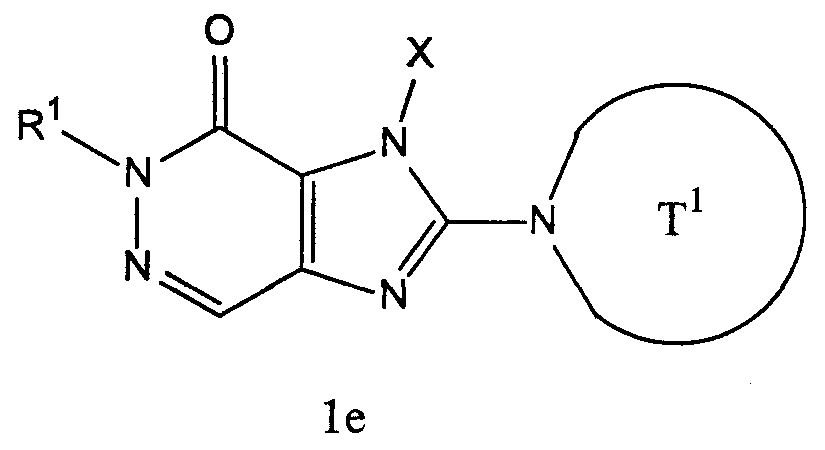
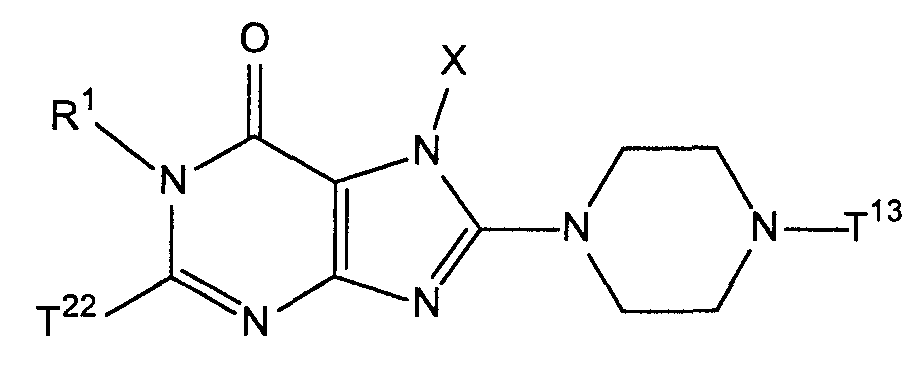
[1] соединение, представленное следующей формулой, его соль или гидрат
где Т1 представляет собой моноциклическую или бициклическую 4-12-членную гетероциклическую группу, содержащую один или два атома азота в кольце, и которая может иметь один или несколько заместителей;
Х представляет собой С1-6 алкильную группу, которая может содержать один или несколько заместителей, С2-6 алкенильную группу, которая может содержать один или несколько заместителей, С2-6 алкинильную группу, которая может содержать один или несколько заместителей, С6-10 арильную группу, которая может содержать один или несколько заместителей, 5-10-членную гетероарильную группу, которая может содержать один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может содержать один или несколько заместителей, или 5-10-членную гетероарил С1-6 алкильную группу, которая может содержать один или несколько заместителей;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу, представленную формулой -CR2=;
R1 и R2, каждый независимо, представляют собой группу, представленную формулой -А0-А1-А2 (где А0 представляет собой одинарную связь или С1-6 алкиленовую группу, которая может содержать 1-3 заместителя, выбранных из группы В, включающей заместители указанные далее;
А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA-, группу, представленную формулой -СО-NRA-, группу, представленную формулой -NRA-СО-, группу, представленную формулой -SO2-NRA-, или группу, представленную формулой -NRA-SO2-;
А2 и RA, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу С6-10 арил С1-6 алкильную группу или С2-7 алкилкарбонильную группу;
при этом А2 и RA каждый, независимо, могут содержать 1-3 заместителя, выбранных из группы заместителей В, указанной далее:
когда Z2 представляет собой группу, представленную формулой -CR2=, R1 и R2 могут вместе представлять собой 5-7-членное кольцо,
за исключением случаев, когда [1] R1 представляет собой атом водорода; Z1 представляет собой атом азота и Z2 представляет собой -СН=; [2] Z1 представляет собой атом азота и Z2 представляет собой -С(ОН)=.
<Группа заместителей В>
Группа заместителей В представляет собой группу, включающую гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может содержать один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1-CO-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RB3 (где RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -CO-RB4-RB5, и группу, представленную формулой -СН2-СО-RB4-RB5 (где RB4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRB6-; RB5 и RB6, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклил С1-6 алкильную группу, С6-10 арил С1-6 алкильную группу или 5-10-членную гетероарил С1-6 алкильную группу)), и
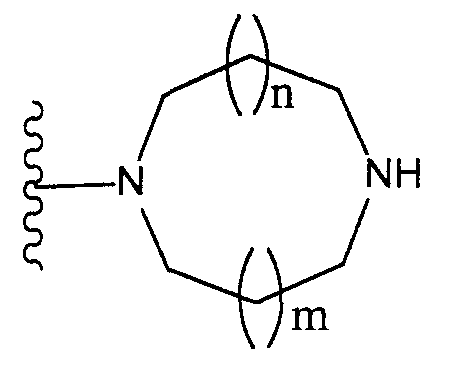
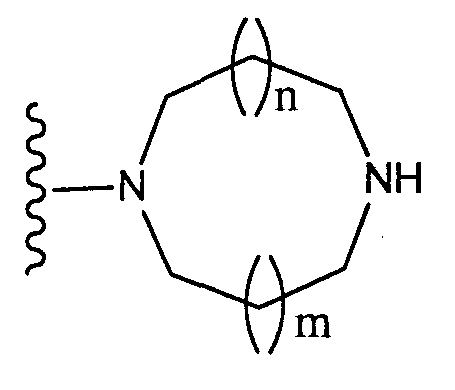
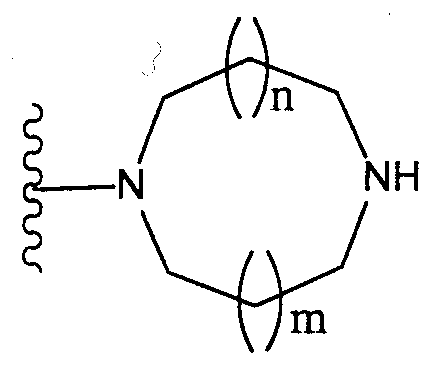
[2] соединение по [1], или его соль, или гидрат, где T1 представляет собой группу, представленную следующей формулой:
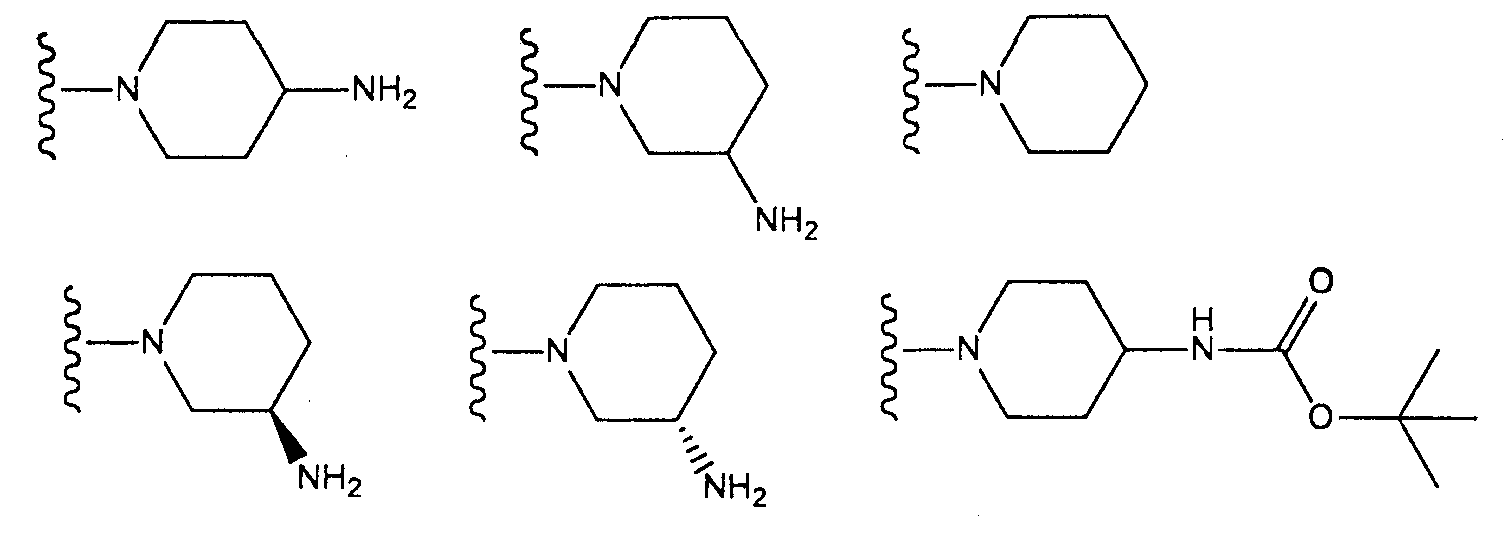
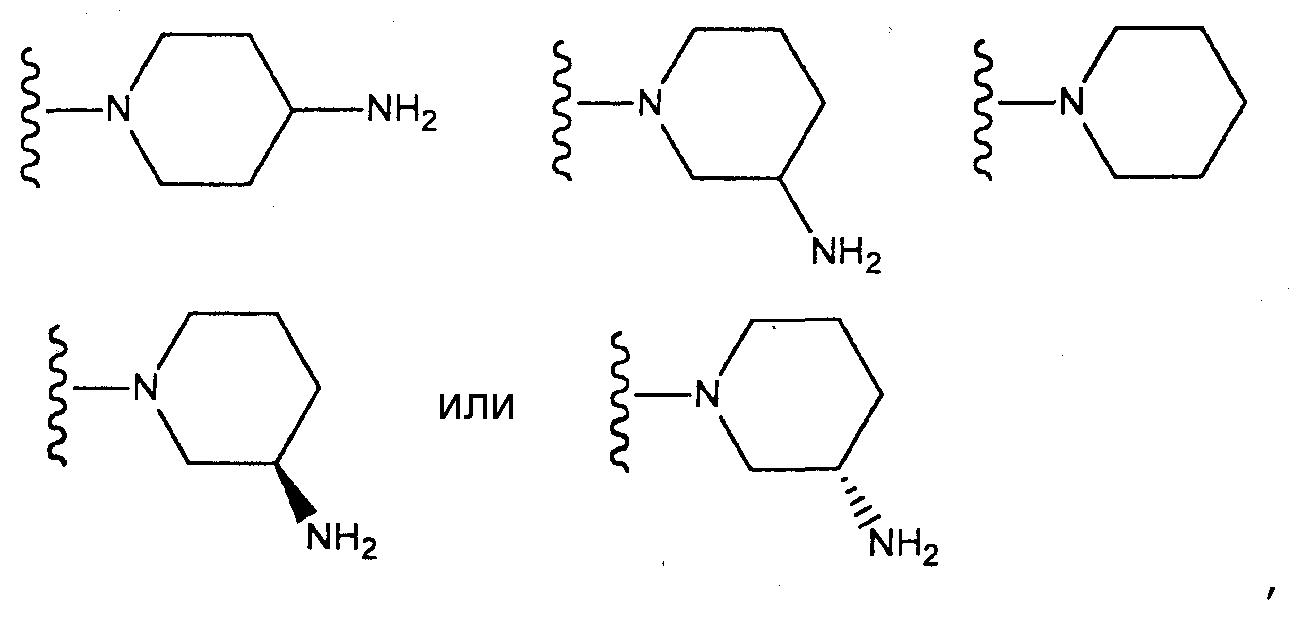
(где n и m, каждый независимо, равен 0 или 1), которая может иметь один или несколько заместителей;
азетидин-1-ильную группу, которая может иметь один или несколько заместителей;
пирролидин-1-ильную группу, которая может иметь один или несколько заместителей;
пиперидин-1-ильную группу, которая может иметь один или несколько заместителей, или
азепан-1-ильную группу, которая может иметь один или несколько заместителей;
[3] соединение по [1], или его соль, или гидрат, где T1 представляет собой группу, представленную следующей формулой:
(где n и m, каждый независимо, равен 0 или 1);
азетидин-1-ильную группу, которая может содержать аминогруппу;
пирролидин-1-ильную группу, которая может содержать аминогруппу;
пиперидин-1-ильную группу, которая может содержать аминогруппу, или
азепан-1-ильную группу, которая может содержать аминогруппу;
[4] соединение по [1], или его соль, или гидрат, где T1 представляет собой пиперазин-1-ильную группу или 3-аминопиперидин-1-ильную группу;
[5] соединение по [1], или его соль, или гидрат, где T1 представляет собой пиперазин-1-ильную группу;
[6] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой группу, представленную формулой -Х1-Х2 (где Х1 представляет собой одинарную связь или метиленовую группу, которая может иметь один или несколько заместителей; Х2 представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, или фенильную группу, которая может иметь один или несколько заместителей);
[7] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой группу, представленную формулой -Х11-Х12 (где Х11 представляет собой одинарную связь или метиленовую группу; Х12 представляет собой С2-6 алкенильную группу, С2-6 алкинильную группу или фенильную группу, которая может иметь один или несколько заместителей);
[8] соединение по [6] или [7], или его соль, или гидрат, где фенильная группа, которая может иметь один или несколько заместителей, представляет собой фенильную группу, которая может иметь в положении 2 заместитель, выбранный из группы, состоящей из гидроксильной группы, атома фтора, атома хлора, метильной группы, этильной группы, трифторметильной группы, винильной группы, метоксигруппы, этоксигруппы, ацетильной группы, цианогруппы, формильной группы и С2-7 алкоксикарбонильной группы;
[9] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой 3-метил-2-бутен-1-ильную группу, 2-бутин-1-ильную группу, бензильную группу или 2-хлорфенильную группу;
[10] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой 2-бутин-1-ильную группу;
[11] соединение по любому из [1]-[10], или его соль, или гидрат, где любая из групп Z1 или Z2 представляет собой атом азота;
[12] соединение по любому из [1]-[10], или его соль, или гидрат, где
Z1 представляет собой атом азота и
Z2 представляет собой группу, представленную формулой -CR2=
(где R2 имеет значения, указанные в пункте [1]);
[13] соединение по любому из [1]-[10], или его соль, или гидрат, где
Z2 представляет собой атом азота и
Z1 представляет собой группу, представленную формулой -CR2=
(где R2 имеет значения, указанные в [1]);
[14] соединение по любому из [1]-[13], или его соль, или гидрат, где R1 представляет собой атом водорода или группу, представленную формулой -А10-А11-А12
(где А10 представляет собой С1-6 алкенильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С;
А11 представляет собой одинарную связь, атом кислорода, атом серы или карбонильную группу;
А12 представляет собой атом водорода, С6-10 арильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членную гетероарильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С:
<Группа заместителей С>
Группа заместителей С представляет собой группу, включающую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRС1-RC2 (где каждый из RС1 и RC2, независимо, представляет собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4, и группу, представленную формулой -СН2-СО-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);
[15] соединение по любому из [1]-[13], или его соль, или гидрат,
где R1 представляет собой атом водорода, С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей С, описанной далее, 5-10-членную гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей С, описанной далее, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей С, описанной далее:
<Группа заместителей С>
Группа заместителей С представляет собой группу, включающую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, представленную формулой -NRС1-RC2 (где каждый из RС1 и RC2, независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4, и группу, представленную формулой -СН2-СО-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу));
[16] соединение по [14] или [15], или его соль, или гидрат, где группа заместителей С представляет собой группу, включающую цианогруппу, С1-6 алкоксигруппу, С2-7 алкоксикарбонильную группу и атом галогена;
[17] соединение по любому из [1]-[13], или его соль, или гидрат, где R1 представляет собой метильную группу, цианобензильную группу, фторцианобензильную группу, фенетильную группу, 2-метоксиэтильную группу, или 4-метоксикарбонилпиридин-2-ильную группу;
[18] соединение по любому из [1]-[13], или его соль, или гидрат, где R1 представляет собой метильную группу или 2-цианобензильную группу;
[19] соединение по любому из [1]-[18], или его соль, или гидрат,
где R2 представляет собой атом водорода, цианогруппу или группу, представленную формулой -А21-А22
(где А21 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA2-, группу, представленную формулой -СО-NRA2-, или группу, представленную формулой NRA2-СО-;
А22 и RA2, каждый независимо, представляют собой атом водорода, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу,
при этом А22 и RA2, каждый независимо, могут иметь 1-3 заместителя, выбранных из группы заместителей D, описанной далее.
<Группа заместителей D>
Группа заместителей D представляет собой группу, включающую гидроксильную группу, цианогруппу, нитрогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRD1-RD2 (где RD1 и RD2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -CO-RD3 (где RD3 представляет собой 4-8-членную гетероциклическую группу), и группу, представленную формулой -СО-RD4-RD5 (где RD4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRD6-; RD5 и RD6, каждый независимо, представляют собой атом водорода, С3-8 циклоалкильную группу или С1-6 алкильную группу));
[20] соединение по любому из [1]-[18], или его соль, или гидрат,
где R2 представляет собой атом водорода, цианогруппу, карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), или группу, представленную формулой -А23-А24
(где А23 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA3-;
А24 и RA3, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, которая может содержать заместитель, выбранный из указанной далее группы заместителей D1, С3-8 циклоалкильную группу, которая может иметь заместитель, выбранной из указанной далее группы заместителей D1, С2-6 алкенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С2-6 алкинильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, фенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, или 5-10-членную гетероарильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1.
<Группа заместителей D1>
Группа заместителей D1 представляет собой группу, включающую карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-илкарбонильную группу, С1-6 алкильную группу и С1-6 алкоксигруппу);
[21] соединение по любому из [1]-[18], или его соль, или гидрат,
где R2 представляет собой атом водорода, цианогруппу, С1-6 алкоксигруппу или группу, представленную формулой -А25-А26
(где А25 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA4-;
А26 и RА4, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, имеющую заместитель, выбранный из группы заместителей D1, описанной далее, С3-8 циклоалкильную группу, имеющую заместитель, выбранный из указанной группы заместителей D1, описанной далее, или фенильную группу, имеющую заместитель, выбранный из группы заместителей D1, описанной далее:
<Группа заместителей D1>
Группа заместителей D1 представляет собой группу, включающую карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-илкарбонильную группу, С1-6 алкильную группу и С1-6 алкоксигруппу);
[22] соединение по любому из [1]-[18], или его соль, или гидрат,
где R2 представляет собой атом водорода, цианогруппу, метоксигруппу, карбамоилфенилоксигруппу, или группу, представленную формулой
(где А27 представляет собой атом кислорода, атом серы или -NH-; А28 и А29, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);
[23] соединение по любому из [1]-[18], или его соль, или гидрат, где R2 представляет собой атом водорода, цианогруппу или 2-карбамоилфенилоксигруппу;
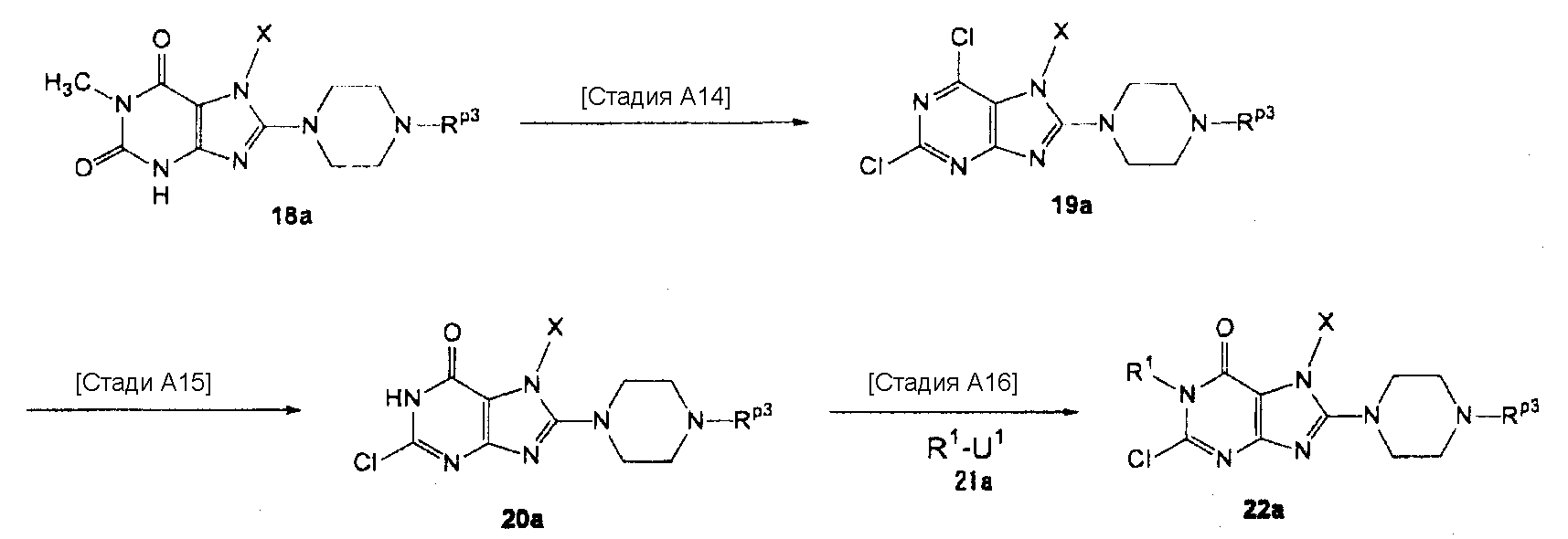
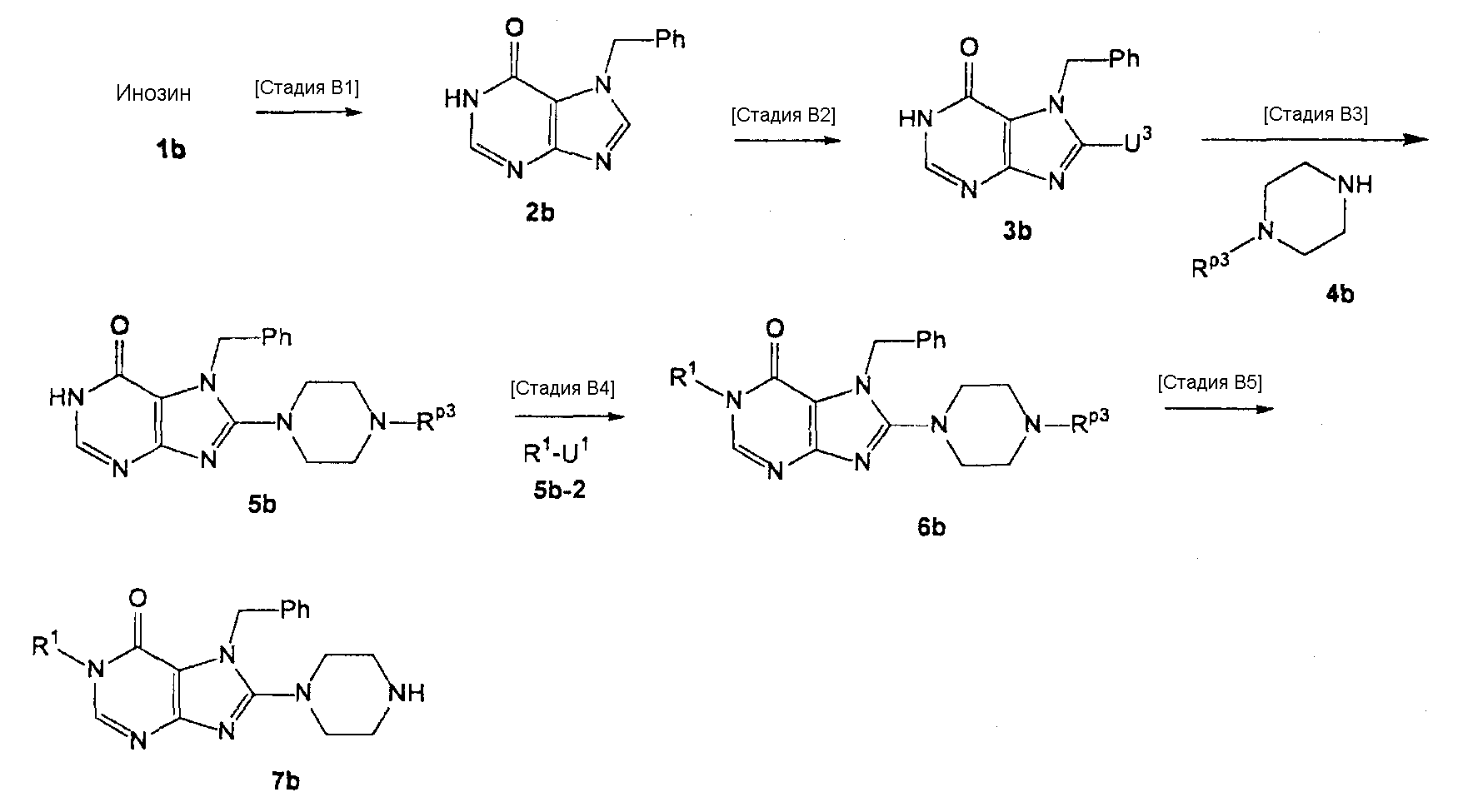
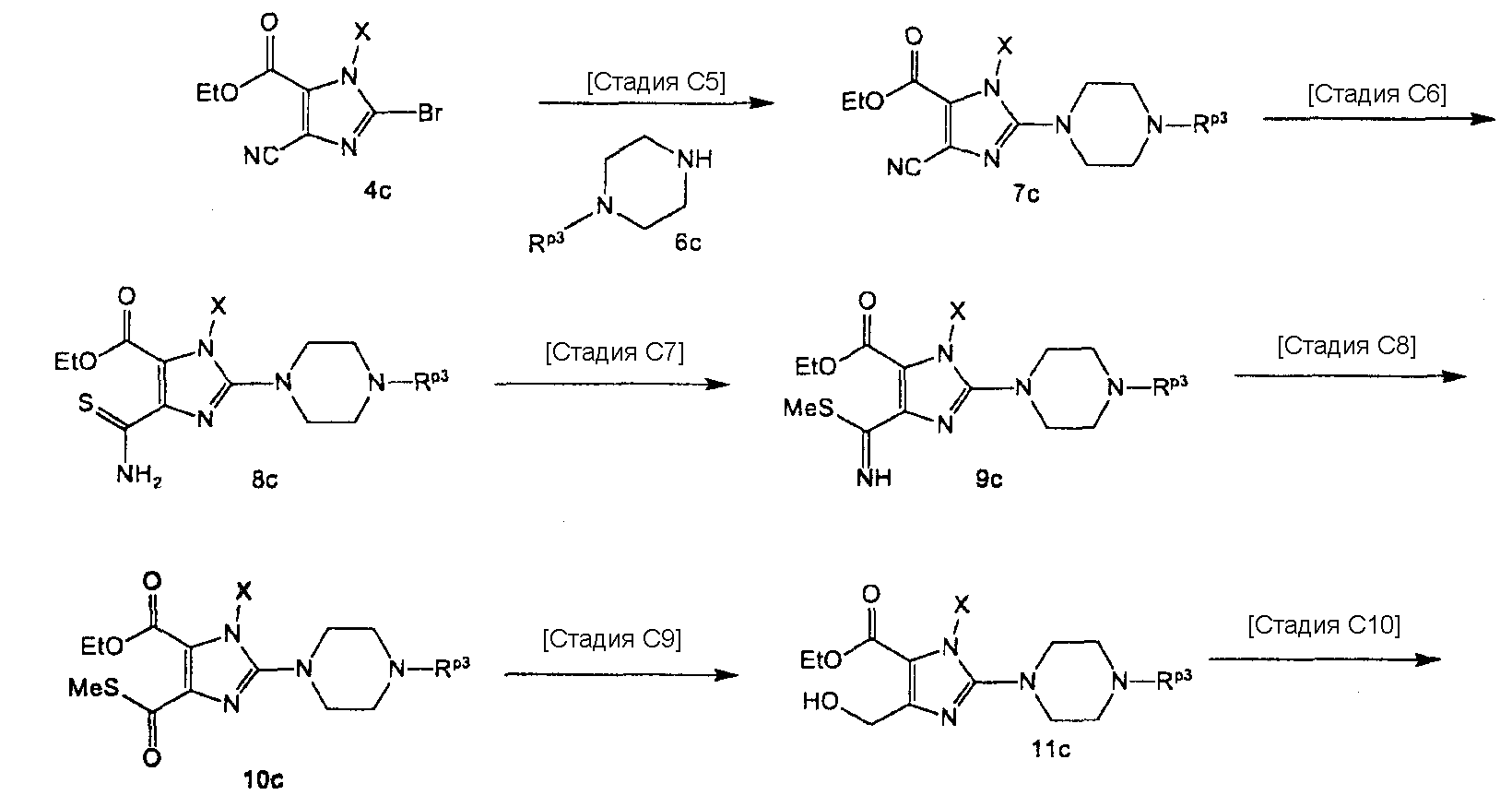
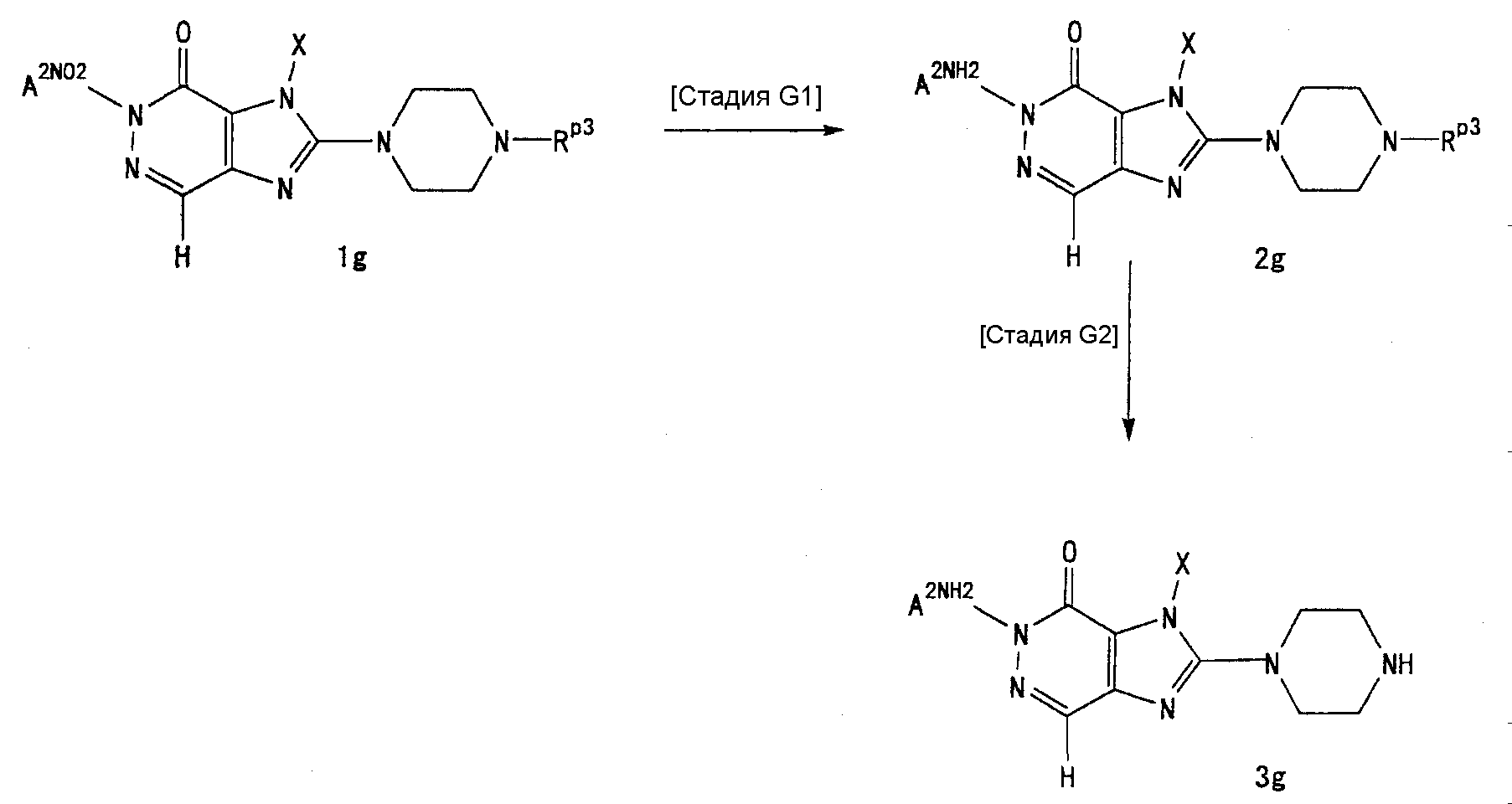
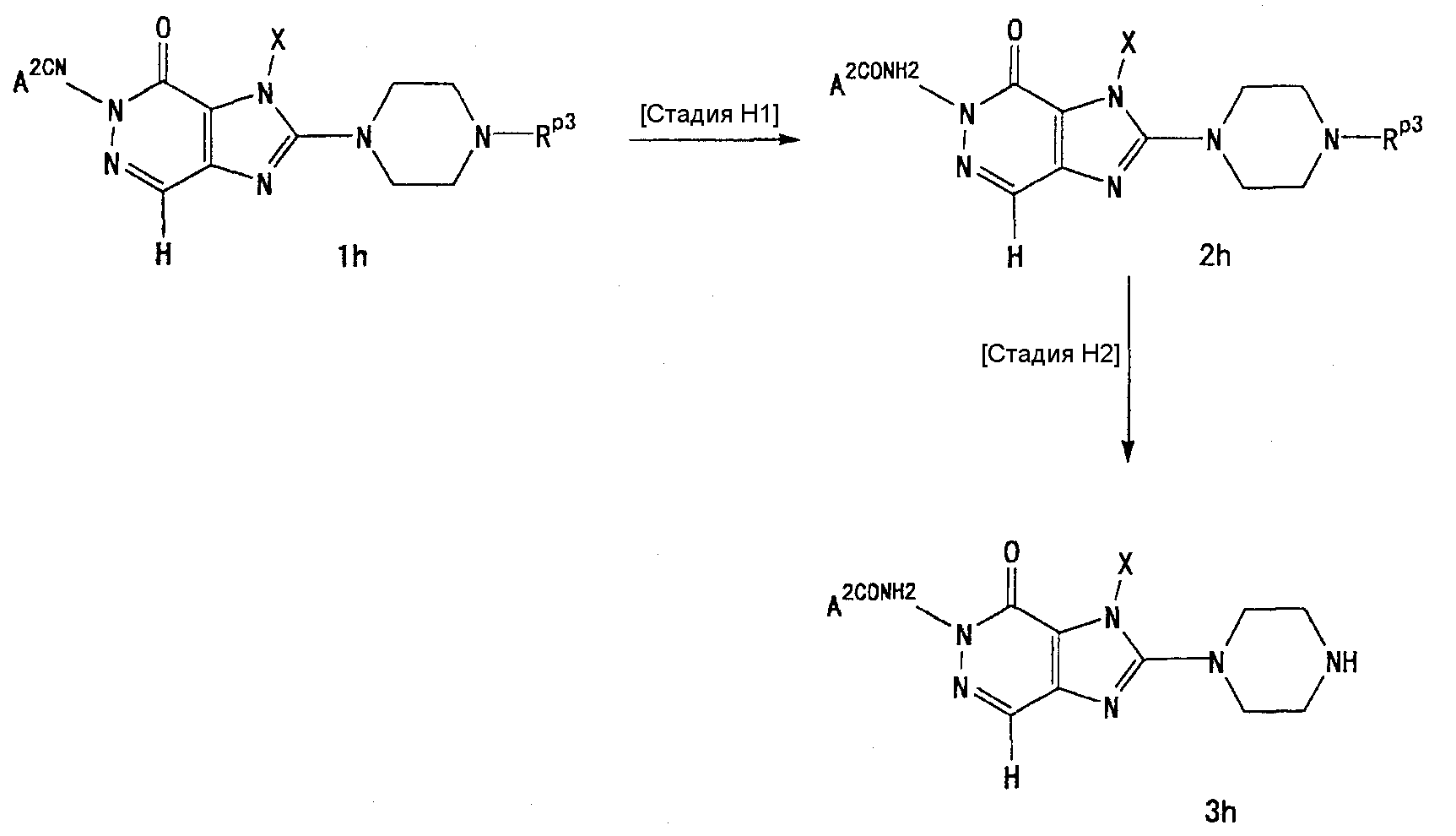
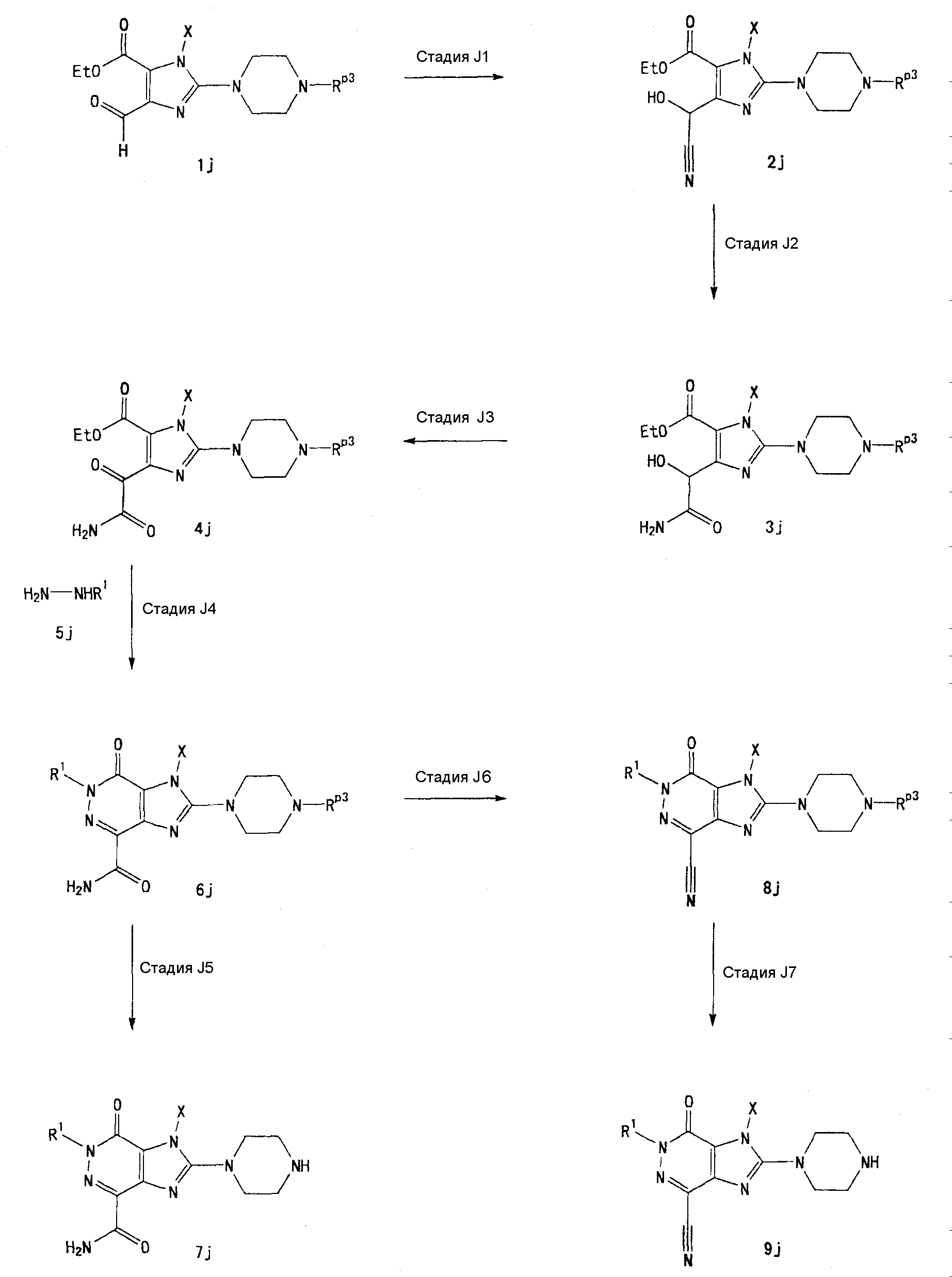
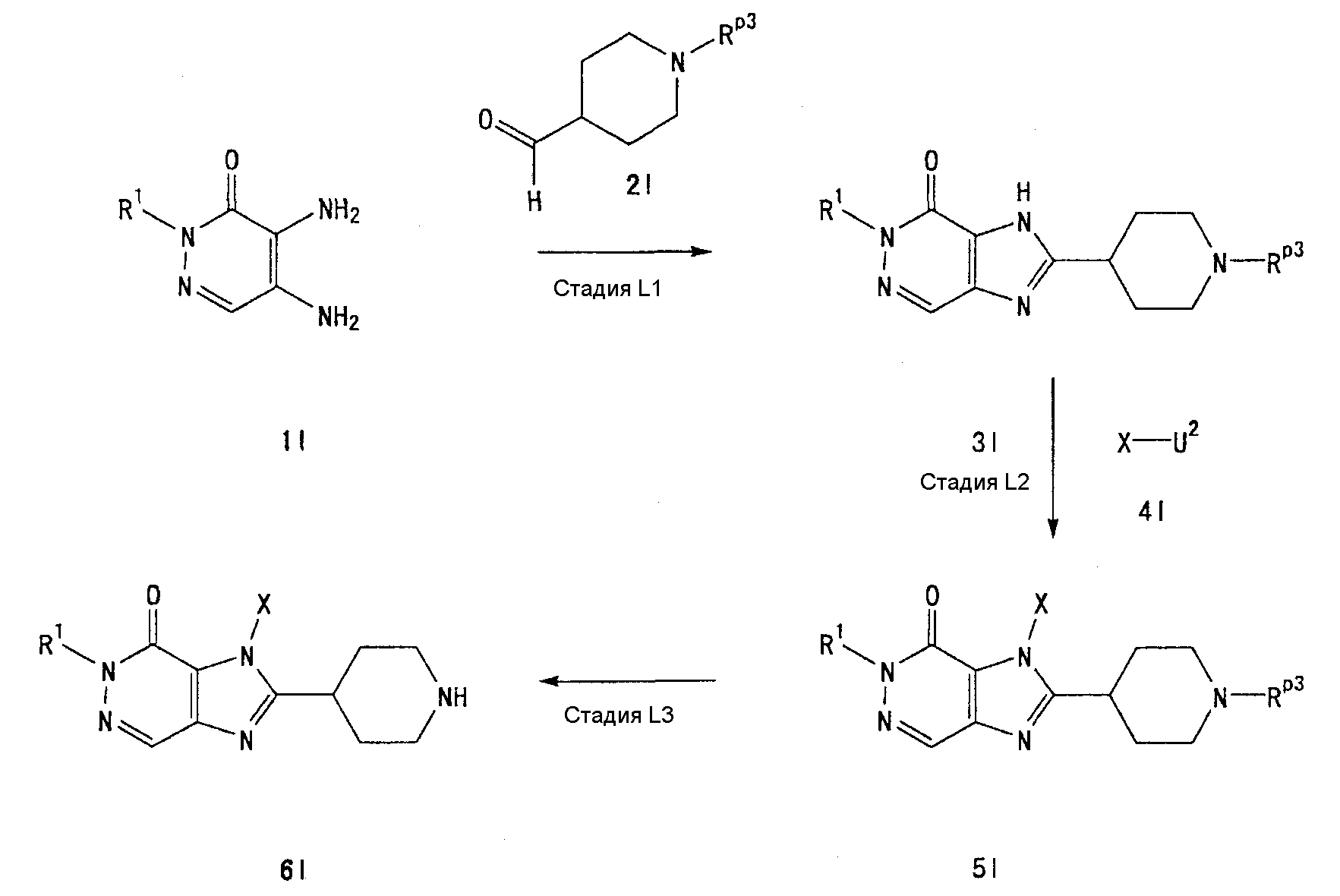
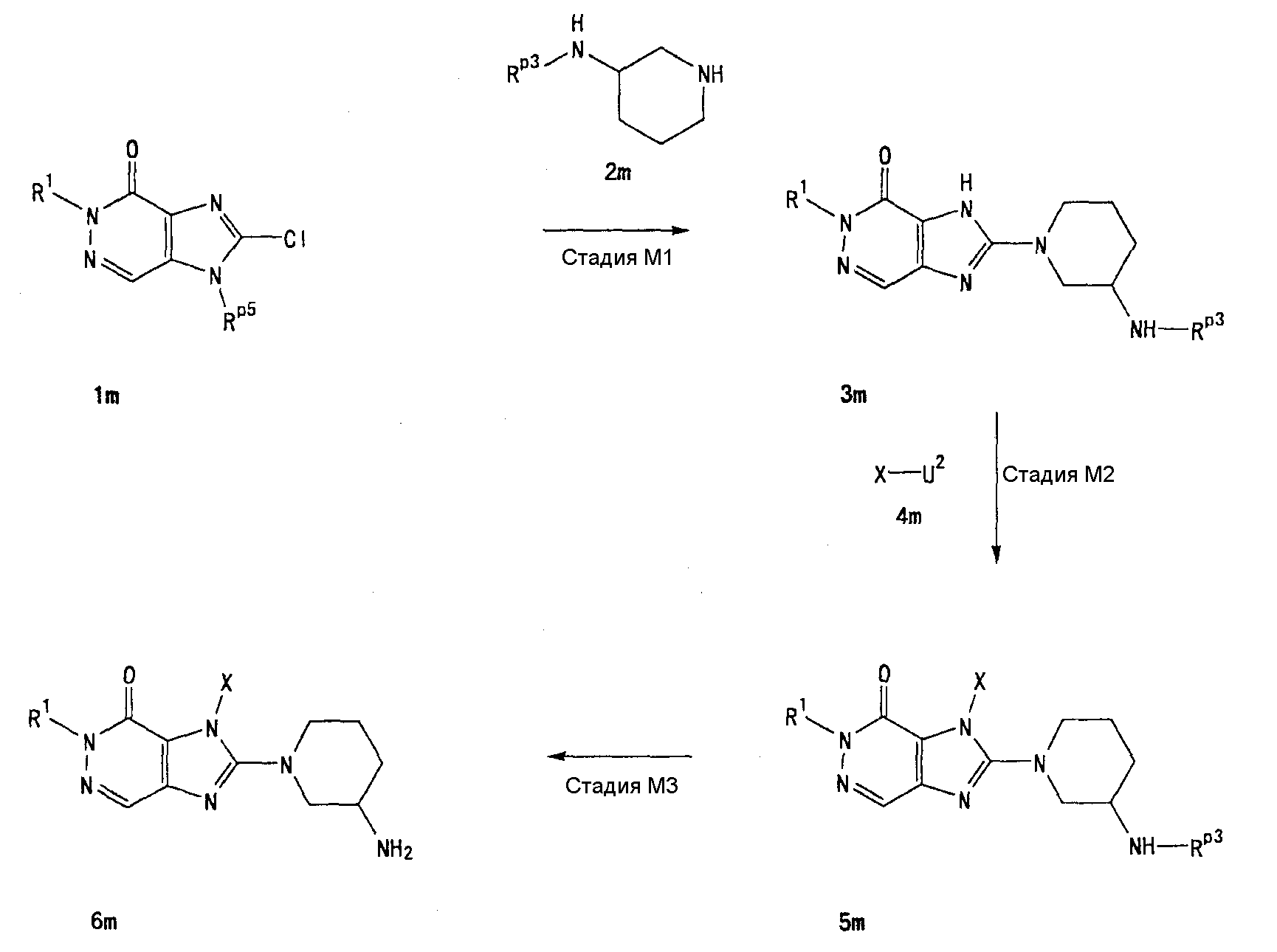
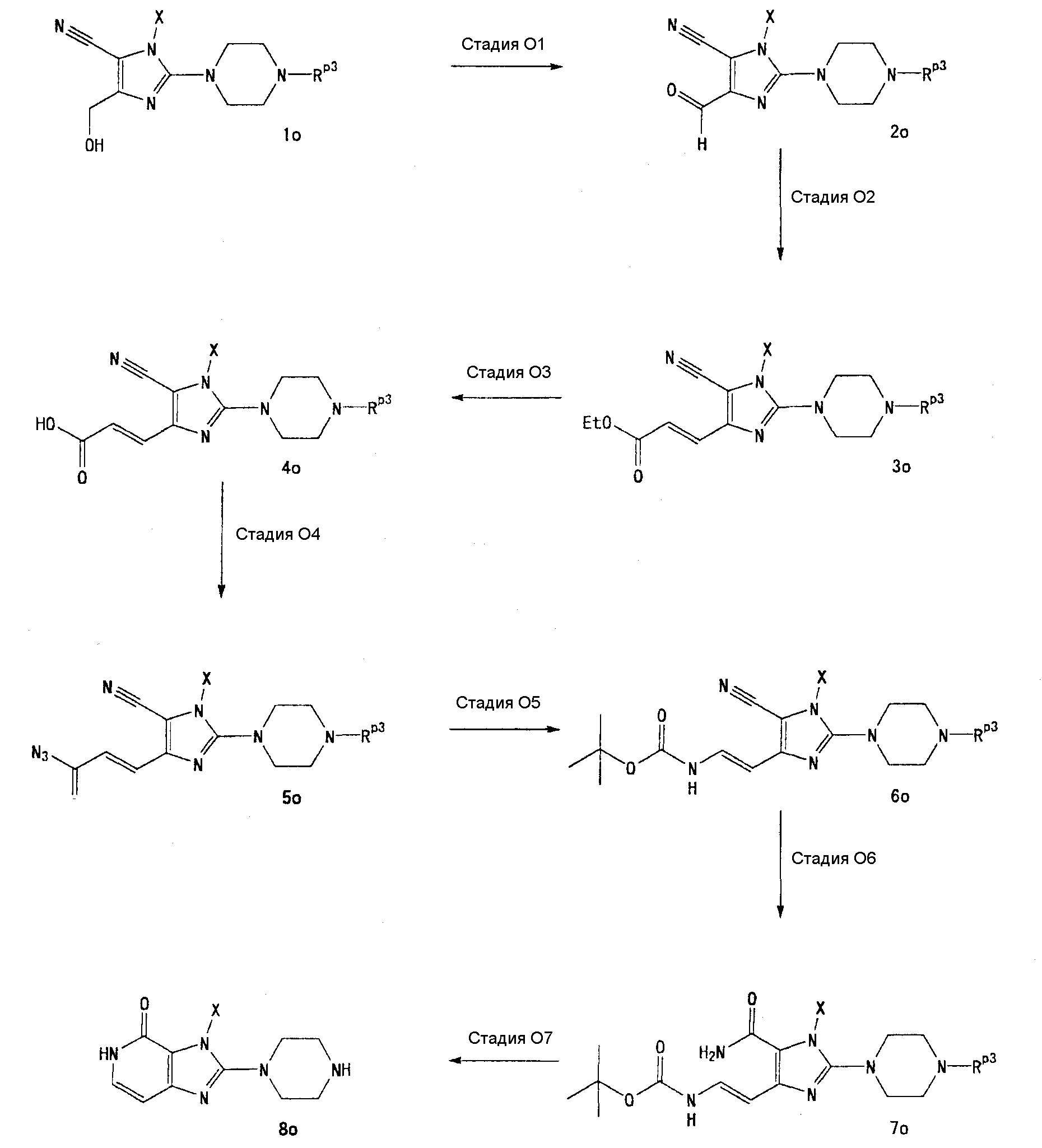
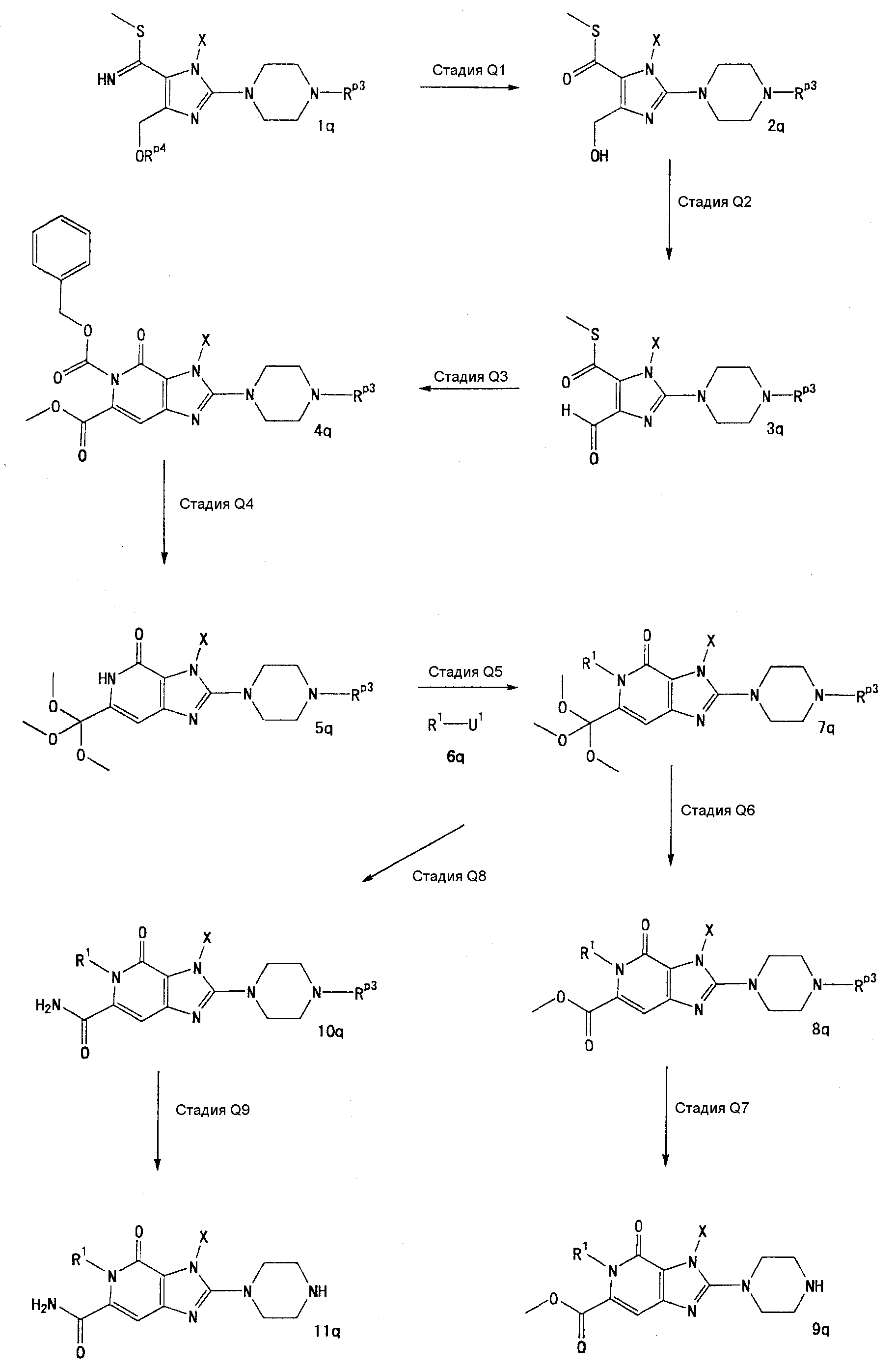
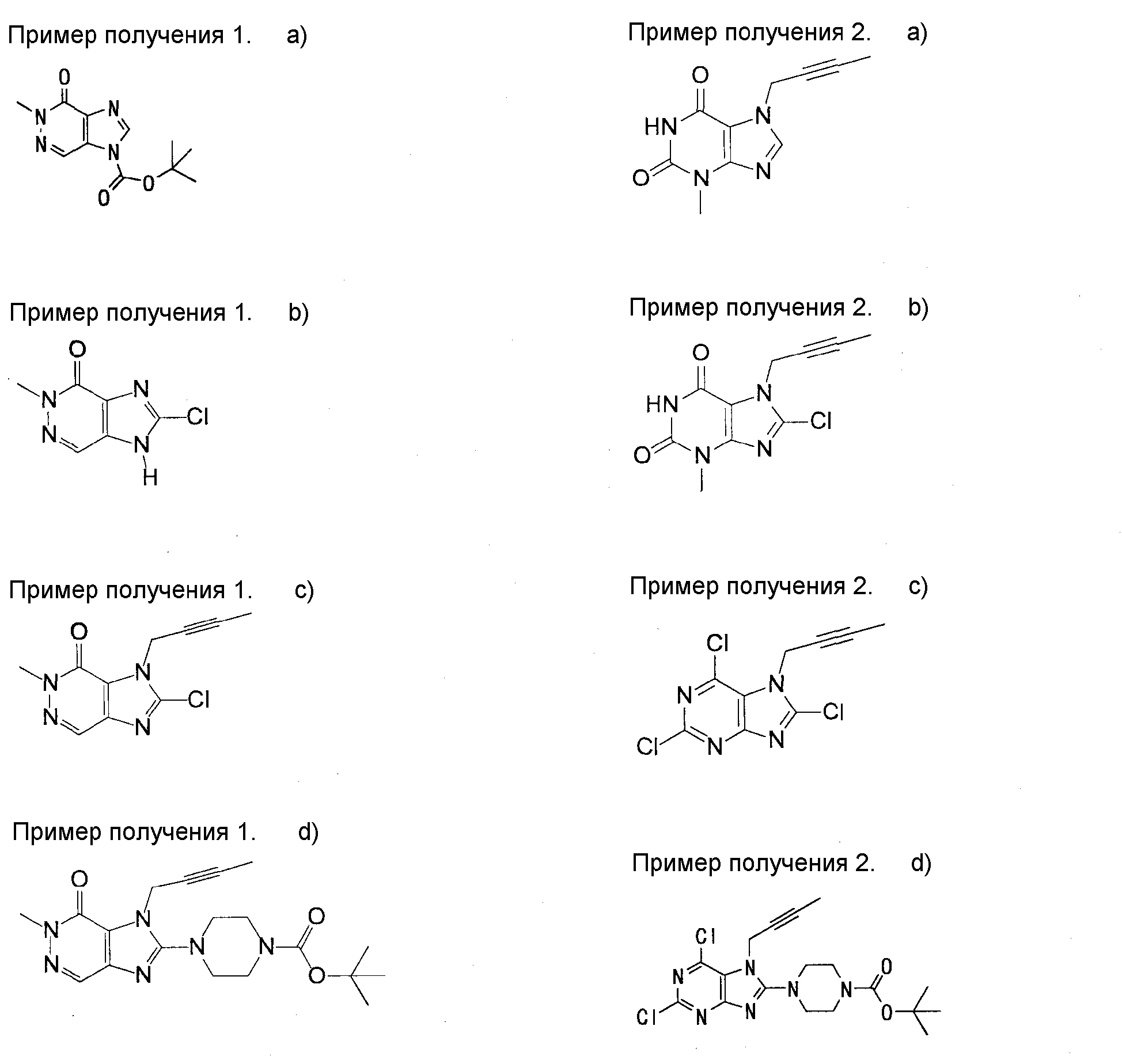
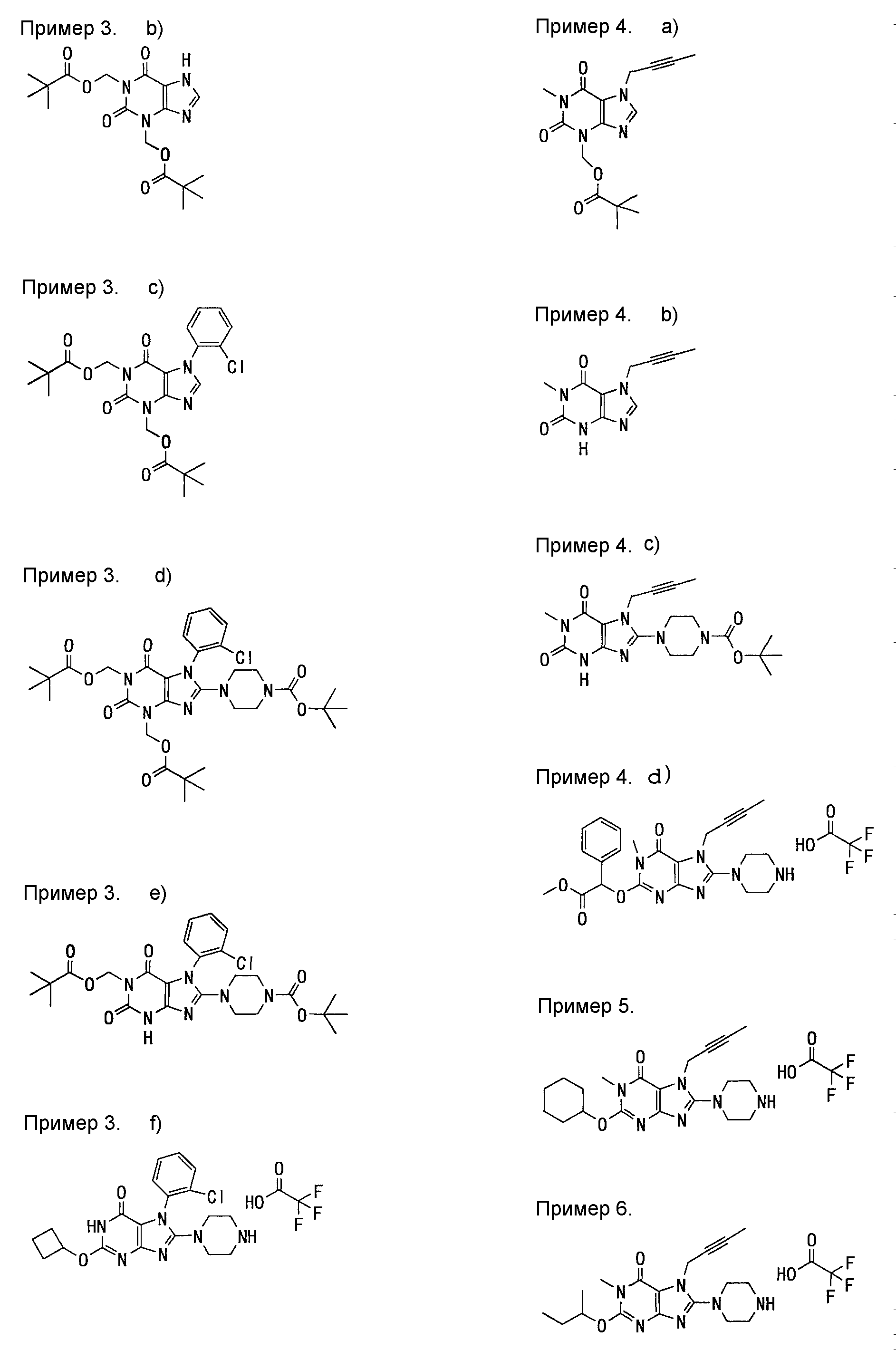
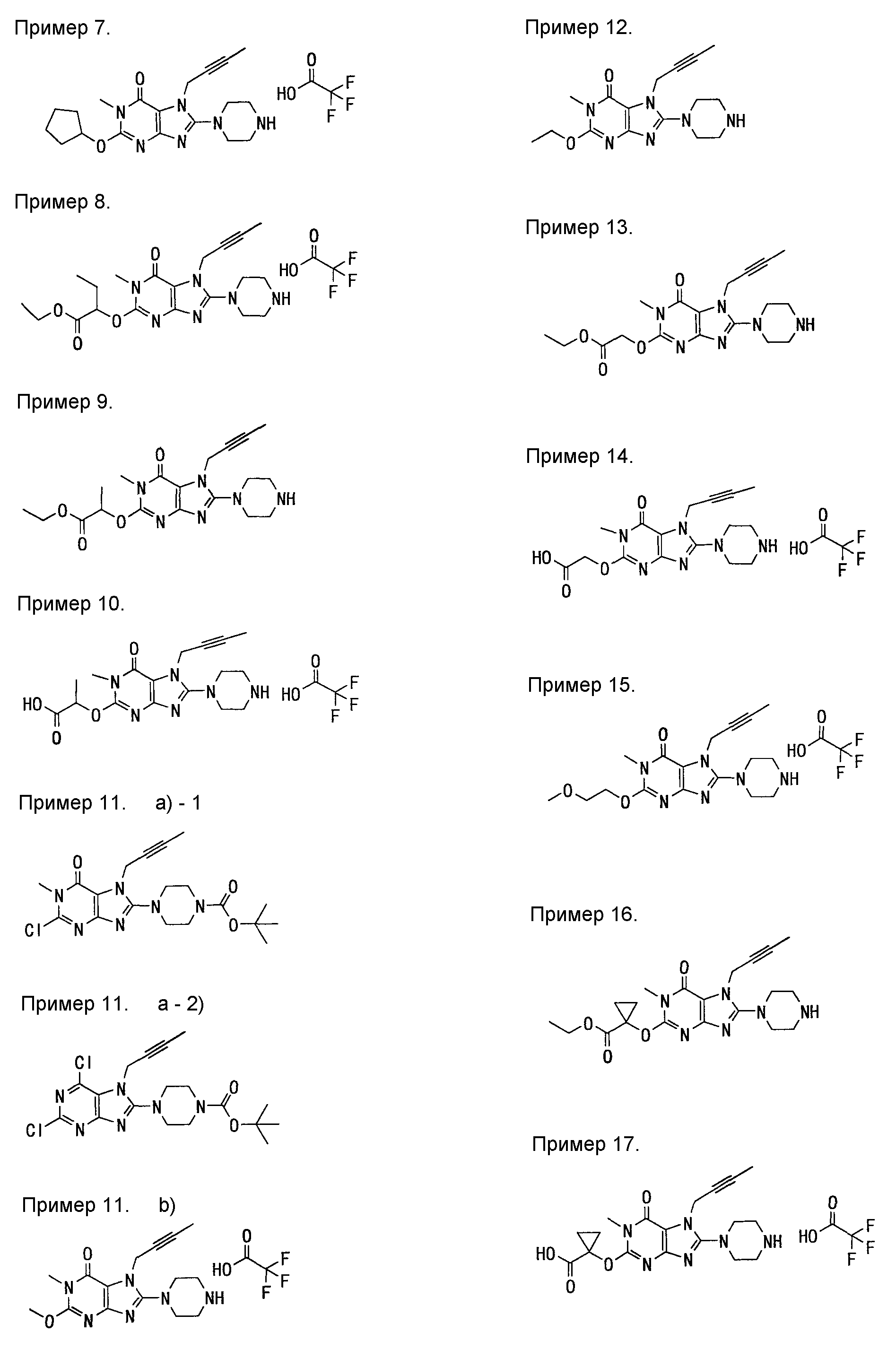
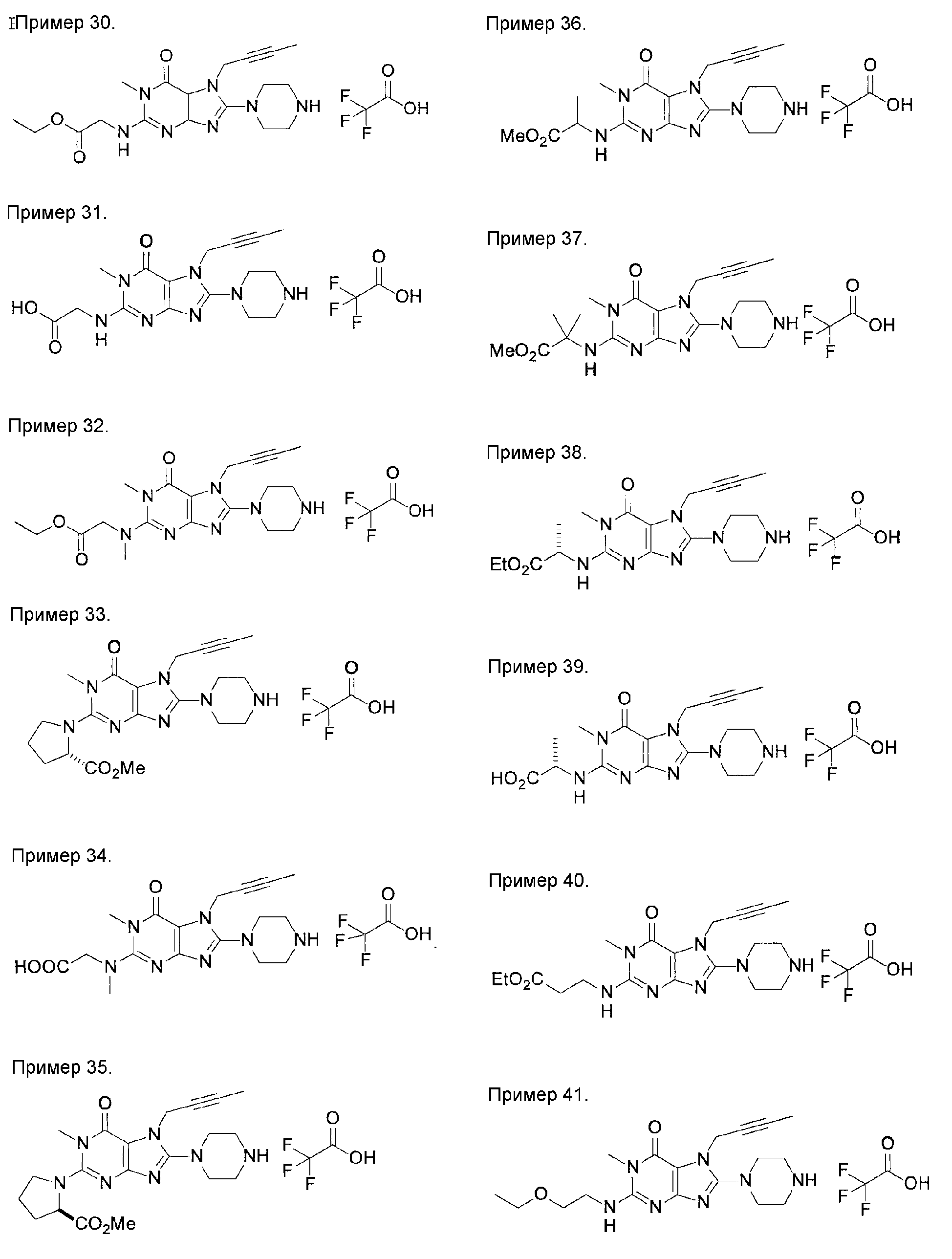
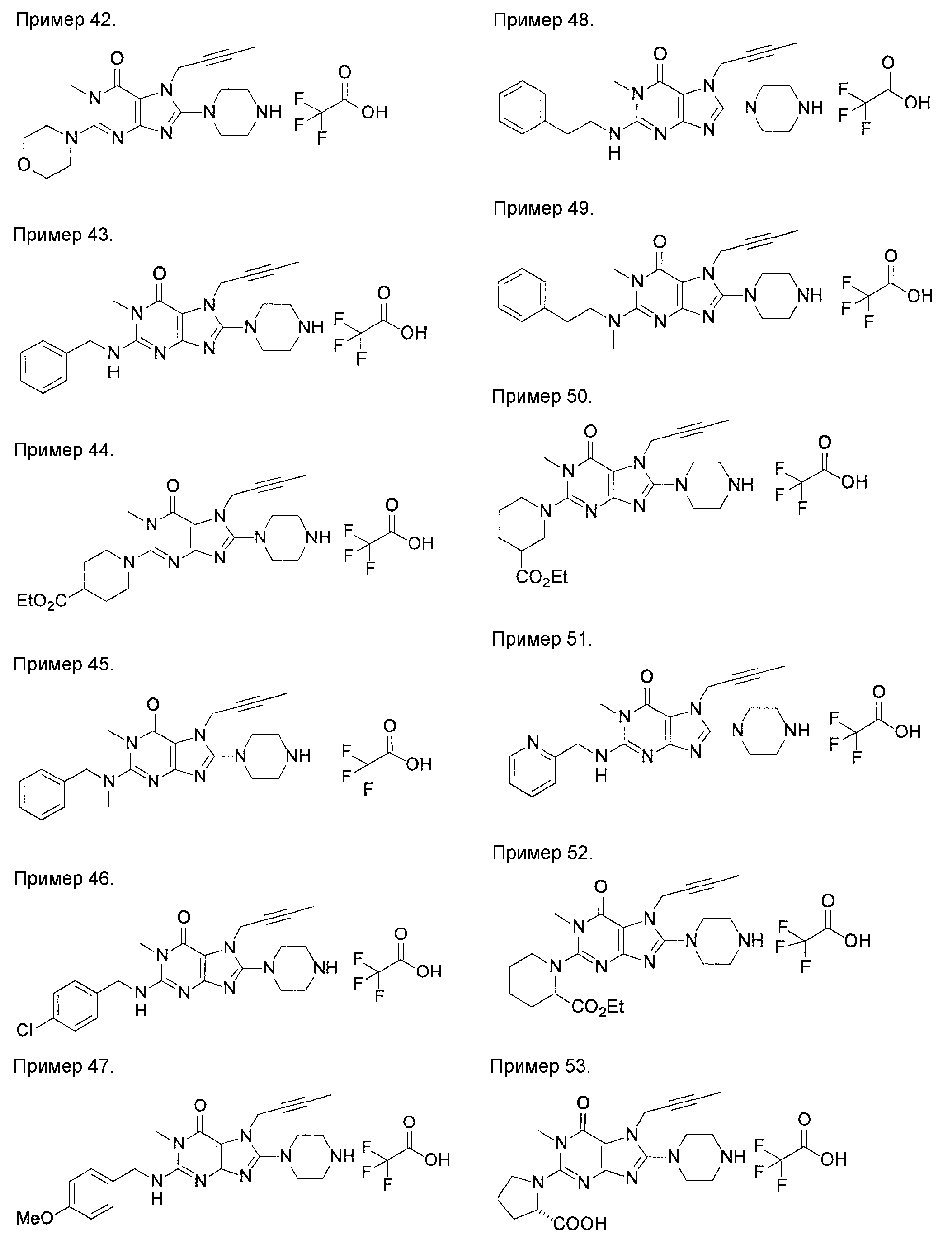
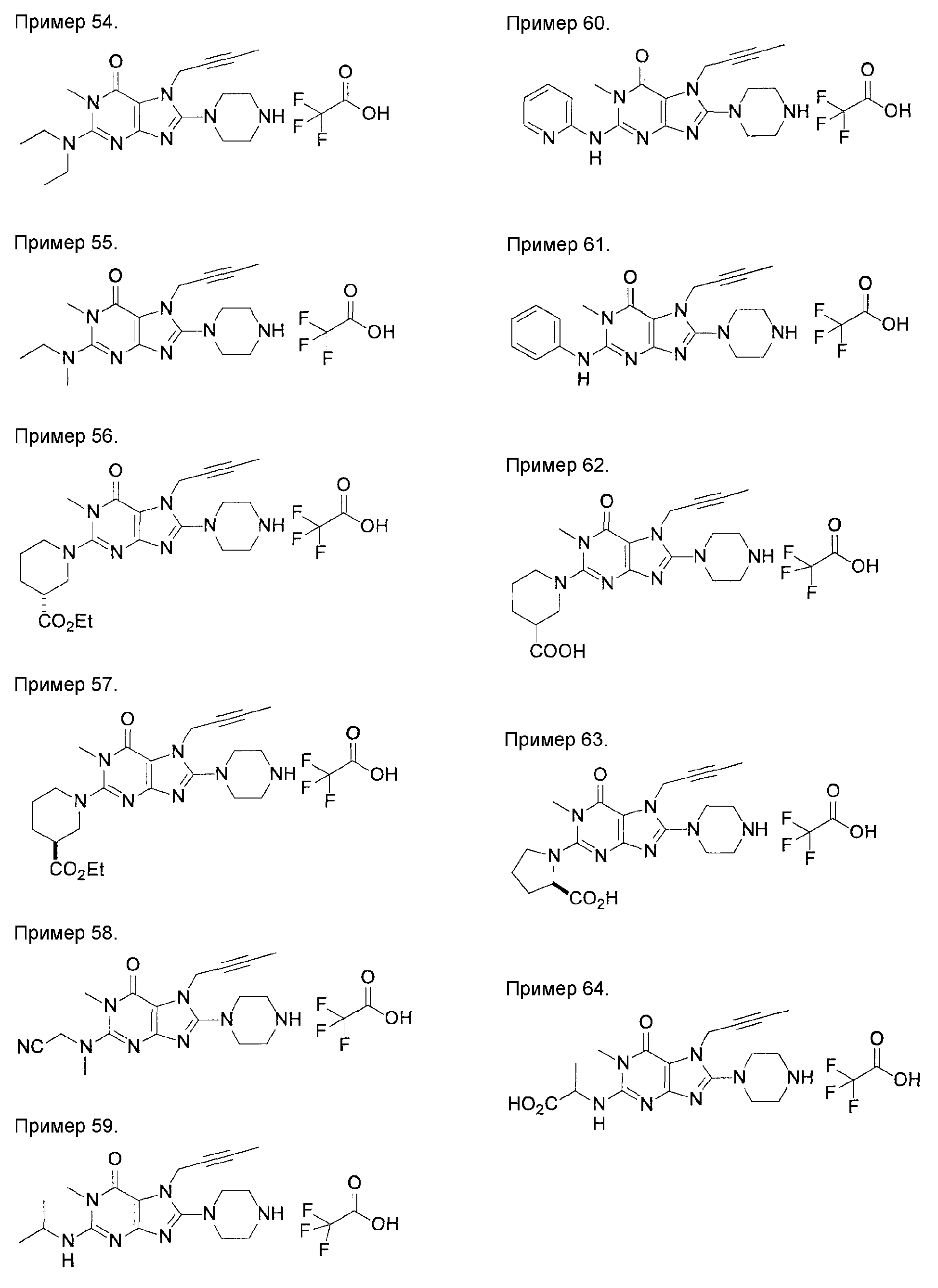
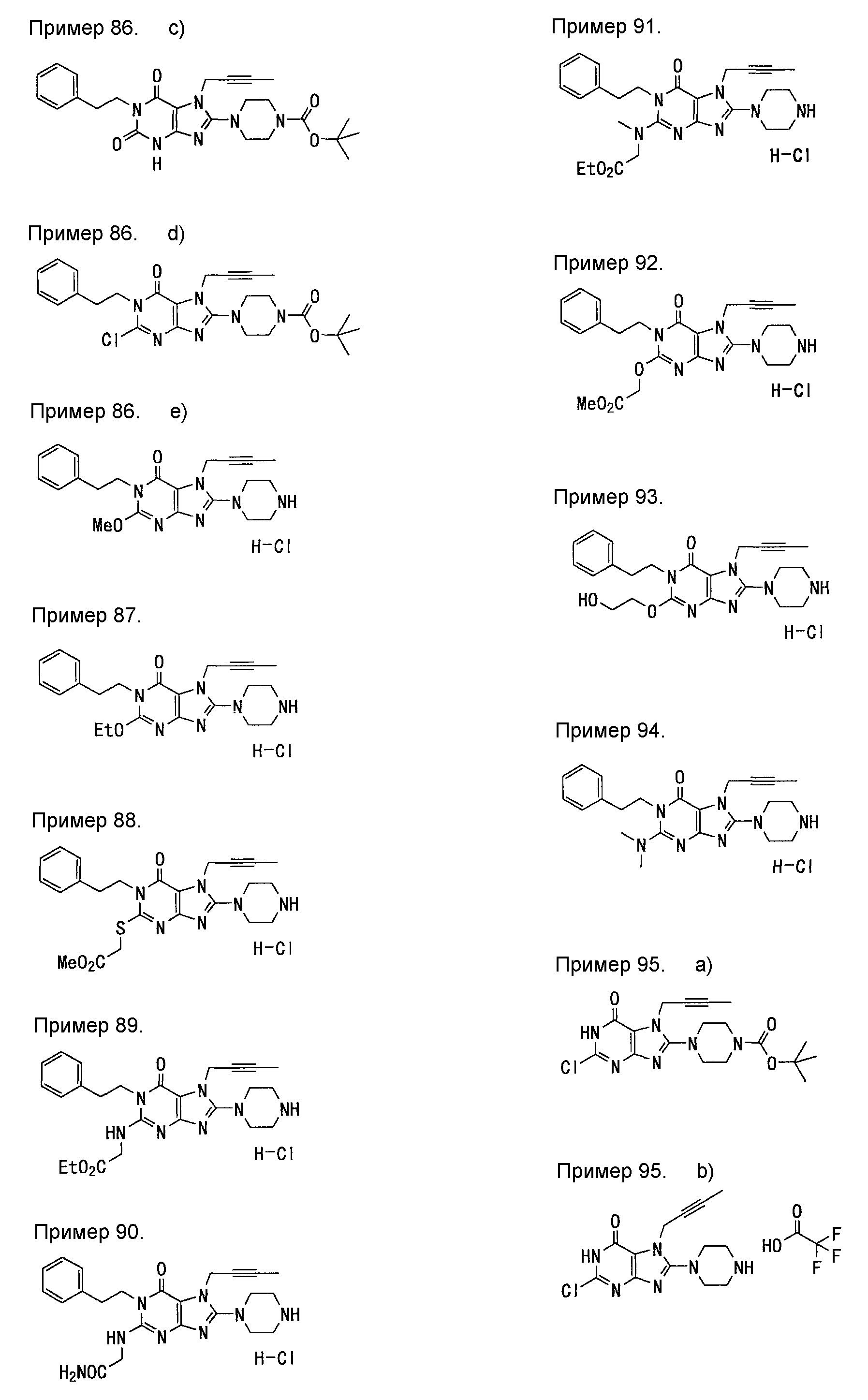
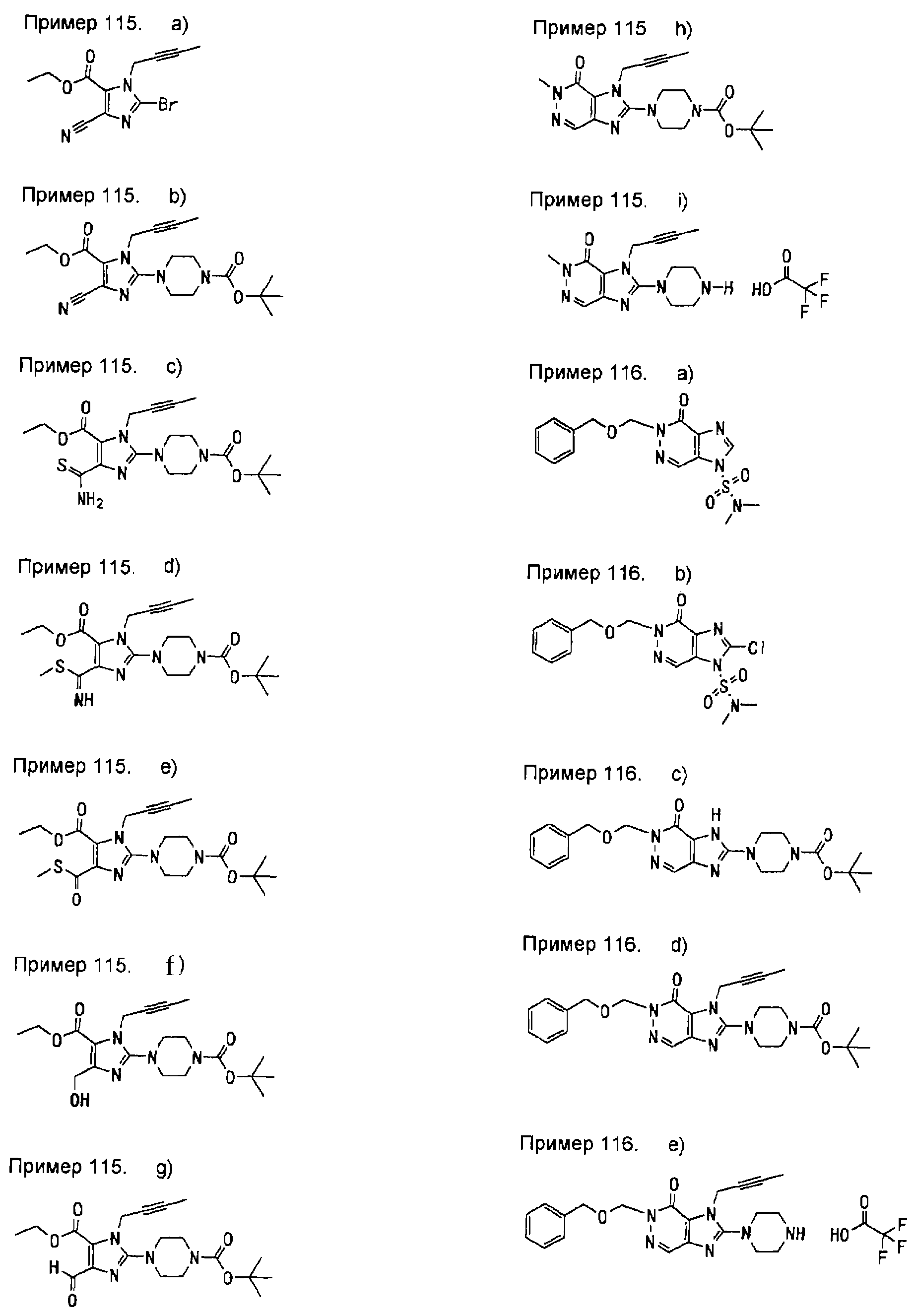
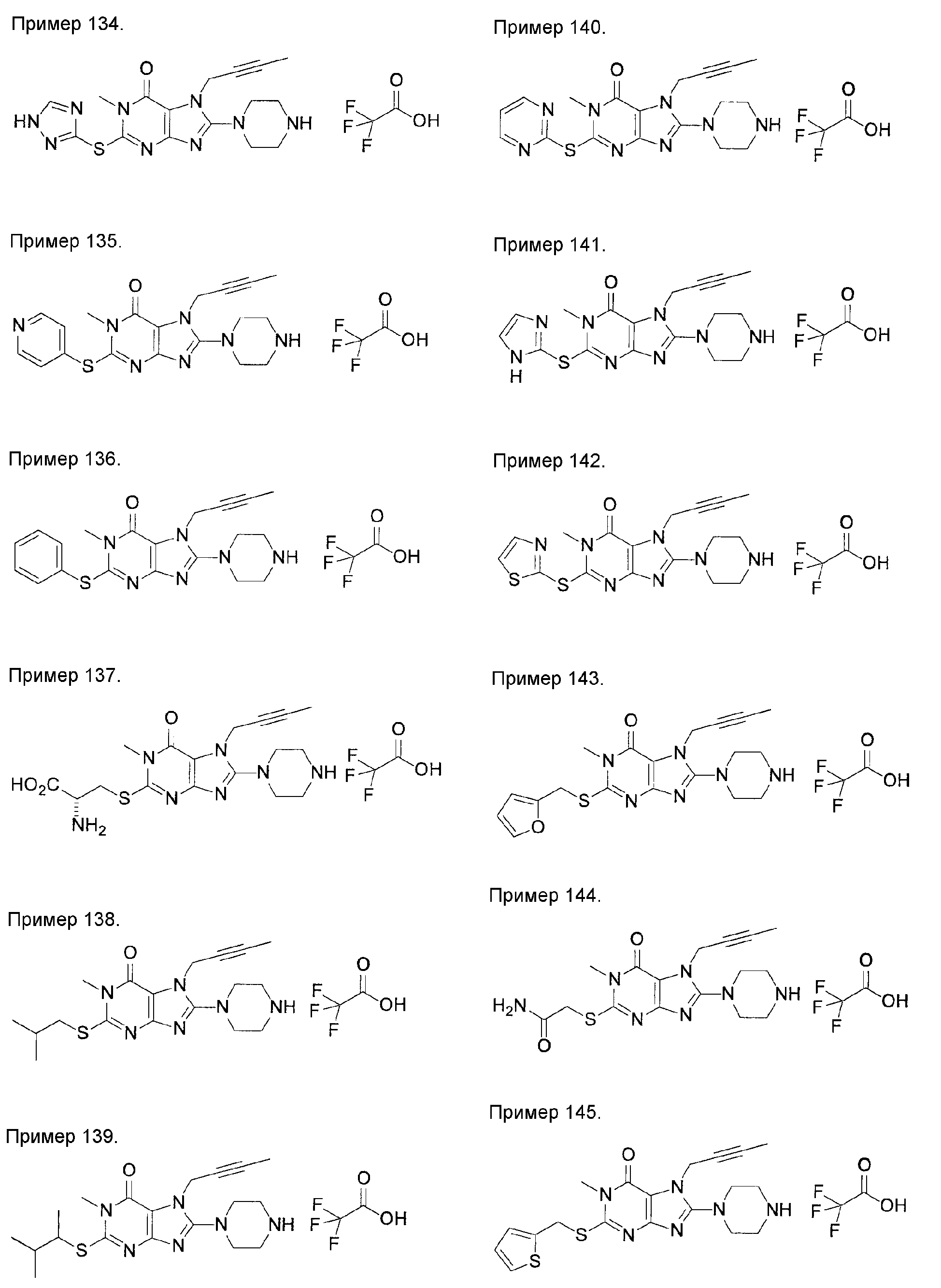
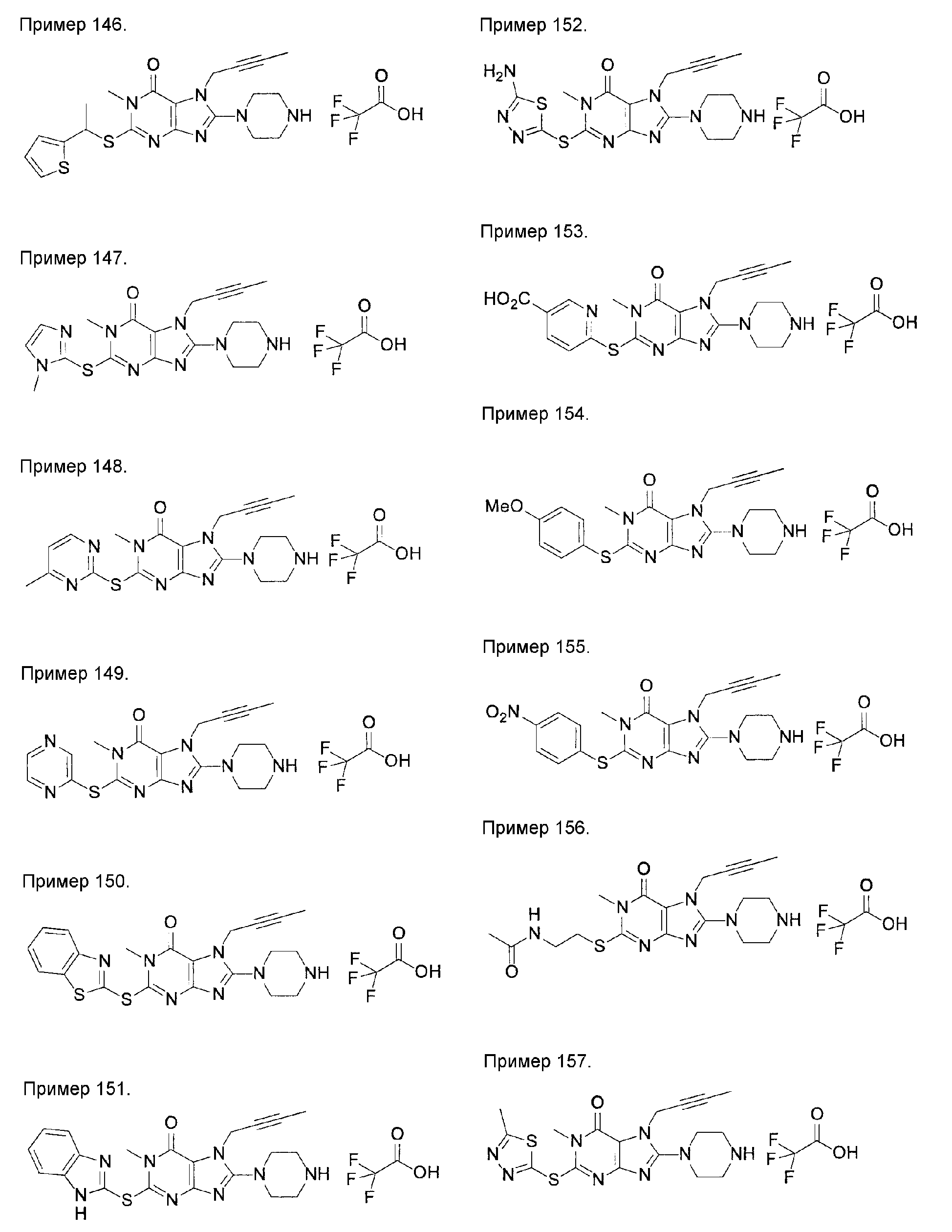
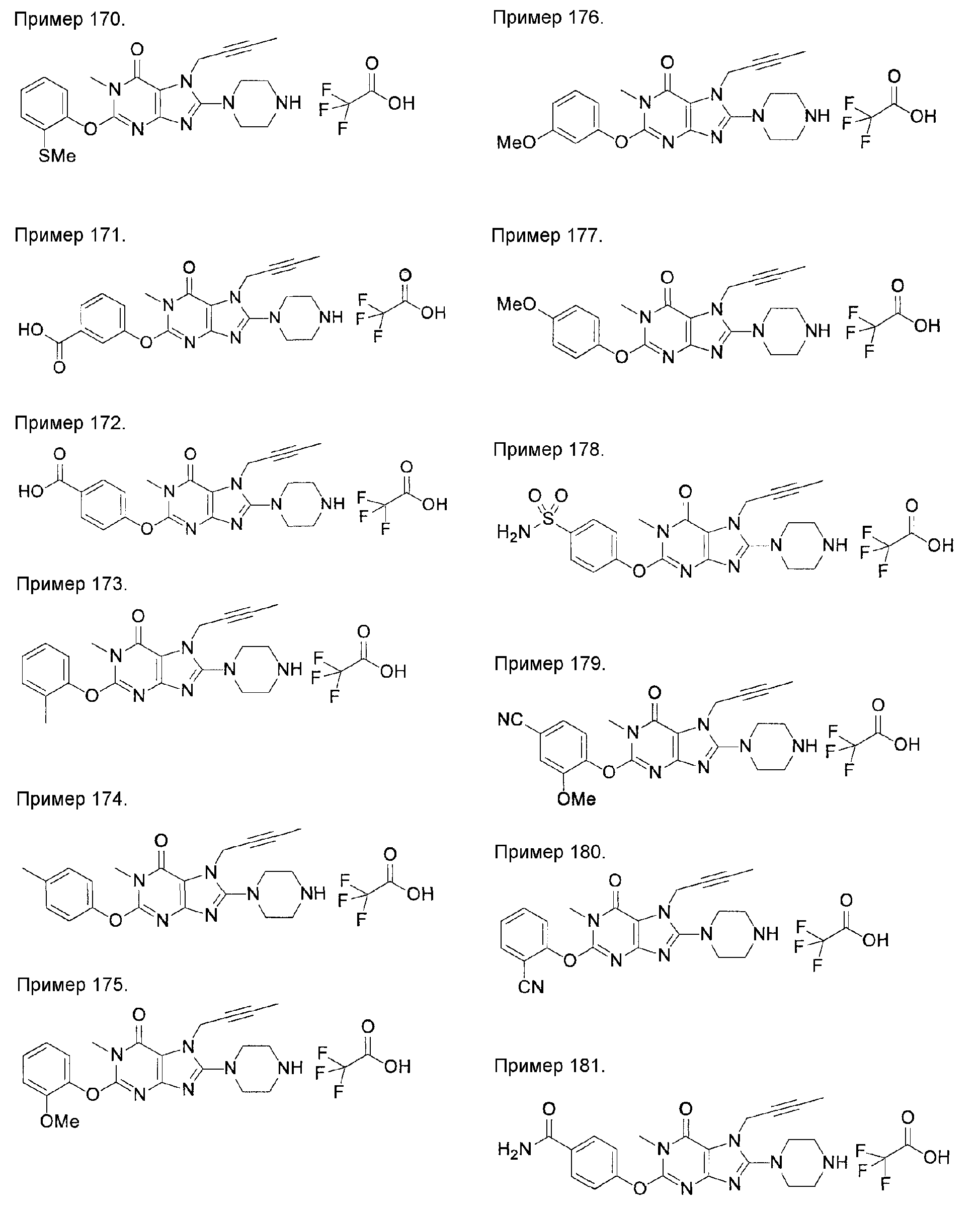
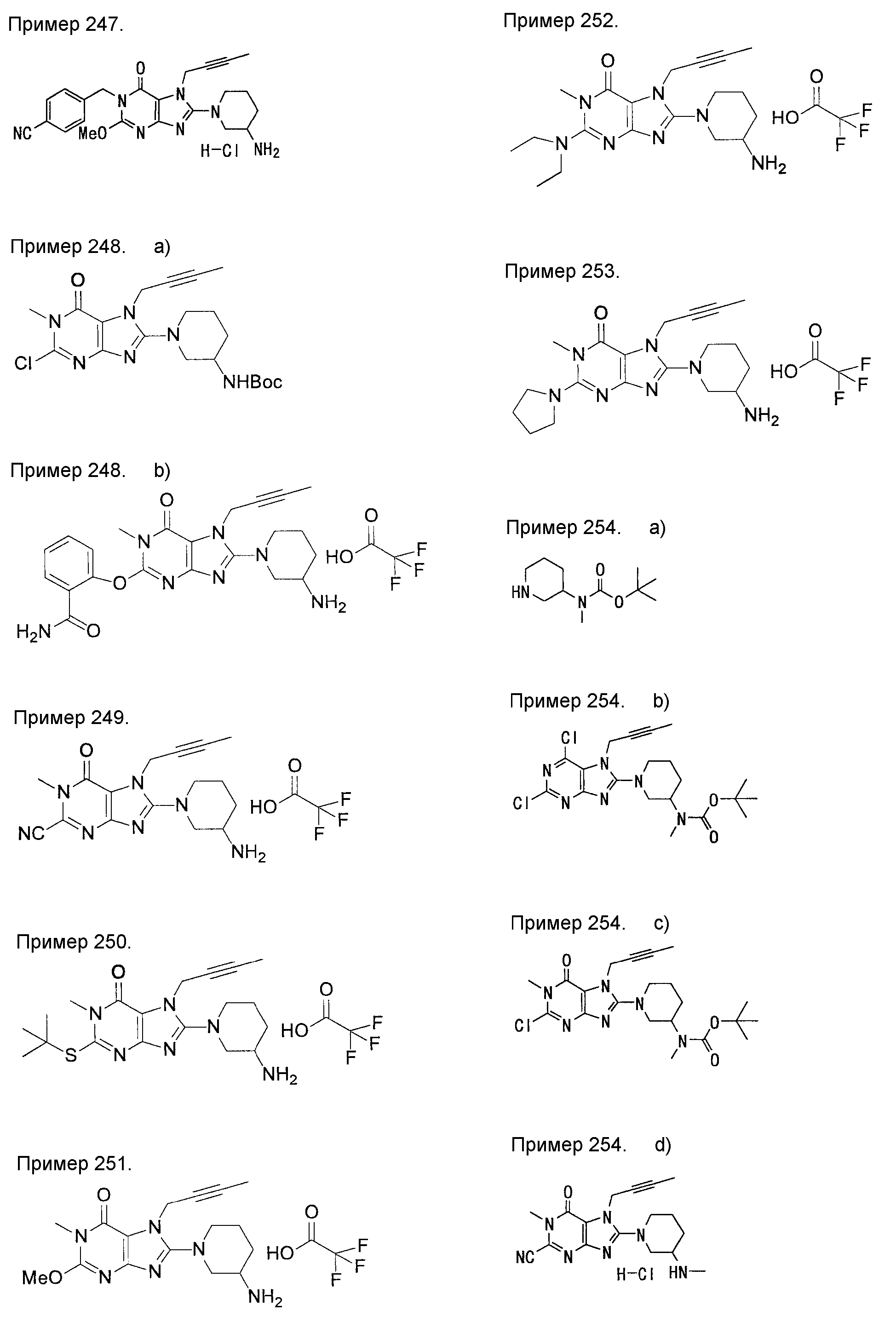
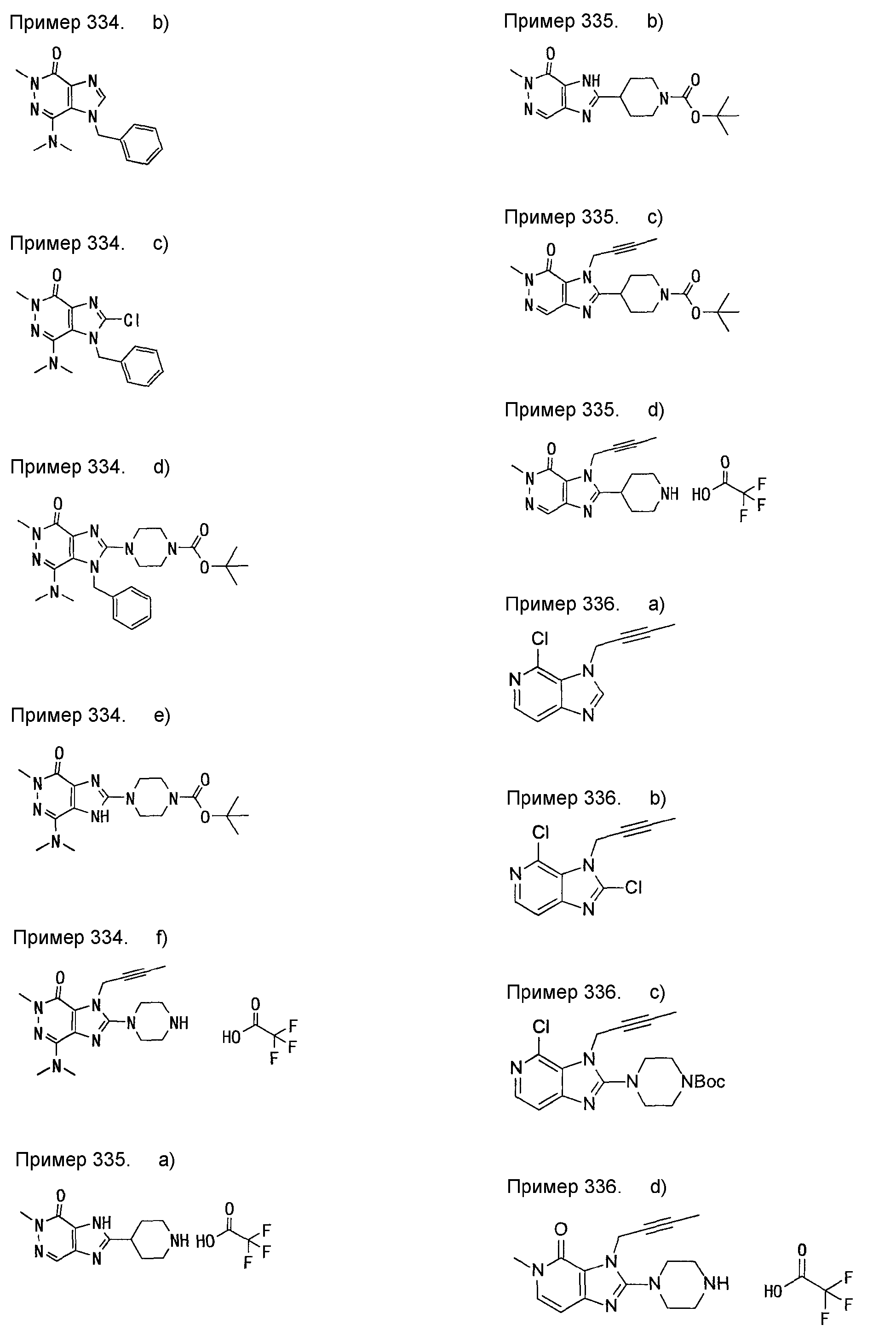
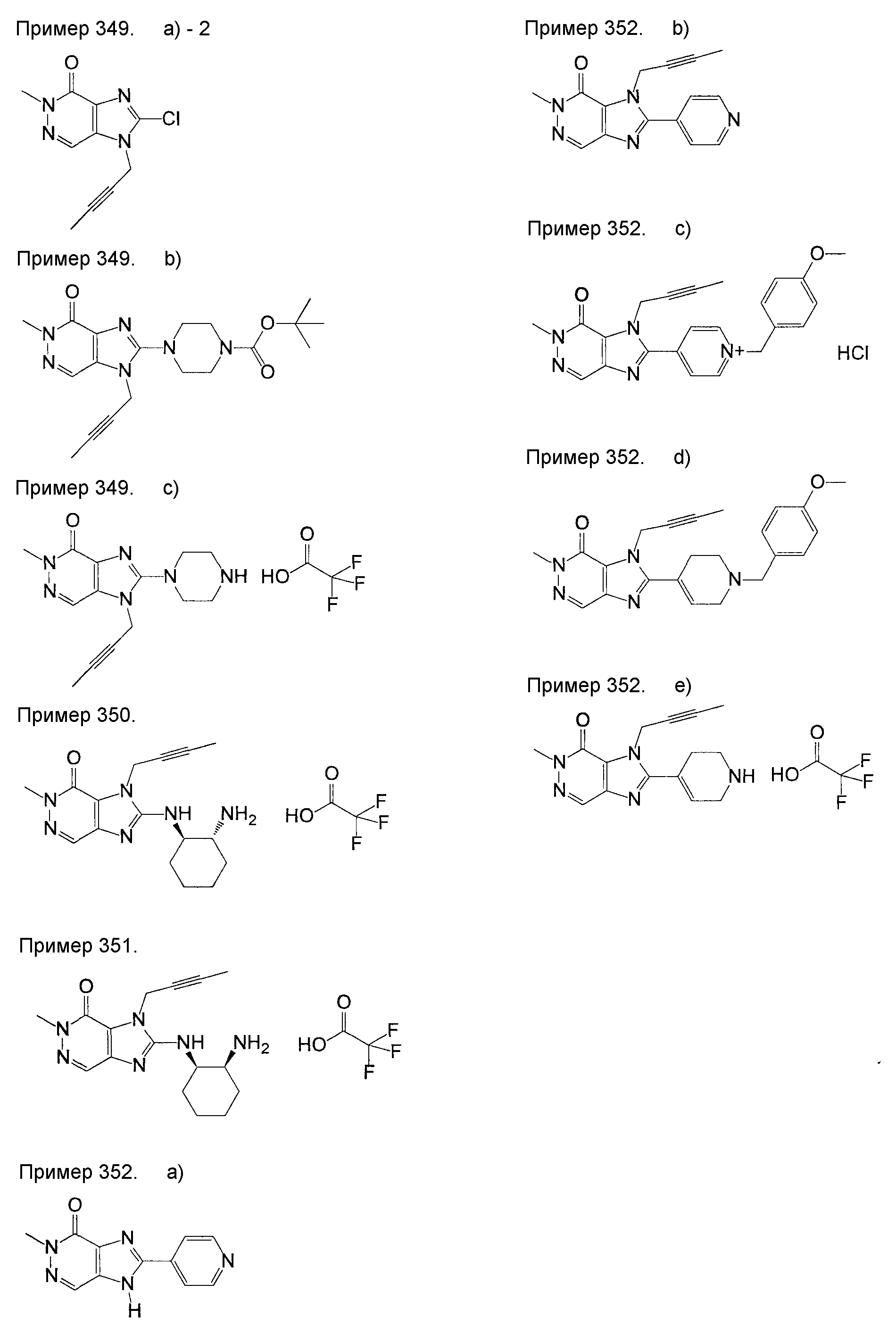
[24] соединение по [1], или его соль, или гидрат, где соединение формулы (I), указанной выше, представляет собой любое соединение, выбранное из группы, включающей
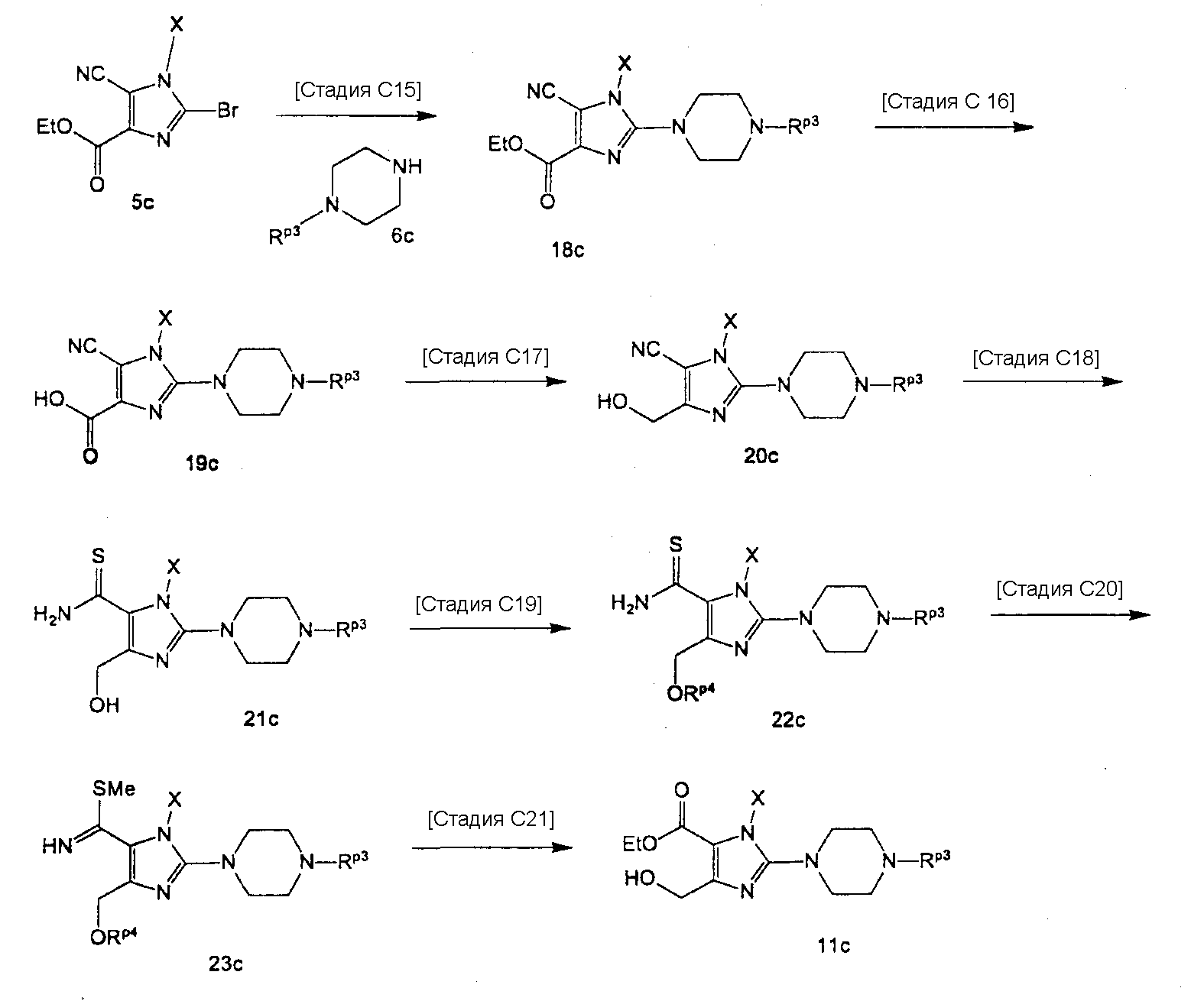
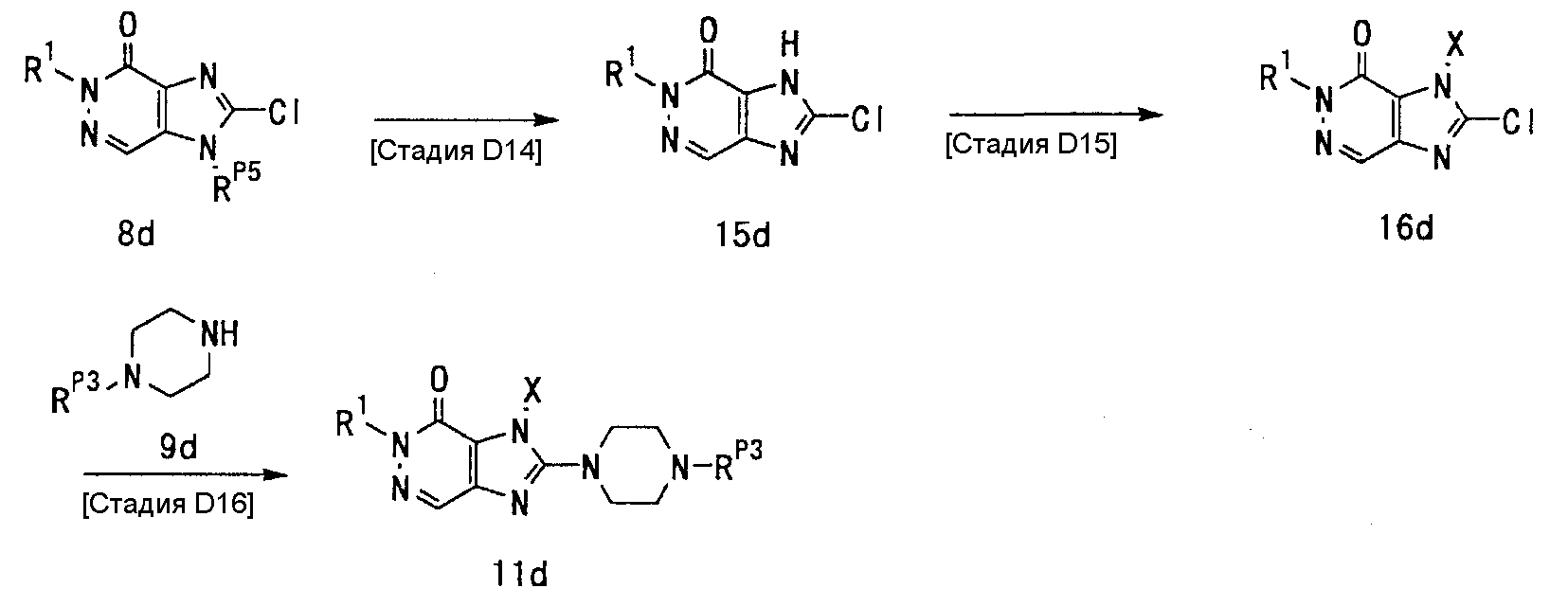
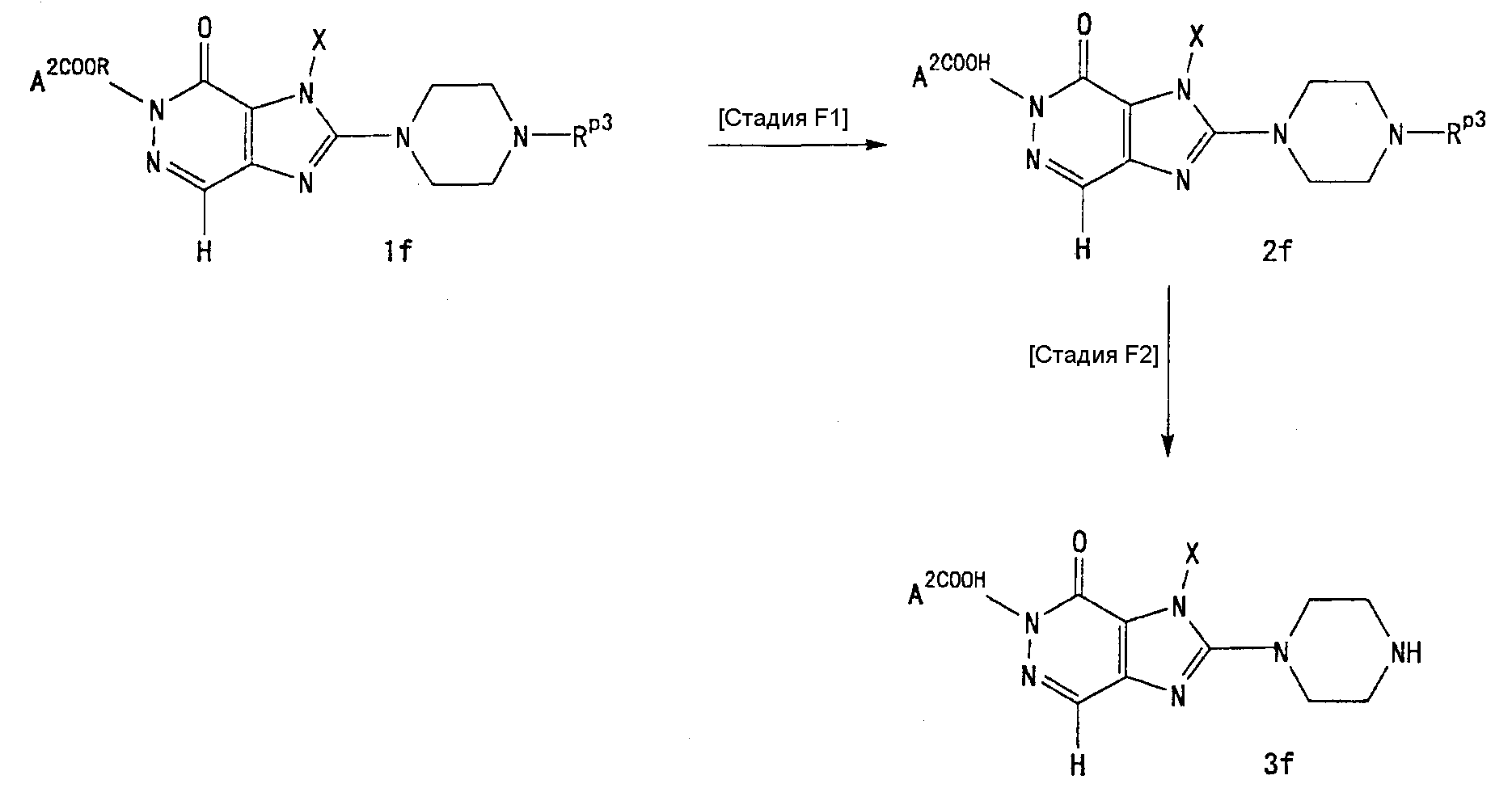
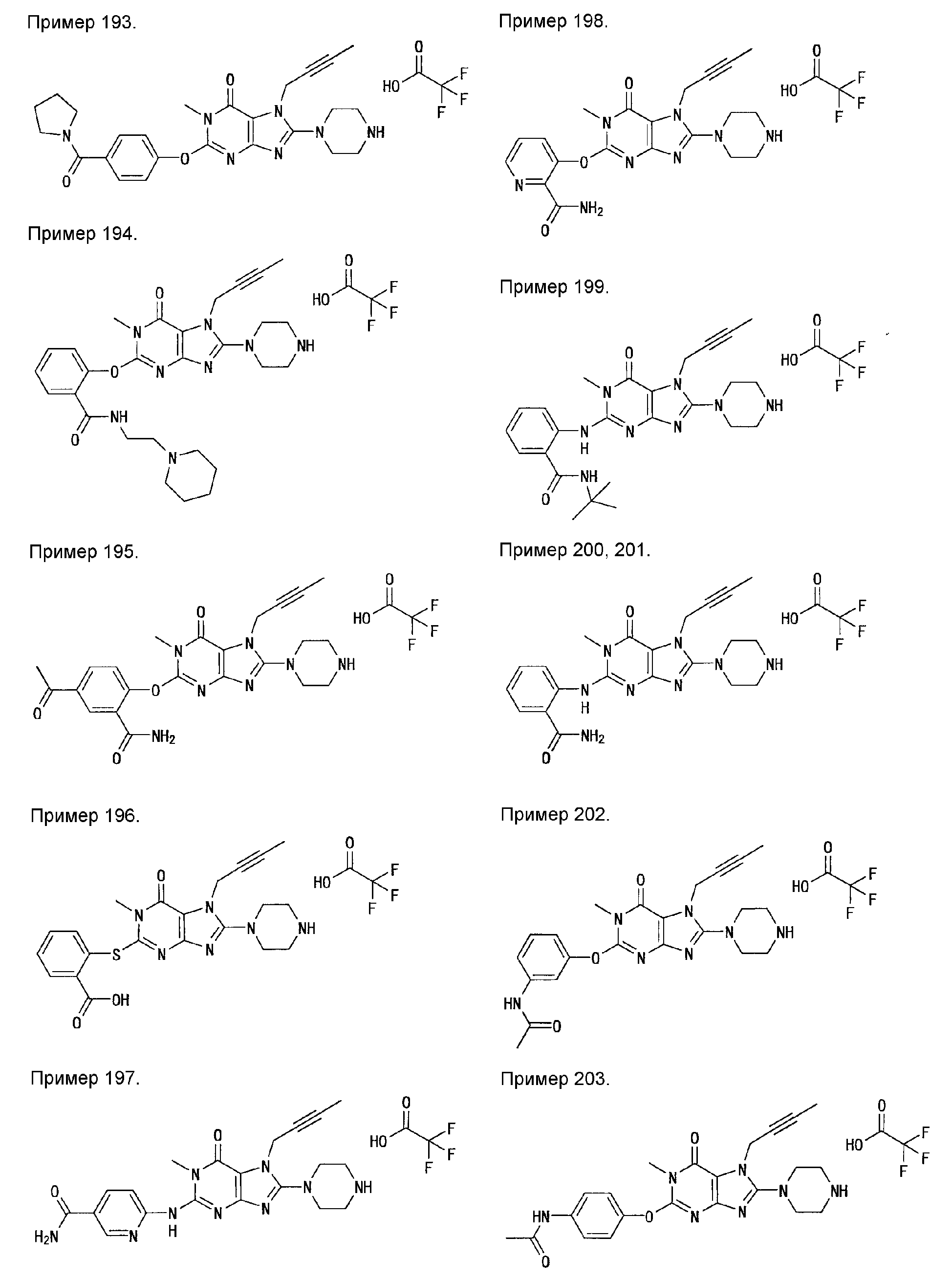
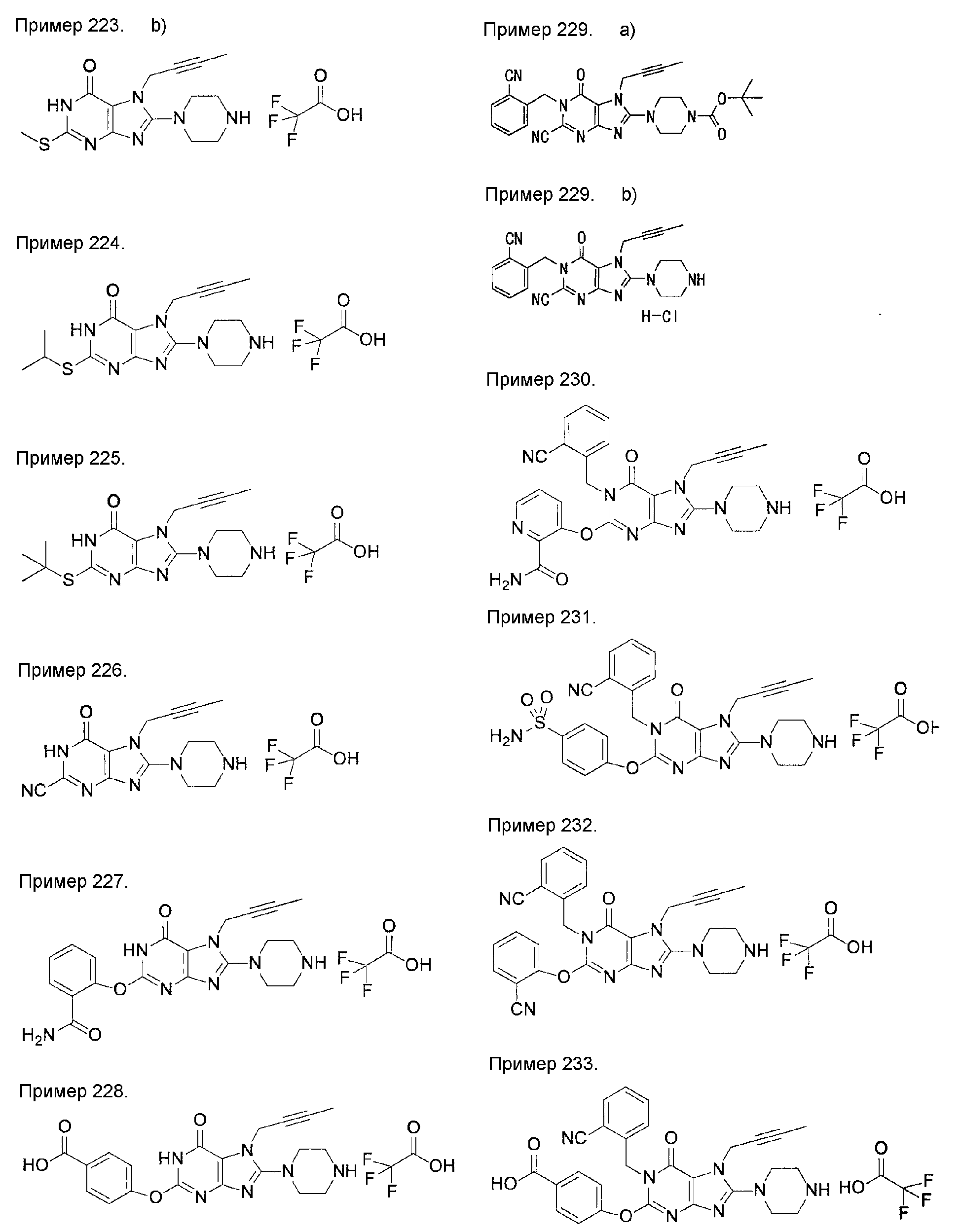
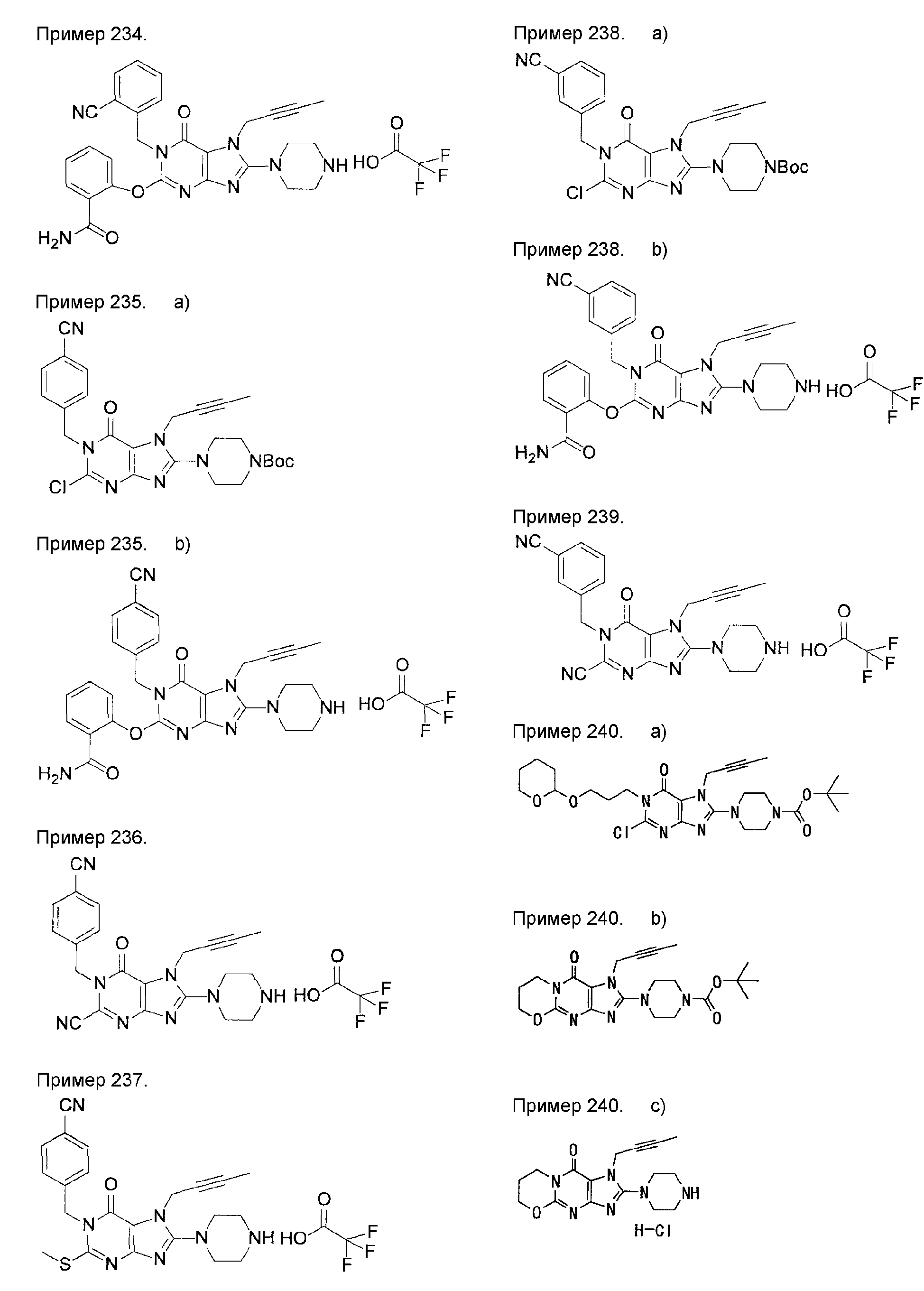
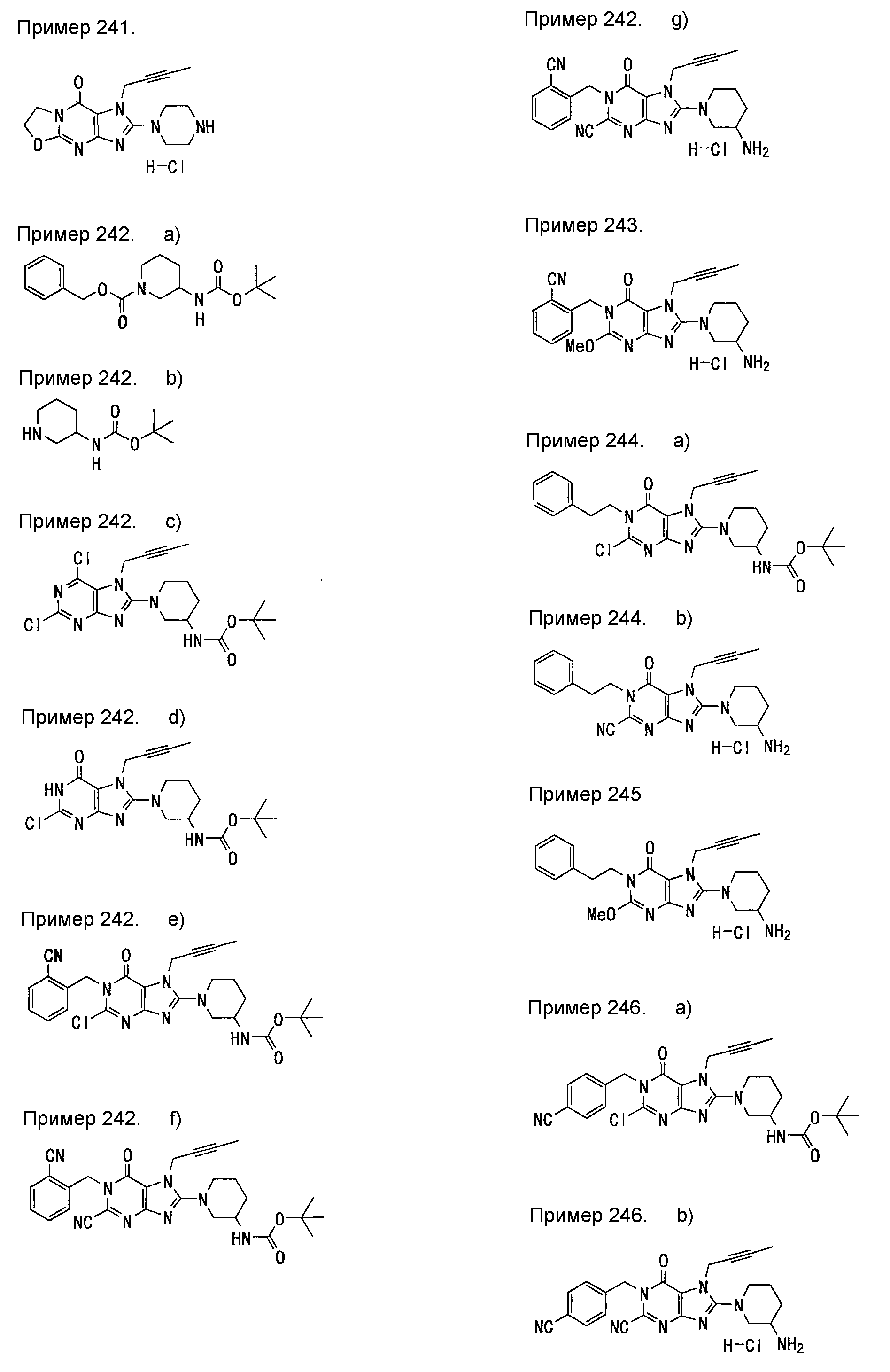
7-(2-бутинил)-2-циано-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он,
3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он,
2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он,
2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид,
7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-карбонитрил и
2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрил;
[25] фармацевтическое средство, содержащее соединение по любому из [1]-[24];
[26] ингибитор дипептидилпептидазы IV, содержащий соединение по любому из [1]-[24];
[27] фармацевтическая композиция, содержащая соединение по любому из [1]-[24] и вспомогательное вещество, используемое при получении препарата;
[28] профилактическое или терапевтическое средство для лечения сахарного диабета, содержащее соединение по любому из [1]-[24];
[29] профилактическое или терапевтическое средство, содержащее соединение по любому из [1]-[24] для лечения сахарного диабета, ожирения, гиперлипидемии, СПИД, остеопороза, желудочно-кишечных нарушений, ангиогенеза, бесплодия, воспалительных заболеваний, аллергических заболеваний или рака;
[30] иммуномодулятор, модулятор гормонов или антиревматическое лекарственное средство, содержащие соединение по любому из [1]-[24];
[31] способ профилактики или лечения заболевания, при котором эффективным является ингибирование дипептидилпептидазы IV, включающий введение пациенту соединения по любому из [1]-[24], или его соли, или гидрата в фармацевтически эффективном количестве;
[32] применение соединения по любому из [1]-[24], или его соли, или гидрата при получении фармацевтического средства;
[33] применение соединения по любому из [1]-[24], или его соли, или гидрата при получении терапевтического или профилактического средства для лечения заболевания, при котором эффективным является ингибирование дипептидилпептидазы IV;
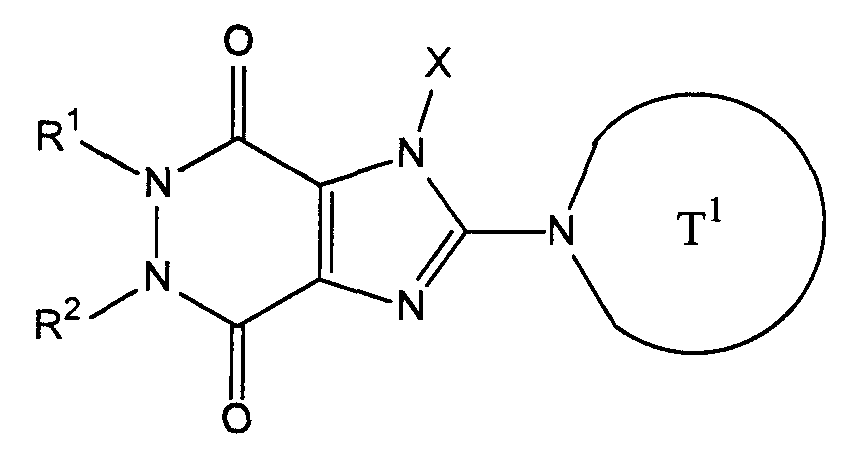
[34] соединение, представленное следующей формулой, или его соль, или гидрат:
где Т0 представляет собой группу Т1, описанную выше в [1], пиридильную группу, которая может иметь один или несколько заместителей, пиридиниевую группу, которая может иметь один или несколько заместителей, группу, представленную следующей ниже формулой:
группу, которая может содержать один или несколько заместителей, представленную следующей формулой:
(где n и m, каждый независимо, равны 0 или 1), или группу, которая может иметь один или несколько заместителей, представленную следующей формулой:
(где n и m, каждый независимо, равны 0 или 1);
Х0 представляет собой С3-8 циклоалкильную группу, которая может иметь один или несколько заместителей, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, С2-6 арильную группу, которая может иметь один или несколько заместителей, 5-10-членную гетероарильную группу, которая может содержать один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может иметь один или несколько заместителей, или 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь один или несколько заместителей;
R1, Z1 и Z2 имеют значения, указанные выше в [1];
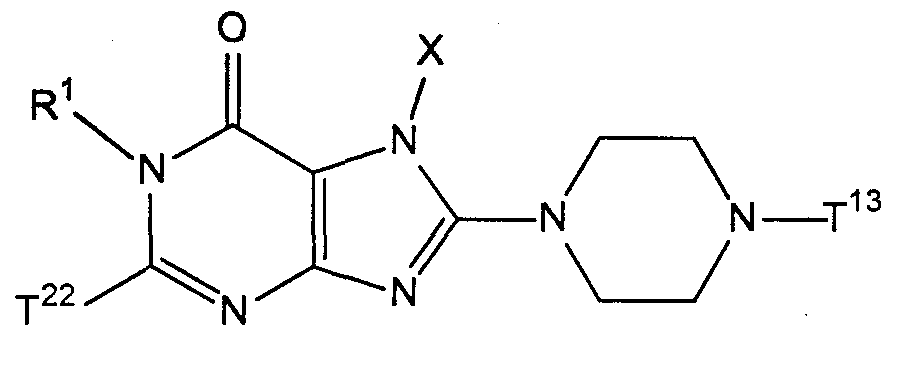
[35] соединение, представленное следующей формулой, или его соль, или гидрат:
где R1, R2, T1, Z1 и Z2 имеют значения указанные выше в [1];
[36] соединение, представленное следующей формулой, или его соль, или гидрат:
где R1, R2, T1 имеют значения, указанные выше в [1];
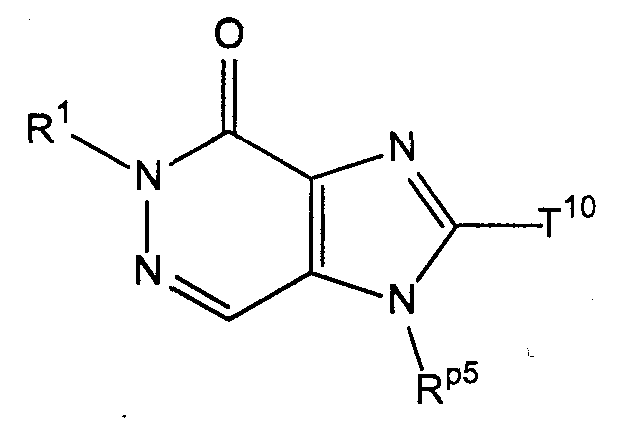
[37] соединение, представленное следующей ниже формулой, или его соль, или гидрат:
где R1 имеет значения, указанные выше в [1];
Rp5 представляет собой трет-бутоксикарбонилоксигруппу, тритильную группу или группу, представленную формулой -SO2NH2, и
Т10 представляет собой атом галогена или атом водорода;
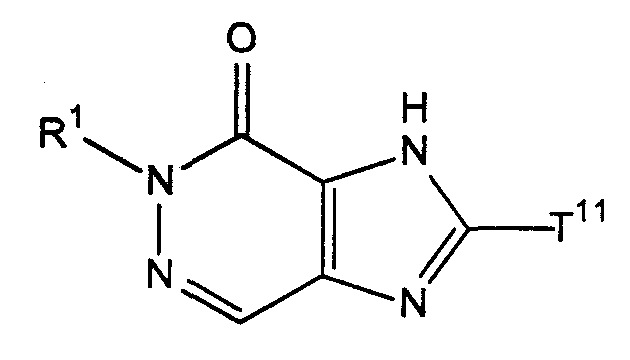
[38] соединение, представленное следующей формулой, или его соль, или гидрат:
где R1 имеет значения, указанные выше в [1], и
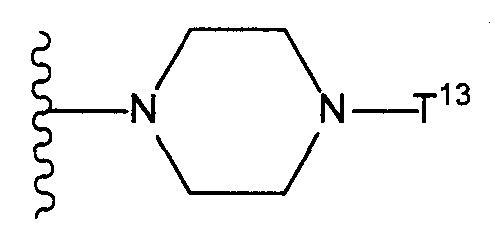
Т11 представляет собой атом галогена или группу, представленную следующей формулой:
(где Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу);
[39] соединение, представленное следующей формулой, или его соль, или гидрат
где R1 и Х имеют значения, указанные выше в [1] соответственно, и
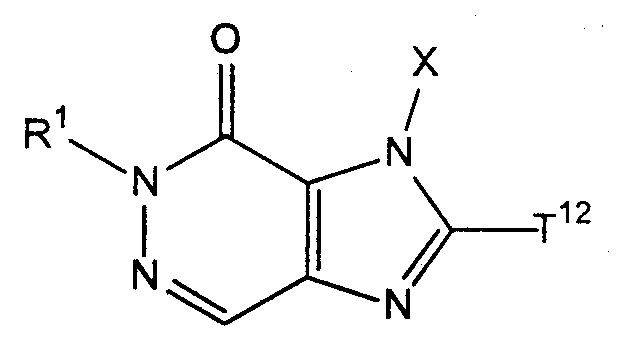
Т12 представляет собой атом галогена;
[40] соединение, представленное следующей формулой, или его соль, или гидрат,
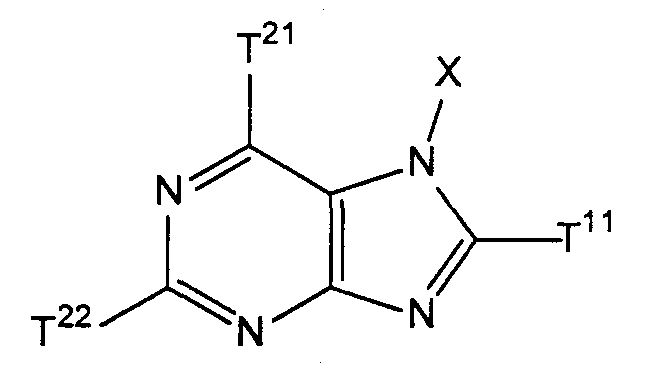
где Х имеет значения, указанные выше в [1], исключая значение, когда Х представляет собой бензильную группу;
Т21 и Т22, каждый независимо, представляют собой атом галогена и
Т11 представляет собой атом галогена или группу, представленную следующей формулой:
(где Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу);
[41] соединение, представленное следующей формулой, или его соль, или гидрат
где Х и R1 имеют значения, указанные выше в [1] соответственно;
Т22 представляет собой атом галогена и
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу;
[42] соединение, представленное следующей формулой, или его соль, или гидрат
где кольцо Т1 представляет собой моноциклическую или бициклическую 6-12-членную гетероциклическую группу, содержащую два атома азота в кольце, которое может иметь один или несколько заместителей;
Х представляет собой С1-6 алкильную группу, которая может иметь один или несколько заместителей, С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, С6-10 арильную группу, которая может иметь один или несколько заместителей, 5-10-членную гетероарильную группу, которая может иметь один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может иметь один или несколько заместителей, или 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь один или несколько заместителей;
Х может образовывать связь с атомом, входящим в состав кольца Т1;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу, представленную формулой -CR2=;
R1 и R2, независимо, представляют собой атом водорода, 4-8-членную гетероциклическую группу, которая может иметь один или несколько заместителей, или группу, представленную формулой -А0-А1-А2
(где А0 представляет собой одинарную связь или С1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей В, описанной далее; А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA-, группу, представленную формулой -CO-NRA-, группу, представленную формулой -NRA-СО, группу, представленную формулой -SO2-NRA- или группу, представленную формулой -NRA-SO2-;
А2 и RА, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу или 4-8-членную гетероциклическую группу, при этом А2 и RА, каждый независимо, могут иметь 1-3 заместителя, выбранных из группы заместителей В, описанной далее:
исключая случаи, когда (i) оба R1 и R2 представляют собой атомы водорода и (ii) R2 представляет собой гидроксильную группу.
<Группа заместителей В>
Группа заместителей В представляет собой группу, включающую гидроксильную группу, цианогруппу, атом галогена, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, группу, представленную формулой -CO-RB-RB2 (где RB представляет собой одинарную связь, атом кислорода, группу, представленную формулой-NRB3-; RB2 и RB3, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, С6-10 арил С1-6 алкильную группу, 5-10-членный гетероарил С1-6 алкильную группу, 1-пирролидинильную группу, 1-морфолинильную группу, 1-пиперазинильную группу или 1-пиперидильную группу)).
Предпочтительный способ осуществления изобретения
Настоящее изобретение подробно проиллюстрировано далее.
Для удобства описания структурная формула соединения здесь иногда изображает определенный изомер. Однако соединения по настоящему изобретению могут включать все возможные изомеры, такие как структурно возможные геометрические изомеры, оптические изомеры, образованные благодаря наличию асимметрических атомов углерода, стереоизомеры, таутомеры и смеси изомеров, и они не ограничиваются формулами, используемыми для удобства в описании, и могут представлять собой любой из двух изомеров или смеси обоих изомеров. Таким образом, соединения по настоящему изобретению могут представлять собой любые оптически активные соединения, молекулы или рацематы которых содержат асимметрический атом углерода, и они не ограничиваются какой-либо из таких форм, а включают обе. Кроме этого, соединения по настоящему изобретению могут проявлять кристаллический полиморфизм, но и в этом случае они не ограничиваются конкретным полиморфом, и могут представлять собой любую из таких кристаллических форм или существовать в виде смеси двух или более кристаллических форм. Соединения по настоящему изобретению также включают как безводные, так и гидратные формы. Вещества, образующиеся в результате метаболизма in vivo соединений по настоящему изобретению, также входят в объем формулы изобретения.
Далее подробно описаны термины и обозначения, используемые в настоящем изобретении.
Как здесь используется, выражение «С1-6 алкильная группа» относится к линейной или разветвленной алкильной группе, содержащей 1-6 атомов углерода, которая является моновалентной группой, полученной при удалении любого атома водорода из молекулы алифатического углеводорода, содержащего 1-6 углеродных атомов, и, в частности, включает, например, метильную группу, этильную группу, 1-пропильную группу, 2-пропильную группу, 2-метил-1-пропильную группу, 2-метил-2-пропильную группу, 1-бутильную группу, 2-бутильную группу, 1-пентильную группу, 2-пентильную группу, 3-пентильную группу, 2-метил-1-бутильную группу, 3-метил-1-бутильную группу, 2-метил-2-бутильную группу, 3-метил-2-бутильную группу, 2,2-диметил-1-пропильную группу, 1-гексильную группу, 2-гексильную группу, 3-гексильную группу, 2-метил-1-пентильную группу, 3-метил-1-пентильную группу, 4-метил-1-пентильную группу, 2-метил-2-пентильную группу, 3-метил-2-пентильную группу, 4-метил-2-пентильную группу, 2-метил-3-пентильную группу, 3-метил-3-пентильную группу, 2,3-диметил-1-бутильную группу, 3,3-диметил-1-бутильную группу, 2,2-диметил-1-бутильную группу, 2-этил-1-бутильную группу, 3,3-диметил-2-бутильную группу и 2,3-диметил-2-бутильную группу.
Как здесь используется, выражение «С2-6 алкенильная группа» относится к линейной или разветвленной алкенильной группе, содержащей 2-6 атомов углерода, и, в частности, включает, например, винильную группу, аллильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, пентенильную группу и гексенильную группу.
Как здесь используется, выражение «С2-6 алкинильная группа» относится к линейной или разветвленной алкинильной группе, содержащей 2-6 атомов углерода, и, в частности, включает, например, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, бутинильную группу, пентинильную группу, гексинильную группу.
Как здесь используется, выражение «С3-6 циклоалкильная группа» относится к циклической алифатической углеводородной группе, содержащей 3-8 углеродных атомов, и, в частности, включает, например, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу и циклооктильную группу.
Как здесь используется, выражение «С1-6 алкиленовая группа» относится к дивалентной группе, полученной при удалении еще одного произвольного водородного атома из «С1-6 алкильной группы», имеющей указанные выше значения, и, в частности, включает, например, метиленовую группу, 1,2-этиленовую группу, 1,1-этиленовую группу, 1,3-пропиленовую группу, тетраметиленовую группу, пентаметиленовую группу и гексаметиленовую группу.
Как здесь используется, выражение «С3-8 циклоалкиленовая группа» относится к дивалентной группе, полученной при удалении еще одного произвольного водородного атома из «С3-8 циклоалкильной группы», имеющей указанные выше значения.
Как здесь используется, выражение «С1-6 алкоксигруппа» относится к оксигруппе, связанной с «С1-6 алкильной группой», указанной выше, и, в частности, включает, например, метоксигруппу, этоксигруппу, 1-пропилоксигруппу, 2-пропилоксигруппу, 2-метил-1-пропилоксигруппу, 2-метил-2-пропилоксигруппу, 1-бутилоксигруппу, 2-бутилоксигруппу, 1-пентилоксигруппу, 2-пентилоксигруппу, 3-пентилоксигруппу, 2-метил-1-бутилоксигруппу, 3-метил-1-бутилоксигруппу, 2-метил-2-бутилоксигруппу, 3-метил-2-бутилоксигруппу, 2,2-диметил-1-пропилоксигруппу, 1-гексилоксигруппу, 2-гексилоксигруппу, 3-гексилоксигруппу, 2-метил-1-пентилоксигруппу, 3-метил-1-пентилоксигруппу, 4-метил-1-пентилоксигруппу, 2-метил-2-пентилоксигруппу, 3-метил-2-пентилоксигруппу, 4-метил-2-пентилоксигруппу, 2-метил-3-пентилоксигруппу, 3-метил-3-пентилоксигруппу, 2,3-диметил-1-бутилоксигруппу, 3,3-диметил-1-бутилоксигруппу, 2,2-диметил-1-бутилоксигруппу, 2-этил-1-бутилоксигруппу, 3,3-диметил-2-бутилоксигруппу и 2,3-диметил-2-бутилоксигруппу.
Как здесь используется, выражение «С1-6 алкилтиогруппа» относится к тиогруппе, связанной с «С1-6 алкильной группой», указанной выше, и, в частности, включает метилтиогруппу, этилтиогруппу, 1-пропилтиогруппу, 2-пропилтиогруппу, бутилтиогруппу и пентилтиогруппу.
Как здесь используется, выражение «С2-7 алкоксикарбонильная группа» относится к карбонильной группе, связанной с «С1-6 алкоксигруппой», указанной выше, и, в частности, включает, например, метоксикарбонильную группу, этоксикарбонильную группу, 1-пропилоксикарбонильную группу и 2-пропилоксикарбонильную группу.
Как здесь используется, выражение «С2-7 алкилкарбонильная группа» относится к карбонильной группе, связанной с «С1-6 алкильной группой», указанной выше, и, в частности, включает, например, метилкарбонильную группу, этилкарбонильную группу, 1-пропилкарбонильную группу и 2-пропилкарбонильную группу.
Как здесь используется, выражение «атом галогена» относится к атому фтора, атому хлора, атому брома и атому йода.
Как здесь используется, выражение «С6-10 арильная группа» относится к ароматической циклической углеводородной группе, содержащей 6-10 атомов углерода, и, в частности, включает, например, фенильную группу, 1-нафтильную группу и 2-нафтильную группу.
Как здесь используется, выражение «гетероатом» относится к атому серы, атому кислорода и атому азота.
Как здесь используется, выражение «5-10-членное гетероарильное кольцо» относится к ароматическому 5-10-членному кольцу, содержащему один или несколько гетероатомов, и, в частности, включают, например, пиридиновое кольцо, тиофеновое кольцо, фурановое кольцо, пиррольное кольцо, оксазольное кольцо, изоксазольное кольцо, тиазольное кольцо, тиадиазольное кольцо, изотиазольное кольцо, имидазольное кольцо, триазольное кольцо, пиразольное кольцо, фуразановое кольцо, тиадиазольное кольцо, оксадиазольное кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, триазиновое кольцо, индольное кольцо, изоиндольное кольцо, индазольное кольцо, хроменовое кольцо, хинолиновое кольцо, изохинолиновое кольцо, циннолиновое кольцо, хиназолиновое кольцо, хиноксалиновое кольцо, нафтиридиновое кольцо, фталазиновое кольцо, пуриновое кольцо, птеридиновое кольцо, тиенофурановое кольцо, имидазотиазольное кольцо, бензофурановое кольцо, бензотиофеновое кольцо, бензоксазольное кольцо, бензотиазольное кольцо, бензотиадиазольное кольцо, бензимидазольное кольцо, имидазопиридиновое кольцо, пирролопиридиновое кольцо, пирролопиримидиновое кольцо и пиридопиримидиновое кольцо. Предпочтительно «5-10-членное гетероарильное кольцо» включает пиридиновое кольцо, тиофеновое кольцо, фурановое кольцо, пиррольное кольцо, имидазольное кольцо, 1,2,4-триазольное кольцо, тиазольное кольцо, тиадиазольное кольцо, пиразольное кольцо, фуразановое кольцо, тиадиазольное кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, изохинолиновое кольцо, бензоксазольное кольцо, бензотиазольное кольцо и бензимидазольное кольцо. Наиболее предпочтительным примером является пиридиновое кольцо.
Как здесь используется, выражение «5-10-членная гетероарильная группа» относится к моновалентной или дивалентной группе, образующейся в результате удаления одного или двух любых водородных атомов из «5-10-членного гетероарильного кольца», указанного выше.
Как здесь используется, выражение «4-8-членное гетероциклическое кольцо» относится к неароматическому кольцу, в котором
(i) число атомов, составляющих кольцо, равно 4-8;
(ii) атомы, составляющие кольцо, включают 1-2 гетероатома;
(iii) кольцо может содержать 1-2 двойные связи;
(iv) кольцо может содержать 1-3 карбонильные группы и
(v) кольцо является моноциклическим.
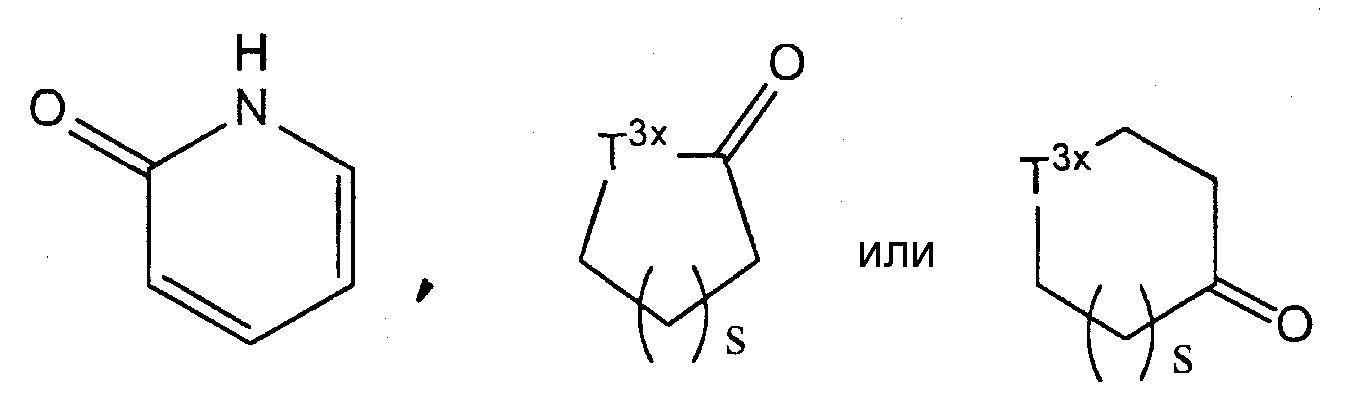
В частности, 4-8-членное гетероциклическое кольцо включает азетидиновое кольцо, пирролидиновое кольцо, пиперидиновое кольцо, азепановое кольцо, азокановое кольцо, тетрагидрофурановое кольцо, тетрагидропирановое кольцо, морфолиновое кольцо, тиоморфолиновое кольцо, пиперазиновое кольцо, тиазолидиновое кольцо, диоксановое кольцо, имидазолиновое кольцо, тиазолиновое кольцо и кольцо, представленное одной из следующих формул:
(где s представляет собой целое число от 1 до 3; Т3х представляет собой метиленовую группу, атом кислорода или группу, представленную формулой -NT4x-, где Т4х представляет собой атом водорода или С1-6 алкильную группу. Предпочтительно «4-8-членные гетероциклические кольца» включают пирролидиновое кольцо, пиперидиновое кольцо, азепановое кольцо, морфолиновое кольцо, тиоморфолиновое кольцо, пиперазиновое кольцо, дигидрофуран-2-оновое кольцо и тиазолидиновое кольцо.
Как здесь используется, выражение «4-8-членная гетероциклическая группа» относится к моновалентной или дивалентной группе, образующейся в результате удаления одного или двух водородных атомов из «4-8-членного гетероцикла», имеющего указанные выше значения. Предпочтительно «4-8-членные гетероциклические группы» включают пиперидин-1-ильную группу, пирролидин-1-ильную группу и морфолин-4-ильную группу.
Как здесь используется, выражение «С6-10 арил С1-6 алкильная группа» относится к группе, полученной замещением произвольного атома водорода в одной из указанных выше «С1-6 алкильных групп» «С6-10 арильной группы», имеющей указанные выше значения, и, в частности, включает, например, бензильную группу, фенетильную группу и 3-фенил-1-пропильную группу.
Как здесь используется, выражение «5-10-членный гетероарил С1-6 алкильная группа» относится к группе, полученной замещением «5-10-членной гетероарильной группой», имеющей указанные выше значения, произвольного атома водорода «С1-6 алкильных групп», и, в частности, включает, например, 2-пиридилметильную и 2-тиенилметильную группу.
Как здесь используется, выражение «4-8-членный гетероциклил С1-6 алкильная группа» относится к группе, полученной заменой произвольного водородного атома в «С1-6 алкильной группе» на «4-8 членную гетероциклическую группу», имеющую указанные выше значения.
Как здесь используется, выражение «моноциклическая или бициклическая 4-12-членная гетероциклическая группа, содержащая один или два атома азота в кольце, которое может иметь один или несколько заместителей» относится к неароматической циклической группе, которая может иметь один или несколько заместителей. В таких неароматических циклических группах
(i) число атомов, составляющих кольцо циклической группы, равно 4-12;
(ii) атомы, составляющие кольцо циклической группы, включают один или два атома азота и
(iii) группа имеет моноциклическую или бициклическую структуру.
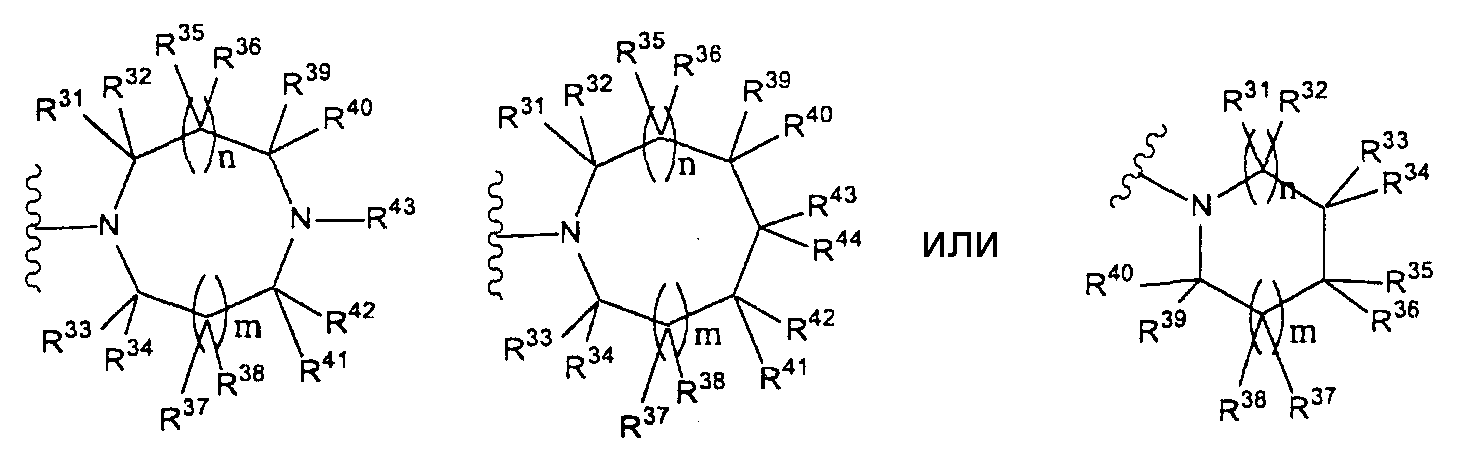
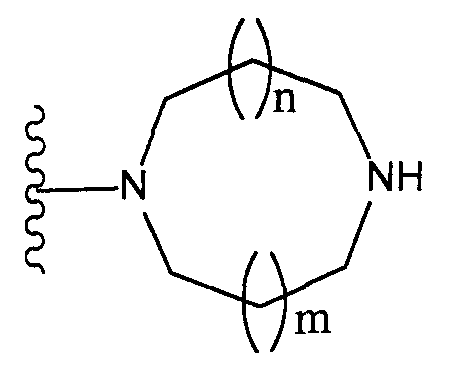
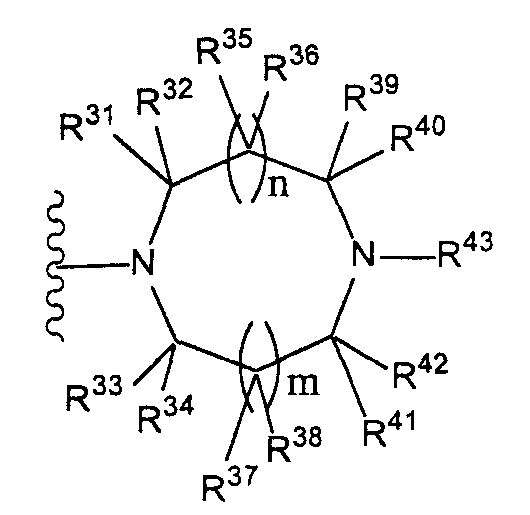
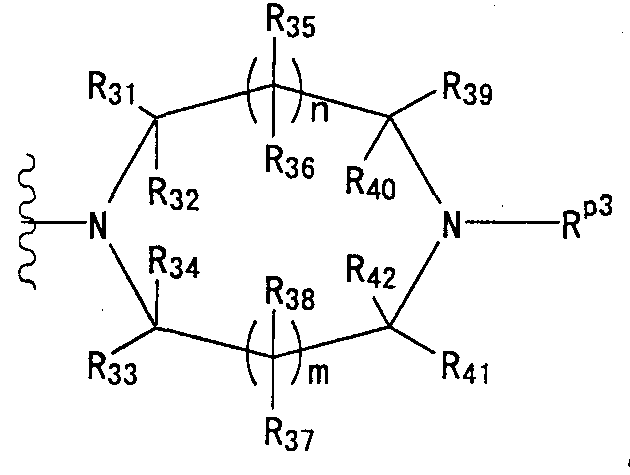
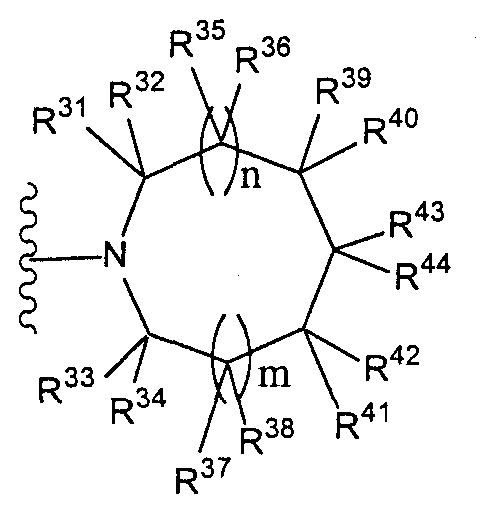
Конкретные примеры таких групп отвечают следующим формулам:
(где n и m, каждый независимо, равны 0 или 1; R31 - R44, каждый независимо, представляют собой атом водорода или заместитель, выбранный из тех, на которые ссылается выражение «которые могут иметь один или несколько заместителей» (заместители указанной далее группы S); любые два радикала из R31-R44 могут совместно образовывать С1-6 алкиленовую группу).
Используемое в тексте выражение «которая может иметь один или несколько заместителей» означает, что рассматриваемая группа может содержать в способном к замещению положении один или несколько заместителей в любых комбинациях. Примерами таких заместителей могут служить заместители, выбранные из указанной далее группы заместителей S.
<Группа заместителей S>
Эта группа включает:
(1) атом галогена,
(2) гидроксильную группу,
(3) меркаптогруппу,
(4) нитрогруппу,
(5) цианогруппу,
(6) формильную группу,
(7) карбоксильную группу,
(8) трифторметильную группу,
(9) трифторметоксигруппу,
(10) аминогруппу,
(11) оксогруппу,
(12) иминогруппу, и
группу, представленную формулой -Т1х-Т2х (где Т1х представляет собой одинарную связь, С1-6 алкиленовую группу, атом кислорода, группу, представленную формулой -СО-, группу, представленную формулой -S-, группу, представленную формулой -S(О)-, группу, представленную формулой -S(О)2-, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRT-, группу, представленную формулой -СО-NRT-, группу, представленную формулой NRT-СО-, группу, представленную формулой -SO2-NRT-, группу, представленную формулой -NRT-SO2-, группу, представленную формулой -NH-СО-NRT- или группу, представленную формулой -NH-CS-NRT-;
T2x представляет собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, фенильную группу, 1-нафтильную группу, 2-нафтильную группу, 5-10-членную гетероарильную группу или 4-8-членную гетероциклическую группу;
RT представляет собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу,
при условии, что T2x и RT, каждый независимо, могут иметь 1-3 заместителя, выбранных из указанных далее группы заместителей Т).
<Группа заместителей Т>
Эта группа включает гидроксил, циано, атом галогена, С1-6 алкил, С3-8 циклоалкил, С2-6 алкенил, С2-6 алкинил, фенил, 1-нафтил, 2-нафтил, 5-10-членный гетероарил, 4-8-членное гетероциклическое кольцо, С1-6 алкокси, С1-6 алкилтио, С2-7 алкоксикарбонильную группу и т.д.
<Группа заместителей S>
Предпочтительно включает
(1) атом галогена,
(2) гидроксильную группу,
(3) цианогруппу,
(4) карбоксильную группу,
(5) трифторметильную группу,
(6) трифторметоксигруппу,
(7) аминогруппу,
(8) С1-6 алкильную группу,
(9) С3-8 циклоалкильную группу,
(10) С2-6 алкенильную группу,
(11) С2-6 алкинильную группу,
(12) фенильную группу и
(13) С1-6 алкоксигруппу.
Как здесь используется, термин «группа, представленная формулой
(где n и m, каждый независимо, представляют собой 0 или 1), которая может содержать один или несколько заместителей», относится к группе, представленной формулой
(где R31-R44 независимо представляют собой атом водорода или группу, выбранную из заместителей, относящихся к фразе «который может иметь один или несколько заместителей», указанной выше (группа заместителей S определена выше); n и m, каждый независимо, представляет собой 0 или 1). Предпочтительно, когда m=n=0. Более предпочтительно, когда термин относится к группе, представленной одной из формул
(где R31, R32, R33, R34 и R35 независимо представляют собой атом водорода или группу, выбранную из групп заместителей, относящихся к фразе «который может иметь один или несколько заместителей» (группа заместителей S определена выше), при условии, что по меньшей мере три из R31, R32, R33, R34 и R35 представляют собой атомы водорода. Еще более предпочтительно, когда термин относится к группе, представленной одной из формул
Наиболее предпочтительно, когда термин относится к группе, представленной формулой
Как здесь используется, термин «группа, представленная формулой
(где n и m, каждый независимо, равны 0 или 1)» относится к группе, представленной одной из формул
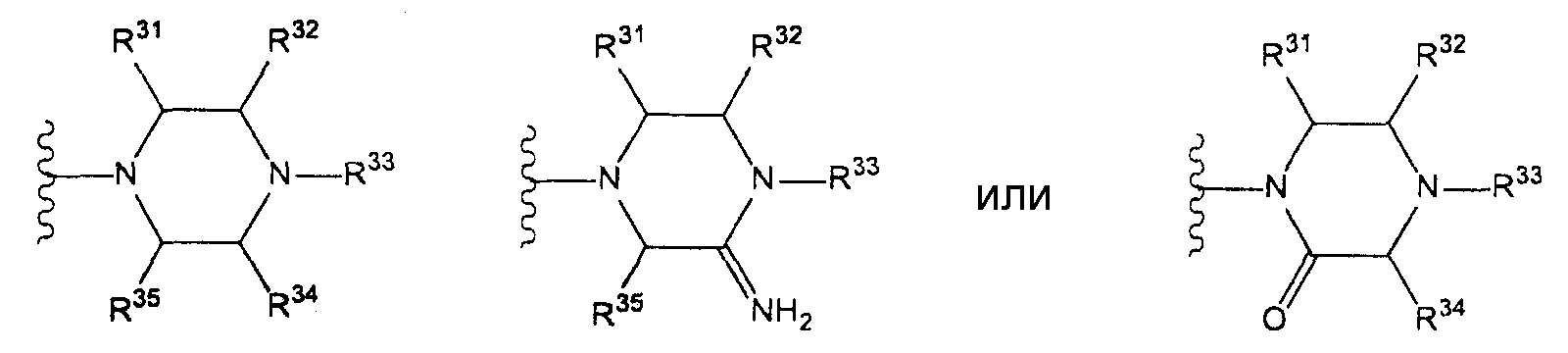
Как здесь используется, термин «пиперидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «пиперидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются фразой «которая может содержать один или несколько заместителей (указанная выше группа заместителей S). Предпочтительный термин «пиперидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к группе следующей формулы:
(где R31, R32, R33, R34 и R35, каждый независимо, представляют собой атом водорода или группу, выбранную из заместителей, на которые ссылаются в фразе «которая может иметь один или несколько заместителей» (указанная выше группа заместителей S), при условии, что по меньшей мере три радикала из R31, R32, R33, R34 и R35 представляют собой атомы водорода. Предпочтительно, когда рассматриваемый термин относится к группе, отвечающей одной из следующих формул:
Еще более предпочтительно, когда рассматриваемый термин относится к группе, отвечающей одной из следующих формул:
Как здесь используется, выражение «азетидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «азетидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей (указанные выше группы заместителей S).
Как здесь используется, выражение «пирролидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «пирролидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей».
Как здесь используется, выражение «пиперидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «пиперидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей».
Как здесь используется, выражение «азепан-1-ильная группа, которая может иметь один или несколько заместителей» относится к «азепан-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей».
Как здесь используется, выражение «пиперидин-1-ильная группа, которая может содержать аминогруппу» относится к «пиперидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции. Конкретное значение выражения «пиперидин-1-ильная группа, которая может содержать аминогруппу» относится к группе, представленной одной из следующих формул:
предпочтительно к группе, представленной одной из формул
Как здесь используется, выражение «азетидин-1-ильная группа, которая может содержать аминогруппу» относится к «азетидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.
Как здесь используется, выражение «пирролидин-1-ильная группа, которая может содержать аминогруппу» относится к «пирролидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.
Как здесь используется, выражение «пиперидин-1-ильная группа, которая может содержать аминогруппу» относится к «пиперидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.
Как здесь используется, выражение «азепан-1-ильная группа, которая может содержать аминогруппу» относится к «азепан-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.
Как здесь используется, выражение «С1-6 алкильная группа, которая может иметь один или несколько заместителей» в указанных выше заместителях группы В относится к «С1-6 алкильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из тех, на который ссылаются выражением «которая может иметь один или несколько заместителей». Предпочтительный термин «С1-6 алкильная группа, которая может иметь один или несколько заместителей» относится к С1-6 алкильной группе, которая может иметь один или два заместителя, выбранных из группы, состоящей из цианогруппы, карбоксильной группы, С2-7 алкоксикарбонильной группы, группы, представленной формулой -NR3TCOR4T, группы, представленной формулой -CONR3TR4T (где R3T и R4T, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу) и С1-6 алкоксигруппы.
В соединении, представленном приведенной выше формулой (I), R1 и R2, каждый независимо, представляют собой группу, представленную формулой -А0-А1-А2 (где А0, А1 и А2 имеют указанные выше значения), в том случае, когда каждый из А0 и А1 представляют собой одинарную связь, “-А0-А1-“ представляет собой одинарную связь.
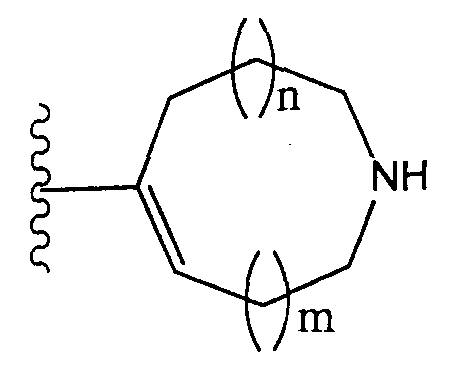
Используемое применительно к приведенной выше формуле (I) выражение «когда Z2 представляет собой группу, представленную формулой -CR2=, R1 и R2 могут совместно образовывать 5-7-членное кольцо» означает, что соединения, отвечающие указанной выше формуле (I), включают соединения (II), представленные следующей формулой:
(где Z1, X и T1 имеют указанные выше значения; АТ1 представляет собой атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, метиленовую группу, которая может иметь один или несколько заместителей, или атом азота, который может иметь один или несколько заместителей; АТ2 представляет собой С2-6 алкиленовую группу, которая может иметь один или несколько заместителей). В представленной выше формуле (II) АТ1 предпочтительно представляет собой атом кислорода, а АТ2 предпочтительно представляет собой С2-4 алкиленовую группу.
Как здесь используется, выражение «цианобензильная группа» относится к бензильной группе, содержащей одну цианогруппу, и, в частности, включает, например, 2-цианобензильную группу, 3-цианобензильную группу и 4-цианобензильную группу.
Как здесь используется, выражение «фторцианобензильная группа» относится к бензильной группе, замещенной атомом фтора и цианогруппой, и, в частности, включает, например, 2-циано-4-фторбензильную группу и 2-циано-6-фторбензильную группу.
Как здесь используется, выражение «карбамоилфеноксигруппа» относится к феноксигруппе, содержащий заместитель формулы -CONH2, примером которой могут служить 2-карбамоилфеноксигруппа, 3-карбамоилфеноксигруппа и 4-карбамоилфеноксигруппа.
Как здесь используется, выражение «соли» не носит ограничительного характера, если такие соли являются фармацевтически применимыми веществами и производными любого соединения по настоящему изобретению. Примерами рассматриваемых солей могут служить соли неорганических кислот, соли органических кислот, соли неорганических оснований, соли органических оснований и соли кислых или основных аминокислот.
Примерами предпочтительных неорганических солей могут служить гидрохлорид, гидробромид, сульфат, нитрат и фосфат. Предпочтительные органические соли включают ацетат, сукцинат, фумарат, малеат, тартрат, цитрат, лактат, стеарат, бензоат, метансульфонат и п-толуолсульфонат.
Примеры предпочтительных солей неорганических оснований включают соли таких щелочных металлов, как соли натрия и калия; соли щелочноземельных металлов, такие как соли кальция и магния; соли алюминия и соли аммония. Предпочтительными примерами органических основных солей могут служить соли диэтиламина, соли диэтаноламина, соли меглюмина и соли N,N'-дибензилэтилендиамина.
Примерами предпочтительных кислых солей аминокислот могут служить аспартат и глютамат. Примеры предпочтительных основных солей аминокислот включают соли аргинина, соли лизина и соли орнитина.
Настоящее изобретение предусматривает соединения, отвечающие следующей формуле (I), его соли или гидраты:
где Т1 представляет собой моноциклическую или бициклическую 4-12-членную гетероциклическую группу, содержащую один или два кольцевых атома азота, и может иметь один или несколько заместителей;
Х представляет собой С1-6 алкильную группу, которая может иметь один или несколько заместителей, С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, С6-10 арильную группу, которая может иметь один или несколько заместителей, 5-10-членную гетероарильную группу, которая может иметь один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может иметь один или несколько заместителей, или 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь один или несколько заместителей;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу, представленную формулой -CR2=;
R1 и R2, каждый независимо, представляют собой группу, представленную формулой -А0-А1-А2
(где А0 представляет собой одинарную связь или С1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей В;
А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA-, группу, представленную формулой -СО- NRA-, группу, представленную формулой -NRA-СО-, группу, представленную формулой -SO2-NRA-, или группу, представленную формулой -NRA-SO2-;
А2 и RА, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу, С6-10 арил С1-6 алкильную группу или С2-7 алкилкарбонильную группу, при условии, что А2 и RA, каждый независимо, имеет 1-3 заместителя, выбранных из указанной далее группы заместителей В).
В том случае, когда Z2 представляет собой группу, представленную формулой -CR2=, R1 и R2 могут совместно образовывать 5-7-членное кольцо.
При этом исключаются случаи, когда [1] R1 представляет собой атом водорода; Z1 представляет собой атом азота, а Z2 представляет собой -СН=; [2] Z1 представляет собой атом азота, а Z2 представляет собой группу -С(ОН)=.
<Группа заместителей В>
Группа заместителей В включает гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1-СО-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RB3 (в которой RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -СО-RB4-RB5, и группу, представленную формулой -СН2-СО-RB4-RB5 (в которой RB4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой NRB6-; RB5 и RB6, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, C3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-гетероциклическую С1-6 алкильную группу, С6-10 арил С1-6 алкильную группу, или 5-10-членный гетероарил С1-6 алкильную группу).
Предпочтительные соединения, представленные формулой (I), включают, например, следующие соединения:
(1) соединения, в которых любой, но не оба из радикалов Z1 и Z2 представляет собой атом азота;
(2) соединения, в которых Z1 представляет собой атом азота; Z2 представляет собой группу, представленную формулой -CR2= (где R2 имеет значения, указанные выше для R2);
(3) соединения, в которых Z2 представляет собой атом азота; Z1 представляет собой группу, представленную формулой -CR2= (где R2 имеет значения указанные выше для R2);
(4) соединения, в которых Т1 является группой, которая может иметь один или несколько заместителей и представлена формулой
(где n и m, каждый независимо, равны 0 или 1), азетидин-1-ильной группой, которая может иметь один или несколько заместителей, пирролидин-1-ильной группой, которая может иметь один или несколько заместителей, пиперидин-1-ильной группой, которая может иметь один или несколько заместителей или азепан-1-ильной группой, которая может иметь один или несколько заместителей;
(5) соединения, в которых Т1 является группой, представленной формулой
(где n и m, каждый независимо, равны 0 или 1), азетидин-1-ильной группой, которая может содержать аминогруппу, пиролидин-1-ильной группой, которая может содержать аминогруппу, пиперидин-1-ильной группой, которая может содержать аминогруппу или азепан-1-ильной группой, которая может содержать аминогруппу;
(6) соединения, в которых Т1 представляет собой пиперазин-1-ильную группу или 3-аминопиперидин-1-ильную группу;
(7) соединения, в которых Т1 представляет собой пиперазин-1-ильную группу;
(8) соединения, в которых Х представляет собой группу, представленную формулой -Х1-Х2 (где Х1 представляет собой одинарную связь или метиленовую группу, которая может иметь один или несколько заместителей; Х2 представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей; С2-6 алкинильную группу, которая может иметь один или несколько заместителей или фенильную группу, которая может иметь один или несколько заместителей);
(9) соединения, в которых Х представляет собой группу, представленную формулой -Х11-Х12 (где Х11 представляет собой одинарную связь или метиленовую группу; Х12 представляет собой С2-6 алкенильную группу, С2-6 алкинильную группу или фенильную группу, которая может иметь один или несколько заместителей);
(10) соединения, в которых фенильная группа, которая может содержать один или несколько заместителей, входящая в состав Х, представленного группой формулы -Х11-Х12, представляет собой фенильную группу, которая может содержать в положении 2 заместитель, выбранный из группы, состоящей из гидроксильной группы, атома фтора, атома хлора, метильной группы, этильной группы, фторметильной группы, винильной группы, метоксигруппы, этоксигруппы, ацетильной группы, цианогруппы, формильной группы и С2-7 алкоксикарбонильной группы;
(11) соединения, в которых Х представляет собой 3-метил-2-бутен-1-ильную группу, 2-бутин-1-ильную группу, бензильную группу или 2-хлорфенильную группу;
(12) соединения, в которых Х представляет собой 2-бутин-1-ильную группу;
(13) соединения, в которых R1 представляет собой атом водорода или группу, представленную формулой -А10-А11-А12,
где А10 представляет собой С1-6 алкиленовую группу, которая может содержать 1-3 заместителя, выбранных из указанной далее группы заместителей С;
А11 представляет собой одинарную связь, атом кислорода, атом серы или карбонильную группу;
А12 представляет собой атом водорода, С6-10 арильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членную гетероарильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной указанной далее группы заместителей С.
<Группа заместителей С>
Группа заместителей С представляет собой группу, содержащую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RC2 (где RC1 и RC2, каждый независимо, представляет собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4, и группу, представленную формулой -CH2-CO-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода, группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);
(14) соединения, в которых R1 представляет собой атом водорода, С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С;
<Группа заместителей С>
Группа заместителей С представляет собой группу, содержащую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RC2 (где RC1 и RC2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4 и группу, представленную формулой -CH2-CO-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода, группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);
(15) соединения, в которых указанная выше группа заместителей С для группы, представленной формулой А10-А11-А12, представленной радикалом R1, включает цианогруппу, С1-6 алкоксигруппу, С2-7 алкоксикарбонильную группу и атом галогена;
(16) соединения, в которых R1 представляет собой метильную группу, цианобензильную группу, фторцианобензильную группу, фенетильную группу, 2-метоксиэтильную группу или 4-метоксикарбонилпиридин-2-ильную группу;
(17) соединения, в которых R1 представляет собой метильную группу или 2-цианобензильную группу;
(18) соединения, в которых R2 представляет собой атом водорода, цианогруппу или группу, представленную формулой -А21-А22,
где А21 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA2-, группу, представленную формулой -СО-NRA2-, или группу, представленную формулой -NRA2-СО-;
А22 и RA2, каждый независимо, представляют собой атом водорода, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, при условии, что А22 и RA2, каждый независимо, могут содержать 1-3 заместителя, выбранных из указанной далее группы заместителей D;
<Группа заместителей D>
Группа заместителей D представляет собой группу, содержащую гидроксильную группу, цианогруппу, нитрогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRD1-RD2 (где из RD1 и RD2, каждый независимо, представляет собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RD3 (где RD3 представляет собой 4-8-членную гетероциклическую группу), и группу, представленную формулой -CO-RD4-RD5 (где RD4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRD6-; RD5 и RD6, каждый независимо, представляют собой атом водорода, С3-8 циклоалкильную группу или С1-6 алкильную группу);
(19) соединение, в котором R2 представляет собой атом водорода, цианогруппу, карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -А23-А24 (где А23 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA3-; А24 и RA3, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С3-8 циклоалкильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С2-6 алкенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С2-6 алкинильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, фенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, или 5-10-членную гетероарильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1.
<Группа заместителей D1>
Группа заместителей D1 представляет собой группу, состоящую из карбоксигруппы, С2-7 алкоксикарбонильной группы, С1-6 алкильной группы, группы, представленной формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-карбонильной группы, С1-6 алкильной группы и С1-6 алкоксигруппы;
(20) соединения, в которых R2 представляет собой атом водорода, цианогруппу, С1-6 алкоксигруппу или группу, представленную формулой -А25-А26 (где А25 представляет собой атом кислорода, атом серы, группу, представленную формулой -NRA4-; A26 и RA4, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, имеющую заместитель, выбранный из указанной далее группы заместителей D1, С3-8 циклоалкильную группу, имеющую заместитель, выбранный из указанной далее группы заместителей D1, или фенильную группу, имеющую заместитель, выбранный из указанной далее группы заместителей D;
<Группа заместителей D1>
Группа заместителей D1 представляет собой группу, состоящую из карбоксильной группы, С2-7 алкоксикарбонильной группы, С1-6 алкильной группы, группы, представленной формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-илкарбонильной группы, С1-6 алкильной группы, С1-6 алкоксигруппы;
(21) соединения, в которых R2 представляет собой атом водорода, цианогруппу, метоксигруппу, карбамоилфенилоксигруппу, группу, представленную одной из следующих формул:
(где А27 представляет собой атом кислорода, атом серы или группу, представленную формулой -NH-;
A28 и А29, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);
(22) соединения, в которых R2 представляет собой атом водорода, цианогруппу или карбамоилфенилоксигруппу.
Из указанных выше соединений предпочтительными по значениям Z1 и Z2 являются соединения (1)-(3), из которых (3) является наиболее предпочтительным; предпочтительными по значениям Т1 являются соединения (4)-(7), из которых (7) является наиболее предпочтительным; предпочтительными по значениям Х являются соединения (8)-(12), из которых (12) является наиболее предпочтительным; предпочтительными по значениям R1 являются соединения (13)-(17), из которых (17) является наиболее предпочтительным; предпочтительными по значениям R2 являются соединения (18)-(22), из которых (22) является наиболее предпочтительным.
Предпочтительные соединения приведенной выше формулы (I) отвечают любым воплощениям 2-5, выбранным из групп, включающих соединения (1)-(3), (4)-(7), (8)-(12), (13)-(17) и (18)-(22).
Примерами предпочтительных соединений могут служить вещества со следующей специальной комбинацией воплощений:
(i) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (1), (4), (8), (13) и (18) соответственно;
(ii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (19) соответственно;
(iii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (20) соответственно;
(iv) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (21) соответственно;
(v) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (22) соответственно;
(vi) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (19) соответственно;
(vii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (20) соответственно;
(viii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (21) соответственно;
(ix) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (22) соответственно;
(x) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (19) соответственно;
(xi) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (20) соответственно;
(xii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (21) соответственно;
(xiii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (22) соответственно;
(xiv) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (19) соответственно;
(xv) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (20) соответственно;
(xvi) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (21) соответственно;
(xvii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (22) соответственно.
В приведенном выше перечне для соединений (ii)-(ix) предпочтительность соединений возрастает в последовательности от (ii) к (ix) и для соединений (x)-(xvii) - от (x) к (xvii).
В следующей ниже таблице приведены конкретные примеры соединений формулы (I), не ограничивающие область изобретения.
Сокращения, используемые в таблице, имеют следующие значения:
Р1 - пиперазин-1-ил; Р2 - 3-аминопиперидин-1-ил; 2Btyn - 2-бутин-1-ил; 3Ме2Bten - 3-метил-2-бутен-1-ил; Ме - метил; Et - этил; 2-CNBen - 2-цианобензил; 6F2CNBen - 6-фтор-2-цианобензил; фенетил-2-фенилэтил; 2Ph20xEt - 2-фенил-2-оксоэтил; -CR2=, -CR2=.
Среди перечисленных выше соединений соединения с номерами 1, 2, 4, 6, 7, 8, 10, 13, 16, 41, 42, 44, 50, 53, 81, 85, 86, 87, 111, 141 и 183 являются предпочтительными, а соединения 2, 4, 8, 10, 81, 87 и 111 являются особенно предпочтительными.
<Типичные методы синтеза>
Далее описаны характерные способы получения соединений, представленных приведенной выше формулой (I).
Далее приводится определение для каждого символа, используемого в способах получения. R31-R42, n, m, R1, R2, X, A0, A1, A2, RA и Т1 имеют указанные выше значения.
U1 и U3, каждый независимо, представляют собой удаляемую группу, такую как атом хлора, атом брома, атом йода, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу.
Rp1, Rp2 и Rp3, каждый независимо, представляют собой NH-защитную группу, например пивалилоксиметильную группу и триметилсилилэтоксиметильную группу.
Rp4 представляет собой гидрокси-защитную группу, такую как трет-бутилдиметилсилильная группа и трет-бутилдифенилсилильная группа.
Rp5 представляет собой NH-защитную группу, такую как N,N-диметилсульфамоил, тритил, бензил и трет-бутоксикарбонил.
U2 и U4, каждый независимо, представляют собой атом хлора, атом брома, атом йода, метансульфонилоксигруппу, п-толуолсульфонилоксигруппу, группу, представленную формулой -В(ОН)2, 4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ильную группу или группу, представленную формулой -Sn(Rz)3 (где Rz представляет собой С1-6 алкильную группу).
Rx2 является группой, представленной формулой -О-Ах, группой, представленной формулой -S-A2, группой, представленной формулой -N(RA)A2 или 4-8-членной гетероциклической группой, которая может иметь один или несколько заместителей (например, 1-пирролидинил, 1-морфолинил, 1-пиперазинил или 1-пиперидил) и т.п.
Rx3 является группой, представленной формулой -А0-А1-А2-, такой как цианогруппа, С1-6 алкильная группа, которая может иметь один или несколько заместителей, С3-8 циклоалкильная группа, которая может иметь один или несколько заместителей, С2-6 алкенильная группа, которая может иметь один или несколько заместителей, С2-6 алкинильная группа, которая может иметь один или несколько заместителей, и С6-10 арильная группа, которая может иметь один или несколько заместителей.
А2COOR представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит эфирную группу.
А2COOН представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит карбоксильную группу.
А2NO2 представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит нитрогруппу.
А2NН2 представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит аминогруппу.
А2CN представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит нитрильную группу.
АCONH2 представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит карбоксамидную группу.
М представляет собой -MgCl, -MgBr, -Sn(Rz)3 (где Rz имеет указанные выше значения) и т.п.
Термин «комнатная температура» относится к температуре в интервале 20-30ºС.
Т1а определяется как группа формулы Т1, или представляет собой группу формулы
группу формулы
(где R31-R44 имеют указанные выше значения, за исключением случая, когда любой из R31-R44 представляет собой -NH-Rp3) или группу формулы
(где R31-R40 имеют указанные выше значения, за исключением случая, когда любой из R31-R40 представляет собой -NH-Rp3).
Если не указано особо, то в примерах реакций, представленных следующими схемами, используемые количества реагентов, катализаторов и пр. (эквиваленты, мас.% и массовые соотношения) приведены в расчете на основное вещество для каждой реакционной схемы. Термин «основное вещество» относится к соединению, изображенному химической формулой в реакционной схеме и имеющему структуру соединений по настоящему изобретению.
Способ получения А
[Стадия А1]
На этой стадии -NH-защитный реагент подвергают взаимодействию с соединением (1а) [CAS No. 56160-64-6] с получением соединения (2а). Условия проведения реакции выбирают в зависимости от типа используемого -NH-защитного реагента. Реакция может проводиться в условиях, которые обычно используются для введения защитной группы с использованием соответствующего реагента.
Термин «-NH-защитный реагент» относится к реагенту, который обычно используется для введения N-защитной группы. Примерами таких -NH-защитных реагентов может служить хлорметилпивалат. Предпочтительно использовать 1-2 эквивалента защитного реагента. Примерами растворителей, которые могут использоваться в рассматриваемой реакции, могут служить ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Предпочтительно использовать N,N-диметилформамид.
Реакция может проводиться в присутствии основания. Примерами оснований, используемых в рассматриваемой реакции, могут служить карбонат цезия, карбонат лития, карбонат натрия, карбонат калия и гидрид натрия. Предпочтительно использовать гидрид натрия. В этом случае предпочтительное количество основания составляет 1-5 эквивалентов. Реакцию можно проводить при температуре 0-150ºС. Предпочтительно использовать комнатную температуру.
[Стадия А2]
На этой стадии соединение (2а) подвергают взаимодействию с соединением (2а-2) с получением соединения (3а).
В качестве соединения (2а-2) может использоваться любое соединение, представляющее собой электрофильный реагент, например алкилгалогенид. Конкретными примерами галоидных алкилов могут служить йодметан, йодэтан, йодпропан, и бензилбромид; алкенилгалогениды, такие как аллилбромид и 1-бром-3-метил-2-бутен, а также алкинилгалогениды, такие как пропаргилбромид и 1-бром-2-бутин. Предпочтительно использовать 1-2 эквивалента электрофильного реагента.
В качестве растворителей для этой реакции могут использоваться диметилсульфоксид, N,N-диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран и толуол.
Реакцию можно проводить в присутствии или в отсутствие основания. Примерами используемых оснований могут служить гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, бутиллитий, метиллитий, литий бис(триметилсилил)амид, натрий бис(триметилсилил)амид и калий бис(триметилсилил)амид. В этом случае предпочтительно использовать один-два эквивалента основания.
Реакцию можно проводить при температуре 0-150ºС.
[Стадия А3]
На этой стадии осуществляют удаление бензильной группы из положения 7 соединения (3а) с получением соединения (4а).
Соединение (4а) может быть получено, например, каталитическим восстановлением соединения (3а) в атмосфере водорода в присутствии металлического катализатора, однако условия реакции не ограничиваются указанными выше.
Конкретные растворители для проведения такой реакции включают метанол, этанол, пропанол, уксусную кислоту, диметилсульфоксид, N,N-диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран и толуол. Примерами металлических катализаторов могут служить палладий на угле, оксид платины и никель Ренея. Предпочтительно использовать 0,5-50 мас.% катализатора. Предпочтительное давление водорода составляет 1-5 атм. Реакция может проводиться при температуре 0-150ºС.
[Стадия А4]
На этой стадии соединение (4а) подвергают взаимодействию с соединением (4а-2) с получением соединения (5а).
Конкретными примерами соединения (4а-2) являются алкилгалогениды, такие как йодметан, йодэтан, йодпропан, и бензилбромид; такие алкенилгалогениды, как аллилбромид и 1-бром-3-метил-2-бутен, или такие алкинилгалогениды, как пропаргилбромид и 1-бром-2-бутин. Указанные галогениды предпочтительно использовать в количестве 1-2 эквивалентов.
Растворители для рассматриваемой реакции включают диметилсульфоксид, N,N-диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран и толуол.
Реакцию можно проводить в присутствии или в отсутствие основания. Примерами оснований, используемых для проведения такой реакции, могут служить гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, бутиллитий, метиллитий, литий бис(триметилсилил)амид, натрий бис(триметилсилил)амид и калий бис(триметилсилил)амид. В этом случае предпочтительно использовать 1-4 эквивалента основания. Реакцию можно проводить при температуре 0-150ºС.
Соединение (5а) может быть получено путем взаимодействия соединения (4а) с соединением (4а-2) в присутствии медного катализатора и основания. В рассматриваемом случае предпочтительно использовать 0,1-2 эквивалента медного катализатора и 1-10 эквивалентов основания.
Соединение (4а-2) может представлять собой арилбороновую кислоту, гетероарилбороновую кислоту, в которых Х представляет собой С6-10 арильную группу, которая может иметь один или несколько заместителей, или 5-10-членную гетероарильную группу, которая может иметь один или несколько заместителей, и U2 представляет собой -В(ОН)2. Предпочтительно использовать один-три эквивалента соединения (4а-2).
Реакция может проводиться в присутствии таких растворителей, как дихлорметан, хлороформ, 1,4-диоксан, тетрагидрофуран, толуол, пиридин, N,N-диметилформамид и N-метилпирролидон.
Основания включают триэтиламин, диизопропилэтиламин, пиридин и N,N-диметиламинопиридин. Медные катализаторы могут представлять собой ацетат меди (II), трифторацетат меди (II), хлорид меди (II) и йодид меди (II). Реакцию можно проводить при температурах 0-150ºС.
[Стадия А5]
На этой стадии соединение (5а) подвергают взаимодействию с галогенирующим агентом с получением соединения (6а).
Конкретные примеры галогенирующих агентов включают N-хлорсукцинимид, N-бромсукцинимид и N-йодсукцинимид. Галогенирующий агент предпочтительно использовать в количестве 1-4 эквивалента.
В качестве растворителей для рассматриваемой реакции можно использовать ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Реакцию можно проводить при температуре 0-150ºС.
[Стадия А6]
На этой стадии соединение (6а) подвергают взаимодействию с соединением (7а) с получением соединения (8а). В данном случае предпочтительно использовать 1-4 эквивалента соединения (7а).
Реакцию можно проводить в таких растворителях, как тетрагидрофуран, ацетонитрил, N,N-диметилформамид, N-метилпирролидон, метанол, этанол, 1,4-диоксан, толуол и ксилол, или в отсутствие растворителя. Реакция может осуществляться при температуре 0-200ºС в присутствии или в отсутствие основания. Примерами оснований могут служить триэтиламин, карбонат калия и 1,8-диазабицикло[5,4,0]ундецен. В рассматриваемом случае предпочтительно использовать 1-4 эквивалента основания.
[Стадия А7]
На этой стадии осуществляют удаление NH-защитной группы из положения 3 соединения (8а) с получением соединения (9а). Условия проведения реакции выбирают в соответствии с типом N-защитной группы, подлежащей удалению. Реакция снятия защитной группы может проводиться в обычных условиях.
Так, например, в том случае, когда Rp2 представляет собой пивалилоксиметильную группу, реакцию проводят в метаноле или смеси метанола с тетрагидрофураном, используя в качестве основания метилат натрия, гидрид натрия или 1,8-диазабицикло[5,4,0]-7-ундецен при температуре 0-150ºС. В этом случае предпочтительно использовать 0,1-2 эквивалента основания.
Если Rp2 представляет собой триметилсилилэтоксиметильную группу, реакцию можно проводить в среде такого растворителя, как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, с использованием такого реагента, как фторид тетрабутиламмония или фторид цезия, при температуре 0-150ºС. В этом случае предпочтительно использовать 1-5 эквивалентов фторидного реагента.
[Стадия А8]
На этой стадии соединение (9а) подвергают хлорированию с получением соединения (10а).
Для условий проведения реакции нет конкретных ограничений, и реакция может проводиться в обычных условиях хлорирования. Так, например, реакцию можно проводить при температуре 0-150ºС в таком растворителе, как оксихлорид фосфора. В рассматриваемом случае предпочтительно использовать 10-200-кратный избыток хлорирующего агента.
В том случае, когда Rp3 представляет собой трет-бутоксикарбонильную группу, которая удаляется при указанных выше условиях, предусматривающих использование оксихлорида фосфора, требуется повторное введение защитной группы.
Нет конкретных ограничений относительно условий проведения реакции введения защитной группы. В случае трет-бутоксикарбонильной группы реакцию можно проводить с использованием такого -NH-защитного агента, как ди-трет-бутилдикарбонат, в среде такого растворителя, как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, в присутствии такого основания, как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, бикарбонат калия, бикарбонат натрия или триэтиламин, при 0-150ºС.
[Стадия А9]
На этой стадии соединение (11а) подвергают взаимодействию с соединением (11а-2) с получением соединения (10а).
Соединение (11а-2) включает производные спирта или производные фенола, представленные общей формулой А2-ОН, производные амина, представленные общей формулой А2(RA)NH или им подобные, и производные тиола, представленные общей формулой A2-SH. В этом случае соединение (11а-2) предпочтительно использовать в количестве 1-10 эквивалентов или в 5-100-кратном массовом избытке.
В качестве растворителей могут использоваться ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол.
Реакцию можно проводить в присутствии или в отсутствие основания. Основания, используемые в реакции, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, бутиллитий, метиллитий, бис(триметилсилил)амид лития, бис(триметилсилил)амид натрия, бис(триметилсилил)амид калия и триэтиламин. В данном случае предпочтительно использовать 1-10 эквивалентов основания. Реакцию можно проводить при температуре 0-150ºС.
[Стадия А10]
На этой стадии осуществляют взаимодействие соединения (10а) и соединения (13а) в присутствии металлического катализатора с получением соединения (12а). В данном случае предпочтительно использовать 1-50 эквивалентов соединения (13а).
Используемые растворители включают ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол.
Металлические катализаторы включают катализаторы на основе палладия и меди. Палладиевые катализаторы включают тетракистрифенилфосфинпалладия, ацетат палладия и дибензилиденацетонат палладия. Медный катализатор может представлять собой йодид меди. Предпочтительно использовать 0,01-2 эквивалента металлического катализатора.
Реакция может проводиться в присутствии фосфороорганического лиганда. Когда реакцию проводят в присутствии фосфороорганического лиганда, примеры лигандов включают о-толилфосфин и дифенилфосфинферроцен. В данном случае предпочтительно использовать 1-5 эквивалентов фосфороорганического лиганда относительно количества металлического катализатора.
Реакцию можно проводить в присутствии или в отсутствие основания. Используемые в реакции основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, фосфат калия, бис(триметилсилил)амид лития, бис(триметилсилил)амид натрия, бис(триметилсилил)амид калия и триэтиламин. Реакцию можно проводить при температуре 0-150ºС.
[Стадия А11]
На этой стадии осуществляют взаимодействие соединения (10а) с цианидирующим реагентом с получением соединения (14а).
Конкретные цианидирующие реагенты включают, например, цианид натрия и цианид калия. Их предпочтительно использовать в количестве 1-20 эквивалентов.
Реакционные растворители включают, например, ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол. Реакцию можно осуществлять при температуре 0-150ºС.
[Стадия А12]
На этой стадии цианогруппу соединения (14а) подвергают гидролизу с получением соединения (15а). Нет специальных ограничений, касающихся условий проведения реакции, и реакцию можно проводить в обычных условиях преобразования цианогруппы в карбамоильную группу путем гидролиза.
Реакционные растворители включают ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол, этанол и смешанный растворитель из тетрагидрофурана и метанола.
Реакцию можно проводить в присутствии или в отсутствие основания. При использовании основания реакцию можно проводить в присутствии водного раствора основания, такого как гидроксид калия, гидроксид натрия, гидроксид лития или аммиак. Взаимодействие может быть достигнуто в результате добавки водного раствора пероксида водорода (предпочтительно в виде 30% водного раствора пероксида водорода).
Реакцию можно проводить при температуре 0-150ºС.
[Стадия А13]
На этой стадии осуществляют удаление группы Rp3 из соединения (16а) с получением соединения (17а). В качестве соединения (16а) могут использоваться соединения (11а), (12а), (14а), (15а) и другие соединения.
Реакцию удаления защитной группы у Rp3 можно проводить в обычных условиях удаления -NH-защитных групп.
Например, когда Rp3 представляет собой трет-бутоксикарбонильную группу, реакцию можно проводить в присутствии кислоты, такой как безводный метанольный раствор хлористого водорода, безводный этанольный раствор хлористого водорода, безводный диоксановый раствор хлористого водорода, трифторуксусная кислота или муравьиная кислота.
Альтернативный способ получения соединения (10а) описан далее.
[Стадия А14]
На этой стадии соединение (18а) подвергают хлорированию с получением соединения (19а). Нет конкретных ограничений, касающихся условия проведения такой реакции, и ее можно проводить в обычных условиях хлорирования. Так, например, реакцию можно проводить в растворителе, таком как оксихлорид фосфора, при температуре 0-150ºС. Предпочтительно использовать 10-200-кратный массовый избыток хлорирующего агента.
В том случае, когда Rp3 представляет собой трет-бутоксикарбонильную группу, которая удаляется в указанных выше условиях, предусматривающих использование оксихлорида фосфора, требуется повторное введение защитной группы.
Нет конкретных ограничений относительно условий проведения реакции введения защитной группы, когда Rp3 представляет собой трет-бутоксикарбонильную группу, реакцию можно проводить с использованием такого -NH-защитного агента, как ди-трет-бутилдикарбонат, в среде такого растворителя, как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, бикарбонат калия, бикарбонат натрия или триэтиламин, при температуре 0-150ºС.
[Стадия А15]
На этой стадии соединение (19а) подвергают частичному гидролизу с получением соединения (20а). Реакцию проводят в присутствии основания, такого как ацетат натрия, карбонат калия или гидроксид натрия. Предпочтительно использовать 1-10 эквивалентов основания. Растворители для такой реакции включают диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, воду и их смеси. Реакция может проводиться при температуре 0-100ºС.
[Стадия А16]
На этой стадии осуществляют взаимодействие соединения (20а) и соединения (21а) с получением соединения (22а). Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А2] способа получения А.
Альтернативный способ получения соединения (19а) описан далее.
[Стадия А17]
На этой стадии осуществляют реакцию замещения с использованием соединения (23а) [CAS No. 1076-22-8] и соединения (4а-2) с получением соединения (24а).
Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А4] способа получения А.
[Стадия А18]
На этой стадии соединение (24а) подвергают взаимодействию с галогенирующим агентом с получением соединения (25а).
Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А5] способа получения А.
[Стадия А19]
На этой стадии соединение (25а) подвергают хлорированию с получением соединения (26а).
Нет конкретных ограничений, касающихся условий проведения такой реакции, и соединение (25а) может реагировать с оксихлоридом фосфора, пентахлоридом фосфора или их смесью в присутствии или в отсутствие растворителя при температуре 0-150ºС. В качестве растворителей могут использоваться толуол, ацетонитрил и дихлорэтан.
[Стадия А20]
На этой стадии соединение (26а) подвергают взаимодействию с соединением (7а) с получением соединения (19а).
Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А6] способа получения А.
Способ получения В
[Стадия В1]
На этой стадии соединение (1b) подвергают бензилированию и сахарную цепочку расщепляют с образованием соединения (2b).
Нет конкретных ограничений, касающихся условий проведения реакции. Соединение (2b) может быть получено путем взаимодействия соединения (1b) с бензилбромидом в среде растворителя, такого как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол при температуре 0-150ºС, в результате добавления 3-10 эквивалентов хлористоводородной кислоты и инкубации полученной смеси при температуре 0-150ºС с целью расщепления сахарного фрагмента. Предпочтительно использовать 1-3 эквивалента бензилбромида.
[Стадия В2]
На этой стадии соединение (2b) подвергают взаимодействию с галогенирующим агентом с получением соединения (3b). Реакцию галогенирования можно проводить при тех же условиях, что использовались для проведения [стадии А5] в способе получения А.
[Стадия В3]
На этой стадии соединение (3b) подвергают взаимодействию с соединением (4b) с получением соединения (5b). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А6] в способе получения А.
[Стадия В4]
На этой стадии соединение (5b) подвергают взаимодействию с соединением (5b-2) с получением соединения (6b). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А2] в способе получения А.
[Стадия В5]
На этой стадии осуществляют удаление группы Rp3 соединения (6b) с получением соединения (7b). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А13] в способе получения А.
Способ получения В-2
Соединение (9b) общей формулы
может быть получено с использованием соединения, представленного формулой Н-Т1а, вместо соединения (7а) на [стадии А6] описанного выше способа получения А, при условиях, используемых для [стадии А6], затем реализуют указанную выше последовательность химических реакций [стадия А7] - [стадия А13].
Соединение (10b) общей формулы
может быть получено с использованием соединения, представленного формулой Н-Т1а, вместо соединения (3b) на [стадии B3] описанного выше способа получения B, при условиях, используемых для [стадии B3], после чего реализуют указанную выше последовательность химических реакций [стадия B4] - [стадия B6]. Предпочтительным примером соединения (8b) может служить трет-бутиловый эфир пиперидин-3-илкарбаминовой кислоты.
Способ получения С
[Стадия С1]
На этой стадии соединение (1с) подвергают взаимодействию с соединением (1с-2) с получением соединения (2с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А4] в способе получения А.
[Стадия С2]
На этой стадии соединение (1с) подвергают взаимодействию с этанолом с получением соединения (3с).
Соединение (3с) может быть получено нагреванием этанольного раствора соединения (2с) с обратным холодильником в присутствии такой кислоты, как серная. Однако реакционные условия не ограничены этим примером. В рассматриваемой реакции предпочтительно использовать 1-2 эквивалента кислоты.
[Стадия С3]
На этой стадии соединение (2с) подвергают взаимодействию с этанолом с получением соединений (4с) и (5с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии С2] в способе получения С.
[Стадия С4]
На этой стадии соединение (3с) подвергают взаимодействию с соединением (3с-2) с получением соединений (4с) и (5с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А4] в способе получения А.
[Стадия С5]
На этой стадии осуществляют взаимодействие соединения (4с) с соединением (6с) с получением соединения (7с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А6] в способе получения А.
[Стадия С6]
На этой стадии соединение (7с) подвергают тиоамидированию с получением соединения (8с). Используемые в реакции растворители могут представлять собой ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Реагенты, используемые для проведения реакции тиоамидирования, включают сульфид аммония, сульфид натрия и сероводород. Предпочтительно использовать 2-10 эквивалентов тиоамидирующего реагента. При использовании сероводорода в качестве тиоамидирующего реагента, реакцию проводят в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин. Реакцию можно проводить при температуре 0-150ºС.
[Стадия С7]
На этой стадии соединение (8с) подвергают взаимодействию с метилирующим реагентом с получением соединения (9с). В качестве метилирующих реагентов можно использовать тетрафторборат триметилоксония, метилсульфат, метилйодид, триметилфосфит. Предпочтительно использовать 1,0-1,5 эквивалента метилирующего реагента.
При использовании тетрафторбората триметилоксония в качестве метилирующего реагента соединение (9с) может быть получено в результате проведения рассматриваемой реакции в галоидированном растворителе, таком как дихлорметан, при температуре в интервале 0-50ºС.
При использовании метилсульфата, метилйодида или триметилфосфита в качестве метилирующего реагента соединение (9с) может быть получено при проведении реакции в присутствии основания, такого как карбонат калия, триэтиламин или N,N-диизопропилэтиламин. В этом случае предпочтительно использовать 1,-1,5 эквивалента основания. В качестве растворителя в этой реакции можно использовать ацетон, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Реакцию можно проводить при температуре 0-100ºС.
[Стадия С8]
На этой стадии соединение (9с) гидролизуют с получением соединения (10с).
Условия проведения реакции гидролиза не регламентируются. Реакцию можно проводить в смешанном растворителе, состоящем из этанола и воды, в присутствии кислоты, такой как серная, хлористоводородная или п-толуолсульфокислота, при температуре 0-80ºС. В рассматриваемом случае предпочтительно использовать 5-50 эквивалентов кислоты.
В том случае, когда группа Rp3 представляет собой трет-бутоксикарбонильную группу, которая удаляется в указанных выше условиях проведения реакции, следует снова вводить защитную группу. Условия проведения реакции введения защитной группы не регламентируются. В том случае, когда группа Rp3 представляет собой трет-бутоксикарбонильную группу, реакцию можно проводить с использованием такого реагента, как трет-бутилдикарбонат в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии основания, такого как пиридин, 4-аминопиридин, триэтиламин и N,N-диизопропилэтиламин, при температуре 0-80ºС. В рассматриваемом случае предпочтительно использовать 2-3 эквивалента основания.
[Стадия С9]
На этой стадии соединение (10с) подвергают взаимодействию с восстанавливающим агентом с получением соединение (11с).
Условия проведения реакции восстановления не регламентируются. Рассматриваемая реакция может проводиться в результате взаимодействия соединения (10с) с водородом в присутствии никеля Ренея в растворителе, таком как бензол, этанол, 2-пропанол или ацетон, при температуре 0-50ºС, или взаимодействия соединения (10с) с восстанавливающим агентом, таким как борогидрид натрия, в растворителе, таком как метанол, этанол или 2-метил-2-пропанол, или в смешанном растворителе, состоящем из воды и тетрагидрофурана, при температуре 0-50ºС, или взаимодействия соединения (10с) с восстанавливающим агентом, таким как борогидрид натрия, в присутствии 1-5 эквивалентов соли ртути, например ацетата ртути, в растворителе, таком как метанол, этанол или 2-метил-2-пропанол, при температуре 0-50ºС. Предпочтительно использовать 2-3 эквивалента восстанавливающего агента.
[Стадия С10]
На этой стадии соединение (11с) подвергают реакции окисления с получением соединения (12с).
При использовании окислителей, таких как диоксид марганца, хлорохромат пиридиния или дихромат пиридиния, соединение (12с) может быть получено проведением реакции в растворителе, таком как дихлорметан или хлороформ, при температуре в интервале 20-80ºС. Соединение (12с) также может быть получено проведением реакции в обычных условиях окисления первичного спирта в альдегид, например окислением по Сверну (Swern). Предпочтительно использовать 5-20 эквивалентов окислителя.
[Стадия С11]
На этой стадии соединение (12с) подвергают взаимодействию с соединением (13с) с получением соединения (17с). Для проведения такой реакции предпочтительно использовать 2-10 эквивалентов соединения (13с).
Соединение (17с) может быть получено смешиванием соединений (12с) и (13с) в растворителе, таком как метанол, этанол, 1-метил-2-пирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, или в в отсутствие растворителя, и последующей реакцией полученной смеси при температуре 20-150ºС. Однако реакционные условия не ограничены этим примером.
[Стадия С12]
На этой стадии соединение (12с) подвергают взаимодействию с гидразином с получением соединения (15с). Рассматриваемую реакцию можно проводить в тех же условиях, что использовались для [стадии С11] способа получения C. Предпочтительно использовать 2-10 эквивалентов гидразина.
[Стадия С13]
На этой стадии проводят реакцию замещения с использованием соединений (15с) и (16с) и получают соединение (17с). Рассматриваемую реакцию можно проводить в тех же условиях, что использовались для [стадии А2] способа получения А. Предпочтительно использовать 1-3 эквивалента соединения (16с).
[Стадия С14]
На этой стадии осуществляют удаление группы Rp3 соединения (17с) и получают соединение (14с). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.
[Стадия С15]
На этой стадии соединение (5с) подвергают взаимодействию с соединением (6с) с получением соединения (18с). Реакцию можно проводить в тех же условиях, что использовались для [стадии А6] способа получения А.
[Стадия С16]
На этой стадии соединение (18с) подвергают гидролизу с получением соединения (19с).
Условия проведения реакции гидролиза не регламентируются. Так, например, соединение (19с) может быть получено выдерживанием соединения (18с) в присутствии основания при температуре 0-100ºС.
В качестве растворителей для проведения рассматриваемой реакции могут использоваться метанол, этанол, тетрагидрофуран, вода или их смеси. Используемые основания включают гидроксид лития, гидроксид натрия и гидроксид калия. Предпочтительно использовать 1-2 эквивалента основания.
[Стадия С17]
На этой стадии соединение (19с) подвергают взаимодействию с восстанавливающим агентом с получением соединения (20с). Реакцию можно проводить в обычных условиях восстановления карбоновой кислоты в метиловый спирт.
В качестве восстанавливающих агентов могут использоваться такие производные борана, как борантетрагидрофурановый комплекс и боранметилсульфидный комплекс, а также борогидрид натрия. Предпочтительно использовать 5-30 эквивалентов восстанавливающего реагента.
При использовании боранового производного в качестве восстанавливающего агента соединение (20с) может быть получено проведением рассматриваемой реакции в растворителе, таком как 1,4-диоксан, тетрагидрофуран или диметоксиэтан, при температуре от -78 до +35ºС.
При использовании борогидрида натрия в качестве восстанавливающего агента вначале осуществляют взаимодействие соединения (19с) с активатором, таким как изобутилхлорформиат при температуре -78 - +20ºС, после чего осуществляют взаимодействие с таким восстанавливающим агентом, как борогидрид натрия, при температуре -78 - +35ºС, в результате чего получают соединение (20с). В качестве растворителя можно использовать 1,4-диоксан, тетрагидрофуран и диметоксиэтан.
[Стадия С18]
На этой стадии соединение (20с) подвергают тиоамидированию с получением соединения (21с). Реакцию можно проводить в тех же условиях, что использовались для [стадии С6] способа получения С.
[Стадия С19]
На этой стадии соединение (21с) подвергают взаимодействию с силилирующим агентом в присутствии основания с образованием соединения (22с).
Используемые для такой реакции растворители включают дихлорметан, N,N-диметилформамид, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Основания включают имидазол, пиридин, 4-диметиламинопиридин, триэтиламин и N,N-диизопропилэтиламин. Силилирующие агенты включают трет-бутилдиметилхлорсилан и трет-бутилхлордифенилсилан. Предпочтительно использовать 1,0-1,5 эквивалента основания и 1,0-1,5 эквивалента силилирующего агента. Реакцию можно проводить при температуре 0-80ºС.
[Стадия С20]
На этой стадии соединение (22с) подвергают метилированию с получением соединения (23с). Реакцию можно проводить в тех же условиях, что использовались для [стадии С7] способа получения С.
[Стадия С21]
На этой стадии соединение (23с) гидролизуют с получением соединение (24с).
Условия проведения реакции гидролиза не регламентируются. Соединение (24с) может быть получено проведением реакции в смешанном растворителе, состоящем из этанола и воды в присутствии такой кислоты, как серная, хлористоводородная или п-толуолсульфокислота, при температуре 50-100ºС.
В том случае, когда в результате реакции удаляется группа -Rp3, группу -NH- следует защищать повторно. Так, например, если -Rp3 представляет собой трет-бутоксикарбонильную группу, то реакцию можно проводить с использованием трет-бутилдикарбоната в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии такого основания, как пиридин, аминопиридин, триэтиламин или N,N-диизопропилэтиламин, при температуре 0-80ºС. Однако условия реакции не регламентируются.
Способ получения D
[Стадия D1]
На этой стадии соединение (1d) подвергают взаимодействию с соединением (1d-2) с получением соединения (2d).
Конкретными примерами соединения (1d-2) могут служить алкилгалогениды, такие как йодметан, йодэтан, йодпропан, бензилбромид, 2-бромацетофенон, хлорметилбензиловый эфир и бромацетонитрил; алкенилгалогениды, такие как аллилбромид и 1-бром-3-метил-2-бутен, а также алкинилгалогениды, такие как пропаргилбромид и 1-бром-2-бутин. Предпочтительно использовать 1-1,5 эквивалента соединения (1d-2).
Используемые в реакции растворители включают N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан и дихлорметан. Реакцию можно проводить в присутствии или в отсутствие основания. Используемее основания включают 1,8-диазабицикло[5,4,0] ундецен, триэтиламин, N,N-диизопропилэтиламин и гидрид натрия. В рассматриваемом случае предпочтительно использовать 1-1,5 эквивалента основания. Реакцию можно проводить при температуре 0-150ºС.
[Стадия D2]
На этой стадии соединение (2d) подвергают взаимодействию с нитритной солью с получением соединения (3d).
Растворители для такой реакции могут представлять собой смешанный растворитель из воды и таких веществ, как N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан. Нитриты включают нитрит натрия и нитрит калия. Предпочтительно использовать 3-5 эквивалентов нитрита. Реакцию можно проводить при температуре 20-120ºС.
[Стадия D3]
На этой стадии соединение (3d) подвергают взаимодействию с аммиаком с получением соединения (4d). Предпочтительно использовать 10-20 эквивалентов аммиака.
Реакцию можно проводить в растворителе, таком как метанол, этанол или 1,4-диоксан, при температуре в интервале 20-200ºС.
[Стадия D4]
На этой стадии соединение (4d) подвергают каталитическому восстановлению в атмосфере водорода или в присутствии 2-3 эквивалентов гидразина с использованием металлического катализатора и в результате получают соединение (5d).
Растворители, используемые в этой реакции, включают метанол, этанол, N,N-диметилформамид, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, воду или их смеси. Металлические катализаторы включают палладий на угле, оксид платины и никель Ренея. Предпочтительное количество катализатора составляет 0,5-10 мас.%. Реакцию можно проводить при температуре 0-150ºС.
[Стадия D5]
На этой стадии соединение (5d) подвергают взаимодействию с ортоформиатом с получением соединения (6d).
Реакцию проводят в присутствии ангидрида карбоновой кислоты, например уксусного ангидрида. Эфиры ортомуравьиной кислоты включают метилортоформиат и этилортоформиат. Предпочтительно использовать 1-20-кратный избыток ортоформиата и 3-10 эквивалентов ангидрида карбоновой кислоты. Реакцию можно проводить при температуре 20-200ºС.
[Стадия D6]
На этой стадии NH-группу в положении 1 соединения (6d) защищают с получением соединения (7d).
Защищающими реагентами служат N,N-диметилсульфамоилхлорид, тритилхлорид, ди-трет-бутилдикарбонат и бензилбромид. Предпочтительное количество защитного агента составляет 1-1,5 эквивалента. Растворители в этой реакции включают дихлорметан, хлороформ, четыреххлористый углерод, толуол, N,N-диметилформамид и тетрагидрофуран. Используемые основания включают 4-диметиламинопиридин, 1,8-диазабицикло[5,4,0]ундецен, триэтиламин и N,N-диизопропилэтиламин. В обычных случаях предпочтительно использовать 1,2 эквивалента основания. Однако в том случае, когда защитный агент представляет собой ди-трет-бутилдикарбонат, предпочтительно использовать 0,005-0,1 эквивалента 4-диметиламинопиридина. Реакцию проводят при температуре 20-200ºС.
[Стадия D7]
На этой стадии соединение (7d) подвергают хлорированию с получением соединения (8d).
Условия такой реакции не регламентируются. Так, например, рассматриваемую реакцию можно проводить следующим образом. При температуре в интервале -100 - +20ºС осуществляют взаимодействие соединения (7d) с основанием, после чего осуществляют взаимодействие с хлорирующим агентом. В результате получают соединение (8d). Соединение (8d) также может быть получено путем взаимодействия соединения (7d) с основанием в присутствии хлорирующего агента. Растворители для такой реакции включают диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан. Используемые основания включают н-бутиллитий, трет-бутилитий, диизопропиламид лития, бис(триметилсилил)амид лития и диизопропиламид магния. Предпочтительно использовать 1-1,5 эквивалента основания. Хлорирующие реагенты включают гексахлорэтан и N-хлорсукцинимид. Предпочтительное количество хлорирующего агента составляет 1-3 эквивалента.
[Стадия D8]
На этой стадии соединение (8d) подвергают взаимодействию c соединением (9d) c получением соединения (10d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А6] способа получения А.
[Стадия D9]
На этой стадии проводили реакцию замещения с использованием соединений (10d) и (10d-2) с получением соединения (11d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А4] способа получения А.
[Стадия D10]
На этой стадии осуществляют удаление Rp3 из соединения (11d) с получением соединения (12d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.
[Стадия D11]
На этой стадии группу, находящуюся в положении 5 соединения (11d), подвергают деалкилированию с получением соединения (13d). Условия реакции деалкилирования специально не регламентируются. Так, например, реакцию можно проводить следующим образом.
В том случае, когда R1 представляет собой бензилоксиметильную группу, соединение (11d) подвергают взаимодействию с 3-10 эквивалентами трибромида бора, трихлорида бора и т.п. в растворителе, таком как дихлорметан, при температуре в интервале -100 - +20ºС. В результате получают соединение (13d).
Если при проведении подобной реакции происходит удаление группы Rp3, то следует повторно защищать группу -NH-. Так, например, если Rp3 представляет собой трет-бутоксикарбонильную группу, то рассматриваемую реакцию можно проводить с использованием реагента, такого как ди-трет-бутилдикарбонат, в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии такого основания, как пиридин, 4-аминопиридин, триэтиламин или N,N-диизопропилэтиламин, при температуре 0-80ºС. Однако рассматриваемую реакцию можно проводить и в других условиях.
[Стадия D12]
На этой стадии соединение (13d) подвергают взаимодействию с соединением (13d-2) с получением соединения (14d). Реакцию можно проводить в тех же условиях, что использовались для [стадии D1] способа получения D.
[Стадия D13]
На этой стадии осуществляют удаление Rp3 из соединения (14d) с получением соединения (12d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.
Альтернативный способ получения соединения (11d) описан далее.
[Стадия D14]
На этой стадии осуществляют удаление защитной группы из соединения (8d) с получением соединения (15d).
Реакцию снятия защитной группы можно проводить в обычных условиях в зависимости от природы защитной группы. Так, например, в случае трет-бутоксикарбонильной группы, снятие защитной группы может осуществляться с использованием основания, такого как гидроксид натрия, карбонат калия и аммиак, в среде тетрагидрофурана, N,N-диметилформамида, метанола, этанола, воды или в их смесях при температуре 0-100ºС. В том случае, когда растворитель и основание добавляют после хлорирования на предыдущей стадии, снятие защитной группы может проводиться без выделения соединения (8d).
[Стадия D15]
На этой стадии Х вводят в соединение (15d) с получением соединения (16d). Реакцию можно проводить с использованием X-U2 при тех же условиях, что использовали на [стадии A4] способа получения А.
Спирт (Х-ОН) может вводиться с использованием реакции Mitsunobu. Соединение (16d) может быть получено путем взаимодействия спирта (Х-ОН) с диалкиловым эфиром азодикарбоновой кислоты и трифенилфосфином в растворителе, таком как тетрагидрофуран, при температуре -70 - 50ºС.
[Стадия D16]
На этой стадии соединение (16d) подвергают взаимодействию c соединением (9d) c получением соединения (11d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А6] способа получения А.
Способ получения Е
Соединение (1е), представленное формулой
может быть получено с использованием соединения (8b) формулы Н-Т1а вместо соединения (6с) на [стадии С5] или [стадии С15] описанного выше способа получения С при тех же условиях, что использовались на [стадии С5], с последующим проведением реакций в описанной выше последовательности [стадия С6] - [стадия С21].
Соединение (1е), представленное формулой
может быть получено с использованием соединения (8b) формулы Н-Т1а вместо соединения (9d) на [стадии D8] описанного выше способа получения D при тех же условиях, что использовались на [стадии D8], с последующим проведением реакций в описанной выше последовательности [стадия С9] - [стадия С13].
Способ получения F
[Стадия F1]
На этой стадии эфирную группу соединения [1f] подвергают гидролизу с получением соединения (2f). Такую реакцию можно проводить при тех же условиях, что использовались при проведении [стадии С16] способа получения С.
[Стадия F2]
На этой стадии осуществляют удаление группы Rp3 из соединения (2f) с образованием соединения (3f). Рассматриваемую реакцию можно проводить при тех же условиях, что использовали для осуществления [стадии A13] способа получения А.
Способ получения G
[Стадия G1]
На этой стадии проводят восстановление нитрогруппы в молекуле соединения (1g) с получением соединения (2g).
В этой реакции в качестве растворителей можно использовать метанол, этанол, тетрагидрофуран, воду или их смеси. В качестве восстанавливающих агентов могут использоваться железо, олово и цинк. Катализаторами могут служить хлористоводородная кислота и такие соли аммония, как хлорид аммония. Реакцию можно проводить при температуре 20-120ºС.
[Стадия G2]
На этой стадии осуществляют удаление Rp3 из соединения (2g) с получением соединения (3g). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.
Способ получения Н
[Стадия Н1]
На этой стадии нитрильную группу соединения (1h) подвергают гидролизу с получением соединения (2h).
Условия проведения такой реакции специально не регламентируются. Так, например, реакцию можно проводить следующим образом. Соединение (2h) может быть получено путем взаимодействия соединения (1h) с пероксидом водорода в присутствии основания при температуре -20 - +50ºС. В качестве растворителей может использоваться метанол, этанол, тетрагидрофуран, вода или их смеси. Основания включают аммиак и такой алкиламин, как триэтиламин.
[Стадия Н2]
На этой стадии осуществляют удаление Rp3 из соединения (2h) с получением соединения (3h). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.
Способ получения I
[Стадия I1]
На этой стадии соединение (1i) подвергают взаимодействию с реагентом на основе алкилметалла или арилметалла с получением соединения (2i).
Условия проведения такой реакции специально не регламентируются. Так, например, реакцию можно проводить следующим образом. Соединение (1i) может вступать в реакцию с реагентом, таким как алкиллитий, ариллитий, алкильный Гриньяровский реагент, или арильный Гриньяровский реагент в растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре в интервале от -100 до +100ºС. Согласно другому способу указанное соединение может вступать в реакцию с алкилцинком или арилцинком в растворителе, таком как N,N-диметилформамид или 1-метил-2-пирролидон, при температуре 0-50ºС.
[Стадия I2]
На этой стадии соединение (2i) подвергают окислению с получением соединения (3i). В качестве окислителя можно использовать типичный реагент, который применяют для окисления спиртов. Так, например, в качестве окислителя можно использовать диоксид марганца в растворителе, таком как дихлорметан или хлороформ, при температуре 20-100ºС. Согласно другому способу в качестве окислителя может быть использован пиридинсульфотриоксид в растворителе, таком как диметилсульфоксид, при температуре в интервале 20-100ºС. Также может использоваться периодинан Десса-Мартина (Dess-Martin) в растворителе, таком как хлороформ, при температуре -50 - +50ºС.
[Стадия I3]
На этой стадии соединение (3i) подвергают взаимодействию с гидразином с получением соединения (4i). Реакцию можно проводить при тех же условиях, что используют для проведения [стадии С12] способа получения С.
[Стадия I4]
На этой стадии осуществляют замещение с использованием соединений (4i) и (5i) с получением соединения (6i). Реакцию можно проводить при тех же условиях, что используют для [стадии А2] способа получения А.
[Стадия I5]
На этой стадии осуществляют удаление группы Rp3 из молекулы соединения (6i) с получением соединения (7i). Реакцию можно проводить при тех же условиях, что используют для [стадии А13] способа получения А.
[Стадия I6]
На этой стадии осуществляют удаление группы Rp3 из молекулы соединения (4i) с получением соединения (7i), в том случае, когда R1 в соединении (7i) представляет собой Н. Рассматриваемую реакцию можно проводить при тех же условиях, что используют для [стадии А13] способа получения А.
Способ получения J
[Стадия J1]
На этой стадии соединение (1j) подвергают взаимодействию с цианидирующим реагентом в присутствии катализатора с получением соединения (2j).
В качестве цианидирующих агентов используют цианид натрия и цианид калия. Катализатором служит уксусная кислота. Примером растворителя может служить ацетонитрил. Реакцию можно проводить при температуре 0-100ºС.
[Стадия J2]
На этой стадии нитрильную группу соединения (2j) подвергают гидролизу с получением соединения (3j). Рассматриваемую реакцию можно проводить при тех же условиях, что используют для [стадии Н1] способа получения Н.
[Стадия J3]
На этой стадии гидроксильную группу соединения (3j) подвергают окислению с получением соединения (4j). Рассматриваемую реакцию можно проводить при тех же условиях, что используют для [стадии I2] способа получения I.
[Стадия J4]
На этой стадии соединение (4j) подвергают взаимодействию с соединением (5j) с получением соединения (6j). Рассматриваемую реакцию можно проводить при тех же условиях, что и [стадию С11] способа получения С.
[Стадия J5]
На этой стадии осуществляют удаление группы Rp3 из соединения (6j) с получением соединения (7j). Рассматриваемую реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
[Стадия J6]
На этой стадии карбамоильную группу соединения (6j) подвергают дегидратации в присутствии основания с получением соединения (8j).
Дегидратирующие агенты включают, например, оксихлорид фосфора. Основания могут включать алкиламины, такие как триэтиламин. В качестве растворителей могут использоваться дихлорметан и хлороформ. Реакцию также можно осуществлять в отсутствие растворителя. Реакцию проводят при температуре 0-100ºС.
[Стадия J7]
На этой стадии осуществляют удаление группы Rp3 из соединения (8j) с получением соединения (9j). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
Способ получения К
[Стадия К1]
На этой стадии осуществляют замещение с участием соединений (1k) и (2k) с образованием соединения (3k). Реакцию можно проводить при тех же условиях, что и [стадию А2] способа получения А.
[Стадия К2]
На этой стадии осуществляют замещение с участием соединений (3k) и (4k) с образованием соединения (5k).
Соединение (5k) может быть получено, например, путем взаимодействия смеси соединений (3k) и (4k) в растворителе, таком как метанол, этанол, 1-метил-2-пирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, или в отсутствие растворителя при температуре 20-200ºС. Однако реакционные условия не ограничены этим примером.
[Стадия К3]
На этой стадии соединение (5k) подвергают хлорированию с получением соединения (6k). Реакцию можно проводить при тех же условиях, что и [стадию D7] способа получения D.
[Стадия К4]
На этой стадии соединение (6k) подвергают взаимодействию с соединением (7k) с получением соединения (8k). Реакцию можно проводить при тех же условиях, что и [стадию А6] способа получения А.
[Стадия К5]
На этой стадии осуществляют удаление группы Rp5 соединения (8k) с получением соединения (9k).
Реакцию удаления защитной группы Rp3 можно проводить в обычных условиях удаления -NH-защищающей группы.
В том случае, когда Rp5 представляет собой бензильную группу, реакция может проводиться в присутствии такого металла, как литий или натрий, в среде жидкого аммиака при температуре от -78 до -30ºС.
[Стадия К6]
На этой стадии осуществляют замещение с участием соединений (9k) и (10k) с образованием соединения (11k). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.
[Стадия К7]
На этой стадии осуществляют удаление группы Rp3 соединения (11k) с получением соединения (12k). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
Способ получения L
[Стадия L1]
На этой стадии соединение (1l) подвергают взаимодействию с соединением (2l) в присутствии окислителя с получением соединение (3l).
Окислители включают соли, такие как хлористое железо (III). Растворители включают метанол, этанол и воду. Реакцию можно проводить при температуре 20-100ºС.
Если в результате реакции происходит удаление группы -Rp3, то следует проводить повторную защиту группы -NH-. Так, например, если Rp3 представляет собой трет-бутоксикарбонильную группу, то реакцию проводят в присутствии реагента, такого как ди-трет-бутилдикарбонат в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии основания, такого как пиридин, 4-аминопиридин, триэтиламин или N,N-диизопропилэтиламин, при температуре 0-80ºС. Однако реакция не ограничивается приведенным примером.
[Стадия L2]
На этой стадии соединение (3l) подвергают взаимодействию с соединением (4l) с получением соединения (5l). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.
[Стадия L3]
На этой стадии осуществляют удаление группы Rp3 соединения (5l) с получением соединения (6l). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
Способ получения М
[Стадия М1]
На этой стадии соединение (1m) подвергают взаимодействию с соединением (2m) с получением соединения (3m). Реакцию можно проводить при тех же условиях, что и [стадию А6] способа получения А.
[Стадия М2]
На этой стадии соединение (3m) подвергают взаимодействию с соединением (4m) с получением соединения (5m). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.
[Стадия М3]
На этой стадии осуществляют удаление группы Rp3 соединения (5m) с получением соединения (6m). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
Способ получения N
[Стадия N1]
На этой стадии соединение (1n) подвергают взаимодействию с аллиламином с получением соединения (2n).
Реакцию можно проводить при температуре 20-150ºС. Растворители для рассматриваемой реакции включают метанол, этанол, воду и их смеси.
[Стадия N2]
На этой стадии проводят восстановление хлорированного соединения (2n) с образованием соединения (3n).
В качестве восстановителя можно использовать такие соли, как хлорид олова. Растворители включают концентрированную соляную кислоту. Реакцию можно проводить при температуре 20-150ºС.
[Стадия N3]
На этой стадии соединения (3n) подвергают взаимодействию с N,N'-дисукцинимидилкарбонатом с получением соединения (4n).
Эту реакцию можно проводить в растворителе, таком как ацетонитрил или тетрагидрофуран. Реакцию можно проводить при температуре 20-100ºС.
[Стадия N4]
На этой стадии осуществляют взаимодействие соединения (4n) и соединения (5n) с получением соединения (6n). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.
[Стадия N5]
На этой стадии осуществляют удаление аллильной группы из соединения (6n) с получением соединения (7n).
Соединение (7n) может быть получено, например, путем взаимодействия соединения (6n) с осмиевой кислотой и периодатом натрия в растворителе, таком как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан или вода, при температуре 20-100ºС. Однако реакционные условия не ограничены этим примером.
[Стадия N6]
На этой стадии соединение (7n) подвергают хлорированию с получением соединения (8n).
Условия проведения такой реакции специально не регламентируются. Реакцию можно проводить в обычных условиях хлорирования. Так, например, соединение (8n) может быть получено с использованием реагента, такого как пентахлорид фосфора, в растворителе, таком как оксихлорид фосфора, при температуре 0-150ºС.
[Стадия N7]
На этой стадии соединение (8n) подвергают взаимодействию с соединением (9n) с получением соединения (10n). Реакцию можно проводить при тех же условиях, что и [стадию А6] способа получения А.
[Стадия N8]
На этой стадии осуществляют удаление группы Rp3 соединения (10n) с получением соединения (11n). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
Способ получения О
[Стадия О1]
На этой стадии гидроксильную группу соединения (1о) подвергают окислению с получением соединения (2о). Реакцию можно проводить при тех же условиях, что и [стадию I2] способа получения I.
[Стадия О2]
На этой стадии соединение (2о) подвергают взаимодействию с этилдиэтилфосфоноацетатом в присутствии основания, с получением соединение (3о).
Основания включают гидрид натрия и диизопропиламид лития. Растворители включают, например, тетрагидрофуран и N,N-диметилформамид. Реакцию можно проводить при температуре 0-100ºС.
[Стадия О3]
На этой стадии эфирное производное соединения (3о) подвергают гидролизу с получением соединения (4о). Реакцию можно проводить при тех же условиях, что и [стадию С16] способа получения С.
[Стадия О4]
На этой стадии соединение (4о) подвергают взаимодействию с дифенилфосфорилазидом в присутствии основания с получением соединения (5о).
Растворители для рассматриваемой реакции включают толуол, трет-бутанол, тетрагидрофуран и дихлорметан. Основания включают третичные амины, такие как триэтиламин и диизопропилэтиламин. Реакцию можно проводить при температуре -50 - +50ºС.
[Стадия О5]
На этой стадии соединение (5о) подвергают перегруппировке с получением соединения (6о).
Такую реакцию можно проводить в трет-бутаноле при температуре 50-100ºС.
[Стадия О6]
На этой стадии нитрильную группу соединения (6о) подвергают гидролизу с получением соединения (7о). Реакцию можно проводить при тех же условиях, что и [стадию Н1] способа получения Н.
[Стадия О7]
На этой стадии соединение (7о) подвергают взаимодействию с кислотой с получением соединения (8о).
Кислоты включают серную кислоту, серную кислоту и трифторуксусную кислоту. Растворители включают в себя метанол, этанол, 1,4-диоксан, воду и их смеси. Температура, при которой осуществляют взаимодействие, находится в интервале 0-50ºС.
Способ получения Р
[Стадия Р1]
На этой стадии соединения (1р) проводят защиту с образованием соединения (2р).
В качестве реагента для защиты -NH-группы может использоваться обычный реагент, используемый для защиты NH-групп. Так, например, в том случае, когда Rp3 представляет собой трет-бутоксикарбонильную группу, реакция может осуществляться при температуре 0-80ºС с использованием реагента, такого как трет-бутилдикарбонат, в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид и тетрагидрофуран, в присутствии основания, такого как пиридин, 4-аминопиридин, триэтиламин и N,N-диизопропилэтиламин.
[Стадия Р2]
На этой стадии соединение (2р) подвергают взаимодействию с соединением (3р) с получением соединения (4р). Реакцию можно проводить при тех же условиях, что и [стадию А2] способа получения А.
[Стадия Р3]
На этой стадии осуществляют удаление группы Rp3 соединения (4р) с получением соединения (5р). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
Способ получения Q
[Стадия Q1]
На этой стадии соединение (1q) подвергают гидролизу с получением соединения (2q).
Растворители для этой реакции включают тетрагидрофуран, метанол и этанол. Кислоты включают неорганические кислоты, такие как соляная и серная кислота. Реакцию можно проводить при температуре 0-100ºС.
[Стадия Q2]
На этой стадии гидроксильную группу соединения (2q) подвергают реакции окисления с образованием соединения (3q). Реакцию можно проводить при тех же условиях, что использовались для [стадии I2] способа получения I.
[Стадия Q3]
На этой стадии соединения (3q) подвергают взаимодействию с метилбензилоксикарбониламино(диметоксифосфорил)ацетатом в присутствии основания с получением соединения (4q).
Основания включают гидрид натрия, трет-бутилат калия и 8-диазабицикло[5.4.0]-7-ундецен. Растворители включают дихлорметан, тетрагидрофуран и N,N-диметилформамид. Реакция может проводиться при температуре 0-100ºС.
[Стадия Q4]
На этой стадии соединения (4q) подвергают взаимодействию с метилатом натрия с получением соединения (5q).
В качестве растворителя можно использовать метанол. Реакцию можно проводить при температуре 0-80ºС.
[Стадия Q5]
На этой стадии соединение (5q) подвергают взаимодействию с соединением (6q) с получением соединения (7q). Реакцию можно проводить при тех же условиях, что использовались для [стадии А2] способа получения А.
[Стадия Q6]
На этой стадии соединение (7q) подвергают взаимодействию с кислотой с получением соединения (8q). Реакцию можно проводить при тех же условиях, что использовались для [стадии О7] способа получения О.
[Стадия Q7]
На этой стадии осуществляют удаление группы Rp3 соединения (8q) с получением соединения (9q). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
[Стадия Q8]
На этой стадии соединение (7q) подвергают взаимодействию с аммиаком с получением соединения (10q).
Растворители для реакции включают метанол, этанол и воду. Реакцию можно проводить при температуре 20-150ºС.
[Стадия Q9]
На этой стадии осуществляют удаление группы Rp3 соединения (10q) с получением соединения (11q). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.
Перечисленные далее соединения, их соли или гидраты чрезвычайно полезны в качестве промежуточных соединений в синтезе соединения (I) по настоящему изобретению.
Соединения, или их соли, или гидраты, представленные общей формулой
[где R1 имеет значения, указанные выше в пункте [1];
Rp5 представляет собой трет-бутоксикарбонилоксигруппу, тритильную группу или группу, представленную формулой -SO2NH2;
Т10 представляет собой атом галогена];
Соединения, их соли или гидраты, отвечающие общей формуле
[где R1 имеет значения, указанные выше в пункте [1];
Т11 представляет собой атом галогена или группу общей формулы
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу];
Соединения, их соли или гидраты, отвечающие общей формуле
[где R1 имеет значения, указанные выше в пункте [1];
Т12 представляет собой атом галогена];
Соединения, их соли или гидраты, отвечающие общей формуле
[где Х имеет значения, указанные в пункте [1], исключая случай, когда Х представляет собой бензильную группу;
Т21 и Т22, каждый независимо, представляют собой атом галогена;
Т11 представляет собой атом галогена или группу, представленную общей формулой
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу];
Соединения, их соли или гидраты, представленные общей формулой
[где Х и R1 имеют значения, указанные выше в пункте [1];
Т22 представляет собой атом галогена;
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу].
Указанные выше способы являются репрезентативными способами получения соединения (I) по настоящему изобретению. Исходные соединения и различные реагенты, используемые в способах получения соединений по настоящему изобретению, могут представлять собой соли, гидраты или сольваты в зависимости от природы исходных соединений, типа растворителей и т.п., и нет специальных ограничений, касающихся этих веществ, если они не ингибируют описанные реакции. Тип используемых растворителей зависит от природы исходных соединений, используемых реагентов и т.д. и конкретно не регламентируется, если такие вещества не ингибируют реакцию и в достаточной степени растворяют исходные материалы. В том случае, когда соединение (I) по настоящему изобретению получают в свободном виде, это соединение может быть обычным способом превращено в его соль или гидрат, являющиеся возможной формой указанного выше соединения (I).
В том случае, когда соединение (I) по настоящему изобретению получают в виде соли или гидрата, такой продукт может быть обычным способом переведен в свободную форму указанного выше соединения (I).
Кроме этого, различные изомеры соединения (I) по настоящему изобретению (например, геометрические изомеры, энантиомеры, образование которых связано с наличием асимметричного атома углерода, ротамеры (вращательные изомеры), стереоизомеры и таутомеры) могут быть выделены и очищены обычными способами, такими как перекристаллизация, образование диастереомерных солей, ферментативное разделение и различные хроматографические методы (например, тонкослойная хроматография, колонная хроматография и газовая хроматография).
Соединения по настоящему изобретению, их соли или гидраты могут быть обычными способами включены в состав таблеток, порошков, частиц, гранул, таблеток с покрытием, капсул, сиропов, пилюль, ингаляторов, свечей, препаратов для инъекций, мазей, глазных притирок, глазных капель, капель для носа, ушных капель, припарок, лосьонов и т.п. Такие рецептуры могут составляться с использованием обычных разбавителей, связующих веществ, смазывающих веществ, красителей, вкусовых веществ и, если это желательно, стабилизаторов, эмульгаторов, усилителей абсорбции, поверхностно-активных агентов, модуляторов рН, консервантов, антиоксидантов и т.п., а также материалов, которые обычно используются в качестве ингредиентов фармацевтических рецептур. Так, например, препарат для перорального применения может быть получен смешиванием соединения по настоящему изобретению или его фармацевтически применимой соли с разбавителем и, если нужно, со связующим, разрыхлителем, смазывающим агентом, красителем, вкусовым веществом и т.п. и общепринятым формированием полученной смеси в виде порошков, частиц, гранул, таблеток, таблеток с покрытием, капсул и т.п. Примерами таких материалов могут служить животные и растительные жиры, например соевое масло, говяжий жир и синтетический глицерид; углеводороды, такие как жидкий парафин, сквалан и твердый парафин; эфирные масла, например октилдодецилмиристат и изопропилмиристат; высшие спирты, например цетостеариловый спирт и бегениловый спирт; силиконовые смолы; силиконовые масла; поверхностно-активные вещества, такие как полиоксиэтиленовый эфир жирной кислоты, эфир сорбита и жирной кислоты, эфир глицерина и жирной кислоты, эфир полиоксиэтиленсорбита и жирной кислоты, полиоксиэтиленовое гидрированное касторовое масло и полиоксиэтилен полиоксипропиленовый блок-сополимер; водно-растворимые полимеры, такие как гидроксиэтилцеллюлоза, полиакриловая кислота, карбоксивиниловый полимер, полиэтиленгликоль, поливинилпирролидон и метилцеллюлоза; низшие спирты, такие как этанол и изопропанол; многоатомные спирты, такие как глицерин, пропиленгликоль, дипропиленгликоль и сорбит; сахара, такие как глюкоза и сахароза; неорганический порошок, такой как безводная кремниевая кислота, магнийалюмосиликат и силикат алюминия, а также очищенная вода. Примерами разбавителей могут служить лактоза, пшеничный крахмал, сахар, глюкоза, маннит, сорбит, кристаллическая целлюлоза и диоксид кремния. В качестве связывающих веществ могут использоваться, например, поливиниловый спирт, поливиниловый эфир, метилцеллюлоза, этилцеллюлоза, аравийская камедь, трагакант, желатин, шеллак, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, поливинилпирролидон, полипропиленгликоль-полиоксиэтиленовый блок-сополимер и меглюмин. Примерами разрыхлителей могут служить крахмал, агар, порошок желатина, кристаллическая целлюлоза, карбонат кальция, бикарбонат натрия, цитрат кальция, декстрин, пектин и кальцийкарбоксиметилцеллюлоза. Примерами смазывающих веществ могут служить стеарат магния, тальк, полиэтиленгликоль, оксид кремния и гидрированное растительное масло. В качестве красителей могут использоваться фармацевтически применимые вещества. Примерами придающих вкус веществ могут служить порошок какао, мятная камфара, ароматизированный порошок из масла перечной мяты, камфара Borneo и порошок корицы. Таблетки и гранулы могут быть покрыты сахаром или, если необходимо, может быть нанесено другое подходящее покрытие. Растворы, например сиропы или препараты для инъекций, могут быть изготовлены смешиванием соединений по настоящему изобретению или их фармацевтически применимых солей с модулятором рН, солюбилизирующим агентом, изотоническим агентом и т.п. и, если необходимо, со вспомогательным растворяющим агентом, стабилизатором и т.п. Нет конкретных ограничений, касающихся способов получения препаратов для наружного применения, и такие препараты могут быть приготовлены обычными способами. В качестве основы препаратов для наружного применения могут использоваться разнообразные материалы, обычно применяемые для производства фармацевтических препаратов, квазилекарств, косметических препаратов и т.п. Примерами таких основных материалов могут служить животные и растительные масла, минеральные масла, эфирные масла, воск, высшие спирты, жирные кислоты, силиконовое масло, поверхностно-активные вещества, фосфолипиды, спирты, многоатомные спирты, водно-растворимые полимеры, глины и очищенная вода. Кроме этого, препараты по настоящему изобретению для наружного применения, если необходимо, могут содержать модуляторы рН, антиоксиданты, хелатирующие агенты, антибактериальные/противогрибковые агенты, красители, дезодоранты и т.п. Однако препараты для наружного применения по настоящему изобретению не ограничиваются основными материалами указанных типов. При необходимости такие препараты могут содержать стимуляторы дифференцировки, агенты, улучшающие кровоснабжение, противомикробные агенты, противовоспалительные агенты, активаторы клеток, витамины, аминокислоты, увлажнители, кератолитические агенты и т.п. Количество перечисленных выше основных материалов регулируется таким образом, чтобы оно попадало в интервал концентраций, используемый для получения обычных препаратов наружного применения.
При введении соединения по настоящему изобретению, его соли или гидрата формы соединения не регламентируются и соединение может применяться обычным пероральным или парентеральным способом. Так, например, соединение может вводиться в виде стандартной лекарственной формы, такой как таблетки, порошки, гранулы, капсулы, сиропы, пилюли, ингаляторы, свечи, препараты для инъекций, мази, глазные мази, глазные капли, капли в нос, ушные капли, компрессы и лосьоны. Доза фармацевтического препарата по настоящему изобретению может выбираться в зависимости от тяжести симптомов, возраста, пола и массы пациента, формы соединения, типа соли, природы заболевания и т.п.
Дозировка может меняться в зависимости от типа заболевания, тяжести симптомов, возраста и пола пациента, лекарственной переносимости и т.п. Фармацевтический агент по настоящему изобретению применяют один или несколько раз с дозой от 0,03 до 1000 мг/взрослый пациент/день, предпочтительно 0,10-500 мг/взрослый пациент/день, более предпочтительно 0,1-100 мг/взрослый пациент/день. Доза инъекции может составлять 1-3000 мкг/кг, предпочтительно 3-1000 мкг/кг.
Соединения по настоящему изобретению могут быть получены, например, способами, описанными в следующих далее примерах. Однако соединения по настоящему изобретению никоим образом не ограничены конкретными примерами, описанными далее.
[Примеры получения]
Пример получения 1
трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1Н-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
(а) трет-Бутил-5-метил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-карбоксилат
Смесь, состоящую из 1,0 г 5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она, 16 мг 4-диметиламинопиридина, 1,6 г ди-трет-бутилдикарбоната и 5 мл тетрагидрофурана, перемешивают при комнатной температуре в течение ночи. Затем к раствору добавляют 0,5 мл тетрагидрофуранового раствора, содержащего 300 мг ди-трет-бутилдикарбоната, и полученную смесь перемешивают при комнатной температуре в течение трех часов. К реакционной смеси добавляют 5 мл трет-бутилметилового эфира и смесь охлаждают льдом. Полученные кристаллы собирают фильтрацией с получением 1,63 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,72 (с, 9Н), 3,39 (с, 3Н), 8,38 (с, 1H), 8,54 (с, 1H).
b) 2-Хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
8,4 мл гексаметилдисилазида лития (1,0 М тетрагидрофурановый раствор) в течение одного часа добавляют по каплям к 300 мл тетрагидрофуранового раствора, содержащего 1,68 г трет-бутил-5-метил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-карбоновой кислоты и 4,15 г гексахлорэтана в атмосфере азота при 0ºС. Полученную смесь перемешивают в течение 30 минут. К раствору добавляют 2 н. водно-аммиачный раствор и смесь перемешивают в течение трех часов. Затем реакционный раствор концентрируют до 50 мл и промывают 20 мл трет-бутилметилового эфира. Раствор подкисляют концентрированной соляной кислотой. Образовавшийся осадок собирают фильтрацией и промывают последовательно 10 мл воды и 10 мл трет-бутилметилового эфира. Таким образом получают 1,03 г указанного в заголовке соединения.
1Н-ЯМР (ДМСО-d6)
δ 1,45 (с, 9Н) 3,72 (с, 3Н), 8,33 (с, 1H).
(c) 3-(2-Бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он
7,72 г 2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она суспендируют в 400 мл тетрагидрофурана в атмосфере азота и добавляют 14,22 г трифенилфосфина и 3,85 г 2-бутин-1-ола. Полученную смесь охлаждают до 0ºС. Добавляют по каплям 100 мл тетрагидрофуранового раствора, содержащего 12,55 г ди-трет-бутилового эфира азодикарбоновой кислоты, и реакционную смесь перемешивают в течение трех часов. Полученную смесь концентрируют при пониженном давлении. К остатку добавляют 50 мл дихлорметана и 50 мл трифторуксусной кислоты и смесь перемешивают в течение 15 часов. Реакционную смесь концентрируют при пониженном давлении. Полученный осадок растворяют в 400 мл этилацетата и промывают 200 мл 5 н. водного раствора гидроксида натрия. Водный слой экстрагируют 100 мл этилацетата. Органические слои объединяют, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный осадок подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (4:1), получают 8,78 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,82 (т, J=2,3 Гц, 3Н), 3,87 (с, 3Н), 5,32 (кв, J=2,3 Гц, 2Н), 8,19 (с, 1H).
(d) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1Н-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
5 мл 1-метил-2-пирролидона в атмосфере азота добавляют к смеси, состоящей из 1,183 г 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она, 0,829 г карбоната калия и 1,395 г трет-бутилпиперазин-1-карбоксилата. Полученную смесь нагревают при 130ºС в течение 6 часов. Реакционную смесь охлаждают и добавляют 50 мл воды. Затем смесь экстрагируют 100 мл этилацетата. Органический слой дважды промывают 50 мл воды и затем 50 мл насыщенного водного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный осадок подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (1:4), получают 1,916 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,52 (с, 9Н), 1,83 (т, J=2,3 Гц, 3Н), 3,38-3,42 (м, 4Н), 3,61-3,64 (м, 4Н), 3,85 (с, 3Н), 5,09 (кв, J=2,3 Гц, 2Н), 8,13 (с, 1Н).
Пример получения 2
трет-Бутил-4-[7-(2-бутинил-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилат
(а) 7-(2-Бутинил)-3-метил-3,7-дигидропурин-2,6-дион
55,3 мл 1-бром-2-бутина и 84,9 г безводного карбоната калия добавляют к смеси 100 г 3-метилксантина [CAS No. 1076-22-8] и 1000 мл N,N-диметилформамида. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. К реакционному раствору добавляют 1000 мл воды и смесь перемешивают при комнатной температуре в течение 1 часа. Полученный белый осадок отфильтровывают. Белое твердое вещество промывают водой и затем трет-бутилметиловым эфиром. Таким образом получают 112 г указанного в заголовке соединения.
1Н-ЯМР (ДМСО-d6)
δ 1,82 (т, J=2,2 Гц, 3H), 3,34 (с, 3H), 5,06 (кв, J=2,2 Гц, 2H), 8,12 (с, 1H), 11,16 (уш.с, 1H).
(b) 7-(2-Бутинил)-8-хлор-3-метил-3,7-дигидропурин-2,6-дион
112 г 7-(2-бутинил)-3-метил-3,7-дигидропурин-2,6-диона растворяют в 2200 мл N,N-диметилформамида и добавляют 75,3 г N-хлорсукцинимида. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют 2200 мл воды и смесь перемешивают при комнатной температуре в течение 1,5 часа. Образовывавшийся белый осадок собирают фильтрацией и последовательно промывают водой и трет-бутилметиловым эфиром. Таким образом получают 117 г указанного в заголовке соединения.
1Н-ЯМР (ДМСО-d6)
δ 1,78 (т, J=2,0 Гц, 3H), 3,30 (с, 3H), 5,06 (кв, J=2,0 Гц, 2H), 11,34 (уш.с, 1H).
(с) 7-(2-Бутинил)-2,6,8-трихлор-7Н-пурин
Смесь, состоящую из 2,52 г 7-(2-бутинил)-8-хлор-3-метил-3,7-дигидропурин-2,6-диона и 100 мл оксихлорида фосфора перемешивают при 120ºС в течение 14 часов. После охлаждения реакционной смеси к раствору добавляют 4,15 г пентахлорида фосфора. Полученную в результате смесь перемешивают при 120ºС в течение 24 часов. После охлаждения реакционного раствора до комнатной температуры растворитель выпаривают при пониженном давлении. Остаток растворяют в тетрагидрофуране. Полученный раствор вливают в насыщенный раствор бикарбоната натрия и полученную смесь экстрагируют этилацетатом. Полученный в результате органический слой промывают водой, затем насыщенным рассолом и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле (этилацетат-гексан, 1:3), получая 2,40 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,82 (т, J=2,4 Гц, 3H), 5,21 (кв, J=2,4 Гц, 2H).
(d) трет-Бутил-4-[7-(2-бутинил-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилат
Смесь из 2,4 г 7-(2-бутинил)-2,6,8-трихлор-7Н-пурина, 1,46 г бикарбоната натрия, 2,43 г трет-бутилпиперазин-1-карбоксилата и 45 мл ацетонитрила перемешивают при комнатной температуре в течение 2 часов 20 минут. Затем добавляют 0,73 г бикарбоната натрия и 1,21 г трет-бутилпиперазин-1-карбоксилата и полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор экстрагируют смесью этилацетат-вода и органический слой промывают 1 н. соляной кислотой, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток обрабатывают диэтиловым эфиром. Образовавшиеся кристаллы собирают фильтрацией и промывают диэтиловым эфиром. Таким образом, получают 3,0 г указанного в заголовке соединения в виде твердого белого вещества.
1Н-ЯМР (ДМСО-d6)
δ 1,42 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,48-3,55 (м, 4H), 3,57-3,63 (м, 4H), 4,89 (кв, J=2 Гц, 2H).
[Примеры]
Пример 1
Трифторацетат этил-[7-(2-хлорфенил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]ацетата
(а) [7-Бензил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат
8,66 г 7-бензилксантина растворяют в 300 мл N,N-диметилформамида и добавляют 1,57 г гидрида натрия и 7,7 мл хлорметилпивалата. Полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор разбавляют этилацетатом и промывают водой и 1 н. раствором соляной кислоты. Органический слой сушат над безводным сульфатом магния и фильтруют. Растворитель выпаривают при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (1:1), получают 2,66 г вещества указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,18 (с, 9H), 5,45 (с, 2H), 6,06 (с, 2H), 7,34-7,39 (м, 5H), 7,58 (с, 1H), 8,18 (с, 1H).
(b) [7-Бензил-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат
2,66 г [7-бензил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата растворяют в 30 мл N,N-диметилформамида и добавляют 1,6 г карбоната калия и 1 мл йодистого метила. Полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и 1 н. раствором соляной кислоты. Органический слой сушат над безводным сульфатом магния и фильтруют. Растворитель выпаривают при пониженном давлении. Остаток обрабатывают толуолом. Таким образом получают 2,16 г вещества указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,18 (с, 9H), 3,41 (с, 3H), 5,49 (с, 2H), 6,11 (с, 2H), 7,26-7,39 (м, 5H), 7,57 (с, 1H).
(с) [1-Метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат
2,349 г [7-бензил-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата растворяют в 100 мл уксусной кислоты и к раствору добавляют 1 г катализатора, представляющего собой 10% палладия на угле. Полученную смесь перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Смесь фильтруют и концентрируют с получением 1,871 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,19 (с, 9H), 3,48 (с, 3H), 6,17 (с, 2H), 7,83 (с, 1H).
(d) [7-(2-Хлорфенил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат
1,60 г [1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата, 1,83 г 2-хлорфенилбороновой кислоты и 1,5 г ацетата меди (II) суспендируют в 30 мл N,N-диметилформамида и в полученную суспензию добавляют 3 мл пиридина. Полученную смесь перемешивают при комнатной температуре в течение 3 дней. Реакционный раствор фильтруют через короткую колонку, заполненную силикагелем, и фильтрат разбавляют этилацетатом. Органический слой промывают 1 н. соляной кислотой, водой и насыщенным рассолом, затем сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют. Остаток суспендируют в эфире и суспензию фильтруют. Фильтрат подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 724 мг соединения, указанного в заголовке.
(е) трет-Бутил-4-[7-(2-хлорфенил)-3-(2,2-диметилпропионилоксиметил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат
724 мг [7-(2-хлорфенил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата суспендируют в 15 мл N,N-диметилформамида и в суспензию добавляют 760 мг N-хлорсукцинимида. Реакционный раствор перемешивают в течение ночи и затем разбавляют этилацетатом. Полученный раствор промывают водой и 1 н. соляной кислотой, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют. Таким образом получают 764 мг [8-хлор-7-(2-хлорфенил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата. Полученное вещество смешивают с 4 г трет-бутилпиперазин-1-карбоксилата. Смесь нагревают при 150ºС и перемешивают в течение трех часов. В реакционную смесь добавляют этилацетат и воду, в результате чего смесь разделяется на слои. Органический слой промывают 1 н. раствором соляной кислоты и сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 724 мг соединения, указанного в заголовке.
(f) трет-Бутил-4-[7-(2-хлорфенил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат
трет-Бутил-4-[7-(2-хлорфенил)-3-(2,2-диметилпропионилоксиметил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат растворяют в смеси, состоящей из 10 мл метанола и 20 мл тетрагидрофурана, и к смеси добавляют 200 мг гидрида натрия. Полученную смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Фильтрат концентрируют. Остаток суспендируют в эфире и смесь фильтруют. Таким образом получают 450 мг соединения, указанного в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,35 (с, 9H), 3,04 (с, 3H), 3,06-3,12 (м, 4H), 3,17-3,22 (м, 4H), 7,48 (дт, J=1,6, 7,6 Гц, 1H), 7,53 (дт, J=2,0, 7,6 Гц, 1H), 7,63 (дд, J=2,0, 8,0 Гц, 1H), 7,65 (дд, J=1,6, 8,0 Гц, 1H).
(g) трет-Бутил-4-[2-хлор-7-(2-хлорфенил)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (g-1) и трет-бутил-4-[2,6-дихлор-7-(2-хлорфенил)-7Н-пурин-8-ил]пиперазин-1-карбоксилат (g-2)
78 мг трет-бутил-4-[7-(2-хлорфенил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 3 мл оксихлорида фосфора и полученную смесь перемешивают при 120ºС в течение ночи. Реакционный раствор концентрируют и остаток растворяют в 1 мл тетрагидрофурана. Раствор выливают в суспензию, состоящую из 50 мг ди-трет-бутилдикарбоната, 1 мл тетрагидрофурана и 0,5 мл воды, содержащей 100 мг бикарбоната натрия. Реакционную смесь перемешивают при комнатной температуре в течение трех часов. Реакционную смесь разбавляют этилацетатом и промывают водой. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Фильтрат концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 16 мг трет-бутил-4-[2,6-дихлор-7-(2-хлорфенил)-7Н-пурин-8-ил]пиперазин-1-карбоксилата, а из фракции, элюированной смесью гексан-этилацетат (1:9), получают 10 мг трет-бутил-4-[2-хлор-7-(2-хлорфенил)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата.
(h) Трифторацетат этил-[7-(2-хлорфенил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]ацетата
10 мг трет-бутил-4-[2-хлор-7-(2-хлорфенил)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этилгликолята растворяют в 0,2 мл N-метилпирролидона и к полученному раствору добавляют 10 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор разбавляют этилацетатом и смесь промывают 1 н. соляной кислотой. Таким образом получают 24 мг трет-бутил-4-[7-(2-хлорфенил)-2-этоксикарбонилметокси-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата. 8 мг полученного соединения растворяют в трифторуксусной кислоте и полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,11 мг соединения, указанного в заголовке.
МС m/e (ESI) 447 (MH+-CF3COOH).
Пример 2
Трифторацетат [7-(2-хлорфенил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]ацетата
16 мг трет-бутил-4-[7-(2-хлорфенил)-2-этоксикарбонилметокси-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата смешивают с 0,4 мл метанола и 0,1 мл 5 н. водного раствора гидроксида натрия и полученную смесь выстаивают при комнатной температуре в течение двух часов. К реакционному раствору добавляют 1 н. соляную кислоту. Подкисленный раствор экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,45 мг соединения, указанного в заголовке.
МС m/e (ESI) 419 (MH+-CF3COOH).
Пример 3
[7-(2-Хлорфенил)-2-циклобутилокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он
(а) [7-Бензил-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат
9,54 г 7-бензилксантина растворяют в 250 мл N,N-диметилформамида и к полученному раствору добавляют 17 г карбоната калия и 14,2 мл хлорметилпивалата. Смесь перемешивают при 50ºС в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и 1 н. соляной кислотой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Растворитель выпаривают при пониженном давлении и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 12,8 г соединения, указанного в заголовке.
(b) [3-(2,2-Диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат
Указанное в заголовке соединение получают, обрабатывая [7-бензил-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат по способу, используемому в примере (1с).
(с) [7-(2-Хлорфенил)-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат
Указанное в заголовке соединение получают, обрабатывая [3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат по способу, используемому в примере (1d).
1Н-ЯМР (CDCl3)
δ 1,16 (с, 9H), 1,22 (с, 9H), 5,99 (с, 2H), 6,19 (с, 2Н), 7,42-7,52 (м, 3H), 7,58-7,61 (м, 1Н), 7,73 (с, 1Н).
(d) трет-Бутил-4-[7-(2-хлорфенил)-1,3-бис-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат
Указанное в заголовке соединение получают, обрабатывая [7-(2-хлорфенил)-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил 2,2-диметилпропионат по способу, используемому в примере (1е).
1H-ЯРМ(CDCl3)
δ 1,16 (с, 9H), 1,23 (с, 9H), 1,44 (с, 9H), 3,20-3,35 (м, 4H), 3,32-3,37 (м, 4H), 5,92 (с, 2H), 6,09 (с, 2H), 7,41-7,49 (м, 2H), 7,52-7,57 (м, 2Н).
(е) трет-Бутил-4-[7-(2-хлорфенил)-1-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат
2,227 г трет-бутил-4-[7-(2-хлорфенил)-1,3-бис(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в смеси, состоящей из 10 мл тетрагидрофурана и 20 мл метанола, затем к раствору добавляют 0,518 мл 1,8-диазабицикло[5,4,0]ундец-7-ена. Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют 1 н. соляную кислоту и осажденное твердое вещество собирают фильтрацией. Твердый материал сушат с получением 1,025 г указанного в заголовке вещества.
1Н-ЯМР (CDCl3)
δ 1,16 (с, 9H), 1,44 (с, 9H), 3,22-3,24 (м, 4H), 3,33-3,35 (м, 4H), 5,90 (с, 2H), 7,43-7,47 (м, 2H), 7,51-7,57 (м, 2H), 8,71 (уш, 1H).
(f) 7-(2-Хлорфенил)-2-циклобутилокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он
8 мг трет-бутил-4-[7-(2-хлорфенил)-1-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,3 мл N,N-диметилформамида и к полученному раствору добавляют 0,05 мл бромциклобутана и 20 мг карбоната калия. Полученную смесь перемешивают при 50ºС в течение ночи. В реакционную смесь добавляют этилацетат и полученную смесь промывают водой. Органический слой концентрируют. Остаток растворяют в метаноле и к раствору добавляют 5 мг гидрида натрия. Полученную смесь перемешивают при комнатной температуре в течение трех часов. Реакционную смесь нейтрализуют 1 н. соляной кислотой и экстрагируют этилацетатом. Растворитель выпаривают и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,89 мг соединения, указанного в заголовке.
МС m/e (ESI) 375 (MH+-CF3COOH).
Пример 4
Трифторацетат метил 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]фенилацетата
(а) [7-(2-Бутинил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат
1,871 г [1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата растворяют в 30 мл N,N-диметилформамида и к полученному раствору добавляют 1,5 г карбоната калия и 0,7 мл 2-бутинилбромида. Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и 1 н. соляной кислотой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Растворитель выпаривают при пониженном давлении и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 2,12 г соединения, указанного в заголовке.
(b) 7-(2-Бутинил)-1-метил-3,7-дигидропурин-2,6-дион
Указанное в заголовке соединение получают, обрабатывая [7-(2-бутинил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат по способу, используемому в примере (1f).
1Н-ЯМР (CDCl3)
δ 1,91 (т, J=2,4 Гц, 3H), 3,39 (с, 3H), 5,10 (с, 2H), 7,93 (с, 1H), 10,62 (с, 1H).
(c) трет-Бутил 4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат
Указанное в заголовке соединение получают, обрабатывая 7-(2-бутинил)-1-метил-3,7-дигидропурин-2,6-дион по способу, используемому в примере (1е).
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,83 (т, J=2,4 Гц, 3H), 3,37 (с, 3H), 3,37-3,39 (м, 4H), 3,58-3,60 (м, 4H), 4,87 (с, 2H), 9,68 (с, 1H).
(d) Трифторацетат метил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]фенилацетата
8 мг трет-бутил-4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг метил-2-бромфенилацетата растворяют в 0,2 мл N,N-диметилформамида и к полученному раствору добавляют 10 мг карбоната калия. Смесь перемешивают при 50ºС в течение ночи. К реакционному раствору добавляют этилацетат и смесь промывают водой и 1 н. соляной кислотой. Органический слой концентрируют. Остаток растворяют в трифторуксусной кислоте и полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,07 мг соединения, указанного в заголовке.
МС m/e (ESI) 451 (MH+-CF3COOH).
Пример 5
Трифторацетат 7-(2-бутинил)-2-циклогексилокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя йодциклогексан вместо метил-2-бромфенилацетата в примере (4d) и следуя способу примера 4, получают указанное в заголовке соединение.
МС m/e (ESI) 385 (MH+-CF3COOH).
Пример 6
Трифторацетат 7-(2-бутинил)-2-(2-бутокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя 2-бромбутан вместо метил-2-бромфенилацетата в примере (4d) и следуя способу примера 4, получают указанное в заголовке соединение.
МС m/e (ESI) 359 (MH+-CF3COOH).
Пример 7
Трифторацетат 7-(2-бутинил)-2-циклопентилокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя бромциклопентан вместо метил-2-бромфенилацетата в примере (4d) и следуя способу примера 4, получают указанное в заголовке соединение.
МС m/e (ESI) 371 (MH+-CF3COOH).
Пример 8
Трифторацетат этил 7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бутаноата
Используя этиловый эфир 2-бромбутановой кислоты вместо метил-2-бромфенилацетата в примере (4d), следуя способу примера 4, получают указанное в заголовке соединение.
МС m/e (ESI) 417 (MH+-CF3COOH).
Пример 9
Этил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]пропионат
Используя этил-2-бромпропионат вместо метил-2-бромфенилацетата в примере (4d), следуя способу примера 4, получают трифторацетат указанного в заголовке соединения. Полученное соединение подвергают хроматографической очистке с использованием NH-силикагеля (силикагель, поверхность которого модифицирована аминогруппами, Fuji Silysia Chemical Ltd. NH-DM 2035). Указанное в заголовке соединение получают из фракции, элюированной смесью этилацетат-метанол (20:1).
МС m/e (ESI) 404 (MH+).
Пример 10
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]пропионовой кислоты
8 мг трет-бутил-4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этил-2-бромпропионата растворяют в 0,2 мл N,N-диметилформамида и к полученному раствору добавляют 10 мг карбоната калия. Смесь перемешивают в течение ночи при 50ºС. К реакционному раствору добавляют этилацетат и полученную смесь промывают водой и 1 н. соляной кислотой. Органический слой концентрируют с получением трет-бутил-4-[7-(2-бутинил)-2-(1-карбоксиэтокси)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата. Это соединение растворяют в 0,4 мл этанола и к полученному раствору добавляют 0,1 мл 5 н. водного раствора гидроксида натрия. Смесь перемешивают при комнатной температуре в течение 3 часов. К раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,37 мг указанного в заголовке соединения.
МС m/e (ESI) 375 (MH+-CF3COOH).
Пример 11
Трифторацетат 7-(2-бутинил)-2-метокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
(а) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (а-1) и трет-бутил-4-[7-(2-бутинил)-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилат (а-2)
5,127 г трет-бутил-4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 75 мл оксихлорида фосфора и после этого смесь перемешивают при 120ºС в течение ночи. Реакционный раствор концентрируют и остаток растворяют в 50 мл тетрагидрофурана. Полученный раствор выливают в суспензию, состоящую из 7 г ди-трет-бутилдикарбоната, 50 мл тетрагидрофурана, 100 г бикарбоната натрия и 200 мл воды, и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь разбавляют этилацетатом и промывают водой. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Фильтрат концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан:этилацетат (1:1), получают 1,348 г трет-бутил-4-[7-(2-бутинил)-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилата [1H-ЯМР (CDCl3) δ 1,50 (с, 9Н), 1,87 (т, J=2,4 Гц, 3Н), 3,64 (м, 8H), 4,81 (кв, J=2,4 Гц, 2Н)], а из фракции, элюированной смесью гексан-этилацетат (1:9), получают 1,238 г трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата [1H-ЯМР (CDCl3) δ 1,49 (с, 9Н), 1,83 (т, J=2,4 Гц, 3Н), 3,42-3,44 (м, 4H), 3,59-3,62 (м, 4H), 3,73 (с, 3H), 4,93 (кв, J=2,4 Гц, 2Н)].
(b) Трифторацетат 7-(2-бутинил)-2-метокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл метанола и к полученному раствору добавляют 10 мг гидрида натрия. Полученную смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,72 мг указанного в заголовке соединения.
МС m/e (ESI) 317 (MH+-CF3COOH).
Пример 12
7-(2-Бутинил)-2-этокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он
Следуя способу примера 11 и используя этанол вместо метанола в примере (11b), получают трифторацетат указанного в заголовке соединения. Полученное соединение подвергают хроматографической очистке с использованием NH-силикагеля. Таким образом указанное в заголовке соединение было получено из фракции, элюированной смесью этилацетат-метанол (20:1).
1H-ЯМР (CDCl3)
δ 1,42 (т, J=7,2 Гц, 3H), 1,82 (т, J=2,4 Гц, 3H), 3,02-3,06 (м, 4H), 3,40-3,42 (м, 4H), 3,46 (с, 3H), 4,51 (кв, J=7,2 Гц, 2H), 4,90 (кв, J=2,4 Гц, 2H).
МС m/e (ESI) 331 (MH+).
Пример 13
Этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетат
Пример 14
[7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]уксусная кислота
Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетата и трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]уксусной кислоты [МС m/e (ESI) 361(MH+-CF3COOH)] получают обработкой трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата этил-2-гидроксиацетатом, вместо этанола, следуя способу, описанному в примере 11. Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетата подвергают хроматографической очистке с использованием NH-силикагеля. Таким образом из фракции, элюированной смесью этилацетат-метанол (20:1), получают этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетат [1H-ЯМР (CDCl3) δ 1,29 (т, J=7,2 Гц, 3H), 1,83 (т, J=2,4 Гц, 3H), 3,02-3,06 (м, 4H), 3,38-3,41 (м, 4H), 3,55 (с, 3H), 4,22 (кв, J=7,2 Гц, 2H), 4,90 (кв, J=2,4 Гц, 2H), 5,03 (с, 2H). МС m/e (ESI) 389(MH+)].
Пример 15
Трифторацетат 7-(2-бутинил)-2-(2-метоксиэтокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Следуя способу, описанному в примере 13, используя 2-метоксиэтанол вместо этил-2-гидроксиацетата, получают указанное в заголовке соединение.
МС m/e (ESI) 361 (MH+-CF3COOH).
Пример 16
Этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]циклопропанкарбоксилат
Используя этил-1-гидроксициклопропанкарбоксилат вместо этил-2-гидроксиацетата в примере 13, следуя способу, описанному в этом примере, получают трифторацетат указанного в заголовке соединения. Полученное соединение подвергают хроматографической очистке с использованием NH-силикагеля. Указанное в заголовке соединение получают из фракции, элюированной смесью этилацетат-метанол (20:1).
1Н-ЯМР (CDCl3)
δ 1,19 (т, J=7,2 Гц, 3H), 1,39-1,42 (м, 2H), 1,67-1,71 (м, 2H), 1,83 (т, J=2,4 Гц, 3H), 3,02-3,05 (м, 4H), 3,37-3,40 (м, 4H), 3,49 (с, 3H), 4,14 (кв, J=7,2 Гц, 2H), 4,90 (кв, J=2,4 Гц, 2H).
МС m/e (ESI) 415 (MH+).
Пример 17
Трифторацетат 1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]циклопропанкарбоновой кислоты
20 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 20 мг этил-1-гидроксициклопропанкарбоксилата растворяют в 20 мл N-метилпирролидона и к полученному раствору добавляют 10 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют с получением 63 мг трет-бутил-4-[7-(2-бутинил)-2-(1-этоксикарбонилциклопропилокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. Полученное соединение растворяют в растворе, состоящем из 0,4 мл этанола и 0,1 мл 5 н. водного раствора гидроксида натрия, и полученную смесь перемешивают при 50ºС в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют с получением 22 мг трет-бутил-4-[7-(2-бутинил)-2-(1-карбоксициклопропилокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. 11 мг полученного соединения растворяют в трифторуксусной кислоте и полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,64 мг указанного в заголовке соединения.
МС m/e (ESI) 387 (MH+-CF3COOH).
Пример 18
Трифторацетат 1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]циклопропанкарбоксамида
11 мг трет-бутил-4-[7-(2-бутинил)-2-(1-карбоксициклопропилокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1 мл тетрагидрофурана и добавляют 0,05 мл триэтиламина и 0,05 мл этилхлоркарбоната. Полученную смесь перемешивают при комнатной температуре в течение 15 минут. К раствору добавляют 0,1 мл 20% водного раствора аммиака и полученную смесь перемешивают при комнатной температуре в течение 15 минут. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученную смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,18 мг указанного в заголовке соединения.
МС m/e (ESI) 386 (MH+-CF3COOH).
Пример 19
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-оксотетрагидрофуран-3-илокси)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя 3-гидроксидигидрофуран-2-он вместо этил-2-гидроксиацетата и следуя способу, описанному в примере 13, получают указанное в заголовке соединение.
МС m/e (ESI) 387 (MH+-CF3COOH).
Пример 20
Трифторацетат 7-(2-бутинил)-1-метил-2-фенокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя фенол вместо этил-2-гидроксиацетата в примере 13 и следуя способу, описанному в этом примере, получают указанное в заголовке соединение.
МС m/e (ESI) 379 (MH+-CF3COOH).
Пример 21
Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетата
Используя этил-2-(трет-бутоксикарбонил)ацетат вместо этил-2-гидроксиацетата в примере 13 и следуя способу, описанному в этом способе, получают указанное в заголовке соединение.
МС m/e (ESI) 373 (MH+-CF3COOH).
Пример 22
Трифторацетат 7-(2-бутинил)-1,2-диметил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 2 мг тетракис(трифенилфосфин)палладия растворяют в 0,2 мл диоксана и к полученному раствору добавляют 0,2 мл хлорида метилцинка (1,5 М раствор в тетрагидрофуране). Полученную смесь перемешивают при 50ºС в течение 0,5 часа. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Полученную смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,56 мг указанного в заголовке соединения.
МС m/e (ESI) 301 (MH+-CF3COOH).
Пример 23
Трифторацетат 7-(2-бутинил)-1-метил-2-бутил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 2 мг тетракис(трифенилфосфин)палладия растворяют в 0,2 мл диоксана и к полученному раствору добавляют 0,3 мл раствора, полученного из 0,5 мл хлорида бутилмагния (2,0 М раствор в диэтиловом эфире) и 2 мл хлорида цинка (0,5 М раствор в тетрагидрофуране). Полученную смесь перемешивают при 50ºС в течения пяти часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,38 мг указанного в заголовке соединения.
МС m/e (ESI) 343 (MH+-CF3COOH).
Пример 24
Трифторацетат 7-(2-бутинил)-1-метил-2-бензил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Указанное в заголовке соединение получают с использованием смешанного раствора, состоящего из 0,5 мл хлорида бензилмагния (2,0 М раствор в диэтиловом эфире) и 2 мл хлорида цинка (0,5 М раствор в тетрагидрофуране), следуя способу, описанному в примере 23.
МС m/e (ESI) 377 (MH+-CF3COOH).
Пример 25
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Указанное в заголовке соединение получают с использованием смешанного раствора, полученного из 0,5 мл хлорида фенетилмагния (2,0 М раствор в диэтиловом эфире) и 2 мл хлорида цинка (0,5 М раствор в тетрагидрофуране), следуя способу, описанному в примере 23.
МС m/e (ESI) 391(MH+-CF3COOH).
Пример 26
Трифторацетат 7-(2-бутинил)-1-метил-2-фенил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 2 мг тетракис(трифенилфосфин)палладия и 20 мг фенилтрибутилолова растворяют в 0,2 мл диоксана и полученную смесь перемешивают в при 80ºС течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,62 мг указанного в заголовке соединения.
МС m/e (ESI) 363 (MH+-CF3COOH).
Пример 27
Трифторацетат 7-(2-бутинил)-1-метил-2-амино-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 20% водного раствора аммиака и полученную смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,82 мг указанного в заголовке соединения.
МС m/e (ESI) 302 (MH+-CF3COOH).
Пример 28
Трифторацетат 7-(2-бутинил)-1-метил-2-метиламино-(8-пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 40% водного раствора метиламина и полученную смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 6,95 мг указанного в заголовке соединения.
МС m/e (ESI) 316 (MH+-CF3COOH).
Пример 29
Трифторацетат 7-(2-бутинил)-1-метил-2-диметиламино-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 40% водного раствора диметиламина и полученную смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 6,95 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,82 (т, J=2,4 Гц, 3H), 2,83 (с, 6H), 3,02-3,05 (м, 4H), 3,39-3,42 (м, 4H), 3,56 (с, 3H), 4,90 (д, J=2,4 Гц, 2H).
МС m/e (ESI) 330 (MH+-CF3COOH).
Пример 30
Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]ацетата
10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг гидрохлорида этилового эфира глицина и 50 мкл триэтиламина. Смесь перемешивают при 80ºС в течение 12 часов. Затем реакционный раствор концентрируют, продувая его газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и раствор концентрируют продувкой газообразного азота. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 7,60 мг указанного в заголовке соединения.
МС m/e (ESI) 388 (MH+-CF3COOH).
Пример 31
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]уксусной кислоты
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг гидрохлорида трет-бутилового эфира глицина и 50 мкл триэтиламина. После перемешивания полученной смеси при 80ºС в течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,36 мг указанного в заголовке соединения.
МС m/e (ESI) 360 (MH+-CF3COOH).
Пример 32
Трифторацетат этил-[N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]уксусной кислоты
Используя гидрохлорид этилового эфира N-метилглицина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 2,06 мг указанного в заголовке соединения.
МС m/e (ESI) 402 (MH+-CF3COOH).
Пример 33
Трифторацетат метил-(S)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоксилата
Используя гидрохлорид метилового эфира L-пролина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 1,35 мг указанного в заголовке соединения.
МС m/e (ESI) 414(MH+-CF3COOH).
Пример 34
Трифторацетат [N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]уксусной кислоты
Используя гидрохлорид трет-бутилового эфира N-метилглицина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 3,16 мг указанного в заголовке соединения.
МС m/e (ESI) 374(MH+-CF3COOH).
Пример 35
Трифторацетат метил-(R)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоксилата
Используя гидрохлорид метилового эфира D-пролина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 0,74 мг указанного в заголовке соединения.
МС m/e (ESI) 414 (MH+-CF3COOH).
Пример 36
Трифторацетат метил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионата
Используя гидрохлорид метилового эфира DL-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 1,20 мг указанного в заголовке соединения.
МС m/e (ESI) 388(MH+-CF3COOH).
Пример 37
Трифторацетат метил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]-2-метилпропионата
Используя гидрохлорид метил-2-аминоизобутилата вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 1,18 мг указанного в заголовке соединения.
МС m/e (ESI) 402 (MH+-CF3COOH).
Пример 38
Трифторацетат этил-(S)-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионата
Используя гидрохлорид этилового эфира L-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 2,38 мг указанного в заголовке соединения.
МС m/e (ESI) 402 (MH+-CF3COOH).
Пример 39
Трифторацетат (S)-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионовой кислоты
Используя гидрохлорид трет-бутилового эфира L-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 0,76 мг указанного в заголовке соединения.
МС m/e (ESI) 374 (MH+-CF3COOH).
Пример 40
Трифторацетат этил-3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионата
Используя гидрохлорид этилового эфира β-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 0,85 мг указанного в заголовке соединения.
МС m/e (ESI) 402 (MH+-CF3COOH).
Пример 41
Трифторацетат 7-(2-бутинил)-2-(2-этоксиэтиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл 2-этоксиэтиламина. После перемешивания полученной смеси в при 80ºС течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с образованием 6,95 мг указанного в заголовке соединения.
МС m/e (ESI) 374 (MH+-CF3COOH).
Пример 42
Трифторацетат 7-(2-бутинил)-1-метил-2-(морфолин-4-ил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя морфолин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 7,31 мг указанного в заголовке соединения.
МС m/e (ESI) 372 (MH+-CF3COOH).
Пример 43
Трифторацетат 2-бензиламино-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя бензиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 8,40 мг указанного в заголовке соединения.
МС m/e (ESI) 392 (MH+-CF3COOH).
Пример 44
Трифторацетат этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-4-карбоксилата
Используя этилизонипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 7,43 мг указанного в заголовке соединения.
МС m/e (ESI) 442 (MH+-CF3COOH).
Пример 45
Трифторацетат 2-(N-бензилметиламино)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя этил-N-метилбензиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,38 мг указанного в заголовке соединения.
Масс-спектр m/e (ESI) 406 (MH+-CF3COOH).
Пример 46
Трифторацетат 7-(2-бутинил)-2-(4-хлорбензиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя 4-хлорбензиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,84 мг указанного в заголовке соединения.
МС m/e (ESI) 426 (MH+-CF3COOH).
Пример 47
Трифторацетат 7-(2-бутинил)-2-(4-метоксибензиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя 4-метоксибензиламин, следуя способу, описанному в примере 41, получают 3,77 мг указанного в заголовке соединения.
МС m/e (ESI) 422 (MH+-CF3COOH).
Пример 48
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-фенилэтиламино)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя фенетиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,70 мг указанного в заголовке соединения.
МС m/e (ESI) 406 (MH+-CF3COOH).
Пример 49
Трифторацетат 7-(2-бутинил)-1-метил-2-[N-(2-фенилэтил)метиламино]-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя N-метилфенетиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,17 мг указанного в заголовке соединения.
МС m/e (ESI) 420 (MH+-CF3COOH).
Пример 50
Трифторацетат этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоксилата
Используя этилнипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,93 мг указанного в заголовке соединения.
МС m/e (ESI) 442(MH+-CF3COOH).
Пример 51
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-илметиламино)-1,7-дигидропурин-6-она
Используя 2-аминометилпиридин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 1,62 мг указанного в заголовке соединения.
МС m/e (ESI) 393(MH+-CF3COOH).
Пример 52
Трифторацетат этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-2-карбоксилата
Используя этилнипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 0,97 мг указанного в заголовке соединения.
МС m/e (ESI) 442(MH+-CF3COOH).
Пример 53
Трифторацетат (S)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоновой кислоты
Используя трет-бутиловый эфир L-пролина вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 4,07 мг указанного в заголовке соединения.
МС m/e (ESI) 400(MH+-CF3COOH).
Пример 54
Трифторацетат 7-(2-бутинил)-2-диэтиламино-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя диэтиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,24 мг указанного в заголовке соединения.
МС m/e (ESI) 358 (MH+-CF3COOH).
Пример 55
Трифторацетат 7-(2-бутинил)-2-(N-этилметиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя N-этилметиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 3,27 мг указанного в заголовке соединения.
МС m/e (ESI) 344 (MH+-CF3COOH).
Пример 56
Трифторацетат этил-(R)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоксилата
Используя этил-(R)-нипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 0,87 мг указанного в заголовке соединения.
МС m/e (ESI) 442 (MH+-CF3COOH).
Пример 57
Трифторацетат этил-(S)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоксилата
Используя этил-(L)-нипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,94 мг указанного в заголовке соединения.
МС m/e (ESI) 442 (MH+-CF3COOH).
Пример 58
Трифторацетат [N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]ацетонитрила
Используя метиламиноацетонитрил вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 1,00 мг указанного в заголовке соединения.
МС m/e (ESI) 355 (MH+-CF3COOH).
Пример 59
Трифторацетат 7-(2-бутинил)-2-изопропиламино-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 50 мкл изопропиламина. Смесь перемешивают при 60ºС в течение 5 часов и затем реакционный раствор концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,28 мг указанного в заголовке соединения.
МС m/e (ESI) 344 (MH+-CF3COOH).
Пример 60
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-иламино)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 50 мкл 2-аминопиридина. Смесь перемешивают при 110ºС в течение 12 часов и затем концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,10 мг указанного в заголовке соединения.
МС m/e (ESI) 379 (MH+-CF3COOH).
Пример 61
Трифторацетат 7-(2-бутинил)-1-метил-2-фениламино-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 100 мкл анилина. Смесь перемешивают при 110ºС в течение 12 часов и затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,23 мг указанного в заголовке соединения.
МС m/e (ESI) 378 (MH+-CF3COOH).
Пример 62
Трифторацетат 1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоновой кислоты
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл этилнипекотата. Смесь перемешивают при 80ºС в течение 12 часов и затем концентрируют продувкой газообразным азотом. Остаток растворяют в растворе, состоящем из 0,20 мл этанола и 0,20 мл 5 н. водного раствора гидроксида натрия. Смесь перемешивают при комнатной температуре в течение пяти часов и концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,92 мг указанного в заголовке соединения.
МС m/e (ESI) 414 (MH+-CF3COOH).
Пример 63
Трифторацетат (R)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоновой кислоты
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг гидрохлорида метилового эфира D-пролина и 50 мкл триэтиламина. После перемешивания полученной смеси при 80ºС в течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Остаток растворяют в растворе, состоящем из 0,20 мл этанола и 0,20 мл 5 н. водного раствора гидроксида натрия. Смесь перемешивают при комнатной температуре в течение пяти часов и затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,42 мг указанного в заголовке соединения.
МС m/e (ESI) 400 (MH+-CF3COOH).
Пример 64
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионовой кислоты
Используя гидрохлорид метилового эфира DL-аланина вместо гидрохлорида метилового эфира D-пролина в примере 63, следуя способу, описанному в этом примере, получают 1,12 мг указанного в заголовке соединения.
МС m/e (ESI) 374 (MH+-CF3COOH).
Пример 65
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-илметилокси)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 25 мг пиридин-2-илметанола и 5 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение 5 часов, затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с образованием 0,58 мг указанного в заголовке соединения.
МС m/e (ESI) 394 (MH+-CF3COOH).
Пример 66
Трифторацетат 7-(2-бутинил)-2-изопропокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 0,10 мл изопропанола и 5 мг гидрида натрия. После перемешивания смеси при комнатной температуре в течение пяти часов к реакционному раствору добавляют насыщенный водный раствор хлорида аммония. Полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,68 мг указанного в заголовке соединения.
МС m/e (ESI) 345 (MH+-CF3COOH).
Пример 67
Трифторацетат 7-(2-бутинил)-2-(2-бутинилокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя 2-бутин-1-ол вместо изопропанола в примере 66, следуя способу, описанному в этом примере, получают 3,40 мг указанного в заголовке соединения.
МС m/e (ESI) 355 (MH+-CF3COOH).
Пример 68
Трифторацетат метил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидина и к полученному раствору добавляют 20 мкл метилмеркаптоацетата и 6 мг карбоната калия. Раствор перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,83 мг указанного в заголовке соединения.
МС m/e (ESI) 391 (MH+-CF3COOH).
Пример 69
Трифторацетат этил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионата
Используя этил-2-меркаптопропионат вместо метилмеркаптоацетата, следуя способу, описанному в примере 68, получают 4,30 мг указанного в заголовке соединения.
МС m/e (ESI) 419 (MH+-CF3COOH).
Пример 70
Трифторацетат этил-3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионата
Используя этил-3-меркаптопропионат вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 3,75 мг указанного в заголовке соединения.
МС m/e (ESI) 419 (MH+-CF3COOH).
Пример 71
Трифторацетат 7-(2-бутинил)-2-этилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя этантиол вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,70 мг указанного в заголовке соединения.
МС m/e (ESI) 347 (MH+-CF3COOH).
Пример 72
Трифторацетат 7-(2-бутинил)-2-(2-гидроксиэтилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя 2-меркаптоэтанол вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 3,57 мг указанного в заголовке соединения.
МС m/e (ESI) 363 (MH+-CF3COOH).
Пример 73
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-илсульфанил)-1,7-дигидропурин-6-она
Используя 2-меркаптопиридин вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,66 мг указанного в заголовке соединения.
МС m/e (ESI) 396 (MH+-CF3COOH).
Пример 74
Трифторацетат 7-(2-бутинил)-1-метил-2-метилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя метилмеркаптан (30% метанольный раствор) вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,08 мг указанного в заголовке соединения.
МС m/e (ESI) 333 (MH+-CF3COOH).
Пример 75
Трифторацетат 7-(2-бутинил)-2-циклогексилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя циклогексантиол вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,13 мг указанного в заголовке соединения.
МС m/e (ESI) 401 (MH+-CF3COOH).
Пример 76
Трифторацетат 7-(2-бутинил)-2-изопропилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг натриевой соли пропан-2-тиола. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,56 мг указанного в заголовке соединения.
МС m/e (ESI) 361 (MH+-CF3COOH).
Пример 77
Трифторацетат 2-трет-бутилсульфанил-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя натриевую соль 2-метил-2-пропантиола вместо натриевой соли пропан-2-тиола в примере 76, следуя способу, описанному в этом примере, получают 2,58 мг указанного в заголовке соединения.
МС m/e (ESI) 375 (MH+-CF3COOH).
Пример 78
Трифторацетат 7-(2-бутинил)-2-меркапто-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Пример 79
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]уксусной кислоты
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл N-метилпирролидона и к полученному раствору добавляют 20 мкл метилмеркаптоацетата и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов и к реакционному раствору добавляют насыщенный водный раствор хлорида аммония. Полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Полученный остаток растворяют в растворе, состоящем из 0,20 мл этанола и 0,20 мл 5 н. водного раствора гидроксида натрия. Полученную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученный раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,96 мг трифторацетата 7-(2-бутинил)-2-меркапто-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она [МС m/e (ESI) 319 (MH+-CF3COOH)] и 0,61 мг трифторацетата [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]уксусной кислоты.
МС m/e (ESI) 377 (MH+-CF3COOH).
Пример 80
Трифторацетат 7-(2-бутинил)-2-этансульфинил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл этантиола и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Остаток растворяют в 0,30 мл дихлорметана и полученную смесь охлаждают до -78ºС. В раствор добавляют 5 мг м-хлорпербензойной кислоты и смесь перемешивают при -78ºС в течение 15 минут. К реакционному раствору добавляют насыщенный водный раствор сульфита натрия и смесь экстрагируют дихлорметаном. Органический слой концентрируют. Остаток растворяют в 0,40 мл трифторуксусной кислоты и раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,21 мг указанного в заголовке соединения.
МС m/e (ESI) 363 (MH+-CF3COOH).
Пример 81
Трифторацетат 7-(2-бутинил)-2-этансульфонил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл этантиола и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Остаток растворяют в 0,3 мл дихлорметана и полученную смесь охлаждают до -78ºС. К раствору добавляют 10 мг м-хлорпербензойной кислоты. Смесь перемешивают при -78ºС в течение 15 минут и затем при 0ºС в течение 15 минут. К реакционному раствору добавляют насыщенный водный раствор сульфита натрия и полученную смесь экстрагируют дихлорметаном. Органический слой концентрируют. Остаток растворяют в трифторуксусной кислоте и раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,19 мг указанного в заголовке соединения.
МС m/e (ESI) 379 (MH+-CF3COOH).
Пример 82
Трифторацетат 7-(2-бутинил)-2-циано-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл N-метилпирролидона и к полученному раствору добавляют 10 мг цианида натрия. Смесь перемешивают при 50ºС в течение 1 часа. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют с получением 14 мг трет-бутил-4-[7-(2-бутинил)-2-циано-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата. 5 мг этого соединения растворяют в трифторуксусной кислоте и полученный раствор концентрируют. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,12 мг указанного в заголовке соединения.
МС m/e (ESI) 312 (MH+-CF3COOH).
Пример 83
7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбоксамид
(a) трет-Бутил-4-[7-(2-бутинил)-2-карбамоил-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
176 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 2 мл N-метилпирролидона и к полученному раствору добавляют 100 мг цианида натрия. Смесь перемешивают при 50ºС в течение 0,5 часа. К реакционной смеси добавляют воду и раствор экстрагируют этилацетатом. Органический слой концентрируют и получают 170 мг трет-бутил-4-[7-(2-бутинил)-2-циано-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. 98 мг полученного соединения растворяют в смеси из 3 мл тетрагидрофурана и 2 мл метанола и к полученному раствору добавляют 0,5 мл 20% водного раствора аммиака и 0,5 мл 30% водного раствора пероксида водорода. Полученную смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют этилацетат и полученную смесь промывают водой. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Растворитель выпаривают при пониженном давлении. Остаток подвергают хроматографической очистке на колонке с силикагелем. Таким образом из фракции, элюированной смесью этилацетат-метанол, получают 77 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=1,2 Гц, 3H), 3,42-3,49 (м, 4H), 3,58-3,65 (м, 4H), 3,95 (с, 3H), 5,01 (д, J=2,4 Гц, 2H), 5,54 (уш. 1H), 7,61 (уш. 1H).
(b) 7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбоксамид
77 мг трет-бутил-4-[7-(2-бутинил)-2-карбамоил-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1 мл трифторуксусной кислоты и полученный раствор концентрируют. Остаток подвергают хроматографической очистке с использованием NH-силикагеля. Таким образом из фракции, элюированной смесью этилацетат-метанол (5:1), получают 49 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,83 (т, J=2,4 Гц, 3H), 3,05-3,07 (м, 4H), 3,45-3,48 (м, 4H), 3,94 (с, 3H), 4,98 (с, 2H), 5,57 (уш, 1H), 7,65 (уш, 1H).
Пример 84
Трифторацетат 7-(2-бутинил)-2-карбокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Пример 85
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
12,5 мг трет-бутил-4-[7-(2-бутинил)-2-карбамоил-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,3 мл тетрагидрофурана и к полученному раствору добавляют 0,2 мл метанола и 0,05 мл 2 н. раствора гидроксида натрия. Смесь перемешивают при 50ºС в течение 2 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с образованием 0,44 мг трифторацетата 7-(2-бутинил)-2-карбокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она [МС m/e (ESI) 331 (MH+-CF3COOH)] и 6,4 мг трифторацетата 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она.
1H-ЯМР (CDCl3)
δ 1,81 (т, J=2,4 Гц, 3H), 3,54 (уш., 4H), 3,63 (с, 3H), 3,83 (уш., 4H), 5,02 (с, 2H), 8,20 (с, 1H).
МС m/e (ESI) 287 (MH+-CF3COOH).
Пример 86
Гидрохлорид 7-(2-бутинил)-2-метокси-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
(a) [7-Бензил-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат
Смесь, состоящую из 500 мг [7-бензил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата, 0,38 мл 2-бромэтилбензола, 390 мг безводного карбоната калия и 5 мл N,N-диметилформамида, перемешивают на масляной бане при 50ºС в течение двух часов. Реакционную смесь экстрагируют этилацетатом и водой и органический слой промывают водой и затем насыщенным рассолом. Органический слой сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси этилацетат-гексан с образованием 540 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,19 (с, 9H), 2,92-2,98 (м, 2H), 4,19-4,25 (м, 2H), 5,48 (с, 2H), 6,11 (с, 2H), 7,17-7,40 (м, 10H), 7,54 (с, 1H).
(b) [7-(2-Бутинил)-8-хлор-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат
Смесь, состоящую из 540 мг [7-бензил-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата, 50 мг 10% палладия на угле и 8 мл уксусной кислоты, перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Реакционную смесь фильтруют и затем концентрируют при пониженном давлении с получением 410 мг остатка.
Остаток смешивают с 0,15 мл 1-бром-2-бутина, 300 мг безводного карбоната калия и 5 мл N,N-диметилформамида. Смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор экстрагируют этилацетатом и водой. Органический слой промывают водой и затем насыщенным рассолом. Органическую фазу сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 470 мг остатка.
Остаток смешивают с 180 мг N-хлорсукцинимида и 5 мл N,N-диметилформамида. Смесь перемешивают при комнатной температуре в течение 2 часов. После добавления 0,5 мл 1 М водного раствора тиосульфата натрия реакционный раствор экстрагируют этилацетатом и водой. Органический слой промывают водой и затем насыщенным рассолом. Органическую фазу сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией из смеси этилацетат-гексан получают 380 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,21 (с, 9H), 1,83 (т, J=2 Гц, 3H), 2,92-2,98 (м, 2H), 4,19-4,25 (м, 2H), 5,11 (кв, J=2 Гц, 2H), 6,05 (с, 2H), 7,18-7,32 (м, 5H).
(c) трет-Бутил-4-[7-(2-бутинил)-2,6-диоксо-1-(2-фенилэтил)-2,3,6,7-тетрагидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 380 мг [7-(2-бутинил)-8-хлор-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата, 460 мг трет-бутилпиперазин-1-карбоксилата и 0,5 мл N-метилпирролидона, перемешивают на масляной бане при 150ºС в течение 15 минут. Реакционную смесь экстрагируют этилацетатом и водой и органический слой последовательно промывают водой и насыщенным рассолом. Органический слой сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток растворяют в смеси этилацетат-гексан (1:1). Раствор фильтруют через небольшое количество силикагеля и затем промывают смесью этилацетат/гексан (1:1). Фильтрат объединяют с промывным раствором. Смешанный раствор концентрируют при пониженном давлении с получением 570 мг остатка.
Остаток смешивают с 5 мл тетрагидрофурана и 2,5 мл метанола. Добавляют 33 мг гидрида натрия и полученную смесь перемешивают при комнатной температуре в течение 30 минут. К реакционному раствору добавляют 1 мл 1 н. соляной кислоты и полученную смесь экстрагируют этилацетатом и водой, затем последовательно промывают водой и насыщенным рассолом. Органическую фазу сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 350 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,85 (т, J=2 Гц, 3H), 2,91-2,98 (м, 2H), 3,37 (уш.с, 4H), 3,56-3,62 (м, 4H), 4,15-4,22 (м, 2H), 4,87 (кв, J=2 Гц, 2H), 7,18-7,35 (м, 5H).
(d) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 290 мг трет-бутил-4-[7-(2-бутинил)-2,6-диоксо-1-(2-фенилэтил)-2,3,6,7-тетрагидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 4 мл оксихлорида фосфора, нагревают и перемешивают на масляной бане при 120ºС в течение 8 часов. Реакционный раствор концентрируют при пониженном давлении и остаток растворяют в 5 мл тетрагидрофурана. Полученный раствор добавляют по каплям к перемешиваемой и охлаждаемой льдом смеси, состоящей из 250 мг ди-трет-бутилдикарбоната, 10 мл насыщенного раствора бикарбоната натрия и 10 мл тетрагидрофурана. Смесь инкубируют при комнатной температуре в течение 4 часов и затем экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным рассолом, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя смесь из 50% этилацетата в гексане. Полученный материал подвергают дополнительной хроматографической очистке на колонке с обращенной фазой, проводя элюирование смесью 50-100% метанол-вода, и в результате получают 60 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,84 (т, J=2 Гц, 3H), 3,10-3,16 (м, 2H), 3,40-3,46 (м, 2H), 3,57-3,63 (м, 4H), 4,42-4,49 (м, 4H), 4,94 (кв, J=2 Гц, 2H), 7,21-7,34 (м, 5H).
(e) Гидрохлорид 7-(2-бутинил)-2-метокси-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
10 мг гидрида натрия (60%; масло) добавляют к смеси, состоящей из 7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 0,5 мл метанола. Смесь перемешивают при комнатной температуре в течение 20 минут. К реакционному раствору добавляют воду. Полученную смесь экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным рассолом и затем концентрируют. К остатку добавляют 0,5 мл трифторуксусной кислоты. Полученную смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют. Полученный остаток очищают на хроматографической колонке с обратимой фазой с использованием смеси 20-80% метанола-вода (содержащей 0,1% концентрированной соляной кислоты) с получением 4,3 мг указанного в заголовке соединения.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (уш.с, 3H), 2,85 (т, J=7 Гц, 2H), 3,28 (уш.с, 4H), 3,48-3,54 (м, 4H), 3,83 (с, 3H), 4,15 (т, J=7 Гц, 2H), 4,97 (уш.с, 2H), 7,16-7,24 (м, 3H), 7,29 (т, J=8 Гц, 2H), 9,08 (уш.с, 2H).
Пример 87
Гидрохлорид 7-(2-бутинил)-2-этокси-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя этанол вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,28 (т, J=7 Гц, 3H), 1,80 (с, 3H), 2,86 (т, J=7 Гц, 2H), 3,27 (уш.с, 4H), 3,46-3,53 (м, 4H), 4,15 (т, J=7 Гц, 2H), 4,25 (кв, J=7 Гц, 2H), 4,97 (с, 2H), 7,17 (д, J=7 Гц, 2H), 7,22 (т, J=7 Гц, 1H), 7,29 (т, J=7 Гц, 2H), 9,04 (уш.с, 2H).
Пример 88
Гидрохлорид метил-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
Используя метилтиогликолят вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 2,96 (т, J=8 Гц, 2H), 3,29 (уш.с, 4H), 3,50-3,56 (м, 4H), 3,68 (с, 3H), 4,16 (с, 2H), 4,23 (т, J=8 Гц, 2H), 4,99 (с, 2H), 7,24-7,38 (м, 5H), 8,96 (уш.с, 2H).
Пример 89
Гидрохлорид этил-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]ацетата
Используя гидрохлорид этилового эфира глицина вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,22 (т, J=7 Гц, 3H), 1,78 (с, 3H), 2,87 (т, J=8 Гц, 2H), 3,26 (уш.с, 4H), 3,47 (уш.с, 4H), 4,05 (д, J=6 Гц, 2H), 4,12 (кв, J=7 Гц, 2H), 4,21 (т, J=8 Гц, 2H), 4,89 (уш.с, 2H), 7,17-7,35 (м, 5H), 7,51 (т, J=6 Гц, 1H), 8,93 (уш.с, 2H).
Пример 90
Гидрохлорид 2-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]ацетамида
Используя гидрохлорид глицинамида вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (с, 3H), 2,87 (т, J=8 Гц, 2H), 3,26 (уш.с, 4H), 3,52 (уш.с, 4H), 3,84 (д, J=5 Гц, 2H), 4,19 (т, J=8 Гц, 2H), 4,91 (с, 2H), 7,02 (с, 1H), 7,16-7,40 (м, 7H), 9,08 (уш.с, 2H).
Пример 91
Гидрохлорид этил-N-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]-N-метиламиноацетата
Используя гидрохлорид этилового эфира N-метилглицина вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,17 (т, J=7 Гц, 3H), 1,80 (с, 3H), 2,76 (с, 3H), 2,96 (т, J=8 Гц, 2H), 3,28 (уш.с, 4H), 3,46-3,52 (м, 4H), 3,88 (с, 2H), 4,09 (кв, J=7 Гц, 2H), 4,27 (т, J=8 Гц, 2H), 4,98 (с, 2H), 7,15-7,30 (м, 5H), 8,95 (уш.с, 2H).
Пример 92
Гидрохлорид метил-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетата
Используя метилгликолят вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 2,93 (т, J=8 Гц, 2H), 3,28 (уш.с, 4H), 3,49 (уш.с, 4H), 3,72 (с, 3H), 4,20 (т, J=8 Гц, 2H), 4,96 (с, 2H), 5,02 (с, 2H), 7,20-7,34 (м, 5H), 8,87 (уш.с, 2H).
Пример 93
Гидрохлорид 7-(2-бутинил)-2-(2-гидроксиэтокси)-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя этиленгликоль вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 2,88 (т, J=8 Гц, 2H), 3,29 (уш.с, 4H), 3,49 (уш.с, 4H), 3,71 (т, J=6 Гц, 2H), 4,18 (т, J=8 Гц, 2H), 4,28 (т, J=6 Гц, 2H), 4,97 (с, 2H), 7,16-7,32 (м, 5H), 8,90 (уш.с, 2H).
Пример 94
Гидрохлорид 7-(2-бутинил)-2-диметиламино-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя 50% водный раствор диметиламина вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 2,60 (с, 6Н), 2,89 (т, J=8 Гц, 2Н), 3,28 (уш.с, 4Н), 3,49 (уш.с, 4Н), 4,26 (т, J=8 Гц, 2Н), 4,98 (с, 2Н), 7,06-7,27 (м, 5Н), 8,93 (уш.с, 2Н).
Пример 95
Трифторацетат 7-(2-бутинил)-2-хлор-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 1,0 г трет-бутил-4-[7-(2-бутинил)-2,6-дихлор-7H-пурин-8-ил]пиперазин-1-карбоксилата, 580 мг ацетата натрия и 10 мл диметилсульфоксида, перемешивают на масляной бане при 80ºС в течение 24 часов. Реакционный раствор экстрагируют этилацетатом и водой. Органический слой промывают водой и затем насыщенным рассолом, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток подвергают очистке путем колоночной хроматографии на силикагеле с использованием смеси 50-70% этилацетата/гексан и перекристаллизовывают из смеси этилацетат-гексан с получением 800 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,44 (уш.с, 4H), 3,56-3,63 (м, 4H), 4,94 (кв, J=2 Гц, 2H).
(b) Трифторацетат 7-(2-бутинил)-2-хлор-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в трифторуксусной кислоте и полученный раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,45 мг указанного в заголовке соединения.
МС m/e (ESI) 307 (MH+-CF3COOH).
Пример 96
Гидрохлорид 2-[7-(2-бутинил)-2-диметиламино-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 100 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 60 мг бромида 2-цианобензила, 68 мг безводного карбоната калия и 1 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение 4 часов. К реакционному раствору добавляют смесь этилацетат-гексан (1:1) и воду. Нерастворимый материал удаляют фильтрацией. Фильтрат экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным рассолом, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя смесь 30-50% этилацетат/гексан с получением 50 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,43-3,49 (м, 4H), 3,58-3,64 (м, 4H), 4,95 (кв, J=2 Гц, 2H), 5,72 (с, 2H), 7,06 (д, J=8 Гц, 1H), 7,39 (т, J=8 Гц, 1H), 7,51 (т, J=8 Гц, 1H), 7,71 (д, J=8 Гц, 1H).
(b) трет-Бутил-4-[7-(2-бутинил)-1-(2-цианобензил)-2-диметиламино-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 20 мкл 50% водного раствора дииметиламина и 0,2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор экстрагируют этилацетатом и водой. Органический слой последовательно промывают водой и насыщенным рассолом и затем концентрируют. Полученный остаток очищают методом тонкослойной хроматографии на силикагеле с использованием смеси 70% этилацетат/гексан и получают 6,5 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,81 (т, J=2 Гц, 3H), 2,73 (с, 6H), 3,38-3,45 (м, 4H), 3,56-3,64 (м, 4H), 4,91 (кв, J=2 Гц, 2H), 5,55 (с, 2H), 7,07 (д, J=8 Гц, 1H), 7,32 (т, J=8 Гц, 1H), 7,46 (т, J=8 Гц, 1H), 7,65 (д, J=8 Гц, 1H).
(c) Гидрохлорид 2-[7-(2-бутинил)-2-диметиламино-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила
6,5 мг трет-бутил-4-[7-(2-бутинил)-1-(2-цианобензил)-2-диметиламино-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,5 мл трифторуксусной кислоты и полученную смесь выстаивают при комнатной температуре в течение 20 минут. Реакционный раствор концентрируют и остаток подвергают хроматографической очистке на колонке с обратимой фазой, используя смесь из 20-80% метанола и воды (содержащую 0,1% концентрированной соляной кислоты) с получением 6,4 мг соединения, указанного в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,76 (с, 3H), 2,69 (с, 6H), 3,28 (уш.с, 4H), 3,51 (уш.с, 4H), 4,91 (с, 2H), 5,40 (с, 2H), 7,04 (д, J=8 Гц, 1H), 7,43 (т, J=8 Гц, 1H), 7,60 (т, J=8 Гц, 1H), 7,83 (д, J=8 Гц, 1H), 8,90 (уш.с, 2H).
Пример 97
Гидрохлорид метил [7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
Используя метилтиогликолят вместо диметиламина и безводный карбонат калия в качестве основания в примере 96 (b), следуя способу, описанному в примере 96, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (с, 3H), 3,29 (уш.с, 4H), 3,56 (уш.с, 4H), 3,65 (с, 3H), 4,12 (с, 2H), 4,99 (с, 2H), 5,48 (с, 2H), 7,10 (д, J=8 Гц, 1H), 7,50 (т, J=8 Гц, 1H), 7,65 (т, J=8 Гц, 1H), 7,92 (д, J=8 Гц, 1H), 8,95 (уш.с, 2H).
Пример 98
Гидрохлорид 2-[7-(2-бутинил)-2-метокси-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила
Используя метанол вместо диметиламина и безводный карбонат калия в качестве основания в примере 96 (b), следуя способу, описанному в примере 96, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (с, 3H), 3,28 (уш.с, 4H), 3,48-3,56 (м, 4H), 3,91 (с, 3H), 4,97 (с, 2H), 5,32 (с, 2H), 7,19 (д, J=8 Гц, 1H), 7,48 (т, J=8 Гц, 1H), 7,63 (т, J=8 Гц, 1H), 7,87 (д, J=8 Гц, 1H), 9,05 (уш.с, 2H).
Пример 99
Гидрохлорид метил [7-(2-бутинил)-1-цианометил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
(а) трет-Бутил 4-[7-(2-бутинил)-2-хлор-1-цианометил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Используя бромацетонитрил вместо диметиламина в примере 96 (b), следуя способу, описанному в примере 96 (а), синтезируют указанное в заголовке соединение.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,84 (т, J=2 Гц, 3H), 3,43-3,49 (м, 4H), 3,58-3,63 (м, 4H), 4,91 (кв, J=2 Гц, 2H), 5,18 (с, 2H).
(b) Гидрохлорид метил [7-(2-бутинил)-1-цианометил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
Используя соединение, полученное в описанном выше примере 99 (а), вместо соединения, полученного в примере 96(а), следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 3,29 (уш.с, 4H), 3,55 (уш.с, 4H), 3,68 (с, 3H), 4,22 (с, 2H), 4,98 (с, 2H), 5,21 (с, 2H), 8,93 (уш.с, 2H).
Пример 100
Гидрохлорид метил [1,7-бис(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
(a) трет-Бутил-4-[1,7-бис(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Используя 1-бром-2-бутин вместо бромида 2-цианобензила в примере 96 (а), следуя способу, описанному в примере 96 (а), синтезируют указанное в заголовке соединение.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,80 (т, J=2 Гц, 3H), 1,83 (т, J=2 Гц, 3H), 3,40-3,45 (м, 4H), 3,57-3,62 (м, 4H), 4,93 (кв, J=2 Гц, 2H), 4,98 (кв, J=2 Гц, 2H).
(b) Гидрохлорид метил [1,7-бис(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
Используя соединение, полученное выше в примере 100 (а), вместо соединения, полученного в примере 96(а), следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (с, 6H), 3,28 (уш.с, 4H), 3,53 (уш.с, 4H), 3,67 (с, 3H), 4,15 (с, 2H), 4,83 (с, 2H), 4,98 (с, 2H), 9,02 (уш.с, 2H).
Пример 101
Гидрохлорид 1,7-бис(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
Используя цианид натрия вместо метилтиогликолята в примере 100, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,81 (с, 3H), 1,82 (с, 3H), 3,28 (уш.с, 4H), 3,56-3,63 (м, 4H), 4,95 (кв, J=2 Гц, 2H), 5,07 (кв, J=2 Гц, 2H), 9,04 (уш.с, 2H).
Пример 102
Гидрохлорид 1,7-бис(2-бутинил)-2-метокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя метанол вместо метилтиогликолята и гидрид натрия в качестве основания в примере 100, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,75 (с, 3H), 1,80 (с, 3H), 3,28 (уш.с, 4H), 3,47-3,55 (м, 4H), 3,98 (с, 3H), 4,66 (с, 2H), 4,96 (с, 2H), 9,01 (уш.с, 2H).
Пример 103
Гидрохлорид метил [1-аллил-7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
(a) трет-Бутил-4-[1-аллил-7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Используя аллилбромид вместо бромида 2-цианобензила в примере 96(а), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,38-3,45 (м, 4H), 3,55-3,63 (м, 4H), 4,90 (д, J=5 Гц, 2H), 4,93 (кв, J=2 Гц, 2H), 5,19-5,29 (м, 2H), 5,93 (ддт, J=10, 17, 5 Гц, 1H).
(b) Гидрохлорид метил [1-аллил-7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
Используя соединение, описанное выше в примере 103(а), вместо соединения, полученного в примере 96(а) в примере 97, следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (с, 3H), 3,27 (уш.с, 4H), 3,48-3,56 (м, 4H), 3,66 (с, 3H), 4,12 (с, 2H), 4,70 (д, J=5 Гц, 2H), 4,98 (уш.с, 2H), 5,07 (д, J=17 Гц, 1H), 5,21 (д, J=10 Гц, 1H), 5,89 (ддт, J=10, 17, 5 Гц, 1H), 9,07 (уш.с, 2H).
Пример 104
Гидрохлорид 1-аллил-7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
Указанное в заголовке соединение синтезируют, следуя способу примера 103, с использованием цианида натрия вместо аллилбромида.
1Н-ЯМР (ДМСО-d6)
δ 1,81 (т, J=2 Гц, 3H), 3,29 (уш.с, 4H), 3,57-3,64 (м, 4H), 4,81 (д, J=5 Гц, 2H), 5,04-5,10 (м, 3H), 5,26 (д, J=10 Гц, 1H), 6,00 (ддт, J=10, 17, 5 Гц, 1H), 9,12 (уш.с, 2H).
Пример 105
Гидрохлорид 1-аллил-7-(2-бутинил)-2-метокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя метанол вместо метилтиогликолята и гидрид натрия в качестве основания в примере 103, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (т, J=2 Гц, 3H), 3,27 (уш.с, 4H), 3,48-3,56 (м, 4H), 3,93 (с, 3H), 4,55 (д, J=5 Гц, 2H), 4,94-5,02 (м, 3H), 5,12 (д, J=10 Гц, 1H), 5,87 (ддт, J=10, 17, 5 Гц, 1H), 9,04 (уш.с, 2H).
Пример 106
Гидрохлорид метил [7-(2-бутинил)-1-(2-метоксиэтил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
(a) трет-Бутил-4-[7-(2-бутинил)-1-(2-метоксиэтил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Используя 2-бромэтилметиловый эфир вместо бромида 2-цианобензила в примере 96(а), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,36 (с, 3H), 3,39-3,45 (м, 4H), 3,56-3,61 (м, 4H), 3,69 (т, J=6 Гц, 2H), 4,50 (т, J=6 Гц, 2H), 4,92 (кв, J=2 Гц, 2H).
(b) Гидрохлорид метил [7-(2-бутинил)-1-(2-метоксиэтил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата
Используя соединение, полученное в описанном выше примере 106(а), вместо соединения, полученного в примере 96(а), используемого в примере 97, следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 3,25-3,32 (м, 7H), 3,50-3,55 (м, 4H), 3,61 (т, J=6 Гц, 2H), 3,67 (с, 3H), 4,14 (с, 2H), 4,25 (т, J=6 Гц, 2H), 4,98 (с, 2H), 9,00 (уш.с, 2H).
Пример 107
Гидрохлорид 7-(2-бутинил)-1-(2-метоксиэтил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
Используя цианид натрия вместо метилтиогликолята в примере 106, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,81 (с, 3H), 3,25 (с, 3H), 3,29 (уш.с, 4H), 3,55-3,64 (м, 6H), 4,34 (т, J=5 Гц, 2H), 5,08 (с, 2H), 9,05 (уш.с, 2H).
Пример 108
Гидрохлорид 7-(2-бутинил)-1-(2-метоксиэтил)-2-метокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Используя метанол вместо метилтиогликолята и безводный карбонат калия в качестве основания в примере 106, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (с, 3H), 3,23 (с, 3H), 3,27 (уш.с, 4H), 3,46-3,55 (м, 6H), 3,94 (с, 3H), 4,13 (т, J=6 Гц, 2H), 4,96 (с, 2H), 9,03 (уш.с, 2H).
Пример 109
Трифторацетат 7-бензил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
(a) 7-Бензил-1,7-дигидропурин-6-он
18,23 г инозина растворяют в 90 мл диметилсульфоксида и к полученному раствору добавляют 16 мл бензилбромида. Смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор вливают в 3 л этилацетата. Полученный верхний слой удаляют и нижний масляный слой растворяют в 10% соляной кислоте (135 мл). Раствор нагревают до 70ºС и перемешивают в течение 4 часов. Раствор охлаждают до комнатной температуры и затем нейтрализуют до рН 7 с использованием 5 н. водного раствора гидроксида натрия. Осажденное твердое вещество собирают фильтрацией и сушат с получением 12,748 г указанного в заголовке соединения.
(b) трет-Бутил-4-(7-бензил-6-оксо-6,7-дигидро-1H-пурин-8-ил)пиперазин-1-карбоксилат
12,748 г 7-бензил-1,7-дигидропурин-6-она растворяют в 150 мл N,N-диметилформамида и к полученному раствору добавляют 7,9 г N-хлорсукцинимида. Реакционный раствор перемешивают в течение ночи и разбавляют этилацетатом. Раствор промывают водой и 1 н. соляной кислотой и затем сушат над безводным сульфатом магния. Раствор фильтруют и фильтрат концентрируют с получением 6,103 г 7-бензил-8-хлор-1,7-дигидропурин-6-она. Полученное вещество смешивают с 20 г трет-бутилпиперазин-1-карбоксилата и смесь нагревают при 150ºС. После перемешивания в течение одного часа реакционную смесь распределяют между этилацетатом и водой. Органический слой промывают 1 н. соляной кислотой и сушат над безводным сульфатом магния. После фильтрации полученное вещество концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью этилацетат-метанол (10:1), получают 1,539 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,39 (с, 9H), 3,07-3,10 (м, 4H), 3,35-3,39 (м, 4H), 5,44 (с, 2H), 7,16-7,18 (м, 2H), 7,22-7,32 (м, 3H), 7,91 (с, 1H), 12,18 (с, 1H).
(c) Трифторацетат 7-бензил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
15 мг трет-бутил-4-(7-бензил-6-оксо-6,7-дигидро-1H-пурин-8-ил)пиперазин-1-карбоксилата растворяют в 1 мл N,N-диметилформамида и к полученному раствору добавляют 10 мг гидрида натрия и 10 мкл метилйодида. Полученную смесь перемешивают при комнатной температуре в течение 3 дней, добавляют этилацетат и воду, затем смесь расслаивалась. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)), в результате чего получают 4,31 мг указанного в заголовке соединения.
МС m/e (ESI) 325(MH+-CF3COOH).
Пример 110
Трифторацетат 7-бензил-1-этил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя йодэтан вместо метилйодида.
МС m/e (ESI) 339(MH+-CF3COOH).
Пример 111
Трифторацетат этил [7-бензил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-ил]ацетата
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя этилбромацетат вместо метилйодида.
МС m/e (ESI) 397 (MH+-CF3COOH).
Пример 112
Трифторацетат 7-бензил-1-(2-метоксиэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя бромид 2-метоксиэтила вместо метилйодида.
МС m/e (ESI) 369 (MH+-CF3COOH).
Пример 113
Трифторацетат 7-бензил-1-(2-пропинил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя пропаргилбромид вместо метилйодида.
МС m/e (ESI) 349 (MH+-CF3COOH).
Пример 114
Трифторацетат 7-бензил-1-цианометил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя бромацетонитрил вместо метилйодида.
МС m/e (ESI) 350 (MH+-CF3COOH).
Пример 115
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) Этил-2-бром-3-(2-бутинил)-5-циано-3H-имидазол-4-карбоксилат
4,56 мл серной кислоты добавляют к 170 мл этанола, содержащего 16,80 г 2-бром-1Н-имидазол-4,5-дикарбонитрила [CAS No. 50847-09-1], и полученную смесь кипятят с обратным холодильником в течение 48 часов. Раствор охлаждают и добавляют к нему 500 мл этилацетата и 200 мл воды. Органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток растворяют в N,N-диметилформамиде и к раствору добавляют 14,1 г карбоната калия и 8,6 мл бромида 2-бутинила. Смесь перемешивают при комнатной температуре в течение 18 часов. К раствору добавляют 500 мл этилацетата и смесь трижды промывают 300 мл воды, затем промывают 300 мл насыщенного раствора хлорида натрия. Полученный раствор сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (9:1), получают 4,09 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,43 (т, J=7,2 Гц, 3H), 1,81 (с, 3H), 4,47 (кв, J=7,2 Гц, 2H), 5,16 (с, 2H).
(b) трет-Бутил-4-[1-(2-бутинил)-4-циано-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
4,09 г этилового эфира 2-бром-3-(2-бутинил)-5-циано-3H-имидазол-4-карбоновой кислоты объединяют с 7,70 г трет-бутилпиперазин-1-карбоксилата и полученную смесь нагревают при перемешивании до 150ºС в течение 50 минут. Реакционную смесь растворяют в толуоле. После этого смесь подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (2:1), получают 4,47 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,43 (т, J=7,2 Гц, 3H), 1,47 (с, 9H), 1,82 (т, J=2,3 Гц, 3H), 3,08-3,13 (м, 4H), 3,57-3,61 (м, 4H), 4,44 (кв, J=7,2 Гц, 2H), 4,89 (кв, J=2,3 Гц, 2H).
(c) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
5 мл 50% водного раствора сульфида аммония добавляют к 20 мл этанольного раствора, содержащего 0,80 г трет-бутил-4-[1-(2-бутинил)-4-циано-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, и полученную смесь нагревают при 60ºС в течение 14 часов. К полученной смеси добавляют 100 мл этилацетата и 50 мл воды, затем органический слой последовательно промывают 50 мл воды и 50 мл насыщенного раствора хлорида натрия. Затем реакционный раствор сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 0,58 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,43 (т, J=7,2 Гц, 3H), 1,48 (с, 9H), 1,82 (т, J=2,3 Гц, 3H), 3,12-3,16 (м, 4H), 3,54-3,59 (м, 4H), 4,44 (кв, J=7,2 Гц, 2H), 4,89 (кв, J=2,3 Гц, 2H), 7,41 (уш.с, 1H), 8,88 (уш.с, 1H).
(d) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
0,235 г тетрафторбората триметилоксония добавляют к 20 мл дихлорметанового раствора, содержащего 0,58 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата и смесь перемешивают при комнатной температуре в течение 18 часов. К полученному раствору добавляют 50 мл дихлорметана и смесь промывают 20 мл насыщенного раствора бикарбоната натрия. Смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 0,55 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,41 (т, J=7,2 Гц, 3H), 1,47 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 2,39 (с, 3H), 3,12-3,16 (м, 4H), 3,56-3,59 (м, 4H), 4,42 (кв, J=7,2 Гц, 2H), 4,80 (кв, J=2,3 Гц, 2H).
(e) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
5 мл 2 н. водного раствора соляной кислоты добавляют к 30 мл этанольного раствора, содержащего 0,55 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, и полученную смесь нагревают при 60ºС в течение 5 часов. После концентрации при пониженном давлении к полученному раствору добавляют 25 мл этилацетата и 1 н. раствор гидроксида натрия. Водный слой экстрагируют 25 мл этилацетата и органические слои объединяют. Полученную смесь промывают 10 мл насыщенного раствора хлорида натрия, содержащего 1 мл 1 н. раствора гидроксида натрия, и сушат над безводным сульфатом магния. Полученный раствор фильтруют и фильтрат концентрируют при пониженном давлении. Остаток растворяют в 10 мл дихлорметана и к полученному раствору добавляют 0,10 мл триэтиламина и 0,256 г ди-трет-бутилдикарбоната. Смесь перемешивают при комнатной температуре в течение 15 часов и затем к ней добавляют 25 мл этилацетата. Смесь последовательно промывают 10 мл 0,1 н. соляной кислоты, 10 мл насыщенного раствора бикарбоната натрия и 10 мл насыщенного раствора хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (4:1), получают 0,15 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,43 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 2,40 (с, 3H), 3,16-3,20 (м, 4H), 3,55-3,59 (м, 4H), 4,35 (кв, J=7,1 Гц, 2H), 4,80 (кв, J=2,3 Гц, 2H).
(f) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
0,187 г ацетата ртути (II) и 0,090 г борогидрида натрия добавляют к 8 мл этанольного раствора, содержащего 0,265 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, при 0ºC и полученную смесь перемешивают при комнатной температуре в течение 4 часов. К раствору добавляют 0,187 г ацетата ртути (II) и 0,090 г борогидрида натрия и полученную смесь перемешивают при комнатной температуре в течение 15 часов. К раствору добавляют 100 мл этилацетата и 50 мл 0,5 н. соляной кислоты и органический слой последовательно промывают 50 мл воды и 50 мл насыщенного раствора хлорида натрия. Смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. 0,172 г исходного материала содержалось во фракции, элюированной смесью гексан-этилацетат (4:1). Таким образом из фракции, элюированной смесью гексан-этилацетат (1:4), получают 0,061 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,42 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 3,17-3,21 (м, 4H), 3,41 (т, J=4,8 Гц, 1H), 3,56-3,60 (м, 4H), 4,36 (кв, J=7,1 Гц, 2H), 4,75 (д, J=4,8 Гц, 2H), 4,81 (кв, J=2,3 Гц, 2H).
(g) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
0,120 г диоксида марганца добавляют к раствору 0,061 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 2 мл дихлорметана и полученную смесь перемешивают при комнатной температуре в течение 15 часов. Реакционный раствор фильтруют через целит и фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (7:3), получают 0,055 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,42 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,82 (т, J=2,3 Гц, 3H), 3,23-3,26 (м, 4H), 3,55-3,59 (м, 4H), 4,45 (кв, J=7,1 Гц, 2H), 4,89 (кв, J=2,3 Гц, 2H), 10,36 (с, 1H).
(h) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
0,05 мл метилгидразина добавляют к раствору 0,055 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 2,5 мл этанола. Смесь перемешивают при 80ºС в течение 15 часов и затем нагревают при 130ºС в течение 14 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (1:1), получают 0,035 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,52 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,38-3,42 (м, 4H), 3,61-3,64 (м, 4H), 3,85 (с, 3H), 5,09 (кв, J=2,3 Гц, 2H), 8,13 (с, 1H).
МС m/e (ESI) 387,4 (МН+).
(i) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
0,4 мл трифторуксусной кислоты добавляют к 0,4 мл раствора 0,0351 г трет-бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в дихлорметане и полученную смесь перемешивают при комнатной температуре в течение одного часа. Раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обратимой фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,0295 г указанного в заголовке соединения.
1Н-ЯМР (CD3OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 3,83 (с, 3H), 5,15 (кв, J=2,3 Гц, 2H), 8,20 (с, 1H).
МС m/e (ESI) 287,9 (МН+-CF3COOH).
Пример 116
Трифторацетат 5-бензилоксиметил-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) Диметиламид 5-бензилоксиметил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты
2,08 г триэтиламина, 2,80 г N,N-диметилсульфамоилхлорида и 0,22 г 4-диметиламинопиридина добавляют к 50 мл дихлорметанового раствора, содержащего 3,04 г 5-бензилоксиметилимидазо[4,5-d]пиридазин-4-она [CAS No. 82137-50-6] (R. Paul Gagnier, Michael J. Halat, Brian A. Otter Journal of Heterocyclic Chemistry, 21, p. 481, 1984), и полученную смесь нагревают с обратным холодильником в течение 4 часов. К раствору добавляют 250 мл этилацетата и смесь последовательно промывают 50 мл 1 н. водного раствора соляной кислоты, 50 мл насыщенного раствора бикарбоната натрия и 50 мл насыщенного раствора хлорида натрия. Полученную смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (2:3), получают 2,86 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 2,98 (с, 6H), 4,77 (с, 2H), 5,74 (с, 2H), 7,30-7,39 (м, 5H), 8,21 (с, 1H), 8,46 (с, 1H).
(b) Диметиламид 5-бензилоксиметил-2-хлор-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты
5,3 мл н-бутилития (2,0 М циклогексановый раствор) в атмосфере азота добавляют при -78ºС в 150 мл тетрагидрофуранового раствора, содержащего 3,34 г диметиламида 5-бензилоксиметил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты и полученную смесь перемешивают при -78ºС в течение одного часа. К полученному раствору добавляют 20 мл раствора 3,26 г гексахлорэтана в тетрагидрофуране. Смеси дают нагреться до комнатной температуры. К полученному раствору добавляют 25 мл 5% водного раствора хлорида аммония, смесь экстрагируют 50 мл этилацетата. Органический слой последовательно промывают 25 мл воды и 25 мл насыщенного раствора хлорида натрия и затем сушат над безводным сульфатом магния. Органическую фазу концентрируют при пониженном давлении. Полученный остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (2:3), получают 2,31 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 3,12 (с, 6H), 4,77 (с, 2H), 5,70 (с, 2H), 7,30-7,39 (м, 5H), 8,48 (с, 1H).
(c) трет-Бутил-4-(6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат
Смесь, состоящую из 2,31 г диметиламида 5-бензилоксиметил-2-хлор-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты и 4,49 г трет-бутилпиперазин-1-карбоксилата, нагревают при 150ºС в атмосфере азота в течение 2,5 часов. Полученный остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной этилацетатом, получают 1,94 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 3,54-3,58 (м, 4H), 3,71-3,75 (м, 4H), 4,68 (с, 2H), 5,65 (с, 2H), 7,25-7,35 (м, 5H), 8,21 (с, 1H), 12,58 (уш.с, 1H).
(d) трет-Бутил-4-[6-бензилоксиметил-1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
0,74 г карбоната калия и 0,078 г 2-бутинилбромида добавляют к 20 мл раствора 0,216 г трет-бутил-4-(6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата в N,N-диметилформамиде и полученную смесь перемешивают при комнатной температуре в течение 16 часов. Затем к раствору добавляют 50 мл этилацетата. Органический слой трижды промывают 20 мл воды и затем 10 мл насыщенного водного раствора хлорида натрия. Полученный раствор сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 0,139 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,86 (т, J=2,3 Гц, 3H), 3,38-3,44 (м, 4H), 3,61-3,66 (м, 4H), 4,72 (с, 2H), 5,10 (кв, J=2,3 Гц, 2H), 5,65 (с, 2H), 7,25-7,38 (м, 5H), 8,18 (с, 1H).
(e) Трифторацетат 5-бензилоксиметил-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
0,0043 г указанного в заголовке соединения получают обработкой 0,0073 г трет-бутил-4-[6-бензилоксиметил-1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и очисткой полученного продукта по способу примера 115(i).
1Н-ЯМР (CD3OD)
δ 1,83 (т, J=2,3 Гц, 2H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 4,69 (с, 2H), 5,15 (кв, J=2,3 Гц, 2H), 5,64 (с, 2H), 7,17-7,32 (м, 5H), 8,20 (с, 1H).
Масс-спектр m/e (ESI) 393,28 (MH+-CF3COOH).
Пример 117
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
8 мл дихлорметанового раствора, содержащего 0,123 г трет-бутил-4-[6-бензилоксиметил-1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата, охлаждают до -78ºС в атмосфере азота и к смеси добавляют 1,9 мл трихлорид бора (1,0 М раствор в дихлорметане). Смесь перемешивают при -78ºС в течение пяти часов и добавляют 10 мл смеси из дихлорметана и метанола в соотношении 1:1. Полученную смесь перемешивают при -78ºС в течение двух часов и затем дают нагреться до комнатной температуры. Растворитель удаляют при пониженном давлении и к смеси добавляют 10 мл метанола. Затем раствор снова концентрируют при пониженном давлении. Остаток растворяют в 3 мл пиридина и полученную смесь нагревают с обратным холодильником в течение двух часов. 0,3 мл такого раствора концентрируют при пониженном давлении. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,005 г указанного в заголовке соединения.
1H-ЯМР (CD3OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 5,16 (кв, J=2,3 Гц, 2H), 8,21 (с, 1H).
Масс-спектр m/e (ESI) 273,16 (MH+-CF3COOH).
Пример 118
Гидрохлорид 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
(a) трет-Бутил-4-[7-(2-бутинил)-2-(2-карбамоилфенокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
200 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 2,0 мл 1-метил-2-пирролидона и добавляют 85 мг салициламида и 129 мг карбоната калия. Полученную смесь перемешивают при 100ºС в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры добавляют 5,0 мл воды. После перемешивания при комнатной температуре в течение 1 часа образовавшийся белый осадок собирают фильтрацией. Полученное в результате белое твердое вещество промывают водой и эфиром с получением 221 мг указанного в заголовке соединения (89%).
1H-ЯМР (ДМСО-d6)
δ 1,43 (с, 9H), 1,79 (т, J=2,5 Гц, 3H), 3,23-3,27 (м, 4H), 3,36 (с, 3H), 3,48-3,52 (м, 4H), 4,95 (кв, 2,5 Гц, 2H), 6,59 (тд, J=8,0, 1,0 Гц, 1H), 6,63 (дд, J=8,0, 1,0 Гц, 1H), 7,14 (ддд, J=8,0, 7,5, 2,0 Гц, 1H), 7,80 (дд, J=7,5, 2,0 Гц, 1H).
МС m/e (ESI) 522(MH+).
(b) Гидрохлорид 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
210 мг трет-бутил-4-[7-(2-бутинил)-2-(2-карбамоилфенокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата объединяют с 3,5 мл метанола и 2,1 мл смеси 4 н. соляной кислоты с этилацетатом. После перемешивания смеси при комнатной температуре в течение 4 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный осадок промывают этанолом и этилацетатом с получением 177 мг указанного в заголовке соединения (96%).
1H-ЯМР (ДМСО-d6)
δ 1,82 (т, J=2,3 Гц, 3H), 3,28-3,32 (м, 4H), 3,48 (с, 3H), 3,54-3,58 (м, 4H), 5,04 (кв, 2,3 Гц, 2H), 6,96 (уш.т, J=7,0 Гц, 1H), 6,99 (уш.д, J=8,0 Гц, 1H), 7,46 (ддд, J=8,0, 7,0, 1,5 Гц, 1H), 7,93 (уш.д, J=8,0 Гц, 1H).
МС m/e (ESI) 422 (MH+-HCl).
Пример 119
3-(2-Бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он
(a) 5-Метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
78,8 г 5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она [CAS No. 76756-58-6] (Shih-Fong Chen and Raymond P. Panzica, Journal of Organic Chemistry 46, p. 2467, 1981) суспендируют в 2,5 л дихлорметана при комнатной температуре и к смеси добавляют 78,8 г триэтиламина. Добавляют 176 г тритилхлорида и полученную смесь перемешивают в течение трех часов. К смеси добавляют 7,5 л этилацетата. После последовательной промывки 3 л воды и 3 л насыщенного раствора хлорида натрия смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (20:80 - 0:100), получают 136,5 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 3,79 (с, 3H), 6,92 (с, 1H), 7,07-7,13 (м, 6H), 7,32-7,40 (м, 9H), 7,87 (с, 1H).
(b) 2-Хлор-5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
220 мл гексаметилдисилазида лития (1,0 М раствор в тетрагидрофуране) в атмосфере азота при -75ºС добавляют к 4 л тетрагидрофуранового раствора, содержащего 68,3 г 5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она, и полученную смесь перемешивают при -75ºС в течение 1 часа. Затем к полученному раствору добавляют 200 мл тетрагидрофуранового раствора, содержащего 82,3 г гексахлорэтана. Смеси дают нагреться до -20ºС. Добавляют 5 л 5% водного раствора хлорида аммония и смесь экстрагируют 4 л этилацетата. Органический слой последовательно промывают 5 л воды и 5 л насыщенного раствора хлорида натрия. Раствор сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток суспендируют в 150 мл трет-бутилметилового эфира и затем фильтруют. Полученное твердое вещество дважды промывают 100 мл трет-бутилметилового эфира с получением 69,7 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 3,78 (с, 3H), 5,81 (с, 1H), 7,25-7,27 (м, 6H), 7,28-7,38 (м, 9H).
(c) трет-Бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазол[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат
69,7 г 2-хлор-5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она объединяют с 153,4 г трет-бутилпиперазин-1-карбоксилата и полученную смесь перемешивают и нагревают до 100ºС в атмосфере азота. После того как смесь становилась легко перемешиваемой, температуру повышают до 150ºС. Смесь выдерживают при этой температуре в течение 1 часа. Реакционному раствору дают охладиться и затем суспендируют в 250 мл трет-бутилметилового эфира. Суспендированный материал собирают фильтрацией. Твердое вещество дважды промывают 200 мл трет-бутилметилового эфира и трижды 200 мл воды. Полученный твердый материал снова дважды промывают 200 мл трет-бутилметилового эфира и сушат с получением 50,3 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 3,56-3,62 (м, 4H), 3,73-3,80 (м, 4H), 3,87 (с, 3H), 8,16 (с, 1H), 12,65 (уш.с, 1H).
(d) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
43,9 г карбоната калия и 27,8 мл 2-бутинилбромида, при 15ºС в атмосфере азота, последовательно добавляют к 5,5 л раствора 88,4 г трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата в N,N-диметилформамиде. Реакционный раствор перемешивают при комнатной температуре в течение 22 часов и затем выливают в 10 л воды. Смесь экстрагируют 5 л этилацетата. Органический слой последовательно промывают дважды 5 л воды и 5 л насыщенного раствора хлорида натрия. Водный слой дважды экстрагируют 3 л этилацетата. Органические слои объединяют и сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2 - 3:7), получают 54,3 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,52 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,38-3,42 (м, 4H), 3,61-3,64 (м, 4H), 3,85 (с, 3H), 5,09 (кв, J=2,3 Гц, 2H), 8,13 (с, 1H).
(e) 3-(2-Бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он
200 мл трифторуксусной кислоты добавляют к 200 мл дихлорметанового раствора, содержащего 54,3 г трет-бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата, и смесь перемешивают при комнатной температуре в течение 1 часа. Смесь концентрируют при пониженном давлении, и остаток растворяют в 500 мл этилацетата. Постепенно добавляют 1 л 10% водного раствора бикарбоната натрия. После этого к раствору добавляют 1 л этилацетата и 500 мл 5 н. водного раствора гидроксида натрия. Образовавшийся органический слой отделяют. Водный слой пять раз экстрагируют 1 л дихлорметана. Органические слои объединяют, промывают 500 мл 2 н. водного раствора гидроксида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток перекристаллизовывают из этилацетата с получением 30,5 г соединения, указанного в заголовке, в виде кристаллов.
1Н-ЯМР (CDCl3)
δ 1,84 (т, J=2,3 Гц, 3H), 3,05-3,09 (м, 4H), 3,38-3,44 (м, 4H), 3,85 (с, 3H), 5,06 (кв, J=2,3 Гц, 2H), 8,13 (с, 3H).
Пример 119-2
3-(2-Бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она толуол-4-сульфонат
98,7 мг 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она растворяют в этаноле и затем при перемешивании добавляют 1 мл этанольного раствора, содержащего 101 мг моногидрата п-толуолсульфокислоты. Смесь в течение двух часов при перемешивании охлаждают льдом. Образовавшийся осадок собирают фильтрацией и затем сушат при 50ºС при пониженном давлении в течение одного часа с получением 153,2 мг указанного в заголовке соединения.
1H-ЯМР (ДМСО-d6)
δ 1,79 (т, J=2 Гц, 3H), 2,27 (с, 3H), 3,25-3,35 (м, 4H), 3,50-3,54 (м, 4H), 3,70 (с, 3H), 5,13 (д, J=2 Гц, 2H), 7,10 (д, J=8 Гц, 2H), 7,47 (д, J=8 Гц, 2H), 8,25 (с, 1H), 8,79 (уш.с, 2H).
Кроме этого, 107,95 мг указанного в заголовке вещества перекристаллизовывают из ацетона с получением 84,9 мг кристаллического продукта.
Пример 120
Трифторацетат 2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) 9H-Флуорен-9-илметил-3-трет-бутоксикарбониламинопиперидин-1-карбоксилат
1,84 г диизопропилэтиламина и 4,71 г дифенилфосфорилазида добавляют к 10 мл раствора 5,01 г 9H-флуорен-9-илметил 3-карбоксипиперидин-1-карбоксилата в трет-бутаноле и полученную смесь в течение 18 часов нагревают при 60ºС в атмосфере азота. Реакционный раствор охлаждают и добавляют 150 мл этилацетата. Органический слой последовательно промывают 100 мл 5% водного раствора серной кислоты, 100 мл 5% водного раствора бикарбоната натрия, 100 мл воды и 100 мл насыщенного раствора хлорида натрия, затем сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают хроматографической очистке на колонке с силикагелем. Таким образом из фракции, элюированной смесью гексан-этилацетат (4:1), получают 1,88 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,45 (с, 9H), 1,45-1,72 (м, 3H), 1,82-1,87 (уш.с, 1H), 3,09-3,30 (уш.с, 2H), 3,58 (уш.с, 2H), 3,82-3,98 (уш.с, 1H), 4,24 (т, J=7,2 Гц, 1H), 4,27-4,48 (уш.с, 2H), 4,52-4,59 (уш.с, 1H), 7,32 (дд, J=10,3, 10,0 Гц, 2H), 7,39 (т, J=10,0 Гц, 2H), 7,59 (д, J=10,0 Гц, 2H), 7,75 (д, J=10,3 Гц, 2H).
(b) трет-Бутилпипердин-3-илкарбамат
25 мл диэтиламина добавляют к 250 мл этанольного раствора 1,88 г 3-трет-бутоксикарбониламинопиперидин-1-карбоксилата и полученную смесь перемешивают при комнатной температуре в течение 18 часов. После концентрирования раствора при пониженном давлении остаток растворяют в смеси, состоящей из 150 мл толуола и 100 мл 10% водного раствора лимонной кислоты. Водный слой подщелачивают 5 н. водным раствором гидроксида натрия и затем дважды экстрагируют 100 мл дихлорметана. Органические слои объединяют, сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 0,79 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,45 (с, 9H), 1,41-1,53 (м, 2H), 1,65-1,72 (м, 1H), 1,79-1,86 (м, 1H), 2,48-2,56 (м, 1H), 2,64-2,70 (м, 1H), 2,78-2,86 (м, 1H), 3,06 (дд, J=12,0, 4,0 Гц, 1H), 3,48-3,62 (уш.с, 1H), 4,71-4,88 (уш.с, 1H).
c) Трифторацетат 2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
0,020 г 2-хлор-5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она и 0,040 г трет-бутилпиперидин-3-илкарбамата смешивают друг с другом и полученную смесь нагревают при 150ºС в течение 1 часа в атмосфере азота. Реакционную смесь подвергают очистке путем колоночной хроматографии на силикагеле. Из фракции, элюированной этилацетатом, получают 0,016 г трет-бутил [1-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-3-ил]карбамата. 0,0080 г полученного соединения растворяют в 0,6 мл N,N-диметилформамида и затем к раствору добавляют 0,0038 г карбоната калия и 0,003 мл 2-бутинилбромида. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь распределяют между 1 мл этилацета и 1 мл воды и органический слой концентрируют. Остаток растворяют в 0,5 мл дихлорметана и после этого добавляют 0,5 мл трифторуксусной кислоты. Через час реакционный раствор концентрируют. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,0046 г указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 1,74-1,80 (уш.с, 1H), 1,82 (уш.с, 3H), 1,96-2,19 (уш.м, 3H), 3,43-3,79 (уш.м, 5H), 3,86 (с, 3H), 5,05 (уш.д, J=16,0 Гц, 1H), 5,23 (уш.д, J=16,0 Гц, 1H), 8,15 (с, 1H).
Пример 121
Трифторацетат 2-(3-аминопиперидин-1-ил)-5-метил-3-(3-метил-2-бутенил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
0,0034 г указанного в заголовке соединения получают с использованием 0,0080 г трет-бутил-[1-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-3-ил]карбамата и 0,004 мл 4-бром-2-метил-2-бутена, следуя способу, описанному в примере 120.
1Н-ЯМР (CDCl3)
δ 1,66-1,74 (уш.с, 1H), 1,76 (с, 3H), 1,80 (с, 3H), 1,96-2,20 (уш.м, 3H), 3,20-3,79 (уш.м, 5H), 3,85 (с, 3H), 4,90-5,05 (м, 2H), 5,37-5,42 (м, 1H), 8,15 (с, 1H).
Пример 122
2-[7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамид
53,0 г трет-бутил-4-[7-(2-бутинил)-2-(2-карбамоилфенокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 160 мл трифторуксусной кислоты и полученную смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют по каплям 1250 мл 2 М водного раствора гидроксида натрия и полученную смесь перемешивают при комнатной температуре в течение 1 часа 50 минут. Образовавшийся белый осадок собирают фильтрацией. Белое твердое вещество промывают водой и затем этанолом, сушат в течение ночи при 60ºС, в результате чего получают 42,8 г указанного в заголовке соединения.
1Н-ЯМР (ДМСО-d6)
δ 1,78 (т, J=2,4 Гц, 3H), 2,82-2,86 (м, 4H), 3,18-3,22 (м, 4H), 3,36 (с, 3H), 4,91 (кв, 2,4 Гц, 2H), 6,58 (тд, J=8,4, 1,2 Гц, 1H), 6,63 (дд, J=8,0, 0,8 Гц, 1H), 7,14 (ддд, J=8,0, 7,2, 2,0 Гц, 1H), 7,80 (дд, J=7,6, 2,0 Гц, 1H).
МС m/e (ESI) 422(МН+).
Пример 123
Трифторацетат 7-(2-бутинил)-2-(3-гидроксипропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 20 мкл 3-меркапто-1-пропанола и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и к остатку добавляют 0,5 мл 5 н. водного раствора соляной кислоты. Смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,15 мг указанного в заголовке соединения.
МС m/e (ESI) 377 (MH+-CF3COOH).
Пример 124
Трифторацетат 7-(2-бутинил)-2-(2-гидроксипропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
1,70 мг указанного в заголовке соединения получают по способу примера 123, используя 1-меркапто-2-пропанол вместо 3-меркапто-1-пропанола.
МС m/e (ESI) 377 (MH+-CF3COOH).
Пример 125
Трифторацетат 7-(2-бутинил)-2-(2,3-дигидроксипропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
2,63 мг указанного в заголовке соединения получают по способу примера 123, используя 3-меркапто-1,2-пропандиол вместо 3-меркапто-1-пропанола.
МС m/e (ESI) 393 (MH+-CF3COOH).
Пример 126
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионовой кислоты
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 20 мкл 3-меркаптопропионовой кислоты и 6 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония, смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,60 мг указанного в заголовке соединения.
МС m/e (ESI) 391 (MH+-CF3COOH).
Пример 127
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионовой кислоты
6,10 мг указанного в заголовке соединения получают по способу примера 126, используя 2-меркаптопропионовую кислоту вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 391 (MH+-CF3COOH).
Пример 128
Трифторацетат 2-втор-бутилсульфанил-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
4,68 мг указанного в заголовке соединения получают по способу примера 126, используя бутан-2-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 375 (MH+-CF3COOH).
Пример 129
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-пропилсульфанил-1,7-дигидропурин-6-она
4,61 мг указанного в заголовке соединения получают по способу примера 126, используя пропан-1-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 361 (MH+-CF3COOH).
Пример 130
Трифторацетат 7-(2-бутинил)-1-метил-2-циклопентилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
5,15 мг указанного в заголовке соединения получают по способу примера 126, используя циклопентантиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 387 (MH+-CF3COOH).
Пример 131
Трифторацетат 7-(2-бутинил)-2-додецилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
4,96 мг указанного в заголовке соединения получают по способу примера 126, используя додекан-1-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 487 (MH+-CF3COOH).
Пример 132
Трифторацетат 2-(2-аминоэтилсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
3,98 мг указанного в заголовке соединения получают по способу примера 126, используя 2-аминоэтантиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 362 (MH+-CF3COOH).
Пример 133
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиофен-2-илсульфанил)-1,7-дигидропурин-6-она
5,11 мг указанного в заголовке соединения получают по способу примера 126, используя тиофен-2-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 401 (MH+-CF3COOH).
Пример 134
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(1H-[1,2,4]триазол-3-илсульфанил)-1,7-дигидропурин-6-она
2,54 мг указанного в заголовке соединения получают по способу примера 126, используя 1Н-[1,2,4]триазол-3-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 386 (MH+-CF3COOH).
Пример 135
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-4-илсульфанил)-1,7-дигидропурин-6-она
0,77 мг указанного в заголовке соединения получают по способу примера 126, используя пиридин-4-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 396 (MH+-CF3COOH).
Пример 136
Трифторацетат 7-(2-бутинил)-1-метил-2-фенилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
1,44 мг указанного в заголовке соединения получают по способу примера 126, используя бензолтиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 395 (MH+-CF3COOH).
Пример 137
Трифторацетат (R)-2-амино-3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионовой кислоты
4,38 мг указанного в заголовке соединения получают по способу примера 126, используя L-цистин вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 406 (MH+-CF3COOH).
Пример 138
Трифторацетат 7-(2-бутинил)-2-(2-метилпропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
4,52 мг указанного в заголовке соединения получают по способу примера 126, используя 2-метилпропан-1-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 375 (MH+-CF3COOH).
Пример 139
Трифторацетат 7-(2-бутинил)-2-(1,2-диметилпропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
3,03 мг указанного в заголовке соединения получают по способу примера 126, используя 2-метилбутан-1-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 389 (MH+-CF3COOH).
Пример 140
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиримидин-2-илсульфанил)-1,7-дигидропурин-6-она
3,60 мг указанного в заголовке соединения получают по способу примера 126, используя пиримидин-2-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 397 (MH+-CF3COOH).
Пример 141
Трифторацетат 7-(2-бутинил)-2-(1H-имидазол-2-илсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
5,75 мг указанного в заголовке соединения получают по способу примера 126, используя 1Н-имидазол-2-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 385 (MH+-CF3COOH).
Пример 142
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиазол-2-илсульфанил)-1,7-дигидропурин-6-она
3,86 мг указанного в заголовке соединения получают по способу примера 126, используя тиазол-2-тиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 402 (MH+-CF3COOH).
Пример 143
Трифторацетат 7-(2-бутинил)-2-(фуран-2-илметилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
4,84 мг указанного в заголовке соединения получают по способу примера 126, используя (фуран-2-ил)метантиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 399 (MH+-CF3COOH).
Пример 144
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетамида
1,86 мг указанного в заголовке соединения получают по способу примера 126, используя 2-меркаптоацетамид вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 376 (MH+-CF3COOH).
Пример 145
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиофен-2-илметилсульфанил)-1,7-дигидропурин-6-она
3,35 мг указанного в заголовке соединения получают по способу примера 126, используя (тиофен-2-ил)метантиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 415 (MH+-CF3COOH).
Пример 146
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[1-(тиофен-2-ил)этилсульфанил]-1,7-дигидропурин-6-она
0,51 мг указанного в заголовке соединения получают по способу примера 126, используя 1-(тиофен-2-ил)этантиол вместо 3-меркаптопропионовой кислоты.
МС m/e (ESI) 429 (MH+-CF3COOH).
Пример 147
Трифторацетат 7-(2-бутинил)-1-метил-2-(1-метил-1H-имидазол-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
5 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7- дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 10 мг 1-метил-1Н-имидазол-2-тиола и 8 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,75 мг указанного в заголовке соединения.
МС m/e (ESI) 399 (MH+-CF3COOH).
Пример 148
Трифторацетат 7-(2-бутинил)-1-метил-2-(4-метилпиримидин-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
4,00 мг указанного в заголовке соединения получают по способу примера 147, используя 4-метилпиримидин-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 411 (MH+-CF3COOH).
Пример 149
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиразин-2-илсульфанил)-1,7-дигидропурин-6-она
4,00 мг указанного в заголовке соединения получают по способу примера 147, используя пиразин-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 411 (MH+-CF3COOH).
Пример 150
Трифторацетат 2-(бензотиазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
0,07 мг указанного в заголовке соединения получают по способу примера 147, используя бензотиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 452 (MH+-CF3COOH).
Пример 151
Трифторацетат 2-(1H-бензимидазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
3,18 мг указанного в заголовке соединения получают по способу примера 147, используя 1Н-бензимидазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 435 (MH+-CF3COOH).
Пример 152
Трифторацетат 2-(5-амино[1,3,4]тиадиазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
3,62 мг указанного в заголовке соединения получают по способу примера 147, используя 5-амино[1,3,4]тиадиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 418 (MH+-CF3COOH).
Пример 153
Трифторацетат 6-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]никотиновой кислоты
1,01 мг указанного в заголовке соединения получают по способу примера 147, используя 6-меркаптоникотиновую кислоту вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 440 (MH+-CF3COOH).
Пример 154
Трифторацетат 7-(2-бутинил)-2-(4-метоксифенилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
4,14 мг указанного в заголовке соединения получают по способу примера 147, используя 4-метоксибензолтиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 425 (MH+-CF3COOH).
Пример 155
Трифторацетат 7-(2-бутинил)-1-метил-2-(4-нитрофенилсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
1,52 мг указанного в заголовке соединения получают по способу примера 147, используя 4-нитробензолтиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 440 (MH+-CF3COOH).
Пример 156
Трифторацетат N-[2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]этил]ацетамида
2,39 мг указанного в заголовке соединения получают по способу примера 147, используя N-(2-меркаптоэтил)ацетамид вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 404 (MH+-CF3COOH).
Пример 157
Трифторацетат 7-(2-бутинил)-1-метил-2-(5-метил[1,3,4]тиадиазол-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
1,24 мг указанного в заголовке соединения получают по способу примера 147, используя 5-метил[1,3,4]тиадиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 417 (MH+-CF3COOH).
Пример 158
Трифторацетат 7-(2-бутинил)-2-(4,6-диметилпиримидин-2-илсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
3,11 мг указанного в заголовке соединения получают по способу примера 147, используя 4,6-диметилпиримидин-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 425 (MH+-CF3COOH).
Пример 159
Трифторацетат 7-(2-бутинил)-1-метил-2-(4-метилтиазол-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
4,01 мг указанного в заголовке соединения получают по способу примера 147, используя 4-метилтиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 416 (MH+-CF3COOH).
Пример 160
Трифторацетат 2-(бензоксазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
0,84 мг указанного в заголовке соединения получают по способу примера 147, используя бензоксазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 436 (MH+-CF3COOH).
Пример 161
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-([1,3,4]тиадиазол-2-илсульфанил)-1,7-дигидропурин-6-она
1,95 мг указанного в заголовке соединения получают по способу примера 147, используя [1,3,4]тиадиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 403 (MH+-CF3COOH).
Пример 162
Трифторацетат 2-аллилсульфанил-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
2,85 мг указанного в заголовке соединения получают по способу примера 147, используя аллилмеркаптан вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 359 (MH+-CF3COOH).
Пример 163
Трифторацетат 7-(2-бутинил)-1-метил-2-(3-метилсульфанилфениламино)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
1,32 мг указанного в заголовке соединения получают по способу примера 147, используя 3-метилсульфанилфениламин вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 424 (MH+-CF3COOH).
Пример 164
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиоморфолин-4-ил)-1,7-дигидропурин-6-она
5,33 мг указанного в заголовке соединения получают по способу примера 147, используя тиоморфолин вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 388 (MH+-CF3COOH).
Пример 165
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]-2-метилпропионовой кислоты
1,63 мг указанного в заголовке соединения получают по способу примера 147, используя 2-меркапто-2-метилпропионовую кислоту вместо 1-метил-1Н-имидазол-2-тиола.
МС m/e (ESI) 405 (MH+-CF3COOH).
Пример 166
Трифторацетат 7-(2-бутинил)-2-(N-изопропилметиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и затем к раствору добавляют 30 мкл N-изопропилметиламина. После перемешивания смеси при 80ºС в течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный в результате остаток растворяют в 0,60 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,66 мг указанного в заголовке соединения.
МС m/e (ESI) 358 (MH+-CF3COOH).
Пример 167
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила
5 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 1-метил-2-пирролидона, затем добавляют 5 мг 3-цианофенола и 8 мг гидрида натрия. Смесь перемешивают при 90ºС в течение трех часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,02 мг указанного в заголовке соединения.
МС m/e (ESI) 404 (MH+-CF3COOH).
Пример 168
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила
2,76 мг указанного в заголовке соединения получают по способу примера 167, используя 4-цианофенол вместо 3-цианофенола.
МС m/e (ESI) 404 (MH+-CF3COOH).
Пример 169
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(3-толилокси)-1,7-дигидропурин-6-она
3,14 мг указанного в заголовке соединения получают по способу примера 167, используя 3-метилфенол вместо 3-цианофенола.
МС m/e (ESI) 393 (MH+-CF3COOH).
Пример 170
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-метилсульфанилфенокси)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
3,50 мг указанного в заголовке соединения получают по способу примера 167, используя 2-метилсульфанилфенол вместо 3-цианофенола.
МС m/e (ESI) 425 (MH+-CF3COOH).
Пример 171
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты
5 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этил-3-гидроксибензоата растворяют в 0,2 мл N-метилпирролидона и к смеси добавляют 8 мг гидрида натрия. Полученную смесь перемешивают при 90ºС в течение 3 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в смеси, состоящей из 0,4 мл этанола и 0,1 мл 5 н. водного раствора гидроксида натрия. Полученную смесь перемешивают при 50ºС в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,09 мг указанного в заголовке соединения.
МС m/e (ESI) 423 (MH+-CF3COOH).
Пример 172
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты
1,55 мг указанного в заголовке соединения получают по способу примера 171, используя этил-4-гидроксибензоат вместо 3-гидроксибензойной кислоты.
МС m/e (ESI) 423 (MH+-CF3COOH).
Пример 173
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(2-толилокси)-1,7-дигидропурин-6-она
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 1-метил-2-пирролидона, затем добавляют 5 мг 2-метилфенола и 8 мг карбоната калия. Смесь перемешивают при 90ºС в течение пяти часов. К реакционному раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,40 мг указанного в заголовке соединения.
МС m/e (ESI) 393 (MH+-CF3COOH).
Пример 174
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(4-толилокси)-1,7-дигидропурин-6-она
3,95 мг указанного в заголовке соединения получают по способу примера 173, используя 4-метилфенол вместо 2-метилфенола.
МС m/e (ESI) 393 (MH+-CF3COOH).
Пример 175
Трифторацетат 7-(2-бутинил)-2-(2-метоксифенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
5,24 мг указанного в заголовке соединения получают по способу примера 173, используя 2-метоксифенол вместо 2-метилфенола.
МС m/e (ESI) 409 (MH+-CF3COOH).
Пример 176
Трифторацетат 7-(2-бутинил)-2-(3-метоксифенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
2,84 мг указанного в заголовке соединения получают по способу примера 173, используя 3-метоксифенол вместо 2-метилфенола.
МС m/e (ESI) 409 (MH+-CF3COOH).
Пример 177
Трифторацетат 7-(2-бутинил)-2-(4-метоксифенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
5,61 мг указанного в заголовке соединения получают по способу примера 173, используя 4-метоксифенол вместо 2-метилфенола.
МС m/e (ESI) 409 (MH+-CF3COOH).
Пример 178
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензолсульфонамида
4,21 мг указанного в заголовке соединения получают по способу примера 173, используя 4-гидроксибензолсульфонамид вместо 2-метилфенола.
МС m/e (ESI) 458 (MH+-CF3COOH).
Пример 179
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-3-метоксибензонитрила
4,24 мг указанного в заголовке соединения получают по способу примера 173, используя 4-гидрокси-3-метоксибензонитрил вместо 2-метилфенола.
МС m/e (ESI) 434 (MH+-CF3COOH).
Пример 180
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила
5,26 мг указанного в заголовке соединения получают по способу примера 173, используя 2-цианофенол вместо 2-метилфенола.
МС m/e (ESI) 404 (MH+-CF3COOH).
Пример 181
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
4,80 мг указанного в заголовке соединения получают по способу примера 173, используя 4-гидроксибензамид вместо 2-метилфенола.
МС m/e (ESI) 422 (MH+-CF3COOH).
Пример 182
Трифторацетат этил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензоата
4,38 мг указанного в заголовке соединения получают по способу примера 173, используя этил-2-гидроксибензоат вместо 2-метилфенола.
МС m/e (ESI) 451 (MH+-CF3COOH).
Пример 183
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиримидин-2-илокси)-1,7-дигидропурин-6-она
1,12 мг указанного в заголовке соединения получают по способу примера 173, используя пиримидин-2-ол вместо 2-метилфенола.
МС m/e (ESI) 381 (MH+-CF3COOH).
Пример 184
Трифторацетат 7-(2-бутинил)-2-(4,6-диметилпиримидин-2-илокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
0,66 мг указанного в заголовке соединения получают по способу примера 173, используя 4,6-диметилпиримидин-2-ол вместо 2-метилфенола.
МС m/e (ESI) 409 (MH+-CF3COOH).
Пример 185
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этил-3-гидроксибензоата растворяют в 0,2 мл N-метилпирролидона, затем к смеси добавляют 10 мг карбоната калия. Смесь перемешивают при 90ºС в течение 3 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 1,0 мл аммиака (7 н. метанольный раствор). Смесь перемешивают при 50ºС в течение ночи. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,91 мг указанного в заголовке соединения.
МС m/e (ESI) 422(MH+-CF3COOH).
Пример 186
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-3,5-диметилбензойной кислоты
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо -6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 1-метил-2-пирролидона и к полученному раствору добавляют 8 мг 4-гидрокси-3,5-диметилбензойной кислоты и 8 мг карбоната калия. Смесь перемешивают при 100ºС в течение 2 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,71 мг указанного в заголовке соединения.
МС m/e (ESI) 451(MH+-CF3COOH).
Пример 187
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-3-фторбензойной кислоты
3,49 мг указанного в заголовке соединения получают по способу примера 186, используя 3-фтор-4-гидроксибензойную кислоту вместо 4-гидрокси-3,5-диметилбензойной кислоты.
МС m/e (ESI) 441 (MH+-CF3COOH).
Пример 188
Трифторацетат [4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетата
3,45 мг указанного в заголовке соединения получают по способу примера 186, используя (4-гидроксифенил)уксусную кислоту вместо 4-гидрокси-3,5-диметилбензойной кислоты.
МС m/e (ESI) 437 (MH+-CF3COOH).
Пример 189
Трифторацетат [2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]уксусной кислоты
1,34 мг указанного в заголовке соединения получают по способу примера 186, используя (2-гидроксифенил)уксусную кислоту вместо 4-гидрокси-3,5-диметилбензойной кислоты.
МС m/e (ESI) 437 (MH+-CF3COOH).
Пример 190
Трифторацетат 2-(2-ацетилфенокси)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
1,99 мг указанного в заголовке соединения получают по способу примера 186, используя 1-(2-гидроксифенил)этанон вместо 4-гидрокси-3,5-диметилбензойной кислоты.
МС m/e (ESI) 421 (MH+-CF3COOH).
Пример 191
Трифторацетат 7-(2-бутинил)-2-(2,6-дифторфенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
5,26 мг указанного в заголовке соединения получают по способу примера 186, используя 2,6-дифторфенол вместо 4-гидрокси-3,5-диметилбензойной кислоты.
МС m/e (ESI) 415 (MH+-CF3COOH).
Пример 192
Трифторацетат 7-(2-бутинил)-1-метил-2-пентафторфенокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
5,61 мг указанного в заголовке соединения получают по способу примера 186, используя 2,3,4,5,6-пентафторфенол вместо 4-гидрокси-3,5-диметилбензойной кислоты.
МС m/e (ESI) 469 (MH+-CF3COOH).
Пример 193
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[4-(пирролидин-1-карбонил)фенокси]-1,7-дигидропурин-6-она
30 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1 мл 1-метил-2-пирролидона, затем к раствору добавляют 15 мг 1-(4 гидроксибензоил)пирролидина и 11 мг карбоната калия. Смесь перемешивают при 100ºС в течение 2,5 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 23,7 мг указанного в заголовке соединения.
МС m/e (ESI) 476 (MH+-CF3COOH).
Пример 194
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-N-[2-(пиперидин-1-ил)этил]бензамида
3,05 мг указанного в заголовке соединения получают по способу примера 193, используя 2-гидрокси-N-[2-(пиперидин-1-ил)этил]бензамид.
МС m/e (ESI) 533 (MH+-CF3COOH).
Пример 195
Трифторацетат 5-ацетил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
0,82 мг указанного в заголовке соединения получают по способу примера 193, используя 5-ацетилсалициламид вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 464 (MH+-CF3COOH).
Пример 196
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]бензойной кислоты
0,70 мг указанного в заголовке соединения получают по способу примера 193, используя тиосалициловую кислоту вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 439 (MH+-CF3COOH).
Пример 197
Трифторацетат 6-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]никотинамида
1,43 мг указанного в заголовке соединения получают по способу примера 193, используя 6-аминоникотинамид вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 422 (MH+-CF3COOH).
Пример 198
Трифторацетат амида 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]пиридин-2-карбоновой кислоты
1,44 мг указанного в заголовке соединения получают по способу примера 193, используя 3-гидроксипиколинамид вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 423 (MH+-CF3COOH).
Пример 199
Трифторацетат N-трет-бутил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]бензамида
0,87 мг указанного в заголовке соединения получают по способу примера 193, используя 2-амино-N-трет-бутилбензамид вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 477 (MH+-CF3COOH).
Примеры 200 и 201
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]бензамида
1,36 мг полярного производного указанного в заголовке соединения и 0,39 мг неполярного производного указанного в заголовке соединения получают по способу примера 193, используя 2-аминобензамид вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 477 (MH+-CF3COOH).
Пример 202
Трифторацетат N-[3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетамида
10,79 мг соединения, указанного в заголовке, получают по способу примера 193, используя 3-ацетамидофенол вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 436 (MH+-CF3COOH).
Пример 203
Трифторацетат N-[4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетамида
11,38 мг соединения, указанного в заголовке, получают по способу примера 193, используя 4-ацетамидофенол вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 436 (MH+-CF3COOH).
Пример 204
Трифторацетат 2-[N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]бензойной кислоты
3,48 мг соединения, указанного в заголовке, получают по способу примера 193, используя 4-метилантраниловую кислоту вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 436 (MH+-CF3COOH).
Пример 205
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты
25,75 мг соединения, указанного в заголовке, получают по способу примера 193, используя салициловую кислоту вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 423 (MH+-CF3COOH).
Пример 206
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]бензолсульфонамида
0,91 мг соединения, указанного в заголовке, получают по способу примера 193, используя 2-аминобензолсульфонамид вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 457 (MH+-CF3COOH).
Пример 207
Трифторацетат этилового эфира 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]бензойной кислоты
0,66 мг соединения, указанного в заголовке, получают по способу примера 193, используя этилтиосалицилат вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 467 (MH+-CF3COOH).
Пример 208
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]пиридин-2-карбоновой кислоты
4,36 мг соединения, указанного в заголовке, получают по способу примера 193, используя 3-гидроксипиколиновую кислоту вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 424 (MH+-CF3COOH).
Пример 209
Трифторацетат N-[2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетамида
0,126 мг соединения, указанного в заголовке, получают по способу примера 193, используя 2-ацетамидофенол вместо 1-(4-гидроксибензоил)пирролидина.
МС m/e (ESI) 436 (MH+-CF3COOH).
Пример 210
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-N,N-диметилбензамида
100 мг салициловой кислоты и 0,76 мл 2 M тетрагидрофуранового раствора диметиламина растворяют в 1 мл N,N-диметилформамида и к полученному раствору добавляют 109 мкл диэтилцианофосфата и 250 мкл триэтиламина. Смесь перемешивают при комнатной температуре в течение 5,5 часа. К реакционному раствору добавляют воду, и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и к одной трети аликвоты остатка добавляют 20 мг трет-бутилового эфира 4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоновой кислоты, карбонат калия и 1 мл 1-метил-2-пирролидона. Смесь перемешивают при 150ºС в течение 1,5 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,06 мг указанного в заголовке соединения.
МС m/e (ESI) 450 (MH+-CF3COOH).
Пример 211
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[2-(тиазолидин-3-карбонил)фенокси]-1,7-дигидропурин-6-она
2,10 мг соединения, указанного в заголовке, получают по способу примера 210, используя тиазолидин вместо диметиламина.
МС m/e (ESI) 494 (MH+-CF3COOH).
Пример 212
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[2-(пирролидин-1-карбонил)фенокси]-1,7-дигидропурин-6-она
6,86 мг соединения, указанного в заголовке, получают по способу примера 210, используя пирролидон вместо диметиламина.
МС m/e (ESI) 476 (MH+-CF3COOH).
Пример 213
Трифторацетат 7-(2-бутинил)-1-метил-2-[2-(морфолин-4-карбонил)фенокси]-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
3,63 мг соединения, указанного в заголовке, получают по способу примера 210, используя морфолин вместо диметиламина.
МС m/e (ESI) 492 (MH+-CF3COOH).
Пример 214
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетонитрила
Пример 215
Трифторацетат [7-(2-бутинил)-2-цианометил-1-метил-6-оксо-8-(пиперазин-1-ил)-2,3,6,7-тетрагидро-1H-пурин-2-ил]ацетонитрила
8 мг трет-бутилового эфира 4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоновой кислоты растворяют в 0,8 мл ацетонитрила и затем к полученному раствору добавляют 8 мг гидрида натрия. Смесь перемешивают при 60ºС в течение трех часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,85 мг и 2,20 мг указанных в заголовке соединений (примеры 214 и 215) соответственно.
(Пример 214) МС m/e (ESI) 326 (MH+-CF3COOH).
(Пример 215) МС m/e (ESI) 367 (MH+-CF3COOH).
Пример 216
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-оксопропил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,8 мл ацетона и к полученному раствору добавляют 8 мг гидрида натрия. Полученную смесь перемешивают при 60ºС в течение трех часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,17 мг указанного в заголовке соединения.
МС m/e (ESI) 343 (MH+-CF3COOH).
Пример 217
Трифторацетат 7-(2-бутинил)-2-этинил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
50 мкл триметилсилилацетилена растворяют в 1,0 мл тетрагидрофурана, затем при -78ºС добавляют 0,27 мл н-бутиллития (1,56 М раствора в гексане). Смесь перемешивают при 0ºС в течение 15 минут и в полученный реакционный раствор добавляют 1,0 мл тетрагидрофуранового раствора, содержащего 10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. После перемешивания полученной смеси при комнатной температуре в течение 30 минут к реакционному раствору добавляют насыщенный раствор хлорида аммония. Смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 1,0 мл метанола. К раствору добавляют 10 мг карбоната калия. После перемешивания полученной смеси при комнатной температуре в течение 1 часа добавляют насыщенный раствор хлорида аммония. Полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,06 мг указанного в заголовке соединения.
МС m/e (ESI) 311 (MH+-CF3COOH).
Пример 218
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пропан-2-сульфинил)-1,7-дигидропурин-6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7- дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к раствору добавляют 20 мкл 2-пропантиола и 6 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,30 мл дихлорметана. Смесь охлаждают до -78ºС. К смеси добавляют 5 мл м-хлорпербензойной кислоты и полученную смесь перемешивают при -78ºС в течение 15 минут. К реакционному раствору добавляют насыщенный раствор сульфита натрия и смесь экстрагируют дихлорметаном. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,89 мг указанного в заголовке соединения.
МС m/e (ESI) 377 (MH+-CF3COOH).
Пример 219
Трифторацетат N-ацетил-N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетамида
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 20% водного аммика и смесь перемешивают при 80ºC в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в 0,4 мл пиридина. К смеси добавляют 0,05 мл уксусного ангидрида. Полученную смесь перемешивают при комнатной температуре в течение 48 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,49 мг указанного в заголовке соединения.
МС m/e (ESI) 386 (MH+-CF3COOH).
Пример 220
Трифторацетат N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетамида
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 20% водного раствора аммиака и смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в 0,4 мл пиридина. К раствору добавляют 0,05 мл уксусного ангидрида. Полученную смесь перемешивают при комнатной температуре в течение 48 часов. Реакционный раствор концентрируют и остаток растворяют в метаноле. К раствору добавляют 10 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и образовавшийся остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,36 мг указанного в заголовке соединения.
МС m/e (ESI) 344 (MH+-CF3COOH).
Пример 221
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетонитрила
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, и к полученному раствору добавляют 50 мкл гидроксиацетонитрила и 5 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,12 мг указанного в заголовке соединения.
МС m/e (ESI) 342 (MH+-CF3COOH).
Пример 222
Трифторацетат N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]гуанидина
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 10 мг гуанидина. Смесь перемешивают при 90ºС в течение 12 часов. Реакционный раствор концентрируют и остаток растворяют в 1,0 мл трифторуксусной кислоты. Полученный раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,20 мг указанного в заголовке соединения.
МС m/e (ESI) 344 (MH+-CF3COOH).
Пример 223
Трифторацетат 7-(2-бутинил)-2-метилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
50 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1,2 мл N,N-диметилформамида и к полученному раствору добавляют 44 мкл (2-хлорметоксиэтил)триметилсилана и 34 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле с получением 55 мг указанного в заголовке соединения.
1Н-ЯМР (CDCl3)
δ 0,07 (с, 9H), 0,97 (т, J=8, 4 Гц, 2H), 1,49 (с, 9H), 1,82 (т, J=2, 4 Гц, 3H), 3,40-3,44 (м, 4H), 3,58-3,62 (м, 4H), 3,71 (т, J=8,4 Гц, 2H), 4,92 (кв, J=2,4 Гц, 2H), 5,67 (с, 2H).
(b) Трифторацетат 7-(2-бутинил)-2-метилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин -6-она
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и затем к полученному раствору добавляют 50 мкл метилмеркаптана (30%; метанольный раствор) и 10 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,60 мл трифторуксусной кислоты. Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Затем раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,99 мг указанного в заголовке соединения.
МС m/e (ESI) 319 (MH+-CF3COOH).
Пример 224
Трифторацетат 7-(2-бутинил)-2-изопропилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
2,97 мг соединения, указанного в заголовке, получают по способу примера 223, используя натриевую соль пропан-2-тиола вместо метилмеркаптана.
МС m/e (ESI) 347 (MH+-CF3COOH).
Пример 225
Трифторацетат 2-трет-бутилсульфанил-7-(2-бутинил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она
2,99 мг соединения, указанного в заголовке, получают по способу примера 223, используя натриевую соль 2-метил-2-пропантиола вместо метилмеркаптана.
МС m/e (ESI) 361 (MH+-CF3COOH).
Пример 226
Трифторацетат 7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
Растворяют 6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,15 мл 1-метил-2-пирролидона и затем к раствору добавляют 8 мг цианида натрия и 10 мг карбоната калия. Смесь перемешивают при 50ºC в течение пяти часов. В реакционную смесь добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,60 мл трифторуксусной кислоты. Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Затем раствор концентрируют, продувая его газообразным азотом. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 1,46 мг соединения, указанного в заголовке.
МС m/e (ESI) 298 (MH+-CF3COOH).
Пример 227
Трифторацетат 2-[7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
Растворяют 6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,15 мл 1-метил-2-пирролидона и затем к раствору добавляют 8 мг салициламида и 8 мг карбоната калия. Смесь перемешивают при 100ºC в течение трех часов. В реакционную смесь добавляют раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,80 мл трифторуксусной кислоты. Смесь перемешивают при комнатной температуре в течение 5 часов. Раствор концентрируют, продувая его газообразным азотом. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,45 мг соединения, указанного в заголовке.
МС m/e (ESI) 408 (MH+-CF3COOH).
Пример 228
Трифторацетат 4-[7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты
Получают 1,55 мг соединения, указанного в заголовке, используя 4-гидроксибензойную кислоту, вместо салициламида по способу, описанному в примере 227.
МС m/e (ESI) 409 (MH+-CF3COOH).
Пример 229
Гидрохлорид 7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
(a) трет-Бутил-4-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, полученного в примере 96(a), 10 мг цианида натрия и 0,3 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь экстрагируют смесью этилацетат-вода, и органический слой промывают водой и затем насыщенным раствором соли. Органический слой концентрируют. Остаток очищают методом тонкослойной хроматографии (50% этилацетата в гексане), получая 6,1 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,83 (с, 3H), 3,50 (с, 4H), 3,58-3,64 (м, 4H), 4,99 (с, 2H), 5,74 (с, 2H), 7,02 (д, J=8 Гц, 1H), 7,44 (т, J=8 Гц, 1H), 7,55 (т, J=8 Гц, 1H), 7,74 (д, J=8 Гц, 1H).
(b) Гидрохлорид 7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
Смесь, состоящую из 6,1 мг трет-бутил-4-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 0,2 мл трифторуксусной кислоты перемешивают при комнатной температуре в течение 20 минут. Реакционную смесь концентрируют и остаток очищают хроматографически на колонке с обращенной фазой, используя растворитель, содержащий от 20 до 60% метанола в воде (0,1% концентрированной соляной кислоты), получая 5,0 мг соединения, указанного в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 3,30 (с, 4H), 3,60-3,70 (м, 4H), 5,09 (с, 2H), 5,60 (с, 2H), 7,27 (д, J=8 Гц, 1H), 7,54 (т, J=8 Гц, 1H), 7,68 (т, J=8 Гц, 1H), 7,94 (д, J=8 Гц, 1H), 9,36 (уш.с, 2H).
Пример 230
Трифторацетат 3-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]пиридин-2-карбоксиламида
Растворяют 7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,2 мл 1-метил-2-пирролидона и затем добавляют к раствору 8 мг 3-гидроксипиридин-2-карбоксиламида и 8 мг карбоната калия. Смесь перемешивают при 100ºC в течение 2 часов. В реакционную смесь добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,93 мг соединения, указанного в заголовке.
МС m/e (ESI) 524 (MH+-CF3COOH).
Пример 231
Трифторацетат 4-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензолсульфонамида
Получают 1,90 мг соединения, указанного в заголовке, используя 4-гидроксибензолсульфонамид, вместо 3-гидроксипиридин-2-карбоксиламида, по способу, описанному в примере 230.
МС m/e (ESI) 559 (MH+-CF3COOH).
Пример 232
Трифторацетат 2-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила
Получают 2,15 мг соединения, указанного в заголовке, используя 2-цианофенол вместо 3-гидроксипиридин-2-карбоксиламида по способу, описанному в примере 230.
МС m/e (ESI) 505 (MH+-CF3COOH).
Пример 233
Трифторацетат 4-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты
Получают 3,74 мг соединения, указанного в заголовке, используя 4-гидроксибензойную кислоту вместо 3-гидроксипиридин-2-карбоксиламида по способу, описанному в примере 230.
МС m/e (ESI) 524 (MH+-CF3COOH).
Пример 234
Трифторацетат 2-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
Получают 3,74 мг соединения, указанного в заголовке, используя салициламид вместо 3-гидроксипиридин-2-карбоксиламида по способу, описанному в примере 230.
МС m/e (ESI) 523 (MH+-CF3COOH).
Пример 235
Трифторацетат 2-[7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Растворяют 100 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 1,2 мл N,N-диметилформамида и затем добавляют к раствору 97 мг 4-цианобензилбромида и 68 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение 4 часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле, получая 71 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,84 (т, J=2,5 Гц, 3H), 3,43-3,47 (м, 4H), 3,59-3,63 (м, 4H), 4,94 (кв, 2,5 Гц, 2H), 5,53 (с, 2H), 7,42 (д, J=8,0 Гц, 2H), 7,62 (д, J=8,0 Гц, 2H).
(b) Трифторацетат 2-[7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 10 мг салициламида и 10 мг карбоната калия. Смесь перемешивают при 100ºC в течение 12 часов. В реакционную смесь добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 6,69 мг соединения, указанного в заголовке.
МС m/e (ESI) 523 (MH+-CF3COOH).
Пример 236
Трифторацетат 7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 10 мг цианида натрия. Смесь перемешивают при 50ºC в течение 2 часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 3,87 мг соединения, указанного в заголовке.
МС m/e (ESI) 413 (МН+-CF3COOH).
Пример 237
Трифторацетат 4-[7-(2-бутинил)-2-метилсульфанил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 20 мкл метилмеркаптана (30%; метанольный раствор) и 10 мг карбоната калия. Смесь перемешивают при 50ºC в течение 2 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 6,69 мг соединения, указанного в заголовке.
МС m/e (ESI) 434 (МН+-CF3COOH).
Пример 238
Трифторацетат 2-[7-(2-бутинил)-1-(3-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-(3-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата
Растворяют 100 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 1,2 мл N,N-диметилформамида и затем добавляют к раствору 97 мг 3-цианобензилбромида и 68 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение 12 часов. Затем к реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле, получая 71 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,84 (т, J=2,5 Гц, 3H), 3,43-3,47 (м, 4H), 3,59-3,63 (м, 4H), 4,94 (кв, 2,5 Гц, 2H), 5,53 (с, 2H), 7,42 (д, J=8,0 Гц, 2H), 7,62 (д, J=8,0 Гц, 2H).
(b) Трифторацетат 2-[7-(2-бутинил)-1-(3-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(3-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 10 мг салициламида и 10 мг карбоната калия. Смесь перемешивают при 100ºC в течение пяти часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 8,76 мг соединения, указанного в заголовке.
Масс-спектр m/e (ESI) 523 (MH+-CF3COOH).
Пример 239
Трифторацет 7-(2-бутинил)-1-(3-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(3-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем к раствору добавляют 10 мг цианида натрия. Смесь перемешивают при 50ºC в течение 1 часа. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 4,96 мг соединения, указанного в заголовке.
МС m/e (ESI) 413 (MH+-CF3COOH).
Пример 240
Гидрохлорид 1-(2-бутинил)-2-(пиперазин-1-ил)-7,8-дигидро-1H,6H-5-окса-1,3,4,8a-тетраазациклопента[b]нафталин-9-он
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-[3-(тетрагидропиран-2-илокси)пропил]-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 20 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, полученного в примере 95(a), 20 мкл 2-(3-бромпропокси)тетрагидропирана, 20 мг безводного карбоната калия и 0,2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение ночи. Реакционный раствор экстрагируют смесью этилацетат-вода и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток очищают методом тонкослойной хроматографии (70% этилацетата в гексане), получая 8 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,50-1,81 (м, 6H), 1,83 (т, J=2 Гц, 3H), 2,06 (кв, J=7 Гц, 2H), 3,38-3,62 (м, 10H), 3,80-3,90 (м, 2H), 4,34-4,47 (м, 2H), 4,59 (т, J=3 Гц, 1H), 4,92 (кв, J=2 Гц, 2H).
(b) трет-Бутил-4-[1-(2-бутинил)-9-оксо-1,7,8,9-тетраазациклопента[b]нафталин-2-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-[3-(тетрагидропиран-2-илокси)пропил]-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 0,2 мл этанола и каталитического количества моногидрата пара-толуолсульфокислоты перемешивают при комнатной температуре в течение 4 часов и затем добавляют к раствору 40 мг безводного карбоната калия. Смесь дополнительно перемешивают в течение ночи. Реакционный раствор экстрагируют смесью этилацетат-вода и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток очищают методом тонкослойной хроматографии (20% метанола в этилацетате), получая 3 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,82 (т, J=2 Гц 3H), 2,18-2,26 (м, 2H), 3,37-3,43 (м, 4H), 3,56-3,62 (м, 4H), 4,07 (т, J=6 Гц, 2H), 4,43 (т, J=5 Гц, 2H), 4,88 (кв, J=2 Гц, 2H).
(c) Гидрохлорид 1-(2-бутинил)-2-(пиперазин-1-ил)-7,8-дигидро-1H,6H-5-окса-1,3,4,8a-тетраазациклопента[b]нафталин-9-она
Смесь, состоящую из 3 мг трет-бутил-4-[1-(2-бутинил)-9-оксо-1,7,8,9-тетраазациклопента[b]нафталин-2-ил]пиперазин-1-карбоксилата и 0,5 мл трифторуксусной кислоты, перемешивают при комнатной температуре в течение 20 минут. Затем раствор концентрируют и остаток очищают на хроматографической колонке с обращенной фазой, используя растворитель - от 20 до 50% метанола в воде (0,1% концентрированной соляной кислоты), получая 2,1 мг соединения, указанного в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,79 (с, 3H), 2,08-2,16 (м, 2H), 3,27 (уш.с, 4H), 3,44-3,54 (м, 4H), 3,90 (т, J=6 Гц, 2H), 4,38 (т, J=5 Гц, 2H), 4,94 (с, 2H), 9,02 (уш.с, 2H).
Пример 241
Гидрохлорид 1-(2-бутинил)-2-(пиперазин-1-ил)-6,7-дигидро-1H-5-окса-1,3,4,7a-тетрааза-сим-индацен-8-она
В примере 240 получают соединение, указанное в заголовке, используя 2-(2-бромэтокси)тетрагидропиран, вместо 2-(3-бромпропокси)тетрагидропирана, по способу, описанному в примере 240.
1Н-ЯМР (ДМСО-d6)
δ 1,80 (с, 3H), 3,27 (уш.с, 4H), 4,19 (т, J=8 Гц, 2H), 4,70 (т, J=8 Гц, 2H), 4,94 (с, 2H), 9,06 (уш.с, 2H).
Пример 242
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
(a) Бензил-3-трет-бутоксикарбониламинопиперидин-1-карбоксилата
Добавляют по каплям 88 г бензилхлороформиата (30%-ный раствор в толуоле) к смеси, состоящей из 24,3 г этилпиперидин-3-карбоксилата, 26 мл триэтиламина и 300 мл этилацетата, в течение 30 минут при охлаждении смеси льдом. Реакционную смесь фильтруют, для того чтобы удалить нерастворимое вещество. Фильтрат снова фильтруют через небольшой слой силикагеля. Фильтрат концентрируют.
Добавляют к остатку 200 мл этанола и 40 мл водного раствора (5 M) гидроксида натрия. Смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор концентрируют и к остатку добавляют 200 мл воды. Смесь экстрагируют метил-трет-бутиловым эфиром. К водному слою добавляют 5 M водный раствор соляной кислоты и смесь экстрагируют этилацетатом. Органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют, получая маслянистый остаток (30,9 г).
Смесь, состоящую из 30 г этого остатка, 24,5 мл дифенилфосфорилазида, 15,9 мл триэтиламина и 250 мл трет-бутанола, перемешивают при комнатной температуре в течение 1,5 часов. Смесь дополнительно перемешивают в масляной бане при 100ºC в течение 20 часов. Реакционный раствор концентрируют и остаток экстрагируют смесью этилацетат-вода. Органический слой промывают разбавленным водным раствором бикарбоната натрия и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - от 10 до 20% этилацетата в гексане, и при последующей перекристаллизации из смеси этилацетат-гексан получают 21,4 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,43 (с, 9H), 1,48-1,92 (м, 4H), 3,20-3,80 (м, 5H), 4,58 (уш.с, 1H), 5,13 (с, 2H), 7,26-7,40 (м, 5H).
(b) трет-Бутил-пиперидин-3-илкарбамат
Смесь, состоящую из 10 г бензил-3-трет-бутоксикарбониламинопиперидин-1-карбоксилата, 500 мг катализатора - 10% палладия на угле - и 100 мл этанола, перемешивают при комнатной температуре в атмосфере водорода в течение ночи. Катализатор удаляют путем фильтрации. Фильтрат концентрируют и сушат, получая 6,0 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,44 (с, 9H), 1,47-1,80 (м, 4H), 2,45-2,60 (м, 1H), 2,60-2,75 (м, 1H), 2,75-2,90 (м, 1H), 3,05 (дд, J=3 Гц, 12 Гц, 1H), 3,57 (уш.с, 1H), 4,83 (уш.с, 1H).
(c) трет-Бутил-[1-[7-(2-бутинил)-2,6-дихлор-7H-пурин-8-ил]пиперидин-3-ил]карбамат
Смесь, состоящую из 1,25 г 7-(2-бутинил)-2,6,8-трихлор-7H-пурина, 1,0 г трет-бутилпиперидин-3-илкарбамата и 10 мл ацетонитрила, перемешивают при комнатной температуре в течение 10 минут. По каплям добавляют в течение 10 минут 0,63 мл триэтиламина и затем смесь непрерывно перемешивают при комнатной температуре в течение 30 минут. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток кристаллизуется из смеси метил-трет-бутиловый эфир-гексан, получают 1,79 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,43 (с, 9H), 1,60-2,02 (м, 4H), 1,83 (т, J=2 Гц, 3H), 3,32-3,41 (м, 1H), 3,42-3,52 (м, 1H), 3,67-3,76 (м, 1H), 3,80-3,91 (м, 1H), 4,76-4,90 (м, 3H).
(d) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат
Смесь, состоящую из 1,79 г трет-бутил-[1-[7-(2-бутинил)-2,6-дихлор-7H-пурин-8-ил]пиперидин-3-ил]карбамата, 1,0 г ацетата натрия и 18 мл диметилсульфоксида, перемешивают в масляной бане при 120ºC в течение трех часов. Эту смесь удаляют из масляной бани и к реакционному раствору добавляют 18 мл воды. Смесь охлаждают до комнатной температуры. Кристаллы собирают путем фильтрации и промывают водой и затем метил-трет-бутиловым эфиром. Затем кристаллы сушат, получая 1,59 г соединения, указанного в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,39 (с, 9H), 1,34-1,88 (м, 4H), 1,78 (с, 3H), 2,81 (т, J=11 Гц, 1H), 2,95 (т, J=11 Гц, 1H), 3,48-3,60 (м, 2H), 3,64 (д, J=6 Гц, 1H), 4,90 (с, 2H), 6,94 (д, J=8 Гц, 1H).
(e) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат
Смесь, состоящую из 100 мг трет-бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата, 66 мг безводного карбоната калия, 70 мг 2-цианобензилбромида и 1 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение пяти часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - смесь 50% этилацетата в гексане; получают 44,7 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,44 (с, 9H), 1,59-1,81 (м, 2H), 1,83 (т, J=2 Гц, 3H), 1,86-1,94 (м, 2H), 3,20-3,50 (м, 3H), 3,66 (д, J=7 Гц, 1H), 3,86 (уш.с, 1H), 4,88-5,06 (м, 3H), 5,72 (с, 2H), 7,06 (д, J=8 Гц, 1H), 7,38 (т, J=8 Гц, 1H), 7,51 (т, J=8 Гц, 1H), 7,70 (д, J=8 Гц, 1H).
(f) трет-Бутил-[1-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1-пурин-8-ил]пиперидин-3-ил]карбамата
Смесь, состоящую из 15 мг трет-бутил-[1-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата, 20 мг цианида натрия и 0,2 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение трех часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток очищают методом тонкослойной хроматографии, используя растворитель - 50% этилацетата в гексане (проявляется три раза), и получают 10,3 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,44 (с, 9H), 1,52-1,98 (м, 4H), 1,81 (т, J=2 Гц 3H), 3,24 (дд, J=7 Гц, 12 Гц, 1H), 3,30-3,40 (м, 1H), 3,46-3,56 (м, 1H), 3,72 (д, J=12 Гц, 1H), 3,86 (уш.с, 1H), 4,86-5,10 (м, 3H), 5,73 (с, 2H), 7,00 (д, J=8 Гц, 1H), 7,42 (т, J=8 Гц, 1H), 7,54 (дт, J=2 Гц, 8 Гц, 1H), 7,73 (дд, J=2 Гц, 8 Гц, 1H).
(g) Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
Смесь, состоящую из 10,3 мг трет-бутил-[1-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата и 0,2 мл трифторуксусной кислоты, перемешивают в течение 20 минут. Реакционный раствор концентрируют и остаток очищают хроматографически на колонке с обращенной фазой, используя растворитель - от 20 до 80% метанола в воде (0,1% концентрированной соляной кислоты), и получают 8,0 мг соединения, указанного в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,60-1,74 (м, 2H), 1,79 (т, J=2 Гц, 3H), 1,88-2,03 (м, 2H), 3,14-3,28 (м, 2H), 3,42 (уш.с, 1H), 3,52-3,82 (м, 2H), 4,98-5,12 (м, 2H), 5,58 (с, 2H), 7,26 (д, J=8 Гц, 1H), 7,53 (т, J=8 Гц, 1H), 7,66 (т, J=8 Гц, 1H), 7,93 (д, J=8 Гц, 1H), 8,16 (уш.с, 3H).
Пример 243
Гидрохлорид 2-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-6-оксо-6,7-дигидропурин-1-илметил]бензонитрила
Смесь, состоящую из 15 мг трет-бутил-[1-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата, 20 мг безводного карбоната калия и 0,2 мл метанола, перемешивают в течение трех часов. Последующие стадии проводятся по тому же самому способу, который использовался в примере 242, стадии (f) и (g). Таким образом синтезируют соединение, указанное в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,58-1,72 (м, 2H), 1,84-1,94 (м, 1H), 1,96-2,04 (м, 1H), 3,08-3,20 (м, 2H), 3,36-3,70 (м, 3H), 3,90 (с, 3H), 4,90-5,02 (м, 2H), 5,32 (с, 2H), 7,20 (д, J=8 Гц, 1H), 7,47 (т, J=8 Гц, 1H), 7,63 (т, J=8 Гц, 1H), 7,87 (д, J=8 Гц, 1H), 8,12 (уш.с, 3H).
Пример 244
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-2-карбонитрила
(a) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат
Соединение, указанное в заголовке, получают, используя 2-бромэтилбензол вместо 2-цианобензилбромида по способу, описанному в примере 242(e).
1Н-ЯМР (CDCl3)
δ 1,44 (с, 9H), 1,58-1,80 (м, 2H), 1,83 (т, J=2 Гц, 3H), 1,86-1,94 (м, 2H), 3,00-3,06 (м, 2H), 3,20-3,50 (м, 3H), 3,60 (д, J=12 Гц, 1H), 3,85 (уш.с, 1H), 4,42-4,48 (м, 2H), 4,88-5,04 (м, 3H), 7,02-7,34 (м, 5H).
(b) Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-2-карбонитрила
Соединение, указанное в заголовке, синтезируют, используя трет-бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат по способу, описанному в примере 242 (f) и (g).
1Н-ЯМР (ДМСО-d6)
δ 1,60-1,72 (м, 2H), 1,83 (с, 3H), 1,88-2,06 (м, 3H), 3,04 (т, J=7 Гц, 2H), 3,35-3,60 (м, 2H), 3,75 (д, J=12 Гц, 1H), 4,35 (т, J=7 Гц, 2H), 5,09 (с, 2H), 7,18 (д, J=7 Гц, 2H), 7,22-7,34 (м, 3H), 8,16 (уш.с, 3H).
Пример 245
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-1-(2-фенилэтил)-1,7-дигидропурин-6-она
Соединение, указанное в заголовке, синтезируют, используя трет-бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат по способу, описанному в примере 243.
1Н-ЯМР (ДМСО-d6)
δ 1,56-1,72 (м, 2H), 1,80 (т, J=2 Гц, 3H), 1,84-2,04 (м, 2H), 2,85 (т, J=7 Гц, 2H), 3,08-3,18 (м, 2H), 3,34-3,54 (м, 2H), 3,64 (д, J=12 Гц, 1H), 3,83 (с, 3H), 4,15 (т, J=7 Гц, 2H), 4,88-5,02 (м, 2H), 7,16-7,24 (м, 3H), 7,29 (т, J=7 Гц, 2H), 8,09 (уш.с, 3H).
Пример 246
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
(a) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат
Соединение, указанное в заголовке, получают, используя 4-цианобензилбромид вместо 2-цианобензилбромида по способу, описанному в примере 242(e).
1Н-ЯМР (CDCl3)
δ 1,44 (с, 9H), 1,58-1,80 (м, 2H), 1,82 (т, J=2 Гц, 3H), 1,85-1,95 (м, 2H), 3,18-3,26 (м, 1H), 3,29-3,37 (м, 1H), 3,40-3,48 (м, 1H), 3,65 (д, J=12 Гц, 1H), 3,86 (уш.с, 1H), 4,86-5,04 (м, 3H), 5,22 (с, 2H), 7,41 (д, J=8 Гц, 2H), 7,62 (д, J=8 Гц, 2H).
(b) Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
Соединение, указанное в заголовке, синтезируют, используя трет-бутил-[1-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат, по способу, описанному в примере 242 (f) и (g).
1Н-ЯМР (ДМСО-d6)
δ 1,62-1,72 (м, 2H), 1,80 (с, 3H), 1,88-1,96 (м, 1H), 1,98-2,06 (м, 1H), 3,16-3,26 (м, 2H), 3,41 (уш.с, 1H), 3,50-3,80 (м, 2H), 5,07 (с, 2H), 5,49 (с, 2H), 7,49 (д, J=8 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 8,16 (уш.с, 3H).
Пример 247
Гидрохлорид 4-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-6-оксо-6,7-дигидропурин-1-илметил]бензонитрила
Соединение, указанное в заголовке, синтезируют, используя трет-бутил [1-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат по способу, описанному в примере 243.
1Н-ЯМР (ДМСО-d6)
δ 1,58-1,70 (м, 2H), 1,79 (с, 3H), 1,84-2,04 (м, 2H), 3,08-3,20 (м, 2H), 3,36-3,70 (м, 3H), 3,89 (с, 3H), 4,88-5,02 (м, 2H), 5,22 (с, 2H), 7,39 (д, J=8 Гц, 2H), 7,79 (д, J=8 Гц, 2H), 8,14 (уш.с, 3H).
Пример 248
Соль 2-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамид трифторуксусной кислоты
(a) трет-Бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат
Растворяют 700 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 7,0 мл диметилсульфоксида и затем к раствору добавляют 114 мкл метилйодида и 299 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение 30 минут и к реакционному раствору добавляют 40 мл воды. Смесь перемешивают при комнатной температуре в течение 30 минут и образовавшийся белый осадок собирают путем фильтрации. Образовавшееся белое твердое вещество промывают водой и затем гексаном, получая 540 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,44 (с, 9H), 1,72-1,94 (м, 4H), 1,81 (т, J=2,4 Гц, 3H), 3,16-3,92 (м, 5H), 3,72 (с, 3H), 4,91 (дд, J=17,6, 2,4 Гц, 1H), 5,01 (д, J=17,6 Гц, 1H).
(b) Трифторацетат 2-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамида
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к этому раствору 10 мг салициламида и 10 мг карбоната калия. Смесь перемешивают при 100ºC в течение 2 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 5,54 мг соединения, указанного в заголовке.
МС m/e (ESI) 436 (MH+-CF3COOH).
Пример 249
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем к раствору добавляют 10 мг цианида натрия. Смесь перемешивают при 60ºC в течение 2 часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 3,67 мг соединения, указанного в заголовке.
МС m/e (ESI) 326 (MH+-CF3COOH).
Пример 250
Трифторацетат 8-(3-аминопиперидин-1-ил)-2-трет-бутилсульфанил-7-(2-бутинил)-1-метил-1,7-дигидропурин-6-она
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем к раствору добавляют 10 мг натриевой соли 2-метил-2-пропантиола. Смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 5,00 мг соединения, указанного в заголовке.
МС m/e (ESI) 389 (MH+-CF3COOH).
Пример 251
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-1-метил-1,7-дигидропурин-6-она
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,6 мл метанола и затем добавляют к раствору 8 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,14 мг соединения, указанного в заголовке.
МС m/e (ESI) 331 (MH+-CF3COOH).
Пример 252
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-диэтиламино-1-метил-1,7-дигидропурин-6-она
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 50 мкл диэтиламина. Смесь перемешивают при 60ºC в течение 4 часов. Добавляют 1 н. соляную кислоту к реакционному раствору и смесь экстрагируют этилацетатом. Органический слой концентрируют и образовавшийся остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,17 мг соединения, указанного в заголовке.
МС m/e (ESI) 372 (MH+-CF3COOH).
Пример 253
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-2-(пирролидин-1-ил)-1,7-дигидропурин-6-она
Используя пирролидин, вместо диэтиламина, получают 1,94 мг соединения, указанного в заголовке, по способу, описанному в примере 252.
МС m/e (ESI) 370 (MH+-CF3COOH).
Пример 254
Гидрохлорид 8-(3-метиламинопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
(a) трет-Бутил-N-метил-N-(пиперидин-3-ил)карбамат
Добавляют 0,4 г гидрида натрия (60%; суспензия в масле) к смеси, состоящей из 3,3 г 3-трет-бутоксикарбониламинопиперидин-1-карбоксилата, 0,75 мл метилйодида и 20 мл N,N-диметилформамида, в водяную баню при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - от 10 до 20% этилацетата в гексане, для того чтобы получить маслянистый материал (3,04 г). Все количество материала объединяют с 20 мл этанола и катализатором - 10% палладия на угле. Эту смесь перемешивают при комнатной температуре в атмосфере водорода в течение пяти часов. После удаления катализатора путем фильтрации фильтрат концентрируют, получая 1,82 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,46 (с, 9H), 1,48-1,64 (м, 2H), 1,72-1,84 (м, 2H), 2,43 (дт, J=3 Гц, 12 Гц, 1H), 2,60 (т, J=12 Гц, 1H), 2,75 (с, 3H), 2,74-3,02 (м, 2H), 3,86 (уш.с, 1H).
(b) трет-Бутил-N-[1-[7-(2-бутинил)-2,6-дихлоро-7H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамат
Соединение, указанное в заголовке, синтезируют, используя 7-(2-бутинил)-2,6,8-трихлор-7H-пурин и трет-бутилпиперидин-3-илкарбамата по способу, описанному в примере 242 (c).
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,70-2,02 (м, 7H), 2,83 (с, 3H), 3,00 (т, J=12 Гц, 1H), 3,14 (т, J=12 Гц, 1H), 3,96-4,25 (м, 3H), 4,80 (с, 2H).
(c) трет-Бутил-N-[1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамат
Смесь, состоящую из 580 мг трет-бутил-N-[1-[7-(2-бутинил)-2,6-дихлоро-7H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата, 315 мг ацетата натрия и 6 мл диметилсульфоксида, перемешивают в масляной бане при 120ºC в течение 7 часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния, фильтруют через небольшой слой силикагеля. Фильтрат концентрируют, остаток кристаллизуется из смеси этилацетат-гексан и получают 420 мг трет-бутил-N-[1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата. Смесь, состоящую из аликвоты (100 мг) полученного выше соединения, 0,17 мл метилйодида, 48 мг безводного карбоната калия и 0,5 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - 50% этилацетата в гексане, для того чтобы получить 104 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,47 (с, 9H), 1,62-1,74 (м, 1H), 1,81 (т, J=2 Гц, 3H), 1,82-1,96 (м, 3H), 2,82 (с, 3H), 2,86 (т, J=12 Гц, 1H), 3,02 (т, J=12 Гц, 1H), 3,68-3,82 (м, 2H), 3,72 (с, 3H), 4,20 (уш.с, 1H), 4,90 (с, 2H).
(d) Гидрохлорид 7-(2-бутинил)-1-метил-8-(3-метиламинопиперидин-1-ил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
Используя трет-бутил-N-[1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата, синтезируют соединение, указанное в заголовке, по способу, описанному в примере 242 (f) и (g).
1Н-ЯМР (ДМСО-d6)
δ 1,60-1,77 (м, 2H), 1,81 (с, 3H), 1,84-2,00 (м, 1H), 2,02-2,12 (м, 1H), 2,60 (т, J=5 Гц, 3H), 3,17-3,40 (м, 3H), 3,46-3,56 (м, 1H), 3,79 (д, J=12 Гц, 1H), 5,00-5,15 (м, 2H), 9,01 (уш.с, 2H).
Пример 255
Гидрохлорид 2-[7-(2-бутинил)-1-метил-8-(3-метиламинопиперидин-1-ил)-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамида
Смесь, состоящую из 20 мг трет-бутил-N-[1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата, 20 мг 2-гидроксибензамида, 20 мг безводного карбоната калия и 0,3 мл N-метил-2-пирролидона, перемешивают в масляной бане при 80ºC в течение 4 часов. Последующие стадии синтеза были проведены в соответствии с тем же самым способом, который использовался в примере 242 (f) и (g), для того чтобы получить соединение, указанное в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 1,69 (уш.с, 2H), 1,82 (с, 3H), 1,92 (уш.с, 1H), 2,07 (уш.с, 1H), 2,62 (с, 3H), 3,10-3,40 (м, 4H), 3,48 (с, 3H), 3,76 (уш.с, 1H), 5,02 (уш.с, 2H), 6,96 (уш.с, 2H), 7,44 (уш.с, 1H), 7,91 (уш.с, 1H), 8,81 (уш.с, 2H).
Пример 256
Гидрохлорид 8-(3-аминопирролидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила
Соединение, указанное в заголовке, синтезируют, используя трет-бутилпирролидин-3-илкарбамат, вместо трет-бутил-N-метил-N-(пиперидин-3-ил)карбамата в примере 254, по способу, описанному в примере 254 стадии (b), (c) и (d).
1Н-ЯМР (ДМСО-d6)
δ 1,81 (с, 3H), 2,13 (уш.с, 1H), 2,32 (уш.с, 1H), 3,64 (с, 3H), 3,74-3,86 (м, 2H), 3,93 (уш.с, 3H), 5,19 (д, J=18 Гц, 1H), 5,28 (д, J=18 Гц, 1H), 8,32 (уш.с, 3H).
Пример 257
Гидрохлорид 2-[8-(3-аминопирролидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамида
Соединение, указанное в заголовке, синтезируют, используя 2-гидроксибензамид по способу, описанному в примерах 255 и 256.
1Н-ЯМР (ДМСО-d6)
δ 1,82 (с, 3H), 2,11 (уш.с, 1H), 2,32 (уш.с, 1H), 3,46 (с, 3H), 3,72-4,00 (м, 5H), 5,15 (д, J=19 Гц, 1H), 5,23 (д, J=19 Гц, 1H), 6,90-7,02 (м, 2H), 7,42-7,50 (м, 1H), 7,90-7,99 (м, 1H), 8,22 (уш.с, 3H).
Пример 258
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) трет-Бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
Добавляют 0,299 г триэтиламина, 0,023 г 4-диметиламинопиридина и 0,645 г ди-трет-бутилдикарбоната к раствору 0,448 г трифторацетата 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она в 20 мл N,N-диметилформамида при комнатной температуре и смесь перемешивают в течение пяти часов. Затем добавляют к этому раствору 2 мл 5 н. водного раствора гидроксида натрия и смесь перемешивают в течение 1 часа. Реакционный раствор выливают в смесь 200 мл этилацетата и 100 мл насыщенного водного раствора хлорида аммония. Органический слой промывают два раза водой (100 мл) и затем насыщенным раствором хлорида натрия (100 мл). Органическую жидкость сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают 0,298 г соединения, указанного в заголовке, из фракции, элюированной этилацетатом.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 3,41 (м, 4H), 3,63 (м, 4H), 5,06 (кв, J=2,3 Гц, 2H), 8,17 (с, 1H), 9,92 (уш.с, 1H).
(b) Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Добавляют 0,005 г карбоната калия и 0,003 мл 3-бром-1-пропина к раствору 0,010 г трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 0,5 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 10 часов. Добавляют к реакционному раствору 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и образовавшийся остаток растворяют в смеси, состоящей из 0,5 мл дихлорметана и 0,5 мл трифторуксусной кислоты. Смесь перемешивают в течение 1 часа и затем концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,011 г соединения, указанного в заголовке.
МС m/e (ESI) 311,29 (MH+-CF3COOH).
Пример 259
Трифторацетат [3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромацетонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 312,28 (MH+-CF3COOH).
Пример 260
Трифторацетат 3-(2-бутинил)-5-(2-гидроксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтанола по способу, описанному в примере 258(b).
МС m/e (ESI) 317,30 (MH+-CF3COOH).
Пример 261
Трифторацетат 3-(2-бутинил)-5-(2-метоксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромэтилметилового эфира по способу, описанному в примере 258(b).
МС m/e (ESI) 331,32 (MH+-CF3COOH).
Пример 262
Трифторацетат этил [3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этилбромацетата по способу, описанному в примере 258(b).
МС m/e (ESI) 359,13 (MH+-CF3COOH).
Пример 263
Трифторацетат 3-(2-бутинил)-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и (2-бромэтил)бензола по способу, описанному в примере 258(b).
МС m/e (ESI) 377,34 (MH+-CF3COOH).
Пример 264
Трифторацетат 3-(2-бутинил)-5-(2-феноксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтилфенилового эфира по способу, описанному в примере 258(b).
МС m/e (ESI) 393,32 (MH+-CF3COOH).
Пример 265
Трифторацетат 3-(2-бутинил)-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 258(b).
МС m/e (ESI) 391,32 (MH+-CF3COOH).
Пример 266
Трифторацетат 3-(2-бутинил)-5-[2-(3-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-3'-метоксиацетофенона по способу, описанному в примере 258(b).
МС m/e (ESI) 421,33 (MH+-CF3COOH).
Пример 267
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,81 (т, J=2,5 Гц, 3H), 3,45-3,49 (м, 4H), 3,66-3,70 (м, 4H), 5,15 (кв, J=2,5 Гц, 2H), 5,62 (с, 2H), 7,34 (дд, J=7,6, 1,5 Гц, 1H), 7,45 (тд, J=7,6, 1,5 Гц, 1H), 7,59 (тд, J=7,6, 1,7 Гц, 1H), 7,75 (дд, J=7,6, 1,7 Гц, 1H), 8,25 (с, 1H).
Масс-спектр m/e (ESI) 388,32 (MH+-CF3COOH).
Пример 268
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(2-трифторметилбензил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-(трифторметил)бензилбромида по способу, описанному в примере 258(b).
МС m/e (ESI) 431,21 (MH+-CF3COOH).
Пример 269
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(3-трифторметилбензил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-(трифторметил)бензилбромида по способу, описанному в примере 258(b).
МС m/e (ESI) 431,23 (MH+-CF3COOH).
Пример 270
Трифторацетат 3-(2-бутинил)-5-(2-нитробензил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-нитробензилбромида по способу, описанному в примере 258(b).
МС m/e (ESI) 408,25 (MH+-CF3COOH).
Пример 271
Трифторацетат 3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-бромметилбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 388,27 (MH+-CF3COOH).
Пример 272
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметилбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 388,29 (MH+-CF3COOH).
Пример 273
Трифторацетат метил-3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензоата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-3-(бромметил)бензоата по способу, описанному в примере 258(b).
МС m/e (ESI) 421,29 (MH+-CF3COOH).
Пример 274
Трифторацетат метил-4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензоата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-4-(бромметил)бензоата по способу, описанному в примере 258(b).
МС m/e (ESI) 421,31 (MH+-CF3COOH).
Пример 275
Трифторацетат этил-5-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]фуран-2-карбоксилата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этил-5-(бромметил)фуран-2-карбоксилата по способу, описанному в примере 258(b).
МС m/e (ESI) 425,30 (MH+-CF3COOH).
Пример 276
Трифторацетат 3-(2-бутинил)-5-[2-(2-нитрофенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-2'-нитроацетофенона по способу, описанному в примере 258(b).
MC m/e (ESI) 436,28 (MH+-CF3COOH).
Пример 277
Трифторацетат 4-[2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетил]бензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-4'-цианоацетофенона по способу, описанному в примере 258(b).
МС m/e (ESI) 416,31 (MH+-CF3COOH).
Пример 278
Трифторацетат 3-(2-бутинил)-5-[2-(4-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-4'-метоксиацетофенона по способу, описанному в примере 258(b).
МС m/e (ESI) 421,32 (MH+-CF3COOH).
Пример 279
Трифторацетат 3-(2-бутинил)-5-[2-(2-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-2'-метоксиацетофенона по способу, описанному в примере 258(b).
МС m/e (ESI) 421,33 (MH+-CF3COOH).
Пример 280
Трифторацетат 4-[2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]этил]бензойной кислоты
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и трет-бутил-4-(2-бромэтил)бензоата по способу, описанному в примере 258(b).
МС m/e (ESI) 421,33 (MH+-CF3COOH).
Пример 281
Бистрифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(пиридин-2-илметил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 2-(хлорметил)пиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 364,24 (MH+-2CF3COOH).
Пример 282
Бистрифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(пиридин-3-илметил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 3-(хлорметил)пиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 364,30 (MH+-2CF3COOH).
Пример 283
Бистрифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(пиридин-4-илметил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 4-(хлорметил)пиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 364,26 (MH+-2CF3COOH).
Пример 284
Бистрифторацетат 3-(2-бутинил)-5-[2-оксо-2-(пиридин-2-ил)этил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидробромида 2-(2-бромацетил)пиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 392,27 (MH+-2CF3COOH).
Пример 285
Бистрифторацетат 3-(2-бутинил)-5-[2-оксо-2-(пиридин-3-ил)этил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидробромида 3-(2-бромацетил)пиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 392,27 (MH+-2CF3COOH).
Пример 286
Бистрифторацетат 3-(2-бутинил)-5-[2-оксо-2-(пиридин-4-ил)этил]-2-оксоэтил]]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидробромида 4-(2-бромацетил)пиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 392,28 (MH+-2CF3COOH).
Пример 287
Трифторацетат 3-(2-бутинил)-5-(2-метоксипиридин-3-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-(хлорметил)-2-метоксипиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 394,30 (MH+-CF3COOH).
Пример 288
Бистрифторацетат метил-6-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]никотината
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-6-(хлорметил)никотината по способу, описанному в примере 258(b).
МС m/e (ESI) 422,31 (MH+-CF3COOH).
Пример 289
Трифторацетат 5-(6-аминопиридин-3-илметил)-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-(трет-бутоксикарбониламино)-5-(бромметил)пиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 379,31 (MH+-CF3COOH).
Пример 290
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-циано-5-этокси-N-метилбензамида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3-циано-5-этокси-N-метилбензамида по способу, описанному в примере 258(b).
МС m/e (ESI) 489,35 (MH+-CF3COOH).
Пример 291
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3,5-дициано-N-метилбензамида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3,5-дициано-N-метилбензамида по способу, описанному в примере 258(b).
МС m/e (ESI) 470,33 (MH+-CF3COOH).
Пример 292
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-циано-5-фтор-N-метилбензамида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3-циано-5-фтор-N-метилбензамида по способу, описанному в примере 258(b).
МС m/e (ESI) 463,33 (MH+-CF3COOH).
Пример 293
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо-[4,5-d]пиридазин-5-илметил]-5-циано-2-этокси-N-метилбензамида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-5-циано-2-этокси-N-метилбензамида по способу, описанному в примере 258(b).
МС m/e (ESI) 489,35 (MH+-CF3COOH).
Пример 294
Трифторацетат 5-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-2-фторбензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 5-бромметил-2-фторбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 406,15 (MH+-CF3COOH).
Пример 295
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-5-фторбензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметил-5-фторбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 406,16 (MH+-CF3COOH).
Пример 296
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-фторбензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3-фторбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 406,23 (MH+-CF3COOH).
Пример 297
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-фторбензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметил-3-фторбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 406,25 (MH+-CF3COOH).
Пример 298
Трифторацетат 3-(2-бутинил)-5-(изохинолин-1-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 1-бромметилизохинолина по способу, описанному в примере 258(b).
1Н-ЯМР (CDCl3)
δ 1,80 (т, J=2,4 Гц, 3H), 3,46 (м, 4H), 3,68 (м, 4H), 5,17 (кв, J=2,4 Гц, 2H), 6,22 (с, 2H), 7,94 (дд, J=8,2, 8,0 Гц, 1H), 8,08 (т, J=8,2 Гц, 1H), 8,21 (д, J=8,0 Гц, 1H), 8,24 (д, J=6,4 Гц, 1Н), 8,27 (с, 1H), 8,46 (д, J=6,4 Гц, 1H), 8,68 (д, J=8,2 Гц, 1H).
MC m/e (ESI) 414,32 (MH+-CF3COOH).
Пример 299
Трифторацетат 3-(2-бутинил)-5-(2-фторпиридин-3-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 3-(бромметил)-2-фторпиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 384,22 (MH+-CF3COOH).
Пример 300
Трифторацетат 3-(2-бутинил)-5-(2-фторпиридин-4-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 4-(бромметил)-2-фторпиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 384,20 (MH+-CF3COOH).
Пример 301
Трифторацетат 3-(2-бутинил)-5-(6-фторпиридин-2-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 2-(бромметил)-6-фторпиридина по способу, описанному в примере 258(b).
МС m/e (ESI) 384,22 (MH+-CF3COOH).
Пример 302
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензамида
Добавляют 0,005 г карбоната калия и 0,007 г 2-бромметилбензонитрила к раствору, содержащему 0,010 г трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 0,5 мл N,N-диметилформамида, и смесь перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору добавляют 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и остаток растворяют в 1,0 мл метанола. К этому раствору добавляют 0,2 мл водного раствора аммиака и 0,2 мл 31% водного раствора пероксида водорода и смесь перемешивают при 5ºC в течение 20 часов. Добавляют к реакционному раствору 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и образовавшийся остаток растворяют в смеси, состоящей из 0,5 мл дихлорметана и 0,5 мл трифторуксусной кислоты. Смесь перемешивают в течение 1 часа и затем концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 0,009 г соединения, указанного в заголовке.
МС m/e (ESI) 406,28 (MH+-CF3COOH).
Пример 303
Трифторацетат 3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензамида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-бромметилбензонитрила по способу, описанному в примере 302.
МС m/e (ESI) 406,30 (MH+-CF3COOH).
Пример 304
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензамида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметилбензонитрила по способу, описанному в примере 302.
МС m/e (ESI) 406,31 (MH+-CF3COOH).
Пример 305
Трифторацетат 3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензойной кислоты
Добавляют 0,005 г карбоната калия и 0,008 г метил-3-(бромметил)бензоата к раствору 0,010 г трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 0,5 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 20 часов. В реакционную смесь добавляют 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и остаток растворяют в 1,0 мл метанола. Добавляют к этому раствору 0,1 мл 5 н. водного раствора гидроксида натрия и смесь перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору добавляют 1 мл этилацетата и 1 мл воды. Раствор подкисляют, используя концентрированную соляную кислоту, и слои разделяют. Органический слой концентрируют и остаток растворяют в смеси, состоящей из 0,5 мл дихлорметана и 0,5 мл трифторуксусной кислоты. Смесь перемешивают в течение 1 часа и затем концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 0,008 г соединения, указанного в заголовке.
МС m/e (ESI) 407,29 (MH+-CF3COOH).
Пример 306
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензойной кислоты
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-4-(бромметил)бензоата по способу, описанному в примере 305.
МС m/e (ESI) 407,30 (MH+-CF3COOH).
Пример 307
Трифторацетат 5-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]фуран-2-карбоновой кислоты
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этил-5-(бромметил)фуран-2-карбоксилата по способу, описанному в примере 305.
МС m/e (ESI) 397,28 (MH+-CF3COOH).
Пример 308
Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) трет-Бутил-4-(1-бензил-6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и бензилбромида по способу, описанному в примере 116(d).
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 3,13-3,18 (м, 4H), 3,50-3,54 (м, 4H), 4,72 (с, 2H), 5,61 (с, 2H), 5,65 (с, 2H), 7,20-7,35 (м, 10H), 8,22 (с, 1H).
(b) Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем обработки трет-бутил-4-(1-бензил-6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата по способу, описанному в примере 117.
1Н-ЯМР (CD3OD)
δ 3,31-3,37 (м, 4H), 3,40-3,46 (м, 4H), 5,68 (с, 2H), 7,22-7,36 (м, 5H), 8,25 (с, 1H).
MC m/e (ESI), 311,24 (MH+-CF3COOH).
Пример 309
Трифторацетат 3-бензил-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) трет-Бутил-4-(1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трифторацетата 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она по способу, описанному в примере 258(a).
1Н-ЯМР (CDCl3)
δ 1,47 (с, 9H), 3,12-3,16 (м, 4H), 3,47-3,52 (м, 4H), 5,58 (с, 2H), 7,20-7,34 (м, 5H), 8,20 (с, 1H), 10,04 (уш.с, 1H).
(b) Трифторацетат 3-бензил-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и метилйодида по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 3,29-3,35 (м, 4H), 3,36-3,41 (м, 4H), 3,83 (с, 3H), 5,68 (с, 2H), 7,21-7,34 (м, 5H), 8,20 (с, 1H).
MC m/e (ESI) 325,01 (MH+-CF3COOH).
Пример 310
Трифторацетат 3-бензил-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 3,31-3,36 (м, 4H), 3,44-3,49 (м, 4H), 5,69 (с, 2H), 5,77 (с, 2H), 7,22-7,52 (м, 8H), 8,06 (д, J=9,3 Гц, 2H), 8,32 (с, 1H).
MC m/e (ESI) 429,39 (MH+-CF3COOH).
Пример 311
Трифторацетат 3-бензил-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и (2-бромэтил)бензола по способу, описанному в примере 258(b).
1Н-ЯМР (CDCl3)
δ 3,11 (т, J=8,1 Гц, 2H), 3,24-3,29 (м, 4H), 3,37-3,42 (м, 4H), 4,46 (т, J=8,1 Гц, 2H), 5,58 (с, 2H), 7,09-7,34 (м, 10H), 8,20 (с, 1H).
MS m/e (ESI), 415,54 (MH+-CF3COOH).
Пример 312
Трифторацетат 3-бензил-5-(2-феноксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтилфенилового эфира по способу, описанному в примере 258(b).
1Н-ЯМР (CDCl3)
δ 3,21-3,24 (м, 4H), 3,37-3,42 (м, 4H), 4,37 (т, J=5,8 Гц, 2H), 4,64 (т, J=5,8 Гц, 2H), 5,58 (с, 2H), 6,86-6,94 (м, 3H), 7,07-7,34 (м, 7H), 8,21 (с, 1H).
MC m/e (ESI) 431,57 (MH+-CF3COOH).
Пример 313
Трифторацетат 3-бензил-2-(пиперазин-1-ил)-5-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-бром-1-пропина по способу, описанному в примере 258(b).
МС m/e (ESI) 349,31 (MH+-CF3COOH).
Пример 314
Трифторацетат [3-бензил-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромацетонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 350,30 (MH+-CF3COOH).
Пример 315
Трифторацетат 3-бензил-5-(2-гидроксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтанола по способу, описанному в примере 258(b).
МС m/e (ESI) 355,32 (MH+-CF3COOH).
Пример 316
Трифторацетат 3-бензил-5-(2-метоксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромэтилметилового эфира по способу, описанному в примере 258(b).
МС m/e (ESI) 369,35 (MH+-CF3COOH).
Пример 317
Трифторацетат этил [3-бензил-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этилбромацетата по способу, описанному в примере 258(b).
МС m/e (ESI) 397,33 (MH+-CF3COOH).
Пример 318
Трифторацетат 3-бензил-5-[2-(3-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-3'-метоксиацетофенона по способу, описанному в примере 258(b).
МС m/e (ESI) 459,34 (MH+-CF3COOH).
Пример 319
Трифторацетат 2-[3-бензил-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 326,33 (MH+-CF3COOH).
Пример 320
Трифторацетат 5-метил-2-(пиперазин-1-ил)-3-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 3-бром-1-пропина по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 2,99 (т, J=3,3 Гц, 1H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 3,83 (с, 3H), 5,75 (д, J=3,3 Гц, 2H), 8,20 (с, 1H).
MC m/e (ESI) 273,1 (MH+-CF3COOH).
Пример 321
Трифторацетат 3-(2-бутенил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 1-бром-2-бутена по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,69 и 1,84 (дд, J=6,3, 1,3 Гц, и дд, J=6,3, 1,3 Гц, 3H), 3,43-3,48 (м, 4H), 3,54-3,58 (м, 4H), 3,82 и 3,84 (с, 3H), 4,94 и 5,07 (д, J=6,5 Гц, и д, J=6,5 Гц, 2H), 5,63-5,80 и 6,11-6,20 (м, 2H), 8,19 и 8,22 (с, 1H).
MC m/e (ESI), 289,2 (MH+-CF3COOH).
Пример 322
Трифторацетат 5-метил-3-(2-пентенил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 1-бром-2-пентена по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 0,97 и 1,08 (т, J=7,7 Гц, и т, J=7,7 Гц, 3H), 2,04-2,27 (м, 2H), 3,42-3,46 (м, 4H), 3,54-3,58 (м, 4H), 3,81 и 3,84 (с, 3H), 4,91-4,96 (м, 2H), 5,59-5,81 и 6,14-6,22 (м, 2H), 8,19 и 8,22 (с, 1H)
MC m/e (ESI) 303,25 (MH+-CF3COOH).
Пример 323
Трифторацетат 5-метил-3-(3-метил-2-бутенил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 1-бром-3-метил-2-бутена по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,75 (с, 3H), 1,83 (с, 3H), 3,43-3,47 (м, 4H), 3,52-3,57 (м, 4H), 3,84 (с, 3H), 5,00 (д, J=6,8 Гц, 2H), 5,40-5,45 (м, 1H), 8,17 (с, 1H).
MC m/e (ESI) 303,27 (MH+-CF3COOH).
Пример 324
Трифторацетат 3-циклопропилметил-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и циклопропилметилбромида по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 0,44-0,55 (м, 4H), 0,81-0,85 (м, 1H), 3,42-3,46 (м, 4H), 3,54-3,58 (м, 4H), 3,83 (с, 3H), 4,39 (д, J=6,6 Гц, 2H), 8,21 (с, 1H).
MC m/e (ESI) 289,25 (MH+-CF3COOH).
Пример 325
Бистрифторацетат 5-[2-(2-аминофенил)-2-оксоэтил]-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) трет-Бутил-4-[1-(2-бутинил)-6-[2-(2-нитрофенил)-2-оксоэтил]-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-2'-нитроацетофенона по способу, описанному в примере 258(b).
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,37-3,44 (м, 4H), 3,50-3,55 (м, 4H), 5,04 (кв, J=2,3 Гц, 2H), 5,44 (с, 2H), 7,62 (м, 1H), 7,71-7,74 (м, 2H), 8,13 (д, J=7,9 Гц, 1H), 8,21 (с, 1H).
(b) Бистрифторацетат 5-[2-(2-аминофенил)-2-оксоэтил]-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Добавляют 2 мл воды, 0,070 г железа и 0,007 г хлорида аммония к раствору 0,058 г трет-бутил-4-[1-(2-бутинил)-6-[2-(2-нитрофенил)-2-оксоэтил]-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 5 мл этанола и смесь кипятят с обратным холодильником в течение трех часов. Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Остаток растворяют в 4 мл дихлорметана и добавляют к раствору 4 мл трифторуксусной кислоты. После перемешивания смеси в течение двух часов раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,051 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,82 (т, J=2,3 Гц, 3H), 3,45-3,50 (м, 4H), 3,68-3,72 (м, 4H), 5,16 (кв, J=2,3 Гц, 2H), 5,68 (с, 2H), 6,56 (т, J=7,2 Гц, 1H), 6,67 (д, J=7,2 Гц, 1H), 7,30 (т, J=7,2 Гц, 1H), 7,85 (д, J=7,2 Гц, 1H), 8,25 (с, 1H).
MC m/e (ESI) 406,22 (MH+-CF3COOH).
Пример 326
Трифторацетат 3-(2-бутинил)-5,7-диметил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 0,5 мл 0,3 M тетрагидрофуранового раствора метилмагнийбромида в 3 мл тетрагидрофуранового раствора 0,050 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата при температуре -70ºC в атмосфере азота и дают смеси нагреться до комнатной температуры. Добавляют к этому раствору 10 мл 5% водного раствора хлорида аммония и смесь экстрагируют 30 мл этилацетата. Органический слой последовательно промывают 10 мл воды и 10 мл насыщенного раствора хлорида натрия, затем сушат над сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (1:1), 0,049 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,37 (т, J=7,1 Гц, 3H), 1,47 (д, J=6,9 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 3,17-3,22 (м, 4H), 3,55-3,59 (м, 4H), 3,84 (д, J=6,9 Гц, 1H), 4,38 (кв, J=7,1 Гц, 2H), 4,78 (кв, J=2, 3 Гц, 2H), 5,12 (кв, J=6,9 Гц, 1H).
(b) трет-Бутил-4-[4-ацетил-1-(2-бутинил)-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(g).
1Н-ЯМР (CDCl3)
δ 1,38 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,79 (т, J=2,3 Гц, 3H), 2,53 (с, 3H), 3,14-3,18 (м, 4H), 3,56-3,60 (м, 4H), 4,38 (кв, J=7,1 Гц, 2H), 4,77 (кв, J=2,3 Гц, 2H).
(c) Трифторацетат 3-(2-бутинил)-5,7-диметил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Добавляют 0,15 мл метилгидразина к раствору 0,019 г трет-бутил[4-ацетил-1-(2-бутинил)-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 3 мл этанола и смесь нагревают при 110ºC в течение 25 часов. Раствор концентрируют при пониженном давлении. Остаток растворяют в 0,5 мл дихлорметана и добавляют к раствору 0,5 мл трифторуксусной кислоты. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,017 г соединения, указанного в заголовке.
МС m/e (ESI) 301,33 (MH+-CF3COOH).
Пример 327
Трифторацетат 3-(2-бутинил)-7-фенил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксифенилметил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата и фенилмагнийбромида по способу, описанному в примере 326(a).
1Н-ЯМР (CDCl3)
δ 1,33 (т, J=7,3 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,2 Гц, 3H), 3,16-3,27 (м, 4H), 3,55-3,59 (м, 4H), 4,24-4,34 (м, 2H), 4,39 (д, J=8,3 Гц, 1H), 4,78 (кв, J=2,2 Гц, 2H), 6,09 (д, J=8,3 Гц, 1H), 7,22 (т, J=8,0 Гц, 1H), 7,30 (т, J=8,0 Гц, 2H), 7,41 (д, J=8,0 Гц, 2H).
(b) трет-Бутил-4-[4-бензоил-1-(2-бутинил)-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксифенилметил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(g).
1Н-ЯМР (CDCl3)
δ 0,92 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,22-3,28 (м, 4H), 3,57-3,62 (м, 4H), 4,03 (кв, J=7,1 Гц, 2H), 4,88 (кв, J=2,3 Гц, 2H), 7,43 (т, J=8,1 Гц, 2H), 7,55 (т, J=8,1 Гц, 1H), 7,92 (д, J=8,l Гц, 2H).
(c) трет-Бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксифенилметил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата и гидразина по способу, описанному в примере 115(h).
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,44-3,48 (м, 4H), 3,63-3,67 (м, 4H), 5,15 (кв, J=2,3 Гц, 2H), 7,40-7,50 (м, 3H), 8,34 (д, J=8,1 Гц, 2H), 10,70 (с, 1H).
(d) Трифторацетат 3-(2-бутинил)-7-фенил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(i).
МС m/e (ESI) 349,30 (MH+-CF3COOH).
Пример 328
Трифторацетат 3-(2-бутинил)-5-метил-7-фенил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метилйодида по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,83 (т, J=2,4 Гц, 3H), 3,47-3,51 (м, 4H), 3,71-3,75 (м, 4H), 3,92 (с, 3H), 5,22 (кв, J=2,4 Гц, 2H), 7,43-7,48 (м, 3H), 8,35 (д, J=8,1 Гц, 2H).
MC m/e (ESI) 363,31 (MH+-CF3COOH).
Пример 329
Трифторацетат [3-(2-бутинил)-4-оксо-7-фенил-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]уксусной кислоты
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и трет-бутилбромацетата по способу, описанному в примере 258(b).
МС m/e (ESI) 407,29 (MH+-CF3COOH).
Пример 330
Трифторацетат 2-[3-(2-бутинил)-4-оксо-7-фенил-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).
МС m/e (ESI) 464,33 (MH+-CF3COOH).
Пример 331
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-7-трифторметил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(2,2,2-трифтор-1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 0,065 г цинка и раствор 0,200 г трифторметилйодида в 2 мл N,N-диметилформамида к раствору 0,155 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 3 мл N,N-диметилформамида в атмосфере азота и смесь перемешивают при обработке ультразвуком в течение 30 минут. К смеси добавляют 30 мл этилацетата и 30 мл 5%-ного раствора хлорида аммония. Органический слой промывают два раза водой (20 мл) и затем 20 мл насыщенного раствора хлорида натрия, и сушат над сульфатом магния. Органическую жидкость концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью этилацетат-гексан (1:9), получают 0,013 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,39 (т, J=6,9 Гц, 3H), 1,48 (с, 9H), 1,83 (т, J=2,4 Гц, 3H), 3,15-3,26 (м, 4H), 3,55-3,60 (м, 4H), 4,34 (кв кв, J=10,2, 6,9 Гц, 2H), 4,53-4,64 (уш.с, 1H), 4,83 (кв кв, J=17,6, 2,4 Гц, 2H), 5,39-5,47 (уш.с, 1H).
(b) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-7-трифторметил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Добавляют 0,060 г реактива Dess-Martin к раствору 0,013 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(2,2,2-трифтор-1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 4 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к этому раствору 5 мл дихлорметана, 10 мл насыщенного водного раствора бикарбоната натрия и 0,100 г гидросульфита натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток растворяют в 4 мл этанола и добавляют к раствору 0,2 мл метилгидразина. Смесь нагревают при 110ºC в течение 20 часов. Раствор концентрируют при пониженном давлении. Остаток растворяют в 0,5 мл дихлорметана и добавляют к раствору 0,5 мл трифторуксусной кислоты. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,008 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,71-3,75 (м, 4H), 3,87 (с, 3H), 5,18 (кв, J=2,3 Гц, 2H).
MC m/e (ESI) 355,16 (MH+-CF3COOH).
Пример 332
Трифторацетат 1-(2-бутинил)-6-метил-7-оксо-2-(пиперазин-1-ил)-6,7-дигидроимидазо[4,5-d]пиридазин-4-карбоксамида
(a) трет-Бутил-4-[1-(2-бутинил)-4-(цианогидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 0,200 г цианида натрия и 0,010 мл уксусной кислоты к раствору трет-бутил-4-[1-(2-бутинил)-5-метоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 15 мл ацетонитрила и смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют к раствору 100 мл этилацетата и смесь промывают два раза водой (50 мл) и затем 50 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 0,274 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2,5 Гц, 3H), 3,19-3,23 (м, 4H), 3,56-3,60 (м, 4H), 3,95 (с, 3H), 4,68 (д, J=9,0 Гц, 1H), 4,82 (кв, J=2,5 Гц, 2H), 5,72 (д, J=9,0 Гц, 1H).
(b) трет-Бутил-4-[1-(2-бутинил)-4-(карбамоилгидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 3,2 мл 30% водного раствора пероксида водорода и 3,2 мл 28% водного раствор аммиака к раствору 0,274 г трет-бутил-4-[1-(2-бутинил)-4-(цианогидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 8 мл метанола при 5ºC и смесь перемешивают в течение 15 часов. В этот раствор добавляют 100 мл насыщенного раствора гидросульфита натрия и смесь экстрагируют два раза 100 мл этилацетата. Органические слои объединяют. Объединенные органические слои сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью метанол-этилацетат (1:9), 0,039 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,83 (т, J=2,5 Гц, 3H), 3,13-3,25 (м, 4H), 3,54-3,57 (м, 4H), 3,91 (с, 3H), 4,33-4,37 (уш.с, 1H), 4,77 (кв, J=2,5 Гц, 2H), 5,54 (с, 1H), 5,63 (с, 1H), 6,82 (с, 1H).
(c) трет-Бутил-4-[4-аминооксалил-1-(2-бутинил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 0,051 мл триэтиламина и раствор 0,058 г комплекса триоксид серы-пиридин в 1 мл диметилсульфоксида к раствору 0,038 г трет-бутил-4-[1-(2-бутинил)-4-(карбамоилгидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 2 мл дихлорметана при 0ºC и смесь перемешивают при комнатной температуре в течение 15 часов. Затем добавляют 0,102 мл триэтиламина и раствор 0,116 г комплекса триоксид серы-пиридин в 1 мл диметилсульфоксида и смесь перемешивают при комнатной температуре в течение 8 часов. Добавляют к раствору 50 мл этилацетата и органический слой промывают последовательно водным раствором 1% серной кислоты (20 мл), насыщенным раствором бикарбоната натрия (20 мл) и насыщенным раствором хлорида натрия (20 мл). Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:1), 0,021 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,82 (т, J=2,5 Гц, 3H), 3,19-3,23 (м, 4H), 3,56-3,59 (м, 4H), 3,84 (с, 3H), 4,84 (кв, J=2,5 Гц, 2H), 5,62 (уш.с, 1H), 7,02 (уш.с, 1H).
(d) трет-Бутил-4-[1-(2-бутинил)-4-карбамоил-6-метил-7-оксо-6,7-дигидро-1H-дигидроимидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[4-аминооксалил-1-(2-бутинил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(h).
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 3,46-3,50 (м, 4H), 3,63-3,66 (м, 4H), 3,99 (с, 3H), 5,12 (кв, J=2,3 Гц, 2H), 6,16 (с, 1H), 8,85 (с, 1H).
(e) Трифторацетат 1-(2-бутинил)-6-метил-7-оксо-2-(пиперазин-1-ил)-6,7-дигидроимидазо[4,5-d]пиридазин-4-карбоксамида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-4-карбамоил-6-метил-7-оксо-6,7-дигидро-1H-дигидроимидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(i).
МС m/e (ESI) 330,18 (MH+-CF3COOH).
Пример 333
Трифторацетат 1-(2-бутинил)-6-метил-7-оксо-2-(пиперазин-1-ил)-6,7-дигидроимидазо[4,5-d]пиридазин-4-карбонитрила
Добавляют 0,030 мл триэтиламина и 0,015 мл оксихлорида фосфора к раствору 0,015 г трет-бутил-4-[1-(2-бутинил)-4-карбамоил-6-метил-7-оксо-6,7-дигидро-1H-дигидроимидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 1 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к этому раствору 1 мл дихлорметана и 1 мл трифторуксусной кислоты. Спустя один час раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,001 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,74-3,78 (м, 4H), 3,88 (с, 3H), 5,18 (кв, J=2,3 Гц, 2H).
MC m/e (ESI) 312,25 (MH+-CF3COOH).
Пример 334
Трифторацетат 3-(2-бутинил)-7-диметиламино-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) 1-Бензил-7-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
Добавляют 0,604 г карбоната калия и 0,297 мл метилйодида к раствору 1,035 г 1-бензил-7-хлор-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 30 мл N,N-диметилформамида (J. A. Carbon, Journal of the American Chemical Society, 80, p. 6083, 1958) и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к раствору 300 мл этилацетата и 100 мл воды и органический слой промывают два раза водой (100 мл) и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной этилацетатом, 0,280 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 3,86 (с, 3H), 5,64 (с, 2H), 7,11-7,16 (м, 2H), 7,35-7,43 (м, 3H), 7,90 (с, 1H).
(b) 1-Бензил-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
Добавляют 2 мл водного раствора 50% диметиламина к раствору 0,138 г 1-бензил-7-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 2 мл этанола и смесь нагревают при 130ºC в течение 72 часов. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью метанол-этилацетат (1:19), 0,139 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 2,73 (с, 6H), 3,79 (с, 3H), 5,59 (с, 2H), 7,12-7,16 (м, 2H), 7,30-7,39 (м, 3H), 7,79 (с, 1H).
(c) 1-Бензил-2-хлор-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
Добавляют 1,15 мл 1 M раствора дибутилмагния в тетрагидрофуране к раствору 0,320 мл диизопропиламина в 2 мл тетрагидрофурана при комнатной температуре в атмосфере азота и смесь перемешивают в течение 8 часов. Этот раствор добавляют к раствору 0,162 г 1-бензил-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 4 мл тетрагидрофурана при комнатной температуре в атмосфере азота и смесь перемешивают при комнатной температуре в течение 15 часов. Затем в этот раствор добавляют по каплям раствор 0,540 г гексахлорэтана в 5 мл тетрагидрофурана. После перемешивания смеси в течение 4 часов в нее добавляют 30 мл 5% водного раствора хлорида аммония. Смесь экстрагируют этилацетатом (100 мл). Органический слой промывают последовательно водой (30 мл) и 30 мл насыщенного раствора хлорида натрия и сушат над сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (2:1), 0,094 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 2,68 (с, 6H), 3,78 (с, 3H), 5,60 (с, 2H), 7,05-7,08 (м, 2H), 7,29-7,37 (м, 3H).
(d) трет-Бутил-4-[1-бензил-7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования 1-бензил-2-хлор-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она по способу, описанному в примере 116(c).
1Н-ЯМР (CDCl3)
δ 1,47 (с, 9H), 2,68 (с, 6H), 3,19-3,22 (м, 4H), 3,41-3,46 (м, 4H), 3,76 (с, 3H), 5,40 (с, 2H), 6,88 (м, 2H), 7,20-7,25 (м, 3H).
(e) трет-Бутил-4-[7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
Добавляют раствор 0,117 г трет-бутил-4-[1-бензил-7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 5 мл тетрагидрофурана к 15 мл жидкого аммиака и добавляют к смеси при кипячении с обратным холодильником 0,009 г лития. Добавляют к раствору 1 мл 5%-ного водного раствора хлорида аммония и растворитель выпаривают. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,007 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,48 (с, 9H), 3,11 (с, 6H), 3,55-3,58 (м, 8H), 3,69 (с, 3H).
(f) Трифторацетат 3-(2-бутинил)-7-диметиламино-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 1-бром-2-бутина по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,80 (т, J=2,3 Гц, 3H), 2,75 (с, 6H), 3,44-3,48 (м, 4H), 3,62-3,65 (м, 4H), 3,68 (с, 3H), 5,16 (кв, J=2,3 Гц, 2H).
MC m/e (ESI) 330,16 (MH+-CF3COOH).
Пример 335
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) Трифторацетат 5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Добавляют 2,71 г хлорида железа (III) к раствору 0,292 г 4,5-диамино-2-метил-2H-пиридазин-3-она в 16 мл этанола [CAS No. 4725-76-2] (Martine Beljean-Leymarie, Michel Pays и Jean-Claude Richer, Canadian Journal of Chemistry 61, p. 2563, 1983) и 0,426 г трет-бутил-4-формилпиперидин-1-карбоксилата и смесь нагревают с обратным холодильником в течение 6 часов. Реакционный раствор охлаждают до комнатной температуры. Раствор фильтруют и концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,061 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 2,06-2,17 (м, 2H), 2,28-2,35 (м, 2H), 3,15-3,24 (м, 2H), 3,29-3,35 (м, 1H), 3,50-3,56 (м, 2H), 3,85 (с, 3H), 8,28 (с, 1H).
(b) трет-Бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трифторацетата 5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она по способу, описанному в примере 258(a).
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 2,00-2,16 (м, 4H), 2,85-2,99 (уш.с, 2H), 3,23 (тт, J=11,9, 4,0 Гц, 1H), 3,95 (с, 3H), 4,11-4,40 (уш.с, 2H), 8,39 (с, 1H), 13,90 (с, 1H).
(c) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперидин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-1-карбоксилата по способу, описанному в примере 119(d).
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 1,93-2,00 (м, 4H), 2,85-2,96 (уш.с, 2H), 3,14 (кв, J=7,9 Гц, 1H), 3,85 (с, 3H), 4,16-4,37 (уш.с, 2H), 5,39 (кв, J=2,3 Гц, 2H), 8,24 (с, 1H).
(d) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперидин-1-карбоксилата по способу, описанному в примере 115(i).
1Н-ЯМР (CD3OD)
δ 1,80 (т, J=2,3 Гц, 3H), 2,10-2,11 (м, 2H), 2,25-2,32 (м, 2H), 3,18-3,41 (м, 3H), 3,56-3,61 (м, 2H), 3,83 (с, 3H), 5,47 (т, J=2,3 Гц, 2H), 8,27 (с, 1H).
MC m/e (ESI), 286,27 (MH+-CF3COOH).
Пример 336
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
(a) 3-(2-Бутинил)-4-хлор-3H-имидазо[4,5-c]пиридин
Суспендируют 2,0 г 4-хлор-1H-имидазо[4,5-c]пиридина, 1,37 мл 1-бром-2-бутина и 1,98 г карбоната калия в 15 мл N,N-диметилформамида и суспензию перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор разбавляют этилацетатом и промывают водой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью гексан-этилацетат (1:2), 1,79 г смеси (1:1), состоящей из соединения, указанного в заголовке, и соединения, алкилированного в положение-1.
(b) 3-(2-Бутинил)-2,4-дихлор-3H-имидазо[4,5-c]пиридин
Добавляют по каплям раствор диизопропиламида лития в 2,22 мл тетрагидрофурана к 5 мл тетрагидрофуранового раствора 490 мг 3-(2-бутинил)-4-хлор-3H-имидазо[4,5-c]пиридина в бане со смесью сухой лед-метанол и смесь перемешивают при температуре ниже -66ºC в течение 20 минут. Образовавшуюся реакционную смесь добавляют по каплям к раствору 1,13 г гексахлорэтана в 2 мл тетрагидрофурана, при этом контролируют, чтобы температура смеси была -63ºC или ниже. Смесь перемешивают в течение 1 часа и 40 минут в той же самой бане и затем добавляют к раствору насыщенный водный раствор хлорида аммония. Образовавшуюся смесь экстрагируют два раза этилацетатом и органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Затем образовавшийся остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью гексан-этилацетат (2:1), 120 мг коричневого маслянистого материала.
1Н-ЯМР (ДМСО-d6)
δ 1,78 (с, 3H), 5,29 (с, 2H), 7,70 (д, J=5,6 Гц, 1H), 8,21 (д, J=5,6 Гц, 1H).
(c) трет-Бутил-4-[3-(2-бутинил)-4-хлор-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилат
Растворяют в этаноле 211 мг трет-бутил-3-(2-бутинил)-2,4-дихлор-3H-имидазо[4,5-c]пиридина, 197 мг пиперазин-1-карбоксилата и 222 мг бикарбоната натрия, смесь перемешивают при 80ºC в течение 30 минут и затем при комнатной температуре в течение трех часов и 20 минут. Реакционный раствор разбавляют этилацетатом и раствор промывают водой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью гексан-этилацетат (3:1), 244 мг соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,52 (с, 9H), 1,87 (с, 3H), 3,47-3,49 (м, 4H), 3,65-3,68 (м, 4H), 4,94 (с, 2H), 7,41 (д, J=5,2 Гц, 1H), 8,15 (д, J=5,2 Гц, 1H).
(d) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
Растворяют 98 мг ацетата натрия в 2 мл диметилсульфоксида, содержащего 0,3 ммоль трет-бутил-4-[3-(2-бутинил)-4-хлор-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата, и смесь перемешивают при 120ºC в течение 4 часов. Затем добавляют к реакционному раствору 100 мг карбоната калия и 1 мл метилйодида. Смесь перемешивают при комнатной температуре. Реакционный раствор разбавляют этилацетатом и раствор промывают водой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Растворяют 5 мг продукта, полученного из фракции, элюированной смесью метанол-этилацетат (1:10), в 0,5 мл трифторуксусной кислоты и смесь концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,55 мг соединения, указанного в заголовке.
МС m/e (ESI) 286 (MH+-CF3COOH).
Пример 337
Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
(a) Аллил-(3-нитропиридин-4-ил)амин
Добавляют 40 мл аллиламина к раствору 18,0 г гидрохлорида 4-этокси-3-нитропиридина в 400 мл этанола и смесь нагревают с обратным холодильником в течение 8 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (1:1), 13,6 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 4,00 (м, 2H), 5,29-5,35 (м, 2H), 5,87-5,98 (м, 1H), 6,63 (д, J=6,5 Гц, 1H), 8,30 (д, J=6,5 Гц, 1H), 8,31 (уш.с, 1H), 9,23 (с, 1H).
(b) N*-4*-Аллил-2-хлорпиридин-3,4-диамин
Добавляют 55 мл 35%-ной соляной кислоты к 3,02 г аллил-(3-нитропиридин-4-ил)амина и смесь нагревают до 90ºC. Добавляют к этому раствору 19,1 г хлорида олова и смесь выдерживают при 90ºC в течение 30 минут. Реакционный раствор охлаждают на водяной бане со льдом и затем добавляют к раствору 250 мл воды со льдом. Реакционный раствор концентрируют при пониженном давлении и затем добавляют к раствору 250 мл метанола, насыщенного аммиаком. Смесь перемешивают в течение 20 часов. Добавляют к раствору 750 мл этилацетата и смесь фильтруют через целит. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (1:1), 2,88 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 3,29-3,58 (уш.с, 2H), 3,84 (д, J=6,3 Гц, 2H), 4,26-4,37 (уш.с, 1H), 5,24 (д, J=11,0 Гц, 1H), 5,29 (д, J=16,0 Гц, 1H), 5,85-5,98 (ддт, J=16,0, 11,0, 6,5 Гц, 1H), 6,43 (д, J=6,5 Гц, 1H), 7,66 (д, J=6,5 Гц, 1H).
(c) 1-Аллил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-он
Добавляют раствор 4,46 г N,N'-дисукцинимидилкарбоната в 400 мл ацетонитрила к раствору, содержащему 2,88 г N*-4*-аллил-2-хлоропиридин-3,4-диамина в ацетонитриле, и смесь нагревают с обратным холодильником в течение 70 часов. Раствор концентрируют при пониженном давлении и остаток растворяют в смеси, состоящей из 500 мл этилацетата и 300 мл воды. Органический слой промывают два раза 1 н. соляной кислотой (100 мл) и затем насыщенным раствором хлорида натрия (100 мл). Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-дихлорметан (1:1), 2,30 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 4,51 (д, J=5,7 Гц, 1H), 5,25, (д, J=16,0 Гц, 1H), 5,30 (д, J=10,9 Гц, 1H), 5,85-5,95 (ддт, J=16,0, 10,9, 5,7 Гц, 1H), 6,91 (д, J=6,9 Гц, 1H), 8,10 (д, J=6,9 Гц, 1H), 8,99 (уш.с, 1H).
(d) 1-Аллил-3-бензил-4-хлоро-1,3-дигидроимидазо[4,5-c]пиридин-2-он
Добавляют 0,76 г карбоната калия и 0,94 г бензилбромида к раствору 1,05 г 1-аллил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-она в 50 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 14 часов. Добавляют к этому раствору 300 мл воды и 300 мл этилацетата, органический слой промывают три раза водой (100 мл) и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении, получая 1,57 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 4,56 (д, J=5,7 Гц, 1H), 5,23 (д, J=16,0 Гц, 1H), 5,30 (д, J=10,9 Гц, 1H), 5,44 (с, 2H), 5,85-5,95 (ддт, J=16,0, 10,9, 5,7 Гц, 1H), 6,91 (д, J=6,9 Гц, 1H), 7,25-7,34 (м, 5H), 8,08 (д, J=6,9 Гц, 1H), 8,99 (уш.с, 1H).
(e) 3-Бензил-4-хлоро-1,3-дигидроимидазо[4,5-c]пиридин-2-он
Добавляют 1,5 мл воды, 1,06 г 4-метилморфолин-N-оксида, 3 мл водного раствора (2%) осмиевой кислоты и 6 мл водного раствора 1,94 г периодата натрия к раствору 0,75 г 1-аллил-3-бензил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-она в 15 мл 1,4-диоксана и смесь нагревают при 60ºC в течение 18 часов. Добавляют к раствору 200 мл воды и смесь экстрагируют 100 мл этилацетата. Органический слой промывают два раза водой (50 мл) и затем промывают 50 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (1:1), 0,38 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 5,44 (с, 2H), 7,01 (д, J=6,5 Гц, 1H), 7,30-7,38 (м, 5H), 8,08 (д, J=6,5 Гц, 1H), 9,18 (с, 1H).
(f) 3-Бензил-2,4-дихлор-1,3-дигидроимидазо[4,5-c]пиридин
Добавляют 5 мл оксихлорида фосфора и 0,338 г пентахлорида фосфора к 0,383 г 3-бензил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-она и смесь нагревают с обратным холодильником в течение 24 часов. Раствор концентрируют при пониженном давлении и остаток выливают в 50 г ледяной воды. Смесь экстрагируют 100 мл этилацетата. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (2:1), 0,13 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 5,43 (с, 2H), 7,12 (д, J=6,5 Гц, 1H), 7,30-7,38 (м, 5H), 8,18 (д, J=6,5 Гц, 1H).
(g) трет-Бутил-4-(3-бензил-4-хлоро-3H-имидазо[4,5-c]пиридин-2-ил)пиперазин-1-карбоксилат
Добавляют 0,094 г трет-бутилпиперазин-1-карбоксилата к раствору 0,127 г 3-бензил-2,4-дихлор-1,3-дигидроимидазо[4,5-c]пиридина в 1 мл N,N-диметилформамида и смесь нагревают при 150ºC в течение двух часов. Добавляют к смеси 25 мл этилацетата и органический слой промывают три раза водой (10 мл) и затем 10 мл водного насыщенного раствора хлорида натрия. Органическую жидкость сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (3:2), 0,029 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,44 (с, 9H), 3,21-3,25 (м, 4H), 3,49-3,53 (м, 4H), 5,53 (с, 2H), 7,08 (д, J=6,5 Гц, 1H), 7,30-7,38 (м, 5H), 8,14 (д, J=6,5 Гц, 1H).
(h) Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
Добавляют 1 мл воды и 1 мл 35%-ной соляной кислоты к раствору 0,029 г трет-бутил-4-(3-бензил-4-хлор-3H-имидазо[4,5-c]пиридин-2-ил)пиперазин-1-карбоксилата в 2 мл N,N-диметилформамида и смесь кипятят с обратным холодильником в течение 36 часов. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,006 г соединения, указанного в заголовке.
МС m/e (ESI) 310,29 (MH+-CF3COOH).
Пример 338
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
(a) 2-Бром-1-(2-бутинил)-1H-имидазол-4,5-дикарбонитрил
Добавляют 69,8 г карбоната калия и раствор 74 мл 1-бром-2-бутина в 50 мл N,N-диметилформамида к раствору 90,6 г 2-бром-1H-имидазол-4,5-дикарбонитрила [CAS No 50847-09-1] в 520 мл N,N-диметилформамида и смесь нагревают при 50ºC в течение 8 часов. Добавляют к раствору 1 л этилацетата и 500 мл воды и органический слой промывают два раза водой (500 мл), затем 500 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (1:4), 48,0 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,87 (т, J=2,3 Гц, 3H), 4,85 (кв, J=2,3 Гц, 2H).
(b) Этил-2-бром-1-(2-бутинил)-5-циано-1H-имидазол-4-карбоксилат
Добавляют 25 мл концентрированной серной кислоты к раствору 48,0 г 2-бром-1-(2-бутинил)-1H-имидазол-4,5-дикарбонитрила в 500 мл этанола и смесь кипятят с обратным холодильником в течение 110 часов. Реакционный раствор охлаждают до комнатной температуры, затем концентрируют при пониженном давлении. Остаток растворяют в смеси, состоящей из 500 мл этилацетата и 500 мл воды, и значение pH раствора доводят до 8, используя гидроксид калия. Водный слой экстрагируют 500 мл этилацетата и органические слои объединяют. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (1:3), 21,7 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,43 (т, J=7,0 Гц, 3H), 1,87 (т, J=2,3 Гц, 3H), 4,46 (кв, J=7,0 Гц, 2H), 4,85 (кв, J=2,3 Гц, 2H).
(c) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Получают 25,1 г соединения, указанного в заголовке, путем использования 21,7 г этил-2-бром-1-(2-бутинил)-5-циано-1H-имидазол-4-карбоксилата по способу, описанному в примере 115(b).
1Н-ЯМР (CDCl3)
δ 1,43 (т, J=7,0 Гц, 3H), 1,49 (с, 9H), 1,87 (т, J=2,3 Гц, 3H), 3,22-3,26 (м, 4H), 3,56-3,61 (м, 4H), 4,44 (кв, J=7,0 Гц, 2H), 4,68 (кв, J=2,3 Гц, 2H).
(d) трет-Бутил-4-[1-(2-бутинил)-4-карбокси-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 16 мл 5 н. водного раствора гидроксида натрия к раствору 25,1 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 500 мл этанола и смесь перемешивают при комнатной температуре в течение двух часов. Затем раствор концентрируют при пониженном давлении. Остаток растворяют в смеси, состоящей из 1 л этилацетата и 500 мл воды. Добавляют к раствору 50 мл 2 н. соляной кислоты. Органический слой промывают насыщенным раствором хлорида натрия (200 мл) и сушат над сульфатом магния. Органическую жидкость концентрируют при пониженном давлении, получая 23,2 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,87 (т, J=2,3 Гц, 3H), 3,22-3,26 (м, 4H), 3,56-3,61 (м, 4H), 4,68 (кв, J=2,3 Гц, 2H).
(e) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют по каплям 6,9 г триэтиламина и затем раствор 10,19 г изобутилхлорформиата в 100 мл тетрагидрофурана к 600 мл тетрагидрофурана, содержащего 22,9 г трет-бутил-4-[1-(2-бутинил)-4-карбокси-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилата, при -10ºC. После удаления осадка путем фильтрации раствор снова охлаждают до -10ºC. К раствору добавляют по каплям 100 мл водного раствора 9,45 г борогидрида натрия. Спустя 1 час добавляют к раствору 500 мл этилацетата и 500 мл воды. Значение pH раствора устанавливают 5, используя 1 н. соляную кислоту, и затем доводят до 10, добавляя насыщенный раствор бикарбоната натрия. Органический слой промывают последовательно водой (500 мл) и 500 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (4:1), 19,1 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 2,26 (т, J=6,3 Гц, 1H), 3,13-3,17 (м, 4H), 3,53-3,57 (м, 4H), 4,58 (кв, J=2,3 Гц, 2H), 4,64 (д, J=6,3 Гц, 2H).
(f) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 3,28 г диоксида марганца к раствору 1,35 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 5 мл дихлорметана. Реакционный раствор перемешивают при комнатной температуре в течение 15 часов, затем перемешивают и нагревают с обратным холодильником в течение пяти часов. Раствор фильтруют и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 1,11 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,88 (т, J=2,3 Гц, 3H), 3,24-3,28 (м, 4H), 3,59-3,63 (м, 4H), 4,70 (кв, J=2,3 Гц, 2H), 9,87 (с, 1H).
(g) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-(2-этоксикарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 0,038 г гидрида натрия к раствору 0,243 г этилдиэтилфосфонацетата в 5 мл тетрагидрофурана при 5ºC и в атмосфере азота. Добавляют раствор 0,310 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 5 мл тетрагидрофурана и смесь перемешивают в течение 30 минут. Добавляют к раствору 50 мл этилацетата и 25 мл 0,1 н. раствора гидроксида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (3:7), 0,380 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,33 (т, J=7,4 Гц, 3H), 1,50 (с, 9H), 1,86 (т, J=2,3 Гц, 3H), 3,19-3,23 (м, 4H), 3,55-3,59 (м, 4H), 4,25 (кв, J=7,4 Гц, 2H), 4,59 (кв, J=2,3 Гц, 2H), 6,70 (д, J=15,8 Гц, 1H), 7,50 (д, J=15,8 Гц, 1H).
(h) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-(2-карбоксивинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-циано-4-(2-этоксикарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 338(d).
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,86 (т, J=2,3 Гц, 3H), 3,19-3,23 (м, 4H), 3,55-3,59 (м, 4H), 4,59 (кв, J=2,3 Гц, 2H), 6,70 (д, J=15,8 Гц, 1H), 7,50 (д, J=15,8 Гц, 1H).
(i) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-(2-азидкарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Смесь, состоящую из 0,200 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-(2-карбоксивинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата, 0,073 мл триэтиламина и раствора 0,108 мл дифенилфосфорилазида в 2 мл трет-бутилового спирта, нагревают при 50ºC в атмосфере азота в течение 4 часов. Добавляют к раствору 50 мл этилацетата и смесь промывают 20 мл воды. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 0,178 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,86 (т, J=2,2 Гц, 3H), 3,19-3,23 (м, 4H), 3,55-3,59 (м, 4H), 4,59 (кв, J=2,2 Гц, 2H), 6,67 (д, J=15,4 Гц, 1H), 7,56 (д, J=15,4 Гц, 1H).
(j) трет-Бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилат
В атмосфере азота нагревают с обратным холодильником раствор 0,178 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-(2-азидкарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 10 мл трет-бутилового спирта в течение 15 часов. Раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (9:11), 0,169 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,84 (т, J=2,2 Гц, 3H), 3,16-3,19 (м, 4H), 3,54-3,58 (м, 4H), 4,51 (кв, J=2,2 Гц, 2H), 5,83 (д, J=15,0 Гц, 1H), 6,43-6,53 (м, 1H), 7,55-7,66 (м, 1H).
(k) трет-Бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-карбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 332(b).
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,84 (т, J=2,2 Гц, 3H), 3,21-3,25 (м, 4H), 3,54-3,58 (м, 4H), 4,68 (кв, J=2,2 Гц, 2H), 5,90 (уш.с, 1H), 6,36 (уш.д, J=14,8 Гц, 1H), 6,92 (уш.д, J=8,4 Гц, 1H), 7,45 (уш.с, 1H), 7,52 (м, 1H).
(l) Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
Добавляют 0,1 мл 5 н. соляной кислоты к раствору 0,0075 г трет-бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-карбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 0,3 мл этанола и смесь перемешивают при комнатной температуре в течение 15 часов. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,0043 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,81 (т, J=2,4 Гц, 3H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 5,15 (кв, J=2,4 Гц, 2H), 6,60 (д, J=7,1 Гц, 1H), 7,18 (д, J=7,1 Гц, 1H).
MC m/e (ESI) 272,32 (MH+-CF3COOH).
Пример 339
Трифторацетат 3-(2-бутинил)-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
(a) трет-Бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трифторацетата 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она по способу, описанному в примере 258(a).
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,35-3,39 (м, 4H), 3,60-3,64 (м, 4H), 5,07 (кв, J=2,3 Гц, 2H), 6,55 (д, J=7,1 Гц, 1H), 6,97 (д, J=7,1 Гц, 1H).
(b) Трифторацетат 3-(2-бутинил)-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и (2-бромэтил)бензола по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,83 (т, J=2,4 Гц, 3H), 3,05 (т, J=7,3 Гц, 2H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 4,26 (т, J=7,3 Гц, 2H), 5,18 (кв, J=2,4 Гц, 2H), 6,46 (д, J=7,3 Гц, 1H), 7,15 (д, J=7,3 Гц, 1H), 7,16-7,30 (м, 5H).
MC m/e (ESI) 376,36 (MH+-CF3COOH).
Пример 340
Трифторацетат 3-(2-бутинил)-5-(2-феноксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромэтилфенилового эфира по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,80 (т, J=2,4 Гц, 3H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 4,30 (т, J=5,5 Гц, 2H), 4,44 (т, J=5,5 Гц, 2H), 5,16 (кв, J=2,4 Гц, 2H), 6,59 (д, J=6,1 Гц, 1H), 6,87-6,91 (м, 3H), 7,20-7,24 (м, 2H), 7,50 (д, J=6,1 Гц, 1H).
MC m/e (ESI) 392,34 (MH+-CF3COOH).
Пример 341
Трифторацетат 3-(2-бутинил)-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,79 (т, J=2,3 Гц, 3H), 3,46-3,50 (м, 4H), 3,64-3,68 (м, 4H), 5,16 (кв, J=2,3 Гц, 2H), 5,61 (с, 2H), 6,65 (д, J=7,3 Гц, 1H), 7,37 (д, J=7,3 Гц, 1H), 7,57 (т, J=8,0 Гц, 2H), 7,69 (т, J=8,0 Гц, 1H), 8,10 (д, J=8,0 Гц, 2H).
MC m/e (ESI) 392,34 (MH+-CE3COOH).
Пример 342
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-c]пиридин-5-илметил]бензонитрила
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).
1Н-ЯМР (CD3OD)
δ 1,78 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,64-3,67 (м, 4H), 5,14 (кв, J=2,3 Гц, 2H), 5,47 (с, 2H), 6,67 (д, J=7,0 Гц, 1H), 7,20 (дд, J=7,2, 1,0 Гц, 1H), 7,46 (тд, J=7,2, 1,0 Гц, 1H), 7,50 (д, J=7,0 Гц, 1H), 7,60 (тд, J=7,2, 1,0 Гц, 1H), 7,80 (дд, J=7,2, 1,0 Гц, 1H).
MC m/e (ESI) 387,34 (MH+-CE3COOH).
Пример 343
Трифторацетат метил-3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилата
(a) трет-Бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 10 мл 50%-ного водного раствора сульфида аммония к раствору 3,596 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 50 мл этанола и смесь перемешивают при комнатной температуре в течение 16 часов. К раствору добавляют 400 мл этилацетата и смесь промывают три раза 100 мл воды и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (4:1), 3,221 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,84 (т, J=2,4 Гц, 3H), 3,17-3,21 (м, 4H), 3,54-3,60 (м, 4H), 3,62 (т, J=5,8 Гц, 1H), 4,68 (д, J=5,8 Гц, 2H), 5,05 (кв, J=2,4 Гц, 2H), 7,35 (уш.с, 1H), 8,46 (уш.с, 1H).
(b) трет-Бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 0,668 г имидазола и 2,70 г трет-бутилхлордифенилсилана к раствору 3,221 г трет-бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 25 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют к раствору 300 мл этилацетата и органический слой промывают три раза 100 мл воды и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 4,357 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,05 (с, 9H), 1,49 (с, 9H), 1,84 (т, J=2,4 Гц, 3H), 3,06-3,11 (м, 4H), 3,53-3,57 (м, 4H), 4,74 (с, 2H), 5,19 (кв, J=2,4 Гц, 2H), 7,31 (уш.д, J=4,1 Гц, 1H), 7,37 (т, J=7,2 Гц, 4H), 7,44 (д, J=7,2 Гц, 2H), 7,63 (д, J=7,2 Гц, 4H), 9,28 (уш.д, J=4,1 Гц, 1H).
(c) трет-Бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 1,23 г тетрафторбората триметилоксония к раствору 4,351 г трет-бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 100 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к раствору 300 мл этилацетата и органический слой промывают последовательно 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлорида аммония. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении, для того чтобы получить 4,439 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,05 (с, 9H), 1,49 (с, 9H), 1,84 (уш.с, 3H), 2,36 (уш.с, 3H), 3,11-3,15 (м, 4H), 3,54-3,58 (м, 4H), 4,63 (уш.с, 2H), 4,66 (уш.с, 2H), 7,37 (т, J=7,2 Гц, 4H), 7,44 (д, J=7,2 Гц, 2H), 7,63 (д, J=7,2 Гц, 4H).
(d) трет-Бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Добавляют 30 мл 5 н. соляной кислоты к раствору 5,05 г трет-бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 100 мл тетрагидрофурана и смесь перемешивают при комнатной температуре в течение 22 часов. Раствор концентрируют при пониженном давлении. Остаток растворяют в 100 мл дихлорметана и в этот раствор добавляют 2,05 г ди-трет-бутилдикарбоната. Раствор подщелачивают 5 н. раствором гидроксида натрия и смесь перемешивают в течение 2 часов. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 2,24 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 2,47 (с, 3H), 3,21-3,25 (м, 4H), 3,27 (т, J=5,6 Гц, 1H), 3,56-3,60 (м, 4H), 4,81 (кв, J=2,4 Гц, 2H), 4,89 (д, J=5,6 Гц, 2H).
(e) трет-Бутил-4-[1-(2-бутинил)-4-формил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(g).
1Н-ЯМР (CDCl3)
δ 1,48 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 2,58 (с, 3H), 3,22-3,26 (м, 4H), 3,56-3,60 (м, 4H), 4,80 (кв, J=2,4 Гц, 2H), 9,88 (с, 1H).
(f) 5-Бензиловый, 6-метиловый эфир 2-(4-трет-бутоксикарбонилпиперазин-1-ил)-3-(2-бутинил)-4-оксо-3,4-дигидроимидазо[4,5-c]пиридин-5,6-дикарбоновой кислоты
Добавляют 0,079 г 1,8-диазабицикло[5,4,0]-7-ундецена и затем 5 мл дихлорметана, содержащего 0,194 г трет-бутил-4-[1-(2-бутинил)-4-формил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, к раствору 0,174 г метилбензилоксикарбониламино(диметоксифосфорил)ацетата в 2 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 16 часов. Раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью этилацетат-гексан (3:2), получают 0,147 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,49 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,37-3,41 (м, 4H), 3,59-3,64 (м, 4H), 3,83 (с, 3H), 5,04 (кв, J=2,3 Гц, 2H), 5,46 (с, 2H), 7,33-7,38 (м, 3H), 7,41 (с, 1H), 7,45-7,48 (м, 2H).
(g) трет-Бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилат
Добавляют 0,023 г натрия к 2 мл метанола в атмосфере азота. После прекращения выделения водорода добавляют к этому раствору 0,147 г 5-бензилового, 6-метилового эфира 2-(4-трет-бутоксикарбонилпиперазин-1-ил)-3-(2-бутинил)-4-оксо-3,4-дигидроимидазо[4,5-c]пиридин-5,6-дикарбоновой кислоты в 2 мл метанола. Смесь перемешивают при комнатной температуре в течение 16 часов. Затем добавляют к этому раствору 40 мл этилацетата, 20 мл 5%-ного водного раствора хлорида аммония и 1 мл 1 н. соляной кислоты. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной этилацетатом, 0,108 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,20 (с, 9H), 3,37-3,41 (м, 4H), 3,59-3,64 (м, 4H), 5,07 (кв, J=2, 3 Гц, 2H), 6,82 (с, 1H), 8,60 (уш.с, 1H).
(h) Трифторацетат метил-3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 338(l).
1Н-ЯМР (CD3OD)
δ 1,81 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,64-3,67 (м, 4H), 3,95 (с, 3H), 5,17 (кв, J=2,3 Гц, 2H), 7,35 (с, 1H).
MC m/e (ESI) 330,16 (MH+-CF3COOH).
Пример 344
Трифторацетат метил-3-(2-бутинил)-5-метил-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилата
Добавляют 0,024 г карбоната калия и 0,027 мл метилйодида к раствору 0,030 г трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата в 2 мл N,N-диметилформамида и смесь нагревают при 50ºC в течение 48 часов. Добавляют к этому раствору 2 мл этилацетата и 2 мл воды. Водный слой экстрагируют 1 мл этилацетата. Органические слои объединяют и затем разделяют на две равные части. Одну часть концентрируют путем продувки газообразным азотом и остаток растворяют в 0,5 мл метанола. Раствор объединяют с 0,1 мл 5 н. соляной кислоты и смесь выдерживают в течение 1 часа. Растворитель удаляют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,007 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,81 (т, J=2,4 Гц, 3H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 3,74 (с, 3H), 3,94 (с, 3H), 5,17 (кв, J=2,4 Гц, 2H), 7,25 (с, 1H).
MS m/e (ESI) 344,30 (MH+-CF3COOH).
Пример 345
Трифторацетат 3-(2-бутинил)-5-метил-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксиламида
Другую часть раствора, полученного в примере 344, концентрируют путем продувки газообразным азотом. Остаток обрабатывают аммиачной водой (1 мл, 28% аммиака). Раствор нагревают до кипения с обратным холодильником в запаянной трубке в течение 48 часов. Раствор концентрируют при пониженном давлении. Последующие стадии синтеза были проведены в соответствии со способом, который был использован в примере 115(i). Таким образом синтезируют 0,010 г соединения, указанного в заголовке.
МС m/e (ESI) 329,32 (MH+-CF3COOH).
Пример 346
Трифторацетат метил-3-(2-бутинил)-4-оксо-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 344.
МС m/e (ESI) 448,31 (MH+-CF3COOH).
Пример 347
Трифторацетат метил-3-(2-бутинил)-5-(2-цианобензил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилата
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 344.
МС m/e (ESI) 445,32 (MH+-CF3COOH).
Пример 348
Трифторацетат 3-(2-бутинил)-5-(2-цианобензил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксиламида
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 345.
МС m/e (ESI) 430,34 (MH+-CF3COOH).
Пример 349
Трифторацетат 1-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a)-1 3-(2-Бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он
и
(a)-2 1-(2-Бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
Добавляют 0,166 г карбоната калия и 0,106 мкл 2-бутинилбромида к раствору 0,184 г 2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 10 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 18 часов. Добавляют к этому раствору 50 мл этилацетата и смесь промывают три раза водой (20 мл) и затем насыщенным раствором хлорида натрия (20 мл). Органическую жидкость сушат над сульфатом магния и концентрируют при пониженном давлении. Затем остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают 0,175 г 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она из фракции, элюированной смесью гексан-этилацетат (4:1), и 0,033 г 1-(2-бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она из фракции, элюированной смесью гексан-этилацетат (2:3).
3-(2-Бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он:
1Н-ЯМР (CDCl3)
δ 1,82 (т, J=2,3 Гц, 3H), 3,87 (с, 3H), 5,32 (кв, J=2,3 Гц, 2H), 8,19 (с, 1H).
1-(2-Бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он:
1Н-ЯМР (CDCl3)
δ 1,87 (т, J=2,3 Гц, 3H), 3,91,(с, 3H), 4,90 (кв, J=2,3 Гц, 2H), 8,20 (с, 1H).
(b) трет-Бутил-4-[1-(2-бутинил)-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат
Соединение, указанное в заголовке, получают путем использования 1-(2-бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она и трет-бутилпиперазин-1-карбоксилата по способу, описанному в примере 119(c).
1Н-ЯМР (CDCl3)
δ 1,50 (с, 9H), 1,87 (т, J=2,3 Гц, 3H), 3,30-3,34 (м, 4H), 3,59-3,63 (м, 4H), 3,90 (с, 3H), 4,70 (кв, J=2,3 Гц, 2H), 8,11 (с, 1H).
(c) Трифторацетат 1-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[5-метил-1-(2-бутинил)-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(i).
1Н-ЯМР (CD3OD)
δ 1,84 (т, J=2,4 Гц, 3H), 3,44-3,48 (м, 4H), 3,58-3,62 (м, 4H), 3,86 (с, 3H), 4,96 (кв, J=2,4 Гц, 2H), 8,39 (с, 1H).
MC m/e (ESI) 287,17 (MH+-CF3COOH).
Пример 350
Трифторацетат 2-[(1R*,2R*)2-аминоциклогексиламино]-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем взаимодействия 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она и транс-1,2-циклогександиамина по способу, который был использован в примере 119(c), с очисткой продукта методом жидкостной хроматографии высокого разрешения с обращенной фазой.
1Н-ЯМР (CD3OD)
δ 1,39-1,49 (м, 2H), 1,50-1,61 (м, 2H), 1,80 (т, J=2,3 Гц, 3H), 1,85-1,92 (м, 2H), 2,11-2,18 (м, 2H), 3,19 (тд, J=11,0, 4,1 Гц, 1H), 3,80 (с, 3H), 3,93 (тд, J=11,0, 4,2 Гц, 1H), 4,91 (д кв, J=18,0, 2,3 Гц, 1H), 5,44 (д кв, J=18,0, 2,3 Гц, 1H), 8,07 (с, 1H).
Mc m/e (ESI) 315,19 (MH+-CF3COOH).
Пример 351
Трифторацетат 2-[(1R*,2S*)2-аминоциклогексиламино]-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Соединение, указанное в заголовке, получают путем взаимодействия 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она и цис-1,2-циклогександиамина по способу, который был использован в примере 119(c), с очисткой продукта методом жидкостной хроматографии высокого разрешения с обращенной фазой.
1Н-ЯМР (CD3OD)
δ 1,54-1,68 (м, 3H), 1,71-1,81 (м, 2H), 1,83 (т, J=2,4 Гц, 3H), 1,85-1,91 (м, 2H), 1,91-2,01 (м, 1H), 3,69 (м, 1H), 3,80 (с, 3H), 4,37 (м, 1H), 5,04 (д кв, J=18,3, 2,4 Гц, 1H), 5,55 (д кв, J=18,3, 2,4 Гц, 1H), 8,09 (с, 1H).
MC m/e (ESI) 315,27 (MH+-CF3COOH).
Пример 352
Трифторацетат 3-(2-бутинил)-5-метил-2-(1,2,3,6-тетрагидропиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
(a) 5-Метил-2-(пиридин-4-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-он
Добавляют 0,560 г 4,5-диамино-2-метил-2H-пиридазин-3-она и 0,535 г 4-пиридинкарбальдегида к 10 мл нитробензола и смесь нагревают при 190ºC в атмосфере азота в течение трех часов. Реакционный раствор охлаждают и осадок собирают путем фильтрации, получая 0,381 г соединения, указанного в заголовке.
1Н-ЯМР (ДМСО-d6)
δ 3,78 (с, 3H), 8,14 (д, J=6,0 Гц, 2H), 8,48 (с, 1H), 8,76 (д, J=6,0 Гц, 2H).
MC m/e (ESI) 228,1 (MH+).
(b) 3-(2-Бутинил)-5-метил-2-(пиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он
Соединение, указанное в заголовке, получают путем использования 5-метил-2-(пиридин-4-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-она и 2-бутинилбромида по способу, описанному в примере 119(d).
1Н-ЯМР (CDCl3)
δ 1,84 (т, J=2,3 Гц, 3H), 3,91 (с, 3H), 5,37 (кв, J=2,3 Гц, 2H), 7,89 (д, J=6,1 Гц, 2H), 8,32 (с, 1H), 8,85 (д, J=2,3 Гц, 2H).
(c) Хлорид 4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]-1-(4-метоксибензил)пиридиния
Добавляют 0,045 г 3-(2-бутинил)-5-метил-2-(пиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она и 0,060 мкл пара-метоксибензилхлорида к 0,100 мл N,N-диметилформамида и смесь перемешивают при 65ºC в атмосфере азота в течение 4 часов. Реакционный раствор охлаждают и добавляют к нему 1 мл ацетона и 1 мл диэтилового эфира. Осадок собирают путем фильтрации, получая 0,060 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,75 (т, J=2,3 Гц, 3H), 3,74 (с, 3H), 3,77 (с, 3H), 5,64 (кв, J=2, 3 Гц, 2H), 5,86 (с, 2H), 7,05 (д, J=8,3 Гц, 2H), 7,54 (д, J=8,3 Гц, 2H), 8,43 (с, 1H), 8,70 (д, J=6,3 Гц, 2H), 9,24 (д, J=6,3 Гц, 2H).
(d) 3-(2-Бутинил)-2-[1-(4-метоксибензил)-1,2,3,6-тетрагидропиридин-4-ил]-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он
Добавляют 0,020 г борогидрида натрия к раствору 0,060 г хлорида 4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]-1-(4-метоксибензил)пиридиния в 5 мл метанола и смесь перемешивают в течение 1 часа. Добавляют к раствору 15 мл воды и 0,1 мл 5 н. соляной кислоты, для того чтобы разложить восстанавливающий агент. Затем раствор подщелачивают, добавляя 1 мл 5 н. раствора гидроксида натрия и смесь экстрагируют 30 мл этилацетата. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью метанол-этилацетат (1:19), 0,033 г соединения, указанного в заголовке.
1Н-ЯМР (CDCl3)
δ 1,80 (т, J=2,4 Гц, 3H), 2,71-2,78 (м, 4H), 3,25-3,28 (м, 2H), 3,62 (с, 2H), 3,82 (с, 3H), 3,87 (с, 3H), 5,30 (кв, J=2,4 Гц, 2H), 6,61 (м, 1H), 6,89 (д, J=9,1 Гц, 2H), 7,30 (д, J=9,1 Гц, 2H), 8,22 (с, 1H).
(e) Трифторацетат 3-(2-бутинил)-5-метил-2-(1,2,3,6-тетрагидропиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она
Добавляют 0,10 мл 1-хлорэтилхлорформиата к раствору 0,033 г 3-(2-бутинил)-2-[1-(4-метоксибензил)-1,2,3,6-тетрагидропиридин-4-ил]-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она в 2 мл 1,2-дихлорэтана и смесь нагревают с обратным холодильником в течение 90 минут. Добавляют 5 мл метанола к раствору и смесь дополнительно нагревают с обратным холодильником в течение 4 часов. Затем раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой, получая 0,010 г соединения, указанного в заголовке.
1Н-ЯМР (CD3OD)
δ 1,81 (т, J=2,4 Гц, 3H), 2,89-2,94 (м, 2H), 3,52 (т, J=6,2 Гц, 2H), 3,84 (с, 3H), 4,01 (кв, J=2,8 Гц, 2H), 5,27 (кв, J=2,4 Гц, 2H), 6,67 (м, 1H), 8,30 (с, 1H).
MC m/e (ESI) 284,22 (MH+-CF3COOH).
[Пример испытания 1] Анализ ингибирующей активности DPPIV
Растворяют в реакционном буфере (50 мМ Трис-HCl (pH 7,4)/0,1% BSA (альбумин бычьей сыворотки)) DPP-IV, произведенный из свиных почек, при концентрации 10 мкмоль/мл. Этот раствор (110 мкл) объединяют с 15 мкл реагента и после этого смесь выдерживают при комнатной температуре в течение 20 минут. К этому раствору добавляют 25 мкл раствора (2 ммоль/л) Gly-Pro-пара-нитроанилида (до окончательной концентрации 0,33 ммоль/л), для того чтобы инициировать ферментативную реакцию. Время реакции составляет 20 минут. С целью прерывания реакции в реакционную смесь добавляют 25 мкл 1 н. раствора фосфорной кислоты. Регистрируют поглощение этого раствора при длине волны 405 нм и затем рассчитывают степень ингибирования ферментативной реакции, для того чтобы определить концентрацию ингибирования на 50%, IC50.
| Таблица 1 | |
| Номер примера | IC50 (мкмоль/л) |
| Пример 1 | 0,287 |
| Пример 4 | 0,211 |
| Пример 7 | 0,401 |
| Пример 9 | 0,141 |
| Пример 12 | 0,183 |
| Пример 13 | 0,125 |
| Пример 16 | 0,272 |
| Пример 20 | 0,152 |
| Пример 22 | 0,170 |
| Пример 29 | 0,310 |
| Пример 53 | 0,0469 |
| Пример 64 | 0,126 |
| Пример 73 | 0,0334 |
| Пример 76 | 0,0865 |
| Пример 79 | 0,0357 |
| Пример 82 | 0,161 |
| Пример 83 | 0,0274 |
| Пример 86 | 0,00408 |
| Пример 88 | 0,00289 |
| Пример 98 | 0,00969 |
| Пример 109 | 1,48 |
| Пример 119 | 0,154 |
| Пример 120 | 0,116 |
| Пример 122 | 0,0153 |
| Пример 129 | 0,115 |
| Пример 142 | 0,0685 |
| Пример 146 | 0,0817 |
| Пример 159 | 0,0377 |
| Пример 229 | 0,00897 |
| Пример 230 | 0,000890 |
| Пример 234 | 0,00174 |
| Пример 235 | 0,00144 |
| Пример 238 | 0,00119 |
| Пример 243 | 0,00215 |
| Пример 248 | 0,00640 |
| Пример 266 | 0,00155 |
| Пример 267 | 0,00722 |
| Пример 297 | 0,00622 |
| Пример 311 | 0,0775 |
| Пример 341 | 0,00732 |
[Пример испытания 2]
Влияние соединений на толерантность к глюкозе нормальных мышей (испытание in vivo)
Животные: самцы С57BL/6N мышей (закуплены у фирмы Charles River Japan, Inc.).
Метод: получение и введение испытуемых соединений
Каждое испытуемое соединение суспендируют в 0,5% растворе метилцеллюлозы (МЦ) при концентрации, указанной далее в таблице. Суспензию испытуемого соединения и NVP DPP728 (US патент No. 6011155) или 0,5% раствор МЦ, который используется как среда для контрольной группы, вводят перорально в дозировке 10 мл/кг. Через 30 минут дают орально раствор глюкозы в дозировке 10 мл/кг. Дозировка глюкозы, введенная орально, составляет 2 г/кг.
[Сбор крови и определение содержания глюкозы в крови]
Непосредственно до введения испытуемого соединения и NVP DPP728, непосредственно до введения раствора глюкозы и через 30, 60 и 120 минут после введения, без анестезии хвостовую вену слегка надрезают лезвием бритвы, для того чтобы вытекла кровь. Собирают 10 мкл крови и сразу объединяют со 140 мкл 0,6 M раствора перхлорной кислоты. Пробу подвергают центрифугированию c ускорением 1500 g при температуре 4ºC в течение 10 минут в центрифуге с замораживанием GS-6KR (Beckman Corp.). Концентрацию глюкозы в образовавшейся жидкости над осадком определяют, используя набор Glucose CII TEST WAKO (фирма Wako Pure Chemical Industries).
Результаты
Величина площади под кривой «изменение содержания глюкозы во времени» (AUC0-120; площадь под кривой) была получена из временной зависимости содержания глюкозы от начала введения глюкозы до 120-й минуты после введения; определение проводят для каждой группы, обработанной 0,5% раствором МЦ, группы, обработанной NVP DPP728 и группы, обработанной испытуемым соединением. Коэффициент улучшения толерантности к глюкозе для испытуемого соединения определяют, приняв величину AUC0-120 для группы, обработанной 0,5% раствором МЦ, за 100%, а величину AUC0-120 для группы, обработанной NVP DPP728 (доза 10 мг/кг), за 0%, в соответствии с указанной далее формулой.
Коэффициент улучшения толерантности к глюкозе (%) = (AUC0-120 для группы, обработанной испытуемым соединением - AUC0-120 для группы, обработанной NVP DPP728 (10 мг/кг))/ AUC0-120 для группы, обработанной 0,5% раствором МЦ, - AUC0-120 для группы, обработанной NVP DPP728 (10 мг/кг)) × 100.
Чем ниже этот коэффициент (в %), тем значительнее улучшения толерантности к глюкозе.
Установлено, что некоторые из новых конденсированных производных имидазола настоящего изобретения оказывают существенное влияние на толерантность к глюкозе нормальных мышей в ходе описанного выше эксперимента in vivo, который включает в себя пероральное введение соединений при дозировке 0,1-10 (мг/кг).
[Пример испытания 3]
Приемлемая временная диаграмма введения в испытании in vivo
В идеале требуется, чтобы лекарственный препарат для лечения послеобеденной гипергликемии обладал сравнимой эффективностью при лечении послеобеденной гипергликемии, как при введении препарата непосредственно до еды, так и при введении за 1 час до еды. Таким образом, превосходный лекарственный препарат, проявляющий повышенную эффективность, может быть разработан за счет расширения приемлемой временной диаграммы введения препарата.
Метод
Описанные далее соответствующие испытания были проведены в сочетании с испытанием in vivo (введение препарата за 0,5 час), как описано в примере испытания 2.
1. Испытуемое соединение вводится одновременно с подачей 2 г/кг глюкозы (испытуемое соединение суспендируется в водном растворе 0,5% метилцеллюлозы; раствор объединяют с равным объемом раствора глюкозы; смесь вводится перорально в дозировке 10 мл/кг).
2. Испытуемое соединение вводится за 1 час до подачи глюкозы (2 г/кг) (испытуемое соединение суспендируется в водном растворе 0,5% метилцеллюлозы и вводится перорально за один час до орального введения раствора глюкозы; каждое соединение задается перорально в дозировке 10 мл/кг).
Коэффициент улучшения толерантности к глюкозе оценивается в каждом испытании. Приемлемая временная диаграмма введения препарата может быть определена путем оценивания: достигается ли сопоставимая степень улучшения при двух типах введения, предпочтительно, когда дозы различаются в 3 раза или меньше, и наиболее предпочтительно, путем оценивания: достигается ли сопоставимая степень улучшения при двух типах введения, когда дозы являются одинаковыми. Оказалось, что такие представительные соединения по настоящему изобретению (в том числе, соединения, выбранные из группы, состоящей из тех, что приведены в примерах 82, 119, 120, 122, 229 и 267) имеют достаточно широкие интервалы приемлемой временной диаграммы введения, как указано выше.
[Пример испытания 4]
Назначение: влияние испытуемого соединения на содержание глюкозы в крови голодающих самцов крыс Wistar (in vivo испытание)
Животные: самцы крыс Wistar (поставляются фирмой Charles River Japan, Inc.).
Метод: получение и введение испытуемых соединений
Испытуемое соединение суспендируют в 0,5% растворе метилцеллюлозы (МЦ) и вводят перорально в дозировке 5 мл/кг. Контрольную группу животных обрабатывают 0,5% раствором МЦ. Раствор вводят перорально в дозировке 5 мл/кг.
[Сбор крови и определение содержание глюкозы в крови]
Непосредственно перед введением испытуемого соединения или 0,5% раствора МЦ и через 0,5, 1 и 3 часа после введения без анестезии хвостовую вену слегка надрезают лезвием бритвы, для того чтобы вытекла кровь. Отбирают 10 мкл крови и объединяют со 140 мкл 0,6 M раствора перхлорной кислоты. Пробу подвергают центрифугированию c ускорением 3000 g при температуре 4ºC в течение 10 минут и определяют концентрацию глюкозы в образовавшейся жидкости над осадком, используя набор CII TEST WAKO (фирма Wako Pure Chemical Industries).
Результаты
Установлено, что некоторые из новых конденсированных производных имидазола настоящего изобретения (в частности, соединения, выбранные из группы, состоящей из тех, что приведены в примерах 82, 119, 120, 122, 229 и 267) не оказывают существенного влияния на содержание глюкозы в пробах крови, отобранных в любое время, по сравнению с контрольной группой, обработанной одной средой, в эксперименте in vivo, как описано выше, где каждое соединение вводится перорально в дозировке 10-30 мг/кг.
[Пример испытания 5]
Влияние испытуемого соединения на толерантность к глюкозе самцов крыс Zucker fa/fa (модельные животные с сахарным диабетом тучных, типа II) (испытание in vivo)
Животные: самцы крыс Zucker fa/fa (поставляются фирмой Charles River Japan, Inc.).
Метод: получение и введение испытуемых соединений
Испытуемое соединение суспендируют в 0,5% растворе метилцеллюлозы (МЦ). Суспензию испытуемого соединения или 0,5% раствор МЦ, который используется в контрольной группе, обработанной средой, дают перорально в дозировке 5 мл/кг. Спустя 0,5 часа перорально дают раствор глюкозы в дозировке 5 мл/кг. Доза глюкозы, введенной перорально, составляет 2 г/кг.
Метод: отбор крови и определение содержания глюкозы, инсулина и GLP-1
Непосредственно перед введением испытуемого соединения или 0,5% раствора МЦ, непосредственно перед введением глюкозы и 0,5, 1, 2 и 3 часа после введения глюкозы, без анестезии, хвостовую вену слегка надрезают лезвием бритвы, для того чтобы вытекла кровь. Отбирают 250 мкл крови, используя покрытый гепарином капилляр, и переносят в пробирку для центрифугирования. Пробу подвергают центрифугированию c ускорением 10000 g при температуре 4ºC в течение 2 минут. Содержание инсулина и GLP-1 определяют в образовавшейся жидкости над осадком, используя набор для анализа инсулина (Morinaga Biochemical Institute) и набор Active GLP-1 ELISA (Linco) соответственно. Одновременно отбирают 10 мкл крови и объединяют со 140 мкл 0,6 M раствора перхлорной кислоты. Пробу подвергают центрифугированию c ускорением 3000 g при температуре 4ºC в течение 10 минут и определяют концентрацию глюкозы в образовавшейся жидкости над осадком, используя набор CII TEST WAKO (фирма Wako Pure Chemical Industries). Определяют только содержание глюкозы через три часа после введения глюкозы.
Результаты
Величину площади под кривой «изменение содержания глюкозы во времени» (AUCГлю(0-3ч)) от начала введения глюкозы до 3 часов после введения; величину площади под кривой содержания инсулина во времени (AUCинс(0-2ч)) и величину площади под кривой содержания GLP-1 во времени (AUCGLP-1 (0-2ч)) определяют для каждой группы животных, обработанных 0,5% раствором МЦ, и для каждой группы, обработанной испытуемым соединением. Изменение толерантности к глюкозе, изменение содержания инсулина и изменение содержания GLP-1, вызванные испытуемым соединением определяют, приняв величину AUC для группы, обработанной 0,5% раствором МЦ, за 100%, в соответствии с указанными далее формулами:
*Степень изменения толерантности к глюкозе (%) = (AUC0-3ч для группы, обработанной испытуемым соединением/AUC0-2ч для группы, обработанной 0,5% раствором МЦ) × 100;
*Степень изменения содержания инсулина и GLP-1 (%) = AUC0-2ч для группы, обработанной испытуемым соединением/AUC0-2ч для группы, обработанной 0,5% раствором МЦ) × 100.
Установлено, что некоторые из новых конденсированных производных имидазола настоящего изобретения (в частности, соединения, выбранные из группы, состоящей из тех, что приведены в примерах 82, 119, 120, 122, 229 и 267) изменяют содержание инсулина и GLP-1 в степени больше чем 100% и показывают степень изменения толерантности к глюкозе меньше чем 100% в эксперименте in vivo, как описано выше, где каждое соединение вводится перорально в дозировке 0,10-10 (мг/кг).
[Пример испытания 6]
Оценка для фермента (цитохром Р450), метаболизирующего лекарственный препарат
Ингибирующую активность IC50 определяют, используя систему экспрессии для рекомбинантного P450 и флуоресцентных субстратов (фирма GENTEST Corp.), которые указаны в таблицах 2 и 3, согласно методике испытания Procedure (WWW.gentest.com) и получены на фирме GENTEST Corp. Оцениваемые молекулярные разновидности P450 представляют собой пять молекулярных разновидностей, CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4. Применяемые экспериментальные условия показаны далее. Интенсивность флуоресценции определяют, используя планшетный счетчик (CYTO FLUOR Multi-Well Plate Reader Series 4000; PerSeptive Biosystems Corp.). Степень ингибирования определяют как среднюю величину из девяти независимых измерений в секунду, используя в качестве показателя интенсивности флуоресценцию, эмитируемую метаболитом флуоресцентного субстрата.
В таблице 2 приведены субстраты, метаболиты, ингибиторы, длины волн возбуждения и длины волн флуоресценции, применяемые в этом анализе.
| Таблица 2 | |||||
| Молекулярные разновидности p450 | Субстрат | Метаболит | Ингибитор | Длина волны возбуждения (нм) | Длина волны флуоресценции (нм) |
| CYP1A2 | CEC | CHC | α-нафтофлавон | 409 | 460 |
| CYP2C9 | MFC | HFC | сульфафеназол | 409 | 530 |
| CYP2C19 | CEC | CHC | транилципропин | 409 | 460 |
| CYP2D6 | AMMC | AHMC | квинидин | 390 | 460 |
| CYP3A4 | BFC | HFC | кетоконазол | 409 | 530 |
Сокращения для субстратов и метаболитов приведены в таблице 3.
| Таблица 3 | |
| CEC | 3-циано-7-этоксикумарин |
| СНС | 3-циано-7-гидроксикумарин |
| MFC | 7-метокси-4-(трифторметил)кумарин |
| HFC | 7-гидрокси-4-(трифторметил)кумарин |
| CEC | 7-этокси-3-цианокумарин |
| СНС | 7-гидрокси-3-цианокумарин |
| AMMC | 3-[2-(N,N-диэтил-N-метиламино)этил]-7-метокси-4-метилкумарин |
| АНМС | 3-[2-(N,N-диэтиламино)этил]-7-гидрокси-4-метилкумарин |
| BFC | 7-бензилокси-4-(трифторметил)кумарин |
| HFC | 7-гидрокси-4-(трифторметил)кумарин |
Результаты анализа
Соединения по настоящему изобретению оценивают по их способности ингибировать метаболические реакции благодаря P450 в примере испытания 6. Этот эксперимент продемонстрировал, что представительные соединения по настоящему изобретению (в том числе соединения, выбранные из группы, состоящей из тех, что указаны в примерах 82, 119, 120, 122, 229 и 267) имеют значения IC50, равные 10 мкМ или выше в отношении к пяти молекулам из группы P450, а именно к молекулярным разновидностям, CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4.
[Пример испытания 7]
Подавление тока канала hERG
(1) Активность в отношении ингибирования тока канала hERG оценивают в соответствии с сообщением Zhou Z. и др. в Biophysical Journal, 74(1), 230-241 (1998).
(2) Этот эксперимент проводят, используя клетки HEK-293, в которые был введен канальный ген hERG (подтип 1) (линия клеток установлена авторами этого изобретения).
(3) За одни или несколько суток до эксперимента клетки высевают на стеклянную чашку, покрытую полилизином. Клетки культивируют до дня эксперимента. В начале эксперимента стеклянную чашку с засеянными клетками переносят в баню для проведения измерения. Ток канала hERG измеряется с помощью клемм электрического напряжения, используя методику штепсельного соединителя. Ток измеряют, используя усилитель тока (Axon Instruments). Ток регистрируют и анализируют, используя программное обеспечение pCLAMP (Axon Instruments).
(4) Ток канала hERG индуцируется в клетках путем приложения деполяризующего импульса с фиксирующим потенциалом от -80 до +20 мв в течение 5 секунд и до -50 мв в течение 4 секунд, с интервалами 20 секунд. После стабилизации величины тока в контрольном растворе клетки подвергают перфузии с растворами, содержащими различные концентрации испытуемых соединений.
(5) Амплитуду тока канала hERG определяют как пиковое значение шлейфового тока, который наблюдается при восстановлении напряжения до -50 мв. Ингибирующая способность испытуемого соединения на ток канала hERG (IC50) оценивается по изменению пикового значения шлейфового тока после добавления испытуемого соединения при различной концентрации. Пиковое значение шлейфового тока, зарегистрированное для нормального раствора, принимается равным 100%.
Результаты испытания
Представительные соединения по настоящему изобретению (в том числе соединения, выбранные из группы, состоящей из соединений, приведенных в примерах 82, 119, 120, 122, 229 и 267) оцениваются по способности испытуемого соединения ингибировать ток канала hERG в примере испытания 7. Значения IC50 для этих соединений составляли 30 мкМ или выше.
Структурные формулы для соединений в описанных выше примерах получения и в примерах, показаны далее.
Промышленная применимость
В настоящем изобретении предоставляются конденсированные производные имидазола, обладающие DPPIV-ингибирующей активностью.
Следовательно, конденсированные производные имидазола настоящего изобретения могут применяться в качестве терапевтических и профилактических препаратов, например, при лечении сахарного диабета, ожирения, гиперлипидемии, СПИД, остеопороза, желудочно-кишечных нарушений, ангиогенеза, бесплодия, в качестве противоспалительных и антиаллергических препаратов, иммуномодулирующих средств, гормональных регуляторов, противоревматических лекарственных препаратов и противоопухолевых препаратов.
Кроме того, с использованием индекса способности этих соединений улучшать толерантность к глюкозе, соединения были испытаны, для того чтобы оценить их эффективность после перорального введения. Таким образом, была подтверждена достаточная эффективность этих соединений и продемонстрирована их применимость в качестве фармацевтических препаратов.
Claims (33)
1. Соединение, представленное следующей формулой, или его соль или гидрат
где Т1 представляет собой моноциклическую 5-6-членную гетероциклическую группу,
содержащую один или два атома азота в кольце, которая может иметь одну или более аминогруппу в качестве заместителей;
Х представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей, C2-6 алкинильную группу, фенильную группу, которая может иметь один или несколько заместителей, выбранных из алкильной группы или галогена или фенил С1-6 алкильной группы;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу формулы -CR2=;
R1 и R2, каждый независимо, представляют собой группу формулы -А0-А1-А2 (где А0 представляет собой одинарную связь или C1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранные из группы В, состоящей из указанных ниже заместителей; А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -O-СО-, группу, представленную формулой -СО-O-, группу, представленную формулой -NRA-, группу, представленную формулой -CO-NRA-, группу, представленную формулой -NRA-CO-, группу, представленную формулой -SO2-NRA-, или группу, представленную формулой -NRA-SO2-;
А2 и RA, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил C1-6 алкильную группу, С6-10 арил С1-6 алкильную группу, или С2-7 алкилкарбонильную группу;
причем А2 и RA, каждый независимо, могут иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей В:
когда Z2 представляет собой группу формулы -CR2=, R1 и R2 могут вместе образовывать 5-7-членное кольцо;
за исключением случаев, когда [1] R1 представляет собой атом водорода, Z1 представляет собой атом азота и Z2 представляет собой группу -СН=; [2] Z1 представляет собой атом азота и Z2 представляет собой группу -С(ОН)=;
<группа заместителей В>
группа заместителей В представляет собой группу, включающую гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, C1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1-CO-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RB3 (где RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -CO-RB4-RB5, и группу, представленную формулой -CH2-CO-RB4-RB5 (где RB4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRB6 -; RB5 и RB6, каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членный гетероцикл С1-6 алкильную группу, С6-10 арил C1-6 алкильную группу или 5-10-членный гетероарил С1-6 алкильную группу)).
где Т1 представляет собой моноциклическую 5-6-членную гетероциклическую группу,
содержащую один или два атома азота в кольце, которая может иметь одну или более аминогруппу в качестве заместителей;
Х представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей, C2-6 алкинильную группу, фенильную группу, которая может иметь один или несколько заместителей, выбранных из алкильной группы или галогена или фенил С1-6 алкильной группы;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу формулы -CR2=;
R1 и R2, каждый независимо, представляют собой группу формулы -А0-А1-А2 (где А0 представляет собой одинарную связь или C1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранные из группы В, состоящей из указанных ниже заместителей; А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -O-СО-, группу, представленную формулой -СО-O-, группу, представленную формулой -NRA-, группу, представленную формулой -CO-NRA-, группу, представленную формулой -NRA-CO-, группу, представленную формулой -SO2-NRA-, или группу, представленную формулой -NRA-SO2-;
А2 и RA, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил C1-6 алкильную группу, С6-10 арил С1-6 алкильную группу, или С2-7 алкилкарбонильную группу;
причем А2 и RA, каждый независимо, могут иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей В:
когда Z2 представляет собой группу формулы -CR2=, R1 и R2 могут вместе образовывать 5-7-членное кольцо;
за исключением случаев, когда [1] R1 представляет собой атом водорода, Z1 представляет собой атом азота и Z2 представляет собой группу -СН=; [2] Z1 представляет собой атом азота и Z2 представляет собой группу -С(ОН)=;
<группа заместителей В>
группа заместителей В представляет собой группу, включающую гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, C1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1-CO-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RB3 (где RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -CO-RB4-RB5, и группу, представленную формулой -CH2-CO-RB4-RB5 (где RB4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRB6 -; RB5 и RB6, каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членный гетероцикл С1-6 алкильную группу, С6-10 арил C1-6 алкильную группу или 5-10-членный гетероарил С1-6 алкильную группу)).
3. Соединение по п.1 или его соль или гидрат, где Т1 представляет собой пиперазин-1-ильную группу или 3-аминопиперидин-1-ильную группу.
4. Соединение по п.1 или его соль или гидрат, где Т1 представляет собой пиперазин-1-ильную группу.
5. Соединение по п.1 или его соль или гидрат, где Х представляет собой 3-метил-2-бутен-1-ильную группу, 2-бутин-1-ильную группу, бензильную группу или 2-хлорфенильную группу.
6. Соединение по п.1 или его соль или гидрат, где Х представляет собой 2-бутин-1-ильную группу.
7. Соединение по п.1 или его соль или гидрат, где любая из групп Z1 или Z2 представляет собой атом азота.
8. Соединение по п.1 или его соль или гидрат, где Z1 представляет собой атом азота; а Z2 является группой, представленной формулой -CR2=, где R2 имеет значения, указанные в п.1.
9. Соединение по п.1 или его соль или гидрат, где Z2 представляет собой атом азота; и Z1 является группой, представленной формулой -CR2=, где R2 имеет значения, указанные в п.1.
10. Соединение по п.1 или его соль или гидрат,
где R1 представляет собой атом водорода или группу, представленную формулой -A10-A11-A12 (где А10 представляет собой C1-6 алкенильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С;
А11 представляет собой одинарную связь, атом кислорода, атом серы или карбонильную группу;
А12 представляет собой атом водорода, С6-10 арильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, 5-10-членную гетероарильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, или С6-10 арил C1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С:
<группа заместителей C>
группа заместителей С представляет собой группу, включающую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, C1-6 алкильную группу, С1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RС2 (где RС1 и RС2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RС3-RС4, и группу, представленную формулой -СН2-CO-RС3-RС4 (где RС3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRС5-; RС4 и RС5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу).
где R1 представляет собой атом водорода или группу, представленную формулой -A10-A11-A12 (где А10 представляет собой C1-6 алкенильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С;
А11 представляет собой одинарную связь, атом кислорода, атом серы или карбонильную группу;
А12 представляет собой атом водорода, С6-10 арильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, 5-10-членную гетероарильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, или С6-10 арил C1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С:
<группа заместителей C>
группа заместителей С представляет собой группу, включающую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, C1-6 алкильную группу, С1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RС2 (где RС1 и RС2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RС3-RС4, и группу, представленную формулой -СН2-CO-RС3-RС4 (где RС3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRС5-; RС4 и RС5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу).
11. Соединение по п.1 или его соль или гидрат, где R1 представляет собой атом водорода, С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, 5-10-членный гетероарил C1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С:
<группа заместителей С>
группа заместителей С представляет собой группу, включающую: гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RC2 (где RC1 и RC2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RC3-RC4, и группу, представленную формулой -CH2-CO-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу).
<группа заместителей С>
группа заместителей С представляет собой группу, включающую: гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RC2 (где RC1 и RC2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RC3-RC4, и группу, представленную формулой -CH2-CO-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу).
12. Соединение по п.10 или его соль или гидрат, где группа заместителей С представляет собой группу, включающую цианогруппу, C1-6 алкоксигруппу, С2-7 алкоксикарбонильную группу и атом галогена.
13. Соединение по п.1 или его соль или гидрат, где R1 представляет собой метильную группу, цианобензильную группу, фторцианобензильную группу, фенилэтильную группу, 2-метоксиэтильную группу или 4-метоксикарбонилпиридин-2-ильную группу.
14. Соединение по п.1 или его соль или гидрат, где R1 представляет собой метильную группу, или 2-цианобензильную группу.
15. Соединение по любому из пп.1-14 или его соль или гидрат, где R2 представляет собой атом водорода, цианогруппу или группу, представленную формулой -А21-А22,
(где А21 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -O-СО-, группу, представленную формулой -СО-O-, группу, представленную формулой -NRA2-, группу, представленную формулой -CO-NRA2-, или группу, представленную формулой -NRА2 -СО-;
А22 и RA2, каждый независимо, представляют собой атом водорода, цианогруппу, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил C1-6 алкильную группу или С6-10 арил С1-6 алкильную группу;
причем А22 и RA2, каждый независимо, может иметь 1-3 заместителя, выбранные из указанных ниже заместителей группы D:
<группа заместителей D>
группа заместителей D представляет собой группу, включающую гидроксильную группу, цианогруппу, нитрогруппу, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRD1-RD2, (где RD1 и RD2, каждый, независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RD3 (в которой RD3 представляет собой 4-8-членную гетероциклическую группу), и группу, представленную формулой -CO-RD4-RD5 (где RD4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRD6-; RD5 и RD6, каждый независимо, представляют собой атом водорода, С3-8 циклоалкильную группу или C1-6 алкильную группу)).
(где А21 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -O-СО-, группу, представленную формулой -СО-O-, группу, представленную формулой -NRA2-, группу, представленную формулой -CO-NRA2-, или группу, представленную формулой -NRА2 -СО-;
А22 и RA2, каждый независимо, представляют собой атом водорода, цианогруппу, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил C1-6 алкильную группу или С6-10 арил С1-6 алкильную группу;
причем А22 и RA2, каждый независимо, может иметь 1-3 заместителя, выбранные из указанных ниже заместителей группы D:
<группа заместителей D>
группа заместителей D представляет собой группу, включающую гидроксильную группу, цианогруппу, нитрогруппу, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRD1-RD2, (где RD1 и RD2, каждый, независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RD3 (в которой RD3 представляет собой 4-8-членную гетероциклическую группу), и группу, представленную формулой -CO-RD4-RD5 (где RD4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRD6-; RD5 и RD6, каждый независимо, представляют собой атом водорода, С3-8 циклоалкильную группу или C1-6 алкильную группу)).
16. Соединение по любому из пп.1-14 или его соль или гидрат, где R2 представляет собой атом водорода, цианогруппу, карбоксигруппу, С2-7 алкоксикарбонильную группу, C1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), или группу, представленную формулой -А23-А24,
(где А23 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA3-;
А24 и RA3, каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С3-8 циклоалкильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С2-6 алкенильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С2-6 алкинильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, фенильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, или 5-10-членную гетероарильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1:
<группа заместителей D1>
группа заместителей D1 представляет собой группу, включающую
карбоксигруппу, С2-7 алкоксикарбонильную группу, C1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), пирролидин-1-илкарбонильную группу, C1-6 алкильную группу и C1-6 алкоксигруппу).
(где А23 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA3-;
А24 и RA3, каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С3-8 циклоалкильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С2-6 алкенильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С2-6 алкинильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, фенильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, или 5-10-членную гетероарильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1:
<группа заместителей D1>
группа заместителей D1 представляет собой группу, включающую
карбоксигруппу, С2-7 алкоксикарбонильную группу, C1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), пирролидин-1-илкарбонильную группу, C1-6 алкильную группу и C1-6 алкоксигруппу).
17. Соединение по любому из пп.1-14 или его соль или гидрат, где R2 представляет собой атом водорода, цианогруппу, C1-6 алкоксигруппу или группу, представленную формулой -А25-А26 (где А25 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA4-;
А26 и RA4 каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, содержащую заместитель, выбранный из указанной ниже группы заместителей D1, С3-8 циклоалкильную группу, имеющую заместитель, выбранный из указанной ниже группы заместителей D1, или фенильную группу, имеющую заместитель, выбранный из указанной ниже группы заместителей D1:
<группа заместителей D1>
группа заместителей D1 включает карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), пирролидин-1-илкарбонильную группу, C1-6 алкильную группу и С1-6 алкоксигруппу).
А26 и RA4 каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, содержащую заместитель, выбранный из указанной ниже группы заместителей D1, С3-8 циклоалкильную группу, имеющую заместитель, выбранный из указанной ниже группы заместителей D1, или фенильную группу, имеющую заместитель, выбранный из указанной ниже группы заместителей D1:
<группа заместителей D1>
группа заместителей D1 включает карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), пирролидин-1-илкарбонильную группу, C1-6 алкильную группу и С1-6 алкоксигруппу).
18. Соединение по любому из пп.1-14 или его соль или гидрат, где R2 представляет собой атом водорода, цианогруппу, метоксигруппу, карбамоилфенилоксигруппу, или группу, представленную следующей формулой:
(где А27 представляет собой атом кислорода, атом серы, или -NH-;
А28 и А29, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу).
(где А27 представляет собой атом кислорода, атом серы, или -NH-;
А28 и А29, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу).
19. Соединение по любому из пп.1-14 или его соль или гидрат, где R2 представляет собой атом водорода, цианогруппу, или 2-карбамоилфенилоксигруппу.
20. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
7-(2-бутинил)-2-циано-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он.
7-(2-бутинил)-2-циано-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он.
21. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он.
3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он.
22. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он.
2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он.
23. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.
2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.
24. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-карбонитрил.
7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-карбонитрил.
25. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо [4,5-d] пиридазин-5-илметил]бензонитрил.
2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо [4,5-d] пиридазин-5-илметил]бензонитрил.
26. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
2-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.
2-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.
27. Соединение по п.1 или его соль или гидрат, где соединение формулы (I) представляет собой
2-[7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.
2-[7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.
28. Ингибитор дипептидилпептидазы IV, содержащий соединение по п.1.
29. Фармацевтическая композиция, являющаяся ингибитором дипептидилпептидазы IV, содержащая соединение по п.1 и вспомогательный агент, используемый при получении препаратов.
30. Профилактическое или терапевтическое средство, содержащее соединение по п.1, для лечения сахарного диабета, ожирения, гиперлипидемии.
31. Профилактическое или терапевтическое средство по п.30 для лечения сахарного диабета.
32. Способ профилактики или лечения заболевания, при котором эффективным является ингибирование дипептидилпептидазы IV, включающий введение пациенту соединения по п.1 или его соли или гидрата в фармацевтически эффективном количестве.
33. Применение соединения по п.1 или его соли или гидрата для получения терапевтического или профилактического средства, предназначенного для лечения заболевания, при котором эффективным является ингибирование дипептидилпептидазы IV.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002-166069 | 2002-06-06 | ||
| JP2002166069 | 2002-06-06 | ||
| JP2002-209373 | 2002-07-18 | ||
| JP2002209373 | 2002-07-18 | ||
| JP2002-307750 | 2002-10-23 | ||
| JP2002307750 | 2002-10-23 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2004139111A RU2004139111A (ru) | 2005-08-10 |
| RU2297418C2 RU2297418C2 (ru) | 2007-04-20 |
| RU2297418C9 true RU2297418C9 (ru) | 2009-01-27 |
Family
ID=29740540
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2004139111/04A RU2297418C9 (ru) | 2002-06-06 | 2003-06-03 | Новые конденсированные производные имидазола, ингибитор дипептидилпептидазы iv, фармацевтическая композиция, способ лечения и применение на их основе |
Country Status (19)
| Country | Link |
|---|---|
| US (4) | US20060100199A1 (ru) |
| EP (1) | EP1514552A4 (ru) |
| JP (2) | JP3675813B2 (ru) |
| KR (1) | KR100985160B1 (ru) |
| CN (2) | CN100469778C (ru) |
| AU (1) | AU2003241960B2 (ru) |
| BR (1) | BR0311697A (ru) |
| CA (1) | CA2485641C (ru) |
| HK (2) | HK1100219A1 (ru) |
| IL (1) | IL165178A0 (ru) |
| IS (1) | IS7625A (ru) |
| MX (1) | MXPA04012226A (ru) |
| NO (1) | NO20050054L (ru) |
| NZ (1) | NZ536794A (ru) |
| PL (1) | PL374007A1 (ru) |
| RU (1) | RU2297418C9 (ru) |
| TW (1) | TWI273104B (ru) |
| WO (1) | WO2003104229A1 (ru) |
| ZA (1) | ZA200500041B (ru) |
Families Citing this family (129)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| MXPA02012272A (es) * | 2000-07-04 | 2003-04-25 | Novo Nordisk As | Compuestos heterociclicos que son inhibidores de la enzima dipeptidilpeptidasa-iv. |
| EE05735B1 (et) * | 2001-02-24 | 2015-01-15 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Ksantiini derivaadid, nende valmistamine ja kasutamine ravimina |
| US7074798B2 (en) | 2002-02-25 | 2006-07-11 | Eisai Co., Ltd | Xanthine derivative and DPPIV inhibitor |
| PL374007A1 (en) * | 2002-06-06 | 2005-09-19 | Eisai Co, Ltd. | Novel fused imidazole derivative |
| US7407955B2 (en) | 2002-08-21 | 2008-08-05 | Boehringer Ingelheim Pharma Gmbh & Co., Kg | 8-[3-amino-piperidin-1-yl]-xanthines, the preparation thereof and their use as pharmaceutical compositions |
| US7569574B2 (en) | 2002-08-22 | 2009-08-04 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Purine derivatives, the preparation thereof and their use as pharmaceutical compositions |
| US7495005B2 (en) | 2002-08-22 | 2009-02-24 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Xanthine derivatives, their preparation and their use in pharmaceutical compositions |
| MXPA05003252A (es) * | 2002-09-26 | 2005-07-05 | Eisai Co Ltd | Farmaco de combinacion. |
| US7482337B2 (en) | 2002-11-08 | 2009-01-27 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Xanthine derivatives, the preparation thereof and their use as pharmaceutical compositions |
| DE10254304A1 (de) * | 2002-11-21 | 2004-06-03 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Xanthinderivate, deren Herstellung und deren Verwendung als Arzneimittel |
| UY28103A1 (es) * | 2002-12-03 | 2004-06-30 | Boehringer Ingelheim Pharma | Nuevas imidazo-piridinonas sustituidas, su preparación y su empleo como medicacmentos |
| US7109192B2 (en) | 2002-12-03 | 2006-09-19 | Boehringer Ingelheim Pharma Gmbh & Co Kg | Substituted imidazo-pyridinones and imidazo-pyridazinones, the preparation thereof and their use as pharmaceutical compositions |
| BR0316991A (pt) | 2002-12-04 | 2005-10-25 | Eisai Co Ltd | Compostos de anel de 1,3-diidro-imidazol fundido |
| US7550590B2 (en) * | 2003-03-25 | 2009-06-23 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| WO2004096806A1 (ja) * | 2003-04-30 | 2004-11-11 | Sumitomo Pharmaceuticals Co. Ltd. | 縮合イミダゾール誘導体 |
| DE602004026289D1 (de) | 2003-05-05 | 2010-05-12 | Probiodrug Ag | Glutaminylcyclase-hemmer |
| AU2003902828A0 (en) * | 2003-06-05 | 2003-06-26 | Fujisawa Pharmaceutical Co., Ltd. | Dpp-iv inhibitor |
| US7566707B2 (en) | 2003-06-18 | 2009-07-28 | Boehringer Ingelheim International Gmbh | Imidazopyridazinone and imidazopyridone derivatives, the preparation thereof and their use as pharmaceutical compositions |
| DE10327439A1 (de) * | 2003-06-18 | 2005-01-05 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Imidazopyridazinon- und Imidazopyridonderivate, deren Herstellung und deren Verwendung als Arzneimittel |
| US7678909B1 (en) | 2003-08-13 | 2010-03-16 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| US7169926B1 (en) | 2003-08-13 | 2007-01-30 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| US20050065148A1 (en) | 2003-08-13 | 2005-03-24 | Syrrx, Inc. | Dipeptidyl peptidase inhibitors |
| WO2005026148A1 (en) | 2003-09-08 | 2005-03-24 | Takeda San Diego, Inc. | Dipeptidyl peptidase inhibitors |
| JPWO2005051949A1 (ja) * | 2003-11-26 | 2007-06-21 | 住友製薬株式会社 | 新規縮合イミダゾール誘導体 |
| DE10355304A1 (de) | 2003-11-27 | 2005-06-23 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue 8-(Piperazin-1-yl)-und 8-([1,4]Diazepan-1-yl)-xanthine, deren Herstellung und deren Verwendung als Arzneimittel |
| JPWO2005053695A1 (ja) * | 2003-12-04 | 2007-12-06 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 多発性硬化症予防剤または治療剤 |
| WO2005061505A1 (en) * | 2003-12-16 | 2005-07-07 | Pfizer Products Inc. | Bicyclic imidazolyl pyrimidin-4-one cannabinoid receptor ligands and uses thereof |
| DE10359098A1 (de) * | 2003-12-17 | 2005-07-28 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue 2-(Piperazin-1-yl)- und 2-([1,4]Diazepan-1-yl)-imidazo[4,5-d]pyridazin-4-one, deren Herstellung und deren Verwendung als Arzneimittel |
| US7217711B2 (en) | 2003-12-17 | 2007-05-15 | Boehringer Ingelheim International Gmbh | Piperazin-1-yl and 2-([1,4]diazepan-1-yl)-imidazo[4,5-d]-pyridazin-4-ones, the preparation thereof and their use as pharmaceutical compositions |
| DE10360835A1 (de) | 2003-12-23 | 2005-07-21 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Bicyclische Imidazolverbindungen, deren Herstellung und deren Verwendung als Arzneimittel |
| US7501426B2 (en) | 2004-02-18 | 2009-03-10 | Boehringer Ingelheim International Gmbh | 8-[3-amino-piperidin-1-yl]-xanthines, their preparation and their use as pharmaceutical compositions |
| AU2005219508B2 (en) * | 2004-02-18 | 2012-02-16 | Boehringer Ingelheim International Gmbh | 8-[3-amino-piperidin-1-yl]-xanthine, the production thereof and the use in the form of a DPP inhibitor |
| DE102004009039A1 (de) * | 2004-02-23 | 2005-09-08 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | 8-[3-Amino-piperidin-1-yl]-xanthine, deren Herstellung und Verwendung als Arzneimittel |
| US7732446B1 (en) | 2004-03-11 | 2010-06-08 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| US7393847B2 (en) | 2004-03-13 | 2008-07-01 | Boehringer Ingleheim International Gmbh | Imidazopyridazinediones, their preparation and their use as pharmaceutical compositions |
| DE102004012366A1 (de) * | 2004-03-13 | 2005-09-29 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Imidazopyridazindione, deren Herstellung und deren Verwendung als Arzneimittel |
| WO2005095381A1 (en) | 2004-03-15 | 2005-10-13 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| CN100522960C (zh) * | 2004-04-08 | 2009-08-05 | 惠氏公司 | 作为黄体酮受体调节剂的硫代酰胺衍生物 |
| US7179809B2 (en) * | 2004-04-10 | 2007-02-20 | Boehringer Ingelheim International Gmbh | 2-Amino-imidazo[4,5-d]pyridazin-4-ones, their preparation and their use as pharmaceutical compositions |
| JP2007531780A (ja) * | 2004-04-10 | 2007-11-08 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 新規な2−アミノ−イミダゾ[4,5−d]ピリダジン−4−オン及び2−アミノ−イミダゾ[4,5−c]ピリダジン−4−オン、その製法及び医薬としての使用 |
| DE102004022970A1 (de) * | 2004-05-10 | 2005-12-01 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Imidazolderivate, deren Herstellung und deren Verwendung als Intermediate zur Herstellung von Arzneimitteln und Pestiziden |
| US7439370B2 (en) | 2004-05-10 | 2008-10-21 | Boehringer Ingelheim International Gmbh | Imidazole derivatives, their preparation and their use as intermediates for the preparation of pharmaceutical compositions and pesticides |
| WO2005118555A1 (en) | 2004-06-04 | 2005-12-15 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| DE102004030502A1 (de) * | 2004-06-24 | 2006-01-12 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue Imidazole und Triazole, deren Herstellung und Verwendung als Arzneimittel |
| WO2006019965A2 (en) | 2004-07-16 | 2006-02-23 | Takeda San Diego, Inc. | Dipeptidyl peptidase inhibitors |
| DE102004038269A1 (de) * | 2004-08-06 | 2006-03-16 | Sanofi-Aventis Deutschland Gmbh | Substituierte, bizyklische 8-Piperidino-xanthine, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| DE102004043944A1 (de) | 2004-09-11 | 2006-03-30 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue 8-(3-Amino-piperidin-1-yl)-7-(but-2-inyl)-xanthine, deren Herstellung und deren Verwendung als Arzneimittel |
| DE102004044221A1 (de) | 2004-09-14 | 2006-03-16 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Neue 3-Methyl-7-butinyl-xanthine, deren Herstellung und deren Verwendung als Arzneimittel |
| AR051596A1 (es) * | 2004-10-26 | 2007-01-24 | Irm Llc | Compuestos heterociclicos condensados nitrogenados como inhibidores de la actividad del receptor canabinoide 1; composiciones farmaceuticas que los contienen y su empleo en la preparacion de medicamentos para el tratamiento de trastornos alimentarios |
| DE102004054054A1 (de) | 2004-11-05 | 2006-05-11 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Verfahren zur Herstellung chiraler 8-(3-Amino-piperidin-1-yl)-xanthine |
| WO2006068978A2 (en) | 2004-12-21 | 2006-06-29 | Takeda Pharmaceutial Company Limited | Dipeptidyl peptidase inhibitors |
| CA2590912A1 (en) | 2004-12-24 | 2006-06-29 | Dainippon Sumitomo Pharma Co., Ltd. | Bicyclic pyrrole derivatives |
| DOP2006000008A (es) * | 2005-01-10 | 2006-08-31 | Arena Pharm Inc | Terapia combinada para el tratamiento de la diabetes y afecciones relacionadas y para el tratamiento de afecciones que mejoran mediante un incremento de la concentración sanguínea de glp-1 |
| WO2006112331A1 (ja) * | 2005-04-13 | 2006-10-26 | Dainippon Simitomo Pharma Co., Ltd. | 新規縮合ピロール誘導体 |
| DE102005035891A1 (de) | 2005-07-30 | 2007-02-08 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | 8-(3-Amino-piperidin-1-yl)-xanthine, deren Herstellung und deren Verwendung als Arzneimittel |
| WO2007017423A2 (en) * | 2005-08-11 | 2007-02-15 | F. Hoffmann-La Roche Ag | Pharmaceutical composition comprising a dpp-iv inhibitor |
| SI1942898T2 (sl) | 2005-09-14 | 2014-08-29 | Takeda Pharmaceutical Company Limited | Dipeptidil-peptidazni inhibitorji za zdravljenje diabetesa |
| KR101368988B1 (ko) | 2005-09-16 | 2014-02-28 | 다케다 야쿠힌 고교 가부시키가이샤 | 디펩티딜 펩티다제 억제제 |
| GB0526291D0 (en) | 2005-12-23 | 2006-02-01 | Prosidion Ltd | Therapeutic method |
| WO2007112347A1 (en) | 2006-03-28 | 2007-10-04 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| PE20071221A1 (es) | 2006-04-11 | 2007-12-14 | Arena Pharm Inc | Agonistas del receptor gpr119 en metodos para aumentar la masa osea y para tratar la osteoporosis y otras afecciones caracterizadas por masa osea baja, y la terapia combinada relacionada a estos agonistas |
| MX2008013120A (es) | 2006-04-11 | 2008-10-27 | Arena Pharm Inc | Metodos para utilizar el receptor gpr119 para identificar compuestos utiles para incrementar la masa osea en un individuo. |
| EP1852108A1 (en) | 2006-05-04 | 2007-11-07 | Boehringer Ingelheim Pharma GmbH & Co.KG | DPP IV inhibitor formulations |
| PE20110235A1 (es) | 2006-05-04 | 2011-04-14 | Boehringer Ingelheim Int | Combinaciones farmaceuticas que comprenden linagliptina y metmorfina |
| KR101541791B1 (ko) | 2006-05-04 | 2015-08-04 | 베링거 인겔하임 인터내셔날 게엠베하 | 다형태 |
| EP2057160A1 (en) | 2006-08-08 | 2009-05-13 | Boehringer Ingelheim International GmbH | Pyrrolo [3, 2 -d]pyrimidines as dpp-iv inhibitors for the treatment of diabetes mellitus |
| US8324383B2 (en) | 2006-09-13 | 2012-12-04 | Takeda Pharmaceutical Company Limited | Methods of making polymorphs of benzoate salt of 2-[[6-[(3R)-3-amino-1-piperidinyl]-3,4-dihydro-3-methyl-2,4-dioxo-1(2H)-pyrimidinyl]methyl]-benzonitrile |
| EP2089383B1 (en) | 2006-11-09 | 2015-09-16 | Probiodrug AG | 3-hydr0xy-1,5-dihydr0-pyrr0l-2-one derivatives as inhibitors of glutaminyl cyclase for the treatment of ulcer, cancer and other diseases |
| TW200838536A (en) | 2006-11-29 | 2008-10-01 | Takeda Pharmaceutical | Polymorphs of succinate salt of 2-[6-(3-amino-piperidin-1-yl)-3-methyl-2,4-dioxo-3,4-dihydro-2H-pyrimidin-1-ylmethy]-4-fluor-benzonitrile and methods of use therefor |
| SI2091948T1 (sl) | 2006-11-30 | 2012-07-31 | Probiodrug Ag | Novi inhibitorji glutaminil ciklaze |
| US8093236B2 (en) | 2007-03-13 | 2012-01-10 | Takeda Pharmaceuticals Company Limited | Weekly administration of dipeptidyl peptidase inhibitors |
| EP2142514B1 (en) | 2007-04-18 | 2014-12-24 | Probiodrug AG | Thiourea derivatives as glutaminyl cyclase inhibitors |
| JP2008289437A (ja) * | 2007-05-28 | 2008-12-04 | Sony Corp | レーザーを用いた酵素活性測定方法及び酵素活性測定装置 |
| AU2008290582B2 (en) * | 2007-08-17 | 2014-08-14 | Boehringer Ingelheim International Gmbh | Purin derivatives for use in the treatment of fab-related diseases |
| UY31685A (es) * | 2008-03-04 | 2009-11-10 | Smithkline Beecham Corp | Compuestos antivirales, composiciones y metodos para usarlos |
| JPWO2009113423A1 (ja) * | 2008-03-10 | 2011-07-21 | 大日本住友製薬株式会社 | 二環性ピロール化合物 |
| PE20140960A1 (es) | 2008-04-03 | 2014-08-15 | Boehringer Ingelheim Int | Formulaciones que comprenden un inhibidor de dpp4 |
| EP2108960A1 (en) | 2008-04-07 | 2009-10-14 | Arena Pharmaceuticals, Inc. | Methods of using A G protein-coupled receptor to identify peptide YY (PYY) secretagogues and compounds useful in the treatment of conditons modulated by PYY |
| PE20100156A1 (es) * | 2008-06-03 | 2010-02-23 | Boehringer Ingelheim Int | Tratamiento de nafld |
| UY32030A (es) | 2008-08-06 | 2010-03-26 | Boehringer Ingelheim Int | "tratamiento para diabetes en pacientes inapropiados para terapia con metformina" |
| BRPI0916997A2 (pt) | 2008-08-06 | 2020-12-15 | Boehringer Ingelheim International Gmbh | Inibidor de dpp-4 e seu uso |
| EA031225B1 (ru) * | 2008-08-15 | 2018-12-28 | Бёрингер Ингельхайм Интернациональ Гмбх | Ингибиторы дпп-4 для заживления ран |
| AU2009290911A1 (en) | 2008-09-10 | 2010-03-18 | Boehringer Ingelheim International Gmbh | Combination therapy for the treatment of diabetes and related conditions |
| US20200155558A1 (en) | 2018-11-20 | 2020-05-21 | Boehringer Ingelheim International Gmbh | Treatment for diabetes in patients with insufficient glycemic control despite therapy with an oral antidiabetic drug |
| NZ592924A (en) | 2008-12-23 | 2014-05-30 | Boehringer Ingelheim Int | Salt forms of a xanthine derivative |
| TW201036975A (en) | 2009-01-07 | 2010-10-16 | Boehringer Ingelheim Int | Treatment for diabetes in patients with inadequate glycemic control despite metformin therapy |
| AR077642A1 (es) | 2009-07-09 | 2011-09-14 | Arena Pharm Inc | Moduladores del metabolismo y el tratamiento de trastornos relacionados con el mismo |
| JP5934645B2 (ja) | 2009-09-11 | 2016-06-15 | プロビオドルグ エージー | グルタミニルシクラーゼ阻害剤としてのヘテロ環式誘導体 |
| CA2782179C (en) | 2009-11-27 | 2020-06-23 | Boehringer Ingelheim International Gmbh | Treatment of genotyped diabetic patients with dpp-iv inhibitors such as linagliptin |
| JP6026284B2 (ja) | 2010-03-03 | 2016-11-16 | プロビオドルグ エージー | グルタミニルシクラーゼの阻害剤 |
| EA022420B1 (ru) | 2010-03-10 | 2015-12-30 | Пробиодруг Аг | Гетероциклические ингибиторы глутаминилциклазы (qc, ec 2.3.2.5) |
| AU2011237775A1 (en) | 2010-04-06 | 2012-11-22 | Arena Pharmaceuticals, Inc. | Modulators of the GPR119 receptor and the treatment of disorders related thereto |
| WO2011131748A2 (en) | 2010-04-21 | 2011-10-27 | Probiodrug Ag | Novel inhibitors |
| NZ602921A (en) | 2010-05-05 | 2016-01-29 | Boehringer Ingelheim Int | Combination therapy comprising the administration of a glp-1 receptor agonist and a ddp-4 inhibitor |
| JP5843855B2 (ja) | 2010-06-24 | 2016-01-13 | ベーリンガー インゲルハイム インターナショナル ゲゼルシャフト ミット ベシュレンクテル ハフツング | 糖尿病療法 |
| CN103261200B (zh) * | 2010-09-13 | 2016-03-30 | 阿迪维纳斯疗法有限公司 | 作为a2b腺苷受体拮抗剂的前药的嘌呤化合物、它们的制备方法及医药用途 |
| JP5941916B2 (ja) | 2010-09-22 | 2016-06-29 | アリーナ ファーマシューティカルズ, インコーポレイテッド | Gpr119レセプターのモジュレーターおよびそれに関連する障害の処置 |
| US9034883B2 (en) | 2010-11-15 | 2015-05-19 | Boehringer Ingelheim International Gmbh | Vasoprotective and cardioprotective antidiabetic therapy |
| WO2012088682A1 (en) * | 2010-12-29 | 2012-07-05 | Shanghai Fochon Pharmaceutical Co Ltd. | 2-(3-aminopiperidin-1-yl)-[1,2,4]triazolo[1,5-c]pyrimidine-5,7(3h,6h)-dione derivates as dipeptidyl peptidase iv(dpp-iv) inhibitors |
| US8530670B2 (en) | 2011-03-16 | 2013-09-10 | Probiodrug Ag | Inhibitors |
| WO2012135570A1 (en) | 2011-04-01 | 2012-10-04 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| US20140066369A1 (en) | 2011-04-19 | 2014-03-06 | Arena Pharmaceuticals, Inc. | Modulators Of The GPR119 Receptor And The Treatment Of Disorders Related Thereto |
| WO2012145603A1 (en) | 2011-04-22 | 2012-10-26 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| US20140051714A1 (en) | 2011-04-22 | 2014-02-20 | Arena Pharmaceuticals, Inc. | Modulators Of The GPR119 Receptor And The Treatment Of Disorders Related Thereto |
| WO2012170702A1 (en) | 2011-06-08 | 2012-12-13 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| US9051329B2 (en) | 2011-07-05 | 2015-06-09 | Merck Sharp & Dohme Corp. | Tricyclic heterocycles useful as dipeptidyl peptidase-IV inhibitors |
| ES2713566T3 (es) | 2011-07-15 | 2019-05-22 | Boehringer Ingelheim Int | Derivado de quinazolina dimérico sustituido, su preparación y su uso en composiciones farmacéuticas para el tratamiento de la diabetes de tipo I y II |
| WO2013055910A1 (en) | 2011-10-12 | 2013-04-18 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| WO2013097052A1 (en) * | 2011-12-30 | 2013-07-04 | Abbott Laboratories | Bromodomain inhibitors |
| US9555001B2 (en) | 2012-03-07 | 2017-01-31 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition and uses thereof |
| EP3685839A1 (en) | 2012-05-14 | 2020-07-29 | Boehringer Ingelheim International GmbH | Linagliptin for use in the treatment of albuminuria and kidney related diseases |
| WO2013174767A1 (en) | 2012-05-24 | 2013-11-28 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in modifying food intake and regulating food preference |
| CN103709163B (zh) * | 2012-09-29 | 2016-12-21 | 齐鲁制药有限公司 | 黄嘌呤衍生物、其制备方法及用途 |
| WO2014074668A1 (en) | 2012-11-08 | 2014-05-15 | Arena Pharmaceuticals, Inc. | Modulators of gpr119 and the treatment of disorders related thereto |
| BR112015013611A2 (pt) * | 2012-12-20 | 2017-11-14 | Merck Sharp & Dohme | composto, e, composição farmacêutica |
| EP2994138A4 (en) | 2013-05-10 | 2016-12-28 | Nimbus Apollo Inc | ACC-HEMMER AND USES THEREOF |
| WO2014182945A1 (en) | 2013-05-10 | 2014-11-13 | Nimbus Apollo, Inc. | Acc inhibitors and uses thereof |
| CA2911822A1 (en) | 2013-05-10 | 2014-11-13 | Nimbus Apollo, Inc. | Acc inhibitors and uses thereof |
| MX2015015421A (es) * | 2013-05-10 | 2016-06-21 | Nimbus Apollo Inc | Inhibidores de acetil-coa carboxilasa (acc) y usos de los mismos. |
| AR096758A1 (es) * | 2013-06-28 | 2016-02-03 | Abbvie Inc | Inhibidores cristalinos de bromodominios |
| ES2950384T3 (es) | 2014-02-28 | 2023-10-09 | Boehringer Ingelheim Int | Uso médico de un inhibidor de DPP-4 |
| CA2961186A1 (en) * | 2014-09-18 | 2016-03-24 | Sunovion Pharmaceuticals Inc. | Tricyclic derivative |
| KR20180006881A (ko) | 2015-03-09 | 2018-01-19 | 인테크린 테라퓨틱스, 아이엔씨. | 비알코올성 지방간 질환 및/또는 지방이영양증의 치료 방법 |
| EP3974431A1 (en) * | 2015-06-25 | 2022-03-30 | Boehringer Ingelheim International GmbH | Process for the preparation of a xanthine-based compound |
| CN109310697A (zh) | 2016-06-10 | 2019-02-05 | 勃林格殷格翰国际有限公司 | 利格列汀和二甲双胍的组合 |
| AU2018249822A1 (en) | 2017-04-03 | 2019-10-31 | Coherus Biosciences Inc. | PPArgamma agonist for treatment of progressive supranuclear palsy |
| PL3461819T3 (pl) | 2017-09-29 | 2020-11-30 | Probiodrug Ag | Inhibitory cyklazy glutaminylowej |
| CN108299436B (zh) * | 2018-02-09 | 2020-01-17 | 上海慈瑞医药科技股份有限公司 | 黄嘌呤类化合物及其药物组合物和应用 |
| KR20230104781A (ko) | 2020-10-05 | 2023-07-10 | 인라이븐 테라퓨틱스, 인크. | Bcr-abl 티로신 키나아제의 억제를 위한 5- 및 6-아자인돌 화합물 |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US219178A (en) * | 1879-09-02 | Improvement in steam-pressure regulators | ||
| US122228A (en) * | 1871-12-26 | Improvement in head-blocks | ||
| US100199A (en) * | 1870-02-22 | Improvement in ditcher and grader | ||
| GB8515934D0 (en) * | 1985-06-24 | 1985-07-24 | Janssen Pharmaceutica Nv | (4-piperidinomethyl and-hetero)purines |
| GB9906714D0 (en) | 1999-03-23 | 1999-05-19 | Ferring Bv | Compositions for improving fertility |
| MXPA02012272A (es) | 2000-07-04 | 2003-04-25 | Novo Nordisk As | Compuestos heterociclicos que son inhibidores de la enzima dipeptidilpeptidasa-iv. |
| EE05735B1 (et) * | 2001-02-24 | 2015-01-15 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Ksantiini derivaadid, nende valmistamine ja kasutamine ravimina |
| EP1399124B1 (en) * | 2001-06-11 | 2007-10-10 | Firmenich Sa | Stable transparent perfuming emulsion |
| WO2003004496A1 (en) | 2001-07-03 | 2003-01-16 | Novo Nordisk A/S | Dpp-iv-inhibiting purine derivatives for the treatment of diabetes |
| US7074798B2 (en) * | 2002-02-25 | 2006-07-11 | Eisai Co., Ltd | Xanthine derivative and DPPIV inhibitor |
| PL374007A1 (en) | 2002-06-06 | 2005-09-19 | Eisai Co, Ltd. | Novel fused imidazole derivative |
| US7569574B2 (en) * | 2002-08-22 | 2009-08-04 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Purine derivatives, the preparation thereof and their use as pharmaceutical compositions |
| MXPA05003252A (es) | 2002-09-26 | 2005-07-05 | Eisai Co Ltd | Farmaco de combinacion. |
| US7109192B2 (en) * | 2002-12-03 | 2006-09-19 | Boehringer Ingelheim Pharma Gmbh & Co Kg | Substituted imidazo-pyridinones and imidazo-pyridazinones, the preparation thereof and their use as pharmaceutical compositions |
| BR0316991A (pt) | 2002-12-04 | 2005-10-25 | Eisai Co Ltd | Compostos de anel de 1,3-diidro-imidazol fundido |
| WO2004096806A1 (ja) | 2003-04-30 | 2004-11-11 | Sumitomo Pharmaceuticals Co. Ltd. | 縮合イミダゾール誘導体 |
| US7169926B1 (en) * | 2003-08-13 | 2007-01-30 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| JPWO2005053695A1 (ja) * | 2003-12-04 | 2007-12-06 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 多発性硬化症予防剤または治療剤 |
-
2003
- 2003-06-03 PL PL03374007A patent/PL374007A1/xx not_active Application Discontinuation
- 2003-06-03 KR KR1020047019831A patent/KR100985160B1/ko not_active IP Right Cessation
- 2003-06-03 NZ NZ536794A patent/NZ536794A/en not_active IP Right Cessation
- 2003-06-03 AU AU2003241960A patent/AU2003241960B2/en not_active Ceased
- 2003-06-03 BR BR0311697-2A patent/BR0311697A/pt not_active IP Right Cessation
- 2003-06-03 CN CNB2006101515284A patent/CN100469778C/zh not_active Expired - Fee Related
- 2003-06-03 TW TW092115068A patent/TWI273104B/zh not_active IP Right Cessation
- 2003-06-03 CN CNB038189682A patent/CN100348599C/zh not_active Expired - Fee Related
- 2003-06-03 EP EP03733276A patent/EP1514552A4/en not_active Withdrawn
- 2003-06-03 US US10/516,971 patent/US20060100199A1/en not_active Abandoned
- 2003-06-03 WO PCT/JP2003/007010 patent/WO2003104229A1/ja active Application Filing
- 2003-06-03 JP JP2004511299A patent/JP3675813B2/ja not_active Expired - Fee Related
- 2003-06-03 CA CA2485641A patent/CA2485641C/en not_active Expired - Fee Related
- 2003-06-03 MX MXPA04012226A patent/MXPA04012226A/es active IP Right Grant
- 2003-06-03 RU RU2004139111/04A patent/RU2297418C9/ru not_active IP Right Cessation
- 2003-06-06 US US10/457,002 patent/US20040116328A1/en not_active Abandoned
-
2004
- 2004-08-30 JP JP2004249414A patent/JP4420334B2/ja not_active Expired - Fee Related
- 2004-11-11 IL IL16517804A patent/IL165178A0/xx not_active IP Right Cessation
-
2005
- 2005-01-04 IS IS7625A patent/IS7625A/is unknown
- 2005-01-04 ZA ZA200500041A patent/ZA200500041B/xx unknown
- 2005-01-05 NO NO20050054A patent/NO20050054L/no not_active Application Discontinuation
- 2005-08-26 US US11/212,407 patent/US20060063787A1/en not_active Abandoned
- 2005-12-01 HK HK07107870.3A patent/HK1100219A1/xx not_active IP Right Cessation
- 2005-12-01 HK HK05110940A patent/HK1078869A1/xx not_active IP Right Cessation
-
2008
- 2008-08-28 US US12/199,982 patent/US7772226B2/en not_active Expired - Fee Related
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2297418C9 (ru) | Новые конденсированные производные имидазола, ингибитор дипептидилпептидазы iv, фармацевтическая композиция, способ лечения и применение на их основе | |
| KR100867485B1 (ko) | 병용 의약 | |
| AU2018208676B2 (en) | Macrocyclic compounds as trk kinase inhibitors | |
| EP3573987B1 (en) | Tyrosine amide derivatives as rho- kinase inhibitors | |
| CA2880251C (en) | Novel heteroaryl and heterocycle compounds, composition and methods thereof | |
| KR20020038941A (ko) | 포스포디에스테라아제 억제제로서의5-(2-치환된-5-헤테로사이클릴설포닐피리드-3-일)-디하이드로피라졸로[4,3-d]피리미딘-7-온 | |
| WO2005053695A1 (ja) | 多発性硬化症予防剤または治療剤 | |
| WO2011013729A1 (ja) | Ttk阻害作用を有する縮合イミダゾール誘導体 | |
| MX2011001333A (es) | Derivados de pirazolo [3, 4] pirimidin-4-ilo y sus usos para tratar la diabetes y obesidad. | |
| CN116323622A (zh) | 双环杂芳基类衍生物及其制备方法和用途 | |
| EP2740730A1 (en) | Dibenzooxepin derivative | |
| US20240228469A1 (en) | Pcsk9 inhibitors and methods of use thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner | ||
| TH4A | Reissue of patent specification | ||
| TH4A | Reissue of patent specification | ||
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20110604 |