RU2297418C9 - Novel condensed derivatives of imidazole, inhibitors of dipeptidyl peptidase iv, pharmaceutical composition, method of treatment and using based on thereof - Google Patents
Novel condensed derivatives of imidazole, inhibitors of dipeptidyl peptidase iv, pharmaceutical composition, method of treatment and using based on thereof Download PDFInfo
- Publication number
- RU2297418C9 RU2297418C9 RU2004139111/04A RU2004139111A RU2297418C9 RU 2297418 C9 RU2297418 C9 RU 2297418C9 RU 2004139111/04 A RU2004139111/04 A RU 2004139111/04A RU 2004139111 A RU2004139111 A RU 2004139111A RU 2297418 C9 RU2297418 C9 RU 2297418C9
- Authority
- RU
- Russia
- Prior art keywords
- group
- formula
- compound
- represented
- methyl
- Prior art date
Links
- 0 C*N[C@](CCCC1)[C@@]1N Chemical compound C*N[C@](CCCC1)[C@@]1N 0.000 description 8
- UZFSSDLWBZWJRU-UHFFFAOYSA-N CNC(CCCC1)C1N Chemical compound CNC(CCCC1)C1N UZFSSDLWBZWJRU-UHFFFAOYSA-N 0.000 description 1
- UZFSSDLWBZWJRU-RQJHMYQMSA-N CN[C@@H](CCCC1)[C@@H]1N Chemical compound CN[C@@H](CCCC1)[C@@H]1N UZFSSDLWBZWJRU-RQJHMYQMSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/28—Oxygen atom
- C07D473/30—Oxygen atom attached in position 6, e.g. hypoxanthine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/08—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease
- A61P19/10—Drugs for skeletal disorders for bone diseases, e.g. rachitism, Paget's disease for osteoporosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/04—Anorexiants; Antiobesity agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/06—Antihyperlipidemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/04—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/04—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms
- C07D473/06—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 two oxygen atoms with radicals containing only hydrogen and carbon atoms, attached in position 1 or 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/02—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6
- C07D473/18—Heterocyclic compounds containing purine ring systems with oxygen, sulphur, or nitrogen atoms directly attached in positions 2 and 6 one oxygen and one nitrogen atom, e.g. guanine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/26—Heterocyclic compounds containing purine ring systems with an oxygen, sulphur, or nitrogen atom directly attached in position 2 or 6, but not in both
- C07D473/36—Sulfur atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D473/00—Heterocyclic compounds containing purine ring systems
- C07D473/40—Heterocyclic compounds containing purine ring systems with halogen atoms or perhalogeno-alkyl radicals directly attached in position 2 or 6
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/12—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains three hetero rings
- C07D491/14—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Public Health (AREA)
- Pharmacology & Pharmacy (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Diabetes (AREA)
- Immunology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Physical Education & Sports Medicine (AREA)
- Rheumatology (AREA)
- Endocrinology (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Reproductive Health (AREA)
- Virology (AREA)
- Emergency Medicine (AREA)
- Molecular Biology (AREA)
- Tropical Medicine & Parasitology (AREA)
- Communicable Diseases (AREA)
- Oncology (AREA)
- Pain & Pain Management (AREA)
- AIDS & HIV (AREA)
- Child & Adolescent Psychology (AREA)
- Gynecology & Obstetrics (AREA)
- Pregnancy & Childbirth (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Pulmonology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
Description
Настоящее изобретение относится к новым конденсированным имидазольным производным, являющимся ценными ингибиторами дипептидилпептидизы-IV (DPPIV), и к их применению.The present invention relates to new condensed imidazole derivatives, which are valuable inhibitors of dipeptidyl peptidysis-IV (DPPIV), and their use.
Описание уровня техникиDescription of the prior art
Дипептидилпептидиза IV (DPPIV) представляет собой сериновую протеазу, которая специфически гидролизует дипептид - Х-Pro (X = произвольная аминокислота) на свободном N-конце полипептидной цепи.Dipeptidyl peptidysis IV (DPPIV) is a serine protease that specifically hydrolyzes the dipeptide X-Pro (X = arbitrary amino acid) at the free N-terminus of the polypeptide chain.
Гормоны, стимулирующие глюкозазависимую секрецию инсулина, известные как инкретины (GLP-1: глюкагонподобный пептид-1 и GIP: глюкозазависимый инсулинотропный полипептид), выделяющиеся в пищеварительном тракте после приема пищи, быстро гидролизуются и инактивируются под действием DPPIV. При подавлении гидролиза под действием DPPIV воздействие инкретина (GLP-1 или GIP) усиливается, что в свою очередь повышает глюкозастимулируемую секрецию инсулина из β-клеток поджелудочной железы. Было показано, что это приводит к улучшению гипергликемии в пероральном тесте на толерантность к глюкозе (см. Diabetologia 1999 Nov, 42(11), 1324-31). Кроме этого известно, что GLP-1 участвует в процессах, способствующих уменьшению аппетита и подавляющих желание к приему пищи. Также сообщается о том, что GLP-1 влияет на защитные функции β-клеток поджелудочной железы, усиливая их дифференцировку и пролиферацию. Таким образом, ингибитор DPPVI может служить полезным терапевтическим и профилактическим агентом в лечении таких заболеваний, связанных с действием GLP-1 и/или GIP, как ожирение и сахарный диабет.Hormones that stimulate glucose-dependent insulin secretion, known as incretins (GLP-1: glucagon-like peptide-1 and GIP: glucose-dependent insulinotropic polypeptide), released in the digestive tract after a meal, are rapidly hydrolyzed and inactivated by DPPIV. When hydrolysis is suppressed by DPPIV, incretin (GLP-1 or GIP) is enhanced, which in turn increases glucose-stimulated insulin secretion from pancreatic β-cells. This has been shown to improve hyperglycemia in the oral glucose tolerance test (see Diabetologia 1999 Nov, 42 (11), 1324-31). In addition, GLP-1 is known to be involved in processes that reduce appetite and suppress the desire for food. It is also reported that GLP-1 affects the protective functions of pancreatic β-cells, enhancing their differentiation and proliferation. Thus, a DPPVI inhibitor can serve as a useful therapeutic and prophylactic agent in the treatment of diseases associated with the action of GLP-1 and / or GIP, such as obesity and diabetes.
Кроме этого, имеется много сообщений, подтверждающих взаимосвязь между дипептидилпептидазой IV и различными заболеваниями, описанными далее. Таким образом, ингибитор DPPIV может служить терапевтическим средством при заболеваниях, таких какIn addition, there are many reports confirming the relationship between dipeptidyl peptidase IV and the various diseases described below. Thus, a DPPIV inhibitor can serve as a therapeutic agent in diseases such as
(1) профилактические и терапевтические средства для лечения СПИД (см. Science 1993, 262, 2045-2050),(1) prophylactic and therapeutic agents for treating AIDS (see Science 1993, 262, 2045-2050),
(2) профилактические и терапевтические средства для лечения остеопороза (см. Clinical Chemistry 1988, 34, 2499-2501),(2) prophylactic and therapeutic agents for the treatment of osteoporosis (see Clinical Chemistry 1988, 34, 2499-2501),
(3) профилактические и терапевтические средства для лечения желудочно-кишечных нарушений (см. Endocrinology 2000, 141, 4013-4020),(3) prophylactic and therapeutic agents for the treatment of gastrointestinal disorders (see Endocrinology 2000, 141, 4013-4020),
(4) профилактические и терапевтические средства для лечения сахарного диабета, ожирения и гиперлипидемии (см. Diabetes 1998, 47, 1663-1670, и Life Sci 2000, 66(2), 91-103),(4) prophylactic and therapeutic agents for the treatment of diabetes mellitus, obesity and hyperlipidemia (see Diabetes 1998, 47, 1663-1670, and Life Sci 2000, 66 (2), 91-103),
(5) профилактические и терапевтические средства для лечения ангиогенеза (см. Agents and Action 1991, 32, 125-127),(5) prophylactic and therapeutic agents for the treatment of angiogenesis (see Agents and Action 1991, 32, 125-127),
(6) профилактические и терапевтические средства для лечения бесплодия (см. International Publication WO 00/56296),(6) prophylactic and therapeutic agents for the treatment of infertility (see International Publication WO 00/56296),
(7) профилактические и терапевтические средства для лечения воспалительных состояний, аутоиммунных заболеваний и хронических ревматоидных артритов (см. The Journal of Immunology 2001, 166, 2041-2048) и(7) prophylactic and therapeutic agents for treating inflammatory conditions, autoimmune diseases, and chronic rheumatoid arthritis (see The Journal of Immunology 2001, 166, 2041-2048) and
(8) профилактические и терапевтические средства для лечения рака (см. Br. J. Cancer 1999, март, 79 (7-8), 1042-8, и J. Androl 2000 март-апрель, 21(2), 220-6).(8) prophylactic and therapeutic agents for the treatment of cancer (see Br. J. Cancer 1999, March, 79 (7-8), 1042-8, and J. Androl 2000 March-April, 21 (2), 220-6 )
Некоторые DPPIV ингибиторы описаны в публикации патента США No. 2002/0161001; международной публикации WO 03/004496 и в публикации патента США No. 2002/0198205. Однако нет данных об ингибиторе DPPIV с гипоксантиновой или имидазопиридазиноновой структурой.Some DPPIV inhibitors are described in US Pat. 2002/0161001; International Publication WO 03/004496 and US Patent Publication No. 2002/0198205. However, there is no evidence of a DPPIV inhibitor with a hypoxanthine or imidazopyridazinone structure.
Как следует из изложенного выше, были предприняты многочисленные попытки поиска соединений, обладающих DPPIV-ингибирующей активностью, которые могли бы использоваться в качестве терапевтических средств. Однако до настоящего времени не обнаружено соединение, сочетающее высокую DPPIV-ингибирующую активность с высокой клинической эффективностью. Цель настоящего изобретения состоит в разработке соединений с DPPIV-ингибирующей активностью, которые могли бы использоваться в качестве профилактических, терапевтических и успокаивающих средств при лечении сахарного диабета и родственных заболеваний.As follows from the foregoing, numerous attempts have been made to search for compounds with DPPIV-inhibitory activity, which could be used as therapeutic agents. However, to date, no compound has been found that combines high DPPIV-inhibitory activity with high clinical efficacy. An object of the present invention is to provide compounds with DPPIV-inhibitory activity, which could be used as prophylactic, therapeutic and sedative agents in the treatment of diabetes mellitus and related diseases.
Сущность изобретенияSUMMARY OF THE INVENTION
Авторы настоящего изобретения провели широкие исследования в указанной выше области. Результатом этих исследований стал синтез новых конденсированных производных имидазола, включая производные гипоксантина и имидазопиридазинона. При осуществлении настоящего изобретения авторы также обнаружили, что полученные соединения обладают отличной DPPIV-ингибирующей активностью. Настоящее изобретение охватываетThe authors of the present invention have conducted extensive research in the above field. The result of these studies was the synthesis of new condensed imidazole derivatives, including hypoxanthine and imidazopyridazinone derivatives. In the implementation of the present invention, the authors also found that the obtained compounds have excellent DPPIV-inhibitory activity. The present invention covers
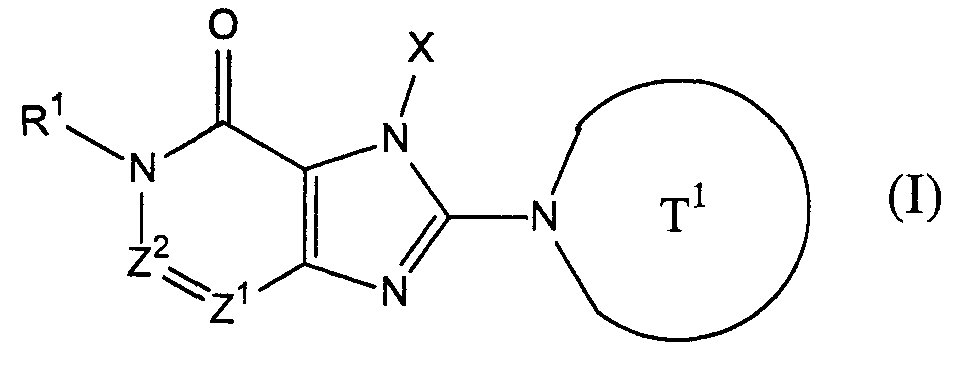
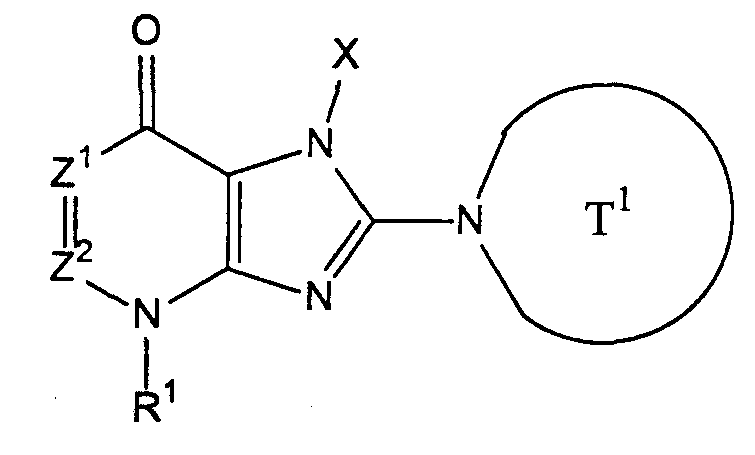
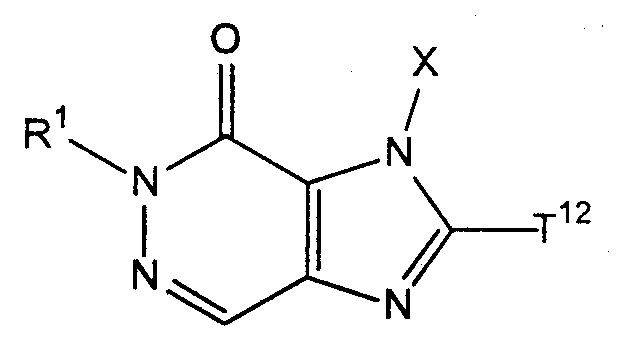
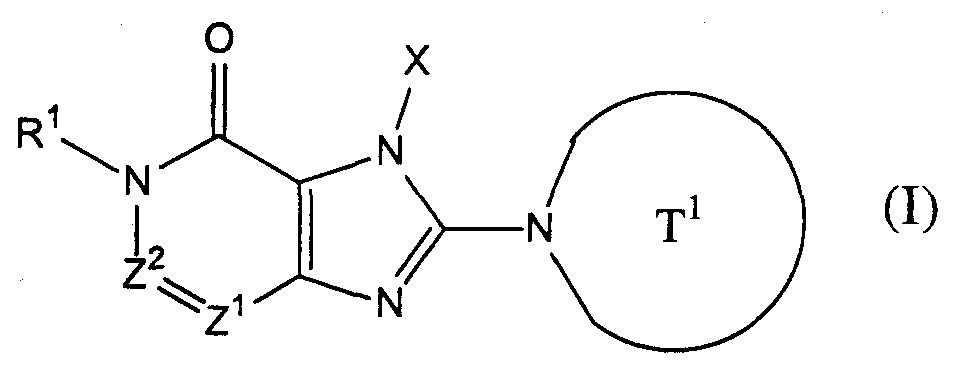
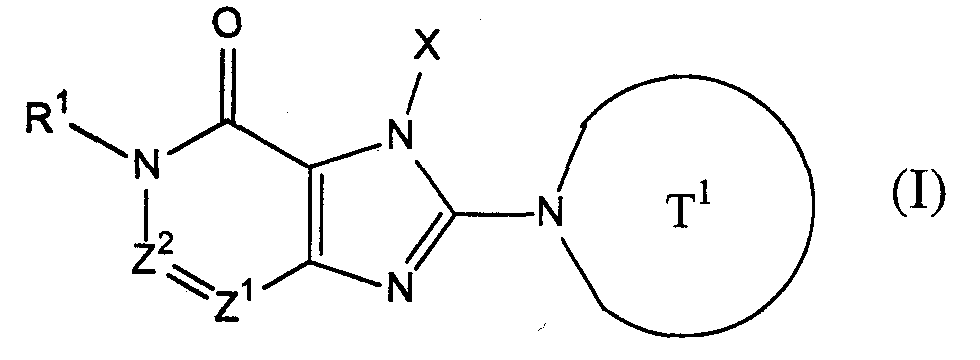
[1] соединение, представленное следующей формулой, его соль или гидрат[1] a compound represented by the following formula, a salt or hydrate thereof
где Т1 представляет собой моноциклическую или бициклическую 4-12-членную гетероциклическую группу, содержащую один или два атома азота в кольце, и которая может иметь один или несколько заместителей;where T 1 represents a monocyclic or bicyclic 4-12-membered heterocyclic group containing one or two nitrogen atoms in the ring, and which may have one or more substituents;
Х представляет собой С1-6 алкильную группу, которая может содержать один или несколько заместителей, С2-6 алкенильную группу, которая может содержать один или несколько заместителей, С2-6 алкинильную группу, которая может содержать один или несколько заместителей, С6-10 арильную группу, которая может содержать один или несколько заместителей, 5-10-членную гетероарильную группу, которая может содержать один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может содержать один или несколько заместителей, или 5-10-членную гетероарил С1-6 алкильную группу, которая может содержать один или несколько заместителей;X represents a C 1-6 alkyl group which may contain one or more substituents, a C 2-6 alkenyl group which may contain one or more substituents, a C 2-6 alkynyl group which may contain one or more substituents, C 6 A -10 aryl group which may contain one or more substituents, a 5-10 membered heteroaryl group which may contain one or more substituents, a C 6-10 aryl C 1-6 alkyl group which may contain one or more substituents, or 5-10 membered getter aryl C 1-6 alkyl group which may contain one or more substituents;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу, представленную формулой -CR2=;Z 1 and Z 2 each independently represent a nitrogen atom or a group represented by the formula —CR 2 =;
R1 и R2, каждый независимо, представляют собой группу, представленную формулой -А0-А1-А2 (где А0 представляет собой одинарную связь или С1-6 алкиленовую группу, которая может содержать 1-3 заместителя, выбранных из группы В, включающей заместители указанные далее;R 1 and R 2 each independently represent a group represented by the formula —A 0 —A 1 —A 2 (wherein A 0 is a single bond or a C 1-6 alkylene group which may contain 1-3 substituents selected from group B, including the substituents indicated below;
А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA-, группу, представленную формулой -СО-NRA-, группу, представленную формулой -NRA-СО-, группу, представленную формулой -SO2-NRA-, или группу, представленную формулой -NRA-SO2-;And 1 represents a single bond, an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group, a carbonyl group, a group represented by the formula —O — CO—, a group represented by the formula —CO — O—, a group represented by the formula —NR A - a group represented by the formula —CO — NR A— , a group represented by the formula —NR A —CO—, a group represented by the formula —SO 2 —NR A -, or a group represented by the formula —NR A —SO 2 -;
А2 и RA, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу С6-10 арил С1-6 алкильную группу или С2-7 алкилкарбонильную группу;A 2 and R A each independently represent a hydrogen atom, a halogen atom, a cyano group, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, C 6- 10 aryl group, 5-10 membered heteroaryl group, 4-8 membered heterocyclic group, 5-10 membered heteroaryl C 1-6 alkyl group C 6-10 aryl C 1-6 alkyl group or C 2-7 alkylcarbonyl group ;
при этом А2 и RA каждый, независимо, могут содержать 1-3 заместителя, выбранных из группы заместителей В, указанной далее:wherein A 2 and R A each, independently, may contain 1-3 substituents selected from the group of substituents B indicated below:
когда Z2 представляет собой группу, представленную формулой -CR2=, R1 и R2 могут вместе представлять собой 5-7-членное кольцо,when Z 2 represents a group represented by the formula —CR 2 =, R 1 and R 2 may together be a 5-7 membered ring,
за исключением случаев, когда [1] R1 представляет собой атом водорода; Z1 представляет собой атом азота и Z2 представляет собой -СН=; [2] Z1 представляет собой атом азота и Z2 представляет собой -С(ОН)=.unless [1] R 1 represents a hydrogen atom; Z 1 represents a nitrogen atom and Z 2 represents —CH =; [2] Z 1 represents a nitrogen atom and Z 2 represents —C (OH) =.
<Группа заместителей В><Deputy group B>
Группа заместителей В представляет собой группу, включающую гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может содержать один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1-CO-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RB3 (где RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -CO-RB4-RB5, и группу, представленную формулой -СН2-СО-RB4-RB5 (где RB4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRB6-; RB5 и RB6, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклил С1-6 алкильную группу, С6-10 арил С1-6 алкильную группу или 5-10-членную гетероарил С1-6 алкильную группу)), иSubstituent group B is a group comprising a hydroxyl group, a mercapto group, a cyano group, a nitro group, a halogen atom, a trifluoromethyl group, a C 1-6 alkyl group which may contain one or more substituents, a C 3-8 cycloalkyl group, C 2-6 alkenyl group, C 2-6 alkynyl group, C 6-10 aryl group, 5-10 membered heteroaryl group, 4-8 membered heterocyclic group, C 1-6 alkoxy group, C 1-6 alkylthio group, the group represented by the formula -SO 2 -NR B1 -R B2 , a group represented by the formula -NR B1 -CO-R B2 , groups y represented by the formula —NR B1 —R B2 (where R B1 and R B2 each independently represents a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R B3 (where R B3 represents 4 -8 membered heterocyclic group), a group represented by the formula —CO — R B4 —R B5 , and a group represented by the formula —CH 2 —CO — R B4 —R B5 (where R B4 represents a single bond, an oxygen atom, or a group represented by the formula —NR B6 -; R B5 and R B6 each independently represent a hydrogen atom, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, 5 A 10-membered heteroaryl group, a 4-8-membered heterocyclyl C 1-6 alkyl group, a C 6-10 aryl C 1-6 alkyl group or a 5-10-membered heteroaryl C 1-6 alkyl group)), and
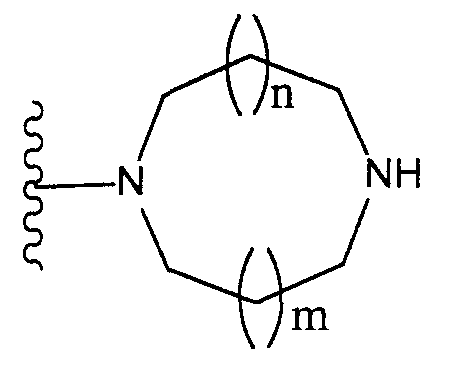
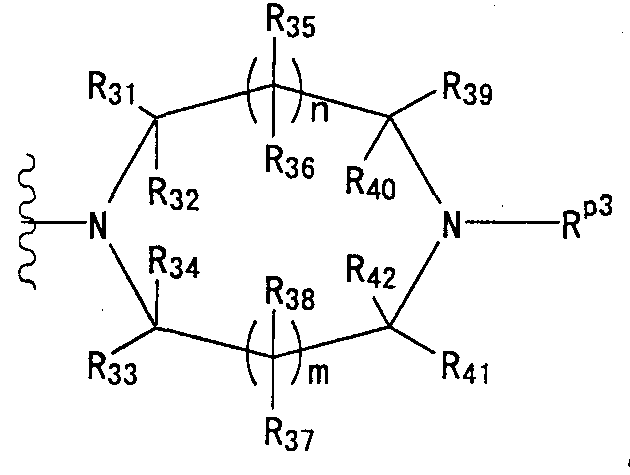
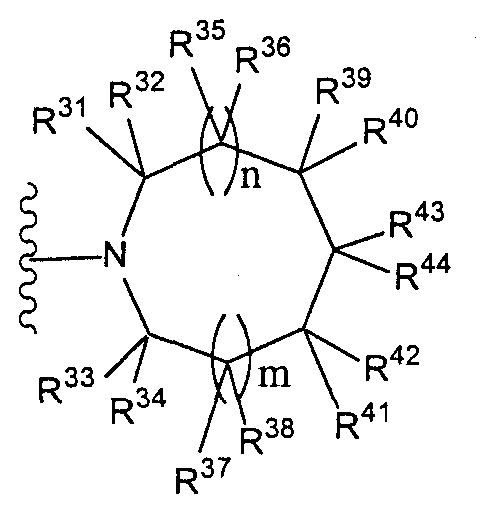
[2] соединение по [1], или его соль, или гидрат, где T1 представляет собой группу, представленную следующей формулой:[2] the compound according to [1], or a salt or hydrate thereof, wherein T 1 represents a group represented by the following formula:
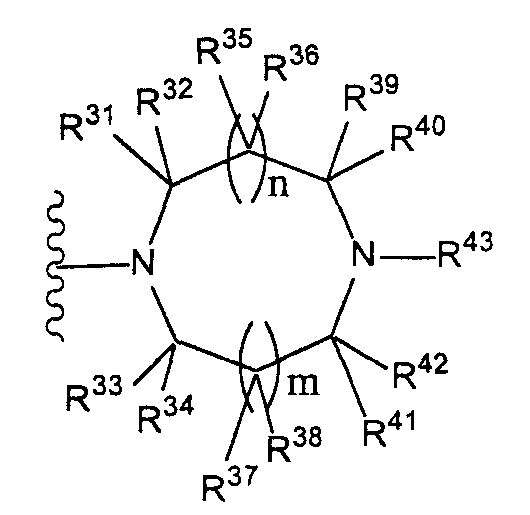
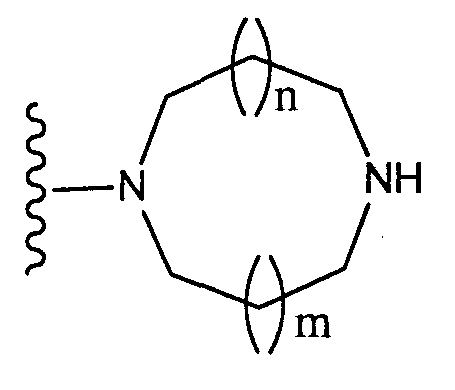
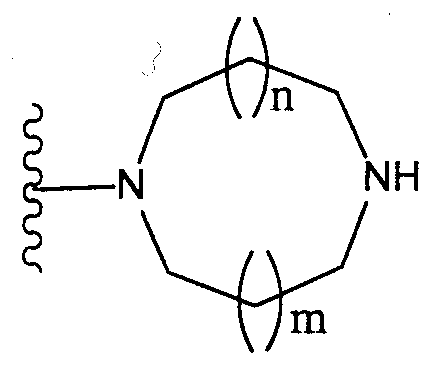
(где n и m, каждый независимо, равен 0 или 1), которая может иметь один или несколько заместителей;(where n and m, each independently, is 0 or 1), which may have one or more substituents;
азетидин-1-ильную группу, которая может иметь один или несколько заместителей;azetidin-1-ilen group, which may have one or more substituents;
пирролидин-1-ильную группу, которая может иметь один или несколько заместителей;a pyrrolidin-1-yl group which may have one or more substituents;
пиперидин-1-ильную группу, которая может иметь один или несколько заместителей, илиpiperidin-1-ilen group, which may have one or more substituents, or
азепан-1-ильную группу, которая может иметь один или несколько заместителей;an azepan-1-yl group which may have one or more substituents;
[3] соединение по [1], или его соль, или гидрат, где T1 представляет собой группу, представленную следующей формулой:[3] the compound according to [1], or a salt or hydrate thereof, wherein T 1 represents a group represented by the following formula:
(где n и m, каждый независимо, равен 0 или 1);(where n and m, each independently, is 0 or 1);
азетидин-1-ильную группу, которая может содержать аминогруппу;azetidin-1-ilen group, which may contain an amino group;
пирролидин-1-ильную группу, которая может содержать аминогруппу;pyrrolidin-1-ilen group, which may contain an amino group;
пиперидин-1-ильную группу, которая может содержать аминогруппу, илиpiperidin-1-ilen group, which may contain an amino group, or
азепан-1-ильную группу, которая может содержать аминогруппу;an azepan-1-yl group which may contain an amino group;
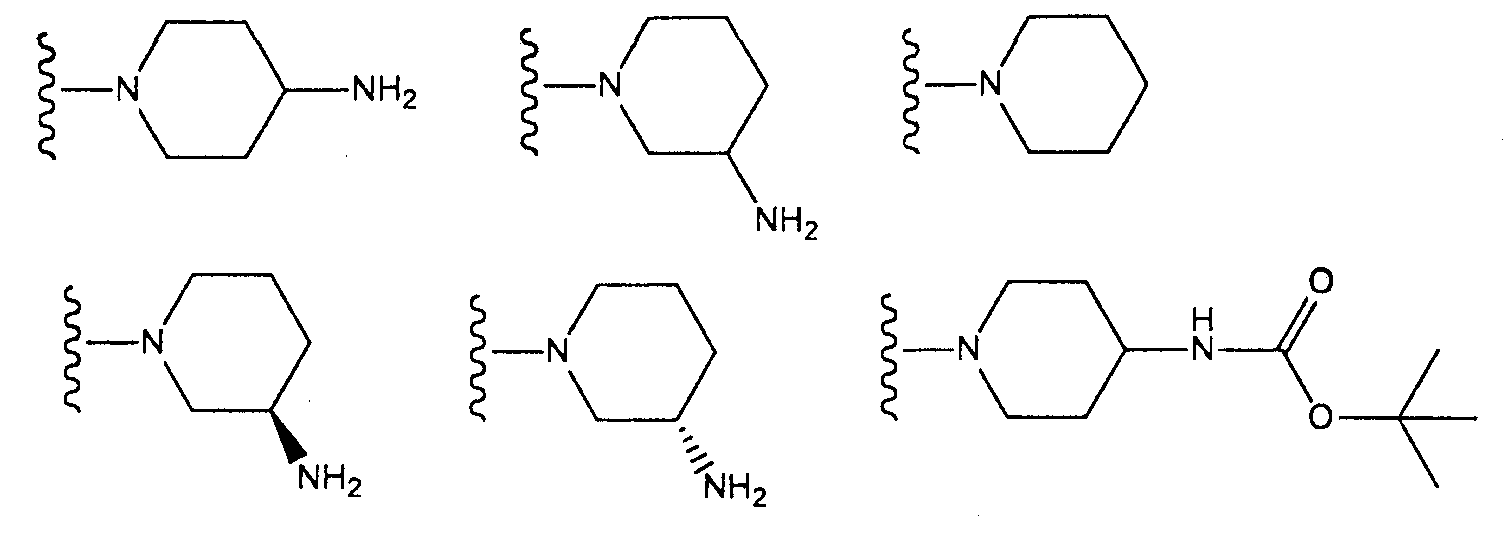
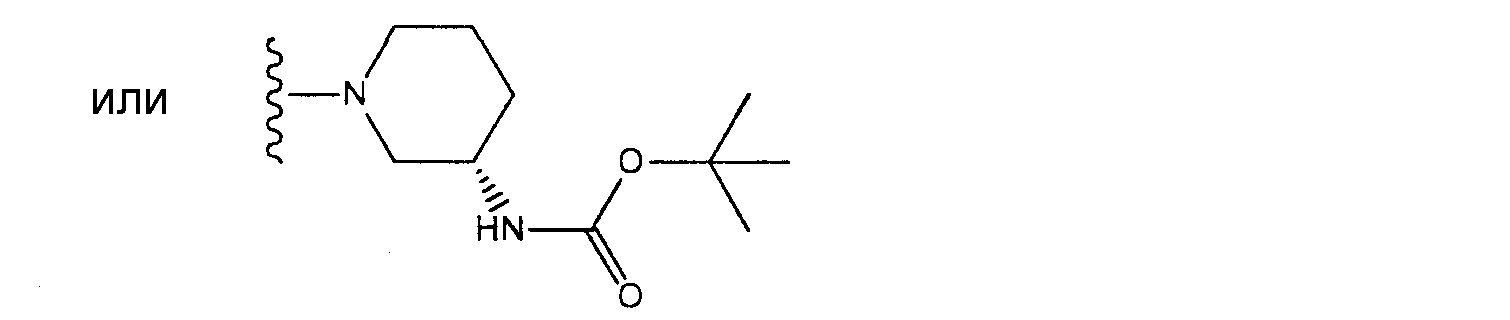
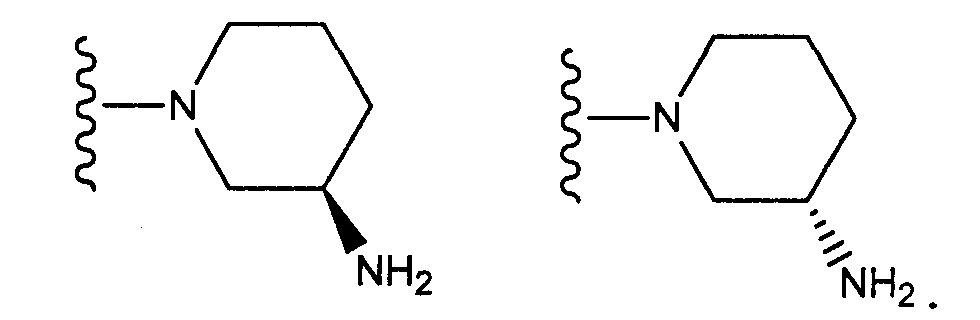
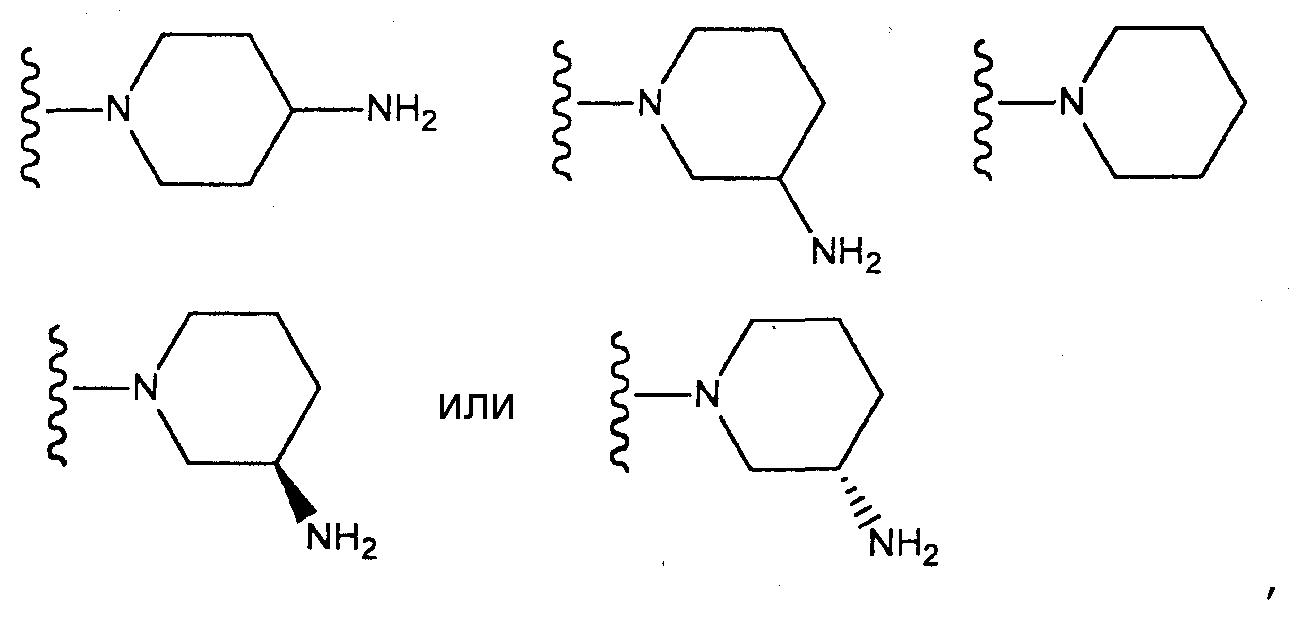
[4] соединение по [1], или его соль, или гидрат, где T1 представляет собой пиперазин-1-ильную группу или 3-аминопиперидин-1-ильную группу;[4] the compound according to [1], or a salt or hydrate thereof, wherein T 1 is a piperazin-1-yl group or a 3-aminopiperidin-1-yl group;
[5] соединение по [1], или его соль, или гидрат, где T1 представляет собой пиперазин-1-ильную группу;[5] the compound according to [1], or a salt or hydrate thereof, wherein T 1 is a piperazin-1-yl group;
[6] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой группу, представленную формулой -Х1-Х2 (где Х1 представляет собой одинарную связь или метиленовую группу, которая может иметь один или несколько заместителей; Х2 представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, или фенильную группу, которая может иметь один или несколько заместителей);[6] the compound according to any one of [1] to [5], or a salt or hydrate thereof, wherein X is a group represented by the formula —X 1 —X 2 (where X 1 is a single bond or a methylene group which may have one or more substituents; X 2 represents a C 2-6 alkenyl group which may have one or more substituents, a C 2-6 alkynyl group which may have one or more substituents, or a phenyl group which may have one or more substitutes);
[7] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой группу, представленную формулой -Х11-Х12 (где Х11 представляет собой одинарную связь или метиленовую группу; Х12 представляет собой С2-6 алкенильную группу, С2-6 алкинильную группу или фенильную группу, которая может иметь один или несколько заместителей);[7] the compound according to any one of [1] to [5], or a salt or hydrate thereof, wherein X is a group represented by the formula —X 11 —X 12 (where X 11 is a single bond or a methylene group; X 12 represents a C 2-6 alkenyl group, a C 2-6 alkynyl group or a phenyl group which may have one or more substituents);
[8] соединение по [6] или [7], или его соль, или гидрат, где фенильная группа, которая может иметь один или несколько заместителей, представляет собой фенильную группу, которая может иметь в положении 2 заместитель, выбранный из группы, состоящей из гидроксильной группы, атома фтора, атома хлора, метильной группы, этильной группы, трифторметильной группы, винильной группы, метоксигруппы, этоксигруппы, ацетильной группы, цианогруппы, формильной группы и С2-7 алкоксикарбонильной группы;[8] the compound according to [6] or [7], or a salt or hydrate thereof, wherein the phenyl group, which may have one or more substituents, is a phenyl group, which may have in position 2 a substituent selected from the group consisting of from a hydroxyl group, a fluorine atom, a chlorine atom, a methyl group, an ethyl group, a trifluoromethyl group, a vinyl group, a methoxy group, an ethoxy group, an acetyl group, a cyano group, a formyl group, and a C 2-7 alkoxycarbonyl group;
[9] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой 3-метил-2-бутен-1-ильную группу, 2-бутин-1-ильную группу, бензильную группу или 2-хлорфенильную группу;[9] the compound according to any one of [1] to [5], or a salt or hydrate thereof, wherein X represents a 3-methyl-2-buten-1-yl group, a 2-butyn-1-yl group, a benzyl group or a 2-chlorophenyl group;
[10] соединение по любому из [1]-[5], или его соль, или гидрат, где Х представляет собой 2-бутин-1-ильную группу;[10] the compound according to any one of [1] to [5], or a salt or hydrate thereof, wherein X is a 2-butyn-1-yl group;
[11] соединение по любому из [1]-[10], или его соль, или гидрат, где любая из групп Z1 или Z2 представляет собой атом азота;[11] the compound according to any one of [1] to [10], or a salt or hydrate thereof, wherein any of the groups Z 1 or Z 2 represents a nitrogen atom;
[12] соединение по любому из [1]-[10], или его соль, или гидрат, где[12] the compound according to any one of [1] to [10], or a salt or hydrate thereof, wherein
Z1 представляет собой атом азота иZ 1 represents a nitrogen atom and
Z2 представляет собой группу, представленную формулой -CR2=Z 2 represents a group represented by the formula —CR 2 =
(где R2 имеет значения, указанные в пункте [1]);(where R 2 has the meanings specified in paragraph [1]);
[13] соединение по любому из [1]-[10], или его соль, или гидрат, где[13] the compound according to any one of [1] to [10], or a salt or hydrate thereof, wherein
Z2 представляет собой атом азота иZ 2 represents a nitrogen atom and
Z1 представляет собой группу, представленную формулой -CR2=Z 1 represents a group represented by the formula —CR 2 =
(где R2 имеет значения, указанные в [1]);(where R 2 has the meanings indicated in [1]);
[14] соединение по любому из [1]-[13], или его соль, или гидрат, где R1 представляет собой атом водорода или группу, представленную формулой -А10-А11-А12 [14] the compound according to any one of [1] to [13], or a salt or hydrate thereof, wherein R 1 represents a hydrogen atom or a group represented by the formula -A 10 -A 11 -A 12
(где А10 представляет собой С1-6 алкенильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С;(where A 10 represents a C 1-6 alkenyl group, which may have 1-3 substituents selected from the following substituent group C;
А11 представляет собой одинарную связь, атом кислорода, атом серы или карбонильную группу;A 11 represents a single bond, an oxygen atom, a sulfur atom or a carbonyl group;
А12 представляет собой атом водорода, С6-10 арильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членную гетероарильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С:A 12 represents a hydrogen atom, a C 6-10 aryl group which may have 1-3 substituents selected from the following substituent group C, a 5-10 membered heteroaryl group which may have 1-3 substituents selected from the following substituent groups C, a 5-10 membered heteroaryl C 1-6 alkyl group which may have 1-3 substituents selected from the following substituent group C, or a C 6-10 aryl C 1-6 alkyl group which may have 1 -3 substituents selected from the following substituent group C:
<Группа заместителей С><Deputy group C>
Группа заместителей С представляет собой группу, включающую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRС1-RC2 (где каждый из RС1 и RC2, независимо, представляет собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4, и группу, представленную формулой -СН2-СО-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);The substituent group C represents a group comprising a hydroxyl group, a nitro group, a cyano group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR C1- R C2 (where each of R C1 and R C2 independently represents a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R C3 —R C4 and a group represented by the formula —CH 2 —CO — R C3 -R C4 (where R C3 represents a single bond, an oxygen atom or a group represented by the formula -NR C5 -; R C4 and R C5 each independently represent a hydrogen atom or a C 1-6 alkyl group);
[15] соединение по любому из [1]-[13], или его соль, или гидрат,[15] the compound according to any one of [1] to [13], or a salt or hydrate thereof,
где R1 представляет собой атом водорода, С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей С, описанной далее, 5-10-членную гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей С, описанной далее, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей С, описанной далее:where R 1 represents a hydrogen atom, a C 1-6 alkyl group which may have 1-3 substituents selected from the group of substituents C described below, a 5-10 membered heteroaryl C 1-6 alkyl group which may have a 1- 3 substituents selected from substituent group C described below, or a C 6-10 aryl C 1-6 alkyl group which may have 1-3 substituents selected from substituent group C described below:
<Группа заместителей С><Deputy group C>
Группа заместителей С представляет собой группу, включающую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, представленную формулой -NRС1-RC2 (где каждый из RС1 и RC2, независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4, и группу, представленную формулой -СН2-СО-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу));The substituent group C represents a group comprising a hydroxyl group, a nitro group, a cyano group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group represented by the formula —NR C1 -R C2 (where each of R C1 and R C2 independently represents a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R C3 —R C4 , and a group represented by the formula —CH 2 —CO — R C3 - R C4 (where R C3 represents a single bond, an oxygen atom or a group represented by the formula —NR C5 -; R C4 and R C5 each independently represent a hydrogen atom or a C 1-6 alkyl group));
[16] соединение по [14] или [15], или его соль, или гидрат, где группа заместителей С представляет собой группу, включающую цианогруппу, С1-6 алкоксигруппу, С2-7 алкоксикарбонильную группу и атом галогена;[16] the compound according to [14] or [15], or a salt or hydrate thereof, wherein the substituent group C is a group comprising a cyano group, a C 1-6 alkoxy group, a C 2-7 alkoxycarbonyl group and a halogen atom;
[17] соединение по любому из [1]-[13], или его соль, или гидрат, где R1 представляет собой метильную группу, цианобензильную группу, фторцианобензильную группу, фенетильную группу, 2-метоксиэтильную группу, или 4-метоксикарбонилпиридин-2-ильную группу;[17] the compound according to any one of [1] to [13], or a salt or hydrate thereof, wherein R 1 is a methyl group, a cyanobenzyl group, a fluorocyanobenzyl group, a phenethyl group, a 2-methoxyethyl group, or 4-methoxycarbonylpyridin-2 an alkyl group;
[18] соединение по любому из [1]-[13], или его соль, или гидрат, где R1 представляет собой метильную группу или 2-цианобензильную группу;[18] the compound according to any one of [1] to [13], or a salt or hydrate thereof, wherein R 1 is a methyl group or a 2-cyanobenzyl group;
[19] соединение по любому из [1]-[18], или его соль, или гидрат,[19] the compound according to any one of [1] to [18], or a salt or hydrate thereof,
где R2 представляет собой атом водорода, цианогруппу или группу, представленную формулой -А21-А22 where R 2 represents a hydrogen atom, a cyano group or a group represented by the formula -A 21 -A 22
(где А21 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA2-, группу, представленную формулой -СО-NRA2-, или группу, представленную формулой NRA2-СО-;(where A 21 represents a single bond, an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group, a carbonyl group, a group represented by the formula —O — CO—, a group represented by the formula —CO — O—, a group represented by the formula —NR A2 -, a group represented by the formula —CO — NR A2 -, or a group represented by the formula NR A2 —CO—;
А22 и RA2, каждый независимо, представляют собой атом водорода, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу,A 22 and R A2 each independently represent a hydrogen atom, a cyano group, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group A 5-10 membered heteroaryl group, a 4-8 membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group,
при этом А22 и RA2, каждый независимо, могут иметь 1-3 заместителя, выбранных из группы заместителей D, описанной далее.wherein A 22 and R A2 , each independently, may have 1-3 substituents selected from the group of substituents D described below.
<Группа заместителей D><Deputy group D>
Группа заместителей D представляет собой группу, включающую гидроксильную группу, цианогруппу, нитрогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRD1-RD2 (где RD1 и RD2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -CO-RD3 (где RD3 представляет собой 4-8-членную гетероциклическую группу), и группу, представленную формулой -СО-RD4-RD5 (где RD4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRD6-; RD5 и RD6, каждый независимо, представляют собой атом водорода, С3-8 циклоалкильную группу или С1-6 алкильную группу));The substituent group D is a group comprising a hydroxyl group, a cyano group, a nitro group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR D1 —R D2 (where R D1 and R D2 each independently represent a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R D3 (where R D3 represents a 4-8 membered heterocyclic group), and a group represented by the formula -CO-R D4 -R D5 (where R D4 represents a single bond, oxygen atom, or a group represented by formula -NR D6 -; R D5 and R D6, each independently represent a hydrogen atom, a C 3-8 cycloalkyl group or a C 1-6 alkyl group));
[20] соединение по любому из [1]-[18], или его соль, или гидрат,[20] the compound according to any one of [1] to [18], or a salt or hydrate thereof,
где R2 представляет собой атом водорода, цианогруппу, карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), или группу, представленную формулой -А23-А24 where R 2 represents a hydrogen atom, a cyano group, a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or a C 1-6 alkyl group), or a group represented by the formula -A 23 -A 24
(где А23 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA3-;(where A 23 represents an oxygen atom, a sulfur atom or a group represented by the formula —NR A3 -;
А24 и RA3, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, которая может содержать заместитель, выбранный из указанной далее группы заместителей D1, С3-8 циклоалкильную группу, которая может иметь заместитель, выбранной из указанной далее группы заместителей D1, С2-6 алкенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С2-6 алкинильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, фенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, или 5-10-членную гетероарильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1.A 24 and R A3 each independently represent a hydrogen atom, a C 1-6 alkyl group which may contain a substituent selected from the following substituent group D1, a C 3-8 cycloalkyl group which may have a substituent selected from the following substituent groups D1; a C 2-6 alkenyl group which may have a substituent selected from the following substituent group D1; a C 2-6 alkynyl group which may have a substituent selected from the following substituent group D1; a phenyl group which may have s an substituent selected from the following D1 substituent group, or a 5-10 membered heteroaryl group which may have a substituent selected from the following D1 substituent group.
<Группа заместителей D1><Deputy group D1>
Группа заместителей D1 представляет собой группу, включающую карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-илкарбонильную группу, С1-6 алкильную группу и С1-6 алкоксигруппу);The substituent group D1 is a group comprising a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or C 1-6 alkyl group), a pyrrolidin-1-ylcarbonyl group, a C 1-6 alkyl group and a C 1-6 alkoxy group);
[21] соединение по любому из [1]-[18], или его соль, или гидрат,[21] the compound according to any one of [1] to [18], or a salt or hydrate thereof,
где R2 представляет собой атом водорода, цианогруппу, С1-6 алкоксигруппу или группу, представленную формулой -А25-А26 where R 2 represents a hydrogen atom, a cyano group, a C 1-6 alkoxy group or a group represented by the formula -A 25 -A 26
(где А25 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA4-;(where A 25 represents an oxygen atom, a sulfur atom or a group represented by the formula —NR A4 -;
А26 и RА4, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, имеющую заместитель, выбранный из группы заместителей D1, описанной далее, С3-8 циклоалкильную группу, имеющую заместитель, выбранный из указанной группы заместителей D1, описанной далее, или фенильную группу, имеющую заместитель, выбранный из группы заместителей D1, описанной далее:A 26 and R A4 each independently represent a hydrogen atom, a C 1-6 alkyl group having a substituent selected from the group of substituents D1 described below, a C 3-8 cycloalkyl group having a substituent selected from the specified group of substituents D1, described below, or a phenyl group having a substituent selected from the group of substituents D1 described below:
<Группа заместителей D1><Deputy group D1>
Группа заместителей D1 представляет собой группу, включающую карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-илкарбонильную группу, С1-6 алкильную группу и С1-6 алкоксигруппу);The substituent group D1 is a group comprising a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or C 1-6 alkyl group), a pyrrolidin-1-ylcarbonyl group, a C 1-6 alkyl group and a C 1-6 alkoxy group);
[22] соединение по любому из [1]-[18], или его соль, или гидрат,[22] the compound according to any one of [1] to [18], or a salt or hydrate thereof,
где R2 представляет собой атом водорода, цианогруппу, метоксигруппу, карбамоилфенилоксигруппу, или группу, представленную формулойwhere R 2 represents a hydrogen atom, a cyano group, a methoxy group, a carbamoylphenyloxy group, or a group represented by the formula
(где А27 представляет собой атом кислорода, атом серы или -NH-; А28 и А29, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);(where A 27 represents an oxygen atom, a sulfur atom or —NH—; A 28 and A 29 each independently represent a hydrogen atom or a C 1-6 alkyl group);
[23] соединение по любому из [1]-[18], или его соль, или гидрат, где R2 представляет собой атом водорода, цианогруппу или 2-карбамоилфенилоксигруппу;[23] the compound according to any one of [1] to [18], or a salt or hydrate thereof, wherein R 2 represents a hydrogen atom, a cyano group or a 2-carbamoylphenyloxy group;
[24] соединение по [1], или его соль, или гидрат, где соединение формулы (I), указанной выше, представляет собой любое соединение, выбранное из группы, включающей[24] the compound according to [1], or a salt or hydrate thereof, wherein the compound of formula (I) above is any compound selected from the group consisting of
7-(2-бутинил)-2-циано-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он,7- (2-butynyl) -2-cyano-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one,
3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он,3- (2-butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one,
2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он,2- (3-aminopiperidin-1-yl) -3- (2-butynyl) -5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one,
2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид,2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide,
7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-карбонитрил и7- (2-butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile and
2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрил;2- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzonitrile;
[25] фармацевтическое средство, содержащее соединение по любому из [1]-[24];[25] a pharmaceutical agent comprising a compound according to any one of [1] to [24];
[26] ингибитор дипептидилпептидазы IV, содержащий соединение по любому из [1]-[24];[26] a dipeptidyl peptidase IV inhibitor comprising a compound according to any one of [1] to [24];
[27] фармацевтическая композиция, содержащая соединение по любому из [1]-[24] и вспомогательное вещество, используемое при получении препарата;[27] a pharmaceutical composition comprising a compound according to any one of [1] to [24] and an excipient used in the preparation of a preparation;
[28] профилактическое или терапевтическое средство для лечения сахарного диабета, содержащее соединение по любому из [1]-[24];[28] a prophylactic or therapeutic agent for the treatment of diabetes mellitus, containing the compound according to any one of [1] to [24];
[29] профилактическое или терапевтическое средство, содержащее соединение по любому из [1]-[24] для лечения сахарного диабета, ожирения, гиперлипидемии, СПИД, остеопороза, желудочно-кишечных нарушений, ангиогенеза, бесплодия, воспалительных заболеваний, аллергических заболеваний или рака;[29] a prophylactic or therapeutic agent containing a compound according to any one of [1] to [24] for the treatment of diabetes mellitus, obesity, hyperlipidemia, AIDS, osteoporosis, gastrointestinal disturbances, angiogenesis, infertility, inflammatory diseases, allergic diseases or cancer;
[30] иммуномодулятор, модулятор гормонов или антиревматическое лекарственное средство, содержащие соединение по любому из [1]-[24];[30] an immunomodulator, a hormone modulator, or an anti-rheumatic drug, comprising a compound according to any one of [1] to [24];
[31] способ профилактики или лечения заболевания, при котором эффективным является ингибирование дипептидилпептидазы IV, включающий введение пациенту соединения по любому из [1]-[24], или его соли, или гидрата в фармацевтически эффективном количестве;[31] a method for the prevention or treatment of a disease in which the inhibition of dipeptidyl peptidase IV is effective, comprising administering to a patient a compound according to any one of [1] to [24], or a salt or hydrate thereof in a pharmaceutically effective amount;
[32] применение соединения по любому из [1]-[24], или его соли, или гидрата при получении фармацевтического средства;[32] the use of a compound according to any one of [1] to [24], or a salt or hydrate thereof, in the manufacture of a pharmaceutical agent;
[33] применение соединения по любому из [1]-[24], или его соли, или гидрата при получении терапевтического или профилактического средства для лечения заболевания, при котором эффективным является ингибирование дипептидилпептидазы IV;[33] the use of a compound according to any one of [1] to [24], or a salt or hydrate thereof, in the manufacture of a therapeutic or prophylactic agent for treating a disease in which the inhibition of dipeptidyl peptidase IV is effective;
[34] соединение, представленное следующей формулой, или его соль, или гидрат:[34] a compound represented by the following formula, or a salt thereof, or a hydrate thereof:
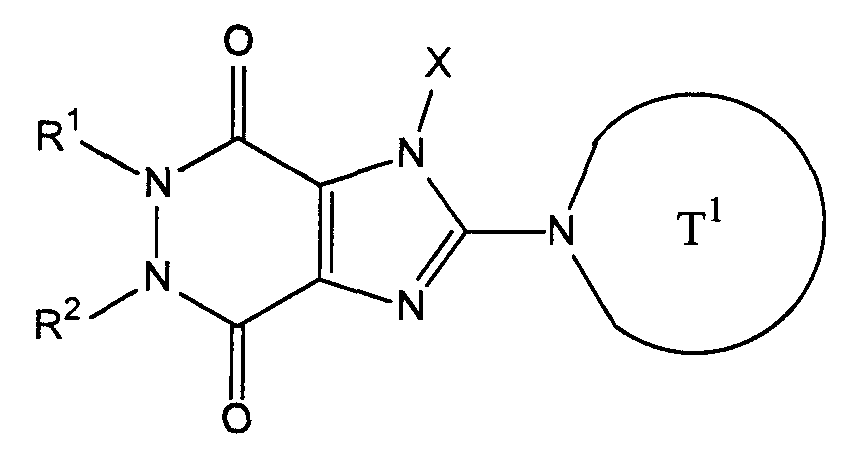
где Т0 представляет собой группу Т1, описанную выше в [1], пиридильную группу, которая может иметь один или несколько заместителей, пиридиниевую группу, которая может иметь один или несколько заместителей, группу, представленную следующей ниже формулой:where T 0 represents a group T 1 described above in [1], a pyridyl group which may have one or more substituents, a pyridinium group which may have one or more substituents, a group represented by the following formula:
группу, которая может содержать один или несколько заместителей, представленную следующей формулой:a group which may contain one or more substituents represented by the following formula:
(где n и m, каждый независимо, равны 0 или 1), или группу, которая может иметь один или несколько заместителей, представленную следующей формулой:(where n and m, each independently, are 0 or 1), or a group which may have one or more substituents represented by the following formula:
(где n и m, каждый независимо, равны 0 или 1);(where n and m, each independently, are 0 or 1);
Х0 представляет собой С3-8 циклоалкильную группу, которая может иметь один или несколько заместителей, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, С2-6 арильную группу, которая может иметь один или несколько заместителей, 5-10-членную гетероарильную группу, которая может содержать один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может иметь один или несколько заместителей, или 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь один или несколько заместителей;X 0 represents a C 3-8 cycloalkyl group which may have one or more substituents, a C 1-6 alkyl group which may have one or more substituents, a C 2-6 alkenyl group which may have one or more substituents, C A 2-6 alkynyl group which may have one or more substituents, a C 2-6 aryl group which may have one or more substituents, a 5-10 membered heteroaryl group which may contain one or more substituents, C 6-10 aryl C 1-6 alkyl group which may Met one or more substituents, or a 5-10 membered heteroaryl C1-6 alkyl group which may have one or more substituents;
R1, Z1 и Z2 имеют значения, указанные выше в [1];R 1 , Z 1 and Z 2 have the meanings indicated above in [1];
[35] соединение, представленное следующей формулой, или его соль, или гидрат:[35] a compound represented by the following formula, or a salt thereof, or a hydrate thereof:
где R1, R2, T1, Z1 и Z2 имеют значения указанные выше в [1];where R 1 , R 2 , T 1 , Z 1 and Z 2 have the meanings indicated above in [1];
[36] соединение, представленное следующей формулой, или его соль, или гидрат:[36] a compound represented by the following formula, or a salt thereof, or a hydrate thereof:
где R1, R2, T1 имеют значения, указанные выше в [1];where R 1 , R 2 , T 1 have the meanings indicated above in [1];
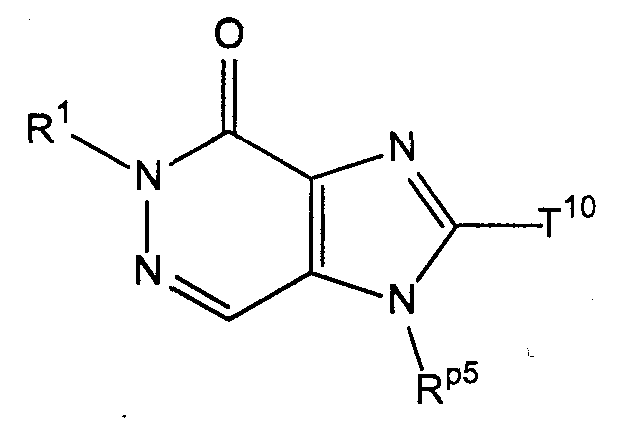
[37] соединение, представленное следующей ниже формулой, или его соль, или гидрат:[37] the compound represented by the following formula, or a salt or hydrate thereof:
где R1 имеет значения, указанные выше в [1];where R 1 has the meanings indicated above in [1];
Rp5 представляет собой трет-бутоксикарбонилоксигруппу, тритильную группу или группу, представленную формулой -SO2NH2, иR p5 represents a tert-butoxycarbonyloxy group, a trityl group or a group represented by the formula —SO 2 NH 2 , and
Т10 представляет собой атом галогена или атом водорода;T 10 represents a halogen atom or a hydrogen atom;
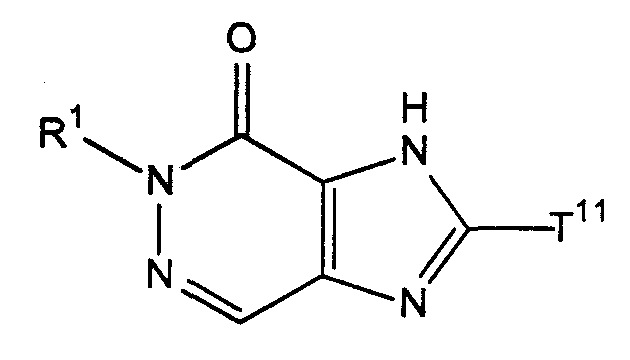
[38] соединение, представленное следующей формулой, или его соль, или гидрат:[38] a compound represented by the following formula, or a salt thereof, or a hydrate thereof:
где R1 имеет значения, указанные выше в [1], иwhere R 1 has the meanings indicated above in [1], and
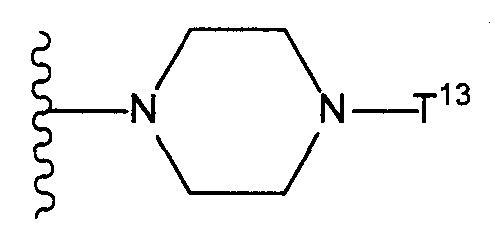
Т11 представляет собой атом галогена или группу, представленную следующей формулой:T 11 represents a halogen atom or a group represented by the following formula:
(где Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу);(where T 13 represents a tert-butoxycarbonyl group, a benzyloxycarbonyl group, or a formyl group);
[39] соединение, представленное следующей формулой, или его соль, или гидрат[39] a compound represented by the following formula, or a salt thereof, or a hydrate thereof
где R1 и Х имеют значения, указанные выше в [1] соответственно, иwhere R 1 and X have the meanings indicated above in [1], respectively, and
Т12 представляет собой атом галогена;T 12 represents a halogen atom;
[40] соединение, представленное следующей формулой, или его соль, или гидрат,[40] a compound represented by the following formula, or a salt thereof, or a hydrate thereof,
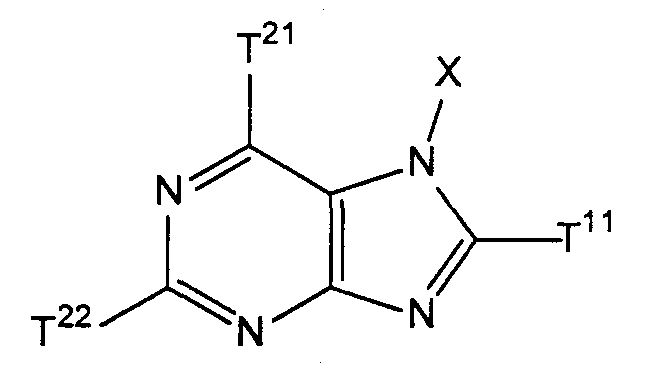
где Х имеет значения, указанные выше в [1], исключая значение, когда Х представляет собой бензильную группу;where X has the meanings indicated above in [1], excluding the meaning when X represents a benzyl group;
Т21 и Т22, каждый независимо, представляют собой атом галогена иT 21 and T 22 each independently represent a halogen atom and
Т11 представляет собой атом галогена или группу, представленную следующей формулой:T 11 represents a halogen atom or a group represented by the following formula:
(где Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу);(where T 13 represents a tert-butoxycarbonyl group, a benzyloxycarbonyl group, or a formyl group);
[41] соединение, представленное следующей формулой, или его соль, или гидрат[41] a compound represented by the following formula, or a salt or hydrate thereof
где Х и R1 имеют значения, указанные выше в [1] соответственно;where X and R 1 have the meanings indicated above in [1], respectively;
Т22 представляет собой атом галогена иT 22 represents a halogen atom and
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу;T 13 represents a tert-butoxycarbonyl group, a benzyloxycarbonyl group or a formyl group;
[42] соединение, представленное следующей формулой, или его соль, или гидрат[42] a compound represented by the following formula, or a salt or hydrate thereof
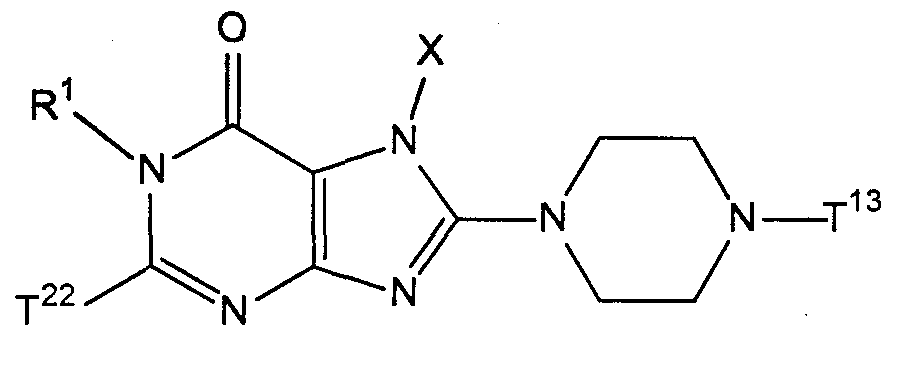
где кольцо Т1 представляет собой моноциклическую или бициклическую 6-12-членную гетероциклическую группу, содержащую два атома азота в кольце, которое может иметь один или несколько заместителей;where the ring T 1 represents a monocyclic or bicyclic 6-12 membered heterocyclic group containing two nitrogen atoms in the ring, which may have one or more substituents;
Х представляет собой С1-6 алкильную группу, которая может иметь один или несколько заместителей, С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, С6-10 арильную группу, которая может иметь один или несколько заместителей, 5-10-членную гетероарильную группу, которая может иметь один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может иметь один или несколько заместителей, или 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь один или несколько заместителей;X represents a C 1-6 alkyl group which may have one or more substituents, a C 2-6 alkenyl group which may have one or more substituents, a C 2-6 alkynyl group which may have one or more substituents, C 6 A -10 aryl group which may have one or more substituents, a 5-10 membered heteroaryl group which may have one or more substituents, a C 6-10 aryl C 1-6 alkyl group which may have one or more substituents, or 5-10 membered heteroaryl C 1-6 alkyl group which may have one or more substituents;
Х может образовывать связь с атомом, входящим в состав кольца Т1;X may form a bond with the atom that is part of the ring T 1 ;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу, представленную формулой -CR2=;Z 1 and Z 2 each independently represent a nitrogen atom or a group represented by the formula —CR 2 =;
R1 и R2, независимо, представляют собой атом водорода, 4-8-членную гетероциклическую группу, которая может иметь один или несколько заместителей, или группу, представленную формулой -А0-А1-А2 R 1 and R 2 independently represent a hydrogen atom, a 4-8 membered heterocyclic group which may have one or more substituents, or a group represented by the formula —A 0 —A 1 —A 2
(где А0 представляет собой одинарную связь или С1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранных из группы заместителей В, описанной далее; А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA-, группу, представленную формулой -CO-NRA-, группу, представленную формулой -NRA-СО, группу, представленную формулой -SO2-NRA- или группу, представленную формулой -NRA-SO2-;(where A 0 represents a single bond or a C 1-6 alkylene group which may have 1-3 substituents selected from substituent group B described below; A 1 represents a single bond, an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group a group, a carbonyl group, a group represented by the formula —O — CO—, a group represented by the formula —CO — O—, a group represented by the formula —NR A -, a group represented by the formula —CO — NR A -, a group represented by the formula — NR A —CO, a group represented by the formula —SO 2 —NR A - or a group ln formula -NR A -SO 2 -;
А2 и RА, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу или 4-8-членную гетероциклическую группу, при этом А2 и RА, каждый независимо, могут иметь 1-3 заместителя, выбранных из группы заместителей В, описанной далее:A 2 and R A each independently represent a hydrogen atom, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, 5 A 10-membered heteroaryl group or a 4-8 membered heterocyclic group, wherein A 2 and R A each independently may have 1-3 substituents selected from substituent group B described below:
исключая случаи, когда (i) оба R1 и R2 представляют собой атомы водорода и (ii) R2 представляет собой гидроксильную группу.except where (i) both R 1 and R 2 are hydrogen atoms and (ii) R 2 is a hydroxyl group.
<Группа заместителей В><Deputy group B>
Группа заместителей В представляет собой группу, включающую гидроксильную группу, цианогруппу, атом галогена, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, группу, представленную формулой -CO-RB-RB2 (где RB представляет собой одинарную связь, атом кислорода, группу, представленную формулой-NRB3-; RB2 и RB3, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, С6-10 арил С1-6 алкильную группу, 5-10-членный гетероарил С1-6 алкильную группу, 1-пирролидинильную группу, 1-морфолинильную группу, 1-пиперазинильную группу или 1-пиперидильную группу)).Substituent group B is a group comprising a hydroxyl group, a cyano group, a halogen atom, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group A 5-10 membered heteroaryl group, a 4-8 membered heterocyclic group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a group represented by the formula —CO — R B —R B2 (where R B is a single bond, an oxygen atom, a group represented by formula-NR B3 -; R B2 and R B3, each independently represent a hydrogen atom, a C 1-6 al yl group, a C3-8 cycloalkyl group, C2-6 alkenyl group, C2-6 alkynyl group, a C 6-10 aryl group, 5-10-membered heteroaryl group, C 6-10 aryl C 1-6 alkyl group , 5-10 membered heteroaryl C 1-6 alkyl group, 1-pyrrolidinyl group, 1-morpholinyl group, 1-piperazinyl group or 1-piperidyl group)).
Предпочтительный способ осуществления изобретенияPreferred Embodiment
Настоящее изобретение подробно проиллюстрировано далее.The present invention is illustrated in detail below.
Для удобства описания структурная формула соединения здесь иногда изображает определенный изомер. Однако соединения по настоящему изобретению могут включать все возможные изомеры, такие как структурно возможные геометрические изомеры, оптические изомеры, образованные благодаря наличию асимметрических атомов углерода, стереоизомеры, таутомеры и смеси изомеров, и они не ограничиваются формулами, используемыми для удобства в описании, и могут представлять собой любой из двух изомеров или смеси обоих изомеров. Таким образом, соединения по настоящему изобретению могут представлять собой любые оптически активные соединения, молекулы или рацематы которых содержат асимметрический атом углерода, и они не ограничиваются какой-либо из таких форм, а включают обе. Кроме этого, соединения по настоящему изобретению могут проявлять кристаллический полиморфизм, но и в этом случае они не ограничиваются конкретным полиморфом, и могут представлять собой любую из таких кристаллических форм или существовать в виде смеси двух или более кристаллических форм. Соединения по настоящему изобретению также включают как безводные, так и гидратные формы. Вещества, образующиеся в результате метаболизма in vivo соединений по настоящему изобретению, также входят в объем формулы изобретения.For convenience of description, the structural formula of the compound here sometimes depicts a specific isomer. However, the compounds of the present invention can include all possible isomers, such as structurally possible geometric isomers, optical isomers formed due to the presence of asymmetric carbon atoms, stereoisomers, tautomers and mixtures of isomers, and they are not limited to the formulas used for convenience in the description, and can represent any of two isomers or a mixture of both isomers. Thus, the compounds of the present invention can be any optically active compounds whose molecules or racemates contain an asymmetric carbon atom, and they are not limited to any of these forms, but include both. In addition, the compounds of the present invention may exhibit crystalline polymorphism, but even then they are not limited to a particular polymorph, and may be any of such crystalline forms or exist as a mixture of two or more crystalline forms. The compounds of the present invention also include both anhydrous and hydrated forms. Substances resulting from the in vivo metabolism of the compounds of the present invention are also included in the scope of the claims.
Далее подробно описаны термины и обозначения, используемые в настоящем изобретении.The following describes in detail the terms and symbols used in the present invention.
Как здесь используется, выражение «С1-6 алкильная группа» относится к линейной или разветвленной алкильной группе, содержащей 1-6 атомов углерода, которая является моновалентной группой, полученной при удалении любого атома водорода из молекулы алифатического углеводорода, содержащего 1-6 углеродных атомов, и, в частности, включает, например, метильную группу, этильную группу, 1-пропильную группу, 2-пропильную группу, 2-метил-1-пропильную группу, 2-метил-2-пропильную группу, 1-бутильную группу, 2-бутильную группу, 1-пентильную группу, 2-пентильную группу, 3-пентильную группу, 2-метил-1-бутильную группу, 3-метил-1-бутильную группу, 2-метил-2-бутильную группу, 3-метил-2-бутильную группу, 2,2-диметил-1-пропильную группу, 1-гексильную группу, 2-гексильную группу, 3-гексильную группу, 2-метил-1-пентильную группу, 3-метил-1-пентильную группу, 4-метил-1-пентильную группу, 2-метил-2-пентильную группу, 3-метил-2-пентильную группу, 4-метил-2-пентильную группу, 2-метил-3-пентильную группу, 3-метил-3-пентильную группу, 2,3-диметил-1-бутильную группу, 3,3-диметил-1-бутильную группу, 2,2-диметил-1-бутильную группу, 2-этил-1-бутильную группу, 3,3-диметил-2-бутильную группу и 2,3-диметил-2-бутильную группу.As used here, the expression "C 1-6 alkyl group" refers to a linear or branched alkyl group containing 1-6 carbon atoms, which is a monovalent group obtained by removing any hydrogen atom from an aliphatic hydrocarbon molecule containing 1-6 carbon atoms and, in particular, includes, for example, a methyl group, an ethyl group, a 1-propyl group, a 2-propyl group, a 2-methyl-1-propyl group, a 2-methyl-2-propyl group, a 1-butyl group, 2 -butyl group, 1-pentyl group, 2-pentyl group, 3-pentyl group, 2-methyl-1-butyl group, 3-methyl-1-butyl group, 2-methyl-2-butyl group, 3-methyl-2-butyl group, 2,2-dimethyl-1 -propyl group, 1-hexyl group, 2-hexyl group, 3-hexyl group, 2-methyl-1-pentyl group, 3-methyl-1-pentyl group, 4-methyl-1-pentyl group, 2-methyl- 2-pentyl group, 3-methyl-2-pentyl group, 4-methyl-2-pentyl group, 2-methyl-3-pentyl group, 3-methyl-3-pentyl group, 2,3-dimethyl-1-butyl group, 3,3-dimethyl-1-butyl group, 2,2-dimethyl-1-butyl group, 2-ethyl-1-butyl th group, 3,3-dimethyl-2-butyl group and 2,3-dimethyl-2-butyl group.
Как здесь используется, выражение «С2-6 алкенильная группа» относится к линейной или разветвленной алкенильной группе, содержащей 2-6 атомов углерода, и, в частности, включает, например, винильную группу, аллильную группу, 1-пропенильную группу, 2-пропенильную группу, 1-бутенильную группу, 2-бутенильную группу, 3-бутенильную группу, пентенильную группу и гексенильную группу.As used here, the expression "C 2-6 alkenyl group" refers to a linear or branched alkenyl group containing 2-6 carbon atoms, and, in particular, includes, for example, a vinyl group, allyl group, 1-propenyl group, 2- propenyl group, 1-butenyl group, 2-butenyl group, 3-butenyl group, pentenyl group and hexenyl group.
Как здесь используется, выражение «С2-6 алкинильная группа» относится к линейной или разветвленной алкинильной группе, содержащей 2-6 атомов углерода, и, в частности, включает, например, этинильную группу, 1-пропинильную группу, 2-пропинильную группу, бутинильную группу, пентинильную группу, гексинильную группу.As used here, the expression "C 2-6 alkynyl group" refers to a linear or branched alkynyl group containing 2-6 carbon atoms, and, in particular, includes, for example, an ethynyl group, a 1-propynyl group, a 2-propynyl group, butynyl group, pentynyl group, hexynyl group.
Как здесь используется, выражение «С3-6 циклоалкильная группа» относится к циклической алифатической углеводородной группе, содержащей 3-8 углеродных атомов, и, в частности, включает, например, циклопропильную группу, циклобутильную группу, циклопентильную группу, циклогексильную группу, циклогептильную группу и циклооктильную группу.As used here, the expression "C 3-6 cycloalkyl group" refers to a cyclic aliphatic hydrocarbon group containing 3-8 carbon atoms, and, in particular, includes, for example, cyclopropyl group, cyclobutyl group, cyclopentyl group, cyclohexyl group, cycloheptyl group and cyclooctyl group.
Как здесь используется, выражение «С1-6 алкиленовая группа» относится к дивалентной группе, полученной при удалении еще одного произвольного водородного атома из «С1-6 алкильной группы», имеющей указанные выше значения, и, в частности, включает, например, метиленовую группу, 1,2-этиленовую группу, 1,1-этиленовую группу, 1,3-пропиленовую группу, тетраметиленовую группу, пентаметиленовую группу и гексаметиленовую группу.As used here, the expression "C 1-6 alkylene group" refers to a divalent group obtained by the removal of another arbitrary hydrogen atom from a "C 1-6 alkyl group" having the above meanings, and, in particular, includes, for example, methylene group, 1,2-ethylene group, 1,1-ethylene group, 1,3-propylene group, tetramethylene group, pentamethylene group and hexamethylene group.
Как здесь используется, выражение «С3-8 циклоалкиленовая группа» относится к дивалентной группе, полученной при удалении еще одного произвольного водородного атома из «С3-8 циклоалкильной группы», имеющей указанные выше значения.As used here, the expression "C 3-8 cycloalkylene group" refers to a divalent group obtained by removing another arbitrary hydrogen atom from the "C 3-8 cycloalkyl group" having the above meanings.
Как здесь используется, выражение «С1-6 алкоксигруппа» относится к оксигруппе, связанной с «С1-6 алкильной группой», указанной выше, и, в частности, включает, например, метоксигруппу, этоксигруппу, 1-пропилоксигруппу, 2-пропилоксигруппу, 2-метил-1-пропилоксигруппу, 2-метил-2-пропилоксигруппу, 1-бутилоксигруппу, 2-бутилоксигруппу, 1-пентилоксигруппу, 2-пентилоксигруппу, 3-пентилоксигруппу, 2-метил-1-бутилоксигруппу, 3-метил-1-бутилоксигруппу, 2-метил-2-бутилоксигруппу, 3-метил-2-бутилоксигруппу, 2,2-диметил-1-пропилоксигруппу, 1-гексилоксигруппу, 2-гексилоксигруппу, 3-гексилоксигруппу, 2-метил-1-пентилоксигруппу, 3-метил-1-пентилоксигруппу, 4-метил-1-пентилоксигруппу, 2-метил-2-пентилоксигруппу, 3-метил-2-пентилоксигруппу, 4-метил-2-пентилоксигруппу, 2-метил-3-пентилоксигруппу, 3-метил-3-пентилоксигруппу, 2,3-диметил-1-бутилоксигруппу, 3,3-диметил-1-бутилоксигруппу, 2,2-диметил-1-бутилоксигруппу, 2-этил-1-бутилоксигруппу, 3,3-диметил-2-бутилоксигруппу и 2,3-диметил-2-бутилоксигруппу.As used herein, the term “C 1-6 alkoxy group” refers to an oxy group bonded to a “C 1-6 alkyl group” as defined above, and particularly includes, for example, a methoxy group, an ethoxy group, a 1-propyloxy group, a 2-propyloxy group , 2-methyl-1-propyloxy group, 2-methyl-2-propyloxy group, 1-butyloxy group, 2-butyloxy group, 1-pentyloxy group, 2-pentyloxy group, 3-pentyloxy group, 2-methyl-1-butyloxy group, 3-methyl-1 -butyloxy group, 2-methyl-2-butyloxy group, 3-methyl-2-butyloxy group, 2,2-dimethyl-1-propyloxy group, 1-hexyloxy group, 2-hexyl xy group, 3-hexyloxy group, 2-methyl-1-pentyloxy group, 3-methyl-1-pentyloxy group, 4-methyl-1-pentyloxy group, 2-methyl-2-pentyloxy group, 3-methyl-2-pentyloxy group, 4-methyl- 2-pentyloxy group, 2-methyl-3-pentyloxy group, 3-methyl-3-pentyloxy group, 2,3-dimethyl-1-butyloxy group, 3,3-dimethyl-1-butyloxy group, 2,2-dimethyl-1-butyloxy group, 2-ethyl-1-butyloxy group, 3,3-dimethyl-2-butyloxy group and 2,3-dimethyl-2-butyloxy group.
Как здесь используется, выражение «С1-6 алкилтиогруппа» относится к тиогруппе, связанной с «С1-6 алкильной группой», указанной выше, и, в частности, включает метилтиогруппу, этилтиогруппу, 1-пропилтиогруппу, 2-пропилтиогруппу, бутилтиогруппу и пентилтиогруппу.As used herein, the term “C 1-6 alkylthio group” refers to a thio group bonded to a “C 1-6 alkyl group” as defined above, and in particular includes methylthio group, ethylthio group, 1-propylthio group, 2-propylthio group, butylthio group, and pentylthio group.
Как здесь используется, выражение «С2-7 алкоксикарбонильная группа» относится к карбонильной группе, связанной с «С1-6 алкоксигруппой», указанной выше, и, в частности, включает, например, метоксикарбонильную группу, этоксикарбонильную группу, 1-пропилоксикарбонильную группу и 2-пропилоксикарбонильную группу.As used here, the expression "C 2-7 alkoxycarbonyl group" refers to a carbonyl group associated with a "C 1-6 alkoxy group" above, and in particular includes, for example, a methoxycarbonyl group, an ethoxycarbonyl group, a 1-propyloxycarbonyl group and a 2-propyloxycarbonyl group.
Как здесь используется, выражение «С2-7 алкилкарбонильная группа» относится к карбонильной группе, связанной с «С1-6 алкильной группой», указанной выше, и, в частности, включает, например, метилкарбонильную группу, этилкарбонильную группу, 1-пропилкарбонильную группу и 2-пропилкарбонильную группу.As used here, the expression "C 2-7 alkylcarbonyl group" refers to the carbonyl group associated with the "C 1-6 alkyl group" above, and, in particular, includes, for example, methylcarbonyl group, ethylcarbonyl group, 1-propylcarbonyl a group and a 2-propylcarbonyl group.
Как здесь используется, выражение «атом галогена» относится к атому фтора, атому хлора, атому брома и атому йода.As used herein, the term “halogen atom” refers to a fluorine atom, a chlorine atom, a bromine atom, and an iodine atom.
Как здесь используется, выражение «С6-10 арильная группа» относится к ароматической циклической углеводородной группе, содержащей 6-10 атомов углерода, и, в частности, включает, например, фенильную группу, 1-нафтильную группу и 2-нафтильную группу.As used here, the expression "C 6-10 aryl group" refers to an aromatic cyclic hydrocarbon group containing 6-10 carbon atoms, and, in particular, includes, for example, a phenyl group, a 1-naphthyl group and a 2-naphthyl group.
Как здесь используется, выражение «гетероатом» относится к атому серы, атому кислорода и атому азота.As used herein, the term “heteroatom” refers to a sulfur atom, an oxygen atom, and a nitrogen atom.
Как здесь используется, выражение «5-10-членное гетероарильное кольцо» относится к ароматическому 5-10-членному кольцу, содержащему один или несколько гетероатомов, и, в частности, включают, например, пиридиновое кольцо, тиофеновое кольцо, фурановое кольцо, пиррольное кольцо, оксазольное кольцо, изоксазольное кольцо, тиазольное кольцо, тиадиазольное кольцо, изотиазольное кольцо, имидазольное кольцо, триазольное кольцо, пиразольное кольцо, фуразановое кольцо, тиадиазольное кольцо, оксадиазольное кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, триазиновое кольцо, индольное кольцо, изоиндольное кольцо, индазольное кольцо, хроменовое кольцо, хинолиновое кольцо, изохинолиновое кольцо, циннолиновое кольцо, хиназолиновое кольцо, хиноксалиновое кольцо, нафтиридиновое кольцо, фталазиновое кольцо, пуриновое кольцо, птеридиновое кольцо, тиенофурановое кольцо, имидазотиазольное кольцо, бензофурановое кольцо, бензотиофеновое кольцо, бензоксазольное кольцо, бензотиазольное кольцо, бензотиадиазольное кольцо, бензимидазольное кольцо, имидазопиридиновое кольцо, пирролопиридиновое кольцо, пирролопиримидиновое кольцо и пиридопиримидиновое кольцо. Предпочтительно «5-10-членное гетероарильное кольцо» включает пиридиновое кольцо, тиофеновое кольцо, фурановое кольцо, пиррольное кольцо, имидазольное кольцо, 1,2,4-триазольное кольцо, тиазольное кольцо, тиадиазольное кольцо, пиразольное кольцо, фуразановое кольцо, тиадиазольное кольцо, пиридазиновое кольцо, пиримидиновое кольцо, пиразиновое кольцо, изохинолиновое кольцо, бензоксазольное кольцо, бензотиазольное кольцо и бензимидазольное кольцо. Наиболее предпочтительным примером является пиридиновое кольцо.As used here, the expression "5-10 membered heteroaryl ring" refers to an aromatic 5-10 membered ring containing one or more heteroatoms, and, in particular, include, for example, a pyridine ring, a thiophene ring, a furan ring, a pyrrole ring , oxazole ring, isoxazole ring, thiazole ring, thiadiazole ring, isothiazole ring, imidazole ring, triazole ring, pyrazole ring, furazan ring, thiadiazole ring, oxadiazole ring, pyridazine ring, pyrimidine ring ring, pyrazine ring, triazine ring, indole ring, isoindole ring, indazole ring, chromene ring, quinoline ring, isoquinoline ring, cinnoline ring, quinazoline ring, quinoxaline ring, naphthyridine ring, phthalazine ring, purine ring, pteridine ring imidazothiazole ring, benzofuran ring, benzothiophene ring, benzoxazole ring, benzothiazole ring, benzothiadiazole ring, benzimidazole ring, imidazopyridine ring ring, pyrrolopyridine ring, pyrrolopyrimidine ring and pyridopyrimidine ring. Preferably, the “5-10 membered heteroaryl ring” includes a pyridine ring, a thiophene ring, a furan ring, a pyrrole ring, an imidazole ring, a 1,2,4-triazole ring, a thiazole ring, a thiadiazole ring, a pyrazole ring, a furazan ring, a thiadiazole ring, pyridazine ring, pyrimidine ring, pyrazine ring, isoquinoline ring, benzoxazole ring, benzothiazole ring and benzimidazole ring. The most preferred example is a pyridine ring.
Как здесь используется, выражение «5-10-членная гетероарильная группа» относится к моновалентной или дивалентной группе, образующейся в результате удаления одного или двух любых водородных атомов из «5-10-членного гетероарильного кольца», указанного выше.As used here, the expression "5-10 membered heteroaryl group" refers to a monovalent or divalent group resulting from the removal of one or two any hydrogen atoms from the "5-10 membered heteroaryl ring" above.
Как здесь используется, выражение «4-8-членное гетероциклическое кольцо» относится к неароматическому кольцу, в которомAs used here, the expression “4-8 membered heterocyclic ring” refers to a non-aromatic ring in which
(i) число атомов, составляющих кольцо, равно 4-8;(i) the number of atoms making up the ring is 4-8;
(ii) атомы, составляющие кольцо, включают 1-2 гетероатома;(ii) the atoms that make up the ring include 1-2 heteroatoms;
(iii) кольцо может содержать 1-2 двойные связи;(iii) the ring may contain 1-2 double bonds;
(iv) кольцо может содержать 1-3 карбонильные группы и(iv) the ring may contain 1-3 carbonyl groups and
(v) кольцо является моноциклическим.(v) the ring is monocyclic.
В частности, 4-8-членное гетероциклическое кольцо включает азетидиновое кольцо, пирролидиновое кольцо, пиперидиновое кольцо, азепановое кольцо, азокановое кольцо, тетрагидрофурановое кольцо, тетрагидропирановое кольцо, морфолиновое кольцо, тиоморфолиновое кольцо, пиперазиновое кольцо, тиазолидиновое кольцо, диоксановое кольцо, имидазолиновое кольцо, тиазолиновое кольцо и кольцо, представленное одной из следующих формул:In particular, the 4-8 membered heterocyclic ring includes an azetidine ring, a pyrrolidine ring, a piperidine ring, an azepane ring, an azocane ring, a tetrahydrofuran ring, a tetrahydropyran ring, a morpholine ring, a thiomorpholine ring, a piperazine ring, a thiazolidine ring, a thiazolidine ring a thiazoline ring and a ring represented by one of the following formulas:
(где s представляет собой целое число от 1 до 3; Т3х представляет собой метиленовую группу, атом кислорода или группу, представленную формулой -NT4x-, где Т4х представляет собой атом водорода или С1-6 алкильную группу. Предпочтительно «4-8-членные гетероциклические кольца» включают пирролидиновое кольцо, пиперидиновое кольцо, азепановое кольцо, морфолиновое кольцо, тиоморфолиновое кольцо, пиперазиновое кольцо, дигидрофуран-2-оновое кольцо и тиазолидиновое кольцо.(where s is an integer from 1 to 3; T 3x represents a methylene group, an oxygen atom or a group represented by the formula —NT 4x -, where T 4x represents a hydrogen atom or a C 1-6 alkyl group. Preferably, “4- 8-membered heterocyclic rings include a pyrrolidine ring, a piperidine ring, an azepane ring, a morpholine ring, a thiomorpholine ring, a piperazine ring, a dihydrofuran-2-one ring and a thiazolidine ring.
Как здесь используется, выражение «4-8-членная гетероциклическая группа» относится к моновалентной или дивалентной группе, образующейся в результате удаления одного или двух водородных атомов из «4-8-членного гетероцикла», имеющего указанные выше значения. Предпочтительно «4-8-членные гетероциклические группы» включают пиперидин-1-ильную группу, пирролидин-1-ильную группу и морфолин-4-ильную группу.As used here, the expression “4-8 membered heterocyclic group” refers to a monovalent or divalent group resulting from the removal of one or two hydrogen atoms from a “4-8 membered heterocycle” having the above meanings. Preferred “4-8 membered heterocyclic groups” include a piperidin-1-yl group, a pyrrolidin-1-yl group and a morpholin-4-yl group.
Как здесь используется, выражение «С6-10 арил С1-6 алкильная группа» относится к группе, полученной замещением произвольного атома водорода в одной из указанных выше «С1-6 алкильных групп» «С6-10 арильной группы», имеющей указанные выше значения, и, в частности, включает, например, бензильную группу, фенетильную группу и 3-фенил-1-пропильную группу.As used here, the expression "C 6-10 aryl C 1-6 alkyl group" refers to a group obtained by substituting an arbitrary hydrogen atom in one of the above "C 1-6 alkyl groups" of a "C 6-10 aryl group" having the above values, and, in particular, includes, for example, a benzyl group, a phenethyl group and a 3-phenyl-1-propyl group.
Как здесь используется, выражение «5-10-членный гетероарил С1-6 алкильная группа» относится к группе, полученной замещением «5-10-членной гетероарильной группой», имеющей указанные выше значения, произвольного атома водорода «С1-6 алкильных групп», и, в частности, включает, например, 2-пиридилметильную и 2-тиенилметильную группу.As used here, the expression “5-10 membered heteroaryl C 1-6 alkyl group” refers to the group obtained by substitution of a “5-10 membered heteroaryl group” having the above meanings, an arbitrary hydrogen atom “C 1-6 alkyl groups ", And, in particular, includes, for example, a 2-pyridylmethyl and 2-thienylmethyl group.
Как здесь используется, выражение «4-8-членный гетероциклил С1-6 алкильная группа» относится к группе, полученной заменой произвольного водородного атома в «С1-6 алкильной группе» на «4-8 членную гетероциклическую группу», имеющую указанные выше значения.As used here, the expression “4-8 membered heterocyclyl C 1-6 alkyl group” refers to the group obtained by replacing an arbitrary hydrogen atom in the “C 1-6 alkyl group” with a “4-8 membered heterocyclic group” having the above values.
Как здесь используется, выражение «моноциклическая или бициклическая 4-12-членная гетероциклическая группа, содержащая один или два атома азота в кольце, которое может иметь один или несколько заместителей» относится к неароматической циклической группе, которая может иметь один или несколько заместителей. В таких неароматических циклических группахAs used here, the expression "monocyclic or bicyclic 4-12 membered heterocyclic group containing one or two nitrogen atoms in the ring, which may have one or more substituents" refers to a non-aromatic cyclic group, which may have one or more substituents. In such non-aromatic cyclic groups
(i) число атомов, составляющих кольцо циклической группы, равно 4-12;(i) the number of atoms making up the ring of the cyclic group is 4-12;
(ii) атомы, составляющие кольцо циклической группы, включают один или два атома азота и(ii) the atoms that make up the ring of the cyclic group include one or two nitrogen atoms and
(iii) группа имеет моноциклическую или бициклическую структуру.(iii) the group has a monocyclic or bicyclic structure.
Конкретные примеры таких групп отвечают следующим формулам:Specific examples of such groups correspond to the following formulas:
(где n и m, каждый независимо, равны 0 или 1; R31 - R44, каждый независимо, представляют собой атом водорода или заместитель, выбранный из тех, на которые ссылается выражение «которые могут иметь один или несколько заместителей» (заместители указанной далее группы S); любые два радикала из R31-R44 могут совместно образовывать С1-6 алкиленовую группу).(where n and m, each independently, are 0 or 1; R 31 to R 44 , each independently, are a hydrogen atom or a substituent selected from those referred to by the phrase “which may have one or more substituents” (substituents of the specified further S); any two radicals from R 31 -R 44 may together form a C 1-6 alkylene group).
Используемое в тексте выражение «которая может иметь один или несколько заместителей» означает, что рассматриваемая группа может содержать в способном к замещению положении один или несколько заместителей в любых комбинациях. Примерами таких заместителей могут служить заместители, выбранные из указанной далее группы заместителей S.Used in the text, the expression "which may have one or more substituents" means that the group in question may contain one or more substituents in any combination in a substitutable position. Examples of such substituents are those selected from the following substituent group S.
<Группа заместителей S><Deputy group S>
Эта группа включает:This group includes:
(1) атом галогена,(1) a halogen atom,
(2) гидроксильную группу,(2) a hydroxyl group,
(3) меркаптогруппу,(3) mercapto group,
(4) нитрогруппу,(4) a nitro group,
(5) цианогруппу,(5) a cyano group,
(6) формильную группу,(6) a formyl group,
(7) карбоксильную группу,(7) a carboxyl group,
(8) трифторметильную группу,(8) a trifluoromethyl group,
(9) трифторметоксигруппу,(9) trifluoromethoxy group,
(10) аминогруппу,(10) an amino group,
(11) оксогруппу,(11) oxo group,
(12) иминогруппу, и(12) an imino group, and
группу, представленную формулой -Т1х-Т2х (где Т1х представляет собой одинарную связь, С1-6 алкиленовую группу, атом кислорода, группу, представленную формулой -СО-, группу, представленную формулой -S-, группу, представленную формулой -S(О)-, группу, представленную формулой -S(О)2-, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRT-, группу, представленную формулой -СО-NRT-, группу, представленную формулой NRT-СО-, группу, представленную формулой -SO2-NRT-, группу, представленную формулой -NRT-SO2-, группу, представленную формулой -NH-СО-NRT- или группу, представленную формулой -NH-CS-NRT-;a group represented by the formula —T 1x —T 2x (where T 1x represents a single bond, a C 1-6 alkylene group, an oxygen atom, a group represented by the formula —CO—, a group represented by the formula —S—, a group represented by the formula - S (O) -, a group represented by —S (O) 2 -, a group represented by —O — CO—, a group represented by —CO — O—, a group represented by —NR T -, a group represented by by the formula —CO — NR T -, a group represented by the formula NR T —CO—, a group represented by the formula —SO 2 —NR T -, a group represented by the formula —N R T —SO 2 -, a group represented by the formula —NH — CO — NR T - or a group represented by the formula —NH — CS — NR T -;
T2x представляет собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, фенильную группу, 1-нафтильную группу, 2-нафтильную группу, 5-10-членную гетероарильную группу или 4-8-членную гетероциклическую группу;T 2x represents a hydrogen atom, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a phenyl group, a 1-naphthyl group, a 2-naphthyl group, 5- A 10 membered heteroaryl group or a 4-8 membered heterocyclic group;
RT представляет собой атом водорода, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу или С2-6 алкинильную группу,R T represents a hydrogen atom, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group or a C 2-6 alkynyl group,
при условии, что T2x и RT, каждый независимо, могут иметь 1-3 заместителя, выбранных из указанных далее группы заместителей Т).provided that T 2x and R T , each independently, may have 1-3 substituents selected from the following substituent groups T).
<Группа заместителей Т><Deputy group T>
Эта группа включает гидроксил, циано, атом галогена, С1-6 алкил, С3-8 циклоалкил, С2-6 алкенил, С2-6 алкинил, фенил, 1-нафтил, 2-нафтил, 5-10-членный гетероарил, 4-8-членное гетероциклическое кольцо, С1-6 алкокси, С1-6 алкилтио, С2-7 алкоксикарбонильную группу и т.д.This group includes hydroxyl, cyano, halogen atom, C 1-6 alkyl, C 3-8 cycloalkyl, C 2-6 alkenyl, C 2-6 alkynyl, phenyl, 1-naphthyl, 2-naphthyl, 5-10 membered heteroaryl A 4-8 membered heterocyclic ring, C 1-6 alkoxy, C 1-6 alkylthio, C 2-7 alkoxycarbonyl group, etc.
<Группа заместителей S><Deputy group S>
Предпочтительно включаетPreferably includes
(1) атом галогена,(1) a halogen atom,
(2) гидроксильную группу,(2) a hydroxyl group,
(3) цианогруппу,(3) a cyano group,
(4) карбоксильную группу,(4) a carboxyl group,
(5) трифторметильную группу,(5) a trifluoromethyl group,
(6) трифторметоксигруппу,(6) trifluoromethoxy group,
(7) аминогруппу,(7) an amino group,
(8) С1-6 алкильную группу,(8) a C 1-6 alkyl group,
(9) С3-8 циклоалкильную группу,(9) a C 3-8 cycloalkyl group,
(10) С2-6 алкенильную группу,(10) a C 2-6 alkenyl group,
(11) С2-6 алкинильную группу,(11) a C 2-6 alkynyl group,
(12) фенильную группу и(12) a phenyl group and
(13) С1-6 алкоксигруппу.(13) C 1-6 alkoxy.
Как здесь используется, термин «группа, представленная формулойAs used here, the term "group represented by the formula
(где n и m, каждый независимо, представляют собой 0 или 1), которая может содержать один или несколько заместителей», относится к группе, представленной формулой(where n and m, each independently, are 0 or 1), which may contain one or more substituents "refers to a group represented by the formula
(где R31-R44 независимо представляют собой атом водорода или группу, выбранную из заместителей, относящихся к фразе «который может иметь один или несколько заместителей», указанной выше (группа заместителей S определена выше); n и m, каждый независимо, представляет собой 0 или 1). Предпочтительно, когда m=n=0. Более предпочтительно, когда термин относится к группе, представленной одной из формул(where R 31 -R 44 independently represent a hydrogen atom or a group selected from the substituents related to the phrase “which may have one or more substituents” above (a group of substituents S is defined above); n and m each independently represent itself 0 or 1). Preferably, when m = n = 0. More preferably, when the term refers to a group represented by one of the formulas
(где R31, R32, R33, R34 и R35 независимо представляют собой атом водорода или группу, выбранную из групп заместителей, относящихся к фразе «который может иметь один или несколько заместителей» (группа заместителей S определена выше), при условии, что по меньшей мере три из R31, R32, R33, R34 и R35 представляют собой атомы водорода. Еще более предпочтительно, когда термин относится к группе, представленной одной из формул(where R 31 , R 32 , R 33 , R 34 and R 35 independently represent a hydrogen atom or a group selected from groups of substituents related to the phrase “which may have one or more substituents” (substituent group S is defined above), when provided that at least three of R 31 , R 32 , R 33 , R 34 and R 35 are hydrogen atoms, even more preferably when the term refers to a group represented by one of the formulas
Наиболее предпочтительно, когда термин относится к группе, представленной формулойMost preferably, when the term refers to a group represented by the formula
Как здесь используется, термин «группа, представленная формулойAs used here, the term "group represented by the formula
(где n и m, каждый независимо, равны 0 или 1)» относится к группе, представленной одной из формул(where n and m, each independently, are 0 or 1) "refers to the group represented by one of the formulas
Как здесь используется, термин «пиперидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «пиперидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются фразой «которая может содержать один или несколько заместителей (указанная выше группа заместителей S). Предпочтительный термин «пиперидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к группе следующей формулы:As used herein, the term “piperidin-1-yl group which may have one or more substituents” refers to a “piperidin-1-yl group” which may have one or more substituents at substitutable positions selected from the group by which is referred to by the phrase “which may contain one or more substituents (the above group of substituents S). A preferred term “piperidin-1-yl group which may have one or more substituents” refers to a group of the following formula:
(где R31, R32, R33, R34 и R35, каждый независимо, представляют собой атом водорода или группу, выбранную из заместителей, на которые ссылаются в фразе «которая может иметь один или несколько заместителей» (указанная выше группа заместителей S), при условии, что по меньшей мере три радикала из R31, R32, R33, R34 и R35 представляют собой атомы водорода. Предпочтительно, когда рассматриваемый термин относится к группе, отвечающей одной из следующих формул:(where R 31 , R 32 , R 33 , R 34 and R 35 each independently represent a hydrogen atom or a group selected from substituents referred to in the phrase “which may have one or more substituents” (the above group of substituents S), provided that at least three radicals from R 31 , R 32 , R 33 , R 34 and R 35 are hydrogen atoms, preferably when the term in question refers to a group corresponding to one of the following formulas:
Еще более предпочтительно, когда рассматриваемый термин относится к группе, отвечающей одной из следующих формул:Even more preferably, when the term in question refers to a group corresponding to one of the following formulas:
Как здесь используется, выражение «азетидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «азетидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей (указанные выше группы заместителей S).As used here, the expression "azetidin-1-ilen group, which may have one or more substituents" refers to "azetidin-1-ilen group", which may have one or more substituents in substitutable positions selected from the group, by which is referred to by the expression "which may contain one or more substituents (the above group of substituents S).
Как здесь используется, выражение «пирролидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «пирролидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей».As used here, the expression "pyrrolidin-1-yl group that may have one or more substituents" refers to a "pyrrolidin-1-yl group" which may have one or more substituents at substitutable positions selected from the group by which is referred to by the expression "which may contain one or more substituents."
Как здесь используется, выражение «пиперидин-1-ильная группа, которая может иметь один или несколько заместителей» относится к «пиперидин-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей».As used herein, the expression “piperidin-1-yl group which may have one or more substituents” refers to a “piperidin-1-yl group” which may have one or more substituents at substitutable positions selected from the group by which is referred to by the expression "which may contain one or more substituents."
Как здесь используется, выражение «азепан-1-ильная группа, которая может иметь один или несколько заместителей» относится к «азепан-1-ильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из группы, на которую ссылаются выражением «которая может содержать один или несколько заместителей».As used herein, the expression “azepan-1-yl group which may have one or more substituents” refers to a “azepan-1-yl group” which may have one or more substituents at substitutable positions selected from the group by which is referred to by the expression "which may contain one or more substituents."
Как здесь используется, выражение «пиперидин-1-ильная группа, которая может содержать аминогруппу» относится к «пиперидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции. Конкретное значение выражения «пиперидин-1-ильная группа, которая может содержать аминогруппу» относится к группе, представленной одной из следующих формул:As used herein, the expression “piperidin-1-yl group which may contain an amino group” refers to a “piperidin-1-yl group” which may contain an amino group in a substitutable position. The specific meaning of the expression “piperidin-1-yl group which may contain an amino group” refers to a group represented by one of the following formulas:
предпочтительно к группе, представленной одной из формулpreferably to the group represented by one of the formulas
Как здесь используется, выражение «азетидин-1-ильная группа, которая может содержать аминогруппу» относится к «азетидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.As used here, the expression "azetidin-1-ilen group, which may contain an amino group" refers to "azetidin-1-ilen group", which may contain an amino group in a substitutable position.
Как здесь используется, выражение «пирролидин-1-ильная группа, которая может содержать аминогруппу» относится к «пирролидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.As used herein, the expression “pyrrolidin-1-yl group which may contain an amino group” refers to a “pyrrolidin-1-yl group” which may contain an amino group in a substitutable position.
Как здесь используется, выражение «пиперидин-1-ильная группа, которая может содержать аминогруппу» относится к «пиперидин-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.As used herein, the expression “piperidin-1-yl group which may contain an amino group” refers to a “piperidin-1-yl group” which may contain an amino group in a substitutable position.
Как здесь используется, выражение «азепан-1-ильная группа, которая может содержать аминогруппу» относится к «азепан-1-ильной группе», которая может содержать аминогруппу в способной к замещению позиции.As used herein, the expression “azepan-1-yl group which may contain an amino group” refers to “azepan-1-yl group” which may contain an amino group in a substitutable position.
Как здесь используется, выражение «С1-6 алкильная группа, которая может иметь один или несколько заместителей» в указанных выше заместителях группы В относится к «С1-6 алкильной группе», которая может иметь один или несколько заместителей в способных к замещению позициях, выбранных из тех, на который ссылаются выражением «которая может иметь один или несколько заместителей». Предпочтительный термин «С1-6 алкильная группа, которая может иметь один или несколько заместителей» относится к С1-6 алкильной группе, которая может иметь один или два заместителя, выбранных из группы, состоящей из цианогруппы, карбоксильной группы, С2-7 алкоксикарбонильной группы, группы, представленной формулой -NR3TCOR4T, группы, представленной формулой -CONR3TR4T (где R3T и R4T, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу) и С1-6 алкоксигруппы.As used here, the expression "C 1-6 alkyl group which may have one or more substituents" in the above substituents of group B refers to a "C 1-6 alkyl group" which may have one or more substituents in substitutable positions selected from those referred to by the expression "which may have one or more substituents." The preferred term “C 1-6 alkyl group which may have one or more substituents” refers to a C 1-6 alkyl group which may have one or two substituents selected from the group consisting of a cyano group, a carboxyl group, C 2-7 alkoxycarbonyl group, a group represented by the formula —NR 3T COR 4T , a group represented by the formula —CONR 3T R 4T (where R 3T and R 4T each independently represents a hydrogen atom or a C 1-6 alkyl group) and C 1-6 alkoxy groups.
В соединении, представленном приведенной выше формулой (I), R1 и R2, каждый независимо, представляют собой группу, представленную формулой -А0-А1-А2 (где А0, А1 и А2 имеют указанные выше значения), в том случае, когда каждый из А0 и А1 представляют собой одинарную связь, “-А0-А1-“ представляет собой одинарную связь.In the compound represented by the above formula (I), R 1 and R 2 each independently represent a group represented by the formula -A 0 -A 1 -A 2 (where A 0 , A 1 and A 2 have the above meanings) , in the case when each of A 0 and A 1 represents a single bond, “-A 0 -A 1 -“ represents a single bond.
Используемое применительно к приведенной выше формуле (I) выражение «когда Z2 представляет собой группу, представленную формулой -CR2=, R1 и R2 могут совместно образовывать 5-7-членное кольцо» означает, что соединения, отвечающие указанной выше формуле (I), включают соединения (II), представленные следующей формулой:Used in relation to the above formula (I), the expression "when Z 2 represents a group represented by the formula -CR 2 =, R 1 and R 2 can together form a 5-7 membered ring" means that the compounds corresponding to the above formula ( I) include compounds (II) represented by the following formula:
(где Z1, X и T1 имеют указанные выше значения; АТ1 представляет собой атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, метиленовую группу, которая может иметь один или несколько заместителей, или атом азота, который может иметь один или несколько заместителей; АТ2 представляет собой С2-6 алкиленовую группу, которая может иметь один или несколько заместителей). В представленной выше формуле (II) АТ1 предпочтительно представляет собой атом кислорода, а АТ2 предпочтительно представляет собой С2-4 алкиленовую группу.(where Z 1 , X and T 1 have the above meanings; A T1 represents an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group, a carbonyl group, a methylene group which may have one or more substituents, or a nitrogen atom which may have one or more substituents; A T2 is a C 2-6 alkylene group which may have one or more substituents). In the above formula (II), A T1 is preferably an oxygen atom, and A T2 is preferably a C 2-4 alkylene group.
Как здесь используется, выражение «цианобензильная группа» относится к бензильной группе, содержащей одну цианогруппу, и, в частности, включает, например, 2-цианобензильную группу, 3-цианобензильную группу и 4-цианобензильную группу.As used here, the expression "cyanobenzyl group" refers to a benzyl group containing one cyano group, and, in particular, includes, for example, a 2-cyanobenzyl group, a 3-cyanobenzyl group and a 4-cyanobenzyl group.
Как здесь используется, выражение «фторцианобензильная группа» относится к бензильной группе, замещенной атомом фтора и цианогруппой, и, в частности, включает, например, 2-циано-4-фторбензильную группу и 2-циано-6-фторбензильную группу.As used herein, the term “fluorocyanobenzyl group” refers to a benzyl group substituted by a fluorine atom and a cyano group, and in particular includes, for example, a 2-cyano-4-fluorobenzyl group and a 2-cyano-6-fluorobenzyl group.
Как здесь используется, выражение «карбамоилфеноксигруппа» относится к феноксигруппе, содержащий заместитель формулы -CONH2, примером которой могут служить 2-карбамоилфеноксигруппа, 3-карбамоилфеноксигруппа и 4-карбамоилфеноксигруппа.As used herein, the term “carbamoylphenoxy group” refers to a phenoxy group containing a substituent of the formula —CONH 2 , exemplified by the 2-carbamoylphenoxy group, the 3-carbamoylphenoxy group, and the 4-carbamoylphenoxy group.
Как здесь используется, выражение «соли» не носит ограничительного характера, если такие соли являются фармацевтически применимыми веществами и производными любого соединения по настоящему изобретению. Примерами рассматриваемых солей могут служить соли неорганических кислот, соли органических кислот, соли неорганических оснований, соли органических оснований и соли кислых или основных аминокислот.As used here, the expression “salts” is not restrictive if such salts are pharmaceutically applicable substances and derivatives of any compound of the present invention. Examples of the salts in question are salts of inorganic acids, salts of organic acids, salts of inorganic bases, salts of organic bases and salts of acidic or basic amino acids.
Примерами предпочтительных неорганических солей могут служить гидрохлорид, гидробромид, сульфат, нитрат и фосфат. Предпочтительные органические соли включают ацетат, сукцинат, фумарат, малеат, тартрат, цитрат, лактат, стеарат, бензоат, метансульфонат и п-толуолсульфонат.Examples of preferred inorganic salts include hydrochloride, hydrobromide, sulfate, nitrate and phosphate. Preferred organic salts include acetate, succinate, fumarate, maleate, tartrate, citrate, lactate, stearate, benzoate, methanesulfonate and p-toluenesulfonate.
Примеры предпочтительных солей неорганических оснований включают соли таких щелочных металлов, как соли натрия и калия; соли щелочноземельных металлов, такие как соли кальция и магния; соли алюминия и соли аммония. Предпочтительными примерами органических основных солей могут служить соли диэтиламина, соли диэтаноламина, соли меглюмина и соли N,N'-дибензилэтилендиамина.Examples of preferred salts of inorganic bases include alkali metal salts such as sodium and potassium salts; alkaline earth metal salts such as calcium and magnesium salts; aluminum salts and ammonium salts. Preferred examples of organic base salts include diethylamine salts, diethanolamine salts, meglumine salts, and N, N'-dibenzylethylenediamine salts.
Примерами предпочтительных кислых солей аминокислот могут служить аспартат и глютамат. Примеры предпочтительных основных солей аминокислот включают соли аргинина, соли лизина и соли орнитина.Examples of preferred acidic acid salts of amino acids include aspartate and glutamate. Examples of preferred basic amino acid salts include arginine salts, lysine salts and ornithine salts.
Настоящее изобретение предусматривает соединения, отвечающие следующей формуле (I), его соли или гидраты:The present invention provides compounds corresponding to the following formula (I), its salts or hydrates thereof:
где Т1 представляет собой моноциклическую или бициклическую 4-12-членную гетероциклическую группу, содержащую один или два кольцевых атома азота, и может иметь один или несколько заместителей;where T 1 represents a monocyclic or bicyclic 4-12-membered heterocyclic group containing one or two ring nitrogen atoms, and may have one or more substituents;
Х представляет собой С1-6 алкильную группу, которая может иметь один или несколько заместителей, С2-6 алкенильную группу, которая может иметь один или несколько заместителей, С2-6 алкинильную группу, которая может иметь один или несколько заместителей, С6-10 арильную группу, которая может иметь один или несколько заместителей, 5-10-членную гетероарильную группу, которая может иметь один или несколько заместителей, С6-10 арил С1-6 алкильную группу, которая может иметь один или несколько заместителей, или 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь один или несколько заместителей;X represents a C 1-6 alkyl group which may have one or more substituents, a C 2-6 alkenyl group which may have one or more substituents, a C 2-6 alkynyl group which may have one or more substituents, C 6 A -10 aryl group which may have one or more substituents, a 5-10 membered heteroaryl group which may have one or more substituents, a C 6-10 aryl C 1-6 alkyl group which may have one or more substituents, or 5-10 membered heteroaryl C 1-6 alkyl group which may have one or more substituents;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу, представленную формулой -CR2=;Z 1 and Z 2 each independently represent a nitrogen atom or a group represented by the formula —CR 2 =;
R1 и R2, каждый независимо, представляют собой группу, представленную формулой -А0-А1-А2 R 1 and R 2 each independently represent a group represented by the formula —A 0 —A 1 —A 2
(где А0 представляет собой одинарную связь или С1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей В;(where A 0 is a single bond or a C 1-6 alkylene group which may have 1-3 substituents selected from the following substituent group B;
А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA-, группу, представленную формулой -СО- NRA-, группу, представленную формулой -NRA-СО-, группу, представленную формулой -SO2-NRA-, или группу, представленную формулой -NRA-SO2-;And 1 represents a single bond, an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group, a carbonyl group, a group represented by the formula —O — CO—, a group represented by the formula —CO — O—, a group represented by the formula —NR A - , a group represented by the formula —CO — NR A -, a group represented by the formula —NR A —CO—, a group represented by the formula —SO 2 —NR A -, or a group represented by the formula —NR A —SO 2 -;
А2 и RА, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу, С6-10 арил С1-6 алкильную группу или С2-7 алкилкарбонильную группу, при условии, что А2 и RA, каждый независимо, имеет 1-3 заместителя, выбранных из указанной далее группы заместителей В).A 2 and R A each independently represent a hydrogen atom, a halogen atom, a cyano group, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, C 6- 10 aryl group, 5-10 membered heteroaryl group, 4-8 membered heterocyclic group, 5-10 membered heteroaryl C 1-6 alkyl group, C 6-10 aryl C 1-6 alkyl group or C 2-7 alkylcarbonyl a group, provided that A 2 and R A each independently have 1-3 substituents selected from the following substituent group B).
В том случае, когда Z2 представляет собой группу, представленную формулой -CR2=, R1 и R2 могут совместно образовывать 5-7-членное кольцо.In the case where Z 2 represents a group represented by the formula —CR 2 =, R 1 and R 2 can together form a 5-7 membered ring.
При этом исключаются случаи, когда [1] R1 представляет собой атом водорода; Z1 представляет собой атом азота, а Z2 представляет собой -СН=; [2] Z1 представляет собой атом азота, а Z2 представляет собой группу -С(ОН)=.This excludes cases where [1] R 1 represents a hydrogen atom; Z 1 represents a nitrogen atom, and Z 2 represents —CH =; [2] Z 1 represents a nitrogen atom, and Z 2 represents a group —C (OH) =.
<Группа заместителей В><Deputy group B>
Группа заместителей В включает гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1-СО-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RB3 (в которой RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -СО-RB4-RB5, и группу, представленную формулой -СН2-СО-RB4-RB5 (в которой RB4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой NRB6-; RB5 и RB6, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, C3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-гетероциклическую С1-6 алкильную группу, С6-10 арил С1-6 алкильную группу, или 5-10-членный гетероарил С1-6 алкильную группу).Substituent group B includes a hydroxyl group, a mercapto group, a cyano group, a nitro group, a halogen atom, a trifluoromethyl group, a C 1-6 alkyl group which may have one or more substituents, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, C 2 -6 alkynyl group, C 6-10 aryl group, 5-10 membered heteroaryl group, 4-8 membered heterocyclic group, C 1-6 alkoxy group, C 1-6 alkylthio group, a group represented by the formula —SO 2 —NR B1 -R B2 , a group represented by the formula -NR B1 -CO-R B2 , a group represented by the formula -NR B1 -R B2 (where R B1 and R B2 each independently represent a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R B3 (in which R B3 represents a 4-8 membered heterocyclic group), a group represented by the formula —CO — R B4 —R B5 and a group represented by the formula —CH 2 —CO — R B4 —R B5 (in which R B4 represents a single bond, an oxygen atom or a group represented by the formula NR B6 -; R B5 and R B6 each independently represent a hydrogen atom, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, 5 A 10-membered heteroaryl group, a 4-8 heterocyclic C 1-6 alkyl group, a C 6-10 aryl C 1-6 alkyl group, or a 5-10 membered heteroaryl C 1-6 alkyl group).
Предпочтительные соединения, представленные формулой (I), включают, например, следующие соединения:Preferred compounds represented by formula (I) include, for example, the following compounds:
(1) соединения, в которых любой, но не оба из радикалов Z1 и Z2 представляет собой атом азота;(1) compounds in which any, but not both of the radicals Z 1 and Z 2 represents a nitrogen atom;
(2) соединения, в которых Z1 представляет собой атом азота; Z2 представляет собой группу, представленную формулой -CR2= (где R2 имеет значения, указанные выше для R2);(2) compounds in which Z 1 represents a nitrogen atom; Z 2 represents a group represented by the formula —CR 2 = (wherein R 2 is as defined above for R 2 );
(3) соединения, в которых Z2 представляет собой атом азота; Z1 представляет собой группу, представленную формулой -CR2= (где R2 имеет значения указанные выше для R2);(3) compounds in which Z 2 represents a nitrogen atom; Z 1 represents a group represented by the formula —CR 2 = (wherein R 2 is as defined above for R 2 );
(4) соединения, в которых Т1 является группой, которая может иметь один или несколько заместителей и представлена формулой(4) compounds in which T 1 is a group which may have one or more substituents and is represented by the formula
(где n и m, каждый независимо, равны 0 или 1), азетидин-1-ильной группой, которая может иметь один или несколько заместителей, пирролидин-1-ильной группой, которая может иметь один или несколько заместителей, пиперидин-1-ильной группой, которая может иметь один или несколько заместителей или азепан-1-ильной группой, которая может иметь один или несколько заместителей;(where n and m are each independently 0 or 1), an azetidin-1-yl group which may have one or more substituents, a pyrrolidin-1-yl group which may have one or more substituents, piperidin-1-yl a group which may have one or more substituents or an azepan-1-yl group which may have one or more substituents;
(5) соединения, в которых Т1 является группой, представленной формулой(5) compounds in which T 1 is a group represented by the formula
(где n и m, каждый независимо, равны 0 или 1), азетидин-1-ильной группой, которая может содержать аминогруппу, пиролидин-1-ильной группой, которая может содержать аминогруппу, пиперидин-1-ильной группой, которая может содержать аминогруппу или азепан-1-ильной группой, которая может содержать аминогруппу;(where n and m are each independently 0 or 1), an azetidin-1-yl group which may contain an amino group, a pyrolidin-1-yl group which may contain an amino group, a piperidin-1-yl group which may contain an amino group or an azepan-1-yl group which may contain an amino group;
(6) соединения, в которых Т1 представляет собой пиперазин-1-ильную группу или 3-аминопиперидин-1-ильную группу;(6) compounds in which T 1 represents a piperazin-1-yl group or a 3-aminopiperidin-1-yl group;
(7) соединения, в которых Т1 представляет собой пиперазин-1-ильную группу;(7) compounds in which T 1 represents a piperazin-1-yl group;
(8) соединения, в которых Х представляет собой группу, представленную формулой -Х1-Х2 (где Х1 представляет собой одинарную связь или метиленовую группу, которая может иметь один или несколько заместителей; Х2 представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей; С2-6 алкинильную группу, которая может иметь один или несколько заместителей или фенильную группу, которая может иметь один или несколько заместителей);(8) compounds in which X represents a group represented by the formula —X 1 —X 2 (wherein X 1 represents a single bond or a methylene group which may have one or more substituents; X 2 represents a C 2-6 alkenyl group which may have one or more substituents; a C 2-6 alkynyl group which may have one or more substituents or a phenyl group which may have one or more substituents);
(9) соединения, в которых Х представляет собой группу, представленную формулой -Х11-Х12 (где Х11 представляет собой одинарную связь или метиленовую группу; Х12 представляет собой С2-6 алкенильную группу, С2-6 алкинильную группу или фенильную группу, которая может иметь один или несколько заместителей);(9) compounds in which X represents a group represented by the formula —X 11 —X 12 (wherein X 11 represents a single bond or a methylene group; X 12 represents a C 2-6 alkenyl group, a C 2-6 alkynyl group, or a phenyl group which may have one or more substituents);
(10) соединения, в которых фенильная группа, которая может содержать один или несколько заместителей, входящая в состав Х, представленного группой формулы -Х11-Х12, представляет собой фенильную группу, которая может содержать в положении 2 заместитель, выбранный из группы, состоящей из гидроксильной группы, атома фтора, атома хлора, метильной группы, этильной группы, фторметильной группы, винильной группы, метоксигруппы, этоксигруппы, ацетильной группы, цианогруппы, формильной группы и С2-7 алкоксикарбонильной группы;(10) compounds in which a phenyl group which may contain one or more substituents included in X represented by a group of the formula —X 11 —X 12 is a phenyl group which may contain in position 2 a substituent selected from the group consisting of a hydroxyl group, a fluorine atom, a chlorine atom, a methyl group, an ethyl group, a fluoromethyl group, a vinyl group, a methoxy group, an ethoxy group, an acetyl group, a cyano group, a formyl group, and a C 2-7 alkoxycarbonyl group;
(11) соединения, в которых Х представляет собой 3-метил-2-бутен-1-ильную группу, 2-бутин-1-ильную группу, бензильную группу или 2-хлорфенильную группу;(11) compounds in which X represents a 3-methyl-2-buten-1-yl group, a 2-butyn-1-yl group, a benzyl group, or a 2-chlorophenyl group;
(12) соединения, в которых Х представляет собой 2-бутин-1-ильную группу;(12) compounds in which X represents a 2-butyn-1-yl group;
(13) соединения, в которых R1 представляет собой атом водорода или группу, представленную формулой -А10-А11-А12,(13) compounds in which R 1 represents a hydrogen atom or a group represented by the formula —A 10 —A 11 —A 12 ,
где А10 представляет собой С1-6 алкиленовую группу, которая может содержать 1-3 заместителя, выбранных из указанной далее группы заместителей С;where A 10 represents a C 1-6 alkylene group, which may contain 1-3 substituents selected from the following substituent group C;
А11 представляет собой одинарную связь, атом кислорода, атом серы или карбонильную группу;A 11 represents a single bond, an oxygen atom, a sulfur atom or a carbonyl group;
А12 представляет собой атом водорода, С6-10 арильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членную гетероарильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной указанной далее группы заместителей С.A 12 represents a hydrogen atom, a C 6-10 aryl group which may have 1-3 substituents selected from the following substituent group C, a 5-10 membered heteroaryl group which may have 1-3 substituents selected from the following substituent groups C, a 5-10 membered heteroaryl C 1-6 alkyl group which may have 1-3 substituents selected from the following substituent group C, or a C 6-10 aryl C 1-6 alkyl group which may have 1 -3 substituents selected from the following substituent group C.
<Группа заместителей С><Deputy group C>
Группа заместителей С представляет собой группу, содержащую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RC2 (где RC1 и RC2, каждый независимо, представляет собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4, и группу, представленную формулой -CH2-CO-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода, группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);The substituent group C represents a group containing a hydroxyl group, a nitro group, a cyano group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR C1 —R C2 (where R C1 and R C2 each independently represents a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R C3 —R C4 , and a group represented by the formula —CH 2 —CO — R C3 —R C4 (where R C3 is a single bond, an oxygen atom, a group represented by the formula —NR C5 -; R C4 and R C5 , each n independently represent a hydrogen atom or a C 1-6 alkyl group);
(14) соединения, в которых R1 представляет собой атом водорода, С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С, или С6-10 арил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранных из указанной далее группы заместителей С;(14) compounds in which R 1 represents a hydrogen atom, a C 1-6 alkyl group, which may have 1-3 substituents selected from the following substituent group C, a 5-10 membered heteroaryl C 1-6 alkyl group, which may have 1-3 substituents selected from the following substituent group C, or a C 6-10 aryl C 1-6 alkyl group, which may have 1-3 substituents selected from the following substituent group C;
<Группа заместителей С><Deputy group C>
Группа заместителей С представляет собой группу, содержащую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RC2 (где RC1 и RC2, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RC3-RC4 и группу, представленную формулой -CH2-CO-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода, группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);The substituent group C represents a group containing a hydroxyl group, a nitro group, a cyano group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR C1 —R C2 (where R C1 and R C2 each independently represent a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R C3 —R C4 and a group represented by the formula —CH 2 —CO — R C3 - R C4 (where R C3 represents a single bond, an oxygen atom, a group represented by the formula —NR C5 -; R C4 and R C5 , each not depending on a hydrogen atom or a C 1-6 alkyl group);
(15) соединения, в которых указанная выше группа заместителей С для группы, представленной формулой А10-А11-А12, представленной радикалом R1, включает цианогруппу, С1-6 алкоксигруппу, С2-7 алкоксикарбонильную группу и атом галогена;(15) compounds in which the above substituent group C for the group represented by formula A 10 -A 11 -A 12 represented by the radical R 1 includes a cyano group, a C 1-6 alkoxy group, a C 2-7 alkoxycarbonyl group and a halogen atom;
(16) соединения, в которых R1 представляет собой метильную группу, цианобензильную группу, фторцианобензильную группу, фенетильную группу, 2-метоксиэтильную группу или 4-метоксикарбонилпиридин-2-ильную группу;(16) compounds in which R 1 represents a methyl group, a cyanobenzyl group, a fluorocyanobenzyl group, a phenethyl group, a 2-methoxyethyl group or a 4-methoxycarbonylpyridin-2-yl group;
(17) соединения, в которых R1 представляет собой метильную группу или 2-цианобензильную группу;(17) compounds in which R 1 represents a methyl group or a 2-cyanobenzyl group;
(18) соединения, в которых R2 представляет собой атом водорода, цианогруппу или группу, представленную формулой -А21-А22,(18) compounds in which R 2 represents a hydrogen atom, a cyano group or a group represented by the formula —A 21 —A 22 ,
где А21 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -О-СО-, группу, представленную формулой -СО-О-, группу, представленную формулой -NRA2-, группу, представленную формулой -СО-NRA2-, или группу, представленную формулой -NRA2-СО-;where A 21 represents a single bond, an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group, a carbonyl group, a group represented by the formula —O — CO—, a group represented by the formula —CO — O—, a group represented by the formula —NR A2 -, a group represented by the formula —CO — NR A2 -, or a group represented by the formula —NR A2 —CO—;
А22 и RA2, каждый независимо, представляют собой атом водорода, цианогруппу, С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, при условии, что А22 и RA2, каждый независимо, могут содержать 1-3 заместителя, выбранных из указанной далее группы заместителей D;A 22 and R A2 each independently represent a hydrogen atom, a cyano group, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group A 5-10 membered heteroaryl group, a 4-8 membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group, with the proviso that A 22 and R A2 , each independently, may contain 1-3 substituents selected from the following substituent group D;
<Группа заместителей D><Deputy group D>
Группа заместителей D представляет собой группу, содержащую гидроксильную группу, цианогруппу, нитрогруппу, атом галогена, С1-6 алкильную группу, С1-6 алкоксигруппу, С1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRD1-RD2 (где из RD1 и RD2, каждый независимо, представляет собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -СО-RD3 (где RD3 представляет собой 4-8-членную гетероциклическую группу), и группу, представленную формулой -CO-RD4-RD5 (где RD4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRD6-; RD5 и RD6, каждый независимо, представляют собой атом водорода, С3-8 циклоалкильную группу или С1-6 алкильную группу);The substituent group D is a group containing a hydroxyl group, a cyano group, a nitro group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR D1 —R D2 (where from R D1 and R D2 each independently represents a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R D3 (where R D3 represents a 4-8 membered heterocyclic group), and a group represented by the formula —CO — R D4 —R D5 (wherein R D4 is a single bond, an oxygen atom an ode or a group represented by the formula —NR D6 -; R D5 and R D6 each independently represents a hydrogen atom, a C 3-8 cycloalkyl group or a C 1-6 alkyl group);
(19) соединение, в котором R2 представляет собой атом водорода, цианогруппу, карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), группу, представленную формулой -А23-А24 (где А23 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA3-; А24 и RA3, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С3-8 циклоалкильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С2-6 алкенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, С2-6 алкинильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, фенильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1, или 5-10-членную гетероарильную группу, которая может иметь заместитель, выбранный из указанной далее группы заместителей D1.(19) a compound in which R 2 represents a hydrogen atom, a cyano group, a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula -A 23 -A 24 (where A 23 represents an oxygen atom, a sulfur atom or a group represented by the formula -NR A3 -; A 24 and R A3, each independently represent a hydrogen atom, a C 1-6 alkyl group which may have a substituent selected from yk D1 bound more substituent group, C3-8 cycloalkyl group which may have a substituent selected from Group D1 of said further substituents, C 2-6 alkenyl group which may have a substituent selected from Group D1 of said further substituents, C 2-6 an alkynyl group which may have a substituent selected from the following substituent group D1, a phenyl group which may have a substituent selected from the following substituent group D1, or a 5-10 membered heteroaryl group which may have a substituent, abusive from said further substituent group D1.
<Группа заместителей D1><Deputy group D1>
Группа заместителей D1 представляет собой группу, состоящую из карбоксигруппы, С2-7 алкоксикарбонильной группы, С1-6 алкильной группы, группы, представленной формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-карбонильной группы, С1-6 алкильной группы и С1-6 алкоксигруппы;The substituent group D1 is a group consisting of a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or C 1-6 alkyl group), a pyrrolidine-1-carbonyl group, a C 1-6 alkyl group and a C 1-6 alkoxy group;
(20) соединения, в которых R2 представляет собой атом водорода, цианогруппу, С1-6 алкоксигруппу или группу, представленную формулой -А25-А26 (где А25 представляет собой атом кислорода, атом серы, группу, представленную формулой -NRA4-; A26 и RA4, каждый независимо, представляют собой атом водорода, С1-6 алкильную группу, имеющую заместитель, выбранный из указанной далее группы заместителей D1, С3-8 циклоалкильную группу, имеющую заместитель, выбранный из указанной далее группы заместителей D1, или фенильную группу, имеющую заместитель, выбранный из указанной далее группы заместителей D;(20) compounds in which R 2 represents a hydrogen atom, a cyano group, a C 1-6 alkoxy group or a group represented by the formula -A 25 -A 26 (where A 25 represents an oxygen atom, a sulfur atom, a group represented by the formula -NR A4 -; A 26 and R A4 each independently represent a hydrogen atom, a C 1-6 alkyl group having a substituent selected from the following substituent group D1, a C 3-8 cycloalkyl group having a substituent selected from the following group substituents D1, or a phenyl group having a substituent selected from bound group D further substituents;
<Группа заместителей D1><Deputy group D1>
Группа заместителей D1 представляет собой группу, состоящую из карбоксильной группы, С2-7 алкоксикарбонильной группы, С1-6 алкильной группы, группы, представленной формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу), пирролидин-1-илкарбонильной группы, С1-6 алкильной группы, С1-6 алкоксигруппы;The substituent group D1 is a group consisting of a carboxyl group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or a C 1-6 alkyl group), a pyrrolidin-1-ylcarbonyl group, a C 1-6 alkyl group, a C 1-6 alkoxy group;
(21) соединения, в которых R2 представляет собой атом водорода, цианогруппу, метоксигруппу, карбамоилфенилоксигруппу, группу, представленную одной из следующих формул:(21) compounds in which R 2 represents a hydrogen atom, a cyano group, a methoxy group, a carbamoylphenyloxy group, a group represented by one of the following formulas:
(где А27 представляет собой атом кислорода, атом серы или группу, представленную формулой -NH-;(where A 27 represents an oxygen atom, a sulfur atom or a group represented by the formula —NH—;
A28 и А29, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу);A 28 and A 29 each independently represent a hydrogen atom or a C 1-6 alkyl group);
(22) соединения, в которых R2 представляет собой атом водорода, цианогруппу или карбамоилфенилоксигруппу.(22) compounds in which R 2 represents a hydrogen atom, a cyano group or a carbamoylphenyloxy group.
Из указанных выше соединений предпочтительными по значениям Z1 и Z2 являются соединения (1)-(3), из которых (3) является наиболее предпочтительным; предпочтительными по значениям Т1 являются соединения (4)-(7), из которых (7) является наиболее предпочтительным; предпочтительными по значениям Х являются соединения (8)-(12), из которых (12) является наиболее предпочтительным; предпочтительными по значениям R1 являются соединения (13)-(17), из которых (17) является наиболее предпочтительным; предпочтительными по значениям R2 являются соединения (18)-(22), из которых (22) является наиболее предпочтительным.Of the above compounds, the preferred values of Z 1 and Z 2 are compounds (1) to (3), of which (3) is most preferred; preferred in terms of T 1 are compounds (4) to (7), of which (7) is most preferred; preferred in terms of X are compounds (8) to (12), of which (12) is most preferred; preferred in terms of R 1 are compounds (13) to (17), of which (17) is most preferred; preferred in terms of R 2 are compounds (18) to (22), of which (22) is most preferred.
Предпочтительные соединения приведенной выше формулы (I) отвечают любым воплощениям 2-5, выбранным из групп, включающих соединения (1)-(3), (4)-(7), (8)-(12), (13)-(17) и (18)-(22).Preferred compounds of the above formula (I) correspond to any embodiments 2-5 selected from the groups including compounds (1) - (3), (4) - (7), (8) - (12), (13) - ( 17) and (18) - (22).
Примерами предпочтительных соединений могут служить вещества со следующей специальной комбинацией воплощений:Examples of preferred compounds are substances with the following special combination of embodiments:
(i) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (1), (4), (8), (13) и (18) соответственно;(i) compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (1), (4), (8), (13 ) and (18), respectively;
(ii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (19) соответственно;(ii) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (2), (6), (11), (16 ) and (19), respectively;
(iii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (20) соответственно;(iii) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (2), (6), (11), (16 ) and (20), respectively;
(iv) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (21) соответственно;(iv) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (2), (6), (11), (16 ) and (21), respectively;
(v) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (11), (16) и (22) соответственно;(v) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (2), (6), (11), (16 ) and (22), respectively;
(vi) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (19) соответственно;(vi) compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (2), (6), (12), (17 ) and (19), respectively;
(vii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (20) соответственно;(vii) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (2), (6), (12), (17 ) and (20), respectively;
(viii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (21) соответственно;(viii) compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings given in the above items (2), (6), (12), (17 ) and (21), respectively;
(ix) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (2), (6), (12), (17) и (22) соответственно;(ix) the compounds represented by the above formula (I) in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings given in the above (2), (6), (12), (17) ) and (22), respectively;
(x) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (19) соответственно;(x) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (3), (6), (11), (16 ) and (19), respectively;
(xi) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (20) соответственно;(xi) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (3), (6), (11), (16 ) and (20), respectively;
(xii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (21) соответственно;(xii) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 are as defined above (3), (6), (11), (16 ) and (21), respectively;
(xiii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (11), (16) и (22) соответственно;(xiii) the compounds represented by the above formula (I) in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings given in the above items (3), (6), (11), (16 ) and (22), respectively;
(xiv) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (19) соответственно;(xiv) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (3), (6), (12), (17 ) and (19), respectively;
(xv) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (20) соответственно;(xv) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 are as defined above (3), (6), (12), (17) ) and (20), respectively;
(xvi) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (21) соответственно;(xvi) the compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings of the above items (3), (6), (12), (17 ) and (21), respectively;
(xvii) соединения, представленные вышеуказанной формулой (I), в которой Z1 и Z2, T1, X, R1 и R2 имеют значения по приведенным выше пунктам (3), (6), (12), (17) и (22) соответственно.(xvii) compounds represented by the above formula (I), in which Z 1 and Z 2 , T 1 , X, R 1 and R 2 have the meanings given in the above items (3), (6), (12), (17 ) and (22), respectively.
В приведенном выше перечне для соединений (ii)-(ix) предпочтительность соединений возрастает в последовательности от (ii) к (ix) и для соединений (x)-(xvii) - от (x) к (xvii).In the above list, for compounds (ii) - (ix), the preference of compounds increases in sequence from (ii) to (ix) and for compounds (x) - (xvii) from (x) to (xvii).
В следующей ниже таблице приведены конкретные примеры соединений формулы (I), не ограничивающие область изобретения.The following table provides specific examples of compounds of formula (I), not limiting the scope of the invention.
Сокращения, используемые в таблице, имеют следующие значения:The abbreviations used in the table have the following meanings:
Р1 - пиперазин-1-ил; Р2 - 3-аминопиперидин-1-ил; 2Btyn - 2-бутин-1-ил; 3Ме2Bten - 3-метил-2-бутен-1-ил; Ме - метил; Et - этил; 2-CNBen - 2-цианобензил; 6F2CNBen - 6-фтор-2-цианобензил; фенетил-2-фенилэтил; 2Ph20xEt - 2-фенил-2-оксоэтил; -CR2=, -CR2=.P1 is piperazin-1-yl; P2 is 3-aminopiperidin-1-yl; 2Btyn - 2-butyn-1-yl; 3Me2Bten - 3-methyl-2-buten-1-yl; Me is methyl; Et is ethyl; 2-CNBen - 2-cyanobenzyl; 6F2CNBen - 6-fluoro-2-cyanobenzyl; phenethyl-2-phenylethyl; 2Ph20xEt - 2-phenyl-2-oxoethyl; -CR2 =, -CR 2 =.
Среди перечисленных выше соединений соединения с номерами 1, 2, 4, 6, 7, 8, 10, 13, 16, 41, 42, 44, 50, 53, 81, 85, 86, 87, 111, 141 и 183 являются предпочтительными, а соединения 2, 4, 8, 10, 81, 87 и 111 являются особенно предпочтительными.Among the above compounds, compounds with the numbers 1, 2, 4, 6, 7, 8, 10, 13, 16, 41, 42, 44, 50, 53, 81, 85, 86, 87, 111, 141 and 183 are preferred and compounds 2, 4, 8, 10, 81, 87 and 111 are particularly preferred.
<Типичные методы синтеза><Typical Synthesis Methods>
Далее описаны характерные способы получения соединений, представленных приведенной выше формулой (I).Typical processes for preparing the compounds represented by the above formula (I) are described below.
Далее приводится определение для каждого символа, используемого в способах получения. R31-R42, n, m, R1, R2, X, A0, A1, A2, RA и Т1 имеют указанные выше значения.The following is a definition for each character used in production methods. R 31 -R 42 , n, m, R 1 , R 2 , X, A 0 , A 1 , A 2 , R A and T 1 have the above meanings.
U1 и U3, каждый независимо, представляют собой удаляемую группу, такую как атом хлора, атом брома, атом йода, метансульфонилоксигруппу или п-толуолсульфонилоксигруппу.U 1 and U 3 each independently represent a leaving group, such as a chlorine atom, a bromine atom, an iodine atom, a methanesulfonyloxy group or a p-toluenesulfonyloxy group.
Rp1, Rp2 и Rp3, каждый независимо, представляют собой NH-защитную группу, например пивалилоксиметильную группу и триметилсилилэтоксиметильную группу.R p1 , R p2 and R p3 each independently represent an NH-protecting group, for example a pivaliloxymethyl group and a trimethylsilylethoxymethyl group.
Rp4 представляет собой гидрокси-защитную группу, такую как трет-бутилдиметилсилильная группа и трет-бутилдифенилсилильная группа.R p4 represents a hydroxy protecting group such as a tert-butyldimethylsilyl group and a tert-butyldiphenylsilyl group.
Rp5 представляет собой NH-защитную группу, такую как N,N-диметилсульфамоил, тритил, бензил и трет-бутоксикарбонил.R p5 represents an NH-protecting group such as N, N-dimethylsulfamoyl, trityl, benzyl and tert-butoxycarbonyl.
U2 и U4, каждый независимо, представляют собой атом хлора, атом брома, атом йода, метансульфонилоксигруппу, п-толуолсульфонилоксигруппу, группу, представленную формулой -В(ОН)2, 4,4,5,5-тетраметил-1,3,2-диоксаборан-2-ильную группу или группу, представленную формулой -Sn(Rz)3 (где Rz представляет собой С1-6 алкильную группу).U 2 and U 4 each independently represent a chlorine atom, a bromine atom, an iodine atom, a methanesulfonyloxy group, a p-toluenesulfonyloxy group, a group represented by the formula —B (OH) 2 , 4,4,5,5-tetramethyl-1,3 , 2-dioxaboran-2-yl group or a group represented by the formula —Sn (R z ) 3 (where R z represents a C 1-6 alkyl group).
Rx2 является группой, представленной формулой -О-Ах, группой, представленной формулой -S-A2, группой, представленной формулой -N(RA)A2 или 4-8-членной гетероциклической группой, которая может иметь один или несколько заместителей (например, 1-пирролидинил, 1-морфолинил, 1-пиперазинил или 1-пиперидил) и т.п.R x2 is a group represented by the formula —O — A x , a group represented by the formula —SA 2 , a group represented by the formula —N (R A ) A 2 or a 4-8 membered heterocyclic group which may have one or more substituents ( e.g. 1-pyrrolidinyl, 1-morpholinyl, 1-piperazinyl or 1-piperidyl) and the like.
Rx3 является группой, представленной формулой -А0-А1-А2-, такой как цианогруппа, С1-6 алкильная группа, которая может иметь один или несколько заместителей, С3-8 циклоалкильная группа, которая может иметь один или несколько заместителей, С2-6 алкенильная группа, которая может иметь один или несколько заместителей, С2-6 алкинильная группа, которая может иметь один или несколько заместителей, и С6-10 арильная группа, которая может иметь один или несколько заместителей.R x3 is a group represented by the formula —A 0 —A 1 —A 2 -, such as a cyano group, a C 1-6 alkyl group which may have one or more substituents, a C 3-8 cycloalkyl group which may have one or more substituents, a C 2-6 alkenyl group which may have one or more substituents, a C 2-6 alkynyl group which may have one or more substituents, and a C 6-10 aryl group which may have one or more substituents.
А2COOR представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит эфирную группу.A 2COOR represents a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, a 5-10 membered heteroaryl group, 4-8 a membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group, each of which contains an ether group.
А2COOН представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит карбоксильную группу.A 2COOH represents a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, a 5-10 membered heteroaryl group, 4-8 a membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group, each of which contains a carboxyl group.
А2NO2 представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит нитрогруппу.A 2NO2 represents a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, a 5-10 membered heteroaryl group, 4-8 a membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group, each of which contains a nitro group.
А2NН2 представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит аминогруппу.A 2NH2 represents a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, a 5-10 membered heteroaryl group, 4-8 a membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group, each of which contains an amino group.
А2CN представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит нитрильную группу.A 2CN represents a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, a 5-10 membered heteroaryl group, 4-8 a membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group, each of which contains a nitrile group.
АCONH2 представляет собой С1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил С1-6 алкильную группу или С6-10 арил С1-6 алкильную группу, каждая из которых содержит карбоксамидную группу.A CONH2 represents a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, a 5-10 membered heteroaryl group, 4-8 a membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group, each of which contains a carboxamide group.
М представляет собой -MgCl, -MgBr, -Sn(Rz)3 (где Rz имеет указанные выше значения) и т.п.M represents — MgCl, — MgBr, —Sn (R z ) 3 (where R z is as defined above), and the like.
Термин «комнатная температура» относится к температуре в интервале 20-30ºС.The term "room temperature" refers to a temperature in the range of 20-30ºC.
Т1а определяется как группа формулы Т1, или представляет собой группу формулыT 1a is defined as a group of the formula T 1 , or is a group of the formula
группу формулыa group of formula
(где R31-R44 имеют указанные выше значения, за исключением случая, когда любой из R31-R44 представляет собой -NH-Rp3) или группу формулы(where R 31 -R 44 have the above meanings, unless any of R 31 -R 44 is —NH-R p3 ) or a group of the formula
(где R31-R40 имеют указанные выше значения, за исключением случая, когда любой из R31-R40 представляет собой -NH-Rp3).(where R 31 -R 40 have the above meanings, unless any of R 31 -R 40 is —NH-R p3 ).
Если не указано особо, то в примерах реакций, представленных следующими схемами, используемые количества реагентов, катализаторов и пр. (эквиваленты, мас.% и массовые соотношения) приведены в расчете на основное вещество для каждой реакционной схемы. Термин «основное вещество» относится к соединению, изображенному химической формулой в реакционной схеме и имеющему структуру соединений по настоящему изобретению.Unless otherwise indicated, in the examples of reactions represented by the following schemes, the amounts of reagents, catalysts, etc. used (equivalents, wt.% And mass ratios) are calculated on the basis of the basic substance for each reaction scheme. The term "basic substance" refers to a compound depicted by the chemical formula in the reaction scheme and having the structure of the compounds of the present invention.
Способ получения АThe method of obtaining a
[Стадия А1][Stage A1]
На этой стадии -NH-защитный реагент подвергают взаимодействию с соединением (1а) [CAS No. 56160-64-6] с получением соединения (2а). Условия проведения реакции выбирают в зависимости от типа используемого -NH-защитного реагента. Реакция может проводиться в условиях, которые обычно используются для введения защитной группы с использованием соответствующего реагента.At this stage, the —NH-protecting reagent is reacted with compound (1a) [CAS No. 56160-64-6] to give compound (2a). The reaction conditions are selected depending on the type of -NH-protective reagent used. The reaction can be carried out under conditions that are commonly used to introduce a protecting group using an appropriate reagent.
Термин «-NH-защитный реагент» относится к реагенту, который обычно используется для введения N-защитной группы. Примерами таких -NH-защитных реагентов может служить хлорметилпивалат. Предпочтительно использовать 1-2 эквивалента защитного реагента. Примерами растворителей, которые могут использоваться в рассматриваемой реакции, могут служить ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Предпочтительно использовать N,N-диметилформамид.The term “-NH-protective reagent” refers to a reagent that is commonly used to introduce an N-protective group. Examples of such -NH-protective reagents include chloromethyl pivalate. It is preferable to use 1-2 equivalents of a protective reagent. Examples of solvents that can be used in the reaction under consideration are acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran and dimethoxyethane. N, N-dimethylformamide is preferably used.
Реакция может проводиться в присутствии основания. Примерами оснований, используемых в рассматриваемой реакции, могут служить карбонат цезия, карбонат лития, карбонат натрия, карбонат калия и гидрид натрия. Предпочтительно использовать гидрид натрия. В этом случае предпочтительное количество основания составляет 1-5 эквивалентов. Реакцию можно проводить при температуре 0-150ºС. Предпочтительно использовать комнатную температуру.The reaction may be carried out in the presence of a base. Examples of bases used in the reaction under consideration are cesium carbonate, lithium carbonate, sodium carbonate, potassium carbonate and sodium hydride. Sodium hydride is preferred. In this case, the preferred amount of base is 1-5 equivalents. The reaction can be carried out at a temperature of 0-150ºС. It is preferable to use room temperature.
[Стадия А2][Stage A2]
На этой стадии соединение (2а) подвергают взаимодействию с соединением (2а-2) с получением соединения (3а).In this step, compound (2a) is reacted with compound (2a-2) to give compound (3a).
В качестве соединения (2а-2) может использоваться любое соединение, представляющее собой электрофильный реагент, например алкилгалогенид. Конкретными примерами галоидных алкилов могут служить йодметан, йодэтан, йодпропан, и бензилбромид; алкенилгалогениды, такие как аллилбромид и 1-бром-3-метил-2-бутен, а также алкинилгалогениды, такие как пропаргилбромид и 1-бром-2-бутин. Предпочтительно использовать 1-2 эквивалента электрофильного реагента.As the compound (2a-2), any compound representing an electrophilic reagent, for example, an alkyl halide, can be used. Specific examples of halide alkyls include iodomethane, iodoethane, iodopropane, and benzyl bromide; alkenyl halides such as allyl bromide and 1-bromo-3-methyl-2-butene; and alkynyl halides such as propargyl bromide and 1-bromo-2-butine. It is preferable to use 1-2 equivalents of an electrophilic reagent.
В качестве растворителей для этой реакции могут использоваться диметилсульфоксид, N,N-диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран и толуол.As solvents for this reaction, dimethyl sulfoxide, N, N-dimethylformamide, N-methylpyrrolidone, dioxane, tetrahydrofuran and toluene can be used.
Реакцию можно проводить в присутствии или в отсутствие основания. Примерами используемых оснований могут служить гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, бутиллитий, метиллитий, литий бис(триметилсилил)амид, натрий бис(триметилсилил)амид и калий бис(триметилсилил)амид. В этом случае предпочтительно использовать один-два эквивалента основания.The reaction can be carried out in the presence or absence of a base. Examples of bases used are lithium hydroxide, sodium hydroxide, potassium hydroxide, lithium carbonate, sodium carbonate, potassium carbonate, cesium carbonate, lithium hydride, sodium hydride, potassium hydride, butyllithium, methyl lithium, lithium bis (trimethylsilyl) amide, sodium bis (trimethylsilyl) ) amide and potassium bis (trimethylsilyl) amide. In this case, it is preferable to use one to two equivalents of the base.
Реакцию можно проводить при температуре 0-150ºС.The reaction can be carried out at a temperature of 0-150ºС.
[Стадия А3][Stage A3]
На этой стадии осуществляют удаление бензильной группы из положения 7 соединения (3а) с получением соединения (4а).At this stage, the benzyl group is removed from position 7 of compound (3a) to give compound (4a).
Соединение (4а) может быть получено, например, каталитическим восстановлением соединения (3а) в атмосфере водорода в присутствии металлического катализатора, однако условия реакции не ограничиваются указанными выше.Compound (4a) can be obtained, for example, by catalytic reduction of compound (3a) in a hydrogen atmosphere in the presence of a metal catalyst, however, the reaction conditions are not limited to the above.
Конкретные растворители для проведения такой реакции включают метанол, этанол, пропанол, уксусную кислоту, диметилсульфоксид, N,N-диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран и толуол. Примерами металлических катализаторов могут служить палладий на угле, оксид платины и никель Ренея. Предпочтительно использовать 0,5-50 мас.% катализатора. Предпочтительное давление водорода составляет 1-5 атм. Реакция может проводиться при температуре 0-150ºС.Specific solvents for carrying out such a reaction include methanol, ethanol, propanol, acetic acid, dimethyl sulfoxide, N, N-dimethylformamide, N-methylpyrrolidone, dioxane, tetrahydrofuran and toluene. Examples of metal catalysts include palladium on carbon, platinum oxide, and Raney nickel. It is preferable to use 0.5-50 wt.% The catalyst. The preferred hydrogen pressure is 1-5 atm. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия А4][Stage A4]
На этой стадии соединение (4а) подвергают взаимодействию с соединением (4а-2) с получением соединения (5а).In this step, compound (4a) is reacted with compound (4a-2) to give compound (5a).
Конкретными примерами соединения (4а-2) являются алкилгалогениды, такие как йодметан, йодэтан, йодпропан, и бензилбромид; такие алкенилгалогениды, как аллилбромид и 1-бром-3-метил-2-бутен, или такие алкинилгалогениды, как пропаргилбромид и 1-бром-2-бутин. Указанные галогениды предпочтительно использовать в количестве 1-2 эквивалентов.Specific examples of compound (4a-2) are alkyl halides such as iodomethane, iodoethane, iodopropane, and benzyl bromide; alkenyl halides such as allyl bromide and 1-bromo-3-methyl-2-butene; or alkynyl halides such as propargyl bromide and 1-bromo-2-butine. These halides are preferably used in an amount of 1-2 equivalents.
Растворители для рассматриваемой реакции включают диметилсульфоксид, N,N-диметилформамид, N-метилпирролидон, диоксан, тетрагидрофуран и толуол.Solvents for this reaction include dimethyl sulfoxide, N, N-dimethylformamide, N-methylpyrrolidone, dioxane, tetrahydrofuran and toluene.
Реакцию можно проводить в присутствии или в отсутствие основания. Примерами оснований, используемых для проведения такой реакции, могут служить гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, бутиллитий, метиллитий, литий бис(триметилсилил)амид, натрий бис(триметилсилил)амид и калий бис(триметилсилил)амид. В этом случае предпочтительно использовать 1-4 эквивалента основания. Реакцию можно проводить при температуре 0-150ºС.The reaction can be carried out in the presence or absence of a base. Examples of bases used to carry out such a reaction are lithium hydroxide, sodium hydroxide, potassium hydroxide, lithium carbonate, sodium carbonate, potassium carbonate, cesium carbonate, lithium hydride, sodium hydride, potassium hydride, butyl lithium, methyl lithium, lithium bis (trimethylsilyl) amide, sodium bis (trimethylsilyl) amide and potassium bis (trimethylsilyl) amide. In this case, it is preferable to use 1-4 equivalents of base. The reaction can be carried out at a temperature of 0-150ºС.
Соединение (5а) может быть получено путем взаимодействия соединения (4а) с соединением (4а-2) в присутствии медного катализатора и основания. В рассматриваемом случае предпочтительно использовать 0,1-2 эквивалента медного катализатора и 1-10 эквивалентов основания.Compound (5a) can be obtained by reacting compound (4a) with compound (4a-2) in the presence of a copper catalyst and a base. In this case, it is preferable to use 0.1-2 equivalents of copper catalyst and 1-10 equivalents of base.
Соединение (4а-2) может представлять собой арилбороновую кислоту, гетероарилбороновую кислоту, в которых Х представляет собой С6-10 арильную группу, которая может иметь один или несколько заместителей, или 5-10-членную гетероарильную группу, которая может иметь один или несколько заместителей, и U2 представляет собой -В(ОН)2. Предпочтительно использовать один-три эквивалента соединения (4а-2).Compound (4a-2) may be arylboronic acid, heteroarylboronic acid in which X represents a C 6-10 aryl group which may have one or more substituents, or a 5-10 membered heteroaryl group which may have one or more substituents, and U 2 represents —B (OH) 2 . It is preferable to use one to three equivalents of compound (4a-2).
Реакция может проводиться в присутствии таких растворителей, как дихлорметан, хлороформ, 1,4-диоксан, тетрагидрофуран, толуол, пиридин, N,N-диметилформамид и N-метилпирролидон.The reaction can be carried out in the presence of solvents such as dichloromethane, chloroform, 1,4-dioxane, tetrahydrofuran, toluene, pyridine, N, N-dimethylformamide and N-methylpyrrolidone.
Основания включают триэтиламин, диизопропилэтиламин, пиридин и N,N-диметиламинопиридин. Медные катализаторы могут представлять собой ацетат меди (II), трифторацетат меди (II), хлорид меди (II) и йодид меди (II). Реакцию можно проводить при температурах 0-150ºС.Bases include triethylamine, diisopropylethylamine, pyridine and N, N-dimethylaminopyridine. Copper catalysts can be copper (II) acetate, copper (II) trifluoroacetate, copper (II) chloride and copper (II) iodide. The reaction can be carried out at temperatures of 0-150ºС.
[Стадия А5][Stage A5]
На этой стадии соединение (5а) подвергают взаимодействию с галогенирующим агентом с получением соединения (6а).In this step, compound (5a) is reacted with a halogenating agent to give compound (6a).
Конкретные примеры галогенирующих агентов включают N-хлорсукцинимид, N-бромсукцинимид и N-йодсукцинимид. Галогенирующий агент предпочтительно использовать в количестве 1-4 эквивалента.Specific examples of halogenating agents include N-chlorosuccinimide, N-bromosuccinimide and N-iodosuccinimide. The halogenating agent is preferably used in an amount of 1-4 equivalents.
В качестве растворителей для рассматриваемой реакции можно использовать ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Реакцию можно проводить при температуре 0-150ºС.As solvents for the reaction in question, acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran and dimethoxyethane can be used. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия А6][Stage A6]
На этой стадии соединение (6а) подвергают взаимодействию с соединением (7а) с получением соединения (8а). В данном случае предпочтительно использовать 1-4 эквивалента соединения (7а).In this step, compound (6a) is reacted with compound (7a) to give compound (8a). In this case, it is preferable to use 1-4 equivalents of compound (7a).
Реакцию можно проводить в таких растворителях, как тетрагидрофуран, ацетонитрил, N,N-диметилформамид, N-метилпирролидон, метанол, этанол, 1,4-диоксан, толуол и ксилол, или в отсутствие растворителя. Реакция может осуществляться при температуре 0-200ºС в присутствии или в отсутствие основания. Примерами оснований могут служить триэтиламин, карбонат калия и 1,8-диазабицикло[5,4,0]ундецен. В рассматриваемом случае предпочтительно использовать 1-4 эквивалента основания.The reaction can be carried out in solvents such as tetrahydrofuran, acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, methanol, ethanol, 1,4-dioxane, toluene and xylene, or in the absence of a solvent. The reaction can be carried out at a temperature of 0-200 ° C in the presence or absence of a base. Examples of bases are triethylamine, potassium carbonate and 1,8-diazabicyclo [5.4.0] undecene. In the present case, it is preferable to use 1-4 equivalents of base.
[Стадия А7][Stage A7]
На этой стадии осуществляют удаление NH-защитной группы из положения 3 соединения (8а) с получением соединения (9а). Условия проведения реакции выбирают в соответствии с типом N-защитной группы, подлежащей удалению. Реакция снятия защитной группы может проводиться в обычных условиях.At this stage, the NH-protecting group is removed from position 3 of compound (8a) to give compound (9a). The reaction conditions are selected according to the type of N-protecting group to be removed. The deprotection reaction may be carried out under normal conditions.
Так, например, в том случае, когда Rp2 представляет собой пивалилоксиметильную группу, реакцию проводят в метаноле или смеси метанола с тетрагидрофураном, используя в качестве основания метилат натрия, гидрид натрия или 1,8-диазабицикло[5,4,0]-7-ундецен при температуре 0-150ºС. В этом случае предпочтительно использовать 0,1-2 эквивалента основания.So, for example, in the case when R p2 represents a pivaliloxymethyl group, the reaction is carried out in methanol or a mixture of methanol with tetrahydrofuran using sodium methylate, sodium hydride or 1,8-diazabicyclo [5.4.0] -7 as the base -undecene at a temperature of 0-150ºС. In this case, it is preferable to use 0.1 to 2 equivalents of base.
Если Rp2 представляет собой триметилсилилэтоксиметильную группу, реакцию можно проводить в среде такого растворителя, как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, с использованием такого реагента, как фторид тетрабутиламмония или фторид цезия, при температуре 0-150ºС. В этом случае предпочтительно использовать 1-5 эквивалентов фторидного реагента.If R p2 is a trimethylsilylethoxymethyl group, the reaction can be carried out in a solvent such as acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran or dimethoxyethane, using a reagent such as tetrabutylammonium fluoride or cesium fluoride , at a temperature of 0-150ºС. In this case, it is preferable to use 1-5 equivalents of a fluoride reagent.
[Стадия А8][Stage A8]
На этой стадии соединение (9а) подвергают хлорированию с получением соединения (10а).In this step, compound (9a) is chlorinated to give compound (10a).
Для условий проведения реакции нет конкретных ограничений, и реакция может проводиться в обычных условиях хлорирования. Так, например, реакцию можно проводить при температуре 0-150ºС в таком растворителе, как оксихлорид фосфора. В рассматриваемом случае предпочтительно использовать 10-200-кратный избыток хлорирующего агента.There are no particular restrictions on the reaction conditions, and the reaction can be carried out under ordinary chlorination conditions. So, for example, the reaction can be carried out at a temperature of 0-150ºC in a solvent such as phosphorus oxychloride. In this case, it is preferable to use a 10-200-fold excess of the chlorinating agent.
В том случае, когда Rp3 представляет собой трет-бутоксикарбонильную группу, которая удаляется при указанных выше условиях, предусматривающих использование оксихлорида фосфора, требуется повторное введение защитной группы.In the case where R p3 is a tert-butoxycarbonyl group which is removed under the above conditions involving the use of phosphorus oxychloride, re-introduction of the protective group is required.
Нет конкретных ограничений относительно условий проведения реакции введения защитной группы. В случае трет-бутоксикарбонильной группы реакцию можно проводить с использованием такого -NH-защитного агента, как ди-трет-бутилдикарбонат, в среде такого растворителя, как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, в присутствии такого основания, как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, бикарбонат калия, бикарбонат натрия или триэтиламин, при 0-150ºС.There are no particular restrictions on the conditions for the reaction to introduce the protective group. In the case of a tert-butoxycarbonyl group, the reaction can be carried out using a -NH-protective agent such as di-tert-butyl dicarbonate in a solvent such as acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran or dimethoxyethane, in the presence of a base such as lithium hydroxide, sodium hydroxide, potassium hydroxide, lithium carbonate, sodium carbonate, potassium carbonate, cesium carbonate, potassium bicarbonate, sodium bicarbonate or triethylamine, at 0-150 ° C.
[Стадия А9][Stage A9]
На этой стадии соединение (11а) подвергают взаимодействию с соединением (11а-2) с получением соединения (10а).In this step, compound (11a) is reacted with compound (11a-2) to give compound (10a).
Соединение (11а-2) включает производные спирта или производные фенола, представленные общей формулой А2-ОН, производные амина, представленные общей формулой А2(RA)NH или им подобные, и производные тиола, представленные общей формулой A2-SH. В этом случае соединение (11а-2) предпочтительно использовать в количестве 1-10 эквивалентов или в 5-100-кратном массовом избытке.Compound (11a-2) includes alcohol derivatives or phenol derivatives represented by the general formula A 2 —OH, amine derivatives represented by the general formula A 2 (R A ) NH or the like, and thiol derivatives represented by the general formula A 2 —SH. In this case, the compound (11a-2) is preferably used in an amount of 1-10 equivalents or in a 5-100-fold mass excess.
В качестве растворителей могут использоваться ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол.As solvents, acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran, dimethoxyethane, methanol and ethanol can be used.
Реакцию можно проводить в присутствии или в отсутствие основания. Основания, используемые в реакции, включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, бутиллитий, метиллитий, бис(триметилсилил)амид лития, бис(триметилсилил)амид натрия, бис(триметилсилил)амид калия и триэтиламин. В данном случае предпочтительно использовать 1-10 эквивалентов основания. Реакцию можно проводить при температуре 0-150ºС.The reaction can be carried out in the presence or absence of a base. The bases used in the reaction include lithium hydroxide, sodium hydroxide, potassium hydroxide, lithium carbonate, sodium carbonate, potassium carbonate, cesium carbonate, lithium hydride, sodium hydride, potassium hydride, butyllithium, methyl lithium, lithium bis (trimethylsilyl) amide, bis ( trimethylsilyl) sodium amide, potassium bis (trimethylsilyl) amide and triethylamine. In this case, it is preferable to use 1-10 equivalents of base. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия А10][Stage A10]
На этой стадии осуществляют взаимодействие соединения (10а) и соединения (13а) в присутствии металлического катализатора с получением соединения (12а). В данном случае предпочтительно использовать 1-50 эквивалентов соединения (13а).At this stage, the compound (10a) and the compound (13a) are reacted in the presence of a metal catalyst to produce the compound (12a). In this case, it is preferable to use 1-50 equivalents of compound (13a).
Используемые растворители включают ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол.Solvents used include acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran, dimethoxyethane, methanol and ethanol.
Металлические катализаторы включают катализаторы на основе палладия и меди. Палладиевые катализаторы включают тетракистрифенилфосфинпалладия, ацетат палладия и дибензилиденацетонат палладия. Медный катализатор может представлять собой йодид меди. Предпочтительно использовать 0,01-2 эквивалента металлического катализатора.Metal catalysts include palladium and copper catalysts. Palladium catalysts include tetrakistriphenylphosphine palladium, palladium acetate and palladium dibenzylideneacetonate. The copper catalyst may be copper iodide. It is preferable to use 0.01-2 equivalents of a metal catalyst.
Реакция может проводиться в присутствии фосфороорганического лиганда. Когда реакцию проводят в присутствии фосфороорганического лиганда, примеры лигандов включают о-толилфосфин и дифенилфосфинферроцен. В данном случае предпочтительно использовать 1-5 эквивалентов фосфороорганического лиганда относительно количества металлического катализатора.The reaction can be carried out in the presence of an organophosphorus ligand. When the reaction is carried out in the presence of an organophosphorus ligand, examples of ligands include o-tolylphosphine and diphenylphosphineferrocene. In this case, it is preferable to use 1-5 equivalents of an organophosphorus ligand relative to the amount of metal catalyst.
Реакцию можно проводить в присутствии или в отсутствие основания. Используемые в реакции основания включают гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, гидрид лития, гидрид натрия, гидрид калия, фосфат калия, бис(триметилсилил)амид лития, бис(триметилсилил)амид натрия, бис(триметилсилил)амид калия и триэтиламин. Реакцию можно проводить при температуре 0-150ºС.The reaction can be carried out in the presence or absence of a base. The bases used in the reaction include lithium hydroxide, sodium hydroxide, potassium hydroxide, lithium carbonate, sodium carbonate, potassium carbonate, cesium carbonate, lithium hydride, sodium hydride, potassium hydride, potassium phosphate, lithium bis (trimethylsilyl) amide, bis (trimethylsilyl) amide sodium, bis (trimethylsilyl) potassium amide and triethylamine. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия А11][Stage A11]
На этой стадии осуществляют взаимодействие соединения (10а) с цианидирующим реагентом с получением соединения (14а).At this stage, the compound (10a) is reacted with a cyanidating reagent to produce the compound (14a).
Конкретные цианидирующие реагенты включают, например, цианид натрия и цианид калия. Их предпочтительно использовать в количестве 1-20 эквивалентов.Specific cyanidation reagents include, for example, sodium cyanide and potassium cyanide. They are preferably used in an amount of 1-20 equivalents.
Реакционные растворители включают, например, ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол. Реакцию можно осуществлять при температуре 0-150ºС.Reaction solvents include, for example, acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran, dimethoxyethane, methanol and ethanol. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия А12][Stage A12]
На этой стадии цианогруппу соединения (14а) подвергают гидролизу с получением соединения (15а). Нет специальных ограничений, касающихся условий проведения реакции, и реакцию можно проводить в обычных условиях преобразования цианогруппы в карбамоильную группу путем гидролиза.At this stage, the cyano group of compound (14a) is hydrolyzed to give compound (15a). There are no special restrictions regarding the reaction conditions, and the reaction can be carried out under normal conditions of conversion of the cyano group to a carbamoyl group by hydrolysis.
Реакционные растворители включают ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол, этанол и смешанный растворитель из тетрагидрофурана и метанола.Reaction solvents include acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran, dimethoxyethane, methanol, ethanol and a mixed solvent of tetrahydrofuran and methanol.
Реакцию можно проводить в присутствии или в отсутствие основания. При использовании основания реакцию можно проводить в присутствии водного раствора основания, такого как гидроксид калия, гидроксид натрия, гидроксид лития или аммиак. Взаимодействие может быть достигнуто в результате добавки водного раствора пероксида водорода (предпочтительно в виде 30% водного раствора пероксида водорода).The reaction can be carried out in the presence or absence of a base. When using a base, the reaction can be carried out in the presence of an aqueous solution of a base such as potassium hydroxide, sodium hydroxide, lithium hydroxide or ammonia. The interaction can be achieved by adding an aqueous solution of hydrogen peroxide (preferably in the form of a 30% aqueous solution of hydrogen peroxide).
Реакцию можно проводить при температуре 0-150ºС.The reaction can be carried out at a temperature of 0-150ºС.
[Стадия А13][Stage A13]
На этой стадии осуществляют удаление группы Rp3 из соединения (16а) с получением соединения (17а). В качестве соединения (16а) могут использоваться соединения (11а), (12а), (14а), (15а) и другие соединения.At this stage, R p3 is removed from compound (16a) to give compound (17a). As the compound (16a), compounds (11a), (12a), (14a), (15a) and other compounds can be used.
Реакцию удаления защитной группы у Rp3 можно проводить в обычных условиях удаления -NH-защитных групп.The deprotection reaction at R p3 can be carried out under normal conditions for the removal of -NH-protecting groups.
Например, когда Rp3 представляет собой трет-бутоксикарбонильную группу, реакцию можно проводить в присутствии кислоты, такой как безводный метанольный раствор хлористого водорода, безводный этанольный раствор хлористого водорода, безводный диоксановый раствор хлористого водорода, трифторуксусная кислота или муравьиная кислота.For example, when R p3 is a tert-butoxycarbonyl group, the reaction can be carried out in the presence of an acid, such as anhydrous methanol solution of hydrogen chloride, anhydrous ethanol solution of hydrogen chloride, anhydrous dioxane solution of hydrogen chloride, trifluoroacetic acid or formic acid.
Альтернативный способ получения соединения (10а) описан далее.An alternative method for preparing compound (10a) is described below.
[Стадия А14][Stage A14]
На этой стадии соединение (18а) подвергают хлорированию с получением соединения (19а). Нет конкретных ограничений, касающихся условия проведения такой реакции, и ее можно проводить в обычных условиях хлорирования. Так, например, реакцию можно проводить в растворителе, таком как оксихлорид фосфора, при температуре 0-150ºС. Предпочтительно использовать 10-200-кратный массовый избыток хлорирующего агента.In this step, compound (18a) is chlorinated to give compound (19a). There are no specific restrictions on the conditions for carrying out such a reaction, and it can be carried out under ordinary chlorination conditions. So, for example, the reaction can be carried out in a solvent, such as phosphorus oxychloride, at a temperature of 0-150 ° C. It is preferable to use a 10-200-fold mass excess of the chlorinating agent.
В том случае, когда Rp3 представляет собой трет-бутоксикарбонильную группу, которая удаляется в указанных выше условиях, предусматривающих использование оксихлорида фосфора, требуется повторное введение защитной группы.In the case where R p3 is a tert-butoxycarbonyl group which is removed under the above conditions involving the use of phosphorus oxychloride, re-introduction of the protective group is required.
Нет конкретных ограничений относительно условий проведения реакции введения защитной группы, когда Rp3 представляет собой трет-бутоксикарбонильную группу, реакцию можно проводить с использованием такого -NH-защитного агента, как ди-трет-бутилдикарбонат, в среде такого растворителя, как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, в присутствии основания, такого как гидроксид лития, гидроксид натрия, гидроксид калия, карбонат лития, карбонат натрия, карбонат калия, карбонат цезия, бикарбонат калия, бикарбонат натрия или триэтиламин, при температуре 0-150ºС.There are no particular restrictions on the conditions for the introduction of the protective group, when R p3 is a tert-butoxycarbonyl group, the reaction can be carried out using an -NH-protective agent such as di-tert-butyl dicarbonate in a solvent such as acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran or dimethoxyethane, in the presence of a base such as lithium hydroxide, sodium hydroxide, potassium hydroxide, lithium carbonate, sodium carbonate, potassium carbonate, cesium carbonate, bicarb potassium onate, sodium bicarbonate or triethylamine, at a temperature of 0-150ºС.
[Стадия А15][Stage A15]
На этой стадии соединение (19а) подвергают частичному гидролизу с получением соединения (20а). Реакцию проводят в присутствии основания, такого как ацетат натрия, карбонат калия или гидроксид натрия. Предпочтительно использовать 1-10 эквивалентов основания. Растворители для такой реакции включают диметилсульфоксид, N-метилпирролидон, тетрагидрофуран, воду и их смеси. Реакция может проводиться при температуре 0-100ºС.In this step, compound (19a) is partially hydrolyzed to give compound (20a). The reaction is carried out in the presence of a base such as sodium acetate, potassium carbonate or sodium hydroxide. It is preferable to use 1-10 equivalents of base. Solvents for such a reaction include dimethyl sulfoxide, N-methylpyrrolidone, tetrahydrofuran, water, and mixtures thereof. The reaction can be carried out at a temperature of 0-100ºС.
[Стадия А16][Stage A16]
На этой стадии осуществляют взаимодействие соединения (20а) и соединения (21а) с получением соединения (22а). Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А2] способа получения А.At this stage, the compound (20a) and the compound (21a) are reacted to produce the compound (22a). The reaction can be carried out under the same conditions that were used for the [stage A2] production method A.
Альтернативный способ получения соединения (19а) описан далее.An alternative method for preparing compound (19a) is described below.
[Стадия А17][Stage A17]
На этой стадии осуществляют реакцию замещения с использованием соединения (23а) [CAS No. 1076-22-8] и соединения (4а-2) с получением соединения (24а).At this stage, a substitution reaction is carried out using compound (23a) [CAS No. 1076-22-8] and compound (4a-2) to give compound (24a).
Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А4] способа получения А.The reaction can be carried out under the same conditions that were used to carry out the [step A4] production method A.
[Стадия А18][Stage A18]
На этой стадии соединение (24а) подвергают взаимодействию с галогенирующим агентом с получением соединения (25а).In this step, compound (24a) is reacted with a halogenating agent to give compound (25a).
Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А5] способа получения А.The reaction can be carried out under the same conditions that were used to carry out [stage A5] of the production method A.
[Стадия А19][Stage A19]
На этой стадии соединение (25а) подвергают хлорированию с получением соединения (26а).In this step, compound (25a) is chlorinated to give compound (26a).
Нет конкретных ограничений, касающихся условий проведения такой реакции, и соединение (25а) может реагировать с оксихлоридом фосфора, пентахлоридом фосфора или их смесью в присутствии или в отсутствие растворителя при температуре 0-150ºС. В качестве растворителей могут использоваться толуол, ацетонитрил и дихлорэтан.There are no particular restrictions on the conditions for carrying out such a reaction, and compound (25a) can react with phosphorus oxychloride, phosphorus pentachloride or a mixture thereof in the presence or absence of a solvent at a temperature of 0-150 ° C. As solvents, toluene, acetonitrile and dichloroethane can be used.
[Стадия А20][Stage A20]
На этой стадии соединение (26а) подвергают взаимодействию с соединением (7а) с получением соединения (19а).In this step, compound (26a) is reacted with compound (7a) to give compound (19a).
Реакцию можно проводить при тех же условиях, что использовались для проведения [стадии А6] способа получения А.The reaction can be carried out under the same conditions that were used to carry out [stage A6] of the production method A.
Способ получения ВThe method of obtaining In
[Стадия В1][Stage B1]
На этой стадии соединение (1b) подвергают бензилированию и сахарную цепочку расщепляют с образованием соединения (2b).In this step, compound (1b) is benzylated and the sugar chain is cleaved to form compound (2b).
Нет конкретных ограничений, касающихся условий проведения реакции. Соединение (2b) может быть получено путем взаимодействия соединения (1b) с бензилбромидом в среде растворителя, такого как ацетонитрил, N,N-диметилформамид, N-метилпирролидон, диметилсульфоксид, 1,4-диоксан, тетрагидрофуран, диметоксиэтан, метанол и этанол при температуре 0-150ºС, в результате добавления 3-10 эквивалентов хлористоводородной кислоты и инкубации полученной смеси при температуре 0-150ºС с целью расщепления сахарного фрагмента. Предпочтительно использовать 1-3 эквивалента бензилбромида.There are no specific restrictions regarding the reaction conditions. Compound (2b) can be prepared by reacting compound (1b) with benzyl bromide in a solvent, such as acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, dimethyl sulfoxide, 1,4-dioxane, tetrahydrofuran, dimethoxyethane, methanol and ethanol at a temperature 0-150ºС, as a result of adding 3-10 equivalents of hydrochloric acid and incubating the resulting mixture at a temperature of 0-150ºС in order to break down the sugar fragment. It is preferable to use 1-3 equivalents of benzyl bromide.
[Стадия В2][Stage B2]
На этой стадии соединение (2b) подвергают взаимодействию с галогенирующим агентом с получением соединения (3b). Реакцию галогенирования можно проводить при тех же условиях, что использовались для проведения [стадии А5] в способе получения А.In this step, compound (2b) is reacted with a halogenating agent to give compound (3b). The halogenation reaction can be carried out under the same conditions that were used to carry out [stage A5] in the method of obtaining A.
[Стадия В3][Stage B3]
На этой стадии соединение (3b) подвергают взаимодействию с соединением (4b) с получением соединения (5b). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А6] в способе получения А.In this step, compound (3b) is reacted with compound (4b) to give compound (5b). The reaction can be carried out under the same conditions as were used for the implementation of [step A6] in the production method A.
[Стадия В4][Stage B4]
На этой стадии соединение (5b) подвергают взаимодействию с соединением (5b-2) с получением соединения (6b). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А2] в способе получения А.In this step, compound (5b) is reacted with compound (5b-2) to give compound (6b). The reaction can be carried out under the same conditions as were used for the implementation of [step A2] in the production method A.
[Стадия В5][Stage B5]
На этой стадии осуществляют удаление группы Rp3 соединения (6b) с получением соединения (7b). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А13] в способе получения А.At this stage, the R p3 group of compound (6b) is removed to give compound (7b). The reaction can be carried out under the same conditions as were used for the implementation of [step A13] in the production method A.
Способ получения В-2The method of obtaining b-2
Соединение (9b) общей формулыCompound (9b) of the general formula
может быть получено с использованием соединения, представленного формулой Н-Т1а, вместо соединения (7а) на [стадии А6] описанного выше способа получения А, при условиях, используемых для [стадии А6], затем реализуют указанную выше последовательность химических реакций [стадия А7] - [стадия А13].can be obtained using the compound represented by the formula H-T 1a , instead of the compound (7a) in [Step A6] of the production method A described above, under the conditions used for [Step A6], the above chemical reaction sequence is then carried out [Step A7 ] - [stage A13].
Соединение (10b) общей формулыCompound (10b) of the general formula
может быть получено с использованием соединения, представленного формулой Н-Т1а, вместо соединения (3b) на [стадии B3] описанного выше способа получения B, при условиях, используемых для [стадии B3], после чего реализуют указанную выше последовательность химических реакций [стадия B4] - [стадия B6]. Предпочтительным примером соединения (8b) может служить трет-бутиловый эфир пиперидин-3-илкарбаминовой кислоты.can be obtained using the compound represented by formula H-T 1a , instead of compound (3b) in [Step B3] of the above production method B, under the conditions used for [Step B3], after which the above chemical reaction sequence [step] B4] - [stage B6]. A preferred example of compound (8b) is piperidin-3-yl-carbamic acid tert-butyl ester.
Способ получения СThe method of obtaining C
[Стадия С1][Stage C1]
На этой стадии соединение (1с) подвергают взаимодействию с соединением (1с-2) с получением соединения (2с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А4] в способе получения А.In this step, compound (1c) is reacted with compound (1c-2) to give compound (2c). The reaction can be carried out under the same conditions as used for the implementation of [step A4] in the production method A.
[Стадия С2][Stage C2]
На этой стадии соединение (1с) подвергают взаимодействию с этанолом с получением соединения (3с).In this step, compound (1c) is reacted with ethanol to give compound (3c).
Соединение (3с) может быть получено нагреванием этанольного раствора соединения (2с) с обратным холодильником в присутствии такой кислоты, как серная. Однако реакционные условия не ограничены этим примером. В рассматриваемой реакции предпочтительно использовать 1-2 эквивалента кислоты.Compound (3c) can be obtained by heating an ethanol solution of compound (2c) under reflux in the presence of an acid such as sulfuric acid. However, reaction conditions are not limited to this example. In the reaction in question, it is preferable to use 1-2 equivalents of acid.
[Стадия С3][Stage C3]
На этой стадии соединение (2с) подвергают взаимодействию с этанолом с получением соединений (4с) и (5с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии С2] в способе получения С.In this step, compound (2c) is reacted with ethanol to give compounds (4c) and (5c). The reaction can be carried out under the same conditions as used for the implementation of [step C2] in the process for producing C.
[Стадия С4][Stage C4]
На этой стадии соединение (3с) подвергают взаимодействию с соединением (3с-2) с получением соединений (4с) и (5с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А4] в способе получения А.In this step, compound (3c) is reacted with compound (3c-2) to give compounds (4c) and (5c). The reaction can be carried out under the same conditions as used for the implementation of [step A4] in the production method A.
[Стадия С5][Stage C5]
На этой стадии осуществляют взаимодействие соединения (4с) с соединением (6с) с получением соединения (7с). Реакцию можно проводить при тех же условиях, что использовались для осуществления [стадии А6] в способе получения А.At this stage, the compound (4c) is reacted with the compound (6c) to give the compound (7c). The reaction can be carried out under the same conditions as were used for the implementation of [step A6] in the production method A.
[Стадия С6][Stage C6]
На этой стадии соединение (7с) подвергают тиоамидированию с получением соединения (8с). Используемые в реакции растворители могут представлять собой ацетонитрил, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Реагенты, используемые для проведения реакции тиоамидирования, включают сульфид аммония, сульфид натрия и сероводород. Предпочтительно использовать 2-10 эквивалентов тиоамидирующего реагента. При использовании сероводорода в качестве тиоамидирующего реагента, реакцию проводят в присутствии основания, такого как триэтиламин или N,N-диизопропилэтиламин. Реакцию можно проводить при температуре 0-150ºС.In this step, compound (7c) is thioamidated to give compound (8c). The solvents used in the reaction may be acetonitrile, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran and dimethoxyethane. Reagents used for carrying out the thioamidation reaction include ammonium sulfide, sodium sulfide and hydrogen sulfide. It is preferable to use 2-10 equivalents of a thioamidating reagent. When using hydrogen sulfide as a thioamidating reagent, the reaction is carried out in the presence of a base such as triethylamine or N, N-diisopropylethylamine. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия С7][Stage C7]
На этой стадии соединение (8с) подвергают взаимодействию с метилирующим реагентом с получением соединения (9с). В качестве метилирующих реагентов можно использовать тетрафторборат триметилоксония, метилсульфат, метилйодид, триметилфосфит. Предпочтительно использовать 1,0-1,5 эквивалента метилирующего реагента.In this step, compound (8c) is reacted with a methylating reagent to give compound (9c). As methylating reagents, trimethyloxonium tetrafluoroborate, methyl sulfate, methyl iodide, trimethyl phosphite can be used. It is preferable to use 1.0-1.5 equivalents of methylating reagent.
При использовании тетрафторбората триметилоксония в качестве метилирующего реагента соединение (9с) может быть получено в результате проведения рассматриваемой реакции в галоидированном растворителе, таком как дихлорметан, при температуре в интервале 0-50ºС.When using trimethyloxonium tetrafluoroborate as a methylating reagent, compound (9c) can be obtained by carrying out the reaction in a halogenated solvent such as dichloromethane at a temperature in the range of 0-50 ° C.
При использовании метилсульфата, метилйодида или триметилфосфита в качестве метилирующего реагента соединение (9с) может быть получено при проведении реакции в присутствии основания, такого как карбонат калия, триэтиламин или N,N-диизопропилэтиламин. В этом случае предпочтительно использовать 1,-1,5 эквивалента основания. В качестве растворителя в этой реакции можно использовать ацетон, N,N-диметилформамид, N-метилпирролидон, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Реакцию можно проводить при температуре 0-100ºС.By using methyl sulfate, methyl iodide or trimethyl phosphite as the methylating reagent, compound (9c) can be prepared by reacting in the presence of a base such as potassium carbonate, triethylamine or N, N-diisopropylethylamine. In this case, it is preferable to use 1, -1.5 equivalents of base. Acetone, N, N-dimethylformamide, N-methylpyrrolidone, 1,4-dioxane, tetrahydrofuran and dimethoxyethane can be used as a solvent in this reaction. The reaction can be carried out at a temperature of 0-100ºС.
[Стадия С8][Stage C8]
На этой стадии соединение (9с) гидролизуют с получением соединения (10с).In this step, compound (9c) is hydrolyzed to give compound (10c).
Условия проведения реакции гидролиза не регламентируются. Реакцию можно проводить в смешанном растворителе, состоящем из этанола и воды, в присутствии кислоты, такой как серная, хлористоводородная или п-толуолсульфокислота, при температуре 0-80ºС. В рассматриваемом случае предпочтительно использовать 5-50 эквивалентов кислоты.The conditions for the hydrolysis reaction are not regulated. The reaction can be carried out in a mixed solvent consisting of ethanol and water, in the presence of an acid, such as sulfuric, hydrochloric or p-toluenesulfonic acid, at a temperature of 0-80ºС. In the present case, it is preferable to use 5-50 equivalents of acid.
В том случае, когда группа Rp3 представляет собой трет-бутоксикарбонильную группу, которая удаляется в указанных выше условиях проведения реакции, следует снова вводить защитную группу. Условия проведения реакции введения защитной группы не регламентируются. В том случае, когда группа Rp3 представляет собой трет-бутоксикарбонильную группу, реакцию можно проводить с использованием такого реагента, как трет-бутилдикарбонат в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии основания, такого как пиридин, 4-аминопиридин, триэтиламин и N,N-диизопропилэтиламин, при температуре 0-80ºС. В рассматриваемом случае предпочтительно использовать 2-3 эквивалента основания.In the case when the group R p3 is a tert-butoxycarbonyl group which is removed under the above reaction conditions, the protective group should be introduced again. The conditions for the reaction of introducing a protective group are not regulated. In the case where the R p3 group is a tert-butoxycarbonyl group, the reaction can be carried out using a reagent such as tert-butyl dicarbonate in a solvent such as dichloromethane, chloroform, N, N-dimethylformamide or tetrahydrofuran, in the presence of a base such as pyridine, 4-aminopyridine, triethylamine and N, N-diisopropylethylamine, at a temperature of 0-80 ° C. In this case, it is preferable to use 2-3 equivalents of base.
[Стадия С9][Stage C9]
На этой стадии соединение (10с) подвергают взаимодействию с восстанавливающим агентом с получением соединение (11с).In this step, compound (10c) is reacted with a reducing agent to give compound (11c).
Условия проведения реакции восстановления не регламентируются. Рассматриваемая реакция может проводиться в результате взаимодействия соединения (10с) с водородом в присутствии никеля Ренея в растворителе, таком как бензол, этанол, 2-пропанол или ацетон, при температуре 0-50ºС, или взаимодействия соединения (10с) с восстанавливающим агентом, таким как борогидрид натрия, в растворителе, таком как метанол, этанол или 2-метил-2-пропанол, или в смешанном растворителе, состоящем из воды и тетрагидрофурана, при температуре 0-50ºС, или взаимодействия соединения (10с) с восстанавливающим агентом, таким как борогидрид натрия, в присутствии 1-5 эквивалентов соли ртути, например ацетата ртути, в растворителе, таком как метанол, этанол или 2-метил-2-пропанол, при температуре 0-50ºС. Предпочтительно использовать 2-3 эквивалента восстанавливающего агента.The conditions for the reaction of recovery are not regulated. The reaction in question can be carried out by reacting compound (10c) with hydrogen in the presence of Raney nickel in a solvent such as benzene, ethanol, 2-propanol or acetone, at a temperature of 0-50 ° C, or by reacting compound (10c) with a reducing agent, such as sodium borohydride, in a solvent such as methanol, ethanol or 2-methyl-2-propanol, or in a mixed solvent of water and tetrahydrofuran, at a temperature of 0-50 ° C, or the interaction of compound (10c) with a reducing agent, such as borohydride n Tria, in the presence of 1-5 equivalents of a mercuric salt, eg mercuric acetate in a solvent such as methanol, ethanol or 2-methyl-2-propanol, at a temperature 0-50ºS. It is preferable to use 2-3 equivalents of a reducing agent.
[Стадия С10][Stage C10]
На этой стадии соединение (11с) подвергают реакции окисления с получением соединения (12с).In this step, compound (11c) is subjected to an oxidation reaction to give compound (12c).
При использовании окислителей, таких как диоксид марганца, хлорохромат пиридиния или дихромат пиридиния, соединение (12с) может быть получено проведением реакции в растворителе, таком как дихлорметан или хлороформ, при температуре в интервале 20-80ºС. Соединение (12с) также может быть получено проведением реакции в обычных условиях окисления первичного спирта в альдегид, например окислением по Сверну (Swern). Предпочтительно использовать 5-20 эквивалентов окислителя.When using oxidizing agents such as manganese dioxide, pyridinium chlorochromate or pyridinium dichromate, compound (12c) can be obtained by carrying out the reaction in a solvent, such as dichloromethane or chloroform, at a temperature in the range of 20-80 ° C. Compound (12c) can also be obtained by carrying out the reaction under ordinary conditions of oxidation of a primary alcohol to an aldehyde, for example, Swern oxidation. It is preferable to use 5-20 equivalents of an oxidizing agent.
[Стадия С11][Stage C11]
На этой стадии соединение (12с) подвергают взаимодействию с соединением (13с) с получением соединения (17с). Для проведения такой реакции предпочтительно использовать 2-10 эквивалентов соединения (13с).In this step, compound (12c) is reacted with compound (13c) to give compound (17c). For carrying out such a reaction, it is preferable to use 2-10 equivalents of compound (13c).
Соединение (17с) может быть получено смешиванием соединений (12с) и (13с) в растворителе, таком как метанол, этанол, 1-метил-2-пирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, или в в отсутствие растворителя, и последующей реакцией полученной смеси при температуре 20-150ºС. Однако реакционные условия не ограничены этим примером.Compound (17c) can be prepared by mixing compounds (12c) and (13c) in a solvent such as methanol, ethanol, 1-methyl-2-pyrrolidone, 1,4-dioxane, tetrahydrofuran or dimethoxyethane, or in the absence of a solvent, and the subsequent reaction of the mixture at a temperature of 20-150ºC. However, reaction conditions are not limited to this example.
[Стадия С12][Stage C12]
На этой стадии соединение (12с) подвергают взаимодействию с гидразином с получением соединения (15с). Рассматриваемую реакцию можно проводить в тех же условиях, что использовались для [стадии С11] способа получения C. Предпочтительно использовать 2-10 эквивалентов гидразина.In this step, compound (12c) is reacted with hydrazine to give compound (15c). The reaction in question can be carried out under the same conditions as used for [Step C11] of the preparation method C. It is preferable to use 2-10 equivalents of hydrazine.
[Стадия С13][Stage C13]
На этой стадии проводят реакцию замещения с использованием соединений (15с) и (16с) и получают соединение (17с). Рассматриваемую реакцию можно проводить в тех же условиях, что использовались для [стадии А2] способа получения А. Предпочтительно использовать 1-3 эквивалента соединения (16с).At this stage, a substitution reaction is carried out using compounds (15c) and (16c) to give compound (17c). The reaction in question can be carried out under the same conditions as those used for [Step A2] of the production method A. It is preferable to use 1-3 equivalents of compound (16c).
[Стадия С14][Stage C14]
На этой стадии осуществляют удаление группы Rp3 соединения (17с) и получают соединение (14с). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.At this stage, the R p3 group of compound (17c) is removed and compound (14c) is obtained. The reaction can be carried out under the same conditions as used for [Step A13] of the preparation of A.
[Стадия С15][Stage C15]
На этой стадии соединение (5с) подвергают взаимодействию с соединением (6с) с получением соединения (18с). Реакцию можно проводить в тех же условиях, что использовались для [стадии А6] способа получения А.In this step, compound (5c) is reacted with compound (6c) to give compound (18c). The reaction can be carried out under the same conditions as used for [Step A6] of the preparation of A.
[Стадия С16][Stage C16]
На этой стадии соединение (18с) подвергают гидролизу с получением соединения (19с).In this step, compound (18c) is hydrolyzed to give compound (19c).
Условия проведения реакции гидролиза не регламентируются. Так, например, соединение (19с) может быть получено выдерживанием соединения (18с) в присутствии основания при температуре 0-100ºС.The conditions for the hydrolysis reaction are not regulated. So, for example, compound (19c) can be obtained by keeping compound (18c) in the presence of a base at a temperature of 0-100ºС.
В качестве растворителей для проведения рассматриваемой реакции могут использоваться метанол, этанол, тетрагидрофуран, вода или их смеси. Используемые основания включают гидроксид лития, гидроксид натрия и гидроксид калия. Предпочтительно использовать 1-2 эквивалента основания.As solvents for the reaction in question, methanol, ethanol, tetrahydrofuran, water or mixtures thereof can be used. Used bases include lithium hydroxide, sodium hydroxide and potassium hydroxide. Preferably, 1-2 equivalents of base are used.
[Стадия С17][Stage C17]
На этой стадии соединение (19с) подвергают взаимодействию с восстанавливающим агентом с получением соединения (20с). Реакцию можно проводить в обычных условиях восстановления карбоновой кислоты в метиловый спирт.In this step, compound (19c) is reacted with a reducing agent to give compound (20c). The reaction can be carried out under ordinary conditions of reduction of a carboxylic acid to methyl alcohol.
В качестве восстанавливающих агентов могут использоваться такие производные борана, как борантетрагидрофурановый комплекс и боранметилсульфидный комплекс, а также борогидрид натрия. Предпочтительно использовать 5-30 эквивалентов восстанавливающего реагента.As reducing agents, borane derivatives such as borane tetrahydrofuran complex and borane methyl sulfide complex, as well as sodium borohydride can be used. It is preferable to use 5-30 equivalents of a reducing reagent.
При использовании боранового производного в качестве восстанавливающего агента соединение (20с) может быть получено проведением рассматриваемой реакции в растворителе, таком как 1,4-диоксан, тетрагидрофуран или диметоксиэтан, при температуре от -78 до +35ºС.When using a borane derivative as a reducing agent, compound (20c) can be obtained by carrying out the reaction in a solvent, such as 1,4-dioxane, tetrahydrofuran or dimethoxyethane, at a temperature of from -78 to + 35ºС.
При использовании борогидрида натрия в качестве восстанавливающего агента вначале осуществляют взаимодействие соединения (19с) с активатором, таким как изобутилхлорформиат при температуре -78 - +20ºС, после чего осуществляют взаимодействие с таким восстанавливающим агентом, как борогидрид натрия, при температуре -78 - +35ºС, в результате чего получают соединение (20с). В качестве растворителя можно использовать 1,4-диоксан, тетрагидрофуран и диметоксиэтан.When using sodium borohydride as a reducing agent, the compound (19c) is first reacted with an activator, such as isobutyl chloroformate at a temperature of -78 - + 20ºС, after which it is reacted with a reducing agent, such as sodium borohydride, at a temperature of -78 - + 35ºС, resulting in a compound (20c). As the solvent, 1,4-dioxane, tetrahydrofuran and dimethoxyethane can be used.
[Стадия С18][Stage C18]
На этой стадии соединение (20с) подвергают тиоамидированию с получением соединения (21с). Реакцию можно проводить в тех же условиях, что использовались для [стадии С6] способа получения С.In this step, compound (20c) is thioamidated to give compound (21c). The reaction can be carried out under the same conditions as used for [Step C6] of the preparation of C.
[Стадия С19][Stage C19]
На этой стадии соединение (21с) подвергают взаимодействию с силилирующим агентом в присутствии основания с образованием соединения (22с).In this step, compound (21c) is reacted with a silylating agent in the presence of a base to form compound (22c).
Используемые для такой реакции растворители включают дихлорметан, N,N-диметилформамид, 1,4-диоксан, тетрагидрофуран и диметоксиэтан. Основания включают имидазол, пиридин, 4-диметиламинопиридин, триэтиламин и N,N-диизопропилэтиламин. Силилирующие агенты включают трет-бутилдиметилхлорсилан и трет-бутилхлордифенилсилан. Предпочтительно использовать 1,0-1,5 эквивалента основания и 1,0-1,5 эквивалента силилирующего агента. Реакцию можно проводить при температуре 0-80ºС.Solvents used for such a reaction include dichloromethane, N, N-dimethylformamide, 1,4-dioxane, tetrahydrofuran and dimethoxyethane. Bases include imidazole, pyridine, 4-dimethylaminopyridine, triethylamine and N, N-diisopropylethylamine. Silylating agents include tert-butyldimethylchlorosilane and tert-butylchlorodiphenylsilane. Preferably 1.0-1.5 equivalents of base and 1.0-1.5 equivalents of silylating agent are used. The reaction can be carried out at a temperature of 0-80ºС.
[Стадия С20][Stage C20]
На этой стадии соединение (22с) подвергают метилированию с получением соединения (23с). Реакцию можно проводить в тех же условиях, что использовались для [стадии С7] способа получения С.In this step, compound (22c) is methylated to give compound (23c). The reaction can be carried out under the same conditions as used for [step C7] of the preparation of C.
[Стадия С21][Stage C21]
На этой стадии соединение (23с) гидролизуют с получением соединение (24с).In this step, compound (23c) is hydrolyzed to give compound (24c).
Условия проведения реакции гидролиза не регламентируются. Соединение (24с) может быть получено проведением реакции в смешанном растворителе, состоящем из этанола и воды в присутствии такой кислоты, как серная, хлористоводородная или п-толуолсульфокислота, при температуре 50-100ºС.The conditions for the hydrolysis reaction are not regulated. Compound (24c) can be obtained by carrying out the reaction in a mixed solvent consisting of ethanol and water in the presence of an acid such as sulfuric, hydrochloric or p-toluenesulfonic acid, at a temperature of 50-100ºС.
В том случае, когда в результате реакции удаляется группа -Rp3, группу -NH- следует защищать повторно. Так, например, если -Rp3 представляет собой трет-бутоксикарбонильную группу, то реакцию можно проводить с использованием трет-бутилдикарбоната в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии такого основания, как пиридин, аминопиридин, триэтиламин или N,N-диизопропилэтиламин, при температуре 0-80ºС. Однако условия реакции не регламентируются.In the event that the group —R p3 is removed as a result of the reaction, the group —NH— should be re-protected. So, for example, if -R p3 represents a tert-butoxycarbonyl group, then the reaction can be carried out using tert-butyl dicarbonate in a solvent such as dichloromethane, chloroform, N, N-dimethylformamide or tetrahydrofuran, in the presence of a base such as pyridine, aminopyridine , triethylamine or N, N-diisopropylethylamine, at a temperature of 0-80ºC. However, the reaction conditions are not regulated.
Способ получения DThe method of obtaining D
[Стадия D1][Stage D1]
На этой стадии соединение (1d) подвергают взаимодействию с соединением (1d-2) с получением соединения (2d).In this step, compound (1d) is reacted with compound (1d-2) to give compound (2d).
Конкретными примерами соединения (1d-2) могут служить алкилгалогениды, такие как йодметан, йодэтан, йодпропан, бензилбромид, 2-бромацетофенон, хлорметилбензиловый эфир и бромацетонитрил; алкенилгалогениды, такие как аллилбромид и 1-бром-3-метил-2-бутен, а также алкинилгалогениды, такие как пропаргилбромид и 1-бром-2-бутин. Предпочтительно использовать 1-1,5 эквивалента соединения (1d-2).Specific examples of compound (1d-2) include alkyl halides such as iodomethane, iodoethane, iodopropane, benzyl bromide, 2-bromoacetophenone, chloromethylbenzyl ether and bromoacetonitrile; alkenyl halides such as allyl bromide and 1-bromo-3-methyl-2-butene; and alkynyl halides such as propargyl bromide and 1-bromo-2-butine. It is preferable to use 1-1.5 equivalents of compound (1d-2).
Используемые в реакции растворители включают N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан и дихлорметан. Реакцию можно проводить в присутствии или в отсутствие основания. Используемее основания включают 1,8-диазабицикло[5,4,0] ундецен, триэтиламин, N,N-диизопропилэтиламин и гидрид натрия. В рассматриваемом случае предпочтительно использовать 1-1,5 эквивалента основания. Реакцию можно проводить при температуре 0-150ºС.The solvents used in the reaction include N, N-dimethylformamide, N-methylpyrrolidone, tetrahydrofuran, 1,2-dimethoxyethane, 1,4-dioxane and dichloromethane. The reaction can be carried out in the presence or absence of a base. Useful bases include 1,8-diazabicyclo [5.4.0] undecene, triethylamine, N, N-diisopropylethylamine and sodium hydride. In this case, it is preferable to use 1-1.5 equivalents of base. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия D2][Stage D2]
На этой стадии соединение (2d) подвергают взаимодействию с нитритной солью с получением соединения (3d).In this step, compound (2d) is reacted with a nitrite salt to give compound (3d).
Растворители для такой реакции могут представлять собой смешанный растворитель из воды и таких веществ, как N,N-диметилформамид, N-метилпирролидон, тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан. Нитриты включают нитрит натрия и нитрит калия. Предпочтительно использовать 3-5 эквивалентов нитрита. Реакцию можно проводить при температуре 20-120ºС.The solvents for such a reaction may be a mixed solvent of water and substances such as N, N-dimethylformamide, N-methylpyrrolidone, tetrahydrofuran, 1,2-dimethoxyethane and 1,4-dioxane. Nitrites include sodium nitrite and potassium nitrite. It is preferable to use 3-5 equivalents of nitrite. The reaction can be carried out at a temperature of 20-120ºС.
[Стадия D3][Stage D3]
На этой стадии соединение (3d) подвергают взаимодействию с аммиаком с получением соединения (4d). Предпочтительно использовать 10-20 эквивалентов аммиака.In this step, compound (3d) is reacted with ammonia to give compound (4d). It is preferable to use 10-20 equivalents of ammonia.
Реакцию можно проводить в растворителе, таком как метанол, этанол или 1,4-диоксан, при температуре в интервале 20-200ºС.The reaction can be carried out in a solvent, such as methanol, ethanol or 1,4-dioxane, at a temperature in the range of 20-200 ° C.
[Стадия D4][Stage D4]
На этой стадии соединение (4d) подвергают каталитическому восстановлению в атмосфере водорода или в присутствии 2-3 эквивалентов гидразина с использованием металлического катализатора и в результате получают соединение (5d).At this stage, compound (4d) is subjected to catalytic reduction in a hydrogen atmosphere or in the presence of 2-3 equivalents of hydrazine using a metal catalyst and the result is compound (5d).
Растворители, используемые в этой реакции, включают метанол, этанол, N,N-диметилформамид, тетрагидрофуран, 1,2-диметоксиэтан, 1,4-диоксан, воду или их смеси. Металлические катализаторы включают палладий на угле, оксид платины и никель Ренея. Предпочтительное количество катализатора составляет 0,5-10 мас.%. Реакцию можно проводить при температуре 0-150ºС.Solvents used in this reaction include methanol, ethanol, N, N-dimethylformamide, tetrahydrofuran, 1,2-dimethoxyethane, 1,4-dioxane, water, or mixtures thereof. Metal catalysts include palladium on carbon, platinum oxide and Raney nickel. The preferred amount of catalyst is 0.5-10 wt.%. The reaction can be carried out at a temperature of 0-150ºС.
[Стадия D5][Stage D5]
На этой стадии соединение (5d) подвергают взаимодействию с ортоформиатом с получением соединения (6d).In this step, compound (5d) is reacted with orthoformate to give compound (6d).
Реакцию проводят в присутствии ангидрида карбоновой кислоты, например уксусного ангидрида. Эфиры ортомуравьиной кислоты включают метилортоформиат и этилортоформиат. Предпочтительно использовать 1-20-кратный избыток ортоформиата и 3-10 эквивалентов ангидрида карбоновой кислоты. Реакцию можно проводить при температуре 20-200ºС.The reaction is carried out in the presence of a carboxylic acid anhydride, for example acetic anhydride. Esters of orthoformic acid include methyl orthoformate and ethyl orthoformate. It is preferable to use a 1-20-fold excess of orthoformate and 3-10 equivalents of carboxylic anhydride. The reaction can be carried out at a temperature of 20-200ºС.
[Стадия D6][Stage D6]
На этой стадии NH-группу в положении 1 соединения (6d) защищают с получением соединения (7d).In this step, the NH group at position 1 of compound (6d) is protected to give compound (7d).
Защищающими реагентами служат N,N-диметилсульфамоилхлорид, тритилхлорид, ди-трет-бутилдикарбонат и бензилбромид. Предпочтительное количество защитного агента составляет 1-1,5 эквивалента. Растворители в этой реакции включают дихлорметан, хлороформ, четыреххлористый углерод, толуол, N,N-диметилформамид и тетрагидрофуран. Используемые основания включают 4-диметиламинопиридин, 1,8-диазабицикло[5,4,0]ундецен, триэтиламин и N,N-диизопропилэтиламин. В обычных случаях предпочтительно использовать 1,2 эквивалента основания. Однако в том случае, когда защитный агент представляет собой ди-трет-бутилдикарбонат, предпочтительно использовать 0,005-0,1 эквивалента 4-диметиламинопиридина. Реакцию проводят при температуре 20-200ºС.Protective reagents are N, N-dimethyl sulfamoyl chloride, trityl chloride, di-tert-butyl dicarbonate and benzyl bromide. A preferred amount of protective agent is 1-1.5 equivalents. Solvents in this reaction include dichloromethane, chloroform, carbon tetrachloride, toluene, N, N-dimethylformamide and tetrahydrofuran. Bases used include 4-dimethylaminopyridine, 1,8-diazabicyclo [5.4.0] undecene, triethylamine and N, N-diisopropylethylamine. In normal cases, 1.2 equivalents of base are preferred. However, when the protective agent is di-tert-butyl dicarbonate, it is preferred to use 0.005-0.1 equivalents of 4-dimethylaminopyridine. The reaction is carried out at a temperature of 20-200 ° C.
[Стадия D7][Stage D7]
На этой стадии соединение (7d) подвергают хлорированию с получением соединения (8d).In this step, compound (7d) is chlorinated to give compound (8d).
Условия такой реакции не регламентируются. Так, например, рассматриваемую реакцию можно проводить следующим образом. При температуре в интервале -100 - +20ºС осуществляют взаимодействие соединения (7d) с основанием, после чего осуществляют взаимодействие с хлорирующим агентом. В результате получают соединение (8d). Соединение (8d) также может быть получено путем взаимодействия соединения (7d) с основанием в присутствии хлорирующего агента. Растворители для такой реакции включают диэтиловый эфир, тетрагидрофуран, 1,2-диметоксиэтан и 1,4-диоксан. Используемые основания включают н-бутиллитий, трет-бутилитий, диизопропиламид лития, бис(триметилсилил)амид лития и диизопропиламид магния. Предпочтительно использовать 1-1,5 эквивалента основания. Хлорирующие реагенты включают гексахлорэтан и N-хлорсукцинимид. Предпочтительное количество хлорирующего агента составляет 1-3 эквивалента.The conditions of this reaction are not regulated. So, for example, the reaction in question can be carried out as follows. At a temperature in the range of -100 - + 20ºС, the compound (7d) is reacted with a base, after which they are reacted with a chlorinating agent. The result is a compound (8d). Compound (8d) can also be obtained by reacting compound (7d) with a base in the presence of a chlorinating agent. Solvents for such a reaction include diethyl ether, tetrahydrofuran, 1,2-dimethoxyethane and 1,4-dioxane. Bases used include n-butyllithium, tert-butyl lithium, lithium diisopropylamide, lithium bis (trimethylsilyl) amide and magnesium diisopropylamide. It is preferable to use 1-1.5 equivalents of base. Chlorinating agents include hexachloroethane and N-chlorosuccinimide. A preferred amount of a chlorinating agent is 1-3 equivalents.
[Стадия D8][Stage D8]
На этой стадии соединение (8d) подвергают взаимодействию c соединением (9d) c получением соединения (10d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А6] способа получения А.In this step, compound (8d) is reacted with compound (9d) to give compound (10d). The reaction can be carried out under the same conditions as used for [Step A6] of the preparation of A.
[Стадия D9][Stage D9]
На этой стадии проводили реакцию замещения с использованием соединений (10d) и (10d-2) с получением соединения (11d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А4] способа получения А.At this stage, a substitution reaction was carried out using compounds (10d) and (10d-2) to give compound (11d). The reaction can be carried out under the same conditions as used for [Step A4] of the preparation of A.
[Стадия D10][Stage D10]
На этой стадии осуществляют удаление Rp3 из соединения (11d) с получением соединения (12d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.At this stage, R p3 is removed from compound (11d) to give compound (12d). The reaction can be carried out under the same conditions as used for [Step A13] of the preparation of A.
[Стадия D11][Stage D11]
На этой стадии группу, находящуюся в положении 5 соединения (11d), подвергают деалкилированию с получением соединения (13d). Условия реакции деалкилирования специально не регламентируются. Так, например, реакцию можно проводить следующим образом.At this stage, the group at position 5 of compound (11d) is dealkylated to give compound (13d). The conditions of the dealkylation reaction are not specifically regulated. So, for example, the reaction can be carried out as follows.
В том случае, когда R1 представляет собой бензилоксиметильную группу, соединение (11d) подвергают взаимодействию с 3-10 эквивалентами трибромида бора, трихлорида бора и т.п. в растворителе, таком как дихлорметан, при температуре в интервале -100 - +20ºС. В результате получают соединение (13d).In the case where R 1 represents a benzyloxymethyl group, the compound (11d) is reacted with 3-10 equivalents of boron tribromide, boron trichloride, and the like. in a solvent such as dichloromethane, at a temperature in the range of -100 - + 20 ° C. The result is a compound (13d).
Если при проведении подобной реакции происходит удаление группы Rp3, то следует повторно защищать группу -NH-. Так, например, если Rp3 представляет собой трет-бутоксикарбонильную группу, то рассматриваемую реакцию можно проводить с использованием реагента, такого как ди-трет-бутилдикарбонат, в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии такого основания, как пиридин, 4-аминопиридин, триэтиламин или N,N-диизопропилэтиламин, при температуре 0-80ºС. Однако рассматриваемую реакцию можно проводить и в других условиях.If, when carrying out such a reaction, the group R p3 is removed, then the group -NH- should be re-protected. So, for example, if R p3 represents a tert-butoxycarbonyl group, then the reaction in question can be carried out using a reagent such as di-tert-butyl dicarbonate in a solvent such as dichloromethane, chloroform, N, N-dimethylformamide or tetrahydrofuran, in the presence of a base such as pyridine, 4-aminopyridine, triethylamine or N, N-diisopropylethylamine, at a temperature of 0-80 ° C. However, the reaction in question can be carried out under other conditions.
[Стадия D12][Stage D12]
На этой стадии соединение (13d) подвергают взаимодействию с соединением (13d-2) с получением соединения (14d). Реакцию можно проводить в тех же условиях, что использовались для [стадии D1] способа получения D.In this step, compound (13d) is reacted with compound (13d-2) to give compound (14d). The reaction can be carried out under the same conditions as used for [Step D1] of the preparation of D.
[Стадия D13][Stage D13]
На этой стадии осуществляют удаление Rp3 из соединения (14d) с получением соединения (12d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.At this stage, R p3 is removed from compound (14d) to give compound (12d). The reaction can be carried out under the same conditions as used for [Step A13] of the preparation of A.
Альтернативный способ получения соединения (11d) описан далее.An alternative method for preparing compound (11d) is described below.
[Стадия D14][Stage D14]
На этой стадии осуществляют удаление защитной группы из соединения (8d) с получением соединения (15d).At this stage, a protecting group is removed from compound (8d) to give compound (15d).
Реакцию снятия защитной группы можно проводить в обычных условиях в зависимости от природы защитной группы. Так, например, в случае трет-бутоксикарбонильной группы, снятие защитной группы может осуществляться с использованием основания, такого как гидроксид натрия, карбонат калия и аммиак, в среде тетрагидрофурана, N,N-диметилформамида, метанола, этанола, воды или в их смесях при температуре 0-100ºС. В том случае, когда растворитель и основание добавляют после хлорирования на предыдущей стадии, снятие защитной группы может проводиться без выделения соединения (8d).The deprotection reaction can be carried out under normal conditions, depending on the nature of the protecting group. So, for example, in the case of a tert-butoxycarbonyl group, the deprotection can be carried out using a base such as sodium hydroxide, potassium carbonate and ammonia in tetrahydrofuran, N, N-dimethylformamide, methanol, ethanol, water or mixtures thereof at temperature 0-100ºС. In the case where the solvent and base are added after chlorination in the previous step, deprotection can be carried out without isolating compound (8d).
[Стадия D15][Stage D15]
На этой стадии Х вводят в соединение (15d) с получением соединения (16d). Реакцию можно проводить с использованием X-U2 при тех же условиях, что использовали на [стадии A4] способа получения А.In this step, X is introduced into compound (15d) to give compound (16d). The reaction can be carried out using XU 2 under the same conditions as used in [Step A4] of the preparation of A.
Спирт (Х-ОН) может вводиться с использованием реакции Mitsunobu. Соединение (16d) может быть получено путем взаимодействия спирта (Х-ОН) с диалкиловым эфиром азодикарбоновой кислоты и трифенилфосфином в растворителе, таком как тетрагидрофуран, при температуре -70 - 50ºС.Alcohol (X-OH) may be administered using the Mitsunobu reaction. Compound (16d) can be prepared by reacting an alcohol (X-OH) with dialkyl ether of azodicarboxylic acid and triphenylphosphine in a solvent such as tetrahydrofuran at a temperature of -70 - 50 ° C.
[Стадия D16][Stage D16]
На этой стадии соединение (16d) подвергают взаимодействию c соединением (9d) c получением соединения (11d). Реакцию можно проводить в тех же условиях, что использовались для [стадии А6] способа получения А.In this step, compound (16d) is reacted with compound (9d) to give compound (11d). The reaction can be carried out under the same conditions as used for [Step A6] of the preparation of A.
Способ получения ЕThe method of obtaining E
Соединение (1е), представленное формулойCompound (1e) represented by the formula
может быть получено с использованием соединения (8b) формулы Н-Т1а вместо соединения (6с) на [стадии С5] или [стадии С15] описанного выше способа получения С при тех же условиях, что использовались на [стадии С5], с последующим проведением реакций в описанной выше последовательности [стадия С6] - [стадия С21].can be obtained using compound (8b) of the formula H-T 1a instead of compound (6c) in [step C5] or [step C15] of the above production method C under the same conditions as those used in [step C5], followed by reactions in the above sequence [stage C6] - [stage C21].
Соединение (1е), представленное формулойCompound (1e) represented by the formula
может быть получено с использованием соединения (8b) формулы Н-Т1а вместо соединения (9d) на [стадии D8] описанного выше способа получения D при тех же условиях, что использовались на [стадии D8], с последующим проведением реакций в описанной выше последовательности [стадия С9] - [стадия С13].can be obtained using compound (8b) of the formula H-T 1a instead of compound (9d) in [step D8] of the above production method D under the same conditions as used in [step D8], followed by the reactions in the above sequence [stage C9] - [stage C13].
Способ получения FThe method of obtaining F
[Стадия F1][Stage F1]
На этой стадии эфирную группу соединения [1f] подвергают гидролизу с получением соединения (2f). Такую реакцию можно проводить при тех же условиях, что использовались при проведении [стадии С16] способа получения С.At this stage, the ester group of compound [1f] is hydrolyzed to give compound (2f). Such a reaction can be carried out under the same conditions that were used during the [stage C16] method for producing C.
[Стадия F2][Stage F2]
На этой стадии осуществляют удаление группы Rp3 из соединения (2f) с образованием соединения (3f). Рассматриваемую реакцию можно проводить при тех же условиях, что использовали для осуществления [стадии A13] способа получения А.At this stage, R p3 is removed from compound (2f) to form compound (3f). The reaction in question can be carried out under the same conditions as used for the implementation of [step A13] of the production method A.
Способ получения GThe method of obtaining G
[Стадия G1][Stage G1]
На этой стадии проводят восстановление нитрогруппы в молекуле соединения (1g) с получением соединения (2g).At this stage, nitro groups are reduced in the molecule of compound (1g) to give compound (2g).
В этой реакции в качестве растворителей можно использовать метанол, этанол, тетрагидрофуран, воду или их смеси. В качестве восстанавливающих агентов могут использоваться железо, олово и цинк. Катализаторами могут служить хлористоводородная кислота и такие соли аммония, как хлорид аммония. Реакцию можно проводить при температуре 20-120ºС.In this reaction, methanol, ethanol, tetrahydrofuran, water or mixtures thereof can be used as solvents. As reducing agents, iron, tin and zinc can be used. Hydrochloric acid and ammonium salts such as ammonium chloride can serve as catalysts. The reaction can be carried out at a temperature of 20-120ºС.
[Стадия G2][Stage G2]
На этой стадии осуществляют удаление Rp3 из соединения (2g) с получением соединения (3g). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.At this stage, R p3 is removed from compound (2g) to give compound (3g). The reaction can be carried out under the same conditions as used for [Step A13] of the preparation of A.
Способ получения НThe method of obtaining N
[Стадия Н1][Stage H1]
На этой стадии нитрильную группу соединения (1h) подвергают гидролизу с получением соединения (2h).At this stage, the nitrile group of compound (1h) is hydrolyzed to give compound (2h).
Условия проведения такой реакции специально не регламентируются. Так, например, реакцию можно проводить следующим образом. Соединение (2h) может быть получено путем взаимодействия соединения (1h) с пероксидом водорода в присутствии основания при температуре -20 - +50ºС. В качестве растворителей может использоваться метанол, этанол, тетрагидрофуран, вода или их смеси. Основания включают аммиак и такой алкиламин, как триэтиламин.The conditions for such a reaction are not specifically regulated. So, for example, the reaction can be carried out as follows. Compound (2h) can be obtained by reacting compound (1h) with hydrogen peroxide in the presence of a base at a temperature of -20 - + 50ºС. As solvents, methanol, ethanol, tetrahydrofuran, water or mixtures thereof can be used. Bases include ammonia and an alkylamine such as triethylamine.
[Стадия Н2][Stage H2]
На этой стадии осуществляют удаление Rp3 из соединения (2h) с получением соединения (3h). Реакцию можно проводить в тех же условиях, что использовались для [стадии А13] способа получения А.At this stage, R p3 is removed from compound (2h) to give compound (3h). The reaction can be carried out under the same conditions as used for [Step A13] of the preparation of A.
Способ получения IThe method of obtaining I
[Стадия I1][Stage I1]
На этой стадии соединение (1i) подвергают взаимодействию с реагентом на основе алкилметалла или арилметалла с получением соединения (2i).In this step, compound (1i) is reacted with an alkyl metal or aryl metal reagent to give compound (2i).
Условия проведения такой реакции специально не регламентируются. Так, например, реакцию можно проводить следующим образом. Соединение (1i) может вступать в реакцию с реагентом, таким как алкиллитий, ариллитий, алкильный Гриньяровский реагент, или арильный Гриньяровский реагент в растворителе, таком как диэтиловый эфир или тетрагидрофуран, при температуре в интервале от -100 до +100ºС. Согласно другому способу указанное соединение может вступать в реакцию с алкилцинком или арилцинком в растворителе, таком как N,N-диметилформамид или 1-метил-2-пирролидон, при температуре 0-50ºС.The conditions for such a reaction are not specifically regulated. So, for example, the reaction can be carried out as follows. Compound (1i) can be reacted with a reagent, such as alkyl lithium, aryllithium, an alkyl Grinyarovsky reagent, or an aryl Grinyarovsky reagent in a solvent, such as diethyl ether or tetrahydrofuran, at a temperature in the range from -100 to + 100ºС. According to another method, said compound can be reacted with alkylzinc or arylzinc in a solvent such as N, N-dimethylformamide or 1-methyl-2-pyrrolidone at a temperature of 0-50 ° C.
[Стадия I2][Stage I2]
На этой стадии соединение (2i) подвергают окислению с получением соединения (3i). В качестве окислителя можно использовать типичный реагент, который применяют для окисления спиртов. Так, например, в качестве окислителя можно использовать диоксид марганца в растворителе, таком как дихлорметан или хлороформ, при температуре 20-100ºС. Согласно другому способу в качестве окислителя может быть использован пиридинсульфотриоксид в растворителе, таком как диметилсульфоксид, при температуре в интервале 20-100ºС. Также может использоваться периодинан Десса-Мартина (Dess-Martin) в растворителе, таком как хлороформ, при температуре -50 - +50ºС.In this step, compound (2i) is oxidized to give compound (3i). As an oxidizing agent, a typical reagent can be used, which is used for the oxidation of alcohols. So, for example, manganese dioxide in a solvent, such as dichloromethane or chloroform, at a temperature of 20-100ºС can be used as an oxidizing agent. According to another method, pyridine sulfotrioxide in a solvent such as dimethyl sulfoxide can be used as an oxidizing agent at a temperature in the range of 20-100 ° C. A Dess-Martin periodinan may also be used in a solvent such as chloroform at a temperature of -50 to + 50 ° C.
[Стадия I3][Stage I3]
На этой стадии соединение (3i) подвергают взаимодействию с гидразином с получением соединения (4i). Реакцию можно проводить при тех же условиях, что используют для проведения [стадии С12] способа получения С.In this step, compound (3i) is reacted with hydrazine to give compound (4i). The reaction can be carried out under the same conditions that are used to carry out [step C12] of the method for producing C.
[Стадия I4][Stage I4]
На этой стадии осуществляют замещение с использованием соединений (4i) и (5i) с получением соединения (6i). Реакцию можно проводить при тех же условиях, что используют для [стадии А2] способа получения А.At this stage, substitution is carried out using compounds (4i) and (5i) to give compound (6i). The reaction can be carried out under the same conditions as that used for [Step A2] of the preparation of A.
[Стадия I5][Stage I5]
На этой стадии осуществляют удаление группы Rp3 из молекулы соединения (6i) с получением соединения (7i). Реакцию можно проводить при тех же условиях, что используют для [стадии А13] способа получения А.At this stage, the R p3 group is removed from the molecule of compound (6i) to give compound (7i). The reaction can be carried out under the same conditions as used for [Step A13] of the preparation of A.
[Стадия I6][Stage I6]
На этой стадии осуществляют удаление группы Rp3 из молекулы соединения (4i) с получением соединения (7i), в том случае, когда R1 в соединении (7i) представляет собой Н. Рассматриваемую реакцию можно проводить при тех же условиях, что используют для [стадии А13] способа получения А.At this stage, the group R p3 is removed from the molecule of compound (4i) to obtain compound (7i), in the case when R 1 in compound (7i) is H. The reaction in question can be carried out under the same conditions as used for [ stage A13] method of obtaining A.
Способ получения JThe method of obtaining J
[Стадия J1][Stage J1]
На этой стадии соединение (1j) подвергают взаимодействию с цианидирующим реагентом в присутствии катализатора с получением соединения (2j).In this step, compound (1j) is reacted with a cyanidating reagent in the presence of a catalyst to give compound (2j).
В качестве цианидирующих агентов используют цианид натрия и цианид калия. Катализатором служит уксусная кислота. Примером растворителя может служить ацетонитрил. Реакцию можно проводить при температуре 0-100ºС.Sodium cyanide and potassium cyanide are used as cyanidizing agents. The catalyst is acetic acid. An example of a solvent is acetonitrile. The reaction can be carried out at a temperature of 0-100ºС.
[Стадия J2][Stage J2]
На этой стадии нитрильную группу соединения (2j) подвергают гидролизу с получением соединения (3j). Рассматриваемую реакцию можно проводить при тех же условиях, что используют для [стадии Н1] способа получения Н.At this stage, the nitrile group of compound (2j) is hydrolyzed to give compound (3j). The reaction in question can be carried out under the same conditions as used for the [Step H1] process for producing N.
[Стадия J3][Stage J3]
На этой стадии гидроксильную группу соединения (3j) подвергают окислению с получением соединения (4j). Рассматриваемую реакцию можно проводить при тех же условиях, что используют для [стадии I2] способа получения I.In this step, the hydroxyl group of compound (3j) is oxidized to give compound (4j). The reaction in question can be carried out under the same conditions as used for [stage I2] of the production method I.
[Стадия J4][Stage J4]
На этой стадии соединение (4j) подвергают взаимодействию с соединением (5j) с получением соединения (6j). Рассматриваемую реакцию можно проводить при тех же условиях, что и [стадию С11] способа получения С.In this step, compound (4j) is reacted with compound (5j) to give compound (6j). The reaction in question can be carried out under the same conditions as [step C11] of the process for producing C.
[Стадия J5][Stage J5]
На этой стадии осуществляют удаление группы Rp3 из соединения (6j) с получением соединения (7j). Рассматриваемую реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group is removed from compound (6j) to give compound (7j). The reaction in question can be carried out under the same conditions as [stage A13] of the preparation of A.
[Стадия J6][Stage J6]
На этой стадии карбамоильную группу соединения (6j) подвергают дегидратации в присутствии основания с получением соединения (8j).At this stage, the carbamoyl group of compound (6j) is dehydrated in the presence of a base to give compound (8j).
Дегидратирующие агенты включают, например, оксихлорид фосфора. Основания могут включать алкиламины, такие как триэтиламин. В качестве растворителей могут использоваться дихлорметан и хлороформ. Реакцию также можно осуществлять в отсутствие растворителя. Реакцию проводят при температуре 0-100ºС.Dehydrating agents include, for example, phosphorus oxychloride. Bases may include alkylamines such as triethylamine. Dichloromethane and chloroform may be used as solvents. The reaction can also be carried out in the absence of a solvent. The reaction is carried out at a temperature of 0-100ºС.
[Стадия J7][Stage J7]
На этой стадии осуществляют удаление группы Rp3 из соединения (8j) с получением соединения (9j). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group is removed from compound (8j) to give compound (9j). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
Способ получения КThe method of obtaining K
[Стадия К1][Stage K1]
На этой стадии осуществляют замещение с участием соединений (1k) и (2k) с образованием соединения (3k). Реакцию можно проводить при тех же условиях, что и [стадию А2] способа получения А.At this stage, substitution is carried out with the participation of compounds (1k) and (2k) to form compound (3k). The reaction can be carried out under the same conditions as [stage A2] of the production method A.
[Стадия К2][Stage K2]
На этой стадии осуществляют замещение с участием соединений (3k) и (4k) с образованием соединения (5k).At this stage, substitution is carried out with the participation of compounds (3k) and (4k) to form compound (5k).
Соединение (5k) может быть получено, например, путем взаимодействия смеси соединений (3k) и (4k) в растворителе, таком как метанол, этанол, 1-метил-2-пирролидон, 1,4-диоксан, тетрагидрофуран или диметоксиэтан, или в отсутствие растворителя при температуре 20-200ºС. Однако реакционные условия не ограничены этим примером.Compound (5k) can be obtained, for example, by reacting a mixture of compounds (3k) and (4k) in a solvent such as methanol, ethanol, 1-methyl-2-pyrrolidone, 1,4-dioxane, tetrahydrofuran or dimethoxyethane, or lack of solvent at a temperature of 20-200ºС. However, reaction conditions are not limited to this example.
[Стадия К3][Stage K3]
На этой стадии соединение (5k) подвергают хлорированию с получением соединения (6k). Реакцию можно проводить при тех же условиях, что и [стадию D7] способа получения D.In this step, compound (5k) is chlorinated to give compound (6k). The reaction can be carried out under the same conditions as [step D7] of the preparation of D.
[Стадия К4][Stage K4]
На этой стадии соединение (6k) подвергают взаимодействию с соединением (7k) с получением соединения (8k). Реакцию можно проводить при тех же условиях, что и [стадию А6] способа получения А.In this step, compound (6k) is reacted with compound (7k) to give compound (8k). The reaction can be carried out under the same conditions as [stage A6] of the production method A.
[Стадия К5][Stage K5]
На этой стадии осуществляют удаление группы Rp5 соединения (8k) с получением соединения (9k).At this stage, the R p5 group of compound (8k) is removed to give compound (9k).
Реакцию удаления защитной группы Rp3 можно проводить в обычных условиях удаления -NH-защищающей группы.The deprotection reaction of R p3 can be carried out under normal conditions of removal of the -NH-protecting group.
В том случае, когда Rp5 представляет собой бензильную группу, реакция может проводиться в присутствии такого металла, как литий или натрий, в среде жидкого аммиака при температуре от -78 до -30ºС.In the case when R p5 represents a benzyl group, the reaction can be carried out in the presence of a metal such as lithium or sodium in liquid ammonia at temperatures from -78 to -30 ° C.
[Стадия К6][Stage K6]
На этой стадии осуществляют замещение с участием соединений (9k) и (10k) с образованием соединения (11k). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.At this stage, substitution is carried out with the participation of compounds (9k) and (10k) to form compound (11k). The reaction can be carried out under the same conditions as [stage A4] of the production method A.
[Стадия К7][Stage K7]
На этой стадии осуществляют удаление группы Rp3 соединения (11k) с получением соединения (12k). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group of compound (11k) is removed to obtain compound (12k). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
Способ получения LThe method of obtaining L
[Стадия L1][Stage L1]
На этой стадии соединение (1l) подвергают взаимодействию с соединением (2l) в присутствии окислителя с получением соединение (3l).In this step, compound (1l) is reacted with compound (2l) in the presence of an oxidizing agent to give compound (3l).
Окислители включают соли, такие как хлористое железо (III). Растворители включают метанол, этанол и воду. Реакцию можно проводить при температуре 20-100ºС.Oxidizing agents include salts such as ferric chloride (III). Solvents include methanol, ethanol and water. The reaction can be carried out at a temperature of 20-100ºС.
Если в результате реакции происходит удаление группы -Rp3, то следует проводить повторную защиту группы -NH-. Так, например, если Rp3 представляет собой трет-бутоксикарбонильную группу, то реакцию проводят в присутствии реагента, такого как ди-трет-бутилдикарбонат в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид или тетрагидрофуран, в присутствии основания, такого как пиридин, 4-аминопиридин, триэтиламин или N,N-диизопропилэтиламин, при температуре 0-80ºС. Однако реакция не ограничивается приведенным примером.If, as a result of the reaction, the -R p3 group is removed, then the -NH- group must be re-protected. So, for example, if R p3 is a tert-butoxycarbonyl group, then the reaction is carried out in the presence of a reagent such as di-tert-butyl dicarbonate in a solvent such as dichloromethane, chloroform, N, N-dimethylformamide or tetrahydrofuran, in the presence of a base such as pyridine, 4-aminopyridine, triethylamine or N, N-diisopropylethylamine, at a temperature of 0-80 ° C. However, the reaction is not limited to the above example.
[Стадия L2][Stage L2]
На этой стадии соединение (3l) подвергают взаимодействию с соединением (4l) с получением соединения (5l). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.In this step, compound (3l) is reacted with compound (4l) to give compound (5l). The reaction can be carried out under the same conditions as [stage A4] of the production method A.
[Стадия L3][Stage L3]
На этой стадии осуществляют удаление группы Rp3 соединения (5l) с получением соединения (6l). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group of compound (5l) is removed to give compound (6l). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
Способ получения МThe method of obtaining M
[Стадия М1][Stage M1]
На этой стадии соединение (1m) подвергают взаимодействию с соединением (2m) с получением соединения (3m). Реакцию можно проводить при тех же условиях, что и [стадию А6] способа получения А.In this step, compound (1m) is reacted with compound (2m) to give compound (3m). The reaction can be carried out under the same conditions as [stage A6] of the production method A.
[Стадия М2][Stage M2]
На этой стадии соединение (3m) подвергают взаимодействию с соединением (4m) с получением соединения (5m). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.In this step, compound (3m) is reacted with compound (4m) to give compound (5m). The reaction can be carried out under the same conditions as [stage A4] of the production method A.
[Стадия М3][Stage M3]
На этой стадии осуществляют удаление группы Rp3 соединения (5m) с получением соединения (6m). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group of compound (5m) is removed to obtain compound (6m). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
Способ получения NThe method of obtaining N
[Стадия N1][Stage N1]
На этой стадии соединение (1n) подвергают взаимодействию с аллиламином с получением соединения (2n).In this step, compound (1n) is reacted with allylamine to give compound (2n).
Реакцию можно проводить при температуре 20-150ºС. Растворители для рассматриваемой реакции включают метанол, этанол, воду и их смеси.The reaction can be carried out at a temperature of 20-150ºС. Solvents for the reaction in question include methanol, ethanol, water, and mixtures thereof.
[Стадия N2][Stage N2]
На этой стадии проводят восстановление хлорированного соединения (2n) с образованием соединения (3n).At this stage, the chlorinated compound (2n) is reduced to form compound (3n).
В качестве восстановителя можно использовать такие соли, как хлорид олова. Растворители включают концентрированную соляную кислоту. Реакцию можно проводить при температуре 20-150ºС.Salts such as tin chloride can be used as a reducing agent. Solvents include concentrated hydrochloric acid. The reaction can be carried out at a temperature of 20-150ºС.
[Стадия N3][Stage N3]
На этой стадии соединения (3n) подвергают взаимодействию с N,N'-дисукцинимидилкарбонатом с получением соединения (4n).In this step, compounds (3n) are reacted with N, N'-disuccinimidyl carbonate to give compound (4n).
Эту реакцию можно проводить в растворителе, таком как ацетонитрил или тетрагидрофуран. Реакцию можно проводить при температуре 20-100ºС.This reaction can be carried out in a solvent such as acetonitrile or tetrahydrofuran. The reaction can be carried out at a temperature of 20-100ºС.
[Стадия N4][Stage N4]
На этой стадии осуществляют взаимодействие соединения (4n) и соединения (5n) с получением соединения (6n). Реакцию можно проводить при тех же условиях, что и [стадию А4] способа получения А.In this step, the compound (4n) and the compound (5n) are reacted to produce the compound (6n). The reaction can be carried out under the same conditions as [stage A4] of the production method A.
[Стадия N5][Stage N5]
На этой стадии осуществляют удаление аллильной группы из соединения (6n) с получением соединения (7n).At this stage, the allyl group is removed from compound (6n) to give compound (7n).
Соединение (7n) может быть получено, например, путем взаимодействия соединения (6n) с осмиевой кислотой и периодатом натрия в растворителе, таком как тетрагидрофуран, 1,4-диоксан, 1,2-диметоксиэтан или вода, при температуре 20-100ºС. Однако реакционные условия не ограничены этим примером.Compound (7n) can be obtained, for example, by reacting compound (6n) with osmic acid and sodium periodate in a solvent such as tetrahydrofuran, 1,4-dioxane, 1,2-dimethoxyethane or water, at a temperature of 20-100 ° C. However, reaction conditions are not limited to this example.
[Стадия N6][Stage N6]
На этой стадии соединение (7n) подвергают хлорированию с получением соединения (8n).In this step, compound (7n) is chlorinated to give compound (8n).
Условия проведения такой реакции специально не регламентируются. Реакцию можно проводить в обычных условиях хлорирования. Так, например, соединение (8n) может быть получено с использованием реагента, такого как пентахлорид фосфора, в растворителе, таком как оксихлорид фосфора, при температуре 0-150ºС.The conditions for such a reaction are not specifically regulated. The reaction can be carried out under ordinary chlorination conditions. For example, compound (8n) can be prepared using a reagent such as phosphorus pentachloride in a solvent such as phosphorus oxychloride at a temperature of 0-150 ° C.
[Стадия N7][Stage N7]
На этой стадии соединение (8n) подвергают взаимодействию с соединением (9n) с получением соединения (10n). Реакцию можно проводить при тех же условиях, что и [стадию А6] способа получения А.In this step, compound (8n) is reacted with compound (9n) to give compound (10n). The reaction can be carried out under the same conditions as [stage A6] of the production method A.
[Стадия N8][Stage N8]
На этой стадии осуществляют удаление группы Rp3 соединения (10n) с получением соединения (11n). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group of compound (10n) is removed to give compound (11n). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
Способ получения ОThe method of obtaining About
[Стадия О1][Stage O1]
На этой стадии гидроксильную группу соединения (1о) подвергают окислению с получением соединения (2о). Реакцию можно проводить при тех же условиях, что и [стадию I2] способа получения I.At this stage, the hydroxyl group of compound (1o) is oxidized to give compound (2o). The reaction can be carried out under the same conditions as [stage I2] of the production method I.
[Стадия О2][Stage O2]
На этой стадии соединение (2о) подвергают взаимодействию с этилдиэтилфосфоноацетатом в присутствии основания, с получением соединение (3о).In this step, compound (2o) is reacted with ethyl diethylphosphonoacetate in the presence of a base to give compound (3o).
Основания включают гидрид натрия и диизопропиламид лития. Растворители включают, например, тетрагидрофуран и N,N-диметилформамид. Реакцию можно проводить при температуре 0-100ºС.Bases include sodium hydride and lithium diisopropylamide. Solvents include, for example, tetrahydrofuran and N, N-dimethylformamide. The reaction can be carried out at a temperature of 0-100ºС.
[Стадия О3][Stage O3]
На этой стадии эфирное производное соединения (3о) подвергают гидролизу с получением соединения (4о). Реакцию можно проводить при тех же условиях, что и [стадию С16] способа получения С.In this step, the ester derivative of compound (3 °) is hydrolyzed to give compound (4 °). The reaction can be carried out under the same conditions as [stage C16] of the process for producing C.
[Стадия О4][Stage O4]
На этой стадии соединение (4о) подвергают взаимодействию с дифенилфосфорилазидом в присутствии основания с получением соединения (5о).In this step, compound (4 °) is reacted with diphenylphosphoryl azide in the presence of a base to give compound (5 °).
Растворители для рассматриваемой реакции включают толуол, трет-бутанол, тетрагидрофуран и дихлорметан. Основания включают третичные амины, такие как триэтиламин и диизопропилэтиламин. Реакцию можно проводить при температуре -50 - +50ºС.Solvents for the reaction in question include toluene, tert-butanol, tetrahydrofuran and dichloromethane. Bases include tertiary amines such as triethylamine and diisopropylethylamine. The reaction can be carried out at a temperature of -50 - + 50ºС.
[Стадия О5][Stage O5]
На этой стадии соединение (5о) подвергают перегруппировке с получением соединения (6о).In this step, compound (5 °) is rearranged to give compound (6 °).
Такую реакцию можно проводить в трет-бутаноле при температуре 50-100ºС.Such a reaction can be carried out in tert-butanol at a temperature of 50-100ºС.
[Стадия О6][Stage O6]
На этой стадии нитрильную группу соединения (6о) подвергают гидролизу с получением соединения (7о). Реакцию можно проводить при тех же условиях, что и [стадию Н1] способа получения Н.At this stage, the nitrile group of compound (6 °) is hydrolyzed to give compound (7 °). The reaction can be carried out under the same conditions as [stage H1] of the process for producing N.
[Стадия О7][Stage O7]
На этой стадии соединение (7о) подвергают взаимодействию с кислотой с получением соединения (8о).In this step, compound (7 °) is reacted with an acid to give compound (8 °).
Кислоты включают серную кислоту, серную кислоту и трифторуксусную кислоту. Растворители включают в себя метанол, этанол, 1,4-диоксан, воду и их смеси. Температура, при которой осуществляют взаимодействие, находится в интервале 0-50ºС.Acids include sulfuric acid, sulfuric acid and trifluoroacetic acid. Solvents include methanol, ethanol, 1,4-dioxane, water, and mixtures thereof. The temperature at which the interaction is carried out is in the range of 0-50 ° C.
Способ получения РThe method of obtaining P
[Стадия Р1][Stage P1]
На этой стадии соединения (1р) проводят защиту с образованием соединения (2р).At this stage, compounds (1p) are protected to form compound (2p).
В качестве реагента для защиты -NH-группы может использоваться обычный реагент, используемый для защиты NH-групп. Так, например, в том случае, когда Rp3 представляет собой трет-бутоксикарбонильную группу, реакция может осуществляться при температуре 0-80ºС с использованием реагента, такого как трет-бутилдикарбонат, в растворителе, таком как дихлорметан, хлороформ, N,N-диметилформамид и тетрагидрофуран, в присутствии основания, такого как пиридин, 4-аминопиридин, триэтиламин и N,N-диизопропилэтиламин.As a reagent for protecting the —NH group, a conventional reagent used to protect the NH groups can be used. So, for example, when R p3 is a tert-butoxycarbonyl group, the reaction can be carried out at a temperature of 0-80 ° C using a reagent such as tert-butyl dicarbonate in a solvent such as dichloromethane, chloroform, N, N-dimethylformamide and tetrahydrofuran, in the presence of a base such as pyridine, 4-aminopyridine, triethylamine and N, N-diisopropylethylamine.
[Стадия Р2][Stage P2]
На этой стадии соединение (2р) подвергают взаимодействию с соединением (3р) с получением соединения (4р). Реакцию можно проводить при тех же условиях, что и [стадию А2] способа получения А.In this step, compound (2p) is reacted with compound (3p) to give compound (4p). The reaction can be carried out under the same conditions as [stage A2] of the production method A.
[Стадия Р3][Stage P3]
На этой стадии осуществляют удаление группы Rp3 соединения (4р) с получением соединения (5р). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group of the compound (4p) is removed to obtain the compound (5p). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
Способ получения QThe method of obtaining Q
[Стадия Q1][Stage Q1]
На этой стадии соединение (1q) подвергают гидролизу с получением соединения (2q).In this step, compound (1q) is hydrolyzed to give compound (2q).
Растворители для этой реакции включают тетрагидрофуран, метанол и этанол. Кислоты включают неорганические кислоты, такие как соляная и серная кислота. Реакцию можно проводить при температуре 0-100ºС.Solvents for this reaction include tetrahydrofuran, methanol and ethanol. Acids include inorganic acids such as hydrochloric and sulfuric acid. The reaction can be carried out at a temperature of 0-100ºС.
[Стадия Q2][Stage Q2]
На этой стадии гидроксильную группу соединения (2q) подвергают реакции окисления с образованием соединения (3q). Реакцию можно проводить при тех же условиях, что использовались для [стадии I2] способа получения I.At this stage, the hydroxyl group of compound (2q) is subjected to an oxidation reaction to form compound (3q). The reaction can be carried out under the same conditions as those used for [Step I2] of the production method I.
[Стадия Q3][Stage Q3]
На этой стадии соединения (3q) подвергают взаимодействию с метилбензилоксикарбониламино(диметоксифосфорил)ацетатом в присутствии основания с получением соединения (4q).In this step, compounds (3q) are reacted with methylbenzyloxycarbonylamino (dimethoxyphosphoryl) acetate in the presence of a base to give compound (4q).
Основания включают гидрид натрия, трет-бутилат калия и 8-диазабицикло[5.4.0]-7-ундецен. Растворители включают дихлорметан, тетрагидрофуран и N,N-диметилформамид. Реакция может проводиться при температуре 0-100ºС.Bases include sodium hydride, potassium tert-butylate and 8-diazabicyclo [5.4.0] -7-undecene. Solvents include dichloromethane, tetrahydrofuran and N, N-dimethylformamide. The reaction can be carried out at a temperature of 0-100ºС.
[Стадия Q4][Stage Q4]
На этой стадии соединения (4q) подвергают взаимодействию с метилатом натрия с получением соединения (5q).In this step, compounds (4q) are reacted with sodium methylate to give compound (5q).
В качестве растворителя можно использовать метанол. Реакцию можно проводить при температуре 0-80ºС.As a solvent, methanol can be used. The reaction can be carried out at a temperature of 0-80ºС.
[Стадия Q5][Stage Q5]
На этой стадии соединение (5q) подвергают взаимодействию с соединением (6q) с получением соединения (7q). Реакцию можно проводить при тех же условиях, что использовались для [стадии А2] способа получения А.In this step, compound (5q) is reacted with compound (6q) to give compound (7q). The reaction can be carried out under the same conditions as those used for [Step A2] of the preparation of A.
[Стадия Q6][Stage Q6]
На этой стадии соединение (7q) подвергают взаимодействию с кислотой с получением соединения (8q). Реакцию можно проводить при тех же условиях, что использовались для [стадии О7] способа получения О.In this step, compound (7q) is reacted with an acid to give compound (8q). The reaction can be carried out under the same conditions as those used for [Step O7] of the preparation of O.
[Стадия Q7][Stage Q7]
На этой стадии осуществляют удаление группы Rp3 соединения (8q) с получением соединения (9q). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group of compound (8q) is removed to give compound (9q). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
[Стадия Q8][Stage Q8]
На этой стадии соединение (7q) подвергают взаимодействию с аммиаком с получением соединения (10q).In this step, compound (7q) is reacted with ammonia to give compound (10q).
Растворители для реакции включают метанол, этанол и воду. Реакцию можно проводить при температуре 20-150ºС.Solvents for the reaction include methanol, ethanol and water. The reaction can be carried out at a temperature of 20-150ºС.
[Стадия Q9][Stage Q9]
На этой стадии осуществляют удаление группы Rp3 соединения (10q) с получением соединения (11q). Реакцию можно проводить при тех же условиях, что и [стадию А13] способа получения А.At this stage, the R p3 group of compound (10q) is removed to obtain compound (11q). The reaction can be carried out under the same conditions as [stage A13] of the preparation of A.
Перечисленные далее соединения, их соли или гидраты чрезвычайно полезны в качестве промежуточных соединений в синтезе соединения (I) по настоящему изобретению.The following compounds, their salts or hydrates thereof, are extremely useful as intermediates in the synthesis of compound (I) of the present invention.
Соединения, или их соли, или гидраты, представленные общей формулойCompounds or their salts or hydrates represented by the general formula
[где R1 имеет значения, указанные выше в пункте [1];[where R 1 has the meanings indicated in paragraph [1] above;
Rp5 представляет собой трет-бутоксикарбонилоксигруппу, тритильную группу или группу, представленную формулой -SO2NH2;R p5 represents a tert-butoxycarbonyloxy group, a trityl group or a group represented by the formula —SO 2 NH 2 ;
Т10 представляет собой атом галогена];T 10 represents a halogen atom];
Соединения, их соли или гидраты, отвечающие общей формулеCompounds, their salts or hydrates of the general formula
[где R1 имеет значения, указанные выше в пункте [1];[where R 1 has the meanings indicated in paragraph [1] above;
Т11 представляет собой атом галогена или группу общей формулыT 11 represents a halogen atom or a group of the general formula
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу];T 13 represents a tert-butoxycarbonyl group, a benzyloxycarbonyl group or a formyl group];
Соединения, их соли или гидраты, отвечающие общей формулеCompounds, their salts or hydrates of the general formula
[где R1 имеет значения, указанные выше в пункте [1];[where R 1 has the meanings indicated in paragraph [1] above;
Т12 представляет собой атом галогена];T 12 represents a halogen atom];
Соединения, их соли или гидраты, отвечающие общей формулеCompounds, their salts or hydrates of the general formula
[где Х имеет значения, указанные в пункте [1], исключая случай, когда Х представляет собой бензильную группу;[where X has the meanings specified in paragraph [1], except when X is a benzyl group;
Т21 и Т22, каждый независимо, представляют собой атом галогена;T 21 and T 22 each independently represent a halogen atom;
Т11 представляет собой атом галогена или группу, представленную общей формулойT 11 represents a halogen atom or a group represented by the general formula
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу];T 13 represents a tert-butoxycarbonyl group, a benzyloxycarbonyl group or a formyl group];
Соединения, их соли или гидраты, представленные общей формулойCompounds, their salts or hydrates represented by the general formula
[где Х и R1 имеют значения, указанные выше в пункте [1];[where X and R 1 have the meanings indicated in paragraph [1] above;
Т22 представляет собой атом галогена;T 22 represents a halogen atom;
Т13 представляет собой трет-бутоксикарбонильную группу, бензилоксикарбонильную группу или формильную группу].T 13 represents a tert-butoxycarbonyl group, a benzyloxycarbonyl group or a formyl group].
Указанные выше способы являются репрезентативными способами получения соединения (I) по настоящему изобретению. Исходные соединения и различные реагенты, используемые в способах получения соединений по настоящему изобретению, могут представлять собой соли, гидраты или сольваты в зависимости от природы исходных соединений, типа растворителей и т.п., и нет специальных ограничений, касающихся этих веществ, если они не ингибируют описанные реакции. Тип используемых растворителей зависит от природы исходных соединений, используемых реагентов и т.д. и конкретно не регламентируется, если такие вещества не ингибируют реакцию и в достаточной степени растворяют исходные материалы. В том случае, когда соединение (I) по настоящему изобретению получают в свободном виде, это соединение может быть обычным способом превращено в его соль или гидрат, являющиеся возможной формой указанного выше соединения (I).The above methods are representative methods for the preparation of compound (I) of the present invention. The starting compounds and various reagents used in the methods for preparing the compounds of the present invention can be salts, hydrates or solvates depending on the nature of the starting compounds, such as solvents and the like, and there are no special restrictions on these substances if they are not inhibit the described reactions. The type of solvent used depends on the nature of the starting compounds, the reagents used, etc. and it is not specifically regulated if such substances do not inhibit the reaction and sufficiently dissolve the starting materials. In the case when the compound (I) of the present invention is obtained in free form, this compound can be converted in the usual way into its salt or hydrate, which is a possible form of the above compound (I).
В том случае, когда соединение (I) по настоящему изобретению получают в виде соли или гидрата, такой продукт может быть обычным способом переведен в свободную форму указанного выше соединения (I).In the case where the compound (I) of the present invention is obtained in the form of a salt or hydrate, such a product can be converted into the free form of the above compound (I) in the usual way.
Кроме этого, различные изомеры соединения (I) по настоящему изобретению (например, геометрические изомеры, энантиомеры, образование которых связано с наличием асимметричного атома углерода, ротамеры (вращательные изомеры), стереоизомеры и таутомеры) могут быть выделены и очищены обычными способами, такими как перекристаллизация, образование диастереомерных солей, ферментативное разделение и различные хроматографические методы (например, тонкослойная хроматография, колонная хроматография и газовая хроматография).In addition, various isomers of compound (I) of the present invention (for example, geometric isomers, enantiomers whose formation is due to the presence of an asymmetric carbon atom, rotamers (rotational isomers), stereoisomers and tautomers) can be isolated and purified by conventional methods, such as recrystallization , the formation of diastereomeric salts, enzymatic separation and various chromatographic methods (for example, thin layer chromatography, column chromatography and gas chromatography).
Соединения по настоящему изобретению, их соли или гидраты могут быть обычными способами включены в состав таблеток, порошков, частиц, гранул, таблеток с покрытием, капсул, сиропов, пилюль, ингаляторов, свечей, препаратов для инъекций, мазей, глазных притирок, глазных капель, капель для носа, ушных капель, припарок, лосьонов и т.п. Такие рецептуры могут составляться с использованием обычных разбавителей, связующих веществ, смазывающих веществ, красителей, вкусовых веществ и, если это желательно, стабилизаторов, эмульгаторов, усилителей абсорбции, поверхностно-активных агентов, модуляторов рН, консервантов, антиоксидантов и т.п., а также материалов, которые обычно используются в качестве ингредиентов фармацевтических рецептур. Так, например, препарат для перорального применения может быть получен смешиванием соединения по настоящему изобретению или его фармацевтически применимой соли с разбавителем и, если нужно, со связующим, разрыхлителем, смазывающим агентом, красителем, вкусовым веществом и т.п. и общепринятым формированием полученной смеси в виде порошков, частиц, гранул, таблеток, таблеток с покрытием, капсул и т.п. Примерами таких материалов могут служить животные и растительные жиры, например соевое масло, говяжий жир и синтетический глицерид; углеводороды, такие как жидкий парафин, сквалан и твердый парафин; эфирные масла, например октилдодецилмиристат и изопропилмиристат; высшие спирты, например цетостеариловый спирт и бегениловый спирт; силиконовые смолы; силиконовые масла; поверхностно-активные вещества, такие как полиоксиэтиленовый эфир жирной кислоты, эфир сорбита и жирной кислоты, эфир глицерина и жирной кислоты, эфир полиоксиэтиленсорбита и жирной кислоты, полиоксиэтиленовое гидрированное касторовое масло и полиоксиэтилен полиоксипропиленовый блок-сополимер; водно-растворимые полимеры, такие как гидроксиэтилцеллюлоза, полиакриловая кислота, карбоксивиниловый полимер, полиэтиленгликоль, поливинилпирролидон и метилцеллюлоза; низшие спирты, такие как этанол и изопропанол; многоатомные спирты, такие как глицерин, пропиленгликоль, дипропиленгликоль и сорбит; сахара, такие как глюкоза и сахароза; неорганический порошок, такой как безводная кремниевая кислота, магнийалюмосиликат и силикат алюминия, а также очищенная вода. Примерами разбавителей могут служить лактоза, пшеничный крахмал, сахар, глюкоза, маннит, сорбит, кристаллическая целлюлоза и диоксид кремния. В качестве связывающих веществ могут использоваться, например, поливиниловый спирт, поливиниловый эфир, метилцеллюлоза, этилцеллюлоза, аравийская камедь, трагакант, желатин, шеллак, гидроксипропилметилцеллюлоза, гидроксипропилцеллюлоза, поливинилпирролидон, полипропиленгликоль-полиоксиэтиленовый блок-сополимер и меглюмин. Примерами разрыхлителей могут служить крахмал, агар, порошок желатина, кристаллическая целлюлоза, карбонат кальция, бикарбонат натрия, цитрат кальция, декстрин, пектин и кальцийкарбоксиметилцеллюлоза. Примерами смазывающих веществ могут служить стеарат магния, тальк, полиэтиленгликоль, оксид кремния и гидрированное растительное масло. В качестве красителей могут использоваться фармацевтически применимые вещества. Примерами придающих вкус веществ могут служить порошок какао, мятная камфара, ароматизированный порошок из масла перечной мяты, камфара Borneo и порошок корицы. Таблетки и гранулы могут быть покрыты сахаром или, если необходимо, может быть нанесено другое подходящее покрытие. Растворы, например сиропы или препараты для инъекций, могут быть изготовлены смешиванием соединений по настоящему изобретению или их фармацевтически применимых солей с модулятором рН, солюбилизирующим агентом, изотоническим агентом и т.п. и, если необходимо, со вспомогательным растворяющим агентом, стабилизатором и т.п. Нет конкретных ограничений, касающихся способов получения препаратов для наружного применения, и такие препараты могут быть приготовлены обычными способами. В качестве основы препаратов для наружного применения могут использоваться разнообразные материалы, обычно применяемые для производства фармацевтических препаратов, квазилекарств, косметических препаратов и т.п. Примерами таких основных материалов могут служить животные и растительные масла, минеральные масла, эфирные масла, воск, высшие спирты, жирные кислоты, силиконовое масло, поверхностно-активные вещества, фосфолипиды, спирты, многоатомные спирты, водно-растворимые полимеры, глины и очищенная вода. Кроме этого, препараты по настоящему изобретению для наружного применения, если необходимо, могут содержать модуляторы рН, антиоксиданты, хелатирующие агенты, антибактериальные/противогрибковые агенты, красители, дезодоранты и т.п. Однако препараты для наружного применения по настоящему изобретению не ограничиваются основными материалами указанных типов. При необходимости такие препараты могут содержать стимуляторы дифференцировки, агенты, улучшающие кровоснабжение, противомикробные агенты, противовоспалительные агенты, активаторы клеток, витамины, аминокислоты, увлажнители, кератолитические агенты и т.п. Количество перечисленных выше основных материалов регулируется таким образом, чтобы оно попадало в интервал концентраций, используемый для получения обычных препаратов наружного применения.The compounds of the present invention, their salts or hydrates can be conventionally incorporated into tablets, powders, particles, granules, coated tablets, capsules, syrups, pills, inhalers, suppositories, injectable preparations, ointments, eye lapping, eye drops, drops for nose, ear drops, poultices, lotions, etc. Such formulations can be formulated using conventional diluents, binders, lubricants, colorants, flavors, and, if desired, stabilizers, emulsifiers, absorption enhancers, surfactants, pH modulators, preservatives, antioxidants, etc., and also materials that are commonly used as ingredients in pharmaceutical formulations. For example, an oral preparation can be prepared by mixing a compound of the present invention or a pharmaceutically acceptable salt thereof with a diluent and, if necessary, with a binder, disintegrant, lubricating agent, coloring agent, flavoring agent and the like. and conventionally forming the resulting mixture in the form of powders, particles, granules, tablets, coated tablets, capsules, and the like. Examples of such materials include animal and vegetable fats, such as soybean oil, beef tallow, and synthetic glyceride; hydrocarbons such as liquid paraffin, squalane and paraffin wax; essential oils, for example octyldodecyl myristate and isopropyl myristate; higher alcohols, for example cetostearyl alcohol and behenyl alcohol; silicone resins; silicone oils; surfactants such as polyoxyethylene fatty acid ester, sorbitol fatty acid ester, glycerol fatty acid ester, polyoxyethylene sorbitol fatty acid ester, polyoxyethylene hydrogenated castor oil and polyoxyethylene polyoxypropylene block copolymer; water soluble polymers such as hydroxyethyl cellulose, polyacrylic acid, carboxyvinyl polymer, polyethylene glycol, polyvinylpyrrolidone and methyl cellulose; lower alcohols such as ethanol and isopropanol; polyhydric alcohols such as glycerin, propylene glycol, dipropylene glycol and sorbitol; sugars such as glucose and sucrose; inorganic powder, such as anhydrous silicic acid, magnesium aluminum silicate and aluminum silicate, as well as purified water. Examples of diluents include lactose, wheat starch, sugar, glucose, mannitol, sorbitol, crystalline cellulose, and silicon dioxide. As binders, for example, polyvinyl alcohol, polyvinyl ether, methyl cellulose, ethyl cellulose, gum arabic, tragacanth, gelatin, shellac, hydroxypropyl methylcellulose, hydroxypropyl cellulose, polyvinylpyrrolidone, polypropylene glycol-polyoxyethylene block copolymene can be used. Examples of disintegrants are starch, agar, gelatin powder, crystalline cellulose, calcium carbonate, sodium bicarbonate, calcium citrate, dextrin, pectin and calcium carboxymethyl cellulose. Examples of lubricants include magnesium stearate, talc, polyethylene glycol, silica and hydrogenated vegetable oil. As dyes, pharmaceutically applicable substances can be used. Examples of flavoring agents include cocoa powder, mint camphor, flavored peppermint oil powder, Borneo camphor and cinnamon powder. Tablets and granules may be sugar coated or, if necessary, another suitable coating may be applied. Solutions, for example syrups or injectable preparations, can be prepared by mixing the compounds of the present invention or their pharmaceutically acceptable salts with a pH modulator, solubilizing agent, isotonic agent, and the like. and, if necessary, with an auxiliary solvent, stabilizer, etc. There are no particular restrictions regarding the methods of preparing preparations for external use, and such preparations can be prepared by conventional methods. A variety of materials commonly used for the manufacture of pharmaceuticals, quasi-drugs, cosmetics, and the like can be used as the basis for topical preparations. Examples of such basic materials are animal and vegetable oils, mineral oils, essential oils, waxes, higher alcohols, fatty acids, silicone oil, surfactants, phospholipids, alcohols, polyhydric alcohols, water-soluble polymers, clays and purified water. In addition, the preparations of the present invention for external use, if necessary, may contain pH modulators, antioxidants, chelating agents, antibacterial / antifungal agents, colorants, deodorants, and the like. However, the topical preparations of the present invention are not limited to the basic materials of these types. If necessary, such preparations may contain differentiation stimulants, blood supply improving agents, antimicrobial agents, anti-inflammatory agents, cell activators, vitamins, amino acids, moisturizers, keratolytic agents, and the like. The amount of the above basic materials is regulated so that it falls into the concentration range used to obtain conventional external preparations.
При введении соединения по настоящему изобретению, его соли или гидрата формы соединения не регламентируются и соединение может применяться обычным пероральным или парентеральным способом. Так, например, соединение может вводиться в виде стандартной лекарственной формы, такой как таблетки, порошки, гранулы, капсулы, сиропы, пилюли, ингаляторы, свечи, препараты для инъекций, мази, глазные мази, глазные капли, капли в нос, ушные капли, компрессы и лосьоны. Доза фармацевтического препарата по настоящему изобретению может выбираться в зависимости от тяжести симптомов, возраста, пола и массы пациента, формы соединения, типа соли, природы заболевания и т.п.Upon administration of a compound of the present invention, its salt or hydrate, the forms of the compound are not regulated and the compound may be administered in the usual oral or parenteral manner. So, for example, the compound can be administered in unit dosage form, such as tablets, powders, granules, capsules, syrups, pills, inhalers, suppositories, injectables, ointments, eye ointments, eye drops, nose drops, ear drops, compresses and lotions. The dose of the pharmaceutical preparation of the present invention may be selected depending on the severity of the symptoms, age, gender and weight of the patient, form of the compound, type of salt, nature of the disease, and the like.
Дозировка может меняться в зависимости от типа заболевания, тяжести симптомов, возраста и пола пациента, лекарственной переносимости и т.п. Фармацевтический агент по настоящему изобретению применяют один или несколько раз с дозой от 0,03 до 1000 мг/взрослый пациент/день, предпочтительно 0,10-500 мг/взрослый пациент/день, более предпочтительно 0,1-100 мг/взрослый пациент/день. Доза инъекции может составлять 1-3000 мкг/кг, предпочтительно 3-1000 мкг/кг.Dosage may vary depending on the type of disease, the severity of the symptoms, age and gender of the patient, drug tolerance, etc. The pharmaceutical agent of the present invention is used one or more times with a dose of 0.03 to 1000 mg / adult patient / day, preferably 0.10-500 mg / adult patient / day, more preferably 0.1-100 mg / adult patient / day. The injection dose may be 1-3000 μg / kg, preferably 3-1000 μg / kg.
Соединения по настоящему изобретению могут быть получены, например, способами, описанными в следующих далее примерах. Однако соединения по настоящему изобретению никоим образом не ограничены конкретными примерами, описанными далее.Compounds of the present invention can be obtained, for example, by the methods described in the following examples. However, the compounds of the present invention are in no way limited to the specific examples described below.
[Примеры получения][Production Examples]
Пример получения 1Production Example 1
трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1Н-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилатtert-Butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate
(а) трет-Бутил-5-метил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-карбоксилат (a) tert-Butyl-5-methyl-4-oxo-4,5-dihydroimidazo [4,5-d] pyridazine-1-carboxylate
Смесь, состоящую из 1,0 г 5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она, 16 мг 4-диметиламинопиридина, 1,6 г ди-трет-бутилдикарбоната и 5 мл тетрагидрофурана, перемешивают при комнатной температуре в течение ночи. Затем к раствору добавляют 0,5 мл тетрагидрофуранового раствора, содержащего 300 мг ди-трет-бутилдикарбоната, и полученную смесь перемешивают при комнатной температуре в течение трех часов. К реакционной смеси добавляют 5 мл трет-бутилметилового эфира и смесь охлаждают льдом. Полученные кристаллы собирают фильтрацией с получением 1,63 г указанного в заголовке соединения.A mixture consisting of 1.0 g of 5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one, 16 mg of 4-dimethylaminopyridine, 1.6 g of di-tert-butyl dicarbonate and 5 ml of tetrahydrofuran, stirred at room temperature overnight. Then, 0.5 ml of a tetrahydrofuran solution containing 300 mg of di-tert-butyl dicarbonate was added to the solution, and the resulting mixture was stirred at room temperature for three hours. 5 ml of tert-butyl methyl ether was added to the reaction mixture, and the mixture was cooled with ice. The resulting crystals were collected by filtration to obtain 1.63 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,72 (с, 9Н), 3,39 (с, 3Н), 8,38 (с, 1H), 8,54 (с, 1H).δ 1.72 (s, 9H), 3.39 (s, 3H), 8.38 (s, 1H), 8.54 (s, 1H).
b) 2-Хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-онb) 2-Chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one
8,4 мл гексаметилдисилазида лития (1,0 М тетрагидрофурановый раствор) в течение одного часа добавляют по каплям к 300 мл тетрагидрофуранового раствора, содержащего 1,68 г трет-бутил-5-метил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-карбоновой кислоты и 4,15 г гексахлорэтана в атмосфере азота при 0ºС. Полученную смесь перемешивают в течение 30 минут. К раствору добавляют 2 н. водно-аммиачный раствор и смесь перемешивают в течение трех часов. Затем реакционный раствор концентрируют до 50 мл и промывают 20 мл трет-бутилметилового эфира. Раствор подкисляют концентрированной соляной кислотой. Образовавшийся осадок собирают фильтрацией и промывают последовательно 10 мл воды и 10 мл трет-бутилметилового эфира. Таким образом получают 1,03 г указанного в заголовке соединения.8.4 ml of lithium hexamethyldisilazide (1.0 M tetrahydrofuran solution) is added dropwise over one hour to 300 ml of a tetrahydrofuran solution containing 1.68 g of tert-butyl-5-methyl-4-oxo-4,5-dihydroimidazo [ 4,5-d] pyridazine-1-carboxylic acid and 4.15 g of hexachloroethane in a nitrogen atmosphere at 0 ° C. The resulting mixture was stirred for 30 minutes. To the solution add 2 N. aqueous ammonia solution and the mixture is stirred for three hours. Then the reaction solution was concentrated to 50 ml and washed with 20 ml of tert-butyl methyl ether. The solution was acidified with concentrated hydrochloric acid. The precipitate formed is collected by filtration and washed successively with 10 ml of water and 10 ml of tert-butyl methyl ether. Thus, 1.03 g of the title compound is obtained.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,45 (с, 9Н) 3,72 (с, 3Н), 8,33 (с, 1H).δ 1.45 (s, 9H) 3.72 (s, 3H), 8.33 (s, 1H).
(c) 3-(2-Бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он(c) 3- (2-Butynyl) -2-chloro-5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one
7,72 г 2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она суспендируют в 400 мл тетрагидрофурана в атмосфере азота и добавляют 14,22 г трифенилфосфина и 3,85 г 2-бутин-1-ола. Полученную смесь охлаждают до 0ºС. Добавляют по каплям 100 мл тетрагидрофуранового раствора, содержащего 12,55 г ди-трет-бутилового эфира азодикарбоновой кислоты, и реакционную смесь перемешивают в течение трех часов. Полученную смесь концентрируют при пониженном давлении. К остатку добавляют 50 мл дихлорметана и 50 мл трифторуксусной кислоты и смесь перемешивают в течение 15 часов. Реакционную смесь концентрируют при пониженном давлении. Полученный осадок растворяют в 400 мл этилацетата и промывают 200 мл 5 н. водного раствора гидроксида натрия. Водный слой экстрагируют 100 мл этилацетата. Органические слои объединяют, сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный осадок подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (4:1), получают 8,78 г указанного в заголовке соединения.7.72 g of 2-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one is suspended in 400 ml of tetrahydrofuran in a nitrogen atmosphere and 14.22 g of triphenylphosphine and 3.85 g of 2 are added -butin-1-ol. The resulting mixture is cooled to 0 ° C. 100 ml of a tetrahydrofuran solution containing 12.55 g of azodicarboxylic acid di-tert-butyl ester are added dropwise and the reaction mixture is stirred for three hours. The resulting mixture was concentrated under reduced pressure. 50 ml of dichloromethane and 50 ml of trifluoroacetic acid were added to the residue, and the mixture was stirred for 15 hours. The reaction mixture was concentrated under reduced pressure. The resulting precipitate was dissolved in 400 ml of ethyl acetate and washed with 200 ml of 5 N. an aqueous solution of sodium hydroxide. The aqueous layer was extracted with 100 ml of ethyl acetate. The organic layers are combined, dried over magnesium sulfate and concentrated under reduced pressure. The resulting precipitate was purified by silica gel column chromatography. Thus, from the fraction eluted with hexane-ethyl acetate (4: 1), 8.78 g of the title compound are obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,82 (т, J=2,3 Гц, 3Н), 3,87 (с, 3Н), 5,32 (кв, J=2,3 Гц, 2Н), 8,19 (с, 1H).δ 1.82 (t, J = 2.3 Hz, 3H), 3.87 (s, 3H), 5.32 (q, J = 2.3 Hz, 2H), 8.19 (s, 1H) .
(d) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1Н-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin- 1-carboxylate
5 мл 1-метил-2-пирролидона в атмосфере азота добавляют к смеси, состоящей из 1,183 г 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она, 0,829 г карбоната калия и 1,395 г трет-бутилпиперазин-1-карбоксилата. Полученную смесь нагревают при 130ºС в течение 6 часов. Реакционную смесь охлаждают и добавляют 50 мл воды. Затем смесь экстрагируют 100 мл этилацетата. Органический слой дважды промывают 50 мл воды и затем 50 мл насыщенного водного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Полученный осадок подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (1:4), получают 1,916 г указанного в заголовке соединения.5 ml of 1-methyl-2-pyrrolidone in a nitrogen atmosphere is added to a mixture consisting of 1.183 g of 3- (2-butynyl) -2-chloro-5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin- 4-one, 0.829 g of potassium carbonate and 1.395 g of tert-butylpiperazine-1-carboxylate. The resulting mixture is heated at 130 ° C for 6 hours. The reaction mixture was cooled and 50 ml of water was added. The mixture is then extracted with 100 ml of ethyl acetate. The organic layer was washed twice with 50 ml of water and then with 50 ml of a saturated aqueous solution of sodium chloride. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The resulting precipitate was purified by silica gel column chromatography. Thus, 1.916 g of the title compound is obtained from the fraction eluted with hexane-ethyl acetate (1: 4).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,52 (с, 9Н), 1,83 (т, J=2,3 Гц, 3Н), 3,38-3,42 (м, 4Н), 3,61-3,64 (м, 4Н), 3,85 (с, 3Н), 5,09 (кв, J=2,3 Гц, 2Н), 8,13 (с, 1Н).δ 1.52 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.38-3.42 (m, 4H), 3.61-3.64 (m, 4H) ), 3.85 (s, 3H), 5.09 (q, J = 2.3 Hz, 2H), 8.13 (s, 1H).
Пример получения 2Production Example 2
трет-Бутил-4-[7-(2-бутинил-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилатtert-Butyl-4- [7- (2-butynyl-2,6-dichloro-7H-purin-8-yl] piperazine-1-carboxylate
(а) 7-(2-Бутинил)-3-метил-3,7-дигидропурин-2,6-дион(a) 7- (2-Butynyl) -3-methyl-3,7-dihydropurin-2,6-dione
55,3 мл 1-бром-2-бутина и 84,9 г безводного карбоната калия добавляют к смеси 100 г 3-метилксантина [CAS No. 1076-22-8] и 1000 мл N,N-диметилформамида. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. К реакционному раствору добавляют 1000 мл воды и смесь перемешивают при комнатной температуре в течение 1 часа. Полученный белый осадок отфильтровывают. Белое твердое вещество промывают водой и затем трет-бутилметиловым эфиром. Таким образом получают 112 г указанного в заголовке соединения.55.3 ml of 1-bromo-2-butine and 84.9 g of anhydrous potassium carbonate are added to a mixture of 100 g of 3-methylxanthine [CAS No. 1076-22-8] and 1000 ml of N, N-dimethylformamide. The resulting mixture was stirred at room temperature for 18 hours. 1000 ml of water was added to the reaction solution, and the mixture was stirred at room temperature for 1 hour. The resulting white precipitate was filtered off. The white solid was washed with water and then with tert-butyl methyl ether. Thus, 112 g of the title compound are obtained.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,82 (т, J=2,2 Гц, 3H), 3,34 (с, 3H), 5,06 (кв, J=2,2 Гц, 2H), 8,12 (с, 1H), 11,16 (уш.с, 1H).δ 1.82 (t, J = 2.2 Hz, 3H), 3.34 (s, 3H), 5.06 (q, J = 2.2 Hz, 2H), 8.12 (s, 1H) 11.16 (br s, 1H).
(b) 7-(2-Бутинил)-8-хлор-3-метил-3,7-дигидропурин-2,6-дион(b) 7- (2-Butynyl) -8-chloro-3-methyl-3,7-dihydropurin-2,6-dione
112 г 7-(2-бутинил)-3-метил-3,7-дигидропурин-2,6-диона растворяют в 2200 мл N,N-диметилформамида и добавляют 75,3 г N-хлорсукцинимида. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют 2200 мл воды и смесь перемешивают при комнатной температуре в течение 1,5 часа. Образовывавшийся белый осадок собирают фильтрацией и последовательно промывают водой и трет-бутилметиловым эфиром. Таким образом получают 117 г указанного в заголовке соединения.112 g of 7- (2-butynyl) -3-methyl-3,7-dihydropurin-2,6-dione are dissolved in 2200 ml of N, N-dimethylformamide and 75.3 g of N-chlorosuccinimide are added. The resulting mixture was stirred at room temperature for five hours. 2200 ml of water was added to the reaction solution, and the mixture was stirred at room temperature for 1.5 hours. The resulting white precipitate was collected by filtration and washed successively with water and tert-butyl methyl ether. Thus, 117 g of the title compound is obtained.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,78 (т, J=2,0 Гц, 3H), 3,30 (с, 3H), 5,06 (кв, J=2,0 Гц, 2H), 11,34 (уш.с, 1H).δ 1.78 (t, J = 2.0 Hz, 3H), 3.30 (s, 3H), 5.06 (q, J = 2.0 Hz, 2H), 11.34 (br s, 1H).
(с) 7-(2-Бутинил)-2,6,8-трихлор-7Н-пурин(c) 7- (2-Butynyl) -2,6,8-trichloro-7H-purine
Смесь, состоящую из 2,52 г 7-(2-бутинил)-8-хлор-3-метил-3,7-дигидропурин-2,6-диона и 100 мл оксихлорида фосфора перемешивают при 120ºС в течение 14 часов. После охлаждения реакционной смеси к раствору добавляют 4,15 г пентахлорида фосфора. Полученную в результате смесь перемешивают при 120ºС в течение 24 часов. После охлаждения реакционного раствора до комнатной температуры растворитель выпаривают при пониженном давлении. Остаток растворяют в тетрагидрофуране. Полученный раствор вливают в насыщенный раствор бикарбоната натрия и полученную смесь экстрагируют этилацетатом. Полученный в результате органический слой промывают водой, затем насыщенным рассолом и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле (этилацетат-гексан, 1:3), получая 2,40 г указанного в заголовке соединения.A mixture consisting of 2.52 g of 7- (2-butynyl) -8-chloro-3-methyl-3,7-dihydropurin-2,6-dione and 100 ml of phosphorus oxychloride was stirred at 120 ° C for 14 hours. After the reaction mixture was cooled, 4.15 g of phosphorus pentachloride was added to the solution. The resulting mixture was stirred at 120 ° C for 24 hours. After the reaction solution was cooled to room temperature, the solvent was evaporated under reduced pressure. The residue was dissolved in tetrahydrofuran. The resulting solution was poured into a saturated sodium bicarbonate solution and the resulting mixture was extracted with ethyl acetate. The resulting organic layer was washed with water, then with saturated brine, and concentrated under reduced pressure. The residue was purified by silica gel column chromatography (ethyl acetate-hexane, 1: 3) to obtain 2.40 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,82 (т, J=2,4 Гц, 3H), 5,21 (кв, J=2,4 Гц, 2H).δ 1.82 (t, J = 2.4 Hz, 3H), 5.21 (q, J = 2.4 Hz, 2H).
(d) трет-Бутил-4-[7-(2-бутинил-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [7- (2-butynyl-2,6-dichloro-7H-purin-8-yl] piperazine-1-carboxylate
Смесь из 2,4 г 7-(2-бутинил)-2,6,8-трихлор-7Н-пурина, 1,46 г бикарбоната натрия, 2,43 г трет-бутилпиперазин-1-карбоксилата и 45 мл ацетонитрила перемешивают при комнатной температуре в течение 2 часов 20 минут. Затем добавляют 0,73 г бикарбоната натрия и 1,21 г трет-бутилпиперазин-1-карбоксилата и полученную смесь перемешивают при комнатной температуре в течение 1 часа. Реакционный раствор экстрагируют смесью этилацетат-вода и органический слой промывают 1 н. соляной кислотой, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток обрабатывают диэтиловым эфиром. Образовавшиеся кристаллы собирают фильтрацией и промывают диэтиловым эфиром. Таким образом, получают 3,0 г указанного в заголовке соединения в виде твердого белого вещества.A mixture of 2.4 g of 7- (2-butynyl) -2,6,8-trichloro-7H-purine, 1.46 g of sodium bicarbonate, 2.43 g of tert-butylpiperazine-1-carboxylate and 45 ml of acetonitrile are stirred at room temperature for 2 hours 20 minutes. Then 0.73 g of sodium bicarbonate and 1.21 g of tert-butyl piperazine-1-carboxylate are added and the resulting mixture is stirred at room temperature for 1 hour. The reaction solution was extracted with ethyl acetate-water, and the organic layer was washed with 1N. hydrochloric acid, dried over anhydrous magnesium sulfate and then concentrated under reduced pressure. The residue is taken up in diethyl ether. The resulting crystals were collected by filtration and washed with diethyl ether. Thus, 3.0 g of the title compound is obtained as a white solid.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,42 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,48-3,55 (м, 4H), 3,57-3,63 (м, 4H), 4,89 (кв, J=2 Гц, 2H).δ 1.42 (s, 9H), 1.83 (t, J = 2 Hz, 3H), 3.48-3.55 (m, 4H), 3.57-3.63 (m, 4H), 4.89 (q, J = 2 Hz, 2H).
[Примеры][Examples]
Пример 1Example 1
Трифторацетат этил-[7-(2-хлорфенил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]ацетатаEthyl [7- (2-chlorophenyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetate trifluoroacetate
(а) [7-Бензил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат(a) [7-Benzyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl 2,2-dimethylpropionate
8,66 г 7-бензилксантина растворяют в 300 мл N,N-диметилформамида и добавляют 1,57 г гидрида натрия и 7,7 мл хлорметилпивалата. Полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор разбавляют этилацетатом и промывают водой и 1 н. раствором соляной кислоты. Органический слой сушат над безводным сульфатом магния и фильтруют. Растворитель выпаривают при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (1:1), получают 2,66 г вещества указанного в заголовке.8.66 g of 7-benzylxanthine was dissolved in 300 ml of N, N-dimethylformamide and 1.57 g of sodium hydride and 7.7 ml of chloromethyl pivalate were added. The resulting mixture was stirred at room temperature overnight. The reaction solution was diluted with ethyl acetate and washed with water and 1 N. hydrochloric acid solution. The organic layer was dried over anhydrous magnesium sulfate and filtered. The solvent was evaporated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 2.66 g of the title compound are obtained from the fraction eluted with hexane-ethyl acetate (1: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,18 (с, 9H), 5,45 (с, 2H), 6,06 (с, 2H), 7,34-7,39 (м, 5H), 7,58 (с, 1H), 8,18 (с, 1H).δ 1.18 (s, 9H), 5.45 (s, 2H), 6.06 (s, 2H), 7.34-7.39 (m, 5H), 7.58 (s, 1H), 8.18 (s, 1H).
(b) [7-Бензил-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат (b) [7-Benzyl-1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl 2,2-dimethylpropionate
2,66 г [7-бензил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата растворяют в 30 мл N,N-диметилформамида и добавляют 1,6 г карбоната калия и 1 мл йодистого метила. Полученную смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и 1 н. раствором соляной кислоты. Органический слой сушат над безводным сульфатом магния и фильтруют. Растворитель выпаривают при пониженном давлении. Остаток обрабатывают толуолом. Таким образом получают 2,16 г вещества указанного в заголовке.2.66 g of [7-benzyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl 2,2-dimethylpropionate are dissolved in 30 ml of N, N-dimethylformamide and 1.6 g are added potassium carbonate and 1 ml of methyl iodide. The resulting mixture was stirred at room temperature overnight. The reaction mixture was diluted with ethyl acetate and washed with water and 1 N. hydrochloric acid solution. The organic layer was dried over anhydrous magnesium sulfate and filtered. The solvent was evaporated under reduced pressure. The residue is treated with toluene. Thus, 2.16 g of the title compound are obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,18 (с, 9H), 3,41 (с, 3H), 5,49 (с, 2H), 6,11 (с, 2H), 7,26-7,39 (м, 5H), 7,57 (с, 1H).δ 1.18 (s, 9H), 3.41 (s, 3H), 5.49 (s, 2H), 6.11 (s, 2H), 7.26-7.39 (m, 5H), 7.57 (s, 1H).
(с) [1-Метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат (c) [1-Methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate
2,349 г [7-бензил-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата растворяют в 100 мл уксусной кислоты и к раствору добавляют 1 г катализатора, представляющего собой 10% палладия на угле. Полученную смесь перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Смесь фильтруют и концентрируют с получением 1,871 г указанного в заголовке соединения.2.349 g of [7-benzyl-1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl 2,2-dimethylpropionate is dissolved in 100 ml of acetic acid and 1 g of catalyst is added to the solution , representing 10% palladium on charcoal. The resulting mixture was stirred in a hydrogen atmosphere at room temperature overnight. The mixture was filtered and concentrated to give 1.871 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,19 (с, 9H), 3,48 (с, 3H), 6,17 (с, 2H), 7,83 (с, 1H).δ 1.19 (s, 9H), 3.48 (s, 3H), 6.17 (s, 2H), 7.83 (s, 1H).
(d) [7-(2-Хлорфенил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат(d) [7- (2-Chlorophenyl) -1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl 2,2-dimethylpropionate
1,60 г [1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата, 1,83 г 2-хлорфенилбороновой кислоты и 1,5 г ацетата меди (II) суспендируют в 30 мл N,N-диметилформамида и в полученную суспензию добавляют 3 мл пиридина. Полученную смесь перемешивают при комнатной температуре в течение 3 дней. Реакционный раствор фильтруют через короткую колонку, заполненную силикагелем, и фильтрат разбавляют этилацетатом. Органический слой промывают 1 н. соляной кислотой, водой и насыщенным рассолом, затем сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют. Остаток суспендируют в эфире и суспензию фильтруют. Фильтрат подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 724 мг соединения, указанного в заголовке.1.60 g of [1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl 2,2-dimethylpropionate, 1.83 g of 2-chlorophenylboronic acid and 1.5 g of acetate copper (II) is suspended in 30 ml of N, N-dimethylformamide and 3 ml of pyridine is added to the resulting suspension. The resulting mixture was stirred at room temperature for 3 days. The reaction solution was filtered through a short column filled with silica gel, and the filtrate was diluted with ethyl acetate. The organic layer is washed with 1 N. hydrochloric acid, water and saturated brine, then dried over anhydrous magnesium sulfate and filtered. The filtrate was concentrated. The residue was suspended in ether and the suspension was filtered. The filtrate was purified by silica gel column chromatography. Thus, 724 mg of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (3: 2).
(е) трет-Бутил-4-[7-(2-хлорфенил)-3-(2,2-диметилпропионилоксиметил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат(e) tert-Butyl-4- [7- (2-chlorophenyl) -3- (2,2-dimethylpropionyloxymethyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H- purin-8-yl] piperazine-1-carboxylate
724 мг [7-(2-хлорфенил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата суспендируют в 15 мл N,N-диметилформамида и в суспензию добавляют 760 мг N-хлорсукцинимида. Реакционный раствор перемешивают в течение ночи и затем разбавляют этилацетатом. Полученный раствор промывают водой и 1 н. соляной кислотой, сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют. Таким образом получают 764 мг [8-хлор-7-(2-хлорфенил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата. Полученное вещество смешивают с 4 г трет-бутилпиперазин-1-карбоксилата. Смесь нагревают при 150ºС и перемешивают в течение трех часов. В реакционную смесь добавляют этилацетат и воду, в результате чего смесь разделяется на слои. Органический слой промывают 1 н. раствором соляной кислоты и сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 724 мг соединения, указанного в заголовке.724 mg of [7- (2-chlorophenyl) -1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate are suspended in 15 ml of N, N- dimethylformamide and 760 mg of N-chlorosuccinimide are added to the suspension. The reaction solution was stirred overnight and then diluted with ethyl acetate. The resulting solution was washed with water and 1 N. hydrochloric acid, dried over anhydrous magnesium sulfate and filtered. The filtrate was concentrated. Thus, 764 mg of [8-chloro-7- (2-chlorophenyl) -1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate is obtained. The resulting material was mixed with 4 g of tert-butylpiperazine-1-carboxylate. The mixture is heated at 150 ° C and stirred for three hours. Ethyl acetate and water are added to the reaction mixture, whereby the mixture is separated into layers. The organic layer is washed with 1 N. hydrochloric acid solution and dried over anhydrous magnesium sulfate, then filtered. The filtrate was concentrated. The residue was purified by silica gel column chromatography. Thus, 724 mg of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (3: 2).
(f) трет-Бутил-4-[7-(2-хлорфенил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (f) tert-Butyl-4- [7- (2-chlorophenyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8-yl] piperazin-1- carboxylate
трет-Бутил-4-[7-(2-хлорфенил)-3-(2,2-диметилпропионилоксиметил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат растворяют в смеси, состоящей из 10 мл метанола и 20 мл тетрагидрофурана, и к смеси добавляют 200 мг гидрида натрия. Полученную смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Фильтрат концентрируют. Остаток суспендируют в эфире и смесь фильтруют. Таким образом получают 450 мг соединения, указанного в заголовке.tert-Butyl-4- [7- (2-chlorophenyl) -3- (2,2-dimethylpropionyloxymethyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8 -yl] piperazine-1-carboxylate was dissolved in a mixture of 10 ml of methanol and 20 ml of tetrahydrofuran, and 200 mg of sodium hydride was added to the mixture. The resulting mixture was stirred at room temperature overnight. To the reaction solution was added 1N. hydrochloric acid and the resulting mixture was extracted with ethyl acetate. The organic layer was dried over anhydrous magnesium sulfate and then filtered. The filtrate was concentrated. The residue was suspended in ether and the mixture was filtered. Thus, 450 mg of the title compound is obtained.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,35 (с, 9H), 3,04 (с, 3H), 3,06-3,12 (м, 4H), 3,17-3,22 (м, 4H), 7,48 (дт, J=1,6, 7,6 Гц, 1H), 7,53 (дт, J=2,0, 7,6 Гц, 1H), 7,63 (дд, J=2,0, 8,0 Гц, 1H), 7,65 (дд, J=1,6, 8,0 Гц, 1H).δ 1.35 (s, 9H), 3.04 (s, 3H), 3.06-3.12 (m, 4H), 3.17-3.22 (m, 4H), 7.48 (dt , J = 1.6, 7.6 Hz, 1H), 7.53 (dt, J = 2.0, 7.6 Hz, 1H), 7.63 (dd, J = 2.0, 8.0 Hz, 1H), 7.65 (dd, J = 1.6, 8.0 Hz, 1H).
(g) трет-Бутил-4-[2-хлор-7-(2-хлорфенил)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (g-1) и трет-бутил-4-[2,6-дихлор-7-(2-хлорфенил)-7Н-пурин-8-ил]пиперазин-1-карбоксилат (g-2)(g) tert-Butyl-4- [2-chloro-7- (2-chlorophenyl) -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate ( g-1) and tert-butyl-4- [2,6-dichloro-7- (2-chlorophenyl) -7H-purin-8-yl] piperazine-1-carboxylate (g-2)
78 мг трет-бутил-4-[7-(2-хлорфенил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 3 мл оксихлорида фосфора и полученную смесь перемешивают при 120ºС в течение ночи. Реакционный раствор концентрируют и остаток растворяют в 1 мл тетрагидрофурана. Раствор выливают в суспензию, состоящую из 50 мг ди-трет-бутилдикарбоната, 1 мл тетрагидрофурана и 0,5 мл воды, содержащей 100 мг бикарбоната натрия. Реакционную смесь перемешивают при комнатной температуре в течение трех часов. Реакционную смесь разбавляют этилацетатом и промывают водой. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Фильтрат концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 16 мг трет-бутил-4-[2,6-дихлор-7-(2-хлорфенил)-7Н-пурин-8-ил]пиперазин-1-карбоксилата, а из фракции, элюированной смесью гексан-этилацетат (1:9), получают 10 мг трет-бутил-4-[2-хлор-7-(2-хлорфенил)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата.78 mg of tert-butyl 4- [7- (2-chlorophenyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8-yl] piperazine-1-carboxylate dissolved in 3 ml of phosphorus oxychloride and the resulting mixture was stirred at 120 ° C overnight. The reaction solution was concentrated and the residue was dissolved in 1 ml of tetrahydrofuran. The solution was poured into a suspension of 50 mg of di-tert-butyl dicarbonate, 1 ml of tetrahydrofuran and 0.5 ml of water containing 100 mg of sodium bicarbonate. The reaction mixture was stirred at room temperature for three hours. The reaction mixture was diluted with ethyl acetate and washed with water. The organic layer was dried over anhydrous magnesium sulfate and then filtered. The filtrate was concentrated and the residue was purified by silica gel column chromatography. Thus, from the fraction eluted with hexane-ethyl acetate (3: 2), 16 mg of tert-butyl-4- [2,6-dichloro-7- (2-chlorophenyl) -7H-purin-8-yl] piperazine- are obtained 1-carboxylate, and from the fraction eluted with hexane-ethyl acetate (1: 9), 10 mg of tert-butyl-4- [2-chloro-7- (2-chlorophenyl) -1-methyl-6-oxo-6 , 7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate.
(h) Трифторацетат этил-[7-(2-хлорфенил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]ацетата (h) Ethyl [7- (2-chlorophenyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetate trifluoroacetate
10 мг трет-бутил-4-[2-хлор-7-(2-хлорфенил)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этилгликолята растворяют в 0,2 мл N-метилпирролидона и к полученному раствору добавляют 10 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор разбавляют этилацетатом и смесь промывают 1 н. соляной кислотой. Таким образом получают 24 мг трет-бутил-4-[7-(2-хлорфенил)-2-этоксикарбонилметокси-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата. 8 мг полученного соединения растворяют в трифторуксусной кислоте и полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,11 мг соединения, указанного в заголовке.10 mg of tert-butyl-4- [2-chloro-7- (2-chlorophenyl) -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate and 10 mg of ethyl glycolate is dissolved in 0.2 ml of N-methylpyrrolidone and 10 mg of sodium hydride is added to the resulting solution. The mixture was stirred at room temperature for 2 hours. The reaction solution was diluted with ethyl acetate and the mixture was washed with 1 N. hydrochloric acid. Thus, 24 mg of tert-butyl-4- [7- (2-chlorophenyl) -2-ethoxycarbonylmethoxy-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazin-1- carboxylate. 8 mg of the obtained compound was dissolved in trifluoroacetic acid, and the resulting mixture was concentrated. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 2.11 mg of the title compound.
МС m/e (ESI) 447 (MH+-CF3COOH).MS m / e (ESI) 447 (MH + -CF 3 COOH).
Пример 2Example 2
Трифторацетат [7-(2-хлорфенил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]ацетата[7- (2-Chlorophenyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetate trifluoroacetate
16 мг трет-бутил-4-[7-(2-хлорфенил)-2-этоксикарбонилметокси-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата смешивают с 0,4 мл метанола и 0,1 мл 5 н. водного раствора гидроксида натрия и полученную смесь выстаивают при комнатной температуре в течение двух часов. К реакционному раствору добавляют 1 н. соляную кислоту. Подкисленный раствор экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,45 мг соединения, указанного в заголовке.16 mg of tert-butyl-4- [7- (2-chlorophenyl) -2-ethoxycarbonylmethoxy-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is mixed with 0.4 ml of methanol and 0.1 ml of 5 N. an aqueous solution of sodium hydroxide and the resulting mixture was allowed to stand at room temperature for two hours. To the reaction solution was added 1N. hydrochloric acid. The acidified solution is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the resulting residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 2.45 mg of the title compound.
МС m/e (ESI) 419 (MH+-CF3COOH).MS m / e (ESI) 419 (MH + -CF 3 COOH).
Пример 3Example 3
[7-(2-Хлорфенил)-2-циклобутилокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он[7- (2-Chlorophenyl) -2-cyclobutyloxy-8- (piperazin-1-yl) -1,7-dihydropurin-6-one
(а) [7-Бензил-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат(a) [7-Benzyl-3- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydropurin-1-yl] methyl-2,2-dimethylpropionate
9,54 г 7-бензилксантина растворяют в 250 мл N,N-диметилформамида и к полученному раствору добавляют 17 г карбоната калия и 14,2 мл хлорметилпивалата. Смесь перемешивают при 50ºС в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и 1 н. соляной кислотой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Растворитель выпаривают при пониженном давлении и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 12,8 г соединения, указанного в заголовке.9.54 g of 7-benzylxanthine was dissolved in 250 ml of N, N-dimethylformamide and 17 g of potassium carbonate and 14.2 ml of chloromethyl pivalate were added to the resulting solution. The mixture was stirred at 50 ° C. overnight. The reaction mixture was diluted with ethyl acetate and washed with water and 1 N. hydrochloric acid. The organic layer was dried over anhydrous magnesium sulfate, then filtered. The solvent was evaporated under reduced pressure, and the residue was purified by silica gel column chromatography. Thus, from the fraction eluted with hexane-ethyl acetate (3: 2), 12.8 g of the title compound are obtained.
(b) [3-(2,2-Диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат (b) [3- (2,2-Dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydropurin-1-yl] methyl 2,2-dimethylpropionate
Указанное в заголовке соединение получают, обрабатывая [7-бензил-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат по способу, используемому в примере (1с).The title compound was obtained by treating [7-benzyl-3- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydropurin-1-yl] methyl 2,2-dimethylpropionate with the method used in example (1c).
(с) [7-(2-Хлорфенил)-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат (c) [7- (2-Chlorophenyl) -3- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydropurin-1-yl] methyl-2,2-dimethylpropionate
Указанное в заголовке соединение получают, обрабатывая [3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил-2,2-диметилпропионат по способу, используемому в примере (1d).The title compound was prepared by treating [3- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydropurin-1-yl] methyl 2,2-dimethylpropionate according to the method used in example (1d).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,16 (с, 9H), 1,22 (с, 9H), 5,99 (с, 2H), 6,19 (с, 2Н), 7,42-7,52 (м, 3H), 7,58-7,61 (м, 1Н), 7,73 (с, 1Н).δ 1.16 (s, 9H), 1.22 (s, 9H), 5.99 (s, 2H), 6.19 (s, 2H), 7.42-7.52 (m, 3H), 7.58-7.61 (m, 1H); 7.73 (s, 1H).
(d) трет-Бутил-4-[7-(2-хлорфенил)-1,3-бис-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (d) tert-Butyl-4- [7- (2-chlorophenyl) -1,3-bis- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydro-1H- purin-8-yl] piperazine-1-carboxylate
Указанное в заголовке соединение получают, обрабатывая [7-(2-хлорфенил)-3-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидропурин-1-ил]метил 2,2-диметилпропионат по способу, используемому в примере (1е).The title compound was obtained by treating [7- (2-chlorophenyl) -3- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydropurin-1-yl] methyl 2,2 -dimethylpropionate according to the method used in example (1e).
1H-ЯРМ(CDCl3) 1 H-NMR (CDCl 3 )
δ 1,16 (с, 9H), 1,23 (с, 9H), 1,44 (с, 9H), 3,20-3,35 (м, 4H), 3,32-3,37 (м, 4H), 5,92 (с, 2H), 6,09 (с, 2H), 7,41-7,49 (м, 2H), 7,52-7,57 (м, 2Н).δ 1.16 (s, 9H), 1.23 (s, 9H), 1.44 (s, 9H), 3.20-3.35 (m, 4H), 3.32-3.37 (m , 4H), 5.92 (s, 2H), 6.09 (s, 2H), 7.41-7.49 (m, 2H), 7.52-7.57 (m, 2H).
(е) трет-Бутил-4-[7-(2-хлорфенил)-1-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (e) t ret-Butyl-4- [7- (2-chlorophenyl) -1- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8 -yl] piperazine-1-carboxylate
2,227 г трет-бутил-4-[7-(2-хлорфенил)-1,3-бис(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в смеси, состоящей из 10 мл тетрагидрофурана и 20 мл метанола, затем к раствору добавляют 0,518 мл 1,8-диазабицикло[5,4,0]ундец-7-ена. Смесь перемешивают при комнатной температуре в течение ночи. К смеси добавляют 1 н. соляную кислоту и осажденное твердое вещество собирают фильтрацией. Твердый материал сушат с получением 1,025 г указанного в заголовке вещества.2.227 g of tert-butyl-4- [7- (2-chlorophenyl) -1,3-bis (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydro-1H-purine- 8-yl] piperazin-1-carboxylate is dissolved in a mixture of 10 ml of tetrahydrofuran and 20 ml of methanol, then 0.518 ml of 1,8-diazabicyclo [5.4.0] undec-7-ene is added to the solution. The mixture was stirred at room temperature overnight. To the mixture is added 1 N. hydrochloric acid and precipitated solid are collected by filtration. The solid material was dried to give 1.025 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,16 (с, 9H), 1,44 (с, 9H), 3,22-3,24 (м, 4H), 3,33-3,35 (м, 4H), 5,90 (с, 2H), 7,43-7,47 (м, 2H), 7,51-7,57 (м, 2H), 8,71 (уш, 1H).δ 1.16 (s, 9H), 1.44 (s, 9H), 3.22-3.24 (m, 4H), 3.33-3.35 (m, 4H), 5.90 (s , 2H), 7.43-7.47 (m, 2H), 7.51-7.57 (m, 2H), 8.71 (br, 1H).
(f) 7-(2-Хлорфенил)-2-циклобутилокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он(f) 7- (2-Chlorophenyl) -2-cyclobutyloxy-8- (piperazin-1-yl) -1,7-dihydropurin-6-one
8 мг трет-бутил-4-[7-(2-хлорфенил)-1-(2,2-диметилпропионилоксиметил)-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,3 мл N,N-диметилформамида и к полученному раствору добавляют 0,05 мл бромциклобутана и 20 мг карбоната калия. Полученную смесь перемешивают при 50ºС в течение ночи. В реакционную смесь добавляют этилацетат и полученную смесь промывают водой. Органический слой концентрируют. Остаток растворяют в метаноле и к раствору добавляют 5 мг гидрида натрия. Полученную смесь перемешивают при комнатной температуре в течение трех часов. Реакционную смесь нейтрализуют 1 н. соляной кислотой и экстрагируют этилацетатом. Растворитель выпаривают и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,89 мг соединения, указанного в заголовке.8 mg tert-butyl-4- [7- (2-chlorophenyl) -1- (2,2-dimethylpropionyloxymethyl) -2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8-yl ] piperazine-1-carboxylate is dissolved in 0.3 ml of N, N-dimethylformamide, and 0.05 ml of bromocyclobutane and 20 mg of potassium carbonate are added to the resulting solution. The resulting mixture was stirred at 50 ° C. overnight. Ethyl acetate was added to the reaction mixture, and the resulting mixture was washed with water. The organic layer is concentrated. The residue was dissolved in methanol and 5 mg of sodium hydride was added to the solution. The resulting mixture was stirred at room temperature for three hours. The reaction mixture was neutralized with 1 N. hydrochloric acid and extracted with ethyl acetate. The solvent was evaporated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.89 mg of the title compound.
МС m/e (ESI) 375 (MH+-CF3COOH).MS m / e (ESI) 375 (MH + -CF 3 COOH).
Пример 4Example 4
Трифторацетат метил 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]фенилацетатаTrifluoroacetate methyl 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] phenylacetate
(а) [7-(2-Бутинил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат(a) [7- (2-Butynyl) -1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate
1,871 г [1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата растворяют в 30 мл N,N-диметилформамида и к полученному раствору добавляют 1,5 г карбоната калия и 0,7 мл 2-бутинилбромида. Смесь перемешивают при комнатной температуре в течение ночи. Реакционную смесь разбавляют этилацетатом и промывают водой и 1 н. соляной кислотой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Растворитель выпаривают при пониженном давлении и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 2,12 г соединения, указанного в заголовке.1.871 g of [1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate are dissolved in 30 ml of N, N-dimethylformamide and 1 is added to the resulting solution, 5 g of potassium carbonate and 0.7 ml of 2-butynyl bromide. The mixture was stirred at room temperature overnight. The reaction mixture was diluted with ethyl acetate and washed with water and 1 N. hydrochloric acid. The organic layer was dried over anhydrous magnesium sulfate, then filtered. The solvent was evaporated under reduced pressure, and the residue was purified by silica gel column chromatography. Thus, 2.12 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (3: 2).
(b) 7-(2-Бутинил)-1-метил-3,7-дигидропурин-2,6-дион (b) 7- (2-Butynyl) -1-methyl-3,7-dihydropurin-2,6-dione
Указанное в заголовке соединение получают, обрабатывая [7-(2-бутинил)-1-метил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат по способу, используемому в примере (1f).The title compound was obtained by treating [7- (2-butynyl) -1-methyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate according to the method, used in example (1f).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,91 (т, J=2,4 Гц, 3H), 3,39 (с, 3H), 5,10 (с, 2H), 7,93 (с, 1H), 10,62 (с, 1H).δ 1.91 (t, J = 2.4 Hz, 3H), 3.39 (s, 3H), 5.10 (s, 2H), 7.93 (s, 1H), 10.62 (s, 1H).
(c) трет-Бутил 4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (c) tert-Butyl 4- [7- (2-butynyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8-yl] piperazine-1-carboxylate
Указанное в заголовке соединение получают, обрабатывая 7-(2-бутинил)-1-метил-3,7-дигидропурин-2,6-дион по способу, используемому в примере (1е).The title compound was obtained by treating 7- (2-butynyl) -1-methyl-3,7-dihydropurin-2,6-dione according to the method used in Example (1e).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,83 (т, J=2,4 Гц, 3H), 3,37 (с, 3H), 3,37-3,39 (м, 4H), 3,58-3,60 (м, 4H), 4,87 (с, 2H), 9,68 (с, 1H).δ 1.48 (s, 9H), 1.83 (t, J = 2.4 Hz, 3H), 3.37 (s, 3H), 3.37-3.39 (m, 4H), 3, 58-3.60 (m, 4H), 4.87 (s, 2H), 9.68 (s, 1H).
(d) Трифторацетат метил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]фенилацетата (d) Methyl 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] phenylacetate trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг метил-2-бромфенилацетата растворяют в 0,2 мл N,N-диметилформамида и к полученному раствору добавляют 10 мг карбоната калия. Смесь перемешивают при 50ºС в течение ночи. К реакционному раствору добавляют этилацетат и смесь промывают водой и 1 н. соляной кислотой. Органический слой концентрируют. Остаток растворяют в трифторуксусной кислоте и полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,07 мг соединения, указанного в заголовке.8 mg tert-butyl 4- [7- (2-butynyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8-yl] piperazine-1-carboxylate and 10 mg of methyl 2-bromophenyl acetate was dissolved in 0.2 ml of N, N-dimethylformamide, and 10 mg of potassium carbonate was added to the resulting solution. The mixture was stirred at 50 ° C. overnight. Ethyl acetate was added to the reaction solution, and the mixture was washed with water and 1N. hydrochloric acid. The organic layer is concentrated. The residue was dissolved in trifluoroacetic acid, and the resulting mixture was concentrated. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.07 mg of the title compound.
МС m/e (ESI) 451 (MH+-CF3COOH).MS m / e (ESI) 451 (MH + -CF 3 COOH).
Пример 5Example 5
Трифторацетат 7-(2-бутинил)-2-циклогексилокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-cyclohexyloxy-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя йодциклогексан вместо метил-2-бромфенилацетата в примере (4d) и следуя способу примера 4, получают указанное в заголовке соединение.Using iodocyclohexane instead of methyl 2-bromophenylacetate in Example (4d) and following the method of Example 4, the title compound was obtained.
МС m/e (ESI) 385 (MH+-CF3COOH).MS m / e (ESI) 385 (MH + -CF 3 COOH).
Пример 6Example 6
Трифторацетат 7-(2-бутинил)-2-(2-бутокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-butoxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя 2-бромбутан вместо метил-2-бромфенилацетата в примере (4d) и следуя способу примера 4, получают указанное в заголовке соединение.Using 2-bromobutane instead of methyl-2-bromophenylacetate in Example (4d) and following the method of Example 4, the title compound is obtained.
МС m/e (ESI) 359 (MH+-CF3COOH).MS m / e (ESI) 359 (MH + -CF 3 COOH).
Пример 7Example 7
Трифторацетат 7-(2-бутинил)-2-циклопентилокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-cyclopentyloxy-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя бромциклопентан вместо метил-2-бромфенилацетата в примере (4d) и следуя способу примера 4, получают указанное в заголовке соединение.Using bromocyclopentane instead of methyl 2-bromophenyl acetate in Example (4d) and following the method of Example 4, the title compound is obtained.
МС m/e (ESI) 371 (MH+-CF3COOH).MS m / e (ESI) 371 (MH + -CF 3 COOH).
Пример 8Example 8
Трифторацетат этил 7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бутаноатаEthyl 7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] butanoate trifluoroacetate
Используя этиловый эфир 2-бромбутановой кислоты вместо метил-2-бромфенилацетата в примере (4d), следуя способу примера 4, получают указанное в заголовке соединение.Using ethyl 2-bromobutanoic acid instead of methyl 2-bromophenyl acetate in Example (4d), following the method of Example 4, the title compound was obtained.
МС m/e (ESI) 417 (MH+-CF3COOH).MS m / e (ESI) 417 (MH + -CF 3 COOH).
Пример 9Example 9
Этил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]пропионатEthyl 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] propionate
Используя этил-2-бромпропионат вместо метил-2-бромфенилацетата в примере (4d), следуя способу примера 4, получают трифторацетат указанного в заголовке соединения. Полученное соединение подвергают хроматографической очистке с использованием NH-силикагеля (силикагель, поверхность которого модифицирована аминогруппами, Fuji Silysia Chemical Ltd. NH-DM 2035). Указанное в заголовке соединение получают из фракции, элюированной смесью этилацетат-метанол (20:1).Using ethyl 2-bromopropionate instead of methyl 2-bromophenyl acetate in Example (4d), following the method of Example 4, the trifluoroacetate of the title compound was obtained. The resulting compound was chromatographed using NH-silica gel (silica gel whose surface is modified by amino groups, Fuji Silysia Chemical Ltd. NH-DM 2035). The title compound was obtained from the fraction eluted with ethyl acetate-methanol (20: 1).
МС m/e (ESI) 404 (MH+).MS m / e (ESI) 404 (MH + ).
Пример 10Example 10
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]пропионовой кислоты2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] propionic acid trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этил-2-бромпропионата растворяют в 0,2 мл N,N-диметилформамида и к полученному раствору добавляют 10 мг карбоната калия. Смесь перемешивают в течение ночи при 50ºС. К реакционному раствору добавляют этилацетат и полученную смесь промывают водой и 1 н. соляной кислотой. Органический слой концентрируют с получением трет-бутил-4-[7-(2-бутинил)-2-(1-карбоксиэтокси)-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата. Это соединение растворяют в 0,4 мл этанола и к полученному раствору добавляют 0,1 мл 5 н. водного раствора гидроксида натрия. Смесь перемешивают при комнатной температуре в течение 3 часов. К раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,37 мг указанного в заголовке соединения.8 mg tert-butyl 4- [7- (2-butynyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8-yl] piperazine-1-carboxylate and 10 mg of ethyl 2-bromopropionate was dissolved in 0.2 ml of N, N-dimethylformamide, and 10 mg of potassium carbonate was added to the resulting solution. The mixture is stirred overnight at 50 ° C. Ethyl acetate was added to the reaction solution, and the resulting mixture was washed with water and 1N. hydrochloric acid. The organic layer was concentrated to give tert-butyl-4- [7- (2-butynyl) -2- (1-carboxyethoxy) -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate. This compound was dissolved in 0.4 ml of ethanol, and 0.1 ml of 5 N was added to the resulting solution. an aqueous solution of sodium hydroxide. The mixture was stirred at room temperature for 3 hours. To the solution is added 1 N. hydrochloric acid and the resulting mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 3.37 mg of the title compound.
МС m/e (ESI) 375 (MH+-CF3COOH).MS m / e (ESI) 375 (MH + -CF 3 COOH).
Пример 11Example 11
Трифторацетат 7-(2-бутинил)-2-метокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-methoxy-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
(а) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилат (а-1) и трет-бутил-4-[7-(2-бутинил)-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилат (а-2) (a) tert-Butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate ( a-1) and tert-butyl-4- [7- (2-butynyl) -2,6-dichloro-7H-purin-8-yl] piperazine-1-carboxylate (a-2)
5,127 г трет-бутил-4-[7-(2-бутинил)-1-метил-2,6-диоксо-2,3,6,7-тетрагидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 75 мл оксихлорида фосфора и после этого смесь перемешивают при 120ºС в течение ночи. Реакционный раствор концентрируют и остаток растворяют в 50 мл тетрагидрофурана. Полученный раствор выливают в суспензию, состоящую из 7 г ди-трет-бутилдикарбоната, 50 мл тетрагидрофурана, 100 г бикарбоната натрия и 200 мл воды, и смесь перемешивают при комнатной температуре в течение 1 часа. Реакционную смесь разбавляют этилацетатом и промывают водой. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Фильтрат концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан:этилацетат (1:1), получают 1,348 г трет-бутил-4-[7-(2-бутинил)-2,6-дихлор-7Н-пурин-8-ил]пиперазин-1-карбоксилата [1H-ЯМР (CDCl3) δ 1,50 (с, 9Н), 1,87 (т, J=2,4 Гц, 3Н), 3,64 (м, 8H), 4,81 (кв, J=2,4 Гц, 2Н)], а из фракции, элюированной смесью гексан-этилацетат (1:9), получают 1,238 г трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата [1H-ЯМР (CDCl3) δ 1,49 (с, 9Н), 1,83 (т, J=2,4 Гц, 3Н), 3,42-3,44 (м, 4H), 3,59-3,62 (м, 4H), 3,73 (с, 3H), 4,93 (кв, J=2,4 Гц, 2Н)].5.127 g of tert-butyl-4- [7- (2-butynyl) -1-methyl-2,6-dioxo-2,3,6,7-tetrahydro-1H-purin-8-yl] piperazine-1-carboxylate dissolved in 75 ml of phosphorus oxychloride and then the mixture is stirred at 120 ° C overnight. The reaction solution was concentrated and the residue was dissolved in 50 ml of tetrahydrofuran. The resulting solution was poured into a suspension of 7 g of di-tert-butyl dicarbonate, 50 ml of tetrahydrofuran, 100 g of sodium bicarbonate and 200 ml of water, and the mixture was stirred at room temperature for 1 hour. The reaction mixture was diluted with ethyl acetate and washed with water. The organic layer was dried over anhydrous magnesium sulfate and then filtered. The filtrate was concentrated and the residue was purified by silica gel column chromatography. Thus, from the fraction eluted with hexane: ethyl acetate (1: 1), 1.348 g of tert-butyl-4- [7- (2-butynyl) -2,6-dichloro-7H-purin-8-yl] piperazine- are obtained 1-carboxylate [ 1 H-NMR (CDCl 3 ) δ 1.50 (s, 9H), 1.87 (t, J = 2.4 Hz, 3H), 3.64 (m, 8H), 4.81 (q, J = 2.4 Hz, 2H)], and from the fraction eluted with hexane-ethyl acetate (1: 9), 1.238 g of tert-butyl-4- [7- (2-butynyl) -2-chloro are obtained -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate [ 1 H-NMR (CDCl 3 ) δ 1.49 (s, 9H), 1.83 (t, J = 2.4 Hz, 3H), 3.42-3.44 (m, 4H), 3.59-3.62 (m, 4H), 3.73 (s, 3H), 4, 93 (q, J = 2.4 Hz, 2H)].
(b) Трифторацетат 7-(2-бутинил)-2-метокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она(b) 7- (2-Butynyl) -2-methoxy-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл метанола и к полученному раствору добавляют 10 мг гидрида натрия. Полученную смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,72 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of methanol and 10 mg of sodium hydride is added to the resulting solution. The resulting mixture was stirred at room temperature for 1 hour. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.72 mg of the title compound.
МС m/e (ESI) 317 (MH+-CF3COOH).MS m / e (ESI) 317 (MH + -CF 3 COOH).
Пример 12Example 12
7-(2-Бутинил)-2-этокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он7- (2-Butynyl) -2-ethoxy-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one
Следуя способу примера 11 и используя этанол вместо метанола в примере (11b), получают трифторацетат указанного в заголовке соединения. Полученное соединение подвергают хроматографической очистке с использованием NH-силикагеля. Таким образом указанное в заголовке соединение было получено из фракции, элюированной смесью этилацетат-метанол (20:1).Following the method of Example 11 and using ethanol instead of methanol in Example (11b), the trifluoroacetate of the title compound was obtained. The resulting compound was chromatographed using NH-silica gel. Thus, the title compound was obtained from the fraction eluted with ethyl acetate-methanol (20: 1).
1H-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,42 (т, J=7,2 Гц, 3H), 1,82 (т, J=2,4 Гц, 3H), 3,02-3,06 (м, 4H), 3,40-3,42 (м, 4H), 3,46 (с, 3H), 4,51 (кв, J=7,2 Гц, 2H), 4,90 (кв, J=2,4 Гц, 2H).δ 1.42 (t, J = 7.2 Hz, 3H), 1.82 (t, J = 2.4 Hz, 3H), 3.02-3.06 (m, 4H), 3.40- 3.42 (m, 4H), 3.46 (s, 3H), 4.51 (q, J = 7.2 Hz, 2H), 4.90 (q, J = 2.4 Hz, 2H).
МС m/e (ESI) 331 (MH+).MS m / e (ESI) 331 (MH + ).
Пример 13Example 13
Этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетатEthyl- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetate
Пример 14Example 14
[7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]уксусная кислота[7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetic acid
Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетата и трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]уксусной кислоты [МС m/e (ESI) 361(MH+-CF3COOH)] получают обработкой трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата этил-2-гидроксиацетатом, вместо этанола, следуя способу, описанному в примере 11. Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетата подвергают хроматографической очистке с использованием NH-силикагеля. Таким образом из фракции, элюированной смесью этилацетат-метанол (20:1), получают этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетат [1H-ЯМР (CDCl3) δ 1,29 (т, J=7,2 Гц, 3H), 1,83 (т, J=2,4 Гц, 3H), 3,02-3,06 (м, 4H), 3,38-3,41 (м, 4H), 3,55 (с, 3H), 4,22 (кв, J=7,2 Гц, 2H), 4,90 (кв, J=2,4 Гц, 2H), 5,03 (с, 2H). МС m/e (ESI) 389(MH+)].Ethyl [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetate trifluoroacetate and trifluoroacetate [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetic acid [MS m / e (ESI) 361 ( MH + -CF 3 COOH)] is obtained by treating tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl ] piperazine-1-carboxylate with ethyl 2-hydroxyacetate, instead of ethanol, following the method described in example 11. Ethyl [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazine-1-) trifluoroacetate il) -6,7-dihydro-1H-purin-2-yloxy] acetate is subjected to chromatographic purification with Using NH-silica gel. Thus, ethyl- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7- is obtained from the fraction eluted with ethyl acetate-methanol (20: 1). dihydro-1H-purin-2-yloxy] acetate [ 1 H-NMR (CDCl 3 ) δ 1.29 (t, J = 7.2 Hz, 3H), 1.83 (t, J = 2.4 Hz, 3H), 3.02-3.06 (m, 4H), 3.38-3.41 (m, 4H), 3.55 (s, 3H), 4.22 (q, J = 7.2 Hz , 2H), 4.90 (q, J = 2.4 Hz, 2H), 5.03 (s, 2H). MS m / e (ESI) 389 (MH + )].
Пример 15Example 15
Трифторацетат 7-(2-бутинил)-2-(2-метоксиэтокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-methoxyethoxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Следуя способу, описанному в примере 13, используя 2-метоксиэтанол вместо этил-2-гидроксиацетата, получают указанное в заголовке соединение.Following the method described in Example 13, using 2-methoxyethanol instead of ethyl 2-hydroxyacetate, the title compound was obtained.
МС m/e (ESI) 361 (MH+-CF3COOH).MS m / e (ESI) 361 (MH + -CF 3 COOH).
Пример 16Example 16
Этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]циклопропанкарбоксилатEthyl 1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] cyclopropanecarboxylate
Используя этил-1-гидроксициклопропанкарбоксилат вместо этил-2-гидроксиацетата в примере 13, следуя способу, описанному в этом примере, получают трифторацетат указанного в заголовке соединения. Полученное соединение подвергают хроматографической очистке с использованием NH-силикагеля. Указанное в заголовке соединение получают из фракции, элюированной смесью этилацетат-метанол (20:1).Using ethyl 1-hydroxycyclopropanecarboxylate instead of ethyl 2-hydroxyacetate in Example 13, following the method described in this Example, trifluoroacetate of the title compound was obtained. The resulting compound was chromatographed using NH-silica gel. The title compound was obtained from the fraction eluted with ethyl acetate-methanol (20: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,19 (т, J=7,2 Гц, 3H), 1,39-1,42 (м, 2H), 1,67-1,71 (м, 2H), 1,83 (т, J=2,4 Гц, 3H), 3,02-3,05 (м, 4H), 3,37-3,40 (м, 4H), 3,49 (с, 3H), 4,14 (кв, J=7,2 Гц, 2H), 4,90 (кв, J=2,4 Гц, 2H).δ 1.19 (t, J = 7.2 Hz, 3H), 1.39-1.42 (m, 2H), 1.67-1.71 (m, 2H), 1.83 (t, J = 2.4 Hz, 3H), 3.02-3.05 (m, 4H), 3.37-3.40 (m, 4H), 3.49 (s, 3H), 4.14 (q, J = 7.2 Hz, 2H); 4.90 (q, J = 2.4 Hz, 2H).
МС m/e (ESI) 415 (MH+).MS m / e (ESI) 415 (MH + ).
Пример 17Example 17
Трифторацетат 1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]циклопропанкарбоновой кислоты1- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] cyclopropanecarboxylic acid trifluoroacetate
20 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 20 мг этил-1-гидроксициклопропанкарбоксилата растворяют в 20 мл N-метилпирролидона и к полученному раствору добавляют 10 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют с получением 63 мг трет-бутил-4-[7-(2-бутинил)-2-(1-этоксикарбонилциклопропилокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. Полученное соединение растворяют в растворе, состоящем из 0,4 мл этанола и 0,1 мл 5 н. водного раствора гидроксида натрия, и полученную смесь перемешивают при 50ºС в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют с получением 22 мг трет-бутил-4-[7-(2-бутинил)-2-(1-карбоксициклопропилокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. 11 мг полученного соединения растворяют в трифторуксусной кислоте и полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,64 мг указанного в заголовке соединения.20 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate and 20 mg of ethyl 1-hydroxycyclopropanecarboxylate was dissolved in 20 ml of N-methylpyrrolidone and 10 mg of sodium hydride was added to the resulting solution. The mixture was stirred at room temperature overnight. To the reaction solution was added 1N. hydrochloric acid and the resulting mixture was extracted with ethyl acetate. The organic layer was concentrated to give 63 mg of tert-butyl-4- [7- (2-butynyl) -2- (1-ethoxycarbonylcyclopropyloxy) -1-methyl-6-oxo-6,7-dihydro-1H-purine-8- yl] piperazine-1-carboxylate. The resulting compound is dissolved in a solution consisting of 0.4 ml of ethanol and 0.1 ml of 5 N. an aqueous solution of sodium hydroxide, and the resulting mixture was stirred at 50 ° C overnight. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated to obtain 22 mg of tert-butyl-4- [7- (2-butynyl) -2- (1-carboxycyclopropyloxy) -1-methyl-6-oxo-6,7-dihydro-1H-purine-8- yl] piperazine-1-carboxylate. 11 mg of the obtained compound was dissolved in trifluoroacetic acid, and the resulting mixture was concentrated. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.64 mg of the title compound.
МС m/e (ESI) 387 (MH+-CF3COOH).MS m / e (ESI) 387 (MH + -CF 3 COOH).
Пример 18Example 18
Трифторацетат 1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]циклопропанкарбоксамидаTrifluoroacetate 1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] cyclopropanecarboxamide
11 мг трет-бутил-4-[7-(2-бутинил)-2-(1-карбоксициклопропилокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1 мл тетрагидрофурана и добавляют 0,05 мл триэтиламина и 0,05 мл этилхлоркарбоната. Полученную смесь перемешивают при комнатной температуре в течение 15 минут. К раствору добавляют 0,1 мл 20% водного раствора аммиака и полученную смесь перемешивают при комнатной температуре в течение 15 минут. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученную смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,18 мг указанного в заголовке соединения.11 mg tert-butyl-4- [7- (2-butynyl) -2- (1-carboxycyclopropyloxy) -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazin-1 β-carboxylate is dissolved in 1 ml of tetrahydrofuran and 0.05 ml of triethylamine and 0.05 ml of ethyl chlorocarbonate are added. The resulting mixture was stirred at room temperature for 15 minutes. 0.1 ml of a 20% aqueous ammonia solution was added to the solution, and the resulting mixture was stirred at room temperature for 15 minutes. Water was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.18 mg of the title compound.
МС m/e (ESI) 386 (MH+-CF3COOH).MS m / e (ESI) 386 (MH + -CF 3 COOH).
Пример 19Example 19
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-оксотетрагидрофуран-3-илокси)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (2-oxotetrahydrofuran-3-yloxy) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя 3-гидроксидигидрофуран-2-он вместо этил-2-гидроксиацетата и следуя способу, описанному в примере 13, получают указанное в заголовке соединение.Using 3-hydroxy dihydrofuran-2-one instead of ethyl 2-hydroxyacetate and following the method described in Example 13, the title compound is obtained.
МС m/e (ESI) 387 (MH+-CF3COOH).MS m / e (ESI) 387 (MH + -CF 3 COOH).
Пример 20Example 20
Трифторацетат 7-(2-бутинил)-1-метил-2-фенокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-phenoxy-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя фенол вместо этил-2-гидроксиацетата в примере 13 и следуя способу, описанному в этом примере, получают указанное в заголовке соединение.Using phenol instead of ethyl 2-hydroxyacetate in Example 13 and following the method described in this Example, the title compound is obtained.
МС m/e (ESI) 379 (MH+-CF3COOH).MS m / e (ESI) 379 (MH + -CF 3 COOH).
Пример 21Example 21
Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетатаEthyl [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] acetate trifluoroacetate
Используя этил-2-(трет-бутоксикарбонил)ацетат вместо этил-2-гидроксиацетата в примере 13 и следуя способу, описанному в этом способе, получают указанное в заголовке соединение.Using ethyl 2- (tert-butoxycarbonyl) acetate instead of ethyl 2-hydroxyacetate in Example 13 and following the method described in this method, the title compound is obtained.
МС m/e (ESI) 373 (MH+-CF3COOH).MS m / e (ESI) 373 (MH + -CF 3 COOH).
Пример 22Example 22
Трифторацетат 7-(2-бутинил)-1,2-диметил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1,2-dimethyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 2 мг тетракис(трифенилфосфин)палладия растворяют в 0,2 мл диоксана и к полученному раствору добавляют 0,2 мл хлорида метилцинка (1,5 М раствор в тетрагидрофуране). Полученную смесь перемешивают при 50ºС в течение 0,5 часа. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Полученную смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,56 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate and 2 mg tetrakis (triphenylphosphine) palladium is dissolved in 0.2 ml of dioxane and 0.2 ml of methylzinc chloride (1.5 M solution in tetrahydrofuran) is added to the resulting solution. The resulting mixture was stirred at 50 ° C for 0.5 hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 4.56 mg of the title compound.
МС m/e (ESI) 301 (MH+-CF3COOH).MS m / e (ESI) 301 (MH + -CF 3 COOH).
Пример 23Example 23
Трифторацетат 7-(2-бутинил)-1-метил-2-бутил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-butyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 2 мг тетракис(трифенилфосфин)палладия растворяют в 0,2 мл диоксана и к полученному раствору добавляют 0,3 мл раствора, полученного из 0,5 мл хлорида бутилмагния (2,0 М раствор в диэтиловом эфире) и 2 мл хлорида цинка (0,5 М раствор в тетрагидрофуране). Полученную смесь перемешивают при 50ºС в течения пяти часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,38 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate and 2 mg tetrakis (triphenylphosphine) palladium is dissolved in 0.2 ml of dioxane and 0.3 ml of a solution obtained from 0.5 ml of butylmagnesium chloride (2.0 M solution in diethyl ether) and 2 ml of zinc chloride are added to the resulting solution (0, 5 M solution in tetrahydrofuran). The resulting mixture was stirred at 50 ° C for five hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 3.38 mg of the title compound.
МС m/e (ESI) 343 (MH+-CF3COOH).MS m / e (ESI) 343 (MH + -CF 3 COOH).
Пример 24Example 24
Трифторацетат 7-(2-бутинил)-1-метил-2-бензил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-benzyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Указанное в заголовке соединение получают с использованием смешанного раствора, состоящего из 0,5 мл хлорида бензилмагния (2,0 М раствор в диэтиловом эфире) и 2 мл хлорида цинка (0,5 М раствор в тетрагидрофуране), следуя способу, описанному в примере 23.The title compound was prepared using a mixed solution of 0.5 ml of benzyl magnesium chloride (2.0 M solution in diethyl ether) and 2 ml of zinc chloride (0.5 M solution in tetrahydrofuran), following the method described in Example 23 .
МС m/e (ESI) 377 (MH+-CF3COOH).MS m / e (ESI) 377 (MH + -CF 3 COOH).
Пример 25Example 25
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (2-phenylethyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Указанное в заголовке соединение получают с использованием смешанного раствора, полученного из 0,5 мл хлорида фенетилмагния (2,0 М раствор в диэтиловом эфире) и 2 мл хлорида цинка (0,5 М раствор в тетрагидрофуране), следуя способу, описанному в примере 23.The title compound was prepared using a mixed solution obtained from 0.5 ml of phenethyl magnesium chloride (2.0 M solution in diethyl ether) and 2 ml of zinc chloride (0.5 M solution in tetrahydrofuran), following the method described in example 23 .
МС m/e (ESI) 391(MH+-CF3COOH).MS m / e (ESI) 391 (MH + -CF 3 COOH).
Пример 26Example 26
Трифторацетат 7-(2-бутинил)-1-метил-2-фенил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-phenyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 2 мг тетракис(трифенилфосфин)палладия и 20 мг фенилтрибутилолова растворяют в 0,2 мл диоксана и полученную смесь перемешивают в при 80ºС течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,62 мг указанного в заголовке соединения.10 mg tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate, 2 mg tetrakis (triphenylphosphine) palladium and 20 mg phenyltributyltin are dissolved in 0.2 ml of dioxane and the resulting mixture is stirred at 80 ° C for 5 hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 4.62 mg of the title compound.
МС m/e (ESI) 363 (MH+-CF3COOH).MS m / e (ESI) 363 (MH + -CF 3 COOH).
Пример 27Example 27
Трифторацетат 7-(2-бутинил)-1-метил-2-амино-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-amino-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 20% водного раствора аммиака и полученную смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,82 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of a 20% aqueous ammonia solution and the resulting mixture was stirred at 80 ° C for 5 hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 3.82 mg of the title compound.
МС m/e (ESI) 302 (MH+-CF3COOH).MS m / e (ESI) 302 (MH + -CF 3 COOH).
Пример 28Example 28
Трифторацетат 7-(2-бутинил)-1-метил-2-метиламино-(8-пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-methylamino (8-piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 40% водного раствора метиламина и полученную смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 6,95 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of a 40% aqueous solution of methylamine and the resulting mixture was stirred at 80 ° C for 5 hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 6.95 mg of the title compound.
МС m/e (ESI) 316 (MH+-CF3COOH).MS m / e (ESI) 316 (MH + -CF 3 COOH).
Пример 29Example 29
Трифторацетат 7-(2-бутинил)-1-метил-2-диметиламино-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-dimethylamino-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 40% водного раствора диметиламина и полученную смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Смесь концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 6,95 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of a 40% aqueous solution of dimethylamine and the resulting mixture was stirred at 80 ° C for 5 hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The mixture was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 6.95 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,82 (т, J=2,4 Гц, 3H), 2,83 (с, 6H), 3,02-3,05 (м, 4H), 3,39-3,42 (м, 4H), 3,56 (с, 3H), 4,90 (д, J=2,4 Гц, 2H).δ 1.82 (t, J = 2.4 Hz, 3H), 2.83 (s, 6H), 3.02-3.05 (m, 4H), 3.39-3.42 (m, 4H ), 3.56 (s, 3H), 4.90 (d, J = 2.4 Hz, 2H).
МС m/e (ESI) 330 (MH+-CF3COOH).MS m / e (ESI) 330 (MH + -CF 3 COOH).
Пример 30Example 30
Трифторацетат этил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]ацетатаEthyl [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] acetate trifluoroacetate
10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг гидрохлорида этилового эфира глицина и 50 мкл триэтиламина. Смесь перемешивают при 80ºС в течение 12 часов. Затем реакционный раствор концентрируют, продувая его газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и раствор концентрируют продувкой газообразного азота. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 7,60 мг указанного в заголовке соединения.10 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, and 15 mg of glycine ethyl ester hydrochloride and 50 μl of triethylamine are added to the resulting solution. The mixture is stirred at 80 ° C for 12 hours. Then the reaction solution was concentrated by flushing it with nitrogen gas. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 7.60 mg of the title compound.
МС m/e (ESI) 388 (MH+-CF3COOH).MS m / e (ESI) 388 (MH + -CF 3 COOH).
Пример 31Example 31
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]уксусной кислоты[7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] acetic acid trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг гидрохлорида трет-бутилового эфира глицина и 50 мкл триэтиламина. После перемешивания полученной смеси при 80ºС в течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,36 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, and 15 mg of glycine tert-butyl ether hydrochloride and 50 μl of triethylamine are added to the resulting solution. After stirring the resulting mixture at 80 ° C for 12 hours, the reaction solution was concentrated by purging with nitrogen gas. The resulting residue was dissolved in 0.40 ml of trifluoroacetic acid, and the solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 2.36 mg of the title compound.
МС m/e (ESI) 360 (MH+-CF3COOH).MS m / e (ESI) 360 (MH + -CF 3 COOH).
Пример 32Example 32
Трифторацетат этил-[N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]уксусной кислотыEthyl [N- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] methylamino] acetic trifluoroacetate acid
Используя гидрохлорид этилового эфира N-метилглицина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 2,06 мг указанного в заголовке соединения.Using N-methylglycine ethyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 2.06 mg of the title compound was obtained.
МС m/e (ESI) 402 (MH+-CF3COOH).MS m / e (ESI) 402 (MH + -CF 3 COOH).
Пример 33Example 33
Трифторацетат метил-(S)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоксилатаMethyl (S) -1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl trifluoroacetate] pyrrolidine 2-carboxylate
Используя гидрохлорид метилового эфира L-пролина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 1,35 мг указанного в заголовке соединения.Using L-proline methyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 1.35 mg of the title compound are obtained.
МС m/e (ESI) 414(MH+-CF3COOH).MS m / e (ESI) 414 (MH + -CF 3 COOH).
Пример 34Example 34
Трифторацетат [N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]уксусной кислоты[N- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] methylamino] acetic acid trifluoroacetate
Используя гидрохлорид трет-бутилового эфира N-метилглицина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 3,16 мг указанного в заголовке соединения.Using N-methylglycine tert-butyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 3.16 mg of the title compound was obtained.
МС m/e (ESI) 374(MH+-CF3COOH).MS m / e (ESI) 374 (MH + -CF 3 COOH).
Пример 35Example 35
Трифторацетат метил-(R)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоксилатаMethyl- (R) -1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl trifluoroacetate] pyrrolidine 2-carboxylate
Используя гидрохлорид метилового эфира D-пролина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 0,74 мг указанного в заголовке соединения.Using D-proline methyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 0.74 mg of the title compound was obtained.
МС m/e (ESI) 414 (MH+-CF3COOH).MS m / e (ESI) 414 (MH + -CF 3 COOH).
Пример 36Example 36
Трифторацетат метил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионатаMethyl 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] propionate trifluoroacetate
Используя гидрохлорид метилового эфира DL-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 1,20 мг указанного в заголовке соединения.Using DL-alanine methyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 1.20 mg of the title compound was obtained.
МС m/e (ESI) 388(MH+-CF3COOH).MS m / e (ESI) 388 (MH + -CF 3 COOH).
Пример 37Example 37
Трифторацетат метил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]-2-метилпропионатаMethyl 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] -2-methylpropionate trifluoroacetate
Используя гидрохлорид метил-2-аминоизобутилата вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 1,18 мг указанного в заголовке соединения.Using methyl 2-aminoisobutylate hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 1.18 mg of the title compound was obtained.
МС m/e (ESI) 402 (MH+-CF3COOH).MS m / e (ESI) 402 (MH + -CF 3 COOH).
Пример 38Example 38
Трифторацетат этил-(S)-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионатаEthyl (S) -2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino trifluoroacetate] propionate
Используя гидрохлорид этилового эфира L-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 2,38 мг указанного в заголовке соединения.Using L-alanine ethyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 2.38 mg of the title compound are obtained.
МС m/e (ESI) 402 (MH+-CF3COOH).MS m / e (ESI) 402 (MH + -CF 3 COOH).
Пример 39Example 39
Трифторацетат (S)-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионовой кислоты(S) -2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] propionic acid trifluoroacetate
Используя гидрохлорид трет-бутилового эфира L-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 0,76 мг указанного в заголовке соединения.Using L-alanine tert-butyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 0.76 mg of the title compound was obtained.
МС m/e (ESI) 374 (MH+-CF3COOH).MS m / e (ESI) 374 (MH + -CF 3 COOH).
Пример 40Example 40
Трифторацетат этил-3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионатаEthyl 3- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] propionate trifluoroacetate
Используя гидрохлорид этилового эфира β-аланина вместо гидрохлорида этилового эфира глицина в примере 30, следуя способу, описанному в этом примере, получают 0,85 мг указанного в заголовке соединения.Using β-alanine ethyl ester hydrochloride instead of glycine ethyl ester hydrochloride in Example 30, following the method described in this example, 0.85 mg of the title compound was obtained.
МС m/e (ESI) 402 (MH+-CF3COOH).MS m / e (ESI) 402 (MH + -CF 3 COOH).
Пример 41Example 41
Трифторацетат 7-(2-бутинил)-2-(2-этоксиэтиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-ethoxyethylamino) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл 2-этоксиэтиламина. После перемешивания полученной смеси в при 80ºС течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с образованием 6,95 мг указанного в заголовке соединения.10 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 20 μl of 2-ethoxyethylamine are added to the resulting solution. After the resulting mixture was stirred at 80 ° C for 12 hours, the reaction solution was concentrated by purging with nitrogen gas. The resulting residue was dissolved in 0.40 ml of trifluoroacetic acid, and the mixture was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 6.95 mg of the title compound.
МС m/e (ESI) 374 (MH+-CF3COOH).MS m / e (ESI) 374 (MH + -CF 3 COOH).
Пример 42Example 42
Трифторацетат 7-(2-бутинил)-1-метил-2-(морфолин-4-ил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (morpholin-4-yl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя морфолин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 7,31 мг указанного в заголовке соединения.Using morpholine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 7.31 mg of the title compound was obtained.
МС m/e (ESI) 372 (MH+-CF3COOH).MS m / e (ESI) 372 (MH + -CF 3 COOH).
Пример 43Example 43
Трифторацетат 2-бензиламино-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2-Benzylamino-7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя бензиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 8,40 мг указанного в заголовке соединения.Using benzylamine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 8.40 mg of the title compound was obtained.
МС m/e (ESI) 392 (MH+-CF3COOH).MS m / e (ESI) 392 (MH + -CF 3 COOH).
Пример 44Example 44
Трифторацетат этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-4-карбоксилатаEthyl 1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] piperidin-4- trifluoroacetate carboxylate
Используя этилизонипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 7,43 мг указанного в заголовке соединения.Using ethyl isonipecotate instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 7.43 mg of the title compound was obtained.
МС m/e (ESI) 442 (MH+-CF3COOH).MS m / e (ESI) 442 (MH + -CF 3 COOH).
Пример 45Example 45
Трифторацетат 2-(N-бензилметиламино)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2- (N-benzylmethylamino) -7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя этил-N-метилбензиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,38 мг указанного в заголовке соединения.Using ethyl N-methylbenzylamine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 2.38 mg of the title compound is obtained.
Масс-спектр m/e (ESI) 406 (MH+-CF3COOH).Mass spectrum m / e (ESI) 406 (MH + -CF 3 COOH).
Пример 46Example 46
Трифторацетат 7-(2-бутинил)-2-(4-хлорбензиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (4-chlorobenzylamino) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя 4-хлорбензиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,84 мг указанного в заголовке соединения.Using 4-chlorobenzylamine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 2.84 mg of the title compound was obtained.
МС m/e (ESI) 426 (MH+-CF3COOH).MS m / e (ESI) 426 (MH + -CF 3 COOH).
Пример 47Example 47
Трифторацетат 7-(2-бутинил)-2-(4-метоксибензиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (4-methoxybenzylamino) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя 4-метоксибензиламин, следуя способу, описанному в примере 41, получают 3,77 мг указанного в заголовке соединения.Using 4-methoxybenzylamine, following the method described in Example 41, 3.77 mg of the title compound are obtained.
МС m/e (ESI) 422 (MH+-CF3COOH).MS m / e (ESI) 422 (MH + -CF 3 COOH).
Пример 48Example 48
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-фенилэтиламино)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (2-phenylethylamino) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя фенетиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,70 мг указанного в заголовке соединения.Using phenethylamine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 2.70 mg of the title compound was obtained.
МС m/e (ESI) 406 (MH+-CF3COOH).MS m / e (ESI) 406 (MH + -CF 3 COOH).
Пример 49Example 49
Трифторацетат 7-(2-бутинил)-1-метил-2-[N-(2-фенилэтил)метиламино]-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- [N- (2-phenylethyl) methylamino] -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя N-метилфенетиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,17 мг указанного в заголовке соединения.Using N-methylphenethylamine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 2.17 mg of the title compound is obtained.
МС m/e (ESI) 420 (MH+-CF3COOH).MS m / e (ESI) 420 (MH + -CF 3 COOH).
Пример 50Example 50
Трифторацетат этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоксилатаEthyl 1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] piperidin-3- trifluoroacetate carboxylate
Используя этилнипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,93 мг указанного в заголовке соединения.Using ethylnipecotate instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 2.93 mg of the title compound was obtained.
МС m/e (ESI) 442(MH+-CF3COOH).MS m / e (ESI) 442 (MH + -CF 3 COOH).
Пример 51Example 51
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-илметиламино)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyridin-2-ylmethylamino) -1,7-dihydropurin-6-one trifluoroacetate
Используя 2-аминометилпиридин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 1,62 мг указанного в заголовке соединения.Using 2-aminomethylpyridine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 1.62 mg of the title compound was obtained.
МС m/e (ESI) 393(MH+-CF3COOH).MS m / e (ESI) 393 (MH + -CF 3 COOH).
Пример 52Example 52
Трифторацетат этил-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-2-карбоксилатаEthyl 1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] piperidin-2- trifluoroacetate carboxylate
Используя этилнипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 0,97 мг указанного в заголовке соединения.Using ethylnipecotate instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 0.97 mg of the title compound was obtained.
МС m/e (ESI) 442(MH+-CF3COOH).MS m / e (ESI) 442 (MH + -CF 3 COOH).
Пример 53Example 53
Трифторацетат (S)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоновой кислотыTrifluoroacetate (S) -1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] pyrrolidin- 2-carboxylic acid
Используя трет-бутиловый эфир L-пролина вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 4,07 мг указанного в заголовке соединения.Using L-proline tert-butyl ether instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 4.07 mg of the title compound was obtained.
МС m/e (ESI) 400(MH+-CF3COOH).MS m / e (ESI) 400 (MH + -CF 3 COOH).
Пример 54Example 54
Трифторацетат 7-(2-бутинил)-2-диэтиламино-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-diethylamino-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя диэтиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,24 мг указанного в заголовке соединения.Using diethylamine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 2.24 mg of the title compound is obtained.
МС m/e (ESI) 358 (MH+-CF3COOH).MS m / e (ESI) 358 (MH + -CF 3 COOH).
Пример 55Example 55
Трифторацетат 7-(2-бутинил)-2-(N-этилметиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (N-ethylmethylamino) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя N-этилметиламин вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 3,27 мг указанного в заголовке соединения.Using N-ethylmethylamine instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 3.27 mg of the title compound was obtained.
МС m/e (ESI) 344 (MH+-CF3COOH).MS m / e (ESI) 344 (MH + -CF 3 COOH).
Пример 56Example 56
Трифторацетат этил-(R)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоксилатаEthyl (R) -1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl trifluoroacetate] piperidine-3-carboxylate
Используя этил-(R)-нипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 0,87 мг указанного в заголовке соединения.Using ethyl- (R) -nipecotate instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 0.87 mg of the title compound is obtained.
МС m/e (ESI) 442 (MH+-CF3COOH).MS m / e (ESI) 442 (MH + -CF 3 COOH).
Пример 57Example 57
Трифторацетат этил-(S)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоксилатаEthyl (S) -1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl trifluoroacetate] piperidine-3-carboxylate
Используя этил-(L)-нипекотат вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 2,94 мг указанного в заголовке соединения.Using ethyl (L) -nipecotate instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 2.94 mg of the title compound was obtained.
МС m/e (ESI) 442 (MH+-CF3COOH).MS m / e (ESI) 442 (MH + -CF 3 COOH).
Пример 58Example 58
Трифторацетат [N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]ацетонитрила[N- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] methylamino] acetonitrile trifluoroacetate
Используя метиламиноацетонитрил вместо 2-этоксиэтиламина в примере 41, следуя способу, описанному в этом примере, получают 1,00 мг указанного в заголовке соединения.Using methylaminoacetonitrile instead of 2-ethoxyethylamine in Example 41, following the method described in this example, 1.00 mg of the title compound are obtained.
МС m/e (ESI) 355 (MH+-CF3COOH).MS m / e (ESI) 355 (MH + -CF 3 COOH).
Пример 59Example 59
Трифторацетат 7-(2-бутинил)-2-изопропиламино-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-isopropylamino-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 50 мкл изопропиламина. Смесь перемешивают при 60ºС в течение 5 часов и затем реакционный раствор концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,28 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 50 μl of isopropylamine are added to the resulting solution. The mixture was stirred at 60 ° C for 5 hours and then the reaction solution was concentrated by purging with nitrogen gas. The resulting residue was dissolved in 0.40 ml of trifluoroacetic acid, and the mixture was concentrated by purging with nitrogen gas. The resulting residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 2.28 mg of the title compound.
МС m/e (ESI) 344 (MH+-CF3COOH).MS m / e (ESI) 344 (MH + -CF 3 COOH).
Пример 60Example 60
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-иламино)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyridin-2-ylamino) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 50 мкл 2-аминопиридина. Смесь перемешивают при 110ºС в течение 12 часов и затем концентрируют продувкой газообразным азотом. Полученный остаток растворяют в 0,40 мл трифторуксусной кислоты и смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,10 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 50 μl of 2-aminopyridine are added to the resulting solution. The mixture is stirred at 110 ° C. for 12 hours and then concentrated by purging with nitrogen gas. The resulting residue was dissolved in 0.40 ml of trifluoroacetic acid, and the mixture was concentrated by purging with nitrogen gas. The resulting residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.10 mg of the title compound.
МС m/e (ESI) 379 (MH+-CF3COOH).MS m / e (ESI) 379 (MH + -CF 3 COOH).
Пример 61Example 61
Трифторацетат 7-(2-бутинил)-1-метил-2-фениламино-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-phenylamino-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 100 мкл анилина. Смесь перемешивают при 110ºС в течение 12 часов и затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,23 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 100 μl of aniline is added to the resulting solution. The mixture is stirred at 110 ° C. for 12 hours and then concentrated by purging with nitrogen gas. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the resulting mixture was concentrated by purging with nitrogen gas. The resulting residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 3.23 mg of the title compound.
МС m/e (ESI) 378 (MH+-CF3COOH).MS m / e (ESI) 378 (MH + -CF 3 COOH).
Пример 62Example 62
Трифторацетат 1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пиперидин-3-карбоновой кислоты1- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] piperidine-3-carboxylic acid trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл этилнипекотата. Смесь перемешивают при 80ºС в течение 12 часов и затем концентрируют продувкой газообразным азотом. Остаток растворяют в растворе, состоящем из 0,20 мл этанола и 0,20 мл 5 н. водного раствора гидроксида натрия. Смесь перемешивают при комнатной температуре в течение пяти часов и концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,92 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 20 μl of ethylnipecotate are added to the resulting solution. The mixture was stirred at 80 ° C for 12 hours and then concentrated by purging with nitrogen gas. The residue is dissolved in a solution consisting of 0.20 ml of ethanol and 0.20 ml of 5 N. an aqueous solution of sodium hydroxide. The mixture was stirred at room temperature for five hours and concentrated by purging with nitrogen gas. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the resulting mixture was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.92 mg of the title compound.
МС m/e (ESI) 414 (MH+-CF3COOH).MS m / e (ESI) 414 (MH + -CF 3 COOH).
Пример 63Example 63
Трифторацетат (R)-1-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]пирролидин-2-карбоновой кислотыTrifluoroacetate (R) -1- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] pyrrolidin- 2-carboxylic acid
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг гидрохлорида метилового эфира D-пролина и 50 мкл триэтиламина. После перемешивания полученной смеси при 80ºС в течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Остаток растворяют в растворе, состоящем из 0,20 мл этанола и 0,20 мл 5 н. водного раствора гидроксида натрия. Смесь перемешивают при комнатной температуре в течение пяти часов и затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,42 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, and 15 mg of D-proline methyl ester hydrochloride and 50 μl of triethylamine are added to the resulting solution. After stirring the resulting mixture at 80 ° C for 12 hours, the reaction solution was concentrated by purging with nitrogen gas. The residue is dissolved in a solution consisting of 0.20 ml of ethanol and 0.20 ml of 5 N. an aqueous solution of sodium hydroxide. The mixture was stirred at room temperature for five hours and then concentrated by purging with nitrogen gas. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the resulting mixture was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.42 mg of the title compound.
МС m/e (ESI) 400 (MH+-CF3COOH).MS m / e (ESI) 400 (MH + -CF 3 COOH).
Пример 64Example 64
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]пропионовой кислоты2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] propionic acid trifluoroacetate
Используя гидрохлорид метилового эфира DL-аланина вместо гидрохлорида метилового эфира D-пролина в примере 63, следуя способу, описанному в этом примере, получают 1,12 мг указанного в заголовке соединения.Using DL-alanine methyl ester hydrochloride instead of D-proline methyl ester hydrochloride in Example 63, following the method described in this example, 1.12 mg of the title compound was obtained.
МС m/e (ESI) 374 (MH+-CF3COOH).MS m / e (ESI) 374 (MH + -CF 3 COOH).
Пример 65Example 65
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-илметилокси)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyridin-2-ylmethyloxy) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 25 мг пиридин-2-илметанола и 5 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение 5 часов, затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с образованием 0,58 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 25 mg of pyridin-2-ylmethanol and 5 mg of sodium hydride are added to the resulting solution. The mixture was stirred at room temperature for 5 hours, then concentrated by purging with nitrogen gas. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the resulting mixture was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.58 mg of the title compound.
МС m/e (ESI) 394 (MH+-CF3COOH).MS m / e (ESI) 394 (MH + -CF 3 COOH).
Пример 66Example 66
Трифторацетат 7-(2-бутинил)-2-изопропокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-isopropoxy-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 0,10 мл изопропанола и 5 мг гидрида натрия. После перемешивания смеси при комнатной температуре в течение пяти часов к реакционному раствору добавляют насыщенный водный раствор хлорида аммония. Полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученную смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,68 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 0.10 ml of isopropanol and 5 mg of sodium hydride are added to the resulting solution. After the mixture was stirred at room temperature for five hours, a saturated aqueous solution of ammonium chloride was added to the reaction solution. The resulting mixture was extracted with ethyl acetate. The organic layer is concentrated. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the resulting mixture was concentrated by purging with nitrogen gas. The resulting residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 2.68 mg of the title compound.
МС m/e (ESI) 345 (MH+-CF3COOH).MS m / e (ESI) 345 (MH + -CF 3 COOH).
Пример 67Example 67
Трифторацетат 7-(2-бутинил)-2-(2-бутинилокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-butynyloxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя 2-бутин-1-ол вместо изопропанола в примере 66, следуя способу, описанному в этом примере, получают 3,40 мг указанного в заголовке соединения.Using 2-butyn-1-ol instead of isopropanol in Example 66, following the method described in this Example, 3.40 mg of the title compound are obtained.
МС m/e (ESI) 355 (MH+-CF3COOH).MS m / e (ESI) 355 (MH + -CF 3 COOH).
Пример 68Example 68
Трифторацетат метил-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетатаTrifluoroacetate methyl- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидина и к полученному раствору добавляют 20 мкл метилмеркаптоацетата и 6 мг карбоната калия. Раствор перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,83 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidine and 20 μl of methyl mercaptoacetate and 6 mg of potassium carbonate are added to the resulting solution. The solution was stirred at room temperature for five hours. A saturated aqueous solution of ammonium chloride was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.40 ml of trifluoroacetic acid. The resulting mixture was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 4.83 mg of the title compound.
МС m/e (ESI) 391 (MH+-CF3COOH).MS m / e (ESI) 391 (MH + -CF 3 COOH).
Пример 69Example 69
Трифторацетат этил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионатаEthyl 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] propionate trifluoroacetate
Используя этил-2-меркаптопропионат вместо метилмеркаптоацетата, следуя способу, описанному в примере 68, получают 4,30 мг указанного в заголовке соединения.Using ethyl 2-mercaptopropionate instead of methyl mercaptoacetate, following the method described in Example 68, 4.30 mg of the title compound are obtained.
МС m/e (ESI) 419 (MH+-CF3COOH).MS m / e (ESI) 419 (MH + -CF 3 COOH).
Пример 70Example 70
Трифторацетат этил-3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионатаEthyl 3- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] propionate trifluoroacetate
Используя этил-3-меркаптопропионат вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 3,75 мг указанного в заголовке соединения.Using ethyl 3-mercaptopropionate instead of methyl mercaptoacetate in Example 68, following the method described in this example, 3.75 mg of the title compound are obtained.
МС m/e (ESI) 419 (MH+-CF3COOH).MS m / e (ESI) 419 (MH + -CF 3 COOH).
Пример 71Example 71
Трифторацетат 7-(2-бутинил)-2-этилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-ethylsulfanyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя этантиол вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,70 мг указанного в заголовке соединения.Using ethanethiol instead of methyl mercaptoacetate in Example 68, following the method described in this example, 4.70 mg of the title compound was obtained.
МС m/e (ESI) 347 (MH+-CF3COOH).MS m / e (ESI) 347 (MH + -CF 3 COOH).
Пример 72Example 72
Трифторацетат 7-(2-бутинил)-2-(2-гидроксиэтилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-hydroxyethylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя 2-меркаптоэтанол вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 3,57 мг указанного в заголовке соединения.Using 2-mercaptoethanol in place of methyl mercaptoacetate in Example 68, following the method described in this example, 3.57 mg of the title compound is obtained.
МС m/e (ESI) 363 (MH+-CF3COOH).MS m / e (ESI) 363 (MH + -CF 3 COOH).
Пример 73Example 73
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-2-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyridin-2-ylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
Используя 2-меркаптопиридин вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,66 мг указанного в заголовке соединения.Using 2-mercaptopyridine instead of methyl mercaptoacetate in Example 68, following the method described in this example, 4.66 mg of the title compound are obtained.
МС m/e (ESI) 396 (MH+-CF3COOH).MS m / e (ESI) 396 (MH + -CF 3 COOH).
Пример 74Example 74
Трифторацетат 7-(2-бутинил)-1-метил-2-метилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-methylsulfanyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя метилмеркаптан (30% метанольный раствор) вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,08 мг указанного в заголовке соединения.Using methyl mercaptan (30% methanol solution) instead of methyl mercaptoacetate in Example 68, following the method described in this example, 4.08 mg of the title compound was obtained.
МС m/e (ESI) 333 (MH+-CF3COOH).MS m / e (ESI) 333 (MH + -CF 3 COOH).
Пример 75Example 75
Трифторацетат 7-(2-бутинил)-2-циклогексилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-cyclohexylsulfanyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя циклогексантиол вместо метилмеркаптоацетата в примере 68, следуя способу, описанному в этом примере, получают 4,13 мг указанного в заголовке соединения.Using cyclohexanethiol instead of methyl mercaptoacetate in Example 68, following the method described in this example, 4.13 mg of the title compound was obtained.
МС m/e (ESI) 401 (MH+-CF3COOH).MS m / e (ESI) 401 (MH + -CF 3 COOH).
Пример 76Example 76
Трифторацетат 7-(2-бутинил)-2-изопропилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-isopropylsulfanyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 15 мг натриевой соли пропан-2-тиола. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Полученную смесь концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,56 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 15 mg of propan-2-thiol sodium salt are added to the resulting solution. The resulting mixture was stirred at room temperature for five hours. A saturated aqueous solution of ammonium chloride was added to the reaction solution, and the resulting mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.40 ml of trifluoroacetic acid. The resulting mixture was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 4.56 mg of the title compound.
МС m/e (ESI) 361 (MH+-CF3COOH).MS m / e (ESI) 361 (MH + -CF 3 COOH).
Пример 77Example 77
Трифторацетат 2-трет-бутилсульфанил-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2-tert-butylsulfanyl-7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя натриевую соль 2-метил-2-пропантиола вместо натриевой соли пропан-2-тиола в примере 76, следуя способу, описанному в этом примере, получают 2,58 мг указанного в заголовке соединения.Using the 2-methyl-2-propanethiol sodium salt in place of the propan-2-thiol sodium salt in Example 76, following the method described in this example, 2.58 mg of the title compound was obtained.
МС m/e (ESI) 375 (MH+-CF3COOH).MS m / e (ESI) 375 (MH + -CF 3 COOH).
Пример 78Example 78
Трифторацетат 7-(2-бутинил)-2-меркапто-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-mercapto-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Пример 79Example 79
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]уксусной кислоты[7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetic acid trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл N-метилпирролидона и к полученному раствору добавляют 20 мкл метилмеркаптоацетата и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов и к реакционному раствору добавляют насыщенный водный раствор хлорида аммония. Полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Полученный остаток растворяют в растворе, состоящем из 0,20 мл этанола и 0,20 мл 5 н. водного раствора гидроксида натрия. Полученную смесь перемешивают при комнатной температуре в течение ночи и затем концентрируют продувкой газообразным азотом. Остаток растворяют в 0,40 мл трифторуксусной кислоты и полученный раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,96 мг трифторацетата 7-(2-бутинил)-2-меркапто-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она [МС m/e (ESI) 319 (MH+-CF3COOH)] и 0,61 мг трифторацетата [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]уксусной кислоты.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of N-methylpyrrolidone and 20 μl of methyl mercaptoacetate and 6 mg of potassium carbonate are added to the resulting solution. The resulting mixture was stirred at room temperature for five hours, and a saturated aqueous solution of ammonium chloride was added to the reaction solution. The resulting mixture was extracted with ethyl acetate. The organic layer is concentrated. The resulting residue was dissolved in a solution consisting of 0.20 ml of ethanol and 0.20 ml of 5 N. an aqueous solution of sodium hydroxide. The resulting mixture was stirred at room temperature overnight and then concentrated by purging with nitrogen gas. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the resulting solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.96 mg of 7- (2-butynyl) -2-mercapto-1 trifluoroacetate -methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one [MS m / e (ESI) 319 (MH + -CF 3 COOH)] and 0.61 mg trifluoroacetate [7- ( 2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetic acid.
МС m/e (ESI) 377 (MH+-CF3COOH).MS m / e (ESI) 377 (MH + -CF 3 COOH).
Пример 80Example 80
Трифторацетат 7-(2-бутинил)-2-этансульфинил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-ethanesulfinyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл этантиола и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Остаток растворяют в 0,30 мл дихлорметана и полученную смесь охлаждают до -78ºС. В раствор добавляют 5 мг м-хлорпербензойной кислоты и смесь перемешивают при -78ºС в течение 15 минут. К реакционному раствору добавляют насыщенный водный раствор сульфита натрия и смесь экстрагируют дихлорметаном. Органический слой концентрируют. Остаток растворяют в 0,40 мл трифторуксусной кислоты и раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,21 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 20 μl of ethanethiol and 6 mg of potassium carbonate are added to the resulting solution. The resulting mixture was stirred at room temperature for five hours. A saturated aqueous solution of ammonium chloride was added to the reaction solution, and the resulting mixture was extracted with ethyl acetate. The organic layer is concentrated. The residue was dissolved in 0.30 ml of dichloromethane and the resulting mixture was cooled to -78 ° C. 5 mg of m-chloroperbenzoic acid was added to the solution, and the mixture was stirred at -78 ° C for 15 minutes. A saturated aqueous solution of sodium sulfite was added to the reaction solution, and the mixture was extracted with dichloromethane. The organic layer is concentrated. The residue was dissolved in 0.40 ml of trifluoroacetic acid, and the solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.21 mg of the title compound.
МС m/e (ESI) 363 (MH+-CF3COOH).MS m / e (ESI) 363 (MH + -CF 3 COOH).
Пример 81Example 81
Трифторацетат 7-(2-бутинил)-2-этансульфонил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-ethanesulfonyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к полученному раствору добавляют 20 мкл этантиола и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют. Остаток растворяют в 0,3 мл дихлорметана и полученную смесь охлаждают до -78ºС. К раствору добавляют 10 мг м-хлорпербензойной кислоты. Смесь перемешивают при -78ºС в течение 15 минут и затем при 0ºС в течение 15 минут. К реакционному раствору добавляют насыщенный водный раствор сульфита натрия и полученную смесь экстрагируют дихлорметаном. Органический слой концентрируют. Остаток растворяют в трифторуксусной кислоте и раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,19 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 20 μl of ethanethiol and 6 mg of potassium carbonate are added to the resulting solution. The resulting mixture was stirred at room temperature for five hours. A saturated aqueous solution of ammonium chloride was added to the reaction solution, and the resulting mixture was extracted with ethyl acetate. The organic layer is concentrated. The residue was dissolved in 0.3 ml of dichloromethane and the resulting mixture was cooled to -78 ° C. 10 mg of m-chloroperbenzoic acid was added to the solution. The mixture is stirred at -78 ° C for 15 minutes and then at 0 ° C for 15 minutes. A saturated aqueous solution of sodium sulfite was added to the reaction solution, and the resulting mixture was extracted with dichloromethane. The organic layer is concentrated. The residue was dissolved in trifluoroacetic acid, and the solution was concentrated. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.19 mg of the title compound.
МС m/e (ESI) 379 (MH+-CF3COOH).MS m / e (ESI) 379 (MH + -CF 3 COOH).
Пример 82Example 82
Трифторацетат 7-(2-бутинил)-2-циано-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-cyano-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл N-метилпирролидона и к полученному раствору добавляют 10 мг цианида натрия. Смесь перемешивают при 50ºС в течение 1 часа. К реакционной смеси добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют с получением 14 мг трет-бутил-4-[7-(2-бутинил)-2-циано-1-метил-6-оксо-6,7-дигидро-1Н-пурин-8-ил]пиперазин-1-карбоксилата. 5 мг этого соединения растворяют в трифторуксусной кислоте и полученный раствор концентрируют. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,12 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of N-methylpyrrolidone and 10 mg of sodium cyanide are added to the resulting solution. The mixture is stirred at 50 ° C for 1 hour. Water was added to the reaction mixture, and the mixture was extracted with ethyl acetate. The organic layer was concentrated to obtain 14 mg of tert-butyl-4- [7- (2-butynyl) -2-cyano-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazin- 1-carboxylate. 5 mg of this compound is dissolved in trifluoroacetic acid and the resulting solution is concentrated. The resulting residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 4.12 mg of the title compound.
МС m/e (ESI) 312 (MH+-CF3COOH).MS m / e (ESI) 312 (MH + -CF 3 COOH).
Пример 83Example 83
7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбоксамид7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carboxamide
(a) трет-Бутил-4-[7-(2-бутинил)-2-карбамоил-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2-carbamoyl-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate
176 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 2 мл N-метилпирролидона и к полученному раствору добавляют 100 мг цианида натрия. Смесь перемешивают при 50ºС в течение 0,5 часа. К реакционной смеси добавляют воду и раствор экстрагируют этилацетатом. Органический слой концентрируют и получают 170 мг трет-бутил-4-[7-(2-бутинил)-2-циано-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. 98 мг полученного соединения растворяют в смеси из 3 мл тетрагидрофурана и 2 мл метанола и к полученному раствору добавляют 0,5 мл 20% водного раствора аммиака и 0,5 мл 30% водного раствора пероксида водорода. Полученную смесь перемешивают при комнатной температуре в течение ночи. К реакционному раствору добавляют этилацетат и полученную смесь промывают водой. Органический слой сушат над безводным сульфатом магния и затем фильтруют. Растворитель выпаривают при пониженном давлении. Остаток подвергают хроматографической очистке на колонке с силикагелем. Таким образом из фракции, элюированной смесью этилацетат-метанол, получают 77 мг указанного в заголовке соединения.176 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 2 ml of N-methylpyrrolidone and 100 mg of sodium cyanide are added to the resulting solution. The mixture is stirred at 50 ° C for 0.5 hours. Water was added to the reaction mixture, and the solution was extracted with ethyl acetate. The organic layer was concentrated to give 170 mg of tert-butyl-4- [7- (2-butynyl) -2-cyano-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazin- 1-carboxylate. 98 mg of the obtained compound is dissolved in a mixture of 3 ml of tetrahydrofuran and 2 ml of methanol, and 0.5 ml of a 20% aqueous ammonia solution and 0.5 ml of a 30% aqueous hydrogen peroxide solution are added to the resulting solution. The resulting mixture was stirred at room temperature overnight. Ethyl acetate was added to the reaction solution, and the resulting mixture was washed with water. The organic layer was dried over anhydrous magnesium sulfate and then filtered. The solvent was evaporated under reduced pressure. The residue was chromatographed on a silica gel column. Thus, 77 mg of the title compound was obtained from the fraction eluted with ethyl acetate-methanol.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=1,2 Гц, 3H), 3,42-3,49 (м, 4H), 3,58-3,65 (м, 4H), 3,95 (с, 3H), 5,01 (д, J=2,4 Гц, 2H), 5,54 (уш. 1H), 7,61 (уш. 1H).δ 1.49 (s, 9H), 1.83 (t, J = 1.2 Hz, 3H), 3.42-3.49 (m, 4H), 3.58-3.65 (m, 4H ), 3.95 (s, 3H), 5.01 (d, J = 2.4 Hz, 2H), 5.54 (br. 1H), 7.61 (br. 1H).
(b) 7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбоксамид (b) 7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carboxamide
77 мг трет-бутил-4-[7-(2-бутинил)-2-карбамоил-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1 мл трифторуксусной кислоты и полученный раствор концентрируют. Остаток подвергают хроматографической очистке с использованием NH-силикагеля. Таким образом из фракции, элюированной смесью этилацетат-метанол (5:1), получают 49 мг указанного в заголовке соединения.77 mg of tert-butyl-4- [7- (2-butynyl) -2-carbamoyl-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 1 ml of trifluoroacetic acid and the resulting solution was concentrated. The residue was subjected to chromatographic purification using NH-silica gel. Thus, 49 mg of the title compound was obtained from the fraction eluted with ethyl acetate-methanol (5: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,83 (т, J=2,4 Гц, 3H), 3,05-3,07 (м, 4H), 3,45-3,48 (м, 4H), 3,94 (с, 3H), 4,98 (с, 2H), 5,57 (уш, 1H), 7,65 (уш, 1H).δ 1.83 (t, J = 2.4 Hz, 3H), 3.05-3.07 (m, 4H), 3.45-3.48 (m, 4H), 3.94 (s, 3H ), 4.98 (s, 2H), 5.57 (br, 1H), 7.65 (br, 1H).
Пример 84Example 84
Трифторацетат 7-(2-бутинил)-2-карбокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-carboxy-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Пример 85Example 85
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
12,5 мг трет-бутил-4-[7-(2-бутинил)-2-карбамоил-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,3 мл тетрагидрофурана и к полученному раствору добавляют 0,2 мл метанола и 0,05 мл 2 н. раствора гидроксида натрия. Смесь перемешивают при 50ºС в течение 2 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Полученную смесь концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с образованием 0,44 мг трифторацетата 7-(2-бутинил)-2-карбокси-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она [МС m/e (ESI) 331 (MH+-CF3COOH)] и 6,4 мг трифторацетата 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она.12.5 mg of tert-butyl-4- [7- (2-butynyl) -2-carbamoyl-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate dissolved in 0.3 ml of tetrahydrofuran and 0.2 ml of methanol and 0.05 ml of 2N are added to the resulting solution. sodium hydroxide solution. The mixture is stirred at 50 ° C for 2 hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting mixture was concentrated. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.44 mg of 7- (2-butynyl) -2-carboxy-1 trifluoroacetate -methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one [MS m / e (ESI) 331 (MH + -CF 3 COOH)] and 6.4 mg of trifluoroacetate 7- (2 -butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one.
1H-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,81 (т, J=2,4 Гц, 3H), 3,54 (уш., 4H), 3,63 (с, 3H), 3,83 (уш., 4H), 5,02 (с, 2H), 8,20 (с, 1H).δ 1.81 (t, J = 2.4 Hz, 3H), 3.54 (br, 4H), 3.63 (s, 3H), 3.83 (br, 4H), 5.02 ( s, 2H), 8.20 (s, 1H).
МС m/e (ESI) 287 (MH+-CF3COOH).MS m / e (ESI) 287 (MH + -CF 3 COOH).
Пример 86Example 86
Гидрохлорид 7-(2-бутинил)-2-метокси-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-methoxy-1- (2-phenylethyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
(a) [7-Бензил-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионат(a) [7-Benzyl-2,6-dioxo-1- (2-phenylethyl) -1,2,6,7-tetrahydropurin-3-yl] methyl 2,2-dimethylpropionate
Смесь, состоящую из 500 мг [7-бензил-2,6-диоксо-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата, 0,38 мл 2-бромэтилбензола, 390 мг безводного карбоната калия и 5 мл N,N-диметилформамида, перемешивают на масляной бане при 50ºС в течение двух часов. Реакционную смесь экстрагируют этилацетатом и водой и органический слой промывают водой и затем насыщенным рассолом. Органический слой сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток перекристаллизовывают из смеси этилацетат-гексан с образованием 540 мг указанного в заголовке соединения.Mixture consisting of 500 mg of [7-benzyl-2,6-dioxo-1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate, 0.38 ml of 2-bromoethylbenzene, 390 mg of anhydrous potassium carbonate and 5 ml of N, N-dimethylformamide, stirred in an oil bath at 50 ° C for two hours. The reaction mixture was extracted with ethyl acetate and water, and the organic layer was washed with water and then with saturated brine. The organic layer was dried over anhydrous magnesium sulfate and then concentrated under reduced pressure. The residue was recrystallized from ethyl acetate-hexane to give 540 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,19 (с, 9H), 2,92-2,98 (м, 2H), 4,19-4,25 (м, 2H), 5,48 (с, 2H), 6,11 (с, 2H), 7,17-7,40 (м, 10H), 7,54 (с, 1H).δ 1.19 (s, 9H), 2.92-2.98 (m, 2H), 4.19-4.25 (m, 2H), 5.48 (s, 2H), 6.11 (s , 2H), 7.17-7.40 (m, 10H), 7.54 (s, 1H).
(b) [7-(2-Бутинил)-8-хлор-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионат(b) [7- (2-Butynyl) -8-chloro-2,6-dioxo-1- (2-phenylethyl) -1,2,6,7-tetrahydropurin-3-yl] methyl-2,2- dimethyl propionate
Смесь, состоящую из 540 мг [7-бензил-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил-2,2-диметилпропионата, 50 мг 10% палладия на угле и 8 мл уксусной кислоты, перемешивают в атмосфере водорода при комнатной температуре в течение ночи. Реакционную смесь фильтруют и затем концентрируют при пониженном давлении с получением 410 мг остатка.Mixture of 540 mg of [7-benzyl-2,6-dioxo-1- (2-phenylethyl) -1,2,6,7-tetrahydropurin-3-yl] methyl-2,2-dimethylpropionate, 50 mg 10 % palladium on charcoal and 8 ml of acetic acid, stirred in a hydrogen atmosphere at room temperature overnight. The reaction mixture was filtered and then concentrated under reduced pressure to obtain 410 mg of a residue.
Остаток смешивают с 0,15 мл 1-бром-2-бутина, 300 мг безводного карбоната калия и 5 мл N,N-диметилформамида. Смесь перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор экстрагируют этилацетатом и водой. Органический слой промывают водой и затем насыщенным рассолом. Органическую фазу сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 470 мг остатка.The residue was mixed with 0.15 ml of 1-bromo-2-butine, 300 mg of anhydrous potassium carbonate and 5 ml of N, N-dimethylformamide. The mixture was stirred at room temperature for 2 hours. The reaction solution was extracted with ethyl acetate and water. The organic layer was washed with water and then with saturated brine. The organic phase was dried over anhydrous magnesium sulfate and concentrated under reduced pressure to obtain 470 mg of a residue.
Остаток смешивают с 180 мг N-хлорсукцинимида и 5 мл N,N-диметилформамида. Смесь перемешивают при комнатной температуре в течение 2 часов. После добавления 0,5 мл 1 М водного раствора тиосульфата натрия реакционный раствор экстрагируют этилацетатом и водой. Органический слой промывают водой и затем насыщенным рассолом. Органическую фазу сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Перекристаллизацией из смеси этилацетат-гексан получают 380 мг указанного в заголовке соединения.The residue was mixed with 180 mg of N-chlorosuccinimide and 5 ml of N, N-dimethylformamide. The mixture was stirred at room temperature for 2 hours. After adding 0.5 ml of a 1 M aqueous solution of sodium thiosulfate, the reaction solution was extracted with ethyl acetate and water. The organic layer was washed with water and then with saturated brine. The organic phase is dried over anhydrous magnesium sulfate and concentrated under reduced pressure. Recrystallization from ethyl acetate-hexane gave 380 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,21 (с, 9H), 1,83 (т, J=2 Гц, 3H), 2,92-2,98 (м, 2H), 4,19-4,25 (м, 2H), 5,11 (кв, J=2 Гц, 2H), 6,05 (с, 2H), 7,18-7,32 (м, 5H).δ 1.21 (s, 9H), 1.83 (t, J = 2 Hz, 3H), 2.92-2.98 (m, 2H), 4.19-4.25 (m, 2H), 5.11 (q, J = 2 Hz, 2H); 6.05 (s, 2H); 7.18-7.32 (m, 5H).
(c) трет-Бутил-4-[7-(2-бутинил)-2,6-диоксо-1-(2-фенилэтил)-2,3,6,7-тетрагидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(c) tert-Butyl-4- [7- (2-butynyl) -2,6-dioxo-1- (2-phenylethyl) -2,3,6,7-tetrahydro-1H-purin-8-yl] piperazine-1-carboxylate
Смесь, состоящую из 380 мг [7-(2-бутинил)-8-хлор-2,6-диоксо-1-(2-фенилэтил)-1,2,6,7-тетрагидропурин-3-ил]метил 2,2-диметилпропионата, 460 мг трет-бутилпиперазин-1-карбоксилата и 0,5 мл N-метилпирролидона, перемешивают на масляной бане при 150ºС в течение 15 минут. Реакционную смесь экстрагируют этилацетатом и водой и органический слой последовательно промывают водой и насыщенным рассолом. Органический слой сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток растворяют в смеси этилацетат-гексан (1:1). Раствор фильтруют через небольшое количество силикагеля и затем промывают смесью этилацетат/гексан (1:1). Фильтрат объединяют с промывным раствором. Смешанный раствор концентрируют при пониженном давлении с получением 570 мг остатка.A mixture consisting of 380 mg of [7- (2-butynyl) -8-chloro-2,6-dioxo-1- (2-phenylethyl) -1,2,6,7-tetrahydropurin-3-yl] methyl 2, 2-dimethylpropionate, 460 mg of tert-butylpiperazine-1-carboxylate and 0.5 ml of N-methylpyrrolidone are stirred in an oil bath at 150 ° C for 15 minutes. The reaction mixture was extracted with ethyl acetate and water, and the organic layer was washed successively with water and saturated brine. The organic layer was dried over anhydrous magnesium sulfate and then concentrated under reduced pressure. The residue was dissolved in ethyl acetate-hexane (1: 1). The solution was filtered through a small amount of silica gel and then washed with ethyl acetate / hexane (1: 1). The filtrate is combined with the wash solution. The mixed solution was concentrated under reduced pressure to obtain 570 mg of a residue.
Остаток смешивают с 5 мл тетрагидрофурана и 2,5 мл метанола. Добавляют 33 мг гидрида натрия и полученную смесь перемешивают при комнатной температуре в течение 30 минут. К реакционному раствору добавляют 1 мл 1 н. соляной кислоты и полученную смесь экстрагируют этилацетатом и водой, затем последовательно промывают водой и насыщенным рассолом. Органическую фазу сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 350 мг указанного в заголовке соединения.The residue is mixed with 5 ml of tetrahydrofuran and 2.5 ml of methanol. 33 mg of sodium hydride was added and the resulting mixture was stirred at room temperature for 30 minutes. 1 ml of 1N was added to the reaction solution. hydrochloric acid and the resulting mixture was extracted with ethyl acetate and water, then washed successively with water and saturated brine. The organic phase was dried over anhydrous magnesium sulfate and concentrated under reduced pressure to obtain 350 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,85 (т, J=2 Гц, 3H), 2,91-2,98 (м, 2H), 3,37 (уш.с, 4H), 3,56-3,62 (м, 4H), 4,15-4,22 (м, 2H), 4,87 (кв, J=2 Гц, 2H), 7,18-7,35 (м, 5H).δ 1.50 (s, 9H), 1.85 (t, J = 2 Hz, 3H), 2.91-2.98 (m, 2H), 3.37 (br s, 4H), 3, 56-3.62 (m, 4H), 4.15-4.22 (m, 2H), 4.87 (q, J = 2 Hz, 2H), 7.18-7.35 (m, 5H) .
(d) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-phenylethyl) -6,7-dihydro-1H-purin-8-yl] piperazin- 1-carboxylate
Смесь, состоящую из 290 мг трет-бутил-4-[7-(2-бутинил)-2,6-диоксо-1-(2-фенилэтил)-2,3,6,7-тетрагидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 4 мл оксихлорида фосфора, нагревают и перемешивают на масляной бане при 120ºС в течение 8 часов. Реакционный раствор концентрируют при пониженном давлении и остаток растворяют в 5 мл тетрагидрофурана. Полученный раствор добавляют по каплям к перемешиваемой и охлаждаемой льдом смеси, состоящей из 250 мг ди-трет-бутилдикарбоната, 10 мл насыщенного раствора бикарбоната натрия и 10 мл тетрагидрофурана. Смесь инкубируют при комнатной температуре в течение 4 часов и затем экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным рассолом, сушат над сульфатом магния и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя смесь из 50% этилацетата в гексане. Полученный материал подвергают дополнительной хроматографической очистке на колонке с обращенной фазой, проводя элюирование смесью 50-100% метанол-вода, и в результате получают 60 мг указанного в заголовке соединения.A mixture consisting of 290 mg of tert-butyl-4- [7- (2-butynyl) -2,6-dioxo-1- (2-phenylethyl) -2,3,6,7-tetrahydro-1H-purin-8 -yl] piperazine-1-carboxylate and 4 ml of phosphorus oxychloride, heated and stirred in an oil bath at 120 ° C for 8 hours. The reaction solution was concentrated under reduced pressure, and the residue was dissolved in 5 ml of tetrahydrofuran. The resulting solution was added dropwise to a stirred and ice-cooled mixture consisting of 250 mg of di-tert-butyl dicarbonate, 10 ml of a saturated sodium bicarbonate solution and 10 ml of tetrahydrofuran. The mixture was incubated at room temperature for 4 hours and then extracted with ethyl acetate. The organic layer was washed successively with water and saturated brine, dried over magnesium sulfate and then concentrated under reduced pressure. The residue was purified by silica gel column chromatography using a mixture of 50% ethyl acetate in hexane. The resulting material was subjected to additional chromatographic purification on a reverse phase column, eluting with a mixture of 50-100% methanol-water, and 60 mg of the title compound was obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,84 (т, J=2 Гц, 3H), 3,10-3,16 (м, 2H), 3,40-3,46 (м, 2H), 3,57-3,63 (м, 4H), 4,42-4,49 (м, 4H), 4,94 (кв, J=2 Гц, 2H), 7,21-7,34 (м, 5H).δ 1.49 (s, 9H), 1.84 (t, J = 2 Hz, 3H), 3.10-3.16 (m, 2H), 3.40-3.46 (m, 2H), 3.57-3.63 (m, 4H), 4.42-4.49 (m, 4H), 4.94 (q, J = 2 Hz, 2H), 7.21-7.34 (m, 5H).
(e) Гидрохлорид 7-(2-бутинил)-2-метокси-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она(e) 7- (2-Butynyl) -2-methoxy-1- (2-phenylethyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
10 мг гидрида натрия (60%; масло) добавляют к смеси, состоящей из 7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 0,5 мл метанола. Смесь перемешивают при комнатной температуре в течение 20 минут. К реакционному раствору добавляют воду. Полученную смесь экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным рассолом и затем концентрируют. К остатку добавляют 0,5 мл трифторуксусной кислоты. Полученную смесь перемешивают при комнатной температуре в течение 30 минут и затем концентрируют. Полученный остаток очищают на хроматографической колонке с обратимой фазой с использованием смеси 20-80% метанола-вода (содержащей 0,1% концентрированной соляной кислоты) с получением 4,3 мг указанного в заголовке соединения.10 mg of sodium hydride (60%; oil) is added to a mixture of 7 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-phenylethyl) -6 , 7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate and 0.5 ml of methanol. The mixture was stirred at room temperature for 20 minutes. Water was added to the reaction solution. The resulting mixture was extracted with ethyl acetate. The organic layer was washed successively with water and saturated brine, and then concentrated. 0.5 ml of trifluoroacetic acid was added to the residue. The resulting mixture was stirred at room temperature for 30 minutes and then concentrated. The resulting residue was purified on a chromatographic column with a reversible phase using a mixture of 20-80% methanol-water (containing 0.1% concentrated hydrochloric acid) to obtain 4.3 mg of the title compound.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (уш.с, 3H), 2,85 (т, J=7 Гц, 2H), 3,28 (уш.с, 4H), 3,48-3,54 (м, 4H), 3,83 (с, 3H), 4,15 (т, J=7 Гц, 2H), 4,97 (уш.с, 2H), 7,16-7,24 (м, 3H), 7,29 (т, J=8 Гц, 2H), 9,08 (уш.с, 2H).δ 1.80 (br s, 3H), 2.85 (t, J = 7 Hz, 2H), 3.28 (br s, 4H), 3.48-3.54 (m, 4H), 3.83 (s, 3H), 4.15 (t, J = 7 Hz, 2H), 4.97 (br s, 2H), 7.16-7.24 (m, 3H), 7.29 (t, J = 8 Hz, 2H), 9.08 (br s, 2H).
Пример 87Example 87
Гидрохлорид 7-(2-бутинил)-2-этокси-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-ethoxy-1- (2-phenylethyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
Используя этанол вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using ethanol instead of methanol in Example 86 (e), following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,28 (т, J=7 Гц, 3H), 1,80 (с, 3H), 2,86 (т, J=7 Гц, 2H), 3,27 (уш.с, 4H), 3,46-3,53 (м, 4H), 4,15 (т, J=7 Гц, 2H), 4,25 (кв, J=7 Гц, 2H), 4,97 (с, 2H), 7,17 (д, J=7 Гц, 2H), 7,22 (т, J=7 Гц, 1H), 7,29 (т, J=7 Гц, 2H), 9,04 (уш.с, 2H).δ 1.28 (t, J = 7 Hz, 3H), 1.80 (s, 3H), 2.86 (t, J = 7 Hz, 2H), 3.27 (br.s, 4H), 3 , 46-3.53 (m, 4H), 4.15 (t, J = 7 Hz, 2H), 4.25 (q, J = 7 Hz, 2H), 4.97 (s, 2H), 7 , 17 (d, J = 7 Hz, 2H), 7.22 (t, J = 7 Hz, 1H), 7.29 (t, J = 7 Hz, 2H), 9.04 (br s, 2H )
Пример 88Example 88
Гидрохлорид метил-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетатаMethyl [7- (2-butynyl) -6-oxo-1- (2-phenylethyl) -8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
Используя метилтиогликолят вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using methylthioglycolate instead of methanol and potassium carbonate as the base in Example 86 (e), following the method described in this example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 2,96 (т, J=8 Гц, 2H), 3,29 (уш.с, 4H), 3,50-3,56 (м, 4H), 3,68 (с, 3H), 4,16 (с, 2H), 4,23 (т, J=8 Гц, 2H), 4,99 (с, 2H), 7,24-7,38 (м, 5H), 8,96 (уш.с, 2H).δ 1.80 (s, 3H), 2.96 (t, J = 8 Hz, 2H), 3.29 (br s, 4H), 3.50-3.56 (m, 4H), 3, 68 (s, 3H), 4.16 (s, 2H), 4.23 (t, J = 8 Hz, 2H), 4.99 (s, 2H), 7.24-7.38 (m, 5H ), 8.96 (br s, 2H).
Пример 89Example 89
Гидрохлорид этил-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]ацетатаEthyl [7- (2-butynyl) -6-oxo-1- (2-phenylethyl) -8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] acetate hydrochloride
Используя гидрохлорид этилового эфира глицина вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using glycine ethyl ester hydrochloride instead of methanol and potassium carbonate as the base in Example 86 (e), following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,22 (т, J=7 Гц, 3H), 1,78 (с, 3H), 2,87 (т, J=8 Гц, 2H), 3,26 (уш.с, 4H), 3,47 (уш.с, 4H), 4,05 (д, J=6 Гц, 2H), 4,12 (кв, J=7 Гц, 2H), 4,21 (т, J=8 Гц, 2H), 4,89 (уш.с, 2H), 7,17-7,35 (м, 5H), 7,51 (т, J=6 Гц, 1H), 8,93 (уш.с, 2H).δ 1.22 (t, J = 7 Hz, 3H), 1.78 (s, 3H), 2.87 (t, J = 8 Hz, 2H), 3.26 (br.s, 4H), 3 47 (br.s, 4H), 4.05 (d, J = 6 Hz, 2H), 4.12 (q, J = 7 Hz, 2H), 4.21 (t, J = 8 Hz, 2H ), 4.89 (br s, 2H), 7.17-7.35 (m, 5H), 7.51 (t, J = 6 Hz, 1H), 8.93 (br s, 2H) .
Пример 90Example 90
Гидрохлорид 2-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]ацетамида2- [7- (2-Butynyl) -6-oxo-1- (2-phenylethyl) -8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] acetamide hydrochloride
Используя гидрохлорид глицинамида вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using glycinamide hydrochloride instead of methanol and potassium carbonate as the base in Example 86 (e), following the method described in this example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (с, 3H), 2,87 (т, J=8 Гц, 2H), 3,26 (уш.с, 4H), 3,52 (уш.с, 4H), 3,84 (д, J=5 Гц, 2H), 4,19 (т, J=8 Гц, 2H), 4,91 (с, 2H), 7,02 (с, 1H), 7,16-7,40 (м, 7H), 9,08 (уш.с, 2H).δ 1.79 (s, 3H), 2.87 (t, J = 8 Hz, 2H), 3.26 (br s, 4H), 3.52 (br s, 4H), 3.84 ( d, J = 5 Hz, 2H), 4.19 (t, J = 8 Hz, 2H), 4.91 (s, 2H), 7.02 (s, 1H), 7.16-7.40 ( m, 7H), 9.08 (br s, 2H).
Пример 91Example 91
Гидрохлорид этил-N-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]-N-метиламиноацетатаEthyl N- [7- (2-butynyl) -6-oxo-1- (2-phenylethyl) -8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl hydrochloride] N-methylaminoacetate
Используя гидрохлорид этилового эфира N-метилглицина вместо метанола и карбонат калия в качестве основания в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using N-methylglycine ethyl ester hydrochloride instead of methanol and potassium carbonate as the base in Example 86 (e), following the method described in this example, the title compound was synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,17 (т, J=7 Гц, 3H), 1,80 (с, 3H), 2,76 (с, 3H), 2,96 (т, J=8 Гц, 2H), 3,28 (уш.с, 4H), 3,46-3,52 (м, 4H), 3,88 (с, 2H), 4,09 (кв, J=7 Гц, 2H), 4,27 (т, J=8 Гц, 2H), 4,98 (с, 2H), 7,15-7,30 (м, 5H), 8,95 (уш.с, 2H).δ 1.17 (t, J = 7 Hz, 3H), 1.80 (s, 3H), 2.76 (s, 3H), 2.96 (t, J = 8 Hz, 2H), 3.28 (br.s, 4H), 3.46-3.52 (m, 4H), 3.88 (s, 2H), 4.09 (q, J = 7 Hz, 2H), 4.27 (t, J = 8 Hz, 2H), 4.98 (s, 2H), 7.15-7.30 (m, 5H), 8.95 (br s, 2H).
Пример 92Example 92
Гидрохлорид метил-[7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетатаMethyl [7- (2-butynyl) -6-oxo-1- (2-phenylethyl) -8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetate hydrochloride
Используя метилгликолят вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using methyl glycolate instead of methanol in Example 86 (e), following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 2,93 (т, J=8 Гц, 2H), 3,28 (уш.с, 4H), 3,49 (уш.с, 4H), 3,72 (с, 3H), 4,20 (т, J=8 Гц, 2H), 4,96 (с, 2H), 5,02 (с, 2H), 7,20-7,34 (м, 5H), 8,87 (уш.с, 2H).δ 1.80 (s, 3H), 2.93 (t, J = 8 Hz, 2H), 3.28 (br s, 4H), 3.49 (br s, 4H), 3.72 ( s, 3H), 4.20 (t, J = 8 Hz, 2H), 4.96 (s, 2H), 5.02 (s, 2H), 7.20-7.34 (m, 5H), 8.87 (br s, 2H).
Пример 93Example 93
Гидрохлорид 7-(2-бутинил)-2-(2-гидроксиэтокси)-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-hydroxyethoxy) -1- (2-phenylethyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
Используя этиленгликоль вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using ethylene glycol instead of methanol in Example 86 (e), following the method described in this Example, the title compound was synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 2,88 (т, J=8 Гц, 2H), 3,29 (уш.с, 4H), 3,49 (уш.с, 4H), 3,71 (т, J=6 Гц, 2H), 4,18 (т, J=8 Гц, 2H), 4,28 (т, J=6 Гц, 2H), 4,97 (с, 2H), 7,16-7,32 (м, 5H), 8,90 (уш.с, 2H).δ 1.80 (s, 3H), 2.88 (t, J = 8 Hz, 2H), 3.29 (br s, 4H), 3.49 (br s, 4H), 3.71 ( t, J = 6 Hz, 2H), 4.18 (t, J = 8 Hz, 2H), 4.28 (t, J = 6 Hz, 2H), 4.97 (s, 2H), 7.16 -7.32 (m, 5H); 8.90 (br s, 2H).
Пример 94Example 94
Гидрохлорид 7-(2-бутинил)-2-диметиламино-1-(2-фенилэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-dimethylamino-1- (2-phenylethyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
Используя 50% водный раствор диметиламина вместо метанола в примере 86 (е), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using a 50% aqueous solution of dimethylamine instead of methanol in Example 86 (e), following the method described in this example, the title compound was synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 2,60 (с, 6Н), 2,89 (т, J=8 Гц, 2Н), 3,28 (уш.с, 4Н), 3,49 (уш.с, 4Н), 4,26 (т, J=8 Гц, 2Н), 4,98 (с, 2Н), 7,06-7,27 (м, 5Н), 8,93 (уш.с, 2Н).δ 1.80 (s, 3H), 2.60 (s, 6H), 2.89 (t, J = 8 Hz, 2H), 3.28 (br s, 4H), 3.49 (br. s, 4H), 4.26 (t, J = 8 Hz, 2H), 4.98 (s, 2H), 7.06-7.27 (m, 5H), 8.93 (br s, 2H )
Пример 95Example 95
Трифторацетат 7-(2-бутинил)-2-хлор-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-chloro-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate
Смесь, состоящую из 1,0 г трет-бутил-4-[7-(2-бутинил)-2,6-дихлор-7H-пурин-8-ил]пиперазин-1-карбоксилата, 580 мг ацетата натрия и 10 мл диметилсульфоксида, перемешивают на масляной бане при 80ºС в течение 24 часов. Реакционный раствор экстрагируют этилацетатом и водой. Органический слой промывают водой и затем насыщенным рассолом, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Полученный остаток подвергают очистке путем колоночной хроматографии на силикагеле с использованием смеси 50-70% этилацетата/гексан и перекристаллизовывают из смеси этилацетат-гексан с получением 800 мг указанного в заголовке соединения.A mixture consisting of 1.0 g of tert-butyl-4- [7- (2-butynyl) -2,6-dichloro-7H-purin-8-yl] piperazine-1-carboxylate, 580 mg of sodium acetate and 10 ml dimethyl sulfoxide, stirred in an oil bath at 80 ° C for 24 hours. The reaction solution was extracted with ethyl acetate and water. The organic layer was washed with water and then with saturated brine, dried over anhydrous magnesium sulfate and concentrated under reduced pressure. The resulting residue was purified by silica gel column chromatography using a mixture of 50-70% ethyl acetate / hexane and recrystallized from ethyl acetate-hexane to give 800 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,44 (уш.с, 4H), 3,56-3,63 (м, 4H), 4,94 (кв, J=2 Гц, 2H).δ 1.49 (s, 9H), 1.83 (t, J = 2 Hz, 3H), 3.44 (br s, 4H), 3.56-3.63 (m, 4H), 4, 94 (q, J = 2 Hz, 2H).
(b) Трифторацетат 7-(2-бутинил)-2-хлор-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она(b) 7- (2-Butynyl) -2-chloro-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в трифторуксусной кислоте и полученный раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (с использованием смеси ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,45 мг указанного в заголовке соединения.8 mg of tert-butyl 4- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in trifluoroacetic acid and the resulting the solution is concentrated. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.45 mg of the title compound.
МС m/e (ESI) 307 (MH+-CF3COOH).MS m / e (ESI) 307 (MH + -CF 3 COOH).
Пример 96Example 96
Гидрохлорид 2-[7-(2-бутинил)-2-диметиламино-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила2- [7- (2-Butynyl) -2-dimethylamino-6-oxo-8- (piperazin-1-yl) -6,7-dihydropurin-1-ylmethyl] benzonitrile hydrochloride
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2-chloro-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine- 1-carboxylate
Смесь, состоящую из 100 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 60 мг бромида 2-цианобензила, 68 мг безводного карбоната калия и 1 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение 4 часов. К реакционному раствору добавляют смесь этилацетат-гексан (1:1) и воду. Нерастворимый материал удаляют фильтрацией. Фильтрат экстрагируют этилацетатом. Органический слой последовательно промывают водой и насыщенным рассолом, сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя смесь 30-50% этилацетат/гексан с получением 50 мг указанного в заголовке соединения.Mixture consisting of 100 mg of tert-butyl 4- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate, 60 mg of 2-cyanobenzyl bromide, 68 mg of anhydrous potassium carbonate and 1 ml of N, N-dimethylformamide are stirred at room temperature for 4 hours. Ethyl acetate-hexane (1: 1) and water were added to the reaction solution. Insoluble material is removed by filtration. The filtrate was extracted with ethyl acetate. The organic layer was washed successively with water and saturated brine, dried over anhydrous magnesium sulfate, and then concentrated under reduced pressure. The residue was purified by silica gel column chromatography using a mixture of 30-50% ethyl acetate / hexane to give 50 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,43-3,49 (м, 4H), 3,58-3,64 (м, 4H), 4,95 (кв, J=2 Гц, 2H), 5,72 (с, 2H), 7,06 (д, J=8 Гц, 1H), 7,39 (т, J=8 Гц, 1H), 7,51 (т, J=8 Гц, 1H), 7,71 (д, J=8 Гц, 1H).δ 1.49 (s, 9H), 1.83 (t, J = 2 Hz, 3H), 3.43-3.49 (m, 4H), 3.58-3.64 (m, 4H), 4.95 (q, J = 2 Hz, 2H), 5.72 (s, 2H), 7.06 (d, J = 8 Hz, 1H), 7.39 (t, J = 8 Hz, 1H) 7.51 (t, J = 8 Hz, 1H); 7.71 (d, J = 8 Hz, 1H).
(b) трет-Бутил-4-[7-(2-бутинил)-1-(2-цианобензил)-2-диметиламино-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [7- (2-butynyl) -1- (2-cyanobenzyl) -2-dimethylamino-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine- 1-carboxylate
Смесь, состоящую из 8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 20 мкл 50% водного раствора дииметиламина и 0,2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение 2 часов. Реакционный раствор экстрагируют этилацетатом и водой. Органический слой последовательно промывают водой и насыщенным рассолом и затем концентрируют. Полученный остаток очищают методом тонкослойной хроматографии на силикагеле с использованием смеси 70% этилацетат/гексан и получают 6,5 мг указанного в заголовке соединения.Mixture of 8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl ] piperazine-1-carboxylate, 20 μl of a 50% aqueous solution of dimethylamine and 0.2 ml of N, N-dimethylformamide are stirred at room temperature for 2 hours. The reaction solution was extracted with ethyl acetate and water. The organic layer was washed successively with water and saturated brine, and then concentrated. The resulting residue was purified by flash chromatography on silica gel using a mixture of 70% ethyl acetate / hexane to give 6.5 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,81 (т, J=2 Гц, 3H), 2,73 (с, 6H), 3,38-3,45 (м, 4H), 3,56-3,64 (м, 4H), 4,91 (кв, J=2 Гц, 2H), 5,55 (с, 2H), 7,07 (д, J=8 Гц, 1H), 7,32 (т, J=8 Гц, 1H), 7,46 (т, J=8 Гц, 1H), 7,65 (д, J=8 Гц, 1H).δ 1.50 (s, 9H), 1.81 (t, J = 2 Hz, 3H), 2.73 (s, 6H), 3.38-3.45 (m, 4H), 3.56- 3.64 (m, 4H), 4.91 (q, J = 2 Hz, 2H), 5.55 (s, 2H), 7.07 (d, J = 8 Hz, 1H), 7.32 ( t, J = 8 Hz, 1H), 7.46 (t, J = 8 Hz, 1H), 7.65 (d, J = 8 Hz, 1H).
(c) Гидрохлорид 2-[7-(2-бутинил)-2-диметиламино-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила(c) 2- [7- (2-Butynyl) -2-dimethylamino-6-oxo-8- (piperazin-1-yl) -6,7-dihydropurin-1-ylmethyl] benzonitrile hydrochloride
6,5 мг трет-бутил-4-[7-(2-бутинил)-1-(2-цианобензил)-2-диметиламино-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,5 мл трифторуксусной кислоты и полученную смесь выстаивают при комнатной температуре в течение 20 минут. Реакционный раствор концентрируют и остаток подвергают хроматографической очистке на колонке с обратимой фазой, используя смесь из 20-80% метанола и воды (содержащую 0,1% концентрированной соляной кислоты) с получением 6,4 мг соединения, указанного в заголовке.6.5 mg tert-butyl-4- [7- (2-butynyl) -1- (2-cyanobenzyl) -2-dimethylamino-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine -1-carboxylate is dissolved in 0.5 ml of trifluoroacetic acid and the resulting mixture is allowed to stand at room temperature for 20 minutes. The reaction solution was concentrated and the residue was chromatographed on a reversible phase column using a mixture of 20-80% methanol and water (containing 0.1% concentrated hydrochloric acid) to obtain 6.4 mg of the title compound.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,76 (с, 3H), 2,69 (с, 6H), 3,28 (уш.с, 4H), 3,51 (уш.с, 4H), 4,91 (с, 2H), 5,40 (с, 2H), 7,04 (д, J=8 Гц, 1H), 7,43 (т, J=8 Гц, 1H), 7,60 (т, J=8 Гц, 1H), 7,83 (д, J=8 Гц, 1H), 8,90 (уш.с, 2H).δ 1.76 (s, 3H), 2.69 (s, 6H), 3.28 (br s, 4H), 3.51 (br s, 4H), 4.91 (s, 2H), 5.40 (s, 2H), 7.04 (d, J = 8 Hz, 1H), 7.43 (t, J = 8 Hz, 1H), 7.60 (t, J = 8 Hz, 1H) 7.83 (d, J = 8 Hz, 1H); 8.90 (br s, 2H).
Пример 97Example 97
Гидрохлорид метил [7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетатаMethyl [7- (2-butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
Используя метилтиогликолят вместо диметиламина и безводный карбонат калия в качестве основания в примере 96 (b), следуя способу, описанному в примере 96, синтезируют указанное в заголовке соединение.Using methylthioglycolate instead of dimethylamine and anhydrous potassium carbonate as the base in Example 96 (b), following the method described in Example 96, the title compound was synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (с, 3H), 3,29 (уш.с, 4H), 3,56 (уш.с, 4H), 3,65 (с, 3H), 4,12 (с, 2H), 4,99 (с, 2H), 5,48 (с, 2H), 7,10 (д, J=8 Гц, 1H), 7,50 (т, J=8 Гц, 1H), 7,65 (т, J=8 Гц, 1H), 7,92 (д, J=8 Гц, 1H), 8,95 (уш.с, 2H).δ 1.79 (s, 3H), 3.29 (br s, 4H), 3.56 (br s, 4H), 3.65 (s, 3H), 4.12 (s, 2H), 4.99 (s, 2H), 5.48 (s, 2H), 7.10 (d, J = 8 Hz, 1H), 7.50 (t, J = 8 Hz, 1H), 7.65 ( t, J = 8 Hz, 1H), 7.92 (d, J = 8 Hz, 1H), 8.95 (br s, 2H).
Пример 98Example 98
Гидрохлорид 2-[7-(2-бутинил)-2-метокси-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила2- [7- (2-Butynyl) -2-methoxy-6-oxo-8- (piperazin-1-yl) -6,7-dihydropurin-1-ylmethyl] benzonitrile hydrochloride
Используя метанол вместо диметиламина и безводный карбонат калия в качестве основания в примере 96 (b), следуя способу, описанному в примере 96, синтезируют указанное в заголовке соединение.Using methanol instead of dimethylamine and anhydrous potassium carbonate as the base in Example 96 (b), following the method described in Example 96, the title compound was synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (с, 3H), 3,28 (уш.с, 4H), 3,48-3,56 (м, 4H), 3,91 (с, 3H), 4,97 (с, 2H), 5,32 (с, 2H), 7,19 (д, J=8 Гц, 1H), 7,48 (т, J=8 Гц, 1H), 7,63 (т, J=8 Гц, 1H), 7,87 (д, J=8 Гц, 1H), 9,05 (уш.с, 2H).δ 1.79 (s, 3H), 3.28 (br s, 4H), 3.48-3.56 (m, 4H), 3.91 (s, 3H), 4.97 (s, 2H ), 5.32 (s, 2H), 7.19 (d, J = 8 Hz, 1H), 7.48 (t, J = 8 Hz, 1H), 7.63 (t, J = 8 Hz, 1H), 7.87 (d, J = 8 Hz, 1H), 9.05 (br s, 2H).
Пример 99Example 99
Гидрохлорид метил [7-(2-бутинил)-1-цианометил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетатаMethyl [7- (2-butynyl) -1-cyanomethyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
(а) трет-Бутил 4-[7-(2-бутинил)-2-хлор-1-цианометил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат (a) t ret-Butyl 4- [7- (2-butynyl) -2-chloro-1-cyanomethyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate
Используя бромацетонитрил вместо диметиламина в примере 96 (b), следуя способу, описанному в примере 96 (а), синтезируют указанное в заголовке соединение.Using bromoacetonitrile instead of dimethylamine in Example 96 (b), following the method described in Example 96 (a), the title compound is synthesized.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,84 (т, J=2 Гц, 3H), 3,43-3,49 (м, 4H), 3,58-3,63 (м, 4H), 4,91 (кв, J=2 Гц, 2H), 5,18 (с, 2H).δ 1.49 (s, 9H), 1.84 (t, J = 2 Hz, 3H), 3.43-3.49 (m, 4H), 3.58-3.63 (m, 4H), 4.91 (q, J = 2 Hz, 2H); 5.18 (s, 2H).
(b) Гидрохлорид метил [7-(2-бутинил)-1-цианометил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата(b) Methyl [7- (2-butynyl) -1-cyanomethyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
Используя соединение, полученное в описанном выше примере 99 (а), вместо соединения, полученного в примере 96(а), следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.Using the compound obtained in Example 99 (a) above, instead of the compound obtained in Example 96 (a), following the method described in Example 97, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 3,29 (уш.с, 4H), 3,55 (уш.с, 4H), 3,68 (с, 3H), 4,22 (с, 2H), 4,98 (с, 2H), 5,21 (с, 2H), 8,93 (уш.с, 2H).δ 1.80 (s, 3H), 3.29 (br s, 4H), 3.55 (br s, 4H), 3.68 (s, 3H), 4.22 (s, 2H), 4.98 (s, 2H); 5.21 (s, 2H); 8.93 (br s, 2H).
Пример 100Example 100
Гидрохлорид метил [1,7-бис(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетатаMethyl [1,7-bis (2-butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
(a) трет-Бутил-4-[1,7-бис(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1,7-bis (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate
Используя 1-бром-2-бутин вместо бромида 2-цианобензила в примере 96 (а), следуя способу, описанному в примере 96 (а), синтезируют указанное в заголовке соединение.Using 1-bromo-2-butine instead of 2-cyanobenzyl bromide in Example 96 (a), following the method described in Example 96 (a), the title compound was synthesized.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,80 (т, J=2 Гц, 3H), 1,83 (т, J=2 Гц, 3H), 3,40-3,45 (м, 4H), 3,57-3,62 (м, 4H), 4,93 (кв, J=2 Гц, 2H), 4,98 (кв, J=2 Гц, 2H).δ 1.49 (s, 9H), 1.80 (t, J = 2 Hz, 3H), 1.83 (t, J = 2 Hz, 3H), 3.40-3.45 (m, 4H) 3.57-3.62 (m, 4H), 4.93 (q, J = 2 Hz, 2H), 4.98 (q, J = 2 Hz, 2H).
(b) Гидрохлорид метил [1,7-бис(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата(b) Methyl [1,7-bis (2-butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
Используя соединение, полученное выше в примере 100 (а), вместо соединения, полученного в примере 96(а), следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.Using the compound obtained in Example 100 (a) above, instead of the compound obtained in Example 96 (a), following the method described in Example 97, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (с, 6H), 3,28 (уш.с, 4H), 3,53 (уш.с, 4H), 3,67 (с, 3H), 4,15 (с, 2H), 4,83 (с, 2H), 4,98 (с, 2H), 9,02 (уш.с, 2H).δ 1.79 (s, 6H), 3.28 (br s, 4H), 3.53 (br s, 4H), 3.67 (s, 3H), 4.15 (s, 2H), 4.83 (s, 2H); 4.98 (s, 2H); 9.02 (br s, 2H).
Пример 101Example 101
Гидрохлорид 1,7-бис(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила1,7-bis (2-butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Используя цианид натрия вместо метилтиогликолята в примере 100, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using sodium cyanide instead of methylthioglycolate in Example 100, following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,81 (с, 3H), 1,82 (с, 3H), 3,28 (уш.с, 4H), 3,56-3,63 (м, 4H), 4,95 (кв, J=2 Гц, 2H), 5,07 (кв, J=2 Гц, 2H), 9,04 (уш.с, 2H).δ 1.81 (s, 3H), 1.82 (s, 3H), 3.28 (br s, 4H), 3.56-3.63 (m, 4H), 4.95 (q, J = 2 Hz, 2H), 5.07 (q, J = 2 Hz, 2H), 9.04 (br s, 2H).
Пример 102Example 102
Гидрохлорид 1,7-бис(2-бутинил)-2-метокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она1,7-bis (2-butynyl) -2-methoxy-8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
Используя метанол вместо метилтиогликолята и гидрид натрия в качестве основания в примере 100, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using methanol instead of methylthioglycolate and sodium hydride as the base in Example 100, following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,75 (с, 3H), 1,80 (с, 3H), 3,28 (уш.с, 4H), 3,47-3,55 (м, 4H), 3,98 (с, 3H), 4,66 (с, 2H), 4,96 (с, 2H), 9,01 (уш.с, 2H).δ 1.75 (s, 3H), 1.80 (s, 3H), 3.28 (br s, 4H), 3.47-3.55 (m, 4H), 3.98 (s, 3H) ), 4.66 (s, 2H), 4.96 (s, 2H), 9.01 (br s, 2H).
Пример 103Example 103
Гидрохлорид метил [1-аллил-7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетатаMethyl [1-allyl-7- (2-butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
(a) трет-Бутил-4-[1-аллил-7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1-allyl-7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate
Используя аллилбромид вместо бромида 2-цианобензила в примере 96(а), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using allyl bromide instead of 2-cyanobenzyl bromide in Example 96 (a), following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,38-3,45 (м, 4H), 3,55-3,63 (м, 4H), 4,90 (д, J=5 Гц, 2H), 4,93 (кв, J=2 Гц, 2H), 5,19-5,29 (м, 2H), 5,93 (ддт, J=10, 17, 5 Гц, 1H).δ 1.49 (s, 9H), 1.83 (t, J = 2 Hz, 3H), 3.38-3.45 (m, 4H), 3.55-3.63 (m, 4H), 4.90 (d, J = 5 Hz, 2H), 4.93 (q, J = 2 Hz, 2H), 5.19-5.29 (m, 2H), 5.93 (ddt, J = 10 17.5 Hz, 1H).
(b) Гидрохлорид метил [1-аллил-7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата(b) Methyl [1-allyl-7- (2-butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
Используя соединение, описанное выше в примере 103(а), вместо соединения, полученного в примере 96(а) в примере 97, следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.Using the compound described in Example 103 (a) above, instead of the compound obtained in Example 96 (a) in Example 97, following the method described in Example 97, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (с, 3H), 3,27 (уш.с, 4H), 3,48-3,56 (м, 4H), 3,66 (с, 3H), 4,12 (с, 2H), 4,70 (д, J=5 Гц, 2H), 4,98 (уш.с, 2H), 5,07 (д, J=17 Гц, 1H), 5,21 (д, J=10 Гц, 1H), 5,89 (ддт, J=10, 17, 5 Гц, 1H), 9,07 (уш.с, 2H).δ 1.79 (s, 3H), 3.27 (br s, 4H), 3.48-3.56 (m, 4H), 3.66 (s, 3H), 4.12 (s, 2H ), 4.70 (d, J = 5 Hz, 2H), 4.98 (br.s, 2H), 5.07 (d, J = 17 Hz, 1H), 5.21 (d, J = 10 Hz, 1H), 5.89 (DDT, J = 10, 17, 5 Hz, 1H), 9.07 (br s, 2H).
Пример 104Example 104
Гидрохлорид 1-аллил-7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила1-allyl-7- (2-butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Указанное в заголовке соединение синтезируют, следуя способу примера 103, с использованием цианида натрия вместо аллилбромида.The title compound was synthesized following the method of Example 103 using sodium cyanide instead of allyl bromide.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,81 (т, J=2 Гц, 3H), 3,29 (уш.с, 4H), 3,57-3,64 (м, 4H), 4,81 (д, J=5 Гц, 2H), 5,04-5,10 (м, 3H), 5,26 (д, J=10 Гц, 1H), 6,00 (ддт, J=10, 17, 5 Гц, 1H), 9,12 (уш.с, 2H).δ 1.81 (t, J = 2 Hz, 3H), 3.29 (br.s, 4H), 3.57-3.64 (m, 4H), 4.81 (d, J = 5 Hz, 2H), 5.04-5.10 (m, 3H), 5.26 (d, J = 10 Hz, 1H), 6.00 (ddt, J = 10, 17, 5 Hz, 1H), 9, 12 (br s, 2H).
Пример 105Example 105
Гидрохлорид 1-аллил-7-(2-бутинил)-2-метокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она1-allyl-7- (2-butynyl) -2-methoxy-8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
Используя метанол вместо метилтиогликолята и гидрид натрия в качестве основания в примере 103, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using methanol instead of methylthioglycolate and sodium hydride as the base in Example 103, following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (т, J=2 Гц, 3H), 3,27 (уш.с, 4H), 3,48-3,56 (м, 4H), 3,93 (с, 3H), 4,55 (д, J=5 Гц, 2H), 4,94-5,02 (м, 3H), 5,12 (д, J=10 Гц, 1H), 5,87 (ддт, J=10, 17, 5 Гц, 1H), 9,04 (уш.с, 2H).δ 1.79 (t, J = 2 Hz, 3H), 3.27 (br s, 4H), 3.48-3.56 (m, 4H), 3.93 (s, 3H), 4, 55 (d, J = 5 Hz, 2H), 4.94-5.02 (m, 3H), 5.12 (d, J = 10 Hz, 1H), 5.87 (ddt, J = 10, 17 5 Hz, 1H); 9.04 (br s, 2H).
Пример 106Example 106
Гидрохлорид метил [7-(2-бутинил)-1-(2-метоксиэтил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетатаMethyl [7- (2-butynyl) -1- (2-methoxyethyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetate hydrochloride
(a) трет-Бутил-4-[7-(2-бутинил)-1-(2-метоксиэтил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -1- (2-methoxyethyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazin- 1-carboxylate
Используя 2-бромэтилметиловый эфир вместо бромида 2-цианобензила в примере 96(а), следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using 2-bromoethyl methyl ether instead of 2-cyanobenzyl bromide in Example 96 (a), following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2 Гц, 3H), 3,36 (с, 3H), 3,39-3,45 (м, 4H), 3,56-3,61 (м, 4H), 3,69 (т, J=6 Гц, 2H), 4,50 (т, J=6 Гц, 2H), 4,92 (кв, J=2 Гц, 2H).δ 1.49 (s, 9H), 1.83 (t, J = 2 Hz, 3H), 3.36 (s, 3H), 3.39-3.45 (m, 4H), 3.56- 3.61 (m, 4H), 3.69 (t, J = 6 Hz, 2H), 4.50 (t, J = 6 Hz, 2H), 4.92 (q, J = 2 Hz, 2H) .
(b) Гидрохлорид метил [7-(2-бутинил)-1-(2-метоксиэтил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетата(b) Methyl [7- (2-butynyl) -1- (2-methoxyethyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl hydrochloride] acetate
Используя соединение, полученное в описанном выше примере 106(а), вместо соединения, полученного в примере 96(а), используемого в примере 97, следуя способу, описанному в примере 97, синтезируют указанное в заголовке соединение.Using the compound obtained in the above Example 106 (a), instead of the compound obtained in the Example 96 (a) used in Example 97, following the method described in the Example 97, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 3,25-3,32 (м, 7H), 3,50-3,55 (м, 4H), 3,61 (т, J=6 Гц, 2H), 3,67 (с, 3H), 4,14 (с, 2H), 4,25 (т, J=6 Гц, 2H), 4,98 (с, 2H), 9,00 (уш.с, 2H).δ 1.80 (s, 3H), 3.25-3.32 (m, 7H), 3.50-3.55 (m, 4H), 3.61 (t, J = 6 Hz, 2H), 3.67 (s, 3H), 4.14 (s, 2H), 4.25 (t, J = 6 Hz, 2H), 4.98 (s, 2H), 9.00 (br s, 2H )
Пример 107Example 107
Гидрохлорид 7-(2-бутинил)-1-(2-метоксиэтил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила7- (2-Butynyl) -1- (2-methoxyethyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Используя цианид натрия вместо метилтиогликолята в примере 106, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using sodium cyanide instead of methylthioglycolate in Example 106, following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,81 (с, 3H), 3,25 (с, 3H), 3,29 (уш.с, 4H), 3,55-3,64 (м, 6H), 4,34 (т, J=5 Гц, 2H), 5,08 (с, 2H), 9,05 (уш.с, 2H).δ 1.81 (s, 3H), 3.25 (s, 3H), 3.29 (br s, 4H), 3.55-3.64 (m, 6H), 4.34 (t, J = 5 Hz, 2H), 5.08 (s, 2H), 9.05 (br s, 2H).
Пример 108Example 108
Гидрохлорид 7-(2-бутинил)-1-(2-метоксиэтил)-2-метокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1- (2-methoxyethyl) -2-methoxy-8- (piperazin-1-yl) -1,7-dihydropurin-6-one hydrochloride
Используя метанол вместо метилтиогликолята и безводный карбонат калия в качестве основания в примере 106, следуя способу, описанному в этом примере, синтезируют указанное в заголовке соединение.Using methanol instead of methylthioglycolate and anhydrous potassium carbonate as the base in Example 106, following the method described in this Example, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (с, 3H), 3,23 (с, 3H), 3,27 (уш.с, 4H), 3,46-3,55 (м, 6H), 3,94 (с, 3H), 4,13 (т, J=6 Гц, 2H), 4,96 (с, 2H), 9,03 (уш.с, 2H).δ 1.79 (s, 3H), 3.23 (s, 3H), 3.27 (br s, 4H), 3.46-3.55 (m, 6H), 3.94 (s, 3H) ), 4.13 (t, J = 6 Hz, 2H), 4.96 (s, 2H), 9.03 (br s, 2H).
Пример 109Example 109
Трифторацетат 7-бензил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7-Benzyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
(a) 7-Бензил-1,7-дигидропурин-6-он(a) 7-Benzyl-1,7-dihydropurin-6-one
18,23 г инозина растворяют в 90 мл диметилсульфоксида и к полученному раствору добавляют 16 мл бензилбромида. Смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор вливают в 3 л этилацетата. Полученный верхний слой удаляют и нижний масляный слой растворяют в 10% соляной кислоте (135 мл). Раствор нагревают до 70ºС и перемешивают в течение 4 часов. Раствор охлаждают до комнатной температуры и затем нейтрализуют до рН 7 с использованием 5 н. водного раствора гидроксида натрия. Осажденное твердое вещество собирают фильтрацией и сушат с получением 12,748 г указанного в заголовке соединения.18.23 g of inosine are dissolved in 90 ml of dimethyl sulfoxide and 16 ml of benzyl bromide are added to the resulting solution. The mixture was stirred at room temperature overnight. The reaction solution was poured into 3 L of ethyl acetate. The resulting upper layer was removed and the lower oil layer was dissolved in 10% hydrochloric acid (135 ml). The solution is heated to 70 ° C and stirred for 4 hours. The solution was cooled to room temperature and then neutralized to pH 7 using 5 N. an aqueous solution of sodium hydroxide. The precipitated solid was collected by filtration and dried to obtain 12.748 g of the title compound.
(b) трет-Бутил-4-(7-бензил-6-оксо-6,7-дигидро-1H-пурин-8-ил)пиперазин-1-карбоксилат(b) tert-Butyl 4- (7-benzyl-6-oxo-6,7-dihydro-1H-purin-8-yl) piperazine-1-carboxylate
12,748 г 7-бензил-1,7-дигидропурин-6-она растворяют в 150 мл N,N-диметилформамида и к полученному раствору добавляют 7,9 г N-хлорсукцинимида. Реакционный раствор перемешивают в течение ночи и разбавляют этилацетатом. Раствор промывают водой и 1 н. соляной кислотой и затем сушат над безводным сульфатом магния. Раствор фильтруют и фильтрат концентрируют с получением 6,103 г 7-бензил-8-хлор-1,7-дигидропурин-6-она. Полученное вещество смешивают с 20 г трет-бутилпиперазин-1-карбоксилата и смесь нагревают при 150ºС. После перемешивания в течение одного часа реакционную смесь распределяют между этилацетатом и водой. Органический слой промывают 1 н. соляной кислотой и сушат над безводным сульфатом магния. После фильтрации полученное вещество концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью этилацетат-метанол (10:1), получают 1,539 г указанного в заголовке соединения.12.748 g of 7-benzyl-1,7-dihydropurin-6-one is dissolved in 150 ml of N, N-dimethylformamide and 7.9 g of N-chlorosuccinimide are added to the resulting solution. The reaction solution was stirred overnight and diluted with ethyl acetate. The solution is washed with water and 1 N. hydrochloric acid and then dried over anhydrous magnesium sulfate. The solution was filtered and the filtrate was concentrated to obtain 6.103 g of 7-benzyl-8-chloro-1,7-dihydropurin-6-one. The resulting substance is mixed with 20 g of tert-butylpiperazine-1-carboxylate and the mixture is heated at 150 ° C. After stirring for one hour, the reaction mixture was partitioned between ethyl acetate and water. The organic layer is washed with 1 N. hydrochloric acid and dried over anhydrous magnesium sulfate. After filtration, the resulting material was concentrated. The residue was purified by silica gel column chromatography. Thus, 1.539 g of the title compound was obtained from the fraction eluted with ethyl acetate-methanol (10: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,39 (с, 9H), 3,07-3,10 (м, 4H), 3,35-3,39 (м, 4H), 5,44 (с, 2H), 7,16-7,18 (м, 2H), 7,22-7,32 (м, 3H), 7,91 (с, 1H), 12,18 (с, 1H).δ 1.39 (s, 9H), 3.07-3.10 (m, 4H), 3.35-3.39 (m, 4H), 5.44 (s, 2H), 7.16-7 18 (m, 2H), 7.22-7.32 (m, 3H), 7.91 (s, 1H), 12.18 (s, 1H).
(c) Трифторацетат 7-бензил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она(c) 7-Benzyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
15 мг трет-бутил-4-(7-бензил-6-оксо-6,7-дигидро-1H-пурин-8-ил)пиперазин-1-карбоксилата растворяют в 1 мл N,N-диметилформамида и к полученному раствору добавляют 10 мг гидрида натрия и 10 мкл метилйодида. Полученную смесь перемешивают при комнатной температуре в течение 3 дней, добавляют этилацетат и воду, затем смесь расслаивалась. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)), в результате чего получают 4,31 мг указанного в заголовке соединения.15 mg of tert-butyl 4- (7-benzyl-6-oxo-6,7-dihydro-1H-purin-8-yl) piperazine-1-carboxylate was dissolved in 1 ml of N, N-dimethylformamide and was added to the resulting solution 10 mg sodium hydride and 10 μl methyl iodide. The resulting mixture was stirred at room temperature for 3 days, ethyl acetate and water were added, then the mixture was stratified. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting solution was concentrated. The residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)), whereby 4.31 mg of the title compound was obtained.
МС m/e (ESI) 325(MH+-CF3COOH).MS m / e (ESI) 325 (MH + -CF 3 COOH).
Пример 110Example 110
Трифторацетат 7-бензил-1-этил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7-Benzyl-1-ethyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя йодэтан вместо метилйодида.The title compound was prepared according to the method described in Example 109 using iodoethane instead of methyl iodide.
МС m/e (ESI) 339(MH+-CF3COOH).MS m / e (ESI) 339 (MH + -CF 3 COOH).
Пример 111Example 111
Трифторацетат этил [7-бензил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-ил]ацетатаEthyl [7-benzyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydropurin-1-yl] acetate trifluoroacetate
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя этилбромацетат вместо метилйодида.The title compound was prepared according to the method described in Example 109 using ethyl bromoacetate instead of methyl iodide.
МС m/e (ESI) 397 (MH+-CF3COOH).MS m / e (ESI) 397 (MH + -CF 3 COOH).
Пример 112Example 112
Трифторацетат 7-бензил-1-(2-метоксиэтил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7-benzyl-1- (2-methoxyethyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя бромид 2-метоксиэтила вместо метилйодида.The title compound was prepared according to the method described in Example 109 using 2-methoxyethyl bromide instead of methyl iodide.
МС m/e (ESI) 369 (MH+-CF3COOH).MS m / e (ESI) 369 (MH + -CF 3 COOH).
Пример 113Example 113
Трифторацетат 7-бензил-1-(2-пропинил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-онаTrifluoroacetate 7-benzyl-1- (2-propynyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя пропаргилбромид вместо метилйодида.The title compound was prepared according to the method described in Example 109 using propargyl bromide instead of methyl iodide.
МС m/e (ESI) 349 (MH+-CF3COOH).MS m / e (ESI) 349 (MH + -CF 3 COOH).
Пример 114Example 114
Трифторацетат 7-бензил-1-цианометил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7-Benzyl-1-cyanomethyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Указанное в заголовке соединение получают по способу, описанному в примере 109, используя бромацетонитрил вместо метилйодида.The title compound was prepared according to the method described in Example 109 using bromoacetonitrile instead of methyl iodide.
МС m/e (ESI) 350 (MH+-CF3COOH).MS m / e (ESI) 350 (MH + -CF 3 COOH).
Пример 115Example 115
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) Этил-2-бром-3-(2-бутинил)-5-циано-3H-имидазол-4-карбоксилат(a) Ethyl 2-bromo-3- (2-butynyl) -5-cyano-3H-imidazole-4-carboxylate
4,56 мл серной кислоты добавляют к 170 мл этанола, содержащего 16,80 г 2-бром-1Н-имидазол-4,5-дикарбонитрила [CAS No. 50847-09-1], и полученную смесь кипятят с обратным холодильником в течение 48 часов. Раствор охлаждают и добавляют к нему 500 мл этилацетата и 200 мл воды. Органический слой сушат над безводным сульфатом магния, фильтруют и концентрируют при пониженном давлении. Остаток растворяют в N,N-диметилформамиде и к раствору добавляют 14,1 г карбоната калия и 8,6 мл бромида 2-бутинила. Смесь перемешивают при комнатной температуре в течение 18 часов. К раствору добавляют 500 мл этилацетата и смесь трижды промывают 300 мл воды, затем промывают 300 мл насыщенного раствора хлорида натрия. Полученный раствор сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (9:1), получают 4,09 г указанного в заголовке соединения.4.56 ml of sulfuric acid is added to 170 ml of ethanol containing 16.80 g of 2-bromo-1H-imidazole-4,5-dicarbonitrile [CAS No. 50847-09-1], and the resulting mixture was refluxed for 48 hours. The solution is cooled and 500 ml of ethyl acetate and 200 ml of water are added to it. The organic layer was dried over anhydrous magnesium sulfate, filtered and concentrated under reduced pressure. The residue was dissolved in N, N-dimethylformamide and 14.1 g of potassium carbonate and 8.6 ml of 2-butynyl bromide were added to the solution. The mixture was stirred at room temperature for 18 hours. 500 ml of ethyl acetate was added to the solution, and the mixture was washed three times with 300 ml of water, then washed with 300 ml of a saturated sodium chloride solution. The resulting solution was dried over anhydrous magnesium sulfate and filtered. The filtrate was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, from the fraction eluted with hexane-ethyl acetate (9: 1), 4.09 g of the title compound are obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (т, J=7,2 Гц, 3H), 1,81 (с, 3H), 4,47 (кв, J=7,2 Гц, 2H), 5,16 (с, 2H).δ 1.43 (t, J = 7.2 Hz, 3H), 1.81 (s, 3H), 4.47 (q, J = 7.2 Hz, 2H), 5.16 (s, 2H) .
(b) трет-Бутил-4-[1-(2-бутинил)-4-циано-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [1- (2-butynyl) -4-cyano-5-ethoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
4,09 г этилового эфира 2-бром-3-(2-бутинил)-5-циано-3H-имидазол-4-карбоновой кислоты объединяют с 7,70 г трет-бутилпиперазин-1-карбоксилата и полученную смесь нагревают при перемешивании до 150ºС в течение 50 минут. Реакционную смесь растворяют в толуоле. После этого смесь подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (2:1), получают 4,47 г указанного в заголовке соединения.4.09 g of 2-bromo-3- (2-butynyl) -5-cyano-3H-imidazole-4-carboxylic acid ethyl ester was combined with 7.70 g of tert-butylpiperazine-1-carboxylate and the resulting mixture was heated with stirring to 150ºС for 50 minutes. The reaction mixture was dissolved in toluene. After that, the mixture is subjected to purification by column chromatography on silica gel. Thus, 4.47 g of the title compound is obtained from the fraction eluted with hexane-ethyl acetate (2: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (т, J=7,2 Гц, 3H), 1,47 (с, 9H), 1,82 (т, J=2,3 Гц, 3H), 3,08-3,13 (м, 4H), 3,57-3,61 (м, 4H), 4,44 (кв, J=7,2 Гц, 2H), 4,89 (кв, J=2,3 Гц, 2H).δ 1.43 (t, J = 7.2 Hz, 3H), 1.47 (s, 9H), 1.82 (t, J = 2.3 Hz, 3H), 3.08-3.13 ( m, 4H), 3.57-3.61 (m, 4H), 4.44 (q, J = 7.2 Hz, 2H), 4.89 (q, J = 2.3 Hz, 2H).
(c) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(c) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-thiocarbamoyl-1H-imidazol-2-yl] piperazine-1-carboxylate
5 мл 50% водного раствора сульфида аммония добавляют к 20 мл этанольного раствора, содержащего 0,80 г трет-бутил-4-[1-(2-бутинил)-4-циано-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, и полученную смесь нагревают при 60ºС в течение 14 часов. К полученной смеси добавляют 100 мл этилацетата и 50 мл воды, затем органический слой последовательно промывают 50 мл воды и 50 мл насыщенного раствора хлорида натрия. Затем реакционный раствор сушат над безводным сульфатом магния и фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 0,58 г указанного в заголовке соединения.5 ml of a 50% aqueous solution of ammonium sulfide is added to 20 ml of an ethanol solution containing 0.80 g of tert-butyl-4- [1- (2-butynyl) -4-cyano-5-ethoxycarbonyl-1H-imidazol-2-yl ] piperazine-1-carboxylate, and the resulting mixture was heated at 60 ° C for 14 hours. To the resulting mixture were added 100 ml of ethyl acetate and 50 ml of water, then the organic layer was washed successively with 50 ml of water and 50 ml of a saturated solution of sodium chloride. Then the reaction solution is dried over anhydrous magnesium sulfate and filtered. The filtrate was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.58 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (3: 2).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (т, J=7,2 Гц, 3H), 1,48 (с, 9H), 1,82 (т, J=2,3 Гц, 3H), 3,12-3,16 (м, 4H), 3,54-3,59 (м, 4H), 4,44 (кв, J=7,2 Гц, 2H), 4,89 (кв, J=2,3 Гц, 2H), 7,41 (уш.с, 1H), 8,88 (уш.с, 1H).δ 1.43 (t, J = 7.2 Hz, 3H), 1.48 (s, 9H), 1.82 (t, J = 2.3 Hz, 3H), 3.12-3.16 ( m, 4H), 3.54-3.59 (m, 4H), 4.44 (q, J = 7.2 Hz, 2H), 4.89 (q, J = 2.3 Hz, 2H), 7.41 (br s, 1H); 8.88 (br s, 1H).
(d) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-methylsulfanylcarbonimidoyl-1H-imidazol-2-yl] piperazine-1-carboxylate
0,235 г тетрафторбората триметилоксония добавляют к 20 мл дихлорметанового раствора, содержащего 0,58 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата и смесь перемешивают при комнатной температуре в течение 18 часов. К полученному раствору добавляют 50 мл дихлорметана и смесь промывают 20 мл насыщенного раствора бикарбоната натрия. Смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 0,55 г указанного в заголовке соединения.0.235 g of trimethyloxonium tetrafluoroborate is added to 20 ml of a dichloromethane solution containing 0.58 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-thiocarbamoyl-1H-imidazol-2-yl] piperazin-1 β-carboxylate and the mixture was stirred at room temperature for 18 hours. To the resulting solution was added 50 ml of dichloromethane and the mixture was washed with 20 ml of a saturated sodium bicarbonate solution. The mixture was dried over anhydrous magnesium sulfate and concentrated under reduced pressure to obtain 0.55 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,41 (т, J=7,2 Гц, 3H), 1,47 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 2,39 (с, 3H), 3,12-3,16 (м, 4H), 3,56-3,59 (м, 4H), 4,42 (кв, J=7,2 Гц, 2H), 4,80 (кв, J=2,3 Гц, 2H).δ 1.41 (t, J = 7.2 Hz, 3H), 1.47 (s, 9H), 1.81 (t, J = 2.3 Hz, 3H), 2.39 (s, 3H) , 3.12-3.16 (m, 4H), 3.56-3.59 (m, 4H), 4.42 (q, J = 7.2 Hz, 2H), 4.80 (q, J = 2.3 Hz, 2H).
(e) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(e) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-methylsulfanylcarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
5 мл 2 н. водного раствора соляной кислоты добавляют к 30 мл этанольного раствора, содержащего 0,55 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, и полученную смесь нагревают при 60ºС в течение 5 часов. После концентрации при пониженном давлении к полученному раствору добавляют 25 мл этилацетата и 1 н. раствор гидроксида натрия. Водный слой экстрагируют 25 мл этилацетата и органические слои объединяют. Полученную смесь промывают 10 мл насыщенного раствора хлорида натрия, содержащего 1 мл 1 н. раствора гидроксида натрия, и сушат над безводным сульфатом магния. Полученный раствор фильтруют и фильтрат концентрируют при пониженном давлении. Остаток растворяют в 10 мл дихлорметана и к полученному раствору добавляют 0,10 мл триэтиламина и 0,256 г ди-трет-бутилдикарбоната. Смесь перемешивают при комнатной температуре в течение 15 часов и затем к ней добавляют 25 мл этилацетата. Смесь последовательно промывают 10 мл 0,1 н. соляной кислоты, 10 мл насыщенного раствора бикарбоната натрия и 10 мл насыщенного раствора хлорида натрия и затем сушат над безводным сульфатом магния. Полученный раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (4:1), получают 0,15 г указанного в заголовке соединения.5 ml 2 n. aqueous hydrochloric acid is added to 30 ml of an ethanol solution containing 0.55 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-methylsulfanylcarbonimidoyl-1H-imidazol-2-yl] piperazin-1 -carboxylate, and the resulting mixture is heated at 60 ° C for 5 hours. After concentration under reduced pressure, 25 ml of ethyl acetate and 1N were added to the resulting solution. sodium hydroxide solution. The aqueous layer was extracted with 25 ml of ethyl acetate and the organic layers were combined. The resulting mixture was washed with 10 ml of a saturated solution of sodium chloride containing 1 ml of 1 N. sodium hydroxide solution, and dried over anhydrous magnesium sulfate. The resulting solution was filtered and the filtrate was concentrated under reduced pressure. The residue was dissolved in 10 ml of dichloromethane and 0.10 ml of triethylamine and 0.256 g of di-tert-butyl dicarbonate were added to the resulting solution. The mixture was stirred at room temperature for 15 hours and then 25 ml of ethyl acetate was added thereto. The mixture is washed successively with 10 ml of 0.1 N. hydrochloric acid, 10 ml of a saturated solution of sodium bicarbonate and 10 ml of a saturated solution of sodium chloride, and then dried over anhydrous magnesium sulfate. The resulting solution was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.15 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (4: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 2,40 (с, 3H), 3,16-3,20 (м, 4H), 3,55-3,59 (м, 4H), 4,35 (кв, J=7,1 Гц, 2H), 4,80 (кв, J=2,3 Гц, 2H).δ 1.43 (t, J = 7.1 Hz, 3H), 1.48 (s, 9H), 1.81 (t, J = 2.3 Hz, 3H), 2.40 (s, 3H) , 3.16-3.20 (m, 4H), 3.55-3.59 (m, 4H), 4.35 (q, J = 7.1 Hz, 2H), 4.80 (q, J = 2.3 Hz, 2H).
(f) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(f) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-hydroxymethyl-1H-imidazol-2-yl] piperazine-1-carboxylate
0,187 г ацетата ртути (II) и 0,090 г борогидрида натрия добавляют к 8 мл этанольного раствора, содержащего 0,265 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, при 0ºC и полученную смесь перемешивают при комнатной температуре в течение 4 часов. К раствору добавляют 0,187 г ацетата ртути (II) и 0,090 г борогидрида натрия и полученную смесь перемешивают при комнатной температуре в течение 15 часов. К раствору добавляют 100 мл этилацетата и 50 мл 0,5 н. соляной кислоты и органический слой последовательно промывают 50 мл воды и 50 мл насыщенного раствора хлорида натрия. Смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. 0,172 г исходного материала содержалось во фракции, элюированной смесью гексан-этилацетат (4:1). Таким образом из фракции, элюированной смесью гексан-этилацетат (1:4), получают 0,061 г соединения, указанного в заголовке.0.187 g of mercury (II) acetate and 0.090 g of sodium borohydride are added to 8 ml of an ethanol solution containing 0.265 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-methylsulfanylcarbonyl-1H-imidazole-2 -yl] piperazine-1-carboxylate, at 0 ° C, and the resulting mixture was stirred at room temperature for 4 hours. 0.187 g of mercury (II) acetate and 0.090 g of sodium borohydride were added to the solution, and the resulting mixture was stirred at room temperature for 15 hours. 100 ml of ethyl acetate and 50 ml of 0.5N are added to the solution. hydrochloric acid and the organic layer are washed successively with 50 ml of water and 50 ml of a saturated solution of sodium chloride. The mixture was dried over anhydrous magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. 0.172 g of the starting material was contained in the fraction eluted with hexane-ethyl acetate (4: 1). Thus, from the fraction eluted with hexane-ethyl acetate (1: 4), 0.061 g of the title compound was obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,42 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 3,17-3,21 (м, 4H), 3,41 (т, J=4,8 Гц, 1H), 3,56-3,60 (м, 4H), 4,36 (кв, J=7,1 Гц, 2H), 4,75 (д, J=4,8 Гц, 2H), 4,81 (кв, J=2,3 Гц, 2H).δ 1.42 (t, J = 7.1 Hz, 3H), 1.48 (s, 9H), 1.81 (t, J = 2.3 Hz, 3H), 3.17-3.21 ( m, 4H), 3.41 (t, J = 4.8 Hz, 1H), 3.56-3.60 (m, 4H), 4.36 (q, J = 7.1 Hz, 2H), 4.75 (d, J = 4.8 Hz, 2H); 4.81 (q, J = 2.3 Hz, 2H).
(g) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(g) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-formyl-1H-imidazol-2-yl] piperazine-1-carboxylate
0,120 г диоксида марганца добавляют к раствору 0,061 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 2 мл дихлорметана и полученную смесь перемешивают при комнатной температуре в течение 15 часов. Реакционный раствор фильтруют через целит и фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (7:3), получают 0,055 г соединения, указанного в заголовке.0.120 g of manganese dioxide is added to a solution of 0.061 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-hydroxymethyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 2 ml of dichloromethane and the resulting mixture was stirred at room temperature for 15 hours. The reaction solution was filtered through celite and the filtrate was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, from the fraction eluted with hexane-ethyl acetate (7: 3), 0.055 g of the title compound is obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,42 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,82 (т, J=2,3 Гц, 3H), 3,23-3,26 (м, 4H), 3,55-3,59 (м, 4H), 4,45 (кв, J=7,1 Гц, 2H), 4,89 (кв, J=2,3 Гц, 2H), 10,36 (с, 1H).δ 1.42 (t, J = 7.1 Hz, 3H), 1.48 (s, 9H), 1.82 (t, J = 2.3 Hz, 3H), 3.23-3.26 ( m, 4H), 3.55-3.59 (m, 4H), 4.45 (q, J = 7.1 Hz, 2H), 4.89 (q, J = 2.3 Hz, 2H), 10.36 (s, 1H).
(h) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(h) tert-Butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin- 1-carboxylate
0,05 мл метилгидразина добавляют к раствору 0,055 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 2,5 мл этанола. Смесь перемешивают при 80ºС в течение 15 часов и затем нагревают при 130ºС в течение 14 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (1:1), получают 0,035 г соединения, указанного в заголовке.0.05 ml of methylhydrazine was added to a solution of 0.055 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-formyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 2.5 ml of ethanol. The mixture is stirred at 80 ° C for 15 hours and then heated at 130 ° C for 14 hours. The reaction solution was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, from the fraction eluted with hexane-ethyl acetate (1: 1), 0.035 g of the title compound is obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,52 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,38-3,42 (м, 4H), 3,61-3,64 (м, 4H), 3,85 (с, 3H), 5,09 (кв, J=2,3 Гц, 2H), 8,13 (с, 1H).δ 1.52 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.38-3.42 (m, 4H), 3.61-3.64 (m, 4H ), 3.85 (s, 3H), 5.09 (q, J = 2.3 Hz, 2H), 8.13 (s, 1H).
МС m/e (ESI) 387,4 (МН+).MS m / e (ESI) 387.4 (MH + ).
(i) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(i) 3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
0,4 мл трифторуксусной кислоты добавляют к 0,4 мл раствора 0,0351 г трет-бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в дихлорметане и полученную смесь перемешивают при комнатной температуре в течение одного часа. Раствор концентрируют. Остаток очищают методом высокоэффективной жидкостной хроматографии с обратимой фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,0295 г указанного в заголовке соединения.0.4 ml of trifluoroacetic acid is added to 0.4 ml of a solution of 0.0351 g of tert-butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [ 4,5-d] pyridazin-2-yl] piperazin-1-carboxylate in dichloromethane and the resulting mixture was stirred at room temperature for one hour. The solution is concentrated. The residue was purified by reversed-phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.0295 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 3,83 (с, 3H), 5,15 (кв, J=2,3 Гц, 2H), 8,20 (с, 1H).δ 1.83 (t, J = 2.3 Hz, 3H), 3.45-3.49 (m, 4H), 3.65-3.69 (m, 4H), 3.83 (s, 3H ), 5.15 (q, J = 2.3 Hz, 2H), 8.20 (s, 1H).
МС m/e (ESI) 287,9 (МН+-CF3COOH).MS m / e (ESI) 287.9 (MH + -CF 3 COOH).
Пример 116Example 116
Трифторацетат 5-бензилоксиметил-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она5-Benzyloxymethyl-3- (2-butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) Диметиламид 5-бензилоксиметил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты(a) 5-Benzyloxymethyl-4-oxo-4,5-dihydroimidazo [4,5-d] pyridazin-1-sulfonic acid dimethylamide
2,08 г триэтиламина, 2,80 г N,N-диметилсульфамоилхлорида и 0,22 г 4-диметиламинопиридина добавляют к 50 мл дихлорметанового раствора, содержащего 3,04 г 5-бензилоксиметилимидазо[4,5-d]пиридазин-4-она [CAS No. 82137-50-6] (R. Paul Gagnier, Michael J. Halat, Brian A. Otter Journal of Heterocyclic Chemistry, 21, p. 481, 1984), и полученную смесь нагревают с обратным холодильником в течение 4 часов. К раствору добавляют 250 мл этилацетата и смесь последовательно промывают 50 мл 1 н. водного раствора соляной кислоты, 50 мл насыщенного раствора бикарбоната натрия и 50 мл насыщенного раствора хлорида натрия. Полученную смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (2:3), получают 2,86 г указанного в заголовке соединения.2.08 g of triethylamine, 2.80 g of N, N-dimethylsulfamoyl chloride and 0.22 g of 4-dimethylaminopyridine are added to 50 ml of a dichloromethane solution containing 3.04 g of 5-benzyloxymethylimidazo [4,5-d] pyridazin-4-one [CAS No. 82137-50-6] (R. Paul Gagnier, Michael J. Halat, Brian A. Otter Journal of Heterocyclic Chemistry, 21, p. 481, 1984), and the resulting mixture was heated under reflux for 4 hours. 250 ml of ethyl acetate was added to the solution, and the mixture was washed successively with 50 ml of 1N. an aqueous solution of hydrochloric acid, 50 ml of a saturated solution of sodium bicarbonate and 50 ml of a saturated solution of sodium chloride. The resulting mixture was dried over anhydrous magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 2.86 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (2: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 2,98 (с, 6H), 4,77 (с, 2H), 5,74 (с, 2H), 7,30-7,39 (м, 5H), 8,21 (с, 1H), 8,46 (с, 1H).δ 2.98 (s, 6H), 4.77 (s, 2H), 5.74 (s, 2H), 7.30-7.39 (m, 5H), 8.21 (s, 1H), 8.46 (s, 1H).
(b) Диметиламид 5-бензилоксиметил-2-хлор-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты(b) 5-Benzyloxymethyl-2-chloro-4-oxo-4,5-dihydroimidazo [4,5-d] pyridazine-1-sulfonic acid dimethylamide
5,3 мл н-бутилития (2,0 М циклогексановый раствор) в атмосфере азота добавляют при -78ºС в 150 мл тетрагидрофуранового раствора, содержащего 3,34 г диметиламида 5-бензилоксиметил-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты и полученную смесь перемешивают при -78ºС в течение одного часа. К полученному раствору добавляют 20 мл раствора 3,26 г гексахлорэтана в тетрагидрофуране. Смеси дают нагреться до комнатной температуры. К полученному раствору добавляют 25 мл 5% водного раствора хлорида аммония, смесь экстрагируют 50 мл этилацетата. Органический слой последовательно промывают 25 мл воды и 25 мл насыщенного раствора хлорида натрия и затем сушат над безводным сульфатом магния. Органическую фазу концентрируют при пониженном давлении. Полученный остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (2:3), получают 2,31 г указанного в заголовке соединения.5.3 ml of n-butyl lithium (2.0 M cyclohexane solution) in nitrogen atmosphere is added at -78 ° C in 150 ml of a tetrahydrofuran solution containing 3.34 g of 5-benzyloxymethyl-4-oxo-4,5-dihydroimidazo dimethylamide [4, 5-d] pyridazine-1-sulfonic acid and the resulting mixture was stirred at -78 ° C for one hour. To the resulting solution was added 20 ml of a solution of 3.26 g of hexachloroethane in tetrahydrofuran. The mixture was allowed to warm to room temperature. To the resulting solution was added 25 ml of a 5% aqueous solution of ammonium chloride, the mixture was extracted with 50 ml of ethyl acetate. The organic layer was washed successively with 25 ml of water and 25 ml of a saturated solution of sodium chloride and then dried over anhydrous magnesium sulfate. The organic phase is concentrated under reduced pressure. The resulting residue was purified by silica gel column chromatography. Thus, 2.31 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (2: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,12 (с, 6H), 4,77 (с, 2H), 5,70 (с, 2H), 7,30-7,39 (м, 5H), 8,48 (с, 1H).δ 3.12 (s, 6H), 4.77 (s, 2H), 5.70 (s, 2H), 7.30-7.39 (m, 5H), 8.48 (s, 1H).
(c) трет-Бутил-4-(6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат(c) tert-Butyl-4- (6-benzyloxymethyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazine-1-carboxylate
Смесь, состоящую из 2,31 г диметиламида 5-бензилоксиметил-2-хлор-4-оксо-4,5-дигидроимидазо[4,5-d]пиридазин-1-сульфокислоты и 4,49 г трет-бутилпиперазин-1-карбоксилата, нагревают при 150ºС в атмосфере азота в течение 2,5 часов. Полученный остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной этилацетатом, получают 1,94 г указанного в заголовке соединения.A mixture consisting of 2.31 g of 5-benzyloxymethyl-2-chloro-4-oxo-4,5-dihydroimidazo [4,5-d] pyridazine-1-sulfonic acid dimethylamide and 4.49 g of tert-butylpiperazine-1-carboxylate , heated at 150 ° C in nitrogen atmosphere for 2.5 hours. The resulting residue was purified by silica gel column chromatography. Thus, 1.94 g of the title compound is obtained from the fraction eluted with ethyl acetate.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,54-3,58 (м, 4H), 3,71-3,75 (м, 4H), 4,68 (с, 2H), 5,65 (с, 2H), 7,25-7,35 (м, 5H), 8,21 (с, 1H), 12,58 (уш.с, 1H).δ 3.54-3.58 (m, 4H), 3.71-3.75 (m, 4H), 4.68 (s, 2H), 5.65 (s, 2H), 7.25-7 35 (m, 5H), 8.21 (s, 1H), 12.58 (br s, 1H).
(d) трет-Бутил-4-[6-бензилоксиметил-1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [6-benzyloxymethyl-1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin- 1-carboxylate
0,74 г карбоната калия и 0,078 г 2-бутинилбромида добавляют к 20 мл раствора 0,216 г трет-бутил-4-(6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата в N,N-диметилформамиде и полученную смесь перемешивают при комнатной температуре в течение 16 часов. Затем к раствору добавляют 50 мл этилацетата. Органический слой трижды промывают 20 мл воды и затем 10 мл насыщенного водного раствора хлорида натрия. Полученный раствор сушат над безводным сульфатом магния и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2), получают 0,139 г указанного в заголовке соединения.0.74 g of potassium carbonate and 0.078 g of 2-butynyl bromide are added to 20 ml of a solution of 0.216 g of tert-butyl-4- (6-benzyloxymethyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1-carboxylate in N, N-dimethylformamide and the resulting mixture was stirred at room temperature for 16 hours. Then, 50 ml of ethyl acetate was added to the solution. The organic layer is washed three times with 20 ml of water and then with 10 ml of a saturated aqueous solution of sodium chloride. The resulting solution was dried over anhydrous magnesium sulfate and then concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.139 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (3: 2).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,86 (т, J=2,3 Гц, 3H), 3,38-3,44 (м, 4H), 3,61-3,66 (м, 4H), 4,72 (с, 2H), 5,10 (кв, J=2,3 Гц, 2H), 5,65 (с, 2H), 7,25-7,38 (м, 5H), 8,18 (с, 1H).δ 1.50 (s, 9H), 1.86 (t, J = 2.3 Hz, 3H), 3.38-3.44 (m, 4H), 3.61-3.66 (m, 4H ), 4.72 (s, 2H), 5.10 (q, J = 2.3 Hz, 2H), 5.65 (s, 2H), 7.25-7.38 (m, 5H), 8 , 18 (s, 1H).
(e) Трифторацетат 5-бензилоксиметил-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(e) 5-Benzyloxymethyl-3- (2-butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
0,0043 г указанного в заголовке соединения получают обработкой 0,0073 г трет-бутил-4-[6-бензилоксиметил-1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и очисткой полученного продукта по способу примера 115(i).0.0043 g of the title compound was obtained by treating 0.0073 g of tert-butyl-4- [6-benzyloxymethyl-1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5 -d] pyridazin-2-yl] piperazine-1-carboxylate and purification of the obtained product according to the method of example 115 (i).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,83 (т, J=2,3 Гц, 2H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 4,69 (с, 2H), 5,15 (кв, J=2,3 Гц, 2H), 5,64 (с, 2H), 7,17-7,32 (м, 5H), 8,20 (с, 1H).δ 1.83 (t, J = 2.3 Hz, 2H), 3.45-3.49 (m, 4H), 3.65-3.69 (m, 4H), 4.69 (s, 2H) ), 5.15 (q, J = 2.3 Hz, 2H), 5.64 (s, 2H), 7.17-7.32 (m, 5H), 8.20 (s, 1H).
Масс-спектр m/e (ESI) 393,28 (MH+-CF3COOH).Mass spectrum m / e (ESI) 393.28 (MH + —CF 3 COOH).
Пример 117Example 117
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
8 мл дихлорметанового раствора, содержащего 0,123 г трет-бутил-4-[6-бензилоксиметил-1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата, охлаждают до -78ºС в атмосфере азота и к смеси добавляют 1,9 мл трихлорид бора (1,0 М раствор в дихлорметане). Смесь перемешивают при -78ºС в течение пяти часов и добавляют 10 мл смеси из дихлорметана и метанола в соотношении 1:1. Полученную смесь перемешивают при -78ºС в течение двух часов и затем дают нагреться до комнатной температуры. Растворитель удаляют при пониженном давлении и к смеси добавляют 10 мл метанола. Затем раствор снова концентрируют при пониженном давлении. Остаток растворяют в 3 мл пиридина и полученную смесь нагревают с обратным холодильником в течение двух часов. 0,3 мл такого раствора концентрируют при пониженном давлении. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,005 г указанного в заголовке соединения.8 ml of a dichloromethane solution containing 0.123 g of tert-butyl-4- [6-benzyloxymethyl-1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2 -yl] piperazine-1-carboxylate, cooled to -78 ° C under nitrogen atmosphere, and 1.9 ml of boron trichloride (1.0 M solution in dichloromethane) was added to the mixture. The mixture was stirred at -78 ° C for five hours and 10 ml of a mixture of dichloromethane and methanol was added in a 1: 1 ratio. The resulting mixture was stirred at -78 ° C for two hours and then allowed to warm to room temperature. The solvent was removed under reduced pressure, and 10 ml of methanol was added to the mixture. Then, the solution was again concentrated under reduced pressure. The residue was dissolved in 3 ml of pyridine and the resulting mixture was heated under reflux for two hours. 0.3 ml of such a solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.005 g of the title compound.
1H-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 5,16 (кв, J=2,3 Гц, 2H), 8,21 (с, 1H).δ 1.83 (t, J = 2.3 Hz, 3H), 3.45-3.49 (m, 4H), 3.65-3.69 (m, 4H), 5.16 (q, J = 2.3 Hz, 2H); 8.21 (s, 1H).
Масс-спектр m/e (ESI) 273,16 (MH+-CF3COOH).Mass spectrum m / e (ESI) 273.16 (MH + —CF 3 COOH).
Пример 118Example 118
Гидрохлорид 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide hydrochloride
(a) трет-Бутил-4-[7-(2-бутинил)-2-(2-карбамоилфенокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2- (2-carbamoylphenoxy) -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine- 1-carboxylate
200 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 2,0 мл 1-метил-2-пирролидона и добавляют 85 мг салициламида и 129 мг карбоната калия. Полученную смесь перемешивают при 100ºС в течение 2 часов. После охлаждения реакционной смеси до комнатной температуры добавляют 5,0 мл воды. После перемешивания при комнатной температуре в течение 1 часа образовавшийся белый осадок собирают фильтрацией. Полученное в результате белое твердое вещество промывают водой и эфиром с получением 221 мг указанного в заголовке соединения (89%).200 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 2.0 ml of 1-methyl-2-pyrrolidone and 85 mg of salicylamide and 129 mg of potassium carbonate are added. The resulting mixture was stirred at 100 ° C for 2 hours. After the reaction mixture was cooled to room temperature, 5.0 ml of water was added. After stirring at room temperature for 1 hour, the resulting white precipitate was collected by filtration. The resulting white solid was washed with water and ether to give 221 mg of the title compound (89%).
1H-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,43 (с, 9H), 1,79 (т, J=2,5 Гц, 3H), 3,23-3,27 (м, 4H), 3,36 (с, 3H), 3,48-3,52 (м, 4H), 4,95 (кв, 2,5 Гц, 2H), 6,59 (тд, J=8,0, 1,0 Гц, 1H), 6,63 (дд, J=8,0, 1,0 Гц, 1H), 7,14 (ддд, J=8,0, 7,5, 2,0 Гц, 1H), 7,80 (дд, J=7,5, 2,0 Гц, 1H).δ 1.43 (s, 9H), 1.79 (t, J = 2.5 Hz, 3H), 3.23-3.27 (m, 4H), 3.36 (s, 3H), 3, 48-3.52 (m, 4H), 4.95 (q, 2.5 Hz, 2H), 6.59 (td, J = 8.0, 1.0 Hz, 1H), 6.63 (dd , J = 8.0, 1.0 Hz, 1H), 7.14 (ddd, J = 8.0, 7.5, 2.0 Hz, 1H), 7.80 (dd, J = 7.5 , 2.0 Hz, 1H).
МС m/e (ESI) 522(MH+).MS m / e (ESI) 522 (MH + ).
(b) Гидрохлорид 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида(b) 2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide hydrochloride
210 мг трет-бутил-4-[7-(2-бутинил)-2-(2-карбамоилфенокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата объединяют с 3,5 мл метанола и 2,1 мл смеси 4 н. соляной кислоты с этилацетатом. После перемешивания смеси при комнатной температуре в течение 4 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный осадок промывают этанолом и этилацетатом с получением 177 мг указанного в заголовке соединения (96%).210 mg tert-butyl-4- [7- (2-butynyl) -2- (2-carbamoylphenoxy) -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazin-1 -carboxylate combined with 3.5 ml of methanol and 2.1 ml of a mixture of 4 N. hydrochloric acid with ethyl acetate. After the mixture was stirred at room temperature for 4 hours, the reaction solution was concentrated by purging with nitrogen gas. The resulting precipitate was washed with ethanol and ethyl acetate to obtain 177 mg of the title compound (96%).
1H-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,82 (т, J=2,3 Гц, 3H), 3,28-3,32 (м, 4H), 3,48 (с, 3H), 3,54-3,58 (м, 4H), 5,04 (кв, 2,3 Гц, 2H), 6,96 (уш.т, J=7,0 Гц, 1H), 6,99 (уш.д, J=8,0 Гц, 1H), 7,46 (ддд, J=8,0, 7,0, 1,5 Гц, 1H), 7,93 (уш.д, J=8,0 Гц, 1H).δ 1.82 (t, J = 2.3 Hz, 3H), 3.28-3.32 (m, 4H), 3.48 (s, 3H), 3.54-3.58 (m, 4H ), 5.04 (br, 2.3 Hz, 2H), 6.96 (br, J = 7.0 Hz, 1H), 6.99 (br, J, 8.0 Hz, 1H ), 7.46 (ddd, J = 8.0, 7.0, 1.5 Hz, 1H), 7.93 (brd, J = 8.0 Hz, 1H).
МС m/e (ESI) 422 (MH+-HCl).MS m / e (ESI) 422 (MH + -HCl).
Пример 119Example 119
3-(2-Бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one
(a) 5-Метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он(a) 5-Methyl-1-trityl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one
78,8 г 5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она [CAS No. 76756-58-6] (Shih-Fong Chen and Raymond P. Panzica, Journal of Organic Chemistry 46, p. 2467, 1981) суспендируют в 2,5 л дихлорметана при комнатной температуре и к смеси добавляют 78,8 г триэтиламина. Добавляют 176 г тритилхлорида и полученную смесь перемешивают в течение трех часов. К смеси добавляют 7,5 л этилацетата. После последовательной промывки 3 л воды и 3 л насыщенного раствора хлорида натрия смесь сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (20:80 - 0:100), получают 136,5 г указанного в заголовке соединения.78.8 g of 5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one [CAS No. 76756-58-6] (Shih-Fong Chen and Raymond P. Panzica, Journal of Organic Chemistry 46, p. 2467, 1981) are suspended in 2.5 L of dichloromethane at room temperature and 78.8 g of triethylamine are added to the mixture. 176 g of trityl chloride are added and the resulting mixture is stirred for three hours. 7.5 L of ethyl acetate was added to the mixture. After washing successively with 3 L of water and 3 L of a saturated solution of sodium chloride, the mixture was dried over anhydrous magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 136.5 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (20:80 - 0: 100).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,79 (с, 3H), 6,92 (с, 1H), 7,07-7,13 (м, 6H), 7,32-7,40 (м, 9H), 7,87 (с, 1H).δ 3.79 (s, 3H), 6.92 (s, 1H), 7.07-7.13 (m, 6H), 7.32-7.40 (m, 9H), 7.87 (s , 1H).
(b) 2-Хлор-5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он(b) 2-Chloro-5-methyl-1-trityl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one
220 мл гексаметилдисилазида лития (1,0 М раствор в тетрагидрофуране) в атмосфере азота при -75ºС добавляют к 4 л тетрагидрофуранового раствора, содержащего 68,3 г 5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она, и полученную смесь перемешивают при -75ºС в течение 1 часа. Затем к полученному раствору добавляют 200 мл тетрагидрофуранового раствора, содержащего 82,3 г гексахлорэтана. Смеси дают нагреться до -20ºС. Добавляют 5 л 5% водного раствора хлорида аммония и смесь экстрагируют 4 л этилацетата. Органический слой последовательно промывают 5 л воды и 5 л насыщенного раствора хлорида натрия. Раствор сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток суспендируют в 150 мл трет-бутилметилового эфира и затем фильтруют. Полученное твердое вещество дважды промывают 100 мл трет-бутилметилового эфира с получением 69,7 г указанного в заголовке соединения.220 ml of lithium hexamethyldisilazide (1.0 M solution in tetrahydrofuran) in a nitrogen atmosphere at -75 ° C is added to 4 l of a tetrahydrofuran solution containing 68.3 g of 5-methyl-1-trityl-1,5-dihydroimidazo [4,5-d ] pyridazin-4-one, and the resulting mixture was stirred at -75 ° C for 1 hour. Then, 200 ml of a tetrahydrofuran solution containing 82.3 g of hexachloroethane are added to the resulting solution. The mixture is allowed to warm to -20ºС. 5 L of a 5% aqueous solution of ammonium chloride was added and the mixture was extracted with 4 L of ethyl acetate. The organic layer was washed successively with 5 L of water and 5 L of a saturated solution of sodium chloride. The solution was dried over anhydrous magnesium sulfate and concentrated under reduced pressure. The residue was suspended in 150 ml of tert-butyl methyl ether and then filtered. The resulting solid was washed twice with 100 ml of tert-butyl methyl ether to give 69.7 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,78 (с, 3H), 5,81 (с, 1H), 7,25-7,27 (м, 6H), 7,28-7,38 (м, 9H).δ 3.78 (s, 3H), 5.81 (s, 1H), 7.25-7.27 (m, 6H), 7.28-7.38 (m, 9H).
(c) трет-Бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазол[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат(c) tert-Butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazole [4,5-d] pyridazin-2-yl) piperazine-1-carboxylate
69,7 г 2-хлор-5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она объединяют с 153,4 г трет-бутилпиперазин-1-карбоксилата и полученную смесь перемешивают и нагревают до 100ºС в атмосфере азота. После того как смесь становилась легко перемешиваемой, температуру повышают до 150ºС. Смесь выдерживают при этой температуре в течение 1 часа. Реакционному раствору дают охладиться и затем суспендируют в 250 мл трет-бутилметилового эфира. Суспендированный материал собирают фильтрацией. Твердое вещество дважды промывают 200 мл трет-бутилметилового эфира и трижды 200 мл воды. Полученный твердый материал снова дважды промывают 200 мл трет-бутилметилового эфира и сушат с получением 50,3 г указанного в заголовке соединения.69.7 g of 2-chloro-5-methyl-1-trityl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one is combined with 153.4 g of tert-butylpiperazine-1-carboxylate and the resulting mixture is stirred and heated to 100 ° C in a nitrogen atmosphere. After the mixture becomes easily mixed, the temperature is increased to 150 ° C. The mixture is kept at this temperature for 1 hour. The reaction solution was allowed to cool and then suspended in 250 ml of tert-butyl methyl ether. Suspended material is collected by filtration. The solid is washed twice with 200 ml of tert-butyl methyl ether and three times with 200 ml of water. The resulting solid was again washed twice with 200 ml of tert-butyl methyl ether and dried to give 50.3 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 3,56-3,62 (м, 4H), 3,73-3,80 (м, 4H), 3,87 (с, 3H), 8,16 (с, 1H), 12,65 (уш.с, 1H).δ 1.50 (s, 9H), 3.56-3.62 (m, 4H), 3.73-3.80 (m, 4H), 3.87 (s, 3H), 8.16 (s , 1H); 12.65 (br s, 1H).
(d) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin- 1-carboxylate
43,9 г карбоната калия и 27,8 мл 2-бутинилбромида, при 15ºС в атмосфере азота, последовательно добавляют к 5,5 л раствора 88,4 г трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата в N,N-диметилформамиде. Реакционный раствор перемешивают при комнатной температуре в течение 22 часов и затем выливают в 10 л воды. Смесь экстрагируют 5 л этилацетата. Органический слой последовательно промывают дважды 5 л воды и 5 л насыщенного раствора хлорида натрия. Водный слой дважды экстрагируют 3 л этилацетата. Органические слои объединяют и сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью гексан-этилацетат (3:2 - 3:7), получают 54,3 г указанного в заголовке соединения.43.9 g of potassium carbonate and 27.8 ml of 2-butynyl bromide, at 15 ° C under nitrogen atmosphere, are successively added to 5.5 l of a solution of 88.4 g of tert-butyl-4- (6-methyl-7-oxo-6, 7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazine-1-carboxylate in N, N-dimethylformamide. The reaction solution was stirred at room temperature for 22 hours and then poured into 10 L of water. The mixture was extracted with 5 L of ethyl acetate. The organic layer is washed twice with 5 L of water and 5 L of a saturated solution of sodium chloride. The aqueous layer was extracted twice with 3 L of ethyl acetate. The organic layers are combined and dried over anhydrous magnesium sulfate. The organic layer was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 54.3 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (3: 2 - 3: 7).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,52 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,38-3,42 (м, 4H), 3,61-3,64 (м, 4H), 3,85 (с, 3H), 5,09 (кв, J=2,3 Гц, 2H), 8,13 (с, 1H).δ 1.52 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.38-3.42 (m, 4H), 3.61-3.64 (m, 4H ), 3.85 (s, 3H), 5.09 (q, J = 2.3 Hz, 2H), 8.13 (s, 1H).
(e) 3-(2-Бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он(e) 3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one
200 мл трифторуксусной кислоты добавляют к 200 мл дихлорметанового раствора, содержащего 54,3 г трет-бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата, и смесь перемешивают при комнатной температуре в течение 1 часа. Смесь концентрируют при пониженном давлении, и остаток растворяют в 500 мл этилацетата. Постепенно добавляют 1 л 10% водного раствора бикарбоната натрия. После этого к раствору добавляют 1 л этилацетата и 500 мл 5 н. водного раствора гидроксида натрия. Образовавшийся органический слой отделяют. Водный слой пять раз экстрагируют 1 л дихлорметана. Органические слои объединяют, промывают 500 мл 2 н. водного раствора гидроксида натрия, сушат над безводным сульфатом магния и концентрируют при пониженном давлении. Остаток перекристаллизовывают из этилацетата с получением 30,5 г соединения, указанного в заголовке, в виде кристаллов.200 ml of trifluoroacetic acid is added to 200 ml of a dichloromethane solution containing 54.3 g of tert-butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4 , 5-d] pyridazin-2-yl] piperazine-1-carboxylate, and the mixture was stirred at room temperature for 1 hour. The mixture was concentrated under reduced pressure, and the residue was dissolved in 500 ml of ethyl acetate. Gradually add 1 liter of a 10% aqueous sodium bicarbonate solution. After that, 1 l of ethyl acetate and 500 ml of 5 N are added to the solution. an aqueous solution of sodium hydroxide. The resulting organic layer was separated. The aqueous layer was extracted five times with 1 L of dichloromethane. The organic layers are combined, washed with 500 ml of 2 N. an aqueous solution of sodium hydroxide, dried over anhydrous magnesium sulfate and concentrated under reduced pressure. The residue was recrystallized from ethyl acetate to give 30.5 g of the title compound as crystals.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,84 (т, J=2,3 Гц, 3H), 3,05-3,09 (м, 4H), 3,38-3,44 (м, 4H), 3,85 (с, 3H), 5,06 (кв, J=2,3 Гц, 2H), 8,13 (с, 3H).δ 1.84 (t, J = 2.3 Hz, 3H), 3.05-3.09 (m, 4H), 3.38-3.44 (m, 4H), 3.85 (s, 3H ), 5.06 (q, J = 2.3 Hz, 2H), 8.13 (s, 3H).
Пример 119-2Example 119-2
3-(2-Бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она толуол-4-сульфонат3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one toluene-4-sulfonate
98,7 мг 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она растворяют в этаноле и затем при перемешивании добавляют 1 мл этанольного раствора, содержащего 101 мг моногидрата п-толуолсульфокислоты. Смесь в течение двух часов при перемешивании охлаждают льдом. Образовавшийся осадок собирают фильтрацией и затем сушат при 50ºС при пониженном давлении в течение одного часа с получением 153,2 мг указанного в заголовке соединения.98.7 mg of 3- (2-butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one is dissolved in ethanol and then with stirring add 1 ml of an ethanol solution containing 101 mg of p-toluenesulfonic acid monohydrate. The mixture is cooled with ice for two hours with stirring. The resulting precipitate was collected by filtration and then dried at 50 ° C under reduced pressure for one hour to obtain 153.2 mg of the title compound.
1H-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (т, J=2 Гц, 3H), 2,27 (с, 3H), 3,25-3,35 (м, 4H), 3,50-3,54 (м, 4H), 3,70 (с, 3H), 5,13 (д, J=2 Гц, 2H), 7,10 (д, J=8 Гц, 2H), 7,47 (д, J=8 Гц, 2H), 8,25 (с, 1H), 8,79 (уш.с, 2H).δ 1.79 (t, J = 2 Hz, 3H), 2.27 (s, 3H), 3.25-3.35 (m, 4H), 3.50-3.54 (m, 4H), 3.70 (s, 3H), 5.13 (d, J = 2 Hz, 2H), 7.10 (d, J = 8 Hz, 2H), 7.47 (d, J = 8 Hz, 2H) 8.25 (s, 1H); 8.79 (br s, 2H).
Кроме этого, 107,95 мг указанного в заголовке вещества перекристаллизовывают из ацетона с получением 84,9 мг кристаллического продукта.In addition, 107.95 mg of the title compound was recrystallized from acetone to give 84.9 mg of a crystalline product.
Пример 120Example 120
Трифторацетат 2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она2- (3-aminopiperidin-1-yl) -3- (2-butynyl) -5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) 9H-Флуорен-9-илметил-3-трет-бутоксикарбониламинопиперидин-1-карбоксилат(a) 9H-Fluoren-9-ylmethyl-3-tert-butoxycarbonylaminopiperidine-1-carboxylate
1,84 г диизопропилэтиламина и 4,71 г дифенилфосфорилазида добавляют к 10 мл раствора 5,01 г 9H-флуорен-9-илметил 3-карбоксипиперидин-1-карбоксилата в трет-бутаноле и полученную смесь в течение 18 часов нагревают при 60ºС в атмосфере азота. Реакционный раствор охлаждают и добавляют 150 мл этилацетата. Органический слой последовательно промывают 100 мл 5% водного раствора серной кислоты, 100 мл 5% водного раствора бикарбоната натрия, 100 мл воды и 100 мл насыщенного раствора хлорида натрия, затем сушат над безводным сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают хроматографической очистке на колонке с силикагелем. Таким образом из фракции, элюированной смесью гексан-этилацетат (4:1), получают 1,88 г соединения, указанного в заголовке.1.84 g of diisopropylethylamine and 4.71 g of diphenylphosphorylazide are added to 10 ml of a solution of 5.01 g of 9H-fluoren-9-ylmethyl 3-carboxypiperidin-1-carboxylate in tert-butanol and the resulting mixture is heated at 60 ° C for 18 hours in the atmosphere nitrogen. The reaction solution was cooled and 150 ml of ethyl acetate was added. The organic layer is washed successively with 100 ml of a 5% aqueous solution of sulfuric acid, 100 ml of a 5% aqueous solution of sodium bicarbonate, 100 ml of water and 100 ml of a saturated solution of sodium chloride, then dried over anhydrous magnesium sulfate. The organic layer was concentrated under reduced pressure. The residue was chromatographed on a silica gel column. Thus, 1.88 g of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (4: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,45 (с, 9H), 1,45-1,72 (м, 3H), 1,82-1,87 (уш.с, 1H), 3,09-3,30 (уш.с, 2H), 3,58 (уш.с, 2H), 3,82-3,98 (уш.с, 1H), 4,24 (т, J=7,2 Гц, 1H), 4,27-4,48 (уш.с, 2H), 4,52-4,59 (уш.с, 1H), 7,32 (дд, J=10,3, 10,0 Гц, 2H), 7,39 (т, J=10,0 Гц, 2H), 7,59 (д, J=10,0 Гц, 2H), 7,75 (д, J=10,3 Гц, 2H).δ 1.45 (s, 9H), 1.45-1.72 (m, 3H), 1.82-1.87 (br s, 1H), 3.09-3.30 (br s, 2H), 3.58 (br.s, 2H), 3.82-3.98 (br.s, 1H), 4.24 (t, J = 7.2 Hz, 1H), 4.27-4 48 (br.s, 2H), 4.52-4.59 (br.s, 1H), 7.32 (dd, J = 10.3, 10.0 Hz, 2H), 7.39 (t , J = 10.0 Hz, 2H), 7.59 (d, J = 10.0 Hz, 2H), 7.75 (d, J = 10.3 Hz, 2H).
(b) трет-Бутилпипердин-3-илкарбамат(b) tert-butylpiperdin-3-ylcarbamate
25 мл диэтиламина добавляют к 250 мл этанольного раствора 1,88 г 3-трет-бутоксикарбониламинопиперидин-1-карбоксилата и полученную смесь перемешивают при комнатной температуре в течение 18 часов. После концентрирования раствора при пониженном давлении остаток растворяют в смеси, состоящей из 150 мл толуола и 100 мл 10% водного раствора лимонной кислоты. Водный слой подщелачивают 5 н. водным раствором гидроксида натрия и затем дважды экстрагируют 100 мл дихлорметана. Органические слои объединяют, сушат над безводным сульфатом магния и концентрируют при пониженном давлении с получением 0,79 г указанного в заголовке соединения.25 ml of diethylamine are added to 250 ml of an ethanol solution of 1.88 g of 3-tert-butoxycarbonylaminopiperidine-1-carboxylate, and the resulting mixture is stirred at room temperature for 18 hours. After the solution was concentrated under reduced pressure, the residue was dissolved in a mixture of 150 ml of toluene and 100 ml of a 10% aqueous citric acid solution. The aqueous layer is alkalinized 5 N. aqueous sodium hydroxide solution and then extracted twice with 100 ml of dichloromethane. The organic layers were combined, dried over anhydrous magnesium sulfate and concentrated under reduced pressure to obtain 0.79 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,45 (с, 9H), 1,41-1,53 (м, 2H), 1,65-1,72 (м, 1H), 1,79-1,86 (м, 1H), 2,48-2,56 (м, 1H), 2,64-2,70 (м, 1H), 2,78-2,86 (м, 1H), 3,06 (дд, J=12,0, 4,0 Гц, 1H), 3,48-3,62 (уш.с, 1H), 4,71-4,88 (уш.с, 1H).δ 1.45 (s, 9H), 1.41-1.53 (m, 2H), 1.65-1.72 (m, 1H), 1.79-1.86 (m, 1H), 2 , 48-2.56 (m, 1H), 2.64-2.70 (m, 1H), 2.78-2.86 (m, 1H), 3.06 (dd, J = 12.0, 4.0 Hz, 1H), 3.48-3.62 (br s, 1H), 4.71-4.88 (br s, 1H).
c) Трифторацетат 2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-онаc) 2- (3-Aminopiperidin-1-yl) -3- (2-butynyl) -5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
0,020 г 2-хлор-5-метил-1-тритил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она и 0,040 г трет-бутилпиперидин-3-илкарбамата смешивают друг с другом и полученную смесь нагревают при 150ºС в течение 1 часа в атмосфере азота. Реакционную смесь подвергают очистке путем колоночной хроматографии на силикагеле. Из фракции, элюированной этилацетатом, получают 0,016 г трет-бутил [1-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-3-ил]карбамата. 0,0080 г полученного соединения растворяют в 0,6 мл N,N-диметилформамида и затем к раствору добавляют 0,0038 г карбоната калия и 0,003 мл 2-бутинилбромида. Полученную смесь перемешивают при комнатной температуре в течение 18 часов. Реакционную смесь распределяют между 1 мл этилацета и 1 мл воды и органический слой концентрируют. Остаток растворяют в 0,5 мл дихлорметана и после этого добавляют 0,5 мл трифторуксусной кислоты. Через час реакционный раствор концентрируют. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,0046 г указанного в заголовке соединения.0.020 g of 2-chloro-5-methyl-1-trityl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one and 0.040 g of tert-butylpiperidin-3-ylcarbamate are mixed with each other and the resulting mixture is heated at 150ºС for 1 hour in a nitrogen atmosphere. The reaction mixture was purified by silica gel column chromatography. From the fraction eluted with ethyl acetate, 0.016 g of tert-butyl [1- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperidin-3- is obtained silt] carbamate. 0.0080 g of the obtained compound was dissolved in 0.6 ml of N, N-dimethylformamide, and then 0.0038 g of potassium carbonate and 0.003 ml of 2-butynyl bromide were added to the solution. The resulting mixture was stirred at room temperature for 18 hours. The reaction mixture was partitioned between 1 ml of ethyl acetate and 1 ml of water, and the organic layer was concentrated. The residue was dissolved in 0.5 ml of dichloromethane and then 0.5 ml of trifluoroacetic acid was added. After one hour, the reaction solution was concentrated. The resulting residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 0.0046 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,74-1,80 (уш.с, 1H), 1,82 (уш.с, 3H), 1,96-2,19 (уш.м, 3H), 3,43-3,79 (уш.м, 5H), 3,86 (с, 3H), 5,05 (уш.д, J=16,0 Гц, 1H), 5,23 (уш.д, J=16,0 Гц, 1H), 8,15 (с, 1H).δ 1.74-1.80 (br.s, 1H), 1.82 (br.s, 3H), 1.96-2.19 (br.m, 3H), 3.43-3.79 ( br.m, 5H), 3.86 (s, 3H), 5.05 (br.s, J = 16.0 Hz, 1H), 5.23 (br.s, J = 16.0 Hz, 1H ), 8.15 (s, 1H).
Пример 121Example 121
Трифторацетат 2-(3-аминопиперидин-1-ил)-5-метил-3-(3-метил-2-бутенил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она2- (3-aminopiperidin-1-yl) -5-methyl-3- (3-methyl-2-butenyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
0,0034 г указанного в заголовке соединения получают с использованием 0,0080 г трет-бутил-[1-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-3-ил]карбамата и 0,004 мл 4-бром-2-метил-2-бутена, следуя способу, описанному в примере 120.0.0034 g of the title compound was prepared using 0.0080 g of tert-butyl- [1- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2 -yl) piperidin-3-yl] carbamate and 0.004 ml of 4-bromo-2-methyl-2-butene, following the method described in example 120.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,66-1,74 (уш.с, 1H), 1,76 (с, 3H), 1,80 (с, 3H), 1,96-2,20 (уш.м, 3H), 3,20-3,79 (уш.м, 5H), 3,85 (с, 3H), 4,90-5,05 (м, 2H), 5,37-5,42 (м, 1H), 8,15 (с, 1H).δ 1.66-1.74 (br s, 1H), 1.76 (s, 3H), 1.80 (s, 3H), 1.96-2.20 (br.m, 3H), 3 , 20-3.79 (br.m, 5H), 3.85 (s, 3H), 4.90-5.05 (m, 2H), 5.37-5.42 (m, 1H), 8 15 (s, 1H).
Пример 122Example 122
2-[7-(2-Бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамид2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide
53,0 г трет-бутил-4-[7-(2-бутинил)-2-(2-карбамоилфенокси)-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 160 мл трифторуксусной кислоты и полученную смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют по каплям 1250 мл 2 М водного раствора гидроксида натрия и полученную смесь перемешивают при комнатной температуре в течение 1 часа 50 минут. Образовавшийся белый осадок собирают фильтрацией. Белое твердое вещество промывают водой и затем этанолом, сушат в течение ночи при 60ºС, в результате чего получают 42,8 г указанного в заголовке соединения.53.0 g of tert-butyl-4- [7- (2-butynyl) -2- (2-carbamoylphenoxy) -1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine -1-carboxylate is dissolved in 160 ml of trifluoroacetic acid and the resulting mixture is stirred at room temperature for one hour. 1250 ml of a 2 M aqueous sodium hydroxide solution was added dropwise to the reaction solution, and the resulting mixture was stirred at room temperature for 1 hour 50 minutes. The resulting white precipitate was collected by filtration. The white solid was washed with water and then ethanol, dried overnight at 60 ° C, whereby 42.8 g of the title compound was obtained.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,78 (т, J=2,4 Гц, 3H), 2,82-2,86 (м, 4H), 3,18-3,22 (м, 4H), 3,36 (с, 3H), 4,91 (кв, 2,4 Гц, 2H), 6,58 (тд, J=8,4, 1,2 Гц, 1H), 6,63 (дд, J=8,0, 0,8 Гц, 1H), 7,14 (ддд, J=8,0, 7,2, 2,0 Гц, 1H), 7,80 (дд, J=7,6, 2,0 Гц, 1H).δ 1.78 (t, J = 2.4 Hz, 3H), 2.82-2.86 (m, 4H), 3.18-3.22 (m, 4H), 3.36 (s, 3H ), 4.91 (q, 2.4 Hz, 2H), 6.58 (td, J = 8.4, 1.2 Hz, 1H), 6.63 (dd, J = 8.0, 0, 8 Hz, 1H), 7.14 (ddd, J = 8.0, 7.2, 2.0 Hz, 1H), 7.80 (dd, J = 7.6, 2.0 Hz, 1H).
МС m/e (ESI) 422(МН+).MS m / e (ESI) 422 (MH + ).
Пример 123Example 123
Трифторацетат 7-(2-бутинил)-2-(3-гидроксипропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (3-hydroxypropylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 20 мкл 3-меркапто-1-пропанола и 6 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и к остатку добавляют 0,5 мл 5 н. водного раствора соляной кислоты. Смесь концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,15 мг указанного в заголовке соединения.7 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, then 20 μl of 3-mercapto-1-propanol and 6 mg of potassium carbonate are added. The resulting mixture was stirred at room temperature for five hours. A saturated solution of ammonium chloride was added to the reaction solution, and the resulting mixture was extracted with ethyl acetate. The organic layer was concentrated and 0.5 ml of 5 N was added to the residue. aqueous hydrochloric acid. The mixture was concentrated by purging with nitrogen gas. The resulting residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.15 mg of the title compound.
МС m/e (ESI) 377 (MH+-CF3COOH).MS m / e (ESI) 377 (MH + -CF 3 COOH).
Пример 124Example 124
Трифторацетат 7-(2-бутинил)-2-(2-гидроксипропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-hydroxypropylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
1,70 мг указанного в заголовке соединения получают по способу примера 123, используя 1-меркапто-2-пропанол вместо 3-меркапто-1-пропанола.1.70 mg of the title compound was obtained by the method of Example 123 using 1-mercapto-2-propanol instead of 3-mercapto-1-propanol.
МС m/e (ESI) 377 (MH+-CF3COOH).MS m / e (ESI) 377 (MH + -CF 3 COOH).
Пример 125Example 125
Трифторацетат 7-(2-бутинил)-2-(2,3-дигидроксипропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2,3-dihydroxypropylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
2,63 мг указанного в заголовке соединения получают по способу примера 123, используя 3-меркапто-1,2-пропандиол вместо 3-меркапто-1-пропанола.2.63 mg of the title compound was obtained by the method of Example 123 using 3-mercapto-1,2-propanediol instead of 3-mercapto-1-propanol.
МС m/e (ESI) 393 (MH+-CF3COOH).MS m / e (ESI) 393 (MH + -CF 3 COOH).
Пример 126Example 126
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионовой кислоты3- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] propionic acid trifluoroacetate
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 20 мкл 3-меркаптопропионовой кислоты и 6 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония, смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,60 мг указанного в заголовке соединения.7 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, then 20 μl of 3-mercaptopropionic acid and 6 mg of potassium carbonate are added. The mixture was stirred at room temperature for five hours. A saturated solution of ammonium chloride was added to the reaction solution, the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.40 ml of trifluoroacetic acid. The solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 4.60 mg of the title compound.
МС m/e (ESI) 391 (MH+-CF3COOH).MS m / e (ESI) 391 (MH + -CF 3 COOH).
Пример 127Example 127
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионовой кислоты2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] propionic acid trifluoroacetate
6,10 мг указанного в заголовке соединения получают по способу примера 126, используя 2-меркаптопропионовую кислоту вместо 3-меркаптопропионовой кислоты.6.10 mg of the title compound was prepared according to the method of Example 126 using 2-mercaptopropionic acid instead of 3-mercaptopropionic acid.
МС m/e (ESI) 391 (MH+-CF3COOH).MS m / e (ESI) 391 (MH + -CF 3 COOH).
Пример 128Example 128
Трифторацетат 2-втор-бутилсульфанил-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2-sec-butylsulfanyl-7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
4,68 мг указанного в заголовке соединения получают по способу примера 126, используя бутан-2-тиол вместо 3-меркаптопропионовой кислоты.4.68 mg of the title compound was prepared according to the method of Example 126 using butan-2-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 375 (MH+-CF3COOH).MS m / e (ESI) 375 (MH + -CF 3 COOH).
Пример 129Example 129
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-пропилсульфанил-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2-propylsulfanyl-1,7-dihydropurin-6-one trifluoroacetate
4,61 мг указанного в заголовке соединения получают по способу примера 126, используя пропан-1-тиол вместо 3-меркаптопропионовой кислоты.4.61 mg of the title compound was obtained by the method of Example 126 using propan-1-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 361 (MH+-CF3COOH).MS m / e (ESI) 361 (MH + -CF 3 COOH).
Пример 130Example 130
Трифторацетат 7-(2-бутинил)-1-метил-2-циклопентилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-cyclopentylsulfanyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
5,15 мг указанного в заголовке соединения получают по способу примера 126, используя циклопентантиол вместо 3-меркаптопропионовой кислоты.5.15 mg of the title compound was obtained by the method of Example 126 using cyclopentantiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 387 (MH+-CF3COOH).MS m / e (ESI) 387 (MH + -CF 3 COOH).
Пример 131Example 131
Трифторацетат 7-(2-бутинил)-2-додецилсульфанил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-dodecylsulfanyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
4,96 мг указанного в заголовке соединения получают по способу примера 126, используя додекан-1-тиол вместо 3-меркаптопропионовой кислоты.4.96 mg of the title compound was prepared according to the method of Example 126 using dodecan-1-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 487 (MH+-CF3COOH).MS m / e (ESI) 487 (MH + -CF 3 COOH).
Пример 132Example 132
Трифторацетат 2-(2-аминоэтилсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2- (2-Aminoethylsulfanyl) -7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
3,98 мг указанного в заголовке соединения получают по способу примера 126, используя 2-аминоэтантиол вместо 3-меркаптопропионовой кислоты.3.98 mg of the title compound was prepared according to the method of Example 126 using 2-aminoethanethiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 362 (MH+-CF3COOH).MS m / e (ESI) 362 (MH + -CF 3 COOH).
Пример 133Example 133
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиофен-2-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (thiophen-2-ylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
5,11 мг указанного в заголовке соединения получают по способу примера 126, используя тиофен-2-тиол вместо 3-меркаптопропионовой кислоты.5.11 mg of the title compound was obtained by the method of Example 126 using thiophene-2-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 401 (MH+-CF3COOH).MS m / e (ESI) 401 (MH + -CF 3 COOH).
Пример 134Example 134
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(1H-[1,2,4]триазол-3-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (1H- [1,2,4] triazol-3-ylsulfanyl) -1,7-dihydropurin-6- trifluoroacetate she
2,54 мг указанного в заголовке соединения получают по способу примера 126, используя 1Н-[1,2,4]триазол-3-тиол вместо 3-меркаптопропионовой кислоты.2.54 mg of the title compound was prepared according to the method of Example 126, using 1H- [1,2,4] triazole-3-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 386 (MH+-CF3COOH).MS m / e (ESI) 386 (MH + -CF 3 COOH).
Пример 135Example 135
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиридин-4-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyridin-4-ylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
0,77 мг указанного в заголовке соединения получают по способу примера 126, используя пиридин-4-тиол вместо 3-меркаптопропионовой кислоты.0.77 mg of the title compound was prepared according to the method of Example 126 using pyridin-4-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 396 (MH+-CF3COOH).MS m / e (ESI) 396 (MH + -CF 3 COOH).
Пример 136Example 136
Трифторацетат 7-(2-бутинил)-1-метил-2-фенилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-phenylsulfanyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
1,44 мг указанного в заголовке соединения получают по способу примера 126, используя бензолтиол вместо 3-меркаптопропионовой кислоты.1.44 mg of the title compound was prepared according to the method of Example 126, using benzenethiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 395 (MH+-CF3COOH).MS m / e (ESI) 395 (MH + -CF 3 COOH).
Пример 137Example 137
Трифторацетат (R)-2-амино-3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]пропионовой кислоты(R) -2-amino-3- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2- trifluoroacetate ilsulfanyl] propionic acid
4,38 мг указанного в заголовке соединения получают по способу примера 126, используя L-цистин вместо 3-меркаптопропионовой кислоты.4.38 mg of the title compound was prepared according to the method of Example 126 using L-cystine instead of 3-mercaptopropionic acid.
МС m/e (ESI) 406 (MH+-CF3COOH).MS m / e (ESI) 406 (MH + -CF 3 COOH).
Пример 138Example 138
Трифторацетат 7-(2-бутинил)-2-(2-метилпропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-methylpropylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
4,52 мг указанного в заголовке соединения получают по способу примера 126, используя 2-метилпропан-1-тиол вместо 3-меркаптопропионовой кислоты.4.52 mg of the title compound was obtained by the method of Example 126 using 2-methylpropan-1-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 375 (MH+-CF3COOH).MS m / e (ESI) 375 (MH + -CF 3 COOH).
Пример 139Example 139
Трифторацетат 7-(2-бутинил)-2-(1,2-диметилпропилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (1,2-dimethylpropylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
3,03 мг указанного в заголовке соединения получают по способу примера 126, используя 2-метилбутан-1-тиол вместо 3-меркаптопропионовой кислоты.3.03 mg of the title compound was obtained by the method of Example 126 using 2-methylbutan-1-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 389 (MH+-CF3COOH).MS m / e (ESI) 389 (MH + -CF 3 COOH).
Пример 140Example 140
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиримидин-2-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyrimidin-2-ylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
3,60 мг указанного в заголовке соединения получают по способу примера 126, используя пиримидин-2-тиол вместо 3-меркаптопропионовой кислоты.3.60 mg of the title compound was obtained by the method of Example 126 using pyrimidin-2-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 397 (MH+-CF3COOH).MS m / e (ESI) 397 (MH + -CF 3 COOH).
Пример 141Example 141
Трифторацетат 7-(2-бутинил)-2-(1H-имидазол-2-илсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (1H-imidazol-2-ylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
5,75 мг указанного в заголовке соединения получают по способу примера 126, используя 1Н-имидазол-2-тиол вместо 3-меркаптопропионовой кислоты.5.75 mg of the title compound was obtained according to the method of Example 126, using 1H-imidazole-2-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 385 (MH+-CF3COOH).MS m / e (ESI) 385 (MH + -CF 3 COOH).
Пример 142Example 142
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиазол-2-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (thiazol-2-ylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
3,86 мг указанного в заголовке соединения получают по способу примера 126, используя тиазол-2-тиол вместо 3-меркаптопропионовой кислоты.3.86 mg of the title compound was prepared according to the method of Example 126, using thiazole-2-thiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 402 (MH+-CF3COOH).MS m / e (ESI) 402 (MH + -CF 3 COOH).
Пример 143Example 143
Трифторацетат 7-(2-бутинил)-2-(фуран-2-илметилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (furan-2-ylmethylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
4,84 мг указанного в заголовке соединения получают по способу примера 126, используя (фуран-2-ил)метантиол вместо 3-меркаптопропионовой кислоты.4.84 mg of the title compound was obtained by the method of Example 126 using (furan-2-yl) methanethiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 399 (MH+-CF3COOH).MS m / e (ESI) 399 (MH + -CF 3 COOH).
Пример 144Example 144
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]ацетамидаTrifluoroacetate 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] acetamide
1,86 мг указанного в заголовке соединения получают по способу примера 126, используя 2-меркаптоацетамид вместо 3-меркаптопропионовой кислоты.1.86 mg of the title compound was prepared according to the method of Example 126 using 2-mercaptoacetamide instead of 3-mercaptopropionic acid.
МС m/e (ESI) 376 (MH+-CF3COOH).MS m / e (ESI) 376 (MH + -CF 3 COOH).
Пример 145Example 145
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиофен-2-илметилсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (thiophen-2-ylmethylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
3,35 мг указанного в заголовке соединения получают по способу примера 126, используя (тиофен-2-ил)метантиол вместо 3-меркаптопропионовой кислоты.3.35 mg of the title compound was prepared according to the method of Example 126 using (thiophen-2-yl) methanethiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 415 (MH+-CF3COOH).MS m / e (ESI) 415 (MH + -CF 3 COOH).
Пример 146Example 146
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[1-(тиофен-2-ил)этилсульфанил]-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- [1- (thiophen-2-yl) ethylsulfanyl] -1,7-dihydropurin-6-one trifluoroacetate
0,51 мг указанного в заголовке соединения получают по способу примера 126, используя 1-(тиофен-2-ил)этантиол вместо 3-меркаптопропионовой кислоты.0.51 mg of the title compound was prepared according to the method of Example 126 using 1- (thiophen-2-yl) ethanethiol instead of 3-mercaptopropionic acid.
МС m/e (ESI) 429 (MH+-CF3COOH).MS m / e (ESI) 429 (MH + -CF 3 COOH).
Пример 147Example 147
Трифторацетат 7-(2-бутинил)-1-метил-2-(1-метил-1H-имидазол-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (1-methyl-1H-imidazol-2-ylsulfanyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
5 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7- дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 10 мг 1-метил-1Н-имидазол-2-тиола и 8 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,75 мг указанного в заголовке соединения.5 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, then 10 mg of 1-methyl-1H-imidazole-2-thiol and 8 mg of potassium carbonate are added. The mixture was stirred at room temperature for five hours. A saturated solution of ammonium chloride was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.40 ml of trifluoroacetic acid. The solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.75 mg of the title compound.
МС m/e (ESI) 399 (MH+-CF3COOH).MS m / e (ESI) 399 (MH + -CF 3 COOH).
Пример 148Example 148
Трифторацетат 7-(2-бутинил)-1-метил-2-(4-метилпиримидин-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (4-methylpyrimidin-2-ylsulfanyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
4,00 мг указанного в заголовке соединения получают по способу примера 147, используя 4-метилпиримидин-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.4.00 mg of the title compound was obtained by the method of Example 147 using 4-methylpyrimidin-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 411 (MH+-CF3COOH).MS m / e (ESI) 411 (MH + -CF 3 COOH).
Пример 149Example 149
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиразин-2-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyrazin-2-ylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
4,00 мг указанного в заголовке соединения получают по способу примера 147, используя пиразин-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.4.00 mg of the title compound was obtained according to the method of Example 147 using pyrazin-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 411 (MH+-CF3COOH).MS m / e (ESI) 411 (MH + -CF 3 COOH).
Пример 150Example 150
Трифторацетат 2-(бензотиазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-онаTrifluoroacetate 2- (Benzothiazol-2-ylsulfanyl) -7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one
0,07 мг указанного в заголовке соединения получают по способу примера 147, используя бензотиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.0.07 mg of the title compound was prepared according to the method of Example 147 using benzothiazole-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 452 (MH+-CF3COOH).MS m / e (ESI) 452 (MH + -CF 3 COOH).
Пример 151Example 151
Трифторацетат 2-(1H-бензимидазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2- (1H-Benzimidazol-2-ylsulfanyl) -7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
3,18 мг указанного в заголовке соединения получают по способу примера 147, используя 1Н-бензимидазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.3.18 mg of the title compound was prepared according to the method of Example 147 using 1H-benzimidazole-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 435 (MH+-CF3COOH).MS m / e (ESI) 435 (MH + -CF 3 COOH).
Пример 152Example 152
Трифторацетат 2-(5-амино[1,3,4]тиадиазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-онаTrifluoroacetate 2- (5-amino [1,3,4] thiadiazol-2-ylsulfanyl) -7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6 -she
3,62 мг указанного в заголовке соединения получают по способу примера 147, используя 5-амино[1,3,4]тиадиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.3.62 mg of the title compound was prepared according to the method of Example 147 using 5-amino [1,3,4] thiadiazole-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 418 (MH+-CF3COOH).MS m / e (ESI) 418 (MH + -CF 3 COOH).
Пример 153Example 153
Трифторацетат 6-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]никотиновой кислоты6- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] nicotinic trifluoroacetate
1,01 мг указанного в заголовке соединения получают по способу примера 147, используя 6-меркаптоникотиновую кислоту вместо 1-метил-1Н-имидазол-2-тиола.1.01 mg of the title compound was obtained by the method of Example 147 using 6-mercaptonicotinic acid instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 440 (MH+-CF3COOH).MS m / e (ESI) 440 (MH + -CF 3 COOH).
Пример 154Example 154
Трифторацетат 7-(2-бутинил)-2-(4-метоксифенилсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (4-methoxyphenylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
4,14 мг указанного в заголовке соединения получают по способу примера 147, используя 4-метоксибензолтиол вместо 1-метил-1Н-имидазол-2-тиола.4.14 mg of the title compound was prepared according to the method of Example 147 using 4-methoxybenzenethiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 425 (MH+-CF3COOH).MS m / e (ESI) 425 (MH + -CF 3 COOH).
Пример 155Example 155
Трифторацетат 7-(2-бутинил)-1-метил-2-(4-нитрофенилсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (4-nitrophenylsulfanyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
1,52 мг указанного в заголовке соединения получают по способу примера 147, используя 4-нитробензолтиол вместо 1-метил-1Н-имидазол-2-тиола.1.52 mg of the title compound was prepared according to the method of Example 147 using 4-nitrobenzenethiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 440 (MH+-CF3COOH).MS m / e (ESI) 440 (MH + -CF 3 COOH).
Пример 156Example 156
Трифторацетат N-[2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]этил]ацетамидаN- [2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] ethyl] acetamide trifluoroacetate
2,39 мг указанного в заголовке соединения получают по способу примера 147, используя N-(2-меркаптоэтил)ацетамид вместо 1-метил-1Н-имидазол-2-тиола.2.39 mg of the title compound was obtained by the method of Example 147 using N- (2-mercaptoethyl) acetamide instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 404 (MH+-CF3COOH).MS m / e (ESI) 404 (MH + -CF 3 COOH).
Пример 157Example 157
Трифторацетат 7-(2-бутинил)-1-метил-2-(5-метил[1,3,4]тиадиазол-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-онаTrifluoroacetate 7- (2-butynyl) -1-methyl-2- (5-methyl [1,3,4] thiadiazol-2-ylsulfanyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6 -she
1,24 мг указанного в заголовке соединения получают по способу примера 147, используя 5-метил[1,3,4]тиадиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.1.24 mg of the title compound was prepared according to the method of Example 147 using 5-methyl [1,3,4] thiadiazole-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 417 (MH+-CF3COOH).MS m / e (ESI) 417 (MH + -CF 3 COOH).
Пример 158Example 158
Трифторацетат 7-(2-бутинил)-2-(4,6-диметилпиримидин-2-илсульфанил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (4,6-dimethylpyrimidin-2-ylsulfanyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
3,11 мг указанного в заголовке соединения получают по способу примера 147, используя 4,6-диметилпиримидин-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.3.11 mg of the title compound was obtained by the method of Example 147 using 4,6-dimethylpyrimidin-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 425 (MH+-CF3COOH).MS m / e (ESI) 425 (MH + -CF 3 COOH).
Пример 159Example 159
Трифторацетат 7-(2-бутинил)-1-метил-2-(4-метилтиазол-2-илсульфанил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (4-methylthiazol-2-ylsulfanyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
4,01 мг указанного в заголовке соединения получают по способу примера 147, используя 4-метилтиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.4.01 mg of the title compound was prepared according to the method of Example 147, using 4-methylthiazole-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 416 (MH+-CF3COOH).MS m / e (ESI) 416 (MH + -CF 3 COOH).
Пример 160Example 160
Трифторацетат 2-(бензоксазол-2-илсульфанил)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2- (Benzoxazol-2-ylsulfanyl) -7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
0,84 мг указанного в заголовке соединения получают по способу примера 147, используя бензоксазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.0.84 mg of the title compound was prepared according to the method of Example 147 using benzoxazole-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 436 (MH+-CF3COOH).MS m / e (ESI) 436 (MH + -CF 3 COOH).
Пример 161Example 161
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-([1,3,4]тиадиазол-2-илсульфанил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2 - ([1,3,4] thiadiazol-2-ylsulfanyl) -1,7-dihydropurin-6-one trifluoroacetate
1,95 мг указанного в заголовке соединения получают по способу примера 147, используя [1,3,4]тиадиазол-2-тиол вместо 1-метил-1Н-имидазол-2-тиола.1.95 mg of the title compound was prepared according to the method of Example 147 using [1,3,4] thiadiazole-2-thiol instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 403 (MH+-CF3COOH).MS m / e (ESI) 403 (MH + -CF 3 COOH).
Пример 162Example 162
Трифторацетат 2-аллилсульфанил-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2-Allylsulfanyl-7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
2,85 мг указанного в заголовке соединения получают по способу примера 147, используя аллилмеркаптан вместо 1-метил-1Н-имидазол-2-тиола.2.85 mg of the title compound was prepared according to the method of Example 147 using allyl mercaptan instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 359 (MH+-CF3COOH).MS m / e (ESI) 359 (MH + -CF 3 COOH).
Пример 163Example 163
Трифторацетат 7-(2-бутинил)-1-метил-2-(3-метилсульфанилфениламино)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (3-methylsulfanylphenylamino) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
1,32 мг указанного в заголовке соединения получают по способу примера 147, используя 3-метилсульфанилфениламин вместо 1-метил-1Н-имидазол-2-тиола.1.32 mg of the title compound was prepared according to the method of Example 147 using 3-methylsulfanylphenylamine instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 424 (MH+-CF3COOH).MS m / e (ESI) 424 (MH + -CF 3 COOH).
Пример 164Example 164
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(тиоморфолин-4-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (thiomorpholin-4-yl) -1,7-dihydropurin-6-one trifluoroacetate
5,33 мг указанного в заголовке соединения получают по способу примера 147, используя тиоморфолин вместо 1-метил-1Н-имидазол-2-тиола.5.33 mg of the title compound was prepared according to the method of Example 147 using thiomorpholine instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 388 (MH+-CF3COOH).MS m / e (ESI) 388 (MH + -CF 3 COOH).
Пример 165Example 165
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]-2-метилпропионовой кислоты2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] -2-methylpropionic acid trifluoroacetate
1,63 мг указанного в заголовке соединения получают по способу примера 147, используя 2-меркапто-2-метилпропионовую кислоту вместо 1-метил-1Н-имидазол-2-тиола.1.63 mg of the title compound was obtained by the method of Example 147 using 2-mercapto-2-methylpropionic acid instead of 1-methyl-1H-imidazole-2-thiol.
МС m/e (ESI) 405 (MH+-CF3COOH).MS m / e (ESI) 405 (MH + -CF 3 COOH).
Пример 166Example 166
Трифторацетат 7-(2-бутинил)-2-(N-изопропилметиламино)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (N-isopropylmethylamino) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и затем к раствору добавляют 30 мкл N-изопропилметиламина. После перемешивания смеси при 80ºС в течение 12 часов реакционный раствор концентрируют продувкой газообразным азотом. Полученный в результате остаток растворяют в 0,60 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Полученный остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,66 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and then 30 μl of N-isopropylmethylamine are added to the solution. After the mixture was stirred at 80 ° C for 12 hours, the reaction solution was concentrated by purging with nitrogen gas. The resulting residue was dissolved in 0.60 ml of trifluoroacetic acid. The solution was concentrated by purging with nitrogen gas. The resulting residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.66 mg of the title compound.
МС m/e (ESI) 358 (MH+-CF3COOH).MS m / e (ESI) 358 (MH + -CF 3 COOH).
Пример 167Example 167
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила3- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzonitrile trifluoroacetate
5 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 1-метил-2-пирролидона, затем добавляют 5 мг 3-цианофенола и 8 мг гидрида натрия. Смесь перемешивают при 90ºС в течение трех часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют, и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,02 мг указанного в заголовке соединения.5 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of 1-methyl-2-pyrrolidone, then 5 mg of 3-cyanophenol and 8 mg of sodium hydride are added. The mixture is stirred at 90 ° C for three hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.02 mg of the title compound.
МС m/e (ESI) 404 (MH+-CF3COOH).MS m / e (ESI) 404 (MH + -CF 3 COOH).
Пример 168Example 168
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzonitrile trifluoroacetate
2,76 мг указанного в заголовке соединения получают по способу примера 167, используя 4-цианофенол вместо 3-цианофенола.2.76 mg of the title compound was prepared according to the method of Example 167 using 4-cyanophenol instead of 3-cyanophenol.
МС m/e (ESI) 404 (MH+-CF3COOH).MS m / e (ESI) 404 (MH + -CF 3 COOH).
Пример 169Example 169
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(3-толилокси)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (3-tolyloxy) -1,7-dihydropurin-6-one trifluoroacetate
3,14 мг указанного в заголовке соединения получают по способу примера 167, используя 3-метилфенол вместо 3-цианофенола.3.14 mg of the title compound was prepared according to the method of Example 167 using 3-methylphenol instead of 3-cyanophenol.
МС m/e (ESI) 393 (MH+-CF3COOH).MS m / e (ESI) 393 (MH + -CF 3 COOH).
Пример 170Example 170
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-метилсульфанилфенокси)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (2-methylsulfanylphenoxy) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
3,50 мг указанного в заголовке соединения получают по способу примера 167, используя 2-метилсульфанилфенол вместо 3-цианофенола.3.50 mg of the title compound was prepared according to the method of Example 167 using 2-methylsulfanylphenol instead of 3-cyanophenol.
МС m/e (ESI) 425 (MH+-CF3COOH).MS m / e (ESI) 425 (MH + -CF 3 COOH).
Пример 171Example 171
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты3- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzoic acid trifluoroacetate
5 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этил-3-гидроксибензоата растворяют в 0,2 мл N-метилпирролидона и к смеси добавляют 8 мг гидрида натрия. Полученную смесь перемешивают при 90ºС в течение 3 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в смеси, состоящей из 0,4 мл этанола и 0,1 мл 5 н. водного раствора гидроксида натрия. Полученную смесь перемешивают при 50ºС в течение ночи. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,09 мг указанного в заголовке соединения.5 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate and 10 mg of ethyl 3-hydroxybenzoate was dissolved in 0.2 ml of N-methylpyrrolidone and 8 mg of sodium hydride was added to the mixture. The resulting mixture was stirred at 90 ° C for 3 hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in a mixture of 0.4 ml of ethanol and 0.1 ml of 5 N. an aqueous solution of sodium hydroxide. The resulting mixture was stirred at 50 ° C. overnight. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.09 mg of the title compound.
МС m/e (ESI) 423 (MH+-CF3COOH).MS m / e (ESI) 423 (MH + -CF 3 COOH).
Пример 172Example 172
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzoic acid trifluoroacetate
1,55 мг указанного в заголовке соединения получают по способу примера 171, используя этил-4-гидроксибензоат вместо 3-гидроксибензойной кислоты.1.55 mg of the title compound was prepared according to the method of Example 171 using ethyl 4-hydroxybenzoate instead of 3-hydroxybenzoic acid.
МС m/e (ESI) 423 (MH+-CF3COOH).MS m / e (ESI) 423 (MH + -CF 3 COOH).
Пример 173Example 173
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(2-толилокси)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (2-tolyloxy) -1,7-dihydropurin-6-one trifluoroacetate
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 1-метил-2-пирролидона, затем добавляют 5 мг 2-метилфенола и 8 мг карбоната калия. Смесь перемешивают при 90ºС в течение пяти часов. К реакционному раствору добавляют 1 н. соляную кислоту и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 4,40 мг указанного в заголовке соединения.7 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of 1-methyl-2-pyrrolidone, then 5 mg of 2-methylphenol and 8 mg of potassium carbonate are added. The mixture is stirred at 90 ° C for five hours. To the reaction solution was added 1N. hydrochloric acid and the resulting mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 4.40 mg of the title compound.
МС m/e (ESI) 393 (MH+-CF3COOH).MS m / e (ESI) 393 (MH + -CF 3 COOH).
Пример 174Example 174
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(4-толилокси)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (4-tolyloxy) -1,7-dihydropurin-6-one trifluoroacetate
3,95 мг указанного в заголовке соединения получают по способу примера 173, используя 4-метилфенол вместо 2-метилфенола.3.95 mg of the title compound was prepared according to the method of Example 173 using 4-methylphenol instead of 2-methylphenol.
МС m/e (ESI) 393 (MH+-CF3COOH).MS m / e (ESI) 393 (MH + -CF 3 COOH).
Пример 175Example 175
Трифторацетат 7-(2-бутинил)-2-(2-метоксифенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2-methoxyphenoxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
5,24 мг указанного в заголовке соединения получают по способу примера 173, используя 2-метоксифенол вместо 2-метилфенола.5.24 mg of the title compound was prepared according to the method of Example 173 using 2-methoxyphenol instead of 2-methylphenol.
МС m/e (ESI) 409 (MH+-CF3COOH).MS m / e (ESI) 409 (MH + -CF 3 COOH).
Пример 176Example 176
Трифторацетат 7-(2-бутинил)-2-(3-метоксифенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (3-methoxyphenoxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
2,84 мг указанного в заголовке соединения получают по способу примера 173, используя 3-метоксифенол вместо 2-метилфенола.2.84 mg of the title compound was prepared according to the method of Example 173 using 3-methoxyphenol instead of 2-methylphenol.
МС m/e (ESI) 409 (MH+-CF3COOH).MS m / e (ESI) 409 (MH + -CF 3 COOH).
Пример 177Example 177
Трифторацетат 7-(2-бутинил)-2-(4-метоксифенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (4-methoxyphenoxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
5,61 мг указанного в заголовке соединения получают по способу примера 173, используя 4-метоксифенол вместо 2-метилфенола.5.61 mg of the title compound was prepared according to the method of Example 173 using 4-methoxyphenol instead of 2-methylphenol.
МС m/e (ESI) 409 (MH+-CF3COOH).MS m / e (ESI) 409 (MH + -CF 3 COOH).
Пример 178Example 178
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензолсульфонамида4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzenesulfonamide trifluoroacetate
4,21 мг указанного в заголовке соединения получают по способу примера 173, используя 4-гидроксибензолсульфонамид вместо 2-метилфенола.4.21 mg of the title compound was prepared according to the method of Example 173 using 4-hydroxybenzenesulfonamide instead of 2-methylphenol.
МС m/e (ESI) 458 (MH+-CF3COOH).MS m / e (ESI) 458 (MH + -CF 3 COOH).
Пример 179Example 179
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-3-метоксибензонитрила4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] -3-methoxybenzonitrile trifluoroacetate
4,24 мг указанного в заголовке соединения получают по способу примера 173, используя 4-гидрокси-3-метоксибензонитрил вместо 2-метилфенола.4.24 mg of the title compound was prepared according to the method of Example 173 using 4-hydroxy-3-methoxybenzonitrile instead of 2-methylphenol.
МС m/e (ESI) 434 (MH+-CF3COOH).MS m / e (ESI) 434 (MH + -CF 3 COOH).
Пример 180Example 180
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzonitrile trifluoroacetate
5,26 мг указанного в заголовке соединения получают по способу примера 173, используя 2-цианофенол вместо 2-метилфенола.5.26 mg of the title compound was prepared according to the method of Example 173 using 2-cyanophenol instead of 2-methylphenol.
МС m/e (ESI) 404 (MH+-CF3COOH).MS m / e (ESI) 404 (MH + -CF 3 COOH).
Пример 181Example 181
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
4,80 мг указанного в заголовке соединения получают по способу примера 173, используя 4-гидроксибензамид вместо 2-метилфенола.4.80 mg of the title compound was prepared according to the method of Example 173 using 4-hydroxybenzamide instead of 2-methylphenol.
МС m/e (ESI) 422 (MH+-CF3COOH).MS m / e (ESI) 422 (MH + -CF 3 COOH).
Пример 182Example 182
Трифторацетат этил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензоатаEthyl 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzoate trifluoroacetate
4,38 мг указанного в заголовке соединения получают по способу примера 173, используя этил-2-гидроксибензоат вместо 2-метилфенола.4.38 mg of the title compound was prepared according to the method of Example 173 using ethyl 2-hydroxybenzoate instead of 2-methylphenol.
МС m/e (ESI) 451 (MH+-CF3COOH).MS m / e (ESI) 451 (MH + -CF 3 COOH).
Пример 183Example 183
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пиримидин-2-илокси)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (pyrimidin-2-yloxy) -1,7-dihydropurin-6-one trifluoroacetate
1,12 мг указанного в заголовке соединения получают по способу примера 173, используя пиримидин-2-ол вместо 2-метилфенола.1.12 mg of the title compound was prepared according to the method of Example 173 using pyrimidin-2-ol instead of 2-methylphenol.
МС m/e (ESI) 381 (MH+-CF3COOH).MS m / e (ESI) 381 (MH + -CF 3 COOH).
Пример 184Example 184
Трифторацетат 7-(2-бутинил)-2-(4,6-диметилпиримидин-2-илокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (4,6-dimethylpyrimidin-2-yloxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
0,66 мг указанного в заголовке соединения получают по способу примера 173, используя 4,6-диметилпиримидин-2-ол вместо 2-метилфенола.0.66 mg of the title compound was obtained by the method of Example 173 using 4,6-dimethylpyrimidin-2-ol instead of 2-methylphenol.
МС m/e (ESI) 409 (MH+-CF3COOH).MS m / e (ESI) 409 (MH + -CF 3 COOH).
Пример 185Example 185
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида3- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 10 мг этил-3-гидроксибензоата растворяют в 0,2 мл N-метилпирролидона, затем к смеси добавляют 10 мг карбоната калия. Смесь перемешивают при 90ºС в течение 3 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 1,0 мл аммиака (7 н. метанольный раствор). Смесь перемешивают при 50ºС в течение ночи. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,91 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate and 10 mg of ethyl 3-hydroxybenzoate is dissolved in 0.2 ml of N-methylpyrrolidone, then 10 mg of potassium carbonate is added to the mixture. The mixture is stirred at 90 ° C for 3 hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 1.0 ml of ammonia (7 N methanol solution). The mixture was stirred at 50 ° C. overnight. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.91 mg of the title compound.
МС m/e (ESI) 422(MH+-CF3COOH).MS m / e (ESI) 422 (MH + -CF 3 COOH).
Пример 186Example 186
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-3,5-диметилбензойной кислоты4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] -3,5-dimethylbenzoic trifluoroacetate acid
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо -6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 1-метил-2-пирролидона и к полученному раствору добавляют 8 мг 4-гидрокси-3,5-диметилбензойной кислоты и 8 мг карбоната калия. Смесь перемешивают при 100ºС в течение 2 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,71 мг указанного в заголовке соединения.7 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of 1-methyl-2-pyrrolidone and 8 mg of 4-hydroxy-3,5-dimethylbenzoic acid and 8 mg of potassium carbonate are added to the resulting solution. The mixture is stirred at 100 ° C for 2 hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 2.71 mg of the title compound.
МС m/e (ESI) 451(MH+-CF3COOH).MS m / e (ESI) 451 (MH + -CF 3 COOH).
Пример 187Example 187
Трифторацетат 4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-3-фторбензойной кислоты4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] -3-fluorobenzoic acid trifluoroacetate
3,49 мг указанного в заголовке соединения получают по способу примера 186, используя 3-фтор-4-гидроксибензойную кислоту вместо 4-гидрокси-3,5-диметилбензойной кислоты.3.49 mg of the title compound was obtained by the method of Example 186 using 3-fluoro-4-hydroxybenzoic acid instead of 4-hydroxy-3,5-dimethylbenzoic acid.
МС m/e (ESI) 441 (MH+-CF3COOH).MS m / e (ESI) 441 (MH + -CF 3 COOH).
Пример 188Example 188
Трифторацетат [4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетата[4- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] phenyl] acetate trifluoroacetate
3,45 мг указанного в заголовке соединения получают по способу примера 186, используя (4-гидроксифенил)уксусную кислоту вместо 4-гидрокси-3,5-диметилбензойной кислоты.3.45 mg of the title compound was prepared according to the method of Example 186 using (4-hydroxyphenyl) acetic acid instead of 4-hydroxy-3,5-dimethylbenzoic acid.
МС m/e (ESI) 437 (MH+-CF3COOH).MS m / e (ESI) 437 (MH + -CF 3 COOH).
Пример 189Example 189
Трифторацетат [2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]уксусной кислоты[2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] phenyl] acetic acid trifluoroacetate
1,34 мг указанного в заголовке соединения получают по способу примера 186, используя (2-гидроксифенил)уксусную кислоту вместо 4-гидрокси-3,5-диметилбензойной кислоты.1.34 mg of the title compound was prepared by the method of Example 186 using (2-hydroxyphenyl) acetic acid instead of 4-hydroxy-3,5-dimethylbenzoic acid.
МС m/e (ESI) 437 (MH+-CF3COOH).MS m / e (ESI) 437 (MH + -CF 3 COOH).
Пример 190Example 190
Трифторацетат 2-(2-ацетилфенокси)-7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2- (2-Acetylphenoxy) -7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
1,99 мг указанного в заголовке соединения получают по способу примера 186, используя 1-(2-гидроксифенил)этанон вместо 4-гидрокси-3,5-диметилбензойной кислоты.1.99 mg of the title compound was prepared according to the method of Example 186, using 1- (2-hydroxyphenyl) ethanone instead of 4-hydroxy-3,5-dimethylbenzoic acid.
МС m/e (ESI) 421 (MH+-CF3COOH).MS m / e (ESI) 421 (MH + -CF 3 COOH).
Пример 191Example 191
Трифторацетат 7-(2-бутинил)-2-(2,6-дифторфенокси)-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2- (2,6-difluorophenoxy) -1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
5,26 мг указанного в заголовке соединения получают по способу примера 186, используя 2,6-дифторфенол вместо 4-гидрокси-3,5-диметилбензойной кислоты.5.26 mg of the title compound was prepared according to the method of Example 186 using 2,6-difluorophenol instead of 4-hydroxy-3,5-dimethylbenzoic acid.
МС m/e (ESI) 415 (MH+-CF3COOH).MS m / e (ESI) 415 (MH + -CF 3 COOH).
Пример 192Example 192
Трифторацетат 7-(2-бутинил)-1-метил-2-пентафторфенокси-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2-pentafluorophenoxy-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
5,61 мг указанного в заголовке соединения получают по способу примера 186, используя 2,3,4,5,6-пентафторфенол вместо 4-гидрокси-3,5-диметилбензойной кислоты.5.61 mg of the title compound was obtained by the method of Example 186 using 2,3,4,5,6-pentafluorophenol instead of 4-hydroxy-3,5-dimethylbenzoic acid.
МС m/e (ESI) 469 (MH+-CF3COOH).MS m / e (ESI) 469 (MH + -CF 3 COOH).
Пример 193Example 193
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[4-(пирролидин-1-карбонил)фенокси]-1,7-дигидропурин-6-она7- (2-butynyl) -1-methyl-8- (piperazin-1-yl) -2- [4- (pyrrolidin-1-carbonyl) phenoxy] -1,7-dihydropurin-6-one trifluoroacetate
30 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1 мл 1-метил-2-пирролидона, затем к раствору добавляют 15 мг 1-(4 гидроксибензоил)пирролидина и 11 мг карбоната калия. Смесь перемешивают при 100ºС в течение 2,5 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 23,7 мг указанного в заголовке соединения.30 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 1 ml of 1-methyl-2-pyrrolidone, then 15 mg of 1- (4 hydroxybenzoyl) pyrrolidine and 11 mg of potassium carbonate are added to the solution. The mixture is stirred at 100 ° C for 2.5 hours. Water was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 23.7 mg of the title compound.
МС m/e (ESI) 476 (MH+-CF3COOH).MS m / e (ESI) 476 (MH + -CF 3 COOH).
Пример 194Example 194
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-N-[2-(пиперидин-1-ил)этил]бензамидаTrifluoroacetate 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] -N- [2- (piperidin-1-yl) ethyl] benzamide
3,05 мг указанного в заголовке соединения получают по способу примера 193, используя 2-гидрокси-N-[2-(пиперидин-1-ил)этил]бензамид.3.05 mg of the title compound was prepared according to the method of Example 193 using 2-hydroxy-N- [2- (piperidin-1-yl) ethyl] benzamide.
МС m/e (ESI) 533 (MH+-CF3COOH).MS m / e (ESI) 533 (MH + -CF 3 COOH).
Пример 195Example 195
Трифторацетат 5-ацетил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида5-Acetyl-2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
0,82 мг указанного в заголовке соединения получают по способу примера 193, используя 5-ацетилсалициламид вместо 1-(4-гидроксибензоил)пирролидина.0.82 mg of the title compound was prepared according to the method of Example 193 using 5-acetylsalicylamide instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 464 (MH+-CF3COOH).MS m / e (ESI) 464 (MH + -CF 3 COOH).
Пример 196Example 196
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]бензойной кислоты2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] benzoic acid trifluoroacetate
0,70 мг указанного в заголовке соединения получают по способу примера 193, используя тиосалициловую кислоту вместо 1-(4-гидроксибензоил)пирролидина.0.70 mg of the title compound was prepared according to the method of Example 193 using thiosalicylic acid instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 439 (MH+-CF3COOH).MS m / e (ESI) 439 (MH + -CF 3 COOH).
Пример 197Example 197
Трифторацетат 6-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]никотинамида6- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] nicotinamide trifluoroacetate
1,43 мг указанного в заголовке соединения получают по способу примера 193, используя 6-аминоникотинамид вместо 1-(4-гидроксибензоил)пирролидина.1.43 mg of the title compound was prepared according to the method of Example 193 using 6-aminonicotinamide instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 422 (MH+-CF3COOH).MS m / e (ESI) 422 (MH + -CF 3 COOH).
Пример 198Example 198
Трифторацетат амида 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]пиридин-2-карбоновой кислоты3- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] pyridin-2-carboxylic amide trifluoroacetate acid
1,44 мг указанного в заголовке соединения получают по способу примера 193, используя 3-гидроксипиколинамид вместо 1-(4-гидроксибензоил)пирролидина.1.44 mg of the title compound was prepared according to the method of Example 193 using 3-hydroxypicolinamide instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 423 (MH+-CF3COOH).MS m / e (ESI) 423 (MH + -CF 3 COOH).
Пример 199Example 199
Трифторацетат N-трет-бутил-2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]бензамидаN-tert-butyl-2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino trifluoroacetate] benzamide
0,87 мг указанного в заголовке соединения получают по способу примера 193, используя 2-амино-N-трет-бутилбензамид вместо 1-(4-гидроксибензоил)пирролидина.0.87 mg of the title compound was prepared according to the method of Example 193 using 2-amino-N-tert-butylbenzamide instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 477 (MH+-CF3COOH).MS m / e (ESI) 477 (MH + -CF 3 COOH).
Примеры 200 и 201Examples 200 and 201
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]бензамида2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] benzamide trifluoroacetate
1,36 мг полярного производного указанного в заголовке соединения и 0,39 мг неполярного производного указанного в заголовке соединения получают по способу примера 193, используя 2-аминобензамид вместо 1-(4-гидроксибензоил)пирролидина.1.36 mg of the polar derivative of the title compound and 0.39 mg of the non-polar derivative of the title compound were prepared according to the method of Example 193 using 2-aminobenzamide instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 477 (MH+-CF3COOH).MS m / e (ESI) 477 (MH + -CF 3 COOH).
Пример 202Example 202
Трифторацетат N-[3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетамидаN- [3- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] phenyl] acetamide trifluoroacetate
10,79 мг соединения, указанного в заголовке, получают по способу примера 193, используя 3-ацетамидофенол вместо 1-(4-гидроксибензоил)пирролидина.10.79 mg of the title compound was prepared according to the method of Example 193 using 3-acetamidophenol instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 436 (MH+-CF3COOH).MS m / e (ESI) 436 (MH + -CF 3 COOH).
Пример 203Example 203
Трифторацетат N-[4-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетамидаN- [4- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] phenyl] acetamide trifluoroacetate
11,38 мг соединения, указанного в заголовке, получают по способу примера 193, используя 4-ацетамидофенол вместо 1-(4-гидроксибензоил)пирролидина.11.38 mg of the title compound was prepared according to the method of Example 193 using 4-acetamidophenol instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 436 (MH+-CF3COOH).MS m / e (ESI) 436 (MH + -CF 3 COOH).
Пример 204Example 204
Трифторацетат 2-[N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]метиламино]бензойной кислоты2- [N- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] methylamino] benzoic trifluoroacetate acid
3,48 мг соединения, указанного в заголовке, получают по способу примера 193, используя 4-метилантраниловую кислоту вместо 1-(4-гидроксибензоил)пирролидина.3.48 mg of the title compound was prepared according to the method of Example 193 using 4-methylanthranilic acid instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 436 (MH+-CF3COOH).MS m / e (ESI) 436 (MH + -CF 3 COOH).
Пример 205Example 205
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzoic acid trifluoroacetate
25,75 мг соединения, указанного в заголовке, получают по способу примера 193, используя салициловую кислоту вместо 1-(4-гидроксибензоил)пирролидина.25.75 mg of the title compound was prepared according to the method of Example 193 using salicylic acid instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 423 (MH+-CF3COOH).MS m / e (ESI) 423 (MH + -CF 3 COOH).
Пример 206Example 206
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-иламино]бензолсульфонамидаTrifluoroacetate 2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylamino] benzenesulfonamide
0,91 мг соединения, указанного в заголовке, получают по способу примера 193, используя 2-аминобензолсульфонамид вместо 1-(4-гидроксибензоил)пирролидина.0.91 mg of the title compound was prepared according to the method of Example 193 using 2-aminobenzenesulfonamide instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 457 (MH+-CF3COOH).MS m / e (ESI) 457 (MH + -CF 3 COOH).
Пример 207Example 207
Трифторацетат этилового эфира 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илсульфанил]бензойной кислоты2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-ylsulfanyl] benzoic acid ethyl ester trifluoroacetate
0,66 мг соединения, указанного в заголовке, получают по способу примера 193, используя этилтиосалицилат вместо 1-(4-гидроксибензоил)пирролидина.0.66 mg of the title compound was prepared according to the method of Example 193 using ethylthiosalicylate instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 467 (MH+-CF3COOH).MS m / e (ESI) 467 (MH + -CF 3 COOH).
Пример 208Example 208
Трифторацетат 3-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]пиридин-2-карбоновой кислоты3- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] pyridine-2-carboxylic acid trifluoroacetate
4,36 мг соединения, указанного в заголовке, получают по способу примера 193, используя 3-гидроксипиколиновую кислоту вместо 1-(4-гидроксибензоил)пирролидина.4.36 mg of the title compound was prepared according to the method of Example 193 using 3-hydroxypicolinic acid instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 424 (MH+-CF3COOH).MS m / e (ESI) 424 (MH + -CF 3 COOH).
Пример 209Example 209
Трифторацетат N-[2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]фенил]ацетамидаN- [2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] phenyl] acetamide trifluoroacetate
0,126 мг соединения, указанного в заголовке, получают по способу примера 193, используя 2-ацетамидофенол вместо 1-(4-гидроксибензоил)пирролидина.0.126 mg of the title compound was prepared according to the method of Example 193 using 2-acetamidophenol instead of 1- (4-hydroxybenzoyl) pyrrolidine.
МС m/e (ESI) 436 (MH+-CF3COOH).MS m / e (ESI) 436 (MH + -CF 3 COOH).
Пример 210Example 210
Трифторацетат 2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]-N,N-диметилбензамида2- [7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] -N, N-dimethylbenzamide trifluoroacetate
100 мг салициловой кислоты и 0,76 мл 2 M тетрагидрофуранового раствора диметиламина растворяют в 1 мл N,N-диметилформамида и к полученному раствору добавляют 109 мкл диэтилцианофосфата и 250 мкл триэтиламина. Смесь перемешивают при комнатной температуре в течение 5,5 часа. К реакционному раствору добавляют воду, и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и к одной трети аликвоты остатка добавляют 20 мг трет-бутилового эфира 4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоновой кислоты, карбонат калия и 1 мл 1-метил-2-пирролидона. Смесь перемешивают при 150ºС в течение 1,5 часа. К реакционному раствору добавляют воду и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,06 мг указанного в заголовке соединения.100 mg of salicylic acid and 0.76 ml of a 2 M tetrahydrofuran solution of dimethylamine are dissolved in 1 ml of N, N-dimethylformamide, and 109 μl of diethyl cyanophosphate and 250 μl of triethylamine are added to the resulting solution. The mixture was stirred at room temperature for 5.5 hours. Water was added to the reaction solution, and the resulting mixture was extracted with ethyl acetate. The organic layer was concentrated and 20 mg of 4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8 tert-butyl ester was added to one third of the aliquot of the residue. -yl] piperazine-1-carboxylic acid, potassium carbonate and 1 ml of 1-methyl-2-pyrrolidone. The mixture is stirred at 150 ° C for 1.5 hours. Water was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.06 mg of the title compound.
МС m/e (ESI) 450 (MH+-CF3COOH).MS m / e (ESI) 450 (MH + -CF 3 COOH).
Пример 211Example 211
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[2-(тиазолидин-3-карбонил)фенокси]-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- [2- (thiazolidin-3-carbonyl) phenoxy] -1,7-dihydropurin-6-one trifluoroacetate
2,10 мг соединения, указанного в заголовке, получают по способу примера 210, используя тиазолидин вместо диметиламина.2.10 mg of the title compound was prepared according to the method of Example 210 using thiazolidine instead of dimethylamine.
МС m/e (ESI) 494 (MH+-CF3COOH).MS m / e (ESI) 494 (MH + -CF 3 COOH).
Пример 212Example 212
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-[2-(пирролидин-1-карбонил)фенокси]-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- [2- (pyrrolidin-1-carbonyl) phenoxy] -1,7-dihydropurin-6-one trifluoroacetate
6,86 мг соединения, указанного в заголовке, получают по способу примера 210, используя пирролидон вместо диметиламина.6.86 mg of the title compound was prepared according to the method of Example 210, using pyrrolidone instead of dimethylamine.
МС m/e (ESI) 476 (MH+-CF3COOH).MS m / e (ESI) 476 (MH + -CF 3 COOH).
Пример 213Example 213
Трифторацетат 7-(2-бутинил)-1-метил-2-[2-(морфолин-4-карбонил)фенокси]-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- [2- (morpholin-4-carbonyl) phenoxy] -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
3,63 мг соединения, указанного в заголовке, получают по способу примера 210, используя морфолин вместо диметиламина.3.63 mg of the title compound was prepared according to the method of Example 210, using morpholine instead of dimethylamine.
МС m/e (ESI) 492 (MH+-CF3COOH).MS m / e (ESI) 492 (MH + -CF 3 COOH).
Пример 214Example 214
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетонитрила[7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] acetonitrile trifluoroacetate
Пример 215Example 215
Трифторацетат [7-(2-бутинил)-2-цианометил-1-метил-6-оксо-8-(пиперазин-1-ил)-2,3,6,7-тетрагидро-1H-пурин-2-ил]ацетонитрилаTrifluoroacetate [7- (2-butynyl) -2-cyanomethyl-1-methyl-6-oxo-8- (piperazin-1-yl) -2,3,6,7-tetrahydro-1H-purin-2-yl] acetonitrile
8 мг трет-бутилового эфира 4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоновой кислоты растворяют в 0,8 мл ацетонитрила и затем к полученному раствору добавляют 8 мг гидрида натрия. Смесь перемешивают при 60ºС в течение трех часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,85 мг и 2,20 мг указанных в заголовке соединений (примеры 214 и 215) соответственно.8 mg of 4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylic acid tert-butyl ester was dissolved in 0.8 ml of acetonitrile and then 8 mg of sodium hydride is added to the resulting solution. The mixture is stirred at 60 ° C for three hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.85 mg and 2.20 mg of the title compounds (Examples 214) and 215), respectively.
(Пример 214) МС m/e (ESI) 326 (MH+-CF3COOH).(Example 214) MS m / e (ESI) 326 (MH + —CF 3 COOH).
(Пример 215) МС m/e (ESI) 367 (MH+-CF3COOH).(Example 215) MS m / e (ESI) 367 (MH + —CF 3 COOH).
Пример 216Example 216
Трифторацетат 7-(2-бутинил)-1-метил-2-(2-оксопропил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-2- (2-oxopropyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,8 мл ацетона и к полученному раствору добавляют 8 мг гидрида натрия. Полученную смесь перемешивают при 60ºС в течение трех часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,17 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.8 ml of acetone and 8 mg of sodium hydride is added to the resulting solution. The resulting mixture was stirred at 60 ° C for three hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.17 mg of the title compound.
МС m/e (ESI) 343 (MH+-CF3COOH).MS m / e (ESI) 343 (MH + -CF 3 COOH).
Пример 217Example 217
Трифторацетат 7-(2-бутинил)-2-этинил-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-ethynyl-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
50 мкл триметилсилилацетилена растворяют в 1,0 мл тетрагидрофурана, затем при -78ºС добавляют 0,27 мл н-бутиллития (1,56 М раствора в гексане). Смесь перемешивают при 0ºС в течение 15 минут и в полученный реакционный раствор добавляют 1,0 мл тетрагидрофуранового раствора, содержащего 10 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата. После перемешивания полученной смеси при комнатной температуре в течение 30 минут к реакционному раствору добавляют насыщенный раствор хлорида аммония. Смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 1,0 мл метанола. К раствору добавляют 10 мг карбоната калия. После перемешивания полученной смеси при комнатной температуре в течение 1 часа добавляют насыщенный раствор хлорида аммония. Полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,06 мг указанного в заголовке соединения.50 μl of trimethylsilylacetylene are dissolved in 1.0 ml of tetrahydrofuran, then 0.27 ml of n-butyllithium (1.56 M solution in hexane) is added at -78 ° C. The mixture was stirred at 0 ° C for 15 minutes and 1.0 ml of a tetrahydrofuran solution containing 10 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo was added to the resulting reaction solution. -6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate. After the resulting mixture was stirred at room temperature for 30 minutes, a saturated solution of ammonium chloride was added to the reaction solution. The mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 1.0 ml of methanol. 10 mg of potassium carbonate was added to the solution. After the resulting mixture was stirred at room temperature for 1 hour, a saturated solution of ammonium chloride was added. The resulting mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 1.06 mg of the title compound.
МС m/e (ESI) 311 (MH+-CF3COOH).MS m / e (ESI) 311 (MH + -CF 3 COOH).
Пример 218Example 218
Трифторацетат 7-(2-бутинил)-1-метил-8-(пиперазин-1-ил)-2-(пропан-2-сульфинил)-1,7-дигидропурин-6-она7- (2-Butynyl) -1-methyl-8- (piperazin-1-yl) -2- (propan-2-sulfinyl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7- дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и к раствору добавляют 20 мкл 2-пропантиола и 6 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,30 мл дихлорметана. Смесь охлаждают до -78ºС. К смеси добавляют 5 мл м-хлорпербензойной кислоты и полученную смесь перемешивают при -78ºС в течение 15 минут. К реакционному раствору добавляют насыщенный раствор сульфита натрия и смесь экстрагируют дихлорметаном. Органический слой концентрируют и остаток растворяют в 0,40 мл трифторуксусной кислоты. Раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 0,89 мг указанного в заголовке соединения.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone and 20 μl of 2-propanethiol and 6 mg of potassium carbonate are added to the solution. The mixture was stirred at room temperature for five hours. A saturated solution of ammonium chloride was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.30 ml of dichloromethane. The mixture is cooled to -78 ° C. 5 ml of m-chloroperbenzoic acid was added to the mixture, and the resulting mixture was stirred at -78 ° C for 15 minutes. A saturated sodium sulfite solution was added to the reaction solution, and the mixture was extracted with dichloromethane. The organic layer was concentrated and the residue was dissolved in 0.40 ml of trifluoroacetic acid. The solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 0.89 mg of the title compound.
МС m/e (ESI) 377 (MH+-CF3COOH).MS m / e (ESI) 377 (MH + -CF 3 COOH).
Пример 219Example 219
Трифторацетат N-ацетил-N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетамидаN-Acetyl-N- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] acetamide trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 20% водного аммика и смесь перемешивают при 80ºC в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в 0,4 мл пиридина. К смеси добавляют 0,05 мл уксусного ангидрида. Полученную смесь перемешивают при комнатной температуре в течение 48 часов. Реакционный раствор концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,49 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of 20% aqueous ammonia and the mixture is stirred at 80ºC for 5 hours. The reaction solution was concentrated and the residue was dissolved in 0.4 ml of pyridine. To the mixture was added 0.05 ml of acetic anhydride. The resulting mixture was stirred at room temperature for 48 hours. The reaction solution was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.49 mg of the title compound.
МС m/e (ESI) 386 (MH+-CF3COOH).MS m / e (ESI) 386 (MH + -CF 3 COOH).
Пример 220Example 220
Трифторацетат N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]ацетамидаN- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] acetamide trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,2 мл 20% водного раствора аммиака и смесь перемешивают при 80ºС в течение 5 часов. Реакционный раствор концентрируют и остаток растворяют в 0,4 мл пиридина. К раствору добавляют 0,05 мл уксусного ангидрида. Полученную смесь перемешивают при комнатной температуре в течение 48 часов. Реакционный раствор концентрируют и остаток растворяют в метаноле. К раствору добавляют 10 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение 6 часов. Реакционную смесь концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и образовавшийся остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 1,36 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.2 ml of a 20% aqueous ammonia solution and the mixture is stirred at 80 ° C for 5 hours. The reaction solution was concentrated and the residue was dissolved in 0.4 ml of pyridine. 0.05 ml of acetic anhydride was added to the solution. The resulting mixture was stirred at room temperature for 48 hours. The reaction solution was concentrated and the residue was dissolved in methanol. 10 mg of potassium carbonate was added to the solution. The resulting mixture was stirred at room temperature for 6 hours. The reaction mixture was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the resulting residue was purified by reverse phase high performance liquid chromatography (using acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.36 mg of the title compound.
МС m/e (ESI) 344 (MH+-CF3COOH).MS m / e (ESI) 344 (MH + -CF 3 COOH).
Пример 221Example 221
Трифторацетат [7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]ацетонитрила[7- (2-Butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] acetonitrile trifluoroacetate
8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, и к полученному раствору добавляют 50 мкл гидроксиацетонитрила и 5 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение одного часа. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Полученный раствор концентрируют и остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 2,12 мг указанного в заголовке соединения.8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, and 50 μl of hydroxyacetonitrile and 5 mg of sodium hydride are added to the resulting solution. The mixture was stirred at room temperature for one hour. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The resulting solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using a mixture of acetonitrile-water as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 2.12 mg of the title compound.
МС m/e (ESI) 342 (MH+-CF3COOH).MS m / e (ESI) 342 (MH + -CF 3 COOH).
Пример 222Example 222
Трифторацетат N-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-ил]гуанидинаN- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yl] guanidine trifluoroacetate
7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона, затем добавляют 10 мг гуанидина. Смесь перемешивают при 90ºС в течение 12 часов. Реакционный раствор концентрируют и остаток растворяют в 1,0 мл трифторуксусной кислоты. Полученный раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,20 мг указанного в заголовке соединения.7 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, then 10 mg of guanidine is added. The mixture is stirred at 90 ° C for 12 hours. The reaction solution was concentrated and the residue was dissolved in 1.0 ml of trifluoroacetic acid. The resulting solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.20 mg of the title compound.
МС m/e (ESI) 344 (MH+-CF3COOH).MS m / e (ESI) 344 (MH + -CF 3 COOH).
Пример 223Example 223
Трифторацетат 7-(2-бутинил)-2-метилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-methylsulfanyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-trimethylsilanylethoxymethyl) -6,7-dihydro-1H-purin-8-yl] piperazine- 1-carboxylate
50 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 1,2 мл N,N-диметилформамида и к полученному раствору добавляют 44 мкл (2-хлорметоксиэтил)триметилсилана и 34 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют насыщенный водный раствор хлорида аммония и полученную смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле с получением 55 мг указанного в заголовке соединения.50 mg of tert-butyl 4- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate was dissolved in 1.2 ml N, N-dimethylformamide and 44 μl of (2-chloromethoxyethyl) trimethylsilane and 34 mg of potassium carbonate were added to the resulting solution. The resulting mixture was stirred at room temperature for 2 hours. A saturated aqueous solution of ammonium chloride was added and the resulting mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was purified by silica gel column chromatography to give 55 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 0,07 (с, 9H), 0,97 (т, J=8, 4 Гц, 2H), 1,49 (с, 9H), 1,82 (т, J=2, 4 Гц, 3H), 3,40-3,44 (м, 4H), 3,58-3,62 (м, 4H), 3,71 (т, J=8,4 Гц, 2H), 4,92 (кв, J=2,4 Гц, 2H), 5,67 (с, 2H).δ 0.07 (s, 9H), 0.97 (t, J = 8.4 Hz, 2H), 1.49 (s, 9H), 1.82 (t, J = 2.4 Hz, 3H) 3.40-3.44 (m, 4H), 3.58-3.62 (m, 4H), 3.71 (t, J = 8.4 Hz, 2H), 4.92 (q, J = 2.4 Hz, 2H); 5.67 (s, 2H).
(b) Трифторацетат 7-(2-бутинил)-2-метилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин -6-она(b) 7- (2-Butynyl) -2-methylsulfanyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата растворяют в 0,15 мл 1-метил-2-пирролидона и затем к полученному раствору добавляют 50 мкл метилмеркаптана (30%; метанольный раствор) и 10 мг карбоната калия. Полученную смесь перемешивают при комнатной температуре в течение пяти часов. К реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,60 мл трифторуксусной кислоты. Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Затем раствор концентрируют продувкой газообразным азотом. Остаток очищают методом высокоэффективной жидкостной хроматографии с обращенной фазой (используя смесь ацетонитрил-вода в качестве подвижной фазы (содержащей 0,1% трифторуксусной кислоты)) с получением 3,99 мг указанного в заголовке соединения.6 mg tert-butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-trimethylsilanylethoxymethyl) -6,7-dihydro-1H-purin-8-yl] piperazin-1 β-carboxylate is dissolved in 0.15 ml of 1-methyl-2-pyrrolidone, and then 50 μl of methyl mercaptan (30%; methanol solution) and 10 mg of potassium carbonate are added to the resulting solution. The resulting mixture was stirred at room temperature for five hours. A saturated solution of ammonium chloride was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.60 ml of trifluoroacetic acid. The resulting mixture was stirred at room temperature for 5 hours. Then, the solution was concentrated by purging with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using an acetonitrile-water mixture as the mobile phase (containing 0.1% trifluoroacetic acid)) to give 3.99 mg of the title compound.
МС m/e (ESI) 319 (MH+-CF3COOH).MS m / e (ESI) 319 (MH + -CF 3 COOH).
Пример 224Example 224
Трифторацетат 7-(2-бутинил)-2-изопропилсульфанил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она7- (2-Butynyl) -2-isopropylsulfanyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
2,97 мг соединения, указанного в заголовке, получают по способу примера 223, используя натриевую соль пропан-2-тиола вместо метилмеркаптана.2.97 mg of the title compound was prepared according to the method of Example 223 using the propan-2-thiol sodium salt instead of methyl mercaptan.
МС m/e (ESI) 347 (MH+-CF3COOH).MS m / e (ESI) 347 (MH + -CF 3 COOH).
Пример 225Example 225
Трифторацетат 2-трет-бутилсульфанил-7-(2-бутинил)-8-(пиперазин-1-ил)-1,7-дигидропурин-6-она2-tert-butylsulfanyl-7- (2-butynyl) -8- (piperazin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
2,99 мг соединения, указанного в заголовке, получают по способу примера 223, используя натриевую соль 2-метил-2-пропантиола вместо метилмеркаптана.2.99 mg of the title compound was prepared according to the method of Example 223 using the 2-methyl-2-propanethiol sodium salt instead of methyl mercaptan.
МС m/e (ESI) 361 (MH+-CF3COOH).MS m / e (ESI) 361 (MH + -CF 3 COOH).
Пример 226Example 226
Трифторацетат 7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила7- (2-Butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile trifluoroacetate
Растворяют 6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,15 мл 1-метил-2-пирролидона и затем к раствору добавляют 8 мг цианида натрия и 10 мг карбоната калия. Смесь перемешивают при 50ºC в течение пяти часов. В реакционную смесь добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,60 мл трифторуксусной кислоты. Образовавшуюся смесь перемешивают при комнатной температуре в течение 5 часов. Затем раствор концентрируют, продувая его газообразным азотом. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 1,46 мг соединения, указанного в заголовке.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-trimethylsilanylethoxymethyl) -6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.15 ml of 1-methyl-2-pyrrolidone and then 8 mg of sodium cyanide and 10 mg of potassium carbonate are added to the solution. The mixture was stirred at 50ºC for five hours. A saturated aqueous solution of ammonium chloride was added to the reaction mixture, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.60 ml of trifluoroacetic acid. The resulting mixture was stirred at room temperature for 5 hours. Then the solution is concentrated by flushing it with gaseous nitrogen. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 1.46 mg of the title compound.
МС m/e (ESI) 298 (MH+-CF3COOH).MS m / e (ESI) 298 (MH + -CF 3 COOH).
Пример 227Example 227
Трифторацетат 2-[7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида2- [7- (2-Butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
Растворяют 6 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-триметилсиланилэтоксиметил)-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,15 мл 1-метил-2-пирролидона и затем к раствору добавляют 8 мг салициламида и 8 мг карбоната калия. Смесь перемешивают при 100ºC в течение трех часов. В реакционную смесь добавляют раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в 0,80 мл трифторуксусной кислоты. Смесь перемешивают при комнатной температуре в течение 5 часов. Раствор концентрируют, продувая его газообразным азотом. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,45 мг соединения, указанного в заголовке.6 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-trimethylsilanylethoxymethyl) -6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.15 ml of 1-methyl-2-pyrrolidone and then 8 mg of salicylamide and 8 mg of potassium carbonate are added to the solution. The mixture was stirred at 100ºC for three hours. Ammonium chloride solution was added to the reaction mixture, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in 0.80 ml of trifluoroacetic acid. The mixture was stirred at room temperature for 5 hours. The solution was concentrated by flushing it with nitrogen gas. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 2.45 mg of the title compound.
МС m/e (ESI) 408 (MH+-CF3COOH).MS m / e (ESI) 408 (MH + -CF 3 COOH).
Пример 228Example 228
Трифторацетат 4-[7-(2-бутинил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты4- [7- (2-Butynyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzoic acid trifluoroacetate
Получают 1,55 мг соединения, указанного в заголовке, используя 4-гидроксибензойную кислоту, вместо салициламида по способу, описанному в примере 227.1.55 mg of the title compound is obtained using 4-hydroxybenzoic acid instead of salicylamide according to the method described in Example 227.
МС m/e (ESI) 409 (MH+-CF3COOH).MS m / e (ESI) 409 (MH + -CF 3 COOH).
Пример 229Example 229
Гидрохлорид 7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила7- (2-Butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
(a) трет-Бутил-4-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2-cyano-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine- 1-carboxylate
Смесь, состоящую из 8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, полученного в примере 96(a), 10 мг цианида натрия и 0,3 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение 4 часов. Реакционную смесь экстрагируют смесью этилацетат-вода, и органический слой промывают водой и затем насыщенным раствором соли. Органический слой концентрируют. Остаток очищают методом тонкослойной хроматографии (50% этилацетата в гексане), получая 6,1 мг соединения, указанного в заголовке.Mixture of 8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl ] piperazine-1-carboxylate obtained in Example 96 (a), 10 mg sodium cyanide and 0.3 ml N, N-dimethylformamide were stirred at room temperature for 4 hours. The reaction mixture was extracted with ethyl acetate-water, and the organic layer was washed with water and then with brine. The organic layer is concentrated. The residue was purified by thin layer chromatography (50% ethyl acetate in hexane) to give 6.1 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,83 (с, 3H), 3,50 (с, 4H), 3,58-3,64 (м, 4H), 4,99 (с, 2H), 5,74 (с, 2H), 7,02 (д, J=8 Гц, 1H), 7,44 (т, J=8 Гц, 1H), 7,55 (т, J=8 Гц, 1H), 7,74 (д, J=8 Гц, 1H).δ 1.50 (s, 9H), 1.83 (s, 3H), 3.50 (s, 4H), 3.58-3.64 (m, 4H), 4.99 (s, 2H), 5.74 (s, 2H), 7.02 (d, J = 8 Hz, 1H), 7.44 (t, J = 8 Hz, 1H), 7.55 (t, J = 8 Hz, 1H) 7.74 (d, J = 8 Hz, 1H).
(b) Гидрохлорид 7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила(b) 7- (2-Butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Смесь, состоящую из 6,1 мг трет-бутил-4-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата и 0,2 мл трифторуксусной кислоты перемешивают при комнатной температуре в течение 20 минут. Реакционную смесь концентрируют и остаток очищают хроматографически на колонке с обращенной фазой, используя растворитель, содержащий от 20 до 60% метанола в воде (0,1% концентрированной соляной кислоты), получая 5,0 мг соединения, указанного в заголовке.A mixture consisting of 6.1 mg of tert-butyl-4- [7- (2-butynyl) -2-cyano-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8 -yl] piperazine-1-carboxylate and 0.2 ml of trifluoroacetic acid are stirred at room temperature for 20 minutes. The reaction mixture was concentrated and the residue was purified by chromatography on a reverse phase column using a solvent containing from 20 to 60% methanol in water (0.1% concentrated hydrochloric acid) to obtain 5.0 mg of the title compound.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 3,30 (с, 4H), 3,60-3,70 (м, 4H), 5,09 (с, 2H), 5,60 (с, 2H), 7,27 (д, J=8 Гц, 1H), 7,54 (т, J=8 Гц, 1H), 7,68 (т, J=8 Гц, 1H), 7,94 (д, J=8 Гц, 1H), 9,36 (уш.с, 2H).δ 1.80 (s, 3H), 3.30 (s, 4H), 3.60-3.70 (m, 4H), 5.09 (s, 2H), 5.60 (s, 2H), 7.27 (d, J = 8 Hz, 1H), 7.54 (t, J = 8 Hz, 1H), 7.68 (t, J = 8 Hz, 1H), 7.94 (d, J = 8 Hz, 1H), 9.36 (br s, 2H).
Пример 230Example 230
Трифторацетат 3-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]пиридин-2-карбоксиламидаTrifluoroacetate 3- [7- (2-butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] pyridin- 2-carboxylamide
Растворяют 7 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,2 мл 1-метил-2-пирролидона и затем добавляют к раствору 8 мг 3-гидроксипиридин-2-карбоксиламида и 8 мг карбоната калия. Смесь перемешивают при 100ºC в течение 2 часов. В реакционную смесь добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,93 мг соединения, указанного в заголовке.7 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.2 ml of 1-methyl-2-pyrrolidone and then 8 mg of 3-hydroxypyridin-2-carboxylamide and 8 mg of potassium carbonate are added to the solution. The mixture was stirred at 100ºC for 2 hours. 1N was added to the reaction mixture. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 2.93 mg of the title compound.
МС m/e (ESI) 524 (MH+-CF3COOH).MS m / e (ESI) 524 (MH + -CF 3 COOH).
Пример 231Example 231
Трифторацетат 4-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензолсульфонамида4- [7- (2-Butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzenesulfonamide trifluoroacetate
Получают 1,90 мг соединения, указанного в заголовке, используя 4-гидроксибензолсульфонамид, вместо 3-гидроксипиридин-2-карбоксиламида, по способу, описанному в примере 230.1.90 mg of the title compound is obtained using 4-hydroxybenzenesulfonamide instead of 3-hydroxypyridine-2-carboxylamide, according to the method described in Example 230.
МС m/e (ESI) 559 (MH+-CF3COOH).MS m / e (ESI) 559 (MH + -CF 3 COOH).
Пример 232Example 232
Трифторацетат 2-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензонитрила2- [7- (2-Butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzonitrile trifluoroacetate
Получают 2,15 мг соединения, указанного в заголовке, используя 2-цианофенол вместо 3-гидроксипиридин-2-карбоксиламида по способу, описанному в примере 230.2.15 mg of the title compound is obtained using 2-cyanophenol instead of 3-hydroxypyridin-2-carboxylamide according to the method described in Example 230.
МС m/e (ESI) 505 (MH+-CF3COOH).MS m / e (ESI) 505 (MH + -CF 3 COOH).
Пример 233Example 233
Трифторацетат 4-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензойной кислоты4- [7- (2-Butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzoic acid trifluoroacetate
Получают 3,74 мг соединения, указанного в заголовке, используя 4-гидроксибензойную кислоту вместо 3-гидроксипиридин-2-карбоксиламида по способу, описанному в примере 230.3.74 mg of the title compound is obtained using 4-hydroxybenzoic acid instead of 3-hydroxypyridin-2-carboxylamide according to the method described in Example 230.
МС m/e (ESI) 524 (MH+-CF3COOH).MS m / e (ESI) 524 (MH + -CF 3 COOH).
Пример 234Example 234
Трифторацетат 2-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида2- [7- (2-Butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
Получают 3,74 мг соединения, указанного в заголовке, используя салициламид вместо 3-гидроксипиридин-2-карбоксиламида по способу, описанному в примере 230.3.74 mg of the title compound is obtained using salicylamide instead of 3-hydroxypyridin-2-carboxylamide according to the method described in Example 230.
МС m/e (ESI) 523 (MH+-CF3COOH).MS m / e (ESI) 523 (MH + -CF 3 COOH).
Пример 235Example 235
Трифторацетат 2-[7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида2- [7- (2-Butynyl) -1- (4-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2-chloro-1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine- 1-carboxylate
Растворяют 100 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 1,2 мл N,N-диметилформамида и затем добавляют к раствору 97 мг 4-цианобензилбромида и 68 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение 4 часов. К реакционной смеси добавляют насыщенный водный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле, получая 71 мг соединения, указанного в заголовке.100 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 1.2 ml N, N-dimethylformamide and then 97 mg of 4-cyanobenzyl bromide and 68 mg of potassium carbonate are added to the solution. The mixture was stirred at room temperature for 4 hours. A saturated aqueous solution of ammonium chloride was added to the reaction mixture, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was purified by silica gel column chromatography to obtain 71 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,84 (т, J=2,5 Гц, 3H), 3,43-3,47 (м, 4H), 3,59-3,63 (м, 4H), 4,94 (кв, 2,5 Гц, 2H), 5,53 (с, 2H), 7,42 (д, J=8,0 Гц, 2H), 7,62 (д, J=8,0 Гц, 2H).δ 1.49 (s, 9H), 1.84 (t, J = 2.5 Hz, 3H), 3.43-3.47 (m, 4H), 3.59-3.63 (m, 4H ), 4.94 (q, 2.5 Hz, 2H), 5.53 (s, 2H), 7.42 (d, J = 8.0 Hz, 2H), 7.62 (d, J = 8 , 0 Hz, 2H).
(b) Трифторацетат 2-[7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида(b) 2- [7- (2-Butynyl) -1- (4-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy trifluoroacetate ] benzamide
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 10 мг салициламида и 10 мг карбоната калия. Смесь перемешивают при 100ºC в течение 12 часов. В реакционную смесь добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 6,69 мг соединения, указанного в заголовке.12 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.3 ml of 1-methyl-2-pyrrolidone and then 10 mg of salicylamide and 10 mg of potassium carbonate are added to the solution. The mixture was stirred at 100ºC for 12 hours. 1N was added to the reaction mixture. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 6.69 mg of the title compound.
МС m/e (ESI) 523 (MH+-CF3COOH).MS m / e (ESI) 523 (MH + -CF 3 COOH).
Пример 236Example 236
Трифторацетат 7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрила7- (2-Butynyl) -1- (4-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile trifluoroacetate
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 10 мг цианида натрия. Смесь перемешивают при 50ºC в течение 2 часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 3,87 мг соединения, указанного в заголовке.12 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.3 ml of 1-methyl-2-pyrrolidone and then 10 mg of sodium cyanide are added to the solution. The mixture was stirred at 50 ° C for 2 hours. Add to the reaction solution 1 N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.87 mg of the title compound.
МС m/e (ESI) 413 (МН+-CF3COOH).MS m / e (ESI) 413 (MH + -CF 3 COOH).
Пример 237Example 237
Трифторацетат 4-[7-(2-бутинил)-2-метилсульфанил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидропурин-1-илметил]бензонитрила4- [7- (2-Butynyl) -2-methylsulfanyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydropurin-1-ylmethyl] benzonitrile trifluoroacetate
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 20 мкл метилмеркаптана (30%; метанольный раствор) и 10 мг карбоната калия. Смесь перемешивают при 50ºC в течение 2 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 6,69 мг соединения, указанного в заголовке.12 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.3 ml of 1-methyl-2-pyrrolidone and then 20 μl of methyl mercaptan (30%; methanol solution) and 10 mg of potassium carbonate are added to the solution. The mixture was stirred at 50 ° C for 2 hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 6.69 mg of the title compound.
МС m/e (ESI) 434 (МН+-CF3COOH).MS m / e (ESI) 434 (MH + -CF 3 COOH).
Пример 238Example 238
Трифторацетат 2-[7-(2-бутинил)-1-(3-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида2- [7- (2-Butynyl) -1- (3-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-1-(3-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата(a) tert-Butyl-4- [7- (2-butynyl) -2-chloro-1- (3-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine- 1-carboxylate
Растворяют 100 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 1,2 мл N,N-диметилформамида и затем добавляют к раствору 97 мг 3-цианобензилбромида и 68 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение 12 часов. Затем к реакционному раствору добавляют насыщенный раствор хлорида аммония и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле, получая 71 мг соединения, указанного в заголовке.100 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate is dissolved in 1.2 ml N, N-dimethylformamide and then 97 mg of 3-cyanobenzyl bromide and 68 mg of potassium carbonate are added to the solution. The mixture was stirred at room temperature for 12 hours. Then, a saturated solution of ammonium chloride was added to the reaction solution, and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the residue was purified by silica gel column chromatography to obtain 71 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,84 (т, J=2,5 Гц, 3H), 3,43-3,47 (м, 4H), 3,59-3,63 (м, 4H), 4,94 (кв, 2,5 Гц, 2H), 5,53 (с, 2H), 7,42 (д, J=8,0 Гц, 2H), 7,62 (д, J=8,0 Гц, 2H).δ 1.49 (s, 9H), 1.84 (t, J = 2.5 Hz, 3H), 3.43-3.47 (m, 4H), 3.59-3.63 (m, 4H ), 4.94 (q, 2.5 Hz, 2H), 5.53 (s, 2H), 7.42 (d, J = 8.0 Hz, 2H), 7.62 (d, J = 8 , 0 Hz, 2H).
(b) Трифторацетат 2-[7-(2-бутинил)-1-(3-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-илокси]бензамида(b) 2- [7- (2-Butynyl) -1- (3-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy trifluoroacetate ] benzamide
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(3-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 10 мг салициламида и 10 мг карбоната калия. Смесь перемешивают при 100ºC в течение пяти часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 8,76 мг соединения, указанного в заголовке.12 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (3-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.3 ml of 1-methyl-2-pyrrolidone and then 10 mg of salicylamide and 10 mg of potassium carbonate are added to the solution. The mixture is stirred at 100ºC for five hours. Add to the reaction solution 1 N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 8.76 mg of the title compound.
Масс-спектр m/e (ESI) 523 (MH+-CF3COOH).Mass spectrum m / e (ESI) 523 (MH + —CF 3 COOH).
Пример 239Example 239
Трифторацет 7-(2-бутинил)-1-(3-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1H-пурин-2-карбонитрилаTrifluoroacetate 7- (2-butynyl) -1- (3-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile
Растворяют 12 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-1-(3-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата в 0,3 мл 1-метил-2-пирролидона и затем к раствору добавляют 10 мг цианида натрия. Смесь перемешивают при 50ºC в течение 1 часа. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 4,96 мг соединения, указанного в заголовке.12 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-1- (3-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine is dissolved 1-carboxylate in 0.3 ml of 1-methyl-2-pyrrolidone and then 10 mg of sodium cyanide are added to the solution. The mixture was stirred at 50 ° C for 1 hour. Add to the reaction solution 1 N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 4.96 mg of the title compound.
МС m/e (ESI) 413 (MH+-CF3COOH).MS m / e (ESI) 413 (MH + -CF 3 COOH).
Пример 240Example 240
Гидрохлорид 1-(2-бутинил)-2-(пиперазин-1-ил)-7,8-дигидро-1H,6H-5-окса-1,3,4,8a-тетраазациклопента[b]нафталин-9-он1- (2-Butynyl) -2- (piperazin-1-yl) -7,8-dihydro-1H hydrochloride, 6H-5-oxa-1,3,4,8a-tetraazacyclopenta [b] naphthalen-9-one
(a) трет-Бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-[3-(тетрагидропиран-2-илокси)пропил]-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- [3- (tetrahydropyran-2-yloxy) propyl] -6,7-dihydro-1H-purine -8-yl] piperazine-1-carboxylate
Смесь, состоящую из 20 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, полученного в примере 95(a), 20 мкл 2-(3-бромпропокси)тетрагидропирана, 20 мг безводного карбоната калия и 0,2 мл N,N-диметилформамида перемешивают при комнатной температуре в течение ночи. Реакционный раствор экстрагируют смесью этилацетат-вода и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток очищают методом тонкослойной хроматографии (70% этилацетата в гексане), получая 8 мг соединения, указанного в заголовке.A mixture consisting of 20 mg of tert-butyl 4- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperazine-1-carboxylate obtained in Example 95 (a), 20 μl of 2- (3-bromopropoxy) tetrahydropyran, 20 mg of anhydrous potassium carbonate and 0.2 ml of N, N-dimethylformamide were stirred at room temperature overnight. The reaction solution was extracted with ethyl acetate-water, and the organic layer was washed with water and then with brine. The organic layer was then concentrated and the residue was purified by thin layer chromatography (70% ethyl acetate in hexane) to give 8 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,50-1,81 (м, 6H), 1,83 (т, J=2 Гц, 3H), 2,06 (кв, J=7 Гц, 2H), 3,38-3,62 (м, 10H), 3,80-3,90 (м, 2H), 4,34-4,47 (м, 2H), 4,59 (т, J=3 Гц, 1H), 4,92 (кв, J=2 Гц, 2H).δ 1.49 (s, 9H), 1.50-1.81 (m, 6H), 1.83 (t, J = 2 Hz, 3H), 2.06 (q, J = 7 Hz, 2H) , 3.38-3.62 (m, 10H), 3.80-3.90 (m, 2H), 4.34-4.47 (m, 2H), 4.59 (t, J = 3 Hz , 1H); 4.92 (q, J = 2 Hz, 2H).
(b) трет-Бутил-4-[1-(2-бутинил)-9-оксо-1,7,8,9-тетраазациклопента[b]нафталин-2-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [1- (2-butynyl) -9-oxo-1,7,8,9-tetraazacyclopenta [b] naphthalene-2-yl] piperazine-1-carboxylate
Смесь, состоящую из 8 мг трет-бутил-4-[7-(2-бутинил)-2-хлор-6-оксо-1-[3-(тетрагидропиран-2-илокси)пропил]-6,7-дигидро-1H-пурин-8-ил]пиперазин-1-карбоксилата, 0,2 мл этанола и каталитического количества моногидрата пара-толуолсульфокислоты перемешивают при комнатной температуре в течение 4 часов и затем добавляют к раствору 40 мг безводного карбоната калия. Смесь дополнительно перемешивают в течение ночи. Реакционный раствор экстрагируют смесью этилацетат-вода и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток очищают методом тонкослойной хроматографии (20% метанола в этилацетате), получая 3 мг соединения, указанного в заголовке.A mixture of 8 mg of tert-butyl-4- [7- (2-butynyl) -2-chloro-6-oxo-1- [3- (tetrahydropyran-2-yloxy) propyl] -6,7-dihydro 1H-purin-8-yl] piperazine-1-carboxylate, 0.2 ml of ethanol and a catalytic amount of p-toluenesulfonic acid monohydrate were stirred at room temperature for 4 hours and then 40 mg of anhydrous potassium carbonate was added to the solution. The mixture was further stirred overnight. The reaction solution was extracted with ethyl acetate-water, and the organic layer was washed with water and then with brine. The organic layer was then concentrated and the residue was purified by thin layer chromatography (20% methanol in ethyl acetate) to obtain 3 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,82 (т, J=2 Гц 3H), 2,18-2,26 (м, 2H), 3,37-3,43 (м, 4H), 3,56-3,62 (м, 4H), 4,07 (т, J=6 Гц, 2H), 4,43 (т, J=5 Гц, 2H), 4,88 (кв, J=2 Гц, 2H).δ 1.48 (s, 9H), 1.82 (t, J = 2 Hz 3H), 2.18-2.26 (m, 2H), 3.37-3.43 (m, 4H), 3 , 56-3.62 (m, 4H), 4.07 (t, J = 6 Hz, 2H), 4.43 (t, J = 5 Hz, 2H), 4.88 (q, J = 2 Hz , 2H).
(c) Гидрохлорид 1-(2-бутинил)-2-(пиперазин-1-ил)-7,8-дигидро-1H,6H-5-окса-1,3,4,8a-тетраазациклопента[b]нафталин-9-она(c) 1- (2-Butynyl) -2- (piperazin-1-yl) -7,8-dihydro-1H, 6H-5-oxa-1,3,4,8a-tetraazacyclopenta [b] naphthalene hydrochloride 9th
Смесь, состоящую из 3 мг трет-бутил-4-[1-(2-бутинил)-9-оксо-1,7,8,9-тетраазациклопента[b]нафталин-2-ил]пиперазин-1-карбоксилата и 0,5 мл трифторуксусной кислоты, перемешивают при комнатной температуре в течение 20 минут. Затем раствор концентрируют и остаток очищают на хроматографической колонке с обращенной фазой, используя растворитель - от 20 до 50% метанола в воде (0,1% концентрированной соляной кислоты), получая 2,1 мг соединения, указанного в заголовке.A mixture consisting of 3 mg of tert-butyl 4- [1- (2-butynyl) -9-oxo-1,7,8,9-tetraazacyclopenta [b] naphthalen-2-yl] piperazine-1-carboxylate and 0 5 ml of trifluoroacetic acid, stirred at room temperature for 20 minutes. The solution was then concentrated and the residue was purified on a reverse phase chromatography column using a solvent of 20 to 50% methanol in water (0.1% concentrated hydrochloric acid) to obtain 2.1 mg of the title compound.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,79 (с, 3H), 2,08-2,16 (м, 2H), 3,27 (уш.с, 4H), 3,44-3,54 (м, 4H), 3,90 (т, J=6 Гц, 2H), 4,38 (т, J=5 Гц, 2H), 4,94 (с, 2H), 9,02 (уш.с, 2H).δ 1.79 (s, 3H), 2.08-2.16 (m, 2H), 3.27 (br s, 4H), 3.44-3.54 (m, 4H), 3.90 (t, J = 6 Hz, 2H), 4.38 (t, J = 5 Hz, 2H), 4.94 (s, 2H), 9.02 (br s, 2H).
Пример 241Example 241
Гидрохлорид 1-(2-бутинил)-2-(пиперазин-1-ил)-6,7-дигидро-1H-5-окса-1,3,4,7a-тетрааза-сим-индацен-8-она1- (2-Butynyl) -2- (piperazin-1-yl) -6,7-dihydro-1H-5-oxa-1,3,4,7a-tetraaza-sim-indacen-8-one hydrochloride
В примере 240 получают соединение, указанное в заголовке, используя 2-(2-бромэтокси)тетрагидропиран, вместо 2-(3-бромпропокси)тетрагидропирана, по способу, описанному в примере 240.In Example 240, the title compound was prepared using 2- (2-bromoethoxy) tetrahydropyran instead of 2- (3-bromopropoxy) tetrahydropyran, according to the method described in Example 240.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,80 (с, 3H), 3,27 (уш.с, 4H), 4,19 (т, J=8 Гц, 2H), 4,70 (т, J=8 Гц, 2H), 4,94 (с, 2H), 9,06 (уш.с, 2H).δ 1.80 (s, 3H), 3.27 (br.s, 4H), 4.19 (t, J = 8 Hz, 2H), 4.70 (t, J = 8 Hz, 2H), 4 94 (s, 2H); 9.06 (br s, 2H).
Пример 242Example 242
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
(a) Бензил-3-трет-бутоксикарбониламинопиперидин-1-карбоксилата(a) Benzyl 3-tert-butoxycarbonylaminopiperidine-1-carboxylate
Добавляют по каплям 88 г бензилхлороформиата (30%-ный раствор в толуоле) к смеси, состоящей из 24,3 г этилпиперидин-3-карбоксилата, 26 мл триэтиламина и 300 мл этилацетата, в течение 30 минут при охлаждении смеси льдом. Реакционную смесь фильтруют, для того чтобы удалить нерастворимое вещество. Фильтрат снова фильтруют через небольшой слой силикагеля. Фильтрат концентрируют.88 g of benzyl chloroformate (30% solution in toluene) are added dropwise to a mixture of 24.3 g of ethyl piperidine-3-carboxylate, 26 ml of triethylamine and 300 ml of ethyl acetate, over 30 minutes while cooling the mixture with ice. The reaction mixture is filtered in order to remove insoluble matter. The filtrate is again filtered through a small layer of silica gel. The filtrate was concentrated.
Добавляют к остатку 200 мл этанола и 40 мл водного раствора (5 M) гидроксида натрия. Смесь перемешивают при комнатной температуре в течение ночи. Реакционный раствор концентрируют и к остатку добавляют 200 мл воды. Смесь экстрагируют метил-трет-бутиловым эфиром. К водному слою добавляют 5 M водный раствор соляной кислоты и смесь экстрагируют этилацетатом. Органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют, получая маслянистый остаток (30,9 г).200 ml of ethanol and 40 ml of an aqueous solution of (5 M) sodium hydroxide are added to the residue. The mixture was stirred at room temperature overnight. The reaction solution was concentrated and 200 ml of water was added to the residue. The mixture was extracted with methyl tert-butyl ether. A 5 M aqueous hydrochloric acid solution was added to the aqueous layer, and the mixture was extracted with ethyl acetate. The organic layer was washed with water and then with brine. The organic layer was dried over anhydrous magnesium sulfate and then concentrated to give an oily residue (30.9 g).
Смесь, состоящую из 30 г этого остатка, 24,5 мл дифенилфосфорилазида, 15,9 мл триэтиламина и 250 мл трет-бутанола, перемешивают при комнатной температуре в течение 1,5 часов. Смесь дополнительно перемешивают в масляной бане при 100ºC в течение 20 часов. Реакционный раствор концентрируют и остаток экстрагируют смесью этилацетат-вода. Органический слой промывают разбавленным водным раствором бикарбоната натрия и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - от 10 до 20% этилацетата в гексане, и при последующей перекристаллизации из смеси этилацетат-гексан получают 21,4 г соединения, указанного в заголовке.A mixture consisting of 30 g of this residue, 24.5 ml of diphenylphosphoryl azide, 15.9 ml of triethylamine and 250 ml of tert-butanol was stirred at room temperature for 1.5 hours. The mixture is further stirred in an oil bath at 100ºC for 20 hours. The reaction solution was concentrated and the residue was extracted with ethyl acetate-water. The organic layer was washed with dilute aqueous sodium bicarbonate and then with brine. The organic layer was dried over anhydrous magnesium sulfate and then concentrated. The residue was purified by silica gel column chromatography using a solvent of 10 to 20% ethyl acetate in hexane, and subsequent recrystallization from ethyl acetate-hexane gave 21.4 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (с, 9H), 1,48-1,92 (м, 4H), 3,20-3,80 (м, 5H), 4,58 (уш.с, 1H), 5,13 (с, 2H), 7,26-7,40 (м, 5H).δ 1.43 (s, 9H), 1.48-1.92 (m, 4H), 3.20-3.80 (m, 5H), 4.58 (br s, 1H), 5.13 (s, 2H); 7.26-7.40 (m, 5H).
(b) трет-Бутил-пиперидин-3-илкарбамат(b) tert-butyl-piperidin-3-ylcarbamate
Смесь, состоящую из 10 г бензил-3-трет-бутоксикарбониламинопиперидин-1-карбоксилата, 500 мг катализатора - 10% палладия на угле - и 100 мл этанола, перемешивают при комнатной температуре в атмосфере водорода в течение ночи. Катализатор удаляют путем фильтрации. Фильтрат концентрируют и сушат, получая 6,0 г соединения, указанного в заголовке.A mixture consisting of 10 g of benzyl-3-tert-butoxycarbonylaminopiperidine-1-carboxylate, 500 mg of catalyst — 10% palladium-carbon — and 100 ml of ethanol was stirred at room temperature in a hydrogen atmosphere overnight. The catalyst is removed by filtration. The filtrate was concentrated and dried, yielding 6.0 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,44 (с, 9H), 1,47-1,80 (м, 4H), 2,45-2,60 (м, 1H), 2,60-2,75 (м, 1H), 2,75-2,90 (м, 1H), 3,05 (дд, J=3 Гц, 12 Гц, 1H), 3,57 (уш.с, 1H), 4,83 (уш.с, 1H).δ 1.44 (s, 9H), 1.47-1.80 (m, 4H), 2.45-2.60 (m, 1H), 2.60-2.75 (m, 1H), 2 , 75-2.90 (m, 1H), 3.05 (dd, J = 3 Hz, 12 Hz, 1H), 3.57 (br.s, 1H), 4.83 (br.s, 1H) .
(c) трет-Бутил-[1-[7-(2-бутинил)-2,6-дихлор-7H-пурин-8-ил]пиперидин-3-ил]карбамат(c) tert-Butyl- [1- [7- (2-butynyl) -2,6-dichloro-7H-purin-8-yl] piperidin-3-yl] carbamate
Смесь, состоящую из 1,25 г 7-(2-бутинил)-2,6,8-трихлор-7H-пурина, 1,0 г трет-бутилпиперидин-3-илкарбамата и 10 мл ацетонитрила, перемешивают при комнатной температуре в течение 10 минут. По каплям добавляют в течение 10 минут 0,63 мл триэтиламина и затем смесь непрерывно перемешивают при комнатной температуре в течение 30 минут. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток кристаллизуется из смеси метил-трет-бутиловый эфир-гексан, получают 1,79 г соединения, указанного в заголовке.A mixture of 1.25 g of 7- (2-butynyl) -2,6,8-trichloro-7H-purine, 1.0 g of tert-butylpiperidin-3-ylcarbamate and 10 ml of acetonitrile was stirred at room temperature for 10 minutes. 0.63 ml of triethylamine are added dropwise over 10 minutes and then the mixture is continuously stirred at room temperature for 30 minutes. The reaction solution was partitioned between ethyl acetate and water, and the organic layer was washed with brine. The organic layer was dried over anhydrous magnesium sulfate and then concentrated. The residue crystallizes from methyl tert-butyl ether-hexane to give 1.79 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (с, 9H), 1,60-2,02 (м, 4H), 1,83 (т, J=2 Гц, 3H), 3,32-3,41 (м, 1H), 3,42-3,52 (м, 1H), 3,67-3,76 (м, 1H), 3,80-3,91 (м, 1H), 4,76-4,90 (м, 3H).δ 1.43 (s, 9H), 1.60-2.02 (m, 4H), 1.83 (t, J = 2 Hz, 3H), 3.32-3.41 (m, 1H), 3.42-3.52 (m, 1H), 3.67-3.76 (m, 1H), 3.80-3.91 (m, 1H), 4.76-4.90 (m, 3H) )
(d) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат(d) tert-Butyl- [1- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] carbamate
Смесь, состоящую из 1,79 г трет-бутил-[1-[7-(2-бутинил)-2,6-дихлор-7H-пурин-8-ил]пиперидин-3-ил]карбамата, 1,0 г ацетата натрия и 18 мл диметилсульфоксида, перемешивают в масляной бане при 120ºC в течение трех часов. Эту смесь удаляют из масляной бани и к реакционному раствору добавляют 18 мл воды. Смесь охлаждают до комнатной температуры. Кристаллы собирают путем фильтрации и промывают водой и затем метил-трет-бутиловым эфиром. Затем кристаллы сушат, получая 1,59 г соединения, указанного в заголовке.A mixture consisting of 1.79 g of tert-butyl- [1- [7- (2-butynyl) -2,6-dichloro-7H-purin-8-yl] piperidin-3-yl] carbamate, 1.0 g sodium acetate and 18 ml of dimethyl sulfoxide, stirred in an oil bath at 120ºC for three hours. This mixture was removed from the oil bath and 18 ml of water was added to the reaction solution. The mixture was cooled to room temperature. The crystals were collected by filtration and washed with water and then with methyl tert-butyl ether. Then, the crystals were dried, yielding 1.59 g of the title compound.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,39 (с, 9H), 1,34-1,88 (м, 4H), 1,78 (с, 3H), 2,81 (т, J=11 Гц, 1H), 2,95 (т, J=11 Гц, 1H), 3,48-3,60 (м, 2H), 3,64 (д, J=6 Гц, 1H), 4,90 (с, 2H), 6,94 (д, J=8 Гц, 1H).δ 1.39 (s, 9H), 1.34-1.88 (m, 4H), 1.78 (s, 3H), 2.81 (t, J = 11 Hz, 1H), 2.95 ( t, J = 11 Hz, 1H), 3.48-3.60 (m, 2H), 3.64 (d, J = 6 Hz, 1H), 4.90 (s, 2H), 6.94 ( d, J = 8 Hz, 1H).
(e) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат(e) tert-Butyl- [1- [7- (2-butynyl) -2-chloro-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperidine -3-yl] carbamate
Смесь, состоящую из 100 мг трет-бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата, 66 мг безводного карбоната калия, 70 мг 2-цианобензилбромида и 1 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение пяти часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - смесь 50% этилацетата в гексане; получают 44,7 мг соединения, указанного в заголовке.Mixture consisting of 100 mg of tert-butyl- [1- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] carbamate, 66 mg of anhydrous potassium carbonate, 70 mg of 2-cyanobenzyl bromide and 1 ml of N, N-dimethylformamide are stirred at room temperature for five hours. The reaction solution was partitioned between ethyl acetate and water, and the organic layer was washed with water and then with brine. The organic layer was dried over anhydrous magnesium sulfate and then concentrated. The residue was purified by silica gel column chromatography using a solvent of 50% ethyl acetate in hexane; 44.7 mg of the title compound are obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,44 (с, 9H), 1,59-1,81 (м, 2H), 1,83 (т, J=2 Гц, 3H), 1,86-1,94 (м, 2H), 3,20-3,50 (м, 3H), 3,66 (д, J=7 Гц, 1H), 3,86 (уш.с, 1H), 4,88-5,06 (м, 3H), 5,72 (с, 2H), 7,06 (д, J=8 Гц, 1H), 7,38 (т, J=8 Гц, 1H), 7,51 (т, J=8 Гц, 1H), 7,70 (д, J=8 Гц, 1H).δ 1.44 (s, 9H), 1.59-1.81 (m, 2H), 1.83 (t, J = 2 Hz, 3H), 1.86-1.94 (m, 2H), 3.20-3.50 (m, 3H), 3.66 (d, J = 7 Hz, 1H), 3.86 (br s, 1H), 4.88-5.06 (m, 3H) 5.72 (s, 2H), 7.06 (d, J = 8 Hz, 1H), 7.38 (t, J = 8 Hz, 1H), 7.51 (t, J = 8 Hz, 1H ), 7.70 (d, J = 8 Hz, 1H).
(f) трет-Бутил-[1-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1-пурин-8-ил]пиперидин-3-ил]карбамата(f) tert-Butyl- [1- [7- (2-butynyl) -2-cyano-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1-purin-8-yl] piperidine -3-yl] carbamate
Смесь, состоящую из 15 мг трет-бутил-[1-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата, 20 мг цианида натрия и 0,2 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение трех часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток очищают методом тонкослойной хроматографии, используя растворитель - 50% этилацетата в гексане (проявляется три раза), и получают 10,3 мг соединения, указанного в заголовке.Mixture of 15 mg of tert-butyl- [1- [7- (2-butynyl) -2-chloro-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8- il] piperidin-3-yl] carbamate, 20 mg of sodium cyanide and 0.2 ml of N, N-dimethylformamide, stirred at room temperature for three hours. The reaction solution was partitioned between ethyl acetate and water, and the organic layer was washed with water and then with brine. Then the organic layer was concentrated and the residue was purified by thin-layer chromatography using a solvent of 50% ethyl acetate in hexane (three times), and 10.3 mg of the title compound was obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,44 (с, 9H), 1,52-1,98 (м, 4H), 1,81 (т, J=2 Гц 3H), 3,24 (дд, J=7 Гц, 12 Гц, 1H), 3,30-3,40 (м, 1H), 3,46-3,56 (м, 1H), 3,72 (д, J=12 Гц, 1H), 3,86 (уш.с, 1H), 4,86-5,10 (м, 3H), 5,73 (с, 2H), 7,00 (д, J=8 Гц, 1H), 7,42 (т, J=8 Гц, 1H), 7,54 (дт, J=2 Гц, 8 Гц, 1H), 7,73 (дд, J=2 Гц, 8 Гц, 1H).δ 1.44 (s, 9H), 1.52-1.98 (m, 4H), 1.81 (t, J = 2 Hz 3H), 3.24 (dd, J = 7 Hz, 12 Hz, 1H), 3.30-3.40 (m, 1H), 3.46-3.56 (m, 1H), 3.72 (d, J = 12 Hz, 1H), 3.86 (br.s , 1H), 4.86-5.10 (m, 3H), 5.73 (s, 2H), 7.00 (d, J = 8 Hz, 1H), 7.42 (t, J = 8 Hz , 1H), 7.54 (dt, J = 2 Hz, 8 Hz, 1H), 7.73 (dd, J = 2 Hz, 8 Hz, 1H).
(g) Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила(g) 8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Смесь, состоящую из 10,3 мг трет-бутил-[1-[7-(2-бутинил)-2-циано-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата и 0,2 мл трифторуксусной кислоты, перемешивают в течение 20 минут. Реакционный раствор концентрируют и остаток очищают хроматографически на колонке с обращенной фазой, используя растворитель - от 20 до 80% метанола в воде (0,1% концентрированной соляной кислоты), и получают 8,0 мг соединения, указанного в заголовке.A mixture consisting of 10.3 mg of tert-butyl- [1- [7- (2-butynyl) -2-cyano-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purine- 8-yl] piperidin-3-yl] carbamate and 0.2 ml of trifluoroacetic acid are stirred for 20 minutes. The reaction solution was concentrated and the residue was purified by chromatography on a reverse phase column using a solvent of 20 to 80% methanol in water (0.1% concentrated hydrochloric acid), and 8.0 mg of the title compound was obtained.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,60-1,74 (м, 2H), 1,79 (т, J=2 Гц, 3H), 1,88-2,03 (м, 2H), 3,14-3,28 (м, 2H), 3,42 (уш.с, 1H), 3,52-3,82 (м, 2H), 4,98-5,12 (м, 2H), 5,58 (с, 2H), 7,26 (д, J=8 Гц, 1H), 7,53 (т, J=8 Гц, 1H), 7,66 (т, J=8 Гц, 1H), 7,93 (д, J=8 Гц, 1H), 8,16 (уш.с, 3H).δ 1.60-1.74 (m, 2H), 1.79 (t, J = 2 Hz, 3H), 1.88-2.03 (m, 2H), 3.14-3.28 (m , 2H), 3.42 (br s, 1H), 3.52-3.82 (m, 2H), 4.98-5.12 (m, 2H), 5.58 (s, 2H), 7.26 (d, J = 8 Hz, 1H), 7.53 (t, J = 8 Hz, 1H), 7.66 (t, J = 8 Hz, 1H), 7.93 (d, J = 8 Hz, 1H), 8.16 (br s, 3H).
Пример 243Example 243
Гидрохлорид 2-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-6-оксо-6,7-дигидропурин-1-илметил]бензонитрила2- [8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -2-methoxy-6-oxo-6,7-dihydropurin-1-ylmethyl] benzonitrile hydrochloride
Смесь, состоящую из 15 мг трет-бутил-[1-[7-(2-бутинил)-2-хлор-1-(2-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата, 20 мг безводного карбоната калия и 0,2 мл метанола, перемешивают в течение трех часов. Последующие стадии проводятся по тому же самому способу, который использовался в примере 242, стадии (f) и (g). Таким образом синтезируют соединение, указанное в заголовке.Mixture of 15 mg of tert-butyl- [1- [7- (2-butynyl) -2-chloro-1- (2-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8- il] piperidin-3-yl] carbamate, 20 mg of anhydrous potassium carbonate and 0.2 ml of methanol, is stirred for three hours. Subsequent steps are carried out according to the same method as used in Example 242, steps (f) and (g). In this way, the title compound is synthesized.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,58-1,72 (м, 2H), 1,84-1,94 (м, 1H), 1,96-2,04 (м, 1H), 3,08-3,20 (м, 2H), 3,36-3,70 (м, 3H), 3,90 (с, 3H), 4,90-5,02 (м, 2H), 5,32 (с, 2H), 7,20 (д, J=8 Гц, 1H), 7,47 (т, J=8 Гц, 1H), 7,63 (т, J=8 Гц, 1H), 7,87 (д, J=8 Гц, 1H), 8,12 (уш.с, 3H).δ 1.58-1.72 (m, 2H), 1.84-1.94 (m, 1H), 1.96-2.04 (m, 1H), 3.08-3.20 (m, 2H), 3.36-3.70 (m, 3H), 3.90 (s, 3H), 4.90-5.02 (m, 2H), 5.32 (s, 2H), 7.20 (d, J = 8 Hz, 1H), 7.47 (t, J = 8 Hz, 1H), 7.63 (t, J = 8 Hz, 1H), 7.87 (d, J = 8 Hz, 1H), 8.12 (br s, 3H).
Пример 244Example 244
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-2-карбонитрила8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -6-oxo-1- (2-phenylethyl) -6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
(a) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат(a) tert-Butyl- [1- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-phenylethyl) -6,7-dihydro-1H-purin-8-yl] piperidine -3-yl] carbamate
Соединение, указанное в заголовке, получают, используя 2-бромэтилбензол вместо 2-цианобензилбромида по способу, описанному в примере 242(e).The title compound was prepared using 2-bromoethylbenzene instead of 2-cyanobenzyl bromide according to the method described in Example 242 (e).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,44 (с, 9H), 1,58-1,80 (м, 2H), 1,83 (т, J=2 Гц, 3H), 1,86-1,94 (м, 2H), 3,00-3,06 (м, 2H), 3,20-3,50 (м, 3H), 3,60 (д, J=12 Гц, 1H), 3,85 (уш.с, 1H), 4,42-4,48 (м, 2H), 4,88-5,04 (м, 3H), 7,02-7,34 (м, 5H).δ 1.44 (s, 9H), 1.58-1.80 (m, 2H), 1.83 (t, J = 2 Hz, 3H), 1.86-1.94 (m, 2H), 3.00-3.06 (m, 2H), 3.20-3.50 (m, 3H), 3.60 (d, J = 12 Hz, 1H), 3.85 (br s, 1H) 4.42-4.48 (m, 2H); 4.88-5.04 (m, 3H); 7.02-7.34 (m, 5H).
(b) Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-2-карбонитрила(b) 8- (3-Aminopiperidin-1-yl) -7- (2-butynyl) -6-oxo-1- (2-phenylethyl) -6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Соединение, указанное в заголовке, синтезируют, используя трет-бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат по способу, описанному в примере 242 (f) и (g).The title compound was synthesized using tert-butyl- [1- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-phenylethyl) -6,7-dihydro-1H-purine -8-yl] piperidin-3-yl] carbamate according to the method described in example 242 (f) and (g).
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,60-1,72 (м, 2H), 1,83 (с, 3H), 1,88-2,06 (м, 3H), 3,04 (т, J=7 Гц, 2H), 3,35-3,60 (м, 2H), 3,75 (д, J=12 Гц, 1H), 4,35 (т, J=7 Гц, 2H), 5,09 (с, 2H), 7,18 (д, J=7 Гц, 2H), 7,22-7,34 (м, 3H), 8,16 (уш.с, 3H).δ 1.60-1.72 (m, 2H), 1.83 (s, 3H), 1.88-2.06 (m, 3H), 3.04 (t, J = 7 Hz, 2H), 3.35-3.60 (m, 2H), 3.75 (d, J = 12 Hz, 1H), 4.35 (t, J = 7 Hz, 2H), 5.09 (s, 2H), 7.18 (d, J = 7 Hz, 2H), 7.22-7.34 (m, 3H), 8.16 (br s, 3H).
Пример 245Example 245
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-1-(2-фенилэтил)-1,7-дигидропурин-6-она8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -2-methoxy-1- (2-phenylethyl) -1,7-dihydropurin-6-one hydrochloride
Соединение, указанное в заголовке, синтезируют, используя трет-бутил-[1-[7-(2-бутинил)-2-хлор-6-оксо-1-(2-фенилэтил)-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат по способу, описанному в примере 243.The title compound was synthesized using tert-butyl- [1- [7- (2-butynyl) -2-chloro-6-oxo-1- (2-phenylethyl) -6,7-dihydro-1H-purine -8-yl] piperidin-3-yl] carbamate according to the method described in example 243.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,56-1,72 (м, 2H), 1,80 (т, J=2 Гц, 3H), 1,84-2,04 (м, 2H), 2,85 (т, J=7 Гц, 2H), 3,08-3,18 (м, 2H), 3,34-3,54 (м, 2H), 3,64 (д, J=12 Гц, 1H), 3,83 (с, 3H), 4,15 (т, J=7 Гц, 2H), 4,88-5,02 (м, 2H), 7,16-7,24 (м, 3H), 7,29 (т, J=7 Гц, 2H), 8,09 (уш.с, 3H).δ 1.56-1.72 (m, 2H), 1.80 (t, J = 2 Hz, 3H), 1.84-2.04 (m, 2H), 2.85 (t, J = 7 Hz, 2H), 3.08-3.18 (m, 2H), 3.34-3.54 (m, 2H), 3.64 (d, J = 12 Hz, 1H), 3.83 (s , 3H), 4.15 (t, J = 7 Hz, 2H), 4.88-5.02 (m, 2H), 7.16-7.24 (m, 3H), 7.29 (t, J = 7 Hz, 2H), 8.09 (br s, 3H).
Пример 246Example 246
Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
(a) трет-Бутил-[1-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат(a) tert-Butyl- [1- [7- (2-butynyl) -2-chloro-1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purin-8-yl] piperidine -3-yl] carbamate
Соединение, указанное в заголовке, получают, используя 4-цианобензилбромид вместо 2-цианобензилбромида по способу, описанному в примере 242(e).The title compound was prepared using 4-cyanobenzyl bromide instead of 2-cyanobenzyl bromide according to the method described in Example 242 (e).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,44 (с, 9H), 1,58-1,80 (м, 2H), 1,82 (т, J=2 Гц, 3H), 1,85-1,95 (м, 2H), 3,18-3,26 (м, 1H), 3,29-3,37 (м, 1H), 3,40-3,48 (м, 1H), 3,65 (д, J=12 Гц, 1H), 3,86 (уш.с, 1H), 4,86-5,04 (м, 3H), 5,22 (с, 2H), 7,41 (д, J=8 Гц, 2H), 7,62 (д, J=8 Гц, 2H).δ 1.44 (s, 9H), 1.58-1.80 (m, 2H), 1.82 (t, J = 2 Hz, 3H), 1.85-1.95 (m, 2H), 3.18-3.26 (m, 1H), 3.29-3.37 (m, 1H), 3.40-3.48 (m, 1H), 3.65 (d, J = 12 Hz, 1H), 3.86 (br.s, 1H), 4.86-5.04 (m, 3H), 5.22 (s, 2H), 7.41 (d, J = 8 Hz, 2H), 7.62 (d, J = 8 Hz, 2H).
(b) Гидрохлорид 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила(b) 8- (3-Aminopiperidin-1-yl) -7- (2-butynyl) -1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Соединение, указанное в заголовке, синтезируют, используя трет-бутил-[1-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат, по способу, описанному в примере 242 (f) и (g).The title compound was synthesized using tert-butyl- [1- [7- (2-butynyl) -2-chloro-1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purine -8-yl] piperidin-3-yl] carbamate, according to the method described in example 242 (f) and (g).
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,62-1,72 (м, 2H), 1,80 (с, 3H), 1,88-1,96 (м, 1H), 1,98-2,06 (м, 1H), 3,16-3,26 (м, 2H), 3,41 (уш.с, 1H), 3,50-3,80 (м, 2H), 5,07 (с, 2H), 5,49 (с, 2H), 7,49 (д, J=8 Гц, 2H), 7,85 (д, J=8 Гц, 2H), 8,16 (уш.с, 3H).δ 1.62-1.72 (m, 2H), 1.80 (s, 3H), 1.88-1.96 (m, 1H), 1.98-2.06 (m, 1H), 3 , 16-3.26 (m, 2H), 3.41 (br s, 1H), 3.50-3.80 (m, 2H), 5.07 (s, 2H), 5.49 (s , 2H), 7.49 (d, J = 8 Hz, 2H), 7.85 (d, J = 8 Hz, 2H), 8.16 (br s, 3H).
Пример 247Example 247
Гидрохлорид 4-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-6-оксо-6,7-дигидропурин-1-илметил]бензонитрила4- [8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -2-methoxy-6-oxo-6,7-dihydropurin-1-ylmethyl] benzonitrile hydrochloride
Соединение, указанное в заголовке, синтезируют, используя трет-бутил [1-[7-(2-бутинил)-2-хлор-1-(4-цианобензил)-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат по способу, описанному в примере 243.The title compound was synthesized using tert-butyl [1- [7- (2-butynyl) -2-chloro-1- (4-cyanobenzyl) -6-oxo-6,7-dihydro-1H-purine- 8-yl] piperidin-3-yl] carbamate according to the method described in example 243.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,58-1,70 (м, 2H), 1,79 (с, 3H), 1,84-2,04 (м, 2H), 3,08-3,20 (м, 2H), 3,36-3,70 (м, 3H), 3,89 (с, 3H), 4,88-5,02 (м, 2H), 5,22 (с, 2H), 7,39 (д, J=8 Гц, 2H), 7,79 (д, J=8 Гц, 2H), 8,14 (уш.с, 3H).δ 1.58-1.70 (m, 2H), 1.79 (s, 3H), 1.84-2.04 (m, 2H), 3.08-3.20 (m, 2H), 3 , 36-3.70 (m, 3H), 3.89 (s, 3H), 4.88-5.02 (m, 2H), 5.22 (s, 2H), 7.39 (d, J = 8 Hz, 2H), 7.79 (d, J = 8 Hz, 2H), 8.14 (br s, 3H).
Пример 248Example 248
Соль 2-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамид трифторуксусной кислотыThe salt of 2- [8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -1-methyl-6-oxo-6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetic acid
(a) трет-Бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамат(a) tert-Butyl [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] carbamate
Растворяют 700 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 7,0 мл диметилсульфоксида и затем к раствору добавляют 114 мкл метилйодида и 299 мг карбоната калия. Смесь перемешивают при комнатной температуре в течение 30 минут и к реакционному раствору добавляют 40 мл воды. Смесь перемешивают при комнатной температуре в течение 30 минут и образовавшийся белый осадок собирают путем фильтрации. Образовавшееся белое твердое вещество промывают водой и затем гексаном, получая 540 мг соединения, указанного в заголовке.700 mg of tert-butyl [1- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] carbamate is dissolved in 7, 0 ml of dimethyl sulfoxide and then 114 μl of methyl iodide and 299 mg of potassium carbonate are added to the solution. The mixture was stirred at room temperature for 30 minutes and 40 ml of water was added to the reaction solution. The mixture was stirred at room temperature for 30 minutes and the resulting white precipitate was collected by filtration. The resulting white solid was washed with water and then with hexane, to give 540 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,44 (с, 9H), 1,72-1,94 (м, 4H), 1,81 (т, J=2,4 Гц, 3H), 3,16-3,92 (м, 5H), 3,72 (с, 3H), 4,91 (дд, J=17,6, 2,4 Гц, 1H), 5,01 (д, J=17,6 Гц, 1H).δ 1.44 (s, 9H), 1.72-1.94 (m, 4H), 1.81 (t, J = 2.4 Hz, 3H), 3.16-3.92 (m, 5H) ), 3.72 (s, 3H), 4.91 (dd, J = 17.6, 2.4 Hz, 1H), 5.01 (d, J = 17.6 Hz, 1H).
(b) Трифторацетат 2-[8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамида(b) 2- [8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -1-methyl-6-oxo-6,7-dihydro-1H-purin-2-yloxy] benzamide trifluoroacetate
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к этому раствору 10 мг салициламида и 10 мг карбоната калия. Смесь перемешивают при 100ºC в течение 2 часов. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 5,54 мг соединения, указанного в заголовке.10 mg of tert-butyl [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] is dissolved carbamate in 0.3 ml of 1-methyl-2-pyrrolidone and then 10 mg of salicylamide and 10 mg of potassium carbonate are added to this solution. The mixture was stirred at 100ºC for 2 hours. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 5.54 mg of the title compound.
МС m/e (ESI) 436 (MH+-CF3COOH).MS m / e (ESI) 436 (MH + -CF 3 COOH).
Пример 249Example 249
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -1-methyl-6-oxo-6,7-dihydro-1H-purine-2-carbonitrile trifluoroacetate
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем к раствору добавляют 10 мг цианида натрия. Смесь перемешивают при 60ºC в течение 2 часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 3,67 мг соединения, указанного в заголовке.10 mg of tert-butyl [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] is dissolved carbamate in 0.3 ml of 1-methyl-2-pyrrolidone and then 10 mg of sodium cyanide are added to the solution. The mixture was stirred at 60 ° C for 2 hours. Add to the reaction solution 1 N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 3.67 mg of the title compound.
МС m/e (ESI) 326 (MH+-CF3COOH).MS m / e (ESI) 326 (MH + -CF 3 COOH).
Пример 250Example 250
Трифторацетат 8-(3-аминопиперидин-1-ил)-2-трет-бутилсульфанил-7-(2-бутинил)-1-метил-1,7-дигидропурин-6-она8- (3-aminopiperidin-1-yl) -2-tert-butylsulfanyl-7- (2-butynyl) -1-methyl-1,7-dihydropurin-6-one trifluoroacetate
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем к раствору добавляют 10 мг натриевой соли 2-метил-2-пропантиола. Смесь перемешивают при комнатной температуре в течение 2 часов. Добавляют к реакционному раствору 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 5,00 мг соединения, указанного в заголовке.10 mg of tert-butyl [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] is dissolved carbamate in 0.3 ml of 1-methyl-2-pyrrolidone and then 10 mg of 2-methyl-2-propanethiol sodium salt is added to the solution. The mixture was stirred at room temperature for 2 hours. Add to the reaction solution 1 N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 5.00 mg of the title compound.
МС m/e (ESI) 389 (MH+-CF3COOH).MS m / e (ESI) 389 (MH + -CF 3 COOH).
Пример 251Example 251
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-метокси-1-метил-1,7-дигидропурин-6-она8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -2-methoxy-1-methyl-1,7-dihydropurin-6-one trifluoroacetate
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,6 мл метанола и затем добавляют к раствору 8 мг гидрида натрия. Смесь перемешивают при комнатной температуре в течение 1 часа. К реакционному раствору добавляют 1 н. соляную кислоту и смесь экстрагируют этилацетатом. Органический слой концентрируют и остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,14 мг соединения, указанного в заголовке.10 mg of tert-butyl [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] is dissolved carbamate in 0.6 ml of methanol and then 8 mg of sodium hydride are added to the solution. The mixture was stirred at room temperature for 1 hour. To the reaction solution was added 1N. hydrochloric acid and the mixture is extracted with ethyl acetate. The organic layer was concentrated and the residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 2.14 mg of the title compound.
МС m/e (ESI) 331 (MH+-CF3COOH).MS m / e (ESI) 331 (MH + -CF 3 COOH).
Пример 252Example 252
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-2-диэтиламино-1-метил-1,7-дигидропурин-6-она8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -2-diethylamino-1-methyl-1,7-dihydropurin-6-one trifluoroacetate
Растворяют 10 мг трет-бутил [1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]карбамата в 0,3 мл 1-метил-2-пирролидона и затем добавляют к раствору 50 мкл диэтиламина. Смесь перемешивают при 60ºC в течение 4 часов. Добавляют 1 н. соляную кислоту к реакционному раствору и смесь экстрагируют этилацетатом. Органический слой концентрируют и образовавшийся остаток растворяют в трифторуксусной кислоте. Раствор концентрируют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 2,17 мг соединения, указанного в заголовке.10 mg of tert-butyl [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] is dissolved carbamate in 0.3 ml of 1-methyl-2-pyrrolidone and then 50 μl of diethylamine are added to the solution. The mixture was stirred at 60 ° C for 4 hours. Add 1 N. hydrochloric acid to the reaction solution and the mixture was extracted with ethyl acetate. The organic layer was concentrated and the resulting residue was dissolved in trifluoroacetic acid. The solution was concentrated and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 2.17 mg of the title compound.
МС m/e (ESI) 372 (MH+-CF3COOH).MS m / e (ESI) 372 (MH + -CF 3 COOH).
Пример 253Example 253
Трифторацетат 8-(3-аминопиперидин-1-ил)-7-(2-бутинил)-1-метил-2-(пирролидин-1-ил)-1,7-дигидропурин-6-она8- (3-aminopiperidin-1-yl) -7- (2-butynyl) -1-methyl-2- (pyrrolidin-1-yl) -1,7-dihydropurin-6-one trifluoroacetate
Используя пирролидин, вместо диэтиламина, получают 1,94 мг соединения, указанного в заголовке, по способу, описанному в примере 252.Using pyrrolidine, instead of diethylamine, 1.94 mg of the title compound are obtained according to the method described in Example 252.
МС m/e (ESI) 370 (MH+-CF3COOH).MS m / e (ESI) 370 (MH + -CF 3 COOH).
Пример 254Example 254
Гидрохлорид 8-(3-метиламинопиперидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила8- (3-Methylaminopiperidin-1-yl) -7- (2-butynyl) -1-methyl-6-oxo-6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
(a) трет-Бутил-N-метил-N-(пиперидин-3-ил)карбамат(a) tert-Butyl-N-methyl-N- (piperidin-3-yl) carbamate
Добавляют 0,4 г гидрида натрия (60%; суспензия в масле) к смеси, состоящей из 3,3 г 3-трет-бутоксикарбониламинопиперидин-1-карбоксилата, 0,75 мл метилйодида и 20 мл N,N-диметилформамида, в водяную баню при комнатной температуре. Смесь перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния и затем концентрируют. Остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - от 10 до 20% этилацетата в гексане, для того чтобы получить маслянистый материал (3,04 г). Все количество материала объединяют с 20 мл этанола и катализатором - 10% палладия на угле. Эту смесь перемешивают при комнатной температуре в атмосфере водорода в течение пяти часов. После удаления катализатора путем фильтрации фильтрат концентрируют, получая 1,82 г соединения, указанного в заголовке.0.4 g of sodium hydride (60%; suspension in oil) is added to a mixture consisting of 3.3 g of 3-tert-butoxycarbonylaminopiperidine-1-carboxylate, 0.75 ml of methyl iodide and 20 ml of N, N-dimethylformamide, in water bath at room temperature. The mixture was stirred at room temperature for 4 hours. The reaction solution was partitioned between ethyl acetate and water, and the organic layer was washed with water and then with brine. The organic layer was dried over anhydrous magnesium sulfate and then concentrated. The residue was purified by silica gel column chromatography using a solvent of 10 to 20% ethyl acetate in hexane to give an oily material (3.04 g). The entire amount of material is combined with 20 ml of ethanol and a catalyst - 10% palladium on charcoal. This mixture was stirred at room temperature under a hydrogen atmosphere for five hours. After removal of the catalyst by filtration, the filtrate was concentrated to obtain 1.82 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,46 (с, 9H), 1,48-1,64 (м, 2H), 1,72-1,84 (м, 2H), 2,43 (дт, J=3 Гц, 12 Гц, 1H), 2,60 (т, J=12 Гц, 1H), 2,75 (с, 3H), 2,74-3,02 (м, 2H), 3,86 (уш.с, 1H).δ 1.46 (s, 9H), 1.48-1.64 (m, 2H), 1.72-1.84 (m, 2H), 2.43 (dt, J = 3 Hz, 12 Hz, 1H), 2.60 (t, J = 12 Hz, 1H), 2.75 (s, 3H), 2.74-3.02 (m, 2H), 3.86 (br s, 1H).
(b) трет-Бутил-N-[1-[7-(2-бутинил)-2,6-дихлоро-7H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамат(b) tert-Butyl-N- [1- [7- (2-butynyl) -2,6-dichloro-7H-purin-8-yl] piperidin-3-yl] -N-methylcarbamate
Соединение, указанное в заголовке, синтезируют, используя 7-(2-бутинил)-2,6,8-трихлор-7H-пурин и трет-бутилпиперидин-3-илкарбамата по способу, описанному в примере 242 (c).The title compound was synthesized using 7- (2-butynyl) -2,6,8-trichloro-7H-purine and tert-butylpiperidin-3-ylcarbamate according to the method described in example 242 (c).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,70-2,02 (м, 7H), 2,83 (с, 3H), 3,00 (т, J=12 Гц, 1H), 3,14 (т, J=12 Гц, 1H), 3,96-4,25 (м, 3H), 4,80 (с, 2H).δ 1.48 (s, 9H), 1.70-2.02 (m, 7H), 2.83 (s, 3H), 3.00 (t, J = 12 Hz, 1H), 3.14 ( t, J = 12 Hz, 1H), 3.96-4.25 (m, 3H), 4.80 (s, 2H).
(c) трет-Бутил-N-[1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамат(c) tert-Butyl-N- [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3 -yl] -N-methylcarbamate
Смесь, состоящую из 580 мг трет-бутил-N-[1-[7-(2-бутинил)-2,6-дихлоро-7H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата, 315 мг ацетата натрия и 6 мл диметилсульфоксида, перемешивают в масляной бане при 120ºC в течение 7 часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Органический слой сушат над безводным сульфатом магния, фильтруют через небольшой слой силикагеля. Фильтрат концентрируют, остаток кристаллизуется из смеси этилацетат-гексан и получают 420 мг трет-бутил-N-[1-[7-(2-бутинил)-2-хлор-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата. Смесь, состоящую из аликвоты (100 мг) полученного выше соединения, 0,17 мл метилйодида, 48 мг безводного карбоната калия и 0,5 мл N,N-диметилформамида, перемешивают при комнатной температуре в течение 4 часов. Реакционный раствор распределяют между этилацетатом и водой и органический слой промывают водой и затем насыщенным раствором соли. Затем органический слой концентрируют и остаток подвергают очистке путем колоночной хроматографии на силикагеле, используя растворитель - 50% этилацетата в гексане, для того чтобы получить 104 мг соединения, указанного в заголовке.Mixture of 580 mg of tert-butyl-N- [1- [7- (2-butynyl) -2,6-dichloro-7H-purin-8-yl] piperidin-3-yl] -N-methylcarbamate, 315 mg of sodium acetate and 6 ml of dimethyl sulfoxide, stirred in an oil bath at 120ºC for 7 hours. The reaction solution was partitioned between ethyl acetate and water, and the organic layer was washed with water and then with brine. The organic layer is dried over anhydrous magnesium sulfate, filtered through a small layer of silica gel. The filtrate was concentrated, the residue was crystallized from ethyl acetate-hexane to give 420 mg of tert-butyl-N- [1- [7- (2-butynyl) -2-chloro-6-oxo-6,7-dihydro-1H-purine- 8-yl] piperidin-3-yl] -N-methylcarbamate. A mixture consisting of an aliquot (100 mg) of the above compound, 0.17 ml of methyl iodide, 48 mg of anhydrous potassium carbonate and 0.5 ml of N, N-dimethylformamide was stirred at room temperature for 4 hours. The reaction solution was partitioned between ethyl acetate and water, and the organic layer was washed with water and then with brine. The organic layer was then concentrated and the residue was purified by silica gel column chromatography using a solvent of 50% ethyl acetate in hexane to obtain 104 mg of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,47 (с, 9H), 1,62-1,74 (м, 1H), 1,81 (т, J=2 Гц, 3H), 1,82-1,96 (м, 3H), 2,82 (с, 3H), 2,86 (т, J=12 Гц, 1H), 3,02 (т, J=12 Гц, 1H), 3,68-3,82 (м, 2H), 3,72 (с, 3H), 4,20 (уш.с, 1H), 4,90 (с, 2H).δ 1.47 (s, 9H), 1.62-1.74 (m, 1H), 1.81 (t, J = 2 Hz, 3H), 1.82-1.96 (m, 3H), 2.82 (s, 3H), 2.86 (t, J = 12 Hz, 1H), 3.02 (t, J = 12 Hz, 1H), 3.68-3.82 (m, 2H), 3.72 (s, 3H); 4.20 (br s, 1H); 4.90 (s, 2H).
(d) Гидрохлорид 7-(2-бутинил)-1-метил-8-(3-метиламинопиперидин-1-ил)-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила(d) 7- (2-Butynyl) -1-methyl-8- (3-methylaminopiperidin-1-yl) -6-oxo-6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Используя трет-бутил-N-[1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата, синтезируют соединение, указанное в заголовке, по способу, описанному в примере 242 (f) и (g).Using tert-butyl-N- [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl ] -N-methylcarbamate, the title compound is synthesized according to the method described in example 242 (f) and (g).
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,60-1,77 (м, 2H), 1,81 (с, 3H), 1,84-2,00 (м, 1H), 2,02-2,12 (м, 1H), 2,60 (т, J=5 Гц, 3H), 3,17-3,40 (м, 3H), 3,46-3,56 (м, 1H), 3,79 (д, J=12 Гц, 1H), 5,00-5,15 (м, 2H), 9,01 (уш.с, 2H).δ 1.60-1.77 (m, 2H), 1.81 (s, 3H), 1.84-2.00 (m, 1H), 2.02-2.12 (m, 1H), 2 60 (t, J = 5 Hz, 3H), 3.17-3.40 (m, 3H), 3.46-3.56 (m, 1H), 3.79 (d, J = 12 Hz, 1H), 5.00-5.15 (m, 2H), 9.01 (br s, 2H).
Пример 255Example 255
Гидрохлорид 2-[7-(2-бутинил)-1-метил-8-(3-метиламинопиперидин-1-ил)-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамида2- [7- (2-Butynyl) -1-methyl-8- (3-methylaminopiperidin-1-yl) -6-oxo-6,7-dihydro-1H-purin-2-yloxy] benzamide hydrochloride
Смесь, состоящую из 20 мг трет-бутил-N-[1-[7-(2-бутинил)-2-хлор-1-метил-6-оксо-6,7-дигидро-1H-пурин-8-ил]пиперидин-3-ил]-N-метилкарбамата, 20 мг 2-гидроксибензамида, 20 мг безводного карбоната калия и 0,3 мл N-метил-2-пирролидона, перемешивают в масляной бане при 80ºC в течение 4 часов. Последующие стадии синтеза были проведены в соответствии с тем же самым способом, который использовался в примере 242 (f) и (g), для того чтобы получить соединение, указанное в заголовке.A mixture consisting of 20 mg of tert-butyl-N- [1- [7- (2-butynyl) -2-chloro-1-methyl-6-oxo-6,7-dihydro-1H-purin-8-yl] piperidin-3-yl] -N-methylcarbamate, 20 mg of 2-hydroxybenzamide, 20 mg of anhydrous potassium carbonate and 0.3 ml of N-methyl-2-pyrrolidone, stirred in an oil bath at 80 ° C for 4 hours. The subsequent synthesis steps were carried out in accordance with the same method as that used in Example 242 (f) and (g) in order to obtain the title compound.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,69 (уш.с, 2H), 1,82 (с, 3H), 1,92 (уш.с, 1H), 2,07 (уш.с, 1H), 2,62 (с, 3H), 3,10-3,40 (м, 4H), 3,48 (с, 3H), 3,76 (уш.с, 1H), 5,02 (уш.с, 2H), 6,96 (уш.с, 2H), 7,44 (уш.с, 1H), 7,91 (уш.с, 1H), 8,81 (уш.с, 2H).δ 1.69 (br s, 2H), 1.82 (s, 3H), 1.92 (br, 1H), 2.07 (br, 1H), 2.62 (s, 3H) ), 3.10-3.40 (m, 4H), 3.48 (s, 3H), 3.76 (br s, 1H), 5.02 (br s, 2H), 6.96 ( broad s, 2H), 7.44 (broad s, 1H), 7.91 (broad s, 1H), 8.81 (broad s, 2H).
Пример 256Example 256
Гидрохлорид 8-(3-аминопирролидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-карбонитрила8- (3-aminopyrrolidin-1-yl) -7- (2-butynyl) -1-methyl-6-oxo-6,7-dihydro-1H-purine-2-carbonitrile hydrochloride
Соединение, указанное в заголовке, синтезируют, используя трет-бутилпирролидин-3-илкарбамат, вместо трет-бутил-N-метил-N-(пиперидин-3-ил)карбамата в примере 254, по способу, описанному в примере 254 стадии (b), (c) и (d).The title compound was synthesized using tert-butylpyrrolidin-3-ylcarbamate instead of tert-butyl-N-methyl-N- (piperidin-3-yl) carbamate in Example 254, according to the method described in Example 254 of Step (b) ), (c) and (d).
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,81 (с, 3H), 2,13 (уш.с, 1H), 2,32 (уш.с, 1H), 3,64 (с, 3H), 3,74-3,86 (м, 2H), 3,93 (уш.с, 3H), 5,19 (д, J=18 Гц, 1H), 5,28 (д, J=18 Гц, 1H), 8,32 (уш.с, 3H).δ 1.81 (s, 3H), 2.13 (br s, 1H), 2.32 (br s, 1H), 3.64 (s, 3H), 3.74-3.86 (m , 2H), 3.93 (br s, 3H), 5.19 (d, J = 18 Hz, 1H), 5.28 (d, J = 18 Hz, 1H), 8.32 (br s , 3H).
Пример 257Example 257
Гидрохлорид 2-[8-(3-аминопирролидин-1-ил)-7-(2-бутинил)-1-метил-6-оксо-6,7-дигидро-1H-пурин-2-илокси]бензамида2- [8- (3-aminopyrrolidin-1-yl) -7- (2-butynyl) -1-methyl-6-oxo-6,7-dihydro-1H-purin-2-yloxy] benzamide hydrochloride
Соединение, указанное в заголовке, синтезируют, используя 2-гидроксибензамид по способу, описанному в примерах 255 и 256.The title compound was synthesized using 2-hydroxybenzamide according to the method described in examples 255 and 256.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,82 (с, 3H), 2,11 (уш.с, 1H), 2,32 (уш.с, 1H), 3,46 (с, 3H), 3,72-4,00 (м, 5H), 5,15 (д, J=19 Гц, 1H), 5,23 (д, J=19 Гц, 1H), 6,90-7,02 (м, 2H), 7,42-7,50 (м, 1H), 7,90-7,99 (м, 1H), 8,22 (уш.с, 3H).δ 1.82 (s, 3H), 2.11 (br s, 1H), 2.32 (br s, 1H), 3.46 (s, 3H), 3.72-4.00 (m , 5H), 5.15 (d, J = 19 Hz, 1H), 5.23 (d, J = 19 Hz, 1H), 6.90-7.02 (m, 2H), 7.42-7 50 (m, 1H); 7.90-7.99 (m, 1H); 8.22 (br s, 3H).
Пример 258Example 258
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -5- (2-propynyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) трет-Бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate
Добавляют 0,299 г триэтиламина, 0,023 г 4-диметиламинопиридина и 0,645 г ди-трет-бутилдикарбоната к раствору 0,448 г трифторацетата 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она в 20 мл N,N-диметилформамида при комнатной температуре и смесь перемешивают в течение пяти часов. Затем добавляют к этому раствору 2 мл 5 н. водного раствора гидроксида натрия и смесь перемешивают в течение 1 часа. Реакционный раствор выливают в смесь 200 мл этилацетата и 100 мл насыщенного водного раствора хлорида аммония. Органический слой промывают два раза водой (100 мл) и затем насыщенным раствором хлорида натрия (100 мл). Органическую жидкость сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают 0,298 г соединения, указанного в заголовке, из фракции, элюированной этилацетатом.0.299 g of triethylamine, 0.023 g of 4-dimethylaminopyridine and 0.645 g of di-tert-butyl dicarbonate are added to a solution of 0.448 g of 3- (2-butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo trifluoroacetate [4,5 -d] pyridazin-4-one in 20 ml of N, N-dimethylformamide at room temperature and the mixture was stirred for five hours. Then add to this solution 2 ml of 5 N. aqueous sodium hydroxide solution and the mixture is stirred for 1 hour. The reaction solution was poured into a mixture of 200 ml of ethyl acetate and 100 ml of a saturated aqueous solution of ammonium chloride. The organic layer was washed twice with water (100 ml) and then with a saturated solution of sodium chloride (100 ml). The organic liquid was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.298 g of the title compound was obtained from the fraction eluted with ethyl acetate.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 3,41 (м, 4H), 3,63 (м, 4H), 5,06 (кв, J=2,3 Гц, 2H), 8,17 (с, 1H), 9,92 (уш.с, 1H).δ 1.50 (s, 9H), 1.84 (t, J = 2.3 Hz, 3H), 3.41 (m, 4H), 3.63 (m, 4H), 5.06 (q, J = 2.3 Hz, 2H), 8.17 (s, 1H), 9.92 (br s, 1H).
(b) Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она ( b) 3- (2-Butynyl) -2- (piperazin-1-yl) -5- (2-propynyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Добавляют 0,005 г карбоната калия и 0,003 мл 3-бром-1-пропина к раствору 0,010 г трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 0,5 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 10 часов. Добавляют к реакционному раствору 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и образовавшийся остаток растворяют в смеси, состоящей из 0,5 мл дихлорметана и 0,5 мл трифторуксусной кислоты. Смесь перемешивают в течение 1 часа и затем концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,011 г соединения, указанного в заголовке.0.005 g of potassium carbonate and 0.003 ml of 3-bromo-1-propine are added to a solution of 0.010 g of tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4, 5-d] pyridazin-2-yl] piperazin-1-carboxylate in 0.5 ml of N, N-dimethylformamide and the mixture was stirred at room temperature for 10 hours. 1 ml of ethyl acetate and 1 ml of water are added to the reaction solution, and the layers are separated. The organic layer was concentrated and the resulting residue was dissolved in a mixture of 0.5 ml of dichloromethane and 0.5 ml of trifluoroacetic acid. The mixture was stirred for 1 hour and then concentrated. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.011 g of the title compound.
МС m/e (ESI) 311,29 (MH+-CF3COOH).MS m / e (ESI) 311.29 (MH + -CF 3 COOH).
Пример 259Example 259
Трифторацетат [3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетонитрила[3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-yl] acetonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромацетонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and bromoacetonitrile according to the method described in example 258 (b).
МС m/e (ESI) 312,28 (MH+-CF3COOH).MS m / e (ESI) 312.28 (MH + -CF 3 COOH).
Пример 260Example 260
Трифторацетат 3-(2-бутинил)-5-(2-гидроксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-hydroxyethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтанола по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromoethanol according to the method described in example 258 (b).
МС m/e (ESI) 317,30 (MH+-CF3COOH).MS m / e (ESI) 317.30 (MH + -CF 3 COOH).
Пример 261Example 261
Трифторацетат 3-(2-бутинил)-5-(2-метоксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-methoxyethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромэтилметилового эфира по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and bromoethyl methyl ether according to the method described in example 258 (b).
МС m/e (ESI) 331,32 (MH+-CF3COOH).MS m / e (ESI) 331.32 (MH + -CF 3 COOH).
Пример 262Example 262
Трифторацетат этил [3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетатаEthyl [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-yl] acetate trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этилбромацетата по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and ethyl bromoacetate according to the method described in example 258 (b).
МС m/e (ESI) 359,13 (MH+-CF3COOH).MS m / e (ESI) 359.13 (MH + -CF 3 COOH).
Пример 263Example 263
Трифторацетат 3-(2-бутинил)-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-phenylethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и (2-бромэтил)бензола по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and (2-bromoethyl) benzene according to the method described in example 258 (b).
МС m/e (ESI) 377,34 (MH+-CF3COOH).MS m / e (ESI) 377.34 (MH + -CF 3 COOH).
Пример 264Example 264
Трифторацетат 3-(2-бутинил)-5-(2-феноксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-phenoxyethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтилфенилового эфира по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromoethylphenyl ether according to the method described in example 258 (b).
МС m/e (ESI) 393,32 (MH+-CF3COOH).MS m / e (ESI) 393.32 (MH + -CF 3 COOH).
Пример 265Example 265
Трифторацетат 3-(2-бутинил)-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-oxo-2-phenylethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromoacetophenone according to the method described in example 258 (b).
МС m/e (ESI) 391,32 (MH+-CF3COOH).MS m / e (ESI) 391.32 (MH + -CF 3 COOH).
Пример 266Example 266
Трифторацетат 3-(2-бутинил)-5-[2-(3-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- [2- (3-methoxyphenyl) -2-oxoethyl] -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4 trifluoroacetate -she
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-3'-метоксиацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromo-3'-methoxyacetophenone according to the method described in example 258 (b).
МС m/e (ESI) 421,33 (MH+-CF3COOH).MS m / e (ESI) 421.33 (MH + -CF 3 COOH).
Пример 267Example 267
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила2- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromomethylbenzonitrile according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,81 (т, J=2,5 Гц, 3H), 3,45-3,49 (м, 4H), 3,66-3,70 (м, 4H), 5,15 (кв, J=2,5 Гц, 2H), 5,62 (с, 2H), 7,34 (дд, J=7,6, 1,5 Гц, 1H), 7,45 (тд, J=7,6, 1,5 Гц, 1H), 7,59 (тд, J=7,6, 1,7 Гц, 1H), 7,75 (дд, J=7,6, 1,7 Гц, 1H), 8,25 (с, 1H).δ 1.81 (t, J = 2.5 Hz, 3H), 3.45-3.49 (m, 4H), 3.66-3.70 (m, 4H), 5.15 (q, J = 2.5 Hz, 2H), 5.62 (s, 2H), 7.34 (dd, J = 7.6, 1.5 Hz, 1H), 7.45 (td, J = 7.6, 1.5 Hz, 1H), 7.59 (td, J = 7.6, 1.7 Hz, 1H), 7.75 (dd, J = 7.6, 1.7 Hz, 1H), 8, 25 (s, 1H).
Масс-спектр m/e (ESI) 388,32 (MH+-CF3COOH).Mass spectrum m / e (ESI) 388.32 (MH + —CF 3 COOH).
Пример 268Example 268
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(2-трифторметилбензил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -5- (2-trifluoromethylbenzyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-(трифторметил)бензилбромида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2- (trifluoromethyl) benzyl bromide according to the method described in example 258 (b).
МС m/e (ESI) 431,21 (MH+-CF3COOH).MS m / e (ESI) 431.21 (MH + -CF 3 COOH).
Пример 269Example 269
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(3-трифторметилбензил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -5- (3-trifluoromethylbenzyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-(трифторметил)бензилбромида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 3- (trifluoromethyl) benzyl bromide according to the method described in example 258 (b).
МС m/e (ESI) 431,23 (MH+-CF3COOH).MS m / e (ESI) 431.23 (MH + -CF 3 COOH).
Пример 270Example 270
Трифторацетат 3-(2-бутинил)-5-(2-нитробензил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-nitrobenzyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-нитробензилбромида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-nitrobenzyl bromide according to the method described in example 258 (b).
МС m/e (ESI) 408,25 (MH+-CF3COOH).MS m / e (ESI) 408.25 (MH + -CF 3 COOH).
Пример 271Example 271
Трифторацетат 3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила3- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-бромметилбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 3-bromomethylbenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 388,27 (MH+-CF3COOH).MS m / e (ESI) 388.27 (MH + -CF 3 COOH).
Пример 272Example 272
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметилбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4-bromomethylbenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 388,29 (MH+-CF3COOH).MS m / e (ESI) 388.29 (MH + -CF 3 COOH).
Пример 273Example 273
Трифторацетат метил-3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензоатаMethyl 3- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzoate trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-3-(бромметил)бензоата по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and methyl 3- (bromomethyl) benzoate according to the method described in example 258 (b).
МС m/e (ESI) 421,29 (MH+-CF3COOH).MS m / e (ESI) 421.29 (MH + -CF 3 COOH).
Пример 274Example 274
Трифторацетат метил-4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензоатаMethyl 4- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzo trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-4-(бромметил)бензоата по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and methyl 4- (bromomethyl) benzoate according to the method described in example 258 (b).
МС m/e (ESI) 421,31 (MH+-CF3COOH).MS m / e (ESI) 421.31 (MH + -CF 3 COOH).
Пример 275Example 275
Трифторацетат этил-5-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]фуран-2-карбоксилатаEthyl 5- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] furan-2- trifluoroacetate carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этил-5-(бромметил)фуран-2-карбоксилата по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and ethyl 5- (bromomethyl) furan-2-carboxylate according to the method described in example 258 (b).
МС m/e (ESI) 425,30 (MH+-CF3COOH).MS m / e (ESI) 425.30 (MH + -CF 3 COOH).
Пример 276Example 276
Трифторацетат 3-(2-бутинил)-5-[2-(2-нитрофенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- [2- (2-nitrophenyl) -2-oxoethyl] -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4 trifluoroacetate -she
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-2'-нитроацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromo-2'-nitroacetophenone according to the method described in example 258 (b).
MC m/e (ESI) 436,28 (MH+-CF3COOH).MS m / e (ESI) 436.28 (MH + -CF 3 COOH).
Пример 277Example 277
Трифторацетат 4-[2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетил]бензонитрила4- [2- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-yl] acetyl] benzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-4'-цианоацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromo-4'-cyanoacetophenone according to the method described in example 258 (b).
МС m/e (ESI) 416,31 (MH+-CF3COOH).MS m / e (ESI) 416.31 (MH + -CF 3 COOH).
Пример 278Example 278
Трифторацетат 3-(2-бутинил)-5-[2-(4-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- [2- (4-methoxyphenyl) -2-oxoethyl] -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4 trifluoroacetate -she
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-4'-метоксиацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromo-4'-methoxyacetophenone according to the method described in example 258 (b).
МС m/e (ESI) 421,32 (MH+-CF3COOH).MS m / e (ESI) 421.32 (MH + -CF 3 COOH).
Пример 279Example 279
Трифторацетат 3-(2-бутинил)-5-[2-(2-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- [2- (2-methoxyphenyl) -2-oxoethyl] -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4 trifluoroacetate -she
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-2'-метоксиацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromo-2'-methoxyacetophenone according to the method described in example 258 (b).
МС m/e (ESI) 421,33 (MH+-CF3COOH).MS m / e (ESI) 421.33 (MH + -CF 3 COOH).
Пример 280Example 280
Трифторацетат 4-[2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]этил]бензойной кислоты4- [2- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-yl] ethyl] benzo trifluoroacetate acid
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и трет-бутил-4-(2-бромэтил)бензоата по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and tert-butyl-4- (2-bromoethyl) benzoate according to the method described in example 258 (b).
МС m/e (ESI) 421,33 (MH+-CF3COOH).MS m / e (ESI) 421.33 (MH + -CF 3 COOH).
Пример 281Example 281
Бистрифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(пиридин-2-илметил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -5- (pyridin-2-ylmethyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one bistrifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 2-(хлорметил)пиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2- (chloromethyl) pyridine hydrochloride according to the method described in example 258 (b).
МС m/e (ESI) 364,24 (MH+-2CF3COOH).MS m / e (ESI) 364.24 (MH + -2CF 3 COOH).
Пример 282Example 282
Бистрифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(пиридин-3-илметил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -5- (pyridin-3-ylmethyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one bistrifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 3-(хлорметил)пиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 3- (chloromethyl) pyridine hydrochloride according to the method described in example 258 (b).
МС m/e (ESI) 364,30 (MH+-2CF3COOH).MS m / e (ESI) 364.30 (MH + -2CF 3 COOH).
Пример 283Example 283
Бистрифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-5-(пиридин-4-илметил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -5- (pyridin-4-ylmethyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one bistrifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 4-(хлорметил)пиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4- (chloromethyl) pyridine hydrochloride according to the method described in example 258 (b).
МС m/e (ESI) 364,26 (MH+-2CF3COOH).MS m / e (ESI) 364.26 (MH + -2CF 3 COOH).
Пример 284Example 284
Бистрифторацетат 3-(2-бутинил)-5-[2-оксо-2-(пиридин-2-ил)этил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- [2-oxo-2- (pyridin-2-yl) ethyl] -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] bistrifluoroacetate pyridazin-4-one
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидробромида 2-(2-бромацетил)пиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2- (2-bromoacetyl) pyridine hydrobromide according to the method described in example 258 (b).
МС m/e (ESI) 392,27 (MH+-2CF3COOH).MS m / e (ESI) 392.27 (MH + -2CF 3 COOH).
Пример 285Example 285
Бистрифторацетат 3-(2-бутинил)-5-[2-оксо-2-(пиридин-3-ил)этил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- [2-oxo-2- (pyridin-3-yl) ethyl] -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] bistrifluoroacetate pyridazin-4-one
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидробромида 3-(2-бромацетил)пиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 3- (2-bromoacetyl) pyridine hydrobromide according to the method described in example 258 (b).
МС m/e (ESI) 392,27 (MH+-2CF3COOH).MS m / e (ESI) 392.27 (MH + -2CF 3 COOH).
Пример 286Example 286
Бистрифторацетат 3-(2-бутинил)-5-[2-оксо-2-(пиридин-4-ил)этил]-2-оксоэтил]]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- [2-oxo-2- (pyridin-4-yl) ethyl] -2-oxoethyl]] 2- (piperazin-1-yl) -3,5-dihydroimidazo bistrifluoroacetate [ 4,5-d] pyridazin-4-one
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидробромида 4-(2-бромацетил)пиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4- (2-bromoacetyl) pyridine hydrobromide according to the method described in example 258 (b).
МС m/e (ESI) 392,28 (MH+-2CF3COOH).MS m / e (ESI) 392.28 (MH + -2CF 3 COOH).
Пример 287Example 287
Трифторацетат 3-(2-бутинил)-5-(2-метоксипиридин-3-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-methoxypyridin-3-ylmethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-(хлорметил)-2-метоксипиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 3- (chloromethyl) -2-methoxypyridine according to the method described in example 258 (b).
МС m/e (ESI) 394,30 (MH+-CF3COOH).MS m / e (ESI) 394.30 (MH + -CF 3 COOH).
Пример 288Example 288
Бистрифторацетат метил-6-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]никотинатаMethyl 6- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] nicotinate bistrifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-6-(хлорметил)никотината по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and methyl 6- (chloromethyl) nicotinate according to the method described in example 258 (b).
МС m/e (ESI) 422,31 (MH+-CF3COOH).MS m / e (ESI) 422.31 (MH + -CF 3 COOH).
Пример 289Example 289
Трифторацетат 5-(6-аминопиридин-3-илметил)-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она5- (6-aminopyridin-3-ylmethyl) -3- (2-butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-(трет-бутоксикарбониламино)-5-(бромметил)пиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2- (tert-butoxycarbonylamino) -5- (bromomethyl) pyridine according to the method described in example 258 (b).
МС m/e (ESI) 379,31 (MH+-CF3COOH).MS m / e (ESI) 379.31 (MH + -CF 3 COOH).
Пример 290Example 290
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-циано-5-этокси-N-метилбензамида4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -3-cyano-trifluoroacetate ethoxy-N-methylbenzamide
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3-циано-5-этокси-N-метилбензамида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4-bromomethyl-3-cyano-5-ethoxy-N-methylbenzamide according to the method described in example 258 (b).
МС m/e (ESI) 489,35 (MH+-CF3COOH).MS m / e (ESI) 489.35 (MH + -CF 3 COOH).
Пример 291Example 291
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3,5-дициано-N-метилбензамида4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -3,5-dicyano trifluoroacetate -N-methylbenzamide
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3,5-дициано-N-метилбензамида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4-bromomethyl-3,5-dicyano-N-methylbenzamide according to the method described in example 258 (b).
МС m/e (ESI) 470,33 (MH+-CF3COOH).MS m / e (ESI) 470.33 (MH + -CF 3 COOH).
Пример 292Example 292
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-циано-5-фтор-N-метилбензамида4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -3-cyano-trifluoroacetate fluoro-N-methylbenzamide
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3-циано-5-фтор-N-метилбензамида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4-bromomethyl-3-cyano-5-fluoro-N-methylbenzamide according to the method described in example 258 (b).
МС m/e (ESI) 463,33 (MH+-CF3COOH).MS m / e (ESI) 463.33 (MH + -CF 3 COOH).
Пример 293Example 293
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо-[4,5-d]пиридазин-5-илметил]-5-циано-2-этокси-N-метилбензамида4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -5-cyano- trifluoroacetate 2-ethoxy-N-methylbenzamide
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-5-циано-2-этокси-N-метилбензамида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4-bromomethyl-5-cyano-2-ethoxy-N-methylbenzamide according to the method described in example 258 (b).
МС m/e (ESI) 489,35 (MH+-CF3COOH).MS m / e (ESI) 489.35 (MH + -CF 3 COOH).
Пример 294Example 294
Трифторацетат 5-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-2-фторбензонитрила5- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -2-fluorobenzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 5-бромметил-2-фторбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 5-bromomethyl-2-fluorobenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 406,15 (MH+-CF3COOH).MS m / e (ESI) 406.15 (MH + -CF 3 COOH).
Пример 295Example 295
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-5-фторбензонитрила2- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -5-fluorobenzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметил-5-фторбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromomethyl-5-fluorobenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 406,16 (MH+-CF3COOH).MS m / e (ESI) 406.16 (MH + -CF 3 COOH).
Пример 296Example 296
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-фторбензонитрила4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -3-fluorobenzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметил-3-фторбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4-bromomethyl-3-fluorobenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 406,23 (MH+-CF3COOH).MS m / e (ESI) 406.23 (MH + -CF 3 COOH).
Пример 297Example 297
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]-3-фторбензонитрила2- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] -3-fluorobenzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметил-3-фторбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromomethyl-3-fluorobenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 406,25 (MH+-CF3COOH).MS m / e (ESI) 406.25 (MH + -CF 3 COOH).
Пример 298Example 298
Трифторацетат 3-(2-бутинил)-5-(изохинолин-1-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (isoquinolin-1-ylmethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 1-бромметилизохинолина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 1-bromomethylisoquinoline according to the method described in example 258 (b).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,80 (т, J=2,4 Гц, 3H), 3,46 (м, 4H), 3,68 (м, 4H), 5,17 (кв, J=2,4 Гц, 2H), 6,22 (с, 2H), 7,94 (дд, J=8,2, 8,0 Гц, 1H), 8,08 (т, J=8,2 Гц, 1H), 8,21 (д, J=8,0 Гц, 1H), 8,24 (д, J=6,4 Гц, 1Н), 8,27 (с, 1H), 8,46 (д, J=6,4 Гц, 1H), 8,68 (д, J=8,2 Гц, 1H).δ 1.80 (t, J = 2.4 Hz, 3H), 3.46 (m, 4H), 3.68 (m, 4H), 5.17 (q, J = 2.4 Hz, 2H) 6.22 (s, 2H), 7.94 (dd, J = 8.2, 8.0 Hz, 1H), 8.08 (t, J = 8.2 Hz, 1H), 8.21 ( d, J = 8.0 Hz, 1H), 8.24 (d, J = 6.4 Hz, 1H), 8.27 (s, 1H), 8.46 (d, J = 6.4 Hz, 1H), 8.68 (d, J = 8.2 Hz, 1H).
MC m/e (ESI) 414,32 (MH+-CF3COOH).MS m / e (ESI) 414.32 (MH + -CF 3 COOH).
Пример 299Example 299
Трифторацетат 3-(2-бутинил)-5-(2-фторпиридин-3-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-fluoropyridin-3-ylmethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 3-(бромметил)-2-фторпиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 3- (bromomethyl) -2-fluoropyridine hydrochloride according to the method described in example 258 (b).
МС m/e (ESI) 384,22 (MH+-CF3COOH).MS m / e (ESI) 384.22 (MH + -CF 3 COOH).
Пример 300Example 300
Трифторацетат 3-(2-бутинил)-5-(2-фторпиридин-4-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (2-fluoropyridin-4-ylmethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 4-(бромметил)-2-фторпиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4- (bromomethyl) -2-fluoropyridine hydrochloride according to the method described in example 258 (b).
МС m/e (ESI) 384,20 (MH+-CF3COOH).MS m / e (ESI) 384.20 (MH + -CF 3 COOH).
Пример 301Example 301
Трифторацетат 3-(2-бутинил)-5-(6-фторпиридин-2-илметил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5- (6-fluoropyridin-2-ylmethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и гидрохлорида 2-(бромметил)-6-фторпиридина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2- (bromomethyl) -6-fluoropyridine hydrochloride according to the method described in example 258 (b).
МС m/e (ESI) 384,22 (MH+-CF3COOH).MS m / e (ESI) 384.22 (MH + -CF 3 COOH).
Пример 302Example 302
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензамида2- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzamide trifluoroacetate
Добавляют 0,005 г карбоната калия и 0,007 г 2-бромметилбензонитрила к раствору, содержащему 0,010 г трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 0,5 мл N,N-диметилформамида, и смесь перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору добавляют 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и остаток растворяют в 1,0 мл метанола. К этому раствору добавляют 0,2 мл водного раствора аммиака и 0,2 мл 31% водного раствора пероксида водорода и смесь перемешивают при 5ºC в течение 20 часов. Добавляют к реакционному раствору 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и образовавшийся остаток растворяют в смеси, состоящей из 0,5 мл дихлорметана и 0,5 мл трифторуксусной кислоты. Смесь перемешивают в течение 1 часа и затем концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 0,009 г соединения, указанного в заголовке.0.005 g of potassium carbonate and 0.007 g of 2-bromomethylbenzonitrile are added to a solution containing 0.010 g of tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5- d] pyridazin-2-yl] piperazine-1-carboxylate in 0.5 ml of N, N-dimethylformamide, and the mixture was stirred at room temperature for 20 hours. 1 ml of ethyl acetate and 1 ml of water were added to the reaction solution, and the layers were separated. The organic layer was concentrated and the residue was dissolved in 1.0 ml of methanol. To this solution was added 0.2 ml of an aqueous solution of ammonia and 0.2 ml of a 31% aqueous solution of hydrogen peroxide, and the mixture was stirred at 5 ° C for 20 hours. 1 ml of ethyl acetate and 1 ml of water are added to the reaction solution, and the layers are separated. The organic layer was concentrated and the resulting residue was dissolved in a mixture of 0.5 ml of dichloromethane and 0.5 ml of trifluoroacetic acid. The mixture was stirred for 1 hour and then concentrated. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 0.009 g of the title compound.
МС m/e (ESI) 406,28 (MH+-CF3COOH).MS m / e (ESI) 406.28 (MH + -CF 3 COOH).
Пример 303Example 303
Трифторацетат 3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензамида3- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzamide trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-бромметилбензонитрила по способу, описанному в примере 302.The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 3-bromomethylbenzonitrile according to the method described in example 302.
МС m/e (ESI) 406,30 (MH+-CF3COOH).MS m / e (ESI) 406.30 (MH + -CF 3 COOH).
Пример 304Example 304
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензамида4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzamide trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 4-бромметилбензонитрила по способу, описанному в примере 302.The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 4-bromomethylbenzonitrile according to the method described in example 302.
МС m/e (ESI) 406,31 (MH+-CF3COOH).MS m / e (ESI) 406.31 (MH + -CF 3 COOH).
Пример 305Example 305
Трифторацетат 3-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензойной кислоты3- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzoic acid trifluoroacetate
Добавляют 0,005 г карбоната калия и 0,008 г метил-3-(бромметил)бензоата к раствору 0,010 г трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 0,5 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 20 часов. В реакционную смесь добавляют 1 мл этилацетата и 1 мл воды и слои разделяют. Органический слой концентрируют и остаток растворяют в 1,0 мл метанола. Добавляют к этому раствору 0,1 мл 5 н. водного раствора гидроксида натрия и смесь перемешивают при комнатной температуре в течение 20 часов. К реакционному раствору добавляют 1 мл этилацетата и 1 мл воды. Раствор подкисляют, используя концентрированную соляную кислоту, и слои разделяют. Органический слой концентрируют и остаток растворяют в смеси, состоящей из 0,5 мл дихлорметана и 0,5 мл трифторуксусной кислоты. Смесь перемешивают в течение 1 часа и затем концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), получая 0,008 г соединения, указанного в заголовке.0.005 g of potassium carbonate and 0.008 g of methyl 3- (bromomethyl) benzoate are added to a solution of 0.010 g of tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4 , 5-d] pyridazin-2-yl] piperazin-1-carboxylate in 0.5 ml of N, N-dimethylformamide and the mixture was stirred at room temperature for 20 hours. 1 ml of ethyl acetate and 1 ml of water are added to the reaction mixture, and the layers are separated. The organic layer was concentrated and the residue was dissolved in 1.0 ml of methanol. Add to this solution 0.1 ml of 5 N. aqueous sodium hydroxide solution and the mixture was stirred at room temperature for 20 hours. 1 ml of ethyl acetate and 1 ml of water are added to the reaction solution. The solution was acidified using concentrated hydrochloric acid, and the layers were separated. The organic layer was concentrated and the residue was dissolved in a mixture of 0.5 ml of dichloromethane and 0.5 ml of trifluoroacetic acid. The mixture was stirred for 1 hour and then concentrated. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 0.008 g of the title compound.
МС m/e (ESI) 407,29 (MH+-CF3COOH).MS m / e (ESI) 407.29 (MH + -CF 3 COOH).
Пример 306Example 306
Трифторацетат 4-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензойной кислоты4- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzoic acid trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метил-4-(бромметил)бензоата по способу, описанному в примере 305.The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and methyl 4- (bromomethyl) benzoate according to the method described in example 305.
МС m/e (ESI) 407,30 (MH+-CF3COOH).MS m / e (ESI) 407.30 (MH + -CF 3 COOH).
Пример 307Example 307
Трифторацетат 5-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]фуран-2-карбоновой кислоты5- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] furan-2-carboxylic acid trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этил-5-(бромметил)фуран-2-карбоксилата по способу, описанному в примере 305.The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and ethyl 5- (bromomethyl) furan-2-carboxylate according to the method described in example 305.
МС m/e (ESI) 397,28 (MH+-CF3COOH).MS m / e (ESI) 397.28 (MH + -CF 3 COOH).
Пример 308Example 308
Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) трет-Бутил-4-(1-бензил-6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат(a) tert-Butyl-4- (1-benzyl-6-benzyloxymethyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и бензилбромида по способу, описанному в примере 116(d).The title compound was prepared by using tert-butyl-4- (6-benzyloxymethyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1- carboxylate and benzyl bromide according to the method described in example 116 (d).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 3,13-3,18 (м, 4H), 3,50-3,54 (м, 4H), 4,72 (с, 2H), 5,61 (с, 2H), 5,65 (с, 2H), 7,20-7,35 (м, 10H), 8,22 (с, 1H).δ 1.48 (s, 9H), 3.13-3.18 (m, 4H), 3.50-3.54 (m, 4H), 4.72 (s, 2H), 5.61 (s , 2H), 5.65 (s, 2H), 7.20-7.35 (m, 10H), 8.22 (s, 1H).
(b) Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(b) 3-Benzyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем обработки трет-бутил-4-(1-бензил-6-бензилоксиметил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата по способу, описанному в примере 117.The title compound was prepared by treating tert-butyl-4- (1-benzyl-6-benzyloxymethyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazine-1-carboxylate according to the method described in example 117.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 3,31-3,37 (м, 4H), 3,40-3,46 (м, 4H), 5,68 (с, 2H), 7,22-7,36 (м, 5H), 8,25 (с, 1H).δ 3.31-3.37 (m, 4H), 3.40-3.46 (m, 4H), 5.68 (s, 2H), 7.22-7.36 (m, 5H), 8 25 (s, 1H).
MC m/e (ESI), 311,24 (MH+-CF3COOH).MS m / e (ESI), 311.24 (MH + -CF 3 COOH).
Пример 309Example 309
Трифторацетат 3-бензил-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) трет-Бутил-4-(1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилат(a) tert-Butyl-4- (1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трифторацетата 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она по способу, описанному в примере 258(a).The title compound was prepared by using 3-benzyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate according to the method described in Example 258 (a )
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,47 (с, 9H), 3,12-3,16 (м, 4H), 3,47-3,52 (м, 4H), 5,58 (с, 2H), 7,20-7,34 (м, 5H), 8,20 (с, 1H), 10,04 (уш.с, 1H).δ 1.47 (s, 9H), 3.12-3.16 (m, 4H), 3.47-3.52 (m, 4H), 5.58 (s, 2H), 7.20-7 34 (m, 5H), 8.20 (s, 1H), 10.04 (br s, 1H).
(b) Трифторацетат 3-бензил-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(b) 3-Benzyl-5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и метилйодида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- (1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1- carboxylate and methyl iodide according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 3,29-3,35 (м, 4H), 3,36-3,41 (м, 4H), 3,83 (с, 3H), 5,68 (с, 2H), 7,21-7,34 (м, 5H), 8,20 (с, 1H).δ 3.29-3.35 (m, 4H), 3.36-3.41 (m, 4H), 3.83 (s, 3H), 5.68 (s, 2H), 7.21-7 34 (m, 5H); 8.20 (s, 1H).
MC m/e (ESI) 325,01 (MH+-CF3COOH).MS m / e (ESI) 325.01 (MH + -CF 3 COOH).
Пример 310Example 310
Трифторацетат 3-бензил-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-5- (2-oxo-2-phenylethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and 2-bromoacetophenone according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 3,31-3,36 (м, 4H), 3,44-3,49 (м, 4H), 5,69 (с, 2H), 5,77 (с, 2H), 7,22-7,52 (м, 8H), 8,06 (д, J=9,3 Гц, 2H), 8,32 (с, 1H).δ 3.31-3.36 (m, 4H), 3.44-3.49 (m, 4H), 5.69 (s, 2H), 5.77 (s, 2H), 7.22-7 52 (m, 8H), 8.06 (d, J = 9.3 Hz, 2H), 8.32 (s, 1H).
MC m/e (ESI) 429,39 (MH+-CF3COOH).MS m / e (ESI) 429.39 (MH + -CF 3 COOH).
Пример 311Example 311
Трифторацетат 3-бензил-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-5- (2-phenylethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и (2-бромэтил)бензола по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and (2-bromoethyl) benzene according to the method described in example 258 (b).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,11 (т, J=8,1 Гц, 2H), 3,24-3,29 (м, 4H), 3,37-3,42 (м, 4H), 4,46 (т, J=8,1 Гц, 2H), 5,58 (с, 2H), 7,09-7,34 (м, 10H), 8,20 (с, 1H).δ 3.11 (t, J = 8.1 Hz, 2H), 3.24-3.29 (m, 4H), 3.37-3.42 (m, 4H), 4.46 (t, J = 8.1 Hz, 2H), 5.58 (s, 2H), 7.09-7.34 (m, 10H), 8.20 (s, 1H).
MS m/e (ESI), 415,54 (MH+-CF3COOH).MS m / e (ESI), 415.54 (MH + -CF 3 COOH).
Пример 312Example 312
Трифторацетат 3-бензил-5-(2-феноксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-5- (2-phenoxyethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтилфенилового эфира по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and 2-bromoethylphenyl ether according to the method described in example 258 (b).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,21-3,24 (м, 4H), 3,37-3,42 (м, 4H), 4,37 (т, J=5,8 Гц, 2H), 4,64 (т, J=5,8 Гц, 2H), 5,58 (с, 2H), 6,86-6,94 (м, 3H), 7,07-7,34 (м, 7H), 8,21 (с, 1H).δ 3.21-3.24 (m, 4H), 3.37-3.42 (m, 4H), 4.37 (t, J = 5.8 Hz, 2H), 4.64 (t, J = 5.8 Hz, 2H), 5.58 (s, 2H), 6.86-6.94 (m, 3H), 7.07-7.34 (m, 7H), 8.21 (s, 1H).
MC m/e (ESI) 431,57 (MH+-CF3COOH).MS m / e (ESI) 431.57 (MH + -CF 3 COOH).
Пример 313Example 313
Трифторацетат 3-бензил-2-(пиперазин-1-ил)-5-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-benzyl-2- (piperazin-1-yl) -5- (2-propynyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 3-бром-1-пропина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and 3-bromo-1-propine according to the method described in example 258 (b).
МС m/e (ESI) 349,31 (MH+-CF3COOH).MS m / e (ESI) 349.31 (MH + -CF 3 COOH).
Пример 314Example 314
Трифторацетат [3-бензил-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетонитрила[3-Benzyl-4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-yl] acetonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромацетонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and bromoacetonitrile according to the method described in example 258 (b).
МС m/e (ESI) 350,30 (MH+-CF3COOH).MS m / e (ESI) 350.30 (MH + -CF 3 COOH).
Пример 315Example 315
Трифторацетат 3-бензил-5-(2-гидроксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-5- (2-hydroxyethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромэтанола по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and 2-bromoethanol according to the method described in example 258 (b).
МС m/e (ESI) 355,32 (MH+-CF3COOH).MS m / e (ESI) 355.32 (MH + -CF 3 COOH).
Пример 316Example 316
Трифторацетат 3-бензил-5-(2-метоксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-5- (2-methoxyethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и бромэтилметилового эфира по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and bromoethyl methyl ether according to the method described in example 258 (b).
МС m/e (ESI) 369,35 (MH+-CF3COOH).MS m / e (ESI) 369.35 (MH + -CF 3 COOH).
Пример 317Example 317
Трифторацетат этил [3-бензил-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]ацетатаEthyl [3-benzyl-4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-yl] acetate trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и этилбромацетата по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and ethyl bromoacetate according to the method described in example 258 (b).
МС m/e (ESI) 397,33 (MH+-CF3COOH).MS m / e (ESI) 397.33 (MH + -CF 3 COOH).
Пример 318Example 318
Трифторацетат 3-бензил-5-[2-(3-метоксифенил)-2-оксоэтил]-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Benzyl-5- [2- (3-methoxyphenyl) -2-oxoethyl] -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-3'-метоксиацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and 2-bromo-3'-methoxyacetophenone according to the method described in example 258 (b).
МС m/e (ESI) 459,34 (MH+-CF3COOH).MS m / e (ESI) 459.34 (MH + -CF 3 COOH).
Пример 319Example 319
Трифторацетат 2-[3-бензил-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрилаTrifluoroacetate 2- [3-benzyl-4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzonitrile
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-бензил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1-benzyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin-1- carboxylate and 2-bromomethylbenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 326,33 (MH+-CF3COOH).MS m / e (ESI) 326.33 (MH + -CF 3 COOH).
Пример 320Example 320
Трифторацетат 5-метил-2-(пиперазин-1-ил)-3-(2-пропинил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она5-methyl-2- (piperazin-1-yl) -3- (2-propynyl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 3-бром-1-пропина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1- carboxylate and 3-bromo-1-propine according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 2,99 (т, J=3,3 Гц, 1H), 3,45-3,49 (м, 4H), 3,65-3,69 (м, 4H), 3,83 (с, 3H), 5,75 (д, J=3,3 Гц, 2H), 8,20 (с, 1H).δ 2.99 (t, J = 3.3 Hz, 1H), 3.45-3.49 (m, 4H), 3.65-3.69 (m, 4H), 3.83 (s, 3H ), 5.75 (d, J = 3.3 Hz, 2H), 8.20 (s, 1H).
MC m/e (ESI) 273,1 (MH+-CF3COOH).MS m / e (ESI) 273.1 (MH + -CF 3 COOH).
Пример 321Example 321
Трифторацетат 3-(2-бутенил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butenyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 1-бром-2-бутена по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1- carboxylate and 1-bromo-2-butene according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,69 и 1,84 (дд, J=6,3, 1,3 Гц, и дд, J=6,3, 1,3 Гц, 3H), 3,43-3,48 (м, 4H), 3,54-3,58 (м, 4H), 3,82 и 3,84 (с, 3H), 4,94 и 5,07 (д, J=6,5 Гц, и д, J=6,5 Гц, 2H), 5,63-5,80 и 6,11-6,20 (м, 2H), 8,19 и 8,22 (с, 1H).δ 1.69 and 1.84 (dd, J = 6.3, 1.3 Hz, and dd, J = 6.3, 1.3 Hz, 3H), 3.43-3.48 (m, 4H ), 3.54-3.58 (m, 4H), 3.82 and 3.84 (s, 3H), 4.94 and 5.07 (d, J = 6.5 Hz, and d, J = 6.5 Hz, 2H), 5.63-5.80 and 6.11-6.20 (m, 2H), 8.19 and 8.22 (s, 1H).
MC m/e (ESI), 289,2 (MH+-CF3COOH).MS m / e (ESI), 289.2 (MH + -CF 3 COOH).
Пример 322Example 322
Трифторацетат 5-метил-3-(2-пентенил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она5-methyl-3- (2-pentenyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 1-бром-2-пентена по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1- carboxylate and 1-bromo-2-pentene according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 0,97 и 1,08 (т, J=7,7 Гц, и т, J=7,7 Гц, 3H), 2,04-2,27 (м, 2H), 3,42-3,46 (м, 4H), 3,54-3,58 (м, 4H), 3,81 и 3,84 (с, 3H), 4,91-4,96 (м, 2H), 5,59-5,81 и 6,14-6,22 (м, 2H), 8,19 и 8,22 (с, 1H)δ 0.97 and 1.08 (t, J = 7.7 Hz, and t, J = 7.7 Hz, 3H), 2.04-2.27 (m, 2H), 3.42-3, 46 (m, 4H), 3.54-3.58 (m, 4H), 3.81 and 3.84 (s, 3H), 4.91-4.96 (m, 2H), 5.59- 5.81 and 6.14-6.22 (m, 2H), 8.19 and 8.22 (s, 1H)
MC m/e (ESI) 303,25 (MH+-CF3COOH).MS m / e (ESI) 303.25 (MH + -CF 3 COOH).
Пример 323Example 323
Трифторацетат 5-метил-3-(3-метил-2-бутенил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она5-methyl-3- (3-methyl-2-butenyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и 1-бром-3-метил-2-бутена по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1- carboxylate and 1-bromo-3-methyl-2-butene according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,75 (с, 3H), 1,83 (с, 3H), 3,43-3,47 (м, 4H), 3,52-3,57 (м, 4H), 3,84 (с, 3H), 5,00 (д, J=6,8 Гц, 2H), 5,40-5,45 (м, 1H), 8,17 (с, 1H).δ 1.75 (s, 3H), 1.83 (s, 3H), 3.43-3.47 (m, 4H), 3.52-3.57 (m, 4H), 3.84 (s , 3H), 5.00 (d, J = 6.8 Hz, 2H), 5.40-5.45 (m, 1H), 8.17 (s, 1H).
MC m/e (ESI) 303,27 (MH+-CF3COOH).MS m / e (ESI) 303.27 (MH + -CF 3 COOH).
Пример 324Example 324
Трифторацетат 3-циклопропилметил-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3-Cyclopropylmethyl-5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперазин-1-карбоксилата и циклопропилметилбромида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperazin-1- carboxylate and cyclopropylmethyl bromide according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 0,44-0,55 (м, 4H), 0,81-0,85 (м, 1H), 3,42-3,46 (м, 4H), 3,54-3,58 (м, 4H), 3,83 (с, 3H), 4,39 (д, J=6,6 Гц, 2H), 8,21 (с, 1H).δ 0.44-0.55 (m, 4H), 0.81-0.85 (m, 1H), 3.42-3.46 (m, 4H), 3.54-3.58 (m, 4H), 3.83 (s, 3H), 4.39 (d, J = 6.6 Hz, 2H), 8.21 (s, 1H).
MC m/e (ESI) 289,25 (MH+-CF3COOH).MS m / e (ESI) 289.25 (MH + -CF 3 COOH).
Пример 325Example 325
Бистрифторацетат 5-[2-(2-аминофенил)-2-оксоэтил]-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она5- [2- (2-aminophenyl) -2-oxoethyl] -3- (2-butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4 bistrifluoroacetate -she
(a) трет-Бутил-4-[1-(2-бутинил)-6-[2-(2-нитрофенил)-2-оксоэтил]-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1- (2-butynyl) -6- [2- (2-nitrophenyl) -2-oxoethyl] -7-oxo-6,7-dihydro-1H-imidazo [4, 5-d] pyridazin-2-yl] piperazin-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бром-2'-нитроацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 2-bromo-2'-nitroacetophenone according to the method described in example 258 (b).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,37-3,44 (м, 4H), 3,50-3,55 (м, 4H), 5,04 (кв, J=2,3 Гц, 2H), 5,44 (с, 2H), 7,62 (м, 1H), 7,71-7,74 (м, 2H), 8,13 (д, J=7,9 Гц, 1H), 8,21 (с, 1H).δ 1.49 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.37-3.44 (m, 4H), 3.50-3.55 (m, 4H ), 5.04 (q, J = 2.3 Hz, 2H), 5.44 (s, 2H), 7.62 (m, 1H), 7.71-7.74 (m, 2H), 8 13 (d, J = 7.9 Hz, 1H); 8.21 (s, 1H).
(b) Бистрифторацетат 5-[2-(2-аминофенил)-2-оксоэтил]-3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(b) 5- [2- (2-aminophenyl) -2-oxoethyl] -3- (2-butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] bistrifluoroacetate pyridazin-4-one
Добавляют 2 мл воды, 0,070 г железа и 0,007 г хлорида аммония к раствору 0,058 г трет-бутил-4-[1-(2-бутинил)-6-[2-(2-нитрофенил)-2-оксоэтил]-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 5 мл этанола и смесь кипятят с обратным холодильником в течение трех часов. Реакционную смесь фильтруют и фильтрат концентрируют при пониженном давлении. Остаток растворяют в 4 мл дихлорметана и добавляют к раствору 4 мл трифторуксусной кислоты. После перемешивания смеси в течение двух часов раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,051 г соединения, указанного в заголовке.2 ml of water, 0.070 g of iron and 0.007 g of ammonium chloride are added to a solution of 0.058 g of tert-butyl-4- [1- (2-butynyl) -6- [2- (2-nitrophenyl) -2-oxoethyl] -7- oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate in 5 ml of ethanol and the mixture was refluxed for three hours. The reaction mixture was filtered and the filtrate was concentrated under reduced pressure. The residue was dissolved in 4 ml of dichloromethane and 4 ml of trifluoroacetic acid was added to the solution. After stirring the mixture for two hours, the solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 0.051 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,82 (т, J=2,3 Гц, 3H), 3,45-3,50 (м, 4H), 3,68-3,72 (м, 4H), 5,16 (кв, J=2,3 Гц, 2H), 5,68 (с, 2H), 6,56 (т, J=7,2 Гц, 1H), 6,67 (д, J=7,2 Гц, 1H), 7,30 (т, J=7,2 Гц, 1H), 7,85 (д, J=7,2 Гц, 1H), 8,25 (с, 1H).δ 1.82 (t, J = 2.3 Hz, 3H), 3.45-3.50 (m, 4H), 3.68-3.72 (m, 4H), 5.16 (q, J = 2.3 Hz, 2H), 5.68 (s, 2H), 6.56 (t, J = 7.2 Hz, 1H), 6.67 (d, J = 7.2 Hz, 1H), 7.30 (t, J = 7.2 Hz, 1H), 7.85 (d, J = 7.2 Hz, 1H), 8.25 (s, 1H).
MC m/e (ESI) 406,22 (MH+-CF3COOH).MS m / e (ESI) 406.22 (MH + -CF 3 COOH).
Пример 326Example 326
Трифторацетат 3-(2-бутинил)-5,7-диметил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5,7-dimethyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4- (1-hydroxyethyl) -1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 0,5 мл 0,3 M тетрагидрофуранового раствора метилмагнийбромида в 3 мл тетрагидрофуранового раствора 0,050 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата при температуре -70ºC в атмосфере азота и дают смеси нагреться до комнатной температуры. Добавляют к этому раствору 10 мл 5% водного раствора хлорида аммония и смесь экстрагируют 30 мл этилацетата. Органический слой последовательно промывают 10 мл воды и 10 мл насыщенного раствора хлорида натрия, затем сушат над сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (1:1), 0,049 г соединения, указанного в заголовке.Add 0.5 ml of a 0.3 M tetrahydrofuran solution of methylmagnesium bromide in 3 ml of a tetrahydrofuran solution of 0.050 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-formyl-1H-imidazol-2-yl] piperazine-1-carboxylate at a temperature of -70ºC in a nitrogen atmosphere and allow the mixture to warm to room temperature. 10 ml of a 5% aqueous solution of ammonium chloride are added to this solution, and the mixture is extracted with 30 ml of ethyl acetate. The organic layer was washed successively with 10 ml of water and 10 ml of a saturated solution of sodium chloride, then dried over magnesium sulfate. The organic layer was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.049 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (1: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,37 (т, J=7,1 Гц, 3H), 1,47 (д, J=6,9 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 3,17-3,22 (м, 4H), 3,55-3,59 (м, 4H), 3,84 (д, J=6,9 Гц, 1H), 4,38 (кв, J=7,1 Гц, 2H), 4,78 (кв, J=2, 3 Гц, 2H), 5,12 (кв, J=6,9 Гц, 1H).δ 1.37 (t, J = 7.1 Hz, 3H), 1.47 (d, J = 6.9 Hz, 3H), 1.48 (s, 9H), 1.81 (t, J = 2.3 Hz, 3H), 3.17-3.22 (m, 4H), 3.55-3.59 (m, 4H), 3.84 (d, J = 6.9 Hz, 1H), 4.38 (q, J = 7.1 Hz, 2H), 4.78 (q, J = 2, 3 Hz, 2H), 5.12 (q, J = 6.9 Hz, 1H).
(b) трет-Бутил-4-[4-ацетил-1-(2-бутинил)-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [4-acetyl-1- (2-butynyl) -5-ethoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(g).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4- (1-hydroxyethyl) -1H-imidazol-2-yl] piperazine-1-carboxylate according to the method described in example 115 (g).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,38 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,79 (т, J=2,3 Гц, 3H), 2,53 (с, 3H), 3,14-3,18 (м, 4H), 3,56-3,60 (м, 4H), 4,38 (кв, J=7,1 Гц, 2H), 4,77 (кв, J=2,3 Гц, 2H).δ 1.38 (t, J = 7.1 Hz, 3H), 1.48 (s, 9H), 1.79 (t, J = 2.3 Hz, 3H), 2.53 (s, 3H) , 3.14-3.18 (m, 4H), 3.56-3.60 (m, 4H), 4.38 (q, J = 7.1 Hz, 2H), 4.77 (q, J = 2.3 Hz, 2H).
(c) Трифторацетат 3-(2-бутинил)-5,7-диметил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(c) 3- (2-Butynyl) -5,7-dimethyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Добавляют 0,15 мл метилгидразина к раствору 0,019 г трет-бутил[4-ацетил-1-(2-бутинил)-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 3 мл этанола и смесь нагревают при 110ºC в течение 25 часов. Раствор концентрируют при пониженном давлении. Остаток растворяют в 0,5 мл дихлорметана и добавляют к раствору 0,5 мл трифторуксусной кислоты. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,017 г соединения, указанного в заголовке.Add 0.15 ml of methylhydrazine to a solution of 0.019 g of tert-butyl [4-acetyl-1- (2-butynyl) -5-ethoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 3 ml of ethanol and the mixture is heated at 110ºC for 25 hours. The solution was concentrated under reduced pressure. The residue was dissolved in 0.5 ml of dichloromethane and 0.5 ml of trifluoroacetic acid was added to the solution. The solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.017 g of the title compound.
МС m/e (ESI) 301,33 (MH+-CF3COOH).MS m / e (ESI) 301.33 (MH + -CF 3 COOH).
Пример 327Example 327
Трифторацетат 3-(2-бутинил)-7-фенил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -7-phenyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксифенилметил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4- (1-hydroxyphenylmethyl) -1H-imidazol-2-yl] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата и фенилмагнийбромида по способу, описанному в примере 326(a).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-formyl-1H-imidazol-2-yl] piperazine-1-carboxylate and phenylmagnesium bromide according to the method, described in example 326 (a).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,33 (т, J=7,3 Гц, 3H), 1,48 (с, 9H), 1,81 (т, J=2,2 Гц, 3H), 3,16-3,27 (м, 4H), 3,55-3,59 (м, 4H), 4,24-4,34 (м, 2H), 4,39 (д, J=8,3 Гц, 1H), 4,78 (кв, J=2,2 Гц, 2H), 6,09 (д, J=8,3 Гц, 1H), 7,22 (т, J=8,0 Гц, 1H), 7,30 (т, J=8,0 Гц, 2H), 7,41 (д, J=8,0 Гц, 2H).δ 1.33 (t, J = 7.3 Hz, 3H), 1.48 (s, 9H), 1.81 (t, J = 2.2 Hz, 3H), 3.16-3.27 ( m, 4H), 3.55-3.59 (m, 4H), 4.24-4.34 (m, 2H), 4.39 (d, J = 8.3 Hz, 1H), 4.78 (q, J = 2.2 Hz, 2H), 6.09 (d, J = 8.3 Hz, 1H), 7.22 (t, J = 8.0 Hz, 1H), 7.30 (t , J = 8.0 Hz, 2H), 7.41 (d, J = 8.0 Hz, 2H).
(b) трет-Бутил-4-[4-бензоил-1-(2-бутинил)-5-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [4-benzoyl-1- (2-butynyl) -5-ethoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксифенилметил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(g).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4- (1-hydroxyphenylmethyl) -1H-imidazol-2-yl] piperazine-1-carboxylate according to the method described in example 115 (g).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 0,92 (т, J=7,1 Гц, 3H), 1,48 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,22-3,28 (м, 4H), 3,57-3,62 (м, 4H), 4,03 (кв, J=7,1 Гц, 2H), 4,88 (кв, J=2,3 Гц, 2H), 7,43 (т, J=8,1 Гц, 2H), 7,55 (т, J=8,1 Гц, 1H), 7,92 (д, J=8,l Гц, 2H).δ 0.92 (t, J = 7.1 Hz, 3H), 1.48 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.22-3.28 ( m, 4H), 3.57-3.62 (m, 4H), 4.03 (q, J = 7.1 Hz, 2H), 4.88 (q, J = 2.3 Hz, 2H), 7.43 (t, J = 8.1 Hz, 2H), 7.55 (t, J = 8.1 Hz, 1H), 7.92 (d, J = 8, l Hz, 2H).
(c) трет-Бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(c) tert-Butyl-4- [1- (2-butynyl) -7-oxo-4-phenyl-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin- 1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(1-гидроксифенилметил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата и гидразина по способу, описанному в примере 115(h).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4- (1-hydroxyphenylmethyl) -1H-imidazol-2-yl] piperazine-1-carboxylate and hydrazine according to the method described in example 115 (h).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,44-3,48 (м, 4H), 3,63-3,67 (м, 4H), 5,15 (кв, J=2,3 Гц, 2H), 7,40-7,50 (м, 3H), 8,34 (д, J=8,1 Гц, 2H), 10,70 (с, 1H).δ 1.50 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.44-3.48 (m, 4H), 3.63-3.67 (m, 4H ), 5.15 (q, J = 2.3 Hz, 2H), 7.40-7.50 (m, 3H), 8.34 (d, J = 8.1 Hz, 2H), 10.70 (s, 1H).
(d) Трифторацетат 3-(2-бутинил)-7-фенил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(d) 3- (2-Butynyl) -7-phenyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(i).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-4-phenyl-6,7-dihydro-1H-imidazo [4,5-d] pyridazin- 2-yl] piperazin-1-carboxylate according to the method described in example 115 (i).
МС m/e (ESI) 349,30 (MH+-CF3COOH).MS m / e (ESI) 349.30 (MH + -CF 3 COOH).
Пример 328Example 328
Трифторацетат 3-(2-бутинил)-5-метил-7-фенил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5-methyl-7-phenyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и метилйодида по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-4-phenyl-6,7-dihydro-1H-imidazo [4,5-d] pyridazin- 2-yl] piperazin-1-carboxylate and methyl iodide according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,83 (т, J=2,4 Гц, 3H), 3,47-3,51 (м, 4H), 3,71-3,75 (м, 4H), 3,92 (с, 3H), 5,22 (кв, J=2,4 Гц, 2H), 7,43-7,48 (м, 3H), 8,35 (д, J=8,1 Гц, 2H).δ 1.83 (t, J = 2.4 Hz, 3H), 3.47-3.51 (m, 4H), 3.71-3.75 (m, 4H), 3.92 (s, 3H ), 5.22 (q, J = 2.4 Hz, 2H), 7.43-7.48 (m, 3H), 8.35 (d, J = 8.1 Hz, 2H).
MC m/e (ESI) 363,31 (MH+-CF3COOH).MS m / e (ESI) 363.31 (MH + -CF 3 COOH).
Пример 329Example 329
Трифторацетат [3-(2-бутинил)-4-оксо-7-фенил-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-ил]уксусной кислоты[3- (2-Butynyl) -4-oxo-7-phenyl-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-yl] acetic acid trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и трет-бутилбромацетата по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-4-phenyl-6,7-dihydro-1H-imidazo [4,5-d] pyridazin- 2-yl] piperazin-1-carboxylate and tert-butyl bromoacetate according to the method described in example 258 (b).
МС m/e (ESI) 407,29 (MH+-CF3COOH).MS m / e (ESI) 407.29 (MH + -CF 3 COOH).
Пример 330Example 330
Трифторацетат 2-[3-(2-бутинил)-4-оксо-7-фенил-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-d]пиридазин-5-илметил]бензонитрила2- [3- (2-Butynyl) -4-oxo-7-phenyl-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-4-фенил-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-4-phenyl-6,7-dihydro-1H-imidazo [4,5-d] pyridazin- 2-yl] piperazin-1-carboxylate and 2-bromomethylbenzonitrile according to the method described in example 258 (b).
МС m/e (ESI) 464,33 (MH+-CF3COOH).MS m / e (ESI) 464.33 (MH + -CF 3 COOH).
Пример 331Example 331
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-7-трифторметил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -7-trifluoromethyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) трет-Бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(2,2,2-трифтор-1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4- (2,2,2-trifluoro-1-hydroxyethyl) -1H-imidazol-2-yl] piperazin-1- carboxylate
Добавляют 0,065 г цинка и раствор 0,200 г трифторметилйодида в 2 мл N,N-диметилформамида к раствору 0,155 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 3 мл N,N-диметилформамида в атмосфере азота и смесь перемешивают при обработке ультразвуком в течение 30 минут. К смеси добавляют 30 мл этилацетата и 30 мл 5%-ного раствора хлорида аммония. Органический слой промывают два раза водой (20 мл) и затем 20 мл насыщенного раствора хлорида натрия, и сушат над сульфатом магния. Органическую жидкость концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью этилацетат-гексан (1:9), получают 0,013 г соединения, указанного в заголовке.Add 0.065 g of zinc and a solution of 0.200 g of trifluoromethyl iodide in 2 ml of N, N-dimethylformamide to a solution of 0.155 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4-formyl-1H-imidazole-2- il] piperazine-1-carboxylate in 3 ml of N, N-dimethylformamide in a nitrogen atmosphere and the mixture was stirred by sonication for 30 minutes. To the mixture was added 30 ml of ethyl acetate and 30 ml of a 5% solution of ammonium chloride. The organic layer was washed twice with water (20 ml) and then 20 ml of a saturated solution of sodium chloride, and dried over magnesium sulfate. The organic liquid was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.013 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (1: 9).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,39 (т, J=6,9 Гц, 3H), 1,48 (с, 9H), 1,83 (т, J=2,4 Гц, 3H), 3,15-3,26 (м, 4H), 3,55-3,60 (м, 4H), 4,34 (кв кв, J=10,2, 6,9 Гц, 2H), 4,53-4,64 (уш.с, 1H), 4,83 (кв кв, J=17,6, 2,4 Гц, 2H), 5,39-5,47 (уш.с, 1H).δ 1.39 (t, J = 6.9 Hz, 3H), 1.48 (s, 9H), 1.83 (t, J = 2.4 Hz, 3H), 3.15-3.26 ( m, 4H), 3.55-3.60 (m, 4H), 4.34 (qs, J = 10.2, 6.9 Hz, 2H), 4.53-4.64 (br.s , 1H); 4.83 (q q, J = 17.6, 2.4 Hz, 2H); 5.39-5.47 (br s, 1H).
(b) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-7-трифторметил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(b) 3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -7-trifluoromethyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Добавляют 0,060 г реактива Dess-Martin к раствору 0,013 г трет-бутил-4-[1-(2-бутинил)-5-этоксикарбонил-4-(2,2,2-трифтор-1-гидроксиэтил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 4 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к этому раствору 5 мл дихлорметана, 10 мл насыщенного водного раствора бикарбоната натрия и 0,100 г гидросульфита натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток растворяют в 4 мл этанола и добавляют к раствору 0,2 мл метилгидразина. Смесь нагревают при 110ºC в течение 20 часов. Раствор концентрируют при пониженном давлении. Остаток растворяют в 0,5 мл дихлорметана и добавляют к раствору 0,5 мл трифторуксусной кислоты. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,008 г соединения, указанного в заголовке.Add 0.060 g of Dess-Martin reagent to a solution of 0.013 g of tert-butyl-4- [1- (2-butynyl) -5-ethoxycarbonyl-4- (2,2,2-trifluoro-1-hydroxyethyl) -1H-imidazole- 2-yl] piperazine-1-carboxylate in 4 ml of dichloromethane and the mixture was stirred at room temperature for 15 hours. 5 ml of dichloromethane, 10 ml of a saturated aqueous sodium bicarbonate solution and 0.100 g of sodium hydrosulfite are added to this solution. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was dissolved in 4 ml of ethanol and 0.2 ml of methylhydrazine was added to the solution. The mixture is heated at 110ºC for 20 hours. The solution was concentrated under reduced pressure. The residue was dissolved in 0.5 ml of dichloromethane and 0.5 ml of trifluoroacetic acid was added to the solution. The solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 0.008 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,71-3,75 (м, 4H), 3,87 (с, 3H), 5,18 (кв, J=2,3 Гц, 2H).δ 1.83 (t, J = 2.3 Hz, 3H), 3.45-3.49 (m, 4H), 3.71-3.75 (m, 4H), 3.87 (s, 3H ), 5.18 (q, J = 2.3 Hz, 2H).
MC m/e (ESI) 355,16 (MH+-CF3COOH).MS m / e (ESI) 355.16 (MH + -CF 3 COOH).
Пример 332Example 332
Трифторацетат 1-(2-бутинил)-6-метил-7-оксо-2-(пиперазин-1-ил)-6,7-дигидроимидазо[4,5-d]пиридазин-4-карбоксамида1- (2-Butynyl) -6-methyl-7-oxo-2- (piperazin-1-yl) -6,7-dihydroimidazo [4,5-d] pyridazin-4-carboxamide trifluoroacetate
(a) трет-Бутил-4-[1-(2-бутинил)-4-(цианогидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1- (2-butynyl) -4- (cyanohydroxymethyl) -5-methoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 0,200 г цианида натрия и 0,010 мл уксусной кислоты к раствору трет-бутил-4-[1-(2-бутинил)-5-метоксикарбонил-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 15 мл ацетонитрила и смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют к раствору 100 мл этилацетата и смесь промывают два раза водой (50 мл) и затем 50 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 0,274 г соединения, указанного в заголовке.Add 0.200 g of sodium cyanide and 0.010 ml of acetic acid to a solution of tert-butyl-4- [1- (2-butynyl) -5-methoxycarbonyl-4-formyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 15 ml of acetonitrile and the mixture was stirred at room temperature for 16 hours. 100 ml of ethyl acetate are added to the solution and the mixture is washed twice with water (50 ml) and then 50 ml of a saturated sodium chloride solution. The organic layer was dried over magnesium sulfate and the solution was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.274 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2,5 Гц, 3H), 3,19-3,23 (м, 4H), 3,56-3,60 (м, 4H), 3,95 (с, 3H), 4,68 (д, J=9,0 Гц, 1H), 4,82 (кв, J=2,5 Гц, 2H), 5,72 (д, J=9,0 Гц, 1H).δ 1.49 (s, 9H), 1.83 (t, J = 2.5 Hz, 3H), 3.19-3.23 (m, 4H), 3.56-3.60 (m, 4H ), 3.95 (s, 3H), 4.68 (d, J = 9.0 Hz, 1H), 4.82 (q, J = 2.5 Hz, 2H), 5.72 (d, J = 9.0 Hz, 1H).
(b) трет-Бутил-4-[1-(2-бутинил)-4-(карбамоилгидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [1- (2-butynyl) -4- (carbamoylhydroxymethyl) -5-methoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 3,2 мл 30% водного раствора пероксида водорода и 3,2 мл 28% водного раствор аммиака к раствору 0,274 г трет-бутил-4-[1-(2-бутинил)-4-(цианогидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 8 мл метанола при 5ºC и смесь перемешивают в течение 15 часов. В этот раствор добавляют 100 мл насыщенного раствора гидросульфита натрия и смесь экстрагируют два раза 100 мл этилацетата. Органические слои объединяют. Объединенные органические слои сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью метанол-этилацетат (1:9), 0,039 г соединения, указанного в заголовке.3.2 ml of a 30% aqueous solution of hydrogen peroxide and 3.2 ml of a 28% aqueous solution of ammonia are added to a solution of 0.274 g of tert-butyl-4- [1- (2-butynyl) -4- (cyanohydroxymethyl) -5-methoxycarbonyl- 1H-imidazol-2-yl] piperazine-1-carboxylate in 8 ml of methanol at 5 ° C and the mixture was stirred for 15 hours. To this solution was added 100 ml of a saturated solution of sodium hydrogen sulfite and the mixture was extracted twice with 100 ml of ethyl acetate. Organic layers are combined. The combined organic layers were dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.039 g of the title compound was obtained from the fraction eluted with methanol-ethyl acetate (1: 9).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,83 (т, J=2,5 Гц, 3H), 3,13-3,25 (м, 4H), 3,54-3,57 (м, 4H), 3,91 (с, 3H), 4,33-4,37 (уш.с, 1H), 4,77 (кв, J=2,5 Гц, 2H), 5,54 (с, 1H), 5,63 (с, 1H), 6,82 (с, 1H).δ 1.48 (s, 9H), 1.83 (t, J = 2.5 Hz, 3H), 3.13-3.25 (m, 4H), 3.54-3.57 (m, 4H ), 3.91 (s, 3H), 4.33-4.37 (br s, 1H), 4.77 (q, J = 2.5 Hz, 2H), 5.54 (s, 1H) 5.63 (s, 1H); 6.82 (s, 1H).
(c) трет-Бутил-4-[4-аминооксалил-1-(2-бутинил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(c) tert-Butyl-4- [4-aminooxalyl-1- (2-butynyl) -5-methoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 0,051 мл триэтиламина и раствор 0,058 г комплекса триоксид серы-пиридин в 1 мл диметилсульфоксида к раствору 0,038 г трет-бутил-4-[1-(2-бутинил)-4-(карбамоилгидроксиметил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 2 мл дихлорметана при 0ºC и смесь перемешивают при комнатной температуре в течение 15 часов. Затем добавляют 0,102 мл триэтиламина и раствор 0,116 г комплекса триоксид серы-пиридин в 1 мл диметилсульфоксида и смесь перемешивают при комнатной температуре в течение 8 часов. Добавляют к раствору 50 мл этилацетата и органический слой промывают последовательно водным раствором 1% серной кислоты (20 мл), насыщенным раствором бикарбоната натрия (20 мл) и насыщенным раствором хлорида натрия (20 мл). Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:1), 0,021 г соединения, указанного в заголовке.0.051 ml of triethylamine and a solution of 0.058 g of a complex of sulfur trioxide-pyridine in 1 ml of dimethyl sulfoxide are added to a solution of 0.038 g of tert-butyl-4- [1- (2-butynyl) -4- (carbamoylhydroxymethyl) -5-methoxycarbonyl-1H-imidazole- 2-yl] piperazine-1-carboxylate in 2 ml of dichloromethane at 0 ° C and the mixture was stirred at room temperature for 15 hours. Then, 0.102 ml of triethylamine and a solution of 0.116 g of a complex of sulfur trioxide-pyridine in 1 ml of dimethyl sulfoxide are added and the mixture is stirred at room temperature for 8 hours. 50 ml of ethyl acetate was added to the solution, and the organic layer was washed successively with an aqueous solution of 1% sulfuric acid (20 ml), saturated sodium bicarbonate solution (20 ml) and saturated sodium chloride solution (20 ml). The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.021 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,82 (т, J=2,5 Гц, 3H), 3,19-3,23 (м, 4H), 3,56-3,59 (м, 4H), 3,84 (с, 3H), 4,84 (кв, J=2,5 Гц, 2H), 5,62 (уш.с, 1H), 7,02 (уш.с, 1H).δ 1.48 (s, 9H), 1.82 (t, J = 2.5 Hz, 3H), 3.19-3.23 (m, 4H), 3.56-3.59 (m, 4H ), 3.84 (s, 3H), 4.84 (q, J = 2.5 Hz, 2H), 5.62 (br s, 1H), 7.02 (br s, 1H).
(d) трет-Бутил-4-[1-(2-бутинил)-4-карбамоил-6-метил-7-оксо-6,7-дигидро-1H-дигидроимидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [1- (2-butynyl) -4-carbamoyl-6-methyl-7-oxo-6,7-dihydro-1H-dihydroimidazo [4,5-d] pyridazin-2- sludge] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[4-аминооксалил-1-(2-бутинил)-5-метоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(h).The title compound was prepared by using tert-butyl-4- [4-aminooxalyl-1- (2-butynyl) -5-methoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate according to the method described in Example 115 (h).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 3,46-3,50 (м, 4H), 3,63-3,66 (м, 4H), 3,99 (с, 3H), 5,12 (кв, J=2,3 Гц, 2H), 6,16 (с, 1H), 8,85 (с, 1H).δ 1.50 (s, 9H), 1.84 (t, J = 2.3 Hz, 3H), 3.46-3.50 (m, 4H), 3.63-3.66 (m, 4H ), 3.99 (s, 3H), 5.12 (q, J = 2.3 Hz, 2H), 6.16 (s, 1H), 8.85 (s, 1H).
(e) Трифторацетат 1-(2-бутинил)-6-метил-7-оксо-2-(пиперазин-1-ил)-6,7-дигидроимидазо[4,5-d]пиридазин-4-карбоксамида(e) 1- (2-Butynyl) -6-methyl-7-oxo-2- (piperazin-1-yl) -6,7-dihydroimidazo [4,5-d] pyridazin-4-carboxamide trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-4-карбамоил-6-метил-7-оксо-6,7-дигидро-1H-дигидроимидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(i).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -4-carbamoyl-6-methyl-7-oxo-6,7-dihydro-1H-dihydroimidazo [4,5- d] pyridazin-2-yl] piperazine-1-carboxylate according to the method described in example 115 (i).
МС m/e (ESI) 330,18 (MH+-CF3COOH).MS m / e (ESI) 330.18 (MH + -CF 3 COOH).
Пример 333Example 333
Трифторацетат 1-(2-бутинил)-6-метил-7-оксо-2-(пиперазин-1-ил)-6,7-дигидроимидазо[4,5-d]пиридазин-4-карбонитрила1- (2-Butynyl) -6-methyl-7-oxo-2- (piperazin-1-yl) -6,7-dihydroimidazo [4,5-d] pyridazin-4-carbonitrile trifluoroacetate
Добавляют 0,030 мл триэтиламина и 0,015 мл оксихлорида фосфора к раствору 0,015 г трет-бутил-4-[1-(2-бутинил)-4-карбамоил-6-метил-7-оксо-6,7-дигидро-1H-дигидроимидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 1 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к этому раствору 1 мл дихлорметана и 1 мл трифторуксусной кислоты. Спустя один час раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,001 г соединения, указанного в заголовке.0.030 ml of triethylamine and 0.015 ml of phosphorus oxychloride are added to a solution of 0.015 g of tert-butyl-4- [1- (2-butynyl) -4-carbamoyl-6-methyl-7-oxo-6,7-dihydro-1H-dihydroimidazo [ 4,5-d] pyridazin-2-yl] piperazin-1-carboxylate in 1 ml of dichloromethane and the mixture was stirred at room temperature for 15 hours. 1 ml of dichloromethane and 1 ml of trifluoroacetic acid are added to this solution. After one hour, the solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.001 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,83 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,74-3,78 (м, 4H), 3,88 (с, 3H), 5,18 (кв, J=2,3 Гц, 2H).δ 1.83 (t, J = 2.3 Hz, 3H), 3.45-3.49 (m, 4H), 3.74-3.78 (m, 4H), 3.88 (s, 3H ), 5.18 (q, J = 2.3 Hz, 2H).
MC m/e (ESI) 312,25 (MH+-CF3COOH).MS m / e (ESI) 312.25 (MH + -CF 3 COOH).
Пример 334Example 334
Трифторацетат 3-(2-бутинил)-7-диметиламино-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -7-dimethylamino-5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) 1-Бензил-7-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он ( a) 1-Benzyl-7-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one
Добавляют 0,604 г карбоната калия и 0,297 мл метилйодида к раствору 1,035 г 1-бензил-7-хлор-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 30 мл N,N-диметилформамида (J. A. Carbon, Journal of the American Chemical Society, 80, p. 6083, 1958) и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к раствору 300 мл этилацетата и 100 мл воды и органический слой промывают два раза водой (100 мл) и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной этилацетатом, 0,280 г соединения, указанного в заголовке.0.604 g of potassium carbonate and 0.297 ml of methyl iodide are added to a solution of 1.035 g of 1-benzyl-7-chloro-1,5-dihydroimidazo [4,5-d] pyridazin-4-one in 30 ml of N, N-dimethylformamide (JA Carbon, Journal of the American Chemical Society, 80, p. 6083, 1958) and the mixture was stirred at room temperature for 15 hours. 300 ml of ethyl acetate and 100 ml of water are added to the solution, and the organic layer is washed twice with water (100 ml) and then 100 ml of a saturated solution of sodium chloride. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.280 g of the title compound was obtained from the fraction eluted with ethyl acetate.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,86 (с, 3H), 5,64 (с, 2H), 7,11-7,16 (м, 2H), 7,35-7,43 (м, 3H), 7,90 (с, 1H).δ 3.86 (s, 3H), 5.64 (s, 2H), 7.11-7.16 (m, 2H), 7.35-7.43 (m, 3H), 7.90 (s , 1H).
(b) 1-Бензил-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он(b) 1-Benzyl-7-dimethylamino-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one
Добавляют 2 мл водного раствора 50% диметиламина к раствору 0,138 г 1-бензил-7-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 2 мл этанола и смесь нагревают при 130ºC в течение 72 часов. Реакционный раствор охлаждают до комнатной температуры и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью метанол-этилацетат (1:19), 0,139 г соединения, указанного в заголовке.Add 2 ml of an aqueous solution of 50% dimethylamine to a solution of 0.138 g of 1-benzyl-7-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one in 2 ml of ethanol and the mixture is heated at 130 ° C within 72 hours. The reaction solution was cooled to room temperature and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.139 g of the title compound was obtained from the fraction eluted with methanol-ethyl acetate (1:19).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 2,73 (с, 6H), 3,79 (с, 3H), 5,59 (с, 2H), 7,12-7,16 (м, 2H), 7,30-7,39 (м, 3H), 7,79 (с, 1H).δ 2.73 (s, 6H), 3.79 (s, 3H), 5.59 (s, 2H), 7.12-7.16 (m, 2H), 7.30-7.39 (m , 3H); 7.79 (s, 1H).
(c) 1-Бензил-2-хлор-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он(c) 1-Benzyl-2-chloro-7-dimethylamino-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one
Добавляют 1,15 мл 1 M раствора дибутилмагния в тетрагидрофуране к раствору 0,320 мл диизопропиламина в 2 мл тетрагидрофурана при комнатной температуре в атмосфере азота и смесь перемешивают в течение 8 часов. Этот раствор добавляют к раствору 0,162 г 1-бензил-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 4 мл тетрагидрофурана при комнатной температуре в атмосфере азота и смесь перемешивают при комнатной температуре в течение 15 часов. Затем в этот раствор добавляют по каплям раствор 0,540 г гексахлорэтана в 5 мл тетрагидрофурана. После перемешивания смеси в течение 4 часов в нее добавляют 30 мл 5% водного раствора хлорида аммония. Смесь экстрагируют этилацетатом (100 мл). Органический слой промывают последовательно водой (30 мл) и 30 мл насыщенного раствора хлорида натрия и сушат над сульфатом магния. Органический слой концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (2:1), 0,094 г соединения, указанного в заголовке.1.15 ml of a 1 M solution of dibutyl magnesium in tetrahydrofuran was added to a solution of 0.320 ml of diisopropylamine in 2 ml of tetrahydrofuran at room temperature under a nitrogen atmosphere, and the mixture was stirred for 8 hours. This solution was added to a solution of 0.162 g of 1-benzyl-7-dimethylamino-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one in 4 ml of tetrahydrofuran at room temperature under a nitrogen atmosphere and the mixture was stirred at room temperature for 15 hours. Then, a solution of 0.540 g of hexachloroethane in 5 ml of tetrahydrofuran is added dropwise to this solution. After the mixture was stirred for 4 hours, 30 ml of a 5% aqueous solution of ammonium chloride was added thereto. The mixture was extracted with ethyl acetate (100 ml). The organic layer was washed successively with water (30 ml) and 30 ml of a saturated solution of sodium chloride and dried over magnesium sulfate. The organic layer was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.094 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 2,68 (с, 6H), 3,78 (с, 3H), 5,60 (с, 2H), 7,05-7,08 (м, 2H), 7,29-7,37 (м, 3H).δ 2.68 (s, 6H), 3.78 (s, 3H), 5.60 (s, 2H), 7.05-7.08 (m, 2H), 7.29-7.37 (m , 3H).
(d) трет-Бутил-4-[1-бензил-7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [1-benzyl-7-dimethylamino-5-methyl-4-oxo-4,5-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin- 1-carboxylate
Соединение, указанное в заголовке, получают путем использования 1-бензил-2-хлор-7-диметиламино-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она по способу, описанному в примере 116(c).The title compound was prepared by using 1-benzyl-2-chloro-7-dimethylamino-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one according to the method described in example 116 ( c)
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,47 (с, 9H), 2,68 (с, 6H), 3,19-3,22 (м, 4H), 3,41-3,46 (м, 4H), 3,76 (с, 3H), 5,40 (с, 2H), 6,88 (м, 2H), 7,20-7,25 (м, 3H).δ 1.47 (s, 9H), 2.68 (s, 6H), 3.19-3.22 (m, 4H), 3.41-3.46 (m, 4H), 3.76 (s , 3H), 5.40 (s, 2H), 6.88 (m, 2H), 7.20-7.25 (m, 3H).
(e) трет-Бутил-4-[7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(e) tert-Butyl-4- [7-dimethylamino-5-methyl-4-oxo-4,5-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate
Добавляют раствор 0,117 г трет-бутил-4-[1-бензил-7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата в 5 мл тетрагидрофурана к 15 мл жидкого аммиака и добавляют к смеси при кипячении с обратным холодильником 0,009 г лития. Добавляют к раствору 1 мл 5%-ного водного раствора хлорида аммония и растворитель выпаривают. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,007 г соединения, указанного в заголовке.A solution of 0.117 g of tert-butyl-4- [1-benzyl-7-dimethylamino-5-methyl-4-oxo-4,5-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine is added -1-carboxylate in 5 ml of tetrahydrofuran to 15 ml of liquid ammonia and 0.009 g of lithium are added to the mixture under reflux. 1 ml of a 5% aqueous solution of ammonium chloride was added to the solution, and the solvent was evaporated. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.007 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,48 (с, 9H), 3,11 (с, 6H), 3,55-3,58 (м, 8H), 3,69 (с, 3H).δ 1.48 (s, 9H), 3.11 (s, 6H), 3.55-3.58 (m, 8H), 3.69 (s, 3H).
(f) Трифторацетат 3-(2-бутинил)-7-диметиламино-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(f) 3- (2-Butynyl) -7-dimethylamino-5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[7-диметиламино-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата и 1-бром-2-бутина по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [7-dimethylamino-5-methyl-4-oxo-4,5-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazine-1-carboxylate and 1-bromo-2-butine according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,80 (т, J=2,3 Гц, 3H), 2,75 (с, 6H), 3,44-3,48 (м, 4H), 3,62-3,65 (м, 4H), 3,68 (с, 3H), 5,16 (кв, J=2,3 Гц, 2H).δ 1.80 (t, J = 2.3 Hz, 3H), 2.75 (s, 6H), 3.44-3.48 (m, 4H), 3.62-3.65 (m, 4H ), 3.68 (s, 3H), 5.16 (q, J = 2.3 Hz, 2H).
MC m/e (ESI) 330,16 (MH+-CF3COOH).MS m / e (ESI) 330.16 (MH + -CF 3 COOH).
Пример 335Example 335
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5-methyl-2- (piperidin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) Трифторацетат 5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(a) 5-Methyl-2- (piperidin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Добавляют 2,71 г хлорида железа (III) к раствору 0,292 г 4,5-диамино-2-метил-2H-пиридазин-3-она в 16 мл этанола [CAS No. 4725-76-2] (Martine Beljean-Leymarie, Michel Pays и Jean-Claude Richer, Canadian Journal of Chemistry 61, p. 2563, 1983) и 0,426 г трет-бутил-4-формилпиперидин-1-карбоксилата и смесь нагревают с обратным холодильником в течение 6 часов. Реакционный раствор охлаждают до комнатной температуры. Раствор фильтруют и концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,061 г соединения, указанного в заголовке.2.71 g of iron (III) chloride was added to a solution of 0.292 g of 4,5-diamino-2-methyl-2H-pyridazin-3-one in 16 ml of ethanol [CAS No. 4725-76-2] (Martine Beljean-Leymarie, Michel Pays and Jean-Claude Richer, Canadian Journal of Chemistry 61, p. 2563, 1983) and 0.426 g of tert-butyl-4-formylpiperidine-1-carboxylate and the mixture is heated with reflux for 6 hours. The reaction solution was cooled to room temperature. The solution was filtered and concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to obtain 0.061 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 2,06-2,17 (м, 2H), 2,28-2,35 (м, 2H), 3,15-3,24 (м, 2H), 3,29-3,35 (м, 1H), 3,50-3,56 (м, 2H), 3,85 (с, 3H), 8,28 (с, 1H).δ 2.06-2.17 (m, 2H), 2.28-2.35 (m, 2H), 3.15-3.24 (m, 2H), 3.29-3.35 (m, 1H), 3.50-3.56 (m, 2H), 3.85 (s, 3H), 8.28 (s, 1H).
(b) трет-Бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-1-карбоксилат(b) tert-Butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperidine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трифторацетата 5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она по способу, описанному в примере 258(a).The title compound was prepared by using 5-methyl-2- (piperidin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate according to the method described in Example 258 (a )
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 2,00-2,16 (м, 4H), 2,85-2,99 (уш.с, 2H), 3,23 (тт, J=11,9, 4,0 Гц, 1H), 3,95 (с, 3H), 4,11-4,40 (уш.с, 2H), 8,39 (с, 1H), 13,90 (с, 1H).δ 1.50 (s, 9H), 2.00-2.16 (m, 4H), 2.85-2.99 (br s, 2H), 3.23 (t, J = 11.9, 4.0 Hz, 1H), 3.95 (s, 3H), 4.11-4.40 (br s, 2H), 8.39 (s, 1H), 13.90 (s, 1H).
(c) трет-Бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперидин-1-карбоксилат(c) tert-Butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperidin- 1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-(6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил)пиперидин-1-карбоксилата по способу, описанному в примере 119(d).The title compound was prepared by using tert-butyl-4- (6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl) piperidin-1- carboxylate according to the method described in example 119 (d).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,81 (т, J=2,3 Гц, 3H), 1,93-2,00 (м, 4H), 2,85-2,96 (уш.с, 2H), 3,14 (кв, J=7,9 Гц, 1H), 3,85 (с, 3H), 4,16-4,37 (уш.с, 2H), 5,39 (кв, J=2,3 Гц, 2H), 8,24 (с, 1H).δ 1.48 (s, 9H), 1.81 (t, J = 2.3 Hz, 3H), 1.93-2.00 (m, 4H), 2.85-2.96 (br s , 2H), 3.14 (q, J = 7.9 Hz, 1H), 3.85 (s, 3H), 4.16-4.37 (br s, 2H), 5.39 (q, J = 2.3 Hz, 2H), 8.24 (s, 1H).
(d) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперидин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(d) 3- (2-Butynyl) -5-methyl-2- (piperidin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперидин-1-карбоксилата по способу, описанному в примере 115(i).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin- 2-yl] piperidin-1-carboxylate according to the method described in example 115 (i).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,80 (т, J=2,3 Гц, 3H), 2,10-2,11 (м, 2H), 2,25-2,32 (м, 2H), 3,18-3,41 (м, 3H), 3,56-3,61 (м, 2H), 3,83 (с, 3H), 5,47 (т, J=2,3 Гц, 2H), 8,27 (с, 1H).δ 1.80 (t, J = 2.3 Hz, 3H), 2.10-2.11 (m, 2H), 2.25-2.32 (m, 2H), 3.18-3.41 (m, 3H), 3.56-3.61 (m, 2H), 3.83 (s, 3H), 5.47 (t, J = 2.3 Hz, 2H), 8.27 (s, 1H).
MC m/e (ESI), 286,27 (MH+-CF3COOH).MS m / e (ESI), 286.27 (MH + -CF 3 COOH).
Пример 336Example 336
Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
(a) 3-(2-Бутинил)-4-хлор-3H-имидазо[4,5-c]пиридин(a) 3- (2-Butynyl) -4-chloro-3H-imidazo [4,5-c] pyridine
Суспендируют 2,0 г 4-хлор-1H-имидазо[4,5-c]пиридина, 1,37 мл 1-бром-2-бутина и 1,98 г карбоната калия в 15 мл N,N-диметилформамида и суспензию перемешивают при комнатной температуре в течение 18 часов. Реакционный раствор разбавляют этилацетатом и промывают водой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью гексан-этилацетат (1:2), 1,79 г смеси (1:1), состоящей из соединения, указанного в заголовке, и соединения, алкилированного в положение-1.2.0 g of 4-chloro-1H-imidazo [4,5-c] pyridine, 1.37 ml of 1-bromo-2-butine and 1.98 g of potassium carbonate in 15 ml of N, N-dimethylformamide are suspended and the suspension is stirred at room temperature for 18 hours. The reaction solution was diluted with ethyl acetate and washed with water. The organic layer was dried over anhydrous magnesium sulfate, then filtered. The filtrate was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 1.79 g of the mixture (1: 1) consisting of the title compound and the compound alkylated at position-1 were obtained from the fraction eluted with hexane-ethyl acetate (1: 2).
(b) 3-(2-Бутинил)-2,4-дихлор-3H-имидазо[4,5-c]пиридин(b) 3- (2-Butynyl) -2,4-dichloro-3H-imidazo [4,5-c] pyridine
Добавляют по каплям раствор диизопропиламида лития в 2,22 мл тетрагидрофурана к 5 мл тетрагидрофуранового раствора 490 мг 3-(2-бутинил)-4-хлор-3H-имидазо[4,5-c]пиридина в бане со смесью сухой лед-метанол и смесь перемешивают при температуре ниже -66ºC в течение 20 минут. Образовавшуюся реакционную смесь добавляют по каплям к раствору 1,13 г гексахлорэтана в 2 мл тетрагидрофурана, при этом контролируют, чтобы температура смеси была -63ºC или ниже. Смесь перемешивают в течение 1 часа и 40 минут в той же самой бане и затем добавляют к раствору насыщенный водный раствор хлорида аммония. Образовавшуюся смесь экстрагируют два раза этилацетатом и органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Затем образовавшийся остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью гексан-этилацетат (2:1), 120 мг коричневого маслянистого материала.A solution of lithium diisopropylamide in 2.22 ml of tetrahydrofuran to 5 ml of a tetrahydrofuran solution of 490 mg of 3- (2-butynyl) -4-chloro-3H-imidazo [4,5-c] pyridine is added dropwise in a bath with a mixture of dry ice-methanol and the mixture is stirred at a temperature below -66ºC for 20 minutes. The resulting reaction mixture was added dropwise to a solution of 1.13 g of hexachloroethane in 2 ml of tetrahydrofuran, while controlling that the temperature of the mixture was -63 ° C or lower. The mixture was stirred for 1 hour and 40 minutes in the same bath, and then a saturated aqueous solution of ammonium chloride was added to the solution. The resulting mixture was extracted twice with ethyl acetate and the organic layer was dried over anhydrous magnesium sulfate, then filtered. The filtrate was concentrated under reduced pressure. Then, the resulting residue is purified by silica gel column chromatography. Thus, 120 mg of a brown oily material was obtained from the fraction eluted with hexane-ethyl acetate (2: 1).
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 1,78 (с, 3H), 5,29 (с, 2H), 7,70 (д, J=5,6 Гц, 1H), 8,21 (д, J=5,6 Гц, 1H).δ 1.78 (s, 3H), 5.29 (s, 2H), 7.70 (d, J = 5.6 Hz, 1H), 8.21 (d, J = 5.6 Hz, 1H) .
(c) трет-Бутил-4-[3-(2-бутинил)-4-хлор-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилат(c) tert-Butyl-4- [3- (2-butynyl) -4-chloro-3H-imidazo [4,5-c] pyridin-2-yl] piperazine-1-carboxylate
Растворяют в этаноле 211 мг трет-бутил-3-(2-бутинил)-2,4-дихлор-3H-имидазо[4,5-c]пиридина, 197 мг пиперазин-1-карбоксилата и 222 мг бикарбоната натрия, смесь перемешивают при 80ºC в течение 30 минут и затем при комнатной температуре в течение трех часов и 20 минут. Реакционный раствор разбавляют этилацетатом и раствор промывают водой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью гексан-этилацетат (3:1), 244 мг соединения, указанного в заголовке.211 mg of tert-butyl-3- (2-butynyl) -2,4-dichloro-3H-imidazo [4,5-c] pyridine, 197 mg of piperazine-1-carboxylate and 222 mg of sodium bicarbonate are dissolved in ethanol, the mixture is stirred at 80ºC for 30 minutes and then at room temperature for three hours and 20 minutes. The reaction solution was diluted with ethyl acetate and the solution was washed with water. The organic layer was dried over anhydrous magnesium sulfate, then filtered. The filtrate was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 244 mg of the title compound was obtained from the fraction eluted with hexane-ethyl acetate (3: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,52 (с, 9H), 1,87 (с, 3H), 3,47-3,49 (м, 4H), 3,65-3,68 (м, 4H), 4,94 (с, 2H), 7,41 (д, J=5,2 Гц, 1H), 8,15 (д, J=5,2 Гц, 1H).δ 1.52 (s, 9H), 1.87 (s, 3H), 3.47-3.49 (m, 4H), 3.65-3.68 (m, 4H), 4.94 (s , 2H), 7.41 (d, J = 5.2 Hz, 1H), 8.15 (d, J = 5.2 Hz, 1H).
(d) Трифторацетат 3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она(d) 3- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
Растворяют 98 мг ацетата натрия в 2 мл диметилсульфоксида, содержащего 0,3 ммоль трет-бутил-4-[3-(2-бутинил)-4-хлор-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата, и смесь перемешивают при 120ºC в течение 4 часов. Затем добавляют к реакционному раствору 100 мг карбоната калия и 1 мл метилйодида. Смесь перемешивают при комнатной температуре. Реакционный раствор разбавляют этилацетатом и раствор промывают водой. Органический слой сушат над безводным сульфатом магния, затем фильтруют. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Растворяют 5 мг продукта, полученного из фракции, элюированной смесью метанол-этилацетат (1:10), в 0,5 мл трифторуксусной кислоты и смесь концентрируют. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,55 мг соединения, указанного в заголовке.98 mg of sodium acetate is dissolved in 2 ml of dimethyl sulfoxide containing 0.3 mmol of tert-butyl-4- [3- (2-butynyl) -4-chloro-3H-imidazo [4,5-c] pyridin-2-yl] piperazine-1-carboxylate, and the mixture was stirred at 120 ° C for 4 hours. Then, 100 mg of potassium carbonate and 1 ml of methyl iodide are added to the reaction solution. The mixture was stirred at room temperature. The reaction solution was diluted with ethyl acetate and the solution was washed with water. The organic layer was dried over anhydrous magnesium sulfate, then filtered. The filtrate was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. 5 mg of the product obtained from the fraction eluted with methanol-ethyl acetate (1:10) was dissolved in 0.5 ml of trifluoroacetic acid, and the mixture was concentrated. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.55 mg of the title compound.
МС m/e (ESI) 286 (MH+-CF3COOH).MS m / e (ESI) 286 (MH + -CF 3 COOH).
Пример 337Example 337
Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она3-benzyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
(a) Аллил-(3-нитропиридин-4-ил)амин(a) Allyl- (3-nitropyridin-4-yl) amine
Добавляют 40 мл аллиламина к раствору 18,0 г гидрохлорида 4-этокси-3-нитропиридина в 400 мл этанола и смесь нагревают с обратным холодильником в течение 8 часов. Реакционный раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (1:1), 13,6 г соединения, указанного в заголовке.40 ml of allylamine is added to a solution of 18.0 g of 4-ethoxy-3-nitropyridine hydrochloride in 400 ml of ethanol, and the mixture is heated under reflux for 8 hours. The reaction solution was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 13.6 g of the title compound were obtained from the fraction eluted with ethyl acetate-hexane (1: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 4,00 (м, 2H), 5,29-5,35 (м, 2H), 5,87-5,98 (м, 1H), 6,63 (д, J=6,5 Гц, 1H), 8,30 (д, J=6,5 Гц, 1H), 8,31 (уш.с, 1H), 9,23 (с, 1H).δ 4.00 (m, 2H), 5.29-5.35 (m, 2H), 5.87-5.98 (m, 1H), 6.63 (d, J = 6.5 Hz, 1H ), 8.30 (d, J = 6.5 Hz, 1H), 8.31 (br s, 1H), 9.23 (s, 1H).
(b) N*-4*-Аллил-2-хлорпиридин-3,4-диамин(b) N * -4 * -allyl-2-chloropyridin-3,4-diamine
Добавляют 55 мл 35%-ной соляной кислоты к 3,02 г аллил-(3-нитропиридин-4-ил)амина и смесь нагревают до 90ºC. Добавляют к этому раствору 19,1 г хлорида олова и смесь выдерживают при 90ºC в течение 30 минут. Реакционный раствор охлаждают на водяной бане со льдом и затем добавляют к раствору 250 мл воды со льдом. Реакционный раствор концентрируют при пониженном давлении и затем добавляют к раствору 250 мл метанола, насыщенного аммиаком. Смесь перемешивают в течение 20 часов. Добавляют к раствору 750 мл этилацетата и смесь фильтруют через целит. Фильтрат концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (1:1), 2,88 г соединения, указанного в заголовке.55 ml of 35% hydrochloric acid are added to 3.02 g of allyl- (3-nitropyridin-4-yl) amine and the mixture is heated to 90 ° C. 19.1 g of tin chloride are added to this solution and the mixture is kept at 90 ° C for 30 minutes. The reaction solution was cooled in an ice water bath and then 250 ml of ice water was added to the solution. The reaction solution was concentrated under reduced pressure and then 250 ml of methanol saturated with ammonia were added to the solution. The mixture was stirred for 20 hours. 750 ml of ethyl acetate are added to the solution and the mixture is filtered through celite. The filtrate was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 2.88 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (1: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 3,29-3,58 (уш.с, 2H), 3,84 (д, J=6,3 Гц, 2H), 4,26-4,37 (уш.с, 1H), 5,24 (д, J=11,0 Гц, 1H), 5,29 (д, J=16,0 Гц, 1H), 5,85-5,98 (ддт, J=16,0, 11,0, 6,5 Гц, 1H), 6,43 (д, J=6,5 Гц, 1H), 7,66 (д, J=6,5 Гц, 1H).δ 3.29-3.58 (br s, 2H), 3.84 (d, J = 6.3 Hz, 2H), 4.26-4.37 (br s, 1H), 5.24 (d, J = 11.0 Hz, 1H), 5.29 (d, J = 16.0 Hz, 1H), 5.85-5.98 (ddt, J = 16.0, 11.0, 6 5 Hz, 1H), 6.43 (d, J = 6.5 Hz, 1H), 7.66 (d, J = 6.5 Hz, 1H).
(c) 1-Аллил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-он(c) 1-Allyl-4-chloro-1,3-dihydroimidazo [4,5-c] pyridin-2-one
Добавляют раствор 4,46 г N,N'-дисукцинимидилкарбоната в 400 мл ацетонитрила к раствору, содержащему 2,88 г N*-4*-аллил-2-хлоропиридин-3,4-диамина в ацетонитриле, и смесь нагревают с обратным холодильником в течение 70 часов. Раствор концентрируют при пониженном давлении и остаток растворяют в смеси, состоящей из 500 мл этилацетата и 300 мл воды. Органический слой промывают два раза 1 н. соляной кислотой (100 мл) и затем насыщенным раствором хлорида натрия (100 мл). Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-дихлорметан (1:1), 2,30 г соединения, указанного в заголовке.A solution of 4.46 g of N, N'-disuccinimidyl carbonate in 400 ml of acetonitrile was added to a solution containing 2.88 g of N * -4 * -allyl-2-chloropyridin-3,4-diamine in acetonitrile, and the mixture was heated under reflux. for 70 hours. The solution was concentrated under reduced pressure and the residue was dissolved in a mixture of 500 ml of ethyl acetate and 300 ml of water. The organic layer is washed twice with 1 N. hydrochloric acid (100 ml) and then a saturated solution of sodium chloride (100 ml). The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 2.30 g of the title compound was obtained from the fraction eluted with ethyl acetate-dichloromethane (1: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 4,51 (д, J=5,7 Гц, 1H), 5,25, (д, J=16,0 Гц, 1H), 5,30 (д, J=10,9 Гц, 1H), 5,85-5,95 (ддт, J=16,0, 10,9, 5,7 Гц, 1H), 6,91 (д, J=6,9 Гц, 1H), 8,10 (д, J=6,9 Гц, 1H), 8,99 (уш.с, 1H).δ 4.51 (d, J = 5.7 Hz, 1H), 5.25, (d, J = 16.0 Hz, 1H), 5.30 (d, J = 10.9 Hz, 1H), 5.85-5.95 (ddt, J = 16.0, 10.9, 5.7 Hz, 1H), 6.91 (d, J = 6.9 Hz, 1H), 8.10 (d, J = 6.9 Hz, 1H), 8.99 (br s, 1H).
(d) 1-Аллил-3-бензил-4-хлоро-1,3-дигидроимидазо[4,5-c]пиридин-2-он(d) 1-Allyl-3-benzyl-4-chloro-1,3-dihydroimidazo [4,5-c] pyridin-2-one
Добавляют 0,76 г карбоната калия и 0,94 г бензилбромида к раствору 1,05 г 1-аллил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-она в 50 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 14 часов. Добавляют к этому раствору 300 мл воды и 300 мл этилацетата, органический слой промывают три раза водой (100 мл) и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении, получая 1,57 г соединения, указанного в заголовке.0.76 g of potassium carbonate and 0.94 g of benzyl bromide are added to a solution of 1.05 g of 1-allyl-4-chloro-1,3-dihydroimidazo [4,5-c] pyridin-2-one in 50 ml of N, N β-dimethylformamide and the mixture was stirred at room temperature for 14 hours. 300 ml of water and 300 ml of ethyl acetate are added to this solution, the organic layer is washed three times with water (100 ml) and then 100 ml of a saturated solution of sodium chloride. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure to obtain 1.57 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 4,56 (д, J=5,7 Гц, 1H), 5,23 (д, J=16,0 Гц, 1H), 5,30 (д, J=10,9 Гц, 1H), 5,44 (с, 2H), 5,85-5,95 (ддт, J=16,0, 10,9, 5,7 Гц, 1H), 6,91 (д, J=6,9 Гц, 1H), 7,25-7,34 (м, 5H), 8,08 (д, J=6,9 Гц, 1H), 8,99 (уш.с, 1H).δ 4.56 (d, J = 5.7 Hz, 1H), 5.23 (d, J = 16.0 Hz, 1H), 5.30 (d, J = 10.9 Hz, 1H), 5 44 (s, 2H), 5.85-5.95 (ddt, J = 16.0, 10.9, 5.7 Hz, 1H), 6.91 (d, J = 6.9 Hz, 1H ), 7.25-7.34 (m, 5H), 8.08 (d, J = 6.9 Hz, 1H), 8.99 (br s, 1H).
(e) 3-Бензил-4-хлоро-1,3-дигидроимидазо[4,5-c]пиридин-2-он(e) 3-Benzyl-4-chloro-1,3-dihydroimidazo [4,5-c] pyridin-2-one
Добавляют 1,5 мл воды, 1,06 г 4-метилморфолин-N-оксида, 3 мл водного раствора (2%) осмиевой кислоты и 6 мл водного раствора 1,94 г периодата натрия к раствору 0,75 г 1-аллил-3-бензил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-она в 15 мл 1,4-диоксана и смесь нагревают при 60ºC в течение 18 часов. Добавляют к раствору 200 мл воды и смесь экстрагируют 100 мл этилацетата. Органический слой промывают два раза водой (50 мл) и затем промывают 50 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (1:1), 0,38 г соединения, указанного в заголовке.1.5 ml of water, 1.06 g of 4-methylmorpholine-N-oxide, 3 ml of an aqueous solution (2%) of osmic acid and 6 ml of an aqueous solution of 1.94 g of sodium periodate are added to a solution of 0.75 g of 1-allyl- 3-benzyl-4-chloro-1,3-dihydroimidazo [4,5-c] pyridin-2-one in 15 ml of 1,4-dioxane and the mixture is heated at 60 ° C for 18 hours. 200 ml of water are added to the solution and the mixture is extracted with 100 ml of ethyl acetate. The organic layer was washed twice with water (50 ml) and then washed with 50 ml of a saturated solution of sodium chloride. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.38 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (1: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 5,44 (с, 2H), 7,01 (д, J=6,5 Гц, 1H), 7,30-7,38 (м, 5H), 8,08 (д, J=6,5 Гц, 1H), 9,18 (с, 1H).δ 5.44 (s, 2H), 7.01 (d, J = 6.5 Hz, 1H), 7.30-7.38 (m, 5H), 8.08 (d, J = 6.5 Hz, 1H), 9.18 (s, 1H).
(f) 3-Бензил-2,4-дихлор-1,3-дигидроимидазо[4,5-c]пиридин(f) 3-Benzyl-2,4-dichloro-1,3-dihydroimidazo [4,5-c] pyridine
Добавляют 5 мл оксихлорида фосфора и 0,338 г пентахлорида фосфора к 0,383 г 3-бензил-4-хлор-1,3-дигидроимидазо[4,5-c]пиридин-2-она и смесь нагревают с обратным холодильником в течение 24 часов. Раствор концентрируют при пониженном давлении и остаток выливают в 50 г ледяной воды. Смесь экстрагируют 100 мл этилацетата. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом, получают из фракции, элюированной смесью этилацетат-гексан (2:1), 0,13 г соединения, указанного в заголовке.5 ml of phosphorus oxychloride and 0.338 g of phosphorus pentachloride are added to 0.383 g of 3-benzyl-4-chloro-1,3-dihydroimidazo [4,5-c] pyridin-2-one and the mixture is heated under reflux for 24 hours. The solution was concentrated under reduced pressure and the residue was poured into 50 g of ice water. The mixture was extracted with 100 ml of ethyl acetate. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.13 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 5,43 (с, 2H), 7,12 (д, J=6,5 Гц, 1H), 7,30-7,38 (м, 5H), 8,18 (д, J=6,5 Гц, 1H).δ 5.43 (s, 2H), 7.12 (d, J = 6.5 Hz, 1H), 7.30-7.38 (m, 5H), 8.18 (d, J = 6.5 Hz, 1H).
(g) трет-Бутил-4-(3-бензил-4-хлоро-3H-имидазо[4,5-c]пиридин-2-ил)пиперазин-1-карбоксилат(g) tert-Butyl-4- (3-benzyl-4-chloro-3H-imidazo [4,5-c] pyridin-2-yl) piperazine-1-carboxylate
Добавляют 0,094 г трет-бутилпиперазин-1-карбоксилата к раствору 0,127 г 3-бензил-2,4-дихлор-1,3-дигидроимидазо[4,5-c]пиридина в 1 мл N,N-диметилформамида и смесь нагревают при 150ºC в течение двух часов. Добавляют к смеси 25 мл этилацетата и органический слой промывают три раза водой (10 мл) и затем 10 мл водного насыщенного раствора хлорида натрия. Органическую жидкость сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (3:2), 0,029 г соединения, указанного в заголовке.0.094 g of tert-butyl piperazine-1-carboxylate is added to a solution of 0.127 g of 3-benzyl-2,4-dichloro-1,3-dihydroimidazo [4,5-c] pyridine in 1 ml of N, N-dimethylformamide and the mixture is heated at 150 ° C in two hours. 25 ml of ethyl acetate were added to the mixture and the organic layer was washed three times with water (10 ml) and then 10 ml of an aqueous saturated sodium chloride solution. The organic liquid was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.029 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (3: 2).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,44 (с, 9H), 3,21-3,25 (м, 4H), 3,49-3,53 (м, 4H), 5,53 (с, 2H), 7,08 (д, J=6,5 Гц, 1H), 7,30-7,38 (м, 5H), 8,14 (д, J=6,5 Гц, 1H).δ 1.44 (s, 9H), 3.21-3.25 (m, 4H), 3.49-3.53 (m, 4H), 5.53 (s, 2H), 7.08 (d , J = 6.5 Hz, 1H), 7.30-7.38 (m, 5H), 8.14 (d, J = 6.5 Hz, 1H).
(h) Трифторацетат 3-бензил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она(h) 3-Benzyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
Добавляют 1 мл воды и 1 мл 35%-ной соляной кислоты к раствору 0,029 г трет-бутил-4-(3-бензил-4-хлор-3H-имидазо[4,5-c]пиридин-2-ил)пиперазин-1-карбоксилата в 2 мл N,N-диметилформамида и смесь кипятят с обратным холодильником в течение 36 часов. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,006 г соединения, указанного в заголовке.Add 1 ml of water and 1 ml of 35% hydrochloric acid to a solution of 0.029 g of tert-butyl-4- (3-benzyl-4-chloro-3H-imidazo [4,5-c] pyridin-2-yl) piperazine- 1-carboxylate in 2 ml of N, N-dimethylformamide and the mixture was refluxed for 36 hours. The solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.006 g of the title compound.
МС m/e (ESI) 310,29 (MH+-CF3COOH).MS m / e (ESI) 310.29 (MH + -CF 3 COOH).
Пример 338Example 338
Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она3- (2-Butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
(a) 2-Бром-1-(2-бутинил)-1H-имидазол-4,5-дикарбонитрил(a) 2-Bromo-1- (2-butynyl) -1H-imidazole-4,5-dicarbonitrile
Добавляют 69,8 г карбоната калия и раствор 74 мл 1-бром-2-бутина в 50 мл N,N-диметилформамида к раствору 90,6 г 2-бром-1H-имидазол-4,5-дикарбонитрила [CAS No 50847-09-1] в 520 мл N,N-диметилформамида и смесь нагревают при 50ºC в течение 8 часов. Добавляют к раствору 1 л этилацетата и 500 мл воды и органический слой промывают два раза водой (500 мл), затем 500 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (1:4), 48,0 г соединения, указанного в заголовке.69.8 g of potassium carbonate and a solution of 74 ml of 1-bromo-2-butyn in 50 ml of N, N-dimethylformamide are added to a solution of 90.6 g of 2-bromo-1H-imidazole-4,5-dicarbonitrile [CAS No. 50847- 09-1] in 520 ml of N, N-dimethylformamide and the mixture is heated at 50 ° C for 8 hours. 1 L of ethyl acetate and 500 ml of water are added to the solution, and the organic layer is washed twice with water (500 ml), then 500 ml of a saturated sodium chloride solution. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, from the fraction eluted with ethyl acetate-hexane (1: 4), 48.0 g of the title compound were obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,87 (т, J=2,3 Гц, 3H), 4,85 (кв, J=2,3 Гц, 2H).δ 1.87 (t, J = 2.3 Hz, 3H); 4.85 (q, J = 2.3 Hz, 2H).
(b) Этил-2-бром-1-(2-бутинил)-5-циано-1H-имидазол-4-карбоксилат(b) Ethyl 2-bromo-1- (2-butynyl) -5-cyano-1H-imidazole-4-carboxylate
Добавляют 25 мл концентрированной серной кислоты к раствору 48,0 г 2-бром-1-(2-бутинил)-1H-имидазол-4,5-дикарбонитрила в 500 мл этанола и смесь кипятят с обратным холодильником в течение 110 часов. Реакционный раствор охлаждают до комнатной температуры, затем концентрируют при пониженном давлении. Остаток растворяют в смеси, состоящей из 500 мл этилацетата и 500 мл воды, и значение pH раствора доводят до 8, используя гидроксид калия. Водный слой экстрагируют 500 мл этилацетата и органические слои объединяют. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (1:3), 21,7 г соединения, указанного в заголовке.25 ml of concentrated sulfuric acid was added to a solution of 48.0 g of 2-bromo-1- (2-butynyl) -1H-imidazole-4,5-dicarbonitrile in 500 ml of ethanol, and the mixture was refluxed for 110 hours. The reaction solution was cooled to room temperature, then concentrated under reduced pressure. The residue was dissolved in a mixture of 500 ml of ethyl acetate and 500 ml of water, and the pH of the solution was adjusted to 8 using potassium hydroxide. The aqueous layer was extracted with 500 ml of ethyl acetate and the organic layers were combined. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 21.7 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (1: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (т, J=7,0 Гц, 3H), 1,87 (т, J=2,3 Гц, 3H), 4,46 (кв, J=7,0 Гц, 2H), 4,85 (кв, J=2,3 Гц, 2H).δ 1.43 (t, J = 7.0 Hz, 3H), 1.87 (t, J = 2.3 Hz, 3H), 4.46 (q, J = 7.0 Hz, 2H), 4 85 (q, J = 2.3 Hz, 2H).
(c) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(c) tert-Butyl-4- [1- (2-butynyl) -5-cyano-4-ethoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Получают 25,1 г соединения, указанного в заголовке, путем использования 21,7 г этил-2-бром-1-(2-бутинил)-5-циано-1H-имидазол-4-карбоксилата по способу, описанному в примере 115(b).25.1 g of the title compound are obtained by using 21.7 g of ethyl 2-bromo-1- (2-butynyl) -5-cyano-1H-imidazole-4-carboxylate according to the method described in Example 115 ( b)
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,43 (т, J=7,0 Гц, 3H), 1,49 (с, 9H), 1,87 (т, J=2,3 Гц, 3H), 3,22-3,26 (м, 4H), 3,56-3,61 (м, 4H), 4,44 (кв, J=7,0 Гц, 2H), 4,68 (кв, J=2,3 Гц, 2H).δ 1.43 (t, J = 7.0 Hz, 3H), 1.49 (s, 9H), 1.87 (t, J = 2.3 Hz, 3H), 3.22-3.26 ( m, 4H), 3.56-3.61 (m, 4H), 4.44 (q, J = 7.0 Hz, 2H), 4.68 (q, J = 2.3 Hz, 2H).
(d) трет-Бутил-4-[1-(2-бутинил)-4-карбокси-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [1- (2-butynyl) -4-carboxy-5-cyano-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 16 мл 5 н. водного раствора гидроксида натрия к раствору 25,1 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-этоксикарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 500 мл этанола и смесь перемешивают при комнатной температуре в течение двух часов. Затем раствор концентрируют при пониженном давлении. Остаток растворяют в смеси, состоящей из 1 л этилацетата и 500 мл воды. Добавляют к раствору 50 мл 2 н. соляной кислоты. Органический слой промывают насыщенным раствором хлорида натрия (200 мл) и сушат над сульфатом магния. Органическую жидкость концентрируют при пониженном давлении, получая 23,2 г соединения, указанного в заголовке.Add 16 ml of 5 N. an aqueous solution of sodium hydroxide to a solution of 25.1 g of tert-butyl 4- [1- (2-butynyl) -5-cyano-4-ethoxycarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 500 ml of ethanol and the mixture was stirred at room temperature for two hours. Then, the solution was concentrated under reduced pressure. The residue is dissolved in a mixture of 1 l of ethyl acetate and 500 ml of water. 50 ml of 2 N are added to the solution. of hydrochloric acid. The organic layer was washed with a saturated solution of sodium chloride (200 ml) and dried over magnesium sulfate. The organic liquid was concentrated under reduced pressure to obtain 23.2 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,87 (т, J=2,3 Гц, 3H), 3,22-3,26 (м, 4H), 3,56-3,61 (м, 4H), 4,68 (кв, J=2,3 Гц, 2H).δ 1.49 (s, 9H), 1.87 (t, J = 2.3 Hz, 3H), 3.22-3.26 (m, 4H), 3.56-3.61 (m, 4H ), 4.68 (q, J = 2.3 Hz, 2H).
(e) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(e) tert-Butyl-4- [1- (2-butynyl) -5-cyano-4-hydroxymethyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют по каплям 6,9 г триэтиламина и затем раствор 10,19 г изобутилхлорформиата в 100 мл тетрагидрофурана к 600 мл тетрагидрофурана, содержащего 22,9 г трет-бутил-4-[1-(2-бутинил)-4-карбокси-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилата, при -10ºC. После удаления осадка путем фильтрации раствор снова охлаждают до -10ºC. К раствору добавляют по каплям 100 мл водного раствора 9,45 г борогидрида натрия. Спустя 1 час добавляют к раствору 500 мл этилацетата и 500 мл воды. Значение pH раствора устанавливают 5, используя 1 н. соляную кислоту, и затем доводят до 10, добавляя насыщенный раствор бикарбоната натрия. Органический слой промывают последовательно водой (500 мл) и 500 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (4:1), 19,1 г соединения, указанного в заголовке.6.9 g of triethylamine are added dropwise and then a solution of 10.19 g of isobutyl chloroformate in 100 ml of tetrahydrofuran to 600 ml of tetrahydrofuran containing 22.9 g of tert-butyl-4- [1- (2-butynyl) -4-carboxy-5 cyano-1H-imidazol-2-yl] piperazine-1-carboxylate, at -10 ° C. After removing the precipitate by filtration, the solution is again cooled to -10ºC. To the solution was added dropwise 100 ml of an aqueous solution of 9.45 g of sodium borohydride. After 1 hour, 500 ml of ethyl acetate and 500 ml of water are added to the solution. The pH of the solution is set to 5 using 1 N. hydrochloric acid, and then adjusted to 10 by adding a saturated solution of sodium bicarbonate. The organic layer was washed successively with water (500 ml) and 500 ml of a saturated solution of sodium chloride. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, from the fraction eluted with ethyl acetate-hexane (4: 1), 19.1 g of the title compound were obtained.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 2,26 (т, J=6,3 Гц, 1H), 3,13-3,17 (м, 4H), 3,53-3,57 (м, 4H), 4,58 (кв, J=2,3 Гц, 2H), 4,64 (д, J=6,3 Гц, 2H).δ 1.48 (s, 9H), 1.84 (t, J = 2.3 Hz, 3H), 2.26 (t, J = 6.3 Hz, 1H), 3.13-3.17 ( m, 4H), 3.53-3.57 (m, 4H), 4.58 (q, J = 2.3 Hz, 2H), 4.64 (d, J = 6.3 Hz, 2H).
(f) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(f) tert-Butyl-4- [1- (2-butynyl) -5-cyano-4-formyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 3,28 г диоксида марганца к раствору 1,35 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 5 мл дихлорметана. Реакционный раствор перемешивают при комнатной температуре в течение 15 часов, затем перемешивают и нагревают с обратным холодильником в течение пяти часов. Раствор фильтруют и затем концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 1,11 г соединения, указанного в заголовке.3.28 g of manganese dioxide are added to a solution of 1.35 g of tert-butyl-4- [1- (2-butynyl) -5-cyano-4-hydroxymethyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 5 ml of dichloromethane. The reaction solution was stirred at room temperature for 15 hours, then stirred and heated under reflux for five hours. The solution was filtered and then concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 1.11 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,88 (т, J=2,3 Гц, 3H), 3,24-3,28 (м, 4H), 3,59-3,63 (м, 4H), 4,70 (кв, J=2,3 Гц, 2H), 9,87 (с, 1H).δ 1.50 (s, 9H), 1.88 (t, J = 2.3 Hz, 3H), 3.24-3.28 (m, 4H), 3.59-3.63 (m, 4H ), 4.70 (q, J = 2.3 Hz, 2H), 9.87 (s, 1H).
(g) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-(2-этоксикарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат(g) tert-Butyl-4- [1- (2-butynyl) -5-cyano-4- (2-ethoxycarbonylvinyl) -1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 0,038 г гидрида натрия к раствору 0,243 г этилдиэтилфосфонацетата в 5 мл тетрагидрофурана при 5ºC и в атмосфере азота. Добавляют раствор 0,310 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-формил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 5 мл тетрагидрофурана и смесь перемешивают в течение 30 минут. Добавляют к раствору 50 мл этилацетата и 25 мл 0,1 н. раствора гидроксида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (3:7), 0,380 г соединения, указанного в заголовке.Add 0.038 g of sodium hydride to a solution of 0.243 g of ethyl diethylphosphonoacetate in 5 ml of tetrahydrofuran at 5 ° C and in a nitrogen atmosphere. A solution of 0.310 g of tert-butyl-4- [1- (2-butynyl) -5-cyano-4-formyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 5 ml of tetrahydrofuran is added and the mixture is stirred for 30 minutes. 50 ml of ethyl acetate and 25 ml of 0.1 N are added to the solution. sodium hydroxide solution. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.380 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (3: 7).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,33 (т, J=7,4 Гц, 3H), 1,50 (с, 9H), 1,86 (т, J=2,3 Гц, 3H), 3,19-3,23 (м, 4H), 3,55-3,59 (м, 4H), 4,25 (кв, J=7,4 Гц, 2H), 4,59 (кв, J=2,3 Гц, 2H), 6,70 (д, J=15,8 Гц, 1H), 7,50 (д, J=15,8 Гц, 1H).δ 1.33 (t, J = 7.4 Hz, 3H), 1.50 (s, 9H), 1.86 (t, J = 2.3 Hz, 3H), 3.19-3.23 ( m, 4H), 3.55-3.59 (m, 4H), 4.25 (q, J = 7.4 Hz, 2H), 4.59 (q, J = 2.3 Hz, 2H), 6.70 (d, J = 15.8 Hz, 1H); 7.50 (d, J = 15.8 Hz, 1H).
(h) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-(2-карбоксивинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат(h) tert-Butyl-4- [1- (2-butynyl) -5-cyano-4- (2-carboxyvinyl) -1H-imidazol-2-yl] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-5-циано-4-(2-этоксикарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 338(d).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -5-cyano-4- (2-ethoxycarbonylvinyl) -1H-imidazol-2-yl] piperazine-1-carboxylate according to the method described in example 338 (d).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,86 (т, J=2,3 Гц, 3H), 3,19-3,23 (м, 4H), 3,55-3,59 (м, 4H), 4,59 (кв, J=2,3 Гц, 2H), 6,70 (д, J=15,8 Гц, 1H), 7,50 (д, J=15,8 Гц, 1H).δ 1.50 (s, 9H), 1.86 (t, J = 2.3 Hz, 3H), 3.19-3.23 (m, 4H), 3.55-3.59 (m, 4H ), 4.59 (q, J = 2.3 Hz, 2H), 6.70 (d, J = 15.8 Hz, 1H), 7.50 (d, J = 15.8 Hz, 1H).
(i) трет-Бутил-4-[1-(2-бутинил)-5-циано-4-(2-азидкарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилат(i) tert-Butyl-4- [1- (2-butynyl) -5-cyano-4- (2-azidecarbonylvinyl) -1H-imidazol-2-yl] piperazine-1-carboxylate
Смесь, состоящую из 0,200 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-(2-карбоксивинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата, 0,073 мл триэтиламина и раствора 0,108 мл дифенилфосфорилазида в 2 мл трет-бутилового спирта, нагревают при 50ºC в атмосфере азота в течение 4 часов. Добавляют к раствору 50 мл этилацетата и смесь промывают 20 мл воды. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 0,178 г соединения, указанного в заголовке.Mixture consisting of 0.200 g of tert-butyl-4- [1- (2-butynyl) -5-cyano-4- (2-carboxyvinyl) -1H-imidazol-2-yl] piperazine-1-carboxylate, 0.073 ml of triethylamine and a solution of 0.108 ml of diphenylphosphoryl azide in 2 ml of tert-butyl alcohol, heated at 50 ° C under nitrogen for 4 hours. 50 ml of ethyl acetate are added to the solution and the mixture is washed with 20 ml of water. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.178 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,86 (т, J=2,2 Гц, 3H), 3,19-3,23 (м, 4H), 3,55-3,59 (м, 4H), 4,59 (кв, J=2,2 Гц, 2H), 6,67 (д, J=15,4 Гц, 1H), 7,56 (д, J=15,4 Гц, 1H).δ 1.48 (s, 9H), 1.86 (t, J = 2.2 Hz, 3H), 3.19-3.23 (m, 4H), 3.55-3.59 (m, 4H ), 4.59 (q, J = 2.2 Hz, 2H), 6.67 (d, J = 15.4 Hz, 1H), 7.56 (d, J = 15.4 Hz, 1H).
(j) трет-Бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилат(j) tert-Butyl-4- [4- (2-tert-butoxycarbonylaminovinyl) -1- (2-butynyl) -5-cyano-1H-imidazol-2-yl] piperazine-1-carboxylate
В атмосфере азота нагревают с обратным холодильником раствор 0,178 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-(2-азидкарбонилвинил)-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 10 мл трет-бутилового спирта в течение 15 часов. Раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (9:11), 0,169 г соединения, указанного в заголовке.Under nitrogen, a solution of 0.178 g of tert-butyl-4- [1- (2-butynyl) -5-cyano-4- (2-azidecarbonylvinyl) -1H-imidazol-2-yl] piperazine-1-carboxylate is heated under reflux in 10 ml of tert-butyl alcohol for 15 hours. The solution was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.169 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (9:11).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,84 (т, J=2,2 Гц, 3H), 3,16-3,19 (м, 4H), 3,54-3,58 (м, 4H), 4,51 (кв, J=2,2 Гц, 2H), 5,83 (д, J=15,0 Гц, 1H), 6,43-6,53 (м, 1H), 7,55-7,66 (м, 1H).δ 1.48 (s, 9H), 1.84 (t, J = 2.2 Hz, 3H), 3.16-3.19 (m, 4H), 3.54-3.58 (m, 4H ), 4.51 (q, J = 2.2 Hz, 2H), 5.83 (d, J = 15.0 Hz, 1H), 6.43-6.53 (m, 1H), 7.55 -7.66 (m, 1H).
(k) трет-Бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-карбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(k) tert-Butyl-4- [4- (2-tert-butoxycarbonylaminovinyl) -1- (2-butynyl) -5-carbamoyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-циано-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 332(b).The title compound was prepared by using tert-butyl-4- [4- (2-tert-butoxycarbonylaminovinyl) -1- (2-butynyl) -5-cyano-1H-imidazol-2-yl] piperazin-1- carboxylate according to the method described in example 332 (b).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,84 (т, J=2,2 Гц, 3H), 3,21-3,25 (м, 4H), 3,54-3,58 (м, 4H), 4,68 (кв, J=2,2 Гц, 2H), 5,90 (уш.с, 1H), 6,36 (уш.д, J=14,8 Гц, 1H), 6,92 (уш.д, J=8,4 Гц, 1H), 7,45 (уш.с, 1H), 7,52 (м, 1H).δ 1.48 (s, 9H), 1.84 (t, J = 2.2 Hz, 3H), 3.21-3.25 (m, 4H), 3.54-3.58 (m, 4H ), 4.68 (q, J = 2.2 Hz, 2H), 5.90 (br.s, 1H), 6.36 (br.s, J = 14.8 Hz, 1H), 6.92 (br.s.d, J = 8.4 Hz, 1H), 7.45 (br.s, 1H), 7.52 (m, 1H).
(l) Трифторацетат 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она(l) 3- (2-Butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
Добавляют 0,1 мл 5 н. соляной кислоты к раствору 0,0075 г трет-бутил-4-[4-(2-трет-бутоксикарбониламиновинил)-1-(2-бутинил)-5-карбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 0,3 мл этанола и смесь перемешивают при комнатной температуре в течение 15 часов. Раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,0043 г соединения, указанного в заголовке.Add 0.1 ml of 5 N. hydrochloric acid to a solution of 0.0075 g of tert-butyl-4- [4- (2-tert-butoxycarbonylaminovinyl) -1- (2-butynyl) -5-carbamoyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 0.3 ml of ethanol and the mixture was stirred at room temperature for 15 hours. The solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.0043 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,81 (т, J=2,4 Гц, 3H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 5,15 (кв, J=2,4 Гц, 2H), 6,60 (д, J=7,1 Гц, 1H), 7,18 (д, J=7,1 Гц, 1H).δ 1.81 (t, J = 2.4 Hz, 3H), 3.45-3.48 (m, 4H), 3.62-3.65 (m, 4H), 5.15 (q, J = 2.4 Hz, 2H), 6.60 (d, J = 7.1 Hz, 1H), 7.18 (d, J = 7.1 Hz, 1H).
MC m/e (ESI) 272,32 (MH+-CF3COOH).MS m / e (ESI) 272.32 (MH + -CF 3 COOH).
Пример 339Example 339
Трифторацетат 3-(2-бутинил)-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она3- (2-Butynyl) -5- (2-phenylethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
(a) трет-Бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [3- (2-butynyl) -4-oxo-4,5-dihydro-3H-imidazo [4,5-c] pyridin-2-yl] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трифторацетата 3-(2-бутинил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она по способу, описанному в примере 258(a).The title compound was prepared by using 3- (2-butynyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate according to the method described in Example 258 (a).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,35-3,39 (м, 4H), 3,60-3,64 (м, 4H), 5,07 (кв, J=2,3 Гц, 2H), 6,55 (д, J=7,1 Гц, 1H), 6,97 (д, J=7,1 Гц, 1H).δ 1.49 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.35-3.39 (m, 4H), 3.60-3.64 (m, 4H ), 5.07 (q, J = 2.3 Hz, 2H), 6.55 (d, J = 7.1 Hz, 1H), 6.97 (d, J = 7.1 Hz, 1H).
(b) Трифторацетат 3-(2-бутинил)-5-(2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она(b) 3- (2-Butynyl) -5- (2-phenylethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и (2-бромэтил)бензола по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [3- (2-butynyl) -4-oxo-4,5-dihydro-3H-imidazo [4,5-c] pyridin-2-yl] piperazine-1-carboxylate and (2-bromoethyl) benzene according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,83 (т, J=2,4 Гц, 3H), 3,05 (т, J=7,3 Гц, 2H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 4,26 (т, J=7,3 Гц, 2H), 5,18 (кв, J=2,4 Гц, 2H), 6,46 (д, J=7,3 Гц, 1H), 7,15 (д, J=7,3 Гц, 1H), 7,16-7,30 (м, 5H).δ 1.83 (t, J = 2.4 Hz, 3H), 3.05 (t, J = 7.3 Hz, 2H), 3.45-3.48 (m, 4H), 3.62- 3.65 (m, 4H), 4.26 (t, J = 7.3 Hz, 2H), 5.18 (q, J = 2.4 Hz, 2H), 6.46 (d, J = 7 , 3 Hz, 1H), 7.15 (d, J = 7.3 Hz, 1H), 7.16-7.30 (m, 5H).
MC m/e (ESI) 376,36 (MH+-CF3COOH).MS m / e (ESI) 376.36 (MH + -CF 3 COOH).
Пример 340Example 340
Трифторацетат 3-(2-бутинил)-5-(2-феноксиэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она3- (2-Butynyl) -5- (2-phenoxyethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромэтилфенилового эфира по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [3- (2-butynyl) -4-oxo-4,5-dihydro-3H-imidazo [4,5-c] pyridin-2-yl] piperazine-1-carboxylate and 2-bromoethylphenyl ether according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,80 (т, J=2,4 Гц, 3H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 4,30 (т, J=5,5 Гц, 2H), 4,44 (т, J=5,5 Гц, 2H), 5,16 (кв, J=2,4 Гц, 2H), 6,59 (д, J=6,1 Гц, 1H), 6,87-6,91 (м, 3H), 7,20-7,24 (м, 2H), 7,50 (д, J=6,1 Гц, 1H).δ 1.80 (t, J = 2.4 Hz, 3H), 3.45-3.48 (m, 4H), 3.62-3.65 (m, 4H), 4.30 (t, J = 5.5 Hz, 2H), 4.44 (t, J = 5.5 Hz, 2H), 5.16 (q, J = 2.4 Hz, 2H), 6.59 (d, J = 6 , 1 Hz, 1H), 6.87-6.91 (m, 3H), 7.20-7.24 (m, 2H), 7.50 (d, J = 6.1 Hz, 1H).
MC m/e (ESI) 392,34 (MH+-CF3COOH).MS m / e (ESI) 392.34 (MH + -CF 3 COOH).
Пример 341Example 341
Трифторацетат 3-(2-бутинил)-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-c]пиридин-4-она3- (2-Butynyl) -5- (2-oxo-2-phenylethyl) -2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-c] pyridin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [3- (2-butynyl) -4-oxo-4,5-dihydro-3H-imidazo [4,5-c] pyridin-2-yl] piperazine-1-carboxylate and 2-bromoacetophenone according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,79 (т, J=2,3 Гц, 3H), 3,46-3,50 (м, 4H), 3,64-3,68 (м, 4H), 5,16 (кв, J=2,3 Гц, 2H), 5,61 (с, 2H), 6,65 (д, J=7,3 Гц, 1H), 7,37 (д, J=7,3 Гц, 1H), 7,57 (т, J=8,0 Гц, 2H), 7,69 (т, J=8,0 Гц, 1H), 8,10 (д, J=8,0 Гц, 2H).δ 1.79 (t, J = 2.3 Hz, 3H), 3.46-3.50 (m, 4H), 3.64-3.68 (m, 4H), 5.16 (q, J = 2.3 Hz, 2H), 5.61 (s, 2H), 6.65 (d, J = 7.3 Hz, 1H), 7.37 (d, J = 7.3 Hz, 1H), 7.57 (t, J = 8.0 Hz, 2H), 7.69 (t, J = 8.0 Hz, 1H), 8.10 (d, J = 8.0 Hz, 2H).
MC m/e (ESI) 392,34 (MH+-CE3COOH).MS m / e (ESI) 392.34 (MH + -CE 3 COOH).
Пример 342Example 342
Трифторацетат 2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо[4,5-c]пиридин-5-илметил]бензонитрила2- [3- (2-Butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-c] pyridin-5-ylmethyl] benzonitrile trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 258(b).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridin-2-yl] piperazine-1-carboxylate and 2-bromomethylbenzonitrile according to the method described in example 258 (b).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,78 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,64-3,67 (м, 4H), 5,14 (кв, J=2,3 Гц, 2H), 5,47 (с, 2H), 6,67 (д, J=7,0 Гц, 1H), 7,20 (дд, J=7,2, 1,0 Гц, 1H), 7,46 (тд, J=7,2, 1,0 Гц, 1H), 7,50 (д, J=7,0 Гц, 1H), 7,60 (тд, J=7,2, 1,0 Гц, 1H), 7,80 (дд, J=7,2, 1,0 Гц, 1H).δ 1.78 (t, J = 2.3 Hz, 3H), 3.45-3.49 (m, 4H), 3.64-3.67 (m, 4H), 5.14 (q, J = 2.3 Hz, 2H), 5.47 (s, 2H), 6.67 (d, J = 7.0 Hz, 1H), 7.20 (dd, J = 7.2, 1.0 Hz , 1H), 7.46 (td, J = 7.2, 1.0 Hz, 1H), 7.50 (d, J = 7.0 Hz, 1H), 7.60 (td, J = 7, 2, 1.0 Hz, 1H); 7.80 (dd, J = 7.2, 1.0 Hz, 1H).
MC m/e (ESI) 387,34 (MH+-CE3COOH).MS m / e (ESI) 387.34 (MH + -CE 3 COOH).
Пример 343Example 343
Трифторацетат метил-3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилатаMethyl 3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -4,5-dihydroimidazo [4,5-c] pyridine-6-carboxylate trifluoroacetate
(a) трет-Бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(a) tert-Butyl-4- [1- (2-butynyl) -4-hydroxymethyl-5-thiocarbamoyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 10 мл 50%-ного водного раствора сульфида аммония к раствору 3,596 г трет-бутил-4-[1-(2-бутинил)-5-циано-4-гидроксиметил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 50 мл этанола и смесь перемешивают при комнатной температуре в течение 16 часов. К раствору добавляют 400 мл этилацетата и смесь промывают три раза 100 мл воды и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (4:1), 3,221 г соединения, указанного в заголовке.Add 10 ml of a 50% aqueous solution of ammonium sulfide to a solution of 3.596 g of tert-butyl-4- [1- (2-butynyl) -5-cyano-4-hydroxymethyl-1H-imidazol-2-yl] piperazin-1- carboxylate in 50 ml of ethanol and the mixture was stirred at room temperature for 16 hours. 400 ml of ethyl acetate was added to the solution, and the mixture was washed three times with 100 ml of water and then with 100 ml of a saturated sodium chloride solution. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 3.221 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (4: 1).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,84 (т, J=2,4 Гц, 3H), 3,17-3,21 (м, 4H), 3,54-3,60 (м, 4H), 3,62 (т, J=5,8 Гц, 1H), 4,68 (д, J=5,8 Гц, 2H), 5,05 (кв, J=2,4 Гц, 2H), 7,35 (уш.с, 1H), 8,46 (уш.с, 1H).δ 1.49 (s, 9H), 1.84 (t, J = 2.4 Hz, 3H), 3.17-3.21 (m, 4H), 3.54-3.60 (m, 4H ), 3.62 (t, J = 5.8 Hz, 1H), 4.68 (d, J = 5.8 Hz, 2H), 5.05 (q, J = 2.4 Hz, 2H), 7.35 (br s, 1H); 8.46 (br s, 1H).
(b) трет-Бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [4- (tert-butyldiphenylsilanyloxymethyl) -1- (2-butynyl) -5-thiocarbamoyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 0,668 г имидазола и 2,70 г трет-бутилхлордифенилсилана к раствору 3,221 г трет-бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 25 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 16 часов. Добавляют к раствору 300 мл этилацетата и органический слой промывают три раза 100 мл воды и затем 100 мл насыщенного раствора хлорида натрия. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 4,357 г соединения, указанного в заголовке.0.668 g of imidazole and 2.70 g of tert-butylchlorodiphenylsilane are added to a solution of 3.221 g of tert-butyl-4- [1- (2-butynyl) -4-hydroxymethyl-5-thiocarbamoyl-1H-imidazol-2-yl] piperazin-1 β-carboxylate in 25 ml of N, N-dimethylformamide and the mixture was stirred at room temperature for 16 hours. 300 ml of ethyl acetate are added to the solution and the organic layer is washed three times with 100 ml of water and then 100 ml of a saturated solution of sodium chloride. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 4.357 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,05 (с, 9H), 1,49 (с, 9H), 1,84 (т, J=2,4 Гц, 3H), 3,06-3,11 (м, 4H), 3,53-3,57 (м, 4H), 4,74 (с, 2H), 5,19 (кв, J=2,4 Гц, 2H), 7,31 (уш.д, J=4,1 Гц, 1H), 7,37 (т, J=7,2 Гц, 4H), 7,44 (д, J=7,2 Гц, 2H), 7,63 (д, J=7,2 Гц, 4H), 9,28 (уш.д, J=4,1 Гц, 1H).δ 1.05 (s, 9H), 1.49 (s, 9H), 1.84 (t, J = 2.4 Hz, 3H), 3.06-3.11 (m, 4H), 3, 53-3.57 (m, 4H), 4.74 (s, 2H), 5.19 (q, J = 2.4 Hz, 2H), 7.31 (br.s, J = 4.1 Hz , 1H), 7.37 (t, J = 7.2 Hz, 4H), 7.44 (d, J = 7.2 Hz, 2H), 7.63 (d, J = 7.2 Hz, 4H ), 9.28 (brd, J = 4.1 Hz, 1H).
(c) трет-Бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(c) tert-Butyl-4- [4- (tert-butyldiphenylsilanyloxymethyl) -1- (2-butynyl) -5-methylsulfanylcarbonimidoyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 1,23 г тетрафторбората триметилоксония к раствору 4,351 г трет-бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-тиокарбамоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 100 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 15 часов. Добавляют к раствору 300 мл этилацетата и органический слой промывают последовательно 100 мл насыщенного раствора бикарбоната натрия и 100 мл насыщенного раствора хлорида аммония. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении, для того чтобы получить 4,439 г соединения, указанного в заголовке.1.23 g of trimethyloxonium tetrafluoroborate are added to a solution of 4.351 g of tert-butyl-4- [4- (tert-butyldiphenylsilanyloxymethyl) -1- (2-butynyl) -5-thiocarbamoyl-1H-imidazol-2-yl] piperazin-1- carboxylate in 100 ml of dichloromethane and the mixture was stirred at room temperature for 15 hours. 300 ml of ethyl acetate are added to the solution and the organic layer is washed successively with 100 ml of a saturated solution of sodium bicarbonate and 100 ml of a saturated solution of ammonium chloride. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure to obtain 4.439 g of the title compound.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,05 (с, 9H), 1,49 (с, 9H), 1,84 (уш.с, 3H), 2,36 (уш.с, 3H), 3,11-3,15 (м, 4H), 3,54-3,58 (м, 4H), 4,63 (уш.с, 2H), 4,66 (уш.с, 2H), 7,37 (т, J=7,2 Гц, 4H), 7,44 (д, J=7,2 Гц, 2H), 7,63 (д, J=7,2 Гц, 4H).δ 1.05 (s, 9H), 1.49 (s, 9H), 1.84 (br s, 3H), 2.36 (br s, 3H), 3.11-3.15 (m , 4H), 3.54-3.58 (m, 4H), 4.63 (br s, 2H), 4.66 (br s, 2H), 7.37 (t, J = 7.2 Hz, 4H), 7.44 (d, J = 7.2 Hz, 2H), 7.63 (d, J = 7.2 Hz, 4H).
(d) трет-Бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(d) tert-Butyl-4- [1- (2-butynyl) -4-hydroxymethyl-5-methylsulfanylcarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Добавляют 30 мл 5 н. соляной кислоты к раствору 5,05 г трет-бутил-4-[4-(трет-бутилдифенилсиланилоксиметил)-1-(2-бутинил)-5-метилсульфанилкарбонимидоил-1H-имидазол-2-ил]пиперазин-1-карбоксилата в 100 мл тетрагидрофурана и смесь перемешивают при комнатной температуре в течение 22 часов. Раствор концентрируют при пониженном давлении. Остаток растворяют в 100 мл дихлорметана и в этот раствор добавляют 2,05 г ди-трет-бутилдикарбоната. Раствор подщелачивают 5 н. раствором гидроксида натрия и смесь перемешивают в течение 2 часов. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью этилацетат-гексан (2:3), 2,24 г соединения, указанного в заголовке.Add 30 ml of 5 N. hydrochloric acid to a solution of 5.05 g of tert-butyl-4- [4- (tert-butyl diphenylsilanyloxymethyl) -1- (2-butynyl) -5-methylsulfanylcarbonimidoyl-1H-imidazol-2-yl] piperazine-1-carboxylate in 100 ml of tetrahydrofuran and the mixture was stirred at room temperature for 22 hours. The solution was concentrated under reduced pressure. The residue was dissolved in 100 ml of dichloromethane and 2.05 g of di-tert-butyl dicarbonate was added to this solution. The solution is alkalinized 5 N. sodium hydroxide solution and the mixture is stirred for 2 hours. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 2.24 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (2: 3).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 2,47 (с, 3H), 3,21-3,25 (м, 4H), 3,27 (т, J=5,6 Гц, 1H), 3,56-3,60 (м, 4H), 4,81 (кв, J=2,4 Гц, 2H), 4,89 (д, J=5,6 Гц, 2H).δ 1.49 (s, 9H), 1.84 (t, J = 2.3 Hz, 3H), 2.47 (s, 3H), 3.21-3.25 (m, 4H), 3, 27 (t, J = 5.6 Hz, 1H), 3.56-3.60 (m, 4H), 4.81 (q, J = 2.4 Hz, 2H), 4.89 (d, J = 5.6 Hz, 2H).
(e) трет-Бутил-4-[1-(2-бутинил)-4-формил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилат(e) tert-Butyl-4- [1- (2-butynyl) -4-formyl-5-methylsulfanylcarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[1-(2-бутинил)-4-гидроксиметил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(g).The title compound was prepared by using tert-butyl-4- [1- (2-butynyl) -4-hydroxymethyl-5-methylsulfanylcarbonyl-1H-imidazol-2-yl] piperazine-1-carboxylate according to the method described in Example 115 (g).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,48 (с, 9H), 1,84 (т, J=2,3 Гц, 3H), 2,58 (с, 3H), 3,22-3,26 (м, 4H), 3,56-3,60 (м, 4H), 4,80 (кв, J=2,4 Гц, 2H), 9,88 (с, 1H).δ 1.48 (s, 9H), 1.84 (t, J = 2.3 Hz, 3H), 2.58 (s, 3H), 3.22-3.26 (m, 4H), 3, 56-3.60 (m, 4H), 4.80 (q, J = 2.4 Hz, 2H), 9.88 (s, 1H).
(f) 5-Бензиловый, 6-метиловый эфир 2-(4-трет-бутоксикарбонилпиперазин-1-ил)-3-(2-бутинил)-4-оксо-3,4-дигидроимидазо[4,5-c]пиридин-5,6-дикарбоновой кислоты(f) 2- (4-tert-butoxycarbonylpiperazin-1-yl) -3- (2-butynyl) -4-oxo-3,4-dihydroimidazo [4,5-c] pyridine 5-benzyl, 6-methyl ester -5,6-dicarboxylic acid
Добавляют 0,079 г 1,8-диазабицикло[5,4,0]-7-ундецена и затем 5 мл дихлорметана, содержащего 0,194 г трет-бутил-4-[1-(2-бутинил)-4-формил-5-метилсульфанилкарбонил-1H-имидазол-2-ил]пиперазин-1-карбоксилата, к раствору 0,174 г метилбензилоксикарбониламино(диметоксифосфорил)ацетата в 2 мл дихлорметана и смесь перемешивают при комнатной температуре в течение 16 часов. Раствор концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом из фракции, элюированной смесью этилацетат-гексан (3:2), получают 0,147 г соединения, указанного в заголовке.Add 0.079 g of 1,8-diazabicyclo [5.4.0] -7-undecene and then 5 ml of dichloromethane containing 0.194 g of tert-butyl-4- [1- (2-butynyl) -4-formyl-5-methylsulfanylcarbonyl -1H-imidazol-2-yl] piperazine-1-carboxylate, to a solution of 0.174 g of methylbenzyloxycarbonylamino (dimethoxyphosphoryl) acetate in 2 ml of dichloromethane, and the mixture was stirred at room temperature for 16 hours. The solution was concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.147 g of the title compound was obtained from the fraction eluted with ethyl acetate-hexane (3: 2).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,49 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,37-3,41 (м, 4H), 3,59-3,64 (м, 4H), 3,83 (с, 3H), 5,04 (кв, J=2,3 Гц, 2H), 5,46 (с, 2H), 7,33-7,38 (м, 3H), 7,41 (с, 1H), 7,45-7,48 (м, 2H).δ 1.49 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.37-3.41 (m, 4H), 3.59-3.64 (m, 4H ), 3.83 (s, 3H), 5.04 (q, J = 2.3 Hz, 2H), 5.46 (s, 2H), 7.33-7.38 (m, 3H), 7 41 (s, 1H); 7.45-7.48 (m, 2H).
(g) трет-Бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилат(g) tert-Butyl-4- [3- (2-butynyl) -4-oxo-6-trimethoxymethyl-4,5-dihydro-3H-imidazo [4,5-c] pyridin-2-yl] piperazine- 1-carboxylate
Добавляют 0,023 г натрия к 2 мл метанола в атмосфере азота. После прекращения выделения водорода добавляют к этому раствору 0,147 г 5-бензилового, 6-метилового эфира 2-(4-трет-бутоксикарбонилпиперазин-1-ил)-3-(2-бутинил)-4-оксо-3,4-дигидроимидазо[4,5-c]пиридин-5,6-дикарбоновой кислоты в 2 мл метанола. Смесь перемешивают при комнатной температуре в течение 16 часов. Затем добавляют к этому раствору 40 мл этилацетата, 20 мл 5%-ного водного раствора хлорида аммония и 1 мл 1 н. соляной кислоты. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной этилацетатом, 0,108 г соединения, указанного в заголовке.Add 0.023 g of sodium to 2 ml of methanol in a nitrogen atmosphere. After the evolution of hydrogen ceased, 0.147 g of 2- (4-tert-butoxycarbonylpiperazin-1-yl) -3- (2-butynyl) -4-oxo-3,4-dihydroimidazo [5-benzyl, 6-methyl ether] was added to this solution. 4,5-c] pyridine-5,6-dicarboxylic acid in 2 ml of methanol. The mixture was stirred at room temperature for 16 hours. Then add to this solution 40 ml of ethyl acetate, 20 ml of a 5% aqueous solution of ammonium chloride and 1 ml of 1 N. of hydrochloric acid. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.108 g of the title compound was obtained from the fraction eluted with ethyl acetate.
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,83 (т, J=2,3 Гц, 3H), 3,20 (с, 9H), 3,37-3,41 (м, 4H), 3,59-3,64 (м, 4H), 5,07 (кв, J=2, 3 Гц, 2H), 6,82 (с, 1H), 8,60 (уш.с, 1H).δ 1.50 (s, 9H), 1.83 (t, J = 2.3 Hz, 3H), 3.20 (s, 9H), 3.37-3.41 (m, 4H), 3, 59-3.64 (m, 4H), 5.07 (q, J = 2.3 Hz, 2H), 6.82 (s, 1H), 8.60 (br s, 1H).
(h) Трифторацетат метил-3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилата(h) Methyl 3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -4,5-dihydroimidazo [4,5-c] pyridine-6-carboxylate trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 338(l).The title compound was prepared by using tert-butyl-4- [3- (2-butynyl) -4-oxo-6-trimethoxymethyl-4,5-dihydro-3H-imidazo [4,5-c] pyridine- 2-yl] piperazin-1-carboxylate according to the method described in example 338 (l).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,81 (т, J=2,3 Гц, 3H), 3,45-3,49 (м, 4H), 3,64-3,67 (м, 4H), 3,95 (с, 3H), 5,17 (кв, J=2,3 Гц, 2H), 7,35 (с, 1H).δ 1.81 (t, J = 2.3 Hz, 3H), 3.45-3.49 (m, 4H), 3.64-3.67 (m, 4H), 3.95 (s, 3H ), 5.17 (q, J = 2.3 Hz, 2H), 7.35 (s, 1H).
MC m/e (ESI) 330,16 (MH+-CF3COOH).MS m / e (ESI) 330.16 (MH + -CF 3 COOH).
Пример 344Example 344
Трифторацетат метил-3-(2-бутинил)-5-метил-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилатаMethyl 3- (2-butynyl) -5-methyl-4-oxo-2- (piperazin-1-yl) -4,5-dihydroimidazo [4,5-c] pyridine-6-carboxylate trifluoroacetate
Добавляют 0,024 г карбоната калия и 0,027 мл метилйодида к раствору 0,030 г трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата в 2 мл N,N-диметилформамида и смесь нагревают при 50ºC в течение 48 часов. Добавляют к этому раствору 2 мл этилацетата и 2 мл воды. Водный слой экстрагируют 1 мл этилацетата. Органические слои объединяют и затем разделяют на две равные части. Одну часть концентрируют путем продувки газообразным азотом и остаток растворяют в 0,5 мл метанола. Раствор объединяют с 0,1 мл 5 н. соляной кислоты и смесь выдерживают в течение 1 часа. Растворитель удаляют и остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой (используя подвижную фазу ацетонитрил-вода (содержащую 0,1% трифторуксусной кислоты)), для того чтобы получить 0,007 г соединения, указанного в заголовке.Add 0.024 g of potassium carbonate and 0.027 ml of methyl iodide to a solution of 0.030 g of tert-butyl-4- [3- (2-butynyl) -4-oxo-6-trimethoxymethyl-4,5-dihydro-3H-imidazo [4,5- c] pyridin-2-yl] piperazine-1-carboxylate in 2 ml of N, N-dimethylformamide and the mixture was heated at 50 ° C for 48 hours. 2 ml of ethyl acetate and 2 ml of water are added to this solution. The aqueous layer was extracted with 1 ml of ethyl acetate. The organic layers are combined and then divided into two equal parts. One part is concentrated by purging with nitrogen gas and the residue is dissolved in 0.5 ml of methanol. The solution is combined with 0.1 ml of 5 N. hydrochloric acid and the mixture was incubated for 1 hour. The solvent was removed and the residue was purified by reverse phase high performance liquid chromatography (using the acetonitrile-water mobile phase (containing 0.1% trifluoroacetic acid)) to give 0.007 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,81 (т, J=2,4 Гц, 3H), 3,45-3,48 (м, 4H), 3,62-3,65 (м, 4H), 3,74 (с, 3H), 3,94 (с, 3H), 5,17 (кв, J=2,4 Гц, 2H), 7,25 (с, 1H).δ 1.81 (t, J = 2.4 Hz, 3H), 3.45-3.48 (m, 4H), 3.62-3.65 (m, 4H), 3.74 (s, 3H ), 3.94 (s, 3H), 5.17 (q, J = 2.4 Hz, 2H), 7.25 (s, 1H).
MS m/e (ESI) 344,30 (MH+-CF3COOH).MS m / e (ESI) 344.30 (MH + -CF 3 COOH).
Пример 345Example 345
Трифторацетат 3-(2-бутинил)-5-метил-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксиламида3- (2-Butynyl) -5-methyl-4-oxo-2- (piperazin-1-yl) -4,5-dihydroimidazo [4,5-c] pyridin-6-carboxylamide trifluoroacetate
Другую часть раствора, полученного в примере 344, концентрируют путем продувки газообразным азотом. Остаток обрабатывают аммиачной водой (1 мл, 28% аммиака). Раствор нагревают до кипения с обратным холодильником в запаянной трубке в течение 48 часов. Раствор концентрируют при пониженном давлении. Последующие стадии синтеза были проведены в соответствии со способом, который был использован в примере 115(i). Таким образом синтезируют 0,010 г соединения, указанного в заголовке.Another part of the solution obtained in Example 344 was concentrated by purging with nitrogen gas. The residue is treated with ammonia water (1 ml, 28% ammonia). The solution was heated to boiling under reflux in a sealed tube for 48 hours. The solution was concentrated under reduced pressure. The subsequent synthesis steps were carried out in accordance with the method that was used in example 115 (i). Thus, 0.010 g of the title compound is synthesized.
МС m/e (ESI) 329,32 (MH+-CF3COOH).MS m / e (ESI) 329.32 (MH + -CF 3 COOH).
Пример 346Example 346
Трифторацетат метил-3-(2-бутинил)-4-оксо-5-(2-оксо-2-фенилэтил)-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилатаMethyl-3- (2-butynyl) -4-oxo-5- (2-oxo-2-phenylethyl) -2- (piperazin-1-yl) -4,5-dihydroimidazo [4,5-c] pyridine trifluoroacetate -6-carboxylate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромацетофенона по способу, описанному в примере 344.The title compound was prepared by using tert-butyl-4- [3- (2-butynyl) -4-oxo-6-trimethoxymethyl-4,5-dihydro-3H-imidazo [4,5-c] pyridine- 2-yl] piperazin-1-carboxylate and 2-bromoacetophenone according to the method described in example 344.
МС m/e (ESI) 448,31 (MH+-CF3COOH).MS m / e (ESI) 448.31 (MH + -CF 3 COOH).
Пример 347Example 347
Трифторацетат метил-3-(2-бутинил)-5-(2-цианобензил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксилатаMethyl 3- (2-butynyl) -5- (2-cyanobenzyl) -4-oxo-2- (piperazin-1-yl) -4,5-dihydroimidazo [4,5-c] pyridine-6-carboxylate trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 344.The title compound was prepared by using tert-butyl-4- [3- (2-butynyl) -4-oxo-6-trimethoxymethyl-4,5-dihydro-3H-imidazo [4,5-c] pyridine- 2-yl] piperazin-1-carboxylate and 2-bromomethylbenzonitrile according to the method described in example 344.
МС m/e (ESI) 445,32 (MH+-CF3COOH).MS m / e (ESI) 445.32 (MH + -CF 3 COOH).
Пример 348Example 348
Трифторацетат 3-(2-бутинил)-5-(2-цианобензил)-4-оксо-2-(пиперазин-1-ил)-4,5-дигидроимидазо[4,5-c]пиридин-6-карбоксиламида3- (2-Butynyl) -5- (2-cyanobenzyl) -4-oxo-2- (piperazin-1-yl) -4,5-dihydroimidazo [4,5-c] pyridin-6-carboxylamide trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[3-(2-бутинил)-4-оксо-6-триметоксиметил-4,5-дигидро-3H-имидазо[4,5-c]пиридин-2-ил]пиперазин-1-карбоксилата и 2-бромметилбензонитрила по способу, описанному в примере 345.The title compound was prepared by using tert-butyl-4- [3- (2-butynyl) -4-oxo-6-trimethoxymethyl-4,5-dihydro-3H-imidazo [4,5-c] pyridine- 2-yl] piperazin-1-carboxylate and 2-bromomethylbenzonitrile according to the method described in example 345.
МС m/e (ESI) 430,34 (MH+-CF3COOH).MS m / e (ESI) 430.34 (MH + -CF 3 COOH).
Пример 349Example 349
Трифторацетат 1-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-она1- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -1,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a)-1 3-(2-Бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он(a) -1 3- (2-Butynyl) -2-chloro-5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one
иand
(a)-2 1-(2-Бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он(a) -2 1- (2-Butynyl) -2-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one
Добавляют 0,166 г карбоната калия и 0,106 мкл 2-бутинилбромида к раствору 0,184 г 2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она в 10 мл N,N-диметилформамида и смесь перемешивают при комнатной температуре в течение 18 часов. Добавляют к этому раствору 50 мл этилацетата и смесь промывают три раза водой (20 мл) и затем насыщенным раствором хлорида натрия (20 мл). Органическую жидкость сушат над сульфатом магния и концентрируют при пониженном давлении. Затем остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают 0,175 г 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она из фракции, элюированной смесью гексан-этилацетат (4:1), и 0,033 г 1-(2-бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она из фракции, элюированной смесью гексан-этилацетат (2:3).Add 0.166 g of potassium carbonate and 0.106 μl of 2-butynyl bromide to a solution of 0.184 g of 2-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one in 10 ml of N, N-dimethylformamide and the mixture stirred at room temperature for 18 hours. 50 ml of ethyl acetate are added to this solution and the mixture is washed three times with water (20 ml) and then with a saturated solution of sodium chloride (20 ml). The organic liquid was dried over magnesium sulfate and concentrated under reduced pressure. The residue is then purified by silica gel column chromatography. Thus, 0.175 g of 3- (2-butynyl) -2-chloro-5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one is obtained from the fraction eluted with hexane-ethyl acetate (4: 1 ), and 0.033 g of 1- (2-butynyl) -2-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one from the fraction eluted with hexane-ethyl acetate (2: 3 )
3-(2-Бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он: 3- (2-Butynyl) -2-chloro-5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one :
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,82 (т, J=2,3 Гц, 3H), 3,87 (с, 3H), 5,32 (кв, J=2,3 Гц, 2H), 8,19 (с, 1H).δ 1.82 (t, J = 2.3 Hz, 3H), 3.87 (s, 3H), 5.32 (q, J = 2.3 Hz, 2H), 8.19 (s, 1H) .
1-(2-Бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-он: 1- (2-Butynyl) -2-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one :
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,87 (т, J=2,3 Гц, 3H), 3,91,(с, 3H), 4,90 (кв, J=2,3 Гц, 2H), 8,20 (с, 1H).δ 1.87 (t, J = 2.3 Hz, 3H), 3.91, (s, 3H), 4.90 (q, J = 2.3 Hz, 2H), 8.20 (s, 1H )
(b) трет-Бутил-4-[1-(2-бутинил)-5-метил-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилат(b) tert-Butyl-4- [1- (2-butynyl) -5-methyl-4-oxo-4,5-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] piperazin- 1-carboxylate
Соединение, указанное в заголовке, получают путем использования 1-(2-бутинил)-2-хлор-5-метил-1,5-дигидроимидазо[4,5-d]пиридазин-4-она и трет-бутилпиперазин-1-карбоксилата по способу, описанному в примере 119(c).The title compound was prepared by using 1- (2-butynyl) -2-chloro-5-methyl-1,5-dihydroimidazo [4,5-d] pyridazin-4-one and tert-butylpiperazine-1-carboxylate by the method described in example 119 (c).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,50 (с, 9H), 1,87 (т, J=2,3 Гц, 3H), 3,30-3,34 (м, 4H), 3,59-3,63 (м, 4H), 3,90 (с, 3H), 4,70 (кв, J=2,3 Гц, 2H), 8,11 (с, 1H).δ 1.50 (s, 9H), 1.87 (t, J = 2.3 Hz, 3H), 3.30-3.34 (m, 4H), 3.59-3.63 (m, 4H ), 3.90 (s, 3H), 4.70 (q, J = 2.3 Hz, 2H), 8.11 (s, 1H).
(c) Трифторацетат 1-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-она(c) 1- (2-Butynyl) -5-methyl-2- (piperazin-1-yl) -1,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
Соединение, указанное в заголовке, получают путем использования трет-бутил-4-[5-метил-1-(2-бутинил)-4-оксо-4,5-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]пиперазин-1-карбоксилата по способу, описанному в примере 115(i).The title compound was prepared by using tert-butyl-4- [5-methyl-1- (2-butynyl) -4-oxo-4,5-dihydro-1H-imidazo [4,5-d] pyridazin- 2-yl] piperazin-1-carboxylate according to the method described in example 115 (i).
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,84 (т, J=2,4 Гц, 3H), 3,44-3,48 (м, 4H), 3,58-3,62 (м, 4H), 3,86 (с, 3H), 4,96 (кв, J=2,4 Гц, 2H), 8,39 (с, 1H).δ 1.84 (t, J = 2.4 Hz, 3H), 3.44-3.48 (m, 4H), 3.58-3.62 (m, 4H), 3.86 (s, 3H ), 4.96 (q, J = 2.4 Hz, 2H), 8.39 (s, 1H).
MC m/e (ESI) 287,17 (MH+-CF3COOH).MS m / e (ESI) 287.17 (MH + -CF 3 COOH).
Пример 350Example 350
Трифторацетат 2-[(1R*,2R*)2-аминоциклогексиламино]-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-онаTrifluoroacetate 2 - [(1R *, 2R *) 2-aminocyclohexylamino] -3- (2-butynyl) -5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one
Соединение, указанное в заголовке, получают путем взаимодействия 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она и транс-1,2-циклогександиамина по способу, который был использован в примере 119(c), с очисткой продукта методом жидкостной хроматографии высокого разрешения с обращенной фазой.The title compound was prepared by reacting 3- (2-butynyl) -2-chloro-5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one and trans-1,2-cyclohexanediamine by the method that was used in example 119 (c), with purification of the product by reverse phase high performance liquid chromatography.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,39-1,49 (м, 2H), 1,50-1,61 (м, 2H), 1,80 (т, J=2,3 Гц, 3H), 1,85-1,92 (м, 2H), 2,11-2,18 (м, 2H), 3,19 (тд, J=11,0, 4,1 Гц, 1H), 3,80 (с, 3H), 3,93 (тд, J=11,0, 4,2 Гц, 1H), 4,91 (д кв, J=18,0, 2,3 Гц, 1H), 5,44 (д кв, J=18,0, 2,3 Гц, 1H), 8,07 (с, 1H).δ 1.39-1.49 (m, 2H), 1.50-1.61 (m, 2H), 1.80 (t, J = 2.3 Hz, 3H), 1.85-1.92 (m, 2H), 2.11-2.18 (m, 2H), 3.19 (td, J = 11.0, 4.1 Hz, 1H), 3.80 (s, 3H), 3, 93 (td, J = 11.0, 4.2 Hz, 1H), 4.91 (d q, J = 18.0, 2.3 Hz, 1H), 5.44 (d q, J = 18, 0, 2.3 Hz, 1H), 8.07 (s, 1H).
Mc m/e (ESI) 315,19 (MH+-CF3COOH).Mc m / e (ESI) 315.19 (MH + -CF 3 COOH).
Пример 351Example 351
Трифторацетат 2-[(1R*,2S*)2-аминоциклогексиламино]-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-онаTrifluoroacetate 2 - [(1R *, 2S *) 2-aminocyclohexylamino] -3- (2-butynyl) -5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one
Соединение, указанное в заголовке, получают путем взаимодействия 3-(2-бутинил)-2-хлор-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она и цис-1,2-циклогександиамина по способу, который был использован в примере 119(c), с очисткой продукта методом жидкостной хроматографии высокого разрешения с обращенной фазой.The title compound was prepared by reacting 3- (2-butynyl) -2-chloro-5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one and cis-1,2-cyclohexanediamine by the method that was used in example 119 (c), with purification of the product by reverse phase high performance liquid chromatography.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,54-1,68 (м, 3H), 1,71-1,81 (м, 2H), 1,83 (т, J=2,4 Гц, 3H), 1,85-1,91 (м, 2H), 1,91-2,01 (м, 1H), 3,69 (м, 1H), 3,80 (с, 3H), 4,37 (м, 1H), 5,04 (д кв, J=18,3, 2,4 Гц, 1H), 5,55 (д кв, J=18,3, 2,4 Гц, 1H), 8,09 (с, 1H).δ 1.54-1.68 (m, 3H), 1.71-1.81 (m, 2H), 1.83 (t, J = 2.4 Hz, 3H), 1.85-1.91 (m, 2H), 1.91-2.01 (m, 1H), 3.69 (m, 1H), 3.80 (s, 3H), 4.37 (m, 1H), 5.04 ( q q, J = 18.3, 2.4 Hz, 1H), 5.55 (q q, J = 18.3, 2.4 Hz, 1H), 8.09 (s, 1H).
MC m/e (ESI) 315,27 (MH+-CF3COOH).MS m / e (ESI) 315.27 (MH + -CF 3 COOH).
Пример 352Example 352
Трифторацетат 3-(2-бутинил)-5-метил-2-(1,2,3,6-тетрагидропиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она3- (2-Butynyl) -5-methyl-2- (1,2,3,6-tetrahydropyridin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one trifluoroacetate
(a) 5-Метил-2-(пиридин-4-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-он(a) 5-Methyl-2- (pyridin-4-yl) -1,5-dihydroimidazo [4,5-d] pyridazin-4-one
Добавляют 0,560 г 4,5-диамино-2-метил-2H-пиридазин-3-она и 0,535 г 4-пиридинкарбальдегида к 10 мл нитробензола и смесь нагревают при 190ºC в атмосфере азота в течение трех часов. Реакционный раствор охлаждают и осадок собирают путем фильтрации, получая 0,381 г соединения, указанного в заголовке.0.560 g of 4,5-diamino-2-methyl-2H-pyridazin-3-one and 0.535 g of 4-pyridinecarbaldehyde are added to 10 ml of nitrobenzene and the mixture is heated at 190 ° C under nitrogen for three hours. The reaction solution was cooled and the precipitate was collected by filtration to obtain 0.381 g of the title compound.
1Н-ЯМР (ДМСО-d6) 1 H-NMR (DMSO-d 6 )
δ 3,78 (с, 3H), 8,14 (д, J=6,0 Гц, 2H), 8,48 (с, 1H), 8,76 (д, J=6,0 Гц, 2H).δ 3.78 (s, 3H), 8.14 (d, J = 6.0 Hz, 2H), 8.48 (s, 1H), 8.76 (d, J = 6.0 Hz, 2H) .
MC m/e (ESI) 228,1 (MH+).MS m / e (ESI) 228.1 (MH + ).
(b) 3-(2-Бутинил)-5-метил-2-(пиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он(b) 3- (2-Butynyl) -5-methyl-2- (pyridin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one
Соединение, указанное в заголовке, получают путем использования 5-метил-2-(пиридин-4-ил)-1,5-дигидроимидазо[4,5-d]пиридазин-4-она и 2-бутинилбромида по способу, описанному в примере 119(d).The title compound was prepared by using 5-methyl-2- (pyridin-4-yl) -1,5-dihydroimidazo [4,5-d] pyridazin-4-one and 2-butynyl bromide according to the method described in Example 119 (d).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,84 (т, J=2,3 Гц, 3H), 3,91 (с, 3H), 5,37 (кв, J=2,3 Гц, 2H), 7,89 (д, J=6,1 Гц, 2H), 8,32 (с, 1H), 8,85 (д, J=2,3 Гц, 2H).δ 1.84 (t, J = 2.3 Hz, 3H), 3.91 (s, 3H), 5.37 (q, J = 2.3 Hz, 2H), 7.89 (d, J = 6.1 Hz, 2H), 8.32 (s, 1H), 8.85 (d, J = 2.3 Hz, 2H).
(c) Хлорид 4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]-1-(4-метоксибензил)пиридиния(c) 4- [1- (2-Butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl] -1- (4) chloride -methoxybenzyl) pyridinium
Добавляют 0,045 г 3-(2-бутинил)-5-метил-2-(пиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она и 0,060 мкл пара-метоксибензилхлорида к 0,100 мл N,N-диметилформамида и смесь перемешивают при 65ºC в атмосфере азота в течение 4 часов. Реакционный раствор охлаждают и добавляют к нему 1 мл ацетона и 1 мл диэтилового эфира. Осадок собирают путем фильтрации, получая 0,060 г соединения, указанного в заголовке.0.045 g of 3- (2-butynyl) -5-methyl-2- (pyridin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one and 0.060 μl of para-methoxybenzyl chloride are added to 0.100 ml of N, N-dimethylformamide and the mixture was stirred at 65 ° C under nitrogen for 4 hours. The reaction solution was cooled and 1 ml of acetone and 1 ml of diethyl ether were added thereto. The precipitate was collected by filtration to obtain 0.060 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,75 (т, J=2,3 Гц, 3H), 3,74 (с, 3H), 3,77 (с, 3H), 5,64 (кв, J=2, 3 Гц, 2H), 5,86 (с, 2H), 7,05 (д, J=8,3 Гц, 2H), 7,54 (д, J=8,3 Гц, 2H), 8,43 (с, 1H), 8,70 (д, J=6,3 Гц, 2H), 9,24 (д, J=6,3 Гц, 2H).δ 1.75 (t, J = 2.3 Hz, 3H), 3.74 (s, 3H), 3.77 (s, 3H), 5.64 (q, J = 2.3 Hz, 2H) 5.86 (s, 2H), 7.05 (d, J = 8.3 Hz, 2H), 7.54 (d, J = 8.3 Hz, 2H), 8.43 (s, 1H) 8.70 (d, J = 6.3 Hz, 2H); 9.24 (d, J = 6.3 Hz, 2H).
(d) 3-(2-Бутинил)-2-[1-(4-метоксибензил)-1,2,3,6-тетрагидропиридин-4-ил]-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он(d) 3- (2-Butynyl) -2- [1- (4-methoxybenzyl) -1,2,3,6-tetrahydropyridin-4-yl] -5-methyl-3,5-dihydroimidazo [4,5 -d] pyridazin-4-one
Добавляют 0,020 г борогидрида натрия к раствору 0,060 г хлорида 4-[1-(2-бутинил)-6-метил-7-оксо-6,7-дигидро-1H-имидазо[4,5-d]пиридазин-2-ил]-1-(4-метоксибензил)пиридиния в 5 мл метанола и смесь перемешивают в течение 1 часа. Добавляют к раствору 15 мл воды и 0,1 мл 5 н. соляной кислоты, для того чтобы разложить восстанавливающий агент. Затем раствор подщелачивают, добавляя 1 мл 5 н. раствора гидроксида натрия и смесь экстрагируют 30 мл этилацетата. Органический слой сушат над сульфатом магния и концентрируют при пониженном давлении. Остаток подвергают очистке путем колоночной хроматографии на силикагеле. Таким образом получают из фракции, элюированной смесью метанол-этилацетат (1:19), 0,033 г соединения, указанного в заголовке.0.020 g of sodium borohydride is added to a solution of 0.060 g of 4- [1- (2-butynyl) -6-methyl-7-oxo-6,7-dihydro-1H-imidazo [4,5-d] pyridazin-2-yl chloride ] -1- (4-methoxybenzyl) pyridinium in 5 ml of methanol and the mixture was stirred for 1 hour. Add to the solution 15 ml of water and 0.1 ml of 5 N. hydrochloric acid in order to decompose a reducing agent. Then the solution is alkalinized by adding 1 ml of 5 N. sodium hydroxide solution and the mixture is extracted with 30 ml of ethyl acetate. The organic layer was dried over magnesium sulfate and concentrated under reduced pressure. The residue was purified by silica gel column chromatography. Thus, 0.033 g of the title compound was obtained from the fraction eluted with methanol-ethyl acetate (1:19).
1Н-ЯМР (CDCl3) 1 H-NMR (CDCl 3 )
δ 1,80 (т, J=2,4 Гц, 3H), 2,71-2,78 (м, 4H), 3,25-3,28 (м, 2H), 3,62 (с, 2H), 3,82 (с, 3H), 3,87 (с, 3H), 5,30 (кв, J=2,4 Гц, 2H), 6,61 (м, 1H), 6,89 (д, J=9,1 Гц, 2H), 7,30 (д, J=9,1 Гц, 2H), 8,22 (с, 1H).δ 1.80 (t, J = 2.4 Hz, 3H), 2.71-2.78 (m, 4H), 3.25-3.28 (m, 2H), 3.62 (s, 2H ), 3.82 (s, 3H), 3.87 (s, 3H), 5.30 (q, J = 2.4 Hz, 2H), 6.61 (m, 1H), 6.89 (d , J = 9.1 Hz, 2H), 7.30 (d, J = 9.1 Hz, 2H), 8.22 (s, 1H).
(e) Трифторацетат 3-(2-бутинил)-5-метил-2-(1,2,3,6-тетрагидропиридин-4-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-она(e) 3- (2-Butynyl) -5-methyl-2- (1,2,3,6-tetrahydropyridin-4-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4- trifluoroacetate she
Добавляют 0,10 мл 1-хлорэтилхлорформиата к раствору 0,033 г 3-(2-бутинил)-2-[1-(4-метоксибензил)-1,2,3,6-тетрагидропиридин-4-ил]-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-она в 2 мл 1,2-дихлорэтана и смесь нагревают с обратным холодильником в течение 90 минут. Добавляют 5 мл метанола к раствору и смесь дополнительно нагревают с обратным холодильником в течение 4 часов. Затем раствор концентрируют при пониженном давлении. Остаток очищают методом жидкостной хроматографии высокого разрешения с обращенной фазой, получая 0,010 г соединения, указанного в заголовке.Add 0.10 ml of 1-chloroethylchloroformate to a solution of 0.033 g of 3- (2-butynyl) -2- [1- (4-methoxybenzyl) -1,2,3,6-tetrahydropyridin-4-yl] -5-methyl- 3,5-dihydroimidazo [4,5-d] pyridazin-4-one in 2 ml of 1,2-dichloroethane and the mixture was heated under reflux for 90 minutes. 5 ml of methanol was added to the solution, and the mixture was further heated under reflux for 4 hours. Then, the solution was concentrated under reduced pressure. The residue was purified by reverse phase high performance liquid chromatography to give 0.010 g of the title compound.
1Н-ЯМР (CD3OD) 1 H-NMR (CD 3 OD)
δ 1,81 (т, J=2,4 Гц, 3H), 2,89-2,94 (м, 2H), 3,52 (т, J=6,2 Гц, 2H), 3,84 (с, 3H), 4,01 (кв, J=2,8 Гц, 2H), 5,27 (кв, J=2,4 Гц, 2H), 6,67 (м, 1H), 8,30 (с, 1H).δ 1.81 (t, J = 2.4 Hz, 3H), 2.89-2.94 (m, 2H), 3.52 (t, J = 6.2 Hz, 2H), 3.84 ( s, 3H), 4.01 (q, J = 2.8 Hz, 2H), 5.27 (q, J = 2.4 Hz, 2H), 6.67 (m, 1H), 8.30 ( s, 1H).
MC m/e (ESI) 284,22 (MH+-CF3COOH).MS m / e (ESI) 284.22 (MH + -CF 3 COOH).
[Пример испытания 1] Анализ ингибирующей активности DPPIV[Test Example 1] DPPIV Inhibitory Activity Assay
Растворяют в реакционном буфере (50 мМ Трис-HCl (pH 7,4)/0,1% BSA (альбумин бычьей сыворотки)) DPP-IV, произведенный из свиных почек, при концентрации 10 мкмоль/мл. Этот раствор (110 мкл) объединяют с 15 мкл реагента и после этого смесь выдерживают при комнатной температуре в течение 20 минут. К этому раствору добавляют 25 мкл раствора (2 ммоль/л) Gly-Pro-пара-нитроанилида (до окончательной концентрации 0,33 ммоль/л), для того чтобы инициировать ферментативную реакцию. Время реакции составляет 20 минут. С целью прерывания реакции в реакционную смесь добавляют 25 мкл 1 н. раствора фосфорной кислоты. Регистрируют поглощение этого раствора при длине волны 405 нм и затем рассчитывают степень ингибирования ферментативной реакции, для того чтобы определить концентрацию ингибирования на 50%, IC50.Dissolved in reaction buffer (50 mM Tris-HCl (pH 7.4) / 0.1% BSA (bovine serum albumin)) DPP-IV produced from pork kidneys at a concentration of 10 μmol / ml. This solution (110 μl) was combined with 15 μl of reagent, and then the mixture was kept at room temperature for 20 minutes. To this solution, 25 μl of a solution (2 mmol / L) of Gly-Pro-para-nitroanilide (to a final concentration of 0.33 mmol / L) was added in order to initiate an enzymatic reaction. The reaction time is 20 minutes. In order to interrupt the reaction, 25 μl of 1 N was added to the reaction mixture. phosphoric acid solution. The absorption of this solution is recorded at a wavelength of 405 nm and then the degree of inhibition of the enzymatic reaction is calculated in order to determine the concentration of inhibition by 50%, IC 50 .
[Пример испытания 2][Test Example 2]
Влияние соединений на толерантность к глюкозе нормальных мышей (испытание in vivo)The effect of compounds on glucose tolerance in normal mice (in vivo test)
Животные: самцы С57BL/6N мышей (закуплены у фирмы Charles River Japan, Inc.).Animals: Male C57BL / 6N mice (purchased from Charles River Japan, Inc.).
Метод: получение и введение испытуемых соединенийMethod: preparation and administration of test compounds
Каждое испытуемое соединение суспендируют в 0,5% растворе метилцеллюлозы (МЦ) при концентрации, указанной далее в таблице. Суспензию испытуемого соединения и NVP DPP728 (US патент No. 6011155) или 0,5% раствор МЦ, который используется как среда для контрольной группы, вводят перорально в дозировке 10 мл/кг. Через 30 минут дают орально раствор глюкозы в дозировке 10 мл/кг. Дозировка глюкозы, введенная орально, составляет 2 г/кг.Each test compound is suspended in a 0.5% methyl cellulose (MC) solution at the concentration indicated in the table below. A suspension of the test compound and NVP DPP728 (US Patent No. 6011155) or a 0.5% solution of MC, which is used as the medium for the control group, is administered orally at a dose of 10 ml / kg. After 30 minutes, an oral glucose solution was given at a dosage of 10 ml / kg. The oral glucose dosage is 2 g / kg.
[Сбор крови и определение содержания глюкозы в крови][Blood collection and determination of blood glucose]
Непосредственно до введения испытуемого соединения и NVP DPP728, непосредственно до введения раствора глюкозы и через 30, 60 и 120 минут после введения, без анестезии хвостовую вену слегка надрезают лезвием бритвы, для того чтобы вытекла кровь. Собирают 10 мкл крови и сразу объединяют со 140 мкл 0,6 M раствора перхлорной кислоты. Пробу подвергают центрифугированию c ускорением 1500 g при температуре 4ºC в течение 10 минут в центрифуге с замораживанием GS-6KR (Beckman Corp.). Концентрацию глюкозы в образовавшейся жидкости над осадком определяют, используя набор Glucose CII TEST WAKO (фирма Wako Pure Chemical Industries).Immediately prior to administration of the test compound and NVP DPP728, immediately prior to administration of the glucose solution, and 30, 60 and 120 minutes after administration, the tail vein is slightly incised with a razor blade without anesthesia to allow blood to flow out. 10 μl of blood is collected and immediately combined with 140 μl of a 0.6 M perchloric acid solution. The sample is subjected to centrifugation with an acceleration of 1500 g at a temperature of 4ºC for 10 minutes in a centrifuge with freezing GS-6KR (Beckman Corp.). The glucose concentration in the resulting liquid above the precipitate was determined using the Glucose CII TEST WAKO kit (Wako Pure Chemical Industries).
Результатыresults
Величина площади под кривой «изменение содержания глюкозы во времени» (AUC0-120; площадь под кривой) была получена из временной зависимости содержания глюкозы от начала введения глюкозы до 120-й минуты после введения; определение проводят для каждой группы, обработанной 0,5% раствором МЦ, группы, обработанной NVP DPP728 и группы, обработанной испытуемым соединением. Коэффициент улучшения толерантности к глюкозе для испытуемого соединения определяют, приняв величину AUC0-120 для группы, обработанной 0,5% раствором МЦ, за 100%, а величину AUC0-120 для группы, обработанной NVP DPP728 (доза 10 мг/кг), за 0%, в соответствии с указанной далее формулой.The area under the curve "change in glucose over time" (AUC 0-120 ; area under the curve) was obtained from the time dependence of glucose from the start of glucose up to 120 minutes after administration; determination is carried out for each group treated with 0.5% MC solution, the group treated with NVP DPP728 and the group treated with the test compound. The glucose tolerance improvement coefficient for the test compound is determined by taking AUC 0-120 for the group treated with 0.5% MC solution as 100%, and AUC 0-120 for the group treated with DPP728 NVP (dose 10 mg / kg) , for 0%, in accordance with the following formula.
Коэффициент улучшения толерантности к глюкозе (%) = (AUC0-120 для группы, обработанной испытуемым соединением - AUC0-120 для группы, обработанной NVP DPP728 (10 мг/кг))/ AUC0-120 для группы, обработанной 0,5% раствором МЦ, - AUC0-120 для группы, обработанной NVP DPP728 (10 мг/кг)) × 100.Glucose tolerance improvement coefficient (%) = (AUC 0-120 for the group treated with the test compound - AUC 0-120 for the group treated with NVP DPP728 (10 mg / kg)) / AUC 0-120 for the group treated with 0.5 % solution of MC, - AUC 0-120 for the group treated with NVP DPP728 (10 mg / kg)) × 100.
Чем ниже этот коэффициент (в %), тем значительнее улучшения толерантности к глюкозе.The lower this coefficient (in%), the greater the improvement in glucose tolerance.
Установлено, что некоторые из новых конденсированных производных имидазола настоящего изобретения оказывают существенное влияние на толерантность к глюкозе нормальных мышей в ходе описанного выше эксперимента in vivo, который включает в себя пероральное введение соединений при дозировке 0,1-10 (мг/кг).It has been found that some of the new condensed imidazole derivatives of the present invention have a significant effect on glucose tolerance in normal mice during the in vivo experiment described above, which involves oral administration of the compounds at a dosage of 0.1-10 (mg / kg).
[Пример испытания 3][Test Example 3]
Приемлемая временная диаграмма введения в испытании in vivoAcceptable Timeline for In vivo Testing
В идеале требуется, чтобы лекарственный препарат для лечения послеобеденной гипергликемии обладал сравнимой эффективностью при лечении послеобеденной гипергликемии, как при введении препарата непосредственно до еды, так и при введении за 1 час до еды. Таким образом, превосходный лекарственный препарат, проявляющий повышенную эффективность, может быть разработан за счет расширения приемлемой временной диаграммы введения препарата.Ideally, a drug for treating afternoon hyperglycemia is required to have comparable efficacy in treating afternoon hyperglycemia, both when administered immediately before meals and when administered 1 hour before meals. Thus, an excellent drug exhibiting increased efficacy can be developed by expanding an acceptable timeline for drug administration.
МетодMethod
Описанные далее соответствующие испытания были проведены в сочетании с испытанием in vivo (введение препарата за 0,5 час), как описано в примере испытания 2.The corresponding tests described below were carried out in conjunction with the in vivo test (administration of the drug in 0.5 hour) as described in Test Example 2.
1. Испытуемое соединение вводится одновременно с подачей 2 г/кг глюкозы (испытуемое соединение суспендируется в водном растворе 0,5% метилцеллюлозы; раствор объединяют с равным объемом раствора глюкозы; смесь вводится перорально в дозировке 10 мл/кг).1. The test compound is administered simultaneously with 2 g / kg glucose (the test compound is suspended in an aqueous solution of 0.5% methylcellulose; the solution is combined with an equal volume of glucose solution; the mixture is administered orally at a dose of 10 ml / kg).
2. Испытуемое соединение вводится за 1 час до подачи глюкозы (2 г/кг) (испытуемое соединение суспендируется в водном растворе 0,5% метилцеллюлозы и вводится перорально за один час до орального введения раствора глюкозы; каждое соединение задается перорально в дозировке 10 мл/кг).2. The test compound is administered 1 hour before glucose supply (2 g / kg) (test compound is suspended in an aqueous solution of 0.5% methylcellulose and administered orally one hour before oral administration of the glucose solution; each compound is given orally at a dosage of 10 ml / kg).
Коэффициент улучшения толерантности к глюкозе оценивается в каждом испытании. Приемлемая временная диаграмма введения препарата может быть определена путем оценивания: достигается ли сопоставимая степень улучшения при двух типах введения, предпочтительно, когда дозы различаются в 3 раза или меньше, и наиболее предпочтительно, путем оценивания: достигается ли сопоставимая степень улучшения при двух типах введения, когда дозы являются одинаковыми. Оказалось, что такие представительные соединения по настоящему изобретению (в том числе, соединения, выбранные из группы, состоящей из тех, что приведены в примерах 82, 119, 120, 122, 229 и 267) имеют достаточно широкие интервалы приемлемой временной диаграммы введения, как указано выше.The glucose tolerance improvement coefficient is evaluated in each trial. An acceptable timeline for drug administration can be determined by evaluating: whether a comparable degree of improvement is achieved with two types of administration, preferably when the doses differ 3 times or less, and most preferably by evaluating: whether a comparable degree of improvement is achieved with two types of administration, when doses are the same. It turned out that such representative compounds of the present invention (including compounds selected from the group consisting of those shown in examples 82, 119, 120, 122, 229 and 267) have sufficiently wide intervals of an acceptable timing of administration, such as indicated above.
[Пример испытания 4][Test Example 4]
Назначение: влияние испытуемого соединения на содержание глюкозы в крови голодающих самцов крыс Wistar (in vivo испытание)Purpose: the effect of the test compound on blood glucose in starving male Wistar rats (in vivo test)
Животные: самцы крыс Wistar (поставляются фирмой Charles River Japan, Inc.).Animals: Male Wistar rats (available from Charles River Japan, Inc.).
Метод: получение и введение испытуемых соединенийMethod: preparation and administration of test compounds
Испытуемое соединение суспендируют в 0,5% растворе метилцеллюлозы (МЦ) и вводят перорально в дозировке 5 мл/кг. Контрольную группу животных обрабатывают 0,5% раствором МЦ. Раствор вводят перорально в дозировке 5 мл/кг.The test compound is suspended in a 0.5% methylcellulose (MC) solution and orally administered at a dose of 5 ml / kg. The control group of animals is treated with a 0.5% solution of MC. The solution is administered orally at a dosage of 5 ml / kg.
[Сбор крови и определение содержание глюкозы в крови][Blood collection and determination of blood glucose]
Непосредственно перед введением испытуемого соединения или 0,5% раствора МЦ и через 0,5, 1 и 3 часа после введения без анестезии хвостовую вену слегка надрезают лезвием бритвы, для того чтобы вытекла кровь. Отбирают 10 мкл крови и объединяют со 140 мкл 0,6 M раствора перхлорной кислоты. Пробу подвергают центрифугированию c ускорением 3000 g при температуре 4ºC в течение 10 минут и определяют концентрацию глюкозы в образовавшейся жидкости над осадком, используя набор CII TEST WAKO (фирма Wako Pure Chemical Industries).Immediately prior to administration of the test compound or 0.5% MC solution and 0.5, 1 and 3 hours after administration without anesthesia, the tail vein is slightly incised with a razor blade so that blood flows out. 10 μl of blood are collected and combined with 140 μl of a 0.6 M perchloric acid solution. The sample is centrifuged at an acceleration of 3000 g at 4 ° C for 10 minutes and the glucose concentration in the resulting liquid above the precipitate is determined using the CII TEST WAKO kit (Wako Pure Chemical Industries).
Результатыresults
Установлено, что некоторые из новых конденсированных производных имидазола настоящего изобретения (в частности, соединения, выбранные из группы, состоящей из тех, что приведены в примерах 82, 119, 120, 122, 229 и 267) не оказывают существенного влияния на содержание глюкозы в пробах крови, отобранных в любое время, по сравнению с контрольной группой, обработанной одной средой, в эксперименте in vivo, как описано выше, где каждое соединение вводится перорально в дозировке 10-30 мг/кг.It was found that some of the new condensed imidazole derivatives of the present invention (in particular, compounds selected from the group consisting of those shown in examples 82, 119, 120, 122, 229 and 267) do not significantly affect the glucose content in the samples blood taken at any time compared to a control group treated with one medium in an in vivo experiment, as described above, where each compound is orally administered at a dosage of 10-30 mg / kg.
[Пример испытания 5][Test Example 5]
Влияние испытуемого соединения на толерантность к глюкозе самцов крыс Zucker fa/fa (модельные животные с сахарным диабетом тучных, типа II) (испытание in vivo)The effect of the test compound on the glucose tolerance of male Zucker fa / fa rats (model animals with obese diabetes mellitus type II) (in vivo test)
Животные: самцы крыс Zucker fa/fa (поставляются фирмой Charles River Japan, Inc.).Animals: Zucker fa / fa male rats (available from Charles River Japan, Inc.).
Метод: получение и введение испытуемых соединенийMethod: preparation and administration of test compounds
Испытуемое соединение суспендируют в 0,5% растворе метилцеллюлозы (МЦ). Суспензию испытуемого соединения или 0,5% раствор МЦ, который используется в контрольной группе, обработанной средой, дают перорально в дозировке 5 мл/кг. Спустя 0,5 часа перорально дают раствор глюкозы в дозировке 5 мл/кг. Доза глюкозы, введенной перорально, составляет 2 г/кг.The test compound is suspended in a 0.5% methyl cellulose (MC) solution. A suspension of the test compound or 0.5% MC solution, which is used in the control group treated with the medium, is given orally at a dosage of 5 ml / kg. After 0.5 hours, a glucose solution at a dosage of 5 ml / kg was orally given. The dose of glucose administered orally is 2 g / kg.
Метод: отбор крови и определение содержания глюкозы, инсулина и GLP-1Method: blood sampling and determination of glucose, insulin and GLP-1
Непосредственно перед введением испытуемого соединения или 0,5% раствора МЦ, непосредственно перед введением глюкозы и 0,5, 1, 2 и 3 часа после введения глюкозы, без анестезии, хвостовую вену слегка надрезают лезвием бритвы, для того чтобы вытекла кровь. Отбирают 250 мкл крови, используя покрытый гепарином капилляр, и переносят в пробирку для центрифугирования. Пробу подвергают центрифугированию c ускорением 10000 g при температуре 4ºC в течение 2 минут. Содержание инсулина и GLP-1 определяют в образовавшейся жидкости над осадком, используя набор для анализа инсулина (Morinaga Biochemical Institute) и набор Active GLP-1 ELISA (Linco) соответственно. Одновременно отбирают 10 мкл крови и объединяют со 140 мкл 0,6 M раствора перхлорной кислоты. Пробу подвергают центрифугированию c ускорением 3000 g при температуре 4ºC в течение 10 минут и определяют концентрацию глюкозы в образовавшейся жидкости над осадком, используя набор CII TEST WAKO (фирма Wako Pure Chemical Industries). Определяют только содержание глюкозы через три часа после введения глюкозы.Immediately prior to administration of the test compound or 0.5% MC solution, immediately before glucose administration, and 0.5, 1, 2, and 3 hours after glucose administration, without anesthesia, the tail vein is slightly cut with a razor blade to allow blood to flow out. 250 μl of blood is collected using a heparin-coated capillary and transferred to a centrifuge tube. The sample is centrifuged with an acceleration of 10,000 g at 4ºC for 2 minutes. The content of insulin and GLP-1 is determined in the formed liquid above the precipitate using an insulin analysis kit (Morinaga Biochemical Institute) and Active GLP-1 ELISA kit (Linco), respectively. At the same time, 10 μl of blood was collected and combined with 140 μl of a 0.6 M perchloric acid solution. The sample is centrifuged at an acceleration of 3000 g at 4 ° C for 10 minutes and the glucose concentration in the resulting liquid above the precipitate is determined using the CII TEST WAKO kit (Wako Pure Chemical Industries). Only the glucose content is determined three hours after glucose administration.
Результатыresults
Величину площади под кривой «изменение содержания глюкозы во времени» (AUCГлю(0-3ч)) от начала введения глюкозы до 3 часов после введения; величину площади под кривой содержания инсулина во времени (AUCинс(0-2ч)) и величину площади под кривой содержания GLP-1 во времени (AUCGLP-1 (0-2ч)) определяют для каждой группы животных, обработанных 0,5% раствором МЦ, и для каждой группы, обработанной испытуемым соединением. Изменение толерантности к глюкозе, изменение содержания инсулина и изменение содержания GLP-1, вызванные испытуемым соединением определяют, приняв величину AUC для группы, обработанной 0,5% раствором МЦ, за 100%, в соответствии с указанными далее формулами:The area under the curve "change in glucose over time" (AUC Glu (0-3 h) ) from the start of glucose up to 3 hours after administration; the area under the curve of insulin content over time (AUC ins (0-2 h) ) and the area under the curve of GLP-1 over time (AUC GLP-1 (0-2 h) ) is determined for each group of animals treated with 0.5% a solution of MC, and for each group treated with the test compound. The change in glucose tolerance, the change in insulin content and the change in GLP-1 caused by the test compound is determined by taking the AUC value for the group treated with 0.5% MC solution as 100%, in accordance with the following formulas:
*Степень изменения толерантности к глюкозе (%) = (AUC0-3ч для группы, обработанной испытуемым соединением/AUC0-2ч для группы, обработанной 0,5% раствором МЦ) × 100;* The degree of change in glucose tolerance (%) = (AUC 0-3h for the group treated with the test compound / AUC 0-2h for the group treated with a 0.5% MC solution) × 100;
*Степень изменения содержания инсулина и GLP-1 (%) = AUC0-2ч для группы, обработанной испытуемым соединением/AUC0-2ч для группы, обработанной 0,5% раствором МЦ) × 100.* The degree of change in insulin content and GLP-1 (%) = AUC 0-2 h for the group treated with the test compound / AUC 0-2 h for the group treated with a 0.5% MC solution) × 100.
Установлено, что некоторые из новых конденсированных производных имидазола настоящего изобретения (в частности, соединения, выбранные из группы, состоящей из тех, что приведены в примерах 82, 119, 120, 122, 229 и 267) изменяют содержание инсулина и GLP-1 в степени больше чем 100% и показывают степень изменения толерантности к глюкозе меньше чем 100% в эксперименте in vivo, как описано выше, где каждое соединение вводится перорально в дозировке 0,10-10 (мг/кг).It was found that some of the new condensed imidazole derivatives of the present invention (in particular, compounds selected from the group consisting of those shown in examples 82, 119, 120, 122, 229 and 267) change the content of insulin and GLP-1 to a degree more than 100% and show a degree of change in glucose tolerance of less than 100% in an in vivo experiment, as described above, where each compound is orally administered at a dosage of 0.10-10 (mg / kg).
[Пример испытания 6][Test Example 6]
Оценка для фермента (цитохром Р450), метаболизирующего лекарственный препаратAssessment for an enzyme (cytochrome P450) metabolizing a drug
Ингибирующую активность IC50 определяют, используя систему экспрессии для рекомбинантного P450 и флуоресцентных субстратов (фирма GENTEST Corp.), которые указаны в таблицах 2 и 3, согласно методике испытания Procedure (WWW.gentest.com) и получены на фирме GENTEST Corp. Оцениваемые молекулярные разновидности P450 представляют собой пять молекулярных разновидностей, CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4. Применяемые экспериментальные условия показаны далее. Интенсивность флуоресценции определяют, используя планшетный счетчик (CYTO FLUOR Multi-Well Plate Reader Series 4000; PerSeptive Biosystems Corp.). Степень ингибирования определяют как среднюю величину из девяти независимых измерений в секунду, используя в качестве показателя интенсивности флуоресценцию, эмитируемую метаболитом флуоресцентного субстрата.The inhibitory activity of IC 50 is determined using the expression system for recombinant P450 and fluorescent substrates (GENTEST Corp.), which are shown in tables 2 and 3, according to the test procedure Procedure (WWW.gentest.com) and obtained from GENTEST Corp. The estimated molecular species P450 are five molecular species, CYP1A2, CYP2C9, CYP2C19, CYP2D6 and CYP3A4. The applicable experimental conditions are shown below. Fluorescence intensity is determined using a plate counter (CYTO FLUOR Multi-Well Plate Reader Series 4000; PerSeptive Biosystems Corp.). The degree of inhibition is defined as the average of nine independent measurements per second, using fluorescence emitted by the metabolite of the fluorescent substrate as an indicator of intensity.
В таблице 2 приведены субстраты, метаболиты, ингибиторы, длины волн возбуждения и длины волн флуоресценции, применяемые в этом анализе.Table 2 shows the substrates, metabolites, inhibitors, excitation wavelengths, and fluorescence wavelengths used in this analysis.
(нм)Fluorescence wavelength
(nm)
Сокращения для субстратов и метаболитов приведены в таблице 3.Abbreviations for substrates and metabolites are shown in table 3.
Результаты анализаAnalysis results
Соединения по настоящему изобретению оценивают по их способности ингибировать метаболические реакции благодаря P450 в примере испытания 6. Этот эксперимент продемонстрировал, что представительные соединения по настоящему изобретению (в том числе соединения, выбранные из группы, состоящей из тех, что указаны в примерах 82, 119, 120, 122, 229 и 267) имеют значения IC50, равные 10 мкМ или выше в отношении к пяти молекулам из группы P450, а именно к молекулярным разновидностям, CYP1A2, CYP2C9, CYP2C19, CYP2D6 и CYP3A4.The compounds of the present invention are evaluated for their ability to inhibit metabolic reactions due to P450 in test example 6. This experiment demonstrated that representative compounds of the present invention (including compounds selected from the group consisting of those specified in examples 82, 119, 120, 122, 229, and 267) have IC 50 values of 10 μM or higher with respect to five molecules from the P450 group, namely the molecular species, CYP1A2, CYP2C9, CYP2C19, CYP2D6, and CYP3A4.
[Пример испытания 7][Test Example 7]
Подавление тока канала hERGHERG channel current suppression
(1) Активность в отношении ингибирования тока канала hERG оценивают в соответствии с сообщением Zhou Z. и др. в Biophysical Journal, 74(1), 230-241 (1998).(1) The hERG channel current inhibition activity is evaluated according to a report by Zhou Z. et al. In Biophysical Journal, 74 (1), 230-241 (1998).
(2) Этот эксперимент проводят, используя клетки HEK-293, в которые был введен канальный ген hERG (подтип 1) (линия клеток установлена авторами этого изобретения).(2) This experiment was carried out using HEK-293 cells into which the hERG channel gene (subtype 1) was introduced (cell line established by the authors of this invention).
(3) За одни или несколько суток до эксперимента клетки высевают на стеклянную чашку, покрытую полилизином. Клетки культивируют до дня эксперимента. В начале эксперимента стеклянную чашку с засеянными клетками переносят в баню для проведения измерения. Ток канала hERG измеряется с помощью клемм электрического напряжения, используя методику штепсельного соединителя. Ток измеряют, используя усилитель тока (Axon Instruments). Ток регистрируют и анализируют, используя программное обеспечение pCLAMP (Axon Instruments).(3) One or several days before the experiment, the cells are seeded on a glass cup coated with polylysine. Cells are cultured until the day of the experiment. At the beginning of the experiment, a glass cup with seeded cells is transferred to a bath for measurement. The channel current hERG is measured using the voltage terminals using the plug connector technique. Current is measured using a current amplifier (Axon Instruments). Current is recorded and analyzed using pCLAMP software (Axon Instruments).
(4) Ток канала hERG индуцируется в клетках путем приложения деполяризующего импульса с фиксирующим потенциалом от -80 до +20 мв в течение 5 секунд и до -50 мв в течение 4 секунд, с интервалами 20 секунд. После стабилизации величины тока в контрольном растворе клетки подвергают перфузии с растворами, содержащими различные концентрации испытуемых соединений.(4) The hERG channel current is induced in cells by applying a depolarizing pulse with a fixing potential from -80 to +20 mV for 5 seconds and to -50 mV for 4 seconds, at intervals of 20 seconds. After stabilization of the current in the control solution, the cells are perfused with solutions containing various concentrations of the test compounds.
(5) Амплитуду тока канала hERG определяют как пиковое значение шлейфового тока, который наблюдается при восстановлении напряжения до -50 мв. Ингибирующая способность испытуемого соединения на ток канала hERG (IC50) оценивается по изменению пикового значения шлейфового тока после добавления испытуемого соединения при различной концентрации. Пиковое значение шлейфового тока, зарегистрированное для нормального раствора, принимается равным 100%.(5) The current amplitude of the hERG channel is defined as the peak value of the loop current, which is observed when the voltage is restored to -50 mV. The inhibitory ability of the test compound for the channel current hERG (IC 50 ) is evaluated by changing the peak value of the loop current after adding the test compound at different concentrations. The peak value of the loop current recorded for a normal solution is assumed to be 100%.
Результаты испытанияTest results
Представительные соединения по настоящему изобретению (в том числе соединения, выбранные из группы, состоящей из соединений, приведенных в примерах 82, 119, 120, 122, 229 и 267) оцениваются по способности испытуемого соединения ингибировать ток канала hERG в примере испытания 7. Значения IC50 для этих соединений составляли 30 мкМ или выше.Representative compounds of the present invention (including compounds selected from the group consisting of the compounds shown in examples 82, 119, 120, 122, 229 and 267) are evaluated by the ability of the test compounds to inhibit the hERG channel current in test example 7. IC values 50 for these compounds was 30 μM or higher.
Структурные формулы для соединений в описанных выше примерах получения и в примерах, показаны далее.Structural formulas for the compounds in the above production examples and in the examples are shown below.
Промышленная применимостьIndustrial applicability
В настоящем изобретении предоставляются конденсированные производные имидазола, обладающие DPPIV-ингибирующей активностью.The present invention provides fused imidazole derivatives having DPPIV inhibitory activity.
Следовательно, конденсированные производные имидазола настоящего изобретения могут применяться в качестве терапевтических и профилактических препаратов, например, при лечении сахарного диабета, ожирения, гиперлипидемии, СПИД, остеопороза, желудочно-кишечных нарушений, ангиогенеза, бесплодия, в качестве противоспалительных и антиаллергических препаратов, иммуномодулирующих средств, гормональных регуляторов, противоревматических лекарственных препаратов и противоопухолевых препаратов.Therefore, the condensed imidazole derivatives of the present invention can be used as therapeutic and prophylactic drugs, for example, in the treatment of diabetes mellitus, obesity, hyperlipidemia, AIDS, osteoporosis, gastrointestinal disorders, angiogenesis, infertility, as anti-inflammatory and anti-allergic drugs, immunomodulating agents, hormonal regulators, anti-rheumatic drugs and antitumor drugs.
Кроме того, с использованием индекса способности этих соединений улучшать толерантность к глюкозе, соединения были испытаны, для того чтобы оценить их эффективность после перорального введения. Таким образом, была подтверждена достаточная эффективность этих соединений и продемонстрирована их применимость в качестве фармацевтических препаратов.In addition, using an index of the ability of these compounds to improve glucose tolerance, the compounds were tested in order to evaluate their effectiveness after oral administration. Thus, the sufficient efficacy of these compounds was confirmed and their applicability as pharmaceuticals was demonstrated.
Claims (33)
где Т1 представляет собой моноциклическую 5-6-членную гетероциклическую группу,
содержащую один или два атома азота в кольце, которая может иметь одну или более аминогруппу в качестве заместителей;
Х представляет собой С2-6 алкенильную группу, которая может иметь один или несколько заместителей, C2-6 алкинильную группу, фенильную группу, которая может иметь один или несколько заместителей, выбранных из алкильной группы или галогена или фенил С1-6 алкильной группы;
Z1 и Z2, каждый независимо, представляют собой атом азота или группу формулы -CR2=;
R1 и R2, каждый независимо, представляют собой группу формулы -А0-А1-А2 (где А0 представляет собой одинарную связь или C1-6 алкиленовую группу, которая может иметь 1-3 заместителя, выбранные из группы В, состоящей из указанных ниже заместителей; А1 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -O-СО-, группу, представленную формулой -СО-O-, группу, представленную формулой -NRA-, группу, представленную формулой -CO-NRA-, группу, представленную формулой -NRA-CO-, группу, представленную формулой -SO2-NRA-, или группу, представленную формулой -NRA-SO2-;
А2 и RA, каждый независимо, представляют собой атом водорода, атом галогена, цианогруппу, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил C1-6 алкильную группу, С6-10 арил С1-6 алкильную группу, или С2-7 алкилкарбонильную группу;
причем А2 и RA, каждый независимо, могут иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей В:
когда Z2 представляет собой группу формулы -CR2=, R1 и R2 могут вместе образовывать 5-7-членное кольцо;
за исключением случаев, когда [1] R1 представляет собой атом водорода, Z1 представляет собой атом азота и Z2 представляет собой группу -СН=; [2] Z1 представляет собой атом азота и Z2 представляет собой группу -С(ОН)=;
<группа заместителей В>
группа заместителей В представляет собой группу, включающую гидроксильную группу, меркаптогруппу, цианогруппу, нитрогруппу, атом галогена, трифторметильную группу, С1-6 алкильную группу, которая может иметь один или несколько заместителей, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, С1-6 алкоксигруппу, C1-6 алкилтиогруппу, группу, представленную формулой -SO2-NRB1-RB2, группу, представленную формулой -NRB1-CO-RB2, группу, представленную формулой -NRB1-RB2 (где RB1 и RB2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RB3 (где RB3 представляет собой 4-8-членную гетероциклическую группу), группу, представленную формулой -CO-RB4-RB5, и группу, представленную формулой -CH2-CO-RB4-RB5 (где RB4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRB6 -; RB5 и RB6, каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членный гетероцикл С1-6 алкильную группу, С6-10 арил C1-6 алкильную группу или 5-10-членный гетероарил С1-6 алкильную группу)).1. The compound represented by the following formula, or its salt or hydrate
where T 1 represents a monocyclic 5-6-membered heterocyclic group,
containing one or two nitrogen atoms in the ring, which may have one or more amino groups as substituents;
X represents a C 2-6 alkenyl group which may have one or more substituents, a C 2-6 alkynyl group, a phenyl group which may have one or more substituents selected from an alkyl group or a halogen or phenyl C 1-6 alkyl group ;
Z 1 and Z 2 each independently represent a nitrogen atom or a group of the formula —CR 2 =;
R 1 and R 2 each independently represent a group of the formula -A 0 -A 1 -A 2 (where A 0 is a single bond or a C 1-6 alkylene group, which may have 1-3 substituents selected from group B consisting of the following substituents; A 1 represents a single bond, an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group, a carbonyl group, a group represented by the formula —O — CO—, a group represented by the formula —CO — O—, a group represented by the formula -NR A -, a group represented by the formula -CO-NR A -, a group representing hydrochloric formula -NR A -CO-, a group represented by the formula -SO 2 -NR A -, or a group represented by the formula -NR A -SO 2 -;
A 2 and R A each independently represent a hydrogen atom, a halogen atom, a cyano group, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, C 6- 10 aryl group, 5-10 membered heteroaryl group, 4-8 membered heterocyclic group, 5-10 membered heteroaryl C 1-6 alkyl group, C 6-10 aryl C 1-6 alkyl group, or C 2-7 an alkylcarbonyl group;
moreover, A 2 and R A , each independently, may have 1-3 substituents selected from the following group of substituents B:
when Z 2 is a group of the formula —CR 2 =, R 1 and R 2 may together form a 5-7 membered ring;
unless [1] R 1 represents a hydrogen atom, Z 1 represents a nitrogen atom and Z 2 represents a —CH═ group; [2] Z 1 represents a nitrogen atom and Z 2 represents a group —C (OH) =;
<group of deputies B>
substituent group B is a group comprising a hydroxyl group, a mercapto group, a cyano group, a nitro group, a halogen atom, a trifluoromethyl group, a C 1-6 alkyl group which may have one or more substituents, a C 3-8 cycloalkyl group, C 2-6 alkenyl group, C 2-6 alkynyl group, C 6-10 aryl group, 5-10 membered heteroaryl group, 4-8 membered heterocyclic group, C 1-6 alkoxy group, C 1-6 alkylthio group, the group represented by the formula —SO 2 -NR B1 -R B2, a group represented by formula -NR B1 -CO-R B2, group, etc. dstavlennuyu formula -NR B1 -R B2 (where R B1 and R B2, each independently represent a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula -CO-R B3 (wherein R B3 represents 4-8 a membered heterocyclic group), a group represented by the formula —CO — R B4 —R B5 , and a group represented by the formula —CH 2 —CO — R B4 —R B5 (where R B4 is a single bond, an oxygen atom, or a group represented by the formula -NR B6 -; R B5 and R B6 each independently represent a hydrogen atom, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group, 5 10-membered heteroaryl group, 4-8-membered heterocycle C 1-6 alkyl group, C 6-10 aryl C 1-6 alkyl group or 5-10-membered heteroaryl C 1-6 alkyl group)).
(где n=0 и m=0);
пирролидин-1-ильную группу, которая может содержать аминогруппу;
пиперидин-1-ильную группу, которая может содержать аминогруппу.2. The compound according to claim 1 or its salt or hydrate, where T 1 represents a group of the following formula:
(where n = 0 and m = 0);
pyrrolidin-1-ilen group, which may contain an amino group;
piperidin-1-ilen group, which may contain an amino group.
где R1 представляет собой атом водорода или группу, представленную формулой -A10-A11-A12 (где А10 представляет собой C1-6 алкенильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С;
А11 представляет собой одинарную связь, атом кислорода, атом серы или карбонильную группу;
А12 представляет собой атом водорода, С6-10 арильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, 5-10-членную гетероарильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, 5-10-членный гетероарил С1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С, или С6-10 арил C1-6 алкильную группу, которая может иметь 1-3 заместителя, выбранные из указанной ниже группы заместителей С:
<группа заместителей C>
группа заместителей С представляет собой группу, включающую гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, C1-6 алкильную группу, С1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RС2 (где RС1 и RС2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RС3-RС4, и группу, представленную формулой -СН2-CO-RС3-RС4 (где RС3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRС5-; RС4 и RС5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу).10. The compound according to claim 1 or its salt or hydrate,
where R 1 represents a hydrogen atom or a group represented by the formula -A 10 -A 11 -A 12 (where A 10 represents a C 1-6 alkenyl group, which may have 1-3 substituents selected from the following substituent group C;
A 11 represents a single bond, an oxygen atom, a sulfur atom or a carbonyl group;
A 12 represents a hydrogen atom, a C 6-10 aryl group which may have 1-3 substituents selected from the following substituent group C, a 5-10 membered heteroaryl group which may have 1-3 substituents selected from the following substituent groups C, a 5-10 membered heteroaryl C 1-6 alkyl group which may have 1-3 substituents selected from the following substituent group C, or a C 6-10 aryl C 1-6 alkyl group which may have 1 -3 substituents selected from the following substituent group C:
<substituent group C>
substituent group C is a group comprising a hydroxyl group, a nitro group, a cyano group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR C1 —R C2 (where R C1 and R C2 each independently represent a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R C3 —R C4 , and a group represented by the formula —CH 2 —CO — R C3 C4 -R (where R C3 represents a single bond, an oxygen atom or a group represented by formula -NR C5 -; R C4 and R C5, azhdy independently represent a hydrogen atom or a C 1-6 alkyl group).
<группа заместителей С>
группа заместителей С представляет собой группу, включающую: гидроксильную группу, нитрогруппу, цианогруппу, атом галогена, С1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRC1-RC2 (где RC1 и RC2, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RC3-RC4, и группу, представленную формулой -CH2-CO-RC3-RC4 (где RC3 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRC5-; RC4 и RC5, каждый независимо, представляют собой атом водорода или С1-6 алкильную группу).11. The compound according to claim 1 or its salt or hydrate, where R 1 represents a hydrogen atom, a C 1-6 alkyl group which may have 1-3 substituents selected from the following substituent group C, 5-10 membered heteroaryl A C 1-6 alkyl group which may have 1-3 substituents selected from the following substituent group C, or a C 6-10 aryl C 1-6 alkyl group which may have 1-3 substituents selected from the following substituent group FROM:
<group of deputies C>
substituent group C represents a group including: a hydroxyl group, a nitro group, a cyano group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR C1 —R C2 (where R C1 and R C2 each independently represent a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO — R C3 —R C4 , and a group represented by the formula —CH 2 —CO — R C3 -R C4 (where R C3 represents a single bond, an oxygen atom or a group represented by the formula -NR C5 -; R C4 and R C5 each independently represent a hydrogen atom or a C 1-6 alkyl group).
(где А21 представляет собой одинарную связь, атом кислорода, атом серы, сульфинильную группу, сульфонильную группу, карбонильную группу, группу, представленную формулой -O-СО-, группу, представленную формулой -СО-O-, группу, представленную формулой -NRA2-, группу, представленную формулой -CO-NRA2-, или группу, представленную формулой -NRА2 -СО-;
А22 и RA2, каждый независимо, представляют собой атом водорода, цианогруппу, C1-6 алкильную группу, С3-8 циклоалкильную группу, С2-6 алкенильную группу, С2-6 алкинильную группу, С6-10 арильную группу, 5-10-членную гетероарильную группу, 4-8-членную гетероциклическую группу, 5-10-членный гетероарил C1-6 алкильную группу или С6-10 арил С1-6 алкильную группу;
причем А22 и RA2, каждый независимо, может иметь 1-3 заместителя, выбранные из указанных ниже заместителей группы D:
<группа заместителей D>
группа заместителей D представляет собой группу, включающую гидроксильную группу, цианогруппу, нитрогруппу, атом галогена, C1-6 алкильную группу, C1-6 алкоксигруппу, C1-6 алкилтиогруппу, трифторметильную группу, группу, представленную формулой -NRD1-RD2, (где RD1 и RD2, каждый, независимо, представляют собой атом водорода или C1-6 алкильную группу), группу, представленную формулой -CO-RD3 (в которой RD3 представляет собой 4-8-членную гетероциклическую группу), и группу, представленную формулой -CO-RD4-RD5 (где RD4 представляет собой одинарную связь, атом кислорода или группу, представленную формулой -NRD6-; RD5 и RD6, каждый независимо, представляют собой атом водорода, С3-8 циклоалкильную группу или C1-6 алкильную группу)).15. The compound according to any one of claims 1 to 14 or its salt or hydrate, where R 2 represents a hydrogen atom, a cyano group or a group represented by the formula -A 21 -A 22 ,
(where A 21 represents a single bond, an oxygen atom, a sulfur atom, a sulfinyl group, a sulfonyl group, a carbonyl group, a group represented by the formula —O — CO—, a group represented by the formula —CO — O—, a group represented by the formula —NR A2 -, a group represented by the formula —CO — NR A2 -, or a group represented by the formula —NR A2 —CO—;
A 22 and R A2 each independently represent a hydrogen atom, a cyano group, a C 1-6 alkyl group, a C 3-8 cycloalkyl group, a C 2-6 alkenyl group, a C 2-6 alkynyl group, a C 6-10 aryl group A 5-10 membered heteroaryl group, a 4-8 membered heterocyclic group, a 5-10 membered heteroaryl C 1-6 alkyl group, or a C 6-10 aryl C 1-6 alkyl group;
moreover, A 22 and R A2 , each independently, may have 1-3 substituents selected from the following substituents of group D:
<substituent group D>
substituent group D is a group comprising a hydroxyl group, a cyano group, a nitro group, a halogen atom, a C 1-6 alkyl group, a C 1-6 alkoxy group, a C 1-6 alkylthio group, a trifluoromethyl group, a group represented by the formula —NR D1 —R D2 , (where R D1 and R D2 each independently represents a hydrogen atom or a C 1-6 alkyl group), a group represented by the formula —CO-R D3 (in which R D3 represents a 4-8 membered heterocyclic group) and a group represented by the formula -CO-R D4 -R D5 (where R D4 represents a single bond, an atom sour genus or group represented by Formula -NR D6 -; R D5 and R D6, each independently represent a hydrogen atom, a C 3-8 cycloalkyl group or a C 1-6 alkyl group)).
(где А23 представляет собой атом кислорода, атом серы или группу, представленную формулой -NRA3-;
А24 и RA3, каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С3-8 циклоалкильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С2-6 алкенильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, С2-6 алкинильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, фенильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1, или 5-10-членную гетероарильную группу, которая может иметь заместитель, выбранный из указанной ниже группы заместителей D1:
<группа заместителей D1>
группа заместителей D1 представляет собой группу, включающую
карбоксигруппу, С2-7 алкоксикарбонильную группу, C1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), пирролидин-1-илкарбонильную группу, C1-6 алкильную группу и C1-6 алкоксигруппу).16. The compound according to any one of claims 1-14, or a salt or hydrate thereof, wherein R 2 represents a hydrogen atom, a cyano group, a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represents a hydrogen atom or a C 1-6 alkyl group), or a group represented by the formula -A 23 -A 24 ,
(where A 23 represents an oxygen atom, a sulfur atom or a group represented by the formula —NR A3 -;
A 24 and R A3 each independently represent a hydrogen atom, a C 1-6 alkyl group which may have a substituent selected from the following substituent group D1, a C 3-8 cycloalkyl group which may have a substituent selected from the following substituent groups D1; a C 2-6 alkenyl group which may have a substituent selected from the following substituent group D1; a C 2-6 alkynyl group which may have a substituent selected from the following substituent group D1; a phenyl group which may have replace s selected from the group D1 shown below substituent or 5-10-membered heteroaryl group which may have a substituent selected from the group D1 shown below substituents:
<substituent group D1>
the group of substituents D1 is a group including
a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or a C 1-6 alkyl group), pyrrolidine -1-ylcarbonyl group, C 1-6 alkyl group and C 1-6 alkoxy group).
А26 и RA4 каждый независимо, представляют собой атом водорода, C1-6 алкильную группу, содержащую заместитель, выбранный из указанной ниже группы заместителей D1, С3-8 циклоалкильную группу, имеющую заместитель, выбранный из указанной ниже группы заместителей D1, или фенильную группу, имеющую заместитель, выбранный из указанной ниже группы заместителей D1:
<группа заместителей D1>
группа заместителей D1 включает карбоксигруппу, С2-7 алкоксикарбонильную группу, С1-6 алкильную группу, группу, представленную формулой -CONRD7RD8 (где RD7 и RD8, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу), пирролидин-1-илкарбонильную группу, C1-6 алкильную группу и С1-6 алкоксигруппу).17. The compound according to any one of claims 1 to 14 or its salt or hydrate, where R 2 represents a hydrogen atom, a cyano group, a C 1-6 alkoxy group or a group represented by the formula -A 25 -A 26 (where A 25 represents an atom oxygen, a sulfur atom or a group represented by the formula —NR A4 -;
A 26 and R A4 each independently represent a hydrogen atom, a C 1-6 alkyl group containing a substituent selected from the following substituent group D1, a C 3-8 cycloalkyl group having a substituent selected from the following substituent group D1, or a phenyl group having a substituent selected from the following D1 substituent group:
<substituent group D1>
the substituent group D1 includes a carboxy group, a C 2-7 alkoxycarbonyl group, a C 1-6 alkyl group, a group represented by the formula —CONR D7 R D8 (where R D7 and R D8 each independently represent a hydrogen atom or C 1-6 alkyl group), a pyrrolidin-1-ylcarbonyl group, a C 1-6 alkyl group and a C 1-6 alkoxy group).
(где А27 представляет собой атом кислорода, атом серы, или -NH-;
А28 и А29, каждый независимо, представляют собой атом водорода или C1-6 алкильную группу).18. The compound according to any one of claims 1 to 14 or its salt or hydrate, where R 2 represents a hydrogen atom, a cyano group, a methoxy group, a carbamoylphenyloxy group, or a group represented by the following formula:
(where A 27 represents an oxygen atom, a sulfur atom, or —NH—;
A 28 and A 29 each independently represent a hydrogen atom or a C 1-6 alkyl group).
7-(2-бутинил)-2-циано-1-метил-8-(пиперазин-1-ил)-1,7-дигидропурин-6-он.20. The compound according to claim 1 or its salt or hydrate, where the compound of formula (I) is
7- (2-butynyl) -2-cyano-1-methyl-8- (piperazin-1-yl) -1,7-dihydropurin-6-one.
3-(2-бутинил)-5-метил-2-(пиперазин-1-ил)-3,5-дигидроимидазо[4,5-d]пиридазин-4-он.21. The compound according to claim 1 or its salt or hydrate, where the compound of formula (I) is
3- (2-butynyl) -5-methyl-2- (piperazin-1-yl) -3,5-dihydroimidazo [4,5-d] pyridazin-4-one.
2-(3-аминопиперидин-1-ил)-3-(2-бутинил)-5-метил-3,5-дигидроимидазо[4,5-d]пиридазин-4-он.22. The compound according to claim 1 or its salt or hydrate, where the compound of formula (I) is
2- (3-aminopiperidin-1-yl) -3- (2-butynyl) -5-methyl-3,5-dihydroimidazo [4,5-d] pyridazin-4-one.
2-[7-(2-бутинил)-1-метил-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.23. The compound according to claim 1 or its salt or hydrate, where the compound of formula (I) is
2- [7- (2-butynyl) -1-methyl-6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide.
7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-карбонитрил.24. The compound according to claim 1 or a salt or hydrate thereof, wherein the compound of formula (I) is
7- (2-butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purine-2-carbonitrile.
2-[3-(2-бутинил)-4-оксо-2-(пиперазин-1-ил)-3,4-дигидроимидазо [4,5-d] пиридазин-5-илметил]бензонитрил.25. The compound according to claim 1 or a salt or hydrate thereof, wherein the compound of formula (I) is
2- [3- (2-butynyl) -4-oxo-2- (piperazin-1-yl) -3,4-dihydroimidazo [4,5-d] pyridazin-5-ylmethyl] benzonitrile.
2-[7-(2-бутинил)-1-(2-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.26. The compound according to claim 1 or its salt or hydrate, where the compound of formula (I) is
2- [7- (2-butynyl) -1- (2-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide.
2-[7-(2-бутинил)-1-(4-цианобензил)-6-оксо-8-(пиперазин-1-ил)-6,7-дигидро-1Н-пурин-2-илокси]бензамид.27. The compound according to claim 1 or a salt or hydrate thereof, wherein the compound of formula (I) is
2- [7- (2-butynyl) -1- (4-cyanobenzyl) -6-oxo-8- (piperazin-1-yl) -6,7-dihydro-1H-purin-2-yloxy] benzamide.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002166069 | 2002-06-06 | ||
| JP2002-166069 | 2002-06-06 | ||
| JP2002-209373 | 2002-07-18 | ||
| JP2002209373 | 2002-07-18 | ||
| JP2002-307750 | 2002-10-23 | ||
| JP2002307750 | 2002-10-23 |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| RU2004139111A RU2004139111A (en) | 2005-08-10 |
| RU2297418C2 RU2297418C2 (en) | 2007-04-20 |
| RU2297418C9 true RU2297418C9 (en) | 2009-01-27 |
Family
ID=29740540
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| RU2004139111/04A RU2297418C9 (en) | 2002-06-06 | 2003-06-03 | Novel condensed derivatives of imidazole, inhibitors of dipeptidyl peptidase iv, pharmaceutical composition, method of treatment and using based on thereof |
Country Status (19)
| Country | Link |
|---|---|
| US (4) | US20060100199A1 (en) |
| EP (1) | EP1514552A4 (en) |
| JP (2) | JP3675813B2 (en) |
| KR (1) | KR100985160B1 (en) |
| CN (2) | CN100469778C (en) |
| AU (1) | AU2003241960B2 (en) |
| BR (1) | BR0311697A (en) |
| CA (1) | CA2485641C (en) |
| HK (2) | HK1078869A1 (en) |
| IL (1) | IL165178A0 (en) |
| IS (1) | IS7625A (en) |
| MX (1) | MXPA04012226A (en) |
| NO (1) | NO20050054L (en) |
| NZ (1) | NZ536794A (en) |
| PL (1) | PL374007A1 (en) |
| RU (1) | RU2297418C9 (en) |
| TW (1) | TWI273104B (en) |
| WO (1) | WO2003104229A1 (en) |
| ZA (1) | ZA200500041B (en) |
Families Citing this family (129)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PL360856A1 (en) * | 2000-07-04 | 2004-09-20 | Novo Nordisk A/S | Purine-2,6-diones which are inhibitors of the enzyme dipeptidyl peptidase iv (dpp-iv) |
| DK1368349T3 (en) * | 2001-02-24 | 2007-05-21 | Boehringer Ingelheim Pharma | Xanthine derivatives, their preparation and their use as pharmaceuticals |
| EP1338595B1 (en) | 2002-02-25 | 2006-05-03 | Eisai Co., Ltd. | Xanthine derivatives as DPP-IV inhibitors |
| KR100985160B1 (en) | 2002-06-06 | 2010-10-05 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | Novel condensed imidazole derivatives |
| US7407955B2 (en) * | 2002-08-21 | 2008-08-05 | Boehringer Ingelheim Pharma Gmbh & Co., Kg | 8-[3-amino-piperidin-1-yl]-xanthines, the preparation thereof and their use as pharmaceutical compositions |
| US7495005B2 (en) | 2002-08-22 | 2009-02-24 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Xanthine derivatives, their preparation and their use in pharmaceutical compositions |
| US7569574B2 (en) | 2002-08-22 | 2009-08-04 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Purine derivatives, the preparation thereof and their use as pharmaceutical compositions |
| WO2004028524A1 (en) * | 2002-09-26 | 2004-04-08 | Eisai Co., Ltd. | Combination drug |
| US7482337B2 (en) * | 2002-11-08 | 2009-01-27 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Xanthine derivatives, the preparation thereof and their use as pharmaceutical compositions |
| DE10254304A1 (en) * | 2002-11-21 | 2004-06-03 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | New xanthine derivatives, their production and their use as medicines |
| UY28103A1 (en) * | 2002-12-03 | 2004-06-30 | Boehringer Ingelheim Pharma | NEW IMIDAZO-PIRIDINONAS REPLACED, ITS PREPARATION AND ITS EMPLOYMENT AS MEDICATIONS |
| US7109192B2 (en) | 2002-12-03 | 2006-09-19 | Boehringer Ingelheim Pharma Gmbh & Co Kg | Substituted imidazo-pyridinones and imidazo-pyridazinones, the preparation thereof and their use as pharmaceutical compositions |
| AU2003302657B8 (en) | 2002-12-04 | 2009-12-03 | Eisai R&D Management Co., Ltd. | Fused 1,3-dihydroimidazole ring compounds |
| US7550590B2 (en) * | 2003-03-25 | 2009-06-23 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| WO2004096806A1 (en) * | 2003-04-30 | 2004-11-11 | Sumitomo Pharmaceuticals Co. Ltd. | Fused imidazole derivative |
| ZA200508439B (en) | 2003-05-05 | 2007-03-28 | Probiodrug Ag | Medical use of inhibitors of glutaminyl and glutamate cyclases |
| AU2003902828A0 (en) * | 2003-06-05 | 2003-06-26 | Fujisawa Pharmaceutical Co., Ltd. | Dpp-iv inhibitor |
| DE10327439A1 (en) * | 2003-06-18 | 2005-01-05 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Novel imidazopyridazinone and imidazopyridone derivatives, their production and their use as pharmaceuticals |
| US7566707B2 (en) | 2003-06-18 | 2009-07-28 | Boehringer Ingelheim International Gmbh | Imidazopyridazinone and imidazopyridone derivatives, the preparation thereof and their use as pharmaceutical compositions |
| US7169926B1 (en) | 2003-08-13 | 2007-01-30 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| RU2006107553A (en) * | 2003-08-13 | 2007-09-20 | Такеда Фармасьютикал Компани Лимитед (Jp) | 4-Pyrimidone derivatives and their use as peptidyl peptidase inhibitors |
| US7678909B1 (en) | 2003-08-13 | 2010-03-16 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| EP1699777B1 (en) | 2003-09-08 | 2012-12-12 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| WO2005051949A1 (en) * | 2003-11-26 | 2005-06-09 | Dainippon Sumitomo Pharma Co., Ltd. | Novel condensed imidazole derivative |
| DE10355304A1 (en) | 2003-11-27 | 2005-06-23 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Novel 8- (piperazin-1-yl) and 8 - ([1,4] diazepan-1-yl) xanthines, their preparation and their use as pharmaceuticals |
| US20070219178A1 (en) * | 2003-12-04 | 2007-09-20 | Eisai Co., Ltd. | Preventive or therapeutic agents for multiple sclerosis |
| WO2005061505A1 (en) * | 2003-12-16 | 2005-07-07 | Pfizer Products Inc. | Bicyclic imidazolyl pyrimidin-4-one cannabinoid receptor ligands and uses thereof |
| US7217711B2 (en) | 2003-12-17 | 2007-05-15 | Boehringer Ingelheim International Gmbh | Piperazin-1-yl and 2-([1,4]diazepan-1-yl)-imidazo[4,5-d]-pyridazin-4-ones, the preparation thereof and their use as pharmaceutical compositions |
| DE10359098A1 (en) * | 2003-12-17 | 2005-07-28 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Novel 2- (piperazin-1-yl) and 2 - ([1,4] diazepan-1-yl) imidazo [4,5-d] pyridazin-4-ones, their preparation and their use as pharmaceuticals |
| DE10360835A1 (en) | 2003-12-23 | 2005-07-21 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | New bicyclic imidazole derivatives are dipeptidylpeptidase-IV inhibitors useful to treat e.g. arthritis, obesity, allograft transplantation and calcitonin-induced osteoporosis |
| AU2005219508B2 (en) * | 2004-02-18 | 2012-02-16 | Boehringer Ingelheim International Gmbh | 8-[3-amino-piperidin-1-yl]-xanthine, the production thereof and the use in the form of a DPP inhibitor |
| US7501426B2 (en) | 2004-02-18 | 2009-03-10 | Boehringer Ingelheim International Gmbh | 8-[3-amino-piperidin-1-yl]-xanthines, their preparation and their use as pharmaceutical compositions |
| DE102004009039A1 (en) | 2004-02-23 | 2005-09-08 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | 8- [3-Amino-piperidin-1-yl] xanthines, their preparation and use as pharmaceuticals |
| US7732446B1 (en) | 2004-03-11 | 2010-06-08 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| DE102004012366A1 (en) * | 2004-03-13 | 2005-09-29 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Imidazopyridazinediones, their preparation and their use as medicines |
| US7393847B2 (en) | 2004-03-13 | 2008-07-01 | Boehringer Ingleheim International Gmbh | Imidazopyridazinediones, their preparation and their use as pharmaceutical compositions |
| CN102134231B (en) | 2004-03-15 | 2020-08-04 | 武田药品工业株式会社 | Dipeptidyl peptidase inhibitors |
| EP1732921B1 (en) * | 2004-04-08 | 2008-11-05 | Wyeth | Thioamide derivatives as progesterone receptor modulators |
| US7179809B2 (en) * | 2004-04-10 | 2007-02-20 | Boehringer Ingelheim International Gmbh | 2-Amino-imidazo[4,5-d]pyridazin-4-ones, their preparation and their use as pharmaceutical compositions |
| CA2561210A1 (en) | 2004-04-10 | 2005-10-20 | Boehringer Ingelheim International Gmbh | Novel 2-amino-imidazo[4,5-d]pyridazin-4-ones and 2-amino-imidazo[4,5-c]pyridin-4-ones, production and use thereof as medicaments |
| DE102004022970A1 (en) * | 2004-05-10 | 2005-12-01 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Novel imidazole derivatives, their preparation and their use as intermediates for the manufacture of medicines and pesticides |
| US7439370B2 (en) | 2004-05-10 | 2008-10-21 | Boehringer Ingelheim International Gmbh | Imidazole derivatives, their preparation and their use as intermediates for the preparation of pharmaceutical compositions and pesticides |
| EP1753730A1 (en) | 2004-06-04 | 2007-02-21 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| DE102004030502A1 (en) * | 2004-06-24 | 2006-01-12 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Novel imidazoles and triazoles, their preparation and use as medicines |
| WO2006019965A2 (en) | 2004-07-16 | 2006-02-23 | Takeda San Diego, Inc. | Dipeptidyl peptidase inhibitors |
| DE102004038269A1 (en) * | 2004-08-06 | 2006-03-16 | Sanofi-Aventis Deutschland Gmbh | Substituted bicyclic 8-piperidino-xanthines, process for their preparation and their use as pharmaceuticals |
| DE102004043944A1 (en) | 2004-09-11 | 2006-03-30 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Novel 8- (3-amino-piperidin-1-yl) -7- (but-2-ynyl) -xanthines, their preparation and their use as pharmaceuticals |
| DE102004044221A1 (en) | 2004-09-14 | 2006-03-16 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | New 3-methyl-7-butynyl xanthines, their preparation and their use as pharmaceuticals |
| AR051596A1 (en) * | 2004-10-26 | 2007-01-24 | Irm Llc | CONDENSED HETEROCICLIC COMPOUNDS NITROGENATED AS INHIBITORS OF THE ACTIVITY OF THE CANABINOID RECEIVER 1; PHARMACEUTICAL COMPOSITIONS THAT CONTAIN THEM AND THEIR EMPLOYMENT IN THE PREPARATION OF MEDICINES FOR THE TREATMENT OF FOOD DISORDERS |
| DE102004054054A1 (en) | 2004-11-05 | 2006-05-11 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Process for preparing chiral 8- (3-amino-piperidin-1-yl) -xanthines |
| EP2805953B1 (en) | 2004-12-21 | 2016-03-09 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| CN101103032B (en) | 2004-12-24 | 2011-05-11 | 大日本住友制药株式会社 | Bicyclic pyrrole derivatives |
| DOP2006000008A (en) * | 2005-01-10 | 2006-08-31 | Arena Pharm Inc | COMBINED THERAPY FOR THE TREATMENT OF DIABETES AND RELATED AFFECTIONS AND FOR THE TREATMENT OF AFFECTIONS THAT IMPROVE THROUGH AN INCREASE IN THE BLOOD CONCENTRATION OF GLP-1 |
| WO2006112331A1 (en) * | 2005-04-13 | 2006-10-26 | Dainippon Simitomo Pharma Co., Ltd. | Novel condensed pyrrole derivative |
| DE102005035891A1 (en) | 2005-07-30 | 2007-02-08 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | 8- (3-amino-piperidin-1-yl) -xanthines, their preparation and their use as pharmaceuticals |
| CA2617715A1 (en) * | 2005-08-11 | 2007-02-15 | F. Hoffmann-La Roche Ag | Pharmaceutical composition comprising a dpp-iv inhibitor |
| CN101374523B (en) | 2005-09-14 | 2012-04-11 | 武田药品工业株式会社 | Dipeptidyl peptidase inhibitors for the treatment of diabetes |
| US8222411B2 (en) | 2005-09-16 | 2012-07-17 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| GB0526291D0 (en) | 2005-12-23 | 2006-02-01 | Prosidion Ltd | Therapeutic method |
| WO2007112347A1 (en) | 2006-03-28 | 2007-10-04 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| PE20071221A1 (en) | 2006-04-11 | 2007-12-14 | Arena Pharm Inc | GPR119 RECEPTOR AGONISTS IN METHODS TO INCREASE BONE MASS AND TO TREAT OSTEOPOROSIS AND OTHER CONDITIONS CHARACTERIZED BY LOW BONE MASS, AND COMBINED THERAPY RELATED TO THESE AGONISTS |
| SG10201404220TA (en) | 2006-04-11 | 2014-10-30 | Arena Pharm Inc | Methods of using gpr119 receptor to identify compounds useful for increasing bone mass in an individual |
| CN101437823B (en) * | 2006-05-04 | 2014-12-10 | 勃林格殷格翰国际有限公司 | Polymorphs |
| EP1852108A1 (en) | 2006-05-04 | 2007-11-07 | Boehringer Ingelheim Pharma GmbH & Co.KG | DPP IV inhibitor formulations |
| PE20110235A1 (en) | 2006-05-04 | 2011-04-14 | Boehringer Ingelheim Int | PHARMACEUTICAL COMBINATIONS INCLUDING LINAGLIPTIN AND METMORPHINE |
| US8071583B2 (en) | 2006-08-08 | 2011-12-06 | Boehringer Ingelheim International Gmbh | Pyrrolo[3,2-D] pyrimidines as DPP-IV inhibitors for the treatment of diabetes mellitus |
| US8324383B2 (en) | 2006-09-13 | 2012-12-04 | Takeda Pharmaceutical Company Limited | Methods of making polymorphs of benzoate salt of 2-[[6-[(3R)-3-amino-1-piperidinyl]-3,4-dihydro-3-methyl-2,4-dioxo-1(2H)-pyrimidinyl]methyl]-benzonitrile |
| JP5379692B2 (en) | 2006-11-09 | 2013-12-25 | プロビオドルグ エージー | 3-Hydroxy-1,5-dihydro-pyrrol-2-one derivatives as inhibitors of glutaminyl cyclase for the treatment of ulcers, cancer and other diseases |
| TW200838536A (en) | 2006-11-29 | 2008-10-01 | Takeda Pharmaceutical | Polymorphs of succinate salt of 2-[6-(3-amino-piperidin-1-yl)-3-methyl-2,4-dioxo-3,4-dihydro-2H-pyrimidin-1-ylmethy]-4-fluor-benzonitrile and methods of use therefor |
| SI2091948T1 (en) | 2006-11-30 | 2012-07-31 | Probiodrug Ag | Novel inhibitors of glutaminyl cyclase |
| US8093236B2 (en) | 2007-03-13 | 2012-01-10 | Takeda Pharmaceuticals Company Limited | Weekly administration of dipeptidyl peptidase inhibitors |
| EP2142514B1 (en) | 2007-04-18 | 2014-12-24 | Probiodrug AG | Thiourea derivatives as glutaminyl cyclase inhibitors |
| JP2008289437A (en) * | 2007-05-28 | 2008-12-04 | Sony Corp | Method for measuring enzyme activity, and device for the same using laser |
| EP2190434B1 (en) * | 2007-08-17 | 2019-04-17 | Boehringer Ingelheim International GmbH | Purin derivatives for use in the treatment of fap-related diseases |
| UY31685A (en) * | 2008-03-04 | 2009-11-10 | Smithkline Beecham Corp | ANTIVIRAL COMPOUNDS, COMPOSITIONS AND METHODS TO USE THEM |
| BRPI0908168A2 (en) * | 2008-03-10 | 2015-12-15 | Dainippon Sumitomo Pharma Co | compound, drug, dipeptidyl peptidase-iv inhibitor, diabetes therapeutic agent, and diabetes treatment method |
| AR071175A1 (en) | 2008-04-03 | 2010-06-02 | Boehringer Ingelheim Int | PHARMACEUTICAL COMPOSITION THAT INCLUDES AN INHIBITOR OF DIPEPTIDIL-PEPTIDASA-4 (DPP4) AND A COMPARING PHARMACO |
| EP2108960A1 (en) * | 2008-04-07 | 2009-10-14 | Arena Pharmaceuticals, Inc. | Methods of using A G protein-coupled receptor to identify peptide YY (PYY) secretagogues and compounds useful in the treatment of conditons modulated by PYY |
| PE20100156A1 (en) * | 2008-06-03 | 2010-02-23 | Boehringer Ingelheim Int | NAFLD TREATMENT |
| UY32030A (en) | 2008-08-06 | 2010-03-26 | Boehringer Ingelheim Int | "TREATMENT FOR DIABETES IN INAPPROPRIATE PATIENTS FOR THERAPY WITH METFORMIN" |
| BRPI0916997A2 (en) | 2008-08-06 | 2020-12-15 | Boehringer Ingelheim International Gmbh | DPP-4 INHIBITOR AND ITS USE |
| AU2009281122C1 (en) * | 2008-08-15 | 2016-04-21 | Boehringer Ingelheim International Gmbh | Purin derivatives for use in the treatment of fab-related diseases |
| EP2344195A2 (en) | 2008-09-10 | 2011-07-20 | Boehringer Ingelheim International GmbH | Combination therapy for the treatment of diabetes and related conditions |
| US20200155558A1 (en) | 2018-11-20 | 2020-05-21 | Boehringer Ingelheim International Gmbh | Treatment for diabetes in patients with insufficient glycemic control despite therapy with an oral antidiabetic drug |
| NZ592924A (en) | 2008-12-23 | 2014-05-30 | Boehringer Ingelheim Int | Salt forms of a xanthine derivative |
| AR074990A1 (en) | 2009-01-07 | 2011-03-02 | Boehringer Ingelheim Int | TREATMENT OF DIABETES IN PATIENTS WITH AN INAPPROPRIATE GLUCEMIC CONTROL THROUGH METFORMIN THERAPY |
| AR077642A1 (en) | 2009-07-09 | 2011-09-14 | Arena Pharm Inc | METABOLISM MODULATORS AND THE TREATMENT OF DISORDERS RELATED TO THE SAME |
| MX2012002993A (en) | 2009-09-11 | 2012-04-19 | Probiodrug Ag | Heterocylcic derivatives as inhibitors of glutaminyl cyclase. |
| BR112012012641A2 (en) | 2009-11-27 | 2020-08-11 | Boehringer Ingelheim International Gmbh | TREATMENT OF GENOTYPED DIABETIC PATIENTS WITH DPP-lVTAL INHIBITORS LIKE LINAGLIPTIN |
| US9181233B2 (en) | 2010-03-03 | 2015-11-10 | Probiodrug Ag | Inhibitors of glutaminyl cyclase |
| SG183229A1 (en) | 2010-03-10 | 2012-09-27 | Probiodrug Ag | Heterocyclic inhibitors of glutaminyl cyclase (qc, ec 2.3.2.5) |
| WO2011127051A1 (en) | 2010-04-06 | 2011-10-13 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| EP2560953B1 (en) | 2010-04-21 | 2016-01-06 | Probiodrug AG | Inhibitors of glutaminyl cyclase |
| MX341025B (en) | 2010-05-05 | 2016-08-04 | Boehringer Ingelheim Int Gmbh * | Combination therapy. |
| ES2802243T3 (en) | 2010-06-24 | 2021-01-18 | Boehringer Ingelheim Int | Diabetes therapy |
| US8940751B2 (en) * | 2010-09-13 | 2015-01-27 | Advinus Therapeutics Private Limited | Purine compounds as prodrugs of A2B adenosine receptor antagonists, their process and medicinal applications |
| CA2812061A1 (en) | 2010-09-22 | 2012-03-29 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| AR083878A1 (en) | 2010-11-15 | 2013-03-27 | Boehringer Ingelheim Int | VASOPROTECTORA AND CARDIOPROTECTORA ANTIDIABETIC THERAPY, LINAGLIPTINA, TREATMENT METHOD |
| WO2012088682A1 (en) * | 2010-12-29 | 2012-07-05 | Shanghai Fochon Pharmaceutical Co Ltd. | 2-(3-aminopiperidin-1-yl)-[1,2,4]triazolo[1,5-c]pyrimidine-5,7(3h,6h)-dione derivates as dipeptidyl peptidase iv(dpp-iv) inhibitors |
| DK2686313T3 (en) | 2011-03-16 | 2016-05-02 | Probiodrug Ag | Benzimidazole derivatives as inhibitors of glutaminyl cyclase |
| US20140018371A1 (en) | 2011-04-01 | 2014-01-16 | Arena Pharmaceuticals, Inc. | Modulators Of The GPR119 Receptor And The Treatment Of Disorders Related Thereto |
| WO2012145361A1 (en) | 2011-04-19 | 2012-10-26 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| WO2012145604A1 (en) | 2011-04-22 | 2012-10-26 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| US20140038889A1 (en) | 2011-04-22 | 2014-02-06 | Arena Pharmaceuticals, Inc. | Modulators Of The GPR119 Receptor And The Treatment Of Disorders Related Thereto |
| WO2012170702A1 (en) | 2011-06-08 | 2012-12-13 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| US9051329B2 (en) | 2011-07-05 | 2015-06-09 | Merck Sharp & Dohme Corp. | Tricyclic heterocycles useful as dipeptidyl peptidase-IV inhibitors |
| EP3517539B1 (en) | 2011-07-15 | 2022-12-14 | Boehringer Ingelheim International GmbH | Substituted dimeric quinazoline derivative, its preparation and its use in pharmaceutical compositions for the treatment of type i and ii diabetes |
| WO2013055910A1 (en) | 2011-10-12 | 2013-04-18 | Arena Pharmaceuticals, Inc. | Modulators of the gpr119 receptor and the treatment of disorders related thereto |
| WO2013097052A1 (en) * | 2011-12-30 | 2013-07-04 | Abbott Laboratories | Bromodomain inhibitors |
| US9555001B2 (en) | 2012-03-07 | 2017-01-31 | Boehringer Ingelheim International Gmbh | Pharmaceutical composition and uses thereof |
| WO2013171167A1 (en) | 2012-05-14 | 2013-11-21 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in the treatment of podocytes related disorders and/or nephrotic syndrome |
| WO2013174767A1 (en) | 2012-05-24 | 2013-11-28 | Boehringer Ingelheim International Gmbh | A xanthine derivative as dpp -4 inhibitor for use in modifying food intake and regulating food preference |
| CN103709163B (en) * | 2012-09-29 | 2016-12-21 | 齐鲁制药有限公司 | Xanthine derivative, Preparation Method And The Use |
| WO2014074668A1 (en) | 2012-11-08 | 2014-05-15 | Arena Pharmaceuticals, Inc. | Modulators of gpr119 and the treatment of disorders related thereto |
| AR094116A1 (en) | 2012-12-20 | 2015-07-08 | Merck Sharp & Dohme | IMIDAZOPIRIDINS REPLACED AS HDM2 INHIBITORS |
| MX2015015417A (en) | 2013-05-10 | 2016-06-21 | Nimbus Apollo Inc | Acc inhibitors and uses thereof. |
| BR112015028214A2 (en) | 2013-05-10 | 2017-07-25 | Nimbus Apollo Inc | acc inhibitors and uses thereof |
| CN105358154A (en) | 2013-05-10 | 2016-02-24 | 尼普斯阿波罗有限公司 | Acc inhibitors and uses thereof |
| BR112015028173A2 (en) * | 2013-05-10 | 2017-07-25 | Nimbus Apollo Inc | acc inhibitors and uses thereof |
| AR096758A1 (en) * | 2013-06-28 | 2016-02-03 | Abbvie Inc | BROMODOMINIUM CRYSTAL INHIBITORS |
| WO2015128453A1 (en) | 2014-02-28 | 2015-09-03 | Boehringer Ingelheim International Gmbh | Medical use of a dpp-4 inhibitor |
| JP2017527606A (en) * | 2014-09-18 | 2017-09-21 | サノビオン ファーマシューティカルズ インクSunovion Pharmaceuticals Inc. | Tricyclic derivatives |
| MX2017011586A (en) | 2015-03-09 | 2017-10-26 | Intekrin Therapeutics Inc | Methods for the treatment of nonalcoholic fatty liver disease and/or lipodystrophy. |
| US10253026B2 (en) * | 2015-06-25 | 2019-04-09 | Boenringer Ingelheim International GmbH | Process for the preparation of (r)-8-(3-aminopiperidin-1-yl)-7-(but-2-yn-1-yl)-3-methyl-1-((4-methylquinazolin-2-yl)methyl)-3,7-dihydro-1h-purine-2,6-dione |
| AU2017276758A1 (en) | 2016-06-10 | 2018-11-08 | Boehringer Ingelheim International Gmbh | Combinations of Linagliptin and metformin |
| CN110996951A (en) | 2017-04-03 | 2020-04-10 | 科赫罗斯生物科学股份有限公司 | PPAR gamma agonists for the treatment of progressive supranuclear palsy |
| EP3461819B1 (en) | 2017-09-29 | 2020-05-27 | Probiodrug AG | Inhibitors of glutaminyl cyclase |
| CN108299436B (en) * | 2018-02-09 | 2020-01-17 | 上海慈瑞医药科技股份有限公司 | Xanthine compound and pharmaceutical composition and application thereof |
| KR20230104781A (en) | 2020-10-05 | 2023-07-10 | 인라이븐 테라퓨틱스, 인크. | 5- and 6-azaindole compounds for inhibition of BCR-ABL tyrosine kinase |
Family Cites Families (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US122228A (en) * | 1871-12-26 | Improvement in head-blocks | ||
| US100199A (en) * | 1870-02-22 | Improvement in ditcher and grader | ||
| US219178A (en) * | 1879-09-02 | Improvement in steam-pressure regulators | ||
| GB8515934D0 (en) * | 1985-06-24 | 1985-07-24 | Janssen Pharmaceutica Nv | (4-piperidinomethyl and-hetero)purines |
| GB9906714D0 (en) | 1999-03-23 | 1999-05-19 | Ferring Bv | Compositions for improving fertility |
| PL360856A1 (en) | 2000-07-04 | 2004-09-20 | Novo Nordisk A/S | Purine-2,6-diones which are inhibitors of the enzyme dipeptidyl peptidase iv (dpp-iv) |
| DK1368349T3 (en) * | 2001-02-24 | 2007-05-21 | Boehringer Ingelheim Pharma | Xanthine derivatives, their preparation and their use as pharmaceuticals |
| BR0210303B1 (en) * | 2001-06-11 | 2014-04-15 | Firmenich & Cie | Alcohol-free perfuming composition and process for preparing it |
| ATE388951T1 (en) | 2001-07-03 | 2008-03-15 | Novo Nordisk As | DPP-IV INHIBITING PURINE DERIVATIVES FOR THE TREATMENT OF DIABETES |
| EP1338595B1 (en) * | 2002-02-25 | 2006-05-03 | Eisai Co., Ltd. | Xanthine derivatives as DPP-IV inhibitors |
| KR100985160B1 (en) | 2002-06-06 | 2010-10-05 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | Novel condensed imidazole derivatives |
| US7569574B2 (en) * | 2002-08-22 | 2009-08-04 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Purine derivatives, the preparation thereof and their use as pharmaceutical compositions |
| WO2004028524A1 (en) | 2002-09-26 | 2004-04-08 | Eisai Co., Ltd. | Combination drug |
| US7109192B2 (en) * | 2002-12-03 | 2006-09-19 | Boehringer Ingelheim Pharma Gmbh & Co Kg | Substituted imidazo-pyridinones and imidazo-pyridazinones, the preparation thereof and their use as pharmaceutical compositions |
| AU2003302657B8 (en) | 2002-12-04 | 2009-12-03 | Eisai R&D Management Co., Ltd. | Fused 1,3-dihydroimidazole ring compounds |
| WO2004096806A1 (en) | 2003-04-30 | 2004-11-11 | Sumitomo Pharmaceuticals Co. Ltd. | Fused imidazole derivative |
| US7169926B1 (en) * | 2003-08-13 | 2007-01-30 | Takeda Pharmaceutical Company Limited | Dipeptidyl peptidase inhibitors |
| US20070219178A1 (en) * | 2003-12-04 | 2007-09-20 | Eisai Co., Ltd. | Preventive or therapeutic agents for multiple sclerosis |
-
2003
- 2003-06-03 KR KR1020047019831A patent/KR100985160B1/en not_active IP Right Cessation
- 2003-06-03 CN CNB2006101515284A patent/CN100469778C/en not_active Expired - Fee Related
- 2003-06-03 PL PL03374007A patent/PL374007A1/en not_active Application Discontinuation
- 2003-06-03 BR BR0311697-2A patent/BR0311697A/en not_active IP Right Cessation
- 2003-06-03 NZ NZ536794A patent/NZ536794A/en not_active IP Right Cessation
- 2003-06-03 RU RU2004139111/04A patent/RU2297418C9/en not_active IP Right Cessation
- 2003-06-03 JP JP2004511299A patent/JP3675813B2/en not_active Expired - Fee Related
- 2003-06-03 EP EP03733276A patent/EP1514552A4/en not_active Withdrawn
- 2003-06-03 MX MXPA04012226A patent/MXPA04012226A/en active IP Right Grant
- 2003-06-03 US US10/516,971 patent/US20060100199A1/en not_active Abandoned
- 2003-06-03 CN CNB038189682A patent/CN100348599C/en not_active Expired - Fee Related
- 2003-06-03 TW TW092115068A patent/TWI273104B/en not_active IP Right Cessation
- 2003-06-03 WO PCT/JP2003/007010 patent/WO2003104229A1/en active Application Filing
- 2003-06-03 CA CA2485641A patent/CA2485641C/en not_active Expired - Fee Related
- 2003-06-03 AU AU2003241960A patent/AU2003241960B2/en not_active Ceased
- 2003-06-06 US US10/457,002 patent/US20040116328A1/en not_active Abandoned
-
2004
- 2004-08-30 JP JP2004249414A patent/JP4420334B2/en not_active Expired - Fee Related
- 2004-11-11 IL IL16517804A patent/IL165178A0/en not_active IP Right Cessation
-
2005
- 2005-01-04 ZA ZA200500041A patent/ZA200500041B/en unknown
- 2005-01-04 IS IS7625A patent/IS7625A/en unknown
- 2005-01-05 NO NO20050054A patent/NO20050054L/en not_active Application Discontinuation
- 2005-08-26 US US11/212,407 patent/US20060063787A1/en not_active Abandoned
- 2005-12-01 HK HK05110940A patent/HK1078869A1/en not_active IP Right Cessation
- 2005-12-01 HK HK07107870.3A patent/HK1100219A1/en not_active IP Right Cessation
-
2008
- 2008-08-28 US US12/199,982 patent/US7772226B2/en not_active Expired - Fee Related
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| RU2297418C9 (en) | Novel condensed derivatives of imidazole, inhibitors of dipeptidyl peptidase iv, pharmaceutical composition, method of treatment and using based on thereof | |
| KR100867485B1 (en) | Combination drug | |
| AU2018208676B2 (en) | Macrocyclic compounds as trk kinase inhibitors | |
| EP3573987B1 (en) | Tyrosine amide derivatives as rho- kinase inhibitors | |
| CA2880251C (en) | Novel heteroaryl and heterocycle compounds, composition and methods thereof | |
| KR20020038941A (en) | 5-(2-Substituted-5-Heterocyclylsulphonylpyrid-3-yl)-Dihydropyrazolo[4,3-D]Pyrimidin-7-Ones as Phosphodiesterase Inhibitors | |
| WO2005053695A1 (en) | Preventive or therapeutic agent for multiple sclerosis | |
| WO2011013729A1 (en) | Fused imidazole derivative having ttk inhibitory action | |
| MX2011001333A (en) | Pyrazolo [3,4] pyrimidin-4-yl derivatives and their uses to treat diabetes and obesity. | |
| CN116323622A (en) | Bicyclic heteroaryl derivatives, preparation method and application thereof | |
| EP2740730A1 (en) | Dibenzooxepin derivative | |
| US20240228469A1 (en) | Pcsk9 inhibitors and methods of use thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PD4A | Correction of name of patent owner | ||
| TH4A | Reissue of patent specification | ||
| TH4A | Reissue of patent specification | ||
| MM4A | The patent is invalid due to non-payment of fees |
Effective date: 20110604 |