NL9302045A - New imidazole derivative with agonistic or antagonistic activity on the histamine H3 receptor - Google Patents
New imidazole derivative with agonistic or antagonistic activity on the histamine H3 receptor Download PDFInfo
- Publication number
- NL9302045A NL9302045A NL9302045A NL9302045A NL9302045A NL 9302045 A NL9302045 A NL 9302045A NL 9302045 A NL9302045 A NL 9302045A NL 9302045 A NL9302045 A NL 9302045A NL 9302045 A NL9302045 A NL 9302045A
- Authority
- NL
- Netherlands
- Prior art keywords
- formula
- group
- aryl
- imidazole
- alkyl
- Prior art date
Links
- 0 CC*(C)CC1CC(CC)C(C)C1 Chemical compound CC*(C)CC1CC(CC)C(C)C1 0.000 description 5
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D233/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings
- C07D233/54—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members
- C07D233/64—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, not condensed with other rings having two double bonds between ring members or between ring members and non-ring members with substituted hydrocarbon radicals attached to ring carbon atoms, e.g. histidine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
Description
NIEUWE IMIDAZOOLAFGELEIDE HET AGONISTISCHE OF ANTAGONISTISCHE ACTIVITEIT OP DE HISTAMINE H3-RECEPTOR.NEW IMIDAZOLE DERIVED THE AGONIST OR ANTAGONIST ACTIVITY ON THE HISTAMINE H3 RECEPTOR.
De uitvinding heeft betrekking op nieuwe imida-zoolafgeleiden met farmacologische activiteit. De uitvinding is in het bijzonder gericht op nieuwe imidaz00lafgeleiden met agonistische of antagonistische activiteit op de histamine H3-receptor. Meer in het bijzonder heeft de uitvinding betrekking op 4- en 5-gesubstitueerde aminoalkylimidazolen en hun afgeleiden.The invention relates to new imidazole derivatives with pharmacological activity. The invention is particularly directed to novel imidazone derivatives with agonistic or antagonistic activity at the histamine H3 receptor. More particularly, the invention relates to 4- and 5-substituted aminoalkylimidazoles and their derivatives.
De uitvinding heeft verder betrekking op de synthese van dergelijke verbindingen, farmaceutische samenstellingen die dergelijke verbindingen of farmacologisch acceptabele zouten daarvan bevatten, en het gebruik van de verbindingen als middelen met biologische activiteit, als middelen met agonistische of antagonistische activiteit op de histamine H3-receptor of voor het bereiden van een farmaceutische samenstelling.The invention further relates to the synthesis of such compounds, pharmaceutical compositions containing such compounds or pharmacologically acceptable salts thereof, and the use of the compounds as agents with biological activity, as agents with agonistic or antagonistic activity on the histamine H3 receptor or for preparing a pharmaceutical composition.
De histamine H3-receptor is een presynaptische receptor, die gelokaliseerd is in zowel het centrale als het perifere zenuwstelsel, de huid en in verschillende organen zoals de longen, de darm en waarschijnlijk eveneens in de milt en het maag-darmstelsel. Stimulering van de H3-receptor leidt tot remming van de afgifte van histamine (autorecep-tor), maar eveneens van andere neurotransmitters (heterore-ceptor), zoals bijvoorbeeld acetylcholine and serotonine.The histamine H3 receptor is a presynaptic receptor, located in both the central and peripheral nervous system, the skin and in various organs such as the lungs, intestine and probably also in the spleen and gastrointestinal tract. Stimulation of the H3 receptor leads to inhibition of the release of histamine (auto receptor), but also of other neurotransmitters (heteroreceptor), such as, for example, acetylcholine and serotonin.
Een aantal selectieve H3 liganden is beschreven. Voor een overzicht zie Leurs et al., Progress in Drug Res. 39, p. 127-165 (1992) and Lipp et al., in The Histamine Receptor, Wiley-Liss, Ine., p. 57-72 (1992). Er is aangetoond dat de H3-receptor beschouwd kan worden als een algemeen regelsysteem en als een potentieel doelwit voor nieuwe therapeutica (Timmerman, J. Med. Chem. 33, p. 4-11 (1990) and Schwartz et al., Agents and Actions 30, 1/2, p. 13-23 (1990)).A number of selective H3 ligands have been described. For an overview, see Leurs et al., Progress in Drug Res. 39, p. 127-165 (1992) and Lipp et al., In The Histamine Receptor, Wiley-Liss, Ine., P. 57-72 (1992). The H3 receptor has been shown to be considered a general control system and a potential target for new therapeutics (Timmerman, J. Med. Chem. 33, pp. 4-11 (1990) and Schwartz et al., Agents and Actions 30, 1/2, pp. 13-23 (1990)).
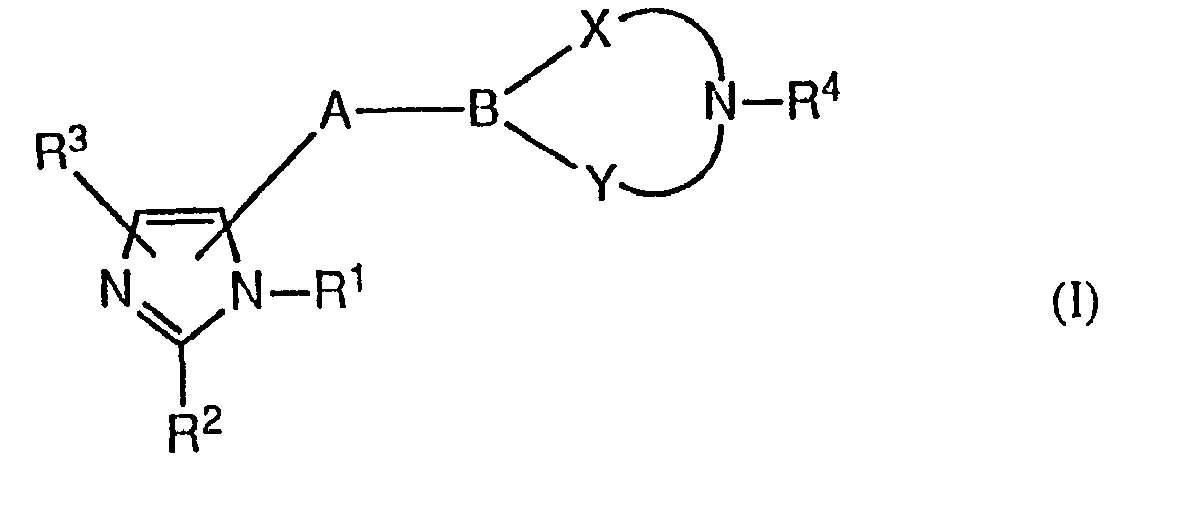
Er is nu een groep nieuwe imidazoolafgeleiden welke agonistisch of antagonistisch activiteit op de H3- receptor vertonen geïdentificeerd. Deze afgeleiden kunnen worden weergegeven door de algemene formule:A group of new imidazole derivatives showing agonistic or antagonistic activity at the H3 receptor has now been identified. These derivatives can be represented by the general formula:
waarin de substituenten zijn zoals gedefinieerd in conclusie 1.wherein the substituents are as defined in claim 1.
De imidazoolafgeleiden van de onderhavige uitvinding vertonen ofwel antagonistische of agonistische activiteit op de histamine H3-receptor en kunnen derhalve gebruikt worden als het actieve ingrediënt van farmaceu-tische samenstellingen.The imidazole derivatives of the present invention show either antagonistic or agonistic activity on the histamine H3 receptor and thus can be used as the active ingredient of pharmaceutical compositions.
De verbindingen met de formulesThe connections with the formulas
waarin R' is waterstof, methyl of ethyl en verbindingen van de formuleswherein R 'is hydrogen, methyl or ethyl and compounds of the formulas
waarin q is 2-5 and R" is waterstof, (C^-Cj)alkyl, aryl of aryl-fCj-Cj)alkyl zijn reeds eerder beschreven. Van deze verbindingen is slechts bekend dat afgeleiden met de formuleswherein q is 2-5 and R "is hydrogen, (C 1 -C 1 -alkyl), aryl or aryl-C 1 -C 1 -C 1 -alkyl have been previously described. These compounds are only known to have derivatives of the formulas
en verbindingen met de formulesand compounds to the formulas
waarin R' is waterstof, methyl, ethyl (ant)agonistische activiteit op de H3-receptor hebben.wherein R 'is hydrogen, methyl, ethyl (ant) agonistic activity at the H3 receptor.
De onderhavige uitvinding omvat zowel lineaire verbindingen als verbindingen met een ringstructuur, welke allen het imidazoolgedeelte gemeen hebben.The present invention includes both linear and ring-structure compounds, all of which share the imidazole portion.
Lineaire verbindingen hebben bijvoorbeeld één van de formulesLinear connections, for example, have one of the formulas
Verbindingen met formule I kunnen in het algemeen gesynthetiseerd worden via een proces dat analoog is aan het proces zoals beschreven door Vollinga et al., Recl. Trav. Chim. Pays-Bas, 112, p. 123-125 (1993). Het proces omvat bij voorkeur C5-lithiatie van een 1,2-ontschermd imidazool en daaropvolgende behandeling met een geschikte elektrofiel.Compounds of formula I can generally be synthesized via a process analogous to the process described by Vollinga et al., Recl. Trav. Chim. Pays-Bas, 112, p. 123-125 (1993). The process preferably includes C5 lithiation of a 1,2-deprotected imidazole and subsequent treatment with a suitable electrophile.
Het elektrofiel kan gekozen worden uit de groep die bestaat uit halogeen, aldehyde, keton, nitril, epoxide of acylhali-de.The electrophile can be selected from the group consisting of halogen, aldehyde, ketone, nitrile, epoxide or acyl halide.
In het algemeen kunnen verbindingen van formule I (waarbij verbindingen waarin R4 waterstof is uitgesloten zijn) bereid worden uit verbindingen van formule I waarin R4 waterstof is. Verbindingen van formule III kunnen bijvoorbeeld gemaakt worden uit verbindingen van formule II door eenvoudige additie- of condensatie-reacties, VUF 4613 kan bijvoorbeeld gemaakt worden door de additie van methyliso-thiocyanaat aan VUF 4702.In general, compounds of formula I (wherein compounds wherein R4 is hydrogen is excluded) can be prepared from compounds of formula I wherein R4 is hydrogen. For example, compounds of formula III can be made from compounds of formula II by simple addition or condensation reactions, VUF 4613 can be made, for example, by the addition of methyl isothiocyanate to VUF 4702.
Voor de synthese van verbindingen van formula II, kunnen l-chloor-60-joodalkanen gebruikt worden als elektro-fielen. In dit geval wordt een<^-chlooralkaan geïntroduceerd op de C5-positie van het 1,2-ontschermde imidazool. De chloorgroep kan omgezet worden in een aminogroep en de beschermende groepen kunnen verwijderd worden.For the synthesis of compounds of formula II, 1-chloro-60-iodoalkanes can be used as electrophiles. In this case, a <^ - chloroalkane is introduced at the C5 position of the 1,2-deprotected imidazole. The chlorine group can be converted to an amino group and the protecting groups can be removed.
Andere verbindingen van formula I (exclusief de verbinding van de formules II en III) zijn gemaakt door gebruikmaking van aldehyden of ketonen als elektrofielen met daaropvolgende verwijdering, omzetting of eliminatie van de gevormde hydroxylgroep.Other compounds of formula I (excluding the compound of formulas II and III) have been made using aldehydes or ketones as electrophiles with subsequent removal, conversion or elimination of the hydroxyl group formed.
Van de imidazoolafgeleiden van de uitvinding vertoont VUF 4702 (4(5)-(5-aminopentyl)-1H-imidazool dioxa-laat) een bijzonder voordelige antagonistische activiteit, terwijl VUF 4708 (4-[(4(5)-imidazoolyl)methyl]piperidine) een goede agonist is.Of the imidazole derivatives of the invention, VUF 4702 (4 (5) - (5-aminopentyl) -1H-imidazole dioxalate) exhibits a particularly advantageous antagonistic activity, while VUF 4708 (4 - [(4 (5) -imidazoolyl) methyl) piperidine) is a good agonist.
De volgende voorbeelden illustreren de synthese van verbindingen van de onderhavige uitvinding, maar zijn nooit bedoeld de omvang daarvan te beperken.The following examples illustrate the synthesis of compounds of the present invention, but are never intended to limit their scope.
VOORBEELD 1EXAMPLE 1
Synthese van 4(5)-(5-aminopentyl)-imidazool dioxalaat (VUF 4702).Synthesis of 4 (5) - (5-aminopentyl) imidazole dioxalate (VUF 4702).
100 gram imidazool (1,5 mol), 160 ml dimethylsul-famoylchloride (1,5 mol) en 210 ml triethylamine (1,5 mol) werden opgelost in 1000 ml toluene. Na 16 uur roeren werd het precipitaat gefiltreerd en het filtraat onder vacuüm geconcentreerd. Het produkt (l-(N,N-dimethyl-sulfamoyl)imidazool) werd gedestilleerd. Het kookpunt was: 110°C bij 0,4 mm Hg.100 grams of imidazole (1.5 mol), 160 ml of dimethylsulfamoyl chloride (1.5 mol) and 210 ml of triethylamine (1.5 mol) were dissolved in 1000 ml of toluene. After stirring for 16 hours, the precipitate was filtered and the filtrate concentrated in vacuo. The product (1- (N, N-dimethylsulfamoyl) imidazole) was distilled. The boiling point was: 110 ° C at 0.4 mm Hg.
17,5 g. 1-(Ν,Ν-Dimethylsulfamoyl)imidazool (0.1 mol) werd opgelost in droog THF (400 ml) onder een atmosfeer van droge stikstof en gekoeld tot -70°C. n-Butyllithium in hexaan (65 ml, 0,1 mol) werd druppelsgewijs toegevoegd (de temperatuur mag -65°C niet overschrijden). Na 15 min werd een oplossing van tert-butyl-dimethylsilyl chloride (15 g, 0,1 mol) in droog THF (30 ml) toegevoegd (in 10 min) en de oplossing werd geroerd bij kamertemperatuur gedurende 1 uur. Het mengsel werd opnieuw gekoeld tot -70°C en n-butyllithium in hexaan (65 ml, 0,01 mol) werd druppelsgewijs toegevoegd (de temperatuur mag niet boven -65°C stijgen). Na 0,5 uur werd geleidelijk een oplossing van l-chloor-5-joodpentaan (23,3 g, 0,1 mol) in droog THF (20 ml) toegevoegd en het mengsel werd overnacht (langzaam) verwarmd tot kamertemperatuur. Het reactiemengsel werd in water (200 ml) gegoten en het THF werd verwijderd onder verminderde druk. Het produkt werd geëxtraheerd met CHC13 (3 x 150 ml) , gedroogd (Na2S04) en onder vacuüm geconcentreerd.17.5 g. 1- (Ν, Ν-Dimethylsulfamoyl) imidazole (0.1 mol) was dissolved in dry THF (400ml) under an atmosphere of dry nitrogen and cooled to -70 ° C. n-Butyl lithium in hexane (65 ml, 0.1 mol) was added dropwise (the temperature should not exceed -65 ° C). After 15 min, a solution of tert-butyl-dimethylsilyl chloride (15 g, 0.1 mol) in dry THF (30 ml) was added (over 10 min) and the solution was stirred at room temperature for 1 hour. The mixture was cooled again to -70 ° C and n-butyl lithium in hexane (65 ml, 0.01 mol) was added dropwise (the temperature should not rise above -65 ° C). After 0.5 hours, a solution of 1-chloro-5-iodo-pentane (23.3 g, 0.1 mol) in dry THF (20 ml) was gradually added and the mixture was warmed (slowly) overnight to room temperature. The reaction mixture was poured into water (200ml) and the THF was removed under reduced pressure. The product was extracted with CHCl 3 (3 x 150 ml), dried (Na 2 SO 4) and concentrated in vacuo.
Het residu en fthalimide (15,0 g/mol) werden opgelost in DMF (300 ml) , waarna Na2C03 werd toegevoegd (12,0 g, mol) en het mengsel verhit werd tot 90°C. Na 7 uur het mengsel gefiltreerd en het oplosmiddel verdampt onder verminderde druk. Het residu werd opgelost in CHC13 (150 ml) , gewassen met H20 (3 x 150 ml) , gedroogd (Na2S04) en geconcentreerd onder vacuüm.The residue and phthalimide (15.0 g / mol) were dissolved in DMF (300 ml), then Na 2 CO 3 was added (12.0 g, mol) and the mixture was heated to 90 ° C. After 7 hours the mixture was filtered and the solvent evaporated under reduced pressure. The residue was dissolved in CHCl 3 (150 ml), washed with H 2 O (3 x 150 ml), dried (Na 2 SO 4) and concentrated in vacuo.
Het ruwe extract werd opgelost in 30 % HBr (300 ml) en onder terugvloeikoeling verhit. Na 16 uur werd het mengsel gekoeld, gefiltreerd en onder vacuüm geconcentreerd. Het residu werd opgelost in absolute etanol (300 ml), verhit onder terugvloeikoeling gedurende een half uur en geconcentreerd onder verminderde druk. De overblijvende donkere olie werd gewassen (met roeren) met delen (100 ml) aceton. Na verschillende wasstappen kristalliseerde de olie. Het residu werd opgelost in H20 en de pH werd verhoogd tot 12 door toevoegen van K2C03. Het produkt werd geëxtraheerd met CDC13, gedroogd op Na2S04 en onder vacuüm geconcentreerd. Het produkt werd opgelost in isopropanol en een overmaat van een verzadigde oplossing van oxaalzuur in isopropanol werd toe gevoegd (langzaam). Het gevormde precipitaat werd verzameld door centrifugatie en gewassen met isopropanol (drie maal). Na rekristallisatie uit methanol/isopropanol werd VUF 4702 verkregen in de vorm van witte kristallen. Het smeltpunt was 155,7-156,6°C.The crude extract was dissolved in 30% HBr (300 ml) and heated to reflux. After 16 hours, the mixture was cooled, filtered and concentrated in vacuo. The residue was dissolved in absolute etanol (300ml), heated at reflux for half an hour and concentrated under reduced pressure. The remaining dark oil was washed (with stirring) with parts (100 ml) of acetone. After several washing steps, the oil crystallized. The residue was dissolved in H 2 O and the pH was raised to 12 by adding K 2 CO 3. The product was extracted with CDCl 3, dried over Na 2 SO 4 and concentrated in vacuo. The product was dissolved in isopropanol and an excess of a saturated solution of oxalic acid in isopropanol was added (slowly). The precipitate formed was collected by centrifugation and washed with isopropanol (three times). After recrystallization from methanol / isopropanol, VUF 4702 was obtained in the form of white crystals. Melting point was 155.7-156.6 ° C.
VOORBEELD 2EXAMPLE 2
Synthese van 4(5)-( -aminoalkyl)imidazool-derivatives.Synthesis of 4 (5) - (-aminoalkyl) imidazole derivatives.
Analoog aan de bereidingswijze van VUF 4702 uit voorbeeld 1, werd een aantal verbindingen gesynthetiseerd volgens formule II, met gebruikmaking van het overeenkomende 1-chloor-CJ-joodalkaan. De betekenis van n, de smeltpunten en de exacte massa resultaten worden gegeven in de tabel hieronder.Analogous to the method of preparation of VUF 4702 from Example 1, a number of compounds were synthesized according to formula II, using the corresponding 1-chloro-CI-iodoalkane. The meaning of n, the melting points and the exact mass results are given in the table below.
VOORBEELD 3EXAMPLE 3
Synthese van N-methyl-N'-[6-(4(5)-imidazoolyl)hexyl]thi-oureum oxalaat (VUF 4740) 3 mmol VUF 4732 als dihydrobroom zuur, werd toegevoegd aan een oplossing van 6 mmol natrium opgelost in absolute ethanol. Deze oplossing werd onder terugvloeikoeling gedurende een half uur verhit en het gevormde precipitaat (na koeling tot kamertemperatuur) werd gefiltreerd.Synthesis of N-methyl-N '- [6- (4 (5) -imidazolyl) hexyl] thiourea oxalate (VUF 4740) 3 mmol VUF 4732 as dihydrobromic acid, was added to a solution of 6 mmol sodium dissolved in absolute ethanol. This solution was heated to reflux for half an hour and the precipitate formed (after cooling to room temperature) was filtered.
9,0 mmol methylisothiocyanaat werden toegevoegd aan het filtraat. Na het onder terugvloeikoeling verhitten van het reactiemengsel gedurende 2 uur werd de ethanol verdampt en het produkt gezuiverd op een kolom met flashsilica-gel met als eerste ethylacetaat als eluens (het produkt blijft op de kolom : Rf = 0-0,1; methylisothiocyanaat elu-eerde Rf = 1,0). Het produkt werd vervolgens geëlueerd met methanol als eluens (Rf = 1,0). Het produkt werd opgelost in ethylacetaat en een overmaat van verzadigde oplossing van oxaalzuur in ethylacetaat werd langzaam toegevoegd. Het gevormde precipitaat werd verzameld door centrifugatie en gewassen met ethylacetaat (drie maal). Na rekristallisatie uit absolute ethanol werd VUF 4740 verkregen in de vorm van witte kristallen. Het smeltpunt was 106,5-110,0°C.9.0 mmol of methyl isothiocyanate were added to the filtrate. After refluxing the reaction mixture for 2 hours, the ethanol was evaporated and the product purified on a column of flash silica gel eluent ethyl acetate (the product remains on the column: Rf = 0-0.1; methyl isothiocyanate elu -Rf = 1.0). The product was then eluted with methanol as the eluent (Rf = 1.0). The product was dissolved in ethyl acetate and an excess of saturated solution of oxalic acid in ethyl acetate was slowly added. The precipitate formed was collected by centrifugation and washed with ethyl acetate (three times). After recrystallization from absolute ethanol, VUF 4740 was obtained in the form of white crystals. Melting point was 106.5-110.0 ° C.
VOORBEELD 4EXAMPLE 4
Synthese van N-gesubstitueerd-N'-[(J-(4(5)-iinidazoolyl)al-kyl]-thioureum-afgeleiden.Synthesis of N-substituted-N '- [(J- (4 (5) -iniidazolyl) alkyl)] thiourea derivatives.
Analoog aan de bereidingswijze van VUF 4740 uit voorbeeld 3 werd een aantal verbindingen gesynthetiseerd volgens formule III met gebruikmaking van de overeenkomende 4(5)-( -aminoalkyl)-imidazoolafgeleide. De betekenis van n, de smeltpunten en de exacte massaresultaten zijn gegeven in de onderstaande tabel.Analogous to the preparation method of VUF 4740 from Example 3, a number of compounds were synthesized according to formula III using the corresponding 4 (5) - (-aminoalkyl) imidazole derivative. The meanings of n, the melting points and the exact mass results are given in the table below.
VOORBEELD 5EXAMPLE 5
Synthese van N-benzyl-4-(l-dimethylsulfamoyl-5-imidazoolyl)-piperid-4-ol (VUF 4765).Synthesis of N-benzyl-4- (1-dimethylsulfamoyl-5-imidazolyl) -piperid-4-ol (VUF 4765).
10 g l-(N,N-Dimethylsulfamoyl)imidazool (47 mmol) werd opgelost in droog THF (150 ml) onder een atmosfeer van droge stikstof en gekoeld tot -70°C. n-Butyllithium in hexaan (35 ml, 57 mmol) werd druppelsgewijs toegevoegd (de temperatuur mag niet boven -65°C stijgen) . Na 15 min werd een oplossing van trimethylsilyl chloride (6,2 g, 57 mmol) in droog THF toegevoegd en de oplossing geroerd bij kamertemperatuur gedurende 1 uur. Het mengsel werd opnieuw gekoeld tot -70°C en n-butyllithium in hexaan (35 ml, 57 mmol) werd druppelsgewijs toegevoegd (de temperatuur mag niet boven -65°C stijgen) . Na 1 uur werd een oplossing van N-benzyl-4-piperidon (10,8 g, 5,7 mmol) in droog THF geleidelijk toegevoegd en het mengsel overnacht tot kamertemperatuur opgewarmd (langzaam) . Het reactiemengsel werd in water gegoten en het THF werd verwijderd onder verminderde druk. Het produkt werd geëxtraheerd met CHC13 (3 x 150 ml), gedroogd (Na2S04) en geconcentreerd onder vacuüm.10 g of 1- (N, N-Dimethylsulfamoyl) imidazole (47 mmol) was dissolved in dry THF (150 ml) under an atmosphere of dry nitrogen and cooled to -70 ° C. n-Butyl lithium in hexane (35 ml, 57 mmol) was added dropwise (the temperature should not rise above -65 ° C). After 15 min, a solution of trimethylsilyl chloride (6.2 g, 57 mmol) in dry THF was added and the solution was stirred at room temperature for 1 hour. The mixture was cooled again to -70 ° C and n-butyl lithium in hexane (35 ml, 57 mmol) was added dropwise (the temperature should not rise above -65 ° C). After 1 hour, a solution of N-benzyl-4-piperidone (10.8 g, 5.7 mmol) in dry THF was gradually added and the mixture warmed to room temperature overnight (slowly). The reaction mixture was poured into water and the THF was removed under reduced pressure. The product was extracted with CHCl 3 (3 x 150 ml), dried (Na 2 SO 4) and concentrated in vacuo.
VOORBEELD 6EXAMPLE 6
Synthese van 4-(l-dimethylsulfamoyl-5-imidazoolyl)piperid-4-ol (VUF 4764).Synthesis of 4- (1-dimethylsulfamoyl-5-imidazoolyl) piperid-4-ol (VUF 4764).
1,0 gram VUF 4765 (2,7 mmol) werd opgelost in methanol. 0,1 gram Pd/C (10%) en 1 gram ammoniumformaat (16 mmol) werden toegevoegd en het mengsel werd onder terug-vloeikoeling verhit gedurende één uur. Na filtratie werd het produkt geconcentreerd onder vacuüm.1.0 gram of VUF 4765 (2.7 mmol) was dissolved in methanol. 0.1 grams of Pd / C (10%) and 1 gram of ammonium formate (16 mmol) were added and the mixture was refluxed for one hour. After filtration, the product was concentrated under vacuum.
VOORBEELD 7EXAMPLE 7
Synthese van 4-(4(5)-imidaz9olyl)l,2,3,6-tetrahydropyridine dihydrobromide (VUF 4736).Synthesis of 4- (4 (5) -imidazolyl) 1,2,3,6-tetrahydropyridine dihydrobromide (VUF 4736).
8,5 gram VUF 4764 werd opgelost in 30% HBr en onder terugvloeikoeling verhit gedurende 16 uur. De oplossing werd onder vacuüm verdampt en het residu werd onder terugvloeikoeling verhit in absolute ethanol. Een wit precipitaat werd verzameld door centrifugatie en gewassen met aceton (drie maal). Het smeltpunt was 271-275°C.8.5 grams of VUF 4764 was dissolved in 30% HBr and refluxed for 16 hours. The solution was evaporated under vacuum and the residue was refluxed in absolute ethanol. A white precipitate was collected by centrifugation and washed with acetone (three times). Melting point was 271-275 ° C.
VOORBEELD 8EXAMPLE 8
Synthese van 4-(4(5)-imidazoolyl)piperidine dihydrobromide (VUF 4735).Synthesis of 4- (4 (5) -imidazolyl) piperidine dihydrobromide (VUF 4735).
1,0 gram VUF 4736 werd opgelost in methanol, 0,1 gram Pd/C (10%) werd toegevoegd en het mengsel werd gehydroge-neerd gedurende 16 uur met 20 atm. H2 in een autoclaaf. Het reactiemengsel werd gefiltreerd, geconcentreerd en gewassen met absolute ethanol. Het smeltpunt was 260-263°C.1.0 gram of VUF 4736 was dissolved in methanol, 0.1 gram of Pd / C (10%) was added and the mixture was hydrogenated at 20 atm for 16 hours. H2 in an autoclave. The reaction mixture was filtered, concentrated and washed with absolute ethanol. Melting point was 260-263 ° C.
VOORBEELD 9EXAMPLE 9
Synthese van 4-[(l-dimethylsulfamoyl-5-imidazoolyl)methyl]-piperidine oxalaat (VUF 4709) I, 0 g of 1-(Ν,Ν-Dimethylsulfamoyl)imidazool (5,7 mmol) werd opgelost in droog THF (50 ml) onder een atmosfeer van droge stikstof en tot -70°C gekoeld. n-Butyllithium in hexaan (3,6 ml, 5,8 mol) werd druppelsgewijs toegevoegd (de temperatuur mag niet boven -65°C stijgen). Na 15 min werd een oplossing tert-butyl-dimethylsilyl chloride (0,9 g, 5,7 mmol) in droog THF (15 ml) toegevoegd (5 min) en de oplossing werd bij kamertemperatuur gedurende l uur geroerd. Het mengsel werd opnieuw gekoeld tot -70°C en n-butyllithium in hexaan (3,6 ml, 5,8 mmol) werd druppelsgewijs toegevoegd (de temperatuur mag niet boven de -65°C stijgen). Na een half uur werd een oplossing van 4-pyridinecarboxaldehyde (0,6 gram, 5,8 mol) in droog THF (15 ml) geleidelijk toegevoegd en het mengsel werd overnacht tot kamertemperatuur (langzaam) opgewarmd. Het reactiemengsel werd in water gegoten (100 ml) en het THF werd verwijderd onder verminderde druk. Het produkt werd geëxtraheerd met CH2C12 (3 x 150 ml), gedroogd (Na2S04) en onder vacuüm geconcentreerd.Synthesis of 4 - [(1-dimethylsulfamoyl-5-imidazoolyl) methyl] -piperidine oxalate (VUF 4709) 1.0 g or 1- (Ν, Ν-Dimethylsulfamoyl) imidazole (5.7 mmol) was dissolved in dry THF ( 50 ml) under an atmosphere of dry nitrogen and cooled to -70 ° C. n-Butyl lithium in hexane (3.6 ml, 5.8 mol) was added dropwise (the temperature should not rise above -65 ° C). After 15 min, a solution of tert-butyl-dimethylsilyl chloride (0.9 g, 5.7 mmol) in dry THF (15 ml) was added (5 min) and the solution was stirred at room temperature for 1 hour. The mixture was cooled again to -70 ° C and n-butyl lithium in hexane (3.6 ml, 5.8 mmol) was added dropwise (the temperature should not rise above -65 ° C). After half an hour, a solution of 4-pyridine carboxaldehyde (0.6 grams, 5.8 moles) in dry THF (15 ml) was gradually added and the mixture warmed (slowly) overnight to room temperature. The reaction mixture was poured into water (100 ml) and the THF was removed under reduced pressure. The product was extracted with CH 2 Cl 2 (3 x 150 ml), dried (Na 2 SO 4) and concentrated in vacuo.
II, 53 gram (28,4 mmol) van het residu (gemaakt uit een grotere partij) werd opgelost in 150 ml acetonitril. 2,5 ml DBU (25 mmol) werd toegevoegd. 3,6 ml azijnzuur anhydride (38 mmol) werd na 10 min. toegevoegd en na 15 min. roeren bij omgevingstemperatuur werd het reactiemengsel geconcen treerd onder vacuüm. Het residu werd opgelost in CH2C12 en gewassen met H20 (drie maal). De organische laag werd gedroogd op Na2S04 en geconcentreerd onder vacuüm. Het produkt werd gezuiverd door een kolom met flash-silicagel met ethy-lacetaat als eluens (Rf op TLC = 0,51).II, 53 grams (28.4 mmol) of the residue (made from a larger batch) was dissolved in 150 ml of acetonitrile. 2.5 ml DBU (25 mmol) was added. 3.6 ml acetic anhydride (38 mmol) was added after 10 min and after stirring at ambient temperature for 15 min, the reaction mixture was concentrated under vacuum. The residue was dissolved in CH 2 Cl 2 and washed with H 2 O (three times). The organic layer was dried over Na2 SO4 and concentrated in vacuo. The product was purified through a flash silica gel column eluting with ethyl acetate (Rf on TLC = 0.51).
7,3 gram van het gezuiverde produkt (16,7 mmol) werd opgelost in 50 ml azijnzuur, 0,7 gram Pd/C (10%) werd toegevoegd en dit mengsel werd gehydrogeneerd gedurende 16 uur met 50 atm. H2 in een autoclaaf. Het reactiemengsel werd gefiltreerd, geconcentreerd en gewassen met absolute ethanol (2 maal met 20 ml.). De hydrogenering was onvolledig en werd nog eenmaal zoals boven beschreven herhaald.7.3 grams of the purified product (16.7 mmol) was dissolved in 50 ml of acetic acid, 0.7 grams of Pd / C (10%) was added and this mixture was hydrogenated at 50 atm for 16 hours. H2 in an autoclave. The reaction mixture was filtered, concentrated and washed with absolute ethanol (2 times with 20 ml.). The hydrogenation was incomplete and was repeated one more time as described above.
Het residu werd opgelost in H20 en de pH werd verhoogd tot 12 door toevoeging van K2C03 en geëxtraheerd met CH2C12. De organische laag werd gedroogd met Na2S04, geconcentreerd onder verminderde druk en opgelost in ethylace-taat. Een overmaat van een verzadigde oplossing van oxaalzuur in ethylacetaat werd langzaam toegevoegd. Het gevormde precipitaat werd verzameld door centrifugatie en gewassen met ethylacetaat (drie maal). Het smelpunt was 120,8 -121,1°C.The residue was dissolved in H 2 O and the pH was raised to 12 by addition of K 2 CO 3 and extracted with CH 2 Cl 2. The organic layer was dried with Na 2 SO 4, concentrated under reduced pressure and dissolved in ethyl acetate. An excess of a saturated solution of oxalic acid in ethyl acetate was slowly added. The precipitate formed was collected by centrifugation and washed with ethyl acetate (three times). The melting point was 120.8-121.1 ° C.
VOORBEELD 10EXAMPLE 10
Synthese van N-gesubstitueerd-N'-[4-[l-dimethylsulfamoyl-4(5)-imidazooly1)methyl]piperidine]thioureum.Synthesis of N-substituted-N '- [4- [1-dimethylsulfamoyl-4 (5) imidazolyl) methyl] piperidine] thiourea.
Analoog aan de bereidingswijze van VUF 4740 uit voorbeeld 3, werd uitgaande van VUF 4709, een aantal verbindingen gesynthetiseerd met de formule:Analogous to the preparation method of VUF 4740 from example 3, starting from VUF 4709, a number of compounds were synthesized with the formula:
De betekenis van R en de smeltpunten worden gegeven in de onderstaande tabel.The meanings of R and the melting points are given in the table below.
VOORBEELD 11EXAMPLE 11
Synthese van 4-[(4(5)-imidazoolyl)methyl]piperidine dihydro-bromic acid (VUF 4708).Synthesis of 4 - [(4 (5) -imidazolyl) methyl] piperidine dihydro-bromic acid (VUF 4708).
5,5 gram (16,5 mmol) VUF 4709 werd onder terug-vloeikoeling verhit in 30% HBr gedurende 16 uur. De oplossig werd geconcentreerd onder verminderde druk en het residu werd opgelost en onder terugvloeikoeling verhit in absolute ethanol gedurende één uur. Dit mengsel werd onder vacuüm geconcentreerd en gewassen met aceton (drie maal). De witte kristallen werden verzameld en het smeltpunt was 221,1 -222,7°C.5.5 grams (16.5 mmol) of VUF 4709 was refluxed in 30% HBr for 16 hours. The solution was concentrated under reduced pressure and the residue was dissolved and refluxed in absolute ethanol for one hour. This mixture was concentrated in vacuo and washed with acetone (three times). The white crystals were collected and the melting point was 221.1-222.7 ° C.
VOORBEELD 12EXAMPLE 12
Synthese van N-gesubstitueerd-N'-[4-[4(5)-imidazoolyl) methyl]-piperidine]thioureum.Synthesis of N-substituted-N '- [4- [4 (5) imidazolyl) methyl] piperidine] thiourea.
Analoog aan de bereidingswijze van VUF 4740 uit voorbeeld 3 werd uitgaande van VUF 4708 een aantal verbindingen gesynthetiseerd met de formule:Analogous to the method of preparation of VUF 4740 from example 3, starting from VUF 4708, a number of compounds were synthesized with the formula:
De betekenis van R en de smeltpunten worden gegeven in de onderstaande tabel.The meanings of R and the melting points are given in the table below.
verbinding R smelt- zout punt (C°)compound R melting salt point (C °)
VUF 4581 (D20) : S 0.99-1.85 (m, 10H, CH2) , 2.97 (t, 2H, J=7 Hz, imidazool-CH2) , 3.50-3.90 (m, 3H, CH and CH2NH) , 7.22 (s, 1H, imidazool-5(4)H), 8.53 (s, 1H, imidazool-2H) ppm.VUF 4581 (D20): S 0.99-1.85 (m, 10H, CH2), 2.97 (t, 2H, J = 7 Hz, imidazole-CH2), 3.50-3.90 (m, 3H, CH and CH2NH), 7.22 (s .1H, imidazole-5 (4) H), 8.53 (s, 1H, imidazole-2H) ppm.
VUF 4582 (D20) : δ 2.94-3.03 (m, 2H, imidazool-CH2) , 3.75-3.97 (m, 2H, CH2NH), 7.11-7.57 (m, 6H, fenyl-H and imidazool-5(4)H), 8.61 (s, 1H, imidazool-2H) ppm.VUF 4582 (D20): δ 2.94-3.03 (m, 2H, imidazole-CH2), 3.75-3.97 (m, 2H, CH2NH), 7.11-7.57 (m, 6H, phenyl-H and imidazole-5 (4) H ), 8.61 (s, 1H, imidazole-2H) ppm.
VUF 4583 (DMSO-d6) : δ 2.89 (t, 2H, J=7 Hz, imidazool-CH2) , 3.59-3.83 (m, 2H, CH2NH) , 4.53-4.77 (m, 2H, CH2-fenyl), 7.18-7.38 (m, 6H, fenyl-H and imidazool-4(5)H), 7.85-8.00 (m, 1H, NH), 8.72 (t, 1H, J=6 Hz, NH) , 8.72 (S, 1H, imidazool-2H), 11.15-11.85 (m, NH and oxalaat) ppm.VUF 4583 (DMSO-d6): δ 2.89 (t, 2H, J = 7 Hz, imidazole-CH2), 3.59-3.83 (m, 2H, CH2NH), 4.53-4.77 (m, 2H, CH2-phenyl), 7.18 -7.38 (m, 6H, phenyl-H and imidazole-4 (5) H), 7.85-8.00 (m, 1H, NH), 8.72 (t, 1H, J = 6 Hz, NH), 8.72 (S, 1H , imidazole-2H), 11.15-11.85 (m, NH and oxalate) ppm.
VUF 4584 (D20): δ 2.66-2.91 (m, 4H, imidazool-CH2 and CH2-fenyl), 3.32-3.80 (m, 4H, CH2NH and CH2CH2-fenyl) , 7.15 (s, 1H, imidazool-5(4)H), 7.10-7.34 (m, 5H, fenyl-H), 8.47 (s, 1H, imidazool-2H) ppm.VUF 4584 (D20): δ 2.66-2.91 (m, 4H, imidazole-CH2 and CH2-phenyl), 3.32-3.80 (m, 4H, CH2NH and CH2CH2-phenyl), 7.15 (s, 1H, imidazole-5 (4 H), 7.10-7.34 (m, 5H, phenyl-H), 8.47 (s, 1H, imidazole-2H) ppm.
VUF 4613 (D20) : δ 1.31 (m, 2H, (CH2CH2)2CH2) , 1.62 (m, 4H, (CH2CH2)2CH2) , 2.67 (t, 2H, J=7 Hz, imidazool-CH2) , 2.82 (m, 3H, CH3) , 3.33 (m, 2H, CH2NH) , 7.14 (s, 1H, imidazool-5(4)H), 8.50 (s, 1H, imidazool-2H) ppm.VUF 4613 (D20): δ 1.31 (m, 2H, (CH2CH2) 2CH2), 1.62 (m, 4H, (CH2CH2) 2CH2), 2.67 (t, 2H, J = 7 Hz, imidazole-CH2), 2.82 (m .3H, CH3), 3.33 (m, 2H, CH2NH), 7.14 (s, 1H, imidazole-5 (4) H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4614 (D20): δ 1.12 (t, 3H, J=7 Hz, CH3) , 1.35 (m, 2H, (CH2CH2)2CH2) , 1.65 (m, 4H, (CH2CH2)2CH2) , 2.72 (t, 2H, J=7 Hz, imidazool-CH2) , 3.47 (m, 4H, CH2NH) , 7.19 (s, 1H, imidazool-5(4)H), 8.55 (s, 1H, imidazool-2H) ppm.VUF 4614 (D20): δ 1.12 (t, 3H, J = 7 Hz, CH3), 1.35 (m, 2H, (CH2CH2) 2CH2), 1.65 (m, 4H, (CH2CH2) 2CH2), 2.72 (t, 2H , J = 7 Hz, imidazole-CH2), 3.47 (m, 4H, CH2NH), 7.19 (s, 1H, imidazole-5 (4) H), 8.55 (s, 1H, imidazole-2H) ppm.
VUF 4615 (D20): δ 0.82 (t, 3H, J=7 Hz, CH3) , 1.30 (m, 4H, (CH2CH2)2CH2) + CH2CH3) , 1.60 (m, 4H, (CH2CH2)2CH2) , 2.67 (t, 2H, J=7 Hz, imidazool-CH2) , 3.30 (m, 4H, CH2NH) , 7.13 (s, 1H, imidazool-5(4)H), 8.50 (s, 1H, imidazool-2H) ppm.VUF 4615 (D20): δ 0.82 (t, 3H, J = 7 Hz, CH3), 1.30 (m, 4H, (CH2CH2) 2CH2) + CH2CH3), 1.60 (m, 4H, (CH2CH2) 2CH2), 2.67 ( t, 2H, J = 7Hz, imidazole-CH2), 3.30 (m, 4H, CH2NH), 7.13 (s, 1H, imidazole-5 (4) H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4616 (D20) : δ 1.08 (s, 6H, CH3) , 1.28 (m, 2H, (CH2CH2)2CH2) , 1.57 (m, 4H, (CH2CH2)2CH2) , 2.65 (t, 2H, imidazool-CH2) , 3.32 (m, 2H, CH2NH) , 4.00 (m, 1H, CHÏ . 7.13 (s, 1H, imidazool-5(4)H), 8.47 (s, 1H, imidazool-2H) ppm.VUF 4616 (D20): δ 1.08 (s, 6H, CH3), 1.28 (m, 2H, (CH2CH2) 2CH2), 1.57 (m, 4H, (CH2CH2) 2CH2), 2.65 (t, 2H, imidazole-CH2) , 3.32 (m, 2H, CH 2 NH), 4.00 (m, 1H, CHI. 7.13 (s, 1H, imidazole-5 (4) H), 8.47 (s, 1H, imidazole-2H) ppm.
VUF 4617 (D20) : δ 1.05-2.05 (m, 16H, (CH2CH2)2CH2 + (CH2CH2)2CH2 + cyclohexyl-CH2) , 2.73 (t, 2H, J=7 Hz, imidazool-CH2) , 3.43 (m, 3H, CH2NH + CHNH), 7.22 (s, 1H, imidazool-5(4)H), 8.58 (s, 1H, imidazool-2H) ppm.VUF 4617 (D20): δ 1.05-2.05 (m, 16H, (CH2CH2) 2CH2 + (CH2CH2) 2CH2 + cyclohexyl-CH2), 2.73 (t, 2H, J = 7Hz, imidazole-CH2), 3.43 (m, 3H, CH 2 NH + CHNH), 7.22 (s, 1H, imidazole-5 (4) H), 8.58 (s, 1H, imidazole-2H) ppm.
VUF 4618 (D20) : δ 1.35 (m, 2H, (CH2CH2)2CH2) , 1.67 (m, 4H, (CH2CH2)2CH2) , 2.75 (t, 2H, J=7 Hz, imidazool-CH2) , 3.53 (m, 2H, CH2NH) , 7.37 (m, 6H, imidazool-5(4)H + fenyl-H), 8.59 (s, 1H, imidazool-2H) ppm.VUF 4618 (D20): δ 1.35 (m, 2H, (CH2CH2) 2CH2), 1.67 (m, 4H, (CH2CH2) 2CH2), 2.75 (t, 2H, J = 7Hz, imidazole-CH2), 3.53 (m .2H, CH2NH), 7.37 (m, 6H, imidazole-5 (4) H + phenyl-H), 8.59 (s, 1H, imidazole-2H) ppm.
VUF 4619 (D20) : δ 1.27 (m, 2H, (CH2CH2)2CH2) , 1.60 (m, 4H, (CH2CH2)2CH2) , 2.67 (t, 2H, J=7 Hz, imidazool-CH2), 3.43 (m, 2H, CH2NH) , 4.63 (m, 2H, CH2-fenyl) , 7.17 (s, 1H, imidazool-5(4)H), 7.36 (m, 5H, fenyl-H), 8.53 (s, 1H, imidazool-2H) ppm.VUF 4619 (D20): δ 1.27 (m, 2H, (CH2CH2) 2CH2), 1.60 (m, 4H, (CH2CH2) 2CH2), 2.67 (t, 2H, J = 7Hz, imidazole-CH2), 3.43 (m , 2H, CH2NH), 4.63 (m, 2H, CH2-phenyl), 7.17 (s, 1H, imidazole-5 (4) H), 7.36 (m, 5H, phenyl-H), 8.53 (s, 1H, imidazole -2H) ppm.
VUF 4631 (D20) : S 1.12 (t, 3H, J=7 Hz, CH3) , 1.95 (m, 2H, CH2CH2NH), 2.77 (t, 2H, J=8 Hz, imidazool-CH2) , 3.15-3.62 (m, 4H, CH2NH), 7.23 (s, 1H, imidazool-5(4)H), 8.57 (s, 1H, imidazool-2H) ppm.VUF 4631 (D20): S 1.12 (t, 3H, J = 7 Hz, CH3), 1.95 (m, 2H, CH2CH2NH), 2.77 (t, 2H, J = 8 Hz, imidazole-CH2), 3.15-3.62 ( m, 4H, CH 2 NH), 7.23 (s, 1H, imidazole-5 (4) H), 8.57 (s, 1H, imidazole-2H) ppm.
VUF 4632 (D20): δ 0.87 (t, 3H, J=7 Hz, CH3) , 1.53 (m, 2H, CH2CH3) , 1.97 (m,2H, CH2CH2NH) , 2.77 (t, 2H, J=7 Hz, imidazool-CH2) , 3.10-3.65 (1, 4H, CH2NH) , 7.23 (s, 1H, imidazool-5(4)H), 8.56 (s, 1H, imidazool-2H) ppm.VUF 4632 (D20): δ 0.87 (t, 3H, J = 7 Hz, CH3), 1.53 (m, 2H, CH2CH3), 1.97 (m, 2H, CH2CH2NH), 2.77 (t, 2H, J = 7 Hz, imidazole-CH2), 3.10-3.65 (1.4H, CH2NH), 7.23 (s, 1H, imidazole-5 (4) H), 8.56 (s, 1H, imidazole-2H) ppm.
VUF 4633 (D20): δ 1.13 (d, 6H, J=7 Hz, CH3) , 1.94 (m, 2H, CH2CH2NH), 2.77 (t, 2H, J=7 Hz, imidazool-CH2) , 3.37-3.58 (m, 2H, CH2NH), 3.89-4.17 (m, 1H, CH), 7.23 (s, 1H, imidazool-5(4)H), 8.57 (s, 1H, imidazool-2H) ppm.VUF 4633 (D20): δ 1.13 (d, 6H, J = 7 Hz, CH3), 1.94 (m, 2H, CH2CH2NH), 2.77 (t, 2H, J = 7 Hz, imidazole-CH2), 3.37-3.58 ( m, 2H, CH 2 NH), 3.89-4.17 (m, 1H, CH), 7.23 (s, 1H, imidazole-5 (4) H), 8.57 (s, 1H, imidazole-2H) ppm.
VUF 4634 (D20) : δ 0.93-1.97 (m, 12H, CH2CH2NH + 5*CH2) , 2.70 (t, 2H, J=8 Hz, imidazool-CH2) , 3.23-3.90 (m, 3H, CH2NH + CHNH) , 7.18 (s, 1H, imidazool-5(4)H), 8.52 (s, 1H, imidazool-2H) ppm.VUF 4634 (D20): δ 0.93-1.97 (m, 12H, CH2CH2NH + 5 * CH2), 2.70 (t, 2H, J = 8 Hz, imidazole-CH2), 3.23-3.90 (m, 3H, CH2NH + CHNH) 7.18 (s, 1H, imidazole-5 (4) H), 8.52 (s, 1H, imidazole-2H) ppm.
VUF 4635 (D20) : δ 1.90 (m, 2H, CH2CH2NH) , 2.70 (t, 2H, J=7 Hz, imidazool-CH2), 3.39-3.65 (m, 2H, CH2NH), 7.27 (s, 1H, imidazool-5(4)H), 8.50 (s, 1H, imidazool-2H) ppm.VUF 4635 (D20): δ 1.90 (m, 2H, CH2CH2NH), 2.70 (t, 2H, J = 7 Hz, imidazole-CH2), 3.39-3.65 (m, 2H, CH2NH), 7.27 (s, 1H, imidazole -5 (4) H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4636 (D20) : 6 1.84 (m, 2H, CH2CH2NH) , 2.39-2.79 (m, 2H, imidazool-CH2), 3.30-3.57 (m, 2H, CH2NH), 4.42-4.73 (m, 2H, CH2-fenyl), 7.10 (s, 1H, imidazool-5(4)H), 7.29 (m, 5H, fenyl-H), 8.47 (s, 1H, imidazool-2H; ppm.VUF 4636 (D20): 6 1.84 (m, 2H, CH2CH2NH), 2.39-2.79 (m, 2H, imidazole-CH2), 3.30-3.57 (m, 2H, CH2NH), 4.42-4.73 (m, 2H, CH2- phenyl), 7.10 (s, 1H, imidazole-5 (4) H), 7.29 (m, 5H, phenyl-H), 8.47 (s, 1H, imidazole-2H; ppm.
VUF 4637 (D20) : δ 1.73 (m, 2H, CH2CH2NH) , 2.58 (t, 2H, J=8 Hz, imidazool-CH2) , 2.82 (t, 2H, J=7 Hz, CH2-fenyl) , 3.10-3.44 (m, 2H, CH2NH) , 3.44-3.79 (m, 2H, CH2CH2-fenyl) , 7.12 (s, 1H, imidazool-5(4)H), 7.16-7.36 (m, 5H, fenyl-H), 8.49 (s, 1H, imidazool-2H) ppm.VUF 4637 (D20): δ 1.73 (m, 2H, CH2CH2NH), 2.58 (t, 2H, J = 8 Hz, imidazole-CH2), 2.82 (t, 2H, J = 7 Hz, CH2-phenyl), 3.10- 3.44 (m, 2H, CH2NH), 3.44-3.79 (m, 2H, CH2CH2-phenyl), 7.12 (s, 1H, imidazole-5 (4) H), 7.16-7.36 (m, 5H, phenyl-H), 8.49 (s, 1H, imidazole-2H) ppm.
VUF 4681 (D20) : δ 1.08 (t, 3H, J=7Hz, CH3) , 1.61 (m, 4H, CH2CH2) , 2.72 (t, 2H, J=7 Hz, imidazool-CH2) , 3.22-3.51 (m, 4H, CH2NH), 7.17 (s, 1H, imidazool-5(4)H), 8.52 (s, 1H, imidazool-2H) ppm.VUF 4681 (D20): δ 1.08 (t, 3H, J = 7Hz, CH3), 1.61 (m, 4H, CH2CH2), 2.72 (t, 2H, J = 7 Hz, imidazole-CH2), 3.22-3.51 (m .4H, CH2NH), 7.17 (s, 1H, imidazole-5 (4) H), 8.52 (s, 1H, imidazole-2H) ppm.
VUF 4682 (D20): δ 0.84 (t, 3H, J=7Hz, CH3) , 1.42-1.78 (m, 6H, CH2CH3 + CH2CH2) , 2.73 (t, 2H, J=7 Hz, imidazool-CH2) , 3.10-3.62 (m, 4H, CH2NH), 7.18 (s, 1H, imidazool-5(4)H), 8.53 (s, 1H, imidazool-2H) ppm.VUF 4682 (D20): δ 0.84 (t, 3H, J = 7Hz, CH3), 1.42-1.78 (m, 6H, CH2CH3 + CH2CH2), 2.73 (t, 2H, J = 7 Hz, imidazole-CH2), 3.10 -3.62 (m, 4H, CH2NH), 7.18 (s, 1H, imidazole-5 (4) H), 8.53 (s, 1H, imidazole-2H) ppm.
VUF 4683 (D20) : <S 1.16 (d, 6H, J=7 Hz, 0¾) , 1.65 (m, 4H, CH2CH2) , 2.76 (t, 2H, J=7 Hz, imidazool-CH2) , 3.43 (m, 2H, CH2NH) , 4.08 (m, 1H, CH), 7.21 (s, 1H, imidazool-5(4)H), 8.55 (s, 1H, imidazool-2H) ppm.VUF 4683 (D20): <S 1.16 (d, 6H, J = 7 Hz, 0¾), 1.65 (m, 4H, CH2CH2), 2.76 (t, 2H, J = 7 Hz, imidazole-CH2), 3.43 (m .2H, CH2NH), 4.08 (m, 1H, CH), 7.21 (s, 1H, imidazole-5 (4) H), 8.55 (s, 1H, imidazole-2H) ppm.
VUF 4684 (DMSO-d6) : δ 1.00-1.95 (m, 14H, CH2CH2 + cyclohexyl-CH2), 2.64 (m, 2H, imidazool-CH2) , 3.37 (m, 2H, CH2NH) , 3.93 (m, 1H, CH3) , 7.20 (s, 1H, imidazool-5(4)H) , 7.28-7.62 (m, 4H, NH + C02H), 8.50 (s, 1H, imidazool-2H) ppm.VUF 4684 (DMSO-d6): δ 1.00-1.95 (m, 14H, CH2CH2 + cyclohexyl-CH2), 2.64 (m, 2H, imidazole-CH2), 3.37 (m, 2H, CH2NH), 3.93 (m, 1H, CH3), 7.20 (s, 1H, imidazole-5 (4) H), 7.28-7.62 (m, 4H, NH + CO2 H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4685 (D20) : δ 1.59 (m, 4H, CH2CH2) , 2.70 (t, 2H, imidazool-CH2) , 3.49 (m, 2H, CH2NH) , 7.31 (m, 6H, imidazool-5(4)Η + fenyl-H), 8.50 (s, 1H, imidazool-2H) ppm.VUF 4685 (D20): δ 1.59 (m, 4H, CH2CH2), 2.70 (t, 2H, imidazole-CH2), 3.49 (m, 2H, CH2NH), 7.31 (m, 6H, imidazole-5 (4) Η + phenyl-H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4686 (DMSO-d6) : δ 1.53 (m, 4H, CH2CH2) , 2.59 (t, 2H, J=7VUF 4686 (DMSO-d6): δ 1.53 (m, 4H, CH2CH2), 2.59 (t, 2H, J = 7
Hz, imïdazool-CH2) , 3.40 (m, 2H, CH2NH) , 4.63 (m, 2H, CH2-benzyl) , 7.13 (s, 1H, imidazool-5(4)H), 7.28 (m, 5H, fenyl-H), 7.71 (m, 1H, N-H), 7.99 (m, 1H, N-H), 8.39 (s, 1H, imidazool-2H) ppm.Hz, imidazole-CH2), 3.40 (m, 2H, CH2NH), 4.63 (m, 2H, CH2-benzyl), 7.13 (s, 1H, imidazole-5 (4) H), 7.28 (m, 5H, phenyl- H), 7.71 (m, 1H, NH), 7.99 (m, 1H, NH), 8.39 (s, 1H, imidazole-2H) ppm.
VUF 4687 (DMSO-d6) : δ 1.55 (m, 4H, CH2CH2) , 2.62 (t, 2H, J=7VUF 4687 (DMSO-d6): δ 1.55 (m, 4H, CH2CH2), 2.62 (t, 2H, J = 7
Hz, imidazool-CH2) , 2.78 (t, 2H, J=7 Hz, CH2-fenyl), 3.37 (m, 2H, CH2NH), 3.57 (m, 2H, CH2CH2-fenyl), 7.27 (m, 6H, imidazool-5(4)H + fenyl-H), 7.63 (m, 2H, N-H), 8.67 (s, 1H, imidazool-2H) ppm.Hz, imidazole-CH2), 2.78 (t, 2H, J = 7Hz, CH2-phenyl), 3.37 (m, 2H, CH2NH), 3.57 (m, 2H, CH2CH2-phenyl), 7.27 (m, 6H, imidazole -5 (4) H + phenyl-H), 7.63 (m, 2H, NH), 8.67 (s, 1H, imidazole-2H) ppm.
VUF 4701 (D20) : δ 1.77 (m, 4H, CH2CH2) , 2.80 (t, 2H, J=8VUF 4701 (D20): δ 1.77 (m, 4H, CH2CH2), 2.80 (t, 2H, J = 8
Hz, imidazool-4(5)-CH2), 3.06 (t, 2H, J=8 HZ, CH2NH) , 7.28 (s, 1H, imidazool-5(4)H), 8.59 (s, 1H, imidazool-2H) ppm.Hz, imidazole-4 (5) -CH2), 3.06 (t, 2H, J = 8 HZ, CH2NH), 7.28 (s, 1H, imidazole-5 (4) H), 8.59 (s, 1H, imidazole-2H ) ppm.
VUF 4702 (D20) : δ 1.37 (m, 2H, (CH2CH2)2CH2) , 1.63 (m, 4H, (CH2CH2)2CH2) , 2.68 (t, 2H, J=7 Hz, imidazool-CH2) , 2.93 (t, 2H, J=7 Hz, CH2NH), 7.16 (s, 1H, imidazool-5(4)H), 8.49 (s, 1H, imidazool-2H) ppm.VUF 4702 (D20): δ 1.37 (m, 2H, (CH2CH2) 2CH2), 1.63 (m, 4H, (CH2CH2) 2CH2), 2.68 (t, 2H, J = 7Hz, imidazole-CH2), 2.93 (t .2H, J = 7Hz, CH2NH), 7.16 (s, 1H, imidazole-5 (4) H), 8.49 (s, 1H, imidazole-2H) ppm.
VUF 4708 (DzO): δ 1.48 (qd, 2H, J=13, 3 Hz, 3,5-Hax), 1.94 (dm, 2H, J= 13 Hz, 3,5-Heq), 2.00 (m, 1H, 4-H), 2.72 (d, 2H, J=7 Hz, imidazool-CH2) , 2.98 (tm, 2H, J=13 Hz, 2.6- Hax), 3.41 (dm, 2H, J=13 Hz, 2.6- Heq), 7.28 (s, 1H, imidazool-5(4)H), 8.59 (s, 1H, imidazool-2H) ppm.VUF 4708 (DzO): δ 1.48 (qd, 2H, J = 13.3 Hz, 3.5-Hax), 1.94 (dm, 2H, J = 13 Hz, 3.5-Heq), 2.00 (m, 1H , 4-H), 2.72 (d, 2H, J = 7 Hz, imidazole-CH2), 2.98 (tm, 2H, J = 13 Hz, 2.6-Hax), 3.41 (dm, 2H, J = 13 Hz, 2.6 - Heq), 7.28 (s, 1H, imidazole-5 (4) H), 8.59 (s, 1H, imidazole-2H) ppm.
VUF 4709 (D20): δ 1.47 (qm, 2H, J=13 Hz, 3,5-Hax), 1.97 (dm, 2H, J=14 Hz, 3,5-Heq), 2.03 (m, 1H, 4-H), 2.87 (d, 2H, J=7 Hz, imidazool-CH2) , 2.97 (tm, 2H, J=13 Hz, 2.6- Hflx), 3.04 (s, 6H, Ν(ΟΗ3 )2), 3.42 (dm, 2H, J=13 Hz, 2,6 Heq), 7.43 (s, 1H, imidazool-5H), 9.16 (s, 1H, imidazool-2H) ppm.VUF 4709 (D20): δ 1.47 (qm, 2H, J = 13 Hz, 3.5-Hax), 1.97 (dm, 2H, J = 14 Hz, 3.5-Heq), 2.03 (m, 1H, 4 -H), 2.87 (d, 2H, J = 7 Hz, imidazole-CH2), 2.97 (tm, 2H, J = 13 Hz, 2.6-Hflx), 3.04 (s, 6H, Ν (ΟΗ3) 2), 3.42 (dm, 2H, J = 13 Hz, 2.6 Heq), 7.43 (s, 1H, imidazole-5H), 9.16 (s, 1H, imidazole-2H) ppm.
VUF 4711 (CDC13) : δ 1.18 (qm, 2H, J=13 Hz, 3,5-Hax), 169 (dm, 2H, J=13 Hz, 3,5-Heq), 1,88 (m, 2H, 4-H), 2.62 (d, J=7 Hz, imidazool-CH2) , 2.82 (S, 6H, N(CH3 )2), 2.90 (tm, 2H, J—13 Hz, 2,6-HaX), 3.07 (d, 3H, J=6 Hz, 0¾) , 4.58 (dm, 2H, J=13 Hz, 2,6-Heg), 6.04 (m, 1H, NH), 6.76 (S, 1H, imidazool-5H), 7.80 (s, 1H, imidazool-2H) ppm.VUF 4711 (CDC13): δ 1.18 (qm, 2H, J = 13 Hz, 3.5-Hax), 169 (dm, 2H, J = 13 Hz, 3.5-Heq), 1.88 (m, 2H , 4-H), 2.62 (d, J = 7 Hz, imidazole-CH2), 2.82 (S, 6H, N (CH3) 2), 2.90 (tm, 2H, J-13 Hz, 2,6-HaX) , 3.07 (d, 3H, J = 6 Hz, 0¾), 4.58 (dm, 2H, J = 13 Hz, 2,6-Heg), 6.04 (m, 1H, NH), 6.76 (S, 1H, imidazole- 5H), 7.80 (s, 1H, imidazole-2H) ppm.
VUF 4712 (CDC13) : δ 0.98-2.10 (m, 15H, CH (CH2CH2) 2NH + (CH2)5), 2.63 (d, 2H, J=7Hz, Imidazool-CH2) , 2.82 (s, 6H, NMe2) , 2,88 (tm, 2H, J=13 Hz, 2,6-HaX(pip)), 4.27 (m, 1H, NHCH), 4.54 (dm, 2H, J=13Hz, 2.6- Heq(pip)) , 5.46 (d, 1H, J=7Hz, NH) , 6.78 (s, 1H, Imidazool-5 H), 7.80 (s, 1H, (Imidazool-2 H)) ppm.VUF 4712 (CDC13): δ 0.98-2.10 (m, 15H, CH (CH2CH2) 2NH + (CH2) 5), 2.63 (d, 2H, J = 7Hz, Imidazole-CH2), 2.82 (s, 6H, NMe2) , 2.88 (tm, 2H, J = 13 Hz, 2,6-HaX (pip)), 4.27 (m, 1H, NHCH), 4.54 (dm, 2H, J = 13Hz, 2.6-Heq (pip)) , 5.46 (d, 1H, J = 7Hz, NH), 6.78 (s, 1H, Imidazole-5H), 7.80 (s, 1H, (Imidazole-2H)) ppm.
VUF 4713 (D20): δ 1.04-1.32 (m, 2H, 3,5-Hax), 1.72 (dm, 2H, J=14Hz, 3,5-Heq), 1,97 (m, 1H, 4-H), 2.64 (d, 2H, J=7Hz, Imidazool-CH2) , 3,01 (s, 3H, CH3), 3,06 (tm, 2H, J=14 Hz, 2.6- Hax) , 4.48 (dm, 2H, J=13Hz, 2.6- Heq), 7.12 (s, 1H, Imidazool-4(5)H), 8.28 (s, 1H, Imidazool-2H) ppm.VUF 4713 (D20): δ 1.04-1.32 (m, 2H, 3.5-Hax), 1.72 (dm, 2H, J = 14Hz, 3.5-Heq), 1.97 (m, 1H, 4-H ), 2.64 (d, 2H, J = 7Hz, Imidazole-CH2), 3.01 (s, 3H, CH3), 3.06 (tm, 2H, J = 14Hz, 2.6-Hax), 4.48 (dm, 2H, J = 13Hz, 2.6-Heq), 7.12 (s, 1H, Imidazole-4 (5) H), 8.28 (s, 1H, Imidazole-2H) ppm.
VUF 4714 (D20) : <5 0.98-2.10 (m, 15H, CH(CH2CH2)2NH + (CH2)5), 2.67 (d, 2H, J=7Hz,VUF 4714 (D20): <5 0.98-2.10 (m, 15H, CH (CH2CH2) 2NH + (CH2) 5), 2.67 (d, 2H, J = 7Hz,
Imidazool-CH2), 3,00 (tm, 2H, J=13 Hz, 2,6-Hax(pip)), 4.10 (m, 1H, NHCH), 4.48 (dm, 2H, J=13Hz, 2,6-Heq(pip)) , 7.22 (s, 1H, Imidazool-4(5)H), 8.54 (s, 1H, Imidazool-2H) ppm.Imidazole-CH2), 3.00 (tm, 2H, J = 13 Hz, 2,6-Hax (pip)), 4.10 (m, 1H, NHCH), 4.48 (dm, 2H, J = 13Hz, 2.6 -Heq (pip)), 7.22 (s, 1H, Imidazole-4 (5) H), 8.54 (s, 1H, Imidazole-2H) ppm.
VUF 4732 (D20) : δ 1.33 (m, 4H, (CH2CH2)2(CH2)2) , 1.61 (m, 4H, (CH2CH2)2CH2CH2) , 2.68 (t, 2H, J=7 Hz, imidazool-CH2), 2.93 (t, 2H, J=7 Hz, CH2NH), 7.14 (s, 1H, imidazool-5(4)H) , 8.50 (s, 1H, imidazool-2H) ppm.VUF 4732 (D20): δ 1.33 (m, 4H, (CH2CH2) 2 (CH2) 2), 1.61 (m, 4H, (CH2CH2) 2CH2CH2), 2.68 (t, 2H, J = 7 Hz, imidazole-CH2) , 2.93 (t, 2H, J = 7Hz, CH 2 NH), 7.14 (s, 1H, imidazole-5 (4) H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4733 (D20) : S 1.38 (m, 8H, (CH2CH2)2(CH2)4) , 1.60 (m, 4H, (CH2CH2)2(CH2)4) , 2.66 (t, 2H, J=7 Hz, imidazool-CH2), 2.93 (t, 2H, J=7 Hz, CH2NH), 7.13 (s, 1H, imidazool-5(4)H), 8.49 (s, 1H, imidazool-2H) ppm.VUF 4733 (D20): S 1.38 (m, 8H, (CH2CH2) 2 (CH2) 4), 1.60 (m, 4H, (CH2CH2) 2 (CH2) 4), 2.66 (t, 2H, J = 7 Hz, imidazole-CH2), 2.93 (t, 2H, J = 7Hz, CH2NH), 7.13 (s, 1H, imidazole-5 (4) H), 8.49 (s, 1H, imidazole-2H) ppm.
VUF 4734 (D20) : δ 1.27 (m, 12H, (CH2CH2)2(CH2)6) , 1.62 (m, 4H, (CH2CH2)2(CH2)6) , 2.67 (t, 2H, J=7 Hz, imidazool-CH2), 2.94 (t, 2H, J=7 Hz, CH2NH), 7.14 (s, 1H, imidazool-5(4)H), 8.50 (s, 1H, imidazool-2H) ppm.VUF 4734 (D20): δ 1.27 (m, 12H, (CH2CH2) 2 (CH2) 6), 1.62 (m, 4H, (CH2CH2) 2 (CH2) 6), 2.67 (t, 2H, J = 7 Hz, imidazole-CH2), 2.94 (t, 2H, J = 7Hz, CH2NH), 7.14 (s, 1H, imidazole-5 (4) H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4735 (D20) : 5 2,03 (m, 2H, 3,5-Hax), 2,39 (dm, 2H, J=13 HZ, 3,5-Heq), 3.29 (m, 3H, 2,6-H0X + 4-H), 3,63 (dm, 2H, J=13 Hz, 2,6 Heq) , 7.48 (s, 1H, imidazool-5(4)H), 8.77 (s, 1H, imidazool-2H) ppm.VUF 4735 (D20): 5 2.03 (m, 2H, 3.5-Hax), 2.39 (dm, 2H, J = 13 HZ, 3.5-Heq), 3.29 (m, 3H, 2, 6-H0X + 4-H), 3.63 (dm, 2H, J = 13 Hz, 2.6 Heq), 7.48 (s, 1H, imidazole-5 (4) H), 8.77 (s, 1H, imidazole -2H) ppm.
VUF 4736 (D20) : δ 2.72 (s, 2H, CH2-CH2-N) , 3.56 (t, 2H, J = 7 Hz, N-CH2-CH2), 3.98 (s, 2H, N-CH2-CH), 6.36 (s, 1H, CH), 7.59 (s, 1H, imidazool-4(5)H), 8.73 (s, 1H, imidazool-2H) ppm.VUF 4736 (D20): δ 2.72 (s, 2H, CH2-CH2-N), 3.56 (t, 2H, J = 7 Hz, N-CH2-CH2), 3.98 (s, 2H, N-CH2-CH) , 6.36 (s, 1H, CH), 7.59 (s, 1H, imidazole-4 (5) H), 8.73 (s, 1H, imidazole-2H) ppm.
VUF 4740 (D20) : δ 1.20-1.78 (m, 8H, CH2-(CH2)4-CH2) , 2.72 (t, 2H, J = 7Hz, imidazool-CH2) , 2.90 (S, 3H, CH3) , 3.18-3.58 (m, 2H, CH2NH) , 7.18 (s, 1H, imidazool-4(5)H), 8.53 (s, 1H, imidazool-2H) ppm.VUF 4740 (D20): δ 1.20-1.78 (m, 8H, CH2- (CH2) 4-CH2), 2.72 (t, 2H, J = 7Hz, imidazole-CH2), 2.90 (S, 3H, CH3), 3.18 -3.58 (m, 2H, CH2NH), 7.18 (s, 1H, imidazole-4 (5) H), 8.53 (s, 1H, imidazole-2H) ppm.
VÜF 4741 (D20) : δ 1.22-1.79 (m, 8H, im-CH2-(CH2)4-CH2) , 2.70 (t, 2H, J = 7 Hz, imidazool-CH2) , 3.34-3.59 (m, 2H, CH2NH), 7.09-7.52 (m, 6H, fenyl-H + imidazool-4(5)H), 8.50 (s, 1H, imidazool-2H) ppm.VÜF 4741 (D20): δ 1.22-1.79 (m, 8H, im-CH2- (CH2) 4-CH2), 2.70 (t, 2H, J = 7 Hz, imidazole-CH2), 3.34-3.59 (m, 2H , CH2NH), 7.09-7.52 (m, 6H, phenyl-H + imidazole-4 (5) H), 8.50 (s, 1H, imidazole-2H) ppm.
VUF 4764 (D20) : <5 2.12-2.28 (m, 4H, CH2CH2NH) , 2.79 (s, 6H, (CH3)2N), 3.36-3.56 (m, 5H, CH2CH2NH + CHOH), 4.36 (s, 2H, CH2-fenyl), 7.40 (s, 1H, imidazool-5H), 7.48 (s, 5H, fenyl-H), 8.64 (s, 1H, imidazool-2H) ppm.VUF 4764 (D20): <5 2.12-2.28 (m, 4H, CH2CH2NH), 2.79 (s, 6H, (CH3) 2N), 3.36-3.56 (m, 5H, CH2CH2NH + CHOH), 4.36 (s, 2H, CH2-phenyl), 7.40 (s, 1H, imidazole-5H), 7.48 (s, 5H, phenyl-H), 8.64 (s, 1H, imidazole-2H) ppm.
VUF 4765 (D20) : S 1.98-2.31 (m, 4H, CH2CH2NH) , 2.52 (s,VUF 4765 (D20): S 1.98-2.31 (m, 4H, CH2CH2NH), 2.52 (s,
6H, (CH3)2N), 3.16-3.42 (m, 5H, CH2CH2NH6H, (CH3) 2N), 3.16-3.42 (m, 5H, CH2CH2NH
+ CHOH), 7.17 (s, 1H, imidazool-5H), 7.87 (s, 1H, imidazool-2H) ppm.+ CHOH), 7.17 (s, 1H, imidazole-5H), 7.87 (s, 1H, imidazole-2H) ppm.
Farmacologische experimentenPharmacological experiments
De agonistische en antagonistische activiteiten op de histamine H3-receptor van de verschillende verbindingen werden bepaald met een testsysteem zoals beschreven in Vollinga et al., Meth. Find. Clin. Exp. Pharmacol., 14(10), p. 747-751 (1992).The agonistic and antagonistic activities on the histamine H3 receptor of the various compounds were determined using a test system as described in Vollinga et al., Meth. Find. Clin. Exp. Pharmacol., 14 (10), p. 747-751 (1992).
De resultaten van de experimenten worden gegeven in de tabellen 2 en 3 hieronder. pD2 is de negatieve waarde van de concentratie van de testverbinding waarbij 50% agonistische activiteit werd gemeten. pA2 is de negatieve logaritme van de concentratie van de testverbinding waarbij de concentratie van de agonist verdubbeld moest worden teneinde hetzelfde effect te verkrijgen als verkregen werd wanneer de antagonist afwezig was.The results of the experiments are given in Tables 2 and 3 below. pD2 is the negative value of the concentration of the test compound at which 50% agonistic activity was measured. pA2 is the negative log of the concentration of the test compound at which the concentration of the agonist had to be doubled in order to obtain the same effect as was obtained when the antagonist was absent.
Farmaceutische samenstellingen, omvattende verbindingen van formule I als het actieve ingrediënt voor therapeutisch beïnvloeden van het humane en dierlijke hista-minerge systeem hebben de vorm van poeders, suspensies, oplossingen, sprays, emulsies, zalven of crèmes en kunnen gebruikt worden voor lokale toediening, intranasale, rectale, vaginale en eveneens voor orale of parenterale (intraveneuze, intradermale, intramusculaire, intrathecale etc.) toediening. Dergelijke samenstellingen kunnen bereid worden door het combineren (d.w.z. door mengen, oplossen etc.) van de actieve verbinding van formule I in de vorm van het vrije zuur of zout met farmaceutisch acceptabele excipienten met een neutraal karakter (zoals waterige of niet-waterige oplossingen, stabilisatoren, emulgatoren, detergentia, additieven) , en verder indien nodig kleurstoffen en geur- en smaakstoffen. De concentratie van het actieve ingrediënt in een farmaceutische samenstelling kan variëren tussen 0,1% en 100%, afhankelijk van de aard van beïnvloeding en de wijze van toediening. De dosis van het actieve ingrediënt dat toegediend wordt kan verder gevarieerd worden tussen 0,1 mg en 100 mg per kg lichaamsgewicht.Pharmaceutical compositions comprising compounds of formula I as the active ingredient for therapeutically influencing the human and animal hista-mineral system are in the form of powders, suspensions, solutions, sprays, emulsions, ointments or creams and can be used for topical administration, intranasal , rectal, vaginal and also for oral or parenteral (intravenous, intradermal, intramuscular, intrathecal, etc.) administration. Such compositions can be prepared by combining (ie by mixing, dissolving, etc.) the active compound of formula I in the form of the free acid or salt with pharmaceutically acceptable excipients of a neutral nature (such as aqueous or non-aqueous solutions, stabilizers, emulsifiers, detergents, additives), and further dyes and fragrances and flavors if necessary. The concentration of the active ingredient in a pharmaceutical composition can vary between 0.1% and 100%, depending on the nature of the influence and the mode of administration. The dose of the active ingredient administered can be further varied between 0.1 mg and 100 mg per kg of body weight.
Claims (23)
Priority Applications (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| PCT/NL1994/000206 WO1995006037A1 (en) | 1993-08-27 | 1994-08-29 | New imidazole derivatives having agonistic or antagonistic activity on the histamine h3 receptor |
| AU78238/94A AU7823894A (en) | 1993-08-27 | 1994-08-29 | New imidazole derivatives having agonistic or antagonistic activity on the histamine h3 receptor |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP93202528 | 1993-08-27 | ||
| EP93202528 | 1993-08-27 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| NL9302045A true NL9302045A (en) | 1995-03-16 |
Family
ID=8214069
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| NL9302045A NL9302045A (en) | 1993-08-27 | 1993-11-25 | New imidazole derivative with agonistic or antagonistic activity on the histamine H3 receptor |
Country Status (1)
| Country | Link |
|---|---|
| NL (1) | NL9302045A (en) |
Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2131625A1 (en) * | 1970-06-25 | 1971-12-30 | Smith Kline French Lab | Thiourea derivatives, processes for their production and medicinal preparations |
| GB1305548A (en) * | 1969-10-29 | 1973-02-07 | ||
| EP0197840A1 (en) * | 1985-03-26 | 1986-10-15 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | (Imidazolyl-4) piperidines, their preparation and their therapeutical use |
| WO1993012107A1 (en) * | 1991-12-18 | 1993-06-24 | Schering Corporation | Imidazoylalkyl substituted with a six membered nitrogen containing heterocyclic ring |
-
1993
- 1993-11-25 NL NL9302045A patent/NL9302045A/en not_active Application Discontinuation
Patent Citations (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB1305548A (en) * | 1969-10-29 | 1973-02-07 | ||
| DE2131625A1 (en) * | 1970-06-25 | 1971-12-30 | Smith Kline French Lab | Thiourea derivatives, processes for their production and medicinal preparations |
| EP0197840A1 (en) * | 1985-03-26 | 1986-10-15 | Institut National De La Sante Et De La Recherche Medicale (Inserm) | (Imidazolyl-4) piperidines, their preparation and their therapeutical use |
| WO1993012107A1 (en) * | 1991-12-18 | 1993-06-24 | Schering Corporation | Imidazoylalkyl substituted with a six membered nitrogen containing heterocyclic ring |
Non-Patent Citations (1)
| Title |
|---|
| F. BORDI ET AL: "Synthesis and binding assays of H3-receptor ligands", FARMACO, vol. 47, no. 11, 1992, PAVIA IT, pages 1343 - 1365 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| EP0934311B1 (en) | New heterocyclylmethyl-substituted pyrazol derivates | |
| DE60218511T2 (en) | DIHYDROXYPYRIMIDINE CARBOXYLAMIDE INHIBITORS OF THE HIV INTEGRASE | |
| DE69525418T2 (en) | Benzimidazole derivatives | |
| WO1995006037A1 (en) | New imidazole derivatives having agonistic or antagonistic activity on the histamine h3 receptor | |
| US10952999B2 (en) | Inhibitor of cyclin-dependent kinase CDK9 | |
| SU1380614A3 (en) | Method of producing derivatives of aryltriazoles or hydrochloride or hydrobromic salts thereof | |
| JP2008526887A (en) | Novel heteropyrrole analogs that act on cannabinoid receptors | |
| CA2781858C (en) | Modulators of tnf-.alpha. signaling | |
| DE69529619T4 (en) | PYRIMIDINYLPYRAZOLDERIVATIVE | |
| EP4206197A1 (en) | Preparation method for novel rho-related protein kinase inhibitor and intermediate in preparation method | |
| DE3601143C2 (en) | Cyclic imide derivatives of 2- (4-butylpiperazin-1-yl) pyridines, processes for their preparation and pharmaceutical compositions containing these compounds | |
| WO2012038904A1 (en) | Nicotinamide derivatives, preparation thereof and therapeutic use thereof | |
| DE69329385T2 (en) | THIAZOLINE DERIVATIVES | |
| US5134151A (en) | 2-picolylamine derivatives | |
| AU2006309576B2 (en) | Ortho-substituted aniline derivative and antioxidant drug | |
| JP3916092B2 (en) | Imidazolidinone derivatives and their acid addition salts and therapeutic agents for senile dementia | |
| TWI808786B (en) | Benzoxazinone derivatives | |
| CA1188303A (en) | 5-(pyridinyl)-1h-benzimidazoles and 1-hydroxy-6- (pyridinyl)-1h-benzimidazoles, their preparation and use as cardiotonics | |
| NL9302045A (en) | New imidazole derivative with agonistic or antagonistic activity on the histamine H3 receptor | |
| KR20240137134A (en) | Piperazine indazole glucocorticoid receptor antagonist | |
| EP4320103A1 (en) | Pyrimidine based ras modulators and uses thereof | |
| EP0304353B1 (en) | Benzimidazoles derivatives and process for their preparation | |
| DE19842833A1 (en) | 2-arylalkylthio-imidazoles, 2-arylalkenylthio-imidazoles and 2-arylalkynylthio-imidazoles as anti-inflammatory and cytokine release inhibitors | |
| CA3196035A1 (en) | Fused tricyclic derivative and pharmaceutical application thereof | |
| DD281385A5 (en) | PROCESS FOR THE PREPARATION OF A 1,3-DIOXY NALKANSAEUREDERIVATE |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A1B | A search report has been drawn up | ||
| BV | The patent application has lapsed |