KR20120046216A - 3-시아노퀴놀린 정제 제형 및 이의 용도 - Google Patents
3-시아노퀴놀린 정제 제형 및 이의 용도 Download PDFInfo
- Publication number
- KR20120046216A KR20120046216A KR1020127002851A KR20127002851A KR20120046216A KR 20120046216 A KR20120046216 A KR 20120046216A KR 1020127002851 A KR1020127002851 A KR 1020127002851A KR 20127002851 A KR20127002851 A KR 20127002851A KR 20120046216 A KR20120046216 A KR 20120046216A
- Authority
- KR
- South Korea
- Prior art keywords
- weight
- composition
- ski
- methoxy
- microcrystalline cellulose
- Prior art date
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2072—Pills, tablets, discs, rods characterised by shape, structure or size; Tablets with holes, special break lines or identification marks; Partially coated tablets; Disintegrating flat shaped forms
- A61K9/2077—Tablets comprising drug-containing microparticles in a substantial amount of supporting matrix; Multiparticulate tablets
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4709—Non-condensed quinolines and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
- A61K47/38—Cellulose; Derivatives thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2027—Organic macromolecular compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyvinyl pyrrolidone, poly(meth)acrylates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/2031—Organic macromolecular compounds obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyethylene glycol, polyethylene oxide, poloxamers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/20—Pills, tablets, discs, rods
- A61K9/2004—Excipients; Inactive ingredients
- A61K9/2022—Organic macromolecular compounds
- A61K9/205—Polysaccharides, e.g. alginate, gums; Cyclodextrin
- A61K9/2054—Cellulose; Cellulose derivatives, e.g. hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Organic Chemistry (AREA)
- Inorganic Chemistry (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
본 발명은 3-시아노퀴놀린, SKI-606을 포함하고, 크로스카멜로스 나트륨, 트윈 또는 둘 다를 추가로 포함하는 고체 조성물에 관한 것이다.
Description
본 발명은 몇몇 시아노퀴놀린 화합물들의 제형에 관한 것이다. 특히, 본 발명은 3-시아노퀴놀린 화합물, 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴, 및 초-붕해제 크로스카멜로스 나트륨, 계면활성제 폴리에틸렌 옥사이드 솔비탄 모노올리에이트(폴리솔베이트/폴리옥시에틸렌 솔비탄 모노올리에이트(트윈(Tween)-80(상표))), 또는 둘 다를 추가로 포함하는 안정한 정제에 관한 것이다.
몇몇 3-시아노퀴놀린 화합물 및 이의 약학적으로 허용 가능한 염은 단백질 키나제 억제제이고 종양 억제 활성을 가지며, 따라서 적어도 부분적으로 상기 수용체의 조절해제로부터 생성되는 몇몇 질병 상태들, 예를 들어 암의 표적화에 유용하다. 수용체 타이로신 키나제는 세포 복제를 개시하는 생화학적 신호의 전달에 중요하다. 상기 키나제는 세포막에 걸쳐 있는 큰 효소이며, 표피 성장 인자 수용체(EGFR)와 같은 성장 인자에 대한 세포 외 결합 도메인 및 단백질 중의 타이로신 아미노산을 인산화하고 따라서 세포 증식에 영향을 미치는 키나제로서 작용하는 세포 내 부분을 갖는다. 상이한 수용체 타이로신 키나제들에 결합하는 성장 인자들의 패밀리를 기본으로 다양한 부류의 수용체 타이로신 키나제들이 공지되어 있다(Wilks, Advances in Cancer Research, 1993, 60, 43-73) . 상기 분류는 EGFR, TGFα, Neu 및 erbB 수용체와 같은 수용체 타이로신 키나제의 EGFR 패밀리를 포함하는 부류 I 수용체 타이로신 키나제, 인슐린 및 IGFI 수용체 및 인슐린 관련된 수용체(IRR)와 같은 수용체 타이로신 키나제의 인슐린 패밀리를 포함하는 부류 II 수용체 타이로신 키나제 및 PDGFα, PDGFβ 및 콜로니 자극 인자 1(CSF1) 수용체와 같은 수용체 타이로신 키나제의 혈소판 유래된 성장 인자(PDGF) 패밀리를 포함하는 부류 III 수용체 타이로신 키나제를 포함한다.
몇몇 타이로신 키나제는, 세포 내에 위치하고 종양 세포 운동, 확산 및 침습 및 후속적으로 전이성 종양 성장에 영향을 미치는 것과 같은 생화학적 신호의 전달에 관련된 비-수용체 타이로신 키나제의 한 부류에 속함이 또한 공지되어 있다(Ulkich et al., Cell, 1990, 61, 203-212, Bolen et al., FASEB J., 1992, 6, 3403-3409, Brickell et al., Critical Reviews in Oncogenesis, 1992, 3, 401-406, Bohlen et al., Oncogene, 1993, 8 2025-2031, Courtneidge et al., Semin . Cancer Biol., 1994, 5, 239-246, Lauffenburger et al., Cell, 1996, 84, 359-369, Hanks et al., BioEssays, 1996, 19, 137-145, Parsons et al., Current Opinion in Cell Biology, 1997, 9, 187-192, Brown et al., Biochimica et Biophysica Acta, 1996, 1287, 121-149 and Schlaepfer et al., Progress in Biophysics and Molecular Biology, 1999, 71, 435-478). Src-패밀리, 예를 들어 Src, Lyn 및 Yes 타이로신 키나제, Abl 패밀리, 예를 들어 Abl 및 Arg, 및 Jak 패밀리, 예를 들어 Jak1 및 Tyk2를 포함한 다양한 부류의 비-수용체 타이로신 키나제들이 공지되어 있다.
상기 3-시아노퀴놀린 화합물 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴(또한 SKI-606 또는 보수티니브(bosutinib)로서 지칭된다)은 pH 8.0에서 대략 0.06 ㎍/㎖의 고유 용해도를 갖는 약 염기이다. pH 8 이하에서, 상기 화합물 SKI-606의 용해도는 이온화로 인해 pH 감소에 따라 기하급수적으로 증가한다. 그러나, 낮은 pH 수용액(pH 3 이하)에서 가수분해를 통한 SKI-606의 분해가 관찰되었지만, 상기 화합물은 5 초과의 pH에서 비교적 안정하다.
기존의 3-시아노퀴놀린의 고체 제형이 갖는 일부 문제로는 가변적인 용해가 있으며, 이는 활성 약학 성분(API)의 입자 크기에 따라 변하는 것으로 보인다. 일반 표준과 반대로, 상기 PIII 제형 중의 보다 작은 API(D90 약 20 ㎛)는 보다 큰 API(D90 약 40 ㎛)에 사용되는 유사한 가공 조건 하에서 용해를 지연시키는 것으로 나타났으며, 그 결과 용해 명세에 달하지 못한다. 이는 보다 큰 정제(보다 큰 농도)의 경우 더 그런 것으로 관찰되었다.
또한, 에이징(aging)/보관 후 제형의 가속화된 용해 특성이 또한 초기 시점들에서 관찰되었다(실온 및 가속화된 조건 하 모두에서 에이징 시 작지만 현저한 용해 이동이 있다). 결과를 2 가지 용해 방법, 즉 0.1N HCl 방법 및 CTAB/pH 5 아세테이트 방법으로 나타내며, 이는 하기에 추가로 논의된다. 상기 0.1N HCl 방법은 처음 10 내지 20 분 이내에 모든 약물을 방출시키는 것으로 밝혀졌으므로, 30 분까지의 시점들에서 용해 프로파일을 보다 잘 나타내기 위해서 후자의 방법이 선택되었다.
따라서, 환자에 사용하기 위해서 API 입자 크기 변화에 내성이고 에이징 및 보관 중에 보다 안정한, 3-시아노퀴놀린 화합물, 예를 들어 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴의 안정한 고체 제형을 제공하는 것이 바람직할 것이다.
2 가지 혁신적인 기법, 즉 용해 및 안정성 성질을 개선시키기 위한 붕해제 유형(및 붕해제 비)의 변화; 및 또한 용해 및 안정성 성질을 개선시키기 위한, 폴록사머의, 폴리에틸렌 옥사이드 솔비탄 모노올리에이트(폴리솔베이트/폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80))와 같은 액체 계면활성제에 의한 대체를 본 발명에서 개시하였다.
첫 번째 실시태양에서, 본 발명은 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴을 포함한 3-시아노퀴놀린의 약학적으로 허용 가능한 고체 조성물을 제공한다. 특정 실시태양에서, 상기와 같은 고체 조성물을 정제로서 제공한다. 일부 실시태양에서, 본 발명은 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴을 포함하는 단위 투여형을 제공한다.
본 발명은 과립 내(intragranular) 성분으로서, 조성물의 중량을 기준으로 (a) 20 내지 80, 또는 30 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; 및 (b) 0.1 내지 20 중량%의 하나 이상의 습윤제를 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 과립 내 성분으로서, 조성물의 중량을 기준으로 (a) 25 내지 80, 또는 30 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; 및 (b) 0.1 내지 20 중량%의 하나 이상의 습윤제를 포함하는 약학적으로 허용 가능한 조성물을 제공하며, 여기에서 상기 조성물의 과립 내 성분은 또한 상기 조성물의 82.5 중량%를 차지하고 과립 외(extragranular) 성분은 상기 조성물의 17.5 중량%를 차지한다.
본 발명은 조성물의 중량을 기준으로 (a) 25 내지 80, 또는 30 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 0.1 내지 5.0 중량%의 하나 이상의 결합제; (c) 1 내지 25 중량%의 하나 이상의 충전제; (d) 0.1 내지 5 중량%의 하나 이상의 붕해제, (e) 0.1 내지 5 중량%의 하나 이상의 습윤제의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 1 내지 25 중량%의 하나 이상의 충전제; 및 (g) 0.1 내지 5 중량%의 하나 이상의 윤활제의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 25 내지 80, 또는 30 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 0.5 내지 5.0 중량%의 포비돈; (c) 1 내지 25 중량%의 미정질 셀룰로스; (d) 0.2 내지 5 중량%의 크로스카멜로스 나트륨; (e) 0.5 내지 5 중량%의 폴록사머의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 1 내지 25 중량%의 미정질 셀룰로스; 및 (g) 0.5 내지 5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 약 69 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 약 2 중량%의 포비돈; (c) 약 6.5 중량%의 미정질 셀룰로스; (d) 약 2 중량%의 크로스카멜로스 나트륨; (e) 약 3 중량%의 폴록사머의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 약 15 중량%의 미정질 셀룰로스; 및 (g) 약 0.5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 25 내지 80, 또는 30 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 0.5 내지 5.0 중량%의 하나 이상의 결합제; (c) 1 내지 25 중량%의 하나 이상의 충전제; (d) 0.5 내지 5 중량%의 하나 이상의 붕해제, (e) 0.2 내지 5 중량%의 하나 이상의 습윤제의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 1 내지 25 중량%의 하나 이상의 충전제; (g) 0.5 내지 5 중량%의 하나 이상의 윤활제; 및 (h) 0.5 내지 5 중량%의 하나 이상의 윤활제의 과립 외 성분을 포함하는 빠르게 녹는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 50 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 0.5 내지 5.0 중량%의 포비돈; (c) 1 내지 25 중량%의 미정질 셀룰로스; (d) 0.5 내지 5 중량%의 크로스카멜로스 나트륨; (e) 0.2 내지 5 중량%의 폴록사머의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 1 내지 25 중량%의 미정질 셀룰로스; (g) 0.5 내지 5 중량%의 크로스카멜로스 나트륨; 및 (h) 0.5 내지 5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 빠르게 녹는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 약 69 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 약 2 중량%의 포비돈; (c) 약 6.5 중량%의 미정질 셀룰로스; (d) 약 2 중량%의 크로스카멜로스 나트륨; (e) 약 3 중량%의 폴록사머의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 약 15 중량%의 미정질 셀룰로스; (g) 약 2 중량%의 크로스카멜로스 나트륨; 및 (h) 약 0.5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 25 내지 80, 또는 30 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 포비돈; (c) 미정질 셀룰로스; (d) 0.2 내지 5 중량%의 크로스카멜로스 나트륨; (e) 폴록사머의 과립 내 성분; 및 (f) 미정질 셀룰로스; 및 (g) 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 약 69 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 포비돈; (c) 미정질 셀룰로스; (d) 약 2 중량%의 크로스카멜로스 나트륨; (e) 폴록사머의 과립 내 성분; 및 (f) 미정질 셀룰로스; 및 (g) 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 50 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 포비돈; (c) 미정질 셀룰로스; (d) 0.5 내지 5 중량%의 크로스카멜로스 나트륨; (e) 폴록사머의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 미정질 셀룰로스; (g) 0.5 내지 5 중량%의 크로스카멜로스 나트륨; 및 (h) 마그네슘 스테아레이트의 과립 외 성분을 포함하는 빠르게 녹는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 약 69 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 포비돈; (c) 미정질 셀룰로스; (d) 약 2 중량%의 크로스카멜로스 나트륨; (e) 폴록사머의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 미정질 셀룰로스; (g) 약 2 중량%의 크로스카멜로스 나트륨; 및 (h) 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 과립 내 성분으로서 약 25 중량%, 20 중량%, 또는 심지어 15 중량% 정도로 낮은 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴 및 약 0.25 내지 5 중량%, 0.5 내지 5 중량%, 1 내지 3 중량%, 3 중량%, 2 중량% 또는 1 중량%의 크로스카멜로스 나트륨, 및 과립 외 성분으로서 약 0.25 내지 5 중량%, 0.5 내지 5 중량%, 1 내지 3 중량%, 3 중량%, 2 중량% 또는 1 중량%의 크로스카멜로스 나트륨을 포함하고, 조성물의 나머지 부분은 상술한 바와 같은 추가적인 과립 내 및 과립 외 성분들이 차지하는 약학적으로 허용 가능한 조성물, 예를 들어 소아과용으로 적합한 조성물을 또한 제공한다.
본 발명은 과립 내 성분으로서 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴 및 약 0.25 내지 5 중량%, 0.5 내지 5 중량%, 1 내지 3 중량%, 3 중량%, 2 중량% 또는 1 중량%의 크로스카멜로스 나트륨, 및 과립 외 성분으로서 약 0.25 내지 5 중량%, 0.5 내지 5 중량%, 1 내지 3 중량%, 3 중량%, 2 중량% 또는 1 중량%의 크로스카멜로스 나트륨을 포함하고, 조성물의 나머지 부분은 상술한 바와 같은 추가적인 과립 내 및 과립 외 성분들이 차지하는 약학적으로 허용 가능한 조성물을 또한 제공한다.
본 발명의 추가의 실시태양은 상기 과립을 압착시킴으로써 형성된 정제 또는 정제 코어를 포함하며, 여기에서 상기 코어는 통상적인 수단에 의해, 예를 들어 4% 이하의 중합체 필름 코팅제로 선택적으로 코팅되고, 상기 중합체는 통상적인 코팅 중합체들로 구성된다. 예시적인 중합체 코팅제를 폴리비닐 알콜 및 PEG 3350(오파드라이 레드(Opadry red) II 및 옐로우 II)을 사용하여 적용한다.
본 발명은 또한 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴을 포함하는 빠르게 녹는 약학적으로 허용 가능한 고체 조성물을 제공한다.
본 발명은 또한 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴을 포함하는 안정한, 약학적으로 허용 가능한 고체 조성물의 제조 방법을 제공한다.
본 발명은 또한 피실험자에게 유효량의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴을 포함하는 약학적으로 허용 가능한 고체 조성물을 투여함을 포함하는 암 치료 방법을 제공한다.
본 발명의 SKI-606의 고체 조성물은 다른 것들 중에서도 특히 인간 또는 동물 피실험자, 예를 들어 비 제한적으로 소아, 아동, 성인 및 노인 피실험자에게 투여하기에 유용하다.
두 번째 실시태양에서, 본 발명은 조성물의 중량을 기준으로, 과립 내 및 또는 과립 외 성분으로서, (a) 25 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; 및 (b) 0.1 내지 20 중량%의 하나 이상의 습윤제를 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 25 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 0.5 내지 5.0 중량%의 하나 이상의 결합제; (c) 1 내지 25 중량%의 하나 이상의 충전제; (d) 0.5 내지 5 중량%의 하나 이상의 붕해제, (e) 0.2 내지 5 중량%의 하나 이상의 습윤제의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 1 내지 25 중량%의 하나 이상의 충전제; (g) 0.5 내지 5.0 중량%의 하나 이상의 습윤제; 및 (h) 0.5 내지 5 중량%의 하나 이상의 윤활제의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 50 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 0.5 내지 5.0 중량%의 포비돈; (c) 1 내지 25 중량%의 미정질 셀룰로스; (d) 0.5 내지 5 중량%의 크로스포비돈; (e) 0.5 내지 5 중량%의 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)(상표)의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 1 내지 25 중량%의 미정질 셀룰로스; (g) 0.5 내지 5 중량%의 크로스포비돈; 및 (h) 0.1 내지 5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 약 69 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 약 2 중량%의 포비돈; (c) 약 19.5 중량%의 미정질 셀룰로스; (d) 약 3 중량%의 크로스포비돈; (e) 약 1 중량%의 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)(상표)의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 약 4 중량%의 미정질 셀룰로스; (g) 약 1 중량%의 크로스포비돈; 및 (h) 약 0.5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 약 69 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 약 2 중량%의 포비돈; (c) 약 19.5 중량%의 미정질 셀룰로스; (d) 약 3 중량%의 크로스포비돈; (e) 약 1 중량%의 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)(상표)의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 약 4 중량%의 미정질 셀룰로스; (g) 약 1 중량%의 크로스포비돈; 및 (h) 약 0.5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 조성물의 중량을 기준으로 (a) 약 69 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 약 2 중량%의 포비돈; (c) 약 19.5 중량%의 미정질 셀룰로스; (d) 약 1 중량%의 크로스포비돈; (e) 약 1 중량%의 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)(상표)의 과립 내 성분; 및 조성물의 중량을 기준으로 (f) 약 4 중량%의 미정질 셀룰로스; (g) 약 3 중량%의 크로스포비돈; 및 (h) 약 0.5 중량%의 마그네슘 스테아레이트의 과립 외 성분을 포함하는 약학적으로 허용 가능한 조성물을 제공한다.
본 발명은 또한 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴을 포함하는 안정한, 약학적으로 허용 가능한 고체 조성물의 제조 방법을 제공한다.
본 발명은 또한 피실험자에게 유효량의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴을 포함하는 약학적으로 허용 가능한 고체 조성물을 투여함을 포함하는 암 치료 방법을 제공한다.
본 발명의 SKI-606의 고체 조성물은 다른 것들 중에서도 특히 인간 또는 동물 피실험자, 예를 들어 비 제한적으로 소아, 아동, 성인 및 노인 피실험자에게 투여하기에 유용하다.
도 1은 상이한 붕해제들(크로스카멜로스 나트륨 대 크로스포비돈)을 비교하는 SKI-606 제형에 대한 정제 용해 속도를 요약한다.
도 2는 크로스포비돈을 포함하는 SKI-606 제형의 가속화된 안정성에 대한 용해를 요약한다. 특히 초기 시점들에서 현저한 정제 용해 이동이 존재하는 것으로 보인다.
도 3은 크로스카멜로스 나트륨을 포함하는 SKI-606 제형의 가속화된 안정성에 대한 용해를 요약한다. 이 경우 이동은 관찰되지 않는다(도 2에 비해).
도 4는 정제 용해 속도에 대한 SKI-606 제형 중 다양한 과립 내 및 과립 외(IG 및 EG) 크로스카멜로스 나트륨 농도의 효과를 요약한다.
도 5는 정제 용해 속도에 대한 SKI-606 제형 중 다양한 과립 내 및 과립 외(IG 및 EG) 크로스포비돈 농도의 효과를 요약한다. 이때 보다 넓은 용해가 관찰되는데, 이는 크로스포비돈의 비에 대한 용해의 강한 농도 의존성을 나타낸다. D90의 API를 함유하는 제형은 D90 = 40 또는 60 ㎛의 API를 함유하는 나머지와 현저하게 상이한 용해를 보인다.
도 6은 2% 결합제, 및 2% 과립 내 및 과립 외 붕해제를 함유하는 크로스포비돈 함유 SKI-606 제형의 용해에 대한 활성 약제 성분(API) 입자 크기의 효과를 요약한다.
도 7A 및 B는 크로스카멜로스 나트륨 기재 SKI-606 제형에 대한 CTAB/아세테이트 및 0.1N HCl의 두 매질 중의 API 입자 크기의 효과가 없음을 요약한다. 상기 CTAB/아세테이트 매질은 상기 0.1N HCl보다 더 차별적인 매질로 간주되었다. 이를, 크로스포비돈 기재 정제 제형에서 정제 용해에 대한 API 입자 크기의 전혀 다른 효과를 뚜렷하게 나타내는 도 9A 및 B와 비교하시오.
도 8은 120 내지 190 N 범위 내의 정제 경도에 대한 크로스카멜로스 기재 SKI-606 제형들(실험 A, B 및 C)의 용해 의존성의 결여를 요약하며, 따라서 이는 상기 제형의 용해 견고성을 입증한다. 정제의 경도는 통상적으로 제작 설정을 변경시키기 위해 필요할 수 있으며 상기 제형은 그렇게 하는 능력을 분명히 제공한다.
도 9A 및 B는 0.1N HCl 중의 크로스포비돈 기재 제형의 정제(100 및 500 ㎎ 농도) 용해에 대한 API 입자 크기의 효과를 요약한다. 이를, 상기 의존성을 나타내지 않는 도 7A 및 B와 비교 대조하시오.
도 10은 2주까지 오픈 디쉬(open dish) 가속화된 안정성에 대한 500 ㎎ 크로스포비돈 기재 SKI-606 제형의 정제 용해 상향 이동을 요약한다. 용해 데이터를 다양한 결합제 백분율 및 붕해제 비를 갖는 2 개의 제형에 대해 나타낸다. 현저한 용해 차이가 정제 용해 중 상기 두 회분 모두에 대해 초기에 관찰되며, 이는 가속화된 안정성에 대한 용해 재현성의 결여를 가리킨다. 이를, 안정성에 대해 어떠한 차이도 나타내지 않는 도 11의 크로스카멜로스 나트륨 기재 제형과 비교 대조하시오.
도 11은 도 10의 크로스포비돈(CPV) 회분과 유사한 조건 하에서 안정성에 대한 크로스카멜로스 나트륨(CCS) 기재 제형의 어떠한 용해 이동도 없음을 요약한다.
도 12는 500 및 100 ㎎ 강도 정제에 대해 가속화된 에이징 조건 하에서 0.1N HCl 중의 크로스포비돈(CPV) SKI-606 제형의 추가적인 용해 이동 데이터를 나타낸다. 일관된 상향 추세가 0.1N HCl 중의 상기 강도 둘 다에 대해 관찰된다.
도 13은 다양한 농도의 습윤제(폴록사머)를 갖는 SKI-606 제형에 대한 비교 상의 용해 프로파일들을 요약한다. 폴록사머는 농도 의존적인 방식으로 정제 용해를 감소시키는 뜻밖의 효과를 갖는다.
도 14는 SKI-606 제형 중 과립 용해에 대한 습윤제의 효과를 요약한다. 상기 효과는 폴록사머 농도의 증가가 과립 용해를 증가시켰음을 나타낸다.
도 15는 습윤제(API D90 = 38 ㎛)로서 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)를 함유하는 SKI-606 제형에 대한 40 ℃ 및 40 ℃/75% RH 모두에서의 6주까지의 가속화된 에이징 오픈 디쉬 조건(accelerated aging open dish condition)의 효과를 요약한다. 오픈 디쉬에서 엄격한 안정성 조건 하에서조차 사소한 이동이 나타나는 것으로 관찰된다.
도 16은 습윤제(API D90 = 18 ㎛)로서 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)를 함유하는 SKI-606 제형에 대한 40 ℃ 및 40 ℃/75% RH 모두에서의 6주까지의 가속화된 에이징 오픈 디쉬 조건의 효과를 요약한다. 오픈 디쉬에서 엄격한 안정성 조건 하에서조차 사소한 이동이 나타나는 것으로 관찰된다.
도 17은 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)를 함유하는 SKI-606 제형에서 정제 용해에 대한 API 입자 크기의 효과의 결여를 요약한다.
도 18은 건조제가 있는 병에서 코팅된, 500 ㎎ 농도 크로스카멜로스 기재 제형(2% 결합제 및 2% 과립 내 및 과립 외 CCS) 500 ㎎에 대한, 건조제가 있는 병에서의 가속화된 안정성에 대한 용해를 요약한다. 6M, 40 ℃/75% RH에서 용해 이동은 관찰되지 않는다.
도 19는 건조제가 있는 병에서 코팅된, 상기 500 ㎎ 농도 크로스카멜로스 기재 제형(2% 결합제 및 2% 과립 내 및 과립 외 CCS) 500 ㎎에 대한, 건조제가 없는 병에서의 가속화된 안정성에 대한 용해를 요약한다. 6M, 40 ℃/75% RH에서 매우 적은 용해 이동이 관찰된다.
도 20은 건조제가 있는 병에서 코팅된, 상기 500 ㎎ 농도 크로스카멜로스 기재 제형(2% 결합제 및 2% 과립 내 및 과립 외 CCS) 100 ㎎에 대한, 건조제가 있는 병에서의 가속화된 안정성에 대한 용해를 요약한다. 6M, 40 ℃/75% RH에서 용해 이동은 관찰되지 않는다.
도 21A는 건조제가 있는 병에서 규모 확대된(100 ㎏) 회분 용해 안정성을 요약한다. CTAB/아세테이트 완충제(A)에서 안정성에 대한 용해 이동은 최소이거나 없으며 0.1N HCl(B)에서는 이동이 없다.
도 2는 크로스포비돈을 포함하는 SKI-606 제형의 가속화된 안정성에 대한 용해를 요약한다. 특히 초기 시점들에서 현저한 정제 용해 이동이 존재하는 것으로 보인다.
도 3은 크로스카멜로스 나트륨을 포함하는 SKI-606 제형의 가속화된 안정성에 대한 용해를 요약한다. 이 경우 이동은 관찰되지 않는다(도 2에 비해).
도 4는 정제 용해 속도에 대한 SKI-606 제형 중 다양한 과립 내 및 과립 외(IG 및 EG) 크로스카멜로스 나트륨 농도의 효과를 요약한다.
도 5는 정제 용해 속도에 대한 SKI-606 제형 중 다양한 과립 내 및 과립 외(IG 및 EG) 크로스포비돈 농도의 효과를 요약한다. 이때 보다 넓은 용해가 관찰되는데, 이는 크로스포비돈의 비에 대한 용해의 강한 농도 의존성을 나타낸다. D90의 API를 함유하는 제형은 D90 = 40 또는 60 ㎛의 API를 함유하는 나머지와 현저하게 상이한 용해를 보인다.
도 6은 2% 결합제, 및 2% 과립 내 및 과립 외 붕해제를 함유하는 크로스포비돈 함유 SKI-606 제형의 용해에 대한 활성 약제 성분(API) 입자 크기의 효과를 요약한다.
도 7A 및 B는 크로스카멜로스 나트륨 기재 SKI-606 제형에 대한 CTAB/아세테이트 및 0.1N HCl의 두 매질 중의 API 입자 크기의 효과가 없음을 요약한다. 상기 CTAB/아세테이트 매질은 상기 0.1N HCl보다 더 차별적인 매질로 간주되었다. 이를, 크로스포비돈 기재 정제 제형에서 정제 용해에 대한 API 입자 크기의 전혀 다른 효과를 뚜렷하게 나타내는 도 9A 및 B와 비교하시오.
도 8은 120 내지 190 N 범위 내의 정제 경도에 대한 크로스카멜로스 기재 SKI-606 제형들(실험 A, B 및 C)의 용해 의존성의 결여를 요약하며, 따라서 이는 상기 제형의 용해 견고성을 입증한다. 정제의 경도는 통상적으로 제작 설정을 변경시키기 위해 필요할 수 있으며 상기 제형은 그렇게 하는 능력을 분명히 제공한다.
도 9A 및 B는 0.1N HCl 중의 크로스포비돈 기재 제형의 정제(100 및 500 ㎎ 농도) 용해에 대한 API 입자 크기의 효과를 요약한다. 이를, 상기 의존성을 나타내지 않는 도 7A 및 B와 비교 대조하시오.
도 10은 2주까지 오픈 디쉬(open dish) 가속화된 안정성에 대한 500 ㎎ 크로스포비돈 기재 SKI-606 제형의 정제 용해 상향 이동을 요약한다. 용해 데이터를 다양한 결합제 백분율 및 붕해제 비를 갖는 2 개의 제형에 대해 나타낸다. 현저한 용해 차이가 정제 용해 중 상기 두 회분 모두에 대해 초기에 관찰되며, 이는 가속화된 안정성에 대한 용해 재현성의 결여를 가리킨다. 이를, 안정성에 대해 어떠한 차이도 나타내지 않는 도 11의 크로스카멜로스 나트륨 기재 제형과 비교 대조하시오.
도 11은 도 10의 크로스포비돈(CPV) 회분과 유사한 조건 하에서 안정성에 대한 크로스카멜로스 나트륨(CCS) 기재 제형의 어떠한 용해 이동도 없음을 요약한다.
도 12는 500 및 100 ㎎ 강도 정제에 대해 가속화된 에이징 조건 하에서 0.1N HCl 중의 크로스포비돈(CPV) SKI-606 제형의 추가적인 용해 이동 데이터를 나타낸다. 일관된 상향 추세가 0.1N HCl 중의 상기 강도 둘 다에 대해 관찰된다.
도 13은 다양한 농도의 습윤제(폴록사머)를 갖는 SKI-606 제형에 대한 비교 상의 용해 프로파일들을 요약한다. 폴록사머는 농도 의존적인 방식으로 정제 용해를 감소시키는 뜻밖의 효과를 갖는다.
도 14는 SKI-606 제형 중 과립 용해에 대한 습윤제의 효과를 요약한다. 상기 효과는 폴록사머 농도의 증가가 과립 용해를 증가시켰음을 나타낸다.
도 15는 습윤제(API D90 = 38 ㎛)로서 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)를 함유하는 SKI-606 제형에 대한 40 ℃ 및 40 ℃/75% RH 모두에서의 6주까지의 가속화된 에이징 오픈 디쉬 조건(accelerated aging open dish condition)의 효과를 요약한다. 오픈 디쉬에서 엄격한 안정성 조건 하에서조차 사소한 이동이 나타나는 것으로 관찰된다.
도 16은 습윤제(API D90 = 18 ㎛)로서 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)를 함유하는 SKI-606 제형에 대한 40 ℃ 및 40 ℃/75% RH 모두에서의 6주까지의 가속화된 에이징 오픈 디쉬 조건의 효과를 요약한다. 오픈 디쉬에서 엄격한 안정성 조건 하에서조차 사소한 이동이 나타나는 것으로 관찰된다.
도 17은 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)를 함유하는 SKI-606 제형에서 정제 용해에 대한 API 입자 크기의 효과의 결여를 요약한다.
도 18은 건조제가 있는 병에서 코팅된, 500 ㎎ 농도 크로스카멜로스 기재 제형(2% 결합제 및 2% 과립 내 및 과립 외 CCS) 500 ㎎에 대한, 건조제가 있는 병에서의 가속화된 안정성에 대한 용해를 요약한다. 6M, 40 ℃/75% RH에서 용해 이동은 관찰되지 않는다.
도 19는 건조제가 있는 병에서 코팅된, 상기 500 ㎎ 농도 크로스카멜로스 기재 제형(2% 결합제 및 2% 과립 내 및 과립 외 CCS) 500 ㎎에 대한, 건조제가 없는 병에서의 가속화된 안정성에 대한 용해를 요약한다. 6M, 40 ℃/75% RH에서 매우 적은 용해 이동이 관찰된다.
도 20은 건조제가 있는 병에서 코팅된, 상기 500 ㎎ 농도 크로스카멜로스 기재 제형(2% 결합제 및 2% 과립 내 및 과립 외 CCS) 100 ㎎에 대한, 건조제가 있는 병에서의 가속화된 안정성에 대한 용해를 요약한다. 6M, 40 ℃/75% RH에서 용해 이동은 관찰되지 않는다.
도 21A는 건조제가 있는 병에서 규모 확대된(100 ㎏) 회분 용해 안정성을 요약한다. CTAB/아세테이트 완충제(A)에서 안정성에 대한 용해 이동은 최소이거나 없으며 0.1N HCl(B)에서는 이동이 없다.
1. 정의:
본 발명에 사용된 바와 같이, 화합물 또는 약학적으로 허용 가능한 조성물의 "유효량"은 목적하는 치료 및/또는 예방 효과를 성취할 수 있다. 일부 실시태양에서, "유효량"은 단백질 타이로신 키나제의 변동과 관련된 질환 또는 병의 하나 이상의 증상을 치료하기에 충분한 화합물 또는 화합물 함유 조성물의 최소 이상의 양이다. 특정 실시태양에서, 화합물 또는 화합물 함유 조성물의 "유효량"은 이상 타이로신 키나제 수용체와 관련된 증상, 이와 관련된 질병(예를 들어 악성 및 양성 종양 성장을 포함한 암)을 치료하기에 충분하다.
본 발명에 사용된 바와 같은 "피실험자"란 용어는 포유동물을 의미하며 인간 및 동물 피실험자, 예를 들어 가축(예를 들어 말, 개, 고양이 등)을 포함한다.
본 발명에 사용된 바와 같은 "앓고 있다" 또는 "앓고 있는"이란 용어는 환자가 진단받았거나, 또는 걸린 것으로 의심이 가는 하나 이상의 병을 지칭한다.
본 발명에 사용된 바와 같은 "치료하다" 또는 "치료하는"이란 용어는 질환 또는 병, 또는 상기 질환 또는 병의 하나 이상의 증상을 부분적으로 또는 완전히 경감, 억제, 개시 지연, 예방, 개선 및/또는 완화시킴을 지칭한다.
"치료학적으로 활성인 작용제" 또는 "활성제"는 예방학적 및 치료학적 치료를 포함한 치료(예를 들어 인간 치료, 수의학적 치료)에 유용한 물질, 예를 들어 생물학적으로 활성인 물질을 지칭한다. 치료학적으로 활성인 작용제는 약물 화합물인 유기 분자, 펩타이드, 단백질, 탄수화물, 모노사카라이드, 올리고사카라이드, 폴리사카라이드, 핵단백질, 뮤코단백질, 지단백질, 합성 폴리펩타이드 또는 단백질, 단백질에 결합된 소 분자, 당단백질, 스테로이드, 핵산, DNA, RNA, 뉴클레오타이드, 뉴클레오사이드, 올리고뉴클레오타이드, 안티센스 올리고뉴클레오타이드, 지질, 호르몬, 및 비타민을 포함한다. 치료학적으로 활성인 작용제는 질병, 병 또는 질환의 치료, 예방, 지연, 감소 또는 개선에 약물로서 사용되는 임의의 물질을 포함한다. 본 발명의 제형에 유용한 치료학적으로 활성인 작용제들 중에는 오피오이드 수용체 길항물질 화합물, 오피오이드 진통제 화합물 등이 있다. 치료학적으로 활성인 작용제로서 유용한 화합물에 대한 추가적인 상세한 설명을 하기에 제공한다. 치료학적으로 활성인 작용제는, 예를 들어 제 2 화합물의 효능을 향상시키거나 또는 이의 부작용을 감소시킴으로써 상기 제 2 화합물의 효과 또는 유효성을 증가시키는 화합물을 포함한다.
본 발명에 사용된 바와 같은 "단위 투여형"이란 표현은 치료하려는 피실험자에게 적합한 본 발명 제형의 물리적으로 분리된 단위를 지칭한다. 그러나, 본 발명 조성물의 전체 매일 용법은 건전한 의학적 판단의 범위 내에서 주치의에 의해 결정됨을 알 것이다. 임의의 특정 피실험자 또는 유기체에 대한 구체적인 유효 용량 수준은 치료되는 질환 및 상기 질환의 중증도; 사용되는 구체적인 활성제의 활성; 사용되는 특정 조성물; 상기 피실험자의 연령, 체중, 일반적인 건강, 성별 및 식이요법; 사용되는 특정 활성제의 투여 시간 및 배출 속도; 치료 지속 기간; 사용되는 특정 화합물(들)과 함께 또는 동시에 사용되는 약물 및/또는 추가적인 요법, 및 의학 분야에 널리 공지된 유사한 인자를 포함한 다양한 인자들에 따라 변할 것이다.
간단히, "건조 배합물" 물질은 캡슐 충전 또는 정제 압착 전에 함께 물리적으로 배합된다. 문헌[Handbook of Pharmaceutical Granulation Technology, 1997, Dilip Parikh, Marcel Dekker, Inc. ISBN 0-8247-9882-1, page 309]을 참조하시오.
건식 과립화(슬러깅 또는 롤러 압축)에서 과립 내 물질들을 배합하여 슬러그 또는 롤러 압축물을 제조한다. 물질을 분쇄하고 과립 외 물질들과 배합한 다음 캡슐 충전 또는 정제 20 압착시킨다. 습식 과립화는 과립 내 물질들의 배합을 수반한다. 상기 배합물을 결합제의 존재 또는 부재 하에서 물과 함께 습식 과립화하고(고 전단, 저 전단 과립화기 사용) 건조시킨다(100 ℃ 이하의 온도 사용). 물질을 분쇄하고 과립 외 물질들과 배합한 다음 캡슐 충전 또는 정제 압착시킨다. 문헌[25 Handbook of Pharmaceutical Granulation Technology, 1997, Dilip Parikh, Marcel Dekker, Inc. ISBN 0-8247-9882-1, pages 338-368]을 참조하시오.
2. 약학적으로 허용 가능한 조성물 및 제형:
특정 실시태양에서, 본 발명의 약학적으로 허용 가능한 조성물은 SKI-606 및 하나 이상의 다른 부형제, 예를 들어 하나 이상의 결합제, 담체, 점도 조절 및 현탁제, 습윤제, 습윤제, 감미제, pH 조절제, 풍미제, 보존제 및 이들의 조합을 포함한다. 당해 분야의 숙련가는 특정 성분이 나열되는 범주를 제한하고자 하는 것은 아님을 쉽게 알 것이며; 일부의 경우 특정 성분이 하나보다 많은 범주에 더 적합하게 맞을 수도 있다. 또한, 이해하게 되는 바와 같이, 동일한 성분이 때때로, 특정 제형의 상황 하에서, 예를 들어 상기 성분의 양 및/또는 다른 성분 및/또는 활성 화합물(들)의 존재에 따라 상이한 작용을 수행하거나, 또는 하나보다 많은 작용을 수행할 수 있다.
특정 실시태양에서, 본 발명은 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴(또한 SKI-606으로도 칭함)을 포함하는 약학적으로 허용 가능한 고체 조성물을 제공한다. SKI-606은 미국 특허 제 7,297,795 호에 개시된 바와 같이, SKI-606의 제조 방법과 함께, 미국 특허 제 6,297,258 호에 개시되어 있다. SKI-606은 하기의 구조를 가지며 모노하이드레이트로서 단리된다:
SKI-606 모노하이드레이트
3-시아노퀴놀린 화합물, 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴은 pH 8.0에서 대략 0.06 ㎍/㎖의 고유 용해도를 갖는 약 염기이다. pH 8 이하에서, 상기 화합물 SKI-606의 용해도는 이온화로 인해 pH 감소에 따라 기하급수적으로 증가한다. 그러나, 낮은 pH 수용액에서 가수분해를 통한 SKI-606의 분해가 관찰되었지만, 상기 화합물은, 상기 4 아미노퀴놀린 기가 이온화되지 않는 경우, 5 초과의 pH에서 비교적 안정하다.
특정 실시태양에서, 본 발명의 SKI-606 제형은 입자 크기, 보관 시 가속화된 용해, 및 보관 시 제한된 안정성에 따라 변하는 것으로 보이는 가변적인 용해를 포함한, 3-시아노퀴놀린의 고체 제형이 갖는 하나 이상의 문제가 미연에 방지된다. 본 발명의 크로스카멜로스 SKI-606 제형은 통상적인 붕해제(예를 들어 크로스포비돈, 붕해 시간 약 18 내지 20 분)를 사용하는 필적할만한 SKI-606 제형보다 더 빠른 붕해 시간(2 내지 7 분)을 나타낸다.
특정 실시태양에서, 본 발명의 SKI-606 제형은 고 전단 습식 과립화 또는 팬 코팅에 의해 제조되는 필름 코팅된 SKI-606 제형을 포함한다. 다른 실시태양에서, 상기 필름 코팅된 SKI-606 정제 제형은 다른 통상적인 코팅 기법들에 의해 제조된다.
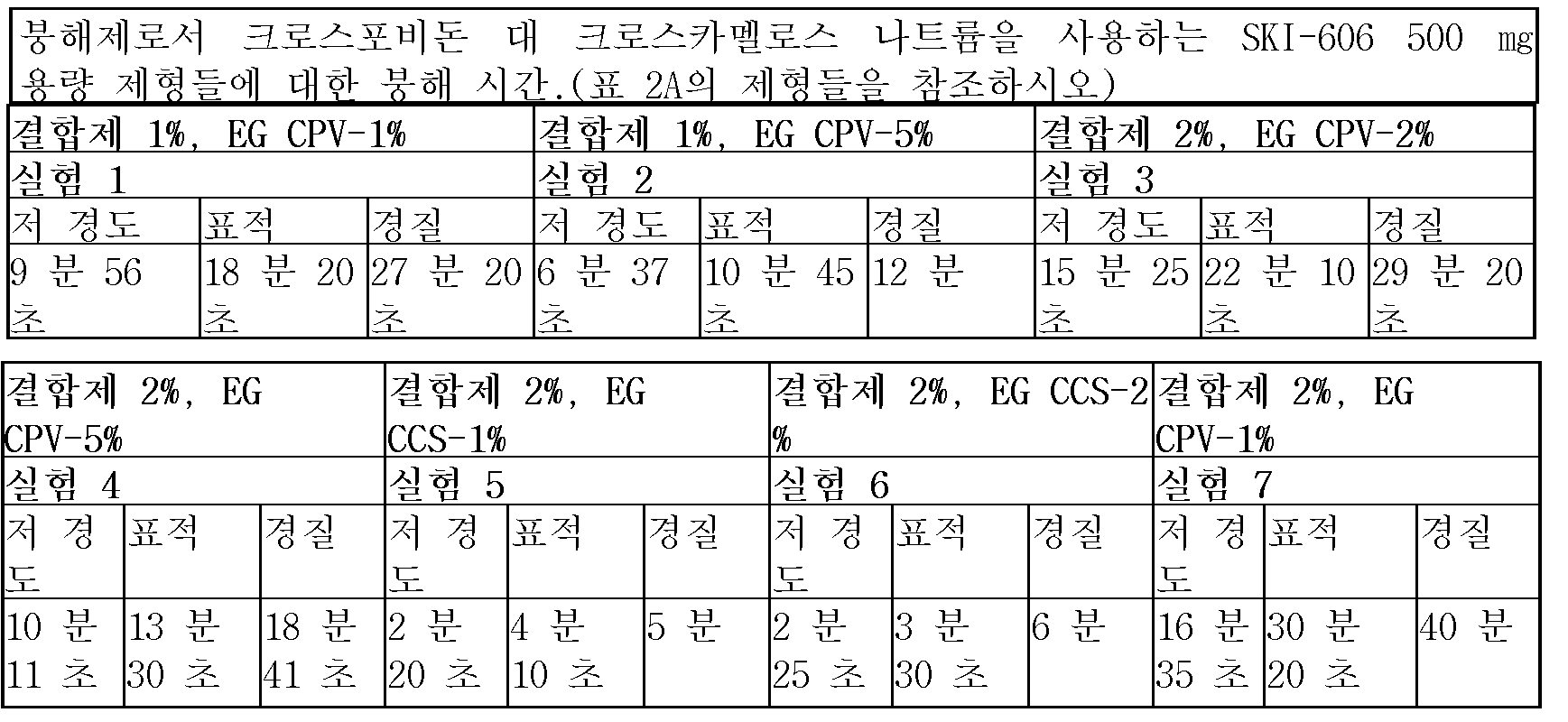
붕해 시간을 통상적인 붕해제인 크로스포비돈, 및 크로스카멜로스 나트륨을 사용하여 SKI-606 제형에 대해 비교하였으며 표 2에 요약하였다. 이 경우 과립 내 붕해제를 3% w/w에서 일정하게 유지시켰다. 상기 두 제형은 현저하게 상이한 붕해 시간을 갖는다, 예를 들어 2% 과립 외(EG) SKI-606/CCS 제형의 정제 붕해 시간(DT)은 단지 3.5 분인데 비해, SKI-606/CPV 제형은 22 분의 DT를 갖는다. 또한 상기 모든 SKI-606/CPV 제형들의 경우 정제 DT는 정제 경도에 강하게 의존하는 것으로 관찰된 반면, SKI-606/CCS 제형의 경우에는 상기와 같은 의존성이 관찰되지 않는다. 예를 들어, 3% IG 및 2% EG SKI-606/CPV 제형의 경우에조차, 저 및 고 경도 정제에 대한 DT 시간은 14 분까지(범위) 변하는 반면, 상기 SKI-606/CCS 제형은 단지 3.5 분까지만 변한다. 이러한 관찰은 상기 SKI-606/CCS 제형이 정제 경도에 대해 견고하였으며, 이는 본 발명의 SKI-606 제형의 정제 제조역량 특성에 관한 현저한 개선임을 가리킨다.
본 발명의 SKI-606 제형의 정제 용해(도 1 참조)를 또한 0.1N HCl 중에서 수행하였으며, 이는 상기 정제 용해가 10 및 15 분째에 SKI-606/CPV 제형에 대해 사용된 경우보다 더 낮은 붕해제 농도에서 상기 SKI-606/CCS 제형의 경우가 더 빠름을 밝혀냈다. 또한 상기 데이터는 보다 낮은 결합제 농도가 특히 초기 시점들에서 용해를 향상시킴을 또한 암시하였다.
특정 실시태양에서, 유사한 용해 결과를 제공하는, 본 발명의 SKI-606 제형 중 크로스카멜로스 나트륨(CCS)의 양은 하기와 같다:
1. 0 내지 2% w/w 과립 내 농도
2. 1 내지 3% 과립 외 농도
3. 결합제(포비돈 농도)도 또한 1 내지 2% w/w로 변할 수 있다.
특정 실시태양에서, 본 발명의 SKI-606 제형 중의 과립 내 성분 대 과립 외 성분 비는 3:1에서부터 2:2까지 변하였다.
특정 실시태양에서, 하나의 과립 내(IG) 성분인 미정질 셀룰로스(MCC)를 포함하는 충전제는 과립 내 부분에서 과립 외(EG) 성분으로 이동하여 타정(tabletting) 중 본 발명의 SKI-606 제형의 보다 빠른 붕해 시간을 촉진하였다. 상기 과립 외 충전제 성분의 양은 상기 SKI-606 제형의 중량을 기준으로 4 중량%에서 15 중량%로 증가하였다.
특정 실시태양에서, 상기 EG 성분 중 MCC의 등급을 정제 배합물 흐름을 촉진하기 위해서 아비셀(Avicel) PH101(상표)에서 아비셀 PH 102(상표)로 변화시켰다.
특정 실시태양에서, 상기 API의 입자 크기 감소가 일반적으로 용해 속도의 증가를 유발한다는 통상적인 관찰과 상반되게, SKI 606 제형의 경우, 상기 API 입자 크기의 감소는 보다 큰 D90 API 입자 크기를 갖는 제형과 동일한 방식으로 가공 시 상기 제형의 용해를 더 낮추는 경향이 있는 것으로 관찰되었다. 따라서 도 6에 요약한 바와 같이, 상기 API 입자 크기가 작을수록 상기 용해 속도는 더 느려지고, 상기 API 입자 크기가 클수록 상기 용해 속도는 더 빨라진다.
용해를 최대화하기 위해서, 기존 제형에 의한 한 가지 가능한 접근법은 SKI-606과 같은 약물의 입자 크기를 증가시키는 것이다. 용해를 늦추기 위한 접근법은 더 작은 입자 크기의 API를 사용하는 것이다.
특정 실시태양에서, 인간 또는 동물 피실험자에게 투여 시 생체 내 효과를 유지시키기 위해서 본 발명의 SKI-606 제형 중 상기 폴록사머의 농도 변화를 수행하지 않았다.
특정 실시태양에서, 본 발명의 제형은 하나 이상의 비-속도-조절 층, 멤브레인 또는 코팅제를 함유할 수 있다. 상기 제형에서 상기 비-속도-조절 층의 위치는 중요하지 않다. 예를 들어, 상기 비-속도-조절 층은 하나 이상의 코어와 장용 코팅제 또는 속도-조절 기구 사이에 존재할 수 있다. 한편으로, 상기 비-속도-조절 층은 장용 코팅제 또는 속도-조절 기구를 둘러싸거나 코팅할 수도 있다. 상기 비-속도-조절 층은 하나 이상의 중합체뿐만 아니라 당해 분야에 공지된 다른 성분들, 예를 들어 비 제한적으로 가소제, 안료/불투명체 등으로 제조될 수 있다. 사용될 수 있는 중합체의 예로는 비 제한적으로 하이드록시프로필 메틸셀룰로스, 하이드록시프로필 셀룰로스, 메틸셀룰로스, 에틸셀룰로스, 폴리비닐 알콜 및 폴리에틸렌 글리콜이 있다. 사용될 수 있는 가소제의 예로는 비 제한적으로 폴리에틸렌 글리콜(들), 글리세린, 트라이아세틴, 트라이에틸 시트레이트, 다이에틸 프탈레이트 및 미네랄 오일이 있다. 사용될 수 있는 안료/불투명체의 예는 비 제한적으로 수용성 염료, 안료 및 천연 생성물을 포함한다.
특정 실시태양에서, 본 발명의 제형은 또한 하나 이상의 장용 코팅제를 포함할 수 있다. 임의의 장용 코팅제, 예를 들어 비 제한적으로 메트아크릴산 및 메트아크릴 에스터 공중합체, 셀룰로스 아세테이트 프탈레이트, 하이드록시프로필 메틸셀룰로스 프탈레이트, 하이드록시프로필 메틸셀룰로스 아세테이트 숙시네이트, 폴리비닐 아세테이트 프탈레이트, 에틸 아크릴레이트/메트아크릴 산 공중합체, 셀룰로스 아세테이트 트라이멜리테이트, 쉘락 및 이들의 조합을 본 발명에 사용할 수 있다. 또한, 본 발명의 제형에 사용되는 장용 코팅제를 단일 층 또는 여러 층으로 형성시킬 수 있다. 상기 코팅제의 두께는 당해 분야의 숙련가들에 의해 쉽게 측정될 수 있으나, 위의 산성 환경에서 상기 제형을 보호하기에 충분해야 한다.
특정 실시태양에서, SKI-606의 약학적으로 허용 가능한 고체 조성물은 하나의 통상적인 붕해제인 크로스포비돈을 크로스카멜로스 나트륨으로 대체함을 기본으로 하여 발명되었으며, 이는 뜻밖에도 상기 SKI-606 제형의 개선된 안정성과 균일한 용해 속도를 생성시켰다(표 1 및 도 1 내지 3을 참조하시오).
습윤제는 당해 분야에 널리 공지되어 있으며 전형적으로는 약물 방출 및 흡수를 촉진한다. 예시적인 습윤제는 폴록사머, 폴리옥시에틸렌 에테르, 폴리옥시에틸렌 솔비탄 지방산 에스터 폴리옥시에틸렌 지방산 에스터, 폴리에틸렌 글리콜 지방산 에스터, 폴리옥시에틸렌 수소화된 피마자유, 폴리옥시에틸렌 알킬 에테르, 폴리솔베이트, 세틸 알콜, 글리세롤 지방산 에스터(예를 들어 트라이아세틴, 글리세롤 모노스테아레이트 등), 폴리옥시메틸렌 스테아레이트, 나트륨 라우릴 설페이트, 솔비탄 지방산 에스터, 슈크로스 지방산 에스터, 벤즈알코늄 클로라이드, 폴리에톡실화된 피마자유, 및 도큐세이트 나트륨 등, 및 이들의 조합을 포함한다. 일부 실시태양에서, 습윤제는 예를 들어 비 제한적으로 폴리솔베이트 80(상표), 글리세린, 폴리솔베이트 65(상표), 폴리솔베이트 60(상표) USP, 폴리솔베이트 40(상표) USP, 폴리솔베이트 20(상표) USP, 옥톡시놀-9, 노녹시놀-10(상표) USP, 폴록사머 235(상표), 폴록사머 188(상표) USP를 포함한다. 일부 실시태양에서, 제공된 습윤제는 상기 제형의 전체 중량을 기준으로 약 0.1 중량% 내지 약 5 중량%, 약 1.0 중량% 내지 약 4 중량%, 또는 약 3.0 중량%를 차지한다. 특정 실시태양에서, 상기 습윤제는 폴록사머, 예를 들어 비 제한적으로 폴록사머 188(상표)(루트롤(Lutrol) F-68)이다.
적합한 결합제(또한 "희석제" 및/또는 "충전제"라 칭한다)는 당해 분야에 공지되어 있다. 예를 들어, 적합한 결합제 및 충전제는 비 제한적으로 전분, 덱스트린, 슈크로스, 솔비톨, 나트륨 사카린, 아세설팜 칼륨, 자일리톨, 아스파탐, 만니톨, 전분, PVP(폴리비닐 피롤리돈), 저 분자량 HPC(하이드록시프로필 셀룰로스), 미정질 셀룰로스(MCC), 저 분자량 HPMC(하이드록시프로필 메틸셀룰로스), 저 분자량 카복시메틸 셀룰로스, 에틸셀룰로스, 알기네이트, 젤라틴, 폴리에틸렌 옥사이드, 아카시아, 덱스트린, 슈크로스, 마그네슘 알루미늄 실리케이트, 및 폴리메트아크릴레이트를 포함한다. 충전제는 미정질 셀룰로스, 전분, 락티톨, 락토오스, 적합한 무기 칼슘염, 슈크로스, 글루코스, 만니톨, 규산, 및 이들의 조합으로 이루어진 군 중에서 선택된 작용제들을 포함한다. 일부 실시태양에서, 결합제 및 충전제는 상기 제형의 전체 중량을 기준으로 약 1 중량% 내지 약 25 중량% 또는 약 21.5 중량%를 차지한다. 일부 실시태양에서, 상기 결합제는 MCC의 하나 이상의 등급, 예를 들어 비 제한적으로 아비셀 PH101(상표) 및 아비셀 PH 102(상표)이다.
본 발명의 SKI-606 제형에의 적합한 붕해제(들)의 혼입은 용해를 촉진한다. 적합한 붕해제들은 당해 분야에 공지되어 있으며 비 제한적으로 아가, 탄산 칼슘, 감자 또는 타피오카 전분, 알긴산, 몇몇 실리케이트, 탄산 나트륨, 크로스포비돈(가교결합된 PVP), 나트륨 카복시메틸 전분(나트륨 전분 글리콜레이트), 가교결합된 나트륨 카복시메틸 셀룰로스(크로스카멜로스), 예비 젤라틴화된 전분(전분 1500), 미정질 전분, 수 불용성 전분, 칼슘 카복시메틸 셀룰로스, 마그네슘 알루미늄 실리케이트(비검(Veegum)) 또는 이들의 조합을 포함한다. 일부 실시태양에서, 붕해제는 크로스포비돈이다. 일부 실시태양에서, 붕해제는 크로스카멜로스 나트륨이다.
일부 실시태양에서, 적합한 윤활제를 본 발명의 SKI-606 제형에 포함시킨다. 적합한 윤활제 또는 활택제(glidant)는 예를 들어 스테아레이트, 나트륨 스테아릴 퓨마레이트 및 마그네슘 염, 마그네슘 스테아레이트를 포함한다. 사용되는 윤활제의 양은 상기 조성물의 중량을 기준으로 0.2 내지 5 중량%, 예를 들어 약 0.5 중량%의 하나 이상의 윤활제이다. 일부 실시태양에서, 상기 윤활제는 마그네슘 스테아레이트이다.
하나 이상의 보존제의 첨가가 SKI-606을 포함하는 조성물에 특히 유용할 수 있으며, 이는 열화 및/또는 침전으로부터의 보호를 제공할 수도 있다. 적합한 보존제는 당해 분야의 숙련가들에게 공지되어 있으며, 임의의 약학적으로 허용 가능한 보존제를 포함한다. 통상적인 보존제는 비 제한적으로 나트륨 벤조에이트, 프로필 파라하이드록시벤조에이트, 소르브산, 프로필파라벤, 메틸파라벤, 부틸화된 하이드록시톨루엔, 프로피오네이트, 칼륨 솔베이트, 인디나비어 및 이들의 조합을 포함한다. 일부 실시태양에서, 제공된 보존제는 상기 제형의 전체 중량을 기준으로 약 0.05 중량% 내지 약 0.25 중량% 또는 약 0.1 중량%를 차지한다.
제공된 조성물을 단위 투여형으로 제형화할 수 있다. 상기와 같은 제형은 당해 분야의 통상적인 숙련가에게 널리 공지되어 있다. 특정 실시태양에서, 본 발명은 정제로서 고체 투여형을 포함하는 제형을 제공한다. 다른 실시태양에서, 본 발명은 경구 투여용 용액을 제공한다. 일부 실시태양에서, 단위 투여형은 50 ㎎, 75 ㎎, 100 ㎎, 125 ㎎, 150 ㎎, 175 ㎎, 200 ㎎, 225 ㎎, 250 ㎎, 275 ㎎, 300 ㎎, 325 ㎎, 350 ㎎, 375 ㎎, 400 ㎎, 425 ㎎, 450 ㎎, 475 ㎎, or 500 ㎎, 525 ㎎, 550 ㎎, 575 ㎎, 600 ㎎, 625 ㎎, 650 ㎎, 675 ㎎, 700 ㎎, 725 ㎎, 750 ㎎, 775 ㎎, 800 ㎎, 825 ㎎, 850 ㎎, 875 ㎎, 900 ㎎, 925 ㎎, 950 ㎎, 975 ㎎, 1000 ㎎, 1025 ㎎, 1050 ㎎, 1075 ㎎, 1100 ㎎, 1125 ㎎, 1150 ㎎, 1175 ㎎, 1200 ㎎, 1225 ㎎, 1250 ㎎, 1275 ㎎, 1300 ㎎, 1325 ㎎, 1350 ㎎, 1375 ㎎, 1400 ㎎, 1425 ㎎, 1450 ㎎, 1475 ㎎, 1500 ㎎의 SKI-606을 함유한다. 일부 실시태양에서, 단위 투여형은 5 ㎎ 내지 500 ㎎, 또는 10 ㎎ 내지 450 ㎎의 SKI-606을 함유한다. 일부 실시태양에서 단위 투여형은 50 ㎎, 75 ㎎, 100 ㎎, 150 ㎎, 250 ㎎, 300 ㎎, 또는 500 ㎎을 함유한다. 일부 실시태양에서, 단위 투여형은 500 ㎎ 초과의 SKI-606을 함유한다.
일부 실시태양에서, 사용되는 SKI-606의 유효 투여량은 사용되는 특정 화합물, 투여 방식 및 치료되는 병의 중증도에 따라 다양할 수 있다. 그러나, 일반적으로, 본 발명의 화합물을, 분할된 용량으로 하루에 2 내지 4 회, 또는 서방성 형태로 선택적으로 제공되는, 약 0.5 내지 약 1000 ㎎/㎏ 체중의 1일 투여량으로 투여하는 경우 만족스러운 결과가 획득된다. 상기 전체 1일 투여량은 약 1 내지 1000 ㎎, 바람직하게는 약 2 내지 500 ㎎이도록 설계된다. 내복용으로 적합한 투여량 형태는 약학적으로 허용 가능한 고체 또는 액체 담체와의 긴밀한 혼합물로 약 0.5 내지 1000 ㎎의 상기 활성 화합물을 포함한다. 이러한 투여량 섭생을 최적의 치료 반응을 제공하도록 조절할 수도 있다. 예를 들어, 여러 분할 용량을 매일 투여하거나 또는 상기 용량을 치료 상황의 경험이 가리키는 바와 같이 비례적으로 감소시킬 수도 있다.
일부 실시태양에서, 제조 및 투여 용이성의 견지에서 SKI-606의 약학 조성물은 고체 조성물, 특히 정제 및 경질-충전된 또는 액체-충전된 캡슐이다. 바람직한 실시태양에서, SKI-606의 경구 투여가 바람직하다.
암의 치료를 위해서, 본 발명의 SKI-606 제형을 다른 종양 억제 물질 또는 방사선 요법과 함께 투여할 수 있다. 상기 다른 물질 또는 방사선 치료를 본 발명의 화합물과 동시에 또는 상이한 시기에 제공할 수 있다. 이러한 복합 요법은 상승작용에 효과를 주며 개선된 효능을 생성시킬 수도 있다. 예를 들어, 본 발명의 화합물을 유사분열 억제제, 예를 들어 탁솔 또는 빈블라스틴, 알킬화제, 예를 들어 시스플라틴 또는 사이클로포스파미드, 대사길항물질, 예를 들어 5-플루오로유라실 또는 하이드록시유레아, DNA 삽입물질(intercalator), 예를 들어 아드리아마이신 또는 블레오마이신, 국소이성화효소 억제제, 예를 들어 에토포시드 또는 캄토테신, 혈관형성 억제제, 예를 들어 안지오스타틴, 및 항에스트로젠, 예를 들어 타목시펜과 함께 사용할 수 있다.
미국 특허 제 6,297,258 호에 SKI-606 및 다른 3-시아노퀴놀린 화합물에 대해 개시된 결과들을 근거로, 본 발명의 SKI-606 제형은 종양을 치료하거나, 종양의 성장을 억제하거나, 종양을 근절하는데 유용한, 현저한 효능을 갖는 유용한 종양 억제제이다. 특히, 본 발명의 화합물은 EGFR을 발현하는 종양, 예를 들어 유방, 신장, 방광, 구강, 후두, 식도, 위, 결장, 난소 또는 폐의 종양을 치료하거나, 상기 종양의 성장을 억제하거나, 상기 종양을 근절하는데 유용하다. 또한, 본 발명의 화합물은 erbB2(Her2) 종양 유전자에 의해 생산된 수용체 단백질을 발현하는 유방의 종양을 치료하거나, 상기 종양의 성장을 억제하거나 상기 종양을 근절하는데 유용하다. 상기 획득된 결과를 근거로, 본 발명의 화합물은 또한 다낭성 신장병의 치료에 유용하다.
3. 조합 생성물 및 병용 투여:
특정 실시태양에서, 본 발명의 조성물 및 이의 제형을 본 발명에 개시된 바와 같은 하나 이상의 질환을 치료하기 위해 단독으로 투여하거나, 또는 한편으로 본 발명에 개시된 바와 같은 하나 이상의 질환을 치료하기에 유용한 하나 이상의 다른 활성제와 함께(동시든 또는 연속적으로든) 투여할 수 있다. 따라서, 본 발명의 조성물 또는 이의 제형을 하나 이상의 활성제와 동시에, 그 전에 또는 후속으로 투여할 수 있다.
특정 실시태양에서, 본 발명의 조성물은 SKI-606 이외에, SKI-606이 아닌 하나 이상의 다른 활성제를 포함한다. 일부 실시태양에서, 본 발명의 제형은 또 다른 항암 화합물 및 SKI-606을 둘 다 포함한다.
본 발명의 복합 조성물 중에 존재하는 추가적인 활성제(들)의 양은 전형적으로는, 유일한 치료제로서 상기 활성제를 포함하는 조성물 중에서 통상적으로 투여되는 양보다 많지 않을 것이다. 본 발명의 특정 실시태양에서, 상기 추가적인 활성제의 양은, 유일한 치료제로서 상기 화합물을 포함하는 조성물 중에 통상적으로 존재하는 양의 약 50% 내지 100%의 범위일 것이다.
특정 실시태양에서, 본 발명의 제형을 또한 변비 및 장 기능장애의 개선을 돕는 위장 기능장애의 통상적인 요법과 함께 및/또는 이와 공동으로 사용할 수 있다. 예를 들어, 통상적인 요법은 비 제한적으로 장관의 기능성 자극, 대변 연화제, 완하제(예를 들어 다이페닐메탄 완하제, 변통 완하제, 삼투압 완하제, 염수 완하제 등), 팽변 완하제(bulk forming agent) 및 완하제, 윤활제, 정맥 내 수화, 및 비위(nasogastric) 감압을 포함한다.
4. 본 발명 조성물의 용도 및 키트:
제공된 조성물, 및 이의 제형은 혈관형성, 면역 억제, 겸상 적혈구 빈혈증, 혈관 상처, 및 망막 병증을 수반하는 암을 포함한 병의 치료, 염증 관련된 질환(예를 들어 과민성 장 증후군), 면역 억제, 만성 염증의 치료에 또한 유용하다.
더욱 추가의 실시태양에서, 본 발명 조성물 및 이의 제형의 수의학적 용도(예를 들어 가축, 예를 들어 말, 개, 고양이 등의 치료)를 제공한다. 따라서, 인간 피실험자에 대해 상기 논의된 바와 유사한 수의학적 용도에 있어서 제공된 제형의 용도가 고려된다.
본 발명의 조성물 및 이의 제형을 복합 요법에 사용할 수 있다, 즉 본 발명의 조성물 또는 이의 제형을 하나 이상의 다른 목적하는 치료 또는 의학적 시술과 동시에, 그 전에 또는 이에 후속하여 투여할 수 있음을 알 것이다. 복합 섭생에 사용하기 위한 특정 복합 요법(치료 또는 시술)은 목적하는 치료 및/또는 시술의 양립성 및 성취하고자 하는 목적하는 치료 효과를 고려할 것이다. 사용되는 요법들이 동일한 질환에 대해 목적하는 효과를 성취하거나(예를 들어 제형을, 동일한 질환의 치료에 사용되는 또 다른 화합물과 동시에 투여하거나), 또는 이들 요법이 상이한 효과(예를 들어 임의의 부작용의 억제)를 성취할 수 있음을 또한 알 것이다. 본 발명에 사용된 바와 같이, 특정 질병 또는 병의 치료 또는 예방을 위해 통상적으로 투여되는 추가적인 치료 화합물들은 "치료되는 질병 또는 병에 적합한"으로서 공지된다.
다른 실시태양에서, 본 발명의 조성물 및 이의 제형, 및 단위 투여형은 약제, 예를 들어 비 제한적으로 암의 치료에 유용한 약제의 제조에 유용하다.
본 발명의 조성물 및 이의 제형, 및 용기(예를 들어 호일 또는 플라스틱 패키지 또는 다른 적합한 용기)를 포함하는 약제 팩 및/또는 키트가 더욱 또한 본 발명에 포함된다.
본 출원에 개시된 발명을 보다 충분히 이해할 수 있기 위해서, 하기의 실시예들을 나타낸다. 이들 실시예는 단지 예시를 목적으로 하며 본 발명을 임의의 방식으로 제한하는 것으로 해석해서는 안 됨은 물론이다.
본 발명의 각 태양들의 모든 특징들을 모든 다른 태양들에 준용해서 적용한다.
실시예
1 및 2:
SKI
-606의 약학적으로 허용 가능한 조성물의 제조
SKI-606을 미국 특허 제 6,297,258 및 7,297,795 호 중 하나 이상에 상세히 개시된 방법들에 따라 제조한다. SKI-606의 예시적인 본 발명의 제형 및 비교 상의 SKI-606 제형을 표 1에 요약한다.
| SKI-606 제형 | ||
| 과립 내 성분 | SKI -606 제형 1 | 비교 상의 SKI -606 제형 |
| (% w/w) | (% w/w) | |
| SKI-606 모노하이드레이트 (SKI-606 유리 염기와 동등함) | 69 | 69 |
| 미정질 셀룰로스 (MCC, 아비셀 PH101(상표)) | 6.5 | 17.5 |
| 크로스포비돈 (CPV) | NA | 3 |
| 크로스카멜로스 나트륨 (CCS) | 2 | NA |
| 폴록사머 188(상표)(루트롤 F-68) | 3 | 3 |
| 포비돈 (콜리돈(Kollidon) 25(상표)) | 2 | 2 |
| 과립 내 성분 중량% | 82.5 | 94.5 |
| 과립 외 성분 | ||
| 미정질 셀룰로스 (MCC, 아비셀 101(상표)) | NA | 4 |
| 미정질 셀룰로스 (MCC, 아비셀 102(상표)) | 15 | NA |
| 크로스포비돈 | NA | 1 |
| 크로스카멜로스 나트륨 | 2 | NA |
| 마그네슘 스테아레이트 | 0.5 | 0.5 |
| 과립 외 성분 중량% | 17.5 | 5.5 |
| 코팅제 ( 오파드라이 II 시스템) | 3 | 4 |
| NA - 적용할 수 없거나 입수할 수 없음 | ||
500 ㎎ 농도의 정제를 적합한 툴링(tooling) 장비를 사용하여 압착시키고 상기 정제를 낮은(11 내지 13 kp), 표적(14 내지 16 kp) 및 높은(17 내지 19 kp) 경도로 압착시켰다. 이어서 이들 정제를 0.1N HCl 중에서 붕해 시간에 대해 평가하였다.
비교 상의 SKI-606 제형을 고 전단 습식 과립화, 습식 분쇄, 유동층 건조, 건식 분쇄, 배합 및 압착의 공정에 의해 정제로 제조하고 후속적으로 필름 코팅하였다. 상기 제형은 금식한 개인에게서 높은 위 자극 백분율과 관련되었다.
붕해 시간을 통상적인 붕해제인 크로스포비돈, 및 크로스카멜로스 나트륨을 사용하는 SKI-606 제형에 대해 비교하고 표 2에 요약한다. 이 경우 과립 내 붕해제를 3% w/w로 일정하게 유지시켰다. 상기 두 제형은 현저하게 상이한 붕해 시간을 가졌다, 예를 들어 2% 과립 외(EG) CCS 제형에 대한 정제 붕해 시간(DT)은 단지 3.5 분인데 비해 상기 CPV 제형은 22 분의 DT를 갖는다. 추가로, 정제 DT가 모든 CPV 제형들의 경우 정제 경도에 강하게 의존하는 것으로 관찰된 반면, CCS 제형의 경우에는 상기와 같은 의존성이 관찰되지 않는다. 예를 들어, 상기 2% CPV 제형의 경우에조차, 상기 저 및 고 경도 정제에 대한 DT 시간은 14분까지 다양한 반면, 상기 CCS 제형은 단지 3.5분까지만 변한다. 이러한 관찰은 상기 CCS 제형이 정제 경도에 대해 견고하다는 사실을 지적한다. 이는 특히 상기 정제가 즉시 방출 정제를 의도하므로, 정제 제조역량 특성에 관하여 중대한 개선이다.
이때 경질 정제 → 16 kp 정제 경도, 표적 정제 → 14 내지 16 kp 및 저 경도 → 11 내지 13 kp(kp - 킬로 파스칼)
[표 2A]
본 발명의 SKI-606 제형의 정제 용해(도 1 참조)를 또한 0.1N HCl 중에서 수행하였으며, 이는 상기 정제 용해가 10 및 15 분째에 CPV 제형에 대해 사용된 경우보다 더 낮은 농도에서 상기 CCS 제형의 경우 더 빠름을 밝혀냈다. 또한 상기 데이터는 보다 낮은 결합제 농도가 특히 초기 시점들에서 용해를 향상시킴을 또한 암시하였다.
이들 시험은 CCS 제형이, CPV 제형(이 경우 종점은 수 투입량에 매우 민감하였다)과 달리 과립화 종점에 갑작스럽게 도달되지 않았고 CCS 제형 붕해 시간(DT)이 정제 경도에 덜 민감했다는 점에서 가공적성으로부터 더 양호함을 입증한다. 결합제의 저하는 CPV의 적합한 용해와 상관 있을 수 있다.
붕해제로서 크로스카멜로스 나트륨을 포함하는 본 발명의 SKI-606 제형의 경우, 용해는, 표 3에 요약한 바와 같이, 15 분째에 API 입자 크기에 민감하지 않음이 또한 자명하다. 또한 연구된 모든 IG/EG 범위에 대해서 15 분째에 CCS 제형에 보다 느린 용해를 제공하는 유일한 비는 1%/0% 과립 내/외 붕해제이다. 다른 모든 수준들의 경우 방출은 90% 초과이다.
| 500 ㎎ 코어 정제 붕해 및 용해에 대한 붕해제 및 API D90의 효과 | ||||||||
| 붕해제 유형 | CPV | CPV | CPV | CCS | CCS | CCS | CCS | CCS |
| API D90 (㎛) | 38 | 20 | 20 | 20 | 20 | 38 | 38 | 38 |
| 결합제 (% w/w) | 2 | 2 | 1 | 2 | 2 | 2 | 2 | 2 |
| IG 붕해제 (% w/w) | 3 | 3 | 3 | 3 | 3 | 2 | 1 | 1 |
| EG 붕해제 (% w/w) | 3 | 3 | 1 | 1 | 0 | 0 | 1 | 0 |
| 붕해 시간 (분) [14-16 kp 정제의 경우] |
18.32 | 15.73 | 25.48 | 4.18 | 4.75 | 14.3 | 7.4 | 23.4 |
| 0.1 N HCl 중에서 15 분째에 방출된 % | 67.68 | 50.21 | 23.41 | 94.21 | 92 | 97 | 97.2 | 67.6 |
| 0.1 N HCl 중에서 30 분째에 방출된 % | 94 | 89 | 47 | 98 | 97 | 101 | 99 | 96 |
이들 연구는 상기 크로스카멜로스 나트륨 제형이, 상기 과립화 종점을 확인하기 보다 용이하였고(과-과립화의 위험이 감소됨); 상기 크로스카멜로스 나트륨 제형에 대한 붕해 시간이 정제 경도에 의해 덜 영향을 받았으며; 결합제(포비돈) 농도를 낮춘 결과 정제 붕해 속도에 대한 이의 영향으로 인해 예상된 바와 같이 CPV 제형의 보다 높은 용해 속도를 생성시켰다는 점에서 제조역량의 견지로부터 우수하였음을 보인다. 상기 결합제의 변화는, 상기 결합제 농도와 관계없이 탁월한 정제 붕해 시간 및 용해를 나타내는 CCS 제형에 필요하지 않은 것으로 보였다.
상기 광범위한 실험의 결과들은 크로스카멜로스 나트륨 제형이 약물 물질 입자 크기의 가변성 및 안정성에 대한 생성물의 용해 프로파일의 일관성에 대하여 보다 견고함을 입증하였다. 상기 미정질 셀룰로스의 과립 내외 비를 변화시켜 정제 붕해 시간뿐만 아니라 배합물 흐름을 개선시키고, 상기 폴록사머 및 결합제를 비교 조성물과 동일하게 유지시킴으로써 일부 이점들이 나타났다.
또한 붕해제로서 크로스카멜로스 나트륨을 포함하는 본 발명의 SKI-606 제형의 경우, 용해는 표 2 및 3에 요약한 바와 같이, 보다 작은 입자 크기의 경우 더 느린것이 또한 명백하다.
또한, 2 및 4 주째에 40 ℃(건조 및 습윤)에서 어느 붕해제의 경우든 불상용성 또는 열화가 나타나지 않은 것으로 관찰되었다. 40 ℃ 및 40 ℃/75% RH 조건에서의 안정성 연구에 대한 회분들은, 도 2 및 3에 요약된 바와 같이, CPV의 경우 용해 이동이 관찰되었지만 CCS의 경우 관찰되지 않음을 입증하였다.
상기 측정된 데이터 및 결과들을 근거로, 상기 크로스카멜로스 제형은, 용해에 대한 API 가변성 효과 및 안정성에 대한 용해 이동이 모두 다루어진 바와 같이, 상기 제형을 최소로 변화시키면서(따라서 상기 결합제 포비돈 및 폴록사머를 각각 2% 및 3%로 일정하게 유지시키는 것으로 결정되었다) 우수한 SKI-606 정제 제형을 제공하는 것으로 보인다. 붕해제 유형 및 IG/EG 붕해제 비를 임상에서 3:1에서부터 2:2(% w/w)로 변화시켰다. 도 4 및 5는 크로스카멜로스 및 크로스포비돈 각각에 대한 과립 내 및 과립 외 붕해제 비를 변화시킴으로써 용해에 대한 효과를 개시한다.
실시예
3:
SKI
-606의 빠르게 녹는 약학적으로 허용 가능한 조성물의 제조
SKI-606을 미국 특허 제 6,297,258 및 7,297,795 호 중 하나 이상에 상세히 개시된 방법들에 따라 제조한다. SKI-606의 예시적인 본 발명의 빠르게 녹는 제형 및 비교 상의 SKI-606 제형을 표 4에 요약한다.
| 크로스카멜로스 나트륨을 갖는 예시적인 빠르게 녹는 SKI-606 제형 | ||
| 과립 내 | 빠르게 녹는 SKI -606 제형 | 비교 상의 SKI -606 제형 |
| (% w/w) | (% w/w) | |
| SKI-606 모노하이드레이트 (무수 SKI-606 유리 염기와 동등함) | 69 | 69 |
| 미정질 셀룰로스 (101(상표)) | 6.5 | 17.5 |
| 크로스포비돈 (CPV) | NA | 3 |
| 크로스카멜로스 나트륨 (CCS) | 2 | NA |
| 폴록사머 188 (루트롤 F-68(상표)) | 3 | 3 |
| 포비돈 (콜리돈 25(상표)) | 2 | 2 |
| 과립 내 부분% | 82.5 | 94.5 |
| 과립 외 | ||
| 미정질 셀룰로스 (101(상표)) | -- | 4 |
| 미정질 셀룰로스 (102(상표)) | 15 | -- |
| 크로스포비돈 | NA | 1 |
| 크로스카멜로스 나트륨 | 2 | NA |
| 마그네슘 스테아레이트 | 0.5 | 0.5 |
| 과립 외 부분% | 17.5 | 5.5 |
| 코팅제 | 3 | 4 |
| NA - 적용되지 않거나 입수할 수 없음 | ||
상기 제형의 위 자극 효과는 위 및 상부 GI 관에서의 연장된 체류 시간의 결과일 수 있다. 본 발명의 SKI-606 제형은 GI 관에서 더 빠르게 녹는 약물의 비교적 빠르게 녹는 염을 또한 제공한다. 상기 약물의 빠르게 녹는 염은 몇 가지 언급하자면, 시트레이트, 숙시네이트, 퓨마레이트, 다이-HCl, 다이-메실레이트, 아세테이트, 말리에이트, 타타레이트 및 HCl 염이 있으며, 이들은 빠른 약물 용해를 유발하여 상기 GI 관 내에서 더 빠르게 용해되거나 붕해되는데 유용한 SKI-606 제형을 제공한다.
보다 빠르게 붕해되는 제형은 현행 제형에 몇 가지 변화를 수행함으로써 제조되었다. 이는 상기 제형에서 하기의 변화를 구체화함으로써 수행되었다: 붕해제 크로스포비돈을 크로스카멜로스 나트륨으로 대체함. 상기 붕해제는 상기 크로스포비돈의 "심지(wicking)" 작용 촉진된 붕해에 비해 이른 붕해 시간을 촉진하는 "팽창" 작용에 의해 작용한다. 상기 붕해제는 상기 크로스포비돈과 필적할만한 농도에서 더 빠른 붕해 작용을 발휘하는 것으로 밝혀졌다. 상기 붕해제의 대체 외에 수행된 추가적인 변화는 상기 미정질 셀룰로스 비의 변화였다. 미정질 셀룰로스인 아비셀 PH 101을 과립 내에서 감소시키고 과립 외에서 증가시켜 상기 붕해제 효능의 개선을 도왔다. 상기 등급을 또한 아비셀 101에서 더 큰 입자 크기의 102로 변화시켜 배합물 흐름 및 압착성을 개선시켰다. 이러한 접근법은 더 빠르게 붕해되고 용해되는 정제들을 제공하는 것으로 밝혀졌으며, 이들 정제는 모두 위에서 위 결과물을 개선시키는 것으로 예상된다. 본 발명의 SKI-606 제형은 이러한 접근법을 기본으로 한다.
실시예
4: 코팅된 정제로서
SKI
-606의 약학적으로 허용 가능한 조성물의 제조
SKI-606을 미국 특허 제 6,297,258 및 7,297,795 호 중 하나 이상에 상세히 개시된 방법들에 따라 제조한다. 2 개의 상이한 단위 투여량의 SKI-606의 본 발명의 제형으로부터의 예시적인 코팅된 정제를 표 5에 요약한다.
| 상이한 단위 투여량 농도에서 SKI-606 제형의 코팅된 정제 | ||||||||||
| 청구: 69.0% 회분 크기: 25 Kg |
||||||||||
| 성분 | 작용 | 정제 코어를 기준으로 % wt/wt | 과립 내 고체 부분을 기준으로 | 투입량/ 투여량 단위 (500 mg 용량 농도에 대해서) |
투입량/ 투여량 단위 (100 mg 용량 농도에 대해서) |
전형적인 회분식 |
||||
| % wt/wt | % wt/wt | 투입량 | 단위 | 투입량 | 단위 | 투입량 | 단위 | |||
| 무수 염기와 동등한 SKI-606 모노하이드레이트 |
활성 | 68.96 | 83.6 | 500 | mg | 100.0 | mg | 17.241 | Kg | |
| 미정질 셀룰로스 (PH 101) a | 충전제 | 6.50 | 7.9 | 47.1 | mg | 9.420 | mg | 1.624 | Kg | |
| 크로스카멜로스 나트륨 | 붕해제 | 2.0 | 2.4 | 14.49 | mg | 2.898 | mg | 0.500 | Kg | |
| 폴록사머 188 | 습윤제 | 3.0 | 3.6 | 21.74 | mg | 4.348 | mg | 0.750 | Kg | |
| 포비돈, K-25 | 결합제 | 2.0 | 2.4 | 14.49 | mg | 2.898 | mg | 0.500 | Kg | |
| 정제수 b | 과립화 용액 | QS | QS | 241.86 | mg | 48.37 | mg | 8.340 | Kg | |
| 총계 | 82.46 | 100 | 597.820 | mg | 119.564 | mg | 20.615 | Kg | ||
건조
배합물
및 코팅제 부분:
| 건조 배합물 및 코팅된 SKI-606 제형 | |||||||
| 성분 | 작용 | 정제 코어를 기준으로 % wt/wt | 투입량/ 투여량 단위 |
투입량/ 투여량 단위 |
전형적인 회분식 | ||
| 투입량 (500 mg) | 투입량 (100 mg) | 단위 | 투입량 | 단위 | |||
| 건조된 SKI-606 과립화 부분 | NA | 82.46 | 597.820 | 119.564 | mg | 20.615 | Kg |
| 미정질 셀룰로스 (PH 102) | 충전제 | 15.042 | 109.055 | 21.811 | mg | 3.761 | Kg |
| 크로스카멜로스 나트륨 | 붕해제 | 2.0 | 14.5 | 2.900 | mg | 0.500 | Kg |
| 마그네슘 스테아레이트 | 윤활제 | 0.5 | 3.625 | 0.725 | mg | 0.125 | Kg |
| 총계 | 100.0 | 725.00 | 145.000 | mg | 25.0 | Kg | |
| 코팅제 | |||||||
| 오파드라이-II 옐로우, 85F12390 | 코팅제 | 3.0 | NA | 4.350 | mg | 0.975 | Kg |
| 오파드라이-II 레드, 85F15642 | 21.75 | NA | |||||
| 정제수 | 코팅 담체 | QS | 123.25 | 24.650 | mg | 5.525 | Kg |
| 총계 | 103.0 | 746.75 | 149.350 | mg | 6.5 | Kg | |
상기 SKI-606 제형 및 상기 SKI-606 제형의 코팅된 정제를 하기와 같이 제조하였다:
제조 과정
상기 SKI-606 제형 및 상기 SKI-606 제형의 코팅된 정제를 하기와 같이 제조하였다:
25 ㎏의 회분 크기를 위해 하기의 성분들을 칭량하였다:
SKI-606 모노하이드레이트 17.241 ㎏
미정질 셀룰로스(아비셀 PH 101) 1.624 ㎏
크로스카멜로스 나트륨 0.5 ㎏
포비돈 K-25 0.5 ㎏
폴록사머 0.75 ㎏
1. 상기 포비돈 및 폴록사머를 정제수에 용해시켰다.
2. 상기 과립 내 부분의 SKI-606, 미정질 셀룰로스(PH 101), 및 크로스카멜로스 나트륨을 고 전단 과립화기에 가하고 최소 4 분간 또는 균일할 때까지 혼합하였다. 상기 건조 성분들을 필요에 따라 예비 배합 전에 스크린에 통과시켜 덩어리를 풀 수도 있다.
3. 혼합하는 동안, 상기 단계 1의 용액을 상기 고 전단 과립화기에 가하고 적합한 과립화가 성취될 때까지 혼합하였다. 경우에 따라, 만족스러운 과립화 종점을 성취하기 위해 상기 물의 양을 조절할 수도 있다.
4. 상기 과립을 필요에 따라 밀 또는 스크린에 통과시켜, 건조 전에 균일한 과립화를 촉진할 수도 있다.
5. 만족스러운 종점에 도달할 때까지 상기 과립을 유동층 건조기에서 건조시켰다. 이 시점에서 LOD는 시험 온도 조건 하에서 3% w/w(표적 1 내지 1.5%) 이하이어야 한다.
6. 상기 건조된 과립을 적합한 체 또는 스크린이 구비된 밀에 통과시켜 배합을 위한 만족스러운 입자 크기 분포를 촉진하였다. 이 부분을 단계 10을 위해 유지시킨다.
7. 상기 과립을 적합한 블렌더에 가하였다. 경우에 따라, 상기 건조된 크기의 과립을 최소 5 분간 또는 균일할 때까지 혼합한다.
8. 상기 건조된 과립으로부터 획득된 수율을 기준으로 과립 외 성분들의 양을 계산한다.
9. 상기 건조 배합물 성분들을, 배합 전에, 스크린에 통과시킬 수도 있다. 단계 10에서의 배합을 위해 필요에 따라 미정질 셀룰로스의 샘플을 유지시킨다. 상기 미정질 셀룰로스 및 크로스카멜로스 나트륨을 상기 믹서에 가하고 10 분간 또는 균일할 때까지 배합한다.
10. 단계 6의 과립화 부분 또는 단계 9의 미정질 셀룰로스(PH 102)를 상기 마그네슘 스테아레이트에 가하고 혼합하여 윤활제 예비 배합물을 형성시켰다. 상기 윤활제 예비 배합물을 상기 단계 9 블렌더에 가하고 최소 2 분간 또는 균일할 때까지 혼합한다.
11. 상기 과립을 적합한 툴링을 사용하여 적합한 경도로 압착시킨다.
코팅 현탁액의 제조 및 적용
1. 혼합 전에, 드라이 컬러를 필요에 따라 스크린에 통과시켰다. 적합한 믹서 및 탱크를 사용하여, 상기 컬러 피막에 정제수를 가하고 만족스러운 현탁액이 형성될 때까지 혼합하였다. 상기 현탁액을 적합한 스크린을 통해 체질할 수도 있다.
2. 5 ㎏의 상기 코팅 현탁액을 총 3% wt/wt의 중량 증가를 위해 상기 층에 적용하였다. 이를 경우에 따라 정제 중량 증가에 의해 확인할 수도 있다.
상기 SKI-606 제형 및 상기 SKI-606 제형의 코팅된 정제를 1 ㎏ 코어 정제의 회분 크기를 위해 하기와 같이 제조하였다:
하기의 성분들을 칭량하였다:
SKI-606 모노하이드레이트 718.4 g
미정질 셀룰로스(아비셀 PH 101) 46.23 g
크로스포비돈 10.0 g
포비돈 K-25 20.0 g
폴록사머 188 30.00 g
1. 단계 1로부터의 SKI-606, 미정질 셀룰로스 및 크로스포비돈을 20 메쉬 스크린에 통과시키고 성분들을 고 전단 믹서에 가하였다.
2. 단계 2의 성분들을 고 전단 과립화기에 낮은 플로우 속도(임펠러만)로 2 분간 혼합하였다.
3. 폴록사머 188 및 포비돈 K-25를 또 다른 믹서에서 정제 수에 용해시켰다. 낮은 믹서 속도를 사용하여 기포의 발생을 방지하였다.
4. 상기 임펠러 및 초퍼 속도를 낮게 설정하였다. 단계 4로부터의 용액을 펌프를 사용하여 가하여 단계 3의 혼합물을 과립화하였다. 필요한 경우, 상기 과립화 용액이 고갈되면, 상기 초퍼 및 임펠러를 저속으로 사용하여 추가로 2 내지 5 분간 혼합을 계속하였다. 필요한 경우 상기 과립화 종점에 도달할 때까지 혼합하면서 추가의 정제수를 가하였다. 목적하는 과립화 종점을 검사하였다. 상기 과립화에 사용된 물의 총량 및 전체 혼합 시간뿐만 아니라 입수할 수 있다면 힘 또는 토크 판독을 기록한다.
5. 70 ℃ ± 5 ℃의 유입구 제시된 설정 값 온도를 갖는 유동층 건조기에서 상기 과립을 1.5% 내지 2.5%의 제시된 L.O.D. 범위로 건조시켰다. 수율을 칭량하고 기록하였다.
6. 상기 건조된 과립을 코밀(Comil)에 저속으로 통과시켰다(제시된 밀 속도 700 rpm 이하 및 제시된 스크린: 20 메쉬). 수율을 칭량하고 기록하였다.
최종 배합물:
7. 단계 7의 수율을 기준으로, (과립 외) 무수 첨가에 필요한 성분들의 양을 계산하였다.
8. 단계 9로부터의 분쇄된 과립을 적합한 크기의 V-블렌더로 옮겼다.
9. 미정질 셀룰로스(PH 101), 크로스포비돈을 칭량하고 20-메쉬 스크린에 통과시키고 단계 11의 V-블렌더에 가하였다. 속도 증강(intensifier) 막대 활성화 없이 10 분간 배합한다.
10. 마그네슘 스테아레이트를 30 메쉬 스크린에 통과시키고 같은 분량의 단계 12의 과립과 백(bag) 배합하고 상기 V-블렌더에 가하였다. 속도 증강 막대 없이 2 분간 배합한다.
11. 수율을 칭량하고 기록하였다.
기지의 중량 및 경도로 정제를 압착하고 압착된 정제를 필름 코팅하였다.
특정 실시태양에서, 본 발명의 SKI-606 제형은 3-시아노퀴놀린의 고체 제형이 갖는 하나 이상의 문제점, 즉 도 10 및 12에 요약된 바와 같이, 몇몇 SKI-606 제형의 가변적인 용해, 및 실온 및 완충 용액 중에서 시험 시의 가속화된 조건 또는 산성 조건 하에서 에이징 시 용해에 대한 작지만 현저한 이동을 겪는 경향이 미연에 방지된다. 도 11은 크로스카멜로스 제형에 대한 용해 이동의 결여를 보인다. 도 12는 기존 제형의 용해 이동을 나타낸다. 상기 SKI-606 비교 제형 중의 폴록사머 188이 상기 관찰된 용해 이동의 원인이었다. 폴록사머는 실온에서 고체이나 48 내지 52 ℃의 이의 융점 및 그 부근의 온도에서 액화하는 경향이 있다. 도 13 및 14에 요약된 연구는 상기 크로스포비된 기재 제형 중의 폴록사머가 실제로 상기 정제 용해가 이동하는 이유임을 밝혀냈다.
특정 실시태양에서, SKI-606 정제 제형들은 상기 SKI-606 제형의 중량을 기준으로 0, 1.5, 3, 4.5 및 6% w/w 범위의 다양한 양의 폴록사머로 제조되었다. 뜻밖에도, 상기 제형을 0.1N HCl에서 시험할 때 상기 제형의 폴록사머 함량 퍼센트에 대한 정제 용해의 분명한 의존성이 존재하는 것으로 관찰되었다. 도 13은 0.1N HCl 중에서 유사한 수 및 결합제 첨가속도에서 정제 용해에 대한 다양한 폴록사머 함량의 효과를 요약한다. 상기 폴록사머는 실제로 상기 시험된 정제에 대해 특히 초기 시점들에서 방출을 지연시키는 것으로 보임이 관찰된다. 폴록사머는 15 및 30 분째에 농도 의존적인 방식으로 초기 정제 용해를 지연시키는 것으로 나타났다. 표 8을 참조하시오.
| 다양한 폴록사머 함량을 갖는 SKI-606 500 mg 정제 코어의 0.1N HCl에서의 붕해 시간 | ||
|
폴록사머
농도
(% w/w) |
DoE -1/실험 번호 |
정제
DT
범위 [N=6)
(분) |
| 0 | 2 | 6.2-6.6 |
| 1.5 | 1 | 10.6-12.9 |
| 3.0 | 3 | 11.5-13.1 |
| 4.5 | 7 | 14.1-15.6 |
| 6.0 | 5 | 14.3-14.9 |
정제 중의 폴록사머가 초기에 용해를 지연시키는 경향이 있지만, 표 9에 요약된 데이터에서 보이는 바와 같이 나중의 시점에서 0.1N HCl 매질 중에서의 가속화된 안정성에 대해서는 용해를 가속시키는 것으로 밝혀졌다.
| DoE 회분에 대해 0.1N HCl 및 pH 4 완충제 중에 용해된 퍼센트의 증가(안정성 연구) | ||||
| 물 (G) | 결합제 첨가 속도 (g/분) | 폴록사머 (% w/w) | 15 분째에 0.1N HCl 중의 방출(%)(초기로부터 + - 용해 증가%) | |
| 147 | 58.5 | 0 | 초기 | 66 |
| 1M@40 Deg C | +3 | |||
| 1M@40 Deg C/75% RH | +6 | |||
| 162 | 58.5 | 1.5 | 초기 | 50 |
| 1M@40 Deg C | +19 | |||
| 1M@40 Deg C/75% RH | +22 | |||
| 147 | 58.5 | 3.0 | 초기 | 43 |
| 1M@40 Deg C | +11 | |||
| 1M@40 Deg C/75% RH | +31 | |||
| 158 | 66 | 4.5 | 초기 | 38 |
| 1M@40 Deg C | +13 | |||
| 1M@40 Deg C/75% RH | +8 | |||
| 147 | 58.5 | 6.0 | 초기 | 38 |
| 1M@40 Deg C | +6 | |||
| 1M@40 Deg C/75% RH | +14 | |||
가속화된 안정성에 대해, 폴록사머는 0 내지 3% w/w에서 농도 의존적인 방식으로 용해 이동을 유발한다. 3% 폴록사머 농도 밖에서의 용해 이동은 뚜렷한 추세 없이 평탄 역을 벗어난다. 이러한 결과는 상기 폴록사머가 안정성에 대해 용해 이동이 일어나게 할 수 있음을 입증한다. 에이징 시 및 가속화된 온도에서 상기 폴록사머 쇄는 보다 이동성으로 되는 것으로 여겨지며, 따라서 상기 이동성 중합체 쇄는 과립을 상기 정제 중에서 함께 유지시키는 대신에 상기 정제를 "연화"시키는 경향이 있다. 이는 시간에 따른 과립 연화뿐만 아니라 증가된 붕해 경향의 결과일 수 있다. 안정화 시 붕해 시간이 낮아지는 것으로 또한 나타났다. 상기 정제가 일단 붕해되면 상기 정제 중의 과립들은 실제로 모든 공지된 계면활성제와 매우 유사한 양상을 나타낸다. 계면활성제의 증가는 도 14에 나타낸 바와 같이 과립 용해를 증가시키는 경향이 있다.
이러한 용해 이동 문제는 제형 중의 습윤제인 폴록사머(또한 계면활성제로서도 작용한다)를 대체함으로써 본 발명의 SKI-606 제형에 의해 미연에 방지되었다. 보다 낮은 융점의 계면활성제(실온에서 액체인 것)의 사용은 상기 쟁점을 다루는데 도움이 될 수 있다. 폴리옥시에틸렌 (20) 솔비탄 모노올리에이트(트윈(상표) 또는 폴리솔베이트 80(상표) i)는 사용 중인 통상적으로 사용되는 계면활성제 중 하나이다. 시험된 폴리옥시에틸렌 (20) 솔비탄 모노올리에이트(폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)(상표))의 농도는 상기 제형에서 3% 폴록사머 대신에 1%였다. 이를 붕해제로서 3% IG 및 1% EG CPV와 함께 상기 CPV 제형에 사용하였다. 이는 용해로서 허용가능한 것으로 간주되었으며 상기 농도에서 시험된 다른 제조역량 특성들도 허용 가능하였다. 또한, 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)(상표)은 통상적으로 사용되는 약학적으로 허용 가능한 습윤제이며 또한 계면활성제로서도 작용한다.
용해 이동을 다루는 것 이외에, 이들 제형의 활성 약제 성분 API 입자 크기에 관한 견고성의 시험이 바람직하다. 비교 상의 SKI-606 제형에서 API 입자 크기는 용해에 영향을 미치는 것으로 나타났다, 즉 상기 API 입자 크기가 작을수록 상기 용해가 느려졌다. 상기 SKI/트윈-80 제형의 경우, 상기 효과는 최소화되거나 무시할만하였으며(도 7) 또 다른 습윤제인 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)(상표)을 포함하는 SKI-606 제형은 에이징 시 비교 상의 SKI-606 제형보다 우수하였다(도 15 및 16).
실시예
11 및 12:
SKI
-606의 약학적으로 허용 가능한 조성물의 제조
SKI-606을 미국 특허 제 6,297,258 및 7,297,795 호 중 하나 이상에 상세히 개시된 방법들에 따라 제조한다. SKI-606의 예시적인 본 발명의 제형 및 비교 상의 SKI-606 제형을 표 10에 요약한다.
| SKI-606 제형 | |||
| 과립 내 성분 | SKI -606 제형 1 | 비교 상의 SKI -606 제형 | SKI -606 또 다른 계면활성제 제형 |
| (% w/w) | (% w/w) | (% w/w) | |
| SKI-606 염기와 동등한 SKI-606 모노하이드레이트 | 69 | 69 | 69 |
| 미정질 셀룰로스 (MCC, 아비셀 PH101) | 6.5 | 17.5 | 19.5 |
| 크로스포비돈 (CPV) | NA | 3 | 3 |
| 크로스카멜로스 나트륨 (CCS) | 2 | NA | NA |
| 폴록사머 188(상표)(루트롤 F-68(상표)) | 3 | 3 | NA |
| 폴리옥시에틸렌 솔비탄 모노올리에이트 (트윈 -80) | 1 | ||
| 포비돈 (콜리돈 25) | 2 | 2 | 2 |
| 과립 내 성분 중량 % | 82.5 | 94.5 | 94.5 |
| 과립 외 성분 | |||
| 미정질 셀룰로스 (MCC, 아비셀 101(상표)) | NA | 4 | 4 |
| 미정질 셀룰로스 (MCC, 아비셀 102(상표)) | 15 | NA | NA |
| 크로스포비돈 | NA | 1 | 1 |
| 크로스카멜로스 나트륨 | 2 | NA | NA |
| 마그네슘 스테아레이트 | 0.5 | 0.5 | 0.5 |
| 과립 외 성분 중량 % | 17.5 | 5.5 | 5.5 |
| 코팅제 ( 오파드라이 II 시스템) | 3 | 4 | 4 |
| NA - 적용할 수 없거나 입수할 수 없음 | |||
습윤제로서 폴리옥시에틸렌 솔비탄 모노올리에이트(트윈-80)를 포함하는 또 다른 SKI-606 제형을 표 11 내지 13에 요약한다.
| 폴리옥시에티렌 솔비탄 모노올리에이트(트윈-80) 및 다양한 크로스포비돈을 포함하는 또 다른 SKI-606 제형 | |||
| 성분 | 또 다른 트윈 제형 (% w/w) |
또 다른 트윈 제형 (% w/w) |
또 다른 트윈 제형 (% w/w) |
| SKI-606 염기와 동등한 SKI-606 모노하이드레이트 | 69 | 69 | 69 |
| 미정질 셀룰로스(MCC, 아비셀 PH101) | 21.5 | 20.5 | 18.5 |
| 크로스포비돈(CPV) | 1 | 2 | 4 |
| 크로스카멜로스 나트륨(CCS) | NA | NA | NA |
| 트윈-80(상표) | 1 | 1 | 1 |
| 포비돈 (콜리돈 25(상표)) |
2 | 2 | 2 |
| 과립 내 성분 중량% | 94.5 | 94.5 | 94.5 |
| 미정질 셀룰로스(MCC, 아비셀 101) | 2 | 3 | 5 |
| 크로스포비돈 | 3 | 2 | 0 |
| 마그네슘 스테아레이트 | 0.5 | 0.5 | 0.5 |
| 과립 외 성분 중량% | 5.5 | 5.5 | 5.5 |
| 다양한 폴리옥시에티렌 솔비탄 모노올리에이트(트윈-80)을 포함하는 또 다른 SKI-606 제형 | |||
| 성분 | 또 다른 트윈 제형 (% w/w) |
또 다른 트윈 제형 (% w/w) |
또 다른 트윈 제형 (% w/w) |
| SKI-606 염기와 동등한 SKI-606 모노하이드레이트 | 69 | 69 | 69 |
| 미정질 셀룰로스(MCC, 아비셀 PH101) | 20 | 20.25 | 19.75 |
| 크로스포비돈(CPV) | 3 | 3 | 3 |
| 크로스카멜로스 나트륨(CCS) | NA | NA | NA |
| 트윈-80(상표) | 0.5 | 0.25 | 0.75 |
| 포비돈 (콜리돈 25(상표)) |
2 | 2 | 2 |
| 과립 내 성분 중량% | 94.5 | 94.5 | 94.5 |
| 미정질 셀룰로스(MCC, 아비셀 101) | 4 | 4 | 4 |
| 크로스포비돈 | 1 | 1 | 1 |
| 마그네슘 스테아레이트 | 0.5 | 0.5 | 0.5 |
| 과립 외 성분 중량% | 5.5 | 5.5 | 5.5 |
| 다양한 결합제 농도를 갖는 폴리옥시에티렌 솔비탄 모노올리에이트(트윈-80)를 포함하는 또 다른 SKI-606 제형 | |||
| 성분 | 또 다른 트윈 제형 (% w/w) |
또 다른 트윈 제형 (% w/w) |
또 다른 트윈 제형 (% w/w) |
| SKI-606 염기와 동등한 SKI-606 모노하이드레이트 | 69 | 69 | 69 |
| 미정질 셀룰로스(MCC, 아비셀 PH101) | 20.5 | 19.5 | 18.5 |
| 크로스포비돈(CPV) | 3 | 3 | 3 |
| 크로스카멜로스 나트륨(CCS) | NA | NA | NA |
| 트윈-80(상표) | 1 | 1 | 1 |
| 포비돈 (콜리돈 25(상표)) |
1 | 2 | 3 |
| 과립 내 성분 중량% | 94.5 | 94.5 | 94.5 |
| 미정질 셀룰로스(MCC, 아비셀 101) | 4 | 4 | 4 |
| 크로스포비돈 | 1 | 1 | 1 |
| 마그네슘 스테아레이트 | 0.5 | 0.5 | 0.5 |
| 과립 외 성분 중량% | 5.5 | 5.5 | 5.5 |
상기 비교 상의 SKI-606 제형을 고 전단 습식 과립화, 습식 분쇄, 유동층 건조, 건식 분쇄, 배합 및 압착의 공정에 의해 정제로 제조하고 후속적으로 필름 코팅하였다.
특정 실시태양에서, 본 발명의 SKI-606 제형은 고 전단 습식 과립화 또는 팬 코팅에 의해 제조되는 필름 코팅된 SKI-606 제형을 포함한다. 다른 실시태양에서, 상기 필름 코팅된 SKI-606 정제 제형을 다른 통상적인 코팅 기법에 의해 제조한다.
Claims (20)
- (a) 조성물의 중량을 기준으로 20 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 포비돈; (c) 미정질 셀룰로스; (d) 조성물의 중량을 기준으로 0.25 내지 5 중량%의 크로스카멜로스 나트륨; 및 (e) 폴록사머의 과립 내(intragranular) 성분; 및
(f) 미정질 셀룰로스; 및 (g) 마그네슘 스테아레이트의 과립 외(extragranular) 성분
을 포함하는 약학적으로 허용 가능한 조성물. - (a) 조성물의 중량을 기준으로 25 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 포비돈; (c) 미정질 셀룰로스; (d) 조성물의 중량을 기준으로 0.25 내지 5 중량%의 크로스카멜로스 나트륨; 및 (e) 폴록사머의 과립 내 성분; 및
(f) 미정질 셀룰로스; 및 (g) 마그네슘 스테아레이트의 과립 외 성분
을 포함하는 약학적으로 허용 가능한 조성물. - 제 1 항에 있어서,
4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴의 양이 조성물의 중량을 기준으로 약 69 중량%인 조성물. - 제 1 항 내지 제 3 항 중 어느 한 항에 있어서,
크로스카멜로스 나트륨의 양이 과립 내 부분 중에서 조성물의 중량을 기준으로 약 1 내지 3 중량%인 조성물. - 제 1 항 내지 제 3 항 중 어느 한 항에 있어서,
크로스카멜로스 나트륨의 양이 과립 외 부분 중에서 조성물의 중량을 기준으로 약 1 내지 3 중량%인 조성물. - 제 1 항에 있어서,
포비돈의 양이 조성물의 중량을 기준으로 약 2 중량%인 조성물. - 제 1 항에 있어서,
미정질 셀룰로스의 양이 조성물의 중량을 기준으로 약 21.5 중량%인 조성물. - 제 7 항에 있어서,
과립 내 성분으로서 미정질 셀룰로스의 양이 조성물의 중량을 기준으로 약 6.5 중량%이거나; 또는 과립 외 성분으로서 미정질 셀룰로스의 양이 조성물의 중량을 기준으로 약 15 중량%이거나; 또는 둘 다인 조성물. - 제 1 항에 있어서,
폴록사머의 양이 조성물의 중량을 기준으로 약 3 중량%인 조성물. - 제 1 항에 있어서,
마그네슘 스테아레이트의 양이 조성물의 중량을 기준으로 약 0.5 중량%인 조성물. - 조성물의 중량을 기준으로 (a) 25 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; (b) 0.5 내지 5.0 중량%의 포비돈; (c) 1 내지 25 중량%의 미정질 셀룰로스; (d) 0.5 내지 5 중량%의 크로스카멜로스 나트륨; 및 (e) 0.2 내지 5 중량%의 폴록사머의 과립 내 성분; 및
코팅되지 않은/코어 정제의 조성물의 중량을 기준으로 (f) 1 내지 25 중량%의 미정질 셀룰로스; (g) 0.5 내지 5 중량%의 크로스카멜로스 나트륨; 및 (h) 0.5 내지 5 중량%의 마그네슘 스테아레이트의 과립 외 성분
을 포함하는, 경구 투여용의 약학적으로 허용 가능한 조성물. - 제 8 항에 있어서,
4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴의 양이 조성물의 중량을 기준으로 약 69 중량%인 조성물. - 제 11 항 또는 제 12 항에 있어서,
크로스카멜로스 나트륨의 양이 과립 내 부분 중에서 조성물의 중량을 기준으로 약 1 내지 3 중량%인 조성물. - 제 11 항 또는 제 12 항에 있어서,
크로스카멜로스 나트륨의 양이 과립 외 부분 중에서 조성물의 중량을 기준으로 약 1 내지 3 중량%인 조성물. - 제 11 항에 있어서,
포비돈의 양이 조성물의 중량을 기준으로 약 2 중량%이거나; 미정질 셀룰로스의 양이 조성물의 중량을 기준으로 약 21.5 중량%이거나; 폴록사머의 양이 조성물의 중량을 기준으로 약 3 중량%이거나; 또는 마그네슘 스테아레이트의 양이 조성물의 중량을 기준으로 약 0.5 중량%인 조성물. - 제 15 항에 있어서,
과립 내 성분으로서 미정질 셀룰로스의 양이 조성물의 중량을 기준으로 약 6.5 중량%이거나; 과립 외 성분으로서 미정질 셀룰로스의 양이 조성물의 중량을 기준으로 약 15 중량%이거나; 또는 둘 다인 조성물. - 조성물의 중량을 기준으로 25 내지 80 중량%의 4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴; 및 조성물의 중량을 기준으로 0.25 내지 5 중량%의 크로스카멜로스 나트륨의 과립 내 성분; 및
미정질 셀룰로스; 및 마그네슘 스테아레이트를 선택적으로 포함하는 과립 외 성분
을 포함하는 약학적으로 허용 가능한 조성물. - 제 1 항 또는 제 11 항에 있어서,
4-(2,4-다이클로로-5-메톡시-페닐아미노)-6-메톡시-7-[3-(4-메틸-피페라진-1-일)-프로폭시]-퀴놀린-3-카보나이트릴의 경구 현탁액의 형태인 조성물. - 제 1 항 또는 제 11 항에 있어서,
습윤 과립화된 형태이거나, 필름 코팅된 정제이거나, 또는 팬(pan) 코팅된 정제의 형태인 조성물. - 유효량의 제 1 항 또는 제 11 항에 따른 조성물을 투여함을 포함하는 암의 치료 방법.
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US22253709P | 2009-07-02 | 2009-07-02 | |
| US61/222,537 | 2009-07-02 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| KR20120046216A true KR20120046216A (ko) | 2012-05-09 |
Family
ID=42732381
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020127002851A KR20120046216A (ko) | 2009-07-02 | 2010-06-30 | 3-시아노퀴놀린 정제 제형 및 이의 용도 |
Country Status (15)
| Country | Link |
|---|---|
| EP (1) | EP2448563A2 (ko) |
| JP (1) | JP2011012063A (ko) |
| KR (1) | KR20120046216A (ko) |
| CN (1) | CN102470109A (ko) |
| AR (1) | AR077546A1 (ko) |
| AU (1) | AU2010266342A1 (ko) |
| BR (1) | BRPI1015941A2 (ko) |
| CA (1) | CA2766067A1 (ko) |
| IL (1) | IL217298A0 (ko) |
| MX (1) | MX2012000048A (ko) |
| RU (1) | RU2011152105A (ko) |
| SG (1) | SG177309A1 (ko) |
| TW (1) | TW201113050A (ko) |
| WO (1) | WO2011002857A2 (ko) |
| ZA (1) | ZA201200366B (ko) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190123764A (ko) | 2017-03-31 | 2019-11-01 | 닛세이 에이. 에스. 비 기카이 가부시키가이샤 | 수지제 용기 |
Families Citing this family (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2364495T3 (es) | 2005-02-03 | 2011-09-05 | The General Hospital Corporation | Método para tratar cáncer resistente a gefitinib. |
| PE20070763A1 (es) | 2005-11-04 | 2007-08-08 | Wyeth Corp | COMBINACIONES ANTINEOPLASICAS DE UN INHIBIDOR DE mTOR, TRASTUZUMAB Y/O HKI-272 |
| US8022216B2 (en) | 2007-10-17 | 2011-09-20 | Wyeth Llc | Maleate salts of (E)-N-{4-[3-chloro-4-(2-pyridinylmethoxy)anilino]-3-cyano-7-ethoxy-6-quinolinyl}-4-(dimethylamino)-2-butenamide and crystalline forms thereof |
| SG191676A1 (en) | 2008-06-17 | 2013-07-31 | Wyeth Llc | Antineoplastic combinations containing hki-272 and vinorelbine |
| KR101434009B1 (ko) | 2008-08-04 | 2014-08-25 | 와이어쓰 엘엘씨 | 4-아닐리노-3-사이아노퀴놀린과 카페시타빈의 항신생물성 조합물 |
| LT3000467T (lt) | 2009-04-06 | 2023-04-11 | Wyeth Llc | Krūties vėžio gydymo schema naudojant neratinibą |
| AU2010316683B2 (en) * | 2009-11-09 | 2015-10-08 | Wyeth Llc | Tablet formulations of neratinib maleate |
| WO2011056741A2 (en) | 2009-11-09 | 2011-05-12 | Wyeth Llc | Coated drug spheroids and uses thereof for eliminating or reducing conditions such as emesis and diarrhea |
| CN104447541A (zh) * | 2013-09-16 | 2015-03-25 | 天津市汉康医药生物技术有限公司 | 博舒替尼化合物 |
| CN105384686B (zh) * | 2014-09-04 | 2019-07-26 | 连云港润众制药有限公司 | 一种博舒替尼结晶方法 |
| US20190060325A1 (en) * | 2016-04-08 | 2019-02-28 | Shionogi & Co., Ltd. | Stabilized solid dosage form |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6297258B1 (en) | 1998-09-29 | 2001-10-02 | American Cyanamid Company | Substituted 3-cyanoquinolines |
| NZ534513A (en) * | 2002-02-26 | 2007-04-27 | Astrazeneca Ab | Pharmaceutical formulation of iressa comprising a water-soluble cellulose derivative |
| AU2004267061A1 (en) | 2003-08-19 | 2005-03-03 | Wyeth Holdings Corporation | Process for the preparation of 4-amino-3-quinolinecarbonitriles |
| AU2005283422C1 (en) * | 2004-09-17 | 2017-02-02 | Eisai R & D Management Co., Ltd. | Medicinal composition |
| ES2449197T5 (es) * | 2005-07-01 | 2022-04-28 | Wyeth Llc | Formas cristalinas de 4-[(2,4-dicloro-5-metoxifenil)amino]-6-metoxi-7-[3-(4-metil-1-piperazinil)propoxi]-3- quinolincarbonitrilo y procedimientos de preparación de las mismas |
| WO2008053295A2 (en) * | 2006-10-30 | 2008-05-08 | Wockhardt Research Centre | Pharmaceutical compositions of benzoquinolizine-2-carboxylic acid |
| CN101224185A (zh) * | 2007-12-11 | 2008-07-23 | 山东蓝金生物工程有限公司 | 一种治疗实体肿瘤的伯舒替尼缓释植入剂 |
-
2010
- 2010-06-30 SG SG2011094950A patent/SG177309A1/en unknown
- 2010-06-30 EP EP10732568A patent/EP2448563A2/en not_active Withdrawn
- 2010-06-30 KR KR1020127002851A patent/KR20120046216A/ko not_active Application Discontinuation
- 2010-06-30 RU RU2011152105/15A patent/RU2011152105A/ru unknown
- 2010-06-30 CA CA2766067A patent/CA2766067A1/en not_active Abandoned
- 2010-06-30 MX MX2012000048A patent/MX2012000048A/es not_active Application Discontinuation
- 2010-06-30 WO PCT/US2010/040555 patent/WO2011002857A2/en active Application Filing
- 2010-06-30 CN CN2010800294791A patent/CN102470109A/zh active Pending
- 2010-06-30 BR BRPI1015941A patent/BRPI1015941A2/pt not_active Application Discontinuation
- 2010-06-30 AU AU2010266342A patent/AU2010266342A1/en not_active Abandoned
- 2010-07-01 TW TW099121740A patent/TW201113050A/zh unknown
- 2010-07-01 JP JP2010151063A patent/JP2011012063A/ja not_active Withdrawn
- 2010-07-02 AR ARP100102373A patent/AR077546A1/es not_active Application Discontinuation
-
2011
- 2011-12-29 IL IL217298A patent/IL217298A0/en unknown
-
2012
- 2012-01-17 ZA ZA2012/00366A patent/ZA201200366B/en unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20190123764A (ko) | 2017-03-31 | 2019-11-01 | 닛세이 에이. 에스. 비 기카이 가부시키가이샤 | 수지제 용기 |
Also Published As
| Publication number | Publication date |
|---|---|
| AU2010266342A1 (en) | 2012-01-19 |
| RU2011152105A (ru) | 2013-08-10 |
| EP2448563A2 (en) | 2012-05-09 |
| SG177309A1 (en) | 2012-02-28 |
| CN102470109A (zh) | 2012-05-23 |
| TW201113050A (en) | 2011-04-16 |
| BRPI1015941A2 (pt) | 2016-04-19 |
| IL217298A0 (en) | 2012-02-29 |
| MX2012000048A (es) | 2012-01-27 |
| AR077546A1 (es) | 2011-09-07 |
| CA2766067A1 (en) | 2011-01-06 |
| JP2011012063A (ja) | 2011-01-20 |
| ZA201200366B (en) | 2012-10-31 |
| WO2011002857A2 (en) | 2011-01-06 |
| WO2011002857A3 (en) | 2011-03-10 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR20120046216A (ko) | 3-시아노퀴놀린 정제 제형 및 이의 용도 | |
| JP6530772B2 (ja) | アンチセンス組成物およびその作製および使用 | |
| EP2498756B1 (en) | Tablet formulations of neratinib maleate | |
| JP5775464B2 (ja) | 非晶質cddo−meを含有する遅延放出性経口投薬組成物 | |
| TWI429437B (zh) | 經加衣之藥球及彼於除去或減輕徵狀(諸如嘔吐和腹瀉)之用途 | |
| TW201206447A (en) | Pharmaceutical formulations | |
| TW202313072A (zh) | 檸檬酸鐵之兒科調配物 | |
| DK177906B1 (en) | Dispersible tablet |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E601 | Decision to refuse application |