KR102059210B1 - 온디맨드 탈착 특성을 갖는 단량체를 기초로 하는 치과용 재료 - Google Patents
온디맨드 탈착 특성을 갖는 단량체를 기초로 하는 치과용 재료 Download PDFInfo
- Publication number
- KR102059210B1 KR102059210B1 KR1020147005273A KR20147005273A KR102059210B1 KR 102059210 B1 KR102059210 B1 KR 102059210B1 KR 1020147005273 A KR1020147005273 A KR 1020147005273A KR 20147005273 A KR20147005273 A KR 20147005273A KR 102059210 B1 KR102059210 B1 KR 102059210B1
- Authority
- KR
- South Korea
- Prior art keywords
- independently
- acid
- occurrence
- endo
- exo
- Prior art date
Links
- 239000000178 monomer Substances 0.000 title claims description 32
- 239000005548 dental material Substances 0.000 title description 10
- 239000000853 adhesive Substances 0.000 claims abstract description 41
- 230000001070 adhesive effect Effects 0.000 claims abstract description 41
- 150000001875 compounds Chemical class 0.000 claims abstract description 41
- 239000000463 material Substances 0.000 claims abstract description 37
- 125000001931 aliphatic group Chemical group 0.000 claims abstract description 20
- 229910052739 hydrogen Inorganic materials 0.000 claims abstract description 11
- 229910052799 carbon Inorganic materials 0.000 claims abstract description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims abstract description 4
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 claims abstract description 4
- -1 alkyl radicals Chemical class 0.000 claims description 46
- 150000003254 radicals Chemical class 0.000 claims description 27
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 claims description 21
- 239000002904 solvent Substances 0.000 claims description 17
- CERQOIWHTDAKMF-UHFFFAOYSA-N Methacrylic acid Chemical compound CC(=C)C(O)=O CERQOIWHTDAKMF-UHFFFAOYSA-N 0.000 claims description 12
- 239000002253 acid Substances 0.000 claims description 12
- 239000000654 additive Substances 0.000 claims description 10
- 239000004568 cement Substances 0.000 claims description 10
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 9
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 claims description 9
- 239000000945 filler Substances 0.000 claims description 9
- 150000002148 esters Chemical class 0.000 claims description 8
- 239000002131 composite material Substances 0.000 claims description 7
- 239000007789 gas Substances 0.000 claims description 7
- 238000000034 method Methods 0.000 claims description 7
- 239000003999 initiator Substances 0.000 claims description 6
- 229910052757 nitrogen Inorganic materials 0.000 claims description 6
- 150000003926 acrylamides Chemical class 0.000 claims description 5
- 229910019142 PO4 Inorganic materials 0.000 claims description 4
- WERYXYBDKMZEQL-UHFFFAOYSA-N butane-1,4-diol Chemical compound OCCCCO WERYXYBDKMZEQL-UHFFFAOYSA-N 0.000 claims description 4
- GHLKSLMMWAKNBM-UHFFFAOYSA-N dodecane-1,12-diol Chemical compound OCCCCCCCCCCCCO GHLKSLMMWAKNBM-UHFFFAOYSA-N 0.000 claims description 4
- 239000010452 phosphate Substances 0.000 claims description 4
- GAWIXWVDTYZWAW-UHFFFAOYSA-N C[CH]O Chemical group C[CH]O GAWIXWVDTYZWAW-UHFFFAOYSA-N 0.000 claims description 3
- AMFGWXWBFGVCKG-UHFFFAOYSA-N Panavia opaque Chemical compound C1=CC(OCC(O)COC(=O)C(=C)C)=CC=C1C(C)(C)C1=CC=C(OCC(O)COC(=O)C(C)=C)C=C1 AMFGWXWBFGVCKG-UHFFFAOYSA-N 0.000 claims description 3
- 230000000996 additive effect Effects 0.000 claims description 3
- VYHUMZYFJVMWRC-UHFFFAOYSA-N n-(2-hydroxyethyl)-n-methylprop-2-enamide Chemical compound OCCN(C)C(=O)C=C VYHUMZYFJVMWRC-UHFFFAOYSA-N 0.000 claims description 3
- NCOOVOHQKQGDSY-UHFFFAOYSA-N n-ethyl-n-[3-[ethyl(prop-2-enoyl)amino]propyl]prop-2-enamide Chemical compound C=CC(=O)N(CC)CCCN(CC)C(=O)C=C NCOOVOHQKQGDSY-UHFFFAOYSA-N 0.000 claims description 3
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 claims description 3
- DTGKSKDOIYIVQL-WEDXCCLWSA-N (+)-borneol Chemical group C1C[C@@]2(C)[C@@H](O)C[C@@H]1C2(C)C DTGKSKDOIYIVQL-WEDXCCLWSA-N 0.000 claims description 2
- IJAOUFAMBRPHSJ-UHFFFAOYSA-N (4-ethenylphenyl)methylphosphonic acid Chemical compound OP(O)(=O)CC1=CC=C(C=C)C=C1 IJAOUFAMBRPHSJ-UHFFFAOYSA-N 0.000 claims description 2
- CJBYXOUKKQTXPF-UHFFFAOYSA-N (4-ethenylphenyl)phosphonic acid Chemical compound OP(O)(=O)C1=CC=C(C=C)C=C1 CJBYXOUKKQTXPF-UHFFFAOYSA-N 0.000 claims description 2
- YERHJBPPDGHCRJ-UHFFFAOYSA-N 1-[4-(1-oxoprop-2-enyl)-1-piperazinyl]-2-propen-1-one Chemical compound C=CC(=O)N1CCN(C(=O)C=C)CC1 YERHJBPPDGHCRJ-UHFFFAOYSA-N 0.000 claims description 2
- SMZOUWXMTYCWNB-UHFFFAOYSA-N 2-(2-methoxy-5-methylphenyl)ethanamine Chemical compound COC1=CC=C(C)C=C1CCN SMZOUWXMTYCWNB-UHFFFAOYSA-N 0.000 claims description 2
- UHWLJHBFRWUMNP-UHFFFAOYSA-N 2-(2-methylprop-2-enoylamino)ethylphosphonic acid Chemical compound CC(=C)C(=O)NCCP(O)(O)=O UHWLJHBFRWUMNP-UHFFFAOYSA-N 0.000 claims description 2
- OKKJMXCNNZVCPO-UHFFFAOYSA-N 2-(2-methylprop-2-enoyloxy)ethylphosphonic acid Chemical compound CC(=C)C(=O)OCCP(O)(O)=O OKKJMXCNNZVCPO-UHFFFAOYSA-N 0.000 claims description 2
- XXEYEDZRUQKMLI-UHFFFAOYSA-N 2-(2-phosphonoethoxymethyl)prop-2-enoic acid Chemical compound OC(=O)C(=C)COCCP(O)(O)=O XXEYEDZRUQKMLI-UHFFFAOYSA-N 0.000 claims description 2
- AAMTXHVZOHPPQR-UHFFFAOYSA-N 2-(hydroxymethyl)prop-2-enoic acid Chemical compound OCC(=C)C(O)=O AAMTXHVZOHPPQR-UHFFFAOYSA-N 0.000 claims description 2
- GPLACOONWGSIIP-UHFFFAOYSA-N 2-(n-[2-hydroxy-3-(2-methylprop-2-enoyloxy)propyl]anilino)acetic acid Chemical compound CC(=C)C(=O)OCC(O)CN(CC(O)=O)C1=CC=CC=C1 GPLACOONWGSIIP-UHFFFAOYSA-N 0.000 claims description 2
- NIXOWILDQLNWCW-UHFFFAOYSA-N 2-Propenoic acid Natural products OC(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-N 0.000 claims description 2
- CDIYIEKBGHJSDO-UHFFFAOYSA-N 2-methyl-n-[3-(2-methylprop-2-enoylamino)propyl]prop-2-enamide Chemical compound CC(=C)C(=O)NCCCNC(=O)C(C)=C CDIYIEKBGHJSDO-UHFFFAOYSA-N 0.000 claims description 2
- LRQCBMGUUWENBW-UHFFFAOYSA-N 3-(2-methylprop-2-enoylamino)propane-1-sulfonic acid Chemical compound CC(=C)C(=O)NCCCS(O)(=O)=O LRQCBMGUUWENBW-UHFFFAOYSA-N 0.000 claims description 2
- DSWAQZBIVDRGLP-UHFFFAOYSA-N 3-ethenyl-1-[6-(3-ethenyl-2-oxopyrrolidin-1-yl)hexyl]pyrrolidin-2-one Chemical compound O=C1C(C=C)CCN1CCCCCCN1C(=O)C(C=C)CC1 DSWAQZBIVDRGLP-UHFFFAOYSA-N 0.000 claims description 2
- MAGFQRLKWCCTQJ-UHFFFAOYSA-N 4-ethenylbenzenesulfonic acid Chemical compound OS(=O)(=O)C1=CC=C(C=C)C=C1 MAGFQRLKWCCTQJ-UHFFFAOYSA-N 0.000 claims description 2
- IRQWEODKXLDORP-UHFFFAOYSA-N 4-ethenylbenzoic acid Chemical compound OC(=O)C1=CC=C(C=C)C=C1 IRQWEODKXLDORP-UHFFFAOYSA-N 0.000 claims description 2
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 claims description 2
- WHNWPMSKXPGLAX-UHFFFAOYSA-N N-Vinyl-2-pyrrolidone Chemical compound C=CN1CCCC1=O WHNWPMSKXPGLAX-UHFFFAOYSA-N 0.000 claims description 2
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 claims description 2
- ZJCCRDAZUWHFQH-UHFFFAOYSA-N Trimethylolpropane Chemical compound CCC(CO)(CO)CO ZJCCRDAZUWHFQH-UHFFFAOYSA-N 0.000 claims description 2
- KJBLLFKNQIHZFC-UHFFFAOYSA-N [4-methyl-4-(2-methylprop-2-enoylamino)pentyl]phosphonic acid Chemical compound CC(=C)C(=O)NC(C)(C)CCCP(O)(O)=O KJBLLFKNQIHZFC-UHFFFAOYSA-N 0.000 claims description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 2
- FOTKYAAJKYLFFN-UHFFFAOYSA-N decane-1,10-diol Chemical compound OCCCCCCCCCCO FOTKYAAJKYLFFN-UHFFFAOYSA-N 0.000 claims description 2
- MTHSVFCYNBDYFN-UHFFFAOYSA-N diethylene glycol Chemical compound OCCOCCO MTHSVFCYNBDYFN-UHFFFAOYSA-N 0.000 claims description 2
- 230000005670 electromagnetic radiation Effects 0.000 claims description 2
- IQIJRJNHZYUQSD-UHFFFAOYSA-N ethenyl(phenyl)diazene Chemical compound C=CN=NC1=CC=CC=C1 IQIJRJNHZYUQSD-UHFFFAOYSA-N 0.000 claims description 2
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 2
- 239000011256 inorganic filler Substances 0.000 claims description 2
- 229910003475 inorganic filler Inorganic materials 0.000 claims description 2
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 claims description 2
- 239000011976 maleic acid Substances 0.000 claims description 2
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 2
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims description 2
- BSCJIBOZTKGXQP-UHFFFAOYSA-N n-(2-hydroxyethyl)-2-methylprop-2-enamide Chemical compound CC(=C)C(=O)NCCO BSCJIBOZTKGXQP-UHFFFAOYSA-N 0.000 claims description 2
- UUORTJUPDJJXST-UHFFFAOYSA-N n-(2-hydroxyethyl)prop-2-enamide Chemical compound OCCNC(=O)C=C UUORTJUPDJJXST-UHFFFAOYSA-N 0.000 claims description 2
- JKGFLKYTUYKLQL-UHFFFAOYSA-N n-[4-(prop-2-enoylamino)butyl]prop-2-enamide Chemical compound C=CC(=O)NCCCCNC(=O)C=C JKGFLKYTUYKLQL-UHFFFAOYSA-N 0.000 claims description 2
- ZIWDVJPPVMGJGR-UHFFFAOYSA-N n-ethyl-2-methylprop-2-enamide Chemical compound CCNC(=O)C(C)=C ZIWDVJPPVMGJGR-UHFFFAOYSA-N 0.000 claims description 2
- SWPMNMYLORDLJE-UHFFFAOYSA-N n-ethylprop-2-enamide Chemical compound CCNC(=O)C=C SWPMNMYLORDLJE-UHFFFAOYSA-N 0.000 claims description 2
- 239000012766 organic filler Substances 0.000 claims description 2
- WXZMFSXDPGVJKK-UHFFFAOYSA-N pentaerythritol Chemical compound OCC(CO)(CO)CO WXZMFSXDPGVJKK-UHFFFAOYSA-N 0.000 claims description 2
- 238000010526 radical polymerization reaction Methods 0.000 claims description 2
- UWHCKJMYHZGTIT-UHFFFAOYSA-N tetraethylene glycol Chemical compound OCCOCCOCCOCCO UWHCKJMYHZGTIT-UHFFFAOYSA-N 0.000 claims description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 claims description 2
- ZIBGPFATKBEMQZ-UHFFFAOYSA-N triethylene glycol Chemical compound OCCOCCOCCO ZIBGPFATKBEMQZ-UHFFFAOYSA-N 0.000 claims description 2
- ZTWTYVWXUKTLCP-UHFFFAOYSA-N vinylphosphonic acid Chemical compound OP(O)(=O)C=C ZTWTYVWXUKTLCP-UHFFFAOYSA-N 0.000 claims description 2
- NLVXSWCKKBEXTG-UHFFFAOYSA-N vinylsulfonic acid Chemical compound OS(=O)(=O)C=C NLVXSWCKKBEXTG-UHFFFAOYSA-N 0.000 claims description 2
- CHLIEYMSXLYEBR-UHFFFAOYSA-N 2-(2-phosphonooxyphenyl)ethyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCC1=CC=CC=C1OP(O)(O)=O CHLIEYMSXLYEBR-UHFFFAOYSA-N 0.000 claims 1
- JDKSTARXLKKYPS-UHFFFAOYSA-N 2-[10-(2-methylprop-2-enoyloxy)decyl]propanedioic acid Chemical compound CC(=C)C(=O)OCCCCCCCCCCC(C(O)=O)C(O)=O JDKSTARXLKKYPS-UHFFFAOYSA-N 0.000 claims 1
- ATVJXMYDOSMEPO-UHFFFAOYSA-N 3-prop-2-enoxyprop-1-ene Chemical compound C=CCOCC=C ATVJXMYDOSMEPO-UHFFFAOYSA-N 0.000 claims 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-M dihydrogenphosphate Chemical compound OP(O)([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-M 0.000 claims 1
- MKVYSRNJLWTVIK-UHFFFAOYSA-N ethyl carbamate;2-methylprop-2-enoic acid Chemical compound CCOC(N)=O.CC(=C)C(O)=O.CC(=C)C(O)=O MKVYSRNJLWTVIK-UHFFFAOYSA-N 0.000 claims 1
- 125000000325 methylidene group Chemical group [H]C([H])=* 0.000 claims 1
- ZIUHHBKFKCYYJD-UHFFFAOYSA-N n,n'-methylenebisacrylamide Chemical compound C=CC(=O)NCNC(=O)C=C ZIUHHBKFKCYYJD-UHFFFAOYSA-N 0.000 claims 1
- HNJBEVLQSNELDL-UHFFFAOYSA-N pyrrolidin-2-one Chemical compound O=C1CCCN1 HNJBEVLQSNELDL-UHFFFAOYSA-N 0.000 claims 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 63
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 51
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 42
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 34
- 238000001644 13C nuclear magnetic resonance spectroscopy Methods 0.000 description 30
- 238000005160 1H NMR spectroscopy Methods 0.000 description 30
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 27
- 239000000203 mixture Substances 0.000 description 27
- 239000000725 suspension Substances 0.000 description 26
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 24
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 23
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 19
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 19
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 18
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 17
- 239000012074 organic phase Substances 0.000 description 17
- 239000007787 solid Substances 0.000 description 17
- 239000011541 reaction mixture Substances 0.000 description 16
- 239000011734 sodium Substances 0.000 description 16
- 229910004298 SiO 2 Inorganic materials 0.000 description 15
- 125000005395 methacrylic acid group Chemical group 0.000 description 15
- 238000004440 column chromatography Methods 0.000 description 13
- 239000012043 crude product Substances 0.000 description 12
- 239000000706 filtrate Substances 0.000 description 12
- 239000008346 aqueous phase Substances 0.000 description 11
- 230000015572 biosynthetic process Effects 0.000 description 11
- 238000006243 chemical reaction Methods 0.000 description 11
- 229920006395 saturated elastomer Polymers 0.000 description 11
- 238000003786 synthesis reaction Methods 0.000 description 11
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 10
- 238000010992 reflux Methods 0.000 description 10
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 9
- 238000003795 desorption Methods 0.000 description 9
- 239000011780 sodium chloride Substances 0.000 description 9
- YLQBMQCUIZJEEH-UHFFFAOYSA-N Furan Chemical compound C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 8
- CERQOIWHTDAKMF-UHFFFAOYSA-M Methacrylate Chemical compound CC(=C)C([O-])=O CERQOIWHTDAKMF-UHFFFAOYSA-M 0.000 description 8
- 238000001816 cooling Methods 0.000 description 7
- 239000000047 product Substances 0.000 description 7
- 0 *C(C1(*)C(N2*=C)=O)(C3(*)OC1(*=C)C=C3)C2=O Chemical compound *C(C1(*)C(N2*=C)=O)(C3(*)OC1(*=C)C=C3)C2=O 0.000 description 6
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 6
- 238000010438 heat treatment Methods 0.000 description 6
- DCUFMVPCXCSVNP-UHFFFAOYSA-N methacrylic anhydride Chemical compound CC(=C)C(=O)OC(=O)C(C)=C DCUFMVPCXCSVNP-UHFFFAOYSA-N 0.000 description 6
- 239000002245 particle Substances 0.000 description 6
- 239000012071 phase Substances 0.000 description 6
- 238000006116 polymerization reaction Methods 0.000 description 6
- 239000002244 precipitate Substances 0.000 description 6
- 239000000741 silica gel Substances 0.000 description 6
- 229910002027 silica gel Inorganic materials 0.000 description 6
- 238000001291 vacuum drying Methods 0.000 description 6
- VALXVSHDOMUUIC-UHFFFAOYSA-N 2-methylprop-2-enoic acid;phosphoric acid Chemical compound OP(O)(O)=O.CC(=C)C(O)=O VALXVSHDOMUUIC-UHFFFAOYSA-N 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- 150000001412 amines Chemical class 0.000 description 5
- 125000000751 azo group Chemical group [*]N=N[*] 0.000 description 5
- 229910052740 iodine Inorganic materials 0.000 description 5
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 5
- ABLZXFCXXLZCGV-UHFFFAOYSA-N phosphonic acid group Chemical group P(O)(O)=O ABLZXFCXXLZCGV-UHFFFAOYSA-N 0.000 description 5
- 230000005855 radiation Effects 0.000 description 5
- VNQXSTWCDUXYEZ-UHFFFAOYSA-N 1,7,7-trimethylbicyclo[2.2.1]heptane-2,3-dione Chemical compound C1CC2(C)C(=O)C(=O)C1C2(C)C VNQXSTWCDUXYEZ-UHFFFAOYSA-N 0.000 description 4
- GQHTUMJGOHRCHB-UHFFFAOYSA-N 2,3,4,6,7,8,9,10-octahydropyrimido[1,2-a]azepine Chemical compound C1CCCCN2CCCN=C21 GQHTUMJGOHRCHB-UHFFFAOYSA-N 0.000 description 4
- 239000004971 Cross linker Substances 0.000 description 4
- 238000005481 NMR spectroscopy Methods 0.000 description 4
- 230000002378 acidificating effect Effects 0.000 description 4
- 229930006711 bornane-2,3-dione Natural products 0.000 description 4
- 239000000919 ceramic Substances 0.000 description 4
- 239000000975 dye Substances 0.000 description 4
- 150000002240 furans Chemical class 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- JBESFMOSFGXJEE-UHFFFAOYSA-N 1-(3-hydroxypropyl)pyrrole-2,5-dione Chemical compound OCCCN1C(=O)C=CC1=O JBESFMOSFGXJEE-UHFFFAOYSA-N 0.000 description 3
- OXGKGQZORADNAK-UHFFFAOYSA-N 3-(2,5-dioxopyrrol-1-yl)propyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCCN1C(=O)C=CC1=O OXGKGQZORADNAK-UHFFFAOYSA-N 0.000 description 3
- QOXOZONBQWIKDA-UHFFFAOYSA-N 3-hydroxypropyl Chemical group [CH2]CCO QOXOZONBQWIKDA-UHFFFAOYSA-N 0.000 description 3
- WOBHKFSMXKNTIM-UHFFFAOYSA-N Hydroxyethyl methacrylate Chemical compound CC(=C)C(=O)OCCO WOBHKFSMXKNTIM-UHFFFAOYSA-N 0.000 description 3
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 description 3
- RAWPGIYPSZIIIU-UHFFFAOYSA-N [benzoyl(phenyl)phosphoryl]-phenylmethanone Chemical compound C=1C=CC=CC=1C(=O)P(=O)(C=1C=CC=CC=1)C(=O)C1=CC=CC=C1 RAWPGIYPSZIIIU-UHFFFAOYSA-N 0.000 description 3
- 150000001252 acrylic acid derivatives Chemical class 0.000 description 3
- 238000004026 adhesive bonding Methods 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000000354 decomposition reaction Methods 0.000 description 3
- 238000000113 differential scanning calorimetry Methods 0.000 description 3
- 230000005294 ferromagnetic effect Effects 0.000 description 3
- 150000002290 germanium Chemical class 0.000 description 3
- RRAMGCGOFNQTLD-UHFFFAOYSA-N hexamethylene diisocyanate Chemical compound O=C=NCCCCCCN=C=O RRAMGCGOFNQTLD-UHFFFAOYSA-N 0.000 description 3
- 239000007788 liquid Substances 0.000 description 3
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 3
- 239000000049 pigment Substances 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- 125000001412 tetrahydropyranyl group Chemical group 0.000 description 3
- RPCCBXBZRMZYTJ-UHFFFAOYSA-N 1-(10-hydroxydecyl)pyrrole-2,5-dione Chemical compound OCCCCCCCCCCN1C(=O)C=CC1=O RPCCBXBZRMZYTJ-UHFFFAOYSA-N 0.000 description 2
- YPKNIURCMPHHJJ-UHFFFAOYSA-N 1-(3-triethoxysilylpropyl)pyrrole-2,5-dione Chemical compound CCO[Si](OCC)(OCC)CCCN1C(=O)C=CC1=O YPKNIURCMPHHJJ-UHFFFAOYSA-N 0.000 description 2
- BVQVLAIMHVDZEL-UHFFFAOYSA-N 1-phenyl-1,2-propanedione Chemical compound CC(=O)C(=O)C1=CC=CC=C1 BVQVLAIMHVDZEL-UHFFFAOYSA-N 0.000 description 2
- FFAVPDIHPGHIKA-UHFFFAOYSA-N 11-(furan-2-ylmethoxy)undecan-1-ol Chemical compound OCCCCCCCCCCCOCC1=CC=CO1 FFAVPDIHPGHIKA-UHFFFAOYSA-N 0.000 description 2
- GWJIBEXHLZWCRJ-UHFFFAOYSA-N 2-(11-bromoundecoxy)oxane Chemical compound BrCCCCCCCCCCCOC1CCCCO1 GWJIBEXHLZWCRJ-UHFFFAOYSA-N 0.000 description 2
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 2
- KWNMLYNGZPRTKI-UHFFFAOYSA-N 2-(2-methylprop-2-enoyloxy)ethyl 4-(pyridine-2-carbothioylsulfanylmethyl)benzoate Chemical compound C1=CC(C(=O)OCCOC(=O)C(=C)C)=CC=C1CSC(=S)C1=CC=CC=N1 KWNMLYNGZPRTKI-UHFFFAOYSA-N 0.000 description 2
- RBPAYKFPFFRTOS-UHFFFAOYSA-N 2-(3-hydroxypropyl)-3a,4,7,7a-tetrahydro-octahydro-1h-4,7-epoxyisoindole-1,3-dione Chemical compound C1=CC2OC1C1C2C(=O)N(CCCO)C1=O RBPAYKFPFFRTOS-UHFFFAOYSA-N 0.000 description 2
- INEZXIFHJBJBRB-UHFFFAOYSA-N 2-(4-methoxyphenyl)-1,3-dithiane Chemical compound C1=CC(OC)=CC=C1C1SCCCS1 INEZXIFHJBJBRB-UHFFFAOYSA-N 0.000 description 2
- PPFKQEVWJGRSJC-UHFFFAOYSA-N 2-(benzenesulfonylmethyl)pyridine Chemical compound C=1C=CC=CC=1S(=O)(=O)CC1=CC=CC=N1 PPFKQEVWJGRSJC-UHFFFAOYSA-N 0.000 description 2
- PTZRYAAOQPNAKU-UHFFFAOYSA-N 2-[(1-carboxy-3-cyanobutyl)diazenyl]-4-cyanopentanoic acid Chemical compound N#CC(C)CC(C(O)=O)N=NC(C(O)=O)CC(C)C#N PTZRYAAOQPNAKU-UHFFFAOYSA-N 0.000 description 2
- CXIOOULWQJYISP-UHFFFAOYSA-N 2-[11-(furan-2-ylmethoxy)undecoxy]oxane Chemical compound C1CCCOC1OCCCCCCCCCCCOCC1=CC=CO1 CXIOOULWQJYISP-UHFFFAOYSA-N 0.000 description 2
- UEKHZPDUBLCUHN-UHFFFAOYSA-N 2-[[3,5,5-trimethyl-6-[2-(2-methylprop-2-enoyloxy)ethoxycarbonylamino]hexyl]carbamoyloxy]ethyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCOC(=O)NCCC(C)CC(C)(C)CNC(=O)OCCOC(=O)C(C)=C UEKHZPDUBLCUHN-UHFFFAOYSA-N 0.000 description 2
- YXOPBYDUQAMUKT-UHFFFAOYSA-N 2-methylidenebut-3-enyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCC(=C)C=C YXOPBYDUQAMUKT-UHFFFAOYSA-N 0.000 description 2
- YDIYEOMDOWUDTJ-UHFFFAOYSA-M 4-(dimethylamino)benzoate Chemical compound CN(C)C1=CC=C(C([O-])=O)C=C1 YDIYEOMDOWUDTJ-UHFFFAOYSA-M 0.000 description 2
- KQTNPYFTDBWYBY-UHFFFAOYSA-N 4-(pyridine-2-carbothioylsulfanylmethyl)benzoic acid Chemical compound C1=CC(C(=O)O)=CC=C1CSC(=S)C1=CC=CC=N1 KQTNPYFTDBWYBY-UHFFFAOYSA-N 0.000 description 2
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 2
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 239000004156 Azodicarbonamide Substances 0.000 description 2
- VTYYLEPIZMXCLO-UHFFFAOYSA-L Calcium carbonate Chemical compound [Ca+2].[O-]C([O-])=O VTYYLEPIZMXCLO-UHFFFAOYSA-L 0.000 description 2
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 2
- UQSXHKLRYXJYBZ-UHFFFAOYSA-N Iron oxide Chemical compound [Fe]=O UQSXHKLRYXJYBZ-UHFFFAOYSA-N 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- MZRVEZGGRBJDDB-UHFFFAOYSA-N N-Butyllithium Chemical compound [Li]CCCC MZRVEZGGRBJDDB-UHFFFAOYSA-N 0.000 description 2
- 229910010413 TiO 2 Inorganic materials 0.000 description 2
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 2
- CRFFPGKGPOBBHV-UHFFFAOYSA-N [benzoyl(diethyl)germyl]-phenylmethanone Chemical compound C=1C=CC=CC=1C(=O)[Ge](CC)(CC)C(=O)C1=CC=CC=C1 CRFFPGKGPOBBHV-UHFFFAOYSA-N 0.000 description 2
- KIMKGBGMXUPKJT-UHFFFAOYSA-N [diethyl-(4-methoxybenzoyl)germyl]-(4-methoxyphenyl)methanone Chemical compound C=1C=C(OC)C=CC=1C(=O)[Ge](CC)(CC)C(=O)C1=CC=C(OC)C=C1 KIMKGBGMXUPKJT-UHFFFAOYSA-N 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 125000005262 alkoxyamine group Chemical group 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- VSCWAEJMTAWNJL-UHFFFAOYSA-K aluminium trichloride Chemical compound Cl[Al](Cl)Cl VSCWAEJMTAWNJL-UHFFFAOYSA-K 0.000 description 2
- XOZUGNYVDXMRKW-AATRIKPKSA-N azodicarbonamide Chemical compound NC(=O)\N=N\C(N)=O XOZUGNYVDXMRKW-AATRIKPKSA-N 0.000 description 2
- 235000019399 azodicarbonamide Nutrition 0.000 description 2
- TZCXTZWJZNENPQ-UHFFFAOYSA-L barium sulfate Chemical compound [Ba+2].[O-]S([O-])(=O)=O TZCXTZWJZNENPQ-UHFFFAOYSA-L 0.000 description 2
- ISAOCJYIOMOJEB-UHFFFAOYSA-N benzoin Chemical compound C=1C=CC=CC=1C(O)C(=O)C1=CC=CC=C1 ISAOCJYIOMOJEB-UHFFFAOYSA-N 0.000 description 2
- 239000012965 benzophenone Substances 0.000 description 2
- 125000004432 carbon atom Chemical group C* 0.000 description 2
- 239000003638 chemical reducing agent Substances 0.000 description 2
- 238000006352 cycloaddition reaction Methods 0.000 description 2
- 239000011351 dental ceramic Substances 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- 239000011521 glass Substances 0.000 description 2
- FFUAGWLWBBFQJT-UHFFFAOYSA-N hexamethyldisilazane Chemical compound C[Si](C)(C)N[Si](C)(C)C FFUAGWLWBBFQJT-UHFFFAOYSA-N 0.000 description 2
- 230000003301 hydrolyzing effect Effects 0.000 description 2
- 125000002768 hydroxyalkyl group Chemical group 0.000 description 2
- 239000011630 iodine Substances 0.000 description 2
- 239000012948 isocyanate Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 2
- KJIFKLIQANRMOU-UHFFFAOYSA-N oxidanium;4-methylbenzenesulfonate Chemical compound O.CC1=CC=C(S(O)(=O)=O)C=C1 KJIFKLIQANRMOU-UHFFFAOYSA-N 0.000 description 2
- ZRSNZINYAWTAHE-UHFFFAOYSA-N p-methoxybenzaldehyde Chemical compound COC1=CC=C(C=O)C=C1 ZRSNZINYAWTAHE-UHFFFAOYSA-N 0.000 description 2
- 150000002978 peroxides Chemical class 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- YLOVYOQKFPEOLM-UHFFFAOYSA-N phosphooxychloride Chemical compound ClOP(=O)=O YLOVYOQKFPEOLM-UHFFFAOYSA-N 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 125000006239 protecting group Chemical group 0.000 description 2
- 230000001681 protective effect Effects 0.000 description 2
- 235000012239 silicon dioxide Nutrition 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 125000000542 sulfonic acid group Chemical group 0.000 description 2
- JIAARYAFYJHUJI-UHFFFAOYSA-L zinc dichloride Chemical compound [Cl-].[Cl-].[Zn+2] JIAARYAFYJHUJI-UHFFFAOYSA-L 0.000 description 2
- ZZCNGCMJBJERQI-UHFFFAOYSA-N (1-prop-2-enoylpiperidin-4-yl) dihydrogen phosphate Chemical compound OP(O)(=O)OC1CCN(C(=O)C=C)CC1 ZZCNGCMJBJERQI-UHFFFAOYSA-N 0.000 description 1
- WYTZZXDRDKSJID-UHFFFAOYSA-N (3-aminopropyl)triethoxysilane Chemical compound CCO[Si](OCC)(OCC)CCCN WYTZZXDRDKSJID-UHFFFAOYSA-N 0.000 description 1
- ATOUXIOKEJWULN-UHFFFAOYSA-N 1,6-diisocyanato-2,2,4-trimethylhexane Chemical compound O=C=NCCC(C)CC(C)(C)CN=C=O ATOUXIOKEJWULN-UHFFFAOYSA-N 0.000 description 1
- XQTSHPKZMZENSB-UHFFFAOYSA-N 1-(3-bromopropyl)pyrrole-2,5-dione Chemical compound BrCCCN1C(=O)C=CC1=O XQTSHPKZMZENSB-UHFFFAOYSA-N 0.000 description 1
- SWVSKCPPMNGBGL-UHFFFAOYSA-N 10-aminodecan-1-ol Chemical compound NCCCCCCCCCCO SWVSKCPPMNGBGL-UHFFFAOYSA-N 0.000 description 1
- CFKBCVIYTWDYRP-UHFFFAOYSA-N 10-phosphonooxydecyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCCCCCCCCCOP(O)(O)=O CFKBCVIYTWDYRP-UHFFFAOYSA-N 0.000 description 1
- JGMOKGBVKVMRFX-UHFFFAOYSA-N 17-acetyl-10,13-dimethyl-1,2,8,9,11,12,14,15,16,17-decahydrocyclopenta[a]phenanthren-3-one Chemical compound C1=CC2=CC(=O)CCC2(C)C2C1C1CCC(C(=O)C)C1(C)CC2 JGMOKGBVKVMRFX-UHFFFAOYSA-N 0.000 description 1
- KWVGIHKZDCUPEU-UHFFFAOYSA-N 2,2-dimethoxy-2-phenylacetophenone Chemical compound C=1C=CC=CC=1C(OC)(OC)C(=O)C1=CC=CC=C1 KWVGIHKZDCUPEU-UHFFFAOYSA-N 0.000 description 1
- CHFHDBOJMWAJGI-UHFFFAOYSA-N 2-(10-hydroxydecyl)-3a,4,7,7a-tetrahydro-4,7-epoxyisoindole-1,3-dione Chemical compound OCCCCCCCCCCN1C(=O)C2C3OC(C=C3)C2C1=O CHFHDBOJMWAJGI-UHFFFAOYSA-N 0.000 description 1
- IBDVWXAVKPRHCU-UHFFFAOYSA-N 2-(2-methylprop-2-enoyloxy)ethyl 3-oxobutanoate Chemical compound CC(=O)CC(=O)OCCOC(=O)C(C)=C IBDVWXAVKPRHCU-UHFFFAOYSA-N 0.000 description 1
- RNQMRGKIIJATHS-UHFFFAOYSA-N 2-(3-prop-2-enoyloxypropoxy)ethylphosphonic acid Chemical compound OP(O)(=O)CCOCCCOC(=O)C=C RNQMRGKIIJATHS-UHFFFAOYSA-N 0.000 description 1
- OBTZDIRUQWFRFZ-UHFFFAOYSA-N 2-(5-methylfuran-2-yl)-n-(4-methylphenyl)quinoline-4-carboxamide Chemical compound O1C(C)=CC=C1C1=CC(C(=O)NC=2C=CC(C)=CC=2)=C(C=CC=C2)C2=N1 OBTZDIRUQWFRFZ-UHFFFAOYSA-N 0.000 description 1
- JPMRGPPMXHGKRO-UHFFFAOYSA-N 2-(chloromethyl)pyridine hydrochloride Chemical compound Cl.ClCC1=CC=CC=N1 JPMRGPPMXHGKRO-UHFFFAOYSA-N 0.000 description 1
- JKNCOURZONDCGV-UHFFFAOYSA-N 2-(dimethylamino)ethyl 2-methylprop-2-enoate Chemical compound CN(C)CCOC(=O)C(C)=C JKNCOURZONDCGV-UHFFFAOYSA-N 0.000 description 1
- LYRWNAXKUQELGU-UHFFFAOYSA-N 2-Methacryloyloxyethyl phenyl phosphate Chemical compound CC(=C)C(=O)OCCOP(O)(=O)OC1=CC=CC=C1 LYRWNAXKUQELGU-UHFFFAOYSA-N 0.000 description 1
- TXBCBTDQIULDIA-UHFFFAOYSA-N 2-[[3-hydroxy-2,2-bis(hydroxymethyl)propoxy]methyl]-2-(hydroxymethyl)propane-1,3-diol Chemical compound OCC(CO)(CO)COCC(CO)(CO)CO TXBCBTDQIULDIA-UHFFFAOYSA-N 0.000 description 1
- NLGDWWCZQDIASO-UHFFFAOYSA-N 2-hydroxy-1-(7-oxabicyclo[4.1.0]hepta-1,3,5-trien-2-yl)-2-phenylethanone Chemical compound OC(C(=O)c1cccc2Oc12)c1ccccc1 NLGDWWCZQDIASO-UHFFFAOYSA-N 0.000 description 1
- SGRBRAQXECVTBV-UHFFFAOYSA-N 2-methyl-n-propan-2-ylbutan-2-amine Chemical compound CCC(C)(C)NC(C)C SGRBRAQXECVTBV-UHFFFAOYSA-N 0.000 description 1
- JZQHTTYHPIAPCZ-UHFFFAOYSA-N 2-prop-1-en-2-yloxirane Chemical compound CC(=C)C1CO1 JZQHTTYHPIAPCZ-UHFFFAOYSA-N 0.000 description 1
- DYTFHCXVBKNMNJ-UHFFFAOYSA-N 3-(2,5-dioxopyrrol-1-yl)propylphosphonic acid Chemical compound OP(O)(=O)CCCN1C(=O)C=CC1=O DYTFHCXVBKNMNJ-UHFFFAOYSA-N 0.000 description 1
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 1
- OXTNCQMOKLOUAM-UHFFFAOYSA-N 3-Oxoglutaric acid Chemical compound OC(=O)CC(=O)CC(O)=O OXTNCQMOKLOUAM-UHFFFAOYSA-N 0.000 description 1
- KVAPQRRKYFVCPC-UHFFFAOYSA-N 3-[1,3-dioxo-7-(phosphonooxymethyl)-4,7a-dihydro-3ah-octahydro-1h-4,7-epoxyisoindol-2-yl]propyl 2-methylprop-2-enoate Chemical compound C1=CC2OC1(COP(O)(O)=O)C1C2C(=O)N(CCCOC(=O)C(=C)C)C1=O KVAPQRRKYFVCPC-UHFFFAOYSA-N 0.000 description 1
- MHSOAJHLLSVFGP-UHFFFAOYSA-N 3-[7-(11-hydroxyundecoxymethyl)-1,3-dioxo-4,7a-dihydro-3aH-4,7-epoxyisoindol-2-yl]propyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCCN1C(=O)C2C3OC(COCCCCCCCCCCCO)(C=C3)C2C1=O MHSOAJHLLSVFGP-UHFFFAOYSA-N 0.000 description 1
- YAKORWDPUKAVJK-UHFFFAOYSA-N 3-[7-(hydroxymethyl)-1,3-dioxo-4,7a-dihydro-3aH-4,7-epoxyisoindol-2-yl]propyl 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)OCCCN1C(=O)C2C3OC(CO)(C=C3)C2C1=O YAKORWDPUKAVJK-UHFFFAOYSA-N 0.000 description 1
- CQQSQBRPAJSTFB-UHFFFAOYSA-N 4-(bromomethyl)benzoic acid Chemical compound OC(=O)C1=CC=C(CBr)C=C1 CQQSQBRPAJSTFB-UHFFFAOYSA-N 0.000 description 1
- 125000001999 4-Methoxybenzoyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C(*)=O 0.000 description 1
- YYVYAPXYZVYDHN-UHFFFAOYSA-N 9,10-phenanthroquinone Chemical compound C1=CC=C2C(=O)C(=O)C3=CC=CC=C3C2=C1 YYVYAPXYZVYDHN-UHFFFAOYSA-N 0.000 description 1
- 239000004342 Benzoyl peroxide Substances 0.000 description 1
- OMPJBNCRMGITSC-UHFFFAOYSA-N Benzoylperoxide Chemical compound C=1C=CC=CC=1C(=O)OOC(=O)C1=CC=CC=C1 OMPJBNCRMGITSC-UHFFFAOYSA-N 0.000 description 1
- LCFVJGUPQDGYKZ-UHFFFAOYSA-N Bisphenol A diglycidyl ether Chemical compound C=1C=C(OCC2OC2)C=CC=1C(C)(C)C(C=C1)=CC=C1OCC1CO1 LCFVJGUPQDGYKZ-UHFFFAOYSA-N 0.000 description 1
- 229920002799 BoPET Polymers 0.000 description 1
- 238000006418 Brown reaction Methods 0.000 description 1
- YTPMMHRVMUWHIK-UHFFFAOYSA-N CC(C(OCCCN(C(C(CC1)C2C1(COC(C(C)=C)=O)C=C)=O)C2=O)=O)=C Chemical compound CC(C(OCCCN(C(C(CC1)C2C1(COC(C(C)=C)=O)C=C)=O)C2=O)=O)=C YTPMMHRVMUWHIK-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 description 1
- 229920001651 Cyanoacrylate Polymers 0.000 description 1
- QSJXEFYPDANLFS-UHFFFAOYSA-N Diacetyl Chemical group CC(=O)C(C)=O QSJXEFYPDANLFS-UHFFFAOYSA-N 0.000 description 1
- 238000005698 Diels-Alder reaction Methods 0.000 description 1
- BUDQDWGNQVEFAC-UHFFFAOYSA-N Dihydropyran Chemical compound C1COC=CC1 BUDQDWGNQVEFAC-UHFFFAOYSA-N 0.000 description 1
- 239000005977 Ethylene Substances 0.000 description 1
- KRHYYFGTRYWZRS-UHFFFAOYSA-M Fluoride anion Chemical compound [F-] KRHYYFGTRYWZRS-UHFFFAOYSA-M 0.000 description 1
- 239000002841 Lewis acid Substances 0.000 description 1
- 206010061274 Malocclusion Diseases 0.000 description 1
- 238000005654 Michaelis-Arbuzov synthesis reaction Methods 0.000 description 1
- 238000010546 Norrish type I reaction Methods 0.000 description 1
- 238000006086 Paal-Knorr synthesis reaction Methods 0.000 description 1
- 239000005662 Paraffin oil Substances 0.000 description 1
- 229920002396 Polyurea Polymers 0.000 description 1
- WUGQZFFCHPXWKQ-UHFFFAOYSA-N Propanolamine Chemical compound NCCCO WUGQZFFCHPXWKQ-UHFFFAOYSA-N 0.000 description 1
- KEAYESYHFKHZAL-UHFFFAOYSA-N Sodium Chemical compound [Na] KEAYESYHFKHZAL-UHFFFAOYSA-N 0.000 description 1
- 244000028419 Styrax benzoin Species 0.000 description 1
- 235000000126 Styrax benzoin Nutrition 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 235000008411 Sumatra benzointree Nutrition 0.000 description 1
- GSEJCLTVZPLZKY-UHFFFAOYSA-N Triethanolamine Chemical compound OCCN(CCO)CCO GSEJCLTVZPLZKY-UHFFFAOYSA-N 0.000 description 1
- MMCVBYKTEMVMBF-UHFFFAOYSA-N [1,3-dioxo-2-(10-phosphonooxydecyl)-7,7a-dihydro-3ah-octahydro-1h-4,7-epoxyisoindol-4-yl]methyl 2-methylprop-2-enoate Chemical compound O=C1N(CCCCCCCCCCOP(O)(O)=O)C(=O)C2C1C1(COC(=O)C(=C)C)C=CC2O1 MMCVBYKTEMVMBF-UHFFFAOYSA-N 0.000 description 1
- PUCSXJXFFCTRSD-UHFFFAOYSA-N [1,3-dioxo-2-(3-triethoxysilylpropyl)-7,7a-dihydro-3aH-4,7-epoxyisoindol-4-yl]methyl 2-methylprop-2-enoate Chemical compound CCO[Si](CCCN1C(=O)C2C3OC(COC(=O)C(C)=C)(C=C3)C2C1=O)(OCC)OCC PUCSXJXFFCTRSD-UHFFFAOYSA-N 0.000 description 1
- 239000004480 active ingredient Substances 0.000 description 1
- 125000002252 acyl group Chemical group 0.000 description 1
- 239000004840 adhesive resin Substances 0.000 description 1
- 229920006223 adhesive resin Polymers 0.000 description 1
- PYKYMHQGRFAEBM-UHFFFAOYSA-N anthraquinone Natural products CCC(=O)c1c(O)c2C(=O)C3C(C=CC=C3O)C(=O)c2cc1CC(=O)OC PYKYMHQGRFAEBM-UHFFFAOYSA-N 0.000 description 1
- 150000004056 anthraquinones Chemical class 0.000 description 1
- 229910052787 antimony Inorganic materials 0.000 description 1
- WATWJIUSRGPENY-UHFFFAOYSA-N antimony atom Chemical compound [Sb] WATWJIUSRGPENY-UHFFFAOYSA-N 0.000 description 1
- 239000003849 aromatic solvent Substances 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 229940125717 barbiturate Drugs 0.000 description 1
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 1
- VJRITMATACIYAF-UHFFFAOYSA-N benzenesulfonohydrazide Chemical compound NNS(=O)(=O)C1=CC=CC=C1 VJRITMATACIYAF-UHFFFAOYSA-N 0.000 description 1
- 229960002130 benzoin Drugs 0.000 description 1
- RWCCWEUUXYIKHB-UHFFFAOYSA-N benzophenone Chemical compound C=1C=CC=CC=1C(=O)C1=CC=CC=C1 RWCCWEUUXYIKHB-UHFFFAOYSA-N 0.000 description 1
- 150000008366 benzophenones Chemical class 0.000 description 1
- 150000001565 benzotriazoles Chemical class 0.000 description 1
- 235000019400 benzoyl peroxide Nutrition 0.000 description 1
- 239000012455 biphasic mixture Substances 0.000 description 1
- 238000004061 bleaching Methods 0.000 description 1
- 238000005282 brightening Methods 0.000 description 1
- 229910000019 calcium carbonate Inorganic materials 0.000 description 1
- 125000005587 carbonate group Chemical class 0.000 description 1
- 125000002843 carboxylic acid group Chemical group 0.000 description 1
- 150000001735 carboxylic acids Chemical class 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 239000003054 catalyst Substances 0.000 description 1
- 229910010293 ceramic material Inorganic materials 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 230000000052 comparative effect Effects 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- NLCKLZIHJQEMCU-UHFFFAOYSA-N cyano prop-2-enoate Chemical class C=CC(=O)OC#N NLCKLZIHJQEMCU-UHFFFAOYSA-N 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 210000003298 dental enamel Anatomy 0.000 description 1
- 150000004985 diamines Chemical class 0.000 description 1
- RCJVRSBWZCNNQT-UHFFFAOYSA-N dichloridooxygen Chemical compound ClOCl RCJVRSBWZCNNQT-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 1
- XVKKIGYVKWTOKG-UHFFFAOYSA-N diphenylphosphoryl(phenyl)methanone Chemical compound C=1C=CC=CC=1P(=O)(C=1C=CC=CC=1)C(=O)C1=CC=CC=C1 XVKKIGYVKWTOKG-UHFFFAOYSA-N 0.000 description 1
- 238000001035 drying Methods 0.000 description 1
- 230000000694 effects Effects 0.000 description 1
- 239000003822 epoxy resin Substances 0.000 description 1
- 238000005530 etching Methods 0.000 description 1
- NLFBCYMMUAKCPC-KQQUZDAGSA-N ethyl (e)-3-[3-amino-2-cyano-1-[(e)-3-ethoxy-3-oxoprop-1-enyl]sulfanyl-3-oxoprop-1-enyl]sulfanylprop-2-enoate Chemical compound CCOC(=O)\C=C\SC(=C(C#N)C(N)=O)S\C=C\C(=O)OCC NLFBCYMMUAKCPC-KQQUZDAGSA-N 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 235000013355 food flavoring agent Nutrition 0.000 description 1
- QQYNRBAAQFZCLF-UHFFFAOYSA-N furan-maleic anhydride adduct Chemical compound O1C2C3C(=O)OC(=O)C3C1C=C2 QQYNRBAAQFZCLF-UHFFFAOYSA-N 0.000 description 1
- 229910052732 germanium Inorganic materials 0.000 description 1
- GNPVGFCGXDBREM-UHFFFAOYSA-N germanium atom Chemical compound [Ge] GNPVGFCGXDBREM-UHFFFAOYSA-N 0.000 description 1
- 239000002241 glass-ceramic Substances 0.000 description 1
- 235000019382 gum benzoic Nutrition 0.000 description 1
- 229940042795 hydrazides for tuberculosis treatment Drugs 0.000 description 1
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 1
- AMGQUBHHOARCQH-UHFFFAOYSA-N indium;oxotin Chemical compound [In].[Sn]=O AMGQUBHHOARCQH-UHFFFAOYSA-N 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 229910052500 inorganic mineral Chemical class 0.000 description 1
- XEEYBQQBJWHFJM-UHFFFAOYSA-N iron Substances [Fe] XEEYBQQBJWHFJM-UHFFFAOYSA-N 0.000 description 1
- LIKBJVNGSGBSGK-UHFFFAOYSA-N iron(3+);oxygen(2-) Chemical compound [O-2].[O-2].[O-2].[Fe+3].[Fe+3] LIKBJVNGSGBSGK-UHFFFAOYSA-N 0.000 description 1
- SZVJSHCCFOBDDC-UHFFFAOYSA-N iron(II,III) oxide Inorganic materials O=[Fe]O[Fe]O[Fe]=O SZVJSHCCFOBDDC-UHFFFAOYSA-N 0.000 description 1
- 230000001678 irradiating effect Effects 0.000 description 1
- 150000007517 lewis acids Chemical class 0.000 description 1
- 239000004611 light stabiliser Substances 0.000 description 1
- 230000005291 magnetic effect Effects 0.000 description 1
- 229910052748 manganese Inorganic materials 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 150000002739 metals Chemical class 0.000 description 1
- 125000001434 methanylylidene group Chemical group [H]C#[*] 0.000 description 1
- 230000003641 microbiacidal effect Effects 0.000 description 1
- 239000011707 mineral Chemical class 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- GYVGXEWAOAAJEU-UHFFFAOYSA-N n,n,4-trimethylaniline Chemical compound CN(C)C1=CC=C(C)C=C1 GYVGXEWAOAAJEU-UHFFFAOYSA-N 0.000 description 1
- YXAKNAQXSTZETP-UHFFFAOYSA-N n-(5-hydroxypentyl)-2-methylprop-2-enamide Chemical compound CC(=C)C(=O)NCCCCCO YXAKNAQXSTZETP-UHFFFAOYSA-N 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 229910052759 nickel Inorganic materials 0.000 description 1
- PXHVJJICTQNCMI-UHFFFAOYSA-N nickel Substances [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 150000007530 organic bases Chemical class 0.000 description 1
- 125000002524 organometallic group Chemical group 0.000 description 1
- AUONHKJOIZSQGR-UHFFFAOYSA-N oxophosphane Chemical compound P=O AUONHKJOIZSQGR-UHFFFAOYSA-N 0.000 description 1
- BPUBBGLMJRNUCC-UHFFFAOYSA-N oxygen(2-);tantalum(5+) Chemical compound [O-2].[O-2].[O-2].[O-2].[O-2].[Ta+5].[Ta+5] BPUBBGLMJRNUCC-UHFFFAOYSA-N 0.000 description 1
- RVTZCBVAJQQJTK-UHFFFAOYSA-N oxygen(2-);zirconium(4+) Chemical compound [O-2].[O-2].[Zr+4] RVTZCBVAJQQJTK-UHFFFAOYSA-N 0.000 description 1
- FZUGPQWGEGAKET-UHFFFAOYSA-N parbenate Chemical compound CCOC(=O)C1=CC=C(N(C)C)C=C1 FZUGPQWGEGAKET-UHFFFAOYSA-N 0.000 description 1
- PNJWIWWMYCMZRO-UHFFFAOYSA-N pent‐4‐en‐2‐one Natural products CC(=O)CC=C PNJWIWWMYCMZRO-UHFFFAOYSA-N 0.000 description 1
- IEQIEDJGQAUEQZ-UHFFFAOYSA-N phthalocyanine Chemical compound N1C(N=C2C3=CC=CC=C3C(N=C3C4=CC=CC=C4C(=N4)N3)=N2)=C(C=CC=C2)C2=C1N=C1C2=CC=CC=C2C4=N1 IEQIEDJGQAUEQZ-UHFFFAOYSA-N 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004014 plasticizer Substances 0.000 description 1
- 229910052697 platinum Inorganic materials 0.000 description 1
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 1
- 229920000647 polyepoxide Polymers 0.000 description 1
- 229920002635 polyurethane Polymers 0.000 description 1
- 239000004814 polyurethane Substances 0.000 description 1
- 150000004032 porphyrins Chemical class 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- ZJLMKPKYJBQJNH-UHFFFAOYSA-N propane-1,3-dithiol Chemical compound SCCCS ZJLMKPKYJBQJNH-UHFFFAOYSA-N 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 230000001698 pyrogenic effect Effects 0.000 description 1
- 150000004040 pyrrolidinones Chemical class 0.000 description 1
- 239000010453 quartz Substances 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- 230000002285 radioactive effect Effects 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 239000012966 redox initiator Substances 0.000 description 1
- 229920005989 resin Polymers 0.000 description 1
- 239000011347 resin Substances 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229940058287 salicylic acid derivative anticestodals Drugs 0.000 description 1
- 150000003872 salicylic acid derivatives Chemical class 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- RMAQACBXLXPBSY-UHFFFAOYSA-N silicic acid Chemical compound O[Si](O)(O)O RMAQACBXLXPBSY-UHFFFAOYSA-N 0.000 description 1
- 239000000377 silicon dioxide Substances 0.000 description 1
- JVBXVOWTABLYPX-UHFFFAOYSA-L sodium dithionite Chemical compound [Na+].[Na+].[O-]S(=O)S([O-])=O JVBXVOWTABLYPX-UHFFFAOYSA-L 0.000 description 1
- 239000012312 sodium hydride Substances 0.000 description 1
- 229910000104 sodium hydride Inorganic materials 0.000 description 1
- CHLCPTJLUJHDBO-UHFFFAOYSA-M sodium;benzenesulfinate Chemical compound [Na+].[O-]S(=O)C1=CC=CC=C1 CHLCPTJLUJHDBO-UHFFFAOYSA-M 0.000 description 1
- 239000011877 solvent mixture Substances 0.000 description 1
- 239000004071 soot Substances 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 239000007858 starting material Substances 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- BUUPQKDIAURBJP-UHFFFAOYSA-N sulfinic acid Chemical compound OS=O BUUPQKDIAURBJP-UHFFFAOYSA-N 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- PBCFLUZVCVVTBY-UHFFFAOYSA-N tantalum pentoxide Inorganic materials O=[Ta](=O)O[Ta](=O)=O PBCFLUZVCVVTBY-UHFFFAOYSA-N 0.000 description 1
- BGQMOFGZRJUORO-UHFFFAOYSA-M tetrapropylammonium bromide Chemical compound [Br-].CCC[N+](CCC)(CCC)CCC BGQMOFGZRJUORO-UHFFFAOYSA-M 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 229920001169 thermoplastic Polymers 0.000 description 1
- 125000005409 triarylsulfonium group Chemical group 0.000 description 1
- 150000003918 triazines Chemical class 0.000 description 1
- BDZBKCUKTQZUTL-UHFFFAOYSA-N triethyl phosphite Chemical compound CCOP(OCC)OCC BDZBKCUKTQZUTL-UHFFFAOYSA-N 0.000 description 1
- 239000013638 trimer Substances 0.000 description 1
- 238000005292 vacuum distillation Methods 0.000 description 1
- XASAPYQVQBKMIN-UHFFFAOYSA-K ytterbium(iii) fluoride Chemical compound F[Yb](F)F XASAPYQVQBKMIN-UHFFFAOYSA-K 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- 239000011592 zinc chloride Substances 0.000 description 1
- 235000005074 zinc chloride Nutrition 0.000 description 1
- 229910001928 zirconium oxide Inorganic materials 0.000 description 1
- 229910000859 α-Fe Inorganic materials 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/80—Preparations for artificial teeth, for filling teeth or for capping teeth
- A61K6/884—Preparations for artificial teeth, for filling teeth or for capping teeth comprising natural or synthetic resins
- A61K6/887—Compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
- A61K6/889—Polycarboxylate cements; Glass ionomer cements
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/15—Compositions characterised by their physical properties
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/80—Preparations for artificial teeth, for filling teeth or for capping teeth
- A61K6/884—Preparations for artificial teeth, for filling teeth or for capping teeth comprising natural or synthetic resins
- A61K6/887—Compounds obtained by reactions only involving carbon-to-carbon unsaturated bonds
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/47—One nitrogen atom and one oxygen or sulfur atom, e.g. cytosine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07F—ACYCLIC, CARBOCYCLIC OR HETEROCYCLIC COMPOUNDS CONTAINING ELEMENTS OTHER THAN CARBON, HYDROGEN, HALOGEN, OXYGEN, NITROGEN, SULFUR, SELENIUM OR TELLURIUM
- C07F3/00—Compounds containing elements of Groups 2 or 12 of the Periodic Table
- C07F3/06—Zinc compounds
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08F—MACROMOLECULAR COMPOUNDS OBTAINED BY REACTIONS ONLY INVOLVING CARBON-TO-CARBON UNSATURATED BONDS
- C08F122/00—Homopolymers of compounds having one or more unsaturated aliphatic radicals each having only one carbon-to-carbon double bond, and at least one being terminated by a carboxyl radical and containing at least one other carboxyl radical in the molecule; Salts, anhydrides, esters, amides, imides or nitriles thereof
- C08F122/10—Esters
- C08F122/12—Esters of phenols or saturated alcohols
- C08F122/22—Esters containing nitrogen
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K6/00—Preparations for dentistry
- A61K6/30—Compositions for temporarily or permanently fixing teeth or palates, e.g. primers for dental adhesives
Landscapes
- Health & Medical Sciences (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Life Sciences & Earth Sciences (AREA)
- Epidemiology (AREA)
- Plastic & Reconstructive Surgery (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Medicinal Chemistry (AREA)
- Polymers & Plastics (AREA)
- Dental Preparations (AREA)
- Addition Polymer Or Copolymer, Post-Treatments, Or Chemical Modifications (AREA)
Abstract
본 발명은 화학식 I의 열불안정성 또는 광불안정성 중합가능한 화합물을 포함하는 치과용 수복 재료에 관한 것이다:
[화학식 I]
[(Z1)m-Q1-X)]k-T-[Y-Q2-(Z2)n]l
상기 식에서,
T는 열불안정성 또는 광불안정성 기를 나타내고, Z1 및 Z2는 각 경우에 독립적으로 비닐 기, CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 -Si(OR)3, -COOH, -O-PO(OH)2, -PO(OH)2, -SO2OH 및 -SH에서 선택된 접착성 기를 나타내고, 여기서 하나 이상의 Z1 또는 Z2는 중합가능한 기이고, Q1는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내고, Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내고, X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-을 나타내고, R, R1, R2 및 R3은 각 경우에 독립적으로 H 또는 C1-C7 알킬 라디칼을 나타내고 k, l, m 및 n은 각 경우에 독립적으로 1, 2 또는 3이다.
[화학식 I]
[(Z1)m-Q1-X)]k-T-[Y-Q2-(Z2)n]l
상기 식에서,
T는 열불안정성 또는 광불안정성 기를 나타내고, Z1 및 Z2는 각 경우에 독립적으로 비닐 기, CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 -Si(OR)3, -COOH, -O-PO(OH)2, -PO(OH)2, -SO2OH 및 -SH에서 선택된 접착성 기를 나타내고, 여기서 하나 이상의 Z1 또는 Z2는 중합가능한 기이고, Q1는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내고, Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내고, X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-을 나타내고, R, R1, R2 및 R3은 각 경우에 독립적으로 H 또는 C1-C7 알킬 라디칼을 나타내고 k, l, m 및 n은 각 경우에 독립적으로 1, 2 또는 3이다.
Description
본 발명은 온디맨드 탈착(DoD) 특성을 갖는 단량체, 및 특히 접착제 및 시멘트를 제조하기 위한 치과용 재료에서 단량체 성분으로서의 이의 용도에 관한 것이다.
다시 탈착할 수 있는 접착제 접합은 다양한 기술 분야에서 점점 더 중요하다. 자동화된 제조 공정의 관점에서 성분의 탈착, 서브성분이 접착제 접합된 복합 성분의 수선 또는 제품 수명의 종료시 그러한 성분을 재활용할 경우 재료 분리의 간소화가 그 예이다. 접착제 접합의 탈착은 예를 들어 가열에 의해 접착제 접합 층의 강도를 유의적으로 감소시킴으로써 필요시마다 실현될 수 있다.
따라서, DE 제198 32 629호 A1에는 폴리우레탄, 폴리우레아 또는 에폭시 수지를 기초로 하는 가역적 접착제 접합을 형성하는 접착제 시스템으로서, 추가 성분은 접착제 성분의 분해가 일어나도록 에너지를 도입시킴으로써 활성화될 수 있는 접착제 시스템이 기술된다. 예를 들면, 접착제 수지의 분해를 초래하는 유기 염기 또는 산은 열 또는 복사 에너지를 도입시킴으로써 차단된 전구체로부터 방출될 수 있다.
WO 제2010/128042호 A1에는 일반적인 접착제 매트릭스 및 미립자 팽창 재료, 예컨대 아조디카르본아미드 등으로 이루어진 항공기 또는 자동차 구성물의 탈착가능한 접착제 접합을 위한 산업용 접착제 조성물이 기술된다. 상기 성분은 접착제 접합을 적어도 팽창 재료의 팽창 온도로 가열함으로써 탈착된다.
치과 분야에서, 접착제 접합의 탈착은, 성공적인 교정 후 치아 에나멜의 손상 없이 치아 표면에 접착제 접합시켜 부정교합을 교정하는 브라켓(bracket)을 다시 제거해야 하는 치과교정술에 있어 특히 중요하다. 게다가, 기계적으로 제거가 어려운 고강도 세라믹 수복물(restoration) 또는 크라운의 수선 또는 완전한 교체의 경우, 쉽게 연화되거나 또는 분리될 수 있는 시멘트 접합이 유리할 것이다.
치과교정 분야와 관련하여, US 제2007/0142498호 A1에는 열적으로 조절가능한 첨가제, 예컨대 열가소성 중합체 등을 함유하는 치과용 조성물이 기술된다.
US 제2007/0142497호 A1에는 산 불안정성 3차 카르보네이트 기 및 광산을 갖는 디메타크릴레이트를 기초로 하는 치과용 조성물, 예컨대 트리아릴설포늄 염 등이 기술된다. 이러한 조성물은 가시 범위 내 광으로 적당한 개시제, 예컨대 비스아실 포스핀 옥시드 이르가큐어(Irgacure) 819 등에 의해 광화학적으로 경화되고(광접합) 증가된 온도에서 UV광을 조사함으로써 다시 연화될 수 있다(광열 탈착).
본 발명의 목적은 중합가능하고, 특히 치아 구조 및/또는 치과용 세라믹에 우수한 기재 접착력을 제시하며 열 도입에 의해 기재로부터 탈착되고, 이에 따라 온디맨드 탈착 특성을 갖는 접착제 또는 복합 시멘트를 제조하기에 특히 적당한 접착성 치과용 수복(restorative) 재료를 제공하는 것이다.
이러한 목적은 본 발명에 따라 하기 화학식 I의 열불안정성(thermolabile) 또는 광불안정성(photolabile) 중합가능한 화합물을 기초로 하는 치과용 수복 재료에 의해 실현된다:
[화학식 I]
[(Z1)m-Q1-X)]k-T-[Y-Q2-(Z2)n]l
상기 식에서,
T는 열불안정성 또는 광불안정성 기를 나타내고,
Z1 및 Z2는 각 경우에 독립적으로 비닐 기, CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 -Si(OR)3, -COOH, -O-PO(OH)2, -PO(OH)2, -SO2OH 및 -SH에서 선택된 접착성 기를 나타내고, 하나 이상의 Z1 또는 Z2는 중합가능한 기이며,
Q1는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3이 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내며,
X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3을 나타내고,
R, R1, R2 및 R3은 각 경우에 독립적으로 H 또는 C1-C7 알킬 라디칼을 나타내며
k, l, m 및 n은 각 경우에 독립적으로 1, 2 또는 3이다.
구체예에서, 하나 이상의 Z1 또는 Z2는 중합가능한 기이고 하나 이상의 Z1 또는 Z2는 접착성 기이다. 이러한 문맥에서 Z1 및 Z2 중 하나가 중합가능한 기를 나타내고 Z1 및 Z2 중 다른 하나가 접착성 기를 나타내는 상기 화학식 I의 화합물이 바람직하다. 또다른 구체예에서, Z1 및 Z2는 둘다 중합가능한 기를 나타낸다.
라디칼이 기, 예컨대 -O- 등이 개재될 수 있다는 표시는, 기가 라디칼의 탄소쇄에 삽입되는 것, 즉 양측 상에 탄소 원자로 경계를 이룬다는 것을 이해할 것이다. 따라서 이러한 기의 갯수는 탄소 원자의 갯수보다 적어도 1개 미만이고 그 기는 말단에 존재할 수 없다. 본 발명에 따르면, 지정된 기가 개재되지 않은 라디칼이 바람직하다.
본 발명에 따르면, 화학적 원자가 이론에 적합한 화합물만이 고려된다.
각 경우에 서로 독립적으로
Z1 및 Z2 중 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 바람직하게는 -Si(OR)3, -COOH, -O-PO(OH)2, -PO(OH)2, -SO2OH 및 -SH에서 선택된 접착성 기를 나타내고,
Q1는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, 또는 -NR3-CO-가 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C10 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-가 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C10 라디칼을 나타내고,
X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-를 나타내고,
R은 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R1은 각 경우에 독립적으로 H 또는 CH3이고,
R2는 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R3은 각 경우에 독립적으로 H, CH3 또는 C2H5이고/이거나,
k, l, m 및 n은 각 경우에 독립적으로 1 또는 2인 화학식 I의 이러한 화합물이 특히 바람직하다.
모든 변수가 각각 상기 정의된 바람직한 의미 중 하나를 갖는 화합물이 특히 바람직하다.
바람직한 구체예에서, T는 열불안정성 기이다.
Z1 및 Z2는 각 경우에 독립적으로 비닐 기, CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 -O-PO(OH)2, -PO(OH)2 및 -SO2OH에서 선택된 산 기를 나타내고, 여기서 하나 이상의 Z1 또는 Z2는 중합가능한 기이고 하나 이상의 Z1 또는 Z2는 산 기이고,
Q1은 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-가 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C10 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-가 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C10 라디칼을 나타내고,
X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-를 나타내고,
R1, R2 및 R3은 각 경우에 독립적으로 H 또는 C1-C7 알킬 라디칼을 나타내고,
k, l, m 및 n은 각 경우에 독립적으로 1, 2 또는 3인 화학식 I의 이러한 화합물이 문맥상 바람직하다.
이러한 문맥에서 화학식 I의 이러한 화합물은 Z1 및 Z2 중 하나가 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나가 산 기를 나타내는 것이 바람직하다.
각 경우에 서로 독립적으로
Z1 및 Z2 중 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나는 각 경우에 독립적으로 -O-PO(OH)2 및 -PO(OH)2 및 -SO2OH에서 선택된 산 기를 나타내고,
Q1은 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-가 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C10 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-가 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C10 라디칼을 나타내고,
X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3- 또는 -NR3-CO-를 나타내고,
R1은 각 경우에 독립적으로 H 또는 CH3이고,
R2는 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R3은 각 경우에 독립적으로 H, CH3 또는 C2H5이고/이거나,
k, l, m 및 n은 각 경우에 독립적으로 1 또는 2인 화학식 I의 이러한 화합물이 문맥상 특히 바람직하다.
모든 변수가 각각 상기 정의된 바람직한 의미 중 하나를 갖는 화합물이 특히 바람직하다.
적당한 열불안정성 기는 자체 기술 분야에 공지되어 있다. 이것은 본 발명에 따라 하나 이상의 열불안정성 공유 결합을 함유한다는 점을 특징으로 한다. 열불안정성 공유 결합을 갖는 바람직한 열불안정성 기는 열불안정성 알콕시아민, 옥심-에스테르, 옥심-우레탄 또는 아조 기뿐만 아니라 열불안정성 고리화첨가(cycloaddition) 부가물, 예컨대 디일스-알더(Diels-Alder) 부가물, 헤테로-디일스-알더 부가물을 포함한다. 열불안정성 기의 예는 또한 문헌[R. J. Wojtecki et al., Nature Materials 2011, 10, 14-27]에 기술되어 있다.
특히, T는
로 이루어진 군에서 선택된 열불안정성 기인 화학식 I의 이러한 화합물이 바람직하다:
상기 식에서,
R4는 H 또는 C1-C10 알킬 라디칼이고,
R5는 H, C1-C5 알킬 라디칼, F 또는 CN이고,
R6은 H, C1-C5 알킬 라디칼, F 또는 CN이고,
R9는 각 경우에 독립적으로 CH3, C2H5, OCH3 또는 OC2H5이고
p는 각 경우에 독립적으로 0, 1, 2 또는 3이다.
본 발명에 따르면, 화학식 I의 열불안정성 중합가능한 화합물이 화학식 II의 디일스-알더 부가물인 치과용 재료가 특히 바람직하다:
[화학식 II]
상기 식에서, 제시된 변수는 상기 정의된 의미를 갖는다. 본 발명에 따르면, 화학식 II는 순수한 엑소 생성물 또는 순수한 엔도 생성물 및 엑소와 엔도 생성물의 혼합물을 포함한다.
이러한 문맥에서 각 경우에 서로 독립적으로
Z1 및 Z2 중 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 바람직하게는 -Si(OR)3, -COOH, -O-PO(OH)2, -PO(OH)2, -SO2OH 및 -SH에서 선택된 접착성 기를 나타내고,
Q1은 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C15 라디칼, 바람직하게는 C1-C10 라디칼, 바람직하게는 C1-C8 라디칼, 특히 C2-C6 라디칼, 특히 바람직하게는 C1-C2 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C15 라디칼, 바람직하게는 C1-C10 라디칼, 바람직하게는 C1-C8 라디칼, 특히 C2-C6 라디칼, 특히 바람직하게는 C2-C3 라디칼을 나타내고,
R은 각 경우에 독립적으로 CH3 또는 C2H5이고,
R1은 각 경우에 독립적으로 H 또는 CH3이고,
R2는 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R3은 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R4는 H, CH3 또는 C2H5이고,
R5은 H, F 또는 CN, 특히 H이고,
R6은 H, F 또는 CN, 특히 H이고/이거나
m 및 n은 각 경우에 독립적으로 1 또는 2인 화학식 II의 이러한 화합물이 바람직하다.
각 경우에 서로 독립적으로
Z1 및 Z2 중 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 바람직하게는 -Si(OR)3, -O-PO(OH)2, -PO(OH)2 및 -SH에서 선택된 접착성 기를 나타내고,
Q1은 메틸렌 또는 에틸렌 라디칼을 나타내고,
Q2는 에틸렌 또는 프로필렌 라디칼을 나타내고,
R은 각 경우에 독립적으로 CH3 또는 C2H5이고,
R1은 각 경우에 독립적으로 H 또는 CH3이고,
R2는 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R3은 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R4는 H, CH3 또는 C2H5이고,
R5는 H, F 또는 CN, 특히 H이고,
R6은 H, F 또는 CN, 특히 H이고/이거나,
m 및 n은 각 경우에 1인 화학식 II의 화합물이 특히 바람직하다.
모든 변수가 각각 상기 정의된 바람직한 의미 중 하나를 갖는 화합물이 특히 바람직하다.
또다른 구체예에서, T는 광불안정성 기이다. 적당한 광불안정성 기는 자체 기술 분야에 공지되어 있다. 이것은 통상 하나 이상의 광불안정성 공유 결합을 함유한다는 점을 특징으로 한다. 광불안정성 공유 결합을 갖는 바람직한 광불안정성 기는 벤조인 에테르, 옥시알킬페닐아세토페논, 디알킬옥시아세토페논, 벤조일디페닐포스핀 옥시드, 디벤조일페닐포스핀 옥시드, 디알킬벤조일 및 디알킬디벤조일 게르마늄 유도체를 포함한다.
특히, T가
로 이루어진 군에서 선택된 광불안정성 기인 화학식 I의 이러한 화합물이 바람직하다:
상기 식에서,
R7은 각 경우에 독립적으로 C1-C10 알킬 라디칼을 나타내고,
R8은 각 경우에 독립적으로 C1-C7 알킬 라디칼을 나타내고,
R9는 각 경우에 독립적으로 CH3, C2H5, OCH3 또는 OC2H5이고
p는 각 경우에 독립적으로 0, 1, 2 또는 3이다.
본 발명에 따르면, 화학식 I의 광불안정성 중합가능한 화합물이 화학식 III의 디벤조일페닐포스핀 옥시드 또는 화학식 IV의 디알킬디벤조일 게르마늄 유도체인 치과용 재료가 특히 바람직하다:
[화학식 III]
[화학식 IV]
상기 식에서, 제시된 변수는 상기 정의된 의미를 갖는다.
이러한 문맥에서, 각 경우에 서로 독립적으로
Z1 및 Z2 중 하나는 각 경우에 독립적으로 CH2=CR1CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 바람직하게는 -Si(OR)3, -O-PO(OH)2, -PO(OH)2 및 -SH에서 선택된 접착성 기를 나타내고,
Q1은 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C15 라디칼, 바람직하게는 C1-C10 라디칼, 바람직하게는 C1-C8 라디칼, 특히 C2-C6 라디칼, 특히 바람직하게는 C1-C2 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C15 라디칼, 바람직하게는 C1-C10 라디칼, 바람직하게는 C1-C8 라디칼, 특히 C2-C6 라디칼, 특히 바람직하게는 C2-C3 라디칼을 나타내고,
X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-을 나타내고,
R은 각 경우에 독립적으로 CH3 또는 C2H5이고,
R8은 각 경우에 독립적으로 C1-C5 알킬 라디칼을 나타내고,
m 및 n은 각 경우에 독립적으로 1 또는 2인 화학식 III 및 IV의 이러한 화합물이 바람직하다.
각 경우에 서로 독립적으로
Z1 및 Z2 중 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 바람직하게는 -Si(OR)3, -O-PO(OH)2, -PO(OH)2 및 -SH에서 선택된 접착성 기를 나타내고,
Q1은 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O- 또는 -O-CO-가 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C8 라디칼, 특히 C2-C6 라디칼, 특히 바람직하게는 C1-C2 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O- 또는 -O-CO-가 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C8 라디칼, 특히 C2-C6 라디칼, 특히 바람직하게는 C2-C3 라디칼을 나타내고,
X 및 Y는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O- 또는 -O-CO-를 나타내고,
R은 각 경우에 독립적으로 CH3 또는 C2H5이고,
R8은 각 경우에 독립적으로 C1-C4 알킬 라디칼을 나타내고,
m 및 n은 각 경우에 1인 화학식 III 및 IV의 화합물이 특히 바람직하다.
모든 변수가 각각 상기 정의된 바람직한 의미 중 하나를 갖는 화합물이 특히 바람직하다.
놀랍게도 화학식 I의 하나 이상의 열불안정성 및/또는 하나의 광불안정성 중합가능한 화합물, 바람직하게는 화학식 II의 하나 이상의 열불안정성 중합가능한 화합물 및/또는 화학식 III 또는 IV의 광불안정성 중합가능한 화합물을 포함하는 본 발명에 따른 치과용 수복 재료는 중합 후 한편으로는 치아 구조 및 치과용 세라믹에 대해 탁월한 접착력뿐만 아니라 탁월한 기계적 특성을 나타내고 다른 한편으로는 열 도입에 의해 (열불안정성 접합) 또는 UV 광 또는 가시광 조사에 의해 (광불안정성 접합) 기재로부터 쉽게 탈착될 수 있다는 것을 발견하였다.
화학식 II의 중합가능한 디일스-알더 부가물은 쉽게 제조될 수 있다. 예를 들면, 적절하게 작용기화된 푸란 유도체를, 적절하게 N-작용기화된 말레인이미드와 디일스-알더 반응에 관용적인 반응 조건 하에, 특히 80∼120℃에서, 예를 들어 방향족 용매 중에서 반응시키고, 경우에 따라 중합 억제제(예, 문헌[team of authors, Organikum, Wiley-VCH, 21st ed., Weinheim etc. 2001, 330 et seq.])뿐만 아니라 적당한 촉매(예, 브?스테드 또는 루이스 산)의 첨가를 동반함으로써 상응한 중합가능한 디일스-알더 부가물을 형성할 수 있다:
특정예: 퍼푸릴 메타크릴레이트(Z1 = CH2=CR1-CO-O-, Q1 = -CH2-, R1 = CH3, R4 = H 및 m = 1) 및 N-[3-(디히드록시포스포릴)프로필]-말레인이미드(Z2 = -PO(OH)2, Q2 = -(CH2)3-, R5 및 R6 = H 및 n = 1)의 디일스-알더 반응:
중합가능한 또는 강산성 기로 작용기화된 푸란 유도체의 합성에 적당한 출발 재료는 구입 가능한 것, 예컨대 퍼푸랄, 퍼푸릴 알콜 또는 피로묵산(예, 문헌[Ullmann's Encyclopedia of Industrial Chemistry, 5th Ed., Vol. A 12, VCH, Weinheim etc. 1989, page 119 et seq.])이다. 치환된 푸란 유도체는, 예를 들어 상응한 1,4-디케토 화합물을 가열함으로써 파알-노르(Paal-Knorr) 합성에 의해 제조될 수 있다(예, 문헌[W. Walter, W. Francke, Beyer-Walter Lehrbuch der Organischen Chemie, S. Hirzel Verlag, Stuttgart and Leipzig 2004, 24th ed., page 769]). 중합가능한 또는 강산성 기로 작용기화된 말레인이미드는 말레산 무수물과 상응하게 작용기화된 아민을 반응시킴으로써 가장 쉽게 제조될 수 있다.
화학식 II의 디일스-알더 부가물의 합성 절차는 또한 단계별일 수 있는데, 우선 적절하게 작용기화된 말레인이미드 및 푸란 유도체로부터 적당한 디일스-알더 부가물을 제조하고 나중에 중합가능한 또는 강산성 산 기만을 도입하는데, 여기서 합성은 경우에 따라 보호기를 사용하여 수행된다. 예를 들면, 상기 나열된 디일스-알더 부가물은 예컨대 또한 우선 예컨대 테트라히드로피라닐(THP) 기로 보호되는 퍼푸릴 알콜을 N-(3-브로모프로필)말레인이미드를 갖는 디일스-알더 부가물로 전환시키도록 중합가능한 메타크릴레이트 기 및 강산성 포스폰산 기에 의해 제조될 수 있다. 디일스-알더 부가물과 예를 들어 트리에틸 포스피트(P(OC2H5)3)의 반응으로 예컨대 미카엘리스-아르부조프(Michaelis-Arbuzov) 반응을 통한 포스폰산 기의 도입 후, THP 보호기는 분해될 수 있고, 형성된 OH 기는 예를 들어 메타크릴산 무수물(MAAH)에 의해 메타크릴레이트화될 수 있고 최종적으로 포스폰산 기가 가수분해 방출될 수 있다:
본 발명에 따른 화학식 II의 열불안정성 디일스-알더 부가물의 예는 다음과 같다:
본 발명에 따른 화학식 III의 광불안정성 디벤조일페닐포스핀 옥시드의 예는 다음과 같다:
본 발명에 따른 화학식 IV의 광불안정성 디알킬디벤조일 게르마늄 유도체는 다음과 같다:
본 발명에 따른 치과용 재료는 바람직하게는 화학식 I의 열불안정성 또는 광불안정성 중합가능한 화합물 이외에 하나 이상의 추가 라디칼 중합가능한 단량체(공단량체), 특히 단작용성 또는 다작용성 (메타)아크릴산 유도체를 포함한다. 단작용성 (메타)아크릴산 유도체란 하나의 (메타)아크릴산 기를 갖는 화합물을 의미하고, 다작용성 (메타)아크릴산 유도체란 둘 이상의, 바람직하게는 2∼4개의 (메타)아크릴산 기를 갖는 화합물을 의미한다. 다작용성 단량체는 가교결합 효과를 갖는다.
본 발명에 따른 바람직한 단작용성 또는 다작용성 (메타)아크릴산 유도체는 메틸, 에틸, 히드록시에틸, 부틸, 벤질, 테트라히드로퍼푸릴 또는 이소보르닐 (메타)아크릴레이트, 비스페놀-A-디(메타)아크릴레이트, 비스-GMA(메타크릴산 및 비스페놀 A 디글리시딜 에테르의 부가 생성물), UDMA (2-히드록시에틸 메타크릴레이트(HEMA) 및 2,2,4-트리메틸헥사메틸렌 디이소시아네이트의 부가 생성물), 디-, 트리- 또는 테트라-에틸렌 글리콜 디(메타)아크릴레이트, 트리메틸올프로판 트리(메타)아크릴레이트, 펜타에리트리톨 테트라(메타)아크릴레이트, 글리세롤 디(메타)아크릴레이트, 1,4-부탄디올 디(메타)아크릴레이트, 1,10-데칸디올 디(메타)아크릴레이트 및 1,12-도데칸디올 디(메타)아크릴레이트이다.
특히 바람직한 단작용성 또는 다작용성 (메타)아크릴산 유도체는 N-비닐피롤리돈 및 알릴 에테르뿐만 아니라 N-일치환 또는 이치환된 아크릴아미드, 예컨대 N-에틸아크릴아미드, N,N-디메타크릴아미드, N-(2-히드록시에틸)아크릴아미드 또는 N-메틸-N-(2-히드록시에틸)아크릴아미드, N-일치환된 메타크릴아미드, 예컨대 N-에틸메타크릴아미드 또는 N-(2-히드록시에틸)메타크릴아미드이다. 이러한 단량체는 높은 가수분해 안정성을 특징으로 하고 비교적 낮은 점도로 인해 희석성 단량체로서 특히 적당하다.
높은 가수분해 안정성을 갖는 바람직한 다작용성 (메타)아크릴산 유도체는 가교결합성 피롤리돈, 예컨대 1,6-비스(3-비닐-2-피롤리돈일)-헥산, 비스아크릴아미드, 예컨대 메틸렌 또는 에틸렌 비스아크릴아미드 및 비스(메타)아크릴아미드, 예컨대 N,N'-디에틸-1,3-비스(아크릴아미도)-프로판, 1,3-비스(메타크릴아미도)-프로판, 1,4-비스(아크릴아미도)-부탄 또는 1,4-비스(아크릴로일)-피페라진이고, 이는 상응한 디아민과 (메타)아크릴산 클로라이드를 반응시킴으로써 합성될 수 있다.
열불안정성 가교결합성 단량체는 본 발명에 따라 또한 공단량체로서 특히 적당하다. 열불안정성 가교결합성 단량체는 2개의 중합가능한 기 사이에 하나 이상의 열불안정성 기를 갖는다. 그 예로는 2개의 (메타)아크릴 기 사이에 한 이상의 열불안정성 기를 갖는 다작용성 (메타)아크릴레이트 또는 (메타)아크릴아미드가 있다. 원칙적으로, 열불안정성 기로서 고려되는 것은 화학식 I의 화합물에 대해 상기 정의된 것과 동일한 기, 특히 열불안정성 알콕시아민, 옥심-에스테르, 옥심-우레탄 또는 아조 기뿐만 아니라 열불안정성 고리화첨가 부가물, 예컨대 디일스-알더 부가물, 헤테로-디일스-알더 부가물이다. 그 예로는 디- 또는 트리-이소시아네이트와 1-히드록시메틸아크릴계 에스테르, 예컨대 1-히드록시메틸 에틸 아크릴레이트 또는 β-케토 에스테르(메타)아크릴레이트, 예컨대 2-아세토아세톡시에틸 메타크릴레이트의 화학량론적 반응에 의해 얻어진 생성물뿐만 아니라 퍼푸릴 메타크릴레이트 및 N-(3-(메타크릴로일옥시)프로필)-말레인이미드 유래의 디일스-알더 부가물, 예컨대 디일스-알더 부가물, N-히드록시-(메타)아크릴아미드와 디- 또는 트리-이소시아네이트, 예컨대 헥사메틸렌-1,6-디이소시아네이트(HDI), 2,2,4-트리메틸헥사메틸렌-1,6-디이소시아네이트 또는 HDI 삼량체의 반응 생성물이 있다. 기체-방출성 열불안정성 가교결합성 단량체가 또한 특히 적당하다. 그 예로는 아조비스(4-시아노발레르산)과 히드록시알킬 (메타)아크릴레이트, 예컨대 히드록시에틸 (메타)아크릴레이트 또는 히드록시프로필 (메타)아크릴레이트 또는 N-(히드록시알킬) (메타)아크릴아미드, 예컨대 N-(5-히드록시펜틸) 메타크릴아미드 또는 N-메틸-N-(2-히드록시에틸)아크릴아미드의 에스테르화 생성물이 있다.
화학식 I의 열불안정성 또는 광불안정성 중합가능한 화합물, 및 경우에 따라 상기 지정된 공단량체 이외에, 본 발명에 따른 치과용 수복 재료는 또한 바람직하게는 라디칼 중합가능한, 산 기 함유 단량체(접착성 단량체)를 포함할 수 있다. 바람직한 산 기는 카르복실산 기, 포스폰산 기, 인산 기 및 설폰산 기이다.
중합가능한 카르복실산을 갖는 바람직한 단량체는 말레산, 아크릴산, 메타크릴산, 2-(히드록시메틸)아크릴산, 4-(메타)아크릴로일옥시에틸트리멜리트산 무수물, 10-메타크릴로일옥시데실말론산, N-(2-히드록시-3-메타크릴로일옥시프로필)-N-페닐글리신 및 4-비닐벤조산이다.
중합가능한 포스폰산 기를 갖는 바람직한 단량체는 비닐 포스폰산, 4-비닐페닐 포스폰산, 4-비닐벤질 포스폰산, 2-메타크릴로일옥시에틸 포스폰산, 2-메타크릴아미도에틸 포스폰산, 4-메타크릴아미도-4-메틸-펜틸 포스폰산, 2-[4-(디히드록시포스포릴)-2-옥사-부틸]-아크릴산, 2-[4-(디히드록시포스포릴)-2-옥사-부틸]-아크릴산 에틸 및 -2,4,6-트리메틸페닐 에스테르이다.
중합가능한 인산 기를 갖는 바람직한 단량체는 2-메타크릴로일옥시프로필 모노- 또는 디-히드로겐 포스페이트, 2-메타크릴로일옥시에틸 모노- 또는 디-히드로겐 포스페이트, 2-메타크릴로일옥시에틸페닐 히드로겐 포스페이트, 디펜타에리트리톨펜타메타크릴로일옥시 포스페이트, 10-메타크릴로일옥시데실 디히드로겐 포스페이트, 인산 모노-(1-아크릴로일-피페리딘-4-일)-에스테르, 6-(메타크릴아미도)헥실 디히드로겐 포스페이트 및 1,3-비스-(N-아크릴로일-N-프로필-아미노)-프로판-2-일-디히드로겐 포스페이트이다.
중합가능한 설폰산 기를 갖는 바람직한 단량체는 비닐설폰산, 4-비닐페닐설폰산 및 3-(메타크릴아미도)프로필설폰산이다.
바람직하게는, 상기 지정된 단량체의 혼합물을 사용한다. 단량체 혼합물의 총 중량을 기준으로, 바람직한 단량체 혼합물은
1∼90 중량%, 바람직하게는 5∼80 중량%, 특히 바람직하게는 5∼70 중량%의 화학식 I의 화합물, 특히 화학식 II, III 및/또는 IV의 화합물,
0∼70 중량%, 바람직하게는 1∼60 중량%, 특히 바람직하게는 5∼50 중량%, 특히 바람직하게는 10∼30 중량%의 공단량체, 특히 모노- 및/또는 다작용성 (메타)아크릴레이트,
0∼70 중량%, 바람직하게는 1∼60 중량%, 특히 바람직하게는 5∼50 중량%의 열불안정성 가교결합성 단량체, 및
0∼40 중량%, 바람직하게는 1∼30 중량%, 특히 바람직하게는 5∼20 중량%의 접착성 단량체
를 포함한다.
특히 바람직한 단량체 혼합물은 (각 경우에 단량체 혼합물의 총 중량을 기준으로) 하기 표에 제시된 바와 같다:
더하여, 본 발명에 따른 치과용 수복 재료는 바람직하게는 또한 라디칼 중합을 위한 개시제를 포함한다.
바람직하게는, 벤조페논, 벤조인 및 이의 유도체 또는 α-디케톤 또는 이의 유도체, 예컨대 9,10-페난트렌퀴논, 1-페닐-프로판-1,2-디온, 디아세틸 또는 4,4'-디클로로벤질은, 특히 화학식 I의 열불안정성 화합물의 경우 라디칼 광중합을 개시하는 데 사용된다. 환원제로서 캄포르퀴논 및 2,2-디메톡시-2-페닐-아세토페논이 특히 바람직하게 사용되며, 아민과 조합된 α-디케톤, 예컨대 4-(디메틸아미노)-벤조에이트, N,N-디메틸아미노에틸 메타크릴레이트, N,N-디메틸-sym.-크실리딘 또는 트리에탄올아민이 특히 바람직하다. 노리쉬(Norrish)형 I 광개시제, 특히 아실 또는 비스아실포스핀 옥시드, 모노아실트리알킬- 또는 디아실디알킬-게르마늄 화합물, 예컨대 벤조일트리메틸게르마늄, 디벤조일디에틸게르마늄 또는 비스-(4-메톡시벤조일)디에틸게르마늄이 또한 특히 적당하다. 또한 상이한 광개시제의 혼합물, 예컨대 캄포르퀴논과 조합된 디벤조일디에틸게르마늄 및 4-디메틸아미노벤조산 에틸 에스테르 등이 사용될 수 있다.
바람직하게는, 산화환원-개시제 조합, 예컨대 벤조일 퍼옥시드와 N,N-디메틸-sym.-크실리딘 또는 N,N-디메틸-p-톨루이딘의 조합 등이, 특히 화학식 I의 광불안정성 화합물의 경우 실온에서 수행되는 중합을 위한 개시제로서 사용된다. 추가적으로, 퍼옥시드 및 환원제, 예컨대 아스코르브산, 바르비투레이트 또는 설핀산 등으로 이루어진 산화환원 시스템이 또한 특히 적당하다.
본 발명에 따른 치과용 수복 재료는 또한 열적 기체-방출성 첨가제를 포함할 수 있다. 적당한 기체-방출성 첨가제는, 예를 들어 아조 화합물, 예컨대 아조디카르본아미드, 2,2'-아조비스이소부티로니트릴 또는 2,2'-아조비스(4-시아노펜탄산), N-니트로소 화합물, 히드라지드, 예컨대 벤젠설포닐 히드라지드, 퍼옥시드, 예컨대 디쿠몰 퍼옥시드 또는 아세톤 디카르복실산이다. 이러한 화합물의 예는, 예를 들어 문헌[St. Quinn, Plastics, Additives & Compounding 2001, 3, 16-21]에 기술되어 있다. 분해 온도는, 예컨대 아조 화합물의 경우, 치환 패턴에 의해 자체 공지된 방식으로 설정될 수 있다(예, 문헌[D. Braun, R. Jakobi, Monatshefte Chemie 1982, 113, 1403-1414]).
추가적으로, 본 발명에 따른 치과용 수복 재료는 방출된 전자기 방사선을 열로 전환할 수 있는 첨가제를 포함할 수 있다. 그러한 소위 방사선-대-열(radiation-to-heat) 전환체는 UV, NIR 또는 IR 방사선, 가시광, 마이크로파 또는 전파 방사선을 열로 전환시켜 열불안정성 기를 분해시킬 수 있는 유기, 무기 또는 유기금속성 물질 또는 혼합 성분이다. 이의 예로는 UV, NIR 또는 IR 방사선을 흡수하는 염료 및 안료가 있다. IR 범위에서 흡수하는 염료의 예는 아조, 메틴, 안트라퀴논 또는 포르피린 염료이다. NIR 방사선을 흡수하는 안료의 예는 안티몬 및 인듐 주석 산화물, 프탈로시아닌 안료, 그을음(soot), Ni 및 Pt 디티올렌 착체이다. UV 범위에서 흡수하는 화합물의 예는 벤조트리아졸, 트리아진, 벤조페논, 시아노아크릴레이트, 살리실산 유도체 및 장애 아민 광 안정화제(HALS)이다. 마이크로파(1∼300 GHz) 또는 전파(10 kHz∼1 GHz)의 주파수 범위에서 흡수하는 첨가제의 예로는 산화철 적철석(Fe2O3) 또는 자철석(Fe3O4)을 포함하는 강자성 세라믹 물질, 소위 페라이트 및 예를 들어 금속 Zn, Mn, 또는 Ni의 추가 산화물이 있고 분말로서 구입 가능한 것이다.
본 발명에 따른 치과용 수복 재료는 추가적으로 또한 바람직하게는 기계적 특성을 향상시키거나 또는 점도를 조절하는 유기 또는 무기 충전 입자를 포함한다. 바람직한 무기 미립자 충전재는 산화물, 예컨대 ZrO2 및 TiO2, 또는 평균 입도가 0.005∼2 ㎛, 바람직하게는 0.1∼1 ㎛인 SiO2, ZrO2 및/또는 TiO2의 혼합 산화물, 평균 입도가 5∼200 nm, 바람직하게는 10∼100 nm인 나노미립자 또는 마이크로파인(microfine) 충전재, 예컨대 발열성 규산 또는 침강 실리카, 평균 입도가 0.01∼10 ㎛, 바람직하게는 0.1∼1 ㎛인 미니충전재, 예컨대 석영, 유리 세라믹 또는 유리 분말과, 평균 입도가 10∼1000 nm, 바람직하게는 100∼300 nm인 X-선-불투명 충전재, 예컨대 이테르븀 트리플루오리드 또는 나노미립자 탄탈(V) 옥시드 또는 바륨 설페이트를 기초로 하는 비정질 구형 재료이다.
게다가, 본 발명에 따른 치과용 수복 재료는 예를 들어 안정화제, 향미제, 염료, 살미생물성(microbiocidal) 활성 성분, 플루오리드 이온-방출성 첨가제, 광학 광택제 또는 가소화제뿐만 아니라 추가의 첨가제, 특히 용매, 예컨대 물 또는 에탄올 또는 상응한 용매 혼합물을 포함할 수 있다.
하기 성분을 포함하는 화학식 I, 특히 화학식 II, III 및/또는 IV의 열불안정성 또는 광불안정성 중합가능한 화합물을 기초로 하는 치과용 수복 재료가 특히 바람직하다:
a) 0.1∼50 중량%, 특히 1∼40 중량%, 바람직하게는 2∼30 중량%, 특히 바람직하게는 5∼30 중량%의 화학식 I, 특히 화학식 II, III 및/또는 IV의 화합물,
b) 0.01∼10 중량%, 바람직하게는 0.1∼3.0 중량%, 특히 바람직하게는 0.2∼2 중량%의 개시제,
c) 0∼80 중량%, 바람직하게는 1∼60 중량%, 특히 바람직하게는 5∼50 중량%의 공단량체,
d) 0∼30 중량%, 바람직하게는 0.5∼15 중량%, 특히 바람직하게는 1∼5 중량%의 접착성 단량체,
e) 0∼80 중량%의 충전재,
f) 0∼70 중량%의 용매.
바람직한 충전재 함량은 목적하는 용도에 따라 달라진다. 접착제는 바람직하게는 0∼20 중량%를 포함하고 시멘트 및 복합재는 바람직하게는 20∼80 중량%의 충전재를 포함한다.
또한 용매 함량도 동일하게 적용된다. 접착제는 바람직하게는 0∼60 중량%, 특히 바람직하게는 1∼50 중량%의 용매를 포함한다. 용매로서 물을 포함하는 치과용 재료가 바람직하다. 0∼20 중량%, 특히 1∼10 중량%의 물을 포함하는 치과용 재료가 특히 바람직하다.
본 발명에 따른 치과용 수복 재료의 탈착 특성은 재료의 조성에 의해 목표 방식에 영향을 미칠 수 있다. 특정 목적에 적당한 조성의 조정은 당업자의 일반 상식 및 능력에 속한다. 따라서, 가열에 의한 온디맨드 탈착 능력은 열불안정성 또는 광불안정성 성분, 즉 경우에 따라 열불안정성 가교결합성 단량체 및 기체-방출성 첨가제뿐만 아니라 특히 화학식 I의 열불안정성 또는 광불안정성 중합가능한 화합물의 사용된 농도에 따라 증가한다. 추가적으로, 탈착 특성은 또한 공단량체의 선택에 의해 다양해질 수 있고, 이때 가교결합성 밀도 및 또한 이에 따른 강도 및 탄성 계수는 가교결합성 단량체의 비율에 의해 또는 단작용성 단량체의 첨가에 의해 다양해질 수 있다.
화학식 I, 바람직하게는 화학식 II, III 및/또는 IV의 열불안정성 또는 광불안정성 중합가능한 화합물을 기초로 하는 본 발명에 따른 치과용 재료는 특히 예를 들어 브라켓, 크라운 또는 베니어(veneer)를 가역적으로 부착시키는 데 사용될 수 있다. 바람직하게는, 접합은 화학식 I의 열불안정성 또는 광불안정성 중합가능한 화합물을 기초로 하는 재료(접착제 또는 시멘트)를 경화시킴으로써 초기에 형성된다. 탈착시키기 위해서는, 접착제 접합된 부분을 간단히 열불안정성 접합의 분해가 시작되는 온도보다 높은 온도로 가열하거나 또는 적당한 파장의 광으로 조사하여야 한다. 목적하는 에너지의 도입은 예를 들어 IR 방사선원 또는 레이저를 통해 실시할 수 있다. 더하여, 강자성 입자, 예컨대 강자성 나노입자 등이 본 발명에 따른 치과용 재료에 혼입되는 경우 교번 자기장의 작용에 의해 유도 가열이 실현될 수 있다.
본 발명의 목적은 또한 치과용 수복 재료, 바람직하게는 접착제 또는 시멘트, 특히 바람직하게는 자기-에칭 접착제 또는 시멘트를 제조하기 위한 화학식 I, 특히 화학식 II, III 및/또는 IV의 열불안정성 또는 광불안정성 중합가능한 화합물의 용도이다.
본 발명은 하기 실시예에 의해 좀 더 상세하게 설명된다.
실시예
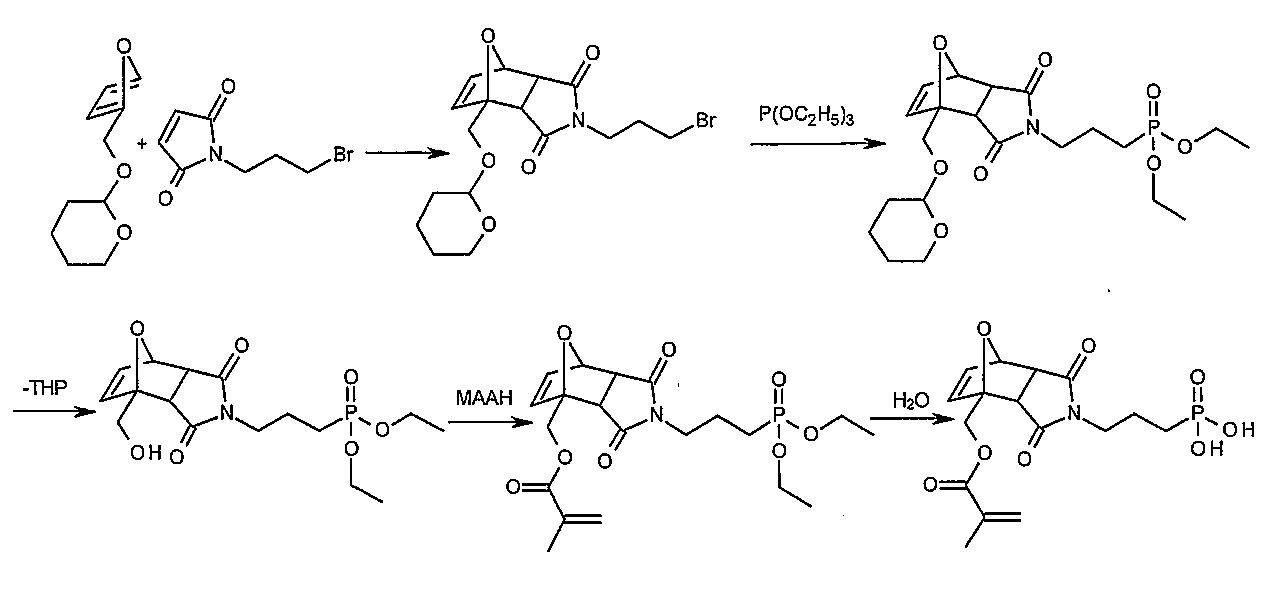
1
메타크릴산-3,5-
디옥소
-4-(3-
포스포노옥시프로필
)-10-옥사-4-
아자
-
트리시클로[
5.2.1.0
2,6
]데크-8-엔-1-
일메틸
에스테르(
MATPA
)의 합성
단계 1: 4,10-디옥사-트리시클로[5.2.1.02,6]데크-8-엔-3,5-디온
아세토니트릴(200 ㎖) 중 말레산 무수물(98.06 g, 1.0 몰) 및 푸란(102.12 g, 1.5 몰)의 용액을 96시간 동안 실온에서 교반하였다. 형성된 침전물을 여과시키고, 아세토니트릴(100 ㎖)로 세척하고 진공 건조 오븐(125 mbar, 50℃)에서 건조시켰다. 123.30 g(740 mmol, 74% 수율)의 백색 고체를 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ = 3.31 (s, 2H), 5.35 (s, 2H), 6.58 (s, 2H).
13C-NMR (DMSO-d6, 100 MHz): δ = 49.0, 81.6, 136.8, 171.5.
단계 2: 4-(3-히드록시-프로필)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-3,5-디온
메탄올(30 ㎖) 중 3-아미노-1-프로판올(15.02 g, 200 mmol)의 용액을 메탄올(70 ㎖) 중 4,10-디옥사-트리시클로[5.2.1.02,6]데크-8-엔-3,5-디온(33.23 g, 200 mmol)의 현탁액에 적가하였다. 그리고나서 반응 혼합물을 환류 하에 가열하였다. 24시간 후, 이 용액을 회전식 증발기에서 농축시켰다. 황색을 띈 고체를 물(100 ㎖)에 용해시키고 디클로로메탄(3 x 200 ㎖)으로 추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고, 회전식 증발기에서 농축시키고 미세 진공(fine vacuum) 하에 건조시켰다. 25.40 g(114 mmol, 57% 수율)의 백색 고체를 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ = 1.59 (m, 2H), 2.91 (s, 2H), 3.38 (m, 4H), 4.45 (br s, 1H), 5.12 (s, 2H), 6.55 (s, 2H).
13C-NMR (DMSO-d6, 100 MHz): δ = 30.5, 35.5, 47.0, 58.3, 80.3, 136.4, 176.4.
단계 3: 1-(3-히드록시-프로필)-피롤-2,5-디온
톨루엔(300 ㎖) 중 4-(3-히드록시-프로필)-10-옥사-4-아자-트리시클로 [5.2.1.02,6]데크-8-엔-3,5-디온(17.80 g, 79.8 mmol)의 용액을 환류 하에 16시간 동안 가열하였다. 이 용액을 회전식 증발기에서 농축시키고 잔류물을 미세 진공 하에 건조시켰다. 11.92 g(76.8 mmol, 96% 수율)의 백색 고체를 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ = 1.65 (m, 2H), 3.40 (t, 2H; J = 6.2 Hz), 3.47 (t, 2H; J = 7.4 Hz), 4.48 (br s, 1H), 6.99 (s, 2H).
13C-NMR (DMSO-d6, 100 MHz): δ = 31.2, 34.7, 58.4, 134.4, 171.0.
단계 4: 메타크릴산-4-(3-히드록시프로필)-3,5-디옥소-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-1-일메틸 에스테르
1-(3-히드록시-프로필)-피롤-2,5-디온(5.17 g, 33.3 mmol), 퍼푸릴 메타크릴레이트(5.65 g, 34.0 mmol) 및 BHT(10 mg)를 벤젠(60 ㎖)에 용해시켰다. 이 용액을 가벼운 기류의 도입에 의해 동반되는 환류 하에 가열하였다. 용매를 20시간 후 증류시켰다. 갈색을 띈 오일을 컬럼 크로마토그래피(SiO2, 에틸 아세테이트)에 의해 정제하였다. 2.84 g(8.8 mmol, 27% 수율, 엑소 및 엔도 이성질체의 혼합물)의 황색을 띈 오일을 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ (엔도 이성질체) = 1.55-1.64 (m, 2H), 1.88 (s, 3H), 3.01-3.05 (d, 1H; J = 6.4 Hz), 3.09 (d, 1H; J = 6.4 Hz), 3.32-3.49 (m, 4H), 4.41 (d, 1H; J = 12.8 Hz), 4.45-4.48 (m, 1H), 4.78-4.84 (m, 1H), 5.15 (d, 1H; J = 1.5 Hz), 5.68-5.70 (m, 1H), 6.00-6.03 (m, 1H), 6.47-6.52 (m, 1H), 6.58-6.64 (m, 1H).
13C-NMR (DMSO-d6, 100 MHz): δ (엔도 이성질체) = 17.8, 30.5, 35.6, 48.1, 49.6, 58.2, 61.7, 80.5, 88.8, 126.2, 135.4, 136.7, 137.3, 166.1, 174.7, 176.0.
단계 5: 메타크릴산-3,5-디옥소-4-(3-포스포노옥시프로필)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-1-일메틸 에스테르(MATPA)
테트라히드로푸란(20 ㎖) 중 메타크릴산-4-(3-히드록시프로필)-3,5-디옥소-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-1-일메틸 에스테르(2.6 g, 8.2 mmol), BHT(10 mg) 및 트리에틸아민(910 mg, 9.0 mmol)의 용액을 -5℃에서 테트라히드로푸란(30 ㎖) 중 포스포록시클로라이드(1.39 g, 9.0 mmol)의 용액에 적가하였다. 첨가를 완료한 후, 현탁액을 3시간 동안 -5℃에서 교반하고 이후 물(2 ㎖)을 적가하였다. 현탁액을 추가 30분 동안 -5℃에서 교반하고 이후 침전물을 냉각 여과시켰다. 황색을 띈 여과물을 포화된 수성 NaCl 용액(3 x 30 ㎖)으로 세척하였다. 결합된 수성 상을 테트라히드로푸란(2 x 30 ㎖)으로 재추출하였다. 결합된 유기 상을 Na2SO4 하에 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 갈색을 띈 오일에 아세토니트릴(2 x 50 ㎖)을 첨가하여 물을 제거하고 회전식 증발기에서 농축시켰다. 잔류물에 디에틸 에테르(50 ㎖)를 첨가하고 실온에서 교반하였다. 1시간 후 용매를 경사분리하였다. 갈색 오일을 회전식 증발기 상에서 미세 진공 하에 건조시켰다. 2.46 g(6.1 mmol, 75% 수율, 엑소 및 엔도 이성질체의 혼합물)의 갈색을 띈 수지를 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ (엔도 이성질체) = 1.73-1.82 (m, 2H), 1.87 (s, 3H), 3.03 (d, 1H; J = 6.5 Hz), 3.10 (d, 1H; J = 6.5 Hz), 3.42-3.48 (m, 2H), 3.76-3.84 (m, 2H), 4.41 (d, 1H; J = 12.5 Hz), 4.84 (d, 1H; J = 12.5 Hz), 5.15 (s, 1H), 5.69 (s, 1H), 6.01 (s, 1H), 6.50 (d, 1H; J = 5.7 Hz), 6.59-6.63 (m, 1H), 6.94 (br, 2H).
13C-NMR (DMSO-d6, 100 MHz): δ (엔도 이성질체) = 17.8, 28.2 (d, J = 7 Hz), 35.2, 48.2, 49.7, 61.6, 63.0 (d, J = 5 Hz), 80.4, 88.8, 126.2, 135.4, 136.7, 137.3, 166.1, 174.7, 176.0.
31P-NMR (DMSO-d6, 162 MHz): δ = -1.3.
실시예
2
메타크릴산-3-(3,5-
디옥소
-1-
포스포노옥시메틸
-10-옥사-4-
아자
-
트리시클로[5.2.1.0
2,6
]데크
-8-엔-4-일)-프로필 에스테르의 합성
단계 1: 메타크릴산-3-(2,5-디옥소-2,5-디히드로-피롤-1-일)-프로필 에스테르
1-(3-히드록시프로필)-피롤-2,5-디온(5.36 g, 34.5 mmol), 트리에틸아민(3.85 g, 38.0 mmol) 및 N,N-디메틸아미노피리딘(120 mg, 1.0 mmol)을 디클로로메탄(80 ㎖) 중에 용해시켰다. 디클로로메탄(20 ㎖) 중 메타크릴산 무수물(5.86 g, 38.0 mmol) 및 BHT(10 mg)의 용액을 0℃에서 적가하고, 그리고나서 반응 혼합물을 2시간 동안 0℃에서 그리고 22시간 동안 실온에서 교반하였다. 반응 용액을 물(3 x 50 ㎖)로 세척하였다. 결합된 수성 상을 디클로로메탄(50 ㎖)으로 재추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 미정제 생성물을 컬럼 크로마토그래피(SiO2, n-헥산/에틸 아세테이트 1:1)에 의해 정제하였다. 2.81 g(12.5 mmol, 35% 수율)의 황색을 띈 오일을 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.95 (2, 3H), 1.97-2.04 (m, 2H), 3.66 (t, 2H; J = 6.9 Hz), 4.15 (t, 2H; J = 6.2 Hz), 5.57 (m, 1H), 6.12 (s, 1H), 6.72 (s, 2H).
13C-NMR (CDCl3, 100 MHz): δ = 18.3, 27.6, 34.9, 61.8, 125.6, 134.2, 126.2, 167.2, 170.6.
단계 2: 메타크릴산-3-(1-히드록시메틸-3,5-디옥소-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-4-일)-프로필 에스테르
메타크릴산-3-(2,5-디옥소-2,5-디히드로-피롤-1-일)-프로필 에스테르(2.71 g, 12.1 mmol), 퍼푸릴 알콜(1.28 g, 13.0 mmol) 및 BHT(10 mg)를 벤젠(40 ㎖) 중에 용해시켰다. 이 용액을 가벼운 기류의 도입에 의해 동반되는 환류 하에 가열하였다. 용매를 20시간 후 증류시켰다. 미정제 생성물로서 수득한 갈색을 띈 오일을 컬럼 크로마토그래피(SiO2, 에틸 아세테이트)에 의해 정제하였다. 3.10 g(9.6 mmol, 80% 수율, 엑소 및 엔도 이성질체의 혼합물)의 황색 오일을 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.78-1.89 (m, 0.4H; 엑소), 1.93-2.02 (m, 5.8H; 엑소/엔도), 2.94-3.02 (m, 3H; 엔도), 3.43-3.48 (m, 0.6H; 엑소), 3.55-3.69 (m, 2.2H; 엑소/엔도), 4.05-4.14 (m, 4.4H; 엑소/엔도), 4.15-4.22 (m, 0.2H; 엑소), 4.25-4.31 (m, 0.2H; 엑소), 5.25 (m, 1H; 엔도), 5.28-5.32 (m, 0.2H; 엑소), 5.57-5.60 (m, 1.2H; 엑소/엔도), 6.10-6.12 (m, 0.2H; 엔도), 6.12-6.14 (m, 1H; 엔도), 6.35-6.38 (m, 0.2H; 엑소), 6.46-6.49 (m, 0.2H; 엑소), 6.52-6.56 (m, 1H; 엔도), 6.59-6.62 (m, 1H; 엔도).
13C-NMR (CDCl3, 100 MHz): δ = 18.3, 26.6 (엔도), 26.7 (엑소), 35.5 (엑소), 35.8 (엔도), 46.0 (엑소), 48.1 (엔도), 49.9, 60.7 (엔도), 61.3 (엑소), 61.4 (엔도), 61.6 (엑소), 79.5 (엑소), 80.9 (엔도), 91.5 (엔도), 92.1 (엑소), 125.7 (엔도), 125.8 (엑소), 134.9 (엑소), 135.7 (엑소), 136.1 (엑소), 136.2 (엔도), 137.0 (엔도), 138.3 (엔도), 167.2 (엑소), 167.3 (엔도), 174.7 (엑소), 175.1 (엑소), 175.8 (엔도), 175.9 (엔도).
단계 3: 메타크릴산-3-(3,5-디옥소-1-포스포노옥시메틸-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-4-일)-프로필 에스테르
테트라히드로푸란(20 ㎖) 중 메타크릴산-3-(1-히드록시메틸-3,5-디옥소-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-4-일)-프로필 에스테르(3.00 g, 9.3 mmol), BHT(10 mg) 및 트리에틸아민(1.04 g, 10.3 mmol)의 용액을 -5℃에서 테트라히드로푸란(30 ㎖) 중 포스포록시클로라이드(1.57 g, 10.3 mmol)의 용액에 적가하였다. 첨가를 완료한 후, 현탁액을 3시간 동안 -5℃에서 교반하고 이후 물(2 ㎖)을 적가하였다. 현탁액을 추가 30분 동안 -5℃에서 교반하고 그리고나서 침전물을 냉각 여과시켰다. 황색을 띈 여과물을 포화된 수성 NaCl 용액(3 x 30 ㎖)으로 세척하였다. 결합된 수성 상을 테트라히드로푸란(2 x 30 ㎖)으로 재추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 갈색을 띈 오일에 아세토니트릴(2 x 50 ㎖)을 첨가하여 물을 제거하고 회전식 증발기에서 농축시켰다. 잔류물에 디에틸 에테르(2 x 50 ㎖)를 첨가하고 실온에서 교반하였다. 1시간 후 용매를 경사분리하였다. 갈색 오일을 회전식 증발기에서 미세 진공 하에 건조시켰다. 3.19 g(7.9 mmol, 85% 수율, 엑소 및 엔도 이성질체의 혼합물)의 흡습성 백색 폼을 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ = 1.65-1.75 (m, 0.4H; 엑소), 1.75-1.85 (m, 2H; 엔도), 1.87 (s, 3.6H; 엑소/엔도), 3.02 (dd, 2H; J = 28.2 Hz, 6.4 Hz; 엔도), 3.29 (t, 0.4H; J = 7.0 Hz; 엑소), 3.41-3.49 (m, 2.2H; 엑소/엔도), 3.66 (dd, 0.2H; J = 7.8 Hz, 5.6 Hz; 엑소), 3.94-4.08 (m, 3.4H; 엑소/엔도), 4.32 (dd, 0.2H; J = 12.2 Hz, 5.2 Hz; 엑소), 4.42 (dd, 0.2H; J = 12.2 Hz, 5.8 Hz; 엑소), 4.54 (q, 1H; J = 6.1 Hz; 엔도), 5.08-5.11 (m, 1H; 엔도), 5.25-5.29 (m, 0.2H; 엑소), 5.64-5.68 (m, 1.2H; 엑소/엔도), 6.00-6.05 (m, 1.2H; 엑소/엔도), 6.36 (d, 0.2H, J = 5.5 Hz; 엑소), 6.44-6.50 (m, 1.2H; 엑소/엔도), 6.54-6.58 (m, 1H; 엔도), 6.66 (br s, 2.4H; 엑소/엔도).
13C-NMR (DMSO-d6, 100 MHz): δ = 17.9, 26.1 (엑소), 26.2 (엔도), 34.6 (엑소), 34.8 (엔도), 45.6 (엑소), 47.3 (엑소), 48.0 (엔도), 49.8 (엔도), 61.5 (엔도), 61.6 (엑소), 62.9 (d, J = 5 Hz; 엔도), 63.3 (d, J = 5 Hz; 엑소), 78.7 (엑소), 80.4 (엔도), 89.7 (d, J = 10 Hz; 엔도), 90.0 (d, J = 10 Hz; 엑소), 125.6, 134.5 (엑소), 135.4 (엑소), 135.8 (엔도), 136.8 (엔도), 137.0 (엔도), 166.4, 174.7 (엑소), 174.7 (엔도), 174.8 (엑소), 176.1 (엔도).
실시예
3
실시예
1로부터의 인산
메타크릴레이트
MATPA
의
라디칼
광중합
실시예 1로부터의 인산 메타크릴레이트 MATPA 2.97 g, 가교결합제 N,N'-디에틸-1,3-비스(아크릴아미도)-프로판 6.95 g, 광개시제 캄포르퀴논 0.03 g 및 아민 촉진제 4-(디메틸아미노)-벤조에이트 0.05 g의 혼합물을 제조하였다. 혼합물 액적을 유리판에 배치하고, PET 필름을 덮고 청색상(Bluephase) 중합 램프(Ivoclar Vivadent AG, 광도 1000 mW/cm-2)로 20초 동안 조사하였다. 그리고나서 조사된 층을 경화시켰다. 혼합물을 포토 DSC(시차주사 열량측정기, Perkin Elmer DSC 7)로 추가로 조사하고 273 J/g의 중합 열이 측정되었다.
실시예
4
실시예
1로부터의 인산
메타크릴레이트
MATPA
를 기초로 하는 광 경화성 접착제의 제조
접착제를, 실시예 1로부터의 인산 메타크릴레이트 MATPA 1.09 g, 단작용성 공단량체 2-히드록시에틸 메타크릴레이트 1.49 g, 가교결합제 비스-GMA 3.25 g, 가교결합제 UDMA 0.99 g, 가교결합제 글리세롤 디메타크릴레이트 1.01 g, 광개시제 캄포르퀴논 0.02 g, 아민 촉진제 4-(디메틸아미노)-벤조에이트 0.05 g, 아실포스핀 옥시드 광개시제 Lucirin TPO 0.10 g 및 용매 에탄올 2.00 g으로 제조하였다. 접착제를 청색상 중합 램프(Ivoclar Vivadent AG, 광도 1000 mW/cm-2)로 경화시킬 수 있었다.
실시예
5
메타크릴산-3-[3,5-
디옥소
-1-(11-
포스포노옥시운데실옥시메틸
)-10-옥사-4-
아자
-트리시클로[
5.2.1.0
2,6
]데크
-8-엔-4-일]-프로필 에스테르의 합성
단계 1: 2-(11-브로모운데실옥시)-테트라히드로피란
3,4-디히드로-2H-피란(21.87 g, 260 mmol)을 디클로로메탄(100 ㎖) 중 11-브로모운데칸올(50.24 g, 200 mmol) 및 톨루엔-4-설폰산 모노히드레이트(80 mg, 0.4 mmol)의 용액에 적가하였다. 반응 혼합물을 실온에서 교반하였다. 24시간 후, 갈색 용액을 실리카겔의 박층 상에 여과시켰다. 여과물을 회전식 증발기에서 농축시키고 미세 진공 하에 건조시켰다. 65.85 g(196 mmol, 98% 수율)의 담황색을 띈 오일을 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.23-1.37 (m, 12H), 1.37-1.47 (m, 2H), 1.48-1.64 (m, 6H), 1.65-1.76 (m, 1H), 1.77-1.90 (m, 3H), 3.35-3.42 (m, 3H), 3.46-3.53 (m, 1H), 3.70-3.75 (m, 1H), 3.84-3.90 (m, 1H), 4.56-4.58 (m, 1H).
13C-NMR (CDCl3, 100.6 MHz): δ = 19.7, 25.4, 26.2, 28.2, 28.8, 29.4, 29.5, 29.6, 29.8, 30.8, 32.9, 33.9, 62.3, 67.7, 98.8.
단계 2: 2-[11-(푸란-2-일메톡시)-운데실옥시]-테트라히드로피란
퍼푸릴 알콜(9.81 g, 100 mmol)을 THF(100 ㎖) 중 수소화나트륨(2.40 g, 100 mmol)의 현탁액에 적가하였다. 현탁액을 1시간 동안 실온에서 교반한 후, THF(100 ㎖) 중 2-(11-브로모운데실옥시)-테트라히드로피란(33.53 g, 100 mmol)의 용액을 적가하였다. 반응 혼합물을 16시간 동안 환류 하에 가열하였다. 냉각 후, 포화된 수성 NH4Cl 용액(100 ㎖)으로 켄칭을 수행하였다. 2상 혼합물을 에틸 아세테이트(3 x 100 ㎖)로 추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고, 회전식 증발기에서 농축시키고 미세 진공 하에 건조시켰다. 미정제 생성물을 컬럼 크로마토그래피(SiO2, 디클로로메탄)로 정제하였다. 20.58 g(58.4 mmol, 58% 수율)의 황색을 띈 오일을 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.25-1.40 (m, 16H), 1.48-1.62 (m, 6H), 1.66-1.74 (m, 1H), 1.78-1.87 (m, 1H), 3.34-3.40 (m, 1H), 3.45 (t, 2H; J = 6.8 Hz), 3.47-3.52 (m, 1H), 3.70-3.75 (m, 1H), 3.84-3.90 (m, 1H), 4.42 (s, 2H), 4.56-4.58 (m, 1H), 6.28-6.30 (m, 1H), 6.32-6.33 (s, 1H), 7.38-7.39 (m, 1H).
13C-NMR (CDCl3, 100.6 MHz): δ = 19.7, 25.5, 26.1, 26.3, 29.1, 29.4, 29.5, 29.5, 29.5, 29.6, 29.7, 29.8, 30.8, 62.3, 64.7, 67.7, 70.4, 98.8, 108.9, 110.2, 142.6, 152.2.
단계 3: 11-(푸란-2-일메톡시)-운데칸-1-올
메탄올(100 ㎖) 중 2-[11-(푸란-2-일메톡시)-운데실옥시]-테트라히드로피란(20.48 g, 58.1 mmol) 및 톨루엔-4-설폰산 모노히드레이트(480 mg, 2.4 mmol)의 용액을 20시간 동안 실온에서 교반하였다. 반응 혼합물을 회전식 증발기에서 농축시키고 미정제 생성물을 컬럼 크로마토그래피(SiO2, 에틸 아세테이트)로 정제하였다. 7.18 g(26.8 mmol, 46% 수율)의 황색을 띈 고체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.25-1.37 (m, 14H), 1.51-1.62 (m, 4H), 1.84 (s, 1H), 3.45 (t, 2H; J = 6.8 Hz), 3.61 (t, 2H; J = 6.8 Hz), 4.43 (s, 2H), 6.29-6.30 (m, 1H), 6.32-6.34 (m, 1H), 7.39-7.40 (m, 1H).
13C-NMR (CDCl3, 100.6 MHz): δ = 25.8, 26.1, 29.4, 29.5, 29.5, 29.6, 29.6, 32.8, 62.9, 64.7, 70.4, 108.9, 110.2, 142.6, 152.1.
단계 4: 메타크릴산-3-[3,5-디옥소-1-(11-히드록시-운데실옥시메틸)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-4-일]-프로필 에스테르
톨루엔(100 ㎖) 중 11-(푸란-2-일메톡시)-운데칸-1-올 (7.00 g, 26.1 mmol), 메타크릴산-3-(2,5-디옥소-2,5-디히드로-피롤-1-일)-프로필 에스테르(5.82 g, 26.1 mmol) 및 BHT(10 mg)의 용액을 가벼운 기류의 도입에 의해 동반되는 80℃로 가열하였다. 20시간 후, 용액을 회전식 증발기에서 농축시키고 미정제 생성물을 컬럼 크로마토그래피(SiO2, 에틸 아세테이트)로 정제하였다. 6.16 g(12.5 mmol, 48% 수율, 엑소 및 엔도 이성질체의 혼합물)을 황색을 띈 오일로서 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.25-1.36 (m, 22.4H; 엑소/엔도), 1.51-1.63 (m, 6.6H; 엑소/엔도), 1.76 (s, 1.6H; 엑소/엔도), 1.81-1.88 (m, 1.2H; 엑소), 1.92-1.98 (m, 6.4H; 엑소/엔도), 2.91 (dd, 2H; J = 40.2 Hz, 6.4 Hz; 엔도), 3.43-3.51 (m, 2.4H; 엑소), 3.52-3.65 (m, 8.4H), 3.81 (d, 1H; J = 11.6 Hz; 엔도), 4.01 (d, 0.6H; J = 11.6 Hz; 엔도), 4.06-4.15 (m, 5H; 엑소/엔도), 5.23-5.24 (m, 1H; 엔도), 5.28-5.30 (m, 0.6H; 엑소), 5.57-5.58 (m, 1.6H; 엑소/엔도), 6.11-6.14 (m, 1.6H; 엑소/엔도), 6.30-6.32 (d, 0.6H; J = 5.8 Hz; 엑소), 6.44-6.46 (m, 0.6H; 엑소), 6.51-6.54 (m, 2H; 엔도).
13C-NMR (CDCl3, 100.6 MHz): δ = 18.3, 18.3, 25.7, 26.0, 26.7, 29.4, 29.4, 29.4, 29.5, 29.5, 29.5, 29.6, 32.8, 35.4, 35.7, 45.7, 47.8, 48.3, 49.9, 61.5, 61.6, 62.9, 67.9, 68.4, 72.1, 72.2, 79.6, 81.0, 90.7, 91.4, 125.6, 125.7, 135.1, 135.3, 136.1, 136.2, 136.6, 138.1, 167.2, 174.5, 174.8, 175.0, 176.0.
단계 5: 메타크릴산-3-[3,5-디옥소-1-(11-포스포노옥시-운데실옥시메틸)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-4-일]-프로필 에스테르
THF(30 ㎖) 중 메타크릴산-3-[3,5-디옥소-1-(11-히드록시-운데실옥시메틸)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-4-일]-프로필 에스테르(6.06 g, 12.3 mmol), BHT(10 mg) 및 트리에틸아민(1.37 g, 13.6 mmol)의 용액을 -5℃에서 THF(50 ㎖) 중 포스포록시클로라이드(2.08 g, 13.6 mmol)의 용액에 적가하였다. 첨가를 완료한 후, 현탁액을 3시간 동안 -5℃에서 교반한 후 물(2 ㎖)을 적가하였다. 현탁액을 추가 30분 동안 얼음 배쓰에서 교반한 후 침전물을 냉각 여과하였다. 황색을 띈 여과물을 포화된 수성 NaCl 용액(3 x 50 ㎖)으로 세척하였다. 결합된 수성 상을 THF(2 x 30 ㎖)로 재추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 갈색을 띈 오일에 아세토니트릴(2 x 50 ㎖)을 첨가하여 물을 제거하고 회전식 증발기에서 농축시켰다. 갈색 오일에 디에틸 에테르(4 x 100 ㎖)를 첨가하고 실온에서 10분 동안 교반하였다. 암갈색 오일을 침전시켰다. 용매를 경사분리하였다. 배합된 에테르 용액을 회전식 증발기에서 농축시키고 미세 진공 하에 건조하였다. 3.87 g(6.8 mmol, 55% 수율, 엑소 및 엔도 이성질체의 혼합물)의 갈색을 띈 오일을 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ = 1.22-1.32 (m, 22.4H; 엑소/엔도), 1.43-1.60 (m, 6.6H; 엑소/엔도), 1.69-1.76 (m, 1.2H; 엑소), 1.80-1.85 (m, 2H; 엔도), 1.87-1.91 (m, 5.8H; 엑소/엔도), 2.96 (dd, 2H; J = 55.6 Hz, 6.4 Hz; 엔도), 3.30 (t, 1H; J = 6.4 Hz; 엔도), 3.36-3.54 (m, 6H; 엔도), 3.59-3.66 (m, 1.6H; 엑소/엔도), 3.90-4.09 (m, 7.2H; 엑소/엔도), 5.08-5.09 (m, 1H; 엔도), 5.24-5.26 (m, 0.6H; 엑소), 5.67-5.69 (m, 1.6H; 엑소/엔도), 6.00-6.06 (m, 1.6H; 엑소/엔도), 6.32-6.34 (m, 0.6H; 엑소), 6.43-6.47 (m, 1.6H; 엑소/엔도), 6.52-6.55 (m, 1H; 엔도), 8.68 (br s, 3.2H; 엑소/엔도).
13C-NMR (DMSO-d6, 100.6 MHz): δ = 17.9, 25.1, 25.5, 26.1, 28.6, 28.8, 29.0, 29.0, 29.0, 29.8, 29.9, 30.4, 34.7, 45.5, 47.3, 48.1, 49.6, 61.3, 61.6, 65.2 (d; J = 5 Hz), 67.6, 68.1, 70.9, 71.0, 78.7, 80.3, 90.3, 90.8, 125.6, 134.5, 135.9, 135.8, 136.4, 137.6, 166.3, 166.4, 174.7, 174.9, 175.0, 176.2.
31P-NMR (DMSO-d6, 162 MHz): δ = -1.1.
실시예
6
메타크릴산-3,5-
디옥소
-4-(10-
포스포노옥시
-데실)-10-옥사-4-
아자
-
트리시클로[
5.2.1.0
2,6
]데크-8-엔-1-
일메틸
에스테르의 합성
단계 1: 4-(10-히드록시-데실)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-3,5-디온
메탄올(20 ㎖) 중 10-아미노-1-데칸올(5.36 g, 30.9 mmol)의 용액을 메탄올(30 ㎖) 중 4,10-디옥사트리시클로 [5.2.1.02,6]데크-8-엔-3,5-디온(5.13 g, 30.9 mmol)의 현탁액에 적가하였다. 반응 혼합물을 환류 하에 24시간 동안 가열한 후 회전식 증발기에서 농축시켰다. 미정제 생성물을 컬럼 크로마토그래피(SiO2, 에틸 아세테이트)로 정제하였다. 1.52 g(4.7 mmol, 15% 수율)의 황색을 띈 고체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.22-1.37 (m, 12H), 1.51-1.59 (m, 4H), 2.60 (br s, 1H), 2.84 (s, 2H), 3.46 (t, 2H; J = 7.4 Hz), 3.62 (t, 2H; J = 6.5 Hz), 5.26 (s, 2H), 6.51 (s, 2H).
13C-NMR (CDCl3, 100.6 MHz): δ = 25.7, 26.6, 27.5, 29.0, 29.3, 29.3, 29.4, 32.7, 39.0, 47.4, 62.9, 80.9, 136.6, 176.4.
단계 2: 1-(10-히드록시-데실)-피롤-2,5-디온
톨루엔(50 ㎖) 중 4-(10-히드록시-데실)-10-옥사-4-아자-트리시클로 [5.2.1.02,6]-데크-8-엔-3,5-디온(1.52 g, 4.7 mmol)의 현탁액을 환류 하에 16시간 동안 가열하였다. 미용해된 잔류물로부터 용액을 경사분리시키고, 회전식 증발기에서 농축시키고 미세 진공 하에 건조하였다. 1.15 g(4.5 mmol, 97% 수율)의 백색 고체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.25-1.36 (m, 12H), 1.52-1.61 (m, 4H), 2.63 (br s, 1H), 3.50 (t, 2H; J = 7.2 Hz), 3.63 (t, 2H; J = 6.8 Hz), 6.69 (s, 2H).
13C-NMR (CDCl3, 100.6 MHz): δ = 25.7, 26.7, 28.5, 29.0, 29.3, 29.4, 32.7, 37.9, 63.0, 134.0, 170.9.
단계 3: 메타크릴산-4-(10-히드록시데실)-3,5-디옥소-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-1-일메틸 에스테르
톨루엔(30 ㎖) 중 퍼푸릴 메타크릴레이트(750 mg, 4.5 mmol), 1-(10-히드록시-데실)-피롤-2,5-디온(1.05 g, 4.1 mmol) 및 BHT(5 mg)의 용액을 가벼운 기류의 도입에 의해 동반되는 80℃로 가열하였다. 20시간 후, 반응 용액을 회전식 증발기에서 농축시키고 미세 진공 하에 건조하였다. 미정제 생성물을 컬럼 크로마토그래피(SiO2, n-헥산/에틸 아세테이트 1:1)로 정제하였다. 560 mg(1.3 mmol, 33% 수율)의 엔도 이성질체를 백색 고체로서 수득하고 430 mg(1.0 mmol, 25% 수율)의 엑소 이성질체를 황색을 띈 오일로서 수득하였다.
엔도 이성질체:
1H-NMR (CDCl3, 400 MHz): δ = 1.19-1.36 (m, 12H), 1.37-1.46 (m, 2H), 1.52-1.61 (m, 3H), 1.97 (s, 3H), 3.31 (t, 2H; J = 7.6 Hz), 3.38 (d, 1H; J = 7.6 Hz), 3.61-3.66 (m, 3H), 4.69 (d, 1H; J = 12.8 Hz), 4.91 (d, 1H; J = 12.8 Hz), 5.31 (dd, 1H; J = 5.3 Hz, 1.7 Hz), 5.61-5.61 (m, 1H), 6.17 (s, 1H), 6.36 (d, 1H; J = 5.8 Hz), 6.45 (dd, 1H; J = 5.7 Hz, 1.6 Hz).
13C-NMR (CDCl3, 100.6 MHz): δ = 18.3, 25.7, 26.8, 27.4, 29.0, 29.3, 29.4, 32.8, 38.7, 46.8, 47.7, 62.2, 62.9, 79.6, 89.8, 126.5, 134.4, 135.6, 135.7, 166.8, 174.4, 174.6.
엑소 이성질체:
1H-NMR (CDCl3, 400 MHz): δ = 1.25-1.35 (m, 12H), 1.52-1.58 (m, 4H), 1.95 (s, 3H), 1.99 (br s, 1H), 2.95 (dd, 2H; J = 28.2 Hz, 6.5 Hz), 3.46 (t, 2H; J = 7.5 Hz), 3.61 (t, 2H; J = 6.8 Hz), 4.52 (d, 1H; J = 12.8 Hz), 4.98 (d, 1H; J = 12.8 Hz), 5.27 (d, 1H; J = 1.6 Hz), 5.59-5.61 (m, 1H), 6.13 (s, 1H), 6.45 (d, 1H; J = 5.8 Hz), 6.56 (dd, 1H; J = 5.6 Hz, 1.6 Hz).
13C-NMR (CDCl3, 100.6 MHz): δ = 18.3, 25.8, 26.6, 27.5, 29.0, 29.3, 29.3, 29.4, 32.8, 39.0, 48.3, 49.9, 61.6, 62.9, 81.1, 89.6, 126.3, 135.8, 137.1, 137.4, 166.8, 174.3, 175.8.
단계 4: 메타크릴산-3,5-디옥소-4-(10-포스포노옥시-데실)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-1-일메틸 에스테르
THF(30 ㎖) 중 엔도/엑소 메타크릴산-4-(10-히드록시데실)-3,5-디옥소-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-1-일메틸 에스테르(890 mg, 2.1 mmol), BHT(5 mg) 및 트리에틸아민(240 mg, 2.3 mmol)의 용액을 -5℃에서 THF(20 ㎖) 중 포스포록시클로라이드(360 mg, 2.3 mmol)의 용액에 적가하였다. 첨가를 완료한 후, 현탁액을 3시간 동안 -5℃에서 교반한 후 물(2 ㎖)을 적가하였다. 현탁액을 추가 30분 동안 얼음 배쓰에서 교반한 후 침전물을 냉각 여과시켰다. 황색을 띈 여과물을 포화된 수성 NaCl 용액(3 x 50 ㎖)으로 세척하였다. 결합된 수성 상을 THF(2 x 30 ㎖)로 재추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 갈색을 띈 오일에 아세토니트릴(2 x 50 ㎖)을 첨가하여 물을 제거하고 회전식 증발기에서 농축시켰다. 잔류물을 미세 진공 하에 건조시켰다. 1.01 g(2.0 mmol, 95% 수율, 엑소 및 엔도 이성질체의 혼합물)의 무색 오일을 수득하였다.
실시예
7
실시예
5 및 6으로부터의
메타크릴레이트
포스페이트를
기초로 하는
DoD
접착제의 제조
ZrO2 세라믹과 본 발명에 따른 복합 시멘트 사이의 전단 접착력을 조사하기 위해 3개의 프라이머 용액을 제조하였다. 각각 에탄올 중 실시예 5로부터의 메타크릴레이트 포스페이트(프라이머 A) 1 중량%의 용액, 에탄올 중 실시예 6으로부터의 메타크릴레이트 포스페이트(프라이머 B) 1 중량%의 용액 및 에탄올 중 10-메타크릴로일옥시데실 포스페이트(프라이머 C, 비교예) 1 중량%의 용액이 존재하였다.
접합 강도를 측정하기 위해 각 프라이머 용액을 ZrO2 세라믹 테스트물(testpiece)(IPS e.max ZirCAD, Ivoclar Vivadent, 이트륨-안정화된 지르코늄 산화물)에 적용하고 용매를 블로우 오프(blown off)하였다. 그리고나서 복합 시멘트 멀티링크 오토믹스(Multilink Automix)(Ivoclar Vivadent)를 프라이머 층에 적용하고 20초 동안 청색상 C8 LED 램프(Ivoclar Vivadent)로 경화시킨 후 3분 동안 Spectramat 광 퍼니스(Ivoclar Vivadent)에서 경화시켰다. 그리고나서 테스트물을 24시간 동안 37℃에서 물에 저장하고 접착제 전단 강도를 ISO 가이드라인 "ISO 1994-ISO TR 11405: 치아 구조에의 접착의 테스트시 치과용 재료 안내"와 유사하게 측정하였다. 제2 런(run)에서, 물 저장 후 테스트물을 130℃에서 60분 동안 건조 오븐에서 추가 저장한 후 테스트물의 신속한 냉각 후 전단 접착력만을 측정하였다. 그 결과는 하기 표 1에 나타내었으며 세라믹 복합재 접합의 온도 로드에 따라 본 발명에 따른 접착성 단량체를 갖는 프라이머는 접합 강도에 훨씬 더 많은 감소를 나타내고 이에 따라 그러한 접합은 더욱 쉽게 탈착될 수 있다는 것을 나타낸다.
실시예
8
4-[4(5)-(
메타크릴로일옥시메틸
)-2-피리딘-2-일-3,6-
디히드로
-2H-
티오
피란-2-일설파닐메틸]-벤조산-2-(
메타크릴로일옥시
)-에틸 에스테르의 합성
단계 1: 2-벤젠설포닐메틸피리딘
아세토니트릴(200 ㎖) 중 2-(클로로메틸)피리딘히드로클로라이드(32.81 g, 200 mmol)의 현탁액에 나트륨 페닐 설피네이트(49.24 g, 300 mmol), 테트라프로필암모늄 브로마이드(10.64 g, 40 mmol) 및 1,8-디아자비시클로[5.4.0]운데크-7-엔(30.44 g, 200 mmol)을 첨가하였다. 반응 혼합물을 환류 하에 16시간 동안 가열한 후 회전식 증발기에서 농축하였다. 잔류물을 디클로로메탄(200 ㎖) 중에 흡수시키고, 포화된 수성 NaCl 용액(3 x 100 ㎖)으로 세척하고, Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 대략 절반 부피로 농축시켰다. 갈색 용액을 실리카겔 층 상에서 여과시켰다. 41.55 g(178 mmol; 89% 수율)의 황색을 띈 고체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 4.56 (s, 2H), 7.21-7.24 (m, 1H), 7.42-7.48 (m, 3H), 7.58-7.62 (m, 1H), 7.66-7.70 (m, 3H), 8.41-8.42 (m, 1H).
13C-NMR (CDCl3, 100.6 MHz): δ = 64.6, 123.4, 125.7, 128.4, 129.0, 133.8, 136.7, 138.2, 148.8, 149.7.
단계 2: 4-(피리딘-2-카르보티오일설파닐메틸)-벤조산
얼음 냉각을 동반하여, 아세토니트릴(100 ㎖) 중 1,8-디아자비시클로[5.4.0]운데크-7-엔 (79.56 g, 523 mmol)의 용액을 아세토니트릴(500 ㎖) 중 2-벤젠설포닐메틸피리딘(40.64 g, 174 mmol) 및 황(16.76 g, 523 mmol)의 현탁액에 적가하였다. 첨가를 완료한 후, 암적색 용액을 22시간 동안 실온에서 교반하였다. 그리고나서 4-(브로모메틸)벤조산(37.46 g, 174 mmol)을 분할 첨가하였다. 반응 혼합물을 추가 4시간 동안 실온에서 교반한 후 2 N 염산(200 ㎖)을 첨가하였다(pH = 1). 적색 침전물을 적색 용액으로부터 침전시켰다. 현탁액을 여과하고 여과 잔류물을 아세토니트릴(100 ㎖)로 세척하였다. 여과물에 tert-부틸 메틸 에테르(200 ㎖) 및 포화된 수성 NaCl 용액(100 ㎖)을 첨가하였다. 상을 분리시키고 유기 상을 포화된 수성 NaCl 용액(2 x 100 ㎖)으로 세척하였다. 그리고나서 결합된 수성 상을 tert-부틸 메틸 에테르(100 ㎖)로 재추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 잔류물을 앞서 수득한 여과 잔류물과 배합시키고, 아세토니트릴(200 ㎖)을 첨가하고 4시간 동안 실온에서 교반하였다. 그리고나서 수득한 현탁액을 여과시켰다. 여과 잔류물을 아세토니트릴(50 ㎖)로 세척하고 진공 건조 오븐(50℃, 125 mbar)에서 건조시켰다. 44.95 g(155 mmol; 89% 수율)의 적색 고체를 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ = 4.66 (s, 2H), 7.56-7.58 (m, 2H), 7.70-7.73 (m, 1H), 7.94-7.96 (m, 2H), 7.00-8.03 (m, 1H), 8.26-8.28 (m, 1H), 8.66-8.68 (m, 1H), 13.03 (s, 1H).
13C-NMR (DMSO-d6, 100.6 MHz): δ = 39.6, 121.9, 127.8, 129.4, 129.5, 129.9, 137.7, 140.6, 148.3, 155.3, 166.9, 226.0.
단계 3: 4-(피리딘-2-카르보티오일설파닐메틸)-벤조산-2-(메타크릴로일옥시)-에틸 에스테르
디클로로메탄(100 ㎖) 중 4-(피리딘-2-카르보티오일설파닐메틸)-벤조산(10.39 g, 35.9 mmol), 2-히드록시에틸 메타크릴레이트(4.67 g, 35.9 mmol), N,N-디메틸아미노피리딘(600 mg, 5.0 mmol) 및 BHT(10 mg)의 현탁액을 0℃로 냉각시켰다. 3-(에틸이미노메틸리덴아미노)-N,N-디메틸-프로판-1-아민히드로클로라이드(8.26 g, 43.1 mmol)를 첨가하고 반응 혼합물을 1시간 동안 0℃에서 그리고 16시간 동안 실온에서 교반하였다. 적색 반응 용액을 실리카겔 층(SiO2, 디클로로메탄) 상에서 여과시키고 여과물을 회전식 증발기에서 농축시켰다. 유성 적색 고체에 n-헥산(100 ㎖)을 첨가하고, 20시간 동안 실온에서 교반하고 여과시켰다. 여과 잔류물을 n-헥산(50 ㎖)으로 세척하고 진공 건조 오븐(50℃, 125 mbar)에서 건조시켰다. 11.22 g(27.9 mmol; 78% 수율)의 담적색 고체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.95 (s, 3H), 4.47-4.50 (m, 2H), 4.54-4.58 (m, 4H), 5.58-5.59 (m, 1H), 6.13-6.14 (m, 1H), 7.46-7.49 (m, 3H), 7.7 -7.81 (m, 1H), 7.98-8.00 (m, 2H), 8.31-8.33 (m, 1H), 8.59-8.61 (m, 1H).
13C-NMR (CDCl3, 100.6 MHz): δ = 18.3, 40.8, 62.4, 62.7, 122.3, 126.2, 127.0, 129.0, 129.5, 130.0, 135.9, 137.0, 141.0, 148.0, 156.1, 166.0, 167.1, 225.4.
단계 4: 메타크릴산-2-메틸렌-부트-3-에닐 에스테르
리튬 디이소프로필아미드(파라핀 오일 중 30 중량%, 53.58 g, 150 몰)에 디에틸 에테르(150 ㎖)를 첨가하고 -5℃로 냉각시켰다. 그리고나서 이소프렌 모노옥시드(11.78 g, 140 mmol)를 적가하였다. 반응 혼합물을 3시간 동안 -5℃에서 교반한 후 1시간 동안 실온에서 교반하였다. 얼음 냉각을 동반하여, 2N 염산(100 ㎖)을 첨가하고 상을 분리시켰다. 유기 상을 수성 NaHCO3 용액(5 중량%; 100 ㎖)으로 세척하고 결합된 수성 상을 디에틸 에테르(5 x 50 ㎖)로 재추출하였다. 그리고나서 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다(40℃, 750 mbar-90 mbar). 수득한 황색을 띈 오일을 아세토니트릴(3 x 100 ㎖)로 추출하고 배합된 아세토니트릴 용액을 회전식 증발기에서 농축시켰다(40℃, 150 mbar-90 mbar). 이렇게 수득한 황색 액체를 디클로로메탄(70 ㎖) 중에 용해시켰다. 트리에틸아민(5.06 g, 50.0 mmol) 및 N,N-디메틸아미노피리딘(600 mg, 5.0 mmol)을 첨가하고 용액을 -5℃로 냉각시켰다. 디클로로메탄(30 ㎖) 중 메타크릴산 무수물(7.71 g, 50.0 mmol) 및 BHT(10 mg)의 용액을 적가하였다. 반응 혼합물을 2시간 동안 -5℃에서 그리고 22시간 동안 실온에서 교반하고, 물(3 x 100 ㎖)로 세척하고, Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 황색-갈색 오일을 디클로로메탄(50 ㎖) 중에 용해시키고 실리카겔 층 상에서 여과시켰다. 여과물을 회전식 증발기에서 농축시키고 미세 진공 하에 건조시켰다. 3.85 g(25.3 mmol; 51% 수율)의 황색 액체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.97 (s, 3H), 4.84 (s, 2H), 5.14 (d, J = 11.2 Hz; 1H), 5.22-5.29 (m, 3H), 5.58 (s, 1H), 6.14 (s, 1H), 6.39 (dd, J = 11.0 Hz, 17.8 Hz; 1H).
13C-NMR (CDCl3, 100.6 MHz): δ = 18.3, 63.7, 114.6, 117.8, 125.7, 136.2, 136.2, 140.7, 167.0.
단계 5: 4-[4(5)-(메타크릴로일옥시메틸)-2-피리딘-2-일-3,6-디히드로-2H-티오피란-2-일설파닐메틸]-벤조산-2-(메타크릴로일옥시)-에틸 에스테르
4-(피리딘-2-카르보티오일설파닐메틸)-벤조산-2-(메타크릴로일옥시)-에틸 에스테르(6.59 g, 16.4 mmol) 및 트리플루오로아세트산(1.87 g, 16.4 mmol)을 클로로포름(70 ㎖) 중에 용해시켰다. 클로로포름(30 ㎖) 중 메타크릴산-2-메틸렌-부트-3-에닐 에스테르(3.75 g, 24.6 mmol)의 용액을 적가하였다. 초기에 적색 용액을 24시간 동안 실온에서 교반하고, 이때 탈색 증가가 발생하였다. 그리고나서 용액을 수성 NaHCO3 용액(5 중량%; 3 x 50 ㎖)으로 세척하고, Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 약간 적색을 띈 미정제 생성물을 컬럼 크로마토그래피(SiO2, n-헥산/에틸 아세테이트 4:1)로 정제하였다. 7.22 g(13.0 mmol; 80% 수율)의 불가분성 이성질체 혼합물을 황색을 띈 오일로서 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.94 (s, 3H), 1.95 (s, 3H), 2.84-2.95 (m, 1H), 3.07-3.20 (m, 2H), 3.44-3.56 (m, 2H), 3.78 (d, J = 12.8 Hz; 1H), 4.46-4.48 (m, 2H), 4.53-4.55 (m, 2H), 4.57-4.63 (m, 2H), 5.56-5.59 (m, 2H), 5.88-5.89 (m, 0.7H), 5.97-5.98 (m, 0.3H), 6.12 (s, 1H), 6.13 (s, 1H), 7.13-7.16 (m, 3H), 7.60-7.65 (m, 1H), 7.69-7.74 (m, 1H), 7.82-7.85 (m, 2H), 8.51-8.54 (m, 1H).
13C-NMR (CDCl3, 100.6 MHz): δ = 18.3, 18.3, 26.1, 26.4, 35.1, 38.9, 39.4, 61.1, 62.4, 62.6, 68.1, 68.7, 121.5, 121.6, 122.5, 122.6, 124.9, 125.8, 126.1, 128.2, 128.2, 129.0, 129.0, 129.6, 129.7, 129.8, 132.2, 135.9, 136.1, 136.7, 136.7, 143.2, 143.4, 148.1, 148.2, 161.2, 161.4, 166.0, 167.0, 167.1.
실시예
9
메타크릴산-4-[3-(
메타크릴로일옥시
)-프로필]-3,5-
디옥소
-10-옥사-4-
아자
-
트리
시클로[
5.2.1.0
2,6
]데크
-8-엔-1-
일메틸
에스테르의 합성
1-히드록시메틸-4-(3-히드록시-프로필)-10-옥사-4-아자-트리시클로[5.2.1.02,6] 데크-8-엔-3,5-디온(18.29 g, 72.2 mmol), 트리에틸아민(16.08 g, 159 mmol), N,N-디메틸아미노피리딘(600 mg, 5.0 mmol) 및 BHT(10 mg)를 디클로로메탄(100 ㎖) 중에 용해시켰다. 디클로로메탄(50 ㎖) 중 메타크릴산 무수물(24.49 g, 159 mmol)의 용액을 0℃에서 적가하였다. 투명한 황색 용액을 2시간 동안 -0℃에서 교반한 후, 얼음 배쓰를 제거하고 실온에서 교반을 계속하였다. 22시간 후, 반응 용액을 물(3 x 100 ㎖)로 세척하였다. 결합된 수성 상을 디클로로메탄(100 ㎖)으로 재추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고 회전식 증발기에서 농축시켰다. 갈색을 띈 오일을 컬럼 크로마토그래피(SiO2, n-헥산/에틸 아세테이트 2:1)로 정제하였다. 15.04 g(38.6 mmol, 53% 수율, 엑소 및 엔도 이성질체의 혼합물)의 황색 오일을 수득하였다.
1H-NMR (DMSO-d6, 400 MHz): δ = 1.81-1.90 (m, 9.6H; 엑소/엔도), 3.04 (d, 1H; J = 6.5 Hz; 엔도), 3.10 (d, 1H; J = 6.5 Hz; 엔도), 3.31-3.35 (m, 0.4H; 엑소), 3.47-3.51 (m, 2.2H; 엑소/엔도), 3.70-3.73 (m, 0.2H; 엑소), 3.99-4.05 (m, 2.4H; 엑소/엔도), 4.41 (d, 1H; J = 12.6 Hz; 엔도), 4.63 (d, 0.2H; J = 12.8 Hz; 엑소), 4.79 (d, 0.2H; J = 12.8 Hz; 엑소), 4.84 (d, 1H; J = 12.6 Hz; 엔도), 5.15 (d, 1H; J = 1.6 Hz; 엔도), 5.32 (dd, 0.2H; J = 5.6 Hz, 1.5 Hz; 엑소), 5.67-5.69 (m, 2.2H; 엑소/엔도), 5.71-5.73 (m, 0.2H; 엑소), 6.01-6.08 (m, 2.4H; 엑소/엔도), 6.42 (d, 0.2H; J = 6.1 Hz; 엑소), 6.49-6.53 (m, 1.2H; 엑소/엔도), 6.60-6.62 (m, 1H; 엔도).
13C-NMR (DMSO-d6, 100.6 MHz): δ = 17.8 (엔도), (17.8; 엑소), 17.9, (26.2), 26.2, (34.6), 34.9, (46.4), (47.3), 48.2, 49.7, 61.4, (61.5), 61.6, (62.0), (78.8), 80.5, 88.8 (89.1), 125.5, 126.1, (126.3), (134.3), (135.4), 135.5, (135.7), 135.8, 136.6, 137.2, 166.0, 166.4, (174.5), (174.6), 174.7, 176.0.
실시예 10
메타크릴산-3,5-
디옥소
-4-(3-
트리에톡시실릴프로필
)-10-옥사-4-
아자
-
트리시클
로[
5.2.1.0
2,6
]데크
-8-엔-1-
일메틸
에스테르의 합성
단계 1: N-(3-트리에톡시실릴프로필)-말레이미드(SI126)
말레산 무수물(29.42 g, 300 mmol)을 톨루엔(100 ㎖) 중에 현탁시켰다. 톨루엔(75 ㎖) 중 3-아미노프로필트리에톡시실란(66.41 g, 300 mmol)의 용액을 적가하고 반응 용액을 실온에서 교반하였다. 2시간 후, 염화아연(13.63 g, 100 mmol)을 먼저 첨가한 후, 톨루엔(75 ㎖) 중 헥사메틸디실라잔(60.52 g, 375 mmol)의 용액을 적가하였다. 현탁액을 환류 하에 24시간 동안 가열하고 실온으로 냉각시킨 후 셀라톰(Celatom) 상에서 여과하였다. 여과물을 회전식 증발기에서 농축시키고 미세 진공 하에 건조시켰다. 미정제 생성물을 진공 증류로 정제하였다(bp: 125℃/0.03 mbar). 15.14 g(50.3 mmol, 17% 수율)의 무색 액체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 0.41-0.49 (m, 2H), 1.08 (t, 9H; J = 7.1 Hz), 1.49-1.60 (m, 2H), 3.37 (t, 2H; J = 7.3 Hz), 3.60-3.70 (m, 6H), 6.59 (s, 2H).
13C-NMR (CDCl3, 100.6 MHz): δ = 6.1, 16.7, 20.5, 38.7, 56.8, 132.5, 169.2.
29Si-NMR (CDCl3, 79.5 MHz): δ = -46.4.
단계 2: 메타크릴산-3,5-디옥소-4-(3-트리에톡시실릴프로필)-10-옥사-4-아자-트리시클로[5.2.1.02,6]데크-8-엔-1-일메틸 에스테르
톨루엔(150 ㎖) 중 퍼푸릴 메타크릴레이트(8.24 g, 49.6 mmol), N-(3-트리에톡시실릴프로필)-말레이미드(14.94 g, 49.6 mmol) 및 BHT(10 mg)의 용액을 가벼운 기류의 도입에 의해 동반되는 80℃로 가열하였다. 20시간 후, 용매를 회전식 증발기에서 농축시키고 미정제 생성물을 컬럼 크로마토그래피(SiO2, n-헥산/에틸 아세테이트 2:1)로 정제하였다. 5.67 g(12.1 mmol, 24% 수율, 엑소 및 엔도 이성질체의 혼합물)의 무색 오일을 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 0.43-0.47 (m, 2.2H; 엑소/엔도), 1.06-1.10 (m, 9.9H; 엑소/엔도), 1.37-1.46 (m, 0.2H; 엑소), 1.50-1.58 (m, 2H, 엔도), 1.82 (s, 3H; 엔도), 1.84 (s, 0.3H; 엑소), 2.85 (dd, 2H, J = 28.2 Hz, 6.4 Hz; 엔도), 3.19 (t, 0.2H; J = 7.3 Hz; 엑소), 3.28 (d, 0.2H; J = 7.3 Hz; 엑소), 3.35 (t, 2H; J = 7.3 Hz; 엔도), 3.63-3.71 (m, 6.6H; 엑소/엔도), 4.38 (d, 1H, J = 12.7 Hz; 엔도), 4.56 (d, 0.1H, J = 12.7 Hz; 엑소), 4.78 (d, 0.1H, J = 12.7 Hz; 엑소), 4.87 (d, 1H, J = 12.7 Hz; 엔도), 5.15 (s, 1H; 엔도), 5.18-5.20 (m, 0.1H; 엑소), 5.48 (s, 1H; 엔도), 5.50 (s, 0.1H; 엑소), 6.00 (s, 1H; 엔도), 6.05 (s, 0.1H; 엑소), 6.22 (d, 0.1H, J = 5.4 Hz; 엑소), 6.34 (d, 1.1H, J = 5.4 Hz; 엔도/엑소), 6.45-6.47 (m, 1H; 엔도).
13C-NMR (CDCl3, 100.6 MHz): δ = 5.9 (엔도), 6.3 (엑소), 16.6, 19.5, 45.2 (엑소), 46.1 (엑소), 46.7 (엔도), 48.3 (엔도), 56.7, 60.0 (엔도), 60.6 (엑소), 77.9 (엑소), 79.4 (엔도), 87.9 (엔도), 78.1 (엑소), 124.6 (엔도), 124.8 (엑소), 132.8 (엑소), 134.0 (엑소), 134.1 (엑소), 134.1 (엔도), 135.5 (엔도), 135.8 (엔도), 165.1, 172.7 (엔도), 172.8 (엑소), 172.9 (엑소), 174.2 (엔도).
29Si-NMR (CDCl3, 79.5 MHz): δ = -46.6 (엑소), -46.3 (엔도).
실시예
11
비스
-(4-
메타크릴로일옥시벤조일
)-
디에틸게르마늄의
합성
단계 1: 2-(4-메톡시페닐)-1,3-디티안
클로로포름(500 ㎖) 중 p-아니살데히드(136.2 g, 1.0 몰)의 용액에 1,3-프로판디티올(108.2 g, 1.0 몰)을 첨가하고 -10℃로 냉각하였다. 45분 동안 현탁액에 HCl 기체 스트림을 통과시켰다. 그리고나서 추가 30분 동안 0℃에서 교반을 수행한 후, 냉각 배쓰를 제거하고 반응 혼합물을 16시간 동안 실온에서 교반하였다. 용매를 회전식 증발기에서 제거하고 잔류물에 메탄올(300 ㎖)을 첨가하였다. 현탁액을 24시간 동안 실온에서 교반하고 여과시켰다. 여과 잔류물을 메탄올(50 ㎖)로 세척하고 진공 건조 오븐(125 mbar, 50℃)에서 건조시켰다. 219.9 g(970 mmol, 97% 수율)의 백색 고체를 수득하였다(mp: 117-119℃).
1H-NMR (CDCl3, 400 MHz): δ = 1.87 1.97 (m, 1H, -CH2-), 2.13-2.20 (m, 1H, -CH2 ), 2.88-2.93 (m, 2H, S-CH2-), 3.02-3.09 (m, 2H, S-CH2-), 3.79 (s, 3H, O-CH3), 5.13 (s, 1H, S-CH-S), 6.85-6.87 (m, 2H, Ar-H3 ,5), 7.38-7.40 (m, 2H, Ar-H2 ,6).
13C-NMR (CDCl3, 100.6 MHz): δ = 25.1 (-CH2-), 32.2 (-CH2-), 50.1 (S-C-S), 55.3 (O-CH3), 114.1 (Ar-C3 ,5), 128.9 (Ar-C2 ,6), 131.3 (Ar-C1), 159.6 (Ar-C4).
단계 2: 비스-[2-(4-메톡시페닐)-1,3-디티안-2-일]-디에틸게르마늄
2-(4-메톡시페닐)-1,3-디티안(113.2 g, 500 mmol)을 보호 가스 하에 무수(absolute) THF(500 ㎖) 중에 용해시키고 -5℃로 냉각시켰다. n-헥산(200 ㎖, 500 mmol) 중 2.5 M 부틸리튬 용액을 적가하였다. 그리고나서 갈색 반응 용액을 3시간 동안 -5℃에서 교반한 후, 무수 THF(100 ㎖) 중 디에틸게르마늄 디클로라이드(42.0 g, 208 mmol)의 용액을 적가하였다. 반응 혼합물을 밤새 해동 얼음 배쓰에서 추가로 교반한 후, 물(200 ㎖) 및 에틸 아세테이트(400 ㎖)를 첨가하고 상을 분리시켰다. 유기 상을 물(2 x 125 ㎖)로 세척하고 결합된 수성 상을 에틸 아세테이트(150 ㎖)를 재추출하였다. 결합된 유기 상을 포화된 수성 NaCl 용액(150 ㎖)으로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 회전식 증발기에서 농축시키고 미세 진공 하에 건조시켰다. 잔류물에 에틸 아세테이트(100 ㎖)를 첨가하고 현탁액을 실온에서 교반하였다. 20시간 후, 메탄올(100 ㎖)을 첨가하고 추가 24시간 후 현탁액을 여과시켰다. 여과 잔류물을 에틸 아세테이트(20 ㎖)로 세척하고 진공 건조 오븐(125 mbar, 50℃)에서 건조시켰다. 88.8 g(153 몰, 73% 수율)의 백색 고체를 수득하였다(mp: 115-116℃).
1H-NMR (CDCl3, 400 MHz): δ = 1.15 (m, 6H, -CH3), 1.28 (m, 4H, Ge-CH2-), 1.77-1.81 (m, 2H, -CH2-), 1.94-2.05 (m, 2H, -CH2-), 2.24-2.29 (m, 4H, S-CH2-), 2.70-2.77 (m, 4H, S-CH2-), 3.82 (s, 6H, O-CH3), 6.80-6.82 (m, 4H, Ar-H3 ,5), 7.78-7.80 (m, 4H, Ar-H2 ,6).
13C-NMR (CDCl3, 100.6 MHz): δ = 4.5 (-CH3), 10.2 (Ge-CH2-), 25.2 (-CH2-), 25.6 (S-CH2-), 51.2 (Ge-C-S), 55.2 (O-CH3), 113.3 (Ar-C3 ,5), 131.4 (Ar-C2 ,6), 132.5 (Ar-C1), 157.5 (Ar-C4).
단계 3: 비스-(4-메톡시벤조일)-디에틸게르마늄
THF(900 ㎖) 중 비스-[2-(4-메톡시페닐)-1,3-디티안-2-일]-디에틸게르마늄(87.21 g, 150 몰)의 용액에 물(220 ㎖)을 첨가하였다. 탄산칼슘(180.2 g, 1.80 몰) 및 요오드(456.9 g, 1.80 몰)를 각각 동일하게 8부분으로 나누었다. 30분의 간격 후, 각 경우에, CaCO3 및 요오드의 각 한 부분을 간헐적인 얼음 냉각을 동반하여 반응 혼합물에 첨가하였다. 첨가를 완료한 후, 반응 혼합물을 24시간 동안 실온에서 교반하고 그리고나서 실리카겔의 박층 상에서 여과시켰다. 강력한 교반을 동반하여 색상이 완전하게 황색으로 변화할 때까지 적갈색 여과물에 포화된 수성 나트륨 디티오니트 용액(1600 ㎖)을 첨가하였다. 현탁액을 여과하고 여과 잔류물을 에틸 아세테이트(400 ㎖)로 세척하였다. 여과물을 에틸 아세테이트(800 ㎖)로 희석시키고 상을 분리시켰다. 유기 상을 물(2 x 250 ㎖)로 세척하고 결합된 수성 상을 에틸 아세테이트(2 x 200 ㎖)로 재추출하였다. 결합된 유기 상을 포화된 수성 NaCl 용액(200 ㎖)으로 세척하고, Na2SO4 상에서 건조시키고, 여과하고, 회전식 증발기에서 농축시키고 미세 진공 하에 건조시켰다. 미정제 생성물을 컬럼 크로마토그래피(SiO2, n-헥산/에틸 아세테이트 9:1)로 정제하였다. 38.4 g(95.9 mmol, 64% 수율)의 황색 고체를 수득하였다(mp: 47-50℃).
1H-NMR (CDCl3, 400 MHz): δ = 1.12 (t, 6H; J = 7.9 Hz, -CH3), 1.47 (q, 4H; J = 7.9 Hz, Ge-CH2-), 3.80 (s, 6H, O-CH3), 6.87-6.91 (m, 4H, Ar-H3 ,5), 7.71-7.75 (m, 4H, Ar-H2 ,6).
13C-NMR (CDCl3, 100.6 MHz): δ = 6.4 (-CH3), 9.0 (Ge-CH2-), 55.5 (O-CH3), 114.1 (Ar-C3 ,5), 130.5 (Ar-C2 ,6), 135.0 (Ar-C1), 163.8 (Ar-C4), 227.4 (C=O).
단계 4: 비스-(4-히드록시벤조일)-디에틸게르마늄
비스-(4-메톡시벤조일)디에틸게르마늄(8.0 g, 20.0 mmol)을 보호 가스 하에서 무수 톨루엔(200 ㎖) 중에 용해시키고 셀라톰(10 g) 및 염화알루미늄(9.6 g, 72.0 mmol)을 첨가하였다. 반응 혼합물을 2시간 동안 환류 하에 가열하였다. 냉각 후, 물(10 ㎖)을 첨가하고 현탁액을 10분 동안 실온에서 교반하였다. 용매를 회전식 증발기에서 제거하였다. 잔류물에 에틸 아세테이트(300 ㎖)를 첨가하였다. 현탁액을 16시간 동안 실온에서 교반하고 실리카겔의 박층 상에서 여과시켰다. 여과물을 회전식 증발기에서 농축시켰다. 유성 갈색 잔류물에 클로로포름(200 ㎖)을 첨가하였다. 현탁액을 16시간 동안 실온에서 교반하고 여과시켰다. 여과 잔류물을 클로로포름(80 ㎖)으로 세척하고 진공 건조 오븐(50℃, 125 mbar)에서 건조시켰다. 4.23 g(11.3 mmol, 57% 수율)의 담황색 고체를 수득하였다(mp: 167-168℃).
1H-NMR (DMSO-d6, 400 MHz): δ = 1.04 (t, 6H; J = 7.9 Hz, -CH3), 1.38 (q, 4H; J = 7.9 Hz, Ge-CH2-), 6.88 (d, 4H; J = 8.5 Hz, Ar-H3 ,5), 7.58 (d, 4H; J = 8.5 Hz, Ar-H2 ,6), 10.53 (s, 2H, OH).
13C-NMR (DMSO-d6, 100.6 MHz): δ = 6.1 (-CH3), 8.9 (Ge-CH2-), 115.7 (Ar-C3,5), 130.3 (Ar-C2 ,6), 133.3 (Ar-C1), 162.7 (Ar-C4), 225.5 (C=O).
단계 5: 비스-(4-메타크릴로일옥시벤조일)-디에틸게르마늄
디클로로메탄(50 ㎖) 중 메타크릴산 무수물(5.89 g, 38.2 mmol) 및 BHT(10 mg)의 용액을 -5℃에서 디클로로메탄(100 ㎖) 중 비스-(4-히드록시벤조일)-디에틸게르마늄(6.78 g, 18.2 mmol), 트리에틸아민(3.86 g, 38.2 mmol) 및 N,N-디메틸아미노피리딘(240 mg, 2.0 mmol)의 용액에 적가하였다. 첨가를 완료한 후, 용액을 1시간 동안 -5℃에서 그리고 20시간 동안 실온에서 교반하였다. 반응 용액을 물(3 x 100 ㎖)로 세척하였다. 결합된 수성 상을 디클로로메탄(2 x 50 ㎖)으로 재추출하였다. 결합된 유기 상을 Na2SO4 상에서 건조시키고, 여과하고, 회전식 증발기에서 농축시키고r 미세 진공 하에 건조시켰다. 미정제 생성물을 컬럼 크로마토그래피(SiO2, n-헥산/에틸 아세테이트 4:1)로 정제하였다. 4.40 g(8.6 mmol, 47% 수율)의 황색 고체를 수득하였다.
1H-NMR (CDCl3, 400 MHz): δ = 1.13 (t, 6H; J = 7.9 Hz, -CH3), 1.51 (q, 4H; J = 7.9 Hz, Ge-CH2-), 2.04 (s, 6H, CH3), 5.79-5.77 (m, 2H, C=CH), 6.34 (s, 2H, C=CH), 7.23-7.20 (m, 4H, Ar-H3 ,5), 7.80-7.77 (m, 4H, Ar-H2 ,6).
13C-NMR (CDCl3, 100.6 MHz): δ = 6.5 (Ge-CH2-), 9.0 (Ge-CH2-CH3), 18.3 (CH3), 122.3 (Ar C3 ,5), 128.0 (C=CH2), 129.6 (Ar-C2 ,6), 135.4 (C=C), 138.6 (Ar-C1), 155.0 (Ar-C4), 165.1 (C=O), 228.3 (Ge-C=O).
Claims (24)
- 하기 화학식 II의 열불안정성 중합가능한 화합물을 포함하는 치과용 수복(restorative) 재료:
[화학식 II]
상기 식에서,
Z1 및 Z2는 각 경우에 독립적으로 비닐 기, CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 -Si(OR)3, -COOH, -O-PO(OH)2, -PO(OH)2, -SO2OH 및 -SH에서 선택된 접착성 기를 나타내고, 여기서 하나 이상의 Z1 또는 Z2는 중합가능한 기이고,
Q1은 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -S-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C20 라디칼을 나타내고,
R, R1, R2 및 R3은 각 경우에 독립적으로 H 또는 C1-C7 알킬 라디칼을 나타내고,
R4는 H 또는 C1-C10 알킬 라디칼이고,
R5는 H, C1-C5 알킬 라디칼, F 또는 CN이고,
R6은 H, C1-C5 알킬 라디칼, F 또는 CN이고,
m 및 n은 각 경우에 독립적으로 1, 2 또는 3이다. - 제1항에 있어서, 각 경우에 서로 독립적으로
Z1 및 Z2 중 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기를 나타내고 Z1 및 Z2 중 나머지 하나는 각 경우에 독립적으로 CH2=CR1-CO-O- 및 CH2=CR1-CO-NR2-에서 선택된 중합가능한 기 또는 -Si(OR)3, -COOH, -O-PO(OH)2, -PO(OH)2, SO2OH 및 -SH에서 선택된 접착성 기를 나타내고,
Q1은 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (m+1)-가 선형 또는 분지형 지방족 C1-C15 라디칼을 나타내고,
Q2는 각 경우에 독립적으로 부재하거나 또는 -O-, -CO-O-, -O-CO-, -CO-NR3-, -NR3-CO-, -O-CO-NR3-, -NR3-CO-O- 또는 -NR3-CO-NR3-이 개재될 수 있는 (n+1)-가 선형 또는 분지형 지방족 C1-C15 라디칼을 나타내고,
R은 각 경우에 독립적으로 CH3 또는 C2H5이고,
R1은 각 경우에 독립적으로 H 또는 CH3이고,
R2는 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R3은 각 경우에 독립적으로 H, CH3 또는 C2H5이고,
R4는 H, CH3 또는 C2H5이고,
R5는 H, F 또는 CN이고,
R6은 H, F 또는 CN이고/이거나
m 및 n은 각 경우에 독립적으로 1 또는 2인 치과용 수복 재료. - 제1항 또는 제2항에 있어서, 하나 이상의 추가 라디칼 중합가능한 단량체를 포함하는 치과용 수복 재료.
- 제3항에 있어서,
메틸, 에틸, 히드록시에틸, 부틸, 벤질, 테트라히드로퍼푸릴 또는 이소보르닐 (메타)아크릴레이트, 비스페놀-A-디(메타)아크릴레이트, 2,2-비스[4-(2-히드록시-3-메타크릴옥시프로폭시)페닐]프로판, 우레탄 디메타크릴레이트, 디-, 트리- 또는 테트라-에틸렌 글리콜 디(메타)아크릴레이트, 트리메틸올프로판 트리(메타)아크릴레이트, 펜타에리트리톨 테트라(메타)아크릴레이트, 글리세롤 디(메타)아크릴레이트, 1,4-부탄디올 디(메타)아크릴레이트, 1,10-데칸디올 디(메타)아크릴레이트, 1,12-도데칸디올 디(메타)아크릴레이트,
하나 이상의 N-일치환 또는 이치환된 아크릴아미드, N-에틸아크릴아미드, N,N-디메타크릴아미드, N-(2-히드록시에틸)아크릴아미드, N-메틸-N-(2-히드록시에틸)아크릴아미드, 하나 이상의 N-일치환된 메타크릴아미드, N-에틸메타크릴아미드, N-(2-히드록시에틸)메타크릴아미드, N-비닐피롤리돈, 하나 이상의 가교결합성 알릴 에테르,
하나 이상의 가교결합성 피롤리돈, 1,6-비스(3-비닐-2-피롤리돈일)-헥산, 하나 이상의 가교결합성 비스아크릴아미드, 메틸렌 또는 에틸렌 비스아크릴아미드, 하나 이상의 가교결합성 비스(메타)아크릴아미드, N,N'-디에틸-1,3-비스(아크릴아미도)-프로판, 1,3-비스(메타크릴아미도)-프로판, 1,4-비스(아크릴아미도)-부탄, 1,4-비스(아크릴로일)-피페라진, 및
하나 이상의 열불안정성 가교결합성 단량체로 이루어진 군에서 선택되는 하나 이상을 포함하는 치과용 수복 재료. - 제1항 또는 제2항에 있어서, 하나 이상의 열불안정성 가교결합성 단량체를 포함하는 치과용 수복 재료.
- 제1항 또는 제2항에 있어서, 하나 이상의 라디칼 중합가능한, 산 기 함유 단량체를 포함하는 치과용 수복 재료.
- 제6항에 있어서,
말레산, 아크릴산, 메타크릴산, 2-(히드록시메틸)아크릴산, 4-(메타)아크릴로일옥시에틸트리멜리트산 무수물, 10-메타크릴로일옥시데실말론산, N-(2-히드록시-3-메타크릴로일옥시프로필)-N-페닐글리신, 4-비닐벤조산,
비닐포스폰산, 4-비닐페닐포스폰산, 4-비닐벤질포스폰산, 2-메타크릴로일옥시에틸포스폰산, 2-메타크릴아미도에틸포스폰산, 4-메타크릴아미도-4-메틸-펜틸-포스폰산, 2-[4-(디히드록시포스포릴)-2-옥사-부틸]-아크릴산, 2-[4-(디히드록시포스포릴)-2-옥사-부틸]-아크릴산 에틸- 또는 -2,4,6-트리메틸페닐 에스테르,
2-메타크릴로일옥시프로필 모노- 또는 디-히드로겐 포스페이트, 2-메타크릴로일옥시에틸페닐 히드로겐 포스페이트, 디펜타에리트리톨-펜타메타크릴로일옥시포스페이트, 10-메타크릴로일옥시데실 디히드로겐 포스페이트, 인산 모노-(1-아크릴로일-피페리딘-4-일)-에스테르, 6-(메타크릴아미도)헥실 디히드로겐 포스페이트, 1,3-비스-(N-아크릴로일-N-프로필-아미노)-프로판-2-일-디히드로겐 포스페이트,
비닐설폰산, 4-비닐페닐설폰산, 및 3-(메타크릴아미도)프로필설폰산으로 이루어진 군에서 선택되는 하나 이상을 포함하는 치과용 수복 재료. - 제1항 또는 제2항에 있어서, 라디칼 중합을 위한 개시제를 포함하는 치과용 수복 재료.
- 제1항 또는 제2항에 있어서, 열적 기체-방출성 첨가제를 포함하는 치과용 수복 재료.
- 제1항 또는 제2항에 있어서, 방출된 전자기 방사선을 열로 전환시킬 수 있는 첨가제를 포함하는 치과용 수복 재료.
- 제1항에 있어서, 유기 및/또는 무기 충전재를 포함하는 치과용 수복 재료.
- 제1항에 있어서,
a) 0.1∼50 중량%의 화학식 II의 화합물,
b) 0.01∼10 중량%의 개시제,
c) 0∼80 중량%의 공단량체,
d) 0∼30 중량%의 접착성 단량체,
e) 0∼80 중량%의 충전재,
f) 0∼70 중량%의 용매
를 포함하는 치과용 수복 재료. - 제11항 또는 제12항에 있어서, 접착제로서 사용하고, 0∼20 중량%의 충전재를 포함하는 치과용 수복 재료.
- 제11항 또는 제12항에 있어서, 복합재로서 사용하고, 20∼80 중량%의 충전재를 포함하는 치과용 수복 재료.
- 제1항 또는 제2항에 정의된 화학식 II의 화합물을 치과용 수복 재료의 제조에 사용하는 방법.
- 제15항에 있어서, 접착제 또는 시멘트의 제조에 사용하는 방법.
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
- 삭제
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP11180645.1 | 2011-09-08 | ||
| EP11180645 | 2011-09-08 | ||
| PCT/EP2012/067679 WO2013034777A2 (de) | 2011-09-08 | 2012-09-10 | Dentalmaterialien auf basis von monomeren mit debonding-on-demand eigenschaften |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20140067015A KR20140067015A (ko) | 2014-06-03 |
| KR102059210B1 true KR102059210B1 (ko) | 2019-12-24 |
Family
ID=46880686
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147005273A KR102059210B1 (ko) | 2011-09-08 | 2012-09-10 | 온디맨드 탈착 특성을 갖는 단량체를 기초로 하는 치과용 재료 |
| KR1020147005278A KR102059211B1 (ko) | 2011-09-08 | 2012-09-10 | 온디맨드 탈착 특성을 갖는 화합물을 기초로 하는 치과용 재료 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020147005278A KR102059211B1 (ko) | 2011-09-08 | 2012-09-10 | 온디맨드 탈착 특성을 갖는 화합물을 기초로 하는 치과용 재료 |
Country Status (11)
| Country | Link |
|---|---|
| US (2) | US9320686B2 (ko) |
| EP (2) | EP2753291B1 (ko) |
| JP (2) | JP6095665B2 (ko) |
| KR (2) | KR102059210B1 (ko) |
| CN (2) | CN103781456B (ko) |
| BR (2) | BR112014004526A2 (ko) |
| CA (2) | CA2845887C (ko) |
| IN (1) | IN2014DN00942A (ko) |
| MX (2) | MX351429B (ko) |
| RU (2) | RU2627843C2 (ko) |
| WO (2) | WO2013034777A2 (ko) |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP2883528B1 (de) | 2013-12-15 | 2018-01-31 | Ivoclar Vivadent AG | Dentalwerkstoffe auf Basis von polymerisierbaren Aziden und Alkinen |
| EP2965740A1 (de) | 2014-07-11 | 2016-01-13 | Ivoclar Vivadent AG | Dentalmaterialien mit Debonding-on-Demand-Eigenschaften |
| EP3091037A1 (de) | 2015-05-07 | 2016-11-09 | Ivoclar Vivadent AG | Sulfonsäureester als regler in radikalischen polymerisationsreaktionen |
| ES2759899T3 (es) * | 2015-10-13 | 2020-05-12 | Ivoclar Vivadent Ag | Composiciones polimerizables a base de compuestos térmicamente escindibles |
| EP3184096B1 (de) * | 2015-12-21 | 2018-11-07 | Ivoclar Vivadent AG | Dentalmaterialien mit lichtinduzierter reversibler farbgebung |
| FR3064267B1 (fr) * | 2017-03-27 | 2021-07-23 | Arkema France | Compose reticulant, son procede de synthese, composition liquide comprenant ledit compose reticulant, son procede de polymerisation, et materiau obtenu apres polymerisation de ladite composition |
| US10717261B2 (en) * | 2017-10-19 | 2020-07-21 | Bell Helicopter Textron Inc. | Selectively activated frangible bonding system |
| JP7090884B2 (ja) * | 2018-04-02 | 2022-06-27 | 株式会社トクヤマデンタル | 高誘電率を有する官能基を有する酸性基含有重合性単量体 |
| EP3621089B1 (de) | 2018-09-10 | 2021-08-25 | Ivoclar Vivadent AG | Dentalmaterial mit magnetpartikeln mit verbesserter farbabschirmung |
| EP3640273A1 (en) * | 2018-10-16 | 2020-04-22 | Centre National De La Recherche Scientifique | Double dynamic polymers |
| US11358899B2 (en) | 2020-04-03 | 2022-06-14 | Covestro (Netherlands) B.V. | Self-healing optical fibers and the compositions used to create the same |
| WO2022178444A1 (en) * | 2021-02-22 | 2022-08-25 | Oregon Health & Science University | Dental adhesives formulated with secondary methacrylamides |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070142494A1 (en) * | 2005-12-20 | 2007-06-21 | Kalgutkar Rajdeep S | Dental compositions including a thermally labile component, and the use thereof |
Family Cites Families (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| SE520727C2 (sv) * | 1996-03-04 | 2003-08-19 | Ciba Sc Holding Ag | Alkylfenylbisacylfosfinoxid och fotoinitiatorblandningar |
| DE19832629A1 (de) | 1998-07-21 | 2000-02-03 | Daimler Chrysler Ag | Klebstoffsystem zur Bildung reversibler Klebeverbindungen |
| EP1213309A1 (en) | 2000-12-05 | 2002-06-12 | Huntsman International Llc | Supramolecular polymer forming polymer |
| FR2838048B1 (fr) * | 2002-04-03 | 2005-05-27 | Prod Dentaires Pierre Rolland | Produit dentaire reticulable/dereticulable |
| US7446132B2 (en) * | 2003-10-29 | 2008-11-04 | John Carcich | Zeolite additive for rubber and plastic |
| EP2267062B1 (en) | 2003-11-04 | 2017-10-25 | SupraPolix B.V. | Supramolecular polymers containing quadruple hydrogen bonding units in the polymer backbone |
| JP4397249B2 (ja) * | 2004-02-23 | 2010-01-13 | 三菱レイヨン株式会社 | 熱可塑性架橋ポリマー及び熱解離性架橋モノマー |
| US7919110B2 (en) * | 2005-01-25 | 2011-04-05 | Boston Scientific Scimed, Inc. | Medical device drug release regions containing non-covalently bound polymers |
| DE502005006753D1 (de) * | 2005-08-01 | 2009-04-16 | Ivoclar Vivadent Ag | Photopolymerisierbare Dentalmaterialien mit Bisacylphosphinoxiden als Initiator |
| US7776940B2 (en) | 2005-12-20 | 2010-08-17 | 3M Innovative Properties Company | Methods for reducing bond strengths, dental compositions, and the use thereof |
| US20070142498A1 (en) | 2005-12-20 | 2007-06-21 | Brennan Joan V | Dental compositions including thermally responsive additives, and the use thereof |
| EP2026744B1 (en) * | 2006-06-09 | 2016-03-30 | DENTSPLY International Inc. | Low stress flowable dental compositions |
| JP5665316B2 (ja) * | 2006-06-16 | 2015-02-04 | デンツプライ インターナショナル インコーポレーテッド | 光重合性且つ光開裂性の樹脂及び低応力複合組成物 |
| US8445558B2 (en) * | 2006-09-13 | 2013-05-21 | 3M Innovative Properties Company | Dental compositions including organogelators, products, and methods |
| EP1905415B1 (de) * | 2006-09-27 | 2009-07-01 | Ivoclar Vivadent AG | Polymerisierbare Zusammensetzungen mit Acylgermanium-Verbindungen als Initiatoren |
| US7935131B2 (en) * | 2006-10-25 | 2011-05-03 | University Of Rochester | Shape memory polymers |
| EP2310376B1 (en) | 2008-07-04 | 2014-11-05 | SupraPolix B.V. | High flow supramolecular compounds |
| US20100021839A1 (en) * | 2008-07-22 | 2010-01-28 | Xerox Corporation | Toner compositions |
| DE102009019483A1 (de) | 2009-05-04 | 2010-11-11 | Eads Deutschland Gmbh | Klebstoff-Zusammensetzung für lösbare Klebeverbindungen und Modifikation der Verkapselungsmaterialien für gezielte Energieeinbringung |
-
2012
- 2012-09-10 KR KR1020147005273A patent/KR102059210B1/ko active IP Right Grant
- 2012-09-10 CN CN201280043640.XA patent/CN103781456B/zh active Active
- 2012-09-10 MX MX2014002747A patent/MX351429B/es active IP Right Grant
- 2012-09-10 EP EP12762248.8A patent/EP2753291B1/de active Active
- 2012-09-10 JP JP2014529019A patent/JP6095665B2/ja active Active
- 2012-09-10 IN IN942DEN2014 patent/IN2014DN00942A/en unknown
- 2012-09-10 WO PCT/EP2012/067679 patent/WO2013034777A2/de active Application Filing
- 2012-09-10 KR KR1020147005278A patent/KR102059211B1/ko active IP Right Grant
- 2012-09-10 CA CA2845887A patent/CA2845887C/en active Active
- 2012-09-10 RU RU2014113543A patent/RU2627843C2/ru not_active IP Right Cessation
- 2012-09-10 CN CN201280043708.4A patent/CN103930085B/zh active Active
- 2012-09-10 RU RU2014113541/15A patent/RU2014113541A/ru not_active Application Discontinuation
- 2012-09-10 CA CA2845885A patent/CA2845885C/en not_active Expired - Fee Related
- 2012-09-10 BR BR112014004526A patent/BR112014004526A2/pt not_active Application Discontinuation
- 2012-09-10 US US14/343,300 patent/US9320686B2/en active Active
- 2012-09-10 US US14/343,297 patent/US9668946B2/en active Active
- 2012-09-10 JP JP2014529018A patent/JP6100262B2/ja active Active
- 2012-09-10 MX MX2014002746A patent/MX341258B/es active IP Right Grant
- 2012-09-10 WO PCT/EP2012/067680 patent/WO2013034778A2/de active Application Filing
- 2012-09-10 BR BR112014004703A patent/BR112014004703A2/pt not_active Application Discontinuation
- 2012-09-10 EP EP12761572.2A patent/EP2753290B1/de active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20070142494A1 (en) * | 2005-12-20 | 2007-06-21 | Kalgutkar Rajdeep S | Dental compositions including a thermally labile component, and the use thereof |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR102059210B1 (ko) | 온디맨드 탈착 특성을 갖는 단량체를 기초로 하는 치과용 재료 | |
| JP5366602B2 (ja) | 数個のGe原子を含む開始剤を含む重合性組成物 | |
| US9040602B2 (en) | Dental materials on the basis of highly acidic polymerizable bisphosphonic acids | |
| US20080076847A1 (en) | Polymerizable compositions with acylgermanes as initiatiors | |
| US10213367B2 (en) | Dental materials with debonding-on-demand properties | |
| CN106535862B (zh) | 具有可控的网状结构的复合材料 | |
| US20040077754A1 (en) | Dental materials based on acrylic-ester phosphonic acids | |
| US9861557B2 (en) | Dental materials on the basis of urea group-containing monomers | |
| EP1974712B1 (de) | Dentalmaterialien auf der Basis von radikalisch polymerisationsfähigen, N,O-funktionalisierten Acrylsäure-hydroxamiden | |
| JP6771324B2 (ja) | 有機珪素化合物及び歯科用修復材組成物 | |
| ES2683883T3 (es) | Ácidos ß-cetofosfónicos y materiales dentales a base de los mismos | |
| EP2289483A1 (de) | Verwendung von polymerisierbaren makrocyclischen Polyethern und makrocyclischen heteroanalogen Polyethern in Dentalmaterialien | |
| JP5323460B2 (ja) | アルキレンジアミン−n,n,n’,n’−四酢酸−(メタ)アクリルアミドに基づく歯科材料 | |
| JP6726276B2 (ja) | 熱的に切断可能な化合物をベースとした重合性組成物 | |
| US9393181B2 (en) | Dental materials with improved hydrolysis stability based on phthalic acid monomers | |
| CN113292594B (zh) | 长波吸收光引发剂 | |
| JP2019501230A5 (ko) |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant |