KR100589032B1 - 질소 함유 방향환 유도체 - Google Patents
질소 함유 방향환 유도체 Download PDFInfo
- Publication number
- KR100589032B1 KR100589032B1 KR1020057020292A KR20057020292A KR100589032B1 KR 100589032 B1 KR100589032 B1 KR 100589032B1 KR 1020057020292 A KR1020057020292 A KR 1020057020292A KR 20057020292 A KR20057020292 A KR 20057020292A KR 100589032 B1 KR100589032 B1 KR 100589032B1
- Authority
- KR
- South Korea
- Prior art keywords
- group
- formula
- compound
- atom
- ring
- Prior art date
Links
- 0 CN(C=*)c1ccc(*)cc1* Chemical compound CN(C=*)c1ccc(*)cc1* 0.000 description 12
- RUYDLPJWOKOHOJ-UHFFFAOYSA-N CC1c(cnc(O)c2)c2C(Cl)=NC=CC1 Chemical compound CC1c(cnc(O)c2)c2C(Cl)=NC=CC1 RUYDLPJWOKOHOJ-UHFFFAOYSA-N 0.000 description 1
- ZDAHJTXBJVGOCT-UHFFFAOYSA-N CNC(Nc(ccc(Oc1c(cc(c(OCC2CCNCC2)c2)C#N)c2ncc1)c1)c1Cl)=O Chemical compound CNC(Nc(ccc(Oc1c(cc(c(OCC2CCNCC2)c2)C#N)c2ncc1)c1)c1Cl)=O ZDAHJTXBJVGOCT-UHFFFAOYSA-N 0.000 description 1
- KTDRJLRJAHBQDQ-UHFFFAOYSA-N COc(cc(cc1)N)c1C#N Chemical compound COc(cc(cc1)N)c1C#N KTDRJLRJAHBQDQ-UHFFFAOYSA-N 0.000 description 1
- VRVHOWMIZCPNDC-UHFFFAOYSA-N C[NH+](c(cc1)ccc1Oc1ncnc(Nc(cc2)ccc2SC)c1)[O-] Chemical compound C[NH+](c(cc1)ccc1Oc1ncnc(Nc(cc2)ccc2SC)c1)[O-] VRVHOWMIZCPNDC-UHFFFAOYSA-N 0.000 description 1
- NAQOGHZQCMKHPY-UHFFFAOYSA-N Nc(cc1)cc([U])c1C#N Chemical compound Nc(cc1)cc([U])c1C#N NAQOGHZQCMKHPY-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/73—Unsubstituted amino or imino radicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4706—4-Aminoquinolines; 8-Aminoquinolines, e.g. chloroquine, primaquine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/47—Quinolines; Isoquinolines
- A61K31/4738—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4745—Quinolines; Isoquinolines ortho- or peri-condensed with heterocyclic ring systems condensed with ring systems having nitrogen as a ring hetero atom, e.g. phenantrolines
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/517—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with carbocyclic ring systems, e.g. quinazoline, perimidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/519—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim ortho- or peri-condensed with heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/04—Antineoplastic agents specific for metastasis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D207/00—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D207/02—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D207/30—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members
- C07D207/34—Heterocyclic compounds containing five-membered rings not condensed with other rings, with one nitrogen atom as the only ring hetero atom with only hydrogen or carbon atoms directly attached to the ring nitrogen atom having two double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/24—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with substituted hydrocarbon radicals attached to ring carbon atoms
- C07D213/26—Radicals substituted by halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/62—Oxygen or sulfur atoms
- C07D213/63—One oxygen atom
- C07D213/68—One oxygen atom attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/74—Amino or imino radicals substituted by hydrocarbon or substituted hydrocarbon radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/72—Nitrogen atoms
- C07D213/75—Amino or imino radicals, acylated by carboxylic or carbonic acids, or by sulfur or nitrogen analogues thereof, e.g. carbamates
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D213/00—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members
- C07D213/02—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members
- C07D213/04—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom
- C07D213/60—Heterocyclic compounds containing six-membered rings, not condensed with other rings, with one nitrogen atom as the only ring hetero atom and three or more double bonds between ring members or between ring members and non-ring members having three double bonds between ring members or between ring members and non-ring members having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D213/78—Carbon atoms having three bonds to hetero atoms, with at the most one bond to halogen, e.g. ester or nitrile radicals
- C07D213/81—Amides; Imides
- C07D213/82—Amides; Imides in position 3
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/18—Halogen atoms or nitro radicals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/20—Oxygen atoms
- C07D215/22—Oxygen atoms attached in position 2 or 4
- C07D215/233—Oxygen atoms attached in position 2 or 4 only one oxygen atom which is attached in position 4
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/36—Sulfur atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/38—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D215/00—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems
- C07D215/02—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom
- C07D215/16—Heterocyclic compounds containing quinoline or hydrogenated quinoline ring systems having no bond between the ring nitrogen atom and a non-ring member or having only hydrogen atoms or carbon atoms directly attached to the ring nitrogen atom with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D215/48—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/34—One oxygen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/32—One oxygen, sulfur or nitrogen atom
- C07D239/42—One nitrogen atom
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/02—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings
- C07D239/24—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members
- C07D239/28—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings not condensed with other rings having three or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, directly attached to ring carbon atoms
- C07D239/46—Two or more oxygen, sulphur or nitrogen atoms
- C07D239/47—One nitrogen atom and one oxygen or sulfur atom, e.g. cytosine
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D239/00—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings
- C07D239/70—Heterocyclic compounds containing 1,3-diazine or hydrogenated 1,3-diazine rings condensed with carbocyclic rings or ring systems
- C07D239/72—Quinazolines; Hydrogenated quinazolines
- C07D239/86—Quinazolines; Hydrogenated quinazolines with hetero atoms directly attached in position 4
- C07D239/88—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D249/00—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms
- C07D249/02—Heterocyclic compounds containing five-membered rings having three nitrogen atoms as the only ring hetero atoms not condensed with other rings
- C07D249/04—1,2,3-Triazoles; Hydrogenated 1,2,3-triazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D261/00—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings
- C07D261/02—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings
- C07D261/06—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members
- C07D261/10—Heterocyclic compounds containing 1,2-oxazole or hydrogenated 1,2-oxazole rings not condensed with other rings having two or more double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D261/14—Nitrogen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D277/00—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings
- C07D277/02—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings
- C07D277/20—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D277/32—Heterocyclic compounds containing 1,3-thiazole or hydrogenated 1,3-thiazole rings not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D277/38—Nitrogen atoms
- C07D277/44—Acylated amino or imino radicals
- C07D277/48—Acylated amino or imino radicals by radicals derived from carbonic acid, or sulfur or nitrogen analogues thereof, e.g. carbonylguanidines
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/02—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings
- C07D307/34—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members
- C07D307/56—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom not condensed with other rings having two or three double bonds between ring members or between ring members and non-ring members with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to ring carbon atoms
- C07D307/68—Carbon atoms having three bonds to hetero atoms with at the most one bond to halogen
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D319/00—Heterocyclic compounds containing six-membered rings having two oxygen atoms as the only ring hetero atoms
- C07D319/04—1,3-Dioxanes; Hydrogenated 1,3-dioxanes
- C07D319/06—1,3-Dioxanes; Hydrogenated 1,3-dioxanes not condensed with other rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Diabetes (AREA)
- Heart & Thoracic Surgery (AREA)
- Rheumatology (AREA)
- Cardiology (AREA)
- Pain & Pain Management (AREA)
- Ophthalmology & Optometry (AREA)
- Oncology (AREA)
- Transplantation (AREA)
- Physical Education & Sports Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Dermatology (AREA)
- Emergency Medicine (AREA)
- Endocrinology (AREA)
- Hematology (AREA)
- Obesity (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Pyridine Compounds (AREA)
- Quinoline Compounds (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
본 발명은 하기 화학식 Ⅰ로 표시되는 화합물 또는 그 염 또는 이들의 수화물에 관한 것이다.
화학식 Ⅰ
[식중 Ag은 선택적으로 치환된 5 내지 14원 복소환식기 등을 의미하고; Xg는 -O-, -S- 등을 의미하고; Yg는 선택적으로 치환된 C6 -14 아릴기 또는 5 내지 14원 복소환식기 등을 의미하고; Tg1는 식
(식중, Eg은 단결합 또는 식 -N(Rg2)- 등을 의미한다. Rg1 및 Rg2은 각각 독립적으로 수소 원자, 또는 선택적으로 치환된 C1 -6 알킬기 등을 의미한다. Zg는 C1 -8 알킬기, C3 -8 지환식 탄화수소기, C6 -14 아릴기 등을 의미함)로 표시되는 기 등을 의미함]
Description
본 발명은 혈관 신생의 이상 증식을 수반하는 각종 질환에 대한 예방 및 치료에 유효한 신규 화합물 및 이러한 신규 화합물을 포함하는 혈관신생 저해제, 항종양제 등의 의약 조성물에 관한 것이다.
혈관 신생은 태아기의 혈관수 형성이나 각 장기의 형태적, 기능적 발달시에 불가결한 생물학적 현상이다. 신생 혈관은 내피 세포의 유주(遊走), 증식, 관강(管腔) 형성 등의 복수의 과정을 거쳐 구축되며, 그 과정에는 마스트 세포, 림프구, 간질 세포 등의 관여도 중요하다는 것이 보고되고 있다(J. Folkman and Y. Shing, J. Biol. Chem., 267, 10931, 1992). 성숙 개체에서는 여성 성주기시 생리적인 혈관이 신생되지만, 성숙 개체에 있어서는 혈관 신생의 병적 증가가 여러가지 질환의 발증 또는 진행 과정에 관여하고 있는 것으로 알려져 있다. 구체적으로는 암, 류마티스성관절염, 아테롬성 동맥경화증, 당뇨병성 망막증, 혈관종, 건선 등이 혈관 신생의 이상을 수반하는 질환의 예로서 들 수 있다(J. Folkman, N. Engl. J. Med., 333, 1757, 1995). 특히 고형암의 증식은 혈관 신생에 의존한다는 것이 보고되고 있으며, 혈관 신생 저해제가 난치성 고형암에 대한 새로운 치료약으로 될 것으로 기대되고 있다(Folkman J., J. Natl. Cancer Inst., 82, 4, 1990).
우레아 구조를 갖는 화합물에 관한 선행 기술로는 WO 9900357 및 WO 0043366 공보 등이 있다.
WO 9900357호 공보에는, raf 키나제에 대한 저해 작용을 나태내고 항종양 효과를 갖는 비페닐우레아 유도체가 기재되어 있지만, 혈관 신생 저해 작용에 대한 작용은 개시되어 있지 않다. WO 0043366호 공보에는 시험관내 A 375 휴먼 멜라노마(human melanoma) 세포에 대한 핵 형태 변화 작용이 약하고, 혈관 내피 세포 증식 인자(Vascular Endothelial Growth Factor, VEGF라 약칭한다)로 자극한 내피 세포에 대하여 증식 억제 작용을 보이며, 항종양 효과를 갖는 퀴놀린 유도체 및 퀴나졸린 유도체가 기재되어 있지만, VEGF 이외의 혈관 신생 인자에 대한 작용은 개시되어 있지 않다.
발명의 개시
상기한 바와 같이, 의약으로서 유용한 혈관 신생 저해 화합물의 제공이 소망되고 있다. 그러나, 우수한 혈관 신생 저해 작용을 나타내며, 또, 의약으로서도 유용성이 높아 임상에서 유효하게 작용하는 화합물은 아직 발견되지 않았다.
본 발명의 목적은, (1) 강력한 혈관 신생 억제 작용을 갖거나 또는 강력한 혈관 신생 억제 작용과 종양 세포 증식 억제 작용의 양 작용을 지님으로써 항종양 활성을 나타내며, (2) 물성, 체내 동태, 안전성 등에 있어서도 의약으로서의 자질이 우수한 유용성을 나타내고, (3) 혈관 신생의 이상 증식을 수반하는 각종 질환의 개선, 예방 및 치료에 유용한, 혈관 신생 저해 화합물을 탐색하여 알아내는 데에 있다.
본 발명자들은 상기 목적에 감안하여 집중적으로 연구를 거듭한 결과, 하기식 화학식 I로 표시되는 신규 화합물 또는 그 염 또는 이들의 수화물을 합성하는 데에 성공한 동시에, 또한, 하기식 화학식 I 또는 그 염 또는 이들의 수화물이 우수한 혈관 신생 저해 작용을 보이는 것을 알아냄으로써, 본 발명을 완성하였다.
즉 본 발명은, 하기 화학식 Ⅰ, Ⅱ, Ⅲa, Ⅲb, Ⅲc, Ⅲd, Ⅲe, Ⅲf, Ⅲg, Ⅲh의 화합물, 또는 그 염 또는 그 수화물에 관한 것이다.
<1>
[화학식 Ⅰ]
[식중 Ag는 선택적으로 치환된 C6 -14 아릴기 또는 선택적으로 치환된 5 내지 14원 복소환식기를 의미하고; Xg는 단결합, -O-, -S-, C1 -6 알킬렌기, -SO-, -SO2- 또는 식 -N(Rg3)-(식중, Rg3은 수소 원자, 선택적으로 치환된 C1 -6 알킬기 또는 선택적으로 치환된 C2 -7 아실기를 의미함)를 의미하고; Yg는 각각 선택적으로 치환된 C6 - 14 아릴기, 5 내지 14원 복소환식기, C1 -8 알킬기, C3 -8 지환식 탄화수소기, C6 -14 아릴 C1 -6 알킬기, 5 내지 14원 헤테로아릴 C1 -6 알킬기, 식 -(CH2)gSO2-(식중, g은 1-8의 정수를 의미함), 식 -(CH2)fa-CH=CH-(CH2)fb-(식중, fa 및 fb는 각각 0, 1, 2 또는 3을 의미함), 식 -(CH2)fa-CH=CH-(CH2)fb-SO2-(식중, fa 및 fb는 각각 0, 1, 2 또는 3을 의미함), 식 -(CH2)fa-C ≡C-(CH2)fb-(식중, fa 및 fb는 각각 0, 1, 2 또는 3을 의미함) 또는 식 -(CH2)fa-C ≡C-(CH2)fb-SO2-(식중, fa 및 fb는 각각 0, 1, 2 또는 3을 의미함)를 의미하고; Tg1는 하기 화학식 (1) 또는 (2)를 나타내며,
(1)
{식중, Eg은 단결합 또는 식 -N(Rg2)-을 의미하며, Rg2는 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C2 -7 아실기 또는 선택적으로 치환된 C2 -7 알콕시카르보닐기를 의미하고, Rg1은 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C2 -7 아실기 또는 선택적으로 치환된 C2 -7 알콕시카르보닐기를 의미하며, Zg는 수소 원자, 선택적으로 치환된 C1 -8 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 C6 -14 아릴 C1 -6 알킬기, 식 -OR200, 식 -SR200, 식 -COR200, 식 -SO2R200(식중, R200는 수소 원자, 선택적으로 치환된 C1 -8 알킬기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 C6 -14 아릴 C1 -6 알킬기, 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 복소환 C1 -6 알킬기를 의미함), 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 복소환 C1 -6 알킬기를 의미함}, 또는
(2)
{식중, Rg1 및 Zg은 상기 Rg1 및 Zg과 같은 의미를 지니며, Zg1 및 Zg2은 각각 동일하거나 또는 상이하여도 좋으며, (1) 단결합 (2) -O-, -S- 및 질소 원자에서 선택되는 1 이상의 원자를 쇄의 중간 또는 말단에 갖고 있더라도 좋고, 옥소기로 치환되어 있어도 좋은 C1 -6 알킬렌기 또는 (3) 선택적으로 치환된 C2 -6 알케닐기를 의미함}로 나타나는 기를 의미함] ;
<2>
[화학식 Ⅱ]
[식중, A는, 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미하고; X는 산소 원자, 황 원자, -SO- 또는 -SO2-를 의미하고; Y는 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 선택적으로 치환된 C1 -6 알킬렌기를 의미하고; E는 단결합 또는 -NR2-을 의미하고; R1 및 R2는 각각 독립적으로, 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C2 -7 아실기 또는 선택적으로 치환된 C2 -7 알콕시카르보닐기를 의미하고; Z는 식 -Z11-Z12(식중, Z11는 단결합, 산소 원자, 황 원자, -CO-, -SO2- 또는 선택적으로 치환된 C1 -6 알킬렌기를 의미하고, Z12는 수소 원자, 선택적으로 치환 된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 식
(식중, Z31, Z33 및 Z34는 각각 독립적으로 메틸렌기, -CO-, -NH- 또는 -O-을 의미하고, Z32는 단결합, 메틸렌기, -CO-, -NH- 또는 -O-을 의미함)로 표시되는 기를 의미함)로 나타내는 기를 의미한다. 다만, A는 (1) 시아노기, (2) 할로겐 원자, (3) 니트로기 및 (4) 식, -VX1-VX2-VX22-VX3(식중, VX1, VX2 및 VX22은 각각 독립적으로 단결합, 산소 원자, 황 원자, -CO-, -SO-, -SO2-, 식 -NRX1-, 식 -CONRX1-, 식 -NRX1CO-, 식 -SO2NRX1-, 식 -NRX1SO2-, 식 -O-CO-, 식 -C(O)O-, 식 -NRX1C(O)O-, 식-NRX1C(O)NRX2-, 식 -O-C(O)NRX1-, 식 -O-C(O)O-, 선택적으로 치환된 C1 -6 알킬렌기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미하고; VX3, RX1 및 RX2은 각각 독립적으로 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 선택적으로 치환된 C1 -6 알콕시기를 의미함)로 이루어지는 군에서 선택되는 1 내지 6개의 기로 치환되어 있더라도 좋음]
로 나타내어지는 화합물 또는 그 염 또는 이들의 수화물 ;
<3> X가 산소 원자 또는 황 원자인, <2>에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<4> Z가 선택적으로 치환된 시클로프로필기, 선택적으로 치환된 2-티아졸릴기 또는 식
(식중, Z13는 니트릴기, 메틸설포닐기 또는 -NHCOCH3기를 의미함)
로 표시되는 기인, <2> 또는 <3>에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<5> E가 식 -NR2-(식중, R2는 <2>에 있어서의 R2와 같은 의미임)로 표시되는 기이며, Y가 각각 선택적으로 치환된 페닐기, 피리딜기 또는 식
(식중, W11 및 W12는 각각 독립적으로 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미함)로 표시되는 기인, <2>∼<4> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<6> E가 단결합이며, Y가 또한 선택적으로 치환된 식
(식중, W13는 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미함)로 표시되는 기인, <2>∼<4> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
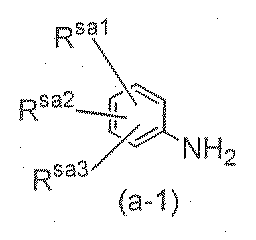
<7> A가, 식
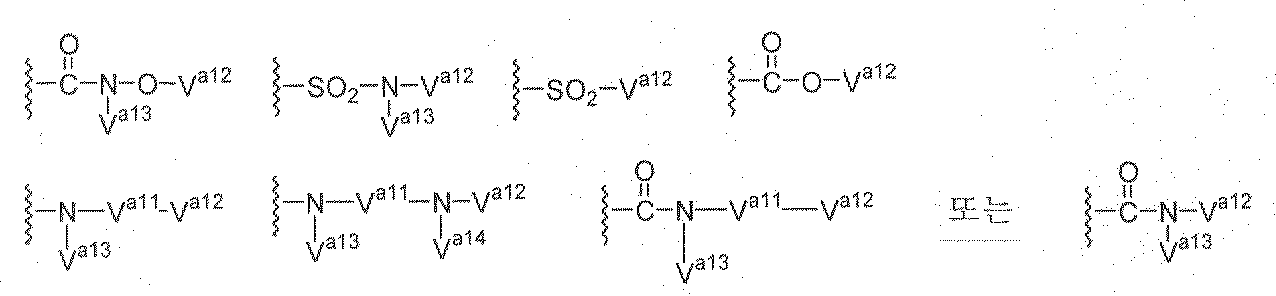
[식중, W는 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미하고; Ra13는 수소 원자, 할로겐 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C1 -6 알콕시기, 아미노기 또는 니트로기를 의미하고; Ra12는 시아노기 또는 식
(식중, Va11은 -CO- 또는 -SO2-를 의미하고; Va12, Va13 및 Va14은 각각 독립적으로 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2-6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미함)로 표시되는 기를 의미하고; Ra11는 식 -Va21-Va22-Va23(식중, Va21은 선택적으로 치환된 C1 -6 알킬렌기, 단결합 또는 식
으로 표시되는 기를 의미하고; Va22는 단결합, 산소 원자, 황 원자, -CO-, -SO-, -SO2-, 식 -CONRa14-, 식 -SO2NRa14-, 식 -NRa14SO2-, 식 -NRa14CO- 또는 식 -NRa14-을 의미하며(식중, Ra14은 수소 원자, 선택적으로 치환된 C1 -6 알킬기 또는 선택적으로 치환된 C3 -8 지환식 탄화수소기를 의미함); Va23는 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미함)로 표시되는 기를 의미함]로 표시되는 기인, <2>∼<6> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<8> A가, 식
(식중, W는 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미하고; Ra11, Ra12 및 Ra13은 <7>에 있어서의 Ra11, Ra12 및 Ra13과 각각 같은 의미임)
로 표시되는 기인, <2>∼<6> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<9> A가, 또한 선택적으로 치환된 식
[식중, W는 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미하고; Ab11는 (1) 선택적으로 치환된 5 내지 14원 복소환식기 또는 (2) 식
(식중, Vb11 및 Vb12은 각각 독립적으로 단결합, -SO2-, -NHCO- 또는 식 -(CH2)b-CO-(식중 b는 0에서부터 6의 정수를 의미함)로 표시되는 기를 의미하고; Rb13는 단결합, 선택적으로 치환된 C1 -6 알킬렌기, 선택적으로 치환된 C3 -8 지환식 탄화수소기 또는 선택적으로 치환된 5 내지 14원 복소환식기를 의미하고; Rb11 및 Rb12은 각각 독립적으로 수소 원자, 수산기, 할로겐 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 선택적으로 치환된 5 내지 14원 복소환식기를 의미함)로 나타내는 기를 의미함]
로 표시되는 기인, <2>∼<6> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<10> A가, 식
[식중, W는 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미하고; Rc13는, (1) 수소 원자, (2) 시아노기, (3) 할로겐 원자, (4) 포르밀기, (5) 선택적으로 치환된 C1 -6 알킬기, (6)식
(식중, Vc21은 -CO- 또는 메틸렌기를 의미하고; Vc22 및 Vc23은 각각 독립적으로 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2-6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 5 내지 14원 복소환식기, 선택적으로 치환된 5 내지 14원 방향족 복소 환식기 또는 선택적으로 치환된 C6 -14 아릴기를 의미함)로 표시되는 기 또는 (7) 식 -Vc21-O-Vc22(식중, Vc21 및 Vc22은 상기 Vc21 및 Vc22과 같은 의미임)로 표시되는 기를 의미하고; Rc12는 수소 원자, 선택적으로 치환된 C1 -6 알킬기 또는 선택적으로 치환된 C3 -8 지환식 탄화수소기를 의미하고; Rc11는 식 -Vc11-Vc12-Vc13(식중, Vc11은 단결합, 산소 원자, 선택적으로 치환된 벤젠환, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 -CO-을 의미하고; Vc12는 단결합, 산소 원자 또는 선택적으로 치환된 C1 -6 알킬렌기를 의미하고; Vc13는 (1) 선택적으로 치환된 C1 -6 알킬기, (2) 선택적으로 치환된 C2 -6 알케닐기, (3) 선택적으로 치환된 C2 -6 알키닐기, (4) 선택적으로 치환된 C3 -8 지환식 탄화수소기, (5) 수산기, (6) 카르복실기, (7) 선택적으로 치환된 C2 -7 알콕시카르보닐기, (8) 선택적으로 치환된 5 내지 14원 복소환식기, (9) 선택적으로 치환된 5 내지 14원 방향족 복소환식기, (10) 선택적으로 치환된 C6 -14 아릴기, (11) 식 -NRc21Rc22(식중, Rc21 및 Rc22은 각각 독립적으로 수소 원자 또는 선택적으로 치환된 C1 -6 알킬기를 의미함)로 표시되는 기 또는 (12) 수소 원자를 의미함)로 표시되는 기를 의미함]
로 표시되는 기인, <2>∼<6> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<11>
[화학식 Ⅲa]
[식중, R1, R2 및 Z12는 <2>에 있어서의 R1, R2 및 Z12와 같은 의미를 의미한다.(다만, Z12가 피라졸릴기인 경우는 제외한다); Ya1는 식
(식중, W31 및 W32는 각각 독립적으로 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미하고; R300 및 R301은 각각 독립적으로 수소 원자, 할로겐 원자, 시아노기, 니트로기, 아미노기, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C1 -6 알콕시기, 선택적으로 치환된 C2 -7 알콕시카르보닐기, 포르밀기, 식
(식중, V300 및 V301는 각각 독립적으로 수소 원자 또는 선택적으로 치환된 C1 -6 알킬기를 의미함)로 표시되는 기 또는 선택적으로 치환된 C2 -7 아실기를 의미함)로 표시되는 기를 의미하고; Ra11 및 Ra12은 <7>에 있어서의 Ra11 및 Ra12와 각각 같은 의미를 의미하고; 다만, 상기 정의에 있어서 (1) Ra12가 식
(식중, Va12 및 Va13은 <7>에 있어서의 Va12 및 Va13과 각각 같은 의미임)로 표시되는 기를 의미하고, R1 및 R2가 수소 원자를 의미하여, 또한 Z12가 C6 -14 아릴기, 6 내지 14원 복소환식기 또는 6 내지 14원 방향족 복소환식기를 의미하는 경우, 및 (2) Ra12가 식
(식중, Va11, Va12, Va13 및 Va14은 <7>에 있어서의 Va11, Va12, Va13 및 Va14과 각각 같은 의미임)로 이루어지는 군에서 선택되는 기를 의미하고, R2가 수소 원자를 의미하며, 또한 Z12가 (a) C6 -14 아릴기, (b) 5 내지 14원 복소환식기, (c) 5 내지 14원 방향족 복소환식기, (d) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C1 -6 알킬기, (e) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알케닐기, (f) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알키닐기 또는 (g) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C3 -8 지환식 탄화수소기를 의미하는 경우는 제외함]
로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<12> Ra11이, 메틸기, 2-메톡시에틸기, 식
(식중, Ra53은 메틸기, 시클로프로필메틸기 또는 시아노메틸기를 의미하고; Ra51는 수소 원자, 불소 원자 또는 수산기를 의미하고; Ra52는 1-피롤리디닐기, 1-피페리디닐기, 4-모르폴리닐기, 디메틸아미노기 또는 디에틸아미노기를 의미함)로 표시되는 기인, <11>에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<13> Z12가, 메틸기, 에틸기, 시클로프로필기, 2-티아졸릴기 또는 4-플루오로페닐기 인, <11> 또는 <12>에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<14> Ya1이, 식
(식중, Ra61은 수소 원자, 메틸기, 트리플루오로메틸기, 염소 원자 또는 불소 원자를 의미함)로 표시되는 기인, <11>∼<13> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<15> Ra12이, 시아노기 또는 식 -CONHRa62(식중, Ra62은 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C1 -6 알콕시기 또는 선택적으로 치환된 C3 -8 시클로알콕시기를 의미함)로 표시되는 기인, <11>∼<14> 중 어느 것에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<16>
[화학식 Ⅲb]
(식중 Z21는 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기 또는 선택적으로 치환된 C3 -8 지환식 탄화수소기를 의미하고;
Ra120는 시아노기 또는 식
(식중, Va15은 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기를 의미함. Va11, Va12, Va13 및 Va14은 <7>에 있어서의 Va11, Va12, Va13 및 Va14과 각각 같은 의미임)로 표시되는 기를 의미하고;
R300 및 R301는 <11>에 있어서의 R300 및 R301와 각각 같은 의미를 의미하고; Ra11는 <7>에 있어서의 Ra11와 각각 같은 의미를 의미하고; 다만, Ra120이 식
(식중, Va11, Va12, Va13 및 Va14은 <7>에 있어서의 Va11, Va12, Va13 및 Va14과 각각 같은 의미를 의미하고, Va15는 상기 정의와 같은 의미임)로 이루어지는 군에서 선택되는 기를 의미하고, 또한 Z21가 (a) C3 -8 지환식 탄화수소기, (b) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C1 -6 알킬기, (c) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알케닐기 또는 (d) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알키닐기를 의미하는 경우는 제외함)로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<17>
[화학식 Ⅲc]
(식중, Z22는 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미하고; R300 및 R301는 <11>에 있어서의 R300 및 R301과 각각 같은 의미를 의미하고; Vd13는 식
(식중, Va12 및 Va13은 <7>에 있어서의 Va12 및 Va13과 각각 같은 의미임)로 이루어지는 군에서 선택되는 기를 의미하고; Vd11는 선택적으로 치환된 C1 -6 알킬렌기, 또는 식
으로 표시되는 기를 의미하고; Vd12는 (1) 식 -NRd11Rd12(식중, Rd11 및 Rd12은 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미함)로 표시되는 기 또는 (2) 선택적으로 치환된 5 내지 14원 복소환식기를 의미함)로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<18>
[화학식 Ⅲd]
(식중, R1, R2 및 Z12는 <2>에 있어서의 R1, R2 및 Z12와 각각 같은 의미를 의미하고; W11는 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미하고; R300는 <11>에 있어서의 R300와 같은 의미를 의미하고; Ra11는 <7>에 있어서의 Ra11와 같은 의미를 의미하고; Ra120는 <16>에 있어서의 Ra120와 같은 의미를 의미하고; 다만, 상기 정의에 있어서, (1) Ra120가 식
(식중, Va12 및 Va13은 <7>에 있어서의 Va12 및 Va13과 각각 같은 의미임)로 표시되는 기를 의미하고, R1 및 R2가 수소 원자를 의미하고, 또한 Z12가 C6 -14 아릴기, 6 내지 14원 복소환식기 또는 6 내지 14원 방향족 복소환식기를 의미하는 경우, 및 (2) Ra120가 식
(식중, Va11, Va12, Va13 및 Va14은 <7>에 있어서의 Va11, Va12, Va13 및 Va14과 각각 같은 의미를 의미하며, Va15는 <16>에 있어서의 Va15와 같은 의미임)로 이루어지는 군에서 선택되는 기를 의미하고, R2가 수소 원자를 의미하며, 또한 Z12가 (a) C6 -14 아릴기, (b) 5 내지 14원 복소환식기, (c) 5 내지 14원 방향족 복소환식기, (d) 5 내 지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C1 -6 알킬기, (e) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알케닐기, (f) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알키닐기 또는 (g) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C3 -8 지환식 탄화수소기를 의미하는 경우는 제외함)로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<19> 화학식
(식중, W41 및 W는 각각 독립적으로 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미하며, 다만 W41 및 W가 함께 질소 원자인 경우는 제외하고; Xy1는 각각 선택적으로 치환된 식
(식중, Z12는 <2>에 있어서의 Z12와 같은 의미를 의미하고; W11은 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미함)로 이루어지는 군에서 선택되는 기를 의미하고; Ab11은 <9>에 있어서의 Ab11과 같은 의미임)로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<20>
[화학식 Ⅲf]
(식중, Rc13은 <10>에 있어서의 Rc13와 같은 의미를 의미한다. Xy2는 각각 선택적으로 치환된 식
(식중, Z12, R1 및 R2는 <2>에 있어서의 Z12, R1 및 R2와 각각 같은 의미를 의미하고; W11은 선택적으로 치환된 탄소 원자 또는 질소 원자를 의미함)로 이루어지는 군에서 선택되는 기를 의미하며, Rc11 및 Rc12은 <10>에 있어서의 Rc11 및 Rc12과 각각 같은 의미를 의미한다. 다만, 상기 정의에 있어서, (1) R1 및 R2가 수소 원자이고, Z12가 (a) C6 -14 아릴기, (b) 5 내지 14원 복소환식기, (c) 5 내지 14원 방향족 복소환식기, 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C1-6 알 킬기, (d) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알케닐기, (e) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알키닐기 또는 (f) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C3 -8 지환식 탄화수소기를 의미하는 경우인 경우, 및 (2) Xy2가 식
(식중, Z12는 (a) C6 -14 아릴기, (b) 5 내지 14원 복소환식기, (c) 5 내지 14원 방향족 복소환식기, (d) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C1 -6 알킬기, (e) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알케닐기, (f) 5 내지 10원 복소환식기 또는 C5 -10 지환식 탄화수소기로 치환된 C2 -6 알키닐기 또는 (g) C3 -8 지환식 탄화수소기를 의미함)로 표시되는 기인 경우는 제외함)
로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<21> Rc11이, 식
(식중, Vf11은 단결합, 선택적으로 치환된 C1 -6 알킬렌기 또는 식
으로 나타내는 기를 의미하고; Vf12는 (1) 수소 원자, (2) 수산기, (3) 선택적으로 치환된 5 내지 14원 복소환식기, (4) 선택적으로 치환된 5 내지 14원 방향족 복소환식기, (5) 선택적으로 치환된 C6 -14 아릴기 또는 (6) 식 -NRf21Rf22(식중, Rf21 및 Rf22은 각각 독립적으로 수소 원자 또는 선택적으로 치환된 C1 -6 알킬기를 의미함)로 표시되는 기를 의미함)
로 표시되는 기인, <10> 또는 <20>에 기재한 화합물 또는 그 염 또는 이들의 수화물;
<22>
[화학식 Ⅲg]
[식중, X는 <2>에 있어서의 X와 같은 의미를 의미하고; R300 및 R301는 <11>에 있어서의 R300 및 R301와 각각 같은 의미를 의미하고; A31는, 식
(식중, Rc13은 <10>에 있어서의 Rc13와 같은 의미를 의미하며, W, Ra11 및 Ra13은 <7>에 있어서의 W, Ra11 및 Ra13과 각각 같은 의미를 의미하고; Ab11는 <9>에 있어서의 Ab11와 같은 의미를 의미하고; Rc12는 <10>에 있어서의 Rc12와 각각 같은 의미를 의미하고; Re11는 식
(식중, Vf11 및 Vf12은 <21>에 있어서의 Vf11 및 Vf12과 각각 같은 의미를 의미한다. 다만 Vf12이 수소 원자인 경우는 제외한다)로 표시되는 기를 의미함)로 이루어지는 군에서 선택되는 기를 의미함]
로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<23>
[화학식 Ⅲh]
(식중, Z12, R1 및 R2는 <2>에 있어서의 Z12, R1 및 R2와 각각 같은 의미를 의미하고; R300 및 R301은 <11>에 있어서의 R300 및 R301과 각각 같은 의미를 의미하고; A32는, 식
(식중, Rc13은 <10>에 있어서의 Rc13와 같은 의미를 의미하며, W, Ra11, Ra12 및 Ra13은 <7>에 있어서의 W, Ra11, Ra12 및 Ra13과 각각 같은 의미를 의미하고; Ab11는 <9>에 있어서의 Ab11와 같은 의미를 의미하고; Rc11 및 Rc12는 <10>에 있어서의 Rc11 및 Rc12과 각각 같은 의미임)로 이루어지는 군에서 선택되는 기를 의미함)
로 표시되는 화합물 또는 그 염 또는 이들의 수화물;
<24> 상기 화합물이, N-(4-(6-시아노-7-(3-(4-피리딜)프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아, N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-2-일)에 톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아, N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-1-일)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아, N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-2-일)에톡시)-4-퀴놀릴)옥시페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-1-일)에톡시)-4-퀴놀릴)옥시페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-(1,3-티아졸-2-일)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-(3-시아노페닐)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-(2-(메틸설포닐)페닐)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-시클로프로필우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(1,3-티아졸-2-일)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-시클로프로필우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-시클로프로필메틸우레아, N-(4-(6-시아노-7-(3-(모르폴린-4-일)프로폭시)퀴놀린-4-일옥시)-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(3-(디에틸아미노)프로폭시)-4-퀴놀릴옥시)페닐)-N'-(4-플루오로페닐)우레아, N-(4-(6-시아노-7-(3-(4-모르폴리노)프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(3-(메틸설포닐)페닐)우레아, N-(4-(6-시아노-7-(3-(디에틸아미노)프로폭시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(3-(1-(4-에틸피 페라지노))프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아, N-(4-(6-시아노-7-(3-시아노프로폭시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(2-(메틸설포닐)에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(2-(메틸설포닐)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아,N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-페닐우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(3-메톡시카르보닐프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아, N-(4-(6-시아노-7-(3-카르복시프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아, N-(4-(6-시아노-7-(2-(2-히드록시에톡시)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아, N-(4-(6-시아노-7-(3-(디에틸아미노)프로폭시)-4-퀴놀릴옥시)페닐)-N'-(3-(메틸설포닐)페닐)우레아, N-(4-(6-시아노-7-(3-(4-모르폴리노)프로폭시)-4-퀴놀릴)옥시페닐)-N'-(3-(메틸설포닐)페닐)우레아, N-(4-(6-시아노-7-(3-(디에틸아미노)프로폭시)-4-퀴놀릴옥시)페닐)-N'-페닐우레아, N-(4-(6-시아노-7-(3-(4-모르폴리노)프로폭시)-4-퀴놀릴)옥시페닐)-N'-페닐우레아, N-(4-(6-시아노-7-(3-(4-모르폴리노)프로폭시)-4-퀴놀릴)옥시페닐)-N'-(2-옥소-1,2,3,4-테트라히드로-6-퀴놀릴)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-(3-아세트아미드페닐)우레아, N-(4-(6-시아노-7-벤질옥시-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴) 옥시-2-플루오로페닐)-N'-페닐우레아, 4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드, 7-(2-메톡시에톡시)-4-(4-((1,3-티아졸-2-일아미노)카르보닐)아미노페녹시)-6-퀴놀린카르복사미드, 4-(4-((아닐리노카르보닐)아미노)-3-플루오로페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드, 4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(4-((시클로프로필아미노)카르보닐)아미노페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드, 7-메톡시-4-(4-((1,3-티아졸-2-일아미노)카르보닐)아미노페녹시)-6-퀴놀린카르복사미드, 4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(4-((시클로프로필아미노)카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(5-((아닐리노카르보닐)아미노)-2-피리딜옥시)-7-메톡시-6-퀴놀린카르복사미드, 4-(4-(아닐리노카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(4-(아닐리노카르보닐)아미노페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드, 4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드, 4-(4-((4-플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드, 7-(2-메톡시에톡시)-4-(4-((1,3-티아졸-2-일아미노)카르보닐)아미노-3-플루오로페녹시)-6-퀴놀린카르복사미드 및 4-(4-((4-플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-메톡시-6-퀴놀린카르복사미드로부터 선택되는 어느 하나의 화합물인, <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물;
<25> 상기 화합물이, N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아, N-(2-클로로-4-((6-시아노-7-((1-메틸-4-피페리딜)메톡시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아, N-(4-((6-시아노-7-(((2R)-3-(디에틸아미노)-2-히드록시프로필)옥시)-4-퀴놀릴)옥시)페닐)-N'-(4-플루오로페닐)우레아, N-(4-((6-시아노-7-(((2R)-2-히드록시-3-(1-피롤리디노)프로필)옥시)-4-퀴놀릴)옥시)페닐)-N'-(4-플루오로페닐)우레아, N-{4-[6-시아노-7-(2-히드록시-3-피롤리딘-1-일-프로폭시)-퀴놀린-4-일록시]-2-메틸페닐}-N'-시클로프로필-우레아, 4-(4-(4-플루오로아닐리노)카르보닐)-4-메틸아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드, N6-시클로프로필-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드, N6-(2-메톡시에틸)-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드, N6-(2-피리딜)-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드, N6-(2-플루오로에틸)-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드, N6-메톡시-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드, N6-메틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드, N6-에틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시- 6-퀴놀린카르복사미드, 6-카르바모일-4-(1-에틸카르바모일-1H-인돌-5-일옥시)-7-메톡시퀴놀린, 6-카르바모일-7-메톡시-4-(1-프로필카르바모일-1H-인돌-5-일옥시)퀴놀린, 6-카르바모일-7-메톡시-4-[1-(1-메틸)에틸카르바모일-1H-인돌-5-일옥시]퀴놀린, N4-(4-{4-[(아닐리노카르보닐)아미노]-3-클로로페녹시}-2-피리딜)-1-메틸-4-피페리딘카르복사미드, N1-페닐-3-클로로-5-[(2-{[(1-메틸-4-피페리딜)카르보닐]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드, N4-[4-(3-클로로-4-{[(4-플루오로아닐리노)카르보닐]아미노}페녹시)-2-피리딜]-1-메틸-4-피페리딘카르복사미드, 1-(2-클로로-4-{6-[4-(2-디에틸아미노에톡시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아, 1-{2-클로로-4-[6-[4-((2R)-2-히드록시-3-디에틸아미노프로폭시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시]-페닐}-3-시클로프로필우레아, 1-(2-클로로-4-{6-[4-((2R)-2-히드록시-3-피롤리디노프로폭시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시]-페닐}-3-시클로프로필우레아, 및 1-(2-클로로-4-{6-[4-(2-디에틸아미노프로폭시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아로부터 선택되는 어느 하나의 화합물인, <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물;
<26> 상기 화합물이, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(3-클로로-4-(에틸아미노카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드, N6-메톡시-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드, 4-(3-클로로-4-(메틸아미노카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드 및 N6-메톡 시-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드로부터 선택되는 어느 하나의 화합물인, <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물;
<27> <1>∼<6> 중 어느 것에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 의약;
<28> <1>∼<6> 중 어느 것에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 혈관 신생 저해 활성에 기초한 의약;
<29>
화학식 Ⅱ
[식중, A는 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미하고; X는 산소 원자, 황 원자, -SO- 또는 -SO2-를 의미하고; Y는 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 선택적으로 치환된 C1 -6 알킬렌기를 의미하고; E는 단결합 또는 -NR2-을 의미하고; R1 및 R2는 각각 독립적으로, 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소 기, 선택적으로 치환된 C2 -7 아실기 또는 선택적으로 치환된 C2 -7 알콕시카르보닐기를 의미하고; Z는 식 -Z11-Z12(식중, Z11는 단결합, 산소 원자, 황 원자, -CO-, -SO2- 또는 선택적으로 치환된 C1 -6 알킬렌기를 의미하고, Z12는 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 식
(식중, Z31, Z33 및 Z34는 각각 독립적으로 메틸렌기, -CO-, -NH- 또는 -O-을 의미한다. Z32는 단결합, 메틸렌기, -CO-, -NH- 또는 -O-을 의미함)로 표시되는 기를 의미함)로 표시되는 기를 의미한다. 다만, A는 (1) 시아노기, (2) 할로겐 원자, (3) 니트로기 및 (4) 식 -VX1-VX2-VX22-VX3(식중, VX1, VX2 및 VX22은 각각 독립적으로, 단결합, 산소 원자, 황 원자, -CO-, -SO-, -SO2-, 식 -NRX1-, 식 -CONRX1-, 식 -NRX1CO-, 식 -SO2NRX1-, 식 -NRX1SO2-, -O-CO-, -C(O)O-, 식 -NRX1C(O)O-, 식 -NRX1C(O)NRX2-, 식 -O-C(O)NRX1-, -O-C(O)O-, 선택적으로 치환된 C1 -6 알킬렌기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기 또는 선택적으로 치환된 5 내지 14원 방향족 복소환식기를 의미하고; VX3, RX1 및 RX2은, 각각 독립적으로 수소 원자, 선택적으로 치환된 C1 -6 알킬기, 선택적으로 치환된 C2 -6 알케닐기, 선택적으로 치환된 C2 -6 알키닐기, 선택적으로 치환된 C3 -8 지환식 탄화수소기, 선택적으로 치환된 C6 -14 아릴기, 선택적으로 치환된 5 내지 14원 복소환식기, 선택적으로 치환된 5 내지 14원 방향족 복소환식기 또는 선택적으로 치환된 C1 -6 알콕시기를 의미함)로 이루어지는 군에서 선택되는 1 내지 6개의 기로 치환되어 있더라도 좋음]
로 표시되는 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물과, 약리학적으로 허용될 수 있는 담체를 포함하는 의약 조성물;
<30> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는, 혈관 신생 저해 작용이 유효한 질환에 대한 예방·치료제;
<31> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 혈관 신생 저해제;
<32> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 항종양제;
<33> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 혈관종 치료제;
<34> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 암전이 억제제;
<35> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 망막혈관신생증 치료제 또는 당뇨병성 망막증 치료제;
<36> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 염증성 질환 치료제;
<37> <1> 또는 <2>에 기재한 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는, 변형성관절염, 류머티스성관절염, 건선 또는 지연성 과민 반응으로 이루어지는 염증성 질환 치료제;
<38> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 아테롬성 동맥 경화증 치료제;
<39> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는, 췌장암 치료제, 위암 치료제, 대장암 치료 제, 유암 치료제, 전립선암 치료제, 폐암 치료제, 신장암 치료제, 뇌종양 치료제, 혈액암 치료제 또는 난소암 치료제;
<40> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는, 혈관 신생 저해 작용에 기초한 항종양제;
<41> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물의 약리학상 유효량을 환자에게 투여하여, 혈관 신생 저해 작용이 유효한 질환을 예방·치료하는 방법;
<42> <1> 또는 <2>에 기재한 화합물 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을, 혈관 신생 저해 작용이 유효한 질환에 대한 예방·치료제의 제조에 이용하는 것;
등에 관한 것이다.
이하, 본 발명의 내용에 관해서 상세히 설명한다.
본 명세서 중에서는, 화합물의 구조식이 편의상 일정한 이성체를 나타내는 경우가 있지만, 본 발명에는 화합물의 구조상 생기는 모든, 기하 이성체, 비대칭 탄소에 기초한 광학 이성체, 입체 이성체, 호변 이성체 등의 전부의 이성체 및 이성체 혼합물을 포함하여, 편의상의 식 기재에 한정되는 것은 아니다. 또, 본 발명의 화합물이 생체내에서 산화, 환원, 가수분해, 포합(抱合) 등의 대사작용에 의해 또 원하는 활성을 나타내는 화합물도 포함하고, 또한 본 발명은 생체내에서 산화, 환원, 가수분해 등의 대사작용에 의해 본 발명 화합물을 생성하는 화합물도 포함한다. 또한, 물을 비롯한 용매화물도 본 발명에 포함된다.
이하에, 본 명세서에 있어서 이용하는 용어를 정의한다.
본 명세서에서 「할로겐 원자」란, 불소 원자, 염소 원자, 브롬 원자, 요오드 원자 등의 할로겐 원자를 의미하며, 불소 원자, 염소 원자, 브롬 원자가 바람직하다.
본 명세서에 있어서 「C1 -6 알킬기」란, 탄소수 1∼6의 직쇄 또는 분지쇄형의 알킬기를 나타내며, 구체적으로는 예컨대 메틸기, 에틸기, n-프로필기, i-프로필기, n-부틸기, i-부틸기, sec-부틸기, t-부틸기, n-펜틸기, i-펜틸기, sec-펜틸기, t-펜틸기, 네오펜틸기, 1-메틸부틸기, 2-메틸부틸기, 1,1-디메틸프로필기, 1,2-디메틸프로필기, n-헥실기, i-헥실기, 1-메틸펜틸기, 2-메틸펜틸기, 3-메틸펜틸기, 1,1-디메틸부틸기, 1,2-디메틸부틸기, 2,2-디메틸부틸기, 1,3-디메틸부틸기, 2,3-디메틸부틸기, 3,3-디메틸부틸기, 1-에틸부틸기, 2-에틸부틸기, 1,1,2-트리메틸프로필기, 1,2,2-트리메틸프로필기, 1-에틸-1-메틸프로필기, 1-에틸-2-메틸프로필기 등을 들 수 있고, 바람직하게는 메틸기, 에틸기, n-프로필기, i-프로필기, n-부틸기, i-부틸기, sec-부틸기, t-부틸기, n-펜틸기, i-펜틸기, sec-펜틸기, t-펜틸기, 네오펜틸기, 1-메틸부틸기, 2-메틸부틸기, 1,1-디메틸프로필기, 1,2-디메틸프로필기, n-헥실기, i-헥실기이며, 보다 바람직하게는 메틸기, 에틸기, n-프로필기, i-프로필기, n-부틸기, i-부틸기, sec-부틸기, t-부틸기, n-펜틸기, i-펜틸기, sec-펜틸기, t-펜틸기, 네오펜틸기, 1-메틸부틸기, 2-메틸부틸기, 1,1-디메틸프로필기, 1,2-디메틸프로필기, 더욱 바람직하게는 메틸기, 에틸기, n-프로필기, i-프로필기, n-부틸기, i-부틸기, sec-부틸기, t-부틸기이며, 가장 바람직하게는 메틸기, 에틸기, n-프로필기, i-프로필기이다.
본 명세서에 있어서 「C1 -6 알킬렌기」란, 상기 「C1 -6 알킬기」로부터 또한 수소 원자를 1개 제외하고 유도되는 2가의 기를 의미하며, 구체적으로는 예컨대, 메틸렌기, 에틸렌기, 메틸에틸렌기, 프로필렌기, 에틸에틸렌기, 1,1-디메틸에틸렌기, 1,2-디메틸에틸렌기, 트리메틸렌기, 1-메틸트리메틸렌기, 1-에틸트리메틸렌기, 2-메틸트리메틸렌기, 1,1-디메틸트리메틸렌기, 테트라메틸렌기, 펜타메틸렌기, 헥사메틸렌기 등을 들 수 있다.
본 명세서에 있어서 「C2 -6 알케닐기」란, 탄소수 2∼6의 직쇄 또는 분지쇄형의 알케닐기를 의미하며, 탄소수 2 이상의 상기 「C1 -6 알킬기」 중에 이중 결합을 갖는 치환기를 의미한다. 구체적으로는 예컨대 에테닐기, 1-프로펜-1-일기, 2-프로펜-1-일기, 3-프로펜-1-일기, 1-부텐-1-일기, 1-부텐-2-일기, 1-부텐-3-일기, 1-부텐-4-일기, 2-부텐-1-일기, 2-부텐-2-일기, 1-메틸-1-프로펜-1-일기, 2-메틸-1-프로펜-1-일기, 1-메틸-2-프로펜-1-일기, 2-메틸-2-프로펜-1-일기, 1-메틸-1-부텐-1-일기, 2-메틸-1-부텐-1-일기, 3-메틸-1-부텐-1-일기, 1-메틸-2-부텐-1-일기, 2-메틸-2-부텐-1-일기, 3-메틸-2-부텐-1-일기, 1-메틸-3-부텐-1-일기, 2-메틸-3-부텐-1-일기, 3-메틸-3-부텐-1-일기, 1-에틸-1-부텐-1-일기, 2-에틸-1-부텐-1-일기, 3-에틸-1-부텐-1-일기, 1-에틸-2-부텐-1-일기, 2-에틸-2-부텐-1-일기, 3-에틸-2-부텐-1-일기, 1-에틸-3-부텐-1-일기, 2-에틸-3-부텐-1-일기, 3-에틸-3-부텐-1-일기, 1,1-디메틸-1-부텐-1-일기, 1,2-디메틸-1-부텐-1-일기, 1,3-디메틸-1-부텐-1-일기, 2,2-디메틸-1-부텐-1-일기, 3,3-디메틸-1-부텐-1-일기, 1,1-디메틸-2-부텐-1-일기, 1,2-디메틸-2-부텐-1-일기, 1,3-디메틸-2-부텐-1-일기, 2,2-디메틸-2-부텐-1-일기, 3,3-디메틸-2-부텐-1-일기, 1,1-디메틸-3-부텐-1-일기, 1,2-디메틸-3-부텐-1-일기, 1,3-디메틸-3-부텐-1-일기, 2,2-디메틸-3-부텐-1-일기, 3,3-디메틸-3-부텐-1-일기, 1-펜텐-1-일기, 2-펜텐-1-일기, 3-펜텐-1-일기, 4-펜텐-1-일기, 1-펜텐-2-일기, 2-펜텐-2-일기, 3-펜텐-2-일기, 4-펜텐-2-일기, 1-펜텐-3-일기, 2-펜텐-3-일기, 1-펜텐-1-일기, 2-펜텐-1-일기, 3-펜텐-1-일기, 4-펜텐-1-일기, 1-펜텐-2-일기, 2-펜텐-2-일기, 3-펜텐-2-일기, 4-펜텐-2-일기, 1-펜텐-3-일기, 2-펜텐-3-일기, 1-메틸-1-펜텐-1-일기, 2-메틸-1-펜텐-1-일기, 3-메틸-1-펜텐-1-일기, 4-메틸-1-펜텐-1-일기, 1-메틸-2-펜텐-1-일기, 2-메틸-2-펜텐-1-일기, 3-메틸-2-펜텐-1-일기, 4-메틸-2-펜텐-1-일기, 1-메틸-3-펜텐-1-일기, 2-메틸-3-펜텐-1-일기, 3-메틸-3-펜텐-1-일기, 4-메틸-3-펜텐-1-일기, 1-메틸-4-펜텐-1-일기, 2-메틸-4-펜텐-1-일기, 3-메틸-4-펜텐-1-일기, 4-메틸-4-펜텐-1-일기, 1-메틸-1-펜텐-2-일기, 2-메틸-1-펜텐-2-일기, 3-메틸-1-펜텐-2-일기, 4-메틸-1-펜텐-2-일기, 1-메틸-2-펜텐-2-일기, 2-메틸-2-펜텐-2-일기, 3-메틸-2-펜텐-2-일기, 4-메틸-2-펜텐-2-일기, 1-메틸-3-펜텐-2-일기, 2-메틸-3-펜텐-2-일기, 3-메틸-3-펜텐-2-일기, 4-메틸-3-펜텐-2-일기, 1-메틸-4-펜텐-2-일기, 2-메틸-4-펜텐-2-일기, 3-메틸-4-펜텐-2-일기, 4-메틸-4-펜텐-2-일기, 1-메틸-1-펜텐-3-일기, 2-메틸-1-펜텐-3-일기, 3-메틸-1-펜텐-3-일기, 4-메틸-1-펜텐-3-일기, 1-메틸-2-펜텐-3-일기, 2-메틸-2-펜텐-3-일기, 3-메틸-2-펜텐-3-일 기, 4-메틸-2-펜텐-3-일기, 1-헥센-1-일기, 1-헥센-2-일기, 1-헥센-3-일기, 1-헥센-4-일기, 1-헥센-5-일기, 1-헥센-6-일기, 2-헥센-1-일기, 2-헥센-2-일기, 2-헥센-3-일기, 2-헥센-4-일기, 2-헥센-5-일기, 2-헥센-6-일기, 3-헥센-1-일기, 3-헥센-2-일기, 3-헥센-3-일기 등을 들수있고, 바람직하게는 에테닐기, 1-프로펜-1-일기, 2-프로펜-1-일기, 3-프로펜-1-일기, 1-부텐-1-일기, 1-부텐-2-일기, 1-부텐-3-일기, 1-부텐-4-일기, 2-부텐-1-일기, 2-부텐-2-일기, 1-메틸-1-프로펜-1-일기, 2-메틸-1-프로펜-1-일기, 1-메틸-2-프로펜-1-일기, 2-메틸-2-프로펜-1-일기, 1-메틸-1-부텐-1-일기, 2-메틸-1-부텐-1-일기, 3-메틸-1-부텐-1-일기, 1-메틸-2-부텐-1-일기, 2-메틸-2-부텐-1-일기, 3-메틸-2-부텐-1-일기, 1-메틸-3-부텐-1-일기, 2-메틸-3-부텐-1-일기, 3-메틸-3-부텐-1-일기, 1-에틸-1-부텐-1-일기, 2-에틸-1-부텐-1-일기, 3-에틸-1-부텐-1-일기, 1-에틸-2-부텐-1-일기, 2-에틸-2-부텐-1-일기, 3-에틸-2-부텐-1-일기, 1-에틸-3-부텐-1-일기, 2-에틸-3-부텐-1-일기, 3-에틸-3-부텐-1-일기, 1,1-디메틸-1-부텐-1-일기, 1,2-디메틸-1-부텐-1-일기, 1,3-디메틸-1-부텐-1-일기, 2,2-디메틸-1-부텐-1-일기, 3,3-디메틸-1-부텐-1-일기, 1,1-디메틸-2-부텐-1-일기, 1,2-디메틸-2-부텐-1-일기, 1,3-디메틸-2-부텐-1-일기, 2,2-디메틸-2-부텐-1-일기, 3,3-디메틸-2-부텐-1-일기, 1,1-디메틸-3-부텐-1-일기, 1,2-디메틸-3-부텐-1-일기, 1,3-디메틸-3-부텐-1-일기, 2,2-디메틸-3-부텐-1-일기, 3,3-디메틸-3-부텐-1-일기이며, 보다 바람직하게는 에테닐기, 1-프로펜-1-일기, 2-프로펜-1-일기, 3-프로펜-1-일기, 1-부텐-1-일기, 1-부텐-2-일기, 1-부텐-3-일기, 1-부텐-4-일기, 2-부텐-1-일기, 2-부텐-2-일기, 1-메틸-1-프로펜-1-일기, 2-메틸-1-프로펜-1-일기, 1-메틸- 2-프로펜-1-일기, 2-메틸-2-프로펜-1-일기, 1-메틸-1-부텐-1-일기, 2-메틸-1-부텐-1-일기, 3-메틸-1-부텐-1-일기, 1-메틸-2-부텐-1-일기, 2-메틸-2-부텐-1-일기, 3-메틸-2-부텐-1-일기, 1-메틸-3-부텐-1-일기, 2-메틸-3-부텐-1-일기, 3-메틸-3-부텐-1-일기이며, 가장 바람직하게는 에테닐기, 1-프로펜-1-일기, 2-프로펜-1-일기, 3-프로펜-1-일기, 1-부텐-1-일기, 1-부텐-2-일기, 1-부텐-3-일기, 1-부텐-4-일기, 2-부텐-1-일기, 2-부텐-2-일기이다.
본 명세서에 있어서 「C2 -6 알키닐기」란, 탄소수 2∼6의 직쇄 또는 분지쇄형의 알키닐기를 나타내며, 탄소수 2 이상의 상기 「C1 -6 알킬기」 중에 삼중 결합을 갖는 치환기를 의미한다. 구체적으로는 예컨대 에티닐기, 1-프로핀-1-일기, 2-프로핀-1-일기, 3-프로핀-1-일기, 1-부틴-1-일기, 1-부틴-2-일기, 1-부틴-3-일기, 1-부틴-4-일기, 2-부틴-1-일기, 2-부틴-2-일기, 1-메틸-1-프로핀-1-일기, 2-메틸-1-프로핀-1-일기, 1-메틸-2-프로핀-1-일기, 2-메틸-2-프로핀-1-일기, 1-메틸-1-부틴-1-일기, 2-메틸-1-부틴-1-일기, 3-메틸-1-부틴-1-일기, 1-메틸-2-부틴-1-일기, 2-메틸-2-부틴-1-일기, 3-메틸-2-부틴-1-일기, 1-메틸-3-부틴-1-일기, 2-메틸-3-부틴-1-일기, 3-메틸-3-부틴-1-일기, 1-에틸-1-부틴-1-일기, 2-에틸-1-부틴-1-일기, 3-에틸-1-부틴-1-일기, 1-에틸-2-부틴-1-일기, 2-에틸-2-부틴-1-일기, 3-에틸-2-부틴-1-일기, 1-에틸-3-부틴-1-일기, 2-에틸-3-부틴-1-일기, 3-에틸-3-부틴-1-일기, 1,1-디메틸-1-부틴-1-일기, 1,2-디메틸-1-부틴-1-일기, 1,3-디메틸-1-부틴-1-일기, 2,2-디메틸-1-부틴-1-일기, 3,3-디메틸-1-부틴-1-일기, 1,1-디메틸-2-부틴-1-일기, 1,2-디메틸-2-부틴-1-일기, 1,3-디메틸-2-부틴-1-일기, 2,2-디메틸-2-부틴-1-일기, 3,3-디메틸-2-부틴-1-일기, 1,1-디메틸-3-부틴-1-일기, 1,2-디메틸-3-부틴-1-일기, 1,3-디메틸-3-부틴-1-일기, 2,2-디메틸-3-부틴-1-일기, 3,3-디메틸-3-부틴-1-일기, 1-펜틴-1-일기, 2-펜틴-1-일기, 3-펜틴-1-일기, 4-펜틴-1-일기, 1-펜틴-2-일기, 2-펜틴-2-일기, 3-펜틴-2-일기, 4-펜틴-2-일기, 1-펜틴-3-일기, 2-펜틴-3-일기, 1-펜틴-1-일기, 2-펜틴-1-일기, 3-펜틴-1-일기, 4-펜틴-1-일기, 1-펜틴-2-일기, 2-펜틴-2-일기, 3-펜틴-2-일기, 4-펜틴-2-일기, 1-펜틴-3-일기, 2-펜틴-3-일기, 1-메틸-1-펜틴-1-일기, 2-메틸-1-펜틴-1-일기, 3-메틸-1-펜틴-1-일기, 4-메틸-1-펜틴-1-일기, 1-메틸-2-펜틴-1-일기, 2-메틸-2-펜틴-1-일기, 3-메틸-2-펜틴-1-일기, 4-메틸-2-펜틴-1-일기, 1-메틸-3-펜틴-1-일기, 2-메틸-3-펜틴-1-일기, 3-메틸-3-펜틴-1-일기, 4-메틸-3-펜틴-1-일기, 1-메틸-4-펜틴-1-일기, 2-메틸-4-펜틴-1-일기, 3-메틸-4-펜틴-1-일기, 4-메틸-4-펜틴-1-일기, 1-메틸-1-펜틴-2-일기, 2-메틸-1-펜틴-2-일기, 3-메틸-1-펜틴-2-일기, 4-메틸-1-펜틴-2-일기, 1-메틸-2-펜틴-2-일기, 2-메틸-2-펜틴-2-일기, 3-메틸-2-펜틴-2-일기, 4-메틸-2-펜틴-2-일기, 1-메틸-3-펜틴-2-일기, 2-메틸-3-펜틴-2-일기, 3-메틸-3-펜틴-2-일기, 4-메틸-3-펜틴-2-일기, 1-메틸-4-펜틴-2-일기, 2-메틸-4-펜틴-2-일기, 3-메틸-4-펜틴-2-일기, 4-메틸-4-펜틴-2-일기, 1-메틸-1-펜틴-3-일기, 2-메틸-1-펜틴-3-일기, 3-메틸-1-펜틴-3-일기, 4-메틸-1-펜틴-3-일기, 1-메틸-2-펜틴-3-일기, 2-메틸-2-펜틴-3-일기, 3-메틸-2-펜틴-3-일기, 4-메틸-2-펜틴-3-일기, 1-헥신-일기, 1-헥신-2-일기, 1-헥신-3-일기, 1-헥신-4-일기, 1-헥신-5-일기, 1-헥신-6-일기, 2-헥신-1-일기, 2-헥신-2-일기, 2-헥신-3- 일기, 2-헥신-4-일기, 2-헥신-5-일기, 2-헥신-6-일기, 3-헥신-1-일기, 3-헥신-2-일기, 3-헥신-3-일기 등을 들수있고, 바람직하게는 에티닐기, 1-프로핀-1-일기, 2-프로핀-1-일기, 3-프로핀-1-일기, 1-부틴-1-일기, 1-부틴-2-일기, 1-부틴-3-일기, 1-부틴-4-일기, 2-부틴-1-일기, 2-부틴-2-일기, 1-메틸-1-프로핀-1-일기, 2-메틸-1-프로핀-1-일기, 1-메틸-2-프로핀-1-일기, 2-메틸-2-프로핀-1-일기, 1-메틸-1-부틴-1-일기, 2-메틸-1-부틴-1-일기, 3-메틸-1-부틴-1-일기, 1-메틸-2-부틴-1-일기, 2-메틸-2-부틴-1-일기, 3-메틸-2-부틴-1-일기, 1-메틸-3-부틴-1-일기, 2-메틸-3-부틴-1-일기, 3-메틸-3-부틴-1-일기, 1-에틸-1-부틴-1-일기, 2-에틸-1-부틴-1-일기, 3-에틸-1-부틴-1-일기, 1-에틸-2-부틴-1-일기, 2-에틸-2-부틴-1-일기, 3-에틸-2-부틴-1-일기, 1-에틸-3-부틴-1-일기, 2-에틸-3-부틴-1-일기, 3-에틸-3-부틴-1-일기, 1,1-디메틸-1-부틴-1-일기, 1,2-디메틸-1-부틴-1-일기, 1,3-디메틸-1-부틴-1-일기, 2,2-디메틸-1-부틴-1-일기, 3,3-디메틸-1-부틴-1-일기, 1,1-디메틸-2-부틴-1-일기, 1,2-디메틸-2-부틴-1-일기, 1,3-디메틸-2-부틴-1-일기, 2,2-디메틸-2-부틴-1-일기, 3,3-디메틸-2-부틴-1-일기, 1,1-디메틸-3-부틴-1-일기, 1,2-디메틸-3-부틴-1-일기, 1,3-디메틸-3-부틴-1-일기, 2,2-디메틸-3-부틴-1-일기, 3,3-디메틸-3-부틴-1-일기이며, 보다 바람직하게는 에티닐기, 1-프로핀-1-일기, 2-프로핀-1-일기, 3-프로핀-1-일기, 1-부틴-1-일기, 1-부틴-2-일기, 1-부틴-3-일기, 1-부틴-4-일기, 2-부틴-1-일기, 2-부틴-2-일기, 1-메틸-1-프로핀-1-일기, 2-메틸-1-프로핀-1-일기, 1-메틸-2-프로핀-1-일기, 2-메틸-2-프로핀-1-일기, 1-메틸-1-부틴-1-일기, 2-메틸-1-부틴-1-일기, 3-메틸-1-부틴-1-일기, 1-메틸-2-부틴-1-일기, 2-메틸-2-부틴-1-일기, 3- 메틸-2-부틴-1-일기, 1-메틸-3-부틴-1-일기, 2-메틸-3-부틴-1-일기, 3-메틸-3-부틴-1-일기이며, 더욱 바람직하게는 에티닐기, 1-프로핀-1-일기, 2-프로핀-1-일기, 3-프로핀-1-일기, 1-부틴-1-일기, 1-부틴-2-일기, 1-부틴-3-일기, 1-부틴-4-일기, 2-부틴-1-일기, 2-부틴-2-일기이며, 가장 바람직하게는 에티닐기, 1-프로핀-1-일기, 2-프로핀-1-일기, 3-프로핀-1-일기이다.
본 명세서에 있어서 「C3 -8의 시클로알킬기」란, 탄소수 3∼8의 환상의 알킬기를 의미하며, 구체적으로는 예컨대, 시클로프로필기, 시클로부틸기, 시클로펜틸기, 시클로헥실기를 들 수 있다. 바람직하게는 시클로프로필기이다.
본 명세서에 있어서 「C3 -8 시클로알케닐기」란, 탄소수 3∼8의 환상의 알케닐기를 나타내며, 구체적으로는 예컨대, 시클로펜테닐기, 시클로헥세닐기를 들 수 있다.
본 명세서에 있어서 「C3 -8 시클로알키닐기」란, 탄소수 3∼8의 환상의 알키닐기를 나타내며, 구체적으로는 예컨대, 시클로헥시닐기를 들 수 있다.
본 명세서에 있어서 「C3 -8 시클로알킬옥시기」란, 상기 C3 -8 시클로알킬기에 있어서, 그 말단에 산소 원자가 결합된 것이 해당되며, 구체적으로는 예컨대, 시클로프로필옥시기, 시클로부틸옥시기, 시클로펜틸옥시기, 시클로헥실옥시기를 들 수 있다.
본 명세서에 있어서 「C3 -8 지환식 탄화수소기」란, 탄소수 3∼8의 환상의 탄 화수소기로서, 상기 「C3 -8의 시클로알킬기」, 「C3 -8 시클로알케닐기」 및 「C3 -8 시클로알키닐기」로 정의된 치환기를 의미한다. 바람직하게는 시클로프로필기이다.
본 명세서에 있어서 「C1 -6 알콕시기」란, 산소 원자에 상기 「C1 -6 알킬기」가 결합한 치환기를 의미하며, 구체적으로는 예컨대 메톡시기, 에톡시기, n-프로폭시기, i-프로폭시기, n-부톡시기, i-부톡시기, sec-부톡시기, t-부톡시기, n-펜틸옥시기, i-펜틸옥시기, sec-펜틸옥시기, t-펜틸옥시기, 네오펜틸옥시기, 1-메틸부톡시기, 2-메틸부톡시기, 1,1-디메틸프로폭시기, 1,2-디메틸프로폭시기, n-헥실옥시기, i-헥실옥시기, 1-메틸펜틸옥시기, 2-메틸펜틸옥시기, 3-메틸펜틸옥시기, 1,1-디메틸부톡시기, 1,2-디메틸부톡시기, 2,2-디메틸부톡시기, 1,3-디메틸부톡시기, 2,3-디메틸부톡시기, 3,3-디메틸부톡시기, 1-에틸부톡시기, 2-에틸부톡시기, 1,1,2-트리메틸프로폭시기, 1,2,2-트리메틸프로폭시기, 1-에틸-1-메틸프로폭시기, 1-에틸-2-메틸프로폭시기 등을 들 수 있고, 바람직하게는 메톡시기, 에톡시기, n-프로폭시기, i-프로폭시기, n-부톡시기, i-부톡시기, sec-부톡시기, t-부톡시기, n-펜틸옥시기, i-펜틸옥시기, sec-펜틸옥시기, t-펜틸옥시기, 네오펜틸옥시기, 1-메틸부톡시기, 2-메틸부톡시기, 1,1-디메틸프로폭시기, 1,2-디메틸프로폭시기, n-헥실옥시기, i-헥실옥시기이며, 보다 바람직하게는 메톡시기, 에톡시기, n-프로폭시기, i-프로폭시기, n-부톡시기, i-부톡시기, sec-부톡시기, t-부톡시기, n-펜틸옥시기, i-펜틸옥시기, sec-펜틸옥시기, t-펜틸옥시기, 네오펜틸옥시기, 1-메틸부톡시기, 2-메틸부톡시기, 1,1-디메틸프로폭시기, 1,2-디메틸프로폭시기, 더욱 바람 직하게는 메톡시기, 에톡시기, n-프로폭시기, i-프로폭시기, n-부톡시기, i-부톡시기, sec-부톡시기, t-부톡시기, 가장 바람직하게는 메톡시기, 에톡시기, n-프로폭시기, i-프로폭시기이다.
본 명세서에 있어서 「C2 -7 아실기」란, 상기 「C1 -6 알킬기」,「C2 -6 알케닐기」, 「C2 -6 알키닐기」 또는 페닐기의 말단에 카르보닐기가 결합된 치환기를 의미하며, 구체적으로는 예컨대 아세틸기, 프로피오닐기, 부티릴기, 이소부티릴기, 발레릴기, 이소발레릴기, 피발로일기, 헥사노일기, 옥타노일기, 아크릴로일기, 메타크릴로일기, 크로토닐기, 벤조일기 등의 기를 들 수 있다. 바람직하게는 아세틸기, 프로피오닐기, 부티릴기, 이소부티릴기, 발레릴기, 이소발레릴기, 피발로일기, 헥사노일기, 옥타노일기, 아크릴로일기, 메타크릴로일기, 크로토닐기, 벤조일기이며, 보다 바람직하게는 아세틸기, 프로피오닐기, 부티릴기, 이소부티릴기, 발레릴기, 이소발레릴기, 피발로일기, 헥사노일기, 옥타노일기, 벤조일기이며, 더욱 바람직하게는 아세틸기, 프로피오닐기, 부티릴기, 이소부티릴기, 벤조일기이며, 가장 바람직하게는 아세틸기, 프로피오닐기, 벤조일기이다.
본 명세서에 있어서 「C2 -7 알콕시카르보닐기」란, 상기 「C1 -6 알콕시기」가 결합하는 카르보닐기를 의미하여, 구체적으로 예시하면, 메톡시카르보닐기, 에톡시카르보닐기, n-프로폭시카르보닐기, i-프로폭시카르보닐기, sec-프로폭시카르보닐기, n-부톡시카르보닐기, i-부톡시카르보닐기, 1,2-디메틸프로폭시카르보닐기, 2-에틸프로폭시카르보닐기 등을 들 수 있다.
본 명세서에 있어서 「n-」란 노르말 타입 또는 1급 치환기임을 의미하고, 「sec-」란 2급 치환기임을 의미하고, 「t-」란 3급 치환기임을 의미하고, 「i-」란 이소 타입의 치환기인 것을 의미한다.
본 명세서에 있어서 「C1 -6 알킬렌디옥시기」란, 상기 「C1 -6C1 -6 알킬기」로부터 수소 원자를 1개 더 제하여 유도되는 2가 기의 말단에 각각 산소 원자를 갖는 치환기를 의미하며, 구체적으로는 예컨대, 메틸렌디옥시기, 에틸렌디옥시기, 프로필렌디옥시기, 부틸렌디옥시기, 펜티렌디옥시기, 헥시렌디옥시기 등을 들 수 있다.
본 명세서에 있어서 「C6 -14 아릴기」란, 탄소수 6 내지 14의 방향족환식기를 말하며, 구체적으로는 예컨대, 벤젠, 펜탈렌, 인덴, 나프탈렌, 아줄렌, 헵탈렌, 비페닐렌, 인다센, 아세나프틸렌, 플루오렌, 페날렌, 페난트렌, 안트라센 등을 들 수 있고, 바람직하게는 벤젠, 펜탈렌, 인덴, 나프탈렌, 아줄렌 등이 있다.
본 명세서에 있어서 「헤테로 원자」란, 구체적으로는 산소 원자, 황 원자, 질소 원자, 인, 비소, 안티몬, 규소, 게르마늄, 주석, 납, 붕소, 수은 등을 들 수 있고, 바람직하게는 산소 원자, 황 원자, 질소 원자이다.
본 명세서에 있어서 「5 내지 14원 방향족 복소환식기」란, 환식기의 고리를 구성하는 원자의 수가 5 내지 14이며, 그 환식기의 고리를 구성하는 원자의 종류가 질소 원자, 황 원자 및 산소 원자 등의 헤테로 원자를 하나 이상 포함하는 방향족인 환식기를 의미한다. 구체적으로는, 예컨대, 피롤 고리, 피리딘 고리, 피리돈 고리, 피리다진 고리, 피리미딘 고리, 피라진 고리, 피라졸 고리, 이미다졸 고리, 트 리아졸 고리, 테트라졸 고리, 인돌 고리, 이소인돌 고리, 인돌리진 고리, 푸린 고리, 인다졸 고리, 퀴놀린 고리, 이소퀴놀린 고리, 퀴놀리진 고리, 프탈라진 고리, 나프틸리딘 고리, 퀴녹살린 고리, 퀴나졸린 고리, 신놀린 고리, 프테리딘 고리, 이미다조피리딘 고리, 이미다조트리아진 고리, 피라지노피리다진 고리, 아크리딘 고리, 페난트리딘 고리, 카르바졸고리, 카르바졸린 고리, 페리미딘 고리, 페난트로린 고리, 페나신 고리, 옥사디아졸 고리, 벤즈이미다졸, 피롤로피리딘 고리, 피롤로피리미딘 고리, 피리도피리미딘 고리 등의 함질소 방향족 복소환; 티오펜 고리, 벤조티오펜 고리 등의 함황 방향족 복소환; 푸란 고리, 피란 고리, 시클로펜타피란 고리, 벤조푸란 고리, 이소벤조푸란 고리 등의 함산소 방향족 복소환; 티아졸 고리, 티아디졸 고리, 이소티아졸 고리, 벤즈옥사졸 고리, 벤즈티아졸 고리, 벤즈티아디아졸 고리, 페노티아진 고리, 이속사졸 고리, 푸라잔 고리, 페녹사진 고리, 피라졸로옥사졸 고리, 이미다조티아졸 고리, 티에노프란 고리, 푸로피롤 고리, 피리도옥사진 고리, 푸로피리딘 고리, 푸로피리미딘 고리, 피에노피리미딘 고리, 옥사졸 고리 등의 질소 원자, 황 원자 및 산소 원자에서 선택되는 2개 이상의 이원자를 포함하여 이루어지는 방향족 복소환을 들 수 있다. 이러한 「5 내지 14원 방향족 복소환식기」로서는 바람직하게는 피리딘 고리, 피리돈 고리, 피리미딘 고리, 이미다졸 고리, 인돌 고리, 퀴놀린 고리, 이소퀴놀린 고리, 퀴놀리진 고리, 프탈라진 고리, 나프틸리딘 고리, 퀴나졸린 고리, 신놀린 고리, 아크리딘고리, 페나신 고리, 티오펜 고리, 벤조티오펜 고리, 푸란 고리, 피란 고리, 벤조푸란 고리, 티아졸 고리, 벤즈티아졸 고리, 페노티아진 고리, 피롤로피리미딘 고리, 플로피리신 고리, 티에 노피리미딘 고리 등을 들 수 있고, 보다 바람직하게는 피리딘 고리, 티오펜 고리, 벤조티오펜 고리, 티아졸 고리, 벤조티아졸 고리, 퀴놀린 고리, 퀴나졸린 고리, 신놀린 고리, 피롤로피리미딘 고리, 피리미딘 고리, 플로피리신 고리, 티에노피리미딘 고리 등을 들 수 있다.
본 명세서에 있어서 「5 내지 14원 비방향족 복소환식기」란, 환식기의 고리를 구성하는 원자의 수가 5 내지 14이며, 그 환식기의 고리를 구성하는 원자의 종류가 질소 원자, 황 원자 및 산소 원자 등의 헤테로 원자를 하나 이상 포함하는 방향족이 아닌 환식기를 의미한다. 구체적으로는, 예컨대, 피롤리디닐기, 피롤리닐기, 피페리디닐기, 피페라지닐기, N-메틸피페라지닐기, 이미다졸리닐기, 피라졸리디닐기, 이미다졸리디닐기, 모르폴리닐기, 테트라히드로파리닐기, 아제티디닐기, 옥세타닐기, 옥사티오라닐기, 피리돈 고리, 2-피롤리돈 고리, 에틸렌우레아 고리, 1,3-디옥솔란 고리, 1,3-디옥산 고리, 1,4-디옥산 고리, 프탈이미드 고리, 호박산이미드 고리 등의 비방향족 복소환식기를 들 수 있다. 이러한 「5 내지 14원 비방향족 복소환식기」로서는, 바람직하게는 피롤리디닐기, 피페리디닐기, 모르폴리닐기 등을 들 수 있고, 보다 바람직하게는 피롤리디닐기, 피페리디닐기, 모르폴리닐기, 피롤고리 등을 들 수 있다.
본 명세서에 있어서 「5 내지 14원 복소환식기」란, 환식기의 고리를 구성하는 원자의 수가 5 내지 14이며, 그 환식기의 고리를 구성하는 원자의 종류가 질소 원자, 황 원자 및 산소 원자 등의 헤테로 원자를 하나 이상 포함하는 방향족 또는 비방향족인 환식기를 의미하고, 전자가 「5 내지 14원 방향족 복소환식기」이며, 후자가 「5 내지 14원 비방향족 복소환식기」이다. 따라서, 「5 내지 14원 복소환식기」의 구체예로서는 전술한 「5 내지 14원 방향족 복소환식기」의 구체예 및 전술한 「5 내지 14원 비방향족 복소환식기」의 구체예를 들 수 있다.
이러한 「5 내지 14원 복소환식기」로서는, 바람직하게는 피롤리디닐기, 피페리디닐기, 모르폴리닐기, 피롤 고리, 피리딘 고리, 피리돈 고리, 피리미딘 고리, 이미다졸 고리, 인돌 고리, 퀴놀린 고리, 이소퀴놀린 고리, 퀴놀리딘 고리, 프탈라진 고리, 나프틸리딘 고리, 퀴나졸린 고리, 신놀린 고리, 아크리딘고리, 페나신 고리, 티오펜 고리, 벤조티오펜 고리, 푸란 고리, 피란 고리, 벤조푸란 고리, 티아졸 고리, 벤즈티아졸 고리, 페노티아진 고리, 카르보스티릴 고리 등을 들 수 있고, 보다 바람직하게는 피롤리디닐기, 피페리디닐기, 모르폴리닐기, 피롤 고리, 피리딘 고리, 티오펜 고리, 벤조티오펜 고리, 티아졸 고리, 벤즈티아졸 고리, 퀴놀린 고리, 퀴나졸린 고리, 신놀린 고리, 카르보스티릴 고리 등을 들 수 있고, 더욱 바람직하게는 티아졸 고리, 퀴놀린 고리, 퀴나졸린 고리, 신놀린 고리, 카르보스티릴 고리이다.
본 명세서에 있어서 「6 내지 14원 방향족 복소환식기」란, 상기 「5 내지 14원 방향족 복소환식기」로 정의되는 치환기 중, 환식기의 고리를 구성하는 원자의 수가 6 내지 14인 치환기를 의미한다. 구체적으로는 예컨대 피리딘 고리, 피리돈 고리, 피리미딘 고리, 인돌 고리, 퀴놀린 고리, 이소퀴놀린 고리, 퀴놀리진 고리, 프탈라진 고리, 나프틸리딘 고리, 퀴나졸린 고리, 신놀린 고리, 아크리딘 고리, 벤조티오펜 고리, 벤조푸란 고리, 티아졸 고리, 벤즈티아졸 고리, 페노티아진 고리 등을 들 수 있다.
본 명세서에 있어서 「6 내지 14원 복소환식기」란, 상기 「5 내지 14원 복소환식기」로 정의되는 치환기 중, 환식기의 고리를 구성하는 원자의 수가 6 내지 14인 치환기를 의미한다. 구체적으로는 예컨대, 피페리디닐기, 피페라지닐기, N-메틸피페라지닐기, 모르폴리닐기, 테트라히드로피라닐기, 1,4-디옥산 고리, 프탈이미드 고리 등을 들 수 있다.
본 명세서에 있어서 「C6 -14 아릴 C1 -6 알킬기(=아랄킬기)」란 상기 「C1 -6 알킬기」에 있어서, 치환 가능한 부분이 상기 「C6 -14 아릴기」로 치환된 기를 말하며, 구체적으로는 예컨대, 벤질기, 페네틸기, 3-페닐프로필기, 4-페닐부틸기, 5-페닐펜틸기, 6-페닐헥실기, 1-나프틸메틸기, 2-나프틸메틸기, 1-나프틸에틸기, 2-나프틸에틸기, 1-나프틸프로필기, 2-나프틸프로필기 등을 들 수 있다. 바람직하게는 벤질기, 페네틸기, 3-페닐프로필기, 4-페닐부틸기, 5-페닐펜틸기, 6-페닐헥실기, 1-나프틸메틸기, 2-나프틸메틸기, 1-나프틸에틸기, 2-나프틸에틸기, 1-나프틸프로필기, 2-나프틸프로필기이며, 보다 바람직하게는 벤질기, 페네틸기, 3-페닐프로필기, 4-페닐부틸기, 5-페닐펜틸기, 6-페닐헥실기, 1-나프틸메틸기, 2-나프틸메틸기이며, 더욱 바람직하게는 벤질기, 페네틸기, 3-페닐프로필기, 4-페닐부틸기이며, 가장 바람직하게는 벤질기, 페네틸기이다.
본 명세서에 있어서 「5 내지 14원 복소환식기 C1 -6 알킬기」란, 상기 「C1 -6 알킬기」에 있어서, 치환 가능한 부분이 상기 「5 내지 14원 복소환식기」로 치환 된 기를 말하며, 구체적으로는 예컨대, 2-피리딜메틸기, 3-피리딜메틸기, 2-퀴놀리노메틸기 등을 의미한다.
본 명세서에 있어서 「이탈기」로서는, 통상 유기 합성상 이탈기로서 알려져 있는 기라면 어떠한 기라도 좋으며 특별히 한정되지 않지만, 구체적으로는 예컨대 염소 원자, 브롬 원자, 요오드 원자 등의 할로겐 원자; 예컨대 메틸티오기, 에틸티오기, 프로필티오기 등의 알킬티오기; 예컨대 페닐티오기, 톨루일티오기, 2-피리딜티오기 등의 아릴티오기; 예컨대 메탄설포닐옥시기, 트리플루오로메탄설포닐옥시기, 에탄설포닐옥시기, 프로판설포닐옥시기 등의 알킬설포닐옥시기; 예컨대 벤젠설포닐옥시기, p-톨루엔설포닐옥시기 등의 아릴설포닐옥시기; 예컨대 아세톡시기, 트리플루오로아세톡시기 등의 알카노일옥시기; 예컨대 메톡시기, 에톡시기, 프로폭시기 등의 알콕시기; 예컨대 메틸아미노기, 에틸아미노기, 프로필아미노기, 부틸아미노기 등의 알킬아미노기; 예컨대 디메틸아미노기, 디에틸아미노기, 디프로필아미노기, 메틸에틸아미노기, 에틸프로필아미노기, 메틸프로필아미노기 등의 디알킬아미노기; 디페녹시포스포릴옥시기 등의 치환 포스포릴옥시기 등을 들 수 있고, 바람직하게는 염소 원자, 브롬 원자, 요오드 원자 등의 할로겐 원자, 트리플루오로메탄설포닐옥시기 등이다.
본 명세서에서 「치환기를 갖고 있더라도 좋다」란, 「치환 가능한 부위에, 임의로 조합하여 하나 또는 여러 개의 치환기를 갖고 있어도 좋다」와 같은 의미이며, 치환기는 구체적으로는 예컨대, (1) 할로겐 원자, (2) 수산기, (3) 티올기, (4) 니트로기, (5) 니트릴기, (6) 옥소기, (7) 아지도기, (8) 구아니디노기, (9) 히드라지노기, (10) 이소시아노기, (11) 시아네이트기, (12) 이소시아네이트기, (13) 티오시아네이트기, (14) 이소티오시아네이트기, (15) 니트로소기, (16) 카르바미도기(우레이도기), (17) 포르밀기, (18) C1-6 이미도일기, (19) 선택적으로 할로겐화 또는 수산화된, C1-6 알킬기, C2-6 알케닐기, C2-6 알키닐기, C3-6 시클로알킬기, C3-6 시클로알케닐기, C3-6 시클로알키닐기, C1-6 알콕시기, C2-6 알케닐옥시기, C2-6 알키닐옥시기, C3-6 시클로알킬옥시기, C1-6 알킬티오기, C2-6 알케닐티오기, C2-6 알키닐티오기, C3-6 시클로알킬티오기, 또는 C1-6 알킬렌디옥시기, (20) C6-14 아릴기, (21) 5 내지 14원 복소환식기, (22) 카르복실기, (23) 트리플루오로메틸기, (24) C6-14 아릴-C1-6 알킬기 (25) 5 내지 14원 복소환 C1-6 알킬기 또는 (26) 식 -VXX1- VXX2-VXX3-VXX4(식중, VXX1, VXX2 및 VXX3은 각각 독립적으로 1) 단결합, 2) 산소 원자, 3) 황 원자, 4) 식 -CO-, 5) 식 -SO-, 6) 식 -SO2-, 7) 식 -NRXX1-, 8) 식 -CONRXX1-, 9) 식 -NRXX1CO-, 10) 식 -SO2NRXX1-, 11) 식 -NRXX1SO2-, 12) 식 -O-CO-, 13) 식 -C(O)O-, 14) 식 -NRXX1C(O)O-, 15) 식 -NRXX1C(O)NRXX2-, 16) 식 -O-C(O)NRXX1-, 17) 식 -O-C(O)O-, 18) C1-6 알킬렌기, 19) C2-6 알케닐기, 20) C1-6 알키닐기, 21) C3-8 지환식 탄화수소기, 22) C6-14 아릴기, 23) 5 내지 14원 복소환식기 또는 24) 5 내지 14원 방향족 복소환식기를 의미하고; VXX4, RXX1 및 RXX2는 각각 독립적으로 1) 수소 원자, 2) C1-6 알킬기, 3) C2-6 알케닐기, 4) C1-6 알키닐기, 5) C3-8 지환식 탄화수소기, 6) C6-14 아릴기, 7) 5 내지 14원 복소환식기, 8) 5 내지 14원 방향족 복소환식기 또는 9) C1-6 알콕시기를 의미함)로 표시되는 기 등을 들 수 있다.
따라서 「치환기를 갖고 있더라도 좋다」란, 구체적으로는 예컨대, 수산기; 티올기; 니트로기; 모르폴리노기; 티오모르폴리노기; 불소 원자, 염소 원자, 브롬 원자, 요오드 원자 등의 할로겐 원자; 니트릴기; 아지도기; 포르밀기; 메틸기, 에틸기, 프로필기, 이소프로필기, 부틸기 등의 알킬기; 비닐기, 알릴기, 프로페닐기 등의 알케닐기; 에티닐기, 부티닐기, 프로파르길기 등의 알키닐기, 저급 알킬기에 대응하는 메톡시기, 에톡시기, 프로폭시기, 부톡시기 등의 알콕시기; 플루오로메틸기, 디플루오로메틸기, 트리플루오로메틸기, 플루오로에틸기 등의 할로게노알킬기; 히드록시메틸기, 히드록시에틸기, 히드록시프로필기 등의 히드록시알킬기; 구아니디노기; 포름이미도일기; 아세트이미도일기; 카르바모일기; 티오카르바모일기; 카르바모일메틸기, 카르바모일에틸기 등의 카르바모일알킬기; 메틸카르바모일기, 디메틸카르바모일기 등의 알킬카르바모일기; 카르바미도기; 아세틸기 등의 알카노일기; 아미노기; 메틸아미노기, 에틸아미노기, 이소프로필아미노기 등의 알킬아미노기; 디메틸아미노기, 메틸에틸아미노기, 디에틸아미노기 등의 디알킬아미노기; 아미노메틸기, 아미노에틸기, 아미노프로필기 등의 아미노알킬기; 카르복시기; 메톡시카르보닐기, 에톡시카르보닐기, 프로폭시카르보닐기 등의 알콕시카르보닐기; 메톡시카르보닐메틸기, 에톡시카르보닐메틸기, 프로폭시카르보닐메틸기, 메톡시카르보닐에틸기, 에톡시카르보닐에틸기, 프로폭시카르보닐에틸기 등의 알콕시카르보닐알킬기; 메틸옥시메틸기, 메틸옥시에틸기, 에틸옥시메틸기, 에틸옥시에틸기 등의 알킬옥시알킬기; 메틸티오메틸기, 메틸티오에틸기, 에틸티오메틸기, 에틸티오에틸기 등의 알킬티오알킬기; 아미노메틸아미노메틸기, 아미노에틸아미노메틸기 등의 아미노알킬아미노알킬기; 메틸카르보닐옥시기, 에틸카르보닐옥시기, 이소프로필카르보닐옥시기 등의 알킬카르보닐옥시기; 옥시메틸기, 벤질옥시에틸옥시에틸기 등의 아릴알콕시알콕시알킬기; 히드록시에틸옥시메틸기, 히드록시에틸옥시에틸기 등의 히드록시알콕시알킬기; 벤질옥시메틸기, 벤질옥시에틸기, 벤질옥시프로필기 등의 아릴알콕시알킬기; 트리메틸암모니오기, 메틸에틸메틸암모니오기, 트리에틸암모니오기 등의 제4급 암모니오기; 시클로프로필기, 시클로부틸기, 시클로펜틸기, 시클로헥실기 등의 시클로알킬기; 시클로프로페닐기, 시클로부테닐기, 시클로펜테닐기, 시클로헥세닐기 등의 시클로알케닐기; 페닐기, 피리디닐기, 티에닐기, 푸릴기, 피롤릴기 등의 아릴기; 메틸티오기, 에틸티오기, 프로필티오기, 부틸티오기 등의 알킬티오기; 페닐티오기, 피리디닐티오기, 티에닐티오기, 푸릴티오기, 피롤릴티오기 등의 아릴티오기; 벤질기, 트리틸기, 디메톡시트리틸기 등의 아릴 저급 알킬기; 설포닐기, 메실기, p-톨루엔설포닐기 등의 치환 설포닐기; 벤조일기 등의 아릴로일기; 플루오로페닐기, 브로모페닐기 등의 할로게노아릴기; 메틸렌디옥시기 등의 옥시알콕시기 등의 치환기로 치환되어 있더라도 좋은 것을 의미한다.
본 명세서에 있어서 「C1 -6 이미도일기」란, 예컨대, 포름이미도일, 헥산이미도일, 호박산이미도일 등을 들 수 있다.
본 명세서에 있어서, 고리 A가 5 내지 14원 복소환식기를 의미하는 경우, 피리딘 고리, 피리미딘 고리, 피리도피리미딘 고리, 이소퀴놀린 고리, 프탈라진 고리, 퀴놀린 고리, 퀴나졸린 고리, 피리미드피리미딘 고리, 퀴녹살린 고리, 피리도피리딘 고리, 피롤로피리딘 고리, 피롤로피리미딘 고리, 인돌 고리, 피라졸로피리딘 고리, 피라졸로피리미딘 고리, 티에노피리딘 고리, 티에노피리미딘 고리, 벤조티아졸 고리, 티아졸로피리딘 고리, 티아졸로피리미딘 고리, 벤즈이미다졸 고리, 이미다조피리딘 고리, 이미다조피리미딘 고리, 티아졸 고리, 이미다졸 고리, 피라졸 고리, 벤조푸란 고리, 푸로피리딘 고리, 푸로피리미딘 고리, 벤조옥사졸 고리, 옥사졸로피리딘 고리, 옥사졸로피리미딘 고리, 피리도피리미딘-7-온 고리, 피라진 고리, 피리다진 고리, 피리돈 고리, 피리미돈 고리, 옥시인돌 고리, 피라졸로퀴나졸린 고리, 피라졸로퀴놀린 고리, 피롤로퀴나졸린 고리, 피롤로퀴놀린 고리, 이소인돌린-1-온 고리, 이소아자인돌린-1-온 고리, 이소플라본 고리, 벤조피란-4-온 고리, 벤즈이미다졸린-2-온 고리, 1,3-디옥소-1,3-디히드로이소인돌 고리, 2,3-디히드로-피롤로피리딘-2-온 고리, 2,3-디히드로-피롤로퀴놀린-2-온 고리, 이미다졸-2-온 고리, 벤젠 고리, 나프탈렌 고리, 옥사졸 고리, 이속사졸 고리, 이속사티아졸 고리 및 퀴나졸린-4-온 고리에서 선택되는 하나의 고리가 바람직하다. 바람직하게는 퀴놀린 고리, 피리딘 고리, 피롤로피리미딘 고리, 피리미딘 고리, 퀴나졸린 고 리, 피리도피리딘 고리, 피리도피리미딘 고리, 피라졸로피리미딘 고리, 티아졸로피리딘 고리, 푸로피리딘 고리, 티에노피리미딘 고리 등을 들 수 있다. 보다 바람직하게는 퀴놀린 고리, 피리딘 고리, 피롤로피리미딘 고리, 티에노피리미딘 고리, 피리미딘 고리, 푸로피리딘 고리 등을 들 수 있지만, 이들에 한정되는 것이 아니다.
또, Y가 5 내지 14원 복소환식기 등의 헤테로 원자를 갖는 기를 의미하는 경우, 그 헤테로 원자로부터 X나 Tg1 등의 치환기에 결합하는 경우도 당연 본 발명 중에 포함된다.
다음에, 본 발명 화합물의 제조법에 관해서 설명한다. 화학식 I이나 II로 표시되는 본 발명 화합물의 제조 방법으로서는 여러 가지 방법을 생각할 수 있으며, 통상의 유기 합성 수단을 이용하여 합성할 수 있지만, 대표적인 것으로는 예컨대 이하에 나타내는 방법에 의해 제조할 수 있다.
[대표적 제조 방법]
[제조 방법 1]
상기 식중, U는 이탈기를 의미한다. 기타 각 기호는 상기 정의와 같은 의미를 의미한다. 이탈기는 예컨대 할로겐기, 트리플루오로메탄설포닐기 등을 예로 들 수 있다. 반응에 사용되는 용매는 특별히 한정되지 않지만, 원료 물질과 용이하게 반응하지 않는 것이 바람직하고, 예컨대, 1-메틸피롤리돈, 디메틸포름아미드, 클로 르벤젠 등을 들 수 있다. 염기로서 유기 염기, 무기 염기를 가하여도 좋다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도이다.
이하, 대표적 제조 방법에 있어서 각 식중, Z, R300, R301, W, W11, R1, R2 및 Y는 상기 정의와 같은 의미를 의미하고; Xsa1는 산소 원자 또는 황 원자를 의미하고; Rsa4는 상기 정의 R2와 같은 의미를 의미하고; Rsa5는 선택적으로 치환된 C1-6 알킬기 또는 선택적으로 치환된 C1 -6 아릴기를 의미하고; 화합물(a-6)은 화합물(a-61) 또는 화합물(a-62)을 의미하고; Rsa70는 선택적으로 치환된 C1 -6 알킬기를 의미하고; G1은 선택적으로 치환된 질소 원자 또는 산소 원자를 의미하고; U는 이탈기를 의미하고; n 및 s는 각각 0에서부터 6의 정수를 의미하고; Rsa90는 니트로기 또는 아미노기를 의미하고; Rsa82는 t-부톡시카르보닐기, 벤질기 등의 아미노기의 보호기를 의미하고; Rsa1, Rsa2, Rsa3, Rsa50, Rsa60, Rsa71 및 Rsa80은 각각 독립적으로, 상기 (3)에 기재한 고리 A가 갖고 있어도 좋은 치환기로부터 선택되는 치환기와 같은 의미를 의미한다.
[제조 방법 2-1]
(각 식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(G2)의 대표적 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 A-1><공정 A-2>
아닐린 유도체(a-1)로부터 퀴놀론 유도체(a-3)로의 고리화 반응 공정이다. 테트라헤드론(Tetrahedron) 53,1743(1997) 등에서 보고되고 있는 통상의 방법을 이용하여 합성할 수 있다.
<공정 A-1>
구체적으로는 예컨대, 원하는 치환기를 갖는 아닐린 유도체(a-1)에 트리메틸오르토포르메이트 또는 트리에틸오르토포르메이트 등의 오르토 에스테르 유도체와 멜드럼산을 에탄올 등의 알콜 속에서 반응시킴으로써 화합물(a-2)을 얻을 수 있다. 반응 온도는 실온에서부터 가열 환류 온도로 행할 수 있고, 반응 시간은 10분에서부터 30시간이다.
<공정 A-2>
계속해서, 화합물(a-2)을 페닐에테르, 비페닐 등의 혼합 용매 또는 다우섬(Dawtherm A) 속에서 가열함으로써 화합물(a-3)을 얻을 수 있다. 반응 온도는 40℃에서부터 가열 환류 온도로 행할 수 있고, 반응 시간은 10분에서부터 30시간이다.
<공정 A-3>
클로르화 공정이다. 화합물(a-3)에 옥시염화인, 염화티오닐 등의 염소화제를 반응시킴으로써 화합물(a-4)을 얻을 수 있다. 반응 용매는 옥시염화인, 염화티오닐, 벤젠, 톨루엔 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도로 행할 수 있으며, 반응 시간은 10분에서부터 30시간이다.
<공정 A-4>
화합물(a-4)과 화합물(a-42)을 반응시켜 니트로체 화합물(a-5)을 얻는 공정이다. 반응 용매로서는 1-메틸피롤리돈, 디메틸포름아미드, 클로르벤젠, 2,6-루티딘 등을 이용할 수 있다. 반응은 염기를 가하더라도 좋으며, 구체적으로는 예컨대 디이소프로필에틸아민, 2,6-루티딘 등의 유기 염기 또는 탄산칼륨 등의 무기 염기 등을 이용할 수 있다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도로 행할 수 있다.
<공정 A-42>
화합물(a-4)와 화합물(a-43)을 반응시켜 아미노체 화합물(a-61)을 얻는 공정이다. 반응 용매로서는 1-메틸피롤리돈, 디메틸설폭시드 등을 이용할 수 있다. 반응에는 수소화나트륨 등의 염기를 이용할 수 있다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도로 행할 수 있다.
<공정 A-5>
니트로체 화합물(a-5)의 아미노체 화합물(a-61)로의 환원 반응 공정이다. 일반적으로 이용되는 니트로기에서 아미노기로의 환원 반응에 이용되고 있는 조건에 따라 행할 수 있다. 구체적으로는 예컨대, 철-염화암모늄, 철-염산, 또는 철-초산 등에 의한 환원, 수산화팔라듐-수소에 의한 접촉 환원 등을 들 수 있다. 반응 용매는 메탄올, 에탄올, 테트라히드로푸란, 디메틸포름아미드 등을 들 수 있고, 접촉 환원은 상압 또는 가압하에서 행할 수 있다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도로 행할 수 있다.
<공정 A-6>
아미노체 화합물(a-61)의 알킬화 공정이다. 아미노체 화합물(a-61)과 알데히드 유도체 또는 케톤 유도체를 반응시켜, 이민 형성후에 시아노수소화붕소나트륨 등의 환원제로 환원함으로써 화합물(a-62)을 얻을 수 있다.
또, 아미노체 화합물(a-61)에 염기 존재하, 산염화물 유도체 또는 산무수물을 반응시키고, 이어서 수소화리튬알루미늄 등의 환원제로 환원함으로써 화합물(a-62)을 얻을 수도 있다.
<공정 A-7>
아미노 유도체(a-61) 또는 화합물(a-62)에 카바메이트 유도체(a-81)를 반응시켜 우레아 유도체 화합물(a-10)을 얻는 공정이다. 반응 용매는 클로로포름, 톨루엔, 아세토니트릴, 디메틸포름아미드, 디메틸설폭시드 등을 이용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응은 빙냉하에서부터 가열 환류 온도로 행한 다. 반응은 수소화나트륨, 트리에틸아민, 피리딘 등의 유기 염기 화합물이나 탄산칼륨, 탄산나트륨 등의 무기 염기를 가하여 행할 수도 있다.
<공정 A-8>
아미노 유도체(a-61) 또는 화합물(a-62)에 이소시아네이트 유도체(a-82)를 반응시켜 화합물(a-7)을 얻는 공정이다. 반응 용매는 클로로포름, 톨루엔, 아세토니트릴, 디메틸포름아미드, 디메틸설폭시드 등을 이용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응은 빙냉하에서부터 가열 환류 온도로 행할 수 있다. 반응은 트리에틸아민, 피리딘 등의 유기 염기 화합물이나 탄산칼륨, 탄산나트륨 등의 무기 염기를 가하여 행할 수도 있다.
<공정 A-9>
화합물(a-7)과 화합물(a-83)을 피리딘 등의 염기 존재하에서 반응시켜 우레아 유도체(a-10)를 얻는 공정이다. 반응 용매는 디메틸설폭시드, 디메틸포름아미드, 테트라히드로푸란 등을 이용할 수 있고, 반응 시간은 10분에서부터 30시간이다. 반응 온도는 0℃에서부터 가열 환류 온도로 행할 수 있다.
<공정 A-10>
아미노체 화합물(a-61) 또는 화합물(a-62)에 페닐클로로포르메이트 등의 카바메이트화 시약(a-84)을 작용시켜 카바메이트 유도체(a-9)를 얻는 공정이다. 반응은 피리딘 등의 염기를 이용할 수 있다. 반응 용매는 디메틸설폭시드, 디메틸포름아미드, 테트라히드로푸란 등을 사용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다.
<공정 A-11>
카바메이트 유도체(a-9)에 아민 유도체(a-85)를 작용시킴으로써 우레아 유도체 화합물(a-10)을 얻는 공정이다. 반응은 트리에틸아민 등의 염기를 이용할 수 있다. 반응 용매는 디메틸설폭시드, 디메틸포름아미드 등을 용매로서 사용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반응 온도는 실온에서부터 가열 환류 온도이다.
[제조 방법 2-2]
화합물(a-10)의 다른 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 A-12>
4-클로로퀴놀린 유도체(a-4)에 우레아 구조를 부분 구조로서 갖는 페놀 유도체(a-12)를 작용시켜, 직접 한 공정에서 목적의 화합물(a-11)을 얻는 공정이다. 1-메틸피롤리돈, 디메틸포름아미드, 클로르벤젠 등을 반응 용매로서 사용할 수 있다. 적절하게 염기로서 유기 염기 예를 들면 디이소프로필에틸아민 등, 또는 무기 염기 예를 들면 탄산칼륨, 수소화나트륨 등을 가하더라도 좋다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도이다.
[제조 방법 2-3]
화합물(a-5), 화합물(a-61)의 다른 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 2A-1>
화합물(a-5)에 피리딘 유도체(2 a-1)를 반응시켜, 화합물(2a-2)을 얻는 공정이다. 반응은 탄산칼륨 등의 염기를 이용하더라도 좋다. 반응 용매는 디메틸포름아미드 등을 이용할 수 있고, 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류 온도로 행할 수 있다.
<공정 2A-2>
퀴놀론체(a-5)의 티오퀴놀론체(2a-3)으로의 변환 반응 공정이다. 반응 시약으로서, 황화나트륨, 5황화인 등의 황화 시약을 퀴놀론체(a-5)에 작용시킴으로써 티오퀴놀론체를 얻을 수 있다. 반응 용매로서, 디글림 등을 이용할 수 있다. 반응 온도는 실온에서부터 가열 환류 온도이다. 반응 시간은 10분에서부터 30시간이다.
<공정 2A-3>
티오퀴놀론체(2a-3)에 화합물(2a-4)을 반응시켜 화합물(2a-5)을 얻는 공정이 다. 반응 용매는 디메틸포름아미드 등을 이용할 수 있다. 반응 온도는 실온에서부터 가열 환류 온도이다. 반응 시간은 10분에서부터 30시간이다. 적절하게, 피리딘 등의 염기를 사용할 수 있다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 2A-4>
화합물(a-4)에 히드록시피리딘 유도체(2a-6)를 반응시킴으로써 화합물(2a-7)을 얻는 공정이다. 1-메틸피롤리돈, 디메틸포름아미드, 클로르벤젠 등을 반응 용매로서 이용할 수 있다. 적절하게 염기로서 유기 염기, 예컨대 디이소프로필에틸아민 등, 또는 무기 염기, 예컨대 탄산칼륨 등을 가하더라도 좋다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도이다.
<공정 2A-5>
화합물(2a-7)과 이민 유도체와의 팔라듐 커플링 반응에 의해 화합물(2a-8)을 얻는 반응이다. 반응은 톨루엔 등을 용매로서 사용하고, 촉매로서 팔라듐 유도체, 예컨대 트리스(디벤질리덴아세톤)디팔라듐(0)), 포스핀 유도체, 예컨대, (2,2'-비 스(디페닐포스피노)-1,1'-비나프틸)을 사용하고, 염기로서, 예컨대, t-부톡시칼륨 등을 사용할 수 있다. 반응 온도는 약 50℃에서부터 가열 환류 온도이다. 반응 시간은 약 1시간에서부터 10시간이다.
<공정 2A-6>
화합물(2a-8)로부터 아미노 유도체 화합물(2a-9)을 얻는 공정이다. 반응은 에탄올, 물 등을 사용하고, 염산 등의 산을 작용시킴으로써 행한다. 반응 온도는 0℃에서부터 약 100℃이다. 반응 시간은 10분에서부터 약 10시간이다.
<공정 2A-7>
화합물(2a-9)을 탈클로르화하여 화합물(2a-10)을 얻는 공정이다. 팔라듐탄소-수소에 의한 접촉 환원 등을 사용할 수 있다. 반응 용매는 메탄올, 에탄올, 테트라히드로푸란 등을 들 수 있고, 접촉 환원은 상압 또는 가압하에서 행할 수 있다. 염기로서, 트리에틸아민 등을 사용할 수 있다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도이다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 2A-8>
퀴놀론체 화합물(a-3)을 4-아미노알콕시퀴놀린체(2a-11)로 변환하는 반응이다. 화합물(a-3)에 N-알킬프탈이미드 유도체를 작용시키고, 히드라진 수화물 등에 의해 탈보호함으로써 목적의 화합물(2a-11)을 얻을 수 있다. 용매는 디메틸포름아미드, 테트라히드로푸란 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 염기로서, 탄산칼륨 등을 사용할 수 있다.
[제조 방법 2-4]
화합물(a-4)의 다른 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 3A-1>
에나민(3a-1)을 얻는 공정이다. 아닐린 유도체 화합물(a-1)에 디에틸 에톡시메틸렌말로네이트를 작용시킴으로써 화합물(3a-1)을 얻을 수 있다. 반응은 무용매로 진행하고, 반응 온도는 100℃ 정도가 알맞으며, 반응 시간은 30분에서 수 시간이다.
<공정 3A-2>
고리화 반응 공정이다. 화합물(3a-1)을 비페닐에테르-비페닐의 혼합 용매 중에서, 약 200℃에서부터 260℃ 정도 가열함으로써, 고리화 반응이 진행되어 목적의 화합물(3a-2)을 얻을 수 있으며, 반응 시간은 30분에서부터 10시간이다.
<공정 3A-3>
클로르화 공정이다. <공정 A-3>과 같은 식의 조작에 의해 화합물(3a-2)로부터 클로르체 화합물(3a-3)을 얻을 수 있다.
[제조 방법 3]
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(G3)의 대표적 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 B-1>
화합물(a-4)을 인돌 유도체(b-2)와 반응시켜, 화합물(b-1)을 얻는 공정이다. 반응은 상기 <공정 A-4>와 같은 조건으로 행할 수 있다.
<공정 B-2>
화합물(b-1)로부터 우레아 유도체 화합물(b-3)을 얻는 공정이다. 시약으로서 는 상기 이소시아네이트 유도체(a-82)나 상기 카바메이트 유도체(a-81)를 이용할 수 있다. 반응은 상기 <공정 A-7>, <공정 A-8> 및 <공정 A-9>와 같은 식의 조건으로 수행할 수 있다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 B-3>
인돌의 3번 위치로의 치환기의 도입 공정이다. 화합물(b-4)을 N-클로로숙신이미드, N-브로모숙신산이미드 등의 할로겐화 시약 또는, 옥시염화인이나 티오닐클로라이드와 디메틸포름아미드와의 혼합 시약을 작용시킴으로써 화합물(b-5)을 얻을 수 있다. 반응 용매는 2-프로판올, 테트라히드로푸란, 아세토니트릴, 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
[제조 방법 4-1]
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(G4-1)의 대표 적 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
화학식(G4-1)은 WO97/02266, PCT/EP96/02728, Journal of Medicinal Chemistry, 1996, Vol. 39, No.12, 2285-2292에 기재된 방법에 따라 합성할 수 있다.
<공정 C-1>
이미데이트를 합성하는 반응이다. 시아노초산에틸을 디옥산 등의 용매 속에서 염산을 작용시킴으로써 목적의 이미데이트체 화합물(c-2)을 얻을 수 있다. 반응 온도는 0℃ 부근에서부터 실온이 바람직하고, 반응 시간은 수시간에서 수일간이다.
<공정 C-2>
아미딘을 합성하는 반응이다. 화합물(c-2)을 에탄올 중에서 암모니아 가스를 작용시킴으로써 목적의 아미딘체 화합물(c-3)을 얻을 수 있다. 반응 온도는 0℃ 부근에서부터 실온이며, 반응 시간은 수시간이다.
<공정 C-3>
피롤 유도체를 합성하는 반응이다. 화합물(c-3)을 에탄올 중에서, α-할로케톤 유도체(c-31)와 반응시킴으로써, 목적의 피롤 유도체 화합물(c-4)을 얻을 수 있다. 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 수시간에서 수일간이다.
<공정 C-4>
피롤 고리의 피롤로피리미딘 고리로의 폐환(閉環) 반응이다. 화합물(c-4)에 포름아미드, 포름산을 작용시킴으로써 목적의 화합물(c-5)을 얻을 수 있다. 용매로서는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 100℃ 부근에서부터 가열 환류 온도이다. 반응 시간은 수시간에서 수일간이다.
<공정 C-5>
클로르화 공정이다. <공정 A-3>과 같은 식의 조작에 의해, 목적의 클로르체 화합물(c-6)을 얻을 수 있다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 C-6>
피롤 유도체 화합물(c-70)의 5번 위치에 치환기를 도입하는 반응이다. 화합물(c-70)에 2,6-루티딘 존재화, 화합물(c-71)을 질소 기류화, 차광 조건으로 작용 시킴으로써 목적의 화합물(c-8)을 얻을 수 있다. 반응 용매는 디클로로메탄 등을 사용할 수 있고, 반응 온도는 0℃에서부터 실온이며, 반응 시간은 1시간에서부터 30시간이다.
<공정 C-7>
(공정 C-4)과 같은 식의 조작에 의해 화합물(c-9)을 얻을 수 있다.
<공정 C-8>
(공정 A-3)과 같은 식의 조작에 의해 화합물(c-10)을 얻을 수 있다.
[제조 방법 4-2]
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(G4-2)의 대표적 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 2C-1>
클로르화 반응이다. 화합물(2c-1)에 염화티오닐을 작용시키면 목적의 화합물(2c-2)을 얻을 수 있다. 반응 용매는 염화티오닐 등을 사용할 수 있고, 반응 온도는 가열 환류 온도이며, 반응 시간은 수시간에서부터 수일이다.
<공정 2C-2>
카르복실산의 카바메이트 유도체(2 c-3)로의 전위 반응이다. 카르복실산 유도체 화합물(2c-2)에 디페닐포스포릴아지드, 트리에틸아민 존재화, tert-부탄올, 벤질알콜, 트리메틸실릴알콜 등을 작용시키면 목적의 카바메이트 유도체 화합물(2c-3)을 얻을 수 있다. 반응 용매는, tert-부탄올, 벤질알콜, 디메틸포름아미드, 톨루엔 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
<공정 2C-3>
요오드화 반응이다. 염기에 의해 피리딘의 3번 위치에 음이온을 발생시켜, 요오드를 작용시킴으로써 요오드체 화합물을 얻고, 또한 탈카바메이트 반응을 행함으로써 목적의 화합물(2c-4)을 얻을 수 있다. 요오드화의 반응 용매는 테트라히드로푸란, 디에틸에테르 등을 사용할 수 있고, 반응 온도는 -78℃에서부터 실온이며, 반응 시간은 10분에서부터 30시간이다. 염기로서, n-부틸리튬 등을 사용할 수 있다. N, N, N', N'-테트라메틸에티엔디아민 등의 염기도 적절하게 첨가할 수 있다. 탈카바메이트 반응의 반응 용매는 물, 알콜류 등을 사용할 수 있고, 산으로서, 브롬화수소산 수용액, 염산 수용액 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 1분에서부터 수시간이다.
<공정 2C-4>
<공정 A-4>과 같은 식의 조작에 의해 목적의 화합물(2c-5)을 얻을 수 있다.
<공정 2C-5>
요오드체(2c-5)와 아세틸렌 유도체와의 커플링 반응이다. 요오드체에 테트라키스(트리페닐포스핀)팔라듐 등, 요드화제1구리 등 존재화, (트리메틸)아세틸렌 등을 작용시킴으로써 목적의 화합물(2c-6)을 얻을 수 있다. 반응 용매는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
<공정 2C-6>
고리화 반응이다. 화합물(2c-6)을 요드화제1구리 존재화, 가열함으로써 목적의 고리화체 화합물(2c-7)을 얻을 수 있다. 반응 용매는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 80℃에서부터 가열 환류 온도이며, 반응 시간은 5분에서부터 10시간이다.
[제조 방법 4-3]
제조 방법 4-2 중의 화합물(2c-7)의 다른 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 2C-7>
케톤체(2c-8)의 티오케톤체(2c-90)로의 변환 반응이다. <공정 2A-2>와 같은 식의 조작에 의해 합성할 수 있다.
<공정 2C-8>
<공정 2A-3>과 같은 식의 조작에 의해 합성할 수 있다.
[제조 방법 5-1]
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(G5-1)의 대표적 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 D-1>
(공정 A-4)와 같은 식의 조작에 의해 목적의 화합물(d-2)을 얻을 수 있다.
<공정 D-2>
클로르기의 아미노화 공정이다. 2-클로로피리미딘 유도체(d-2)에 암모니아를 작용시킴으로써 목적의 아미노체 화합물(d-3)을 얻을 수 있다. 반응 용매는 에탄올, 테트라히드로푸란 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
<공정 D-3>
니트로체 화합물(d-3)의 아미노체 화합물(d-4)로의 환원 반응이다. (공정 A-5)와 같은 식의 조작에 의해 목적의 아미노체 화합물(d-4)을 얻을 수 있다.
<공정 D-4>
(공정 A-7)과 같은 식의 조작에 의해 목적의 우레아체 화합물(d-5)을 얻을 수 있다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 D-6>
(공정 A-4)와 같은 식의 조작에 의해 목적의 화합물(d-8)을 얻을 수 있다.
<공정 D-7>
탈클로르화 및 니트로기의 환원 반응 공정이다. 수산화팔라듐-수소 등의 일반적인 접촉 환원 조건에 의해 목적의 화합물(d-9)을 얻을 수 있다. 반응 용매는 메탄올, 에탄올, 테트라히드로푸란, 디메틸포름아미드 등을 들 수 있고, 접촉 환원은 상압 또는 가압하에서 행할 수 있다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도이다.
<공정 D-8>
(공정 A-7)과 같은 식의 조작에 의해 목적의 우레아체 화합물(d-10)을 얻을 수 있다.
[제조 방법 5-2]
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(G5-2)의 대표적 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 2D-1>
탈카바메이트 반응이다. 화합물(2d-1)에 산을 작용시킴으로써 목적의 아민 유도체 화합물(2d-2)을 얻을 수 있다. 용매로서, 물, 디옥산, 테트라히드로푸란, 메탄올, 에탄올 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 산으로서, 염산, 브롬화수소산, 트리플루오로초산 등을 사용할 수 있다.
<공정 2D-2>
화합물(2d-2)을 이용하여, 제조 방법 5-1 중의 [공정 D-6]∼[공정 D-8]과 같은 식으로 조작하여, 우레아 유도체(2d-3)를 얻을 수 있다.
[제조 방법 6]
(각 식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(G6-1)(G6-2)(G6-3)의 다른 제조 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 E-1>
요오드체와 에틸아크릴레이트와의 커플링 반응이다. 화합물(e-1)에, 촉매로서 팔라듐아세테이트 등, 3급 아민, 예컨대, 트리부틸아민 등의 존재화에 에틸아크릴레이트를 작용시키면 목적의 화합물(e-2)을 얻을 수 있다. 반응 용매는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 100℃에서부터 가열 환류 온도이며, 반응 시간은 5분에서부터 30시간이다.
<공정 E-2>
이중 결합의 환원, 이어서 고리화 반응과 니트로기의 환원 반응이다. 화합물(e-2)에 팔라듐탄소-수소의 조건으로 반응을 수행하면 이중 결합의 환원, 고리화 반응, 니트로기의 환원이 진행된다. 반응 용매는 메탄올, 에탄올, 테트라히드로푸란, 디메틸포름알데히드 등을 사용할 수 있고, 접촉 환원은 상압 또는 가압하에서 행할 수 있다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부터 가열 환류의 온도이다.
<공정 E-3>
광 조사에 의한 이중 결합의 이성화 및, 그 후의 고리화 반응이다. 반응 용매는 메탄올 등을 사용할 수 있고, 2'-아세토나프톤 존재화, 광 조사함으로써 목적의 화합물(e-4)을 얻을 수 있다. 반응 시간은 10분에서부터 30시간이다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 2E-1>
니트로화 반응이다. 화합물(2e-1)에 황산, 발연 질산을 작용시킴으로써 목적의 화합물(2e-2)을 얻을 수 있다. 반응 용매는 황산, 발연 질산 등을 사용할 수 있고, 반응 온도는 0℃에서부터 실온이다. 반응 시간은 10분에서부터 30시간이다.
<공정 2E-2>
니트로기의 전위 반응이다. 화합물(2e-2)에 황산을 작용시킴으로써 목적의 화합물(2e-3)을 얻을 수 있다. 반응 용매는 황산을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
<공정 2E-3>
화합물(2e-3)을 니트로기를 함유하는 원하는 구핵제(求核劑)와 1-메틸피롤리돈, 디메틸포름아미드, 클로르벤젠 등을 반응 용매로서 이용하여 구핵 치환 반응시킴으로써 목적의 니트로체 화합물(2e-4)을 얻을 수 있다. 적절한 염기로서 유기 염기 예를 들면 디이소프로필에틸아민 등, 또는 무기 염기 예를 들면 탄산칼륨 등을 가하더라도 좋다. 반응 시간은 10분에서부터 30시간이다. 반응 온도는 실온에서부 터 가열 환류의 온도이다.
<공정 2E-4>
니트로기의 아미노기로의 환원 반응이다. <A-5>와 같은 식의 조작에 의해 목적의 화합물(2e-5)을 얻을 수 있다.
<공정 2E-5>
카르복실산과 디아민체(2 e-5)에 의한 축합 반응이다. 디아민체 화합물(2e-5)에 카르복실산을 작용시킴으로써 목적의 화합물(2e-6)을 얻을 수 있다. 반응 용매는 포로인산 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 탈수제로서, 폴리인산, 오산화인 등을 이용할 수 있다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 3E-1>
저널 오브 헤테로사이클릭 케미스트리, 35권, 1313(1998)에 기재한 방법에 의해서 합성할 수 있다. α-할로케톤 유도체(3e-1)에 말로노니트릴을 작용시킴으로써 화합물(3e-2)을 합성할 수 있다. 반응 용매는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간이다. 염기로서, 디에틸아민을 사용할 수 있다.
<공정 3E-2>
푸로피리미딘 고리 구축 공정이다. 화합물(3e-2)을 포름아미드 중, 무수초산을 첨가하여, 200℃ 정도로 가열함으로써 목적의 화합물(3e-3)을 얻을 수 있다. 반응 시간은 수시간 정도이다.
<공정 3E-3>
브롬화 반응이다. 화합물(3e-3)에 디브로모메탄과 아질산이소아밀을 작용시킴으로써 목적의 브롬체 화합물(3e-4)을 얻을 수 있다. 반응 용매는 디브로모메탄 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간이다.
<공정 3E-4>
(공정 A-4)와 같은 식의 조작에 의해 화합물(3e-5)을 얻을 수 있다.
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 3E-5>
(공정 A-1)과 같은 식의 조작에 의해 화합물(3e-7)을 얻을 수 있다.
<공정 3E-6>
(공정 A-2)와 같은 식의 조작에 의해 화합물(3e-8)을 얻을 수 있다.
<공정 3E-7>
(공정 A-3)과 같은 식의 조작에 의해 화합물(3e-9)을 얻을 수 있다.
(식중, Rsa100은 선택적으로 치환된 페닐아미노기 또는 선택적으로 치환된 벤질아미노기 등의 치환기를 의미함) 저널 오브 메디시널 케미스트리(Journal of Medicinal Chemistry), 40, 3601(1997) 등에 합성 방법이 기재된 화합물.
(식중, Rsa101은 불소 원자, 선택적으로 치환된 아미노기, 선택적으로 치환된 C1 -6 알콕시기 또는 선택적으로 치환된 C2 -7 아실아미노기 등의 치환기를 의미함)저널 오브 메디시널 케미스트리(Journal of Medicinal Chemistry), 39, 1823(1996) 등에 합성 방법이 기재된 화합물.
[제조 방법 7]
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(II)의 대표적 제조 방법
(1) 식
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물(a-01)은 일반적으로 지금까지 알려져 있는 통상의 유기 반응 등을 이용하여 합성할 수 있다. 또, 화합물(a-01)으로서, 상기 제조 방법 4-1, 4-2, 5-1, 5-2, 6 중에 기재한 화합물(c-6), (c-10), (2c-4), (d-1), (d-2), (d-7), (3e-4), (2e-4), (3e-9), (4e-1), (4e-2) 또는 (4e-3) 등을 이용할 수 있다. 화합물(a-01)을 이용하여, (제조 방법 2-1) 중의 (공정 A-4)∼(공정 A-11)에 기재한 반응 조건, (제조 방법 2-2) 중에 기재한 반응 조건, (제조 방법 2-3) 중에 기재한 반응 조건 및 (제조 방법 3) 중에 기재한 반응 조건을 이용함으로써, 화합물(II)을 제조할 수 있다.
(식 중의 기호는 상기 정의와 같은 의미임)
화합물(a-03) 또는 (a-04)을, 제조 방법 2-1 중의 [A-5]∼[A-11]의 조건을 적절하게 조합하여 이용하여, 우레아 유도체(II)를 얻을 수 있다. 화합물(a-03) 또는 (a-04)으로서는 구체적으로는 예컨대 화합물(2c-7), (2c-92), (e-4), (3e-5), (e-3), (e-6) 등을 이용할 수 있다.
[제조 방법 8-1]
[화학식 Ⅰa]
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물의 대표적 합성법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 O-1>
환원적 아미노화 공정이다. 화합물(o-1)에 알데히드 유도체를 환원적으로 작용시킴으로써 목적의 화합물(o-2)을 얻을 수 있다. 반응 용매는 초산, 테트라히드로푸란, 디클로로에탄, 디클로로메탄, 메탄올 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간 이다. 환원제로서는, 나트륨트리아세톡시보로히드리드, 나트륨보로히드리드 등을 사용할 수 있다.
<공정 O-2>
카바메이트화 공정이다. 화합물(o-2)에 클로로포르메이트 유도체를 작용시킴으로써 목적의 화합물(o-3)을 얻을 수 있다. 반응 용매는 테트라히드로푸란, 디클로로메탄 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간이다. 염기로서는 피리딘, 트리에틸아민 등을 사용할 수 있다.
<공정 O-3>
니트로기의 아미노기로의 환원 공정이다. <A-5>와 같은 식의 조작에 의해 목적의 화합물(o-4)을 얻을 수 있다.
<공정 O-4>
분자내 고리화 반응 공정이다. 분자 내에 존재하는 아미노기와 카바메이트기가 반응시켜 목적의 화합물(o-5)을 얻을 수 있다. 반응 용매는 테트라히드로푸란, 디메틸포름아미드, 디메틸설폭시드, 아세토니트릴 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간이다. 염기로서는 수소화나트륨, 피리딘, 트리에틸아민 등을 사용할 수 있다.
[제조 방법 8-2]
화합물(o-5)의 다른 제조 방법
(식 중의 기호는 상기 정의와 같은 의미이다)
<공정 O-5>
니트로기의 아미노기로의 환원 공정이다. <A-5>와 같은 식의 조작에 의해 목적의 디아민체 화합물(o-6)을 얻을 수 있다.
<공정 O-6>
분자내 고리화 반응 공정이다. 분자내에 존재하는 2개의 아미노기를 포스겐, 트리포스겐, 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드, (1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트, 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드, 1,1-카르보닐디이미다졸 등을 축합제로서 이용함으로써 목적의 화합물(o-5)을 얻을 수 있다. 반응 용매는 테트라히드로푸란, 디메틸포름아미드, 디메틸설폭시드, 아세토니트릴 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간이다. 염기로서 적절한, 수소화나트륨, 피리딘, 트리에틸아민 등을 첨가할 수 있다.
[제조 방법 9]
화학식 Ⅱ
(식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물 II 중의 고리 A 상의 치환기의 변환 반응
일반적으로 이용되고 있는 산화 반응, 환원 반응, 에스테르 형성 반응, 아미드 형성 반응, 보호기 형성 반응, 탈보호 반응, 가수분해 반응, 탈수 반응, 전이 반응, 구핵 반응, 구핵 치환 반응 및 방향환 구전자(求電子) 치환 반응 등 유기 반응을 적절하게 이용함으로써 수행할 수 있다.
구체적으로는 예컨대 다음과 같이, 고리 A 상의 치환기 변환을 할 수 있다. 또, 이하의 반응을 (1) 적절하게 조합하여 행할 수 있고, (2) 최종물뿐만 아니라 중간체에 이용할 수도 있고, (3) 고리 A에 직접 결합하고 있는 치환기의 변환뿐만 아니라, 고리 A의 치환기 중에 있어서, 직접 결합하지 않는 부위의 치환기 변환에도 이용할 수 있다.
[제조 방법 10]
(식중, G1은 선택적으로 치환된 질소 원자 또는 산소 원자를 의미한다. 그 밖에 각 기호는, 상기 정의와 같은 의미임)
<공정 H-1>
에스테르체 화합물(h-1)의 알콜체 화합물(h-2)로의 환원 반응이다. 환원제로서는 리튬보로히드리드, 리튬알루미늄히드리드 등을 사용할 수 있고, 반응 용매는 디에틸에테르, 테트라히드로푸란 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
<공정 H-2>
알콜체 화합물(h-2)의 알데히드체 화합물(h-3)로의 산화 반응이다. 산화제로서는 이산화망간, 피리듐클로로크로메이트(PCC), 피리듐디크로메이트(PDC) 등을 사용할 수 있고, 반응 용매는 클로로포름, 디클로로메탄, 톨루엔 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간이다.
<공정 H-3>
환원적 탈아미노화 반응이다. 알데히드 유도체 화합물(h-3)에 아미노 유도체를 반응시켜, 이민 형성후에 시아노수소화붕소나트륨 등으로 환원함으로써 화합물(h-4)을 얻을 수 있다. 반응 용매로서, 메탄올, 테트라히드로푸란 등을 사용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다.
(식중, 각 기호는, 상기 정의와 같은 의미임)
<공정 H-4>
에스테르체 화합물(h-5)의 알콜체 화합물(h-6)로의 환원 반응이다. (공정 H-1)과 같은 식의 조작에 의해 목적의 화합물(h-6)을 합성할 수 있다.
<공정 H-5>
알콜체 화합물(h-6)의 알데히드체 화합물(h-7)로의 산화 반응이다. (공정 H-2)와 같은 식의 조작에 의해 목적의 화합물(h-7)을 합성할 수 있다.
<공정 H-6>
환원적 탈아미노화 반응이다. (공정 H-3)과 같은 식의 조작에 의해 화합물(h-7)로부터 목적의 화합물(h-8)을 얻을 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 H-7>
시아노기의 아미노메틸기로의 환원 반응 공정이다. 통상의 접촉 환원 반응(팔라듐-탄소, 수산화팔라듐-수소등)에 의해 화합물(h-9)로부터 목적의 화합물(h-10)을 얻을 수 있다. 반응 용매로서, 테트라히드로푸란, 메탄올, 에탄올 등을 사용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다. 산으로서, 트리플루오로초산, 염산 등을 첨가할 수 있다.
[제조 방법 10-2]
(식중, 각 기호는, 상기 정의와 같은 의미임)
<공정 2H-1>
화합물(2h-1) 중의 에스테르의 가수분해 반응을 행하여, 화합물(2 h-2)을 얻는 공정이다. 반응중, 수산화칼륨, 수산화나트륨, 탄산칼슘, 탄산나트륨 등의 염기를 이용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다. 용매는 물, 테트라히드로푸란 등을 이용할 수 있다.
<공정 2H-2>
카르복실산과 아민 유도체와의 축합 반응에 의한 아미드 유도체(2h-3)의 합성이다. 화합물(2h-2)과 아민 유도체를 축합제 존재화 반응시킴으로써 화합물(2h- 3)을 얻을 수 있다. 축합제로서, 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드, (1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트 등을 이용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다. 용매는 디메틸포름아미드, 테트라히드로푸란 등을 이용할 수 있다.
<공정 2H-3>
카르복실산과 알콜과의 축합 반응에 의한 에스테르체(2h-4)의 합성이다. 화합물(2h-2)과 알콜 유도체를 축합제 존재화 반응시킴으로써 화합물(2h-3)을 얻을 수 있다. 축합제로서, 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드 등을 이용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다. 용매는 디메틸포름아미드, 테트라히드로푸란 등을 이용할 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 2H-4>
화합물(2h-5) 중의 에스테르의 가수분해 반응을 행하여, 화합물(2h-6)을 얻는 공정이다. (공정 2H-1)과 같은 식의 조작에 의해 화합물(2h-5)로부터 화합물 (2h-6)을 얻을 수 있다.
<공정 2H-5>
카르복실산 유도체(2h-6)와 아미노 유도체와의 축합 반응에 의해 아미드 유도체(2h-7)를 합성하는 공정이다. (공정 2H-2)와 같은 식의 조작에 의해 화합물(2h-6)로부터 화합물(2h-7)을 얻을 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 2H-6>
카르바모일 화합물(2h-8)의 탈수 반응에 의한 니트릴 유도체(2h-9)를 얻는 공정이다. 반응 용매는 테트라히드로푸란, 디에틸에테르 등을 사용할 수 있고, 탈수 시약으로서, 염화티오닐, 트리플루오로초산무수물, 디시클로헥실카르보디이미드 등을 사용할 수 있다. 염기로서, 피리딘, 트리에틸아민 등을 사용할 수 있다. 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간 이다.
[제조 방법 10-3]
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 3H-1>
아미노기의 아실화 공정이다. 화합물(3h-1)에 산염화물, 또는 산무수물 등을 작용시킴으로써 목적의 화합물(3h-2)을 얻을 수 있다. 반응 용매는 테트라히드로푸란 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 염기로서 트리에틸아민 등을 사용할 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 3H-20>
아실화 공정이다. 화합물(3h-3)에 산염화물, 산무수물 등을 작용시킴으로써 목적의 화합물(3h-4)을 얻을 수 있다. 반응 용매는 테트라히드로푸란, 피리딘 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 염기로서 트리에틸아민, 피리딘 등을 사용할 수 있다.
<공정 3H-21>
고리화 반응이다. 반응 용매는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 100℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 염기로서, 탄산칼륨 등을 사용할 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 3H-3>
술폰아미드화 공정이다. 화합물(3h-5)에 설포닐클로라이드 유도체를 작용시킴으로써 목적의 화합물(3h-6)을 얻을 수 있다. 반응 용매는 테트라히드로푸란, 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 염기로서, 트리에틸아민, 피리딘 등을 사용할 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 3H-4>
탈벤질옥시카르보닐화 공정이다. 통상의 접촉 환원 반응(팔라듐-탄소, 수산화팔라듐-탄소와 수소 등)에 의해, 화합물(3h-7)로부터 화합물(3h-8)을 얻을 수 있다. 용매로서, 테트라히드로푸란, 메탄올, 에탄올 등을 사용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다. 산으로서, 트리플루오로초산, 염산 등을 첨가할 수 있다.
[제조 방법 11]
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 I-1>
카르복실산의 아미노 유도체(i-2)로의 전위 반응이다. 카르복실산 유도체(i-1)에 디페닐포스포릴아지드, 트리에틸아민 존재화, 벤질알콜을 작용시킴으로써, 화 합물(i-1)로부터 화합물(i-2)을 얻을 수 있다. 반응 용매는 벤질알콜, 디메틸포름아미드, 톨루엔 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
<공정 I-2>
(공정 A-4)(공정 A-5)(공정 A-7)와 같은 식의 조작에 의해, 화합물(i-2)로부터 화합물(i-3)을 얻을 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 I-3>
카르바모일기의 아미노기로의 전위 반응 공정이다. 브롬수, 수산화나트륨 등의 염기를 작용시킴으로써, 화합물(i-4)로부터 아미노체 화합물(i-5)을 얻을 수 있다. 반응 용매는 물 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 10시간이다.
[제조 방법 12-1]
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 M-1>
메틸티오기의 메틸술폰기로의 변환 반응이다. 화합물(m-1)에 과산을 작용시킴으로써 목적의 화합물(m-2)을 얻을 수 있다. 과산으로서는 3-클로로과벤조산 등을 사용할 수 있고, 반응 용매로서는 염화 메틸렌, 클로로포름 등을 사용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 실온이다.
[제조 방법 12-2]
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 2M-1>
구전자 반응에 의한 방향환으로의 치환기 도입 공정이다. 화합물(2m-1)에 구전자 시약을 반응시켜 화합물(2m-2)을 얻을 수 있다. 구전자 시약로서는 구체적으로는 예컨대 빌스마이어(Vilsmeier) 시약(디메틸포름아미드나 N-메틸포름아닐리드와 옥시염화인으로부터 조정할 수 있음), N-클로로호박산이미드, N-브로모호박산이미드, 아실클로라이드와 루이스산(예컨대, 염화알루미늄, 티타늄테트라클로라이드 등)의 조합, 식,
으로 표시되는 시약 등을 작용시킬 수 있다. 각각, 포르밀기, 클로르기, 브롬기, 아실기, 디메틸아미노메틸기 등을 도입할 수 있다. 반응 용매는 디메틸포름아미드, 아세토니트릴, 디클로로메탄, 톨루엔 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
[제조 방법 13]
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 Q-1>
화합물(q-1) 중의 수산기의 보호기의 탈보호 반응 공정이다. 반응은 벤질기로 보호된 페놀기를 탈보호하는 통상 이루어지고 있는 방법과 같은 식으로 행할 수 있다. 구체적으로는 예컨대, 시약으로서 트리플루오로초산-티오아니솔, 수산화팔라듐-수소, 산화백금-수소 등을 이용할 수 있다. 반응 용매는 트리플루오로초산, 디메틸포름아미드 등을 이용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반응 온도는 실온에서부터 가열 환류 온도로 행할 수 있다.
(식중, Rsa90은 아미노기 또는 니트로기를 의미한다. 그 밖의 각 기호는 상기 정의와 같은 의미임)
<공정 Q-2>
화합물(q-3) 중의 수산기의 보호기의 탈보호 반응 공정이다. 반응은 상기 (공정 Q-1)과 동일한 조건으로 행할 수 있다.
[제조 방법 14]
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 R-1>
화합물(r-1)에 할로겐화 알킬 유도체(r-2) 등의 구전자 시약을 반응시켜, 화합물(r-3)을 얻는 공정이다. 반응은 디메틸포름아미드, 디메틸설폭시드, 테트라히드로푸란 등을 용매로서 사용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도로 행할 수 있다. 반응은 염기를 이용하더라도 좋고, 구체적으로는 예컨대 탄산칼륨, 탄산세슘 등을 들 수 있다.
반응시키는 할로겐화 알킬 유도체(Rsa71-U)로서는 구체적으로는 예컨대 (1) 식, Rsa80S-(CH2)s-Cl(식중, s는 1-6의 정수를 의미한다. 그 밖의 기호는 상기 정의와 같은 의미임)로 표시되는 할로겐화 알킬티오 유도체, (2) 식, Br-(CH2)s-Cl(식중, s는 1-6의 정수를 의미함)로 표시되는 할로겐화 알킬 유도체, (3) 식
(식중, U는 이탈기를 의미함)로 표시되는 프로필렌옥사이드 유도체, (4) 식
(식중, U는 이탈기를 의미하여, Rsa82는 t-부톡시카르보닐기, 벤질기 등의 아미노기의 보호기를 의미하여, s는 1-6의 정수를 의미함)로 표시되는 화합물 또는 (5) C1 -6 알콕시기로 치환된 할로겐화 알킬 유도체 등을 들 수 있다.
(식중, Rsa73은 수소 원자 또는 2-(트리메틸실릴)에톡시메틸기를 의미한다. 그 밖의 각 기호는 상기 정의와 같은 의미임)
<공정 R-2>
페놀 유도체(r-4)에 작용시켜, 치환기 Rsa71를 도입하는 공정이다. (공정 R-1)과 같은 식의 조작에 의해 치환기 Rsa71를 도입할 수 있다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 R-3>
수산기의 트리플레이트화 공정이다. 화합물(r-6) 파라니트로페닐트리플레이트 등의 트리플레이트화 시약을 작용시킴으로써 목적의 화합물(r-7)을 얻을 수 있다. 반응 용매는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다. 염기로서, 탄산칼륨 등을 사용할 수 있다.
<공정 R-4>
트리플레이트기의 시아노기로의 변환 반응이다. 화합물(r-7)에 시안화아연(Zn(CN)2) 등의 시아노화 시약을 작용시킴으로써 목적의 화합물(r-8)을 얻을 수 있다. 촉매로서, 테트라키스트리페닐포스핀팔라듐 등을 사용할 수 있다. 반응 용매는 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 실온에서부터 가열 환류 온도이며, 반응 시간은 10분에서부터 30시간이다.
(식중, 각 기호는 상기 정의와 같은 의미임)
<공정 R-5>
치환기 Rsa71 중에 티오에틸기가 있는 경우의 화합물(r-3)에 3-클로로과벤조산 등의 산화제를 반응시켜 화합물(2r-2)을 얻는 공정이다. 반응 용매로서는 염화메틸렌, 클로로포름 등을 사용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 실온이다.
<공정 R-6>
치환기 Rsa71 중에 염소 원자, 브롬 원자, 요오드 원자 등의 할로겐 원자나 메탄설포닐옥시기 등의 이탈기, 또는 에폭시드기 등이 있는 경우의 화합물(r-3)에 구핵제를 반응시켜 화합물(2r-1) 또는 화합물(2r-4)을 얻는 공정이다. 구핵제로서는 구체적으로는 예컨대, 트리아졸 또는 이미다졸 등의 함질소 방향족환 유도체, 모르폴린, 피롤리딘 등의 아민 유도체, 알콜 유도체, 페놀 유도체, 티올 유도체 등의 구핵제를 반응시킬 수 있다.
반응 용매로서는 디메틸포름아미드, 테트라히드로푸란, 디메틸포름아미드 등 을 사용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이며, 염기로서 탄산칼륨, 수소화나트륨 등을 사용할 수도 있다.
<공정 R-7>
(식중, Rsa82은 t-부톡시카르보닐기, 벤질기 등의 아미노기의 보호기를 의미하며, 기타 각 기호는 상기 정의와 같은 의미임)
보호기로 보호된 아미노기가 있는 화합물(r-90) 또는 화합물(r-91)은 아미노기의 탈보호 반응을 행하고, 계속해서 탈보호된 아미노기를 알킬화할 수 있다.
(1) 아미노기의 탈보호 반응의 공정; 탈보호의 시약으로서, 트리플루오로초산, 염산 등을 사용할 수 있다. 또, 보호기가 벤질기인 경우, 통상의 접촉 환원 반응(수산화팔라듐-수소 등)에 의한 탈보호 반응도 사용할 수 있다. 용매로서, 트리플루오로초산, 메탄올, 에탄올 등을 사용할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다.
(2) 탈보호된 아미노기의 알킬화 공정; 탈보호된 아미노 유도체에 알데히드 유도체 또는 케톤 유도체를 반응시키고, 이민 형성후에 시아노수소화붕소나트륨 등의 환원제로 환원함으로써 화합물(2r-3)을 얻을 수 있다. 반응 용매로서, 메탄올, 테트라히드로푸란 등을 사용할 수 있고, 반응 시간은 10분에서부터 30시간이며, 반 응 온도는 0℃에서부터 가열 환류 온도이다.
[제조 방법 15]
(각 식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물의 다른 합성 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 P-1>
화합물(p-1)을 수소화나트륨 등의 염기 존재화, 알콜 유도체(p-2)를 반응시켜 화합물(p-3)을 얻을 수 있다. 1-메틸피롤리돈이나 N, N-디메틸포름아미드 등의 용매 속에서 반응을 하여 합성할 수 있다. 반응 시간은 10분에서부터 30시간이며, 반응 온도는 0℃에서부터 가열 환류 온도이다.
[제조 방법 16]
(각 식 중의 기호는 상기 정의와 같은 의미임)로 표시되는 화합물의 다른 합 성 방법
(각 식 중의 기호는 상기 정의와 같은 의미임)
<공정 P-2>
카바메이트 유도체를 얻는 반응이다. 아미노 유도체에 페닐클로로포르메이트를 작용시킴으로써 얻을 수 있다. 반응 용매는 테트라히드로푸란, 디메틸포름아미드 등을 사용할 수 있고, 반응 온도는 0℃에서부터 가열 환류 온도이며, 반응 시간은 30분에서부터 30시간이다.
상기 반응은 적절하게, 아미노기, 수산기나 카르복실기 등의 반응성 관능기를 보호하여 이루어진다.
아미노기의 보호기로서, 구체예를 들면, 통상, 유기 합성상 아미노기의 보호기로서 알려져 있는 기라면 어떠한 기라도 좋으며 특별히 한정되지 않지만, 예를 들면 포르밀기, 아세틸기, 클로로아세틸기, 디클로로아세틸기, 프로피오닐기, 페닐아세틸기, 페녹시아세틸기, 티에닐아세틸기 등의 치환 또는 비치환의 저급 알카노일기; 벤질옥시카르보닐기, t-부톡시카르보닐기, p-니트로벤질옥시카르보닐기 등의 치환 또는 비치환의 저급 알콕시카르보닐기; 메틸기, t-부틸기, 2,2,2-트리클로로에틸기, 트리틸기, p-메톡시벤질기, p-니트로벤질기, 디페닐메틸기, 피발로일옥시 메틸기 등의 치환 저급 알킬기; 트리메틸실릴기, t-부틸디메틸실릴기 등의 치환 실릴기; 트리메틸실릴메톡시메틸기, 트리메틸실릴에톡시메틸기, t-부틸디메틸실릴메톡시메틸기, t-부틸디메틸실릴에톡시메틸기 등의 치환 실릴알콕시알킬기; 벤질리덴기, 살리실리덴기, p-니트로벤질리덴기, m-클로르벤질리덴기, 3,5-디(t-부틸)-4-히드록시벤질리덴기, 3,5-디(t-부틸)벤질리덴기 등의 치환 또는 비치환의 벤질리덴기 등을 예로 들 수 있다.
이들 보호기의 이탈은 사용한 보호기의 종류에 따라, 가수분해, 환원 등 통상의 방법에 의해 행할 수 있다.
수산기의 보호기로서는 구체예를 들면, 통상, 유기 합성상 수산기의 보호기로서 알려져 있는 기로 보호된 수산기라면 어떠한 기라도 좋으며 특별히 한정되지 않지만, 예컨대 수산기의 보호기로서는 트리메틸실릴기, t-부틸디메틸실릴기 등의 저급 알킬실릴기; 예컨대 메톡시메틸기, 2-메톡시에톡시메틸기 등의 저급 알콕시메틸기; 예컨대 테트라히드로피라닐기; 예컨대 벤질기, p-메톡시벤질기, 2,4-디메톡시벤질기, o-니트로벤질기, p-니트로벤질기, 트리틸기 등의 아랄킬기; 예컨대 포르밀기, 아세틸기 등의 아실기; 예컨대 t-부톡시카르보닐기, 2-요오드에톡시카르보닐기, 2,2,2-트리클로로에톡시카르보닐기 등의 저급 알콕시카르보닐기; 예컨대 2-프로페닐옥시카르보닐기, 2-클로로-2-프로페닐옥시카르보닐기, 3-메톡시카르보닐-2-프로페닐옥시카르보닐기, 2-메틸-2-프로페닐옥시카르보닐기, 2-부테닐옥시카르보닐기, 신나밀옥시카르보닐기 등의 알케닐옥시카르보닐기; 예컨대 벤질옥시카르보닐기, p-메톡시벤질옥시카르보닐기, o-니트로벤질옥시카르보닐기, p-니트로벤질옥시 카르보닐기 등의 아랄킬옥시카르보닐기 등을 들 수 있다.
이들 보호기의 이탈은 사용한 보호기의 종류에 따라, 가수분해, 환원 등 통상의 방법에 의해 행할 수 있다.
카르복실기의 보호기로서는 구체예를 들면, 통상, 유기 합성상 카르복실기의 보호기로서 알려져 있는 기로 보호된 카르복실기라면 어떠한 기라도 좋으며 특별히 한정되지 않지만, 카르복실기의 보호기로서는 예컨대, 메틸기, 에틸기, 이소프로필기, t-부틸기같은 직쇄 또는 분지쇄형의 탄소수 1∼4의 저급 알킬기, 예컨대 2-요드화에틸기, 2,2,2-트리클로로에틸기와 같은 할로게노 저급 알킬기, 예컨대 메톡시메틸기, 에톡시메틸기, 이소부톡시메틸기와 같은 저급 알콕시메틸기, 부티릴옥시메틸기, 피발로일옥시메틸기와 같은 저급 지방족 아실옥시메틸기, 예컨대, 1-메톡시카르보닐옥시에틸기, 1-에톡시카르보닐옥시에틸기와 같은 1-저급 알콕시카르보닐옥시에틸기, 예컨대 벤질, p-메톡시벤질기, o-니트로벤질기, p-니트로벤질기와 같은 아랄킬기, 벤즈히드릴기 및 프탈리딜기 등을 예로 들 수 있다.
이들 보호기의 이탈은 사용한 보호기의 종류에 따라, 가수분해, 환원 등 통상의 방법에 의해 행할 수 있다.
또, 카르복실기의 에스테르로서는, 유기 합성상 통상 이용되는 것이라면 특별히 한정되지 않으며, 생리학상 허용되고, 그리고 생리적 조건하에서 가수분해되는 에스테르기를 포함하는 것으로, 구체적으로는 예컨대, 탄소수 1 내지 6의 알킬기, 탄소수 6 내지 12의 아릴기, 벤질기 등의 탄소수 7 내지 20의 아랄킬기, 탄소수 7 내지 20의 헤테로아릴알킬기, 4-메톡시벤질기, 알카노일옥시알킬기, 예컨대 아세톡시메틸기, 프로피오닐옥시메틸기 또는 피발록시메틸기, 알콕시카르보닐옥시알킬기, 예컨대 메톡시카르보닐옥시메틸기, 에톡시카르보닐옥시메틸기 또는 2-메톡시카르보닐옥시에틸기, (5-메틸-2-옥소-1,3-디옥소-4-일)-메틸기 등을 예로 들 수 있다.
본 발명에서 사용할 수 있는 용매로서는, 반응을 저해하지 않는 것으로, 통상 유기 합성상 이용되고 있는 것이라면 어떠한 용매라도 좋으며 특별히 한정되지 않지만, 예컨대, 메탄올, 에탄올, 프로판올, 부탄올 등의 저급 알콜류, 에틸렌글리콜, 글리세린 등의 폴리알콜류, 아세톤, 메틸에틸케톤, 디에틸케톤, 시클로헥사논 등의 케톤류, 디에틸에테르, 이소프로필에테르, 테트라히드로푸란, 디옥산, 2-메톡시에탄올, 1,2-디메톡시에탄 등의 에테르류, 아세토니트릴, 프로피오니트릴 등의 니트릴류, 초산메틸, 초산에틸, 초산이소프로필, 초산부틸, 프탈산디에틸 등의 에스테르류, 디클로로메탄, 클로로포름, 사염화탄소, 1,2-디클로로에탄, 트리클로로에틸렌, 테트라클로로에틸렌 등의 할로겐화 탄화수소류, 벤젠, 톨루엔, 크실렌, 모노 클로르벤젠, 니트로벤젠, 인덴, 피리딘, 퀴놀린, 코리딘, 페놀 등의 방향족류, 펜탄, 시클로헥산, 헥산, 헵탄, 옥탄, 이소옥탄, 석유벤진, 석유에테르 등의 탄화수소류, 에탄올아민, 디에틸아민, 트리에틸아민, 피롤리딘, 피페리딘, 피페라진, 모르폴린, 아닐린, 디메틸아닐린, 벤질아민, 톨루이딘 등의 아민류, 포름아미드, N-메틸피롤리돈, N,N-디메틸이미다졸론, N,N-디메틸아세트아미드, N,N-디메틸포름아미드 등의 아미드류, 헥사메틸인산트리아미드, 헥사메틸아인산트리아미드 등의 인산아미드류, 물, 기타 일반적으로 사용되는 용매 등의 일종 또는 이종 이상의 혼 합 용매를 예로 들 수 있고, 그 혼합비는 특별히 한정되지 않는다.
염기로서의 구체예를 들면, 통상 유기 합성상 염기로서 알려져 있는 것이라면 어떠한 것이라도 좋으며 특별히 한정되지 않지만, 예컨대 탄산나트륨, 탄산수소나트륨, 탄산칼륨, 수소화나트륨, 수소화칼륨, t-부톡시칼륨, 피리딘, 디메틸아미노피리딘, 트리메틸아민, 트리에틸아민, N,N-디이소프로필에틸아민, N-메틸모르폴린, N-메틸피롤리딘, N-메틸피페리딘, N,N-디메틸아닐린, 1,8-디아자비시클로[5,4,0]운데카-7-엔(DBU), 피리딘, 4-디메틸아미노피리딘, 피콜린, 루티딘, 퀴놀린, 이소퀴놀린, 수산화나트륨, 수산화칼륨, 수산화리튬, 부틸리튬, 나트륨메틸레이트, 칼륨메틸레이트, 나트륨에틸레이트 등의 나트륨 또는 칼륨알코올레이트 등을 들 수 있다.
할로겐화제로서의 구체예를 들면, 포스겐, 디포스겐(포스겐2량체), 트리포스겐(포스겐3량체), 염화티오닐, 브롬화티오닐, 삼염화인, 삼브롬화인, 옥시염화인, 오염화인, 트리클로로메틸·클로로프로메이트, 염화옥자릴이나, 산아미드 또는 인산아미드에 이들 할로겐화제를 작용시켜 얻어지는 빌스마이어 시약 등, 통상 산할로겐화물의 합성에 이용되고 있는 할로겐화제라면, 어느 것이나 이용할 수 있다.
환원제로서는, 통상 유기 합성에 이용되고 있는 것이라면 좋으며, 특별히 한정되지 않지만, 예컨대 NaBH4, LiBH4, Zn(BH4)2, Me4NBH(OAc)3, NaBH3CN, 셀렉트리드(Selectride), 과수소화물(Super Hydride ;LiB HEt3), LiAlH4, DIBAL, LiAlH(t-BuO)3, Red-al, binap 등의 외에, 백금, 팔라듐, 로듐, 루테늄, 니켈 등의 접촉 수 소 첨가 촉매 등을 들 수 있다.
이상의 반응 종료후, 원하는 바에 따라 통상의 처리법에 의해서, 예컨대 실리카겔 또는 흡착 수지 등을 이용하는 컬럼 크로마토그래피나 적당한 용매로부터 재결정함으로써 정제하는 것이 가능하다.
본 명세서에 있어서 「약리학적으로 허용할 수 있는 염」으로서는, 특별히 종류는 한정되지 않지만, 예를 들면 염산염, 황산염, 탄산염, 중탄산염, 브롬화수소산염, 요오드화수소산염 등의 무기산의 부가염; 초산염, 말레인산염, 젖산염, 타르타르산염, 트리플루오로초산염 등의 유기카르복실산의 부가염; 메탄술폰산염, 히드록시메탄술폰산염, 히드록시에탄술폰산염, 벤젠술폰산염, 톨루엔술폰산염, 타우린염 등의 유기 술폰산의 부가염; 트리메틸아민염, 트리에틸아민염, 피리딘염, 프로카인염, 피콜린염, 디시클로헥실아민염, N,N'-디벤질에틸렌디아민염, N-메틸글루카민염, 디에탄올아민염, 트리에탄올아민염, 트리스(히드록시메틸아미노)메탄염, 페네틸벤질아민염 등의 아민의 부가염; 아르기닌염, 리신염, 세린염, 글리신염, 아스파라긴산염, 글루타민산염 등의 아미노산의 부가염 등을 예로 들 수 있다.
본 발명에 따른 의약의 투여량은 증상의 정도, 연령, 성별, 체중, 투여 형태, 질환의 종류 등에 따라 다르지만, 통상 성인 1일당 100 ㎍∼10 g이며, 1회∼수회에 나눠 투여한다.
본 발명에 따른 의약의 투여 형태는 특별히 한정되지 않으며, 통상 이용되는 방법에 의해 경구 또는 비경구적으로 투여할 수 있다.
이들 제제화에는 통상 이용되는 부형제, 결합제, 활택제, 착색제, 교미교취 제 등 및 필요에 따라 안정화제, 유화제, 흡수 촉진제, 계면 활성제 등을 사용할 수 있으며, 일반적으로 의약품 제제의 원료로서 이용되는 성분을 배합하여 통상의 방법에 의해 제제화된다.
이들 성분으로서는 예컨대, 동식물유(대두유, 우지, 합성 글리세라이드 등), 탄화수소(유동 파라핀, 스쿠알렌, 고형 파라핀 등), 에스테르유(미리스틴산옥틸도데실, 미리스틴산이소프로필 등), 고급 알콜(세트스테아릴알콜, 베헤닐알콜 등), 실리콘 수지, 실리콘유, 계면 활성제(폴리옥시에틸렌지방산에스테르, 소르비탄지방산에스테르, 글리세린지방산에스테르, 폴리옥시에틸렌소르비탄지방산에스테르, 폴리옥시에틸렌 경화 피마자유, 폴리옥시에틸렌폴리옥시프로필렌 블록 코폴리머 등), 수용성 고분자(히드록시에틸셀룰로오스, 폴리아크릴산, 카르복시비닐 폴리머, 폴리에틸렌글리콜, 폴리비닐피롤리돈, 메틸셀룰로오스 등), 알콜(에탄올, 이소프로판올 등), 다가 알콜(글리세린, 프로필렌글리콜, 디프로필렌글리콜, 소르비톨 등), 당(글루코오스, 자당 등), 무기 분체(무수규산, 규산알루미늄마그네슘, 규산알루미늄 등), 정제수 등을 들 수 있다. pH 조제를 위해서는 무기산(염산, 인산 등), 무기산의 알칼리 금속염(인산나트륨 등), 무기 염기(수산화나트륨 등), 유기산(저급 지방산, 시트르산, 젖산 등), 유기산의 알칼리 금속염(시트르산나트륨, 젖산나트륨 등), 유기 염기(아르기닌, 에탄올아민 등) 등을 이용할 수 있다. 또, 필요에 따라서, 방부제, 항산화제 등을 첨가할 수 있다.
본 발명에 의한 화합물은 시험관내에 있어서, 1) 혈관 신생 인자 혼합액에 의해서 유도되는 혈관 내피 세포의 침윤적 관강 형성, 2) 단독의 혈관 신생 인자에 의해서 특이적으로 유도되는 혈관 내피 세포의 관강 형성, 3) 여러 가지 혈관 신생 인자의 수용체 키나제를 강력히 억제한다. 또한 이들 작용을 갖는 화합물 군 중에 암 세포의 증식을 억제하는 화합물도 알아냈다. 내피 세포의 침윤·관강 형성은 혈관 신생에 있어서의 중요한 프로세스이며, 그 저해 작용을 갖는 화합물은 혈관 신생 억제 작용을 갖는다. 더구나, 생체에 있어서의 혈관 신생은 단독의 혈관 신생 인자가 아니라 복수의 혈관 신생 인자의 상가(相加)·상승적인 작용에 의해 진행되는 것이 알려져 있다((1) Koolwijk P, van Erck MGM, de Vree WJA, Vermeer MA, Weich HA, Hane maaijer R, van Hinsbergh VWM. Cooperative effect of TNF-alpha, bFGF and VEGF on the formation of tubular structures of human microvascular endothelial cells in a fibrin matrix. Role of urokinase activity. J. Cell Biol. 1996, 132, P 1177-1188.; (2) Tallquist MD, Soriano P, Klinghoffer RA. Growth factor signaling pathways in vascular development. Oncogene 1999, 18, P 7917-7932.). 따라서, 암 세포 등에 의해 생산되는 복수의 혈관 신생 인자에 의해 유도되는 관강 형성을 억제하는 본 발명 화합물은 생체에 있어서 강력한 혈관 신생 저해 작용을 나타내는 것이 기대되어, 혈관 신생 저해제로서 매우 유용하다.
본 발명에 따른 화합물의 생화학적 활성 및 의약으로서의 작용 효과(혈관 신생 저해 활성, 항종양 활성 등)은 이하의 방법에 의해 평가할 수 있다.
한편, 이하는 약리 시험예에서 사용되는 약호의 일람을 나타낸다.
<약호 일람>
DNA(deoxyribonucleic acid, 데옥시리보핵산)
VEGFR2(vascular endothelial growth factor receptor2, 혈관 내피 증식 인자 수용체2)
human placenta(인간 태반)
Hepes(N-[2-Hydroxyethyl]piperazine-N'-[2-ethanesulfonic acid], 헤페스(완충액))
MgCl2(Magnesium Chloride, 염화마그네슘)
MnCl2(Manganese Chloride, 염화망간)
Na3VO4(Sodium Orthovanadate(V), 오르토바나딘(V)산나트륨)
ATP(Adenosine 5'-Triphosphate, 아데노신5'-삼인산)
EDTA(Ethylenediaminetetraacetic acid, 에틸렌디아민사초산)
HTRF(Homogenous Time-Resolved Fluorescence, 시간 분해 형광)
FGFR1(Fibroblast growth factor receptor1, 선유아세포 증식 인자 수용체1)
PDGFRβ(Platelet derived growth factor receptor β, 혈소판 유래 증식 인자 수용체β)
HGFR(Hepatocyte growth factor receptor, 간세포 증식 인자 수용체)
*EGFR(Epidermal growth factor receptor, 상피 증식 인자 수용체)
Tris(Tris(hydroxymethyl) aminomethane, 트리스(완충액))
NaCl(Sodium Chrolide, 염화나트륨)
BSA(Bovine Serum Albumin, 소혈청 알부민)
HRP(Horseradish peroxidase, 호스라디쉬 퍼옥시다아제)
EGTA(N,N,N',N'-Tetraacetic acid, N,N,N',N'-사초산)
SDS(Sodium Dodecylsulfate, 도데실황산나트륨)
NP-40(Nonidet P-40, 노니데트 P-40)
PCR : 폴리머라제 chain reaction, 폴리머라제 연쇄 반응
RT-PCR : reverse transcription-폴리머라제 chain reaction, 역전사 폴리머라제 연쇄 반응
RNA : ribonucleic acid, 리보핵산
cDNA : complementary DNA, 상보적 DNA
cRNA : complementary RNA, 상보적 RNA
dNTP : dATP, dCTP, dGTP, dTTP로 이루어진 혼합물
UTP : Uridine 5'-triphosphate, 우리딘 5'-삼인산
CTP : Cytidine 5'-triphosphate, 시티딘 5'-삼인산
dATP : 2'-Deoxyadenosine 5'-triphosphate, 2'-데옥시아데노신 5'-삼인산
dCTP : 2'-Deoxycytidine 5'-triphosphate, 2'-데옥시시티딘 5'-삼인산
dGTP : 2'-Deoxyguanosine 5'-triphosphate, 2'-데옥시구아노신 5'-삼인산
dUTP : 2'-Deoxyuridine 5'-triphosphate, 2'-데옥시우리딘 5'-삼인산
GAPDH : 글리세르알데히드 3-포스페이트 디하이드로게나제(glyceraldehyde 3-phosphate dehydrogenease)
FBS : Fetal bovine serum, 소태아 혈청
PBS : Phosphate buffered saline, 인산 완충 생리 식염수
MTT : (3-[4,5-Dimethlythiazol2-yl]-2,5-diphenyltetrazolium bromide; Thiazolyl blue) (3-[4,5-디메틸티아졸-2-일]-2,5-디페닐테트라졸륨 브로마이드 ; 티아졸릴 블루)
DMSO : Dimethyl sulfoxide, 디메틸설폭시드
PDGF : Platelet derived growth factor, 혈소판 유래 증식 인자
EGF : Epidermal growth factor, 상피 증식 인자
FGF2 : Fibroblast growth factor2, 섬유아세포 증식 인자2
VEGF : Vascular endothelial growth factor, 혈관 내피 증식 인자
HGF : Hepatocyte growth factor, 간 세포 증식 인자
TNF-α : Tumor Necrosis factor alpha, 종양 괴사 인자 알파
FCS : Fetal Bovine Serum, 소 태아 혈청
EGM-2 : Endothelial Cell Growth Medium-2, 내피 세포 증식 배지
약리 시험예 1 : 혈관 신생 인자 혼합물 자극에 의한 혈관 내피 세포의 침윤성 관강 형성(invasive tube formation)에 대한 저해 작용
인간 제대정맥 내피 세포(HUVEC)는 보고되어 있는 방법(신생화학실험 강좌 “세포배양기술”, p.197-202)에 따라서 단리하여, 5% CO2 인큐베이터 중(37℃)에 있어서 EGM-2 배지(크로네틱스사로부터 구입)를 이용하여 융합상태(융합상태)가 될 때까지 배양했다. Transwell(코스타사로부터 구입) 배양 플레이트의 내부 웰에 0.4 ml의 우시피브리노젠(시그마사로부터 구입)을 가하고 0.7 units/ml units/ml의 트롬빈(시그마사로부터 구입)으로 굳게 했다. HUVEC를 트립신, EDTA를 이용하여 회수한 후, 내피 세포 배양용 무혈청 배지(Human Endothelial Serum Free Medium Basal Growth Medium, SFM라 약칭함, GIBCO BRL사로부터 구입)에 현탁하고, 이 세포 현탁액 0.4 ml(1.4 ×105개)를 굳힌 피브린겔 위에 접종하여, 약 4시간 동안 5% CO2 인큐베이터 중(37℃)에서 배양했다. 4시간후, Transwell의 외부 챔버에 혈관 신생인자의 혼합물{10 ng/ml EGF(GIBCO BRL사로부터 구입), 30 ng/ml FGF2(GIBCO BRL사로부터 구입), 75 ng/ml VEGF(와코쥰야쿠사로부터 구입), 50 ng/ml HGF(R&D사로부터 구입), 7.5 ng/ml TNF-α(겐자임사로부터 구입)[각 혈관 신생 인자의 농도는 이용한 HUVEC의 로트에 따라 다소 변함]}와 희석시킨 피검 물질을 포함하는 1.5 ml의 SFM 용액을 가하여 5% CO2 인큐베이터 중(37℃)에서 배양했다. 피검 물질 첨가후, 2일째 및 4일째에 새롭게 조제한 혈관 신생 인자의 혼합물과 피검 물질을 포함하는 1.5 ml의 SFM 용액으로 교환했다. 피검 물질 첨가 개시일부터 6일째에 inner well의 배양 상청을 흡인 제거한 후, PBS에 용해한 3.3 mg/ml MTT(시그마사로부터 구입) 용액 0.4 ml를 가하여 약 1시간 5% CO2 인큐베이터(37℃) 속에서 배양했다. MTT에 의해서 염색된 피브린겔 내에 형성되는 관강(tube)의 수를 현미경 관찰에 의해 스코어화했다. 즉, 피검 물질 비존재하에서의 관강의 수를 +++, 관강이 전혀 형성되어 있지 않은 때의 수를 -로 하여, 피검 물질을 작용시켰을 때의 관강의 수를 +++, ++, +, +/-, -의 5단계로 스코어화함으로써 피검 물질의 저해 작용의 세기를 평가했다.
약리 시험예 2 : 혈관 신생 인자 자극에 의한 혈관 내피 세포의 관강 형성(sandwich tube formation)에 대한 저해 작용
인간 제대정맥 내피 세포(HUVEC)는 약리 시험예 1과 같은 식의 방법에 따라서 단리하여, 5% CO2 인큐베이터 중(37℃)에 있어서 EGM-2 배지(크로네틱스사로부터 구입)을 이용하여 융합상태가 될 때까지 배양했다. 콜라겐:5xRPMI1640:재구성용 완충액(이상, 니쓰타젤라틴으로부터 구입)의 7:2:1의 빙냉 혼합액을, 24웰 플레이트의 각 웰에 0.4 ml 씩 나눠 부은 후, 5% CO2 인큐베이터 중(37℃)에서 40분간 정치하여 겔화시켰다. HUVEC를 트립신, EDTA를 이용하여 회수한 후, 각 웰에 혈관 신생 인자인 20 ng/ml FGF2(GIBCO BRL사로부터 구입)으로 10 ng/ml EGF(GIBCO BRL사로부터 구입), 또는 25 ng/ml VEGF(와코쥰야쿠사로부터 구입)과 10 ng/ml EGF, 또는 30 ng/ml HGF(R&D사로부터 구입)과 10 ng/ml EGF를 가한 내피 세포 배양용 무혈청 배지(SFM, 기부코사로부터 구입)에 의해 HUVEC를 현탁하고, 이 세포 현탁액을 0.4 ml(세포수는 사용하는 HUVEC의 로트에 따라 다소 다르지만, 1∼1.2 ×105개의 세포를 이용했다)씩 가하여, 5% CO2 인큐베이터 중(37℃)에서 밤새 배양했다. 다음날, 상층의 배지를 흡인 제거한 후, 콜라겐:5xRPMI1640:재구성용 완충액(이상, 니쓰타젤라틴사로부터 구입)의 7:2:1의 빙냉 혼합액을 0.4 ml씩 중층하여, 5% CO2 인큐베이터 중(37℃)에서 4시간 정치하여 겔화시켰다. 상층에 상기한 각 혈관 신생 인자와 희석시킨 피검 물질을 포함하는 SFM의 용액 1.5 ml를 가하여 5% CO2 인큐베이터 중(37℃)에서 배양했다. 피검 물질 첨가후 4일째에 각 웰의 배양 상청을 흡인 제거한 후, PBS에 용해한 3.3 mg/ml MTT(시그마사로부터 구입) 용액 0.4 ml를 각 웰에 가하여 5% CO2 인큐베이터 중(37℃)에서 약 2시간 배양했다. 각 웰의 콜라겐 겔 내에 형성된 관강(tube)이 MTT에 의해 염색되고, 그 관강상을 컴퓨터(맥킨토시)에 취득하여, 관강의 전체 길이를 화상 해석 소프트 「Mac Scope」(미타니쇼지로부터 구입)에 의해 구했다. 피검 물질을 첨가하지 않은 웰 내에 형성된 관강의 전체 길이에 대한, 피검 물질을 첨가한 웰 내에 형성된 관강의 전체 길이의 비를 % 표시로 구하여, 이 비의 값으로부터 각 피검 물질이 관강의 형성을 50% 저해하는 데 필요한 농도(IC50)를 구했다.
약리
시험예
3 :
수용체형 티로신
키나아제
활성에 대한
저해능의
측정
이 분석법은 피검 물질의 티로신 키나아제 활성을 저해하는 능력을 결정한다. VEGFR2의 세포질 도메인을 암호화하는 DNA는 전유전자 합성(Edwards M, International Biotechnology Lab 5(3), 19-25, 1987) 또는 클로닝에 의해 얻어진다. 이어서, 이들은 적절한 발현계에 있어서 발현됨으로써, 티로신 키나아제 활성을 갖는 폴리펩티드를 얻을 수 있다. 예컨대, 곤충 세포(insect cell)에 있어서 조직 전환 단백질의 발현에 의해 얻어진 VEGFR2의 세포질 도메인이, 고유의 티로신 키나아제 활성을 보이는 것이 발견되었다. VEGFR2(Genbank 취득 번호 L04947)의 경우, 세포질 도메인을 암호화하는 1.7 kb의 DNA 단편이며, 리신 791에서부터 시작하며, 또한 종지 코돈을 포함하고, Terman 등(Oncogene, 6(9), 1677-1683, 1991)에 기재되어 있는 DNA 단편을, human placental cDNA library(클론테크사로부터 구입)로부터 단리하고, 그리고 바큐로바이러스 트랜스플레이스 벡터(pBlueBacHis(GIBCO BRL사로부터 구입))에 클로닝했다. 이 조직 전환 구축물을 곤충세포(스폰도프테아 프루가페르다 ; Spondoptea frugiperda9(Sf9))에 형질감염하여, 조직 전환 바큐로 바이러스를 조제한 (조직 전환 바큐로 바이러스의 조제 및 사용은 표준 텍스트(Bac-To-Bac Baculovirus Expression System(GIBCO BRL사))에 찾아볼 수 있음). 다른 티로신 키나아제에 관해 분석법에 있어서의 사용을 위해, 리신 398로부터 시작하는 세포질 단편(FGFR1, Genbank 취득 번호 X52833), 리신 558로부터 시작하는 세포질 단편(PDGFRβ, Genbank 취득 번호 M21616) 또는 리신 974로부터 시작하는 세포질 단편(HGFR, Genbank 취득 번호 J02958)는 같은 방법으로 클로닝 및 발현될 수 있다. EGFR는 시그마사(제품 번호 E-2645)로부터 구입했다.
VEGFR2의 티로신 키나아제 발현을 위해, Sf9 세포를 VEGFR2 조직 전환 바이러스에 의해서 감염시키고, 그리고 48시간후에 수집했다. 수집한 세포를, 빙냉한 인산 완충화 생리식염수(PBS)로 세척하고, 이어서 빙냉한 용해 완충액(50 mM Tris-HCl(pH8.5), 5 mM 2-머캅토에탄올, 100 mM KCl, 1 mM 페닐메틸설포닐플루오라이드), 1%(v/v) NP-40)를 1.5 ×108개의 세포당 20 ml를 사용하여 재현탁했다. 현탁액을 4℃에서 12000 rpm에서 30분간 원심 분리하여, 상청을 얻었다.
이 상청을 완충액 A{20 mM Tris-HCl(pH8.5), 5 mM 2-머캅토에탄올, 500 mM KCl, 20 mM 이미다졸, 10%(v/v)글리세롤}로 평형화한 Ni-NTA 아가로스 컬럼(3 ml, 키아겐사로부터 구입)에 첨가했다. 이 컬럼을 완충액 A에서 30 ml, 계속해서 완충액 B{20 mM Tris-HCl(pH8.5), 5 mM 2-머캅토에탄올, 1 M KCl, 10%(v/v)글리세롤}로 6 ml, 또한 완충액 A 6 ml로 세척했다. 세척후, 완충액 C{20 mM Tris-HCl(pH8.5), 5 mM 2-머캅토에탄올, 100 mM KCl, 100 mM 이미다졸, 10%(v/v)글리세롤} 6 ml로 용출시켰다. 이 용출액을 투석막(Spectrum Laboratories사로부터 구입)에 넣고, 투석 버퍼{20 mM Tris-HCl(pH7.5), 10%(v/v)글리세롤, 1 mM 디티오스레이톨, 0.1 mM Na3VO4, 0.1 mM EGTA}로 투석했다. 투석후, SDS 전기 영동에 제공하여, 쿠마지 브릴리언트 블루 염색에 있어서 분자량 약 100 kDa으로 검출되는 재조합 단백질(His6-VEGFR2, N말에 히스티딘 6개를 융합시킨 VEGFR2의 세포질 도메인)을, BSA(소혈청 알부민, 시그마사로부터 구입)을 표준 물질로 하여 단백 정량을 실시한 후, 사용할 때까지 -80℃에 보존했다. FGFR1의 세포질 도메인, PDGFRβ의 세포질 도메인 또는 HGFR의 세포질 도메인에 관해서도 같은 방법을 이용하여, 각각의 N말에 히스티딘 6개를 융합시킨 재조합 단백질(His6-FGFR1, His6-PDGFRβ 또는 His6-HGFR)을 얻었다.
티로신 키나아제 반응은 다음과 같이 행했다. 예컨대 VEGFR2의 경우, 96웰 둥근 바닥 플레이트(NUNC사, 제품 번호 163320)의 각 웰에, 키나아제 반응액{200 mM Hepes(pH7.4), 80 mM MgCl2, 16 mM MnCl2, 2 mM Na3VO4} 10 ㎕, 비오틴 결합 폴리(Glu4 : Tyr1)(biotin-poly(GT), 시아이에스다이아그노스티크사로부터 구입) 250 ng(증류수로 15배 희석시킨 것 6 ㎕), His6-VEGFR2 15 ng(0.4% BSA 용액으로 240배 희석시킨 것 10㎕) 및 디메틸설폭시드에 용해시킨 피검 물질(0.1% BSA 용액으로 100배 희석시킨 것을 4 ㎕)을 첨가하여 30 ㎕로 했다. 이어서, 4 μM ATP(증류수로 희석)을 10 ㎕ 첨가하여 30℃에서 10분간 항온처리후, 500 mM EDTA(pH8.0)을 10 ㎕ 첨가했다.
티로신인산화 비오틴-폴리(GT)는 균일 시간-해상도 형광법(Homogenous Time-Resolved Fluorescence ; HTRF)을 이용하여 측정했다(Analytical Biochemistry, 269, 94-104, 1999). 즉, 상기 키나아제 반응 용액을 96웰 흑색 하프 플레이트(코스타사, 제품 번호 3694)로 옮겨, 유로피움(europium) 크리프테이트를 표지한 항포스포티로신 항체(Eu(K)-PY20, 시아이에스다이아그노스티크사로부터 구입) 7.5 ng(20 mM Hepes(pH7.0), 0.5 M KF, 0.1% BSA 용액으로 250배 희석시킨 것 25 ㎕) 및 XL665을 표지한 스트렙타비딘(XL665-SA, 시아이에스다이아그노스티크사로부터 구입) 250 ng(20 mM Hepes(pH7.0), 0.5 M KF, 0.1% BSA 용액으로 62.5배 희석시킨 것을 25 ㎕)을 첨가하여, 실온에서 30분간 방치후, 디스커버리 HTRF 마이크로 플레이트 분석기(팩커드사 제조)로, 여기 파장 337 nm 조사시의 665 nm 및 620 nm의 형광 강도를 측정했다. Biotin-poly(GT)의 티로신 인산화율은 시아이에스다이아그노스티크사의 HTRF 표준 실험법 텍스트에 기재되어 있는 deltaF% 값으로 나타내어진다. 피검 물질 비존재하에서의 His6-VEGFR2 첨가에 의한 deltaF% 값을 100%, 피검 물질 및 His6-VEGFR2 비존재하에서의 deltaF% 값을 0%로하여, 피검 물질 존재하에서의 deltaF% 값의 비율(%)을 구했다. 이 비율(%)에 의해 VEGFR2 키나아제 활성을 50% 저해하는 데 필요한 피검 물질의 농도(IC50)를 산출했다.
FGFR1, EGFR 또는 HGFR 키나아제 활성에 대한 저해능의 측정은 각각 His6-FGFR1을 15 ng, EGFR를 23 ng 또는 His6-HGFR를 30 ng 이용하여, 상술한 티로신 키나아제 반응 및 HTRF법을 이용했다. PDGFRβ 키나아제 활성에 대한 저해능의 측정은 His6-PDGFRβ을 50 ng 이용하여, 상술한 티로신 키나아제 반응을 행한 후, 이하의 방법으로 티로신 인산화 biotin-poly(GT)를 검출했다.
즉, 키나아제 반응액을 96-웰 스트렙타비딘코팅된 플레이트(PIERCE사, 제품 번호 15129)에 첨가하여, 실온에서 30분간 항온처리했다. 세척액{20 mM Tris-HCl(pH7.6), 137 mM NaCl, 0.05% Tween-20, 0.1% BSA} 150 ㎕로 3회 세척하고, 항포스포티로신(PY20)-HRP 접합체(Transduction Laboratories사, 제조 번호 P-11625) 70 ㎕{20 mM Tris-HCl(pH7.6), 137 mM NaCl, 0.05% Tween-20,1% BSA로 2000배로 희석}을 첨가하여, 실온에서 1시간 항온처리했다. 항온처리후, 세척액 150 ㎕로 3회 세척하고, TMB 막 퍼옥시다제 기질(프나코시사, 제조 번호 50-5077-03)을 100 ㎕ 첨가하여 반응을 시작했다. 실온에서 10분 방치후, 1 M 인산을 100 ㎕ 첨가하여 반응을 멈추고, 마이크로 플레이트 리더(BIO KINETICS READER EL304, BIO-TEK INSTRUMENTS사 제조)에 의해 450 nm의 흡광도를 측정했다. 피검 물질을 첨가하지 않고서 His6-PDGFRβ를 첨가한 경우의 흡광도를 100%, 피검 물질 및 His6-PDGFRβ을 첨가하지 않는 경우의 흡광도를 0%로 하여, 피검 물질 존재하에서의 흡광도율을 구했다. 이 흡광도율에 의해 PDGFRβ키나아제 활성을 50% 저해하는 데 필요한 피검 물질의 농도(IC50)를 산출했다.
약리
시험예
4 :
암 세포 및 정상 세포의 세포 증식에 대한 저해 작용
암 세포(예컨대 인간 췌장암 세포 KP-4) 또는 정상 세포(예컨대 래트 소장 상피 세포 IEC-18)를 3∼4일마다 10% FBS를 포함하는 RPMI1640 배지(닛수이세이야쿠로부터 구입)로 계대 배양하여, 증식기의 세포를 사용했다. 트립신-EDTA를 이용하여 세포를 회수한 후, 세포수를 계측하여(KP-4의 경우는 2 ×103개/well, IEC18의 경우는 8 ×102개/well이 되도록) 10% FBS를 포함하는 RPMI1640 배지로 희석시킨 0.1 ml의 세포 현탁액을 세포 배양용 96웰 플레이트에 살포하였다. 밤새 5% CO2 인큐베이터 중(37℃)에서 배양한 후, 10% FBS를 포함하는 RPMI1640 배지에 희석시킨 피검 물질의 용액 0.1 ml를 첨가하고 또 5% CO2 인큐베이터 중(37℃)에서 배양했다. 피검 물질 첨가후 3일째에 PBS에 용해한 3.3 mg/ml MTT(시그마사로부터 구입) 용액 0.05 ml를 가하여, 5% CO2 인큐베이터 중(37℃)에서 약 2시간 배양했다. 배양 상청을 흡인 제거하여 각 웰에 생성한 포르마잔을 DMSO에 용해한 후, 측정 파장을 540 nm, 대조 파장을 660 nm로 하여, 각 웰의 흡광도를 플레이트 리더 MTP-32(코로나 전기)를 이용하여 측정했다. 피검 물질을 첨가하지 않은 웰의 흡광도에 대한, 피검 물질을 첨가한 웰의 흡광도의 비를 % 표시로 구하여, 이 비의 값에서 세포 증식을 50% 저해하는 데에 필요한 피검 물질의 농도(IC50)를 구했다.
약리
시험예
5 :
L6
(
래트
근아세포
)의
PDGF
의존성의 증식에 대한 작용
L6(래트 근아세포)를 3∼4일마다 10% FBS를 포함하는 D-MEM 배지(닛수이세이야쿠로부터 구입)로 계대 배양하여, 증식기의 세포를 사용했다. 트립신-EDTA를 이용하여 세포를 회수하고, 10% FBS를 포함하지 않는 D-MEM 배지로 1회 세척한 후, 세포수를 계측했다. Type-I 콜라겐을 코팅한 조직 배양용 96웰 플레이트에, 10% FBS를 포함하지 않는 D-MEM 배지로 희석시킨 0.1 ml의 세포 현탁액을 5 ×103개/well이 되도록 살포하여, 5% CO2 인큐베이터 중(37℃)에서 밤새 배양했다. 다음날 10% FBS를 포함하지 않는 D-MEM 배지로 희석시킨 피검 물질의 용액 0.05 ml를 가하고, 거의 동시에 40 nM의 PDGF 용액 0.05 ml를 가한(최종농도 10 nM) 후, 또 5% CO2 인큐베이터 중(37℃)에서 배양했다. 피검 물질 첨가후 3일째에 각 웰에 WST-1 용액(와코쥰야쿠로부터 구입)의 0.01 ml를 가하여 5% CO2 인큐베이터 중(37℃)에서 약 3시간 배양하여 발색시켰다. 측정 파장을 415 nm, 대조 파장을 660 nm로 하여, 각 웰의 흡광도를 플레이트 리더 MTP-32(코로나 전기)를 이용하여 측정했다. 피검 물질을 첨가하지 않은 웰의 흡광도에 대한, 피검 물질을 첨가한 웰의 흡광도의 비를 % 표시로 구하여, 이 비의 값으로부터 세포 증식을 50% 저해하는 데 필요한 피검 물질의 농도(IC50)를 구했다.
약리
시험예
6 :
DNA
마이크로 어레이/정량적
PCR
에 의한
mRNA
발현 해석
1. 샘플로부터 전 RNA의 추출
세포는 5% CO2 조건하 또는 저산소하(1%) 37℃에서 배양했다. 예컨대 HUVEC의 경우, EGM-2 배지(클로네틱스사로부터 구입)을 이용하여 5% CO2 조건하 37℃에서 배양했다. 피검 물질을 작용시킨 후, 일정 시간후에 첨부한 조작법에 따라서 TRIZOL 시약(GIBCO BRL사로부터 구입)을 이용하여 세포 용해를 행했다. 구체적으로는 다음과 같다. 배양 면적 10 ㎠에 대하여 1 ml의 TRIZOL 시약을 가하여, 수회 피페팅을 행한후, 회수한다. 그 샘플을 원심 분리한 후, 얻어진 상청을 실온에서 5분간 방치한 후, 사용한 TRIZOL 시약 1 ml에 대하여 0.2 ml의 비율로 클로로포름(쥰세이가가쿠사로부터 구입)을 첨가한다. 이 용액을 15초간 격하게 진탕, 교반하여 실온에서 2∼3분간 방치한 후 원심 분리를 행한다(12,000 ×g, 10분간, 4℃). 원심 분리후 수층(水層)을 새로운 튜브로 옮겨, 사용한 TRIZOL 시약 1 ml 대하여 0.5 ml의 비율로 이소프로필알콜(와코쥰야쿠사로부터 구입)을 가하여, 실온에서 10분간 방치한 후 원심 분리를 행한다(12,000 ×g, 10분간, 4℃). 얻어진 침전을 75% 에탄올(와코쥰야쿠사로부터 구입)로 세척한 후 바람에 말려, 전 RNA로서 이후의 조작에 사용한다.
2. RNA의 정량
RNA는 노던블로트 해석·DNA 마이크로 어레이·RT-PCR·정량적 PCR 등의 기술에 의해 정량할 수 있다. 바람직하게는 DNA 마이크로 어레이·정량적 PCR인 것이 바람직하다. 이하에 각각에 관하여 설명하지만, 본 발명은 이에 의해 한정되지 않는다.
1) DNA 마이크로어레이에 의한 정량(Schena M. 등, Science, 270(5235), 467-70, 1995 및 Lockhart, D.J. 등, Nature Biotechnology, 14(13), 1675-1680, 1996)는 다음과 같은 식으로 실행한다.
① cDNA 합성과 비오틴 표지
맨 처음에 얻어진 RNA를 주형으로서 SuperScript Choice System(GIBCO BRL사로부터 구입) 및 T7-d(T)24 프라이머를 이용하여 2본쇄의 cDNA를 합성하고, 계속해서 그 cDNA를 주형으로서 비오틴화한 cRNA를 합성한다.
구체적으로는, 우선 10 ㎍의 RNA에 5 ㎍의 T7-d(T)24 프라이머, 1×제1사슬 완충액, 10 mM DTT, 500 μM의 dNTP 혼합물, 20 unit/㎕의 SuperScriptⅡ 역전사효소를 가하여, 42℃에서 1시간 반응시켜 1본쇄 cDNA를 합성했다. 계속해서 1×제2 사슬 완충액, 200 μM의 dNTP 혼합물, 67 U/ml DNA 리가제, 270 U/ml DNA 폴리머라제Ⅰ, 13 U/ml RNaseH를 첨가하여 16℃에서 2시간 반응시켜 2본쇄 cDNA를 합성했다. 또한 67 U/ml T4 DNA 폴리머라제Ⅰ를 첨가하여 16℃에서 5분간 반응시킨 후, 10 ㎕의 0.5 M EDTA(시그마사로부터 구입)을 가하여 반응을 정지시켰다.
생성된 cDNA를 페놀/클로로포름(Ambion사로부터 구입)으로 정제하고, RNA Transcript Labeling Kit(Enzo Diagnostics사로부터 구입)을 이용하여, 첨부한 조작법에 따라서, 비오틴화 UTP 및 CTP에 의한 라벨화 반응을 행했다. 반응 생성물을 Rneasy 컬럼(키아겐사로부터 구입)으로 정제한 후, 200 mM Tris 아세테이트 pH8.1, 150 mM 아세트산마그네슘, 50 mM 아세트산칼륨 중에 94℃에서 35분간 가열하여 cRNA를 단편화했다.
② DNA 마이크로 어레이(GeneChip)에의 혼성화와 측정
단편화한 cRNA를, 예컨대 100 mM MES, 1 M 나트륨 염, 20 mM EDTA, 0.01% Tween20 중, 45℃에서 16시간, GeneChip(Affymetrix사로부터 구입) Hu6800/Human Cancer G 110 Array 또는 동등한 제품에 혼성화시킨다. 혼성화한 후, GeneChip은 Affymetrix fluidics station에 첨부한 프로토콜 EukGE-WS2 또는 이용한 어레이에 최적인 프로토콜에 따라서 세척·염색한다. 염색에는 스트렙타비딘-피코에리트린(Molecular Probe사로부터 구입)과 비오틴화 항스트렙타비딘 염소 항체(Vector사로부터 구입)를 이용한다. 염색후의 GeneChip를 HP 아르곤-이온 레이져 공초점 현미경(Hewlett Packard사로부터 구입)을 이용하여 scan하여, 형광 강도를 측정한다. 이 형광의 경우, 측정은 488 nm에서 여기시켜 570 nm에서 방사시켜 수행한다.
정량적 데이터 해석은 전부 GeneChip 소프트웨어(Affymetrix사로부터 구입) 또는 Genespring(Silicon Genetics사로부터 구입)을 이용하여 수행했다. RNA의 정량을 수행하기 위해서, 각각의 프로브 군마다 「차이값(완전 매치 혼성화 시그널-미스매치 시그널)」의 평균 차이값(average difference)을 구하여, 이 값이 5 이상이고, 또 2개의 조건 사이에서 RNA의 정량치가 괴리되고 있는 경우, 바람직하게는 1.8배 이상 괴리되고 있는 경우에 대하여, 그 유전자의 발현이 유의적으로 「증가」 또는 「감소」했다고 판단한다.
2) 정량적 PCR에 의한 정량은 다음과 같이 행한다.
정량적 PCR는 SYBR Green(아프라이드바이오시스템즈사로부터 구입)과 ABI Prism 7700 Sequence Detection System(Perkin-Elmer Applied Biosystems사로부터 구입) 또는 이와 동등한 제품을 이용하여, 다음과 같이 행한다.
조작은 역전사 반응 및 PCR 반응의 2단계로 행한다. 최초의 단계인 역전사 반응은 생성된 RNA에 dNTP·oligo d(T)16 프라이머·RNase 억제제·Multiscribe 역전사효소(Perkin-Elmer Applied Biosystems사로부터 구입)를 가하여, 25℃에서 10분간 보온한 후, 48℃에서 30분간 가열함으로써 행한다. 반응을 95℃에서 5분간 가열함으로써 정지시킨다.
생성된 cDNA를 제2단계의 PCR 반응에 사용한다. PCR 반응은 예컨대 4 ng cDNA, 1×SYBR PCR 완충액, 3 mM MgCl2, 200 μM each dATP, dCTP, dGTP, 400 μM dUTP, 200 nM 프라이머 쌍, 0.01 U/㎕ AmpErase UNG, 0.025 U/㎕ Ampli Taq Gold DNA Polymerase(Perkin-Elmer Applied Biosystems사로부터 구입)의 반응계에서 행한다. 반응 조건은 50℃에서 2분간, 95℃에서 10분간 그리고 95℃에서 20초간·55℃에서 20초간·72℃에서 30초간을 40 사이클로 행했다. 프라이머와 프로브는 Primer Expression(Perkin-Elmer Applied Biosystems사로부터 구입) 또는 그것과 동등한 소프트웨어를 이용하여 설계한다. 복수회의 피검 물질의 비교는 정량치를 각 검체의 전사량에 변동이 적은 하우스 키핑(house keeping) 유전자, 바람직하게는 GAPDH의 mRNA 레벨에 의해 보정하여 행한다.
약리 시험예 7 : 마우스 피하 공기 양법을 이용한 생체내 혈관 신생 유도 활성의 평가
① VEGF(Vascular Endothelial Growth Factor) 발현 벡터의 구축
인간 태반 cDNA 라이브러리(도요보사로부터 구입)를 주형으로 하여, VEGF의 배열 번호 5' CCGGATCCATGAACTTTCTGCTG 3' 및 5' GTGAATTCTGTATCGATCGTT 3'를 프라이머로 하여 PCR을 행했다. PCR 반응 종료후에 5' 말단을 인산화하고 1.2% 아가로스겔 전기 영동으로 약 600 bp DNA 밴드를 분리했다. 자가 결찰법에 의해서 중합한 후, cDNA를 EcoRI, BamHI 로 절단하여, pUC19 벡터의 EcoRI, BamHI 부위에 삽입했다. 그 후, 대장균 JM83으로 형질전환하여, 형질전환한 클론으로부터 플라스미드를 회수했다. 플라스미드로부터 VEGFcDNA 단편을 HindIII, EcoRI로 잘라낸 후, neo 내성 유전자를 포함하는 발현 벡터에 삽입했다.
② VEGF 고발현주의 제작
인간 췌장암 세포주 KP-1(3 ×106 세포)를 10% FCS 함유 RPMI1640 배지로 밤새 배양한 후, VEGF 발현 벡터의 3 ㎍를 Effctene 형질감염 시약 키트(QIAGEN로부터 구입)를 이용하여 KP-1 세포에 도입했다. 젠네티신 600 ㎍/ml를 포함하는 10% FCS 함유 RPMI1640 배지에서 배양하고, 고발현 약제 내성 세포를 선택하여, VEGF 고발현 KP-1세포(KP-1/VEGF)로 했다.
③ 배양액 상청 중의 VEGF량의 측정
KP-1/VEGF를 5 ×105 세포 /ml로 조정하고, 각 0.5 ml를 24 구멍 플레이트의 웰 내에 주입하여 37℃하에서, 24시간 배양했다. 배양 상청을 회수하여 VEGF 측정 키트(주·면역생물연구소로부터 구입)를 이용하여 VEGF를 정량하여, 고발현을 확인했다.
④ 마우스 피하 공기낭법을 이용한 in vivo 혈관 신생 유도 활성의 평가
밀리포어링(니혼미리포아사로부터 구입)을 0.45 ㎛의 듀라포아 필터 멤브란(니혼미리포아사로부터 구입)으로 시일하여 챔버를 제작한다. 이 챔버 내에 0.17 ml의 콜라겐 겔로 현탁한 3 ×106개의 인간 췌장암 KP-1/VEGF 세포를 주입구에 주입하여, 봉입했다. 다음에, 마취하에서 6주된 C57BL/6N 암컷 마우스의 등부 피하에 약 10 ml의 공기를 주입하고 공기낭을 제작하여, 거기에 앞의 챔버를 이식했다. 이식이 종료되고 나서 약 6시간 후에 0.5% 메틸 셀룰로즈에 현탁한 피검 물질을 경구 투여(0.1 ml/10 g 체중)하여, 이후 하루 한번 4일간 연속 투여했다.
챔버 이식후 4일 후에, 51Cr(Amersham Pharmacia) 표지한 마우스 적혈구(2.5 ×106 cpm/ml)를 챔버를 이식한 마우스 꼬리 정맥에 0.2 ml 주사했다. 일정 시간후 챔버에 접한 부분의 피부를 잘라 떼내어, 동결한 후에, 챔버에 접한 부분만을 정확히 분리하여, γ-카운터로 방사 활성을 측정했다. 방사 활성으로부터 혈액량을 계산하여, 생체내 혈관 신생 유도 활성의 지표로 했다. 콜라겐 겔만을 봉입한 챔버를 이식한 경우의 혈액량을 상기한 혈액량에서 뺀 값을 혈관 신생량으로 했다. 또, 실험은 대조군(용매 투여군)은 1군에 10마리, 화합물 투여군은 1군에 5마리로 행했다.
약리 시험예 8 : 피하 이식 모델을 이용한 KP -1/ VEGF 세포에 대한 항종양 활성의 평가
1 ×107/ml의 농도로 PBS에 현탁한 VEGF 고발현 췌장암 세포(KP-1/VEGF)를 6주된 암컷 Balb/c(nu/nu) 마우스의 우측 옆구리 피하부에 0.1 ml의 용량으로 이식했다. 종양 체적이 약 100 ㎣이 된 시점에서부터, 피검 물질은 주 5일의 스케줄로 2주간에 걸쳐 경구 투여 했다. 피검 물질은 0.1 ml/10 g 체중의 투여 용량이 되도록, 0.5% methyl cellulose에 현탁했다. 종양 사이즈는 일주일에 2회, 노기스를 이용하여 측정했다. 또, 종양 체적은 노기스로 종양의 장경과 단경을 측정하여, 1/2 ×(장경 ×단경 ×단경)으로 계산했다. 또, 실험은 컨트롤(용매 투여군)은 1군 10마리, 피검 물질 투여군은 1군 5마리로 행했다.
약리 시험예 9 : 췌장 동소 이식 모델을 이용한 종양 증식, 암성 복수 저류, 생존 기간의 평가
6 내지 7주된 암컷 Balb/c(nu/nu) 마우스를 마취하에 개복하여 췌장을 노출시켜, 췌두부에 7 ×107/ml의 농도로 PBS에 현탁한 VEGF 고발현 췌장암 세포(KP-1/VEGF)를 0.1 ml의 용량으로 직접 이식했다. 이식후 4주후부터, 피검 물질을 주 5일의 스케줄로 10주간에 걸쳐 경구 투여했다. 피검 물질은 0.1 ml/10 g 체중의 투여 용량이 되도록, 0.5% 메틸 셀룰로즈에 현탁했다. 이 사이, 시간이 경과함에 따라 일주일에 2회 체중을 측정하여, 복수 저류의 유무를 외견(外見)으로 기록했다. 생존 기간에 대해서는 사망한 마우스의 수를 실험 종료시까지 누계했다. 또, 사후 부검이 가능했던 개체에 대해서는 종양 중량을 측정했다. 또, 실험은 1군에 8에서 10마리의 범위에서 행했다.
이하의 실시예에 의해 본 발명을 상세히 또 구체적으로 설명하지만, 본 발명은 이들 실시예에 한정되는 것이 아니다.
[제조예]
제조예
1
*2-(3- 클로로프로필 )-1,2,3- 트리아졸 ( 제조예 1-A)
1-(3-
클로로프로필
)-1,2,3-
트리아졸
(
제조예
1-B)
수소화나트륨(1.55 g, 30.8301 mmol, 오일중 60%)을 헥산에 현탁시킨 후 방치하고, 웃물을 제거한 것에 디메틸포름아미드(25 ml) 를 가하여 현탁시키고, 빙냉하에서, 이것에 1H-1,2,3-트리아졸(1.5 ml, 25.8867 mmol)을 적하했다. 실온에서 5분간 교반하고, 완전히 용해시킨 후, 1-브로모-3-클로로프로판(2.82 ml, 28.4754 mmol)을 가하여 실온에서 8시간동안 교반했다. 빙냉하에 물을 가하고, 디에틸에테르, 이어서 초산에틸로 추출하고, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시키고, 용매를 감압 증류 수거한 후, NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)로 이성체 분리, 정제하여, 각각 무색 유상물로서, 저극성 2-(3-클로로프로필)-1,2,3-트리아졸(0.429 g, 2.9466 mmol, 11.38%), 고극성 1-(3-클로로프로필)-1,2,3-트리아졸(0.910 g, 6.2504 mmol, 24.15%)을 얻었다.
2-(3-
클로로프로필
)-1,2,3-
트리아졸
(
제조예
1-A)
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.42(2H, tt, J=6.4Hz, 6.4Hz), 3.54(2H, t, J=6.4Hz), 4.64(2H, t, J=6.4Hz), 7.61(2H, s).
1-(3-
클로로프로필
)-1,2,3-
트리아졸
(
제조예
1-B)
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.41(2H, m), 3.52(2H, d, J=6.0Hz), 4.60(2H, d, J=6.4Hz), 7.61(1H, d, J=0.8Hz), 7.72(1H, d, J=0.8Hz).
제조예
2
1-
클로로
-3-(4-
피리딜
)프로판
3-(4-피리딜)-1-프로판올(2.68 g, 19.3724 mmol)을 디클로로메탄(100 ml)에 용해하여, 트리페닐포스핀(5.6 g. 21.3096 mmol)을 가하고, 계속해서 빙냉하, N-클로로호박산이미드(2.6 g, 19.3724 mmol)를 조금씩 가하고, 그대로 밤새 교반했다. 용매를 감압 증류 수거한 후 잔사를 초산에틸에 용해시키고, 1 N 염산으로 추출했다. 이것을 포화중조수로 중화시킨 후 초산에틸로 추출하고, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시키고, 용매를 감압 증류 수거한 후, 황갈색 유상물로서 표제 화합물(2,375 g, 15.2605 mmol, 78.77%)을 얻었다. 추가로 정제하지 않고서 다음 반응에 이용했다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.11(2H, m), 2.80(2H, t, J=7.6Hz), 3.54(2H, t, J=6.4Hz), 7.14(2H, dd, J=1.6Hz, 4.4Hz), 8.52(2H, dd, J=1.6Hz, 4.4Hz).
제조예
3
4-아미노-3-
플루오로페놀
3-플루오로-4-니트로페놀(5.0 g, 31.83 mmol)을 초산에틸(50 ml), 테트라히드로푸란(75 ml) 에 용해하고, 팔라듐탄소(2.0 g)를 가하여, 수소 분위기하 실온에서 8.5시간동안 교반했다. 촉매를 여과 제거하여, 에탄올로 세척한 후 용매를 감압 증류 수거하여, 생성된 결정에 헥산:에탄올=1:1을 가하여 세척했다. 결정을 여과 수취하고, 디에틸에테르로 세척하고, 흡인 건조시켜, 담황색 결정으로서 표제 화합물(1.62 g, 12.74 mmol, 40.61%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.35(1H, brs), 6.32(1H, dd, J=2.4Hz, 8.4Hz), 6.39-6.45(1H, m), 6.57(1H, dd, J=8.4Hz, 10.4Hz).
제조예
4
N-(2,4-
디플루오로페닐
)-
N'
-(2-
플루오로
-4-
하이드록시페닐
)
우레아
4-아미노-3-플루오로니트로페놀(500 mg, 3.9333 mmol)을 테트라히드로푸란(15 ml)에 용해하고, 2,4-디플루오로이소시아네이트(0.56 ml, 4.7199 mmol)를 적하하고, 질소 분위기하에서 1시간동안 가열 환류했다. 방냉후 용매를 감압 증류 수거하고, 생성된 결정에 헥산:에탄올=1:1을 가하여 세척했다. 결정을 여과 수취하고, 헥산:에탄올=1:1로 세척하고, 흡인 건조시켜, 연보라색 결정으로서 표제 화합물(960 mg, 3.4016 mmol, 86.48%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.54(1H, m), 6.60(1H, ddd, J=2.4Hz, 2.4Hz, 8.8Hz), 7.00(1H, m), 7.27(1H, ddd, J=2.8Hz, 9.0Hz, 11.6Hz), 7.69(1H, m), 8.07(1H, ddd, J=6.0Hz, 9.0Hz, 9.0Hz), 8.53(1H, s), 8.72(1H, s), 9.56(1H, s).
제조예
5
7-
벤질옥시
-6-
시아노
-4-(4-
니트로페녹시
)퀴놀린
WO98/13350에 기재한 7-벤질옥시-4-클로로-6-시아노퀴놀린(2.60 g, 8.83 mmol)에, 4-니트로페놀(2.46 g, 17.7 mmol), 루티딘(2.06 ml, 17.7 mmol)을 가하여 155-158℃에서 2시간동안 가열 교반했다. 반응계를 실온으로 되돌린 후에 테트라히드로푸란에 용해하고, 포화중조수를 가하여 10분간 교반하고 감압 농축하여 석출하는 고체를 여과 수취하고, 실리카겔 컬럼 크로마토그래피(후지시리시아 NH 타입, 용출액; 헥산:초산에틸 50:50 →초산에틸만)에 가하여, 목적물을 포함하는 분획을 농축하여 생성된 고체를 디에틸에테르로 세척했다. 감압 건조시켜 표제 화합물(1.84 g, 4.63 mmol, 52.6%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.48(2H, s), 6.89(1H, d, J=6.1Hz), 7.30-7.60(8H, m), 7.78(1H, s), 8.36-8.41(2H, m), 8.80(1H, s), 8.85(1H, d, J=6.1Hz).
제조예
6
4-(4-
아미노페녹시
)-7-(
벤질옥시
)-6-
시아노퀴놀린
제조예 5에서 생성된 7-벤질옥시-6-시아노-4-(4-니트로페녹시)퀴놀린에 철분(0.6 g), 염화암모늄(1.4 g), 에탄올(100 ml), 물(30 ml)을 가하여 90℃에서 2.5시간동안 교반했다. 반응계를 실온으로 되돌린 후 세라이트 여과하고, 여과액을 분액하여 유기층을 물, 포화식염수로 순차적으로 세척하고, 황산나트륨으로 건조한 후 감압 농축 건조(乾固)시켜, 목적물을 포함하는 미정제물 1.31 g를 얻었다. 이 미정제물은 다음 반응(제조예 7)에 그대로 이용했다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.75(2H, br), 5.35(2H, s), 6.46(1H, d, J=5.2Hz), 6.75-6.78(2H, m), 6.94-6.97(2H, m), 7.35(1H, d, J=7.6Hz), 7.42(2H, t, J=6.8Hz), 7.50-7.55(3H, m), 8.63(1H, d, J=5.2Hz), 8.72(1H, s).
제조예
7
7-
벤질옥시
-6-
시아노
-4-(3-
플루오로
-4-
니트로페녹시
)퀴놀린
WO98/13350에 기재한 7-벤질옥시-4-클로로-6-시아노퀴놀린(8.82 g, 30.0 mmol)을 1-메틸피롤리돈(30 ml)에 현탁시키고, 3-플루오로-4-니트로페놀(5.18 g, 33.0 mmol), N,N-디이소프로필에틸아민(3.88 g, 30.0 mmol)을 가하여 110℃에서 4시간동안 가열 교반했다. 반응계를 실온으로 되돌린 후에 물을 가하여 고체를 석출시켰다. 생성된 고체를 여과 쉬취하여, 물, 메탄올, 초산에틸로 세척한 후, 60℃에서 건조시켜 무색 결정으로서 표제 화합물(4.98 g, 12.0 mmol, 40%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.37(2H, s), 6.73(1H, d, J=5.2Hz), 7.07-7.13(2H, m), 7.33-7.45(3H, m), 7.50-7.56(2H, m), 7.60(1H, s), 8.21-8.27(1H, m), 8.55(1H, s), 8.83(1H, d, J=5.2Hz).
제조예
8
7-
벤질옥시
-6-
시아노
-4-(3-
플루오로
-4-
아미노페녹시
)퀴놀린
제조예 7에서 얻은 7-벤질옥시-6-시아노-4-(3-플루오로-4-니트로페녹시)퀴놀린(5.30 g, 12.8 mmol)과 철(3.57 g, 64.0 mmol), 염화암모늄(6.85 g, 128 mmol)을 에탄올(120 ml)-물(30 ml)의 혼합 용매에 현탁시켜 100℃에서 3시간동안 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하고, 초산에틸(500 ml)-N,N-디메틸포름아미드 DMF(50 ml)의 혼합 용매로 세척하여 넣었다. 유기층을 물 및 포화식염수로 세척하고, 황산마그네슘으로 건조한 후 농축했다. 생성된 고체를 초산에틸-헥산의 혼합 용매로부터 재결정한 후, 건조시켜 담갈색 결정으로서 표제 화합물(2.53 g, 6.56 mmol, 51%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.80(2H, brs), 5.35(2H, s), 6.48(1H, d, J=5.3Hz), 6.78-6.90(3H, m), 7.32-7.44(3H, m), 7.51(1H, s), 7.52-7.56(2H, m), 8.66(1H, d, J=5.3Hz), 8.69(1H, s).
제조예
9
6-
시아노
-7-(2-
메톡시에톡시
)-4-(4-
니트로페녹시
)퀴놀린
4-클로로-6-7-(2-메톡시에톡시)퀴놀린(3 g)과 4-니트로페놀(3.17 g), 2,6-루티딘(2.7 ml)의 혼합물을 1.5시간동안 오일조에서 155℃로 가열 교반했다. 반응 종료후, 초산에틸을 가하여 고체를 석출시켜 여과 수취했다. 고체를 1N 수산화나트륨수로 세척하고, 수세한 후 건조시켜 표제 화합물을 1.8 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.41-4.44(2H, m), 6.85(1H, d, J=5.2Hz), 7.54(2H, d, J=9.2Hz), 7.68(1H, s), 8.37(2H, d, J=9.2 Hz), 8.74(1H, s), 8.83(1H, d, J=5.2Hz).
제조예
10
4-(4-
아미노페녹시
)-6-
시아노
-7-(2-
메톡시에톡시
)퀴놀린
6-시아노-7-(2-메톡시에톡시)-4-(4-니트로페녹시)퀴놀린(1.8 g)과 철(1.8 g), 염화암모늄(3.6 g)을 에탄올(30 ml)-물(7 ml)의 혼합 용매에 현탁시켜 80℃에서 2시간동안 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸로 세척하여 넣었다. 유기층을 포화식염수로 세척하고, 황산마그네슘으로 건조하고, 농축하여 얻어진 고체를 에테르로 세척하고, 건조시켜 표제 화합물을 1.2 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.38-4.41(2H, m), 5.19(2H, brd), 6.45(1H, d, J=5.2Hz), 6.65(2H, d, J=8.8Hz), 6.93(2H, d, J=8.8Hz), 7.59(1H, s), 8.68(1H, d, J=5.2 HZ), 8.71(1H, s).
제조예
11
6-
시아노
-4-(3-
플루오로
-4-
니트로페녹시
)-7-(2-
메톡시에톡시
)퀴놀린
4-클로로-6-시아노-7-(2-메톡시에톡시)퀴놀린(1.7 g)과 3-플루오로-4-니트로페놀(2.0 g)을 클로르벤젠(20 ml)에 현탁시켜, 6시간동안 가열 환류했다. 반응 종료후, 용매를 증류 수거하고 초산에틸을 가하여 고체를 석출시켰다. 얻어진 고체를 여과 수취하여 에테르로 세척한 후 1N 수산화나트륨수로 세척하고, 추가로 수세하고 건조시켜, 표제 화합물을 1.55 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.38(3H, s), 3.78-3.81(2H, m), 4.44-4.47(2H, m), 7.02(1H, d, J=5.2Hz), 7.33-7.37(1H, m), 7.69(1H, dd, J=2.8Hz, J=12Hz), 7.72(1H, s), 8.33(1H, t, J=8.8HZ), 8.75(1H, s), 8.88(1H, d, J=5.2Hz).
제조예
12
4-(4-아미노-3-
플루오로페녹시
)-6-
시아노
-7-(2-
메톡시에톡시
)퀴놀린
제조예 10과 같은 식으로, 제조예 11에서 얻은 니트로체(1.55 g)로부터, 표제 화합물을 1.23 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.38(3H, s), 3.78-3.81(2H, m), 4.42-4.44(2H, m), 5.25-5.27(2H, brd), 6.54(1H, d, J=5.2Hz), 6.87-6.89(2H, m), 7.10-7.14(1H, m), 7.62(1H, s), 8.72(1H, d, J=5.2 HZ), 8.74(1H, s).
제조예
13
6-
시아노
-7-
메톡시
-4-(4-
니트로페녹시
)퀴놀린
제조예 7과 같은 식으로 하여 얻은 4-클로로-6-시아노-7-메톡시퀴놀린(0.35 g)과 4-니트로페놀(0.36 g), 2,6-루티딘(0.25 ml)의 혼합물을 오일조를 이용하여 170℃에서 가열 교반했다. 반응 종료후, 반응 혼합물에 물, 초산에틸을 가하여 추출했다. 유기층을 포화탄산수소나트륨 수용액 및 포화식염수로 세척하고, 황산마그네슘으로 건조시켜 농축했다. 얻어진 잔사를 NH 실리카겔(후지시리시아가가쿠)에 가하여, 용매(초산에틸-헥산=1-2)로 용출하고 농축하여 표제 화합물을 0.2 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 4.06(3H, s), 6.87(1H, d, J=5.6Hz), 7.54(2H, d, J=8.8Hz), 7.65(1H, s), 8.36(2H, d, J=8.8Hz), 8.75(1H, s), 8.84(1H, d, J=5.6Hz).
제조예
14
4-(4-
아미노페녹시
)-6-
시아노
-7-
메톡시퀴놀린
제조예 10과 같은 식으로 하여 6-시아노-7-메톡시-4-(4-니트로페녹시)퀴놀린(0.2 g)으로부터 표제 화합물을 0.17 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 4.06(3H, s), 5.15-5.20(2H, m), 6.46(1H, d, J=5.6Hz), 6.66(2H, d, J=8.8Hz), 6.93(2H, d, J=8.8Hz), 7.56(1H, s), 8.69(1H, d, J=5.6Hz), 8.71(1H, s).
제조예
15
6-
시아노
-4-(3-
플루오로
-4-
니트로페녹시
)-7-
메톡시퀴놀린
제조예 7과 같은 식으로 하여 얻은 4-클로로-6-시아노-7-메톡시퀴놀린(0.5 g)으로부터 제조예 13과 같은 식으로 하여 표제 화합물을 0.33 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 4.07(3H, s), 7.00(1H, d, J=5.2Hz), 7.30-7.34(1H, m), 7.65(1H, dd, J=2.8Hz, J=12Hz), 7.66(1H, s), 8.30(1H, t, J=8.8Hz), 8.72(1H, s), 8.87(1H, d, J=5.2Hz).
제조예
16
4-(4-아미노-3-
플루오로페녹시
)-6-
시아노
-7-
메톡시퀴놀린
제조예 10과 같은 식으로 하여 6-시아노-4-(3-플루오로-4-니트로페녹시)-7-메톡시퀴놀린(0.32 g)으로부터 표제 화합물을 0.24 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 4.06(3H, s), 5.26(2H, brs), 6.54(1H, d, J=5.2Hz), 6.85-6.91(2H, m), 7.11(1H, dd, J=2.0Hz, J=11.2Hz), 7.59(1H, s), 8.72(1H, d, J=5.2Hz), 8.73(1H, s).
제조예
17
페닐
N-(4-(6-
시아노
-7-(2-
메톡시에톡시
)-4-
퀴놀릴
)
옥시페닐
)
카르바메이트
제조예 10에 의해 생성된 4-(4-아미노페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(3.354 g, 10.0 mmol)을 질소 분위기하에서, 디메틸포름아미드(35 ml)에 용해시킨 후, 빙수욕 냉각하고, 피리딘(2.43 ml, 30.0 mmol), 페닐 클로로포르메이트(1.38 ml, 11.0 mmol)을 순차적으로 가하여, 실온에서 3시간동안 교반했다. 반응액에 물(40 ml)을 가하여 석출된 결정을 여과 수취했다. 여과액을 초산에틸로 추출하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 건조제를 여과 분별하고, 감압 농축하여 얻어진 결정과 앞의 결정을 합쳐 헥산-초산에틸(5:1)에 현탁시켜 밤새 교반한 후, 결정을 여과 수취하고, 감압 건조시켜 담갈색 결정으로서 표제 화합물(4.334 g, 9.52 mmol, 95.2%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.53(3H, s), 3.91(2H, t, J=4.4Hz), 4.38(2H, t, J=4.4Hz), 6.49(1H, d, J=5.2Hz), 7.07(1H, br), 7.17-7.32(5H, m), 7.40-7.45(2H, m), 7.44(1H, s), 7.59(2H, d, J=8.8Hz), 8.67(1H, d, J=5.6Hz), 8.70(1H, s).
제조예
18
페닐 N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )- 퀴놀릴)옥시 -2- 플루오로페닐 ) 카르바메이트
제조예 12에서 생성된 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(2500 mg)을 디메틸포름아미드 20 ml와 피리딘 1.7 ml에 용해하여 질소 기류하에서 0℃로 냉각했다. 여기에 크로르탄산페닐 0.97 ml를 가하여, 실온에서 2시간동안 교반했다. 이 반응액에 초산에틸, 물을 가하여 분배하고, 유기층을 물, 포화식염수의 순으로 세척하고, 무수황산나트륨으로 건조한 후, 감압하에서 농축하여 3.7 g의 잔사를 얻었다. 이것을 테트라히드로푸란에 용해시킨 후, n-헥산을 가하여, 석출된 고체를 여과 수취하여 2.2 g(수율 67%)의 표제 화합물을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.36(3H, s), 3.89-3.94(2H, m), 4.34-4.39(2H, m), 6.52(1H, d, J=5.6Hz), 7.01-7.06(2H, m), 7.21-7.30(4H, m), 7.40-7.45(2H, m), 7.49(1H, s), 8.26(1H, brs), 8.66(1H, s), 8.70(1H, d, J=5.6Hz).
제조예
19
페닐
N-(4-(6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시페닐
)
카르바메이트
제조예 14에서 얻은 4-(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(747 mg)을 디메틸포름아미드 7 ml과 피리딘 0.34 ml에 용해하여 질소 기류하에서 0℃로 냉각했다. 여기에 크로르탄산페닐 0.34 ml를 가하여, 실온에서 2시간동안 교반했다. 이 반응액에 초산에틸, 물을 가하고, 석출된 고체를 여과 수취하여 590 mg(수율 56%)의 표제 화합물을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.04(3H, s), 6.52(1H, d, J=5.6Hz), 7.20-7.30(5H, m), 7.40-7.46(2H, m), 7.60(1H, s), 7.62-7.68(2H, m), 8.72(1H, d, J=5.6Hz), 8.75(1H, s), 10.4(1H, brs).
제조예
20
6-
클로로
-4-(4-
니트로페녹시
)피리미딘
4,6-디클로로피리미딘(750 mg)을 4-니트로페놀(700 mg) 및 수소화나트륨(60%)(200 mg)의 디메틸포름아미드(13 ml) 현탁액에 0℃에서 가하여, 80℃에서 1.5시간동안 가열 교반했다. 반응액을 포화식염수에 부어, 초산에틸로 추출했다. 유기층을 황산마그네슘으로 건조한 후 농축하고 잔사를 NH 실리카겔(후지시리시아가가쿠)에 가하여, 용매(초산에틸-헥산=1-4)로 용출하고 농축하여, 표제 화합물을 700 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 7.08(1H, d, J=0.8Hz), 7.30-7.37(2H, m), 8.32-8.36(2H, m), 8.60(1H, d, J=0.8Hz).
제조예
21
4-(4-아미노-3-
플루오로페녹시
)-7-
히드록시퀴놀린
-6-
카르보니트릴
7-벤질옥시-6-시아노-4-(3-플루오로-4-니트로페녹시)퀴놀린 2.6 g에 트리플루오로초산 26 ml, 티오아니솔 2.6 ml를 가하여 70℃-72℃에서 15시간동안 교반하여 실온으로 되돌린 후, 반응계를 농축하여 잔사에 포화중조수, 메탄올을 가하여 석출된 황색의 결정을 여과 수취했다. 건조후 2.61 g의 결정을 얻었다. 이 결정의 일부 640 mg에 철 950 mg, 염화암모늄 1.8 g, 에탄올 10 ml, 테트라히드로푸란 10 ml, 물 10 ml를 가하여 1시간동안 환류하고, 반응계를 세라이트 여과하여, 여과액에 초산에틸, 물을 가해 분액 추출하고, 유기층을 농축 건조시켜 표제 화합물 355 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 5.22(2H, s), 6.42(1H, d, J=5.8Hz), 6.80-6.90(2H, m), 7.08(2H, d, J=12.0Hz), 8.60-8.65(2H, m), 11.60(1H, brs)
제조예
22
페닐
3-
메틸설포닐페닐카르바메이트
1-아미노-3-메틸티오벤젠(1.27 ml, 10 mmol)을 테트라히드로푸란(10 ml)에 용해시키고, 질소 분위기하, 실온에서 트리에틸아민(1.46 ml, 10.5 mmol), 페닐 클로로포르메이트(1.32 ml, 10.5 mmol)을 순차적으로 적하하고, 하룻밤 교반했다. 반응액을 초산에틸과 물로 분배하고, 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거, 감압 건조한 후, 잔사를 디클로로메탄(50 ml)에 용해시켜, 빙수욕 냉각하에서 3-클로로과벤조산(4.93 g, 20 mmol)을 서서히 가했다. 반응액에 포화티오황산나트륨 수용액을 가한 후, 불용물을 여과 수거하여, 여과액을 초산에틸로 추출하고, 포화탄산나트륨 수용액으로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거하고, 잔사를 실리카겔 컬럼 크로마토그래피(초산에틸:헥산=1:1)로 정제하여, 표제 화합물(2.545 g, 8.74 mmol, 87.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3)δ(ppm) : 3.07(3H, s), 7.18-7.29(4H, m), 7.40-7.44(2H, m), 7.55(1H, t, J=8.0Hz), 7.68(1H, d, J=8.0Hz), 7.80(1H, d, J=8.0Hz), 8.05(1H, s).
제조예
23
4-[(2,2-디메틸-4,6- 디옥소 -[1,3]디옥산-5- 일리덴메틸 )-아미노]-2- 메톡시 - 벤조니트릴
4-아미노-2-클로로벤조니트릴(3 g)을 1-메틸-2-피롤리돈(10 ml)에 용해하고, 나트륨메톡시드(2.12 g)를 가하여 7시간동안 100℃에서 가열 교반했다. 반응액을 포화염화암모늄 수용액에 부어 에틸 아세테이트로 추출하고, 유기층을 황산마그네슘으로 건조한 후 농축했다. 생성된 잔사를 NH 실리카겔 컬럼 크로마토그래피에 가하여 용매(에틸 아세테이트-n-헥산=1-2)로 용출하여, 아닐린체(1.26 g)를 얻었다. 이 아닐린체(1.26 g)를 에톡시메틸렌멜드럼산(1.7 g)과 함께 에탄올 속에서 가열 환류했다. 2시간후 석출된 고체를 여과 수취하여, 에탄올로 세척한 후 건조시켜 표제 화합물(1.9 g)을 얻었다.
1H-NMR Spectrum (DMSO-d6)δ(ppm) : 1.66(6H, s), 3.94(3H, s), 7.21-7.26(1H, m), 7.46-7.50(1H, m), 7.72(1H, d, J=8.4Hz), 8.70(1H, s).
제조예
24
7-
메톡시
-4-옥소-1,4-
디히드로
-퀴놀린-6-
카르보니트릴
제조예 457-3과 같은 식으로 하여 4-[(2,2-디메틸-4,6-디옥소-[1,3]디옥산-5-일리덴메틸)-아미노]-2-메톡시-벤조니트릴(1.9 g)을 가열 폐환하여, 표제 화합물(1.08 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.96(3H, s), 6.02(1H, d, J=7.6Hz), 7.06(1H, s), 7.89(1H, d, J=7.6Hz), 8.30(1H, s).
제조예
25
6-
메톡시카르보닐
-7-
메톡시
-4-(5-
인돌릴옥시
)퀴놀린
메틸 4-클로로-7-메톡시퀴놀린-6-카르복실레이트(WO0050405에 기재, P. 34, 8.5 g, 33.77 mmol), 5-히드록시인돌(7 g), 디이소프로필에틸아민(8.9 ml, N-메틸피롤리돈(8.9 ml)을 혼합하여, 130℃에서 5시간, 이어서 150℃에서 8시간동안 가열 교반했다. 방냉후의 용액을 실리카겔에 흡착시켜, 실리카겔 컬럼(헥산-초산에틸계)으로 생성했다. 생성된 황색 유상물에 에탄올, 디에틸에테르, 헥산을 가하여 방치하자 결정이 석출되었다. 이것을 여과 수취하고, 디에틸에테르, 헥산으로 세척하고, 흡인 건조시켜, 담황색 결정(3.506 g, 10.06 mmol, 29.80%)을 얻었다.
1H-NMR Spectrum (DMSO-d6)δ(ppm) : 3.86(3H, s), 3.97(3H, s),6.38(1H, d, J=5.2Hz), 6.46(1H, s), 6.98(1H, d, J=8.8Hz), 7.44-7.52(4H, m), 8.60-8.65(2H, m), 11.29(1H, s).
제조예
26
7-(2-
메톡시에톡시
)-4-옥소-1,4-
디히드로
-6-
퀴놀린카르복실산
WO9813350에 기재한 7-메톡시-4-옥소-1,4-디히드로퀴놀린-6-카르보니트릴(8.0 g)을 이용하여, 제조예 152-1과 같은 식의 조작을 하여 표제 화합물(6.3 g)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.33(3H, s), 3.71-3.73(2H, m), 4.21-4.22(2H, m), 6.28(1H, d, J=7.2Hz), 7.15(1H, s), 8.59(1H, d, J=7.2Hz), 8.40(1H, s)
[실시예]
실시예
1
N-(4-(6- 시아노 -7-(3-(4- 피리딜 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 - N' -(4- 메톡시페닐)우레아
실시예 87에서 합성한 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(200 mg)를 디메틸포름아미드(4 ml) 에 용해하고, 탄산칼륨(130 mg, 0.9400 mmol), 요드화칼륨(3 mg), 1-클로로-3-(4-피리딜)프로판(80 mg, 0.5159 mmol)을 가하여, 80℃에서 5시간동안30분 가열 교반했다. 방냉후 포화식염수를 가한 후 초산에틸로 추출하고, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 용매를 감압 증류 수거하고, 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제했다. 생성된 결정을 에탄올에 현탁시켜, 이것을 디에틸에테르로 희석하여, 결정을 여과 수취하고, 디에틸에테르로 세척, 흡인 건조시킴으로써, 담황색 결정으로서 표제 화합물(60 mg)을 얻었다.
*1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.17(2H, d), 2.84(2H, t, J=7.8Hz), 3.70(3H, s), 4.28(2H, t, J=6.2Hz), 6.51(1H, d, J=5.2Hz), 6.86(2H, d, J=9.0Hz), 7.22(2H, d, J=9.0Hz), 7.29(2H, d, J=6.0Hz), 7.35(2H, d, J=9.0Hz), 7.57(1H, s), 7.58(2H, d, J=9.0Hz), 8.46(2H, d, J=6.0Hz), 8.49(1H, s), 8.71(1H, d, J=5.2Hz), 8.74(1H, s), 8.76(1H, s).
실시예
2
N-(4-(6- 시아노 -7-(4- 피코릴옥시 )- 퀴놀릴)옥시페닐 )- N' -(4- 메톡시페닐 ) 우레아
실시예 87에서 합성한 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(100 mg)를 디메틸포름아미드(2 ml)에 용해하고, 탄산칼륨(97 mg, 0.7018 mmol), 요드화칼륨(3 mg), 4-피코릴클로라이드(40 mg, 0.2462 mmol)를 가하여, 80℃에서 3시간동안 가열 교반했다. 방냉후 물을 가한 후 초산에틸로 추출하고, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거하여, 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제했다. 생성된 결정을 아세톤에 현탁시켜, 이것을 디에틸에테르로 희석시키고, 결정을 여과 수취하여, 디에틸에테르로 세척하고, 흡인 건조시킴으로써, 담황색 결정인 표제 화합물(30 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.70(3H, s), 5.54(2H, s), 6.53(1H, d, J=5.2Hz), 6.86(2H, d, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.36(2H, d, J=8.8Hz), 7.52(2H, d, J=6.4Hz), 7.59(2H, d, J=8.8Hz), 7.66(1H, s), 8.55(1H, brs), 8.63(2H, d, J=6.0Hz), 8.72(1H, d, J=5.2Hz), 8.81(1H, brs), 8.82(1H, s).
*실시예 3
N-(4-(6- 시아노 -7-(3- 피코릴옥시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐 ) 우레아
실시예 87에서 합성한 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(200 mg)를 이용하여 실시예 2와 같은 식의 반응을 행하여, 표제 화합물(68 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.70(3H, s), 5.50(2H, s), 6.54(1H, d, J=5.0Hz), 6.86(2H, d, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.35(2H, d, J=8.8Hz), 7.49(2H, dd, J=4.8Hz, 7.6Hz), 7.58(2H, d, J=8.8Hz), 7.74(1H, s), 7.95(1H, d, J=7.6Hz), 8.49(1H, s), 8.59(1H, dd, J=1.6,Hz, 4.8Hz), 7.83-8.80(3H, m).
실시예
4
N-(4-(6- 시아노 -7-(2-(1,2,3- 트리아졸 -2-일) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4-플루오로페닐)우레아(실시예 4-A)
N-(4-(6- 시아노 -7-(2-(1,2,3- 트리아졸 -1-일) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4-플루오로페닐)우레아(실시예 4-B)
실시예 90에서 합성한 N-(4-(6-시아노-7-(2-클로로에톡시)-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(210 mg, 0.4403 mmol)를 N,N-디메틸포름아미드(2.5 ml)에 용해하고, 탄산칼륨(180 mg, 1.3209 mmol), 요드화칼륨(15 mg), 1H-1,2,3-트리아졸(0.078 ml, 1.3209 mmol)을 가하여, 60℃에서 20분간, 이어서 65℃에서 3시간동안 가열 교반했다. 방냉후 테트라히드로푸란, 초산에틸을 가하여, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 용매를 감압 증류 수거한 후, 실리카겔 컬럼 크로마토그래피(초산에틸·메탄올계)에 가하여, 이성체 분리를 했다. 저극성인 것은 생성된 결정을 에탄올에 현탁시켜 세척하고, 여과 수취하고, 그 후 디메틸설폭시드에 용해시킨 다음, 이것을 에탄올로 희석하여 결정을 석출시켜, 여과 수취하고, 에탄올, 이어서 디에틸에테르로 세척하고, 흡인 건조시킴으로써, 또 고극성인 것은 생성된 결정을 에탄올에 현탁시켜 세척하고, 여과 수취하고, 에탄올, 이어서 디에틸에테르로 세척하고, 흡인 건조시킴으로써, 각각 무색 결정으로서, 저극성 N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-2-일)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(37 mg, 0.0703 mmol, 16.02%), 고극성 N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-1-일)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(62 mg, 0.1182 mmol, 26.85%)을 얻었다.
저극성
(
실시예
4-A)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.81(2H, t, J=4.6Hz), 4.92(2H, t, J=4.6Hz), 6.52(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.46(2H, dd, J=5.0Hz, 8.8Hz), 7.59(2H, d, J=8.8Hz), 7.65(1H, s), 7.80(2H, s), 8.71(1H, s), 8.72(1H, d, J=5.2Hz), 8.77(1H, s), 8.86(1H, s).
고극성
(
실시예
4-B)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.72(2H, t, J=4.8Hz), 4.93(2H, t, J=4.8Hz), 6.53(1H, d, J=5.2Hz), 7.11(2H, t, J=8.4Hz), 7.23(2H, d, J=8.8Hz), 7.46(2H, dd, J=4.4Hz, 8.4Hz), 7.59(2H, d, J=8.8Hz), 7.64(1H, s), 7.77(1H, s), 8.18(1H, s), 8.73(1H, d, J=5.2Hz), 8.73(1H, s), 8.75(1H, s), 8.83(1H, s).
실시예
5
N-(4-(6- 시아노 -7-(2-(1,2,3- 트리아졸 -2-일) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4-메톡시페닐)우레아(실시예 5-A)
N-(4-(6- 시아노 -7-(2-(1,2,3- 트리아졸 -1-일) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4-메톡시페닐)우레아(실시예 5-B)
실시예 91에서 합성한 N-(4-(6-시아노-7-(2-클로로에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(300 mg, 0.6136 mmol)를 이용하여 실시예 4와 같은 식의 반응을 수행하여, 각각 무색 결정으로서, 저극성 N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-2-일)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(87 mg, 0.1652 mmol, 26.93%), 고극성 N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-1-일)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(83 mg, 0.1576 mmol, 25.69%)를 얻었다.
저극성
(
실시예
5-A)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.70(3H, s), 4.81(2H, t, J=5.0Hz), 4.92(2H, t, J=5.0Hz), 6.52(1H, d, J=5.4Hz), 6.86(2H, d, J=8.8Hz), 7.21(2H, d, J=9.2Hz), 7.35(2H, d, J=8.8Hz), 7.57(2H, d, J=9.2Hz), 7.65(1H, s), 7.80(2H, s), 8.49(1H, s), 8.71(1H, s), 8.72(1H, d, J=5.4Hz), 8.73(1H, s).
고극성
(
실시예
5-B)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.70(3H, s), 4.72(2H, t, J=5.2Hz), 4.93(2H, t, J=5.2Hz), 6.53(1H, d, J=5.2Hz), 6.85(2H, d, J=9.0Hz), 7.21(2H, d, J=9.0Hz), 7.35(2H, d, J=9.0Hz), 7.57(2H, d, J=9.0Hz), 7.64(1H, s), 7.77(1H, s), 8.18(1H, s), 8.49(1H, s), 8.72(1H, d, J=5.2Hz), 8.73(1H, s), 8.75(1H, s).
실시예
6
N-(4-(6- 시아노 -7-(2-(1,2,3- 트리아졸 -2-일) 에톡시 )-4- 퀴놀릴 ) 옥시 -3- 플루오로페닐)-N'-(2,4-디플루오로페닐)우레아(실시예 6-A)
N-(4-(6- 시아노 -7-(2-(1,2,3- 트리아졸 -1-일) 에톡시 )-4- 퀴놀릴 ) 옥시 -3- 플루오로페닐)-N'-(2,4-디플루오로페닐)우레아(실시예 6-B)
수소화나트륨(35 mg, 0.8774 mmol, 오일중 60%에서)을 N,N-디메틸포름아미드(2.5 ml)에 현탁시키고, 빙냉하 1H-1,2,3-트리아졸 1H-1,2,3-트리아졸(0.051 ml, 0.8774 mmol)을 실온에서 완전히 용해될 때까지 15분간 교반했다. 이것에 N-(4-(6-시아노-7-(2-클로로에톡시)-4-퀴놀릴)옥시페닐)-N'-(2,4-디플루오로페닐)우레아(225 mg, 0.4386 mmol), 요드화칼륨(10 mg)을 가하여 50℃에서 10시간동안 가열 교반했다. 방냉후 테트라히드로푸란, 초산에틸을 가하여, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하고, 용매를 감압 증류하여 수거한 후, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸·메탄올계)에 가하여, 이성체 분리를 했다. 저극성인 것은 생성된 결정을 디메틸설폭시드에 용해하고, 이것을 에탄올로 희석하여 결정을 석출시켜, 여과 수취하고, 에탄올, 이어서 디에틸에테르로 세척, 흡인하여 건조시킴으로써, 고극성인 것은 NH 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 생성된 결정을 에탄올에 현탁시키고 세척하고, 이것을 헥산으로 희석한 후 여과 수취하고, 헥산으로 세척하고, 흡인 건조시킴으로써, 핑크색 결정으로서 저극성 N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-2-일)에톡시)-4-퀴놀릴)옥시-3-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아(15 mg, 0.0275 mmol, 6.27%)을, 또, 무색 결정으로서 고극성 N-(4-(6-시아노-7-(2-(1,2,3-트리아졸-1-일)에톡시)-4-퀴놀릴)옥시-3-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아(30 mg, 0.0550 mmol, 12.54%)을 얻었다.
저극성
(
실시예
6-A)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.82(2H, t, J=4.8Hz), 4.92(2H, t, J=4.82Hz), 6.63(1H, d, J=5.0Hz), 7.05(1H, m), 7.14(1H, d, J=9.6Hz), 7.32(1H, m), 7.40(1H, m), 7.66(1H, s), 7.80(2H, s), 8.11(1H, m), 8.26(1H, t, J=9.6Hz), 8.70(1H, s), 8.75(1H, d, J=5.0Hz), 8.99(1H, s), 9.07(1H, s).
고극성
(
실시예
6-B)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.73(2H, t, J=5.2Hz), 4.93(2H, t, J=5.2Hz), 6.63(1H, d, J=5.2Hz), 7.05(1H, m), 7.15(1H, m), 7.32(1H, ddd, J=2.8Hz, 8.8Hz, 11.6Hz), 7.40(1H, dd, J=2.8Hz, 11.6Hz), 7.66(1H, s), 7.77(1H, s), 8.11(1H, m), 8.18(1H, s), 8.26(1H, t, J=8.8Hz), 8.74(1H, s), 8.75(1H, d, J=5.2Hz), 8.99(1H, d, J=2.2Hz), 9.07(1H, d, J=2.2Hz).
실시예
7
N-(4-(6- 시아노 -7-(3-(모르폴린-4-일) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4-메톡시페닐)우레아
실시예 87에서 합성한 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(100 mg)를 디메틸포름아미드(2.5 ml)에 용해하고, 탄산칼륨(65 mg, 0.4690 mmol), 1-클로로-3-(모르폴린-4-일)프로판(38 mg, 0.2345 mmol, J. Am. Chem. Soc. 67, 736(1945)에 기재한 방법으로 합성)을 가하여, 80℃에서 2시간동안 가열 교반했다. 방냉후 포화식염수를 가한 후 초산에틸로 추출하고, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 용매를 감압 증류 수거하고, 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제했다. 생성된 결정을 초산에틸에 현탁시켜, 이것을 디에틸에테르로 희석시키고, 결정을 여과 수취하고, 디에틸에테르로 세척하여, 흡인 건조시킴으로써, 담황색 결정으로서 표제 화합물(120 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.99(2H, m), 2.38(4H, brs), 2.49(2H, m), 3.57(4H, t, J=4.6Hz), 3.70(3H, s), 4.33(2H, t, J=6.2Hz), 6.51(1H, d, J=5.6Hz), 6.86(2H, d, J=9.2Hz), 7.22(2H, d, J=9.2Hz), 7.35(2H, d, J=9.2Hz), 7.58(2H, d, J=9.2Hz), 7.59(1H, s), 8.49(1H, s), 8.71(1H, d, J=5.6Hz), 8.74(1H, s), 8.75(1H, s).
실시예
8
N-(4-(6- 시아노 -7-(3-(1,2,3- 트리아졸 -2-일) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )-N'-(4-메톡시페닐)우레아
실시예 7과 같은 식의 조작에 의해 실시예 87에서 합성한 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트와 2-(3-클로로프로필)1,2,3-트리아졸로부터 표제 화합물을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.41(2H, m), 3.70(3H, s), 4.29(2H, t, J=6.0Hz), 4.68(2H, t, J=6.6Hz), 6.52(1H, d, J=5.2Hz), 6.86(2H, d, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.35(2H, d, J=8.8Hz), 7.54(1H, s), 7.58(2H, d, J=8.8Hz), 7.78(2H, s), 8.49(1H, s), 8.71(1H, d, J=5.2Hz), 8.74(1H, s), 8.77(1H, s).
실시예
9
N-(4-(6- 시아노 -7-(3-(1,2,3- 트리아졸 -1-일) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )-N'-(4-메톡시페닐)우레아
실시예 7과 같은 식의 조작에 의해 실시예 87에서 합성한 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트와 1-(3-클로로프로필)-1,2,3-트리아졸로부터 표제 화합물을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.41(2H, m), 3.70(3H, s), 4.28(2H, t, J=6.0Hz), 4.63(2H, t, J=6.6Hz), 6.52(1H, d, J=5.4Hz), 6.86(2H, d, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.35(2H, d, J=8.8Hz), 7.57(1H, s), 7.58(2H, d, J=8.8Hz), 7.73(1H, s), 8.19(1H, s), 8.49(1H, s), 8.72(1H, d, J=5.4Hz), 8.74(1H, s), 8.77(1H, s).
실시예
10
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
4-(4-아미노페녹시)-7-(2-메톡시에톡시)-6-시아노퀴놀린(109 mg, 0.325 mmol)을 톨루엔(5 ml)에 가열하에 용해시킨 후, 4-플루오로페닐 이소시아네이트(0.057 ml, 0.488 mmol)를 가하여 1시간동안 가열 환류했다. 방냉후, 석출된 결정을 여과 수취하여, 초산에틸로 세척하고, 감압 건조시켜, 백색 결정으로서 표제 화합물(148 mg, 0.311 mmol, 96.4%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.41-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 7.11(2H, t, J=9.0Hz), 7.23(2H, d, J=9.0Hz), 7.46(2H, q, J=4.8Hz), 7.57-7.62(3H, m), 8.71-8.76(3H, m), 8.82(1H, s).
실시예
11
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2- 피리딜 ) 우레아
페닐N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(104 mg, 0.228 mmol)를 디메틸설폭시드(1 ml)에 용해시킨 후, 2-아미노피리딘(43 mg, 0.457 mmol)을 가하여, 85℃에서 3시간동안 교반하에 가열했다. 방냉후, 초산에틸, 물을 가하여 분배하고, 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 건조제를 여과 분별하고, 감압 농축후, 잔사에 초산에틸-헥산을 가하여, 석출된 결정을 여과 수취하고, 감압 건조시켜, 백색 결정으로서 표제 화합물(86 mg, 0.189 mmol, 82.7%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.39-4.42(2H, m), 6.53(1H, d, J=5.2Hz), 6.99(1H, m), 7.18(1H, d, J=8.4Hz), 7.26(2H, d, J=9.2Hz), 7.56(1H, d, J=8.4Hz), 7.62(1H, s), 7.68-7.77(3H, m), 8.26(1H, d, J=5.2Hz), 8.72(1H, d, J=5.2Hz), 8.77(1H, s), 9.89(1H, brs).
실시예
12
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(1,3-티아졸-2-일)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(106 mg, 0.233 mmol)로부터 표제 화합물(37 mg, 0.08 mmol, 34.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.79(2H, m), 4.40-4.43(2H, m), 6.53(1H, d, J=5.6Hz), 7.10(1H, d, J=3.2Hz), 7.72(1H, d, J=8.8Hz), 7.37(1H, m), 7.57-7.67(3H, m), 8.72(1H, d, J=5.2Hz), 8.77(1H, s), 9.53(1H, brs).
실시예
13
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 히드록시페닐)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(117 mg, 0.257 mmol)로부터 표제 화합물(52 mg, 0.110 mmol, 43.0%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.77-3.79(2H, m), 4.41-4.43(2H, m), 6.51(1H, d, J=5.2Hz), 6.67(2H, d, J=8.0Hz), 7.15-7.25(3H, m), 7.57(2H, d, J=8.0Hz), 7.62(1H, s), 8.37(1H, s), 8.70-8.76(3H, m), 9.05(1H, s).
실시예
14
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3- 메톡시페닐 )우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(120 mg, 0.263 mmol)로부터 표제 화합물(50 mg, 0.103 mmol, 39.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.72(3H, s), 3.76-3.79(2H, m), 4.39-4.43(2H, m), 6.50-6.57(2H, m), 6.93(1H, d, J=8.0Hz), 7.14-7.19(2H, m), 7.24(2H, d, J=8.8Hz), 7.59(2H, d, J=8.8Hz), 7.62(1H, s), 8.69-8.73(2H, m), 8.76(1H, s), 8.80(1H, s).
실시예
15
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3- 히드록시페닐)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(102 mg, 0.234 mmol)로부터 표제 화합물(25 mg, 0.053 mmol, 23.7%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.79(2H, m), 4.40-4.43(2H, m), 6.36(1H, d, J=9.2Hz), 6.52(1H, d, J=5.2Hz), 6.79(1H, d, J=8.0Hz), 7.00-7.06(2H, m), 7.23(2H, d, J=9.2Hz), 7.58(2H, d, J=8.8Hz), 7.62(1H, s), 8.59(1H, s), 8.71(1H, d, J=4.8Hz), 8.76(1H, s), 9.31(1H, brs).
실시예
16
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2- 히드록시페닐)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(108 mg, 0.237 mmol)로부터 표제 화합물(78 mg, 0.166 mmol, 69.9%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.6Hz), 6.69-6.85(3H, m), 7.22(2H, d, J=8.8Hz), 7.57-7.62(3H, m), 7.99(1H, d, J=8.0Hz), 8.34(1H, br), 8.71(1H, d, J=5.2Hz), 8.76(1H, s), 9.62(1H, brs).
실시예
17
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(1H-2- 이미다졸릴)우레아
2-아미노이미다졸(132 mg, 1.0 mmol)을 디메틸포름아미드(2 ml)와 물(1 ml)의 혼합 용매에 용해시킨 후, 트리에틸아민(0.42 ml, 3.0 mmol), 페닐클로로포르메이트(0.14 ml, 1.1 mmol)를 실온에서 가하여 10분간 교반했다. 이것에 4-(4-아미노페녹시)-7-(2-메톡시에톡시)-6-시아노퀴놀린(168 mg, 0.5 mmol)을 가하여 하룻밤 교반했다. 반응액을 초산에틸(30 ml)로 희석한 후, 물(10 mlx2), 포화식염수(10 ml)로 세척하여, 유기층을 무수황산나트륨으로 건조시켰다. 건조제를 여과 분별하여, 여과액을 감압 농축하고, 잔사를 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:에탄올 95:5)에 의해 정제하여, 백색 결정으로서 표제 화합물(20 mg, 0.045 mmol, 8.98%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.53(1H, d, J=5.2Hz), 6.70(1H, s), 7.24(2H, d, J=8.8Hz), 7.57-7.67(3H, m), 8.72(1H, d, J=5.6Hz), 8.76(1H, s).
실시예
18
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2,4- 디플루오로페닐)우레아
4-(4-아미노페녹시)-7-(2-메톡시에톡시)-6-시아노퀴놀린(106 mg, 0.316 mmol)으로부터 실시예 10과 같은 식의 수법에 의해 표제 화합물(136 mg, 0.277 mmol, 87.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 7.04(1H, m), 7.23-7.34(3H, m), 7.57-7.62(3H, m), 8.06(1H, m), 8.52(1H, s), 8.71(1H, d, J=5.6Hz), 8.76(1H, s), 9.16(1H, s).
실시예
19
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3- 시아노페닐 )우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(109 mg, 0.239 mmol)로부터 표제 화합물(38 mg, 0.079 mmol, 33.1%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 7.26(2H, d, J=8.8Hz), 7.41(1H, d, J=6.4Hz), 7.49(1H, t, J=8.0Hz), 7.55-7.62(3H, m), 7.68(1H, dd, J=1.2, 8.8Hz), 7.97(1H, s), 8.71(1H, d, J=6.4Hz), 8.76(1H, s), 9.00(1H, s), 9.05(1H, s).
실시예
20
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2- 플루오로페닐)우레아
4-(4-아미노페녹시)-7-(2-메톡시에톡시)-6-시아노퀴놀린(109 mg, 0.325 mmol)으로부터 실시예 10과 같은 식의 수법에 의해, 표제 화합물(75 mg, 0.159 mmol, 48.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 7.01(1H, m), 7.13(1H, t, J=8.0Hz), 7.20-7.27(3H, m), 7.55-7.63(3H, m), 8.14(1H, t, J=8.0Hz), 8.56(1H, brs), 8.72(1H, d, J=6.4Hz), 8.76(1H, s), 9.22(1H, s).
실시예
21
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3-( 메틸설포닐 )페닐)우레아
4-(4-아미노페녹시)-7-(2-메톡시에톡시)-6-시아노퀴놀린(100 mg, 0.298 mmol)에 대해, 디이소프로필에틸아민(0.057 ml, 0.328 mmol), 페닐 N-[3-(메틸설포닐)페닐]카르바메이트(96 mg, 0.328 mmol)를 반응시켜, 실시예 34와 같은 식의 수법에 의해, 표제 화합물(120 mg, 0.225 mmol, 75.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.19(3H, s), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.53(1H, d, J=5.6Hz), 7.26(2H, d, J=8.8Hz), 7.50-7.69(6H, m), 8.16(1H, brs), 8.72(1H, d, J=5.2Hz), 8.76(1H, s), 8.95(1H, s), 9.15(1H, s).
실시예
22
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3-( 메틸설파닐 )페닐)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(193 mg, 0.424 mmol)로부터 표제 화합물(210 mg, 0.420 mmol, 98.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.43(3H, s), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 6.83(1H, d, J=7.2Hz), 7.14-7.24(4H, m), 7.48(1H, s), 7.58-7.61(3H, m), 8.71(1H, d, J=5.2Hz), 8.75(1H, s), 9.62(1H, s), 9.76(1H, s).
실시예
23
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' - 시클로프로필우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(195 mg, 0.428 mmol)로부터 표제 화합물(145 mg, 0.347 mmol, 80.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.4(2H, brs), 0.63(2H, d, J=6.8Hz), 2.53(1H, m), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.42(1H, s), 6.48(1H, d, J=5.2Hz), 6.97(2H, d, J=9.2Hz), 7.53(2H, d, J=9.2Hz), 7.60(1H, s), 8.44(1H, s), 8.70(1H, d, J=4.8Hz), 8.74(1H, s).
실시예
24
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로 -2-히드록시페닐)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(156 mg, 0.343 mmol)로부터 표제 화합물(132 mg, 0.270 mmol, 78.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.6Hz), 6.57(1H, m), 6.62(1H, m), 7.23(2H, d, J=8.8Hz), 7.57(2H, d, J=8.8Hz), 7.62(1H, s), 7.98(1H, m), 8.12(1H, s), 8.71(1H, d, J=5.6Hz), 9.40(1H, s), 10.47(1H, s).
실시예
25
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(1,3-티아졸-2-일)우레아
페닐 N-(4(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(200 mg)와 2-아미노티아졸(85 mg)을 디메틸포름아미드 1 ml에 용해하고, 여기에 트리에틸아민 0.12 ml를 가하여, 90℃에서 2시간동안 가열 교반했다. 방냉후에, 물을 가하여 석출되는 개체를 여과 수취하고, 이것을 초산에틸로 세척하여 110 mg(수율 57%)의 표제 화합물을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.37(3H, s), 3.75-3.80(2H, m), 4.40-4.45(2H, m), 6.63(1H, d, J=5.6Hz), 7.14(1H, d, J=3.2Hz), 7.16-7.20(1H, m), 7.39(1H, d, J=3.2Hz), 7.42-7.47(1H, m), 7.64(1H, s), 8.21-8.27(1H, m), 8.74-8.76(2H, m)
실시예
26
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' - 시클로프로필우레아
실시예 25와 같은 식의 수법에 의해, 페닐 N-(4(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(147 mg, 0.310 mmol)로부터 표제 화합물(83 mg, 0.190 mmol, 61.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.40(2H, br), 0.61-0.66(2H, m), 2.53(1H, m), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.58(1H, d, J=5.6Hz), 6.79(1H, d, J=2.0Hz), 7.08(1H, dd, J=2.0, 10.4Hz), 7.32(1H, dd, J=2.4, 11.6Hz), 7.62(1H, s), 8.18-8.22(2H, m), 8.71-8.74(2H, m).
실시예
27
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' - 시클로프로필메틸우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(157 mg, 0.345 mmol)로부터 표제 화합물(144 mg, 0.333 mmol, 96.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.16-0.18(2H, m), 0.39-0.43(2H, m), 0.94(1H, m), 2.97(2H, t, J=6.4Hz), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.22(1H, m), 6.49(1H, d, J=5.6Hz), 7.17(2H, d, J=8.8Hz), 7.52(2H, d, J=8.8Hz), 7.61(1H, s), 8.60(1H, s), 8.70(1H, d, J=5.2Hz), 8.75(1H, s).
실시예
28
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' - 시클로프로필메틸우레아
실시예 25와 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(147 mg, 0.310 mmol)로부터 표제 화합물(83 mg, 0.190 mmol, 61.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.16-0.18(2H, m), 0.41-0.46(2H, m), 0.94(1H, m), 2.99(2H, t, J=6.0Hz), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.58(1H, d, J=5.6Hz), 6.71(1H, t, J=5.6Hz), 7.08(1H, d, J=9.2Hz), 7.33(1H, dd, J=2.8, 11.6Hz), 7.63(1H, s), 8.24(1H, t, J=9.2Hz), 8.38(1H, s), 8.55-8.59(2H, m).
실시예
29
N-(4-(6- 시아노 -7-(3-(모르폴린-4-일) 프로폭시 )-4- 퀴놀릴옥시 )-2- 플루오로페닐)-N'-(2,4-디플루오로페닐)우레아
N-(4-(6-시아노-7-히드록시퀴놀린-4-일옥시)-2-플루오로페닐)-N-(2,4-디플루오로페닐)우레아(100 mg, 0.2220 mmol)를 이용하여 실시예 7과 같은 식의 반응을 행하여, 담황색 결정으로서 표제 화합물(35 mg, 0.0606 mmol, 27.30%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.99(2H, m), 2.38(4H, brs), 2.50(2H, t, J=7.2Hz), 3.57(4H, t, J=4.6Hz), 4.33(2H, t, J=6.4Hz), 6.62(1H, d, J=5.4Hz), 7.06(1H, m), 7.15(1H, m), 7.32(1H, ddd, J=2.8Hz, 8.8Hz, 11.6Hz), 7.41(1H, dd, J=2.8Hz, 11.6Hz), 7.61(1H, s), 8.12(1H, m), 8.27(1H, dt, J=2.0Hz, 9.2Hz), 8.74(1H, s), 8.74(1H, d, J=5.4Hz), 8.99(1H, m), 9.07(1H, m).
실시예
30
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴옥시 ) 페닐 )- N' -(4- 플루오로페닐)우레아
나트륨 6-시아노-4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(110 mg, 0.252 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(69 mg, 0.131 mmol, 51.9%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.2Hz), 1.89-1.95(2H, m), 2.44-2.49(4H, m), 2.58-2.62(2H, m), 4.31(2H, t, J=6.0Hz), 6.51(1H, d, J=5.2Hz), 7.11(2H, t, J=8.4Hz), 7.23(2H, d, J=8.8Hz), 7.44-7.48(2H, m), 7.56-7.57(2H, m), 7.60(1H, s), 8.71(1H, d, J=5.2Hz), 8.74-8.76(2H, m), 8.85(1H, s).
실시예
31
N-(4-(6- 시아노 -7-(3-(4- 모르폴리노 )프로필)-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
6-시아노-4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(110 mg, 0.252 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(73 mg, 0.135 mmol, 53.5%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.99(2H, t, J=6.4Hz), 2.30-2.60(6H, m), 3.55-3.58(4H, m), 4.31-4.34(2H, m), 6.51(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.23(2H, d, J=9.2Hz), 7.44-7.48(2H, m), 7.57-7.60(3H, m), 8.70-8.75(3H, m), 8.82(1H, s).
실시예
32
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2-피리딜)우레아
실시예 25의 방법과 같은 식으로 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(250 mg)와 2-아미노피리딘(100 mg)으로부터 표제 화합물 210 mg(수율 84%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.80(2H, m), 4.39-4.45(2H, m), 6.64(1H, d, J=5.2Hz), 7.00-7.05(1H, m), 7.15-7.19(1H, m), 7.37-7.47(2H, m), 7.64(1H, s), 7.50-7.80(1H, m), 8.25-8.30(1H, m), 8.31-8.37(1H, m), 8.74(1H, d, J=5.2Hz), 8.76(1H, s), 9.87(1H, s)
실시예
33
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(3-(메틸설파닐)페닐)우레아
실시예 25의 방법과 같은 식으로 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(160 mg)와 3-(메틸티오)아닐린(88 mg)으로부터 표제 화합물 100 mg(수율 61%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.43(3H, s), 3.36(3H, s), 3.75-3.80(2H, m), 4.40-4.45(2H, m), 6.62(1H, d, J=5.6Hz), 6.86-6.89(1H, m), 7.11-7.17(2H, m), 7.20-7.25(1H, m), 7.37-7.43(1H, m), 7.47(1H, s), 7.63(1H, s), 8.21-8.28(1H, m), 8.66(1H, brs), 8.73-8.76(2H, m), 9.11-9.13(1H, m)
*실시예 34
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(3-(메틸설포닐)페닐)우레아
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(106 mg)과 페닐 N-(3-(메틸설포닐)페닐)카르바메이트(96 mg)를 톨루엔 5 ml에 가하고, 또 디이소프로필에틸아민 0.06 ml를 가하여, 3시간동안 가열 환류했다. 방냉후 초산에틸을 가하여, 석출된 불용물을 여과했다. 여과액을 농축하여 생성된 잔사를 테트라히드로푸란으로 용해하여, 여기에 톨루엔을 가하고, 석출된 고체를 여과 수취하여, 표제 화합물 13 mg(수율 8%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.20(3H, s), 3.35(3H, s), 3.75-3.80(2H, m), 4.38-4.43(2H, m), 6.63(1H, d, J=5.2Hz), 7.14-7.17(1H, m), 7.39-7.45(1H, m), 7.51-7.61(2H, m) 7.62-7.70(2H, m), 8.16-8.27(2H, m), 8.73-8.76(3H, m), 9.47-9.49(1H, m)
실시예
35
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2-플루오로페닐)우레아
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(100 mg)을 톨루엔 4.5 ml에 가하여, 가열 환류했다. 여기에 2-플루오로페닐이소시아네이트(0.05 ml)를 가하여, 1시간동안 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 초산에틸/톨루엔=1/1로 세척하여 표제 화합물 100 mg(수율 72%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.37(3H, s), 3.75-3.80(2H, m), 4.40-4.45(2H, m), 6.62(1H, d, 5.6Hz), 6.97-7.05(1H, m), 7.11-7.18(1H, m), 7.21-7.28(1H, m), 7.38-7.45(1H, m), 7.64(1H, s), 8.14-8.20(1H, m), 8.26-8.33(1H, m), 8.73-8.76(2H, m), 9.06(1H, brs), 9.14(1H, brs)
실시예
36
N-(4-(6- 시아노 -7- 메톡시 -4- 퀴놀릴 ) 옥시페닐 )- N' -(2,4- 디플루오로페닐 ) 우레아
4-(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(180 mg)을 톨루엔 5.5 ml에 가하여, 가열 환류했다. 여기에 2,4-디플루오로페닐이소시아네이트(0.12 ml)를 가하여, 1시간동안 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 초산에틸/톨루엔=1/1로 세척하여 표제 화합물 195 mg(수율70%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.05(3H, s), 6.52(1H, d, J=5.2Hz), 7.01-7.08(1H, m), 7.21-7.34(3H, m), 7.56-7.62(3H, m), 8.02-8.10(1H, m), 8.52(1H, s), 8.72(1H, d, J=5.2Hz), 8.76(1H, s), 9.18(1H, s).
실시예
37
N-(4-(6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시페닐
)-
N'
-
페닐우레아
4-(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(148 mg)을 톨루엔 5.5 ml에 가하여 가열 환류했다. 여기에 페닐이소시아네이트(0.08 ml)를 가하여, 1시간동안 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 초산에틸/톨루엔=1/1으로 세척하여 표제 화합물 150 mg을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.05(3H, s), 6.50-6.54(1H, m), 6.96(t, 1 H, 7.2Hz), 7.23(2H, d, J=9.2Hz), 7.27(2H, d, J=7.2Hz), 7.44(2H, d, J=7.2Hz), 7.56-7.62(3H, m), 8.68-8.77(3H, m), 8.83(1H, brs).
실시예
38
N-(4-(6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시페닐
)-
N'
-(1-부틸)
우레아
4-(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(150 mg)을 톨루엔 2.5 ml과 아세토니트릴 2.5 ml에 가하여, 가열 환류했다. 여기에 n-부틸 이소시아네이트(0.12 ml)를 가하여, 1시간동안 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 초산에틸/톨루엔=1/1로 세척하여 표제 화합물 110 mg(수율 55%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.88(3H, t, J=7.6Hz), 1.25-1.45(4H, m), 3.04-3.11(2H, m), 4.05(3H, s), 6.13(1H, t, J=5.6Hz), 6.49(1H, d, J=5.6Hz), 7.16(2H, d, J=9.2Hz), 7.52(2H, d, J=9.2Hz), 7.58(1H, s), 8.55(1H, s), 8.71(1H, d, J=5.6Hz), 8.75(1H, s)
실시예
39
N-(4-(6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시페닐
)-
N'
-(4-
플루오로페닐
)
우레아
4-(4-아미노페녹시)-6-시아노-7-메톡시에톡시퀴놀린(150 mg)을 톨루엔 5.0 ml과 아세토니트릴 2.5 ml에 가하여, 가열 환류했다. 여기에 4-플루오로페닐 이소시아네이트(0.12 ml)를 가하여, 1시간동안 가열 환류했다. 방냉후, 석출한 고체를 여과 수취하고, 초산에틸/톨루엔=1/1로 세척하여 표제 화합물 150 mg(수율68%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.05(3H, s), 6.52(1H, d, J=5.6Hz), 7.08-7.14(2H, m), 7.23(2H, d, J=8.8Hz), 7.43-7.49(2H, m), 7.56-7.61(3H, m), 8.71-8.76(3H, m), 8.85(1H, s)
실시예
40
N-(4-(6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시페닐
)-
N'
-(2-
피리딜
)
우레아
페닐 N-(4-(6-시아노-7-메톡시-4-퀴놀릴)옥시페닐)카르바메이트(150 mg)와 2-아미노피리딘(69 mg)을 디메틸설폭사미드 1 ml에 용해하여 80℃에서 1.5시간동안 가열 교반했다. 방냉후에, 물을 가하여 석출되는 개체를 여과 수취하고, 이것을 초산에틸로 세척하여 82 mg(수율 54%)의 표제 화합물을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.05(3H, s), 6.54(1H, d, J=5.6Hz), 6.98-7.03(1H, m), 7.26-7.30(2H, m), 7.45-7.52(1H, m), 7.60(1H, s), 7.63-7.78(3H, m), 8.25-8.30(1H, m), 8.73(1H, d, J=5.6Hz), 8.78(1H, s), 9.59(1H, s), 10.67(1H, s)
실시예
41
N-(4-(6-
시아노
-7-
메톡시에톡시
-4-
퀴놀릴
)
옥시
-
페닐
)-
N'
-(3-
피리딜
)
우레아
실시예 40의 방법과 같은 식으로, 페닐 N-(4-(6-시아노-7-메톡시-4-퀴놀릴)옥시페닐)카르바메이트(100 mg)와 3-아미노피리딘(46 mg)으로부터 표제 화합물 32 mg(수율 32%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.05(3H, s), 6.53(1H, d, J=5.2Hz), 7.22-7.34(3H, m), 7.57-7.63(3H, m), 7.91-7.96(1H, m), 8.17-8.20(1H, m), 8.59-8.63(1H, m), 8.73(1H, d, J=5.2Hz), 8.76(1H, s), 8.91(1H, brs), 9.00(1H, brs).
실시예
42
N-(4-(6-
시아노
-7-
메톡시에톡시
-4-
퀴놀릴
)
옥시
-
페닐
)-
N'
-(4-
피리딜
)
우레아
실시예 40의 방법과 같은 식으로, 페닐 N-(4-(6-시아노-7-메톡시-4-퀴놀릴)옥시페닐)카르바메이트(150 mg)와 4-아미노피리딘(69 mg)으로부터 표제 화합물 45 mg(수율 30%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.05(3H, s), 6.54(1H, d, J=5.2Hz), 7.26(2H, d, J=9.0Hz), 7.43(2H, d, J=7.0Hz), 7.57-7.64(3H, m), 8.35(2H, d, J=7.0Hz), 8.71-8.77(2H, m), 9.05(1H, brs), 9.16(1H, brs).
실시예
43
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(131 mg)로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물 10 mg을 얻었다.
1H-NMR(CDCl3) δ(ppm) : 2.02-2.15(2H, m), 2.27(6H, s), 2.54(2H, t, J=7.4Hz), 3.80(3H, s),4.28(2H, t, J=7.4Hz), 6.42(1H, d, J=5.3Hz), 6.80(1H, brs), 6.90(2H, d, J=9.3Hz), 7.03(1H, brs), 7.08(2H, d, J=9.3Hz), 7.28(2H, d, J=9.3Hz), 7.46(1H, s), 7.48(2H, d, J=9.3HZ), 8.62(1H, d, J=5.3Hz), 8.66(1H, s)
실시예
44
N-[4-(6- 시아노 -7-(2-(디메틸아미노) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(145 mg)로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물 110 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.28(6H, s), 2.76(2H, t, J=5.3Hz), 3.70(3H, s),4.37(2H, t, J=5.3Hz), 6.51(1H, d, J=5.4Hz), 6.86(2H, d, J=8.7Hz), 7.21(2H, d, J=8.7Hz), 7.35(2H, d, J=8.7Hz), 7.58(2H, d, J=8.7Hz), 7.62(1H, s), 8.50(1H, s), 8.72(1H, d, J=5.4Hz), 8.75(2H, s)
실시예
45
N-(4-(6- 시아노 -7-(3-(1- 피롤로디노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 - N' -(4- 메톡시페닐)우레아
N-(4-(6-시아노-7-(3-클로로프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(140 mg)를 디메틸포름아미드에 용해하고, 피롤리딘(163㎕)을 가하여, 80℃에서 6시간동안 가열 교반했다. 반응액을 포화식염수에 부어, 초산에틸로 추출하였다. 이후, 유기층을 황산마그네슘으로 건조시켜, 농축시켰다. 잔사를 NH 실리카겔(후지시리시아가가쿠)에 가하여, 용매(초산에틸)로 용출하고, 또한, 용매(초산에틸-메탄올=10-1)로 용출하고 농축하여 표제 화합물을 31 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.67-1.73(4H, m), 1.96-2.04(2H, m), 2.44-2.49(4H, m), 2.61(2H, t, J=6.8Hz), 3.72(3H, s), 4.34(2H, t, J=6.4Hz), 6.53(1H, d, J=5.2Hz), 6.88(2H, d, J=8.8Hz), 7.23(2H, d, J=9.2Hz), 7.37(2H, d, J=8.8Hz), 7.60(1H, s), 7.61(2H, d, J=9.2Hz), 8.63(1H, brs), 8.73(1H, d, J=5.2 HZ), 8.76(1H, s), 8.88(1H, brs).
실시예
46
N-(4-(6- 시아노 -7-(3-(1- 피페리디노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(156 mg)로부터 실시예 7과 같은 식의 수법에 의해 표제 화합물 67 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.30-1.57(6H, m), 1.93-2.03(2H, m), 2.31-2.53(6H, m), 3.72(3H, s), 4.33(2H, t, J=6.5Hz), 6.52(1H, d, J=4.9Hz), 6.87(2H, d, J=8.9Hz), 7.23(2H, d, J=8.9Hz), 7.38(2H, d, J=8.9Hz), 7.57-7.63(3H, m), 8.53(1H, brs), 8.72(1H, d, J=4.9Hz), 8.76(1H, s), 8.79(1H, brs)
실시예
47
N-(4-(6- 시아노 -7-(2-(1- 피롤리디노 ) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(188 mg)로부터 실시예 7과 같은 식의 수법에 의해 표제 화합물 54 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.68-1.74(4H, m), 2.58-2.65(4H, m), 2.93(2H, t, J=6.4Hz), 3.72(3H, s), 4.40(2H, t, J=6.4Hz), 6.53(1H, d, J=5.7Hz), 6.88(2H, d, J=9.1Hz), 7.24(2H, d, J=9.1Hz), 7.37(2H, d, J=9.1Hz), 7.60(2H, d, J=9.1Hz), 7.62(1H, s), 8.52(1H, s), 8.73(1H, d, J=5.7Hz), 8.77(2H, s)
실시예
48
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(134 mg)로부터 실시예 7과 같은 식의 수법에 의해 표제 화합물 45 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.97(6H, t, J=7.8Hz), 1.88-1.96(2H, m), 2.43-2.53(4H, m), 2.61(2H, t, J=7.8Hz), 3.72(3H, s),4.33(2H, t, J=7.8Hz), 6.53(1H, d, J=5.2Hz), 6.88(2H, d, J=8.8Hz), 7.24(2H, d, J=8.8Hz), 7.38(2H, d, J=8.8Hz), 7.53-7.63(3H, m), 8.55(1H, s), 8.73(1H, d, J=5.2Hz), 8.76(1H, s), 8.80(1H, s)
실시예
49
N-(4-(6- 시아노 -7-(3-(디메틸아미노) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐)-N'-(2,4-디플루오로페닐)우레아
나트륨 6-시아노-4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-퀴놀리놀레이트(100 mg)로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물 35 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.94-2.01(2H, m), 2.43(2H, t, J=7.2Hz), 2.50(6H, s), 4.33(2H, t, J=7.2Hz), 6.64(1H, d, J=5.2Hz), 7.04-7.46(4H, m), 7.61(1H, s), 8.09-8.34(2H, m), 8.74-8.78(2H, m), 9.06(1H, brs), 9.14(1H, brs).
실시예
50
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐)-N'-(2,4-디플루오로페닐)우레아
나트륨 6-시아노-4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-퀴놀리놀레이트( 95 mg)로부터 실시예 7과 같은 식의 수법에 의해 표제 화합물 43 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.97(6H, t, J=7.8Hz), 1.88-1.98(2H, m), 2.45-2.52(4H, m), 2.61(2H, t, J=7.8Hz), 4.33(2H, t, J=7.8Hz), 6.63(1H, d, J=5.9Hz), 7.03-7.45(4H, m), 7.60(1H, s), 8.09-8.17(1H, m), 8.28(1H, t, J=11.5Hz), 8.74-8.78(2H, m), 9.03(1H, brs), 9.11(1H, brs).
실시예
51
N-(4-(6- 시아노 -7-(4-(디메틸아미노) 부톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
N-(4-(6-시아노-7-(4-클로로부톡시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(120 mg)를 디메틸포름아미드(3 ml)에 용해하고, 50% 디메틸아민 수용액(93 ㎕)을 가하여, 70℃에서 5시간동안 가열 교반했다. 반응액을 포화식염수에 부어, 초산에틸로 추출하고, 유기층을 황산마그네슘으로 건조한 후 농축하여 생성된 잔사를 NH 실리카겔(후지시리시아가가쿠)에 가하여, 용매(초산에틸-메탄올=10-1)로 용출하고, 농축했다. 생성된 고체를 테트라히드로푸란을 이용하여 멜크의 실리카겔에 가하여, 테트라히드로푸란, 초산에틸로 불순물을 용출한 후, 용매(테트라히드로푸란-메탄올-트리에틸아민=10-1-1, 초산에틸-메탄올-트리에틸아민=10-1-1)로 용출하고 농축하여, 고체로서 표제 화합물을 10 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.71-1.78(2H, m), 1.82-1.91(2H, m), 2.42(6H, s), 2.64-2.72(2H, m), 3.72(3H, s), 4.33(2H, t, J=6.0Hz), 6.54(1H, d, J=5.2Hz), 6.88(2H, d, J=8.8Hz), 7.23(2H, d, J=8.8Hz), 7.37(2H, d, J=8.8Hz), 7.60(2H, d, J=8.8Hz), 7.61(1H, s), 8.64(1H, brs), 8.73(1H, d, J=5.2Hz), 8.78(1H, s), 8.91(1H, brs).
실시예
52
N-(4-(6- 시아노 -7-(4- 모르폴리노부톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -4- 메톡시페닐)우레아
실시예 51과 같은 식으로 N-(4-(6-시아노-7-(4-클로로부톡시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(110 mg)로부터 표제 화합물을 11 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.65-1.77(2H, m), 1.84-1.93(2H, m), 2.32-2.48(6H, m), 3.51-3.66(4H, m), 3.72(3H, s), 4.33(2H, t, J=6.0Hz), 6.53(1H, d, J=4.8Hz), 6.88(2H, d, J=8.4Hz), 7.24(2H, d, J=8.4Hz), 7.37(2H, d, J=8.4Hz), 7.60(2H, d, J=8.4Hz), 7.61(1H, s), 8.57(1H, brs), 8.73(1H, d, J=4.8Hz), 8.78(1H, s), 8.82(1H, brs).
실시예
53
N-(4-(6- 시아노 -7-(3-(1-(4-에틸) 피페라지노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )-N'-(4-메톡시페닐)우레아
실시예 51과 같은 식으로, N-(4-(6-시아노-7-(3-클로로프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(150 mg)로부터 표제 화합물을 16 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.98(3H, t, J=7.2Hz), 1.91-2.06(2H, m), 2.26-2.48(12H, m), 3.72(3H, s), 4.33(2H, t, J=6.0Hz), 6.53(1H, d, J=5.2Hz), 6.88(2H, d, J=8.8Hz), 7.23(2H, d, J=8.8Hz), 7.37(2H, d, J=8.8Hz), 7.59(1H, s), 7.60(2H, d, J=8.8Hz), 8.58(1H, brs), 8.73(1H, d, J=5.2 HZ), 8.76(1H, s), 8.83(1H, brs).
실시예
54
N-(4-(6- 시아노 -7-(2-(4- 모르폴리노 ) 에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )-N'-(2,4-디플루오로페닐)우레아
나트륨 6-시아노-4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-퀴놀리놀레이트(200 mg) 우레아로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물을 10 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.56(4H, t, J=4.4Hz), 2.83(2H, t, J=5.6Hz), 3.59(4H, t, J=4.4Hz), 4.43(2H, t, J=5.6Hz), 6.64(1H, d, J=5.2Hz), 7.04-7.10(1H, m), 7.14-7.19(1H, m), 7.30-7.36(1H, m), 7.42(1H, dd, J=2.8Hz, J=12Hz), 7.66(1H, s), 8.10-8.16(1H, m), 8.28(1H, t, J=9.2HZ), 8.75(1H, s), 8.76(1H, d, J=5.2Hz), 9.02-9.05(1H, m), 9.09-9.13(1H, m).
실시예
55
N-(4-(6- 시아노 -7-(3- 시아노프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2,4-디플루오로페닐)우레아
실시예 7과 같은 식으로, 나트륨 6-시아노-4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-퀴놀리놀레이트(300 mg)로부터 표제 화합물을 15 mg 얻었다.
*1H-NMR(DMSO-d6) δ(ppm) : 2.14-2.21(2H, m), 2.73(2H, t, J=7.2Hz), 4.38(2H, t, J=6.4Hz), 6.65(1H, d, J=5.2Hz), 7.04-7.11(1H, m), 7.15-7.19(1H, m), 7.31-7.37(1H, m), 7.43(1H, dd, J=2.8Hz, J=11.6Hz), 7.67(1H, s), 8.10-8.16(1H, m), 8.29(1H, t, J=9.2HZ), 8.77(1H, d, J=5.2Hz), 8.79(1H, s), 9.03-9.06(1H, m), 9.11-9.14(1H, m).
실시예
56
N-(4-6- 시아노 -7-(2-( 메틸티오 ) 에톡시 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2,4-디플루오로페닐)우레아
실시예 7과 같은 식으로, 나트륨 6-시아노-4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-퀴놀리놀레이트(130 mg)로부터 표제 화합물을 95 mg 얻었다.
*1H-NMR(DMSO-d6) δ(ppm) : 2.25(3H, s), 2.99(2H, t, J=6.0Hz), 4.49(2H, t, J=6.0Hz), 6.64(1H, d, J=5.2Hz), 7.04-7.11(1H, m), 7.15-7.19(1H, m), 7.30-7.37(1H, m), 7.43(1H, dd, J=2.4Hz, J=11.6Hz), 7.66(1H, s), 8.09-8.17(1H, m), 8.29(1H, t, J=9.2Hz), 8.76(1H, d, J=5.2Hz), 8.77(1H, s), 9.01-9.05(1H, m), 9.09-9.13(1H, m).
실시예
57
N-(4-(6- 시아노 -7-(2-( 메틸설포닐 ) 에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )-N'-(2,4-디플루오로페닐)우레아
N-(4-6-시아노-7-(2-(메틸티오)에톡시-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아(84 mg)를 메탄올(1 ml)과 염화메틸렌(5 ml)의 혼합 용매에 용해하여, 0℃에서 교반하에 메타-과벤조산을 2등량 가하여, 30분간 교반했다. 반응액을 포화탄산수소나트륨 수용액에 부어, 초산에틸로 추출하여 유기층을 황산마그네슘으로 건조한 후 농축했다. 잔사를 NH 실리카겔(후지시리시아가가쿠)에 가하여, 용매(초산에틸-헥산=10-1)로 용출하고 농축하여, 표제 화합물을 21 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.02(3H, s), 3.79(2H, t, J=4.8Hz), 4.67(2H, t, J=4.8Hz), 6.67(1H, d, J=5.2Hz), 7.04-7.10(1H, m), 7.15-7.19(1H, m), 7.31-7.34(1H, m), 7.43(1H, dd, J=2.8Hz, J=12Hz), 7.73(1H, s), 8.10-8.16(1H, m), 8.28(1H, t, J=9.2HZ), 8.79(1H, d, J=5.2Hz), 8.81(1H, s), 9.02-9.05(1H, m), 9.11-9.14(1H, m).
실시예
58
N-(4-(6- 시아노 -7-(2-( 메틸티오 ) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
실시예 7과 같은 식으로, 나트륨 6-시아노-4-(4-((2,4-디플루오로아닐리노)카르보닐)아미노-3-플루오로페녹시)-7-퀴놀리놀레이트(300 mg)로부터 표제 화합물을 112 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.25(3H, s), 2.99(2H, t, J=6.0Hz), 4.49(2H, t, J=6.0Hz), 6.54(1H, d, J=5.2Hz), 7.13(2H, t, J=8.8Hz), 7.25(2H, d, J=8.8Hz), 7.46-7.51(2H, m), 7.61(2H, d, J=8.8Hz), 7.65(1H, s), 8.74(1H, d, J=5.2Hz), 8.78(1H, s), 8.82(1H, brs), 8.91(1H, brs).
실시예
59
N-(4-(6- 시아노 -7-(2-( 메틸설포닐 ) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
실시예 56과 같은 식으로 N-(4-(6-시아노-7-(2-(메틸티오)에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(100 mg)로부터 표제 화합물을 11 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.20(3H, s), 3.79(2H, t, J=5.6Hz), 4.69(2H, t, J=5.6Hz), 6.57(1H, d, J=5.2Hz), 7.13(2H, t, J=8.8Hz), 7.25(2H, d, J=8.8Hz), 7.46-7.52(2H, m), 7.62(2H, d, J=8.8Hz), 7.72(1H, s), 8.76(1H, d, J=5.2Hz), 8.82(1H, s), 8.90(1H, brs), 8.99(1H, brs).
실시예
60
N-(4-(6- 클로로 -5,7- 디메톡시 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2,4- 디플루오로페닐)우레아
실시예 10과 같은 식으로, 4-(4-아미노-3-플루오로페녹시)-6-클로로-5,7-디메톡시퀴놀린(235 mg)과 2,4-디플루오로페닐 이소시아네이트로부터 표제 화합물을 173 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.93(3H, s), 4.07(3H, s), 6.67(1H, d, J=5.2Hz), 6.91-6.96(1H, m), 7.00(1H, s), 7.03-7.09(1H, m), 7.20(1H, dd, J=2.8Hz, J=8.0Hz), 7.30-7.37(1H, m), 8.08-8.20(2H, m), 8.69(1H, d, J=5.2Hz), 9.01(1H, brd, J=2.0Hz), 9.04(1H, brd, J=2.0Hz).
실시예
61
N-(4-(6- 시아노 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2,4- 디플루오로페닐)우레아
실시예 10과 같은 식으로, 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-메톡시퀴놀린(238 mg)과 2,4-디플루오로페닐 이소시아네이트로부터 표제 화합물을 130 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 4.08(3H, s), 6.64(1H, d, J=5.2Hz), 7.04-7.10(1H, m), 7.15-7.19(1H, m), 7.31-7.37(1H, m), 7.43(1H, dd, J=2.8Hz, J=12Hz), 7.63(1H, s), 8.13(1H, dt, J=6.4Hz, J=9.2Hz), 8.29(1H, t, J=9.2Hz), 8.77(1H, d, J=5.2Hz), 8.78(1H, s), 9.05(1H, brs), 9.13(1H, brs).
실시예
62
N-(4-(6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시페닐
)-
N'
-(4-
메톡시페닐
)
우레아
실시예 10과 같은 식으로, 4-아미노(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(170 mg)과 4-메톡시페닐 이소시아네이트로부터 표제 화합물을 55 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.72(3H, s), 4.07(3H, s), 6.54(1H, d, J=5.2Hz), 6.88(2H, d, J=8.8Hz), 7.24(2H, d, J=8.8Hz), 7.37(2H, d, J=8.8Hz), 7.60(2H, d, J=8.8Hz), 7.61(1H, s), 8.62(1H, brs), 8.74(1H, d, J=5.2Hz), 8.78(1H, s), 8.87(1H, brs).
실시예
63
N-(4-(6- 시아노 -7-(2-(4- 모르폴리노 ) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
실시예 7과 같은 식으로, 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트로부터 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.50-2.55(4H, m), 2.87(2H, t, J=5.6Hz), 3.57(4H, t, J=4.4Hz), 3.60(3H, s), 4.38(2H, t, J=5.6Hz), 6.85(2H, d, J=8.8Hz), 7.02(1H, s), 7.06(1H, d, J=5.2Hz), 7.21(2H, d, J=8.8Hz), 7.36(2H, d, J=8.8Hz), 7.58(2H, d, J=8.8Hz), 8.65(1H, s), 8.68(1H, brs), 8.73(1H, d, J=5.2Hz), 8.92(1H, brs)
실시예
64
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' - 시클로헥실우레아
실시예 10과 같은 식으로, 4-(4-아미노페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(60 mg)과 시클로헥실이소시아네이트로부터 표제 화합물을 25 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.12-1.24(3H, m), 1.26-1.38(2H, m), 1.51-1.59(1H, m), 1.63-1.72(2H, m), 1.78-1.86(2H, m), 3.38(3H, s), 3.42-3.52(1H, m), 3.78-3.80(2H, m), 4.42-4.44(2H, m), 6.18(1H, brd, J=8.0Hz), 6.50(1H, d, J=5.2Hz), 7.18(2H, d, J=9.2Hz), 7.53(2H, d, J=9.2Hz), 7.63(1H, s), 8.55(1H, brs), 8.72(1H, d, J=5.2Hz), 8.77(1H, s).
실시예
65
N-(4-(6-
시아노
-7-(2-
메톡시에톡시
)-4-
퀴놀릴
)
옥시페닐
)-
N'
-
페닐우레아
4-(4-아미노페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(600 mg)을 톨루엔(15 ml)에 현탁시켜 가열 환류하여, 용해시키자마자 바로 페닐 이소시아네이트(292 ㎕)를 적하하고 30분간 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 에테르, 초산에틸로 세척하여, 건조시켜 표제 화합물을 760 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.38(3H, s), 3.78-3.81(2H, m), 4.42-4.45(2H, m), 6.54(1H, d, J=5.2Hz), 6.98(1H, t, J=7.2Hz), 7.24-7.31(4H, m), 7.47(2H, d, J=7.2Hz), 7.62(2H, d, J=8.8Hz), 7.64(1H, s), 8.74(1H, d, J=5.2Hz), 8.79(1H, s), 8.85(1H, brs), 8.99(1H, brs).
실시예
66
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2,4-디플루오로페닐)우레아
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(352 mg)을 톨루엔(20 ml)에 현탁하고, 가열 환류하여 용해시킨 후 2,4-디플루오로페닐 이소시아네이트(236 ㎕)를 적하하여, 30분간 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 에테르, 초산에틸로 세척하여, 건조시켜 표제 화합물을 380 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.38(3H, s), 3.78-3.81(2H, m), 4.42-4.46(2H, m), 6.64(1H, d, J=5.2Hz), 7.04-7.11(1H, m), 7.15-7.19(1H, m), 7.31-7.37(1H, m), 7.43(1H, dd, J=2.8Hz, J=8.0Hz), 7.66(1H, s), 8.13(1H, dt, J=6Hz, J=9.2Hz), 8.28(1H, t, J=9.2Hz), 8.76(1H, d, J=5.2Hz), 8.77(1H, s), 9.05(1H, brs), 9.13(1H, brs).
실시예
67
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -( 메톡시페닐)우레아
실시예 10과 같은 식으로, 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(620 mg)과 4-메톡시페닐 이소시아네이트로부터 표제 화합물을 570 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.38(3H, s), 3.73(3H, s), 3.78-3.81(2H, m), 4.43-4.45(2H, m), 6.63(1H, d, J=5.2Hz), 6.89(2H, d, J=8.8Hz), 7.13-7.17(1H, m), 7.37(2H, d, J=8.8Hz), 7.41(1H, dd, J=2.8Hz, J=11.6Hz), 7.65(1H, s), 8.28(1H, t, J=8.8Hz), 8.60(1H, brs), 8.76(1H, d, J=5.2Hz), 8.77(1H, s), 8.94(1H, brs).
실시예
68
N-(4-(6- 시아노 -7-( 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐 ) 우레아
실시예 10과 같은 식으로, 4-(4-아미노페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(890 mg)과 4-메톡시페닐 이소시아네이트로부터 표제 화합물을 450 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.36(3H, s), 3.70(3H, s), 3.76-3.79(2H, m), 4.40-4.42(2H, m), 6.51(1H, d, J=5.6Hz), 6.86(2H, d, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.35(2H, d, J=8.8Hz), 7.58(2H, d, J=8.8Hz), 7.62(1H, s), 8.53(1H, brs), 8.71(1H, d, J=5.6Hz), 8.76(1H, s), 8.80(1H, brs).
실시예
69
N-((4-
피리미딜
)
옥시페닐
)-
N'
-(4-
메톡시페닐
)
우레아
6-클로로-4-(4-니트로페녹시)피리미딘(300 mg)의 초산에틸(10 ml)-메탄올(10 ml)의 혼합 용매 용액에 수산화팔라듐(20 mg)을 가하여, 상압의 수소 분위기하 실온에서 13시간동안 교반했다. 반응액을 여과하고, 여과액을 농축하여 잔사를 NH 실리카겔(후지시리시아가가쿠)에 가하였다. 용매(초산에틸-헥산=1-2)로 용출하고 농축하여, 4-(4-아미노페녹시)피리미딘을 70 mg 얻었다. 실시예 10과 같은 식으로, 생성된 4-(4-아미노페녹시)피리미딘(70 mg)과 4-메톡시페닐 이소시아네이트로부터 표제 화합물을 107 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.72(3H, s), 6.87(2H, d, J=8.8Hz), 7.09(1H, dd, J=1.6Hz, J=5.6Hz), 7.12(2H, d, J=8.8Hz), 7.36(2H, d, J=8.8Hz), 7.51(2H, d, J=8.8Hz), 8.56(1H, s), 8.66(1H, d, J=5.6 HZ), 8.74-8.76(2H, m).
실시예
70
N-(4-(6- 시아노 -7-(3- 메톡시카르보닐프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
실시예 7과 같은 식으로, 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트로부터 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.09(2H, tt, J=6.4Hz, J=6.4Hz), 2.56(2H, t, J=6.4Hz), 3.62(3H, s), 3.71(3H, s), 4.31(2H, t, J=6.4Hz), 6.52(1H, d, J=5.2Hz), 6.86(2H, d, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.35(2H, d, J=8.8Hz), 7.57(2H, d, J=8.8Hz), 7.59(1H, s), 8.50(1H, s), 8.72(1H, d, J=5.2Hz) 8.74(1H, s), 8.75(1H, s).
실시예
71
N-(4-(6- 시아노 -7-(3- 카르복시프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
N-(4-(6-시아노-7-(3-메톡시카르보닐프로폭시)-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(100 mg)를 메탄올(16 ml)과 2N 수산화나트륨 수용액(3 ml)의 혼합 용매에 가하여, 80℃에서 35분간 가열 교반했다. 반응액을 여과하고, 이어서 5N 염산 수용액 1.2 ml를 가했다. 석출된 고체를 여과 수취하여, 메탄올 이어서 에테르로 세척하여 목적물 50 mg을 담황색 고체로서 얻었다.
*1H-NMR(DMSO-d6) δ(ppm) : 2.05(2H, tt, J=6.4Hz, J=6.4Hz), 2.47(2H, t, J=6.4Hz), 3.70(3H, s), 4.31(2H, t, J=6.4Hz), 6.52(1H, d, J=5.2Hz), 6.86(2H, d, J=8.8Hz), 7.22(2H, d, J=8.8Hz), 7.35(2H, d, J=8.8Hz), 7.57(2H, d, J=8.8Hz), 7.59(1H, s), 8.50(1H, s), 8.71(1H, d, J=5.2Hz) 8.75(1H, s), 8.76(1H, s).
실시예
72
N-(4-(6- 시아노 -7-(2-(2- 히드록시에톡시 ) 에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4-메톡시페닐)우레아
실시예 7과 같은 식으로, 나트륨 6-시아노-4-(4-((4-메톡시아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트로부터 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.54-3.57(4H, m), 3.72(3H, s), 3.87-3.90(2H, m), 4.41-4.45(2H, m), 4.62-4.65(1H, m), 6.54(1H, d, J=5.2Hz), 6.87(2H, d, J=8.8Hz), 7.24(2H, d, J=8.8Hz), 7.38(2H, d, J=8.8Hz), 7.60(2H, d, J=8.8Hz), 7.64(1H, s), 8.62(1H, brs), 8.74(1H, d, J=5.2Hz), 8.78(1H, s), 8.87(1H, brs).
실시예
73
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴옥시 ) 페닐 )- N' -(3-(메틸설포닐)페닐)우레아
N-4-((6-시아노-7-히드록시-4-퀴놀릴)옥시)페닐-N'-(3-(메틸설포닐)페닐)우레아(119 mg, 0.25 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(8.8 mg, 0.015 mmol, 6.0%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.2Hz), 1.87-1.95(2H, m), 2.40-2.70(6H, m), 3.18(3H, s), 4.29-4.33(2H, m), 6.51(1H, d, J=5.2Hz), 7.25(2H, d, J=8.8Hz), 7.49-7.68(6H, m), 8.16(1H, brs), 8.71(1H, d, J=5.2Hz), 8.75(1H, s), 9.02(1H, brs), 9.21(1H, brs).
실시예
74
N-(4-(6- 시아노 -7-(3-(4- 모르폴리노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3-(메틸설포닐)페닐)우레아
N-4-((6-시아노-7-히드록시-4-퀴놀릴)옥시)페닐-N'-(3-(메틸설포닐)페닐)우레아(119 mg, 0.25 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(81 mg, 0.135 mmol, 53.7%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.95-2.04(2H, m), 2.34-2.60(6H, m), 3.18(3H, s), 3.54-3.60(4H, m), 4.30-4.36(2H, m), 6.52(1H, d, J=5.2Hz), 7.25(2H, d, J=8.8Hz), 7.50-7.68(6H, m), 8.16(1H, s), 8.72(1H, d, J=5.2Hz), 8.75(1H, s), 8.95(1H, s), 9.15(1H, s).
실시예
75
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴옥시 ) 페닐 )- N' - 페닐우레아
나트륨4-(4-((아닐리노카르보닐)아미노)페녹시)-6-시아노-7-퀴놀리놀레이트(210 mg, 0.50 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(70 mg, 0.137 mmol, 27.5%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.2Hz), 1.85-1.95(2H, m), 2.40-2.55(4H, m), 2.60(2H, t, J=6.8Hz), 4.31(2H, t, J=6.0Hz), 6.51(1H, d, J=5.2Hz), 6.96(1H, m), 7.22-7.30(4H, m), 7.45(2H, d, J=8.0Hz), 7.56-7.61(3H, m), 8.70-8.72(2H, m), 8.75(1H, s), 8.84(1H, s).
실시예
76
N-(4-(6- 시아노 -7-(3-(4- 모르폴리노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' - 페닐우레아
나트륨4-(4-((아닐리노카르보닐)아미노)페녹시)-6-시아노-7-퀴놀리놀레이트(105 mg, 0.25 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(67 mg, 0.128 mmol, 51.0%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.92-2.02(2H, m), 2.35-2.57(6H, m), 3.55-3.57(4H, m), 4.30-4.34(2H, m), 6.51(1H, d, J=5.6Hz), 6.96(1H, t, J=7.2Hz), 7.22-7.30(4H, m), 7.45(2H, d, J=7.6Hz), 7.58-7.61(3H, m), 8.69-8.72(2H, m), 8.75(1H, s), 8.83(1H, s).
실시예
77
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(1H-[d] 이미다졸-2-일)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(101 mg, 0.222 mmol)로부터 표제 화합물(71 mg, 0.14 mmol, 64.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.79(2H, m), 4.40-4.43(2H, m), 6.54(1H, d, J=5.2Hz), 7.04-7.07(2H, m), 7.26(2H, d, J=8.8Hz), 7.34-7.37(2H, m), 7.62(1H, s), 7.73(2H, d, J=8.8Hz), 8.72(1H, d, J=5.2Hz), 8.77(1H, s).
실시예
78
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2-옥소-1,2,3,4-테트라히드로-6-퀴놀릴)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물(70 mg, 0.134 mmol, 60.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.38-2.43(2H, m), 2.81-2.85(2H, m), 3.36(3H, s), 3.75-3.79(2H, m), 4.40-4.43(2H, m), 6.51(1H, d, J=5.2Hz), 6.76(1H, d, J=8.4Hz), 7.16(1H, dd, J=2.0, 8.4Hz), 7.22(2H, dd, J=8.8Hz), 7.30(1H, s), 7.58(2H, d, J=8.8Hz), 7.62(1H, s), 8.52(1H, s), 8.71(1H, d, J=5.2Hz), 8.75(2H, s), 9.95(1H, s).
실시예
79
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 아세트아미드페닐)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물(100 mg, 0.197 mmol, 89.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.00(3H, s), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 7.23(2H, d, J=8.8Hz), 7.35(2H, d, J=8.8Hz), 7.46(2H, d, J=8.8Hz), 7.58(2H, d, J=8.8Hz), 7.62(1H, s), 8.59(1H, s), 8.72(1H, d, J=5.2Hz), 8.76(1H, s), 8.77(1H, s), 9.80(1H, s).
실시예
80
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3- 아세트아미드페닐)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물(95 mg, 0.186 mmol, 84.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.02(3H, s), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.6Hz), 7.15-7.20(3H, m), 7.23(2H, d, J=8.8Hz), 7.59(2H, d, J=8.8Hz), 7.62(1H, s), 7.76(1H, s), 8.71-8.76(4H, m), 9.90(1H, s).
실시예
81
N-(4-(6- 시아노 -7- 벤질옥시 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2,4- 디플루오로페닐)우레아
N-(2,4-디플루오로페닐)-N'-(2-플루오로-4-히드록시페닐)우레아(227 mg, 0.8058 mmol), 4-클로로-6-시아노-7-벤질옥시퀴놀린(250 mmol, 0.8482 mmol)을 이용하여 실시예 86의 별법과 같은 식으로 반응을 행하여, 방냉, 추출, 세척후 용매를 감압 증류 수거하고, 생성된 결정을 디에틸에테르에 현탁시켜 세척한 후 여과 수취했다. 이것을 테트라히드로푸란에 용해하여, 실리카겔 여과하고, 용매를 감압 증류 수거했다. 생성된 결정을 디에틸에테르에 현탁시켜 세척한 후 여과 수취하고, 디에틸에테르로 세척, 흡인 건조후, 담갈색 결정으로서 표제 화합물(70 mg, 0.1295 mmol, 16.07%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.45(2H, s), 6.63(1H, d, J=5.4Hz), 7.05(1H, m), 7.15(1H, m), 7.29-7.46(5H, m), 7.54(2H, d, J=7.6Hz), 7.71(1H, s), 8.11(1H, dt, J=6.0Hz, 9.2Hz), 8.27(1H, d, J=9.2Hz), 8.74(1H, d, J=5.4Hz), 8.77(1H, s), 8.99(1H, s), 9.07(1H, s).
실시예
82
N-(4-(7-(
벤질옥시
)-6-
시아노
-4-
퀴놀릴
)
옥시페닐
-
N'
-(2-
티아졸릴
)
우레아
4-(4-아미노페녹시)-7-(벤질옥시)-6-시아노퀴놀린(2.61 g, 7.10 mmol) 및 페닐 N-(2-티아졸릴)카르바메이트(1.88 g, 8.54 mmol)로부터 실시예 34와 같은 식의 수법에 의해, 표제 화합물(3.19 g, 6.46 mmol, 91%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.47(2H, s), 6.55(1H, d, J=5.3Hz), 7.12(1H, d, J=3.5Hz), 7.29(2H, d, J=8.7Hz), 7.36-7.58(6H, m), 7.65(2H, d, J=8.7Hz), 7.72(1H, s), 8.74(1H, d, J=5.3Hz), 8.80(1H, s), 9.18(1H, s).
실시예
83
N-(4-(6-
시아노
-7-히드록시-4-
퀴놀릴
)
옥시페닐
)-
N'
-(2-
티아졸릴
)
우레아
실시예 82에서 생성된 N-(4-(7-(벤질옥시)-6-시아노-4-퀴놀릴)옥시페닐-N'-(2-티아졸)우레아(3.09 g, 7.66 mmol)를 트리플루오로초산(25 ml), 티오아니솔(4.50 ml, 38.3 mmol)에 용해시킨 후, 65℃에서 15시간동안 교반했다. 반응액을 감압 농축하여 생성된 잔사에 5% 탄산수소나트륨 수용액과 디에틸에테르를 가하여 교반하고, 석출된 결정을 여과 수취하여, 물, 디에틸에테르로 세척하고, 감압 건조시켰다. 미정제 생성물을 헥산-초산에틸 혼합 용매에 현탁시켜 초음파처리하여, 결정을 여과 수취하고, 디에틸에테르로 세척한 후, 실온에서 통풍 건조시켜, 황색 결정으로서 표제 화합물(1.94 g, 4.80 mmol, 63%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.44(1H, d, J=5.2Hz), 7.12(1H, d, J=3.7Hz), 7.28(2H, d, J=7.8Hz), 7.39(1H, d, J=3.7Hz), 7.42(1H, s), 7.64(2H, d, J=7.8Hz), 8.65(1H, d, J=5.2Hz), 8.68(1H, s), 9.14(1H, s).
실시예
84
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴옥시 ) 페닐 - N' -(2- 티아졸릴)우레아
실시예 83에서 얻어진 N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(2-티아졸릴)우레아(101 mg, 0.250 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(26 mg, 0.0503 mmol, 20%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.05(6H, t, J=7.2Hz), 2.03-2.12(2H, m), 2.58(4H, q, J=7.2Hz), 2.71(2H, t, J=7.0Hz), 4.28(2H, t, J=6.2Hz), 6.47(1H, d, J=5.3Hz), 6.92(1H, d, J=3.7Hz), 7.17(2H, d, J=8.8Hz), 7.43(1H, d, J=3.7Hz), 7.47(1H, s), 7.67(2H, d, J=8.8Hz), 8.65(1H, d, J=5.3Hz), 8.67(1H, s).
실시예
85
N-(4-(6- 시아노 -7-(3-(4- 모르폴리노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2- 티아졸릴)우레아
실시예 83에서 생성된 N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(2-티아졸릴)우레아(101 mg, 0.250 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(19 mg, 0.0358 mmol, 14%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.08-2.16(2H, m), 2.46-2.52(4H, m),2.62(2H, t, J=7.0Hz), 3.70-3.76(4H, m), 4.30(2H, t, J=6.2Hz), 6.47(1H, d, J=5.3Hz), 6.92(1H, d, J=3.7Hz), 7.17(2H, d, J=8.8Hz), 7.42(1H, d, J=3.7Hz), 7.48(1H, s), 7.67(2H, d, J=8.8Hz), 8.66(1H, d, J=5.3Hz), 8.69(1H, s).
실시예
86
N-(4-(6-
시아노
-7-
벤질옥시
-4-
퀴놀릴
)
옥시페닐
)-
N'
-(4-
메톡시페닐
)
우레아
4-아미노(4-아미노페녹시)-7-(벤질옥시)-6-시아노퀴놀린(1.0 g)에 톨루엔(60 ml), 아세토니트릴(30 ml)을 가하여, 환류하여 용해시킨 후, 환류하에서 4-메톡시페닐 이소시아네이트(0.53 ml)를 가했다. 1시간동안 환류하에서 교반한 후 다시 4-메톡시페닐 이소시아네이트(0.30 ml)를 가했다. 또 다시 환류하에서 40분간 교반한후, 실온으로 되돌렸다. 석출된 결정을 여과 수취하고 톨루엔-아세토니트릴=1:1 혼합 용매로 세척하여 표제 화합물을 담갈색 결정으로서 얻었다(0.60 g). 세척액으로부터 석출된 결정을 여과 수취하여 또한 표제 화합물을 담갈색 결정으로서 얻었다(0.20 g).
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.73(3H, s), 5.98(2H, s), 6.56(1H, d, J=5.2Hz), 6.89(2H, d, J=9.3Hz), 7.24(2H, d, J=9.3Hz), 7.33-7.65(9H, m), 7.72(1H, s), 8.74(1H, d, J=5.2Hz), 8.82(1H, s), 8.89(1H, brs), 9.19(1H, brs).
실시예
86-2
N-(4-(6-
시아노
-7-
벤질옥시
-4-
퀴놀릴
)
옥시페닐
)-
N'
-(4-
메톡시페닐
)
우레아
N-(4-히드록시페닐)-N'-(4-메톡시페닐)우레아(4.25 g, 16.46 mmol)에 1-메틸피롤리돈(3.4 ml), 디이소프로필에틸아민(3.6 ml, 20.78 mmol)을 가하고, 130℃에서 가열 교반하여, 완전히 용해시킨 후, 4-클로로-6-시아노-7-벤질옥시퀴놀린(5.10 g, 17.32 mmol)을 가하여, 130℃에서 1.5시간, 150℃에서 1시간동안 교반했다. 디이소프로필에틸아민(1.2 ml, 6.93 mmol)을 추가로 가한후 1시간동안 더 교반했다. 방냉후 테트라히드로푸란, 초산에틸을 가하여, 포화중조수, 이어서 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 용매를 감압 증류 수거했다. 생성된 결정을 디에틸에테르·헥산, 아세토니트릴·디에틸에테르·헥산, 메탄올, 디메틸설폭시드·물로 순차적으로 세척했다. 이렇게 해서 생성된 결정을 테트라히드로푸란에 용해하여, 실리카겔 여과(실리카겔 200 cc)하고, 테트라히드로푸란 3000 ml로 흘려, 용매를 감압 증류 수거했다. 생성된 결정을 디에틸에테르, 아세토니트릴, 디에틸에테르:에탄올=5:1로 순차적으로 세척하고, 흡인 건조시켜, 갈색 결정으로서 표제 화합물(3.70 g, 7.1627 mmol, 43.52%)을 얻었다.
실시예
87
나트륨 6- 시아노 -4-(4-((4- 메톡시아닐리노 )카르보닐) 아미노페녹시 )-7- 퀴놀리놀레이트
N-(4-(6-시아노-7-벤질옥시-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(12.2 g)에 트리플루오로초산(122 ml), 티오아니솔(11.7 ml)을 가하여 50℃에서 밤새 교반하고, 또한 40℃에서 24시간동안 교반했다. 원료 소실을 확인한 후 반응계를 감압 농축하고 테트라히드로푸란, 포화중조수를 가하여, 석출되는 황결정을 여과 수취하고, 감압 건조시켜 표제 화합물을 얻었다(6.8 g). 또한 여과액에 에테르를 가하여, 석출된 황결정을 여과 수취하고, 감압 건조시켜 표제 화합물을 얻었다(2.0 g).
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.72(3H, s), 6.56(1H, d, J=6.1Hz), 6.88(2H, d, J=8.7Hz), 7.23(2H, d, J=8.7Hz), 7.37(2H, d, J=8.7Hz), 7.44(1H, s), 7.60(2H, d, J=8.7Hz), 8.57(1H, s), 8.67(1H, d, J=6.1Hz), 8.70(1H, s), 8.82(1H, s).
실시예
88
나트륨 6- 시아노 -4-(4-((4- 플루오로아닐리노 )카르보닐) 아미노페녹시 )-7- 퀴놀리놀레이트
4-(4-아미노페녹시)-7-(벤질옥시)-6-시아노퀴놀린(7.776 g, 21.2 mmol)을 톨루엔(400 ml)과 아세토니트릴(200 ml)의 혼합 용매에 용해시킨 후, 4-플루오로페닐 이소시아네이트(3.68 ml, 31.7 mmol)를 가하여, 120℃에서 1시간동안 가열 환류했다. 반응액을 감압 농축하여, 잔사를 테트라히드로푸란(150 ml)에 현탁시킨 후, 헥산(150 ml)을 가하여 초음파처리하고, 석출된 결정을 여과 수취하고, 감압 건조시켜 담갈색 결정으로서 N-(4-(7-(벤질옥시)-6-시아노-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(9.81 g, 19.4 mmol, 91.9%)를 얻었다. 이것을 트리플루오로초산(100 ml), 티오아니솔(9.13 ml, 77.7 mmol)에 질소 분위기하에서 용해시킨 후, 60℃에서 12시간동안 교반했다. 반응액을 감압 농축하여 얻어진 잔사에 테트라히드로푸란(50 ml)을 가한 후, 1N 수산화나트륨 수용액(150 ml)을 가하고, 물(150 ml)을 더 가하여 교반하고, 석출된 결정을 여과 수취하여, 물, 디에틸에테르, 초산에틸로 세척하고, 70℃에서 건조시켜 황색 결정으로서 표제 화합물(3.646 g, 8.36 mmol, 43.0%)을 얻었다.
네가티브 ESI-MS 413 (M-Na)-
실시예
89
나트륨 6- 시아노 -4-(4-(2,4- 디플루오로아닐리노 )카르보닐)아미노-3- 플루오로페녹시)-7-퀴놀리놀레이트
실시예 81에서 얻은 7-벤질옥시체(1.1 g)와 트리플루오로초산(10 ml), 티오아니솔(1 ml)의 혼합물을 오일조를 이용하여, 16시간, 63∼67℃에서 가열 교반했다. 반응 종료후, 반응액을 농축하고 포화탄산수소나트륨 수용액을 가하여, 석출된 고체를 여과 수취했다. 얻어진 고체를 물, 에테르, 초산에틸로 세척하여, 건조시켜 표제 화합물을 정량적으로 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.54(1H, d, J=5.6Hz), 7.04-7.10(1H, m), 7.14-7.17(1H, m), 7.31-7.36(1H, m), 7.40(1H, dd, J=2.8Hz, J=12Hz), 7.44(1H, s), 8.10-8.16(1H, m), 8.27(1H, t, J=8.8HZ), 8.67(1H, s), 8.68(1H, d, J=5.2Hz), 8.99-9.03(1H, m), 9.07-9.11(1H, m).
실시예
90
N-(4-(6- 시아노 -7-(2- 클로로에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(400 mg, 0.9166 mmol)를 디메틸포름아미드(5.0 ml)에 용해하고, 1-브로모-2-클로로에탄(0.12 ml, 1.4479 mmol), 탄산칼륨 (200 mg, 1.4479 mmol)을 가하여, 55℃에서 4시간동안 가열 교반했다. 방냉후 테트라히드로푸란, 초산에틸을 가하고, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 용매를 감압 증류 수거한 후, 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸·메탄올계)에 가하였다. 생성된 결정을 디에틸에테르에 현탁시켜, 헥산으로 희석시키고, 결정을 여과 수취하고, 헥산으로 세척하여, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(331 mg, 0.6941 mmol, 75.72%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.07(2H, t, J=5.2Hz), 4.59(2H, t, J=5.2Hz), 6.54(1H, d, J=5.6Hz), 7.12(2H, t, J=9.0Hz), 7.24(2H, d, J=9.0Hz), 7.44-7.48(2H, m), 7.59(2H, d, J=9.0Hz), 7.65(1H, s), 8.72(1H, s), 8.73(1H, d, J=5.6Hz), 8.78(1H, s), 8.82(1H, s).
실시예
91
N-(4-(6- 시아노 -7-(2- 클로로에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐 )우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(500 mg, 1.1725 mmol)를 이용하여 실시예 90와 같은 식의 방법에 의해, 황색 결정으로서 표제 화합물(501 mg, 1.0247 mmol, 87.39%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.70(3H, s), 4.06(2H, t, J=5.0Hz), 4.59(2H, t, J=5.0Hz), 6.53(1H, d, J=5.6Hz), 6.86(2H, d, J=9.2Hz), 7.22(2H, d, J=9.2Hz), 7.35(2H, d, J=9.2Hz), 7.58(2H, d, J=9.2Hz), 7.65(1H, s), 8.55(1H, m), 8.73(1H, d, J=5.6Hz), 8.78(1H, m), 8.88(1H, s).
실시예
92
N-(4-(6- 시아노 -7-(2- 클로로에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2,4- 디플루오로페닐)우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(2,4-디플루오로페닐)우레아(300 mg, 0.6661 mmol)를 이용하여 실시예 90과 같은 식의 방법에 의해, 담황색 결정으로서 표제 화합물(227 mg, 0.4426 mmol, 66.45%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.07(2H, t, J=5.0Hz), 4.59(2H, t, J=5.0Hz), 6.64(1H, d, J=5.4Hz), 7.06(1H, m), 7.16(1H, m), 7.32(1H, ddd, J=2.8Hz, 8.8Hz, 11.6Hz), 7.41(1H, dd, J=2.8Hz, 11.6Hz), 7.67(1H, s), 7.93(1H, s), 8.12(1H, m), 8.27(1H, dt, J=4.0Hz, 9.2Hz), 8.76(1H, d, J=5.4Hz), 8.77(1H, s), 8.97-9.09(1H, m).
실시예
93
N-(4-(6- 시아노 -7-(4- 클로로부톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐 )우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(200 mg)와 탄산칼륨(65 mg), 1-브로모-4-클로로부탄(81 ㎕)을 디메틸포름아미드(3 ml)에 현탁하여, 1시간 50분 동안 가열 교반했다. 반응액을 포화식염수에 부어, 초산에틸로 추출했다. 유기층을 황산마그네슘으로 건조한 후, NH 실리카(후지시리시아가가쿠)를 통과시켜, 초산에틸로 잘 세척하고, 여과액을 농축하였다. 얻어진 고체를 에테르로 세척하고, 건조시켜 표제 화합물을 110 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.96-2.00(4H, m), 3.72(3H, s), 3.77-3.80(2H, m), 4.33-4.37(2H, m), 6.53(1H, d, J=5.2Hz), 6.88(2H, d, J=8.8Hz), 7.23(2H, d, J=8.8Hz), 7.38(2H, d, J=8.8Hz), 7.60(2H, d, J=8.8Hz), 7.62(1H, s), 8.65(1H, brs), 8.73(1H, d, J=5.2 HZ), 8.77(1H, s), 8.90(1H, brs).
실시예
94
N-(4-(6- 시아노 -7-(3- 클로로프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 메톡시페닐)우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(4-메톡시페닐)우레아(500 mg)와 1-클로로-3-요오드프로판(188 ㎕)으로부터 실시예 93과 같은 식의 수법에 의해, 표제 화합물을 310 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.28-2.35(2H, m), 3.72(3H, s), 3.86-3.90(2H, m), 4.41-4.45(2H, m), 6.54(1H, d, J=5.2Hz), 6.88(2H, d, J=8.8Hz), 7.24(2H, d, J=8.8Hz), 7.38(2H, d, J=8.8Hz), 7.61(2H, d, J=8.8Hz), 7.65(1H, s), 8.66(1H, brs), 8.74(1H, d, J=5.2HZ), 8.79(1H, s), 8.91(1H, brs).
실시예
95
N-(4-(7-( 벤질옥시 )-6- 시아노 -4- 퀴놀릴 ) 옥시페닐 )- N' -(3-( 메틸설포닐 ) 페닐 )우레아
4-(4-아미노페녹시)-7-(벤질옥시)-6-시아노퀴놀린(919 mg, 2.5 mmol)을 디메틸설폭시드(10 ml)에 용해시킨 후, 페닐 N-(3-(메틸설포닐)페닐)카르바메이트(801 mg, 2.75 mmol)를 가하여, 85℃에서 2시간동안 가열했다. 반응액을 초산에틸로 희석한 후, 1N 수산화나트륨 수용액(10 ml), 물(20 mlx2), 포화식염수(10 ml)로 세척하여, 무수황산나트륨으로 건조시켰다. 건조제를 여과 분별한 후, 여과액을 감압 농축하여, 잔사를 초산에틸(30 ml)에 현탁시킨 후, 헥산(30 ml)을 가하여 초음파처리하고, 석출된 결정을 여과 수취하고, 감압 건조시켜 담갈색 결정으로서 표제 화합물(1.43 g, 2.5 mmol, 정량적)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.18(3H, s), 5.44(2H, s), 6.53(1H, d, J=5.2Hz), 7.24(2H, d, J=8.8Hz), 7.37(1H, d, J=8.0Hz), 7.44(2H, t, J=7.2Hz), 7.45-7.69(8H, m), 8.16(1H, s), 8.71(1H, d, J=5.2Hz), 8.78(1H, s), 9.12(1H, s), 9.31(1H, s).
실시예
96
N-(4-(7-(
벤질옥시
)-6-
시아노
-4-
퀴놀릴
)
옥시페닐
)-
N'
-
페닐우레아
4-(4-아미노페녹시)-7-(벤질옥시)-6-시아노퀴놀린(919 mg, 2.5 mmol) 및 페닐 이소시아네이트(0.298 ml, 2.75 mmol)를 이용하여, 실시예 10과 같은 식의 수법에 의해, 담갈색 결정으로서 표제 화합물(1.126 g, 2.3 mmol, 92.5%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.45(2H, s), 6.53(1H, dd, J=1.6, 5.2Hz), 6.96(1H, dd, J=6.0, 7.2Hz), 7.23(2H, d, J=7.6Hz), 7.27(2H, dd, J=7.2, 7.6Hz), 7.37(1H, d, J=7.2Hz), 7.42-7.47(4H, m), 7.54(2H, d, J=8.0Hz), 7.60(2H, dd, J=1.2, 8.8Hz), 7.70(1H, s), 8.71(1H, dd, J=1.6, 5.2Hz), 8.78(1H, d, J=1.2Hz), 8.88(1H, brs), 9.02(1H, brs).
실시예
97
N-(4-((6- 시아노 -7-히드록시-4- 퀴놀릴 ) 옥시 ) 페닐 )- N' -(3-( 메틸설포닐 ) 페닐 )우레아
N-(4-(7-(벤질옥시)-6-시아노-4-퀴놀릴)옥시페닐)-N'-(3-(메틸설포닐)페닐)우레아(1.43 g, 2.5 mmol)를 트리플루오로초산(10 ml), 티오아니솔(1.17 ml, 10 mmol)에 질소 분위기하에서 용해시킨 후, 65℃에서 19시간동안 교반했다. 반응액을 감압 농축하여 생성된 잔사에 5% 탄산수소나트륨 수용액(30 ml)과 초산에틸(50 ml)을 가하여 교반하고, 석출된 결정을 여과 수취하여, 물, 초산에틸로 세척하고, 감압 건조시켰다. 여과액의 유기층을 분리 수취하여, 포화식염수로 세척하고, 무수황산나트륨으로 건조한 후, 감압 농축하여 황색 결정형의 잔사를 얻었다. 이것과 앞의 결정을 합쳐 초산에틸(40 ml)에 현탁시키고 초음파처리하여, 결정을 여과 수취하고, 디에틸에테르로 세척한 후, 60℃에서 건조시켜 황색 결정으로서 표제 화합물(862 mg, 1.8 mmol, 72.7%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.18(3H, s), 6.43(1H, d, J=5.2Hz), 7.22-7.25(3H, m), 7.43(1H, s), 7.48-7.68(5H, m), 8.16(1H, s), 8.63(1H, d, J=5.2Hz), 8.67(1H, s), 9.36(1H, s), 9.55(1H, s).
실시예
98
나트륨 4-(4-((
아닐리노카르보닐
)아미노)
페녹시
)-6-
시아노
-7-
퀴놀리놀레이트
N-(4-(7-(벤질옥시)-6-시아노-4-퀴놀릴)옥시페닐-N'-페닐우레아(1.126 g, 2.31 mmol)로부터, 실시예 87과 같은 식의 수법에 의해, 황색 결정으로서 표제 화합물(811 mg, 1.94 mmol, 83.8%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.26(1H, d, J=5.2Hz), 6.96(1H, m), 7.18-7.29(5H, m), 7.45(2H, d, J=8.4Hz), 7.57(2H, d, J=8.0Hz), 8.50-8.51(2H, m), 8.74(1H, s), 8.86(1H, s).
실시예
99
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' - 페닐우레아
실시예 10과 같은 식으로, 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린과 페닐 이소시아네이트로부터 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.38(3H, s), 3.78-3.81(2H, m), 4.42-4.45(2H, m), 6.64(1H, d, J=5.2Hz), 7.00(1H, t, J=7.2Hz), 7.15-7.19(1H, m), 7.31(2H, t, J=7.2Hz), 7.42(1H, dd, J=2.8Hz, J=12Hz), 7.48(2H, d, J=7.2Hz), 7.66(1H, s), 8.28(1H, t, J=8.8HZ), 8.72(1H, brs), 8.76(1H, d, J=5.2Hz), 8.78(1H, s), 9.15(1H, brs).
실시예
100
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(4-플루오로페닐)우레아
실시예 10과 같은 식으로, 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린과 4-플루오로 페닐이소시아네이트로부터 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.38(3H, s), 3.78-3.81(2H, m), 4.42-4.45(2H, m), 6.64(1H, d, J=5.2Hz), 7.12-7.18(3H, m), 7.42(1H, dd, J=2.8Hz, J=12Hz), 7.46-7.51(2H, m), 7.65(1H, s), 8.25(1H, t, J=9.2Hz), 8.71(1H, brs), 8.76(1H, d, J=5.2 HZ), 8.77(1H, s), 9.18(1H, brs).
실시예
101
N-(1H- 벤조[d]이미다졸 -6-일)- N' -(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴)옥시페닐)우레아(실시예 101-A)
N-(1H- 벤조[d]이미다졸 -5-일)- N' -(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴)옥시페닐)우레아(실시예 101-B)
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물의 혼합물(77.5 mg, 0.157 mmol, 71.4%)을 백색 결정으로서 얻었다.
상기 화합물(실시예 101-A)과 (실시예 101-B)의 혼합물
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.53(1H, d, J=5.6Hz), 6.99-7.62(6H, m), 7.82 (2/5H, s), 7.91(3/5H, s), 8.08(3/5H, s), 8.13(2/5H, s), 8.59-8.79(5H, m), 12.26 (3/5H, s), 12.29 (2/5H, s).
실시예
102
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2-옥소-2,3- 디히드로-1H-벤조[d]이미다졸-5-일)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물(104.2 mg, 0.204 mmol, 93.0%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 6.81(2H, s), 7.22(2H, d, J=8.0Hz), 7.31(1H, s), 7.58(2H, d, J=8.0Hz), 7.62(1H, s), 8.53(1H, s), 8.71-8.76(3H, m), 10.41(1H, s), 10.50(1H, s).
실시예
103
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2-옥소-2,3- 디히드로-1,3-벤조옥사졸-5-일)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물(101 mg, 0.197 mmol, 89.9%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.37(3H, s), 3.76-3.39(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 6.91(1H, dd, J=2.0, 8.8Hz), 7.17(1H, d, J=8.4Hz), 7.24(2H, d, J=8.8Hz), 7.48(1H, s), 7.59(2H, d, J=8.8Hz), 7.62(1H, s), 8.71-8.77(3H, m), 8.81(1H, s), 11.53(1H, s).
실시예
104
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2-옥소-2,3- 디히드로-1,3-벤조옥사졸-6-일)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물(111 mg, 0.217 mmol, 98.8%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.37(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.52(1H, d, J=5.2Hz), 6.99(1H, d, J=8.4Hz), 7.07(1H, dd, J=2.0, 8.4Hz), 7.24(2H, d, J=8.8Hz), 7.56-7.63(4H, m), 8.72(1H, d, J=5.2Hz), 8.74(1H, s), 8.76(1H, s), 8.82(1H, s), 11.46(1H, s).
실시예
105
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(2-옥소-2,3- 디히드로-1H-5-인돌릴)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(100 mg, 0.220 mmol)로부터 표제 화합물(69 mg, 0.135 mmol, 61.7%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.45(2H, s), 3.76-3.79(2H, s), 4.40-4.43(2H, m), 6.51(1H, d, J=5.2Hz), 6.72(1H, d, J=8.4Hz), 7.17(1H, dd, J=2.0, 8.4Hz), 7.22(2H, d, J=8.8Hz), 7.37(1H, s), 7.58(2H, d, J=8.8Hz), 7.62(1H, s), 8.49(1H, s), 8.71(1H, d, J=5.2Hz), 8.74(1H, s), 8.75(1H, s), 10.23(1H, s).
실시예
106
*N-(4-(6- 시아노 -7-(3- 히드록시프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
나트륨 6-시아노-4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(109 mg, 0.250 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(64 mg, 0.135 mmol, 54.2%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.97(2H, t, J=6.0Hz), 3.63(2H, m), 4.34(2H, t, J=6.0Hz), 4.63(1H, t, J=5.2Hz), 6.51(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.23(2H, d, J=8.8Hz), 7.44-7.47(2H, m), 7.57-7.60(3H, m), 8.70-8.75(3H, m), 8.82(1H, s).
실시예
107
N-(4-(6- 시아노 -7-(3-( 메틸설파닐 ) 프로폭시 )-4- 퀴놀릴옥시 ) 페닐 )- N' -(4- 플루오로페닐)우레아
나트륨 6-시아노-4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(109 mg, 0.250 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(37 mg, 0.074 mmol, 29.5%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.08-2.12(5H, m), 2.69(2H, t, J=7.2Hz), 4.36(2H, t, J=6.0Hz), 6.52(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.23(2H, d, J=8.8Hz), 7.44-7.48(2H, m), 7.57-7.60(3H, m), 8.71-8.76(3H, m), 8.82(1H, s).
실시예
108
N-(4-(6- 시아노 -7-(3-( 메틸설포닐 ) 프로폭시 )-4- 퀴놀릴옥시 ) 페닐 )- N' -(4- 플루오로페닐)우레아
나트륨 6-시아노-4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(109 mg, 0.250 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(70 mg, 0.131 mmol, 52.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.27(2H, m), 3.04(3H, s), 3.21-3.37(2H, m), 4.41(2H, t, J=6.4Hz), 6.53(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.23(2H, d, J=8.8Hz), 7.44-7.48(2H, m), 7.57-7.61(3H, m), 8.71-8.73(2H, m), 8.77(1H, s), 8.82(1H, s).
실시예
109
N-(4-(6- 시아노 -7-(3-(2- 옥소테트라히드로 -1H-1- 피롤릴 ) 프로폭시 )-4- 퀴놀릴옥시)페닐)-N'-(4-플루오로페닐)우레아
나트륨 6-시아노-4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(109 mg, 0.250 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(11.2 mg, 0.021 mmol, 8.3%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.93(2H, m), 2.03(2H, t, J=6.0Hz), 2.19(2H, t, J=8.0Hz), 3.37-3.42(4H, m), 4.27(2H, t, J=6.0Hz), 6.51(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.23(2H, d, J=8.8Hz), 7.44-7.48(2H, m), 7.55(1H, s), 7.58(2H, d, J=8.8Hz), 8.70-8.73(2H, m), 8.75(1H, s), 8.82(1H, s).
실시예
110
N-(4-(6- 시아노 -7-(3-(1,3- 디옥소 -2,3- 디히드로 -1H-2- 이소인돌릴 ) 프로폭시 )-4-퀴놀릴옥시)페닐)-N'-(4-플루오로페닐)우레아
나트륨 6-시아노-4-(4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(436 mg, 1.00 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(416 mg, 0.692 mmol, 69.2%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.17(2H, t, J=5.6Hz), 3.84(2H, t, J=6.4Hz), 4.32(2H, t, J=6.0Hz), 6.51(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.23(2H, d, J=9.2Hz), 7.44-7.48(2H, m), 7.52(1H, s), 7.58(2H, d, J=8.8Hz), 7.78-7.84(4H, m), 8.69-8.73(3H, m), 8.82(1H, s).
실시예
111
N-(3-(6- 시아노 -4-(3- 플루오로 -4-((4- 플루오로아닐리노 )카르보닐) 아미노페녹시)-7-퀴놀릴)옥시프로필)메탄술폰아미드
나트륨 6-시아노-4-(3-플루오로-4-((4-플루오로아닐리노)카르보닐)아미노페녹시)-7-퀴놀리놀레이트(114 mg, 0.25 mmol)로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(73 mg, 0.129 mmol, 51.3%)을 담갈색 결정으로서 얻었다.
*1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.02(2H, t, J=6.4Hz), 2.91(3H, s), 3.20(2H, q, J=6.4Hz), 4.34(2H, t, J=6.4Hz), 6.62(1H, d, J=5.2Hz), 7.12-7.38(4H, m), 7.40(1H, dd, J=2.8, 11.6Hz), 7.44-7.48(2H, m), 7.61(1H, s), 8.24(1H, t, J=9.2Hz), 8.62(1H, d, J=2.0Hz), 8.74(1H, s), 8.75(1H, s), 9.09(1H, s).
실시예
112
4-(4-((4- 플루오로아닐리노 )카르보닐) 아미노페녹시 )-7-(2- 메톡시에톡시 )-6-퀴놀린카르복사미드
실시예10에서 얻은 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(360 mg, 0.762 mmol)를 디메틸설폭시드(4.5 ml)에 용해시키고, 5N 수산화나트륨 수용액(1.5 ml)을 가하여, 80℃에서 60분간 교반하에서 가열했다. 반응액을 빙수욕 냉각하고, 2N 염산(3.75 ml)을 가하여 중화하고, 또 물(21 ml)로 희석하여 석출된 미정제 결정을 여과 수취했다. 이것을 에탄올(20 ml)에 현탁시켜 초음파처리하여, 결정을 여과 수취한 후 감압 건조시켜, 표제 화합물(214 mg, 0.436 mmol, 57.3%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.34(3H, s), 3.78-3.81(2H, m), 4.38-4.41(2H, m), 6.46(1H, d, J=5.6Hz), 7.11(2H, d, J=8.8Hz), 7.23(2H, d, J=8.4Hz), 7.46(2H, m), 7.54(1H, s), 7.58(2H, d, J=8.8Hz), 7.80(1H, s), 7.82(1H, s), 8.64(1H, d, J=5.6Hz), 8.75(1H, s), 8.78(1H, s), 8.83(1H, s).
실시예
113
7-(2- 메톡시에톡시 )-4-(4-((1,3-티아졸-2- 일아미노 )카르보닐) 아미노페녹시 )-6-퀴놀린카르복사미드
실시예 12에서 생성된 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-(1,3-티아졸-2-일)우레아(409 mg, 0.886 mmol)로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(181 mg, 0.377 mmol, 42.6%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.78-3.81(2H, m), 4.39-4.42(2H, m), 6.47(1H, d, J=5.2Hz), 7.11(1H, brs), 7.26(2H, d, J=8.8Hz), 7.37(1H, d, J=3.2Hz), 7.55(1H, s), 7.62(2H, d, J=8.8Hz), 7.80(1H, s), 7.82(1H, s), 8.65(1H, d, J=5.2Hz), 8.78(1H, s), 9.10(1H, s).
실시예
114
4-4-(( 아닐리노카르보닐 )아미노)-3- 플루오로페녹시 -7-(2- 메톡시에톡시 )-6- 퀴놀린카르복사미드
실시예 99에서 생성된 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-페닐우레아(106 mg, 0.224 mmol)로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(21 mg, 0.043 mmol, 19.1%)을 갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.78-3.81(2H, m), 4.39-4.42(2H, m), 6.55(1H, d, J=5.2Hz), 6.98(1H, t, J=7.6Hz), 7.13(1H, d, J=8.4Hz), 7.29(2H, t, J=7.6Hz), 7.39(1H, dd, J=2.4, 12.0Hz), 7.45(2H, d, J=8.4Hz), 7.56(1H, s), 7.82(2H, brs), 8.25(1H, m), 8.63(1H, s), 8.67(1H, d, J=5.2Hz), 8.76(1H, s), 9.06(1H, s).
실시예
115
4-(4-((4- 플루오로아닐리노 )카르보닐) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 39에서 생성된 N-(4-(6-시아노-7-메톡시-4-퀴놀릴)옥시-페닐)-N'-(4-플루오로페닐)우레아(391 mg, 0.913 mmol)로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(201 mg, 0.450 mmol, 49.2%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.24(2H, d, J=8.8Hz), 7.44-7.48(2H, m), 7.51(1H, s), 7.59(2H, d, J=8.8Hz), 7.75(1H, s), 7.87(1H, s), 8.68-8.70(2H, m), 8.85(1H, s), 8.95(1H, s).
실시예
116
4-(4-(( 시클로프로필아미노 )카르보닐) 아미노페녹시 )-7-(2- 메톡시에톡시 )-6-퀴놀린카르복사미드
실시예 23에서 생성된 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-시클로프로필우레아(150 mg, 0.358 mmol)로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(71 mg, 0.163 mmol, 45.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.40-0.44(2H, m), 0.62-0.66(2H, m), 2.43-2.48(1H, m), 3.36(3H, s), 3.80-3.83(2H, m), 4.40-4.43(2H, m), 6.43-6.46(2H, m), 7.18(2H, d, J=8.8Hz), 7.53-7.67(3H, m), 7.81(1H, s), 7.83(1H, s), 8.46(1H, s), 8.65(1H, d, J=5.6Hz), 8.79(1H, s).
실시예
117
N-4-((6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시
)
페닐
)-
N'
-(1,3-티아졸-2-일)
우레아
실시예 36과 같은 식의 수법에 의해, 4-(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(291 mg, 1.0 mmol)과 2-페녹시카르바모일아미노-1,3-티아졸(264 mg, 1.2 mmol)로부터 표제 화합물(390 mg, 0.934 mmol, 93.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.05(3H, s), 6.52(1H, d, J=5.2Hz), 7.11(1H, br), 7.27(2H, d, J=8.8Hz), 7.37(1H, d, J=3.2Hz), 7.59(1H, s), 7.62(2H, d, J=8.8Hz), 8.72(1H, d, J=5.2Hz), 8.77(1H, s), 9.12(1H, s).
실시예
118
7- 메톡시 -4-(4-((1,3-티아졸-2- 일아미노 )카르보닐) 아미노페녹시 )-6- 퀴놀린카르복사미드
실시예 117에서 생성된 N-4-((6-시아노-7-메톡시-4-퀴놀릴)옥시)페닐-N'-(1,3-티아졸-2-일)우레아(354 mg, 0.848 mmol)로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(195 mg, 0.448 mmol, 52.8%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.47(1H, d, J=5.2Hz), 7.10(1H, br), 7.25(2H, d, J=8.8Hz), 7.36(1H, d, J=3.6Hz), 7.50(1H, s), 7.62(2H, d, J=8.8Hz), 7.73(1H, s), 7.85(1H, s), 8.64(1H, d, J=5.2Hz), 8.67(1H, s), 9.45(1H, s).
실시예
119
4-(4-((2,4- 디플루오로아닐리노 )카르보닐)아미노-3- 플루오로페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
실시예 61에서 생성된 N-(4-(6-시아노-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아(118 mg, 0.254 mmol)로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(36 mg, 0.448 mmol, 29.4%)을 연한 복숭아색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.56(1H, d, J=5.2Hz), 7.06(1H, m), 7.12(1H, m), 7.33(1H, m), 7.39(1H, dd, J=2.8, 11.6Hz), 7.51(1H, s), 7.73(1H, s), 7.84(1H, s), 8.11(1H, m), 8.25(1H, t, J=9.2Hz), 8.65(1H, s), 8.66(1H, d, J=5.2Hz), 8.99(1H, s), 9.06(1H, s).
실시예
120
N-4-((6-
시아노
-7-
메톡시
-4-
퀴놀릴
)
옥시
)
페닐
-
N'
-
시클로프로필우레아
실시예 36와 같은 식의 수법에 의해, 4-(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(381 mg, 1.308 mmol)으로부터 표제 화합물(293 mg, 0.783 mmol, 59.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.40-0.44(2H, m), 0.62-0.67(2H, m), 2.53-2.58(1H, m), 4.07(3H, m), 6.44(1H, d, J=2.0Hz), 6.51(1H, d, J=5.6Hz), 7.19(2H, d, J=8.8Hz), 7.56(2H, d, J=8.8Hz), 7.60(1H, s), 8.48(1H, s), 8.73(1H, d, J=5.6Hz), 8.77(1H, s).
실시예
121
4-(4-(( 시클로프로필아미노 )카르보닐) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 120에서 생성된 N-4-((6-시아노-7-메톡시-4-퀴놀릴)옥시)페닐-N'-시클로프로필우레아(279 mg, 0.745 mmol)로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(79 mg, 0.201 mmol, 26.9%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.40-0.43(2H, m), 0.62-0.64(2H, m), 2.42-2.45(1H, m), 4.02(3H, s), 6.42-6.44(2H, m), 7.16(2H, d, J=8.0Hz), 7.49(1H, s), 7.53(2H, d, J=8.0Hz), 7.72(1H, s), 7.84(1H, s), 8.45(1H, s), 8.63(1H, d, J=5.6Hz), 8.67(1H, s).
실시예
122
N-(4-(5,6-디메틸-4-7H-피롤로[2,3-d] 피리미딜 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
4-(4-아미노페녹시)-5,6-디메틸-7H-피롤로[2,3-d]-피리미딘을 톨루엔(16 mg)(0.8 ml), 아세토니트릴(0.5 ml)에 환류하에서 용해시킨 후, 4-플루오로페닐 이소시아네이트(7.9 μM)를 가했다. 1시간동안 교반하여 실온으로 되돌려 반응계를 농축하고 잔사에 디에틸에테르를 가하여 결정화시켜 여과 수취했다. 결정을 디에틸에테르로 세척하여, 표제 화합물(5 mg)을 얻었다.
MS m/z 392(M+H)
1H-NMR(DMSO-d6) δ(ppm) : 2.29(3H, s), 2.31(3H, s), 7.00-7.16(4H, m), 7.38-7.50(4H, m), 8.10(1H, s), 8.50(2H, s), 11.75(1H, s)
중간체는 다음과 같은 식으로 합성했다.
제조예
122-1
4-(
니트로페녹시
)-5,6-디메틸-7H-
피롤로
[2,3-d]-피리미딘
Journal of Medicinal Chemistry, 1996, Vol. 39, No 12,2285-2292에 기재된 4-클로로-5,6-7H-피롤로[2,3-d]-피리미딘(88 mg)에 파라-니트로페놀(121 mg), 탄산칼륨(133 mg), 디메틸포름아미드(1 ml)를 가하여 135-140℃에서 72시간동안 교반했다. 실온으로 되돌린 후 물을 가하고, 테트라히드로푸란, 초산에틸의 혼합 용액으로 추출하고, 유기층을 포화식염수로 세척하여, 무수황산나트륨에 의해 건조한 후 농축 건조시켰다. 생성된 결정을 디에틸에테르로 세척하여, 표제 화합물(90 mg)을 얻었다.
MS m/z 285(M+H)
1H-NMR(DMSO-d6)δ(ppm) : 2.28(3H, s), 2.32(3H, s), 7.50(2H, d, J=9.5Hz), 8.20(1H, s), 8.30(2H, d, J=9.5Hz), 11.98(1H, s)
제조예
122-2
4-(
아미노페녹시
)-5,6-디메틸-7H-
피롤로
[2,3-d]-피리미딘
상기 중간체 합성법에 의해 합성한 4-(니트로페녹시)-5,6-디메틸-7H-피롤로[2,3-d]-피리미딘(80 mg)에 철분(0.1 g), 염화암모늄(0.2 g), 에탄올(4 ml), 물(1 ml)을 가하여 75-82℃에서 1.5시간동안 교반했다. 반응계를 실온으로 되돌린 후 테트라히드로푸란(3 ml), 초산에틸(3 ml)을 가하여 세라이트 여과하고, 여과액을 분액하여 유기층을 물, 포화식염수로 순차적으로 세척하여, 황산나트륨으로 건조한 후 감압 농축 건조하고, 디에틸에테르로 세척하여, 표제 화합물(22 mg)을 얻었다.
MS m/z 255(M+H)
1H-NMR(DMSO-d6)δ(ppm) : 2.27(3H, s), 2.29(3H, s), 4.90-5.00(2H, m), 6.52-6.88(4H, m), 8.06(1H, s), 11.66(1H, s)
실시예
123
4-(4-(3,4-
디히드로퀴나졸린
-2-온-3-일)
페닐옥시
)-6,7-
디메톡시퀴놀린
6,7-디메톡시-4-(4-(2-아미노페닐)메틸아미노페닐옥시)퀴놀린(40 mg, 0.0996 mmol)을 디메틸포름아미드(0.5 ml)에 용해하고, 1,1'-카르보닐디이미다졸(19 mg, 0.1196 mmol)을 가하여, 70℃에서 8시간동안 가열 교반했다. 실온까지 냉각한 후, 반응액을 테트라히드로푸란으로 희석시키고, 이것에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하고, 무수황산마그네슘으로 건조한 후, 용매를 감압 증류 수거했다. 잔사를 실리카겔 컬럼(초산에틸-메탄올계)으로 정제하여, 헥산-디에틸에테르로 재결정하고, 무색 결정으로서 표제 화합물(3 mg, 0.0070 mmol, 7.05%)을 얻었다.
1H-NMR(CDCl3) δ(ppm) : 4.06(6H, s), 4.89(2H, s), 6.57(1H, d, J=5.2Hz), 6.77(1H, d, J=7.6Hz), 6.87(1H, brs), 7.03(1H, t, J=7.6Hz), 7.14(1H, d, J=7.6Hz), 7.23(3H, m, covered by CDCl3), 7.44(1H, s), 7.48(2H, d, J=8.8Hz), 7.55(1H, s), 8.52(1H, d, J=5.2Hz).
중간체는 다음과 같이 합성했다.
제조예
123-1
6,7-
디메톡시
-4-(4-(2-
니트로페닐메틸이미노
)
페닐옥시
)퀴놀린
6,7-디메톡시-4-(4-아미노페닐옥시)퀴놀린(500 mg, 1.6873 mmol)을 테트라히드로푸란(64 ml)에 용해하고, 2-니트로벤즈알데히드(320 mg, 2.1091 mmol), 초산(0.58 ml)을 가한 후, 나트륨 트리아세톡시보로히드리드(720 mg, 3.3746 mmol)를 가하여, 실온에서 11시간 30분동안 교반했다. 물, 포화중조수를 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조한 후, 용매를 감압 증류 수거했다. 생성된 결정을 헥산-디에틸에테르로 세척하여, 여과 수취하고, 헥산으로 세척하여, 실온에서 흡인 건조한 후, 담황색 결정으로서 표제 화합물(453 mg)을 얻었다.
1H-NMR(CDCl3) δ(ppm) : 4.06(6H, s), 6.54(1H, d, J=5.2Hz), 7.25(2H, d, J=8.4Hz), 7.40(2H, d, J=8.4Hz), 7.44(1H, s), 7.57(1H, s), 7.65(1H, dd, J=7.6, 8.0Hz), 7.77(1H, dd, J=7.6, 7.6Hz), 8.10(1H, d, J=8.0Hz), 8.33(1H, d, J=7.6Hz), 8.51(1H, d, J=5.2Hz), 9.01(1H, s).
제조예
123-2
6,7-
디메톡시
-4-(4-(2-
니트로페닐메틸아미노
)
페닐옥시
)퀴놀린
6,7-디메톡시-4-(4-(2-니트로페닐메틸이미노)페닐옥시)퀴놀린(200 mg, 0.4657 mmol)에 테트라히드로푸란(2 ml), 에탄올 (2 ml), 클로로포름 (1 ml)을 가하고 가열하여 완전히 용해시키고, 나트륨 보로히드리드(35 mg, 0.9314 mmol)를 가하여, 1시간 30분동안 가열 환류했다. 실온까지 냉각후 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조한 후, 용매를 감압 증류 수거했다. 잔사를 NH 실리카겔 컬럼(헥산-초산에틸계)으로 정제하여, 황색 유상물로서 표제 화합물(151 mg, 0.3500 mmol, 75.15%)을 얻었다.
1H-NMR(CDCl3) δ(ppm) : 4.04(6H, s),4.46(1H, brs), 4.76(2H, d, J=4.8Hz), 6.42(1H, d, J=5.2Hz), 7.64(2H, d, J=8.8Hz), 6.99(2H, d, J=8.8Hz), 7.40(1H, s), 7.47(1H, dd, J=7.2, 7.2Hz), 7.57(1H, s), 7.62(1H, dd, J=7.2, 7.6Hz), 7.71(1H, d, J=7.6Hz), 8.10(1H, d, J=7.2Hz), 8.45(1H, d, J=5.2Hz).
제조예
123-3
6,7-
디메톡시
-4-(4-(2-
아미노페닐메틸아미노
)
페닐옥시
)퀴놀린
6,7-디메톡시-4-(4-(2-니트로페닐메틸아미노)페닐옥시)퀴놀린(150 mg, 0.35 mmol)을 에탄올(2.8 ml), 물(0.7 ml)에 용해하고, 철분(78 mg, 1.4 mmol), 염화암모늄(150 mg, 2.8 mmol)을 가하여, 1시간동안 가열 환류했다. 실온까지 냉각후 테트라히드로푸란, 물로 반응액을 희석하여, 불필요한 것을 여과 제거했다. 여과액을 감압 증류 수거한 후, 잔사를 실리카겔 컬럼(초산에틸계)으로 정제하여, 생성된 비결정질 물질을 헥산, 초산에틸로 고화시키고, 생성된 결정을 헥산-초산에틸로 세척하고, 여과 수취하고, 헥산 세척하여, 실온에서 흡인 건조한 후, 유백색 결정으로서 표제 화합물(80 mg, 0.1993 mmol, 56.93%)을 얻었다.
1H-NMR(CDCl3) δ(ppm) : 3.78(1H, brs), 4.05(3H, s), 4.06(3H, s), 4.15(2H, brs), 4.26(2H, s), 6.44(1H, d, J=5.2Hz), 6.74-6.81(4H, m), 7.06(2H, d, J=8.8Hz), 7.16-7.22(2H, m), 7.42(1H, s), 7.60(1H, s), 8.46(1H, d, J=5.2Hz).
실시예
124
N-(4-(2- 페닐피리딘 -4-일) 옥시페닐 )- N' -(4- 플루오로페닐 ) 우레아
4-(2-페닐피리딘-4-일)옥시아닐린(110 mg, 0.42 mM)을 초산에틸(10 ml)에 가하고, 교반하에서 파라-플루오로페닐 이소시아네이트(0.56 ml, 4.9 mM)를 가하여 0.5시간동안 교반했다. 반응 용액에 n-헥산(20 ml)을 가하여 감압하에서 용매를 일부 증류 제거하고, 석출된 고체를 여과 수취하여, 목적물(98 mg)을 회색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.81(1H, dd, J=5.6Hz, J=2.4Hz), 7.10-7.20(4H, m), 7.42-7.52(6H, m), 7.57(2H, d, J=8.8Hz) 8.01(2H, d, J=8.4Hz), 8.53(1H, d, J=5.6Hz), 8.74(1H, s), 8.80(1H, s).
원료·중간체는 다음과 같이 합성했다.
제조예
124-1
4-(2-
페닐피리딘
-4-일)
옥시아닐린
4-클로로-2-페닐피리딘 1.0 g(5.5 mM), 파라-니트로페놀(1.68 g, 12 mM), 휴니히 염기(디이소프로필에틸아민) 5 ml, 1-메틸피롤리돈(10 ml)을 160℃에서 20시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 이어서 유기층을 물로 5회 세척했다. 용매를 감압하에 증류 제거하고 잔사를 실리카겔 크로마토그래피(헥산:초산에틸=4:1)로 정제하여, 4-(4-니트로페녹시)-2-페닐피리딘을 담황색 고체로서 490 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 7.08-7.14(1H, m), 7.40-7.53(5H, m), 7.74(1H, s), 8.07-8.13(2H, m) 8.34(2H, d, J=8.8Hz), 8.68(1H, dd, J=5.6Hz , J=1.2Hz).
4-(4-니트로페녹시)-2-페닐피리딘(490 mg), 철분(1 g), 염화암모늄(2 g), 에탄올(10 ml), 디메틸포름아미드(10 ml), 물(5 ml)을 100℃에서 10분간 교반했다. 세라이트 여과하고, 여과액에 물을 가하여 초산에틸로 추출했다. 유기층을 물로 5회 세척한 후 용매를 감압 증류 수거하여 4-(2-페닐피리딘-4-일)옥시아닐린(460 mg)을 갈색 유상물로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.12-5.16(2H, m), 6.65(2H, d, J=8.8Hz), 6.74(1H, dd, J=5.6Hz , J=2.4Hz), 6.89(2H, d, J=8.8Hz), 7.38(1H, d, J=2.4Hz), 7.40-7.52(3H, m), 7.98(2H, d, J=8.0Hz), 8.48(1H, d, J=5.6Hz).
실시예
125
N-(4-(3-
페닐피리딘
-4-일)
옥시페닐
)-
N'
-(4-
플루오로페닐
)
우레아
4-(3-페닐피리딘-4-일)옥시아닐린(84 mg, 0.32 mM)을 초산에틸(10 ml)에 가하고, 교반하에 파라-플루오로페닐 이소시아네이트(0.54 ml, 4.7 mM)을 가하여 40분간 교반했다. 반응 용액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(클로로포름:메탄올=10:1)를 실행했다. 생성된 잔사에 초산에틸과 n-헥산을 가하고 용매를 감압 증류 수거하여 목적물(82 mg)을 담황색 비결정질 물질로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.69(1H, dd, J=5.6Hz, J=1.6Hz), 7.06-7.15(4H, m), 7.37-7.54 (7H, m), 7.64(2H, d, J=7.6Hz), 8.38(1H, dd, J=5.6Hz, J=1.6Hz), 8.51(1H, d, J=1.6Hz), 8.70(1H, s), 8.75(1H, s).
원료·중간체는 다음과 같이 합성했다.
제조예
125-1
4-(3-
페닐피리딘
-4-일)
옥시아닐린
4-클로로-3-페닐피리딘(200 mg, 1.06 mM), 파라-니트로페놀 440 mg(3.18 mM) 휴니히 염기(isoPr2EtN, 디이소프로필에틸아민)(1 ml), 1-메틸피롤리돈(2 ml)을 160℃에서 2시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 용매를 감압하에 증류 제거했다. 잔사를 실리카겔 크로마토그래피(헥산:초산에틸=4:1 이어서 2:1)로 정제하여, 4-(4-니트로페녹시)-3-페닐피리딘을 담황색 유상물로서(150 mg) 얻었다.
1H-NMR(CDCl3) δ(ppm) : 6.98(1H, d, J=5.6Hz), 7.12(2H, d, J=9.2Hz), 7.37-7.48(3H, m), 7.50-7.56(2H, m) 8.24(2H, d, J=9.3Hz), 8.55(1H, d, J=5.6Hz), 8.71(1H, s).
4-(4-니트로페녹시)-3-페닐피리딘(150 mg), 철분(300 mg), 염화암모늄(600 mg), 에탄올(5 ml), 디메틸포름아미드(5 ml), 물(2.5 ml)을 100℃에서 15분간 교반했다. 세라이트 여과하고, 여과액에 물을 가하여 초산에틸로 추출했다. 유기층을 물로 5회 세척한 후 용매를 감압 증류 수거하여, 4-(3-페닐피리딘-4-일)옥시아닐린(84 mg)을 황색 유상물로서 얻었다.
1H-NMR(CDCl3) δ(ppm) : 6.65-6.74(3H, m), 6.88(2H, d, J=8.8Hz), 7.36-7.50(3H, m), 7.64(2H, d, J=8.8Hz), 8.34(1H, dd, J=5.6Hz, J=0.8Hz), 8.54(1H, s).
실시예
126
N-(3-(6,7-
디메톡시퀴놀린
-4-일)
옥시프로필
)-
N'
-(4-
플루오로페닐
)
우레아
6,7-디메톡시-4-(3-아미노프로폭시)퀴놀린 150 mg(0.57 mM)과 초산에틸(20 ml)을 실온에서 교반하에, 4-플루오로페닐 이소시아네이트(0.078 ml, 0.68 mM)를 가하고 또 15분간 교반했다. 석출된 고체를 여과 수취하여 목적물(92 mg)을 백색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.03(2H, tt, J=6.0Hz, J=6.0Hz), 3.36(2H, t, J=6.0Hz), 3.89(3H, s), 3.91(3H, s), 4.27(2H, t, J=6.0Hz), 6.29(1H, t, J=6.0Hz), 6.88(1H, d, J=5.2Hz), 7.00-7.07(2H, m), 7.31(1H, s), 7.34-7.41(3H, m), 8.47(1H, s), 8.51(1H, d, J=5.2Hz).
원료·중간체는 다음과 같은 식으로 얻었다.
제조예
126-1
6,7-
디메톡시
-4-(3-
아미노프로폭시
)퀴놀린
6,7-디메톡시-4-히드록시퀴놀린(4.0 g, 19.5 mM), N-(3-브로모프로필)프탈이미드(5.8 g, 21.5 mM), 탄산칼륨(5.4 g, 39 mM), DMF 디메틸포름아미드(20 ml)를 60℃에서 1.5시간동안 교반했다. 반응 용액에 물, 초산에틸, 테트라히드로푸란을 가하여 추출했다. 잠시 방치한 후 석출된 고체를 여과 수취하여 N-(3-(6,7-디메톡시퀴놀린-4-일옥시)프로필)프탈이미드(1.1 g)를 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.22(2H, tt, J=6.0Hz, J=6.0Hz), 3.82(3H, s), 3.86(2H, t, J=6.0Hz), 3.90(3H, s), 4.29(2H, t, J=6.0Hz), 6.82(1H, d, J=5.2Hz), 7.27(1H, s), 7.31(1H, s), 7.77-7.84(4H, m), 8.49(1H, d, J=5.2Hz).
N-(3-(6,7-디메톡시퀴놀린-4-일옥시)프로필)프탈이미드(600 mg, 1.53 mM), 히드라진 1 수화물(300 mg, 6.12 mM), 에탄올(5 ml), 메탄올(5 ml), 테트라히드로푸란(5 ml)을 환류하에 2시간동안 교반했다. 용매를 감압 증류 수거하여 잔사를 실리카겔 크로마토그래피(후지시라알 NH 타입 실리카겔, 클로로포름:메탄올=20:1)로 정제하여, 목적물(150 mg)을 갈색 유상물로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.93(2H, tt, J=6.0Hz, J=6.0Hz), 2.77(2H, t, J=6.0Hz), 3.88(3H, s), 3.91(3H, s), 4.29(2H, t, J=6.0Hz), 6.89(1H, d, J=5.2Hz), 7.31(1H, s), 7.34(1H, s), 8.51(1H, d, J=5.2Hz).
실시예
127
N-(4-(6- 시아노 -7-((1- 메틸피페리딘 -3-일) 메톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐)-N'-(4-플루오로페닐)우레아
6-시아노-4-(4-(4-플루오로아닐리노카르보닐)아미노-3-플루오로페녹시)퀴놀린-7-올나트륨염((222 mg)과 탄산칼륨(162 mg), 3-클로로메틸-1-메틸피페리딘 히드로클로라이드(86 mg)를 디메틸포름아미드(1.7 ml)에 현탁하여, 70-80℃에서 밤새 교반한 후, 물을 가하여 테트라히드로푸란, 초산에틸 혼합 용매로 추출하고, 감압 농축하여 잔사를 NH 실리카(후지시리시아가가쿠)로 정제했다. 생성된 고체를 에테르로 세척하고, 건조시켜 표제 화합물(10 mg)을 얻었다.
MS Spectrum : 544(M+1)
1H-NMR Spectrum : (DMSOd6) 1.30-2.70(12 H, m), 4.17(2H, d, J=6.7Hz), 6.61(1H, d, J=5.0Hz), 7.06-7.18(3H, m), 7.36-7.50(3H, m),7.60(1H, s,), 8.20-8.28(1H, m), 8.63(1H, s,), 8.74(1H, d, J=5.0Hz), 8.75(1H, s,), 9.10(1H, s,)
실시예
128
N-(3-(5,6-디메틸-4-7H-피롤로[2,3-d] 피리미딜 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
4-아미노-(3-아미노페녹시)-5,6-디메틸-7H-피롤로[2,3-d]-피리미딘(27 mg)을 톨루엔(1 ml), 아세토니트릴(0.5 ml)에 환류하에 용해시킨 후, 4-플루오로페닐 이소시아네이트(13.3 μM)를 가했다. 1시간동안 교반하여 실온으로 되돌려 석출된 결정을 여과 수취하여, 표제 화합물(26 mg)을 얻었다.
MS(ESI) m/z 392(M+1)
1H-NMR(DMSO-d6)δ(ppm) : 2.31(3H, s), 2.46-2.50(3H, m), 6.78-7.48(8H, m), 8.14(1H, s), 8.52(1H, s), 8.82(1H, s), 11.79(1H, s)
중간체는 다음과 같이 합성했다.
제조예
128-1
4-(3-
니트로페녹시
)-5,6-디메틸-7H-
피롤로
[2,3-d]-피리미딘
Journal of Medicinal Chemistry, 1996, Vol. 39, No 12,2285-2292에 기재된 4-클로로-5,6-디메틸-7H-피롤로[2,3-d]-피리미딘(177 mg)에 3-니트로페놀 3-니트로페놀(243 mg), 탄산칼륨(268 mg) 디메틸포름아미드(2 ml)를 가하여 120-130℃에서 72시간동안 교반했다. 실온으로 되돌린 후 물을 가하고, 테트라히드로푸란, 초산에틸의 혼합 용액으로 추출하여, 유기층을 포화식염수로 세척하고, 무수황산나트륨에 의해 건조한 후 농축 건조시켰다. 생성된 결정을 디에틸에테르로 세척하여, 표제 화합물(130 mg)을 얻었다.
MS(ESI) m/z 285(M+1)
1H-NMR(DMSO-d6)δ(ppm) : 2.31(3H, s), 2.46-2.50(3H, m), 7.70-8.18(5H, m), 11.89(1H, s)
제조예
128-2
4-(3-
아미노페녹시
)-5,6-디메틸-7H-
피롤로
[2,3-d]-피리미딘
상기 중간체 합성법에 의해 합성한 4-(3-니트로페녹시)-5,6-디메틸-7H-피롤로[2,3-d]-피리미딘(110 mg)에 철분(0.12 g), 염화암모늄(0.24 g), 에탄올(5 ml), 물(1 ml)을 가하여 80-90℃에서 3시간동안 교반했다. 반응계를 실온으로 되돌린 후 테트라히드로푸란(3 ml), 초산에틸(3 ml)을 가하여 세라이트 여과하고, 여과액을 초산에틸로 분액 추출하여 유기층을 물, 포화식염수로 순차적으로 세척했다. 황산나트륨으로 건조한 후 감압 농축 건조시키고, 디에틸에테르로 세척하여, 표제 화합물(37 mg)을 얻었다.
1H-NMR(DMSO-d6)δ(ppm) : 2.27(3H, s), 2.29(3H, s), 5.15-5.24(2H, m), 6.28(1H, d, J=8.1Hz), 6.32(1H, s), 6.40(1H, d, J=8.1Hz), 7.01(1H, t, J=8.1Hz), 8.12(1H, s), 11.72(1H, s).
실시예
129
N-6-((6,7-
디메톡시
-4-
퀴놀릴
)
옥시
)-3-
피리딜
-
N'
-
페닐우레아
6-((6,7-디메톡시-4-퀴놀릴)옥시)-3-피리딜아민(59.5 mg, 200 mmol) 및 페닐 이소시아네이트(26.2 mg, 220 mmol)를 N, N-디메틸포름아미드(1 ml)중에, 실온에서 18시간동안 교반했다. 반응액을 초산에틸로 희석한 후, 물 및 포화식염수로 세척하여, 유기층을 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 초산에틸로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(68 mg, 163 mmol, 82%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum : (DMSOd6) 3.90(3H, s), 3.95(3H, s), 6.55(1H, d, J=5.2Hz), 6.96-7.02(1H, m), 7.26-7.32(3H, m), 7.40(1H, s), 7.41(1H, s), 7.47(2H, d, J=8.4Hz), 8.14(1H, dd, J=2.8, 8.8Hz), 8.35(1H, d, J=2.8Hz), 8.55(1H, d, J=5.2Hz), 8.89(1H, s), 8.99(1H, s).
중간체는 다음과 같이 합성했다.
제조예
129-1
6,7-
디메톡시
-4-((5-니트로-2-
피리딜
)
옥시
)퀴놀린
6,7-디메톡시-1,4-디히드로-4-퀴놀리논(4.10 g, 20.0 mmol), 2-브로모-5-니트로피리딘(4.46 g, 22.0 mmol) 및 탄산칼륨(5.53 g, 40.0 mmol)을 N,N-디메틸포름아미드(20 ml) 중에, 70℃에서 3시간동안 가열 교반했다. 반응액을 초산에틸로 희석하여, 불필요한 것을 여과 분별한 후, 물 및 포화식염수로 세척하여, 유기층을 무수황산마그네슘으로 건조한 후, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(2.23 g, 6.81 mmol, 34%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum : (CDCl3) 3.95(3H, s), 4.06(3H, s), 7.07(1H, d, J=5.2Hz), 7.16(1H, s), 7.26(1H, d, J=8.8Hz), 7.49(1H, s), 8.60(1H, dd, J=2.8, 8.8Hz), 8.74(1H, d, J=5.2Hz), 9.08(1H, d, J=2.8Hz).
제조예
129-2
6-((6,7-
디메톡시
-4-
퀴놀릴
)
옥시
)-3-
피리딘아민
6,7-디메톡시-4-((5-니트로-2-피리딜)옥시)퀴놀린(654 mg, 2.00 mmol), 철분(559 mg, 10.0 mmol) 및 염화암모늄(1.07 g, 20.0 mmol)을 에탄올(20 ml)-물(5 ml) 중에 80℃에서 20분간 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸로 잘 세척하였다. 유기층을 물 및 포화식염수로 세척하고, 무수황산마그네슘으로 건조한 후, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 초산에틸로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(380 mg, 1.28 mmol, 64%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum : (CDCl3) 3.73(2H, s), 4.02(3H, s), 4.04(3H, s), 6.61(1H, d, J=5.2Hz), 6.96(1H, d, J=8.8Hz), 7.18(1H, dd, J=2.8, 8.8Hz), 7.41(1H, s), 7.53(1H, s), 7.85(1H, d, J=2.8Hz), 8.54(1H, d, J=5.2Hz).
실시예
130
N-6-((6,7-
디메톡시
-4-
퀴놀릴
)
옥시
)-3-
피리딜
-
N'
-(4-
플루오로페닐
)
우레아
실시예 129와 같은 식의 수법에 의해, 4-플루오로페닐 이소시아네이트(30.1 mg, 220 mmol)로부터 표제 화합물(67 mg, 154 mmol, 77%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum : (DMSOd6) 3.89(3H, s), 3.95(3H, s), 6.79(1H, d, J=5.0Hz), 7.11-7.16(2H, m), 7.29(1H, d, J=8.6Hz), 7.39(1H, s), 7.41(1H, s), 7.45-7.51(2H, m), 8.13(1H, dd, J=2.6, 8.6Hz), 8.34(1H, d, J=2.6Hz), 8.55(1H, d, J=5.0Hz), 8.93(1H, s), 8.99(1H, s).
실시예
131
N-6-((6,7-
디메톡시
-4-
퀴놀릴
)
옥시
)-3-
피리딜
-
N'
-(1,3-티아졸-2-일)
우레아
실시예 129에서 생성된 6-((6,7-디메톡시-4-퀴놀릴)옥시)-3-피리딘아민(89.1 mg, 300 mmol) 및 페닐 N-(2-티아졸릴)카르바메이트(79.3 mg, 360 mmol)를 디메틸 설폭시드(1 ml) 중에 85℃에서 1시간동안 교반했다. 반응액을 초산에틸로 희석한 후, 물 및 포화식염수로 세척하고, 유기층을 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 초산에틸로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(88 mg, 208 mmol, 69%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum : (DMSOd6) 3.89(3H, s), 3.95(3H, s), 6.81(1H, d, J=5.2Hz), 7.12(1H, d, J=3.6Hz), 7.31(1H, d, J=8.8Hz), 7.36-7.40(2H, m), 7.42(1H, s), 8.18(1H, dd, J=2.8, 8.8Hz), 8.37(1H, d, J=2.8Hz), 8.56(1H, d, J=5.2Hz), 9.30(1H, s).
실시예
132
4-(5-(( 아닐리노카르보닐 )아미노)-2- 피리딜옥시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 129와 같은 식의 수법에 의해, 4-((5-아미노-2-피리딜)옥시)-7-메톡시-6-퀴놀린카르복사미드(55.0 mg, 177 mmol)로부터 표제 화합물(59 mg, 137 mmol, 78%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum : (DMSOd6) 4.04(3H, s), 6.86(1H, d, J=5.2Hz), 6.96-7.02(1H, m), 7.26-7.34(3H, m), 7.47(2H, d, J=7.6Hz), 7.54(1H, s), 7.74(1H, s), 7.86(1H, s), 8.15(1H, dd, J=2.8, 8.8Hz), 8.36(1H, d, J=2.8Hz), 8.55(1H, s), 8.75(1H, d, J=5.2Hz), 8.90(1H, s), 9.01(1H, s).
중간체는 다음과 같이 합성했다.
제조예
132-1
7-
메톡시
-4-((5-니트로-2-
피리딜
)
옥시
)-6-
퀴놀린카르복사미드
실시예 129와 같은 식의 수법에 의해, WO98/13350에 기재한 7-메톡시-4-옥소-1,4-디히드로-6-퀴놀린카르복사미드의 가수분해에 의해 유도되는 7-메톡시-4-옥소-1,4-히드록시-6-퀴놀린카르복사미드(1.09 g, 5.00 mmol)로부터 표제 화합물(93.0 mg, 273 mmol, 5%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum : (CDCl3) 4.15(3H, s), 5.92(1H, s), 7.21(1H, d, J=5.2Hz), 7.35(1H, d, J=9.2Hz), 7.63(1H, s), 7.79(1H, s), 8.62(1H, dd, J=2.8, 8.8Hz), 8.94(1H, d, J=5.2Hz), 8.96(1H, s), 9.02(1H, d, J=5.2Hz).
제조예
132-2
4-((5-아미노-2-
피리딜
)
옥시
)-7-
메톡시
-6-
퀴놀린카르복사미드
7-메톡시-4-((5-니트로-2-피리딜)옥시)-6-퀴놀린카르복사미드(93.0 mg, 273 mmol), 철분(76.0 mg, 1.36 mmol) 및 염화암모늄(146 mg, 2.73 mmol)을 에탄올(4 ml)-물(1 ml) 중에 80℃에서 20분간 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸-테트라히드로푸란 혼합 용매로 잘 세척하였다. 유기층을 물 및 포화식염수로 세척하고, 무수황산마그네슘으로 건조한 후, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=20:1)에 가하여, 목적물을 포함하는 분획을 농축하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(61.0 mg, 197 mmol, 72%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum : (DMSOd6) 4.03(3H, s), 6.60(1H, d, J=5.4Hz), 7.04(1H, d, J=8.4Hz), 7.18(1H, dd, J=2.6, 8.4Hz), 7.50(1H, s), 7.68(1H, d, J=2.6Hz), 7.73(1H, s), 7.86(1H, s), 8.61(1H, s), 8.67(1H, d, J=5.4Hz).
실시예
133
N-(4-(6- 시아노 -7-((3- 메틸설포닐 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )-N'-(4-플루오로페닐)우레아
실시예 7과 같은 식으로 6-시아노-4-{4-[4-플루오로아닐리노카르보닐]아미노-3-플루오로페녹시}퀴놀린-7-올나트륨염(100 mg)으로부터 표제 화합물을 67 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.24-2.32(2H, m), 3.05(3H, s), 3.30-3.35(2H, m), 4.42(2H, t, J=6Hz), 6.63(1H, d, J=5.6Hz), 7.11-7.15(3H, m), 7.40(1H, dd, J=2.8Hz, J=8.0Hz), 7.44-7.48(2H, m), 7.63(1H, s), 8.21-8.26(1H, m), 8.64(1H, br), 8.75(1H, d, J=5.6Hz), 8.77(1H, s), 9.10(1H, br).
실시예
134
N-(4-(6- 시아노 -7-((3- 메틸티오 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )-N'-(4-플루오로페닐)우레아
실시예 7과 같은 식으로 6-시아노-4-{4-[4-플루오로아닐리노카르보닐]아미노-3-플루오로페녹시}퀴놀린-7-올나트륨염(100 mg)으로부터 표제 화합물을 30 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.09(3H, s), 2.06-2.14(2H, m), 2.67(2H, t, J=7.2Hz), 4.37(2H, t, J=6Hz), 6.62(1H, d, J=5.2Hz), 7.10-7.15(3H, m), 7.39(1H, dd, J=2.8Hz, J=7.6Hz), 7.44-7.48(2H, m), 7.60(1H, s), 8.21-8.26(1H, m), 8.65(1H, br), 8.74(1H, d, J=5.2Hz), 8.75(1H, s), 9.12(1H, brd, J=3.2Hz).
실시예
135
N-(4-(6- 시아노 -7-(3-( 에톡시카르보닐 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐)-N'-(4-플루오로페닐)우레아
실시예 7과 같은 식으로 6-시아노-4-{4-[4-플루오로아닐리노카르보닐]아미노-3-플루오로페녹시}퀴놀린-7-올나트륨염(1.0 g)으로부터 표제 화합물을 850 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.17(3H, t, J=7.2Hz), 2.05-2.13(2H, m), 2.53(2H, t, J=7.2Hz), 4.07(2H, q, J=7.2Hz), 4.31(2H, t, J=6.4Hz), 6.61(1H, d, J=5.2Hz), 7.10-7.15(3H, m), 7.40(1H, dd, J=2.8Hz, J=7.6Hz), 7.44-7.48(2H, m), 7.60(1H, s), 8.22-8.27(1H, m), 8.64(1H, br), 8.74(1H, d, J=5.2Hz), 8.74(1H, s), 9.10(1H, br).
실시예
136
N-(4-(6- 시아노 -7-(3- 카르복시프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(4-플루오로페닐)우레아
N-(4-(6-시아노-7-(3-(에톡시카르보닐)프로폭시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아(800 mg)를 메탄올(45 ml)에 용해하여, 2N NaOH수(15 ml)를 가하여 40분간 80℃에서 가열 교반했다. 반응 종료후, 반응액을 빙수에 붓고, 1N HCl로 중화하여 석출된 고체를 여과 수취했다. 생성된 고체를 물로 세척하고, 건조시켜 표제 화합물을 230 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.01-2.08(2H, m), 2.46(2H, t, J=7.6Hz), 4.30(2H, t, J=6.4Hz), 6.61(1H, d, J=5.2Hz), 7.10-7.15(3H, m), 7.39(1H, dd, J=2.8Hz, J=8.0Hz), 7.44-7.48(2H, m), 7.59(1H, s), 8.21-8.26(1H, m), 8.66(1H, br), 8.73(1H, d, J=5.2Hz), 8.74(1H, s), 9.13(1H, br).
실시예
137
N-(4-(6- 시아노 -7-(3-(( 시클로프로필아미노 )카르보닐) 프로폭시 )-4- 퀴놀릴 ) 옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아
N-(4-(6-시아노-7-(3-카르복시프로폭시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아(100 mg)를 디메틸포름아미드(3 ml)에 용해하고, 빙냉 교반하에 1-에틸-3-(3-디메틸아미노프로필)-카르보디이미드(44 mg)와 1-히드록시-1H-벤조트리아졸(35 mg)을 가하여 실온에서 30분간 교반했다. 다음에, 시클로프로필아민(16 ㎕)을 가하여 18시간동안 실온에서 교반했다. 반응 종료후, 반응액을 1N 수산화나트륨수에 부어, 초산에틸로 추출하여 생성된 유기층을 포화식염수로 세척하고, 황산마그네슘으로 건조시켰다. 유기층을 농축하고, 얻어진 고체를 에테르, 소량의 초산에틸로 세척하여 표제 화합물을 38 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.34-0.38(2H, m), 0.54-0.59(2H, m), 1.99-2.06(2H, m), 2.25(2H, t, J=7.2Hz), 2.56-2.63(1H, m), 4.27(2H, t, J=6.4Hz), 6.60(1H, d, J=5.2Hz), 7.10-7.15(3H, m), 7.39(1H, dd, J=2.8Hz, J=8.0Hz), 7.44-7.49(2H, m), 7.59(1H, s), 7.95(1H, brd, J=3.6Hz), 8.21-8.25(1H, m), 8.67(1H, br), 8.73(1H, d, J=5.2Hz), 8.74(1H, s), 9.15(1H, br).
실시예
138
N-(4-(6- 시아노 -7-(3-(( 피페리디노 )카르보닐) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐)-N'-(4-플루오로페닐)우레아
N-(4-(6-시아노-7-(3-카르복시프로폭시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아(100 mg)로부터 실시예 137과 같은 식의 조작에 의해 표제 화합물을 33 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.38-1.60(6H, m), 2.01-2.09(2H, m), 2.53(2H, t, J=7.2Hz), 3.39-3.46(4H, m), 4.31(2H, t, J=6.0Hz), 6.61(1H, d, J=5.2Hz), 7.10-7.15(3H, m), 7.40(1H, dd, J=2.4Hz, J=8.0Hz), 7.43-7.49(2H, m), 7.61(1H, s), 8.20-8.27(1H, m), 8.70(1H, br), 8.73(1H, d, J=5.2Hz), 8.74(1H, s), 9.17(1H, br).
실시예
139
N-(4-(6- 시아노 -7-(3-((디메틸아미노) 설포닐 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐)-N'-(4-플루오로페닐)우레아
실시예 7과 같은 식으로 6-시아노-4-{4-[4-플루오로아닐리노카르보닐]아미노-3-플루오로페녹시}퀴놀린-7-올나트륨염(100 mg)으로부터 표제 화합물을 35 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.19-2.27(2H, m), 2.80(6H, s), 3.26-3.31(2H, m), 4.41(2H, t, J=6.4Hz), 6.63(1H, d, J=5.2Hz), 7.10-7.16(3H, m), 7.40(1H, dd, J=2.8Hz, J=7.6Hz), 7.44-7.49(2H, m), 7.61(1H, s), 8.21-8.27(1H, m), 8.68(1H, br), 8.75(1H, d, J=5.2Hz), 8.77(1H, s), 9.15(1H, br).
실시예
140
N-(4-(6- 시아노 -7-(3-(( 시클로프로필아미노 ) 설포닐 ) 프로폭시 )-4- 퀴놀릴 ) 옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아
실시예 7과 같은 식으로 6-시아노-4-{4-[4-플루오로아닐리노카르보닐]아미노-3-플루오로페녹시}퀴놀린-7-올나트륨염(100 mg)으로부터 표제 화합물을 31 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.51-0.63(4H, m), 2.17-2.25(2H, m), 3.15-3.22(1H, m), 3.26-3.33(2H, m), 4.42(2H, t, J=6.0Hz), 6.63(1H, d, J=5.2Hz), 7.10-7.16(3H, m), 7.40(1H, dd, J=2.8Hz, J=8.0Hz), 7.44-7.48(2H, m), 7.56(1H, brd, J=2.8Hz), 7.61(1H, s), 8.21-8.27(1H, m), 8.63-8.66(1H, m), 8.75(1H, d, J=5.2Hz), 8.77(1H, s), 9.11-9.13(1H, m).
실시예
141
N-(4-(7- 벤질옥시 -6- 시아노 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2- 티아졸릴 )우레아
페닐 N-(4-(6-시아노-7-벤질옥시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(6.93 g)와 2-아미노티아졸(2.75 g)을 디메틸포름아미드(70 ml)에 용해하고, 여기에 디이소프로필에틸아민(4.8 ml)을 가하여, 90℃에서 2시간동안 가열 교반했다. 방냉후에 물을 가하여 석출되는 개체를 여과 수취하고, 이것을 초산에틸로 세척하여 5.53 g(수율 79%)의 표제 화합물을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.46(2H, s), 6.63(1H, d, J=5.2Hz), 7.13-7.19(2H, m), 7.33-7.48(5H, m), 7.54(2H, d, J=6.8Hz), 7.72(1H, s), 8.21-8.27(1H, m), 8.73-8.78(2H, m)
중간체는 다음과 같이 합성했다.
제조예
141-1
페닐 N-(4-(6- 시아노 -7- 벤질옥시 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 ) 카르바메이트
제조예 8에서 합성한 7-벤질옥시-6-시아노-4-(3-플루오로-4-아미노페녹시)퀴놀린(9.45 g)을 디메틸포름아미드(70 ml)와 피리딘(5.9 ml)에 용해하여 질소 기류하에 0℃로 냉각했다. 여기에 크로르탄산페닐(3.4 ml)을 가하여, 밤새 2시간동안 교반했다. 이 반응액에 물을 가하여 석출된 결정을 여과 수취하고, 이것을 테트라히드로푸란 및 톨루엔 중에서 분쇄하여 6.93 g(수율 56%)의 표제 화합물을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.36(2H, s), 6.53(1H, d, J=5.3), 6.98-7.05(2H, m), 7.17-7.47(9H, m), 7.51-7.58(3H, m), 8.67-8.71(2H, m)
실시예
142
N-[4-(6- 시아노 -7-[3-(모르폴린-4-일) 프로폭시 ]-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐]-N’-(2-티아졸릴)우레아
N-(4-(6-시아노-7-히드록시-퀴놀릴)옥시-2-플루오로페닐)-N'-(2-티아졸릴)우레아(150 mg)를 디메틸포름아미드(3 ml)에 용해하고, 탄산칼륨(150 mg), 1-클로로-3-(모르폴린-4-일)프로판(70 mg)을 가하여, 60℃에서 2시간동안 가열 교반했다. 방냉후에 물을 가하여 초산에틸로 추출하고, 유기층을 포화식염수로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(20 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.94-2.04(2H, m), 2.34-2.52(6H, m), 3.54-3.61(4H, m), 4.34(2H, t, J=6.2Hz), 6.61(1H, d, J=5.6Hz), 7.12-7.20(2H, m), 7.37-7.47(2H, m), 7.61(1H, s), 8.21-8.27(1H, m), 8.73-8.76(2H, m)
중간체는 다음의 방법으로 합성했다.
제조예
142-1
N-(4-(6- 시아노 -7-히드록시-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2- 티아졸릴 )우레아
실시예 141에서 합성한 N-(4-(7-벤질옥시-6-시아노-퀴놀릴)옥시-2-플루오로페닐)-N'-(2-티아졸릴)우레아(5.53 g)를 TFA(55 ml)에 용해하고, 여기에 티오아니솔(5.5 ml)을 가하여 70℃에서 6시간동안 가열 교반했다. 반응 용액을 냉각후에 감압 농축하고, 여기에 중조수와 메탄올을 가하여, 석출된 결정을 여과했다. 이것을 디에틸에테르로 세척하여 표제 화합물 3.63 g(수율 80%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.50(1H, d, J=5.6Hz), 7.12-7.19(2H, m), 7.35-7.45(3H, m), 8.19-8.27(1H, m), 8.61-8.66(2H, m)
실시예
143
N-(4-(6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐-N'-(2-티아졸릴)우레아
실시예 142에서 합성한 N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2-티아졸릴)우레아(150 mg)를 디메틸포름아미드(2.5 ml)에 용해하고, 탄산칼륨(150 mg), 1-클로로-3-(디에틸아미노)프로판(80 mg)을 가하여, 60℃에서 2시간동안 가열 교반했다. 방냉후에 물을 가하여 초산에틸로 추출하고, 유기층을 포화식염수로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(10 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.0Hz), 1.85-1.96(2H, m), 2.40-2.65(6H, m), 4.32(2H, t, J=6.0Hz), 6.62(1H, d, J=5.2Hz), 7.12-7.20(2H, m), 7.36-7.48(2H, m), 7.59(1H, s), 8.20-8.24(1H, m), 8.73-8.77(2H, m)
실시예
144
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3- 메틸이속사졸-5-일)우레아
제조예 10에서 합성한 4-(4-아미노페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(100 mg)과 페닐 N-(3-메틸이속사졸-5-일)카르바메이트(81 mg)를 톨루엔(5 ml)에 가하고, 또 디이소프로필에틸아민(0.88 ml)을 가하여 100℃에서 2시간동안 가열 교반했다. 방냉후에 석출된 결정을 여과하고, 이것을 초산에틸과 톨루엔(1/1)의 혼합 용매로 세척하여, 표제 화합물(102 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.16(3H, s), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.44(2H, m), 5.95(1H, s), 6.52(1H, d, J=5.2Hz), 7.26(2H, d, J=9.2Hz), 7.58-7.64(3H, m), 8.71(1H, d, J=5.2Hz), 8.76(1H, s), 9.04(1H, brs).
중간체는 다음의 방법으로 합성했다.
제조예
144-1
N-(3-
메틸이속사졸
-5-일)
카르바메이트
알드리치사로부터 구입한 5-아미노-3-메틸이속사졸(1 g)을 테트라히드로푸란(40 ml)과 피리딘(1.5 ml)에 용해하고, 질소 분위기하에서 0℃로 냉각한 후에 크로르탄산페닐(1.4 ml)을 가한 후, 1.5시간동안 실온에서 교반했다. 여기에 물을 가하여 초산에틸로 2회 추출하고, 유기층을 합쳐, 물, 포화식염수의 순으로 세척한 후에 무수황산나트륨으로 건조하고, 감압하에서 농축했다. 생성된 잔사를 초산에틸과 n-헥산으로부터 결정화하여 표제 화합물(450 mg, 수율 20%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.27(3H, s), 6.03(1H, s), 7.16-7.30(3H, m), 7.37-7.44(2H, m), 7.81(1H, brs)
실시예
145
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(5- 메틸이속사졸-3-일)우레아
제조예 10에서 합성한 4-(4-아미노페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(100 mg)과 페닐 N-(5-메틸이속사졸-3-일)카르바메이트(72 mg)를 톨루엔(5 ml)에 가하고, 또 디이소프로필에틸아민(0.50 ml)을 가하여 2시간동안 가열 환류했다. 방냉후에 석출된 결정을 여과하고, 이것을 초산에틸과 톨루엔(1/1)의 혼합 용매로 세척하여, 표제 화합물(120 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.36(3H, s), 3.37(3H, s) 3.75-3.78(2H, m), 4.37-4.43(2H, m), 6.50-6.54(2H, m), 7.26(2H, d, J=8.8Hz), 7.56-7.63(3H, m), 8.72(1H, d, J=5.6Hz), 8.76(1H, s), 8.99(1H, brs), 9.51(1H, brs)
중간체는 다음의 방법으로 합성했다.
제조예
145-1
N-(5-
메틸이속사졸
-3-일)
카르바메이트
알드리치사로부터 구입한 3-아미노-5-메틸이속사졸(1.00 g)을 테트라히드로푸란(20 ml)과 피리딘(1.5 ml)에 용해하고, 질소 분위기하에서 0℃로 냉각한 후에 크로르탄산페닐(1.4 ml)을 가한 후, 2시간동안실온에서 교반했다. 여기에 물을 가하여 초산에틸로 2회 추출하고, 유기층을 합쳐, 물, 포화식염수의 순으로 세척한 후에 무수황산나트륨으로 건조시켜, 감압하에서 농축했다. 생성된 잔사를 디에틸에테르와 n-헥산으로 분쇄하여 표제 화합물(1.54 g)(수율 68%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.42(3H, s), 6.56(1H, s), 7.15-7.30(3H, m), 7.36-7.43(2H, m), 8.18(1H, brs)
실시예
146
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(2-옥소-1,2,3,4-테트라히드로-6-퀴놀리닐)우레아
실시예 25의 방법과 같은 식으로 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(65 mg)로부터 표제 화합물(64 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.38-2.45(2H, m), 2.81-2.90(2H, m), 3.36(3H, s), 3.75-3.79(2H, m), 4.40-4.43(2H, m), 6.61(1H, d, J=5.2), 6.77(1H, d, J=8.4Hz), 7.10-7.18(2H, m), 7.30(1H, brs), 7.36-7.42(1H, m), 7.63(1H, s), 8.23-8.29(1H, m), 8.60(1H, brs), 8.73-8.76(2H, m), 8.92-8.94(1H, m), 9.97(1H, brs)
실시예
147
4-(4-(
아닐리노카르보닐
)
아미노페녹시
)-7-
메톡시
-6-
퀴놀린카르복사미드
실시예 37에서 합성한 N-(4-(6-시아노-7-메톡시-4-퀴놀릴)옥시-페닐)-N'-페닐우레아(100 mg)를 80℃에서 디메틸설폭스아시드(3 ml)에 용해시키고, 여기에 5N 수산화나트륨 수용액을 가하여 2시간동안 가열 교반했다. 반응액을 1N 염산으로 중화시킨 후 석출된 결정을 여과 수취한 후에, 에탄올로 세척하여 표제 화합물(60 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 6.56(1H, d, J=6.0Hz), 6.96(1H, t, J=7.6Hz), 7.22-7.30(4H, m), 7.45(2H, d, J=7.6Hz), 7.52(1H, s), 7.59-7.62(2H, m), 7.76(1H, brs), 7.87(1H, brs), 8.69-8.73(2H, m), 8.76(1H, brs), 8.90(1H, brs)
실시예
148
4-(4-( 아닐리노카르보닐 ) 아미노페녹시 )-7-(2- 메톡시에톡시 )-6- 퀴놀린카르복사미드
실시예 65에서 합성한 N-(4-(6-시아노-7-(메톡시에톡시)-4-퀴놀릴)옥시페닐)-N'-페닐우레아(95 mg)로부터 실시예 147과 같은 식으로 표제 화합물(54 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.75-3.81(2H, m), 4.37-4.41(2H, m), 6.46(1H, d, J=5.2), 6.96(1H, t, J=7.6), 7.21-7.30(4H, m), 7.45(2H, d, J=8.4Hz), 7.55(1H, s), 7.59(2H, d, J=8.8Hz), 7.81(1H, brs), 7.82(1H, brs), 8.65(1H, d, J=5.2), 8.77-8.79(2H, m), 8.91(1H, brs)
실시예
149
4-(4-((2,4- 디플루오로페닐 )카르보닐)아미노-3- 플루오로페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복사미드
실시예 66에서 합성한 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(2,4-디플루오로페닐)우레아(100 mg)로부터 실시예 147과 같은 식으로 표제 화합물(35 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :3.34(3H, s), 3.78-3.81(2H, m), 4.39-4.42(2H, m), 6.56(1H, d, J=5.2Hz), 7.03-7.17(2H, m), 7.28-7.43(2H, m), 7.56(1H, s), 7.81(2H, brs), 8.08-8.16(1H, m), 8.28-8.29(1H, m), 8.67(1H, d, J=5.2), 8.76(1H, s), 9.00-9.09(2H, m)
실시예
150
4-(4-((4- 플루오로아닐리노 )카르보닐)아미노-3- 플루오로페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복사미드
실시예 100에서 합성한 N-(4-(6-시아노-7-(2-에톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(4-플루오로페닐)우레아(58 mg)로부터 실시예 147과 같은 식으로 표제 화합물(25 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.34(3H, s), 3.78-3.81(2H, m), 4.39-4.42(2H, m), 6.56(1H, d, J=5.2Hz), 7.10-7.17(3H, m), 7.36-7.50(3H, m), 7.56(1H, s), 7.82(2H, brs), 8.19-8.26(1H, m), 8.64-8.69(2H, m), 8.76(1H, s), 9.13-9.15(1H, m)
실시예
151
7-(2- 메톡시에톡시 )-4-(4-((1,3-티아졸-2- 일아미노 )카르보닐)아미노-3- 플루오로페녹시)-6-퀴놀린카르복사미드
실시예 25에서 합성한 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)-N'-(1,3-티아졸-2-일)우레아(100 mg)로부터 실시예 147과 같은 식으로 표제 화합물(18 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.34(3H, s), 3.78-3.81(2H, m), 4.39-4.42(2H, m), 6.57(1H, d, J=5.2Hz), 7.12-7.19(2H, m), 7.39(1H, d, J=3.6Hz), 7.41-7.46(1H, m), 7.57(1H, s), 7.82(1H, brs), 8.21-8.25(1H, m), 8.68(1H, d, J=5.2Hz), 8.76(1H, s), 9.06(1H, brs)
실시예
152
4-(4-((4- 플루오로아닐리노 )카르보닐)아미노-3- 플루오로페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
실시예 10과 같은 식의 방법으로 6-카르바모일-4-(4-아미노-3-플루오로페녹시)-7-메톡시퀴놀린(50 mg)으로부터 표제 화합물(25 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.55(1H, d, J=5.6Hz), 7.09-7.18(3H, m), 7.35-7.41(1H, m), 7.43-7.49(2H, m), 7.51(1H, s), 7.74(1H, brs), 7.85(1H, brs), 8.18-8.26(1H, m), 8.61-8.68(3H, m), 9.09-9.12(1H, m)
출발 물질은 다음의 방법으로 합성했다.
제조예
152-1
7-
메톡시
-4-옥소-1,4-
디히드로퀴놀린
-6-
카르복실산
제조예 24에 기재한 7-메톡시-4-옥소-1,4-디히드로퀴놀린-6-카르보니트릴(2 g)에 글리세롤(20 ml)과 KOH 수산화칼륨(3.0 g)을 가하여, 160℃에서 3시간동안 가열 교반하고, 물(40 ml)을 가하여 80℃에서 30분간 더 가열했다. 방냉후 2N 염산으로 산성으로 만들고, 석출된 불필요한 물질을 여과 수취하여, 이것을 물로 세척한 후에 감압 건조시켜 표제 화합물(1.6 g)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.87(3H, s), 6.14(1H, d, J=6.0Hz), 7.04(1H, s), 7.98(1H, d, J=6.0), 8.40(1H, s)
제조예
152-2
7-
메톡시
-4-
클로로
-퀴놀린-6-카르보닐 클로라이드
7-메톡시-4-옥소-1,4-디히드로퀴놀린-6-카르복실산(2.0 g)에 염화티오닐(10 ml)과 소량의 DMF 디메틸포름아미드를 가하여, 2시간동안 가열 환류했다. 감압 농축후에 톨루엔으로 2회 공비하여 표제 화합물(2.7 g)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.20(3H, s), 7.80-7.90(1H, m), 8.41(1H, s), 8.90-9.00(2H, m)
제조예
152-3
7-
메톡시
-4-
클로로
-퀴놀린-6-
카르복사미드
7-메톡시-4-클로로-퀴놀린-6-카르보닐 클로라이드(2.7 g)를 테트라히드로푸란(150 ml)에 용해하여, 0℃로 냉각했다. 여기에 30% 암모니아수(5 ml)를 가하여, 실온에서 30분간 교반했다. 물을 가하여 초산에틸로 3회 추출한 후, 유기층을 합쳐 물, 포화식염수로 세척하고, 황산나트륨으로 건조한 후에 감압 건조시켜 표제 화합물(1.35 g)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 7.56-7.66(2H, m), 7.79(1H, brs), 7.88(1H, brs), 8.46-8.49(1H, m), 8.78-8.82(1H, m)
제조예
152-4
6-
카르바모일
-4-(3-
플루오로
-4-
니트로페녹시
)-7-
메톡시퀴놀린
제조예 7과 같은 식으로 7-메톡시-4-클로로-퀴놀린-6-카르복사미드(1.23 g)로부터 표제 화합물(1.1 g)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 6.96(1H, d, J=5.2Hz), 7.25-7.30(1H, m), 7.57(1H, s), 7.61-7.66(1H, m), 7.74(1H, brs), 7.84(1H, brs), 8.25-8.32(1H, m), 8.49(1H, s), 8.80(1H, d, J=5.2Hz)
제조예
152-5
6-
카르바모일
-4-(4-아미노-3-
플루오로페녹시
)-7-
메톡시퀴놀린
제조예 10과 같은 식으로 6-카르바모일-4-(3-플루오로-4-니트로페녹시)-7-메톡시퀴놀린(1.08 g)으로부터 표제 화합물(540 mg)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.01(3H, s), 5.19-5.23(2H, m), 6.44(1H, d, J=5.2), 6.83-6.89(2H, m), 7.05-7.10(1H, m), 7.47(1H, s), 7.71(1H, brs), 7.83(1H, brs), 8.60-8.66(2H, m)
실시예
153
1-(2- 클로로 -4-{6-[4-(2- 디에틸아미노에톡시 )- 페닐 ]-7H- 피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-(2-디에틸아미노에톡시)-페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-페닐}-3-시클로프로필우레아 40 mg(0.0601 밀리몰)을 테트라히드로푸란 1 ml에 녹여 테트라부틸암모늄클로라이드(테트라히드로푸란 1 M 용액)를 0.5 ml(8.3당량) 적하하여, 2시간동안 환류했다. 실온으로 되돌려 물 3 ml를 가하고, 3시간동안 방치하여, 석출된 결정을 여과 수취하여 물, 및 에테르-헥산=1:1으로 세척하고 감압 건조시켜 표제 화합물 22 mg을 얻었다.
MS Spectrum (ESI) : 535(M+1),
1H-NMR Spectrum: (DMSOd6) 0.40-0.54(2H, m), 0.70-0.80(2H, m), 1.06(6H, t, J=7.8Hz) 2.55-2.70(5H, m), 2.88(2H, t, J=7.8Hz), 4.18(2H, t, J=7.8Hz), 7.01(1H, d, J=1.7Hz), 7.12(2H, d, J=8.4Hz), 7.23(1H, d, J=2.5Hz), 7.27(1H, dd, J=8.8Hz, J'=2.5Hz), 7.41(1H, d, J=2.5Hz), 7.97(2H, d, J=8.4Hz), 8.01(1H, s), 8.24(1H, d, J=8.8Hz), 8.36(1H, s), 12.68(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
153-1
2-아미노-5-(4-
벤질옥시페닐
)-1H-피롤-3-
카르복실산에틸에스테르
2-아미디노-초산에틸에스테르 염산염 50.7 g(Liebigs Ann.Chem., 1895(1977)에 기재한 공지 화합물)에 에탄올 700 ml를 가하고 실온 교반하에, 나트륨 에톡시드 22.3 g(2-아미디노-초산에틸에스테르 염산염에 대하여 1당량)을 가하여, 질소 분위기하에서, 15분간 교반했다. 거기에, 1-(4-벤질옥시페닐)-2-브로모에타논(Journal of Heterocyslic Chemistry vol. 2,310(1965), 및 Journal of Medicinal Chemistry vol. 17,55(1974)에 기재한 공지 화합물) 49.9 g을 가하여, 실온, 질소 분위기하에서 36시간동안 교반했다. 물을 가하여, 초산에틸로 분액 추출하고, 유기층을 황산나트륨으로 건조한 후, 농축 건조시켜 표제 화합물 56.7 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 1.32(3H, t, J=7.3Hz), 4.10(2H, q, J=7.3Hz), 5.08(2H, s,), 5.62(2H, s), 6.30(1H, d, J=2.2Hz), 6.95(2H, d, J=7.9Hz), 7.28-7.47 (7H, m), 10.67(1H, brs)
제조예
153-2
6-(4-
벤질옥시페닐
)-7H-
피롤로[2,3-d]피리미딘
-4-올
제조예 153-1에서 합성한 2-아미노-5-(4-벤질옥시페닐)-1H-피롤-3-카르복실산에틸에스테르 56.7 g에 포름산 84 ml, 포름아미드 338 ml, 디메틸포름아미드 169 ml를 가하여, 140℃에서 48시간동안 교반한 후, 실온에서 24시간동안 방치했다. 석출된 고체를 여과 수취하여, 감압 건조한 후, 표제 화합물 41 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 5.12(2H, s), 6.78(1H, s),7.03(2H, d, J=7.0Hz), 7.28-7.47(5H, m), 7.73(2H, d, J=7.0Hz), 7.82(1H, s), 11.80(1H, brs), 12.20(1H, brs)
제조예
153-3
6-(4-
벤질옥시페닐
)-4-
클로로
-7H-
피롤로[2,3-d]피리미딘
제조예 153-2에서 합성한 6-(4-벤질옥시페닐)-7H-피롤로[2,3-d]피리미딘-4-올 20 g에 옥시염화인 200 ml를 가하여, 140℃에서 3시간동안 교반한 후, 실온으로 하여 반응계를 농축했다. 잔사에 빙수를 가하여, 초산에틸-테트라히드로푸란(5:1) 혼합 용매로 분액 추출했다. 유기층을 물, 포화식염수로 세척하여, 황산나트륨으로 건조하고 농축 건조시켜 표제 화합물 12 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 5.18(2H, s), 6.97(1H, d, J=2.4Hz), 7.12(2H, d, J=7.5Hz), 7.30-7.50(5H, m), 7.94(2H, d, J=7.5Hz), 8.70(1H, s), 12.90(1H, brs)
제조예
153-4
6-(4- 벤질옥시페닐 )-4- 클로로 -7-(2- 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘
제조예 153-3에서 합성한 6-(4-벤질옥시페닐)-4-클로로-7H-피롤로[2,3-d]피리미딘 2.46 g의 디메틸포름아미드(30 ml) 용액에 수소화나트륨(60% 분산액, Aldrich) 0.381 g(1.3당량)을 가하여 실온에서 40분간 교반한 후, 2-(클로로메톡시)에틸트리메틸실란 1.68 ml(1.3당량)을 가하여, 실온에서 밤새 교반하고 물 20 ml, 초산 1 ml를 가하여 초산에틸-테트라히드로푸란(5:1) 혼합 용매로 분액 추출했다. 유기층을 황산나트륨으로 건조시켜, 농축하고 NH 실리카겔 컬럼 크로마토그래피(초산에틸)에 가하여, 표제 화합물 2.83 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) -0.10(9H, s), 0.84(2H, t, J=8.0Hz), 3.62(2H, t, J=8.0Hz),5.20(2H, s), 5.61(2H, s),6.81(1H, s), 7.19(2H, d, J=7.7Hz), 7.33-7.52(5H, m), 7.88(2H, d, J=7.7Hz), 8.70(1H, s)
제조예
153-5
4-[6-(4- 벤질옥시페닐 )-7-(2- 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시]-2-클로로페닐아민
제조예 153-4에서 합성한 6-(4-벤질옥시페닐)-4-클로로-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘에 디메틸설폭시드 12 ml를 가하고, 교반하에, 수소화나트륨(60% 분산액, Aldrich) 141 mg(1.5당량), 4-아미노-3-클로로페놀 507 mg(1.5당량)을 가하여, 실온에서 10분간 교반한 후, 135-140℃에서 4시간동안 교반했다. 그 후 실온으로 되돌리고, 물을 가하여 초산에틸-테트라히드로푸란(5:1) 혼합 용매로 분액 추출했다. 유기층을 황산나트륨으로 건조시켜, 농축하고 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 1.20 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) -0.90(9H, s), 0.85(2H, t, J=8.0Hz), 3.61(2H, t, J=8.0Hz), 5.18(2H, s), 5.34(2H, s), 5.59(2H, s), 6.64(1H, s,), 6.85(1H, d, J=8.0Hz), 6.95-6.99(1H, m), 7.15-7.20(3H, m), 7.30-7.55(5H, m), 7.71(2H, d, J=8.0Hz), 8.41(1H, d, J=1.4Hz)
제조예
153-6
1-{4-[6-(4- 벤질옥시페닐 )-7-(2- 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시]-2-클로로페닐}-3-시클로프로필우레아
제조예 153-5에서 합성한 4-[6-(4-벤질옥시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-클로로페닐아민 334 mg을 디메틸포름아미드 4 ml에 녹이고, 피리딘 0.066 ml(1.4당량), 클로로탄산페닐 0.102 ml(1.4당량)을 가해 실온에서, 2.5시간동안 교반한 후, 시클로프로필아민 0.09 ml(2.2당량)을 가하여 밤새 교반했다. 물을 가하여, 초산에틸로 분액 추출하고, 유기층을 포화식염수로 세척하여, 황산나트륨으로 건조, 농축하고 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 330 mg을 얻었다.
MS Spectrum (ESI) : 656(M+1), 678(M+23),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.40-0.46(2H, m), 0.63-0.70(2H, m), 0.87(2H, t, J=7.8Hz), 2.43-2.62(1H, m), 3.62(2H, t, J=7.8Hz), 5.20(2H, s), 5.60(2H, s), 6.75(1H, s), 7.15-7.53(9H, m), 7.73(2H, d, J=8.6Hz), 7.94(1H, s), 7.93(1H, s), 8.18(1H, d, J=9.0Hz), 8.41(1H, d, J=1.8Hz)
제조예
153-7
1-{2- 클로로 -4-[6-(4- 히드록시페닐 )-7-(2- 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아
제조예 153-6에서 합성한 1-{4-[6-(4-벤질옥시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-클로로페닐}-3-시클로프로필우레아 260 mg을 에탄올 10 ml, 테트라히드로푸란 5 ml에 녹이고, 산화백금 100 mg을 가하여, 실온, 상압하에 수소 분위기하에서 밤새 교반한 후, 세라이트 여과하여, 감압 농축했다. 잔사를 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 160 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.40-0.46(2H, m), 0.63-0.70(2H, m), 0.86(2H, t, J=8.1Hz), 2.53-2.62(1H, m), 3.62(2H, t, J=8.1Hz), 5.58(2H, s,), 6.67(1H, s,), 6.90(2H, d, J=8.2Hz), 7.13-7.22(2H, m), 7.43-7.47(1H, m), 7.60(2H, d, J=8.2Hz), 7.93(1H, s), 8.17(1H, d, J=9.1Hz), 8.40(1H, s), 9.38(1H, brs)
제조예
153-8
1-{2- 클로로 -4-[6-[4-(2- 디에틸아미노 -2- 히드록시프로폭시 )- 페닐 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-페닐}-3-시클로프로필우레아
제조예 153-7에서 합성한 1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아 113 mg을 디메틸포름아미드 1 ml에 녹이고 2-클로로에틸디에틸아민염산염 120 mg(3.5당량), 탄산칼륨 138 mg(5당량)을 가하여, 80℃에서 15시간동안 교반했다. 그 후 실온으로 되돌리고, 물을 가하여 초산에틸로 분액 추출했다. 유기층을 황산나트륨으로 건조시켜, 농축하고 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 40 mg을 얻었다.
MS Spectrum(ESI) : 665(M+1),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.40-0.47(2H, m), 0.63-0.70(2H, m), 0.87(2H, t, J=8.9Hz), 0.99(6H, t, J=8.0Hz) 2.52-2.62(5H, m), 2.80(2H, t, J=8.0Hz), 3.62(2H, t, J=8.9Hz), 4.10(2H, t, J=8.0Hz), 5.60(2H, s,), 6.72(1H, s), 7.08(2H, d, J=8.1Hz), 7.17(1H, d, J=3.2Hz), 7.21(1H, dd, J=3.2, 8.4Hz), 7.46(1H, d, J=3.2Hz), 7.71(2H, d, J=8.1Hz), 7.94(1H, s,), 8.18(1H, d, J=8.4Hz), 8.40(1H, s,)
실시예
154
1-(2- 클로로 -4-{6-[4-(2-(1- 피롤리디노 ) 에톡시 )- 페닐 ]-7H- 피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-(2-피롤리디노에톡시)-페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-페닐}-3-시클로프로필우레아 25 mg으로부터 실시예 153과 같은 식의 방법으로 표제 화합물 13 mg을 얻었다.
MS Spectrum(ESI) : 533(M+1),
1H-NMR Spectrum : (DMSOd6) 0.40-0.45(2H, m), 0.60-0.70(2H, m), 1.65-1.72(4H, m), 2.47-2.60(5H, m, covered by DMSO peak), 2.70(2H, t, J=7.6Hz), 4.12(2H, t, J=7.6Hz), 6.82(1H, s), 7.02(2H, d, J=8.5Hz), 7.13(1H, d, J=2.6Hz), 7.17(1H, dd, J=2.6, 8.5Hz), 7.41(1H, d, J=2.6Hz), 7.87(2H, d, J=8.5Hz), 7.91(1H, s), 8.14(1H, d, J=8.5Hz), 8.26(1H, s), 12.59(1H, brs)
제조예
154-1
1-{2- 클로로 -4-[6-[4-(2-(1- 피롤리디노 ) 에톡시 )- 페닐 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
제조예 153-7에서 합성한 1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아 86 mg으로부터 1-(2-클로로에틸)피롤리딘염산염 104 mg, 탄산칼륨 126 mg을 이용하여 제조예 153-8과 같은 식의 방법에 의해 표제 화합물 27 mg을 얻었다.
MS Spectrum(ESI) : 663(M+1),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.40-0.44(2H, m), 0.61-0.69(2H, m), 0.85(2H, t, J=8.0Hz), 1.61-1.76(4H, m), 2.44-2.61(5H, m, covered by DMSO peak), 2.86(2H, t, J=8.0Hz), 3.61(2H, t, J=8.0Hz), 4.13(2H, t, J=8.0Hz), 5.79(2H, s), 6.72(1H, s), 7.09(2H, d, J=8.7Hz), 7.15(1H, d, J=8.7Hz), 7.20(1H, dd, J=2.5, 8.7Hz), 7.44(1H, d, J=2.5Hz), 7.71(2H, d, J=8.7Hz), 7.93(1H, s), 8.16(1H, d, J=8.7Hz), 8.39(1H, s)
실시예
155
1-(2- 클로로 -4-{6-[4-(2-(1- 피롤리디노 ) 프로폭시 ) 페닐 ]-7H- 피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-(2-(1-피롤리디노)프로폭시)페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아 28 mg으로부터 실시예 153과 같은 방법으로 표제 화합물 11 mg을 얻었다.
*MS Spectrum(ESI) : 547(M+1),
제조예
155-1
1-{2- 클로로 -4-[6-[4-(3-(1- 피롤리디노 ) 프로폭시 ) 페닐 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
제조예 153-7에서 합성한 1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아 96 mg으로부터 1-(3-클로로프로필)피롤리딘 146 mg, 탄산칼륨 150 mg, 요드화칼륨 15 mg을 이용하여 제조예 153-8과 같은 식의 방법에 의해 표제 화합물 28 mg을 얻었다.
MS Spectrum(ESI) : 677(M+1),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.39-0.47(2H, m), 0.63-0.70(2H, m), 0.87(2H, t, J=8.0Hz), 1.63-1.73(4H, m), 1.88-1.96(2H, m), 2.40-2.62(7H, m, covered by DMSO peak), 3.61(2H, t, J=8.1Hz), 4.09(2H, t, J=6.6Hz), 5.60(2H, s), 6.72(1H, s), 7.08(2H, d, J=8.9Hz), 7.16(1H, d, J=2.6Hz), 7.21(1H, dd, J=2.4, 8.9Hz), 7.46(1H, d, J=2.6Hz), 7.71(2H, d, J=8.9Hz), 7.95(1H, s), 8.18(1H, d, J=8.9Hz), 8.40(1H, s)
실시예
156
1-{2- 클로로 -4-[6-[4-((2R)-2-히드록시-3- 디에틸아미노프로폭시 ) 페닐 ]-7H- 피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-((2S)-2-히드록시-3-디에틸아미노프로폭시)페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아 22 mg으로부터 실시예 153과 같은 식의 방법으로 표제 화합물 11 mg을 얻었다.
MS Spectrum(ESI) : 565(M+1),
1H-NMR Spectrum : (DMSOd6) 0.40-0.47(2H, m),0.63-0.70(2H, m), 0.96(6H, t, J=6.6Hz) 2.45-2.63(7H, m, covered by DMSO peak), 3.80-4.10(3H, m), 6.93(1H, s,), 7.04(2H, d, J=8.6Hz), 7.15(1H, d, J=2.2Hz), 7.19(1H, dd, J=2.2, 8.6Hz), 7.43(1H, d, J=2.2Hz), 7.88(2H, d, J=8.6Hz), 7.93(1H, s), 8.16(1H, d, J=8.6Hz), 8.28(1H, s), 12.60(1H, brs)
제조예
156-1
1-{2- 클로로 -4-[6-[4-((2S)-2-히드록시-3- 디에틸아미노프로폭시 ) 페닐 ]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
제조예 153-7에서 합성한 1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아 75 mg을 디메틸포름아미드 1 ml에 녹여 p-톨루엔술폰산(2S)-(+)-글리시딜에스테르 91 mg(3당량), 탄산칼륨 92 mg(5당량)을 가하여, 75℃에서 8시간동안 교반했다. 그 후 실온으로 되돌리고, 반응계를 동산(桐山) 여과하여, 여과액에 디에틸아민 0.1 ml를 가하고, 70℃에서 8시간동안 교반했다. 그 후 물을 가하여 초산에틸-테트라히드로푸란으로 분액 추출했다. 유기층을 농축하여 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 24 mg을 얻었다.
MS Spectrum(ESI) : 695(M+1),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.39-0.47(2H, m), 0.63-0.70(2H, m), 0.86(2H, t, J=8.3Hz), 0.97(6H, t, J=7.0Hz), 2.38-2.60(7H, m), 3.61(2H, t, J=8.3Hz), 3.83-4.11(3H, m), 4.82(1H, brs), 5.59(2H, s), 6.73(1H, s), 7.08(2H, d, J=8.5Hz), 7.18(1H, d, J=2.7Hz), 7.21(1H, dd, J=2.7, 8.5Hz), 7.45(1H, d, J=2.7Hz), 7.71(2H, d, J=8.5Hz), 7.94(1H, s,), 8.18(1H, d, J=8.5Hz), 8.40(1H, s,)
실시예
157
1-{2- 클로로 -4-[6-[4-((2R)-2-히드록시-3- 디에틸아미노프로폭시 ) 페닐 ]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-((2R)-2-히드록시-3-디에틸아미노프로폭시)페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아 22 mg으로부터 실시예 153과 같은 식의 방법으로 표제 화합물 11 mg을 얻었다.
MS Spectrum(ESI) : 565(M+1),
1H-NMR Spectrum : (DMSOd6) 0.40-0.47(2H, m), 0.63-0.70(2H, m), 0.96(6H, t, J=6.6Hz) 2.45-2.63(7H, m, covered by DMSO peak), 3.80-4.10(3H, m), 6.93(1H, s,), 7.04(2H, d, J=8.6Hz), 7.16(1H, d, J=2.2Hz), 7.19(1H, dd, J=2.2, 8.6Hz), 7.43(1H, d, J=2.2Hz), 7.89(2H, d, J=8.6Hz), 7.94(1H, s), 8.16(1H, d, J=8.6Hz), 8.28(1H, s) 12.60(1H, brs)
제조예
157-1
1-{2- 클로로 -4-[6-[4-((2R)-2-히드록시-3- 디에틸아미노프로폭시 ) 페닐 ]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
제조예 153-9와 같은 식의 방법에 의해, 1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아 127 mg으로부터 p-톨루엔술폰산(2R)-(-)-글리시딜에스테르 154 mg, 탄산칼륨 155 mg, 디에틸아민 0.15 ml를 이용하여 표제 화합물 62 mg을 얻었다.
MS Spectrum(ESI) : 695(M+1),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.39-0.47(2H, m), 0.63-0.70(2H, m), 0.86(2H, t, J=8.3Hz), 0.97(6H, t, J=7.0Hz) 2.38-2.60(7H, m, covered by DMSO peak), 3.61(2H, t, J=8.3Hz), 3.83-4.11(3H, m), 4.82(1H, brs), 5.60(2H, s), 6.73(1H, s), 7.09(2H, d, J=8.5Hz), 7.16(1H, d, J=2.7Hz), 7.20(1H, dd, J=2.7, 8.5Hz), 7.45(1H, d, J=2.7Hz),7.71(2H, d, J=8.5Hz), 7.94(1H, s), 8.18(1H, d, J=8.5Hz), 8.40(1H, s)
실시예
158
1-(2- 클로로 -4-{6-[4-((2S)-2-히드록시-3- 피롤리디노프로폭시 ) 페닐 ]-7H- 피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-(2-히드록시-3-피롤리디노프로폭시)페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아 30 mg으로부터 실시예 153과 같은 식의 방법으로 표제 화합물 14 mg을 얻었다.
MS Spectrum(ESI) : 563(M+1),
1H-NMR Spectrum : (DMSOd6) 0.40-0.47(2H, m), 0.60-0.70(2H, m), 1.62-1.74(4H, m), 2.40-2.70(7H, m, covered by DMSO peak), 3.88-4.10(3H, m), 4.92(1H, brs) 6.94(1H, s), 7.04(2H, d, J=8.6Hz), 7.15(1H, d, J=2.4Hz), 7.20(1H, dd, J=2.4, 8.6Hz), 7.44(1H, d, J=2.4Hz),7.88(2H, d, J=8.6Hz), 7.94(1H, s,), 8.16(1H, d, J=8.6Hz), 8.28(1H, s) 12.60(1H, brs)
제조예
158-1
1-{2- 클로로 -4-[6-[4-(2S)-2-히드록시-3- 피롤리디노프로폭시 ) 페닐 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
제조예 153-9와 같은 식의 방법에 의해, 1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아 81 mg으로부터 p-톨루엔술폰산(2S)-(+)-글리시딜에스테르 98 mg, 탄산칼륨 99 mg 피롤리딘 0.1 ml를 이용하여 표제 화합물 30 mg을 얻었다.
MS Spectrum(ESI) : 693(M+1),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.40-0.46(2H, m), 0.62-0.70(2H, m), 0.87(2H, t, J=8.4Hz), 1.62-1.72(4H, m), 2.40-2.68(7H, m, covered by DMSO peak), 3.62(2H, t, J=8.4Hz), 3.90-4.10(3H, m), 4.92(1H, brs), 5.60(2H, s,), 6.72(1H, s,), 7.10(2H, d, J=8.8Hz), 7.17(1H, d, J=2.4Hz), 7.21(1H, dd, J=2.4, 8.8Hz), 7.46(1H, d, J=2.4Hz), 7.71(2H, d, J=8.8Hz), 7.95(1H, s), 8.18(1H, d, J=8.8Hz), 8.41(1H, s)
실시예
159
1-(2- 클로로 -4-{6-[4-((2R)-2-히드록시-3- 피롤리디노프로폭시 ) 페닐 ]-7H- 피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-(2-히드록시-3-피롤리디노프로폭시)페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아 70 mg으로부터 실시예 153과 같은 식의 방법으로 표제 화합물 24 mg을 얻었다.
MS Spectrum(ESI) : 563(M+1),
1H-NMR Spectrum : (DMSOd6) 0.40-0.47(2H, m), 0.60-0.70(2H, m), 1.73-1.87(4H, m), 2.49-2.60(7H, m, covered by DMSO peak), 3.94-4.19(3H, m), 4.92(1H, brs) 6.94(1H, d, J=1.2Hz), 7.06(2H, d, J=8.6Hz), 7.15-7.22(2H, m), 7.43(1H, d, J=2.4Hz), 7.91(2H, d, J=8.6Hz), 7.96(1H, s), 8.17(1H, d, J=8.6Hz), 8.29(1H, s) 12.61(1H, brs)
제조예
159-1
1-{2- 클로로 -4-[6-[4-((2R)-2-히드록시-3- 피롤리디노프로폭시 ) 페닐 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
제조예 153-9와 같은 식의 방법에 의해, 1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아 128 mg으로부터 p-톨루엔술폰산(2R)-(-)-글리시딜에스테르 155 mg, 탄산칼륨 156 mg 피롤리딘 0.13 ml를 이용하여 표제 화합물 72 mg을 얻었다.
MS Spectrum(ESI) : 693(M+1),
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.40-0.46(2H, m), 0.60-0.70(2H, m), 0.87(2H, t, J=8.4Hz), 1.62-1.72(4H, m), 2.40-2.68(7H, m, covered by DMSO peak), 3.61(2H, t, J=8.4Hz), 3.90-4.10(3H, m), 4.92(1H, brs,), 5.60(2H, s,), 6.72(1H, s), 7.09(2H, d, J=8.8Hz), 7.16(1H, d, J=2.4Hz), 7.20(1H, dd, J=2.4, 8.8Hz), 7.45(1H, d, J=2.4Hz), 7.71(2H, d, J=8.8Hz), 7.95(1H, s), 8.18(1H, d, J=8.8Hz), 8.40(1H, s)
실시예
160
1-(2- 클로로 -4-{6-[4-(2- 디에틸아미노프로폭시 ) 페닐 ]-7H- 피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아
1-{2-클로로-4-[6-[4-(2-디에틸아미노프로폭시)페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아 17 mg으로부터 실시예 153과 같은 식의 방법으로 표제 화합물 2 mg을 얻었다.
MS Spectrum(ESI) : 549(M+1),
제조예
160-1
4-[4-(4-아미노-3- 클로로페녹시 )-7-(2- 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘-6-일]페놀
제조예 153-5에 의해 합성한 4-[6-(4-벤질옥시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-클로로페닐아민 255 mg을 에탄올 10 ml, 테트라히드로푸란 3 ml에 녹여, 산화백금 100 mg을 가하고, 실온, 상압하에 수소 분위기하에서 밤새 교반한 후, 세라이트 여과하여 여과액을 감압 농축했다. 잔사를 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 105 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.83(2H, t, J=7.8Hz), 3.52(2H, t, J=7.8Hz), 5.33(2H, s), 5.54(2H, s), 6.55(1H, s), 6.83(1H, d, J=8.8Hz), 6.88(2H, d, J=8.8Hz), 6.94(1H, dd, J=2.4, 8.8Hz), 7.17(1H, d, J=2.4Hz), 7.58(2H, d, J=8.8Hz), 8.35(1H, s), 9.84(1H, brs)
제조예
160-2
2- 클로로 -4-[6-[4-(3- 디에틸아미노프로폭시 ) 페닐 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐아민
제조예 160-1에서 합성한 4-[4-(4-아미노-3-클로로페녹시)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-6-일]페놀 47 mg을 디메틸포름아미드 0.5 ml에 녹이고 (3-클로로프로필)디에틸아민 염산염 56 mg(3.1당량), 탄산칼륨 94 mg(7당량)을 가하여, 80℃에서 24시간동안 교반했다. 그 후 실온으로 되돌리고 물을 가하여 초산에틸-테트라히드로푸란 5:1 혼합 용매로 분액 추출했다. 유기층을 황산나트륨으로 건조시켜, 농축하고 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 49 mg을 얻었다.
Ms Spectrum(ESI) : 596(M+1),
제조예
160-3
1-{2- 클로로 -4-[6-[4-(3- 디에틸아미노프로폭시 ) 페닐 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-시클로프로필우레아
제조예 160-2에 의해 합성한 2-클로로-4-[6-[4-(3-디에틸아미노프로폭시)페닐]-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐아민을 디메틸설폭시드 0.6 ml에 녹여, 시클로프로필카르바민산페닐에스테르 23 mg을 가하고, 80℃에서 1.5시간동안 교반했다. 또한 시클로프로필카르바민산페닐에스테르 75 mg을 가하여 100℃에서 5시간동안 교반한 후, 다시 동 시약을 70 mg 가하여, 밤새 교반했다. 실온으로 되돌리고 물을 가하여 초산에틸-테트라히드로푸란 5:1 혼합 용매로 분액 추출했다. 유기층을 황산나트륨으로 건조시켜 농축하고 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 18 mg을 얻었다.
MS Spectrum(ESI) : 679(M+1),
실시예
161
1-(4- 플루오로페닐 )-3-[4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4- 일설파닐 )티아졸-5-일우레아
4-(5-니트로티아졸-2-일설파닐)-6-페닐-7H-피롤로[2,3-d]피리미딘에 철분 323 mg, 에탄올 12 ml, 물 2.4 ml를 가하여 80℃에서 10분간 교반하여 실온으로 되돌린 후, 탄산칼륨 7.5 ml를 가하여, 세라이트 여과하고, 여과액에 초산에틸, 물을 가하여 분액 추출했다. 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켜, 면전(綿栓) 여과하고, 농축 건조시켜 310 mg의 고체를 얻었다. 이 고체를 테트라히드로푸란 10 ml, 톨루엔 10 ml, 아세토니트릴 10 ml에 환류하에 용해하고, 4-플루오로페닐이소시아네이트 0.1 ml를 가하여, 2시간동안 교반했다. 실온으로 되돌려 반응계를 농축하고, 실리카겔 컬럼 크로마토그래피에 가하고, 건조시켜 표제 화합물 33 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.71(1H, s,), 7.12(2H, m), 7.36-7.52(5H, m), 7.62(1H, s), 7.92(2H, d, J=8.1Hz), 8.55(1H, s), 9.12(1H, s), 10.24(1H, s), 12.82(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
161-1
6-
페닐
-7H-
피롤로[2,3-d]피리미딘
-4-
티올
WO97/02266, PCT/EP96/02728에 기재한 6-페닐-7H-피롤로[2,3-d]피리미딘-4-올 2.45 g에 5황화인 6.19 g, 탄산수소나트륨 6.24 g, 디글림 25 ml를 가하여, 80℃에서 1시간동안 교반한 후, 또 5-황화인 3 g, 탄산수소나트륨 3 g을 가하여 1시간동안 교반했다. 그 후 다시, 5황화인 3 g, 탄산수소나트륨 3 g을 가하여 1시간동안 교반했다. 실온으로 되돌리고, 물을 가하여 10분간 교반하고, 석출된 결정을 여과 수취하여 물로 세척하여, 건조시켜 표제 화합물 2.5 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.05(1H, d, J=2.1Hz), 7.32(1H, t, J=7.9Hz), 7.43(2H, t, J=7.9Hz), 7.88(2H, d, J=7.9Hz), 8.05(1H, s), 12.68(1H, brs), 13.36(1H, brs)
제조예
161-2
4-(5-
니트로티아졸
-2-
일설파닐
)-6-
페닐
-7H-
피롤로[2,3-d]피리미딘
6-페닐-7H-피롤로[2,3-d]피리미딘-4-티올에 2-브로모-5-니트로티아졸 1.06 g, 디메틸포름아미드 15 ml를 가하여 실온에서 3시간동안 교반한 후, 피리딘 0.45 ml를 가하여 밤새 교반했다. 물을 가하여, 석출된 결정을 여과 수취하고, 바람에 말려, 감압 건조시켜 표제 화합물 1.20 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.26(1H, J=2.4Hz), 7.36-7.54(3H, m), 8.01(2H, d, J=7.8Hz), 8.90(1H, s,), 8.94(1H, s,), 13.11(1H, brs),
실시예
162
1-[5-(6-
페닐
-7H-
피롤로[2,3-d]피리미딘
-4-
일설파닐
)-3-티아졸-2-
일우레아
5-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일설파닐)-2-티오피닐아민 354 mg에 2-티아조일카르바민산페닐에스테르 265 mg, 디메틸설폭시드 10 ml를 가하여, 80℃에서 2 시간동안 교반했다. 초산에틸, 물을 가하여 분액 추출하여 유기층을 농축하고 실리카겔 컬럼 크로마토그래피에 가하고, 건조시켜 생성된 고체를 에테르로 세척하여 표제 화합물 170 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.55(1H, brs), 6.94(1H, d, J=4.2Hz), 7.05(1H, d, J=1.9Hz), 7.26(1H, d, J=4.2Hz), 7.28-7.50(4H, m), 7.82-7.90(3H, m), 8.49(1H, s), 10.42(1H, brs), 12.54(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
162-1
4-(5-니트로-2-
티오피닐설파닐
)-6-
페닐
-7H-
피롤로[2,3-d]피리미딘
제조예 161-1에 의해 합성한 6-페닐-7H-피롤로[2,3-d]피리미딘-4-티올에 2-브로모-5-니트로티오펜 1.05 g에 탄산칼륨 0.95 g, 디메틸포름아미드 15 ml를 가하여 실온에서 밤새 교반한 후 물을 가하여, 석출된 결정을 여과 수취하고, 바람에 말려, 감압 건조시켜 표제 화합물 1.30 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.08(1H, s), 7.40(1H, t, J=8.0Hz), 7.48(2H, t, J=8.0Hz), 7.56(1H, d, J=4.1Hz), 7.98(2H, d, J=8.0Hz), 8.16(1H, d, J=4.1Hz), 8.70(1H, s), 12.68(1H, brs)
제조예
162-2
5-(6-
페닐
-7H-
피롤로[2,3-d]피리미딘
-4-
일설파닐
)-티오펜-2-
일아민
제조예 162-1에 의해 합성한 4-(5-니트로-2-티오피닐설파닐)-6-페닐-7H-피롤로[2,3-d]피리미딘에 철분 543 mg, 염화암모늄 1.06 g, 디메틸포름아미드 10 ml, 에탄올 20 ml, 물 5 ml를 가하여 90℃에서 2 간 교반하고 테트라히드로푸란 30 ml를 가하여, 실온으로 되돌린 후, 세라이트 여과하고, 여과액에 초산에틸, 물을 가하여 분액 추출했다. 유기층을 무수황산나트륨으로 건조하고, 면전 여과하여, 농축 건조시켜 435 mg의 표제 화합물을 얻었다.
MS Spectrum(ESI) : 325(M+1)
1H-NMR Spectrum : (DMSOd6) 5.98(1H, d, J=4.2Hz), 6.24(2H, s), 6.27(1H, d, J=2.0Hz), 7.00(1H, d, J=4.2Hz), 7.30-7.50(3H, m), 7.80(2H, d, J=7.6Hz), 8.46(1H, s), 12.63(1H, brs)
실시예
163
4-{4-〔3-(4- 플루오로페닐 ) 우레이도 〕 페녹시 )-7H- 피롤로[2,3-d]피리미딘 -6-카르복실산에틸에스테르
4-(4-아미노페녹시)-7H-피롤로[2,3-d]피리미딘-6-카르복실산에틸에스테르 90 mg을 110℃에서 톨루엔 3 ml, 아세토니트릴 1 ml에 용해시키고, 4-플루오로페닐이소시아네이트 16.6 ㎕을 가하여 1시간동안환류하에 교반했다. 실온에 방치하여, 석출된 결정을 여과 수취하고, 건조시켜 표제 화합물 110 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 1.31(3H, t, J=7.9Hz), 4.32(2H, q, J=7.9Hz), 7.07-7.54(9H, m), 8.42(1H, s), 8.72(1H, s), 8.76(1H, s), 13.03(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
163-1
4-(4-
니트로페녹시
)-7H-
피롤로[2,3-d]피리미딘
-6-
카르복실산에틸에스테르
WO9702266(A1)에 기재한 4-클로로에톡시카르보닐-7H-피롤로[2,3-d]피리미딘 577 mg에 4-니트로페놀 390 mg, 탄산칼륨 703 mg, 디메틸포름아미드 8.7 ml를 가하여 120℃에서 14시간동안 교반한 후, 또 4-니트로페닐 40 mg을 가하여 1.5시간동안 교반했다. 실온으로 한 후, 물을 가하여, 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출하고 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조하고, 면전 여과, 농축 건조시켜 생성된 고체를 에테르로 세척하여 표제 화합물 520 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 1.33(3H, t, J=7.9Hz), 4.35(2H, q, J=7.9Hz), 7.28(1H, s), 7.56-7.64(2H, m), 8.30-8.38(2H, m), 8.46(1H, s), 13.21(1H, brs)
제조예
163-2
4-(4-
아미노페녹시
)-7H-
피롤로[2,3-d]피리미딘
-6-
카르복실산에틸에스테르
4-(4-니트로페녹시)-7H-피롤로[2,3-d]피리미딘-6-카르복실산에틸에스테르에, 철분 110 mg, 염화암모늄 220 mg, 에탄올 10 ml, 물 2 ml를 가하여 80-85℃에서 2.5시간동안 교반했다. 실온으로 되돌린 후 테트라히드로푸란 20 ml를 가하여, 5분간 교반한 후, 세라이트 여과하여, 여과액에 초산에틸 100 ml, 물 50 ml를 가하여, 분액 추출했다. 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조, 면전 여과, 농축 건조시켜 표제 화합물 90 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 1.31(3H, t, J=7.9Hz), 4.31(2H, q, J=7.9Hz), 5.10(2H, s), 6.56-6.62(2H, m), 6.86-9.92(3H, m), 8.40(1H, s), 12.98(1H, brs)
실시예
164
4-{4-〔3-(4- 플루오로페닐 ) 우레이도 〕 페녹시 )-7H- 피롤로[2,3-d]피리미딘 -6-카르복실산
실시예 163에서 합성한 4-{4-〔3-(4-플루오로페닐)우레이도〕페녹시)-7H-피롤로[2,3-d]피리미딘-6-카르복실산에틸에스테르 75 mg에 에탄올 7 ml, 물 7 ml, 수산화리튬 1 수화물 31 mg을 가하여 40-45℃에서 24시간동안 교반한 후, 2N-HCl로 중화, 농축 건조시켜 40 mg의 표제 화합물을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.83(1H, s), 7.06-7.16(2H, m), 7.19(2H, m), 7.44-7.48(2H, m), 7.51(2H, d, J=8.0Hz), 8.39(1H, s), 8.72(1H, s), 8.76(1H, s), 12.88(1H, brs)
실시예
165
4-{4-〔3-(4- 플루오로페닐 ) 우레이도 〕 페녹시 )-7H- 피롤로[2,3-d]피리미딘 -6-카르복실산(3-디에틸아미노프로필)아미드
실시예 164에서 합성한 4-{4-〔3-(4-플루오로페닐)우레이도〕페녹시)-7H-피롤로[2,3-d]피리미딘-6-카르복실산 12 mg에 디메틸포름아미드 1 ml, 트리에틸아민 47 ㎕, 디페닐포스포릴아지드 18.5 ㎕, 1-메틸피페라진 8.2 ㎕을 가하여, 실온에서 밤새 교반했다. 물을 가하여, 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출하고, NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올)에 가하여, 표제 화합물 27 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 2.18(3H, s), 2.28-2.48(4H, m), 3.58-3.70(4H, m), 6.56(1H, s), 7.06-7.56(8H, m), 8.36(1H, d, J=1.7Hz), 8.78(1H, s), 8.84(1H, s), 12.67(1H, brs)
실시예
166
4-{4-〔3-(4- 플루오로페닐 ) 우레이도 〕 페녹시 )-7H- 피롤로[2,3-d]피리미딘 -6-카르복실산(3-디에틸아미노프로필)아미드
제조예 164에서 합성한 4-{4-〔3-(4-플루오로페닐)우레이도〕페녹시)-7H-피롤로[2,3-d]피리미딘-6-카르복실산 12 mg에 디메틸포름아미드 0.8 ml, 트리에틸아민 21 ㎕, 디페닐포스포릴아지드(DPPA) 9.5 ㎕, 4-(3-아미노프로필)모르폴린 6.5 ㎕을 가하여, 실온에서 2일간 교반했다. 포화염화암모늄을 가하여, 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출하고, 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조, 면전 여과, 농축 건조시켜 표제 화합물 9 mg을 얻었다.
MS Spectrum(ESI) : 534(M+1)
1H-NMR Spectrum : (DMSOd6) 1.62-1.74(2H, m), 2.20-2.42(6H, m), 2.88-2.98(2H, m), 3.46-3.62(4H, m), 7.06-7.56(9H, m), 8.34(1H, s), 8.84-8.90(2H, m), 12.68(1H, brs)
실시예
167
1-(4- 플루오로페닐 )-3-[4-(6- 히드록시메틸 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시)페닐]우레아
실시예 163에서 합성한 4-{4-〔3-(4-플루오로페닐)우레이도〕페녹시)-7H-피롤로[2,3-d]피리미딘-6-카르복실산에틸에스테르 55 mg에 테트라히드로푸란 9 ml를 가하여, 교반하에, 실온에서 리튬알루미늄히드리드 25 mg을 가하여 2일간 교반했다. 그 후 물을 가하여, 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출하고, 유기층을 세라이트 여과, 농축 건조시켜 표제 화합물 35 mg을 얻었다.
MS Spectrum(ESI) : 394(M+1), 416(M+23)
1H-NMR Spectrum : (DMSOd6) 4.55(2H, d, J=6.7Hz), 5.32(1H, t, J=6.7Hz), 6.84(1H, s), 7.06-7.55(8H, m), 8.22(1H, s), 8.74(1H, s), 8.76(1H, s), 12.11(1H, brs)
실시예
168
1-(4- 플루오로페닐 )-3-[4-(6- 포르밀 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐]우레아
1-(4-플루오로페닐)-3-[4-(6-히드록시메틸-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐]우레아 18 mg에 클로로포름 3 ml, 이산화망간 50 mg을 가하여 실온에서 밤새 교반했다. 반응계에서 테트라히드로푸란, 초산에틸을 가하여, 세라이트 여과, 농축 건조시켜 표제 화합물 16 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.82(1H, s), 7.03-7.60(8H, m), 8.46(1H, s), 8.71(1H, s), 8.75(1H, s), 9.86(1H, s), 13.08(1H, brs)
실시예
169
1-(4- 플루오로페닐 )-3-[4-(6-모르폴린-4- 일메틸 -7H- 피롤로[2,3-d]피리미딘 -4-일옥시)페닐]우레아
실시예 168에서 합성한 1-(4-플루오로페닐)-3-[4-(6-포르밀-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐]우레아에 테트라히드로푸란 0.5 ml, 모르폴린 10 ㎕, 트리아세톡시보로히드리드 26 mg을 가하여 실온에서 밤새 교반했다. 반응계에서 테트라히드로푸란-초산에틸 혼합 용매로 분액 추출하여, 무수황산나트륨에 의해 건조, 농축 건조시켜 표제 화합물 5 mg을 얻었다.
MS Spectrum(ESI) : 463(M+1)
실시예
170
1-(4- 플루오로페닐 )-3-{4-〔6-(4- 메틸 -1- 피페라딜메틸 )-1-7H- 피롤로[2,3-d]피리미딘-4-일옥시)페닐]우레아
실시예 168에서 합성한 1-(4-플루오로페닐)-3-[4-(6-포르밀-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐]우레아에 테트라히드로푸란 0.4 ml, 1-메틸피페라진 11 ㎕, 트리아세톡시보로히드리드 23 mg을 가하여 실온에서 밤새 교반했다. 반응계에서 테트라히드로푸란-초산에틸 혼합 용매로 분액 추출하여, 무수황산나트륨에 의해 건조, 농축 건조시켜 표제 화합물 5 mg을 얻었다.
MS Spectrum(ESI) : 476(M+1)
실시예
171
1-(4- 플루오로페닐 )-3-[4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐 ]우레아
4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민 40 mg을 110℃에서 톨루엔 4.5 ml, 아세토니트릴 4.5 ml에 용해시키고, 4-플루오로페닐이소시아네이트(16.6 μ)를 가하여 1시간동안 교반했다. 실온에 방치하고, 석출된 결정을 여과 수취, 건조시켜 표제 화합물 37 mg을 얻었다.
MS Spectrum(ESI) : 440(M+1), 462(M+23)
1H-NMR Spectrum : (DMSOd6) 7.02(1H, s), 7.06-7.52(11H, m), 7.94(2H, d, J=8.0Hz), 8.28(1H, s),8.77(1H, s), 8.79(1H, s), 12.68(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
171-1
4-(4-
니트로페녹시
)-6-
페닐
-7H-
피롤로[2,3-d]피리미딘
WO97/02266, PCT/EP96/02728에 기재한 4-클로로-6-페닐-7H-피롤로[2,3-d]피리미딘 113 mg에 4-니트로페놀 123 mg, 탄산칼륨 136 mg, 디메틸포름아미드 1.5 ml를 가하여 130-135℃에서 15시간동안 교반한 후, 4-니트로페닐 60 mg, 탄산칼륨 75 mg을 가하여 6시간동안 더 교반했다. 실온으로 한 후, 물을 가하여, 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출하고, 농축 건조시켜 생성된 고체를 에테르로 세척하여, 표제 화합물 112 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.13(1H, s), 7.37(1H, t, J=7.7Hz), 7.47(2H, t, J=7.7Hz), 7.56-7.61(2H, m), 7.74-8.00(2H, m), 8.30-8.38(3H, m), 12.82(1H, brs)
제조예
171-2
4-(6-
페닐
-7H-
피롤로[2,3-d]피리미딘
-4-
일옥시
)
페닐아민
4-(4-니트로페녹시)-6-페닐-7H-피롤로[2,3-d]피리미딘 110 mg에, 철분 110 mg, 염화암모늄 220 mg, 에탄올 10 ml, 물 2 ml를 가하여 80-85℃에서 2.5시간동안 교반했다. 실온으로 되돌린 후 테트라히드로푸란 20 ml를 가하여, 5분간 교반한 후, 세라이트 여과하고, 여과액에 초산에틸 100 ml, 물 50 ml를 가하여, 분액 추출했다. 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조하고, 면전 여과, 농축 건조시켜 표제 화합물 90 mg을 얻었다.
MS spectrum(ESI) m/z 303(M+1)
1H-NMR Spectrum : (DMSOd6) 5.04(2H, brs) 6.57-6.61(2H, m), 6.84-6.90(3H, m), 7.34(1H, t, J=7.7Hz), 7.45(2H, t, J=7.7Hz), 7.87(2H, t, J=7.7Hz), 8.26(1H, s) 12.61(1H, brs)
실시예
172
1-(3- 플루오로페닐 )-3-[4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐 ]우레아
실시예 171과 같은 방법으로, 4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민 36 mg에 3-플루오로페닐이소시아네이트(14 μ)를 반응시켜, 표제 화합물 24 mg을 얻었다.
MS Spectrum(ESI) : 440(M+1), 462(M+23)
1H-NMR Spectrum : (DMSOd6) 7.02(1H, s,), 7.08-7.54(11H, m), 7.94(2H, d, J=8.0Hz), 8.28(1H, s,), 8.88(1H, s,), 9.00(1H, s,), 12.68(1H, brs)
실시예
173
1- 시클로프로필 -3-[4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐 ] 우레아
4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민 40 mg에 시클로프로필카르바민산페닐에스테르 30 mg와, 디메틸설폭시드 0.5 ml를 가하여, 80℃에서 4시간동안 교반했다. 실온으로 한 후, 물을 가하여 초산에틸로 분액 추출하고, 농축 건조시켜 생성된 고체를 에테르로 세척하여, 표제 화합물 6 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 0.30-0.40(2H, m), 0.55-0.65(2H, m), 2.43-2.57(1H, m, coverd by DMSO peak), 6.20(1H, brs), 6.60(2H, d, J=8.90Hz), 6.83(1H, s), 6.87-6.91(1H, m), 7.10-7.16(1H, m), 7.30-7.50(3H, m), 7.90(2H, d, J=8.1Hz), 8.26(1H, d, J=0.4Hz), 8.92(1H, brs,), 12.60(1H, brs)
실시예
174
1-[4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐 ]-3-(티아졸-2-일) 우레아
4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민 520 mg에 2-티아조일카르바민산페닐에스테르 492 mg을 가하여, 80℃에서 4시간동안 교반했다. 석출된 결정을 여과 수취하고 초산에틸, 테트라히드로푸란으로 세척하여, 표제 화합물 275 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.03(1H, d, J=2.0Hz), 7.10(1H, d, J=3.0Hz), 7.18-7.50(7H, m), 7.54(2H, d, J=8.7Hz), 7.74(2H, d, J=8.0Hz), 8.29(1H, s,), 9.10(1H, s,), 12.69(1H, brs)
실시예
175
1-(4- 플루오로페닐 )-3-[2- 플루오로 -4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4-일옥시)페닐]우레아
실시예 171과 같은 식의 방법으로 2-플루오로-4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민 36 mg으로부터 표제 화합물 26 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.05-7.18(4H, m), 7.30-7.50(6H, m), 7.94(2H, d, J=8.1Hz), 8.21(1H, t, J=10.4Hz), 8.32(1H, s), 8.55(1H, d, J=1.9Hz), 9.09(1H, s), 12.73(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
175-1
4-(3-
플루오로
-4-
니트로페녹시
)-6-
페닐
-7H-
피롤로[2,3-d]피리미딘
WO97/02266, PCT/EP96/02728에 기재한 4-클로로-6-페닐-7H-피롤로[2,3-d]피리미딘 360 mg에 3-플루오로-4-니트로페놀 328 mg, 2,6-루티딘 0.22 ml, N-메틸피롤리딘 0.9 ml를 가하여 130℃에서 밤새 교반한 후, 실온으로 하여 물을 가하고, 석출된 고체를 여과 수취하여 물, 디에틸에테르로 세척하고, 수집된 고체를 건조시켜 표제 화합물 112 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.14(1H, s), 7.34-7.44(2H, m), 7.48(2H, t, J=7.8Hz), 7.73(1H, dd, J=2.5Hz, 11.8Hz), 7.89(2H, d, J=7.8Hz), 8.28(1H, t, J=8.5Hz), 8.40(1H, d, J=1.3Hz), 12.87(1H, brs)
제조예
175-2
4-(6-
페닐
-7H-
피롤로[2,3-d]피리미딘
-4-
일옥시
)
페닐아민
제조예 171-2와 같은 식의 방법으로, 상기 중간체 합성법에 의해 합성한 4-(3-플루오로-4-니트로페녹시)-6-페닐-7H-피롤로[2,3-d]피리미딘 125 mg으로부터 표제 화합물 118 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 5.10(2H, s), 6.78-7.04(4H, m), 7.37(1H, t, J=7.9Hz), 7.47(2H, t, J=7.9Hz), 7.92(2H, d, J=7.9Hz), 8.38(1H, s), 12.67(1H, brs)
실시예
176
1-(3- 플루오로페닐 )-3-[2- 플루오로 -4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4-일옥시)페닐]우레아
실시예 171과 같은 식의 방법으로 2-플루오로-4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민 33 mg으로부터 표제 화합물 27 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.78(1H, dt, J=3.3, 9.5Hz), 7.06-7.52(8H, m), 7.97(2H, t, J=8.2Hz), 8.11(1H, t, J=9.5Hz), 8.42(1H, s), 8.62(1H, s), 8.62(1H, s), 9.28(1H, s), 12.73(1H, brs)
실시예
177
1-[2- 플루오로 -4-(6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐 ]-3-(티아졸-2-일)우레아
실시예 171과 같은 식의 방법으로 2-플루오로-4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민 42 mg으로부터 표제 화합물 27 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.06-7.16(3H, m), 7.12-7.44(3H, m), 7.47(2H, t, J=8.1Hz), 7.96(2H, d, J=8.1Hz), 8.12(1H, t, J=9.1Hz), 8.32(1H, s), 8.96(1H, brs), 10.78(1H, brs), 12.73(1H, brs)
실시예
178
5-[6-(4- 히드록시페닐 )-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ]인돌-1- 카르복실산에틸아미드
5-[6-(4-벤질옥시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]인돌-1-카르복실산에틸아미드 30 mg을 트리플루오로초산 1 ml, 티오아니솔 0.1 ml에 녹여, 50-55℃에서 교반했다. 그 후 실온으로 되돌려, 포화중조수를 가하여, 알카리성으로 만들고, 초산에틸-테트라히드로푸란(5:1) 혼합 용매로 분액 추출했다. 유기층을 농축하고, 잔사에 테트라히드로푸란 1 ml와 2 규정 수산화나트륨 수용액 1 ml를 가하여, 5분간 실온에서 교반했다. 그 후, 1 규정 염산으로 중화하여, 초산에틸-테트라히드로푸란(5:1) 혼합 용매로 분액 추출했다. 유기층을 농축하여 잔사를 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 5 mg을 얻었다.
MS Spectrum(ESI) : 468(M+55); (M+Na+MeOH)
1H-NMR Spectrum : (DMSOd6) 1.18(3H, t, J=6.7Hz), 3.20-3.50(2H, m, H2O 피크에 의해 커버됨), 6.67(1H, d, J=3.5Hz), 6.78(1H, s,), 6.83(2H, d, J=8.4Hz), 7.12(1H, dd, J=2.2, 8.4Hz), 7.44(1H, d, J=2.2Hz), 7.74(2H, d, J=8.4Hz), 7.89(1H, d, J=3.3Hz), 8.16-8.22(2H, m), 8.25(1H, d, J=8.4Hz), 9.80(1H, brs,), 12.45(1H, brs),
실시예
179
6-(4-
벤질옥시페닐
)-4-(1H-5-
인돌릴옥시
)-7H-
피롤로[2,3-d]피리미딘
5-[6-(4-벤질옥시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-인돌-1-카르복실산에틸아미드 22 mg을 테트라히드로푸란 1.5 ml에 녹이고, 테트라부틸암모늄플로리드의 테트라히드로푸란 1 M 용액을 가하여, 2시간동안 환류했다. 실온으로 되돌려 물을 가하고, 석출된 결정을 여과 수취하여 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 2 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 5.17(2H, s), 6.40-6.43(1H, m), 6.80(1H, s,), 6.93(1H, dd, J=2.5, 8.8Hz), 7.10(2H, d, J=8.8Hz), 7.30-7.50(8H, m), 7.83(2H, d, J=8.8Hz), 8.20(1H, s), 11.19(1H, brs), 12.51(1H, brs),
중간체는 다음과 같이 합성했다.
제조예
179-1
6-(4- 벤질옥시페닐 )-4-(1H-5- 인돌릴옥시 )-7-(2- 트리메틸실라닐에톡시메틸 )-7H-피롤로[2,3-d]피리미딘
6-(4-벤질옥시페닐)-4-클로로-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘 190 mg에 디메틸포름아미드 1.9 ml, 5-히드록시인돌 108 mg, 탄산칼륨 112 mg을 가하여, 135-140℃에서 4시간동안 교반했다. 그 후 실온으로 되돌려, 물을 가하여 초산에틸-테트라히드로푸란(5:1) 혼합 용매로 분액 추출했다. 유기층을 농축하여 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 90 mg을 얻었다.
MS Spectrum(ESI) : 563(M+1)
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.87(2H, t, J=8.4Hz), 3.62(2H, t, J=8.4Hz) 5.19(2H, s), 5.59(2H, s), 6.42-6.46(1H, m), 6.65(1H, s), 6.83(2H, d, J=8.4Hz), 6.97(1H, dd, J=2.6, 8.6Hz), 7.16(2H, d, J=8.6Hz), 7.32-7.50(8H, m), 7.70(2H, d, J=8.6Hz), 8.37(1H, d, J=1.7Hz), 11.21(1H, brs).
제조예
179-2
5-[6-(4- 벤질옥시페닐 )-7-(2- 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시]인돌-1-카르복실산에틸아미드
6-(4-벤질옥시페닐)-4-(1H-5-인돌릴옥시)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘(81 mg)을 디메틸포름아미드 1 ml에 녹여, 수소화나트륨(60% 분산) 7 mg을 가하고, 5분간 실온에서 교반한 후, 에틸카르바민산페닐에스테르 31 mg을 가하고, 또 2시간동안 교반했다. 그 후, 물을 가하여 초산에틸로 분액 추출했다. 유기층을 농축하여 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여 표제 화합물 62 mg을 얻었다.
MS Spectrum(ESI) : 634(M+1), 688(M+55); (M+Na+MeOH)
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s,), 0.87(3H, t, J=8.5Hz), 1.20(2H, t, J=6.7Hz), 3.10-3.70(4H, m, H2O 피크로 커버됨), 5.20(2H, s), 5.60(2H, s), 6.67(1H, s,), 6.70(1H, d, J=3.8Hz), 7.12-7.20(3H, m), 7.30-7.52(6H, m), 7.72(2H, d, J=9.0Hz), 7.91(1H, d, J=3.8Hz), 8.23(1H, t, J=5.9Hz), 8.29(1H, d, J=9.0Hz), 8.38(1H, s)
실시예
180
N-[4-(2- 시클로프로필 -3- 메틸이미다조[4,5-b]피리딘 -4-일) 옥시페닐 ]- N' -(4-플루오로페닐)우레아
N-[4-(2-시클로프로필-3H-이미다조[4,5-b]피리딘-4-일)옥시페닐]-N'-(4-플루오로페닐)우레아 25 mg, 요오드메탄 13 mg, 탄산칼륨 26 mg, 디메틸포름아미드 5 ml를 70℃에서 20분동안 교반했다. 물을 가하여 초산에틸로 추출하고, 이어서 실리카겔을 추출액에 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 채운 드라이 컬럼에 채워 컬럼 크로마토그래피(초산에틸에 이어서 초산에틸:메탄올=10:1)로 정제하여 목적물 3 mg을 백색 분말로서 얻었다.
1H-NMR(CDCl3) δ(ppm) : 1.13-1.19(2H, m), 1.28-1.35(2H, m), 2.03-2.11(1H, m), 3.95(3H, s), 6.43(1H, d, J=5.6Hz), 6.95-7.04(4H, m), 7.26-7.35(4H, m), 8.19(1H, d, J=5.6Hz).
실시예
181
N-[4-(2-
부틸아미노피리딘
-4-일)
옥시페닐
]-
N'
-(4-
플루오로페닐
)
우레아
4-(4-아미노페녹시)-2-부틸아미노피리딘 54 mg, p-플루오로페닐이소시아네이트 34.5 mg, 테트라히드로푸란 5 ml를 실온하에 2.5시간동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=1:1 이어서 초산에틸)를 행했다. 용매를 감압 증류 수거하여 잔사를 초산에틸-헥산으로부터 고체화하여, 목적물 15 mg을 담황색 분말로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.87(3H, t, J=7.2Hz), 1.30(2H, tq, J=7.2Hz, 7.2Hz), 1.44(2H, tt, J=7.2Hz, 7.2Hz), 3.16(2H, q, J=7.2Hz), 5.80(1H, d, J=2.0Hz), 6.09(1H, ddd, J=5.0Hz, 2.0Hz, 2.0Hz), 6.45(1H, dd, J=5.0Hz, 5.0Hz), 7.03-7.18(4H, m), 7.43-7.55(4H, m), 7.83(1H, dd, J=5.0Hz, 2.0Hz), 8.70(1H, s), 8.74(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
181-1
4-(4-
아미노페녹시
)-2-
부틸아미노피리딘
4-(4-아미노페녹시)-2-부티릴아미노피리딘 80 mg을 테트라히드로푸란 8 ml에 용해하고, 실온 교반하에 수소화리튬알루미늄 67 mg을 가하여, 70℃에서 10분동안 교반했다. 물을 가하여 초산에틸로 추출하고, 이어서 실리카겔을 추출액에 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 채운 드라이 컬럼에 채워 컬럼 크로마토그래피(초산에틸)로 정제하여 목적물 54 mg을 갈색 유상물로서 얻었다.
1H-NMR(CDCl3) δ(ppm) : 0.93(3H, t, J=7.2Hz), 1.40(2H, tq, J=7.2Hz, 7.2Hz), 1.56(2H, tt, J=7.2Hz, 7.2Hz), 3.14(2H, q, J=7.2Hz), 5.82(1H, d, J=2.0Hz), 6.14(1H, dd, J=6.0Hz, 2.0Hz), 6.66-6.74(2H, m), 6.86-6.94(2H, m), 7.87(1H, d, J=6.0Hz).
실시예
182
N-(4- 플루오로페닐 )- N' -{4-[(7-옥소-5,6,7,8- 테트라히드로[1,8]나프틸리딘 -4-일)옥시]페닐}우레아
4-[(7-옥소-5,6,7,8-테트라히드로[1,8]나프틸리딘-4-일)옥시]아닐린 43 mg, p-플루오로페닐이소시아네이트 28 mg, 테트라히드로푸란 5 ml, 디메틸포름아미드 2 ml를 실온하에 30분동안 교반했다. 물을 실온하에서 결정이 석출될 때까지 적하하여, 결정을 여과 수취하고 목적물 48 mg을 백색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.50(2H, t, J=8.0Hz), 2.91(2H, t, J=8.0Hz), 6.24(1H, d, J=6.0Hz), 7.03-7.35(4H, m), 7.40-7.55(4H, m), 7.94(1H, d, J=6.0Hz), 8.70(1H, s), 8.74(1H, s), 10.48(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
182-1
4-
클로로
-3-요오드-2-
피리딘아민
공지 화합물인 tert-부틸 N-(4-클로로-2-피리딜)카르바메이트 10 g, N,N,N’, N’-테트라메틸에틸렌디아민 16.6 ml, 테트라히드로푸란 200 ml의 용액을 -75℃로 냉각하고, 교반하에 n-부틸리튬(2.6M 헥산중 용액) 42 ml를 30분간에 걸쳐 적하했다. 1시간동안 -75℃에서 교반한 후, 요오드 28 g를 테트라히드로푸란 28 ml에 용해시킨 용액을 30분간에 걸쳐 적하했다. 적하 종료후 30분 더 -75℃에서 교반한 후 실온으로 되돌리고, 중황산나트륨 수용액을 가하여 초산에틸로 추출했다. 추출액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=3:1)를 행했다. 용매를 감압 증류 수거하고 잔사에 48% HBr 물을 가하여 100℃에서 5분동안 교반했다. 반응 용액에 빙수 및 5N 수산화나트륨수를 가하여 석출된 고체를 여과 수취했다. 담황색 고체 7.4 g를 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.50(2H, bs), 6.72(1H, d, J=5.6Hz), 7.82(1H, d, J=5.6Hz).
제조예
182-2
3-요오드-4-(4-
니트로페녹시
)-2-
피리딘아민
4-클로로-3-요오드-2-피리딘아민 1.0 g, p-니트로페놀 1.1 g, 디이소프로필에틸아민 1.0 ml, N-메틸-2-피롤리돈 2 ml를 170℃에서 17시간동안 교반했다. 반응 용액을 실온으로 되돌려, 물을 가하여 초산에틸로 추출했다. 추출액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=3:1)를 행했다. 용매를 감압 증류 수거하고 잔사에 초산에틸, 헥산을 가하여 고체화했다. 담황색 결정 540 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.22(1H, d, J=5.2Hz), 6.37(2H, brs), 7.19(2H, d, J=9.2Hz), 7.87(1H, d, J=5.2Hz), 8.26(2H, d, J=9.2Hz).
제조예
182-3
에틸(E)-3-[2-아미노-4-(4-
니트로페녹시
)-3-
피리딜
]-2-
프로페노에이트
3-요오드-4-(4-니트로페녹시)-2-피리딘아민 500 mg, 에틸아크릴레이트 0.3 ml, 팔라듐(II) 아세테이트 30 mg, 트리부틸아민 0.66 ml, 디메틸포름알데히드 5 ml를 130℃에서 20분동안 교반했다. 반응 용액을 실온으로 되돌려 물을 가하여 초산에틸로 추출했다. 추출액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=3:1)를 행했다. 용매를 감압 증류 수거하여 목적물 330 mg을 황색 유상물로서 얻었다.
1H-NMR(CDCl3) δ(ppm) : 1.31(3H, t, J=7.2Hz), 4.25(2H, q, J=7.2Hz), 5.01(2H, s), 6.18(1H, d, J=6.0Hz), 6.57(1H, d, J=16Hz), 7.12-7.19(2H, m), 7.73(1H, d, J=16Hz), 7.99(1H, d, J=6.0Hz), 8.24-8.32(2H, m).
제조예
182-4
4-[(7-옥소-5,6,7,8-
테트라히드로[1,8]나프틸리딘
-4-일)
옥시
]아닐린
에틸(E)-3-[2-아미노-4-(4-니트로페녹시)-3-피리딜]-2-프로페노에이트 330 mg, 팔라듐탄소(10%, 함수) 100 mg, 메탄올 5 ml, 테트라히드로푸란 5 ml를 1기압의 수소 기류하에 하룻밤 교반했다. 팔라듐탄소를 여과 제거하고, 여과액을 감압 증류 수거한 후 잔사를 실리카겔 컬럼 크로마토그래피(초산에틸 이어서 초산에틸:메탄올=5:1)로 정제하여 목적물 43 mg을 백색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.49(2H, t, J=8.0Hz), 2.89(2H, t, J=8.0Hz), 5.09(2H, s), 6.15(1H, dd J=6.0Hz, 2.0Hz), 6.58(2H, dd, J=8.4Hz, 2.0Hz), 6.79(2H, dd, J=8.4Hz, 2.0Hz), 7.89(1H, dd, J=6.0Hz, 2.0Hz), 10.38(1H, s).
실시예
183
N-(4- 플루오로페닐 )- N' -{4-[(7-옥소-7,8- 디히드로[1,8]나프틸리딘 -4-일) 옥시]페닐}우레아
N-(4-플루오로페닐)-N'-{4-[(7-옥소-7,8-디히드로[1,8]나프틸리딘-4-일)옥시]아닐린 30 mg, p-플루오로페닐이소시아네이트 0.016 ml, 디메틸포름아미드 6 ml를 70℃에서 원료가 소실될 때까지 교반했다. 반응 용액을 실온으로 한 후, 물을 적하하여 석출된 고체를 여과 수취했다. 담갈색 고체 22 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.35(1H, d, 5.6Hz), 6.54(1H, d, J=10Hz), 7.05-7.20(4H, m), 7.40-7.60(4H, m), 8.14(1H, d, J=10Hz), 8.29(1H, d, J=5.6Hz), 8.70(1H, s), 8.78(1H, s), 12.13(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
183-1
4-(4-
니트로페녹시
)-7-옥소-7,8-
디히드로[1,8]나프틸리딘
에틸(E)-3-[2-아미노-4-(4-니트로페녹시)-3-피리딜]-2-프로페노에이트 350 mg, 2'-아세토나프톤 50 mg, 메탄올 80 ml를 교반하에 4시간동안 광조사하여, 석출된 고체를 여과 수취했다. 담황색 고체 156 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.57(1H, d, J=9.6Hz), 6.70(1H, d, J=5.6Hz), 7.46(2H, d, J=8.0Hz), 8.05(1H, d, J=9.6Hz), 8.33(2H, d, J=8.0Hz), 8.42(1H, d, J=5.6Hz), 12.31(1H, s).
*제조예 183-2
4-[(7-옥소-7,8-
디히드로[1,8]나프틸리딘
-4-일)
옥시
]아닐린
4-(4-니트로페녹시)-7-옥소-7,8-디히드로[1,8]나프틸리딘 156 mg, 철분 300 mg, 염화암모늄 600 mg, 디메틸포름아미드 2 ml, 에탄올 1 ml, 물 1 ml를 100℃에서 20분동안 교반했다. 세라이트 여과하여 물, 초산에틸을 가하여 추출했다. 유기층을 염화암모늄수로 4회 세척한 후 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 목적물 30 mg을 담황색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.19(2H, brs), 6.29(1H, d, J=5.6Hz), 6.51(1H, d, J=9.6Hz), 6.30(2H, d, J=8.0Hz), 6.87(2H, d, J=8.0Hz), 8.12(1H, d, J=9.6Hz), 8.25(1H, d, J=5.6Hz), 12.10(1H, s).
실시예
184
에틸(E)-3-[2-[( 시클로프로필카르보닐 )아미노]-4-(4-{[(4- 플루오로아닐리노 )카르보닐]아미노}페녹시)-3-피리딜]-2-프로페노에이트
에틸(E)-3-[2-아미노-4-(4-{[(4-플루오로아닐리노)카르보닐]아미노}페녹시)-3-피리딜]-2-프로페노에이트 200 mg, 시클로프로판카르보닐클로라이드 58 mg, 트리에틸아민 0.1 m, 테트라히드로푸란 4 ml, 디메틸포름아미드 1 ml를 실온하에 20분동안 교반했다. 물 소량을 적하하여 석출된 고체를 여과 수취했다. 미황색 고체 130 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.74(4H, m), 1.21(3H, t, J=7.2Hz), 1.88-1.95(1H, m), 4.14(2H, q, J=7.2Hz), 6.53(1H, d, J=5.6Hz), 6.90(1H, d, J=16Hz), 7.07-7.19(4H, m), 7.40-7.48(3H, m), 7.55(2H, d, J=8.0Hz), 8.21(1H, d, J=5.6Hz), 8.72(1H, s), 8.81(1H, s), 10.61(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
184-1
에틸(E)-3-[2-아미노-4-(4-
아미노페녹시
)-3-
피리딜
]-2-
프로페노에이트
에틸(E)-3-[2-아미노-4-(4-니트로페녹시)-3-피리딜]-2-프로페노에이트 350 mg, 철분 700 mg, 염화암모늄 1.4 g, 디메틸포름아미드 7 ml, 에탄올 2 ml, 물 2 ml를 100℃에서 20분동안 교반했다. 세라이트 여과하여 물, 초산에틸을 가하여 추출했다. 유기층을 염화암모늄수로 5회 세척한 후 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 목적물 230 mg을 담황색 고체로서 얻었다.
1H-NMR(CDCl3) δ(ppm) : 1.33(3H, t, J=7.2Hz), 3.68(2H, brs), 4.26(2H, q, J=7.2Hz), 4.87(2H, bs), 6.02(1H, d, J=6.0Hz), 6.68(1H, d, J=16Hz), 6.70(2H, d, J=8.8Hz), 6.87(2H, d, J=8.8Hz), 7.82(1H, d, J=6.0Hz), 7.85(1H, d, J=16Hz).
제조예
184-2
에틸(E)-3-[2-아미노-4-(4-{[(4- 플루오로아닐리노 )카르보닐]아미노} 페녹시 )-3-피리딜]-2-프로페노에이트
에틸(E)-3-[2-아미노-4-(4-아미노페녹시)-3-피리딜]-2-프로페노에이트 230 mg, p-플루오로페닐이소시아네이트 0.11 ml, 테트라히드로푸란 6 ml를 실온에서 30분동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(초산에틸)를 행했다. 용매를 감압 증류 수거하여 백색 고체 200 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.22(3H, t, J=7.2Hz), 4.14(2H, q, J=7.2Hz), 5.83(1H, d, J=5.6Hz), 6.41(2H, brs), 6.62(1H, d, J=16Hz), 7.04-7.14(4H, m), 7.40-7.53(4H, m), 7.72(1H, d, J=16Hz), 7.79(1H, d, J=5.6Hz), 8.69(1H, s), 8.75(1H, s).
실시예
185
N-(4-
플루오로페닐
)-N’-[4-(1H-
피롤로[2,3-b]피리딘
-4-
일옥시
)
페닐
]
우레아
4-(1H-피롤로[2,3-b]피리딘-4-일옥시)아닐린 90 mg을 초산에틸에 실온하에 용해하여, 파라-플루오로페닐이소시아네이트 0.05 ml를 적하했다. 석출된 백색 결정을 여과 수취하여 목적물 65 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.21(1H, d, J=3.6Hz), 6.38(1H, d, J=5.6Hz), 7.08-7.18(4H, m), 7.34(1H, d, J=3.6Hz), 7.43-7.56(4H, m), 8.06(1H, d, J=5.6Hz), 8.72(1H, s), 8.76(1H, s), 11.72(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
185-1
4-(4-
니트로페녹시
)-3-[2-(1,1,1-
트리메틸실릴
)-1-
에티닐
]-2-
피리딘아민
4-(4-니트로페녹시)-3-요오드-2-피리딘아민 1.5 g, (트리메틸실릴)아세틸렌 1.5 ml, 테트라키스(트리페닐포스핀)팔라듐(0) 480 mg, 요드화제1구리 80 mg, 디메틸포름아미드 3 ml, 트리에틸아민 3 ml를 100℃에서 35분동안 교반했다. 실온으로 되돌리고, 물을 가하여 초산에틸로 추출했다. 추출액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 충전하고, 컬럼 정제(헥산:초산에틸=4:1)를 행했다. 유기 용매를 감압 증류 수거하고 잔사에 초산에틸과 헥산을 가하여 고체화시켜, 미갈색 분말의 목적물 560 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.30(9H, s), 6.60(1H, d, J=5.6Hz), 6.67(2H, brs), 7.47(2H, d, J=8.0Hz), 8.24(1H, d, J=5.6Hz), 8.52(2H, d, J=8.0Hz).
제조예
185-2
4-(4-
니트로페녹시
)-1H-
피롤로[2,3-b]피리딘
4-(4-니트로페녹시)-3-[2-(1,1,1-트리메틸실릴)-1-에티닐]-2-피리딘아민 560 mg, 요드화제1구리 680 mg, 디메틸포름아미드 5 ml를 환류하에 25분동안 교반했다. 불용물을 여과 제거한 후, 반응 용액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=2:1 이어서 1:1)를 행했다. 용매를 감압 증류 수거하여 담황색 고체 84 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.14(1H, d, J=3.6Hz), 6.78(1H, d, J=5.2Hz), 7.28(2H, d, J=9.2Hz), 7.43(1H, d, J=3.6Hz), 8.21(1H, d, J=5.2Hz), 8.27(2H, d, J=9.2Hz), 11.92(1H, brs).
제조예
185-3
4-(1H-
피롤로[2,3-b]피리딘
-4-
일옥시
)아닐린
4-(4-니트로페녹시)-1H-피롤로[2,3-b]피리딘 84 mg, 철분160 mg, 염화암모늄 320 ml, 디메틸포름아미드 4 ml, 에탄올 2 ml, 물 2 ml를 100℃에서 15분동안 교반했다. 세라이트 여과하여 물, 초산에틸을 가하여 추출했다. 유기층을 염화암모늄수로 5회 세척한 후 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 목적물 230 mg을 갈색 유상물로서 얻었다.
1H-NMR(CDCl3) δ(ppm) : 6.41(1H, d, J=3.6Hz), 6.42(1H, d, J=5.6Hz), 6.74(2H, d, J=8.8Hz), 7.00(2H, d, J=8.8Hz), 7.20(1H, d, J=3.6Hz), 8.11(1H, d, J=5.6Hz), 10.00(1H, brs).
실시예
186
N1 - 시클로프로필카르보닐 - N1 -[3-(1- 에티닐 )-4-(4-{[(4- 플루오로아닐리노 )카르보닐]아미노}페녹시)-2-피리딜]-1-시클로프로판카르복사미드
N-(4-{[2-아미노-3-(1-에티닐)-4-피리딜]옥시}페닐)-N'-(4-플루오로페닐)우레아 100 mg, 트리에틸아민 0.12 ml, 테트라히드로푸란 5 ml의 용액에 실온 교반하에서 시클로프로판카르보닐클로라이드 57 mg을 가하여, 1.5시간동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 정제(초산에틸)를 행했다. 유기 용매를 감압 증류 수거하고 잔사에 메탄올과 물을 가하여 고체화시켜 백색 분말의 목적물 15 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.97-1.03(8H, m), 1.93-2.02(2H, m), 4.75(1H, s), 6.74(1H, d, J=5.6Hz), 7.08-7.20(4H, m), 7.42-7.49(2H, m), 7.56(2H, d, J=8.8Hz), 8.35(1H, d, J=5.6Hz), 8.72(1H, s), 8.81(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
186-1
3-(1-
에티닐
)-4-(4-
니트로페녹시
)-2-
피리딘아민
4-(4-니트로페녹시)-3-[2-(1,1,1-트리메틸실릴)-1-에티닐]-2-피리딘아민 560 mg, 테트라부틸암모늄플루오라이드(1.0M 테트라히드로푸란중 용액) 1 ml, 테트라히드로푸란 2 ml를 실온에서 10분동안 교반했다. 염화암모늄수, 초산에틸을 가하고 추출하여 추출액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 충분히 세척하고, 초산에틸을 감압 증류 수거하여 목적물 400 mg을 갈색 분말로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 4.52(1H, s), 6.23(1H, d, J=5.6Hz), 6.46(2H, brs), 7.24(2H, d, J=7.2Hz), 7.94(1H, d, J=5.6Hz), 8.27(2H, d, J=7.2Hz).
제조예
186-2
4-(4-
아미노페녹시
)-3-(1-
에티닐
)-2-
피리딘아민
3-(1-에티닐)-4-(4-니트로페녹시)-2-피리딘아민 400 mg, 철분 800 mg, 염화암모늄 1.6 g, 디메틸포름아미드 3 ml, 에탄올 1 ml, 물 1 ml를 100℃에서 30분동안 교반했다. 세라이트 여과하고 여과액에 물, 초산에틸을 가하여 추출했다. 유기층을 염화암모늄수로 5회 세척한 후, 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 목적물 260 mg을 갈색 고체로서 얻었다.
1H-NMR(CDCl3) δ(ppm) : 3.63(1H, s), 3.64(2H, brs), 5.12(2H, brs), 5.95(1H, d, J=5.6Hz), 6.69(2H, dd, J=6.4Hz, 2.0Hz), 6.91(2H, dd, J=6.4Hz, 2.0Hz), 7.81(1H, d, J=5.6Hz).
제조예
186-3
N-(4-{[2-아미노-3-(1- 에티닐 )-4- 피리딜 ] 옥시 } 페닐 )-N’-(4- 플루오로페닐 ) 우레아
4-(4-아미노페녹시)-3-(1-에티닐)-2-피리딘아민 260 mg, 파라-플루오로페닐이소시아네이트 0.13 ml, 테트라히드로푸란 5 ml를 실온하에 20시간동안 교반했다. 반응 용액에 물을 가하여 테트라히드로푸란을 증류 수거하고, 이어서 소량의 초산에틸을 가하여 석출된 고체를 여과 수취했다. 담갈색 고체 200 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 4.53(1H, s), 5.80(1H, d, J=5.6Hz), 6.22(2H, brs), 7.00-7.15(4H, m), 7.40-7.53(4H, m), 7.76(1H, d, J=5.6Hz), 8.69(1H, s), 8.73(1H, s).
실시예
187
N1 - 시클로프로필 -5-[(2-{[4-(4- 히드록시피페리디노 ) 부타노일 ]아미노}-4- 피리딜)옥시]-1H-1-인돌카르복사미드
5-[(2-{[4-(4-히드록시피페리디노)부타노일]아미노}-4-피리딜)옥시]인돌 260 mg, 수소화나트륨(오일중 60%) 53 mg, 디메틸포름아미드 5 ml의 용액에서 실온 교반하에 페닐 N-시클로프로필카르바메이트 120 mg을 가했다. 10분동안 교반한 후, 물을 가하여 초산에틸로 추출했다. 초산에틸층에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 크로마토그래피(클로로포름:메탄올=30:1)로 정제를 했다. 용매를 감압 증류 수거하고 잔사를 초산에틸에 용해하여 1N 수산화나트륨수로 2회 세척했다. 황산나트륨으로 건조한 후, 용매를 감압 증류 수거하여 목적물 20 mg을 백색 분말로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.64(2H, m), 0.68-0.75(2H, m), 1.24-1.34(2H, m), 1.55-1.67(4H, m), 1.83-1.94(2H, m), 2.17(2H, t, J=7.2Hz), 2.28(2H, t, J=7.2Hz), 2.55-2.66(2H, m), 2.73-2.80(1H, m), 3.30-3.40(1H, m), 4.47(1H, d, J=3.6Hz), 6.62(1H, dd, J=5.6Hz, 2.4Hz), 6.64(1H, d, J=3.6Hz), 7.04(1H, dd, J=8.8Hz, 2.4Hz), 7.36(1H, d, J=2.4Hz), 7.61(1H, d, J=2.4Hz), 7.87(1H, d, J=3.6Hz), 8.12(1H, d, J=5.6Hz), 8.25-8.30(2H, m), 10.40(1H, s).
실시예
188
N1 -(2- 플루오로에틸 )-5-[(2-{[4-(4- 히드록시피페리디노 ) 부타노일 ]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드
페닐 N-(2-플루오로에틸)카르바메이트를 이용하여 실시예 188과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.24-1.35(2H, m), 1.57-1.67(4H, m), 1.88(2H, t, J=10.4Hz), 2.17(2H, t, J=7.2Hz), 2.28(2H, t, J=7.2Hz), 2.56-2.55(2H, m), 3.30-3.40(1H, m), 3.55(1H, q, J=4.8Hz), 3.61(1H, q, J=4.8Hz), 4.48(1H, d, J=4.0Hz), 4.52(1H, t, J=4.8Hz), 4.64(1H, t, J=4.8Hz), 6.62(1H, dd, J=5.6Hz, 2.4Hz), 6.70(1H, d, J=3.6Hz), 7.05(1H, dd, J=8.8Hz, 2.4Hz), 7.38(1H, d, J=2.4Hz), 7.62(1H, d, J=2.4Hz), 7.95(1H, d, J=3.6Hz), 8.12(1H, d, J=5.6Hz), 8.28(1H, d, J=8.8Hz), 8.44-8.49(1H, m), 10.41(1H, s).
실시예
189
N1 - 페닐 -5-[(2-{[4-(4- 히드록시피페리디노 ) 부타노일 ]아미노}-4- 피리딜 ) 옥시 ]-1H-1-인돌카르복사미드
페닐이소시아네이트를 이용하여 실시예 187과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.24-1.35(2H, m), 1.57-1.67(4H, m), 1.84-1.96(2H, m), 2.18(2H, t, J=6.8Hz), 2.29(2H, t, J=6.8Hz), 2.56-2.66(2H, m), 3.30-3.40(1H, m), 4.48(1H, d, J=4.4Hz), 6.65(1H, dd, J=5.6Hz, 2.4Hz), 6.77(1H, d, J=3.6Hz), 7.09(1H, dd, J=8.8Hz, 2.4Hz), 7.10-7.16(1H, m), 7.35-7.41(2H, m), 7.43(1H, d, J=2.4Hz), 7.62-7.67(3H, m), 8.10-8.15(2H, m), 8.27(1H, d, J=8.8Hz), 10.10(1H, s), 10.42(1H, s).
실시예
190
N1 - 시클로프로필 -5-[(2-{[2-(4- 히드록시피페리디노 )아세틸]아미노}-4- 피리딜)옥시]-1H-1-인돌카르복사미드
5-[(2-{[2-(4-히드록시피페리디노)아세틸]아미노}-4-피리딜)옥시]인돌을 이용하여 실시예 188과 같은 식으로 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.58-0.63(2H, m), 0.69-0.75(2H, m), 1.35-1.45(2H, m), 1.66-1.74(2H, m), 2.17-2.25(2H, m), 2.64-2.72(2H, m), 2.72-2.80(1H, m), 3.04(2H, s), 3.38-3.49(1H, m), 4.57(1H, d, J=4.4Hz), 6.65(1H, d, J=3.6Hz), 6.68(1H, dd, J=5.6Hz, 2.4Hz), 7.05(1H, dd, J=8.8Hz, 2.4Hz), 7.38(1H, d, J=2.8Hz), 7.59(1H, d, J=2.8Hz), 7.87(1H, d, J=3.6Hz), 8.15(1H, d, J=5.6Hz), 8.27-8.82(2H, m), 9.85(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
190-1
5-[(2-{[2-(4-
히드록시피페리디노
)아세틸]아미노}-4-
피리딜
)
옥시
]인돌
N1-시클로프로필-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 2.0 g, 트리에틸아민 2.3 ml, 테트라히드로푸란 20 ml의 용액중에 실온 교반하에 브로모아세틸클로라이드 2.14 g을 가했다. 30분동안 교반한 후 물을 가하여 초산에틸로 추출했다. 추출액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 잘 세척하여, 초산에틸층을 합쳐 감압 증류 수거하고, 녹갈색 유상물 900 mg을 얻었다. 얻어진 유상물 900 mg을 4-히드록시피페리딘 640 mg, 탄산칼륨 1.2 g, 디메틸포름아미드 20 ml과 함께 70℃에서 35분동안 교반했다. 물을 가하여 초산에틸로 추출했다. 추출액을 물로 3회, 식염수로 1회 세척하고 이어서 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 잘 선별하고, 용매를 감압 증류 수거하여 목적물 530 mg을 담황색 분말로서 얻었다.
*1H-NMR(DMSO-d6) δ(ppm) : 1.35-1.47(2H, m), 1.68-1.75(2H, m), 2.21(2H, t, J=10.00Hz), 2.64-2.74(2H, m), 3.03(2H, s), 3.40-3.50(1H, m), 4.57(1H, d, J=4.0Hz), 6.42(1H, s), 6.63(1H, dd, J=5.6Hz, 2.4Hz), 6.86(1H, dd, J=8.8Hz, 2.4Hz), 7.30(1H, s), 7.42(1H, d, J=2.4Hz), 7.45(1H, d, J=8.8Hz), 7.59(1H, d, J=2.4Hz), 8.12(1H, d, J=5.6Hz), 9.81(1H, s), 11.25(1H, s).
실시예
191
N1 -(2- 플루오로에틸 )-5-[(2-{[2-(4- 히드록시피페리디노 )아세틸]아미노}-4- 피리딜)옥시]-1H-1-인돌카르복사미드
5-[(2-{[2-(4-히드록시피페리디노)아세틸]아미노}-4-피리딜)옥시]인돌페닐과 N-(2-플루오로에틸)카르바메이트를 이용하여 실시예 187과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.35-1.45(2H, m), 1.66-1.74(2H, m), 2.21(2H, t, J=10.0Hz), 2.65-2.72(2H, m), 3.04(2H, s), 3.38-3.50(1H, m), 3.55(1H, q, J=4.8Hz), 3.62(1H, q, J=4.8Hz), 4.52(1H, t, J=4.8Hz), 4.56(1H, d, J=4.4Hz), 4.64(1H, t, J=4.8Hz), 6.67(1H, dd, J=5.6Hz, 2.4Hz), 6.70(1H, d, J=3.6Hz), 7.06(1H, dd, J=8.8Hz, 2.4Hz), 7.40(1H, d, J=2.4Hz), 7.60(1H, d, J=2.4Hz), 7.95(1H, d, J=3.6Hz), 8.15(1H, d, J=5.6Hz), 8.30(1H, d, J=8.8Hz), 8.47(1H, t, J=4.8Hz), 9.85(1H, s).
실시예
192
N1 - 시클로프로필 -5-[(2-{[3-(4- 히드록시피페리디노 ) 프로피오닐 ]아미노}-4- 피리딜)옥시]-1H-1-인돌카르복사미드
5-[(2-{[3-(4-히드록시피페리디노)프로피오닐]아미노}-4-피리딜)옥시]인돌을 이용하여 실시예 187과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.58-0.64(2H, m), 0.70-0.76(2H, m), 1.29-1.91(2H, m), 1.62-1.72(2H, m), 1.95-2.06(2H, m), 2.38-2.58(4H, m), 2.63-2.73(2H, m), 2.70-2.80(1H, m), 3.35-3.46(1H, m), 4.51(1H, s), 6.61-6.66(2H, m), 7.04(1H, dd, J=8.8Hz, 2.4Hz), 7.36(1H, d, J=2.4Hz), 7.59(1H, d, J=2.4HZ), 7.87(1H, d, J=3.6Hz), 8.13(1H, d, J=5.6Hz), 8.25-8.30(2H, m), 10.77(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
192-1
5-[(2-{[3-(4-
히드록시피페리디노
)
프로피오닐
]아미노}-4-
피리딜
)
옥시
]인돌
N1-시클로프로필-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 2.0 g, 트리에틸아민 2.3 ml, 테트라히드로푸란 80 ml의 용액중에 빙냉 교반하에 3-브로모프로피오닐클로라이드 1.4 ml를 가했다. 10분동안 교반한 후 실온에서 10분동안 교반하여, 물을 가하여 초산에틸로 추출했다. 추출액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 잘 세척하고, 초산에틸층을 합쳐 감압 증류 수거하여, 미황색 유상물 1.7 g을 얻었다. 생성된 유상물 중 900 mg을 4-히드록시피페리딘 470 mg, 탄산칼륨 880 mg, 디메틸포름아미드 10 ml과 함께 70℃에서 30분동안 교반했다. 물을 가하여 초산에틸로 추출했다. 초산에틸층에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 크로마토그래피(클로로포름:메탄올=100:3)로 정제했다. 용매를 감압 증류 수거하여 목적물 170 mg을 백색 분말로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.29-1.42(2H, m), 1.62-1.72(2H, m), 2.00(2H, t, J=7.2Hz), 2.37-2.55(4H, m), 2.62-2.72(2H, m), 3.35-3.46(1H, m), 4.52(1H, d, J=4.0Hz), 6.42(1H, s), 6.59(1H, dd, J=5.6Hz, 2.4Hz), 6.85(1H, dd, J=8.8Hz, 2.4Hz), 7.29(1H, s), 7.41(1H, d, J=2.4Hz), 7.44(1H, d, J=8.8Hz), 7.59(1H, d, J=2.4Hz), 8.10(1H, d, J=5.6Hz), 10.74(1H, s), 11.22(1H, s).
실시예
193
N1 -(2- 플루오로에틸 )-5-({2-[(4- 피페리딜카르보닐 )아미노]-4- 피리딜 } 옥시 )-1H-1-인돌카르복사미드
N1-(2-플루오로에틸)-5-[(2-{[(1-tert-부틸옥시카르보닐-4-피페리딜)카르보닐]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드 160 mg을 트리플루오로초산 10 ml에 용해하여 실온에서 10분동안 교반했다. 초산에틸 및 중조수를 가하여 알카리성으로 만들어 분액했다. 초산에틸층을 1회 식염수로 세척하여 황산마그네슘으로 건조시켰다. 용매를 감압 증류 수거하여 무색 분말 86 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.60-1.73(2H, m), 1.83-1.91(2H, m), 2.65-2.73(1H, m), 2.77-2.87(2H, m), 3.22-3.32(2H, m), 3.55(1H, q, J=5.2Hz), 3.62(1H, q, J=5.2Hz), 4.52(1H, t, J=5.2Hz), 4.64(1H, t, J=5.2Hz), 6.67(1H, dd, J=5.6Hz, 2.4Hz), 6.70(1H, d, J=3.6Hz), 7.05(1H, dd, J=8.8Hz, 2.4Hz), 7.38(1H, d, J=2.4Hz), 7.59(1H, d, J=2.4Hz), 7.96(1H, d, J=3.6Hz), 8.16(1H, d, J=5.6Hz), 8.29(1H, d, J=8.8Hz), 8.49(1H, t, J=5.2Hz), 10.59(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
193-1
N1 -(2- 플루오로에틸 )-5-[(2-{[(1- tert - 부틸옥시카르보닐 -4- 피페리딜 )카르보닐]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드
N1-(2-플루오로에틸)-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 500 mg, 1-tert-부틸옥시카르보닐피페리딘-4-카르복실산 440 mg, 벤조트리아졸-1-일옥시트리스(디메틸아미노)포스포늄 헥사플루오로포스페이트(Bop 시약) 840 mg, 트리에틸아민 0.44 ml, 디메틸포름아미드 10 ml를 실온에서 17시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 추출액에 NH 타입 실리카겔을 가해 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=1:1)를 행했다. 용매를 감압 증류 수거하여 목적물 160 mg을 백색 분말로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.28-1.40(2H, m), 1.36(9H, s), 1.64-1.72(2H, m), 2.54-2.80(3H, m), 3.55(1H, q, J=5.2Hz), 3.61(1H, q, J=5.2Hz), 3.86-3.96(2H, m), 4.52(1H, t, J=5.2Hz), 4.64(1H, t, J=5.2Hz), 6.66(1H, dd, J=5.6Hz, 2.4Hz), 6.70(1H, d, J=3.6Hz), 7.05(1H, dd, J=8.8Hz, 2.4Hz), 7.38(1H, d, J=2.4Hz), 7.59(1H, d, J=2.4Hz), 7.95(1H, d, J=3.6Hz), 8.14(1H, d, J=5.6Hz), 8.28(1H, d, J=8.8Hz), 8.48(1H, t, J=5.2Hz), 10.49(1H, s).
실시예
194
N1 -(2- 플루오로에틸 )-5-[(2-{[(1- 메틸 -4- 피페리딜 )카르보닐]아미노}-4- 피리딜)옥시]-1H-1-인돌카르복사미드
N1-시클로프로필-5-({2-[(4-피페리딜카르보닐)아미노]-4-피리딜}옥시)-1H-1-인돌카르복사미드 70 mg, 포름알데히드(37% 수중) 0.1 ml, 초산 20 mg, 테트라히드로푸란 5 ml를 실온에서 5분동안 교반하고, 이어서 나트륨트리아세톡시보로히드라이드 70 mg을 가하고 10분동안 더 교반했다. 중조수를 가하여 초산에틸로 추출했다. NH 타입 실리카겔을 글라스 필터에 깔아 추출액을 통과시켰다. 실리카겔을 초산에틸로 잘 세척하고 초산에틸층을 합쳐 감압 증류 수거하여 무색 분말 40 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.45-1.56(2H, m), 1.59-1.68(2H, m), 1.73-1.83(2H, m), 2.09(3H, s), 2.30-2.40(1H, m), 2.69-2.77(2H, m), 3.56(1H, q, J=5.2Hz), 3.62(1H, q, J=5.2Hz), 4.52(1H, t, J=5.2Hz), 4.64(1H, t, J=5.2Hz), 6.65(1H, dd, J=5.6Hz, 2.4Hz), 6.70(1H, d, J=3.6Hz), 7.05(1H, dd, J=8.8Hz, 2.4Hz), 7.38(1H, d, J=2.4Hz), 7.60(1H, d, J=2.4Hz), 7.95(1H, d, J=3.6Hz), 8.13(1H, d, J=5.6Hz), 8.29(1H, d, J=8.8Hz), 8.48(1H, t, J=5.2Hz), 10.41(1H, s).
실시예
195
N1 - 시클로프로필 -5-({2-[(4- 피페리딜카르보닐 )아미노]-4- 피리딜 } 옥시 )-1H-1-인돌카르복사미드
N1-시클로프로필-5-[(2-{[(1-tert-부틸옥시카르보닐-4-피페리딜)카르보닐]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드를 이용하여, 실시예 193과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.59-0.66(2H, m), 0.67-0.75(2H, m), 1.30-1.43(2H, m), 1.54-1.62(2H, m), 2.36-2.45(2H, m), 2.45-2.54(1H, m), 2.73-2.80(1H, m), 2.86-2.94(2H, m), 6.60-6.67(2H, m), 7.04(1H, dd, J=8.8Hz, 2.4Hz), 7.36(1H, d, J=2.4Hz), 7.60(1H, d, J=2.4Hz), 7.92(1H, d, J=2.4Hz), 8.13(1H, d, J=5.6Hz), 8.29(1H, d, J=8.8Hz), 8.34(1H, s), 10.36(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
195-1
N1 - 시클로프로필 -5-[(2-{[(1- tert - 부틸옥시카르보닐 -4- 피페리딜 )카르보닐]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드
N1-시클로프로필-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드를 이용하여, 제조예 193-1과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.59-0.64(2H, m), 0.70-0.75(2H, m), 1.28-1.42(11H, m), 1.64-1.71(2H, m), 2.55-2.82(4H, m), 3.87-3.97(2H, m), 6.64-6.68(2H, m), 7.03(1H, dd, J=8.8Hz, 2.4Hz), 7.36(1H, d, J=2.4Hz), 7.59(1H, d, J=2.4Hz), 7.87(1H, d, J=3.6Hz), 8.14(1H, d, J=5.6Hz), 8.27(1H, s), 8.29(1H, d, J=8.8Hz), 10.48(1H, s).
실시예
196
N1 - 시클로프로필 -5-[(2-{[( 1메틸 -4- 피페리딜 )카르보닐]아미노}-4- 피리딜 ) 옥시]-1H-1-인돌카르복사미드
N1-시클로프로필-5-({2-[(4-피페리딜카르보닐)아미노]-4-피리딜}옥시)-1H-1-인돌카르복사미드를 이용하여, 실시예 194와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.59-0.65(2H, m), 0.70-0.76(2H, m), 1.43-1.56(2H, m), 1.59-1.68(2H, m), 1.70-1.81(2H, m), 2.09(3H, s), 2.30-2.40(1H, m), 2.69-2.80(3H, m), 6.62-6.70(2H, m), 7.04(1H, dd, J=8.8Hz, 2.4Hz), 7.36(1H, d, J=2.4Hz), 7.59(1H, d, J=2.4Hz), 7.87(1H, d, J=3.6Hz), 8.13(1H, d, J=5.6Hz), 8.27-8.83(2H, m), 10.41(1H, s).
실시예
197
N1 - 페닐 -5-[(2-{[( 1메틸 -4- 피페리딜 )카르보닐]아미노}-4- 피리딜 ) 옥시 ]-1H-1-인돌카르복사미드
N1-페닐-5-({2-[(4-피페리딜카르보닐)아미노]-4-피리딜}옥시)-1H-1-인돌카르복사미드를 이용하여 실시예 194와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.44-1.56(2H, m), 1.59-1.67(2H, m), 1.73-1.82(2H, m), 2.09(3H, s), 2.30-2.44(1H, s), 2.69-2.76(2H, s), 6.66-6.70(1H, m), 6.77(1H, d, J=3.6Hz), 7.07-7.15(2H, m), 7.35-7.45(3H, m), 7.60-7.68(3H, m), 8.10-8.18(2H, m), 8.27(1H, d, J=8.8Hz), 10.10(1H, s), 10.42(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
197-1
N1
-
페닐
-5-[(2-아미노-4-
피리딜
)
옥시
]-1H-1-
인돌카르복사미드
5-[(2-아미노-4-피리딜)옥시]-1H-인돌 3.0 g을 용해시킨 디메틸포름아미드 용액에 실온에서 수소화나트륨(오일중 60%) 28 mg을 가하여 5분동안 교반한 후, 페닐이소시아네이트 1.6 g를 가하여 20분동안 교반했다. 물을 가하여 초산에틸로 추출하고, 유기층을 물로 세척한 후, 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 크로마토그래피(초산에틸)로 정제했다. 3.4 g의 무색 분말을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.77(1H, d, J=2.4Hz), 5.85(2H, s), 6.14(1H, dd, J=5.6Hz, 2.4Hz), 6.75(1H, d, J=4.0Hz), 7.06(1H, dd, J=8.8Hz, 2.4Hz), 7.13(1H, dd, J=8.0Hz, 8.0Hz), 7.36-7.43(3H, m), 7.64(2H, d, J=8.0Hz), 7.77(1H, d, J=5.6Hz), 8.10(1H, d, J=4.0Hz), 8.25(1H, d, J=8.8Hz), 10.08(1H, s).
제조예
197-2
tert -부틸 4-{[(4-{[1-( 아닐리노카르보닐 )-1H-5- 인돌릴 ] 옥시 }-2- 피리딜 )아미노]카르보닐}-1-피페리딘카르복실레이트
N1-페닐-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드를 이용하여, 제조예 193-1과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.38-1.41(11H, m), 1.64-1.72(2H, m), 2.52-2.75(3H, m), 3.87-3.97(2H, m), 6.68(1H, dd, J=5.6Hz, 2.4Hz), 6.77(1H, d, J=3.6Hz), 7.09(1H, dd, J=8.8Hz, 2.4Hz), 7.13(1H, dd, J=7.2Hz, 7.2Hz), 7.38(2H, dd, J=7.2Hz, 7.2Hz), 7.43(1H, d, J=2.4Hz), 7.61(1H, d, J=2.4Hz), 7.65(2H, d, J=7.2Hz), 8.13(1H, d, J=3.6Hz), 8.15(1H, d, J=5.6Hz), 8.27(1H, d, J=8.8Hz), 10.10(1H, s), 10.50(1H, s).
제조예
197-3
N1 - 페닐 -5-({2-[(4- 피페리딜카르보닐 )아미노]-4- 피리딜 } 옥시 )-1H-1- 인돌카르복사미드
tert-부틸 4-{[(4-{[1-(아닐리노카르보닐)-1H-5-인돌릴]옥시}-2-피리딜)아미노]카르보닐}-1-피페리딘카르복실레이트를 이용하여, 실시예 193과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.32-1.43(2H, m), 1.55-1.63(2H, m), 2.37-2.53(3H, m), 2.88-2.95(2H, m), 6.67(1H, dd, J=5.6Hz, 2.4Hz), 6.77(1H, d, J=3.6Hz), 7.09(1H, dd, J=8.8Hz, 2.4Hz), 7.13(1H, dd, J=7.2Hz, 7.2Hz), 7.38(2H, dd, J=7.2Hz, 7.2Hz), 7.43(1H, 2.4Hz), 7.62-7.67(3H, m), 8.13(1H, d, J=3.6Hz), 8.15(1H, d, J=5.6Hz), 8.27(1H, d, J=8.8Hz), 10.10(1H, bs), 10,40(1H, s).
실시예
198
N1 - 페닐 -5-{[2-({[(1- 시클로프로필메틸 )-4- 피페리딜 ]카르보닐}아미노)-4- 피리딜]옥시}-1H-1-인돌카르복사미드
N1-페닐-5-({2-[(4-피페리딜카르보닐)아미노]-4-피리딜}옥시)-1H-1-인돌카르복사미드와 시클로프로판카르복시알데히드를 이용하여, 실시예 194와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.00-0.06(2H, m), 0.39-0.45(2H, m), 0.72-0.82(1H, m), 1.46-1.59(2H, m), 1.60-1.70(2H, m), 1.80-1.90(2H, m), 2.10(2H, d, J=6.0Hz), 2.33-2.43(1H, m), 2.90-3.00(2H, m), 6.67(1H, dd, J=5.6Hz, 2.4Hz), 6.76(1H, d, J=3.6Hz), 7.06-7.16(2H, m), 7.35-7.45(3H, m), 7.60-7.68(3H, m), 8.12(1H, d, J=3.6Hz), 8.14(1H, d, J=5.6Hz), 8.27(1H, d, J=8.8Hz), 10.09(1H, s), 10.40(1H, s).
실시예
199
N4 -(4-{4-[( 아닐리노카르보닐 )아미노]-3- 클로로페녹시 }-2- 피리딜 )-1- 메틸 -4-피페리딘카르복시아미드
t-부틸 4-{[(4-{4-[(아닐리노카르보닐)아미노]-3-클로로페녹시}-2-피리딜)아미노]카르보닐}-1-피페리딘카르복실레이트 120 mg을 트리플루오로초산 5 ml에 녹여 실온에서 5분동안 교반했다. 중조수와 5N-수산화나트륨수를 가하여 초산에틸로 추출했다. 추출액을 식염수로 세척하여 황산나트륨으로 건조시켰다. 건조제를 여과 제거하여 용매를 감압 증류 수거했다. 잔사에 테트라히드로푸란 5 ml, 초산 26 mg, 나트륨트리아세톡시보로히드라이드 92 mg, 포름알데히드(37% 수중) 0.5 ml를 가하여 실온에서 10분동안 교반했다. 반응 용액에 중조수와 5N-수산화나트륨수를 가하여 초산에틸로 추출했다. 추출액을 식염수로 세척하고, 이어서 NH 타입 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 잘 세척하고, 초산에틸층을 합쳐 감압 증류 수거하고, 잔사를 초산에틸과 헥산으로부터 고체화시켜 무색 분말 80 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.48-1.62(2H, m), 1.62-1.72(2H, m), 1.76-1.86(2H, m), 2.12(3H, s), 2.34-2.44(1H, m), 2.72-2.81(2H, m), 6.68(1H, dd, J=5.6Hz, 2.4Hz), 6.98(1H, dd, J=7.2Hz, 7.2Hz), 7.15(1H, dd, J=8.8Hz, 2.4Hz), 7.29(2H, dd, J=7.2Hz, 7.2Hz), 7.38(1H, d, J=2.4Hz), 7.46(2H, d, J=7.2Hz), 7.66(1H, d, J=2.4Hz), 8.17(1H, d, J=5.6Hz), 8.22(1H, d, J=8.8Hz), 8.38(1H, s), 9.42(1H, s), 10.49(1H, s).
제조예
199-1
t-부틸 4-({[4-(4-아미노-3- 클로로페녹시 )-2- 피리딜 ]아미노}카르보닐)-1- 피페리딘카르복실레이트
2-아미노-4-(4-아미노-3-클로로페녹시)피리딘 600 mg, 1-t-부틸옥시카르보닐피페리딘-4-카르복실산 700 mg, 벤조트리아졸-1-일옥시트리스(디메틸아미노)포스포늄 헥사플루오로포스페이트(Bop 시약) 1.4 g, 트리에틸아민 0.71 ml, 디메틸포름아미드 10 ml를 60℃에서 3.5시간, 이어서 실온에서 19시간동안 교반했다. 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물로 세척한 후, 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 크로마토그래피(헥산:초산에틸=1:1 이어서 초산에틸)로 정제했다. 660 mg의 적갈색 분말을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.30-1.45(11H, m), 1.65-1.74(2H, m), 2.56-2.76(3H, m), 3.88-4.03(2H, m), 5.37(2H, s), 6.59(1H, dd, J=5.6Hz, 2.4Hz), 6.82-6.88(2H, m), 6.07(1H, d, J=2.4Hz), 7.57(1H, d, J=2.4Hz), 8.12(1H, d, J=5.6Hz), 10.48(1H, s).
제조예
199-2
t-부틸 4-{[(4-{3- 클로로 -4-[( 페녹시카르보닐 )아미노] 페녹시 }-2- 피리딜 )아미노]카르보닐}-1-피페리딘카르복실레이트
t-부틸 4-({[4-(4-아미노-3-클로로페녹시)-2-피리딜]아미노}카르보닐)-1-피페리딘카르복실레이트 660 mg, 피리딘 0.14 ml, 테트라히드로푸란 10 ml의 용액 중에 실온 교반하에 페닐클로로포르메이트 0.21 ml를 가하여 13시간동안 교반했다. 반응 용액에 물을 가하고 초산에틸로 추출하여, 유기층을 물로 세척한 후, 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 크로마토그래피(헥산:초산에틸=1:1 이어서 초산에틸)로 정제했다. 500 mg의 무색 유상물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.30-1.45(11H, m), 1.67-1.77(2H, m), 2.58-2.80(3H, m), 3.88-4.00(2H, m), 6.71(1H, dd, J=5.6Hz, 2.4Hz), 7.17-7.28(4H, m), 7.37-7.46(3H, m), 7.67(1H, d, J=2.4Hz), 7.79(1H, d, J=8.8Hz), 8.20(1H, d, J=5.6Hz), 9.78(1H, bs), 10.58(1H, s).
제조예
199-3
t-부틸 4-{[(4-{4-[( 아닐리노카르보닐 )아미노]-3- 클로로페녹시 }-2- 피리딜 )아미노]카르보닐}-1-피페리딘카르복실레이트
t-부틸 4-{[(4-{3-클로로-4-[(페녹시카르보닐)아미노]페녹시}-2-피리딜)아미노]카르보닐}-1-피페리딘카르복실레이트 250 mg, 아닐린 84 mg, 디메틸포름아미드 3 ml를 130℃에서 70분동안 교반했다. 실온으로 되돌린후, 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=1:1 이어서 초산에틸)했다. 용매를 감압 증류 수거하여 무색 유상물 120 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.28-1.45(11H, m), 1.67-1.75(2H, m), 2.57-2.80(3H, m), 3.87-4.03(2H, m), 6.69(1H, dd, J=5.6Hz, 2.4Hz), 6.93(1H, dd, J=7.2Hz, 7.2Hz), 7.15(1H, dd, J=8.8Hz, 2.4Hz), 7.28(2H, dd, J=7.2Hz, 7.2Hz), 7.39(1H, d, J=2.4Hz), 7.45(2H, d, J=7.2Hz), 7.64(1H, d, J=2.4Hz), 8.18(1H, d, J=5.6Hz), 8.21(1H, d, J=8.8Hz), 8.36(1H, s), 9.33(1H, s), 10.55(1H, s).
실시예
200
N4 -[4-(3- 클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노} 페녹시 )-2- 피리딜]-1-메틸-4-피페리딘카르복시아미드
t-부틸4-({[4-(3-클로로-4-{[(시클로프로필아미노)카르보닐]아미노}페녹시)-2-피리딜]아미노}카르보닐)-1-피페리딘카르복실레이트를 이용하여, 실시예 199와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.48(2H, brs), 0.60-0.70(2H, m), 1.50-1.85(6H, m), 2.11(3H, s), 2.33-2.45(1H, m), 2.45-2.58(1H, m), 2.70-2.80(2H, m), 6.66(1H, dd, J=5.6Hz, 2.4Hz), 7.09(1H, dd, J=8.8Hz, 2.4Hz), 7.16(1H, d, J=2.4Hz), 7.32(1H, d, J=2.4Hz), 7.62(1H, s), 7.93(1H, s), 8.16(1H, d, J=5.6Hz), 8.20(1H, d, J=8.8Hz), 10.46(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
200-1
t- 부틸4 -({[4-(3- 클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노} 페녹시 )-2-피리딜]아미노}카르보닐)-1-피페리딘카르복실레이트
제조예 199-2에서 합성한 원료에 대하여 시클로프로필아민을 이용하여 제조예 199-3과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.44(2H, m), 0.60-0.68(2H, m), 1.30-1.44(11H, m), 1.67-1.74(2H, m), 2.50-2.80(4H, m), 3.88-4.00(2H, m), 6.67(1H, dd, J=5.6Hz, 2.4Hz), 7.09(1H, dd, J=8.8Hz, 2.4Hz), 7.16(1H, d, J=2.4Hz), 7.32(1H, d, J=2.4Hz), 7.61(1H, s), 7.93(1H, s), 8.16(1H, d, J=5.6Hz), 8.20(1H, d, J=8.8Hz), 10.54(1H, s).
실시예
201
N4 -[4-(3- 클로로 -4-{[(4- 플루오로아닐리노 )카르보닐]아미노} 페녹시 )-2- 피리딜]-4-피페리딘카르복사미드
t-부틸 4-{[4-(3-클로로-4-{[(4-플루오로아닐리노)카르보닐]아미노}페녹시)-2-피리딜]아미노}카르보닐-1-피페리딘카르복실레이트 320 mg을 트리플루오로초산 10 ml에 용해하여 실온에서 5분동안 교반했다. 초산에틸 및 중조수를 가하여 알카리성으로 만들어 분액했다. 초산에틸층을 1회 식염수로 세척하여 황산마그네슘으로 건조시켰다. 용매를 감압 증류 수거하여 무색 분말 240 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.36-1.48(2H, m), 1.58-1.66(2H, m), 2.39-2.58(3H, m), 2.89-2.98(2H, m), 6.67(1H, dd, J=5.6Hz, 2.4Hz), 7.09-7.18(3H, m), 7.38(1H, d, J=2.4Hz), 7.44-7.50(2H, m), 7.66(1H, d, J=2.4Hz), 8.15(2H, m), 8.38(1H, s), 9.48(1H, s), 10.44(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
201-1
t-부틸 4-{[4-(3- 클로로 -4-{[(4- 플루오로아닐리노 )카르보닐]아미노} 페녹시 )-2-피리딜]아미노}카르보닐-1-피페리딘카르복실레이트
제조예 199-2에서 합성한 원료에 대하여 파라-플루오로아닐린을 이용하여 제조예 199-3과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.32-1.46(11H, m), 1.66-1.75(2H, m), 2.56-2.78(3H, m), 3.88-4.00(2H, m), 6.69(1H, dd, J=5.6Hz, 2.4Hz), 7.10-7.18(3H, m), 7.38(1H, d, J=2.4Hz), 7.43-7.50(2H, m), 7.64(1H, d, J=2.4Hz), 8.17-8.23(2H, m), 8.37(1H, s), 9.45(1H, s), 10.55(1H, s).
실시예
202
N4 -[4-(3- 클로로 -4-{[(4- 플루오로아닐리노 )카르보닐]아미노} 페녹시 )-2- 피리딜]-1-메틸-4-피페리딘카르복사미드
N4-[4-(3-클로로-4-{[(4-플루오로아닐리노)카르보닐]아미노}페녹시)-2-피리딜]-4-피페리딘카르복사미드를 이용하여, 실시예 199와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.48-1.60(2H, m), 1.62-1.70(2H, m), 1.74-1.83(2H, m), 2.11(3H, s), 2.33-2.43(1H, m), 2.70-2.78(2H, m), 6.68(1H, dd, J=5.6Hz, 2.4Hz), 7.10-7.20(3H, m), 7.39(1H, d, J=2.4Hz), 7.44-7.50(2H, m), 7.65(1H, d, J=2.4Hz), 8.16-8.23(2H, m), 8.33(1H, s), 9.41(1H, s), 10.47(1H, s).
실시예
203
N1 -(4-{4-[( 아닐리노카르보닐 )아미노]-3- 클로로페녹시 }-2- 피리딜 )-2-(1- 메틸-4-피페리딜)아세트아미드
tert-부틸 4-{2-[(4-{4-[(아닐리노카르보닐)아미노]-3-클로로페녹시}-2-피리딜)아미노]-2-옥소에틸}-1-피페리딘카르복실레이트를 이용하여, 실시예 199와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.10-1.20(2H, m), 1.50-1.70(3H, m), 1.72-1.80(2H, m), 2.08(3H, s), 2.24(2H, d, J=6.8Hz), 2.63-2.72(2H, m), 6.66(1H, d, J=5.6Hz, 2.4Hz), 6.97(1H, dd, J=7.2Hz, 7.2Hz), 7.14(1H, dd, J=8.8Hz, 2.4Hz), 7.28(2H, dd, J=7.2Hz, 7.2Hz), 7.39(1H, d, J=2.4Hz), 7.47(2H, d, J=7.2Hz), 7.68(1H, d, J=2.4Hz), 8.16(1H, d, J=5.6Hz), 8.20(1H, d, J=8.8Hz), 8.40(1H, s), 9.42(1H, s), 10.48(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
203-1
tert -부틸 4-(2-{[4-(4-아미노-3- 클로로페녹시 )-2- 피리딜 ]아미노}-2- 옥소에틸)-1-피페리딘카르복실레이트
2-아미노-4-(4-아미노-3-클로로페녹시)피리딘 1.0 g , Bop 시약 1.9 g, 트리에틸아민 1.2 ml, 2-[1-(tert-부톡시카르보닐)-4-피페리딜]초산 1.0 g 디메틸포름아미드 10 ml를 60℃에서 2시간, 이어서 실온에서 18시간동안 교반했다. 반응 용액에 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(헥산:초산에틸=1:1)로 정제했다. 담갈색 유상물 570 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.95-1.07(2H, m), 1.36(9H, s), 1.53-1.62(2H, m), 1.30-1.43(1H, m), 2.25(2H, d, J=7.2Hz), 2.55-2.75(2H, m), 3.80-3.92(2H, m), 5.37(2H, s), 6.58(1H, dd, J=5.6Hz, 2.4Hz), 6.80-6.90(2H, m), 7.07(1H, d, J=2.4Hz), 7.61(1H, d, J=2.4Hz), 8.11(1H, d, J=5.6Hz), 10.43(1H, s).
제조예
203-2
tert -부틸 4-{2-[(4-{4-[( 아닐리노카르보닐 )아미노]-3- 클로로페녹시 }-2- 피리딜)아미노]-2-옥소에틸}-1-피페리딘카르복실레이트
tert-부틸 4-(2-{[4-(4-아미노-3-클로로페녹시)-2-피리딜]아미노}-2-옥소에틸)-1-피페리딘카르복실레이트 570 mg, 피리딘 110 mg, 디메틸포름아미드 5 ml의 용액에, 실온 교반하에, 페닐클로로포르메이트 210 mg을 적하하여 30분동안 교반했다. 물을 가하여 초산에틸로 추출했다. 유기층을 물로 2회, 식염수로 1회 세척하고, 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(헥산:초산에틸=1:1 이어서 초산에틸)를 행했다. tert-부틸 4-{2-[(4-{3클로로-4-[(페녹시카르보닐)아미노]페녹시}-2-피리딜)아미노]-2-옥소에틸}-1-피페리딘카르복실레이트의 담황색 유상물 440 mg을 얻었다. 이 유상물에 아닐린 71 mg, 디메틸포름아미드 5 ml를 가하여 130℃에서 15분동안 교반했다. 반응 용액을 실온으로 되돌려, NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=1:1)를 행했다. 용매를 감압 증류 수거하여 목적물 180 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.94-1.06(2H, m), 1.36(9H, s), 1.53-1.61(2H, m), 1.80-1.92(1H, m), 2.27(2H, d, J=6.8Hz), 2.55-2.75(2H, m), 3.80-3.90(2H, m), 6.67(1H, dd, J=5.6Hz, 2.4Hz), 6.98(1H, dd, J=7.2Hz, 7.2Hz), 7.15(1H, dd, J=8.8Hz, 2.4Hz), 7.28(2H, dd, J=7.2Hz, 7.2Hz), 7.39(1H, d, J=2.4Hz), 7.45(2H, d, J=7.2Hz), 7.67(1H, s), 8.17(1H, d, J=5.6Hz), 8.21(1H, d, J=8.8Hz), 8.36(1H, s), 9.38(1H, s), 10.50(1H, s).
실시예
204
N1 - 페닐 -5-[(2-{[2-(1- 메틸 -4- 피페리딜 )아세틸]아미노}-4- 피리딜 ) 옥시 ]-1H-1-인돌카르복사미드
tert-부틸 4-{2-[(4-{[1-(아닐리노카르보닐)-1H-5-인돌릴]옥시}-2-피리딜)아미노]-2-옥소에틸}-1-피페리딘카르복실레이트를 이용하여, 실시예 199와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.08-1.20(2H, m), 1.48-1.66(3H, m), 1.71-1.80(2H, m), 2.07(3H, s), 2.22(2H, d, J=7.2Hz), 2.62-2.69(2H, m), 6.65(1H, dd, J=5.6Hz, 2.4Hz), 6.77(1H, d, J=3.6Hz), 7.07-7.16(2H, m), 7.38(2H, dd, J=7.2Hz, 7.2Hz), 7.43(1H, d, J=2.4Hz), 7.60-7.68(3H, m), 8.10-8.17(2H, m), 8.27(1H, d, J=8.8Hz), 10.09(1H, s), 10.43(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
204-1
tert -부틸 4-{2-[(4-{[1-( 아닐리노카르보닐 )-1H-5- 인돌릴 ] 옥시 }-2- 피리딜 )아미노]-2-옥시에틸}-1-피페리딘카르복실레이트
N1-페닐-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 500 mg, 2-[1-(tert-부톡시카르보닐)-4-피페리딜]초산 350 mg, 벤조트리아졸-1-일트리스(디메틸아미노)포스포늄헥사플루오로포스페이트 640 mg, 트리에틸아민 0.4 ml, 디메틸포름아미드 5 ml를 60℃에서 1시간, 이어서 실온에서 19시간동안 교반했다. 반응 용액에 물을 가하여 초산에틸로 추출했다. 유기층을 물로 2회, 식염수로 1회 세척하고, 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(헥산:초산에틸=1:1 이어서 초산에틸)를 행했다. 무색 유상물 220 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.92-1.08(2H, m), 1.36(9H, s), 1.50-1.62(2H, m), 1.77-1.90(1H, m), 2.24(2H, d, J=6.8Hz), 2.55-2.77(2H, m), 3.78-3.93(2H, m), 6.66(1H, dd, J=5.6Hz, 2.4Hz), 6.77(1H, d, J=3.6Hz), 7.08-7.16(2H, m), 7.35-7.46(3H, m), 7.60-7.68(3H, m), 8.10-8.18(2H, m), 8.27(1H, d, J=8.8Hz), 10.09(1H, s), 10.44(1H, s).
실시예
205
N1 - 페닐 -3- 클로로 -5-[(2-{[(1- 메틸 -4- 피페리딜 )카르보닐]아미노}-4- 피리딜 )옥시]-1H-1-인돌카르복사미드
tert-부틸 4-{[(4-{[1-(아닐리노카르보닐)-3-클로로-1H-5-인돌릴]옥시}-2-피리딜)아미노]카르보닐}-1-피페리딘카르복실레이트 260 mg을 트리플루오로초산 5 ml에 녹여, 실온에서 5분동안 교반했다. 중조수, 5N-수산화나트륨수를 가하여 초산에틸로 추출하고, 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 N1-페닐-3-클로로-5-[(2-{[(4-피페리딜)카르보닐]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드의 미황색 고체 200 mg을 얻었다. 이 고체에 포름알데히드(37% 수중) 0.5 ml, 나트륨트리아세톡시보로히드라이드 170 mg, 초산 50 mg, 테트라히드로푸란 5 ml를 가하여 실온에서 10분동안 교반했다. 중조수, 5N-수산화나트륨수를 가하여 초산에틸로 추출하고, 추출액을 식염수로 1회 세척했다. 이렇게 해서 생성된 초산에틸용액을 NH 타입 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 세척하여 용매를 감압 증류 수거하여 미황색 유상물 210 mg을 얻었다. 이 유상물을 헥산과 초산에틸의 혼합 용매로부터 고체화시켜 90 mg의 분말을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.44-1.56(2H, m), 1.60-1.68(2H, m), 1.73-1.82(2H, m), 2.09(3H, s), 2.30-2.45(1H, m), 2.70-2.76(2H, m), 6.69(1H, dd, J=5.6Hz, 2.4Hz), 7.14(1H, dd, J=7.2Hz, 7.2Hz), 7.22(1H, dd, J=8.8Hz, 2.4Hz), 7.34-7.42(3H, m), 7.60-7.66(3H, m), 8.17(1H, d, J=5.6Hz), 8.33(1H, d, J=8.8Hz), 8.38(1H, s), 10.12(1H, s), 10.45(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
205-1
5-[(2-아미노-4-
피리딜
)
옥시
]-3-
클로로
-1H-1-인돌
5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌 1.0 g, N-클로로호박산이미드 650 mg, 이소프로판올 20 ml를 80℃에서 25분동안 교반했다. 반응 용액에 물을 가하여 초산에틸로 추출했다. 이 추출액을 NH 타입 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 세척하고 용매를 감압 증류 수거하여 적갈색 유상물 1.3 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.73(1H, d, J=2.4Hz), 5.82(2H, s), 6.13(1H, dd, J=5.6Hz, 2.4Hz), 6.93(1H, dd, J=8.8Hz, 2.4Hz), 7.15(1H, d, J=2.4Hz), 7.48(1H, d, J=8.8Hz), 7.58(1H, d, J=2.4Hz), 7.75(1H, d, J=5.6Hz), 11.48(1H, s).
제조예
205-2
N1
-
페닐
-5-[(2-아미노-4-
피리딜
)
옥시
]-3-
클로로
-1H-1-
인돌카르복사미드
5-[(2-아미노-4-피리딜)옥시]-3-클로로-1H-1-인돌 1.3 g, 수소화나트륨 180 mg, 디메틸포름아미드 15 ml의 용액에 실온하에 페닐이소시아네이트를 적하하여, 20분동안 교반했다. 반응 용액에 물을 가하여 초산에틸로 추출했다. 이 추출액에 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(헥산:초산에틸=1:1 이어서 초산에틸)를 행했다. 담적색 유상물 380 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.79(1H, d, J=2.4Hz), 5.89(2H, s), 6.16(1H, dd, J=5.6Hz, 2.4Hz), 7.12-7.20(2H, m), 7.28(1H, d, J=2.4Hz), 7.35-7.42(2H, m), 7.64(2H, d, J=8.0Hz), 7.79(1H, d, J=5.6Hz), 8.31(1H, d, J=8.8Hz), 8.35(1H, s), 10.09(1H, s).
제조예
205-3
tert -부틸 4-{[(4-{[1-( 아닐리노카르보닐 )-3- 클로로 -1H-5- 인돌릴 ] 옥시 }-2- 피리딜)아미노]카르보닐}-1-피페리딘카르복실레이트
N1-페닐-5-[(2-아미노-4-피리딜)옥시]-3-클로로-1H-1-인돌카르복사미드를 이용하여, 제조예 204-1과 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.30-1.43(11H, m), 1.65-1.73(2H, m), 2.55-2.75(3H, m), 3.87-4.00(2H, m), 6.70(1H, dd, J=5.6Hz, 2.4Hz), 7.14(1H, dd, J=7.2Hz, 7.2Hz), 7.22(1H, dd, J=8.8Hz, 2.4Hz), 7.32-7.42(3H, m), 7.60-7.67(3H, m), 8.17(1H, d, J=5.6Hz), 8.32(1H, d, J=8.8Hz), 8.38(1H, s), 10.12(1H, s), 10.53(1H, s).
실시예
206
N-(4- 플루오로페닐 )- N' -(4-{[2-(2- 옥소테트라히드로 -1H-1- 피롤릴 )-4- 피리딜 ]옥시}페닐)우레아
N-(4-플루오로페닐)-N'-(4-{[2-(4-클로로부티릴아미노)-4-피리딜]옥시}페닐)우레아 56 mg, 탄산칼륨 46 mg, 디메틸포름아미드 2 ml를 150℃에서 15분동안 교반했다. 물, 초산에틸을 가하여 추출하고, 추출액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 세척하여, 유기층을 감압 증류 수거했다. 잔사에 초산에틸과 헥산을 가하여 석출된 고체를 여과 수취했다. 미갈색 분말 21 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.98(2H, tt, J=7.6Hz, 7.6Hz), 2.50(2H, t, J=7.6Hz), 3.95(2H, t, J=7.6Hz), 6.70(1H, d, J=5.6Hz), 7.05-7.15(4H, m), 7.45(2H, dd, J=8.4Hz, 5.2Hz), 7.52(2H, d, J=9.2Hz), 7.84(1H, s), 8.22(1H, d, J=5.6Hz), 8.77(1H, s), 8.83(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
206-1
4-{[2-(4-
클로로부티릴아미노
)-4-
피리딜
]
옥시
}아닐린
2-아미노-4-(4-니트로페녹시)피리딘 300 mg, 4-클로로부티릴클로라이드 0.18 ml, 트리에틸아민 0.77 ml, 디메틸포름아미드 1 ml, 테트라히드로푸란 1 ml를 실온에서 10분동안 교반하여, 반응 용액에 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=3:1 이어서 2:1 이어서 1:1)했다. 용매를 감압 증류 수거하여 생성된 잔사 150 mg에 철분 300 mg, 염화암모늄 600 mg, DMF 2 ml, 에탄올 1 ml, 물 1 ml를 100℃에서 20분동안 교반했다. 세라이트 여과하고 물, 초산에틸을 가하여 추출했다. 유기층을 염화암모늄수로 5회 세척한 후 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 목적물 110 mg을 유상물로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.95(2H, tt, J=6.8Hz, 6.8Hz), 2.48(2H, t, J=6.8Hz), 3.62(2H, t, J=6.8Hz), 5.10(2H, brs), 6.55(1H, dd, J=5.6Hz, 1.2Hz), 6.59(2H, d, J=8.4Hz), 6.79(2H, d, J=8.4Hz), 7.57(1H, d, J=1.2Hz), 8.09(1H, d, J=5.6Hz).
제조예
206-2
N-(4- 플루오로페닐 )- N' -(4-{[2-(4- 클로로부티릴아미노 )-4- 피리딜 ] 옥시 } 페닐 )우레아
4-{[2-(4-클로로부티릴아미노)-4-피리딜]옥시}아닐린 100 mg, p-플루오로페닐이소시아네이트 0.037 ml, 테트라히드로푸란 3 ml를 실온에서 25분동안 교반했다. 반응 용액에 물, 초산에틸을 가하여 추출하고, 추출액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=1:1 이어서 초산에틸 이어서 초산에틸:메탄올=10:1)를 행했다. 용매를 감압 증류 수거하여 목적물 56 mg을 백색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.95(2H, tt, J=7.2Hz, 7.2Hz), 2.46(2H, t, J=7.2Hz), 3.62(2H, t, J=7.2Hz), 6.63(1H, d, J=5.6Hz), 7.04-7.16(4H, m), 7.40-7.48(2H, m), 7.51(2H, d, J=8.8Hz), 7.62(1H, s), 8.15(1H, d, J=5.6Hz), 8.71(1H, s), 8.76(1H, s), 10.52(1H, brs).
실시예
207
N-[4-(2- 시클로부탄카르보닐아미노피리딘 -4-일) 옥시페닐 ]- N' -(2- 티아졸릴 ) 우레아
4-(2-시클로부탄카르보닐아미노피리딘-4-일)옥시아닐린 130 mg, 페닐 N-(2-티아졸릴)카르바메이트 110 mg, 디메틸설폭시드 3 ml를 80℃에서 30분동안 교반했다. 반응 용액에 물, 초산에틸을 가하여 추출하고, 초산에틸층을 염화암모늄수로 5회 세척한 후, 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 잔사에 초산에틸을 가하여 석출된 고체를 여과 수취했다. 130 mg의 담갈색 고체를 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.68(1H, m), 1.80-1.93(1H, m), 1.95-2.10(2H, m), 2.05-2.18(2H, m), 3.25-3.35(1H, m), 6.64(1H, d, J=5.6Hz), 7.06-7.17(3H, m), 7.36(1H, d, J=1.6Hz), 7.56(2H, d, J=8.0Hz), 7.66(1H, s), 8.14(1H, d, J=5.6Hz), 9.15(1H, brs), 10.29(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
207-1
N1 - 시클로부탄카르보닐 - N1 -[4-(4- 니트로페녹시 )-2- 피리딜 ]-1- 시클로부탄카르복사미드
2-아미노-4-(4-니트로페녹시)피리딘 1.0 g, 시클로부티릴클로라이드 1.1 g, 트리에틸아민 1.9 ml, 테트라히드로푸란 20 ml를 실온에서 40분동안 교반했다. 물과 초산에틸을 가하여 추출한 후, 추출 용액을 감압 증류 수거하여 잔사를 NH 타입 실리카겔을 충전한 컬럼(헥산:초산에틸=1:1)에 의해 정제했다. 이렇게 해서 얻어진 것을 실리카겔 크로마토그래피(헥산:초산에틸=4:1 이어서 3:1)로 더 정제했다. 맨 처음에 용출되어 나온 것이 목적물이었다. 무색 유상물 720 mg을 얻을 수 있었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.62-1.96(8H, m), 2.10-2.23(4H, m), 3.35-3.45(2H, m), 7.20(1H, d, J=5.6Hz), 7.23(1H, s), 7.40(2H, d, J=9.2Hz), 8.33(2H, d, J=9.2Hz), 8.49(1H, d, J=5.6Hz).
2번째로 용출되어 나온 것은 2-시클로부탄카르보닐아미노-(4-니트로페녹시)피리딘이었다. 백색 결정 560 mg.
1H-NMR(DMSO-d6) δ(ppm) : 1.66-1.80(1H, m), 1.80-1.94(1H, m), 1.98-2.20(4H, m), 3.26-3.36(1H, m), 6.83(1H, d, J=5.6Hz), 7.38(2H, d, J=9.2Hz), 7.81(1H, s), 8.27(1H, d, J=5.6Hz), 8.31(2H, d, J=9.2Hz).
제조예
207-2
4-(4-
아미노페녹시
)-2-
시클로부탄카르보닐아미노피리딘
N1-시클로부탄카르보닐-N1-[4-(4-니트로페녹시)-2-피리딜]-1-시클로부탄카르복사미드 720 mg, 철분 1.4 g, 염화암모늄 2.4 g, 디메틸포름아미드 52 ml, 에탄올 2 ml, 물 1 ml를 100℃에서 15분동안 교반했다. 세라이트 여과하여 물, 초산에틸을 가하여 추출했다. 유기층을 염화암모늄수로 5회 세척한 후 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하여 용매를 감압 증류 수거하고, 잔사에 초산에틸과 헥산을 가하여 석출된 고체를 여과 수취했다. 130 mg의 고체를 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.68-1.80(1H, m), 1.80-1.93(1H, m), 1.96-2.19(4H, m), 3.23-3.34(1H, m), 5.10(2H, brs), 6.55(1H, d, J=5.6Hz), 6.59(2H, d, J=8.4Hz), 6.79(2H, d, J=8.4Hz), 7.61(1H, s), 8.07(1H, d, J=5.6Hz), 10.22(1H, brs).
실시예
208
N1 -[4-{[( 시클로프로필아미노 )카르보닐]아미노}-3- 클로로페녹시 ]-2- 피리딜 ]-1-시클로프로판카르복사미드
2-아미노-4-(4-아미노-3-클로로페녹시)피리딘 2.6 g, 시클로프로판카르보닐클로라이드 2.3 g, 트리에틸아민 4.6 ml, 테트라히드로푸란 30 ml를 실온에서 10분동안 교반했다. 물을 가하여 초산에틸로 추출하여, 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 갈색 유상물 3.69 g을 얻었다. 이렇게 해서 얻은 유상물 중 900 mg을 트리에틸아민 0.37 ml, 테트라히드로푸란 10 ml과 함께 교반하에, 실온에서 페닐클로로포르메이트 0.3 ml를 적하했다. 15분동안 교반한 후 시클로프로필아민 1 ml를 가하여 22시간동안더 교반했다. 반응 용액에 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(헥산:초산에틸=1:1 이어서 초산에틸)를 행했다. 목적물인 갈색 고체 38 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.40-0.52(2H, m), 0.60-0.70(2H, m), 0.70-0.85(4H, m), 1.91-2.00(1H, m), 2.50-2.70(1H, m), 6.67(1H, dd, J=5.6Hz, 2.8Hz), 7.11(1H, dd, J=8.4Hz, 2.8Hz), 7.17(1H, d, J=2.8Hz), 7.33(1H, d, J=2.8Hz), 7.61(1H, d, J=2.8Hz), 7.94(1H, s), 8.18(1H, d, J=5.6Hz), 8.20(1H, d, J=8.4Hz), 10.84(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
208-1
2-아미노-4-(4-아미노-3-
클로로페녹시
)피리딘
공지 화합물인 2-아미노-4-클로로피리딘 5.0 g, 4-아미노-3-클로로페놀 11 g, 수소화나트륨(오일중 60%) 3.1 g, 디메틸설폭시드 80 ml를 160℃에서 9.5시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 추출용액을 물로 5회 세척했다. 추출 용액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 선별하고, 초산에틸층을 합쳐 용매를 감압 증류 수거했다. 진한 자주색 고체 5.1 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.32(2H, s), 5.72(1H, s), 5.86(2H, bs), 6.07(1H, d, J=6.4Hz), 6.83(2H, s), 7.01(1H, s), 7.72(1H, d, J=6.4Hz).
실시예
209
N1 -[5- 브로모 -4-(4-{[( 시클로프로필아미노 )카르보닐]아미노}-3- 클로로페녹시)-2-피리딜]-1-시클로프로판카르복사미드
N1-[5-브로모-4-(4-아미노-3-클로로페녹시)-2-피리딜]-N1-시클로프로필카르보닐-1-시클로프로판카르복사미드 67 mg, 피리딘 52 mg, 디메틸포름아미드 5 ml를 0℃로 냉각하여 페닐클로로포르메이트 54 mg을 가했다. 40분후에 시클로프로판카르보닐클로라이드 80 mg을 가하여 60℃에서 20분동안 교반했다. 실온으로 되돌려 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하고 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(헥산:초산에틸=1:1)로 정제했다. 잔사에 메탄올을 가하여 목적물 11 mg을 백색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.40(2H, brs), 0.65(2H, m), 0.72(4H, brs), 1.90(1H, brs), 2.55(1H, brs), 7.11(1H, d, J=9.2Hz), 7.19(1H, s), 7.38(1H, s), 7.56(1H, s), 7.96(1H, s), 8.22(1H, d, J=9.2Hz), 8.42(1H, s), 10.94(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
209-1
2-아미노-3-
브로모
-4-(4-아미노-3-
클로로페녹시
)피리딘
2-아미노-4-(4-아미노-3-클로로페녹시)피리딘 1.0 g, N-브로모호박산이미드 0.78 g, 이소프로판올 10 ml를 환류하에 15분동안 교반했다. 실온으로 되돌려 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하고 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(헥산:초산에틸=2:1 이어서 1:1 이어서 초산에틸)로 정제했다. 목적물 400 mg을 갈색 유상물로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.39(2H, brs), 5.68(1H, s), 6.06(2H, brs), 6.85(1H, s), 6.86(1H, d, J=2.4Hz), 7.09(1H, d, J=2.4Hz), 7.90(1H, s).
제조예
209-2
N1 -[5- 브로모 -4-(4-아미노-3- 클로로페녹시 )-2- 피리딜 ]- N1 - 시클로프로필카르보닐-1-시클로프로판카르복사미드
2-아미노-3-브로모-4-(4-아미노-3-클로로페녹시)피리딘 400 mg, 트리에틸아민 0.53 ml, 테트라히드로푸란 5 ml의 용액중에 교반하에 실온에서 시클로프로판카르보닐클로라이드 260 mg을 가했다. 40분후에 실리카겔을 반응 용액에 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(헥산:초산에틸=2:1 이어서 1:1 이어서 초산에틸)로 정제했다. 목적물 67 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.66-1.00(8H, m), 1.85-1.96(2H, m), 5.45(2H, brs), 6.77(1H, s), 6.84(1H, d, J=8.8Hz), 6.92(1H, dd, J=8.8Hz, 2.8Hz), 7.17(1H, d, J=2.8Hz), 8.66(1H, s).
실시예
210
N1 -[4-(3,5- 디클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노} 페녹시 )-2-피리딜]-1-시클로프로판카르복사미드
N1-[4-(4-아미노-3,5-디클로로페녹시)-2-피리딜]-N1-시클로프로필카르보닐-1-시클로프로판카르복사미드 96 mg, 피리딘 0.076 ml, 디메틸포름아미드 5 ml의 용액 중에 실온하에서 페닐클로로포르메이트 110 mg을 가했다. 30분동안 교반한 후 시클로프로필아민 0.5 ml를 가하여 70℃에서 10분동안 가온했다. 실온으로 되돌려 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하고 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(초산에틸)로 정제했다. 잔사에 메탄올을 가하고 고체화시켜 목적물 4.8 mg을 담갈색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.42(2H, s), 0.57-0.66(2H, m), 0.70-0.83(4H, m), 1.92-2.01(1H, m), 2.43-2.53(1H, m), 6.62(1H, s), 6.71(1H, d, J=5.6Hz), 7.39(2H, s), 7.69(1H, s), 7.89(1H, s), 8.22(1H, d, J=5.6Hz), 10.89(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
210-1
2-아미노-4-(4-아미노-3,5-
디클로로페녹시
)피리딘
2-아미노-4-(4-아미노-3-클로로페녹시)피리딘 700 mg, N-클로로호박산이미드 0.44 g, 이소프로판올 10 ml를 80℃에서 1시간동안 교반했다. 실온으로 되돌려 물을 가하고 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(초산에틸)로 정제했다. 갈색 유상물 120 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.47(2H, brs), 5.73(1H, d, J=2.4Hz), 5.90(2H, brs), 6.09(1H, dd, J=5.6Hz, 2.4Hz), 7.13(2H, s), 7.75(1H, d, J=5.6Hz).
제조예
210-2
N1 -[4-(4-아미노-3,5- 디클로로페녹시 )-2- 피리딜 ]- N1 - 시클로프로필카르보닐 -1-시클로프로판카르복사미드
2-아미노-4-(4-아미노-3,5-디클로로페녹시)피리딘 120 mg, 트리에틸아민 0.19 ml, 테트라히드로푸란 5 ml의 용액 중에 실온 교반하에, 시클로프로판카르보닐클로라이드 93 mg을 가했다. 20분후, 실리카겔을 반응 용액에 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(초산에틸)로 정제했다. 갈색 유상물 120 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.82-0.98(8H, m), 1.86-1.96(2H, m), 5.55(2H, brs), 6.95(1H, dd, J=5.6Hz, 2.4Hz), 7.03(1H, d, J=2.4Hz), 7.24(2H, s), 8.38(1H, d, J=5.6Hz).
실시예
211
N1 - 시클로프로필 -5-({2-[디( 시클로프로필카르보닐 )아미노]-4- 피리딜 } 옥시 )-1H-1-인돌카르복사미드
N1-시클로프로필-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 100 mg, 트리에틸아민 49 mg을 용해시킨 테트라히드로푸란 용액에 0℃에서 시클로프로판카르보닐클로라이드 51 mg을 가했다. 20분동안 교반한 후, 반응 용액에 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(헥산:초산에틸=1:1이어서 초산에틸)를 행했다. 잔사에 물을 가해 목적물인 백색 고체 19 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.63(2H, m), 0.68-0.75(2H, m), 0.83-0.96(6H, m), 1.86-1.94(2H, m), 2.73-2.80(1H, m), 6.66(1H, d, J=3.6Hz), 6.91(1H, d, J=5.6Hz), 6.98(1H, d, J=2.4Hz), 7.08(1H, dd, J=9.2Hz, 2.4Hz), 7.41(1H, d, J=2.4Hz), 7.87(1H, d, J=3.6Hz), 8.26-8.32(2H, m), 8.38(1H, d, J=5.6Hz).
중간체는 다음과 같은 식으로 얻었다.
제조예
211-1
5-[(2-아미노-4-
피리딜
)
옥시
]-1H-인돌
2-아미노-4-클로로피리딘 2.0 g, 5-히드록시인돌 4.1 g, 수소화나트륨(오일중 60%) 1.25 g, 디메틸설폭시드 20 ml를 160℃에서 9.5시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 실리카겔 크로마토그래피(헥산:초산에틸=1:1 이어서 초산에틸)로 정제했다. 용매를 감압 증류 수거하고 잔사에 소량의 초산에틸을 가하여 고체를 여과 수취했다. 담갈색 고체 490 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.72(1H, d, J=2.0Hz), 5.78(2H, brs), 6.10(1H, d, J=5.6Hz), 6.41(1H, d, J=2.0Hz), 6.82(1H, d, J=8.4Hz), 7.25(1H, s), 7.36-7.7.44(2H, m), 7.73(1H, d, J=5.6Hz), 11.15(1H, s).
제조예
211-2
N1
-
시클로프로필
-5-[(2-아미노-4-
피리딜
)
옥시
]-1H-1-
인돌카르복사미드
5-[(2-아미노-4-피리딜)옥시]-1H-인돌 150 mg을 용해시킨 디메틸포름아미드용액에 실온에서 수소화나트륨(오일중 60%) 28 mg을 가하여 5분동안 교반한 후, 0℃로 냉각하여 페닐 N-시클로프로필카르바메이트 124 mg을 가하여 30분동안 교반했다. 물을 가하여 초산에틸로 추출하고, 유기층을 물로 3회, 염화암모늄수로 1회 세척한 후, 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 크로마토그래피(헥산:초산에틸=1:1 이어서 초산에틸)로 정제했다. 2.4 g의 무색 분말을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.64(2H, m), 0.68-0.76(2H, m), 2.72-2.79(1H, m), 5.74(1H, d, J=2.4Hz), 5.83(2H, brs), 6.12(1H, dd, J=5.6Hz, 2.4Hz), 6.64(1H, d, J=3.6Hz), 7.01(1H, dd, J=9.2Hz, 2.4Hz), 7.32(1H, d, J=2.4Hz), 7.75(1H, d, J=5.6Hz), 7.84(1H, d, J=3.6Hz), 8.24(1H, s), 8.25(1H, d, J=9.2Hz).
실시예
212
N1 - 시클로프로필 -5-({2-[( 시클로프로필카르보닐 )아미노]-4- 피리딜 } 옥시 )-1H-1-인돌카르복사미드
N1-시클로프로필-5-({2-[디(시클로프로필카르보닐)아미노]-4-피리딜}옥시)-1H-1-인돌카르복사미드 190 mg, 염화암모늄 660 mg, 디메틸포름아미드 5 ml, 물 5 ml, 에탄올 5 ml를 100℃에서 1시간동안 교반했다. 물과 초산에틸을 가하여 추출하고, 물로 6회 세척했다. 황산마그네슘으로 건조하고, 건조제를 여과 제거한 후 용매를 감압 증류 수거했다. 잔사에 초산에틸을 가하고 고체화시켜 여과 수취했다. 백색 분말 66 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.64(2H, m), 0.66-0.78(6H, m), 1.88-1.98(1H, m), 2.72-2.80(1H, m), 6.63-6.69(2H, m), 7.04(1H, d, J=8.8Hz), 7.36(1H, s), 7.56(1H, s), 7.87(1H, d, J=3.6Hz), 8.14(1H, d, J=5.6Hz), 8.26(1H, d, J=8.8Hz), 8.28(1H, s), 10.55(1H, s).
실시예
213
N1 - 시클로프로필 -5-{[2-(2,5- 디옥소테트라히드로 -1H-1- 피롤릴 )-4- 피리딜 ] 옥시}-1H-1-인돌카르복사미드(실시예 213-A)
N1 - 시클로프로필 -5-{[2-( 디아세틸아미노 )-4- 피리딜 ] 옥시 }-1H-1-인돌카르복사미드(실시예 213-B)
N1 - 시클로프로필 -5-{[2-( 아세틸아미노 )-4- 피리딜 ] 옥시 }-1H-1-인돌카르복사미드(실시예 213-C)
N1-시클로프로필-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 830 mg, 무수호박산 270 mg, 톨루엔 30 ml를 30분 환류시켰다. 이 반응 용액에 무수초산 50 ml, 초산나트륨 82 mg을 가하여 80℃에서 15분동안 교반했다. 용매를 감압 증류 수거하여 잔사를 실리카겔 크로마토그래피(초산에틸)로 정제했다. 2번째로 용출되어 나온 것은 N1-시클로프로필-5-{[2-(2,5-디옥소테트라히드로-1H-1-피롤릴)-4-피리딜]옥시}-1H-1-인돌카르복사미드였다. 무색 분말 440 mg을 얻었다.
(실시예 213-A)
*1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.63(2H, m), 0.70-0.75(2H, m), 2.70-2.80(1H, m), 2.71(4H, s), 6.66(1H, d, J=3.6Hz), 6.76(1H, d, J=2.4Hz), 7.03(1H, dd, J=5.6Hz, 2.4Hz), 7.10(1H, dd, J=9.2Hz, 2.4Hz), 7.43(1H, d, J=2.4Hz), 7.87(1H, d, J=3.6Hz), 8.29(1H, s), 8.30(1H, d, J=9.2Hz), 8.42(1H, d, J=5.6Hz).
1번째로 용출되어 나온 것은 N1-시클로프로필-5-{[2-(디아세틸아미노)-4-피리딜]옥시}-1H-1-인돌카르복사미드와 N1-시클로프로필-5-{[2-(아세틸아미노)-4-피리딜]옥시}-1H-1-인돌카르복사미드의 혼합물이었다. 이 혼합물을, 실리카겔 크로마토그래피(클로로포름:메탄올=50:1)로 정제했다. 맨 처음에 용출되어 나온 것은 N1-시클로프로필-5-{[2-(디아세틸아미노)-4-피리딜]옥시}-1H-1-인돌카르복사미드였다. 백색 분말 45 mg을 얻었다.
(실시예 213-B)
1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.63(2H, m), 0.70-0.75(2H, m), 2.13(6H, s), 2.74-2.80(1H, m), 6.66(1H, d, J=3.6Hz), 6.96(1H, dd, J=5.6Hz, 2.4Hz), 6.99(1H, d, J=2.4Hz), 7.09(1H, dd, J=9.2Hz, 2.4Hz), 7.43(1H, d, J=2.4Hz), 7.87(1H, d, J=3.6Hz), 8.28(1H, s), 8.30(1H, d, J=9.2Hz), 8.38(1H, d, J=5.6Hz).
2번째로 용출된 것이 N1-시클로프로필-5-{[2-(아세틸아미노)-4-피리딜]옥시}-1H-1-인돌카르복사미드였다. 초산에틸, 헥산으로부터 고체화하여, 28 mg을 얻었다.
(실시예 213-C)
1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.63(2H, m), 0.70-0.75(2H, m), 2.00(3H, s), 2.72-2.80(1H, m), 6.62(1H, d, J=5.6Hz, 2.4Hz), 6.65(1H, d, J=3.6Hz), 7.04(1H, dd, J=9.2Hz, 2.4Hz), 7.36(1H, d, J=2.4Hz), 7.60(1H, s), 7.87(1H, d, J=3.6Hz), 8.13(1H, d, J=9.2 H), 8.25-8.30(2H, m), 10.47(1H, s).
실시예
214
N1 - 시클로프로필 -5-{[2-({[2- 클로로에틸아미노 ]카르보닐}아미노)-4- 피리딜 ]옥시}-1H-1-인돌카르복사미드
N1-시클로프로필-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 400 mg, 2-클로로에틸이소시아네이트 150 mg, 테트라히드로푸란 5 ml를 80℃에서 1.5시간동안 교반했다. 실온으로 되돌려 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 크로마토그래피(헥산:초산에틸=1:1 이어서 초산에틸)로 정제했다. 280 mg의 무색 분말을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.57-0.63(2H, m), 0.70-0.75(2H, m), 2.73-2.80(1H, m), 3.42(2H, q, J=6.0Hz), 3.61(2H, t, J=6.0Hz), 6.52(1H, dd, J=5.6Hz, 2.4Hz), 6.65(1H, d, J=3.6Hz), 6.85(1H, d, J=2.4Hz), 7.04(1H, dd, J=8.8Hz, 2.4Hz), 7.35(1H, d, J=2.4Hz), 7.86(1H, d, J=3.6Hz), 8.04(1H, d, J=5.6Hz), 8.27(1H, s), 8.28(1H, d, J=8.8Hz), 8.34(1H, brs), 9.19(1H, s).
실시예
215
N1 -(2- 플루오로에틸 )-5-({2-[( 시클로프로필카르보닐 )아미노]-4- 피리딜 } 옥시 )-1H-1-인돌카르복시아미드
N1-(2-플루오로에틸)-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 400 mg, 트리에틸아민 0.53 ml를 용해시킨 테트라히드로푸란 용액에 실온에서 시클로프로판카르보닐클로라이드 330 mg을 가했다. 15분동안 교반한 후, 물과 초산에틸을 가하여 추출했다. 추출액을 황산마그네슘으로 건조하고, 이어서 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 용매를 감압 증류 수거하여 490 mg의 유상물을 얻었다. 이 잔사에 염화암모늄 1.5 g, 디메틸포름아미드 10 mml, 물 10 ml, 에탄올 10 ml를 가하여, 110℃에서 1.5시간동안 교반했다. 실온으로 되돌려, 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(초산에틸)를 행했다. 잔사에 초산에틸과 헥산을 가하여 고체화시켜 목적물인 백색 고체180 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.64-0.80(4H, m), 1.88-1.97(1H, m), 3.50-3.65(2H, m), 4.52(1H, t, J=4.8Hz), 4.64(1H, t, J=4.8Hz), 6.65(1H, dd, J=5.6Hz, 2.4Hz), 6.69(1H, d, J=3.6Hz), 7.05(1H, dd, J=8.8Hz, 2.4Hz), 7.38(1H, d, J=2.4Hz), 7.57(1H, d, J=2.4Hz), 7.95(1H, d, J=3.6Hz), 8.14(1H, d, J=5.6Hz), 8.27(1H, d, J=8.8Hz), 8.47(1H, t, J=5.6Hz), 10.77(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
215-1
N1
-(2-
플루오로에틸
)-5-[(2-아미노-4-
피리딜
)
옥시
]-1H-1-
인돌카르복사미드
5-[(2-아미노-4-피리딜)옥시]-1H-인돌 2.0 g, 디메틸포름아미드 30 ml의 용액에 실온에서, 수소화나트륨(오일중 60%) 360 mg을 가했다. 5분동안 교반한 후 빙수욕에 가하여 냉각하에서 페닐 N-(2-플루오로에틸)카르바메이트 1.8 g을 가했다. 실온으로 되돌려 30분동안 교반한 후, 물을 가하여 초산에틸로 추출했다. 이 추출액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 이렇게 해서 얻어진 초산에틸층을 중조수로 1회 세척하여, 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하여 미갈색 분말 1.93 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.52-3.64(2H, m), 4.52(1H, t, J=4.8Hz), 4.64(1H, t, J=4.8Hz), 5.75(1H, d, J=2.4Hz), 5.82(2H, brs), 6.12(1H, dd, J=5.6Hz, 2.4Hz), 6.68(1H, d, J=3.6Hz), 7.02(1H, dd, J=8.8Hz, 2.4Hz), 7.33(1H, d, J=2.4Hz), 7.76(1H, d, J=5.6Hz), 7.92(1H, d, J=3.6Hz), 8.26(1H, d, J=8.8Hz), 8.44(1H, t, J=5.2Hz).
실시예
216
N1 - 시클로프로필 -5-(4-{[2-(2- 옥소테트라히드로 -1H-1- 피롤릴 )-4- 피리딜 ] 옥시}-1H-1-인돌카르복사미드
5-(4-{[2-(2-옥소테트라히드로-1H-1-피롤릴)-4-피리딜]옥시}-1H-1-인돌 130 mg을 용해시킨 디메틸포름아미드 용액에 실온에서 수소화나트륨(오일중 60%) 19 mg을 가하고, 이어서 페닐 N-시클로프로필카르바메이트 82 mg을 가했다. 10분동안 교반한 후 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(헥산:초산에틸=1:1 이어서 초산에틸)를 행했다. 잔사에 초산에틸과 헥산을 가하여 고체화시켜 목적물인 백색 고체 25 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.58-0.63(2H, m), 0.68-0.75(2H, m), 1.97(2H, tt, J=6.4Hz, 6.4Hz), 2.47(2H, t, J=6.4Hz), 2.73-2.80(1H, m), 3.94(2H, t, J=6.4Hz), 6.65(1H, d, J=3.6Hz), 6.71(1H, dd, J=5.6Hz, 2.4Hz), 7.04(1H, dd, J=8.8Hz, 2.4Hz), 7.36(1H, d, J=2.4Hz), 7.81(1H, d, J=2.4Hz), 7.86(1H, d, J=3.6Hz), 8.22(1H, d, J=5.6Hz), 8.27(1H, brs), 8.28(1H, d, J=8.8Hz).
중간체는 다음과 같은 식으로 얻었다.
제조예
216-1
5-(4-{[2-(2-
옥소테트라히드로
-1H-1-
피롤릴
)-4-
피리딜
]
옥시
}-1H-1-인돌
N1-시클로프로필-5-[(2-아미노-4-피리딜)옥시]-1H-1-인돌카르복사미드 1.0 g, 트리에틸아민 1.1 ml, 테트라히드로푸란 20 ml의 용액에 실온에서 4-브로모부티릴 클로리디오 0.8 ml를 가했다. 20분동안 교반한 후 물을 가하여 초산에틸로 추출했다. 이 추출액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 이렇게 해서 얻어진 유상물에 4-히드록시피페리딘 950 mg, 탄산칼륨 1.7 g, 디메틸포름아미드 10 ml를 가하여 70℃에서 20분동안 교반했다. 물을 가하여 초산에틸로 추출하고, 추출 용액에 실리카겔을 가하여 용매를 감압 증류 수거하여 실리카겔에 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피 정제(헥산:초산에틸=1:1 이어서 초산에틸)를 행했다. 맨 처음에 용출되는 것이 목적물이었다. 백색 고체 130 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.97(2H, tt, J=6.4Hz, 6.4Hz), 2.46(2H, t, J=6.4Hz), 3.93(2H, t, J=6.4Hz), 6.42(1H, s), 6.66(1H, d, J=5.6Hz), 6.85(1H, d, J=8.8Hz), 7.29(1H, s), 7.42(1H, s), 7.44(1H, d, J=8.8Hz), 7.80(1H, s), 8.18(1H, d, J=5.6Hz), 11.05(1H, s).
2번째로 용출되어 나온 것이 5-[(2-{[4-(4-히드록시피페리디노)부타노일]아미노}-4-피리딜)옥시]인돌이었다. 담갈색 유상물로서 520 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.25-1.35(2H, m), 1.55-1.67(4H, m), 1.85-1.95(2H, m), 2.17(2H, t, J=6.8Hz), 2.28(2H, t, J=6.8Hz), 2.57-2.67(2H, m), 3.15(1, d, J=3.6Hz), 3.30-3.42(1H, m), 4.48(1H, d, J=3.6Hz), 6.42(1H, s), 6.57(1H, dd, J=5.6Hz, 2.4Hz), 6.85(1H, dd, J=8.8Hz, 2.4Hz), 7.29(1H, d, J=2.4Hz), 7.40-7.43(2H, m), 7.60(1H, d, J=2.4Hz), 8.09(1H, d, J=5.6Hz), 10.37(1H, s), 11.23(1H, s).
실시예
217
1-(4-[6- 시아노 -7-(3- 디에틸아미노프로폭시 )-4- 퀴놀리일옥시 ]2- 플루오로페닐)-3-(4-플루오로페닐)우레아
6-시아노-4-{4-[4-플루오로아닐리노카르보닐]아미노-3-플루오로페녹시}퀴놀린-7-올나트륨염 480 mg을 디메틸포름아미드 5 ml에 용해하고, 탄산칼륨 350 mg, 3-클로로프로필디에틸아민 204 mg을 가하여, 65℃에서 7시간동안 가열 교반했다. 방냉후 물을 가한 후, 초산에틸, 테트라히드로푸란으로 추출하여, 용매를 감압 증류 수거하고, 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물 135 mg을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.96(6H, t, J=7.0Hz) 1.93(2H, quint, J=7.0Hz), 2.45-2.53(4H, m), 2.61(2H, t, J=7.0Hz), 4.32(2H, t, J=7.0Hz), 6.62(1H, d, J=5.3Hz), 7.10-7.19(3H, m), 7.41(1H, dd, J=12.3Hz, J'=2.8Hz), 7.46-7.52(2H, m), 7.60(1H, s), 8.25(1H, t, J=9.0Hz), 8.68(1H, d, J=2.0Hz), 8.76-8.78(2H, m),9.16(1H, s)
중간체는 다음과 같이 합성했다.
제조예
217-1
1-(4-[7- 벤질옥시 -6- 시아노 -4- 퀴놀리일옥시 ]-2- 플루오로페닐 )-3-(4- 플루오로페닐)우레아
제조예 8에서 생성된 7-벤질옥시-6-시아노-4-(3-플루오로-4-아미노페녹시)퀴놀린 6.95 g에 톨루엔 210 ml과 아세토니트릴 20 ml를 가하여, 가열 환류했다. 여기에 44-플루오로페닐이소시아네이트 2.67 ml를 가하여, 1시간동안 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 감압 건조시켜 표제 화합물 7.45 g을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.49(2H, s), 6.61(1H, d, J=5.4Hz), 7.05-7.57(11H, m), 7.54(1H, s), 8.24(1H, t, 9.5Hz), 8.63(1H, s), 8.72(1H, d, J=5.4Hz), 8.77(1H, s), 9.10(1H, s)
제조예
217-2
6- 시아노 -4-(4-[4- 플루오로아닐리노카르보닐 ]아미노-3- 플루오로페녹시 )퀴놀린-7-올나트륨염
1-(4-[7-벤질옥시-6-시아노퀴놀린-4-일옥시]-2-플루오로페닐)-3-(4-플루오로페닐)우레아 1.7 g과 트리플루오로초산 17 ml, 티오아니솔 1.7 ml의 혼합물을 오일배스를 이용하여, 20시간동안 70℃에서 가열 교반했다. 반응 종료후, 반응액을 농축하고 포화탄산수소나트륨 수용액, 메탄올을 가하고, 30분간 교반하여, 석출한 고체를 여과 수취했다. 생성된 고체를 감압 건조하여 표제 화합물 1.15 g 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.62(1H, d, J=5.3Hz), 7.18-7.68(7H, m), 8.24(1H, t, J=8.5Hz), 8.70-8.86(3H, m), 9.20(1H, s)
실시예
218
1-(4-[6- 시아노 -7-(3-모르폴린-4- 프로폭실 )-4- 퀴놀릴옥시 ]2- 플루오로페닐 )-3-(4-플루오로페닐)우레아
6-시아노-4-(4-[4-플루오로아닐리노카르보닐]아미노-3-플루오로페녹시)퀴놀린-7-올나트륨염 450 mg을 디메틸포름아미드 5 ml ,탄산칼륨 328 mg, 4-(3-클로로프로필)모르폴린 194 mg을 이용하여 실시예 217과 같은 식의 방법으로 표제 화합물 205 mg을 얻었다.
*1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.01(2H, quint, J=6.9Hz), 2.36-2.44(4H, m), 2.48-2.54(2H, DMSO 피크에 의해 커버됨), 3.58(4H, t, J=4.0Hz), 4.35(2H, t, J=6.9Hz), 6.64(1H, d, J=5.3Hz), 7.10-7.19(3H, m), 7.41(1H, dd, J=2.9, 12.3Hz), 7.44-7.52(2H, m), 7.63(1H, s), 8.25(1H, t, J=8.9Hz), 8.64(1H, d, J=2.0Hz), 8.74-8.78(2H, m), 9.20(1H, s)
실시예
219
1-(4-[6- 시아노 -7-(3- 디에틸아미노프로폭시 )-4- 퀴놀릴옥시 ]2- 플루오로페닐 )-3-페닐우레아
6-시아노-4-(4-[4-아닐리노카르보닐아미노]-3-페녹시)퀴놀린-7-올나트륨염 179 mg을 디메틸포름아미드 2 ml에 용해하고, 탄산칼륨 135 mg, 3-클로로필디에틸아민 79 mg을 가하여, 65-75℃에서 밤새 가열 교반했다. 방냉후 물을 가하고 초산에틸, 테트라히드로푸란으로 추출하고, 황산나트륨으로 건조하여, 용매를 감압 증류 수거하고, 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물 60 mg을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.94(6H, t, J=7.2Hz) 1.92(2H, quint, J=7.2Hz), 2.43-2.55(4H, DMSO 피크에 의해 커버됨), 2.60(2H, t, J=7.2Hz), 4.42(2H, t, J=7.2Hz), 6.62(1H, d, J=5.0Hz), 6.98(1H, t, J=7.2Hz), 7.12-7.18(1H, m), 7.29(2H, t, J=7.2Hz), 7.40(1H, dd, J=11.9Hz, J'=2.8Hz), 7.46(2H, d, J=7.2Hz), 7.59(1H, s), 8.26(1H, t, J=9.0Hz), 8.67(1H, s), 8.72-8.78(2H, m), 9.16(1H, s)
중간체는 다음과 같이 합성했다.
제조예
219-1
1-(4-[7-
벤질옥시
-6-
시아노
-4-
퀴놀릴옥시
]-2-
플루오로페닐
)-3-
페닐우레아
제조예 8에서 생성된 7-벤질옥시-6-시아노-4-(3-플루오로-4-아미노페녹시)퀴놀린 1.90 g을 톨루엔 60 ml와 아세토니트릴 30 ml에 가하여 가열 환류했다. 여기에 페닐이소시아네이트 0.76 ml를 가하여, 1시간동안 가열 환류했다. 방냉후, 석출된 고체를 여과 수취하고, 감압 건조하여 표제 화합물 1.65 g을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.45(2H, s), 6.62(1H, d, J=5.4Hz), 6.95-7.57(12 H, m), 7.71(1H, s), 8.27(1H, t, 9.2Hz), 8.66(1H, s), 8.74(1H, d, J=5.4Hz), 8.78(1H, s), 9.09(1H, s)
제조예
219-2
6- 시아노 -4-(4-[4- 아닐리노카르보닐아미노 ]-3- 플루오로페녹시 )퀴놀린-7- 올나트륨염
1-(4-[7-벤질옥시-6-시아노-4-퀴놀릴옥시]-2-플루오로페닐)-3-페닐우레아 1.64 g과 트리플루오로초산 16 ml, 티오아니솔 1.6 ml의 혼합물을 오일배스를 이용하여 14시간, 65-72℃에서 가열 교반했다. 반응 종료후, 반응액을 농축하고 포화탄산수소나트륨 수용액, 메탄올을 가하여, 30분간 교반하고, 석출된 고체를 여과 수취했다. 생성된 고체를 감압 건조하여 표제 화합물 1.35 g 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.41(1H, d, J=5.1Hz), 6.98(1H, t, J=7.1Hz), 7.11(1H, d, J=7.1Hz), 7.20-7.40(4H, m), 7.45(2H, d, J=7.1Hz), 8.24(1H, t, J=8.0Hz), 8.55(1H, s), 8.57(1H, d, J=5.1Hz), 8.66(1H, s), 9.10(1H, s),
실시예
220
1-{4-[6- 시아노 -7-(3- 모르폴리노 -4- 프로폭실 )-4- 퀴놀릴옥시 ]-2- 플루오로페닐}-3-페닐우레아
6-시아노-4-(4-[4-아닐리노카르보닐아미노]-3-페녹시)-퀴놀린-7-올나트륨염 505 mg을 디메틸포름아미드 5 ml, 탄산칼륨 380 mg, 4-(3-클로로프로필)모르폴린 195 mg을 이용하여 실시예 217과 같은 식의 방법으로 표제 화합물 301 mg을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.99(2H, quint, J=6.8Hz), 2.33-2.52(4H, m), 2.48-2.54(2H, covered by DMSO peak), 3.58(4H, t, J=4.2Hz), 4.32(2H, t, J=6.8Hz), 6.62(1H, d, J=5.3Hz), 6.98(1H, t, J=7.2Hz), 7.12-7.48(6H, m), 7.60(1H, s), 8.26(1H, t, J=8.5Hz), 8.64(1H, d, J=1.5Hz), 8.72-8.78(2H, m),9.06(1H, s)
실시예
221
N-[4-(6- 시아노 -7-[3-(디메틸아미노) 프로폭시 ]-4- 퀴놀릴옥시 ) 페닐 ]- N' -(4- 플루오로페닐)우레아
6-시아노-4-(4-[(4-플루오로아닐리노)카르보닐]아미노페녹시)퀴놀린-7-올나트륨염 100 mg으로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물 20 mg을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.97(2H, quint, J=7.1Hz) 2.18(6H, s,), 2.42(2H, t, J=7.1Hz), 4.32(2H, t, J=7.1Hz), 6.54(1H, d, J=5.6Hz), 7.05-7.65(9H, m), 8.63(1H, d, J=5.6Hz), 8.76(1H, s) 8.80(1H, s). 8.88(1H, s)
실시예
222
N-(5-(6,7-
디메톡시퀴놀린
-4-
일옥시
)피리딘-2-일)-
N'
-
페닐우레아
5-(6,7-디메톡시퀴놀린-4-일옥시)피리딘-2-일아민(29.7 mg, 0.100 mmol) 및 페닐이소시아네이트(13.1 mg, 0.110 mmol)를 디메틸포름아미드(1 ml) 중, 실온에서 18시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하여, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻은 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=20:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(30.4 mg, 0.073 mmol, 73%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6)δ(ppm) : 3.95(3H, s), 3.96(3H, s), 6.53(1H, d, J=5.4Hz), 7.00-7.06(1H, m), 7.28-7.35(2H, m), 7.41(1H, s), 7.50-7.56(3H, m), 7.76-7.82(2H, m), 8.30-8.33(1H, m), 8.49(1H, d, J=5.4Hz), 9.56(1H, s), 10.04(1H, s).
중간체는 다음과 같이 합성했다.
제조예
222-1
2-
클로로
-6-
요오드피리딘
-3-올
2-클로로-3-히드록시피리딘(5.00 g, 38.6 mmol) 및 요드화나트륨(5.79 g, 38.6 mmol)을 디메틸포름아미드(70 ml) 중에 용해시키고, 빙냉하에 클로라민T(10.9 g, 38.6 mmol)를 가한 후, 실온에서 1시간동안 교반했다. 반응후 2N-염산 수용액(19.3 ml, 38.6 mmol)을 가한 후, 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하여, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=1:2)에 가하여, 목적물을 포함하는 분획을 농축하고, 표제 화합물(9.00 g, 35.2 mmol, 91%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.61(1H, brs), 7.02(1H, d, J=8.2Hz), 7.56(1H, d, J=8.2Hz).
제조예
222-2
4-(2-
클로로
-6-
요오드피리딘
-3-
일옥시
)-6,7-
디메톡시퀴놀린
4-클로로-6,7-디메톡시퀴놀린(2.23 g, 10.0 mmol), 2-클로로-6-요오드피리딘-3-올(2.55 g, 22.0 mmol) 및 디이소프로필에틸아민(1.29 g, 10.0 mmol)을 디메틸포름아미드(5 ml) 중, 130℃에서 3시간동안 가열 교반했다. 반응액을 초산에틸-테트라히드로푸란 혼합 용매와 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(2.16 g, 4.88 mmol, 49%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.05(3H, s), 4.06(3H, s), 6.39(1H, d, J=5.2Hz), 7.20(1H, d, J=8.2Hz), 7.45(1H, s), 7.48(1H, s), 7.75(1H, d, J=8.2Hz), 8.55(1H, d, J=5.2Hz).
제조예
222-3
6-
클로로
-5-(6,7-
디메톡시퀴놀린
-4-
일옥시
)피리딘-2-
일아민
벤조페논이민(1.67 g, 9.21 mmol) 및 tert-부톡시나트륨(885 mg, 9.21 mmol)을 톨루엔(40 ml) 중, 질소 기류하에, 80℃에서 1시간동안 가열 교반한 후, 4-(2-클로로-6-요오드피리딘-3-일옥시)-6,7-디메톡시퀴놀린(3.72 g, 8.40 mmol), 트리스(디벤질리덴아세톤)디팔라듐(0)(86.9 mg, 0.084 mmol) 및 rac-2,2'-비스(디페닐포스피노)-1,1'-비나프틸(157 mg, 0.252 mmol)를 가하고, 또한 90℃에서 6시간동안 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하고, 여과액을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여 목적물을 포함하는 분획을 농축하고, 황색 유상물(1.98 g)을 얻었다. 생성된 황색 유상물(1.98 g)을 에탄올(20 ml)에 용해하여, 1N-염산 수용액(5 ml)을 가하고 실온에서 1시간동안 교반했다. 반응 종료후, 반응액을 5N-수산화나트륨 수용액(1 ml)으로 중화시킨 후, 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하여, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 표제 화합물(506 mg, 1.53 mmol, 18%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.06(3H, s), 4.07(3H, s), 4.71(2H, s), 6.34(1H, d, J=5.2Hz), 6.53(1H, d, J=8.8Hz), 7.37(1H, d, J=8.8Hz), 7.43(1H, s), 7.59(1H, s), 8.50(1H, d, J=5.2Hz).
제조예
222-4
5-(6,7-
디메톡시퀴놀린
-4-
일옥시
)피리딘-2-
일아민
6-클로로-5-(6,7-디메톡시퀴놀린-4-일옥시)피리딘-2-일아민(500 mg, 1.51 mmol)을 메탄올(20 ml), 테트라히드로푸란(10 ml) 및 트리에틸아민(3 ml)의 혼합 용매에 현탁하고, 팔라듐탄소(300 mg)를 가하여, 수소 분위기하 실온에서 15시간동안 교반했다. 세라이트 여과에 의해 촉매를 여과 제거하고, 에탄올로 세척한 후, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(138 mg, 0.465 mmol, 31%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.05(3H, s), 4.07(3H, s), 4.52(2H, s), 6.42(1H, d, J=5.2Hz), 6.61(1H, d, J=8.8Hz), 7.32(1H, dd, J=2.8, 8.8Hz), 7.42(1H, s), 7.57(1H, s), 8.04(1H, d, J=2.8Hz), 8.49(1H, d, J=5.2Hz).
실시예
223
N-(5-(6,7- 디메톡시퀴놀린 -4- 일옥시 )피리딘-2-일)- N' -(4- 플루오로페닐 ) 우레아
제조예 222-4에서 생성된 5-(6,7-디메톡시퀴놀린-4-일옥시)피리딘-2-일아민(44.5 mg, 0.150 mmol) 및 4-플루오로페닐이소시아네이트(22.6 mg, 0.165 mmol)로부터 실시예 222와 같은 식의 수법에 의해 표제 화합물(50.9 mg, 117 mmol, 78%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 6.53(1H, d, J=5.2Hz), 7.13-7.20(2H, m), 7.41(1H, s), 7.51-7.57(3H, m), 7.74-7.82(2H, m), 8.30-8.33(1H, m), 8.49(1H, d, J=5.2Hz), 9.55(1H, s), 10.09(1H, s).
실시예
224
N-(5-(6,7-
디메톡시퀴놀린
-4-
일옥시
)피리딘-2-일)-
N'
-(티아졸-2-일)
우레아
제조예 222-4에서 얻어진 5-(6,7-디메톡시퀴놀린-4-일옥시)피리딘-2-일아민(44.5 mg, 0.150 mmol) 및 티아졸-2-일카르바민산페닐에스테르(39.6 mg, 0.180 mmol)를 디메틸설폭시드(1 ml) 중, 85℃에서 2시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=30:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(46.7 mg, 0.110 mmol, 74%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.95(3H, s), 3.96(3H, s), 6.53(1H, d, J=5.2Hz), 7.20(1H, d, J=3.4Hz), 7.41(1H, s), 7.43(1H, d, J=3.4Hz), 7.54(1H, s), 7.80-7.86(2H, m), 8.36-8.39(1H, m), 8.49(1H, d, J=5.2Hz), 9.92(1H, br s), 11.55(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
224-1
티아졸-2-
일카르바민산페닐에스테르
2-아미노티아졸(5.01 g, 50.0 mmol) 및 피리딘(7.91 g, 100 mmol)을 디메틸포름아미드(50 ml) 중에 용해시키고, 빙냉하에 페닐클로로포르메이트(8.22 g, 52.5 mmol)를 가한 후, 실온에서 1시간동안 교반했다. 반응액을 초산에틸-테트라히드로푸란 혼합 용매와 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물에 초산에틸, 계속하여 헥산을 가하여 석출된 결정을 여과 수취하고, 통풍 건조시킴으로써 표제 화합물(10.6 g, 48.1 mmol, 96%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum(CDCl3) δ(ppm) : 6.97(1H, d, J=3.4Hz), 7.24-7.32(3H, m), 7.40-7.46(2H, m), 7.52(1H, d, J=3.4Hz), 13.19(1H, s).
실시예
225
N-(6-
클로로
-5-(6,7-
디메톡시퀴놀린
-4-
일옥시
)피리딘-2-일)-
N'
-
페닐우레아
제조예 222-3에서 생성된 6-클로로-5-(6,7-디메톡시퀴놀린-4-일옥시)피리딘-2-일아민(33.2 mg, 0.100 mmol) 및 페닐이소시아네이트(13.1 mg, 0.110 mmol)를 디메틸포름아미드(1 ml) 중에, 60℃에서 2시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(17.5 mg, 0.039 mmol, 39%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.96(6H, s), 6.50(1H, d, J=5.2Hz), 7.01-7.07(1H, m), 7.30-7.37(2H, m), 7.43(1H, s), 7.46-7.51(2H, m), 7.54(1H, s), 7.94-8.00(2H, m), 8.49(1H, d, J=5.2Hz), 9.29(1H, br s), 9.75(1H, br s).
실시예
226
N-(5-(6,7-
디메톡시퀴놀린
-4-
일설파닐
)티오펜-2-일)-
N'
-
페닐우레아
5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일아민(89.0 mg, 0.280 mmol) 및 페닐이소시아네이트(36.6 mg, 0.307 mmol)를 디메틸포름아미드(1 ml) 중에, 실온에서 1시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=50:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(60.0 mg, 0.137 mmol, 48%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.95(3H, s), 3.98(3H, s), 6.70(1H, d, J=3.6Hz), 6.74(1H, d, J=4.8Hz), 6.98-7.03(1H, m), 7.26-7.36(4H, m), 7.40(1H, s), 7.43-7.50(2H, m), 8.48(1H, d, J=4.8Hz), 9.02(1H, br s), 10.27(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
226-1
6,7-
디메톡시
-1H-퀴놀린-4-
티온
WO9717329에 기재한 6,7-디메톡시-1H-퀴놀린-4-온(10.3 g, 50.0 mmol), 오황화이인(26.7 g, 60.0 mmol) 및 탄산수소나트륨(26.7 g, 318 mmol)을 디글라임(디에틸렌글리콜디메틸에테르)(100 ml) 중에 현탁시켜, 80℃에서 2시간동안 가열 교반했다. 반응액을 실온으로 되돌린 후, 빙수(1000 ml)에 쏟아 넣어, 석출된 결정을 여과 수취하고, 물로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(8.19 g, 37.0 mmol, 74%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.87(3H, s), 3.91(3H, s), 7.07(1H, s), 7.19(1H, d, J=6.8Hz), 7.74(1H, d, J=6.8Hz), 8.11(1H, s), 12.76(1H, br s).
제조예
226-2
6,7-
디메톡시
-4-(5-
니트로티오펜
-2-
일설파닐
)퀴놀린
6,7-디메톡시-1H-퀴놀린-4-티온(2.21 g, 10.0 mmol), 2-브로모-5-니트로티오펜(2.29 g, 11.0 mmol) 및 탄산칼륨(2.07 g, 15.0 mmol)을 디메틸포름아미드(30 ml) 중에, 실온에서 1시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 표제 화합물(1.93 g, 5.54 mmol, 55%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.04(3H, s), 4.06(3H, s), 7.10(1H, d, J=4.8Hz), 7.22(1H, d, J=4.4Hz), 7.37(1H, s), 7.46(1H, s), 7.89(1H, d, J=4.4Hz), 8.60(1H, d, J=4.8Hz).
제조예
226-3
5-(6,7-
디메톡시퀴놀린
-4-
일설파닐
)티오펜-2-
일아민
6,7-디메톡시-4-(5-니트로티오펜-2-일설파닐)퀴놀린(1.39 g, 4.00 mmol), 철(1.12 g, 20.0 mmol) 및 염화암모늄(2.18 g, 40.0 mmol)을 에탄올(32 ml)-물(8 ml)의 혼합 용매에 현탁시켜 80℃에서 5분간 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸로 잘 세척하였다. 유기층을 물 및 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 표제 화합물(1.93 g, 5.54 mmol, 55%)을 황갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.04(3H, s), 4.06(3H, s), 4.15(2H, s), 6.21(1H, d, J=3.8Hz), 6.87(1H, d, J=5.0Hz), 7.04(1H, d, J=3.8Hz), 7.31(1H, s), 7.40(1H, s), 8.47(1H, d, J=5.0Hz).
실시예
227
N-(5-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티오펜-2-일)- N' -(4- 플루오로페닐 ) 우레아
5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일아민(31.8 mg, 0.100 mmol) 및 4-플루오로페닐이소시아네이트(15.1 mg, 0.110 mmol)로부터, 실시예 226과 같은 식의 수법에 의해, 표제 화합물(29.3 mg, 64.3 mmol, 64%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.97(3H, s), 6.70(1H, d, J=4.0Hz), 6.74(1H, d, J=5.2Hz), 7.10-7.18(2H, m), 7.31(1H, s), 7.33(1H, d, J=4.0Hz), 7.39(1H, s), 7.45-7.51(2H, m), 8.48(1H, d, J=5.2Hz), 9.05(1H, br s), 10.29(1H, br s).
실시예
228
N-(5-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티오펜-2-일)- N' -(3- 플루오로페닐 ) 우레아
5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일아민(64.0 mg, 0.200 mmol) 및 4-플루오로페닐이소시아네이트(15.1 mg, 0.110 mmol)로부터, 실시예 226과 같은 식의 수법에 의해, 표제 화합물(62.0 mg, 0.136 mmol, 68%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.95(3H, s), 3.97(3H, s), 6.72(1H, d, J=3.6Hz), 6.75(1H, d, J=4.6Hz), 6.80-6.85(1H, m), 7.17-7.21(1H, m), 7.29-7.36(3H, m), 7.40(1H, s), 7.42-7.48(1H, m), 8.48(1H, d, J=4.6Hz), 9.18(1H, br s), 10.27(1H, br s).
실시예
229
N-(3- 시아노페닐 )- N' -(5-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티오펜-2-일) 우레아
5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일아민(64 mg, 0.200 mmol) 및 3-시아노페닐이소시아네이트(31.7 mg, 0.220 mmol)로부터, 실시예 226과 같은 식의 수법에 의해, 표제 화합물(60.0 mg, 0.130 mmol, 65%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.95(3H, s), 3.97(3H, s), 6.73-6.77(2H, m), 7.31(1H, s), 7.34(1H, d, J=4.0Hz), 7.40(1H, s), 7.44-7.48(1H, m), 7.49-7.54(1H, m), 7.71-7.75(1H, m), 7.94-7.96(1H, m), 8.48(1H, d, J=4.8Hz), 9.30(1H, br s), 10.40(1H, br s).
실시예
230
N-(5-(6,7-
디메톡시퀴놀린
-4-
일설파닐
)티오펜-2-일)-
N'
-(티아졸-2-일)
우레아
5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일아민(31.8 mg, 0.100 mmol) 및 티아졸-2-일카르바민산페닐에스테르(33.0 mg, 0.150 mmol)를 디메틸설폭시드(1 ml) 중에, 85℃에서 2시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=20:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하여, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(25.6 mg, 0.058 mmol, 58%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.95(3H, s), 3.97(3H, s), 6.74(1H, d, J=5.0Hz), 6.75-6.80(1H, m), 7.04-7.10(1H, m), 7.32(1H, s), 7.34(1H, d, J=4.0Hz), 7.36-7.39(1H, m), 7.40(1H, s), 8.48(1H, d, J=5.0Hz).
실시예
231
N-(5-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티오펜-2-일)- N' -(3- 메탄설포닐페닐 )우레아
5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일아민(64.0 mg, 0.200 mmol) 및 (3-메탄설포닐페닐)카르바민산페닐에스테르(87.4 mg, 0.300 mmol)로부터, 실시예 230과 같은 식의 수법에 의해, 표제 화합물(61.0 mg, 0.118 mmol, 59%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.20(3H, s), 3.95(3H, s), 3.97(3H, s), 6.75(1H, d, J=4.8Hz), 6.76(1H, d, J=4.0Hz), 7.32(1H, s), 7.35(1H, d, J=4.0Hz), 7.40(1H, s), 7.53-7.60(2H, m), 7.70-7.74(1H, m), 8.13-8.16(1H, m), 8.48(1H, d, J=4.8Hz), 9.40(1H, br s), 10.35(1H, br s).
실시예
232
N-(5-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티오펜-2-일)- N' -(2- 히드록시메틸페닐)우레아
(5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일)카르바민산페닐에스테르(43.9 mg, 0.100 mmol) 및 2-아미노벤질알콜(24.6 mg, 0.200 mmol)로부터, 실시예 230과 같은 식의 수법에 의해, 표제 화합물(27.0 mg, 0.058 mmol, 58%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.96(3H, s), 4.54(2H, d, J=5.6Hz), 5.51(1H, t, J=5.6Hz), 6.65(1H, d, J=4.0Hz), 6.74(1H, d, J=4.8Hz), 7.02-7.07(1H, m), 7.22-7.27(1H, m), 7.28-7.34(3H, m), 7.39(1H, s), 7.80-7.84(1H, m), 8.46-8.50(2H, m), 10.89(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
232-1
(5-(6,7-
디메톡시퀴놀린
-4-
일설파닐
)티오펜-2-일)
카르바민산페닐에스테르
5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일아민(696 mg, 2.00 mmol) 및 피리딘(174 mg, 2.20 mmol)을 테트라히드로푸란(10 ml)-디메틸포름아미드(5 ml)의 혼합 용매 중에 용해시키고, 빙냉하에 페닐클로로포르메이트(329 mg, 2.10 mmol)를 가한 후, 실온에서 1시간동안 교반했다. 반응액을 초산에틸수에 분배하고, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물에 초산에틸, 계속하여 헥산을 가하여 석출된 결정을 여과 수취하여, 통풍 건조시킴으로써 표제 화합물(720 mg, 1.64 mmol, 82%)을 황갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.08(3H, s), 4.09(3H, s), 6.86-6.92(2H, m), 7.10-7.16(2H, m), 7.20-7.26(2H, m), 7.34(1H, s), 7.36-7.41(2H, m), 7.80-7.85(1H, m), 8.35(1H, d, J=5.6Hz), 8.75(1H, br s).
실시예
233
N-(5-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티오펜-2-일)- N' -(3- 히드록시메틸페닐)우레아
제조예 232-1에서 생성된 (5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일)카르바민산페닐에스테르(43.9 mg, 0.100 mmol) 및 3-아미노벤질알콜(24.6 mg, 0.200 mmol)로부터, 실시예 230과 같은 식의 수법에 의해, 표제 화합물(25.0 mg, 0.054 mmol, 54%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.95(3H, s), 3.97(3H, s), 4.46(2H, d, J=5.6Hz), 5.19(1H, t, J=5.6Hz), 6.70(1H, d, J=4.0Hz), 6.75(1H, d, J=4.8Hz), 6.93-6.97(1H, m), 7.21-7.26(1H, m), 7.30-7.34(3H, m), 7.40(1H, s), 7.43-7.46(1H, m), 8.48(1H, d, J=4.8Hz), 8.97(1H, s).
실시예
234
N-(5-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티오펜-2-일)- N' -(4- 히드록시메틸페닐)우레아
(5-(6,7-디메톡시퀴놀린-4-일설파닐)티오펜-2-일)카르바민산페닐에스테르(43.9 mg, 0.100 mmol) 및 4-아미노벤질알콜(224 mg, 1.82 mmol)로부터, 실시예 230과 같은 식의 수법에 의해, 표제 화합물(27.0 mg, 0.058 mmol, 58%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.97(3H, s), 4.42(2H, d, J=5.6Hz), 5.07(1H, t, J=5.6Hz), 6.69(1H, d, J=4.0Hz), 6.75(1H, d, J=5.0Hz), 7.21-7.26(2H, m), 7.30-7.34(2H, m), 7.38-7.43(3H, m), 8.47(1H, d, J=5.0Hz), 8.88(1H, s), 10.13(1H, s).
실시예
235
N-(2-(6,7-
디메톡시퀴놀린
-4-
일설파닐
)티아졸-5-일)-
N'
-
페닐우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(64.0 mg, 0.200 mmol) 및 페닐이소시아네이트(26.2 mg, 0.220 mmol)를 디메틸포름아미드(1 ml) 중에, 실온에서 15시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하여, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=30:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(53.2 mg, 0.121 mmol, 60%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 6.98-7.05(2H, m), 7.26-7.34(2H, m), 7.39(1H, s), 7.43-7.47(3H, m), 7.64(1H, s), 8.55(1H, d, J=4.8Hz), 9.10(1H, s), 10.29(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
235-1
6,7-
디메톡시
-4-(5-
니트로티아졸
-2-
일설파닐
)퀴놀린
6,7-디메톡시-1H-퀴놀린-4-티온(2.21 g, 10.0 mmol)을 디메틸포름아미드(30 ml)에 현탁하여, 0℃에서 2-브로모-5-니트로티아졸(2.30 g, 11.0 mmol)을 가한 후, 실온에서 1시간동안 교반했다. 반응액을 초산에틸과 1N-수산화나트륨 수용액에 분배하고, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(1.70 g, 4.87 mmol, 49%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.00(3H, s), 4.08(3H, s), 7.50(1H, s), 7.54(1H, s), 7.70(1H, d, J=4.8Hz), 8.37(1H, s), 8.83(1H, d, J=4.8Hz).
제조예
235-2
2-(6,7-
디메톡시퀴놀린
-4-
일설파닐
)티아졸-5-
일아민
6,7-디메톡시-4-(5-니트로티아졸-2-일설파닐)퀴놀린(699 mg, 2.00 mmol), 철(559 mg, 10.0 mmol) 및 염화암모늄(1.07 g, 20.0 mmol)을 에탄올(20 ml)-물(5 ml)의 혼합 용매에 현탁시켜 80℃에서 20분간 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸-테트라히드로푸란의 혼합 용매로 잘 세척하였다. 유기층을 물 및 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=30:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 표제 화합물(190 mg, 0.595 mmol, 30%)을 황갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.99(2H, br s), 4.04(3H, s), 4.05(3H, s), 7.10(1H, d, J=5.2Hz), 7.17(1H, s), 7.41(1H, s), 7.42(1H, s), 8.54(1H, d, J=5.2Hz).
실시예
236
N-(2-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티아졸-5-일)- N' -(4- 플루오로페닐 ) 우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(64.0 mg, 0.200 mmol) 및 4-플루오로페닐이소시아네이트(30.1 mg, 0.220 mmol)로부터, 실시예 235와 같은 식의 수법에 의해, 표제 화합물(62.3 mg, 0.136 mmol, 68%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 7.03(1H, d, J=4.8Hz), 7.10-7.18(2H, m), 7.39(1H, s), 7.42-7.48(3H, m), 7.64(1H, s), 8.55(1H, d, J=4.8Hz), 9.14(1H, s), 10.32(1H, br s).
실시예
237
N-(2-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티아졸-5-일)- N' -(3- 플루오로페닐 ) 우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(95.8 mg, 0.300 mmol) 및 3-플루오로페닐이소시아네이트(45.2 mg, 0.330 mmol)로부터, 실시예 235와 같은 식의 수법에 의해, 표제 화합물(70.0 mg, 0.153 mmol, 51%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 6.80-6.86(1H, m), 7.06(1H, d, J=4.8Hz), 7.16-7.20(1H, m), 7.28-7.35(1H, m), 7.38-7.45(3H, m), 7.66(1H, s), 8.55(1H, d, J=4.8Hz), 9.33(1H, s), 10.37(1H, br s).
실시예
238
N-(3- 시아노페닐 )- N' -(2-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티아졸-5-일) 우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(95.8 mg, 0.300 mmol) 및 3-시아노페닐이소시아네이트(47.6 mg, 0.330 mmol)로부터, 235와 같은 식의 수법에 의해, 표제 화합물(94.0 mg, 0.203 mmol, 68%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 7.07(1H, d, J=4.8Hz), 7.40(1H, s), 7.43(1H, s), 7.45-7.54(2H, m), 7.67(1H, s), 7.70-7.74(1H, m), 7.91-7.94(1H, m), 8.56(1H, d, J=4.8Hz), 9.44(1H, s), 10.49(1H, br s).
실시예
239
N-(2,4- 디플루오로페닐 )- N' -(2-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티아졸-5-일)우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(95.8 mg, 0.300 mmol) 및 2,4-디플루오로페닐이소시아네이트(51.2 mg, 0.330 mmol)로부터, 실시예 235와 같은 식의 수법에 의해, 표제 화합물(123 mg, 0.259 mmol, 86%)을 연한 오렌지색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 7.04(1H, d, J=4.8Hz), 7.05-7.09(1H, m), 7.30-7.37(1H, m), 7.39(1H, s), 7.43(1H, s), 7.65(1H, s), 7.84-7.91(1H, m), 8.54(1H, d, J=4.8Hz), 8.84(1H, s), 10.48(1H, br s).
실시예
240
N-(2- 클로로페닐 )- N' -(2-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티아졸-5-일) 우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(95.8 mg, 0.300 mmol) 및 2-클로로페닐이소시아네이트(50.6 mg, 0.330 mmol)로부터, 실시예 235와 같은 식의 수법에 의해, 표제 화합물(132 mg, 0.279 mmol, 93%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 7.05(1H, d, J=5.0Hz), 7.07-7.12(1H, m), 7.28-7.34(1H, m), 7.39(1H, s), 7.43(1H, s), 7.47-7.50(1H, m), 7.67(1H, s), 8.01-8.04(1H, m), 8.55(1H, d, J=5.0Hz), 8.62(1H, s), 10.85(1H, br s).
실시예
241
N-(3- 클로로페닐 )- N' -(2-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티아졸-5-일) 우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(95.8 mg, 0.300 mmol) 및 3-클로로페닐이소시아네이트(50.6 mg, 0.330 mmol)로부터, 실시예 235와 같은 식의 수법에 의해, 표제 화합물(124 mg, 0.262 mmol, 87%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 7.04-7.09(2H, m), 7.30-7.34(2H, m), 7.40(1H, s), 7.43(1H, s), 7.63-7.66(2H, m), 8.55(1H, d, J=4.8Hz), 9.30(1H, s), 10.40(1H, br s).
실시예
242
N-(4- 클로로페닐 )- N' -(2-(6,7- 디메톡시퀴놀린 -4- 일설파닐 )티아졸-5-일) 우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(95.8 mg, 0.300 mmol) 및 4-클로로페닐이소시아네이트(50.6 mg, 0.330 mmol)로부터, 실시예 235와 같은 식의 수법에 의해, 표제 화합물(120 mg, 0.253 mmol, 85%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 7.04(1H, d, J=4.8Hz), 7.31-7.36(2H, m), 7.39(1H, s), 7.43(1H, s), 7.45-7.50(2H, m), 7.65(1H, s), 8.55(1H, d, J=4.8Hz), 9.24(1H, s), 10.34(1H, br s).
실시예
243
N-(2-(6,7-
디메톡시퀴놀린
-4-
일설파닐
)티아졸-5-일)-
N'
-(티아졸-2-일)
우레아
2-(6,7-디메톡시퀴놀린-4-일설파닐)티아졸-5-일아민(216 mg, 0.676 mmol) 및 피리딘(58.8 mg, 0.743 mmol )을 테트라히드로푸란(3 ml) 중에 용해시켜, 빙냉하에 4-니트로페닐클로로포르메이트(150 mg, 0.743 mmol)를 가하여, 실온에서 30분간 교반한 후, 2-아미노티아졸(101 mg, 1.01 mmol) 및 트리에틸아민(1 ml)을 가한 후, 60℃에서 1시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=30:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(57 mg, 0.128 mmol, 19%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 3.95(3H, s), 7.03-7.09(2H, m), 7.34-7.38(1H, m), 7.40(1H, s), 7.43(1H, s), 7.66(1H, br s), 8.55(1H, d, J=4.8Hz).
실시예
244
7-
메톡시
-4-(5-(3-
페닐우레이도
)티오펜-2-
일설파닐
)퀴놀린-6-
카르복사미드
4-(5-아미노티오펜-2-일설파닐)-7-메톡시퀴놀린-6-카르복사미드(49.0 mg, 0.150 mmol) 및 페닐이소시아네이트(19.6 mg, 0.165 mmol)를 디메틸포름아미드(1 ml) 중에, 실온에서 2시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(25.0 mg, 0.056 mmol, 37%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.72(1H, d, J=3.4Hz), 6.77(1H, d, J=4.8Hz), 6.98-7.03(1H, m), 7.27-7.34(2H, m), 7.35(1H, d, J=3.4Hz), 7.43-7.49(2H, m), 7.53(1H, s), 7.80(1H, br s), 7.89(1H, br s), 8.52(1H, s), 8.65(1H, d, J=4.8Hz), 8.95(1H, br s), 10.21(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
244-1
7-
메톡시
-4-(5-
니트로티오펜
-2-
일설파닐
)퀴놀린-6-
카르복사미드
4-클로로-7-메톡시퀴놀린-6-카르복사미드(1.18 g, 5.00 mmol) 및 황화나트륨(1.20 g, 5.50 mmol)을 디메틸포름아미드(10 ml) 중, 60℃에서 3시간동안 가열 교반했다. 반응액을 실온까지 냉각한 후, 2-브로모-5-니트로티오펜(1.25 g, 6.00 mmol)을 가하고, 60℃에서 1시간동안 더 가열 교반했다. 반응액을 실온으로 되돌린 후, 빙수(50 ml)에 쏟아 넣어, 석출된 결정을 여과 수취하고, 물 및 메탄올로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(700 mg, 1.94 mmol, 39%)을 황갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.04(3H, s), 7.17(1H, d, J=4.6Hz), 7.59(1H, s), 7.66(1H, d, J=4.0Hz), 7.82(1H, br s), 7.90(1H, br s), 8.23(1H, d, J=4.0Hz), 8.53(1H, s), 8.76(1H, d, J=4.6Hz).
제조예
244-2
(4-(5-
아미노티오펜
-2-
일설파닐
)-7-
메톡시퀴놀린
-6-
카르복사미드
)
7-메톡시-4-(5-니트로티오펜-2-일설파닐)퀴놀린-6-카르복사미드(320 mg, 0.885 mmol), 철(247 mg, 4.43 mmol) 및 염화암모늄(481 mg, 8.85 mmol)을 에탄올(8 ml)-물(2 ml)-디메틸포름아미드(1 ml)의 혼합 용매에 현탁시켜 80℃에서 15분간 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 테트라히드로푸란-메탄올의 혼합 용매로 잘 세척하였다. 유기층에 초산에틸을 가하고 물 및 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=20:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 표제 화합물(164 mg, 0.495 mmol, 56%)을 황갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.00(1H, d, J=4.0Hz), 6.34(2H, s), 6.83(1H, d, J=4.8Hz), 7.08(1H, d, J=4.0Hz), 7.51(1H, s), 7.77(1H, br s), 7.86(1H, br s), 8.47(1H, s), 8.66(1H, d, J=4.8Hz).
실시예
245
4-(5-(3-(4- 플루오로페닐 ) 우레이도 )티오펜-2- 일설파닐 )-7- 메톡시퀴놀린 -6- 카르복사미드
4-(5-아미노티오펜-2-일설파닐)-7-메톡시퀴놀린-6-카르복사미드(49.0 mg, 0.150 mmol) 및 4-플루오로페닐이소시아네이트(22.6 mg, 0.165 mmol)로부터, 실시예 244와 같은 식의 수법에 의해, 표제 화합물(50.0 mg, 0.107 mmol, 71%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 6.72(1H, d, J=4.0Hz), 6.76(1H, d, J=4.8Hz), 7.10-7.18(2H, m), 7.35(1H, d, J=4.0Hz), 7.45-7.51(2H, m), 7.53(1H, s), 7.80(1H, br s), 7.89(1H, br s), 8.52(1H, s), 8.65(1H, d, J=4.8Hz), 8.99(1H, br s), 10.24(1H, br s).
실시예
246
7- 메톡시 -4-(5-(3-티아졸-2- 일우레이도 )티오펜-2- 일설파닐 )퀴놀린-6- 카르복사미드
4-(5-아미노티오펜-2-일설파닐)-7-메톡시퀴놀린-6-카르복사미드(66.0 mg, 0.200 mmol) 및 티아졸-2-일카르바민산페닐에스테르(66.0 mg, 0.300 mmol)를 디메틸설폭시드(1 ml) 중에, 85℃에서 2시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=15:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(35.0 mg, 0.077 mmol, 38%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 6.77(1H, d, J=4.8Hz), 6.77-6.83(1H, m), 7.01-7.12(1H, m), 7.34-7.39(2H, m), 7.51(1H, s), 7.80(1H, br s), 7.89(1H, br s), 8.52(1H, s), 8.65(1H, d, J=4.8Hz).
실시예
247
N1 -[5-({7-[3-(디메틸아미노) 프로폭시 ]-6- 메톡시 -4- 퀴놀릴 } 설파닐 )-2- 티에닐]-N'-(4-플루오로페닐)우레아
5-({7-[3-(디에틸아미노)프로폭시]-6-메톡시-4-퀴놀릴}설파닐)-2-티오페닐아민 190 mg, 파라-플루오로페닐이소시아네이트 69 mg, 테트라히드로푸란 30 ml를 실온에서 30분동안 교반했다. 유기 용매를 감압 증류 수거하고 잔사를 NH 타입 실리카겔을 이용하여 컬럼 크로마토그래피로 정제(초산에틸 이어서 초산에틸:메탄올=10:1)를 행했다. 용매를 감압 증류 수거하여 잔사에 초산에틸을 가해 고체화시켰다. 황갈색 고체 16 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.93(6H, t, J=7.2Hz), 1.87(2H, tt, J=7.2Hz, 7.2Hz), 2.40-2.57(6H, m), 3.94(3H, s), 4.15(2H, t, J=7.2Hz), 6.68(1H, d, J=4.0Hz), 6.71(1H, d, J=4.8Hz), 7.11(2H, dd, J=8.8Hz, 8.8Hz), 7.28(1H, s), 7.30(1H, d, J=4.0Hz), 7.34(1H, s), 7.45(2H, dd, J=8.8Hz, 4.8Hz), 8.44(1H, d, J=4.8Hz), 8.94(1H, bs), 10.15(1H, bs).
중간체는 다음과 같은 식으로 얻었다.
제조예
247-1
7-(
벤질옥시
)-6-
메톡시
-1,4-
디히드로
-4-
퀴놀린티온
7-(벤질옥시)-6-메톡시-1,4-디히드로-4-퀴놀린 28.1 g, 오황화이인 53.4 g, 탄산수소나트륨 53.7 g, 디에틸렌글리콜 디메틸에테르 200 ml를, 80℃에서 2시간동안 교반했다. 실온으로 되돌려 빙수중에 전개하고 40분동안 교반한 후 고체를 여과 수취하여, 60℃에서 풍건하였다. 황색 분말 29.1 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.85(3H, s), 5.22(2H, s), 7.15(1H, s), 7.17(1H, d, J=6.4Hz), 7.33-7.50(5H, m), 7.71(1H, d, J=6.4Hz), 8.11(1H, s).
제조예
247-2
2-{[7-(
벤질옥시
)-6-
메톡시
-4-
퀴놀릴
]
설파닐
}-5-
니트로티오펜
7-(벤질옥시)-6-메톡시-1,4-디히드로-4-퀴놀린티온 14.3 g, 2-브로모-5-니트로티오펜 10 g, 탄산칼륨 9.9 g, 디메틸포름아미드 150 ml를 실온에서 6시간동안 교반했다. 물을 가하여 석출된 고체를 여과 수취하고, 고체를 물 이어서 초산에틸로 세척했다. 15.7 g의 황색 분말을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.92(3H, s), 5.29(2H, s), 7.23(1H, dd, J=4.8Hz, 1.6Hz), 7.32-7.44(4H, m), 7.49(2H, d, J=8.0Hz), 7.55(1H, s), 7.57(1H, dd, J=4.4Hz, 1.6Hz), 8.16(1H, dd, J=4.4Hz, 2.0Hz), 8.58(1H, dd, J=4.8Hz, 1.6Hz).
제조예
247-3
6-
메톡시
-4-[(5-니트로-2-
티에닐
)
설파닐
]-7-
퀴놀리놀
7-(벤질옥시)-6-메톡시-4-[(5-니트로-2-티에닐)설파닐]퀴놀린 4.0 g, 트리플루오로초산 40 ml, 티오아니솔 4 ml를 65℃에서 2시간동안 교반했다. 실온으로 되돌려 용매를 감압 증류 수거하고 잔사에 메탄올 80 ml, 이어서 중조수를 발포가 수습될 때까지 가했다. 석출된 고체를 여과 수취하여, 황색 분말 2.7 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.92(3H, s), 7.16(1H, d, J=4.8Hz), 7.31(1H, s), 7.33(1H, s), 7.55(1H, d, J=4.0Hz), 8.15(1H, d, J=4.0Hz), 8.52(1H, d, J=4.8Hz).
제조예
247-4
N,N- 디에틸 -N-[3-({6- 메톡시 -4-[(5-니트로-2- 티에닐 ) 설파닐 ]-7- 퀴놀릴 } 옥시 )프로필]아민
6-메톡시-4-[(5-니트로-2-티에닐)설파닐]-7-퀴놀리놀 500 mg, 3-디에틸아미노프로판올 290 mg, 디에틸아조디카르복실레이트 390 mg, 트리페닐포스핀 590 mg, 테트라히드로푸란 30 ml, 1-메틸-2-피롤리디논 2 ml, 디메틸설폭시드 10 ml를 0℃에서 5시간동안, 이어서 실온에서 10시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 추출액을 2N 염산수로 역추출했다. 염산수 추출액에 5N 수산화나트륨수를 가하여 초산에틸로 추출하고, 추출액을 물 이어서 식염수로 세척하여, 황산마그네슘으로 건조시켰다. NH 타입 실리카겔을 글라스 필터에 깔아 초산에틸층을 통과시키고, 용매를 감압 증류 수거하여 적갈색 유상물 500 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.92(6H, t, J=7.2Hz), 1.87(2H, tt, J=7.2Hz, 7.2Hz), 2.40-2.58(6H, m), 3.93(3H, s), 4.20(2H, t, J=7.2Hz), 7.21(1H, d, J=4.8Hz), 7.37(1H, s), 7.42(1H, s), 7.58(1H, d, J=4.0Hz), 8.18(1H, d, J=4.0Hz), 8.60(1H, d, J=4.8Hz).
제조예
247-5
5-({7-[3-(
디에틸아미노
)
프로폭시
]-6-
메톡시
-4-
퀴놀릴
}
설파닐
)-2-
티오펜아민
N,N-디에틸-N-[3-({6-메톡시-4-[(5-니트로-2-티에닐)설파닐]-7-퀴놀릴}옥시)프로필]아민 525 mg, 철분 330 mg, 염화암모늄 660 mg, 에탄올 20 ml, 물 5 ml를 80℃에서 80분동안 교반했다. 세라이트 여과하여, 여과액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(초산에틸 이어서 초산에틸:메탄올=3:1)를 행했다. 190 mg의 갈색 유상물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.91(6H, t, J=7.2Hz), 1.88(2H, tt, J=7.2Hz, 7.2Hz), 2.47-2.57(6H, m), 3.92(3H, s), 4.16(2H, t, J=7.2Hz), 5.96(1H, d, J=4.0Hz), 6.76(1H, d, J=4.8Hz), 6.25-6.30(2H, m), 7.04(1H, d, J=4.0Hz), 7.22(1H, s), 7.33(1H, s), 8.45(1H, d, J=4.8Hz).
실시예
248
N-[2-({7-[3-( 디에틸아미노 ) 프로폭시 ]-6- 메톡시 -4- 퀴놀릴 } 설파닐 )-1,3-티아졸-5-일]-N'-(4-플루오로페닐)우레아
N,N-디에틸-N-[3-({6-메톡시-4-[(5-니트로1-1,3-티아졸-2-일)설파닐]-7-퀴놀릴}옥시)프로필]아민 770 mg, 철분 480 mg, 에탄올 17 ml, 초산 3.4 ml를 80℃에서 10분동안 교반했다. 반응 용액에 물 100 ml, 초산에틸 60 ml, 탄산칼륨 10 g을 가하고 이어서 세라이트 여과했다. 여과액을 분액하여, 초산에틸층을 NH 타입 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 이렇게 해서 얻어진 초산에틸 용액에 p-플루오로페닐이소시아네이트 0.58 ml를 가하여 실온에서 17시간동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(초산에틸:메탄올=100:1 이어서 50:1 이어서 10:1)를 행했다. 목적물을 담황색 고체로서 30 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.93(6H, t, J=7.2Hz), 1.88(2H, tt, J=6.4Hz, 6.4Hz), 2.46(4H, q, J=7.2Hz),2.55(2H, t, J=6.4Hz), 3.92(3H, s), 4.17(2H, t, J=6.4Hz), 7.00(1H, d, J=5.2Hz), 7.10(2H, dd, J=8.8Hz, 8.8Hz), 7.36(1H, s), 7.38(1H, s), 7.43(2H, dd, J=8.8Hz, 4.8Hz), 7.60(1H, s), 8.51(1H, d, J=5.2Hz), 9.10 (1 H. bs).
중간체는 다음과 같은 식으로 얻었다.
제조예
248-1
2-{[7-(
벤질옥시
)-6-
메톡시
-4-
퀴놀릴
]
설파닐
}-5-니트로-1,3-티아졸
7-(벤질옥시)-6-메톡시-1,4-디히드로-4-퀴놀린티온 14.8 g, 2-브로모-5-니트로-1,3-티아졸 10.4 g, 탄산칼륨 10.3 g, 디메틸포름아미드 150 ml를 실온에서 50분동안 교반했다. 반응액에 물 800 ml를 가하여 석출한 고체를 여과 수취하고 초산에틸로 세척하여 목적물을 담황토색 분말로서 13.4 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.87(3H, s), 5.32(2H, s), 7.32-7.53(6H, m), 7.64(1H, s), 7.86(1H, d, J=4.8Hz), 8.70(1H, s), 8.80(1H, d, J=4.8Hz).
제조예
248-2
6-
메톡시
-4-[(5-니트로-1,3-티아졸-2-일)
설파닐
]-7-
퀴놀리놀
2-{[7-(벤질옥시)-6-메톡시-4-퀴놀릴]설파닐}-5-니트로-1,3-티아졸 2.0 g, 트리플루오로초산 20 ml, 티오아니솔 2 ml를 65℃에서 90분동안 교반했다. 실온으로 되돌려 용매를 감압 증류 수거하고 잔사에 메탄올 40 ml, 이어서 중조수를 발포가 수습될 때까지 가했다. 석출된 고체를 여과 수취하여, 황색 분말 1.4 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.87(3H, s), 7.40(1H, s), 7.43(1H, s), 7.78(1H, d, J=4.8Hz), 8.71(1H, d, J=2.4Hz), 8.74(1H, dd, J=4.8Hz, 2.4Hz), 10.52(1H, s).
제조예
248-3
N,N- 디에틸 -N-[3-({6- 메톡시 -4-[(5- 니트로1 -1,3-티아졸-2-일) 설파닐 ]-7- 퀴놀릴}옥시)프로필]아민
6-메톡시-4-[(5-니트로-1,3-티아졸-2-일)설파닐]-7-퀴놀리놀을 이용하여 제조예 247-2와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.95(6H, t, J=6.8Hz), 1.91(2H, tt, J=6.4Hz, 6.4Hz), 2.45-2.65(6H, m), 3.86(3H, s), 4.20(2H, t, J=6.4Hz), 7.42(1H, s), 7.49(1H, s), 7.83(1H, d, J=4.4Hz), 8.69(1H, s), 8.79(1H, d, J=4.4Hz).
실시예
249
N6 -(2- 메톡시에틸 )-4-(3- 클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노}페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드
4-(3-클로로-4-{[(시클로프로필아미노)카르보닐]아미노}페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복실산 200 mg, 2-메톡시에틸아민 38 mg, 벤조트리아졸-1-일옥시-트리스(디메틸아미노)포스포늄 헥사플루오로포스페이트(Bop 시약) 230 mg, 트리에틸아민 0.12 ml, 디메틸포름아미드 5 ml를 실온에서 14시간동안 교반했다. 반응 용액에 물, 초산에틸을 가하여 추출하고, 추출액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(초산에틸)를 행했다. 용매를 감압 증류 수거하여 목적물 120 mg을 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.45(2H, m), 0.62-0.68(2H, m), 2.48-2.60(1H, m), 3.30(3H, s), 3.37(3H, s), 3.45-3.55(4H, m), 3.79(2H, t, J=4.4Hz), 4.40(2H, t, J=4.4Hz), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.23(1H, dd, J=9.2Hz, 2.8Hz), 7.49(1H, d, J=2.8Hz), 7.55(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.42-8.47(1H, m), 8.66(1H, d, J=5.2Hz), 8.74(1H, s).
중간체는 다음과 같은 식으로 얻었다.
제조예
249-1
메틸
4-
클로로
-7-(2-
메톡시에톡시
)-6-
퀴놀린카르복실레이트
7-(2-메톡시에톡시)-4-옥소-1,4-디히드로-6-퀴놀린카르복실산 7.5 g, 염화티오닐 60 ml, 디메틸포름아미드 1 ml를 80℃에서 3시간동안 교반했다. 반응 용액을 감압 증류 수거하고, 잔사에 톨루엔을 가하여 감압 증류 수거를 2회 더 행했다. 잔사에 메탄올을 가하고, 이어서 트리에틸아민 10 ml를 가했다. 이렇게 해서 얻어진 용액을 감압 증류 수거하고, 잔사에 물과 5N 수산화나트륨수를 가하여 pH 4로 하여 초산에틸로 추출했다. 생성된 초산에틸층을 NH 타입 실리카겔을 깔아놓은 글라스 필터에 통과시키고, 이어서 용매를 감압 증류 수거했다. 잔사에 에테르를 가하여 고체를 여과 수취하여, 3.6 g의 담갈색 고체의 목적물을 얻었다. 여과액을 NH 타입 실리카겔을 이용한 컬럼 크로마토그래피(헥산:초산에틸=3:1)로 정제하여 담황색 고체 1.3 g의 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.33(3H, s), 3.71-3.75(2H, m), 3.86(3H, s), 4.32-4.35(2H, m), 7.62(1H, s), 7.66(1H, d, J=4.8Hz), 8.42(1H, s), 8.83(1H, d, J=4.8Hz).
제조예
249-2
메틸 4-(4-아미노-3- 클로로페녹시 )-7-(2- 메톡시에톡시 )-6- 퀴놀린카르복실레이트
메틸 4-클로로-7-(2-메톡시에톡시)-6-퀴놀린카르복실레이트 4.9 g, 4-아미노-3-클로로페놀 2.0 g, 수소화나트륨 550 mg, 디메틸포름아미드 20 ml를 100℃에서 2시간동안 교반했다. 실온으로 되돌려, 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(헥산:초산에틸=1:1 이어서 초산에틸)로 정제했다. 목적물 3.2 g을 보라색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 3.34(3H, s), 3.72(2H, t, J=4.4Hz), 3.83(3H, s), 4.29(2H, t, J=4.4Hz), 5.44(2H, s), 6.44(1H. d, J=5.6Hz), 6.88(1H, d, J=8.8Hz), 7.00(1H, dd, J=8.8Hz, 2.4Hz), 7.23(1H, d, J=2.4Hz), 7.49(1H, s), 8.53(1H, s), 8.63(1H, d, J=5.6Hz).
제조예
249-3
메틸 4-{3- 클로로 -4-[( 페녹시카르보닐 )아미노] 페녹시 }-7-(2- 메톡시에톡시 )-6-퀴놀린카르복실레이트
메틸 4-(4-아미노-3-클로로페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복실레이트 3.2 g, 피리딘 0.71 ml, 테트라히드로푸란 50 ml를 빙수 교반하고, 페닐클로로포르메이트 1.1 ml를 적하했다. 40분후, 피리딘 0.8 ml과 페닐클로로포르메이트 1.1 ml를 가하여 10분동안 더 교반했다. 물을 가하여 초산에틸로 추출하고, 추출 용액을 실리카겔을 깔아놓은 글라스 필터에 통과시켰다. 실리카겔을 초산에틸로 세척하여 용매를 감압 증류 수거하고, 잔사에 헥산과 초산에틸을 가하여 고체를 여과 수취했다. 미적색 고체 3.2 g를 얻었다.
1H-NMR(CDCl3) δ(ppm) : 3.50(3H, s), 3.80(2H, t, J=4.4Hz), 3.98(3H, s), 4.37(2H, t, J=4.4Hz), 6.49(1H, d, J=5.6Hz), 7.17-7.30(6H, m), 7.40-7.52(3H, m), 8.30-8,37(1H, m), 8.66(1H, d, J=5.6Hz), 8.80(1H, s).
제조예
249-4
메틸 4-(3- 클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노} 페녹시 )-7-(2-메톡시에톡시)-6-퀴놀린카르복실레이트
메틸 4-{3-클로로-4-[(페녹시카르보닐)아미노]페녹시}-7-(2-메톡시에톡시)-6-퀴놀린카르복실레이트 3.2 g, 시클로프로필아민 1.3 ml, 디메틸포름아미드 20 ml를 60℃에서 10분동안 교반했다. 실온으로 되돌려, 물을 가하여 초산에틸로 추출했다. 추출 용액에 실리카겔을 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 충전한 드라이 컬럼에 채워 컬럼 크로마토그래피(초산에틸 이어서 초산에틸:메탄올=50:1 이어서 20:1)로 정제했다. 목적물 2.26 g을 백색 분말로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.45(2H, m), 0.61-0.69(2H, m), 2.50-2.58(1H, m), 3.36(3H, s), 3.73(2H, t, J=4.4Hz), 3.84(3H, s), 4.31(2H, t, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 7.18(1H, s), 7.24(1H, dd, J=8.8Hz, 2.4Hz), 7.49(1H, d, J=2.4Hz), 7.52(1H, s), 7.96(1H, s), 8.26(1H, d, J=8.8Hz), 8.55(1H, s), 8.67(1H, d, J=5.2Hz).
제조예
249-5
4-(3- 클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노} 페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복실산
메틸 4-(3-클로로-4-{[(시클로프로필아미노)카르보닐]아미노}페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복실레이트 2.26 g, 2N 수산화나트륨수 20 ml, 메탄올 20 ml, 테트라히드로푸란 20 ml를 실온에서 1시간동안 교반했다. 5N 염산수를 가하고 유기 용매를 10 ml 감압 증류 수거하여, 석출되는 고체를 여과 수취했다. 메탄올과 물의 혼합 용매로 고체를 세척하여 목적물을 미적색 분말 2.0 g로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.45(2H, m), 0.60-0.68(2H, m), 2.50-2.59(1H, m), 3.34(3H, s), 3.73(2H, t, J=4.4Hz), 4.30(2H, t, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 7.23(1H, dd, J=9.2Hz, 2.8Hz), 7.25(1H, s), 7.49(1H, d, J=2.8Hz), 7.50(1H, s), 8.00(1H, s), 8.25(1H, d, J=9.2Hz), 8.50(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
250
N6 -(2- 플루오로에틸 )-4-(3- 클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노}페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드
2-플루오로에틸아민염산염을 이용하여, 실시예 249와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.45(2H, m), 0.60-0.68(2H, m), 2.48-2.58(1H, m), 3.35(3H, s), 3.61(1H, td, J=4.8Hz, 4.8Hz), 3.68(1H, td, J=4.8Hz, 4.8Hz), 3.78(2H, t, J=4.8Hz), 4.41(2H, t, J=4.8Hz), 4.50(1H, t, J=4.8Hz), 4.62(1H, t, J=4.8Hz), 6.53(1H, d, J=5.2Hz), 7.20(1H, s), 7.24(1H, dd, J=9.2Hz, 2.4Hz), 7.49(1H, d, J=2.4Hz), 7.56(1H, s), 7.98(1H, s), 8.26(1H, d, J=9.2Hz), 8.59(1H, t, J=4.8Hz), 8.67(1H, d, J=5.2Hz), 8.70(1H, s).
실시예
251
N6 - 메톡시 -4-(3- 클로로 -4-{[( 시클로프로필아미노 )카르보닐]아미노} 페녹시 )-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드
O-메틸히드록실아민 염산염을 이용하여, 실시예 249와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.44(2H, m), 0.62-0.98(2H, m), 2.50-2.60(1H, m), 3.35(3H, s), 3.73(3H, s), 3.77(2H, t, J=4.4Hz), 4.35(2H, t, J=4.4Hz), 6.52(1H, d, J=5.2Hz), 7.18(1H, s), 7.22(1H, dd, J=9.2Hz, 2.4Hz), 7.47(1H, d, J=2.4Hz), 7.52(1H, s), 7.96(1H, s), 8.26(1H, d, J=9.2Hz), 8.41(1H, s), 8.66(1H, d, J=5.2Hz), 11.30(1H, s).
실시예
252
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )-퀴놀린-4- 일설파닐 ]-티오펜-2-일}-3-(티아졸-2-일)우레아
실시예 246과 같은 식으로 4-(5-아미노-티오펜-2-일설파닐)-7-(2-메톡시에톡시)-퀴놀린-6-카르보니트릴(118 mg)과 티아졸-2-일-카르바민산 페닐에스테르(77 mg)로부터, 표제 화합물(45 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.40-4.42(2H, m), 6.76-6.79(1H, m), 6.80(1H, d, J=5.2Hz), 7.02-7.08(1H, m), 7.32-7.38(1H, m), 7.35(1H, d, J=4.0Hz), 7.63(1H, s), 8.62(1H, s), 8.70(1H, d, J=5.2Hz).
제조예
252-1
7-(2-
메톡시에톡시
)-4-
티옥소
-1,4-
디히드로퀴놀린
-6-
카르보니트릴
제조예 226-1과 같은 식으로 6-시아노-7-메톡시에톡시-1H-퀴놀린-4-온(10 g)으로부터 표제 화합물(9 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.74-3.77(2H, m), 4.31-4.34(2H, m), 7.16-7.19(2H, m), 7.82(1H, d, J=6.8Hz), 8.86(1H, s), 12.84(1H, br s).
제조예
252-2
7-(2-
메톡시에톡시
)-
4(5-니트로티오펜-2-일설파닐)퀴놀린
-6-
카르보니트릴
제조예 226-2와 같은 식의 수법에 의해, 7-(2-메톡시에톡시)-4-티옥소-1,4-디히드로퀴놀린-6-카르보니트릴(7.1 g) 및 2-브로모-5-니트로티오펜(6.3 g)으로부터 표제 화합물(2.2 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.75-3.78(2H, m), 4.41-4.44(2H, m), 7.18(1H, d, J=4.4Hz), 7.68(1H, d, J=4.8Hz), 7.69(1H, s), 8.23(1H, d, J=4.4Hz), 8.70(1H, s), 8.79(1H, d, J=4.8Hz).
제조예
252-3
4-(5-아미노-티오펜-2-
일설파닐
)-7-(2-
메톡시에톡시
)퀴놀린-6-
카르보니트릴
제조예 226-3에 따라서 7-(2-메톡시에톡시)-4(5-니트로티오펜-2-일설파닐)퀴놀린-6-카르보니트릴(2.2 g)로부터 표제 화합물(0.93 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.74-3.78(2H, m), 4.38-4.41(2H, m), 5.98(1H, d, J=3.6Hz), 6.37(2H, t, br s), 6.86(1H, d, J=4.8Hz), 7.07(1H, d, J=3.6Hz), 7.61(1H, s), 8.54(1H, s), 8.71(1H, d, J=4.8Hz).
실시예
253
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )-퀴놀린-4- 일설파닐 ]티오펜-2-일}-3-(4-플루오로페닐)우레아
실시예 252와 같은 식으로 4-(5-아미노-티오펜-2-일설파닐)-7-(2-메톡시에톡시)-퀴놀린-6-카르보니트릴(30 mg)과 4-플루오로페닐이소시아네이트로부터 표제 화합물(24 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.39-4.43(2H, m), 6.71(1H, d, J=3.6Hz), 6.80(1H, d, J=4.8Hz), 7.12(2H, t, J=9.2Hz), 7.34(1H, d, J=4.0Hz), 7.43-7.47(2H, m), 7.63(1H, s), 8.62(1H, s), 8.70(1H, d, J=4.8Hz), 8.97(1H, br s), 10,23(1H, br s).
실시예
254
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일설파닐 ]티오펜-2-일}-3-(3- 플루오로페닐)우레아
실시예 252와 같은 식으로 4-(5-아미노-티오펜-2-일설파닐)-7-(2-메톡시에톡시)-퀴놀린-6-카르보니트릴(30 mg)과 3-플루오로페닐이소시아네이트로부터 표제 화합물(20 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.39-4.43(2H, m), 6.73(1H, d, J=4.0Hz), 6.81(1H, d, J=4.8Hz), 6.78-6.85(1H, m), 7.15-7.19(1H, m), 7.27-7.32(1H, m), 7.35(1H, d, J=4.0Hz), 7.40-7.45(1H, m), 7.63(1H, s), 8.62(1H, s), 8.70(1H, d, J=4.8Hz), 9.18(1H, br s), 10.30(1H, br s).
실시예
255
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일설파닐 ]티오펜-2-일}-3- 시클로프로필우레아
실시예 252와 같은 식의 수법에 의해, 4-(5-아미노-티오펜-2-일설파닐)-7-(2-메톡시에톡시)-퀴놀린-6-카르보니트릴(35 mg)과 시클로프로필아민으로으로부터 표제 화합물(15 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41-0.46(2H, m), 0.61-0.68(2H, m), 2.48-2.55(1H, m), 3.36(3H, s), 3.75-3.79(2H, m), 4.39-4.43(2H, m), 6.63(1H, d, J=4.0Hz), 6.77(1H, d, J=4.8Hz), 6.79-7.84(1H, m), 7.28(1H, d, J=4.0Hz), 7.62(1H, s), 8.60(1H, s), 8.69(1H, d, J=4.8Hz), 9.93(1H, br s).
실시예
256
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일설파닐 ]티오펜-2-일}-3-(2- 플루오로페닐)우레아
실시예 252와 같은 식으로 4-(5-아미노티오펜-2-일설파닐)-7-(2-메톡시에톡시)퀴놀린-6-카르보니트릴(38 mg)과 2-플루오로페닐 이소시아네이트로부터, 표제 화합물(15 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.39-4.43(2H, m), 6.72(1H, d, J=4.0Hz), 6.80(1H, d, J=4.8Hz), 7.02-7.08(1H, m), 7.12-7.16(1H, m), 7.21-7.27(1H, m), 7.36(1H, d, J=4.0Hz), 7.63(1H, s), 7.99-8.04(1H, m), 8.62(1H, s), 8.70(1H, d, J=4.8Hz), 8.74-8.78(1H, m), 10.45(1H, brs).
실시예
257
1-{5-[6- 시아노 -7-(2- 메톡시 - 에톡시 )퀴놀린-4- 일설파닐 ]티오펜-2-일}-3- 페닐우레아
실시예 252와 같은 식으로 4-(5-아미노티오펜-2-일설파닐)-7-(2-메톡시에톡시)퀴놀린-6-카르보니트릴(38 mg)과 페닐 이소시아네이트로부터 표제 화합물(12 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3,75-3.78(2H, m), 4.39-4.43(2H, m), 6.71(1H, d, J=4.0Hz), 6.81(1H, d, J=4.8Hz), 6.97-7.01(1H, m), 7.28(2H, t, J=7.6Hz), 7.34(1H, d, J=4.0Hz), 7.44(2H, d, J=7.6Hz), 7.63(1H, s), 8.62(1H, s), 8.70(1H, d, J=4.8Hz), 8.94(1H, br s), 10.21(1H, br s).
실시예
258
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일설파닐 ]티오펜-2-일}-3-(2,4-디플루오로페닐)우레아
실시예 252와 같은 식의 수법에 의해, 4-(5-아미노티오펜-2-일설파닐)-7-(2-메톡시에톡시)퀴놀린-6-카르보니트릴(30 mg)과 2,4-디플루오로페닐 이소시아네이트로부터 표제 화합물(18 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.74-3.78(2H, m), 4.39-4.43(2H, m), 6.71(1H, d, J=4.0Hz), 6.80(1H, d, J=4.8Hz), 7.01-7.08(1H, m), 7.29-7.34(1H, m), 7.35(1H, d, J=4.0Hz), 7.63(1H, s), 7.89-7.97(1H, m), 8.62(1H, s), 8.70(1H, d, J=4.8Hz), 8.73(1H, br s), 10.44(1H, br s).
실시예
259
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일설파닐 ]티오펜-2-일}-3-(파라-톨릴)우레아
실시예 252와 같은 식의 수법에 의해, 4-(5-아미노티오펜-2-일설파닐)-7-(2-메톡시에톡시)퀴놀린-6-카르보니트릴(30 mg)과 파라-톨릴 이소시아네이트로부터 표제 화합물(28 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.23(3H, s), 3.36(3H, s), 3.75-3.78(2H, m), 4.39-4.43(2H, m), 6.69(1H, d, J=4.0Hz), 6.80(1H, d, J=4.8Hz), 7.08(2H, d, J=8.0Hz), 7.32(2H, d, J=8.0Hz), 7.33(1H, d, J=4.0Hz), 7.63(1H, s), 8.61(1H, s), 8.70(1H, d, J=4.8Hz), 8.81(1H, br s), 10.15(1H, br s).
실시예
260
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일설파닐 ]-티오펜-2-일}-3-(3-시아노-페닐)-우레아
실시예 252와 같은 식의 수법에 의해, 4-(5-아미노티오펜-2-일설파닐)-7-(2-메톡시에톡시)퀴놀린-6-카르보니트릴(30 mg)과 3-시아노페닐 이소시아네이트로부터 표제 화합물(33 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.39-4.43(2H, m), 6.75(1H, d, J=4.0Hz), 6.80(1H, d, J=4.8Hz), 7.36(1H, d, J=4.0Hz), 7.43-7.52(2H, m), 7.63(1H, s), 7.70-7.73(1H, m), 7.91-7.94(1H, m), 8.62(1H, s), 8.70(1H, d, J=4.8Hz), 9.30(1H, br s), 10.44(1H, br s).
실시예
261
1-{5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일설파닐 ]티오펜-2-일}-3-(4- 시아노페닐)우레아
실시예 252와 같은 식의 수법에 의해, 4-(5-아미노티오펜-2-일설파닐)-7-(2-메톡시에톡시)퀴놀린-6-카르보니트릴(30 mg)과 4-시아노페닐 이소시아네이트로부터 표제 화합물(28 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.35(3H, s), 3.74-3.78(2H, m), 4.39-4.43(2H, m), 6.76(1H, d, J=4.0Hz), 6.80(1H, d, J=4.8Hz), 7.36(1H, d, J=4.0Hz), 7.61-7.66(3H, m), 7.71-7.75(2H, m), 8.62(1H, s), 8.70(1H, d, J=4.8Hz), 9.48(1H, br s), 10.44(1H, br s).
실시예
262
N-[4-(7-(2- 메톡시에톡시 )-6- 시아노 -4- 퀴노일 ) 옥시페닐 (- N' -(4- 시클로프로필)우레아
실시예 249-4와 같은 식의 수법에 의해, 7-(2-메톡시에톡시)-6-시아노-4-(4-아미노-3-클로로페녹시)퀴놀린(380 mg)으로부터 표제 화합물(220 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.38-0.44(2H, m), 0.63-0.69(2H, m), 2.53-2.60(1H, m), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.43(2H, m), 6.58(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, J=8.8Hz), 7.50(1H, d, J=2.8Hz), 7.63(1H, s), 7.98(1H, s), 8.28(1H, d, J=8.8Hz), 8.73(1H, d, J=5.2Hz), 8.74(1H, s).
제조예
262-1
7-(2-
메톡시에톡시
)-6-
시아노
-4-(4-아미노-3-
클로로페녹시
)퀴놀린
공지의 방법으로 생성된 4-클로로-7-메톡시에톡시-6-시아노퀴놀린(800 mg)으로부터, 제조예 395-1과 같은 식의 수법에 의해 표제 화합물(380 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.75-3.78(2H, m), 4.39-4.41(2H, m), 5.46(2H, br s), 6.51(1H, d, J=5.2Hz), 6.89(1H, d, J=8.8Hz), 7.01(1H, dd, J=2.8, 8.8Hz), 7.24(1H, d, J=2.8Hz), 7.60(1H, s), 8.70(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
263
(4-{4-[3-(4- 플루오로 - 페닐 ) 우레이도 ] 페녹시 }-7- 메톡시퀴놀린 -6-일) 카르바민산 벤질 에스테르
실시예 10과 같은 식으로 [4-(4-아미노-페녹시)-7-메톡시-퀴놀린-6-일]-카르바민산 벤질 에스테르(330 mg), 4-플루오로페닐이소시아네이트로부터, 표제 화합물(380 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.97(3H, s), 5.19(2H, s), 6.42(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.19(2H, d, J=8.8Hz), 7.29-7.49(8H, m), 7.57(2H, d, J=8.8Hz), 8.49(1H, d, J=5.2Hz), 8.67(1H, s), 8.80(1H, br s), 8.87(1H, br s), 8.98(1H, s).
중간체는 다음과 같이 합성했다.
제조예
263-1
(7-
메톡시
-4-옥소-1,4-
디히드로퀴놀린
-6-일)
카르바민산
벤질 에스테르
7-메톡시-4-옥소-1,4-디히드로퀴놀린-6-카르복실산(2.58 g)를 N,N-디메틸포름아미드(50 ml)에 용해하고, 벤질알콜(3.29 ml), 디페닐포스포릴아지드(2.51 ml) 및 트리에틸아민(1.63 ml)을 가하여, 95℃에서 5시간동안 가열 교반했다. 반응액을 포화식염수에 부어 에틸 아세테이트로 추출하고, 유기층을 황산마그네슘으로 건조한 후 농축했다. 생성된 잔사를 NH 실리카겔 컬럼 크로마토그래피에 가하여, 용매(에틸 아세테이트-메탄올=5-1)로 용출하여, 표제 화합물(2.03 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.85(3H, s), 5.14(2H, s), 5.93(1H, d, J=7.2Hz), 7.07(1H, s), 7.39-7.43(5H, m), 7.74-7.81(1H, m), 8.30(1H, br s), 8.75(1H, s), 11.97(1H, br s).
제조예
263-2
(4-
클로로
-7-
메톡시퀴놀린
-6-일)
카르바민산
벤질 에스테르
(7-메톡시-4-옥소-1,4-디히드로퀴놀린-6-일)카르바민산 벤질 에스테르(2 g)를 염화티오닐(20 ml)과 N,N-디메틸포름아미드(0.5 ml)의 혼액에 가하여 2시간동안 가열 환류시켰다. 반응 종료후 염화티오닐을 증류 수거하고, 톨루엔을 더 가하여 농축하는 작업을 3회 반복하여 표제 화합물(2.4 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.98(3H, s), 5.22(2H, s), 7.26-7.49(6H, m), 7.55(1H, d, J=5.2Hz), 8.63(1H, d, J=5.2Hz), 8.65(1H, s), 9.12(1H, br s).
제조예
263-3
[4-(4-
아미노페녹시
)-7-
메톡시퀴놀린
-6-일]
카르바민산
벤질 에스테르
제조예 7과 같은 식으로 (4-클로로-7-메톡시퀴놀린-6-일)카르바민산 벤질 에스테르(2.4 g)와 4-니트로페놀(2.07 g)로부터 4-페녹시퀴놀린체(465 mg)를 얻었다. 이 4-페녹시퀴놀린체(450 mg)를 제조예 8과 같은 식으로 환원하여, 표제 화합물(330 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.96(3H, s), 5.15(2H, br s), 5.18(2H, s), 6.34(1H, d, J=5.2Hz), 6.65(2H, d, J=8.4Hz), 6.90(2H, d, J=8.4Hz), 7.29-7.46(6H, m), 8.45(1H, d, J=5.2Hz), 8.65(1H, s), 8.95(1H, s).
실시예
264
1-[4-(6-아미노-7-
메톡시퀴놀린
-4-
일옥시
)
페닐
]-3-(4-
플루오로페닐
)
우레아
(4-{4-[3-(4-플루오로페닐)우레이도]페녹시}-7-메톡시퀴놀린-6-일)카르바민산 벤질 에스테르(100 mg)를 테트라히드로푸란(10 ml)-메탄올(10 m)의 혼액에 용해하고, 10% 팔라듐-카본(10 mg)을 가하여 1기압 수소 가스 분위기하에서 실온에서 7시간동안 교반했다. 반응액을 세라이트 여과하고, 여과액을 농축하고, 표제 화합물(60 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 5.44(2H, s), 6.34(1H, d, J=5.2Hz), 7.07-7.15(4H, m), 7.23(1H, s), 7.23(1H, s), 7.43-7.48(2H, m), 7.53(2H, d, J=8.8Hz), 8.25(1H, d, J=5.2Hz), 8.83(1H, br s), 8.87(1H, br s).
실시예
265
N-(4-{4-[3-(4- 플루오로페닐 ) 우레이도 ] 페녹시 }-7- 메톡시퀴놀린 -6-일) 아세트아미드
1-[4-(6-아미노-7-메톡시퀴놀린-4-일옥시)페녹시]-3-(4-플루오로페닐)우레아(50 mg)를 피리딘(5 ml)에 용해하고, 무수초산(0.5 ml)을 가하여 12시간동안 실온에서 방치했다. 반응액을 포화식염수에 부어 에틸 아세테이트로 추출하여, 유기층을 황산마그네슘으로 건조하고 농축하고, 표제 화합물(50 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.17(3H, s), 4.01(3H, s), 6.41(1H, d, J=5.6Hz), 7.11(2H, t, J=8.8Hz), 7.18(2H, d, J=8.8Hz), 7.42-7.49(3H, m), 7.57(2H, d, J=8.8Hz), 8.49(1H, d, J=5.6Hz), 8.78(1H, br s), 8.85(1H, br s), 8.98(1H, s), 9.45(1H, s).
실시예
266
N-(4-{4-[3-(4- 플루오로페닐 ) 우레이도 ] 페녹시 }-7- 메톡시퀴놀린 -6-일) 메탄설폰아미드
1-[4-(6-아미노-7-메톡시퀴놀린-4-일옥시)페녹시]-3-(4-플루오로페닐)우레아(50 mg)를 테트라히드로푸란(3 ml)에 용해하고, 트리에틸아민(0.3 ml) 및 메탄설포닐클로라이드(14 ㎕)를 가하여 실온에서 1시간동안 교반했다. 반응액을 포화염화암모늄 수용액에 부어 에틸 아세테이트로 추출하고, 유기층을 포화식염수로 세척하여 황산마그네슘으로 건조시켰다. 유기층을 농축하고, 생성된 잔사를 실리카겔 컬럼 크로마토그래피에 가하여 용매(에틸 아세테이트-메탄올=5-1)로 용출하여, 표제 화합물(13 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.05(3H, s), 3.98(3H, s), 6.43(1H, d, J=5.2Hz), 7.11(2H, t, J=8.8Hz), 7.19(2H, d, J=8.8Hz), 7.43-7.48(3H, m), 7.57(2H, d, J=8.8Hz), 8.12(1H, s), 8.53(1H, d, J=5.2Hz), 8.76(1H, br s), 8.84(1H, br s), 9.31(1H, br).
실시예
267
(4-{3- 플루오로 -4-[3-(4- 플루오로페닐 ) 우레이도 ] 페녹시 }-7- 메톡시퀴놀린 -6-일)카르바민산 벤질 에스테르
실시예 10과 같은 식으로 [4-(4-아미노-3-플루오로-페녹시)-7-메톡시퀴놀린-6-일]카르바민산 벤질 에스테르(166 mg)와 4-플루오로페닐이소시아네이트로부터 표제 화합물(180 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.97(3H, s), 5.18(2H, s), 6.51(1H, d, J=5.2Hz), 7.05-7.09(1H, m), 7.12(2H, t, J=8.8Hz), 7.29-7.41(4H, m), 7.42-7.49(5H, m), 8.20(1H, t, J=8.8Hz), 8.52(1H, d, J=5.2Hz), 8.62-8.64(1H, m), 8.65(1H, s), 8.99(1H, s), 9.12(1H, br s).
중간체는 다음과 같은 식으로 합성했다.
제조예
267-1
[4-(3- 플루오로 -4- 니트로페녹시 )-7- 메톡시퀴놀린 -6-일] 카르바민산 벤질 에스테르
(4-클로로-7-메톡시퀴놀린-6-일)카르바민산 벤질 에스테르(1.58 g)를 1-메틸-2-피롤리돈(5 ml)에 가하고, 3-플루오로-4-니트로페놀(0.87 g) 및 N, N-디이소프로필에틸아민(1.2 ml)을 가하여 130℃에서 6시간동안 가열 교반했다. 반응액을 포화탄산수소나트륨 수용액에 부어, 에틸 아세테이트로 추출하고, 유기층을 포화식염수로 세척한 후 황산마그네슘으로 건조시켰다. 유기층을 농축하고, 생성된 잔사를 NH 실리카겔 컬럼 크로마토그래피에 가하여 용매(에틸 아세테이트)로 용출하여, 표제 화합물(188 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.98(3H, s), 5.16(2H, s), 6.96(1H, d, J=5.2Hz), 7.16-7.21(1H, m), 7.28-7.43(5H, m), 7.50(1H, s), 7.53-7.58(1H, m), 8.26(1H, t, J=8.8Hz), 8.51(1H, s), 8.66(1H, d, J=5.2Hz), 9.04(1H, br s).
제조예
267-2
[4-(4-아미노-3- 플루오로페녹시 )-7- 메톡시퀴놀린 -6-일] 카르바민산 벤질 에스테르
제조예 10과 같은 식의 수법에 의해, [4-(3-플루오로-4-니트로페녹시)-7-메톡시퀴놀린-6-일]카르바민산 벤질 에스테르(188 mg)를 에탄올, 물의 혼액 중에서, 철 및 염화암모늄을 이용해 환원하여, 표제 화합물(170 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.96(3H, s), 5.18(4H, br s), 6.40(1H, d, J=5.2Hz), 6.79-6.86(2H, m), 7.04(1H, dd, J=2.4Hz, J=12Hz), 7.29-7.46(6H, m), 8.47(1H, d, J=5.2Hz), 8.63(1H, s), 8.95(1H, br s).
실시예
268
1-[4-(6-아미노-7- 메톡시퀴놀린 -4- 일옥시 )-2- 플루오로페닐 ]-3-(4- 플루오로페닐)우레아
실시예 264와 같은 식으로 (4-{3-플루오로-4-[3-(4-플루오로페닐)우레이도]페녹시}-7-메톡시-퀴놀린-6-일)카르바민산 벤질 에스테르(180 mg)로부터 표제 화합물(125 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 5.45(2H, br s), 6.45(1H, d, J=5.2Hz), 6.96-7.01(1H, m), 7.12(2H, t, J=8.8Hz), 7.17-7.26(3H, m), 7.42-7.48(2H, m), 8.13(1H, t, J=9.2Hz), 8.29(1H, d, J=5.2Hz), 8.58(1H, br s), 9.10(1H, br s).
실시예
269
N-(4-{3- 플루오로 -4-[3-(4- 플루오로페닐 ) 우레이도 ] 페녹시 }-7- 메톡시퀴놀린 -6-일)아세트아미드
실시예 265와 같은 식의 수법에 의해, 1-[4-(6-아미노-7-메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-3-(4-플루오로페닐)우레아(60 mg)로부터 표제 화합물(50 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.16(3H, s), 4.01(3H, s), 6.50(1H, d, J=5.2Hz), 7.05-7.09(1H, m), 7.12(2H, t, J=8.8Hz), 7.33(1H, dd, J=2.8Hz, J=12Hz), 7.43-7.49(3H, m), 8.16-8.23(1H, m), 8.52(1H, d, J=5.2Hz), 8.62(1H, br s), 8.96(1H, br s), 9.12(1H, br s), 9.45(1H, br s).
실시예
270
{4-[3- 플루오로 -4-(3-(티아졸-2-일) 우레이도 ) 페녹시 ]-7- 메톡시퀴놀린 -6-일}카르바민산 벤질 에스테르
실시예 224와 같은 식으로 [4-(4-아미노-3-플루오로페녹시)-7-메톡시퀴놀린-6-일]카르바민산 벤질 에스테르(100 mg)와 티아졸릴-2-일-카르바민산 페닐 에스테르(79 mg)를 디메틸설폭시드(1 ml)중에서 80℃로 가열하여, 표제 화합물(38 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.97(3H, s), 5.19(2H, s), 6.53(1H, d, J=5.2Hz), 7.09-7.13(1H, m), 7.14(1H, d, J=3.6Hz), 7.29-7.41(5H, m), 7.42-7.46(3H, m), 8.20(1H, t, J=9.2Hz), 8.53(1H, d, J=5.2Hz), 8.65(1H, s), 9.00(1H, br s), 9.04(1H, br), 10.83(1H, brs).
실시예
271
1-[4-(6-아미노-7- 메톡시퀴놀린 -4- 일옥시 )-2- 플루오로페닐 ]-3-(티아졸-2-일)우레아
{4-[3-플루오로-4-(3-(티아졸-2-일)우레이도)페녹시]-7-메톡시퀴놀린-6-일}카르바민산 벤질 에스테르(100 mg)를 트리플루오로초산(3 ml)과 티오아니솔(0.1 ml)의 혼액에 가하여, 60℃에서 2시간동안 가열 교반했다. 용매를 증류 수거하고, 잔사를 NH 실리카겔 컬럼 크로마토그래피에 가하여 용매(에틸 아세테이트-메탄올=10-1)로 용출하여, 표제 화합물(23 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.94(3H, s), 5.47(2H, br s), 6.48(1H, d, J=5.2Hz), 6.99-7.03(1H, m), 7.13(1H, d, J=3.6Hz), 7.17(1H, s), 7.23-7.31(2H, m), 7.38(1H, d, J=3.6Hz), 8.13(1H, t, J=8.8Hz), 8.29(1H, d, J=5.2Hz), 8.97(1H, br), 10.80(1H, br).
실시예
272
N-{4-[3- 플루오로 -4-(3-(티아졸-2-일) 우레이도 ) 페녹시 ]-7- 메톡시퀴놀린 -6-일}아세트아미드
실시예 265와 같은 식으로 1-[4-(6-아미노-7-메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-3-(티아졸-2-일)우레아(15 mg)로부터, 표제 화합물(4 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.15(3H, s), 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 7.07-7.12(1H, m), 7.12(1H, d, J=3.6Hz), 7.34-7.41(2H, m), 7.45(1H, s), 8.19(1H, t, J=9.2Hz), 8.53(1H, d, J=5.2Hz), 8.95-8.98(1H, m), 9.07(1H, br), 9.45(1H, br s).
실시예
273
N-{4-[3- 플루오로 -4-(3-(티아졸-2-일) 우레이도 ) 페녹시 ]-7- 메톡시퀴놀린 -6-일}메탄슬폰아미드
실시예 266과 같은 식으로 1-[4-(6-아미노-7-메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-3-(티아졸-2-일)우레아(50 mg)로부터, 표제 화합물(5 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.06(3H, s), 4.00(3H, s), 6.55(1H, d, J=5.2Hz), 7.09-7.16(2H, m), 7.25-7.35(1H, m), 7.39(1H, d, J=3.2Hz), 7.49(1H, s), 8.10(1H, s), 8.21(1H, t, J=9.2Hz), 8.57(1H, d, J=5.2Hz), 9.02(1H, br s), 9.32(1H, br s), 10.78(1H, br s).
실시예
274
{4-[4-( 시클로프로필우레이도 )-3- 플루오로페녹시 ]-7- 메톡시퀴놀린 -6-일} 카르바민산 벤질 에스테르
실시예 224와 같은 식으로 [4-(4-아미노-3-플루오로페녹시)-7-메톡시퀴놀린-6-일]카르바민산 벤질 에스테르(100 mg)와 시클로프로필-카르바민산 페닐 에스테르(64 mg)를 디메틸설폭시드(0.7 ml) 중, 85℃에서 5시간동안40분 가열 교반하여, 표제 화합물(11 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.60-0.65(2H, m), 2.50-2,56(1H, m), 3.95(3H, s), 5.16(2H, s), 6.46(1H, d, J=5.2Hz), 6.77-6.80(1H, m), 6.99-7.03(1H, m), 7.23-7.45(7H, m), 8.16(1H, t, J=9.2Hz), 8.19(1H, s), 8.49(1H, d, J=5.2Hz), 8.63(1H, s), 8.97(1H, s).
실시예
275
N-{4-[4-( 시클로프로필우레이도 )3- 플루오로페녹시 ]-7- 메톡시퀴놀린 -6-일} 아세트아미드
실시예 264와 같은 식으로 {4-[4-(시클로프로필우레이도)-3-플루오로페녹시]-7-메톡시퀴놀린-6-일}카르바민산 벤질 에스테르(11 mg)를 트리플루오로초산(3 ml)과 티오아니솔(0.5 ml)의 혼액에서 60℃로 가열 교반하여 탈벤질화했다. 생성된 아미노체를 실시예 265와 같은 식으로 아세틸화하여, 표제 화합물(2 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.36-0.40(2H, m), 0.58-0.63(2H, m), 2.14(3H, s), 2,46-2.55(1H, m), 3.99(3H, s), 6.44(1H, d, J=5.2Hz), 6.77(1H, d, J=2.8Hz), 6.97-7.01(1H, m), 7.23(1H, dd, J=2.8Hz, J=11.6Hz), 7.41(1H, s), 8.15(1H, t, J=8.8Hz), 8.17(1H, br s), 8.48(1H, d, J=5.2Hz), 8.93(1H, s), 9.42(1H, s).
실시예
276
4-[4-( 시클로프로필우레이도 )-2- 메틸페녹시 ]-7- 메톡시퀴놀린 -6- 카르복실산 아미드
실시예 11과 같은 식으로 [4-(6-카르바모일-7-메톡시퀴놀린-4-일옥시)-3-메틸페닐]카르바민산 페닐 에스테르(100 mg)와 시클로프로필아민으로부터 표제 화합물(61 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.59-0.65(2H, m), 2.04(3H, s), 2.49-2.55(1H, m), 4.01(3H, s), 6.26(1H, d, J=5.2Hz), 6.41-6.47(1H, m), 7.05(1H, d, J=8.8Hz), 7.35(1H, dd, J=2.4Hz, J=8.8Hz), 7.42(1H, d, J=2.4Hz), 7.48(1H, s), 7.71(1H, br s), 7.84(1H, br s), 8.27-8.42(1H, m), 8.59(1H, d, J=5.2Hz), 8.69(1H, s).
중간체는 다음과 같은 식으로 합성했다.
제조예
276-1
4-(4-아미노-2-
메틸페녹시
)-7-
메톡시퀴놀린
-6-
카르복실산
아미드
제조예 458-1과 같은 식으로 4-클로로-7-메톡시퀴놀린-6-카르복실산 아미드(1 g)와 4-아미노-2-메틸페놀로부터 표제 화합물(430 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.93(3H, s), 4.01(3H, s), 5.06-5.09(2H, m), 6.27(1H, d, J=5,2Hz), 6.49(1H, dd, J=2.8Hz, J=8.4Hz), 6.54(1H, d, J=2.8Hz), 6.84(1H, d, J=8.4Hz), 7.47(1H, s), 7.71(1H, br s), 7.83(1H, br s), 8.59(1H, d, J=5.2Hz), 8.69(1H, s).
제조예
276-2
[4-(6- 카르바모일 -7- 메톡시퀴놀린 -4- 일옥시 )-3- 메틸페닐 ] 카르바민산 페닐 에스테르
제조예 17과 같은 식으로 4-(4-아미노-2-메틸페녹시)-7-메톡시퀴놀린-6-카르복실산 아미드(330 mg)와 클로르탄산페닐로부터 표제 화합물(112 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.08(3H, s), 4.02(3H, s), 6.30(1H, d, J=5.2Hz), 7.19-7.55(9H, m), 7.73(1H, br s), 7.85(1H, br s), 8.62(1H, d, J=5.2Hz), 8.71(1H, s), 10.33(1H, br s).
실시예
277
1-(3- 플루오로페닐 )-3-[4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시)페닐]우레아
실시예 10과 같은 식의 수법에 의해, 4-(6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민(90 mg)과 3-플루오로페닐 이소시아네이트로부터 표제 화합물(118 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.74-6.80(1H, m), 7.11-7.15(1H, m), 7.20(2H, d, J=8.8Hz), 7.23(1H, s), 7.29(1H, t, J=7.6Hz), 7.34-7.38(1H, m), 7.46-7.51(1H, d, m), 7.52(2H, d, J=8.8Hz), 7.87-7.92(1H, m), 8.08(1H, d, J=8.0Hz), 8.31(1H, s), 8.63-8.66(1H, m), 8.82(1H, br s), 8.93(1H, br s), 12.78(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
277-1
4-(4-
니트로페녹시
)-6-(피리딘-2-일)-7-H-
피롤로[2,3-d]피리미딘
제조예 7과 같은 식으로, 4-클로로-6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘(0.8 g)과 니트로페놀(1.45 g)로부터 표제 화합물(1.0 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 7.33(1H, s), 7.37(1H, dd, J=4.8Hz, J=7.2Hz), 7.59(2H, d, J=9.2Hz), 7.88-7.94(1H, m), 8.12(1H, d, J=7.2Hz), 8.33(2H, d, J=9.2Hz), 8.38(1H, s), 8.66(1H, d, J=4.8Hz), 12.92(1H, br s).
제조예
277-2
4-(6-(피리딘-2-일)-7H-
피롤로[2,3-d]피리미딘
-4-
일옥시
)
페닐아민
제조예 8과 같은 식으로 4-(4-니트로페녹시)-6-(피리딘-2-일)-7-H-피롤로[2,3-d]피리미딘(1.0 g)으로부터, 표제 화합물(0.4 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.06(2H, br s), 6.60(2H, d, J=8.8Hz), 6.90(2H, d, J=8.8Hz), 7.07(1H, s), 7.32-7.36(1H, m), 7.86-7.91(1H, m), 8.03(1H, d, J=8.0Hz), 8.29(1H, s), 8.64(1H, d, J=4Hz), 12.71(1H, br s).
실시예
278
1-(4- 플루오로페닐 )-3-[4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시)페닐]우레아
실시예 10과 같은 식으로, 4-(6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민(100 mg)과 4-플루오로페닐 이소시아네이트로부터 표제 화합물(120 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 7.11(2H, t, J=8.8Hz), 7.19(2H, d, J=8.8Hz), 7.22(1H, s), 7.35(1H, dd, J=7.2Hz, J=7.6Hz), 7.43-7.48(2H, m), 7.51(2H, d, J=8.8Hz), 7.87-7.92(1H, m), 8.08(1H, d, J=8.0Hz), 8.32(1H, s), 8.64-8.66(1H, m), 8.73(1H, br s), 8.75(1H, br s), 12.78(1H, br s).
*실시예 279
1-[4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 )- 페닐 ]-3-(티아졸-2-일)우레아
실시예 224와 같은 식으로 4-(6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민(100 mg)과 (티아졸-2-일)카르바민산 페닐 에스테르(116 mg)를 디메틸설폭시드(2.5 ml) 중, 80℃에서 1시간동안 가열 교반하여, 표제 화합물(110 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 7.10(1H, d, J=3.6Hz), 7.23(2H, d, J=8.8Hz), 7.24(1H, s), 7.34-7.40(2H, m), 7.55(2H, d, J=8.8Hz), 7.87-7.93(1H, m), 8.09(1H, d, J=8.0Hz), 8.32(1H, s), 8.63-8.67(1H, m), 9.06(1H, br s), 12.79(1H, br s).
실시예
280
1-(4- 플루오로페닐 )-3-[2- 플루오로 -4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘-4-일옥시)-페닐]-우레아
실시예 10과 같은 식의 수법에 의해, 2-플루오로-4-(6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민(100 mg)과 4-플루오로페닐 이소시아네이트로부터 표제 화합물(110 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 7.07-7.16(3H, m), 7.28(1H, s), 7.33-7.38(2H, m), 7.42-7.48(2H, m), 7.87-7.93(1H, m), 8.08-8.14(2H, m), 8.33(1H, s),8.53-8.56(1H, m), 8.64-8.66(1H, m), 9.08(1H, br s), 12.83(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
280-1
4-(3-
플루오로
-4-
니트로페녹시
)-6-(피리딘-2-일)-7H-
피롤로[2,3-d]피리미딘
제조예 7과 같은 식으로 WO9702266, PCT/EP96/02728에 기재한 4-클로로-6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘(0.7 g)과 플루오로니트로페놀(0.95 g)로부터 표제 화합물(0.75 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 7.34-7.45(3H, m), 7.74(1H, dd, J=2.4Hz, J=12.4Hz), 7.89-7.94(1H, m), 8.12(1H, d, J=8.0Hz), 8.28(1H, t, J=8.8Hz), 8.41(1H, s), 8.65-8.68(1H, m), 12.96(1H, br s).
제조예
280-2
2- 플루오로 -4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐아민
제조예 8과 같은 식의 수법에 의해 4-(3-플루오로-4-니트로페녹시)-6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘(750 mg)으로부터 표제 화합물(450 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.10(2H, br s), 6.79-6.83(2H, m), 7.01-7.05(1H, m), 7.16(1H, s), 7.32-7.38(1H, m), 7.86-7.92(1H, m), 8.06(1H, d, J=7.6Hz), 8.31(1H, s), 8.64(1H, d, J=4.4Hz), 12.75(1H, br s).
실시예
281
1-(3- 플루오로페닐 )-3-[2- 플루오로 -4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘-4-일옥시)페닐]우레아
실시예 10과 같은 식으로 2-플루오로-4-(6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민(100 mg)과 3-플루오로페닐 이소시아네이트로부터, 표제 화합물(30 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.76-6.83(1H, m), 7.11(2H, d, J=8.8Hz), 7.27-7.39(4H, m), 7.48-7.53(1H, m), 7.87-7.94(1H, m), 8.11(2H, d, J=8.8Hz), 8.34(1H, s), 8.61-8.65(1H, m), 8.66(1H, br d, J=4.0Hz), 9.27(1H, br s), 12.83(1H, br s).
실시예
282
1-[2- 플루오로 -4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐]-3-(티아졸-2-일)우레아
실시예 224와 같은 식의 수법에 의해, 2-플루오로-4-(6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민(100 mg)과 (티아졸-2-일)카르바민산 페닐 에스테르(109 mg)로부터 표제 화합물(100 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 7.07-7.17(2H, m), 7.29(1H, s), 7.35-7.44(3H, m), 7.87-7.95(1H, m), 8.08-8.15(2H, m), 8.34(1H, s), 8.66(1H, br d, J=4.0Hz), 8.99(1H, br), 10.81(1H, brs), 12.83(1H, brs).
실시예
283
1- 시클로프로필 -3-[2- 플루오로 -4-(6-(피리딘-2-일)-7H- 피롤로[2,3-d]피리미딘-4-일옥시)페닐]우레아
실시예 224와 같은 식으로 2-플루오로-4-(6-(피리딘-2-일)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐아민(75 mg)과 시클로프로필카르바민산 페닐 에스테르(66 mg)로부터, 표제 화합물(15 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.42(2H, m), 0.60-0.66(2H, m), 2.49-2.57(1H, m), 6.76(1H, d, J=2.4Hz), 7.01-7.05(1H, m), 7.24-7.29(2H, m), 7.33-7.37(1H, m), 7.86-7.92(1H, m), 8.05-8.12(2H, m), 8.13-8.16(1H, m), 8.32(1H, s), 8.62-8.66(1H, m), 12.79(1H, br s).
실시예
284
7-((2R)-2-히드록시-3-( 피롤리딘 -1-일) 프로폭시 )-4-(1H-인돌-5- 일옥시 )퀴놀린-6-카르보니트릴
실시예 454와 같은 식으로 4-(1H-인돌-5-일옥시)-(2R)-7-옥시라닐메톡시퀴놀린-6-카르보니트릴(0.73 g)로부터 표제 화합물(0.56 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.61-2.72(4H, m), 2.44-2.58(6H, m), 2.68-2.73(1H, m), 3.99-4.06(1H, m), 4.20(1H, dd, J=6.0Hz, J=10.4Hz), 4.29(1H, dd, J=3.6Hz, J=10.4Hz), 5.02(1H, br s), 6.42(1H, d, J=5.2Hz), 6.44-6.48(1H, m), 6.99(1H, dd, J=1.6Hz, J=8.4Hz), 7.43-7.47(2H, m), 7.51(1H, d, J=8.4Hz), 7.59(1H, s), 8.65(1H, d, J=5.2Hz), 8.77(1H, s).
중간체는 다음과 같은 식으로 합성했다.
제조예
284-1
4-(1H-인돌-5-
일옥시
)-(2R)-7-
옥시라닐메톡시퀴놀린
-6-
카르보니트릴
(2R)-옥시란-2-일메틸 4-메틸-1-벤젠설포네이트를 이용하여, 실시예 7과 같은 식의 수법에 의해, 4-(1H-인돌-5-일옥시)-7-히드록시퀴놀린-6-카르보니트릴(1 g)로부터 표제 화합물(0.73 g)을 고체로서 얻었다.
*1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.82(1H, dd, J=2.4Hz, J=4.8Hz), 2.91(1H, t, J=4.8Hz), 3.44-3.49(1H, m), 4.17(1H, dd, J=6.4Hz, J=11.6Hz), 4.71(1H, dd, J=2.4Hz, J=11.6Hz), 6.44(1H, d, J=5.2Hz), 6.46-6.48(1H, m), 6.99(1H, dd, J=2.4Hz, J=8.8Hz), 7.44-7.46(2H, m), 7.52(1H, d, J=8.8Hz), 7.62(1H, s), 8.67(1H, d, J=5.2Hz), 8.82(1H, s), 11.31(1H, br s).
실시예
285
5-[6- 시아노 -7-((2R)-2-히드록시-3-( 피롤리딘 -1-일) 프로폭시 )퀴놀린-4- 일옥시]인돌-1-카르복실산 시클로프로필아미드
7-((2R)-2-히드록시-3-(피롤리딘-1-일)프로폭시)-4-(1H-인돌-5-일옥시)퀴놀린-6-카르보니트릴(0.56 g)을 트리에틸실릴클로라이드와 이미다졸을 이용하여 실릴에테르화하여, 목적물을 0.48 g 얻었다. 실시예 310과 같은 식의 수법에 의해, 트리에틸실릴에테르체(0.2 g)로부터 아미드체를 얻어, 초산, 테트라히드로푸란, 물의 혼합액 중 50℃에서 탈보호하여 표제 화합물(35 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.58-0.63(2H, m), 0.71-0.76(2H, m), 1.84-1.94(2H, m), 1.98-2.06(2H, m), 2.73-2.79(1H, m), 3.07-3.16(2H, m), 3.33-3.38(2H, m), 3.57-3.64(2H, m), 4.28-4.36(3H, m), 6.55(1H, d, J=5.6Hz), 6.70(1H, d, J=3.6Hz), 7.19(1H, dd, J=2.4Hz, J=8.8Hz), 7.53(1H, d, J=2.4Hz),7.66(1H, s), 7.88(1H, d, J=3.6Hz), 8.32(1H, d, J=2.8Hz), 8.35(1H, d, J=8.8Hz), 8.74(1H, d, J=5.6Hz),8.87(1H, s).
실시예
286
5-[6- 시아노 -7-(3-( 피롤리딘 -1-일) 프로폭시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산 시클로프로필아미드
실시예 310과 같은 식으로 4-(1H-인돌-5-일옥시)-7-(3-(피롤리딘-1-일)프로폭시)퀴놀린-6-카르보니트릴(150 mg)로부터 표제 화합물(35 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.59-0.64(2H, m), 0.71-0.76(2H, m), 1.64-1.72(4H, m), 1.95-2.03(2H, m), 2.38-2.48(4H, m), 2.59(2H, d, J=6.8Hz), 2.74-2.81(1H, m), 4.33(2H, d, J=6.4Hz), 6.47(1H, d, J=5.2Hz), 6.68(1H, d, J=3.6Hz), 7.19(1H, dd, J=2.4Hz, 8.8Hz), 7.52(1H, d, J=2.4Hz), 7.58(1H, s), 7.90(1H, d, J=3.6Hz), 8.23(1H, d, J=2.8Hz), 8.35(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.79(1H, s).
실시예
287
5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산 시클로프로필아미드
실시예 310과 같은 식으로, 4-(1H-인돌-5-일옥시)-7-(2-메톡시에톡시퀴놀린-6-카르보니트릴(450 mg)로부터 표제 화합물(210 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.59-0.65(2H, m), 0.71-0.77(2H, m), 2.74-2.82(1H, m), 3.76-3.80(2H, m), 0.59-0.65(2H, m), 4.39-4.43(2H, m), 6.47(1H, d, J=5.2Hz), 6.68(1H, d, J=3.6Hz), 7.19(1H, dd, J=2.4Hz, J=8.8Hz), 7.52(1H, d, J=2.4Hz), 7.62(1H, s), 7.90(1H, d, J=3.6Hz), 8.30(1H, d, J=2.8Hz), 8.35(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.79(1H, s).
중간체는 다음과 같이 합성했다.
제조예
287-1
4-(1H-인돌-5-
일옥시
)-7-(2-
메톡시에톡시
)퀴놀린-6-
카르보니트릴
실시예 309와 같은 식으로 4-클로로-7-메톡시에톡시-6-시아노퀴놀린(1.0 g)과 5-히드록시인돌로부터 표제 화합물(0.8 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.37(3H, s), 3.76-3.79(2H, m), 4.39-4.43(2H, m), 6.43(1H, d, J=5.6Hz), 6.45-6.49(1H, m), 6.99(1H, dd, J=2.4Hz, J=8.8Hz), 7.43-7.47(2H, m), 7.52(1H, d, J=8.8Hz), 7.61(1H, s), 8.66(1H, d, J=5.6Hz), 8.79(1H, s), 11.31(1H, br s).
실시예
288
4-(1H-인돌-5-
일옥시
)-7-(3-(
피롤리딘
-1-일)
프로폭시
)퀴놀린-6-
카르보니트릴
실시예 7과 같은 식으로 4-(1H-인돌-5-일옥시)-7-히드록시퀴놀린-6-카르보니트릴(1.98 g)과 1-(3-클로로필)피롤리딘의 염산염으로부터 표제 화합물(1.27 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.64-1.72(4H, m), 1.95-2.03(2H, m), 2.42-2.48(4H, m), 2.59(2H, t, J=7.2Hz), 4.32(2H, t, J=6.4Hz), 6.43(1H, d, J=5.2Hz), 6.46-6.48(1H, m), 6.99(1H, dd, J=2.4Hz, J=8.8Hz), 7.43-7.47(2H, m), 7.51(1H, d, J=8.8Hz), 7.57(1H, s), 8.66(1H, d, J=5.2Hz), 8.78(1H, s), 11.30(1H, br s).
실시예
289
5-[6- 시아노 -7-(3-( 피롤리딘 -1-일) 프로폭시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산(티아졸-2-일)아미드
실시예 312와 같은 식으로 4-(1H-인돌-5-일옥시)-7-(3-(피롤리딘-1-일)프로폭시)퀴놀린-6-카르보니트릴(200 mg)로부터 표제 화합물(155 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.66-1.76(4H, m), 1.98-2.07(2H, m), 2.52-2.61(4H, m), 2.70(2H, t, J=7.2Hz), 4.34(2H, t, J=6.4Hz), 6.51(1H, d, J=5.2Hz), 6.63(1H, d, J=3.6Hz), 6.95(1H, d, J=4.4Hz), 7.16(1H, dd, J=2.4Hz, J=8.8Hz), 7.38(1H, d, J=4.4Hz), 7.50(1H, d, J=2.4Hz), 7.59(1H, s), 8.09(1H, d, J=3.6Hz), 8.68(1H, d, J=5.2Hz), 8.72(1H, d, J=8.8Hz), 8.81(1H, s).
실시예
290
5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산(티아졸-2-일)아미드
실시예 312와 같은 식으로 4-(1H-인돌-5-일옥시)-7-(2-메톡시에톡시)퀴놀린-6-카르보니트릴(100 mg)로부터 표제 화합물(31 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.37(3H, s), 3.77-3.80(2H, m), 4.41(2H, m), 6.51(1H, d, J=5.2Hz), 6.59-6.64(1H, m), 6.88-6.95(1H, m), 7.12-7.18(1H, m), 7.32-7.39(1H, m), 7.48-7.51(1H, m), 7.62(1H, s), 8.06-8.13(1H, m), 8.69(1H, d, J=5.2Hz), 8.69-8.77(1H, m), 8.81(1H, s).
실시예
291
5-(7- 벤질옥시 -6- 시아노퀴놀린 -4- 일옥시 ]인돌-1- 카르복실산 (2- 플루오로 -에틸)-아미드
실시예 310과 같은 식으로 5-(7-벤질옥시-6-시아노퀴놀린-4-일옥시)인돌(4.5 g)과 (2-플루오로-에틸)카르바민산 페닐 에스테르로부터 표제 화합물(3.6 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.54-3.61(1H, m), 3.61-3.66(1H, m), 4.53(1H, t, J=4.8Hz), 4.65(1H, t, J=4.8Hz), 5.45(2H, s), 6.48(1H, d, J=5.2Hz), 6.73(1H, d, J=3.6Hz), 7.20(1H, dd, J=2.4Hz, J=8.8Hz), 7.34-7.39(1H, m), 7.42-7.47(2H, m), 7.53-7.57(3H, m), 7.70(1H, s), 7.98(1H, d, J=3.6Hz), 8.36(1H, d, J=8.8Hz), 8.50(1H, t, J=5.2Hz), 8.68(1H, d. J=5.2Hz), 8.82(1H, s).
실시예
292
5-(6- 시아노 -7- 히드록시퀴놀린 -4- 일옥시 ]인돌-1- 카르복실산(2-플루오로에틸)아미드
제조예 21과 같은 식의 수법에 의해, 5-(7-벤질옥시-6-시아노퀴놀린-4-일옥시]인돌-1-카르복실산(2-플루오로에틸)아미드(3 g)로부터 트리플루오로초산을 이용하여 표제 화합물(2.17 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.54-3.59(1H, m), 3.61-3.65(1H, m), 4.53(1H, t, J=5.2Hz), 4.65(1H, t, J=5.2Hz), 6.39(1H, d, J=5.2Hz), 6.73(1H, d, J=3.6Hz), 7.19(1H, dd, J=2.4Hz, J=8.8Hz), 7.41(1H, s), 7.53(1H, d, J=2.4Hz), 7.98(1H, d, J=3.6Hz), 8.35(1H, d, J=8.8Hz), 8.50(1H, t, J=5.2Hz), 8.61(1H, d. J=5.2Hz), 8.71(1H, s).
실시예
293
5-[6- 시아노 -7-(피페리딘-4-일) 메톡시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산 (2-플루오로에틸)아미드
실시예 301과 같은 식으로 5-(6-시아노-7-히드록시퀴놀린-4-일옥시]인돌-1-카르복실산(2-플루오로-에틸)아미드(1 g)와 4-브로모에틸피페리딘-1-카르복실산 tert-부틸 에스테르로부터 tert-부톡시카르보닐체(150 mg)를 얻은 후, 트리플루오로초산으로 tert-부톡시카르보닐기를 탈보호하여 표제 화합물(97 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.48-1.61(2H, m), 1.95-2.02(2H, m), 2.16-2.26(1H, m), 2.92-3.01(2H, m), 3.28-3.38(2H, m), 3.54-3.59(1H, m), 3.61-3.66(1H, m), 4.02-4.07(1H, m), 4.22(2H, d, J=6.4Hz), 4.53(1H, t, J=5.2Hz), 4.65(1H, t, J=5.2Hz), 6.49(1H, d, J=5.2Hz), 6.74(1H, d, J=4.0Hz), 7.19(1H, dd, J=2.4Hz, J=8.8HZ), 7.54(1H, d, J=2.4Hz), 7.64(1H, s), 7.99(1H, d, J=4.0Hz), 8.36(1H, d, J=8.8Hz), 8.51(1H, t, J=5.6Hz), 8.82(1H, s).
실시예
294
5-[6- 시아노 -7-(1-( 메틸피페리딘 -4-일) 메톡시 )퀴놀린- 일옥시 ]인돌-1-카르복실산(2-플루오로-에틸)아미드
실시예 302와 같은 식으로 5-[6-시아노-7-(피페리딘-4-일메톡시)퀴놀린-일옥시]인돌-1-카르복실산(2-플루오로-에틸)아미드(97 mg)로부터 표제 화합물(35 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.52-1.61(2H, m), 1.89-2.07(5H, m), 2.31(3H, s), 2.92-2.98(2H, m), 3.69-3.74(1H, m), 3.76-3.81(1H, m), 4.30(2H, d, J=6.0Hz), 4.68(1H, t, J=5.2Hz), 4.80(1H, t, J=5.2Hz), 6.63(1H, d, J=5.2Hz), 6.88(1H, d, J=4.0Hz), 7.35(1H, dd, J=2.4Hz, J=8.8Hz), 7.69(1H, d, J=2.4Hz), 7.73(1H, s), 8.13(1H, d, J=4.0Hz), 8.51(1H, d, J=8.8Hz), 8.65(1H, t, J=5.2Hz), 8.83(1H, d, J=5.2Hz), 8.94(1H, s).
실시예
295
5-[6- 시아노 -7-(2- 메톡시에톡시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산 에틸아미드
실시예 310과 같은 식으로 7-(메톡시에톡시)-4-(1H-인돌-5-일옥시)퀴놀린-6-카르보니트릴(100 mg)로부터 표제 화합물(77 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.18(3H, t, J=7.2Hz), 3.28-3.33(2H, m), 3.37(1H, s), 3.76-3.80(2H, m), 4.40-4.44(2H, m), 6.48(1H, d, J=5.2Hz), 6.71(1H, d, J=3.6Hz), 7.19(1H, dd, J=2.4Hz, J=8.8Hz), 7.53(1H, d, J=2.4Hz), 7.62(1H, s), 7.93(1H, d, J=3.6Hz), 8.24(1H, d, J=5.2Hz), 8.35(1H, d, J=8.8Hz), 8.69(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
296
7-(3-
디에틸아미노프로폭시
)-4-(1H-인돌-5-
일옥시
)퀴놀린-6-
카르보니트릴
실시예 7과 같은 식으로 4-(1H-인돌-5-일옥시)-7-히드록시퀴놀린-6-카르보니트릴(0.8 g)과 3-디에틸아미노프로필클로라이드로부터 표제 화합물(0.46 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.2Hz), 1.88-1.94(2H, m), 2.43-2.49(4H, m), 2.59(2H, t, J=6.8Hz), 4.30(2H, t, J=6.0Hz), 6.42(1H, d, J=5.2Hz), 6.45-6.48(1H, m), 6.98(1H, dd, J=2.4Hz, J=8.8Hz), 7.43-7.47(2H, m), 7.51(1H, d, J=8.8Hz), 7.55(1H, s), 8.65(1H, d, J=5.2Hz), 8.77(1H, s), 11.30(1H, br s).
실시예
297
5-[6- 시아노 -7-(3- 디에틸아미노프로폭시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산 에틸아미드
실시예 310과 같은 식의 수법에 의해, 7-(3-디에틸아미노프로폭시)-4-(1H-인돌-5-일옥시)퀴놀린-6-카르보니트릴(230 mg)로부터 표제 화합물(35 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.2Hz), 1,18(3H, t, J=7.2Hz), 1.89-1.94(2H, m), 2.43-2.49(4H, m), 2.59(2H, t, J=7.2Hz), 3.29-3.37(2H, m), 4.31(2H, t, J=6.0Hz), 6.47(1H, d, J=5.2Hz), 6.70(1H, d, J=3.6Hz), 7.18(1H, dd, J=2.4Hz, J=8.8Hz), 7.52(1H, d, J=2.4Hz), 7.57(1H, s), 7.93(1H, d, J=3.6Hz), 8.24(1H, t, J=5.2Hz), 8.35(1H, d, J=8.8Hz), 8.67(1H, d, J=5.2Hz), 8.78(1H, s).
실시예
298
5-[6- 시아노 -7-(3- 디에틸아미노프로폭시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산 시클로프로필아미드
실시예 310과 같은 식으로 7-(3-디에틸아미노프로폭시)-4-(1H-인돌-5-일옥시)퀴놀린-6-카르보니트릴(0.5 g)로부터 표제 화합물(0.21 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.59-0.64(2H, m), 0.71-0.76(2H, m), 0.95(6H, t, J=7.2Hz), 1.87-1.95(2H, m), 2.43-2.49(4H, m), 2.59(2H, t, J=6.8Hz), 2.74-2.81(1H, m), 4.31(2H, t, J=6.0Hz), 6.46(1H, d, J=5.2Hz), 6.68(1H, d, J=3.6Hz), 7.19(1H, dd, J=2.4Hz, J=8.8Hz), 7.52(1H, d, J=2.4Hz), 7.56(1H, s), 7.90(1H, d, J=3.6Hz), 8.30(1H, d, J=3,2Hz), 8.35(1H, d, J=8.8Hz), 8.67(1H, d, J=5.2Hz), 8.78(1H, s).
실시예
299
5-[6- 시아노 -7-(3-( 피롤리딘 -1-일) 프로폭시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산 에틸아미드
실시예 310과 같은 식으로 7-(3-(피롤리딘-1-일)프로폭시)-4-(1H-인돌-5-일옥시)퀴놀린-6-카르보니트릴(100 mg)로부터 표제 화합물(31 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.18(3H, t, J=7.2Hz), 1.85-1.99(4H, m), 2.40-2.49(2H, m), 3.01-3.48(8H, m), 4.39(2H, t, J=6.0Hz), 6.50(1H, d, J=5.2Hz), 6.71(1H, d, J=3.6Hz), 7.18(1H, dd, J=2.4Hz, J=8.8Hz), 7.53(1H, d, J=2.4Hz), 7.62(1H, s), 7.96(1H, d, J=3.6Hz), 8.28(1H, t, J=5.2Hz), 8.36(1H, d, J=8.8Hz), 8.70(1H, d, J=5.2Hz), 8.82(1H, s).
실시예
300
5-[6- 시아노 -7-(3- 디에틸아미노프로폭시 )퀴놀린-4- 일옥시 ]인돌-1- 카르복실산(티아졸-2-일)아미드
실시예 312와 같은 식으로 7-(3-디에틸아미노-프로폭시)-4-(1H-인돌-5-일옥시)퀴놀린-6-카르보니트릴(80 mg)로부터 표제 화합물(5 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.00(6H, t, J=7.2Hz), 1.93-2.01(2H, m), 2.59(4H, q, J=7.2Hz), 2.72(2H, t, J=6.8Hz), 4.33(2H, t, J=6.0Hz), 6.51(1H, d, J=5.2Hz), 6.64(1H, d, J=3.6Hz), 6.98(1H, d, J=4.0Hz), 7.16(1H, dd, J=2.4Hz, J=8.8Hz), 7.40(1H, d, J=4.0Hz), 7.50(1H, d, J=2.4Hz), 7.58(1H, s), 8.09(1H, d, J=3.6Hz), 8.68(1H, d, J=5.2Hz), 8.70(1H, d, J=8.8Hz), 8.81(1H, s).
실시예
301
6-
시아노
-4-(1H-인돌-5-
일옥시
)-7-(피페리딘-4-일)
메틸옥시퀴놀린
6-시아노-4-(1H-인돌-5-일옥시)-7-[(1-(t-부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린(0.25 g, 0.5015 mmol)을 에탄올(2 ml), 테트라히드로푸란(2 ml)에 용해하고, 실온에서 진한 염산(0.2 ml)을 가하여, 그대로 17시간동안 교반했다. 용매를 감압 증류 수거하고, 포화중조수를 가하여, 이것을 테트라히드로푸란, 초산에틸의 혼합 용매로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 NH 실리카겔에 흡착시켜, NH 실리카겔에 의한 컬럼 크로마토그래피(초산에틸·메탄올계)로 정제하고, 생성된 결정을 에탄올에 현탁하여, 이것을 디에틸에테르, 헥산으로 희석했다. 결정을 여과 수취하고, 디에틸에테르로 세척하여, 흡인 건조시킴으로써, 담황색 결정으로서 표제 화합물(15 mg, 0.0376 mmol, 7.51%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.23-1.29(2H, m), 1.74-1.77(2H, m), 1.95(1H, brs), 2.48-2.55(2H, m), 2.97-3.00(2H, m), 4.12(2H, d, J=5.6Hz), 6.43(1H, d, J=5.2Hz), 6.47(1H, s), 6.88(1H, dd, J=2.4, 9.2Hz), 7.45(1H, d, J=2.4Hz), 7.46(1H, s), 7.52(1H, d, J=9.2Hz), 7.57(1H, s), 8.66(1H, d, J=5.2Hz), 8.79(1H, s), 11.31(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
301-1
7-
벤질옥시
-6-
시아노
-4-(1H-인돌-5-
일옥시
)퀴놀린
7-벤질옥시-6-시아노-4-클로로퀴놀린(23 g, 78.03 mmol)을 N-메틸피롤리돈(15.8 ml)에 현탁시키고, 5-히드록시인돌(12.5 g, 83.64 mmol), 디이소프로필에틸아민(15.8 ml)을 가하여, 150℃에서 10시간동안 가열 교반했다. 실온으로 방냉한 후, 물, 테트라히드로푸란을 가하여, 결정을 완전히 용해시켰다. 테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거한 후, 잔사를 실리카겔에 흡착시켰다. 실리카겔 컬럼 크로마토그래피(헥산·테트라히드로푸란계)로 정제하고, 진한 염산(0.2 ml)을 가하여, 그대로 17시간동안 교반했다. 용매를 감압 증류 수거하여, 포화중조수를 가하고, 이것을 테트라히드로푸란, 초산에틸의 혼합 용매로 추출하여, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하여, 용매를 감압 증류 수거했다. 생성된 결정을 초산에틸에 현탁하여, 이것을 디에틸에테르, 헥산으로 희석했다. 결정을 여과 수취하여, 디에틸에테르·헥산으로 세척하고, 흡인 건조시킴으로써, 담황색 결정으로서 표제 화합물(12.5 g, 31.93 mmol, 40.92%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.45(2H, s), 6.44(1H, d, J=5.2Hz), 6.47(1H, m), 6.99(1H, dd, J=2.4, 8.8Hz), 7.37(1H, t, J=7.4Hz), 7.42-7.46(4H, m), 7.51-7.56(3H, m), 7.69(1H, s), 8.66(1H, d, J=5.2Hz), 8.82(1H, s), 11.29(1H, s).
제조예
301-2
6-
시아노
-4-(1H-인돌-5-
일옥시
)-7-
히드록시퀴놀린
7-벤질옥시-6-시아노-4-(1H-인돌-5-일옥시)퀴놀린(3 g, 76642 mmol)을 테트라히드로푸란(250 ml)에 용해하여, 10% 팔라듐-카본 분말(500 mg, 물 함유 제품)을 가하여, 수소 분위기하에서 실온에서 11시간동안 교반했다. 10% 팔라듐-카본 분말(300 mg, 물 함유 제품)을 추가하여, 수소 분위기하 실온에서 9시간동안 교반한 후, 또한 10% 팔라듐-카본 분말(200 mg, 물 함유 제품)을 추가하여, 수소 분위기하에서 실온에서 5시간동안 교반했다. 촉매를 여과 제거하여, 이것을 에탄올로 세척한 후, 여과액을 감압 증류 수거했다. 생성된 결정을 에탄올에 현탁하고, 이것을 헥산으로 희석하여, 결정을 여과 수취하고, 헥산:에탄올=3:1로 세척하여, 흡인 건조시킴으로써, 담황색 결정으로서 표제 화합물(1.82 g, 6.0402 mmol, 79.12%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.34(1H, d, J=5.4Hz), 6.46(1H, m), 6.98(1H, dd, J=2.4, 8.8Hz), 7.40-7.46(3H, m), 7.51(1H, d, J=8.8Hz), 8.58(1H, d, J=5.4Hz), 8.70(1H, s), 11.29(1H, s), 11.58(1H, s).
제조예
301-3
6- 시아노 -4-(1H-인돌-5- 일옥시 )-7-[(1-( tert - 부톡시카르보닐옥시 )피페리딘-4-일)메틸옥시]퀴놀린
6-시아노-4-(1H-인돌-5-일옥시)-7-히드록시퀴놀린(1.72 g, 5.7084 mmol)을 N,N-디메틸포름아미드(20 ml)에 용해하고, 탄산칼륨(0.87 g, 6.2792 mmol), tert-부틸 4-브로모메틸피페리딘-1-카르복실레이트(1.75 g, 6.2792 mmol)를 가하여, 70℃에서 7시간동안 가열 교반했다. 실온으로 방냉한 후, 물을 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거한 후, 잔사를 실리카겔에 흡착시켰다. 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 생성된 황색 유상물에 초산에틸·에탄올·헥산을 가하여, 결정을 석출시켰다. 결정을 여과 수취하여, 헥산:에탄올=10:1로 세척하고, 흡인 건조시킴으로써, 담황색 결정으로서 표제 화합물(1.786 g, 3.3852 mmol, 59.30%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.20-1.33(2H, m), 1.39(9H, s), 1.78-1.82(2H, m), 2.06(1H, m), 2.78(2H, m), 3.98-4.02(2H, n), 4.17(2H, d, J=6.4Hz), 6.43(1H, d, J=5.2Hz), 6.49(1H, s), 6.98(1H, dd, J=2.4Hz, 8.8Hz), 7.44-7.46(2H, m), 7.51(1H, d, J=8.8Hz), 7.58(1H, s), 8.66(1H, d, J=5.2Hz), 8.79(1H, s), 11.30(1H, s).
실시예
302
6-
시아노
-4-(1H-인돌-5-
일옥시
)-7-[(1-
메틸피페리딘
-4-일)
메틸옥시
]퀴놀린
6-시아노-4-(1H-인돌-5-일옥시)-7-[(1-메틸피페리딘-4-일)메틸옥시]퀴놀린(30 mg, 0.0753 mmol)을 테트라히드로푸란(2.5 ml), 메탄올(2.5 ml)에 용해하여, 초산(0.009 ml), 포르말린 수용액(0.047 ml, 0.5648 mmol, 12N)을 가했다. 또한 실온에서 나트륨시아노보로히드라이드(10 mg)를 가하여, 실온에서 1시간동안 교반했다. 포화중조수를 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거한 후, 잔사를 NH 실리카겔에 흡착시켰다. NH 실리카겔 컬럼 크로마토그래피(초산에틸:메탄올=10:1)로 정제하여, 생성된 결정을 디에틸에테르에 현탁시켰다. 결정을 여과 수취하고, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(7 mg, 0.0170 mmol, 22.54%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.35-1.44(2H, m), 1.76-1.91(5H, m), 2.15(3H, s), 2.78-2.82(2H, m), 4.14(2H, d, J=6.0Hz), 6.42(1H, d, J=5.2Hz), 6.47(1H, s), 6.98(1H, dd, J=2.4, 8.8Hz), 7.44-7.46(2H, m), 7.51(1H, d, J=8.8Hz), 7.57(1H, s), 8.66(1H, d, J=5.2Hz), 8.78(1H, s), 11.31(1H, s).
실시예
303
6- 시아노 -4-(1- 에틸카르바모일인돌 -5- 일옥시 )-7-[(피페리딘-4-일) 메틸옥시 ]퀴놀린
6-시아노-4-(1-에틸카르바모일인돌-5-일옥시)-7-[(1-(t-부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린(180 mg, 0.0753 mmol)을 트리플루오로초산(1 ml)에 용해하여, 실온에서 0.5시간동안 교반했다. 포화중조수를 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거한 후, 생성된 비결정질 물질에 에탄올을 가하여 결정화시켰다. 이것을 헥산으로 희석시킨 후 결정을 여과 수취하고, 헥산으로 세척하여, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(132 mg, 0.2811 mmol, 88.96%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.18(3H, t, J=7.2Hz), 1.50-1.59(2H, m), 1.96-2.01(2H, m), 2.21(1H, brs), 2.93-2.99(2H, m), 3.28-3.37(4H, m), 4.22(2H, d, J=6.0Hz), 6.49(1H, d, J=5.6Hz), 6.71(1H, d, J=3.6Hz), 7.17(1H, dd, J=2.4, 8.8Hz), 7.53(1H, d, J=2.4Hz), 7.64(1H, s), 7.95(1H, d, J=8.8Hz), 8.26(1H, t, J=5.4Hz), 8.36(1H, d, J=8.8Hz), 8.42(1H, brs), 8.69(1H, d, J=5.6Hz), 8.81(1H, s).
출발 원료는 다음과 같은 식으로 합성했다.
제조예
303-1
6- 시아노 -4-(1- 에틸카르바모일인돌 -5- 일옥시 )-7-[(1-(t- 부톡시카르보닐옥시 )피페리딘-4-일)메틸옥시]퀴놀린
6-시아노-4-(1H-인돌-5-일옥시)-7-[(1-(t-부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린(350 mg, 0.7062 mmol), 페닐 N-에틸카르바메이트(140 mg)를 이용하여 실시예 310과 같은 식의 반응에 의해, 무색 결정으로서 표제 화합물(180 mg, 0.3160 mmol, 44,74%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.18(3H, t, J=7.0Hz), 1.18-1.35(2H, m), 1.40(9H, s), 1.78-1.82(2H, m), 2.16(1H, m), 2.79(2H, m), 3.32(2H, q, J=7.0Hz), 3.98-4.02(2H, m), 4.18(2H, d, J=6.0Hz), 6.48(1H, d, J=5.2Hz), 6.70(1H, d, J=3.8Hz), 7.18(1H, dd, J=2.4, 9.2Hz), 7.52(1H, d, J=2.4Hz), 7.59(1H, s), 7.93(1H, d, J=3.8Hz), 8.22(1H, brs), 8.35(1H, d, J=9.2Hz), 8.68(1H, d, J=5.2Hz), 8.79(1H, s).
실시예
304
6- 시아노 -4-(1- 에틸카르바모일인돌 -5- 일옥시 )-7-[(1- 메틸피페리딘 -4-일) 메틸옥시]퀴놀린
6-시아노-4-(1-에틸카르바모일인돌-5-일옥시)-7-[(피페리딘-4-일)메틸옥시]퀴놀린(122 mg, 0.2598 mmol)을 이용하여 실시예 302와 같은 식의 반응을 한 후, NH 실리카겔 컬럼 크로마토그래피(초산에틸:메탄올=10:1)로 정제했다. 생성된 결정을 에탄올에 현탁하고, 헥산으로 희석하여, 결정을 여과 수취하고, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(28 mg, 0.0579 mmol, 22.29%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.20(3H, t, J=7.2Hz), 1.38-1.47(2H, m), 1.78-1.93(5H, m), 2.18(3H, s), 2.80-2.84(2H, m), 3.33-3.37(2H, m), 4.17(2H, d, J=6.0Hz), 6.49(1H, d, J=5.2Hz), 6.72(1H, d, J=3.6Hz), 7.20(1H, dd, J=2.4, 9.2Hz), 7.54(1H, d, J=2.4Hz), 7.60(1H, s), 7.95(1H, d, J=3.6Hz), 8.25(1H, m), 8.37(1H, d, J=9.0Hz), 8.70(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
305
6- 시아노 -4-(1- 시클로프로필카르바모일인돌 -5- 일옥시 )-7-[(피페리딘-4-일) 메틸옥시]퀴놀린
6-시아노-4-(1-시클로프로필카르바모일인돌-5-일옥시)-7-[(1-(t-부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린(965 mg, 1.6590 mmol)을 이용하여 실시예 301과 같은 식으로, 담황색 결정으로서 표제 화합물(962 mg, quant.)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.60-0.64(2H, m), 0.71-0.74(2H, m), 1.50-1.60(2H, m), 1.96-2.00(2H, m), 2.21(1H, m), 2.75-2.81(1H, m), 2.90-2.98(2H, m), 3.28-3.36(2H, m), 4.21(2H, d, J=6.0Hz), 6.49(1H, d, J=5.2Hz), 6.69(1H, d, J=3.8Hz), 7.19(1H, dd, J=2,4Hz, 8.8Hz), 7.52(1H, d, J=2.4Hz), 7.64(1H, s), 7.92(1H, d, J=3.8Hz), 8.33(1H, m), 8.36(1H, d, J=8.8Hz), 8.51(1H, brs), 8.69(1H, d, J=5.2Hz), 8.81(1H, s).
출발 원료는 다음과 같은 식으로 합성했다.
제조예
305-1
6- 시아노 -4-(1- 시클로프로필카르바모일인돌 -5- 일옥시 )-7-[(1-(t- 부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린
6-시아노-4-(1H-인돌-5-일옥시)-7-[(1-(t-부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린(1.0 g, 2.0056 mmol), 페닐 N-시클로프로필카르바메이트(426 mg)를 이용하여 실시예 310과 같은 식의 반응에 의해, 담적색 결정으로서 표제 화합물(965 mg, 1.6590 mmol, 82.72%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.59-0.64(2H, m), 0.71-0.76(2H, m), 1.21-1.33(2H, m), 1.40(9H, s), 1.78-1.82(2H, m), 2.07(1H, m), 2.40-2.70(3H, m), 3.95-4.15(2H, m), 4.18(2H, d, J=6.0Hz), 6.48(1H, d, J=5.2Hz), 6.80(1H, d, J=3.6Hz), 7.19(1H, dd, J=2.4Hz, 8.8Hz), 7.52(1H, d, J=2.4Hz), 7.59(1H, s), 7.90(1H, d, J=3.6Hz), 8.29(1H, brs), 8.35(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.79(1H, s).
실시예
306
6- 시아노 -4-(1- 시클로프로필카르바모일인돌 -5- 일옥시 )-7-[(1- 메틸피페리딘 -4-일)메틸옥시]퀴놀린
6-시아노-4-(1-시클로프로필카르바모일인돌-5-일옥시)-7-[(피페리딘-4-일)메틸옥시]퀴놀린(862 mg, 1.7900 mmol)을 이용하여 실시예 302와 같은 식의 방법에 의해, 무색 결정으로서 표제 화합물(335 mg, 0.6760 mmol, 37.76%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.59-0.64(2H, m), 0.71-0.76(2H, m), 1.35-1.45(2H, m), 1.76-1.91(5H, m), 2.16(3H, s), 2.74-2.82(3H, m), 4.15(2H, d, J=6.0Hz), 6.47(1H, d, J=5.2Hz), 6.68(1H, d, J=3.8Hz), 7.19(1H, dd, J=2.4Hz, 8.8Hz), 7.52(1H, d, J=2.4Hz), 7.58(1H, s), 7.90(1H, d, J=3.8Hz), 8.30(1H, d, J=2.4Hz), 8.35(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.78(1H, s).
실시예
307
6- 시아노 -7-[(피페리딘-4-일) 메틸옥시 ]-4-[1-(2- 티아졸릴카르바모일 )인돌-5-일옥시]퀴놀린
6-시아노-4-[1-(2-티아졸릴카르바모일)인돌-5-일옥시]-7-[(1-(t-부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린(220 mg, 0.3522 mmol)을 이용하여 실시예 301과 같은 식의 방법에 의해, 무색 결정으로서 표제 화합물(114 mg, 0.2136 mmol)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.50-1.60(2H, m), 1.97-2.01(2H, m), 2.22(1H, brs), 2.93-2.99(2H, m), 3.31-3.37(2H, m), 4.22(2H, d, J=5.6Hz), 6.53(1H, d, J=5.2Hz), 6.70(1H, d, J=3.0Hz), 7.09(1H, d, J=4.2Hz), 7.20(1H, dd, J=2.4Hz, 8.8Hz), 7.47(1H, d, J=4.2Hz), 7.53(1H, d, J=2.4Hz), 7.65(1H, s), 8.09(1H, d, J=3.0Hz), 8.10-8.67(1H, brs), 8.67(1H, d, J=8.8Hz), 8.70(1H, d, J=5.2Hz), 8.83(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
307-1
6- 시아노 -4-[1-(2- 티아졸릴카르바모일 )인돌-5- 일옥시 ]-7-[(1-(t- 부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린
6-시아노-4-(1H-인돌-5-일옥시)-7-[(1-(t-부톡시카르보닐옥시)피페리딘-4-일)메틸옥시]퀴놀린(300 mg, 0.6017 mmol), 수소화나트륨(51 mg, 1.2636 mmol, 오일중 60%), 페닐 N-(2-티아졸릴)카르바메이트(146 mg, 0.6619 mmol)를 이용하여 실시예 312와 같은 식의 반응에 의해, 담황색 결정으로서 표제 화합물(220 mg, 0.3522 mmol, 58.53%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.21-1.33(2H, m), 1.39(9H, s), 1.78-1.82(2H, m), 2.06(1H, m), 2.78(2H, m), 3.98-4.02(2H, m), 4.17(2H, d, J=6.4Hz), 6.51(1H, d, J=5.2Hz), 6.69(1H, d, J=3.4Hz), 7.08(1H, d, J=4.6Hz), 7.20(1H, dd, J=2.4Hz, 9.2Hz), 7.47(1H, d, J=4.6Hz), 7.53(1H, d, J=2.4Hz), 7.59(1H, s), 8.08(1H, d, J=3.4Hz), 8.67(1H, d, J=9.2Hz), 8.69(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
308
6- 시아노 -7-[(1- 메틸피페리딘 -4-일) 메틸옥시 ]-4-[1-(2- 티아졸릴카르바모일 )인돌-5-일옥시]퀴놀린
6-시아노-7-[(피페리딘-4-일)메틸옥시]-4-[1-(2-티아졸릴카르바모일)인돌-5-일옥시]퀴놀린(104 mg, 0.1982 mmol)을 이용하여 실시예 302와 같은 식의 반응을 행하고, NH 실리카겔 컬럼 크로마토그래피(초산에틸:메탄올=10:1)로 정제하여, 생성된 결정을 에탄올에 현탁하고, 이것을 헥산으로 희석하여, 결정을 여과 수취하고, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(38 mg, 0.0705 mmol, 35.60%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.45-1.48(2H, m), 1.83-1.95(3H, m), 2.08-2.15(2H, m), 2.29(3H, s), 2.93-2.96(2H, m), 4.19(2H, d, J=5.6Hz), 6.53(1H, d, J=5.2Hz), 6.67(1H, d, J=3.4Hz), 7.01(1H, d, J=4.4Hz), 7.19(1H, dd, J=2.4Hz, 9.2Hz), 7.42(1H, d, J=4.4Hz), 7.53(1H, d, J=2.4Hz), 7.62(1H, s), 7.81(1H, d, J=3.4Hz), 8.71(1H, d, J=5.2Hz), 8.73(1H, d, J=9.2Hz), 8.83(1H, s).
실시예
309
6-
카르바모일
-4-(1H-인돌-5-
일옥시
)-7-
메톡시퀴놀린
6-카르바모일-4-클로로-7-메톡시퀴놀린(2.0 g, 8.4509 mmol), 5-히드록시인돌(1.68 g), 디이소프로필에틸아민(2.2 ml), N-메틸피롤리돈(2.2 ml)을 혼합하여, 150℃에서 5시간동안 가열 교반했다. 방냉한 후 일부 고화시킨 반응 용액을 디메틸설폭시드에 용해시킨 후, NH 실리카겔에 흡착시켜, NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제했다. 생성된 결정을 에탄올에 현탁시켜, 이것을 디에틸에테르, 헥산으로 희석시키고, 결정을 여과 수취하여, 디에틸에테르:헥산=1:5로 결정을 세척하고, 흡인 건조하여, 담황색 결정으로서 표제 화합물(1.291 g, 3.8698 mmol, 45.79%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.37(1H, d, J=5.2Hz), 6.46(1H, brs), 6.98(1H, dd, J=2.4Hz, 8.4Hz), 7.43-7.45(2H, m), 7.48(1H, s), 7.51(1H, d, J=8.4Hz), 7.71(1H, brs), 7.84(1H, brs), 8.58(1H, d, J=5.2Hz), 8.74(1H, s), 11.29(1H, s).
실시예
310
6- 카르바모일 -4-[1-(2,4- 디플루오로페닐카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(100 mg, 0.3 mmol)을 N,N-디메틸포름아미드(0.5 ml)에 용해하고, 빙냉하에, 수소화나트륨(12 mg, 0.3 mmol)을 가하여, 실온에서 15분간 교반했다. 이것에 페닐 N-(2,4-디플루오로페닐)카르바메이트(79 mg, 0.3150 mmol)를 가하여, 실온에서 2시간동안 교반했다. 반응 용액에 물을 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 여과액을 감압 증류 수거했다. 생성된 결정을 에탄올에 현탁시키고, 이것을 헥산으로 희석시킨 후 결정을 여과 수취하여, 헥산으로 결정을 세척하고, 흡인 건조한 후, 무색 결정으로서 표제 화합물(84 mg, 0.1718 mmol, 57.28%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 6.45(1H, J, J=5.2Hz), 6.81(1H, d, J=3.8Hz), 7.14-7.19(1H, m), 7.23(1H, dd, J=2.4Hz, 8.8Hz), 7.39-7.49(1H, m), 7.51(1H, s), 7.50-7.58(2H, m), 7.72(1H, brs), 7.85(1H, brs), 8.11(1H, d, J=3.8Hz), 8.32(1H, d, J=8.8Hz), 8.62(1H, d, J=5.2Hz), 8.73(1H, s), 10.03(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
310-1
페닐
N-(2,4-
디플루오로페닐
)
카르바메이트
2,4-디플루오로아닐린(10 ml, 98.21 mmol)을 테트라히드로푸란(200 ml)에 용해하여, 이것에 실온에서 피리딘(8.7 ml, 108.33 mmol)을 가하여, 교반했다. 이것을 빙냉하고, 클로로포름산페닐(13.6 ml, 108.33 mmol)을 15분에 걸쳐 적하하여, 그 후 실온에서 24시간동안 교반했다. 반응 용액에 물을 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 여과액을 감압 증류 수거했다. 생성된 결정을 에탄올에 현탁하고, 이것을 헥산으로 희석시킨 후 결정을 여과 수취하여, 헥산으로 결정을 세척하고, 흡인 건조후, 연보라색 결정으로서 표제 화합물(21.00 g, 84.26 mmol, 85.80%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :7.05-7.12(1H, m), 7.19(2H, d, J=7.6Hz), 7.24(1H, t, J=7.6Hz), 7.33(1H, m), 7.41(2H, t, J=7.6Hz), 7.59-7.68(1H, m), 9.91(1H, brs).
실시예
311
6- 카르바모일 -4-[1-(4- 디플루오로페닐카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(100 mg, 0.3 mmol), 페닐 N-(4-플루오로페닐)카르바메이트(86 mg)를 이용하여 실시예 310과 같은 식의 반응을 행하여, 무색 결정으로서 표제 화합물(60 mg, 0.1275 mmol, 42.51%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 6.45(1H, d, J=5.2Hz), 6.79(1H, d, J=3.6Hz), 7.21-7.26(3H, m), 7.51(1H, s), 7.57(1H, d, J=2.0Hz), 7.67(2H, dd, J=5.2Hz, 8.8Hz), 7.73(1H, brs), 7.85(1H, brs), 8.13(1H, d, J=3.6Hz), 8.33(1H, d, J=8.8Hz), 8.62(1H, d, J=5.2Hz), 8.73(1H, s), 10.16(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
311-1
페닐
N-(4-
디플루오로페닐
)
카르바메이트
4-플루오로아닐린(5 ml, 52.78 mmol)을 이용하여 제조예 310-1과 같은 방법에 의해, 연보라색 결정으로서 표제 화합물(10.031 g, 43.38 mmol, 82.19%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :7.13-7.27(5H, m), 7.39-7.44(2H, m), 7.48-7.52(2H, m), 10.26(1H, s).
실시예
312
6- 카르바모일 -4-[1-(2- 티아졸릴카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
수소화나트륨(50 mg, 1.2524 mmol)을 N,N-디메틸포름아미드(0.5 ml)에 현탁시키고, 여기에 실온에서 페닐 N-(2,4-디플루오로페닐)카르바메이트(79 mg, 0.3150 mmol), 이어서 6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(200 mg, 0.5964 mmol)을 가하여, 실온에서 10시간동안 교반했다. 이 반응 용액에 물, 포화식염수를 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 여과액을 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼(헥산-테트라히드로푸란계)에 가하였다. 생성된 결정을 1적(滴)의 디메틸설폭시드로 적신 후에 에탄올에 현탁시킨 후 결정을 여과 수취하고, 에탄올로 결정을 세척하여, 흡인 건조후, 담황색 결정으로서 표제 화합물(138 mg, 0.3003 mmol, 50.36%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 6.46(1H, d, J=5.2Hz), 6.69(1H, d, J=3.6Hz), 7.09(1H, d, J=4.4Hz), 7.20(1H, dd, J=2.4Hz, 8.8Hz), 7.47(1H, d, J=4.4Hz), 7.51(1H, s), 7.52(1H, d, J=2.4Hz), 7.73(1H, brs), 7.86(1H, brs), 8.08(1H, d, J=3.6Hz), 8.62(1H, d, J=5.2Hz), 8.67(1H, d, J=8.8Hz), 8.74(1H, s), 13.16(1H, s).
실시예
313
6- 카르바모일 -4-(1- 시클로프로필카르바모일 -1H-인돌-5- 일옥시 )-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(100 g, 0.3 mmol), 페닐 N-(4-플루오로페닐)카르바메이트(56 mg)를 이용하여 실시예 310과 같은 식의 반응을 행하여, 무색 결정으로서 표제 화합물(35 mg, 0.0840 mmol, 28.02%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.62(2H, m), 0.73(2H, m), 2.78(1H, m), 4.02(3H, s), 6.42(1H, d, J=5.2Hz), 6.68(1H, d, J=3.2Hz), 7.18(1H, d, J=9.0Hz), 7.50(2H, m), 7.73(1H, s), 7.85(1H, s), 7.89(1H, d, J=3.2Hz), 8.30(1H, s), 8.34(1H, d, J=9.0Hz), 8.61(1H, d, J=5.2Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
313-1
페닐
N-
시클로프로필카르바메이트
시클로프로필아민(3 ml, 43.29 mmol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하여, 생성된 결정을 디에틸에테르:헥산=1:2에 현탁시키고, 결정을 여과 수취하여, 디에틸에테르:헥산=1:2로 세척하고, 흡인 건조시킴으로써, 담황색 결정으로서 표제 화합물(5.832 g, 32.91 mmol, 76.03%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) :0.60-0.65(2H, m), 0.76-0.80(2H, m), 2.69(1H, brs), 5.23(1H, brs), 7.13(2H, d, J=7.6Hz), 7.19(1H, t, J=7.6Hz), 7.35(2H, t, J=7.6Hz).
실시예
314
6- 카르바모일 -4-[1-(2- 플루오로에틸카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
실시예
315
4-[1-(2- 플루오로에틸카르바모일 )1H-인돌-5- 일옥시 ]-6-(2- 플루오로에틸우레이도카르바모일)-7-메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(800 mg, 2.3998 mmol), 수소화나트륨(104 mg, 2.5918 mmol), 페닐 N-(2-플루오로에틸)카르바메이트(483 mg, 2.6398 mmol)를 이용하여 실시예 310과 같은 식의 반응을 행하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼 크로마토그래피(초산에틸·테트라히드로푸란·메탄올계)에 가하여, 원료를 제거한 후, 생성된 것을 또 NH-실리카겔에 흡착시켜, NH-실리카겔 컬럼 크로마토그래피(초산에틸·테트라히드로푸란·메탄올계)에 가하여, 저극성, 고극성 각각의 화합물을 결정으로서 얻었다. 이들을 각각 에탄올에 현탁시키고, 이것을 헥산으로 희석했다. 결정을 여과 수취하고, 헥산으로 결정을 세척하여, 흡인 건조한 후, 무색 결정으로서 저극성 화합물 4-[1-(2-플루오로에틸카르바모일)-1H-인돌-5-일옥시]-6-(2-플루오로에틸우레이도카르바모일)-7-메톡시퀴놀린(49 mg, 0.0958 mmol, 3.99%)을, 또, 담황색 결정으로서 고극성 화합물 6-카르바모일-4-[1-(2-플루오로에틸카르바모일)1H-인돌-5-일옥시]-7-메톡시퀴놀린(632 mg, 1.4961 mmol, 62.34%)을 얻었다.
저극성
(
실시예
315)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.59(4H, m), 4.01(3H, s), 4.47(1H, m), 4.53(1H, m), 4.59(1H, m), 4.65(1H, m), 6.46(1H, d, J=4.4Hz), 6.73(1H, d, J=2.0Hz), 7.19(1H, d, J=8.8Hz), 7.53(2H, s), 7.97(1H, d, J=2.0Hz), 8.35(1H, d, J=8.8Hz), 8.50(1H, m), 8.51(1H, s), 8.63(1H, m), 8.64(1H, d, J=4.4Hz), 10.62(1H, s).
고극성
(
실시예
314)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.56(1H, dt, J=5.0Hz, 5.0Hz), 3.63(1H, dt, J=5.0Hz, 5.0Hz), 4.02(3H, s), 4.53(1H, t, J=5.0Hz), 4.65(1H, t, J=5.0Hz), 6.43(1H, d, J=5.2Hz), 6.73(1H, d, J=3.8Hz), 7.19(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.52(1H, d, J=2.4Hz), 7.72(1H, brs), 7.85(1H, brs), 7.98(1H, d, J=3.8Hz), 8.35(1H, d, J=8.8Hz), 8.49(1H, t, J=5.0Hz), 8.61(1H, d, J=5.2Hz), 8.72(1H, s).
한편, 출발 원료는 다음과 같이 합성했다.
제조예
314-1
페닐
N-(2-
플루오로에틸
)
카르바메이트
2-플루오로에틸아민(0.5 g, 5.0321 mmol)을 디메틸포름아미드(10 ml)에 용해하고, 실온에서 피리딘(0.87 ml, 10.5674 mmol)을 가하여 교반했다. 이것을 빙냉하여, 클로로포름산페닐(0.67 ml, 5.2837 mmol)을 적하하고, 적하 종료후 실온에서 2.5시간동안 교반했다. 반응액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척, 무수황산마그네슘으로 건조하여, 용매를 감압 증류 수거했다. 잔사를 실리카겔 컬럼 크로마토그래피(헥산:초산에틸=2:1)로 정제하여, 담황색 결정으로서 표제 화합물(0.797 g, 4.3509 mmol, 86.46%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.55(1H, q, J=4.8Hz), 3.62(1H, q, J=4.8Hz), 4.51(1H, t, J=4.8Hz), 4.62(1H, t, J=4.8Hz), 5.39(1H, brs), 7.13(2H, d, J=7.6Hz), 7.21(1H, t, J=7.6Hz), 7.37(2H, t, J=7.6Hz).
실시예
316
6-
카르바모일
-4-(1-
에틸카르바모일
-1H-인돌-5-
일옥시
)-7-
메톡시퀴놀린
실시예
317
4-(1- 에틸카르바모일 -1H-인돌-5- 일옥시 )-6- 에틸우레이도카르바모일 -7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(1.2 g, 3.6141 mmol), 페닐 N-4-에틸카르바메이트(822 mg, 4.9761 mmol), 수소화나트륨(195 mg, 4.8799 mmol)을 이용하여 실시예 310과 같은 식의 반응을 행하여, 무색 결정으로서 각각 저극성 화합물 4-(1-에틸카르바모일-1H-인돌-5-일옥시)-6-에틸우레이도카르바모일-7-메톡시퀴놀린(105 mg, 0.2208 mmol, 6.11%)을, 고극성 화합물 6-카르바모일-4-(1-에틸카르바모일-1H-인돌-5-일옥시)-7-메톡시퀴놀린(506 mg, 1.2511 mmol, 34.62%)을 얻었다.
저극성
(
실시예
317)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.11(3H, t, J=7.2Hz),1.77(3H, t, J=7.2Hz), 3.23(2H, q, J=7.2Hz), 3.29(2H, q, J=7.2Hz), 4.01(3H, s), 6.45(1H, d, J=5.2Hz), 6.70(1H, d, J=3.6Hz), 7.17(1H, dd, J=2.4Hz, 8.8Hz), 7.51(1H, d, J=2.4Hz), 7.52(1H, s), 7.93(1H, d, J=3.6Hz), 8.24(1H, t, J=5.6Hz), 8.35(1H, d, J=8.8Hz), 8.44(1H, m), 8.52(1H, s), 8.64(1H, d, J=5.2Hz), 10.46(1H, s).
고극성
(
실시예
316)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.18(3H, t, J=7.2Hz), 3.32(2H, q, J=7.2Hz), 4.02(3H, s), 6.42(1H, d, J=5.2Hz), 6.70(1H, d, J=3.6Hz), 7.17(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.51(1H, d, J=2.4Hz), 7.71(1H, brs), 7.84(1H, brs), 7.93(1H, d, J=3.6Hz), 8.23(1H, t, J=5.6Hz), 8.34(1H, d, J=8.8Hz), 8.61(1H, d, J=5.2Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
316-1
페닐
N-
에틸카르바메이트
에틸아민염산염(20.3 g, 0.25 mol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하여, 생성된 결정을 헥산에 현탁시키고, 결정을 여과 수취하여, 헥산 세척하고, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(33.33 g, 0.2018 mol, 80.71%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.21(3H, t, J=7.2Hz), 3.31(2H, m), 5.02(1H, brs), 7.12(2H, d, J=7.6Hz), 7.19(1H, t, J=7.6Hz), 7.35(2H, t, J=7.6Hz).
실시예
318
6-
카르바모일
-7-
메톡시
-4-(1-
프로필카르바모일
-1H-인돌-5-
일옥시
)퀴놀린
실시예
319
7- 메톡시 -4-(1- 프로필카르바모일 -1H-인돌-5- 일옥시 )-6- 프로필우레이도카르바모일퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(400 mg, 1.2 mmol), 페닐 N-노르말프로필카르바메이트(237 mg, 1.3199 mmol), 수소화나트륨(55 mg, 1.3199 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 담황색 결정으로서 각각 저극성 화합물 7-메톡시-4-(1-프로필카르바모일-1H-인돌-5-일옥시)-6-프로필우레이도카르바모일퀴놀린(49 mg, 0.0973 mmol, 8.11%)을, 고극성 화합물 6-카르바모일-7-메톡시-4-(1-노르말프로필카르바모일-1H-인돌-5-일옥시)퀴놀린(218 mg, 0.5210 mmol, 43.41%)을 얻었다.
저극성
(
실시예
319)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.89(3H, t, J=7.2Hz), 0.91(3H, t, J=7.2Hz), 1.51(2H, q, J=7.2Hz), 1.59(2H, q, J=7.2Hz), 3.18(2H, t, J=7.2Hz), 3.25(2H, t, J=7.2Hz), 4.02(3H, s), 6.45(1H, d, J=5.2Hz), 6.70(1H, d, J=3.6Hz), 7.27(1H, dd. J=2.4Hz, 8.8Hz), 7.51(1H, d, J=2.4Hz), 7.52(1H, s) 7.95(1H, d, J=3.6Hz), 8.22(1H, m), 8.34(1H, d, J=8.8Hz), 8.47(1H, brs), 8.54(1H, s), 8.64(1H, d, J=5.2Hz), 10.45(1H, s).
고극성
(
실시예
318)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.92(3H. t, J=7.2Hz), 1.58(2H, q, J=7.2Hz), 3.24(2H, q, J=7.2Hz), 4.02(3H, s), 6.42(1H, d, J=5.2Hz), 6.70(1H, d, J=3.6Hz), 7.17(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.51(1H, d, J=2.4Hz), 7.72(1H, brs), 7.49(1H, brs), 7.95(1H, d, J=3.6Hz), 8.23(1H, t, J=5.2Hz), 8.34(1H, d, J=8.8Hz), 8.61(1H, d, J=5.2Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
318-1
페닐
N-(n-프로필)
카르바메이트
n-프로필아민(4.1 ml, 50 mmol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하여, 생성된 결정을 헥산에 현탁시키고, 결정을 여과 수취하여, 헥산 세척하고, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(4.502 g, 25.12 mmol, 50.24%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :0.86(3H, t, J=7.4Hz), 1.41-1.50(2H, m), 3.00(2H, q, J=6.8Hz), 7.06(2H, d, J=8.0Hz), 7.17(1H, t, J=8.0Hz), 7.36(2H, t, J=8.0Hz), 7.72(1H, m).
실시예
320
6- 카르바모일 -7- 메톡시 -4-[1-(1- 메틸 ) 에틸카르바모일 -1H-인돌-5- 일옥시 ]퀴놀린
실시예
321
7- 메톡시 -4-[1-(1- 메틸 ) 에틸카르바모일 -1H-인돌-5- 일옥시 ]-6-(1- 메틸 ) 에틸우레이도카르바모일퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(400 mg, 1.2 mmol), 페닐 N-(1-메틸)에틸카르바메이트(237 mg), 수소화나트륨(55 mg, 1.3199 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 담황색 결정으로서 저극성 화합물 7-메톡시-4-[1-(1-메틸)에틸카르바모일-1H-인돌-5-일옥시]-6-(1-메틸)에틸우레이도카르바모일퀴놀린(62 mg, 0.1231 mmol, 10.26%)을, 또, 무색 결정으로서 고극성 화합물 6-카르바모일-7-메톡시-4-[1-(1-메틸)에틸카르바모일-1H-인돌-5-일옥시]퀴놀린(309 mg, 0.7384 mmol, 43.41%)을 얻었다.
무색 결정으로서 표제 화합물(60 mg, 0.1275 mmol, 61.54%)을 얻었다.
저극성
(
실시예
321)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.17(6H, d, J=5.8Hz), 1.22(6H, d, J=5.8Hz), 3.88(1H, m), 4.01(3H, s), 4.03(1H, m), 6.45(1H, d, J=5.4Hz), 6.69(1H, d, J=3.4Hz), 7.16(1H, dd, J=2.4Hz, 8.6Hz), 7.50(1H, d, J=2.4Hz), 7.52(1H, s), 7.98(1H, s), 7.99(1H, d, J=3.4Hz), 8.33(2H, m), 8.52(1H, s), 8.64(1H, d, J=5.4Hz), 10.46(1H, s).
고극성
(
실시예
320)
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.23(6H, d, J=6.4Hz), 4.00(1H, m), 4.33(3H, s), 6.42(1H, d, J=5.4Hz), 6.69(1H, d, J=3.6Hz), 7.17(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.51(1H, d, J=2.4Hz), 7.72(1H, brs), 7.85(1H, brs), 7.97(1H, s), 7.99(1H, d, J=3.5Hz), 8.33(1H, d, J=8.8Hz), 8.61(1H, d, J=5.4Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
320-1
페닐
N-(
iso
-프로필)
카르바메이트
i-프로필아민(4.3 ml, 50 mmol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하여, 생성된 결정을 헥산에 현탁시키고, 결정을 여과 수취하여, 헥산 세척하고, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(5.105 g, 28.48 mmol, 56.97%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.01(6H, d, J=6.4Hz), 3.58-3.67(1H, m), 7.07(2H, d, J=7.6Hz), 7.17(1H, t, J=7.6Hz), 7.35(2H, t, J=7.6Hz), 7.65(1H, m).
실시예
322
4-(1-
노르말부틸카르바모일
-1H-인돌-5-
일옥시
)-6-
카르바모일
-7-
메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(335 g, 1.0 mmol), 페닐 N-노르말부틸카르바메이트(213 mg, 1.1 mmol), 수소화나트륨(44 mg, 1.1 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 무색 결정으로서 표제 화합물(203 mg, 0.4694 mmol, 46.94%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.92(3H, t, J=7.2Hz), 1.36(2H, m), 1.55(2H, m), 3.29(2H, m), 4.02(3H, s), 6.42(1H, d, J=5.4Hz), 6.70(1H, d, J=3.6Hz), 7.17(1H, dd, J=2.4Hz, 8.8Hz), 7.50-7.52(2H, m), 7.73(1H, brs), 7.85(1H, brs), 7.94(1H, d. J=3.6Hz), 8.22(1H, t, J=5.4Hz), 8.34(1H, d, J=8.8Hz), 8.61(1H, d, J=5.4Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
322-1
페닐
N-(n-부틸)
카르바메이트
n-부틸아민(4.9 ml, 50 mmol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하여, 실리카겔 컬럼 크로마토그래피(헥산:초산에틸=4:1)로 정제함으로써, 무색 유상물로서 표제 화합물(8.11 g, 41.97 mmol, 71.97%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 0.95(3H, t, J=7.2Hz), 1.35-1.45(2H, m), 1.52-1.60(2H, m), 3.27(2H, q, J=7.2Hz), 5.01(1H, brs), 7.12(2H, d, J=7.2Hz), 7.19(1H, t, J=7.2Hz), 7.35(2H, t, J=7.2Hz).
실시예
323
6- 카르바모일 -4-[1-(1,1- 디메틸에틸카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(335 mg, 1.0 mmol), 페닐 N-(1,1-디메틸에틸)카르바메이트(213 mg, 1.1 mmol), 수소화나트륨(44 mg, 1.1 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 무색 결정으로서 표제 화합물(225 mg, 0.5203 mmol, 52.03%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.42(9H, s), 4.02(3H, s), 6.41(1H, d, J=5.0Hz), 6.65(1H, d, J=3.8Hz), 7.15(1H, dd, J=2.4Hz, 9.2Hz), 7.50(2H, s), 7.63(1H, s), 7.72(1H, brs), 7.85(1H, brs), 7.95(1H, d, J=3.8Hz), 8.26(1H, d, J=9.2Hz), 8.61(1H, d, J=5.0Hz), 8.73(1H, s).
출발 원료는 이하와 같이 합성했다.
제조예
323-1
페닐
N-(t-부틸)
카르바메이트
t-부틸아민(5.3 ml, 50 mmol)을 이용하여 제조예 310-1과 같은 식의 방법에 의해, 핑크색 결정으로서 표제 화합물(3.910 g, 20.23 mmol, 40.46%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.26(9H, s), 7.05(2H, d, J=8.0Hz), 7.16(1H, t, J=8.0Hz), 7.35(2H, t, J=8.0Hz), 7.53(1H, s).
실시예
324
6- 카르바모일 -4-[1-(3- 플루오로프로필카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(280 mg, 0.8349 mmol), 페닐 N-(3-플루오로프로필)카르바메이트(181 mg, 0.9184 mmol), 수소화나트륨(37 mg, 0.9184 mmol)을 이용하여 실시예 310과 같은 방법에 의해, 무색 결정으로서 표제 화합물(105 mg, 0.2406 mmol, 28.82%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.89-2.03(2H, m), 3.39(2H, m), 4.02(3H, s), 4.49(1H, t, J=6.0Hz), 4.61(1H, d, J=6.0Hz), 6.42(1H, d, J=5.2Hz), 6.71(1H, d, J=3.6Hz), 7.18(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.52(1H, d, J=2.4Hz), 7.72(1H, brs), 7.85(1H, brs), 7.94(1H, d, J=3.6Hz), 8.32(1H, t, J=5.4Hz), 8.34(1H, d, J=8.8Hz), 8.61(1H, d, J=5.2Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
324-1
페닐
N-(3-
플루오로프로필
)
카르바메이트
3-플루오로프로필아민염산염(0.92 g(wet), 8.10 mmol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하여, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제함으로써, 핑크색 결정으로서 표제 화합물(0.470 g, 2.3832 mmol, 29.42%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.96(1H, m), 2.03(1H, m), 3.44(2H, q, J=6.4Hz), 4.54(1H, t, J=5.6Hz), 4.65(1H, t, J=5.6Hz), 5.22(1H, brs), 7.12(2H, d, J=7.6Hz), 7.20(1H, t, J=7.6Hz), 7.36(2H, t, J=7.6Hz).
실시예
325
6- 카르바모일 -4-[1-(3- 클로로프로필카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(280 mg, 0.8349 mmol), 페닐 N-(3-클로로프로필)카르바메이트(197 mg, 0.9184 mmol), 수소화나트륨(37 mg, 0.9184 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 무색 결정으로서 표제 화합물(136 mg, 0.3003 mmol, 35.97%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.03(2H, q, J=6.4Hz), 3.42(2H, q, J=6.4Hz), 3.74(2H, t, J=6.4Hz), 4.02(3H, s), 6.42(1H, d, J=5.2Hz), 6.71(1H, d, J=3.6Hz), 7.18(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.52(1H, d, J=2.4Hz), 7.72(1H, brs), 7.85(1H, brs), 7.94(1H, d, J=3.6Hz), 8.30(1H, d, J=5.4Hz), 8.34(1H, d, J=8.8Hz), 8.61(1H, d, J=5.2Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
325-1
페닐
N-(3-
클로로프로필
)
카르바메이트
3-클로로프로필아민염산염(6.5 g, 50 mmol)을 이용하여, 제조예 310-1과 같은 식의 반응을 행하고, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 생성된 결정을 디에틸에테르에 현탁시키고, 헥산으로 희석하여, 결정을 여과 수취하고, 헥산 세척하여, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(4.316 g, 20.20 mmol, 40.40%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.91(2H, 5중선, J=6.0Hz), 3.18(2H, q, J=6.0Hz), 3.68(2H, t, J=6.0Hz), 7.08(2H, d, J=8.0Hz), 7.18(1H, t, J=8.0Hz), 7.35(2H, t, J=8.0Hz), 7.81(1H, t, J=6.0Hz).
실시예
326
6- 카르바모일 -4-[1-(3- 에톡시프로필카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(280 mg, 0.8349 mmol), 페닐 N-(3-에톡시프로필)카르바메이트(197 mg, 0.9184 mmol), 수소화나트륨(37 mg, 0.9184 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 무색 결정으로서 표제 화합물(103 mg, 0.2227 mmol, 26.67%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.01(3H, t, J=6.8Hz), 1.80(2H, t, J=6.8Hz), 3.34(2H, q, J=6.8Hz),3.39-3.46(4H, m), 4.02(3H, s), 6.24(1H, d, J=5.2Hz), 6.70(1H, d, J=3.6Hz), 7.18(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.51(1H, d, J=2.4Hz), 7.72(1H, brs), 7.85(1H, brs), 7.93(1H, d, J=3.6Hz), 8.22(1H, t, J=5.2Hz), 8.34(1H, d, J=8.8Hz), 8.61(1H, d, J=5.2Hz), 8.72(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
326-1
페닐
N-(3-
에톡시프로필
)
카르바메이트
3-에톡시프로필아민(6.0 ml, 50 mmol)을 디메틸포름아미드(100 ml)에 용해하여, 이하 제조예 310-1과 같은 식의 반응을 행하고, NH 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 담황색 유상물로서 표제 화합물(10.76 g, 48.19 mmol, 96.39%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.22(3H, t, J=7.0Hz), 1.85(2H, 5중선, J=6.0Hz), 3.40(2H, q, J=6.0Hz), 3.51(2H, q, J=7.0Hz), 3.56(2H, t, J=6.0Hz), 5.58(1H, brs), 7.12(2H, d, J=7.6Hz), 7.18(1H, t, J=7.6Hz), 7.35(2H, t, J=7.6Hz).
실시예
327
6- 카르바모일 -4-[1-(3- 디에틸아미노프로필카르바모일 )1H-인돌-5- 일옥시 ]-7-메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(240 mg, 0.7157 mmol), 페닐 N-(3-디에틸아미노프로필)카르바메이트(197 mg, 0.7872 mmol), 수소화나트륨(31 mg, 0.7872 mmol)을 이용하여 실시예 310과 같은 식의 반응을 행하여, 무색 결정으로서 표제 화합물(65 mg, 0.1328 mmol, 18.55%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.94(6H, t, J=7.2Hz), 1.69(2H, m), 2.42-2.48(6H, m), 3.27-3.30(2H, m), 4.02(3H, s), 6.42(1H, d, J=5.4Hz), 6.70(1H, d, J=3.6Hz), 7.17(1H, dd, J=2.4Hz, 8.8Hz), 7.50(1H, s), 7.51(1H, d, J=2.4Hz), 7.72(1H, brs), 7.84(1H, brs), 7.91(1H, d, J=3.6Hz), 8.26(1H, t, J=5.6Hz), 8.33(1H, d, J=8.8Hz), 8.61(1H, d, J=5.4Hz), 8.72(1H, s).
제조예
327-1
페닐
N-(3-
디에틸아미노프로필
)
카르바메이트
3-디에틸아미노프로필아민(7.9 ml, 50 mmol)을 디메틸포름아미드(100 ml)에 용해하여, 이하 제조예 310-1과 같은 식의 반응을 행하고, NH 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 담황색 유상물로서 표제 화합물(7.21 g, 28.80 mmol, 57.60%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) :1.06(6H, t, J=7.0Hz), 1.71(2H, 5중선, J=6.0Hz), 2.49-2.57(6H, m), 3.36(2H, q, J=6.Hz), 6.83(1H, brs), 7.12(2H, t, J=7.6Hz), 7.17(1H, t, J=7.6Hz), 7.34(2H, t, J=7.6Hz).
실시예
328
6-
카르바모일
-7-
메톡시
-4-[1-(3-
메틸티오프로필
)1H-인돌-5-
일옥시
]퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(280 mg, 0.8349 mmol), 페닐 N-(3-메틸티오프로필)카르바메이트(207 mg, 0.9184 mmol), 수소화나트륨(37 mg, 0.9184 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 무색 결정으로서 표제 화합물(177 mg, 0.3810 mmol, 45.64%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.84(2H, tt, J=6.8Hz, 6.8Hz), 2.48(3H, s), 2.55(2H, t, J=6.8Hz), 3.57(2H, m), 4.02(3H, s), 6.42(1H, d, J=5.0Hz), 6.70(1H, d, J=3.4Hz), 7.18(1H, d, J=8.8Hz), 7.50(1H, s), 7.51(1H, s), 7.72(1H, s), 7.85(1H, s), 7.94(1H, d, J=3.4Hz), 8.27(1H, brs), 8.34(1H, d, J=8.8Hz), 8.61(1H, d, J=5.0Hz), 8.72(1H, s).
제조예
328-1
페닐
N-(3-
메틸티오프로필
)
카르바메이트
3-메틸티오프로필아민(5.5 ml, 50 mmol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하고, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 황색 유상물로서 표제 화합물(10.486 g, 46.54 mmol, 93.08%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.89(2H, 5중선, J=6.8Hz), 2.12(3H, s), 2.58(2H, t, J=6.8Hz), 3.38(2H, q, J=6.8Hz), 5.21(1H, brs), 7.12(2H, t, J=7.6Hz), 7.19(1H, t, J=7.6Hz), 7.35(2H, t, J=7.6Hz).
실시예
329
6- 카르바모일 -4-[1-(2- 클로로에틸카르바모일 )1H-인돌-5- 일옥시 ]-7- 메톡시퀴놀린
6-카르바모일-4-(1H-인돌-5-일옥시)-7-메톡시퀴놀린(280 mg, 0.8349 mmol), 페닐 N-(2-클로로에틸)카르바메이트(184 mg, 0.9184 mmol), 수소화나트륨(37 mg, 0.9184 mmol)을 이용하여 실시예 310과 같은 식의 방법에 의해, 담황색 결정으로서 표제 화합물(36 mg, 0.0820 mmol, 9.82%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 4.03(2H, t, J=9.2Hz), 4.59(2H, t, J=9.2Hz), 6.44(1H, d, J=5.6Hz), 6.75(1H, d, J=3.6Hz), 7.24(1H, dd, J=2.4Hz, 8.8Hz), 7.51(1H, s), 7.57(1H, d, J=2.4Hz), 7.72(1H, brs), 7.76(1H, d, J=3.6Hz), 7.85(1H, brs), 8.38(1H, d, J=8.8Hz), 8.62(1H, d, J=5.6Hz), 8.72(1H, s).
제조예
329-1
페닐
N-(2-
클로로에틸
)
카르바메이트
2-클로로에틸아민염산염(5.8 g, 50 mmol)을 이용하여 제조예 310-1과 같은 식의 반응을 행하고, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 생성된 결정을 디에틸에테르·헥산에 현탁시키고, 결정을 여과 수취하고, 헥산으로 세척하여, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(6.088 g, 30.49 mmol, 60.99%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.38(2H, q, J=6.0Hz), 3.66(2H, t, J=6.0Hz), 7.09(2H, t, J=7.6Hz), 7.19(1H, t, J=7.6Hz), 7.36(2H, t, J=7.6Hz), 8.01(1H, t, J=6.0Hz).
실시예
330
4-[1-(2,4- 디플루오로페닐카르바모일 )-1H-인돌-5- 일옥시 ]-6,7- 디메톡시퀴놀린
4-(1H-인돌-5-일옥시)-6,7-디메톡시퀴놀린(40 mg, 0.1249 mmol, WO9717329에 기재)을 N,N-디메틸포름아미드(0.7 ml)에 용해하고, 수소화나트륨(10 mg)을 가하여, 실온에서 15분간 교반했다. 이것에 2,4-디플루오로페닐이소시아네이트(0.018 ml, 0.1561 mmol)를 가하여, 실온에서 2시간동안 교반했다. 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 여과액을 감압 증류 수거했다. 생성된 결정을 디에틸에테르:에탄올=10:1에 현탁시키고, 이것을 헥산으로 희석시킨 후 결정을 여과 수취하고, 디에틸에테르: 에탄올=10:1로 결정을 세척하여, 흡인 건조한 후, 무색 결정으로서 표제 화합물(35 mg, 0.0736 mmol, 58.94%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.06(3H, s), 4.07(3H, s), 6.44(1H, J, J=5.2Hz), 6.75(1H, d, J=4.0Hz), 6.94-7.20(2H, m), 7.23(1H, dd, J=2.4, 8.8Hz), 7.42-7.48(3H, m), 7.63(1H, s), 8.14-8.22(1H, m), 8.29(1H, d, J=8.8Hz), 8.47(1H, d, J=5.2Hz).
실시예
331-1
4-[1-(
페닐카르바모일
)-1H-인돌-5-
일옥시
]-6,7-
디메톡시퀴놀린
4-(1H-인돌-5-일옥시)-6,7-디메톡시퀴놀린(25 mg, 0.0780 mmol), 페닐이소시아네이트(0.013 ml, 0.117 mmol)를 이용하여 실시예 330과 같은 식의 반응을 행하고, 생성된 결정을 디에틸에테르:에탄올=10:1에 현탁시켜, 결정을 여과 수취하고, 디에틸에테르로 결정을 세척하여, 흡인 건조한 후, 무색 결정으로서 표제 화합물(11 mg, 0.0250 mmol, 32.09%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.03(3H, s), 4.12(3H, s), 6.45(1H, m), 6.73(1H, m), 7.16-7.27(2H, m), 7.38-7.43(3H, m), 7.65-7.69(3H, m), 7.97(2H, m), 8.08(1H, m), 8.43(1H, brs), 8.38(1H, d, J=8.8Hz).
실시예
331-2
4-[1-(2-
티아졸릴카르바모일
)-1H-인돌-5-
일옥시
]-6,7-
디메톡시퀴놀린
4-(1H-인돌-5-일옥시)-6,7-디메톡시퀴놀린(25 mg, 0.0780 mmol)을 N,N-디메틸포름아미드(0.4 ml)에 용해하여, 수소화나트륨(6 mg)을 가하고, 실온에서 15분간 교반했다. 이것에 페닐 N-(2-티아졸릴)카르바메이트(30 mg, 0.1362 mmol)를 가하여, 80℃에서 2시간동안 교반했다. 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 여과액을 감압 증류 수거했다. 잔사를 실리카겔 컬럼 크로마토그래피(헥산·초산에틸·에탄올계)에 가하여, 생성된 결정을 에탄올에 현탁시키고, 이것을 헥산으로 희석시킨 후 결정을 여과 수취하여, 헥산으로 결정을 세척하고, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(23 mg, 0.0515 mmol, 66.04%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.94(6H, s), 6.42(1H, d, J=5.2Hz), 6.68(1H, d, J=3.4Hz), 7.08(1H, d, J=4.0Hz), 7.17(1H, d, J=8.8Hz), 7.38(1H, s), 7.46-7.48(2H, m), 7.56(1H, s), 8.07(1H, d, J=3.4Hz), 8.43(1H, d, J=5.2Hz), 8.65(1H, d, J=8.8Hz), 13.13(1H, brs).
실시예
332
4-(1-
시클로프로필카르바모일
-1H-인돌-5-
일옥시
)-6,7-
디메톡시퀴놀린
4-(1H-인돌-5-일옥시)-6,7-디메톡시퀴놀린(50 mg, 0.1560 mmol), 수소화나트륨(8 mg, 0.1873 mmol), 페닐 N-시클로프로필카르바메이트(30 mg, 0.1716 mmol)를 이용하여 실시예 310과 같은 식의 반응을 행하여, 담적색 결정으로서 표제 화합물(30 mg, 0.0744 mmol, 47.64%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.71(2H, m), 0.94(2H, m), 2.91(1H, m), 4.06(3H, s), 4.07(3H, s), 5.79(1H, brs), 6.41(1H, d, J=5.2Hz), 6.63(1H, d, J=3.2Hz), 7.16(1H, dd, J=2.4Hz, 8.8Hz), 7.26(1H, s), 7.39-7.43(2H, m), 7.63(1H, s), 8.26(1H, d, J=8.8Hz), 8.45(1H, d, J=5.2Hz).
실시예
333
4-[1-(2-
플루오로에틸카르바모일
)1H-인돌-5-
일옥시
]-6,7-
디메톡시퀴놀린
4-(1H-인돌-5-일옥시)-6,7-디메톡시퀴놀린(75 mg, 0.3122 mmol), 수소화나트륨(13 mg, 0.3278 mmol), 페닐 N-(2-플루오로에틸)카르바메이트(45 mg, 0.3278 mmol)을 이용하여 실시예 310과 같은 식의 반응을 행하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)에 가하여, 무색 결정으로서 표제 화합물(24 mg, 0.0586 mmol, 18.78%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :3.56(1H, q, J=5.0Hz), 3.63(1H, q, J=5.0Hz), 3.92(3H, s), 3.96(3H, s), 4.53(1H, t, J=5.0Hz), 4.65(1H, t, J=5.0Hz), 6.39(1H, d, J=5.0Hz), 6.71(1H, d, J=3.8Hz), 7.17(1H, dd, J=2.0Hz, 8.8Hz), 7.40(1H, s), 7.49(1H, d, J=2.0Hz), 7.55(1H, s), 7.96(1H, d, J=3.8Hz), 8.34(1H, d, J=8.8Hz), 8.42(1H, d, J=5.0Hz), 8.48(1H, t, J=5.0Hz).
실시예
334
6,7-
디메톡시
-4-(5-(1-(4-
플루오로페닐카르보닐
)-
인돌릴)옥시
)퀴놀린
6,7-디메톡시-4-(5-인돌릴옥시)퀴놀린(25 mg, 0.0780 mmol, WO9717329, P.52에 기재)을 톨루엔(1.6 ml)에 용해하여, 4-플루오로페닐 이소시아네이트(22 ml, 0.1951 mmol, 2.5 eqM)를 가하고, 질소 분위기하에서 5시간 30분동안 가열 환류했다. 방냉후 반응액을 초산에틸로 희석하여, 포화식염수로 세척하고, 무수황산마그네슘으로 건조하여, 용매를 감압 증류 수거하고, 잔사를 실리카겔 컬럼 크로마토그래피(헥산-초산에틸계)로 정제했다. 생성된 결정을 에탄올에 현탁시켜, 이것을 헥산으로 희석시키고, 결정을 여과 수취하여, 헥산 세척하고, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(18 mg, 0.0393 mmol, 50.44%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.05(3H, s), 4.07(3H, s), 6.43(1H, d, J=5.6Hz), 6.72(1H, d, J=3.4Hz), 7.12(2H, t, J=8.8Hz), 7.22(1H, dd, J=2.0, 8.8Hz), 7.43(3H, m), 7.53(2H, m), 7.62(1H, d, J=3.6Hz), 7.63(1H, s), 8.29(1H, d, J=8.8Hz), 8.46(1H, d, J=5.6Hz).
실시예
335
6,7-
디메톡시
-4-[5-(1-(4-
플루오로페닐카르바모일
)-
인돌리닐)옥시
]퀴놀린
6,7-디메톡시-(4-(5-인돌리닐옥시)퀴놀린(20 mg, 0.0620 mmol)을 이용하여 실시예 334와 같은 식의 반응을 행함으로써, 담황색 결정으로서 표제 화합물(18 mg, 0.0392 mmol, 63.19%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.30(2H, t, J=8.4Hz), 4.05(3H, s), 4.06(3H, s), 4.12(2H, t, J=8.4Hz), 6.45(1H, d, J=5.2Hz), 6.47(1H, brs), 7.01-7.07(4H, m), 7.42(2H, dd, J=9.2, 13.2Hz), 7.43(1H, s), 7.57(1H, s), 8.04(1H, d, J=8.8Hz), 8.48(1H, d, J=5.2Hz).
중간체는 다음과 같이 합성했다.
제조예
335-1
6,7-
디메톡시
-4-(5-
인돌리닐옥시
)퀴놀린
6,7-디메톡시-4-(5-인돌릴옥시)퀴놀린(30 mg, 0.0780 mmol, WO9717329, P.52에 기재)을 트리플루오로초산(0.9 ml)에 용해하고, 빙냉하에 트리에틸실란(45 ml, 0.2808 mmol, 3.0 eqM)을 가하여, 질소 분위기하에서 실온에서 4시간 30분동안 교반했다. 방냉후 반응액을 초산에틸로 희석시키고, 포화중조수로 중화하여, 초산에틸로 추출하고, 포화식염수로 세척, 무수황산마그네슘으로 건조하여, 용매를 감압 증류 수거했다. 잔사를 실리카겔 컬럼 크로마토그래피(초산에틸-에탄올계)로 정제하여, 담황색 결정으로서 표제 화합물(20 mg, 0.0620 mmol, 66.28%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.08(2H, t, J=8.4Hz), 3.65(2H, t, J=8.4Hz), 4.06(6H, s), 6.48(1H, d, J=5.4Hz), 6.69(1H, d, J=8.4Hz), 6.84(1H, dd, J=1.6, 8.4Hz), 6.95(1H, d, J=1.6Hz), 7.49(1H, s), 7.60(1H, s), 8.48(1H, d, J=5.4Hz).
실시예
336
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3- 메틸티오프로필)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(40 mg, 0.088 mmol)와 3-(메틸티오)프로필아민으로부터 표제 화합물(35.7 mg, 0.077 mmol, 87.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.68(2H, m), 2.04(3H, s), 3.16(2H, m), 3.18-3.35(2H, m), 3.36(3H, s), 3.76-3.79(2H, m), 4.40-4.42(2H, m), 6.23(1H, t, J=5.6Hz), 6.48(1H, d, J=5.2Hz), 7.16(2H, d, J=9.2Hz), 7.52(2H, d, J=9.2Hz), 7.61(1H, s), 8.59(1H, s), 8.70(1H, d, J=4.0Hz), 8.75(1H, s).
실시예
337
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -(3- 메틸설포닐프로필)우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(50 mg, 0.11 mmol)와 3-(메탄설포닐)프로필아민으로부터 표제 화합물(32.4 mg, 0.065 mmol, 59.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.85(2H, m), 2.97(3H, s), 3.11(2H, m), 3.21(2H, m), 3.36(3H, s), 3.77(2H, m), 4.41(2H, m), 6.30(1H, m), 6.48(1H, d, J=5.6Hz), 7.16(2H, d, J=8.8Hz), 7.53(2H, d, J=8.8Hz), 7.61(1H, s), 8.67(1H, s), 8.70(1H, d, J=5.2Hz), 8.75(1H, s).
실시예
338
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 )- N' -( 메틸설포닐 ) 우레아
질소 분위기하에, 수소화나트륨(11 mg, 0.275 mmol)을 테트라히드로푸란(8 ml)에 현탁시키고, 빙수욕 냉각하에 메탄설포닐아미드(31.4 mg, 0.330 mmol)를 가한 후, 실온에서 10분동안 교반했다. 페닐 N-(4-(6-시아노-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(50 mg, 0.110 mmol)를 가하여 60℃에서 1시간동안 교반했다. 불용물을 여과 제거하여, 감압 농축한 후, 테트라히드로푸란-헥산(1:2)을 가하여 결정화시켜, 표제 화합물(37.6 mg, 0.082 mmol, 75.0%)을 회백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.75(3H, s), 3.36(3H, s), 3.77(2H, m), 4.41(2H, m), 6.47(1H, d, J=5.2Hz), 7.05(1H, d, J=8.8Hz), 7.61(2H, d, J=8.8Hz), 7.64(1H, s), 8.44(1H, s), 8.69(2H, d, J=5.2Hz), 8.75(1H, s).
실시예
339
메틸 4-(4-(((4- 플루오로아닐리노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6- 퀴놀린카르복실레이트
실시예 10과 같은 식의 수법에 의해, 4-(4-아미노페녹시)-7-메톡시-6-메톡시카르보닐퀴놀린(486 mg, 1.5 mmol)과 4-플루오로페닐 이소시아네이트로부터 표제 화합물(600 mg, 1.3 mmol, 86.8%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.85(3H, s), 3.96(3H, s), 6.46(1H, d, J=5.2Hz), 7.12(2H, m), 7.23(2H, d, J=8.8Hz), 7.46(2H, m), 7.51(1H, s), 7.58(2H, d, J=8.8Hz), 8.59(1H, s), 8.67(1H, d, J=5,2Hz), 8.73(1H, s), 8.82(1H, s).
출발 물질은 다음의 방법으로 합성했다.
제조예
339-1
7-
메톡시
-6-
메톡시카르보닐
-4-(4-
니트로페녹시
)퀴놀린
WO0050405에 기재한 4-클로로-7-메톡시-6-메톡시카르보닐퀴놀린 히드로클로라이드(5.19 g, 18.0 mmol)로부터, 제조예 11과 같은 식의 수법에 의해 표제 화합물(1.743 g, 4.91 mmol, 27.2%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.97(3H, s), 4.07(3H, s), 6.62(1H, d, J=5.2Hz), 7.32(2H, d, J=9.2Hz), 7.55(1H, s), 8.36(2H, d, J=9.2Hz), 8.69(1H, s), 8.76(1H, d, J=5.2Hz).
제조예
339-2
4-(4-
아미노페녹시
)-7-
메톡시
-6-
메톡시카르보닐퀴놀린
제조예 10과 같은 식으로 7-메톡시-6-메톡시카르보닐-4-(4-니트로페녹시)퀴놀린(1.73 g, 4.88 mmol)으로부터 표제 화합물(1.053 g, 3.25 mmol, 66.5%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.97(3H, s), 4.04(3H, s), 6.42(1H, d, J=5.2Hz), 6.76(2H, m), 6.98(2H, m), 7.48(1H, s), 8.61(1H, d, J=5.2Hz), 8.83(1H, s).
실시예
340
메틸 7- 메톡시 -4-(4-(((1,3-티아졸-2- 일아미노 )카르보닐)아미노) 페녹시 )-6-퀴놀린카르복실레이트
실시예 131과 같은 식의 수법에 의해, 4-(4-아미노페녹시)-7-메톡시-6-메톡시카르보닐퀴놀린(486 mg, 1.5 mmol)과 페닐 N-(1,3-티아졸-2-일)카르바메이트로부터 표제 화합물(306 mg, 0.68 mmol, 45.3%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.85(3H, s), 3.97(3H, s), 6.47(1H, d, J=5.2Hz), 7.11(1H, br), 7.27(2H, d, J=9.2Hz), 7.37(1H, br), 7.52(1H, s), 7.61(2H, d, J=9.2Hz), 8.59(1H, s), 8.67(1H, d, J=5.2Hz), 9.11(1H, br), 10.53(1H, br).
실시예
341
4-(4-(((4- 플루오로아닐리노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6- 퀴놀린카르복실산
메틸 4-(4-(((4-플루오로아닐리노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실레이트(300 mg, 0.65 mmol)에 메탄올(9 ml), 2규정 수산화나트륨 수용액(3 ml)을 가하여, 실온에서 2시간, 60℃에서 20분간 교반했다. 반응액을 실온으로 방냉하고, 1규정 염산을 가하여 중화시킨 후, 메탄올(6 ml), 물(6 ml)을 가하여 하룻밤 교반하여, 석출된 담갈색 결정을 여과 수취하고, 감압 건조하여, 표제 화합물(227 mg, 0.51 mmol, 78.0%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.97(3H, s), 6.49(1H, d, J=5.2Hz), 7.11(2H, m), 7.23(2H, d, J=8.8Hz), 7.46(2H, m), 7.49(1H, s), 7.58(2H, d, J=8.8Hz), 8.57(1H, s), 8.67(1H, d, J=5.2Hz), 8.75(1H, s), 8.84(1H, s).
실시예
342
7- 메톡시 -4-(4-(((1,3-티아졸-2- 일아미노 )카르보닐)아미노) 페녹시 )-6- 퀴놀린카르복실산
실시예 341과 같은 식의 수법에 의해, 메틸 7-메톡시-4-(4-(((1,3-티아졸-2-일아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복실레이트(263 mg, 0.58 mmol)로부터 표제 화합물(243 mg, 0.56 mmol, 95.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.00(3H, s), 6.63(1H, d, J=5.2Hz), 7.10(1H, d, J=3.6Hz), 7.31(2H, d, J=8.8Hz), 7.36(1H, d, J=3.6Hz), 7.57(1H, s), 7.65(2H, d, J=8.8Hz), 8.62(1H, s), 8.78(1H, d, J=5.2Hz), 9.64(1H, s).
실시예
343
2-프로필 4-(4-(((4- 플루오로아닐리노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복실레이트
4-(4-(((4-플루오로아닐리노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(84 mg, 0.19 mmol)을 디메틸포름아미드(1 ml)에 용해시킨 후, 빙냉 교반하에 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드(54 mg, 0.28 mmol), 1-히드록시-1H-벤조트리아졸1수화물(38 mg, 0.28 mmol), 트리에틸아민(0.079 ml, 0.56 mmol), 2-프로판올(0.15 ml)을 가하여 실온에서 하룻밤 교반했다. 반응액을 그대로 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(15.0 mg, 0.03 mmol, 16%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.32(6H, d, J=6.4Hz), 3.95(3H, s), 5.15(1H, m), 6.45(1H, d, J=5.2Hz), 7.11(2H, m), 7.23(2H, d, J=9.2Hz), 7.46(2H, m), 7.50(1H, s), 7.58(2H, d, J=9.2Hz), 8.48(1H, s), 8.66(1H, d, J=5.2Hz), 8.73(1H, s), 8.82(1H, s).
실시예
344
2- 메톡시에틸 4-(4-(((4- 플루오로아닐리노 )카르보닐)아미노) 페녹시 )-7- 메톡시-6-퀴놀린카르복실레이트
4-(4-(((4-플루오로아닐리노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(84 mg, 0.19 mmol)을 디메틸포름아미드(1 ml)에 용해시킨 후, 빙냉 교반하에 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드(54 mg, 0.28 mmol), 1-히드록시-1H-벤조트리아졸1수화물(38 mg, 0.28 mmol), 트리에틸아민(0.079 ml, 0.56 mmol), 2-메톡시에탄올(0.15 ml)을 가하여 실온에서 하룻밤 교반했다. 반응액을 그대로 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(47.1 mg, 0.093 mmol, 49.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.29(3H, s), 3.65(2H, m), 3.96(3H, s), 4.40(2H, m), 6.46(1H, d, J=5.2Hz), 7.11(2H, m), 7.24(2H, d, J=8.8Hz), 7.46(2H, m), 7.51(1H, s), 7.58(2H, d, J=8.8Hz), 8.56(1H, s), 8.67(1H, d, J=5.2Hz), 8.73(1H, s), 8.81(1H, s).
실시예
345
2- 메톡시에틸 7- 메톡시 -4-(4-(((1,3-티아졸-2- 일아미노 )카르보닐)아미노) 페녹시)-6-퀴놀린카르복실레이트
7-메톡시-4-(4-(((1,3-티아졸-2-일아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복실산(87.3 mg, 0.20 mmol)을 디메틸포름아미드(1 ml)에 용해시킨 후, 빙냉 교반하에 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드(58 mg, 0.30 mmol), 1-히드록시-1H-벤조트리아졸1수화물(41 mg, 0.30 mmol), 트리에틸아민(0.084 ml, 0.60 mmol), 2-메톡시에틸아민(0.052 ml, 0.60 mmol)을 가하여 실온에서 5시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 물로 세척하여, 무수황산마그네슘으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸, 이어서 헥산을 가하여 결정을 석출시켜, 여과 수취하고, 감압 건조하여, 표제 화합물(24.4 mg, 0.049 mmol, 24.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.29(3H, s), 3.48(4H, s), 4.02(3H, s), 6.47(1H, d, J=5.2Hz), 7.11(1H, br), 7.26(2H, d, J=8.8Hz), 7.37(1H, br), 7.51(1H, s), 7.61(2H, d, J=8.8Hz), 8.44(1H, s), 8.62(1H, s), 8.65(1H, d, J=5.2Hz), 9.11(1H, s), 10.54(1H, s).
실시예
346
N6 - 메톡시 -7- 메톡시 -4-(4-(((1,3-티아졸-2- 일아미노 )카르보닐)아미노) 페녹시)-6-퀴놀린카르복사미드
7-메톡시-4-(4-(((1,3-티아졸-2-일아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복실산(55 mg, 0.13 mmol)과 메톡실아민 히드로클로라이드로부터, 실시예 345와 같은 식의 수법에 의해, 표제 화합물(36.1 mg, 0.078 mmol, 61.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.73(3H, s), 3.97(3H, s), 6.47(1H, d, J=5.2Hz), 7.11(1H, br), 7.25(2H, d, J=8.8Hz), 7.37(1H, br), 7.48(1H, s), 7.62(2H, d, J=8.8Hz), 8.44(1H, s), 8.65(1H, d, J=5.2Hz), 9.11(1H, s), 11.44(1H, s).
실시예
347
4-(4-(2,4- 디플루오로아닐리노 )카르보닐) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 10과 같은 식의 방법으로 4-(4-아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드(50 mg, 0.16 mmol)와 2,4-디플루오로페닐 이소시아네이트로부터 표제 화합물(59.9 mg, 0.13 mmol, 79.8%)을 담황색 결정으로서 얻었다.
*1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.00(3H, s), 6.46(1H, d, J=5.2Hz), 7.03(1H, m), 7.23(2H, d, J=8.8Hz), 7.33(1H, m), 7.50(1H, s), 7.58(2H, d, J=8.8Hz), 7.72(1H, s), 7.84(1H, s), 8.07(1H, m), 8.52(1H, s), 8.64(1H, d, J=5.2Hz), 8.67(1H, s), 9.16(1H, s).
출발 물질은 다음의 방법으로 합성했다.
제조예
347-1
4-(4-
아미노페녹시
)-7-
메톡시
-6-
퀴놀린카르복사미드
제조예 14에 기재된 4-(4-아미노페녹시)-6-시아노-7-메톡시퀴놀린(4.76 g, 11.6 mmol)으로부터 실시예 112와 같은 식의 수법에 의해 표제 화합물(1.56 g, 5.0 mmol, 43.4%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.00(3H, s), 5.15(2H, m), 6.39(1H, d, J=5.2Hz), 6.65(2H, d, J=8.8Hz), 6.92(2H, d, J=8.8Hz), 7.46(1H, s), 7.70(1H, s), 7.83(1H, s), 8.60(1H, d, J=5.2Hz), 8.66(1H, s).
실시예
348
4-(4-(4- 플루오로아닐리노 )카르보닐)-4- 메틸아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 10과 같은 방법으로 7-메톡시-4-(4-메틸아미노페녹시)-6-퀴놀린카르복사미드(288 mg, 0.89 mmol)와 4-플루오로페닐 이소시아네이트로부터 표제 화합물(265 mg, 0.58 mmol, 64.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.29(3H, s), 4.00(3H, s), 6,65(1H, d, J=5.2Hz), 7.06(2H, m), 7.32(2H, d, J=8.8Hz), 7.41-7.48(4H, m), 7.51(1H, s), 7.73(1H, s), 7.85(1H, s), 8.23(1H, s), 8.67(1H, s), 8.69(1H, d, J=5.2Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
348-1
7-
메톡시
-4-(4-
메틸아미노페녹시
)-6-
퀴놀린카르복사미드
4-메틸아미노페놀(1.04 g, 8.45 mmol)을 디메틸설폭시드(10 ml)에 용해시키고, 실온에서 수소화나트륨(290 mg, 8.45 mmol)을 서서히 가하여 20분간 교반했다. 제조예 152-3에서 생성된 7-메톡시-4-클로로-6-퀴놀린카르복사미드(1.00 g, 4.23 mmol)를 가하여, 100℃에서 3시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(815 mg, 2.52 mmol, 59.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.88(3H, s), 4.09-4.16(4H, m), 5.88(1H, br), 6.45(1H, d, J=5.6Hz), 6.68(2H, m), 7.01(2H, m), 7.51(1H, s), 7.80(1H, br), 8.61(1H, d, J=5.6Hz), 9.31(1H, s).
실시예
349
7- 메톡시 -4-(4-((2- 티아졸릴아미노 )카르보닐)-4- 메틸아미노페녹시 )-6- 퀴놀린카르복사미드
실시예 131과 같은 식의 방법으로 6-카르바모일-7-메톡시-4-(4-메틸아미노페녹시)퀴놀린(50 mg, 0.16 mmol)과 페닐 N-(1,3-티아졸-2-일)카르바메이트로부터 표제 화합물(33.0 mg, 0.073 mmol, 47.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.37(3H, s), 4.02(3H, s), 6.64(1H, br), 7.02(1H, br), 7.30-7.33(3H, m), 7.47(2H, d, J=8.8Hz), 7.51(1H, s), 7.72(1H, s), 7.85(1H, s), 8.67(1H, s), 8.69(1H, d, J=5.2Hz).
실시예
350
4-(4-( 시클로프로필아미노카르보닐 )-4- 메틸아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 4-니트로페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시페닐)-N-메틸카르바메이트(73 mg, 0.15 mmol)와 시클로프로필아민으로부터 표제 화합물(30.0 mg, 0.073 mmol, 49.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.54(2H, m), 2.50(1H, m), 3.16(3H, s), 4.03(3H, s), 6.27(1H, d, J=2.8Hz), 6.60(1H, d, J=5.6Hz), 7.27(2H, m), 7.36(2H, m), 7.52(1H, s), 7.73(1H, s), 7.85(1H, s), 8.66(1H, s), 8.69(1H, d, J=5.6Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
350-1
4- 니트로페닐 N-(4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시페닐 )-N- 메틸카르바메이트
제조예 17과 같은 방법으로 6-카르바모일-7-메톡시-4-(4-메틸아미노페녹시)퀴놀린(323 mg, 1.00 mmol)과 4-니트로페닐 클로로포르메이트로부터 표제 화합물(373 mg, 0.076 mmol, 76.4%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.47(3H, s), 4.15(3H, s), 5.89(1H, br), 6.56(1H, d, J=5.6Hz), 7.23-7.45(6H, m), 7.56(1H, s), 7.82(1H, s), 8.27(2H, d, J=8.8Hz), 8.69(1H, d, J=5.6Hz), 9.29(1H, s).
실시예
351
7- 메톡시 -4-(4-((3- 메틸티오프로필아미노 )카르보닐)-4- 메틸아미노페녹시 )-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 4-니트로페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시페닐)-N-메틸카르바메이트(73 mg, 0.15 mmol)와 3-(메틸티오)프로필아민으로부터 표제 화합물(44.8 mg, 0.099 mmol, 65.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.64(2H, m), 2.01(3H, s), 2.42(2H, m), 3.09(2H, m), 3.16(3H, s), 4.01(3H, s), 6.17(1H, t, J=5.6Hz), 6.59(1H, d, J=5.2Hz), 7.28(2H, d, J=8.8Hz), 7.37(2H, d, J=8.8Hz), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 8.65(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
352
4-(4-((3- 메틸설포닐프로필아미노 )카르보닐)-4- 메틸아미노페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 4-니트로페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시페닐)-N-메틸카르바메이트(73 mg, 0.15 mmol)와 3-(메틸설포닐)프로필아민으로부터 표제 화합물(42.7 mg, 0.088 mmol, 58.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.81(2H, m), 2.94(3H, s), 3.06(2H, m), 3.12(2H, m), 3.17(3H, s), 4.01(3H, s), 6.26(1H, t, J=5.6Hz), 6.60(1H, d, J=5.2Hz), 7.28(2H, d, J=8.8Hz), 7.39(2H, d, J=8.8Hz), 7.51(1H, s), 7.72(1H, s), 7.84(1H, s), 8.65(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
353
4-(3- 플루오로 -4-((3- 메틸티오프로필아미노 )카르보닐) 아미노페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 4-페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(89.5 mg, 0.20 mmol)와 3-(메틸티오)프로필아민으로부터 표제 화합물(71.1 mg, 0.155 mmol, 77.5%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.69(2H, m), 2.04(3H, s), 2.04-2.05(2H, m), 3.17(2H, m), 4.01(3H, s), 6.51(1H, d, J=5.2Hz), 6.65(1H, t, J=6.0Hz), 7.05(1H, d, J=9.6Hz), 7.30(1H, dd, J=2.8, 11.6Hz), 7.49(1H, s), 7.71(1H, s), 7.83(1H, s), 8.21(1H, m), 8.33(1H, s), 8.64-8.65(2H, m).
출발 물질은 다음의 방법으로 합성했다.
제조예
353-1
페닐 N-(4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 ) 카르바메이트
제조예 17과 같은 식의 방법으로 6-카르바모일-7-메톡시-4-(3-플루오로-4-아미노페녹시)퀴놀린(752 mg, 2.30 mmol)으로부터 표제 화합물(391.5 mg, 0.875 mmol, 38.1%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.14(3H, s), 5.92(1H, s), 6.52(1H, d, J=5.6Hz), 7.02(2H, m), 7.21-7.31(4H, m), 7.43(2H, m), 7.55(1H, s), 7.81(1H, s), 8.23(1H, br), 8.68(1H, d, J=5.6Hz), 9.27(1H, s).
실시예
354
4-(3- 플루오로 -4-((3- 메틸설포닐프로필아미노 )카르보닐) 아미노페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 4-페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(89.5 mg, 0.20 mmol)와 3-(메틸설포닐)프로필아민으로부터 표제 화합물(41.3 mg, 0.084 mmol, 42.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.85(2H, m), 2.97(3H, s), 3.12(2H, m), 3.21(2H, m), 4.01(3H, s), 6.51(1H, d, J=5.2Hz), 6.73(1H, t, J=5.6Hz), 7.05(1H, d, J=9.6Hz), 7.31(1H, dd, J=2.8, 11.6Hz), 7.50(1H, s), 7.72(1H, s), 7.83(1H, s), 8.20(1H, m), 8.40(1H, s), 8.64-8.66(2H, m).
실시예
355
4-(3- 플루오로 -4-((2,2,2- 트리플루오로에틸아미노 )카르보닐) 아미노페녹시 )-7-메톡시-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(67 mg, 0.15 mmol)와 2,2,2-트리플루오로에틸아민으로부터 표제 화합물(47.4 mg, 0.105 mmol, 69.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.96(2H, m), 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 7.09(1H, d, J=8.8Hz), 7.17(1H, t, J=6.4Hz), 7.35(1H, dd, J=2.8, 11.6Hz), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 8.16(1H, m), 8.51(1H, s), 8.64-8.67(2H, m).
실시예
356
4-(4-((3- 에톡시프로필아미노 )카르보닐)아미노-3- 플루오로페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(67 mg, 0.15 mmol)와 3-에톡시프로필아민으로부터 표제 화합물(45.2 mg, 0.099 mmol, 66.0%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.10(3H, t, J=7.2Hz), 1.65(2H, m), 3.14(2H, q, J=7.2Hz), 3.35-3.44(4H, m), 4.01(3H, s), 6.52(1H, d, J=5.2Hz), 6.61(1H, m), 7.05(1H, d, J=8.8Hz), 7.31(1H, dd, J=2.8, 11.6Hz), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 8.22(1H, m), 8.35(1H, s), 8.64-8.67(2H, m).
실시예
357
4-(3- 플루오로 -4-((2- 플루오로에틸아미노 )카르보닐) 아미노페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(33 mg, 0.074 mmol)와 2-플루오로에틸아민 히드로클로라이드로부터 표제 화합물(23.9 mg, 0.057 mmol, 77.8%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.08(2H, m), 4.02(3H, s), 4.40(1H, t, J=5.2Hz), 4.52(1H, t, J=5.2Hz), 6.55(1H, d, J=5.2Hz), 6.88(1H, m), 7.08(1H, d, J=9.2Hz), 7.33(1H, dd, J=2.8, 11.6Hz), 7.51(1H, s), 7.74(1H, s), 7.85(1H, s), 8.21(1H, m), 8.51(1H, s), 8.65(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
358
4-(4-((3- 클로로프로필아미노 )카르보닐)아미노-3- 플루오로페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(33 mg, 0.074 mmol)와 3-클로로필아민으로부터 표제 화합물(22.0 mg, 0.049 mmol, 66.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.89(2H, m), 3.22(2H, m), 3.68(2H, m), 4.01(3H, s), 6.52(1H, d, J=5.2Hz), 6.71(1H, m), 7.06(1H, d, J=8.8Hz), 7.31(1H, dd, J=2.8, 11.6Hz), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 8.20(1H, m), 8.37(1H, s), 8.64-8.66(2H, m).
실시예
359
4-(3- 플루오로 -4-((3- 플루오로프로필아미노 )카르보닐) 아미노페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(67 mg, 0.15 mmol)와 3-플루오로프로필아민 히드로클로라이드로부터 표제 화합물(7.9 mg, 0.018 mmol, 12.2%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.82(2H, m), 3.20(2H, m), 4.01(3H, s), 4.44(1H, t, J=6.0Hz), 4.55(1H, t, J=6.0Hz), 6.52(1H, d, J=5.2Hz), 6.69(1H, m), 7.06(1H, d, J=8.8Hz), 7.31(1H, dd, J=2.8, 11.6Hz), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 8.21(1H, m), 8.38(1H, s), 8.64-8.66(2H, m).
실시예
360
7-(2- 메톡시에톡시 )-4-(4-((3- 메톡시프로필아미노 )카르보닐) 아미노페녹시 )-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(50 mg, 0.106 mmol)와 3-메톡시프로필아민으로부터 표제 화합물(35.2 mg, 0.075 mmol, 71.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.66(2H, m), 3.13(2H, m), 3.23(3H, s), 3.28-3.34(2H, m), 3.36(3H, s), 3.79(2H, m), 4.40(2H, m), 6.16(1H, m), 6.43(1H, d, J=5.6Hz), 7.15(2H, d, J=8.8Hz), 7.51(2H, d, J=8.8Hz), 7.54(1H, s), 7.79(1H, s), 7.81(1H, s), 8.60(1H, s), 8.63(1H, d, J=5.6Hz), 8.77(1H, s).
출발 물질은 다음의 방법으로 합성했다.
제조예
360-1
4-(4-
아미노페녹시
)-7-(2-
메톡시에톡시
)-6-
퀴놀린카르복사미드
제조예 10에 기재한 4-(4-아미노페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(3.448 g, 9.67 mmol)으로부터, 실시예 112와 같은 식의 수법에 의해, 표제 화합물(1.303 g)을 갈색 결정으로서 얻었다. 이대로 다음 반응에 이용했다.
제조예
360-2
4- 페닐 N-(4-(6- 카르바모일 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시페닐 ) 카르바메이트
제조예 17과 같은 방법으로 4-(4-아미노페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드(1.303 g, 3.69 mmol)로부터 표제 화합물(1.462 g, 3.09 mmol, 83.7%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.48(3H, s), 3.89(2H, m), 4.44(2H, m), 5.87(1H, s), 6.50(1H, d, J=5.6Hz), 7.16-7.29 (7H, m), 7.42(2H, m), 7.58(1H, s), 7.60(1H, s), 8.10(1H, s), 8.64(1H, d, J=5.6Hz), 9.31(1H, s).
실시예
361
4-(4-((2- 플루오로에틸아미노 )카르보닐) 아미노페녹시 )-7-(2- 메톡시에톡시 )-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(47.3 mg, 0.10 mmol)와 2-플루오로에틸아민 히드로클로라이드로부터 표제 화합물(33.1 mg, 0.075 mmol, 74.8%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.26-3.38(5H, m), 3.79(2H, m), 4.38-4.41(3H, m), 4.51(1H, t, J=5.2Hz), 6.39(1H, m), 6.43(1H, d, J=5.2Hz), 7.17(2H, d, J=8.8Hz), 7.50-7.54(3H, m), 7.79(1H, s), 7.81(1H, s), 8.63(1H, d, J=5.2Hz), 8.71(1H, s), 8.77(1H, s).
실시예
362
4-(4-((3- 플루오로프로필아미노 )카르보닐) 아미노페녹시 )-7-(2- 메톡시에톡시 )-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-(2-메톡시에톡시)-4-퀴놀릴)옥시페닐)카르바메이트(47.3 mg, 0.10 mmol)와 3-플루오로프로필아민 히드로클로라이드로부터 표제 화합물(8.0 mg, 0.018 mmol, 17.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.76-1.87(2H, m), 3.17(2H, m), 3.36(3H, s), 3.79(2H, m), 4.38-4.45(3H, m), 4.55(1H, m), 6.24(1H, m), 6.43(1H, d, J=5.2Hz), 7.16(2H, d, J=8.8Hz), 7.51(2H, d, J=8.8Hz), 7.53(1H, s), 7.79(1H, s), 7.81(1H, s), 8.62-8.64(2H, m), 8.77(1H, s).
실시예
363
4-(3- 플루오로 -4-((3- 메톡시프로필아미노 )카르보닐) 아미노페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(50 mg, 0.102 mmol)와 3-메톡시프로필아민으로부터 표제 화합물(37.2 mg, 0.076 mmol, 75.2%)을 백색 결정으로서 얻었다.
*1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.66(2H, m), 3.16(2H, m), 3.23(3H, s), 3.28-3.34(2H, m), 3.36(3H, s), 3.79(2H, m), 4.40(2H, m), 6.52(1H, d, J=5.6Hz), 6.62(1H, m), 7.06(1H, d, J=11.2Hz), 7.31(1H, dd, J=2.8, 11.6Hz), 7.55(1H, s), 7.80(1H, s), 7.81(1H, s), 8.22(1H, m), 8.36(1H, s), 8.65(1H, d, J=5.6Hz), 8.75(1H, s).
출발 물질은 다음의 방법으로 합성했다.
제조예
363-1
4-(4-아미노-3-
플루오로페녹시
)-7-(2-
메톡시에톡시
)-6-
퀴놀린카르복사미드
제조예 12에 기재된 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(6.368 g, 18.0 mmol)으로부터, 실시예 112와 같은 식의 수법에 의해, 표제 화합물(991 mg)을 담황색 결정으로서 얻었다. 이대로 다음 반응에 이용했다.
제조예
363-2
페닐 N-(4-(6- 카르바모일 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐)카르바메이트
제조예 17과 같은 방법으로 4-(4-아미노-3-플루오로페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드(991 mg, 2.67 mmol)로부터 표제 화합물(1.074 g, 2.19 mmol, 81.9%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.48(3H, s), 3.90(2H, m), 4.46(2H, m), 5.88(1H, s), 6.58(1H, d, J=5.2Hz), 7.02-7.06(2H, m), 7.21-7.30(4H, m), 7.43(2H, m), 7.71(1H, s), 8.08(1H, s), 8.27(1H, br), 8.68(1H, d, J=5.2Hz), 9.29(1H, s).
실시예
364
4-(4-(3- 플루오로 -(2- 플루오로에틸아미노 )카르보닐) 아미노페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(49.1 mg, 0.10 mmol)와 2-플루오로에틸아민 히드로클로라이드로부터 표제 화합물(35.4 mg, 0.077 mmol, 76.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.36(3H, s), 3.45(2H, m), 3.79(2H, m), 4.38-4.41(3H, m), 4.52(1H, t, J=4.8Hz), 6.52(1H, d, J=5.2Hz), 6.87(1H, m), 7.07(1H, d, J=6.8Hz), 7.33(1H, dd, J=2.8, 11.6Hz), 7.55(1H, s), 7.79(1H, s), 7.81(1H, s), 8.20(1H, m), 8.49(1H, s), 8.65(1H, d, J=5.2Hz), 8.75(1H, s).
실시예
365
4-(4-(3- 플루오로 -(2- 플루오로프로필아미노 )카르보닐) 아미노페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(49.1 mg, 0.10 mmol)와 3-플루오로프로필아민 히드로클로라이드로부터 표제 화합물(6.8 mg, 0.014 mmol, 14.3%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.76-1.87(2H, m), 3.18(2H, m), 3.34(3H, s), 3.79(2H, m), 4.38-4.45(3H, m), 4.55(1H, m), 6.52(1H, d, J=5.2Hz), 6.69(1H, m), 7.07(1H, d, J=8.8Hz), 7.32(1H, dd, J=2.8, 11.6Hz), 7.55(1H, s), 7.80(1H, s), 7.81(1H, s), 8.21(1H, m), 8.39(1H, s), 8.65(1H, d, J=5.2Hz), 8.75(1H, s).
실시예
366
4-(3- 클로로 -4-((4- 플루오로아닐리노 )카르보닐) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 10과 같은 방법으로 4-(4-아미노-3-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(50 mg, 0.145 mmol)와 4-플루오로페닐 이소시아네이트로부터 표제 화합물(53.6 mg, 0.111 mmol, 76.9%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.01(3H, s), 6.55(1H, d, J=5.2Hz), 7.14(2H, m), 7.28(1H, dd, J=2.4, 9.2Hz), 7.47(2H, m), 7.51(1H, s), 7.55(1H, d, J=2.4Hz), 7.73(1H, s), 7.85(1H, s), 8.25(1H, d, J=9.2Hz), 8.38(1H, s), 8.65(1H, s), 8.67(1H, d, J=5.2Hz), 9.43(1H, s).
출발 물질은 다음의 방법으로 합성했다.
제조예
366-1
4-(4-아미노-3-
클로로페녹시
)-7-
메톡시
-6-
퀴놀린카르복사미드
4-아미노-3-클로로페놀(1.213 g, 8.45 mmol)을 디메틸설폭시드(10 ml)에 용해시키고, 실온에서 수소화나트륨(290 mg, 8.45 mmol)을 서서히 가하여 30분간 교반했다. 제조예 152-3에서 얻어진 7-메톡시-4-클로로퀴놀린-6-카르복사미드(1.00 g, 4.23 mmol)를 가하여, 100℃에서 2시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸/메탄올 9:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 테트라히드로푸란에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(1.216 g, 3.54 mmol, 83.7%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.10(2H, s), 4.13(3H, s), 5.90(1H, br), 6.46(1H, d, J=5.6Hz), 6.86(1H, m), 6.93(1H, dd, J=2.4, 8.4Hz), 7.13(1H, d, J=2.4Hz), 7.53(1H, s), 7.80(1H, br), 8.64(1H, d, J=5.6Hz), 9.27(1H, s).
실시예
367
4-(3- 클로로 -4-((2- 티아졸릴아미노 )카르보닐) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 131과 같은 방법으로 4-(4-아미노-3-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(50 mg, 0.145 mmol)와 페닐 N-(1,3-티아졸-2-일)카르바메이트로부터 표제 화합물(38.3 mg, 0.082 mmol, 56.2%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.02(3H, s), 6.56(1H, d, J=5.2Hz), 7.15(1H, s), 7.31(1H, d, J=8.0Hz), 7.40(1H, s), 7.51(1H, s), 7.59(1H, s), 7.73(1H, s), 7.85(1H, s), 8.27(1H, d, J=8.0Hz), 8.65(1H, s), 8.67(1H, d, J=5.2Hz), 11.19(1H, s).
실시예
368
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(70 mg, 0.15 mmol)와 시클로프로필아민으로부터 표제 화합물(22.4 mg, 0.052 mmol, 34.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.66(2H, m), 2.56(1H, m), 4.01(3H, s), 6.51(1H, d, J=5.6Hz), 7.18(1H, d, J=2.8Hz), 7.23(1H, dd, J=2.8, 8.8Hz), 7.48(1H, d, J=2.8Hz), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 7.97(1H, s), 8.25(1H, d, J=8.8Hz), 8.64(1H, s), 8.65(1H, d, J=5.6Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
368-1
페닐 N-(4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 클로로페닐 ) 카르바메이트
제조예 17과 같은 방법으로 4-(4-아미노-3-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(600 mg, 1.745 mmol)로부터 표제 화합물(708 mg, 1.526 mmol, 87.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.14(3H, s), 5.89(1H, br), 6.50(1H, d, J=5.6Hz), 7.16(2H, dd, J=2.4, 8.8Hz), 7.22-7.30(4H, m), 7.44(2H, m), 7.55(1H, s), 7.81(1H, br), 8.31(1H, d, J=8.8Hz), 8.68(1H, d, J=5.6Hz), 9.27(1H, s).
실시예
369
4-(3- 클로로 -4-(2- 플루오로에틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(200 mg, 0.431 mmol)와 2-플루오로에틸아민 히드로클로라이드로부터 표제 화합물(95.8 mg, 0.221 mmol, 51.3%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.98(1H, m), 3.46(1H, m), 4.02(3H, s), 4.42(1H, t, J=4.8Hz), 4.53(1H, dd, J=4.8, 5.6Hz), 6.52(1H, d, J=5.2Hz), 7.23(1H, d, J=2.4, 8.8Hz), 7.29(1H, m), 7.48(1H, d, J=2.4Hz), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 8.22-8.25(2H, m), 8.64-8.66(2H, m).
실시예
370
7- 벤질옥시 -4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(7-벤질옥시-6-카르바모일-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(760 mg, 1.452 mmol)와 시클로프로필아민으로부터 표제 화합물(663 mg, 1.363 mmol, 93.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 5.44(2H, s), 6.54(1H, d, J=5.6Hz), 6.82(1H, d, J=2.8Hz), 7.08(1H, m), 7.33(1H, dd, J=2.8, 12.0Hz), 7.38(1H, d, J=7.2Hz), 7.44(2H, m), 7.58(2H, d, J=7.2Hz), 7.61(1H, s), 7.75(1H, s), 7.84(1H, s), 8.20-8.24(2H, m), 8.63(1H, s), 8.66(1H, d, J=5.6Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
370-1
4-(4-아미노-3-
플루오로페녹시
)-7-(
벤질옥시
)-6-
퀴놀린카르복사미드
제조예 8에 기재된 4-(4-아미노-3-플루오로페녹시)-7-벤질옥시-6-시아노퀴놀린(2.27 g, 5.89 mmol)으로부터 실시예 112와 같은 식의 수법에 의해 표제 화합물(752 mg, 1.86 mmol, 31.6%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.77(2H, s), 5.34(2H, s), 5.78(1H, br), 6.47(1H, d, J=5.2Hz), 6.79-6.91(3H, m), 7.41-7.54(5H, m), 7.62(1H, s), 7.81(1H, br), 8.65(1H, d, J=5.2Hz), 9.31(1H, s).
제조예
370-2
페닐 N-(4-(7- 벤질옥시 -6- 카르바모일 -4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 ) 카르바메이트
제조예 17과 같은 방법으로 4-(4-아미노-3-플루오로페녹시)-7-(벤질옥시)-6-퀴놀린카르복사미드(752 mg, 1.864 mmol)로부터 표제 화합물(760 mg, 1.452 mmol, 77.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.35(2H, s), 5.80(1H, br), 6.52(1H, d, J=5.2Hz), 7.03(2H, m), 7.22-7.30(4H, m), 7.41-7.49(5H, m), 7.53(2H, d, J=6.8Hz), 7.64(1H, s), 7.82(1H, br), 8.24(1H, br), 8.69(1H, d, J=5.2Hz), 9.30(1H, s).
실시예
371
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-히드록시-6-퀴놀린카르복사미드
실시예 83과 같은 식의 수법에 의해, 7-벤질옥시-4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-6-퀴놀린카르복사미드(640 mg, 1.316 mmol)로부터 표제 화합물(498 mg, 1.256 mmol, 95.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.66(2H, m), 2.57(1H, m), 6.42(1H, d, J=5.2Hz), 6.83(1H, s), 7.31(1H, d, J=9.2Hz), 7.30(1H, s), 7.34(1H, dd, J=2.8, 11.6Hz), 8.08(1H, s), 8.21-8.26(2H, m), 8.61(1H, d, J=5.2Hz), 8.91(1H, br), 8.96(1H, s).
실시예
372
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-(3-(N,N- 디에틸아미노)프로폭시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.126 mmol)와 N-(3-클로로필)-N,N-디에틸아민 히드로클로라이드로부터 표제 화합물(34.2 mg, 0.067 mmol, 53.2%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 0.95(6H, t, J=7.2Hz), 1.96(2H, m), 2.44-2.49(4H, m), 2.57-2.59(3H, m), 4.30(2H, m), 6.52(1H, d, J=5.2Hz), 6.70(1H, s), 7.09(1H, d, J=10.8Hz), 7.32(1H, m), 7.50(1H, s), 7.79(1H, s), 7.91(1H, s), 8.19-8.22(2H, m), 8.66(1H, d, J=5.2Hz), 8.69(1H, s).
실시예
373
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-(2-(N,N- 디에틸아미노)에톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.126 mmol)와 N-(2-브로모에틸)-N,N-디에틸아민 히드로브로마이드로부터 표제 화합물(20.6 mg, 0.042 mmol, 33.0%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 0.97(6H, t, J=7.2Hz), 2.50-2.58(5H, m), 2.85(2H, m), 4.36(2H, m), 6.52(1H, d, J=5.2Hz), 6.81(1H, s), 7.09(1H, d, J=6.8Hz), 7.34(1H, d, J=11.6Hz), 7.57(1H, s), 7.81(1H, s), 8.19-8.22(2H, m), 8.31(1H, s), 8.67(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
374
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-(3-(4- 모르폴리노)프로폭시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르복사미드)(50 mg, 0.126 mmol)와 N-(3-클로로필)모르폴린으로부터 표제 화합물(35.0 mg, 0.067 mmol, 53.0%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.01(2H, m), 2.39(4H, br), 2.46-2.50(2H, m), 2.56(1H, m), 3.59(4H, m), 4.31(2H, m), 6.52(1H, d, J=5.2Hz), 6.82(1H, s), 7.08(1H, d, J=8.4Hz), 7.31(1H, m), 7.52(1H, s), 7.78(2H, s), 8.19-8.24(2H, m), 8.65-8.67(2H, m).
실시예
375
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-(2-(4- 모르폴리노)에톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.126 mmol)와 N-(2-클로로에틸)모르폴린 히드로클로라이드로부터 표제 화합물(35.1 mg, 0.069 mmol, 54.6%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.50-2.56(5H, m), 2.79(2H, m), 3.60(4H, br), 4.41(2H, m), 6.53(1H, d, J=5.2Hz), 6.81(1H, s), 7.08(1H, d, J=9.6Hz), 7.33(1H, d, J=12.8Hz), 7.58(1H, s), 7.87(1H, s), 8.19-8.23(2H, m), 8.39(1H, s), 8.67(1H, d, J=5.2Hz), 8.82(1H, s).
실시예
376
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-((2- 피리딜 )메톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.126 mmol)와 2-클로로메틸피리딘 히드로클로라이드로부터 표제 화합물(20.2 mg, 0.041 mmol, 32.8%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 5.53(2H, s), 6.54(1H, d, J=5.2Hz), 6.80(1H, s), 7.08(1H, d, J=10.4Hz), 7.30-7.40(2H, m), 7.59(1H, s), 7.62(1H, d, J=8.0Hz), 7.79(1H, s), 7.86(1H, dd, J=2.0, 7.6Hz), 8.19-8.23(3H, m), 8.61-8.68(3H, m).
실시예
377
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-((3- 피리딜 )메톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.126 mmol)와 3-클로로메틸피리딘 히드로클로라이드로부터 표제 화합물(20.2 mg, 0.041 mmol, 32.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 5.47(2H, s), 6.55(1H, d, J=5.2Hz), 6.81(1H, s), 7.08(1H, d, J=10.0Hz), 7.32(1H, d, J=12.4Hz), 7.45(1H, m), 7.64(1H, s), 7.73(1H, s), 7.83(1H, s), 7.98(1H, m), 8.23(2H, br), 8.57(2H, br), 8.66(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
378
4-(4-( 시클로프로필아미노카르보닐 )아미노-3- 플루오로페녹시 )-7-((4- 피리딜 )메톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(4-(시클로프로필아미노카르보닐)아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.126 mmol)와 4-클로로메틸피리딘 히드로클로라이드로부터 표제 화합물(29.8 mg, 0.061 mmol, 48.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 5.50(2H, s), 6.54(1H, d, J=5.2Hz), 6.80(1H, s), 7.07(1H, d, J=8.0Hz), 7.32(1H, d, J=11.6Hz), 7.53-7.55(3H, m), 7.76(1H, s), 7.92(1H, s), 8.19-8.22(2H, m), 8.55(1H, s), 8.60-8.66(3H, m).
실시예
379
7- 벤질옥시 -4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(7-벤질옥시-6-카르바모일-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(2.97 g, 5.50 mmol)와 시클로프로필아민으로부터 표제 화합물(2.433 g, 4.84 mmol, 87.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 5.41(2H, s), 6.51(1H, d, J=5.6Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, m), 7.35(1H, d, J=7.2Hz), 7.42(2H, m), 7.48(1H, s), 7.55(2H, d, J=7.2Hz), 7.59(1H, s), 7.73(1H, s), 7.82(1H, s), 7.97(1H, s), 8.25(1H, d, J=9.2Hz), 8.60(1H, s), 8.64(1H, d, J=5.6Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
379-1
4-(4-아미노-3-
클로로페녹시
)-7-
벤질옥시
-6-
시아노퀴놀린
4-아미노-3-클로로페놀(10.77 g, 75.0 mmol)을 디메틸설폭시드(150 ml)에 용해시키고, 실온에서 수소화나트륨(3.00 g, 75.0 mmol)을 서서히 가하여 30분간 교반했다. 공지의 방법으로 합성된 7-벤질옥시-4-클로로-6-시아노퀴놀린(14.737 g, 50.0 mmol)을 가하여, 100℃에서 2시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(11.777 g, 29.3 mmol, 58.6%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.13(2H, s), 5.35(2H, s), 6.47(1H, d, J=5.2Hz), 6.85(1H, d, J=8.8Hz), 6.92(1H, dd, J=2.4, 9.2Hz), 7.13(1H, d, J=2.4Hz), 7.36(1H, d, J=7.6Hz), 7.42(2H, m), 7.51-7.55(3H, m), 8.65(1H, d, J=5.2Hz), 8.69(1H, s).
제조예
379-2
4-(4-아미노-3-
클로로페녹시
)-7-(
벤질옥시
)-6-
퀴놀린카르복사미드
4-(4-아미노-3-클로로페녹시)-7-벤질옥시-6-시아노퀴놀린(14.55 g, 36.2 mmol)으로부터 실시예 112와 같은 식의 수법에 의해, 표제 화합물(5.74 g, 13.7 mmol, 37.8%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.10(2H, s), 5.34(2H, s), 5.78(1H, br), 6.47(1H, d, J=5.2Hz), 6.85(1H, d, J=8.4Hz), 6.92(1H, dd, J=2.4, 8.4Hz), 7.13(1H, d, J=2.4Hz), 7.38-7.53(4H, m), 7.62(1H, s), 7.82(1H, br), 8.62(1H, s), 8.64(1H, d, J=5.2Hz), 9.30(1H, s).
제조예
379-3
페닐 N-(4-(7- 벤질옥시 -6- 카르바모일 -4- 퀴놀릴 ) 옥시 -2- 클로로페닐 ) 카르바메이트
제조예 17과 같은 방법으로 4-(4-아미노-3-클로로페녹시)-7-(벤질옥시)-6-퀴놀린카르복사미드(4.20 g, 10.0 mmol)로부터 표제 화합물(2.97 g, 5.50 mmol, 55.0%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.35(2H, s), 5.81(1H, br), 6.51(1H, d, J=5.2Hz), 7.16(1H, dd, J=2.8, 8.8Hz), 7.22-7.30(4H, m), 7.41-7.54(8H, m), 7.64(1H, s), 7.81(1H, br), 8.32(1H, d, J=9.2Hz), 8.69(1H, d, J=5.2Hz), 9.30(1H, s).
실시예
380
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-히드록시-6- 퀴놀린카르복사미드
실시예 83과 같은 식의 수법에 의해, 7-벤질옥시-4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-6-퀴놀린카르복사미드(1.016 g, 2.02 mmol)로부터 표제 화합물(697 mg, 1.69 mmol, 83.6%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.43(2H, m), 0.68(2H, m), 2.58(1H, m), 6.56(1H, d, J=5.6Hz), 7.23(1H, s), 7.30(1H, m), 7.36(1H, s), 7.55(1H, d, J=2.4Hz), 8.01(1H, s), 8.19(1H, s), 8.33(1H, d, J=9.2Hz), 8.72(1H, d, J=5.6Hz), 8.82(1H, s), 9.01(1H, s).
실시예
381
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.121 mmol)와 2-메톡시에틸브로마이드로부터 표제 화합물(29.9 mg, 0.063 mmol, 52.4%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.57(1H, m), 3.36(3H, s), 3.81(2H, m), 4.41(2H, m), 6.53(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.41(1H, d, J=2.8Hz), 7.57(1H, s), 7.82(1H, s), 7.83(1H, s), 7.99(1H, s), 8.28(1H, d, J=9.2Hz), 8.68(1H, d, J=5.2Hz), 8.77(1H, s).
실시예
382
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(3-(4- 모르폴리노)프로폭시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.121 mmol)와 N-(3-클로로필)모르폴린으로부터 표제 화합물(30.5 mg, 0.056 mmol, 46.6%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.02(2H, m), 2.39(4H, br), 2.46-2.59(3H, m), 3.59(4H, m), 4.31(2H, m), 6.53(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.52(1H, s), 7.78(2H, s), 7.98(1H, s), 8.28(1H, d, J=9.2Hz), 8.65(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
383
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(2-(4- 모르폴리노)에톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.121 mmol)와 N-(2-클로로에틸)모르폴린 히드로클로라이드로부터 표제 화합물(29.8 mg, 0.057 mmol, 46.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.50-2.56(5H, m), 2.80(2H, m), 3.60(4H, br), 4.41(2H, m), 6.53(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 8.8Hz), 7.50(1H, d, J=2.8Hz), 7.58(1H, s), 7.87(1H, s), 7.99(1H, s), 8.27(1H, d, J=8.8Hz), 8.38(1H, s), 8.67(1H, d, J=5.2Hz), 8.82(1H, s).
실시예
384
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(3-(1- 피페리디노)프로폭시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.121 mmol)와 1-(클로로필)피페리딘 히드로클로라이드로부터 표제 화합물(27.3 mg, 0.051 mmol, 41.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.36(2H, m), 1.47(4H, m), 1.99(2H, m), 2.33(4H, br), 2.42(2H, m), 2.56(1H, m), 4.27(2H, m), 6.50(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.49(1H, s), 7.76(2H, br), 7.96(1H, s), 8.25(1H, d, J=8.8Hz), 8.64(1H, d, J=5.2Hz), 8.65(1H, s).
실시예
385
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(2-(1- 피롤리디노)에톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(50 mg, 0.121 mmol)와 1-(클로로에틸)피롤리딘 히드로클로라이드로부터 표제 화합물(24.6 mg, 0.048 mmol, 39.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.67(4H, br), 2.49-2.58(5H, m), 2.89(2H, m), 4.38(2H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.56(1H, s), 7.72(1H, s), 7.96(1H, s), 8.25(1H, d, J=9.2Hz), 8.33(1H, s), 8.65(1H, d, J=5.2Hz), 8.76(1H, s).
실시예
386
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(2- 히드록시에톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(206 mg, 0.499 mmol)와 2-브로모에탄올로부터 표제 화합물(63.7 mg, 0.139 mmol, 27.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.84(2H, m), 4.30(2H, m), 5.12(1H, t, J=5.2Hz), 6.51(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 8.8Hz), 7.49(1H, d, J=2.8Hz), 7.54(1H, s), 7.82(1H, s), 7.94(1H, s), 7.97(1H, s), 8.26(1H, d, J=8.8Hz), 8.66(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
387
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(3- 히드록시프로폭시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(206 mg, 0.499 mmol)와 3-브로모프로판올로부터 표제 화합물(67.0 mg, 0.142 mmol, 28.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.98(2H, m), 2.56(1H, m), 3.62(2H, m), 4.32(2H, m), 4.69(1H, m), 6.50(1H, d, J=5.2Hz), 7.18-7.24(2H, m), 7.48-7.50(2H, m), 7.73(1H, s), 7.86(1H, s), 7.97(1H, s), 8.26(1H, d, J=8.4Hz), 8.64(1H, d, J=5.2Hz), 8.67(1H, s).
실시예
388
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-((4R)-2,2-디메틸-1,3-디옥솔란-4-일)메톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(413 mg, 1.00 mmol)와 ((4R)-2,2-디메틸-1,3-디옥솔란-4-일)메틸 4-톨루엔설포네이트로부터 표제 화합물(234.4 mg, 0.445 mmol, 44.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.33(3H, s), 1.40(3H, s), 2.56(1H, m), 3.99(1H, m), 4.14(1H, m), 4.27(1H, m), 4.41(1H, m), 4.58(1H, m), 6.51(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 8.8Hz), 7.49(1H, d, J=2.8Hz), 7.57(1H, s), 7.84(2H, br), 7.99(1H, s), 8.28(1H, d, J=8.8Hz), 8.67(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
389
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-((4S)-2,2-디메틸-1,3-디옥솔란-4-일)메톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(413 mg, 1.00 mmol)와 ((4S)-2,2-디메틸-1,3-디옥솔란-4-일)메틸 4-톨루엔설포네이트)로부터 표제 화합물(253 mg, 0.480 mmol, 48.0%)을 담황색 결정으로서 얻었다.
*실시예 390
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-((2R)-2,3-디히드록시프로필)옥시-6-퀴놀린카르복사미드
4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-((4R)-2,2-디메틸-1,3-디옥솔란-4-일)메톡시)-6-퀴놀린카르복사미드(219 mg, 0.416 mmol)를 트리플루오로초산(2 ml)-테트라히드로푸란(2 ml)-물(1 ml)에 실온에서 용해시킨 후, 1시간동안 교반했다. 반응액을 물(30 ml)로 희석하여, 이것에 탄산수소나트륨(3 g)을 서서히 가하여 중화시킨 후, 초산에틸로 추출하고, 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하고, 테트라히드로푸란에 현탁시켜, 석출된 결정을 여과 수취하여, 소량의 초산에틸로 세척하고, 통풍 건조하여 표제 화합물(121.4 mg, 0.249 mmol, 60.0%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.53(2H, m), 3.94(1H, m), 4.24(1H, m), 4.33(1H, m), 4.83(1H, t, J=5.6Hz), 5.26(1H, d, J=5.6Hz), 6.53(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.26(1H, dd, J=2.8, 9.2Hz), 7.51(1H, d, J=2.8Hz), 7.54(1H, s), 7.84(1H, s), 7.99(2H, br), 8.28(1H, d, J=9.2Hz), 8.67(1H, d, J=5.2Hz), 8.81(1H, s).
실시예
391-1
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-((2S)-2,3-디히드록시프로필)옥시-6-퀴놀린카르복사미드
4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-((4S)-2,2-디메틸-1,3-디옥솔란-4-일)메톡시)-6-퀴놀린카르복사미드(236 mg, 0.448 mmol)를 트리플루오로초산(2 ml)-테트라히드로푸란(2 ml)-물(1 ml)에, 실온에서 용해시킨 후, 1시간동안 교반했다. 반응액을 물(30 ml)로 희석시키고, 이것에 탄산수소나트륨(3 g)을 서서히 가하여 중화시킨 후, 초산에틸로 추출하고, 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하고, 테트라히드로푸란에 현탁시켜, 석출된 결정을 여과 수취하여, 소량의 초산에틸로 세척하고, 통풍 건조하여 표제 화합물(115.6 mg, 0.237 mmol, 53.0%)을 백색 결정으로서 얻었다.
실시예
391-2
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(1,3- 디옥솔란-2-일)메톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(310 mg, 0.75 mmol)와 2-(브로모메틸)-1,3-디옥솔란)으로부터 표제 화합물(71.2 mg, 0.143 mmol, 19.0%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 3.92-4.02(4H, m), 4.36(2H, m), 5.36(1H, m), 6.53(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.26(1H, dd, J=2.8, 8.8Hz), 7.51(1H, d, J=2.8Hz), 7.58(1H, s), 7.81(1H, s), 7.83(1H, s), 7.99(1H, s), 8.28(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.75(1H, s).
실시예
392
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(3-(N,N- 디에틸아미노)프로필)옥시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(250 mg, 0.606 mmol)와 N-(3-클로로프로필)-N,N-디에틸아민 히드로클로라이드로부터 표제 화합물(119.6 mg, 0.227 mmol, 37.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 0.95(6H, t, J=7.2Hz), 1.96(2H, m), 2.45-2.59 (7H, m), 4.30(2H, m), 6.52(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.50(1H, s), 7.79(1H, s), 7.86(1H, s), 7.99(1H, s), 8.27(1H, d, J=9.2Hz), 8.66(1H, d, J=5.2Hz), 8.69(1H, s).
실시예
393
tert -부틸 4-(((6-( 아미노카르보닐 )-4-(3- 클로로 -4-(( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(700 mg, 1.696 mmol)와 tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트로부터 표제 화합물(460 mg, 0.754 mmol, 44.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.17-1.25(3H, m), 1.39(9H, s), 1.79(2H, m), 2.10(1H, m), 2.56(1H, m), 2.74(1H, m), 4.01(2H, m), 4.12(2H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.50(1H, s), 7.70(1H, br), 7.71(1H, br), 7.97(1H, s), 8.25(1H, d, J=9.2Hz), 8.55(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
394
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-((1- 메틸 -4- 피페리딜)메톡시)-6-퀴놀린카르복사미드
tert-부틸 4-(((6-(아미노카르보닐)-4-(3-클로로-4-((시클로프로필아미노)카르보닐)아미노)페녹시)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트(460 mg, 0.754 mmol)를 트리플루오로초산(2.3 ml)에 실온에서 용해시킨 후, 2시간동안 교반했다. 반응액을 감압 농축하고, 포화탄산수소나트륨 수용액을 서서히 가하여 중화시켜, 초산에틸로 추출하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-((4-피페리딜)메톡시)-6-퀴놀린카르복사미드를 미정제 생성물로서 얻었다. 이것을 테트라히드로푸란(10 ml)-물(10 ml)에 용해시킨 후, 37% 포름알데히드 수용액(1 ml), 초산(0.086 ml, 1.51 mmol), 시아노수소화붕소나트륨(95 mg, 1.51 mmol)을 실온에서 가하여, 20분간 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(226.1 mg, 0.431 mmol, 2공정 57.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6)δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.37(2H, m), 1.74-1.89(5H, m), 2.15(3H, s), 2.56(1H, m), 2.79(2H, m), 4.11(2H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.49(1H, s), 7.70(1H, s), 7.74(1H, s), 7.96(1H, s), 8.25(1H, d, J=9.2Hz), 8.59(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
395
메틸 4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시-6-퀴놀린카르복실레이트
실시예 11과 같은 식의 수법에 의해, 페닐 N-(2-클로로-4-(7-메톡시-6-메톡시카르보닐-4-퀴놀릴)옥시페닐)카르바메이트(3.184 g, 6.65 mmol)와 시클로프로필아민으로부터 표제 화합물(2.894 g, 6.55 mmol, 98.5%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.85(3H, s), 3.96(3H, s), 6.52(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.50(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.56(1H, s), 8.68(1H, d, J=5.2Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
395-1
메틸
4-(4-아미노-3-
클로로페녹시
)-7-
메톡시
-6-
퀴놀린카르복실레이트
4-아미노-3-클로로페놀(3.17 g, 22.05 mmol)을 디메틸설폭시드(50 ml)에 용해시키고, 실온에서 수소화나트륨(882 mg, 22.05 mmol)을 서서히 가하여 30분간 교반했다. WO0050405에 기재한 4-클로로-7-메톡시-6-메톡시카르보닐퀴놀린(3.70 g, 14.7 mmol)을 가하여, 100℃에서 3시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(3.092 g, 8.62 mmol, 57.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.98(3H, s), 4.06(3H, s), 4.12(2H, s), 6.44(1H, d, J=5.2Hz), 6.86(1H, d, J=8.8Hz), 6.95(1H, dd, J=2.8, 8.8Hz), 7.16(1H, d, J=2.8Hz), 7.49(1H, s), 8.64(1H, d, J=5.2Hz), 8.80(1H, s).
제조예
395-2
페닐 N-(2- 클로로 -4-(7- 메톡시 -6- 메톡시카르보닐 -4- 퀴놀릴 ) 옥시페닐 ) 카르바메이트
제조예 17과 같은 식으로 메틸 4-(4-아미노-3-클로로페녹시)-7-메톡시-6-퀴놀린카르복실레이트(3.09 g, 8.61 mmol)로부터 표제 화합물(3.184 g, 6.65 mmol, 77.2%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.98(3H, s), 4.06(3H, s), 6.48(1H, d, J=5.2Hz), 7.17(1H, dd, J=2.8, 9.2Hz), 7.21-7.31(4H, m), 7.41-7.46(2H, m), 7.50(2H, br), 8.32(1H, d, J=8.8Hz), 8.67(1H, d, J=5.2Hz), 8.77(1H, s).
실시예
396
4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복실산
메틸 4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실레이트(2.87 g, 6.50 mmol)에 메탄올(48 ml), 2규정 수산화나트륨 수용액(16 ml)을 가하여, 실온에서 1.5시간, 60℃에서 15분간 교반했다. 반응액을 실온으로 방냉하고, 1규정 염산을 가하여 중화시킨 후, 메탄올을 증류 제거하고, 석출된 담갈색 결정을 여과 수취하여, 충분히 물로 세척한 후, 70℃에서 건조하여, 표제 화합물(2.628 g, 6.14 mmol, 94.6%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 3.96(3H, s), 6.51(1H, d, J=5.2Hz), 7.17-7.26(2H, m), 7.49(2H, s), 7.96(1H, s), 8.26(1H, d, J=9.2Hz), 8.52(1H, s), 8.66(1H, d, J=5.2Hz), 13.08(1H, br).
실시예
397
N6 - 시클로프로필 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)를 디메틸포름아미드(2 ml)에 용해시킨 후, 빙냉 교반하에 1-에틸-3-(3-디메틸아미노프로필)카르보디이미드 히드로클로라이드(77 mg, 0.40 mmol), 1-히드록시-1H-벤조트리아졸1수화물(61 mg, 0.40 mmol), 트리에틸아민(0.112 ml, 0.80 mmol), 시클로프로필아민(0.055 ml)을 가하여 실온에서 하룻밤 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(40.0 mg, 0.086 mmol, 42.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.57(2H, m), 0.65(2H, m), 0.69(2H, m), 2.57(1H, m), 2.86(1H, m), 3.97(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.21(1H, dd, J=2.8, 9.2Hz), 7.46(1H, d, J=2.8Hz), 7.47(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.33(1H, m), 8.40(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
398
N6 -(2- 메톡시에틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
*4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-메톡시에틸아민으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(17.8 mg, 0.037 mmol, 18.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.57(1H, m), 3.29(3H, s), 3.47(4H, s), 4.01(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.51(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.43(1H, s), 8.59(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
399
N6 -(2-(4- 모르폴리노 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 N-(2-아미노에틸)모르폴린으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(62.9 mg, 0.116 mmol, 57.9%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.43(4H, br), 2.47-2.51(2H, m), 2.56(1H, m), 3.43(2H, m), 3.60(4H, m), 4.04(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.48(1H, m), 8.66(1H, d, J=5.2Hz), 8.67(1H, s).
실시예
400
N6 -(3-(4- 모르폴리노 )프로필)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 N-(3-아미노프로필)모르폴린으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(84.7 mg, 0.153 mmol, 76.1%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.69(2H, m), 2.33-2.37(6H, m), 2.56(1H, m), 3.30-3.37(2H, m), 3.56(4H, m), 4.02(3H, s), 6.51(1H, d, J=5.6Hz), 7.20(1H, d, J=2.8Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.98(1H, s), 8.27(1H, d, J=9.2Hz), 8.40(1H, m), 8.52(1H, s), 8.66(1H, d, J=5.6Hz).
실시예
401
N6 -(2-( 디에틸아미노 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 N-(2-아미노에틸)-N,N-디에틸아민으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(67.7 mg, 0.129 mmol, 64.0%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 0.98(6H, t, J=7.2Hz), 2.47-2.59 (7H, m), 3.37(2H, m), 4.03(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.25(1H, d, J=8.8Hz), 8.48(1H, m), 8.65(1H, d, J=5.2Hz), 8.69(1H, s).
실시예
402
*N6 -(3-(1- 피롤리디노 )프로필)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 1-(3-아미노프로필)피롤리딘으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(87.0 mg, 0.162 mmol, 80.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.65-1.72(6H, m), 2.41-2.49(6H, m), 2.56(1H, m), 3.28-3.36(2H, m), 4.01(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, m), 7.22(1H, m), 7.47(1H, d, J=2.8Hz), 7.50(1H, s), 7.96(1H, s), 8.25(1H, dd, J=1.2, 9.2Hz), 8.41(1H, m), 8.51(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
403
N6 -(2-(2- 피리딜 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-(2-아미노에틸)피리딘으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(78.4 mg, 0.147 mmol, 73.7%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.02(2H, m), 3.68(2H, m), 3.97(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.21-7.24(2H, m), 7.32(1H, d, J=7.6Hz), 7.47-7.49(2H, m), 7.72(1H, m), 7.97(1H, s), 8.26(1H, d, J=8.8Hz), 8.53-8.59(3H, m), 8.65(1H, d, J=5.2Hz).
실시예
404
N6 -(2-( 메틸설포닐 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-(메틸설포닐)에틸아민으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(58.8 mg, 0.110 mmol, 55.2%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.06(3H, s), 3.41(2H, m), 3.75(2H, m), 4.01(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.66(1H, d, J=5.2Hz), 8.67(1H, s), 8.75(1H, m).
실시예
405
N6 -(1H-2- 이미다졸릴 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-아미노이미다졸로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(27.0 mg, 0.055 mmol, 27.3%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 4.03(3H, s), 6.55(1H, d, J=5.2Hz), 6.72(1H, m), 6.85(1H, m), 7.18(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 8.8Hz), 7.48(1H, d, J=2.8Hz), 7.55(1H, s), 7.97(1H, s), 8.26(1H, d, J=8.8Hz), 8.52(1H, s), 8.68(1H, d, J=5.2Hz), 11.21(1H, br), 11.80(1H, m).
실시예
406
N6 -(1,3-티아졸-2-일)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-아미노티아졸로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(83.7 mg, 0.164 mmol, 81.7%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 4.03(3H, s), 6.56(1H, dd, J=1.6, 5.2Hz), 7.18(1H, s), 7.23(1H, m), 7.30(1H, s), 7.47-7.57(3H, m), 7.97(1H, s), 8.26(1H, dd, J=1.6, 8.8Hz), 8.53(1H, s), 8.69(1H, dd, J=1.6, 5.2Hz), 12.28(1H, s).
실시예
407
N6 -(2- 피리딜 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 2-아미노피리딘으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(17.0 mg, 0.034 mmol, 33.6%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 4.09(3H, s), 6.55(1H, d, J=5.2Hz), 7.15-7.26(3H, m), 7.50(1H, s), 7.59(1H, s), 7.86(1H, m), 7.98(1H, s), 8.26(2H, d, J=9.2Hz), 8.36(1H, m), 8.68-8.70(2H, m), 10.70(1H, s).
실시예
408
N6 -(3- 피리딜 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 3-아미노피리딘으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(46.4 mg, 0.092 mmol, 92.1%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 4.09(3H, s), 6.56(1H, d, J=5.2Hz), 7.23-7.41(3H, m), 7.46(1H, s), 7.57(1H, s), 8.03(1H, s), 8.18-8.31(3H, m), 8.48(1H, s), 8.68(1H, d, J=5.2Hz), 8.80(1H, s), 10.58(1H, s).
실시예
409
N6 -(4- 피리딜 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 4-아미노피리딘으로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(31.1 mg, 0.062 mmol, 61.7%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 4.01(3H, s), 6.56(1H, d, J=5.2Hz), 7.21-7.24(2H, m), 7.47(1H, d, J=2.8Hz), 7.57(1H, s), 7.71(2H, d, J=5.6Hz), 7.99(1H, s), 8.26(1H, d, J=9.2Hz), 8.44-8.48(3H, m), 8.69(1H, d, J=5.2Hz), 10.73(1H, s).
실시예
410
N6 -(2- 히드록시에틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-아미노에탄올로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(34.4 mg, 0.073 mmol, 36.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.40(2H, m), 3.55(2H, m), 4.03(3H, s), 4.80(1H, t, J=5.6Hz), 6.56(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.50(1H, d, J=2.8Hz), 7.53(1H, s), 7.99(1H, s), 8.28(1H, d, J=9.2Hz), 8.42(1H, m), 8.65(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
411
N6 -(3-히드록시프로필)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
*4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 3-아미노프로판올로부터, 실시예 397과 같은 식의 수법에 의해 표제 화합물(51.2 mg, 0.106 mmol, 52.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.67(2H, m), 2.56(1H, m), 3.36(2H, m), 3.50(2H, m), 4.02(3H, s), 4.56(1H, t, J=5.2Hz), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.50(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.48(1H, m), 8.57(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
412
N6 -((2-히드록시-1-( 히드록시메틸 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)을 디메틸포름아미드(4 ml)에 질소 분위기하에서 용해시켜, 세리놀(37 mg, 0.40 mmol), 트리에틸아민(0.2 ml), (1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트(177 mg, 0.40 mmol)를 순차적으로 실온에서 가한 후, 8시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸/메탄올 9/1)에 의해 정제했다. 목적물을 포함하는 분획을 감압 농축한 후, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(75.8 mg, 0.151 mmol, 75.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 3.50(2H, m), 3.56(2H, m), 3.96(1H, m), 4.03(3H, s), 4.80(2H, t, J=5.2Hz), 6.51(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.53(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.29(1H, m), 8.66(1H, d, J=5.2Hz), 8.72(1H, s).
실시예
413
N6 -(1,3- 디옥솔란 -2- 일메틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(200 mg, 0.467 mmol)과 2-아미노메틸-1,3-디옥솔란으로부터, 실시예 412와 같은 식의 수법에 의해 표제 화합물(190.3 mg, 0.371 mmol, 79.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.51(2H, m), 3.85(2H, m), 3.96(2H, m), 4.04(3H, s), 5.04(1H, m), 6.51(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.54(1H, s), 7.99(1H, s), 8.27(1H, d, J=9.2Hz), 8.48(1H, m), 8.64(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
414
N6 -( tert - 부톡시 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(428 mg, 1.00 mmol)과 tert-부톡실아민 히드로클로라이드로부터, 실시예 412와 같은 식의 수법에 의해 표제 화합물(360 mg, 0.722 mmol, 72.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.25(9H, s), 2.56(1H, m), 3.97(3H, s), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.49(1H, s), 7.97(1H, s), 8.24(1H, s), 8.26(1H, d, J=9.2Hz), 8.65(1H, d, J=5.2Hz), 10.75(1H, s).
실시예
415
N6 -(2- 플루오로에틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(171 mg, 0.40 mmol)과 2-플루오로에틸아민 히드로클로라이드로부터, 실시예 412와 같은 식의 수법에 의해 표제 화합물(130.7 mg, 0.276 mmol, 69.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 2.56(1H, m), 3.59(1H, m), 3.67(1H, m), 4.03(3H, s), 4.50(1H, m), 4.62(1H, m), 6.52(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.53(1H, s), 7.99(1H, s), 8.28(1H, d, J=9.2Hz), 8.58-8.62(2H, m), 8.67(1H, d, J=5.2Hz).
실시예
416
N6 -(2-( 메틸티오 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(171 mg, 0.40 mmol)과 2-(메틸티오)에틸아민으로부터, 실시예 412와 같은 식의 수법에 의해 표제 화합물(146.2 mg, 0.292 mmol, 73.0%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.10(3H, s), 2.56(1H, m), 2.67(2H, m), 3.50(2H, m), 4.02(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.51(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.56(1H, m), 8.61(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
417
N6 - 메톡시 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(171 mg, 0.40 mmol)과 메톡실아민 히드로클로라이드로부터, 실시예 412와 같은 식의 수법에 의해 표제 화합물(109.3 mg, 0.239 mmol, 59.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 3.74(3H, s), 3.99(3H, s), 6.54(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.49(1H, s), 7.99(1H, s), 8.28(1H, d, J=9.2Hz), 8.43(1H, s), 8.67(1H, d, J=5.2Hz), 11.46(1H, s).
실시예
418
N-(4-((7-( 벤질옥시 )-6- 시아노 -4- 퀴놀릴 )) 옥시 -2- 클로로페닐 )- N' - 시클로프로필우레아
4-(4-아미노-3-클로로페녹시)-7-벤질옥시-6-시아노퀴놀린(8.037 g, 20.0 mmol)을 디메틸포름아미드(40 ml)에 질소 분위기하에서 용해시키고, 피리딘(1.94 ml, 24.0 mmol), 페닐 클로로포르메이트(3.01 ml, 24.0 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(3.46 ml, 50 mmol)을 적하하고, 3시간동안 더 교반했다. 반응액에 물(400 ml), 디에틸에테르(400 ml)를 가하여 하룻밤 교반하고, 석출된 결정을 여과 수취하여, 물, 디에틸에테르로 세척하고, 70℃에서 건조시킴으로써 표제 화합물(8.570 g, 17.7 mmol, 88.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 5.45(2H, s), 6.58(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.36(1H, m), 7.44(2H, t, J=7.2Hz), 7.50(1H, d, J=2.8Hz), 7.54(2H, d, J=7.2Hz), 7.71(1H, s), 7.98(1H, s), 8.27(1H, d, J=9.2Hz), 8.73(1H, d, J=5.2Hz), 8.77(1H, s).
실시예
419
N-(2- 클로로 -4-((6- 시아노 -7-(3-( 디에틸아미노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 ) 페닐)-N'-시클로프로필우레아
N-(4-((7-(벤질옥시)-6-시아노-4-퀴놀릴))옥시-2-클로로페닐)-N'-시클로프로필우레아(8.53 g, 17.6 mmol)로부터 실시예 83과 같은 식의 수법에 의해, N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시-2-클로로페닐)-N'-시클로프로필우레아인 미정제 생성물(5.67 g)을 담갈색 결정으로서 얻었다. 이 미정제 생성물(500 mg, 1.60 mmol)과 N-(3-클로로프로필)-N,N-디에틸아민염산염으로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(200 mg, 0.394 mmol, 24.6%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 0.79(2H, m), 0.96(2H, m), 1.05(6H, t, J=7.2Hz), 2.06(2H, m), 2.52-2.60(5H, m), 2.67-2.73(3H, m), 4.29(2H, t, J=6.0Hz), 5.00(1H, s), 6.49(1H, d, J=5.2Hz), 7.12(1H, dd, J=2.8, 8.8Hz), 7.48(1H, s), 7.72(1H, s), 8.44(1H, d, J=8.8Hz), 8.66(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
420
tert -부틸 4-(((4-(3- 클로로 -4-(( 시클로프로필아미노 )카르보닐) 아미노페녹시)-6-시아노-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시-2-클로로페닐)-N'-시클로프로필우레아 미정제 생성물(1.00 g, 3.20 mmol)과 tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(275.8 mg, 0.466 mmol, 14.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 0.79(2H, m), 0.96(2H, m), 1.33(3H, m), 1.48(9H, s), 1.93(2H, m), 2.16(1H, m), 2.68(1H, m), 2.79(2H, m), 4.06(2H, d, J=6.8Hz), 4.20(2H, m), 4.99(1H, s), 6.50(1H, d, J=5.2Hz), 7.12(1H, dd, J=2.8, 9.2Hz), 7.43(1H, d, J=2.8Hz), 7.72(1H, s), 8.44(1H, d, J=9.2Hz), 8.66(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
421
N-(2- 클로로 -4-((6- 시아노 -7-(4- 피페리딜메톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐 )- N' - 시클로프로필우레아
tert-부틸 4-(((4-(3-클로로-4-((시클로프로필아미노)카르보닐)아미노페녹시)-6-시아노-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트(501 mg, 0.846 mmol)에 트리플루오로초산(2.5 ml)을 실온에서 가하여 1시간동안 교반했다. 반응액을 빙수욕 냉각하에, 물(35 ml)로 희석시키고, 탄산수소나트륨(3.5 g)을 서서히 가하여 중화시켜, 초산에틸로 추출했다. 유기층을 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 헥산으로 희석함으로써 석출된 결정을 여과 수취하고, 통풍 건조하여 표제 화합물(414.4 mg, 0.842 mmol, 99.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.49(2H, m), 1.92-1.97(3H, m), 2.48(1H, m), 2.56(1H, m), 2.86-2.93(3H, m), 4.19(2H, d, J=6.0Hz), 6.58(1H, dd, J=1.2, 5.2Hz), 7.20(1H, s), 7.24(1H, d, J=9.2Hz), 7.48(1H, d, J=1.2Hz), 7.63(1H, s), 7.99(1H, s), 8.27(1H, d, J=9.2Hz), 8.72-8.75(2H, m).
실시예
422
N-(2- 클로로 -4-((6- 시아노 -7-((1- 메틸 -4- 피페리딜 ) 메톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐)-N'-시클로프로필우레아
N-(2-클로로-4-((6-시아노-7-(4-피페리딜메톡시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아(540 mg, 0.846 mmol)를 테트라히드로푸란(20 ml)-메탄올(20 ml)에 용해시킨 후, 37% 포름알데히드 수용액(1 ml), 초산(0.10 ml, 1.69 mmol), 시아노수소화붕소나트륨(106 mg, 1.69 mmol)을 실온에서 가하여, 1시간동안 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(282 mg, 0.557 mmol, 65.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.66(2H, m), 1.39(2H, m), 1.75-1.90(5H, m), 2.15(3H, s), 2.56(1H, m), 2.79(2H, d, J=7.2Hz), 4.14(2H, d, J=5.6Hz), 6.57(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.58(1H, s), 7.98(1H, s), 8.27(1H, d, J=9.2Hz), 8.71-8.75(2H, m).
실시예
423
N-(4-((7-(3- 브로모프로폭시 )-6- 시아노 -4- 퀴놀릴 ) 옥시 )-2- 클로로페닐 )- N' - 시클로프로필우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시-2-클로로페닐)-N'-시클로프로필우레아의 미정제 생성물(500 mg, 1.60 mmol)과 1,3-디브로모프로판으로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(129 mg, 0.250 mmol, 15.6%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.43(2H, m), 0.65(2H, m), 2.37(2H, m), 2.56(1H, m), 3.65(2H, m), 4.41(2H, m), 6.60(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.26(1H, dd, J=2.8, 8.8Hz), 7.51(1H, d, J=2.8Hz), 7.65(1H, s), 7.99(1H, s), 8.28(1H, d, J=8.8Hz), 8.73-8.78(2H, m).
실시예
424
N-(2- 클로로 -4-(6- 시아노 -7-(3-(1- 피롤리디노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시 ) 페닐)-N'-시클로프로필우레아
N-(4-((7-(3-브로모프로폭시)-6-시아노-4-퀴놀릴)옥시)-2-클로로페닐)-N'-시클로프로필우레아(116 mg, 0.225 mmol)를 디메틸포름아미드(1.2 ml)에 용해시키고, 피롤리딘(0.20 ml)을 가하여 실온에서 4시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(57.3 mg, 0.113 mmol, 50.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6)δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.68(4H, br), 1.99(2H, m), 2.45-2.61 (7H, m), 4.33(2H, m), 6.56(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.59(1H, s), 7.98(1H, s), 8.27(1H, d, J=9.2Hz), 8.72(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
425
N-(2- 클로로 -4-((6- 시아노 -7-((1- 메틸 -3- 피페리딜 ) 메톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐)-N'-시클로프로필우레아
4-(4-아미노-3-클로로페녹시)-6-시아노-7-((1-메틸-3-피페리딜)메톡시)퀴놀린(246 mg, 0.582 mmol)을 디메틸포름아미드(6 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.19 ml, 2.33 mmol), 페닐 클로로포르메이트(0.15 ml, 1.16 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.20 ml, 2.91 mmol)을 적하하여, 3시간동안 더 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 메탄올에 현탁시키고, 이것을 물로 희석하여 결정을 여과 수취하고, 70℃에서 건조시킴으로써, 표제 화합물(198.7 mg, 0.393 mmol, 67.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.18(1H, m), 1.54(1H, m), 1.68(1H, m), 1.79(1H, m), 1.90(2H, m), 2.11(1H, m), 2.17(3H, s), 2.56(1H, m), 2.65(1H, m), 2.85(1H, m), 4.18(2H, d, J=6.4Hz), 6.59(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.26(1H, dd, J=2.8, 9.2Hz), 7.51(1H, s), 7.60(1H, s), 8.00(1H, s), 8.29(1H, d, J=9.2Hz), 8.74-8.76(2H, m).
출발 물질은 다음과 같은 식으로 합성했다.
제조예
425-1
4-(4-아미노-3- 클로로페녹시 )-6- 시아노 -7-((1- 메틸 -3- 피페리딜 ) 메톡시 )퀴놀린
4-(4-아미노-3-클로로페녹시)-7-벤질옥시-6-시아노퀴놀린(3.728 g, 9.28 mmol)으로부터 실시예 83과 같은 식의 수법에 의해, 4-(4-아미노-3-클로로페녹시)-6-시아노-7-히드록시퀴놀린의 미정제 생성물(3.306 g)을 담갈색 결정으로서 얻었다. 이 미정제 생성물(500 mg, 1.60 mmol)과 3-클로로메틸-1-메틸피페리딘 히드로클로라이드로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(246 mg, 0.581 mmol, 36.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.25(1H, m), 1.62-2.01(5H, m), 2.27(1H, m), 2.33(3H, s), 2.33(1H, m), 2.76(1H, m), 4.05-4.15(4H, m), 6.46(1H, d, J=5.2Hz), 6.86(1H, d, J=8.8Hz), 6.93(1H, dd, J=2.8, 8.8Hz), 7.14(1H, d, J=2.8Hz), 7.43(1H, s), 8.65-8.67(2H, m).
실시예
426
tert -부틸 4-(2-((4-(3- 클로로 -4-(( 시클로프로필아미노 )카르보닐) 아미노페녹시)-6-시아노-7-퀴놀릴)옥시)에틸)-1-피페리딘카르복실레이트
tert-부틸 4-(((4-(4-아미노-3-클로로페녹시)-6-시아노-7-퀴놀릴)옥시)에틸)-1-피페리딘카르복실레이트(486.5 mg, 0.930 mmol)를 디메틸포름아미드(5 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.170 ml, 2.09 mmol), 페닐 클로로포르메이트(0.175 ml, 1.34 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.322 ml, 4.65 mmol)을 적하하고, 하룻밤 더 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(343 mg, 0.566 mmol, 60.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 0.80(2H, m), 0.95(2H, m), 1.21-1.28(3H, m), 1.47(9H, s), 1.77(2H, m), 1.89(2H, m), 2.67(1H, m), 2.75(2H, m), 4.12(2H, m), 4.28(2H, m), 4.97(1H, s), 6.50(1H, d, J=5.2Hz), 7.12(1H, dd, J=2.8, 8.8Hz), 7.25(1H, d, J=2.8Hz), 7.45(1H, s), 7.72(1H, s), 8.44(1H, d, J=8.8Hz), 8.66(1H, s), 8.68(1H, d, J=5.2Hz).
출발 물질은 다음과 같은 식으로 합성했다.
제조예
426-1
tert - 부틸4 -(2-(((4-아미노-3- 클로로페녹시 )-6- 시아노 -7- 퀴놀릴 ) 옥시 )에틸)-1-피페리딘카르복실레이트
4-(4-아미노-3-클로로페녹시)-6-시아노-7-히드록시퀴놀린의 미정제 생성물(742 mg, 2.38 mmol)과 tert-부틸 4-(브로모에틸)-1-피페리딘카르복실레이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(492.6 mg, 0.942 mmol, 39.6%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.11-1.31(4H, m), 1.46(9H, s), 1.77(2H, m), 1.90(2H, m), 2.52-2.56(3H, m), 4.11(2H, m), 4.27(2H, m), 6.48(1H, d, J=5.2Hz), 6.86(1H, d, J=9.2Hz), 6.93(1H, dd, J=2.8, 9.2Hz), 7.14(1H, d, J=2.8Hz), 7.44(1H, s), 8.66-8.68(2H, m).
실시예
427
N-(2- 클로로 -4-((6- 시아노 -7-(2-(4- 피페리딜 ) 에톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐 )-N'-시클로프로필우레아
tert-부틸 4-(((4-(3-클로로-4-((시클로프로필아미노)카르보닐)아미노페녹시)-6-시아노-7-퀴놀릴)옥시)에틸)-1-피페리딘카르복실레이트(343 mg, 0.566 mmol)에 트리플루오로초산(3.0 ml)을 실온에서 가하여 1시간동안 교반했다. 반응액을 빙수욕 냉각하에, 물(40 ml)로 희석시키고, 탄산수소나트륨(4.0 g)을 서서히 가하여 중화시켜, 초산에틸로 추출했다. 유기층을 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 헥산으로 희석함으로써 석출된 결정을 여과 수취하고, 통풍 건조하여 표제 화합물(286 mg, 0.566 mmol, 정량적)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 0.78(2H, m), 0.95(2H, m), 1.63(2H, m), 1.96-2.05(5H, m), 2.66(1H, m), 2.90(2H, m), 3.41(2H, m), 4.27-4.30(3H, m), 5.10(1H, s), 6.50(1H, d, J=5.2Hz), 7.12(1H, dd, J=2.8, 8.8Hz), 7.27(1H, d, J=2.8Hz), 7.46(1H, s), 7.73(1H, s), 8.44(1H, d, J=8.8Hz), 8.66(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
428
N-(2- 클로로 -4-((6- 시아노 -7-(2-(1- 메틸 -4- 피페리딜 ) 에톡시 )-4- 퀴놀릴 ) 옥시 )페닐)-N'-시클로프로필우레아
N-(2-클로로-4-((6-시아노-7-(2-(4-피페리딜에톡시))-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아(286 mg, 0.566 mmol)를 테트라히드로푸란(5 ml)-메탄올(5 ml)에 용해시킨 후, 37% 포름알데히드 수용액(0.5 ml), 초산(0.065 ml, 1.13 mmol), 시아노수소화붕소나트륨(71 mg, 1.13 mmol)을 실온에서 가하여, 1시간동안 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(218.2 mg, 0.420 mmol, 74.1%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.23(2H, m), 1.50(1H, m), 1.71-1.88(6H, m), 2.15(3H, s), 2.56(1H, m), 2.75(2H, m), 4.33(2H, t, J=6.4Hz), 6.58(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.26(1H, dd, J=2.8, 9.2Hz), 7.50(1H, d, J=2.8Hz), 7.62(1H, s), 8.00(1H, s), 8.28(1H, d, J=9.2Hz), 8.73-8.75(2H, m).
실시예
429
N-(2- 클로로 -4-((6- 시아노 -7-(((2R)-3-( 디에틸아미노 )-2-히드록시프로필) 옥시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아
(4-(4-아미노-3-클로로페녹시)-6-시아노-7-(((2R)-3-(디에틸아미노)-2-히드록시프로필)옥시)퀴놀린)(96.9 mg, 0.22 mmol)을 디메틸포름아미드(1 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.027 ml, 0.33 mmol), 페닐 클로로포르메이트(0.035 ml, 0.28 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.10 ml)을 적하하여, 밤새 더 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(61.6 mg, 0.118 mmol, 53.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 0.96(6H, t, J=7.2Hz), 2.42-2.67 (7H, m), 3.95(1H, m), 4.21(1H, m), 4.30(1H, m), 4.91(1H, m), 6.57(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.50(1H, d, J=2.8Hz), 7.61(1H, s), 7.98(1H, s), 8.27(1H, d, J=9.2Hz), 8.70(1H, s), 8.72(1H, d, J=5.2Hz).
출발 물질은 다음과 같은 식으로 합성했다.
제조예
429-1
4-(4-아미노-3-
클로로페녹시
)-6-
시아노
-7-((2R)-
옥시란
-2-일)
메톡시퀴놀린
4-(4-아미노-3-클로로페녹시)-6-시아노-7-히드록시퀴놀린의 미정제 생성물(1.00 g, 3.21 mmol)과 (2R)-옥시란-2-일메틸 4-메틸-1-벤젠설포네이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(198 mg, 0.538 mmol, 16.8%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.93(1H, m), 2.98(1H, m), 3.50(1H, m), 4.12(2H, m), 4.24(1H, dd, J=5.2, 11.2Hz), 4.49(1H, dd, J=2.8, 11.2Hz), 6.49(1H, d, J=5.2Hz), 6.86(1H, d, J=8.8Hz), 6.93(1H, dd, J=2.8, 8.8Hz), 7.14(1H, d, J=2.8Hz), 7.48(1H, s), 8.66-8.68(2H, m).
제조예
429-2
4-(4-아미노-3- 클로로페녹시 )-6- 시아노 -7-(((2R)-3-( 디에틸아미노 )-2-히드록시프로필)옥시)퀴놀린
4-(4-아미노-3-클로로페녹시)-6-시아노-7-((2R)-옥시란-2-일)메톡시퀴놀린(96 mg, 0.261 mmol)을 질소 분위기하, 테트라히드로푸란(2.6 ml)에 용해시키고, 디에틸아민(0.5 ml)을 가하여, 50℃에서 5일간 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(96.9 mg, 0.220 mmol, 84.2%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.09(6H, t, J=7.2Hz), 2.57-2.74(8H, m), 4.12(2H, m), 4.25(2H, d, J=4.8Hz), 6.48(1H, d, J=5.2Hz), 6.85(1H, d, J=8.8Hz), 6.93(1H, dd, J=2.8, 8.8Hz), 7.14(1H, d, J=2.8Hz), 7.49(1H, s), 8.66-8.68(2H, m).
실시예
430
N-(2- 클로로 -4-((6- 시아노 -7-(((2S)-3-( 디에틸아미노 )-2-히드록시프로필) 옥시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아
4-(4-아미노-3-클로로페녹시)-6-시아노-7-(((2S)-3-(디에틸아미노)-2-히드록시프로필)옥시)퀴놀린(78.6 mg, 0.18 mmol)을 디메틸포름아미드(1 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.022 ml, 0.27 mmol), 페닐 클로로포르메이트(0.028 ml, 0.22 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.10 ml)을 적하하여, 밤새 더 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(37.8 mg, 0.072 mmol, 40.5%)을 담황색 결정으로서 얻었다.
출발 물질은 다음과 같은 식으로 합성했다.
제조예
430-1
4-(4-아미노-3-
클로로페녹시
)-6-
시아노
-7-((2S)-
옥시란
-2-일)
메톡시퀴놀린
4-(4-아미노-3-클로로페녹시)-6-시아노-7-히드록시퀴놀린의 미정제 생성물(1.00 g, 3.21 mmol)과 (2S)-옥시란-2-일메틸 4-메틸-1-벤젠설포네이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(147 mg, 0.400 mmol, 12.5%)을 담갈색 결정으로서 얻었다.
제조예
430-2
4-(4-아미노-3- 클로로페녹시 )-6- 시아노 -7-(((2S)-3-( 디에틸아미노 )-2-히드록시프로필)옥시)퀴놀린
4-(4-아미노-3-클로로페녹시)-6-시아노-7-((2S)-옥시란-2-일)메톡시퀴놀린(72 mg, 0.196 mmol)을 질소 분위기하에, 테트라히드로푸란(2.0 ml)에 용해시키고, 디에틸아민(0.4 ml)을 가하여, 50℃에서 5일간 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(78.6 mg, 0.178 mmol, 91.1%)을 담황색 결정으로서 얻었다.
실시예
431
N-(2- 클로로 -4-((6- 시아노 -7-(((2R)-2-히드록시-3-(1- 피롤리디노 )프로필) 옥시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아
4-(4-아미노-3-클로로페녹시)-6-시아노-7-(((2R)-2-히드록시-3-(1-피롤리디노)프로필)옥시)퀴놀린(95.1 mg, 0.217 mmol)을 디메틸포름아미드(1 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.026 ml, 0.33 mmol), 페닐 클로로포르메이트(0.034 ml, 0.27 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.10 ml)을 적하하여, 하룻밤 더 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(40.3 mg, 0.077 mmol, 35.6%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.44(2H, m), 0.68(2H, m), 1.69(4H, br), 2.50-2.75 (7H, m), 4.02(1H, m), 4.22(1H, dd, J=5.6, 10.4Hz), 4.31(1H, dd, J=3.6, 10.4Hz), 5.04(1H, m), 6.59(1H, d, J=5.2Hz), 7.21(1H, d, J=2.8Hz), 7.27(1H, dd, J=2.8, 9.2Hz), 7.52(1H, d, J=2.8Hz), 7.63(1H, s), 7.99(1H, s), 8.29(1H, d, J=9.2Hz), 8.72-8.74(2H, m).
제조예
431-1
4-(4-아미노-3- 클로로페녹시 )-6- 시아노 -7-(((2R)-2-히드록시-3-(1- 피롤리디노)프로필)옥시)퀴놀린
4-(4-아미노-3-클로로페녹시)-6-시아노-7-((2R)-옥시란-2-일)메톡시퀴놀린(96 mg, 0.261 mmol)을 질소 분위기하에, 테트라히드로푸란(2.0 ml)에 용해시키고, 피롤리딘(0.2 ml)을 가하여, 실온에서 5일간 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(95.5 mg, 0.218 mmol, 83.4%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.26(2H, m), 1.82(4H, br), 2.58-2.76(5H, m), 2.94(1H, m), 4.11(2H, m), 4.20-4.45(2H, m), 6.48(1H, d, J=5.2Hz), 6.85(1H, d, J=8.8Hz), 6.93(1H, dd, J=2.8, 8.8Hz), 7.14(1H, d, J=2.8Hz), 7.49(1H, s), 8.66-8.68(2H, m).
실시예
432
N-(2- 클로로 -4-((6- 시아노 -7-(((2S)-2-히드록시-3-(1- 피롤리디노 )프로필) 옥시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아
4-(4-아미노-3-클로로페녹시)-6-시아노-7-(((2R)-2-히드록시-3-(1-피롤리디노)프로필)옥시)퀴놀린(82.0 mg, 0.187 mmol)을 디메틸포름아미드(1 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.023 ml, 0.28 mmol), 페닐 클로로포르메이트(0.029 ml, 0.23 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.10 ml)을 적하하여, 밤새 더 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(25.0 mg, 0.048 mmol, 25.6%)을 담황색 결정으로서 얻었다.
제조예
432-1
4-(4-아미노-3- 클로로페녹시 )-6- 시아노 -7-(((2S)-2-히드록시-3-(1- 피롤리디노)프로필)옥시)퀴놀린
4-(4-아미노-3-클로로페녹시)-6-시아노-7-((2S)-옥시란-2-일)메톡시퀴놀린(72 mg, 0.196 mmol)을 질소 분위기하에, 테트라히드로푸란(1.5 ml)에 용해시키고, 피롤리딘(0.15 ml)을 가하여, 실온에서 5일간 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(82.0 mg, 0.187 mmol, 95.4%)을 담황색 결정으로서 얻었다.
실시예
433
메틸 4-(4-(((4- 플루오로아닐리노 )카르보닐)( 메틸 )아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복실레이트
실시예 10과 같은 식의 수법에 의해, 메틸 7-메톡시-4-(4-(메틸아미노)페녹시)퀴놀린카르복실레이트(828 mg, 2.45 mmol)와 4-플루오로페닐 이소시아네이트로부터 표제 화합물(1.078 g, 2.27 mmol, 92.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.39(3H, s), 3.98(3H, s), 4.06(3H, s), 6.20(1H, s), 6.57(1H, d, J=5.2Hz), 6.97(2H, m), 7.24-7.34(4H, m), 7.46(2H, m), 7.52(1H, s), 8.71(1H, d, J=5,2Hz), 8.78(1H, s).
출발 물질은 다음의 방법으로 합성했다.
제조예
433-1
메틸
7-
메톡시
-4-(4-(
메틸아미노
)
페녹시
)-6-
퀴놀린카르복실레이트
4-메틸아미노페놀(1.11 g, 9.00 mmol)을 디메틸설폭시드(15 ml)에 용해시키고, 실온에서 수소화나트륨(360 mg, 9.00 mmol)을 서서히 가하여 20분간 교반했다. 공지의 방법으로 얻어지는 4-클로로-7-메톡시-6-메톡시카르보닐퀴놀린(1.51 g, 6.00 mmol)을 가하여, 100℃에서 2시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(830 mg, 2.45 mmol, 40.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.88(3H, s), 3.83(1H, br), 3.97(3H, s), 4.04(3H, s), 6.42(1H, d, J=5.2Hz), 6.68(2H, d, J=8.8Hz), 7.01(2H, d, J=8.8Hz), 7.45(1H, s), 8.60(1H, d, J=5.2Hz), 8.84(1H, s).
실시예 434
4-(4-(((4-플루오로아닐리노)카르보닐)(메틸)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산
메틸 4-(4-(((4-플루오로아닐리노)카르보닐)(메틸)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실레이트(1.042 g, 2.19 mmol)에 메탄올(20 ml), 2규정 수산화나트륨 수용액(5 ml)을 가하여, 실온으로 3시간동안 교반했다. 반응액에 2규정 염산을 가하여 중화시킨 후, 메탄올을 감압 증류 수거하여, 석출된 백색 결정을 여과 수취하고, 70℃에서 건조하여, 표제 화합물(1.01 g, 2.19 mmol, 정량적)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.29(3H, s), 3.96(3H, s), 6.64(1H, d, J=5.2Hz), 7.06(2H, t, J=8.8Hz), 7.33(2H, d, J=8.8Hz), 7.42-7.50(5H, m), 8.23(1H, s), 8.54(1H, s), 8.70(1H, d, J=5.2Hz), 13.09(1H, br).
실시예
435
N6 - 시클로프로필 -4-(4-(((4- 플루오로아닐리노 )카르보닐)( 메틸 )아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(4-(((4-플루오로아닐리노)카르보닐)(메틸)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(115 mg, 0.25 mmol)을 디메틸포름아미드(2 ml)에 질소 분위기하에서 용해시키고, 트리에틸아민(0.2 ml), (1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트(221 mg, 0.50 mmol), 시클로프로필아민(0.10 ml)을 순차적으로 실온에서 가한 후, 밤새 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 의해 정제했다. 목적물을 포함하는 분획을 감압 농축한 후, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(78.7 mg, 0.157 mmol, 63.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.57(2H, m), 0.70(2H, m), 2.86(1H, m), 3.29(3H, s), 3.98(3H, s), 6.64(1H, d, J=5.2Hz), 7.06(2H, t, J=8.8Hz), 7.31(2H, d, J=8.8Hz), 7.42-7.49(5H, m), 8.23(1H, s), 8.34(1H, d, J=4.0Hz), 8.43(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
436
N6 -(2- 메톡시에틸 )-4-(4-(((4- 플루오로아닐리노 )카르보닐)( 메틸 )아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
실시예 435와 같은 식의 수법에 의해, 4-(4-(((4-플루오로아닐리노)카르보닐)(메틸)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(115 mg, 0.25 mmol)과 2-메톡시에틸아민으로부터 표제 화합물(97.0 mg, 0.187 mmol, 75.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.29(3H, s), 3.30(3H, s), 3.48(4H, br), 4.02(3H, s), 6.65(1H, d, J=5.2Hz), 7.06(2H, t, J=8.8Hz), 7.32(2H, d, J=8.8Hz), 7.43-7.48(4H, m), 7.52(1H, s), 8.23(1H, s), 8.45(1H, br), 8.62(1H, s), 8.69(1H, d, J=5.2Hz).
실시예
437
N6 - 메톡시 -4-(4-(((4- 플루오로아닐리노 )카르보닐)( 메틸 )아미노) 페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
실시예 435와 같은 식의 수법에 의해, 4-(4-(((4-플루오로아닐리노)카르보닐)(메틸)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(115 mg, 0.25 mmol)과 메톡실아민 히드로클로라이드로부터 표제 화합물(79.2 mg, 0.161 mmol, 64.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.29(3H, s), 3.73(3H, s), 3.98(3H, s), 6.65(1H, d, J=5.2Hz), 7.06(2H, t, J=8.8Hz), 7.32(2H, d, J=8.8Hz), 7.42-7.50(5H, m), 8.23(1H, s), 8.44(1H, s), 8.69(1H, d, J=5.2Hz), 11.45(1H, s).
실시예
438
N6 -(2- 에톡시에틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)을 디메틸포름아미드(2 ml)에 질소 분위기하에서 용해시키고, 2-에톡시에틸아민(0.042 ml, 0.40 mmol), 트리에틸아민(0.2 ml), ((1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트)(133 mg, 0.20 mmol)를 순차적으로 실온에서 가한 후, 밤새 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(87.7 mg, 0.176 mmol, 87.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.64(2H, m), 1.13(3H, t, J=6.8Hz), 2.56(1H, m), 3.44-3.53(6H, m), 4.02(3H, s), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.25(1H, s), 8.26(1H, dd, J=2.8, 9.2Hz), 8.46(1H, m), 8.62(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
439
N6 -(2-(2- 프로폭시 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-(2-프로폭시)에틸아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(90.0 mg, 0.175 mmol, 87.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.11(6H, d, J=6.4Hz), 2.56(1H, m), 3.43-3.53(4H, m), 3.60(1H, m), 4.02(3H, s), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.26(1H, d, J=8.8Hz), 8.43(1H, m), 8.46(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
440
N6 -(2- 시아노에틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 3-아미노프로피오니트릴로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(73.8 mg, 0.154 mmol, 76.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 2.81(2H, m), 3.56(2H, m), 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 8.8Hz), 7.49(1H, d, J=2.8Hz), 7.53(1H, s), 7.99(1H, s), 8.27(1H, d, J=8.8Hz), 8.61(1H, s), 8.67(1H, d, J=5.2Hz), 8.74(1H, m).
실시예
441
N6 - 시아노메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(86 mg, 0.20 mmol)과 2-아미노아세토니트릴 히드로클로라이드로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(82.7 mg, 0.178 mmol, 88.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 4.05(3H, s), 4.35(2H, d, J=5.6Hz), 6.54(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.50(1H, d, J=2.8Hz), 7.56(1H, s), 7.99(1H, s), 8.28(1H, d, J=9.2Hz), 8.69(1H, d, J=5.2Hz), 8.71(1H, s), 9.05(1H, m).
실시예
442
N6 - 메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 40% 메틸아민(메탄올 용액)으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(31.6 mg, 0.072 mmol, 71.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 2.82(3H, d, J=4.8Hz), 4.00(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.50(1H, s), 7.96(1H, s), 8.26(1H, d, J=9.2Hz), 8.34(1H, m), 8.57(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
443
N6 -에틸-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 2.0M 에틸아민(테트라히드로푸란 용액)으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(29.6 mg, 0.065 mmol, 65.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.13(3H, t, J=7.2Hz), 2.56(1H, m), 3.25-3.35(2H, m), 4.00(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.21(1H, dd, J=2.8, 9.2Hz), 7.46(1H, d, J=2.8Hz), 7.49(1H, s), 7.96(1H, s), 8.25(1H, d, J=9.2Hz), 8.37(1H, m), 8.52(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
444
N6 -프로필-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 프로필아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(21.6 mg, 0.046 mmol, 46.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 0.90(3H, t, J=7.2Hz), 1.54(2H, m), 2.56(1H, m), 3.22-3.28(2H, m), 4.00(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.21(1H, dd, J=2.8, 9.2Hz), 7.46(1H, d, J=2.8Hz), 7.49(1H, s), 7.97(1H, s), 8.27(1H, d, J=9.2Hz), 8.35(1H, m), 8.49(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
445
N6 -프로파길-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 프로파길아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(25.4 mg, 0.055 mmol, 54.6%)을 백색분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 3.13(1H, m), 4.00(3H, s), 4.10(2H, m), 6.53(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.53(1H, s), 7.99(1H, s), 8.27(1H, d, J=9.2Hz), 8.59(1H, s), 8.67(1H, d, J=5.2Hz), 8.79(1H, m).
실시예
446
N6 - 시클로프로필메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 (아미노메틸)시클로프로판 히드로클로라이드로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(25.6 mg, 0.053 mmol, 53.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.26(2H, m), 0.41-0.47(4H, m), 0.65(2H, m), 1.06(1H, m), 2.56(1H, m), 3.22(2H, m), 4.03(3H, s), 6.53(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.98(1H, s), 8.27(1H, d, J=9.2Hz), 8.45(1H, m), 8.56(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
447
N6 -( cis -2- 플루오로시클로프로필 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 cis-2-플루오로시클로프로필아민 토실레이트로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(38.4 mg, 0.079 mmol, 79.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.03-1.17(2H, m), 2.56(1H, m), 2.91(1H, m), 4.00(3H, s), 4.79(1H, m), 6.51(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.51(1H, s), 7.98(1H, s), 8.26(1H, d, J=8.8Hz), 8.45(1H, m), 8.50(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
448
N6 -(3- 메톡시프로필 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 3-메톡시프로필아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(30.3 mg, 0.061 mmol, 60.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.77(2H, m), 2.56(1H, m), 3.24(3H, s), 3.34-3.42(4H, m), 4.00(3H, s), 6.51(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.50(1H, s), 7.96(1H, s), 8.27(1H, dd, J=2.8, 9.2Hz), 8.41(1H, m), 8.54(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
449
N6 -(2-아미노-2- 옥소에틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 글리신아미드 히드로클로라이드로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(37.4 mg, 0.077 mmol, 77.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 3.94(2H, d, J=5.6Hz), 4.07(3H, s), 6.53(1H, d, J=5.2Hz), 7.14(1H, s), 7.20(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.44(1H, s), 7.50(1H, d, J=2.8Hz), 7.56(1H, s), 7.99(1H, s), 8.27(1H, d, J=9.2Hz), 8.67-8.71(2H, m), 8.77(1H, s).
실시예
450
N6 -((2R) 테트라히드로 -2- 푸라닐메틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)와 R-테트라히드로푸르푸릴아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(31.8 mg, 0.062 mmol, 62.2%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.62(1H, m), 1.78-1.93(3H, m), 2.57(1H, m), 3.38(2H, m), 3.64(1H, dd, J=3.6, 14.0Hz), 3.79(1H, dd, J=4.0, 14.0Hz), 3.99(1H, m), 4.02(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, s), 7.23(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.26(1H, d, J=8.8Hz), 8.41(1H, m), 8.59(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
451
N6 -((2S) 테트라히드로 -2- 푸라닐메틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 S-테트라히드로푸르푸릴아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(36.4 mg, 0.071 mmol, 71.2%)을 백색분말로서 얻었다.
실시예
452
N-(4-(6-
시아노
-7-히드록시-4-
퀴놀릴
)
옥시페닐
)-
N'
-(4-
플루오로페닐
)
우레아
N-(4-(7-(벤질옥시)-6-시아노-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(6.20 g, 12.3 mmol)를 트리플루오로초산(60 ml), 티오아니솔(3.6 ml, 30.7 mmol)에 질소 분위기하에서 용해시킨 후, 60℃에서 밤새 교반했다. 반응액을 감압 농축하고 얻어진 잔사에 물(100 ml)을 가한 후, 탄산수소나트륨을 가하여 중화시키고, 또 디에틸에테르(200 ml)를 가하여 교반하고, 석출된 결정을 여과 수취하여, 물, 디에틸에테르로 세척하고, 70℃에서 건조하여 황색 결정으로서 표제 화합물(4.816 g, 11.6 mmol, 94.8%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.42(1H, d, J=5.2Hz), 7.11(2H, m), 7.22(2H, m), 7.41(1H, s), 7.46(2H, m), 7.58(2H, m), 8.64(1H, d, J=5.2Hz), 8.67(1H, s), 8.73(1H, s), 8.82(1H, s).
실시예
453
N-(4-(6- 시아노 -7-((2R)- 옥시란 -2-일) 메톡시 -4- 퀴놀릴 ) 옥시페닐 )- N' -(4- 플루오로페닐)우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(1.24 g, 3.0 mmol)와 (2R)-옥시란-2-일메틸 4-메틸-1-벤젠설포네이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(713 mg, 1.52 mmol, 50.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.81(1H, m), 2.92(1H, m), 3.46(1H, m), 4.17(1H, dd, J=6.8, 11.6Hz), 4.71(1H, dd, J=2.4, 11.6Hz), 6.53(1H, d, J=5.2Hz), 7.12(2H, m), 7.24(2H, m), 7.46(2H, m), 7.58(2H, m), 7.63(1H, s), 8.71-8.73(2H, m), 8.78(1H, s), 8.83(1H, s).
실시예
454
N-(4-((6- 시아노 -7-(((2R)-2-히드록시-3-(1- 피롤리디노 )프로필) 옥시 )-4- 퀴놀릴)옥시)페닐)-N'-(4-플루오로페닐)우레아
N-(4-(6-시아노-7-((2R)-옥시란-2-일)메톡시-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(200 mg, 0.425 mmol)를 질소 분위기하에, 테트라히드로푸란(5.0 ml)에 용해시키고, 피롤리딘(0.5 ml)을 가하여, 실온에서 밤새 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸-메탄올 9:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 메탄올(5 ml)을 가하여 결정화시켜, 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(157.7 mg, 0.291 mmol, 68.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.67(4H, br), 2.47-2.52(5H, m), 2.69(1H, m), 4.01(1H, m), 4.20(1H, dd, J=5.6, 10.8Hz), 4.30(1H, dd, J=3.6, 10.8Hz), 5.02(1H, d, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 7.11(2H, m), 7.23(2H, m), 7.46(2H, m), 7.57-7.61(3H, m), 8.70-8.75(3H, m), 8.83(1H, s).
실시예
455
N-(4-((6- 시아노 -7-(((2R)-3-( 디에틸아미노 )-2-히드록시프로필) 옥시 )-4- 퀴놀릴)옥시)페닐)-N'-(4-플루오로페닐)우레아
N-(4-(6-시아노-7-((2R)-옥시란-2-일)메톡시-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(200 mg, 0.425 mmol)를 질소 분위기하에, 테트라히드로푸란(5.0 ml)에 용해시키고, 디에틸아민(1.0 ml)을 가하여, 60℃에서 밤새 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸-메탄올 9:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 메탄올(5 ml)을 가하여 결정화시키고, 여과 수취하여, 통풍 건조시킴으로써, 표제 화합물(126.4 mg, 0.233 mmol, 54.7%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.96(6H, t, J=7.2Hz), 2.42-2.57(5H, m), 2.64(1H, m), 3.95(1H, m), 4.21(1H, dd, J=5.6, 10.4Hz), 4.30(1H, dd, J=3.6, 10.4Hz), 4.91(1H, d, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 7.11(2H, m), 7.23(2H, m), 7.46(2H, m), 7.56-7.60(3H, m), 8.70-8.75(3H, m), 8.82(1H, s).
실시예
456
N-(4-((6- 시아노 -7-(((2R)-2-히드록시-3-(1- 피페리디노 )프로필) 옥시 )-4- 퀴놀릴)옥시)페닐)-N'-(4-플루오로페닐)우레아
*N-(4-(6-시아노-7-((2R)-옥시란-2-일)메톡시-4-퀴놀릴)옥시페닐)-N'-(4-플루오로페닐)우레아(200 mg, 0.425 mmol)를 질소 분위기하에, 테트라히드로푸란(5.0 ml)에 용해시키고, 피페리딘(0.5 ml)을 가하여, 60℃에서 밤새 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸-메탄올 9:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 메탄올(5 ml)을 가하여 결정화시켜, 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(169.8 mg, 0.306 mmol, 71.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.36(2H, m), 1.47(4H, m), 2.34-2.51(6H, m), 4.02(1H, m), 4.20(1H, dd, J=5.6, 10.4Hz), 4.30(1H, dd, J=3.2, 10.4Hz), 4.93(1H, d, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 7.11(2H, m), 7.23(2H, m), 7.46(2H, m), 7.57-7.62(3H, m), 8.70-8.75(3H, m), 8.83(1H, s).
실시예
457
메틸 7-( 벤질옥시 )-4-(3- 클로로 -(4-(( 시클로프로필아미노 )카르보닐)아미노)페녹시)-6-퀴놀린카르복실레이트
메틸4-(4-아미노-3-클로로페녹시)-7-(벤질옥시)-6-퀴놀린카르복실레이트(3.938 g, 9.06 mmol)를 디메틸포름아미드(40 ml)에 질소 분위기하에서 용해시키고, 피리딘(1.10 ml, 13.6 mmol), 페닐 클로로포르메이트(1.70 ml, 13.6 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(1.88 ml, 27.2 mmol)을 적하하고, 밤새 더 교반했다. 반응액을 초산에틸(400 ml)과 물(200 ml)에 분배하여, 유기층을 물로 세척한 후, 감압 농축하고, 초산에틸(40 ml)을 가하여 석출된 결정을 여과 수취하고, 통풍 건조시킴으로써 표제 화합물(2.225 g, 4.30 mmol, 47.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 3.87(3H, s), 5.39(2H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.32(1H, m), 7.41(2H, m), 7.49(1H, d, J=2.8Hz), 7.54(2H, m), 7.61(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.60(1H, s), 8.67(1H, d, J=5.2Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
457-1
메틸 4-(((2,2-디메틸-4,6- 디옥소 -1,3-디옥산-5- 일리덴 ) 메틸 )아미노)-2- 히드록시벤조에이트
공지 화합물인 메틸 4-아미노-2-히드록시벤조에이트(7.59 g, 45.4 mmol)에 멜드럼산(7.2 g, 50 mmol), 오르토포름산트리에틸(50 ml), 2-프로판올(50 ml)을 가하여 100℃에서 1시간동안 교반했다. 실온으로 방냉하고, 석출된 결정을 여과 수취하여, 디에틸에테르로 세척하고, 통풍 건조시켜 표제 화합물(13.98 g, 43.5 mmol, 95.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.76(6H, s), 3.97(3H, s), 6.75(1H, dd, J=2.4, 8.8Hz), 6.83(1H, d, J=2.4Hz), 7.90(1H, d, J=8.8Hz), 8.65(1H, m), 11.0(1H, s), 11.20(1H, m).
제조예
457-2
메틸 2-( 벤질옥시 )-4-(((2,2-디메틸-4,6- 디옥소 -1,3-디옥산-5- 일리덴 ) 메틸 )아미노)벤조에이트
질소 분위기하 실온에서, 메틸 4-(((2,2-디메틸-4,6-디옥소-1,3-디옥산-5-일리덴)메틸)아미노)-2-히드록시벤조에이트(13.975 g, 43.5 mmol)를 디메틸포름아미드(140 ml)에 현탁시키고, 수소화나트륨(1.87 g, 46.8 mmol)을 서서히 가했다. 1.5시간후, 벤질브로마이드(5.7 ml, 47.9 mmol)를 적하하여, 2일간 교반했다. 반응액을 물(700 ml)로 희석하여, 밤새 교반한 후, 석출된 결정을 여과 수취하여, 디에틸에테르로 세척하고, 70℃에서 건조시킴으로써 표제 화합물(15.477 g, 37.6 mmol, 86.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.76(6H, s), 3.91(3H, s), 5.23(2H, s), 6.83(1H, s), 6.88(1H, m), 7.26-7.54(5H, m), 7.95(1H, m), 8.62(1H, m), 11.24(1H, m).
제조예
457-3
메틸
7-(
벤질옥시
)-4-옥소-1,4-
디히드로
-6-
퀴놀린카르복실레이트
메틸 2-(벤질옥시)-4-(((2,2-디메틸-4,6-디옥소-1,3-디옥산-5-일리덴)메틸)아미노)벤조에이트(15.477 g, 37.6 mmol)에 Dowtherm A(160 ml)를 가하여 200℃에서 1시간동안 교반했다. 실온으로 방냉하여, 석출된 결정을 여과 수취하고, 디에틸에테르로 세척하여, 통풍 건조시킴으로써 표제 화합물(7.19 g, 23.2 mmol, 61.8%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.81(3H, s), 5.26(2H, s), 5.97(1H, d, J=7.6Hz), 7.09(1H, s), 7.30-7.53(5H, m), 7.84(1H, m), 8.46(1H, s), 11.69(1H, m).
제조예
457-4
메틸
7-(
벤질옥시
)-4-
클로로
-6-
퀴놀린카르복실레이트
메틸 7-(벤질옥시)-4-옥소-1,4-디히드로-6-퀴놀린카르복실레이트(7.19 g, 23.2 mmol)에 티오닐클로라이드(70 ml)와 촉매량의 디메틸포름아미드를 가하여, 교반하에 3시간동안 가열 환류시켰다. 반응액을 감압 농축하고, 2규정 수산화나트륨 용액을 서서히 가하여 중화시킨 후, 초산에틸로 추출하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하고, 디에틸에테르를 가하여 결정화시켜, 여과 수취하고, 통풍 건조시켜 표제 화합물(4.067 g, 12.4 mmol)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.00(3H, s), 5.33(2H, s), 7.31-7.58 (7H, m), 8.66(1H, s), 8.75(1H, d, J=5.2Hz).
제조예
457-5
메틸
4-(4-아미노-3-
클로로페녹시
)-7-(
벤질옥시
)-6-
퀴놀린카르복실레이트
4-아미노-3-클로로페놀(2.22 g, 15.45 mmol)을 디메틸설폭시드(40 ml)에 용해시키고, 실온에서 수소화나트륨(618 mg, 15.45 mmol)을 서서히 가하여 30분간 교반했다. 메틸 7-(벤질옥시)-4-클로로-6-퀴놀린카르복실레이트(4.05 g, 12.36 mmol)를 가하여, 100℃에서 2시간동안 교반하에 가열했다. 실온으로 방냉하고, 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(3.938 g, 9.06 mmol, 73.3%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.98(3H, s), 4.11(2H, m), 5.34(2H, s), 6.43(1H, d, J=5.2Hz), 6.85(1H, d, J=8.8Hz), 6.93(1H, dd, J=2.8, 8.8Hz), 7.14(1H, d, J=2.8Hz), 7.30-7.57(6H, m), 8.62(1H, d, J=5.2Hz), 8.82(1H, s).
실시예
458
N6 -(2- 플루오로에틸 )-4-(4-(( 시클로프로필아미노 )카르보닐)아미노-3- 메틸페녹시)-7-메톡시-6-퀴놀린카르복사미드
메틸 4-(4-아미노-3-메틸페녹시)-7-메톡시-6-퀴놀린카르복실레이트(30 mg, 0.0736 mmol)를 N,N-디메틸포름아미드(1.4 ml)에 용해하고, 트리에틸아민(0.071 ml), 벤조트리아졸-1-일트리스(디메틸아미노)포스포늄헥사플루오로포스페이트(63 mg)를 가하고, 이것에 2-플루오로에틸아민염산염(14 mg)을 가하여, 실온에서 5시간동안 교반했다. 반응 용액에 물을 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 여과액을 감압 증류 수거했다. 생성된 결정을 에탄올에 현탁시키고, 이것을 디에틸에테르로 희석시킨 후 결정을 여과 수취하여, 디에틸에테르로 결정을 세척하고, 흡인 건조시킨 후, 담황색 결정으로서 표제 화합물(22 mg, 0.0486 mmol, 66.03%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :0.41-0.45(2H, m), 0.63-0.69(2H, m), 2.22(3H, s), 2.52-2.60(1H, m), 3.61(1H, q, J=5.2Hz), 3.67(1H, q, J=5.2Hz), 4.03(3H, s), 4.52(1H, t, J=5.2Hz), 4.64(1H, t, J=5.2Hz), 6.47(1H, d, J=5.0Hz), 6.78(1H, m), 7.05(1H, dd, J=2.8Hz, 8.8Hz), 7.11(1H, d, J=2.8Hz), 7.52(1H, s), 7.63(1H, s), 7.94(1H, d, J=8.8Hz), 8.59-8.62(2H, m), 8.66(1H, d, J=5.0Hz).
출발 원료는 다음와 같이 합성했다.
제조예
458-1
메틸
4-(4-아미노-3-
메틸페녹시
)-7-
메톡시
-6-
퀴놀린카르복실레이트
WO0050405에 기재된 메틸 4-클로로-7-메톡시-6-퀴놀린카르복실레이트(1.5 g, 5.9127 mmol), 4-아미노-3-크레졸(1.46 g, 11.8254 mmol)을 이용하여 제조예 395-1과 같은 방법에 의해, 갈색 결정으로서 표제 화합물(158 mg, 0.4669 mmol, 7.90%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.06(3H, s), 3.84(3H, s), 3.95(3H, s), 4.93(2H, s), 6.40(1H, d, J=5.0Hz), 6.69(1H, d, J=8.4Hz), 6.82(1H, d, J=8.4Hz), 6.86(1H, s), 7.47(1H, s), 8.56(1H, s), 8.62(1H, d, J=5.0Hz).
제조예
458-2
메틸 4-(4-(( 시클로프로필아미노 )카르보닐)아미노-3- 메틸페녹시 )-7- 메톡시 -6-퀴놀린카르복실레이트
4-(4-아미노-3-메틸페녹시)-7-메톡시-6-메톡시카르보닐퀴놀린(158 mg, 0.4669 mmol)을 이용하여 제조예 17과 같은 조작에 의해 페닐카르바메이트화시키고, 그대로 정제하지 않고 계속해서 실시예 11과 같은 식의 조작에 의해 시클로프로필아민을 작용시킴으로써, 담갈색 결정으로서 표제 화합물(173 mg, 0.4105 mmol, 87.92%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.40-0.43(2H, m), 0.61-0.66(2H, m), 2.20(3H, s), 2.52-2.57(1H, m), 3.85(3H, s), 3.96(3H, s), 6.45(1H, d, J=5.4Hz), 6.75(1H, s), 7.04(1H, dd, J=2.4Hz, 8.8Hz), 7.10(1H, d, J=2.4Hz), 7.51(1H, s), 7.60(1H, s), 7.92(1H, d, J=8.8Hz), 8.57(1H, s), 8.66(1H, d, J=5.4Hz).
제조예
458-3
4-(4-(( 시클로프로필아미노 )카르보닐)아미노-3- 메틸페녹시 )-7- 메톡시 -6- 퀴놀린카르복실산
N-시클로프로필-N'-[2-메틸-4-(6-카르복실-7-메톡시-4-퀴놀릴)옥시페닐]우레아(173 mg, 0.3972 mmol)를 메탄올(3 ml)에 용해하고, 2N 수산화나트륨 수용액(1 ml)을 가하여, 60℃에서 45분간 가열 교반했다. 용매를 감압 증류 수거하여, 석출된 결정을 다시 메탄올에 용해하고, 이것에 1N 염산을 pH 4가 될 때까지 가하고, 이것에 포화식염수를 가했다. 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거하여, 생성된 결정을 아세톤·디에틸에테르에 현탁시켜, 결정을 여과 수취하고, 흡인 건조시킴으로써, 갈색 결정으로서 표제 화합물(95 mg, 0.2332 mmol, 56.80%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.66(2H, m), 2.25(3H, s), 2.57(1H, m), 3.51(1H, brs), 4.05(3H, s), 6.84(1H, d, J=6.8Hz), 7.12(1H, brs), 7.16(1H, dd, J=2.4Hz, 8.8Hz), 7.21(1H, brs), 7.74(1H, s), 7.92(1H, s), 8.06(1H, d, J=8.8Hz), 8.70(1H, s), 8.95(1H, d, J=6.8Hz).
실시예
459
N6 -(2- 메톡시에틸 )-4-(4-(( 시클로프로필아미노 )카르보닐)아미노-3- 메틸페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(4-((시클로프로필아미노)카르보닐)아미노-3-메틸페녹시)-7-메톡시-6-퀴놀린카르복실산(30 mg, 0.0736 mmol), 2-메톡시에틸아민(0.0123 ml)을 이용하여 실시예 458과 같은 식의 반응을 행하고, NH 실리카겔 컬럼 크로마토그래피(초산에틸:메탄올=10:1)로 정제하여, 생성된 결정을 아세톤:디에틸에테르=1:5에 현탁시키고, 여과 수취하여, 디에틸에테르로 결정을 세척하고, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(17 mg, 0.0366 mmol, 49.73%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41-0.45(2H, m), 0.63-0.69(2H, m), 2.22(3H, s), 2.54-2.60(1H, s), 3.30(3H, s), 3.50(4H, m), 4.04(3H, s), 6.47(1H, d, J=5.0Hz), 6.78(1H, m), 7.05(1H, dd, J=2.4Hz, 8.4Hz), 7.12(1H, d, J=2.4Hz), 7.52(1H, s), 7.63(1H, s), 7.94(1H, d, J=8.4Hz), 8.45(1H, brs), 8.63(1H, s), 8.66(1H, d, J=5.0Hz).
실시예
460
N6 - 메톡시 -4-(4-(( 시클로프로필아미노 )카르보닐)아미노-3- 메틸페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
4-(4-((시클로프로필아미노)카르보닐)아미노-3-메틸페녹시)-7-메톡시-6-퀴놀린카르복실산(30 mg, 0.0736 mmol), 메톡시아민염산염(0.0123 ml)을 이용하여 실시예 458과 같은 식의 반응을 행하고, NH 실리카겔 컬럼 크로마토그래피(초산에틸:메탄올=10:1)로 정제하여, 생성된 결정을 에탄올에 현탁시키고, 헥산으로 희석하여, 여과 수취하고, 헥산으로 결정을 세척하여, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(7 mg, 0.0160 mmol, 21.74%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :0.40-0.45(2H, m), 0.63-0.68(2H, m), 2.21(3H, s), 2.51(3H, s), 2.53-2.59(1H, m), 3.94(3H, s), 6.46(1H, d, J=5.0Hz), 6.79(1H, s), 7.04(1H, d, J=8.4Hz), 7.09(1H, s), 7.43(1H, s), 7.63(1H, s), 7.92(1H, d, J=8.4Hz), 8.04(1H, s), 8.62(1H, d, J=5.0Hz), 9.86(1H, s).
실시예
461
N-[4-(2- 시클로프로필 -3H- 이미다조[4,5-b]피리딘 -4-일) 옥시페닐 ]- N' -(4- 플루오로페닐)우레아
2-시클로프로필-7-(4-아미노페닐옥시)-3H-이미다조[4,5-b]피리딘 130 mg, p-플루오로페닐이소시아네이트 0.06 ml, 테트라히드로푸란 5 ml, 디메틸포름아미드 0.5 ml를 실온하에 35분동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하고 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(초산에틸 이어서 초산에틸:메탄올=10:1)를 행했다. 생성된 잔사를 초산에틸-메탄올-헥산으로부터 고체화하여 목적물을 회색 고체로서 38 mg 얻었다.
H-NMR(DMSO-d6) δ(ppm) : 1.02-1.12(4H, m), 2.04-2.14(1H, m), 6.34(0.75H, d, J=5.6Hz), 6.35(0.25H, d, J=5.6Hz), 7.05-7.18(4H, m), 7.40-7.55(4H, m), 7.98(0.75H, d, J=5.6Hz), 8.07(0.25H, d, J=5.6Hz) 8.69(0.75H, s), 8.70(0.25H, s), 8.73(0.75H, s), 8.76(0.25H, s).
원료는 다음과 같은 식으로 얻었다.
제조예
461-1
2-
시클로프로필
-7-(4-
아미노페닐옥시
)-3H-
이미다조[4,5-b]피리딘
4-클로로-2-니트로아미노피리딘 9.3 g을 빙냉한 진한 황산 60 ml에 조금씩 가했다. 다 가한후 곧바로 냉욕을 제거하고 실온에서 2.5시간동안 교반했다. 반응 용액을 얼음에 전개하고 이어서 진한 암모니아수를 pH 5가 될 때까지 가했다. 석출된 고체를 여과 수취하여 60℃에서 바람에 말려 황색의 고체 11.2 g를 얻었다. 이렇게 해서 얻은 고체 11.2 g을 p-니트로페놀 10.8 g, 휴니히 염기 17 ml, 1-메틸-2-피롤리디논 34 ml의 혼합물에 가하여 120℃에서 3시간동안 가열 교반했다. 실온으로 되돌리고 이어서 물 50 ml를 가하여, 석출된 고체를 여과 수취했다. 60℃에서 풍건하여 4.77 g의 고체를 얻었다. 이 고체 4.77 g를 테트라히드로푸란 100 ml에 녹이고, 팔라듐탄소(Pd-C(10%, wet)) 2.0 g를 가하여 상압하에 24시간동안 환원시켰다. Pd-C를 여과 제거한 후 용매를 감압 증류 수거하여 적갈색의 유상물 5.2 g을 얻었다. 이 유상물 5.2 g을 시클로프로판카르복실산 4.6 g, 인산 50 ml의 혼합물에 가하여 160℃에서 5시간동안 가열 교반했다. 반응 용액을 얼음에 전개하여 5N 수산화나트륨물로 중화시키고, 초산에틸로 추출했다. 추출액을 황산마그네슘으로 건조하고 이어서 용매를 감압 증류 수거했다. 생성된 잔사를 NH 타입 실리카겔(클로로포름:메탄올=10:1)로 정제했다. 용매를 감압 증류 수거하여 생성된 잔사를 소량의 초산에틸에 녹여 방치하여, 석출된 고체를 여과 수취하여 목적물인 흑보라색 고체 130 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.00-1.12(4H, m), 2.05-2.14(1H, m), 5.08(2H, bs), 6.23(1H, d, J=5.6Hz), 6.61(2H, d, J=8.8Hz), 6.83(1.5H, d, J=8.8Hz), 6.90(0.5H, d, J=8.8Hz), 7.92(0.75H, d, J=5.6Hz), 8.01(0.25H, d, J=5.6Hz), 12.75(0.75H, s), 12.85(0.25H, s).
실시예
462
N-[4-(2- 시클로부탄카르보닐아미노피리딘 -4-일) 옥시페닐 ]- N' -(4- 플루오로페닐)우레아
N-[4-(2-아미노피리딘-4-일)옥시페닐]-N'-(4-플루오로페닐)우레아 100 mg, 트리에틸아민 0.12 ml, 테트라히드로푸란 10 ml를 실온 교반한 용액에 시클로부탄카르보닐클로라이드 70 mg을 가하여 15분동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하고 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(클로로포름:메탄올=40:1)를 행했다. 생성된 잔사를 초산에틸-메탄올-헥산으로부터 고체화하여 목적물을 백색고체로서 64 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.68-1.78(1H, m), 1.80-1.92(1H, m), 1.95-2.18(4H, m), 3.24-3.34(1H, m), 6.63(1H, dd, J=5.6Hz, J=2.4Hz), 7.05-7.15(4H, m), 7.42-7.49(2H, m), 7.52(2H, d, J=8.8Hz), 7.66(1H, d, J=2.4Hz), 8.13(1H, d, J=5.6Hz), 8.71(1H, s), 8.77(1H, s), 10.29(1H, s).
원료는 다음과 같은 식으로 얻었다.
제조예
462-1
2-아미노-4-(4-
니트로페녹시
)피리딘
2-아미노-4-클로로피리딘 15.88 g, p-니트로페놀 34.5 g 큐니히 염기 52 ml, 1-메틸-2-피롤리디논 100 ml를 160℃에서 15시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 용매를 감압하에 증류 제거했다. 잔사를 NH 타입 실리카겔을 이용하여 컬럼 크로마토그래피(헥산:초산에틸=1:1)로 정제하여, 목적물인 담황색 고체 3.24 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 6.04(1H, d, J=2.4Hz), 6.12(2H, brs), 6.26(1H, dd, J=6.0Hz, J=2.4Hz), 7.32(2H, d, J=8.8Hz), 7.92(1H, d, J=6.0Hz), 8.31(2H, d, J=8.8Hz).
제조예
462-2
2-아미노-4-(4-
아미노페녹시
)피리딘
2-아미노-4-(4-니트로페녹시)피리딘 1 g을 철분 2.0 g, 염화암모늄 4.0 g, 에탄올 30 ml, 디메틸포름아미드 30 ml, 물 15 ml의 혼합물에 가하여, 100℃에서 10분 격하게 교반했다. 반응액을 세라이트 여과하고 용매를 감압 증류 수거하여 0.53 g의 목적물을 고체로서 얻었다.
1H-NMR(DMSO-d6) d(ppm) : 5.04(2H, bs), 5.72(1H, d, J=1.6Hz), 5.81(2H, brs), 6.05(1H, dd, J=5.6Hz, J=1.6Hz), 6.57(2H, d, J=8.8Hz), 6.75(2H, d, J=8.8Hz), 7.70(1H, d, J=5.6Hz).
제조예
462-3
N-[4-(2-
아미노피리딘
-4-일)
옥시페닐
]-
N'
-(4-
플루오로페닐
)
우레아
2-아미노-4-(4-아미노페녹시)피리딘 0.53 g을 테트라히드로푸란 20 ml, 디메틸포름아미드 10 ml의 혼합 용매에 녹이고 실온하에 p-플루오로페닐이소시아네이트 0.36 ml를 가하여 1시간동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(클로로포름: 메탄올=20:1 이어서 10:1)를 행했다. 용매를 감압 증류 수거하여 목적물을 백색 분말로서 610 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 5.78(1H, s), 5.87(1H, s), 5.89(1H, s), 6.09-6.13(1H, m), 7.00-7.15(4H, m), 7.42-7.52(4H, m), 7.77(1H, dd, J=6.0Hz, J=1.6Hz), 8.69(1H, s), 8.73(1H, s).
실시예 462와 같은 식으로 조작하여, 이하의 검체를 합성했다.
실시예
463
N-[4-(2-
부타노일아미노피리딘
-4-일)
옥시페닐
]-
N'
-(4-
플루오로페닐
)
우레아
1H-NMR(DMSO-d6) δ(ppm) : 0.85(3H, t, J=7.2Hz), 1.52(2H, tq, J=7.2Hz, J=7.2Hz), 2.30(2H, t, J=7.2Hz), 6.63(1H, dd, J=5.6Hz, J=2.0Hz), 7.06-7.16(4H, m), 7.42-7.50(2H, m), 7.52(2H, d, J=8.8Hz), 7.65(1H, d, J=2.0Hz), 8.14(1H, d, J=5.6Hz), 8.72(1H, s), 8.77(1H, s), 10.45(1H, s).
*실시예 464
N-{4-[2-(4- 에톡시카르보닐부타노일 ) 아미노피리딘 -4-일] 옥시페닐 }- N' -(4- 플루오로페닐)우레아
1H-NMR(DMSO-d6) δ(ppm) : 1.14(3H, t, J=7.2Hz), 1.74(2H, tt, J=7.2Hz, J=7.2Hz), 2.26(2H, t, J=7.2Hz), 2.35(2H, t, J=7.2Hz), 4.01(2H, q, J=7.2Hz), 6.62(1H, dd, J=6.0Hz, J=2.4Hz), 7.05-7.15(4H, m), 7.41-7.49(2H, m), 7.51(2H, d, J=8.8Hz), 7.62(1H, d, J=2.4Hz), 8.14(1H, d, J=6.0Hz), 8.70(1H, s), 8.76(1H, s).
실시예
465
N-[4-(2-
니코티노일아미노피리딘
-4-일)
옥시페닐
]-
N'
-(4-
플루오로페닐
)
우레아
1H-NMR(DMSO-d6) δ(ppm) : 6.75(1H, dd, J=5.6Hz, J=2.4Hz), 7.06-7.18(4H, m), 7.42-7.58(5H, m), 7.75(1H, 2.4Hz), 8.22(2H, m), 8.72(2H, brs), 8.78(1H, s), 9.06(1H, s).
실시예
466
N-{4-[2-(4- 카르복시부타노일 ) 아미노피리딘 -4-일] 옥시페닐 }- N' -(4- 플루오로페닐)우레아
N-{4-[2-(4-에톡시카르보닐부티릴)아미노피리딘-4-일]옥시페닐}-N'-(4-플루오로페닐)우레아 22 mg, 2N 수산화나트륨 수용액 1 ml, 메탄올 2 ml, 디메틸포름아미드 1 ml를 80℃에서 20분동안 교반했다. 실온으로 되돌린 후, 5N 염산수 0.4 ml를 가하고, 석출된 고체를 여과 수취하여 목적물인 백색 고체 16 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.72(2H, tt, J=7.2Hz, J=7.2Hz), 2.20(2H, t, J=7.2Hz), 2.36(2H, t, J=7.2Hz), 6.62(1H, dd, J=6.0Hz, J=2.0Hz), 7.05-7.15(4H, m), 7.41-7.49(2H, m), 7.52(2H, d, J=8.8Hz), 7.63(1H, d, J=2.0Hz), 8.14(1H, d, J=6.0Hz), 8.71(1H, s), 8.76(1H, s), 10.46(1H, s), 12.03(1H, s).
실시예
467
N-(4-{2-[( 시클로프로필메틸 ) 아미노카르보닐 ]피리딘-4-일} 옥시페닐 )- N' -(4-플루오로페닐)우레아
4-(4-아미노페녹시)-2-[(시클로프로필메틸)아미노카르보닐]피리딘 100 mg을 테트라히드로푸란 5 ml에 녹이고 실온하에 p-플루오로페닐이소시아네이트 0.075 ml를 가하여 1시간동안 교반했다. 반응 용액에 NH 타입 실리카겔을 가하여 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=1:1 이어서 초산에틸 이어서 초산에틸:메탄올=10:1)를 행했다. 용매를 감압 증류 수거하여 잔사에 초산에틸과 헥산을 가하고 석출된 고체를 여과 수취하여, 목적물을 담황색 분말로서 25 mg 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.21(2H, bs), 0.38(2H, bs), 1.02(1H, bs), 3.12(2H, dd, J=6.0Hz, 6.0Hz), 7.07-7.21(5H, m), 7.37(1H, s), 7.43-7.51(2H, m), 7.56(2H, d, J=8.0Hz), 8.49(1H, d, J=5.2Hz), 8.74(1H, s), 8.81(1H, s), 8.83(1H, t, J=6.0Hz).
원료는 다음과 같은 식으로 얻었다.
제조예
467-1
4-
클로로
-2-[(
시클로프로필메틸
)
아미노카르보닐
]피리딘
4-클로로-2-카르복시피리딘 2.0 g, (아미노메틸)시클로프로판염산염 1.7 g, 1-에틸-3-(3-디에틸아미노프로필)카르보디이미드염산염(WSC) 2.9 g, 1-히드록시벤조트리아졸(HOBt) 2.3 g, 트리에틸아민 2.1 ml, 테트라히드로푸란 30 ml를 실온에서 2시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 이어서 실리카겔을 추출액에 가하여 용매를 감압 증류 수거했다. 이 실리카겔을 실리카겔을 채운 드라이 컬럼에 채워 컬럼 크로마토그래피(헥산:초산에틸=4:1 이어서 2:1)로 정제했다. 목적물을 황색 유상물로서 1.5 g 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.19-0.30(2H, m), 0.36-0.43(2H, m), 0.99-1.09(1H, m), 3.15(2H, dd, J=6.4Hz, J=6.4Hz), 7.75(1H, d, J=5.6Hz), 8.01(1H, s), 8.62(1H, d, J=5.6Hz), 8.90(1H, t, J=6.4Hz).
제조예
467-2
2-[(
시클로프로필메틸
)
아미노카르보닐
]-4-(4-
니트로페녹시
)피리딘
4-클로로-2-[(시클로프로필메틸)아미노카르보닐]피리딘 1.5 g, p-니트로페놀 2.0 g 휴니히 염기 3.1 ml, 1-메틸-2-피롤리디논 6.2 ml를 160℃에서 3시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 용매를 감압하에 증류 제거했다. 잔사를 NH 타입 실리카겔을 이용하여 컬럼 크로마토그래피(헥산:초산에틸=4:1 이어서 2:1)로 정제하여, 목적물인 무색 유상물 0.35 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.19-0.24(2H, m), 0.36-0.41(2H, m), 1.02(1H, bs), 3.13(2H, dd, J=6.4Hz, J=6.4Hz), 7.34(1H, dd, J=5.6Hz, J=1.6Hz), 7.44(2H, d, J=8.8Hz), 7.55(1H, d, J=1.6Hz), 8.33(2H, d, J=8.8Hz), 8.61(1H, d, J=5.6Hz), 8.90(1H, t, J=6.4Hz).
제조예
467-3
4-(4-
아미노페녹시
)-2-[(
시클로프로필메틸
)
아미노카르보닐
]피리딘
2-[(시클로프로필메틸)아미노카르보닐]-4-(4-니트로페녹시)피리딘 0.35 g을 철분 0.7 g, 염화암모늄 1.4 g, 에탄올 10 ml, 디메틸포름아미드 10 ml, 물 5 ml의 혼합물에 가하여, 100℃에서 20분 격하게 교반했다. 반응액을 세라이트 여과하고 용매를 감압 증류 수거하여 0.37 g의 목적물을 담갈색 유상물로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.20-0.30(2H, m), 0.38-0.44(2H, m), 0.99-1.10(1H, m), 3.13(2H, dd, J=6.4Hz, J=6.4Hz), 5.14-5.19(2H, m), 6.65(2H, d, J=8.8Hz), 6.87(2H, d, J=8.8Hz), 7.10(1H, dd, J=5.6Hz, J=2.8Hz), 7.35(1H, d, J=2.8Hz), 8.47(1H, d, J=5.6Hz), 8.81(1H, t, J=6.4Hz).
실시예
468
N-{4-[2-(
부틸로일아미노
)피리딘-4-일]
옥시페닐
}-
N'
-
시클로프로필우레아
페닐 N-{4-[2-(부틸로일아미노)피리딘-4-일]옥시페닐}카르바메이트 0.116 g, 시클로프로필아민 0.034 g, 트리에틸아민 0.041 ml, 테트라히드로푸란 10 ml를 밀봉한 관 속에서 100℃에서 1시간동안 가열했다. 반응 용액에 NH 타입 실리카겔을 가하고 용매를 감압 증류 수거하여 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 NH 타입 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(초산에틸)를 행했다. 용매를 감압 증류 수거하고 잔사에 초산에틸과 헥산을 가하여 석출된 고체를 여과 수취하여, 목적물 20 mg을 백색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.45(2H, m), 0.61-0.67(2H, m), 0.86(3H, t, J=7.2Hz), 1.54(2H, tq, J=7.2Hz, J=7.2Hz), 2.31(2H, t, J=7.2Hz), 2.48-2.58(1H, m), 6.42(1H, s), 6.62(1H, dd, J=5.6Hz, J=2.0Hz), 7.05(2H, d, J=8.8Hz), 7.49(2H, d, J=8.8Hz), 7.64(1H, d, J=2.0Hz), 8.15(1H, d, J=5.6Hz), 8.41(1H, s), 10.82(1H, s).
원료는 다음과 같은 식으로 얻었다.
제조예
468-1
2-
부틸로일아미노
-4-(4-
니트로페녹시
)피리딘
2-아미노-4-(4-니트로페녹시)피리딘 1.0 g, 트리에틸아민 1.8 ml, 테트라히드로푸란 20 ml의 교반 용액 중에 실온하에 부틸로일클로라이드 0.93 ml를 적하했다. 1시간동안 교반한 후, 물을 가하여 초산에틸로 추출하고, 황산마그네슘으로 건조한 후 용매를 감압 증류 수거했다. 잔사를 실리카겔 크로마토그래피(헥산:초산에틸=2:1)로 정제하여 목적물을 무색 유상물로서 0.6 g 얻었다.
1H-NMR(CDCl3) δ(ppm) : 0.99(3H, t, J=7.2Hz), 1.73(2H, tq, J=7.2Hz, J=7.2Hz), 2.36(2H, t, J=7.2Hz), 6.72(1H, dd, J=5.6Hz, 2.4Hz), 7.21(2H, d, J=8.8Hz), 7.95(1H, d, J=2.4Hz), 8.22(1H, d, J=5.6Hz), 8.25(1H, brs), 8.30(2H, d, J=8.8Hz).
제조예
468-2
4-(4-
아미노페녹시
)-2-(
부티릴아미노
)피리딘
2-부티릴아미노-4-(4-니트로페녹시)피리딘 0.6 g, 철분 1.2 g, 염화암모늄 2.8 g, 에탄올 10 ml, 디메틸포름아미드 10 ml, 물 5 ml의 혼합물을 100℃에서 10분 격하게 교반했다. 반응액을 세라이트 여과하여 용매를 감압 증류 수거하고, 이어서 여과액에 물을 가하여 초산에틸로 추출했다. 황산마그네슘으로 건조하고 이어서 용매를 감압 증류 수거하여 0.6 g의 목적물을 담황색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.86(3H, t, J=7.2Hz), 1.54(2H, tq, J=7.2Hz, J=7.2Hz), 2.30(2H, t, J=7.2Hz), 5.06-5.15(2H, m), 6.56(1H, dd, J=5.6Hz, J=2.4Hz), 6.61(2H, d, J=8.8Hz), 6.81(2H, d, J=8.8Hz), 7.61(1H, d, J=2.4Hz), 8.10(1H, d, J=5.6Hz), 10.38(1H, s).
제조예
468-3
페닐
N-{4-[2-(
부틸로일아미노
)피리딘-4-일]
옥시페닐
}
카르바메이트
4-(4-아미노페녹시)-2-(부티릴아미노)피리딘 0.3 g, 트리에틸아민 0.14 ml, 테트라히드로푸란 10 ml의 빙냉 교반 용액 중에 페닐클로로포르메이트 0.14 ml를 적하했다. 냉욕을 제거하여 실온하에서 밤새 교반했다. 반응 용액에 실리카겔을 가하여 용매를 감압 증류 수거하고 실리카겔에 반응 생성물을 흡착시켰다. 이 실리카겔을 충전한 드라이 컬럼에 채워, 컬럼 정제(헥산:초산에틸=2:1 이어서 1:1)를 행했다. 용매를 감압 증류 수거하여 목적물을 무색 고체로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.86(3H, t, J=7.2Hz), 1.54(2H, tq, J=7.2Hz, J=7.2Hz), 2.31(2H, t, J=7.2Hz), 6.64-6.80(1H, m), 7.16(2H, d, J=8.8Hz), 7.22-7.31(3H, m), 7.41-7.48(2H, m), 7.60(2H, d, J=8.8Hz), 7.66(1H, d, J=2.0Hz), 8.17(1H, dd, J=5.6Hz, J=2.0Hz) 10.72(1H, s), 10.90(1H, s).
실시예
469
1-[4-(5- 디메틸아미노메틸 -6- 페닐 -7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ) 페닐 ]-(3-플루오로페닐)우레아
1-(3-플루오로페닐)-3-[4-(6-페닐-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐]우레아 50 mg에 N,N-디메틸메틸렌암모늄옥화물(Eschenmoser's salt) 29.5 mg, 디메틸포름아미드 1.5 ml를 가하여, 100℃에서 밤새 교반한 후, 물을 가하여, 초산에틸로 분액 추출했다. 유기층을 농축하여, 감압 건조하고 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올)에 가하여, 표제 화합물 20 mg을 얻었다.
MS Spectrum(ESI) : 497(M+1)
*1H-NMR Spectrum : (DMSOd6) 2.26(6H, s), 3.64(2H, s), 6.73-6.80(1H, m), 6.85(1H, s), 7.08-7.58(10 H, m), 8.00(1H, d, J=7.7Hz), 8.26(1H, d, J=0.9Hz), 8.82(1H, s), 8.92(1H, s), 12.54(1H, brs)
실시예
470
1-{4-[6-(4- 벤질옥시페닐 )-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ]-2- 클로로페닐}-3-시클로프로필우레아
1-{4-[6-(4-벤질옥시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-클로로페닐}-3-시클로프로필우레아 38 mg을 테트라히드로푸란 0.8 ml에 녹이고, 테트라부틸암모늄플루오라이드(테트라히드로푸란 1M 용액) 0.2 ml를 적하하여, 2시간동안 환류시켰다. 실온으로 되돌려, 물을 가하고, 초산에틸-테트라히드로푸란으로 분액 추출했다. 유기층을 물, 포화식염수로 세척하고, 농축, 감압 건조시켜 표제 화합물 26 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 0.39-0.44(2H, m), 0.60-0.70(2H, m), 2.50-2.60(1H, m), 5.18(2H, s), 6.93(1H, s), 7.09-7.50(10 H, m), 7.89(2H, d, J=8.1Hz), 7.92(1H, s), 8.13(1H, d, J=8.1Hz), 8.28(1H, d, J=1.0Hz), 12.60(1H, brs)
실시예
471
1-{2- 클로로 -4-[6-(4- 히드록시페닐 )-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ]- 페닐}-3-시클로프로필우레아
1-{4-[6-(4-벤질옥시페닐)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-클로로페닐}-3-시클로프로필우레아 24 mg에 트리플루오로초산 2 ml, 티오아니솔 0.1 ml를 가하여, 45℃에서 30분간 교반했다. 반응계를 감압 농축한 후, 포화중조수를 가하여, 알카리성으로 만든 후, 초산에틸-테트라히드로푸란으로 분액 추출했다. 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조한 후, 농축, 감압 건조시켜 표제 화합물 15 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 0.39-0.44(2H, m), 0.60-0.67(2H, m), 2.52-2.60(1H, m), 6.80-6.88(3H, m), 7.12(1H, d, J=2.0Hz), 7.27(1H, dd, J=9.0Hz, J'=2.0Hz), 7.40(1H, d, J=2.0Hz), 7.76(2H, d, J=9.0Hz), 7.91(1H, s), 8.13(1H, d, J=9.0Hz), 8.25(1H, d, J=1.0Hz), 9.77(1H, brs), 12.50(1H, brs)
실시예
472
1-{4-[6-(4- 벤질옥시페닐 )-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시 ] 페닐 }-3-(3-플루오로페닐)우레아
6-(4-벤질옥시페닐)-4-(4-니트로페녹시)-7H-피롤로[2,3-d]피리미딘 550 mg에, 철분 600 mg, 염화암모늄 1.1 g, 에탄올 10 ml, 테트라히드로푸란 20 ml, 물 10 ml를 가하여 80-85℃에서 1.5시간동안 교반했다. 실온으로 되돌린 후 세라이트 여과하고, 여과액에 초산에틸, 물을 가하여, 분액 추출했다. 유기층을 무수황산나트륨으로 건조하고, 면전 여과하여, 농축 건조시켜 아미노체를 포함하는 미정제물 493 mg을 얻었다. 이 미정제물 중에서 490 mg을 톨루엔 10 ml, 아세토니트릴 10 ml에 90℃에서 용해시키고, 3-플루오로페닐이소시아네이트 0.3 ml를 가하여 1시간동안 교반했다. 실온에 방치하여, 석출된 결정을 여과 수취하고, 건조시켜 표제 화합물 450 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 5.17(2H, s), 6.77(1H, dt, J=2.9, 7.8Hz), 6.88(1H, d, J=1.2Hz), 7.08-7.53 (14 H, m), 7.88(2H, d, J=9.1Hz), 8.25(1H, s), 8.75(1H, s), 8.98(1H, s), 12.56(1H, brs)
실시예
473
1-(3- 플루오로페닐 )-3-{4-[6-(4- 히드록시페닐 )-7H- 피롤로[2,3-d]피리미딘 -4-일옥시]페닐}우레아
1-{4-[6-(4-벤질옥시페닐)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}-3-(3-플루오로페닐)우레아 377 mg을 트리플루오로초산 4 ml, 티오아니솔 0.4 ml에 녹여, 45℃에서 40분간 교반했다. 그 후 실온으로 되돌려, 탄산칼륨을 가하여, 알카리성 초산에틸-테트라히드로푸란(5:1) 혼합 용매로 분액 추출했다. 유기층을 농축 건조시켜 표제 화합물 310 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.70-6.80(2H, m), 6.82(2H, d, J=8.3Hz), 7.10-7.52(7H, m), 7.75(2H, d, J=8.3Hz), 8.23(1H, s),8.85(1H, s), 8.98(1H, s), 8.98(1H, s), 12.48(1H, brs)
실시예
474
1-(4-{6-[4-(2- 디에틸아미노에톡시 )- 페닐 ]-7H- 피롤로[2,3-d]피리미딘 -4- 일옥시}페닐)-3-(3-플루오로페닐)우레아
1-(3-플루오로페닐)-3-{4-[6-(4-히드록시페닐)-7H-피롤로[2,3-d]피리미딘-4-일옥시]페닐}우레아 114 mg을 디메틸포름아미드 2 ml에 녹이고 2-클로로에틸디에틸아민염산염 44 mg(약 1당량), 탄산수소칼륨 63 mg(2.5당량)을 가하여, 50-60℃에서 16시간동안 교반했다. 그 후 2-클로로에틸디에틸아민염산염 17 mg, 탄산수소칼륨 20 mg, 디메틸포름아미드 1 ml를 가하여, 같은 온도에서 밤새 교반했다. 그 후 실온으로 되돌려, 물을 가하여 초산에틸-테트라히드로푸란으로 분액 추출했다. 유기층을 물, 포화식염수로 세척하고, 농축하여 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물을 포함하는 미정제물 고체 33 mg을 얻었다. 이것을 초산에틸로 세척하여, 표제 화합물 5 mg을 얻었다.
MS Spectrum(ESI) : 555(M+1),
1H-NMR Spectrum : (DMSOd6) 0.96(6H, t, J=7.4Hz) 2.53(4H, q, J=7.4Hz), 2.78(2H, t, J=6.2Hz), 4.06(2H, t, J=6.2Hz), 6.74-6.88(2H, m), 7.02(2H, d, J=9.0Hz), 7.09-7.54(7H, m), 7.86(2H, d, J=9.0Hz), 8.25(1H, s),8.83(1H, brs), 8.96(1H, brs), 12.50(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
474-1
6-(4-
벤질옥시페닐
)-4-(4-
니트로페녹시
)-7H-
피롤로[2,3-d]피리미딘
4-니트로페놀 3.09 g에 탄산칼륨 2.97 g, 디메틸포름아미드 30 ml를 가하여 130℃에서 10분간 교반한 후, 6-(4-벤질옥시페닐)-4-클로로-7H-피롤로[2,3-d]피리미딘 2.49 g을 가하여, 130℃에서 5시간, 135℃에서 밤새 교반했다. 실온으로 한 후, 물을 가하여, 석출된 고체를 여과 수취하고 NH 실리카겔 컬럼 크로마토그래피(초산에틸), 실리카겔 컬럼 크로마토그래피(초산에틸)에 가하여, 에테르, 초산에틸을 가하고, 초음파처리했다. 고체를 여과 수취하여 표제 화합물 1.2 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 5.18(2H, s), 6.99(1H, d, J=1.7Hz), 7.08-7.13(2H, m), 7.28-7.48(5H, m), 7.53-7.60(2H, m), 7.88-7.93(2H, m), 8.30-8.35(3H, m),12.71(1H, brs)
실시예
475
1-(3- 플루오로페닐 )-3-{4-[6-(4- 피롤리딘 -1- 일페닐 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시]페닐}우레아
4-클로로-6-(4-피롤리딘-1-일페닐)-7H-피롤로[2,3-d]피리미딘 630 mg에 4-니트로페놀 646 mg, 탄산칼륨 817 mg, 디메틸포름아미드 6.3 ml를 가하여 130℃에서 밤새 교반했다. 물을 가하여, 초산에틸로 분액 추출하고, 유기층을 물, 포화식염수로 세척하고, 농축 건조시켜 510 mg의 고체를 얻었다. 이 고체에 철분 500 mg, 염화암모늄 1 g, 에탄올 20 ml, 테트라히드로푸란 10 ml, 물 3 ml를 가하여 80℃에서 2시간동안 교반했다. 실온으로 되돌린 후 세라이트 여과하고, 여과액에 초산에틸, 테트라히드로푸란, 물을 가하여, 분액 추출하여, 유기층을 무수황산나트륨으로 건조하고, 면전 여과, 농축 건조시켜 380 mg의 미정제물을 얻었다. 이것에 톨루엔 5 ml, 아세토니트릴 5 ml, 테트라히드로푸란 5 ml를 가하여 100℃에서 용해시키고, 3-플루오로페닐이소시아네이트 0.19 ml를 가하여 1시간동안 교반했다. 실온에 방치하고, 석출된 결정을 여과 수취하여, 에테르로 세척하고, 감압 건조시켜 표제 화합물 40 mg을 얻었다.
MS Spectrum(ESI; nega) : 509(M+1)
1H-NMR Spectrum : (DMSOd6) 1.85-2.02(4H, m), 3.10-3.32(4H, m), 6.42(1H, d, J=8.2Hz), 6.60(1H, d, J=8.2Hz), 6.70-6.80(2H, m), 7.02-7.53(9H, m), 8.00(1H, s), 8.99(1H, s), 9.17(1H, s), 11.81(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
475-1
2-아미노-5-(4-
피롤리딘
-1-
페닐
)-1H-피롤-3-
카르복실산에틸에스테르
2-아미디노-초산에틸에스테르염산염 13.8 g(Liebigs Ann. Chem., 1895(1977)에 기재된 공지 화합물)에 에탄올 150 ml를 가하여 0℃에서 나트륨에톡시드 5.94 g(2-아미디노초산에틸에스테르염산염에 대하여 0.97당량)를 가하여, 질소 분위기하에서, 10분간 교반했다. 거기에, 2-브로모-1-(4-피롤리딘-1-페닐)-에타논(랭커스터) 12 g를 가하여, 실온에서 48시간동안 교반했다. 초산에틸을 가하여, 초음파처리하고, 고체를 여과하여 여과액을 농축하고, 실리카겔 컬럼 크로마토그래피(초산에틸)에 가하여, 표제 화합물 4.82 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 1.22(3H, d, J=7.3Hz), 1.88-1.98(4H, m), 3.16-3.24(4H, m), 4.06-4.14(2H, m), 5.52(2H, s), 6.13(1H, d, J=2.8Hz), 6.48(2H, d, J=8.8Hz), 7.28(2H, d, J=8.8Hz), 10.48(1H, s)
제조예
475-2
6-(4-
피롤리딘
-1-
일페닐
)-7H-
피롤로[2,3-d]피리미딘
-4-올
2-아미노-5-(4-피롤리딘-1-페닐)-1H-피롤-3-카르복실산에틸에스테르 4.80 g에 포름산 8 ml, 포름아미드 31.8 ml, 디메틸포름아미드 15.9 ml를 가하여, 140℃에서 48시간동안 교반한 후, 실온에서 24시간동안 방치했다. 석출된 고체를 여과 수취하고, 감압 건조한 후, 표제 화합물 3.0 g을 얻었다.
1H-NMR Spectrum : (DMSOd6) 1.86-2.00(4H, m), 3.08-3.13(4H, m), 6.54(2H, d, J=8.8Hz), 6.62(1H, s), 7.61(2H, d, J=8.8Hz), 7.78(1H, s), 12.40(1H, brs)
제조예
475-3
4-
클로로
-6-(4-
피롤리딘
-1-
일페닐
)-7H-
피롤로[2,3-d]피리미딘
6-(4-피롤리딘-1-일페닐)-7H-피롤로[2,3-d]피리미딘-4-올 1.9 g에 옥시염화인 20 ml를 가하여, 140℃에서 3시간동안 교반한 후, 실온으로 하여 반응계를 농축했다. 잔사에 빙수를 가하여, 중조로 중화하고, 초산에틸로 분액 추출했다. 유기층을 황산나트륨으로써 건조시켜 농축 건조시켜 표제 화합물을 포함하는 미정제물 12 g를 얻었다.
1H-NMR Spectrum : (DMSOd6) 1.86-2.02(4H, m), 3.10-3.32(4H, m), 6.60(2H, d, J=8.9Hz), 6.77(1H, d, J=2.0Hz), 7.81(2H, d, J=8.9Hz), 8.46(1H, s), 12.70(1H, brs)
실시예
476
N-{4-[6-( 메틸아미노 )카르보닐-7- 메톡시 -4- 퀴놀릴 ] 옥시페닐 }- N' -(4- 플루오로페닐)우레아
4-(4-아미노-페녹시)-7-메톡시-퀴놀린-6-카르복실산 메틸아미드(65 mg)와 이소시안산 4-플루오로페닐(0.05 ml)로부터 실시예 10의 방법에 의해 표제 화합물(85 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.81-2.84(3H, m), 4.00(3H, s), 6.46(1H, s), 7.07-7.24(4H, m), 7.43-7.61(5H, m), 8.32-8.38(1H, m), 8.59-8.65(2H, m), 8.80(1H, brs), 8.89(1H, brs)
출발 원료는 이하의 3공정으로 합성했다.
제조예
476-1
4-
클로로
-7-
메톡시퀴놀린
-6-
카르복실산
메틸아미드
7-메톡시-4-옥소-1,4-디히드로퀴놀린-6-카르복실산(947 mg)으로부터 제조예 152-2의 방법에 의해 합성한 7-메톡시-4-클로로-퀴놀린-6-카르보닐 클로라이드를 테트라히드로푸란(70 ml)에 용해하여, 0℃로 냉각했다. 여기에 40% 메틸아민 수용액(0.4 ml)을 가하여, 실온에서 30분간 교반했다. 물을 가하여 초산에틸로 3회 추출한 후, 유기층을 합쳐 물, 포화식염수로 세척하고, 황산나트륨으로 건조시킨 후에 감압 건조시켜 표제 화합물(710 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.07-3.10(3H, m), 4.12(3H, s), 7.40-7.43(1H, m), 7.56(1H, s), 7.83(1H, brs), 8.73-8.77(1H, m), 9.13(1H, s)
제조예
476-2
7-
메톡시
-4-(4-
니트로페녹시
)퀴놀린-6-
카르복실산
메틸아미드
4-클로로-7-메톡시퀴놀린-6-카르복실산 메틸아미드(492 mg)와 4-니트로페놀(492 mg)로부터 제조예 7의 방법에 의해 표제 화합물(736 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.76-2.82(3H, m), 4.02(3H, s), 6.86(1H, d, J=5.2Hz), 7.45-7.51(2H, m), 7.56(1H, s), 8.32-8.38(2H, m), 8.45(1H, s), 8.76-8.79(1H, m)
제조예
476-3
4-(4-
아미노페녹시
)-7-
메톡시퀴놀린
-6-
카르복실산
메틸아미드
7-메톡시-4-(4-니트로페녹시)-퀴놀린-6-카르복실산 메틸아미드(736 mg)로부터 제조예 10의 방법에 의해서 표제 화합물(250 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.81-2.84(3H, m), 3.99(3H, s), 5.14-5.19(2H, m), 6.39(1H, d, J=5.2Hz), 6.45(2H, d, J=8.4Hz), 6.92(2H, d, J=8.4Hz), 7.46(1H, s), 8.30-8.38(1H, m), 8.57-8.61(2H, m)
실시예
477
N-{4-[6-( 메틸아미노 )카르보닐-7- 메톡시 -4- 퀴놀릴 ] 옥시페닐 }- N' -(2- 티아졸릴)우레아
4-(4-아미노-페녹시)-7-메톡시퀴놀린-6-카르복실산 메틸아미드(65 mg)와 페닐 N-(2-티아졸릴)카르바메이트(49 mg)로부터 실시예 11에 기재한 방법으로 표제 화합물(32 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.80-2.85(3H, m), 4.00(3H, s), 6.47(1H, d, J=5.2Hz), 7.05-7.15(1H, m), 7.25(2H, d, J=8.8Hz), 7.35-7.40(1H, m), 7.50(1H, s), 7.62(2H, d, J=8.8Hz), 8.58-8.66(2H, m)
실시예
478
N-{4-[6-(디메틸아미노)카르보닐-7- 메톡시 -4- 퀴놀릴 ] 옥시페닐 }- N' -(2- 티아졸릴)우레아
4-(4-아미노페녹시)-7-메톡시퀴놀린-6-카르복실산 디메틸아미드(100 mg)와 페닐 N-(2-티아졸릴)카르바메이트(60 mg)로부터 실시예 11에 기재한 방법으로 표제 화합물(60 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.78(3H, s), 3.00(3H, s), 3.97(3H, s), 6.47(1H, d, J=5.2Hz), 7.05-7.15(1H, m), 7.24(2H, d, J=8.8Hz), 7.35-7.39(1H, m), 7.48(1H, s), 7.60(2H, d, J=8.8Hz), 8.04(1H, s), 8.62(1H, d, J=5.2Hz)
출발 물질은 이하의 3공정에 의해 합성했다.
제조예
478-1
4-
클로로
-7-
메톡시
-퀴놀린-6-
카르복실산
디메틸아미드
7-메톡시-4-옥소-1,4-디히드로퀴놀린-6-카르복실산(1.0 g)으로부터 제조예 152-2의 방법에 의해 합성한 7-메톡시-4-클로로-퀴놀린-6-카르보닐 클로라이드를 테트라히드로푸란(60 ml)에 용해하여, 0℃로 냉각했다. 여기에 디이소프로필에틸아민(1.6 ml)과 2.0M 디메틸아민 테트라히드로푸란 용액(3 ml)을 가하여, 실온에서 하룻밤 교반했다. 물을 가하여 초산에틸로 3회 추출한 후, 유기층을 합쳐 물, 포화식염수로 세척하고, 황산나트륨으로 건조시킨 후에 감압 건조시켜 표제 화합물(933 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.75(3H, s), 3.01(3H, s), 3.97(3H, s), 7.57(1H, s), 7.63(1H, d, J=4.8Hz), 7.93(1H, s), 8.78(1H, d, J=4.8Hz)
제조예
478-2
7-
메톡시
-4-(4-
니트로페녹시
)-퀴놀린-6-
카르복실산
디메틸아미드
4-클로로-7-메톡시퀴놀린-6-카르복실산 디메틸아미드(933 mg)와 4-니트로페놀(737 mg)로부터 제조예 10의 방법에 의해 표제 화합물(904 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.75(3H, s), 2.99(3H, s), 3.95(3H, s), 6.87(1H, d, J=5.2Hz), 7.46(2H, d, J=7.2Hz), 7.55(1H, s), 7.94(1H, s), 8.33(2H, d, J=7.2Hz), 8.76(1H, d, J=5.2Hz)
제조예
478-3
4-(4-
아미노페녹시
)-7-
메톡시퀴놀린
-6-
카르복실산
디메틸아미드
7-메톡시-4-(4-니트로페녹시)퀴놀린-6-카르복실산 디메틸아미드(904 mg)로부터 제조예 10의 방법에 의해서 표제 화합물(511 mg)을 얻었다.
1H-NMR(CDCl3) δ(ppm) 2.90(3H, s), 3.18(3H, s), 3.98(3H, s), 6.43(1H, d, J=5.6Hz), 6.75(2H, d, J=8.8Hz), 6.95(2H, d, J=8.8Hz), 7.45(1H, s), 8.27(1H, s), 8.57(1H, d, J=5.6Hz)
실시예
479
N-{4-[6-( 시클로프로필아미노 )카르보닐-7- 메톡시 -4- 퀴놀릴 ] 옥시페닐 }- N' -(4-플루오로페닐)우레아
실시예 341에서 합성한 N-[4-(6-카르복시-7-메톡시-4-퀴놀릴)옥시페닐]-N'-(4-플루오로페닐)우레아(60 mg)를 디메틸포름아미드(1.5 ml)에 용해시킨 후, 1-에틸-3-(3-디에틸아미노프로필)-카르보디이미드 하이드로클로라이드(39 mg), 1-히드록시-1H-벤조트리아졸 모노하이드레이트(31 mg), 트리에틸아민(30 ㎕), 시클로프로필아민(0.05 ml)을 가하여 실온에서 밤새 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 물로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸로 결정을 석출시켜, 여과 수취하고, 감압 건조시켜, 표제 화합물(29 mg)을 백색 결정으로서 얻었다.
1H-NMR(CDCl3) δ(ppm) 0.45-0.59(2H, m), 0.67-0.73(2H, m), 2.82-2.89(1H, m), 3.97(3H, s), 6.45(1H, d, J=5.2Hz), 7.08-7.23(4H, m), 7.43-7.50(3H, m), 7.55-7.60(2H, m), 8.32-8.35(1H, m), 8.42(1H, s), 8.62(1H, d, J=5.2Hz), 8.75(1H, brs), 8.84(1H, brs)
실시예
480
N-[4-(6- 아미노메틸 -7- 메톡시퀴놀린 -4- 일옥시 )- 페닐 ]- N' - 페닐우레아 트리플루오로아세테이트
실시예 37에서 합성한 N-[4-(6-시아노-7-메톡시퀴놀린-4-일옥시)페닐]-N'-페닐우레아(100 mg)를 에탄올(5 ml)과 테트라히드로푸란(5 ml)의 혼합 용매에 용해하고, 트리플루오로초산(0.5 ml)과 50% 팔라듐탄소(50 mg)를 가하여, 수소 기류하에 밤새 교반했다. 팔라듐탄소를 여과 수취한 후, 여과액을 농축했다. 생성된 잔사를 테트라히드로푸란으로 세척하여, 표제 화합물(70 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.02(3H, s), 4.24(2H, s), 6.64(1H, d, J=5.6Hz), 6.94-6.99(1H, m), 7.21-7.31(4H, m), 7.44-7.49(2H, m), 7.53(1H, s), 7.62-7.66(2H, m), 8.25(2H, brs), 8.48(1H, s), 8.76(1H, d, J=5.6Hz), 8.87(1H, brs), 9.04(1H, brs)
실시예
481
N-[4-(6-
아세틸아미노메틸
-7-
메톡시퀴놀린
-4-
일옥시
)
페닐
]-
N'
-
페닐우레아
N-[4-(6-아미노메틸-7-메톡시-퀴놀린-4-일옥시)페닐]-N'-페닐우레아 트리플루오로아세테이트(40 mg)를 피리딘(1.0 ml)과 무수초산(1.0 ml)에 용해하여 밤새 실온에서 교반했다. 반응 용액을 감압하에 농축하여, 얻어진 미정제 생성물을 초산에틸로 결정화하여 표제 화합물(13 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.90(3H, s), 3.98(3H, s), 4.37-4.40(2H, m), 6.46(1H, d, J=5.2Hz), 6.93-6.99(1H, m), 7.18-7.30(4H, m), 7.40(1H, s), 7.45(2H, d, J=7.6Hz), 7.59(2H, d, J=8.8Hz), 8.06(1H, s), 8.38-8.44(1H, m), 8.59(1H, d, J=5.2Hz) 8.70(1H, s), 8.83(1H, s)
실시예
482
N-(2- 플루오로 -4-〔(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' - 시클로프로필우레아
시클로프로필아민(0.10 ml)을 디메틸설폭시드(0.8 ml)에 가하여, 여기에〔4-(6-카르바모일-7-메톡시퀴놀린-4-일옥시)-2-플루오로페닐〕카르바민산 페닐 에스테르(80 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가하고 석출된 결정을 여과 수취하여, 표제 화합물(33 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.38-0.41(2H, m), 0.62-0.66(2H, m), 2.51-2.59(1H, m), 4.01(3H, s), 6.52(1H, d, J=5.2Hz), 6.78-6.81(1H, m), 7.04-7.09(1H, m), 7.28-7.34(1H, m), 7.50(1H, s), 7.72(1H, brs), 7.84(1H, brs), 8.16-8.23(2H, m), 8.63-8.67(2H, m)
출발 물질은 다음과 같이 합성했다.
제조예
482-1
〔4-(6- 카르바모일 -7- 메톡시퀴놀린 -4- 일옥시 )-2- 플루오로페닐 〕 카르바민산 페닐 에스테르
제조예 152-5에서 합성한 6-카르바모일-4-(4-아미노-3-플루오로페녹시)-7-메톡시퀴놀린으로부터 제조예 17에 기재한 방법으로 표제 화합물을 얻었다.
H-NMR(CDCl3) δ(ppm) 4.13(3H, s), 5.90(1H, brs), 6.53(1H, d, J=5.6Hz), 6.99-7.06(2H, m), 7.20-7.30(4H, m), 7.40-7.45(2H, m), 7.59(1H, s), 7.80(1H, brs), 8.24(1H, brs), 8.68(1H, d, J=5.6Hz), 9.27(1H, s)
실시예
483
N-(2- 플루오로 -4-〔(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' -(2- 티아졸릴)우레아
실시예 152-5에서 합성한 6-카르바모일-4-(4-아미노-3-플루오로페녹시)-7-메톡시퀴놀린(60 mg)과 페닐 N-(2-티아졸릴)카르바메이트(60 mg)로부터 실시예 224에 기재한 방법으로 표제 화합물(24 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.02(3H, s), 6.57(1H, d, J=5.2Hz), 7.12-7.18(2H, m), 7.37-7.45(2H, m), 7.51(1H, s), 7.73(1H, brs), 7.85(1H, brs), 8.18-8.26(1H, m), 8.64-8.69(2H, m)
실시예
484
N-{4-[6-( 메틸아미노 )카르보닐-7- 메톡시 -4- 퀴놀릴 ] 옥시페닐 }- N' - 시클로프로필우레아
N-[4-(7-메톡시-6-메틸카르바모일퀴놀린-4-일옥시)페닐]카르바민산 페닐 에스테르(80 mg)와 시클로프로필아민(20 mg)으로 실시예 11에 기재한 방법에 의하여 표제 화합물(33 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.39-0.43(2H, m), 0.62-0.68(2H, m), 2.50-2.58(1H, m), 2.84(3H, d, J=4.8Hz), 4.02(3H, s), 6.43-6.46(2H, m), 7.14-7.20(2H, m), 7.50(1H, s), 7.53-7.57(2H, m), 8.35-8.38(1H, m), 8.47(1H, brs), 8.61(1H, s), 8.64(1H, d, J=5.2Hz)
출발 물질은 다음의 방법으로 합성했다.
제조예
484-1
N-[4-(7- 메톡시 -6- 메틸카르바모일퀴놀린 -4- 일옥시 ) 페닐 ] 카르바민산 페닐 에스테르
4-(4-아미노페녹시)-7-메톡시퀴놀린-6-카르복실산 메틸아미드(53 mg)로부터 제조예 17에 기재한 방법으로 표제 화합물(60 mg)을 얻었다.
1H-NMR(CDCl3) δ(ppm) 3.08(3H, d, J=4.8Hz), 4.12(3H, s), 6.48(1H, d, J=5.2Hz), 7.14-7.29(6H, m), 7.37-7.45(2H, m), 7.55-7.63(3H, m), 7.89(1H, brs), 8.63(1H, d, J=5.2Hz), 9.28(1H, s)
실시예
485
N-(2- 플루오로 -4-〔(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' - 시클로부틸우레아
〔4-(6-카르바모일-7-메톡시퀴놀린-4-일옥시)-2-플루오로-페닐〕카르바민산 페닐 에스테르(73 mg)와 시클로부틸아민(28 mg)으로부터 실시예 11에 기재한 방법에 의해 표제 화합물(28 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.52-2.67(2H, m), 2.72-2.87(2H, m), 2.14-2.26(2H, m), 4.01(3H, s), 4.04-4.18(1H, m), 6.51(1H, d, J=5.2Hz), 6.88(1H, d, J=8.0Hz), 7.02-7.08(1H, m), 7.27-7.34(1H, m), 7.50(1H, s), 7.72(1H, brs), 7.84(1H, brs), 8.15-8.26(2H, m), 8.63-8.67(2H, m)
실시예
486
N-(2- 플루오로 -4-〔(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' - 시클로펜틸우레아
〔4-(6-카르바모일-7-메톡시퀴놀린-4-일옥시)-2-플루오로페닐〕카르바민산 페닐 에스테르(80 mg)와 시클로펜틸아민(38 mg)으로부터 실시예 11에 기재한 방법에 의해 표제 화합물(68 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.30-1.40(2H, m), 1.49-1.59(4H, m), 1.78-1.88(2H, m), 3.88-3.98(1H, m), 4.01(3H, s), 6.51(1H, d, J=5.2Hz), 6.67(1H, d, J=7.2Hz), 7.02-7.07(1H, m), 7.27-7.33(1H, m), 7.50(1H, s), 7.72(1H, brs), 7.84(1H, brs), 8.20-8.28(2H, m), 8.63-8.67(2H, m)
실시예
487
N-(2- 플루오로 -4-〔(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' -(2-프로필)우레아
〔4-(6-카르바모일-7-메톡시퀴놀린-4-일옥시)-2-플루오로페닐〕카르바민산 페닐 에스테르(60 mg)와 이소프로필아민(25 mg)으로부터 실시예 11에 기재한 방법에 의해 표제 화합물(39 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.09(6H, d, J=6.4Hz), 3.70-3.80(1H, m), 4.01(3H, s), 6.50-6.55(2H, m), 7.03-7.07(1H, m), 7.27-7.34(1H, m), 7.50(1H, s), 7.72(1H, brs), 7.84(1H, brs), 8.20-8.27(2H, m), 8.63-8.66(2H, m)
실시예
488
N-[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 메틸 - 페닐 ]- N' - 시클로프로필우레아
시클로프로필아민(0.10 ml)을 디메틸설폭시드(0.8 ml)에 가하여, 여기에 [4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시)-2-메틸페닐]카르바민산 페닐에스테르(136 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가하고 석출된 결정을 여과 수취하여 표제 화합물(90 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.38-0.44(2H, m), 0.62-0.69(2H, m), 2.22(3H, s), 2.53-2.60(1H, m), 4.03(3H, s), 6.46(1H, d, J=5.2Hz), 6.75-6.79(1H, m), 7.01-7.12(2H, m), 7.50(1H, s), 7.62(1H, s), 7.73(1H, brs), 7.85(1H, brs), 7.90-7.96(1H, m), 8.62-8.69(2H, m)
출발 물질은 다음의 3공정에 의해 합성했다.
제조예
488-1
6-
카르바모일
-4-(3-
메틸
-4-
니트로페녹시
)-7-
메톡시퀴놀린
제조예 7과 같은 식으로 7-메톡시-4-클로로-퀴놀린-6-카르복시아미드(1.0 g)와 4-니트로-3-메틸페놀(810 mg)로부터 표제 화합물(1.2 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.54(3H, s), 4.00(3H, s), 6.80(1H, d, J=5.2Hz), 7.28-7.32(1H, m), 7.41-7.43(1H, m), 7.54(1H, s), 7.72(1H, brs), 7.83(1H, brs), 8.13-8.16(1H, m), 8.55(1H, s), 8.72-8.76(1H, m)
제조예
488-2
4-(6-
카르바모일
-7-
메톡시
-4-
퀴놀릴
)
옥시
-2-
메틸
-
페닐아민
제조예 8과 같은 식으로 6-카르바모일-4-(3-메틸-4-니트로페녹시)-7-메톡시퀴놀린(1.2 g)으로부터 표제 화합물(0.22 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.07(3H, s), 4.00(3H, s), 4.88-4.94(2H, m), 6.39(1H, d, J=5.2Hz), 6.70-6.71(1H, m), 6.77-6.88(2H, m), 7.46(1H, s), 7.70(1H, brs), 7.83(1H, brs), 8.59(1H, d, J=5.2Hz), 8.66(1H, s)
제조예
488-3
[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 메틸페닐 ] 카르바민산 페닐에스테르
4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-메틸페닐아민으로부터 제조예 141-1에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(CDCl3) δ(ppm) 2.38(3H, s), 4.12(3H, s), 5.88(1H, brs), 6.49(1H, d, J=5.6Hz), 6.76(1H, brs), 7.04-7.09(2H, m), 7.20-7.29(3H, m), 7.38-7.45(2H, m), 7.54(1H, s), 7.80(1H, brs), 7.94(1H, brs), 8.64(1H, d, J=5.6Hz), 9.29(1H, s)
실시예
489
N-[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 )-2- 트리플루오로메틸 - 페닐 ]- N' -시클로프로필우레아
시클로프로필아민(0.10 ml)을 디메틸설폭시드(0.8 ml)에 가하여, 여기에 [4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시)-2-트리플루오로메틸페닐]카르바민산 페닐에스테르(140 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가하고 석출된 결정을 여과 수취하여 표제 화합물(103 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.38-0.44(2H, m), 0.62-0.68(2H, m), 2.51-2.59(1H, m), 4.02(3H, s), 6.52(1H, d, J=5.2Hz), 7.18-7.24(1H, m), 7.50-7.62(3H, m), 7.70-7.77(2H, m), 7.84(1H, brs), 8.07-8.14(1H, m), 8.64-8.69(2H, m)
출발 물질은 다음의 3공정에 의해 합성했다.
제조예
489-1
6-
카르바모일
-4-(3-
트리플루오로메틸
-4-
니트로페녹시
)-7-
메톡시퀴놀린
제조예 7과 같은 식으로 7-메톡시-4-클로로퀴놀린-6-카르복시아미드(900 mg)와 4-니트로-3-(트리플루오로메틸)페놀로부터 표제 화합물(1.2 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.03(3H, s), 6.91(1H, d, J=5.2Hz), 7.57(1H, s), 7.72-7.87(3H, m), 8.01-8.05(1H, m), 8.27-8.32(1H, m), 8.58(1H, s), 8.75-8.79(1H, m)
제조예
489-2
4-(6-
카르바모일
-7-
메톡시
-4-
퀴놀릴
)
옥시
-2-
트리플루오로메틸페닐아민
6-카르바모일-4-(3-트리플루오로메틸-4-니트로페녹시)-7-메톡시퀴놀린(0.60 g)을 테트라히드로푸란(10 ml)과 메탄올(10 ml)에 용해하여, 팔라듐탄소(600 mg)로 수소 분위기하에서서 10시간동안 접촉 환원하여, 표제 화합물(0.60 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.00(3H, s), 5.71(2H, brs), 6.42(1H, d, J=5.2Hz), 6.93-6.98(1H, m), 7.23-7.30(2H, m), 7.46-7.52(1H, m), 7.71(1H, brs), 7.83(1H, brs), 8.60-8.69(2H, m)
제조예
489-3
[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 트리플루오로메틸페닐 ] 카르바민산 페닐에스테르
4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-트리플루오로메틸-페닐아민으로부터 제조예 141-1에 기재한 방법으로 표제 화합물을 얻었다.
H-NMR(CDCl3) δ(ppm) 4.12(3H, s), 5.90(1H, brs), 6.48(1H, d, J=5.6Hz), 7.20-7.30(4H, m), 7.38-7.51(3H, m), 7.56(1H, s), 7.80(1H, brs), 8.27-8.31(1H, m), 8.70(1H, d, J=5.2Hz), 9.26(1H, s)
실시예
490
N-[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2,3- 디메틸페닐 ]- N' - 시클로프로필우레아
시클로프로필아민(0.10 ml)을 디메틸설폭시드(3.0 ml)에 가하고, 여기에 [4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시)-2,3-디메틸페닐]카르바민산 페닐에스테르(120 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가하고 석출된 결정을 여과 수취하여 표제 화합물(60 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.37-0.44(2H, m), 0.60-0.65(2H, m), 2.01(3H, s), 2.14(3H, s), 4.01(3H, s), 6.23(1H, d, J=5.2Hz), 6.64-6.69(1H, m), 6.98(1H, d, J=8.8Hz), 7.50(1H, s), 7.60-7.69(2H, m), 7.73(1H, brs), 7.85(1H, brs), 8.60(1H, d, 5.2Hz), 8.71(1H, s)
출발 물질은 이하의 2공정에 의해 합성했다.
제조예
490-1
4-(6-
카르바모일
-7-
메톡시
-4-
퀴놀릴
)
옥시
-2,3-
디메틸페닐아민
제조예 7과 같은 식으로 7-메톡시-4-클로로-퀴놀린-6-카르복시아미드(890 mg)와 4-니트로-2,3-디메틸페놀(940 mg)로부터 표제 화합물(840 mg)을 얻었다. 계속해서, 6-카르바모일-4-(2,3-디메틸-4-니트로페녹시)-7-메톡시퀴놀린(840 mg)을 테트라히드로푸란(25 ml)과 메탄올(25 ml)에 용해하여, 팔라듐탄소(840 mg)로 수소 분위기하에서서 10시간동안 접촉 환원하여, 표제 화합물(639 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.92(3H, s), 2.02(3H, s) 4.00(3H, s), 4.82-4.88(2H, m), 6.22(1H, d, J=5.2Hz), 6.60(1H, d, J=8.4Hz), 6.75(1H, d, J=8.4Hz), 7.471 H, s), 7.71(1H, brs), 7.84(1H, brs), 8.57(1H, d, J=5.2Hz), 8.70(1H, s)
제조예
490-2
[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2,3- 디메틸페닐 ] 카르바민산 페닐에스테르
4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2,3-디메틸페닐아민으로부터 제조예 141-1에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(CDCl3-d6) δ(ppm) 2.13(3H, s), 2.33(3H, s), 4.13(3H, s), 5.88(1H, brs), 6.29(1H, d, J=5.6Hz), 6.98-7.01(1H, m), 7.20-7.25(4H, m), 7.38-7.42(2H, m), 7.54(1H, s), 7.70(1H, brs), 7.80(1H, brs), 8.60(1H, d, J=5.6Hz), 9.36(1H, s)
실시예
491
N-[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 )-2,5- 디메틸페닐 ]- N' - 시클로프로필우레아
시클로프로필아민(0.06 ml)을 디메틸설폭시드(2.0 ml)에 가하고, 여기에 [4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시)-2,5-디메틸페닐]카르바민산 페닐에스테르(100 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가하고 석출된 결정을 여과 수취하여 표제 화합물(60 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.40-0.44(2H, m), 0.63-0.67(2H, m), 2.04(3H, s), 2.17(3H, s), 2.53-2.60(1H, m), 4.03(3H, s), 6.29(1H, d, J=5.2Hz), 6.75-6.78(1H, m), 7.02(1H, s), 7.51(1H, s), 7.58(1H, s), 7.74(1H, brs), 7.83-7.88(2H, m), 8.62(1H, d, 5.2Hz), 8.72(1H, s)
출발 물질은 이하의 2공정에 의해 합성했다.
제조예
491-1
4-(6-
카르바모일
-7-
메톡시
-4-
퀴놀릴
)
옥시
-2,5-
디메틸페닐아민
4-아미노-2,5-디메틸페놀(1.0 g)을 디메틸설폭시드(5 ml)에 용해하고, 60% 수소화나트륨(1.0 g)을 가하여 잠시 교반했다. 여기에 7-메톡시-4-클로로퀴놀린-6-카르복시아미드(900 mg)를 가하여, 100℃에서 6시간동안 가열했다. 이 반응 용액에 물을 가하여, 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸로 세척하여 표제 화합물(135 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.91(3H, s), 2.03(3H, s), 4.01(3H, s), 6.26(1H, d, J=5.2Hz), 6.57(1H, s), 6.77(1H, s), 7.46(1H, s), 7.70(1H, brs), 7.83(1H, brs), 8.57(1H, d, J=5.2Hz), 8.69(1H, s)
제조예
491-2
[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2,5- 디메틸페닐 ] 카르바민산 페닐에스테르
4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2,5-디메틸페닐아민으로부터 제조예 141-1에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(CDCl3) δ(ppm) 2.13(3H, s), 2.33(3H, s), 4.13(3H, s), 5.88(1H, brs), 6.30(1H, d, J=5.6Hz), 6.75(1H, brs), 6.94(1H, s), 7.18-7.32(3H, m), 7.38-7.45(2H, m), 7.54(1H, s), 7.82(2H, brs), 8.62(1H, d, J=5.6Hz), 9.32(1H, s)
실시예
492
N-{4-[6- 시아노 -7-(2-히드록시-3-( 피롤리딘 -1-일) 프로폭시 )퀴놀린-4- 일옥시 ]-2-플루오로페닐}-N'-(4-플루오로페닐)우레아
N-[4-(6-시아노-7-옥시라닐메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-N'-(4-플루오로페닐)우레아(100 mg)에 테트라히드로푸란 1 ml과 피롤리딘 0.1 ml를 가하여 50℃에서 30분간 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(45 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.60-1.70(4H, m), 2.40-2.75(6H, m), 3.95-4.05(1H, m), 4.20(1H, dd, J=10, 6.0Hz), 4.30(1H, dd, J=10, 4Hz), 5.02(1H, d, J=4.4Hz), 6.61(1H, d, J=5.2), 7.10-7.17(3H, m), 7.35-7.50(3H, m), 7.62(1H, s), 8.21-8.27(1H, m), 8.62-8.64(1H, m), 8.72-8.75(2H, m), 9.09(1H, brs)
출발 물질은 이하의 2공정에 의해 합성했다.
제조예
492-1
4-(4-아미노-3-
플루오로페녹시
)-7-
옥시라닐메톡시퀴놀린
-6-
카르보니트릴
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-히드록시퀴놀린(400 mg)에 디메틸포름아미드 6 ml, 에피브로모히드린 1.3 ml, 탄산칼륨 380 mg을 가하여, 실온에서 밤새 교반했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조하고 용매를 감압 증류 수거하여, 표제 화합물(400 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.79-2.93(2H, m), 3.42-3.49(1H, m), 4.15(1H, dd, J=12, 7.2Hz), 4.69(1H, dd, J=12, 2.4Hz), 5.25(2H, brs), 6.53(1H, d, J=5.2), 6.83-6.89(2H, m), 7.07-7.15(1H, m), 7.61(1H, s), 8.69-8.74(2H, m)
제조예
492-2
N-[4-(6- 시아노 -7- 옥시라닐메톡시퀴놀린 -4- 일옥시 )-2- 플루오로페닐 ]- N' -(4-플루오로페닐)우레아
4-(4-아미노-3-플루오로페녹시)-7-옥시라닐메톡시-퀴놀린-6-카르보니트릴(400 mg), 디메틸포름아미드(2 ml), 이소시안산 4-플루오로페닐(0.15 ml)을 가하여, 밤새 실온에서 교반했다. 이 반응 용액에 물을 가하여 석출된 결정을 여과 수취하여, 표제 화합물(480 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.79-2.95(2H, m), 3.40-3.50(1H, m), 4.10-4.20(1H, m), 4.65-4.76(1H, m) 6.62(1H, d, J=6.0Hz), 7.05-7.18(3H, m), 7.36-7.50(3H, m), 7.62(1H, s), 8.20-8.28(1H, m), 8.60-8.68(1H, m), 8.73-8.80(2H, m), 9.10(1H, brs)
실시예
493
N-{4-[6- 시아노 -7-(3- 디에틸아미노 -2- 히드록시프로폭시 )퀴놀린-4- 일옥시 ]-2-플루오로페닐}-N'-(4-플루오로페닐)우레아
N-[4-(6-시아노-7-옥시라닐메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-N'-(4-플루오로페닐)우레아(100 mg)에 테트라히드로푸란 1 ml과 디에틸아민(0.1 ml)을 가하여 50℃에서 30분간 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(32 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.958(6H, t, J=7Hz), 2.40-2.68(6H, m), 3.91-3.99(1H, m), 4.20(1H, dd, J=10, 5.2Hz), 4.31(1H, dd, J=10, 3.6Hz), 4.91(1H, d, J=4.4Hz), 6.61(1H, d, J=5.2Hz), 7.10-7.17(3H, m), 7.37-7.49(3H, m), 7.62(1H, s), 8.21-8.27(1H, m), 8.63(1H, brs), 8.72-8.75(2H, m), 9.10(1H, brs)
실시예
494
N-{4-[6- 시아노 -7-(2-히드록시-(3-모르폴린-4-일) 프로폭시 )퀴놀린-4- 일옥시 ]-2-플루오로페닐}-N'-(4-플루오로페닐)우레아
N-[4-(6-시아노-7-옥시라닐메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-N'-(4-플루오로페닐)우레아(100 mg)에 테트라히드로푸란 1 ml과 모르폴린 0.1 ml를 가하여 50℃에서 30분간 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(32 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.38-2.58(6H, m), 3.53-3.59(4H, m), 4.03-4.09(1H, m), 4.22(1H, dd, J=10, 6.0Hz), 4.31(1H, dd, J=10, 4.0Hz), 5.03(1H, d, J=4.8), 6.61(1H, d, J=5.2Hz), 7.10-7.17(3H, m), 7.36-7.49(3H, m), 7.64(1H, s), 8.20-8.27(1H, m), 8.60-8.64(1H, m), 8.73-8.75(2H, m), 9.10(1H, brs)
실시예
495
N-{4-[6- 시아노 -7-(2-히드록시-3-( 피롤리딘 -1-일) 프로폭시 )퀴놀린-4- 일옥시 ]-2-플루오로페닐}-N'-(티아졸-2-일)우레아
N-[4-(6-시아노-7-옥시라닐메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-N'-(티아졸-2-일)우레아(120 mg)에 테트라히드로푸란 1 ml과 피롤리딘 0.1 ml를 가하여 50℃에서 40분간 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(70 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.60-1.70(4H, m), 2.40-2.75(6H, m), 3.95-4.05(1H, m), 4.20(1H, dd, J=10, 6.0Hz), 4.31(1H, dd, J=10, 4Hz), 5.02(1H, brs), 6.62(1H, d, J=5.2Hz), 6.85(1H, s), 7.10-7.20(2H, m), 7.37-7.47(2H, m), 7.62(1H, s), 8.20-8.26(1H, m), 8.71-8.76(2H, m), 9.05(1H, brs)
출발 물질은 다음의 방법으로 합성했다.
제조예
495-1
N-[4-(6- 시아노 -7- 옥시라닐메톡시퀴놀린 -4- 일옥시 )-2- 플루오로페닐 ]- N' -(티아졸-2-일)우레아
4-(4-아미노-3-플루오로페녹시)-7-옥시라닐메톡시퀴놀린-6-카르보니트릴(100 mg)에 디메틸설폭시드 1 ml와 페닐 N-(2-티아졸릴)카르바메이트(94 mg)를 가하여, 80℃에서 90분간 가열했다. 여기에 물을 가하여 석출된 결정을 여과 수취하여, 표제 화합물(16 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.78-2.94(2H, m), 3.41-3.49(1H, m), 4.17(1H, dd, J=12, 6.4Hz), 4.71(1H, dd, J=12, 2.0), 6.64(1H, d, J=5.2Hz), 7.08-7.20(3H, m), 7.36-7.48(2H, m), 7.65(1H, s), 8.20-8.27(1H, m), 8.73-8.79(2H, m), 9.07(1H, brs)
실시예
496
N-{4-[6- 시아노 -7-(2-히드록시-3-(피페리딘-1-일) 프로폭시 )퀴놀린-4- 일옥시 ]-2-플루오로페닐}-N'-(4-플루오로페닐)우레아
N-[4-(6-시아노-7-옥시라닐메톡시퀴놀린-4-일옥시)-2-플루오로페닐]-N'-(4-플루오로페닐)우레아(78 mg)에 테트라히드로푸란 1.5 ml와 피페리딘(0.08 ml)을 가하여 50℃에서 30분간 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(32 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.30-1.55(6H, m), 2.35-2.55(6H, m), 4.00-4.08(1H, m), 4.20(1H, dd, J=10, 6.0Hz), 4.30(1H, dd, J=10, 4.0Hz), 4.94(1H, d, J=4.8Hz), 6.61(1H, d, J=5.6Hz), 7.10-7.17(3H, m), 7.36-7.50(3H, m), 7.63(1H, m), 8.20-8.23(1H, m), 8.62-8.64(1H, m), 8.72-8.75(2H, m), 9.10(1H, m)
실시예
497
N-(4-{6- 시아노 -7-[(2R)-2-히드록시-3-(피페리딘-1-일) 프로폭시 ]퀴놀린-4- 일옥시}-2-플루오로페닐)-N'-(4-플루오로페닐)우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-플루오로페닐)-N'-(4-플루오로페닐)우레아(345 mg)로부터 실시예 496의 방법에 의해 표제 화합물(115 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : H-NMR(DMSO-d6) δ(ppm) : 1.30-1.55(6H, m), 2.35-2.55(6H, m), 4.00-4.08(1H, m), 4.20(1H, dd, J=10, 6.0Hz), 4.30(1H, dd, J=10, 4.0Hz), 4.94(1H, d, J=4.8Hz), 6.61(1H, d, J=5.6Hz), 7.10-7.17(3H, m), 7.36-7.50(3H, m), 7.63(1H, m), 8.20-8.23(1H, m), 8.62-8.64(1H, m), 8.72-8.75(2H, m), 9.10(1H, m)
*출발 물질은 이하의 2공정에 의해 합성했다.
제조예
497-1
4-(4-아미노-3- 플루오로 - 페녹시 )-7-[(2R)- 옥시란 -2-일] 메톡시퀴놀린 -6- 카르보니트릴
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-히드록시퀴놀린(1000 mg)에 디메틸포름아미드 8 ml, p-톨루엔술폰산(2R)-글리시딜 에스테르(1000 mg), 탄산칼륨(940 mg)을 가하여, 50℃에서 4시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(초산에틸)로 정제하여, 표제 화합물(659 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.79-2.93(2H, m), 3.42-3.49(1H, m), 4.15(1H, dd, J=12, 7.2Hz), 4.69(1H, dd, J=12, 2.4Hz), 5.25(2H, brs), 6.53(1H, d, J=5.2Hz), 6.83-6.89(2H, m), 7.07-7.15(1H, m), 7.61(1H, s), 8.69-8.74(2H, m)
제조예
497-2
N-(4-{6- 시아노 -7-[(2R)- 옥시란 -2-일] 메톡시퀴놀린 -4- 일옥시 }-2- 플루오로페닐)-N'-(4-플루오로페닐)우레아
4-(4-아미노-3-플루오로페녹시)-7-[(2R)-옥시란-2-일]메톡시퀴놀린-6-카르보니트릴(150 mg)로부터 제조예 492-1에 기재한 방법에 따라서 표제 화합물(200 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.79-2.95(2H, m), 3.40-3.50(1H, m), 4.10-4.20(1H, m), 4.65-4.76(1H, m) 6.62(1H, d, J=6.0Hz), 7.05-7.18(3H, m), 7.36-7.50(3H, m), 7.62(1H, s), 8.20-8.28(1H, m), 8.60-8.68(1H, m), 8.73-8.80(2H, m), 9.10(1H, brs)
실시예
498
N-(4-{6- 시아노 -7-[3- 디에틸아미노 -(2R)-2-히드록시- 프로폭시 ]-퀴놀린-4- 일옥시}-2-플루오로페닐)-N'-(4-플루오로페닐)우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-플루오로페닐)-N'-(4-플루오로페닐)우레아(200 mg)로부터 실시예 493의 방법에 의해 표제 화합물(120 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.96(6H, t, J=7Hz), 2.40-2.68(6H, m), 3.91-3.99(1H, m), 4.20(1H, dd, J=10, 5.2Hz), 4.31(1H, dd, J=10, 3.6Hz), 4.91(1H, d, J=4.4Hz), 6.61(1H, d, J=5.2Hz), 7.10-7.17(3H, m), 7.37-7.49(3H, m), 7.62(1H, s), 8.21-8.27(1H, m), 8.63(1H, brs), 8.72-8.75(2H, m), 9.10(1H, brs)
실시예
499
N-(4-{6- 시아노 -7-[3-디메틸아미노-(2R)-2-히드록시- 프로폭시 ]-퀴놀린-4- 일옥시}-2-플루오로페닐)-N'-(4-플루오로페닐)우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-플루오로페닐)-N'-(4-플루오로페닐)우레아(40 mg)에 테트라히드로푸란 0.5 ml와 2N 테트라히드로푸란중 디메틸아민 용액(Aldrich사 제조) 0.2 ml를 가하여 실온에서 밤새 교반했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(45 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 2.20(6H, m), 2.30-2.58(2H, m), 3.95-4.95(1H, m), 4.19(1H, dd, J=10, 5.6Hz), 4.29(1H, dd, J=10, 4.0Hz), 4.99(1H, d, J=4.4Hz), 6.61(1H, d, J=5.6Hz), 7.10-7.17(3H, m), 7.37-7.50(3H, m), 7.62(1H, s), 8.20-8.30(1H, m), 8.64(1H, brs), 8.70-8.76(2H, m), 9.11(1H, brs)
실시예
500
N-(4-{6- 시아노 -7-[3- 디에틸아미노 -(2R)-2-히드록시- 프로폭시 ]-퀴놀린-4- 일옥시}-2-플루오로페닐)-N'-(티아졸-2-일)우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-플루오로페닐)-N'-(티아졸-2-일)우레아(200 mg)에 테트라히드로푸란 4 ml와 디에틸아민 0.2 ml를 가하여 50℃에서 2시간동안 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(60 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.96(6H, t, J=7.0Hz), 2.40-2.70(6H, m), 3.90-3.98(1H, m), 4.21(1H, dd, J=10, 5.2Hz), 4.31(1H, dd, J=10, 3.2Hz), 4.90-4.95(1H, m), 6.62(1H, d, J=5.2Hz), 7.11-7.20(2H, m), 7.36-7.47(2H, m), 7.62(1H, s), 8.20-8.27(1H, m), 8.72-8.76(2H, m)
출발 물질은 다음과 같이 합성했다.
제조예
500-1
N-(4-{6- 시아노 -7-[(2R)- 옥시란 -2-일] 메톡시퀴놀린 -4- 일옥시 }-2- 플루오로페닐)-N'-(티아졸-2-일)우레아
4-(4-아미노-3-플루오로페녹시)-7-[(2R)-옥시란-2-일]메톡시퀴놀린-6-카르보니트릴(300 mg)로부터 실시예 495에 기재한 방법에 의해 표제 화합물(370 mg)을 담황색 결정으로서 얻었다.
H-NMR(DMSO-d6) δ(ppm) : 2.78-2.94(2H, m), 3.41-3.49(1H, s), 4.17(1H, dd, J=12, 6.4Hz), 4.71(1H, dd, J=12, 2.0Hz), 6.64(1H, d, J=5.2Hz), 7.08-7.20(2H, m), 7.36-7.48(2H, m), 7.65(1H, s), 8.20-8.27(1H, m), 8.73-8.79(2H, m), 9.07(1H, brs)
실시예
501
N-(2- 플루오로 -4-{[6- 시아노 -7-(4- 피페리딜메톡시 )-4- 퀴놀릴 ] 옥시 } 페닐 )- N' -(4-플루오로페닐)우레아
4-(6-시아노-4-{3-플루오로-4-[3-(4-플루오로페닐)우레이도]페녹시}퀴놀린-7-일옥시메틸)피페리딘-1-카르복실산 tert-부틸 에스테르 (395 mg)를 트리플루오로초산(2 ml)에 용해하여, 10분간 실온에서 교반했다. 여기에 물 20 ml를 가하여 탄산수소나트륨으로 중화시키고, 석출된 결정을 여과 수취하여, 표제 화합물(260 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.15-1.30(2H, m), 1.69-1.76(2H, m), 1.85-2.00(1H, m), 2.44-2.70(2H, m), 2.90-2.99(2H, m), 4.09-4.25(3H, m), 6.61(1H, d, J=5.2Hz), 7.05-7.14(3H, m), 7.34-7.40(1H, m), 7.48-7.55(2H, m), 7.59(1H, s), 8.10-8.17(1H, m), 8.70-8.76(2H, m)
출발 물질은 이하의 2공정에 의해 합성했다.
제조예
501-1
4-[4-(4-아미노-3- 플루오로페녹시 )-6- 시아노퀴놀린 -7- 일옥시메틸 ]-피페리딘-1-카르복실산 tert-부틸 에스테르
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-히드록시퀴놀린(500 mg)에 디메틸포름아미드 4 ml, tert-부틸 4-(브로모메틸)-1-피페리딘카르복시레이트(708 mg), 탄산칼륨(467 mg)을 가하여, 50℃에서 4시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(n-헥산:초산에틸)로 정제하여, 표제 화합물(398 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.16-1.31(2H, m), 1.39(9H, s), 1.72-1.82(2H, m), 2.00-2.08(1H, m), 2.65-2.83(2H, m), 3.93-4.03(2H, m), 4.11-4.18(2H, m), 5.20-5.26(2H, m), 6.50(1H, d, J=5.2Hz), 6.82-6.85(2H, m), 7.02-7.10(1H, m), 7.56(1H, s), 8.65-8.72(2H, m)
제조예
501-2
4-(6- 시아노 -4-{3- 플루오로 -4-[3-(4- 플루오로페닐 ) 우레이도 ] 페녹시 }퀴놀린-7-일옥시메틸)피페리딘-1-카르복실산 tert-부틸 에스테르
4-[4-(4-아미노-3-플루오로페녹시)-6-시아노퀴놀린-7-일옥시메틸]피페리딘-1-카르복실산 tert-부틸 에스테르(619 mg)와 이소시안산 4-플루오로페닐(0.22 ml)로부터 실시예 492의 방법과 같은 식으로 표제 화합물(500 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.20-1.35(2H, m), 1.39(9H, s), 1.73-1.85(2H, m), 2.00-2.10(1H, m), 2.63-2.86(2H, m), 3.92-4.06(2H, m), 4.13-4.20(2H, m), 6.61(1H, d, J=5.6Hz), 7.10-7.16(3H, m) 7.36-7.50(3H, m), 7.60(1H, s), 8.20-8.28(1H, m), 8.68-8.76(2H, m), 9.27(1H, brs)
실시예
502
N-{4-[6- 시아노 -7-(1- 메틸피페리딘 -4-일) 메톡시퀴놀린 -4- 일옥시 ]-2- 플루오로페닐}-N'-(4-플루오로페닐)우레아
N-(2-플루오로-4-{[6-시아노-7-(4-피페리디노메톡시)-4-퀴놀릴]옥시}페닐)-N'-(4-플루오로페닐)우레아(180 mg)를 테트라히드로푸란(10 ml)-메탄올(10 ml)에 용해시킨 후, 37% 포름알데히드 수용액(0.5 ml), 초산(0.04 ml), 나트륨시아노보로히드라이드(43 mg)를 실온에서 가하여, 1시간동안 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(130 mg)을 백색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.13-1.47(2H, m), 1.73-1.92(5H, m), 2.15(3H, s), 2.77-2.85(2H, m), 4.13-4.16(2H, m), 6.61(1H, d, J=5.6Hz), 7.10-7.16(3H, m), 7.36-7.49(3H, m), 7.59(1H, s), 8.20-8.26(1H, m), 8.62-8.68(1H, m), 8.72-8.76(2H, m), 9.08-9.15(1H, m)
실시예
503
N-{4-[6- 시아노 -7-(피페리딘-4- 일메톡시 )퀴놀린-4- 일옥시 ]-2- 플루오로페닐 }-N'-(2-티아졸릴)우레아
4-{6-시아노-4-[3-플루오로-4-(3-(티아졸-2-일)우레이도)페녹시]퀴놀린-7-일옥시메틸}피페리딘-1-카르복실산 tert-부틸 에스테르(370 mg)로부터 실시예 501의 방법에 의해 표제 화합물(240 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.45-1.56(2H, m), 1.92-2.00(2H, m), 2.13-2.23(1H, m), 2.45-2.50(2H, m), 2.85-2.98(2H, m), 4.18-4.23(2H, m), 6.64(1H, d, J=5.2Hz), 7.14-7.19(2H, m), 7.37-7.47(2H, m), 7.65(1H, s), 8.21-8.28(1H, m), 8.74-8.79(2H, m), 9.06(1H, brs)
출발 물질은 다음의 방법으로 합성했다.
제조예
503-1
4-{6- 시아노 -4-[3- 플루오로 -4-(3-(티아졸-2-일) 우레이도 ) 페녹시 ]퀴놀린-7- 일옥시메틸}피페리딘-1-카르복실산 tert-부틸 에스테르
4-[4-(4-아미노-3-플루오로페녹시)-6-시아노퀴놀린-7-일옥시메틸]피페리딘-1-카르복실산 tert-부틸 에스테르로부터 실시예 495의 중간체 합성법에 기재한 방법으로 합성했다.
1H-NMR(DMSO-d6) δ(ppm) : 1.18-1.32(2H, m), 1.39(9H, s), 1.73-1.83(2H, m), 2.00-2.10(1H, m), 2.63-2.86(2H, m), 3.95-4.05(2H, m), 4.13-4.20(2H, m), 6.62(1H, d, J=5.2Hz), 7.10-7.20(2H, m), 7.36-7.47(2H, m), 7.61(1H, s), 8.20-8.27(1H, m), 8.72-8.77(2H, m)
실시예
504
N-{4-[6- 시아노 -7-(1- 메틸피페리딘 -4- 일메톡시 )퀴놀린-4- 일옥시 ]-2- 플루오로페닐}-N'-(2-티아졸릴)우레아
N-{4-[6-시아노-7-(피페리딘-4-일메톡시)퀴놀린-4-일옥시]-2-플루오로페닐}-N'-(2-티아졸릴)우레아로부터 실시예 502에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.30-1.46(2H, m), 1.70-1.93(5H, m), 2.15(3H, s), 2.77-2.85(2H, m), 4.13-4.17(2H, m), 6.62(1H, d, J=5.2Hz), 7.12-7.19(2H, m), 7.37-7.47(2H, m), 7.60(1H, s), 8.20-8.30(1H, m), 8.73-8.76(2H, m)
실시예
505
N-{4-[6- 시아노 -7-(1- 메틸피페리딘 -3- 일메톡시 )퀴놀린-4- 일옥시 ]-2- 플루오로페닐}-N'-(2-티아졸릴)우레아
4-(4-아미노-3-플루오로페녹시)-7-(1-메틸피페리딘-3-일메톡시)퀴놀린-6-카르보니트릴로부터 실시예 495의 중간체 합성에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.10-1.20(1H, m), 1.43-1.96(5H, m), 2.05-2.15(1H, m), 2.16(3H, s), 2.61-2.67(1H, m), 2.80-2.87(1H, m), 4.15-4.19(2H, m), 6.62(1H, d, J=5.6Hz), 7.12-7.20(2H, m), 7.37-7.47(2H, m), 7.60(1H, s), 8.20-8.26(1H, m), 8.72-8.77(2H, m)
출발 물질은 다음의 방법으로 합성했다.
제조예
505-1
4-(4-아미노-3- 플루오로페녹시 )-7-(1- 메틸피페리딘 -3- 일메톡시 )퀴놀린-6- 카르보니트릴
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-히드록시퀴놀린(400 mg)에 디메틸포름아미드 4 ml, 3-클로로메틸-1-메틸피페리딘 히드로클로라이드 621 mg, 탄산칼륨 840 mg을 가하여, 120℃에서 3시간동안 교반했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하여, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 NH 실리카겔 컬럼 크로마토그래피(초산에틸)로 정제하여, 표제 화합물(60 mg)을 얻었다.
H-NMR(DMSO-d6) 1.10-1.20(1H, m), 1.45-1.95(5H, m), 2.03-2.14(1H, m), 2.14(3H, s), 2.56-2.68(1H, m), 2.78-2.88(1H, m), 4.12-4.18(2H, m), 5.23-5.28(2H, m), 6.51(1H, d, J=5.2Hz), 6.83-6.89(2H, m), 7.03-7.10(1H, m), 7.56(1H, s), 8.65-8.72(2H, m)
실시예
506
N-(4-〔(7- 시아노 -6- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' -(4- 플루오로 - 페닐 ) 우레아
4-(4-아미노페녹시)-6-메톡시퀴놀린-7-카르보니트릴(180 mg)에 톨루엔(5 ml), 아세토니트릴(1.5 ml,) 이소시안산 4-플루오로페닐(0.105 ml)을 가하여, 30분간 가열 환류했다. 방냉후에 석출된 결정을 여과 수취하고, 톨루엔으로 세척하여 표제 화합물(230 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.05(3H, m), 6.66(1H, d, J=5.2Hz), 7.08-7.14(2H, m), 7.24(2H, d, J=8.8Hz), 7.43-7.48(2H, m), 7.59(2H, d, J=8.8Hz), 7.76(1H, s), 8.54(1H, s), 8.64(1H, d, J=5.2Hz), 8.74(1H, brs), 8.84(1H, brs)
출발 물질은 이하의 4 공정에 의해 합성했다.
제조예
506-1
6-
메톡시
-4-(4-
니트로페녹시
)퀴놀린-7-올
7-벤질옥시-6-메톡시-4-(4-니트로페녹시)퀴놀린(4.0 g)에 트리플루오로초산(30 ml)과 티오아니솔(3 ml)을 가하여, 70℃에서 2시간동안 가열 교반했다. 반응 용액을 냉각한 후에 감압 농축하고, 여기에 중조수와 메탄올을 가하여, 석출된 결정을 여과했다. 이것을 디에틸에테르로 세척하여 표제 화합물 4.0 g을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.94(3H, s), 6.93(1H, d, J=5.6Hz), 7.42(1H, s), 7.55-7.60(3H, m), 8.40(2H, d, J=10Hz), 8.71(1H, d, J=6Hz)
제조예
506-2
트리플루오로메탄설폰산
6-
메톡시
-4-(4-
니트로페녹시
)퀴놀린-7-일 에스테르
6-메톡시-4-(4-니트로페녹시)퀴놀린-7-올(1.0 g)을 디메틸포름아미드(10 ml)에 용해하여 트리플루오로메탄설폰산 4-니트로페닐에스테르(640 mg)와 탄산칼륨(1.3 g)을 가하여 실온에서 5시간동안 교반했다. 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 이것을 초산에틸로 재결정하여 표제 화합물(1.0 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.04(3H, s), 7.01(1H, d, J=4.8Hz), 7.52-7.57(2H, m), 7.80(1H, s), 8.18(1H, s), 8.34-8.39(2H, m), 8.72-8.76(1H, m)
제조예
506-3
6-
메톡시
-4-(4-
니트로페녹시
)퀴놀린-7-
카르보니트릴
트리플루오로메탄설폰산 6-메톡시-4-(4-니트로페녹시)퀴놀린-7-일 에스테르(500 mg)를 디메틸포름아미드(5 ml)에 용해하여, 시안화아연(260 mg)과 테트라키스트리페닐포스핀팔라듐(0가)(130 mg)을 가하여 질소 기류하에 110℃에서 2시간동안 가열 교반했다. 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 이것을 초산에틸로 재결정하여 표제 화합물(300 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.03(3H, s), 7.05(1H, d, J=5.2Hz), 7.51-7.56(2H, m), 7.68(1H, s), 8.34-8.39(2H, m), 8.62(1H, s), 8.76(1H, d, J=5.2Hz)
제조예
506-4
4-(4-
아미노페녹시
)-6-
메톡시퀴놀린
-7-
카르보니트릴
6-메톡시-4-(4-니트로페녹시)퀴놀린-7-카르보니트릴(290 mg)을 제조예 10의 방법으로 철 환원하여 표제 화합물(180 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.05(3H, s), 5.19(2H, s), 6.59(1H, d, J=5.2Hz), 6.66(2H, d, J=8.8Hz), 6.94(2H, d, J=8.8Hz), 7.73(1H, s), 8.51(1H, s), 8.61(1H, d, J=5.2Hz)
실시예
507
N-(4-〔(7- 카르바모일 -6- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' -(4- 플루오로페닐 )우레아
N-(4-〔(7-시아노-6-메톡시-4-퀴놀릴)옥시〕페닐)-N'-(4-플루오로페닐)우레아(43 mg)를 디메틸설폭시드 1.5 ml에 80℃에서 용해하고, 여기에 5N NaOH 수용액을 가하여 2시간동안 가열 교반했다. 반응액을 1N HCl로 중화시킨 후 석출된 결정을 여과 수취한 후에, 에탄올로 세척하여 표제 화합물 17 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.00(3H, s), 6.58(1H, d, J=5.2Hz), 7.06-7.14(2H, m), 7.17-7.24(2H, m), 7.45-7.53(2H, m), 7.55-7.67(3H, m), 7.70(1H, brs), 7.86(1H, brs), 8.22(1H, s), 8.56(1H, d, J=5.2Hz)
실시예
508
N-(4-〔(7- 아미노메틸 -6- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' -(4- 플루오로페닐 )우레아 트리플루오로아세테이트
N-(4-〔(7-시아노-6-메톡시-4-퀴놀릴)옥시〕페닐)-N'-(4-플루오로페닐)우레아(50 mg)로부터 실시예 480의 방법으로 표제 화합물(52 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.01(3H, s), 4.21-4.26(2H, m), 6.66(1H, d, J=5.2Hz), 7.08-7.15(2H, m), 7.23(2H, d, J=8.8Hz), 7.43-7.50(2H, m), 7.61(2H, d, J=8.8Hz), 7.67(1H, s), 8.08(1H, s), 8.63(1H, d, J=5.2Hz), 8.85(1H, brs), 8.95(1H, brs)
실시예
509
N-(4-〔(7- 아세틸아미노메틸 -6- 메톡시 -4- 퀴놀릴 ) 옥시 〕 페닐 )- N' -(4- 플루오로페닐)우레아
N-(4-〔(7-아미노메틸-6-메톡시-4-퀴놀릴)옥시〕페닐)-N'-(4-플루오로페닐)우레아 트리플루오로아세테이트(30 mg)를 실시예 481에 기재한 방법으로 표제 화합물(5 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.94(3H, s), 3.96(3H, s), 4.37-4.40(2H, m), 6.51(1H, d, J=5.2Hz), 7.08-7.14(2H, m), 7.20(2H, d, J=8.8Hz), 7.43-7.50(2H, m), 7.50-7.60(3H, m), 7.74(1H, s), 8.39-8.45(1H, m), 8.50(1H, d, J=5.2Hz), 8.80(1H, brs), 8.88(1H, brs)
실시예
510
4-{4-[3-(4- 플루오로페닐 ) 우레이도 ] 페녹시 } 푸로 [2,3-b]피리딘-2- 카르복실산 메틸 에스테르
4-(4-아미노페녹시)푸로[2,3-b]피리딘-2-카르복실산 메틸 에스테르(28 mg)에 톨루엔(1 ml), 아세토니트릴(0.5 ml,) 이소시안산 4-플루오로페닐(0.02 ml)을 가하여, 30분간 가열 환류했다. 방냉후에 석출된 결정을 여과 수취하고, 톨루엔으로 세척하여 표제 화합물(24 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.87(3H, s), 6.75(1H, d, J=5.6Hz), 7.08-7.14(2H, m), 7.21-7.25(2H, m), 7.40(1H, s), 7.43-7.48(2H, m), 7.55-7.60(2H, m), 8.35(1H, d, J=5.6Hz), 8.79(1H, brs), 8.89(1H, brs)
출발 물질은 이하의 5공정에 의해 합성했다.
제조예
510-1
5-[(2,2-디메틸-4,6- 디옥소 -[1.3]디옥산-5- 일리덴메틸 )아미노]푸란-2- 카르복실산 메틸 에스테르
랭카스터사 제조의 메틸 5-아미노-2-프로에이트(4 g)를 오르토포름산트리에틸(20 ml)과 이소프로필알콜(20 ml)의 혼합 용액에 가하고, 또 멜드럼산(4.5 g)을 가하여 100℃에서 1시간동안 가열 교반했다. 방냉후, 석출된 결정을 여과 수취하고, 이것을 이소프로필알콜로 세척하여 표제 화합물(7.8 g)을 얻었다.
1H-NMR(CDCl3) δ(ppm) 1.75(6H, s), 3.89(3H, s), 6.04-6.09(1H, m), 7.08-7.12(1H, m), 8.56-8.64(1H, m), 11.4-11.6(1H, m)
제조예
510-2
4-옥소-4,7-
디히드로
-
푸로[2,3-b]피리딘
-2-
카르복실산
메틸
에스테르
5-[(2,2-디메틸-4,6-디옥소-[1.3]디옥산-5-일리덴메틸)아미노]푸란-2-카르복실산 메틸 에스테르(4.0 g)를 다우섬 A(Dowtherm A)(30 ml)에 가하여, 200℃에서 1시간동안 가열 교반했다. 방냉후, 석출된 결정을 여과 수취하고, 이것을 디에틸에테르로 세척하여 표제 화합물(2.0 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.86(3H, s), 6.77(1H, d, J=5.6Hz), 7.71(1H, s), 8.18(1H, d, J=5.6Hz), 11.85(1H, brs)
제조예
510-22
4-
클로로
-
푸로[2,3-b]피리딘
-2-
카르복실산
메틸
에스테르
4-옥소-4,7-디히드로-푸로[2,3-b]피리딘-2-카르복실산 메틸 에스테르(2.0 g)에 염화티오닐(8.0 ml)과 디메틸포름아미드(0.08 ml)를 가하여, 1시간동안 가열 환류했다. 방냉후, 감압하에 농축하여 석출된 결정을 여과 수취하고, 이것을 테트라히드로푸란과 초산에틸로 세척하여 표제 화합물(2.1 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.92(3H, s), 7.66(1H, d, J=5.2Hz), 7.86(1H, s), 8.49(1H, d, J=5.2Hz)
제조예
510-3
4-(4-
니트로페녹시
)-
푸로[2,3-b]피리딘
-2-
카르복실산
메틸
에스테르
4-클로로-푸로[2,3-b]피리딘-2-카르복실산 메틸 에스테르(1.0 g)에 N-메틸피롤리돈(4.0 ml)과 디이소프로필에틸아민(1.3 ml), 파라니트로페놀(822 mg)을 가하여 140℃에서 5시간동안 가열 교반했다. 방냉후에 물을 가하여 초산에틸로 추출하여, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 이것을 테트라히드로푸란으로 재결정하여 표제 화합물(70 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.87(3H, s), 7.04(1H, d, J=5.6Hz), 7.48-7.53(2H, m), 7.59(1H, s), 8.32-8.37(2H, m), 8.47(1H, d, J=5.6Hz)
제조예
510-4
4-(4-
아미노페녹시
)-
푸로[2,3-b]피리딘
-2-
카르복실산
메틸
에스테르의 합성
4-(4-니트로페녹시)-푸로[2,3-b]피리딘-2-카르복실산 메틸 에스테르(70 mg)를 제조예 10의 방법으로 철 환원하여 표제 화합물(55 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.86(3H, s), 5.23(2H, brs), 6.64(2H, d, J=8.4Hz), 6.72(1H, d, J=6.0Hz), 6.93(2H, d, J=8.4Hz), 7.23(1H, s), 8.31(1H, d, J=6.0Hz)
실시예
511
N-(4- 플루오로 - 페녹시 )- N' -[4-(2- 히드록시메틸 - 푸로[2,3-b]피리딘 -4- 일옥시 )페닐]우레아
4-{4-[3-(4-플루오로페닐)우레이도]페녹시}-푸로[2,3-b]피리딘-2-카르복실산 메틸 에스테르(13 mg)를 테트라히드로푸란(3 ml)에 용해하고, 여기에 수소화붕소리튬(10 mg)을 가하여 실온에서 밤새 교반했다. 소량의 아세톤을 가한 후에 물을 가하여, 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조하고 용매를 감압 증류 수거하여, 표제 화합물(10 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.52(2H, d, J=6.0Hz), 5.52(1H, t, J=6.0Hz), 6.38(1H, s), 6.69(1H, d, J=5.6Hz), 7.07-7.19(4H, m), 7.43-7.49(2H, m), 7.51-7.57(2H, m), 8.11(1H, d, J=5.4Hz), 8.11(1H, brs), 8.81(1H, brs)
실시예
512
N-(4- 플루오로페닐 )- N' -[4-(6- 페닐 - 푸로[2.3-d]피리미딘 -4- 일옥시 ) 페닐 ] 우레아
4-(6-페닐-푸로[2.3-d]피리미딘-4-일옥시)페닐아민(40 mg)에 톨루엔(1 ml), 아세토니트릴(0.5 ml), 이소시안산 4-플루오로페닐(0.03 ml)을 가하여, 30분간 가열 환류했다. 방냉후에 석출된 결정을 여과 수취하고, 톨루엔으로 세척하여 표제 화합물(42 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 7.08-7.15(2H, m), 7.23(2H, d, J=8.4Hz), 7.43-7.57(7H, m), 7.65(1H, s), 7.97(2H, d, J=8.4Hz), 8.50(1H, s), 8.74-8.81(2H, m)
출발 원료는 이하의 4공정에 의해 합성했다.
제조예
512-1
6-
페닐
-
푸로[2.3-d]피리미딘
-4-
일아민
J. Heterocyclic Chem., 35, 1313(1998)에 기재된 방법으로 합성한 2-아미노-5-페닐-3-푸로니트릴(1.8 g)에 포름아미드(10 ml)와 무수초산 2 방울을 가하여, 200℃에서 2시간동안 가열 교반했다. 방냉후, 석출된 결정을 여과 수취하고, 디에틸에테르로 세척하여 표제 화합물(1.3 g)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 7.30(1H, s), 7.35-7.41(1H, m), 7.46-7.53(2H, m), 7.74-7.79(2H, m), 8.16(1H, m)
제조예
512-2
4-(4-
니트로페녹시
-6-
페닐
-
푸로[2.3-d]피리미딘
6-페닐푸로[2.3-d]피리미딘-4-일아민(211 mg)에 디브로모메탄(1.2 ml)과 아질산이소아밀(1.2 ml)을 가하여, 80℃에서 30분간 가열 교반했다. 반응 용액을 감압하에 농축하고, 물을 가하여, 초산에틸로 추출하여, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 여기에 디메틸포름아미드(10 ml)와 파라니트로벤젠(222 mg)과 탄산칼륨(414 mg)을 가하여, 80℃에서 1시간동안 가열 교반했다. 이 반응 용액에 물을 가하여, 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 이것을 초산에틸로 재결정하여 표제 화합물(150 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 7.43-7.67(5H, m), 7.76(1H, s), 7.98-8.03(2H, m), 8.34-8.39(2H, m), 8.56(1H, s)
제조예
512-3
4-(6-
페닐
-
푸로[2.3-d]피리미딘
-4-
일옥시
)
페닐아민
4-(4-니트로페녹시-6-페닐-푸로[2.3-d]피리미딘(150 mg)을 제조예 6의 방법으로 철 환원하여 표제 화합물(50 mg)을 얻었다.
1H-NMR(DMSO-d6) 5.10(2H, brs), 6.59-6.63(2H, m), 6.91-6.96(2H, m), 7.42-7.56(4H, m), 7.91-7.95(2H, m), 8.47(1H, s)
실시예
513
6-
카르복시
-7-
메톡시
-4-(인돌-5-
일옥시
)퀴놀린
6-메톡시카르보닐-7-메톡시-4-(인돌-5-일옥시)퀴놀린(400 mg)을 테트라히드로푸란(5 ml)에 용해하고, 여기에 1.5규정 수산화리튬 수용액(2.5 ml)을 가하여, 실온에서 3시간동안 교반했다. 이 반응 용액을 1규정 염산 수용액으로 pH 4로 만들고, 석출된 결정을 여과 수취하고, 초산에틸로 세척하여, 표제 화합물(280 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.94(3H, s), 6.37(1H, d, J=5.2Hz), 6.43-6.47(1H, m), 6.95-7.01(1H, m), 7.40-7.55(4H, m), 8.55-8.61(2H, m), 11.3(1H, brs)
중간체를 다음과 같이 합성했다.
제조예
513-1
6-
메톡시카르보닐
-7-
메톡시
-4-(인돌-5-
일옥시
)퀴놀린
메틸 4-클로로-7-메톡시퀴놀린-6-카르복실레이트(WO0050405, P. 34, 8.5 g, 33.77 mmol), 5-히드록시인돌(7 g), 디이소프로필에틸아민(8.9 ml, N-메틸피롤리돈(8.9 ml)을 혼합하여, 130℃에서 5시간, 이어서 150℃에서 8시간동안 가열 교반했다. 방냉후의 용액을 실리카겔에 흡착시켜, 실리카겔 컬럼(헥산-초산에틸계)으로 생성했다. 생성된 황색 유상물에 에탄올, 디에틸에테르, 헥산을 가하여, 방치하자 결정이 석출되었다. 이것을 여과 수취하여, 디에틸에테르, 헥산으로 세척하고, 흡인 건조시켜, 담황색 결정(3.506 g, 10.06 mmol, 29.80%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.86(3H, s), 3.97(3H, s),6.38(1H, d, J=5.2Hz),6.46(1H, s),6.98(1H, d, J=8.8Hz),7.44-7.52(4H, m),8.60-8.65(2H, m),11.29(1H, s)
실시예
514
6-(2-
메톡시에틸카르바모일
)-7-
메톡시
-4-(인돌-5-
일옥시
)퀴놀린
6-카르복시-7-메톡시-4-(인돌-5-일옥시)퀴놀린(100 mg)을 디메틸포름아미드(4.0 ml)에 용해하고, 메톡시에틸아민(0.04 ml), 트리에틸아민(0.08 ml), 벤조트리아졸-1-일옥시트리스(디메틸아미노)포스포늄헥사플루오로포스페이트(198 mg)를 가하여 실온에서 5시간동안 교반했다. 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 이것을 초산에틸로 재결정하여 표제 화합물(86 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.29(3H, s), 3.46-3.49(4H, m), 4.02(3H, s), 6.37(1H, d, J=5.2Hz), 6.45-6.47(1H, m), 6.95-7.00(1H, m), 7.41-7.54(4H, m), 8.42-8.45(1H, m), 8.59(1H, d, J=5.2Hz), 8.68(1H, s), 11.3(1H, brs).
실시예
515
6-(2- 메톡시에틸카르보닐 )-7- 메톡시 -4-(1- 에틸카르바모일 -인돌-5- 일옥시 )퀴놀린
60% 수소화나트륨(10 mg)을 디메틸포름아미드(1 ml)에 가하여, 실온에서 교반하고, 여기에 6-(2-메톡시에틸카르바모일)-7-메톡시-4-(인돌-5-일옥시)퀴놀린(10 mg)을 가하여, 15분간 더 교반했다. 여기에 에틸카르바민산 페닐에스테르(43 mg)를 가하여 1시간동안 교반했다. 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 이것을 초산에틸로 재결정하여 표제 화합물(27 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.18(3H, t, J=7.2Hz), 3.27-3.29(5H, m), 3.47-3.49(4H, m), 4.02(3H, s), 6.42(1H, d, J=5.2Hz), 6.70(1H, d, J=3.6Hz), 7.15-7.20(1H, m), 7.50-7.52(2H, m), 7.93(1H, d, J=3.6Hz), 8.20-8.50(3H, m), 8.61(1H, d, J=5.2Hz), 8.67(1H, s)
실시예
516
6-(2- 메톡시에틸카르보닐 )-7- 메톡시 -4-[1-(2- 플루오로에틸카르바모일 )인돌-5-일옥시]퀴놀린
6-(2-메톡시에틸카르바모일)-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 515와 같은 순서로 2-플루오로에틸카르바민산페닐에스테르를 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.24(3H, s), 3.45-3.67(6H, m), 4.02(3H, s), 4.50-4.68(2H, m), 6.43(1H, d, J=5.2Hz), 6.72(1H, d, J=3.6Hz), 7.16-7.21(1H, m), 7.50-7.54(2H, m), 7.98(1H, d, J=3.6Hz), 8.35(1H, d, J=9.2Hz), 8.42-8.53(2H, m), 8.61(1H, d, J=5.2Hz), 8.76(1H, s)
실시예
517
6-(2-
플루오로에틸카르바모일
)-7-
메톡시
-4-(인돌-5-
일옥시
)퀴놀린
6-카르복시-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 514와 같은 순서로 2-플루오로에틸아민염산염을 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.53-3.71(2H, m), 4.02(3H, s), 4.48-4.63(2H, m), 6.37(1H, d, J=5.2Hz), 6.45-6.47(1H, m), 6.95-7.00(1H, m), 7.42-7.46(2H, m), 7.48-7.53(2H, m), 8.57-8.63(2H, m), 8.66(1H, s), 11.6(1H, brs)
실시예
518
6-(2- 플루오로에틸카르보닐 )-7- 메톡시 -4-((1- 에틸카르바모일 )인돌-5- 일옥시 )퀴놀린
6-(2-플루오로에틸카르바모일)-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 515의 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.18(3H, t, J=7.2Hz), 3.27-3.32(2H, m), 3.56-3.68(2H, m), 4.02(3H, s), 4.47-4.65(2H, m), 6.42(1H, d, J=5.2Hz), 6.70(1H, d, J=4.0Hz), 7.15-7.20(1H, m) 7.50-7.52(2H, m), 7.93(1H, d, J=4.0Hz), 8.22-8.27(1H, m), 8.34(1H, d, J=8.9Hz), 8.57-8.66(3H, m).
실시예
519
6-
메톡시카르바모일
-7-
메톡시
-4-(인돌-5-
일옥시
)퀴놀린
6-카르복시-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 514와 같은 순서로 메틸히드록실아민염산염을 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.73(3H, s), 3.98(3H, s), 6.38(1H, d, J=5.2Hz), 6.44-6.48(1H, m), 6.95-7.00(1H, m), 7.40-7.54(4H, m), 8.49(1H, s), 8.59(1H, d, J=5.2Hz), 11.29(1H, brs), 11.45(1H, brs)
실시예
520
6-
메톡시카르바모일
-7-
메톡시
-4-((1-
에틸카르바모일
)인돌-5-
일옥시
)퀴놀린
6-메톡시카르바모일-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 515의 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.16(3H, t, J=7.2Hz), 3.27-3.30(2H, m), 3.73(3H, s), 3.98(3H, s), 6.43(1H, d, J=5.2Hz), 6.70(1H, d, J=3.2Hz), 7.15-7.20(1H, m), 7.45-7.53(2H, m), 7.93(1H, d, J=3.6Hz), 8.21-8.26(1H, m), 8.35(1H, d, J=8.8Hz), 8.48(1H, s), 8.61(1H, d, J=5.2Hz), 11.45(1H, brs)
실시예
521
6- 메톡시카르바모일 -7- 메톡시 -4-((1- 시클로프로필카르바모일 )인돌-5- 일옥시 )퀴놀린
6-메톡시카르바모일-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 시클로프로필카르바민산 페닐에스테르를 이용하여, 실시예 515의 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.58-0.65(2H, m), 0.70-0.77(2H, m), 2.73-2.82(1H, m), 3.73(3H, s), 3.98(3H, s), 6.42(1H, d, J=5.2Hz), 6.68(1H, d, J=3.6Hz), 7.15-7.20(1H, m), 7.47-7.52(2H, m), 7.89(1H, d, J=3.6Hz), 8.28-8.36(2H, m), 8.48(1H, s), 8.61(1H, d, J=5.2Hz), 11.44(1H, brs)
실시예
522
6-(피리딘-2-
일카르바모일
)-7-
메톡시
-4-(인돌-5-
일옥시
)퀴놀린
6-카르복시-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 514와 같은 순서로 2-아미노피리딘을 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 4.08(3H, s), 6.39-6.48(2H, m), 6.97-7.02(1H, m), 7.15-7.20(1H, m), 7.43-7.60(4H, m), 7.83-7.89(1H, m), 8.25-8.38(2H, m), 8.60-8.80(2H, m), 10.70(1H, brs), 11.30(1H, brs)
실시예
523
6-(피리딘-2- 일카르바모일 )-7- 메톡시 -4-((1- 에틸카르바모일 )인돌-5- 일옥시 )퀴놀린
6-(피리딘-2-일카르바모일)-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 515의 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.18(3H, t, J=7.6Hz), 3.27-3.30(2H, m), 4.10(3H, s), 6.46(1H, d, J=5.2Hz), 6.71(1H, d, J=3.6Hz), 7.15-7.21(2H, m), 7.53(1H, d, J=2.8Hz), 7.60(1H, s), 7.83-7.89(1H, m), 7.93(1H, d, J=3.6Hz), 8.22-8.38(4H, m), 8.65(1H, d, J=5.2Hz), 8.76(1H, d, J=5.2Hz), 10.70(1H, brs)
실시예
524
6- 메톡시카르보닐 -7- 메톡시 -4-[1-(2- 플루오로에틸카르바모일 )인돌-5- 일옥시 ]퀴놀린
6-메톡시카르보닐-7-메톡시-4-(인돌-5-일옥시)퀴놀린으로부터 실시예 515와 같은 식으로 2-플루오로에틸카르바민산페닐에스테르를 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.50-3.68(2H, m), 3.84(3H, s), 3.97(3H, s), 4.48-4.70(2H, m), 6.42(1H, d, J=5.6Hz), 6.72(1H, d, J=3.6Hz), 7.17-7.22(1H, m), 7.45-7.56(2H, m), 7.98(1H, d, J=3.6Hz), 8.35(1H, d, J=9.2Hz), 8.46-8.53(1H, m), 8.58-8.64(2H, m)
실시예
525
6-
카르복시
-7-
메톡시
-4-[1-(2-
플루오로에틸카르바모일
)인돌-5-
일옥시
]퀴놀린
6-메톡시카르보닐-7-메톡시-4-[1-(2-플루오로에틸카르바모일)인돌-5-일옥시]퀴놀린으로부터 실시예 513과 같은 순서로 2-페닐카르바민산페닐에스테르를 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.50-3.70(2H, m), 3.94(3H, s), 4.48-4.70(2H, m), 6.42(1H, d, J=5.2Hz), 6.72(1H, d, J=3.6Hz), 7.18-7.22(1H, m), 7.42-7.55(2H, m), 7.98(1H, d, J=3.6Hz), 8.35(1H, d, J=9.2Hz), 8.46-8.52(1H, m), 8.54-8.64(2H, m)
실시예
526
6- 메톡시카르바모일 -7- 메톡시 -4-[1-(2- 플루오로에틸카르바모일 )인돌-5- 일옥시]퀴놀린
6-카르복시-7-메톡시-4-[1-(2-플루오로에틸카르바모일)인돌-5-일옥시]퀴놀린으로부터 실시예 514와 같은 순서로 메틸히드록실아민염산염을 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 3.53-3.66(2H, m), 3.73(3H, s), 3.98(3H, s), 4.50-4.68(2H, m), 6.43(1H, d, J=5.2Hz), 6.73(1H, d, J=3.6Hz), 7.15-7.21(1H, m), 7.47-7.54(2H, m), 7.98(1H, d, J=3.6Hz), 8.35(1H, d, J=8.4Hz), 8.46-8.53(2H, m), 8.61(1H, d, J=5.2Hz), 11.5(1H, brs)
실시예
527
6- 이소부톡시카르바모일 -7- 메톡시 -4-[1-(2- 플루오로에틸카르바모일 )인돌-5-일옥시]퀴놀린
6-카르복시-7-메톡시-4-[1-(2-플루오로에틸카르바모일)인돌-5-일옥시]퀴놀린으로부터 실시예 514와 같은 순서로 o-이소부틸히드록실아민염산염을 이용하여 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.93(6H, d), 1.90-2.00(1H, m), 3.52-3.67(2H, m), 3.70(2H, d, J=6.8Hz), 3.97(3H, s), 4.50-4.69(2H, m), 6.43(1H, d, J=5.6Hz), 6.73(1H, d, J=4.0Hz), 7.15-7.21(1H, m), 7.47-7.54(2H, m), 7.98(1H, d, J=4.0Hz), 8.35(1H, d, J=9.2Hz), 8.41(1H, s), 8.45-8.55(1H, m), 8.61(1H, d, J=5.6Hz), 11.84(1H, brs)
실시예
528
N-[2- 플루오로 -4-([6- 시아노 -7-([(2R)-2-히드록시-3-(1- 피롤리디노 )프로필]옥시)-4-퀴놀릴]옥시)페닐]-N'-(2-티아졸릴)우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-플루오로페닐)-N'-(티아졸-2-일)우레아로부터 실시예 495에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.60-1.70(4H, m), 2.40-2.75(6H, m), 3.95-4.05(1H, m), 4.20(1H, dd, J=10, 6.0Hz), 4.31(1H, dd, J=10, 4Hz), 5.02(1H, brs), 6.62(1H, d, J=5.2Hz), 7.10-7.20(2H, m), 7.37-7.47(2H, m), 7.62(1H, s), 8.20-8.26(1H, m), 8.71-8.76(2H, m), 9.05(1H, brs)
실시예
529
N-[2- 플루오로 -4-([6- 시아노 -7-([(2R)-2-히드록시-3-(1- 피페리디노 )프로필]옥시)-4-퀴놀릴]옥시)페닐]-N'-(2-티아졸릴)우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시-퀴놀린-4-일옥시}-2-플루오로페닐)-N'-티아졸-2-일-우레아로부터 실시예 496에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.30-1.55(6H, m), 2.32-2.55(6H, m), 3.97-4.16(1H, m), 4.20(1H, dd, J=10, 6Hz), 4.30(1H, dd, J=10, 4.0Hz), 4.44(1H, brs), 6.62(1H, d, J=5.2Hz), 7.11-7.21(2H, m), 7.37-7.47(2H, m), 7.64(1H, s), 8.20-8.27(1H, m), 8.72-8.76(2H, m)
실시예
530
N-[2- 플루오로 -4-([6- 시아노 -7-([(2R)-2-히드록시-3-(1- 피롤리디노 )프로필]옥시)-4-퀴놀릴]옥시)페닐]-N'-시클로프로필우레아
N-(2-플루오로-4-[(6-시아노-7-[(2R)-(옥시란-2-일)메톡시]-4-퀴놀릴)옥시]페닐)-N'-시클로프로필우레아로부터 실시예 492에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.37-0.44(2H, m), 0.62-0.69(2H, m), 1.63-1.75(4H, m), 2.45-2.60(6H, m), 2.65-2.77(1H, m), 3.98-4.08(1H, m), 4.22(1H, dd, J=10, 5.2Hz), 4.31(1H, dd, J=10, 3.6Hz), 5.04(1H, brs), 6.59(1H, d, J=5.6Hz), 6.82-6.85(1H, m), 7.08-7.13(1H, m), 7.32-7.38(1H, m), 7.63(1H, s), 8.20-8.28(2H, m), 8.72-8.76(2H, m)
출발 물질은 이하의 2공정에 의해 합성했다.
제조예
530-1
[2- 플루오로 -4-([6- 시아노 -7-([(2R)-( 옥시란 -2-일] 메톡시 )-4- 퀴놀릴 ] 옥시 ) 페닐]카르바민산 페닐에스테르
4-(4-아미노-3-플루오로-페녹시)-7-[(2R)-옥시란-2-일]메톡시퀴놀린-6-카르보니트릴로부터 제조예 141-1에 기재한 방법으로 합성했다.
1H-NMR(CDCl3) δ(ppm) 2.90-3.01(2H, m), 3.44-3.55(1H, m), 4.21-4.28(1H, m), 4.47-4.54(1H, m), 6.53(1H, d, J=5.2Hz), 7.00-7.06(2H, m), 7.19-7.30(4H, m), 7.40-7.46(2H, m), 7.48-7.53(1H, m), 8.27(1H, brs), 8.65-8.73(2H, m)
제조예
530-2
N-(2- 플루오로 -4-[(6- 시아노 -7-[(2R)-( 옥시란 -2-일) 메톡시 ]-4- 퀴놀릴 ) 옥시 ]페닐)-N'-시클로프로필우레아
시클로프로필아민(0.04 ml)을 디메틸설폭시드(3 ml)에 가하여, 여기에 [2-플루오로-4-([6-시아노-7-([(2R)-옥시란-2-일]메톡시)-4-퀴놀릴]옥시)페닐]카르바민산 페닐에스테르(212 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가하고 석출된 결정을 여과 수취하여 표제 화합물(150 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.37-0.44(2H, m), 0.61-0.69(2H, m), 2.50-2.60(1H, m), 2.78-2.79(2H, m), 3.45-3.50(1H, m), 4.20(1H, dd, J=12, 6.0Hz), 4.73(1H, dd, J=12, 2.4Hz), 6.59(1H, d, J=5.6Hz), 6.82-6.85(1H, m), 7.08-7.13(1H, m), 7.32-7.38(1H, m), 7.63(1H, s), 8.20-8.28(2H, m), 8.72-8.78(2H, m)
실시예
531
N-[2- 플루오로 -4-([6- 시아노 -7-([(2R)-2-히드록시-3-(1- 피페리디노 )프로필]옥시)-4-퀴놀릴]옥시)페닐]-N'-시클로프로필우레아
N-(2-플루오로-4-[(6-시아노-7-[(2R)-(옥시란-2-일)메톡시]-4-퀴놀릴)옥시]페닐)-N'-시클로프로필우레아로부터 실시예 496에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.38-0.44(2H, m), 0.62-0.69(2H, m), 1.33-1.54(6H, m), 2.30-2.70(7H, m), 4.00-4.09(1H, m), 4.21(1H, dd, J=10.4, 5.6Hz), 4.32(1H, dd, J=10.4, 3.2Hz), 4.95(1H, d, J=4.4Hz), 6.59(1H, d, J=5.6Hz), 6.83-6.85(1H, m), 7.08-7.13(1H, m), 7.32-7.38(1H, m), 7.64(1H, s), 8.20-8.28(2H, m), 8.72-8.78(2H, m)
실시예
532
N-[2- 플루오로 -4-([6- 시아노 -7-([3-(1- 피페리디노 )프로필] 옥시 )-4- 퀴놀릴 ] 옥시)페닐]-N'-(2-티아졸릴)우레아
2-플루오로-4-([6-시아노-7-([3-(1-피페리디노)프로필]옥시)-4-퀴놀릴]옥시)페닐아민으로부터 실시예 495에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.30-1.53(6H, m), 1.92-2.00(2H, m), 2.30-2.50(6H, m), 4.28-4.35(2H, m), 6.62(1H, d, J=5.6Hz), 7.12-7.20(2H, m), 7.36-7.47(2H, m), 7.60(1H, s), 8.20-8.28(1H, m), 8.72-8.77(2H, m).
출발 물질은 다음의 방법으로 합성했다.
제조예
532-1
2- 플루오로 -4-([6- 시아노 -7-([3-(1- 피페리디노 )프로필] 옥시 )-4- 퀴놀릴 ] 옥시 )페닐아민
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-히드록시퀴놀린(200 mg)에 디메틸포름아미드(4 ml), 1-(3-클로로프로필피페리딘)염산염(268 mg), 탄산칼륨(374 mg)을 가하여, 60℃에서 8시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하여, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(초산에틸)로 정제하여, 표제 화합물(80 mg)을 담황색 결정으로서 얻었다.
1H-NMR(CDCl3) δ(ppm) 1.38-1.64(6H, m), 2.07-2.18(2H, m), 2.37-2.48(6H, m), 3.79(2H, brs), 4.24-4.34(2H, m), 6.47(1H, d, J=5.6Hz), 6.77-6.92(3H, m), 7.46(1H, s), 8.63-8.67(2H, m)
실시예
533
N-[2- 플루오로 -4-([6- 시아노 -7-([3-(1- 피롤리디노 )프로필] 옥시 )-4- 퀴놀릴 ] 옥시)페닐]-N'-(2-티아졸릴)우레아
2-플루오로-4-([6-시아노-7-([3-(1-피롤리디노)프로필]옥시)-4-퀴놀릴]옥시)페닐아민으로부터 실시예 495에 기재한 방법으로 표제 화합물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.65-1.72(4H, m), 1.94-2.02(2H, m), 2.40-2.50(4H, m), 2.56-2.62(2H, m), 4.30-4.36(2H, m), 6.63(1H, d, J=5.6Hz), 7.13-7.20(2H, m), 7.37-7.47(2H, m), 7.60(1H, s), 8.20-8.27(1H, m), 8.72-8.76(2H, m)
출발 물질은 다음의 방법으로 합성했다.
제조예
533-1
2- 플루오로 -4-([6- 시아노 -7-([3-(1- 피롤리디노 )프로필] 옥시 )-4- 퀴놀릴 ] 옥시 )페닐아민
4-(4-아미노-3-플루오로페녹시)-6-시아노-7-히드록시퀴놀린(300 mg)에 디메틸포름아미드(4 ml), 1-(3-클로로프로필피롤리딘)염산염(376 mg), 탄산칼륨(553 mg)을 가하여, 60℃에서 8시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(초산에틸)로 정제하여, 표제 화합물(200 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) δ(ppm) 1.62-1.72(4H, m), 1.93-2.03(2H, m), 2.40-2.49(4H, m), 2.55-2.61(2H, m), 4.28-4.35(2H, m), 5.22-5.25(2H, m), 6.51(1H, d, J=4.8Hz), 6.82-6.90(2H, m), 7.06-7.12(1H, m) 7.56(1H, s), 8.68-8.72(2H, m)
실시예
534
N-(2- 클로로 -5-((6- 시아노 -7-(2-(1- 피롤리디노 ) 에톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐 )-N'-페닐우레아
4-(3-아미노-4-클로로페녹시)-6-시아노-7-(2-(1-피롤리디노)에톡시)퀴놀린(44.5 mg, 0.109 mmol)과 페닐 이소시아네이트로부터 실시예 11과 같은 식의 수법에 의해, 표제 화합물(19.8 mg, 0.038 mmol, 34.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.69(4H, m), 2.59(4H, m), 2.91(2H, t, J=5.6Hz), 4.38(2H, t, J=5.6Hz), 6.66(1H, d, J=5.2Hz), 6.97-7.01(2H, m), 7.24-7.28(2H, m), 7.41(2H, d, J=7.2Hz), 7.60-7.63(2H, m), 8.20(1H, m), 8.51(1H, s), 8.74-8.76(2H, m), 9.53(1H, d, J=4.4Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
534-1
7-(
벤질옥시
)-4-(4-
클로로
-3-
니트로페녹시
)-6-
시아노퀴놀린
7-(벤질옥시)-4-클로로-6-시아노퀴놀린(5.462 g, 18.53 mmol)과 4-클로로-3-니트로페놀로부터 제조예 11과 같은 식의 수법에 의해, 표제 화합물(4.794 g, 11.10 mmol, 59.9%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.74(2H, s), 6.57(1H, d, J=5.2Hz), 7.34-7.55(6H, m), 7.58(1H, s), 7.70(1H, d, J=8.8Hz), 7.76(1H, d, J=2.8Hz), 8.64(1H, s), 8.76(1H, d, J=5.2Hz).
제조예
534-2
4-(4-
클로로
-3-
니트로페녹시
)-6-
시아노
-7-
히드록시퀴놀린
7-(벤질옥시)-4-(4-클로로-3-니트로페녹시)-6-시아노퀴놀린(1.00 g, 2.32 mmol)으로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(743 mg, 2.17 mmol, 93.9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.73(1H, d, J=5.2Hz), 7.45(1H, s), 7.69(1H, dd, J=2.8, 8.8Hz), 7.91(1H, d, J=8.8Hz), 8.14(1H, d, J=2.8Hz), 8.67(1H, s), 8.71(1H, d, J=5.2Hz), 11.71(1H, br).
제조예
534-3
4-(3-아미노-4-
클로로페녹시
)-6-
시아노
-7-
히드록시퀴놀린
4-(4-클로로-3-니트로페녹시)-6-시아노-7-히드록시퀴놀린)(743 mg, 2.17 mmol)으로부터 제조예 6과 같은 식의 수법에 의해, 표제 화합물(464 mg, 1.49 mmol, 68.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.62-5.65(2H, m), 6.43(1H, dd, J=2.8, 8.8Hz), 6.54(1H, d, J=5.2Hz), 6.63(1H, d, J=2.8Hz), 7.30(1H, d, J=8.8Hz), 7.41(1H, s), 8.62(1H, s), 8.65(1H, d, J=5.2Hz).
제조예
534-4
4-(3-아미노-4-
클로로페녹시
)-6-
시아노
-7-(2-(1-
피롤리디노
)
에톡시
)퀴놀린
4-(3-아미노-4-클로로페녹시)-6-시아노-7-히드록시퀴놀린(200 mg, 0.642 mmol)과 1-(2-클로로에틸)피롤리딘 히드로클로라이드로부터 실시예 7과 같은 식의 수법에 의해, 표제 화합물(143 mg, 0.350 mmol, 54.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.84(4H, m), 2.74(4H, m), 3.08(2H, t, J=5.6Hz), 4.20-4.24(2H, m), 4.37(2H, t, J=5.6Hz), 6.50(1H, dd, J=2.8, 8.8Hz), 6.54(1H, d, J=5.2Hz), 6.59(1H, d, J=2.8Hz), 7.33(1H, d, J=8.8Hz), 7.46(1H, s), 8.64(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
535
N-(2- 클로로 -5-((6- 시아노 -7-(2-(1- 피롤리디노 ) 에톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐 )-N'-(1,3-티아졸-2-일)우레아
4-(3-아미노-4-클로로페녹시)-6-시아노-7-(2-(1-피롤리디노)에톡시)퀴놀린(46.6 mg, 0.114 mmol)과 페닐 N-(1,3-티아졸-2-일)카르바메이트로부터 실시예 131과 같은 식의 수법에 의해, 표제 화합물(5.7 mg, 0.011 mmol, 9.35%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.69(4H, m), 2.61(4H, m), 2.93(2H, m), 4.39(2H, m), 6.65(1H, d, J=5.2Hz), 7.06(1H, dd, J=2.8, 8.8Hz), 7.13-7.14(2H, m), 7.38-7.40(2H, m), 7.63(1H, s), 7.66(1H, d, J=8.8Hz), 8.19(1H, d, J=3.2Hz), 8.75(1H, d, J=5.2Hz), 8.77(1H, s).
실시예
536
N-(2- 클로로 -5-((6- 시아노 -7-(2-(1- 피롤리디노 ) 에톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐 )-N'-시클로프로필우레아
4-(3-아미노-4-클로로페녹시)-6-시아노-7-(2-(1-피롤리디노)에톡시)퀴놀린(47.9 mg, 0.117 mmol)을 디메틸포름아미드(1 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.019 ml, 0.234 mmol), 페닐 클로로포르메이트(0.030 ml, 0.234 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.1 ml)을 적하하고, 밤새 더 교반했다. 반응액을 초산에틸과 물에 분배하여, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸로부터 석출시킨 결정을 여과 수취하여, 통풍 건조시킴으로써 표제 화합물(12.6 mg, 0.026 mmol, 21.9%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.39(2H, m), 0.63(2H, m), 1.70(4H, m), 2.49-2.53(1H, m), 2.60(4H, m), 2.91(2H, m), 4.40(2H, m), 6.64(1H, d, J=5.2Hz), 6.93(1H, dd, J=2.8, 8.8Hz), 7.33(1H, d, J=2.8Hz), 7.57(1H, d, J=8.8Hz), 7.64(1H, s), 8.09(1H, s), 8.19(1H, d, J=2.8Hz), 8.75-8.77(2H, m).
실시예
537
N-(2- 클로로 -5-((6- 시아노 -7-((2R)-2-히드록시-3-(1- 피롤리디노 ) 프로폭시 )-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아
실시예 11과 같은 식의 수법에 의해, 페닐 N-(2-클로로-5-((6-시아노-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시-4-퀴놀릴)옥시)페닐)카르바메이트)(107 mg, 0.191 mmol)와 시클로프로필아민으로부터 표제 화합물(20.7 mg, 0.040 mmol, 20.7%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.40(2H, m), 0.65(2H, m), 1.69(4H, m), 2.49-2.68(6H, m), 2.72(1H, m), 4.03(1H, m), 4.23(1H, dd, J=5.6, 10.4Hz), 4.33(1H, dd, J=4.4, 10.4Hz), 5.03(1H, m), 6.64(1H, d, J=5.2Hz), 6.94(1H, dd, J=2.8, 8.4Hz), 7.33(1H, m), 7.56-7.93(2H, m), 8.10(1H, s), 8.20(1H, d, J=2.8Hz), 8.71-8.77(2H, m).
출발 물질은 다음의 방법으로 합성했다.
제조예
537-1
4-(3-아미노-4-
클로로페녹시
)-6-
시아노
-7-((2R)
옥시란
-2-일)
메톡시퀴놀린
4-(3-아미노-4-클로로페녹시)-6-시아노-7-히드록시퀴놀린(264 mg, 0.847 mmol)과 (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(201 mg, 0.547 mmol, 64.6%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.93(1H, dd, J=2.4, 4.8Hz), 2.98(1H, dd, J=4.0, 4.8Hz), 3.50(1H, m), 4.21-4.24(3H, m), 4.50(1H, dd, J=3.2, 11.2Hz), 6.50(1H, dd, J=2.8, 8.8Hz), 6.56(1H, d, J=5.2Hz), 6.59(1H, d, J=2.8Hz), 7.33(1H, d, J=8.8Hz), 7.48(1H, s), 8.67(1H, s), 8.69(1H, d, J=5.2Hz).
제조예
537-2
4-(3-아미노-4- 클로로페녹시 )-6- 시아노 -7-(((2R)-2-히드록시-3-(1- 피롤리디노)프로필)옥시)퀴놀린
4-(3-아미노-4-클로로페녹시)-6-시아노-7-((2R)옥시란-2-일)메톡시퀴놀린)(201 mg, 0.547 mmol)을 질소 분위기하에서, 테트라히드로푸란(5.0 ml)에 용해시키고, 피롤리딘(0.456 ml)을 가하여, 실온에서 밤새 교반했다. 반응액을 감압 농축하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(235 mg, 0.535 mmol, 98.0%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.82(4H, m), 2.59(2H, m), 2.65(1H, dd, J=4.0, 12.0Hz), 2.74(2H, m), 2.94(1H, dd, J=5.2, 12.0Hz), 4.19-4.27(5H, m), 6.50(1H, dd, J=2.8, 8.8Hz), 6.55(1H, d, J=5.2Hz), 6.59(1H, d, J=2.8Hz), 7.33(1H, d, J=8.8Hz), 7.50(1H, s), 8.65(1H, s), 8.68(1H, d, J=5.2Hz).
제조예
537-3
페닐 N-(2- 클로로 -5-((6- 시아노 -7-((2R)-2-히드록시-3-(1- 피롤리디노 ) 프로폭시-4-퀴놀릴)옥시)페닐)카르바메이트
4-(3-아미노-4-클로로페녹시)-6-시아노-7-(((2R)-2-히드록시-3-(1-피롤리디노)프로필)옥시)퀴놀린(235 mg, 0.535 mmol)으로부터 제조예 17과 같은 식의 수법에 의해, 표제 화합물(107 mg, 0.191 mmol, 35.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.20(4H, m), 3.39-3.48(5H, m), 4.11(1H, m), 4.25(1H, m), 4.44(1H, dd, J=4.8, 9.2Hz), 4.67(1H, m), 6.50(1H, m), 6.57-6.60(2H, m), 6.91(1H, m), 7.17-7.49(6H, m), 8.17(1H, s), 8.66(1H, d, J=5.2Hz), 8.71(1H, d, J=5.6Hz).
실시예
538
N6 - 메틸 -4-(4- 클로로 -3-(((4- 플루오로아닐리노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, N6-메틸-4-(3-아미노-4-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(72 mg, 0.2 mmol)와 4-플루오로페닐 이소시아네이트로부터 표제 화합물(77.6 mg, 0.157 mmol, 77.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.82(3H, d, J=4.4Hz), 4.01(3H, s), 6.62(1H, d, J=5.2Hz), 6.96(1H, dd, J=2.8, 8.8Hz), 7.10(2H, m), 7.40(2H, m), 7.51(1H, s), 7.60(1H, d, J=8.8Hz), 8.15(1H, d, J=2.8Hz), 8.35(1H, d, J=4.4Hz), 8.47(1H, s), 8.54(1H, s), 8.68(1H, d, J=5.2Hz), 9.56(1H, s).
출발 물질은 다음의 방법으로 합성했다.
제조예
538-1
메틸
4-(4-
클로로
-3-
니트로페녹시
)-7-
메톡시
-6-
퀴놀린카르복실레이트
메틸 4-클로로-7-메톡시-6-퀴놀린카르복실레이트(2.517 g, 10.0 mmol)와 4-클로로-3-니트로페놀로부터 제조예 11과 같은 식의 수법에 의해, 표제 화합물(2.114 g, 5.44 mmol, 54.4%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.97(3H, s), 4.06(3H, s), 6.54(1H, d, J=5.2Hz), 7.38(1H, dd, J=2.8, 8.8Hz), 7.53(1H, s), 7.66(1H, d, J=8.8Hz), 7.75(1H, d, J=2.8Hz), 8.70(1H, s), 8.73(1H, d, J=8.8Hz).
제조예
538-2
4-(4-
클로로
-3-
니트로페녹시
)-7-
메톡시
-6-
퀴놀린카르복실산
메틸 4-(4-클로로-3-니트로페녹시)-7-메톡시-6-퀴놀린카르복실레이트(1.00 g, 2.57 mmol)에 메탄올(30 ml), 2규정 수산화나트륨 수용액(10 ml)을 가하여, 60℃에서 1시간동안 교반했다. 반응액을 실온으로 방냉하여, 2규정 염산을 가하여 중화시킨 후, 메탄올을 증류 수거하여, 석출된 담갈색 결정을 여과 수취하고, 충분히 물로 세척한 후, 70℃에서 건조시켜, 표제 화합물(897 mg, 2.39 mmol, 93.1%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.97(3H, s), 6.76(1H, d, J=5.2Hz), 7.53(1H, s), 7.70(1H, dd, J=2.8, 8.8Hz), 7.91(1H, d, J=8.8Hz), 8.16(1H, d, J=2.8Hz), 8.49(1H, s), 8.73(1H, d, J=5.2Hz), 13.13(1H, br).
제조예
538-3
N6
-
메틸
-4-(4-
클로로
-3-
니트로페녹시
)-7-
메톡시
-6-
퀴놀린카르복사미드
4-(4-클로로-3-니트로페녹시)-7-메톡시-6-퀴놀린카르복실산(897 mg, 2.39 mmol)을 디메틸포름아미드(10 ml)에 질소 분위기하에서 용해시키고, 40% 메틸아민-메탄올 용액(2.0 ml), 트리에틸아민(1.0 ml), (1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트(1.27 g, 2.87 mmol)를 순차적으로 실온에서 가한 후, 4시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(928 mg, 정량적)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.82(3H, d, J=4.4Hz), 4.01(3H, s), 6.77(1H, d, J=5.2Hz), 7.54(1H, s), 7.68(1H, dd, J=2.8, 8.8Hz), 7.90(1H, d, J=8.8Hz), 8.13(1H, d, J=2.8Hz), 8.35(1H, d, J=4.4Hz), 8.53(1H, s), 8.72(1H, d, J=5.2Hz).
제조예
538-4
N6
-
메틸
-4-(3-아미노-4-
클로로페녹시
)-7-
메톡시
-6-
퀴놀린카르복사미드
N6-메틸-4-(4-클로로-3-니트로페녹시)-7-메톡시-6-퀴놀린카르복사미드(928 mg, 2.39 mmol)로부터 제조예 6과 같은 식의 수법에 의해, 표제 화합물(614 mg, 1.72 mmol, 71.7%)을 담회색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.08(3H, d, J=5.2Hz), 4.12(3H, s), 4.17-4.21(2H, m), 6.49-6.54(2H, m), 6.59(1H, d, J=2.8Hz), 7.30(1H, d, J=8.8Hz), 7.51(1H, s), 7.86(1H, br), 8.64(1H, d, J=5.2Hz), 9.23(1H, s).
실시예
539
N6 - 메틸 -4-(4- 클로로 -3-(((1,3-티아졸-2- 일아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
실시예 131과 같은 식의 수법에 의해, N6-메틸-4-(3-아미노-4-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(143 mg, 0.4 mmol)와 페닐 N-(1,3-티아졸-2-일)카르바메이트로부터 표제 화합물(170.4 mg, 0.352 mmol, 88.0%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.82(3H, d, J=4.8Hz), 4.01(3H, s), 6.62(1H, d, J=5.2Hz), 7.03(1H, dd, J=2.8, 8.8Hz), 7.13(1H, d, J=3.6Hz), 7.39(1H, d, J=3.6Hz), 7.52(1H, s), 7.64(1H, d, J=8.8Hz), 8.16(1H, d, J=2.8Hz), 8.35(1H, d, J=4.8Hz), 8.55(1H, s), 8.68(1H, d, J=5.2Hz), 11.30(1H, br).
실시예
540
N6 - 메틸 -4-(4- 클로로 -3-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
N6-메틸-4-(3-아미노-4-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(179 mg, 0.50 mmol)를 디메틸포름아미드(2 ml)에 질소 분위기하에서 용해시키고, 피리딘(0.061 ml, 0.75 mmol), 페닐 클로로포르메이트(0.094 ml, 0.75 mmol)를 실온에서 적하하여, 1시간동안 교반했다. 시클로프로필아민(0.2 ml)을 적하하여, 또 밤새 교반했다. 반응액을 초산에틸과 물에 분배하여, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸로부터 석출시킨 결정을 여과 수취하고, 통풍 건조시킴으로써 표제 화합물(163.9 mg, 0.372 mmol, 74.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.39(2H, m), 0.62(2H, m), 2.49-2.53(1H, m), 2.83(3H, d, J=4.8Hz), 4.02(3H, s), 6.60(1H, d, J=5.2Hz), 6.90(1H, dd, J=3.2, 8.8Hz), 7.32(1H, d, J=2.8Hz), 7.52-7.56(2H, m), 8.07(1H, s), 8.16(1H, d, J=3.2Hz), 8.37(1H, d, J=4.8Hz), 8.54(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
541
N6 - 메틸 -4-(4- 클로로 -3-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
N6-메틸-4-(3-아미노-4-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(108 mg, 0.30 mmol)로부터 실시예 540과 같은 식의 수법에 의해, 표제 화합물(71.9 mg, 0.173 mmol, 57.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.60(3H, d, J=4.4Hz), 2.81(3H, d, J=4.8Hz), 4.00(3H, s), 6.59(1H, d, J=5.2Hz), 6.87(1H, dd, J=2.8, 8.4Hz), 7.14(1H, t, J=7.6Hz), 7.50-7.54(2H, m), 8.13(1H, d, J=2.8Hz), 8.19(1H, s), 8.35(1H, d, J=4.4Hz), 8.53(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
542
N6 - 메틸 -4-(4- 클로로 -3-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
N6-메틸-4-(3-아미노-4-클로로페녹시)-7-메톡시-6-퀴놀린카르복사미드(107 mg, 0.30 mmol)로부터 실시예 540과 같은 식의 수법에 의해, 표제 화합물(90.6 mg, 0.211 mmol, 70.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.02(3H, t, J=7.2Hz), 2.81(3H, t, J=4.4Hz), 3.06(2H, m), 4.00(3H, s), 6.58(1H, d, J=5.2Hz), 6.87(1H, dd, J=3.2, 8.8Hz), 7.13(1H, m), 7.50-7.54(2H, m), 8.14-8.15(2H, m), 8.35(1H, d, J=4.4Hz), 8.53(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
543
N-(2- 클로로 -4-(6- 시아노 -7-(((2R) 옥시란 -2- 일메톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐 )-N'-시클로프로필우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시-2-클로로페닐)-N'-시클로프로필우레아(873 mg, 2.21 mmol)와 (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(663 mg, 1.47 mmol, 66.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 2.83(1H, m), 2.93(1H, m), 3.48(1H, m), 4.18(1H, dd, J=6.4, 12.0Hz), 4.72(1H, m), 6.61(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.27(1H, dd, J=2.4, 9.2Hz), 7.51(1H, d, J=2.8Hz), 7.65(1H, s), 8.00(1H, s), 8.29(1H, dd, J=4.0, 9.2Hz), 8.75(1H, d, J=5.2Hz), 8.78(1H, s).
실시예
544
N-(2- 클로로 -4-((6- 시아노 -7-(((2R)-2-히드록시-3-(1- 피페리디노 )프로필) 옥시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아
N-(2-클로로-4-(6-시아노-7-(((2R)옥시란-2-일메톡시)-4-퀴놀릴)옥시)페닐)-N'-시클로프로필우레아(113 mg, 0.25 mmol)에 테트라히드로푸란(2.5 ml), 피페리딘(0.25 ml)을 가하여 실온에서 밤새 교반했다. 반응액을 감압 농축하고, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(57.7 mg, 0.108 mmol, 43.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.35(2H, m), 1.48(4H, m), 2.34-2.51(6H, m), 2.56(1H, m), 4.02(1H, m), 4.19(1H, dd, J=6.0, 10.4Hz), 4.29(1H, dd, J=3.6, 10.4Hz), 4.93(1H, d, J=4.0Hz), 6.57(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 8.8Hz), 7.50(1H, d, J=2.8Hz), 7.62(1H, s), 7.98(1H, s), 8.27(1H, d, J=8.8Hz), 8.71-8.73(2H, m).
실시예
545
N6 - 메틸 -4-(4-(((4- 플루오로아닐리노 )카르보닐)( 메틸 )아미노) 페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
실시예 435와 같은 식의 수법에 의해, 4-(4-(((4-플루오로아닐리노)카르보닐)(메틸)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(115 mg, 0.25 mmol)과 40% 메틸아민-메탄올 용액으로부터 표제 화합물(89.4 mg, 0.188 mmol, 75.6%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.83(3H, d, J=4.8Hz), 3.28(3H, s), 4.01(3H, s), 6.65(1H, d, J=5.2Hz), 7.08(2H, m), 7.32(2H, m), 7.42-7.48(4H, m), 7.51(1H, s), 8.23(1H, s), 8.35(1H, d, J=4.8Hz), 8.60(1H, s), 8.69(1H, d, J=5.2Hz).
실시예
546
N6 -에틸-4-(4-(((4- 플루오로아닐리노 )카르보닐)( 메틸 )아미노) 페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
실시예 435와 같은 식의 수법에 의해, 4-(4-(((4-플루오로아닐리노)카르보닐)(메틸)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(115 mg, 0.25 mmol)과 2.0M 에틸아민-테트라히드로푸란 용액으로부터 표제 화합물(87.0 mg, 0.178 mmol, 71.5%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.13(3H, t, J=7.2Hz), 3.28(3H, s), 3.28-3.36(2H, m), 4.01(3H, s), 6.64(1H, d, J=5.2Hz), 7.06(2H, m), 7.31(2H, m), 7.42-7.48(4H, m), 7.51(1H, s), 8.23(1H, s), 8.39(1H, t, J=5.2Hz), 8.55(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
547
N6 -(2-(1- 피롤리디노 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 1-(2-아미노에틸)피롤리딘으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(42.9 mg, 0.082 mmol, 81.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.70(4H, m), 2.48-2.61 (7H, m), 3.43(2H, m), 4.01(3H, s), 6.52(1H, d, J=5.2Hz), 7.18(1H, s), 7.22(1H, dd, J=2.4, 8.8Hz), 7.47(1H, d, J=2.4Hz), 7.51(1H, s), 7.97(1H, s), 8.26(1H, d, J=8.8Hz), 8.50(1H, m), 8.64(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
548
N6 -(2-(1- 피페리디노 )에틸)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 1-(2-아미노에틸)피페리딘으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(44.6 mg, 0.083 mmol, 82.9%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.39(2H, m), 1.51(4H, m), 2.39(4H, m), 2.43-2.49(2H, m), 2.56(1H, m), 3.39(2H, m), 4.05(3H, s), 6.52(1H, d, J=5.2Hz), 7.18(1H, s), 7.23(1H, dd, J=2.8, 8.8Hz), 7.48(1H, d, J=2.8Hz), 7.53(1H, s), 7.96(1H, s), 8.26(1H, d, J=8.8Hz), 8.48(1H, m), 8.66(1H, d, J=5.2Hz), 8.70(1H, s).
실시예
549
N6 -(2-프로필)-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 2-프로필아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(15.2 mg, 0.032 mmol, 32.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.17(6H, d, J=6.8Hz), 2.56(1H, m), 3.99(3H, s), 4.08(1H, m), 6.51(1H, d, J=5.2Hz), 7.19(1H, s), 7.22(1H, dd, J=2.8, 8.8Hz), 7.46(1H, d, J=2.8Hz), 7.49(1H, s), 7.97(1H, s), 8.15(1H, d, J=8.0Hz), 8.26(1H, d, J=8.8Hz), 8.43(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
550
N6 - 시클로펜틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(43 mg, 0.10 mmol)과 시클로펜틸아민으로부터, 실시예 438과 같은 식의 수법에 의해 표제 화합물(34.3 mg, 0.069 mmol, 69.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.53(4H, m), 1.67(2H, m), 1.89(2H, m), 2.56(1H, m), 4.00(3H, s), 4.23(1H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, s), 7.22(1H, dd, J=2.8, 8.8Hz), 7.46(1H, d, J=2.8Hz), 7.48(1H, s), 7.97(1H, s), 8.23-8.27(2H, m), 8.41(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
551
N-(4-(6-
아미노피리미딘
-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
6-(4-아미노페녹시)피리미딘-4-일아민(88.9 mg, 0.440 mmol) 및 페닐이소시아네이트(52.4 mg, 0.440 mmol)를 디메틸포름아미드(2 ml) 중, 실온에서 3시간동안 교반했다. 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(98.0 mg, 0.305 mmol, 69%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.66(1H, s), 6.81(2H, br s), 6.94-6.99(1H, m), 7.03-7.08(2H, m), 7.25-7.32(2H, m), 7.43-7.52(4H, m), 8.07(1H, s), 8.74(1H, s), 8.80(1H, s).
중간체는 다음과 같이 합성했다.
제조예
551-1
4-
클로로
-6-(4-
니트로페녹시
)피리미딘
2,4-디클로로피리미딘(2.98 g, 20.0 mmol), 4-니트로페놀(2.78 g, 20.0 mmol), 및 탄산칼륨(4.15 g, 30.0 mmol)을 디메틸포름아미드(20 ml) 중, 실온에서 15시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=1:4)에 가하여, 목적물을 포함하는 분획을 농축하여, 표제 화합물(3.89 g, 15.5 mmol, 77%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 7.08(1H, d, J=0.6Hz), 7.32-7.37(2H, m), 8.32-8.37(2H, m), 8.60(1H, d, J=0.6Hz).
제조예
551-2
6-(4-
니트로페녹시
)피리미딘-4-
일아민
4-클로로-6-(4-니트로페녹시)피리미딘(1.04 g, 4.00 mmol)을 암모니아-에탄올 용액(14%, 10 ml) 중에서 오토클레이브를 이용하여, 110℃에서 15시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물 및 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=1:1)에 가하여, 목적물을 포함하는 분획을 농축하여, 표제 화합물(306 mg, 1.32 mmol, 33%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.00(2H, br s), 6.03(1H, s), 7.25-7.32(2H, m), 8.26-8.33(3H, m).
제조예
551-3
6-(4-
아미노페녹시
)피리미딘-4-
일아민
6-(4-니트로페녹시)피리미딘-4-일아민(306 mg, 1.32 mmol), 철분(369 mg, 6.60 mmol) 및 염화암모늄(706 mg, 13.2 mmol)을 에탄올(20 ml)-물(5 ml)의 혼합 용매에 현탁시켜, 80℃에서 20분간 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸로 잘 세척하였다. 유기층을 포화식염수로 세척하여, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 농축하여, 표제 화합물(266 mg, 1.32 mmol, 100%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.05(2H, br s), 5.55(1H, s), 6.57-6.62(2H, m), 6.73(2H, br s), 6.77-6.82(2H, m), 8.04(1H, s).
실시예
552
N-(6-(4-(3-
페닐우레이도
)
페녹시
)피리미딘-4-일)
아세트아미드
N-(4-(6-아미노피리미딘-4-일옥시)페닐)-N'-페닐우레아(60.0 mg, 0.187 mmol)를 무수초산(1 ml)-피리딘(1 ml)의 혼합 용매 중에, 60℃에서 18시간동안 가열 교반했다. 반응액을 실온으로 되돌린 후, 물에 쏟아 넣어, 석출된 결정을 여과 수취하고, 물, 메탄올로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(35.0 mg, 0.096 mmol, 52%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.11(3H, s), 6.94-7.00(1H, m), 7.10-7.15(2H, m), 7.25-7.31(2H, m), 7.44-7.54(5H, m), 8.49(1H, d, J=0.4Hz), 8.72(1H, s), 8.80(1H, s), 10.94(1H, s).
실시예
553
N-(4-(6-
아미노피리미딘
-4-
일옥시
)
페닐
)-
N'
-(4-
플루오로페닐
)
우레아
6-(4-아미노페녹시)피리미딘-4-일아민(88.9 mg, 0.440 mmol) 및 4-플루오로페닐이소시아네이트(60.3 mg, 0.440 mmol)으로부터, 실시예 551과 같은 식의 수법에 의해, 표제 화합물(100 mg, 0.295 mmol, 65%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.66(1H, d, J=0.6Hz), 6.81(2H, br s), 7.04-7.15(4H, m), 7.44-7.52(4H, m), 8.07(1H, d, J=0.6Hz), 8.84(1H, s), 8.85(1H, s).
실시예
554
N-(6-(4-(3-(4-
플루오로페닐
)
우레이도
)
페녹시
)피리미딘-4-일)
아세트아미드
N-(4-(6-아미노피리미딘-4-일옥시)페닐)-N'-(4-플루오로페닐우레아)(60.0 mg, 0.176 mmol)로부터, 실시예 552와 같은 식의 수법에 의해, 표제 화합물(56 mg, 0.147 mmol, 79%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.11(3H, s), 7.09-7.16(4H, m), 7.44-7.54(5H, m), 8.49(1H, s), 8.80(1H, s), 8.83(1H, s), 10.94(1H, s).
실시예
555
N-(4-(6-
아미노피리미딘
-4-
일옥시
)
페닐
)-
N'
-(3-
메탄설포닐페닐
)
우레아
6-(4-아미노페녹시)피리미딘-4-일아민(88.9 mg, 0.440 mmol) 및 (3-메틸설포닐페닐)카르바민산페닐에스테르(128 mg, 0.440 mmol)를 디메틸설폭시드(2 ml) 중에, 85℃에서 18시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=30:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(75.0 mg, 0.188 mmol, 43%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.20(3H, s), 5.67(1H, s), 6.82(2H, br s), 7.04-7.12(2H, m), 7.44-7.59(4H, m), 7.65-7.70(1H, m), 8.07(1H, s), 8.16-8.19(1H, m), 8.92(1H, br s), 9.19(1H, br s).
실시예
556
N-(6-(4-(3-(3-
메틸설포닐페닐
)
우레이도
)
페녹시
)피리미딘-4-일)
아세트아미드
N-(4-(6-아미노피리미딘-4-일옥시)페닐)-N'-(3-메틸설포닐페닐)우레아(50.0 mg, 0.125 mmol)로부터, 실시예 552와 같은 식의 수법에 의해, 표제 화합물(13 mg, 0.029 mmol, 24%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.11(3H, s), 3.20(3H, s), 7.11-7.17(2H, m), 7.50-7.59(5H, m), 7.66-7.70(1H, m), 8.16-8.19(1H, m), 8.50(1H, s), 9.01(1H, br s), 9.28(1H, br s), 10.95(1H, s).
실시예
557
N-(4-(2-
아미노피리미딘
-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
4-(4-아미노페녹시)피리미딘-2-일아민(101 mg, 0.500 mmol) 및 페닐이소시아네이트(59.6 mg, 0.500 mmol)로부터, 실시예 551과 같은 식의 수법에 의해, 표제 화합물(105 mg, 0.327 mmol, 65%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.07(1H, d, J=5.8Hz), 6.61(2H, br s), 6.94-6.99(1H, m), 7.05-7.10(2H, m), 7.25-7.31(2H, m), 7.43-7.51(4H, m), 8.08(1H, d, J=5.8Hz), 8.74(1H, br s), 8.79(1H, br s).
중간체는 다음과 같이 합성했다.
제조예
557-1
4-
클로로
-6-(4-
니트로페녹시
)피리미딘-2-
일아민
2-아미노-4,6-디클로로피리미딘(3.28 g, 20.0 mmol), 4-니트로페놀(2.78 g, 20.0 mmol) 및 탄산칼륨(4.15 g, 30.0 mmol)을 디메틸포름아미드(20 ml) 중에 100℃에서 3시간동안 가열 교반했다. 반응액을 실온으로 되돌린 후, 빙수(100 ml)에 쏟아 넣어, 석출된 결정을 여과 수취하고, 물로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(4.93 g, 18.5 mmol, 92%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.43(1H, s), 7.25(2H, br s), 7.46-7.52(2H, m), 8.28-8.34(2H, m).
제조예
557-2
4-(4-
아미노페녹시
)피리미딘-2-
일아민
4-클로로-6-(4-니트로페녹시)피리미딘-2-일아민(1.60 g, 1.32 mmol)을 메탄올(30 ml)-테트라히드로푸란(30 ml)의 혼합 용매에 현탁하고, 수산화팔라듐탄소(300 mg)를 가하여, 수소 분위기하에서 실온에서 18시간동안 교반했다. 세라이트 여과에 의해 촉매를 여과 제거하고, 에탄올로 세척한 후, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하여, 표제 화합물(910 mg, 4.50 mmol, 75%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.01(2H, br s), 5.93(1H, d, J=5.4Hz), 6.50-6.60(4H, m), 6.76-6.82(2H, m), 8.03(1H, d, J=5.4Hz).
실시예
558
N-(4-(2-
아미노피리미딘
-4-
일옥시
)
페닐
)-
N'
-(4-
플루오로페닐
)
우레아
4-(4-아미노페녹시)피리미딘-2-일아민(101 mg, 0.500 mmol) 및 4-플루오로페닐이소시아네이트(68.6 mg, 0.500 mmol)로부터, 실시예 551과 같은 식의 수법에 의해, 표제 화합물(105 mg, 0.309 mmol, 62%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.06(1H, d, J=5.6Hz), 6.61(2H, br s), 7.05-7.15(4H, m), 7.44-7.52(4H, m), 8.08(1H, d, J=5.6Hz), 8.75-8.79(2H, m).
실시예
559
N-(4-(2-
아미노피리미딘
-4-
일옥시
)
페닐
)-
N'
-(3-
메틸설포닐페닐
)
우레아
4-(4-아미노페녹시)피리미딘-2-일아민(101 mg, 0.500 mmol) 및 (3-메틸설포닐페닐)카르바민산페닐에스테르(146 mg, 0.500 mmol)로부터, 실시예 555와 같은 식의 수법에 의해, 표제 화합물(96 mg, 0.240 mmol, 48%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.20(3H, s), 6.07(1H, d, J=5.8Hz), 6.61(2H, br s), 7.06-7.12(2H, m), 7.46-7.59(4H, m), 7.65-7.70(1H, m), 8.09(1H, d, J=5.8Hz), 8.16-8.19(1H, m), 8.89(1H, br s), 9.18(1H, br s).
실시예
560
4-(3- 플루오로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(2- 메톡시에톡시)-6-퀴놀린카르복사미드
4-(4-아미노-3-플루오로페녹시)-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드(100 mg)로부터 실시예 11과 같은 식의 수법에 의해 생성된 페닐 N-(4-(6-카르바모일-7-(2-메톡시에톡시)-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트와 시클로프로필아민으로부터 표제 화합물(22 mg)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.39(2H, m), 0.63(2H, m), 2.49(1H, m), 3.30(3H, s), 3.79(2H, m), 4.39(2H, m), 6.51(1H, d, J=5.2Hz), 6.79(1H, s), 7.06(1H, m), 7.31(1H, m), 7.54(1H, s), 7.79(1H, s), 7.83(1H, s), 8.18-8.22(2H, m), 8.65(1H, d, J=5.2Hz), 8.74(1H, s).
실시예
561
1-[4-(7- 벤질옥시 -6- 시아노퀴놀린 -4- 일옥시 )-2- 메틸페닐 ]-3- 시클로프로필우레아
제조예 17과 같은 식으로 4-(4-아미노-2-메틸페녹시)-7-메톡시퀴놀린-6-카르복실산 아미드(2 g)와 클로르탄산페닐로부터 카르바메이트(1.73 g)를 고체로서 얻었다. 다음에, 실시예 11과 같은 식으로 카르바메이트(1.7 g)를 디메틸설폭시드 중에, 실온에서 시클로프로필아민으로 처리하여 표제 화합물(1.4 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.59-0.64(2H, m), 2.23(3H. s), 2.50-2.56(1H, m), 5.42(2H, s), 6.49(1H, d, J=5.2Hz), 6.73-6.75(1H, m), 7.02(1H, dd, J=2.8Hz, J=8.8Hz), 7.08(1H, d, J=2.8Hz), 7.32-7.53(5H, m), 7.60(1H, s), 7.66(1H, s), 7.89(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.73(1H, s).
중간체는 다음과 같은 식으로 합성했다.
제조예
561-1
4-(4-아미노-3-
메틸페녹시
)-7-
벤질옥시퀴놀린
-6-
카르보니트릴
제조예 395-1과 같은 식으로 7-벤질옥시-4-클로로퀴놀린-6-카르보니트릴(5 g)과 4-아미노-3-메틸페놀로부터 표제 화합물(3.6 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.07(3H, s), 4.94(2H, s), 5.43(2H, s), 6.46(1H, d, J=5,2Hz), 6.69(1H, d, J=8.8Hz), 6.82(1H, dd, J=2.8Hz, J=8.8Hz), 6.87(1H, d, J=2.8Hz), 7.36(1H, t, J=7.2Hz), 7.44(2H, t, J=7.2Hz), 7.53(2H, d, J=7.2Hz), 7.66(1H, s), 8.67(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
562
1-[4-(6- 시아노 -7- 히드록시퀴놀린 -4- 일옥시 )-2- 메틸페닐 ]-3- 시클로프로필우레아
제조예 301-2와 같은 식으로 1-[4-(7-벤질옥시-6-시아노-퀴놀린-4-일옥시)-2-메틸-페닐]-3-시클로프로필-우레아(0.8 g)를 테트라히드로푸란 중에, 팔라듐-카본을 이용해 탈벤질화하여, 표제 화합물(0.5 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.36-0.41(2H, m), 0.59-0.65(2H, m), 2.17(3H, s), 2.49-2.56(1H, m), 6.32(1H, d, J=5.2Hz), 6.74(1H, d, J=2.8Hz), 7.01(1H, dd, J=2.4Hz, J=8.8Hz), 7.07(1H, d, J=2.4Hz), 7.30(1H, s), 7.59(1H, s), 7.90(1H, d, J=8.8Hz), 8.56(1H, d, J=5.2Hz), 8.57(1H, s).
실시예
563
1-[4-(6- 시아노 -(2R)-7- 옥시라닐메톡시퀴놀린 -4- 일옥시 )-2- 메틸페닐 ]-3- 시클로프로필우레아
제조예 284-1과 같은 식으로 1-[4-(6-시아노-7-히드록시퀴놀린-4-일옥시)-2-메틸페닐]-3-시클로프로필우레아(500 mg)로부터 표제 화합물(312 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.42(2H, m), 0.59-0.65(2H, m), 2.18(3H, s), 2.49-2.56(1H, m), 2.78-2.81(1H, m), 2.89(1H, t, J=4.8Hz), 3.42-3.47(1H, m), 4.14(1H, dd, J=6.4Hz, J=11.6Hz), 4.68(1H, dd, J=2.4Hz, J=11.6Hz), 6.49(1H, d, J=5.2Hz), 6.74(1H, d, J=2.4Hz), 7.03(1H, dd, J=2.4Hz, J=8.4Hz), 7.09(1H, d, J=2.4Hz), 7.59(1H, s), 7.61(1H, s), 7.92(1H, d, J=8.4Hz), 8.70(1H, d, J=5.2Hz), 8.74(1H, s).
실시예
564
1-{4-[6- 시아노 -7-((2R)-2-히드록시-3- 피롤리딘 -1-일- 프로폭시 )퀴놀린-4- 일옥시]-2-메틸-페닐}-3-시클로프로필-우레아
실시예 284와 같은 식으로 1-[4-(6-시아노-7-(2R)-옥시라닐메톡시퀴놀린-4-일옥시)-2-메틸페닐]-3-시클로프로필-우레아(55 mg)와 피롤리딘으로부터 표제 화합물(11 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.58-0.65(2H, m), 2.26(3H, s), 1.62-1.69(4H, m), 2.44-2.56(6H, m), 2.68(1H, dd, J=6.4Hz, J=12Hz), 3.96-4.03(1H, m), 4.18(1H, dd, J=5.6Hz, J=10.4Hz), 4.28(1H, dd, J=3.6Hz, J=10.4Hz), 5.00(1H, d, J=5.2Hz), 6.48(1H, d, J=5.2Hz), 6.75(1H, d, J=2.4Hz), 7.03(1H, dd, J=2.4Hz, J=8.8Hz), 7.09(1H, d, J=2.4Hz), 7.58(1H, s), 7.60(1H, s), 7.91(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
565
1-{4-[6- 시아노 -7-((2R)-2-히드록시-3-피페리딘-1- 일프로폭시 )퀴놀린-4- 일옥시]-2-메틸페닐}-3-시클로프로필-우레아
실시예 284와 같은 식으로 [1-[4-(6-시아노-(2R)-7-옥시라닐메톡시퀴놀린-4-일옥시)-2-메틸페닐]-3-시클로프로필우레아(100 mg)와 피페리딘으로부터 표제 화합물(8 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.59-0.66(2H, m), 1.31-1.38(2H, m), 1.43-1.53(4H, m), 2.20(3H, s), 2.33-2.58 (7H, m), 3.99-4.06(1H, m), 4.19(1H, dd, J=5.6Hz, J=10.4Hz), 4.29(1H, dd, J=3.2Hz, J=10.4Hz), 4.94(1H, br), 6.49(1H, d, J=5.2Hz), 6.75-6.79(1H, m), 7.02-7.08(1H, m), 7.09-7.13(1H, m), 7.60(1H, s), 7.62(1H, s), 7.93(1H, d, J=9.2Hz), 8.70(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
566
1-{4-[6- 시아노 -7-(3- 디에틸아미노 -(2R)-2-히드록시- 프로폭시 )퀴놀린-4- 일옥시]-2-메틸-페닐}-3-시클로프로필-우레아
실시예 284와 같은 식으로 [1-[4-(6-시아노-(2R)-7-옥시라닐메톡시퀴놀린-4-일옥시)-2-메틸페닐]-3-시클로프로필우레아(55 mg)와 디에틸아민으로부터 표제 화합물(21 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.59-0.65(2H, m), 0.91-1.00(6H, m), 2.18(3H, s), 2.43-2.69 (7H, m), 3.91-4.00(1H, m), 4.17-4.22(1H, m), 4.26-4.31(1H, m), 6.48(1H, d, J=5.2Hz), 6.76(1H, d, J=2.8Hz), 7.03(1H, dd, J=2.8Hz, J=8.8Hz), 7.09(1H, d, J=2.4Hz), 7.58(1H, s), 7.60(1H, s), 7.91(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
567
1-{4-[6- 시아노 -7-(3- 피롤리딘 -1- 일프로폭시 )퀴놀린-4- 일옥시 ]-2- 메틸페닐 }-3-시클로프로필우레아
실시예 7과 같은 식으로 1-[4-(6-시아노-7-히드록시퀴놀린-4-일옥시)-2-메틸페닐]-3-시클로프로필우레아(60 mg)와 1-(3-클로로필)피롤리딘으로부터 표제 화합물(23 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.59-0.65(2H, m), 1.62-1.69(4H, m), 1.93-2.01(2H, m), 2.18(3H, s), 2.39-2.45(4H, m), 2.49-2.55(1H, m), 2.57(2H, t, J=7.2Hz), 4.30(2H, t, J=6.4Hz), 6.48(1H, d, J=5.2Hz), 6.75(1H, d, J=2.8Hz), 7.03(1H, dd, J=2.8Hz, J=8.8Hz), 7.08(1H, d, J=2.8Hz), 7.55(1H, s), 7.60(1H, s), 7.91(1H, d, J=8.8Hz), 8.68(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
568
N-
페닐
-
N'
-(4-(6-
페닐아미노피리미딘
-4-
일옥시
)
페닐
)
우레아
N-(6-(4-아미노페녹시)피리미딘-4-일)페닐아민(55.6 mg, 0.200 mmol) 및 페닐이소시아네이트(26.1 mg, 0.220 mmol)를 디메틸포름아미드(1 ml) 중에, 실온에서 12시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(69.0 mg, 0.174 mmol, 87%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.06(1H, d, J=1.6Hz), 6.95-7.02(2H, m), 7.11-7.16(2H, m), 7.25-7.34(4H, m), 7.44-7.50(2H, m), 7.50-7.56(2H, m), 7.58-7.63(2H, m), 8.35(1H, d, J=1.6Hz), 8.71(1H, s), 8.79(1H, s), 9.54(1H, s).
중간체는 다음과 같이 합성했다.
제조예
568-1
N-(6-(4-
니트로페녹시
)피리미딘-4-일)
페닐아민
4-클로로-6-(4-니트로페녹시)피리미딘(508 mg, 2.00 mmol) 및 아닐린(559 mg, 6.00 mmol)을 1-메틸피롤리돈(5 ml)중, 90℃에서 3시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=1:3)에 가하여, 목적물을 포함하는 분획을 농축하여, 표제 화합물(508 mg, 1.65 mmol, 82%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 6.34(1H, s), 7.03(1H, br s), 7.21-7.35(5H, m), 7.40-7.46(2H, m), 8.26-8.32(2H, m), 8.35(1H, s).
제조예
568-2
N-(6-(4-
아미노페녹시
)피리미딘-4-일)
페닐아민
N-(6-(4-니트로페녹시)피리미딘-4-일)페닐아민(508 mg, 1.65 mmol), 철분(461 mg, 8.25 mmol) 및 염화암모늄(882 mg, 16.5 mmol)을 에탄올(16 ml)-물(4 ml)의 혼합 용매에 현탁시켜, 80℃에서 20분간 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸로 잘 세척하였다. 유기층을 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(387 mg, 1.39 mmol, 84%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.64(2H, br s), 6.17(1H, d, J=0.8Hz), 6.67-6.73(2H, m), 6.77(1H, br s), 6.89-6.95(2H, m), 7.14-7.20(1H, m), 7.26-7.32(2H, m), 7.35-7.41(2H, m), 8.37(1H, d, J=0.8Hz).
실시예
569
N-(3-
메틸설포닐페닐
)-
N'
-(4-(6-
페닐아미노피리미딘
-4-
일옥시
)
페닐
)
우레아
N-(6-(4-아미노페녹시)피리미딘-4-일)페닐아민(55.6 mg, 0.200 mmol) 및 (3-메틸설포닐페닐)카르바민산페닐에스테르(63.8 mg, 0.220 mmol)를 디메틸설폭시드(1 ml) 중에, 85℃에서 2시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(77.0 mg, 0.162 mmol, 81%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.20(3H, s), 6.07(1H, s), 6.98-7.03(1H, m), 7.12-7.17(2H, m), 7.28-7.34(2H, m), 7.50-7.63(6H, m), 7.66-7.72(1H, m), 8.17-8.20(1H, m), 8.34(1H, s), 8.93(1H, br s), 9.19(1H, br s), 9.54(1H, s).
실시예
570
N-(4-(6-(4-
메틸설파닐페닐아미노
)피리미딘-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
N-(6-(4-아미노페녹시)피리미딘-4-일)-4-메틸설파닐페닐아민(194 mg, 0.600 mmol) 및 페닐이소시아네이트(78.6 mg, 0.660 mmol)를 디메틸포름아미드(2 ml) 중에, 실온에서 18시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(250 mg, 0.564 mmol, 94%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.44(3H, s), 6.03(1H, d, J=1.6Hz), 6.95-7.00(1H, m), 7.10-7.15(2H, m), 7.22-7.32(4H, m), 7.44-7.50(2H, m), 7.50-7.60(4H, m), 8.34(1H, d, J=1.6Hz), 8.73(1H, br s), 8.81(1H, br s), 9.56(1H, s).
중간체는 다음과 같이 합성했다.
제조예
570-1
N-(6-(4-
니트로페녹시
)피리미딘-4-일)-4-
메틸설파닐페닐아민
4-클로로-6-(4-니트로페녹시)피리미딘(2.33 g, 9.25 mmol), 4-(메틸티오)아닐린(1.29 g, 9.25 mmol) 및 디이소프로필에틸아민(1.79 g, 13.9 mmol)을 1-메틸피롤리돈(10 ml) 중에, 80℃에서 18시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1 N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=1:3)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(620 mg, 1.75 mmol, 19%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.51(3H, s), 6.28(1H, d, J=1.0Hz), 6.99(1H, br s), 7.23-7.34(6H, m), 8.26-8.32(2H, m), 8.34(1H, d, J=1.0Hz).
제조예
570-2
N-(6-(4-
아미노페녹시
)피리미딘-4-일)-4-
메틸설파닐페닐아민
*N-(6-(4-니트로페녹시)피리미딘-4-일)-4-메틸설파닐페닐아민(620 mg, 1.75 mmol), 철분(489 mg, 8.75 mmol) 및 염화암모늄(936 mg, 17.5 mmol)을 에탄올(16 ml)-물(4 ml)의 혼합 용매에 현탁시켜, 80℃에서 1시간동안 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 초산에틸-테트라히드로푸란의 혼합 용매로 잘 세척하였다. 유기층을 물, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 건조제를 여과 분별하여, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(392 mg, 1.21 mmol, 69%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.49(3H, s), 3.65(2H, br s), 6.10(1H, d, J=1.0Hz), 6.66-6.72(2H, m), 6.76(1H, br s), 6.88-6.94(2H, m), 7.21-7.30(4H, m), 8.35(1H, d, J=1.0Hz).
실시예
571
N-(3- 메틸설포닐페닐 )- N' -(4-(6-(4- 메틸설파닐페닐아미노 )피리미딘-4- 일옥시)페닐)우레아
N-(6-(4-아미노페녹시)피리미딘-4-일)-4-메틸설파닐페닐아민(194 mg, 0.600 mmol) 및 (3-메틸설포닐페닐)카르바민산페닐에스테르(192 mg, 0.660 mmol)를 디메틸설폭시드(2 ml) 중에 85℃에서 18시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(297 mg, 0.569 mmol, 95%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.44(3H, s), 3.20(3H, s), 6.04(1H, d, J=0.8Hz), 7.12-7.17(2H, m), 7.22-7.27(2H, m), 7.50-7.63(6H, m), 7.67-7.71(1H, m), 8.17-8.20(1H, m), 8.34(1H, d, J=0.8Hz), 8.92(1H, s), 9.17(1H, s), 9.56(1H, s).
실시예
572
N-(4-(6-(4-
메틸설포닐페닐아미노
)피리미딘-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
N-(4-(6-(4-메틸설파닐페닐아미노)피리미딘-4-일옥시)페닐)-N'-페닐우레아(180 mg, 0.406 mmol) 및 3-클로로과벤조산(200 mg, 0.812 mmol)을 디클로로메탄(6 ml) 중에, 실온에서 12시간동안 교반했다. 포화티오황산나트륨 수용액을 가하여 반응을 정지한 후, 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(137 mg, 0.288 mmol, 71%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.16(3H, s), 6.18(1H, s), 6.97-7.02(1H, m), 7.13-7.19(2H, m), 7.27-7.33(2H, m), 7.46-7.51(2H, m), 7.53-7.59(2H, m), 7.81-7.87(2H, m), 7.89-7.94(2H, m), 8.47(1H, s), 8.72(1H, s), 8.81(1H, s), 10.06(1H, s).
실시예
573
N-(3- 메틸설포닐페닐 )- N' -(4-(6-(4- 메틸설포닐페닐아미노 )피리미딘-4- 일옥시)페닐)우레아
N-(3-메틸설포닐페닐)-N'-(4-(6-(4-메틸설파닐페닐아미노)피리미딘-4-일옥시)페닐)우레아(230 mg, 0.441 mmol)로부터, 실시예 572와 같은 식의 수법에 의해, 표제 화합물(157 mg, 0.284 mmol, 64%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.16(3H, s), 3.20(3H, s), 6.19(1H, d, J=1.0Hz), 7.04-7.10(2H, m), 7.50-7.60(4H, m), 7.66-7.70(1H, m), 7.82-7.88(2H, m), 7.88-7.94(2H, m), 8.17-8.20(1H, m), 8.47(1H, d, J=1.0Hz), 8.95(1H, s), 9.19(1H, s), 10.06(1H, s).
실시예
574
N-(4-(6-(4-
플루오로페닐아미노
)피리미딘-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
N-(4-(6-클로로피리미딘-4-일옥시)페닐)-N'-페닐우레아(68.0 mg, 0.200 mmol) 및 4-플루오로아닐린(111 mg, 1.00 mmol)을 1-메틸피롤리돈(1 ml) 중에, 130℃에서 3시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 포화탄산수소나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(33.0 mg, 0.079 mmol, 40%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.00(1H, d, J=0.8Hz), 6.95-7.00(1H, m), 7.10-7.19(4H, m), 7.26-7.32(2H, m), 7.44-7.50(2H, m), 7.50-7.56(2H, m), 7.57-7.63(2H, m), 8.33(1H, d, J=0.8Hz), 8.68(1H, s), 8.76(1H, s), 9.56(1H, s).
중간체는 다음과 같이 합성했다.
제조예
574-1
4-(6-
클로로피리미딘
-4-
일옥시
)
페닐아민
4-클로로-6-(4-니트로페녹시)피리미딘(2.52 g, 10.0 mmol), 철분(2.79 g, 50.0 mmol) 및 염화암모늄(5.35 g, 100 mmol)을 에탄올(100 ml)-물(25 ml)의 혼합 용매에 현탁시켜, 80℃에서 1시간동안 가열 교반했다. 반응 종료후, 반응 혼합물을 세라이트 여과하여, 에탄올-초산에틸의 혼합 용매로 잘 세척하였다. 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=2:3)에 가하여, 목적물을 포함하는 분획을 농축하여, 표제 화합물(1.74 g, 7.85 mmol, 79%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.71(2H, br s), 6.70-6.75(2H, m), 6.84(1H, s), 6.90-6.95(2H, m), 8.60(1H, s).
제조예
574-2
N-(4-(6-
클로로피리미딘
-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
4-(6-클로로피리미딘-4-일옥시)페닐아민(663 mg, 3.00 mmol) 및 페닐이소시아네이트(393 mg, 3.30 mmol)를 디메틸포름아미드(5 ml) 중에, 실온에서 18시간동안 교반했다. 반응액을 물에 쏟아 넣어, 석출된 결정을 여과 수취하고, 물, 에탄올로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(988 mg, 2.91 mmol, 97%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.94-7.00(1H, m), 7.14-7.20(2H, m), 7.25-7.32(2H, m), 7.33(1H, d, J=0.8Hz), 7.43-7.49(2H, m), 7.50-7.56(2H, m), 8.65(1H, d, J=0.8Hz), 8.70(1H, s), 8.78(1H, s).
실시예
575
N-(4-(6-(3-
플루오로페닐아미노
)피리미딘-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
N-(4-(6-클로로피리미딘-4-일옥시)페닐)-N'-페닐우레아(68.0 mg, 0.200 mmol) 및 3-플루오로아닐린(111 mg, 1.00 mmol)을 1-메틸피롤리돈(1 ml) 중에, 150℃에서 90분간 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 포화탄산수소나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(43.0 mg, 0.104 mmol, 52%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.09(1H, s), 6.77-6.83(1H, m), 6.95-7.00(1H, m), 7.11-7.17(2H, m), 7.26-7.36(4H, m), 7.45-7.50(2H, m), 7.50-7.55(2H, m), 7.71-7.77(1H, m), 8.42(1H, s), 8.69(1H, s), 8.77(1H, s), 9.76(1H, s).
실시예
576
N-(4-(6-(2-
플루오로페닐아미노
)피리미딘-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
N-(4-(6-클로로피리미딘-4-일옥시)페닐)-N'-페닐우레아(68.0 mg, 0.200 mmol) 및 2-플루오로아닐린(111 mg, 1.00 mmol)을 1-메틸피롤리돈(1 ml) 중에 170℃에서 3시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 포화탄산수소나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:2)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(26.0 mg, 0.062 mmol, 31%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.17(1H, d, J=0.8Hz), 6.95-7.00(1H, m), 7.10-7.19(4H, m), 7.22-7.32(3H, m), 7.45-7.50(2H, m), 7.50-7.55(2H, m), 7.86-7.93(1H, m), 8.29(1H, d, J=0.8Hz), 8.69(1H, s), 8.76(1H, s), 9.32(1H, s).
실시예
577
N-(4-(6-(3,5-
디플루오로페닐아미노
)피리미딘-4-
일옥시
)
페닐
)-
N'
-
페닐우레아
N-(4-(6-클로로피리미딘-4-일옥시)페닐)-N'-페닐우레아(68.0 mg, 0.200 mmol) 및 3,5-디플루오로아닐린(129 mg, 1.00 mmol)을 1-메틸피롤리돈(1 ml) 중, 170℃에서 3시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 포화탄산수소나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=1:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(17.5 mg, 0.040 mmol, 20%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 6.09(1H, s), 6.77-6.85(1H, m), 6.95-7.00(1H, m), 7.13-7.19(2H, m), 7.27-7.33(2H, m), 7.38-7.50(4H, m), 7.50-7.58(2H, m), 8.46(1H, s), 8.69(1H, s), 8.78(1H, s), 9.94(1H, s).
실시예
578
N- 페닐 - N' -(4-(6-(3,4,5- 트리메톡시페닐아미노 )피리미딘-4- 일옥시 ) 페닐 ) 우레아염산염
N-(4-(6-클로로피리미딘-4-일옥시)페닐)-N'-페닐우레아(68.0 mg, 0.200 mmol) 및 3,4,5-트리메톡시아닐린(183 mg, 1.00 mmol)을 1-메틸피롤리돈(1 ml) 중에 150℃에서 2시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 포화탄산수소나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 1N-염산을 이용하여 염산염으로 한 후, 메탄올에 현탁시켜, 이것을 초산에틸로 희석하여 결정을 여과 수취하고, 초산에틸로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(50.0 mg, 0.095 mmol, 48%)을 담녹색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.61(3H, s), 3.74(6H, s), 6.03(1H, s), 6.90(2H, s), 6.95-7.00(1H, m), 7.10-7.16(2H, m), 7.27-7.33(2H, m), 7.45-7.50(2H, m), 7.50-7.55(2H, m), 8.36(1H, s), 8.91(1H, s), 9.02(1H, s), 9.55(1H, s).
실시예
579
1-(4-(6-(N-
메틸
-N-
페닐아미노
)피리미딘-4-
일옥시
)
페닐
)-3-
페닐우레아
N-(4-(6-클로로피리미딘-4-일옥시)페닐)-N'-페닐우레아(68.0 mg, 0.200 mmol) 및 N-메틸아닐린(107 mg, 1.00 mmol)을 1-메틸피롤리돈(1 ml) 중에, 130℃에서 36시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=1:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(38 mg, 0.092 mmol, 46%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.42(3H, s), 5.75(1H, s), 6.95-7.03(3H, m), 7.25-7.38(5H, m), 7.41-7.50(6H, m), 8.27(1H, s), 8.64(1H, s), 8.68(1H, s).
실시예
580
N-(5- 클로로 -2- 티아졸릴 )- N' -(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시-2-플루오로페닐)우레아
실시예 145와 같은 식의 수법에 의해, 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(71.0 mg, 0.200 mmol)과 2-아미노-5-클로로티아졸 및 페닐클로로포르메이트로부터 조제되는 페닐 5-클로로-2-티아졸릴카르바메이트로부터 표제 화합물(66.0 mg, 0.128 mmol, 64%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.38(3H, s), 3.80(2H, m), 4.43(2H, m), 6.65(1H, d, J=5.2Hz), 7.20(1H, m), 7.44(1H, s), 7.47(1H, m), 7.66(1H, s), 8.20(1H, m), 8.76(1H, d, J=5.2Hz), 8.77(1H, s), 9.02(1H, s), 11.01(1H, s).
실시예
581
N-(4-(6- 시아노 -7-(2- 메톡시에톡시 )-4- 퀴놀릴 ) 옥시 -2- 플루오로페닐 )- N' -(4-시클로프로필-2-티아졸릴)우레아
실시예 145와 같은 식의 수법에 의해, 4-(4-아미노-3-플루오로페녹시)-6-시아노-7-(2-메톡시에톡시)퀴놀린(71.0 mg, 0.200 mmol)과 2-아미노-4-시클로프로필티아졸 및 페닐클로로포르메이트로부터, 조제되는 페닐 4-시클로프로필-2-티아졸릴카르바메이트로부터 표제 화합물(88.0 mg, 0.169 mmol, 85%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.75(2H, m), 0.84(2H, m), 1.95(1H, m), 3.38(3H, s), 3.80(2H, m), 4.44(2H, m), 6.64(1H, d, J=5.2Hz), 6.72(1H, s), 7.19(1H, m), 7.46(1H, m), 7.66(1H, s), 8.25(1H, m), 8.76(1H, d, J=5.2Hz), 8.77(1H, s), 10.84(1H, br s).
실시예
582
4-(3- 클로로 -4-( 메틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(150 mg, 0.324 mmol)와 40% 메틸아민(메탄올 용액)으로부터 표제 화합물(65.0 mg, 0.162 mmol, 50%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.68(3H, d, J=4.4Hz), 4.03(3H, s), 6.53(1H, d, J=5.0Hz), 6.88(1H, q, J=4.4Hz), 7.23(1H, dd, J=2.8, 8.2Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.74(1H, s), 7.86(1H, s), 8.12(1H, s), 8.25(1H, d, J=8.2Hz), 8.67(1H, s), 8.68(1H, d, J=5.0Hz).
실시예
583
4-(3- 클로로 -4-( 에틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(150 mg, 0.324 mmol)와 2M 에틸아민(테트라히드로푸란 용액)으로부터 표제 화합물(92.0 mg, 0.221 mmol, 68%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.2Hz), 3.14(2H, m), 4.03(3H, s), 6.53(1H, d, J=5.2Hz), 6.99(1H, t, J=5.6Hz), 7.23(1H, dd, J=2.8, 8.8Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.73(1H, s), 7.85(1H, s), 8.07(1H, s), 8.27(1H, d, J=8.8Hz), 8.66(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
584
4-(3- 클로로 -4-(1- 프로필아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(150 mg, 0.324 mmol)와 프로필아민으로부터 표제 화합물(111 mg, 0.258 mmol, 80%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.91(3H, t, J=7.4Hz), 1.47(2H, m), 3.08(2H, m), 4.03(3H, s), 6.53(1H, d, J=5.2Hz), 7.03(1H, t, J=5.6Hz), 7.23(1H, dd, J=2.8, 8.8Hz), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.74(1H, s), 7.85(1H, s), 8.09(1H, s), 8.28(1H, d, J=8.8Hz), 8.66(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
585
4-(3- 클로로 -4-( 시아노메틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(150 mg, 0.324 mmol)와 2-아미노아세토니트릴 히드로클로라이드로부터 표제 화합물(107 mg, 0.251 mmol, 77%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.03(3H, s), 4.22(2H, t, J=6.0Hz), 6.56(1H, d, J=5.2Hz), 7.28(1H, dd, J=2.8, 8.8Hz), 7.50(1H, t, J=6.0Hz), 7.53(1H, s), 7.54(1H, d, J=2.8Hz), 7.74(1H, s), 7.86(1H, s), 8.17(1H, d, J=8.8Hz), 8.51(1H, s), 8.66(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
586
4-(3- 클로로 -4-(2- 시아노에틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(150 mg, 0.324 mmol)와 3-아미노프로피오니트릴로부터 표제 화합물(109 mg, 0.248 mmol, 76%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.72(2H, t, J=6.4Hz), 3.41(2H, m), 4.03(3H, s), 6.54(1H, d, J=5.2Hz), 7.25(1H, dd, J=2.8, 8.8Hz), 7.37(1H, t, J=6.0Hz), 7.50(1H, d, J=2.8Hz), 7.52(1H, s), 7.74(1H, s), 7.86(1H, s), 8.24(1H, d, J=8.8Hz), 8.31(1H, s), 8.66(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
589
4-(3- 클로로 -4-( cis -2- 플루오로 - 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-메톡시-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(150 mg, 0.324 mmol)와 cis-2-플루오로시클로프로필아민 토실레이트로부터 표제 화합물(39.0 mg, 0.088 mmol, 27%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.82(1H, m), 1.11(1H, m), 2.68(1H, m), 4.04(3H, s), 4.78(1H, m), 6.54(1H, d, J=5.2Hz), 7.25(1H, dd, J=2.8, 8.8Hz), 7.32(1H, d, J=3.6Hz), 7.50(1H, d, J=2.8Hz), 7.52(1H, s), 7.74(1H, s), 7.86(1H, s), 8.25(1H, s), 8.29(1H, d, J=8.8Hz), 8.66(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
590
4-(3- 클로로 -4-( 아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(100 mg, 0.22 mmol)와 암모니아수(2 ml)로부터 표제 화합물(61.0 mg, 79%)을 담적색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.01(3H, s), 6.41(2H, s), 6.51(1H, d, J=5.2Hz), 7.21(1H, d, J=9.2Hz), 7.47(1H, d, J=2.8Hz), 7.50(1H, s), 7.73(1H, s), 7.84(1H, s), 8.15(1H, s), 8.25(1H, d, J=8.8Hz), 8.65(1H, d, J=5.2Hz), 8.66(1H, s).
실시예
591
N-(4-(6,7-
디메톡시퀴놀린
-4-
일옥시
)
페닐
)-
N'
-티아졸-2-
일우레아
4-(6,7-디메톡시퀴놀린-4-일옥시)페닐카르바민산페닐에스테르(208 mg, 0.500 mmol) 및 2-아미노티아졸(100 mg, 1.00 mmol)을 디메틸설폭시드(1 ml) 중, 85℃에서 1시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=20:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(150 mg, 0.355 mmol, 71%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.02-4.05(6H, m), 6.46(1H, d, J=5.2Hz), 6.92(1H, d, J=3.6Hz), 7.16-7.22(2H, m), 7.40-7.44(2H, m), 7.56(1H, s), 7.61-7.67(2H, m), 8.48(1H, d, J=5.2Hz).
중간체는 다음과 같이 합성했다.
제조예
591-1
4-(6,7-
디메톡시퀴놀린
-4-
일옥시
)
페닐카르바민산페닐에스테르
WO 97/17329의 방법에 의해 얻어지는 4-(6,7-디메톡시퀴놀린-4-일옥시)페닐아민(2.96 g, 10.0 mmol) 및 트리에틸아민(1.21 g, 12.0 mmol )을 디메틸포름아미드(30 ml)중에 용해시키고, 빙냉하에 페닐클로로포르메이트(1.72 g, 11.0 mmol)를 가한 후, 실온에서 1시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=3:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(2.50 g, 6.00 mmol, 60%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3)δ(ppm) : 4.05(3H, s), 4.06(3H, s), 6.46(1H, d, J=5.2Hz), 7.12(1H, br s), 7.16-7.28(5H, m), 7.38-7.44(3H, m), 7.53-7.60(3H, m), 8.49(1H, d, J=5.2Hz).
실시예
592
N-
시클로프로필
-
N'
-(4-(6,7-
디메톡시퀴놀린
-4-
일옥시
)
페닐
)
우레아
4-(6,7-디메톡시퀴놀린-4-일옥시)페닐카르바민산페닐에스테르(104 mg, 0.250 mmol) 및 시클로프로필아민(28.5 mg, 0.500 mmol)을 디메틸설폭시드(1 ml) 중, 실온에서 2시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=15:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(76 mg, 0.200 mmol, 80%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 0.70-0.75(2H, m), 0.87-0.92(2H, m), 2.60-2.66(1H, m), 4.04-4.07(6H, m), 4.93(1H, s), 6.45(1H, d, J=5.2Hz), 6.99(1H, s), 7.12-7.18(2H, m), 7.42(1H, s), 7.50-7.56(2H, m), 7.57(1H, s), 8.48(1H, d, J=5.2Hz).
실시예
593
N-(4-(6,7-
디메톡시퀴놀린
-4-
일옥시
)-2-
플루오로페닐
)-
N'
-티아졸-2-
일우레아
4-(6,7-디메톡시퀴놀린-4-일옥시)-2-플루오로페닐카르바민산페닐에스테르(109 mg, 0.250 mmol) 및 2-아미노티아졸(50.0 mg, 0.500 mmol)을 디메틸설폭시드(1 ml) 중, 85℃에서 2시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=30:1)에 가하여, 목적물을 포함하는 분획을 농축하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(95.0 mg, 0.216 mmol, 86%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.05(3H, s), 4.06(3H, s), 6.52(1H, d, J=5.2Hz), 6.92(1H, d, J=3.6Hz), 6.96-7.04(2H, m), 7.36(1H, d, J=3.6Hz), 7.40(1H, s), 7.53(1H, s), 8.30-8.36(1H, m), 8.47(1H, d, J=5.2Hz).
중간체는 다음과 같이 합성했다.
제조예
593-1
4-(6,7-
디메톡시퀴놀린
-4-
일옥시
)-2-
플루오로페닐카르바민산페닐에스테르
일본 특허 공개 평11-158149의 방법에 의해 얻어지는 4-(6,7-디메톡시퀴놀린-4-일옥시)-2-플루오로페닐아민(3.55 g, 9.17 mmol) 및 피리딘(3.63 g, 45.8 mmol )을 디메틸포름아미드(30 ml) 중에 용해시키고, 빙냉하에 페닐클로로포르메이트(1.51 g, 9.64 mmol)를 가한 후, 실온에서 1시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:헥산=2:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(2.30 g, 5.29 mmol, 58%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 4.05(3H, s), 4.06(3H, s), 6.52(1H, d, J=5.2Hz), 7.00-7.05(2H, m), 7.18-7.30(4H, m), 7.40-7.46(3H, m), 7.50(1H, s), 8.21(1H, br s), 8.53(1H, d, J=5.2Hz).
실시예
594
N- 시클로프로필 - N' -(4-(6,7- 디메톡시퀴놀린 -4- 일옥시 )-2- 플루오로페닐 ) 우레아
4-(6,7-디메톡시퀴놀린-4-일옥시)-2-플루오로페닐카르바민산페닐에스테르(109 mg, 0.250 mmol) 및 시클로프로필아민(28.5 mg, 0.500 mmol)을 디메틸설폭시드(1 ml) 중, 실온에서 2시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=50:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(73 mg, 0.183 mmol, 73%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 0.71-0.76(2H, m), 0.90-0.95(2H, m), 2.60-2.66(1H, m), 4.05(3H, s), 4.06(3H, s), 5.00(1H, s), 6.50(1H, d, J=5.2Hz), 6.95-7.02(2H, m), 7.23(1H, s), 7.43(1H, s), 7.52(1H, s), 8.25-8.32(1H, m), 8.51(1H, d, J=5.2Hz).
실시예
595
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7-(2- 에톡시에톡시)-6-퀴놀린카르복사미드
실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(206 mg, 0.499 mmol)와 2-에톡시에틸브로마이드로부터 표제 화합물(96.0 mg, 0.198 mmol, 39.7%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.16(3H, t, J=7.2Hz), 2.56(1H, m), 3.53(2H, q, J=7.2Hz), 3.83(2H, m), 4.40(2H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.49(1H, d, J=2.8Hz), 7.56(1H, s), 7.85(1H, s), 7.87(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.66(1H, d, J=5.2Hz), 8.78(1H, s).
실시예
596
4-(3- 클로로 -4-( 시클로프로필아미노카르보닐 ) 아미노페녹시 )-7- 시클로프로필메톡시-6-퀴놀린카르복사미드
*실시예 7과 같은 식의 수법에 의해, 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-히드록시-6-퀴놀린카르복사미드(206 mg, 0.499 mmol)와 브로모메틸시클로프로판으로부터 표제 화합물(61.4 mg, 0.132 mmol, 26.4%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41-0.47(4H, m), 0.60-0.69(4H, m), 1.39(1H, m), 2.56(1H, m), 4.14(2H, d, J=6.8Hz), 6.52(1H, d, J=5.2Hz), 7.20(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 8.8Hz), 7.49-7.50(2H, m), 7.83(1H, s), 7.85(1H, s), 7.98(1H, s), 8.28(1H, d, J=8.8Hz), 8.66(1H, d, J=5.2Hz), 8.72(1H, s).
실시예
597
4-(3- 플루오로 -4-( 메틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(73 mg)와 메틸아민(2M 테트라히드로푸란 용액)으로부터 표제 화합물(37 mg)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.65(3H, d, J=4.4Hz), 4.01(3H, s), 6.45-6.46(1H, m), 6.51-6.52(1H, m), 7.04-7.06(1H, m), 7.28-7.31(1H, m), 7.50(1H, s), 7.72(1H, s), 7.84(1H, s), 8.17-8.22(1H, m), 8.40(1H, s), 8.64-8.65(2H, m).
실시예
598
4-(3- 플루오로 -4-( 에틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-플루오로페닐)카르바메이트(69 mg)와 에틸아민(2M 테트라히드로푸란 용액)으로부터 표제 화합물(38 mg)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.05(3H, t, J=7Hz), 3.11(2H, q, J=7Hz), 4.01(3H, s), 6.50-6.52(1H, m), 6.57-6.58(1H, m), 7.04-7.06(1H, m), 7.28-7.32(1H, m), 7.50(1H, s), 7.73(1H, s), 7.84(1H, s), 8.19-8.24(1H, m), 8.33(1H, s), 8.64-8.65(2H, m).
실시예
599
tert -부틸 4-((((4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-7-메톡시-6-퀴놀릴)카르보닐)아미노)메틸)-1-피페리딘카르복실레이트
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산)(171 mg, 0.40 mmol)을 디메틸포름아미드(4 ml)에 질소 분위기하에서 용해시키고, tert-부틸 4-아미노메틸-1-피페리딘카르복실레이트(171 mg, 0.80 mmol), 트리에틸아민(0.2 ml), 1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트(265 mg, 0.60 mmol)를 순차적으로 실온에서 가한 후, 밤새 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(249 mg, 정량적)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.05(2H, m), 1.22(1H, m), 1.37(9H, s), 1.66(2H, m), 2.56(1H, m), 2.67(2H, m), 3.20(2H, m), 3.93(2H, m), 3.99(3H, s), 6.51(1H, d, J=5.2Hz), 7.17-7.24(2H, m), 7.46(1H, d, J=2.8Hz), 7.49(1H, s), 7.97(1H, s), 8.26(1H, dd, J=2.8, 8.8Hz), 8.39(1H, m), 8.46(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
600
N6 -(1- 메틸 -4- 피페리딜메틸 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
tert-부틸 4-((((4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀릴)카르보닐)아미노)메틸)-1-피페리딘카르복실레이트(249 mg, 0.40 mmol)에 트리플루오로초산(1 ml)을 실온에서 가하여, 2시간동안 교반했다. 반응액을 포화탄산수소나트륨 수용액에 부어 중화시키고, 초산에틸로 3회 추출하여, 유기층을 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 잔사를 테트라히드로푸란(5 ml)-메탄올(5 ml)에 용해시키고, 37% 포름알데히드 수용액(0.5 ml), 초산(0.05 ml), 시아노수소화붕소나트륨(50 mg, 0.8 mmol)을 실온에서 순차적으로 가하여 1시간동안 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하고, 유기층을 포화탄산수소나트륨 수용액, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸로부터 결정화시켜, 여과 수취하고, 통풍 건조시켜 표제 화합물(125.6 mg, 0.233 mmol, 58.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.18(2H, m), 1.49(1H, m), 1.64(2H, m), 1.78(2H, m), 2.11(3H, s), 2.56(1H, m), 2.73(2H, m), 3.18(2H, m), 3.99(3H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.4Hz), 7.22(1H, dd, J=2.8, 8.8Hz), 7.46(1H, d, J=2.4Hz), 7.49(1H, s), 7.97(1H, s), 8.26(1H, dd, J=2.8, 8.8Hz), 8.35(1H, m), 8.47(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
601
tert -부틸 4-(((4-(3- 클로로 -4-(( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-6-(메틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
실시예 7과 같은 식의 수법에 의해, N6-메틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(225.5 mg, 0.528 mmol)와 tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트로부터 표제 화합물(188.4 mg, 0.302 mmol, 57.1%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.13-1.26(3H, m), 1.39(9H, s), 1.75(2H, m), 2.06(1H, m), 2.56(1H, m), 2.75(1H, m), 2.81(3H, d, J=4.8Hz), 3.99(2H, m), 4.10(2H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.21(1H, dd, J=2.8, 9.2Hz), 7.45(1H, d, J=2.8Hz), 7.48(1H, s), 7.96(1H, s), 8.18(1H, d, J=4.8Hz), 8.25(1H, d, J=9.2Hz), 8.43(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
602
tert -부틸 4-(((4-(3- 클로로 -4-(( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-6-(에틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
실시예 7과 같은 식의 수법에 의해, N6-에틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드)(170.5 mg, 0.387 mmol)와 tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트로부터 표제 화합물(155.4 mg, 0.244 mmol, 63.0%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.10-1.16(4H, m), 1.27(2H, m), 1.39(9H, s), 1.76(2H, m), 2.05(1H, m), 2.56(1H, m), 2.75(1H, m), 3.20-3.40(2H, m), 4.01(2H, m), 4.11(2H, m), 6.51(1H, d, J=5.2Hz), 7.17-7.23(2H, m), 7.45(1H, d, J=2.8Hz), 7.48(1H, s), 7.96(1H, s), 8.20-8.27(2H, m), 8.44(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
603
N6 - 메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((1-메틸-4-피페리딜)메톡시)-6-퀴놀린카르복사미드
tert-부틸 4-(((4-(3-클로로-4-((시클로프로필아미노)카르보닐)아미노)페녹시)-6-(메틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트(179.0 mg, 0.287 mmol)에 트리플루오로초산(1 ml)을 실온에서 가하여, 2시간동안 교반했다. 반응액을 포화탄산수소나트륨 수용액에 부어 중화시키고, 초산에틸-테트라히드로푸란(1:1)으로 5회 추출하여, 유기층을 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 잔사를 테트라히드로푸란(5 ml)-메탄올(5 ml)에 용해시키고, 37% 포름알데히드 수용액(0.3 ml), 초산(0.05 ml), 시아노수소화붕소나트륨(36 mg, 0.57 mmol)을 실온에서 순차적으로 가하여 1시간동안 교반했다. 반응액을 초산에틸과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 포화탄산수소나트륨 수용액, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸로부터 결정화시켜, 여과 수취하고, 통풍 건조시켜 표제 화합물(101.0 mg, 0.188 mmol, 65.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.65(2H, m), 1.34(2H, m), 1.72-1.89(5H, m), 2.14(3H, s), 2.56(1H, m), 2.78(2H, m), 2.82(3H, d, J=4.4Hz), 4.08(2H, d, J=6.4Hz), 6.51(1H, d, J=5.2Hz), 7.19-7.23(2H, m), 7.45(1H, d, J=2.8Hz), 7.48(1H, s), 7.97(1H, s), 8.20(1H, d, J=4.4Hz), 8.25(1H, d, J=9.2Hz), 8.45(1H, s), 8.63(1H, d, J=5.2Hz).
실시예
604
N6 -에틸-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((1-메틸-4-피페리딜)메톡시)-6-퀴놀린카르복사미드
tert-부틸 4-(((4-(3-클로로-4-((시클로프로필아미노)카르보닐)아미노)페녹시)-6-(에틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트(147.2 mg, 0.231 mmol)로부터 실시예 603과 같은 식의 수법에 의해, 표제 화합물(82.6 mg, 0.150 mmol, 64.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.14(3H, t, J=7.2Hz), 1.36(2H, m), 1.75-1.89(5H, m), 2.15(3H, s), 2.56(1H, m), 2.79(2H, m), 3.20-3.40(2H, m), 4.08(2H, d, J=6.4Hz), 6.51(1H, d, J=5.2Hz), 7.20-7.23(2H, m), 7.46(1H, d, J=2.8Hz), 7.48(1H, s), 7.98(1H, s), 8.22-8.27(2H, m), 8.47(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
605
1-[4-(7-
벤질옥시
-6-
시아노퀴놀린
-4-
일옥시
)-2-
클로로
-
페닐
]-3-에틸-
우레아
제조예 17과 같은 식의 조작에 의해 4-(4-아미노-3-클로로페녹시)-7-벤질옥시-퀴놀린-6-카르보니트릴(1.78 g)과 클로르탄산페닐로부터 카르바메이트(1.51 g)를 고체로서 얻었다. 다음에, 실시예 11과 같은 식으로 카르바메이트(1.5 g)를 디메틸설폭시드 중에, 실온에서 에틸아민으로 처리하여 표제 화합물(1.4 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.6Hz), 3.08-3.16(2H, m), 5.45(2H, s), 6.58(1H, d, J=5.2Hz), 6.99(1H, t, J=5.2Hz), 7.23(1H, dd, J=2.8Hz, J=9.2Hz), 7.36(1H, t, J=7.2Hz), 7.44(2H, t, J=7.2Hz), 7.48(1H, d, J=2.8Hz), 7.54(2H, d, J=7.2Hz), 7.70(1H, s), 8.06(1H, s), 8.26(1H, d, J=8.8Hz), 8.72(1H, d, J=5.2Hz), 8.76(1H, s).
실시예
606
1-(2- 클로로 -4-(6- 시아노 -(2R)-7- 옥시라닐메톡시퀴놀린 -4- 일옥시 )- 페닐 )-3-에틸우레아
제조예 21과 같은 식으로 1-(4-(7-벤질옥시-6-시아노퀴놀린-4-일옥시)-2-클로로-페닐)-3-에틸우레아(1 g)를 트리플루오로초산과 티오아니솔로 처리하여 탈보호하고, 생성된 히드록시체(0.48 g)를 실시예 543과 같은 식으로 처리하여 표제 화합물(0.31 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 2.81(1H, dd, J=2.8Hz, J=5.2Hz), 2.91(1H, t, J=4.8Hz), 3.80-3.16(2H, m), 3.44-3.48(1H, m), 4.17(1H, dd, J=6.4Hz, J=11.6Hz), 4.71(1H, dd, J=2Hz, J=11.6Hz), 6.59(1H, d, J=5.2Hz), 6.99(1H, t, J=5.2Hz), 7.24(1H, dd, J=2.8Hz, J=9.2Hz), 7.49(1H, d, J=2.8Hz), 7.64(1H, s), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.73(1H, d, J=5.2Hz), 8.76(1H, s).
실시예
607
1-(2- 클로로 -4-(6- 시아노 -7-((2R)-2-히드록시-3- 피롤리딘 -1- 일프로폭시 )퀴놀린-4-일옥시)페닐)-3-에틸우레아
실시예 544와 같은 식으로 1-(2-클로로-4-(6-시아노-(2R)-7-옥시라닐메톡시퀴놀린-4-일옥시)-페닐)-3-에틸우레아(110 mg)와 피롤리딘으로부터 표제 화합물(38 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.07(3H, t, J=7.2Hz), 1.62-1.72(4H, m), 2.44-2.56(5H, m), 2.67-2.73(1H, m), 3.08-3.16(2H, m), 3.97-4.04(1H, m), 4.17-4.23(1H, m), 4.25-4.32(1H, m), 5.02(1H, d, J=4.4Hz), 6.57(1H, d, J=5.2Hz), 6.97-7.03(1H, m), 7.23(1H, dd, J=2.4Hz, J=9.2Hz), 7.49(1H, d, J=2.4Hz), 7.61(1H, s), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.72(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
608
1-(2- 클로로 -4-(6- 시아노 -7-((2R)-3- 디에틸아미노 -2- 히드록시프로폭시 )퀴놀린-4-일옥시)페닐)-3-에틸우레아
실시예 544와 같은 식으로 1-(2-클로로-4-(6-시아노-(2R)-7-옥시라닐메톡시퀴놀린-4-일옥시)페닐)-3-에틸우레아(100 mg)와 디에틸아민으로부터 표제 화합물(12 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.96(6H, t, J=7.2Hz), 1.06(3H, t, J=7.2Hz), 2.42-2.57(5H, m), 2.64(1H, dd, J=7.6Hz, J=13.2Hz), 3.08-3.16(2H, m), 3.91-4.00(1H, m), 4.21(1H, dd, J=5.2Hz, J=10Hz), 4.30(1H, dd, J=3.6Hz, J=10Hz), 4.88-4.93(1H, m), 6.57(1H, d, J=5.2Hz), 6.99(1H, t, J=4.8Hz), 7.23(1H, dd, J=2.8Hz, J=9.2Hz), 7.49(1H, d, J=2.8Hz), 7.61(1H, s), 8.06(1H, s), 8.26(1H, d, J=9.2Hz), 8.72(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
609
1-(2- 클로로 -4-(6- 시아노 -7-((2R)-2-히드록시-3-피페리딘-1- 일프로폭시 )퀴놀린-4-일옥시)페닐)-3-에틸우레아
실시예 544와 같은 식으로 1-(2-클로로-4-(6-시아노-(2R)-7-옥시라닐메톡시퀴놀린-4-일옥시)페닐)-3-에틸우레아(100 mg)와 피페리딘으로부터 표제 화합물(46 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 1.32-1.39(2H, m), 1.44-1.53(4H, m), 2.34-2.51(6H, m), 3.08-3.16(2H, m), 3.99-4.07(1H, m), 4.19(1H, dd, J=5.6Hz, J=10.4Hz), 4.30(1H, dd, J=3.2Hz, J=10.4Hz), 4.93(1H, d, J=4.4Hz), 6.57(1H, d, J=5.2Hz), 6.99(1H, t, J=5.2Hz), 7.23(1H, dd, J=2.8Hz, J=9.2Hz), 7.48(1H, d, J=2.8Hz), 7.62(1H, s), 8.06(1H, s), 8.27(1H, d, J=9.2Hz), 8.72(1H, d, J=5.2Hz), 8.72(1H, s).
실시예
610
1-(2- 클로로 -4-(6-(4-(피페리딘-4- 일메톡시 ) 페닐 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아
4-(4-(4-(3-클로로-4-(3-시클로프로필우레이도)페녹시)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-6-일)페녹시메틸)피페리딘-1-카르복실산 tert-부틸에스테르 37 mg을 트리플루오로초산 1 ml에 녹여, 실온에서 2시간동안 교반했다. 반응계를 감압 농축한 후, 포화중조수를 가하여, 알카리성으로 하여, 초산에틸로 분액 추출했다. 유기층을 황산나트륨으로 건조하고, 농축 건조시켜 표제 화합물25 mg을 얻었다.
MS Spectrum(ESI) : 533(M+1),
실시예
611
1-(2- 클로로 -4-{6-(4-(1- 메틸피페리딘 -4- 일메톡시 ) 페닐 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아
1-(2-클로로-4-{6-[4-(피페리딘-4-일메톡시)페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시}-2-페닐)-3-시클로프로필우레아 24 mg에 메탄올 2 ml, 염화메틸렌 2 ml, 37% 포름알데히드 수용액 0.05 ml, 초산 4.4 ㎕를 가하여 교반하에 트리아세톡시보로하이드리드 30 mg을 가하여, 실온에서 40분간 교반했다. 물을 가하여, 초산에틸-테트라히드로푸란 5:1 혼합 용매로 추출한 후, 농축하고, NH 실리카겔 컬럼 크로마토그래피에 가하여, 12 mg의 표제 화합물을 얻었다.
MS Spectrum(ESI) : 547(M+1),
실시예
612
4-{4-[4-[3- 클로로 -4-(3- 시클로프로필우레이도 ) 페녹시 ]-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-6-일]페녹시메틸}피페리딘-1-카르복실산 tert-부틸에스테르
1-{2-클로로-4-[6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-페닐}-3-시클로프로필우레아 60 mg에 4-브로모메틸피페리딘-1-카르복실산 tert-부틸에스테르 38 mg과 탄산칼륨 59 mg, 디메틸포름아미드 1 ml를 가하여, 70-75℃에서 6시간동안 교반했다. 그 후 실온으로 되돌려 물을 가하고, 초산에틸로 분액 추출했다. 유기층을 황산나트륨으로 건조하고, 농축 건조시켜 표제 화합물 63 mg을 얻었다.
MS Spectrum(ESI) : 786(M+23),
실시예
613
4-(2,3-디메틸-4-( 메틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2,3-디메틸페닐)카르바메이트)(56 mg)와 메틸아민(2M 테트라히드로푸란 용액)으로부터 표제 화합물(30 mg)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.01(3H, s), 2.14(3H, s), 2.64(3H, d, J=3.2Hz), 4.01(3H, s), 6.24(1H, d, J=5.2Hz), 6.28(1H, d, J=4.4Hz), 6.97(1H, d, J=8.8Hz), 7.49(1H, s), 7.60(1H, d, J=8.4Hz), 7.73-7.85(3H, m), 8.59(1H, d, J=4.8Hz), 8.71(1H, s).
실시예
614
4-(2,3-디메틸-4-( 에틸아미노카르보닐 ) 아미노페녹시 )-7- 메톡시 -6- 퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2,3-디메틸페닐)카르바메이트(55 mg)와 에틸아민(2M 테트라히드로푸란 용액)으로부터 표제 화합물(33 mg)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.54(3H, t, J=7Hz), 2.01(3H, s), 2.14(3H, s), 3.07-3.12(2H, m), 4.01(3H, s), 6.24(1H, d, J=4.8Hz), 6.41(1H, m), 6.97(1H, d, J=8.4Hz), 7.49(1H, s), 7.64(1H, d, J=8.8Hz), 7.73(2H, brs), 7.85(1H, s), 8.59(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
615
4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(372.0 mg, 0.90 mmol)에 대해, (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트(308 mg, 1.35 mmol), 탄산칼륨(149 mg, 1.08 mmol), 디메틸포름아미드(9 ml)를 가하여, 60℃에서 7시간동안 교반했다. 반응액을 실온으로 방냉한 후, 피롤리딘(1 ml)을 첨가하고, 또 밤새 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=95:5)에 가하여, 목적물을 포함하는 분획을 농축한 후, 초산에틸로부터 결정을 석출시켜 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(133.3 mg, 0.247 mmol, 27.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.67(4H, m), 2.45-2.59(6H, m), 2.69(1H, m), 4.05(1H, m), 4.19(1H, dd, J=6.0, 10.0Hz), 4.32(1H, dd, J=3.6, 10.0Hz), 5.19(1H, d, J=4.8Hz), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 8.8Hz), 7.49(1H, d, J=2.8Hz), 7.53(1H, s), 7.82(1H, s), 7.97(1H, s), 7.99(1H, s), 8.26(1H, d, J=8.8Hz), 8.66(1H, d, J=5.2Hz), 8.80(1H, s).
실시예
616
N-{[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 ]-2- 메틸페닐 ]}- N' -(4- 플루오로페닐)-N-메틸우레아
6-카르바모일-4-클로로-7-메톡시퀴놀린(100 mg, 0.2982 mmol), N-(4-플루오로페닐)-N'-(4-히드록시-2-메틸페닐)-N'-메틸우레아(100 mg, 0.2917 mmol), 디이소프로필에틸아민(0.1 ml, 0.4375 mmol)을 N-메틸피롤리돈(0.1 ml)에 용해하여, 150℃에서 3시간동안 가열 교반했다. 실온까지 냉각한 후, 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 실리카겔 컬럼 크로마토그래피(헥산·초산에틸·에탄올), 이어서 NH 실리카겔 컬럼 크로마토그래피(헥산·초산에틸·에탄올)로 정제하여, 생성된 비결정질 물질에 디에틸에테르를 가하여 현탁시키고, 이것을 헥산으로 희석하여, 침전을 여과 수취하고, 디에틸에테르:헥산=1:1로 세척하여, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(11 mg, 0.023 mmol, 7.95%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :2.21(3H, s), 3.16(3H, s), 4.02(3H, s), 6.71(1H, d, J=5.2Hz), 7.05(2H, t, J=8.8Hz), 7.18(1H, dd, J=2.8Hz, 8.4Hz), 7.28(1H, d, J=2.8Hz), 7.39-7.44(3H, m), 7.51(1H, s), 7.72(1H, brs), 7.84(1H, brs), 7.89(1H, brs), 8.66(1H, s), 8.70(1H, d, J=5.2Hz).
출발 원료는 다음과 같이 합성했다.
제조예
616-1
4-
벤질옥시
-2-
메틸아닐린
4-아미노-3-크레졸(10 g, 81.20 mmol)을 디메틸설폭시드(80 ml)에 용해하고, 수소화나트륨(3.25 g, 81.20 mmol, 오일중 60%)을 가하여, 질소 분위기하에서 실온에서 15분간 교반했다. 여기에 벤질브로마이드(4.83 ml, 40.60 mmol)를 가하여, 질소 분위기하에서 실온에서 밤새 교반했다. 반응 용액에 물을 가하여, 디에틸에테르·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸·에탄올), 이어서 NH 실리카겔 컬럼 크로마토그래피(헥산·초산에틸)로 정제하여, 보라색 유상물로서 표제 화합물(6.55 g, 30.72 mmol, 75.64%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) :2.16(3H, s), 3.36(2H, brs), 4.99(2H, s), 6.61(1H, d, J=8.4Hz), 6.69(1H, dd, J=2.8Hz, 8.4Hz), 6.75(1H, d, J=2.8Hz), 7.30(1H, t, J=6.8Hz), 7.37(2H, t, J=6.8Hz), 7.42(2H, d, J=6.8Hz).
제조예
616-2
N-
메틸
-4-
벤질옥시
-2-
메틸아닐린
4-벤질옥시-2-메틸아닐린(6.55 g, 30.72 mmol)을 N,N-디메틸포름아미드(10 ml), 메탄올(60 ml)에 용해하고, 1H-벤조트리아졸-1-메탄올(4.58 g, 30.72 mmol)을 가하여, 실온에서 0.5시간동안 교반했다. 여기에 N,N-디메틸포름아미드(20 ml)를 가하여, 석출된 결정을 완전히 용해하여, 실온에서 수소화붕소나트륨(2.32 g, 61.44 mmol)을 소량씩 가해(내부 온도 상승), 그대로 0.5시간동안 교반했다. 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸)로 정제하여, 갈색 유상물로서 표제 화합물(4.364 g, 19.20 mmol, 62.49%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.13(3H, s), 2.86(3H, s), 4.99(2H, s), 6.24(1H, d, J=9.6Hz),6.79-6.81(2H, m), 7.30(1H, t, J=6.8Hz), 7.37(2H, t, J=6.8Hz), 7.43(2H, d, J=6.8Hz).
제조예
616-3
N-(4-
플루오로페닐
)-
N'
-(4-히드록시-2-
메틸페닐
)-
N'
-
메틸우레아
N-메틸-4-벤질옥시-2-메틸아닐린(2.64 g, 11.61 mmol)을 N,N-디메틸포름아미드(20 ml)에 용해시키고, 수소화나트륨(1.16 g, 29.00 mmol, 오일중 60%)을 가하여, 질소 분위기하에서 85℃에서 45분간 교반했다. 여기에 페닐 N-(4-플루오로페닐)카르바메이트(3.50 g, 12.76 mmol)를 가하고, 또한 질소 분위기하에서 85℃에서 1시간동안 교반했다. 실온까지 냉각시킨 후, 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 NH 실리카겔에 흡착시키고, NH 실리카겔 컬럼 크로마토그래피(헥산·초산에틸·에탄올)로 대강 정제하여, 황색 유상물로서 N'-(4-벤질옥시-2-메틸페닐)-N-(4-플루오로페닐)-N'-메틸우레아(2.66 g)를 얻었다. 이것을 메탄올(50 ml)에 용해하고, 10% 팔라듐탄소(0.2 g)를 가하여, 수소 분위기하에서 실온에서 2시간동안 교반했다. 촉매를 여과 제거하고, 에탄올로 세척한 후, 용매를 감압 증류 수거했다. 석출된 결정을 에탄올에 현탁시켜, 디에틸에테르, 헥산으로 희석시킨 후, 결정을 여과 수취하여, 헥산 세척하고, 흡인 건조시켜, 갈색 결정으로서 표제 화합물(0.83 g, 3.0258 mmol, 41.86%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.07(3H, s), 3.04(3H, s), 6.63(1H, d, J=8.0Hz), 6.67(1H, s), 6.97-7.03(3H, m), 7.34-7.39(2H, m), 7.54(1H, brs), 9.46(1H, s).
실시예
617
N-{[4-(7- 벤질옥시 -6- 시아노 -4- 퀴놀릴 ) 옥시 ]-2- 메틸페닐 ]}- N' -(4- 플루오로페닐)-N-메틸우레아
6-시아노-4-클로로-7-메톡시퀴놀린(90 mg, 0.3038 mmol), N-(4-플루오로페닐)-N'-(4-히드록시-2-메틸페닐)-N'-메틸우레아(100 mg, 0.3646 mmol)를 디메틸설폭시드(3 ml)에 용해하고, 수소화나트륨(15 mg, 0.3646 mmol)을 가하여, 85℃에서 1시간동안 가열 교반했다. 실온까지 냉각한 후, 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 NH 실리카겔 컬럼 크로마토그래피(초산에틸)로 정제하여, 생성된 결정을 디에틸에테르에 현탁시키고, 여과 수취하여, 디에틸에테르로 세척하고, 흡인 건조한 후, 핑크색 결정으로서 표제 화합물(80 mg, 0.1502 mmol, 49.44%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.21(3H, s), 3.16(3H, s), 5.46(2H, s), 6.76(1H, d, J=5.4Hz), 7.05(2H, t, J=8.8Hz), 7.20(1H, dd, J=2.4Hz, 8.4Hz), 7.29(1H, d, J=2.4Hz), 7.34-7.46(6H, m), 7.54(2H, d, J=6.8Hz), 7.72(1H, s), 7.91(1H, brs), 8.75(1H, s), 8.77(1H, d, J=5.4Hz).
실시예
618
N-{[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 ]-2- 플루오로페닐 ]}- N' -(4- 플루오로페닐)-N-메틸우레아
6-카르바모일-4-클로로-7-메톡시퀴놀린(41 mg, 0.1744 mmol), N-(2-플루오로-4-히드록시페닐)-N'-(4-플루오로페닐)-N-메틸우레아(57 mg, 0.2048 mmol)를 디메틸설폭시드(1.0 ml)에 용해하고, 수소화나트륨(8.4 mg, 0.2093 mmol)을 가하여, 85℃에서 0.5시간동안 가열 교반했다. 반응 용액을 실온까지 냉각하여, 반응 용액에 물을 가하고, 석출된 결정을 여과 수취했다. 이 결정을 아세톤:디에틸에테르=1:2에 더 현탁시킨 후, 다시 결정을 여과 수취하여, 디에틸에테르 세척하고, 흡인 건조한 후, 황색 결정으로서 표제 화합물(46 mg, 0.0961 mmol, 55.13%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.44(3H, s), 4.01(3H, s), 6.44(1H, d, J=5.4Hz), 6.99(1H, brs), 7.10(1H, dd, J=2.4Hz, 8.4Hz), 7.34(2H, t, J=8.8Hz), 7.38(1H, d, J=8.4Hz), 7.47(1H, s), 7.59(2H, dd, J=5.0Hz, 8.8Hz), 7.69(1H, brs), 7.81(1H, brs), 8.59(1H, d, J=5.4Hz), 8.69(1H, s).
출발 원료는 다음과 같이 합성했다.
제조예
618-1
4-
벤질옥시
-2-
플루오로니트로벤젠
3-플루오로-4-니트로페놀(10 g, 63.65 mmol)을 N,N-디메틸포름아미드(120 ml)에 용해하고, 수소화나트륨(2.68 g, 67.00 mmol, 오일중 60%)을 가하여, 질소 분위기하에서 실온에서 15분간 교반했다. 여기에 벤질브로마이드(7.6 ml, 63.65 mmol)를 가하여, 질소 분위기하에서 실온에서 밤새 교반했다. 반응 용액에 물을 가하여, 석출된 결정을 여과 수취하고, 물로 세척하여, 흡인 건조한 후, 담황색 결정으로서 표제 화합물의 미정제 결정(16.06 g, 정량적)을 얻었다. 더 정제하지 않고, 다음 반응에 이용했다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :5.25(2H, s), 7.04(1H, dd, J=1.6Hz, 9.2Hz), 7.27(1H, dd, J=2.8Hz, 14.0Hz), 7.32-7.42(3H, m), 7.46(2H, d, J=6.8Hz), 8.15(1H, t, J=9.2Hz).
제조예
618-2
4-
벤질옥시
-2-
플루오로아닐린
4-벤질옥시-2-플루오로니트로벤젠의 미정제 결정(16.06 g, 63.65 mmol)을 에탄올(1000 ml), 물(200 ml)에 용해하고, 전해철분(14.0 g, 254.60 mmol), 염화암모늄(27.2 g, 509.20 mmol)을 가하여, 4.5시간동안 가열 환류했다. 반응 용액을 거의 실온으로 냉각하여, 불용물을 여과 제거하고, 에탄올로 세척한 후, 여과액의 용매를 감압 증류 수거했다. 잔사를 초산에틸에 용해하여, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 용매를 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼 크로마토그래피그래피(헥산·초산에틸계)로 정제하여, 갈색 유상물로서 표제 화합물(11.25 g, 51.78 mmol, 81.35%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.44(2H, brs), 4.98(2H, s), 6.10(1H, dd, J=2.8Hz, 8.8Hz), 6.68-6.74(2H, m), 7.30-7.43(5H, m).
제조예
618-3
N-{1-(1H-
벤조트리아졸릴
)
메틸
}-4-
벤질옥시
-2-
플루오로아닐린
4-벤질옥시-2-플루오로아닐린(11.25 g, 51.78 mmol)을 메탄올(300 ml)에 용해하고, 1H-벤조트리아졸-1-메탄올(8.11 g, 54.37 mmol)을 가하여 실온에서 10시간동안 교반했다. 석출된 결정을 여과 수취하고, 결정을 에탄올로 세척하여, 흡인 건조시킴으로써, 무색 결정으로서 표제 화합물(12.01 g, 34.47 mmol, 66.57%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 4.92(2H, s), 6.07(2H, d, J=6.8Hz), 6.64(1H, dd, J=2.8Hz, 9.2Hz), 6.78(1H, dd, J=2.8Hz, 9.2Hz), 6.82(1H, m), 6.99(1H, t, J=9.2Hz), 7.24-7.38(6H, m), 7.53(1H, t, J=8.4Hz), 7.99(1H, d, J=8.4Hz), 8.10(1H, d, J=8.4Hz).
제조예
618-4
N-
메틸
-4-
벤질옥시
-2-
플루오로아닐린
N-{1-(1H-벤조트리아졸릴)메틸}-4-벤질옥시-2-플루오로아닐린(14.13 g, 40.56 mmol)을 N,N-디메틸포름아미드(200 ml), 메탄올(150 ml), 에탄올(50 ml)에 용해하고, 수소화붕소나트륨(3.06 g, 81.12 mmol)을 가하여, 실온에서 2.5시간동안 교반했다. 수소화붕소나트륨(0.78 g, 20.28 mmol)을 더 가하여, 실온에서 13.5시간동안 교반했다. 반응 용액에 물을 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 담황색 결정으로서 표제 화합물(5.98 g, 26.31 mmol, 64.87%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.64(3H, d, J=4.8Hz), 4.97(2H, s), 5.02(1H, d, J=4.8Hz), 6.55(1H, t, J=9.2Hz), 6.68(1H, d, J=9.2Hz), 6.79(1H, J=13.2Hz), 7.25-7.50(5H, m).
제조예
618-5
N-(4-
벤질옥시
-2-
플루오로페닐
)-
N'
-(4-
플루오로페닐
)-N-
메틸우레아
N-메틸-4-벤질옥시-2-플루오로아닐린(250 mg, 1.0805 mmol)을 N,N-디메틸포름아미드(5.0 ml)에 용해하고, 수소화나트륨(65 mg, 1.6207 mmol, 오일중 60%)을 가하여, 질소 분위기하에서 95℃에서 45분간 교반했다. 여기에 4-플루오로페닐이소시아네이트(0.14 ml, 1.1836 mmol)를 가해, 질소 분위기하에서 85℃에서 0.75시간동안 교반했다. 또한 4-플루오로페닐이소시아네이트(0.14 ml, 0.5094 mmol)를 가하고, 질소 분위기하에서 85℃에서 0.5시간동안 교반했다. 실온까지 냉각한 후, 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 NH 실리카겔에 흡착시켜, NH 실리카겔 컬럼 크로마토그래피(헥산·초산에틸계)로 정제하여, 담황색 유상물로서 표제 화합물(0.105 g, 0.2881 mmol, 21.67%)을 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.16(3H, s), 3.44(3H, s), 5.01(2H, s), 6.90(1H, d, J=2.0Hz), 6.78(1H, dd, J=2.0Hz, 8.4Hz), 6.91(1H, d, J=8.4Hz), 7.19(2H, t, J=8.4Hz), 7.30-7.46(5H, m).
제조예
618-6
N-(2-
플루오로
-4-
히드록시페닐
)-
N'
-(4-
플루오로페닐
)-N-
메틸우레아
N-(4-벤질옥시-2-플루오로페닐)-N'-(4-플루오로페닐)-N-메틸우레아(105 mg, 0.2881 mmol)를 메탄올(10 ml)에 용해하여, 10% 팔라듐탄소(20 mg)를 가하고, 수소 분위기하에서 실온에서 0.75시간동안 교반했다. 촉매를 여과 제거하고, 에탄올로 세척한 후, 여과액의 용매를 감압 증류 수거했다. 석출된 결정을 디에틸에테르에 현탁한 후, 결정을 여과 수취하여, 디에틸에테르 세척하고, 흡인 건조시켜, 무색 결정으로서 표제 화합물(57 mg, 0.2048 mmol, 71.10%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.07(3H, s), 6.41(1H, d, J=1.6Hz), 6.54(1H, dd, J=1.6Hz, 8.4Hz), 7.00(1H, d, J=8.4Hz), 7.38(2H, t, J=8.8Hz), 7.53(2H, dd, J=4.8Hz, 8,8Hz).
실시예
619
N- 시클로프로필 - N' -{[4-(6-( 메톡시 ) 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 ]-2-플루오로페닐]}우레아
N-{[4-(6-카르복실-7-메톡시-4-퀴놀릴)옥시]-2-플루오로페닐]}-N'-시클로프로필우레아(40 mg, 0.0972 mmol), 염산 O-메틸히드록실아민(16 mg, 0.1945 mmol)을 이용하여 실시예 412와 같은 식의 반응을 수행했다. 반응 종료후, 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 생성된 결정을 아세톤에 현탁하고, 디에틸에테르로 희석하여, 결정을 여과 수취하고, 디에틸에테르 세척하여, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(20 mg, 0.0454 mmol, 46.71%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.66(2H, m), 2.56(1H, m), 3.75(3H, s), 3.99(3H, s), 6.54(1H, d, J=5.0Hz), 6.82(1H, s), 7.08(1H, d, J=8.4Hz), 7.32(1H, d, J=8.4Hz), 7.50(1H, s), 8.19-8.24(2H, m), 8.43(1H, s), 8.67(1H, d, J=5.0Hz), 11.46(1H, s).
실시예
620
N- 시클로프로필 - N' -{[4-(6-(2- 에톡시에틸 ) 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시]-2-플루오로페닐]}우레아
N-{[4-(6-카르복실-7-메톡시-4-퀴놀릴)옥시]-2-플루오로페닐]}-N'-시클로프로필우레아(40 mg, 0.0972 mmol), 2-에톡시에틸아민(17 mg, 0.1945 mmol)을 이용하여 실시예 412와 같은 식의 반응을 수행했다. 반응 종료후, 반응 용액에 물을 가하여, 석출된 결정을 여과 수취했다. 이것을 아세톤에 현탁하고, 디에틸에테르로 희석하여, 결정을 여과 수취하고, 디에틸에테르 세척하여, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(33 mg, 0.0684 mmol, 70.93%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.39-0.44(2H, m), 0.63-0.68(2H, m), 1.14(3H, t, J=6.6Hz), 2.57(1H, m), 3.46-3.55(6H, m), 4.04(3H, s), 6.54(1H, d, J=5.2Hz), 6.81(1H, m), 7.08(1H, m), 7.33(1H, dd, J=2.4Hz, 11.6Hz), 7.53(1H, s), 8.19-8.24(2H, m), 8.46(1H, t, J=5.2Hz), 8.63(1H, s), 8.68(1H, d, J=5.2Hz).
실시예
621
N- 시클로프로필 - N' -{[4-(6-(2- 플루오로시클로프로필 ) 카르바모일 -7- 메톡시 -4-퀴놀릴)옥시]-2-플루오로페닐]}우레아
N-{[4-(6-카르복실-7-메톡시-4-퀴놀릴)옥시]-2-플루오로페닐]}-N'-시클로프로필우레아(40 mg, 0.0972 mmol), 2-플루오로시클로프로필아민·토실산염(39 mg, 0.1945 mmol)을 이용하여 실시예 412와 같은 식의 반응을 수행했다. 반응 종료후, 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 잔사를 실리카겔에 흡착시켜, 실리카겔 컬럼 크로마토그래피(초산에틸·에탄올계)로 정제하여, 생성된 결정을 아세톤:디에틸에테르=1:3에 현탁시켜, 여과 수취하고, 디에틸에테르로 세척하여, 흡인 건조한 후, 무색 결정으로서 표제 화합물(12 mg, 0.0256 mmol, 26.35%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.05-1.18(2H, m), 2.56(1H, m), 2.93(1H, m), 4.01(3H, m), 4.54-4.93(1H, m), 6.54(1H, d, J=5.2Hz), 6.80(1H, m), 7.08(1H, m), 7.32(1H, dd, J=2.0Hz, 11.6Hz), 7.53(1H, s), 8.22(2H, m), 8.45(1H, m), 8.52(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
622
N-{[4-(6-(2- 시아노에틸 ) 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 ]-2- 플루오로페닐]}-N'-시클로프로필우레아
N-{[4-(6-카르복실-7-메톡시-4-퀴놀릴)옥시]-2-플루오로페닐]}-N'-시클로프로필우레아(40 mg, 0.0972 mmol), 2-시아노에틸아민(14 mg, 0.1945 mmol)을 이용하여 실시예 412와 같은 식의 반응을 수행했다. 반응 종료후, 반응 용액에 물을 가하여, 초산에틸로 추출하고, 포화식염수로 세척하여, 무수황산마그네슘으로 건조하고, 용매를 감압 증류 수거했다. 생성된 결정을 아세톤에 현탁하고, 디에틸에테르로 희석하여, 결정을 여과 수취하고, 디에틸에테르 세척하여, 흡인 건조한 후, 담황색 결정으로서 표제 화합물(18 mg, 0.0684 mmol, 39.96%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.41(2H, m), 0.63-0.66(2H, m), 2.56(1H, m), 2.82(2H, t, J=6.4Hz), 3.57(2H, q, J=6.4Hz), 4.03(3H, s), 6.54(1H, d, J=5.2Hz), 6.81(1H, m), 7.08(1H, m), 7.32(1H, dd, J=2.4Hz, 11.6Hz), 7.54(1H, s), 8.18-8.26(2H, m), 8.61(1H, s), 8.68(1H, d, J=5.2Hz), 8.73(1H, m).
실시예
623
N-[4-(6-
카르바모일
-7-
메톡시
-4-
퀴놀릴
)
옥시
-2-
메틸페닐
]-
N'
-
메틸우레아
[4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-메틸페닐]카르바민산 페닐에스테르(70 mg)를 디메틸설폭시드(0.8 ml)에 가하고, 여기에 메틸아민 2N테트라히드로푸란 용액(0.4 ml)을 가하여, 5분간 교반했다. 이 반응 용액에 물, 초산에틸을 가하고 석출된 결정을 여과 수취하여 표제 화합물(48 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.20(3H, s), 2.65(3H, d, J=4.8Hz), 4.01(3H, s), 6.38-6.47(2H, m), 7.00-7.05(1H, m), 7.09(1H, d, J=2.8Hz), 7.49(1H, s), 7.71(1H, brs), 7.74(1H, s), 7.84(1H, brs), 7.86-7.92(1H, m), 8.63(1H, d, J=5.2Hz), 8.66(1H, s)
실시예
624
N-[4-(6-
카르바모일
-7-
메톡시
-4-
퀴놀릴
)
옥시
-2-
메틸
-
페닐
]-
N'
-
에틸우레아
[4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-메틸-페닐]-카르바민산 페닐에스테르(65 mg)를 디메틸설폭시드(1.0 ml)에 가하고, 여기에 2N 테트라히드로푸란중 에틸아민 용액(0.37 ml)을 가하여, 5분간 교반했다. 이 반응 용액에 물, 초산에틸을 가해 석출된 결정을 여과 수취하여 표제 화합물(38 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.06(3H, t, J=7.2Hz), 2.20(3H, s), 3.06-3.16(2H, m), 4.01(3H, s), 6.44(1H, d, J=5.6Hz), 6.49-6.45(1H, m), 7.00-7.04(1H, m), 7.09(1H, d, J=2.8Hz), 7.49(1H, s), 7.68(1H, s),7.71(1H, brs), 7.84(1H, brs), 7.88-7.95(1H, m), 8.63(1H, d, J=5.6Hz), 8.66(1H, s)
실시예
625
N-[2- 플루오로 -4-([6- 시아노 -7-([3-(1- 피페리디노 )프로필] 옥시 )-4- 퀴놀릴 ] 옥시)페닐]-N'-시클로프로필우레아
시클로프로필아민(0.05 ml)을 디메틸설폭시드(0.5 ml)에 가하여, 여기에 [2-플루오로-4-([6-시아노-7-([3-(1-피페리디노)프로필]옥시)-4-퀴놀릴]옥시)페닐]카르바민산 페닐 에스테르(66 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가해 석출된 결정을 여과 수취하여 표제 화합물(33 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.38-0.45(2H, m), 0.61-0.69(2H, m), 1.30-1.55(6H, m), 1.92-2.02(2H, m), 2.30-2.50(6H, m), 2.53-2.59(1H, m), 4.33(2H, t, J=6.0Hz), 6.59(1H, d, J=5.6Hz), 6.82-6.86(1H, m), 7.07-7.13(1H, m), 7.31-7.37(1H, m), 7.61(1H, s), 8.20-8.29(2H, m), 8.72-8.77(2H, m)
출발물은 다음과 같이 합성했다.
제조예
625-1
[2- 플루오로 -4-([6- 시아노 -7-([3-(1- 피페리디노 )프로필] 옥시 )-4- 퀴놀릴 ] 옥시)페닐]카르바민산 페닐 에스테르
2-플루오로-4-([6-시아노-7-([3-(1-피페리디노)프로필]옥시)-4-퀴놀릴]옥시)페닐아민(66 mg)으로부터 제조예 141-1에 기재한 방법으로 표제 화합물(33 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.40-1.75(6H, m), 1.90-2.15(4H, m), 2.50-2.67(2H, m), 3.13-3.27(2H, m), 4.30-4.38(2H, m), 6.54(1H, d, J=5.2Hz), 6.97-7.06(2H, m), 7.20-7.30(6H, m), 8.01(1H, s), 8.27(1H, brs), 8.66(1H, s), 8.72(1H, d, J=5.2Hz)
실시예
626
N-[4-(7-
벤질옥시
-6-
시아노퀴놀린
-4-
일옥시
)-2-
클로로
-
페닐
]-
N'
-
메틸우레아
[4-(7-벤질옥시-6-시아노퀴놀린-4-일옥시)-2-클로로페닐]카르바민산 페닐 에스테르(1.17 g)를 디메틸포름아미드(6 ml)에 가하고, 여기에 2N 테트라히드로푸란중 메틸아민 용액(0.4 ml)을 가하여, 실온에서 10분간 교반했다. 여기에 물(15 ml)을 가하여, 석출된 결정을 여과 수취하고, 이것을 에틸에테르로 세척하여 표제 화합물(968 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.66(3H, d, J=4.0Hz), 5.45(2H, s), 6.59(1H, d, J=5.2Hz), 6.86-6.92(1H, m), 7.24(1H, dd, J=8.8, 4.8Hz), 7.32-7.57(6H, m), 7.71(1H, s), 8.12(1H, s), 8.21-8.28(1H, m), 8.73(1H, d, J=5.2Hz), 8.76(1H, s)
출발 물은 다음과 같이 합성했다.
제조예
626-1
[4-(7- 벤질옥시 -6- 시아노퀴놀린 -4- 일옥시 )-2- 클로로페닐 ]- 카르바민산 페닐 에스테르
4-(4-아미노-3-클로로페닐)-7-벤질옥시-6-시아노퀴놀린(1.68 g)으로부터 제조예 141-1에 기재한 방법으로 표제 화합물(1.69 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 5.28(2H, s), 6.44(1H, d, J=5.2Hz), 7.09(1H, dd, J=2.8, 9.2Hz), 7.13-7.50(13 H, m), 8.24-8.30(1H, m), 8.60-8.65(2H, m)
실시예
627
N-[2-
클로로
-4-(6-
시아노
-7-
히드록시퀴놀린
-4-
일옥시
)-
페닐
]-
N'
-
메틸우레아
트리플루오로초산(10 ml)에 N-[4-(7-벤질옥시-6-시아노퀴놀린-4-일옥시)-2-클로로페닐]-N'-메틸우레아(968 mg)와 티오아니솔(3.7 ml)을 가하여, 50℃에서 밤새 교반했다. 이것을 감압하에 농축한 후, 초산에틸과 탄산수소나트륨 수용액을 가하여 석출된 결정을 여과 수취하고, 초산에틸로 세척하여 표제 화합물(849 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.66(3H, d, J=4.0Hz), 5.30(1H, d, d=5.2Hz), 6.37(1H, s), 6.83-6.90(1H, m), 7.12-7.16(1H, m), 7.33-7.35(1H, m), 8.00(1H, s), 8.08(1H, brs), 8.14-8.19(2H, m)
실시예
628
N-(4-{6- 시아노 -7-[(2R)- 옥시란 -2-일] 메톡시퀴놀린 -4- 일옥시 }-2- 클로로페닐 )-N'-메틸-우레아
N-[2-클로로-4-(6-시아노-7-히드록시퀴놀린-4-일옥시)페닐]-N'-메틸우레아(600 mg)를 디메틸포름아미드(4 ml)에 가하고, 여기에 p-톨루엔술폰산(2R)-글리시딜 에스테르(484 mg), 탄산칼륨(450 mg)을 가하여, 50℃에서 4시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸로 재결정하여, 표제 화합물(650 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.68(3H, d, J=4.8Hz), 2.80-2.96(2H, m), 3.45-3.51(1H, m), 4.18(1H, dd, J=11.6, 6.4Hz), 4.73(1H, dd, J=11.6, 2.0Hz), 6.61(1H, d, J=5.2Hz), 6.86-6.93(1H, m), 7.26(1H, dd, J=9.2, 2.8Hz), 7.51(1H, d, J=2.8Hz), 7.66(1H, s), 8.14(1H, s), 8.27(1H, d, J=9.2Hz), 8.75(1H, d, J=5.2Hz), 8.78(1 H. s)
실시예
629
N-(4-{6- 시아노 -7-[(2R)-2-히드록시-3- 피롤리딘 -1- 일프로폭시 ]퀴놀린-4- 일옥시}-2-클로로페닐)-N'-메틸-우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-클로로페닐)-N'-메틸우레아(110 mg)에 테트라히드로푸란 1.0 ml과 피롤리딘(0.10 ml)을 가하여 60℃에서 2시간동안 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(65 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.55-1.73(4H, m), 2.45-2.58(5H, m), 2.68-2.77(4H, m), 4.00-4.06(1H, m), 4.22(1H, dd, J=10.4, 5.6Hz), 4.32(1H, dd, J=10.4, 3.2Hz), 5.00-5.05(1H, m), 6.59(1H, d, J=5.2Hz), 6.86-6.93(1H, m), 7.26(1H, dd, J=9.2, 2.8Hz), 7.51(1H, d, J=2.8Hz), 7.63(1H, s), 8.14(1H, brs), 8.27(1H, dd, J=9.2, 2.8Hz), 8.72-8.76(2H, m).
실시예
630
N-(4-{6- 시아노 -7-[(2R)-2-히드록시-3-피페리딘-1- 일프로폭시 ]퀴놀린-4- 일옥시}-2-클로로페닐)-N'-메틸우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-클로로페닐)-N'-메틸우레아(110 mg)에 테트라히드로푸란 2.0 ml와 피페리딘(0.20 ml)을 가하여 60℃에서 3시간동안 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올계)로 정제하여, 표제 화합물(80 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.30-1.42(2H, m), 1.45-1.57(4H, m), 2.35-2.50(6H, m), 2.68(3H, d, J=4.4Hz), 4.00-4.08(1H, m), 4.22(1H, dd, J=10.4, 6.0Hz), 4.32(1H, dd, J=10.4, 3.2Hz), 4.93-4.97(1H, m), 6.59(1H, d, J=5.6Hz), 6.86-6.93(1H, m), 7.26(1H, dd, J=9.2, 2.8Hz), 7.51(1H, d, J=2.8Hz), 7.64(1H, s), 8.14(1H, brs), 8.27(1H, dd, J=9.2, 2.8Hz), 8.72-8.76(2H, m).
실시예
631
N-(4-{6- 시아노 -7-[3- 디에틸아미노 -(2R)-2- 히드록시프로폭시 ]퀴놀린-4- 일옥시}-2-클로로페닐)-N'-메틸우레아
N-(4-{6-시아노-7-[(2R)-옥시란-2-일]메톡시퀴놀린-4-일옥시}-2-클로로페닐)-N'-메틸우레아(100 mg)에 테트라히드로푸란 3.0 ml와 디에틸아민(1.50 ml)을 가하여 60℃에서 5시간동안 가열했다. 이 반응 용액을 NH 실리카겔 컬럼 크로마토그래피(초산에틸-메탄올)로 정제하여, 표제 화합물(75 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.98(6H, t, J=7.2Hz), 2.40-2.70(9H, m), 3.93-4.00(1H, m), 4.23(1H, dd, J=10.4, 5.6Hz), 4.32(1H, dd, J=10.4, 3.6Hz), 4.93(1H, brs), 6.59(1H, d, J=5.6Hz), 6.86-6.93(1H, m), 7.26(1H, dd, J=9.2, 2.8Hz), 7.51(1H, d, J=2.8Hz), 7.63(1H, s), 8.14(1H, brs), 8.27(1H, dd, J=9.2, 2.8Hz), 8.72-8.76(2H, m).
실시예
632
메틸 4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6- 퀴놀린카르복실레이트
페닐 N-(2-클로로-4-(7-메톡시-6-메톡시카르보닐-4-퀴놀릴)옥시페닐)카르바메이트(1.92 g, 4.00 mmol) 및 40% 메틸아민(메탄올 용액)(2 ml)을 디메틸포름아미드(8 ml) 중에, 실온에서 30분간 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(1.41 g, 3.39 mmol, 85%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.68(3H, d, J=4.4Hz), 3.87(3H, s), 3.99(3H, s), 6.54(1H, d, J=5.2Hz), 6,89(1H, q, J=4.4Hz), 7.25(1H, dd, J=2.8, 9.0Hz), 7.50(1H, d, J=2.8Hz), 7.54(1H, s), 8.13(1H, s), 8.26(1H, d, J=9.0Hz), 8.58(1H, s), 8.69(1H, d, J=5.2Hz).
실시예
633
4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6- 퀴놀린카르복실산
메틸 4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실레이트(1.31 g, 3.15 mmol)에 메탄올(14 ml), 2규정 수산화나트륨 수용액(7 ml)을 가하여, 60℃에서 30분간 교반했다. 반응액을 실온으로 방냉하고, 2규정 염산을 가하여 중화시킨 후, 메탄올을 증류 제거하고, 석출된 백색 결정을 여과 수취하여, 충분히 물로 세척한 후, 60℃에서 건조시켜, 표제 화합물(1.26 g, 3.15 mmol, 100%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.68(3H, d, J=4.4Hz), 3.98(3H, s), 6.54(1H, d, J=5.0Hz), 6.89(1H, q, J=4.4Hz), 7.25(1H, dd, J=2.8, 9.0Hz), 7.48-7.53(2H, m), 8.13(1H, s), 8.25(1H, d, J=9.0Hz), 8.54(1H, s), 8.69(1H, d, J=5.0Hz), 13.12(1H, brs).
실시예
634
N6 - 메틸 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)을 디메틸포름아미드(3 ml)에 용해시키고, 40% 메틸아민-메탄올 용액(0.100 ml), 트리에틸아민(0.250 ml) 및 1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트(221 mg, 0.500 mmol)를 순차적으로 실온에서 가한 후, 15시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(85.0 mg, 0.204 mmol, 82%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.68(3H, d, J=4.2Hz), 2.84(3H, d, J=4.2Hz), 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 6.88(1H, q, J=4.2Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.45(1H, d, J=2.8Hz), 7.52(1H, s), 8.12(1H, s), 8.24(1H, d, J=9.2Hz), 8.36(1H, q, J=4.2Hz), 8.59(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
635
N6 -에틸-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)과 2.0M 에틸아민(테트라히드로푸란 용액)으로부터, 실시예 634와 같은 식의 수법에 의해 표제 화합물(93.0 mg, 0.217 mmol, 87%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.15(3H, t, J=7.2Hz), 2.68(3H, d, J=4.4Hz), 3.28-3.38(2H, m), 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 6.87(1H, q, J=4.4Hz), 7.21(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.51(1H, s), 8.11(1H, s), 8.25(1H, d, J=9.2Hz), 8.38(1H, m), 8.54(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
636
N6 - 시클로프로필 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)과 시클로프로필아민으로부터, 실시예 634와 같은 식의 수법에 의해 표제 화합물(66.0 mg, 0.150 mmol, 60%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.59(2H, m), 0.69(2H, m), 2.68(3H, d, J=4.8Hz), 2.87(1H, m), 3.99(3H, s), 6.53(1H, d, J=5.2Hz), 6.88(1H, q, J=4.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.49(1H, s), 8.12(1H, s), 8.25(1H, d, J=9.2Hz), 8.34(1H, d, J=4.0Hz), 8.41(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
637
N6 - 메톡시 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)과 메톡실아민 히드로클로라이드로부터, 실시예 634와 같은 식의 수법에 의해 표제 화합물(51.0 mg, 0.118 mmol, 47%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.56(3H, d, J=4.4Hz), 3.74(3H, s), 3.99(3H, s), 6.54(1H, d, J=5.2Hz), 6.88(1H, q, J=4.4Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.50(1H, s), 8.12(1H, s), 8.25(1H, d, J=9.2Hz), 8.43(1H, s), 8.67(1H, d, J=5.2Hz), 11.46(1H, s).
실시예
638
N6 -(2- 메톡시에틸 )-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)와 2-메톡시에틸아민으로부터, 실시예 634와 같은 식의 수법에 의해 표제 화합물(71.0 mg, 0.154 mmol, 62%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) d (ppm) : 2.68(3H, d, J=4.4Hz), 3.30(3H, s), 3.46-3.52(4H, m), 4.03(3H, s), 6.54(1H, d, J=5.2Hz), 6.88(1H, q, J=4.4Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.53(1H, s), 8.12(1H, s), 8.25(1H, d, J=9.2Hz), 8.46(1H, m), 8.61(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
639
N6 -(2- 플루오로에틸 )-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)과 2-플루오로에틸아민 히드로클로라이드로부터, 실시예 634와 같은 식의 수법에 의해 표제 화합물(86.0 mg, 0.192 mmol, 77%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.68(3H, d, J=4.4Hz), 3.59(1H, m), 3.67(1H, m), 4.03(3H, s), 4.50(1H, m), 4.62(1H, m), 6.54(1H, d, J=5.2Hz), 6.88(1H, q, J=4.4Hz), 7.24(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.53(1H, s), 8.12(1H, s), 8.24(1H, d, J=9.2Hz), 8.58-8.62(2H, m), 8.67(1H, d, J=5.2Hz).
실시예
640
N6 -((2R) 테트라히드로 -2- 푸라닐메틸 )-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)와 R-테트라히드로푸르푸릴아민으로부터, 실시예634와 같은 식의 수법에 의해 표제 화합물(81.0 mg, 0.167 mmol, 67%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.62(1H, m), 1.80-2.00(3H, m), 2.68(3H, d, J=4.4Hz), 3.40(2H, m), 3.66(1H, dd, J=3.6, 14.0Hz), 3.81(1H, dd, J=4.0, 14.0Hz), 3.99(1H, m), 4.02(3H, s), 6.54(1H, d, J=5.2Hz), 6.88(1H, q, J=4.4Hz), 7.23(1H, dd, J=2.8, 8.8Hz), 7.48(1H, d, J=2.8Hz), 7.54(1H, s), 8.12(1H, s), 8.24(1H, d, J=8.8Hz), 8.43(1H, m), 8.61(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
641
N6 -((2S) 테트라히드로 -2- 푸라닐메틸 )-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)와 S-테트라히드로푸르푸릴아민으로부터, 실시예 634와 같은 식의 수법에 의해 표제 화합물(85.0 mg, 0.175 mmol, 70%)을 백색 분말로서 얻었다.
실시예
642
N6 -(2- 에톡시에틸 )-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)과 2-에톡시에틸아민으로부터, 실시예 634와 같은 식의 수법에 의해 표제 화합물(94.0 mg, 0.199 mmol, 80%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.15(3H, t, J=6.8Hz), 2.68(3H, d, J=4.4Hz), 3.45-3.56(6H, m), 4.04(3H, s), 6.54(1H, d, J=5.2Hz), 6.89(1H, q, J=4.4Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.54(1H, s), 8.13(1H, s), 8.25(1H, dd, J=2.8, 9.2Hz), 8.46(1H, m), 8.64(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
643
N6 - 이소부톡시 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(100 mg, 0.250 mmol)과 이소부톡실아민 히드로클로라이드로부터, 실시예634와 같은 식의 수법에 의해 표제 화합물(72.0 mg, 0.152 mmol, 61%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, d, J=6.8Hz), 1.97(1H, m), 2.68(3H, d, J=4.4Hz), 3.71(2H, d, J=6.8Hz), 3.99(3H, s), 6.54(1H, d, J=5.2Hz), 6.89(1H, q, J=4.4Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.50(1H, s), 8.13(1H, s), 8.25(1H, dd, J=2.8, 9.2Hz), 8.36(1H, s), 8.67(1H, d, J=5.2Hz), 11.35(1H, br s).
실시예
644
4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-3-디에틸아미노-2-히드록시프로폭시)-6-퀴놀린카르복사미드
4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(372.0 mg, 0.90 mmol)에 (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트(308 mg, 1.35 mmol), 탄산칼륨(149 mg, 1.08 mmol), 디메틸포름아미드(9 ml)를 가하여, 60℃에서 6시간동안 교반했다. 계속해서 디에틸아민(2 ml)을 첨가하여, 50℃에서 밤새 더 교반했다. 반응액을 초산에틸과 물에 분배하여,유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=95:5)에 가하여, 목적물을 포함하는 분획을 농축한 후, 디에틸에테르로부터 결정을 석출시켜 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(177.5 mg, 0.327 mmol, 36.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 0.94(6H, t, J=7.2Hz), 2.44-2.60 (7H, m), 3.98(1H, m), 4.21(1H, dd, J=5.6, 10.0Hz), 4.31(1H, dd, J=3.2, 10.0Hz), 5.09(1H, d, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.24(1H, dd, J=2.8, 8.8Hz), 7.49(1H, d, J=2.8Hz), 7.52(1H, s), 7.84(1H, s), 7.97(1H, s), 8.00(1H, s), 8.26(1H, d, J=8.8Hz), 8.65(1H, d, J=5.2Hz), 8.81(1H, s).
실시예
645
N6 - 메틸 -7-( 벤질옥시 )-4-(3- 클로로 -(4-(( 메틸아미노 )카르보닐)아미노) 페녹시)-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(7-(벤질옥시)-6-(메틸아미노)카르보닐-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(645 mg, 1.16 mmol)와 2M 메틸아민-테트라히드로푸란 용액으로부터 표제 화합물(466 mg, 0.950 mmol, 81.6%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.66(3H, d, J=4.4Hz), 2.81(3H, d, J=4.4Hz), 5.42(2H, s), 6.51(1H, d, J=5.2Hz), 6.86(1H, q, J=4.4Hz), 7.21(1H, dd, J=2.8, 9.2Hz), 7.30-7.45(4H, m), 7.52-7.55(3H, m), 8.10(1H, s), 8.22(1H, d, J=9.2Hz), 8.38(1H, q, J=4.4Hz), 8.49(1H, s), 8.62(1H, d, J=5.2Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
645-1
페닐 4-(((2,2-디메틸-4,6- 디옥소 -1,3-디옥산-5- 일리덴 ) 메틸 )아미노)-2- 히드록시벤조에이트
페닐 4-아미노살리실레이트(42.2 g, 184 mmol)에 대해, 멜드럼산(29.2 g, 202 mmol), 오르토포름산 트리에틸(200 ml) 및 이소프로판올(200 ml)을 가하여, 100℃에서 1시간동안 가열 교반했다. 반응액을 실온으로 방냉한 후, 밤새 더 교반했다. 석출된 결정을 여과 수취하고, 이소프로판올 및 디에틸에테르로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(69.5 g, 181 mmol, 99%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.69(6H, s), 7.21-7.28(2H, m), 7.29-7.36(3H, m), 7.44-7.52(2H, m), 8.04(1H, d, J=8.4Hz), 8.64(1H, s), 10.52(1H, br s), 11.24(1H, br s).
제조예
645-2
페닐
7-(
벤질옥시
)-4-옥소-1,4-
디히드로
-6-
퀴놀린카르복실레이트
페닐 4-(((2,2-디메틸-4,6-디옥소-1,3-디옥산-5-일리덴)메틸)아미노)-2-히드록시벤조에이트(11.5 g, 0.030 mmol), 벤질브로마이드(5.64 g, 0.033 mmol) 및 탄산칼륨(4.56 g, 0.033 mmol)을 디메틸포름아미드(45 ml) 중에, 80℃에서 3시간동안 교반했다. 반응액을 초산에틸-테트라히드로푸란 혼합 용매와 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 에탄올에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 백색 결정을 얻었다. 얻어진 미정제 결정을 다우섬 A(Dowtherm A)(50 ml) 중에, 200℃에서 1시간동안 가열 교반했다. 반응액을 실온으로 방냉한 후, 디에틸에테르(25 ml)를 가하고, 또 밤새 교반했다. 석출된 결정을 여과 수취하고, 디에틸에테르로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(1.20 g, 3.23 mmol, 11%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 5.33(2H, s), 6.03(1H, d, J=7.4Hz), 7.19(1H, s), 7.21-7.27(2H, m), 7.28-7.36(2H, m), 7.36-7.43(2H, m), 7.43-7.50(2H, m), 7.52-7.58(2H, m), 7.90(1H, d, J=7.4Hz), 8.71(1H, s), 11.79(1H, br s).
제조예
645-3
N6
-
메틸
-7-(
벤질옥시
)-4-
클로로
-6-
퀴놀린카르복사미드
페닐 7-(벤질옥시)-4-옥소-1,4-디히드로-6-퀴놀린카르복실레이트(1.20 g, 3.23 mmol)에 티오닐클로라이드(12 ml)와 촉매량의 디메틸포름아미드를 가하여, 교반하에 2시간동안 가열 환류시켰다. 반응액을 감압 농축하고, 톨루엔으로 2회 공비시킨 후, 잔사를 디메틸포름아미드(20 ml)에 현탁시켜, 빙수욕 냉각하에 40% 메틸아민-메탄올 용액(5 ml)을 서서히 가하여 1시간동안 교반했다. 반응액을 초산에틸-테트라히드로푸란(1:1)과 물에 분배하고, 유기층을 포화염화암모늄 수용액, 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하고, 디에틸에테르, 이어서 헥산을 가하여 결정화시켜, 여과 수취하고, 통풍 건조시켜 표제 화합물(947 mg, 2.90 mmol, 89.7%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.97(3H, d, J=4.8Hz), 5.35(2H, s), 7.40-7.52(6H, m), 7.64(1H, s), 7.91(1H, m), 8.75(1H, q, J=4.8Hz), 9.16(1H, s).
제조예
645-4
N6
-
메틸
-4-(4-아미노-3-
클로로페녹시
)-7-(
벤질옥시
)-6-
퀴놀린카르복사미드
4-아미노-3-클로로페놀(624 mg, 4.35 mmol)을 디메틸설폭시드(15 ml)에 용해시키고, 실온에서 수소화나트륨(174 mg, 4.35 mmol)을 서서히 가하여 30분간 교반했다. N6-메틸-7-(벤질옥시)-4-클로로-6-퀴놀린카르복사미드(947 mg, 2.90 mmol)를 가하여, 100℃에서 2시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 1N 수산화나트륨 수용액, 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(1.098 g, 2.53 mmol, 87.3%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.96(3H, d, J=4.8Hz), 4.10(2H, m), 5.35(2H, s), 6.46(1H, d, J=5.2Hz), 6.84(1H, d, J=8.8Hz), 6.93(1H, dd, J=2.8, 8.8Hz), 7.14(1H, d, J=2.8Hz), 7.39-7.54(5H, m), 7.58(1H, s), 7.95(1H, br), 8.62(1H, d, J=5.2Hz), 9.28(1H, s).
제조예
645-5
페닐 N-(4-(7-( 벤질옥시 )-6-( 메틸아미노 )카르보닐-4- 퀴놀릴 ) 옥시 -2- 클로로페닐)카르바메이트
제조예 17과 같은 식으로 N6-메틸-4-(4-아미노-3-클로로페녹시)-7-(벤질옥시)-6-퀴놀린카르복사미드(1.098 g, 2.53 mmol)로부터 표제 화합물(1.291 g, 2.33 mmol, 92.1%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 2.96(3H, d, J=4.8Hz), 5.35(2H, s), 6.50(1H, d, J=5.2Hz), 7.15(1H, dd, J=2.8, 8.8Hz), 7.19-7.30(6H, m), 7.40-7.52(6H, m), 7.61(1H, s), 7.95(1H, m), 8.30(1H, q, J=4.8Hz), 8.67(1H, d, J=5.2Hz), 9.27(1H, s).
실시예
646
N6 - 메틸 -7-( 벤질옥시 )-4-(3- 클로로 -(4-(( 에틸아미노 )카르보닐)아미노) 페녹시)-6-퀴놀린카르복사미드
실시예 11과 같은 식의 수법에 의해, 페닐 N-(4-(7-(벤질옥시)-6-(메틸아미노)카르보닐-4-퀴놀릴)옥시-2-클로로페닐)카르바메이트(645 mg, 1.16 mmol)와 2M 에틸아민-테트라히드로푸란 용액으로부터 표제 화합물(579 mg, 1.15 mmol, 98.4%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 2.81(3H, d, J=4.8Hz), 3.11(2H, m), 5.42(2H, s), 6.51(1H, d, J=5.2Hz), 6.99(1H, m), 7.19(1H, dd, J=2.8, 9.2Hz), 7.30-7.45(4H, m), 7.52-7.55(3H, m), 8.06(1H, s), 8.24(1H, d, J=9.2Hz), 8.38(1H, q, J=4.8Hz), 8.49(1H, s), 8.62(1H, d, J=5.2Hz).
실시예
647
N6 - 메틸 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-히드록시-6-퀴놀린카르복사미드
N6-메틸-7-(벤질옥시)-4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드(466.3 mg, 0.95 mmol)로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(365.7 mg, 0.91 mmol, 96.1%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.66(3H, brs), 2.85(3H, brs), 6.37(1H, m), 6.86(1H, m), 7.10-7.30(2H, m), 7.45(1H, m), 8.09(1H, brs), 8.22(1H, m), 8.56(1H, m), 8.84(1H, brs).
실시예
648
N6 - 메틸 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-히드록시-6-퀴놀린카르복사미드
N6-메틸-7-(벤질옥시)-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드(578.5 mg, 1.15 mmol)로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(431.4 mg, 1.04 mmol, 90.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 2.85(3H, brs), 3.12(2H, m), 6.36(1H, m), 6.98(1H, m), 7.20-7.24(2H, m), 7.45(1H, d, J=2.8Hz), 8.05(1H, s), 8.25(1H, d, J=9.2Hz), 8.55(1H, m), 8.84(1H, s).
실시예
649
tert -부틸 4-(((4-(3- 클로로 -4-(( 메틸아미노 )카르보닐)아미노) 페녹시 )-6-( 메틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
실시예 7과 같은 식의 수법에 의해, N6-메틸-4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(120 mg, 0.299 mmol)와 tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트)로부터 표제 화합물(98.4 mg, 0.165 mmol, 55.0%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.17-1.33(3H, m), 1.39(9H, s), 1.75(2H, m), 2.06(1H, m), 2.66(3H, d, J=4.4Hz), 2.77(1H, m), 2.81(3H, d, J=4.8Hz), 3.97(2H, m), 4.10(2H, d, J=6.0Hz), 6.51(1H, d, J=5.2Hz), 6.85(1H, q, J=4.4Hz), 7.20(1H, dd, J=2.8, 8.8Hz), 7.44(1H, d, J=2.8Hz), 7.48(1H, s), 8.10(1H, s), 8.18(1H, q, J=4.8Hz), 8.22(1H, d, J=8.8Hz), 8.43(1H, s), 8.63(1H, d, J=5.2Hz).
실시예
650
tert -부틸 4-(((4-(3- 클로로 -4-(( 에틸아미노 )카르보닐)아미노) 페녹시 )-6-( 메틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
실시예 7과 같은 식의 수법에 의해, N6-메틸-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(143 mg, 0.345 mmol)와 tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트로부터 표제 화합물(119.5 mg, 0.195 mmol, 56.6%)을 담갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 1.18-1.26(3H, m), 1.39(9H, s), 1.76(2H, m), 2.06(1H, m), 2.77(1H, m), 2.81(3H, d, J=4.8Hz), 3.12(2H, m), 3.98(2H, m), 4.10(2H, d, J=6.0Hz), 6.51(1H, d, J=5.2Hz), 6.97(1H, m), 7.19(1H, dd, J=2.8, 8.8Hz), 7.44(1H, d, J=2.8Hz), 7.48(1H, s), 8.04(1H, s), 8.18(1H, q, J=4.8Hz), 8.24(1H, d, J=8.8Hz), 8.43(1H, s), 8.63(1H, d, J=5.2Hz).
실시예
651
N6 - 메틸 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-((1- 메틸 -4-피페리딜)메톡시)-6-퀴놀린카르복사미드
tert-부틸 4-(((4-(3-클로로-4-((메틸아미노)카르보닐)아미노)페녹시)-6-(메틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트(98.4 mg, 0.165 mmol)에 트리플루오로초산(1 ml)을 실온에서 가하여, 2시간동안 교반했다. 반응액을 감압 농축한 후, 잔사를 메탄올에 용해시키고, 트리에틸아민을 적하하여 중화시켰다. 용매를 증류 제거하여, 잔사를 테트라히드로푸란(2 ml)-메탄올(2 ml)에 용해시키고, 37% 포름알데히드 수용액(0.3 ml), 초산(0.05 ml), 시아노수소화붕소나트륨(21 mg, 0.33 mmol)을 실온에서 순차적으로 가하여 30분간 교반했다. 반응액을 초산에틸-테트라히드로푸란(1:1)과 포화탄산수소나트륨 수용액에 분배하고, 유기층을 포화탄산수소나트륨 수용액, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 실리카겔 컬럼 크로마토그래피에 가하여, 목적물 분획을 감압 농축하여, 초산에틸-헥산(1:5)부터 결정화시켜, 여과 수취하고, 통풍 건조시켜 표제 화합물(64.2 mg, 0.125 mmol, 76.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.34(2H, m), 1.72-1.89(5H, m), 2.15(3H, s), 2.66(3H, d, J=4.4Hz), 2.77-2.83(5H, m), 4.08(2H, d, J=6.4Hz), 6.51(1H, d, J=5.2Hz), 6.85(1H, q, J=4.8Hz), 7.20(1H, dd, J=2.8, 8.8Hz), 7.44(1H, d, J=2.8Hz), 7.48(1H, s), 8.10(1H, s), 8.20(1H, q, J=4.4Hz), 8.22(1H, d, J=8.8Hz), 8.45(1H, s), 8.63(1H, d, J=5.2Hz).
실시예
652
N6 - 메틸 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-((1- 메틸 -4-피페리딜)메톡시)-6-퀴놀린카르복사미드
tert-부틸 4-(((4-(3-클로로-4-((에틸아미노)카르보닐)아미노)페녹시)-6-(메틸아미노카르보닐)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트(119.5 mg, 0.195 mmol)에 트리플루오로초산(1 ml)을 실온에서 가하여, 2시간동안 교반했다. 반응액을 감압 농축한 후, 잔사를 메탄올에 용해시키고, 트리에틸아민을 적하하여 중화시켰다. 용매를 증류 제거하여, 잔사를 테트라히드로푸란(2 ml)-메탄올(2 ml)에 용해시키고, 37% 포름알데히드 수용액(0.3 ml), 초산(0.05 ml), 시아노수소화붕소나트륨(25 mg, 0.39 mmol)을 실온에서 순차적으로 가하여 30분간 교반했다. 반응액을 초산에틸-테트라히드로푸란(1:1)과 포화탄산수소나트륨 수용액에 분배하여, 유기층을 포화탄산수소나트륨 수용액, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 수거한 후, 실리카겔 컬럼 크로마토그래피에 가하여, 목적물 분획을 감압 농축하여, 초산에틸-헥산(1:5)으로부터 결정화시켜, 여과 수취하고, 통풍 건조시켜 표제 화합물(78.3 mg, 0.149 mmol, 76.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 1.34(2H, m), 1.72-1.89(5H, m), 2.15(3H, s), 2.76-2.82(5H, m), 3.12(2H, m), 4.08(2H, d, J=6.4Hz), 6.51(1H, d, J=5.2Hz), 6.97(1H, m), 7.19(1H, dd, J=2.8, 8.8Hz), 7.44(1H, d, J=2.8Hz), 7.48(1H, s), 8.04(1H, s), 8.19(1H, q, J=4.4Hz), 8.24(1H, d, J=8.8Hz), 8.45(1H, s), 8.63(1H, d, J=5.2Hz).
실시예
653
N6 - 메틸 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-3-디에틸아미노-2-히드록시프로폭시)-6-퀴놀린카르복사미드
N6-메틸-4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(120 mg, 0.299 mmol)에 대해, (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트(103 mg, 0.499 mmol), 탄산칼륨(50 mg, 0.359 mmol), 디메틸포름아미드(3 ml)를 가하여, 60℃에서 7시간동안 교반했다. 계속해서 디에틸아민(1.5 ml)을 첨가하여, 60℃에서 밤새 더 교반했다. 반응액을 초산에틸-테트라히드로푸란(1:1)과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=95:5)에 가하여, 목적물을 포함하는 분획을 농축한 후, 초산에틸-헥산(1:1)으로부터 결정을 석출시켜 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(71.8 mg, 0.135 mmol, 45.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.2Hz), 2.40-2.60(6H, m), 2.66(3H, d, J=4.8Hz), 2.85(3H, d, J=4.8Hz), 4.00(1H, m), 4.18(1H, dd, J=6.0, 10.0Hz), 4.32(1H, dd, J=3.2, 10.0Hz), 5.12(1H, d, J=4.0Hz), 6.52(1H, d, J=5.2Hz), 6.86(1H, q, J=4.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.53(1H, s), 8.10(1H, s), 8.23(1H, d, J=9.2Hz), 8.50(1H, q, J=4.8Hz), 8.65(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
654
N6 - 메틸 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-3-디에틸아미노-2-히드록시프로폭시)-6-퀴놀린카르복사미드
N6-메틸-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(143 mg, 0.345 mmol)로부터, 실시예 653과 같은 식의 수법에 의해 표제 화합물(92.4 mg, 0.170 mmol, 49.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, t, J=7.2Hz), 1.06(3H, t, J=7.2Hz), 2.40-2.60(6H, m), 2.85(3H, d, J=4.8Hz), 3.12(2H, m), 4.00(1H, m), 4.18(1H, dd, J=6.0, 9.6Hz), 4.32(1H, dd, J=3.2, 9.6Hz), 5.12(1H, d, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 6.98(1H, m), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.53(1H, s), 8.05(1H, s), 8.25(1H, d, J=9.2Hz), 8.50(1H, q, J=4.8Hz), 8.65(1H, d, J=5.2Hz), 8.72(1H, s).
실시예
655
N6 - 메틸 -4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-메틸-4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(120 mg, 0.299 mmol)에 대해, (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트(103 mg, 0.499 mmol), 탄산칼륨(50 mg, 0.359 mmol), 디메틸포름아미드(3 ml)를 가하여, 60℃에서 7시간동안 교반했다. 반응액을 실온으로 방냉한 후, 피롤리딘(0.5 ml)을 첨가하고, 밤새 더 교반했다. 반응액을 초산에틸-테트라히드로푸란(1:1)과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=95:5)에 가하여, 목적물을 포함하는 분획을 농축한 후, 초산에틸-헥산(1:1)으로부터 결정을 석출시켜 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(79.3 mg, 0.150 mmol, 50.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.67(4H, m), 2.40-2.60(5H, m), 2.64-2.69(4H, m), 2.85(3H, d, J=4.8Hz), 4.06(1H, m), 4.17(1H, m), 4.33(1H, dd, J=3.6, 10.4Hz), 5.23(1H, d, J=4.8Hz), 6.52(1H, d, J=5.2Hz), 6.86(1H, q, J=4.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.54(1H, s), 8.10(1H, s), 8.23(1H, d, J=9.2Hz), 8.50(1H, q, J=4.8Hz), 8.65(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
656
N6 - 메틸 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-메틸-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(143 mg, 0.345 mmol)로부터, 실시예 655와 같은 식의 수법에 의해 표제 화합물(94.8 mg, 0.175 mmol, 50.7%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 1.67(4H, m), 2.40-2.60(5H, m), 2.66(1H, dd, J=6.4, 12.4Hz), 2.85(3H, d, J=4.8Hz), 3.12(2H, m), 4.06(1H, m), 4.16(1H, dd, J=6.0, 10.0Hz), 4.33(1H, dd, J=3.2, 10.0Hz), 5.23(1H, d, J=5.2Hz), 6.51(1H, d, J=5.2Hz), 6.98(1H, m), 7.21(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.53(1H, s), 8.05(1H, s), 8.25(1H, d, J=8.8Hz), 8.50(1H, q, J=4.8Hz), 8.65(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
657
N- 시클로프로필 - N' -(4-(6-(4-(2- 디에틸아미노에톡시 )- 페닐 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)우레아
N-시클로프로필-N'-(4-(6-(4-(2-디에틸아미노에톡시)-페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)우레아 65 mg을 테트라히드로푸란 2 ml에 녹이고 테트라부틸암모늄플로라이드(테트라히드로푸란 1M 용액)를 0.5 ml 적하하여, 3시간동안 환류했다. 실온으로 되돌려 물을 가하여 교반하고, 석출된 결정을 여과 수취하여 물, 및 에테르-헥산=1:1로 세척하고 감압 건조시켜 표제 화합물 25 mg을 얻었다.
MS Spectrum(ESI) : 519(M+1),
1H-NMR Spectrum: (DMSOd6) 0.38-0.43(2H, m),0.62-0.68(2H, m), 0.99(6H, t, J=7.3Hz) 2.53-2.61(5H, m), 2.80(2H, t, J=6.9Hz), 4.08(2H, t, J=6.9Hz), 6.79-6.84(1H, m),6.91(1H, s), 7.01-7.07(3H, m), 7.26(1H, dd, J=2.9, 11.2Hz),7.88(2H, d, J=9.0Hz), 8.05-8.16(1H, m), 8.18(1H, brs), 8.28(1H, s), 12.68(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
657-1
6-(4- 벤질옥시페닐 )-4-(3- 플루오로 -4- 니트로페녹시 )-7-( 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘
6-(4-벤질옥시페닐)-4-클로로-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘 490 mg에 3-플루오로-4-니트로페놀 248 mg, 2,6-루티딘 0.208 ml, N-메틸피롤리딘 1 ml를 가하여 130℃에서 24시간동안 교반했다. 그 후 실온으로 되돌려, 물을 가하여 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출하고 유기층을 포화식염수로 세척하여 황산나트륨으로 건조하고, 농축하여 NH 실리카겔 컬럼 크로마토그래피(초산에틸)에 가하여, 표제 화합물 472 mg을 얻었다.
1H-NMR Spectrum: (DMSOd6) -0.08(9H, s),0.87(2H, t, J=7.4Hz), 3.63(2H, t, J=7.4Hz), 5.20(2H, s), 5.61(2H, s), 6.83(1H, s), 7.00-7.80(11H, m), 8.30(1H, t, J=8.6Hz), 8.40(1H, s).
제조예
657-2
4-(6-(4- 벤질옥시페닐 )-7-( 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐아민
6-(4-벤질옥시페닐)-4-(3-플루오로-4-니트로페녹시)-7-(트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘 470 mg에 철분 400 mg, 염화암모늄 1 g, 에탄올 20 ml, 테트라히드로푸란 10 ml, 물 10 ml를 가하여 85℃에서 3시간동안 교반했다. 실온으로 되돌린 후, 세라이트 여과하고, 여과액에 초산에틸, 물을 가하여 분액 추출했다. 유기층을 포화식염수로 세척하여 무수황산나트륨으로 건조하고, 면전 여과, 농축하여 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 263 mg을 얻었다.
MS Spectrum(ESI) : 557(M+1).
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.85(2H, t, J=8.9Hz), 3.61(2H, t, J=8.9Hz), 5.09-5.13(2H, m), 5.19(2H, s), 5.59(2H, s), 6.60(1H, s), 6.79-6.73(2H, m), 7.03(1H, d, J=11.5Hz), 7.16(2H, d, J=9.6Hz), 7.32-7.50(5H, m), 7.70(2H, d, J=9.6Hz), 8.40(1H, s).
제조예
657-3
N-(4-(6-(4- 벤질옥시페닐 )-7-(2- 트리메틸실라닐에톡시메틸 )-7H- 피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)-N'-시클로프로필우레아
4-[6-(4-벤질옥시페닐)-7-(트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시]-2-플루오로페닐아민 261 mg을 디메틸포름아미드 3 ml에 녹이고, 피리딘 0.053 ml, 클로로탄산페닐 0.082 ml를 가하여 실온에서 2시간동안 교반한 후, 시클로프로필아민 0.081 ml를 가하여 밤새 교반했다. 물을 가하여, 초산에틸로 분액 추출하고, 유기층을 포화식염수로 세척하여 황산나트륨으로 건조하고, 농축하여 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 265 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) -0.09(9H, s), 0.38-0.43(2H, m),0.60-0.70(2H, m),0.87(2H, t, J=7.5Hz), 2.50-2.60(1H, m), 3.61(2H, t, J=7.5Hz), 5.20(2H, s), 5.60(2H, s), 6.61(1H, s), 6.68-6.72(1H, m), 7.04(1H, d, J=8.3Hz), 7.18(2H, d, J=9.0Hz), 7.28(1H, dd, J=3.4, 11.7Hz), 7.32-7.53(5H, m), 7.72(2H, d, J=9.0Hz), 8.10(1H, t, J=8.2Hz), 8.18(1H, brs),8.40(1H, s).
제조예
657-4
N- 시클로프로필 - N' -(2- 플루오로 -4-(6-(4- 히드록시페닐 )-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐)우레아
1-(4-(6-(4-벤질옥시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)-3-시클로프로필우레아 263 mg을 에탄올 7 ml, 테트라히드로푸란 3 ml에 녹여, 산화백금 30 mg을 가하고, 실온, 상압하에서 수소 분위기하에서 밤새 교반한 후, 세라이트 여과하여, 감압 농축했다. 잔사를 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 160 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) -0.08(9H, s), 0.39-0.43(2H, m),0.61-0.68(2H, m), 0.86(2H, t, J=7.5Hz), 2.50-2.60(1H, m), 3.61(2H, t, J=7.5Hz), 5.58(2H, s), 6.63(1H, s), 6.78-6.82(1H, m), 6.90(2H, d, J=8.6Hz), 7.01-7.07(1H, m, ), 7.28(1H, dd, J=3.3, 11.9Hz), 7.60(2H, d, J=8.6Hz), 8.06-8.13(1H, m, ), 8.19(1H, brs), 8.40(1H, s).
제조예
657-5
N- 시클로프로필 - N' -(4-(6-(4-(2- 디에틸아미노에톡시 )- 페닐 )-7-(2- 트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)우레아
N-시클로프로필-N'-(2-플루오로-4-(6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-페닐)우레아 100 mg을 디메틸포름아미드 1 ml에 녹이고 2-클로로에틸디에틸아민염산염 110 mg, 탄산칼륨 126 mg을 가하여, 80℃에서 15시간동안 교반했다. 그 후 실온으로 되돌려 물을 가하여 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출했다. 유기층을 포화식염수로 세척하여 황산나트륨으로 건조하고, 농축하여 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 67 mg을 얻었다.
MS Spectrum(ESI) : 649(M+1).
실시예
658
N- 시클로프로필 - N' -(2- 플루오로 -4-(6-(4-((2R)-2-히드록시-3- 피롤리딘 -1- 일프로폭시)-페닐)- 7H-피롤로[2,3-d]피리미딘-4-일옥시)-페닐)우레아
N-시클로프로필-N'-(2-플루오로-4-(6-(4-((2R)-2-히드록시-3-피롤리디노프로폭시)-페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-페닐)우레아 63 mg으로부터 실시예 657과 같은 방법으로 표제 화합물 30 mg을 얻었다.
MS Spectrum(ESI) : 547(M+1),
1H-NMR Spectrum : (DMSOd6) 0.38-0.43(2H, m), 0.60-0.69(2H, m), 1.65-1.72(4H, m), 2.45-2.70(7H, m, covered by DMSO peak), 3.90-4.10(3H, m), 4.96(1H, brs) 6.91(1H, s), 6.76-6.80(1H, m), 7.01-7.07(3H, m), 7.26(1H, dd, J=10.9, 2.4Hz), 7.88(2H, d, J=9.1Hz), 8.06-8.14(1H, m,), 8.15(1H, brs,), 8.28(1H, s,) 12.60(1H, brs)
중간체는 다음과 같이 합성했다.
제조예
658-1
N- 시클로프로필 - N' -(2- 플루오로 -4-(6-(4-((2R)-2-히드록시-3- 피롤리디노프로폭시)페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐)우레아
N-시클로프로필-N'-(2-플루오로-4-(6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)페닐)우레아 89 mg을 디메틸포름아미드 2 ml에 녹이고 p-톨루엔술폰산(2R)-(-)-글리시딜에스테르 111 mg(3당량), 탄산칼륨 112 mg(5당량)을 가하여, 65℃에서 밤새 교반했다. 그 후 실온으로 되돌려 정치하고, 웃물을 기울여 따랐다.(디메틸포름아미드1.8 ml분) 거기에 피롤리딘 0.1 ml를 가하여, 65℃에서 3시간동안 교반했다. 그 후 물을 가하여 초산에틸-테트라히드로푸란으로 분액 추출했다. 유기층을 농축하고 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 63 mg을 얻었다.
MS Spectrum(ESI) : 677(M+1).
실시예
659
*N- 시클로프로필 - N' -(4-(6-(4-(3- 디에틸아미노 -(2R)-2- 히드록시프로폭시 )- 페닐)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)우레아
N-시클로프로필-N'-(4-(6-(4-(3-디에틸아미노-(2R)-2-히드록시프로폭시)-페닐])-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)우레아 5 mg으로부터 실시예 657과 같은 식의 방법으로 표제 화합물 1 mg을 얻었다.
MS Spectrum(ESI) : 549(M+1).
중간체는 다음과 같이 합성했다.
제조예
659-1
N- 시클로프로필 - N' -(4-(6-(4-(3- 디에틸아미노 -(2R)-2- 히드록시프로폭시 )- 페닐))-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-플루오로페닐)우레아
N-시클로프로필-N'-(2-플루오로-4-(6-(4-히드록시페닐)-7-(2-트리메틸실라닐에톡시메틸)-7H-피롤로[2,3-d]피리미딘-4-일옥시)-2-페닐)우레아 89 mg을 디메틸포름아미드 2 ml에 녹이고 p-톨루엔술폰산(2R)-(-)-글리시딜에스테르 111 mg(3당량), 탄산칼륨 112 mg(5당량)을 가하여, 65℃에서 밤새 교반했다. 그 후 실온으로 되돌려 정치하고, 웃물을 기울여 따랐다.(디메틸포름아미드 0.2 ml 분) 거기에 테트라히드로푸란 1 ml, 디에틸아민 0.4 ml를 가하여, 65℃에서 30시간동안 교반했다. 그 후 물을 가하여 초산에틸-테트라히드로푸란으로 분액 추출했다. 유기층을 농축하여 NH 실리카겔 컬럼 크로마토그래피(헥산-초산에틸)에 가하여, 표제 화합물 5 mg을 얻었다.
MS Spectrum(ESI) : 679(M+1).
실시예
660
7-( 벤질옥시 )-4-(3- 클로로 -(4-(( 시클로프로필아미노 )카르보닐)아미노) 페녹시)-6-퀴놀린카르복실산
메틸 7-(벤질옥시)-4-(3-클로로-(4-((시클로프로필아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복실레이트(2.218 g, 4.28 mmol)에 메탄올(30 ml), 2규정 수산화나트륨 수용액(10 ml)을 가하여, 60℃에서 1시간동안 교반했다. 반응액을 실온으로 방냉하여, 1규정 염산을 가하여 중화시킨 후, 메탄올을 증류 제거하여, 석출된 담갈색 결정을 여과 수취하고, 충분히 물로 세척한 후, 70℃에서 건조시켜, 표제 화합물(2.121 g, 4.21 mmol, 98.3%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.43(2H, m), 0.67(2H, m), 2.57(1H, m), 5.40(2H, s), 6.56(1H, d, J=5.2Hz), 7.21(1H, d, J=2.8Hz), 7.26(1H, dd, J=2.8, 8.8Hz), 7.32-7.44(3H, m), 7.51(1H, d, J=2.8Hz), 7.56(2H, d, J=6.8Hz), 7.60(1H, s), 8.00(1H, s), 8.28(1H, dd, J=2.8, 8.8Hz), 8.57(1H, s), 8.69(1H, d, J=5.2Hz).
실시예
661
N6 - 메틸 -7-( 벤질옥시 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드
7-(벤질옥시)-4-(3-클로로-(4-((시클로프로필아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복실산(1.056 g, 2.10 mmol)을 디메틸포름아미드(10 ml)에 질소 분위기하에서 용해시키고, 40% 메틸아민-메탄올 용액(2 ml), 트리에틸아민(1 ml), (1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트(1.11 g, 2.52 mmol)를 순차적으로 실온에서 가한 후, 6시간동안 교반했다. 반응액에 물을 가하여 결정을 석출시키고, 여과 수취하여, 충분히 물로 세척한 후, 70℃에서 건조시킴으로써, 표제 화합물(988 mg, 1.91 mmol, 91.2%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 2.82(3H, d, J=4.4Hz), 5.42(2H, s), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.21(1H, dd, J=2.8, 8.8Hz), 7.30-7.55 (7H, m), 7.96(1H, s), 8.25(1H, d, J=8.8Hz), 8.38(1H, q, J=4.4Hz), 8.49(1H, s), 8.62(1H, d, J=5.2Hz).
실시예
662
N6 -에틸-7-( 벤질옥시 )-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드
7-(벤질옥시)-4-(3-클로로-(4-((시클로프로필아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복실산(1.056 g, 2.10 mmol)과 2M 에틸아민-테트라히드로푸란 용액으로부터, 실시예 661과 같은 식의 수법에 의해 표제 화합물(1.022 g, 1.92 mmol, 91.8%)을 백색 결정으로서 얻었다.
*1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.04(3H, t, J=7.2Hz), 2.56(1H, m), 3.25-3.31(2H, m), 5.39(2H, s), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 8.8Hz), 7.32-7.44(3H, m), 7.47(1H, d, J=2.8Hz), 7.56(2H, d, J=7.2Hz), 7.59(1H, s), 7.97(1H, s), 8.26(1H, d, J=8.8Hz), 8.34(1H, t, J=7.2Hz), 8.49(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
663
N6 - 메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-히드록시-6-퀴놀린카르복사미드
N6-메틸-7-(벤질옥시)-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드)(983 mg, 1.90 mmol)로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(811 mg, 1.90 mmol, 정량적)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 2.85(3H, s), 6.32(1H, br), 7.18-7.24(4H, m), 7.45(1H, s), 7.96(1H, s), 8.25(1H, d, J=9.2Hz), 8.51(1H, m), 8.81(1H, s).
실시예
664
N6 -에틸-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-히드록시-6-퀴놀린카르복사미드
N6-에틸-7-(벤질옥시)-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드)(1.016 g, 1.91 mmol)로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(845 mg, 1.91 mmol, 정량적)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.16(3H, t, J=7.2Hz), 2.56(1H, m), 3.36(2H, m), 6.41(1H, d, J=5.2Hz), 7.15-7.35(4H, m), 7.49(1H, d, J=2.4Hz), 7.97(1H, s), 8.27(1H, dd, J=4.0, 9.2Hz), 8.60(1H, d, J=5.2Hz), 8.88(1H, s), 12.68(1H, br).
실시예
665
N6 - 메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-(3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-메틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(213.4 mg, 0.50 mmol)와 1-(3-클로로프로필)피롤리딘 히드로클로라이드로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(78.4 mg, 0.146 mmol, 29.1%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.68(4H, m), 1.99(2H, m), 2.44(4H, m), 2.54-2.59(3H, m), 2.83(3H, d, J=4.8Hz), 4.28(2H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.49(1H, s), 7.96(1H, s), 8.24-8.27(2H, m), 8.53(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
666
N6 -에틸-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-(3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(213.4 mg, 0.50 mmol)와 1-(3-클로로프로필)피롤리딘 히드로클로라이드로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(85.0 mg, 0.154 mmol, 30.8%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.16(3H, t, J=7.2Hz), 1.68(4H, m), 2.00(2H, m), 2.44(4H, m), 2.53-2.60(3H, m), 3.32-3.36(2H, m), 4.27(2H, m), 6.51(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.48(1H, s), 7.96(1H, s), 8.24-8.27(2H, m), 8.51(1H, s), 8.64(1H, d, J=5.2Hz).
실시예
667
N6 - 메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((2R)옥시란-2-일)메톡시-6-퀴놀린카르복사미드
N6-메틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(426.9 mg, 1.00 mmol)와 (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(230.0 mg, 0.476 mmol, 47.6%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 2.56(1H, m), 2.79-2.90(2H, m), 2.84(3H, d, J=4.4Hz), 3.47(1H, m), 4.16(1H, dd, J=6.0, 11.6Hz), 4.63(1H, dd, J=2.4, 11.6Hz), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.54(1H, s), 7.97(1H, s), 8.24-8.28(2H, m), 8.53(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
668
N6 -에틸-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((2R)옥시란-2-일)메톡시-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드)(440.9 mg, 1.00 mmol)와 (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(235.4 mg, 0.474 mmol, 47.4%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.15(3H, t, J=7.2Hz), 2.56(1H, m), 2.82(1H, m), 2.89(1H, m), 3.28-3.36(2H, m), 3.48(1H, m), 4.17(1H, dd, J=2.0, 11.2Hz), 4.62(1H, dd, J=2.4, 11.2Hz), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.53(1H, s), 7.97(1H, s), 8.24-8.30(2H, m), 8.52(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
669
N6 - 메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-메틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-((2R)옥시란-2-일)메톡시-6-퀴놀린카르복사미드(225 mg, 0.466 mmol)를 질소 분위기하에서, 테트라히드로푸란(5.0 ml)에 용해시켜, 피롤리딘(1.0 ml)을 가하고, 실온에서 밤새 교반했다. 반응액을 감압 농축하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=95:5)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸로부터 결정을 석출시켜 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(164.5 mg, 0.297 mmol, 63.7%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.67(4H, m), 2.48-2.59(6H, m), 2.66(1H, dd, J=6.4, 12.0Hz), 2.85(3H, d, J=4.8Hz), 4.05(1H, m), 4.16(1H, dd, J=6.0, 10.0Hz), 4.34(1H, dd, J=3.2, 10.0Hz), 5.24(1H, d, J=4.8Hz), 6.51(1H, d, J=5.2Hz), 7.18-7.25(2H, m), 7.48(1H, d, J=2.8Hz), 7.54(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.50(1H, q, J=4.8Hz), 8.65(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
670
N6 -에틸-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((시클로프로필아미노)카르보닐)아미노)페녹시)-7-((2R)옥시란-2-일)메톡시-6-퀴놀린카르복사미드)(230 mg, 0.463 mmol)로부터 실시예 669와 같은 식의 수법에 의해, 표제 화합물(146.0 mg, 0.257 mmol, 55.5%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.16(3H, t, J=7.2Hz), 1.67(4H, m), 2.47-2.58(6H, m), 2.68(1H, dd, J=6.8, 12.0Hz), 3.30-3.40(2H, m), 4.04(1H, m), 4.19(1H, dd, J=5.6, 9.6Hz), 4.33(1H, dd, J=3.2, 9.6Hz), 5.18(1H, d, J=4.8Hz), 6.51(1H, d, J=5.2Hz), 7.18-7.25(2H, m), 7.48(1H, d, J=2.8Hz), 7.52(1H, s), 7.97(1H, s), 8.26(1H, d, J=9.2Hz), 8.53(1H, m), 8.65(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
670-1
N-(4-((6- 시아노 -7-((1- 메틸 -4- 피페리딜 ) 메톡시 ]-4- 퀴놀릴 ) 옥시 )-2- 플루오로페닐)-N'-시클로프로필우레아
N-(4-((6-시아노-7-(4-피페리딜메톡시)-4-퀴놀릴)옥시)-2-플루오로페닐)-N'-시클로프로필우레아 320 mg을 테트라히드로푸란 20 ml에 현탁하여 포름알데히드(37% 수용액) 1 ml, 초산 80 mg, 이어서 나트륨트리아세톡시보로히드라이드 280 mg을 실온 교반하에 가했다. 20분동안 교반한 후, 2N 수산화나트륨 수용액과 초산에틸을 가하여 추출했다. 추출액을 NH 타입 실리카겔을 깔아놓은 글라스 필터에 통과시켜, 초산에틸:메탄올=20:1의 혼합 용매로 실리카겔을 잘 세척하였다. 유기 용매를 합쳐 감압 증류 수거했다. 잔사에 초산에틸을 가하여 여과 수취하여 130 mg의 담황색 고체를 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.35-0.45(2H, m), 0.59-0.69(2H, m), 1.32-1.46(2H, m), 1.71-1.89(5H, m), 2.14(3H, s), 2.49-2.59(1H, m), 2.74-2.84(2H, m), 4.12(2H, d, J=5.2Hz), 6.56(1H, d, J=5.2Hz), 6.80(1H, s), 7.07(1H, d, J=9.2Hz), 7.31(1H, d, J=11.2Hz), 7.55(1H, s), 8.16-8.27(2H, m), 8.69(1H, s), 8.70(1H, d, J=5.2Hz).
중간체는 다음과 같은 식으로 얻었다.
제조예
670-1-1
tert -부틸 4-(((4-(4-아미노-3- 플루오로페녹시 )-6- 시아노 -7- 퀴놀릴 ) 옥시 ) 메틸)-1-피페리딘카르복실레이트
4-(4-아미노-3-플루오로페녹시)-7-히드록시-6-퀴놀린카르보니트릴 500 mg, tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트 550 mg, 탄산칼륨 700 mg, 디메틸포름아미드 5 ml를 60℃에서 2시간동안 교반했다. 물과 초산에틸을 가하여 추출하고, 추출액을 황산마그네슘으로 건조시켰다. 건조제를 여과 제거하고, 여과액에 실리카겔을 가하여, 감압 증류 수거하여 흡착시켰다. 실리카겔을 채운 드라이 컬럼에 반응액을 흡착시킨 실리카겔을 충전하여 컬럼 크로마토그래피(헥산:초산에틸=1:1 이어서 1:2 이어서 1:3 이어서 초산에틸)를 행했다. 423 mg의 갈색 유상물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.20-1.32(2H, m), 1.39(9H, s), 1.75-1.83(2H, m), 1.98-2.10(1H, m), 2.67-2.88(2H, m), 3.94-4.05(2H, m), 4.15(2H, d, J=6.4Hz), 5.25(2H, bs), 6.51(1H, d, J=5.2Hz), 6.83-6.88(2H, m), 7.06-7.7.11(1H, m), 7.55(1H, s), 8.69(1H, s), 8.70(1H, d, J=5.2Hz).
제조예
670-1-2
tert - 부틸4 -(((6- 시아노 -4-(3- 플루오로 -4-(( 페녹시카르보닐 )아미노) 페녹시 )-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
tert-부틸 4-(((4-(4-아미노-3-플루오로페녹시)-6-시아노-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트 523 mg, 피리딘 0.17 ml, 테트라히드로푸란 10 ml를 빙냉 교반하여, 페닐 클로로포르메이트를 적하했다. 적하 종료후 곧바로 냉욕을 제거하고, 실온으로 되돌렸다. 15분동안 교반한 후 물과 초산에틸을 가하여 추출했다. 추출액에 실리카겔을 가하여 용매를 감압 증류 수거하여 흡착시켰다. 실리카겔을 채운 드라이 컬럼에 반응액을 흡착시킨 실리카겔을 충전하여 컬럼 크로마토그래피(헥산:초산에틸=1:1 이어서 1:2 이어서 초산에틸)로 정제했다. 황색 분말 490 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 1.20-1.32(2H, m), 1.39(9H, s), 1.75-1.83(2H, m), 1.98-2.10(1H, m), 2.70-2.85(2H, m), 3.95-4.04(2H, m), 4.16(2H, d, J=6.0Hz), 6.64(1H, d, J=5.2Hz), 7.16-7.28(4H, m), 7.38-7.46(3H, m), 7.59(1H, s), 7.80(1H, dd, J=8.8Hz, 8.8Hz), 8.72(1H, s), 8.75(1H, d, J=5.2Hz), 10.02(1H, brs).
제조예
670-1-3
tert -부틸 4-(((6- 시아노 -4-(4-((( 시클로프로필아미노 )카르보닐)아미노)-3-플루오로페녹시)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트
tert-부틸 4-(((6-시아노-4-(3-플루오로-4-((페녹시카르보닐)아미노)페녹시)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트 490 mg, 시클로프로필아민 0.72 ml, 테트라히드로푸란 5 ml를 60℃에서 35분동안 교반했다. 반응 용액에 실리카겔을 가하여 용매를 감압 증류 수거하여 흡착시켰다. 실리카겔을 채운 드라이 컬럼에 반응액을 흡착시킨 실리카겔을 충전하여 컬럼 크로마토그래피(초산에틸 이어서 초산에틸:메탄올=20:1)로 정제했다. 담황색 고체 340 mg을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.37-0.44(2H, m), 0.59-0.69(2H, m), 1.29-1.32(2H, m), 1.39(9H, s), 1.77-1.84(2H, m), 1.99-2.11(1H, m), 2.39-2.59(1H, m), 2.59-2.87(2H, m), 3.96-4.04(2H, m), 4.16(2H, d, J=6.4Hz), 6.57(1H, d, J=5.2Hz), 6.80(1H, d, J=2.8Hz), 7.05-7.11(1H, m), 7.31(1H, dd, J=12.0Hz, 2.8Hz), 7.58(1H, s), 8.19-8.27(2H, m), 8.71(1H, s), 8.73(1H, d, J=5.2Hz)
제조예
670-1-4
N-(4-((6- 시아노 -7-(4- 피페리딜메톡시 )-4- 퀴놀릴 ) 옥시 )-2- 플루오로페닐 )-N’-시클로프로필우레아
tert-부틸 4-(((6-시아노-4-(4-(((시클로프로필아미노)카르보닐)아미노)-3-플루오로페녹시)-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트 340 mg에 트리플루오로초산 5 ml를 가하여 실온에서 7분동안 교반했다. 반응 용액에 포화중조수와 초산에틸을 가하여 추출했다. 초산에틸층을 식염수로 세척하여, 황산나트륨으로 건조시켰다. 건조제를 여과 제거하고 용매를 감압 증류 수거하여 320 mg의 담황색 고체를 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.37-0.44(2H, m), 0.59-0.69(2H, m), 1.47-1.59(2H, m), 1.92-2.02(2H, m), 2.14-2.25(1H, m), 2.47-2.57(3H, m), 2.87-2.98(2H, m), 4.19(2H, d, J=6.4Hz), 6.59(1H, d, J=5.2Hz), 6.88(1H, d, J=2.8Hz), 7.05-7.10(1H, m), 7.31(1H, dd, J=12.0Hz, 2.8Hz), 7.63(1H, s), 8.11(1H, dd, J=9.2Hz, 9.2Hz), 8.28(1H, s), 8.73(1H, d, J=5.2Hz), 8.74(1H, s).
실시예
671
4-(4-(3- 에틸우레이도 )-3- 플루오로페녹시 )-7- 메톡시퀴놀린 -6- 카르복실산 메틸에스테르
실시예 11과 같은 식으로 페닐 N-(2-플루오로-4-(7-메톡시-6-메톡시카르보닐-4-퀴놀릴)옥시페닐)카르바메이트(0.9 g)를 디메틸설폭시드 중, 실온에서 에틸아민으로 처리하여 표제 화합물(0.6 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.05(3H, t, J=7.2Hz), 3.07-3.15(2H, m), 3.85(3H, s), 3.96(3H, s), 6.52(1H, d, J=5.2Hz), 6.58(1H, t, J=5.2Hz), 7.04-7.08(1H, m), 7.31(1H, dd, J=2.8Hz, J=12Hz), 7.51(1H, s), 8.21(1H, t, J=9.2Hz), 8.33(1H, br s), 8.55(1H, s), 8.67(1H, d, J=5.2Hz).
중간체는 다음과 같이 합성했다.
제조예
671-1
메틸
4-(4-니트로-3-
플루오로페녹시
)-7-
메톡시
-6-
퀴놀린카르복실레이트
제조예 7과 같은 식의 조작에 의해, 4-클로로-7-메톡시-6-메톡시카르보닐퀴놀린(2.51 g)으로부터 메틸 4-(4-니트로-3-플루오로페녹시)-7-메톡시-6-퀴놀린카르복실레이트(2.44 g)를 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.83(3H, s), 3.99(3H, s), 6.93(1H, d, J=5.1Hz), 7.30-7.33(1H, m), 7.58(1H, m), 7.65-7.69(1H, m), 8.27-831(1H, m), 8.44(1H, s), 8.81(1H, d, J=5.1Hz).
제조예
671-2
메틸
4-(4-아미노-3-
플루오로페녹시
)-7-
메톡시
-6-
퀴놀린카르복실레이트
제조예 8과 같은 식의 조작에 의해, 메틸 4-(4-니트로-3-플루오로페녹시)-7-메톡시-6-퀴놀린카르복실레이트(2.40 g)로부터 메틸 4-(4-아미노-3-플루오로페녹시)-7-메톡시-6-퀴놀린카르복실레이트(1.54 g)를 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) :3.84(3H, s), 3.95(3H, s), 5.21(2H, brd), 6.46(1H, d, J=5.1Hz), 6.85-6.86(2H, m), 7.09(1H, d, J=11.9Hz), 7.49(1H, s), 8.55(1H, s), 8.65(1H, d, J=5.1Hz).
제조예
671-3
페닐 N-(2- 플루오로 -4-(7- 메톡시 -6- 메톡시카르보닐 -4- 퀴놀릴 ) 옥시페닐 ) 카르바메이트
제조예 17과 같은 식의 조작에 의해, 메틸 4-(4-아미노-3-플루오로페녹시)-7-메톡시-6-퀴놀린카르복실레이트(1.50 g)로부터, 페닐 N-(2-플루오로-4-(7-메톡시-6-메톡시카르보닐-4-퀴놀릴)옥시페닐)카르바메이트(1.87 g)를 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.98(3H, s), 4.05(3H, s), 6.49(1H, d, J=5.3Hz), 7.03-7.05(2H, m), 7.22-7.28(4H, m), 7.50(1H, s), 8.25(1H, brs), 8.67(1H, d, J=5.1Hz), 8.77(1H, s).
실시예
672
4-(4-(3- 시클로프로필우레이도 )-3- 플루오로페녹시 )-7- 메톡시퀴놀린 -6- 카르복실산 메틸에스테르
실시예 11과 같은 식으로 페닐 N-(2-플루오로-4-(7-메톡시-6-메톡시카르보닐-4-퀴놀릴)옥시페닐)카르바메이트(0.9 g)를 디메틸설폭시드 중에, 실온에서 시클로프로필아민으로 처리하여 표제 화합물(0.5 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.41(2H, m), 0.60-0.66(2H, m), 2.51-2.57(1H, m), 3.47(3H, s), 3.59(3H, s), 6.52(1H, d, J=5.6Hz), 6.79-6.82(1H, m), 7.05-7.10(1H, m), 7.32(1H, dd, J=2.8Hz, J=11.6Hz), 7.51(1H, s), 8.17-8.24(2H, m), 8.55(1H, s), 8.30(1H, d, J=5.6Hz).
실시예
673.
4-(4-(3-
에틸우레이도
)-3-
플루오로페녹시
)-7-
메톡시퀴놀린
-6-
카르복실산
실시예 633과 같은 식으로 4-(4-(3-에틸우레이도)-3-플루오로페녹시)-7-메톡시퀴놀린-6-카르복실산 메틸에스테르(600 mg)를 가수분해하여, 표제 화합물(210 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.05(3H, t, J=7.2Hz), 3.07-3.15(2H, m), 3.96(3H, s), 6.54(1H, d, J=5.2Hz), 6.77(1H, t, J=5.6Hz), 7.03-7.09(1H, m), 7.31(1H, dd, J=2.4Hz, J=11.6Hz), 7.50(1H, s), 8.21(1H, t, J=9.2Hz), 8.45(1H, br s), 8.56(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
674
4-(4-(3- 시클로프로필우레이도 )-3- 플루오로페녹시 )-7- 메톡시퀴놀린 -6- 카르복실산
실시예 633과 같은 식으로 4-(4-(3-시클로프로필우레이도)-3-플루오로페녹시)-7-메톡시-퀴놀린-6-카르복실산 메틸에스테르(500 mg)를 가수분해하여, 표제 화합물(220 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.38-0.43(2H, m), 0.61-0.67(2H, m), 2.51-2.58(1H, m), 3.95(3H, s), 6.52(1H, d, J=5.2Hz), 6.83(1H, d, J=2.8Hz), 7.05-7.09(1H, m), 7.31(1H, dd, J=2.4Hz, J=11.6Hz), 7.47(1H, s), 8.20(1H, t, J=9.2Hz), 8.22-8.26(1H, m), 8.46(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
675
4-(4-(3- 에틸우레이도 )-3- 플루오로페녹시 )-7- 메톡시퀴놀린 -6- 카르복실산 메톡시아미드
실시예 634와 같은 식으로 4-(4-(3-에틸우레이도)-3-플루오로페녹시)-7-메톡시퀴놀린-6-카르복실산(65 mg)을 메톡실아민, 트리에틸아민, 벤조트리아졸-1-일옥시트리스(디메틸아미노)포스포늄헥사플루오로포스페이트로 처리하여, 표제 화합물(21 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.05(3H, t, J=7.2Hz), 3.08-3.15(2H, m), 3.73(3H, s), 3.97(3H, s), 6.52(1H, d, J=5.2Hz), 6.56-6.61(1H, m), 7.02-7.07(1H, m), 7.30(1H, dd, J=2.4Hz, J=11.6Hz), 7.48(1H, s), 8.22(1H, t, J=9.2Hz), 8.33(1H, br s), 8.41(1H, s), 8.65(1H, d, J=5.2Hz), 11.44(1H, br s).
실시예
676
4-(4-(3- 에틸우레이도 )-3- 플루오로페녹시 )-7- 메톡시퀴놀린 -6- 카르복실산 cis-(2-플루오로시클로프로필)아미드
실시예 634와 같은 식으로 4-(4-(3-에틸우레이도)-3-플루오로페녹시)-7-메톡시퀴놀린-6-카르복실산(20 mg)을 cis-2-플루오로시클로프로필아민, 트리에틸아민, 벤조트리아졸-1-일옥시트리스(디메틸아미노)포스포늄헥사플루오로포스페이트로 처리하여, 표제 화합물(9 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.05(3H, t, J=7.2Hz), 1.04-1.18(2H, m), 2.87-2.95(1H, m), 3.08-3.15(2H, m), 3.99(3H, s), 4.69-4.74(0.5H, m), 4.86-4.90(0.5H, m), 6.52(1H, d, J=5.2Hz), 6.58(1H, t, J=5.2Hz), 7.02-7.07(1H, m), 7.30(1H, dd, J=2.4Hz, J=11.6Hz), 7.51(1H, s), 8.21(1H, t, J=9.2Hz), 8.31-8.35(1H, m), 8.45(1H, d, J=4Hz), 8.50(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
677
4-(4-(3- 에틸우레이도 )-3- 플루오로페녹시 )-7- 메톡시퀴놀린 -6- 카르복실산 (2-에톡시에틸)-아미드
실시예 634와 같은 식으로 4-(4-(3-에틸우레이도)-3-플루오로페녹시)-7-메톡시퀴놀린-6-카르복실산(50 mg)을 에톡시에틸아민, 트리에틸아민, 벤조트리아졸-1-일옥시트리스(디메틸아미노)포스포늄헥사플루오로포스페이트로 처리하여, 표제 화합물(18 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.05(3H, t, J=7.2Hz), 1.13(3H, t, J=7.2Hz), 3.07-3.15(2H, m), 3.46-3.57(6H, m), 4.02(3H, s), 6.52(1H, d, J=5.2Hz), 6.58(1H, t, J=5.2Hz), 7.02-7.07(1H, m), 7.30(1H, dd, J=2.4Hz, J=11.6Hz), 7.51(1H, s), 8.21(1H, t, J=9.2Hz), 8.31-8.35(1H, m), 8.44(1H, t, J=5.2Hz), 8.61(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
678
4-(4-(3- 에틸우레이도 )-3- 플루오로 - 페녹시 )-7- 메톡시퀴놀린 -6- 카르복실산 (2-시아노에틸)아미드
실시예 634와 같은 식으로 4-(4-(3-에틸우레이도)-3-플루오로-페녹시)-7-메톡시퀴놀린-6-카르복실산(40 mg)을 시아노에틸아민, 트리에틸아민, 벤조트리아졸-1-일옥시트리스(디메틸아미노)포스포늄헥사플루오로포스페이트로 처리하여, 표제 화합물(29 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.05(3H, t, J=7.2Hz), 2.78(2H, t, J=6.4Hz), 3.07-3.15(2H, m), 3.52-3.58(2H, m), 4.01(3H, s), 6.52(1H, d, J=5.2Hz), 6.56-6.61(1H, m), 7.02-7.07(1H, m), 7.30(1H, dd, J=2.4Hz, J=11.6Hz), 7.52(1H, s), 8.21(1H, t, J=9.2Hz), 8.33(1H, br s), 8.59(1H, s), 8.65(1H, d, J=5.2Hz), 8.72(1H, t, J=6Hz).
실시예
679
1-(4-(7-
벤질옥시
-6-
시아노퀴놀린
-4-
일옥시
)-2-
메틸페닐
)-3-
에틸우레아
제조예 17과 같은 식으로 4-(4-아미노-3-메틸페녹시)-7-벤질옥시퀴놀린-6-카르보니트릴(2 g)과 클로르탄산페닐로부터 카르바메이트(2.1 g)를 고체로서 얻었다. 다음에, 실시예 11과 같은 식으로 카르바메이트(1 g)를 디메틸설폭시드 중에, 실온에서 에틸아민으로 처리하여 표제 화합물(0.87 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.57(3H, t, J=7.2Hz), 2.20(3H, s), 3.07-3.15(2H, m), 5.43(2H, s), 6.48-6.55(2H, m), 7.02(1H, dd, J=2.8Hz, J=8.8Hz), 7.08(1H, d, J=2.8Hz), 7.34-7.55(5H, m), 7.68(2H, s), 7.92(1H, d, J=8.8Hz), 8.70(1H, d, J=5.6Hz), 8.74(1H, s).
실시예
680
N-(4-(6-
시아노
-7-
히드록시퀴놀린
-4-
일옥시
)-2-
메틸페닐
)-
N'
-
에틸우레아
제조예 301-2와 같은 식으로 N-(4-(7-벤질옥시-6-시아노퀴놀린-4-일옥시)-2-메틸페닐)-N'-에틸우레아(0.8 g)를 테트라히드로푸란 중에, 팔라듐-카본을 이용하여 탈벤질화하여, 표제 화합물(0.42 g)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 2.20(3H, s), 3.07-3.15(2H, m), 6.37(1H, d, J=5.2Hz), 6.52(1H, t, J=5.6Hz), 7.01(1H, dd, J=2.8Hz, J=8.8Hz), 7.08(1H, d, J=2.8Hz), 7.35(1H, s), 7.68(1H, s), 7.93(1H, d, J=8.8Hz), 8.59(1H, d, J=5.2Hz), 8.61(1H, s).
실시예
681
N-(4-(6- 시아노 -7-(피페리딘-4- 일메톡시 )퀴놀린-4- 일옥시 )-2- 메틸페닐 )- N' -시클로프로필우레아
실시예 7과 같은 식으로 N-(4-(6-시아노-7-히드록시퀴놀린-4-일옥시)-2-메틸페닐)-N'-시클로프로필우레아(410 mg)와 4-브로모에틸-피페리딘-1-카르복실산 tert-부틸 에스테르로부터 목적물을 얻은 후, 탈보호하여 표제 화합물(15 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.37-0.43(2H, m), 0.63-0.66(2H, m), 1.44-1.56(2H, m), 1.92-1.98(2H, m), 2.11-2.20(1H, m), 2.20(3H, s), 2.51-2.58(1H, m), 2.85-2.94(2H, m), 3.15-3.45(2H, m), 4.19(2H, d, J=6.4Hz), 6.51(1H, d, J=5.2Hz), 6.79(1H, d, J=2.8Hz), 7.04(1H, dd, J=2.8Hz, J=8.8Hz), 7.10(1H, d, J=2.8Hz), 7.62(1H, s), 7.64(1H, s), 7.93(1H, d, J=8.8Hz), 8.71(1H, d, J=5.2Hz), 8.75(1H, s).
실시예
682
N-(4-(6- 시아노 -7-(1- 메틸 -피페리딘-4- 일메톡시 )퀴놀린-4- 일옥시 )-2- 메틸페닐)-N'-시클로프로필우레아
실시예 670과 같은 식으로 N-(4-(6-시아노-7-(피페리딘-4-일메톡시)퀴놀린-4-일옥시)-2-메틸페닐)-N'-시클로프로필우레아(10 mg)로부터 표제 화합물(3 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.38-0.44(2H, m), 0.61-0.67(2H, m), 1.38-1.50(2H, m), 1.78-1.85(2H, m), 2.04-2.13(1H, m), 2.20(3H, s), 2.26(3H, br s), 2.48-2.58(1H, m), 2.84-2.99(2H, m), 3.04-3.54(2H, m), 4.15(2H, d, J=6Hz), 6.50(1H, d, J=5.2Hz), 6.82(1H, d, J=2.8Hz), 7.04(1H, dd, J=2.4Hz, J=8.8Hz), 7.10(1H, d, J=2.4Hz), 7.58(1H, s), 7.66(1H, s), 7.93(1H, d, J=8.8Hz), 8.71(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
683
N-(4-(6- 시아노 -7-(피페리딘-4- 일메톡시 )퀴놀린-4- 일옥시 )-2- 메틸페닐 )- N' -에틸우레아
실시예 7과 같은 식으로 N-(4-(6-시아노-7-히드록시-퀴놀린-4-일옥시)-2-메틸페닐)-N'-에틸우레아(410 mg)와 4-브로모에틸-피페리딘-1-카르복실산 tert-부틸 에스테르로부터 목적물을 얻은 후 탈보호하여, 표제 화합물(15 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 1.44-1.57(2H, m), 1.93-1.99(2H, m), 2,11-2.20(1H, m), 2.20(3H, s), 2.88-2.98(2H, m), 3.07-3.14(2H, m), 3.15-3.45(2H, m), 4.19(2H, d, J=6Hz), 6.51(1H, d, J=5.2Hz), 6.57(1H, t, J=5.6Hz), 7.02(1H, dd, J=2.4Hz, J=8.8Hz), 7.09(1H, d, J=2.4Hz), 7.62(1H, s), 7.73(1H, s), 7.94(1H, d, J=8.8Hz), 8.71(1H, d, J=5.2Hz), 8.74(1H, s).
실시예
684
N-(4-(6- 시아노 -7-(1- 메틸 -피페리딘-4- 일메톡시 )퀴놀린-4- 일옥시 )-2- 메틸페닐)-N'-에틸우레아
실시예 670과 같은 식으로 N-(4-(6-시아노-7-(피페리딘-4-일메톡시)퀴놀린-4-일옥시)-2-메틸페닐)-N'-에틸우레아(15 mg)로부터 표제 화합물(5 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 1.38-1.51(2H, m), 1.78-1.86(2H, m), 2.07-2.18(1H, m), 2.20(3H, s), 2.28(3H, br s), 2.89-2.97(2H, m), 3.07-3.15(2H, m), 3.15-3.41(2H, m), 4.15(2H, d, J=6Hz), 6.50(1H, d, J=5.2Hz), 6.58(1H, t, J=5.6Hz), 7.03(1H, dd, J=2.8Hz, J=8.8Hz), 7.09(1H, d, J=2.4Hz), 7.58(1H, s), 7.73(1H, s), 7.94(1H, d, J=8.8Hz), 8.79(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
697
메틸 4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6- 퀴놀린카르복실레이트
페닐 N-(2-클로로-4-(7-메톡시-6-메톡시카르보닐-4-퀴놀릴)옥시페닐)카르바메이트(1.92 g, 4.00 mmol) 및 2M-에틸아민(테트라히드로푸란 용액)(4 ml)을 디메틸포름아미드(8 ml) 중에, 실온에서 30분간 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(1.60 g, 3.72 mmol, 93%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.09(3H, t, J=7.4Hz), 3.15(2H, m), 3.87(3H, s), 3.99(3H, s), 6.54(1H, d, J=5.2Hz), 7.01(1H, t, J=5.4Hz), 7.25(1H, dd, J=2.8, 9.0Hz), 7.50(1H, d, J=2.8Hz), 7.54(1H, s), 8.08(1H, s), 8.28(1H, d, J=9.0Hz), 8.58(1H, s), 8.69(1H, d, J=5.2Hz).
*실시예 698
4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6- 퀴놀린카르복실산
메틸 4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실레이트(1.50 g, 3.49 mmol)에 메탄올(14 ml), 2규정 수산화나트륨 수용액(7 ml)을 가하여, 60℃에서 90분간 교반했다. 반응액을 실온으로 방냉하여, 2규정 염산을 가하여 중화시킨 후, 메탄올을 증류 제거하여, 석출된 백색 결정을 여과 수취하고, 충분히 물로 세척한 후, 60℃에서 건조시켜, 표제 화합물(1.36 g, 3.27 mmol, 94%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.09(3H, t, J=7.4Hz), 3.15(2H, m), 3.98(3H, s), 6.53(1H, d, J=5.0Hz), 7.00(1H, t, J=5.4Hz), 7.25(1H, dd, J=2.8, 9.0Hz), 7.48-7.53(2H, m), 8.08(1H, s), 8.27(1H, d, J=9.0Hz), 8.54(1H, s), 8.68(1H, d, J=5.0Hz), 13.12(1H, brs).
실시예
699
N6 - 메틸 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)을 디메틸포름아미드(3 ml)에 용해시키고, 40% 메틸아민-메탄올 용액(0.100 ml), 트리에틸아민(0.250 ml) 및 1H-1,2,3-벤조트리아졸-1-일옥시)(트리(디메틸아미노))포스포늄 헥사플루오로포스페이트(221 mg, 0.500 mmol)를 순차적으로 실온에서 가한 후, 15시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켰다. 용매를 증류 수거한 후, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(79.0 mg, 0.184 mmol, 74%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.4Hz), 2.85(3H, d, J=4.2Hz), 3.15(2H, m), 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 7.00(1H, t, J=5.2Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.52(1H, s), 8.07(1H, s), 8.26(1H, d, J=9.2Hz), 8.36(1H, q, J=4.2Hz), 8.59(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
700
N6 -에틸-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 2.0M 에틸아민(테트라히드로푸란 용액)으로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(90.0 mg, 0.203 mmol, 81%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.09(3H, t, J=7.4Hz), 1.15(3H, t, J=7.2Hz), 3.15(2H, m), 3.28-3.38(2H, m), 4.02(3H, s), 6.53(1H, d, J=5.2Hz), 7.00(1H, t, J=5.4Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.51(1H, s), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.40(1H, t, J=5.4Hz), 8.54(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
701
N6 - 시클로프로필 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 시클로프로필아민으로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(83.0 mg, 0.182 mmol, 73%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.58(2H, m), 0.71(2H, m), 1.08(3H, t, J=7.4Hz), 2.87(1H, m), 3.14(2H, m), 3.99(3H, s), 6.53(1H, d, J=5.2Hz), 7.00(1H, t, J=4.8Hz), 7.21(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.49(1H, s), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.34(1H, d, J=4.0Hz), 8.42(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
702
N6 - 메톡시 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시 -6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 메톡실아민 히드로클로라이드로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(52.0 mg, 0.117 mmol, 47%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.09(3H, t, J=7.4Hz), 3.15(2H, m), 3.75(3H, s), 4.00(3H, s), 6.54(1H, d, J=5.2Hz), 7.00(1H, t, J=5.4Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.50(1H, s), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.43(1H, s), 8.67(1H, d, J=5.2Hz), 11.45(1H, s).
실시예
703
N6 -(2- 메톡시에틸 )-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 2-메톡시에틸아민으로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(71.0 mg, 0.150 mmol, 60%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) d (ppm) : 1.08(3H, t, J=7.4Hz), 3.15(2H, m), 3.30(3H, s), 3.47-3.52(4H, m), 4.03(3H, s), 6.54(1H, d, J=5.2Hz), 7.00(1H, t, J=5.4Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.53(1H, s), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.44(1H, m), 8.62(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
704
N6 -(2- 플루오로에틸 )-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 2-플루오로에틸아민 히드로클로라이드로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(80.0 mg, 0.174 mmol, 69%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.4Hz), 3.15(2H, m), 3.59(1H, m), 3.67(1H, m), 4.03(3H, s), 4.51(1H, m), 4.63(1H, m), 6.54(1H, d, J=5.2Hz), 7.00(1H, t, J=5.4Hz), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.53(1H, s), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.58-8.62(2H, m), 8.67(1H, d, J=5.2Hz).
실시예
705
N6 -((2R) 테트라히드로 -2- 푸라닐메틸 )-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 R-테트라히드로푸르푸릴아민으로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(99.0 mg, 0.198 mmol, 79%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.4Hz), 1.62(1H, m), 1.80-2.00(3H, m), 3.15(2H, m), 3.40(2H, m), 3.66(1H, dd, J=3.6, 14.0Hz), 3.81(1H, dd, J=4.0, 14.0Hz), 3.99(1H, m), 4.04(3H, s), 6.54(1H, d, J=5.2Hz), 7.00(1H, t, J=5.4Hz), 7.23(1H, dd, J=2.8, 8.8Hz), 7.48(1H, d, J=2.8Hz), 7.54(1H, s), 8.07(1H, s), 8.26(1H, d, J=8.8Hz), 8.43(1H, t, J=5.6Hz), 8.61(1H, s), 8.67(1H, d, J=5.2Hz).
실시예
706
N6 -((2S) 테트라히드로 -2- 푸라닐메틸 )-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 S-테트라히드로푸르푸릴아민으로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(87.0 mg, 0.174 mmol, 70%)을 백색 분말로서 얻었다.
실시예
707
N6 -(2- 에톡시에틸 )-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 2-에톡시에틸아민으로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(112 mg, 0.239 mmol, 95%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.4Hz), 1.16(3H, t, J=6.8Hz), 3.15(2H, m), 3.45-3.56(6H, m), 4.03(3H, s), 6.54(1H, d, J=5.2Hz), 7.01(1H, m), 7.23(1H, dd, J=2.8, 9.2Hz), 7.48(1H, d, J=2.8Hz), 7.54(1H, s), 8.08(1H, s), 8.27(1H, dd, J=2.8, 9.2Hz), 8.46(1H, m), 8.64(1H, d, J=2.0Hz), 8.68(1H, d, J=5.2Hz).
실시예
708
N6 - 이소부톡시 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7- 메톡시-6-퀴놀린카르복사미드
4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-메톡시-6-퀴놀린카르복실산(104 mg, 0.250 mmol)과 이소부톡실아민 히드로클로라이드로부터, 실시예 699와 같은 식의 수법에 의해 표제 화합물(64.0 mg, 0.131 mmol, 53%)을 백색 분말로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.95(6H, d, J=6.8Hz), 1.08(3H, t, J=7.4Hz), 1.97(1H, m), 3.15(2H, m), 3.71(2H, d, J=6.8Hz), 3.99(3H, s), 6.54(1H, d, J=5.2Hz), 7.00(1H, m), 7.23(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.50(1H, s), 8.08(1H, s), 8.27(1H, dd, J=2.8, 9.2Hz), 8.36(1H, s), 8.67(1H, d, J=5.2Hz), 11.36(1H, br s).
실시예
709
N6 -에틸-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-3-디에틸아미노-2-히드록시프로폭시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(80.0 mg, 0.193 mmol)에 대해, (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트(66 mg, 0.290 mmol), 탄산칼륨(32 mg, 0.231 mmol), 디메틸포름아미드(2 ml)를 가하여, 60℃에서 7시간동안 교반했다. 계속해서 디에틸아민(1 ml)을 첨가하고, 또 60℃에서 밤새 교반했다. 반응액을 초산에틸-테트라히드로푸란(1:1)과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=95:5)에 가하여, 목적물을 포함하는 분획을 농축한 후, 초산에틸-헥산(1:1)으로부터 결정을 석출시켜 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(51.7 mg, 0.095 mmol, 49.3%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.94(6H, t, J=7.2Hz), 1.16(3H, t, J=7.2Hz), 2.40-2.60(6H, m), 2.66(3H, d, J=4.8Hz), 3.20-3.40(2H, m), 3.98(1H, m), 4.19(1H, dd, J=5.2, 10.0Hz), 4.31(1H, dd, J=3.2, 10.0Hz), 5.09(1H, d, J=4.8Hz), 6.51(1H, d, J=5.2Hz), 6.86(1H, q, J=4.8Hz), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.52(1H, s), 8.10(1H, s), 8.23(1H, d, J=9.2Hz), 8.54(1H, m), 8.65(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
710
N6 -에틸-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-3-디에틸아미노-2-히드록시프로폭시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(78.0 mg, 0.182 mmol)로부터, 실시예 709와 같은 식의 수법에 의해 표제 화합물(44.5 mg, 0.080 mmol, 43.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.94(6H, t, J=7.2Hz), 1.06(3H, t, J=7.2Hz), 1.16(3H, t, J=7.2Hz), 2.40-2.60(6H, m), 3.12(2H, m), 3.20-3.40(2H, m), 3.98(1H, m), 4.22(1H, dd, J=5.6, 9.6Hz), 4.31(1H, dd, J=3.2, 9.6Hz), 5.08(1H, d, J=4.4Hz), 6.51(1H, d, J=5.2Hz), 6.98(1H, m), 7.22(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.52(1H, s), 8.05(1H, s), 8.25(1H, d, J=9.2Hz), 8.54(1H, m), 8.65(1H, d, J=5.2Hz), 8.73(1H, s).
실시예
711
N6 -에틸-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(80.0 mg, 0.193 mmol)에 대해, (2R)옥시란-2-일메틸 4-메틸-1-벤젠설포네이트(66 mg, 0.290 mmol), 탄산칼륨(32 mg, 0.231 mmol),디메틸포름아미드(2 ml)를 가하여, 60℃에서 7시간동안 교반했다. 반응액을 실온으로 방냉한 후, 피롤리딘(0.5 ml)을 첨가하고, 또 밤새 교반했다. 반응액을 초산에틸-테트라히드로푸란(1:1)과 물에 분배하여, 유기층을 물, 포화식염수로 세척하고, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=95:5)에 가하여, 목적물을 포함하는 분획을 농축한 후, 초산에틸-헥산(1:1)으로부터 결정을 석출시켜 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(54.8 mg, 0.101 mmol, 52.4%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.16(3H, t, J=7.2Hz), 1.67(4H, m), 2.40-2.60(5H, m), 2.65-2.71(4H, m), 3.20-3.40(2H, m), 4.05(1H, m), 4.19(1H, dd, J=6.0, 10.0Hz), 4.32(1H, dd, J=3.6, 10.0Hz), 5.18(1H, d, J=4.4Hz), 6.52(1H, d, J=4.0Hz), 6.86(1H, q, J=4.8Hz), 7.22(1H, d, J=9.2Hz), 7.47(1H, s), 7.52(1H, s), 8.10(1H, s), 8.23(1H, d, J=9.2Hz), 8.53(1H, m), 8.65(1H, d, J=4.0Hz), 8.71(1H, s).
실시예
712
N6 -에틸-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-((2R)-2-히드록시-3-(1-피롤리디노)프로폭시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(78.0 mg, 0.182 mmol)로부터, 실시예 711과 같은 식의 수법에 의해 표제 화합물(47.3 mg, 0.085 mmol, 46.8%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.06(3H, t, J=7.2Hz), 1.16(3H, t, J=7.2Hz), 1.67(4H, m), 2.40-2.60(5H, m), 2.68(1H, dd, J=6.4, 12.0Hz), 3.12(2H, m), 3.35(2H, m), 4.05(1H, m), 4.19(1H, dd, J=6.4, 10.0Hz), 4.32(1H, dd, J=3.6, 10.0Hz), 5.18(1H, d, J=4.8Hz), 6.51(1H, d, J=5.2Hz), 6.98(1H, m), 7.21(1H, dd, J=2.8, 9.2Hz), 7.47(1H, d, J=2.8Hz), 7.52(1H, s), 8.05(1H, s), 8.25(1H, d, J=9.2Hz), 8.53(1H, m), 8.65(1H, d, J=5.2Hz), 8.71(1H, s).
실시예
713
N-(4-((6- 시아노 -7-(((2R)-3-( 디에틸아미노 )-2-히드록시프로필) 옥시 )-4- 퀴놀릴)옥시)페닐)-N'-(티아졸-2-일)우레아
4-(4-아미노페녹시)-6-시아노-7-(((2R)-3-(디에틸아미노)-2-히드록시프로필)옥시)퀴놀린(105 mg, 0.2583 mmol)을 디메틸설폭시드(1 ml)에 용해하고, 페닐 (티아졸-2-일)카르바메이트(60 mg, 0.2712 mmol)를 가하여, 85℃에서 40분간 가열 교반했다. 실온으로 방냉후, 반응액에 물을 가하여, 초산에틸·테트라히드로푸란으로 추출하고, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거한 것을 아세톤에 용해하여, 디에틸에테르로 희석시키고, 석출된 침전을 여과 수취하여, 디에틸에테르로 세척하고, 통풍 건조시킴으로써, 담황색 분말로서 표제 화합물(75 mg, 0.1408 mmol, 54.51%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.96(6H, t, J=7.0Hz), 2.41-2.68(6H, m), 3.96(1H, m), 4.21(1H, dd, J=5.2, 10.0Hz), 4.31(1H, dd, J=3.2, 10.0Hz), 4.92(1H, brs), 6.52(1H, d, J=5.2Hz), 7.10(1H, d, J=3.6Hz), 7.27(2H, d, J=9.0Hz), 7.37(1H, d, J=3.6Hz), 7.61(1H, s), 7.63(2H, d, J=9.0Hz), 8.72(1H, d, J=5.2Hz), 8.76(1H, s), 9.15(1H, brs).
출발 물질은 다음과 같은 식으로 합성했다.
제조예
713-1
4-(4-
아미노페녹시
)-6-
시아노
-7-
히드록시퀴놀린
제조예 5로부터 얻어진 7-벤질옥시-6-시아노-4-(4-니트로페녹시)퀴놀린을 제조예 21의 방법에 따라서 벤질기를 탈보호하여 얻은 6-시아노-7-히드록시-4-(4-니트로페녹시)퀴놀린(1.23 g, 4.00 mmol)을 이용하여 제조예 21과 같은 식으로 니트로기를 환원하여, 표제 화합물(0.864 g, 3.1160 mmol, 77.90%)을 황갈색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 5.18(2H, brs), 6.36(1H, d, J=5.2Hz), 6.65(2H, d, J=8.4Hz), 6.92(2H, d, J=8.4Hz), 7.38(1H, s), 8.60(1H, d, J=5.2Hz), 8.62(1H, s).
제조예
713-2
4-(4-
아미노페녹시
)-6-
시아노
-7-((2R)-
옥시란
-2-일)
메톡시퀴놀린
4-(4-아미노페녹시)-6-시아노-7-히드록시퀴놀린(277 mg, 1.00 mmol)을 디메틸포름아미드(3.0 ml)에 용해하고, 실온에서 수소화나트륨(40 mg, 1.00 mmol, 오일중 60%)을 가하여 교반했다. 여기에 (2R)-옥시란-2-일메틸 4-메틸-1-벤젠설포네이트(228 mg, 1.00 mmol)를 가하여, 60℃에서 5시간동안 가열 교반했다. 실온으로 방냉후, 반응액을 초산에틸과 물에 분배했다. 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켜, 용매를 증류 제거함으로써, 황갈색 고체로서 표제 화합물(322 mg, 0.97 mmol, 97%)을 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 2.82(1H, dd, J=2.8, 4.8Hz), 2.93(1H, dd, J=4.8, 4,8Hz), 3.48(1H, m), 4.17(1H, dd, J=6.6, 12.0Hz), 4.71(1H, dd, J=2.0, 12.0Hz), 5.20(2H, m), 6.49(1H, d, J=5.2Hz), 6.68(2H, d, J=8.8Hz), 6.96(2H, d, J=8.8Hz), 7.62(1H, s), 8.71(1H, d, J=5.2Hz), 8.76(1H, s).
제조예
713-3
4-(4- 아미노페녹시 )-6- 시아노 -7-(((2R)-3-( 디에틸아미노 )-2-히드록시프로필)옥시)퀴놀린
4-(4-아미노페녹시)-6-시아노-7-((2R)-옥시란-2-일)메톡시퀴놀린(297 mg, 0.8900 mmol)을 이용하여 제조예 429-2와 같은 식의 방법에 의해, 표제 화합물을(105 mg, 0.2583 mmol, 29.02%)을 담황색 유상물로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 1.08(6H, t, J=7.0Hz), 1.50-2.50(1H, brs), 2.55-2.76(6H, m), 3.79(2H, brs), 4.15(1H, m), 4.24(2H, d, J=4.8Hz), 6.46(1H, d, J=5.4Hz), 6.77(2H, d, J=8.8Hz), 6.96(2H, d, J=8.8Hz), 7.48(1H, s), 8.64(1H, d, J=5.4Hz), 8.69(1H, s).
실시예
714
N-(4-((6- 시아노 -7-(((2R)-2-히드록시-3-( 피롤리딘 -1-일)프로필) 옥시 )-4- 퀴놀릴)옥시)페닐)-N'-(티아졸-2-일)우레아
4-(4-아미노페녹시)-6-시아노-7-((2R)-옥시란-2-일)메톡시퀴놀린(322 mg, 0.966 mmol) 및 티아졸-2-일카르바민산페닐에스테르(255 mg, 1.26 mmol)를 디메틸설폭시드(2 ml) 중, 85℃에서 4시간동안 가열 교반했다. 반응액을 초산에틸-테트라히드로푸란 혼합 용매와 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 생성물 및 피롤리딘(343 mg, 4.83 mmol)을 디메틸포름아미드(3 ml) 중, 실온에서 15시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=15:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(45 mg, 0.085 mmol, 9%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.67(4H, m), 2.40-2.60(5H, m), 2.73(1H, dd, J=6.4, 12.4Hz), 4.03(1H, m), 4.22(1H, dd, J=6.0, 10.0Hz), 4.33(1H, dd, J=3.2, 10.0Hz), 5.04(1H, d, J=5.2Hz), 6.54(1H, d, J=5.2Hz), 7.12(1H, d, J=3.6Hz), 7.27-7.32(2H, m), 7.38(1H, d, J=3.6Hz), 7.62-7.69(3H, m), 8.74(1H, d, J=5.2Hz), 8.77(1H, s), 9.25(1H, br s), 10.73(1H, br s).
실시예
715
4-{6- 시아노 -4-[4-(3-티아졸-2- 일우레이도 ) 페녹시 ]퀴놀린-7- 일옥시메틸 }피페리딘-1-카르복실산 tert-부틸에스테르
실시예 713과 같은 식으로 4-(4-(4-아미노페녹시)-6-시아노퀴놀린-7-일옥시메틸)-피페리딘-1-카르복실산 tert-부틸 에스테르(225 mg)를 디메틸설폭시드 중, 티아졸-2-일-카르바민산 페닐에스테르와 함께 80℃에서 가열하여, 표제 화합물(240 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.19-1.32(2H, m), 1.39(9H, s), 1.75-1.84(2H, m), 2.01-2.11(1H, m), 2.66-2.87(2H, m), 3.94-4.04(2H, m), 4.17(2H, d, J=5.6Hz), 6.52(1H, d, J=5.2Hz), 7.11(1H, d, J=3.2Hz), 7.27(2H, d, J=8.8Hz), 7.37(1H, d, J=3.2Hz), 7.58(1H, s), 7.62(2H, d, J=8.8Hz), 8.71(1H, d, J=5.2Hz), 8.75(1H, s), 9.14(1H, brs).
중간체는 다음과 같은 식으로 합성했다.
제조예
715-1
4-(4-(4- 아미노페녹시 )-6- 시아노퀴놀린 -7- 일옥시메틸 )-피페리딘-1- 카르복실산 tert-부틸에스테르
제조예 713-2와 같은 식으로 4-(4-아미노페녹시)-7-히드록시퀴놀린-6-카르보니트릴(0.32 g)을 디메틸포름아미드 중 수소화나트륨로 처리한 후, 4-브로모에틸피페리딘-1-카르복실산 tert-부틸에스테르와 반응시켜, 표제 화합물(225 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.18-1.32(2H, m), 1.39(9H, s), 1.75-1.82(2H, m), 1.98-2.10(1H, m), 2.62-2.92(2H, m), 3.94-4.03(2H, m), 4.15(2H, d, J=6Hz), 5.16-5.21(2H, m), 6.45(1H, d, J=5.2Hz), 6.65(2H, d, J=8.8Hz), 6.93(2H, d, J=8.8Hz), 7.55(1H, s), 8.68(1H, d, J=5.2Hz), 8.70(1H, s).
실시예
716
1-(4-(6- 시아노 -7-(피페리딘-4- 일메톡시 )퀴놀린-4- 일옥시 ) 페닐 )-3-(티아졸-2-일)우레아
제조예 670-4와 같은 식으로 4-(6-시아노-4-(4-(3-티아졸-2-일-우레이도)-페녹시)-퀴놀린-7-일옥시메틸)-피페리딘-1-카르복실산 tert-부틸-에스테르(240 mg)를 트리플루오로초산으로 탈보호하여 표제 화합물(220 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.46-1.59(2H, m), 1.87-1.96(2H, m), 2.06-2.18(1H, m), 2.78-2.89(2H, m), 3.08-3.38(2H, m), 4.13(2H, d, J=6Hz), 6.43(1H, d, J=5.2Hz), 7.07(1H, d, J=3.2Hz), 7.20(2H, d, J=9.2Hz), 7.36(1H, d, J=3.2Hz), 7.57(1H, s), 7.68(2H, d, J=9.2Hz), 8.63(1H, d, J=5.2Hz), 8.71(1H, s), 9.82(1H, br).
실시예
717
1-(4-(6- 시아노 -7-(1- 메틸피페리딘 -4- 일메톡시 )퀴놀린-4- 일옥시 ) 페닐 )-3-(티아졸-2-일)우레아
실시예 670과 같은 식으로 1-(4-(6-시아노-7-(피페리딘-4-일메톡시)퀴놀린-4-일옥시)페닐)-3-(티아졸-2-일)우레아(220 mg)로부터 표제 화합물(51 mg)을 고체로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.35-1.48(2H, m), 1.75-1.85(2H, m), 1.89-1.96(1H, m), 2.18(3H, brs), 2.79-2.86(2H, m), 3.18-3.38(2H, m), 4.15(2H, d, J=5.6Hz), 6.52(1H, d, J=5.2Hz), 7.10(1H, d, J=3.2Hz), 7.27(2H, d, J=9.2Hz), 7.37(1H, d, J=3.2Hz), 7.58(1H, s), 7.63(2H, d, J=9.2Hz), 8.72(1H, d, J=5.2Hz), 8.76(1H, s), 9.20(1H, br).
실시예
718
N-(4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 트리플루오로메틸페닐 )- N' - 에틸우레아
2N 테트라히드로푸란중 에틸아민 용액(0.10 ml)을 디메틸설폭시드(0.5 ml)에 가하여, 여기에 (4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-트리플루오로메틸페닐)카르바민산 페닐에스테르(25 mg)를 용해하여 10분간 교반했다. 이 반응 용액에 물, 초산에틸을 가해 석출된 결정을 여과 수취하여 표제 화합물(5.0 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.08(3H, t, J=7.2Hz), 3.10-3.18(2H, m), 4.04(3H, s), 6.54(1H, d, J=5.2Hz), 7.00-7.07(1H, m), 7.51-7.63(3H, m),7.74(1H, brs), 7.82-7.88(2H, m), 8.06-8.13(1H, m), 8.66-8.70(2H, m)
실시예
719
N-[4-(6- 카르바모일 -7- 메톡시 -4- 퀴놀릴 ) 옥시 -2- 트리플루오로메틸페닐 ]- N' - 메틸우레아
*2N 테트라히드로푸란중 메틸아민 용액(1.00 ml)에 [4-(6-카르바모일-7-메톡시-4-퀴놀릴)옥시-2-트리플루오로메틸페닐]카르바민산 페닐에스테르(25 mg)를 가하여, 10분간 교반했다. 석출된 결정을 여과 수취하고 테트라히드로푸란으로 세척하여 표제 화합물(10 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 2.68(3H, d, J=4.0Hz), 4.04(3H, s), 6.54(1H, d, J=5.6Hz), 6.87-6.94(1H, m), 7.51-7.63(3H, m),7.75(1H, brs), 7.86(1H, brs), 7.90(1H, brs), 8.03-8.09(1H, m), 8.66-8.70(2H, m)
실시예
720
N-(4-(7- 벤질옥시 -6- 시아노 -퀴놀린-4- 일옥시 )-2,3- 디메틸페닐 )- N' - 시클로프로필우레아
디메틸포름아미드(10 ml)에 시클로프로필아민(1 ml)을 가하고, 여기에 (4-(7-벤질옥시-6시아노-퀴놀린-4-일옥시)-2,3-디메틸페닐)카르바민산 페닐에스테르(1.99 g)를 가하여, 실온에서 10분간 교반했다. 여기에 물(30 ml)과 초산에틸(30 ml)을 가하여, 석출된 결정을 여과 수취하고, 이것을 초산에틸로 세척하여 표제 화합물(1660 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.40-0.45(2H, m), 0.62-0.67(2H, m), 2.03(3H, s), 2.16(3H, s), 2.52-2.59(1H, m), 5.47(2H, s), 6.33(1H, d, J=5.2Hz), 6.68-6.74(1H, m), 7.00(1H, d, J=8.8Hz), 7.35-7.49(3H, m), 7.52-7.73(5H, m), 8.69(1H, d, J=5.2Hz), 8.76(1H, s)
출발 물질은 이하의 2공정에 의해 합성했다.
제조예
720-1
4-(4-아미노-2,3-
디메틸페녹시
)-7-
벤질옥시
-6-
시아노퀴놀린
도쿄가세이로부터 구입한 4-아미노-2,3-키시레놀(2.80 g)을 디메틸설폭시드(15 ml)에 용해시키고, 실온에서 60% 수소화나트륨(816 mg)을 서서히 가하여 20분간 교반했다. 7-벤질옥시-4-클로로-6-시아노퀴놀린(3.0 g)을 가하여, 100℃에서 4시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 물, 1N 수산화나트륨 수용액, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하고, 얻어진 미정제 생성물을 초산에틸로 세척하여, 표제 화합물(1.72 g)을 담갈색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 1.91(3H, s), 2.01(3H, s), 4.83-4.90(2H, m), 5.44(2H, s), 6.30(1H, d, J=5.2Hz), 6.60(1H, d, J=8.4Hz), 6.73-6.79(1H, m), 7.33-7.47(3H, m), 7.51-7.58(2H, m), 7.67(1H, s), 8.65(1H, d, J=5.2Hz), 8.80(1H, s)
제조예
720-2
[4-(7- 벤질옥시 -6- 시아노퀴놀린 -4- 일옥시 )-2,3- 디메틸페닐 ] 카르바민산 페닐에스테르
4-(4-아미노-2,3-디메틸페녹시)-7-벤질옥시-6-시아노퀴놀린(1.72 g)으로부터 제조예 141-1에 기재한 방법으로 표제 화합물(1.99 g)을 담갈색 결정으로서 얻었다.
1H-NMR(CDCl3) δ(ppm) 2.02(3H, s), 2.13(3H, s), 5.36(2H, s), 6.32(1H, d, J=5.2Hz), 6.78(1H, brs), 7.00(1H, d, J=8.8Hz), 7.20-7.80(12 H, m), 8.62(1H, d, J=5.2Hz), 8.78(1H, s)
실시예
721
N-[2,3-디메틸-4-(6- 시아노 -7- 히드록시퀴놀린 -4- 일옥시 ) 페닐 ]- N' - 시클로프로필우레아
N-[4-(7-벤질옥시-6-시아노퀴놀린-4-일옥시)-2,3-디메틸페닐]-N'-시클로프로필우레아(1600 mg)를 테트라히드로푸란(400 ml)에 가하고, 또 팔라듐-탄소(2000 mg)를 가하여 수소 기류하에 실온에서 밤새 교반했다. 팔라듐-탄소를 여과에 의해 제거하여, 디메틸포름아미드로 세척한 후, 여과액을 감압 농축하여 표제 화합물(827 mg)을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.40-0.46(2H, m), 0.62-0.67(2H, m), 2.03(3H, s), 2.16(3H, s), 2.54-2.60(1H, m), 6.20(1H, d, J=5.2Hz), 6.68(1H, d, J=3.2Hz), 7.00(1H, d, J=8.8Hz), 7.39(1H, brs), 7.65(1H, d, J=8.8Hz) 7.69(1H, s), 8.59(1H, d, J=5.2Hz), 8.71(1H, s)
실시예
722
N-(4-(6- 시아노 -7-(3- 피롤리딘 -1- 일프로폭시 )퀴놀린-4- 일옥시 )-2,3- 디메틸페닐)-N'-시클로프로필우레아
디메틸포름아미드(2 ml)에 실시예 721에서 합성한 N-[2,3-디메틸-4-(6-시아노-7-히드록시퀴놀린-4-일옥시)페닐]-N'-시클로프로필우레아(100 mg), 1-(3-클로로프로필)피롤리딘 염산염(95 mg), 탄산칼륨(150 mg)을 가하여, 60℃에서 7시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸로 세척하여, 표제 화합물(49 mg)을 담황색 결정으로서 얻었다.
1H-NMR(CDCl3) δ(ppm) 0.38-0.44(2H, m), 0.59-0.66(2H, m), 1.64-1.71(4H, m), 1.94-2.00(2H, m), 2.01(3H, s), 2.14(3H, s), 2.40-2.60(7H, m), 4.33(2H, t, J=6.4Hz), 6.30(1H, d, J=5.6Hz), 6.82(1H, brs), 6.99(1H, d, J=8.8Hz), 7.58(1H, s), 7.64(1H, d, J=8.8Hz) 7.69(1H, brs), 8.67(1H, d, J=5.6Hz), 8.80(1H, s).
실시예
723
N-(4-(6- 시아노 -7-((2R)-2-히드록시-3- 피롤리딘 -1- 일프로폭시 )퀴놀린-4- 일옥시)-2,3-디메틸페닐)-N'-시클로프로필우레아
N-(4-(6-시아노-7-((2R)-옥시란-2-일)메톡시-퀴놀린-4-일옥시)-2,3-디메틸페닐)-N'-시클로프로필우레아(110 mg)에 테트라히드로푸란(2.0 ml)과 피롤리딘(0.20 ml)을 가하여 60℃에서 2시간동안 가열했다. 이 반응 용액을 방냉한 후, 석출된 결정을 여과 수취하여, 표제 화합물(18 mg)을 담갈색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.40-0.46(2H, m), 0.62-0.68(2H, m), 1.65-1.73(4H, m), 2.03(3H, s), 2.16(3H, s), 2.45-2.70(7H, m), 4.00-4.08(1H, m), 4.22(1H, dd, J=10.4, 5.6Hz), 4.32(1H, dd, J=10.4, 3.6Hz), 5.04(1H, d, J=4.4Hz), 6.32(1H, d, J=5.6Hz), 6.67-6.72(1H, m), 7.02(1H, d, J=8.8Hz), 7.61-7.72(3H, m), 8.69(1H, d, J=5.6Hz), 8.82(1H, s).
출발 물은 다음과 같이 합성했다.
제조예
723-1
N-(4-(6- 시아노 -7-((2R)- 옥시란 -2-일) 메톡시퀴놀린 -4- 일옥시 }-2,3- 디메틸페닐)-N'-시클로프로필우레아
N-(2,3-디메틸-4-(6-시아노-7-히드록시-퀴놀린-4-일옥시)-페닐)-N'-시클로프로필우레아(476 mg)를 디메틸포름아미드(4 ml)에 가하여, 여기에 p-톨루엔술폰산(2R)-글리시딜 에스테르 (365 mg), 탄산칼륨(340 mg)을 가하여, 50℃에서 4시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸로 세척하여, 표제 화합물(270 mg)을 담황색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.40-0.46(2H, m), 0.62-0.68(2H, m), 2.03(3H, s), 2.16(3H, s), 2.52-2.60(1H, m), 2.80-2.96(2H, m), 3.45-3.52(1H, m), 4.18(1H, dd, J=11.6, 6.4Hz), 4.73(1H, dd, J=11.6, 2.0Hz), 6.34(1H, d, J=5.6Hz), 6.69-6.74(1H, m), 7.01(1H, d, J=8.8Hz), 7.61-7.75(2H, m), 7.95(1H, brs), 8.70(1H, d, J=5.6Hz), 8.85(1H, s).
실시예
724
N-(4-(6- 시아노 -7-((2R)-2-히드록시-3-피페리딘-1- 일프로폭시 )퀴놀린-4- 일옥시)-2,3-디메틸페닐)-N'-시클로프로필우레아
N-(4-(6-시아노-7-((2R)-옥시란-2-일)메톡시-퀴놀린-4-일옥시)-2,3-디메틸페닐)-N'-시클로프로필우레아(80 mg)에 테트라히드로푸란(2.0 ml)과 피페리딘(0.20 ml)을 가하여 60℃에서 4시간동안 가열했다. 이 반응 용액을 방냉후, 석출된 결정을 여과 수취하여, 표제 화합물(50 mg)을 담갈색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.40-0.46(2H, m), 0.62-0.68(2H, m), 1.30-1.55(6H, m), 2.03(3H, s), 2.16(3H, s), 2.30-2.70(7H, m), 4.00-4.09(1H, m), 4.22(1H, dd, J=10.4, 5.6Hz), 4.32(1H, dd, J=10.4, 3.6Hz), 4.95(1H, d, J=4.0Hz), 6.32(1H, d, J=5.6Hz), 6.71-6.74(1H, m), 7.02(1H, d, J=8.8Hz), 7.62-7.70(2H, m), 7.73(1H, brs), 8.69(1H, d, J=5.6Hz), 8.82(1H, s).
실시예
725
N-(4-(6- 시아노 -7-(3- 디에틸아미노 -(2R)-2-히드록시- 프로폭시 )퀴놀린-4- 일옥시)-2,3-디메틸페닐)-N'-시클로프로필우레아
N-(4-(6-시아노-7-((2R)-옥시란-2-일)메톡시퀴놀린-4-일옥시)-2,3-디메틸페닐)-N'-시클로프로필우레아(80 mg)에 테트라히드로푸란(2.0 ml)과 디에틸아민(0.50 ml)을 가하여 60℃에서 6시간동안 가열했다. 이 반응 용액을 방냉후, 석출된 결정을 여과 수취하여, 표제 화합물(32 mg)을 담갈색 결정으로서 얻었다.
1H-NMR(DMSO-d6) δ(ppm) 0.40-0.46(2H, m), 0.62-0.69(2H, m), 0.98(6H, t, J=7.2Hz), 2.03(3H, s), 2.16(3H, s), 2.40-2.70(7H, m), 3.90-4.02(1H, m), 4.22(1H, dd, J=10.4, 5.6Hz), 4.32(1H, dd, J=10.4, 3.6Hz), 4.93(1H, d, J=4.0Hz), 6.32(1H, d, J=5.6Hz), 6.71-6.74(1H, m), 7.02(1H, d, J=8.8Hz), 7.61-7.70(2H, m), 7.72(1H, brs), 8.69(1H, d, J=5.6Hz), 8.82(1H, s).
실시예
726
N6 -에틸-7- 벤질옥시 -4-(3- 클로로 -(4-(( 메틸아미노 )카르보닐)아미노) 페녹시 )-6-퀴놀린카르복사미드
N6-에틸-4-(4-아미노-3-클로로페녹시)-7-벤질옥시-6-퀴놀린카르복사미드)(870 mg, 1.94 mmol) 및 피리딘(460 mg, 5.82 mmol)을 디메틸포름아미드(10 ml) 중에 용해시키고, 빙냉하에 페닐클로로포르메이트(456 mg, 2.91 mmol)를 가한 후, 실온에서 18시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 생성물의 일부(460 mg, 0.810 mmol) 및 40% 메틸아민-메탄올 용액(0.810 ml)을 디메틸포름아미드(5 ml) 중에, 실온에서 30분간 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(359 mg, 0.711 mmol, 74%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.07(3H, t, J=7.4Hz), 2.68(3H, d, J=4.0Hz), 3.30(2H, m), 5.41(2H, s), 6.54(1H, d, J=5.2Hz), 6.89(1H, m), 7.23(1H, dd, J=2.8, 9.2Hz), 7.34-7.40(1H, m), 7.40-7.49(3H, m), 7.55-7.60(2H, m), 7.61(1H, s), 8.13(1H, s), 8.25(1H, dd, J=3.2, 9.2Hz), 8.36(1H, t, J=5.2Hz), 8.51(1H, s), 8.66(1H, d, J=5.2Hz).
출발 물질은 다음의 방법으로 합성했다.
제조예
726-1
N6
-에틸-7-
벤질옥시
-4-
클로로
-6-
퀴놀린카르복사미드
페닐 7-벤질옥시-4-옥소-1,4-디히드로-6-퀴놀린카르복실레이트(2.32 g, 6.25 mmol)에 티오닐클로라이드(10 ml)와 촉매량의 디메틸포름아미드를 가하여, 교반하에 2시간동안 가열 환류시켰다. 반응액을 감압 농축하여, 톨루엔으로 2회 공비시킨 후, 잔사를 디메틸포름아미드(10 ml) 및 트리에틸아민(5 ml)의 혼합 용매에 용해시키고, 빙수욕 냉각하에 2M-에틸아민(테트라히드로푸란 용액)(6.25 ml, 12.5 mmol)을 서서히 가하여 실온에서 3시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 암모니아수, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켰다. 용매를 증류 제거하여, 초산에틸, 이어서 디에틸에테르를 가해 결정화시켜, 여과 수취하고, 통풍 건조시켜 표제 화합물(723 mg, 2.12 mmol, 34%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.2Hz), 3.30(2H, m), 5.41(2H, s), 7.34-7.39(1H, m), 7.40-7.46(2H, m), 7.54-7.59(2H, m), 7.66(1H, d, J=4.8Hz), 7.70(1H, s), 8.36(1H, s), 8.42(1H, m), 8.81(1H, d, J=4.8Hz).
제조예
726-2
N6
-에틸-4-(4-아미노-3-
클로로페녹시
)-7-
벤질옥시
-6-
퀴놀린카르복사미드
4-아미노-3-클로로페놀(379 mg, 2.64 mmol)을 디메틸설폭시드(10 ml)에 용해시키고, 실온에서 수소화나트륨(106 mg, 2.64 mmol)을 서서히 가하여 30분간 교반했다. N6-에틸-7-벤질옥시-4-클로로-6-퀴놀린카르복사미드(720 mg, 2.11 mmol)를 가하여, 100℃에서 2시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배하고, 유기층을 암모니아 수용액, 물, 포화식염수로 세척하여, 무수황산나트륨으로 건조시켰다. 용매를 증류 제거하여, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 통풍 건조시킴으로써, 표제 화합물(870 mg, 1.94 mmol, 92%)을 갈색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.07(3H, t, J=7.2Hz), 3.30(2H, m), 5.40(2H, s), 5.43-5.49(2H, m), 6.47(1H, d, J=5.2Hz), 6.91(1H, d, J=8.8Hz), 7.01(1H, dd, J=2.8, 8.8Hz), 7.24(1H, d, J=2.8Hz), 7.34-7.39(1H, m), 7.41-7.46(2H, m), 7.55-7.60(3H, m), 8.36(1H, t, J=5.2Hz), 8.52(1H, s), 8.62(1H, d, J=5.2Hz).
실시예
727
N6 -에틸-7- 벤질옥시 -4-(3- 클로로 -(4-(( 에틸아미노 )카르보닐)아미노) 페녹시 )-6-퀴놀린카르복사미드
N6-에틸-4-(4-아미노-3-클로로페녹시)-7-벤질옥시-6-퀴놀린카르복사미드(870 mg, 1.94 mmol) 및 피리딘(460 mg, 5.82 mmol)을 디메틸포름아미드(10 ml) 중에 용해시키고, 빙냉하에, 페닐 클로로포르메이트(456 mg, 2.91 mmol)를 가한 후, 실온에서 18시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 생성물의 일부(460 mg, 0.810 mmol) 및 2M 에틸아민-테트라히드로푸란 용액(4.05 ml)을 디메틸포름아미드(5 ml) 중에, 실온에서 30분간 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(347 mg, 0.669 mmol, 83%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.03-1.11(6H, m), 3.14(2H, m), 3.30(2H, m), 5.41(2H, s), 6.54(1H, d, J=5.2Hz), 7.01(1H, m), 7.23(1H, dd, J=2.8, 9.2Hz), 7.34-7.40(1H, m), 7.41-7.49(3H, m), 7.55-7.60(2H, m), 7.61(1H, s), 8.07(1H, s), 8.27(1H, dd, J=3.2, 9.2Hz), 8.36(1H, t, J=5.2Hz), 8.51(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
728
N6 -에틸-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-히드록시-6-퀴놀린카르복사미드
N6-에틸-7-벤질옥시-4-(3-클로로-(4-((메틸아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드(344 mg, 0.681 mmol)로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(253 mg, 0.609 mmol, 90%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.18(3H, t, J=7.2Hz), 2.68(3H, d, J=4.4Hz), 3.38(2H, m), 6.42(1H, d, J=5.2Hz), 6.88(1H, q, J=4.4Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.31(1H, s), 7.49(1H, d, J=2.8Hz), 8.13(1H, s), 8.27(1H, d, J=9.2Hz), 8.61(1H, d, J=5.2Hz), 8.89(1H, s).
실시예
729
N6 -에틸-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-히드록시-6-퀴놀린카르복사미드
N6-에틸-7-벤질옥시-4-(3-클로로-(4-((에틸아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드(332 mg, 0.640 mmol)로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(247 mg, 0.576 mmol, 90%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.2Hz), 1.18(3H, t, J=7.2Hz), 3.14(2H, m), 3.39(2H, m), 6.42(1H, d, J=5.2Hz), 7.00(1H, t, J=5.2Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.30(1H, s), 7.49(1H, d, J=2.8Hz), 8.08(1H, s), 8.29(1H, d, J=9.2Hz), 8.61(1H, d, J=5.2Hz), 8.90(1H, s).
실시예
730
N6 -에틸-4-(3- 클로로 -4-((( 메틸아미노 )카르보닐)아미노) 페녹시 )-7-((1- 메틸 -4-피페리딜)메톡시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((메틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드)(80.0 mg, 0.193 mmol), tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트(80.5 mg, 0.289 mmol) 및 탄산칼륨(33.3 mg, 0.241 mmol)을 디메틸포름아미드(1 ml) 중에, 60℃에서 15시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 생성물을 트리플루오로초산(1 ml) 중에, 실온에서 1시간동안 교반한 후, 반응액을 감압 농축하여, 잔사를 메탄올에 용해시키고, 트리에틸아민을 적하하여 중화시켰다. 용매를 증류 제거하여, 잔사를 테트라히드로푸란(2 ml)-메탄올(2 ml)의 혼합 용매에 용해시키고, 37% 포름알데히드 수용액(0.360 ml), 초산(0.070 ml) 및 시아노수소화붕소나트륨(36.3 mg, 0.579 mmol)을 실온에서 순차적으로 가하여 15분간 교반했다. 반응액에 염기성 실리카겔을 가하여 농축한 후, 실리카겔 컬럼 크로마토그래피에 가하여, 목적물 분획을 감압 농축하여, 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(57.5 mg, 0.109 mmol, 57%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.16(3H, t, J=7.2Hz), 1.38(2H, m), 1.72-1.92(5H, m), 2.17(3H, s), 2.68(3H, d, J=4.4Hz), 2.81(2H, m), 3.36(2H, m), 4.11(2H, d, J=6.0Hz), 6.53(1H, d, J=5.2Hz), 6.87(1H, m), 7.22(1H, dd, J=2.8, 8.8Hz), 7.46(1H, d, J=2.8Hz), 7.49(1H, s), 8.12(1H, s), 8.20-8.28(2H, m), 8.50(1H, s), 8.65(1H, d, J=5.2Hz).
실시예
731
N6 -에틸-4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노)페녹시)-7-((1-메틸-4-피페리딜)메톡시)-6-퀴놀린카르복사미드
N6-에틸-4-(3-클로로-4-(((에틸아미노)카르보닐)아미노)페녹시)-7-히드록시-6-퀴놀린카르복사미드(78.0 mg, 0.182 mmol), tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트(75.9 mg, 0.273 mmol) 및 탄산칼륨(31.4 mg, 0.228 mmol)을 디메틸포름아미드(1 ml) 중, 60℃에서 15시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 생성물을 트리플루오로초산(1 ml) 중에, 실온에서 1시간동안 교반한 후, 반응액을 감압 농축하고, 잔사를 메탄올에 용해시켜, 트리에틸아민을 적하하여 중화시켰다. 용매를 증류 제거하여, 잔사를 테트라히드로푸란(2 ml)-메탄올(2 ml)의 혼합 용매에 용해시키고, 37% 포름알데히드 수용액(0.340 ml), 초산(0.070 ml) 및 시아노수소화붕소나트륨(34.3 mg, 0.546 mmol)을 실온에서 순차적으로 가하여 15분간 교반했다. 반응액에 염기성 실리카겔을 가하여 농축한 후, 실리카겔 컬럼 크로마토그래피에 가하여, 목적물 분획을 감압 농축하고, 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(58.1 mg, 0.108 mmol, 59%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.2Hz), 1.16(3H, t, J=7.2Hz), 1.38(2H, m), 1.72-1.92(5H, m), 2.17(3H, s), 2.81(2H, m), 3.14(2H, m), 3.35(2H, m), 4.10(2H, d, J=6.0Hz), 6.53(1H, d, J=5.2Hz), 7.00(1H, m), 7.22(1H, dd, J=2.8, 8.8Hz), 7.47(1H, d, J=2.8Hz), 7.49(1H, s), 8.07(1H, s), 8.22-8.29(2H, m), 8.50(1H, s), 8.66(1H, d, J=5.2Hz).
실시예
732
N6 - 메톡시 -7- 벤질옥시 -4-(3- 클로로 -(4-(( 에틸아미노 )카르보닐)아미노) 페녹시)-6-퀴놀린카르복사미드
N6-메톡시-4-(4-아미노-3-클로로페녹시)-7-벤질옥시-6-퀴놀린카르복사미드(81.0 mg, 0.180 mmol) 및 피리딘(32.0 mg, 0.404 mmol)을 디메틸포름아미드(2 ml)중에 용해시키고, 빙냉하에, 페닐 클로로포르메이트(42.3 mg, 0.270 mmol)를 가한 후, 실온에서 30분간 교반했다. 반응액에 2M 에틸아민-테트라히드로푸란 용액(0.270 ml)을 가하고, 또 실온에서 30분간 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을, 디에틸에테르에 현탁시켜, 이것을 헥산으로 희석시키고 결정을 여과 수취하여, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(68.5 mg, 0.131 mmol, 73%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.2Hz), 3.15(2H, m), 3.72(3H, s), 5.40(2H, s), 6.54(1H, d, J=5.2Hz), 7.01(1H, m), 7.22(1H, dd, J=2.8, 9.2Hz), 7.32-7.37(1H, m), 7.40-7.46(2H, m), 7.47(1H, d, J=2.8Hz), 7.53-7.60(3H, m), 8.07(1H, s), 8.27(1H, dd, J=3.2, 9.2Hz), 8.34(1H, s), 8.65(1H, d, J=5.2Hz), 11.53(1H, br s).
출발 물질은 다음의 방법으로 합성했다.
제조예
732-1
N6
-
메톡시
-7-
벤질옥시
-4-
클로로
-6-
퀴놀린카르복사미드
페닐 7-벤질옥시-4-옥소-1,4-디히드로-6-퀴놀린카르복실레이트(2.32 g, 6.25 mmol)에 티오닐클로라이드(10 ml)와 촉매량의 디메틸포름아미드를 가하여, 교반하에 2시간동안 가열 환류시켰다. 반응액을 감압 농축하여, 톨루엔으로 2회 공비시킨 후, 잔사를 디메틸포름아미드(20 ml) 및 트리에틸아민(20 ml)의 혼합 용매에 용해시키고, 빙수욕 냉각하에 메톡실아민 히드로클로라이드(10.4 g, 125 mmol)를 가하여 실온에서 18시간동안 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 물, 포화식염수로 세척한 후, 무수황산마그네슘으로 건조시켰다. 용매를 증류 수거한 후, 실리카겔 컬럼 크로마토그래피에 가하여, 목적물 분획을 감압 농축하고, 얻어진 미정제 생성물을, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(392 mg, 1.14 mmol, 18%)을 백색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 3.72(3H, s), 5.41(2H, s), 7.32-7.38(1H, m), 7.40-7.46(2H, m), 7.52-7.56(2H, m), 7.64-7.70(2H, m), 8.22(1H, s), 8.82(1H, d, J=4.8Hz), 11.60(1H, br s).
제조예
732-2
N6
-
메톡시
-4-(4-아미노-3-
클로로페녹시
)-7-
벤질옥시
-6-
퀴놀린카르복사미드
4-아미노-3-클로로페놀(408 mg, 2.84 mmol)을 디메틸설폭시드(10 ml)에 용해시키고, 실온에서 수소화나트륨(114 mg, 2.84 mmol)을 서서히 가하여 30분간 교반했다. N6-메톡시-7-벤질옥시-4-클로로-6-퀴놀린카르복사미드(388 mg, 1.14 mmol)를 가하여, 100℃에서 18시간동안 교반하에 가열했다. 실온으로 방냉하여, 반응액을 초산에틸과 물에 분배, 유기층을 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켰다. 용매를 증류 수거한 후, 실리카겔 컬럼 크로마토그래피에 가하여, 목적물 분획을 감압 농축하여, 얻어진 미정제 생성물을, 초산에틸에 현탁시키고, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(81.0 mg, 0.180 mmol, 16%)을 담적색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.81(3H, s), 4.22(2H, br s), 5.43(2H, s), 6.68(1H, d, J=6.2Hz), 6.88(1H, d, J=8.8Hz), 6.94(1H, dd, J=2.8, 8.8Hz), 7.16(1H, d, J=2.8Hz), 7.41-7.58(5H, m), 8.14(1H, s), 8.66(1H, d, J=6.2Hz), 9.35(1H, s), 10.19(1H, s).
실시예
733
N6 - 메톡시 -4-(3- 클로로 -4-((( 에틸아미노 )카르보닐)아미노) 페녹시 )-7-히드록시-6-퀴놀린카르복사미드
N6-메톡시-7-벤질옥시-4-(3-클로로-(4-((에틸아미노)카르보닐)아미노)페녹시)-6-퀴놀린카르복사미드)(68.3 mg, 0.131 mmol)로부터 실시예 83과 같은 식의 수법에 의해, 표제 화합물(43.3 mg, 0.101 mmol, 77%)을 황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 1.08(3H, t, J=7.2Hz), 3.14(2H, m), 3.76(3H, s), 6.43(1H, d, J=5.2Hz), 7.00(1H, t, J=5.2Hz), 7.25(1H, dd, J=2.8, 9.2Hz), 7.34(1H, brs), 7.48(1H, d, J=2.8Hz), 8.07(1H, s), 8.27(1H, d, J=9.2Hz), 8.60(1H, d, J=5.2Hz), 8.64(1H, s).
실시예
734
N6 - 메틸 -4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드
메틸아민의 메탄올 용액을 이용하여, 실시예 249와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.44(2H, m), 2.62-2.68(2H, m), 2.50-2.60(1H, m), 2.85(3H, d, J=4.8Hz), 3.37(3H, s), 3.79(2H, t, J=4.4Hz), 4.39(2H, t, J=4.4Hz), 6.52(1H, d, J=5.2Hz), 7.18(1H, d, J=2.4Hz), 7.23(1H, dd, J=8.8Hz, 2.4Hz), 7.48(1H, d, J=2.4Hz), 7.55(1H, s), 7.96(1H, s), 8.26(1H, d, J=8.8Hz), 8.35(1H, q, J=4.8Hz), 8.65(1H, d, J=5.2Hz), 8.66(1H, s).
실시예
735
N6 -에틸-4-(3- 클로로 -4-((( 시클로프로필아미노 )카르보닐)아미노) 페녹시 )-7-(2-메톡시에톡시)-6-퀴놀린카르복사미드
에틸아민의 테트라히드로푸란 용액을 이용하여, 실시예 249와 같은 식으로 목적물을 얻었다.
1H-NMR(DMSO-d6) δ(ppm) : 0.38-0.44(2H, m), 2.62-2.68(2H, m), 1.15(3H, t, J=7.2Hz), 2.50-2.60(1H, m), 3.27-3.40(2H, m), 3.36(3H, s), 3.79(2H, t, J=4.4Hz), 4.39(2H, t, J=4.4Hz), 6.51(1H, d, J=5.6Hz), 7.18(1H, d, J=2.8Hz), 7.23(1H, dd, J=8.8Hz, 2.8Hz), 7.48(1H, d, J=2.8Hz), 7.54(1H, s), 7.96(1H, s), 8.26(1H, d, J=8.8Hz), 8.34(1H, t, J=4.8Hz), 8.65(1H, d, J=5.6Hz), 8.68(1H, s).
실시예
736
N-(2- 클로로 -4-(6- 시아노 -7-(3-(1- 피페리디노 ) 프로폭시 )-4- 퀴놀릴 ) 옥시페닐 )-N'-시클로프로필우레아
N-(4-(6-시아노-7-히드록시-4-퀴놀릴)옥시-2-클로로페닐)-N'-시클로프로필우레아(500 mg, 1.60 mmol)와 1-(3-클로로필)피페리딘 히드로클로라이드로부터, 실시예 7과 같은 식의 수법에 의해 표제 화합물(102.2 mg, 0.197 mmol, 12.3%)을 담황색 결정으로서 얻었다.
1H-NMR Spectrum (DMSO-d6) δ(ppm) : 0.42(2H, m), 0.65(2H, m), 1.37(2H, m), 1.48(2H, m), 1.96(2H, m), 2.34(4H, m), 2.43-2.49(4H, m), 2.56(1H, m), 4.31(2H, m), 6.57(1H, d, J=5.2Hz), 7.19(1H, d, J=2.8Hz), 7.25(1H, dd, J=2.8, 8.8Hz), 7.49(1H, d, J=2.8Hz), 7.59(1H, s), 7.98(1H, s), 8.27(1H, d, J=8.8Hz), 8.71-8.74(2H, m).
실시예
737
N-(3-
플루오로페닐
)-
N'
-(4-(
티에노[2,3-d]피리미딘
-4-
일옥시
)
페닐
)
우레아
4-(4-니트로페녹시)티에노[2,3-d]피리미딘 250 mg에, 철분 370 mg, 염화암모늄 750 mg, 에탄올 30 ml, 물 3 ml를 가하여 80-85℃에서 2.5시간동안 교반했다. 실온으로 되돌린 후 테트라히드로푸란을 가하여, 세라이트 여과하고, 여과액에 초산에틸, 물을 가하여, 분액 추출했다. 유기층을 포화식염수로 세척하고, 무수황산나트륨으로 건조시켜, 면전 여과, 농축 건조시켜 아미노체 182 mg을 얻었다. 이중 70 mg을 톨루엔 4 ml, 아세토니트릴 4 ml에 환류하여 용해시키고, 3-플루오로페닐이소시아네이트(90 ㎕)를 가하여 1시간동안 교반했다. 실온에 방치하여, 석출된 결정을 여과 수취하고, 건조시켜 표제 화합물 73 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.72-6.80(1H, m), 7.12(1H, d, J=7.7Hz), 7.22(2H, d, J=7.7Hz), 7.28(1H, dd, J=14.2Hz, 7.1Hz), 7.49(1H, d, J=14.2Hz), 7.52(2H, d, J=7.7Hz) 7.64(1H, dd, J=6.5Hz, 1.5Hz), 7.84(1H, d, J=6.5Hz), 8.60(1H, s,), 9.00(1H, s,), 9.10(1H, s)
중간체는 다음과 같은 식으로 합성했다.
제조예
737-1
4-(4-
니트로페녹시
)
티에노
[2,3-d]피리미딘
Seans Acad. Sci., Ser, C(1967)264(2)207에 기재된 화합물 4-클로로티에노[2,3-d]피리미딘 302 mg에 4-니트로페놀 600 mg, 탄산칼륨 1.2 g, 디메틸포름아미드 2 ml를 가하여 130℃에서 30시간동안 교반한 후, 실온으로 하여 물을 가하고, 초산에틸-테트라히드로푸란 혼합 용매로 분액 추출하여, 농축 건조시켜 생성된 고체를 에테르로 세척하여, 표제 화합물 250 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.63(2H, d, J=8.7Hz), 7.68(1H, d, J=6.1Hz), 8.00(1H, d, J=6.1Hz), 8.35(2H, d, J=8.7Hz), 8.65(1H, s,)
실시예
738
N-(4-
플루오로페닐
)-
N'
-(4-(
티에노[2,3-d]피리미딘
-4-
일옥시
)
페닐
)
우레아
실시예 737에 기재한 아미노체 90 mg으로부터 4-플루오로페닐이소시아네이트(90 ㎕)를 이용하여 실시예 737과 같은 방법으로 표제 화합물 92 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.12(2H, t, J=9.6Hz), 7.20(2H, d, J=8.6Hz), 7.46(2H, dd, J=9.6Hz, 5.2Hz), 7.52(2H, d, J=8.6Hz), 7.63(1H, d, J=6.2Hz), 7.94(1H, d, J=6.2Hz), 8.59(1H, s), 8.89(1H, s), 8.94(1H, s)
실시예
739
N-(3-
플루오로페닐
)-
N'
-(4-(
티에노[3,2-d]피리미딘
-4-
일옥시
)
페닐
)
우레아
실시예 737에 기재한 방법과 같은 식으로 4-(4-니트로페녹시)티에노[3,2-d]피리미딘 375 mg으로부터 아미노체 310 mg을 얻었다. 이 아미노체 135 mg으로부터, 실시예 737에 기재한 방법에 의해, 3-플루오로페닐이소시아네이트(90 ㎕)를 이용하여, 표제 화합물 250 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 6.72-7.56(8H, m), 7.65(1H, d, J=6.2Hz), 8.44(1H, d, J=6.2Hz), 8.68(1H, s,), 8.86(1H, s,), 8.95(1H, s)
중간체는 다음과 같이 합성했다.
제조예
739-1
4-(4-
니트로페녹시
)
티에노
[3,2-d]피리미딘
제조예 737-1에 기재한 방법에 의해, Seans Acad. Sci., Ser, C(1967) 264(1)100에 기재한 화합물 4-클로로티에노[3,2-d]피리미딘 315 mg으로부터 표제 화합물 382 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.63-7.69(2H, m), 7.70(1H, d, J=6.1Hz), 8.32-8.38(2H, m), 8.51(1H, d, J=6.1Hz), 8.73(1H, s,)
실시예
740
N-(4-
플루오로페닐
)-
N'
-(4-(
티에노[3,2-d]피리미딘
-4-
일옥시
)
페닐
)
우레아
실시예 739에 기재한 아미노체 150 mg으로부터 실시예 737과 같은 방법에 의해 4-플루오로페닐이소시아네이트(94 ㎕)를 이용하여 표제 화합물 135 mg을 얻었다.
1H-NMR Spectrum : (DMSOd6) 7.00-7.56(8H, m), 7.65(1H, d, J=6.1Hz), 8.44(1H, d, J=6.1Hz), 8.67(1H, s), 8.73(1H, s), 8.78(1H, s)
실시예
741
N-(4-(6,7-
디메톡시퀴놀린
-4-
일옥시
)
페닐
)-
N'
-(3-
메탄설포닐페닐
)
우레아
WO 97/17329의 방법에 의해 얻어지는 4-(6,7-디메톡시퀴놀린-4-일옥시)페닐아민(296 mg, 1.00 mmol) 및 (3-메탄설포닐페닐)카르바민산페닐에스테르(291 mg, 1.00 mmol)를 디메틸설폭시드(3 ml) 중에, 85℃에서 2시간동안 가열 교반했다. 반응액을 초산에틸과 물에 분배하여, 유기층을 1N-수산화나트륨 수용액, 물, 포화식염수로 세척하고, 무수황산마그네슘으로 건조시켜, 건조제를 여과 분별하고, 여과액을 감압 증류 수거했다. 얻어진 미정제 생성물을 실리카겔 컬럼 크로마토그래피(용출액; 초산에틸:메탄올=30:1)에 가하여, 목적물을 포함하는 분획을 농축하고, 초산에틸에 현탁시켜, 이것을 헥산으로 희석하여 결정을 여과 수취하고, 헥산으로 세척한 후, 통풍 건조시킴으로써, 표제 화합물(430 mg, 0.871 mmol, 87%)을 무색 결정으로서 얻었다.
1H-NMR Spectrum (CDCl3) δ(ppm) : 3.16(3H, s), 4.03(3H, s), 4.05(3H, s), 6.46(1H, d, J=5.2Hz), 7.12-7.18(2H, m), 7.41(1H, s), 7.50-7.62(6H, m), 7.81(1H, s), 7.93(1H, s), 8.11-8.15(1H, m), 8.48(1H, d, J=5.2Hz).
실시예
742
N-(2- 클로로 -4-((6- 시아노 -7-(4- 피페리딜메톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐 )- N' - 메틸우레아
N-(2-클로로-4-(6-시아노-7-히드록시퀴놀린-4-일옥시)페닐)-N'-메틸우레아(125 mg)를 디메틸포름아미드(1.5 ml)에 가하여, 여기에 tert-부틸 4-(브로모메틸)-1-피페리딘카르복실레이트(141 mg)와 탄산칼륨(93 mg)을 가하여, 60℃에서 3시간동안 가열했다. 이 반응 용액에 물을 가하여 초산에틸로 추출하고, 유기층을 물, 포화식염수의 순으로 세척한 후, 무수황산나트륨으로 건조시켜 용매를 감압 증류 수거했다. 얻어진 미정제 생성물을 초산에틸로 재결정하여, tert-부틸 4-(((4-(3-클로로-4-((메틸아미노)카르보닐)아미노페녹시)-6-시아노-7-퀴놀릴)옥시)메틸)-1-피페리딘카르복실레이트(21 mg)를 담황색 결정으로서 얻었다. 이것을 트리플루오로초산(1.0 ml)에 용해하여, 10분간 실온에서 교반했다. 여기에 물 2 ml를 가하여 탄산수소나트륨으로 중화하고, 석출된 결정을 여과 수취하여, 표제 화합물(16 mg)을 얻었다.
H-NMR(DMSO-d6) δ(ppm) : 1.20-1.35(4H, m), 1.70-1.80(2H, m), 1.90-2.01(1H, m), 2.66(3H, d, J=4.4Hz), 2.95-3.05(2H, m), 4.12(2H, d, J=6.0Hz), 6.58(1H, d, J=5.2Hz), 6.84-6.92(1H, m), 7.21-7.26(1H, m), 7.48(1H, d, J=2.4Hz), 7.59(1H, s), 8.12(1H, s), 8.22-8.28(1H, m), 8.71-8.78(2H, m).
실시예
743
N-(2- 클로로 -4-((6- 시아노 -7-((1- 메틸 -4- 피페리딜 ) 메톡시 )-4- 퀴놀릴 ) 옥시 ) 페닐)-N'-메틸우레아
N-(2-클로로-4-((6-시아노-7-(4-피페리딜메톡시)-4-퀴놀릴)옥시)페닐)-N'-메틸우레아(15 mg)를 테트라히드로푸란(0.5 ml)과 메탄올(0.5 ml)에 용해시킨 후, 37% 포름알데히드 수용액(0.03 ml), 초산(0.06 ml), 나트륨시아노보로히드라이드(5.0 mg)를 실온에서 가하여, 1시간동안 교반했다. 반응액에 물을 가하여, 포화탄산수소나트륨 수용액으로 중화하고, 이것을 초산에틸로 추출했다. 유기층을 물로 세척하여, 용매를 증류 제거하여 미정제 생성물을 얻었다. 이것을 초산에틸로 재결정하여 표제 화합물(10 mg)을 백색 결정으로서 얻었다.
H-NMR(DMSO-d6) δ(ppm) : 1.13-1.47(2H, m), 1.75-1.95(5H, m), 2.17(3H, s), 2.68(3H, s), 2.78-2.87(2H, m), 4.17(2H, d, J=6.0Hz), 6.59(1H, d, J=5.2Hz), 6.95(1H, brs), 7.22-7.28(1H, m), 7.48(1H, d, J=2.4Hz), 7.61(1H, s), 8.18(1H, brs), 8.22-8.29(1H, m), 8.72-8.77(2H, m).
이상의 제조예 및 실시예에 있어서 얻어진 화합물의 구조식을 이하의 표 4∼표 51에 나타낸다.
본 발명에 의해, (1) 상피 세포 증식 인자(Epidermal Growth Factor, EGF라 약기한다)/VEGF/섬유아세포 증식 인자(Fibroblast Growth Factor 2, FGF2라 약기한다)/간세포 증식 인자(Hepatocyte Growth Factor, HGF라 약기한다)/종양 괴사 인자 알파(Tumor Necrosis Factor alpha, TNF-α라 약기함)로 구성되는 혈관 신생 인자 혼합액에 의해 유도되는 혈관 내피세포의 침윤적 관강 형성의 강력한 억제 작용, (2) 단독 혈관 신생 인자, (예컨대 VEGF, FGF, HGF 등의 여러 가지 인자)에 의해서 특이적으로 유도되는 혈관 내피 세포의 관강 형성에 대한 강한 억제 작용, (3) 여러 가지 혈관 신생 인자의 수용체 키나아제에 대한 강한 억제 작용 등의 작용을 지니고, 또, 의약으로서도 유용성이 높은 신규 화합물을 제공하는 것이 가능해진다.
또, 상기 (1)에서부터 (3)의 작용을 갖는 화합물군 중에서, 종양 세포의 증식 억제 작용을 갖는 화합물군을 제공하는 것도 가능해진다.
한편, 생체에 있어서의 혈관 신생은 단독 혈관 신생 인자가 아니라 복수의 혈관 신생 인자의 상가·상승적인 작용에 의해 진행되는 것이 알려져 있다((1) Koolwijk P, van Erck MGM, de Vree WJA, Vermeer MA, Weich HA, Hane maaijer R, van Hinsbergh VWM. Cooperative effect of TNF-alpha, bFGF and VEGF on the formation of tubular structures of human microvascular endothelial cells in a fibrin matrix. Role of urokinase activity. J. Cell Biol. 1996, 132, P 1177-1188.; (2) Tallquist MD, Soriano P, Klinghoffer RA. Growth factor signaling pathways in vascular development. Oncogene 1999, 18, P 7917-7932.).
따라서, 암 세포 등에 의해 산생되는 복수의 혈관 신생 인자에 의해 유도되는 관강 형성을 억제하는 본 발명 화합물은 생체에 있어서 강력한 혈관 신생 저해 작용을 보이는 것이 기대되며, 혈관 신생 저해제로서 매우 유용하다. 또, 본 발명 화합물은 혈관 신생 저해 작용이 유효한 질환에 대한 예방·치료제, 혈관 신생 저해제, 항종양제, 혈관종 치료제, 암전이 억제제, 망막혈관신생증 치료제 또는 당뇨병성망막증 치료제, 염증성 질환 치료제, 변형성 관절염, 류머티스성 관절염, 건선 또는 지연성 과민 반응으로 이루어지는 염증성 질환 치료제, 아테롬성 동맥경화증 치료제, 혈관 신생 저해 작용에 기초한 항종양제로서도 유용하다.
Claims (25)
- 하기 화학식 Ⅱ로 표시되는 화합물 또는 그 염 또는 이들의 수화물.화학식 Ⅱ{식중, A는 화학식[식중, W는 A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 탄소 원자 또는 질소 원자이고; Ab11은 (1) A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기 또는 (2) 화학식(식중, Vb11 및 Vb12는 각각 독립적으로 단결합, -NHCO- 또는 화학식 -(CH2)b-CO-(식중 b는 0에서부터 6까지의 정수임)로 표시되는 기이고;Rb13은 단결합, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬렌기, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C3-8 지환식 탄화수소기 또는 A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기이고;Rb11 및 Rb12는 각각 독립적으로 수소 원자, 수산기, 할로겐 원자, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬기, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C3-8 지환식 탄화수소기, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C6-14 아릴기, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기 또는 A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기임)];X는 산소 원자 또는 황 원자이고;E 및 Y는 다음과 같다:(1) E는 화학식 -NR2-로 표시되는 기이며, Y는 A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 페닐기이고;(2) E는 단결합이며, Y는 A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 화학식(식중, W13은 A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 탄소 원자임);R1 및 R2는 각각 독립적으로 수소 원자이고;Z는 화학식 -Z11-Z12로 표시되는 기(식중, Z11은 단결합이고, Z12는 수소 원자, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬기, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C3-8 지환식 탄화수소기, A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C6-14 아릴기 또는 A군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기임)}A군은,(1) 할로겐 원자, (2) 수산기, (3) 티올기, (4) 니트로기, (5) 니트릴기, (6) 옥소기, (7) 아지도기, (8) 구아니디노기, (9) 히드라지노기, (10) 이소시아노기, (11) 시아네이트기, (12) 이소시아네이트기, (13) 티오시아네이트기, (14) 이소티오시아네이트기, (15) 니트로소기, (16) 카르바미도기(우레이도기), (17) 포르밀기, (18) C1-6 이미도일기, (19) 할로겐화 또는 수산화되어도 좋은, C1-6 알킬기, C2-6 알케닐기, C2-6 알키닐기, C3-6 시클로알킬기, C3-6 시클로알케닐기, C3-6 시클로알키닐기, C1-6 알콕시기, C2-6 알케닐옥시기, C2-6 알키닐옥시기, C3-6 시클로알킬옥시기, C1-6 알킬티오기, C2-6 알케닐티오기, C2-6 알키닐티오기, C3-6 시클로알킬티오기, 또는 C1-6 알킬렌디옥시기, (20) C6-14 아릴기, (21) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기, (22) 카르복실기, (23) 트리플루오로메틸기, (24) C6-14 아릴-C1-6 알킬기 (25) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환 C1-6 알킬기 또는 (26) 식 -VXX1- VXX2-VXX3-VXX4로 표시되는 기(식중, VXX1, VXX2 및 VXX3은 각각 독립적으로 1) 단결합, 2) 산소 원자, 3) 황 원자, 4) 식 -CO-, 5) 식 -SO-, 6) 식 -SO2-, 7) 식 -NRXX1-, 8) 식 -CONRXX1-, 9) 식 -NRXX1CO-, 10) 식 -SO2NRXX1-, 11) 식 -NRXX1SO2-, 12) 식 -O-CO-, 13) 식 -C(O)O-, 14) 식 -NRXX1C(O)O-, 15) 식 -NRXX1C(O)NRXX2-, 16) 식 -O-C(O)NRXX1-, 17) 식 -O-C(O)O-, 18) C1-6 알킬렌기, 19) C2-6 알케닐기, 20) C1-6 알키닐기, 21) C3-8 지환식 탄화수소기, 22) C6-14 아릴기, 23) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기 또는 24) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기이고; VXX4, RXX1 및 RXX2는 각각 독립적으로 1) 수소 원자, 2) C1-6 알킬기, 3) C2-6 알케닐기, 4) C1-6 알키닐기, 5) C3-8 지환식 탄화수소기, 6) C6-14 아릴기, 7) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기, 8) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기 또는 9) C1-6 알콕시기임)
- 하기 화학식 Ⅱ로 표시되는 화합물 또는 그 염 또는 이들의 수화물.화학식 Ⅱ{식중, A가 화학식[식중, W는 질소 원자이고;Rc13은 수소 원자, B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬기 또는 화학식(식중, Vc21은 메틸렌기이고; Vc22 및 Vc23은 각각 독립적으로 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬기임);Rc12는 수소 원자 또는 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬기이고;Rc11은 화학식 -Vc11-Vc12-Vc13로 표시되는 기(식중, Vc11은 단결합, B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 벤젠 고리, B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기 또는 -CO-이고; Vc12는 단결합 또는 산소 원자이고; Vc13은 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬기, 수산기, 카르복실기, B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기 또는 수소 원자임)];X는 산소 원자 또는 황 원자이고;E 및 Y는 다음과 같다:(1) E는 화학식 -NR2-로 표시되는 기이며, Y는 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 페닐기 또는 화학식(식중, W11 및 W12는 각각 독립적으로 탄소 원자 또는 질소 원자임);(2) E는 단결합이며, Y는 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 화학식(식중, W13은 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 탄소 원자 또는 질소 원자임);R1 및 R2는 각각 독립적으로 수소 원자이고;Z는 화학식 -Z11-Z12로 표시되는 기(식중, Z11은 단결합이고, Z12는 수소 원자, B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C1-6 알킬기, B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C3-8 지환식 탄화수소기, B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은 C6-14 아릴기 또는 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기임)}B군은,(1) 할로겐 원자, (2) 수산기, (3) 티올기, (4) 니트로기, (5) 니트릴기, (6) 옥소기, (7) 아지도기, (8) 구아니디노기, (9) 히드라지노기, (10) 이소시아노기, (11) 시아네이트기, (12) 이소시아네이트기, (13) 티오시아네이트기, (14) 이소티오시아네이트기, (15) 니트로소기, (16) 카르바미도기(우레이도기), (17) 포르밀기, (18) C1-6 이미도일기, (19) 할로겐화 또는 수산화되어도 좋은, C1-6 알킬기, C2-6 알케닐기, C2-6 알키닐기, C3-6 시클로알킬기, C3-6 시클로알케닐기, C3-6 시클로알키닐기, C1-6 알콕시기, C2-6 알케닐옥시기, C2-6 알키닐옥시기, C3-6 시클로알킬옥시기, C1-6 알킬티오기, C2-6 알케닐티오기, C2-6 알키닐티오기, C3-6 시클로알킬티오기, 또는 C1-6 알킬렌디옥시기, (20) C6-14 아릴기, (21) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기, (22) 카르복실기, (23) 트리플루오로메틸기, (24) C6-14 아릴-C1-6 알킬기 (25) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환 C1-6 알킬기 또는 (26) 식 -VXX1- VXX2-VXX3-VXX4로 표시되는 기(식중, VXX1, VXX2 및 VXX3은 각각 독립적으로 1) 단결합, 2) 산소 원자, 3) 황 원자, 4) 식 -CO-, 5) 식 -SO-, 6) 식 -SO2-, 7) 식 -NRXX1-, 8) 식 -CONRXX1-, 9) 식 -NRXX1CO-, 10) 식 -SO2NRXX1-, 11) 식 -NRXX1SO2-, 12) 식 -O-CO-, 13) 식 -C(O)O-, 14) 식 -NRXX1C(O)O-, 15) 식 -NRXX1C(O)NRXX2-, 16) 식 -O-C(O)NRXX1-, 17) 식 -O-C(O)O-, 18) C1-6 알킬렌기, 19) C2-6 알케닐기, 20) C1-6 알키닐기, 21) C3-8 지환식 탄화수소기, 22) C6-14 아릴기, 23) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기 또는 24) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기이고; VXX4, RXX1 및 RXX2는 각각 독립적으로 1) 수소 원자, 2) C1-6 알킬기, 3) C2-6 알케닐기, 4) C1-6 알키닐기, 5) C3-8 지환식 탄화수소기, 6) C6-14 아릴기, 7) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 복소환식기, 8) 질소, 황 및 산소로 이루어진 군 중에서 선택되는 1 이상의 헤테로 원자를 포함하는 5 내지 14원 방향족 복소환식기 또는 9) C1-6 알콕시기임)
- 삭제
- 삭제
- 삭제
- 하기 화학식 Ⅲf로 표시되는 화합물 또는 그 염 또는 이들의 수화물.화학식 Ⅲf(식중, Rc13은 제2항의 Rc13과 동일한 정의를 가지고,Xy2는 제2항의 B군 중에서 선택되는 1 이상의 치환기를 갖고 있어도 좋은, 화학식(식중, Z12, R1 및 R2는 제2항의 Z12, R1 및 R2와 동일한 정의를 가지고; W11은 탄소 원자 또는 질소 원자임);Rc11 및 Rc12는 제2항의 Rc11 및 Rc12와 동일한 정의를 갖고, 다만 하기 화합물 (1) 및 (2)를 제외함:(1) R1 및 R2가 수소 원자이며, Z12가 (a) C6-14 아릴기, (b) 5 내지 14원 복소환식기, (c) 5 내지 14원 방향족 복소환식기, 5 내지 10원 복소환식기 또는 C5-10 지환식 탄화수소기로 치환된 C1-6 알킬기, (d) 5 내지 10원 복소환식기 또는 C5-10 지환식 탄화수소기로 치환된 C2-6 알케닐기, (e) 5 내지 10원 복소환식기 또는 C5-10 지환식 탄화수소기로 치환된 C2-6 알키닐기 또는 (f) 5 내지 10원 복소환식기 또는 C5-10 지환식 탄화수소기로 치환된 C3-8 지환식 탄화수소기인 화합물;(2) Xy2가 화학식(식중, Z12는 (a) C6-14 아릴기, (b) 5 내지 14원 복소환식기, (c) 5 내지 14원 방향족 복소환식기, (d) 5 내지 10원 복소환식기 또는 C5-10 지환식 탄화수소기로 치환된 C1-6 알킬기, (e) 5 내지 10원 복소환식기 또는 C5-10 지환식 탄화수소기로 치환된 C2-6 알케닐기, (f) 5 내지 10원 복소환식기 또는 C5-10 지환식 탄화수소기로 치환된 C2-6 알키닐기 또는 (g) C3-8 지환식 탄화수소기임)]
- 삭제
- 삭제
- 삭제
- 제1항 또는 제2항에 있어서, 상기 화합물이,N4-(4-{4-[(아닐리노카르보닐)아미노]-3-클로로페녹시}-2-피리딜)-1-메틸-4-피페리딘카르복사미드, N1-페닐-3-클로로-5-[(2-{[(1-메틸-4-피페리딜)카르보닐]아미노}-4-피리딜)옥시]-1H-1-인돌카르복사미드, N4-[4-(3-클로로-4-{[(4-플루오로아닐리노)카르보닐]아미노}페녹시)-2-피리딜]-1-메틸-4-피페리딘카르복사미드, 1-(2-클로로-4-{6-[4-(2-디에틸아미노에톡시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아, 1-{2-클로로-4-[6-[4-((2R)-2-히드록시-3-디에틸아미노프로폭시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시]-페닐}-3-시클로프로필우레아, 1-(2-클로로-4-{6-[4-((2R)-2-히드록시-3-피롤리디노프로폭시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시}-페닐)-3-시클로프로필우레아 및 1-(2-클로로-4-{6-[4-(2-디에틸아미노프로폭시)-페닐]-7H-피롤로[2,3-d]피리미딘-4-일옥시}페닐)-3-시클로프로필우레아로부터 선택되는 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물.
- 삭제
- 삭제
- 삭제
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 혈관 신생 저해제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 항종양제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 혈관종 치료제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 암전이 억제제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 망막 혈관신생증 치료제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 염증성 질환 치료제.
- 제21항에 있어서, 상기 염증성 질환이 변형성 관절염, 류마티스성 관절염, 건선 및 지연성 과민 반응으로부터 선택되는 것인 염증성 질환 치료제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 아테롬성 동맥경화증 치료제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 췌장암 치료제, 위암 치료제, 대장암 치료제, 유방암 치료제, 전립선암 치료제, 폐암 치료제, 신장암 치료제, 뇌종양 치료제, 혈액암 치료제 또는 난소암 치료제.
- 제1항 또는 제2항에 기재된 화합물, 또는 그 약리학적으로 허용되는 염 또는 이들의 수화물을 유효 성분으로 하는 혈관 신생 저해 작용에 기초한 항종양제.
Applications Claiming Priority (6)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2000320420 | 2000-10-20 | ||
| JPJP-P-2000-00320420 | 2000-10-20 | ||
| JP2000386195 | 2000-12-20 | ||
| JPJP-P-2000-00386195 | 2000-12-20 | ||
| JP2001046685 | 2001-02-22 | ||
| JPJP-P-2001-00046685 | 2001-02-22 |
Related Parent Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020037005506A Division KR100600550B1 (ko) | 2000-10-20 | 2001-10-19 | 질소 함유 방향환 유도체 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| KR20050108426A KR20050108426A (ko) | 2005-11-16 |
| KR100589032B1 true KR100589032B1 (ko) | 2006-06-14 |
Family
ID=27344984
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020037005506A KR100600550B1 (ko) | 2000-10-20 | 2001-10-19 | 질소 함유 방향환 유도체 |
| KR1020057020292A KR100589032B1 (ko) | 2000-10-20 | 2001-10-19 | 질소 함유 방향환 유도체 |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| KR1020037005506A KR100600550B1 (ko) | 2000-10-20 | 2001-10-19 | 질소 함유 방향환 유도체 |
Country Status (25)
| Country | Link |
|---|---|
| US (5) | US7253286B2 (ko) |
| EP (3) | EP1777218B1 (ko) |
| JP (3) | JP3712393B2 (ko) |
| KR (2) | KR100600550B1 (ko) |
| CN (3) | CN101024627A (ko) |
| AT (3) | ATE399766T1 (ko) |
| AU (4) | AU9598601A (ko) |
| BE (1) | BE2015C055I2 (ko) |
| CA (1) | CA2426461C (ko) |
| CY (2) | CY1107491T1 (ko) |
| DE (3) | DE60137273D1 (ko) |
| DK (1) | DK1415987T3 (ko) |
| ES (2) | ES2282299T3 (ko) |
| FR (1) | FR15C0070I2 (ko) |
| HU (2) | HU230302B1 (ko) |
| IL (3) | IL155447A0 (ko) |
| LU (1) | LU92858I2 (ko) |
| MX (1) | MX242553B (ko) |
| NL (1) | NL300764I2 (ko) |
| NO (3) | NO326781B1 (ko) |
| NZ (1) | NZ525324A (ko) |
| PT (1) | PT1415987E (ko) |
| RU (1) | RU2264389C3 (ko) |
| TW (1) | TWI304061B (ko) |
| WO (1) | WO2002032872A1 (ko) |
Cited By (15)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8815241B2 (en) | 2005-11-07 | 2014-08-26 | Eisai R&D Management Co., Ltd. | Use of combination of anti-angiogenic substance and c-kit kinase inhibitor |
| US8865737B2 (en) | 2006-08-28 | 2014-10-21 | Eisai R&D Management Co., Ltd. | Antitumor agent for undifferentiated gastric cancer |
| US8952035B2 (en) | 2007-11-09 | 2015-02-10 | Eisai R&D Management Co., Ltd. | Combination of anti-angiogenic substance and anti-tumor platinum complex |
| US8962650B2 (en) | 2011-04-18 | 2015-02-24 | Eisai R&D Management Co., Ltd. | Therapeutic agent for tumor |
| US8969344B2 (en) | 2005-08-02 | 2015-03-03 | Eisai R&D Management Co., Ltd. | Method for assay on the effect of vascularization inhibitor |
| US8969379B2 (en) | 2004-09-17 | 2015-03-03 | Eisai R&D Management Co., Ltd. | Pharmaceutical compositions of 4-(3-chloro-4-(cyclopropylaminocarbonyl)aminophenoxy)-7=methoxy-6-quinolinecarboxide |
| US9006256B2 (en) | 2006-05-18 | 2015-04-14 | Eisai R&D Management Co., Ltd. | Antitumor agent for thyroid cancer |
| US9012458B2 (en) | 2010-06-25 | 2015-04-21 | Eisai R&D Management Co., Ltd. | Antitumor agent using compounds having kinase inhibitory effect in combination |
| US9334239B2 (en) | 2012-12-21 | 2016-05-10 | Eisai R&D Management Co., Ltd. | Amorphous form of quinoline derivative, and method for producing same |
| US9945862B2 (en) | 2011-06-03 | 2018-04-17 | Eisai R&D Management Co., Ltd. | Biomarkers for predicting and assessing responsiveness of thyroid and kidney cancer subjects to lenvatinib compounds |
| US10259791B2 (en) | 2014-08-28 | 2019-04-16 | Eisai R&D Management Co., Ltd. | High-purity quinoline derivative and method for manufacturing same |
| US10517861B2 (en) | 2013-05-14 | 2019-12-31 | Eisai R&D Management Co., Ltd. | Biomarkers for predicting and assessing responsiveness of endometrial cancer subjects to lenvatinib compounds |
| US11090386B2 (en) | 2015-02-25 | 2021-08-17 | Eisai R&D Management Co., Ltd. | Method for suppressing bitterness of quinoline derivative |
| US11369623B2 (en) | 2015-06-16 | 2022-06-28 | Prism Pharma Co., Ltd. | Anticancer combination of a CBP/catenin inhibitor and an immune checkpoint inhibitor |
| US11547705B2 (en) | 2015-03-04 | 2023-01-10 | Merck Sharp & Dohme Llc | Combination of a PD-1 antagonist and a VEGF-R/FGFR/RET tyrosine kinase inhibitor for treating cancer |
Families Citing this family (263)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US7517880B2 (en) * | 1997-12-22 | 2009-04-14 | Bayer Pharmaceuticals Corporation | Inhibition of p38 kinase using symmetrical and unsymmetrical diphenyl ureas |
| US8124630B2 (en) | 1999-01-13 | 2012-02-28 | Bayer Healthcare Llc | ω-carboxyaryl substituted diphenyl ureas as raf kinase inhibitors |
| ES2377847T3 (es) | 1999-01-13 | 2012-04-02 | Bayer Healthcare Llc | Difenil ureas sustituidas con omega-carboxi arilo como agentes inhibidores de la cinasa p38 |
| AU9598601A (en) | 2000-10-20 | 2002-04-29 | Eisai Co Ltd | Nitrogenous aromatic ring compounds |
| MXPA03009662A (es) * | 2001-04-27 | 2004-12-06 | Kirin Brewery | Derivados de quinolina y derivados de quinazolina que tienen grupos azolilo. |
| WO2002092603A1 (en) * | 2001-05-14 | 2002-11-21 | Novartis Ag | Oxazolo-and furopyrimidines and their use in medicaments against tumors |
| DE60233736D1 (de) | 2001-06-22 | 2009-10-29 | Kirin Pharma K K | Chinolinderivat und chinazolinderivat, die die selbstphosphorylierung des hepatocytus-proliferator-rezeptors hemmen, und diese enthaltende medizinische zusammensetzung |
| GB0119249D0 (en) | 2001-08-07 | 2001-10-03 | Novartis Ag | Organic compounds |
| US7323469B2 (en) | 2001-08-07 | 2008-01-29 | Novartis Ag | 7H-pyrrolo[2,3-d]pyrimidine derivatives |
| WO2003033472A1 (fr) * | 2001-10-17 | 2003-04-24 | Kirin Beer Kabushiki Kaisha | Derives de quinoline ou de quinazoline inhibant l'autophosphorylation de recepteurs du facteur de croissance des fibroblastes |
| WO2003068229A1 (en) | 2002-02-11 | 2003-08-21 | Bayer Pharmaceuticals Corporation | Pyridine, quinoline, and isoquinoline n-oxides as kinase inhibitors |
| CA2475703C (en) | 2002-02-11 | 2016-12-20 | Bayer Pharmaceuticals Corporation | Aryl ureas with angiogenesis inhibiting activity |
| EP1481678A4 (en) * | 2002-03-05 | 2009-12-30 | Eisai R&D Man Co Ltd | ANTITUMORAL AGENT CONTAINING A SULFONAMIDE-CONTAINING HETEROCYCLIC COMPOUND AND AN ANGIOGENESIS INHIBITOR |
| US7598258B2 (en) | 2002-05-01 | 2009-10-06 | Kirin Beer Kabushiki Kaisha | Quinoline derivatives and quinazoline derivatives inhibiting autophosphorylation of macrophage colony stimulating factor receptor |
| PE20040522A1 (es) * | 2002-05-29 | 2004-09-28 | Novartis Ag | Derivados de diarilurea dependientes de la cinasa de proteina |
| EP2270006A1 (en) | 2002-08-08 | 2011-01-05 | Amgen, Inc | Pyridazine derivatives useful as vanilloid receptor ligands |
| CA2488739A1 (en) * | 2002-08-30 | 2004-03-11 | Eisai Co., Ltd. | Nitrogen-containing aromatic derivatives |
| AU2003301430A1 (en) * | 2002-10-21 | 2004-05-04 | Kirin Beer Kabushiki Kaisha | N-{2-chloro-4-((6,7-dimethoxy-4-quinolyl)oxy)phenyl}-n'-(5-methyl-3-isoxazolyl)urea salt in crystalline form |
| AU2003280599A1 (en) * | 2002-10-29 | 2004-05-25 | Kirin Beer Kabushiki Kaisha | QUINOLINE DERIVATIVES AND QUINAZOLINE DERIVATIVES INHIBITING AUTOPHOSPHORYLATION OF Flt3 AND MEDICINAL COMPOSITIONS CONTAINING THE SAME |
| AR041992A1 (es) * | 2002-11-06 | 2005-06-08 | Smithkline Beecham Corp | Compuesto de piridinil benzoheterociclico, composicion farmaceutica que lo comprende y su uso para prepararla |
| US7557129B2 (en) | 2003-02-28 | 2009-07-07 | Bayer Healthcare Llc | Cyanopyridine derivatives useful in the treatment of cancer and other disorders |
| JPWO2004080462A1 (ja) * | 2003-03-10 | 2006-06-08 | エーザイ株式会社 | c−Kitキナーゼ阻害剤 |
| MXPA05010782A (es) * | 2003-04-07 | 2005-12-12 | Axys Pharm Inc | Nuevos hidroxamatos como agentees terapeuticos. |
| KR101158270B1 (ko) * | 2003-04-16 | 2012-06-20 | 훈츠만 어드밴스트 머티리얼스(스위처랜드) 게엠베하 | 1-이미다졸릴메틸-치환된-2-나프톨 및 저온 경화용촉진제로서 이들의 용도 |
| WO2004101526A1 (ja) * | 2003-04-22 | 2004-11-25 | Eisai Co., Ltd. | 4-(3-クロロ-4-(シクロプロピルアミノカルボニル)アミノフェノキシ)-7-メトキシ-6-キノリンカルボキサミドの多形結晶及びその製造方法 |
| US7253166B2 (en) | 2003-04-22 | 2007-08-07 | Irm Llc | 6-phenyl-7H-pyrrolo[2,3-d]pyrimidine compounds that induce neuronal differentiation in embryonic stem cells |
| AR044519A1 (es) | 2003-05-02 | 2005-09-14 | Novartis Ag | Derivados de piridin-tiazol amina y de pirimidin-tiazol amina |
| US20070020704A1 (en) | 2003-05-20 | 2007-01-25 | Scott Wilhelm | Diaryl ureas with kinase inhibiting activity |
| US8309562B2 (en) | 2003-07-03 | 2012-11-13 | Myrexis, Inc. | Compounds and therapeutical use thereof |
| WO2006074147A2 (en) | 2005-01-03 | 2006-07-13 | Myriad Genetics, Inc. | Nitrogen containing bicyclic compounds and therapeutical use thereof |
| DE602004010407T2 (de) | 2003-07-23 | 2008-10-16 | Bayer Pharmaceuticals Corp., West Haven | Fluorsubstituierter omega-carboxyaryldiphenylharnstoff zur behandlung und prävention von krankheiten und leiden |
| MXPA05011286A (es) * | 2003-08-20 | 2006-01-24 | Axys Pharm Inc | Derivados de acetileno como inhibidores de histona deacetilasa. |
| EP1673085B1 (en) * | 2003-09-26 | 2011-11-09 | Exelixis, Inc. | C-met modulators and methods of use |
| EP1670794A2 (en) * | 2003-09-30 | 2006-06-21 | Amgen Inc. | Vanilloid receptor ligands and their use in treatments |
| JP4303726B2 (ja) | 2003-11-11 | 2009-07-29 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | ウレア誘導体およびその製造方法 |
| US7767670B2 (en) * | 2003-11-13 | 2010-08-03 | Ambit Biosciences Corporation | Substituted 3-carboxamido isoxazoles as kinase modulators |
| AR047496A1 (es) * | 2003-11-28 | 2006-01-25 | Novartis Ag | Derivados de diaril-urea en el tratamiento de enfermedades dependientes de la quinasa de proteina |
| DE10357510A1 (de) * | 2003-12-09 | 2005-07-07 | Bayer Healthcare Ag | Heteroarylsubstituierte Benzole |
| EP1699780A1 (en) | 2003-12-23 | 2006-09-13 | Pfizer, Inc. | Novel quinoline derivatives |
| CN100569753C (zh) * | 2003-12-25 | 2009-12-16 | 卫材R&D管理有限公司 | 4-(3-氯-4-(环丙基氨基羰基)氨基苯氧基)-7-甲氧基-6-喹啉羧酰胺的甲磺酸盐的结晶(c)及其制备方法 |
| AU2005206571B8 (en) * | 2004-01-23 | 2010-09-02 | Amgen Inc. | Compounds and methods of use |
| JP2007518823A (ja) * | 2004-01-23 | 2007-07-12 | アムゲン インコーポレイテッド | キノリン、キナゾリン、ピリジン、及びピリミジン化合物と炎症、血管新生、及び癌に対する治療におけるそれら化合物の用途 |
| US7534798B2 (en) | 2004-02-11 | 2009-05-19 | Amgen Inc. | Vanilloid receptor ligands and their use in treatments |
| MY139645A (en) | 2004-02-11 | 2009-10-30 | Amgen Inc | Vanilloid receptor ligands and their use in treatments |
| TW200530236A (en) | 2004-02-23 | 2005-09-16 | Chugai Pharmaceutical Co Ltd | Heteroaryl phenylurea |
| KR100799535B1 (ko) * | 2004-02-27 | 2008-01-31 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 신규 피리딘 유도체 및 피리미딘 유도체(2) |
| DE102004017438A1 (de) * | 2004-04-08 | 2005-11-03 | Bayer Healthcare Ag | Hetaryloxy-substituierte Phenylaminopyrimidine |
| US7459562B2 (en) | 2004-04-23 | 2008-12-02 | Bristol-Myers Squibb Company | Monocyclic heterocycles as kinase inhibitors |
| TW200538453A (en) | 2004-04-26 | 2005-12-01 | Bristol Myers Squibb Co | Bicyclic heterocycles as kinase inhibitors |
| EP1751139B1 (en) | 2004-04-30 | 2011-07-27 | Bayer HealthCare LLC | Substituted pyrazolyl urea derivatives useful in the treatment of cancer |
| WO2005107758A1 (en) | 2004-05-06 | 2005-11-17 | Warner-Lambert Company Llc | 4-phenylamino-quinazolin-6-yl-amides |
| AU2005245386B2 (en) | 2004-05-07 | 2008-11-27 | Amgen Inc. | Nitrogenated heterocyclic derivatives as protein kinase modulators and use for the treatment of angiogenesis and cancer |
| WO2005121125A1 (en) * | 2004-06-09 | 2005-12-22 | Pfizer Inc. | Ether-linked heteroaryl compounds |
| US7432373B2 (en) | 2004-06-28 | 2008-10-07 | Bristol-Meyers Squibb Company | Processes and intermediates useful for preparing fused heterocyclic kinase inhibitors |
| US20050288290A1 (en) * | 2004-06-28 | 2005-12-29 | Borzilleri Robert M | Fused heterocyclic kinase inhibitors |
| US7439246B2 (en) | 2004-06-28 | 2008-10-21 | Bristol-Myers Squibb Company | Fused heterocyclic kinase inhibitors |
| WO2006014325A2 (en) * | 2004-07-02 | 2006-02-09 | Exelixis, Inc. | C-met modulators and method of use |
| US7507748B2 (en) * | 2004-07-22 | 2009-03-24 | Amgen Inc. | Substituted aryl-amine derivatives and methods of use |
| JP5096142B2 (ja) * | 2004-07-30 | 2012-12-12 | メチルジーン インコーポレイテッド | Vegfレセプターおよびhgfレセプターシグナル伝達の阻害剤 |
| WO2006030941A1 (ja) * | 2004-09-13 | 2006-03-23 | Eisai R & D Management Co., Ltd. | スルホンアミド含有化合物の血管新生阻害物質との併用 |
| US8772269B2 (en) | 2004-09-13 | 2014-07-08 | Eisai R&D Management Co., Ltd. | Use of sulfonamide-including compounds in combination with angiogenesis inhibitors |
| PE20060664A1 (es) | 2004-09-15 | 2006-08-04 | Novartis Ag | Amidas biciclicas como inhibidores de cinasa |
| GB0421525D0 (en) * | 2004-09-28 | 2004-10-27 | Novartis Ag | Inhibitors of protein kineses |
| US20070054916A1 (en) * | 2004-10-01 | 2007-03-08 | Amgen Inc. | Aryl nitrogen-containing bicyclic compounds and methods of use |
| US7932394B2 (en) | 2004-11-02 | 2011-04-26 | Msd K.K. | Aryloxy-substituted benzimidazole derivatives |
| US7652009B2 (en) | 2004-11-30 | 2010-01-26 | Amgem Inc. | Substituted heterocycles and methods of use |
| US8258145B2 (en) | 2005-01-03 | 2012-09-04 | Myrexis, Inc. | Method of treating brain cancer |
| KR20070104641A (ko) * | 2005-02-03 | 2007-10-26 | 버텍스 파마슈티칼스 인코포레이티드 | 단백질 키나제의 억제제로 유용한 피롤로피리미딘 |
| US7301022B2 (en) | 2005-02-15 | 2007-11-27 | Amgen Inc. | Vanilloid receptor ligands and their use in treatments |
| JO2787B1 (en) | 2005-04-27 | 2014-03-15 | امجين إنك, | Alternative amide derivatives and methods of use |
| EP2354140A1 (en) | 2005-05-20 | 2011-08-10 | Vertex Pharmaceuticals Incorporated | Pyrrolopyridines useful as inhibitors of protein kinase |
| US8093264B2 (en) * | 2005-05-20 | 2012-01-10 | Methylgene Inc. | Fused heterocycles as inhibitors of VEGF receptor and HGF receptor signaling |
| KR100951607B1 (ko) * | 2005-06-23 | 2010-04-09 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드의 비정질 염 및 그 제조방법 |
| US7550483B2 (en) | 2005-06-23 | 2009-06-23 | Eisai R&D Management Co., Ltd. | Amorphous salt of 4-(3-chloro-4-(cyclopropylaminocarbonyl)aminophenoxy)-7-methoxy-6-quinolinecarboxamide and process for preparing the same |
| CA2611688A1 (en) | 2005-06-30 | 2007-01-11 | Amgen Inc. | Bis-aryl kinase inhibitors and their use in the treatment of inflammation, angiogenesis and cancer |
| TW200740820A (en) * | 2005-07-05 | 2007-11-01 | Takeda Pharmaceuticals Co | Fused heterocyclic derivatives and use thereof |
| JP5281287B2 (ja) | 2005-07-13 | 2013-09-04 | Msd株式会社 | ヘテロ環置換ベンズイミダゾール誘導体 |
| EP1925941B1 (en) * | 2005-08-01 | 2012-11-28 | Eisai R&D Management Co., Ltd. | Method for prediction of the efficacy of vascularization inhibitor |
| US8299252B2 (en) | 2005-08-05 | 2012-10-30 | Chugai Seiyaku Kabushiki Kaisha | Pyrazolopyridine and pyrrolopyridine multikinase inhibitors |
| EP1912639A4 (en) * | 2005-08-08 | 2011-10-12 | Janssen Pharmaceutica Nv | Thiazolopyrimidine KINASE INHIBITORS |
| WO2007023768A1 (ja) | 2005-08-24 | 2007-03-01 | Eisai R & D Management Co., Ltd. | 新規ピリジン誘導体およびピリミジン誘導体(3) |
| AU2006285673B2 (en) * | 2005-09-01 | 2010-12-02 | Eisai R&D Management Co., Ltd. | Method for preparation of pharmaceutical composition having improved disintegratability |
| GT200600411A (es) * | 2005-09-13 | 2007-05-21 | Novartis Ag | Combinaciones que comprenden un inhibidor del receptor del factor de crecimiento endotelial vascular |
| EP1935890B1 (en) | 2005-09-30 | 2016-03-16 | Msd K.K. | 2-heteroaryl-substituted indole derivative |
| RU2008120850A (ru) * | 2005-10-28 | 2009-12-10 | Айрм Ллк (Bm) | Соединения и композиции в качестве ингибиторов протеинкиназ |
| WO2007061127A1 (ja) * | 2005-11-22 | 2007-05-31 | Eisai R & D Management Co., Ltd. | 多発性骨髄腫に対する抗腫瘍剤 |
| TW200804288A (en) * | 2005-12-12 | 2008-01-16 | Astrazeneca Ab | Alkylsulphonamide quinolines |
| US8580798B2 (en) | 2005-12-21 | 2013-11-12 | Bayer Intellectual Property Gmbh | Substituted pyrimidine derivatives useful in the treatment of cancer and other disorders |
| WO2007071752A2 (en) * | 2005-12-21 | 2007-06-28 | Novartis Ag | Pyrimidinyl aryl urea derivatives being fgf inhibitors |
| TW200804349A (en) * | 2005-12-23 | 2008-01-16 | Kalypsys Inc | Novel substituted pyrimidinyloxy ureas as inhibitors of protein kinases |
| US7868177B2 (en) | 2006-02-24 | 2011-01-11 | Amgen Inc. | Multi-cyclic compounds and method of use |
| CA2643044A1 (en) * | 2006-02-28 | 2007-09-07 | Amgen Inc. | Cinnoline and quinazoline derivates as phosphodiesterase 10 inhibitors |
| UY30183A1 (es) * | 2006-03-02 | 2007-10-31 | Astrazeneca Ab | Derivados de quinolina |
| GB0604937D0 (en) * | 2006-03-10 | 2006-04-19 | Novartis Ag | Organic compounds |
| GB0605120D0 (en) | 2006-03-14 | 2006-04-26 | Novartis Ag | Organic Compounds |
| PE20080145A1 (es) | 2006-03-21 | 2008-02-11 | Janssen Pharmaceutica Nv | Tetrahidro-pirimidoazepinas como moduladores de trpv1 |
| JP2009536206A (ja) * | 2006-05-05 | 2009-10-08 | ティー ケー ホールディングス インク | ガス生成組成物 |
| US7692024B2 (en) * | 2006-05-05 | 2010-04-06 | Tk Holdings, Inc. | Gas generant compositions |
| WO2008035209A2 (en) * | 2006-05-30 | 2008-03-27 | Methylgene Inc. | Inhibitors of protein tyrosine kinase activity |
| EP2044939A1 (en) * | 2006-06-29 | 2009-04-08 | Eisai R&D Management Co., Ltd. | Therapeutic agent for liver fibrosis |
| WO2008005303A2 (en) * | 2006-06-30 | 2008-01-10 | Janssen Pharmaceutica N.V. | Thiazolopyrimidine modulators of trpv1 |
| CL2007002261A1 (es) | 2006-08-04 | 2008-05-02 | Takeda Pharmaceutical | Compuestos derivados de imidazo[1,2-b]piridazina, inhibidores de quinasa; composicion farmaceutica; y uso en el tratamiento o prevencion del cancer. |
| CA2661333C (en) | 2006-08-23 | 2014-08-05 | Eisai R&D Management Co., Ltd. | Salt of phenoxypyridine derivative or crystal thereof and process for producing the same |
| US7790885B2 (en) * | 2006-08-31 | 2010-09-07 | Eisai R&D Management Co., Ltd. | Process for preparing phenoxypyridine derivatives |
| KR101432318B1 (ko) | 2006-08-31 | 2014-08-20 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 페녹시피리딘 유도체의 제조 방법 |
| US8002915B2 (en) * | 2006-09-30 | 2011-08-23 | Tk Holdings, Inc. | Gas generant compositions |
| EP2077262A4 (en) | 2006-10-23 | 2011-12-28 | Takeda Pharmaceutical | IMINOPYRIDINE DERIVATIVES AND THEIR USE |
| US8563573B2 (en) | 2007-11-02 | 2013-10-22 | Vertex Pharmaceuticals Incorporated | Azaindole derivatives as CFTR modulators |
| MX2009006543A (es) | 2006-12-20 | 2009-06-26 | Amgen Inc | Compuestos heterociclicos y su uso en el tratamiento de la inflamacion, angiogenesis y cancer. |
| CN101541766B (zh) * | 2006-12-22 | 2011-07-27 | 霍夫曼-拉罗奇有限公司 | 作为蛋白激酶抑制剂的嘧啶基衍生物 |
| EP2099442B1 (en) * | 2006-12-26 | 2014-11-19 | Pharmacyclics, Inc. | Method of using histone deacetylase inhibitors and monitoring biomarkers in combination therapy |
| CA2675736A1 (en) * | 2007-01-19 | 2008-07-24 | Eisai R&D Management Co., Ltd. | Composition for treatment of pancreatic cancer |
| WO2008093855A1 (ja) | 2007-01-29 | 2008-08-07 | Eisai R & D Management Co., Ltd. | 未分化型胃癌治療用組成物 |
| US7838234B2 (en) * | 2007-01-30 | 2010-11-23 | Pharmacyclics, Inc. | Methods for determining cancer resistance to histone deacetylase inhibitors |
| EA200970746A1 (ru) * | 2007-02-09 | 2010-02-26 | Такеда Фармасьютикал Компани Лимитед | Конденсированные циклические соединения в качестве частичных агонистов ppar-гамма |
| US8148532B2 (en) | 2007-03-14 | 2012-04-03 | Guoqing Paul Chen | Spiro substituted compounds as angiogenesis inhibitors |
| US20110189167A1 (en) * | 2007-04-20 | 2011-08-04 | Flynn Daniel L | Methods and Compositions for the Treatment of Myeloproliferative Diseases and other Proliferative Diseases |
| WO2008131276A1 (en) * | 2007-04-20 | 2008-10-30 | Deciphera Pharmaceuticals, Llc | Kinase inhibitors useful for the treatment of myleoproliferative diseases and other proliferative diseases |
| US20110160305A1 (en) * | 2007-05-01 | 2011-06-30 | Marty Jones | Oral Delivery of Therapeutic Doses of Glutathione |
| WO2008150015A1 (en) | 2007-06-05 | 2008-12-11 | Takeda Pharmaceutical Company Limited | Heterobicyclic compounds as kinase inhibitors |
| US8324395B2 (en) * | 2007-08-23 | 2012-12-04 | Takeda Pharmaceutical Company Limited | Heterocyclic compound and use thereof |
| WO2009026717A1 (en) | 2007-08-29 | 2009-03-05 | Methylgene Inc. | Inhibitors of protein tyrosine kinase activity |
| WO2009035949A2 (en) * | 2007-09-13 | 2009-03-19 | Arete Therapeutics, Inc. | Soluble epoxide hydrolase inhibitors |
| RS53180B (en) | 2007-10-11 | 2014-06-30 | Glaxosmithkline Llc | NEW SEH INHIBITORS AND THEIR USE |
| JP5343082B2 (ja) * | 2007-10-29 | 2013-11-13 | アムジエン・インコーポレーテツド | ベンゾモルホリン誘導体および使用方法 |
| TWI440638B (zh) * | 2007-10-30 | 2014-06-11 | Otsuka Pharma Co Ltd | 雜環化合物及其藥學組成物 |
| JP5450434B2 (ja) * | 2007-11-16 | 2014-03-26 | アッヴィ・インコーポレイテッド | 関節炎の治療方法 |
| NZ585298A (en) * | 2007-11-16 | 2012-08-31 | Rigel Pharmaceuticals Inc | Carboxamide, sulfonamide and amine compounds for metabolic disorders |
| JP2009132660A (ja) | 2007-11-30 | 2009-06-18 | Eisai R & D Management Co Ltd | 食道癌治療用組成物 |
| WO2009076631A1 (en) * | 2007-12-12 | 2009-06-18 | Rigel Pharmaceuticals, Inc. | Carboxamide, sulfonamide and amine compounds for metabolic disorders |
| WO2009078999A1 (en) | 2007-12-17 | 2009-06-25 | Janssen Pharmaceutica N.V. | Imidazolo-, oxazolo-, and thiazolopyrimidine modulators of trpv1 |
| ES2437595T3 (es) | 2007-12-20 | 2014-01-13 | Novartis Ag | Derivados de tiazol usados como inhibidores de la PI 3 quinasa |
| KR101608096B1 (ko) | 2008-01-23 | 2016-03-31 | 브리스톨-마이어스 스큅 컴퍼니 | 4-피리디논 화합물 및 암을 위한 그의 용도 |
| AU2009210098B2 (en) * | 2008-01-29 | 2013-06-13 | Eisai R & D Management Co., Ltd. | Combined use of angiogenesis inhibitor and taxane |
| JP2009203226A (ja) * | 2008-01-31 | 2009-09-10 | Eisai R & D Management Co Ltd | ピリジン誘導体およびピリミジン誘導体を含有するレセプターチロシンキナーゼ阻害剤 |
| JPWO2009104520A1 (ja) * | 2008-02-18 | 2011-06-23 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | フェノキシピリジン誘導体の製造方法(2) |
| JP2011513339A (ja) * | 2008-03-05 | 2011-04-28 | 9222−9129 ケベック インコーポレイテッド | タンパク質チロシンキナーゼ活性の阻害剤 |
| EP2268623B9 (en) | 2008-03-17 | 2018-02-28 | Ambit Biosciences Corporation | Quinazoline derivatives as raf kinase modulators and methods of use thereof |
| ES2423851T3 (es) * | 2008-04-10 | 2013-09-24 | Taiho Pharmaceutical Co., Ltd. | Compuesto de aciltiourea o sal del mismo y uso del mismo |
| KR20160129909A (ko) * | 2008-04-21 | 2016-11-09 | 렉시컨 파마슈티컬스 인코퍼레이티드 | Limk2 억제제, 그를 포함하는 조성물 및 그의 사용 방법 |
| US20110039892A1 (en) * | 2008-04-23 | 2011-02-17 | Takeda Pharmaceutical Company Limited | Iminopyridine derivative and use thereof |
| MX2010011288A (es) | 2008-04-23 | 2010-11-09 | Rigel Pharmaceuticals Inc | Compuestos de carboxamida para el tratamiento de trastornos metabolicos. |
| US8481569B2 (en) | 2008-04-23 | 2013-07-09 | Takeda Pharmaceutical Company Limited | Iminopyridine derivatives and use thereof |
| BRPI0910737A2 (pt) * | 2008-04-23 | 2019-09-24 | Takeda Pharmaceuticals Co | composto, pró-droga, agente farmacêutico, método para profilaxia ou tratamento de doenças do trato urinário inferior em um mamífero, e, uso de um composto ou uma pró-droga do mesmo. |
| JP5502072B2 (ja) * | 2008-04-30 | 2014-05-28 | ナショナル ヘルス リサーチ インスティテューツ | オーロラキナーゼ阻害剤としての縮合二環式ピリミジン化合物 |
| EA020853B1 (ru) | 2008-05-05 | 2015-02-27 | Мерк Кэнэда Инк. | 3,4-замещенные пиперидиновые производные в качестве ингибиторов ренина |
| WO2009151910A2 (en) * | 2008-05-25 | 2009-12-17 | Wyeth | Combination product of receptor tyrosine kinase inhibitor and fatty acid synthase inhibitor for treating cancer |
| AU2009267161B2 (en) * | 2008-07-03 | 2014-11-06 | Merck Patent Gmbh | Naphthyridininones as Aurora kinase inhibitors |
| US8211911B2 (en) | 2008-08-19 | 2012-07-03 | Guoqing Paul Chen | Compounds as kinase inhibitors |
| CN102131812B (zh) | 2008-08-20 | 2014-04-09 | 硕腾有限责任公司 | 吡咯并[2,3-d]嘧啶化合物 |
| UA104147C2 (uk) | 2008-09-10 | 2014-01-10 | Новартис Аг | Похідна піролідиндикарбонової кислоти та її застосування у лікуванні проліферативних захворювань |
| ES2435918T3 (es) | 2008-09-26 | 2013-12-26 | National Health Research Institutes | Compuestos multicíclicos condensados como inhibidores de las proteína-cinasas |
| AU2009303602B2 (en) * | 2008-10-14 | 2012-06-14 | Sunshine Lake Pharma Co., Ltd. | Compounds and methods of use |
| JP5579619B2 (ja) | 2008-12-01 | 2014-08-27 | 武田薬品工業株式会社 | 複素環化合物およびその用途 |
| JO3101B1 (ar) | 2008-12-02 | 2017-09-20 | Takeda Pharmaceuticals Co | مشتقات بنزوثيازول كعوامل مضادة للسرطان |
| JO3265B1 (ar) | 2008-12-09 | 2018-09-16 | Novartis Ag | مثبطات بيريديلوكسى اندولات vegf-r2 واستخدامها لعلاج المرض |
| TWI447108B (zh) | 2009-01-16 | 2014-08-01 | Exelixis Inc | N-(4-{〔6,7雙(甲氧基)喹啉-4-基〕氧基}苯基)-n’-(4-氟苯基)環丙烷-1,1-二甲醯胺之蘋果酸鹽及其結晶型 |
| KR20110133048A (ko) * | 2009-03-21 | 2011-12-09 | 닝 시 | 아미노 에스테르 유도체, 그의 염 및 이용 방법 |
| WO2010108503A1 (en) | 2009-03-24 | 2010-09-30 | Life & Brain Gmbh | Promotion of neuronal integration in neural stem cell grafts |
| US8603521B2 (en) | 2009-04-17 | 2013-12-10 | Pharmacyclics, Inc. | Formulations of histone deacetylase inhibitor and uses thereof |
| CN101671301B (zh) * | 2009-05-05 | 2014-02-26 | 江苏省药物研究所有限公司 | 杂环取代的二苯脲类衍生物及其用途 |
| US8293753B2 (en) | 2009-07-02 | 2012-10-23 | Novartis Ag | Substituted 2-carboxamide cycloamino ureas |
| US20110112121A1 (en) * | 2009-07-06 | 2011-05-12 | Joerg Berghausen | Pharmaceutical Compositions and Solid Forms |
| UA108618C2 (uk) | 2009-08-07 | 2015-05-25 | Застосування c-met-модуляторів в комбінації з темозоломідом та/або променевою терапією для лікування раку | |
| WO2011021597A1 (ja) * | 2009-08-19 | 2011-02-24 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | キノリン誘導体含有医薬組成物 |
| NZ598455A (en) * | 2009-09-03 | 2014-03-28 | Allergan Inc | Compounds as tyrosine kinase modulators |
| US8802868B2 (en) | 2010-03-25 | 2014-08-12 | Vertex Pharmaceuticals Incorporated | Solid forms of (R)-1(2,2-difluorobenzo[D][1,3]dioxo1-5-yl)-N-(1-(2,3-dihydroxypropyl-6-fluoro-2-(1-hydroxy-2-methylpropan2-yl)-1H-Indol-5-yl)-Cyclopropanecarboxamide |
| CA3108488A1 (en) | 2010-04-22 | 2011-10-27 | Vertex Pharmaceuticals Incorporated | Process of producing cycloalkylcarboxamido-indole compounds |
| KR20130091331A (ko) | 2010-07-16 | 2013-08-16 | 교와 핫꼬 기린 가부시키가이샤 | 함질소 방향족 복소환 유도체 |
| KR101032732B1 (ko) * | 2010-07-29 | 2011-05-06 | 김선자 | 방범 창호프레임 |
| EP2423208A1 (en) | 2010-08-28 | 2012-02-29 | Lead Discovery Center GmbH | Pharmaceutically active compounds as Axl inhibitors |
| US11179500B2 (en) * | 2011-02-24 | 2021-11-23 | Emory University | JAB1 inhibitory compositions for ossification and methods related thereto |
| BR112013030442B1 (pt) * | 2011-06-10 | 2021-11-09 | Merck Patent Gmbh | Compostos de pirimidina e piridina com atividade inibidora de btk, seus usos, composição, e kit |
| US9492423B2 (en) | 2011-09-13 | 2016-11-15 | Pharmacyclics Llc | Formulations of histone deacetylase inhibitor in combination with bendamustine and uses thereof |
| US8841301B2 (en) | 2011-09-26 | 2014-09-23 | Bristol-Myers Squibb Company | Selective NR2B antagonists |
| TWI594986B (zh) * | 2011-12-28 | 2017-08-11 | Taiho Pharmaceutical Co Ltd | Antineoplastic agent effect enhancer |
| CN103508961B (zh) * | 2012-06-26 | 2015-07-22 | 中美冠科生物技术(太仓)有限公司 | 抗肿瘤药物 |
| EP2890380A2 (en) * | 2012-08-29 | 2015-07-08 | Merck Patent GmbH | Ddr2 inhibitors for the treatment of osteoarthritis |
| AR094812A1 (es) | 2013-02-20 | 2015-08-26 | Eisai R&D Man Co Ltd | Derivado de piridina monocíclico como inhibidor del fgfr |
| EP2986293A1 (en) | 2013-04-19 | 2016-02-24 | Astrazeneca AB | A nk3 receptor antagonist compound (nk3ra) for use in a method for the treatment of polycystic ovary syndrome (pcos) |
| JP6404242B2 (ja) | 2013-06-26 | 2018-10-10 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | がんの治療のための併用療法としてのエリブリンおよびレンバチニブの使用 |
| TWI649081B (zh) | 2013-08-02 | 2019-02-01 | 製藥公司 | 治療固態腫瘤之方法 |
| CN103509005B (zh) * | 2013-09-26 | 2015-04-08 | 苏州海特比奥生物技术有限公司 | 喹唑啉类化合物及其制备方法与应用 |
| DK3536685T3 (da) | 2014-04-04 | 2022-03-07 | Pfizer | Bicyklisk-fusionerede heteroaryl- eller arylforbindelser og anvendelse deraf som irak4 inhibitorer |
| IL303422A (en) | 2014-04-15 | 2023-08-01 | Vertex Pharma | Pharmaceutical preparations for the treatment of diseases related to cystic fibrosis transmembrane conductance regulator modulators |
| US9951047B2 (en) * | 2014-08-18 | 2018-04-24 | Eisai R&D Management Co., Ltd. | Salt of monocyclic pyridine derivative and crystal thereof |
| MA40775A (fr) | 2014-10-01 | 2017-08-08 | Respivert Ltd | Dérivé d'acide 4-(4-(4-phényluréido-naphtalén -1-yl) oxy-pyridin-2-yl) amino-benzoïque utilisé en tant qu'inhibiteur de la kinase p38 |
| CN105985289B (zh) * | 2015-02-15 | 2018-12-21 | 正大天晴药业集团股份有限公司 | 一种乐伐替尼的制备方法 |
| CN106046007B (zh) * | 2015-04-07 | 2019-02-05 | 广东众生睿创生物科技有限公司 | 酪氨酸激酶抑制剂及包含该酪氨酸激酶抑制剂的药物组合物 |
| MX2018001658A (es) | 2015-08-20 | 2018-09-06 | Eisai R&D Man Co Ltd | Agente terapeutico contra tumores. |
| KR102029124B1 (ko) * | 2015-08-27 | 2019-10-07 | 화이자 인코포레이티드 | Irak4 조정제로서의 비시클릭-융합된 헤테로아릴 또는 아릴 화합물 |
| CN107266363A (zh) * | 2016-04-06 | 2017-10-20 | 杭州华东医药集团新药研究院有限公司 | 甲磺酸乐伐替尼药物杂质的制备方法 |
| CZ2016240A3 (cs) | 2016-04-27 | 2017-11-08 | Zentiva, K.S. | Soli lenvatinibu |
| KR102218333B1 (ko) | 2016-06-07 | 2021-02-22 | 자코바이오 파마슈티칼스 컴퍼니 리미티드 | Shp2 억제제로서 유용한 신규한 헤테로환형 유도체 |
| CN106243124B (zh) * | 2016-07-29 | 2018-03-09 | 湖北民族学院 | 一种噻吩并嘧啶脲类化合物及其制备方法和应用 |
| US9957233B1 (en) | 2016-08-05 | 2018-05-01 | Calitor Sciences, Llc | Process for preparing substituted quinolin-4-ol compounds |
| CN107698562A (zh) * | 2016-08-09 | 2018-02-16 | 殷建明 | 一种喹啉衍生物及其用途 |
| TWI603962B (zh) | 2016-09-10 | 2017-11-01 | 國立清華大學 | 含硫噁嗪化合物及其合成方法 |
| WO2018059534A1 (zh) * | 2016-09-30 | 2018-04-05 | 广东众生药业股份有限公司 | 酪氨酸激酶抑制剂的晶型、盐型以及制备方法 |
| CN106854180B (zh) * | 2016-11-30 | 2018-08-31 | 济南轩德化工有限公司 | 一种4-氯-7-甲氧基喹啉-6-酰胺的制备方法 |
| WO2018102455A1 (en) | 2016-12-01 | 2018-06-07 | Ignyta, Inc. | Methods for the treatment of cancer |
| WO2018122780A1 (en) * | 2016-12-29 | 2018-07-05 | Dr. Reddy’S Laboratories Limited | Solid state forms of lenvatinib mesylate |
| CN108299294A (zh) * | 2017-01-11 | 2018-07-20 | 江苏恒瑞医药股份有限公司 | 一种乐伐替尼杂质的制备方法 |
| CN106810512B (zh) * | 2017-01-18 | 2019-09-10 | 江苏省中医药研究院 | Idh2突变体抑制剂及其用途 |
| US10800741B2 (en) | 2017-02-07 | 2020-10-13 | Ancureall Pharmaceutical (Shanghai) Co., Ltd. | Quinoline compound, preparation method and medical use therefor |
| CA3044658A1 (en) | 2017-02-08 | 2018-08-16 | Eisai R&D Management Co., Ltd. | Tumor-treating pharmaceutical composition |
| DK3583943T3 (da) | 2017-02-15 | 2024-10-14 | Taiho Pharmaceutical Co Ltd | Farmaceutisk sammensætning |
| WO2018157411A1 (zh) * | 2017-02-28 | 2018-09-07 | 深圳市塔吉瑞生物医药有限公司 | 取代的含氮芳环化合物及其应用 |
| EA202190196A1 (ru) | 2017-03-23 | 2021-08-31 | Джакобио Фармасьютикалс Ко., Лтд. | Новые гетероциклические производные, применимые в качестве ингибиторов shp2 |
| CN107115344B (zh) * | 2017-03-23 | 2019-06-14 | 广东众生睿创生物科技有限公司 | 酪氨酸激酶抑制剂在制备用于预防和/或治疗纤维化疾病的药物中的用途 |
| EP3384901B1 (en) | 2017-04-04 | 2024-08-14 | Synthon B.V. | Pharmaceutical composition comprising lenvatinib mesylate |
| WO2018215668A1 (en) * | 2017-05-26 | 2018-11-29 | Glenmark Pharmaceuticals S.A. | Novel inhibitors of map4k1 |
| CN107513057A (zh) * | 2017-09-06 | 2017-12-26 | 南京医科大学 | 一类乐伐替尼的乏氧活化前药及其应用 |
| PL3689351T3 (pl) * | 2017-09-28 | 2023-03-20 | Chongqing Pharmaceutical Industrial Research Institute Co. Ltd. | Pochodna chinoliny i zastosowanie jej jako inhibitor kinazy tyrozynowej |
| CN107739335A (zh) * | 2017-12-01 | 2018-02-27 | 南京奇可药业有限公司 | 一种乐伐替尼的合成方法 |
| US11332468B2 (en) * | 2017-12-18 | 2022-05-17 | Chiesi Farmaceutici S.P.A. | Azaindole derivatives as Rho-kinase inhibitors |
| AU2017444054B2 (en) * | 2017-12-21 | 2021-10-07 | Hefei Institutes Of Physical Science, Chinese Academy Of Sciences | Class of pyrimidine derivative kinase inhibitors |
| MA51570A (fr) | 2018-01-10 | 2020-11-18 | Eisai R&D Man Co Ltd | Polythérapies pour le traitement du carcinome hépatocellulaire |
| CA3088198A1 (en) | 2018-01-26 | 2019-08-01 | Exelixis, Inc. | Compounds for the treatment of kinase-dependent disorders |
| CN117402114A (zh) * | 2018-01-26 | 2024-01-16 | 埃克塞里艾克西斯公司 | 用于治疗激酶依赖性病症的化合物 |
| US10583133B2 (en) | 2018-03-12 | 2020-03-10 | Shilpa Medicare Limited | Pharmaceutical compositions of lenvatinib |
| CN108623521B (zh) * | 2018-03-22 | 2020-09-04 | 盐城师范学院 | 一种乐伐替尼的制备方法 |
| KR20200135945A (ko) | 2018-03-28 | 2020-12-04 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 간세포 암종 치료제 |
| WO2019222075A1 (en) | 2018-05-14 | 2019-11-21 | Merck Sharp And Dohme Corp. | Biomarkers for a combination therapy comprising lenvatinib and a pd-1 antagonist |
| CN110483482A (zh) * | 2018-05-15 | 2019-11-22 | 北京诺诚健华医药科技有限公司 | 吲哚啉-1-甲酰胺类化合物、其制备方法及其在医药学上的应用 |
| CN110590839B (zh) * | 2018-06-13 | 2022-04-05 | 四川海思科制药有限公司 | 一种乐伐替尼衍生物及制备方法和用途 |
| CN108690013A (zh) * | 2018-07-02 | 2018-10-23 | 秦继伟 | 苯并[d]噻唑衍生物及其作为EGFR抑制剂在癌症治疗中的应用 |
| CN108570044A (zh) * | 2018-07-02 | 2018-09-25 | 秦继伟 | 一种酰胺类化合物及其合成方法和治疗癌症的用途 |
| CN110845408A (zh) * | 2018-08-20 | 2020-02-28 | 润佳(苏州)医药科技有限公司 | 同位素富集的乐伐替尼 |
| HUE055374T2 (hu) | 2018-09-07 | 2021-11-29 | Indena Spa | Eljárás Lenvatinib elõállítására |
| JP2022502495A (ja) | 2018-09-25 | 2022-01-11 | ブラック ダイアモンド セラピューティクス,インコーポレイティド | チロシンキナーゼ阻害剤としてのキナゾリン誘導体、組成物、それらの作製方法、およびそれらの使用 |
| CN113226316A (zh) | 2018-10-04 | 2021-08-06 | 斯索恩有限公司 | 苯磺酸乐伐替尼的晶形和方法 |
| EP3632436B1 (en) | 2018-10-04 | 2022-04-20 | Synthon B.V. | Pharmaceutical composition comprising lenvatinib salts |
| US20210349097A1 (en) | 2018-10-05 | 2021-11-11 | Eisai R&D Management Co., Ltd. | Biomarkers for a combination therapy comprising lenvatinib and everolimus |
| EP3861346A1 (en) | 2018-10-05 | 2021-08-11 | Eisai R&D Management Co., Ltd. | Biomarkers for a therapy comprising a sorafenib compound |
| CN111116468A (zh) * | 2018-10-31 | 2020-05-08 | 正大天晴药业集团股份有限公司 | 用于治疗胰腺癌的喹啉类化合物或其药学上可接受的盐 |
| TW202038957A (zh) | 2018-12-21 | 2020-11-01 | 日商第一三共股份有限公司 | 抗體-藥物結合物與激酶抑制劑之組合 |
| JP2020100598A (ja) | 2018-12-25 | 2020-07-02 | 公益財団法人応用生化学研究所 | レンバチニブ誘導体、並びにそれを用いた医薬研究用組成物及び腫瘍治療剤 |
| KR102318875B1 (ko) | 2019-03-19 | 2021-11-01 | 보로노이 주식회사 | 헤테로아릴 유도체, 이를 제조하는 방법, 및 이를 유효성분으로 포함하는 약학적 조성물 |
| CN109776432B (zh) * | 2019-03-21 | 2020-07-24 | 广州六顺生物科技股份有限公司 | 一种多靶点激酶抑制剂、药物组合物及多靶点激酶抑制剂的制备方法和应用 |
| CA3135157A1 (en) | 2019-04-01 | 2020-10-08 | Chiome Bioscience, Inc. | Medicament for treating cancer |
| KR102690225B1 (ko) * | 2019-04-03 | 2024-07-30 | 프라임진(베이징) 코., 엘티디. | 퀴놀린 함유 화합물, 의약 조성물 및 그의 용도 |
| KR20220038696A (ko) | 2019-07-19 | 2022-03-29 | 아나제네시스 바이오테크놀로지스 에스.에이.에스. | 폴리방향족 우레아 유도체 및 근육 질환 치료에서의 이들의 용도 |
| MX2022001111A (es) | 2019-08-02 | 2022-02-16 | Cttq Akeso Shanghai Biomed Tech Co Ltd | Anticuerpo anti-pd-1 y uso farmaceutico del mismo. |
| BR112022002013A2 (pt) | 2019-08-02 | 2022-03-29 | Akeso Pharmaceuticals Inc | Anticorpo biespecífico anti-ctla4/anti-pd-1 e uso do mesmo |
| CN110437223B (zh) * | 2019-08-06 | 2022-11-25 | 江苏千之康生物医药科技有限公司 | 乐伐替尼酸的噻唑酮衍生物及其应用 |
| WO2021217537A1 (zh) * | 2020-04-30 | 2021-11-04 | 天津睿创康泰生物技术有限公司 | 一种乐伐替尼游离碱晶型及其制备方法 |
| MX2022013984A (es) | 2020-05-08 | 2023-01-30 | Halia Therapeutics Inc | Inhibidores de cinasa 7 relacionada con el gen nunca en mitosis a (nek7). |
| WO2021226547A2 (en) * | 2020-05-08 | 2021-11-11 | Halia Therapeutics, Inc. | Targeted nek7 inhibition for modulation of the nlrp3 inflammasome |
| CN112194623A (zh) * | 2020-10-16 | 2021-01-08 | 四川伊诺达博医药科技有限公司 | 一种乐伐替尼衍生物关键中间体的合成方法 |
| WO2022146022A1 (ko) * | 2020-12-29 | 2022-07-07 | 주식회사 티씨노바이오사이언스 | 엑토뉴클레오티드 피로포스파타아제-포스포디에스터라아제의 저해 활성을 갖는 신규한 나프티리딘온 유도체 및 이들의 용도 |
| EP4029501A1 (en) | 2021-01-19 | 2022-07-20 | Anagenesis Biotechnologies | Combination of polyaromatic urea derivatives and glucocorticoid or hdac inhibitor for the treatment of diseases or conditions associated with muscle cells and/or satellite cells |
| WO2022226182A1 (en) * | 2021-04-22 | 2022-10-27 | Halia Therapeutics, Inc. | Nek7 inhibitors |
| CN113372270A (zh) * | 2021-06-24 | 2021-09-10 | 江西国药有限责任公司 | 一种仑伐替尼及其制备方法 |
| CN113582924A (zh) * | 2021-09-09 | 2021-11-02 | 四川国康药业有限公司 | 一种多靶点酪氨酸激酶抑制剂及其制备方法和用途 |
| EP4147689A1 (en) | 2021-09-13 | 2023-03-15 | Lotus Pharmaceutical Co., Ltd. | Lenvatinib formulation |
| CA3237696A1 (en) | 2021-11-08 | 2023-05-11 | Progentos Therapeutics, Inc. | Platelet-derived growth factor receptor (pdgfr) alpha inhibitors and uses thereof |
| CN115124534B (zh) * | 2021-11-23 | 2023-09-15 | 中山大学 | 非核苷酸类prmt5小分子抑制剂、制备方法及用途 |
| CN118742292A (zh) | 2022-03-31 | 2024-10-01 | 卫材R&D管理有限公司 | 脂质体组合物及含脂质体的药物组合物 |
| WO2023225300A2 (en) * | 2022-05-20 | 2023-11-23 | Emory University | Compounds and pharmaceutical compositions useful for managing sickle cell disease and conditions related thereto |
| WO2023228095A1 (en) | 2022-05-24 | 2023-11-30 | Daiichi Sankyo Company, Limited | Dosage regimen of an anti-cdh6 antibody-drug conjugate |
| EP4289427A1 (en) * | 2022-06-10 | 2023-12-13 | Anagenesis Biotechnologies | Dihydro[1,8]naphthyridin-7-one and pyrido[3,2-b][1,4]oxazin-3-one for use in treating cancer, and metastases in particular. |
| CN116751161A (zh) * | 2023-06-28 | 2023-09-15 | 中国人民解放军军事科学院军事医学研究院 | 喹啉类化合物及其制备方法、药物组合物及医药用途 |
Family Cites Families (193)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US189629A (en) * | 1877-04-17 | Improvement in adjustable elastic buckets for chain-pumps | ||
| CU22545A1 (es) | 1994-11-18 | 1999-03-31 | Centro Inmunologia Molecular | Obtención de un anticuerpo quimérico y humanizado contra el receptor del factor de crecimiento epidérmico para uso diagnóstico y terapéutico |
| US4526988A (en) * | 1983-03-10 | 1985-07-02 | Eli Lilly And Company | Difluoro antivirals and intermediate therefor |
| ATE85080T1 (de) | 1984-02-17 | 1993-02-15 | Genentech Inc | Menschlicher transformationswachstumsfaktor und vorlaeufer oder fragment hiervon, zellen, dna, vektoren und verfahren zu ihrer herstellung, zusammensetzungen und produkte, die diese enthalten, sowie davon abgeleitete antikoerper und diagnostizierverfahren. |
| US4716102A (en) * | 1984-08-15 | 1987-12-29 | Regents Of The University Of California | Purified AIDS-associated virus ARV-2 |
| CA1264738A (en) * | 1984-12-04 | 1990-01-23 | Eli Lilly And Company | Treatment of tumors in mammals |
| JPS62168137A (ja) * | 1985-12-20 | 1987-07-24 | Fuji Photo Film Co Ltd | ハロゲン化銀カラ−写真感光材料およびその処理方法 |
| CA1339136C (en) | 1987-07-01 | 1997-07-29 | Sailesh Amilal Varia | Amorphous form of aztreonam |
| AU4128089A (en) * | 1988-09-15 | 1990-03-22 | Rorer International (Overseas) Inc. | Monoclonal antibodies specific to human epidermal growth factor receptor and therapeutic methods employing same |
| US4983615A (en) | 1989-06-28 | 1991-01-08 | Hoechst-Roussel Pharmaceuticals Inc. | Heteroarylamino- and heteroaryloxypyridinamine compounds which are useful in treating skin disorders |
| JPH0340486A (ja) | 1989-07-07 | 1991-02-21 | Asahi Chem Ind Co Ltd | 印刷配線基板 |
| JP2980326B2 (ja) | 1989-08-31 | 1999-11-22 | 株式会社東芝 | ディスク制御装置 |
| US5180818A (en) * | 1990-03-21 | 1993-01-19 | The University Of Colorado Foundation, Inc. | Site specific cleavage of single-stranded dna |
| GB9105677D0 (en) | 1991-03-19 | 1991-05-01 | Ici Plc | Heterocyclic compounds |
| US5367057A (en) * | 1991-04-02 | 1994-11-22 | The Trustees Of Princeton University | Tyrosine kinase receptor flk-2 and fragments thereof |
| CA2102780C (en) | 1991-05-10 | 2007-01-09 | Alfred P. Spada | Bis mono-and bicyclic aryl and heteroaryl compounds which inhibit egf and/or pdgf receptor tyrosine kinase |
| US5721237A (en) | 1991-05-10 | 1998-02-24 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | Protein tyrosine kinase aryl and heteroaryl quinazoline compounds having selective inhibition of HER-2 autophosphorylation properties |
| US5710158A (en) | 1991-05-10 | 1998-01-20 | Rhone-Poulenc Rorer Pharmaceuticals Inc. | Aryl and heteroaryl quinazoline compounds which inhibit EGF and/or PDGF receptor tyrosine kinase |
| JPH04341454A (ja) | 1991-05-16 | 1992-11-27 | Canon Inc | シート収納装置 |
| US5750376A (en) | 1991-07-08 | 1998-05-12 | Neurospheres Holdings Ltd. | In vitro growth and proliferation of genetically modified multipotent neural stem cells and their progeny |
| WO1993024627A1 (en) | 1992-06-03 | 1993-12-09 | Case Western Reserve University | Bandage for continuous application of biologicals |
| GB9221220D0 (en) | 1992-10-09 | 1992-11-25 | Sandoz Ag | Organic componds |
| GB9323290D0 (en) | 1992-12-10 | 1994-01-05 | Zeneca Ltd | Quinazoline derivatives |
| JPH07176103A (ja) | 1993-12-20 | 1995-07-14 | Canon Inc | 光磁気記録再生システムならびにこれに用いる磁気ヘッド及び光磁気記録媒体 |
| GB9326136D0 (en) * | 1993-12-22 | 1994-02-23 | Erba Carlo Spa | Biologically active 3-substituted oxindole derivatives useful as anti-angiogenic agents |
| IL112249A (en) | 1994-01-25 | 2001-11-25 | Warner Lambert Co | Pharmaceutical compositions containing di and tricyclic pyrimidine derivatives for inhibiting tyrosine kinases of the epidermal growth factor receptor family and some new such compounds |
| US6811779B2 (en) * | 1994-02-10 | 2004-11-02 | Imclone Systems Incorporated | Methods for reducing tumor growth with VEGF receptor antibody combined with radiation and chemotherapy |
| JP3660391B2 (ja) | 1994-05-27 | 2005-06-15 | 株式会社東芝 | 半導体装置の製造方法 |
| JPH0848078A (ja) | 1994-08-05 | 1996-02-20 | Nippon Paper Ind Co Ltd | 感熱記録体 |
| GB9510757D0 (en) | 1994-09-19 | 1995-07-19 | Wellcome Found | Therapeuticaly active compounds |
| US5656454A (en) | 1994-10-04 | 1997-08-12 | President And Fellows Of Harvard College | Endothelial cell-specific enhancer |
| IL115256A0 (en) * | 1994-11-14 | 1995-12-31 | Warner Lambert Co | 6-Aryl pyrido (2,3-d) pyrimidines and naphthyridines and their use |
| GB9424249D0 (en) | 1994-12-01 | 1995-01-18 | T & N Technology Ltd | Brake pads |
| JPH08176138A (ja) | 1994-12-19 | 1996-07-09 | Mercian Corp | イソクマリン誘導体 |
| US5658374A (en) | 1995-02-28 | 1997-08-19 | Buckman Laboratories International, Inc. | Aqueous lecithin-based release aids and methods of using the same |
| US5624937A (en) * | 1995-03-02 | 1997-04-29 | Eli Lilly And Company | Chemical compounds as inhibitors of amyloid beta protein production |
| US6579314B1 (en) | 1995-03-10 | 2003-06-17 | C.R. Bard, Inc. | Covered stent with encapsulated ends |
| EP3103799B1 (en) | 1995-03-30 | 2018-06-06 | OSI Pharmaceuticals, LLC | Quinazoline derivatives |
| GB9508538D0 (en) * | 1995-04-27 | 1995-06-14 | Zeneca Ltd | Quinazoline derivatives |
| US5880141A (en) * | 1995-06-07 | 1999-03-09 | Sugen, Inc. | Benzylidene-Z-indoline compounds for the treatment of disease |
| SK72996A3 (en) | 1995-06-07 | 1997-04-09 | Pfizer | Heterocyclic ring-fused pyrimidine derivatives and pharmaceutical compositions on their base |
| GB9514265D0 (en) | 1995-07-13 | 1995-09-13 | Wellcome Found | Hetrocyclic compounds |
| JP3493903B2 (ja) * | 1995-09-29 | 2004-02-03 | 株式会社デンソー | 半導体装置 |
| GB9520822D0 (en) | 1995-10-11 | 1995-12-13 | Wellcome Found | Therapeutically active compounds |
| AR004010A1 (es) | 1995-10-11 | 1998-09-30 | Glaxo Group Ltd | Compuestos heterociclicos |
| US6346398B1 (en) * | 1995-10-26 | 2002-02-12 | Ribozyme Pharmaceuticals, Inc. | Method and reagent for the treatment of diseases or conditions related to levels of vascular endothelial growth factor receptor |
| WO1997017329A1 (fr) * | 1995-11-07 | 1997-05-15 | Kirin Beer Kabushiki Kaisha | Derives de quinoline et derives de quinazoline inhibant l'autophosphorylation d'un recepteur de facteur de croissance originaire de plaquettes, et compositions pharmaceutiques les contenant |
| US5849759A (en) | 1995-12-08 | 1998-12-15 | Berlex Laboratories, Inc. | Naphthyl-substituted benzimidazole derivatives as anti-coagulants |
| JPH09176103A (ja) | 1995-12-28 | 1997-07-08 | Nitto Chem Ind Co Ltd | ハロメチルビフェニル誘導体の製造方法 |
| GB9604361D0 (en) | 1996-02-29 | 1996-05-01 | Pharmacia Spa | 4-Substituted pyrrolopyrimidine compounds as tyrosine kinase inhibitors |
| NZ332173A (en) | 1996-04-17 | 2000-06-23 | Du Pont Pharm Co | N-(amidinophenyl)-n'-(subst.)-3h-2,4-benzodiazepin-3-one derivatives as factor xa inhibitors |
| CA2258093A1 (en) | 1996-06-28 | 1998-01-08 | Mark E. Duggan | Fibrinogen receptor antagonists |
| PT912559E (pt) | 1996-07-13 | 2003-03-31 | Glaxo Group Ltd | Compostos heterociclicos fundidos como inibidores de proteina tirosina quinase |
| CZ8799A3 (cs) | 1996-07-13 | 1999-06-16 | Glaxo Group Limited | Bicyklické heteroaromatické sloučeniny, způsob jejich výroby a farmaceutický prostředek |
| HRP970371A2 (en) | 1996-07-13 | 1998-08-31 | Kathryn Jane Smith | Heterocyclic compounds |
| NZ334125A (en) | 1996-09-25 | 2000-10-27 | Zeneca Ltd | Quinoline derivatives inhibiting the effect of growth factors such as VEGF |
| CN1072657C (zh) | 1996-09-30 | 2001-10-10 | 日本农药株式会社 | 1,2,3-噻二唑衍生物和其盐以及农业园艺病毒防治剂及其使用方法 |
| EP0837063A1 (en) | 1996-10-17 | 1998-04-22 | Pfizer Inc. | 4-Aminoquinazoline derivatives |
| AU4718997A (en) | 1996-11-27 | 1998-06-22 | Pfizer Inc. | Fused bicyclic pyrimidine derivatives |
| WO1998032436A1 (en) | 1997-01-29 | 1998-07-30 | Eli Lilly And Company | Treatment for premenstrual dysphoric disorder |
| CO4950519A1 (es) | 1997-02-13 | 2000-09-01 | Novartis Ag | Ftalazinas, preparaciones farmaceuticas que las comprenden y proceso para su preparacion |
| ATE345339T1 (de) * | 1997-02-19 | 2006-12-15 | Berlex Lab | N-heterocyclische derivate als nos inhibitoren |
| US6090556A (en) | 1997-04-07 | 2000-07-18 | Japan Science & Technology Corporation | Method for quantitatively determining the expression of a gene |
| AU7526798A (en) | 1997-04-18 | 1998-11-27 | Smithkline Beecham Plc | Acetamide and urea derivatives, process for their preparation and their use in the treatment of cns disorders |
| AU7585498A (en) | 1997-05-23 | 1998-12-11 | Bayer Corporation | Inhibition of p38 kinase activity by aryl ureas |
| US6093742A (en) | 1997-06-27 | 2000-07-25 | Vertex Pharmaceuticals, Inc. | Inhibitors of p38 |
| WO1999001738A2 (en) | 1997-06-30 | 1999-01-14 | University Of Maryland, Baltimore | Heparin binding-epidermal growth factor in the diagnosis of interstitial cystitis |
| JP3765918B2 (ja) | 1997-11-10 | 2006-04-12 | パイオニア株式会社 | 発光ディスプレイ及びその駆動方法 |
| JP4194678B2 (ja) * | 1997-11-28 | 2008-12-10 | キリンファーマ株式会社 | キノリン誘導体およびそれを含む医薬組成物 |
| KR100704977B1 (ko) | 1997-12-22 | 2007-04-09 | 바이엘 코포레이션 | 대칭성 및 비대칭성 치환디페닐우레아를 이용한 raf키나제의 저해 |
| DE1043995T1 (de) | 1997-12-22 | 2001-06-07 | Bayer Corp., Pittsburgh | INHIBIERUNG DER p38 KINASE-AKTIVITÄT DURCH DIE VERWENDUNG VON ARYL- UND HETEROARYLSUBSTITUIERTEN HARNSTOFFEN |
| IL136738A0 (en) | 1997-12-22 | 2001-06-14 | Bayer Ag | Inhibition of p38 kinase activity using substituted heterocyclic ureas |
| NZ505844A (en) | 1997-12-22 | 2003-10-31 | Bayer Ag | Inhibition of raf kinase using substituted heterocyclic ureas |
| RS49779B (sr) | 1998-01-12 | 2008-06-05 | Glaxo Group Limited, | Biciklična heteroaromatična jedinjenja kao inhibitori protein tirozin kinaze |
| GB9800575D0 (en) | 1998-01-12 | 1998-03-11 | Glaxo Group Ltd | Heterocyclic compounds |
| NZ506329A (en) | 1998-02-25 | 2004-01-30 | Inst Genetics Llc | Inhibitors of phospholipase enzymes |
| UA60365C2 (uk) | 1998-06-04 | 2003-10-15 | Пфайзер Продактс Інк. | Похідні ізотіазолу, спосіб їх одержання, фармацевтична композиція та спосіб лікування гіперпроліферативного захворювання у ссавця |
| NZ512189A (en) | 1998-11-19 | 2003-10-31 | Warner Lambert Co | N-[4-(3-chloro-4-fluoro-phenylamino)-7-(3-morpholin-4- yl-propoxy)-quinazolin-6-yl]-acrylamide useful as an irreversible inhibitor of tyrosine kinases |
| WO2000042012A1 (en) | 1999-01-13 | 2000-07-20 | Bayer Corporation | φ-CARBOXYARYL SUBSTITUTED DIPHENYL UREAS AS RAF KINASE INHIBITORS |
| UA73492C2 (en) | 1999-01-19 | 2005-08-15 | Aromatic heterocyclic compounds as antiinflammatory agents | |
| AU771504B2 (en) * | 1999-01-22 | 2004-03-25 | Kyowa Hakko Kirin Co., Ltd. | Quinoline derivatives and quinazoline derivatives |
| JP3270834B2 (ja) | 1999-01-27 | 2002-04-02 | ファイザー・プロダクツ・インク | 抗がん剤として有用なヘテロ芳香族二環式誘導体 |
| UA71945C2 (en) | 1999-01-27 | 2005-01-17 | Pfizer Prod Inc | Substituted bicyclic derivatives being used as anticancer agents |
| MXPA01008182A (es) | 1999-02-10 | 2003-08-20 | Astrazeneca Ab | Derivados de quinazolina como inhibidores de angiotensina. |
| GB9904103D0 (en) | 1999-02-24 | 1999-04-14 | Zeneca Ltd | Quinoline derivatives |
| JP2000328080A (ja) | 1999-03-12 | 2000-11-28 | Shin Etsu Chem Co Ltd | シートベルト用低摩擦化処理剤 |
| RS49836B (sr) * | 1999-03-31 | 2008-08-07 | Pfizer Products Inc., | Postupci i intermedijeri za dobijanje anti-kancernih jedinjenja |
| CN101073668A (zh) * | 1999-04-28 | 2007-11-21 | 德克萨斯大学董事会 | 用于通过选择性抑制vegf来治疗癌症的组合物和方法 |
| AU4778500A (en) | 1999-05-20 | 2000-12-12 | Takeda Chemical Industries Ltd. | Composition containing ascorbic acid salt |
| JP4304357B2 (ja) | 1999-05-24 | 2009-07-29 | 独立行政法人理化学研究所 | 完全長cDNAライブラリーの作成法 |
| PE20010306A1 (es) | 1999-07-02 | 2001-03-29 | Agouron Pharma | Compuestos de indazol y composiciones farmaceuticas que los contienen utiles para la inhibicion de proteina kinasa |
| WO2001012600A1 (en) * | 1999-08-12 | 2001-02-22 | Cor Therapeutics, Inc. | INHIBITORS OF FACTOR Xa |
| CO5200835A1 (es) | 1999-09-28 | 2002-09-27 | Bayer Corp | Piridinas y piridacinas sustituidas con actividad de inhibicion de angiogenesis |
| UA75054C2 (uk) | 1999-10-13 | 2006-03-15 | Бьорінгер Інгельхайм Фарма Гмбх & Ко. Кг | Заміщені в положенні 6 індолінони, їх одержання та їх застосування як лікарського засобу |
| JP2001131071A (ja) | 1999-10-29 | 2001-05-15 | Meiji Seika Kaisha Ltd | 非晶質および非晶質を含有する医薬組成物 |
| JP2003525595A (ja) | 1999-11-01 | 2003-09-02 | キュラゲン コーポレイション | 脈管形成に含まれる差動発現遺伝子、それにコードされるポリペプチド、及びそれを用いた方法 |
| US20080241835A1 (en) | 1999-11-01 | 2008-10-02 | Genentech, Inc. | Differentially expressed genes involved in angiogenesis, the polypeptides encoded thereby, and methods of using the same |
| EP1232150B1 (en) * | 1999-11-16 | 2007-10-10 | Boehringer Ingelheim Pharmaceuticals Inc. | Urea derivatives as anti-inflammatory agents |
| UA75055C2 (uk) | 1999-11-30 | 2006-03-15 | Пфайзер Продактс Інк. | Похідні бензоімідазолу, що використовуються як антипроліферативний засіб, фармацевтична композиція на їх основі |
| WO2001045689A2 (en) | 1999-12-22 | 2001-06-28 | Sugen, Inc. | Indolinone derivatives for modulation of c-kit tyrosine protein kinase |
| EP1251130B1 (en) * | 1999-12-24 | 2005-02-16 | Kyowa Hakko Kogyo Co., Ltd. | Fused purine derivatives |
| EP1243582A4 (en) * | 1999-12-24 | 2003-06-04 | Kirin Brewery | CHINOLINE AND CHINAZOLINE DERIVATIVES AND MEDICATIONS CONTAINING THEM |
| CN1329390C (zh) | 2000-02-15 | 2007-08-01 | 苏根公司 | 吡咯取代的2-二氢吲哚酮蛋白激酶抑制剂 |
| EP1287029A2 (en) | 2000-06-09 | 2003-03-05 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of colon cancer |
| WO2002016348A1 (en) | 2000-08-09 | 2002-02-28 | Astrazeneca Ab | Antiangiogenic bicyclic derivatives |
| AU9598601A (en) * | 2000-10-20 | 2002-04-29 | Eisai Co Ltd | Nitrogenous aromatic ring compounds |
| TWI283575B (en) | 2000-10-31 | 2007-07-11 | Eisai Co Ltd | Medicinal compositions for concomitant use as anticancer agent |
| TW558430B (en) * | 2000-11-01 | 2003-10-21 | Kao Corp | Cleaning device |
| EP1339458B1 (en) | 2000-11-22 | 2007-08-15 | Novartis AG | Combination comprising an agent decreasing vegf activity and an agent decreasing egf activity |
| US7238813B2 (en) | 2000-11-29 | 2007-07-03 | Smithkline Beecham Corporation | Chemical compounds |
| AU2002254152A1 (en) | 2001-03-08 | 2002-09-24 | Millennium Pharmaceuticals | (homo) piperazine substituted quinolines for inhibiting the phosphorylation of kinases |
| PT1385551E (pt) | 2001-04-06 | 2008-11-03 | Wyeth Corp | Associações antineoplásicas compreendendo cci-779 (derivado de rapamicina) associado a gemcitabina ou fluorouracilo |
| MXPA03009662A (es) | 2001-04-27 | 2004-12-06 | Kirin Brewery | Derivados de quinolina y derivados de quinazolina que tienen grupos azolilo. |
| HUP0400038A3 (en) | 2001-05-16 | 2007-05-29 | Novartis Ag | Combination comprising n-{5-[4-{-methyl-piperazino-methyl)-benzoylamino]-2-methylphenyl}-4-(3-pyridyl)-2pyrimidine-amine and a chemotherapeutic agent |
| DE60233736D1 (de) | 2001-06-22 | 2009-10-29 | Kirin Pharma K K | Chinolinderivat und chinazolinderivat, die die selbstphosphorylierung des hepatocytus-proliferator-rezeptors hemmen, und diese enthaltende medizinische zusammensetzung |
| GB0117144D0 (en) | 2001-07-13 | 2001-09-05 | Glaxo Group Ltd | Process |
| GB0119467D0 (en) | 2001-08-09 | 2001-10-03 | Smithkline Beecham Plc | Novel compound |
| WO2003023360A2 (en) | 2001-09-10 | 2003-03-20 | Meso Scale Technologies, Llc | Methods and apparatus for conducting multiple measurements on a sample |
| JP2005511506A (ja) | 2001-09-20 | 2005-04-28 | アブ サイエンス | 間質性膀胱炎を治療するための強力で選択的かつ非毒性のc−kit阻害剤の使用方法 |
| AU2002338807A1 (en) | 2001-09-27 | 2003-04-14 | Novartis Ag | Use of c-kit inhibitors for the treatment of myeloma |
| EP1430048A1 (en) | 2001-09-27 | 2004-06-23 | Allergan, Inc. | 3-(arylamino)methylene-1, 3-dihydro-2h-indol-2-ones as kinase inhibitors |
| US20040191254A1 (en) * | 2001-10-09 | 2004-09-30 | Fagin James Alexander | Method of treatment of thyroid cancer |
| WO2003033472A1 (fr) | 2001-10-17 | 2003-04-24 | Kirin Beer Kabushiki Kaisha | Derives de quinoline ou de quinazoline inhibant l'autophosphorylation de recepteurs du facteur de croissance des fibroblastes |
| TW200300348A (en) | 2001-11-27 | 2003-06-01 | American Cyanamid Co | 3-cyanoquinolines as inhibitors of egf-r and her2 kinases |
| GB0201508D0 (en) | 2002-01-23 | 2002-03-13 | Novartis Ag | Organic compounds |
| EP1481678A4 (en) | 2002-03-05 | 2009-12-30 | Eisai R&D Man Co Ltd | ANTITUMORAL AGENT CONTAINING A SULFONAMIDE-CONTAINING HETEROCYCLIC COMPOUND AND AN ANGIOGENESIS INHIBITOR |
| JP2005520834A (ja) | 2002-03-20 | 2005-07-14 | ダナ−ファーバー キャンサー インスティテュート,インコーポレイテッド | 小細胞肺癌の同定、診断、および治療のための方法および組成物 |
| US7598258B2 (en) | 2002-05-01 | 2009-10-06 | Kirin Beer Kabushiki Kaisha | Quinoline derivatives and quinazoline derivatives inhibiting autophosphorylation of macrophage colony stimulating factor receptor |
| UA77303C2 (en) * | 2002-06-14 | 2006-11-15 | Pfizer | Derivatives of thienopyridines substituted by benzocondensed heteroarylamide useful as therapeutic agents, pharmaceutical compositions and methods for their use |
| AU2003251968A1 (en) | 2002-07-16 | 2004-02-02 | Children's Medical Center Corporation | A method for the modulation of angiogenesis |
| US7169936B2 (en) * | 2002-07-23 | 2007-01-30 | Boehringer Ingelheim Pharma Gmbh & Co. Kg | Indolinone derivatives substituted in the 6-position, their preparation and their use as medicaments |
| CA2488739A1 (en) | 2002-08-30 | 2004-03-11 | Eisai Co., Ltd. | Nitrogen-containing aromatic derivatives |
| GB0223380D0 (en) | 2002-10-09 | 2002-11-13 | Astrazeneca Ab | Combination therapy |
| CN1297258C (zh) | 2002-10-09 | 2007-01-31 | 高山生物科学股份有限公司 | 埃坡霉素d+5-氟尿嘧啶/吉西他滨 |
| JP4749660B2 (ja) | 2002-10-16 | 2011-08-17 | 武田薬品工業株式会社 | 安定な固形製剤 |
| EP1552833B1 (en) | 2002-10-16 | 2016-12-28 | Takeda Pharmaceutical Company Limited | Process for producing an amorphous optically active isomer of lansoprazole |
| AU2003280599A1 (en) | 2002-10-29 | 2004-05-25 | Kirin Beer Kabushiki Kaisha | QUINOLINE DERIVATIVES AND QUINAZOLINE DERIVATIVES INHIBITING AUTOPHOSPHORYLATION OF Flt3 AND MEDICINAL COMPOSITIONS CONTAINING THE SAME |
| CA2502979A1 (en) | 2002-11-06 | 2004-05-21 | Cyclacel Limited | Pharmaceutical composition comprising a cdk inhibitor and gemcitabine |
| GB0226434D0 (en) | 2002-11-13 | 2002-12-18 | Astrazeneca Ab | Combination product |
| ITSV20020056A1 (it) * | 2002-11-14 | 2004-05-15 | Alstom Transp Spa | Dispositivo e metodo di verifica di motori software logici di comando di impianti ferroviari, in particolare di impianti di stazione |
| AR042042A1 (es) | 2002-11-15 | 2005-06-08 | Sugen Inc | Administracion combinada de una indolinona con un agente quimioterapeutico para trastornos de proliferacion celular |
| AU2004206860B2 (en) | 2003-01-14 | 2010-03-18 | Cytokinetics, Inc. | Compounds, compositions and methods |
| NL1022425C2 (nl) | 2003-01-17 | 2004-08-03 | Trespa Int Bv | Fenolhars, toepassing van een dergelijk fenolhars alsmede een daarmee vervaardigd vormdeel. |
| JP3581361B1 (ja) | 2003-02-17 | 2004-10-27 | 株式会社脳機能研究所 | 脳活動測定装置 |
| MY143789A (en) | 2003-02-18 | 2011-07-15 | Helsinn Healthcare Sa | Use of palonosetron treating post- operative nausea and vomiting |
| ZA200507321B (en) * | 2003-03-05 | 2007-03-28 | Celgene Corp | Diphenylethylene compounds and uses thereof |
| JPWO2004080462A1 (ja) | 2003-03-10 | 2006-06-08 | エーザイ株式会社 | c−Kitキナーゼ阻害剤 |
| CN1761682A (zh) | 2003-03-14 | 2006-04-19 | 大正制药株式会社 | 单克隆抗体与产生该单克隆抗体的杂交瘤 |
| CN101928284A (zh) | 2003-03-14 | 2010-12-29 | 小野药品工业株式会社 | 含氮杂环衍生物以及包含所述化合物作为活性成分的药物 |
| DE10317649A1 (de) | 2003-04-17 | 2004-11-04 | Robert Bosch Gmbh | Verfahren und Vorrichtung zum Betreiben eines Verbrennungsmotors im Schiebebetrieb |
| WO2004101526A1 (ja) | 2003-04-22 | 2004-11-25 | Eisai Co., Ltd. | 4-(3-クロロ-4-(シクロプロピルアミノカルボニル)アミノフェノキシ)-7-メトキシ-6-キノリンカルボキサミドの多形結晶及びその製造方法 |
| JP2005008534A (ja) | 2003-06-17 | 2005-01-13 | Soc De Conseils De Recherches & D'applications Scientifiques (Scras) | 抗癌剤及び癌の治療方法 |
| EP1648465B1 (en) | 2003-07-10 | 2010-08-25 | AstraZeneca AB | Use of the quinazoline derivative zd6474 combined with platinum compounds and optionally ionising radiation in the treatment of diseases associated with angiogenesis and/or increased vascular permeability |
| JP2007502809A (ja) * | 2003-08-15 | 2007-02-15 | アブ サイエンス | II型糖尿病を治療するためのc−kit阻害剤の使用方法 |
| KR20060121818A (ko) | 2003-08-21 | 2006-11-29 | 오에스아이 파마슈티컬스, 인코포레이티드 | N-치환된 벤즈이미다졸릴 c-kit 억제제 |
| MXPA06003163A (es) | 2003-09-23 | 2006-06-05 | Novartis Ag | Combinacion de un inhibidor de receptor de vegf con un agente quimioterapeutico. |
| EP1673085B1 (en) | 2003-09-26 | 2011-11-09 | Exelixis, Inc. | C-met modulators and methods of use |
| JP2005124034A (ja) | 2003-10-20 | 2005-05-12 | Nippon Telegr & Teleph Corp <Ntt> | 発信者の特定及び発信者への呼び返しを可能とする回線設定方法 |
| JP4303726B2 (ja) | 2003-11-11 | 2009-07-29 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | ウレア誘導体およびその製造方法 |
| AR047496A1 (es) | 2003-11-28 | 2006-01-25 | Novartis Ag | Derivados de diaril-urea en el tratamiento de enfermedades dependientes de la quinasa de proteina |
| JP5006651B2 (ja) | 2003-12-05 | 2012-08-22 | ブリストル−マイヤーズ スクウィブ カンパニー | 2型血管内皮増殖因子受容体の阻害剤 |
| CN100569753C (zh) | 2003-12-25 | 2009-12-16 | 卫材R&D管理有限公司 | 4-(3-氯-4-(环丙基氨基羰基)氨基苯氧基)-7-甲氧基-6-喹啉羧酰胺的甲磺酸盐的结晶(c)及其制备方法 |
| KR100799535B1 (ko) * | 2004-02-27 | 2008-01-31 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 신규 피리딘 유도체 및 피리미딘 유도체(2) |
| KR20050091462A (ko) | 2004-03-12 | 2005-09-15 | 한국과학기술연구원 | 푸로피리미딘 화합물 및 이를 포함하는 ddr2 티로신키나아제 활성 저해제 |
| CN1960732A (zh) | 2004-06-03 | 2007-05-09 | 霍夫曼-拉罗奇有限公司 | 用吉西他滨和egfr-抑制剂治疗 |
| US8772269B2 (en) * | 2004-09-13 | 2014-07-08 | Eisai R&D Management Co., Ltd. | Use of sulfonamide-including compounds in combination with angiogenesis inhibitors |
| WO2006030941A1 (ja) | 2004-09-13 | 2006-03-23 | Eisai R & D Management Co., Ltd. | スルホンアミド含有化合物の血管新生阻害物質との併用 |
| WO2006030826A1 (ja) | 2004-09-17 | 2006-03-23 | Eisai R & D Management Co., Ltd. | 医薬組成物 |
| CA2581375A1 (en) | 2004-09-27 | 2006-04-06 | Kosan Biosciences Incorporated | Specific kinase inhibitors |
| CA2586420A1 (en) | 2004-11-22 | 2007-04-12 | King Pharmaceuticals Research & Development, Inc. | Enhancing treatment of cancer and hif-1 mediated disoders with adenosine a3 receptor antagonists |
| US7612200B2 (en) | 2004-12-07 | 2009-11-03 | Locus Pharmaceuticals, Inc. | Inhibitors of protein kinases |
| ME01222B (me) | 2005-02-28 | 2013-06-20 | Eisai R&D Man Co Ltd | Nova kombinovana upotreba jedinjenja sulfonamida u liječenju kancera |
| JP5106098B2 (ja) * | 2005-02-28 | 2012-12-26 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | スルホンアミド化合物の抗癌剤との新規併用 |
| DE102005017446B4 (de) * | 2005-04-15 | 2008-06-05 | Südzucker AG Mannheim/Ochsenfurt | Temperaturführung bei der alkalischen Extraktion |
| KR100951607B1 (ko) | 2005-06-23 | 2010-04-09 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 4-(3-클로로-4-(시클로프로필아미노카르보닐)아미노페녹시)-7-메톡시-6-퀴놀린카르복사미드의 비정질 염 및 그 제조방법 |
| US7550483B2 (en) * | 2005-06-23 | 2009-06-23 | Eisai R&D Management Co., Ltd. | Amorphous salt of 4-(3-chloro-4-(cyclopropylaminocarbonyl)aminophenoxy)-7-methoxy-6-quinolinecarboxamide and process for preparing the same |
| WO2007014335A2 (en) | 2005-07-27 | 2007-02-01 | The University Of Texas System | Combinations comprising gemcitabine and tyrosine kinase inhibitors for the treatment of pancreatic cancer |
| EP1925941B1 (en) | 2005-08-01 | 2012-11-28 | Eisai R&D Management Co., Ltd. | Method for prediction of the efficacy of vascularization inhibitor |
| JP4989476B2 (ja) | 2005-08-02 | 2012-08-01 | エーザイ・アール・アンド・ディー・マネジメント株式会社 | 血管新生阻害物質の効果を検定する方法 |
| WO2007052850A1 (ja) | 2005-11-07 | 2007-05-10 | Eisai R & D Management Co., Ltd. | 血管新生阻害物質とc-kitキナーゼ阻害物質との併用 |
| WO2007061127A1 (ja) | 2005-11-22 | 2007-05-31 | Eisai R & D Management Co., Ltd. | 多発性骨髄腫に対する抗腫瘍剤 |
| AR059066A1 (es) | 2006-01-27 | 2008-03-12 | Amgen Inc | Combinaciones del inhibidor de la angiopoyetina -2 (ang2) y el inhibidor del factor de crecimiento endotelial vascular (vegf) |
| RU2448708C3 (ru) | 2006-05-18 | 2017-09-28 | Эйсай Ар Энд Ди Менеджмент Ко., Лтд. | Противоопухолевое средство против рака щитовидной железы |
| US8238322B2 (en) * | 2006-06-30 | 2012-08-07 | Nokia Corporation | Optimizing of channel allocation in a wireless communications system |
| EP2065372B1 (en) | 2006-08-28 | 2012-11-28 | Eisai R&D Management Co., Ltd. | Antitumor agent for undifferentiated gastric cancer |
| US20080057195A1 (en) * | 2006-08-31 | 2008-03-06 | United Technologies Corporation | Non-line of sight coating technique |
| CA2675736A1 (en) | 2007-01-19 | 2008-07-24 | Eisai R&D Management Co., Ltd. | Composition for treatment of pancreatic cancer |
| WO2008093855A1 (ja) | 2007-01-29 | 2008-08-07 | Eisai R & D Management Co., Ltd. | 未分化型胃癌治療用組成物 |
| TW200901975A (en) | 2007-03-05 | 2009-01-16 | Kyowa Hakko Kogyo Kk | Pharmaceutical composition |
| TW200901960A (en) | 2007-03-05 | 2009-01-16 | Kyowa Hakko Kogyo Kk | Pharmaceutical composition |
| WO2009060945A1 (ja) | 2007-11-09 | 2009-05-14 | Eisai R & D Management Co., Ltd. | 血管新生阻害物質と抗腫瘍性白金錯体との併用 |
| EP3028743A3 (en) | 2008-03-05 | 2017-01-25 | Vicus Therapeutics, LLC | Compositions for mucositis and oncology therapies |
| CA2723617A1 (en) | 2008-05-14 | 2009-11-19 | Amgen Inc. | Combinations vegf(r) inhibitors and hepatocyte growth factor (c-met) inhibitors for the treatment of cancer |
-
2001
- 2001-10-19 AU AU9598601A patent/AU9598601A/xx active Pending
- 2001-10-19 HU HU0302603A patent/HU230302B1/hu active Protection Beyond IP Right Term
- 2001-10-19 CA CA2426461A patent/CA2426461C/en not_active Expired - Lifetime
- 2001-10-19 EP EP06023078A patent/EP1777218B1/en not_active Expired - Lifetime
- 2001-10-19 AT AT04025700T patent/ATE399766T1/de not_active IP Right Cessation
- 2001-10-19 DE DE60137273T patent/DE60137273D1/de not_active Expired - Lifetime
- 2001-10-19 DE DE60134679T patent/DE60134679D1/de not_active Expired - Lifetime
- 2001-10-19 EP EP01976786A patent/EP1415987B1/en not_active Expired - Lifetime
- 2001-10-19 IL IL15544701A patent/IL155447A0/xx active IP Right Grant
- 2001-10-19 MX MXPA03003362 patent/MX242553B/es active IP Right Grant
- 2001-10-19 DE DE60126997T patent/DE60126997T2/de not_active Expired - Lifetime
- 2001-10-19 AU AU2001295986A patent/AU2001295986B2/en active Active
- 2001-10-19 KR KR1020037005506A patent/KR100600550B1/ko active Protection Beyond IP Right Term
- 2001-10-19 PT PT01976786T patent/PT1415987E/pt unknown
- 2001-10-19 ES ES01976786T patent/ES2282299T3/es not_active Expired - Lifetime
- 2001-10-19 CN CNA2007100070964A patent/CN101024627A/zh active Pending
- 2001-10-19 TW TW090125928A patent/TWI304061B/zh active
- 2001-10-19 EP EP04025700A patent/EP1506962B1/en not_active Expired - Lifetime
- 2001-10-19 RU RU2003114740A patent/RU2264389C3/ru active Protection Beyond IP Right Term
- 2001-10-19 KR KR1020057020292A patent/KR100589032B1/ko not_active IP Right Cessation
- 2001-10-19 DK DK01976786T patent/DK1415987T3/da active
- 2001-10-19 NZ NZ525324A patent/NZ525324A/en not_active IP Right Cessation
- 2001-10-19 JP JP2002536056A patent/JP3712393B2/ja not_active Expired - Lifetime
- 2001-10-19 AT AT06023078T patent/ATE419239T1/de not_active IP Right Cessation
- 2001-10-19 WO PCT/JP2001/009221 patent/WO2002032872A1/ja active Application Filing
- 2001-10-19 ES ES06023078T patent/ES2318649T3/es not_active Expired - Lifetime
- 2001-10-19 AT AT01976786T patent/ATE355275T1/de active
- 2001-10-19 CN CNB018197108A patent/CN1308310C/zh not_active Expired - Lifetime
- 2001-10-19 CN CN2007100070979A patent/CN101029022B/zh not_active Expired - Lifetime
-
2003
- 2003-04-14 NO NO20031731A patent/NO326781B1/no not_active IP Right Cessation
- 2003-04-15 IL IL155447A patent/IL155447A/en active Protection Beyond IP Right Term
- 2003-04-18 US US10/420,466 patent/US7253286B2/en active Active
-
2005
- 2005-04-21 JP JP2005124034A patent/JP4354929B2/ja not_active Expired - Lifetime
- 2005-12-02 US US11/293,785 patent/US7612092B2/en not_active Expired - Lifetime
-
2006
- 2006-02-03 US US11/347,749 patent/US20060160832A1/en not_active Abandoned
- 2006-07-19 AU AU2006203099A patent/AU2006203099A1/en not_active Abandoned
- 2006-11-16 AU AU2006236039A patent/AU2006236039B2/en not_active Expired
-
2007
- 2007-05-18 CY CY20071100675T patent/CY1107491T1/el unknown
- 2007-09-12 NO NO20074657A patent/NO20074657L/no not_active Application Discontinuation
-
2008
- 2008-02-21 IL IL189677A patent/IL189677A0/en unknown
- 2008-10-02 US US12/244,227 patent/US7973160B2/en not_active Expired - Fee Related
-
2009
- 2009-05-21 JP JP2009123432A patent/JP5086304B2/ja not_active Expired - Lifetime
-
2011
- 2011-01-07 US US12/986,638 patent/US8372981B2/en not_active Expired - Lifetime
-
2015
- 2015-10-08 NO NO2015021C patent/NO2015021I1/no not_active IP Right Cessation
- 2015-10-16 NL NL300764C patent/NL300764I2/nl unknown
- 2015-10-16 CY CY2015037C patent/CY2015037I2/el unknown
- 2015-10-19 FR FR15C0070C patent/FR15C0070I2/fr active Active
- 2015-10-22 BE BE2015C055C patent/BE2015C055I2/fr unknown
- 2015-10-23 LU LU92858C patent/LU92858I2/xx unknown
-
2016
- 2016-02-10 HU HUS1600009C patent/HUS1600009I1/hu unknown
Cited By (24)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US9504746B2 (en) | 2004-09-17 | 2016-11-29 | Eisai R&D Management Co., Ltd. | Pharmaceutical compositions of 4-(3-chloro-4-(cyclopropylaminocarbonyl)aminophenoxy)-7-methoxy-6-quinolinecarboxamide |
| US8969379B2 (en) | 2004-09-17 | 2015-03-03 | Eisai R&D Management Co., Ltd. | Pharmaceutical compositions of 4-(3-chloro-4-(cyclopropylaminocarbonyl)aminophenoxy)-7=methoxy-6-quinolinecarboxide |
| US8969344B2 (en) | 2005-08-02 | 2015-03-03 | Eisai R&D Management Co., Ltd. | Method for assay on the effect of vascularization inhibitor |
| US9006240B2 (en) | 2005-08-02 | 2015-04-14 | Eisai R&D Management Co., Ltd. | Method for assay on the effect of vascularization inhibitor |
| US8815241B2 (en) | 2005-11-07 | 2014-08-26 | Eisai R&D Management Co., Ltd. | Use of combination of anti-angiogenic substance and c-kit kinase inhibitor |
| US9006256B2 (en) | 2006-05-18 | 2015-04-14 | Eisai R&D Management Co., Ltd. | Antitumor agent for thyroid cancer |
| US8865737B2 (en) | 2006-08-28 | 2014-10-21 | Eisai R&D Management Co., Ltd. | Antitumor agent for undifferentiated gastric cancer |
| KR101472600B1 (ko) * | 2006-08-28 | 2014-12-15 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 미분화형 위암에 대한 항종양제 |
| US8952035B2 (en) | 2007-11-09 | 2015-02-10 | Eisai R&D Management Co., Ltd. | Combination of anti-angiogenic substance and anti-tumor platinum complex |
| KR101513326B1 (ko) * | 2007-11-09 | 2015-04-17 | 에자이 알앤드디 매니지먼트 가부시키가이샤 | 혈관 신생 저해 물질과 항종양성 백금 착물의 병용 |
| US9012458B2 (en) | 2010-06-25 | 2015-04-21 | Eisai R&D Management Co., Ltd. | Antitumor agent using compounds having kinase inhibitory effect in combination |
| US8962650B2 (en) | 2011-04-18 | 2015-02-24 | Eisai R&D Management Co., Ltd. | Therapeutic agent for tumor |
| US11598776B2 (en) | 2011-06-03 | 2023-03-07 | Eisai R&D Management Co., Ltd. | Biomarkers for predicting and assessing responsiveness of thyroid and kidney cancer subjects to lenvatinib compounds |
| US9945862B2 (en) | 2011-06-03 | 2018-04-17 | Eisai R&D Management Co., Ltd. | Biomarkers for predicting and assessing responsiveness of thyroid and kidney cancer subjects to lenvatinib compounds |
| US9334239B2 (en) | 2012-12-21 | 2016-05-10 | Eisai R&D Management Co., Ltd. | Amorphous form of quinoline derivative, and method for producing same |
| US10517861B2 (en) | 2013-05-14 | 2019-12-31 | Eisai R&D Management Co., Ltd. | Biomarkers for predicting and assessing responsiveness of endometrial cancer subjects to lenvatinib compounds |
| US10407393B2 (en) | 2014-08-28 | 2019-09-10 | Eisai R&D Management Co., Ltd. | High-purity quinoline derivative and method for manufacturing same |
| US10822307B2 (en) | 2014-08-28 | 2020-11-03 | Eisai R&D Management Co., Ltd. | High-purity quinoline derivative and method for manufacturing same |
| US11186547B2 (en) | 2014-08-28 | 2021-11-30 | Eisai R&D Management Co., Ltd. | High-purity quinoline derivative and method for manufacturing same |
| US10259791B2 (en) | 2014-08-28 | 2019-04-16 | Eisai R&D Management Co., Ltd. | High-purity quinoline derivative and method for manufacturing same |
| US11090386B2 (en) | 2015-02-25 | 2021-08-17 | Eisai R&D Management Co., Ltd. | Method for suppressing bitterness of quinoline derivative |
| US11547705B2 (en) | 2015-03-04 | 2023-01-10 | Merck Sharp & Dohme Llc | Combination of a PD-1 antagonist and a VEGF-R/FGFR/RET tyrosine kinase inhibitor for treating cancer |
| US12083112B2 (en) | 2015-03-04 | 2024-09-10 | Eisai R&D Management Co., Ltd. | Combination of a PD-1 antagonist and a VEGFR/FGFR/RET tyrosine kinase inhibitor for treating cancer |
| US11369623B2 (en) | 2015-06-16 | 2022-06-28 | Prism Pharma Co., Ltd. | Anticancer combination of a CBP/catenin inhibitor and an immune checkpoint inhibitor |
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| KR100589032B1 (ko) | 질소 함유 방향환 유도체 | |
| US10358446B2 (en) | Bruton's tyrosine kinase inhibitors | |
| KR102475498B1 (ko) | 리신 특이적 데메틸라아제-1의 억제제 | |
| JP5947307B2 (ja) | Kcnq2/3調節因子としての置換6−アミノ−ニコチンアミド | |
| US7312330B2 (en) | Bicycloheteroarylamine compounds as ion channel ligands and uses thereof | |
| KR20190003941A (ko) | 불소로 치환된 시클로프로필아민계 화합물 및 이의 제조 방법, 약물 조성물 및 용도 | |
| WO2017114383A1 (zh) | 一类新型的egfr野生型和突变型的激酶抑制剂 | |
| CA2909310A1 (en) | Quinazolines and azaquinazolines as dual inhibitors of ras/raf/mek/erk and pi3k/akt/pten/mtor pathways | |
| WO2010011349A2 (en) | Pyrimidine-2,4-diamine jak2 kinase inhibiting anti-inflammation use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A107 | Divisional application of patent | ||
| A201 | Request for examination | ||
| E902 | Notification of reason for refusal | ||
| E701 | Decision to grant or registration of patent right | ||
| GRNT | Written decision to grant | ||
| LAPS | Lapse due to unpaid annual fee |