JP7361766B2 - ヒト免疫不全ウイルス複製の阻害剤 - Google Patents
ヒト免疫不全ウイルス複製の阻害剤 Download PDFInfo
- Publication number
- JP7361766B2 JP7361766B2 JP2021514019A JP2021514019A JP7361766B2 JP 7361766 B2 JP7361766 B2 JP 7361766B2 JP 2021514019 A JP2021514019 A JP 2021514019A JP 2021514019 A JP2021514019 A JP 2021514019A JP 7361766 B2 JP7361766 B2 JP 7361766B2
- Authority
- JP
- Japan
- Prior art keywords
- chloro
- methyl
- indazol
- difluorophenyl
- ethyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000003112 inhibitor Substances 0.000 title claims description 12
- 241000725303 Human immunodeficiency virus Species 0.000 title description 17
- 230000029812 viral genome replication Effects 0.000 title 1
- 150000001875 compounds Chemical class 0.000 claims description 151
- 150000003839 salts Chemical class 0.000 claims description 75
- -1 OC 1 -C 3 alkyl Chemical group 0.000 claims description 47
- 229910052739 hydrogen Inorganic materials 0.000 claims description 41
- 239000001257 hydrogen Substances 0.000 claims description 41
- 125000001153 fluoro group Chemical group F* 0.000 claims description 32
- 150000002431 hydrogen Chemical class 0.000 claims description 32
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 27
- 239000000460 chlorine Substances 0.000 claims description 23
- 235000019000 fluorine Nutrition 0.000 claims description 22
- 239000003814 drug Substances 0.000 claims description 20
- 229910052731 fluorine Inorganic materials 0.000 claims description 20
- 125000001309 chloro group Chemical group Cl* 0.000 claims description 18
- 125000000217 alkyl group Chemical group 0.000 claims description 16
- 229910052801 chlorine Inorganic materials 0.000 claims description 15
- 229940079593 drug Drugs 0.000 claims description 15
- 239000008194 pharmaceutical composition Substances 0.000 claims description 15
- 125000001424 substituent group Chemical group 0.000 claims description 15
- 208000031886 HIV Infections Diseases 0.000 claims description 12
- 208000037357 HIV infectious disease Diseases 0.000 claims description 12
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 12
- 208000033519 human immunodeficiency virus infectious disease Diseases 0.000 claims description 12
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 12
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims description 10
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims description 9
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 claims description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 8
- 239000011737 fluorine Substances 0.000 claims description 8
- 208000030507 AIDS Diseases 0.000 claims description 6
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims description 6
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 6
- 239000003419 rna directed dna polymerase inhibitor Substances 0.000 claims description 5
- 108010078851 HIV Reverse Transcriptase Proteins 0.000 claims description 4
- 229950005928 cabotegravir Drugs 0.000 claims description 4
- WCWSTNLSLKSJPK-LKFCYVNXSA-N cabotegravir Chemical compound C([C@H]1OC[C@@H](N1C(=O)C1=C(O)C2=O)C)N1C=C2C(=O)NCC1=CC=C(F)C=C1F WCWSTNLSLKSJPK-LKFCYVNXSA-N 0.000 claims description 4
- 229960002542 dolutegravir Drugs 0.000 claims description 4
- RHWKPHLQXYSBKR-BMIGLBTASA-N dolutegravir Chemical compound C([C@@H]1OCC[C@H](N1C(=O)C1=C(O)C2=O)C)N1C=C2C(=O)NCC1=CC=C(F)C=C1F RHWKPHLQXYSBKR-BMIGLBTASA-N 0.000 claims description 4
- 229950010812 fostemsavir Drugs 0.000 claims description 4
- SWMDAPWAQQTBOG-UHFFFAOYSA-N fostemsavir Chemical compound C1=2N(COP(O)(O)=O)C=C(C(=O)C(=O)N3CCN(CC3)C(=O)C=3C=CC=CC=3)C=2C(OC)=CN=C1N1C=NC(C)=N1 SWMDAPWAQQTBOG-UHFFFAOYSA-N 0.000 claims description 4
- 229960001627 lamivudine Drugs 0.000 claims description 4
- JTEGQNOMFQHVDC-NKWVEPMBSA-N lamivudine Chemical compound O=C1N=C(N)C=CN1[C@H]1O[C@@H](CO)SC1 JTEGQNOMFQHVDC-NKWVEPMBSA-N 0.000 claims description 4
- 239000002777 nucleoside Substances 0.000 claims description 4
- 150000003833 nucleoside derivatives Chemical class 0.000 claims description 4
- 125000006645 (C3-C4) cycloalkyl group Chemical group 0.000 claims description 3
- 125000004206 2,2,2-trifluoroethyl group Chemical group [H]C([H])(*)C(F)(F)F 0.000 claims description 3
- 125000004778 2,2-difluoroethyl group Chemical group [H]C([H])(*)C([H])(F)F 0.000 claims description 3
- 102100035875 C-C chemokine receptor type 5 Human genes 0.000 claims description 3
- 101710149870 C-C chemokine receptor type 5 Proteins 0.000 claims description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 claims description 3
- 229910052736 halogen Inorganic materials 0.000 claims description 3
- 150000002367 halogens Chemical class 0.000 claims description 3
- 238000004519 manufacturing process Methods 0.000 claims description 3
- 229960004710 maraviroc Drugs 0.000 claims description 3
- GSNHKUDZZFZSJB-QYOOZWMWSA-N maraviroc Chemical compound CC(C)C1=NN=C(C)N1[C@@H]1C[C@H](N2CC[C@H](NC(=O)C3CCC(F)(F)CC3)C=3C=CC=CC=3)CC[C@H]2C1 GSNHKUDZZFZSJB-QYOOZWMWSA-N 0.000 claims description 3
- 238000002560 therapeutic procedure Methods 0.000 claims description 3
- ZIAOVIPSKUPPQW-UHFFFAOYSA-N 3-chloro-5-[1-[(4-methyl-5-oxo-1h-1,2,4-triazol-3-yl)methyl]-2-oxo-4-(trifluoromethyl)pyridin-3-yl]oxybenzonitrile Chemical compound N1C(=O)N(C)C(CN2C(C(OC=3C=C(C=C(Cl)C=3)C#N)=C(C=C2)C(F)(F)F)=O)=N1 ZIAOVIPSKUPPQW-UHFFFAOYSA-N 0.000 claims description 2
- 108010019625 Atazanavir Sulfate Proteins 0.000 claims description 2
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 claims description 2
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 claims description 2
- AXRYRYVKAWYZBR-GASGPIRDSA-N atazanavir Chemical compound C([C@H](NC(=O)[C@@H](NC(=O)OC)C(C)(C)C)[C@@H](O)CN(CC=1C=CC(=CC=1)C=1N=CC=CC=1)NC(=O)[C@@H](NC(=O)OC)C(C)(C)C)C1=CC=CC=C1 AXRYRYVKAWYZBR-GASGPIRDSA-N 0.000 claims description 2
- 230000034303 cell budding Effects 0.000 claims description 2
- CJBJHOAVZSMMDJ-HEXNFIEUSA-N darunavir Chemical compound C([C@@H]([C@H](O)CN(CC(C)C)S(=O)(=O)C=1C=CC(N)=CC=1)NC(=O)O[C@@H]1[C@@H]2CCO[C@@H]2OC1)C1=CC=CC=C1 CJBJHOAVZSMMDJ-HEXNFIEUSA-N 0.000 claims description 2
- 239000003085 diluting agent Substances 0.000 claims description 2
- 229950003141 doravirine Drugs 0.000 claims description 2
- 239000003937 drug carrier Substances 0.000 claims description 2
- 239000002835 hiv fusion inhibitor Substances 0.000 claims description 2
- 239000004030 hiv protease inhibitor Substances 0.000 claims description 2
- 238000007918 intramuscular administration Methods 0.000 claims description 2
- 230000035800 maturation Effects 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 229940068586 prezista Drugs 0.000 claims description 2
- 229940107904 reyataz Drugs 0.000 claims description 2
- 229960002814 rilpivirine Drugs 0.000 claims description 2
- YIBOMRUWOWDFLG-ONEGZZNKSA-N rilpivirine Chemical compound CC1=CC(\C=C\C#N)=CC(C)=C1NC1=CC=NC(NC=2C=CC(=CC=2)C#N)=N1 YIBOMRUWOWDFLG-ONEGZZNKSA-N 0.000 claims description 2
- 238000007920 subcutaneous administration Methods 0.000 claims description 2
- 229960004556 tenofovir Drugs 0.000 claims description 2
- VCMJCVGFSROFHV-WZGZYPNHSA-N tenofovir disoproxil fumarate Chemical compound OC(=O)\C=C\C(O)=O.N1=CN=C2N(C[C@@H](C)OCP(=O)(OCOC(=O)OC(C)C)OCOC(=O)OC(C)C)C=NC2=C1N VCMJCVGFSROFHV-WZGZYPNHSA-N 0.000 claims description 2
- 108010002459 HIV Integrase Proteins 0.000 claims 1
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims 1
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 250
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 description 164
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 145
- 239000007787 solid Substances 0.000 description 133
- 239000000243 solution Substances 0.000 description 109
- 239000000203 mixture Substances 0.000 description 105
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 99
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 95
- 235000019439 ethyl acetate Nutrition 0.000 description 92
- 238000000034 method Methods 0.000 description 92
- 238000006243 chemical reaction Methods 0.000 description 82
- 238000002360 preparation method Methods 0.000 description 76
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 75
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 66
- 239000011541 reaction mixture Substances 0.000 description 61
- 230000002829 reductive effect Effects 0.000 description 55
- 239000000047 product Substances 0.000 description 47
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 45
- 238000005160 1H NMR spectroscopy Methods 0.000 description 43
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 43
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 42
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 41
- 230000014759 maintenance of location Effects 0.000 description 40
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 39
- 239000002904 solvent Substances 0.000 description 38
- 238000004809 thin layer chromatography Methods 0.000 description 37
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 36
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 36
- 238000005481 NMR spectroscopy Methods 0.000 description 35
- 150000002500 ions Chemical class 0.000 description 34
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 33
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 32
- 238000000746 purification Methods 0.000 description 30
- 239000000706 filtrate Substances 0.000 description 29
- 239000012044 organic layer Substances 0.000 description 27
- 229910052796 boron Inorganic materials 0.000 description 25
- 239000011734 sodium Substances 0.000 description 25
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 24
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 24
- 238000001914 filtration Methods 0.000 description 24
- BDAGIHXWWSANSR-UHFFFAOYSA-N methanoic acid Natural products OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 24
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical class OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 23
- 238000002474 experimental method Methods 0.000 description 23
- HNQIVZYLYMDVSB-UHFFFAOYSA-N methanesulfonimidic acid Chemical compound CS(N)(=O)=O HNQIVZYLYMDVSB-UHFFFAOYSA-N 0.000 description 22
- 239000007819 coupling partner Substances 0.000 description 21
- 238000002953 preparative HPLC Methods 0.000 description 21
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 21
- 238000003828 vacuum filtration Methods 0.000 description 21
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 20
- 238000003756 stirring Methods 0.000 description 19
- PCBZRNYXXCIELG-WYFCWLEVSA-N COC1=CC=C(C[C@H](NC(=O)OC2CCCC3(C2)OOC2(O3)C3CC4CC(C3)CC2C4)C(=O)N[C@@H]2[C@@H](CO)O[C@H]([C@@H]2O)N2C=NC3=C2N=CN=C3N(C)C)C=C1 Chemical compound COC1=CC=C(C[C@H](NC(=O)OC2CCCC3(C2)OOC2(O3)C3CC4CC(C3)CC2C4)C(=O)N[C@@H]2[C@@H](CO)O[C@H]([C@@H]2O)N2C=NC3=C2N=CN=C3N(C)C)C=C1 PCBZRNYXXCIELG-WYFCWLEVSA-N 0.000 description 18
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 18
- 239000012267 brine Substances 0.000 description 18
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 18
- 239000010410 layer Substances 0.000 description 17
- 125000004353 pyrazol-1-yl group Chemical group [H]C1=NN(*)C([H])=C1[H] 0.000 description 17
- 239000007821 HATU Substances 0.000 description 16
- 239000000463 material Substances 0.000 description 16
- 239000000725 suspension Substances 0.000 description 15
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 14
- 239000007832 Na2SO4 Substances 0.000 description 14
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 14
- 238000010898 silica gel chromatography Methods 0.000 description 14
- 229910052938 sodium sulfate Inorganic materials 0.000 description 14
- 235000011152 sodium sulphate Nutrition 0.000 description 14
- 238000004128 high performance liquid chromatography Methods 0.000 description 13
- 229920006395 saturated elastomer Polymers 0.000 description 13
- OSWFIVFLDKOXQC-UHFFFAOYSA-N 4-(3-methoxyphenyl)aniline Chemical compound COC1=CC=CC(C=2C=CC(N)=CC=2)=C1 OSWFIVFLDKOXQC-UHFFFAOYSA-N 0.000 description 12
- 235000019253 formic acid Nutrition 0.000 description 12
- 239000002245 particle Substances 0.000 description 11
- 239000002244 precipitate Substances 0.000 description 11
- PAQZWJGSJMLPMG-UHFFFAOYSA-N 2,4,6-tripropyl-1,3,5,2$l^{5},4$l^{5},6$l^{5}-trioxatriphosphinane 2,4,6-trioxide Chemical compound CCCP1(=O)OP(=O)(CCC)OP(=O)(CCC)O1 PAQZWJGSJMLPMG-UHFFFAOYSA-N 0.000 description 10
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 10
- 239000012043 crude product Substances 0.000 description 10
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 10
- 230000000694 effects Effects 0.000 description 9
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 9
- 239000000741 silica gel Substances 0.000 description 9
- 229910002027 silica gel Inorganic materials 0.000 description 9
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 8
- 238000010828 elution Methods 0.000 description 8
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 8
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 8
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 7
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 7
- FXRMFOLZFQCWNG-UHFFFAOYSA-N N-(7-amino-4-chloro-1-methylindazol-3-yl)-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound NC=1C=CC(=C2C(=NN(C=12)C)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC)Cl FXRMFOLZFQCWNG-UHFFFAOYSA-N 0.000 description 7
- IMNFDUFMRHMDMM-UHFFFAOYSA-N N-Heptane Chemical compound CCCCCCC IMNFDUFMRHMDMM-UHFFFAOYSA-N 0.000 description 7
- 229910004298 SiO 2 Inorganic materials 0.000 description 7
- 241000700605 Viruses Species 0.000 description 7
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 7
- 229910052737 gold Inorganic materials 0.000 description 7
- 239000010931 gold Substances 0.000 description 7
- 239000012299 nitrogen atmosphere Substances 0.000 description 7
- 239000000126 substance Substances 0.000 description 7
- VQEPOQSIXGAOMF-IUYQGCFVSA-N 2-[(2S,4R)-9-(difluoromethyl)-5,5-difluoro-7,8-diazatricyclo[4.3.0.02,4]nona-1(6),8-dien-7-yl]acetic acid Chemical compound FC([C@@H]1C[C@@H]11)(F)C2=C1C(C(F)F)=NN2CC(=O)O VQEPOQSIXGAOMF-IUYQGCFVSA-N 0.000 description 6
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 6
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 6
- 238000004458 analytical method Methods 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 239000012298 atmosphere Substances 0.000 description 6
- 239000003480 eluent Substances 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 6
- CDXVUROVRIFQMV-UHFFFAOYSA-N oxo(diphenoxy)phosphanium Chemical compound C=1C=CC=CC=1O[P+](=O)OC1=CC=CC=C1 CDXVUROVRIFQMV-UHFFFAOYSA-N 0.000 description 6
- 239000012071 phase Substances 0.000 description 6
- KKEFPICWHXMILG-IUYQGCFVSA-N 2-[(2S,4R)-5,5-difluoro-9-(trifluoromethyl)-7,8-diazatricyclo[4.3.0.02,4]nona-1(6),8-dien-7-yl]acetic acid Chemical compound FC([C@@H]1C[C@@H]11)(F)C2=C1C(C(F)(F)F)=NN2CC(=O)O KKEFPICWHXMILG-IUYQGCFVSA-N 0.000 description 5
- HBAQYPYDRFILMT-UHFFFAOYSA-N 8-[3-(1-cyclopropylpyrazol-4-yl)-1H-pyrazolo[4,3-d]pyrimidin-5-yl]-3-methyl-3,8-diazabicyclo[3.2.1]octan-2-one Chemical class C1(CC1)N1N=CC(=C1)C1=NNC2=C1N=C(N=C2)N1C2C(N(CC1CC2)C)=O HBAQYPYDRFILMT-UHFFFAOYSA-N 0.000 description 5
- 229940124522 antiretrovirals Drugs 0.000 description 5
- 230000015572 biosynthetic process Effects 0.000 description 5
- 238000004587 chromatography analysis Methods 0.000 description 5
- 238000003786 synthesis reaction Methods 0.000 description 5
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 5
- CZBNUDVCRKSYDG-NSHDSACASA-N (2s)-3-(3,5-difluorophenyl)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical compound CC(C)(C)OC(=O)N[C@H](C(O)=O)CC1=CC(F)=CC(F)=C1 CZBNUDVCRKSYDG-NSHDSACASA-N 0.000 description 4
- NSKVWZIEYFSHIM-UHFFFAOYSA-N 2,6-dichloro-3-nitrobenzonitrile Chemical compound [O-][N+](=O)C1=CC=C(Cl)C(C#N)=C1Cl NSKVWZIEYFSHIM-UHFFFAOYSA-N 0.000 description 4
- JJQHGFRLPJLOJC-UHFFFAOYSA-N 2-(3-cyclopropylpyrazol-1-yl)acetic acid Chemical compound OC(=O)CN1C=CC(C2CC2)=N1 JJQHGFRLPJLOJC-UHFFFAOYSA-N 0.000 description 4
- QSVBVBFCFAOLAG-UHFFFAOYSA-N 4-chloro-1-(2,2-difluoroethyl)-7-nitroindazol-3-amine Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)F)N QSVBVBFCFAOLAG-UHFFFAOYSA-N 0.000 description 4
- IUSPKTIVYGCXMZ-UHFFFAOYSA-N 4-chloro-7-nitro-1h-indazol-3-amine Chemical compound C1=CC(Cl)=C2C(N)=NNC2=C1[N+]([O-])=O IUSPKTIVYGCXMZ-UHFFFAOYSA-N 0.000 description 4
- 108060001084 Luciferase Proteins 0.000 description 4
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 4
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 4
- 229940123527 Nucleotide reverse transcriptase inhibitor Drugs 0.000 description 4
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 4
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 238000005054 agglomeration Methods 0.000 description 4
- 230000002776 aggregation Effects 0.000 description 4
- 235000019270 ammonium chloride Nutrition 0.000 description 4
- FJDQFPXHSGXQBY-UHFFFAOYSA-L caesium carbonate Chemical compound [Cs+].[Cs+].[O-]C([O-])=O FJDQFPXHSGXQBY-UHFFFAOYSA-L 0.000 description 4
- 229910000024 caesium carbonate Inorganic materials 0.000 description 4
- 239000003610 charcoal Substances 0.000 description 4
- 239000003795 chemical substances by application Substances 0.000 description 4
- 238000004440 column chromatography Methods 0.000 description 4
- 229910000027 potassium carbonate Inorganic materials 0.000 description 4
- 238000010791 quenching Methods 0.000 description 4
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 4
- 235000017557 sodium bicarbonate Nutrition 0.000 description 4
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 4
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 4
- 238000004704 ultra performance liquid chromatography Methods 0.000 description 4
- QCSLIRFWJPOENV-UHFFFAOYSA-N (2-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC=CC=C1F QCSLIRFWJPOENV-UHFFFAOYSA-N 0.000 description 3
- HEYONDYPXIUDCK-UHFFFAOYSA-L (5-diphenylphosphanyl-9,9-dimethylxanthen-4-yl)-diphenylphosphane;palladium(2+);dichloride Chemical compound Cl[Pd]Cl.C=12OC3=C(P(C=4C=CC=CC=4)C=4C=CC=CC=4)C=CC=C3C(C)(C)C2=CC=CC=1P(C=1C=CC=CC=1)C1=CC=CC=C1 HEYONDYPXIUDCK-UHFFFAOYSA-L 0.000 description 3
- CQOQHGBSJIWOCA-UHFFFAOYSA-N 2,6-dichloro-3-nitrobenzaldehyde Chemical compound [O-][N+](=O)C1=CC=C(Cl)C(C=O)=C1Cl CQOQHGBSJIWOCA-UHFFFAOYSA-N 0.000 description 3
- IMJHQTMWQWGHCX-UHFFFAOYSA-N 2-(2,2-difluoroacetyl)bicyclo[3.1.0]hexan-3-one Chemical compound C1C(=O)C(C(=O)C(F)F)C2CC21 IMJHQTMWQWGHCX-UHFFFAOYSA-N 0.000 description 3
- VJLZSQVPMCGUHH-UHFFFAOYSA-N 2-amino-6-(2,4-difluorophenyl)pyridine-3-carboxylic acid Chemical compound NC1=C(C(=O)O)C=CC(=N1)C1=C(C=C(C=C1)F)F VJLZSQVPMCGUHH-UHFFFAOYSA-N 0.000 description 3
- SCHJQNWCMFEPJJ-UHFFFAOYSA-N 2-amino-6-(2-fluorophenyl)pyridine-3-carboxylic acid Chemical compound C1=C(C(O)=O)C(N)=NC(C=2C(=CC=CC=2)F)=C1 SCHJQNWCMFEPJJ-UHFFFAOYSA-N 0.000 description 3
- XQIZZXZPBIMBGY-UHFFFAOYSA-N 4-chloro-1-methyl-7-nitroindazol-3-amine Chemical compound C1=CC([N+]([O-])=O)=C2N(C)N=C(N)C2=C1Cl XQIZZXZPBIMBGY-UHFFFAOYSA-N 0.000 description 3
- ZCAGPOLJGQCYKJ-UHFFFAOYSA-N 4-chloro-7-nitro-1-(2,2,2-trifluoroethyl)indazol-3-amine Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)(F)F)N ZCAGPOLJGQCYKJ-UHFFFAOYSA-N 0.000 description 3
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 3
- WVDDGKGOMKODPV-UHFFFAOYSA-N Benzyl alcohol Chemical compound OCC1=CC=CC=C1 WVDDGKGOMKODPV-UHFFFAOYSA-N 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 3
- XTHFKEDIFFGKHM-UHFFFAOYSA-N Dimethoxyethane Chemical compound COCCOC XTHFKEDIFFGKHM-UHFFFAOYSA-N 0.000 description 3
- 206010059866 Drug resistance Diseases 0.000 description 3
- AVNYEBJZDPZOKJ-UHFFFAOYSA-N N-(4-chloro-1-methyl-7-nitroindazol-3-yl)-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])C)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC AVNYEBJZDPZOKJ-UHFFFAOYSA-N 0.000 description 3
- RJGHLBMMMIVMBJ-UHFFFAOYSA-N N-(4-chloro-1-methyl-7-nitroindazol-3-yl)methanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])C)NS(=O)(=O)C RJGHLBMMMIVMBJ-UHFFFAOYSA-N 0.000 description 3
- BTQCYIMPHCTVCC-UHFFFAOYSA-N N-[4-chloro-1-(2,2-difluoroethyl)-7-nitroindazol-3-yl]cyclopropanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)F)NS(=O)(=O)C1CC1 BTQCYIMPHCTVCC-UHFFFAOYSA-N 0.000 description 3
- UZRVXBUXCYOAOS-UHFFFAOYSA-N N-[4-chloro-7-nitro-1-(2,2,2-trifluoroethyl)indazol-3-yl]methanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)(F)F)NS(=O)(=O)C UZRVXBUXCYOAOS-UHFFFAOYSA-N 0.000 description 3
- UYIXXDMFEDHPMF-UHFFFAOYSA-N N-[7-amino-4-chloro-1-(2,2,2-trifluoroethyl)indazol-3-yl]-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound NC=1C=CC(=C2C(=NN(C=12)CC(F)(F)F)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC)Cl UYIXXDMFEDHPMF-UHFFFAOYSA-N 0.000 description 3
- HRLPDQGPXDMJPL-UHFFFAOYSA-N N-[7-amino-4-chloro-1-(2,2-difluoroethyl)indazol-3-yl]-N-[(4-methoxyphenyl)methyl]cyclopropanesulfonamide Chemical compound NC=1C=CC(=C2C(=NN(C=12)CC(F)F)N(S(=O)(=O)C1CC1)CC1=CC=C(C=C1)OC)Cl HRLPDQGPXDMJPL-UHFFFAOYSA-N 0.000 description 3
- 238000011225 antiretroviral therapy Methods 0.000 description 3
- YKXMZSYOSBDLMM-UHFFFAOYSA-N bicyclo[3.1.0]hexan-3-ol Chemical compound C1C(O)CC2CC21 YKXMZSYOSBDLMM-UHFFFAOYSA-N 0.000 description 3
- WQQZKEFUOHKGII-UHFFFAOYSA-N bicyclo[3.1.0]hexan-3-one Chemical compound C1C(=O)CC2CC21 WQQZKEFUOHKGII-UHFFFAOYSA-N 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 125000004212 difluorophenyl group Chemical group 0.000 description 3
- 239000012091 fetal bovine serum Substances 0.000 description 3
- 238000002347 injection Methods 0.000 description 3
- 239000007924 injection Substances 0.000 description 3
- AVZYJMPWCXZZFJ-UHFFFAOYSA-N methyl 2-amino-6-(2,4-difluorophenyl)pyridine-3-carboxylate Chemical compound NC1=C(C(=O)OC)C=CC(=N1)C1=C(C=C(C=C1)F)F AVZYJMPWCXZZFJ-UHFFFAOYSA-N 0.000 description 3
- 239000012074 organic phase Substances 0.000 description 3
- 230000001566 pro-viral effect Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 239000008259 solid foam Substances 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- 239000003643 water by type Substances 0.000 description 3
- QQLRSCZSKQTFGY-UHFFFAOYSA-N (2,4-difluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(F)C=C1F QQLRSCZSKQTFGY-UHFFFAOYSA-N 0.000 description 2
- MOHYOXXOKFQHDC-UHFFFAOYSA-N 1-(chloromethyl)-4-methoxybenzene Chemical compound COC1=CC=C(CCl)C=C1 MOHYOXXOKFQHDC-UHFFFAOYSA-N 0.000 description 2
- XOPPUHHUVPPCRQ-UHFFFAOYSA-N 1-[(4-methoxyphenyl)methyl]cyclopropane-1-sulfonamide Chemical compound C1=CC(OC)=CC=C1CC1(S(N)(=O)=O)CC1 XOPPUHHUVPPCRQ-UHFFFAOYSA-N 0.000 description 2
- MLZLGSOLBOLYJW-UHFFFAOYSA-N 2-(3,5-difluorophenyl)propanoic acid Chemical compound OC(=O)C(C)C1=CC(F)=CC(F)=C1 MLZLGSOLBOLYJW-UHFFFAOYSA-N 0.000 description 2
- VQEPOQSIXGAOMF-UHFFFAOYSA-N 2-(3-(difluoromethyl)-5,5-difluoro-3b,4,4a,5-tetrahydro-1h-cyclopropa[3,4]cyclopenta[1,2-c]pyrazol-1-yl)acetic acid Chemical compound C12CC2C(F)(F)C2=C1C(C(F)F)=NN2CC(=O)O VQEPOQSIXGAOMF-UHFFFAOYSA-N 0.000 description 2
- 125000004217 4-methoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C([H])=C1OC([H])([H])[H])C([H])([H])* 0.000 description 2
- JKVZDIFRPVCPJI-UHFFFAOYSA-N 7-bromo-4-chloro-1-methylindazol-3-amine Chemical compound C1=CC(Br)=C2N(C)N=C(N)C2=C1Cl JKVZDIFRPVCPJI-UHFFFAOYSA-N 0.000 description 2
- QGZKDVFQNNGYKY-UHFFFAOYSA-N Ammonia Chemical compound N QGZKDVFQNNGYKY-UHFFFAOYSA-N 0.000 description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 description 2
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 2
- 208000033962 Fontaine progeroid syndrome Diseases 0.000 description 2
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 2
- WTDHULULXKLSOZ-UHFFFAOYSA-N Hydroxylamine hydrochloride Chemical compound Cl.ON WTDHULULXKLSOZ-UHFFFAOYSA-N 0.000 description 2
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 2
- 239000005089 Luciferase Substances 0.000 description 2
- AMACRZNQWUGVSQ-UHFFFAOYSA-N N-(4-chloro-1-methyl-7-nitroindazol-3-yl)-N-methylsulfonylmethanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])C)N(S(=O)(=O)C)S(=O)(=O)C AMACRZNQWUGVSQ-UHFFFAOYSA-N 0.000 description 2
- MZBLAEJZKQDJKA-UHFFFAOYSA-N N-[4-chloro-1-(2,2-difluoroethyl)-7-nitroindazol-3-yl]-N-[(4-methoxyphenyl)methyl]cyclopropanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)F)N(S(=O)(=O)C1CC1)CC1=CC=C(C=C1)OC MZBLAEJZKQDJKA-UHFFFAOYSA-N 0.000 description 2
- BNBJJEJNKSLOAO-UHFFFAOYSA-N N-[4-chloro-1-(2,2-difluoroethyl)-7-nitroindazol-3-yl]methanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)F)NS(=O)(=O)C BNBJJEJNKSLOAO-UHFFFAOYSA-N 0.000 description 2
- LFSKEEYKUJEOAK-UHFFFAOYSA-N N-[4-chloro-7-nitro-1-(2,2,2-trifluoroethyl)indazol-3-yl]-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)(F)F)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC LFSKEEYKUJEOAK-UHFFFAOYSA-N 0.000 description 2
- XIMVKBDIIFQNDZ-UHFFFAOYSA-N N-[7-amino-4-chloro-1-(2,2-difluoroethyl)indazol-3-yl]-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound NC=1C=CC(=C2C(=NN(C=12)CC(F)F)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC)Cl XIMVKBDIIFQNDZ-UHFFFAOYSA-N 0.000 description 2
- 229910019142 PO4 Inorganic materials 0.000 description 2
- 229940124158 Protease/peptidase inhibitor Drugs 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 2
- 239000013543 active substance Substances 0.000 description 2
- 229910052782 aluminium Inorganic materials 0.000 description 2
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 2
- 235000011114 ammonium hydroxide Nutrition 0.000 description 2
- 239000003903 antiretrovirus agent Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- HNYOPLTXPVRDBG-UHFFFAOYSA-N barbituric acid Chemical compound O=C1CC(=O)NC(=O)N1 HNYOPLTXPVRDBG-UHFFFAOYSA-N 0.000 description 2
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 2
- 210000000234 capsid Anatomy 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- JCWIWBWXCVGEAN-UHFFFAOYSA-L cyclopentyl(diphenyl)phosphane;dichloropalladium;iron Chemical compound [Fe].Cl[Pd]Cl.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1.[CH]1[CH][CH][CH][C]1P(C=1C=CC=CC=1)C1=CC=CC=C1 JCWIWBWXCVGEAN-UHFFFAOYSA-L 0.000 description 2
- 230000003013 cytotoxicity Effects 0.000 description 2
- 231100000135 cytotoxicity Toxicity 0.000 description 2
- NKLCNNUWBJBICK-UHFFFAOYSA-N dess–martin periodinane Chemical compound C1=CC=C2I(OC(=O)C)(OC(C)=O)(OC(C)=O)OC(=O)C2=C1 NKLCNNUWBJBICK-UHFFFAOYSA-N 0.000 description 2
- HPNMFZURTQLUMO-UHFFFAOYSA-N diethylamine Chemical compound CCNCC HPNMFZURTQLUMO-UHFFFAOYSA-N 0.000 description 2
- LGIBDQRYOFBMTC-UHFFFAOYSA-N dnc010031 Chemical compound C1=CC(O)=CC=C1C1C(=O)NC2=CC=CC=C2C2=C3C1=CNC3=NC=C2 LGIBDQRYOFBMTC-UHFFFAOYSA-N 0.000 description 2
- YXFKKLLBEIZKAO-UHFFFAOYSA-N ethyl 2-[9'-(difluoromethyl)spiro[1,3-dithiolane-2,5'-7,8-diazatricyclo[4.3.0.02,4]nona-1(6),8-diene]-7'-yl]acetate Chemical compound C1=2N(CC(=O)OCC)N=C(C(F)F)C=2C2CC2C21SCCS2 YXFKKLLBEIZKAO-UHFFFAOYSA-N 0.000 description 2
- RULJEGNYRJHGJJ-UHFFFAOYSA-N ethyl 2-[9-(difluoromethyl)-5,5-difluoro-7,8-diazatricyclo[4.3.0.02,4]nona-1(6),8-dien-7-yl]acetate Chemical compound C12CC2C(F)(F)C2=C1C(C(F)F)=NN2CC(=O)OCC RULJEGNYRJHGJJ-UHFFFAOYSA-N 0.000 description 2
- YMINJWQOSFPOLL-UHFFFAOYSA-N ethyl 2-[9-(difluoromethyl)-7,8-diazatricyclo[4.3.0.02,4]nona-1(6),8-dien-7-yl]acetate Chemical compound C12CC2CC2=C1C(C(F)F)=NN2CC(=O)OCC YMINJWQOSFPOLL-UHFFFAOYSA-N 0.000 description 2
- 238000003818 flash chromatography Methods 0.000 description 2
- 238000002290 gas chromatography-mass spectrometry Methods 0.000 description 2
- 239000012456 homogeneous solution Substances 0.000 description 2
- 208000015181 infectious disease Diseases 0.000 description 2
- 229940124525 integrase strand transfer inhibitor Drugs 0.000 description 2
- 229910052740 iodine Inorganic materials 0.000 description 2
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 2
- 235000019341 magnesium sulphate Nutrition 0.000 description 2
- 238000004949 mass spectrometry Methods 0.000 description 2
- 230000010534 mechanism of action Effects 0.000 description 2
- KIEWZIXFBLIREP-UHFFFAOYSA-N n-[(4-methoxyphenyl)methyl]cyclopropanesulfonamide Chemical compound C1=CC(OC)=CC=C1CNS(=O)(=O)C1CC1 KIEWZIXFBLIREP-UHFFFAOYSA-N 0.000 description 2
- OFSFIXASTARXSY-UHFFFAOYSA-N n-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound COC1=CC=C(CNS(C)(=O)=O)C=C1 OFSFIXASTARXSY-UHFFFAOYSA-N 0.000 description 2
- 229940056360 penicillin g Drugs 0.000 description 2
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 2
- 239000010452 phosphate Substances 0.000 description 2
- 238000001556 precipitation Methods 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 125000000246 pyrimidin-2-yl group Chemical group [H]C1=NC(*)=NC([H])=C1[H] 0.000 description 2
- 238000004007 reversed phase HPLC Methods 0.000 description 2
- 238000012552 review Methods 0.000 description 2
- 239000000377 silicon dioxide Substances 0.000 description 2
- 239000002002 slurry Substances 0.000 description 2
- 229910000029 sodium carbonate Inorganic materials 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 229960005322 streptomycin Drugs 0.000 description 2
- CIHOLLKRGTVIJN-UHFFFAOYSA-N tert‐butyl hydroperoxide Chemical compound CC(C)(C)OO CIHOLLKRGTVIJN-UHFFFAOYSA-N 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- ITMCEJHCFYSIIV-UHFFFAOYSA-M triflate Chemical compound [O-]S(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-M 0.000 description 2
- 229910000404 tripotassium phosphate Inorganic materials 0.000 description 2
- 235000019798 tripotassium phosphate Nutrition 0.000 description 2
- JRHPOFJADXHYBR-HTQZYQBOSA-N (1r,2r)-1-n,2-n-dimethylcyclohexane-1,2-diamine Chemical compound CN[C@@H]1CCCC[C@H]1NC JRHPOFJADXHYBR-HTQZYQBOSA-N 0.000 description 1
- CLGIPVVEERQWSQ-UHFFFAOYSA-N (2,3,4-trifluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(F)C(F)=C1F CLGIPVVEERQWSQ-UHFFFAOYSA-N 0.000 description 1
- SZYXKFKWFYUOGZ-UHFFFAOYSA-N (2,3-difluorophenyl)boronic acid Chemical compound OB(O)C1=CC=CC(F)=C1F SZYXKFKWFYUOGZ-UHFFFAOYSA-N 0.000 description 1
- IPEIGKHHSZFAEW-UHFFFAOYSA-N (2,4,6-trifluorophenyl)boronic acid Chemical compound OB(O)C1=C(F)C=C(F)C=C1F IPEIGKHHSZFAEW-UHFFFAOYSA-N 0.000 description 1
- QNEGDGPAXKYZHZ-UHFFFAOYSA-N (2,4-dichlorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(Cl)C=C1Cl QNEGDGPAXKYZHZ-UHFFFAOYSA-N 0.000 description 1
- NRIQRAMCXSJILE-UHFFFAOYSA-N (2,4-difluoro-3-methoxyphenyl)boronic acid Chemical compound COC1=C(F)C=CC(B(O)O)=C1F NRIQRAMCXSJILE-UHFFFAOYSA-N 0.000 description 1
- KTOJGSDLJNUAEP-UHFFFAOYSA-N (2,5-difluorophenyl)boronic acid Chemical compound OB(O)C1=CC(F)=CC=C1F KTOJGSDLJNUAEP-UHFFFAOYSA-N 0.000 description 1
- DBZAICSEFBVFHL-UHFFFAOYSA-N (2,6-difluorophenyl)boronic acid Chemical compound OB(O)C1=C(F)C=CC=C1F DBZAICSEFBVFHL-UHFFFAOYSA-N 0.000 description 1
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- UHDDEIOYXFXNNJ-UHFFFAOYSA-N (3,4,5-trifluorophenyl)boronic acid Chemical compound OB(O)C1=CC(F)=C(F)C(F)=C1 UHDDEIOYXFXNNJ-UHFFFAOYSA-N 0.000 description 1
- QWQBQRYFWNIDOC-UHFFFAOYSA-N (3,5-difluorophenyl)boronic acid Chemical compound OB(O)C1=CC(F)=CC(F)=C1 QWQBQRYFWNIDOC-UHFFFAOYSA-N 0.000 description 1
- FEZRHYMTLJNUTK-UHFFFAOYSA-N (3-chloro-2,4-difluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(F)C(Cl)=C1F FEZRHYMTLJNUTK-UHFFFAOYSA-N 0.000 description 1
- WJDZZXIDQYKVDG-UHFFFAOYSA-N (3-chloro-4-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(F)C(Cl)=C1 WJDZZXIDQYKVDG-UHFFFAOYSA-N 0.000 description 1
- OLKIYJDSLMKNLC-UHFFFAOYSA-N (3-cyano-4-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(F)C(C#N)=C1 OLKIYJDSLMKNLC-UHFFFAOYSA-N 0.000 description 1
- HZFFUMBZBGETES-UHFFFAOYSA-N (3-methylsulfonylphenyl)boronic acid Chemical compound CS(=O)(=O)C1=CC=CC(B(O)O)=C1 HZFFUMBZBGETES-UHFFFAOYSA-N 0.000 description 1
- YBNDRTRLXPEWKQ-UHFFFAOYSA-N (4-chloro-2-fluorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(Cl)C=C1F YBNDRTRLXPEWKQ-UHFFFAOYSA-N 0.000 description 1
- CAYQIZIAYYNFCS-UHFFFAOYSA-N (4-chlorophenyl)boronic acid Chemical compound OB(O)C1=CC=C(Cl)C=C1 CAYQIZIAYYNFCS-UHFFFAOYSA-N 0.000 description 1
- KAVXXYBTIPXTRQ-UHFFFAOYSA-N (4-fluoro-2-methylsulfonylphenyl)boronic acid Chemical compound CS(=O)(=O)C1=CC(F)=CC=C1B(O)O KAVXXYBTIPXTRQ-UHFFFAOYSA-N 0.000 description 1
- NEZHJPAWXWRHBO-UHFFFAOYSA-N (5-chloro-2,4-difluorophenyl)boronic acid Chemical compound OB(O)C1=CC(Cl)=C(F)C=C1F NEZHJPAWXWRHBO-UHFFFAOYSA-N 0.000 description 1
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 1
- DXLQEJHUQKKSRB-UHFFFAOYSA-N 1,1,1-trifluoro-n-pyridin-2-yl-n-(trifluoromethylsulfonyl)methanesulfonamide Chemical compound FC(F)(F)S(=O)(=O)N(S(=O)(=O)C(F)(F)F)C1=CC=CC=N1 DXLQEJHUQKKSRB-UHFFFAOYSA-N 0.000 description 1
- WSLDOOZREJYCGB-UHFFFAOYSA-N 1,2-Dichloroethane Chemical compound ClCCCl WSLDOOZREJYCGB-UHFFFAOYSA-N 0.000 description 1
- VYMPLPIFKRHAAC-UHFFFAOYSA-N 1,2-ethanedithiol Chemical compound SCCS VYMPLPIFKRHAAC-UHFFFAOYSA-N 0.000 description 1
- IMLSAISZLJGWPP-UHFFFAOYSA-N 1,3-dithiolane Chemical compound C1CSCS1 IMLSAISZLJGWPP-UHFFFAOYSA-N 0.000 description 1
- BHKKSKOHRFHHIN-MRVPVSSYSA-N 1-[[2-[(1R)-1-aminoethyl]-4-chlorophenyl]methyl]-2-sulfanylidene-5H-pyrrolo[3,2-d]pyrimidin-4-one Chemical compound N[C@H](C)C1=C(CN2C(NC(C3=C2C=CN3)=O)=S)C=CC(=C1)Cl BHKKSKOHRFHHIN-MRVPVSSYSA-N 0.000 description 1
- RTMMSCJWQYWMNK-UHFFFAOYSA-N 2,2,2-trifluoroethyl trifluoromethanesulfonate Chemical compound FC(F)(F)COS(=O)(=O)C(F)(F)F RTMMSCJWQYWMNK-UHFFFAOYSA-N 0.000 description 1
- NKULBUOBGILEAR-UHFFFAOYSA-N 2,2-difluoroethyl trifluoromethanesulfonate Chemical compound FC(F)COS(=O)(=O)C(F)(F)F NKULBUOBGILEAR-UHFFFAOYSA-N 0.000 description 1
- DMIYKWPEFRFTPY-UHFFFAOYSA-N 2,6-dichlorobenzaldehyde Chemical compound ClC1=CC=CC(Cl)=C1C=O DMIYKWPEFRFTPY-UHFFFAOYSA-N 0.000 description 1
- KZDCMKVLEYCGQX-UDPGNSCCSA-N 2-(diethylamino)ethyl 4-aminobenzoate;(2s,5r,6r)-3,3-dimethyl-7-oxo-6-[(2-phenylacetyl)amino]-4-thia-1-azabicyclo[3.2.0]heptane-2-carboxylic acid;hydrate Chemical compound O.CCN(CC)CCOC(=O)C1=CC=C(N)C=C1.N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 KZDCMKVLEYCGQX-UDPGNSCCSA-N 0.000 description 1
- NXFFJDQHYLNEJK-UHFFFAOYSA-N 2-[4-[(4-chlorophenyl)methyl]-7-fluoro-5-methylsulfonyl-2,3-dihydro-1h-cyclopenta[b]indol-3-yl]acetic acid Chemical compound C1=2C(S(=O)(=O)C)=CC(F)=CC=2C=2CCC(CC(O)=O)C=2N1CC1=CC=C(Cl)C=C1 NXFFJDQHYLNEJK-UHFFFAOYSA-N 0.000 description 1
- WZJLNCJISKSABO-UHFFFAOYSA-N 2-amino-5-bromo-6-methoxypyridine-3-carboxylic acid Chemical compound COc1nc(N)c(cc1Br)C(O)=O WZJLNCJISKSABO-UHFFFAOYSA-N 0.000 description 1
- INERBKPRIWEQRQ-UHFFFAOYSA-N 2-amino-6-chloropyridine-3-carboxylic acid Chemical compound NC1=NC(Cl)=CC=C1C(O)=O INERBKPRIWEQRQ-UHFFFAOYSA-N 0.000 description 1
- SYDXANXSWQIFKU-UHFFFAOYSA-N 2-amino-6-methoxypyridine-3-carboxylic acid Chemical compound COC1=CC=C(C(O)=O)C(N)=N1 SYDXANXSWQIFKU-UHFFFAOYSA-N 0.000 description 1
- CCUUFQHNUBIZLQ-UHFFFAOYSA-N 2-amino-6-phenylmethoxypyridine-3-carboxylic acid Chemical compound NC1=C(C(=O)O)C=CC(=N1)OCC1=CC=CC=C1 CCUUFQHNUBIZLQ-UHFFFAOYSA-N 0.000 description 1
- LBLYYCQCTBFVLH-UHFFFAOYSA-M 2-methylbenzenesulfonate Chemical compound CC1=CC=CC=C1S([O-])(=O)=O LBLYYCQCTBFVLH-UHFFFAOYSA-M 0.000 description 1
- 125000004211 3,5-difluorophenyl group Chemical group [H]C1=C(F)C([H])=C(*)C([H])=C1F 0.000 description 1
- TWYUOUVQRHKSFE-UHFFFAOYSA-N 3-bromo-6-chloro-2-fluorobenzonitrile Chemical compound FC1=C(Br)C=CC(Cl)=C1C#N TWYUOUVQRHKSFE-UHFFFAOYSA-N 0.000 description 1
- LBUNNMJLXWQQBY-UHFFFAOYSA-N 4-fluorophenylboronic acid Chemical compound OB(O)C1=CC=C(F)C=C1 LBUNNMJLXWQQBY-UHFFFAOYSA-N 0.000 description 1
- MNNQIBXLAHVDDL-UHFFFAOYSA-N 5-bromopyridine-2-carboxylic acid Chemical compound OC(=O)C1=CC=C(Br)C=N1 MNNQIBXLAHVDDL-UHFFFAOYSA-N 0.000 description 1
- GZIVKNLUMBURSC-UHFFFAOYSA-N 6-phenylmethoxypyridine-3-carboxylic acid Chemical compound N1=CC(C(=O)O)=CC=C1OCC1=CC=CC=C1 GZIVKNLUMBURSC-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 1
- USFZMSVCRYTOJT-UHFFFAOYSA-N Ammonium acetate Chemical compound N.CC(O)=O USFZMSVCRYTOJT-UHFFFAOYSA-N 0.000 description 1
- 239000005695 Ammonium acetate Substances 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 1
- KRKNYBCHXYNGOX-UHFFFAOYSA-K Citrate Chemical compound [O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O KRKNYBCHXYNGOX-UHFFFAOYSA-K 0.000 description 1
- 229910021591 Copper(I) chloride Inorganic materials 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- DSLZVSRJTYRBFB-LLEIAEIESA-N D-glucaric acid Chemical compound OC(=O)[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O DSLZVSRJTYRBFB-LLEIAEIESA-N 0.000 description 1
- RGHNJXZEOKUKBD-SQOUGZDYSA-M D-gluconate Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O RGHNJXZEOKUKBD-SQOUGZDYSA-M 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 108010032976 Enfuvirtide Proteins 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000400611 Eucalyptus deanei Species 0.000 description 1
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 1
- 229940099797 HIV integrase inhibitor Drugs 0.000 description 1
- CPELXLSAUQHCOX-UHFFFAOYSA-N Hydrogen bromide Chemical compound Br CPELXLSAUQHCOX-UHFFFAOYSA-N 0.000 description 1
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 description 1
- JVTAAEKCZFNVCJ-UHFFFAOYSA-M Lactate Chemical compound CC(O)C([O-])=O JVTAAEKCZFNVCJ-UHFFFAOYSA-M 0.000 description 1
- FYYHWMGAXLPEAU-UHFFFAOYSA-N Magnesium Chemical compound [Mg] FYYHWMGAXLPEAU-UHFFFAOYSA-N 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- ZIYBIEZYLPJPKG-UHFFFAOYSA-N N-(7-bromo-4-chloro-1-methylindazol-3-yl)-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound BrC=1C=CC(=C2C(=NN(C=12)C)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC)Cl ZIYBIEZYLPJPKG-UHFFFAOYSA-N 0.000 description 1
- IMCFAWQUNZCDHB-UHFFFAOYSA-N N-(7-bromo-4-chloro-1-methylindazol-3-yl)methanesulfonamide Chemical compound BrC=1C=CC(=C2C(=NN(C=12)C)NS(=O)(=O)C)Cl IMCFAWQUNZCDHB-UHFFFAOYSA-N 0.000 description 1
- OTQYFZKDEYBJMF-UHFFFAOYSA-N N-[(2,6-dichloro-3-nitrophenyl)methylidene]hydroxylamine Chemical compound ClC1=C(C=NO)C(=CC=C1[N+](=O)[O-])Cl OTQYFZKDEYBJMF-UHFFFAOYSA-N 0.000 description 1
- PCMKRLYEGGMIMY-UHFFFAOYSA-N N-[4-chloro-1-(2,2-difluoroethyl)-7-nitroindazol-3-yl]-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)F)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC PCMKRLYEGGMIMY-UHFFFAOYSA-N 0.000 description 1
- UXLFQONUWBTLSQ-UHFFFAOYSA-N N-[4-chloro-1-(2,2-difluoroethyl)-7-nitroindazol-3-yl]-N-methylsulfonylmethanesulfonamide Chemical compound CS(=O)(=O)N(C1=NN(CC(F)F)C2=C(C=CC(Cl)=C12)[N+]([O-])=O)S(C)(=O)=O UXLFQONUWBTLSQ-UHFFFAOYSA-N 0.000 description 1
- UMYIMDANVNIAOA-UHFFFAOYSA-N N-[4-chloro-7-nitro-1-(2,2,2-trifluoroethyl)indazol-3-yl]-N-methylsulfonylmethanesulfonamide Chemical compound ClC1=C2C(=NN(C2=C(C=C1)[N+](=O)[O-])CC(F)(F)F)N(S(=O)(=O)C)S(=O)(=O)C UMYIMDANVNIAOA-UHFFFAOYSA-N 0.000 description 1
- IUILHGWGBIQVGE-PMERELPUSA-N N-[7-[2-[(1S)-1-amino-2-(3,5-difluorophenyl)ethyl]-7-(2-fluorophenyl)-4-oxopyrido[2,3-d]pyrimidin-3-yl]-4-chloro-1-methylindazol-3-yl]-N-[(4-methoxyphenyl)methyl]methanesulfonamide Chemical compound N[C@@H](CC1=CC(=CC(=C1)F)F)C=1N(C(C2=C(N=1)N=C(C=C2)C1=C(C=CC=C1)F)=O)C=1C=CC(=C2C(=NN(C=12)C)N(S(=O)(=O)C)CC1=CC=C(C=C1)OC)Cl IUILHGWGBIQVGE-PMERELPUSA-N 0.000 description 1
- 229910002651 NO3 Inorganic materials 0.000 description 1
- NHNBFGGVMKEFGY-UHFFFAOYSA-N Nitrate Chemical compound [O-][N+]([O-])=O NHNBFGGVMKEFGY-UHFFFAOYSA-N 0.000 description 1
- 229910002666 PdCl2 Inorganic materials 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-L Phosphate ion(2-) Chemical compound OP([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-L 0.000 description 1
- ZLMJMSJWJFRBEC-UHFFFAOYSA-N Potassium Chemical compound [K] ZLMJMSJWJFRBEC-UHFFFAOYSA-N 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 108010052090 Renilla Luciferases Proteins 0.000 description 1
- NCDNCNXCDXHOMX-UHFFFAOYSA-N Ritonavir Natural products C=1C=CC=CC=1CC(NC(=O)OCC=1SC=NC=1)C(O)CC(CC=1C=CC=CC=1)NC(=O)C(C(C)C)NC(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-L Sulfate Chemical compound [O-]S([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-L 0.000 description 1
- 101800001690 Transmembrane protein gp41 Proteins 0.000 description 1
- 206010066901 Treatment failure Diseases 0.000 description 1
- 108010067390 Viral Proteins Proteins 0.000 description 1
- ALMFIOZYDASRRC-UHFFFAOYSA-N [4-(trifluoromethyl)phenyl]boronic acid Chemical compound OB(O)C1=CC=C(C(F)(F)F)C=C1 ALMFIOZYDASRRC-UHFFFAOYSA-N 0.000 description 1
- WDCNOFNVHZOFOW-UHFFFAOYSA-N [4-fluoro-2-(hydroxymethyl)phenyl]boronic acid Chemical compound OCC1=CC(F)=CC=C1B(O)O WDCNOFNVHZOFOW-UHFFFAOYSA-N 0.000 description 1
- PWMOQHMTXJYUGE-UHFFFAOYSA-N [4-fluoro-3-(hydroxymethyl)phenyl]boronic acid Chemical compound OCC1=CC(B(O)O)=CC=C1F PWMOQHMTXJYUGE-UHFFFAOYSA-N 0.000 description 1
- SJZAPSHKTOTRBQ-UHFFFAOYSA-N [dimethylamino(triazolo[4,5-b]pyridin-1-yl)methylidene]-dimethylazanium Chemical compound C1=CC=C2[N+](=C(N(C)C)N(C)C)N=NC2=N1 SJZAPSHKTOTRBQ-UHFFFAOYSA-N 0.000 description 1
- WXIONIWNXBAHRU-UHFFFAOYSA-N [dimethylamino(triazolo[4,5-b]pyridin-3-yloxy)methylidene]-dimethylazanium Chemical compound C1=CN=C2N(OC(N(C)C)=[N+](C)C)N=NC2=C1 WXIONIWNXBAHRU-UHFFFAOYSA-N 0.000 description 1
- LVZGQWKTUCVPBQ-UHFFFAOYSA-N acetic acid;trifluoroborane Chemical compound CC(O)=O.FB(F)F LVZGQWKTUCVPBQ-UHFFFAOYSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 229910021529 ammonia Inorganic materials 0.000 description 1
- 235000019257 ammonium acetate Nutrition 0.000 description 1
- 229940043376 ammonium acetate Drugs 0.000 description 1
- 150000003863 ammonium salts Chemical class 0.000 description 1
- 238000002832 anti-viral assay Methods 0.000 description 1
- 230000000840 anti-viral effect Effects 0.000 description 1
- 239000004599 antimicrobial Substances 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 230000004888 barrier function Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- 229940077388 benzenesulfonate Drugs 0.000 description 1
- SRSXLGNVWSONIS-UHFFFAOYSA-M benzenesulfonate Chemical compound [O-]S(=O)(=O)C1=CC=CC=C1 SRSXLGNVWSONIS-UHFFFAOYSA-M 0.000 description 1
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 1
- 235000019445 benzyl alcohol Nutrition 0.000 description 1
- 230000027455 binding Effects 0.000 description 1
- 238000010170 biological method Methods 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- ZADPBFCGQRWHPN-UHFFFAOYSA-N boronic acid Chemical compound OBO ZADPBFCGQRWHPN-UHFFFAOYSA-N 0.000 description 1
- 239000011449 brick Substances 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- MIOPJNTWMNEORI-UHFFFAOYSA-N camphorsulfonic acid Chemical compound C1CC2(CS(O)(=O)=O)C(=O)CC1C2(C)C MIOPJNTWMNEORI-UHFFFAOYSA-N 0.000 description 1
- 150000004657 carbamic acid derivatives Chemical class 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 238000002512 chemotherapy Methods 0.000 description 1
- 229940001468 citrate Drugs 0.000 description 1
- ZCIGNRJZKPOIKD-CQXVEOKZSA-N cobicistat Chemical compound S1C(C(C)C)=NC(CN(C)C(=O)N[C@@H](CCN2CCOCC2)C(=O)N[C@H](CC[C@H](CC=2C=CC=CC=2)NC(=O)OCC=2SC=NC=2)CC=2C=CC=CC=2)=C1 ZCIGNRJZKPOIKD-CQXVEOKZSA-N 0.000 description 1
- 229960002402 cobicistat Drugs 0.000 description 1
- 229910052681 coesite Inorganic materials 0.000 description 1
- 238000007398 colorimetric assay Methods 0.000 description 1
- 229940000425 combination drug Drugs 0.000 description 1
- OXBLHERUFWYNTN-UHFFFAOYSA-M copper(I) chloride Chemical compound [Cu]Cl OXBLHERUFWYNTN-UHFFFAOYSA-M 0.000 description 1
- 229910052906 cristobalite Inorganic materials 0.000 description 1
- 239000013058 crude material Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- WEIMJSIRDZDHAH-UHFFFAOYSA-N cyclopent-3-en-1-ol Chemical compound OC1CC=CC1 WEIMJSIRDZDHAH-UHFFFAOYSA-N 0.000 description 1
- WMSPXQIQBQAWLL-UHFFFAOYSA-N cyclopropanesulfonamide Chemical compound NS(=O)(=O)C1CC1 WMSPXQIQBQAWLL-UHFFFAOYSA-N 0.000 description 1
- PFWWSGFPICCWGU-UHFFFAOYSA-N cyclopropanesulfonyl chloride Chemical compound ClS(=O)(=O)C1CC1 PFWWSGFPICCWGU-UHFFFAOYSA-N 0.000 description 1
- VRLDVERQJMEPIF-UHFFFAOYSA-N dbdmh Chemical compound CC1(C)N(Br)C(=O)N(Br)C1=O VRLDVERQJMEPIF-UHFFFAOYSA-N 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- HQWPLXHWEZZGKY-UHFFFAOYSA-N diethylzinc Chemical compound CC[Zn]CC HQWPLXHWEZZGKY-UHFFFAOYSA-N 0.000 description 1
- NZZFYRREKKOMAT-UHFFFAOYSA-N diiodomethane Chemical compound ICI NZZFYRREKKOMAT-UHFFFAOYSA-N 0.000 description 1
- VAYGXNSJCAHWJZ-UHFFFAOYSA-N dimethyl sulfate Chemical compound COS(=O)(=O)OC VAYGXNSJCAHWJZ-UHFFFAOYSA-N 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N dimethylselenoniopropionate Natural products CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 238000004821 distillation Methods 0.000 description 1
- 239000000890 drug combination Substances 0.000 description 1
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 1
- PEASPLKKXBYDKL-FXEVSJAOSA-N enfuvirtide Chemical group C([C@@H](C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](C)C(=O)N[C@@H](CO)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C=CC=CC=1)C(N)=O)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(C)=O)[C@@H](C)O)[C@@H](C)CC)C1=CN=CN1 PEASPLKKXBYDKL-FXEVSJAOSA-N 0.000 description 1
- 229960002062 enfuvirtide Drugs 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- GZKHDVAKKLTJPO-UHFFFAOYSA-N ethyl 2,2-difluoroacetate Chemical compound CCOC(=O)C(F)F GZKHDVAKKLTJPO-UHFFFAOYSA-N 0.000 description 1
- CMSIJCXFYYYCDW-UHFFFAOYSA-N ethyl 2-[9-(difluoromethyl)-5-oxo-7,8-diazatricyclo[4.3.0.02,4]nona-1(6),8-dien-7-yl]acetate Chemical compound C12CC2C(=O)C2=C1C(C(F)F)=NN2CC(=O)OCC CMSIJCXFYYYCDW-UHFFFAOYSA-N 0.000 description 1
- HZZRIIPYFPIKHR-UHFFFAOYSA-N ethyl 2-hydrazinylacetate;hydron;chloride Chemical compound Cl.CCOC(=O)CNN HZZRIIPYFPIKHR-UHFFFAOYSA-N 0.000 description 1
- 239000002024 ethyl acetate extract Substances 0.000 description 1
- 239000006260 foam Substances 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 238000007429 general method Methods 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 229940050410 gluconate Drugs 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 238000004896 high resolution mass spectrometry Methods 0.000 description 1
- 239000003084 hiv integrase inhibitor Substances 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- KJDJPXUIZYHXEZ-UHFFFAOYSA-N hydrogen sulfate;methylaminoazanium Chemical compound CN[NH3+].OS([O-])(=O)=O KJDJPXUIZYHXEZ-UHFFFAOYSA-N 0.000 description 1
- QAOWNCQODCNURD-UHFFFAOYSA-M hydrogensulfate Chemical compound OS([O-])(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-M 0.000 description 1
- RCBVKBFIWMOMHF-UHFFFAOYSA-L hydroxy-(hydroxy(dioxo)chromio)oxy-dioxochromium;pyridine Chemical compound C1=CC=NC=C1.C1=CC=NC=C1.O[Cr](=O)(=O)O[Cr](O)(=O)=O RCBVKBFIWMOMHF-UHFFFAOYSA-L 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 238000010255 intramuscular injection Methods 0.000 description 1
- 239000007927 intramuscular injection Substances 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- BAUYGSIQEAFULO-UHFFFAOYSA-L iron(2+) sulfate (anhydrous) Chemical class [Fe+2].[O-]S([O-])(=O)=O BAUYGSIQEAFULO-UHFFFAOYSA-L 0.000 description 1
- JJWLVOIRVHMVIS-UHFFFAOYSA-N isopropylamine Chemical compound CC(C)N JJWLVOIRVHMVIS-UHFFFAOYSA-N 0.000 description 1
- 229940001447 lactate Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000011777 magnesium Substances 0.000 description 1
- 229910052749 magnesium Inorganic materials 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000003550 marker Substances 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 239000013264 metal-organic assembly Substances 0.000 description 1
- JEIXBBIBJBCFBI-UHFFFAOYSA-N methyl 2-amino-6-chloropyridine-3-carboxylate Chemical compound COC(=O)C1=CC=C(Cl)N=C1N JEIXBBIBJBCFBI-UHFFFAOYSA-N 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- DUWWHGPELOTTOE-UHFFFAOYSA-N n-(5-chloro-2,4-dimethoxyphenyl)-3-oxobutanamide Chemical compound COC1=CC(OC)=C(NC(=O)CC(C)=O)C=C1Cl DUWWHGPELOTTOE-UHFFFAOYSA-N 0.000 description 1
- ICTGBOFCIDHVPA-UHFFFAOYSA-N n-methylsulfonylmethanesulfonamide Chemical compound CS(=O)(=O)NS(C)(=O)=O ICTGBOFCIDHVPA-UHFFFAOYSA-N 0.000 description 1
- 108700004028 nef Genes Proteins 0.000 description 1
- 101150023385 nef gene Proteins 0.000 description 1
- 239000002547 new drug Substances 0.000 description 1
- 238000006396 nitration reaction Methods 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 206010073131 oligoastrocytoma Diseases 0.000 description 1
- 150000003891 oxalate salts Chemical class 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- PIBWKRNGBLPSSY-UHFFFAOYSA-L palladium(II) chloride Chemical compound Cl[Pd]Cl PIBWKRNGBLPSSY-UHFFFAOYSA-L 0.000 description 1
- 244000052769 pathogen Species 0.000 description 1
- 239000008188 pellet Substances 0.000 description 1
- 239000011591 potassium Substances 0.000 description 1
- 229910052700 potassium Inorganic materials 0.000 description 1
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 1
- 239000000843 powder Substances 0.000 description 1
- 238000004237 preparative chromatography Methods 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 235000019260 propionic acid Nutrition 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- GRJJQCWNZGRKAU-UHFFFAOYSA-N pyridin-1-ium;fluoride Chemical compound F.C1=CC=NC=C1 GRJJQCWNZGRKAU-UHFFFAOYSA-N 0.000 description 1
- 238000000611 regression analysis Methods 0.000 description 1
- 238000004366 reverse phase liquid chromatography Methods 0.000 description 1
- 230000002441 reversible effect Effects 0.000 description 1
- 229960000311 ritonavir Drugs 0.000 description 1
- NCDNCNXCDXHOMX-XGKFQTDJSA-N ritonavir Chemical compound N([C@@H](C(C)C)C(=O)N[C@H](C[C@H](O)[C@H](CC=1C=CC=CC=1)NC(=O)OCC=1SC=NC=1)CC=1C=CC=CC=1)C(=O)N(C)CC1=CSC(C(C)C)=N1 NCDNCNXCDXHOMX-XGKFQTDJSA-N 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 235000012239 silicon dioxide Nutrition 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 235000010378 sodium ascorbate Nutrition 0.000 description 1
- PPASLZSBLFJQEF-RKJRWTFHSA-M sodium ascorbate Substances [Na+].OC[C@@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RKJRWTFHSA-M 0.000 description 1
- 229960005055 sodium ascorbate Drugs 0.000 description 1
- AKHNMLFCWUSKQB-UHFFFAOYSA-L sodium thiosulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=S AKHNMLFCWUSKQB-UHFFFAOYSA-L 0.000 description 1
- 235000019345 sodium thiosulphate Nutrition 0.000 description 1
- PPASLZSBLFJQEF-RXSVEWSESA-M sodium-L-ascorbate Chemical compound [Na+].OC[C@H](O)[C@H]1OC(=O)C(O)=C1[O-] PPASLZSBLFJQEF-RXSVEWSESA-M 0.000 description 1
- 229910052682 stishovite Inorganic materials 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-L succinate(2-) Chemical compound [O-]C(=O)CCC([O-])=O KDYFGRWQOYBRFD-UHFFFAOYSA-L 0.000 description 1
- BDHFUVZGWQCTTF-UHFFFAOYSA-M sulfonate Chemical compound [O-]S(=O)=O BDHFUVZGWQCTTF-UHFFFAOYSA-M 0.000 description 1
- HHVIBTZHLRERCL-UHFFFAOYSA-N sulfonyldimethane Chemical compound CS(C)(=O)=O HHVIBTZHLRERCL-UHFFFAOYSA-N 0.000 description 1
- BKSHRYOTCPWATO-UHFFFAOYSA-N sulfonylmethanesulfonamide Chemical compound NS(=O)(=O)C=S(=O)=O BKSHRYOTCPWATO-UHFFFAOYSA-N 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 230000009897 systematic effect Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- HOSFWVKBQANICW-UMSFTDKQSA-N tert-butyl N-[(1S)-1-[3-[4-chloro-3-[(4-methoxyphenyl)methyl-methylsulfonylamino]-1-methylindazol-7-yl]-7-(2-fluorophenyl)-4-oxopyrido[2,3-d]pyrimidin-2-yl]-2-(3,5-difluorophenyl)ethyl]carbamate Chemical compound CC(C)(C)OC(=O)N[C@@H](CC1=CC(=CC(=C1)F)F)C2=NC3=C(C=CC(=N3)C4=CC=CC=C4F)C(=O)N2C5=C6C(=C(C=C5)Cl)C(=NN6C)N(CC7=CC=C(C=C7)OC)S(=O)(=O)C HOSFWVKBQANICW-UMSFTDKQSA-N 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 239000012096 transfection reagent Substances 0.000 description 1
- 229910052905 tridymite Inorganic materials 0.000 description 1
- 230000017613 viral reproduction Effects 0.000 description 1
- 238000010792 warming Methods 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Description
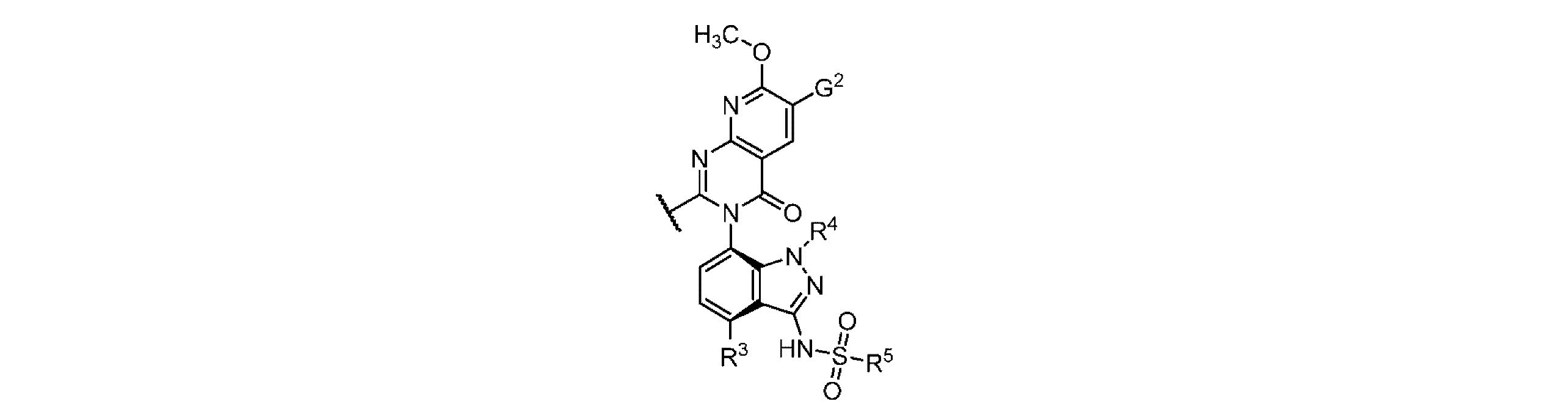
R0、R1及びR2は各々独立に、水素、Cl、F、-OMe、-CN又は-CH3から選択され、但し、置換基Cl、-OMe及び-CH3は2回を超えて使用されなくてもよく、置換基-CNは1回を超えて使用されなくてもよく、
Qは
ここで、ベンゼン環はフッ素で最大2回、塩素で最大2回さらに置換されていてもよく、但し、ベンゼン環に直接結合している3個以下の置換基はハロゲンであり、ベンゼン環に直接結合している2個以下の置換基はクロリドであり、
G3及びG4は独立に、水素、メチル、フルオロ、クロロ又はOC1~C2アルキルから選択され、但し、G3及びG4の少なくとも1つは水素でなければならず、
G5は水素、メチル、フルオロ、クロロ、OC1~C3アルキル、シアノ、-CH2OH又は-SO2(C1~C3アルキル)であり、
G6は水素、メチル、フルオロ、クロロ又はOC1~C3アルキルであり、
G7は水素、メチル、フルオロ、クロロ、OC1~C3アルキル又はCOOHであり、
G8は水素、C1~C4アルキル、フルオロ、クロロ、OC1~C3アルキル、COOH、-CN、-CH2OH又は-SO2(C1~C3アルキル)であり、
G9は水素、C1~C4アルキル、フルオロ、クロロ、OC1~C3アルキル、COOH、CO-モルホリン、C(CH3)2CH2OH又は-SO2-モルホリンであり、ここで、C1~C4アルキルは1~3個のフッ素で場合により置換されており、
R3は水素、Cl又はFであり、
R4は水素、C1~C3アルキル又はシクロプロピルであり、ここで、C1~C3アルキルは1~3個のフッ素で場合により置換されており、シクロプロピルは1~2個のフッ素で場合により置換されており、
R5はC1~C3アルキル又はC3~C4シクロアルキルであり、
Wは
DCM(1200mL)中のシクロペンタ-3-エノール(130g、1545mmol)の撹拌溶液に、ジエチル亜鉛(ヘキサン中1.0M、3091mL、3091mmol)を0~5℃で3時間かけて滴下添加し、続いてDCM(300mL)中のジヨードメタン(249mL、3091mmol)を0℃で1時間かけて滴下添加した。反応混合物を27℃に加温し(注記:白色沈殿物が観察された)、N2雰囲気下で16時間撹拌した。反応の進行をTLC(SiO2、20%EtOAc/pet、Rf=0.3、UV不活性、PMA活性)によりモニターした。完了後、反応混合物を飽和NH4Cl水溶液(1.5L)でクエンチし、セライトベッドに通して濾過した。水層をDCM(2×1000mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過し、濾液を減圧下で濃縮して、粗製のビシクロ[3.1.0]ヘキサン-3-オール(180g、収率:粗製)を赤色がかった液体として得た。1H NMR (400 MHz, クロロホルム-d) δ = 4.41 - 4.35 (m, 1H), 2.18 - 2.05 (m, 2H), 1.73 (d, J = 13.9 Hz, 2H), 1.35 - 1.25 (m, 2H), 1.21 - 1.14 (m, 1H), 0.57 - 0.43 (m, 2H). GCMS: m/z = 98.1).
DCM(5000mL)中のビシクロ[3.1.0]ヘキサン-3-オール(210g、2054mmol)の撹拌溶液に、デス-マーチンペルヨージナン(954g、2249mmol)を0℃で少量ずつ添加し、N2雰囲気下で27℃に加温し、16時間撹拌した。反応の進行をTLC(SiO2、20%アセトン/Hex、Rf=0.3、UV不活性、PMA活性)によりモニターした。完了後、反応混合物をセライトベッドに通して濾過し、濾液を1N NaOH溶液(8×1000mL)で洗浄し、DCM(5×1000mL)で抽出した。合わせた有機層を無水Na2SO4で乾燥させ、濾過した。濾液を減圧下(浴温度:20℃)で濃縮して、粗化合物を褐色液体として得、これを70℃での下方蒸留により精製して、ビシクロ[3.1.0]ヘキサン-3-オン(125g、収率:62%、淡黄色粘性液体を得た。1H NMR (400 MHz, クロロホルム-d) δ = 2.61 - 2.54 (m, 2H), 2.17 - 2.12 (m, 2H), 1.54 - 1.46 (m, 2H), 0.92 - 0.86 (m, 1H), -0.01 - -0.08 (m, 1H), GCMS: M/Z = 96.1).
THF(1500mL)中のビシクロ[3.1.0]ヘキサン-3-オン(125g、1274mmol)の撹拌溶液に、LDA(THF中2.0M、0.701L、1402mmol)をN2雰囲気下、-78℃で添加し、1時間撹拌し、続いてTHF(300mL)中のジフルオロ酢酸エチル(174g、1402mmol)を-78℃で30分間ゆっくりと添加した。添加後、反応混合物を27℃に加温し、N2雰囲気下で1時間撹拌した。反応の進行をTLC(SiO2、20%アセトン/ヘキサン、Rf=0.3、UV活性)によりモニターした。完了後、反応混合物を1N HCl(2000mL)でクエンチし、30分間撹拌し、EtOAc(3×1000mL)で抽出した。合わせた有機層をブライン(1000mL)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、2-(2,2-ジフルオロアセチル)ビシクロ[3.1.0]ヘキサン-3-オン(180g、収率:71.2%、淡黄色粘性液体を得た。1H NMR (400 MHz, クロロホルム-d) δ = 6.18 (t, J = 54.8 Hz, 1H), 2.70 - 2.62 (m, 1H), 2.35 (d, J = 19.4 Hz, 1H), 2.14 (br s, 1H), 1.26 - 1.21 (m, 1H), 1.04-1.03 (m, 1H), 0.22-0.21 (m, 1H), LCMS: M/Z = 173.17).
エタノール(2L)中の2-(2,2-ジフルオロアセチル)ビシクロ[3.1.0]ヘキサン-3-オン(180g、910mmol)の撹拌溶液に、エチル2-ヒドラジニルアセテート塩酸塩(422g、2729mmol)を添加し、続いて硫酸(20mL、375mmol)をN2雰囲気下、27℃で添加し、30分間撹拌した。反応混合物を100℃にさらに加熱し、16時間撹拌した。反応の進行をTLC(SiO2、20%アセトン/ヘキサン、Rf=0.3、UV活性)によりモニターした。完了後、反応混合物を減圧下で蒸発させ、残留物をEtOAc(2000mL)に溶解し、水(2×1L)、ブライン(1.0L)で洗浄し、無水Na2SO4で乾燥させ、濾過した。濾液を減圧下で濃縮して、粗製物(N66158-21-A1、440g)を得た。上記粗化合物を、溶離液として0~2%アセトン/Petを用いるカラムクロマトグラフィー(シリカゲル:100~200メッシュ)により精製した。生成物を含有する画分を収集し、減圧下で濃縮して、エチル2-(3-(ジフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセテート(110g、収率:46.4%をオフホワイトの固体として得た。1H NMR (400 MHz, DMSO-d6) δ = 6.86 (t, J = 54.8 Hz, 1H), 4.93 (s, 2H), 4.14 (q, J = 7.2 Hz, 2H), 2.88 - 2.79 (m, 1H), 2.76 - 2.68 (m, 1H), 2.14 - 2.04 (m, 2H), 1.19 (t, J = 7.2 Hz, 3H), 1.10 - 1.03 (m, 1H), 0.14 (q, J = 4.3 Hz, 1H). LCMS M+H=257.13.
0℃のシクロヘキサン(3.5L)中のエチル2-(3-(ジフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセテート(110g、422mmol)及びセライト(395g)の撹拌溶液に、二クロム酸ピリジニウム(794g、2110mmol)を少量ずつ添加し、続いてtert-ブチルヒドロペルオキシド(355mL、2130mmol)をN2雰囲気下で10分間かけて滴下添加した。反応混合物を27℃に加温し、48時間撹拌した。反応の進行をTLC(SiO2、30%アセトン/pet、Rf=0.4、UV活性)によりモニターした。完了後、反応混合物を濾過し、EtOAc(1000mL)で洗浄した。有機層を飽和Na2S2O3水溶液(2×500ml)、飽和FeSO4(300ml)及びブライン(500ml)で洗浄した。有機層を無水Na2SO4で乾燥させ、濾過し、減圧下で蒸発させて、粗化合物(150g)を得た。
DCM(1500mL)中のエチル2-(3-(ジフルオロメチル)-5-オキソ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセテート(75g、269mmol)の撹拌溶液に、エタン-1,2-ジチオール(43.0mL、511mmol)を添加し、続いて三フッ化ホウ素酢酸(72.6mL、511mmol)をN2雰囲気下、27℃で添加し、27℃で16時間撹拌した。反応の進行をTLC(SiO2、20%アセトン/Pet、Rf=0.35、UV活性)によりモニターした。完了後、反応混合物を0℃に冷却し、飽和NaHCO3(500mL)で中和し、DCM(2×1000mL)で抽出した。合わせた有機物をブライン(1000mL)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で蒸発させて、粗製のN66187-25-A1を褐色液体として得た。上記粗製物を、溶離液として5~10%EtOAc/Petを用いるシリカゲル(100~200メッシュ)を使用するカラムクロマトグラフィーにより精製した。生成物を含有する画分を収集し、減圧下で濃縮して、エチル2-(3-(ジフルオロメチル)-4,4a-ジヒドロスピロ[シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-5,2'-[1,3]ジチオラン]-1(3bH)-イル)アセテート(80g、収率:74.0%)をオフホワイトの固体として得た。1H NMR (400 MHz, クロロホルム-d) δ = 6.61 (t, J = 55.2 Hz, 1H), 5.00 - 4.85 (m, 2H), 4.29 - 4.19 (m, 2H), 3.55 - 3.46 (m, 4H), 2.63 - 2.53 (m, 1H), 2.49 - 2.38 (m, 1H), 1.30 - 1.24 (m, 4H), 0.65 - 0.60 (m, 1H). LCMS M+H = 346.9.
DCM(20mL)中の1,3-ジブロモ-5,5-ジメチルイミダゾリジン-2,4-ジオン(26.3g、92mmol)の撹拌溶液に、HF-ピリジン(2.460g、24.83mmol)をN2雰囲気下、-70℃で添加し、30分間撹拌し、続いてDCM(20mL)中のエチル2-(3-(ジフルオロメチル)-4,4a-ジヒドロスピロ[シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-5,2'-1,3]ジチオラン]-1(3bH)-イル)アセテート(10g 24.83mmol)を同じ温度で添加した。反応混合物を-40℃に加温し、1時間撹拌した。反応の進行をTLC(SiO2、30%EtOAc/Pet、Rf=0.3、UV不活性)によりモニターした。完了後、反応混合物を飽和NaHCO3(200mL)で中和し、27℃にてEtOAc(2×100mL)で抽出した。合わせた有機物をブライン(50ml)で洗浄し、無水Na2SO4で乾燥させ、濾過し、減圧下で蒸発させて、粗製物(15g)を褐色ガム状物として得た。上記粗化合物を、溶離液として0~25%EtOAc/Petを用いるシリカゲル(100~200メッシュ)を使用するカラムクロマトグラフィーにより精製した。生成物を含有する画分を収集し、減圧下で濃縮して、エチル2-(3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセテート(8.5g、収率:91%)を淡黄色固体として得た。1H NMR (400 MHz, クロロホルム-d) δ = 6.62 (t, J = 55.2 Hz, 1H), 4.82 (s, 2H), 4.30 - 4.18 (m, 2H), 2.51 - 2.37 (m, 2H), 1.42 - 1.35 (m, 1H), 1.31 - 1.23 (m, 3H), 1.14 - 1.08 (m, 1H). LCMS M+H = 293.07.
THF(17mL)及びMeOH(65.6mL)中のエチル2-(3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセテート(15g、49.8mmol)の撹拌溶液に、LiOH(水65.6mL中1.788g、74.7mmol)をN2雰囲気下、0℃で添加した。反応混合物を27℃で3時間撹拌した。反応の進行をTLC(SiO2、5%MeOH/DCM、Rf=0.2、UV活性)によりモニターした。完了後、反応混合物を減圧下で蒸発させ、水(50mL)で希釈し、EtOAc(2×250mL)で洗浄して不純物を除去した。水層を1N HClでpH=2~3まで酸性化し、EtOAc(3×1000mL)で抽出した。合わせた有機物を無水Na2SO4で乾燥させ、濾過し、減圧下で蒸発させて、2-(3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)酢酸(14g、収率:98%)をオフホワイトの固体として得た。LCMS M+H = 265.15.
エタノール(1.08L)中の3-ブロモ-6-クロロ-2-フルオロベンゾニトリル(360.0g、1.55mol、1.0当量)の溶液に、メチルヒドラジン硫酸塩(1.11kg、7.73mol、5.0当量)を添加し、続いてトリエチルアミン(1.3L、9.3mol、6.0当量)を25~35℃で添加した。反応混合物を110℃に加熱し、15時間維持した(反応をTLCによりモニターした)。反応の完了後、混合物を室温に冷却した。水(3.0L)を添加し、混合物を室温で1時間撹拌した。固体を濾過により単離し、水で洗浄した。湿潤固体を真空下、50℃で12~15時間乾燥させた。粗固体をカラムクロマトグラフィー(10%EA/ヘキサン~40%EA/ヘキサン)により精製して、生成物を淡黄色固体として得た。収量:185.0g(46.0%)。
DCM(30mL)中の7-ブロモ-4-クロロ-1-メチル-1H-インダゾール-3-アミン(1.40g、5.37mmol)の溶液に、ヒューニッヒ塩基(3.75mL、21.5mmol)を添加し、次いで反応物を氷浴中で冷却し、メタンスルホニルクロリド(1.26mL、16.1mmol)を添加した。反応混合物をこの温度で1時間撹拌した(沈殿物が形成された)。次いで、混合物をジクロロメタン(100mL)で希釈し、水、1M HCl及びブラインで洗浄し、乾燥させ(Na2SO4)、濾過し、真空中で濃縮した。残留物をEtOH(30ml)及び10mlの20%NaOH水溶液に取り入れた。得られた混合物を均一な溶液になるまでヒートガンで加熱し、室温で30分間撹拌した。混合物を水(80mL)で希釈し、1N HCl(60mL)で酸性化した。沈殿物を濾過し、水で洗浄し、真空中で乾燥させて、表題生成物(1.5g)をオフホワイトの固体として得た。1H NMR (500 MHz, CDCl3) δ 7.48 (d, J=7.9 Hz, 1H), 7.24 (br s, 1H), 6.95 (d, J=7.9 Hz, 1H), 4.38 (s, 3H), 3.42 (s, 3H). LC/MS (M+H)+ = 337.80.
DMF(30mL)中のN-(7-ブロモ-4-クロロ-1-メチル-1H-インダゾール-3-イル)メタンスルホンアミド(1.3g、3.84mmol)及び1-(クロロメチル)-4-メトキシベンゼン(0.625mL、4.61mmol)の混合物に、炭酸セシウム(1.626g、4.99mmol)を添加し、混合物を80℃で2時間加熱した。混合物を水(100mL)に注ぎ入れ、EtOAc(50ml、2×)で抽出した。合わせた有機層をブラインで洗浄し、MgSO4で乾燥させ、濾過し、真空中で濃縮した。残留物をBioateg(0~35%EtOAc-ヘキサン)により精製して、表題生成物(1.5g)を白色泡状物として得た。1H NMR (500 MHz, CDCl3) δ 7.44 (d, J=7.9 Hz, 1H), 7.31 (d, J=8.5 Hz, 2H), 6.99 (d, J=7.9 Hz, 1H), 6.84 (d, J=8.5 Hz, 2H), 4.99 (br s, 1H), 4.76 (br s, 1H), 4.40 (s, 3H), 3.80 (s, 3H), 3.01 (s, 3H).
参考文献:Andersen, Jacob et al, Synlett 2005 (14), 2209-2213に従う。NMP(10mL)中のN-(7-ブロモ-4-クロロ-1-メチル-1H-インダゾール-3-イル)-N-(4-メトキシベンジル)メタンスルホンアミド(600.0mg、1.308mmol)、ヨウ化銅(I)(49.8mg、0.262mmol)、アスコルビン酸ナトリウム(518mg、2.62mmol)及び(1R,2R)-N1,N2-ジメチルシクロヘキサン-1,2-ジアミン(46.5mg、0.327mmol)の混合物に、水(2.0mL)中のアジ化ナトリウム(255mg、3.92mmol)の溶液を添加した。次いで、混合物を密封し、マイクロ波システムにおいて120℃で2.5時間加熱した。次いで、混合物をセライトのパッドに通して濾過し、パッドをEtOAcで洗浄した。濾液を水(100mL)に注ぎ入れ、EtOAc(50ml、2×)で抽出した。合わせた有機層をブラインで洗浄し、MgSO4で乾燥させ、濾過し、真空中で蒸発させた。残留物をBiotage(5~100%EtOAc/ヘキサン)により精製して、表題生成物(400mg)をオフホワイトの固体として得た。F1H NMR (400 MHz, CDCl3) δ 7.33 - 7.29 (m, 2H), 6.89 (d, J=7.8 Hz, 1H), 6.85 - 6.79 (m, 2H), 6.48 (d, J=7.8 Hz, 1H), 5.11 (br.s, 1H), 4.81 (br.s, 1H), 4.30 (s, 3H), 3.80 (br s, 2H), 3.79 (s, 3H), 2.99 (s, 3H). LC/MS (M+H)+ = 395.00.
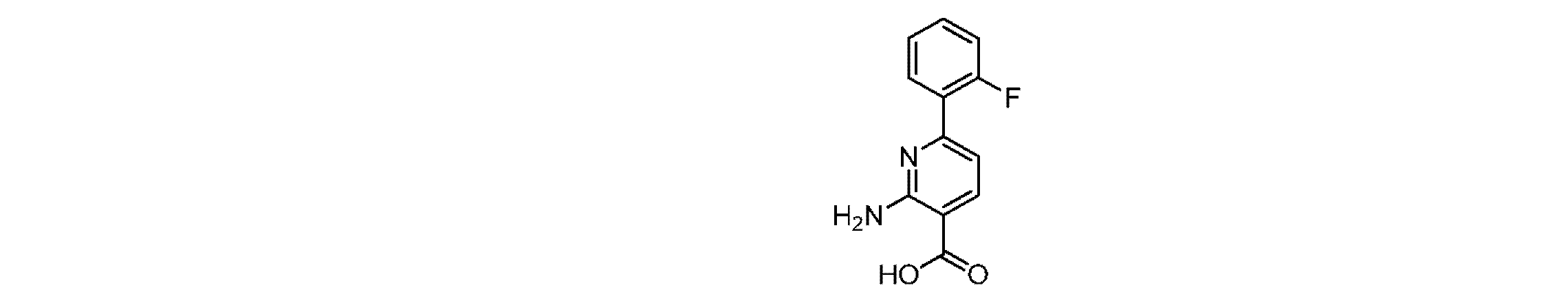
ジオキサン(46mL)及び水(12mL)中の2-アミノ-6-クロロニコチン酸(1.0g、5.79mmol)、Pd(dppf)2Cl2(0.21g、0.29mmol)、(2-フルオロフェニル)ボロン酸(1.14g、8.11mmol)及び炭酸ナトリウム(1.23g、11.59mmol)の溶液を脱気し、100℃に3時間加熱した。周囲温度に冷却した後、反応混合物を水に添加し、エーテルで洗浄した。次いで、水層を0.5Mクエン酸で酸性化した。水性スラリーを10%IPA/DCM(×3)で洗浄した。次いで、水層を濾過して、純度約80%の半純粋生成物のオフホワイトの固体(0.87g、65%)を得、これをさらに精製することなく次の反応で使用した。1H NMR (500 MHz, DMSO-d6) δ 8.14 (br d, J=7.94 Hz, 1H), 7.90-7.97 (m, 1H), 7.48-7.54 (m, 1H), 7.31-7.37 (m, 2H), 7.04 (br d, J=8.24 Hz, 1H). LC/MS: m/z = 233.15 [M+1]+.
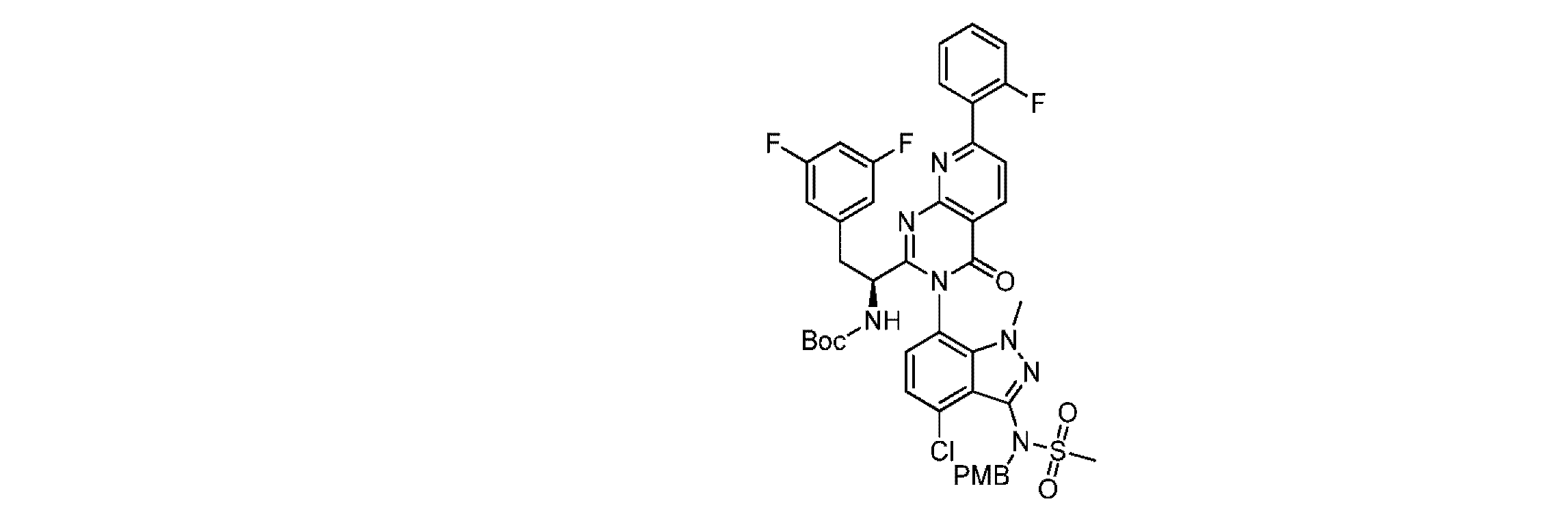
圧力バイアル内のピリジン(6.03mL)中の(S)-2-((tert-ブトキシカルボニル)アミノ)-3-(3,5-ジフルオロフェニル)プロパン酸(0.908g、3.01mmol)、N-(7-アミノ-4-クロロ-1-メチル-1H-インダゾール-3-イル)-N-(4-メトキシベンジル)メタンスルホンアミド(1.190g、3.01mmol)及び亜リン酸ジフェニル(2.334mL、12.06mmol)の混合物を、アルミニウムブロック内にて75℃で2時間加熱し、室温に冷却した。反応物をEtOAc(約150mL)で希釈し、0.5Mクエン酸で洗浄し、Na2SO4で乾燥させ、真空中で濃縮した。残留物を、ヘキサン中0~50%酢酸エチル、次いでヘキサン中50~70%酢酸エチルを使用するシリカゲルフラッシュカラムクロマトグラフィー(220g iscoカラム)により精製した。所望の画分を濃縮して、黄色固体(1.37g、52%)を得た。LC/MS: m/z = 874.25 [M+1]+.
DCM(3.92mL)中のtert-ブチル(S)-(1-(3-(4-クロロ-3-(N-(4-メトキシベンジル)メチルスルホンアミド)-1-メチル-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)カルバメート(1.37g、1.567mmol)の溶液に、ジオキサン中4N HCl(3.92mL、15.67mmol)を添加した。1時間撹拌した後、得られた淡黄色懸濁液をDCMで希釈し、飽和NaHCO3水溶液で洗浄し、Na2SO4で乾燥させ、真空中で濃縮して、黄色固体(1.16g、96%)を得、これをさらに精製することなく用いた。LC/MS: m/z = 774.20 [M+1]+.
DCM(7.56ml)及びTFA(4.73mL)中の(S)-N-(7-(2-(1-アミノ-2-(3,5-ジフルオロフェニル)エチル)-7-(2-フルオロフェニル)-4-オキソピリド[2,3-d]ピリミジン-3(4H)-イル)-4-クロロ-1-メチル-1H-インダゾール-3-イル)-N-(4-メトキシベンジル)メタンスルホンアミド(1.17g、1.511mmol)の溶液に、TfOH(0.403mL、4.53mmol)を添加した。反応物を1時間撹拌し、次いで真空中で濃縮した。残留物を1M NaOHとEtOAcとの間で分配した。EtOAc層を乾燥させ(Na2SO4)、真空中で濃縮した。アトロプ異性体の粗混合物を、ヘキサン中20~100%酢酸エチルを使用するシリカゲル(120g iscoカラム)上で精製した。所望の画分を濃縮して、オフホワイトの固体を得た。この固体を、95:5 水:0.1%TFA含有アセトニトリル中10~60%95:5 CH3CN:0.1%TFA含有水を使用する275g C18カラム上でさらに精製して、アトロプ異性体を分離した。第2の(主)溶出ピークを濃縮した(220mg)。主アトロプ異性体を、A:B勾配、溶媒A 80%ヘプタン、0.1%TFA 溶媒B 20%エタノール、0.1%TFAを使用するChiralpak ID、25mm×250mm、5uカラム上でのSFCクロマトグラフィーによりキラル精製して、所望の生成物(176mg、18%、キラル純度98.2%)を得た。LC/MS: m/z = 654.15 [M+1]+.
DMF(1mL)中の(S)-N-((6P)-7-(2-(1-アミノ-2-(3,5-ジフルオロフェニル)エチル)-7-(2-フルオロフェニル)-4-オキソピリド[2,3-d]ピリミジン-3(4H)-イル)-4-クロロ-1-メチル-1H-インダゾール-3-イル)メタンスルホンアミド(0.03g、0.039mmol)の撹拌溶液に、2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)酢酸(11mg、0.041mmol)、2-(3H-[1,2,3]トリアゾロ[4,5-b]ピリジン-3-イル)-1,1,3,3-テトラメチルイソウロニウムヘキサフルオロホスフェート(V)(0.018g、0.047mmol)及びDIPEA(0.024mL、0.137mmol)を添加した。1時間後、反応混合物を分取HPLCにより直接精製した。精製条件:カラム:Zorbax Eclipse Plus C18、21.2×100mm、5μm粒子;溶媒A=100%水中0.1%ギ酸。溶媒B=アセトニトリル。流速=40mL/分。開始%B=55 最終%B=75。勾配時間=7分、次いで98%Bで2分保持。波長=215及び254nm。ESI+範囲:150~1500ダルトン。生成物を単離した。(0.0143g、28%)。1H NMR (500 MHz, メタノール-d4) δ 8.73 - 8.81 (m, 1 H) 8.05 - 8.15 (m, 2 H) 7.58 - 7.68 (m, 1 H) 7.25 - 7.49 (m, 4 H) 6.52 - 6.85 (m, 4 H) 4.89 - 4.93 (m, 1 H) 4.54 - 4.64 (m, 2 H) 3.67 (s, 3 H) 3.49 - 3.55 (m, 1 H) 3.34 - 3.36 (m, 1 H) 3.26 (s, 3 H) 3.12 - 3.20 (m, 1 H) 2.38 - 2.47 (m, 2 H) 1.33 - 1.40 (m, 1 H) 0.98 - 1.04 (m, 1 H). LC/MS保持時間= 1.39分; m/z = 899.2 [M]+ (カラム: Acquity UPLC BEH C18, 2.1 x 30 mm, 1.7 μm粒子; 溶媒A = 100%水中0.1%ギ酸. 溶媒B = 100%アセトニトリル中0.1%ギ酸. 流速 = 0.8 mL/分. 開始% B = 5. 終了% B = 95. 勾配時間 = 1.6分, 次いで95%Bで0.25分ホールド. 波長 = 215 nm).
AcOH(60mL)中の2-アミノ-6-メトキシニコチン酸(3.0g、17.84mmol)のスラリーに、NBS(3.81g、21.41mmol)を添加した。20分後、混合物を水(500mL)中に添加し、得られた沈殿物を濾過して、生成物(2.85g、91%)を得た。1H NMR (500 MHz, DMSO-d6) δ 12.73 (s, 1H), 8.05 (s, 1H), 7.43 (br s, 1H), 3.90 (s, 3H). LC/MS: m/z = 247.0 [M+1]+.
脱気したジオキサン(32mL)及び水(8mL)中の2-アミノ-5-ブロモ-6-メトキシニコチン酸(1.0g、4.05mmol)、(2-フルオロフェニル)ボロン酸(0.79g、5.67mmol)、炭酸ナトリウム(0.86g、8.10mmol)及びPd(dppf)2Cl2(0.15g、0.202mmol)の溶液を、100℃に3時間加熱した。周囲温度に冷却したら、反応物を水に添加し、エーテル(×2)で洗浄した。水層を0.5Mクエン酸で酸性化し、濾過した。粗生成物をフラッシュカラムシリカゲルクロマトグラフィー(20~100%EtOAc/hex 1%AcOH含有)により精製して、半純粋生成物(0.60g)を得た。この物質をC18逆相クロマトグラフィー(10~60%MeCN/水、0.1%TFA)によりさらに精製して、生成物(0.36g、34%)白色固体を得た。1H NMR (500 MHz, DMSO-d6) δ 12.55 (br s, 1H), 7.87 (s, 1H), 7.43 (br s, 2H), 7.33-7.40 (m, 2H), 7.22 (br t, J=7.78 Hz, 2H). LC/MS: m/z = 263.15 [M+1]+.
ピリジン(2.75ml)中の(S)-2-((tert-ブトキシカルボニル)アミノ)-3-(3,5-ジフルオロフェニル)プロパン酸(0.414g、1.373mmol)、2-アミノ-5-(2-フルオロフェニル)-6-メトキシニコチン酸(0.36g、1.373mmol)及び亜リン酸ジフェニル(1.063ml、5.49mmol)の混合物を、1時間撹拌した。次いで、N-(7-アミノ-4-クロロ-1-メチル-1H-インダゾール-3-イル)-N-(4-メトキシベンジル)メタンスルホンアミド(0.542g、1.373mmol)を添加し、反応物を75℃に2.5時間加熱した。周囲温度に冷却したら、反応物を真空中で濃縮した。粗生成物を、ヘキサン中0~60%酢酸エチルを使用するシリカゲルクロマトグラフィー(220g iscoカラム)により精製して、生成物(0.54g、44%)を淡黄色固体として得た。LC/MS: m/z = 904.25 [M+1]+.
DCM(2.99ml)及びTFA(1.867ml))中の(S)-tert-ブチル(1-(3-(4-クロロ-3-(N-(4-メトキシベンジル)メチルスルホンアミド)-1-メチル-1H-インダゾール-7-イル)-6-(2-フルオロフェニル)-7-メトキシ-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)カルバメート(0.54g、0.597mmol)の溶液に、TfOH(0.053ml、0.597mmol)を添加した。混合物を1時間撹拌し、真空中で濃縮した。残留物を酢酸エチルと1M NaOHとの間で分配した。EtOAc層をNa2SO4で乾燥させ、真空中で濃縮した。粗生成物を、ヘキサン中20~80%酢酸エチルを使用するシリカゲル(80g iscoカラム)上で精製して、オフホワイトの固体(0.257g)、第1の溶出/主アトロプ異性体を得た。この生成物をSFCクロマトグラフィーによりキラル精製した:溶媒A:(70%)のヘプタン、溶媒B:(30%)のエタノール、カラム:ChiralPak ID(25×250mm、5ミクロン)流速45ml/分、波長- 214、220nm 温度 周囲温度。1H NMR (500 MHz, DMSO-d6) δ 8.16 - 8.30 (m, 1 H) 7.20 - 7.53 (m, 6 H) 6.87 - 7.05 (m, 1 H) 6.60 - 6.71 (m, 2 H) 3.95 - 4.04 (m, 3 H) 3.59 - 3.71 (m, 3 H) 3.42 - 3.50 (m, 1 H) 3.17 - 3.23 (m, 1 H) 3.11 - 3.16 (m, 3 H) 2.77 - 2.84 (m, 1 H). LC/MS: m/z = 684.20 [M+1]+.
DMF(0.731mL)中の(S)-N-((6P)-7-(2-(1-アミノ-2-(3,5-ジフルオロフェニル)エチル)-6-(2-フルオロフェニル)-7-メトキシ-4-オキソピリド[2,3-d]ピリミジン-3(4H)-イル)-4-クロロ-1-メチル-1H-インダゾール-3-イル)メタンスルホンアミド(0.05g、0.073mmol)の撹拌溶液に、2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)酢酸(0.019g、0.073mmol)、2-(3H-[1,2,3]トリアゾロ[4,5-b]ピリジン-3-イル)-1,1,3,3-テトラメチルイソウロニウムヘキサフルオロホスフェート(V)(0.028g、0.073mmol)及びDIPEA(0.013mL、0.073mmol)を添加した。反応混合物を2時間撹拌し、DMFで希釈し、濾過し、次いで分取HPLCにより直接精製した。精製条件:カラム:Waters Xterra C18、19×100mm、10μm粒子;溶媒A=100%水中0.1%NH4OH。溶媒B=アセトニトリル。流速=40mL/分。開始%B=56。最終%B=76。勾配時間=6分、次いで98%Bで2分保持。波長=215及び254nm。ESI+範囲:150~1500ダルトン。生成物を単離した(0.040g、59%)。1H NMR (500 MHz, メタノール-d4) δ 8.42 - 8.46 (m, 1 H) 7.45 - 7.54 (m, 2 H) 7.21 - 7.34 (m, 4 H) 6.56 - 6.84 (m, 4 H) 4.88 - 4.92 (m, 2 H) 4.53 - 4.64 (m, 2 H) 4.15 - 4.19 (m, 3 H) 3.64 - 3.68 (m, 3 H) 3.48 - 3.54 (m, 1 H) 3.23 - 3.27 (m, 3 H) 3.12 - 3.20 (m, 1 H) 2.40 - 2.49 (m, 2 H) 1.34 - 1.41 (m, 1 H) 1.00 - 1.05 (m, 1 H). LC/MS保持時間= 1.42分; m/z = 930.7 [M+H]+ (カラム: Acquity UPLC BEH C18, 2.1 x 30 mm, 1.7 μm粒子; 溶媒A = 100%水中0.1%ギ酸. 溶媒B = 100%アセトニトリル中0.1%ギ酸. 流速 = 0.8 mL/分. 開始% B = 5. 終了% B = 95. 勾配時間 = 1.6分, 次いで95%Bで0.25分ホールド. 波長 = 215 nm.
(ステップ2b) 0~5℃のDCM(9.04L、8.0V)中の粗オキシム(上記の調製物、1.13kg、4.80mol、1.0当量)の撹拌溶液に、トリエチルアミン(「TEA」、1.02kg、10.09mol、2.1当量)を添加した。5分間撹拌した後、メタンスルホニルクロリド(0.60kg、5.29mol、1.1当量)を15℃でゆっくりと添加した(観察:添加中に発熱が認められる)。次いで、反応塊を室温で30~45分間撹拌した。反応(反応の進行をTLC;移動相:ヘキサン中20%酢酸エチルによりモニターした)の完了後、反応塊を水(6.78L、6.0V)で希釈し、有機層を分離し、水層をDCM(3.4L、3.0V)で抽出した。合わせた有機層をブライン(5.65L、5.0V)で洗浄し、Na2SO4で乾燥させ、真空下で濃縮した。得られた粗固体を室温にてヘキサン(4.50L、4.0V)で摩砕した。湿潤物質を熱風オーブン内にて50~55℃で5~6時間乾燥させて、乾燥生成物、2,6-ジクロロ-3-ニトロベンゾニトリル(0.95kg、収率91%)を黄色固体として得た。1H NMR (400 MHz, CDCl3): δ 8.07 (d, J = 8.8 Hz, 1H), 7.63 (d, J = 8.8 Hz, 1H).
(ii) 室温のエタノール(10.5L、20.0V)中のN-(4-クロロ-1-メチル-7-ニトロ-1H-インダゾール-3-イル)-N-(メチルスルホニル)メタンスルホンアミド(上記で調製)の撹拌溶液に、5%NaOH水溶液(4.38L、7.0V)をゆっくりと添加した[注記:滴下漏斗によるゆっくりとした添加が好ましい]。反応塊を同じ温度で3時間撹拌した。反応(TLCによりモニターした)[TLC分析のための試料調製:約1.0mlの試料を2.0N HCl水溶液で酸性化してpH:2~3に到達させ、これを酢酸エチルで抽出し、有機層をTLCにより分析した]の完了後、反応塊を0~5℃に冷却し、反応温度を10℃未満に維持しながらpHを2.0N HCl水溶液(3.13L、5.0V)の添加により2~3に調整した[注記:HClを添加すると沈殿が生じ、撹拌とともに増加した]。反応混合物を室温に加温し、次いで1.5~2.0時間撹拌した。得られた固体を濾過により単離し、次いで水(1.25L、2.0V)で洗浄し、続いてヘキサン(1.25L、2.0V)で洗浄した。真空濾過を60~90分間維持することにより、バルク残留水を固体から除去した。湿潤物質を熱風オーブン内にて50℃で6~7時間(水分含有率が1.0%未満になるまで)乾燥させて、乾燥生成物、N-(4-クロロ-1-メチル-7-ニトロ-1H-インダゾール-3-イル)メタンスルホンアミド(640.0g、76%)を黄色固体として得た。1H NMR (400 MHz, CDCl3): δ 8.05 (d, J = 8.32 Hz, 1H), 7.32 (bs, 1H), 7.17 (d, J = 8.28 Hz, 1H), 4.15 (s, 3H), 3.45 (s, 3H).
ステップ2b: 室温のエタノール(1.7L、10.0V)中のN-(4-クロロ-1-(2,2-ジフルオロエチル)-7-ニトロ-1H-インダゾール-3-イル)-N-(メチルスルホニル)メタンスルホンアミド(上記で調製した物質の全体)の撹拌溶液に、5%NaOH水溶液(1.19L、7.0V)をゆっくりと添加した[注記:滴下漏斗によるゆっくりとした添加が好ましい]。反応塊を同じ温度で3時間撹拌した。反応[TLC分析のための試料調製:反応溶液のアリコート(約1mL)を2.0N HCl水溶液で酸性化してpH2~3に到達させ、次いで混合物を酢酸エチルで抽出し、有機層をTLCにより分析した]の完了後、反応塊を0~5℃に冷却し、pHを10℃未満で2.0N HCl水溶液(約850mL、5.0V)の添加により2~3に調整した[注記:HClを添加すると沈殿が生じ、撹拌とともに固体が徐々に増加した]。反応混合物を室温に加温し、次いで1.5~2.0時間撹拌した。得られた固体を濾過により単離し、次いで水(340mL、2.0V)で洗浄し、続いてヘキサン(340mL、2.0V)で洗浄した。真空濾過を60~90分間維持することにより、バルク残留水を固体から除去した。湿潤物質を熱風オーブン内にて50℃で6~7時間(水分含有率が1.0%未満になるまで)乾燥させて、乾燥生成物、N-(4-クロロ-1-(2,2-ジフルオロエチル)-7-ニトロ-1H-インダゾール-3-イル)メタンスルホンアミド(170.0g、75%)を黄色固体として得た。1H NMR (400MHz, CDCl3): δ 8.15 (d, J = 8.3 Hz, 1H), 7.52 (bs, 1H), 7.24 (d, J = 8.3 Hz, 1H), 6.04 (tt, J1 = 3.7 Hz, J2 = 7.9 Hz, 1H), 5.02 (td, J1 = 3.9 Hz, J2 = 14.3 Hz, 2H), 3.42 (s, 4H).
(ステップ2b): 室温のエタノール(200mL、10.0V)中のN-(4-クロロ-7-ニトロ-1-(2,2,2-トリフルオロエチル)-1H-インダゾール-3-イル)-N-(メチルスルホニル)メタンスルホンアミド(上記で調製した物質の全体)の撹拌溶液に、5%NaOH水溶液(140mL、7.0V)をゆっくりと添加した[注記:滴下漏斗によるゆっくりとした添加が好ましい]。反応塊を同じ温度で2時間撹拌した。反応[TLC分析のための試料調製:反応溶液のアリコート(約1.0ml)を2.0N HCl水溶液の添加により酸性化してpH2~3に到達させ、次いで混合物を酢酸エチルで抽出し、有機相をTLCにより分析した]の完了後、反応塊を0~5℃に冷却し、温度を10℃未満に維持しながらpHを2.0N HCl水溶液(100mL、5.0V)の添加により2~3に調整した[注記:HClを添加すると沈殿が生じ、撹拌とともに増加した]。反応混合物を室温に加温し、次いで1.5~2.0時間撹拌した。固体を濾過により単離し、次いで水(60mL、3.0V)で洗浄し、続いてヘキサン(60mL、3.0V)で洗浄した。真空濾過を60~90分間維持することにより、バルク残留水を固体から除去した。湿潤物質を熱風オーブン内にて50℃で6~7時間(水分含有率が1.0%未満になるまで)乾燥させて、N-(4-クロロ-7-ニトロ-1-(2,2,2-トリフルオロエチル)-1H-インダゾール-3-イル)メタンスルホンアミド(22.1g、87%)を黄色固体として得た。1H NMR (400 MHz, CDCl3): δ 8.19 (d, J = 8.40 Hz, 1H), 7.56 (bs, 1H), 7.30 (d, J = 8.40 Hz, 1H), 5.34 (q, J = 8.30 Hz, 2H), 3.46 (s, 3H).
-25℃のアセトニトリル(92mL)中の(S)-2-((tert-ブトキシカルボニル)アミノ)-3-(3,5-ジフルオロフェニル)プロパン酸(5.49g、18.23mmol)及び2-アミノ-6-(ベンジルオキシ)ニコチン酸(4.45g、18.23mmol)の懸濁液(黄色溶液)に、ピリジン(9.83mL、122mmol)、続いて2,4,6-トリプロピル-1,3,5,2,4,6-トリオキサトリホスフィナン2,4,6-トリオキシド(「T3P」、45.2ml、76mmol)を添加した。反応混合物(T3P添加後、透明な溶液になった)を-25℃~10℃で4.5時間にわたって撹拌し、次いでN-(7-アミノ-4-クロロ-1-メチル-1H-インダゾール-3-イル)-N-(4-メトキシベンジル)メタンスルホンアミド(6g、15.19mmol)を添加し、混合物を室温に加温しながら18時間撹拌した。反応混合物を酢酸エチルで希釈し、1N NaOH、次いで水、次いで0.5Mクエン酸、次いで水で洗浄し、次いでNa2SO4で乾燥させ、真空中で濃縮した。得られた残留物を、15CVにわたってヘキサン中0~60%酢酸エチルを使用し、次いで10CVで60%EtOAcにて保持して、シリカ(330g RediSep Goldカラム)上で精製した。所望の画分をプールし、濃縮して、淡黄色固体(8.1g、9.14mmol、収率60.1%)である、tert-ブチルN-[(1S)-1-[(3P,3P)-7-(ベンジルオキシ)-3-(4-クロロ-3-{N-[(4-メトキシフェニル)メチル]メタンスルホンアミド}-1-メチル-1H-インダゾール-7-イル)-4-オキソ-3H,4H-ピリド[2,3-d]ピリミジン-2-イル]-2-(3,5-ジフルオロフェニル)エチル]カルバメート(主)及びtert-ブチルN-[(1S)-1-[(3M,3M)-7-(ベンジルオキシ)-3-(4-クロロ-3-{N-[(4-メトキシフェニル)メチル]メタンスルホンアミド}-1-メチル-1H-インダゾール-7-イル)-4-オキソ-3H,4H-ピリド[2,3-d]ピリミジン-2-イル]-2-(3,5-ジフルオロフェニル)エチル]カルバメート(副)の混合物を得た。LC/MS: m/z = 886.25 [M+1]+.
TFA(21.1mL、274mmol)を、ジクロロメタン(45.7mL)中のtert-ブチル(S)-(1-(7-(ベンジルオキシ)-3-(4-クロロ-3-(N-(4-メトキシベンジル)メチルスルホンアミド)-1-メチル-1H-インダゾール-7-イル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)カルバメート(ステップ1からの生成物、8.1g、9.14mmol)の溶液に添加した。混合物を室温で2時間撹拌した。得られた淡黄色溶液を濃縮した。残留物を酢酸エチルに取り入れ、次いで1N NaOHで3回洗浄し、次いでNa2SO4で乾燥させ、次いで真空中で濃縮して、油状残留物を得た。残留物を、溶媒A:溶媒B 65:35→0:100(2CV)、次いで0:100(9CV);溶媒A=ヘキサン;溶媒B=9:9:2 ヘキサン:酢酸エチル:MeOHの勾配方法により、シリカゲル(330g RediSep Goldカラム)上で精製した。第1の溶出異性体(主)を収集し、真空中で濃縮して、N-[(6P)-7-{2-[(1S)-1-アミノ-2-(3,5-ジフルオロフェニル)エチル]-7-ヒドロキシ-4-オキソ-3H,4H-ピリド[2,3-d]ピリミジン-3-イル}-4-クロロ-1-メチル-1H-インダゾール-3-イル]-N-[(4-メトキシフェニル)メチル]メタンスルホンアミド(4.1g、5.89mmol、収率64.5%)を得た。1H NMR (500 MHz, DMSO-d6) δ 7.86 - 7.98 (m, 1 H) 7.15 - 7.37 (m, 4 H) 6.97 - 7.06 (m, 1 H) 6.70 - 6.89 (m, 4 H) 6.40 - 6.48 (m, 1 H) 4.70 - 4.88 (m, 2 H) 3.41 - 3.81 (m, 7 H) 3.20 - 3.28 (m, 1 H) 3.08 - 3.12 (m, 3 H) 2.71 - 2.79 (m, 1 H) 1.69 - 2.00 (m, 2 H). LC/MS: m/z = 696.20 [M+1]+.
撹拌子を備えた5mLバイアルに、THF(1.0mL)中の3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-2-((S)-1-(2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミド)-2-(3,5-ジフルオロフェニル)エチル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-7-イルトリフルオロメタンスルホネート(30mg、0.031mmol)の溶液、水(0.25mL)中のK3PO4(0.025g、0.094mmol)の溶液、ジクロロ[9,9-ジメチル-4,5-ビス(ジフェニルホスフィノ)キサンテン]パラジウム(II)(2.377mg、3.14μmol)、及び適切なボロン酸(0.094mmol)を添加した。バイアルを脱気し(フラスコを排気し、雰囲気をArに置き換え、このプロセスを3回繰り返した)、次いでAr雰囲気下で維持した。混合物を室温で16時間撹拌した。混合物に、メタノール中2Mアンモニア(1mL)を添加した。混合物を2時間撹拌し、次いで減圧下で濃縮した。得られた残留物をDMFに溶解し、溶液を濾過し、濾液を分取HPLC精製に供して、示されている通りの生成物を得た。
HPLC精製は以下に示す条件のうちの1つを使用して行い、場合により続いて、以下に示す異なる条件を使用する第2のHPLC精製を行った。粗反応混合物で得られた分析HPLCデータに基づいて、最初の溶媒A:溶媒B比、勾配時間、最終の溶媒A:溶媒B比、及び最終の溶媒A:溶媒B濃度での保持時間を修正することにより、精製条件を各標的化合物に対して最適化した。
HPLC条件A:カラム:Zorbax Eclipse Plus C18、21.2×100mm、5μm粒子;溶媒A=100%水中0.1%ギ酸。溶媒B=アセトニトリル。流速=40mL/分。波長=215及び254nm。ESI+範囲:150~1500ダルトン。
HPLC条件B:カラム:Sunfire prep C18 OBD、30×100mm、5μm粒子;溶媒A:水:MeCN 95:5 0.1%TFA含有、溶媒B:MeCN:水 95:5 0.1%TFA含有。流速=42mL/分。波長=220及び254nm。
HPLC条件C:カラム:Waters Xterra C18、19×100mm、10μm粒子;溶媒A=100%水中0.1%NH4OH。溶媒B=アセトニトリル。流速=40mL/分。波長=215及び254nm。ESI+範囲:150~1500ダルトン。
LCMS方法C:
カラム:Acquity UPLC BEH C18、2.1×30mm、1.7μm粒子;溶媒A=100%水中0.1%ギ酸。溶媒B=100%アセトニトリル中0.1%ギ酸。流速=0.8mL/分。開始%B=5。最終%B=95。勾配時間=1.6分、次いで95%Bで0.25分保持。波長=215nm。
LCMS方法F:
カラム:Acquity BEH C18、2.1×30mm、1.7μm粒子;溶媒A=100%水中0.1%ギ酸。溶媒B=100%アセトニトリル中0.1%ギ酸。流速=0.8mL/分。開始%B=5。最終%B=95。勾配時間=1.7分、次いで95%Bで0.2分保持。波長=215及び254nm。
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,6-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,3-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(4-フルオロ-3-(ヒドロキシメチル)フェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(5-クロロ-2,4-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-3-(シクロプロパンスルホンアミド)-1-(2,2-ジフルオロエチル)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-5,5-ジフルオロ-3-(トリフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(4-クロロ-2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,5-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-(2,2-ジフルオロエチル)-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-3-(メチルスルホンアミド)-1-(2,2,2-トリフルオロエチル)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-5,5-ジフルオロ-3-(トリフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-4-オキソ-7-(3,4,5-トリフルオロフェニル)-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(4-クロロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-4-オキソ-7-(4-(トリフルオロメチル)フェニル)-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-4-オキソ-7-(2,3,4-トリフルオロフェニル)-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(4-フルオロ-2-(ヒドロキシメチル)フェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-5,5-ジフルオロ-3-(トリフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(4-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(4-フルオロ-2-(メチルスルホニル)フェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-3-(シクロプロパンスルホンアミド)-1-(2,2-ジフルオロエチル)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(3,5-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(3-クロロ-2,4-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(3-(メチルスルホニル)フェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,4-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-5,5-ジフルオロ-3-(トリフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,4-ジクロロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,4-ジフルオロ-3-メトキシフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-3-(メチルスルホンアミド)-1-(2,2,2-トリフルオロエチル)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-4-オキソ-7-(2,4,6-トリフルオロフェニル)-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(3-クロロ-4-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(3-シアノ-4-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-6-(2-フルオロフェニル)-7-メトキシ-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-5,5-ジフルオロ-3-(トリフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-(2,2-ジフルオロエチル)-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-5,5-ジフルオロ-3-(トリフルオロメチル)-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
(S)-N-(1-((3P)-3-(4-クロロ-1-(2,2-ジフルオロエチル)-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-(3-シクロプロピル-1H-ピラゾール-1-イル)アセトアミドの調製
(S)-N-(1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-(3-シクロプロピル-1H-ピラゾール-1-イル)アセトアミドの調製
(S)-N-(1-((3P)-3-(4-クロロ-3-(シクロプロパンスルホンアミド)-1-(2,2-ジフルオロエチル)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-(3-シクロプロピル-1H-ピラゾール-1-イル)アセトアミドの調製
(S)-N-(1-((3P)-3-(4-クロロ-3-(メチルスルホンアミド)-1-(2,2,2-トリフルオロエチル)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-(3-シクロプロピル-1H-ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,4-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[3,2-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2-フルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[3,2-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
N-((S)-1-((3P)-3-(4-クロロ-1-メチル-3-(メチルスルホンアミド)-1H-インダゾール-7-イル)-7-(2,4-ジフルオロフェニル)-4-オキソ-3,4-ジヒドロピリド[2,3-d]ピリミジン-2-イル)-2-(3,5-ジフルオロフェニル)エチル)-2-((3bS,4aR)-3-(ジフルオロメチル)-5,5-ジフルオロ-3b,4,4a,5-テトラヒドロ-1H-シクロプロパ[3,4]シクロペンタ[1,2-c]ピラゾール-1-イル)アセトアミドの調製
各実施例のIUPAC化学名を以下に列挙する。この際、これらの名称は、一般のソフトウェア、ツール、例えばChemDraw又はJChemにより認識されない。したがって、上記実施例セクション全体にわたって使用される化学名は、ChemDrawを用いて生成された。この化学名は、P/M命名法、例えば「(3P)-」を除去した後にChemDrawを使用して化学構造に変換することができる。
HIV細胞培養アッセイ- MT-2細胞、293T細胞及びNL4-3ウイルスのプロウイルスDNAクローンを、アメリカ国立衛生研究所、AIDS研究及び標準試薬プログラム(NIH AIDS Research and Reference Reagent Program)から入手した。MT-2細胞を、10%の熱不活性化ウシ胎児血清(FBS)、100μg/mlのペニシリンG及び最大100単位/mLのストレプトマイシンを補充したRPMI1640培地中で増殖させた。293T細胞を、10%の熱不活性化FBS、100μg/mLのペニシリンG及び100μg/mLのストレプトマイシンを補充したDMEM培地中で増殖させた。nef遺伝子の一部分をウミシイタケルシフェラーゼ(Renilla luciferase)遺伝子に置き換えた組換えNL4-3プロウイルスクローンを使用して、これらの研究において使用される参照ウイルスを作製した。組換えウイルスを、Mirus Bio LLC(Madison、WI)から入手したTransit-293トランスフェクション試薬を使用して、293T細胞への組換えNL4-3プロウイルスクローンのトランスフェクションにより調製した。2~3日後に上清を回収し、ルシフェラーゼ酵素活性を測定することによりルシフェラーゼ酵素活性をマーカーとして使用して、存在するウイルスの量をMT-2細胞において力価測定した。ルシフェラーゼは、Promega(Madison、WI)から入手したEnduRen Live Cell Substrateを使用して定量化した。化合物の系列希釈の存在下で組換えウイルスに4~5日間感染させたMT-2細胞におけるルシフェラーゼ活性を測定することにより、組換えウイルスに対する化合物の抗ウイルス活性を定量化した。
(1)式Iの化合物、又はその薬学的に許容される塩:
R 0 、R 1 及びR 2 は各々独立に、水素、Cl、F、-OMe、-CN又は-CH 3 から選択され、但し、置換基Cl、-OMe及び-CH 3 は2回を超えて使用されなくてもよく、置換基-CNは1回を超えて使用されなくてもよく、
Qは
G 2 は
ここで、ベンゼン環はフッ素で最大2回、塩素で最大2回さらに置換されていてもよく、但し、ベンゼン環に直接結合している3個以下の置換基はハロゲンであり、ベンゼン環に直接結合している2個以下の置換基はクロリドであり、
G 3 及びG 4 は独立に、水素、メチル、フルオロ、クロロ又はOC 1 ~C 2 アルキルから選択され、但し、G 3 及びG 4 の少なくとも1つは水素でなければならず、
G 5 は水素、メチル、フルオロ、クロロ、OC 1 ~C 3 アルキル、シアノ、-CH 2 OH又は-SO 2 (C 1 ~C 3 アルキル)であり、
G 6 は水素、メチル、フルオロ、クロロ又はOC 1 ~C 3 アルキルであり、
G 7 は水素、メチル、フルオロ、クロロ、OC 1 ~C 3 アルキル又はCOOHであり、
G 8 は水素、C 1 ~C 4 アルキル、フルオロ、クロロ、OC 1 ~C 3 アルキル、COOH、-CN、-CH 2 OH又は-SO 2 (C 1 ~C 3 アルキル)であり、
G 9 は水素、C 1 ~C 4 アルキル、フルオロ、クロロ、OC 1 ~C 3 アルキル、COOH、CO-モルホリン、C(CH 3 ) 2 CH 2 OH又は-SO 2 -モルホリンであり、ここで、C 1 ~C 4 アルキルは1~3個のフッ素で場合により置換されており、
R 3 は水素、Cl又はFであり、
R 4 は水素、C 1 ~C 3 アルキル又はシクロプロピルであり、ここで、C 1 ~C 3 アルキルは1~3個のフッ素で場合により置換されており、シクロプロピルは1~2個のフッ素で場合により置換されており、
R 5 はC 1 ~C 3 アルキル又はC 3 ~C 4 シクロアルキルであり、
Wは
ここで、R 6 及びR 7 は独立に、1~3個のフッ素で場合により置換されているメチルから選択される]。
(2)Wが
ここで、R 6 が、1個のフッ素で場合により置換されているメチルであり、R 7 が、1~3個のフッ素で場合により置換されているメチルである、(1)に記載の化合物又は塩。
(3)Wが
(4)G 2 が
(5)Qが
(6)Qが
(7)Qが
(8)R 0 がFであり、R 1 がFであり、R 2 がHである、(1)から(7)のいずれかに記載の化合物又は塩。
(9)R 0 、R 1 及びR 2 が各々独立に、水素、F、Cl又は-CH 3 から選択され、但し、R 0 、R 1 及びR 2 基の少なくとも1つが水素であるが、R 0 及びR 1 が両方ともFである場合にはR 2 が水素ではない、(1)から(8)のいずれかに記載の化合物又は塩。
(10)R 0 、R 1 及びR 2 が各々独立に、Cl、F、-OMe、-CN又は-CH 3 から選択され、但し、置換基Cl、-OMe及び-CH 3 が2回を超えて使用されなくてもよく、置換基-CNが1回を超えて使用されなくてもよい、(1)から(8)のいずれかに記載の化合物又は塩。
(11)R 3 がクロリドであり、R 4 がメチル、2,2-ジフルオロエチル又は2,2,2-トリフルオロエチルであり、R 5 がメチル又はシクロプロピルである、(1)から(10)のいずれかに記載の化合物又は塩。
(12)
(13)(1)から(12)のいずれかに記載の化合物又は塩を含む、医薬組成物。
(14)薬学的に許容される担体、賦形剤及び/又は希釈剤をさらに含む、(13)に記載の組成物。
(15)(13)又は(14)に記載の組成物を患者に投与することを含む、HIV感染を処置する方法。
(16)前記投与が経口である、(15)に記載の方法。
(17)前記投与が、筋肉内注射により投与することを含む、(15)に記載の方法。
(18)前記投与が、皮下注射により投与することを含む、(15)に記載の方法。
(19)ヌクレオシドHIV逆転写酵素阻害剤、非ヌクレオシドHIV逆転写酵素阻害剤、HIVプロテアーゼ阻害剤、HIV融合阻害剤、HIV付着阻害剤、CCR5阻害剤、CXCR4阻害剤、HIV出芽又は成熟阻害剤及びHIVインテグラーゼ阻害剤からなる群から選択される、AIDS又はHIV感染の処置に使用される少なくとも1つの他の薬剤の投与をさらに含む、(15)に記載の方法。
(20)前記少なくとも1つの他の薬剤が、ドルテグラビル、ラミブジン、ホステムサビル、カボテグラビル、マラビロク、リルピビリン、Reyataz、テノホビル、アラフェナミド、EfDA、ドラビリン及びPrezistaからなる群から選択される、(19)に記載の方法。
(21)前記少なくとも1つの他の薬剤が、ドルテグラビル、ラミブジン、ホステムサビル及びカボテグラビルからなる群から選択される、(20)に記載の方法。
(22)治療において使用するための、(1)から(12)のいずれかに記載の化合物又はその薬学的に許容される塩。
(23)HIV感染の処置において使用するための、(1)から(12)のいずれかに記載の化合物又はその薬学的に許容される塩。
(24)HIV感染の処置のための医薬の製造において使用するための、(1)から(12)のいずれかに記載の化合物又はその薬学的に許容される塩。
Claims (22)
- 式Iの化合物、又はその薬学的に許容される塩:
R0、R1及びR2は各々独立に、水素、Cl、F、-OMe、-CN又は-CH3から選択され、但し、置換基Cl、-OMe及び-CH3は2回を超えて使用されなくてもよく、置換基-CNは1回を超えて使用されなくてもよく、
Qは
G2は
ここで、ベンゼン環はフッ素で最大2回、塩素で最大2回さらに置換されていてもよく、但し、ベンゼン環に直接結合している3個以下の置換基はハロゲンであり、ベンゼン環に直接結合している2個以下の置換基はクロリドであり、
G3及びG4は独立に、水素、メチル、フルオロ、クロロ又はOC1~C2アルキルから選択され、但し、G3及びG4の少なくとも1つは水素でなければならず、
G5は水素、メチル、フルオロ、クロロ、OC1~C3アルキル、シアノ、-CH2OH又は-SO2(C1~C3アルキル)であり、
G6は水素、メチル、フルオロ、クロロ又はOC1~C3アルキルであり、
G7は水素、メチル、フルオロ、クロロ、OC1~C3アルキル又はCOOHであり、
G8は水素、C1~C4アルキル、フルオロ、クロロ、OC1~C3アルキル、COOH、-CN、-CH2OH又は-SO2(C1~C3アルキル)であり、
G9は水素、C1~C4アルキル、フルオロ、クロロ、OC1~C3アルキル、COOH、CO-モルホリン、C(CH3)2CH2OH又は-SO2-モルホリンであり、ここで、C1~C4アルキルは1~3個のフッ素で場合により置換されており、
R3は水素、Cl又はFであり、
R4は水素、C1~C3アルキル又はシクロプロピルであり、ここで、C1~C3アルキルは1~3個のフッ素で場合により置換されており、シクロプロピルは1~2個のフッ素で場合により置換されており、
R5はC1~C3アルキル又はC3~C4シクロアルキルであり、
Wは
ここで、R6及びR7は独立に、1~3個のフッ素で場合により置換されているメチルから選択される]。 - R0がFであり、R1がFであり、R2がHである、請求項1から7のいずれか一項に記載の化合物又は塩。
- R0、R1及びR2が各々独立に、水素、F、Cl又は-CH3から選択され、但し、R0、R1及びR2基の少なくとも1つが水素であるが、R0及びR1が両方ともFである場合にはR2が水素ではない、請求項1から8のいずれか一項に記載の化合物又は塩。
- R0、R1及びR2が各々独立に、Cl、F、-OMe、-CN又は-CH3から選択され、但し、置換基Cl、-OMe及び-CH3が2回を超えて使用されなくてもよく、置換基-CNが1回を超えて使用されなくてもよい、請求項1から8のいずれか一項に記載の化合物又は塩。
- R3がクロリドであり、R4がメチル、2,2-ジフルオロエチル又は2,2,2-トリフルオロエチルであり、R5がメチル又はシクロプロピルである、請求項1から10のいずれか一項に記載の化合物又は塩。
- 請求項1から12のいずれか一項に記載の化合物又は塩を含み、薬学的に許容される担体、賦形剤及び/又は希釈剤をさらに含む、医薬組成物。
- 請求項1から12のいずれか一項に記載の化合物又は塩を含む、HIV感染を処置するための医薬組成物。
- 経口投与のための、請求項14に記載の医薬組成物。
- 筋肉内投与のための、請求項14に記載の医薬組成物。
- 皮下投与のための、請求項14に記載の医薬組成物。
- ヌクレオシドHIV逆転写酵素阻害剤、非ヌクレオシドHIV逆転写酵素阻害剤、HIVプロテアーゼ阻害剤、HIV融合阻害剤、HIV付着阻害剤、CCR5阻害剤、CXCR4阻害剤、HIV出芽又は成熟阻害剤及びHIVインテグラーゼ阻害剤からなる群から選択される、AIDS又はHIV感染の処置に使用される少なくとも1つの他の薬剤と組み合わせて使用するための、請求項14に記載の医薬組成物。
- 前記少なくとも1つの他の薬剤が、ドルテグラビル、ラミブジン、ホステムサビル、カボテグラビル、マラビロク、リルピビリン、Reyataz、テノホビル、アラフェナミド、EfDA、ドラビリン及びPrezistaからなる群から選択される、請求項18に記載の医薬組成物。
- 前記少なくとも1つの他の薬剤が、ドルテグラビル、ラミブジン、ホステムサビル及びカボテグラビルからなる群から選択される、請求項19に記載の医薬組成物。
- 請求項1から12のいずれか一項に記載の化合物又はその薬学的に許容される塩を含む、治療において使用するための医薬組成物。
- HIV感染の処置のための医薬の製造における、請求項1から12のいずれか一項に記載の化合物又はその薬学的に許容される塩の使用。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201862731196P | 2018-09-14 | 2018-09-14 | |
| US62/731,196 | 2018-09-14 | ||
| US201862733259P | 2018-09-19 | 2018-09-19 | |
| US62/733,259 | 2018-09-19 | ||
| PCT/IB2019/057710 WO2020053811A1 (en) | 2018-09-14 | 2019-09-12 | Inhibitors of human immunodeficiency virus replication |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2022500425A JP2022500425A (ja) | 2022-01-04 |
| JPWO2020053811A5 JPWO2020053811A5 (ja) | 2022-08-09 |
| JP7361766B2 true JP7361766B2 (ja) | 2023-10-16 |
Family
ID=68240777
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2021514019A Active JP7361766B2 (ja) | 2018-09-14 | 2019-09-12 | ヒト免疫不全ウイルス複製の阻害剤 |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US20220089598A1 (ja) |
| EP (1) | EP3849982A1 (ja) |
| JP (1) | JP7361766B2 (ja) |
| WO (1) | WO2020053811A1 (ja) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US20210395262A1 (en) * | 2018-10-24 | 2021-12-23 | VIIV Healthcare UK (No.5) Limited | Inhibitors of human immunodeficiency virus replication |
| US11541055B2 (en) | 2018-10-24 | 2023-01-03 | VIIV Healthcare UK (No.5) Limited | Inhibitors of human immunodeficiency virus replication |
| US20210403465A1 (en) * | 2018-10-29 | 2021-12-30 | VIIV Healthcare UK (No.5) Limited | Quinazolinyl-indazole derivatives and their use as inhibitors of human immunodeficiency virus replication |
| WO2020154656A1 (en) | 2019-01-25 | 2020-07-30 | Brown University | Compositions and methods for treating, preventing or reversing age-associated inflammation and disorders |
| WO2021107066A1 (ja) | 2019-11-28 | 2021-06-03 | 塩野義製薬株式会社 | インテグラーゼ阻害剤及び抗hiv薬を組み合わせることを特徴とするhiv感染症の予防及び治療用医薬 |
| WO2024175044A2 (en) * | 2023-02-23 | 2024-08-29 | Ascletis Bioscience Co., Ltd. | Inhibitors of human immunodeficiency virus replication, method of making and method of using thereof |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016504392A (ja) | 2013-01-09 | 2016-02-12 | ギリアード サイエンシーズ, インコーポレイテッド | 抗レトロウイルス剤としての(ヘテロ)アリールアセトアミド誘導体 |
| JP2016510038A (ja) | 2013-03-01 | 2016-04-04 | ギリアード サイエンシーズ, インコーポレイテッド | Hivの処置のためのアミド化合物 |
| JP2017525722A (ja) | 2014-08-29 | 2017-09-07 | ギリアード サイエンシーズ, インコーポレイテッド | 抗レトロウイルス剤 |
| JP2021534102A (ja) | 2018-08-09 | 2021-12-09 | ヴィーブ ヘルスケア ユーケー(ナンバー5)リミテッド | ヒト免疫不全ウイルス複製の阻害剤 |
| JP7301000B2 (ja) | 2017-05-02 | 2023-06-30 | ヴィーブ ヘルスケア ユーケー(ナンバー5)リミテッド | ヒト免疫不全ウイルス複製の阻害剤 |
| JP7307747B2 (ja) | 2018-04-11 | 2023-07-12 | ヴィーブ ヘルスケア ユーケー(ナンバー5)リミテッド | ヒト免疫不全ウイルス複製の阻害剤としての4-オキソ-3,4-ジヒドロキナゾリン化合物 |
Family Cites Families (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102464654B (zh) | 2010-11-12 | 2016-01-13 | 上海泓博智源医药技术有限公司 | 抗病毒化合物 |
| CA2840095A1 (en) | 2011-07-06 | 2013-01-10 | Gilead Sciences, Inc. | Compounds for the treatment of hiv |
| CN102863512B (zh) | 2011-07-07 | 2016-04-20 | 上海泓博智源医药技术有限公司 | 抗病毒化合物 |
| CA2896244C (en) | 2013-01-09 | 2017-07-04 | Gilead Sciences, Inc. | 5-membered heteroaryls and their use as antiviral agents |
| NZ631726A (en) | 2013-01-09 | 2017-01-27 | Gilead Sciences Inc | Therapeutic compounds for the treatment of viral infections |
| WO2015130966A1 (en) | 2014-02-28 | 2015-09-03 | Gilead Sciences, Inc. | Antiviral agents |
| WO2015130964A1 (en) | 2014-02-28 | 2015-09-03 | Gilead Sciences, Inc. | Therapeutic compounds |
| MA42795B1 (fr) | 2016-08-19 | 2019-08-30 | Gilead Sciences Inc | Composés thérapeutiques utiles pour le traitement prophylactique ou thérapeutique d'une infection par le virus du vih |
| JP7083398B2 (ja) | 2018-02-15 | 2022-06-10 | ギリアード サイエンシーズ, インコーポレイテッド | ピリジン誘導体およびhiv感染を処置するためのその使用 |
| CN116854630A (zh) | 2018-02-16 | 2023-10-10 | 吉利德科学公司 | 用于制备可用于治疗逆转录病毒科病毒感染的治疗性化合物的方法和中间体 |
-
2019
- 2019-09-12 EP EP19787072.8A patent/EP3849982A1/en active Pending
- 2019-09-12 WO PCT/IB2019/057710 patent/WO2020053811A1/en unknown
- 2019-09-12 US US17/272,377 patent/US20220089598A1/en active Pending
- 2019-09-12 JP JP2021514019A patent/JP7361766B2/ja active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2016504392A (ja) | 2013-01-09 | 2016-02-12 | ギリアード サイエンシーズ, インコーポレイテッド | 抗レトロウイルス剤としての(ヘテロ)アリールアセトアミド誘導体 |
| JP2016510038A (ja) | 2013-03-01 | 2016-04-04 | ギリアード サイエンシーズ, インコーポレイテッド | Hivの処置のためのアミド化合物 |
| JP2017525722A (ja) | 2014-08-29 | 2017-09-07 | ギリアード サイエンシーズ, インコーポレイテッド | 抗レトロウイルス剤 |
| JP7301000B2 (ja) | 2017-05-02 | 2023-06-30 | ヴィーブ ヘルスケア ユーケー(ナンバー5)リミテッド | ヒト免疫不全ウイルス複製の阻害剤 |
| JP7307747B2 (ja) | 2018-04-11 | 2023-07-12 | ヴィーブ ヘルスケア ユーケー(ナンバー5)リミテッド | ヒト免疫不全ウイルス複製の阻害剤としての4-オキソ-3,4-ジヒドロキナゾリン化合物 |
| JP2021534102A (ja) | 2018-08-09 | 2021-12-09 | ヴィーブ ヘルスケア ユーケー(ナンバー5)リミテッド | ヒト免疫不全ウイルス複製の阻害剤 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2022500425A (ja) | 2022-01-04 |
| WO2020053811A9 (en) | 2022-03-03 |
| EP3849982A1 (en) | 2021-07-21 |
| WO2020053811A1 (en) | 2020-03-19 |
| US20220089598A1 (en) | 2022-03-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7361766B2 (ja) | ヒト免疫不全ウイルス複製の阻害剤 | |
| JP7433303B2 (ja) | ヒト免疫不全ウイルス複製の阻害剤 | |
| ES2911948T3 (es) | Inhibidores de la replicación del virus de la inmunodeficiencia humana | |
| JP7500555B2 (ja) | ヒト免疫不全ウイルス複製の阻害剤 | |
| US20210379071A1 (en) | Inhibitors of human immunodeficiency virus replication | |
| JP2022509919A (ja) | ヒト免疫不全ウイルス複製の阻害剤 | |
| ES2969030T3 (es) | Derivados de quinazolinil-indazol y su uso como inhibidores de replicación de virus de inmunodeficiencia humana | |
| TW202317574A (zh) | Cdk2抑制劑 | |
| JP2022505841A (ja) | ヒト免疫不全ウイルス複製の阻害剤 | |
| JP7532354B2 (ja) | ヒト免疫不全ウイルス複製の阻害剤 | |
| JP6739516B2 (ja) | 呼吸器合胞体ウイルス阻害剤 | |
| JP7545414B2 (ja) | ヒト免疫不全ウイルス複製阻害剤 | |
| ES2974657T3 (es) | Derivados de n-substituido-6-oxo-1,6-dihidropirimidina-2-ilo como inhibidores de la replicación del virus de inmunodeficiencia humana | |
| CN115397424A (zh) | 人类免疫缺陷病毒复制的抑制剂 | |
| US20240374598A1 (en) | Inhibitors of human immunodeficiency virus replication | |
| EA043730B1 (ru) | Ингибиторы репликации вируса иммунодефицита человека | |
| WO2024028316A1 (en) | 1h-pyrrolo[3,2-b]pyridine derivatives as irreversible inhibitors of mutant egfr for the treatment of cancer | |
| KR20220151655A (ko) | 인간 면역결핍 바이러스 복제의 억제제 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220801 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20220801 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20230803 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20230905 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20231003 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7361766 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |