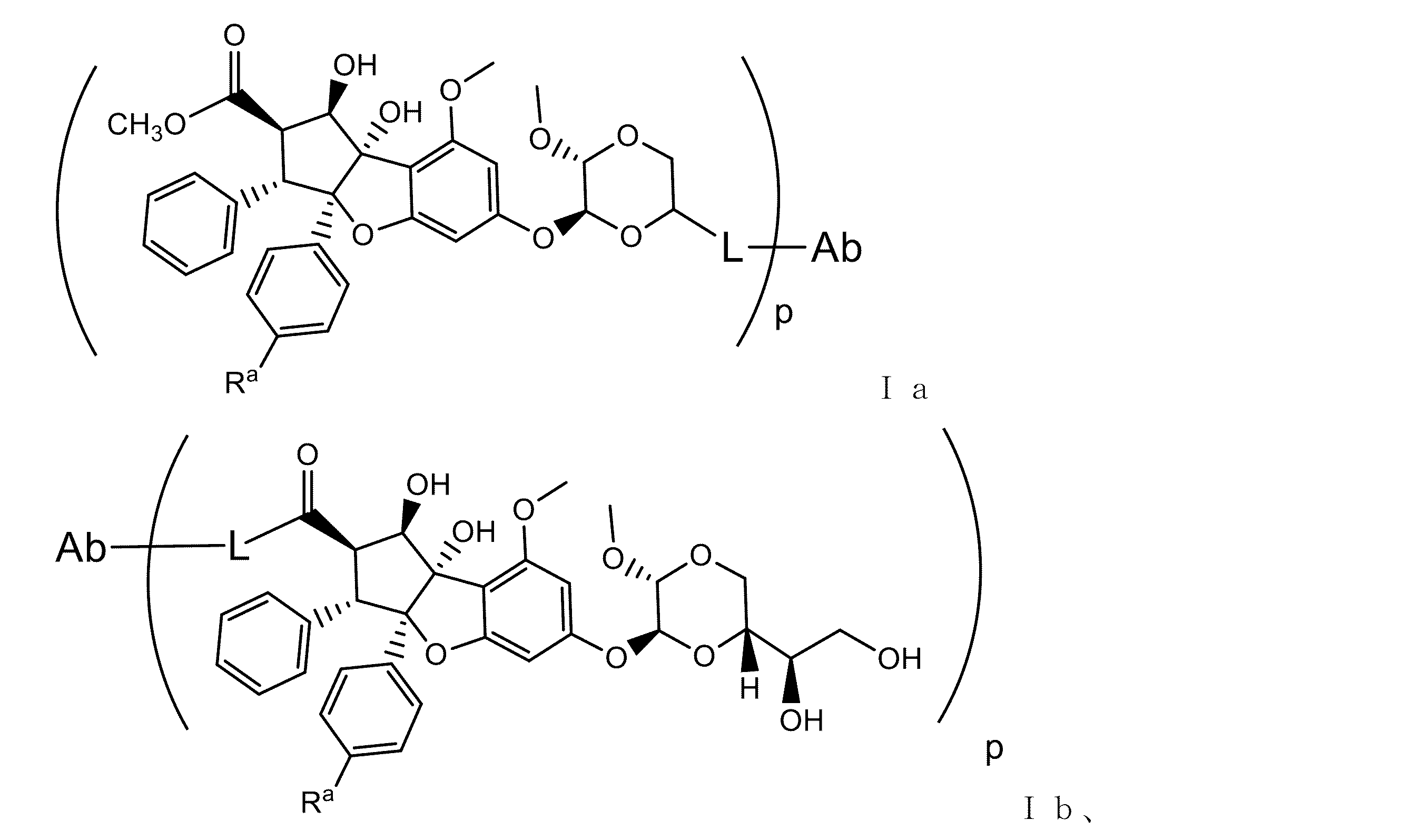
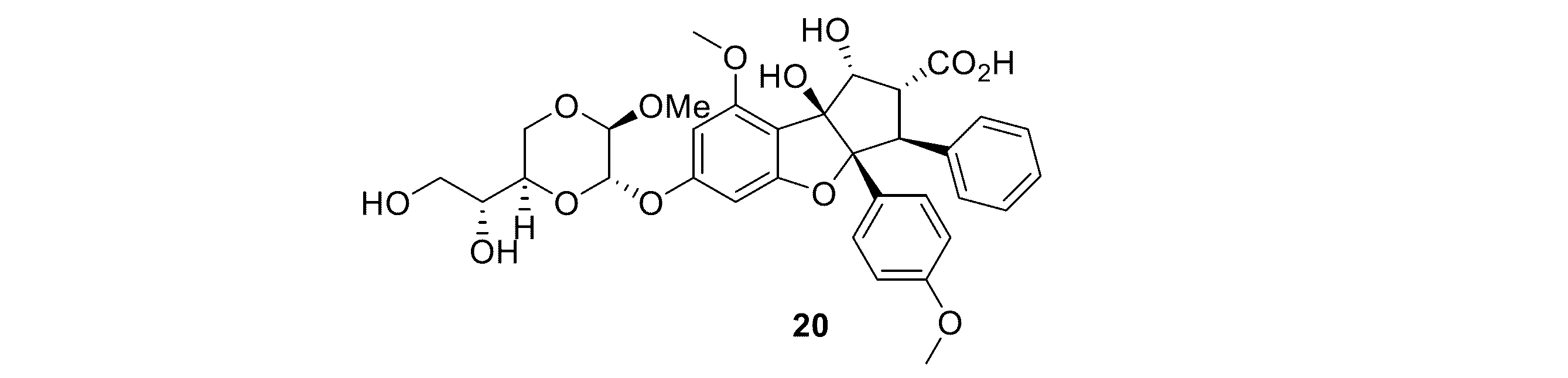
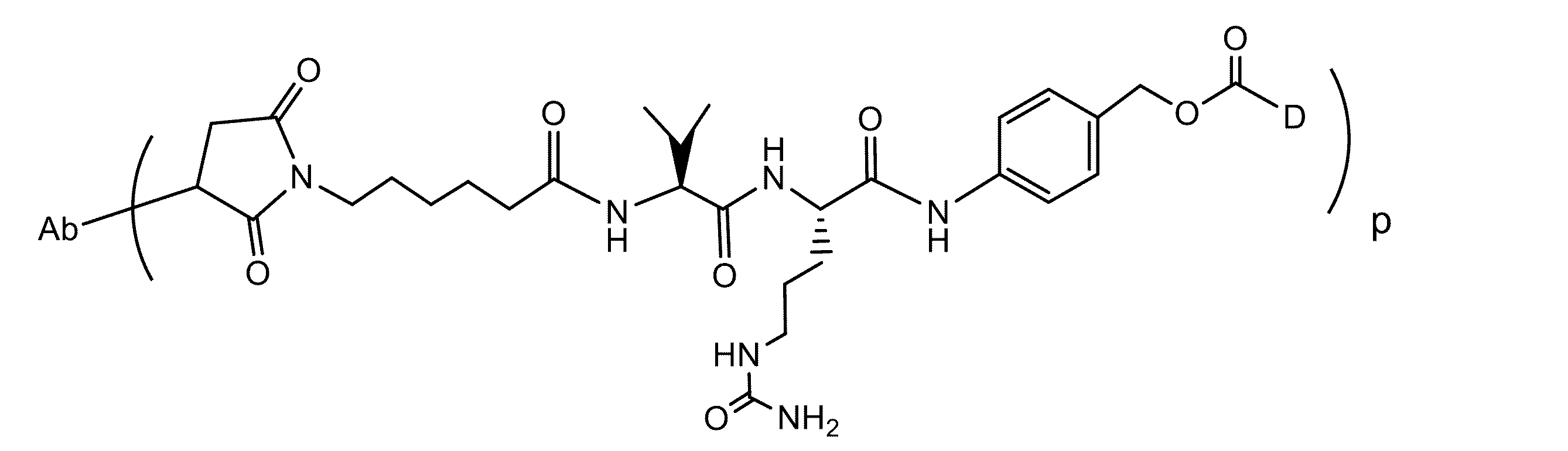
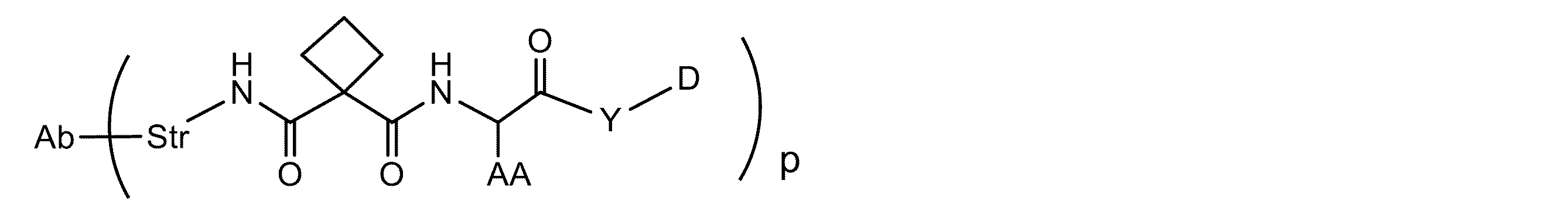JP7043425B2 - シルベストロール抗体-薬物コンジュゲート及び使用方法 - Google Patents
シルベストロール抗体-薬物コンジュゲート及び使用方法 Download PDFInfo
- Publication number
- JP7043425B2 JP7043425B2 JP2018563547A JP2018563547A JP7043425B2 JP 7043425 B2 JP7043425 B2 JP 7043425B2 JP 2018563547 A JP2018563547 A JP 2018563547A JP 2018563547 A JP2018563547 A JP 2018563547A JP 7043425 B2 JP7043425 B2 JP 7043425B2
- Authority
- JP
- Japan
- Prior art keywords
- antibody
- drug conjugate
- compound according
- formula
- silvestrol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000003814 drug Substances 0.000 title claims description 108
- 229940079593 drug Drugs 0.000 title claims description 98
- GVKXFVCXBFGBCD-UHFFFAOYSA-N silvestrol Natural products COC1OCC(C(O)CO)OC1OC(C=C1OC)=CC2=C1C1(O)C(O)C(C(=O)OC)C(C=3C=CC=CC=3)C1(C=1C=CC(OC)=CC=1)O2 GVKXFVCXBFGBCD-UHFFFAOYSA-N 0.000 title claims description 14
- GVKXFVCXBFGBCD-QKDMMWSPSA-N silvestrol Chemical compound CO[C@@H]1OC[C@H]([C@H](O)CO)O[C@H]1OC(C=C1OC)=CC2=C1[C@]1(O)[C@H](O)[C@H](C(=O)OC)[C@@H](C=3C=CC=CC=3)[C@]1(C=1C=CC(OC)=CC=1)O2 GVKXFVCXBFGBCD-QKDMMWSPSA-N 0.000 title claims description 13
- 239000000611 antibody drug conjugate Substances 0.000 claims description 182
- 229940049595 antibody-drug conjugate Drugs 0.000 claims description 182
- 206010028980 Neoplasm Diseases 0.000 claims description 129
- -1 NPTIIb Proteins 0.000 claims description 118
- 239000000203 mixture Substances 0.000 claims description 114
- 150000001875 compounds Chemical class 0.000 claims description 95
- 239000000427 antigen Substances 0.000 claims description 87
- 108091007433 antigens Proteins 0.000 claims description 83
- 102000036639 antigens Human genes 0.000 claims description 83
- 238000000034 method Methods 0.000 claims description 80
- 201000011510 cancer Diseases 0.000 claims description 61
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 58
- 108090000623 proteins and genes Proteins 0.000 claims description 54
- 125000005647 linker group Chemical group 0.000 claims description 45
- 235000018417 cysteine Nutrition 0.000 claims description 38
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 claims description 38
- 235000018102 proteins Nutrition 0.000 claims description 33
- 102000004169 proteins and genes Human genes 0.000 claims description 33
- 239000011734 sodium Substances 0.000 claims description 33
- 125000000539 amino acid group Chemical group 0.000 claims description 31
- 108060003951 Immunoglobulin Proteins 0.000 claims description 30
- 239000000562 conjugate Substances 0.000 claims description 30
- 102000018358 immunoglobulin Human genes 0.000 claims description 30
- 102100038080 B-cell receptor CD22 Human genes 0.000 claims description 27
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 claims description 25
- 101000579425 Homo sapiens Proto-oncogene tyrosine-protein kinase receptor Ret Proteins 0.000 claims description 24
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 claims description 24
- 102100033423 GDNF family receptor alpha-1 Human genes 0.000 claims description 23
- 238000011282 treatment Methods 0.000 claims description 23
- 102000005962 receptors Human genes 0.000 claims description 19
- 108020003175 receptors Proteins 0.000 claims description 19
- 101000628535 Homo sapiens Metalloreductase STEAP2 Proteins 0.000 claims description 18
- 102100034845 KiSS-1 receptor Human genes 0.000 claims description 18
- 102100026711 Metalloreductase STEAP2 Human genes 0.000 claims description 18
- 102100022430 Melanocyte protein PMEL Human genes 0.000 claims description 17
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 claims description 16
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 15
- 101000997961 Homo sapiens GDNF family receptor alpha-1 Proteins 0.000 claims description 15
- 102100032129 Lymphocyte antigen 6K Human genes 0.000 claims description 15
- 102100032780 Semaphorin-5B Human genes 0.000 claims description 15
- 238000004519 manufacturing process Methods 0.000 claims description 15
- 101000713169 Homo sapiens Solute carrier family 52, riboflavin transporter, member 2 Proteins 0.000 claims description 14
- 102100036862 Solute carrier family 52, riboflavin transporter, member 2 Human genes 0.000 claims description 14
- 230000014509 gene expression Effects 0.000 claims description 14
- 101000620359 Homo sapiens Melanocyte protein PMEL Proteins 0.000 claims description 13
- 101000623901 Homo sapiens Mucin-16 Proteins 0.000 claims description 13
- 102100032131 Lymphocyte antigen 6E Human genes 0.000 claims description 13
- 102100023123 Mucin-16 Human genes 0.000 claims description 13
- 108010023729 Complement 3d Receptors Proteins 0.000 claims description 12
- 101001091205 Homo sapiens KiSS-1 receptor Proteins 0.000 claims description 12
- 101001065550 Homo sapiens Lymphocyte antigen 6K Proteins 0.000 claims description 12
- 101000853730 Homo sapiens RING finger and transmembrane domain-containing protein 2 Proteins 0.000 claims description 12
- 101000654679 Homo sapiens Semaphorin-5B Proteins 0.000 claims description 12
- 101000835745 Homo sapiens Teratocarcinoma-derived growth factor 1 Proteins 0.000 claims description 12
- NQTADLQHYWFPDB-UHFFFAOYSA-N N-Hydroxysuccinimide Chemical compound ON1C(=O)CCC1=O NQTADLQHYWFPDB-UHFFFAOYSA-N 0.000 claims description 12
- 102100035928 RING finger and transmembrane domain-containing protein 2 Human genes 0.000 claims description 12
- 102100026404 Teratocarcinoma-derived growth factor 1 Human genes 0.000 claims description 12
- 102100029690 Tumor necrosis factor receptor superfamily member 13C Human genes 0.000 claims description 12
- 125000002947 alkylene group Chemical group 0.000 claims description 12
- 239000008194 pharmaceutical composition Substances 0.000 claims description 11
- 102000011412 Complement 3d Receptors Human genes 0.000 claims description 10
- 102100031036 Leucine-rich repeat-containing G-protein coupled receptor 5 Human genes 0.000 claims description 10
- 229910004013 NO 2 Inorganic materials 0.000 claims description 10
- 150000001413 amino acids Chemical group 0.000 claims description 10
- 125000003118 aryl group Chemical group 0.000 claims description 10
- 210000002307 prostate Anatomy 0.000 claims description 10
- 102100025218 B-cell differentiation antigen CD72 Human genes 0.000 claims description 9
- 102100024220 CD180 antigen Human genes 0.000 claims description 9
- 102100031511 Fc receptor-like protein 2 Human genes 0.000 claims description 9
- 101000980829 Homo sapiens CD180 antigen Proteins 0.000 claims description 9
- 101001063456 Homo sapiens Leucine-rich repeat-containing G-protein coupled receptor 5 Proteins 0.000 claims description 9
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 9
- 101000844504 Homo sapiens Transient receptor potential cation channel subfamily M member 4 Proteins 0.000 claims description 9
- 102100038210 Lymphocyte antigen 6 complex locus protein G6d Human genes 0.000 claims description 9
- 102100026159 Tomoregulin-1 Human genes 0.000 claims description 9
- 229910052757 nitrogen Inorganic materials 0.000 claims description 9
- 229910052760 oxygen Inorganic materials 0.000 claims description 9
- 239000004475 Arginine Substances 0.000 claims description 8
- 102000000844 Cell Surface Receptors Human genes 0.000 claims description 8
- 108010001857 Cell Surface Receptors Proteins 0.000 claims description 8
- 102100032768 Complement receptor type 2 Human genes 0.000 claims description 8
- 239000004471 Glycine Substances 0.000 claims description 8
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 claims description 8
- ODKSFYDXXFIFQN-BYPYZUCNSA-P L-argininium(2+) Chemical compound NC(=[NH2+])NCCC[C@H]([NH3+])C(O)=O ODKSFYDXXFIFQN-BYPYZUCNSA-P 0.000 claims description 8
- 108010006444 Leucine-Rich Repeat Proteins Proteins 0.000 claims description 8
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 claims description 8
- 239000004472 Lysine Substances 0.000 claims description 8
- 241000124008 Mammalia Species 0.000 claims description 8
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 8
- 235000004279 alanine Nutrition 0.000 claims description 8
- 125000000217 alkyl group Chemical group 0.000 claims description 8
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 8
- 125000000524 functional group Chemical group 0.000 claims description 8
- 210000004901 leucine-rich repeat Anatomy 0.000 claims description 8
- 125000006850 spacer group Chemical group 0.000 claims description 8
- 102100026094 C-type lectin domain family 12 member A Human genes 0.000 claims description 7
- 101001065568 Homo sapiens Lymphocyte antigen 6E Proteins 0.000 claims description 7
- 101000834948 Homo sapiens Tomoregulin-2 Proteins 0.000 claims description 7
- KDXKERNSBIXSRK-YFKPBYRVSA-N L-lysine Chemical compound NCCCC[C@H](N)C(O)=O KDXKERNSBIXSRK-YFKPBYRVSA-N 0.000 claims description 7
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 claims description 7
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 claims description 7
- 102000052922 Large Neutral Amino Acid-Transporter 1 Human genes 0.000 claims description 7
- 206010060862 Prostate cancer Diseases 0.000 claims description 7
- 102100036735 Prostate stem cell antigen Human genes 0.000 claims description 7
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 7
- 108091006232 SLC7A5 Proteins 0.000 claims description 7
- 102100026160 Tomoregulin-2 Human genes 0.000 claims description 7
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 claims description 7
- 150000003573 thiols Chemical class 0.000 claims description 7
- 239000004474 valine Substances 0.000 claims description 7
- 101710129514 B-cell differentiation antigen CD72 Proteins 0.000 claims description 6
- 102100031658 C-X-C chemokine receptor type 5 Human genes 0.000 claims description 6
- 102100031517 Fc receptor-like protein 1 Human genes 0.000 claims description 6
- 101710120224 Fc receptor-like protein 1 Proteins 0.000 claims description 6
- 108091006027 G proteins Proteins 0.000 claims description 6
- 102000030782 GTP binding Human genes 0.000 claims description 6
- 108091000058 GTP-Binding Proteins 0.000 claims description 6
- 101000846911 Homo sapiens Fc receptor-like protein 2 Proteins 0.000 claims description 6
- 101000958332 Homo sapiens Lymphocyte antigen 6 complex locus protein G6d Proteins 0.000 claims description 6
- 101000825475 Homo sapiens Protein shisa-2 homolog Proteins 0.000 claims description 6
- 101000834937 Homo sapiens Tomoregulin-1 Proteins 0.000 claims description 6
- 108010076800 Kisspeptin-1 Receptors Proteins 0.000 claims description 6
- 102100037603 P2X purinoceptor 5 Human genes 0.000 claims description 6
- 102100022938 Protein shisa-2 homolog Human genes 0.000 claims description 6
- 102000014105 Semaphorin Human genes 0.000 claims description 6
- 108050003978 Semaphorin Proteins 0.000 claims description 6
- 102100038437 Sodium-dependent phosphate transport protein 2B Human genes 0.000 claims description 6
- 102100031228 Transient receptor potential cation channel subfamily M member 4 Human genes 0.000 claims description 6
- 229910052799 carbon Inorganic materials 0.000 claims description 6
- 229960002173 citrulline Drugs 0.000 claims description 6
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 6
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 claims description 6
- 150000003839 salts Chemical class 0.000 claims description 6
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 claims description 6
- 102100027203 B-cell antigen receptor complex-associated protein beta chain Human genes 0.000 claims description 5
- 102100032312 Brevican core protein Human genes 0.000 claims description 5
- 101710188619 C-type lectin domain family 12 member A Proteins 0.000 claims description 5
- 102100031507 Fc receptor-like protein 5 Human genes 0.000 claims description 5
- 101000914491 Homo sapiens B-cell antigen receptor complex-associated protein beta chain Proteins 0.000 claims description 5
- 101000846908 Homo sapiens Fc receptor-like protein 5 Proteins 0.000 claims description 5
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 claims description 5
- DGAQECJNVWCQMB-PUAWFVPOSA-M Ilexoside XXIX Chemical compound C[C@@H]1CC[C@@]2(CC[C@@]3(C(=CC[C@H]4[C@]3(CC[C@@H]5[C@@]4(CC[C@@H](C5(C)C)OS(=O)(=O)[O-])C)C)[C@@H]2[C@]1(C)O)C)C(=O)O[C@H]6[C@@H]([C@H]([C@@H]([C@H](O6)CO)O)O)O.[Na+] DGAQECJNVWCQMB-PUAWFVPOSA-M 0.000 claims description 5
- RHGKLRLOHDJJDR-BYPYZUCNSA-N L-citrulline Chemical compound NC(=O)NCCC[C@H]([NH3+])C([O-])=O RHGKLRLOHDJJDR-BYPYZUCNSA-N 0.000 claims description 5
- PEEHTFAAVSWFBL-UHFFFAOYSA-N Maleimide Chemical compound O=C1NC(=O)C=C1 PEEHTFAAVSWFBL-UHFFFAOYSA-N 0.000 claims description 5
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 claims description 5
- 101710178300 Tumor necrosis factor receptor superfamily member 13C Proteins 0.000 claims description 5
- HAXFWIACAGNFHA-UHFFFAOYSA-N aldrithiol Chemical compound C=1C=CC=NC=1SSC1=CC=CC=N1 HAXFWIACAGNFHA-UHFFFAOYSA-N 0.000 claims description 5
- 125000004450 alkenylene group Chemical group 0.000 claims description 5
- 125000004419 alkynylene group Chemical group 0.000 claims description 5
- 229910052801 chlorine Inorganic materials 0.000 claims description 5
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 5
- 230000001419 dependent effect Effects 0.000 claims description 5
- 229910052731 fluorine Inorganic materials 0.000 claims description 5
- 229910052708 sodium Inorganic materials 0.000 claims description 5
- ALBODLTZUXKBGZ-JUUVMNCLSA-N (2s)-2-amino-3-phenylpropanoic acid;(2s)-2,6-diaminohexanoic acid Chemical compound NCCCC[C@H](N)C(O)=O.OC(=O)[C@@H](N)CC1=CC=CC=C1 ALBODLTZUXKBGZ-JUUVMNCLSA-N 0.000 claims description 4
- JUIKUQOUMZUFQT-UHFFFAOYSA-N 2-bromoacetamide Chemical compound NC(=O)CBr JUIKUQOUMZUFQT-UHFFFAOYSA-N 0.000 claims description 4
- 108091008875 B cell receptors Proteins 0.000 claims description 4
- 102100025473 Carcinoembryonic antigen-related cell adhesion molecule 6 Human genes 0.000 claims description 4
- 108010078791 Carrier Proteins Proteins 0.000 claims description 4
- 101000914326 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 6 Proteins 0.000 claims description 4
- 102000004310 Ion Channels Human genes 0.000 claims description 4
- 108090000862 Ion Channels Proteins 0.000 claims description 4
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 claims description 4
- RHGKLRLOHDJJDR-UHFFFAOYSA-N Ndelta-carbamoyl-DL-ornithine Natural products OC(=O)C(N)CCCNC(N)=O RHGKLRLOHDJJDR-UHFFFAOYSA-N 0.000 claims description 4
- 108010029485 Protein Isoforms Proteins 0.000 claims description 4
- 102000001708 Protein Isoforms Human genes 0.000 claims description 4
- 102000003425 Tyrosinase Human genes 0.000 claims description 4
- 108060008724 Tyrosinase Proteins 0.000 claims description 4
- 235000003704 aspartic acid Nutrition 0.000 claims description 4
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 claims description 4
- 125000003178 carboxy group Chemical group [H]OC(*)=O 0.000 claims description 4
- 235000013477 citrulline Nutrition 0.000 claims description 4
- 239000002299 complementary DNA Substances 0.000 claims description 4
- 239000003102 growth factor Substances 0.000 claims description 4
- 239000003446 ligand Substances 0.000 claims description 4
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 4
- 230000005945 translocation Effects 0.000 claims description 4
- 102100020998 Aspartate beta-hydroxylase domain-containing protein 1 Human genes 0.000 claims description 3
- 108010046304 B-Cell Activation Factor Receptor Proteins 0.000 claims description 3
- 102100027205 B-cell antigen receptor complex-associated protein alpha chain Human genes 0.000 claims description 3
- 102000001893 Bone Morphogenetic Protein Receptors Human genes 0.000 claims description 3
- 108010040422 Bone Morphogenetic Protein Receptors Proteins 0.000 claims description 3
- 108010085074 Brevican Proteins 0.000 claims description 3
- 108010061298 CXCR5 Receptors Proteins 0.000 claims description 3
- 101001024441 Candida albicans (strain SC5314 / ATCC MYA-2876) Major facilitator superfamily multidrug transporter NAG3 Proteins 0.000 claims description 3
- 102100030886 Complement receptor type 1 Human genes 0.000 claims description 3
- 102100026245 E3 ubiquitin-protein ligase RNF43 Human genes 0.000 claims description 3
- 102000012545 EGF-like domains Human genes 0.000 claims description 3
- 108050002150 EGF-like domains Proteins 0.000 claims description 3
- 102000002045 Endothelin Human genes 0.000 claims description 3
- 108050009340 Endothelin Proteins 0.000 claims description 3
- 101710105157 GDNF family receptor alpha-1 Proteins 0.000 claims description 3
- 102100031546 HLA class II histocompatibility antigen, DO beta chain Human genes 0.000 claims description 3
- 102000018713 Histocompatibility Antigens Class II Human genes 0.000 claims description 3
- 108010027412 Histocompatibility Antigens Class II Proteins 0.000 claims description 3
- 101000783987 Homo sapiens Aspartate beta-hydroxylase domain-containing protein 1 Proteins 0.000 claims description 3
- 101000914489 Homo sapiens B-cell antigen receptor complex-associated protein alpha chain Proteins 0.000 claims description 3
- 101000922405 Homo sapiens C-X-C chemokine receptor type 5 Proteins 0.000 claims description 3
- 101000727061 Homo sapiens Complement receptor type 1 Proteins 0.000 claims description 3
- 101000941929 Homo sapiens Complement receptor type 2 Proteins 0.000 claims description 3
- 101000692702 Homo sapiens E3 ubiquitin-protein ligase RNF43 Proteins 0.000 claims description 3
- 101100119857 Homo sapiens FCRL2 gene Proteins 0.000 claims description 3
- 101000866281 Homo sapiens HLA class II histocompatibility antigen, DO beta chain Proteins 0.000 claims description 3
- 101000576802 Homo sapiens Mesothelin Proteins 0.000 claims description 3
- 101000628547 Homo sapiens Metalloreductase STEAP1 Proteins 0.000 claims description 3
- 101001024605 Homo sapiens Next to BRCA1 gene 1 protein Proteins 0.000 claims description 3
- 101001121964 Homo sapiens OCIA domain-containing protein 1 Proteins 0.000 claims description 3
- 101000604039 Homo sapiens Sodium-dependent phosphate transport protein 2B Proteins 0.000 claims description 3
- 101000662690 Homo sapiens Trafficking protein particle complex subunit 10 Proteins 0.000 claims description 3
- 101710160635 Lymphocyte antigen 6 complex locus protein G6d Proteins 0.000 claims description 3
- 101710157879 Lymphocyte antigen 6E Proteins 0.000 claims description 3
- 101710158212 Lymphocyte antigen 6K Proteins 0.000 claims description 3
- 102000018697 Membrane Proteins Human genes 0.000 claims description 3
- 108010052285 Membrane Proteins Proteins 0.000 claims description 3
- 102100025096 Mesothelin Human genes 0.000 claims description 3
- 102100026712 Metalloreductase STEAP1 Human genes 0.000 claims description 3
- 101100182721 Mus musculus Ly6e gene Proteins 0.000 claims description 3
- 101000623899 Mus musculus Mucin-13 Proteins 0.000 claims description 3
- 101100042271 Mus musculus Sema3b gene Proteins 0.000 claims description 3
- 101100365741 Mus musculus Shisa2 gene Proteins 0.000 claims description 3
- 102100027183 OCIA domain-containing protein 1 Human genes 0.000 claims description 3
- 108010092528 Phosphate Transport Proteins Proteins 0.000 claims description 3
- 102000016462 Phosphate Transport Proteins Human genes 0.000 claims description 3
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 claims description 3
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 claims description 3
- 108010067787 Proteoglycans Proteins 0.000 claims description 3
- 102000016611 Proteoglycans Human genes 0.000 claims description 3
- 108010080192 Purinergic Receptors Proteins 0.000 claims description 3
- 102000014400 SH2 domains Human genes 0.000 claims description 3
- 108050003452 SH2 domains Proteins 0.000 claims description 3
- 108091058557 SILV Proteins 0.000 claims description 3
- 108091006576 SLC34A2 Proteins 0.000 claims description 3
- 101710199399 Semaphorin-5B Proteins 0.000 claims description 3
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 claims description 3
- 102000003618 TRPM4 Human genes 0.000 claims description 3
- 101710175559 Tomoregulin-1 Proteins 0.000 claims description 3
- 102100037456 Trafficking protein particle complex subunit 10 Human genes 0.000 claims description 3
- 102100039094 Tyrosinase Human genes 0.000 claims description 3
- 241000269368 Xenopus laevis Species 0.000 claims description 3
- 101100365738 Xenopus laevis shisa1 gene Proteins 0.000 claims description 3
- FNXLCIKXHOPCKH-UHFFFAOYSA-N bromamine Chemical compound BrN FNXLCIKXHOPCKH-UHFFFAOYSA-N 0.000 claims description 3
- 229910052794 bromium Inorganic materials 0.000 claims description 3
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 claims description 3
- 210000000805 cytoplasm Anatomy 0.000 claims description 3
- 239000003085 diluting agent Substances 0.000 claims description 3
- 125000002228 disulfide group Chemical group 0.000 claims description 3
- ZUBDGKVDJUIMQQ-UBFCDGJISA-N endothelin-1 Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(O)=O)NC(=O)[C@H]1NC(=O)[C@H](CC=2C=CC=CC=2)NC(=O)[C@@H](CC=2C=CC(O)=CC=2)NC(=O)[C@H](C(C)C)NC(=O)[C@H]2CSSC[C@@H](C(N[C@H](CO)C(=O)N[C@@H](CO)C(=O)N[C@H](CC(C)C)C(=O)N[C@@H](CCSC)C(=O)N[C@H](CC(O)=O)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CCC(O)=O)C(=O)N2)=O)NC(=O)[C@@H](CO)NC(=O)[C@H](N)CSSC1)C1=CNC=N1 ZUBDGKVDJUIMQQ-UBFCDGJISA-N 0.000 claims description 3
- 239000003623 enhancer Substances 0.000 claims description 3
- 229910052739 hydrogen Inorganic materials 0.000 claims description 3
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 claims description 3
- PGLTVOMIXTUURA-UHFFFAOYSA-N iodoacetamide Chemical compound NC(=O)CI PGLTVOMIXTUURA-UHFFFAOYSA-N 0.000 claims description 3
- 210000003593 megakaryocyte Anatomy 0.000 claims description 3
- 239000000825 pharmaceutical preparation Substances 0.000 claims description 3
- 229940127557 pharmaceutical product Drugs 0.000 claims description 3
- 229910052709 silver Inorganic materials 0.000 claims description 3
- 239000004332 silver Substances 0.000 claims description 3
- 239000001488 sodium phosphate Substances 0.000 claims description 3
- 229910000162 sodium phosphate Inorganic materials 0.000 claims description 3
- 208000035782 susceptibility to 1 Hirschsprung disease Diseases 0.000 claims description 3
- 108010037277 thymic shared antigen-1 Proteins 0.000 claims description 3
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 claims description 3
- 101100004180 Chironomus tentans BR3 gene Proteins 0.000 claims description 2
- 108090000722 Glial cell line-derived neurotrophic factor receptors Proteins 0.000 claims description 2
- 101100425948 Homo sapiens TNFRSF13C gene Proteins 0.000 claims description 2
- 108060008245 Thrombospondin Proteins 0.000 claims description 2
- 102000002938 Thrombospondin Human genes 0.000 claims description 2
- LMBFAGIMSUYTBN-MPZNNTNKSA-N teixobactin Chemical compound C([C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H](CCC(N)=O)C(=O)N[C@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CO)C(=O)N[C@H]1C(N[C@@H](C)C(=O)N[C@@H](C[C@@H]2NC(=N)NC2)C(=O)N[C@H](C(=O)O[C@H]1C)[C@@H](C)CC)=O)NC)C1=CC=CC=C1 LMBFAGIMSUYTBN-MPZNNTNKSA-N 0.000 claims description 2
- 101001136592 Homo sapiens Prostate stem cell antigen Proteins 0.000 claims 2
- 239000008177 pharmaceutical agent Substances 0.000 claims 1
- 210000004027 cell Anatomy 0.000 description 136
- 241000282414 Homo sapiens Species 0.000 description 101
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 72
- 239000000243 solution Substances 0.000 description 66
- 230000027455 binding Effects 0.000 description 53
- 238000002360 preparation method Methods 0.000 description 46
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 44
- 125000003275 alpha amino acid group Chemical group 0.000 description 42
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 42
- WEVYAHXRMPXWCK-UHFFFAOYSA-N Acetonitrile Chemical compound CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 description 39
- 102000004196 processed proteins & peptides Human genes 0.000 description 39
- 229920001184 polypeptide Polymers 0.000 description 38
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 35
- 239000000543 intermediate Substances 0.000 description 34
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 32
- 239000007787 solid Substances 0.000 description 31
- 230000035772 mutation Effects 0.000 description 30
- 238000006243 chemical reaction Methods 0.000 description 29
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 28
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 description 27
- 239000011541 reaction mixture Substances 0.000 description 27
- SCVJRXQHFJXZFZ-KVQBGUIXSA-N 2-amino-9-[(2r,4s,5r)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]-3h-purine-6-thione Chemical compound C1=2NC(N)=NC(=S)C=2N=CN1[C@H]1C[C@H](O)[C@@H](CO)O1 SCVJRXQHFJXZFZ-KVQBGUIXSA-N 0.000 description 25
- 150000007523 nucleic acids Chemical class 0.000 description 23
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 22
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 22
- 230000021615 conjugation Effects 0.000 description 22
- 235000019439 ethyl acetate Nutrition 0.000 description 22
- 108020004707 nucleic acids Proteins 0.000 description 22
- 102000039446 nucleic acids Human genes 0.000 description 22
- 238000006467 substitution reaction Methods 0.000 description 22
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 description 21
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-Diisopropylethylamine (DIPEA) Chemical compound CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 21
- 230000002829 reductive effect Effects 0.000 description 21
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 20
- 230000015572 biosynthetic process Effects 0.000 description 19
- 238000000338 in vitro Methods 0.000 description 18
- 235000001014 amino acid Nutrition 0.000 description 17
- 238000001727 in vivo Methods 0.000 description 17
- 238000003556 assay Methods 0.000 description 16
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 15
- 241001465754 Metazoa Species 0.000 description 15
- 241000699670 Mus sp. Species 0.000 description 15
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 15
- 208000035475 disorder Diseases 0.000 description 15
- 230000000694 effects Effects 0.000 description 15
- 239000012044 organic layer Substances 0.000 description 15
- 239000002953 phosphate buffered saline Substances 0.000 description 15
- 101150029707 ERBB2 gene Proteins 0.000 description 14
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 14
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 14
- 239000013598 vector Substances 0.000 description 14
- 239000003981 vehicle Substances 0.000 description 14
- QTBSBXVTEAMEQO-UHFFFAOYSA-N acetic acid Substances CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 13
- 230000010056 antibody-dependent cellular cytotoxicity Effects 0.000 description 13
- 239000000872 buffer Substances 0.000 description 13
- 230000000875 corresponding effect Effects 0.000 description 13
- 201000010099 disease Diseases 0.000 description 13
- 230000006870 function Effects 0.000 description 13
- 239000000047 product Substances 0.000 description 13
- 238000000746 purification Methods 0.000 description 13
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 12
- 125000004432 carbon atom Chemical group C* 0.000 description 12
- 238000005516 engineering process Methods 0.000 description 12
- 239000012634 fragment Substances 0.000 description 12
- 238000002953 preparative HPLC Methods 0.000 description 12
- DJQYYYCQOZMCRC-UHFFFAOYSA-N 2-aminopropane-1,3-dithiol Chemical group SCC(N)CS DJQYYYCQOZMCRC-UHFFFAOYSA-N 0.000 description 11
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 239000003153 chemical reaction reagent Substances 0.000 description 11
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 10
- 238000005481 NMR spectroscopy Methods 0.000 description 10
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 10
- 210000000349 chromosome Anatomy 0.000 description 10
- 229940127089 cytotoxic agent Drugs 0.000 description 10
- 239000012636 effector Substances 0.000 description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 description 10
- 230000004044 response Effects 0.000 description 10
- UHOVQNZJYSORNB-UHFFFAOYSA-N Benzene Chemical compound C1=CC=CC=C1 UHOVQNZJYSORNB-UHFFFAOYSA-N 0.000 description 9
- 229940024606 amino acid Drugs 0.000 description 9
- 239000002254 cytotoxic agent Substances 0.000 description 9
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 description 9
- 238000004128 high performance liquid chromatography Methods 0.000 description 9
- 208000032839 leukemia Diseases 0.000 description 9
- 239000002609 medium Substances 0.000 description 9
- 241000894007 species Species 0.000 description 9
- 125000001424 substituent group Chemical group 0.000 description 9
- 229940124597 therapeutic agent Drugs 0.000 description 9
- 125000003396 thiol group Chemical group [H]S* 0.000 description 9
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 description 8
- 238000011579 SCID mouse model Methods 0.000 description 8
- 210000004369 blood Anatomy 0.000 description 8
- 239000008280 blood Substances 0.000 description 8
- 230000003833 cell viability Effects 0.000 description 8
- 238000012054 celltiter-glo Methods 0.000 description 8
- 230000002401 inhibitory effect Effects 0.000 description 8
- 230000003834 intracellular effect Effects 0.000 description 8
- 238000012746 preparative thin layer chromatography Methods 0.000 description 8
- 230000001225 therapeutic effect Effects 0.000 description 8
- QOSSAOTZNIDXMA-UHFFFAOYSA-N Dicylcohexylcarbodiimide Chemical compound C1CCCCC1N=C=NC1CCCCC1 QOSSAOTZNIDXMA-UHFFFAOYSA-N 0.000 description 7
- 108010087819 Fc receptors Proteins 0.000 description 7
- 102000009109 Fc receptors Human genes 0.000 description 7
- 108010024636 Glutathione Proteins 0.000 description 7
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 7
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 7
- 241000282485 Vulpes vulpes Species 0.000 description 7
- 239000002253 acid Substances 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 230000004071 biological effect Effects 0.000 description 7
- 239000000460 chlorine Substances 0.000 description 7
- 230000004540 complement-dependent cytotoxicity Effects 0.000 description 7
- 231100000599 cytotoxic agent Toxicity 0.000 description 7
- VHJLVAABSRFDPM-QWWZWVQMSA-N dithiothreitol Chemical compound SC[C@@H](O)[C@H](O)CS VHJLVAABSRFDPM-QWWZWVQMSA-N 0.000 description 7
- 150000002148 esters Chemical class 0.000 description 7
- 229960003180 glutathione Drugs 0.000 description 7
- 210000004408 hybridoma Anatomy 0.000 description 7
- 229940127121 immunoconjugate Drugs 0.000 description 7
- 238000001990 intravenous administration Methods 0.000 description 7
- 238000011068 loading method Methods 0.000 description 7
- 125000004108 n-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 7
- 230000003389 potentiating effect Effects 0.000 description 7
- 239000002904 solvent Substances 0.000 description 7
- 238000003756 stirring Methods 0.000 description 7
- 238000003786 synthesis reaction Methods 0.000 description 7
- 238000002560 therapeutic procedure Methods 0.000 description 7
- QHKJIJXBJCOABP-UHFFFAOYSA-N 1-benzofuran-2-carboxamide Chemical compound C1=CC=C2OC(C(=O)N)=CC2=C1 QHKJIJXBJCOABP-UHFFFAOYSA-N 0.000 description 6
- 239000004215 Carbon black (E152) Substances 0.000 description 6
- GKQLYSROISKDLL-UHFFFAOYSA-N EEDQ Chemical compound C1=CC=C2N(C(=O)OCC)C(OCC)C=CC2=C1 GKQLYSROISKDLL-UHFFFAOYSA-N 0.000 description 6
- HNDVDQJCIGZPNO-YFKPBYRVSA-N L-histidine Chemical compound OC(=O)[C@@H](N)CC1=CN=CN1 HNDVDQJCIGZPNO-YFKPBYRVSA-N 0.000 description 6
- WMFOQBRAJBCJND-UHFFFAOYSA-M Lithium hydroxide Chemical compound [Li+].[OH-] WMFOQBRAJBCJND-UHFFFAOYSA-M 0.000 description 6
- 239000002202 Polyethylene glycol Substances 0.000 description 6
- 239000007983 Tris buffer Substances 0.000 description 6
- 210000003719 b-lymphocyte Anatomy 0.000 description 6
- 230000004663 cell proliferation Effects 0.000 description 6
- 238000001516 cell proliferation assay Methods 0.000 description 6
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 6
- 239000012230 colorless oil Substances 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 6
- 229930195733 hydrocarbon Natural products 0.000 description 6
- 230000001965 increasing effect Effects 0.000 description 6
- 230000005764 inhibitory process Effects 0.000 description 6
- 230000004048 modification Effects 0.000 description 6
- 238000012986 modification Methods 0.000 description 6
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 description 6
- 229920001223 polyethylene glycol Polymers 0.000 description 6
- 230000009261 transgenic effect Effects 0.000 description 6
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 6
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 6
- 125000006516 2-(benzyloxy)ethyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])OC([H])([H])C([H])([H])* 0.000 description 5
- 208000026310 Breast neoplasm Diseases 0.000 description 5
- 241000282693 Cercopithecidae Species 0.000 description 5
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 5
- 102100026120 IgG receptor FcRn large subunit p51 Human genes 0.000 description 5
- 206010035226 Plasma cell myeloma Diseases 0.000 description 5
- QIXRWIVDBZJDGD-UHFFFAOYSA-N benzyl (4-nitrophenyl) carbonate Chemical compound C1=CC([N+](=O)[O-])=CC=C1OC(=O)OCC1=CC=CC=C1 QIXRWIVDBZJDGD-UHFFFAOYSA-N 0.000 description 5
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 5
- 239000012267 brine Substances 0.000 description 5
- 210000004978 chinese hamster ovary cell Anatomy 0.000 description 5
- 238000010494 dissociation reaction Methods 0.000 description 5
- 230000005593 dissociations Effects 0.000 description 5
- 230000009977 dual effect Effects 0.000 description 5
- 238000010828 elution Methods 0.000 description 5
- 238000003818 flash chromatography Methods 0.000 description 5
- 238000004191 hydrophobic interaction chromatography Methods 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 239000010410 layer Substances 0.000 description 5
- 239000000463 material Substances 0.000 description 5
- 201000000050 myeloid neoplasm Diseases 0.000 description 5
- 239000003921 oil Substances 0.000 description 5
- 229920000642 polymer Polymers 0.000 description 5
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 5
- 238000001542 size-exclusion chromatography Methods 0.000 description 5
- 239000011780 sodium chloride Substances 0.000 description 5
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 5
- OFFSPAZVIVZPHU-UHFFFAOYSA-N 1-benzofuran-2-carboxylic acid Chemical compound C1=CC=C2OC(C(=O)O)=CC2=C1 OFFSPAZVIVZPHU-UHFFFAOYSA-N 0.000 description 4
- PCBZRNYXXCIELG-WYFCWLEVSA-N COC1=CC=C(C[C@H](NC(=O)OC2CCCC3(C2)OOC2(O3)C3CC4CC(C3)CC2C4)C(=O)N[C@@H]2[C@@H](CO)O[C@H]([C@@H]2O)N2C=NC3=C2N=CN=C3N(C)C)C=C1 Chemical compound COC1=CC=C(C[C@H](NC(=O)OC2CCCC3(C2)OOC2(O3)C3CC4CC(C3)CC2C4)C(=O)N[C@@H]2[C@@H](CO)O[C@H]([C@@H]2O)N2C=NC3=C2N=CN=C3N(C)C)C=C1 PCBZRNYXXCIELG-WYFCWLEVSA-N 0.000 description 4
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical group [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 4
- SBJKKFFYIZUCET-JLAZNSOCSA-N Dehydro-L-ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(=O)C1=O SBJKKFFYIZUCET-JLAZNSOCSA-N 0.000 description 4
- SBJKKFFYIZUCET-UHFFFAOYSA-N Dehydroascorbic acid Natural products OCC(O)C1OC(=O)C(=O)C1=O SBJKKFFYIZUCET-UHFFFAOYSA-N 0.000 description 4
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 4
- 102100031968 Ephrin type-B receptor 2 Human genes 0.000 description 4
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 4
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 4
- 101710177940 IgG receptor FcRn large subunit p51 Proteins 0.000 description 4
- 206010025323 Lymphomas Diseases 0.000 description 4
- PCLIMKBDDGJMGD-UHFFFAOYSA-N N-bromosuccinimide Chemical compound BrN1C(=O)CCC1=O PCLIMKBDDGJMGD-UHFFFAOYSA-N 0.000 description 4
- 239000004698 Polyethylene Substances 0.000 description 4
- 229920001213 Polysorbate 20 Polymers 0.000 description 4
- 206010039491 Sarcoma Diseases 0.000 description 4
- 238000002835 absorbance Methods 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- 150000001412 amines Chemical class 0.000 description 4
- 239000002246 antineoplastic agent Substances 0.000 description 4
- 239000007864 aqueous solution Substances 0.000 description 4
- 125000002619 bicyclic group Chemical group 0.000 description 4
- 229910052796 boron Inorganic materials 0.000 description 4
- 125000003917 carbamoyl group Chemical group [H]N([H])C(*)=O 0.000 description 4
- CREMABGTGYGIQB-UHFFFAOYSA-N carbon carbon Chemical compound C.C CREMABGTGYGIQB-UHFFFAOYSA-N 0.000 description 4
- 239000011203 carbon fibre reinforced carbon Substances 0.000 description 4
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 4
- 238000004113 cell culture Methods 0.000 description 4
- 239000006143 cell culture medium Substances 0.000 description 4
- 239000003638 chemical reducing agent Substances 0.000 description 4
- 238000004440 column chromatography Methods 0.000 description 4
- 230000000295 complement effect Effects 0.000 description 4
- 230000003013 cytotoxicity Effects 0.000 description 4
- 231100000135 cytotoxicity Toxicity 0.000 description 4
- 235000020960 dehydroascorbic acid Nutrition 0.000 description 4
- 239000011615 dehydroascorbic acid Substances 0.000 description 4
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 description 4
- 231100000673 dose–response relationship Toxicity 0.000 description 4
- 239000003937 drug carrier Substances 0.000 description 4
- 238000001914 filtration Methods 0.000 description 4
- IRXSLJNXXZKURP-UHFFFAOYSA-N fluorenylmethyloxycarbonyl chloride Chemical compound C1=CC=C2C(COC(=O)Cl)C3=CC=CC=C3C2=C1 IRXSLJNXXZKURP-UHFFFAOYSA-N 0.000 description 4
- 230000012010 growth Effects 0.000 description 4
- 125000005842 heteroatom Chemical group 0.000 description 4
- FUZZWVXGSFPDMH-UHFFFAOYSA-N hexanoic acid Chemical compound CCCCCC(O)=O FUZZWVXGSFPDMH-UHFFFAOYSA-N 0.000 description 4
- 238000013537 high throughput screening Methods 0.000 description 4
- AMWRITDGCCNYAT-UHFFFAOYSA-L hydroxy(oxo)manganese;manganese Chemical compound [Mn].O[Mn]=O.O[Mn]=O AMWRITDGCCNYAT-UHFFFAOYSA-L 0.000 description 4
- 230000002998 immunogenetic effect Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 238000010253 intravenous injection Methods 0.000 description 4
- 210000003292 kidney cell Anatomy 0.000 description 4
- 230000000670 limiting effect Effects 0.000 description 4
- 238000004020 luminiscence type Methods 0.000 description 4
- 210000004698 lymphocyte Anatomy 0.000 description 4
- 210000004962 mammalian cell Anatomy 0.000 description 4
- 238000005259 measurement Methods 0.000 description 4
- 239000003094 microcapsule Substances 0.000 description 4
- 230000003647 oxidation Effects 0.000 description 4
- 238000007254 oxidation reaction Methods 0.000 description 4
- 239000005022 packaging material Substances 0.000 description 4
- 230000036961 partial effect Effects 0.000 description 4
- 230000007170 pathology Effects 0.000 description 4
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 4
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 4
- 230000009467 reduction Effects 0.000 description 4
- 238000010405 reoxidation reaction Methods 0.000 description 4
- 229920006395 saturated elastomer Polymers 0.000 description 4
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 4
- 229940074404 sodium succinate Drugs 0.000 description 4
- ZDQYSKICYIVCPN-UHFFFAOYSA-L sodium succinate (anhydrous) Chemical compound [Na+].[Na+].[O-]C(=O)CCC([O-])=O ZDQYSKICYIVCPN-UHFFFAOYSA-L 0.000 description 4
- KDYFGRWQOYBRFD-UHFFFAOYSA-N succinic acid Chemical compound OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 4
- 125000000446 sulfanediyl group Chemical group *S* 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 210000004881 tumor cell Anatomy 0.000 description 4
- 230000004614 tumor growth Effects 0.000 description 4
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 4
- 238000000108 ultra-filtration Methods 0.000 description 4
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 3
- ZKRSYXWTVSTKLW-UHFFFAOYSA-N 1-(5-aminopentyl)pyrrole-2,5-dione;hydrochloride Chemical compound Cl.NCCCCCN1C(=O)C=CC1=O ZKRSYXWTVSTKLW-UHFFFAOYSA-N 0.000 description 3
- AZUYLZMQTIKGSC-UHFFFAOYSA-N 1-[6-[4-(5-chloro-6-methyl-1H-indazol-4-yl)-5-methyl-3-(1-methylindazol-5-yl)pyrazol-1-yl]-2-azaspiro[3.3]heptan-2-yl]prop-2-en-1-one Chemical compound ClC=1C(=C2C=NNC2=CC=1C)C=1C(=NN(C=1C)C1CC2(CN(C2)C(C=C)=O)C1)C=1C=C2C=NN(C2=CC=1)C AZUYLZMQTIKGSC-UHFFFAOYSA-N 0.000 description 3
- OZAIFHULBGXAKX-UHFFFAOYSA-N 2-(2-cyanopropan-2-yldiazenyl)-2-methylpropanenitrile Chemical compound N#CC(C)(C)N=NC(C)(C)C#N OZAIFHULBGXAKX-UHFFFAOYSA-N 0.000 description 3
- PGHKJMVOHWKSLJ-UHFFFAOYSA-N 2-methoxyethyl n-(2-methoxyethoxycarbonylimino)carbamate Chemical compound COCCOC(=O)N=NC(=O)OCCOC PGHKJMVOHWKSLJ-UHFFFAOYSA-N 0.000 description 3
- KLDLRDSRCMJKGM-UHFFFAOYSA-N 3-[chloro-(2-oxo-1,3-oxazolidin-3-yl)phosphoryl]-1,3-oxazolidin-2-one Chemical compound C1COC(=O)N1P(=O)(Cl)N1CCOC1=O KLDLRDSRCMJKGM-UHFFFAOYSA-N 0.000 description 3
- NHQDETIJWKXCTC-UHFFFAOYSA-N 3-chloroperbenzoic acid Chemical compound OOC(=O)C1=CC=CC(Cl)=C1 NHQDETIJWKXCTC-UHFFFAOYSA-N 0.000 description 3
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 3
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- 206010006187 Breast cancer Diseases 0.000 description 3
- 201000009030 Carcinoma Diseases 0.000 description 3
- 206010057248 Cell death Diseases 0.000 description 3
- 102100020743 Dipeptidase 1 Human genes 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 241000196324 Embryophyta Species 0.000 description 3
- VGGSQFUCUMXWEO-UHFFFAOYSA-N Ethene Chemical compound C=C VGGSQFUCUMXWEO-UHFFFAOYSA-N 0.000 description 3
- 239000005977 Ethylene Substances 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102000003886 Glycoproteins Human genes 0.000 description 3
- 108090000288 Glycoproteins Proteins 0.000 description 3
- 241000282412 Homo Species 0.000 description 3
- 101000869050 Homo sapiens Caveolae-associated protein 2 Proteins 0.000 description 3
- 101001064462 Homo sapiens Ephrin type-B receptor 2 Proteins 0.000 description 3
- 101000829779 Homo sapiens Probable G-protein coupled receptor 19 Proteins 0.000 description 3
- 208000008839 Kidney Neoplasms Diseases 0.000 description 3
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 3
- 108060001084 Luciferase Proteins 0.000 description 3
- 239000005089 Luciferase Substances 0.000 description 3
- 208000008589 Obesity Diseases 0.000 description 3
- 108700020796 Oncogene Proteins 0.000 description 3
- 241000283973 Oryctolagus cuniculus Species 0.000 description 3
- 102000035195 Peptidases Human genes 0.000 description 3
- 108091005804 Peptidases Proteins 0.000 description 3
- CXOFVDLJLONNDW-UHFFFAOYSA-N Phenytoin Chemical compound N1C(=O)NC(=O)C1(C=1C=CC=CC=1)C1=CC=CC=C1 CXOFVDLJLONNDW-UHFFFAOYSA-N 0.000 description 3
- 102100023417 Probable G-protein coupled receptor 19 Human genes 0.000 description 3
- 206010038389 Renal cancer Diseases 0.000 description 3
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 3
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 3
- VMHLLURERBWHNL-UHFFFAOYSA-M Sodium acetate Chemical compound [Na+].CC([O-])=O VMHLLURERBWHNL-UHFFFAOYSA-M 0.000 description 3
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 3
- 230000004913 activation Effects 0.000 description 3
- 230000002411 adverse Effects 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 238000013459 approach Methods 0.000 description 3
- 125000004429 atom Chemical group 0.000 description 3
- 230000008901 benefit Effects 0.000 description 3
- 230000010261 cell growth Effects 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 238000004587 chromatography analysis Methods 0.000 description 3
- 238000004590 computer program Methods 0.000 description 3
- 229920001577 copolymer Polymers 0.000 description 3
- VEQSYQFANVTOGA-UHFFFAOYSA-N cyclobutane-1,1-dicarboxamide Chemical compound NC(=O)C1(C(N)=O)CCC1 VEQSYQFANVTOGA-UHFFFAOYSA-N 0.000 description 3
- 230000009089 cytolysis Effects 0.000 description 3
- 231100000433 cytotoxic Toxicity 0.000 description 3
- 230000001472 cytotoxic effect Effects 0.000 description 3
- 230000006378 damage Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 150000002019 disulfides Chemical class 0.000 description 3
- 238000001962 electrophoresis Methods 0.000 description 3
- 230000013595 glycosylation Effects 0.000 description 3
- 238000006206 glycosylation reaction Methods 0.000 description 3
- 229910052736 halogen Inorganic materials 0.000 description 3
- 150000002367 halogens Chemical class 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000001900 immune effect Effects 0.000 description 3
- 229940072221 immunoglobulins Drugs 0.000 description 3
- 238000000099 in vitro assay Methods 0.000 description 3
- 238000001802 infusion Methods 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- 238000004255 ion exchange chromatography Methods 0.000 description 3
- 125000000959 isobutyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])* 0.000 description 3
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 3
- 210000003734 kidney Anatomy 0.000 description 3
- 201000010982 kidney cancer Diseases 0.000 description 3
- 238000004949 mass spectrometry Methods 0.000 description 3
- 125000001570 methylene group Chemical group [H]C([H])([*:1])[*:2] 0.000 description 3
- 210000001616 monocyte Anatomy 0.000 description 3
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 3
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 3
- 230000000269 nucleophilic effect Effects 0.000 description 3
- 235000020824 obesity Nutrition 0.000 description 3
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 description 3
- 239000003208 petroleum Substances 0.000 description 3
- 239000003880 polar aprotic solvent Substances 0.000 description 3
- 238000003752 polymerase chain reaction Methods 0.000 description 3
- 229910000160 potassium phosphate Inorganic materials 0.000 description 3
- 235000011009 potassium phosphates Nutrition 0.000 description 3
- 230000000069 prophylactic effect Effects 0.000 description 3
- 238000000159 protein binding assay Methods 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 238000004007 reversed phase HPLC Methods 0.000 description 3
- 238000012216 screening Methods 0.000 description 3
- 238000010898 silica gel chromatography Methods 0.000 description 3
- 239000001632 sodium acetate Substances 0.000 description 3
- 235000017281 sodium acetate Nutrition 0.000 description 3
- 208000024891 symptom Diseases 0.000 description 3
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 description 3
- FPGGTKZVZWFYPV-UHFFFAOYSA-M tetrabutylammonium fluoride Chemical compound [F-].CCCC[N+](CCCC)(CCCC)CCCC FPGGTKZVZWFYPV-UHFFFAOYSA-M 0.000 description 3
- 230000001988 toxicity Effects 0.000 description 3
- 231100000419 toxicity Toxicity 0.000 description 3
- 238000011830 transgenic mouse model Methods 0.000 description 3
- 238000002054 transplantation Methods 0.000 description 3
- 230000004580 weight loss Effects 0.000 description 3
- AGGWFDNPHKLBBV-YUMQZZPRSA-N (2s)-2-[[(2s)-2-amino-3-methylbutanoyl]amino]-5-(carbamoylamino)pentanoic acid Chemical compound CC(C)[C@H](N)C(=O)N[C@H](C(O)=O)CCCNC(N)=O AGGWFDNPHKLBBV-YUMQZZPRSA-N 0.000 description 2
- TVRPDIKPMQUOSL-NSHDSACASA-N (2s)-4-phenylmethoxybutane-1,2-diol Chemical compound OC[C@@H](O)CCOCC1=CC=CC=C1 TVRPDIKPMQUOSL-NSHDSACASA-N 0.000 description 2
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 2
- VMOSNUJHBOYEEW-AWEZNQCLSA-N 1-[[(2S)-5-(carbamoylamino)-1-[4-(hydroxymethyl)anilino]-1-oxopentan-2-yl]carbamoyl]cyclobutane-1-carboxylic acid Chemical compound OCC1=CC=C(C=C1)NC([C@H](CCCNC(=O)N)NC(=O)C1(CCC1)C(=O)O)=O VMOSNUJHBOYEEW-AWEZNQCLSA-N 0.000 description 2
- SYSYDBHYJSCCEU-UHFFFAOYSA-N 1H-cyclopenta[b][1]benzofuran-2-carboxylic acid Chemical compound C1C(=CC=2OC3=C(C=21)C=CC=C3)C(=O)O SYSYDBHYJSCCEU-UHFFFAOYSA-N 0.000 description 2
- IZCHJUIDVIHHAI-UHFFFAOYSA-N 2,3,3a,4a-tetrahydro-1H-cyclopenta[b][1]benzofuran-2-carboxylic acid Chemical compound C1C(CC2OC3C(=C21)C=CC=C3)C(=O)O IZCHJUIDVIHHAI-UHFFFAOYSA-N 0.000 description 2
- ZFFMLCVRJBZUDZ-UHFFFAOYSA-N 2,3-dimethylbutane Chemical group CC(C)C(C)C ZFFMLCVRJBZUDZ-UHFFFAOYSA-N 0.000 description 2
- HZAXFHJVJLSVMW-UHFFFAOYSA-N 2-Aminoethan-1-ol Chemical compound NCCO HZAXFHJVJLSVMW-UHFFFAOYSA-N 0.000 description 2
- 125000000022 2-aminoethyl group Chemical group [H]C([*])([H])C([H])([H])N([H])[H] 0.000 description 2
- 125000004398 2-methyl-2-butyl group Chemical group CC(C)(CC)* 0.000 description 2
- 125000004918 2-methyl-2-pentyl group Chemical group CC(C)(CCC)* 0.000 description 2
- 125000004922 2-methyl-3-pentyl group Chemical group CC(C)C(CC)* 0.000 description 2
- 125000001494 2-propynyl group Chemical group [H]C#CC([H])([H])* 0.000 description 2
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 2
- PBVAJRFEEOIAGW-UHFFFAOYSA-N 3-[bis(2-carboxyethyl)phosphanyl]propanoic acid;hydrochloride Chemical compound Cl.OC(=O)CCP(CCC(O)=O)CCC(O)=O PBVAJRFEEOIAGW-UHFFFAOYSA-N 0.000 description 2
- 125000004917 3-methyl-2-butyl group Chemical group CC(C(C)*)C 0.000 description 2
- 125000004919 3-methyl-2-pentyl group Chemical group CC(C(C)*)CC 0.000 description 2
- 125000004920 4-methyl-2-pentyl group Chemical group CC(CC(C)*)C 0.000 description 2
- ROUFCTKIILEETD-UHFFFAOYSA-N 5-nitro-2-[(5-nitropyridin-2-yl)disulfanyl]pyridine Chemical compound N1=CC([N+](=O)[O-])=CC=C1SSC1=CC=C([N+]([O-])=O)C=N1 ROUFCTKIILEETD-UHFFFAOYSA-N 0.000 description 2
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical compound N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 2
- 230000003844 B-cell-activation Effects 0.000 description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 2
- 102000002086 C-type lectin-like Human genes 0.000 description 2
- 108050009406 C-type lectin-like Proteins 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 2
- 102000011727 Caspases Human genes 0.000 description 2
- 108010076667 Caspases Proteins 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- 241000254173 Coleoptera Species 0.000 description 2
- 241000699800 Cricetinae Species 0.000 description 2
- 241000699802 Cricetulus griseus Species 0.000 description 2
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 2
- 108020004414 DNA Proteins 0.000 description 2
- 229920002307 Dextran Polymers 0.000 description 2
- 241000588724 Escherichia coli Species 0.000 description 2
- 108010010803 Gelatin Proteins 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 206010053759 Growth retardation Diseases 0.000 description 2
- 229910004373 HOAc Inorganic materials 0.000 description 2
- 241000238631 Hexapoda Species 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 2
- 229930194542 Keto Natural products 0.000 description 2
- ONIBWKKTOPOVIA-BYPYZUCNSA-N L-Proline Chemical compound OC(=O)[C@@H]1CCCN1 ONIBWKKTOPOVIA-BYPYZUCNSA-N 0.000 description 2
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 2
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 241000406668 Loxodonta cyclotis Species 0.000 description 2
- BZLVMXJERCGZMT-UHFFFAOYSA-N Methyl tert-butyl ether Chemical compound COC(C)(C)C BZLVMXJERCGZMT-UHFFFAOYSA-N 0.000 description 2
- 241000699660 Mus musculus Species 0.000 description 2
- 101100327295 Mus musculus Cd22 gene Proteins 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- SECXISVLQFMRJM-UHFFFAOYSA-N N-Methylpyrrolidone Chemical compound CN1CCCC1=O SECXISVLQFMRJM-UHFFFAOYSA-N 0.000 description 2
- HDFGOPSGAURCEO-UHFFFAOYSA-N N-ethylmaleimide Chemical group CCN1C(=O)C=CC1=O HDFGOPSGAURCEO-UHFFFAOYSA-N 0.000 description 2
- 108091005461 Nucleic proteins Chemical group 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Natural products OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 2
- 239000004372 Polyvinyl alcohol Substances 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- 208000017414 Precursor T-cell acute lymphoblastic leukemia Diseases 0.000 description 2
- 241000288906 Primates Species 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- NBBJYMSMWIIQGU-UHFFFAOYSA-N Propionic aldehyde Chemical compound CCC=O NBBJYMSMWIIQGU-UHFFFAOYSA-N 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- KYQCOXFCLRTKLS-UHFFFAOYSA-N Pyrazine Chemical compound C1=CN=CC=N1 KYQCOXFCLRTKLS-UHFFFAOYSA-N 0.000 description 2
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 2
- KAESVJOAVNADME-UHFFFAOYSA-N Pyrrole Chemical compound C=1C=CNC=1 KAESVJOAVNADME-UHFFFAOYSA-N 0.000 description 2
- 241000700159 Rattus Species 0.000 description 2
- 208000015634 Rectal Neoplasms Diseases 0.000 description 2
- 241000283984 Rodentia Species 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 2
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 2
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical compound [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 description 2
- 229930006000 Sucrose Natural products 0.000 description 2
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- 241000251539 Vertebrata <Metazoa> Species 0.000 description 2
- HYSPJPGXSALJRR-DHIFEGFHSA-N [4-[[(2s)-5-(carbamoylamino)-2-[[(2s)-2-[6-(2,5-dioxopyrrol-1-yl)hexanoylamino]-3-methylbutanoyl]amino]pentanoyl]amino]phenyl]methyl (4-nitrophenyl) carbonate Chemical compound N([C@@H](C(C)C)C(=O)N[C@@H](CCCNC(N)=O)C(=O)NC=1C=CC(COC(=O)OC=2C=CC(=CC=2)[N+]([O-])=O)=CC=1)C(=O)CCCCCN1C(=O)C=CC1=O HYSPJPGXSALJRR-DHIFEGFHSA-N 0.000 description 2
- CHKFLBOLYREYDO-SHYZEUOFSA-N [[(2s,4r,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-4-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl] phosphono hydrogen phosphate Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)C[C@@H](COP(O)(=O)OP(O)(=O)OP(O)(O)=O)O1 CHKFLBOLYREYDO-SHYZEUOFSA-N 0.000 description 2
- 210000001015 abdomen Anatomy 0.000 description 2
- DHKHKXVYLBGOIT-UHFFFAOYSA-N acetaldehyde Diethyl Acetal Natural products CCOC(C)OCC DHKHKXVYLBGOIT-UHFFFAOYSA-N 0.000 description 2
- 150000001241 acetals Chemical class 0.000 description 2
- 230000009471 action Effects 0.000 description 2
- 125000002252 acyl group Chemical group 0.000 description 2
- 125000004423 acyloxy group Chemical group 0.000 description 2
- 210000000577 adipose tissue Anatomy 0.000 description 2
- 230000002776 aggregation Effects 0.000 description 2
- 238000004220 aggregation Methods 0.000 description 2
- 125000003342 alkenyl group Chemical group 0.000 description 2
- 125000003545 alkoxy group Chemical group 0.000 description 2
- 150000001408 amides Chemical class 0.000 description 2
- 238000010171 animal model Methods 0.000 description 2
- 230000001093 anti-cancer Effects 0.000 description 2
- 229940041181 antineoplastic drug Drugs 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 125000004104 aryloxy group Chemical group 0.000 description 2
- 235000009582 asparagine Nutrition 0.000 description 2
- 229960001230 asparagine Drugs 0.000 description 2
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 2
- AGEZXYOZHKGVCM-UHFFFAOYSA-N benzyl bromide Chemical compound BrCC1=CC=CC=C1 AGEZXYOZHKGVCM-UHFFFAOYSA-N 0.000 description 2
- 230000033228 biological regulation Effects 0.000 description 2
- 235000010290 biphenyl Nutrition 0.000 description 2
- 239000004305 biphenyl Substances 0.000 description 2
- LRHPLDYGYMQRHN-UHFFFAOYSA-N butyl alcohol Substances CCCCO LRHPLDYGYMQRHN-UHFFFAOYSA-N 0.000 description 2
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 125000004452 carbocyclyl group Chemical group 0.000 description 2
- 150000001720 carbohydrates Chemical class 0.000 description 2
- 235000014633 carbohydrates Nutrition 0.000 description 2
- 150000007942 carboxylates Chemical class 0.000 description 2
- YCIMNLLNPGFGHC-UHFFFAOYSA-N catechol Chemical compound OC1=CC=CC=C1O YCIMNLLNPGFGHC-UHFFFAOYSA-N 0.000 description 2
- 238000005341 cation exchange Methods 0.000 description 2
- 230000022534 cell killing Effects 0.000 description 2
- 238000003570 cell viability assay Methods 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 230000000973 chemotherapeutic effect Effects 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 238000003776 cleavage reaction Methods 0.000 description 2
- 238000010367 cloning Methods 0.000 description 2
- 238000002648 combination therapy Methods 0.000 description 2
- 230000009827 complement-dependent cellular cytotoxicity Effects 0.000 description 2
- 229940126142 compound 16 Drugs 0.000 description 2
- 239000000470 constituent Substances 0.000 description 2
- 230000008602 contraction Effects 0.000 description 2
- 238000007796 conventional method Methods 0.000 description 2
- 230000002596 correlated effect Effects 0.000 description 2
- 239000013058 crude material Substances 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- MFNYBOWJWGPXFM-UHFFFAOYSA-N cyclobutanecarboxamide Chemical compound NC(=O)C1CCC1 MFNYBOWJWGPXFM-UHFFFAOYSA-N 0.000 description 2
- TXWOGHSRPAYOML-UHFFFAOYSA-M cyclobutanecarboxylate Chemical compound [O-]C(=O)C1CCC1 TXWOGHSRPAYOML-UHFFFAOYSA-M 0.000 description 2
- 210000005220 cytoplasmic tail Anatomy 0.000 description 2
- 238000002784 cytotoxicity assay Methods 0.000 description 2
- 231100000263 cytotoxicity test Toxicity 0.000 description 2
- 230000002950 deficient Effects 0.000 description 2
- 239000003405 delayed action preparation Substances 0.000 description 2
- 238000001514 detection method Methods 0.000 description 2
- 239000003599 detergent Substances 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 230000018109 developmental process Effects 0.000 description 2
- 238000003745 diagnosis Methods 0.000 description 2
- JPNJEJSZSMXWSV-UHFFFAOYSA-N diethyl cyclobutane-1,1-dicarboxylate Chemical compound CCOC(=O)C1(C(=O)OCC)CCC1 JPNJEJSZSMXWSV-UHFFFAOYSA-N 0.000 description 2
- 239000000539 dimer Substances 0.000 description 2
- 230000003828 downregulation Effects 0.000 description 2
- 230000002708 enhancing effect Effects 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000013604 expression vector Substances 0.000 description 2
- 239000000706 filtrate Substances 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 230000004927 fusion Effects 0.000 description 2
- 206010017758 gastric cancer Diseases 0.000 description 2
- 239000008273 gelatin Substances 0.000 description 2
- 229920000159 gelatin Polymers 0.000 description 2
- 235000019322 gelatine Nutrition 0.000 description 2
- 235000011852 gelatine desserts Nutrition 0.000 description 2
- 210000003714 granulocyte Anatomy 0.000 description 2
- 239000001963 growth medium Substances 0.000 description 2
- 231100000001 growth retardation Toxicity 0.000 description 2
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 2
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 2
- ALBYIUDWACNRRB-UHFFFAOYSA-N hexanamide Chemical compound CCCCCC(N)=O ALBYIUDWACNRRB-UHFFFAOYSA-N 0.000 description 2
- 229920001519 homopolymer Polymers 0.000 description 2
- 210000004293 human mammary gland Anatomy 0.000 description 2
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 2
- 238000003384 imaging method Methods 0.000 description 2
- 102000027596 immune receptors Human genes 0.000 description 2
- 108091008915 immune receptors Proteins 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000008676 import Effects 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 230000006698 induction Effects 0.000 description 2
- 238000001155 isoelectric focusing Methods 0.000 description 2
- 125000000468 ketone group Chemical group 0.000 description 2
- 201000007270 liver cancer Diseases 0.000 description 2
- 208000014018 liver neoplasm Diseases 0.000 description 2
- 210000005265 lung cell Anatomy 0.000 description 2
- RLSSMJSEOOYNOY-UHFFFAOYSA-N m-cresol Chemical compound CC1=CC=CC(O)=C1 RLSSMJSEOOYNOY-UHFFFAOYSA-N 0.000 description 2
- FPYJFEHAWHCUMM-UHFFFAOYSA-N maleic anhydride Chemical compound O=C1OC(=O)C=C1 FPYJFEHAWHCUMM-UHFFFAOYSA-N 0.000 description 2
- 230000001404 mediated effect Effects 0.000 description 2
- TWXDDNPPQUTEOV-FVGYRXGTSA-N methamphetamine hydrochloride Chemical compound Cl.CN[C@@H](C)CC1=CC=CC=C1 TWXDDNPPQUTEOV-FVGYRXGTSA-N 0.000 description 2
- TVLFFKVMWDJCFG-UHFFFAOYSA-N methyl 2-bromo-2-methoxyacetate Chemical compound COC(Br)C(=O)OC TVLFFKVMWDJCFG-UHFFFAOYSA-N 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 125000002950 monocyclic group Chemical group 0.000 description 2
- DNIAPMSPPWPWGF-UHFFFAOYSA-N monopropylene glycol Natural products CC(O)CO DNIAPMSPPWPWGF-UHFFFAOYSA-N 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 125000001280 n-hexyl group Chemical group C(CCCCC)* 0.000 description 2
- 125000001624 naphthyl group Chemical group 0.000 description 2
- 230000007935 neutral effect Effects 0.000 description 2
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 description 2
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- 210000001672 ovary Anatomy 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- 239000007800 oxidant agent Substances 0.000 description 2
- 239000001301 oxygen Substances 0.000 description 2
- AQIXEPGDORPWBJ-UHFFFAOYSA-N pentan-3-ol Chemical compound CCC(O)CC AQIXEPGDORPWBJ-UHFFFAOYSA-N 0.000 description 2
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 2
- 230000002093 peripheral effect Effects 0.000 description 2
- 239000012071 phase Substances 0.000 description 2
- 229940068977 polysorbate 20 Drugs 0.000 description 2
- 229920002451 polyvinyl alcohol Polymers 0.000 description 2
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 2
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 2
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 2
- 239000002244 precipitate Substances 0.000 description 2
- 239000003755 preservative agent Substances 0.000 description 2
- 230000002265 prevention Effects 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 230000035755 proliferation Effects 0.000 description 2
- BDERNNFJNOPAEC-UHFFFAOYSA-N propan-1-ol Chemical compound CCCO BDERNNFJNOPAEC-UHFFFAOYSA-N 0.000 description 2
- QELSKZZBTMNZEB-UHFFFAOYSA-N propylparaben Chemical compound CCCOC(=O)C1=CC=C(O)C=C1 QELSKZZBTMNZEB-UHFFFAOYSA-N 0.000 description 2
- 235000019419 proteases Nutrition 0.000 description 2
- 108020001775 protein parts Proteins 0.000 description 2
- 230000005180 public health Effects 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 150000003254 radicals Chemical class 0.000 description 2
- 239000000376 reactant Substances 0.000 description 2
- 230000009257 reactivity Effects 0.000 description 2
- 206010038038 rectal cancer Diseases 0.000 description 2
- 201000001275 rectum cancer Diseases 0.000 description 2
- 238000010992 reflux Methods 0.000 description 2
- 239000011347 resin Substances 0.000 description 2
- 229920005989 resin Polymers 0.000 description 2
- GHMLBKRAJCXXBS-UHFFFAOYSA-N resorcinol Chemical compound OC1=CC=CC(O)=C1 GHMLBKRAJCXXBS-UHFFFAOYSA-N 0.000 description 2
- 230000007017 scission Effects 0.000 description 2
- 239000000741 silica gel Substances 0.000 description 2
- 229910002027 silica gel Inorganic materials 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- 206010041823 squamous cell carcinoma Diseases 0.000 description 2
- 239000007858 starting material Substances 0.000 description 2
- 201000011549 stomach cancer Diseases 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000001384 succinic acid Substances 0.000 description 2
- 239000005720 sucrose Substances 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 229910052717 sulfur Inorganic materials 0.000 description 2
- 238000002198 surface plasmon resonance spectroscopy Methods 0.000 description 2
- VZGDMQKNWNREIO-UHFFFAOYSA-N tetrachloromethane Chemical compound ClC(Cl)(Cl)Cl VZGDMQKNWNREIO-UHFFFAOYSA-N 0.000 description 2
- 231100001274 therapeutic index Toxicity 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 2
- 125000000430 tryptophan group Chemical group [H]N([H])C(C(=O)O*)C([H])([H])C1=C([H])N([H])C2=C([H])C([H])=C([H])C([H])=C12 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 229920003169 water-soluble polymer Polymers 0.000 description 2
- HDTRYLNUVZCQOY-UHFFFAOYSA-N α-D-glucopyranosyl-α-D-glucopyranoside Natural products OC1C(O)C(O)C(CO)OC1OC1C(O)C(O)C(O)C(CO)O1 HDTRYLNUVZCQOY-UHFFFAOYSA-N 0.000 description 1
- KJJITHAVZJBOHG-NSHDSACASA-N (2s)-2-amino-5-(carbamoylamino)-n-[4-(hydroxymethyl)phenyl]pentanamide Chemical compound NC(=O)NCCC[C@H](N)C(=O)NC1=CC=C(CO)C=C1 KJJITHAVZJBOHG-NSHDSACASA-N 0.000 description 1
- NBMSMZSRTIOFOK-SFHVURJKSA-N (2s)-5-(carbamoylamino)-2-(9h-fluoren-9-ylmethoxycarbonylamino)pentanoic acid Chemical compound C1=CC=C2C(COC(=O)N[C@@H](CCCNC(=O)N)C(O)=O)C3=CC=CC=C3C2=C1 NBMSMZSRTIOFOK-SFHVURJKSA-N 0.000 description 1
- GLCBVPTXBCWHQZ-JSGCOSHPSA-N (3s,6s)-3-methoxy-6-(2-phenylmethoxyethyl)-1,4-dioxan-2-one Chemical compound O1C(=O)[C@@H](OC)OC[C@@H]1CCOCC1=CC=CC=C1 GLCBVPTXBCWHQZ-JSGCOSHPSA-N 0.000 description 1
- AXKGIPZJYUNAIW-UHFFFAOYSA-N (4-aminophenyl)methanol Chemical compound NC1=CC=C(CO)C=C1 AXKGIPZJYUNAIW-UHFFFAOYSA-N 0.000 description 1
- QLDDWBLUYSHYKH-UHFFFAOYSA-N (4-methoxyphenyl) 3-phenyl-2,3,3a,8b-tetrahydro-1H-cyclopenta[b][1]benzofuran-2-carboxylate Chemical compound COC1=CC=C(C=C1)OC(=O)C1CC2C(OC3=C2C=CC=C3)C1C1=CC=CC=C1 QLDDWBLUYSHYKH-UHFFFAOYSA-N 0.000 description 1
- LOVPHSMOAVXQIH-UHFFFAOYSA-N (4-nitrophenyl) hydrogen carbonate Chemical compound OC(=O)OC1=CC=C([N+]([O-])=O)C=C1 LOVPHSMOAVXQIH-UHFFFAOYSA-N 0.000 description 1
- WNXJIVFYUVYPPR-UHFFFAOYSA-N 1,3-dioxolane Chemical compound C1COCO1 WNXJIVFYUVYPPR-UHFFFAOYSA-N 0.000 description 1
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 1
- ASOKPJOREAFHNY-UHFFFAOYSA-N 1-Hydroxybenzotriazole Chemical compound C1=CC=C2N(O)N=NC2=C1 ASOKPJOREAFHNY-UHFFFAOYSA-N 0.000 description 1
- CKWDTYIMADAGII-UHFFFAOYSA-N 1-[5-(2,5-dioxopyrrol-1-yl)pentylcarbamoyl]cyclobutane-1-carboxylic acid Chemical compound OC(=O)C1(CCC1)C(=O)NCCCCCN1C(=O)C=CC1=O CKWDTYIMADAGII-UHFFFAOYSA-N 0.000 description 1
- WJFKNYWRSNBZNX-UHFFFAOYSA-N 10H-phenothiazine Chemical compound C1=CC=C2NC3=CC=CC=C3SC2=C1 WJFKNYWRSNBZNX-UHFFFAOYSA-N 0.000 description 1
- HYZJCKYKOHLVJF-UHFFFAOYSA-N 1H-benzimidazole Chemical compound C1=CC=C2NC=NC2=C1 HYZJCKYKOHLVJF-UHFFFAOYSA-N 0.000 description 1
- NAGPPGSGKSYQTH-UHFFFAOYSA-N 1H-cyclopenta[b][1]benzofuran-2-carboxamide Chemical compound C1C(=CC=2OC3=C(C=21)C=CC=C3)C(=O)N NAGPPGSGKSYQTH-UHFFFAOYSA-N 0.000 description 1
- CBCDBHDPQWFGEP-UHFFFAOYSA-N 2,3,3a,8b-tetrahydro-1H-cyclopenta[b][1]benzofuran-2-carboxylic acid Chemical compound C1C(CC2OC3=C(C21)C=CC=C3)C(=O)O CBCDBHDPQWFGEP-UHFFFAOYSA-N 0.000 description 1
- HVAKORJPVBGPHR-UHFFFAOYSA-N 2,3,3a,8b-tetrahydro-1h-cyclopenta[b][1]benzofuran-2-carboxamide Chemical compound O1C2=CC=CC=C2C2C1CC(C(=O)N)C2 HVAKORJPVBGPHR-UHFFFAOYSA-N 0.000 description 1
- HMRTXQOBASRLAO-UHFFFAOYSA-N 2-(carbamoylamino)pentanamide Chemical compound CCCC(C(N)=O)NC(N)=O HMRTXQOBASRLAO-UHFFFAOYSA-N 0.000 description 1
- JKMHFZQWWAIEOD-UHFFFAOYSA-N 2-[4-(2-hydroxyethyl)piperazin-1-yl]ethanesulfonic acid Chemical compound OCC[NH+]1CCN(CCS([O-])(=O)=O)CC1 JKMHFZQWWAIEOD-UHFFFAOYSA-N 0.000 description 1
- 125000004493 2-methylbut-1-yl group Chemical group CC(C*)CC 0.000 description 1
- 101710111653 2-methylisocitrate lyase Proteins 0.000 description 1
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 description 1
- KIUMMUBSPKGMOY-UHFFFAOYSA-N 3,3'-Dithiobis(6-nitrobenzoic acid) Chemical compound C1=C([N+]([O-])=O)C(C(=O)O)=CC(SSC=2C=C(C(=CC=2)[N+]([O-])=O)C(O)=O)=C1 KIUMMUBSPKGMOY-UHFFFAOYSA-N 0.000 description 1
- 125000004921 3-methyl-3-pentyl group Chemical group CC(CC)(CC)* 0.000 description 1
- QLILRKBRWXALIE-UHFFFAOYSA-N 3-nitropyridine Chemical compound [O-][N+](=O)C1=CC=CN=C1 QLILRKBRWXALIE-UHFFFAOYSA-N 0.000 description 1
- LRDIEHDJWYRVPT-UHFFFAOYSA-N 4-amino-5-hydroxynaphthalene-1-sulfonic acid Chemical compound C1=CC(O)=C2C(N)=CC=C(S(O)(=O)=O)C2=C1 LRDIEHDJWYRVPT-UHFFFAOYSA-N 0.000 description 1
- ZAZNJJBYYFZFMO-SDVWDBJSSA-N 6-[[(2S,3R,6S)-6-(2-aminoethyl)-3-methoxy-1,4-dioxan-2-yl]oxy]-1,8b-dihydroxy-8-methoxy-3a-(4-methoxyphenyl)-3-phenyl-2,3-dihydro-1H-cyclopenta[b][1]benzofuran-2-carboxylic acid Chemical compound CO[C@H]1[C@@H](O[C@H](CO1)CCN)OC2=CC3=C(C(=C2)OC)C4(C(C(C(C4(O3)C5=CC=C(C=C5)OC)C6=CC=CC=C6)C(=O)O)O)O ZAZNJJBYYFZFMO-SDVWDBJSSA-N 0.000 description 1
- SLXKOJJOQWFEFD-UHFFFAOYSA-N 6-aminohexanoic acid Chemical compound NCCCCCC(O)=O SLXKOJJOQWFEFD-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- VTCAOLPBVDMJLD-UHFFFAOYSA-N 9h-fluoren-9-ylmethyl n-(2-aminoethyl)carbamate Chemical compound C1=CC=C2C(COC(=O)NCCN)C3=CC=CC=C3C2=C1 VTCAOLPBVDMJLD-UHFFFAOYSA-N 0.000 description 1
- OZAIFHULBGXAKX-VAWYXSNFSA-N AIBN Substances N#CC(C)(C)\N=N\C(C)(C)C#N OZAIFHULBGXAKX-VAWYXSNFSA-N 0.000 description 1
- 208000030507 AIDS Diseases 0.000 description 1
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- 208000010507 Adenocarcinoma of Lung Diseases 0.000 description 1
- 241001198713 Aglia Species 0.000 description 1
- OMNVYXHOSHNURL-WPRPVWTQSA-N Ala-Phe Chemical compound C[C@H](N)C(=O)N[C@H](C(O)=O)CC1=CC=CC=C1 OMNVYXHOSHNURL-WPRPVWTQSA-N 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 206010061424 Anal cancer Diseases 0.000 description 1
- 208000007860 Anus Neoplasms Diseases 0.000 description 1
- 241000473391 Archosargus rhomboidalis Species 0.000 description 1
- 208000023275 Autoimmune disease Diseases 0.000 description 1
- 230000024704 B cell apoptotic process Effects 0.000 description 1
- 101710187595 B-cell receptor CD22 Proteins 0.000 description 1
- 108010003455 BLyS receptor Proteins 0.000 description 1
- 206010005003 Bladder cancer Diseases 0.000 description 1
- 102100027052 Bone morphogenetic protein receptor type-1B Human genes 0.000 description 1
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- 102100026008 Breakpoint cluster region protein Human genes 0.000 description 1
- 101710140080 Brevican core protein Proteins 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 108090000342 C-Type Lectins Proteins 0.000 description 1
- 102000003930 C-Type Lectins Human genes 0.000 description 1
- WQYFZCIDZLSKNM-UONOGXRCSA-N CO[C@H]1CO[C@H](CO1)CCOCC2=CC=CC=C2 Chemical compound CO[C@H]1CO[C@H](CO1)CCOCC2=CC=CC=C2 WQYFZCIDZLSKNM-UONOGXRCSA-N 0.000 description 1
- JETHDVDRKKLOOH-AWEZNQCLSA-N C[C@@H](CCCNC(=O)N)NC(=O)OCC1C2=CC=CC=C2C3=CC=CC=C13 Chemical compound C[C@@H](CCCNC(=O)N)NC(=O)OCC1C2=CC=CC=C2C3=CC=CC=C13 JETHDVDRKKLOOH-AWEZNQCLSA-N 0.000 description 1
- OYPRJOBELJOOCE-UHFFFAOYSA-N Calcium Chemical compound [Ca] OYPRJOBELJOOCE-UHFFFAOYSA-N 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 241000282472 Canis lupus familiaris Species 0.000 description 1
- BVKZGUZCCUSVTD-UHFFFAOYSA-L Carbonate Chemical compound [O-]C([O-])=O BVKZGUZCCUSVTD-UHFFFAOYSA-L 0.000 description 1
- 229920002134 Carboxymethyl cellulose Polymers 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 238000003734 CellTiter-Glo Luminescent Cell Viability Assay Methods 0.000 description 1
- 102000006574 Chemokine CXCL13 Human genes 0.000 description 1
- 108010008955 Chemokine CXCL13 Proteins 0.000 description 1
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 1
- 241000282552 Chlorocebus aethiops Species 0.000 description 1
- 108010023736 Chondroitinases and Chondroitin Lyases Proteins 0.000 description 1
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 206010009944 Colon cancer Diseases 0.000 description 1
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 1
- 108091035707 Consensus sequence Proteins 0.000 description 1
- FBPFZTCFMRRESA-FSIIMWSLSA-N D-Glucitol Natural products OC[C@H](O)[C@H](O)[C@@H](O)[C@H](O)CO FBPFZTCFMRRESA-FSIIMWSLSA-N 0.000 description 1
- IGXWBGJHJZYPQS-SSDOTTSWSA-N D-Luciferin Chemical compound OC(=O)[C@H]1CSC(C=2SC3=CC=C(O)C=C3N=2)=N1 IGXWBGJHJZYPQS-SSDOTTSWSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- WQZGKKKJIJFFOK-QTVWNMPRSA-N D-mannopyranose Chemical compound OC[C@H]1OC(O)[C@@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-QTVWNMPRSA-N 0.000 description 1
- CYCGRDQQIOGCKX-UHFFFAOYSA-N Dehydro-luciferin Natural products OC(=O)C1=CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 CYCGRDQQIOGCKX-UHFFFAOYSA-N 0.000 description 1
- OKKJLVBELUTLKV-MZCSYVLQSA-N Deuterated methanol Chemical compound [2H]OC([2H])([2H])[2H] OKKJLVBELUTLKV-MZCSYVLQSA-N 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 102100024746 Dihydrofolate reductase Human genes 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 238000012286 ELISA Assay Methods 0.000 description 1
- 206010014733 Endometrial cancer Diseases 0.000 description 1
- 206010014759 Endometrial neoplasm Diseases 0.000 description 1
- 108010059378 Endopeptidases Proteins 0.000 description 1
- 102000005593 Endopeptidases Human genes 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000283086 Equidae Species 0.000 description 1
- 206010073306 Exposure to radiation Diseases 0.000 description 1
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 1
- 238000011771 FVB mouse Methods 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108090000331 Firefly luciferases Proteins 0.000 description 1
- BJGNCJDXODQBOB-UHFFFAOYSA-N Fivefly Luciferin Natural products OC(=O)C1CSC(C=2SC3=CC(O)=CC=C3N=2)=N1 BJGNCJDXODQBOB-UHFFFAOYSA-N 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- 102000016970 Follistatin Human genes 0.000 description 1
- 108010014612 Follistatin Proteins 0.000 description 1
- 241000233866 Fungi Species 0.000 description 1
- 206010017993 Gastrointestinal neoplasms Diseases 0.000 description 1
- 102000034615 Glial cell line-derived neurotrophic factor Human genes 0.000 description 1
- 108091010837 Glial cell line-derived neurotrophic factor Proteins 0.000 description 1
- 102000006395 Globulins Human genes 0.000 description 1
- 108010044091 Globulins Proteins 0.000 description 1
- 208000017891 HER2 positive breast carcinoma Diseases 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 239000012981 Hank's balanced salt solution Substances 0.000 description 1
- 102100028999 High mobility group protein HMGI-C Human genes 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000021519 Hodgkin lymphoma Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 241001272567 Hominoidea Species 0.000 description 1
- 101000933320 Homo sapiens Breakpoint cluster region protein Proteins 0.000 description 1
- 101000731086 Homo sapiens Brevican core protein Proteins 0.000 description 1
- 101000912622 Homo sapiens C-type lectin domain family 12 member A Proteins 0.000 description 1
- 101100496086 Homo sapiens CLEC12A gene Proteins 0.000 description 1
- 101000932213 Homo sapiens Dipeptidase 1 Proteins 0.000 description 1
- 101000935587 Homo sapiens Flavin reductase (NADPH) Proteins 0.000 description 1
- 101000986379 Homo sapiens High mobility group protein HMGI-C Proteins 0.000 description 1
- 101001041117 Homo sapiens Hyaluronidase PH-20 Proteins 0.000 description 1
- 101001044893 Homo sapiens Interleukin-20 receptor subunit alpha Proteins 0.000 description 1
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 1
- 101000917826 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor II-a Proteins 0.000 description 1
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 1
- 101000606090 Homo sapiens Tyrosinase Proteins 0.000 description 1
- 108010003272 Hyaluronate lyase Proteins 0.000 description 1
- 102000001974 Hyaluronidases Human genes 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 108010073807 IgG Receptors Proteins 0.000 description 1
- 102000009490 IgG Receptors Human genes 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 102000018071 Immunoglobulin Fc Fragments Human genes 0.000 description 1
- 108010091135 Immunoglobulin Fc Fragments Proteins 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- SIKJAQJRHWYJAI-UHFFFAOYSA-N Indole Chemical compound C1=CC=C2NC=CC2=C1 SIKJAQJRHWYJAI-UHFFFAOYSA-N 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 238000012695 Interfacial polymerization Methods 0.000 description 1
- 102100022706 Interleukin-20 receptor subunit alpha Human genes 0.000 description 1
- OWIKHYCFFJSOEH-UHFFFAOYSA-N Isocyanic acid Chemical compound N=C=O OWIKHYCFFJSOEH-UHFFFAOYSA-N 0.000 description 1
- VHJLVAABSRFDPM-IMJSIDKUSA-N L-1,4-dithiothreitol Chemical compound SC[C@H](O)[C@@H](O)CS VHJLVAABSRFDPM-IMJSIDKUSA-N 0.000 description 1
- FADYJNXDPBKVCA-UHFFFAOYSA-N L-Phenylalanyl-L-lysin Natural products NCCCCC(C(O)=O)NC(=O)C(N)CC1=CC=CC=C1 FADYJNXDPBKVCA-UHFFFAOYSA-N 0.000 description 1
- LEVWYRKDKASIDU-IMJSIDKUSA-N L-cystine Chemical compound [O-]C(=O)[C@@H]([NH3+])CSSC[C@H]([NH3+])C([O-])=O LEVWYRKDKASIDU-IMJSIDKUSA-N 0.000 description 1
- 229930182816 L-glutamine Natural products 0.000 description 1
- 125000002066 L-histidyl group Chemical group [H]N1C([H])=NC(C([H])([H])[C@](C(=O)[*])([H])N([H])[H])=C1[H] 0.000 description 1
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 1
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 1
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 1
- 108090001090 Lectins Proteins 0.000 description 1
- 102000004856 Lectins Human genes 0.000 description 1
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 1
- 101710174256 Leucine-rich repeat-containing G-protein coupled receptor 5 Proteins 0.000 description 1
- 206010024305 Leukaemia monocytic Diseases 0.000 description 1
- 206010024612 Lipoma Diseases 0.000 description 1
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 1
- 102100029204 Low affinity immunoglobulin gamma Fc region receptor II-a Human genes 0.000 description 1
- DDWFXDSYGUXRAY-UHFFFAOYSA-N Luciferin Natural products CCc1c(C)c(CC2NC(=O)C(=C2C=C)C)[nH]c1Cc3[nH]c4C(=C5/NC(CC(=O)O)C(C)C5CC(=O)O)CC(=O)c4c3C DDWFXDSYGUXRAY-UHFFFAOYSA-N 0.000 description 1
- 206010058467 Lung neoplasm malignant Diseases 0.000 description 1
- 208000028018 Lymphocytic leukaemia Diseases 0.000 description 1
- 239000004907 Macro-emulsion Substances 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 238000003820 Medium-pressure liquid chromatography Methods 0.000 description 1
- 102000003939 Membrane transport proteins Human genes 0.000 description 1
- 108090000301 Membrane transport proteins Proteins 0.000 description 1
- 102000003735 Mesothelin Human genes 0.000 description 1
- 108090000015 Mesothelin Proteins 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 239000012359 Methanesulfonyl chloride Substances 0.000 description 1
- QRMHDGWGLNLHMN-UHFFFAOYSA-N Methyl methoxyacetate Chemical compound COCC(=O)OC QRMHDGWGLNLHMN-UHFFFAOYSA-N 0.000 description 1
- 102000008109 Mixed Function Oxygenases Human genes 0.000 description 1
- 108010074633 Mixed Function Oxygenases Proteins 0.000 description 1
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 1
- QPCDCPDFJACHGM-UHFFFAOYSA-N N,N-bis{2-[bis(carboxymethyl)amino]ethyl}glycine Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(=O)O)CCN(CC(O)=O)CC(O)=O QPCDCPDFJACHGM-UHFFFAOYSA-N 0.000 description 1
- DXFQZCVBYBLEPO-UHFFFAOYSA-N N-[5-(2,5-dioxopyrrol-1-yl)pentylcarbamoyl]cyclobutanecarboxamide Chemical compound C1(CCC1)C(=O)NC(NCCCCCN1C(C=CC1=O)=O)=O DXFQZCVBYBLEPO-UHFFFAOYSA-N 0.000 description 1
- 102100031688 N-acetylgalactosamine-6-sulfatase Human genes 0.000 description 1
- 229910017917 NH4 Cl Inorganic materials 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 241000238413 Octopus Species 0.000 description 1
- 108020005187 Oligonucleotide Probes Proteins 0.000 description 1
- 240000007594 Oryza sativa Species 0.000 description 1
- 235000007164 Oryza sativa Nutrition 0.000 description 1
- 101710160107 Outer membrane protein A Proteins 0.000 description 1
- 206010033128 Ovarian cancer Diseases 0.000 description 1
- 206010061535 Ovarian neoplasm Diseases 0.000 description 1
- 102000004316 Oxidoreductases Human genes 0.000 description 1
- 108090000854 Oxidoreductases Proteins 0.000 description 1
- 241000609499 Palicourea Species 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000002471 Penile Neoplasms Diseases 0.000 description 1
- 206010034299 Penile cancer Diseases 0.000 description 1
- 102000000447 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Human genes 0.000 description 1
- 108010055817 Peptide-N4-(N-acetyl-beta-glucosaminyl) Asparagine Amidase Proteins 0.000 description 1
- 108010030544 Peptidyl-Lys metalloendopeptidase Proteins 0.000 description 1
- PCNDJXKNXGMECE-UHFFFAOYSA-N Phenazine Natural products C1=CC=CC2=NC3=CC=CC=C3N=C21 PCNDJXKNXGMECE-UHFFFAOYSA-N 0.000 description 1
- 239000004793 Polystyrene Substances 0.000 description 1
- 208000008691 Precursor B-Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 1
- 101710120463 Prostate stem cell antigen Proteins 0.000 description 1
- 229940123573 Protein synthesis inhibitor Drugs 0.000 description 1
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical compound C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 235000001537 Ribes X gardonianum Nutrition 0.000 description 1
- 235000001535 Ribes X utile Nutrition 0.000 description 1
- 235000016919 Ribes petraeum Nutrition 0.000 description 1
- 244000281247 Ribes rubrum Species 0.000 description 1
- 235000002355 Ribes spicatum Nutrition 0.000 description 1
- 239000012891 Ringer solution Substances 0.000 description 1
- 229920005654 Sephadex Polymers 0.000 description 1
- 239000012507 Sephadex™ Substances 0.000 description 1
- 108010071390 Serum Albumin Proteins 0.000 description 1
- 102000007562 Serum Albumin Human genes 0.000 description 1
- 108010029157 Sialic Acid Binding Ig-like Lectin 2 Proteins 0.000 description 1
- XUIMIQQOPSSXEZ-UHFFFAOYSA-N Silicon Chemical compound [Si] XUIMIQQOPSSXEZ-UHFFFAOYSA-N 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 241000256248 Spodoptera Species 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 210000001744 T-lymphocyte Anatomy 0.000 description 1
- 239000012317 TBTU Substances 0.000 description 1
- 208000024770 Thyroid neoplasm Diseases 0.000 description 1
- HDTRYLNUVZCQOY-WSWWMNSNSA-N Trehalose Natural products O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-WSWWMNSNSA-N 0.000 description 1
- 108010051765 Type I Bone Morphogenetic Protein Receptors Proteins 0.000 description 1
- 208000025865 Ulcer Diseases 0.000 description 1
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 description 1
- 208000002495 Uterine Neoplasms Diseases 0.000 description 1
- 101150117115 V gene Proteins 0.000 description 1
- 238000012452 Xenomouse strains Methods 0.000 description 1
- SKUQSGHOPITFNA-UHFFFAOYSA-N [N+](=O)([O-])S(=S)(O)C#N Chemical compound [N+](=O)([O-])S(=S)(O)C#N SKUQSGHOPITFNA-UHFFFAOYSA-N 0.000 description 1
- SORGEQQSQGNZFI-UHFFFAOYSA-N [azido(phenoxy)phosphoryl]oxybenzene Chemical compound C=1C=CC=CC=1OP(=O)(N=[N+]=[N-])OC1=CC=CC=C1 SORGEQQSQGNZFI-UHFFFAOYSA-N 0.000 description 1
- CLZISMQKJZCZDN-UHFFFAOYSA-N [benzotriazol-1-yloxy(dimethylamino)methylidene]-dimethylazanium Chemical compound C1=CC=C2N(OC(N(C)C)=[N+](C)C)N=NC2=C1 CLZISMQKJZCZDN-UHFFFAOYSA-N 0.000 description 1
- 239000008351 acetate buffer Substances 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 239000002671 adjuvant Substances 0.000 description 1
- 239000003463 adsorbent Substances 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 239000003570 air Substances 0.000 description 1
- 108010011559 alanylphenylalanine Proteins 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 125000000304 alkynyl group Chemical group 0.000 description 1
- HDTRYLNUVZCQOY-LIZSDCNHSA-N alpha,alpha-trehalose Chemical compound O[C@@H]1[C@@H](O)[C@H](O)[C@@H](CO)O[C@@H]1O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 HDTRYLNUVZCQOY-LIZSDCNHSA-N 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 1
- 239000012080 ambient air Substances 0.000 description 1
- 229960002684 aminocaproic acid Drugs 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 150000008064 anhydrides Chemical class 0.000 description 1
- XLJMAIOERFSOGZ-UHFFFAOYSA-N anhydrous cyanic acid Natural products OC#N XLJMAIOERFSOGZ-UHFFFAOYSA-N 0.000 description 1
- 239000003242 anti bacterial agent Substances 0.000 description 1
- 230000000844 anti-bacterial effect Effects 0.000 description 1
- 230000003302 anti-idiotype Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 229940125644 antibody drug Drugs 0.000 description 1
- 238000011230 antibody-based therapy Methods 0.000 description 1
- 230000005888 antibody-dependent cellular phagocytosis Effects 0.000 description 1
- 201000011165 anus cancer Diseases 0.000 description 1
- 239000008346 aqueous phase Substances 0.000 description 1
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- 230000005784 autoimmunity Effects 0.000 description 1
- NCEFRBSXBILZPP-UHFFFAOYSA-M azanium;potassium;sulfate Chemical compound [NH4+].[K+].[O-]S([O-])(=O)=O NCEFRBSXBILZPP-UHFFFAOYSA-M 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000003385 bacteriostatic effect Effects 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229960000686 benzalkonium chloride Drugs 0.000 description 1
- UREZNYTWGJKWBI-UHFFFAOYSA-M benzethonium chloride Chemical compound [Cl-].C1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 UREZNYTWGJKWBI-UHFFFAOYSA-M 0.000 description 1
- 229960001950 benzethonium chloride Drugs 0.000 description 1
- CADWTSSKOVRVJC-UHFFFAOYSA-N benzyl(dimethyl)azanium;chloride Chemical compound [Cl-].C[NH+](C)CC1=CC=CC=C1 CADWTSSKOVRVJC-UHFFFAOYSA-N 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- SQVRNKJHWKZAKO-UHFFFAOYSA-N beta-N-Acetyl-D-neuraminic acid Natural products CC(=O)NC1C(O)CC(O)(C(O)=O)OC1C(O)C(O)CO SQVRNKJHWKZAKO-UHFFFAOYSA-N 0.000 description 1
- GNTFBMAGLFYMMZ-UHFFFAOYSA-N bicyclo[3.2.2]nonane Chemical compound C1CC2CCC1CCC2 GNTFBMAGLFYMMZ-UHFFFAOYSA-N 0.000 description 1
- 230000001588 bifunctional effect Effects 0.000 description 1
- 238000013357 binding ELISA Methods 0.000 description 1
- 230000005540 biological transmission Effects 0.000 description 1
- 230000002051 biphasic effect Effects 0.000 description 1
- SIPUZPBQZHNSDW-UHFFFAOYSA-N bis(2-methylpropyl)aluminum Chemical compound CC(C)C[Al]CC(C)C SIPUZPBQZHNSDW-UHFFFAOYSA-N 0.000 description 1
- ACBQROXDOHKANW-UHFFFAOYSA-N bis(4-nitrophenyl) carbonate Chemical compound C1=CC([N+](=O)[O-])=CC=C1OC(=O)OC1=CC=C([N+]([O-])=O)C=C1 ACBQROXDOHKANW-UHFFFAOYSA-N 0.000 description 1
- HUTDDBSSHVOYJR-UHFFFAOYSA-H bis[(2-oxo-1,3,2$l^{5},4$l^{2}-dioxaphosphaplumbetan-2-yl)oxy]lead Chemical compound [Pb+2].[Pb+2].[Pb+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O HUTDDBSSHVOYJR-UHFFFAOYSA-H 0.000 description 1
- 210000002459 blastocyst Anatomy 0.000 description 1
- 201000000053 blastoma Diseases 0.000 description 1
- 210000001109 blastomere Anatomy 0.000 description 1
- 230000017531 blood circulation Effects 0.000 description 1
- 229910021538 borax Inorganic materials 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 210000000481 breast Anatomy 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- ZTQSAGDEMFDKMZ-UHFFFAOYSA-N butyric aldehyde Natural products CCCC=O ZTQSAGDEMFDKMZ-UHFFFAOYSA-N 0.000 description 1
- 239000011575 calcium Substances 0.000 description 1
- 229910052791 calcium Inorganic materials 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 238000005251 capillar electrophoresis Methods 0.000 description 1
- 239000002041 carbon nanotube Substances 0.000 description 1
- 229910021393 carbon nanotube Inorganic materials 0.000 description 1
- 239000001768 carboxy methyl cellulose Substances 0.000 description 1
- 235000010948 carboxy methyl cellulose Nutrition 0.000 description 1
- 239000008112 carboxymethyl-cellulose Substances 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 230000021164 cell adhesion Effects 0.000 description 1
- 230000011712 cell development Effects 0.000 description 1
- 230000024245 cell differentiation Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000023549 cell-cell signaling Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000005119 centrifugation Methods 0.000 description 1
- 239000002738 chelating agent Substances 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 150000001805 chlorine compounds Chemical class 0.000 description 1
- 238000011098 chromatofocusing Methods 0.000 description 1
- 230000004186 co-expression Effects 0.000 description 1
- 238000005354 coacervation Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 208000029742 colonic neoplasm Diseases 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 230000024203 complement activation Effects 0.000 description 1
- 229940125810 compound 20 Drugs 0.000 description 1
- 239000012141 concentrate Substances 0.000 description 1
- 238000011109 contamination Methods 0.000 description 1
- 229910000365 copper sulfate Inorganic materials 0.000 description 1
- ARUVKPQLZAKDPS-UHFFFAOYSA-L copper(II) sulfate Chemical compound [Cu+2].[O-][S+2]([O-])([O-])[O-] ARUVKPQLZAKDPS-UHFFFAOYSA-L 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 210000004748 cultured cell Anatomy 0.000 description 1
- 238000012258 culturing Methods 0.000 description 1
- 125000004093 cyano group Chemical group *C#N 0.000 description 1
- CCQPAEQGAVNNIA-UHFFFAOYSA-N cyclobutane-1,1-dicarboxylic acid Chemical compound OC(=O)C1(C(O)=O)CCC1 CCQPAEQGAVNNIA-UHFFFAOYSA-N 0.000 description 1
- TXWOGHSRPAYOML-UHFFFAOYSA-N cyclobutanecarboxylic acid Chemical compound OC(=O)C1CCC1 TXWOGHSRPAYOML-UHFFFAOYSA-N 0.000 description 1
- 125000000582 cycloheptyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- NZNMSOFKMUBTKW-UHFFFAOYSA-N cyclohexanecarboxylic acid Chemical compound OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 1
- HPXRVTGHNJAIIH-UHFFFAOYSA-N cyclohexanol Chemical compound OC1CCCCC1 HPXRVTGHNJAIIH-UHFFFAOYSA-N 0.000 description 1
- UKJLNMAFNRKWGR-UHFFFAOYSA-N cyclohexatrienamine Chemical group NC1=CC=C=C[CH]1 UKJLNMAFNRKWGR-UHFFFAOYSA-N 0.000 description 1
- 125000006547 cyclononyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000000640 cyclooctyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])C1([H])[H] 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- UFULAYFCSOUIOV-UHFFFAOYSA-N cysteamine Chemical compound NCCS UFULAYFCSOUIOV-UHFFFAOYSA-N 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 230000001934 delay Effects 0.000 description 1
- 230000002074 deregulated effect Effects 0.000 description 1
- 238000001212 derivatisation Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- UQLDLKMNUJERMK-UHFFFAOYSA-L di(octadecanoyloxy)lead Chemical compound [Pb+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O UQLDLKMNUJERMK-UHFFFAOYSA-L 0.000 description 1
- JGFBRKRYDCGYKD-UHFFFAOYSA-N dibutyl(oxo)tin Chemical compound CCCC[Sn](=O)CCCC JGFBRKRYDCGYKD-UHFFFAOYSA-N 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 108020001096 dihydrofolate reductase Proteins 0.000 description 1
- KZNICNPSHKQLFF-UHFFFAOYSA-N dihydromaleimide Natural products O=C1CCC(=O)N1 KZNICNPSHKQLFF-UHFFFAOYSA-N 0.000 description 1
- 238000007865 diluting Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 229910001873 dinitrogen Inorganic materials 0.000 description 1
- 150000002016 disaccharides Chemical class 0.000 description 1
- 230000009266 disease activity Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- 239000002270 dispersing agent Substances 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000012377 drug delivery Methods 0.000 description 1
- 238000000132 electrospray ionisation Methods 0.000 description 1
- 239000003480 eluent Substances 0.000 description 1
- 201000008184 embryoma Diseases 0.000 description 1
- 230000012202 endocytosis Effects 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 210000000981 epithelium Anatomy 0.000 description 1
- 210000003013 erythroid precursor cell Anatomy 0.000 description 1
- DUYAAUVXQSMXQP-UHFFFAOYSA-N ethanethioic S-acid Chemical compound CC(S)=O DUYAAUVXQSMXQP-UHFFFAOYSA-N 0.000 description 1
- 125000005678 ethenylene group Chemical group [H]C([*:1])=C([H])[*:2] 0.000 description 1
- 125000005677 ethinylene group Chemical group [*:2]C#C[*:1] 0.000 description 1
- OFJLSOXXIMLDDL-UHFFFAOYSA-N ethyl (4-nitrophenyl) carbonate Chemical compound CCOC(=O)OC1=CC=C([N+]([O-])=O)C=C1 OFJLSOXXIMLDDL-UHFFFAOYSA-N 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 210000003527 eukaryotic cell Anatomy 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 210000003754 fetus Anatomy 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 239000011737 fluorine Substances 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 230000002538 fungal effect Effects 0.000 description 1
- 238000002523 gelfiltration Methods 0.000 description 1
- 210000004602 germ cell Anatomy 0.000 description 1
- 230000000762 glandular Effects 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 230000002518 glial effect Effects 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- JAXFJECJQZDFJS-XHEPKHHKSA-N gtpl8555 Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)N[C@H](B1O[C@@]2(C)[C@H]3C[C@H](C3(C)C)C[C@H]2O1)CCC1=CC=C(F)C=C1 JAXFJECJQZDFJS-XHEPKHHKSA-N 0.000 description 1
- 229940093915 gynecological organic acid Drugs 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 201000010536 head and neck cancer Diseases 0.000 description 1
- 208000014829 head and neck neoplasm Diseases 0.000 description 1
- 208000014951 hematologic disease Diseases 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 229940022353 herceptin Drugs 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 238000005734 heterodimerization reaction Methods 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 230000004727 humoral immunity Effects 0.000 description 1
- 229960002773 hyaluronidase Drugs 0.000 description 1
- 150000007857 hydrazones Chemical class 0.000 description 1
- 150000002430 hydrocarbons Chemical class 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- ZMZDMBWJUHKJPS-UHFFFAOYSA-N hydrogen thiocyanate Natural products SC#N ZMZDMBWJUHKJPS-UHFFFAOYSA-N 0.000 description 1
- 229920001477 hydrophilic polymer Polymers 0.000 description 1
- 125000001165 hydrophobic group Chemical group 0.000 description 1
- 229920001600 hydrophobic polymer Polymers 0.000 description 1
- WGCNASOHLSPBMP-UHFFFAOYSA-N hydroxyacetaldehyde Natural products OCC=O WGCNASOHLSPBMP-UHFFFAOYSA-N 0.000 description 1
- TUJKJAMUKRIRHC-UHFFFAOYSA-N hydroxyl Chemical compound [OH] TUJKJAMUKRIRHC-UHFFFAOYSA-N 0.000 description 1
- 229920003063 hydroxymethyl cellulose Polymers 0.000 description 1
- 229940031574 hydroxymethyl cellulose Drugs 0.000 description 1
- 229940044700 hylenex Drugs 0.000 description 1
- 230000003463 hyperproliferative effect Effects 0.000 description 1
- 230000002267 hypothalamic effect Effects 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 210000000987 immune system Anatomy 0.000 description 1
- 230000002163 immunogen Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000004615 ingredient Substances 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 108091008042 inhibitory receptors Proteins 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000007154 intracellular accumulation Effects 0.000 description 1
- 238000007918 intramuscular administration Methods 0.000 description 1
- 230000002601 intratumoral effect Effects 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 238000002955 isolation Methods 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- GRHBQAYDJPGGLF-UHFFFAOYSA-N isothiocyanic acid Chemical compound N=C=S GRHBQAYDJPGGLF-UHFFFAOYSA-N 0.000 description 1
- 239000002523 lectin Substances 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 210000005229 liver cell Anatomy 0.000 description 1
- 244000144972 livestock Species 0.000 description 1
- 238000003819 low-pressure liquid chromatography Methods 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 201000005249 lung adenocarcinoma Diseases 0.000 description 1
- 201000005202 lung cancer Diseases 0.000 description 1
- 208000020816 lung neoplasm Diseases 0.000 description 1
- 208000003747 lymphoid leukemia Diseases 0.000 description 1
- 208000019420 lymphoid neoplasm Diseases 0.000 description 1
- 239000012931 lyophilized formulation Substances 0.000 description 1
- 125000003588 lysine group Chemical group [H]N([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 210000002540 macrophage Anatomy 0.000 description 1
- 230000036210 malignancy Effects 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 210000005075 mammary gland Anatomy 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 230000008774 maternal effect Effects 0.000 description 1
- 108010082117 matrigel Proteins 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 230000009061 membrane transport Effects 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 1
- 229930182817 methionine Natural products 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- HYLOONIBWUNKDH-PXIJUOARSA-N methyl (1r,2r,3s,3ar,8bs)-1,6,8b-trihydroxy-8-methoxy-3a-(4-methoxyphenyl)-3-phenyl-2,3-dihydro-1h-cyclopenta[b][1]benzofuran-2-carboxylate Chemical compound C1([C@H]2[C@@]3(OC4=C(C(=CC(O)=C4)OC)[C@]3(O)[C@H](O)[C@@H]2C(=O)OC)C=2C=CC(OC)=CC=2)=CC=CC=C1 HYLOONIBWUNKDH-PXIJUOARSA-N 0.000 description 1
- 239000004292 methyl p-hydroxybenzoate Substances 0.000 description 1
- 235000010270 methyl p-hydroxybenzoate Nutrition 0.000 description 1
- 229960002216 methylparaben Drugs 0.000 description 1
- 239000004530 micro-emulsion Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 244000005700 microbiome Species 0.000 description 1
- 239000004005 microsphere Substances 0.000 description 1
- 230000005012 migration Effects 0.000 description 1
- 238000013508 migration Methods 0.000 description 1
- 239000003607 modifier Substances 0.000 description 1
- 125000001620 monocyclic carbocycle group Chemical group 0.000 description 1
- 201000006894 monocytic leukemia Diseases 0.000 description 1
- 150000002772 monosaccharides Chemical class 0.000 description 1
- 210000003205 muscle Anatomy 0.000 description 1
- 208000025113 myeloid leukemia Diseases 0.000 description 1
- OWIUPIRUAQMTTK-UHFFFAOYSA-M n-aminocarbamate Chemical compound NNC([O-])=O OWIUPIRUAQMTTK-UHFFFAOYSA-M 0.000 description 1
- 239000002088 nanocapsule Substances 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 210000000822 natural killer cell Anatomy 0.000 description 1
- 108010068617 neonatal Fc receptor Proteins 0.000 description 1
- 230000001537 neural effect Effects 0.000 description 1
- 230000004766 neurogenesis Effects 0.000 description 1
- 125000004433 nitrogen atom Chemical group N* 0.000 description 1
- 210000004967 non-hematopoietic stem cell Anatomy 0.000 description 1
- ZCYXXKJEDCHMGH-UHFFFAOYSA-N nonane Chemical compound CCCC[CH]CCCC ZCYXXKJEDCHMGH-UHFFFAOYSA-N 0.000 description 1
- 239000002736 nonionic surfactant Substances 0.000 description 1
- UMRZSTCPUPJPOJ-KNVOCYPGSA-N norbornane Chemical compound C1C[C@H]2CC[C@@H]1C2 UMRZSTCPUPJPOJ-KNVOCYPGSA-N 0.000 description 1
- BKIMMITUMNQMOS-UHFFFAOYSA-N normal nonane Natural products CCCCCCCCC BKIMMITUMNQMOS-UHFFFAOYSA-N 0.000 description 1
- 238000003953 normal phase liquid chromatography Methods 0.000 description 1
- 239000012038 nucleophile Substances 0.000 description 1
- 239000002751 oligonucleotide probe Substances 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 150000007524 organic acids Chemical class 0.000 description 1
- 235000005985 organic acids Nutrition 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 150000002923 oximes Chemical class 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- LXCFILQKKLGQFO-UHFFFAOYSA-N p-hydroxybenzoic acid methyl ester Natural products COC(=O)C1=CC=C(O)C=C1 LXCFILQKKLGQFO-UHFFFAOYSA-N 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 238000007911 parenteral administration Methods 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000007310 pathophysiology Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 125000000538 pentafluorophenyl group Chemical group FC1=C(F)C(F)=C(*)C(F)=C1F 0.000 description 1
- 125000003538 pentan-3-yl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])C([H])([H])[H] 0.000 description 1
- MYDQAEQZZKVJSL-UHFFFAOYSA-N pentyl carbamate Chemical compound CCCCCOC(N)=O MYDQAEQZZKVJSL-UHFFFAOYSA-N 0.000 description 1
- 201000002628 peritoneum cancer Diseases 0.000 description 1
- 230000035699 permeability Effects 0.000 description 1
- 150000002978 peroxides Chemical class 0.000 description 1
- 229960003742 phenol Drugs 0.000 description 1
- 229950000688 phenothiazine Drugs 0.000 description 1
- WVDDGKGOMKODPV-ZQBYOMGUSA-N phenyl(114C)methanol Chemical compound O[14CH2]C1=CC=CC=C1 WVDDGKGOMKODPV-ZQBYOMGUSA-N 0.000 description 1
- OJMIONKXNSYLSR-UHFFFAOYSA-N phosphorous acid Chemical compound OP(O)O OJMIONKXNSYLSR-UHFFFAOYSA-N 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 229920003023 plastic Polymers 0.000 description 1
- 239000004033 plastic Substances 0.000 description 1
- 210000001778 pluripotent stem cell Anatomy 0.000 description 1
- 229920000191 poly(N-vinyl pyrrolidone) Polymers 0.000 description 1
- 229920003229 poly(methyl methacrylate) Polymers 0.000 description 1
- 239000004926 polymethyl methacrylate Substances 0.000 description 1
- 229920005862 polyol Polymers 0.000 description 1
- 150000003077 polyols Chemical class 0.000 description 1
- 229920001451 polypropylene glycol Polymers 0.000 description 1
- 229920002223 polystyrene Polymers 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- LJCNRYVRMXRIQR-OLXYHTOASA-L potassium sodium L-tartrate Chemical compound [Na+].[K+].[O-]C(=O)[C@H](O)[C@@H](O)C([O-])=O LJCNRYVRMXRIQR-OLXYHTOASA-L 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 208000017426 precursor B-cell acute lymphoblastic leukemia Diseases 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000001902 propagating effect Effects 0.000 description 1
- 238000011321 prophylaxis Methods 0.000 description 1
- 235000010232 propyl p-hydroxybenzoate Nutrition 0.000 description 1
- 239000004405 propyl p-hydroxybenzoate Substances 0.000 description 1
- QQONPFPTGQHPMA-UHFFFAOYSA-N propylene Natural products CC=C QQONPFPTGQHPMA-UHFFFAOYSA-N 0.000 description 1
- 125000004805 propylene group Chemical group [H]C([H])([H])C([H])([*:1])C([H])([H])[*:2] 0.000 description 1
- 229960003415 propylparaben Drugs 0.000 description 1
- 235000019833 protease Nutrition 0.000 description 1
- 230000013777 protein digestion Effects 0.000 description 1
- 239000013636 protein dimer Substances 0.000 description 1
- 239000000007 protein synthesis inhibitor Substances 0.000 description 1
- 239000003586 protic polar solvent Substances 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 238000010791 quenching Methods 0.000 description 1
- 230000000171 quenching effect Effects 0.000 description 1
- LISFMEBWQUVKPJ-UHFFFAOYSA-N quinolin-2-ol Chemical compound C1=CC=C2NC(=O)C=CC2=C1 LISFMEBWQUVKPJ-UHFFFAOYSA-N 0.000 description 1
- 230000005855 radiation Effects 0.000 description 1
- 238000007420 radioactive assay Methods 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 229920005604 random copolymer Polymers 0.000 description 1
- 230000035484 reaction time Effects 0.000 description 1
- 230000008707 rearrangement Effects 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 238000006722 reduction reaction Methods 0.000 description 1
- 238000006894 reductive elimination reaction Methods 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 235000009566 rice Nutrition 0.000 description 1
- 102220005400 rs34324664 Human genes 0.000 description 1
- 239000012266 salt solution Substances 0.000 description 1
- 238000007127 saponification reaction Methods 0.000 description 1
- 238000000926 separation method Methods 0.000 description 1
- 238000013207 serial dilution Methods 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 210000000717 sertoli cell Anatomy 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- SQVRNKJHWKZAKO-OQPLDHBCSA-N sialic acid Chemical compound CC(=O)N[C@@H]1[C@@H](O)C[C@@](O)(C(O)=O)OC1[C@H](O)[C@H](O)CO SQVRNKJHWKZAKO-OQPLDHBCSA-N 0.000 description 1
- 229910052710 silicon Inorganic materials 0.000 description 1
- 239000010703 silicon Substances 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- 208000000587 small cell lung carcinoma Diseases 0.000 description 1
- 235000017557 sodium bicarbonate Nutrition 0.000 description 1
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 1
- 229910000029 sodium carbonate Inorganic materials 0.000 description 1
- 235000011006 sodium potassium tartrate Nutrition 0.000 description 1
- 229910052938 sodium sulfate Inorganic materials 0.000 description 1
- 235000011152 sodium sulphate Nutrition 0.000 description 1
- 235000010339 sodium tetraborate Nutrition 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 239000000600 sorbitol Substances 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 230000002269 spontaneous effect Effects 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 239000003381 stabilizer Substances 0.000 description 1
- 230000000087 stabilizing effect Effects 0.000 description 1
- 230000003068 static effect Effects 0.000 description 1
- SFVFIFLLYFPGHH-UHFFFAOYSA-M stearalkonium chloride Chemical compound [Cl-].CCCCCCCCCCCCCCCCCC[N+](C)(C)CC1=CC=CC=C1 SFVFIFLLYFPGHH-UHFFFAOYSA-M 0.000 description 1
- 210000000130 stem cell Anatomy 0.000 description 1
- 238000011146 sterile filtration Methods 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000010254 subcutaneous injection Methods 0.000 description 1
- 239000007929 subcutaneous injection Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 229960002317 succinimide Drugs 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 150000003456 sulfonamides Chemical class 0.000 description 1
- 239000011593 sulfur Substances 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical class ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 1
- 230000001629 suppression Effects 0.000 description 1
- 230000004083 survival effect Effects 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000002459 sustained effect Effects 0.000 description 1
- 230000005062 synaptic transmission Effects 0.000 description 1
- 208000011580 syndromic disease Diseases 0.000 description 1
- 238000007910 systemic administration Methods 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 231100000378 teratogenic Toxicity 0.000 description 1
- 230000003390 teratogenic effect Effects 0.000 description 1
- AOCSUUGBCMTKJH-UHFFFAOYSA-N tert-butyl n-(2-aminoethyl)carbamate Chemical compound CC(C)(C)OC(=O)NCCN AOCSUUGBCMTKJH-UHFFFAOYSA-N 0.000 description 1
- LPCNXVJXDPVSMA-UHFFFAOYSA-N tert-butyl n-[2-(9h-fluoren-9-ylmethoxycarbonylamino)ethyl]carbamate Chemical compound C1=CC=C2C(COC(=O)NCCNC(=O)OC(C)(C)C)C3=CC=CC=C3C2=C1 LPCNXVJXDPVSMA-UHFFFAOYSA-N 0.000 description 1
- YBRBMKDOPFTVDT-UHFFFAOYSA-N tert-butylamine Chemical compound CC(C)(C)N YBRBMKDOPFTVDT-UHFFFAOYSA-N 0.000 description 1
- 125000001302 tertiary amino group Chemical group 0.000 description 1
- DPKBAXPHAYBPRL-UHFFFAOYSA-M tetrabutylazanium;iodide Chemical compound [I-].CCCC[N+](CCCC)(CCCC)CCCC DPKBAXPHAYBPRL-UHFFFAOYSA-M 0.000 description 1
- 229940126585 therapeutic drug Drugs 0.000 description 1
- 238000004809 thin layer chromatography Methods 0.000 description 1
- SRVJKTDHMYAMHA-WUXMJOGZSA-N thioacetazone Chemical compound CC(=O)NC1=CC=C(\C=N\NC(N)=S)C=C1 SRVJKTDHMYAMHA-WUXMJOGZSA-N 0.000 description 1
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 1
- 229930192474 thiophene Natural products 0.000 description 1
- OKYDCMQQLGECPI-UHFFFAOYSA-N thiopyrylium Chemical compound C1=CC=[S+]C=C1 OKYDCMQQLGECPI-UHFFFAOYSA-N 0.000 description 1
- 201000002510 thyroid cancer Diseases 0.000 description 1
- 238000004448 titration Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 102000035160 transmembrane proteins Human genes 0.000 description 1
- 108091005703 transmembrane proteins Proteins 0.000 description 1
- 102000027257 transmembrane receptors Human genes 0.000 description 1
- 108091008578 transmembrane receptors Proteins 0.000 description 1
- PYHOFAHZHOBVGV-UHFFFAOYSA-N triazane Chemical compound NNN PYHOFAHZHOBVGV-UHFFFAOYSA-N 0.000 description 1
- BSVBQGMMJUBVOD-UHFFFAOYSA-N trisodium borate Chemical compound [Na+].[Na+].[Na+].[O-]B([O-])[O-] BSVBQGMMJUBVOD-UHFFFAOYSA-N 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 230000007306 turnover Effects 0.000 description 1
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 1
- 231100000397 ulcer Toxicity 0.000 description 1
- 238000000870 ultraviolet spectroscopy Methods 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 201000005112 urinary bladder cancer Diseases 0.000 description 1
- 230000002485 urinary effect Effects 0.000 description 1
- 125000005500 uronium group Chemical group 0.000 description 1
- 206010046766 uterine cancer Diseases 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 229920002554 vinyl polymer Polymers 0.000 description 1
- 230000003612 virological effect Effects 0.000 description 1
- 239000003039 volatile agent Substances 0.000 description 1
- 238000005406 washing Methods 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/335—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin
- A61K31/357—Heterocyclic compounds having oxygen as the only ring hetero atom, e.g. fungichromin having two or more oxygen atoms in the same ring, e.g. crown ethers, guanadrel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/54—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic compound
- A61K47/541—Organic ions forming an ion pair complex with the pharmacologically or therapeutically active agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6801—Drug-antibody or immunoglobulin conjugates defined by the pharmacologically or therapeutically active agent
- A61K47/6803—Drugs conjugated to an antibody or immunoglobulin, e.g. cisplatin-antibody conjugates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6849—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a receptor, a cell surface antigen or a cell surface determinant
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/68—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment
- A61K47/6835—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site
- A61K47/6851—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell
- A61K47/6855—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an antibody, an immunoglobulin or a fragment thereof, e.g. an Fc-fragment the modifying agent being an antibody or an immunoglobulin bearing at least one antigen-binding site the antibody targeting a determinant of a tumour cell the tumour determinant being from breast cancer cell
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- G—PHYSICS
- G01—MEASURING; TESTING
- G01N—INVESTIGATING OR ANALYSING MATERIALS BY DETERMINING THEIR CHEMICAL OR PHYSICAL PROPERTIES
- G01N33/00—Investigating or analysing materials by specific methods not covered by groups G01N1/00 - G01N31/00
- G01N33/48—Biological material, e.g. blood, urine; Haemocytometers
- G01N33/50—Chemical analysis of biological material, e.g. blood, urine; Testing involving biospecific ligand binding methods; Immunological testing
- G01N33/53—Immunoassay; Biospecific binding assay; Materials therefor
- G01N33/566—Immunoassay; Biospecific binding assay; Materials therefor using specific carrier or receptor proteins as ligand binding reagents where possible specific carrier or receptor proteins are classified with their target compounds
- G01N33/567—Immunoassay; Biospecific binding assay; Materials therefor using specific carrier or receptor proteins as ligand binding reagents where possible specific carrier or receptor proteins are classified with their target compounds utilising isolate of tissue or organ as binding agent
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/57—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2
- A61K2039/572—Medicinal preparations containing antigens or antibodies characterised by the type of response, e.g. Th1, Th2 cytotoxic response
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/62—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier
- A61K2039/627—Medicinal preparations containing antigens or antibodies characterised by the link between antigen and carrier characterised by the linker
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Organic Chemistry (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Cell Biology (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Urology & Nephrology (AREA)
- Hematology (AREA)
- Biophysics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Oncology (AREA)
- Genetics & Genomics (AREA)
- General Physics & Mathematics (AREA)
- Analytical Chemistry (AREA)
- Pathology (AREA)
- Microbiology (AREA)
- Biotechnology (AREA)
- Food Science & Technology (AREA)
- Physics & Mathematics (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Peptides Or Proteins (AREA)
- Medicinal Preparation (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Plural Heterocyclic Compounds (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Description
米国特許法施行規則1.53(b)条の下に出願されたこの正規の出願は、米国特許法119(e)条の下、2016年6月6日出願の米国仮特許出願第62/346024号の利益を主張し、その全体が参照によって組み込まれる。
またはその薬学的に許容される塩であって、
式中、
Raは、CH3O、CN、NO2、及びClから選択される基であり、
Lは、リンカーであり、
pは、1~8の整数であり、
Abは、1つ以上の腫瘍関連抗原または細胞表面受容体に結合する抗体である、抗体-薬物コンジュゲート化合物またはその薬学的に許容される塩を含む。
のシルベストロール-リンカー中間体化合物であって、
式中、
Raは、CH3O、CN、NO2、及びClから選択される基であり、
R1は、-OCH3及びL-Xから選択され、
R2は、-CH(OH)CH2OH及びL-Xから選択され、
Lは、リンカーであり、
Xは、マレイミド、チオール、アミノ、臭化物、ブロモアセトアミド、ヨードアセトアミド、p-トルエンスルホン酸、ヨウ化物、ヒドロキシル、カルボキシル、ピリジルジスルフィド、及びN-ヒドロキシスクシンイミドから選択される反応性官能基を含む、シルベストロール-リンカー中間体化合物を含む。
別段定義されない限り、本明細書で使用される技術的及び科学的な用語は、本発明が属する分野の当業者により一般的に理解されるものと同じ意味を有し、それらは、Singleton et al.(1994) Dictionary of Microbiology and Molecular Biology,2nd Ed.,J.Wiley&Sons,New York,NY、及びJaneway,C.,Travers,P.,Walport,M.,Shlomchik(2001)Immunobiology,5th Ed.,Garland Publishing,New Yorkと一致する。
本開示の実施形態のうちのいずれかにおいて、抗体は、ヒト化である。一実施形態において、抗体は、本開示の実施形態のいずれかにおけるようなHVRを含み、ヒトアクセプターフレームワーク、例えば、ヒト免疫グロブリンフレームワークまたはヒトコンセンサスフレームワークを更に含む。特定の実施形態において、ヒトアクセプターフレームワークは、ヒトVLカッパIコンセンサス(VLKI)フレームワーク及び/またはVHフレームワークVH1である。特定の実施形態において、ヒトアクセプターフレームワークは、以下の変異のうちのいずれか1つを含む、ヒトVLカッパIコンセンサス(VLKI)フレームワーク及び/またはVHフレームワークVH1である。
特定の実施形態において、本明細書に提供される抗体は、1μM以下、100nM以下、50nM以下、10nM以下、5nM以下、1nM以下、0.1nM以下、0.01nM以下、または0.001nM以下の解離定数(Kd)を有し、かつ任意で、10-13M以上(例えば、10-8M以下、例えば、10-8M~10-13M、例えば、10-9M~10-13M)である。
特定の実施形態において、本明細書に提供される抗体は、抗体断片である。抗体断片としては、Fab、Fab’、Fab’-SH、F(ab’)2、Fv、及びscFv断片、ならびに本明細書に記載される他の断片が挙げられるが、これらに限定されない。特定の抗体断片の概説については、Hudson et al.Nat.Med.9:129-134(2003)を参照されたい。scFv断片の概説については、例えば、Pluckthun,in The Pharmacology of Monoclonal Antibodies,vol.113,Rosenburg and Moore eds.,(Springer-Verlag,New York),pp.269-315(1994)を参照されたく、またWO1993/16185、ならびにUS5571894及びUS5587,58もまた参照されたい。エピトープ残基に結合し、増加したインビボ半減期を有するサルベージ受容体を含むFab及びF(ab’)2断片の考察については、US5869046を参照されたい。
特定の実施形態において、本明細書に提供される抗体は、キメラ抗体である。特定のキメラ抗体は、例えば、US4816567及びMorrison et al.,Proc.Natl.Acad.Sci.USA,81:6851-6855(1984))に記載されている。一例において、キメラ抗体は、非ヒト可変領域(例えば、マウス、ラット、ハムスター、ウサギ、または非ヒト霊長類(サルなど)に由来する可変領域)及びヒト定常領域を含む。更なる一例において、キメラ抗体は、クラスまたはサブクラスが親抗体のクラスまたはサブクラスから変化した「クラススイッチ」抗体である。キメラ抗体には、その抗原結合断片が含まれる。
特定の実施形態において、本明細書に提供される抗体は、ヒト抗体である。ヒト抗体は、当該技術分野において既知である様々な技術を使用して産生することができる。ヒト抗体は一般に、van Dijk and van de Winkel,Curr. Opin.Pharmacol.5:368-74(2001)及びLonberg,Curr.Opin.Immunol.20:450-459(2008)に記載されている。
本発明の抗体は、所望される活性(複数可)を有する抗体についてコンビナトリアルライブラリをスクリーニングすることによって単離され得る。例えば、ファージ提示ライブラリを生成し、所望される結合特性を保有する抗体についてそのようなライブラリをスクリーニングするための様々な方法が、当該技術分野において既知である。そのような方法は、例えば、Hoogenboom et al.in Methods in Molecular Biology178:1-37(O’Brien et al.,ed.,Human Press,Totowa,NJ,2001)に概説され、例えば、McCafferty et al.,Nature348:552-554、Clackson et al.,Nature352:624-628(1991)、Marks et al.,J.Mol.Biol.222:581-597(1992)、Marks and Bradbury,in Methods in Molecular Biology248:161-175(Lo,ed.,Human Press,Totowa,NJ,2003)、Sidhu et al.,J.Mol.Biol.338(2):299-310(2004)、Lee et al.,J.Mol.Biol.340(5):1073-1093(2004)、Fellouse,Proc.Natl.Acad.Sci.USA101(34):12467-12472(2004)、及びLee et al.,J.Immunol.Methods284(1-2):119-132(2004)に更に記載されている。
特定の実施形態において、本明細書に提供される抗体は、多重特異性抗体、例えば、二重特異性抗体である。「多重特異性抗体」という用語は、最も広義に使用され、多重エピトープ特異性を有する(すなわち、1つの生物学的分子上の2つもしくはそれ以上の異なるエピトープに特異的に結合することができるか、または2つもしくはそれ以上の異なる生物学的分子上のエピトープに特異的に結合することができる)抗原結合ドメインを含む抗体を具体的に網羅する。いくつかの実施形態において、多重特異性抗体は、少なくとも2つの異なる部位に対する結合特異性を有するモノクローナル抗体である。いくつかの実施形態において、多重特異性抗体(二重特異性抗体など)の抗原結合ドメインは、2つのVH/VL単位を含み、第1のVH/VL単位は、第1のエピトープに特異的に結合し、第2のVH/VL単位は、第2のエピトープに特異的に結合し、各VH/VL単位は、重鎖可変ドメイン(VH)及び軽鎖可変ドメイン(VL)を含む。そのような多重特異性抗体としては、完全長抗体、2つ以上のVL及びVHドメインを有する抗体、抗体断片(Fab、Fv、dsFv、scFv、ダイアボディ、二重特異性ダイアボディ、及びトリアボディなど)、共有結合的または非共有結合的に連結されている抗体断片が挙げられるが、これらに限定されない。重鎖可変領域の少なくとも一部分及び/または軽鎖可変領域の少なくとも一部分を更に含むVH/VL単位はまた、「アーム」または「ヘミマー」または「半抗体」とも称され得る。いくつかの実施形態において、ヘミマーは、第2のヘミマーとの分子内ジスルフィド結合が形成されることを可能にするのに十分な重鎖可変領域の一部分を含む。いくつかの実施形態において、ヘミマーは、例えば、相補的ホール変異またはノブ変異を含む第2のヘミマーまたは半抗体とのヘテロ二量体化を可能にする、ノブ変異またはホール変異を含む。ノブ変異及びホール変異は、本明細書において更に考察される。
特定の実施形態において、抗体の1つ以上の残基がシステイン残基で置換されている、システイン操作された抗体、例えば、「THIOMAB(商標)抗体」を作製することが望ましい場合がある。特定の実施形態において、置換された残基は、抗体の到達可能な部位で生じる。それらの残基をシステインで置換することによって、反応性チオール基がそれにより抗体の到達可能な部位に位置付けられ、本明細書に更に記載されるように、それを使用して、抗体を薬物部分にコンジュゲートして、免疫コンジュゲートを作製することができる。特定の実施形態において、以下の残基、軽鎖のV205(Kabat番号付け)、軽鎖のK149(Kabat番号付け)、重鎖のA118(EU番号付け)、及び重鎖Fc領域のS400(EU番号付け)のいずれか1つ以上が、システインで置換され得る。システイン操作された抗体は、例えば、US7521541、Shen,B.et al(2012)Nat.Biotechnol.30(2):184-189、Sukumaran et al(2015)Pharm Res32:1884-1893に記載されるように生成され得る。
(1)BMPR1B(骨形成タンパク質受容体IB型、Genbank受託番号NM_001203)ten Dijke,P.,et al.Science264(5155):101-104(1994)、Oncogene14(11):1377-1382(1997))、WO2004063362(請求項2)、WO2003042661(請求項12)、US2003134790-A1(38~39頁)、WO2002102235(請求項13、296頁)、WO2003055443(91~92頁)、WO200299122(実施例2、528~53頁)、WO2003029421(請求項6)、WO2003024392(請求項2、図112)、WO200298358(請求項1、183頁)、WO200254940(100~101頁)、WO200259377(349~350頁)、WO200230268(請求項27、376頁)、WO200148204(実施例、図4)NP_001194骨形成タンパク質受容体、IB型/pid=NP_001194.1-相互参照:MIM:603248、NP_001194.1、AY065994。
「リンカー」(L)は、1つ以上のシルベストロール薬物部分を抗体(Ab)に連結して、式IIa及びIIbの抗体-薬物コンジュゲート(ADC)を形成するために使用することができる、二官能性または多官能性部分である。いくつかの実施形態において、抗体-薬物コンジュゲート(ADC)は、薬物に及び抗体に共有結合するための反応性官能基を有するリンカーを使用して調製することができる。例えば、いくつかの実施形態において、抗体(Ab)のシステインチオールは、リンカーの反応性官能基または薬物-リンカー中間体と結合を形成して、ADCを作製することができる。
シルベストロール(CAS登録番号697235-38-4)(メチル(1R,2R,3S,3aR,8bS)-6-(((2S,3R,6R)-6-((R)-1,2-ジヒドロキシエチル)-3-メトキシ-1,4-ジオキサン-2-イル)オキシ)-1,8b-ジヒドロキシ-8-メトキシ-3a-(4-メトキシフェニル)-3-フェニル-2,3,3a,8b-テトラヒドロ-1H-シクロペンタ[b]ベンゾフラン-2-カルボキシレートと称される)(化合物16、実施例1a)は、Aglaia foveolataから単離されたロカグレート誘導体であり(Pan,L.,et al(2014)Nat.Prod.Rep.31:924-939)、p53活性とは独立してG2/Mチェックポイント遺伝子を制御する(Mi,Q.et al(2006)Anticancer Res.26(5A):3349-56)。シルベストロール及び類似体は、強力かつ選択的なタンパク質合成阻害剤であり、それらの抗過剰増殖特性について研究されている(Liu,T.et al(2012)Journal of Medicinal Chemistry,55(20):8859-8878、WO2015/085221、WO2013016658、WO2004041812、US8137509、US8404088、WO2006007634、US7816544)。シルベストロールは、以下の構造を有する。
式中、
Raは、CH3O、CN、NO2、及びClから選択される基であり、
R1は、-OCH3及びL-Xから選択され、
R2は、-CH(OH)CH2OH及びL-Xから選択され、
Lは、リンカーであり、
Xは、マレイミド、チオール、アミノ、臭化物、ブロモアセトアミド、ヨードアセトアミド、p-トルエンスルホン酸、ヨウ化物、ヒドロキシル、カルボキシル、ピリジルジスルフィド、及びN-ヒドロキシスクシンイミドから選択される反応性官能基を含む。
nは、1~6であり、
Rは独立して、H、C1-C12アルキル、及びC6-C20アリールから選択されるか、または2つのRが、C3-C7炭素環状環を形成し、
アルキレン、アルケニレン、アルキニレン、アルキル、及びアリールは、F、Cl、Br、N(CH3)2、NO2、及びOCH3から選択される1つ以上の基で任意で置換される。
-Str-PM-Y-
を有する、プロテアーゼ-切断可能な非ペプチドリンカーであり、式中、Strは、Xに共有結合したストレッチャー単位であり、PMは、ペプチドミメティック単位であり、Yは、シルベストロール薬物部分に共有結合したスペーサー単位である。
を有し、式中、R7及びR8は一緒になって、C3-C7シクロアルキル環を形成し、
AAは、H、-CH3、-CH2(C6H5)、-CH2CH2CH2CH2NH2、-CH2CH2CH2NHC(NH)NH2、-CHCH(CH3)CH3、及び-CH2CH2CH2NHC(O)NH2から選択されるアミノ酸側鎖である。
-Str-Pep-Y-
を有するペプチドリンカーであり、式中、Strは、抗体に共有結合したストレッチャー単位であり、Pepは、2~12個のアミノ酸残基のペプチドであり、Yは、シルベストロール薬物部分に共有結合したスペーサー単位である。
表5 シルベストロール-リンカー中間体
本発明は、式Ia及びIbから選択される、リンカーを通してシルベストロール薬物部分に共有結合した抗体を有する抗体-薬物コンジュゲート化合物、
またはその薬学的に許容される塩であって、
式中、
Raは、CH3O、CN、NO2、及びClから選択される基であり、
Lは、リンカーであり、
pは、1~8の整数であり、
Abは、1つ以上の腫瘍関連抗原または細胞表面受容体に結合する抗体である、抗体-薬物コンジュゲート化合物またはその薬学的に許容される塩を提供する。
(1)BMPR1B(骨形成タンパク質受容体IB型)、
(2)E16(LAT1、SLC7A5)、
(3)STEAP1(前立腺の6回膜貫通上皮抗原)、
(4)MUC16(0772P、CA125)、
(5)MPF(MPF、MSLN、SMR、巨核球増強因子、メソテリン)、
(6)Napi2b(NAPI-3B、NPTIIb、SLC34A2、溶質輸送体ファミリー34(リン酸ナトリウム)、メンバー2、II型ナトリウム依存性リン酸輸送体3b)、
(7)Sema 5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、セマフォリン5b Hlog、セマドメイン、7回トロンボスポンジン反復(1型及び1型様)、膜貫通ドメイン(TM)、ならびに短い細胞質ドメイン、(セマフォリン)5B)、
(8)PSCA hlg(2700050C12Rik、C530008O16Rik、RIKEN cDNA 2700050C12、RIKEN cDNA 2700050C12遺伝子)、
(9)ETBR(エンドセリンB型受容体)、
(10)MSG783(RNF124、仮説上のタンパク質FLJ20315)、
(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前立腺癌関連遺伝子1、前立腺癌関連タンパク質1、前立腺の6回膜貫通上皮抗原2、6回膜貫通前立腺タンパク質)、
(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、一過性受容体電位カチオンチャネル、サブファミリーM、メンバー4)、
(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、奇形癌種由来の成長因子)、
(14)CD21(CR2(補体受容体2)またはC3DR(C3d/エプスタイン・バーウイルス受容体)またはHs73792)、
(15)CD79b(CD79B、CD79β、IGb(免疫グロブリン関連ベータ)、B29)、
(16)FcRH2(IFGP4、IRTA4、SPAP1A(SH2ドメイン含有ホスファターゼアンカータンパク質1a)、SPAP1B、SPAP1C)、
(17)HER2、
(18)NCA、
(19)MDP、
(20)IL20Rα、
(21)ブレビカン、
(22)EphB2R、
(23)ASLG659、
(24)PSCA、
(25)GEDA、
(26)BAFF-R(B細胞活性化因子受容体、BLyS受容体3、BR3)、
(27)CD22(B細胞受容体CD22-Bアイソフォーム)、
(28)CD79a(CD79A、CD79α、免疫グロブリン関連アルファ)、
(29)CXCR5(バーキットリンパ腫受容体1)、
(30)HLA-DOB(MHCクラスII分子のベータサブユニット(Ia抗原))、
(31)P2X5(プリン受容体P2Xリガンド開口型イオンチャネル5)、
(32)CD72(B細胞分化抗原CD72、Lyb-2)、
(33)LY64(リンパ球抗原64(RP105)、ロイシンリッチ反復(LRR)ファミリーのI型膜タンパク質)、
(34)FcRH1(Fc受容体様タンパク質1)、
(35)FcRH5(IRTA2、免疫グロブリンスーパーファミリー受容体転位関連2)、
(36)TENB2(推定上の膜貫通プロテオグリカン)、
(37)PMEL17(silver相同体、SILV、D12S53E、PMEL17、SI、SIL)、
(38)TMEFF1(EGF様ドメイン及び2つのフォリスタチン様ドメインを有する膜貫通タンパク質1、トモレグリン-1)、
(39)GDNF-Ra1(GDNFファミリー受容体アルファ1、GFRA1、GDNFR、GDNFRA、RETL1、TRNR1、RET1L、GDNFR-アルファ1、GFR-ALPHA-1)、
(40)Ly6E(リンパ球抗原6複合体、遺伝子座E、Ly67、RIG-E、SCA-2、TSA-1)、
(41)TMEM46(shisa相同体2(Xenopus laevis)、SHISA2)、
(42)Ly6G6D(リンパ球抗原6複合体、遺伝子座G6D、Ly6-D、MEGT1)、
(43)LGR5(ロイシンリッチ反復含有Gタンパク質結合型受容体5、GPR49、GPR67)、
(44)RET(retがん原遺伝子、MEN2A、HSCR1、MEN2B、MTC1、PTC、CDHF12、Hs.168114、RET51、RET-ELE1)、
(45)LY6K(リンパ球抗原6複合体、遺伝子座K、LY6K、HSJ001348、FLJ35226)、
(46)GPR19(Gタンパク質結合型受容体19、Mm.4787)、
(47)GPR54(KISS1受容体、KISS1R、GPR54、HOT7T175、AXOR12)、
(48)ASPHD1(アスパラギン酸ベータ-ヒドロキシラーゼドメイン含有1、LOC253982)、
(49)チロシナーゼ(TYR、OCAIA、OCA1A、チロシナーゼ、SHEP3)、
(50)TMEM118(ringフィンガータンパク質、膜貫通2、RNFT2、FLJ14627)、
(51)GPR172A(Gタンパク質共役型受容体172A、GPCR41、FLJ11856、D15Ertd747e)、
(52)CD33、ならびに
(53)CLL-1から選択される1つ以上の腫瘍関連抗原または細胞表面受容体に結合する。
-Str-PM-Y-
を有する、プロテアーゼ-切断可能な非ペプチドリンカーであり、式中、Strは、抗体に共有結合したストレッチャー単位であり、PMは、ペプチドミメティック単位であり、Yは、シルベストロール薬物部分に共有結合したスペーサー単位である。
を有し、式中、R6は、C1-C12アルキレン、C1-C12アルキレン-C(=O)、C1-C12アルキレン-NH、(CH2CH2O)r、(CH2CH2O)r-C(=O)、(CH2CH2O)r-CH2、及びC1-C12アルキレン-NHC(=O)CH2CH(チオフェン-3-イル)からなる群から選択され、rは、1~10の範囲の整数である。
を有し、式中、R7及びR8は一緒になって、C3-C7シクロアルキル環を形成し、
AAは、H、-CH3、-CH2(C6H5)、-CH2CH2CH2CH2NH2、-CH2CH2CH2NHC(NH)NH2、-CHCH(CH3)CH3、及び-CH2CH2CH2NHC(O)NH2から選択されるアミノ酸側鎖である。
-Str-Pep-Y-
を有するペプチドリンカーであり、式中、Strは、抗体に共有結合したストレッチャー単位であり、Pepは、2~12個のアミノ酸残基のペプチドであり、Yは、シルベストロール薬物部分に共有結合したスペーサー単位である。
を有し、式中、R6は、C1-C12アルキレン、C1-C12アルキレン-C(=O)、C1-C12アルキレン-NH、(CH2CH2O)r、(CH2CH2O)r-C(=O)、(CH2CH2O)r-CH2、及びC1-C12アルキレン-NHC(=O)CH2CH(チオフェン-3-イル)からなる群から選択され、rは、1~10の範囲の整数である。
表6 抗体-薬物コンジュゲート(ADC)
DAR=薬物/抗体比平均
A118C(EU番号付け)=A121C(連続的番号付け)=A114C(Kabat番号付け)
野生型(「WT」)、システイン操作された変異抗体(「チオ」)、軽鎖(「LC」)、重鎖(「HC」)、6-マレイミドカプロイル(「MC」)、マレイミドプロパノイル(「MP」)、バリン-シトルリン(「val-cit」または「vc」)、アラニン-フェニルアラニン(「ala-phe」)、p-アミノベンジル(「PAB」)、及びp-アミノベンジルオキシカルボニル(「PABC」)
一般に、抗体-薬物コンジュゲート(ADC)の細胞毒性または細胞増殖抑制性活性は、受容体タンパク質(例えば、HER2)を有する哺乳動物細胞を細胞培養培地中でADCの抗体に曝露し、細胞を約6時間~約5日間の期間培養し、細胞生存率を測定することによって測定される。細胞に基づくインビトロアッセイを使用して、本発明のADCの生存率(増殖)、細胞毒性、及びアポトーシス(カスパーゼ活性化)の誘導を測定した。
表7 遊離薬物シルベストロール化合物のインビトロ有効性
本発明の抗体-薬物コンジュゲート(ADC)のインビボ有効性は、マウスにおける腫瘍異種移植片研究によって測定され得る(実施例7~10)。本発明のADCは、腫瘍増殖を阻害する上で驚くべきかつ予想外の標的依存性及び用量依存性効力を示した。ADCの効力は、腫瘍細胞の標的抗原発現と相関した。
1)ビヒクル(HisAc 20mM、Sucr 240mM、TW-20 0.02%(pH5.5))、100uL、静脈内に一度
2)チオ抗CD22 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-104)、1mg/kgで静脈内に一度、
3)チオ抗CD22 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-104)、3mg/kgで静脈内に一度、
4)チオ抗CD22 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-104)、6mg/kgで静脈内に一度、
5)チオ抗CD22 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-104)、10mg/kgで静脈内に一度、
6)チオ抗Her2 7C2 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-103)、3mg/kgで静脈内に一度、を静脈内に一度投薬した後に実施例9に従って実行される、CB-17 Fox Chase SCIDマウスにおけるCD22発現Bjab-lucヒト異種移植片モデルでの、経時的なインビボ適合腫瘍体積変化のプロットにおける抗体-薬物コンジュゲートの有効性を示す。
1)ビヒクル(HisAc 20mM、Sucr 240mM、TW-20 0.02%(pH5.5))、100uL、静脈内に一度
2)シルベストロール、0.09mg/kg、静脈内に一度
3)シルベストロール、1mg/kg、腹腔内qd×5で2週間
4)チオ抗Her2 7C2 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-103)、1mg/kgで静脈内に一度
5)チオ抗Her2 7C2 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-103)、3mg/kgで静脈内に一度
6)チオ抗Her2 7C2 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-103)、6mg/kgで静脈内に一度
7)チオ抗Her2 7C2 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-103)、10mg/kgで静脈内に一度
8)チオ抗CD22 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-104)、3mg/kgで静脈内に一度
ビヒクル及びオフターゲット対照ADC-104と比較して、抗HER2 7C2シルベストロール-アミン(ADC-103)の試験した全ての用量レベルについて活性が見られる。1及び3mg/kgで投薬したADC-103は中程度の活性を示し、6及び10mg/kgはおよそ静止状態である。3mg/kgで投薬したCD22対照シルベストロール-アミン(ADC-104)では、いくらかの成長遅延は存在しない。安全信号として、体重減少は見られない。
1)ビヒクル(ヒスチジン緩衝液番号8)、100μL、静脈内に一度
2)チオCD22 LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-104)、10mg/kgで静脈内に一度
3)チオHer2(7C2)LC-K149C-MC-vc-PAB-シルベストロール-アミン(ADC-103)、10mg/kgで静脈内に一度
4)チオCD22 HC-A140C-MC-vc-PAB-アミノ-シルベストロール(ADC-105)、1mg/kgで静脈内に一度
5)チオCD22 HC-A140C-MC-vc-PAB-アミノ-シルベストロール(ADC-105)、3mg/kgで静脈内に一度
6)チオCD22 HC-A140C-MC-vc-PAB-アミノ-シルベストロール(ADC-105)、6mg/kgで静脈内に一度
7)チオCD22 HC-A140C-MC-vc-PAB-アミノ-シルベストロール(ADC-105)、10mg/kgで静脈内に一度
8)チオHer2(7C2)HC-A140C-MC-vc-PAB-アミノ-シルベストロール(ADC-106)、3mg/kgで静脈内に一度
9)チオHer2(7C2)HC-A140C-MC-vc-PAB-アミノ-シルベストロール(ADC-106)、10mg/kgで静脈内に一度
1)ビヒクル(ヒスチジン緩衝液番号8)、100uL、静脈内に一度
2)チオHu抗CD22 10F4v3 LC K149C-MC-sq-cit-PAB-シルベストロール-アミン(ADC-110)、3mg/kgで静脈内に一度
3)チオHu抗CD22 10F4v3 LC K149C-MC-sq-cit-PAB-シルベストロール-アミン(ADC-110)、6mg/kgで静脈内に一度
4)チオHu抗CD22 10F4v3 LC K149C-MC-sq-cit-PAB-シルベストロール-アミン(ADC-110)、10mg/kgで静脈内に一度
5)チオHu抗LY6E 9B12v12 LC K149C-MC-sq-cit-PAB-シルベストロール-アミン(ADC-109)、10mg/kgで静脈内に一度
6)チオHu抗CD22 10F4v3 LC K149C-MC-sq-cit-PAB-アミノ-シルベストロール(ADC-108)、0.3mg/kgで静脈内に一度
7)チオHu抗CD22 10F4v3 LC K149C-MC-sq-cit-PAB-アミノ-シルベストロール(ADC-108)、1mg/kgで静脈内に一度
8)チオHu抗CD22 10F4v3 LC K149C-MC-sq-cit-PAB-アミノ-シルベストロール(ADC-108)、3mg/kgで静脈内に一度
9)チオHu抗CD22 10F4v3 LC K149C-MC-sq-cit-PAB-アミノ-シルベストロール(ADC-108)、6mg/kgで静脈内に一度
10)チオHu抗LY6E 9B12v12 LC K149C-MC-sq-cit-PAB-アミノ-シルベストロール(ADC-107)、6mg/kgで静脈内に一度
本発明の治療抗体-薬物コンジュゲートの薬学的製剤は典型的には、凍結乾燥製剤または水溶液の形態で、所望される程度の純度を有し、かつ1つ以上の任意の薬学的に許容される担体、賦形剤、及び/またはビヒクルを有する単位投薬量の注射可能な形態で、非経口投与、すなわち、ボーラス、静脈内、腫瘍内注射のために調製される(Remington’s Pharmaceutical Sciences 16th edition,Osol,A.Ed.(1980))。薬学的に許容される担体は一般に、レシピエントに対し、用いられる投薬量及び濃度で無毒であり、緩衝液(リン酸、クエン酸、及び他の有機酸など)、アスコルビン酸及びメチオニンを含む酸化防止剤、保存剤(オクタデシルジメチルベンジル塩化アンモニウム、塩化ヘキサメトニウム、塩化ベンザルコニウム、塩化ベンゼトニウム、フェノール、ブチル、もしくはベンジルアルコール、アルキルパラベン(メチルもしくはプロピルパラベンなど)、カテコール、レゾルシノール、シクロヘキサノール、3-ペンタノール、及びm-クレゾールなど)、低分子量(約10残基未満)ポリペプチド、タンパク質(血清アルブミン、ゼラチン、もしくは免疫グロブリンなど)、親水性ポリマー(ポリビニルピロリドンなど)、アミノ酸(グリシン、グルタミン、アスパラギン、ヒスチジン、アルギニン、もしくはリジンなど)、単糖類、二糖類、及び他の炭水化物(グルコース、マンノース、もしくはデキストリンを含む)、キレート剤(EDTAなど)、糖類(スクロース、マンニトール、トレハロース、もしくはソルビトールなど)、塩形成対イオン(ナトリウムなど)、金属錯体(例えば、Zn-タンパク質錯体)、及び/または非イオン性界面活性剤(ポリエチレングリコール(PEG)など)を含むが、これらに限定されない。本明細書における例示的な薬学的に許容される担体は、可溶性の中性活性ヒアルロニダーゼ糖タンパク質(sHASEGP)、例えば、ヒト可溶性PH-20ヒアルロニダーゼ糖タンパク質(rHuPH20(HYLENEX(登録商標)、Baxter International,Inc.)など)などの介在性薬物分散剤を更に含む。rHuPH20を含む、特定の例示的なsHASEGP及び使用方法は、米国特許公開第2005/0260186号及び同第2006/0104968号に記載されている。一態様において、sHASEGPは、コンドロイチナーゼなどの1つ以上の追加のグリコサミノグリカナーゼと組み合わされる。
本発明の抗体-薬物コンジュゲートは、例えば、腫瘍抗原の過剰発現を特徴とする様々な疾患または障害を治療するために使用され得ることが企図される。例示的な病態または過剰増殖性障害としては、良性または悪性の固形腫瘍、ならびに血液疾患(白血病及びリンパ系腫瘍など)が挙げられる。他には、ニューロン性、膠細胞性、星状細胞性、視床下部性、腺性、マクロファージ性、上皮性、間質性、胞胚腔性、炎症性、血管新生性、及び免疫性(自己免疫性を含む)障害が挙げられる。
本発明の別の態様において、本明細書に記載される障害の治療、予防、及び/または診断に有用な材料を含有する製造品が提供される。製造品は、容器と、容器上のもしくは容器に関連するラベルまたは添付文書とを含む。好適な容器としては、例えば、ボトル、バイアル、シリンジ、静脈注射用溶液バッグなどが挙げられる。容器は、ガラスまたはプラスチックなどの様々な材料から形成され得る。容器は、それ自体で、または別の組成物との組み合わせで、障害の治療、予防、及び/または診断に有効である組成物を保持し、滅菌アクセスポートを有し得る(例えば、容器は、静脈注射用溶液バッグまたは皮下注射針によって穿孔可能な栓を有するバイアルであり得る)。組成物中の少なくとも1つの活性薬剤は、本発明の抗体-薬物コンジュゲートである。ラベルまたは添付文書は、組成物が、選択される病態を治療するために使用されることを示す。更に、製造品は、(a)本発明の抗体-薬物コンジュゲートを含む組成物を内部に収容した第1の容器と、(b)更なる細胞毒性剤またはさもなければ治療剤を含む組成物を内部に収容した第2の容器とを含み得る。本発明のこの実施形態における製造品は、組成物が特定の病態を治療するために使用され得ることを示す添付文書を更に含み得る。あるいは、または加えて、製造品は、注入用静菌水(BWFI)、リン酸緩衝生理食塩水、リンガー溶液、またはデキストロース溶液などの薬学的に許容される緩衝液を含む第2の(または第3の)容器を更に含んでもよい。それは、他の緩衝液、希釈剤、フィルター、針、及びシリンジを含む、商業的観点及びユーザの観点から望ましい他の材料を更に含んでもよい。
中間体19(24mg、0.0264mmol)及び15(22mg、0.0528mmol)を無水DMF(2.0mL)中に溶解させた。混合物を20℃で2時間撹拌させ、混合物を濃縮し、分取TLC(DCM/MeOH=10/1)によって精製して、LD-51(13mg、41%)を得た。LCMS(5-95、AB、1.5分):RT=0.889分、m/z=1227.5[M+Na]+;1H NMR(400MHz,DMSO-d6)δ9.86(s,1H),7.62(d,J=8.4Hz,2H),7.61-7.50(m,2H),7.44(d,J=8.8Hz,2H),7.05-7.00(m,5H),6.92-6.70(m,4H),6.59(d,J=9.2Hz,2H),6.41-6.35(m,2H),5.84(s,1H),5.69(s,1H),5.32(s,1H),5.18(s,2H),4.86(s,1H),4.75(d,J=4.8Hz,2H),4.62(s,1H),4.51-4.38(m,1H),4.37-4.20(m,2H),4.18-3.98(m,1H),3.98-3.91(m,4H),3.74(s,1H),3.59(m,7H),3.43-3.38(m,5H),2.61(s,2H),2.44(d,J=10.0Hz,4H),1.80-1.55(m,4H),1.53-1.45(m,6H),1.27-1.22(m,4H).
WO2012/113847、WO2014/194247、US7659241、US7498298、US2009/0111756、US2009/0018086、US6214345、Dubowchik et al(2002)BioconjugateChem.13(4):855-869に記載される方法によって調製した4-((S)-2-((S)-2-(6-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)ヘキサンアミド)-3-メチルブタンアミド)-5-ウレイドペンタンアミド)ベンジル4-ニトロフェニルカルボネート(MC-vc-PAB-PNP)(13.91mg、0.020mmol)及びジイソプロピルエチルアミン(DIEA)(8.12mg、0.060mmol)のDMF溶液(5.0mL)に、21a(0.020mmol)を添加した。混合物を25℃で12時間撹拌した。混合物を分取HPLC(アセトニトリル35-65/水中0.225%のFA)によって精製して、LD-52を白色固体として得た。LCMSm/z[M+Na]+1303.6.
1,2-ビス(5-ニトロピリジン-2-イル)ジスルファン及び31の無水DCM:CH3OH/(1:1)溶液を、N2下、室温で24時間撹拌した。混合物を真空下で濃縮した後、残渣をDCMで希釈した。酸化マンガン(MnO2)を添加し、混合物を室温で更に0.5時間撹拌した。混合物をLCMSによって精製して、LD-55を得た。
(S)-4-(2-(1-(5-(2,5-ジオキソ-2,5-ジヒドロ-1H-ピロール-1-イル)ペンチルカルバモイル)シクロブタンカルボキサミド)-5-ウレイドペンタンアミド)ベンジル4-ニトロフェニルカルボネート12(17.78mg、0.0200mmol)及びDIEA(0.010mL、0.0600mmol)のDMF溶液(5.0mL)に、21a(11.0mg、0.020mmol)を添加した。混合物を25℃で12時間撹拌した。LCMSは、出発材料が消費され、所望の生成物が見出されたことを示した。混合物を分取-HPLC(アセトニトリル35-50/水中0.225%のFA、25mL/分)によって精製して、LD-59(10.1mg、48.5%)を白色固体として得た。LCMS(5-95、AB、1.5分):RT=0.688分、[M/2+H]+640.5.
抗体を大量に産生する場合、抗体は、CHO細胞内で産生された。VL及びVHをコードするベクターを、CHO細胞中にトランスフェクトし、IgGを、プロテインA親和性クロマトグラフィーによって細胞培養培地から精製した。
実施例1の還元及び再酸化の手順後に、システイン操作された抗体(THIOMAB(商標))を、PBS(リン酸緩衝生理食塩水)緩衝液に溶解させ、氷上で冷却する。過剰な、約1.5モル~20当量の、チオール反応性基(ピリジルジスルフィド、マレイミド、またはブロモアセトアミドなど)で活性化したシルベストロール-リンカー中間体を、DMSO中に溶解させ、アセトニトリル及び水中で希釈し、PBS中の冷却、還元、再酸化された抗体に添加する。典型的には、50mMのトリス(pH8)中の約20mMの濃度でDMSOストックからの薬物を抗体に添加し、反応混合物のLC-MS分析により決定される、反応が完了するまで約1~約24時間監視する。反応が完了したとき、過剰のエチルマレイミドなどのキャッピング試薬を添加して、反応を停止させ、いかなる未反応の抗体チオール基もキャッピングする。コンジュゲーション混合物を充填し、HiTrap SP FFカラムを通して溶出させて、過剰な薬物及び他の不純物を除去した。反応混合物を、遠心限外濾過によって濃縮し、システイン操作された抗体-薬物コンジュゲートを精製し、PBS中G25樹脂による溶出によって脱塩し、滅菌条件下で0.2μmのフィルターを通して濾過し、貯蔵のために凍結する。
抗体-薬物コンジュゲートのチオHu抗CD22 10F4v3 LC K149Cシルベストロール及びチオHu抗Ly6E 9B12.v12 LC K149Cシルベストロールの有効性を、以下のプロトコルを用いる細胞増殖アッセイによって測定した(CELLTITER GLO(商標)Luminescent Cell Viability Assay,Promega Corp.Technical Bulletin TB288、Mendoza et al.(2002)Cancer Res.62:5485-5488):
1.培地中約4000個の細胞(HER発現SK-BR-3及びKPL-4、CD22陽性BJAB、CD22陽性WSU-DLCL2、またはJurkat)を含有する40μlの細胞培養物のアリコートを、384ウェルの不透明ウェルプレートの各ウェルに堆積させた。
2.培地を含有するが細胞は有さない対照ウェルを調製した。
3.抗体-薬物コンジュゲート(n=3)を実験ウェルに添加し、3~5日間インキュベートした。
4.プレートは、およそ30分間室温で平衡化した。
5.各ウェル内に存在する細胞培養培地の量と等しい量のCELLTITER GLO(商標)試薬を添加した。
6.軌道振盪機で内容物を15分間混合して、細胞溶解を誘導した。
7.プレートを室温で5分間インキュベートして、発光シグナルを安定化した。
8.発光を記録し、活性%としてグラフで報告し、RLU(相対発光単位)は対照に対して正規化した(抗体なし対照マイナス細胞なし対照)。
腫瘍を確立させ、0日目の単一治療前に、(カリパスを使用して測定される)150~200mm3の体積まで成長させた。腫瘍体積を、式、V(mm3)=0.5A×B2(式中、A及びBはそれぞれ、長径及び短径である)に従って、カリパスを使用して測定する。腫瘍体積が3000mm3に達する前、または腫瘍が間近に迫った潰瘍形成の徴候を示したときに、マウスを安楽死させる。各実験群(1群当たり10匹のマウス)から収集したデータを、平均+標準誤差として表す。
乳癌細胞株HCC1569(CRL-2330)は、American Type Culture Collection(ATCC,Manassas,VA)から得た。HCC1569X2細胞株は、インビボでの成長のために最適化された親HCC1569細胞株(ATCC,CRL-2330)の誘導体である。親HCC1569細胞を、雌のSCID ベージュマウスの右側腹部に皮下注射し、1つの腫瘍を回収し、刻み、インビトロで成長させて、HCC1569 XI細胞株をもたらした。HCC1569 XI株を、細胞株の成長を改善する試みの中で、雌のSCID ベージュマウスの右側腹部に再度皮下注射した。この研究からの腫瘍を採取し、インビトロでの成長のために再度適合させて、HCC1569 X2細胞株を生成した。この株に由来するこの細胞株及び腫瘍は、Ly6Eを発現する。
55匹のC.B-17 SCIDマウスの側腹部に、1匹のマウス当たり0.2mLの体積で、2000万個のBjab-luc細胞を皮下に植え付ける。腫瘍が150~250mm3の平均腫瘍体積に達したとき、それらを6つに群分けした(各5匹)。0日目に単一治療を投与する。体積は0.2mLを超えず、針径は28または29ゲージである。
n=60匹のマウスに、1匹のマウス当たり300万個の細胞で、HBSS/Matrigel中に懸濁させたKPL-4細胞を、0.2mLの体積の胸部2/3乳腺脂肪体に植え付ける。腫瘍が150~250mm3の平均腫瘍体積に達したとき、それらを8つに群分けする(各5匹)。0日目に単一治療を投与する。体積は0.2mLを超えず、針径は28または29ゲージである。
Claims (52)
- 1つ以上の腫瘍関連抗原または細胞表面受容体が、(1)~(53)、
(1)BMPR1B(骨形成タンパク質受容体IB型)、
(2)E16(LAT1、SLC7A5)、
(3)STEAP1(前立腺の6回膜貫通上皮抗原)、
(4)MUC16(0772P、CA125)、
(5)MPF(MPF、MSLN、SMR、巨核球増強因子、メソテリン)、
(6)Napi2b(NAPI-3B、NPTIIb、SLC34A2、溶質輸送体ファミリー34(リン酸ナトリウム)、メンバー2、II型ナトリウム依存性リン酸輸送体3b)、
(7)Sema 5b(FLJ10372、KIAA1445、Mm.42015、SEMA5B、SEMAG、セマフォリン5b Hlog、セマドメイン、7回トロンボスポンジン反復(1型及び1型様)、膜貫通ドメイン(TM)、ならびに短い細胞質ドメイン、(セマフォリン)5B)、
(8)PSCA hlg(2700050C12Rik、C530008O16Rik、RIKEN cDNA 2700050C12、RIKEN cDNA 2700050C12遺伝子)、
(9)ETBR(エンドセリンB型受容体)、
(10)MSG783(RNF124、仮説上のタンパク質FLJ20315)、
(11)STEAP2(HGNC_8639、IPCA-1、PCANAP1、STAMP1、STEAP2、STMP、前立腺癌関連遺伝子1、前立腺癌関連タンパク質1、前立腺の6回膜貫通上皮抗原2、6回膜貫通前立腺タンパク質)、
(12)TrpM4(BR22450、FLJ20041、TRPM4、TRPM4B、一過性受容体電位カチオンチャネル、サブファミリーM、メンバー4)、
(13)CRIPTO(CR、CR1、CRGF、CRIPTO、TDGF1、奇形癌種由来の成長因子)、
(14)CD21(CR2(補体受容体2)またはC3DR(C3d/エプスタイン・バーウイルス受容体)またはHs73792)、
(15)CD79b(CD79B、CD79β、IGb(免疫グロブリン関連ベータ)、B29)、
(16)FcRH2(IFGP4、IRTA4、SPAP1A(SH2ドメイン含有ホスファターゼアンカータンパク質1a)、SPAP1B、SPAP1C)、
(17)HER2、
(18)NCA、
(19)MDP、
(20)IL20Rα、
(21)ブレビカン、
(22)EphB2R、
(23)ASLG659、
(24)PSCA、
(25)GEDA、
(26)BAFF-R(B細胞活性化因子受容体、BLyS受容体3、BR3)、
(27)CD22(B細胞受容体CD22-Bアイソフォーム)、
(28)CD79a(CD79A、CD79α、免疫グロブリン関連アルファ)、
(29)CXCR5(バーキットリンパ腫受容体1)、
(30)HLA-DOB(MHCクラスII分子のベータサブユニット(Ia抗原))、
(31)P2X5(プリン受容体P2Xリガンド開口型イオンチャネル5)、
(32)CD72(B細胞分化抗原CD72、Lyb-2)、
(33)LY64(リンパ球抗原64(RP105)、ロイシンリッチ反復(LRR)ファミリーのI型膜タンパク質)、
(34)FcRH1(Fc受容体様タンパク質1)、
(35)FcRH5(IRTA2、免疫グロブリンスーパーファミリー受容体転位関連2)、
(36)TENB2(推定上の膜貫通プロテオグリカン)、
(37)PMEL17(silver相同体、SILV、D12S53E、PMEL17、SI、SIL)、
(38)TMEFF1(EGF様ドメイン及び2つのフォリスタチン様ドメインを有する膜貫通タンパク質1、トモレグリン-1)、
(39)GDNF-Ra1(GDNFファミリー受容体アルファ1、GFRA1、GDNFR、GDNFRA、RETL1、TRNR1、RET1L、GDNFR-アルファ1、GFR-ALPHA-1)、
(40)Ly6E(リンパ球抗原6複合体、遺伝子座E、Ly67、RIG-E、SCA-2、TSA-1)、
(41)TMEM46(shisa相同体2(Xenopus laevis)、SHISA2)、
(42)Ly6G6D(リンパ球抗原6複合体、遺伝子座G6D、Ly6-D、MEGT1)、
(43)LGR5(ロイシンリッチ反復含有Gタンパク質結合型受容体5、GPR49、GPR67)、
(44)RET(retがん原遺伝子、MEN2A、HSCR1、MEN2B、MTC1、PTC、CDHF12、Hs.168114、RET51、RET-ELE1)、
(45)LY6K(リンパ球抗原6複合体、遺伝子座K、LY6K、HSJ001348、FLJ35226)、
(46)GPR19(Gタンパク質結合型受容体19、Mm.4787)、
(47)GPR54(KISS1受容体、KISS1R、GPR54、HOT7T175、AXOR12)、
(48)ASPHD1(アスパラギン酸ベータ-ヒドロキシラーゼドメイン含有1、LOC253982)、
(49)チロシナーゼ(TYR、OCAIA、OCA1A、チロシナーゼ、SHEP3)、
(50)TMEM118(ringフィンガータンパク質、膜貫通2、RNFT2、FLJ14627)、
(51)GPR172A(Gタンパク質結合型受容体172A、GPCR41、FLJ11856、D15Ertd747e)、
(52)CD33、ならびに
(53)CLL-1から選択される、請求項1に記載の抗体-薬物コンジュゲート化合物。 - Abが、抗HER2 4D5、抗CD22、抗CD33、抗Ly6E、抗Napi3b、抗HER2 7C2、及び抗CLL-1から選択される、請求項2に記載の抗体-薬物コンジュゲート化合物。
- Abが、システイン操作された抗体である、請求項1に記載の抗体-薬物コンジュゲート化合物。
- 前記システイン操作された抗体が、HC A118C、LC K149C、HC A140C、LC V205C、LC S121C、及びHC L177Cから選択される変異体である、請求項4に記載の抗体-薬物コンジュゲート化合物。
- Lが、式、
-Str-PM-Y-
を有する、プロテアーゼ-切断可能な非ペプチドリンカーであり、
式中、Strが、前記抗体に共有結合したストレッチャー単位であり、PMが、ペプチドミメティック単位であり、Yが、前記シルベストロール薬物部分に共有結合したスペーサー単位である、請求項1に記載の抗体-薬物コンジュゲート化合物。 - R6が、(CH2)5である、請求項7に記載の抗体-薬物コンジュゲート化合物。
- Yが、パラ-アミノベンジルまたはパラ-アミノベンジルオキシカルボニルを含む、請求項6に記載の抗体-薬物コンジュゲート化合物。
- Lが、式、
-Str-Pep-Y-
を有するペプチドリンカーであり、
式中、Strが、前記抗体に共有結合したストレッチャー単位であり、Pepが、2~12個のアミノ酸残基のペプチドであり、Yが、前記シルベストロール薬物部分に共有結合したスペーサー単位である、請求項1に記載の抗体-薬物コンジュゲート化合物。 - R6が、(CH2)5である、請求項17に記載の抗体-薬物コンジュゲート化合物。
- Pepが、グリシン、アラニン、フェニルアラニン、リジン、アルギニン、バリン、及びシトルリンから独立して選択される2~12個のアミノ酸残基を含む、請求項16に記載の抗体-薬物コンジュゲート化合物。
- Pepが、バリン-シトルリン、アラニン-フェニルアラニン、及びフェニルアラニン-リジンから選択される、請求項19に記載の抗体-薬物コンジュゲート化合物。
- Yが、パラ-アミノベンジルまたはパラ-アミノベンジルオキシカルボニルを含む、請求項16に記載の抗体-薬物コンジュゲート化合物。
- Lが、ジスルフィド基を含む、請求項1に記載の抗体-薬物コンジュゲート化合物。
- pが、1、2、3、または4である、請求項1に記載の抗体-薬物コンジュゲート化合物。
- 前記抗体-薬物コンジュゲート化合物の混合物を含み、前記抗体-薬物コンジュゲート化合物の混合物中の1抗体当たりの平均薬物負荷が、約2~約5である、請求項1に記載の抗体-薬物コンジュゲート化合物。
- 請求項1に記載の抗体-薬物コンジュゲート化合物と、薬学的に許容される希釈剤、担体、または賦形剤と、を含む、薬学的組成物。
- 哺乳動物におけるがんの治療のための医薬品の製造における、請求項1に記載の抗体-薬物コンジュゲート化合物の使用。
- 請求項1に記載の抗体-薬物コンジュゲート化合物を含む、がんを治療するための医薬。
- L-Xが、-CH2CH2-X、-CH2CR2-X、-C(O)NRCH2-X、-CH2O-X、-CH2N(R)-X、-N(R)-X、-N(R)(C1-C12アルキレン)-X、-N(R)(C2-C8アルケニレン)-X、-N(R)(C2-C8アルキニレン)-X、及び-N(R)(CH2CH2O)n-Xから選択され、
nが、1~6であり、
Rが独立して、H、C1-C12アルキル、及びC6-C20アリールから選択されるか、または2つのRが、C3-C7炭素環状環を形成し、
アルキレン、アルケニレン、アルキニレン、アルキル、及びアリールが、F、Cl、Br、N(CH3)2、NO2、及びOCH3から選択される1つ以上の基で任意で置換される、請求項36に記載のシルベストロール-リンカー中間体化合物。 - アルキレンが、-CH2CH2-、-CH2CH2CH2-、-CH(CH3)CH2-、及び-C(CH3)2CH2-から選択される、請求項37に記載のシルベストロール-リンカー中間体化合物。
- Raが、-OCH3である、請求項36に記載のシルベストロール-リンカー中間体化合物。
- R1が、-OCH3であり、R2が、L-Xである、請求項36に記載のシルベストロール-リンカー中間体化合物。
- R1が、L-Xであり、R2が、-CH(OH)CH2OHである、請求項36に記載のシルベストロール-リンカー中間体化合物。
- Lが、式、
-Str-PM-Y-
を有する、プロテアーゼ-切断可能な非ペプチドリンカーであり、
式中、Strが、Xに共有結合したストレッチャー単位であり、PMが、ペプチドミメティック単位であり、Yが、前記シルベストロール薬物部分に共有結合したスペーサー単位である、請求項36に記載のシルベストロール-リンカー中間体化合物。 - Strが、(CH2)5である、請求項43に記載のシルベストロール-リンカー中間体化合物。
- R7及びR8が一緒になって、シクロブチルを形成する、請求項45に記載のシルベストロール-リンカー中間体化合物。
- Yが、パラ-アミノベンジルまたはパラ-アミノベンジルオキシカルボニルを含む、請求項43に記載のシルベストロール-リンカー中間体化合物。
- Lが、式、
-Str-Pep-Y-
を有するペプチドリンカーであり、
式中、Strが、前記抗体に共有結合したストレッチャー単位であり、Pepが、2~12個のアミノ酸残基のペプチドであり、Yが、前記シルベストロール薬物部分に共有結合したスペーサー単位である、請求項36に記載のシルベストロール-リンカー中間体化合物。 - Strが、(CH2)5である、請求項48に記載のシルベストロール-リンカー中間体化合物。
- Pepが、グリシン、アラニン、フェニルアラニン、リジン、アルギニン、バリン、及びシトルリンから独立して選択される2個のアミノ酸残基を含む、請求項48に記載のシルベストロール-リンカー中間体化合物。
- 請求項1に記載の抗体-薬物コンジュゲート化合物を作製する方法であって、抗体を、請求項36に記載の式IIのシルベストロール-リンカー中間体化合物と反応させることを含む、前記方法。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201662346024P | 2016-06-06 | 2016-06-06 | |
| US62/346,024 | 2016-06-06 | ||
| PCT/US2017/035925 WO2017214024A1 (en) | 2016-06-06 | 2017-06-05 | Silvestrol antibody-drug conjugates and methods of use |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2019527673A JP2019527673A (ja) | 2019-10-03 |
| JP2019527673A5 JP2019527673A5 (ja) | 2020-07-09 |
| JP7043425B2 true JP7043425B2 (ja) | 2022-03-29 |
Family
ID=59071109
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2018563547A Active JP7043425B2 (ja) | 2016-06-06 | 2017-06-05 | シルベストロール抗体-薬物コンジュゲート及び使用方法 |
Country Status (5)
| Country | Link |
|---|---|
| US (2) | US10639378B2 (ja) |
| EP (1) | EP3464280B1 (ja) |
| JP (1) | JP7043425B2 (ja) |
| CN (1) | CN109476648B (ja) |
| WO (1) | WO2017214024A1 (ja) |
Families Citing this family (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN107708702A (zh) | 2014-11-17 | 2018-02-16 | 塞勒克塔生物科学有限公司 | 磷脂醚类似物作为靶向癌症的药物载体 |
| WO2017097986A1 (en) | 2015-12-09 | 2017-06-15 | Medizinische Universität Wien | Monomaleimide-functionalized platinum compounds for cancer therapy |
| US10639378B2 (en) | 2016-06-06 | 2020-05-05 | Genentech, Inc. | Silvestrol antibody-drug conjugates and methods of use |
| EP3755693B1 (en) * | 2018-02-19 | 2024-06-12 | Memorial Sloan-Kettering Cancer Center | Agents and methods for treating dysproliferative diseases |
| SG11202009549YA (en) * | 2018-04-10 | 2020-10-29 | Cellectar Biosciences Inc | Phospholipid-flavagline conjugates and methods of using the same for targeted cancer therapy |
| WO2020234461A1 (en) * | 2019-05-23 | 2020-11-26 | Heidelberg Pharma Research Gmbh | Antibody drug conjugates with cleavable linkers |
| CN114761389A (zh) * | 2019-10-10 | 2022-07-15 | 塞勒科塔生物科学公司 | 磷脂-flavagline缀合物和将其用于靶向癌症治疗的方法 |
| WO2024138128A2 (en) | 2022-12-23 | 2024-06-27 | Genentech, Inc. | Cereblon degrader conjugates, and uses thereof |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015095227A2 (en) | 2013-12-16 | 2015-06-25 | Genentech, Inc. | Peptidomimetic compounds and antibody-drug conjugates thereof |
Family Cites Families (328)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US558758A (en) | 1896-04-21 | Fastening insulator-brackets | ||
| US798959A (en) | 1904-12-19 | 1905-09-05 | George W Goss | Corn-husker. |
| US1402931A (en) * | 1915-03-18 | 1922-01-10 | Hewitt Peter Cooper | Method and apparatus for the production and utilization of electric currents |
| US4816567A (en) | 1983-04-08 | 1989-03-28 | Genentech, Inc. | Recombinant immunoglobin preparations |
| US5807715A (en) | 1984-08-27 | 1998-09-15 | The Board Of Trustees Of The Leland Stanford Junior University | Methods and transformed mammalian lymphocyte cells for producing functional antigen-binding protein including chimeric immunoglobulin |
| US4676980A (en) | 1985-09-23 | 1987-06-30 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Target specific cross-linked heteroantibodies |
| US5583024A (en) | 1985-12-02 | 1996-12-10 | The Regents Of The University Of California | Recombinant expression of Coleoptera luciferase |
| US6548640B1 (en) | 1986-03-27 | 2003-04-15 | Btg International Limited | Altered antibodies |
| IL85035A0 (en) | 1987-01-08 | 1988-06-30 | Int Genetic Eng | Polynucleotide molecule,a chimeric antibody with specificity for human b cell surface antigen,a process for the preparation and methods utilizing the same |
| JP3101690B2 (ja) | 1987-03-18 | 2000-10-23 | エス・ビィ・2・インコーポレイテッド | 変性抗体の、または変性抗体に関する改良 |
| AU634186B2 (en) | 1988-11-11 | 1993-02-18 | Medical Research Council | Single domain ligands, receptors comprising said ligands, methods for their production, and use of said ligands and receptors |
| DE3920358A1 (de) | 1989-06-22 | 1991-01-17 | Behringwerke Ag | Bispezifische und oligospezifische, mono- und oligovalente antikoerperkonstrukte, ihre herstellung und verwendung |
| WO1991002536A1 (en) | 1989-08-23 | 1991-03-07 | Scripps Clinic And Research Foundation | Compositions and methods for detection and treatment of epstein-barr virus infection and immune disorders |
| US5208020A (en) | 1989-10-25 | 1993-05-04 | Immunogen Inc. | Cytotoxic agents comprising maytansinoids and their therapeutic use |
| US5959177A (en) | 1989-10-27 | 1999-09-28 | The Scripps Research Institute | Transgenic plants expressing assembled secretory antibodies |
| US6150584A (en) | 1990-01-12 | 2000-11-21 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| US6075181A (en) | 1990-01-12 | 2000-06-13 | Abgenix, Inc. | Human antibodies derived from immunized xenomice |
| JPH053790A (ja) | 1990-04-19 | 1993-01-14 | Fujisawa Pharmaceut Co Ltd | デヒドロペプチダーゼ−i |
| US5256643A (en) | 1990-05-29 | 1993-10-26 | The Government Of The United States | Human cripto protein |
| US5770429A (en) | 1990-08-29 | 1998-06-23 | Genpharm International, Inc. | Transgenic non-human animals capable of producing heterologous antibodies |
| AU9016591A (en) | 1990-10-25 | 1992-05-26 | Tanox Biosystems, Inc. | Glycoproteins associated with membrane-bound immunoglobulins as antibody targets on B cells |
| DK0564531T3 (da) | 1990-12-03 | 1998-09-28 | Genentech Inc | Berigelsesfremgangsmåde for variantproteiner med ændrede bindingsegenskaber |
| US5571894A (en) | 1991-02-05 | 1996-11-05 | Ciba-Geigy Corporation | Recombinant antibodies specific for a growth factor receptor |
| US5440021A (en) | 1991-03-29 | 1995-08-08 | Chuntharapai; Anan | Antibodies to human IL-8 type B receptor |
| US5543503A (en) | 1991-03-29 | 1996-08-06 | Genentech Inc. | Antibodies to human IL-8 type A receptor |
| DK0577752T4 (da) | 1991-03-29 | 2007-10-22 | Genentech Inc | Human PF4A receptorer og deres anvendelse |
| EP0940468A1 (en) | 1991-06-14 | 1999-09-08 | Genentech, Inc. | Humanized antibody variable domain |
| GB9114948D0 (en) | 1991-07-11 | 1991-08-28 | Pfizer Ltd | Process for preparing sertraline intermediates |
| JP3050424B2 (ja) | 1991-07-12 | 2000-06-12 | 塩野義製薬株式会社 | ヒトエンドセリンリセプター |
| US5264557A (en) | 1991-08-23 | 1993-11-23 | The United States Of America As Represented By The Department Of Health And Human Services | Polypeptide of a human cripto-related gene, CR-3 |
| EP0861893A3 (en) | 1991-09-19 | 1999-11-10 | Genentech, Inc. | High level expression of immunoglobulin polypeptides |
| WO1993008829A1 (en) | 1991-11-04 | 1993-05-13 | The Regents Of The University Of California | Compositions that mediate killing of hiv-infected cells |
| US6011146A (en) | 1991-11-15 | 2000-01-04 | Institut Pasteur | Altered major histocompatibility complex (MHC) determinant and methods of using the determinant |
| US6153408A (en) | 1991-11-15 | 2000-11-28 | Institut Pasteur And Institut National De La Sante Et De La Recherche Medicale | Altered major histocompatibility complex (MHC) determinant and methods of using the determinant |
| ATE503496T1 (de) | 1992-02-06 | 2011-04-15 | Novartis Vaccines & Diagnostic | Biosynthetisches bindeprotein für tumormarker |
| IL107366A (en) | 1992-10-23 | 2003-03-12 | Chugai Pharmaceutical Co Ltd | Genes coding for megakaryocyte potentiator |
| US5644033A (en) | 1992-12-22 | 1997-07-01 | Health Research, Inc. | Monoclonal antibodies that define a unique antigen of human B cell antigen receptor complex and methods of using same for diagnosis and treatment |
| US5869445A (en) | 1993-03-17 | 1999-02-09 | University Of Washington | Methods for eliciting or enhancing reactivity to HER-2/neu protein |
| US5801005A (en) | 1993-03-17 | 1998-09-01 | University Of Washington | Immune reactivity to HER-2/neu protein for diagnosis of malignancies in which the HER-2/neu oncogene is associated |
| US6214345B1 (en) | 1993-05-14 | 2001-04-10 | Bristol-Myers Squibb Co. | Lysosomal enzyme-cleavable antitumor drug conjugates |
| JPH08511420A (ja) | 1993-06-16 | 1996-12-03 | セルテック・セラピューテイクス・リミテッド | 抗 体 |
| US5773223A (en) | 1993-09-02 | 1998-06-30 | Chiron Corporation | Endothelin B1, (ETB1) receptor polypeptide and its encoding nucleic acid methods, and uses thereof |
| US5750370A (en) | 1995-06-06 | 1998-05-12 | Human Genome Sciences, Inc. | Nucleic acid encoding human endothlein-bombesin receptor and method of producing the receptor |
| US5789199A (en) | 1994-11-03 | 1998-08-04 | Genentech, Inc. | Process for bacterial production of polypeptides |
| US5840523A (en) | 1995-03-01 | 1998-11-24 | Genetech, Inc. | Methods and compositions for secretion of heterologous polypeptides |
| US5731168A (en) | 1995-03-01 | 1998-03-24 | Genentech, Inc. | Method for making heteromultimeric polypeptides |
| JPH08336393A (ja) | 1995-04-13 | 1996-12-24 | Mitsubishi Chem Corp | 光学活性なγ−置換−β−ヒドロキシ酪酸エステルの製造法 |
| US5869046A (en) | 1995-04-14 | 1999-02-09 | Genentech, Inc. | Altered polypeptides with increased half-life |
| US5707829A (en) | 1995-08-11 | 1998-01-13 | Genetics Institute, Inc. | DNA sequences and secreted proteins encoded thereby |
| US6267958B1 (en) | 1995-07-27 | 2001-07-31 | Genentech, Inc. | Protein formulation |
| US20020193567A1 (en) | 1995-08-11 | 2002-12-19 | Genetics Institute, Inc. | Secreted proteins and polynucleotides encoding them |
| JP3646191B2 (ja) | 1996-03-19 | 2005-05-11 | 大塚製薬株式会社 | ヒト遺伝子 |
| EP0910636A1 (en) | 1996-05-17 | 1999-04-28 | Schering Corporation | Human b-cell antigens, related reagents |
| US5945511A (en) | 1997-02-20 | 1999-08-31 | Zymogenetics, Inc. | Class II cytokine receptor |
| US7033827B2 (en) | 1997-02-25 | 2006-04-25 | Corixa Corporation | Prostate-specific polynucleotide compositions |
| US20030185830A1 (en) | 1997-02-25 | 2003-10-02 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of prostate cancer |
| US6261791B1 (en) | 1997-03-10 | 2001-07-17 | The Regents Of The University Of California | Method for diagnosing cancer using specific PSCA antibodies |
| US6541212B2 (en) | 1997-03-10 | 2003-04-01 | The Regents Of The University Of California | Methods for detecting prostate stem cell antigen protein |
| EP0981541B1 (en) | 1997-03-10 | 2004-06-02 | The Regents Of The University Of California | Psca: prostate stem cell antigen |
| US6555339B1 (en) | 1997-04-14 | 2003-04-29 | Arena Pharmaceuticals, Inc. | Non-endogenous, constitutively activated human protein-coupled receptors |
| US6319688B1 (en) | 1997-04-28 | 2001-11-20 | Smithkline Beecham Corporation | Polynucleotide encoding human sodium dependent phosphate transporter (IPT-1) |
| ES2246069T3 (es) | 1997-05-02 | 2006-02-01 | Genentech, Inc. | Procedimiento de preparacion de anticuerpos multiespecificos que tienen componentes comunes y multimericos. |
| US6890749B2 (en) | 1997-05-15 | 2005-05-10 | Abbott Laboratories | Reagents and methods useful for detecting diseases of the prostate |
| WO1998051824A1 (en) | 1997-05-15 | 1998-11-19 | Abbott Laboratories | Reagents and methods useful for detecting disease of the urinary tract |
| US6171586B1 (en) | 1997-06-13 | 2001-01-09 | Genentech, Inc. | Antibody formulation |
| US6040498A (en) | 1998-08-11 | 2000-03-21 | North Caroline State University | Genetically engineered duckweed |
| US6602677B1 (en) | 1997-09-19 | 2003-08-05 | Promega Corporation | Thermostable luciferases and methods of production |
| US20030060612A1 (en) | 1997-10-28 | 2003-03-27 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| US20020034749A1 (en) | 1997-11-18 | 2002-03-21 | Billing-Medel Patricia A. | Reagents and methods useful for detecting diseases of the breast |
| US6610833B1 (en) | 1997-11-24 | 2003-08-26 | The Institute For Human Genetics And Biochemistry | Monoclonal human natural antibodies |
| US6110695A (en) | 1997-12-02 | 2000-08-29 | The Regents Of The University Of California | Modulating the interaction of the chemokine, B Lymphocyte Hemoattractant, and its Receptor, BLR1 |
| AU760562B2 (en) | 1997-12-05 | 2003-05-15 | Scripps Research Institute, The | Humanization of murine antibody |
| CA2323071C (en) | 1998-03-13 | 2011-06-21 | The Burnham Institute | Molecules that home to various selected organs or tissues |
| ATE375365T1 (de) | 1998-04-02 | 2007-10-15 | Genentech Inc | Antikörper varianten und fragmente davon |
| US6194551B1 (en) | 1998-04-02 | 2001-02-27 | Genentech, Inc. | Polypeptide variants |
| DE19820190A1 (de) | 1998-04-28 | 1999-11-04 | Metagen Gesellschaft Fuer Genomforschung Mbh | Menschliche Nukleinsäuresequenzen aus Pankreas-Tumor |
| AU4078599A (en) | 1998-05-13 | 1999-11-29 | Epimmune, Inc. | Expression vectors for stimulating an immune response and methods of using the same |
| US20030064397A1 (en) | 1998-05-22 | 2003-04-03 | Incyte Genomics, Inc. | Transmembrane protein differentially expressed in prostate and lung tumors |
| US20020187472A1 (en) | 2001-03-09 | 2002-12-12 | Preeti Lal | Steap-related protein |
| WO2000012130A1 (en) | 1998-08-27 | 2000-03-09 | Smithkline Beecham Corporation | Rp105 agonists and antagonists |
| JP4689781B2 (ja) | 1998-09-03 | 2011-05-25 | 独立行政法人科学技術振興機構 | アミノ酸輸送蛋白及びその遺伝子 |
| AU5963699A (en) | 1998-10-02 | 2000-04-26 | Mcmaster University | Spliced form of (erb)b-2/neu oncogene |
| WO2001057188A2 (en) | 2000-02-03 | 2001-08-09 | Hyseq, Inc. | Novel nucleic acids and polypeptides |
| US20030091580A1 (en) | 2001-06-18 | 2003-05-15 | Mitcham Jennifer L. | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US6468546B1 (en) | 1998-12-17 | 2002-10-22 | Corixa Corporation | Compositions and methods for therapy and diagnosis of ovarian cancer |
| US6962980B2 (en) | 1999-09-24 | 2005-11-08 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US20020119158A1 (en) | 1998-12-17 | 2002-08-29 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US6858710B2 (en) | 1998-12-17 | 2005-02-22 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| AU776672B2 (en) | 1998-12-30 | 2004-09-16 | Beth Israel Deaconess Medical Center | Characterization of a calcium channel family |
| KR100940380B1 (ko) | 1999-01-15 | 2010-02-02 | 제넨테크, 인크. | 효과기 기능이 변화된 폴리펩티드 변이체 |
| US6737056B1 (en) | 1999-01-15 | 2004-05-18 | Genentech, Inc. | Polypeptide variants with altered effector function |
| CN1201004C (zh) | 1999-01-29 | 2005-05-11 | 考丽克萨有限公司 | HER-2/neu融合蛋白 |
| GB9905124D0 (en) | 1999-03-05 | 1999-04-28 | Smithkline Beecham Biolog | Novel compounds |
| US7232889B2 (en) | 1999-03-08 | 2007-06-19 | Genentech, Inc. | PRO300 antibodies |
| AU3395900A (en) | 1999-03-12 | 2000-10-04 | Human Genome Sciences, Inc. | Human lung cancer associated gene sequences and polypeptides |
| US7304126B2 (en) | 1999-05-11 | 2007-12-04 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| AU4952600A (en) | 1999-06-03 | 2000-12-28 | Takeda Chemical Industries Ltd. | Screening method with the use of cd100 |
| CN100482281C (zh) | 1999-06-25 | 2009-04-29 | 基因技术股份有限公司 | 抗ErbB抗体-类美坦素偶联物在制备药物中的应用 |
| US20030119113A1 (en) | 1999-07-20 | 2003-06-26 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US7297770B2 (en) | 1999-08-10 | 2007-11-20 | Genentech, Inc. | PRO6496 polypeptides |
| US7294696B2 (en) | 1999-08-17 | 2007-11-13 | Genentech Inc. | PRO7168 polypeptides |
| EP1208202A2 (en) | 1999-09-01 | 2002-05-29 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US20030232056A1 (en) | 1999-09-10 | 2003-12-18 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US20030206918A1 (en) | 1999-09-10 | 2003-11-06 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| US20030129192A1 (en) | 1999-09-10 | 2003-07-10 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of ovarian cancer |
| KR100797667B1 (ko) | 1999-10-04 | 2008-01-23 | 메디카고 인코포레이티드 | 외래 유전자의 전사를 조절하는 방법 |
| US7125978B1 (en) | 1999-10-04 | 2006-10-24 | Medicago Inc. | Promoter for regulating expression of foreign genes |
| CA2387108A1 (en) | 1999-10-29 | 2001-06-07 | Genentech, Inc. | Anti-prostate stem cell antigen (psca) antibody compositions and methods of use |
| EP2363403B1 (en) | 1999-11-29 | 2016-04-20 | The Trustees of Columbia University in the City of New York | Isolation of five novel genes coding for new fc receptors-type melanoma involved in the pathogenesis of lymphoma/melanoma |
| AU1807401A (en) | 1999-11-30 | 2001-06-12 | Corixa Corporation | Compositions and methods for therapy and diagnosis of breast cancer |
| JP2003530083A (ja) | 1999-12-10 | 2003-10-14 | エピミューン インコーポレイテッド | ペプチドおよび核酸組成物を使用する、HER2/neuに対する細胞性免疫応答の誘導 |
| IL149809A0 (en) | 1999-12-15 | 2002-11-10 | Genentech Inc | Shotgun scanning, a combinatorial method for mapping functional protein epitopes |
| DK1616575T3 (da) | 1999-12-23 | 2012-09-10 | Zymogenetics Inc | Fremgangsmåde til behandling af inflammation |
| WO2001046232A2 (en) | 1999-12-23 | 2001-06-28 | Zymogenetics, Inc. | Soluble interleukin-20 receptor |
| US6610286B2 (en) | 1999-12-23 | 2003-08-26 | Zymogenetics, Inc. | Method for treating inflammation using soluble receptors to interleukin-20 |
| NZ502058A (en) | 1999-12-23 | 2003-11-28 | Ovita Ltd | Isolated mutated nucleic acid molecule for regulation of ovulation rate |
| US7297333B2 (en) | 2000-01-20 | 2007-11-20 | Genentech, Inc. | Anti-PRO10268 antibodies |
| US20030224379A1 (en) | 2000-01-21 | 2003-12-04 | Tang Y. Tom | Novel nucleic acids and polypeptides |
| US20020039573A1 (en) | 2000-01-21 | 2002-04-04 | Cheever Martin A. | Compounds and methods for prevention and treatment of HER-2/neu associated malignancies |
| US20030186372A1 (en) | 2000-02-11 | 2003-10-02 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US20030219806A1 (en) | 2000-02-22 | 2003-11-27 | Millennium Pharmaceuticals, Inc. | Novel 18607, 15603, 69318, 12303, 48000, 52920, 5433, 38554, 57301, 58324, 55063, 52991, 59914, 59921 and 33751 molecules and uses therefor |
| AU2001238596A1 (en) | 2000-02-22 | 2001-09-03 | Millennium Pharmaceuticals, Inc. | 18607, a novel human calcium channel |
| US20040005561A1 (en) | 2000-03-01 | 2004-01-08 | Corixa Corporation | Compositions and methods for the detection, diagnosis and therapy of hematological malignancies |
| US20040002068A1 (en) | 2000-03-01 | 2004-01-01 | Corixa Corporation | Compositions and methods for the detection, diagnosis and therapy of hematological malignancies |
| AU2001245280A1 (en) | 2000-03-07 | 2001-09-17 | Hyseq, Inc. | Novel nucleic acids and polypeptides |
| WO2001072962A2 (en) | 2000-03-24 | 2001-10-04 | Fahri Saatcioglu | Novel prostate-specific or testis-specific nucleic acid molecules, polypeptides, and diagnostic and therapeutic methods |
| WO2001072830A2 (de) | 2000-03-31 | 2001-10-04 | Ipf Pharmaceuticals Gmbh | Diagnostik- und arzneimittel zur untersuchung des zelloberflächenproteoms von tumor- und entzündungszellen sowie zur behandlung von tumorerkrankungen und entzündlichen erkrankungen vorzugsweise mit hilfe einer spezifischen chemokinrezeptor-analyse und der chemokinrezeptor-ligand-interaktion |
| WO2001075177A2 (en) | 2000-04-03 | 2001-10-11 | The Government Of The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Tumor markers in ovarian cancer |
| AU2001249885A1 (en) | 2000-04-07 | 2001-10-23 | Arena Pharmaceuticals, Inc. | Non-endogenous, constitutively activated known g protein-coupled receptors |
| CA2403425C (en) | 2000-04-11 | 2013-08-27 | Genentech, Inc. | Multivalent antibodies and uses therefor |
| WO2001088133A2 (en) | 2000-05-18 | 2001-11-22 | Lexicon Genetics Incorporated | Human semaphorin homologs and polynucleotides encoding the same |
| WO2001090304A2 (en) | 2000-05-19 | 2001-11-29 | Human Genome Sciences, Inc. | Nucleic acids, proteins, and antibodies |
| AU2001275437A1 (en) | 2000-06-09 | 2001-12-17 | Idec Pharmaceuticals Corporation | Gene targets and ligands that bind thereto for treatment and diagnosis of ovarian carcinomas |
| JP2004523203A (ja) | 2000-06-16 | 2004-08-05 | インサイト・ゲノミックス・インコーポレイテッド | Gタンパク質結合受容体 |
| AU2001273151A1 (en) | 2000-06-30 | 2002-01-14 | Incyte Genomics, Inc. | Human extracellular matrix and cell adhesion polypeptides |
| JP2004502414A (ja) | 2000-06-30 | 2004-01-29 | ヒューマン ジノーム サイエンシーズ, インコーポレイテッド | B7様ポリヌクレオチド、ポリペプチドおよび抗体 |
| US20020165347A1 (en) | 2000-06-30 | 2002-11-07 | Amgen, Inc. | B7-like molecules and uses thereof |
| WO2002006339A2 (en) | 2000-07-03 | 2002-01-24 | Curagen Corporation | Proteins and nucleic acids encoding same |
| AUPQ866500A0 (en) | 2000-07-05 | 2000-08-03 | Exgenix Operations Pty Ltd | Therapeutic compounds and methods |
| US20040044179A1 (en) | 2000-07-25 | 2004-03-04 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| AU2001283507A1 (en) | 2000-07-27 | 2002-02-13 | Mayo Foundation For Medical Education And Research | B7-h3 and b7-h4, novel immunoregulatory molecules |
| JP2004505617A (ja) | 2000-07-28 | 2004-02-26 | ヴィッセンバッハ,ウルリヒ | Trp8、Trp9およびTrp10、癌の新規マーカー |
| US7229623B1 (en) | 2000-08-03 | 2007-06-12 | Corixa Corporation | Her-2/neu fusion proteins |
| JP2004522412A (ja) | 2000-08-14 | 2004-07-29 | コリクサ コーポレイション | Her−2/neu−関連悪性腫瘍の治療および診断のための組成物および方法 |
| WO2002013847A2 (en) | 2000-08-14 | 2002-02-21 | Corixa Corporation | Methods for diagnosis and therapy of hematological and virus-associated malignancies |
| GB0020953D0 (en) | 2000-08-24 | 2000-10-11 | Smithkline Beecham Biolog | Vaccine |
| KR20030029847A (ko) | 2000-08-24 | 2003-04-16 | 제넨테크, 인크. | 종양의 진단 및 치료를 위한 조성물 및 방법 |
| CA2421949A1 (en) | 2000-09-11 | 2002-03-21 | Hyseq, Inc. | Novel nucleic acids and polypeptides |
| US6613567B1 (en) | 2000-09-15 | 2003-09-02 | Isis Pharmaceuticals, Inc. | Antisense inhibition of Her-2 expression |
| US20030119121A1 (en) | 2000-09-15 | 2003-06-26 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| CA2422033A1 (en) | 2000-09-15 | 2002-03-21 | Zymogenetics, Inc. | Method for treating inflammation |
| UA83458C2 (uk) | 2000-09-18 | 2008-07-25 | Байоджен Айдек Ма Інк. | Виділений поліпептид baff-r (рецептор фактора активації в-клітин сімейства tnf) |
| EP1320604A2 (en) | 2000-09-18 | 2003-06-25 | Biogen, Inc. | Cripto mutant and uses thereof |
| JP2005506033A (ja) | 2000-10-13 | 2005-03-03 | イーオーエス バイオテクノロジー インコーポレイテッド | 前立腺癌の診断法、前立腺癌モジュレータースクリーニングの組成物及び方法 |
| US6596541B2 (en) | 2000-10-31 | 2003-07-22 | Regeneron Pharmaceuticals, Inc. | Methods of modifying eukaryotic cells |
| ATE432986T1 (de) | 2000-11-07 | 2009-06-15 | Zymogenetics Inc | Menschlicher rezeptor für tumor necrosis factor |
| US20020150573A1 (en) | 2000-11-10 | 2002-10-17 | The Rockefeller University | Anti-Igalpha-Igbeta antibody for lymphoma therapy |
| WO2002043478A2 (en) | 2000-11-30 | 2002-06-06 | Medarex, Inc. | Transgenic transchromosomal rodents for making human antibodies |
| WO2002061087A2 (en) | 2000-12-19 | 2002-08-08 | Lifespan Biosciences, Inc. | Antigenic peptides, such as for g protein-coupled receptors (gpcrs), antibodies thereto, and systems for identifying such antigenic peptides |
| EP1357828A2 (en) | 2001-01-12 | 2003-11-05 | University of Medicine and Dentistry of New Jersey | Bone morphogenetic protein-2 in the treatment and diagnosis of cancer |
| US20030119125A1 (en) | 2001-01-16 | 2003-06-26 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US20030119126A1 (en) | 2001-01-16 | 2003-06-26 | Genentech, Inc. | Secreted and transmembrane polypeptides and nucleic acids encoding the same |
| US7754208B2 (en) | 2001-01-17 | 2010-07-13 | Trubion Pharmaceuticals, Inc. | Binding domain-immunoglobulin fusion proteins |
| MXPA03006617A (es) | 2001-01-24 | 2004-12-02 | Protein Design Labs Inc | Metodos de diagnostico de cancer de pecho, composiciones y metodos de rastreo de moduladores de cancer de pecho. |
| WO2002060317A2 (en) | 2001-01-30 | 2002-08-08 | Corixa Corporation | Compositions and methods for the therapy and diagnosis of pancreatic cancer |
| WO2002064775A1 (en) | 2001-02-12 | 2002-08-22 | Bionomics Limited | Identification of genes involved in the tumourigenic process |
| US20030087250A1 (en) | 2001-03-14 | 2003-05-08 | Millennium Pharmaceuticals, Inc. | Nucleic acid molecules and proteins for the identification, assessment, prevention, and therapy of ovarian cancer |
| EP1243276A1 (en) | 2001-03-23 | 2002-09-25 | Franciscus Marinus Hendrikus De Groot | Elongated and multiple spacers containing activatible prodrugs |
| AU2002311787A1 (en) | 2001-03-28 | 2002-10-15 | Zycos Inc. | Translational profiling |
| WO2003008537A2 (en) | 2001-04-06 | 2003-01-30 | Mannkind Corporation | Epitope sequences |
| US6820011B2 (en) | 2001-04-11 | 2004-11-16 | The Regents Of The University Of Colorado | Three-dimensional structure of complement receptor type 2 and uses thereof |
| WO2002083866A2 (en) | 2001-04-17 | 2002-10-24 | The Board Of Trustees Of The University Of Arkansas | Repeat sequences of the ca125 gene and their use for diagnostic and therapeutic interventions |
| WO2002086443A2 (en) | 2001-04-18 | 2002-10-31 | Protein Design Labs, Inc | Methods of diagnosis of lung cancer, compositions and methods of screening for modulators of lung cancer |
| SK14432003A3 (sk) | 2001-04-26 | 2004-07-07 | Biogen, Inc. | Protilátka špecifická pre Cripto, kompozícia obsahujúca takúto protilátku a jej použitie |
| WO2003083041A2 (en) | 2002-03-22 | 2003-10-09 | Biogen, Inc. | Cripto-specific antibodies |
| JP2005504513A (ja) | 2001-05-09 | 2005-02-17 | コリクサ コーポレイション | 前立腺癌の治療及び診断のための組成物及び方法 |
| AU2002344326A1 (en) | 2001-05-11 | 2002-11-25 | Sloan-Kettering Institute For Cancer Research | Nucleic acid sequence encoding ovarian antigen, ca125, and uses thereof |
| SI2116259T1 (sl) | 2001-05-24 | 2012-11-30 | Zymogenetics Inc | Taci imunoglobulin fuzijski proteini |
| WO2002098358A2 (en) | 2001-06-04 | 2002-12-12 | Eos Biotechnology, Inc. | Methods of diagnosis and treatment of androgen-dependent prostate cancer, prostate cancer undergoing androgen-withdrawal, and androgen-independent prostate cancer |
| JP2005518185A (ja) | 2001-06-04 | 2005-06-23 | キュラジェン コーポレイション | 新規タンパク質およびそれをコード化する核酸 |
| CA2449275A1 (en) | 2001-06-05 | 2002-12-12 | Exelixis, Inc. | Dgks as modifiers of the p53 pathway and methods of use |
| WO2002099083A2 (en) | 2001-06-05 | 2002-12-12 | Exelixis, Inc. | Gfats as modifiers of the p53 pathway and methods of use |
| US7235358B2 (en) | 2001-06-08 | 2007-06-26 | Expression Diagnostics, Inc. | Methods and compositions for diagnosing and monitoring transplant rejection |
| WO2002101075A2 (en) | 2001-06-13 | 2002-12-19 | Millennium Pharmaceuticals, Inc. | Novel genes, compositions, kits, and methods for identification, assessment, prevention, and therapy of cervical cancer |
| US7189507B2 (en) | 2001-06-18 | 2007-03-13 | Pdl Biopharma, Inc. | Methods of diagnosis of ovarian cancer, compositions and methods of screening for modulators of ovarian cancer |
| JP2005508144A (ja) | 2001-06-18 | 2005-03-31 | イオス バイオテクノロジー,インコーポレイティド | 卵巣癌の診断方法、卵巣癌のモジュレーターをスクリーニングする組成物及び方法 |
| AU2002322280A1 (en) | 2001-06-21 | 2003-01-21 | Millennium Pharmaceuticals, Inc. | Compositions, kits, and methods for identification, assessment, prevention, and therapy of breast cancer |
| WO2003002717A2 (en) | 2001-06-28 | 2003-01-09 | Schering Corporation | Biological activity of ak155 |
| US20030120040A1 (en) | 2001-06-29 | 2003-06-26 | Genentech, Inc. | Secreted and Transmembrane polypeptides and nucleic acids encoding the same |
| AU2002314433A1 (en) | 2001-07-02 | 2003-01-21 | Licentia Ltd. | Ephrin-tie receptor materials and methods |
| US20040076955A1 (en) | 2001-07-03 | 2004-04-22 | Eos Biotechnology, Inc. | Methods of diagnosis of bladder cancer, compositions and methods of screening for modulators of bladder cancer |
| WO2003003984A2 (en) | 2001-07-05 | 2003-01-16 | Curagen Corporation | Novel proteins and nucleic acids encoding same |
| WO2003055439A2 (en) | 2001-07-18 | 2003-07-10 | The Regents Of The University Of California | Her2/neu target antigen and use of same to stimulate an immune response |
| US20030108963A1 (en) | 2001-07-25 | 2003-06-12 | Millennium Pharmaceuticals, Inc. | Novel genes, compositions, kit, and methods for identification, assessment, prevention and therapy of prostate cancer |
| US20050070689A1 (en) | 2001-08-03 | 2005-03-31 | Genentech, Inc. | Taci and br3 polypeptides and uses thereof |
| WO2003016475A2 (en) | 2001-08-14 | 2003-02-27 | The General Hospital Corporation | Nucleic acid and amino acid sequences involved in pain |
| US20030092013A1 (en) | 2001-08-16 | 2003-05-15 | Vitivity, Inc. | Diagnosis and treatment of vascular disease |
| AU2002313559A1 (en) | 2001-08-23 | 2003-03-10 | Oxford Biomedica (Uk) Limited | Genes |
| AU2002357643A1 (en) | 2001-08-29 | 2003-04-14 | Vanderbilt University | The human mob-5 (il-24) receptors and uses thereof |
| US20030124579A1 (en) | 2001-09-05 | 2003-07-03 | Eos Biotechnology, Inc. | Methods of diagnosis of ovarian cancer, compositions and methods of screening for modulators of ovarian cancer |
| EP1429793B1 (en) | 2001-09-06 | 2015-02-25 | Agensys, Inc. | Nucleic acid and corresponding protein entitled steap-1 useful in treatment and detection of cancer |
| WO2003025138A2 (en) | 2001-09-17 | 2003-03-27 | Protein Design Labs, Inc. | Methods of diagnosis of cancer compositions and methods of screening for modulators of cancer |
| CA2460120A1 (en) | 2001-09-18 | 2003-03-27 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| WO2003025228A1 (en) | 2001-09-18 | 2003-03-27 | Proteologics, Inc. | Methods and compositions for treating hcap associated diseases |
| CA2460621A1 (en) | 2001-09-19 | 2003-03-27 | Nuvelo, Inc. | Novel nucleic acids and polypeptides |
| US20030077644A1 (en) | 2001-09-28 | 2003-04-24 | Bing Yang | Diagnosis and treatment of diseases caused by mutations in CD72 |
| WO2003029277A2 (en) | 2001-10-03 | 2003-04-10 | Rigel Pharmaceuticals, Inc. | Modulators of lymphocyte activation and migration |
| WO2003029421A2 (en) | 2001-10-03 | 2003-04-10 | Origene Technologies, Inc. | Regulated breast cancer genes |
| CA2675409A1 (en) | 2001-10-19 | 2003-05-01 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of inflammatory bowel disorders |
| US20050123925A1 (en) | 2002-11-15 | 2005-06-09 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| US7825089B2 (en) | 2001-10-24 | 2010-11-02 | National Jewish Health | Three-dimensional structures of TALL-1 and its cognate receptors and modified proteins and methods related thereto |
| ES2278079T3 (es) | 2001-10-31 | 2007-08-01 | Alcon, Inc. | Proteinas morfogenicas oseas (bmp), receptores de bmp y proteinas de union a bmp y su utilizacion en el diagnostico y en el tratamiento del glaucoma. |
| WO2003042661A2 (en) | 2001-11-13 | 2003-05-22 | Protein Design Labs, Inc. | Methods of diagnosis of cancer, compositions and methods of screening for modulators of cancer |
| US20030232350A1 (en) | 2001-11-13 | 2003-12-18 | Eos Biotechnology, Inc. | Methods of diagnosis of cancer, compositions and methods of screening for modulators of cancer |
| EP1448226A1 (en) | 2001-11-29 | 2004-08-25 | Genset S.A. | Agonists and antagonists of prolixin for the treatment of metabolic disorders |
| AU2002349784A1 (en) | 2001-12-03 | 2003-06-17 | Asahi Kasei Pharma Corporation | Nf-kappab activating genes |
| AU2002366951A1 (en) | 2001-12-10 | 2003-07-09 | Nuvelo,Inc. | Novel nucleic acids and polypeptides |
| US20030134790A1 (en) | 2002-01-11 | 2003-07-17 | University Of Medicine And Dentistry Of New Jersey | Bone Morphogenetic Protein-2 And Bone Morphogenetic Protein-4 In The Treatment And Diagnosis Of Cancer |
| US7452675B2 (en) | 2002-01-25 | 2008-11-18 | The Queen's Medical Center | Methods of screening for TRPM4b modulators |
| JP2005526501A (ja) | 2002-02-21 | 2005-09-08 | デューク・ユニヴァーシティ | 自己免疫疾患用の試薬および治療方法 |
| JP2005535290A (ja) | 2002-02-22 | 2005-11-24 | ジェネンテック・インコーポレーテッド | 免疫関連疾患の治療のための組成物と方法 |
| AU2003216482A1 (en) | 2002-03-01 | 2003-09-16 | Exelixis, Inc. | MSRAs AS MODIFIERS OF THE p53 PATHWAY AND METHODS OF USE |
| US20050220798A1 (en) | 2002-06-04 | 2005-10-06 | Reinhard Ebner | Cancer-linked gene as target for chemotherapy |
| EP2258712A3 (en) | 2002-03-15 | 2011-05-04 | Multicell Immunotherapeutics, Inc. | Compositions and Methods to Initiate or Enhance Antibody and Major-histocompatibility Class I or Class II-restricted T Cell Responses by Using Immunomodulatory, Non-coding RNA Motifs |
| CA2486490A1 (en) | 2002-03-19 | 2003-12-31 | Curagen Corporation | Therapeutic polypeptides, nucleic acids encoding same, and methods of use |
| CA2478981A1 (en) | 2002-03-21 | 2003-10-02 | Sunesis Pharmaceuticals, Inc. | Identification of kinase inhibitors |
| US7193069B2 (en) | 2002-03-22 | 2007-03-20 | Research Association For Biotechnology | Full-length cDNA |
| WO2003089624A2 (en) | 2002-03-25 | 2003-10-30 | Uab Research Foundation | Fc receptor homolog, reagents, and uses thereof |
| WO2003083074A2 (en) | 2002-03-28 | 2003-10-09 | Idec Pharmaceuticals Corporation | Novel gene targets and ligands that bind thereto for treatment and diagnosis of colon carcinomas |
| US20030194704A1 (en) | 2002-04-03 | 2003-10-16 | Penn Sharron Gaynor | Human genome-derived single exon nucleic acid probes useful for gene expression analysis two |
| WO2003087306A2 (en) | 2002-04-05 | 2003-10-23 | Agensys, Inc. | Nucleic acid and corresponding protein entitled 98p4b6 useful in treatment and detection of cancer |
| US20040101874A1 (en) | 2002-04-12 | 2004-05-27 | Mitokor Inc. | Targets for therapeutic intervention identified in the mitochondrial proteome |
| MXPA04010092A (es) | 2002-04-16 | 2004-12-13 | Genentech Inc | Composiciones y metodos para el diagnostico y tratamiento de tumores. |
| WO2003089904A2 (en) | 2002-04-17 | 2003-10-30 | Baylor College Of Medicine | Aib1 as a prognostic marker and predictor of resistance to encocrine therapy |
| AU2003228869A1 (en) | 2002-05-03 | 2003-11-17 | Incyte Corporation | Transporters and ion channels |
| EP1572925A4 (en) | 2002-05-15 | 2007-08-15 | Avalon Pharmaceuticals | CANCER-RELATED GENE AS A TARGET FOR CHEMOTHERAPY |
| US20030224454A1 (en) | 2002-05-30 | 2003-12-04 | Ryseck Rolf Peter | Human solute carrier family 7, member 11 (hSLC7A11) |
| WO2003102157A2 (en) | 2002-06-03 | 2003-12-11 | Genentech, Inc. | Synthetic antibody phage libraries |
| WO2003101283A2 (en) | 2002-06-04 | 2003-12-11 | Incyte Corporation | Diagnostics markers for lung cancer |
| WO2003104270A2 (en) | 2002-06-06 | 2003-12-18 | Ingenium Pharmaceuticals Ag | Dudulin 2 genes, expression products, non-human animal model: uses in human hematological disease |
| WO2003104275A2 (en) | 2002-06-06 | 2003-12-18 | Oncotherapy Science, Inc. | Genes and polypeptides relating to human colon cancers |
| AU2003249691A1 (en) | 2002-06-07 | 2003-12-22 | Avalon Pharmaceuticals, Inc | Cancer-linked gene as target for chemotherapy |
| WO2003105758A2 (en) | 2002-06-12 | 2003-12-24 | Avalon Pharmaceuticals, Inc. | Cancer-linked gene as target for chemotherapy |
| JP2005533794A (ja) | 2002-06-18 | 2005-11-10 | アーケミックス コーポレイション | アプタマー−毒素分子およびこれを使用する方法 |
| US20040249130A1 (en) | 2002-06-18 | 2004-12-09 | Martin Stanton | Aptamer-toxin molecules and methods for using same |
| US7304149B2 (en) | 2002-06-20 | 2007-12-04 | Washington University In St. Louis | BTLA nucleic acids |
| WO2004001004A2 (en) | 2002-06-21 | 2003-12-31 | Johns Hopkins University School Of Medicine | Membrane associated tumor endothelium markers |
| WO2004009622A2 (en) | 2002-07-19 | 2004-01-29 | Cellzome Ag | Protein complexes of cellular networks underlying the development of cancer and other diseases |
| MXPA05000940A (es) | 2002-07-25 | 2005-05-16 | Genentech Inc | Anticuerpos taci y su uso. |
| EP2357006B1 (en) | 2002-07-31 | 2015-09-16 | Seattle Genetics, Inc. | Drug conjugates and their use for treating cancer, an autoimmune disease or an infectious disease |
| JP2004121218A (ja) | 2002-08-06 | 2004-04-22 | Jenokkusu Soyaku Kenkyusho:Kk | 気管支喘息または慢性閉塞性肺疾患の検査方法 |
| WO2004015426A1 (en) | 2002-08-06 | 2004-02-19 | Bayer Healthcare Ag | Diagnostics and therapeutics for diseases associated with human cxc chemokine receptor 5(cxcr5) |
| CA2495389A1 (en) | 2002-08-19 | 2004-02-26 | Genentech, Inc. | Compositions and methods for the diagnosis and treatment of tumor |
| AU2003278725A1 (en) | 2002-08-27 | 2004-03-19 | Bristol-Myers Squibb Company | Polynucleotide predictor set for identifying protein tyrosine kinase modulators |
| WO2004020595A2 (en) | 2002-08-29 | 2004-03-11 | Five Prime Therapeutics, Inc. | Novel human polypeptides encoded by polynucleotides |
| AU2002951346A0 (en) | 2002-09-05 | 2002-09-26 | Garvan Institute Of Medical Research | Diagnosis of ovarian cancer |
| MXPA05002455A (es) | 2002-09-06 | 2005-06-03 | Mannkind Corp | Secuencias de epitopes. |
| US20060134109A1 (en) | 2002-09-09 | 2006-06-22 | Nura Inc. | G protein coupled receptors and uses thereof |
| JP2004113151A (ja) | 2002-09-27 | 2004-04-15 | Sankyo Co Ltd | 癌遺伝子及びその用途 |
| AU2003278002A1 (en) | 2002-10-03 | 2004-04-23 | Mcgill Univeristy | Antibodies and cyclic peptides which bind cea (carcinoembryonic antigen) and their use as cancer therapeutics |
| AU2003288918A1 (en) | 2002-10-04 | 2004-05-04 | Van Andel Research Institute | Molecular sub-classification of kidney tumors and the discovery of new diagnostic markers |
| US7361740B2 (en) | 2002-10-15 | 2008-04-22 | Pdl Biopharma, Inc. | Alteration of FcRn binding affinities or serum half-lives of antibodies by mutagenesis |
| NZ538996A (en) | 2002-10-31 | 2008-04-30 | Genentech Inc | Methods and compositions for increasing antibody production |
| WO2004041812A1 (en) | 2002-11-08 | 2004-05-21 | The Government Of The State Of Sarawak, Malaysia | Therapeutic compounds and methods |
| CA2503748A1 (en) | 2002-11-08 | 2004-05-27 | Genentech, Inc. | Compositions and methods for the treatment of natural killer cell related diseases |
| US20040146907A1 (en) | 2002-11-13 | 2004-07-29 | Genentech, Inc. | Methods and compositions for detecting dysplasia |
| MXPA05005237A (es) | 2002-11-15 | 2005-08-16 | Univ Arkansas | Gen ca125 y su uso para diagnostico e intervenciones terapeuticas. |
| US8007804B2 (en) | 2002-11-15 | 2011-08-30 | Musc Foundation For Research Development | Complement receptor 2 targeted complement modulators |
| WO2004046342A2 (en) | 2002-11-20 | 2004-06-03 | Biogen Idec Inc. | Novel gene targets and ligands that bind thereto for treatment and diagnosis of carcinomas |
| US7557092B2 (en) | 2002-11-21 | 2009-07-07 | University Of Utah Research Foundation | Purinergic modulation of smell |
| US20040253606A1 (en) | 2002-11-26 | 2004-12-16 | Protein Design Labs, Inc. | Methods of detecting soft tissue sarcoma, compositions and methods of screening for soft tissue sarcoma modulators |
| EP1581641A4 (en) | 2002-12-06 | 2006-11-15 | Diadexus Inc | COMPOSITIONS, SPREADING VARIATIONS AND METHODS RELATED TO OVARAL SPECIFIC GENES AND PROTEINS |
| US20040157278A1 (en) | 2002-12-13 | 2004-08-12 | Bayer Corporation | Detection methods using TIMP 1 |
| EP3263596A1 (en) | 2002-12-16 | 2018-01-03 | Genentech, Inc. | Immunoglobulin variants and uses thereof |
| EP1581171B1 (en) | 2002-12-20 | 2012-06-27 | Abbott Biotherapeutics Corp. | Antibodies against gpr64 and uses thereof |
| WO2004058309A1 (en) | 2002-12-23 | 2004-07-15 | Human Genome Sciences, Inc. | Neutrokine-alpha conjugate, neutrokine-alpha complex, and uses thereof |
| EP1597558A2 (en) | 2003-01-08 | 2005-11-23 | Bristol-Myers Squibb Company | Biomarkers and methods for determining sensitivity to epidermal growth factor receptor modulators |
| US20050227301A1 (en) | 2003-01-10 | 2005-10-13 | Polgen | Cell cycle progression proteins |
| WO2004063355A2 (en) | 2003-01-10 | 2004-07-29 | Protein Design Labs, Inc. | Novel methods of diagnosis of metastatic cancer, compositions and methods of screening for modulators of matastatic cancer |
| US20040171823A1 (en) | 2003-01-14 | 2004-09-02 | Nadler Steven G. | Polynucleotides and polypeptides associated with the NF-kappaB pathway |
| JP2007520996A (ja) | 2003-01-15 | 2007-08-02 | ミレニアム・ファーマシューティカルズ・インコーポレイテッド | 44390、54181、211、5687、884、1405、636、4421、5410、30905、2045、16405、18560、2047、33751、52872、14063、20739、32544、43239、44373、51164、53010、16852、1587、2207、22245、2387、52908、69112、14990、18547、115、579、15985、15625、760、18603、2395、2554、8675、32720、4809、14303、16816、17827、32620、577、619、1423、2158、8263、15402、16209、16386、21165、30911、41897、1643、2543、9626、13231、32409、84260、2882、8203、32678または55053を用いて泌尿器科障害を処置するための方法および組成物 |
| AU2004205631A1 (en) | 2003-01-16 | 2004-08-05 | Genentech, Inc. | Synthetic antibody phage libraries |
| CA2513113A1 (en) | 2003-01-23 | 2004-08-05 | Genentech, Inc. | Methods for producing humanized antibodies and improving yield of antibodies or antigen binding fragments in cell culture |
| EP2196474A3 (en) | 2003-02-14 | 2010-12-15 | Sagres Discovery, Inc. | Therapeutic targets in cancer |
| US20060104968A1 (en) | 2003-03-05 | 2006-05-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminogly ycanases |
| US7871607B2 (en) | 2003-03-05 | 2011-01-18 | Halozyme, Inc. | Soluble glycosaminoglycanases and methods of preparing and using soluble glycosaminoglycanases |
| US20030224411A1 (en) | 2003-03-13 | 2003-12-04 | Stanton Lawrence W. | Genes that are up- or down-regulated during differentiation of human embryonic stem cells |
| PT1725249E (pt) | 2003-11-06 | 2014-04-10 | Seattle Genetics Inc | Compostos de monometilvalina capazes de conjugação a ligandos |
| CA2560740A1 (en) | 2004-03-23 | 2006-10-06 | Trustees Of Boston University | Synthesis of rocaglamide natural products via photochemical generation of oxidopyrylium species |
| WO2005097832A2 (en) | 2004-03-31 | 2005-10-20 | Genentech, Inc. | Humanized anti-tgf-beta antibodies |
| US7785903B2 (en) | 2004-04-09 | 2010-08-31 | Genentech, Inc. | Variable domain library and uses |
| KR100891620B1 (ko) | 2004-04-13 | 2009-04-02 | 에프. 호프만-라 로슈 아게 | 항-p-셀렉틴 항체 |
| WO2006007634A1 (en) | 2004-07-16 | 2006-01-26 | Cerylid Biosciences Ltd | Processes and intermediates |
| TWI309240B (en) | 2004-09-17 | 2009-05-01 | Hoffmann La Roche | Anti-ox40l antibodies |
| AU2005286607B2 (en) | 2004-09-23 | 2011-01-27 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| JO3000B1 (ar) | 2004-10-20 | 2016-09-05 | Genentech Inc | مركبات أجسام مضادة . |
| WO2007008848A2 (en) | 2005-07-07 | 2007-01-18 | Seattle Genetics, Inc. | Monomethylvaline compounds having phenylalanine carboxy modifications at the c-terminus |
| ES2708763T3 (es) | 2005-07-07 | 2019-04-11 | Seattle Genetics Inc | Compuestos de monometilvalina que tienen modificaciones de la cadena lateral de fenilalanina en el extremo C |
| EP1957531B1 (en) | 2005-11-07 | 2016-04-13 | Genentech, Inc. | Binding polypeptides with diversified and consensus vh/vl hypervariable sequences |
| EP1973951A2 (en) | 2005-12-02 | 2008-10-01 | Genentech, Inc. | Binding polypeptides with restricted diversity sequences |
| EP2016101A2 (en) | 2006-05-09 | 2009-01-21 | Genentech, Inc. | Binding polypeptides with optimized scaffolds |
| WO2007139749A2 (en) | 2006-05-22 | 2007-12-06 | Trustees Of Boston University | Asymmetric synthesis of rocaglamides via enantioselective photocycloaddition mediated by chiral bronsted acids |
| US20090182127A1 (en) | 2006-06-22 | 2009-07-16 | Novo Nordisk A/S | Production of Bispecific Antibodies |
| PE20090245A1 (es) | 2007-05-08 | 2009-03-17 | Genentech Inc | Anticuerpos anti-muc16 disenados con cisteina y conjugados de anticuerpos y farmacos |
| CN100592373C (zh) | 2007-05-25 | 2010-02-24 | 群康科技(深圳)有限公司 | 液晶显示面板驱动装置及其驱动方法 |
| BRPI0818780A2 (pt) | 2007-10-19 | 2015-04-22 | Genentech Inc | Anticorpo anti-tenb2 planejados por cisteína e conjugados de medicamento com anticorpos |
| WO2009089004A1 (en) | 2008-01-07 | 2009-07-16 | Amgen Inc. | Method for making antibody fc-heterodimeric molecules using electrostatic steering effects |
| RU2624027C2 (ru) | 2010-04-23 | 2017-06-30 | Дженентек, Инк. | Получение гетеромультимерных белков |
| CA3220104A1 (en) | 2010-06-08 | 2011-12-15 | Genentech, Inc. | Cysteine engineered antibodies and conjugates |
| CN103313990B (zh) | 2010-11-17 | 2016-07-20 | 基因泰克公司 | 丙氨酰美登醇抗体偶联物 |
| PL2678037T3 (pl) | 2011-02-25 | 2015-05-29 | Lonza Ag | Rozgałęziony łącznik do koniugatów białko-lek. |
| LT2691417T (lt) | 2011-03-29 | 2018-10-25 | Roche Glycart Ag | Antikūno fc variantai |
| WO2013016658A1 (en) | 2011-07-27 | 2013-01-31 | The Ohio State University Research Foundation | Silvestrol, silvestrol analogs and uses thereof |
| AR090549A1 (es) | 2012-03-30 | 2014-11-19 | Genentech Inc | Anticuerpos anti-lgr5 e inmunoconjugados |
| BR112014027166A2 (pt) | 2012-05-01 | 2017-06-27 | Genentech Inc | anticorpo, ácido nucleico, célula hospedeira, método para produzir um anticorpo, imunoconjugado, formulação farmacêutica, método de tratamento, método de inibir proliferação e métodos de detecção. |
| MX352581B (es) | 2012-05-21 | 2017-11-29 | Genentech Inc | Anticuerpos e inmunoconjugados contra ly6e y metodos de uso. |
| WO2014107024A1 (ko) * | 2013-01-03 | 2014-07-10 | 셀트리온 | 항체-링커-약물 결합체, 그의 제조방법 및 그를 포함하는 항암제 조성물 |
| SG11201509839TA (en) | 2013-05-31 | 2016-01-28 | Genentech Inc | Anti-wall teichoic antibodies and conjugates |
| CN103330937A (zh) * | 2013-06-15 | 2013-10-02 | 济南环肽医药科技有限公司 | 单克隆抗体抗原结合片段-t-2毒素偶联物 |
| CA2914438C (en) * | 2013-07-23 | 2022-06-14 | Immunomedics, Inc. | Antibody-sn-38 immunoconjugates with a cl2a linker |
| TWI636792B (zh) * | 2013-08-12 | 2018-10-01 | 建南德克公司 | 1-(氯甲基)-2,3-二氫-1h-苯并[e]吲哚二聚體抗體-藥物結合物化合物及使用與治療方法 |
| WO2015085221A2 (en) | 2013-12-05 | 2015-06-11 | Memorial Sloan Kettering Cancer Center | Methods for identifying anti-cancer compounds |
| CN105848685B (zh) | 2013-12-16 | 2020-09-22 | 健泰科生物技术公司 | 拟肽化合物及其抗体药物偶联物 |
| CA2928952A1 (en) | 2013-12-16 | 2015-06-25 | Genentech, Inc. | Peptidomimetic compounds and antibody-drug conjugates thereof |
| CN105440135A (zh) * | 2014-09-01 | 2016-03-30 | 博笛生物科技有限公司 | 用于治疗肿瘤的抗-pd-l1结合物 |
| KR20170086121A (ko) | 2014-12-03 | 2017-07-25 | 제넨테크, 인크. | 4급 아민 화합물 및 그의 항체-약물 접합체 |
| WO2016191703A2 (en) * | 2015-05-27 | 2016-12-01 | The Trustees Of Columbia University In The City Of New York | Tumor deliverable iron and protein synthesis inhibitors as a new class of drugs for the diagnosis and treatment of cancer |
| US10639378B2 (en) | 2016-06-06 | 2020-05-05 | Genentech, Inc. | Silvestrol antibody-drug conjugates and methods of use |
-
2017
- 2017-06-05 US US15/613,477 patent/US10639378B2/en active Active
- 2017-06-05 WO PCT/US2017/035925 patent/WO2017214024A1/en unknown
- 2017-06-05 JP JP2018563547A patent/JP7043425B2/ja active Active
- 2017-06-05 EP EP17731020.8A patent/EP3464280B1/en active Active
- 2017-06-05 CN CN201780043931.1A patent/CN109476648B/zh active Active
-
2020
- 2020-03-23 US US16/827,083 patent/US11648315B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015095227A2 (en) | 2013-12-16 | 2015-06-25 | Genentech, Inc. | Peptidomimetic compounds and antibody-drug conjugates thereof |
Non-Patent Citations (1)
| Title |
|---|
| J. Org. Chem.,2004年,Vol.69,p.3350-3358 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20200222545A1 (en) | 2020-07-16 |
| US20170348422A1 (en) | 2017-12-07 |
| EP3464280A1 (en) | 2019-04-10 |
| US11648315B2 (en) | 2023-05-16 |
| EP3464280B1 (en) | 2021-10-06 |
| CN109476648A (zh) | 2019-03-15 |
| WO2017214024A1 (en) | 2017-12-14 |
| CN109476648B (zh) | 2022-09-13 |
| JP2019527673A (ja) | 2019-10-03 |
| US10639378B2 (en) | 2020-05-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7043425B2 (ja) | シルベストロール抗体-薬物コンジュゲート及び使用方法 | |
| JP6671292B2 (ja) | ペプチド模倣化合物及びその抗体−薬物コンジュゲート | |
| KR102337414B1 (ko) | 펩타이드 모방체 화합물 및 이의 항체-약물 컨쥬게이트 | |
| TWI636792B (zh) | 1-(氯甲基)-2,3-二氫-1h-苯并[e]吲哚二聚體抗體-藥物結合物化合物及使用與治療方法 | |
| JP6621919B2 (ja) | 束縛ジスルフィド薬物コンジュゲート | |
| US11576979B2 (en) | Pyrrolobenzodiazepine prodrugs and antibody conjugates thereof | |
| US12090211B2 (en) | Methods for preparing antibody drug conjugates | |
| US10730900B2 (en) | Calicheamicin-antibody-drug conjugates and methods of use |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20200528 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20200528 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20210518 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20211019 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20220119 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20220308 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20220316 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 7043425 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 |