JP6804931B2 - Anti-adhesion membrane for medical devices and medical devices - Google Patents
Anti-adhesion membrane for medical devices and medical devices Download PDFInfo
- Publication number
- JP6804931B2 JP6804931B2 JP2016207295A JP2016207295A JP6804931B2 JP 6804931 B2 JP6804931 B2 JP 6804931B2 JP 2016207295 A JP2016207295 A JP 2016207295A JP 2016207295 A JP2016207295 A JP 2016207295A JP 6804931 B2 JP6804931 B2 JP 6804931B2
- Authority
- JP
- Japan
- Prior art keywords
- adhesion
- conductive particles
- layer
- adhesion prevention
- prevention film
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
- 239000012528 membrane Substances 0.000 title description 2
- 239000002245 particle Substances 0.000 claims description 205
- 230000002265 prevention Effects 0.000 claims description 136
- 239000010410 layer Substances 0.000 claims description 134
- 239000000463 material Substances 0.000 claims description 55
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 37
- 229910052751 metal Inorganic materials 0.000 claims description 33
- 239000002184 metal Substances 0.000 claims description 33
- 229920005989 resin Polymers 0.000 claims description 30
- 239000011347 resin Substances 0.000 claims description 30
- 239000000126 substance Substances 0.000 claims description 28
- 239000000377 silicon dioxide Substances 0.000 claims description 18
- 229920002050 silicone resin Polymers 0.000 claims description 16
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Chemical compound [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 claims description 14
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 claims description 13
- 229910052737 gold Inorganic materials 0.000 claims description 13
- 239000010931 gold Substances 0.000 claims description 13
- 239000011246 composite particle Substances 0.000 claims description 10
- PXHVJJICTQNCMI-UHFFFAOYSA-N Nickel Chemical compound [Ni] PXHVJJICTQNCMI-UHFFFAOYSA-N 0.000 claims description 8
- 239000000615 nonconductor Substances 0.000 claims description 8
- 229910052697 platinum Inorganic materials 0.000 claims description 7
- RYGMFSIKBFXOCR-UHFFFAOYSA-N Copper Chemical compound [Cu] RYGMFSIKBFXOCR-UHFFFAOYSA-N 0.000 claims description 4
- 239000004696 Poly ether ether ketone Substances 0.000 claims description 4
- BQCADISMDOOEFD-UHFFFAOYSA-N Silver Chemical compound [Ag] BQCADISMDOOEFD-UHFFFAOYSA-N 0.000 claims description 4
- 229910052802 copper Inorganic materials 0.000 claims description 4
- 239000010949 copper Substances 0.000 claims description 4
- 150000002739 metals Chemical class 0.000 claims description 4
- 229910052759 nickel Inorganic materials 0.000 claims description 4
- 229920002530 polyetherether ketone Polymers 0.000 claims description 4
- 229910052709 silver Inorganic materials 0.000 claims description 4
- 239000004332 silver Substances 0.000 claims description 4
- 239000002356 single layer Substances 0.000 claims description 4
- 125000003903 2-propenyl group Chemical group [H]C([*])([H])C([H])=C([H])[H] 0.000 claims description 3
- 239000003822 epoxy resin Substances 0.000 claims description 3
- 239000007849 furan resin Substances 0.000 claims description 3
- 229920006122 polyamide resin Polymers 0.000 claims description 3
- 229920000647 polyepoxide Polymers 0.000 claims description 3
- 229920001721 polyimide Polymers 0.000 claims description 3
- 239000009719 polyimide resin Substances 0.000 claims description 3
- JUPQTSLXMOCDHR-UHFFFAOYSA-N benzene-1,4-diol;bis(4-fluorophenyl)methanone Chemical compound OC1=CC=C(O)C=C1.C1=CC(F)=CC=C1C(=O)C1=CC=C(F)C=C1 JUPQTSLXMOCDHR-UHFFFAOYSA-N 0.000 claims 1
- HDNHWROHHSBKJG-UHFFFAOYSA-N formaldehyde;furan-2-ylmethanol Chemical compound O=C.OCC1=CC=CO1 HDNHWROHHSBKJG-UHFFFAOYSA-N 0.000 claims 1
- LNEPOXFFQSENCJ-UHFFFAOYSA-N haloperidol Chemical compound C1CC(O)(C=2C=CC(Cl)=CC=2)CCN1CCCC(=O)C1=CC=C(F)C=C1 LNEPOXFFQSENCJ-UHFFFAOYSA-N 0.000 claims 1
- 239000010408 film Substances 0.000 description 162
- 238000011156 evaluation Methods 0.000 description 26
- 238000012360 testing method Methods 0.000 description 19
- 230000000052 comparative effect Effects 0.000 description 18
- 229920001296 polysiloxane Polymers 0.000 description 18
- 239000000523 sample Substances 0.000 description 15
- 229910052782 aluminium Inorganic materials 0.000 description 12
- XAGFODPZIPBFFR-UHFFFAOYSA-N aluminium Chemical compound [Al] XAGFODPZIPBFFR-UHFFFAOYSA-N 0.000 description 12
- 239000011248 coating agent Substances 0.000 description 12
- 238000000576 coating method Methods 0.000 description 12
- 239000012620 biological material Substances 0.000 description 11
- 238000000034 method Methods 0.000 description 10
- 239000007769 metal material Substances 0.000 description 9
- 238000011282 treatment Methods 0.000 description 7
- 239000003973 paint Substances 0.000 description 6
- 239000000758 substrate Substances 0.000 description 6
- 210000001015 abdomen Anatomy 0.000 description 5
- 230000000694 effects Effects 0.000 description 5
- 239000002904 solvent Substances 0.000 description 5
- MCMNRKCIXSYSNV-UHFFFAOYSA-N Zirconium dioxide Chemical compound O=[Zr]=O MCMNRKCIXSYSNV-UHFFFAOYSA-N 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 238000009826 distribution Methods 0.000 description 4
- 239000011521 glass Substances 0.000 description 4
- 239000000203 mixture Substances 0.000 description 3
- 238000005240 physical vapour deposition Methods 0.000 description 3
- 229920006310 Asahi-Kasei Polymers 0.000 description 2
- 229920004482 WACKER® Polymers 0.000 description 2
- 239000000853 adhesive Substances 0.000 description 2
- 230000001070 adhesive effect Effects 0.000 description 2
- PNEYBMLMFCGWSK-UHFFFAOYSA-N aluminium oxide Inorganic materials [O-2].[O-2].[O-2].[Al+3].[Al+3] PNEYBMLMFCGWSK-UHFFFAOYSA-N 0.000 description 2
- 238000005229 chemical vapour deposition Methods 0.000 description 2
- 238000005520 cutting process Methods 0.000 description 2
- 230000007423 decrease Effects 0.000 description 2
- 238000010586 diagram Methods 0.000 description 2
- 238000002296 dynamic light scattering Methods 0.000 description 2
- 238000010438 heat treatment Methods 0.000 description 2
- 238000009413 insulation Methods 0.000 description 2
- 239000002923 metal particle Substances 0.000 description 2
- 238000002156 mixing Methods 0.000 description 2
- 230000003449 preventive effect Effects 0.000 description 2
- 239000011342 resin composition Substances 0.000 description 2
- 238000007788 roughening Methods 0.000 description 2
- 238000004528 spin coating Methods 0.000 description 2
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 2
- 229910000838 Al alloy Inorganic materials 0.000 description 1
- CTQNGGLPUBDAKN-UHFFFAOYSA-N O-Xylene Chemical compound CC1=CC=CC=C1C CTQNGGLPUBDAKN-UHFFFAOYSA-N 0.000 description 1
- 230000003187 abdominal effect Effects 0.000 description 1
- 239000002390 adhesive tape Substances 0.000 description 1
- 239000000956 alloy Substances 0.000 description 1
- 229910045601 alloy Inorganic materials 0.000 description 1
- 230000000181 anti-adherent effect Effects 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 238000000149 argon plasma sintering Methods 0.000 description 1
- QXJJQWWVWRCVQT-UHFFFAOYSA-K calcium;sodium;phosphate Chemical compound [Na+].[Ca+2].[O-]P([O-])([O-])=O QXJJQWWVWRCVQT-UHFFFAOYSA-K 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 239000011247 coating layer Substances 0.000 description 1
- 239000002131 composite material Substances 0.000 description 1
- 230000001186 cumulative effect Effects 0.000 description 1
- 238000004925 denaturation Methods 0.000 description 1
- 230000036425 denaturation Effects 0.000 description 1
- 230000006866 deterioration Effects 0.000 description 1
- 238000003618 dip coating Methods 0.000 description 1
- 238000007772 electroless plating Methods 0.000 description 1
- -1 for example Polymers 0.000 description 1
- 238000007646 gravure printing Methods 0.000 description 1
- 230000023597 hemostasis Effects 0.000 description 1
- 230000002439 hemostatic effect Effects 0.000 description 1
- 238000010030 laminating Methods 0.000 description 1
- 238000007561 laser diffraction method Methods 0.000 description 1
- 239000007788 liquid Substances 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000011328 necessary treatment Methods 0.000 description 1
- 239000012811 non-conductive material Substances 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 235000004252 protein component Nutrition 0.000 description 1
- 238000000790 scattering method Methods 0.000 description 1
- 238000007650 screen-printing Methods 0.000 description 1
- 239000004065 semiconductor Substances 0.000 description 1
- 238000005507 spraying Methods 0.000 description 1
- 238000004544 sputter deposition Methods 0.000 description 1
- 239000010935 stainless steel Substances 0.000 description 1
- 229910001220 stainless steel Inorganic materials 0.000 description 1
- 239000002344 surface layer Substances 0.000 description 1
- 239000010409 thin film Substances 0.000 description 1
- 238000007740 vapor deposition Methods 0.000 description 1
- 239000008096 xylene Substances 0.000 description 1
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/12—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material
- A61L31/125—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having a macromolecular matrix
- A61L31/128—Composite materials, i.e. containing one material dispersed in a matrix of the same or different material having a macromolecular matrix containing other specific inorganic fillers not covered by A61L31/126 or A61L31/127
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/04—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating
- A61B18/12—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating by passing a current through the tissue to be heated, e.g. high-frequency current
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/04—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating
- A61B18/12—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating by passing a current through the tissue to be heated, e.g. high-frequency current
- A61B18/14—Probes or electrodes therefor
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/04—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating
- A61B18/12—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating by passing a current through the tissue to be heated, e.g. high-frequency current
- A61B18/14—Probes or electrodes therefor
- A61B18/1402—Probes for open surgery
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/04—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating
- A61B18/12—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating by passing a current through the tissue to be heated, e.g. high-frequency current
- A61B18/14—Probes or electrodes therefor
- A61B18/1442—Probes having pivoting end effectors, e.g. forceps
- A61B18/1445—Probes having pivoting end effectors, e.g. forceps at the distal end of a shaft, e.g. forceps or scissors at the end of a rigid rod
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
- A61L31/082—Inorganic materials
- A61L31/088—Other specific inorganic materials not covered by A61L31/084 or A61L31/086
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L31/00—Materials for other surgical articles, e.g. stents, stent-grafts, shunts, surgical drapes, guide wires, materials for adhesion prevention, occluding devices, surgical gloves, tissue fixation devices
- A61L31/08—Materials for coatings
- A61L31/10—Macromolecular materials
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B32—LAYERED PRODUCTS
- B32B—LAYERED PRODUCTS, i.e. PRODUCTS BUILT-UP OF STRATA OF FLAT OR NON-FLAT, e.g. CELLULAR OR HONEYCOMB, FORM
- B32B27/00—Layered products comprising a layer of synthetic resin
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B32—LAYERED PRODUCTS
- B32B—LAYERED PRODUCTS, i.e. PRODUCTS BUILT-UP OF STRATA OF FLAT OR NON-FLAT, e.g. CELLULAR OR HONEYCOMB, FORM
- B32B27/00—Layered products comprising a layer of synthetic resin
- B32B27/18—Layered products comprising a layer of synthetic resin characterised by the use of special additives
-
- H—ELECTRICITY
- H01—ELECTRIC ELEMENTS
- H01B—CABLES; CONDUCTORS; INSULATORS; SELECTION OF MATERIALS FOR THEIR CONDUCTIVE, INSULATING OR DIELECTRIC PROPERTIES
- H01B1/00—Conductors or conductive bodies characterised by the conductive materials; Selection of materials as conductors
- H01B1/20—Conductive material dispersed in non-conductive organic material
- H01B1/22—Conductive material dispersed in non-conductive organic material the conductive material comprising metals or alloys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00053—Mechanical features of the instrument of device
- A61B2018/00059—Material properties
- A61B2018/00071—Electrical conductivity
- A61B2018/00077—Electrical conductivity high, i.e. electrically conducting
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00053—Mechanical features of the instrument of device
- A61B2018/00059—Material properties
- A61B2018/00089—Thermal conductivity
- A61B2018/00101—Thermal conductivity low, i.e. thermally insulating
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00053—Mechanical features of the instrument of device
- A61B2018/00107—Coatings on the energy applicator
- A61B2018/0013—Coatings on the energy applicator non-sticking
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00571—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body for achieving a particular surgical effect
- A61B2018/00589—Coagulation
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00571—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body for achieving a particular surgical effect
- A61B2018/00595—Cauterization
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00571—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body for achieving a particular surgical effect
- A61B2018/00601—Cutting
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B2018/00571—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body for achieving a particular surgical effect
- A61B2018/0063—Sealing
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61B—DIAGNOSIS; SURGERY; IDENTIFICATION
- A61B18/00—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body
- A61B18/04—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating
- A61B18/12—Surgical instruments, devices or methods for transferring non-mechanical forms of energy to or from the body by heating by passing a current through the tissue to be heated, e.g. high-frequency current
- A61B18/14—Probes or electrodes therefor
- A61B2018/1405—Electrodes having a specific shape
- A61B2018/1412—Blade
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2420/00—Materials or methods for coatings medical devices
- A61L2420/04—Coatings containing a composite material such as inorganic/organic, i.e. material comprising different phases
Landscapes
- Health & Medical Sciences (AREA)
- Surgery (AREA)
- Life Sciences & Earth Sciences (AREA)
- Engineering & Computer Science (AREA)
- Animal Behavior & Ethology (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Heart & Thoracic Surgery (AREA)
- General Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Physics & Mathematics (AREA)
- Medical Informatics (AREA)
- Molecular Biology (AREA)
- Otolaryngology (AREA)
- Biomedical Technology (AREA)
- Plasma & Fusion (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Epidemiology (AREA)
- Vascular Medicine (AREA)
- Inorganic Chemistry (AREA)
- Materials Engineering (AREA)
- Composite Materials (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Dispersion Chemistry (AREA)
- Laminated Bodies (AREA)
- Surgical Instruments (AREA)
- Other Surface Treatments For Metallic Materials (AREA)
Description
本発明は、医療機器用付着防止膜および医療機器に関する。 The present invention relates to an adhesion-preventing film for medical devices and medical devices.
医療用器具の表面に生体物質等が付着することを抑止するため、医療用器具の表面に付着防止膜がコーティングされる場合がある。しかし、例えば、生体物質に高周波電力を放出する医療用器具においては、生体物質のタンパク質成分等が高温で変性することによって医療用器具の表面に生体物質が強固に付着する。このため、生体物質に高周波電力を放出する医療用器具においては、付着防止性能をさらに向上することが強く求められている。
例えば、粘着テープ等の粘着性被切断物を切断する刃物の技術分野においては、特許文献1に記載されたように、第1層にシリカ連続皮膜層、第2層にシリカ粒子不連続層、第3層にシリコーン層が用いられた付着防止膜が知られている。
An anti-adhesion film may be coated on the surface of the medical device in order to prevent biological substances and the like from adhering to the surface of the medical device. However, for example, in a medical device that emits high-frequency power to a biological substance, the biological substance firmly adheres to the surface of the medical device due to denaturation of a protein component or the like of the biological substance at a high temperature. Therefore, in medical instruments that emit high-frequency power to biological substances, it is strongly required to further improve the adhesion prevention performance.
For example, in the technical field of a cutting tool for cutting an adhesive object to be cut such as an adhesive tape, as described in
しかしながら、上記のような従来技術には、以下のような問題がある。
特許文献1に記載の付着防止膜は、導電性を有しないため、例えば高周波処置具のような導電性が要求される医療機器に採用できる技術ではない。
付着防止膜に導電性を付与する技術として、半導体ウェハの集積回路チップの通電検査するためのプローブピンの付着防止膜が知られている。
However, the above-mentioned prior art has the following problems.
Since the adhesion prevention film described in
As a technique for imparting conductivity to an adhesion prevention film, an adhesion prevention film for probe pins for energizing an integrated circuit chip of a semiconductor wafer is known.
本発明は、上記のような問題に鑑みてなされたものであり、生体物質に高周波電力を放出する医療機器に用いて生体物質の付着防止性能を向上することができる医療機器用付着防止膜および生体物質の付着防止性能を向上することができる生体物質に高周波電力を放出する医療機器を提供することを目的とする。 The present invention has been made in view of the above problems, adhesion medical device capable of improving adhesion prevention performance BIOLOGICAL materials using high-frequency power to be that physicians療機device releasing the biological material An object of the present invention is to provide a medical device that emits high-frequency power to a biological substance capable of improving the adhesion prevention performance of the preventive film and the biological substance.
上記の課題を解決するために、本発明の第1の態様の医療機器用付着防止膜は、生体物質に高周波電力を放出する医療機器の表面に形成された単層または多層の付着防止膜であって、連続使用温度が200℃以上の樹脂と複数の導電性粒子とを有する最外層を備え、前記最外層の表面に、前記樹脂から前記複数の導電性粒子の一部が露出することによって凹凸が形成されており、前記複数の導電性粒子は、メディアン径が1μm以上20μm以下である第1の導電性粒子群と、メディアン径が0.01μm以上0.5μm以下である第2の導電性粒子群と、を含む。
ここで、連続使用温度が200℃とは、ISO−75に準拠した樹脂組成物の0.45MPa荷重での熱変形温度が、200℃以上であることである。
In order to solve the above problems, the anti-adhesion film for medical devices according to the first aspect of the present invention is a single-layer or multi-layer anti-adhesion film formed on the surface of a medical device that emits high-frequency power to a biological substance. A resin having a continuous use temperature of 200 ° C. or higher and an outermost layer having a plurality of conductive particles are provided, and a part of the plurality of conductive particles is exposed from the resin on the surface of the outermost layer. The plurality of conductive particles are formed with irregularities, and the plurality of conductive particles include a first conductive particle group having a median diameter of 1 μm or more and 20 μm or less, and a second conductive particle group having a median diameter of 0.01 μm or more and 0.5 μm or less. Includes a group of sex particles .
Here, the continuous use temperature of 200 ° C. means that the thermal deformation temperature of the resin composition conforming to ISO-75 under a load of 0.45 MPa is 200 ° C. or higher.
上記医療機器用付着防止膜においては、医療機器の表面に形成された単層または多層の付着防止膜であって、連続使用温度が200℃以上の樹脂と複数の導電性粒子とを有する最外層を備え、前記最外層の表面に、前記樹脂から前記複数の導電性粒子の一部が露出することによって凹凸が形成されていてもよい。 The adhesion-preventing film for medical devices is a single-layer or multi-layer adhesion-preventing film formed on the surface of a medical device, and is the outermost layer having a resin having a continuous use temperature of 200 ° C. or higher and a plurality of conductive particles. The outermost layer may have irregularities formed on the surface of the outermost layer by exposing a part of the plurality of conductive particles from the resin.
上記医療機器用付着防止膜においては、前記連続使用温度が200℃以上の樹脂は、シリコーン樹脂、フラン樹脂、ポリアミド樹脂、アリル樹脂、ポリイミド樹脂、PEEK(ポリエーテルエーテルケトン)樹脂、エポキシ樹脂、より成る群より、選択された1つ以上の樹脂を含んでもよい。 In the adhesion prevention film for medical devices, the resin having a continuous use temperature of 200 ° C. or higher is a silicone resin, a furan resin, a polyamide resin, an allyl resin, a polyimide resin, a PEEK (polyetheretherketone) resin, an epoxy resin, or more. It may contain one or more selected resins from the group consisting of.
上記医療機器用付着防止膜においては、前記連続使用温度が200℃以上の樹脂は、シリコーン樹脂であってもよい。 In the adhesion prevention film for medical devices, the resin having a continuous use temperature of 200 ° C. or higher may be a silicone resin.
上記医療機器用付着防止膜においては、前記最外層の表面における凹凸の大きさは、最大高さRzで0.3μm以上であってもよい。 In the adhesion prevention film for medical devices, the size of the unevenness on the surface of the outermost layer may be 0.3 μm or more at the maximum height Rz.
上記医療機器用付着防止膜においては、前記第1の導電性粒子群は、不導体からなる粒子状の基材と、前記基材の表面に積層された金属層と、を有する複合粒子を含んでもよい。 In the adhesion prevention film for medical devices, the first conductive particle group includes composite particles having a particulate base material made of a non-conductor and a metal layer laminated on the surface of the base material. It may be.
上記医療機器用付着防止膜においては、前記複数の導電性粒子は、不導体からなる粒子状の基材と、前記基材の表面に積層された金属層と、を有する複合粒子を含んでもよい。 In the adhesion prevention film for medical devices, the plurality of conductive particles may include composite particles having a particulate base material made of a non-conductor and a metal layer laminated on the surface of the base material. ..
上記医療機器用付着防止膜においては、前記複数の導電性粒子は、銀、白金、銅、ニッケル、および金より成る群より、選択された1つ以上の金属を含んでもよい。 In the anti-adhesion film for medical devices, the plurality of conductive particles may contain one or more metals selected from the group consisting of silver, platinum, copper, nickel, and gold.
上記医療機器用付着防止膜においては、前記最外層よりも下層側に、シリカを主成分とし前記医療機器の表面に密着する最下層を備えてもよい。 In the adhesion prevention film for medical devices, a lowermost layer containing silica as a main component and in close contact with the surface of the medical device may be provided on the lower layer side of the outermost layer.
本発明の第2の態様の医療機器は、生体物質に高周波電力を放出する医療機器であって、上記医療機器用付着防止膜を備える。 The medical device according to the second aspect of the present invention is a medical device that emits high-frequency power to a biological substance, and includes the above-mentioned adhesion prevention film for medical devices.
本発明の医療機器用付着防止膜によれば、生体物質に高周波電力を放出する医療機器に用いて生体物質の付着防止性能を向上することができるという効果を奏する。
本発明の生体物質に高周波電力を放出する医療機器によれば、生体物質の付着防止性能を向上することができるという効果を奏する。
According to antiadhesive film medical device of the present invention, an effect that it is possible to improve the adhesion prevention performance BIOLOGICAL materials using high-frequency power to be that physicians療機device releasing the biological material.
According to the medical device that emits high-frequency power to the biological material of the present invention, there is an effect that the adhesion prevention performance of the biological material can be improved.
以下では、本発明の実施形態について添付図面を参照して説明する。すべての図面において、実施形態が異なる場合であっても、同一または相当する部材には同一の符号を付し、共通する説明は省略する。 Hereinafter, embodiments of the present invention will be described with reference to the accompanying drawings. In all the drawings, even if the embodiments are different, the same or corresponding members are designated by the same reference numerals, and common description will be omitted.
[第1の実施形態]
本発明の第1の実施形態の医療機器用付着防止膜について説明する。
図1は、本発明の第1の実施形態の医療機器用付着防止膜の構成例を示す模式的な断面図である。
なお、各図面は、模式図のため形状や寸法は誇張されている(以下の図面も同じ)。
[First Embodiment]
The adhesion prevention film for medical devices according to the first embodiment of the present invention will be described.
FIG. 1 is a schematic cross-sectional view showing a configuration example of an adhesion prevention film for a medical device according to the first embodiment of the present invention.
Since each drawing is a schematic drawing, the shape and dimensions are exaggerated (the same applies to the following drawings).
図1は、医療機器において生体を把持する把持部の表面近くの構造を説明する断面図である。この把持部は把持した生体に高周波を印加する構成になっており、医療機器の把持部の表面付近である医療機器表面部1に非絶縁性(導電性)の付着防止膜2(医療機器用付着防止膜、最外層)が形成されている。
医療機器の非絶縁部を構成する本実施形態の付着防止膜2について説明する。
本実施形態では、医療機器の非絶縁部は、単層の付着防止膜2によって構成される。
付着防止膜2は、医療機器表面部1の表面1a上に積層されている。以下では、誤解のおそれがない場合には、付着防止膜2の膜厚方向において、表面1aの方を下方向、表面1aと反対側の表面2a(最外層の表面)の方を上方向として、下側、下部、上側、上部などと言う場合がある。
図1は拡大図のため、表面1a全体に付着防止膜2が形成されている様子が描かれているが、付着防止膜2を形成する部位は、非絶縁部が形成される部分のみでよい。
表面1aの形状は、付着防止膜2が密着できれば、特に限定されない。例えば、表面1aは平面でもよいし湾曲面でもよい。付着防止膜2が表面1aに対してより強固に密着するためには、表面1aは粗面であってもよい。
ここで、粗面とは、レーザー顕微鏡による算術平均粗さRaで、0.1μm以上2.0μm以下のような凹凸形状が形成された面を意味する。このような粗面は、例えば、ブラスト処理を用いた粗し加工が施されることによって形成可能である。
FIG. 1 is a cross-sectional view illustrating a structure near the surface of a grip portion that grips a living body in a medical device. This grip portion is configured to apply high frequency to the gripped living body, and is a non-insulating (conductive) adhesion prevention film 2 (for medical equipment) on the
The
In the present embodiment, the non-insulating portion of the medical device is composed of a single-layer
The
Since FIG. 1 is an enlarged view, the appearance of the
The shape of the
Here, the rough surface means a surface on which an uneven shape such as 0.1 μm or more and 2.0 μm or less is formed in the arithmetic mean roughness Ra by a laser microscope. Such a rough surface can be formed, for example, by performing a roughing process using a blast treatment.
付着防止膜2は、ベース樹脂であるシリコーン4と、シリコーン4に分散された導電性粒子群である複数の第1の導電性粒子5A(第1の導電性粒子群)および複数の第2の導電性粒子5B(第2の導電性粒子群)とを含んで構成される。
The
シリコーン4は、医療機器表面部1の表面1aに密着するとともに、各第1の導電性粒子5Aおよび各第2の導電性粒子5Bを保持する。シリコーン4を形成するシリコーン樹脂の種類は、連続使用温度が200℃以上であれば、特に限定されない。連続使用温度が200℃であるとは、ISO−75に準拠した樹脂組成物の0.45MPa荷重での熱変形温度が、200℃以上であることである。
シリコーン樹脂としては、例えば、エレクトロニクス用シリコーンレジンSILRES(登録商標)シリーズ(商品名;旭化成ワッカーシリコーン株式会社製)などが用いられてもよい。
The silicone 4 adheres to the
As the silicone resin, for example, silicone resin SILRES (registered trademark) series for electronics (trade name; manufactured by Asahi Kasei Wacker Silicone Co., Ltd.) may be used.
付着防止膜2では、ベース樹脂として、高耐熱性を有するシリコーン樹脂が用いられているため、非絶縁部から高周波を印加する医療機器用付着防止膜として特に良好な性能が得られる。ただし、付着防止膜2に用いるベース樹脂は、高耐熱性を有する樹脂であれば、シリコーン樹脂には限定されない。
例えば、付着防止膜2におけるベース樹脂は、連続使用温度が200℃以上である種々の樹脂が用いられてもよい。ベース樹脂の種類は、例えば、シリコーン樹脂、フラン樹脂、ポリアミド樹脂、アリル樹脂、ポリイミド樹脂、PEEK樹脂、エポキシ樹脂、より成る群より、選択された1つ以上の樹脂を含む樹脂でもよい。
Since the
For example, as the base resin in the
複数の第1の導電性粒子5Aおよび複数の第2の導電性粒子5Bは,付着防止膜2に導電性を付与するとともに、シリコーン4の表面4aから外部に露出することによって、付着防止膜2の表面2aに凹凸形状を形成する。
ただし、第1の導電性粒子群のメディアン径と、第2の導電性粒子群のメディアン径とは互いに異なる。本実施形態では、第1の導電性粒子群のメディアン径は、第2の導電性粒子群のメディアン径よりも大きい。
第1の導電性粒子群のメディアン径が第2の導電性粒子群のメディアン径よりも大きいことによって、第1の導電性粒子5A同士の隙間に、第2の導電性粒子5Bが入り込み易くなる。このため、隣り合う第1の導電性粒子5A同士あるいは第1の導電性粒子5Aと表面1aとの間の隙間に進入した第2の導電性粒子5Bが、第1の導電性粒子5Aあるいは表面1aと当接することによって接触面積および導電路が増加する。このため、付着防止膜2中の第1の導電性粒子5Aおよび第2の導電性粒子5Bと表面1aとの導電性能が向上し、体積抵抗率が低下する。
さらに、隣り合う第1の導電性粒子5A同士あるいは第1の導電性粒子5Aと表面1aとの間の隙間に、第2の導電性粒子5Bが進入することによって、第1の導電性粒子5Aが堅固に支持されるため、第1の導電性粒子5Aの位置の安定性が向上する。
The plurality of first
However, the median diameter of the first conductive particle group and the median diameter of the second conductive particle group are different from each other. In the present embodiment, the median diameter of the first conductive particle group is larger than the median diameter of the second conductive particle group.
When the median diameter of the first conductive particle group is larger than the median diameter of the second conductive particle group, the second
Further, when the second
例えば、第1の導電性粒子群のメディアン径は、1μm以上20μm以下でもよい。例えば、第2の導電性粒子群のメディアン径は、0.01μm以上0.5μm以下でもよい。
ここで、メディアン径は、体積基準累積粒度分布における50%粒子径(D50)の意味である。
粒度分布の測定手段としては、光散乱式の粒度分析装置が用いられる。具体的には、測定対象の粒度の分布範囲に応じて、例えば、レーザー回折・散乱式によるマイクロトラック粒度分析装置、動的光散乱式によるナノトラック粒度分析装置などが適宜使い分けられる。
For example, the median diameter of the first conductive particle group may be 1 μm or more and 20 μm or less. For example, the median diameter of the second conductive particle group may be 0.01 μm or more and 0.5 μm or less.
Here, the median diameter means the 50% particle diameter (D50) in the volume-based cumulative particle size distribution.
As a means for measuring the particle size distribution, a light scattering type particle size analyzer is used. Specifically, for example, a microtrack particle size analyzer based on a laser diffraction / scattering type, a nanotrack particle size analyzer based on a dynamic light scattering type, or the like is appropriately used according to the distribution range of the particle size of the measurement target.
第1の導電性粒子5Aおよび第2の導電性粒子5Bの材質は、生体適合性を有し、非絶縁部に必要な導電性が得られる材質であれば特に限定されない。第1の導電性粒子5Aおよび第2の導電性粒子5Bは、金属粒子であってもよいし、不導体粒子の表面に金属コーティングを施した粒子でもよい。
第1の導電性粒子5Aおよび第2の導電性粒子5Bに用いる金属は、同一金属でもよいし、異種金属でもよい。
第1の導電性粒子5A、第2の導電性粒子5Bに用いることができる金属材料の例としては、銀、白金、銅、ニッケル、金などが挙げられる。
本実施形態では、第1の導電性粒子5Aおよび第2の導電性粒子5Bとして、生体適合性および電気導電率の点で特に好ましい金粒子が用いられている。
The materials of the first
The metals used for the first
Examples of the metal material that can be used for the first
In the present embodiment, gold particles, which are particularly preferable in terms of biocompatibility and electrical conductivity, are used as the first
付着防止膜2における第1の導電性粒子5Aおよび第2の導電性粒子5Bの配合量は、医療機器の非絶縁部に必要なインピーダンスを満足するとともに、切断または封止された生体物質が剥がれやすくなる適宜値を採用すればよい。
例えば、第1の導電性粒子5Aが多くなると、表面2aにおける凹凸形状が、第1の導電性粒子5Aの突出量によって支配されるため、凹凸が大きくなる。このため、生体物質の密着性が低下して、生体物質が剥離しやすくなる。一方、相対的に第2の導電性粒子5Bが減少するため、第1の導電性粒子5A同士および第1の導電性粒子5Aと表面1aとの間に介在する第2の導電性粒子5Bも減って、導電性が低下する。
反対に、相対的に第2の導電性粒子5Bが多くなると、第2の導電性粒子5Bによって導電性は向上するものの、表面2aの凹凸形状は、第2の導電性粒子5Bの突出量によって支配されるため、凹凸が小さくなり、滑らかな平面に近づく。このため、生体物質の密着性が高まって生体物質が剥離しにくくなる。
このような凹凸形状による剥離性能は、凹凸形状の最大高さRzの大きさによって決まってくる。
例えば、表面2aの凹凸の大きさは、最大高さRzで0.3μm以上であってもよい。
The blending amount of the first
For example, when the number of the first
On the contrary, when the number of the second
The peeling performance due to such an uneven shape is determined by the size of the maximum height Rz of the uneven shape.
For example, the size of the unevenness of the
このような構成の付着防止膜2を形成するには、まず、シリコーン4となるシリコーン樹脂、シリコーン樹脂を溶かす溶剤、第1の導電性粒子5A、および第2の導電性粒子5Bを混合して、付着防止膜2を形成するための塗料を調製する。次に、この塗料を、医療機器表面部1における表面1aに塗膜する。
塗膜方法は、特に限定されず、医療機器表面部1の形状などに応じて適宜の塗膜方法が用いられる。例えば、塗膜方法の例としては、スピンコート、スクリーン印刷、インクジェット法、フレキソ印刷、スプレー塗膜、グラビア印刷、ホットスタンプ、ディップコート等が挙げられる。
ただし必要であれば、塗膜する前に、表面1aに粗し加工を行って、表面1aが粗面化されてもよい。
塗膜後に、塗膜層の加熱乾燥を行う。これにより、溶剤が揮発して、シリコーン樹脂が固化して、層厚が減少してシリコーン4の層膜が形成される。この結果、上部の第1の導電性粒子5Aおよび第2の導電性粒子5Bの一部が、表面4aから外部に露出する。また、表面1aに対向する第1の導電性粒子5Aおよび第2の導電性粒子5Bは、表面1aに当接する。
以上で、付着防止膜2が製造される。
In order to form the
The coating film method is not particularly limited, and an appropriate coating film method is used depending on the shape of the
However, if necessary, the
After the coating film, the coating film layer is heat-dried. As a result, the solvent volatilizes, the silicone resin solidifies, the layer thickness decreases, and a layer film of silicone 4 is formed. As a result, a part of the upper first
With the above, the
図1に示すように、本実施形態の付着防止膜2は、シリコーン4が医療機器表面部1の表面1aと密着することによって表面1a上に固着されている。
付着防止膜2の内部には、多くの第1の導電性粒子5Aと第2の導電性粒子5Bとが互いに接触した状態で、シリコーン4に分散されている。第1の導電性粒子5Aおよび第2の導電性粒子5Bは、固化したシリコーン4に保持されて、互いの相対位置が固定されている。
表面1aと付着防止膜2との境界では、表面1aに対向する第1の導電性粒子5Aおよび第2の導電性粒子5Bが、表面1aと当接している。
シリコーン4の表面4aからは、第1の導電性粒子5Aおよび第2の導電性粒子5Bの一部が露出している。このため、付着防止膜2の表面2aには、第1の導電性粒子5Aおよび第2の導電性粒子5Bによる凹凸形状が形成されている。
As shown in FIG. 1, the
Inside the
At the boundary between the
A part of the first
このような構成によって、医療機器表面部1と付着防止膜2の表面の第1の導電性粒子5Aおよび第2の導電性粒子5Bとは導通しており、付着防止膜2全体としては、導電性を有する。
With such a configuration, the
このような付着防止膜2を非絶縁部に用いた医療機器では、非絶縁部から高周波電力を放出する際に、非絶縁部に接触する生体組織が変性して形成される生体物質が付着しやすい。
しかし、本実施形態の付着防止膜2の表面は、金粒子によって凹凸形状が形成された付着防止膜2が形成されている。このため、生体物質の付着力は、平滑面のように全面に均一に密着する場合に比べて低い。したがって、生体物質が付着しても小さな外力によって容易に剥離される。
In a medical device using such an
However, on the surface of the
以上説明したように、本実施形態の付着防止膜2によれば、表面2aに第1の導電性粒子5Aおよび第2の導電性粒子5Bが露出して凹凸が形成されているため、生体物質に高周波電力を放出するような医療機器に用いても生体物質の付着防止性能を向上することができる。
As described above, according to the
[第2の実施形態]
次に、本発明の第2の実施形態の医療機器用付着防止膜について説明する。
図2は、本発明の第2の実施形態の医療機器用付着防止膜の構成例を示す模式的な断面図である。
[Second Embodiment]
Next, the adhesion prevention film for medical devices according to the second embodiment of the present invention will be described.
FIG. 2 is a schematic cross-sectional view showing a configuration example of an adhesion prevention film for a medical device according to a second embodiment of the present invention.
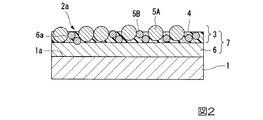
図2に断面構成を示すように、医療機器の非絶縁部は、上記第1の実施形態における付着防止膜2に代えて、多層膜である付着防止膜7(医療機器用付着防止膜)を備える。
付着防止膜7は、医療機器表面部1の表面1a上に積層された第1層6(最下層)と、第1層6の上面6aに積層された第2層3(最外層)と、の2層で構成される。
第1層6は、表面1aに対する付着防止膜7の密着性を向上するために設けられている。
第1層6の材質としては、第2層3および表面1aとの密着性に優れる適宜の材質が用いられる。本実施形態では、後述する第2層3のベース樹脂がシリコーン樹脂からなるため、第1層6として、シリカを主成分とするシリカ層が採用されている。シリカ層を形成するには、例えば、Olam(登録商標)ガラスコートシリーズ(商品名;アートブリード株式会社製)などのコート剤を用いてもよい。
第1層6の層厚は、密着強度、耐久性などの必要に応じて適宜の層厚にすることができる。例えば、第1層6の層厚は、0.1μm以上10μm以下としてもよい。
As shown in the cross-sectional structure in FIG. 2, the non-insulating portion of the medical device is replaced with the adhesion-preventing film 7 (adhesion-preventing film for medical devices) which is a multilayer film, instead of the adhesion-preventing
The
The first layer 6 is provided to improve the adhesion of the
As the material of the first layer 6, an appropriate material having excellent adhesion to the second layer 3 and the
The layer thickness of the first layer 6 can be an appropriate layer thickness as needed, such as adhesion strength and durability. For example, the layer thickness of the first layer 6 may be 0.1 μm or more and 10 μm or less.
第2層3は、本実施形態では、上記第1の実施形態の付着防止膜2と同様に構成される。このため、本実施形態における第2層3のベース樹脂はシリコーン4である。
ただし、上記第1の実施形態と同様、第2層3のベース樹脂は、連続使用温度が200℃以上の樹脂に置換されてもよい。
In the present embodiment, the second layer 3 is configured in the same manner as the
However, as in the first embodiment, the base resin of the second layer 3 may be replaced with a resin having a continuous use temperature of 200 ° C. or higher.
このような構成の付着防止膜7を形成するには、医療機器表面部1の表面1a上に第1層6を形成した後、第2層3を形成する。
第1層6を形成するには、例えば、シリカを溶剤中に含むコート液を医療機器表面部1の表面1aに塗膜した後、加熱乾燥させる。
上記第1の実施形態と同様に、表面1aに粗し加工を施す場合には、第1層6の層厚を粗し加工の凹凸量に比べて十分薄くすることによって、第1層6の上面6aにも凹凸形状を形成することができる。
第2層3は、第1層6上に形成する点を除いては、上記第1の実施形態の付着防止膜2と同様にして形成することができる。
In order to form the
In order to form the first layer 6, for example, a coating liquid containing silica in a solvent is coated on the
Similar to the first embodiment, when the
The second layer 3 can be formed in the same manner as the
本実施形態の付着防止膜7によれば、最外層として、上記第1の実施形態の付着防止膜2と同様の第2層3を備えるため、上記第1の実施形態と同様、生体物質に高周波電力を放出するような医療機器に用いても生体物質の付着防止性能を向上することができる。
さらに付着防止膜7によれば、第2層3と医療機器表面部1の表面1aとの間に第1層6が形成されている。第1層6はシリカ層からなるため、金属製の医療機器表面部1との密着性が良好であり、かつ、第2層3のシリコーン4、第1の導電性粒子5Aおよび第2の導電性粒子5Bとの密着性も良好である。
このため、表面1a上に直に第2層3を形成する場合に比べて、第2層3の密着強度を向上することができる。このため、医療機器の耐久性、信頼性をより向上することができる。
According to the
Further, according to the
Therefore, the adhesion strength of the second layer 3 can be improved as compared with the case where the second layer 3 is formed directly on the
[第3の実施形態]
次に、本発明の第3の実施形態の医療機器用付着防止膜について説明する。
図3は、本発明の第3の実施形態の医療機器用付着防止膜の構成例を示す模式的な断面図である。
[Third Embodiment]
Next, the adhesion prevention film for medical devices according to the third embodiment of the present invention will be described.
FIG. 3 is a schematic cross-sectional view showing a configuration example of an adhesion prevention film for a medical device according to a third embodiment of the present invention.
本実施形態の付着防止膜12(医療機器用付着防止膜)は、上記第1の実施形態の付着防止膜2における第1の導電性粒子5Aに代えて、第1の導電性粒子15Aを備える。第1の導電性粒子15Aの全体は、第1の導電性粒子群を構成する。本実施形態における第1の導電性粒子群のメディアン径は、上記第1の実施形態と同様である。
以下、上記第1の実施形態と異なる点を中心に説明する。
The adhesion prevention film 12 (adhesion prevention film for medical devices) of the present embodiment includes first
Hereinafter, the points different from the first embodiment will be mainly described.
第1の導電性粒子15Aは、不導体からなる粒子状の基材15aと、基材15aの表面に積層された金属層15bとを有する複合粒子である。
基材15aの材質は、不導体であれば限定されない。基材15aの材質は良好な断熱性を有することがより好ましい。基材15aは、中空構造を有していてもよい。中空構造としては、球殻構造でもよいし多孔質構造でもよい。基材15aが中空構造を有する場合、基材15aが中実体である場合に比べて、第1の導電性粒子15Aにおける断熱性を向上することができる。
基材15aの材質は、例えば、ガラス、シリカ、アルミナ、ジルコニアなどが使用できる。基材15aとしては、中空シリカ系粒子、中空ガラス球などが用いられてもよい。中空ガラス球の具体例としては、例えば、3M(登録商標)グラスバブルズ(商品名;3M社製)等が挙げられる。
付着防止膜12における第1の導電性粒子15Aの含有量は、上記第1の実施形態と同様、表面2aの凹凸の大きさが最大高さRzで0.3μm以上となるような含有量であってもよい。
The first
The material of the
As the material of the
The content of the first
金属層15bに用いられる金属材料としては、上記第1の実施形態における第1の導電性粒子5Aと同様、例えば、銀、白金、銅、ニッケル、金等が挙げられる。金属層15bに用いられる金属材料は、第2の導電性粒子5Bに用いられる金属材料と同じでもよいし、異なっていてもよい。
Examples of the metal material used for the
金属層15bの層厚としては、付着防止膜12において必要な導電性および耐久性が確保できれば、特に限定されない。例えば、球体の比表面積は直径の大きさに反比例するため、基材15aの粒子径が小さい場合には金属層15bの層厚は薄くされ、基材15aの粒子径が大きい場合には金属層15bの層厚は厚くされてもよい。
金属層15bは、適宜のコーティングによって基材15aに積層されてもよい。金属層15bの形成に用いることができるコーティング方法としては、例えば、無電解メッキ、PVD(Physical Vapor Deposition)、CVD(Chemical Vapor Deposition)などの手法が適用可能である。PVDの例としては、例えば、スパッタ、蒸着などが挙げられる。
The layer thickness of the
The
このような構成の付着防止膜12は、上記第1の実施形態における付着防止膜2と同様にして、医療機器表面部1上に形成される。
The
付着防止膜12は、上記第1の実施形態の付着防止膜2の第1の導電性粒子5Aに代えて、第1の導電性粒子15Aが用いられる以外は、上記第1の実施形態の付着防止膜2と同様に構成される。このため、上記第1の実施形態と同様、生体物質に高周波電力を放出するような医療機器に用いても生体物質の付着防止性能を向上することができる。
本実施形態における第1の導電性粒子15Aは、金属層15bが基材15aの表面に積層されているため、上記第1の実施形態における第1の導電性粒子5Aに比べて、金属の使用量が低減される。基材15aに用いられる不導体は、金属材料に比べて安価である。第1の導電性粒子15Aは、第1の導電性粒子5Aと同径の場合に、高価な金属材料の使用量が低減されるため、第1の導電性粒子15Aの部品コストが低減される。特に、基材15aとして、金、白金などのように高価な材料が用いられる場合には、部品コストの低減効果が大きくなる。
The
Since the
さらに、本実施形態では、第1の導電性粒子15Aが金属材料と不導体材料との複合体からなるため、熱伝導率が低下する。このため、第1の導電性粒子15Aが付着防止膜12に含有されることで、付着防止膜12の断熱性が向上する。
例えば、付着防止膜12が高周波電力を生体組織(生体物質)に放出する医療機器の電極部の表面に用いられる場合、高周波電力に起因するジュール熱で電極部が高温になる。電極部自体が高温になると、電極部の表面に接触する生体組織が過剰に変性されることによっても、電極部に生体組織が付着しやすくなるおそれがある。
しかし本実施形態では、生体と接触する医療機器の表面に、第1の導電性粒子15Aが含有されることによって、金属粒子のみが含有された場合よりも断熱性の高い付着防止膜12が形成されている。このため、付着防止膜12の良好な断熱性能によって、生体組織が過剰に変性されることを防止できる。この結果、付着防止膜12の付着防止性能がさらに向上する。
Further, in the present embodiment, since the first
For example, when the
However, in the present embodiment, by containing the first
[第4の実施形態]
次に、本発明の第4の実施形態の医療機器について説明する。
図4は、本発明の第4の実施形態の医療機器の一例を示す模式的な構成図である。図5は、図4におけるA−A断面図である。
[Fourth Embodiment]
Next, the medical device of the fourth embodiment of the present invention will be described.
FIG. 4 is a schematic configuration diagram showing an example of a medical device according to a fourth embodiment of the present invention. FIG. 5 is a cross-sectional view taken along the line AA in FIG.
図4に示す本実施形態の高周波ナイフ100は、本実施形態の医療機器の一例である。高周波ナイフ100は、高周波電圧を印加することで、生体組織(生体物質)を切開、切除したり、生体組織を凝固(止血)したり、焼灼したりする医療用処置具である。
高周波ナイフ100は、術者が手で持つための棒状の把持部102と、把持部102の先端から突出された電極部101とを備える。
The high-
The high-
電極部101は、被処置体である生体組織に当接させて高周波電圧を印加する。図5に示すように、電極部101は、金属製の電極本体101Aと、付着防止膜101B(医療機器用付着防止膜)とを備える。
The
図4に示すように、電極本体101Aの外形状は、突出方向の先端の角部に丸みを有する矩形片状とされている。図5に示すように、突出方向に直交する断面では、電極本体101Aは外縁に向かって厚さが薄くなっていく扁平形状である。特に図示しないが、突出方向の先端部における断面形状も同様に、外縁に向かって厚さが薄くなっている。
図4に示すように、電極本体101Aは、把持部102に保持された基端部に接続された配線によって高周波電源103に電気的に接続されている。高周波電源103には、被処置体に装着する対極板106が電気的に接続されている。
As shown in FIG. 4, the outer shape of the
As shown in FIG. 4, the
図5に示すように、付着防止膜101Bは、電極本体表面101aを被覆するように設けられた薄膜である。付着防止膜101Bの外表面は、電極部101の電極表面101bを構成している。
刃部101cを除く電極表面101bの側部には、全体として緩い湾曲形状もしくは平面形状に形成された腹部101dが形成されている。腹部101dは、主として被処置体を押さえて凝固や焼灼などの処置を行うために使用される。
As shown in FIG. 5, the
On the side portion of the
電極本体101Aの材質としては、金属、合金などの導電性を有する適宜の金属材料が用いられる。例えば、電極本体101Aの材質は、アルミニウム合金、ステンレス鋼などが用いられてもよい。
As the material of the
付着防止膜101Bは、上記第1〜第3の実施形態における付着防止膜2、7、12のうちのいずれかと同様の構成が用いられる。本実施形態における電極本体101Aは、上記第1〜第3の実施形態における医療機器表面部1に相当する。
The adhesion-preventing
次に、このような構成の高周波ナイフ100の作用について説明する。
高周波ナイフ100を用いた処置は、例えば、患者に対極板106を装着し、高周波電源103によって電極部101に高周波電圧を印加した状態で行われる。術者は、電極部101に高周波電圧を印加した状態で、患者の被処置部などの被処置体に電極部101の刃部101cまたは腹部101dを接触させる。
電極部101は付着防止膜101Bに覆われている。付着防止膜101Bの内部には、第1および第2の導電性粒子群が分散され、それらの一部が電極表面101bに露出している。付着防止膜101Bの内部において、第1および第2の導電性粒子群の第1および第2の導電性粒子は、互いに接触し、一部が電極本体表面101aに当接することによって、付着防止膜101Bの厚さ方向に連なる導電路が形成されている。
付着防止膜101Bの電極表面101bは、生体組織が付着しにくいシリコーン4から露出する第1および第2の導電性粒子が露出して、凹凸形状が形成されている。
Next, the operation of the high-
The treatment using the
The
The
電極部101と対極板106との間に高周波電圧が印加されると、付着防止膜101Bを介して高周波電流が発生する。電極部101と生体組織との接触部では、電極表面101bにおいて露出する第1および第2の導電性粒子から電流密度の大きい電流が生体組織に流れ、ジュール熱が発生する。これにより被処置体の生体組織の水分が急速に蒸発し、刃部101cで生体組織が破断される。このため、電極部101が生体組織に対して移動されることによって生体組織の切開、切除が可能となる。
腹部101dを被処置体に押し当てた状態で高周波電流が流されると、被処置体の生体組織の水分が急速に蒸発し、腹部101dの近傍で生体組織が凝固される。このため、腹部101dが被処置体に押し当てられることにより止血や生体組織の焼灼が可能となる。
必要な処置が終了すると、術者は、電極部101を被処置体から離間させる。このとき、生体組織と接触している電極表面101bは、付着防止膜101Bによって形成されているため、電極部101を離間する際に、電極表面101bから生体組織が容易に剥離する。
この結果、高周波ナイフ100では、生体組織は電極表面101bにほとんど付着しない。このため、高周波ナイフ100によれば、処置中の処置性能の低下が防止できる。さらに、電極部101が繰り返し使用されても電極部101の耐久性が確保される。
When a high frequency voltage is applied between the
When a high-frequency current is applied while the abdomen 101d is pressed against the treated body, the water content of the living tissue of the treated body rapidly evaporates, and the living tissue is coagulated in the vicinity of the abdomen 101d. Therefore, when the abdomen 101d is pressed against the body to be treated, hemostasis and cauterization of living tissue become possible.
When the necessary treatment is completed, the operator separates the
As a result, in the
以上説明したように、高周波ナイフ100によれば、付着防止膜101Bを電極部101の表面に備えるため、生体物質の付着防止性能を向上することができる。
As described above, according to the high-
なお、上記各実施形態の説明では、最外層が、第1の導電性粒子群および第2の導電性粒子群とからなる場合の例で説明した。しかし、複数の導電性粒子群は、2群には限定されず、3群以上であってもよい。
医療機器用付着防止膜が用いられる医療機器の使用目的に応じて、必要な凹凸形状と導電性とが得られれば、導電性粒子群は1群のみでもよい。
In the description of each of the above embodiments, an example in which the outermost layer is composed of the first conductive particle group and the second conductive particle group has been described. However, the plurality of conductive particle groups is not limited to two groups, and may be three or more groups.
Only one conductive particle group may be used as long as the required uneven shape and conductivity can be obtained according to the purpose of use of the medical device in which the adhesion prevention film for medical devices is used.
上記第2の実施形態の説明では、第1層6がシリカを主成分とするシリカ層からなる場合の例で説明したが、第1層6の材質は、医療機器表面部1および第2層3の材質に応じて適宜の材質を用いることができ、シリカ層には限定されない。
In the description of the second embodiment, the case where the first layer 6 is composed of a silica layer containing silica as a main component has been described, but the material of the first layer 6 is the medical
上記第2の実施形態の説明では、付着防止膜7が2層構成の多層膜の場合の例で説明した。しかし、医療機器用付着防止膜は、3層以上の多層膜でもよい。この場合、最下層と最外層との間に、中間層を備えることができるため、医療機器の把持部の基材および最外層にともに良好な密着性を有する材料がない場合にも、適宜の中間層を挟むことによってより強固な固定が可能になる。
また、第1層6および中間層の材質は、均一成分を有する材質には限定されない。例えば、層厚方向に成分の組成比が変化する傾斜層で構成されてもよい。
In the description of the second embodiment, the case where the
Further, the materials of the first layer 6 and the intermediate layer are not limited to the materials having a uniform component. For example, it may be composed of an inclined layer in which the composition ratio of the components changes in the layer thickness direction.
上記第3の実施形態の説明では、複数の導電性粒子群のうち、第1の導電性粒子群のみに、不導体からなる粒子状の基材と、基材の表面に積層された金属層とを有する複合粒子が含まれる場合の例で説明した。しかし、上記第3の実施形態において第2の導電性粒子群のみに複合粒子が含まれていてもよいし、第1および第2の導電性粒子群に複合粒子が含まれていてもよい。
医療機器用付着防止膜に3以上の導電性粒子群が含まれる場合、3以上の導電性粒子群のうち少なくとも1群に複合粒子が含まれていてもよい。この場合、効率的に部品コスト低減および断熱性向上を図るために、メディアン径が最も大きい導電性粒子群のみに複合粒子が含まれていてもよい。
In the description of the third embodiment, of the plurality of conductive particle groups, only the first conductive particle group has a particulate base material made of a non-conductor and a metal layer laminated on the surface of the base material. The case where composite particles having and are included has been described. However, in the third embodiment, the composite particles may be contained only in the second conductive particle group, or the composite particles may be contained in the first and second conductive particle groups.
When the adhesion prevention film for medical devices contains three or more conductive particle groups, at least one of the three or more conductive particle groups may contain composite particles. In this case, in order to efficiently reduce the component cost and improve the heat insulating property, the composite particles may be contained only in the conductive particle group having the largest median diameter.
次に、上述した第1〜第3の実施形態の医療機器用付着防止膜の実施例について、比較例とともに説明する。
まず、第1の実施形態の付着防止膜2の実施例1〜5と第2の実施形態の付着防止膜7の実施例6について、比較例1、2とともに説明する。
下記[表1]、[表2]に、各実施例、各比較例の医療機器用付着防止膜を形成する最外層形成用塗料の配合組成と、評価結果とを示す。ただし、[表1]では各部材の符号の表記は省略されている。
Next, examples of the adhesion prevention film for medical devices according to the first to third embodiments described above will be described together with comparative examples.
First, Examples 1 to 5 of the
The following [Table 1] and [Table 2] show the composition of the outermost layer-forming paint that forms the adhesion-preventing film for medical devices of each Example and each Comparative Example, and the evaluation results. However, in [Table 1], the notation of the code of each member is omitted.
[実施例1]
実施例1は、付着防止膜2の実施例である。実施例1の付着防止膜2は、以下のようにして製造された。
付着防止膜2を形成する基板として、アルミニウム基板が用いられた。
付着防止膜2を形成するため、10重量部のシリコーン樹脂、30重量部の第1の導電性粒子、30重量部の第2の導電性粒子、および30重量部の溶剤が混合された最外層形成用塗料が調製された。
シリコーン樹脂としては、SILRES(登録商標) MPF 52 E(商品名;旭化成ワッカーシリコーン株式会社製)が用いられた。第1の導電性粒子5Aとしては、メディアン径が5μmの金粒子が用いられた。第2の導電性粒子5Bとしては、メディアン径が50nmの金粒子が用いられた。ここで、粒度分布の測定手段としては、第1の導電性粒子の測定にはレーザー回折・散乱式によるマイクロトラック粒度分析装置が、第2の導電性粒子の測定には動的光散乱式によるナノトラック粒度分析装置が使用された。溶剤としては、キシレンが用いられた。
この最外層形成用塗料は、アルミニウム基板上に、ディップコートによって、塗膜され、200℃の温度条件で1時間乾燥された。これにより、膜厚5.0μmの付着防止膜2が成膜された。
付着防止膜2の表面2aの最大高さRzをレーザー顕微鏡OLS−3500(商品名;オリンパス社製)によって測定したところ、3.5μmであった。
[Example 1]
Example 1 is an example of the
An aluminum substrate was used as the substrate for forming the
An outermost layer in which 10 parts by weight of silicone resin, 30 parts by weight of first conductive particles, 30 parts by weight of second conductive particles, and 30 parts by weight of solvent are mixed to form the
As the silicone resin, SILRES (registered trademark) MPF 52 E (trade name; manufactured by Asahi Kasei Wacker Silicone Co., Ltd.) was used. As the first
The coating material for forming the outermost layer was coated on an aluminum substrate by a dip coat and dried at a temperature of 200 ° C. for 1 hour. As a result, an
The maximum height Rz of the
[実施例2〜5]
実施例2〜5は、[表1]に示すように、第1の導電性粒子5Aおよび第2の導電性粒子5Bのうち少なくとも一方のメディアン径が上記実施例1と異なる点を除いて、実施例1と同様に構成された。
実施例2〜4では、第2の導電性粒子5Bのメディアン径はいずれも50nmとされ、第1の導電性粒子5Aのメディアン径は、それぞれ、1μm、5μm、20μmとされた。
実施例5は、第2の導電性粒子5Bのメディアン径が500nmとされた点を除いて、上記実施例1と同様に構成された。
実施例2〜5の付着防止膜2の表面2aの最大高さRzを上記実施例1と同様にして測定したところ、それぞれ、0.7μm、3.0μm、15.1μm、3.3μmであった。
[Examples 2 to 5]
In Examples 2 to 5, as shown in [Table 1], except that at least one of the first
In Examples 2 to 4, the median diameter of the second
Example 5 was configured in the same manner as in Example 1 above, except that the median diameter of the second
When the maximum height Rz of the
[実施例6]
実施例6は、付着防止膜7の実施例であり、第1層6としてシリカ層を備え、第2層3は、上記実施例3の付着防止膜2と同様に構成された。
実施例6の付着防止膜7は、以下のようにして製造された。
まず、実施例1と同様のアルミニウム基板の表面に、Olam(登録商標) 60(商品名;アートブリード株式会社製)をスピンコートによって塗布した後、200℃で1時間乾燥させた。これにより、層厚1.0μmのシリカ層が形成された。その後、シリカ層上に、第2層3を形成するための最外層形成用塗料が上記実施例1と同様にして塗膜され、200℃の温度条件で1時間乾燥された。これにより、層厚約4.6μmの第2層3が成膜された。
実施例6の付着防止膜7の表面2aの最大高さRzを上記実施例1と同様にして測定したところ、3.6μmであった。
[Example 6]
Example 6 is an example of the
The
First, Olam (registered trademark) 60 (trade name; manufactured by Artbreed Co., Ltd.) was applied to the surface of an aluminum substrate similar to that in Example 1 by spin coating, and then dried at 200 ° C. for 1 hour. As a result, a silica layer having a layer thickness of 1.0 μm was formed. Then, the outermost layer forming paint for forming the second layer 3 was coated on the silica layer in the same manner as in Example 1 above, and dried at a temperature of 200 ° C. for 1 hour. As a result, the second layer 3 having a layer thickness of about 4.6 μm was formed.
The maximum height Rz of the
[比較例1、2]
[表1]に示すように、比較例1の医療機器用付着防止膜は、上記実施例1において、第1の導電性粒子5Aに代えて、メディアン径が10μmの金粒子を60重量部備え、第2の導電性粒子5Bを削除して構成された。
比較例2の医療機器用付着防止膜は、上記実施例1において、第2の導電性粒子5Bに代えて、メディアン径が50nmの金粒子を60重量部備え、第1の導電性粒子5Aを削除して構成された。
比較例1、2の医療機器用付着防止膜の表面2aの最大高さRzを上記実施例1と同様にして測定したところ、それぞれ、7.5μm、0.2μmであった。
[Comparative Examples 1 and 2]
As shown in [Table 1], the adhesion prevention film for medical devices of Comparative Example 1 includes 60 parts by weight of gold particles having a median diameter of 10 μm in place of the first
In the first embodiment, the anti-adhesion film for medical devices of Comparative Example 2 includes 60 parts by weight of gold particles having a median diameter of 50 nm instead of the second
When the maximum height Rz of the
[評価方法]
上記実施例1〜6、比較例1、2の医療機器用付着防止膜を供試サンプルとして、付着性評価と導電性評価とが行われた。[表2]に付着性評価と導電性評価との評価結果が示されている。
[Evaluation method]
Adhesion evaluation and conductivity evaluation were performed using the adhesion prevention films for medical devices of Examples 1 to 6 and Comparative Examples 1 and 2 as test samples. [Table 2] shows the evaluation results of the adhesiveness evaluation and the conductivity evaluation.
付着性評価としては、供試サンプルをホットプレートで200℃で加熱し、その上に生体物質として馬の血液をたらし、その後、JIS K5600−5−6に基づくクロスカット法によるテープ剥離試験が実施された。
付着性評価では、試験後の供試サンプルにおける馬の血液の固化物の剥がれ状態をJIS K5600−5−6に記載の表1の分類に基づいて評価した。剥がれ状態が「分類5」に該当する場合には、付着なし([表2]には○(good)と記載)と評価された。剥がれ状態が「分類0〜4」の場合には、付着あり([表1]には×(no good)と記載)と評価された。
なお、実施例1〜6、比較例1、2の各供試サンプルにおいて、医療機器用付着防止膜の一部または全部が馬の血液の固化物とともに剥がれることはなかった。
As an evaluation of adhesion, a test sample is heated at 200 ° C. on a hot plate, horse blood is poured onto it as a biological substance, and then a tape peeling test by a cross-cut method based on JIS K5600-5-6 is performed. It was implemented.
In the adhesion evaluation, the peeled state of the solidified horse blood in the test sample after the test was evaluated based on the classification in Table 1 described in JIS K5600-5-6. When the peeled state corresponds to "Category 5", it was evaluated as no adhesion (described as "good" in [Table 2]). When the peeling state was "Category 0 to 4", it was evaluated as having adhesion (described as x (no good) in [Table 1]).
In each of the test samples of Examples 1 to 6 and Comparative Examples 1 and 2, a part or all of the adhesion prevention membrane for medical devices was not peeled off together with the solidified horse blood.
導電性評価としては、供試サンプルの体積抵抗率の測定が実施された。
体積抵抗率が1.0×108Ω・cm以下の場合、導電性が良好([表1]には○(good)と記載)、体積抵抗率が1.0×108Ω・cmを超えた場合、導電性が不良([表2]には×(no good)と記載)と評価された。
As the conductivity evaluation, the volume resistivity of the test sample was measured.
When the volume resistivity is not more than 1.0 × 10 8 Ω · cm, the conductive good (described as [Table 1] ○ (good)), the volume resistivity of 1.0 × 10 8 Ω · cm When it exceeded, the conductivity was evaluated as poor (described as × (no good) in [Table 2]).
[評価結果]
[表2]に示す付着性評価の評価結果によれば、実施例1〜6、比較例1の医療機器用付着防止膜においては、加熱状態で変性した馬の血液が付着しても、テープ剥離試験後、「付着なし」と評価される状態になった。このため、生体物質の付着防止性能が良好であることが分かる。
これに対して、第1の導電性粒子5Aを含まない比較例2では、「付着あり」と評価され、生体物質の付着防止性能が劣ることが分かる。
各供試サンプルの医療機器用付着防止膜の表面の材質は共通であるため、これらの相違は、第1の導電性粒子および第2の導電性粒子によって形成される表面の凹凸形状の相違に起因する。
実施例1〜6、比較例1では、いずれも、メディアン径が1μm〜20μmの第1の導電性粒子5Aを含むため、医療機器用付着防止膜の表面の凹凸形状は、上述したように、最大高さRzが0.7μmから15.1μmであった。
これに対して、比較例2における第2の導電性粒子5Bのメディアン径は50nmであるため、第2の導電性粒子5Bが表面に露出しただけでは、医療機器用付着防止膜の表面の凹凸形状に最大高さRzが0.2μmであった。このように比較例2の付着防止膜は、平面に近い滑らかな表面を有するため生体物質との密着が強固になったと考えられる。
[Evaluation results]
According to the evaluation results of the adhesion evaluation shown in [Table 2], in the adhesion prevention films for medical devices of Examples 1 to 6 and Comparative Example 1, even if the horse blood denatured in the heated state adheres, the tape is taped. After the peeling test, it was evaluated as "no adhesion". Therefore, it can be seen that the performance of preventing the adhesion of biological substances is good.
On the other hand, in Comparative Example 2 which does not contain the first
Since the surface material of the adhesion prevention film for medical devices of each test sample is the same, these differences are due to the difference in the uneven shape of the surface formed by the first conductive particles and the second conductive particles. to cause.
In Examples 1 to 6 and Comparative Example 1, since the first
On the other hand, since the median diameter of the second
[表2]に示す導電性評価の評価結果によれば、実施例1〜6、比較例2の医療機器用付着防止膜においては、導電性が良好であった。
これに対して、第2の導電性粒子5Bを含まない比較例1では、導電性が不良であった。
第1の導電性粒子5Aと第2の導電性粒子5Bとが混在する実施例1〜6では、第1の導電性粒子5A同士が当接するとともに、第1の導電性粒子5A同士あるいは第1の導電性粒子5Aとアルミニウム基板との隙間にも、小径の第2の導電性粒子5Bが進入する。このため、これらの隙間に第2の導電性粒子5Bが充填されることで、導電性が向上したと考えられる。
比較例1では、第2の導電性粒子5Bが含まれないため、第1の導電性粒子5A同士あるいは第1の導電性粒子5Aとアルミニウム基板との接触点のみで導通する。この結果、実質的な接触面積が実施例1〜6、比較例2に比べて小さいため、電気抵抗が大きくなると考えられる。
According to the evaluation results of the conductivity evaluation shown in [Table 2], the adhesion prevention films for medical devices of Examples 1 to 6 and Comparative Example 2 had good conductivity.
On the other hand, in Comparative Example 1 which does not contain the second
In Examples 1 to 6 in which the first
In Comparative Example 1, since the second
次に、第3の実施形態の付着防止膜12の実施例7、8と、第2および第3の実施形態を組み合わせた付着防止膜の実施例9,10について説明する。
下記[表3]に、実施例7〜10の医療機器用付着防止膜を形成する最外層形成用塗料の配合組成を示す。ただし、[表3]では各部材の符号の表記は省略されている。
Next, Examples 7 and 8 of the
The following [Table 3] shows the blending composition of the outermost layer forming paint for forming the adhesion prevention film for medical devices of Examples 7 to 10. However, in [Table 3], the notation of the code of each member is omitted.
[実施例7、8]
実施例7、8は、付着防止膜12の実施例である。
実施例7は、上記実施例1の第1の導電性粒子に代えて、第1の導電性粒子15Aが用いられた点を除いて、実施例1と同様に構成された。
本実施例における第1の導電性粒子15Aの基材15a、金属層15bには、それぞれ、中空シリカ、金が用いられた。金属層15bの層厚は0.5μmとされた。本実施例における第1の導電性粒子15Aのメディアン径は20μmであった。
実施例8は、第2の導電性粒子5Bの材質およびメディアン径が変更された点と、第1の導電性粒子15Aの材質が変更された点とを除いて、実施例7と同様に構成された。
本実施例における第2の導電性粒子5Bの材質は白金からなる。本実施例の第2の導電性粒子5Bのメディアン径は500nmであった。
実施例7、8における付着防止膜12の表面12aの最大高さRzを上記実施例1と同様にして測定したところ、それぞれ、16.5μm、14.1μmであった。
[Examples 7 and 8]
Examples 7 and 8 are examples of the
Example 7 was configured in the same manner as in Example 1 except that the first
Hollow silica and gold were used for the
Example 8 has the same configuration as that of Example 7, except that the material and median diameter of the second
The material of the second
When the maximum height Rz of the
[実施例9、10]
実施例9、10は、上記実施例6と同様の第1層6を備える。
実施例9は、上記実施例6の第2層3に代えて、第1の導電性粒子15Aの材質およびメディアン径が変更された点を除いて実施例8の付着防止膜12と同様の構成の層膜を備える。本実施例における第1の導電性粒子15Aの基材15a、金属層15bには、それぞれ、ジルコニア、白金が用いられた。金属層15bの層厚は0.05μmとされた。本実施例における第1の導電性粒子15Aのメディアン径は1μmであった。
実施例10は、上記実施例6の第2層3に代えて、第1の導電性粒子15Aの材質およびメディアン径が変更された点を除いて実施例7の付着防止膜12と同様の構成の層膜を備える。本実施例における第1の導電性粒子15Aの基材15a、金属層15bには、それぞれ、アルミナ、金が用いられた。金属層15bの層厚は0.03μmとされた。本実施例における第1の導電性粒子15Aのメディアン径は1μmであった。
実施例9、10における最外層の表面の最大高さRzを上記実施例1と同様にして測定したところ、それぞれ、0.31μm、0.53μmであった。
[Examples 9 and 10]
Examples 9 and 10 include a first layer 6 similar to that of the sixth embodiment.
Example 9 has the same configuration as the
Example 10 has the same configuration as the
When the maximum height Rz of the surface of the outermost layer in Examples 9 and 10 was measured in the same manner as in Example 1, it was 0.31 μm and 0.53 μm, respectively.
[評価結果]
実施例7〜10を用いて上記実施例1〜6と同様の付着性評価と導電性評価とが行われた。各評価結果について、下記[表4]に示す。[表4]における「付着性」、「導電性」の各評価結果を示す記号の意味は、[表2]における記号の意味と同様である。
[Evaluation results]
Using Examples 7 to 10, the same adhesion evaluation and conductivity evaluation as in Examples 1 to 6 were performed. The evaluation results are shown in [Table 4] below. The meanings of the symbols indicating the evaluation results of "adhesiveness" and "conductiveness" in [Table 4] are the same as the meanings of the symbols in [Table 2].
[表4]に示されたように、いずれも実施例も、付着性評価が「付着なし」([表4]では「○」)、導電性評価が「良好」([表4]では「○」)であった。
このため、第1の導電性粒子15Aが、金属層15bによって表層のみが導電性を有する場合でも、第2の導電性粒子5Bと組み合わされることにより、良好な導電性が得られたことが分かる。
As shown in [Table 4], in each of the examples, the adhesion evaluation was "no adhesion"("○" in [Table 4]), and the conductivity evaluation was "good"("Table4]". ○ ”).
Therefore, it can be seen that even when the first
[断熱性評価]
次に、各実施形態の膜構成における断熱性評価について説明する。
各実施例の断熱性を評価するため、断熱性評価用の供試サンプルが作製された。この断熱性評価用の供試サンプルは、板厚3mmのアルミニウム板の表面に、上述した各実施例の付着防止膜が成膜された。ただし、断熱性の相違を精度よく測定するため、断熱性評価用の供試サンプルの膜厚は、25μm±5μmとされた。
各供試サンプルは、200℃に加熱されたホットプレート上に、アルミニウム板が接触するように配置された。各供試サンプルは、少なくとも1分間加熱された。加熱開始から1分後の膜表面の温度が微小表面用表面温度計によって測定された。この1分後温度は、下記[表5]に示されている。
[Insulation evaluation]
Next, the evaluation of heat insulating properties in the film configuration of each embodiment will be described.
In order to evaluate the heat insulating property of each example, a test sample for evaluating the heat insulating property was prepared. In the test sample for evaluating the heat insulating property, the adhesion prevention film of each of the above-described examples was formed on the surface of an aluminum plate having a plate thickness of 3 mm. However, in order to accurately measure the difference in heat insulating property, the film thickness of the test sample for evaluating heat insulating property was set to 25 μm ± 5 μm.
Each test sample was placed on a hot plate heated to 200 ° C. so that the aluminum plate was in contact with the hot plate. Each test sample was heated for at least 1 minute. The temperature of the
供試サンプルに用いられたアルミニウム板は、1分間の加熱後に、ホットプレートと反対側の表面温度が200℃になった。このため、供試サンプルの1分後温度が200℃未満の場合、付着防止膜による断熱効果が現れていると言える。 The aluminum plate used for the test sample had a surface temperature of 200 ° C. on the opposite side of the hot plate after heating for 1 minute. Therefore, when the temperature after 1 minute of the test sample is less than 200 ° C., it can be said that the heat insulating effect of the adhesion prevention film appears.
断熱性評価としては、供試サンプルの1分後温度が、アルミニウム板の平衡温度(200℃)よりも20℃以上低い場合、断熱性が「非常に良好」(◎(very good))と評価された。供試サンプルの1分後温度が、アルミニウム板の平衡温度よりも5℃以上20℃未満だけ低い場合、断熱性が「良好」(○(good))と評価された。供試サンプルの1分後温度が、アルミニウム板の平衡温度よりも0℃以上5℃未満だけ低い場合、断熱性が「不良」(×(no good))と評価された。
As an evaluation of heat insulating property, when the
[断熱性評価結果]
[表5]に示されたように、実施例1〜6の1分後温度は、それぞれ、188℃、192℃、188℃、191℃、192℃、190℃だった。実施例1〜6の断熱性は「良好」([表5]には「○」と記載)と判定された。
実施例7〜10の1分後温度は、それぞれ、170℃、178℃、176℃、180℃だった。実施例7〜10の断熱性は「非常に良好」([表5]には「◎」と記載)と判定された。
実施例7〜10は、第1の導電性粒子15Aが、金属材料に比べて熱伝導性がよくない不導体の基材15aに薄層の金属層15bが積層されて構成された。このため、実施例7〜10は、断熱性が非常に良好になったと考えられる。実施例7〜10中では最も断熱性が劣る実施例10の1分後温度でも、実施例1〜6の中で最も断熱性が高かった実施例1、3の1分後温度よりも、8℃も低くなっていた。
特に、実施例7は、アルミニウム板の平衡温度よりも30℃も低くなった。この理由は、基材15aとして中空シリカが用いられているため、中空構造による断熱効果が加わったためであると考えられる。
[Insulation evaluation result]
As shown in [Table 5], the temperatures after 1 minute of Examples 1 to 6 were 188 ° C, 192 ° C, 188 ° C, 191 ° C, 192 ° C, and 190 ° C, respectively. The heat insulating properties of Examples 1 to 6 were judged to be "good" (described as "◯" in [Table 5]).
The temperatures after 1 minute of Examples 7 to 10 were 170 ° C., 178 ° C., 176 ° C., and 180 ° C., respectively. The heat insulating property of Examples 7 to 10 was determined to be "very good" (described as "⊚" in [Table 5]).
In Examples 7 to 10, the first
In particular, in Example 7, the temperature was 30 ° C. lower than the equilibrium temperature of the aluminum plate. It is considered that the reason for this is that since hollow silica is used as the
以上、本発明の好ましい各実施形態を、各実施例とともに説明したが、本発明はこれら各実施形態、各実施例に限定されることはない。本発明の趣旨を逸脱しない範囲で、構成の付加、省略、置換、およびその他の変更が可能である。
また、本発明は前述した説明によって限定されることはなく、添付の特許請求の範囲によってのみ限定される。
Although each preferred embodiment of the present invention has been described above together with each embodiment, the present invention is not limited to each of these embodiments and examples. Configurations can be added, omitted, replaced, and other modifications without departing from the spirit of the present invention.
Further, the present invention is not limited by the above description, but is limited only by the appended claims.
1 医療機器表面部
1a 表面
2、12 付着防止膜(医療機器用付着防止膜、最外層)
2a、12a 表面(最外層の表面)
3 第2層(最外層)
4 シリコーン
5A、15A 第1の導電性粒子
5B 第2の導電性粒子
6 第1層(最下層)
7、101B 付着防止膜(医療機器用付着防止膜)
15a 基材
15b 金属層
100 高周波ナイフ(医療機器)
101 電極部
101a 電極本体表面
101A 電極本体
101b 電極表面
1
2a, 12a surface (outermost layer surface)
3 Second layer (outermost layer)
4
7,101B Adhesion prevention film (adhesion prevention film for medical devices)
101
Claims (9)
連続使用温度が200℃以上の樹脂と複数の導電性粒子とを有する最外層を備え、
前記最外層の表面に、前記樹脂から前記複数の導電性粒子の一部が露出することによって凹凸が形成されており、
前記複数の導電性粒子は、
メディアン径が1μm以上20μm以下である第1の導電性粒子群と、
メディアン径が0.01μm以上0.5μm以下である第2の導電性粒子群と、
を含む、
医療機器用付着防止膜。 A single-layer or multi-layered anti-adhesion film formed on the surface of a medical device that emits high-frequency power to a biological substance .
It is provided with an outermost layer having a resin having a continuous use temperature of 200 ° C. or higher and a plurality of conductive particles.
Concavities and convexities are formed on the surface of the outermost layer by exposing a part of the plurality of conductive particles from the resin .
The plurality of conductive particles are
The first conductive particle group having a median diameter of 1 μm or more and 20 μm or less,
A second group of conductive particles having a median diameter of 0.01 μm or more and 0.5 μm or less,
Including ,
Adhesion prevention film for medical devices.
シリコーン樹脂、フラン樹脂、ポリアミド樹脂、アリル樹脂、ポリイミド樹脂、PEEK樹脂、エポキシ樹脂、より成る群より、選択された1つ以上の樹脂を含む、
請求項1に記載の医療機器用付着防止膜。 The resin having a continuous use temperature of 200 ° C. or higher
Includes one or more resins selected from the group consisting of silicone resins, furan resins, polyamide resins, allyl resins, polyimide resins, PEEK resins, epoxy resins.
The adhesion-preventing film for medical devices according to claim 1.
シリコーン樹脂である、
請求項1に記載の医療機器用付着防止膜。 The resin having a continuous use temperature of 200 ° C. or higher
Silicone resin,
The adhesion-preventing film for medical devices according to claim 1.
最大高さRzで0.3μm以上である、
請求項1〜3のいずれか1項に記載の医療機器用付着防止膜。 The size of the unevenness on the surface of the outermost layer is
The maximum height Rz is 0.3 μm or more.
The adhesion-preventing film for medical devices according to any one of claims 1 to 3 .
不導体からなる粒子状の基材と、前記基材の表面に積層された金属層と、を有する複合粒子を含む、
請求項1〜4のいずれか1項に記載の医療機器用付着防止膜。 The first conductive particle group is
A composite particle having a particulate base material made of a non-conductor and a metal layer laminated on the surface of the base material.
The adhesion-preventing film for medical devices according to any one of claims 1 to 4 .
不導体からなる粒子状の基材と、前記基材の表面に積層された金属層と、を有する複合粒子を含む、
請求項1〜4のいずれか1項に記載の医療機器用付着防止膜。 The plurality of conductive particles are
A composite particle having a particulate base material made of a non-conductor and a metal layer laminated on the surface of the base material.
The adhesion-preventing film for medical devices according to any one of claims 1 to 4 .
銀、白金、銅、ニッケル、および金より成る群より、選択された1つ以上の金属を含む、
請求項1〜6のいずれか1項に記載の医療機器用付着防止膜。 The plurality of conductive particles are
Containing one or more metals selected from the group consisting of silver, platinum, copper, nickel, and gold,
The adhesion-preventing film for medical devices according to any one of claims 1 to 6 .
を備える、
請求項1〜7のいずれか1項に記載の医療機器用付着防止膜。 A lowermost layer containing silica as a main component and in close contact with the surface of the medical device is provided on the lower layer side of the outermost layer.
The adhesion-preventing film for medical devices according to any one of claims 1 to 7 .
請求項1〜8のいずれか1項に記載の医療機器用付着防止膜を備える、医療機器。 A medical device that emits high-frequency power to biological substances.
A medical device comprising the adhesion-preventing film for a medical device according to any one of claims 1 to 8 .
Priority Applications (4)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| DE112017000918.9T DE112017000918T5 (en) | 2016-02-22 | 2017-02-13 | Adhesive prevention layer for medical devices and medical device |
| CN201780012095.0A CN108697462B (en) | 2016-02-22 | 2017-02-13 | Anti-adhesion film for medical device and medical device |
| PCT/JP2017/005156 WO2017145842A1 (en) | 2016-02-22 | 2017-02-13 | Adhesion prevention film for medical devices and medical device |
| US16/105,285 US11596719B2 (en) | 2016-02-22 | 2018-08-20 | Adhesion prevention film for medical devices and medical device |
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2016031151 | 2016-02-22 | ||
| JP2016031151 | 2016-02-22 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2017148479A JP2017148479A (en) | 2017-08-31 |
| JP6804931B2 true JP6804931B2 (en) | 2020-12-23 |
Family
ID=59741357
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2016207295A Active JP6804931B2 (en) | 2016-02-22 | 2016-10-21 | Anti-adhesion membrane for medical devices and medical devices |
Country Status (4)
| Country | Link |
|---|---|
| US (1) | US11596719B2 (en) |
| JP (1) | JP6804931B2 (en) |
| CN (1) | CN108697462B (en) |
| DE (1) | DE112017000918T5 (en) |
Families Citing this family (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP3406216A4 (en) * | 2016-01-20 | 2019-10-09 | Olympus Corporation | Surgical instrument |
| JP6995692B2 (en) * | 2018-05-18 | 2022-01-17 | オリンパス株式会社 | High frequency electrodes for medical devices and medical devices |
| EP3831325B1 (en) * | 2018-08-03 | 2024-06-05 | Nihon Parkerizing Co., Ltd. | Surgical electrode having surface treatment coating |
| WO2020183679A1 (en) * | 2019-03-13 | 2020-09-17 | オリンパス株式会社 | Treatment instrument |
| JP7356130B2 (en) * | 2019-06-25 | 2023-10-04 | 国立大学法人東京海洋大学 | Scale adhesion prevention layer, structure with scale adhesion prevention layer, scale adhesion prevention agent |
| WO2023286108A1 (en) * | 2021-07-12 | 2023-01-19 | オリンパス株式会社 | Electrode for high-frequency medical device and medical device |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4314559A (en) * | 1979-12-12 | 1982-02-09 | Corning Glass Works | Nonstick conductive coating |
| US5949029A (en) * | 1994-08-23 | 1999-09-07 | Thomas & Betts International, Inc. | Conductive elastomers and methods for fabricating the same |
| JPH1095448A (en) * | 1996-09-18 | 1998-04-14 | Dainippon Printing Co Ltd | Lid material for carrier tape |
| US20020160193A1 (en) | 2001-02-21 | 2002-10-31 | Karel Hajmrle | Noble metal clad Ni/C conductive fillers and conductive polymers made therefrom |
| US6951559B1 (en) * | 2002-06-21 | 2005-10-04 | Megadyne Medical Products, Inc. | Utilization of a hybrid material in a surface coating of an electrosurgical instrument |
| US20040115477A1 (en) * | 2002-12-12 | 2004-06-17 | Bruce Nesbitt | Coating reinforcing underlayment and method of manufacturing same |
| WO2006048664A2 (en) * | 2004-11-04 | 2006-05-11 | L & P 100 Limited | Medical devices |
| CN100546710C (en) * | 2005-01-24 | 2009-10-07 | 金文申有限公司 | Metallic composite |
| JP4391440B2 (en) * | 2005-04-05 | 2009-12-24 | ジョンソン・エンド・ジョンソン株式会社 | Bipolar tweezers |
| US8814861B2 (en) | 2005-05-12 | 2014-08-26 | Innovatech, Llc | Electrosurgical electrode and method of manufacturing same |
| US8585753B2 (en) * | 2006-03-04 | 2013-11-19 | John James Scanlon | Fibrillated biodegradable prosthesis |
| JP2007256088A (en) | 2006-03-23 | 2007-10-04 | Kanai Hiroaki | Probe pin |
| WO2008011223A1 (en) * | 2006-07-17 | 2008-01-24 | Omg Americas, Inc. | Conductive paste with enhanced color properties |
| JP5243181B2 (en) | 2008-10-20 | 2013-07-24 | スリーエム イノベイティブ プロパティズ カンパニー | Thermoelectric element using conductive polymer composite and conductive polymer material |
| JP5726084B2 (en) | 2008-11-11 | 2015-05-27 | シファメド・ホールディングス・エルエルシー | Thin electrode assembly |
| JP5389542B2 (en) * | 2009-06-15 | 2014-01-15 | オリンパス株式会社 | Electrode for medical device and medical treatment tool |
| JP5540242B2 (en) | 2011-06-17 | 2014-07-02 | 日東商事株式会社 | Surface-treated blade and method for manufacturing the same |
| CN105378855A (en) * | 2013-10-25 | 2016-03-02 | 三井金属矿业株式会社 | Conductive particles and method for producing same |
| JP5884865B2 (en) | 2014-07-25 | 2016-03-15 | 株式会社ノーリツ | Exhaust structure for combustion equipment |
| CA2961291A1 (en) * | 2014-10-29 | 2016-05-06 | Arisdyne Systems, Inc. | Process for dispersing particles in filled resin compositions |
-
2016
- 2016-10-21 JP JP2016207295A patent/JP6804931B2/en active Active
-
2017
- 2017-02-13 DE DE112017000918.9T patent/DE112017000918T5/en not_active Withdrawn
- 2017-02-13 CN CN201780012095.0A patent/CN108697462B/en active Active
-
2018
- 2018-08-20 US US16/105,285 patent/US11596719B2/en active Active
Also Published As
| Publication number | Publication date |
|---|---|
| US20180353658A1 (en) | 2018-12-13 |
| US11596719B2 (en) | 2023-03-07 |
| DE112017000918T5 (en) | 2018-10-31 |
| JP2017148479A (en) | 2017-08-31 |
| CN108697462B (en) | 2021-03-09 |
| CN108697462A (en) | 2018-10-23 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP6804931B2 (en) | Anti-adhesion membrane for medical devices and medical devices | |
| WO2017145842A1 (en) | Adhesion prevention film for medical devices and medical device | |
| US11219480B2 (en) | Apparatus, system and method for excision of soft tissue | |
| JP4391440B2 (en) | Bipolar tweezers | |
| US6685704B2 (en) | Utilization of an active catalyst in a surface coating of an electrosurgical instrument | |
| US20190192212A1 (en) | Conductive adhesion preventing film for medical use and medical device | |
| US4485810A (en) | Surgical cutting blade | |
| US20130274736A1 (en) | Electrosurgical Instrument Having a Coated Electrode | |
| CN207904392U (en) | A kind of heating substrate, heating plate and humidification machine | |
| US20200164115A1 (en) | Electrode for high-frequency medical device and high-frequency medical device | |
| US10357273B2 (en) | Medical device and coating material | |
| TWI794532B (en) | Surgical electrodes with surface-treated coatings | |
| JP6250246B1 (en) | High frequency treatment tool | |
| US20210077175A1 (en) | Hemostatic Surgical Blade, System and Method of Blade Manufacture and Method of Use | |
| JP7179575B2 (en) | Electrodes for medical devices and medical devices used for high-frequency treatment | |
| WO2023286108A1 (en) | Electrode for high-frequency medical device and medical device | |
| WO2019078089A1 (en) | Electrode for high frequency medical device and high frequency medical device | |
| WO2021161785A1 (en) | Electrosurgical electrode | |
| JP6856492B2 (en) | Electrodes for high frequency medical devices and high frequency medical devices | |
| WO2020183679A1 (en) | Treatment instrument | |
| TWI526191B (en) | Electrosurgical instrument and the manufacturing method |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20161024 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20191008 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20201020 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20201106 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20201124 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20201203 |
|
| R151 | Written notification of patent or utility model registration |
Ref document number: 6804931 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R151 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |