JP5009109B2 - 炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 - Google Patents
炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 Download PDFInfo
- Publication number
- JP5009109B2 JP5009109B2 JP2007237561A JP2007237561A JP5009109B2 JP 5009109 B2 JP5009109 B2 JP 5009109B2 JP 2007237561 A JP2007237561 A JP 2007237561A JP 2007237561 A JP2007237561 A JP 2007237561A JP 5009109 B2 JP5009109 B2 JP 5009109B2
- Authority
- JP
- Japan
- Prior art keywords
- catalyst
- partial oxidation
- reaction
- regeneration
- gas
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02P—CLIMATE CHANGE MITIGATION TECHNOLOGIES IN THE PRODUCTION OR PROCESSING OF GOODS
- Y02P20/00—Technologies relating to chemical industry
- Y02P20/50—Improvements relating to the production of bulk chemicals
- Y02P20/584—Recycling of catalysts
Landscapes
- Hydrogen, Water And Hydrids (AREA)
- Carbon And Carbon Compounds (AREA)
- Catalysts (AREA)
Description
CxH2(x+1)+(x/2)O2→xCO+(x+1)H2
部分酸化反応は発熱反応であるため外部からの大量のエネルギー投入は必要ないが、反応温度が高温になりやすく、高温に耐えうる反応容器材料に制約があり装置寿命も短くなる。そのため、比較的低い温度で反応を進める触媒が求められている。
本発明の第2の目的は、その触媒を製造する方法を提供することである。
本発明の第3の目的は、その触媒を使用して水素含有ガスを製造する方法を提供することである。
本発明の第4の目的は、その触媒を使用して水素含有ガスを製造する装置を提供することである。
硝酸マグネシウム(Mg(NO3)2・6H2O)を空気流通下、600℃まで昇温した後5時間保持し、MgOを調製した。
しゅう酸イットリウム(Wako, Y2(C2O4)3・4H2O)を空気流通下、室温から5℃/分の昇温速度で600℃まで昇温し、600℃で5時間保持しY2O3を調製した。
CeO2もY2O3担体と同様の調製法で硝酸セリウム(III)六水和物(Wako, Ce(NO3)3・6H2O)から調製した。
他の担体(Al2O3(Merck)、La2O3(ナカライテスク)、SiO2(FUJI SILYSIA))はそのまま使用した。
所定量のNi(NO3)2・6H2O及びCr(NO3)3・9H2Oを溶解させた水溶液を、担体(MgO)1gに対して、Niとして16m mol、Crとして4m molとなるように加え、一夜放置後、蒸発乾固により乾燥させた。その後、空気流通下、室温から600℃まで昇温し、600℃で5時間保持し触媒を調製した。いわゆる含浸担持法であり、以下この方法で担持した場合、「(担持された物質)/(担体)」と表記する。
なお、触媒表示中のNiO(16)のような括弧内の数字は、担体1gあたりに担持された金属元素の量をm mol単位で表したものである。
所定量のNi(NO3)2・6H2O、Cr(NO3)3・9H2O及びMg(NO3)2・6H2Oを水に溶解させ、蒸発乾固により乾燥させた。その後、空気流通下、室温から600℃まで昇温し、600℃で5時間保持し触媒を調製した。以下この方法で調製した場合、「(担持された物質)−(担体)」と表記する。括弧内の数字の標記は、含浸担持法による触媒調製の場合と同様である。
また、焼成温度を800℃としたこと以外は上記と同様の方法で調製した触媒も作製した。
なお、比較例等、他の組成の触媒もそれぞれの成分の水溶性塩を用いて同様の方法で調製した。
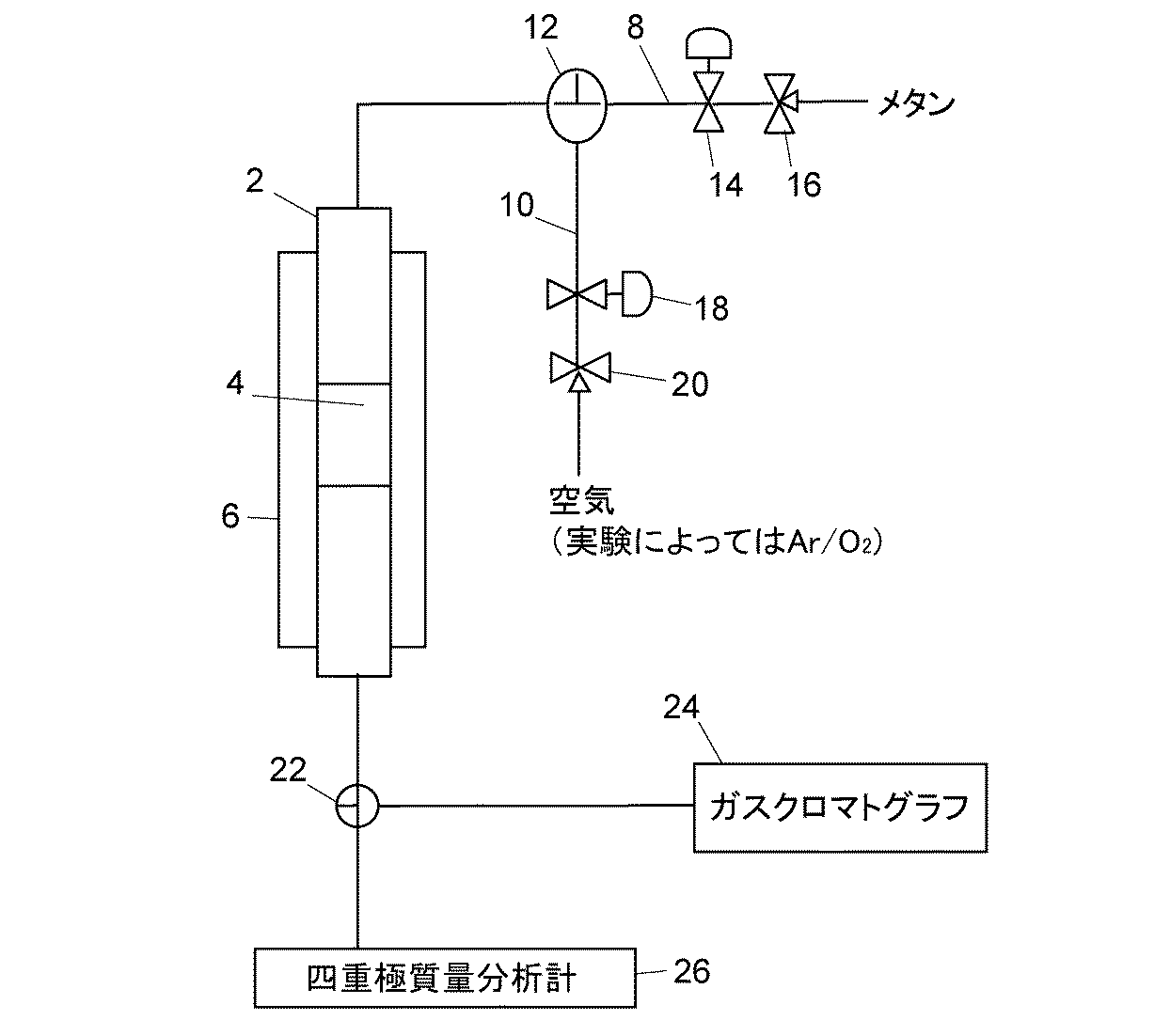
評価のための実験装置として、図1に示される反応装置を使用した。ただし、この反応装置はあくまで評価のための実験装置であり、実際にこの触媒を使用して水素含有ガスを製造する装置はこの反応装置に限定されるものではなく、各部の配置や規模は目的に応じて適宜変更することができる。
製造した触媒は、メタンの部分酸化反応によって評価した。なお、分析装置の感度・分解能の制約から、メタンは不活性ガスであるアルゴンで希釈して導入したが、アルゴンは触媒活性の評価にはなんら影響するものではない。
メタンの部分酸化による水素製造反応をある時間実施した後の触媒は、アルゴンで希釈した酸素ガス、又は空気により酸化し、再びメタンの部分酸化反応に供し、その性能によって完全に再生されたことを評価した。また、後で説明する図2に示すように、触媒のX線回折の結果によっても本発明の触媒は酸化によって再生することが確認された。
以下、本発明を実施例によりさらに詳述する。
メタン転化率は実施例4と同様に高いものの、CO2とH2Oの発生が多くなることから、NiOの含有量を多くすると燃焼反応が起こりやすくなるものと考えられる。
Cr2O3を含有しないほかは実施例1と同様の触媒、すなわちNiO(16)−MgO触媒(MgO1gあたり16m molのNiOが含有されるよう、MgとNiを溶解させた水溶液から調製した触媒)について、メタンの部分酸化反応−触媒再生の繰り返し実験を実施した。反応及び再生時間は10分ずつであり、4回繰り返した。反応温度は1回目を500℃で、2回目を600℃で、3回目を700℃で、4回目を800℃で行った。結果を表4に示す。700℃以上でメタン転化率は上昇してくるが、炭素析出が多く実用には適さない。
担体としてセリア(CeO2)を使用したほかは実施例1と同様の触媒、すなわちNiO(16)−Cr2O3(4)−CeO2触媒(CeO21gあたり16m molのNiOと4m molのCr2O3が含有されるよう、Ce、Ni、Crを総て溶解させた水溶液から調製した触媒)について、メタンの部分酸化反応−触媒再生の繰り返し実験を実施した。反応及び再生時間は10分ずつであり、3回繰り返した。反応温度は1回目を700℃で、2回目を600℃で、3回目を800℃で行った。結果は表4に示すが、メタン転化率は700℃以上で高くなるものの、水素やCOの選択率が低い一方でCO2選択率が高いことから完全酸化反応が進行しており、MgOやSiO2を担体に使用した本発明の触媒のような部分酸化反応触媒とはなっていないことは明らかである。
担体としてセリア(CeO2)を使用したほかは実施例6と同様の触媒、すなわちCeO2担体にNiとCrを含む水溶液を含浸担持させて調製したNiO(16)−Cr2O3(4)/CeO2触媒について、メタンの部分酸化反応−触媒再生反応を各10分ずつ、温度500℃、600℃、700℃、800℃で実施した。メタン転化率は700℃以上で高くなるものの、CO2とH2Oの発生が多いことから燃焼反応が進行していることが明らかであり、部分酸化触媒としての活性は低い。
担体として酸化ランタン(La2O3)を使用したほかは実施例1と同様の触媒、すなわちNiO(16)−Cr2O3(4)−La2O3触媒(La2O31gあたり16m molのNiOと4m molのCr2O3が含有されるよう、La、Ni、Crを総て溶解させた水溶液から調製した触媒)について、比較例2と同様の条件でメタンの部分酸化反応−触媒再生の3回繰り返し実験を実施した。この結果も表4に示すが、水素選択率が低い一方でCO2選択率が高く、メタンの部分酸化反応触媒としては不適である。
担体としてアルミナ(Al2O3)を使用したほかは実施例6と同様の触媒、すなわちAl2O3担体にNiとCrを含む水溶液を含浸担持させて調製したNiO(16)−Cr2O3(4)/Al2O3触媒について、メタンの部分酸化反応−触媒再生反応を各10分ずつ、温度500℃、600℃、700℃、800℃で実施した。この結果も表4に示すが、メタン転化率は700℃以上で高くなるものの、CO選択率が低く、部分酸化反応活性に乏しいことがわかる。
Cr2O3の替わりにCaOを使用したほかは実施例1と同様の触媒、すなわちNiO(16)−CaO(4)−MgO触媒(MgO1gあたり16m molのNiOと4m molのCaOが含有されるよう、Mg、Ni、Caを総て溶解させた水溶液から調製した触媒)について、メタンの部分酸化反応−触媒再生反応を各10分ずつ、温度500℃、600℃、700℃、800℃で実施した結果を表6に示す。700℃以上で部分酸化反応が進行するものの、この温度領域では炭素析出量が多く、実用触媒としては不適である。
Cr2O3の替わりにFe2O3を使用したほかは実施例1と同様の触媒、すなわちNiO(16)−Fe2O3(4)−MgO触媒(MgO1gあたり16m molのNiOと4m molのFe2O3が含有されるよう、Mg、Ni、Feを総て溶解させた水溶液から調製した触媒)について、比較例6と同様の実験を行った結果を表6に示す。どの温度でもCO2発生が多いことから、完全酸化反応が優勢となっていることが明らかであり、部分酸化反応触媒とはならない。
Cr2O3の替わりにAl2O3を使用したほかは実施例1と同様の触媒、すなわちNiO(16)−Al2O3(4)−MgO触媒(MgO1gあたり16m molのNiOと4m molのAl2O3が含有されるよう、Mg、Ni、Alを総て溶解させた水溶液から調製した触媒)について、比較例6と同様の実験を行った結果を表6に示す。反応温度を800℃まで上げれば高いメタン転化率が得られ部分酸化反応が進行するが、炭素析出量が多いため実用的ではない。
Cr2O3の替わりにNd2O3を使用したほかは実施例1と同様の触媒、すなわちNiO(16)−Nd2O3(4)−MgO触媒(MgO1gあたり16m molのNiOと4m molのNd2O3が含有されるよう、Mg、Ni、Ndを総て溶解させた水溶液から調製した触媒)について、比較例6と同様の実験を行った結果を表6に示す。比較例8と同様、反応温度を800℃まで上げれば高いメタン転化率が得られ部分酸化反応が進行するが、炭素析出量が多いため実用的ではない。
Cr2O3の替わりにCo3O4を使用したほかは実施例1と同様の触媒、すなわちNiO(16)−Co3O4(4)−MgO触媒(MgO1gあたり16m molのNiOと4m molのCo3O4が含有されるよう、Mg、Ni、Coを総て溶解させた水溶液から調製した触媒)について、比較例6と同様の実験を行った結果を表6に示す。比較例8と同様、反応温度を800℃まで上げれば高いメタン転化率が得られ部分酸化反応が進行するが、炭素析出量が多いため実用的ではない。
本発明の触媒の格子酸素が部分酸化反応に関与し、再生可能であることを触媒のX線回折測定により確かめた。そのX線回折測定の結果を図2に示す。触媒としては実施例1の触媒を用いた。図中、(A)と(B)では縦軸のスケールが10倍異なる。
なお(B)のc)のパターンは、各ピークの同定のために合成した、Niを含まないCr2O3−MgOのX線回折パターンである。
これまでに提示した実験は、部分酸化反応に供した後の触媒の再生にアルゴンガスで希釈した酸素を用いていた。しかし、再酸化による触媒再生を空気により行うことができれば、装置に酸素供給設備を設置する必要がなくなり、システムの小型化及び低コスト化が実現され、実用化に当たって大きな利点があることは明らかである。そこで、実施例1の触媒を用いて、空気による触媒再生を行った。結果を表7に示す。再生ガスに空気を用いた場合、分析を質量分析装置で行った実験装置の制約から炭素析出量、メタン転化率、CO選択率及びCO2選択率の測定はできなかったが、水素選択率、格子酸素転化率及び他の生成物量を見る限り、アルゴンガスで希釈した酸素による触媒再生と同等の結果が得られており、空気による触媒再生になんら問題のないことが明らかである。
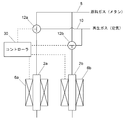
図3に部分酸化触媒が移動できないように固定された固定床反応管を用いた水素含有ガス製造装置の実施例を概略的に示す。
第1の反応管2aに加熱炉6aが配置され、第2の反応管2bに加熱炉6bが配置されている。反応管2a,2bや加熱炉6a,6bは基本的には図1の評価用の装置のものと同じである。反応管2a,2b内には本発明の部分酸化触媒層が充填されている。
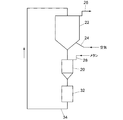
図4に部分酸化触媒が移動可能な状態で保持された移動床反応管を用いた水素含有ガス製造装置の実施例を概略的に示す。
4 部分酸化触媒層
6,6a,6b 電気炉
8 原料ガス供給流路
10 再生ガス供給流路
12,12a,12b 三方切替弁
20 反応部
22 再生部
30 コントローラ
32 触媒受け部
34 搬送路
Claims (12)
- 炭化水素を部分酸化して水素と一酸化炭素を含有する混合ガスを生成させる部分酸化触媒において、
少なくとも触媒成分と担体を含み、触媒成分はニッケルの酸化物とクロムの酸化物のみを含むことを特徴とする部分酸化触媒。 - 担体はマグネシウムの酸化物を含む請求項1の部分酸化触媒。
- 担体はシリコンの酸化物を含む請求項1の部分酸化触媒。
- 担体はイットリウムの酸化物を含む請求項1の部分酸化触媒。
- 触媒成分となる金属元素としてニッケル及びクロムのみ、並びに担体となる金属元素としてのマグネシウム、シリコン又はイットリウムの各金属元素を含む塩を溶解させた混合溶液を調製する工程と、
前記溶液の溶媒を除去する乾燥工程と、
前記乾燥工程後に酸化性雰囲気中で焼成する焼成工程と、
を含んで請求項1に記載の部分酸化触媒を製造する触媒製造方法。 - ニッケルとクロムの各金属元素のみを含む塩を溶解させた溶液を、担体である酸化マグネシウム(MgO)、シリカ(SiO2)又は酸化イットリウム(Y2O3)に加える工程と、
その後、前記溶液の溶媒を除去する乾燥工程と、
前記乾燥工程後に酸化性雰囲気中で焼成する焼成工程と、
を含んで請求項1に記載の部分酸化触媒を製造する触媒製造方法。 - 炭化水素を含む原料ガスを加熱下で請求項1から4のいずれか一項に記載の部分酸化触媒に接触させ、酸化剤としての酸素含有ガスを供給することなく、前記部分酸化触媒中の金属酸化物を構成する格子酸素により前記炭化水素を部分酸化して水素と一酸化炭素を含有する混合ガスを生成させる部分酸化工程と、
前記部分酸化工程を経た前記部分酸化触媒を加熱下で酸素含有ガスと接触させて前記部分酸化触媒を再生する再生工程と、
を含む水素含有ガス製造方法。 - 前記酸素含有ガスとして水蒸気を使用する請求項7に記載の水素含有ガス製造方法。
- 前記酸素含有ガスとして空気を使用する請求項7に記載の水素含有ガス製造方法。
- 内部に請求項1から4のいずれか一項に記載の部分酸化触媒が保持された反応管と、
前記触媒を加熱する加熱炉と、
炭化水素を含む原料ガスを前記反応管に送り前記触媒と接触させる原料ガス供給流路と、
触媒再生に用いる酸素含有ガスを前記反応管に送り前記部分酸化触媒と接触させる再生ガス供給流路と、を備え、
前記反応管中で、酸化剤としての酸素含有ガスの存在しない状態下で前記部分酸化触媒中の金属酸化物を構成する格子酸素により前記原料ガス中の炭化水素を部分酸化して水素と一酸化炭素を含有する混合ガスを生成させ、前記原料ガスが存在しない状態下で前記再生ガス供給流路からの酸素含有ガスにより前記部分酸化触媒を再生する水素含有ガス製造装置。 - 前記反応管は前記部分酸化触媒が移動できないように固定された固定床反応管であり、
前記反応管と加熱炉の組が2組備えられ、
前記原料ガス供給流路と再生ガス供給流路は切替え弁を介して両反応管に接続されており、
前記加熱炉と切替え弁の制御により、一方の反応管での部分酸化反応中に他方の反応管での触媒を再生するようにするとともに、その操作を交互に切り替えることができるようになっている請求項10に記載の水素含有ガス製造装置。 - 前記反応管は前記触媒が移動可能な状態で保持された移動床反応管であり、かつ前記反応管は部分酸化反応を行わせる反応部と、反応部とは異なる場所で触媒再生を行わせる再生部とを備えており、
前記反応部と再生部の間で前記触媒を搬送する搬送路が設けられており、
原料ガス供給流路は前記反応部に接続され、再生ガス供給流路は前記再生部に接続されている請求項10に記載の水素含有ガス製造装置。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007237561A JP5009109B2 (ja) | 2007-09-13 | 2007-09-13 | 炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2007237561A JP5009109B2 (ja) | 2007-09-13 | 2007-09-13 | 炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2009066520A JP2009066520A (ja) | 2009-04-02 |
| JP5009109B2 true JP5009109B2 (ja) | 2012-08-22 |
Family
ID=40603349
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2007237561A Expired - Fee Related JP5009109B2 (ja) | 2007-09-13 | 2007-09-13 | 炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP5009109B2 (ja) |
Families Citing this family (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP5324265B2 (ja) * | 2009-03-11 | 2013-10-23 | 関西電力株式会社 | 炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 |
| JP5630987B2 (ja) * | 2009-11-17 | 2014-11-26 | 中外炉工業株式会社 | 浸炭用ガス供給装置 |
| JP5784548B2 (ja) * | 2012-06-12 | 2015-09-24 | フロンティア・ラボ株式会社 | 触媒反応シミュレーション装置 |
| JP6131370B1 (ja) * | 2016-06-10 | 2017-05-17 | 千代田化工建設株式会社 | 合成ガス製造触媒用担体及びその製造方法、合成ガス製造触媒及びその製造方法、並びに合成ガスの製造方法 |
Family Cites Families (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB8714661D0 (en) * | 1987-06-23 | 1987-07-29 | British Petroleum Co Plc | Catalysts |
| FR2684567B1 (fr) * | 1991-12-09 | 1994-11-04 | Atochem | Catalyseurs massiques a base d'oxydes de chrome et de nickel, et leur application a la fluoration d'hydrocarbures halogenes. |
| GB2311790A (en) * | 1996-04-04 | 1997-10-08 | British Gas Plc | Production of synthesis gas from hydrocarbonaceous feedstock |
| FR2790750B1 (fr) * | 1999-03-10 | 2001-04-20 | Air Liquide | Procede et dispositif de production d'hydrogene par decomposition thermocatalytique d'hydrocarbures |
| JP3976498B2 (ja) * | 2000-12-13 | 2007-09-19 | 独立行政法人科学技術振興機構 | 合成ガス製造触媒及び合成ガス製造方法 |
-
2007
- 2007-09-13 JP JP2007237561A patent/JP5009109B2/ja not_active Expired - Fee Related
Also Published As
| Publication number | Publication date |
|---|---|
| JP2009066520A (ja) | 2009-04-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Zhang et al. | Low temperature catalytic oxidation of propane over cobalt-cerium spinel oxides catalysts | |
| Silvester et al. | NiO supported on Al2O3 and ZrO2 oxygen carriers for chemical looping steam methane reforming | |
| Srisiriwat et al. | Oxidative steam reforming of ethanol over Ni/Al2O3 catalysts promoted by CeO2, ZrO2 and CeO2–ZrO2 | |
| Choudhary et al. | Energy‐efficient syngas production through catalytic oxy‐methane reforming reactions | |
| Zhu et al. | Catalytic partial oxidation of methane to synthesis gas over Ni–CeO2 | |
| Luengnaruemitchai et al. | Activity of different zeolite-supported Ni catalysts for methane reforming with carbon dioxide | |
| Cimino et al. | Insights into the cyclic CO2 capture and catalytic methanation over highly performing Li-Ru/Al2O3 dual function materials | |
| Białobok et al. | Ethanol combustion over strontium-and cerium-doped LaCoO3 catalysts | |
| JP5972678B2 (ja) | 合成ガス製造用触媒および合成ガスの製造方法 | |
| US6846475B1 (en) | Hydrogen refinement apparatus | |
| Jin et al. | Engineering metal-oxide interface by depositing ZrO2 overcoating on Ni/Al2O3 for dry reforming of methane | |
| Pérez-Hernández et al. | Effect of Cu loading on CeO2 for hydrogen production by oxidative steam reforming of methanol | |
| Zhou et al. | A novel catalyst with plate-type anodic alumina supports, Ni/NiAl2O4/γ-Al2O3/alloy, for steam reforming of methane | |
| KR101145122B1 (ko) | 메탄올 및 과산화물 간의 촉매반응 | |
| KR20110074196A (ko) | 메탄과 이산화탄소 개질용 코발트계 촉매 및 이를 이용한 합성가스의 제조방법 | |
| Moraes et al. | Steam reforming of ethanol on Rh/SiCeO2 washcoated monolith catalyst: Stable catalyst performance | |
| KR100612956B1 (ko) | 고성능 수성가스 전환 반응용 촉매와 이의 제조방법 | |
| JP2006346598A (ja) | 水蒸気改質触媒 | |
| JP5009109B2 (ja) | 炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 | |
| EP4072705A1 (en) | <sup2/>? <sub2/>?2?a method to capture and utilize coand an installation for capturing and utilizing co <ns1:sub>2</ns1:sub> | |
| JP4859701B2 (ja) | 水素含有ガスの製造装置 | |
| Caro | Catalytic Membrane Reactors–Lab Curiosity or Key Enabling Technology? | |
| KR101245484B1 (ko) | 수성가스 전환 반응용 촉매와 이 촉매를 이용하여 수성가스전환 반응에 의한 합성가스의 제조방법 | |
| JP5324265B2 (ja) | 炭化水素の部分酸化触媒、それを用いた水素含有ガスの製造方法及び装置 | |
| WO2014182020A1 (ko) | 이산화탄소 개질반응용 모노리스 촉매, 이의 제조방법 및 이를 이용한 합성가스의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20100907 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20100907 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20120118 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20120131 |
|
| A521 | Written amendment |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20120330 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20120529 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20120530 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20150608 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |