JP4234418B2 - マンガンニッケル複合水酸化物粒子 - Google Patents
マンガンニッケル複合水酸化物粒子 Download PDFInfo
- Publication number
- JP4234418B2 JP4234418B2 JP2002379506A JP2002379506A JP4234418B2 JP 4234418 B2 JP4234418 B2 JP 4234418B2 JP 2002379506 A JP2002379506 A JP 2002379506A JP 2002379506 A JP2002379506 A JP 2002379506A JP 4234418 B2 JP4234418 B2 JP 4234418B2
- Authority
- JP
- Japan
- Prior art keywords
- manganese
- nickel
- composite hydroxide
- lithium
- particles
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
Images
Classifications
-
- Y—GENERAL TAGGING OF NEW TECHNOLOGICAL DEVELOPMENTS; GENERAL TAGGING OF CROSS-SECTIONAL TECHNOLOGIES SPANNING OVER SEVERAL SECTIONS OF THE IPC; TECHNICAL SUBJECTS COVERED BY FORMER USPC CROSS-REFERENCE ART COLLECTIONS [XRACs] AND DIGESTS
- Y02—TECHNOLOGIES OR APPLICATIONS FOR MITIGATION OR ADAPTATION AGAINST CLIMATE CHANGE
- Y02E—REDUCTION OF GREENHOUSE GAS [GHG] EMISSIONS, RELATED TO ENERGY GENERATION, TRANSMISSION OR DISTRIBUTION
- Y02E60/00—Enabling technologies; Technologies with a potential or indirect contribution to GHG emissions mitigation
- Y02E60/10—Energy storage using batteries
Landscapes
- Secondary Cells (AREA)
- Battery Electrode And Active Subsutance (AREA)
- Inorganic Compounds Of Heavy Metals (AREA)
Description
【発明の属する技術分野】
本発明は、実質的にマンガン:ニッケルが1:1(以下、「マンガン:ニッケル(1:1)」とする)である複合水酸化物粒子に関する。
【0002】
【従来の技術】
近年のコードレスおよびポータブルなAV機器およびパソコンなどの普及にともない、より小型、より軽量およびより高エネルギー密度の電池への要望が強まっている。特に、リチウム二次電池は、高エネルギー密度を有する電池であることから、次世代の主力電池として期待され、その潜在的市場規模も大きい。
従来、いわゆる共沈殿法を利用して、実質的にマンガン:ニッケルが1:1である複合水酸化物(Ni1/2Mn1/2(OH)2)の粒子が知られており、これを用いた実質的にマンガン:ニッケルが1:1であるリチウムマンガンニッケル複合酸化物が製造され、非水電解質電池用正極活物質として使用できることが知られている(例えば、特許文献1参照。)。しかしながらその電池性能についてはさらに改善の余地があり、さらに充放電特性等の種々の望ましい特性を有するものが強く要望されている。
【特許文献1】
特開2002−42813号
【0003】
【課題を解決するための手段】
本発明者はかかる要望を踏まえ、前記マンガン:ニッケル(1:1)であるリチウムマンガンニッケル複合酸化物を用いた非水電解質電池用正極活物質をさらに改良する目的で鋭意研究し、リチウムマンガンニッケル複合酸化物の燒成に使用するマンガン:ニッケル(1:1)複合水酸化物粒子の形状を制御するすることにより、それを用いた非水電解質二次電池(例えばリチウムイオン二次電池)が非常に優れた充放電特性(サイクル数、エネルギー密度等)を有することを見出し本発明を完成するに至った。
【0004】
すなわち、本発明にかかるリチウムマンガンニッケル複合水酸化物粒子は、マンガンとニッケルの原子比が実質的に1:1である、形式的には(Mn1/2Ni1/ 2)(OH)2なる組成式で表されるものであり、その粒子が特徴ある形状を有するものである。
【0005】
特に本発明にかかるリチウムマンガンニッケル複合水酸化物粒子は、その平均粒径が5〜20μm(好ましくは5〜15μm)、タップ密度が0.6〜1.4g/ml、バルク密度が0.4〜1.0g/mlのものである。また比表面積が20〜100m2/g(好ましくは20〜55m2/g)であることを特徴とする。
さらに、その2次粒子表面および内部の構造は、電子顕微鏡による表面観察に基づけば、1次粒子によるひだ状壁により網状を形成し、そのひだ状壁で囲まれた空間が比較的大きいことを特徴とする。
【0006】
またその2次粒子表面および内部の構造は、共沈澱法において中和反応の過程の酸化状態により大きく依存することを特徴とする。これはマンガンイオンの一部が酸化される条件で製造することにより大きく依存することを意味する。硫酸イオンの測定によればかかる含有硫酸根が0.25〜0.45重量%であることを特徴とする。またX線回折においても15≦2θ≦25にあるピークの最大強度(I0)と、30≦2θ≦40にあるピークの最大強度(I1)との比(I0/I1)が、1〜6であることを特徴とする。
【0007】
本発明はさらに、前記記載のマンガンニッケル複合水酸化物粒子と水酸化リチウムを焼成して得られる、実質的にマンガン:ニッケルが1:1であるリチウムマンガンニッケル複合酸化物をも含むものである。また、それを正極活性物質成分として含有することを特徴とするリチウムイオン二次電池をも含むものである。
また、本発明は、前記記載のマンガンニッケル複合水酸化物粒子、リチウムマンガンニッケル複合酸化物、リチウムイオン二次電池の製造方法をも含むものである。
【0008】
特に本発明にかかる製造方法は、pH9〜13の水溶液中で、錯化剤の存在下、マンガンとニッケルの原子比が実質的に1:1であるマンガン塩とニッケル塩の混合水溶液を、アルカリ溶液と適当な攪拌条件下で反応させて生じる粒子を共沈殿させることにより、マンガンとニッケルの原子比が実質的に1:1で均一に混合されたリチウムマンガンニッケル複合水酸化物をえる方法において、マンガンイオンの酸化の程度を一定の範囲に制御することを特徴とする。
以下、本発明を、発明の実施の形態に即して詳細に説明する。
【0009】
【発明の実施の形態】
マンガンニッケル複合水酸化物粒子の製造
まず本発明に係るリチウムマンガンニッケル複合水酸化物の製造方法を以下説明する。すなわち好ましくは以下のようにいわゆる共沈殿法を用いて、かつマンガンイオンの酸化の程度を一定の範囲に制御する条件で行うことで得ることができる。
すなわちここでいう共沈殿法とは、適当な範囲のpH(例えば9〜13)の水溶液中で、錯化剤の存在下、マンガンとニッケルの原子比が実質的に1:1であるマンガン塩とニッケル塩の混合水溶液を、アルカリ溶液と適当な攪拌条件下で反応させて生じる粒子を共沈殿させることにより、リチウムマンガンニッケル複合水酸化物をえるものである。かかる共沈殿法によりマンガンとニッケルの原子比が実質的に1:1で均一に混合された好ましい粒子径を有する粒子を得ることができる。
【0010】
ここで、使用可能なマンガン塩は特に制限はなく水溶液中で生成するマンガンイオンが錯化剤と錯体を形成可能なものであればよい。具体的には硫酸マンガン、硝酸マンガン、塩化マンガンが挙げられる。同様に使用可能なニッケル塩は、水溶液中で生成するニッケルイオンが錯化剤と錯体を形成可能なものであればよく特に制限はない。具体的には硫酸ニッケル、硝酸ニッケル、塩化ニッケルが挙げられる。本発明においてマンガンとニッケルの原子比が実質的に1:1とは、それぞれプラスマイナス10%程度の範囲であれば含まれる。またこの値は種々の金属分析方法(例えば原子吸光法)により正確に測定することができる。
【0011】
水溶液のpH値は、pH9〜13の範囲が好ましく、反応中必要ならばアルカリ金属水酸化物(例えば水酸化ナトリウム、水酸化カリウム)を添加することによりこの範囲に維持することができる。
また、錯化剤は、水溶液中でマンガンイオンおよびニッケルイオンと錯体を形成可能なものであり、例えばアンモニウムイオン供給体(塩化アンモニウム、炭酸アンモニウム、弗化アンモニウム等)、ヒドラジン、エチレンジアミン四酢酸、ニトリト三酢酸、ウラシル二酢酸、グリシンが挙げられる。
【0012】
また、ここで意味するマンガンイオンの酸化の程度を一定の範囲に制御する条件とは、反応溶液中にバブリングする雰囲気用ガスの窒素に適当量の空気(酸素)を混合することにより制御することである。
マンガンイオンは前記共沈殿法の条件では通常非常に酸化され易く、複雑なマンガン酸化物を与える。一般にこのマンガン酸化物を含有したマンガンニッケル複合水酸化物粒子は、それを原料とした場合に電池の特性が悪くなる。従って、本発明では、できるだけマンガン酸化物の生成を抑制することが必要である。
【0013】
一方、前記共沈殿法において、ほぼ完全にマンガンイオンの酸化を抑制する条件を設定することが可能である。例えば、溶液中の溶存酸素を除去するための試薬(例えばヒドラジン)を加え、さらに酸素を実質的に除いた不活性ガス雰囲気下で反応させる方法である。この場合、得られるマンガンニッケル複合水酸化物粒子のマンガンイオンはほぼ完全に2価を保持する。しかしながら本発明者は、前記共沈殿法においてほぼ完全にマンガンイオンの酸化を抑制する条件下で得られるマンガンニッケル複合水酸化物粒子の形状が大きく異なることを見出した。この条件では、1次粒子が非常に密に積み重なり高い密度の2次粒子を形成し、その表面および内部には実質的に網目のような構造が見られないという特徴を有する。本発明者は、この形状の場合これを原料として水酸化リチウムと焼成して、2次電池材料としてのリチウムマンガンニッケル複合酸化物を得る工程において、溶融状態のリチウムイオンが十分に、均一に、そのマンガンニッケル複合酸化物の結晶の中に取りこまれないことを見出した。
【0014】
これらの知見から、溶融状態のリチウムイオンを十分に、均一に、そのマンガンニッケル複合酸化物の結晶の中に取りこませるためには、マンガンニッケル複合水酸化物粒子の形状が重要であり、好ましい網目構造に制御することが必要となる。このために、本発明においては、好ましい網目構造に制御するために共沈澱反応条件をマンガンイオンは酸化され得るが、不必要な量のマンガン酸化物が生成しない条件下で共沈澱を行う。
【0015】
酸化条件、程度については特に制限はない。好ましくは、溶存酸素はあらかじめ還元剤で除去しておく。還元剤としては、共沈澱を適当な錯化剤の存在下行うものであることから、錯化剤としても還元剤としても作用するヒドラジンの使用が好ましい。ヒドラジンは反応終了後においても約10%程度残留させる程度添加することが好ましい。酸化剤についても特に制限はないが、共沈澱法によりスラリーが得られること、適当な攪拌が必要なことから、溶液中に吹きこむ不活性ガスに含めることが好ましい。このために空気、酸素、その他の酸化性ガス(塩素など)の使用が可能である。
【0016】
マンガンイオンの酸化の程度は種々の方法で評価することができる。目視によれば、酸化の程度が大きい場合、生成する酸化マンガンにより粒子が黒灰色となる。一方ほぼ酸化を抑制した場合、薄青緑色となる。従って、その中間の酸化の程度も評価可能である。さらに従来公知の酸化還元滴定方法などにより定量的にも酸化の程度を評価することができる。また、酸化されたマンガンイオンが対アニオンとして硫酸イオンを含む場合、その硫酸イオンの簡便な分析法により間接的に酸化の程度が評価できる。
【0017】
マンガンニッケル複合水酸化物粒子の形状
前記共沈澱法により得られる粒子リチウムマンガンニッケル複合水酸化物粒子の2次粒子径は、共沈澱法において適用されるpHや反応装置に依存する。通常公知のpHや反応装置を使用することにより平均粒径が5〜20μmのものが得られる。この粒子はより小さい粒径の1次粒子が集まって、大きな2次粒子を形成する。
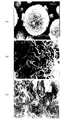
また、電子顕微鏡観察によりその表面、および内部の構造を容易に見分けることができる。酸化を実質的に抑制した条件で得られる粒子は、その1次粒子が強く密に集まり2次粒子を形成する。マンガンの酸化が進むと、粒子の表面および内部の構造は大きく変化する。1次粒子が集まりひだ状態の壁を形成し、これが集まり網目状態の2次粒子を形成する。従って、大きなひだ状の壁で仕切られたスポンジ状の構造を呈する。この構造は、酸化の程度により変化する。特に網目構造で囲まれた空間のサイズの大きさが変化する。酸化がある程度すすむと、むしろこの網目構造はより密になり、囲まれた空間のサイズの大きさが小さくなる。以下に説明する実施例では、このような各条件下での得られた粒子の形状の電子顕微鏡写真を示した。
【0018】
上で説明した2次粒子の表面および内部の構造の違いは、具体的には、タップ密度(TD)、バルク密度(BD)、比表面(BET)に顕著に表れている。酸化の程度が低いほど2次粒子はより1次粒子が強く集まった高い密度の構造を示す。一方これに比較して、酸化が適当な範囲である場合タップ密度(TD)もバルク密度(BD)もほぼ半分となり、粒子内部に空間が存在することが示される。また、この構造状に相違は、比表面に大きく影響し、酸化程度が適当な場合、酸化されていない場合に比較して約2倍となる。
【0019】
リチウムマンガンニッケル複合酸化物
リチウムマンガンニッケル複合酸化物は、上で説明した複合水酸化物粒子と、この複合水酸化物粒子のマンガンとニッケルの合計の原子比とリチウムの原子比が実質的に1:1となるように、リチウム化合物と混合し、得られる混合物を少なくとも850℃以上で、空気気流中焼成加熱して得られるものである。かかる焼成条件および焼成に使用する過熱炉については特に制限はなく、従来公知の
LiMn2O4やLiNiO2の合成に用いられる焼成装置が好ましく使用できる。焼成の際の雰囲気は通常の大気雰囲気が好ましい。
【0020】
使用可能なリチウム化合物としては特に制限はないが、例えば水酸化リチウム、炭酸リチウム、硝酸リチウム、酸化リチウムが挙げられる。特に水酸化リチウムの使用が好ましい。マンガンニッケル(1:1)複合酸化物とリチウム化合物とのモル比は、実質的に1:1である。ここでマンガンニッケル複合酸化物とリチウム化合物とのモル比が実質的に1:1とは、それぞれプラスマイナス10%程度の範囲であれば含まれる。またこれらの値は種々の金属分析方法(例えば原子吸光法)により正確に測定することができる。焼成する前にこれらを十分混合しておくことが好ましい。
【0021】
非水電解質二次電池
本発明のリチウムイオン二次電池は、前記リチウムマンガンニッケル複合酸化物を正極活性物質成分として含有することを特徴とするリチウムイオン二次電池である。その基本的構造については何ら制限はない。通常公知の形状、材料を使用して種々のタイプの電池を構成することができる。また、本発明にかかるリチウムマンガンニッケル複合酸化物を正極活性物質成分として含有することから、かかる電池は図8〜13に示すように、4V付近に極めて平坦でかつ低い分極を特徴とする充放電特性を有し、極めて高い初期容量(200mAh/g程度)を有する。
【0022】
【実施例】
以下本発明を実施例に即して説明するが、本発明はこれらの実施例に限定されるものではない。
実施例1
攪拌機とオーバーフローパイプを備えた15Lの円筒形反応槽に水を13L入れた後、pHが12.2(40℃測定)になるまで32%水酸化ナトリウム水溶液を加え、窒素ガスを0.3L/分の流量にて反応槽内にバブリングさせながら、温度を50℃に保持し一定速度にて攪拌を行った。次にNi:Mnの原子比が1:1となるように混合した1.7mol/L硫酸ニッケル水溶液と1.1mol/L硫酸マンガン水溶液の混合液に2.8mol/L硫酸アンモニウム水溶液を混合水溶液容量に対して5%(v/v)加え、さらにこの混合溶液中の溶存酸素を除去する目的で4wt%ヒドラジン水溶液を混合水溶液量に対して1.3%(v/v)加え、10cc/分の流量にて反応槽に滴下した。さらに反応槽内の溶液がpH12.2になるように32%水酸化ナトリウム水溶液を断続的に加えニッケルマンガン複合水酸化物粒子を形成させた。反応槽内が定常状態になった後、オーバーフローパイプよりニッケルマンガン複合水酸化物粒子を連続的に採取し水洗後、濾過し100℃にて15時間乾燥し乾燥粉末であるニッケルマンガン複合水酸化物を得た。得られたニッケルマンガン複合水酸化物を試料aとした。
【0023】
実施例2
密閉型の反応槽を用い、pHを12.0(40℃測定)にした以外は実施例1と同様の条件にてニッケルマンガン複合水酸化物を製造し、得られたニッケルマンガン複合水酸化物を試料bとした。
【0024】
実施例3
窒素ガス流量を1.0L/分、純空気を0.1L/分の流量にてバブリングした以外は実施例2と同様の条件にてニッケルマンガン複合水酸化物を製造し、得られたニッケルマンガン複合水酸化物を試料cとした。
【0025】
実施例4
窒素ガスを0.5L/分にてバブリングし、pHを11.7(40℃測定)にした以外は実施例1と同様の条件にてニッケルマンガン複合水酸化物を製造し、得られたニッケルマンガン複合水酸化物を試料dとした。
【0026】
実施例5
窒素ガスを0.5L/分の流量にてバブリングし、pHを11.3(40℃測定)にした以外は実施例2と同様の条件にてニッケルマンガン複合水酸化物を製造し、得られたニッケルマンガン複合水酸化物を試料eとした。
【0027】
実施例6
窒素ガスを1.0L/分の流量にてバブリングし、pHを11.9(40℃測定)にした以外は実施例2と同様の条件にてニッケルマンガン複合水酸化物を製造し、得られたニッケルマンガン複合水酸化物を試料fとした。
各実施例で得られた粒子の特性値を以下の表1にまとめた。
【0028】
【表1】
【0029】
また、各実施例1〜6で得られた粒子(a〜f)の電子顕微鏡写真をそれぞれ図1〜6に示した。中和反応時での酸化の程度により、2次粒子の表面および内部の構造が大きく依存することが分かる。
【0030】
また、各実施例1〜6で得られた粒子(a〜f)のX線回折の結果をそれぞれ図7に示した。中和反応時での酸化の程度が、2つのピークの強度比により簡便に評価できることが分かる。また表2には、X線回折において15≦2θ≦25にあるピークの最大強度(I0)と、30≦2θ≦40にあるピークの最大強度(I1)との比(I0/I1)をまとめた。
【0031】
【表2】
【0032】
また、各実施例1〜6で得られた粒子(a〜f)を用いたリチウムイオン二次電池充放電曲線をそれぞれ図8〜13に示した。例えば初期容量が極めて大きく、優れた電池特性を示すことが分かる。
【0033】
【発明の効果】
本発明にかかる製造方法により、実質的にマンガン:ニッケルが1:1である複合水酸化物粒子であって、平均粒径が5〜15μm、タップ密度が0.6〜1.4g/ml、バルク密度が0.4〜1.0g/ml、比表面積が20〜55m2/g、含有硫酸根が0.25〜0.45重量%であり、かつX線回折において15≦2θ≦25にあるピークの最大強度(I0)と、30≦2θ≦40にあるピークの最大強度(I1)との比(I0/I1)が、1〜6であることを特徴とする、マンガンニッケル複合水酸化物粒子を得る。かかる粒子から製造されるリチウムマンガンニッケル複合酸化物を正極活性物質成分として含有することで非常に優れた電池特性を示すリチウムイオン二次電池を得ることができる。
【図面の簡単な説明】
【図1】実施例1で得られた粒子(a)の電子顕微鏡写真である。(A)表面5000倍、(B)表面20000倍、(C)断面20000倍。
【図2】実施例2で得られた粒子(b)の電子顕微鏡写真である。(A)表面5000倍、(B)表面20000倍、(C)断面20000倍。
【図3】実施例3で得られた粒子(c)の電子顕微鏡写真である。(A)表面5000倍、(B)表面20000倍。
【図4】実施例4で得られた粒子(d)の電子顕微鏡写真である。(A)表面5000倍、(B)表面20000倍、(C)断面20000倍。
【図5】実施例5で得られた粒子(e)の電子顕微鏡写真である。(A)表面5000倍、(B)表面20000倍、(C)断面20000倍。
【図6】実施例6で得られた粒子(f)の電子顕微鏡写真である。(A)表面5000倍、(B)表面20000倍、(C)断面20000倍。
【図7】各実施例で得られた各試料(a)〜(f)のX線回折の結果を示す。
【図8】実施例1で得られた粒子(a)を用いてたリチウムイオン二次電池の充放電曲線を示した。
【図9】実施例2で得られた粒子(b)を用いてたリチウムイオン二次電池の充放電曲線を示した。
【図10】実施例3で得られた粒子(c)を用いてたリチウムイオン二次電池の充放電曲線を示した。
【図11】実施例4で得られた粒子(d)を用いてたリチウムイオン二次電池の充放電曲線を示した。
【図12】実施例5で得られた粒子(e)を用いてたリチウムイオン二次電池の充放電曲線を示した。
【図13】実施例6で得られた粒子(f)を用いてたリチウムイオン二次電池の充放電曲線を示した。
Claims (4)
- マンガン:ニッケルが1:1である複合水酸化物粒子であって、平均粒径が5〜15μm、比表面積が20〜100m2/g、含有硫酸根が0.25〜0.45重量%であり、かつX線回折において15°≦2θ°≦25°にあるピークの最大強度(I0)と、30°≦2θ°≦40°にあるピークの最大強度(I1)との比(I0/I1)が、1〜6であることを特徴とする、マンガンニッケル複合水酸化物粒子。
- 請求項1に記載のマンガンニッケル複合水酸化物粒子と水酸化リチウムを焼成して得られる、マンガン:ニッケルが1:1であるリチウムマンガンニッケル複合酸化物。
- 少なくともリチウムイオンを吸蔵・放出することが可能な物質および/または金属リチウムを負極活物質として含む負極、セパレータ、請求項2に記載のリチウムマンガンニッケル複合酸化物を正極活物質として含む正極、ならびに電解質からなる非水電解質二次電池。
- マンガン:ニッケルが1:1である複合水酸化物粒子であって、平均粒径が5〜15μm、比表面積が20〜100m2/g、含有硫酸根が0.25〜0.45重量%であり、かつX線回折において15°≦2θ°≦25°にあるピークの最大強度(I0)と、30°≦2θ°≦40°にあるピークの最大強度(I1)との比(I0/I1)が、1〜6であることを特徴とするマンガンニッケル複合水酸化物粒子を製造する方法において、反応溶液中にバブリングする雰囲気ガスの窒素に空気を混合することによりマンガンイオンの酸化の程度を一定の範囲に制御しつつ、pH9〜13の水溶液中で、錯化剤の存在下、マンガンとニッケルの原子比が1:1であるマンガン塩とニッケル塩の混合水溶液を、アルカリ溶液と攪拌条件下で反応させて生じる粒子を共沈殿させることを特徴とする製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002379506A JP4234418B2 (ja) | 2002-12-27 | 2002-12-27 | マンガンニッケル複合水酸化物粒子 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2002379506A JP4234418B2 (ja) | 2002-12-27 | 2002-12-27 | マンガンニッケル複合水酸化物粒子 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2004210560A JP2004210560A (ja) | 2004-07-29 |
| JP4234418B2 true JP4234418B2 (ja) | 2009-03-04 |
Family
ID=32815992
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002379506A Expired - Fee Related JP4234418B2 (ja) | 2002-12-27 | 2002-12-27 | マンガンニッケル複合水酸化物粒子 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4234418B2 (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7240484B2 (ja) | 2019-03-29 | 2023-03-15 | 三井化学株式会社 | 捺染用インク原料 |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP4595475B2 (ja) * | 2004-10-01 | 2010-12-08 | 住友金属鉱山株式会社 | 非水系電解質二次電池用正極活物質およびこれを用いた非水系電解質二次電池およびその製造方法 |
| US10017875B2 (en) | 2011-03-28 | 2018-07-10 | Sumitomo Metal Mining Co., Ltd. | Nickel manganese composite hydroxide particles and manufacturing method thereof, cathode active material for a non-aqueous electrolyte secondary battery and manufacturing method thereof, and a non-aqueous electrolyte secondary battery |
| KR101696524B1 (ko) | 2011-06-07 | 2017-01-13 | 스미토모 긴조쿠 고잔 가부시키가이샤 | 니켈 복합 수산화물과 그의 제조 방법, 비수계 전해질 이차 전지용 정극 활물질과 그의 제조 방법, 및 비수계 전해질 이차 전지 |
| JP4894969B1 (ja) | 2011-06-07 | 2012-03-14 | 住友金属鉱山株式会社 | ニッケルマンガン複合水酸化物粒子とその製造方法、非水系電解質二次電池用正極活物質とその製造方法、ならびに、非水系電解質二次電池 |
| JP6055967B2 (ja) * | 2012-05-10 | 2017-01-11 | 株式会社田中化学研究所 | 正極活物質及びその製造方法、正極活物質前駆体、リチウム二次電池用正極、並びにリチウム二次電池 |
| KR101525000B1 (ko) * | 2012-09-24 | 2015-06-03 | 한국화학연구원 | 리튬이차전지의 양극 활물질용 니켈-망간 복합 수산화물의 제조방법, 이에 따라 제조된 니켈-망간 복합 수산화물 및 이를 포함하는 리튬이차전지용 양극 활물질 |
| JP6241349B2 (ja) | 2014-03-28 | 2017-12-06 | 住友金属鉱山株式会社 | 非水電解質二次電池用正極活物質の前駆体とその製造方法、及び非水電解質二次電池用正極活物質とその製造方法 |
| JP6583418B2 (ja) | 2015-08-24 | 2019-10-02 | 住友金属鉱山株式会社 | マンガンニッケル複合水酸化物及びその製造方法、リチウムマンガンニッケル複合酸化物及びその製造方法、並びに非水系電解質二次電池 |
| JP6582824B2 (ja) | 2015-09-30 | 2019-10-02 | 住友金属鉱山株式会社 | ニッケルマンガン含有複合水酸化物およびその製造方法 |
| JP6970671B2 (ja) * | 2016-07-28 | 2021-11-24 | 住友化学株式会社 | リチウムニッケル複合酸化物の製造方法 |
| CN115385395A (zh) * | 2017-07-12 | 2022-11-25 | 住友金属矿山株式会社 | 金属复合氢氧化物、非水电解质二次电池用正极活性物质以及使用其的非水电解质二次电池 |
| KR102023063B1 (ko) | 2017-12-15 | 2019-09-19 | 주식회사 포스코 | 이차 전지용 양극 활물질 전구체 제조 방법 및 이를 이용한 제조 장치 |
-
2002
- 2002-12-27 JP JP2002379506A patent/JP4234418B2/ja not_active Expired - Fee Related
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP7240484B2 (ja) | 2019-03-29 | 2023-03-15 | 三井化学株式会社 | 捺染用インク原料 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP2004210560A (ja) | 2004-07-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US10326133B2 (en) | Methods of making inorganic compounds | |
| JP5817143B2 (ja) | 正極活物質前駆体粒子粉末及び正極活物質粒子粉末、並びに非水電解質二次電池 | |
| JP3489685B2 (ja) | マンガン酸リチウム及びその製造方法ならびにそれを用いてなるリチウム電池 | |
| JP4826147B2 (ja) | アルミニウム含有水酸化ニッケル粒子及びその製造方法 | |
| JP5021892B2 (ja) | リチウムイオン二次電池正極材料用前駆体とその製造方法並びにそれを用いた正極材料の製造方法 | |
| JP5678482B2 (ja) | マンガン酸化物及びその製造方法 | |
| JP6237330B2 (ja) | 非水電解質二次電池用正極活物質の前駆体とその製造方法、及び非水電解質二次電池用正極活物質の製造方法 | |
| JP2015191848A (ja) | 非水電解質二次電池用正極活物質の前駆体とその製造方法、及び非水電解質二次電池用正極活物質とその製造方法 | |
| JP2007123255A (ja) | リチウム・遷移金属複合酸化物及びその製造方法並びにそれを用いてなるリチウム電池 | |
| JP2003059490A (ja) | 非水電解質二次電池用正極活物質及びその製造方法 | |
| JP2007091573A (ja) | リチウム−ニッケル−マンガン−コバルト複合酸化物及びその製造方法並びにその用途 | |
| JP4234418B2 (ja) | マンガンニッケル複合水酸化物粒子 | |
| JP7118129B2 (ja) | リチウムイオン電池用正極活物質を作製する方法 | |
| JP6303279B2 (ja) | 正極活物質粒子粉末及びその製造方法、並びに非水電解質二次電池 | |
| JP7064685B2 (ja) | ニッケルマンガン複合水酸化物の製造方法、および非水系電解質二次電池用正極活物質の製造方法 | |
| JP6237229B2 (ja) | 非水電解質二次電池用正極活物質の前駆体とその製造方法及び非水電解質二次電池用正極活物質とその製造方法 | |
| JP2019164981A (ja) | リチウムイオン二次電池用正極活物質前駆体の製造方法、リチウムイオン二次電池用正極活物質中間物の製造方法、及びそれらを併せたリチウムイオン二次電池用正極活物質の製造方法 | |
| JP4602689B2 (ja) | リチウムイオン二次電池用正極材料 | |
| JP2001114521A (ja) | 四三酸化マンガンおよびその製造方法 | |
| JP2021160970A (ja) | スピネル型マンガン酸リチウム及びその製造方法並びにその用途 | |
| JP6876600B2 (ja) | 非水電解質二次電池用正極活物質の前駆体とその製造方法、及び非水電解質二次電池用正極活物質とその製造方法 | |
| JP2005272213A (ja) | リチウムコバルト酸化物の製造方法 | |
| JP2014205617A (ja) | マンガン酸化物及びそれを用いたマンガン酸リチウムの製造方法 | |
| JP6123391B2 (ja) | 四三酸化マンガン及びその製造方法 | |
| JP2021134100A (ja) | スピネル型マンガン酸リチウム及びその製造方法並びにその用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20051004 |
|
| A977 | Report on retrieval |
Free format text: JAPANESE INTERMEDIATE CODE: A971007 Effective date: 20080331 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080930 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20081016 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20081111 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20081211 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111219 Year of fee payment: 3 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4234418 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121219 Year of fee payment: 4 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20121219 Year of fee payment: 4 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20131219 Year of fee payment: 5 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| LAPS | Cancellation because of no payment of annual fees |