JP2023537762A - Compositions and methods for treating cancer using chimeric TIM receptors in combination with inhibitors of poly(ADP-ribose) polymerase - Google Patents
Compositions and methods for treating cancer using chimeric TIM receptors in combination with inhibitors of poly(ADP-ribose) polymerase Download PDFInfo
- Publication number
- JP2023537762A JP2023537762A JP2023510448A JP2023510448A JP2023537762A JP 2023537762 A JP2023537762 A JP 2023537762A JP 2023510448 A JP2023510448 A JP 2023510448A JP 2023510448 A JP2023510448 A JP 2023510448A JP 2023537762 A JP2023537762 A JP 2023537762A
- Authority
- JP
- Japan
- Prior art keywords
- domain
- seq
- amino acid
- acid sequence
- signaling domain
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000000034 method Methods 0.000 title claims abstract description 118
- 239000000203 mixture Substances 0.000 title claims abstract description 25
- 239000003112 inhibitor Substances 0.000 title claims abstract description 24
- 206010028980 Neoplasm Diseases 0.000 title claims description 57
- 201000011510 cancer Diseases 0.000 title claims description 30
- 108010061844 Poly(ADP-ribose) Polymerases Proteins 0.000 title claims description 9
- 102000012338 Poly(ADP-ribose) Polymerases Human genes 0.000 title claims description 9
- 229920000776 Poly(Adenosine diphosphate-ribose) polymerase Polymers 0.000 title claims description 9
- 150000001413 amino acids Chemical group 0.000 claims description 570
- 230000011664 signaling Effects 0.000 claims description 371
- 210000004027 cell Anatomy 0.000 claims description 367
- 102000005962 receptors Human genes 0.000 claims description 331
- 108020003175 receptors Proteins 0.000 claims description 331
- 230000004068 intracellular signaling Effects 0.000 claims description 290
- 101100369802 Caenorhabditis elegans tim-1 gene Proteins 0.000 claims description 189
- 230000027455 binding Effects 0.000 claims description 158
- 108090000623 proteins and genes Proteins 0.000 claims description 110
- 210000001744 T-lymphocyte Anatomy 0.000 claims description 99
- 101000914514 Homo sapiens T-cell-specific surface glycoprotein CD28 Proteins 0.000 claims description 92
- 102100027213 T-cell-specific surface glycoprotein CD28 Human genes 0.000 claims description 92
- 108091033319 polynucleotide Proteins 0.000 claims description 75
- 102000040430 polynucleotide Human genes 0.000 claims description 75
- 239000002157 polynucleotide Substances 0.000 claims description 75
- 239000013598 vector Substances 0.000 claims description 75
- 108090000765 processed proteins & peptides Proteins 0.000 claims description 59
- PCHKPVIQAHNQLW-CQSZACIVSA-N niraparib Chemical compound N1=C2C(C(=O)N)=CC=CC2=CN1C(C=C1)=CC=C1[C@@H]1CCCNC1 PCHKPVIQAHNQLW-CQSZACIVSA-N 0.000 claims description 55
- 108020001507 fusion proteins Proteins 0.000 claims description 53
- 102000037865 fusion proteins Human genes 0.000 claims description 53
- 229950011068 niraparib Drugs 0.000 claims description 51
- 239000012661 PARP inhibitor Substances 0.000 claims description 49
- 229940121906 Poly ADP ribose polymerase inhibitor Drugs 0.000 claims description 49
- 102000004169 proteins and genes Human genes 0.000 claims description 49
- 101000809875 Homo sapiens TYRO protein tyrosine kinase-binding protein Proteins 0.000 claims description 45
- 102100038717 TYRO protein tyrosine kinase-binding protein Human genes 0.000 claims description 44
- 230000000139 costimulatory effect Effects 0.000 claims description 44
- 102000004196 processed proteins & peptides Human genes 0.000 claims description 41
- 125000006850 spacer group Chemical group 0.000 claims description 40
- 230000004913 activation Effects 0.000 claims description 35
- 101000800483 Homo sapiens Toll-like receptor 8 Proteins 0.000 claims description 31
- 102100033110 Toll-like receptor 8 Human genes 0.000 claims description 31
- 102100027207 CD27 antigen Human genes 0.000 claims description 28
- 101000914511 Homo sapiens CD27 antigen Proteins 0.000 claims description 28
- 101000851370 Homo sapiens Tumor necrosis factor receptor superfamily member 9 Proteins 0.000 claims description 27
- 102100036856 Tumor necrosis factor receptor superfamily member 9 Human genes 0.000 claims description 27
- 210000002865 immune cell Anatomy 0.000 claims description 27
- 101000831567 Homo sapiens Toll-like receptor 2 Proteins 0.000 claims description 26
- 102100024333 Toll-like receptor 2 Human genes 0.000 claims description 26
- 238000006467 substitution reaction Methods 0.000 claims description 26
- 108060003951 Immunoglobulin Proteins 0.000 claims description 25
- 102100025390 Integrin beta-2 Human genes 0.000 claims description 25
- 102000018358 immunoglobulin Human genes 0.000 claims description 25
- 230000003834 intracellular effect Effects 0.000 claims description 24
- 102100022153 Tumor necrosis factor receptor superfamily member 4 Human genes 0.000 claims description 23
- 101000934346 Homo sapiens T-cell surface antigen CD2 Proteins 0.000 claims description 21
- 102100025237 T-cell surface antigen CD2 Human genes 0.000 claims description 21
- 101000716102 Homo sapiens T-cell surface glycoprotein CD4 Proteins 0.000 claims description 20
- 108010064548 Lymphocyte Function-Associated Antigen-1 Proteins 0.000 claims description 20
- 102100036011 T-cell surface glycoprotein CD4 Human genes 0.000 claims description 20
- 102000003714 TNF receptor-associated factor 6 Human genes 0.000 claims description 18
- 108090000009 TNF receptor-associated factor 6 Proteins 0.000 claims description 18
- 101710165473 Tumor necrosis factor receptor superfamily member 4 Proteins 0.000 claims description 17
- 108010019670 Chimeric Antigen Receptors Proteins 0.000 claims description 16
- 101001109503 Homo sapiens NKG2-C type II integral membrane protein Proteins 0.000 claims description 16
- 102100022683 NKG2-C type II integral membrane protein Human genes 0.000 claims description 16
- 102100040678 Programmed cell death protein 1 Human genes 0.000 claims description 16
- 101710089372 Programmed cell death protein 1 Proteins 0.000 claims description 16
- 238000002560 therapeutic procedure Methods 0.000 claims description 16
- 101000914496 Homo sapiens T-cell antigen CD7 Proteins 0.000 claims description 15
- 102100037877 Intercellular adhesion molecule 1 Human genes 0.000 claims description 15
- 102100027208 T-cell antigen CD7 Human genes 0.000 claims description 15
- 108090000925 TNF receptor-associated factor 2 Proteins 0.000 claims description 14
- 102100034779 TRAF family member-associated NF-kappa-B activator Human genes 0.000 claims description 14
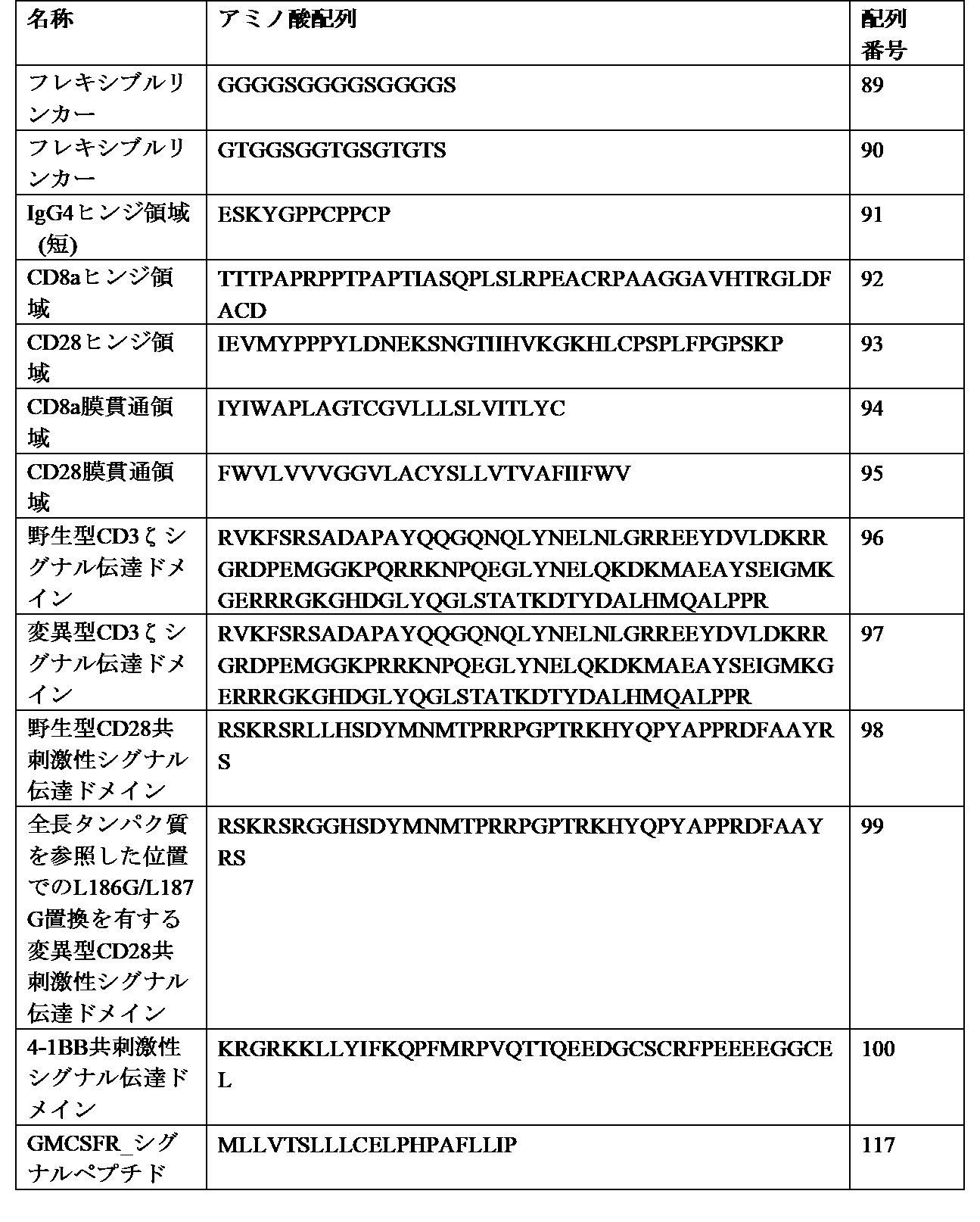
- 206010033128 Ovarian cancer Diseases 0.000 claims description 13
- 206010061535 Ovarian neoplasm Diseases 0.000 claims description 13
- 229950004707 rucaparib Drugs 0.000 claims description 13
- HMABYWSNWIZPAG-UHFFFAOYSA-N rucaparib Chemical compound C1=CC(CNC)=CC=C1C(N1)=C2CCNC(=O)C3=C2C1=CC(F)=C3 HMABYWSNWIZPAG-UHFFFAOYSA-N 0.000 claims description 13
- 101150013553 CD40 gene Proteins 0.000 claims description 12
- 101000851376 Homo sapiens Tumor necrosis factor receptor superfamily member 8 Proteins 0.000 claims description 12
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 claims description 12
- 102100036857 Tumor necrosis factor receptor superfamily member 8 Human genes 0.000 claims description 12
- 239000012528 membrane Substances 0.000 claims description 12
- 108010064593 Intercellular Adhesion Molecule-1 Proteins 0.000 claims description 11
- 238000010361 transduction Methods 0.000 claims description 10
- 230000026683 transduction Effects 0.000 claims description 10
- 102100038078 CD276 antigen Human genes 0.000 claims description 9
- HWGQMRYQVZSGDQ-HZPDHXFCSA-N chembl3137320 Chemical group CN1N=CN=C1[C@H]([C@H](N1)C=2C=CC(F)=CC=2)C2=NNC(=O)C3=C2C1=CC(F)=C3 HWGQMRYQVZSGDQ-HZPDHXFCSA-N 0.000 claims description 9
- 229960000572 olaparib Drugs 0.000 claims description 9
- 206010006187 Breast cancer Diseases 0.000 claims description 8
- 208000026310 Breast neoplasm Diseases 0.000 claims description 8
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 claims description 7
- 206010060862 Prostate cancer Diseases 0.000 claims description 7
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 7
- 239000003814 drug Substances 0.000 claims description 7
- 230000037361 pathway Effects 0.000 claims description 7
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 claims description 7
- 230000001413 cellular effect Effects 0.000 claims description 6
- 108700010039 chimeric receptor Proteins 0.000 claims description 6
- 238000009169 immunotherapy Methods 0.000 claims description 6
- 108091008036 Immune checkpoint proteins Proteins 0.000 claims description 5
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 5
- 102000002689 Toll-like receptor Human genes 0.000 claims description 5
- 108020000411 Toll-like receptor Proteins 0.000 claims description 5
- 201000005202 lung cancer Diseases 0.000 claims description 5
- 208000020816 lung neoplasm Diseases 0.000 claims description 5
- 229950004550 talazoparib Drugs 0.000 claims description 5
- 229940124597 therapeutic agent Drugs 0.000 claims description 5
- JNAHVYVRKWKWKQ-CYBMUJFWSA-N veliparib Chemical compound N=1C2=CC=CC(C(N)=O)=C2NC=1[C@@]1(C)CCCN1 JNAHVYVRKWKWKQ-CYBMUJFWSA-N 0.000 claims description 5
- DENYZIUJOTUUNY-MRXNPFEDSA-N (2R)-14-fluoro-2-methyl-6,9,10,19-tetrazapentacyclo[14.2.1.02,6.08,18.012,17]nonadeca-1(18),8,12(17),13,15-pentaen-11-one Chemical compound FC=1C=C2C=3C=4C(CN5[C@@](C4NC3C1)(CCC5)C)=NNC2=O DENYZIUJOTUUNY-MRXNPFEDSA-N 0.000 claims description 4
- CTLOSZHDGZLOQE-UHFFFAOYSA-N 14-methoxy-9-[(4-methylpiperazin-1-yl)methyl]-9,19-diazapentacyclo[10.7.0.02,6.07,11.013,18]nonadeca-1(12),2(6),7(11),13(18),14,16-hexaene-8,10-dione Chemical compound O=C1C2=C3C=4C(OC)=CC=CC=4NC3=C3CCCC3=C2C(=O)N1CN1CCN(C)CC1 CTLOSZHDGZLOQE-UHFFFAOYSA-N 0.000 claims description 4
- 210000001266 CD8-positive T-lymphocyte Anatomy 0.000 claims description 4
- 102000037982 Immune checkpoint proteins Human genes 0.000 claims description 4
- 239000003102 growth factor Substances 0.000 claims description 4
- 229940126546 immune checkpoint molecule Drugs 0.000 claims description 4
- HAVFFEMDLROBGI-UHFFFAOYSA-N m8926c7ilx Chemical compound C1CC(O)CCN1CC1=CC=C(OC=2C3=C(C(NN=C33)=O)C=CC=2)C3=C1 HAVFFEMDLROBGI-UHFFFAOYSA-N 0.000 claims description 4
- 229950011257 veliparib Drugs 0.000 claims description 4
- 206010009944 Colon cancer Diseases 0.000 claims description 3
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 3
- 102000016266 T-Cell Antigen Receptors Human genes 0.000 claims description 3
- 238000002512 chemotherapy Methods 0.000 claims description 3
- 201000001441 melanoma Diseases 0.000 claims description 3
- 208000002154 non-small cell lung carcinoma Diseases 0.000 claims description 3
- 229950007072 pamiparib Drugs 0.000 claims description 3
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 3
- 108700020463 BRCA1 Proteins 0.000 claims description 2
- 102000036365 BRCA1 Human genes 0.000 claims description 2
- 101150072950 BRCA1 gene Proteins 0.000 claims description 2
- 102000052609 BRCA2 Human genes 0.000 claims description 2
- 108700020462 BRCA2 Proteins 0.000 claims description 2
- 101150008921 Brca2 gene Proteins 0.000 claims description 2
- 201000001342 Fallopian tube cancer Diseases 0.000 claims description 2
- 208000013452 Fallopian tube neoplasm Diseases 0.000 claims description 2
- 208000003721 Triple Negative Breast Neoplasms Diseases 0.000 claims description 2
- 210000005260 human cell Anatomy 0.000 claims description 2
- 201000002628 peritoneum cancer Diseases 0.000 claims description 2
- 150000003384 small molecules Chemical class 0.000 claims description 2
- 208000022679 triple-negative breast carcinoma Diseases 0.000 claims description 2
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 claims description 2
- 230000000149 penetrating effect Effects 0.000 claims 5
- FAQDUNYVKQKNLD-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC2=C3[CH]C=CC=C3C(=O)N=N2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FAQDUNYVKQKNLD-UHFFFAOYSA-N 0.000 claims 2
- KKVYYGGCHJGEFJ-UHFFFAOYSA-N 1-n-(4-chlorophenyl)-6-methyl-5-n-[3-(7h-purin-6-yl)pyridin-2-yl]isoquinoline-1,5-diamine Chemical compound N=1C=CC2=C(NC=3C(=CC=CN=3)C=3C=4N=CNC=4N=CN=3)C(C)=CC=C2C=1NC1=CC=C(Cl)C=C1 KKVYYGGCHJGEFJ-UHFFFAOYSA-N 0.000 claims 1
- 239000012664 BCL-2-inhibitor Substances 0.000 claims 1
- 229940124291 BTK inhibitor Drugs 0.000 claims 1
- 229940123711 Bcl2 inhibitor Drugs 0.000 claims 1
- 229940118364 Bcr-Abl inhibitor Drugs 0.000 claims 1
- 101001042041 Bos taurus Isocitrate dehydrogenase [NAD] subunit beta, mitochondrial Proteins 0.000 claims 1
- 229940124204 C-kit inhibitor Drugs 0.000 claims 1
- 229940124297 CDK 4/6 inhibitor Drugs 0.000 claims 1
- 229940124783 FAK inhibitor Drugs 0.000 claims 1
- 102000013446 GTP Phosphohydrolases Human genes 0.000 claims 1
- 108091006109 GTPases Proteins 0.000 claims 1
- 229940119324 H-Ras inhibitor Drugs 0.000 claims 1
- 229940125497 HER2 kinase inhibitor Drugs 0.000 claims 1
- 102100035108 High affinity nerve growth factor receptor Human genes 0.000 claims 1
- 101000960234 Homo sapiens Isocitrate dehydrogenase [NADP] cytoplasmic Proteins 0.000 claims 1
- 101000599886 Homo sapiens Isocitrate dehydrogenase [NADP], mitochondrial Proteins 0.000 claims 1
- 101001126417 Homo sapiens Platelet-derived growth factor receptor alpha Proteins 0.000 claims 1
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 claims 1
- 101000686031 Homo sapiens Proto-oncogene tyrosine-protein kinase ROS Proteins 0.000 claims 1
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 claims 1
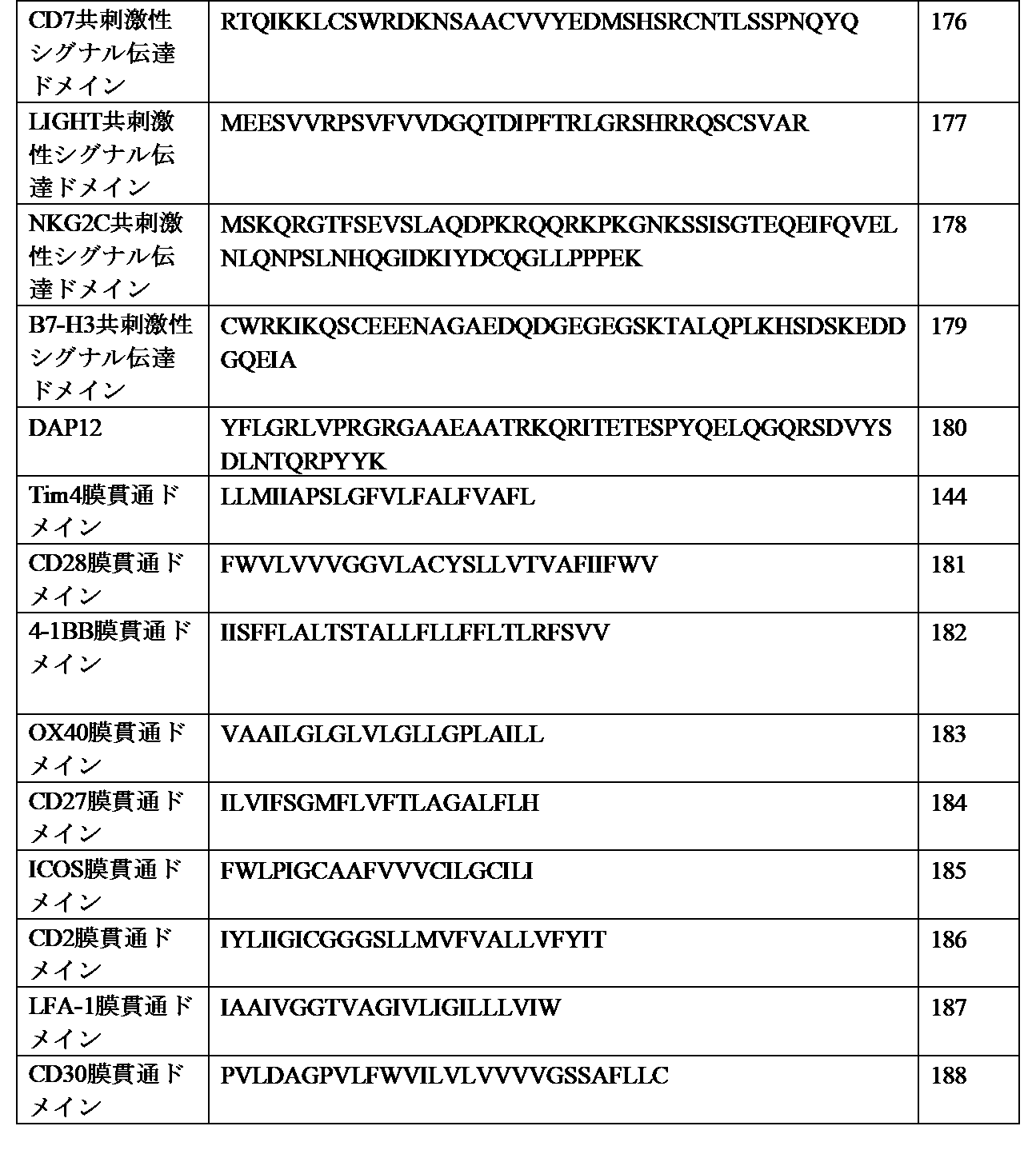
- 101001059454 Homo sapiens Serine/threonine-protein kinase MARK2 Proteins 0.000 claims 1
- 101000823316 Homo sapiens Tyrosine-protein kinase ABL1 Proteins 0.000 claims 1
- 102100039905 Isocitrate dehydrogenase [NADP] cytoplasmic Human genes 0.000 claims 1
- 102100037845 Isocitrate dehydrogenase [NADP], mitochondrial Human genes 0.000 claims 1
- 229940123830 K-Ras inhibitor Drugs 0.000 claims 1
- 101100381978 Mus musculus Braf gene Proteins 0.000 claims 1
- 229940124160 Myc inhibitor Drugs 0.000 claims 1
- 108700019961 Neoplasm Genes Proteins 0.000 claims 1
- 102000048850 Neoplasm Genes Human genes 0.000 claims 1
- 239000012828 PI3K inhibitor Substances 0.000 claims 1
- 102100030485 Platelet-derived growth factor receptor alpha Human genes 0.000 claims 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 claims 1
- 102100023347 Proto-oncogene tyrosine-protein kinase ROS Human genes 0.000 claims 1
- 102100028286 Proto-oncogene tyrosine-protein kinase receptor Ret Human genes 0.000 claims 1
- 229940127361 Receptor Tyrosine Kinase Inhibitors Drugs 0.000 claims 1
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 claims 1
- 102100028904 Serine/threonine-protein kinase MARK2 Human genes 0.000 claims 1
- 108091023040 Transcription factor Proteins 0.000 claims 1
- 102000040945 Transcription factor Human genes 0.000 claims 1
- 102100022596 Tyrosine-protein kinase ABL1 Human genes 0.000 claims 1
- 229940124674 VEGF-R inhibitor Drugs 0.000 claims 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 claims 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 claims 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 claims 1
- 239000004037 angiogenesis inhibitor Substances 0.000 claims 1
- 239000003242 anti bacterial agent Substances 0.000 claims 1
- 239000002260 anti-inflammatory agent Substances 0.000 claims 1
- 229940121363 anti-inflammatory agent Drugs 0.000 claims 1
- 229940088710 antibiotic agent Drugs 0.000 claims 1
- 229940121375 antifungal agent Drugs 0.000 claims 1
- 239000003443 antiviral agent Substances 0.000 claims 1
- 229940121357 antivirals Drugs 0.000 claims 1
- 229940121647 egfr inhibitor Drugs 0.000 claims 1
- 230000005611 electricity Effects 0.000 claims 1
- 229940125829 fibroblast growth factor receptor inhibitor Drugs 0.000 claims 1
- 238000001794 hormone therapy Methods 0.000 claims 1
- 229940043355 kinase inhibitor Drugs 0.000 claims 1
- 229940124302 mTOR inhibitor Drugs 0.000 claims 1
- 239000003628 mammalian target of rapamycin inhibitor Substances 0.000 claims 1
- 239000002829 mitogen activated protein kinase inhibitor Substances 0.000 claims 1
- 244000309459 oncolytic virus Species 0.000 claims 1
- 229940043441 phosphoinositide 3-kinase inhibitor Drugs 0.000 claims 1
- 239000003757 phosphotransferase inhibitor Substances 0.000 claims 1
- 238000001126 phototherapy Methods 0.000 claims 1
- 230000005855 radiation Effects 0.000 claims 1
- 102200145384 rs34127778 Human genes 0.000 claims 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 claims 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 claims 1
- 238000002604 ultrasonography Methods 0.000 claims 1
- 238000002648 combination therapy Methods 0.000 abstract 1
- TZCPCKNHXULUIY-RGULYWFUSA-N 1,2-distearoyl-sn-glycero-3-phosphoserine Chemical compound CCCCCCCCCCCCCCCCCC(=O)OC[C@H](COP(O)(=O)OC[C@H](N)C(O)=O)OC(=O)CCCCCCCCCCCCCCCCC TZCPCKNHXULUIY-RGULYWFUSA-N 0.000 description 68
- ZWZWYGMENQVNFU-UHFFFAOYSA-N Glycerophosphorylserin Natural products OC(=O)C(N)COP(O)(=O)OCC(O)CO ZWZWYGMENQVNFU-UHFFFAOYSA-N 0.000 description 67
- 239000000427 antigen Substances 0.000 description 65
- 108091007433 antigens Proteins 0.000 description 65
- 102000036639 antigens Human genes 0.000 description 65
- 230000014509 gene expression Effects 0.000 description 61
- 108010076504 Protein Sorting Signals Proteins 0.000 description 53
- 210000003719 b-lymphocyte Anatomy 0.000 description 44
- 108010063954 Mucins Proteins 0.000 description 41
- 102000015728 Mucins Human genes 0.000 description 41
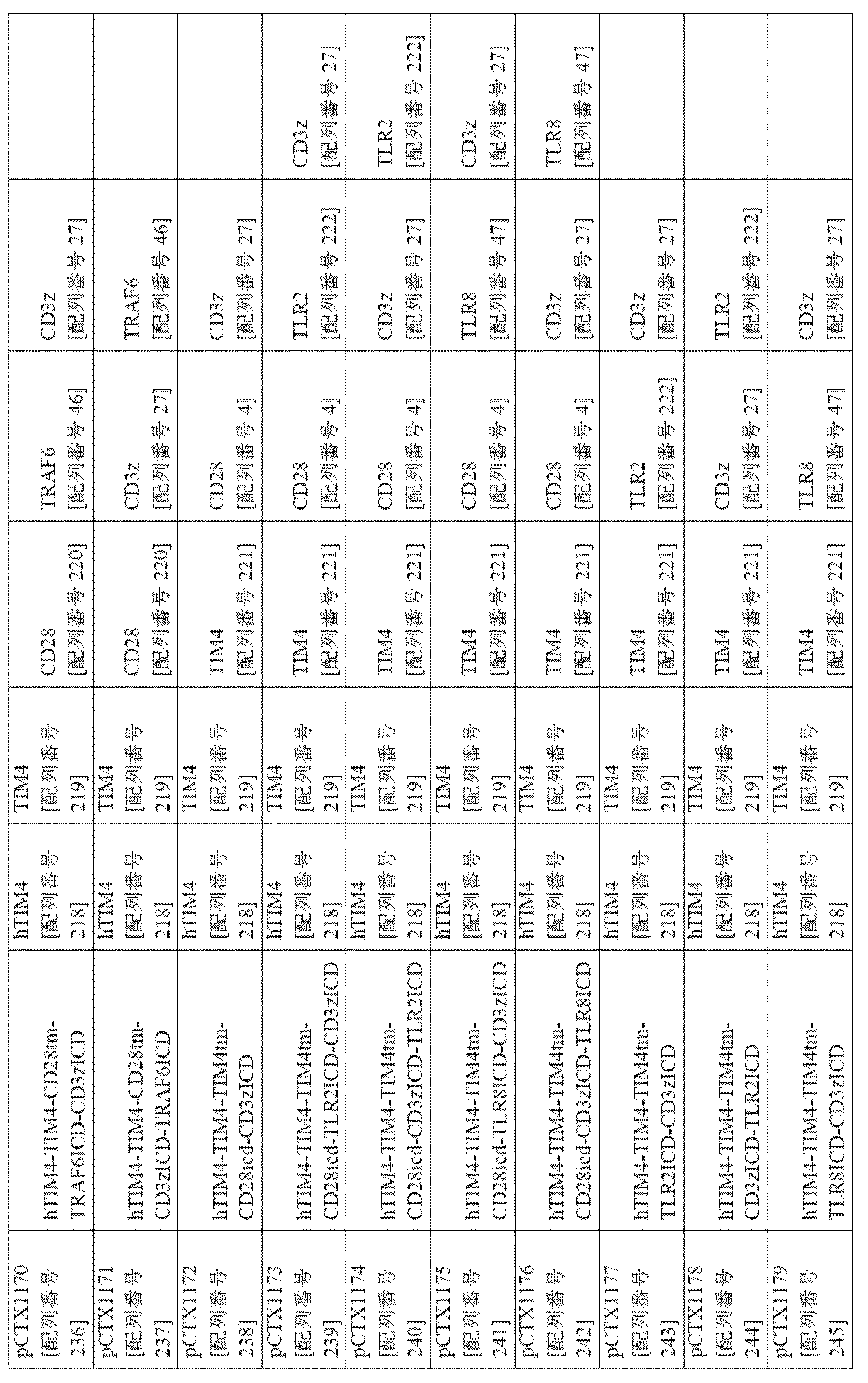
- 150000007523 nucleic acids Chemical class 0.000 description 40
- 102000039446 nucleic acids Human genes 0.000 description 37
- 108020004707 nucleic acids Proteins 0.000 description 37
- 241000282414 Homo sapiens Species 0.000 description 34
- 239000012636 effector Substances 0.000 description 33
- 206010057249 Phagocytosis Diseases 0.000 description 29
- 230000008782 phagocytosis Effects 0.000 description 29
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 28
- -1 CD40L Proteins 0.000 description 27
- 229920001184 polypeptide Polymers 0.000 description 27
- 241000894007 species Species 0.000 description 27
- 239000013603 viral vector Substances 0.000 description 24
- 230000000242 pagocytic effect Effects 0.000 description 21
- 230000001472 cytotoxic effect Effects 0.000 description 20
- 239000002245 particle Substances 0.000 description 20
- 238000007792 addition Methods 0.000 description 19
- 241000700159 Rattus Species 0.000 description 18
- 201000010099 disease Diseases 0.000 description 18
- 210000001519 tissue Anatomy 0.000 description 18
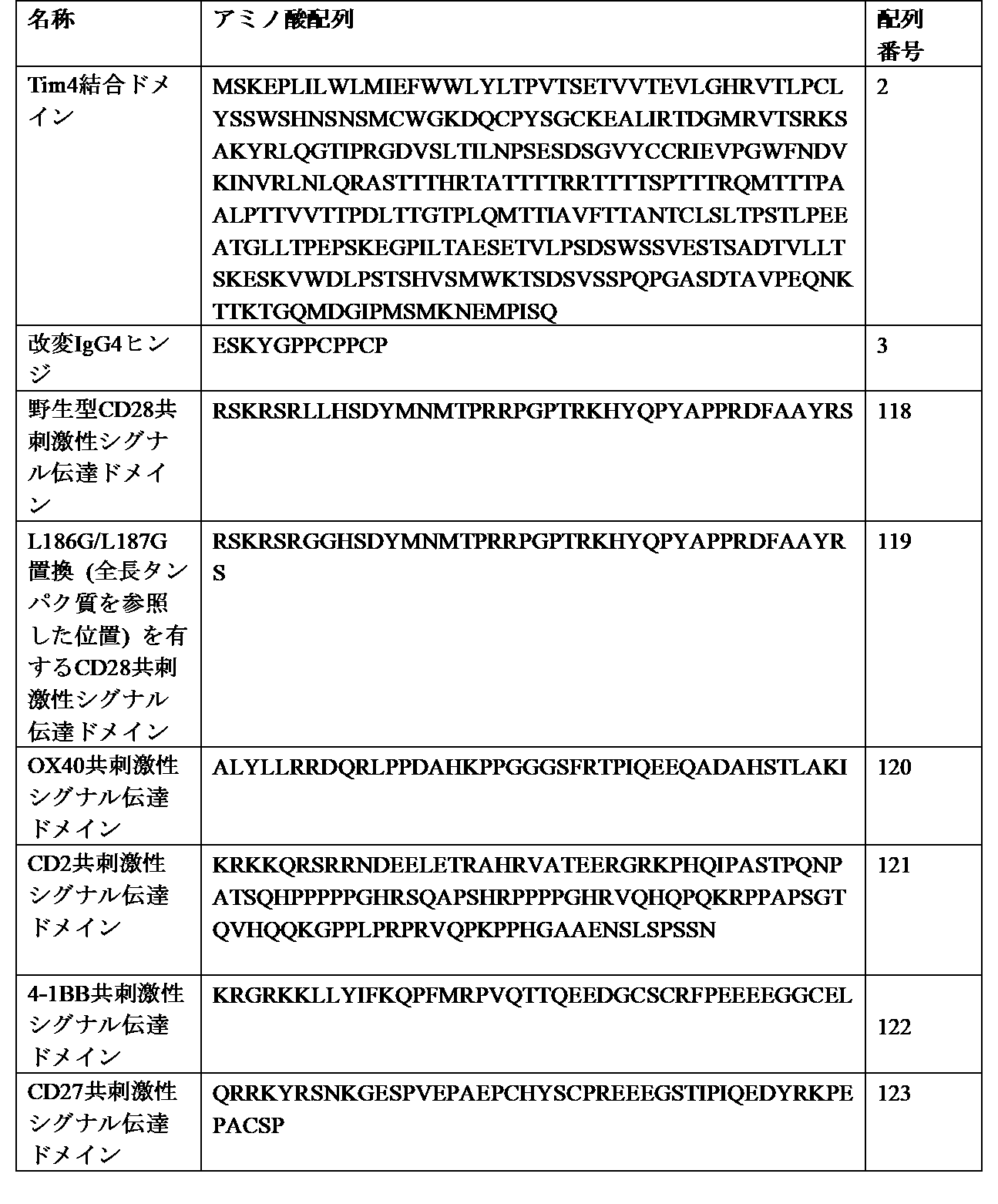
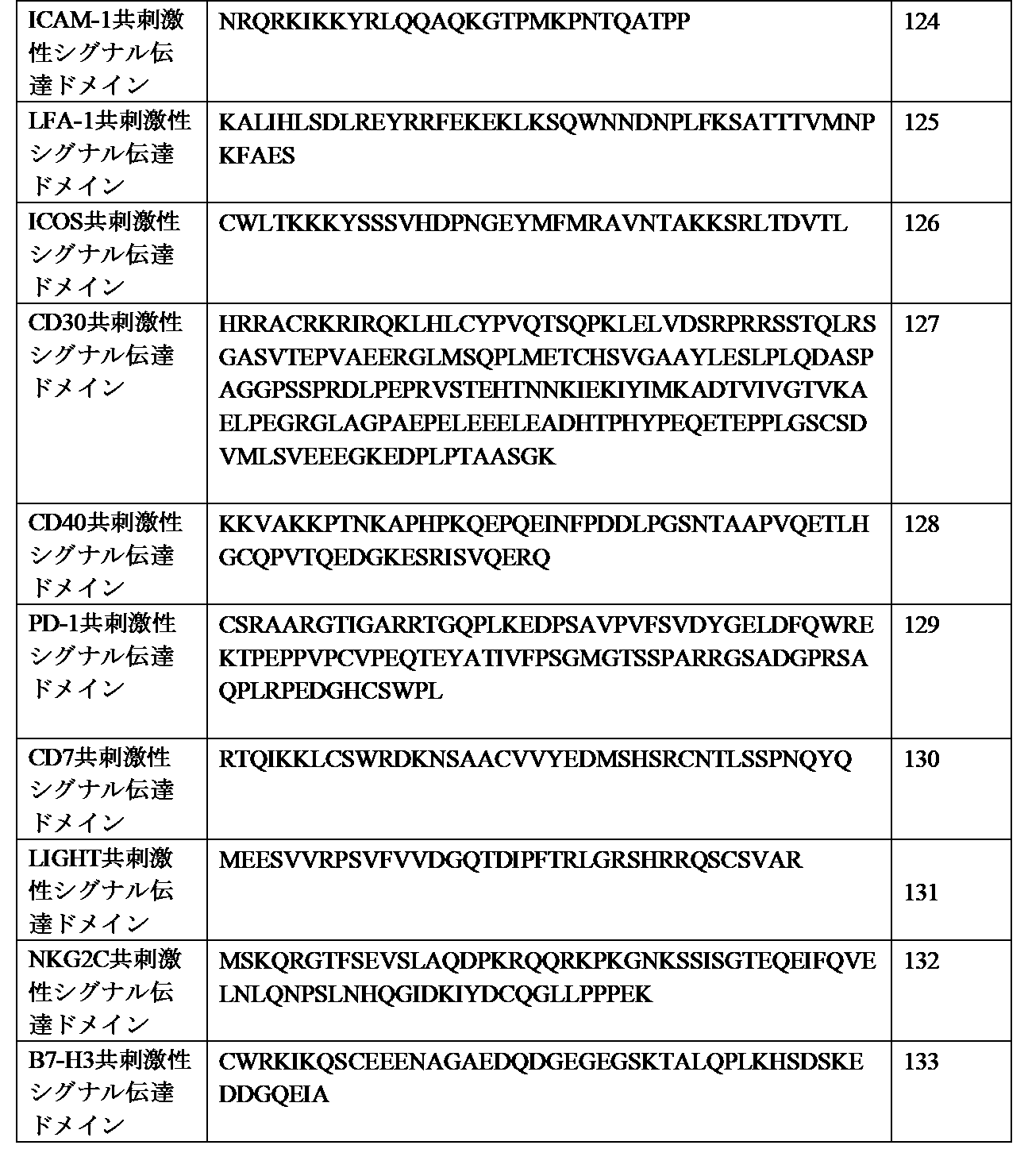
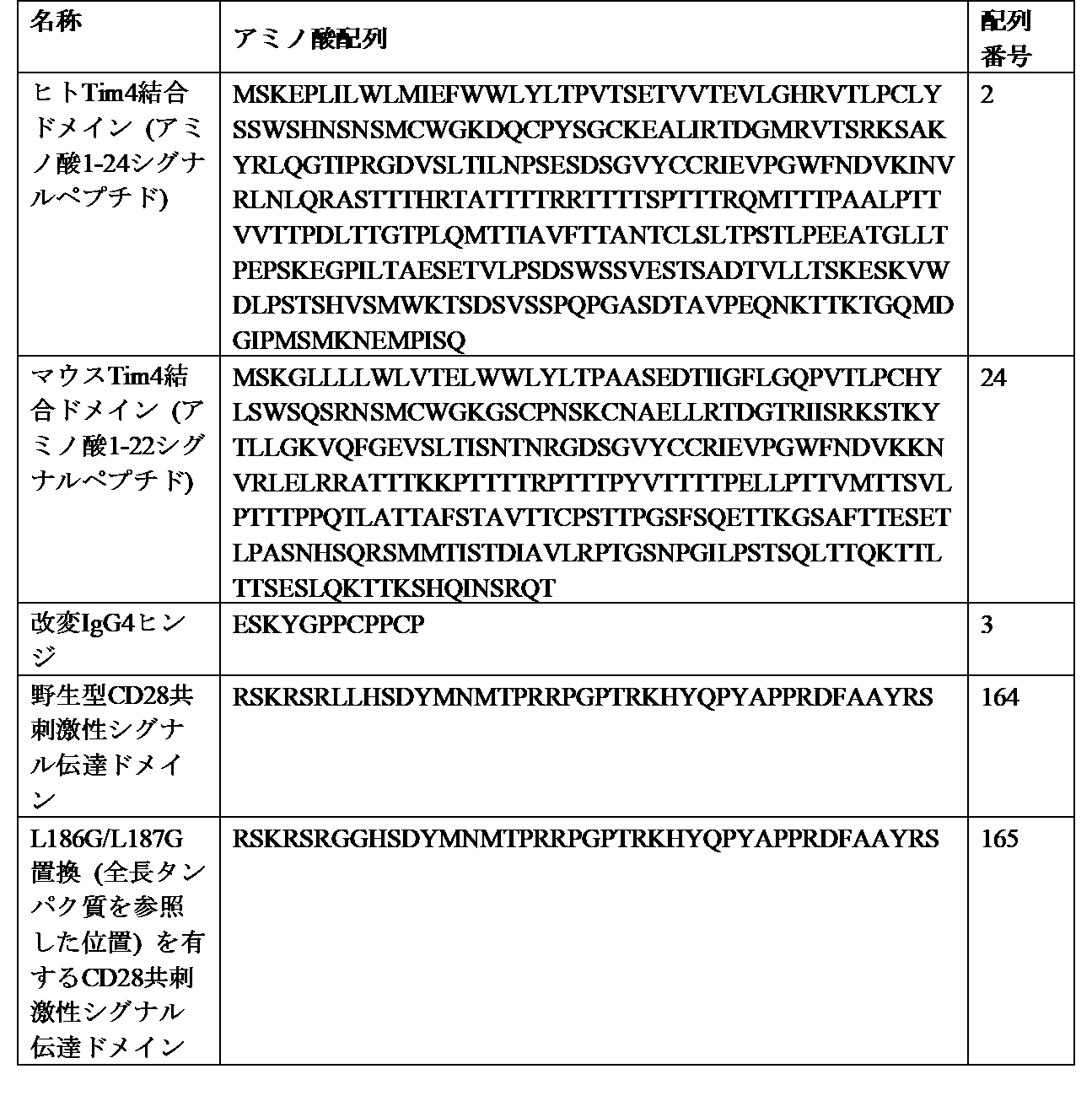
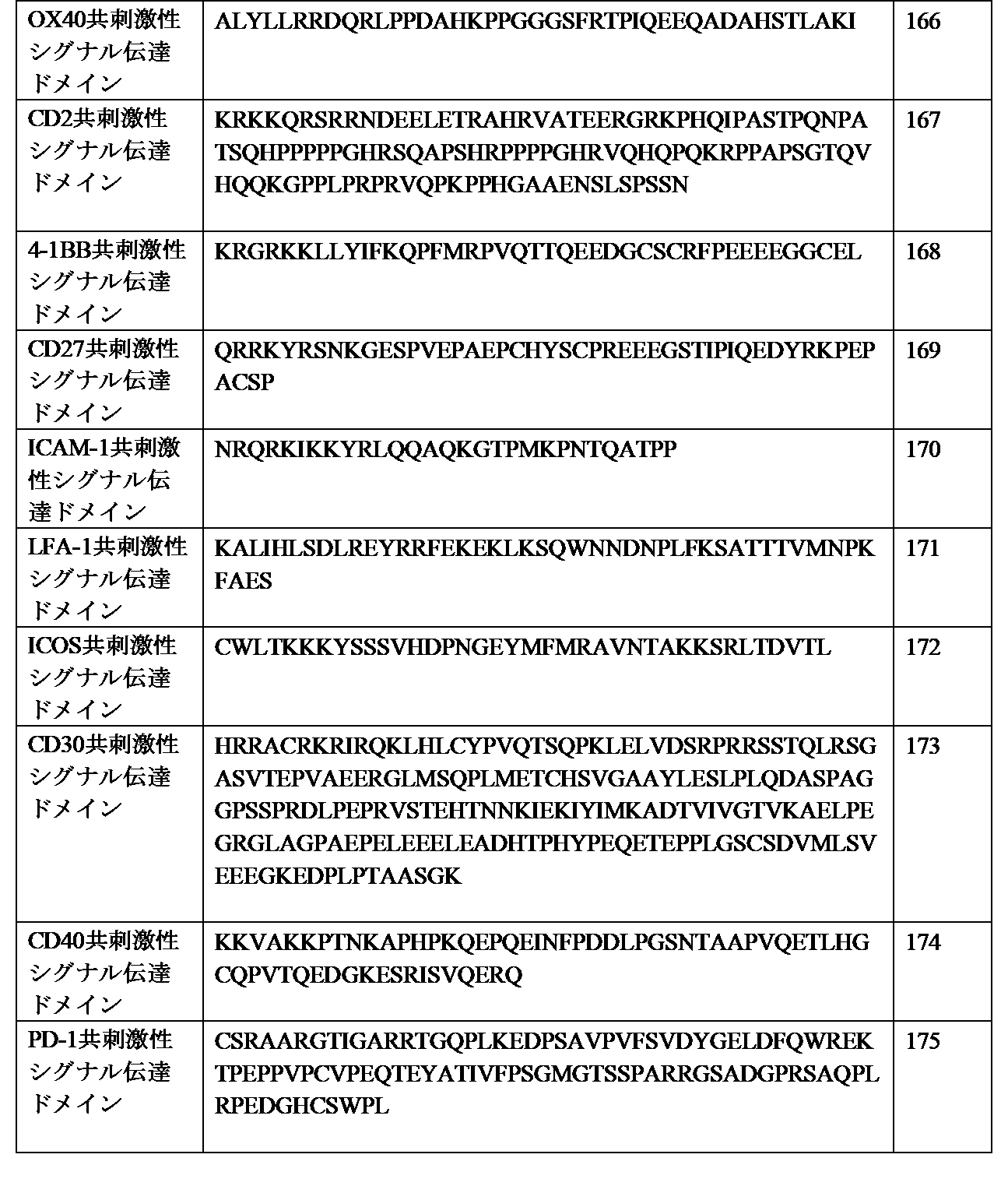
- 101000669511 Homo sapiens T-cell immunoglobulin and mucin domain-containing protein 4 Proteins 0.000 description 17
- 230000004075 alteration Effects 0.000 description 17
- 230000006907 apoptotic process Effects 0.000 description 17
- 238000012217 deletion Methods 0.000 description 17
- 230000037430 deletion Effects 0.000 description 17
- 230000006870 function Effects 0.000 description 16
- 102000045158 human TIMD4 Human genes 0.000 description 16
- 241000283690 Bos taurus Species 0.000 description 15
- 108020004414 DNA Proteins 0.000 description 15
- 230000007781 signaling event Effects 0.000 description 15
- 210000004881 tumor cell Anatomy 0.000 description 15
- 241000282472 Canis lupus familiaris Species 0.000 description 14
- 241000282326 Felis catus Species 0.000 description 14
- 241000283973 Oryctolagus cuniculus Species 0.000 description 14
- 241000288906 Primates Species 0.000 description 14
- 230000001640 apoptogenic effect Effects 0.000 description 14
- 230000004044 response Effects 0.000 description 14
- 102000004127 Cytokines Human genes 0.000 description 13
- 108090000695 Cytokines Proteins 0.000 description 13
- 241001494479 Pecora Species 0.000 description 13
- 108700019146 Transgenes Proteins 0.000 description 13
- 230000000694 effects Effects 0.000 description 13
- 230000035755 proliferation Effects 0.000 description 13
- 230000001105 regulatory effect Effects 0.000 description 13
- 241000283707 Capra Species 0.000 description 12
- 241000700199 Cavia porcellus Species 0.000 description 12
- 241000283073 Equus caballus Species 0.000 description 12
- 101000946843 Homo sapiens T-cell surface glycoprotein CD8 alpha chain Proteins 0.000 description 12
- 102100034922 T-cell surface glycoprotein CD8 alpha chain Human genes 0.000 description 12
- 231100000433 cytotoxic Toxicity 0.000 description 12
- 230000009261 transgenic effect Effects 0.000 description 12
- 230000003612 virological effect Effects 0.000 description 12
- 101001137987 Homo sapiens Lymphocyte activation gene 3 protein Proteins 0.000 description 11
- 102000017578 LAG3 Human genes 0.000 description 11
- 241000699666 Mus <mouse, genus> Species 0.000 description 11
- 241000282898 Sus scrofa Species 0.000 description 11
- 210000000170 cell membrane Anatomy 0.000 description 11
- 230000001939 inductive effect Effects 0.000 description 11
- 230000004048 modification Effects 0.000 description 11
- 238000012986 modification Methods 0.000 description 11
- 125000003729 nucleotide group Chemical group 0.000 description 11
- 102100039498 Cytotoxic T-lymphocyte protein 4 Human genes 0.000 description 10
- 108091008874 T cell receptors Proteins 0.000 description 10
- 208000035475 disorder Diseases 0.000 description 10
- 210000000822 natural killer cell Anatomy 0.000 description 10
- 239000002773 nucleotide Substances 0.000 description 10
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 9
- 108020004684 Internal Ribosome Entry Sites Proteins 0.000 description 9
- 102000004856 Lectins Human genes 0.000 description 9
- 108090001090 Lectins Proteins 0.000 description 9
- 102100024213 Programmed cell death 1 ligand 2 Human genes 0.000 description 9
- 102100028785 Tumor necrosis factor receptor superfamily member 14 Human genes 0.000 description 9
- 230000001965 increasing effect Effects 0.000 description 9
- 239000002523 lectin Substances 0.000 description 9
- 230000001338 necrotic effect Effects 0.000 description 9
- FDLYAMZZIXQODN-UHFFFAOYSA-N olaparib Chemical compound FC1=CC=C(CC=2C3=CC=CC=C3C(=O)NN=2)C=C1C(=O)N(CC1)CCN1C(=O)C1CC1 FDLYAMZZIXQODN-UHFFFAOYSA-N 0.000 description 9
- 239000000047 product Substances 0.000 description 9
- 210000000130 stem cell Anatomy 0.000 description 9
- 238000011282 treatment Methods 0.000 description 9
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 8
- 241000282412 Homo Species 0.000 description 8
- 101000889276 Homo sapiens Cytotoxic T-lymphocyte protein 4 Proteins 0.000 description 8
- 102100029215 Signaling lymphocytic activation molecule Human genes 0.000 description 8
- 230000019491 signal transduction Effects 0.000 description 8
- 230000020382 suppression by virus of host antigen processing and presentation of peptide antigen via MHC class I Effects 0.000 description 8
- 230000009258 tissue cross reactivity Effects 0.000 description 8
- 241000214054 Equine rhinitis A virus Species 0.000 description 7
- 241000124008 Mammalia Species 0.000 description 7
- 108010052285 Membrane Proteins Proteins 0.000 description 7
- 241001529936 Murinae Species 0.000 description 7
- 102100040247 Tumor necrosis factor Human genes 0.000 description 7
- 210000000612 antigen-presenting cell Anatomy 0.000 description 7
- 210000004443 dendritic cell Anatomy 0.000 description 7
- 238000000684 flow cytometry Methods 0.000 description 7
- 230000036541 health Effects 0.000 description 7
- 210000004698 lymphocyte Anatomy 0.000 description 7
- 210000000680 phagosome Anatomy 0.000 description 7
- 230000002829 reductive effect Effects 0.000 description 7
- 108010042407 Endonucleases Proteins 0.000 description 6
- 102000004190 Enzymes Human genes 0.000 description 6
- 108090000790 Enzymes Proteins 0.000 description 6
- 102100034458 Hepatitis A virus cellular receptor 2 Human genes 0.000 description 6
- 101001068133 Homo sapiens Hepatitis A virus cellular receptor 2 Proteins 0.000 description 6
- 101001018097 Homo sapiens L-selectin Proteins 0.000 description 6
- 101000946860 Homo sapiens T-cell surface glycoprotein CD3 epsilon chain Proteins 0.000 description 6
- 102100037850 Interferon gamma Human genes 0.000 description 6
- 108010074328 Interferon-gamma Proteins 0.000 description 6
- 108010002350 Interleukin-2 Proteins 0.000 description 6
- 102000000588 Interleukin-2 Human genes 0.000 description 6
- 102100033467 L-selectin Human genes 0.000 description 6
- 241001465754 Metazoa Species 0.000 description 6
- 241000699670 Mus sp. Species 0.000 description 6
- 230000006044 T cell activation Effects 0.000 description 6
- 102100035794 T-cell surface glycoprotein CD3 epsilon chain Human genes 0.000 description 6
- 241000700605 Viruses Species 0.000 description 6
- 239000004480 active ingredient Substances 0.000 description 6
- 238000003776 cleavage reaction Methods 0.000 description 6
- 230000016396 cytokine production Effects 0.000 description 6
- 230000004069 differentiation Effects 0.000 description 6
- 229940088598 enzyme Drugs 0.000 description 6
- 230000004927 fusion Effects 0.000 description 6
- 230000001404 mediated effect Effects 0.000 description 6
- 230000007017 scission Effects 0.000 description 6
- 230000028327 secretion Effects 0.000 description 6
- 238000013518 transcription Methods 0.000 description 6
- 230000035897 transcription Effects 0.000 description 6
- 102100038080 B-cell receptor CD22 Human genes 0.000 description 5
- 241000710198 Foot-and-mouth disease virus Species 0.000 description 5
- 102100035233 Furin Human genes 0.000 description 5
- 108090001126 Furin Proteins 0.000 description 5
- 108060005986 Granzyme Proteins 0.000 description 5
- 102000001398 Granzyme Human genes 0.000 description 5
- 101000884305 Homo sapiens B-cell receptor CD22 Proteins 0.000 description 5
- 101000935040 Homo sapiens Integrin beta-2 Proteins 0.000 description 5
- 101000738771 Homo sapiens Receptor-type tyrosine-protein phosphatase C Proteins 0.000 description 5
- 101000934341 Homo sapiens T-cell surface glycoprotein CD5 Proteins 0.000 description 5
- 101150069255 KLRC1 gene Proteins 0.000 description 5
- 101100404845 Macaca mulatta NKG2A gene Proteins 0.000 description 5
- 108010061593 Member 14 Tumor Necrosis Factor Receptors Proteins 0.000 description 5
- 101100407308 Mus musculus Pdcd1lg2 gene Proteins 0.000 description 5
- 101000669510 Mus musculus T-cell immunoglobulin and mucin domain-containing protein 4 Proteins 0.000 description 5
- 102100022682 NKG2-A/NKG2-B type II integral membrane protein Human genes 0.000 description 5
- 101710163270 Nuclease Proteins 0.000 description 5
- 108700030875 Programmed Cell Death 1 Ligand 2 Proteins 0.000 description 5
- 101800001494 Protease 2A Proteins 0.000 description 5
- 101800001066 Protein 2A Proteins 0.000 description 5
- 102100037422 Receptor-type tyrosine-protein phosphatase C Human genes 0.000 description 5
- 230000005867 T cell response Effects 0.000 description 5
- 102100025244 T-cell surface glycoprotein CD5 Human genes 0.000 description 5
- 108060008682 Tumor Necrosis Factor Proteins 0.000 description 5
- 230000000259 anti-tumor effect Effects 0.000 description 5
- 230000030741 antigen processing and presentation Effects 0.000 description 5
- 210000001185 bone marrow Anatomy 0.000 description 5
- 238000001415 gene therapy Methods 0.000 description 5
- 238000010362 genome editing Methods 0.000 description 5
- 230000028993 immune response Effects 0.000 description 5
- 238000000338 in vitro Methods 0.000 description 5
- 238000001802 infusion Methods 0.000 description 5
- 239000003446 ligand Substances 0.000 description 5
- 239000002502 liposome Substances 0.000 description 5
- 210000001165 lymph node Anatomy 0.000 description 5
- 229930192851 perforin Natural products 0.000 description 5
- 230000002688 persistence Effects 0.000 description 5
- 210000001539 phagocyte Anatomy 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 230000009467 reduction Effects 0.000 description 5
- 230000001177 retroviral effect Effects 0.000 description 5
- 238000010186 staining Methods 0.000 description 5
- 230000004083 survival effect Effects 0.000 description 5
- 208000024891 symptom Diseases 0.000 description 5
- 230000002123 temporal effect Effects 0.000 description 5
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 description 4
- 102100025218 B-cell differentiation antigen CD72 Human genes 0.000 description 4
- 102100038077 CD226 antigen Human genes 0.000 description 4
- 102100035793 CD83 antigen Human genes 0.000 description 4
- 102100025466 Carcinoembryonic antigen-related cell adhesion molecule 3 Human genes 0.000 description 4
- 201000009030 Carcinoma Diseases 0.000 description 4
- 102000004533 Endonucleases Human genes 0.000 description 4
- 102100029360 Hematopoietic cell signal transducer Human genes 0.000 description 4
- 101000934359 Homo sapiens B-cell differentiation antigen CD72 Proteins 0.000 description 4
- 101000946856 Homo sapiens CD83 antigen Proteins 0.000 description 4
- 101000914337 Homo sapiens Carcinoembryonic antigen-related cell adhesion molecule 3 Proteins 0.000 description 4
- 101000990188 Homo sapiens Hematopoietic cell signal transducer Proteins 0.000 description 4
- 101000599852 Homo sapiens Intercellular adhesion molecule 1 Proteins 0.000 description 4
- 101001047640 Homo sapiens Linker for activation of T-cells family member 1 Proteins 0.000 description 4
- 101000702132 Homo sapiens Protein spinster homolog 1 Proteins 0.000 description 4
- 101000801234 Homo sapiens Tumor necrosis factor receptor superfamily member 18 Proteins 0.000 description 4
- 241000725303 Human immunodeficiency virus Species 0.000 description 4
- 102100024032 Linker for activation of T-cells family member 1 Human genes 0.000 description 4
- 102100034709 Lymphocyte cytosolic protein 2 Human genes 0.000 description 4
- 101710195102 Lymphocyte cytosolic protein 2 Proteins 0.000 description 4
- 102000018697 Membrane Proteins Human genes 0.000 description 4
- 102100024216 Programmed cell death 1 ligand 1 Human genes 0.000 description 4
- 108010074687 Signaling Lymphocytic Activation Molecule Family Member 1 Proteins 0.000 description 4
- 230000006052 T cell proliferation Effects 0.000 description 4
- 108010023649 Tripartite Motif Proteins Proteins 0.000 description 4
- 102000011408 Tripartite Motif Proteins Human genes 0.000 description 4
- 102100033728 Tumor necrosis factor receptor superfamily member 18 Human genes 0.000 description 4
- 101001038499 Yarrowia lipolytica (strain CLIB 122 / E 150) Lysine acetyltransferase Proteins 0.000 description 4
- 108010017070 Zinc Finger Nucleases Proteins 0.000 description 4
- 238000011374 additional therapy Methods 0.000 description 4
- 125000000539 amino acid group Chemical group 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 210000004369 blood Anatomy 0.000 description 4
- 239000008280 blood Substances 0.000 description 4
- 238000010367 cloning Methods 0.000 description 4
- 239000002299 complementary DNA Substances 0.000 description 4
- 150000001875 compounds Chemical class 0.000 description 4
- 210000002472 endoplasmic reticulum Anatomy 0.000 description 4
- 239000003623 enhancer Substances 0.000 description 4
- 239000012634 fragment Substances 0.000 description 4
- 238000010353 genetic engineering Methods 0.000 description 4
- 210000000987 immune system Anatomy 0.000 description 4
- 230000001506 immunosuppresive effect Effects 0.000 description 4
- 230000003993 interaction Effects 0.000 description 4
- 208000032839 leukemia Diseases 0.000 description 4
- 150000002632 lipids Chemical class 0.000 description 4
- 210000002540 macrophage Anatomy 0.000 description 4
- 238000004519 manufacturing process Methods 0.000 description 4
- 239000003550 marker Substances 0.000 description 4
- 210000001806 memory b lymphocyte Anatomy 0.000 description 4
- 210000000066 myeloid cell Anatomy 0.000 description 4
- 210000003643 myeloid progenitor cell Anatomy 0.000 description 4
- 210000000581 natural killer T-cell Anatomy 0.000 description 4
- 210000000056 organ Anatomy 0.000 description 4
- 230000002018 overexpression Effects 0.000 description 4
- 239000008194 pharmaceutical composition Substances 0.000 description 4
- 210000001948 pro-b lymphocyte Anatomy 0.000 description 4
- 102220077395 rs797044870 Human genes 0.000 description 4
- 230000035945 sensitivity Effects 0.000 description 4
- 230000001225 therapeutic effect Effects 0.000 description 4
- 238000012546 transfer Methods 0.000 description 4
- 241001430294 unidentified retrovirus Species 0.000 description 4
- 102100022005 B-lymphocyte antigen CD20 Human genes 0.000 description 3
- 102100036301 C-C chemokine receptor type 7 Human genes 0.000 description 3
- 108010078791 Carrier Proteins Proteins 0.000 description 3
- 102000016289 Cell Adhesion Molecules Human genes 0.000 description 3
- 108010067225 Cell Adhesion Molecules Proteins 0.000 description 3
- 108091026890 Coding region Proteins 0.000 description 3
- 102100025137 Early activation antigen CD69 Human genes 0.000 description 3
- 241000283086 Equidae Species 0.000 description 3
- 241000713800 Feline immunodeficiency virus Species 0.000 description 3
- 108700028146 Genetic Enhancer Elements Proteins 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 102100021186 Granulysin Human genes 0.000 description 3
- 101710168479 Granulysin Proteins 0.000 description 3
- 101000897405 Homo sapiens B-lymphocyte antigen CD20 Proteins 0.000 description 3
- 101000716065 Homo sapiens C-C chemokine receptor type 7 Proteins 0.000 description 3
- 101000934374 Homo sapiens Early activation antigen CD69 Proteins 0.000 description 3
- 101000878605 Homo sapiens Low affinity immunoglobulin epsilon Fc receptor Proteins 0.000 description 3
- 101001109501 Homo sapiens NKG2-D type II integral membrane protein Proteins 0.000 description 3
- 101000971513 Homo sapiens Natural killer cells antigen CD94 Proteins 0.000 description 3
- 101000831007 Homo sapiens T-cell immunoreceptor with Ig and ITIM domains Proteins 0.000 description 3
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 3
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 3
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 3
- 241000713666 Lentivirus Species 0.000 description 3
- 102100038007 Low affinity immunoglobulin epsilon Fc receptor Human genes 0.000 description 3
- 241000714177 Murine leukemia virus Species 0.000 description 3
- 102100022680 NKG2-D type II integral membrane protein Human genes 0.000 description 3
- 102100021462 Natural killer cells antigen CD94 Human genes 0.000 description 3
- 206010028851 Necrosis Diseases 0.000 description 3
- 108091028043 Nucleic acid sequence Proteins 0.000 description 3
- 108010038807 Oligopeptides Proteins 0.000 description 3
- 102000015636 Oligopeptides Human genes 0.000 description 3
- 240000007019 Oxalis corniculata Species 0.000 description 3
- KHGNFPUMBJSZSM-UHFFFAOYSA-N Perforine Natural products COC1=C2CCC(O)C(CCC(C)(C)O)(OC)C2=NC2=C1C=CO2 KHGNFPUMBJSZSM-UHFFFAOYSA-N 0.000 description 3
- 241000713311 Simian immunodeficiency virus Species 0.000 description 3
- 241000700584 Simplexvirus Species 0.000 description 3
- 102100024834 T-cell immunoreceptor with Ig and ITIM domains Human genes 0.000 description 3
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 3
- 230000000735 allogeneic effect Effects 0.000 description 3
- 230000002424 anti-apoptotic effect Effects 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000009286 beneficial effect Effects 0.000 description 3
- 102220354910 c.4C>G Human genes 0.000 description 3
- 230000005779 cell damage Effects 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 230000036755 cellular response Effects 0.000 description 3
- 230000004186 co-expression Effects 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 230000003013 cytotoxicity Effects 0.000 description 3
- 231100000135 cytotoxicity Toxicity 0.000 description 3
- 230000003247 decreasing effect Effects 0.000 description 3
- 238000013461 design Methods 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 210000003162 effector t lymphocyte Anatomy 0.000 description 3
- 239000013604 expression vector Substances 0.000 description 3
- 230000008622 extracellular signaling Effects 0.000 description 3
- 230000003325 follicular Effects 0.000 description 3
- 230000002209 hydrophobic effect Effects 0.000 description 3
- 230000006698 induction Effects 0.000 description 3
- 230000004807 localization Effects 0.000 description 3
- 230000007774 longterm Effects 0.000 description 3
- 210000003826 marginal zone b cell Anatomy 0.000 description 3
- 210000003071 memory t lymphocyte Anatomy 0.000 description 3
- 244000005700 microbiome Species 0.000 description 3
- 230000009149 molecular binding Effects 0.000 description 3
- 210000004877 mucosa Anatomy 0.000 description 3
- 230000017074 necrotic cell death Effects 0.000 description 3
- 210000003720 plasmablast Anatomy 0.000 description 3
- 210000004180 plasmocyte Anatomy 0.000 description 3
- 229920000642 polymer Polymers 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 210000003289 regulatory T cell Anatomy 0.000 description 3
- 210000002707 regulatory b cell Anatomy 0.000 description 3
- 108091008146 restriction endonucleases Proteins 0.000 description 3
- 239000000523 sample Substances 0.000 description 3
- 238000013519 translation Methods 0.000 description 3
- 239000003981 vehicle Substances 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- YBJHBAHKTGYVGT-ZKWXMUAHSA-N (+)-Biotin Chemical compound N1C(=O)N[C@@H]2[C@H](CCCCC(=O)O)SC[C@@H]21 YBJHBAHKTGYVGT-ZKWXMUAHSA-N 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- 208000023275 Autoimmune disease Diseases 0.000 description 2
- 102100023962 Bifunctional arginine demethylase and lysyl-hydroxylase JMJD6 Human genes 0.000 description 2
- 102100032937 CD40 ligand Human genes 0.000 description 2
- 102100037904 CD9 antigen Human genes 0.000 description 2
- 108010021064 CTLA-4 Antigen Proteins 0.000 description 2
- 229940045513 CTLA4 antagonist Drugs 0.000 description 2
- 241000700198 Cavia Species 0.000 description 2
- 208000005243 Chondrosarcoma Diseases 0.000 description 2
- 108010047041 Complementarity Determining Regions Proteins 0.000 description 2
- 108091035707 Consensus sequence Proteins 0.000 description 2
- 201000005171 Cystadenoma Diseases 0.000 description 2
- 102000053602 DNA Human genes 0.000 description 2
- 230000033616 DNA repair Effects 0.000 description 2
- 241000702421 Dependoparvovirus Species 0.000 description 2
- 102000001301 EGF receptor Human genes 0.000 description 2
- 108060006698 EGF receptor Proteins 0.000 description 2
- 238000002965 ELISA Methods 0.000 description 2
- 102100031780 Endonuclease Human genes 0.000 description 2
- 241000713730 Equine infectious anemia virus Species 0.000 description 2
- 108010042634 F2A4-K-NS peptide Proteins 0.000 description 2
- 241001663880 Gammaretrovirus Species 0.000 description 2
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 2
- 102000003886 Glycoproteins Human genes 0.000 description 2
- 108090000288 Glycoproteins Proteins 0.000 description 2
- 102100031573 Hematopoietic progenitor cell antigen CD34 Human genes 0.000 description 2
- 102100026122 High affinity immunoglobulin gamma Fc receptor I Human genes 0.000 description 2
- 102000008949 Histocompatibility Antigens Class I Human genes 0.000 description 2
- 101000868215 Homo sapiens CD40 ligand Proteins 0.000 description 2
- 101000738354 Homo sapiens CD9 antigen Proteins 0.000 description 2
- 101000777663 Homo sapiens Hematopoietic progenitor cell antigen CD34 Proteins 0.000 description 2
- 101000913074 Homo sapiens High affinity immunoglobulin gamma Fc receptor I Proteins 0.000 description 2
- 101000777628 Homo sapiens Leukocyte antigen CD37 Proteins 0.000 description 2
- 101000917858 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-A Proteins 0.000 description 2
- 101000917839 Homo sapiens Low affinity immunoglobulin gamma Fc region receptor III-B Proteins 0.000 description 2
- 101000934338 Homo sapiens Myeloid cell surface antigen CD33 Proteins 0.000 description 2
- 101001102797 Homo sapiens Transmembrane protein PVRIG Proteins 0.000 description 2
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 description 2
- 101000818543 Homo sapiens Tyrosine-protein kinase ZAP-70 Proteins 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 108090000172 Interleukin-15 Proteins 0.000 description 2
- 102100031586 Leukocyte antigen CD37 Human genes 0.000 description 2
- 102100029185 Low affinity immunoglobulin gamma Fc region receptor III-B Human genes 0.000 description 2
- 108091054437 MHC class I family Proteins 0.000 description 2
- 108091054438 MHC class II family Proteins 0.000 description 2
- 102000043131 MHC class II family Human genes 0.000 description 2
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 2
- 102100025243 Myeloid cell surface antigen CD33 Human genes 0.000 description 2
- 108091007491 NSP3 Papain-like protease domains Proteins 0.000 description 2
- 206010029260 Neuroblastoma Diseases 0.000 description 2
- 102000004503 Perforin Human genes 0.000 description 2
- 108010056995 Perforin Proteins 0.000 description 2
- 241001672814 Porcine teschovirus 1 Species 0.000 description 2
- 206010039491 Sarcoma Diseases 0.000 description 2
- 108010003723 Single-Domain Antibodies Proteins 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- 108010090804 Streptavidin Proteins 0.000 description 2
- 241000282887 Suidae Species 0.000 description 2
- 230000024932 T cell mediated immunity Effects 0.000 description 2
- 102100039367 T-cell immunoglobulin and mucin domain-containing protein 4 Human genes 0.000 description 2
- 241001648840 Thosea asigna virus Species 0.000 description 2
- 108010073062 Transcription Activator-Like Effectors Proteins 0.000 description 2
- 102100039630 Transmembrane protein PVRIG Human genes 0.000 description 2
- 102100021125 Tyrosine-protein kinase ZAP-70 Human genes 0.000 description 2
- 208000027418 Wounds and injury Diseases 0.000 description 2
- 230000002159 abnormal effect Effects 0.000 description 2
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000006472 autoimmune response Effects 0.000 description 2
- 239000012472 biological sample Substances 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 208000003362 bronchogenic carcinoma Diseases 0.000 description 2
- 210000004899 c-terminal region Anatomy 0.000 description 2
- 208000037887 cell injury Diseases 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 230000000295 complement effect Effects 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 230000001461 cytolytic effect Effects 0.000 description 2
- 230000003436 cytoskeletal effect Effects 0.000 description 2
- 239000008121 dextrose Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 230000000925 erythroid effect Effects 0.000 description 2
- 239000012530 fluid Substances 0.000 description 2
- 238000009472 formulation Methods 0.000 description 2
- 210000003918 fraction a Anatomy 0.000 description 2
- 230000002068 genetic effect Effects 0.000 description 2
- 201000005787 hematologic cancer Diseases 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- 230000013632 homeostatic process Effects 0.000 description 2
- 230000001900 immune effect Effects 0.000 description 2
- 230000001976 improved effect Effects 0.000 description 2
- 230000005918 in vitro anti-tumor Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 208000014674 injury Diseases 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 102000006495 integrins Human genes 0.000 description 2
- 108010044426 integrins Proteins 0.000 description 2
- 238000005304 joining Methods 0.000 description 2
- 210000001821 langerhans cell Anatomy 0.000 description 2
- 208000012804 lymphangiosarcoma Diseases 0.000 description 2
- 230000000527 lymphocytic effect Effects 0.000 description 2
- 210000003712 lysosome Anatomy 0.000 description 2
- 230000001868 lysosomic effect Effects 0.000 description 2
- 229920002521 macromolecule Polymers 0.000 description 2
- 238000012423 maintenance Methods 0.000 description 2
- 239000000463 material Substances 0.000 description 2
- 210000001616 monocyte Anatomy 0.000 description 2
- 230000000877 morphologic effect Effects 0.000 description 2
- 230000006780 non-homologous end joining Effects 0.000 description 2
- 208000003154 papilloma Diseases 0.000 description 2
- 230000001575 pathological effect Effects 0.000 description 2
- 108010077613 phosphatidylserine receptor Proteins 0.000 description 2
- 150000008298 phosphoramidates Chemical class 0.000 description 2
- 239000013600 plasmid vector Substances 0.000 description 2
- 230000008488 polyadenylation Effects 0.000 description 2
- 239000011148 porous material Substances 0.000 description 2
- 230000000770 proinflammatory effect Effects 0.000 description 2
- 230000002062 proliferating effect Effects 0.000 description 2
- 238000001959 radiotherapy Methods 0.000 description 2
- 230000008707 rearrangement Effects 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- 238000012216 screening Methods 0.000 description 2
- 230000003248 secreting effect Effects 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 210000000952 spleen Anatomy 0.000 description 2
- 230000004936 stimulating effect Effects 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 230000035882 stress Effects 0.000 description 2
- 210000000225 synapse Anatomy 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 210000001541 thymus gland Anatomy 0.000 description 2
- 230000005026 transcription initiation Effects 0.000 description 2
- 230000001960 triggered effect Effects 0.000 description 2
- 108010087967 type I signal peptidase Proteins 0.000 description 2
- 241000701161 unidentified adenovirus Species 0.000 description 2
- SGKRLCUYIXIAHR-AKNGSSGZSA-N (4s,4ar,5s,5ar,6r,12ar)-4-(dimethylamino)-1,5,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4a,5,5a,6-tetrahydro-4h-tetracene-2-carboxamide Chemical compound C1=CC=C2[C@H](C)[C@@H]([C@H](O)[C@@H]3[C@](C(O)=C(C(N)=O)C(=O)[C@H]3N(C)C)(O)C3=O)C3=C(O)C2=C1O SGKRLCUYIXIAHR-AKNGSSGZSA-N 0.000 description 1
- 102000040650 (ribonucleotides)n+m Human genes 0.000 description 1
- IQFYYKKMVGJFEH-OFKYTIFKSA-N 1-[(2r,4s,5r)-4-hydroxy-5-(tritiooxymethyl)oxolan-2-yl]-5-methylpyrimidine-2,4-dione Chemical compound C1[C@H](O)[C@@H](CO[3H])O[C@H]1N1C(=O)NC(=O)C(C)=C1 IQFYYKKMVGJFEH-OFKYTIFKSA-N 0.000 description 1
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 description 1
- KDCGOANMDULRCW-UHFFFAOYSA-N 7H-purine Chemical group N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 1
- 102000007469 Actins Human genes 0.000 description 1
- 108010085238 Actins Proteins 0.000 description 1
- 208000003200 Adenoma Diseases 0.000 description 1
- 206010001233 Adenoma benign Diseases 0.000 description 1
- 101150051188 Adora2a gene Proteins 0.000 description 1
- 241000710929 Alphavirus Species 0.000 description 1
- 108091093088 Amplicon Proteins 0.000 description 1
- 208000005034 Angiolymphoid Hyperplasia with Eosinophilia Diseases 0.000 description 1
- 201000003076 Angiosarcoma Diseases 0.000 description 1
- 108020004491 Antisense DNA Proteins 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 102100029822 B- and T-lymphocyte attenuator Human genes 0.000 description 1
- 102100024222 B-lymphocyte antigen CD19 Human genes 0.000 description 1
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 1
- 102100027314 Beta-2-microglobulin Human genes 0.000 description 1
- 208000003609 Bile Duct Adenoma Diseases 0.000 description 1
- 241000713704 Bovine immunodeficiency virus Species 0.000 description 1
- 208000003174 Brain Neoplasms Diseases 0.000 description 1
- 208000003170 Bronchiolo-Alveolar Adenocarcinoma Diseases 0.000 description 1
- 101710149863 C-C chemokine receptor type 4 Proteins 0.000 description 1
- 102100031650 C-X-C chemokine receptor type 4 Human genes 0.000 description 1
- 239000002126 C01EB10 - Adenosine Substances 0.000 description 1
- 102100032976 CCR4-NOT transcription complex subunit 6 Human genes 0.000 description 1
- 102100024263 CD160 antigen Human genes 0.000 description 1
- 102000017420 CD3 protein, epsilon/gamma/delta subunit Human genes 0.000 description 1
- 108050005493 CD3 protein, epsilon/gamma/delta subunit Proteins 0.000 description 1
- 238000010356 CRISPR-Cas9 genome editing Methods 0.000 description 1
- 238000010453 CRISPR/Cas method Methods 0.000 description 1
- 241000282465 Canis Species 0.000 description 1
- 208000005623 Carcinogenesis Diseases 0.000 description 1
- 201000000274 Carcinosarcoma Diseases 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 102100026550 Caspase-9 Human genes 0.000 description 1
- 108090000566 Caspase-9 Proteins 0.000 description 1
- 206010057248 Cell death Diseases 0.000 description 1
- 208000007389 Cementoma Diseases 0.000 description 1
- 206010008263 Cervical dysplasia Diseases 0.000 description 1
- 206010008342 Cervix carcinoma Diseases 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- 206010008642 Cholesteatoma Diseases 0.000 description 1
- 108091033380 Coding strand Proteins 0.000 description 1
- 108020004705 Codon Proteins 0.000 description 1
- 208000035473 Communicable disease Diseases 0.000 description 1
- 206010010144 Completed suicide Diseases 0.000 description 1
- 241000701022 Cytomegalovirus Species 0.000 description 1
- 239000012623 DNA damaging agent Substances 0.000 description 1
- 102000004163 DNA-directed RNA polymerases Human genes 0.000 description 1
- 108090000626 DNA-directed RNA polymerases Proteins 0.000 description 1
- BWGNESOTFCXPMA-UHFFFAOYSA-N Dihydrogen disulfide Chemical compound SS BWGNESOTFCXPMA-UHFFFAOYSA-N 0.000 description 1
- 206010061818 Disease progression Diseases 0.000 description 1
- 206010059866 Drug resistance Diseases 0.000 description 1
- 208000006402 Ductal Carcinoma Diseases 0.000 description 1
- 241000206602 Eukaryota Species 0.000 description 1
- 229910052693 Europium Inorganic materials 0.000 description 1
- 241000714165 Feline leukemia virus Species 0.000 description 1
- 241000714174 Feline sarcoma virus Species 0.000 description 1
- 241000282324 Felis Species 0.000 description 1
- 201000008808 Fibrosarcoma Diseases 0.000 description 1
- 206010053717 Fibrous histiocytoma Diseases 0.000 description 1
- 102100031351 Galectin-9 Human genes 0.000 description 1
- 101100229077 Gallus gallus GAL9 gene Proteins 0.000 description 1
- 208000007569 Giant Cell Tumors Diseases 0.000 description 1
- 208000032612 Glial tumor Diseases 0.000 description 1
- 206010018338 Glioma Diseases 0.000 description 1
- 241000235503 Glomus Species 0.000 description 1
- 229930186217 Glycolipid Natural products 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 1
- 208000031886 HIV Infections Diseases 0.000 description 1
- 208000001258 Hemangiosarcoma Diseases 0.000 description 1
- 208000002250 Hematologic Neoplasms Diseases 0.000 description 1
- 108010007712 Hepatitis A Virus Cellular Receptor 1 Proteins 0.000 description 1
- 102100034459 Hepatitis A virus cellular receptor 1 Human genes 0.000 description 1
- 208000002291 Histiocytic Sarcoma Diseases 0.000 description 1
- 208000017604 Hodgkin disease Diseases 0.000 description 1
- 208000010747 Hodgkins lymphoma Diseases 0.000 description 1
- 101000864344 Homo sapiens B- and T-lymphocyte attenuator Proteins 0.000 description 1
- 101000980825 Homo sapiens B-lymphocyte antigen CD19 Proteins 0.000 description 1
- 101000922348 Homo sapiens C-X-C chemokine receptor type 4 Proteins 0.000 description 1
- 101000761938 Homo sapiens CD160 antigen Proteins 0.000 description 1
- 101100273713 Homo sapiens CD2 gene Proteins 0.000 description 1
- 101000851181 Homo sapiens Epidermal growth factor receptor Proteins 0.000 description 1
- 101001068136 Homo sapiens Hepatitis A virus cellular receptor 1 Proteins 0.000 description 1
- 101001057504 Homo sapiens Interferon-stimulated gene 20 kDa protein Proteins 0.000 description 1
- 101001055144 Homo sapiens Interleukin-2 receptor subunit alpha Proteins 0.000 description 1
- 101000884270 Homo sapiens Natural killer cell receptor 2B4 Proteins 0.000 description 1
- 101001113440 Homo sapiens Poly [ADP-ribose] polymerase 2 Proteins 0.000 description 1
- 101000884271 Homo sapiens Signal transducer CD24 Proteins 0.000 description 1
- 101000763579 Homo sapiens Toll-like receptor 1 Proteins 0.000 description 1
- 101000831496 Homo sapiens Toll-like receptor 3 Proteins 0.000 description 1
- 101000669447 Homo sapiens Toll-like receptor 4 Proteins 0.000 description 1
- 101000669460 Homo sapiens Toll-like receptor 5 Proteins 0.000 description 1
- 101000669406 Homo sapiens Toll-like receptor 6 Proteins 0.000 description 1
- 101000669402 Homo sapiens Toll-like receptor 7 Proteins 0.000 description 1
- 101000666896 Homo sapiens V-type immunoglobulin domain-containing suppressor of T-cell activation Proteins 0.000 description 1
- 241000713772 Human immunodeficiency virus 1 Species 0.000 description 1
- 241000713340 Human immunodeficiency virus 2 Species 0.000 description 1
- 108010067060 Immunoglobulin Variable Region Proteins 0.000 description 1
- 102000017727 Immunoglobulin Variable Region Human genes 0.000 description 1
- 102100027268 Interferon-stimulated gene 20 kDa protein Human genes 0.000 description 1
- 108090000978 Interleukin-4 Proteins 0.000 description 1
- 101150008942 J gene Proteins 0.000 description 1
- 108010043610 KIR Receptors Proteins 0.000 description 1
- 208000008839 Kidney Neoplasms Diseases 0.000 description 1
- 102100033627 Killer cell immunoglobulin-like receptor 3DL1 Human genes 0.000 description 1
- 208000001509 Krebs 2 carcinoma Diseases 0.000 description 1
- 102100020943 Leukocyte-associated immunoglobulin-like receptor 1 Human genes 0.000 description 1
- 201000004462 Leydig Cell Tumor Diseases 0.000 description 1
- 239000000232 Lipid Bilayer Substances 0.000 description 1
- 206010024612 Lipoma Diseases 0.000 description 1
- 206010025219 Lymphangioma Diseases 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- 108700005089 MHC Class I Genes Proteins 0.000 description 1
- 108700005092 MHC Class II Genes Proteins 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- 108700018351 Major Histocompatibility Complex Proteins 0.000 description 1
- 208000000172 Medulloblastoma Diseases 0.000 description 1
- 208000002030 Merkel cell carcinoma Diseases 0.000 description 1
- 208000010153 Mesonephroma Diseases 0.000 description 1
- 206010027406 Mesothelioma Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 208000034578 Multiple myelomas Diseases 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101100341510 Mus musculus Itgal gene Proteins 0.000 description 1
- 101150065403 NECTIN2 gene Proteins 0.000 description 1
- 102100035488 Nectin-2 Human genes 0.000 description 1
- 206010029266 Neuroendocrine carcinoma of the skin Diseases 0.000 description 1
- 201000004404 Neurofibroma Diseases 0.000 description 1
- 208000009905 Neurofibromatoses Diseases 0.000 description 1
- 208000005890 Neuroma Diseases 0.000 description 1
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 description 1
- 108700026244 Open Reading Frames Proteins 0.000 description 1
- 241000713747 Ovine lentivirus Species 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 206010061902 Pancreatic neoplasm Diseases 0.000 description 1
- 102000010292 Peptide Elongation Factor 1 Human genes 0.000 description 1
- 108010077524 Peptide Elongation Factor 1 Proteins 0.000 description 1
- 208000037581 Persistent Infection Diseases 0.000 description 1
- 235000014676 Phragmites communis Nutrition 0.000 description 1
- 208000007641 Pinealoma Diseases 0.000 description 1
- 206010035226 Plasma cell myeloma Diseases 0.000 description 1
- 208000007452 Plasmacytoma Diseases 0.000 description 1
- 108010064218 Poly (ADP-Ribose) Polymerase-1 Proteins 0.000 description 1
- 102100023712 Poly [ADP-ribose] polymerase 1 Human genes 0.000 description 1
- 102100023652 Poly [ADP-ribose] polymerase 2 Human genes 0.000 description 1
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 1
- 208000034541 Rare lymphatic malformation Diseases 0.000 description 1
- 206010038389 Renal cancer Diseases 0.000 description 1
- 241000712909 Reticuloendotheliosis virus Species 0.000 description 1
- 241000712907 Retroviridae Species 0.000 description 1
- 108091028664 Ribonucleotide Proteins 0.000 description 1
- 239000008156 Ringer's lactate solution Substances 0.000 description 1
- 108091058545 Secretory proteins Proteins 0.000 description 1
- 102000040739 Secretory proteins Human genes 0.000 description 1
- 102000012479 Serine Proteases Human genes 0.000 description 1
- 108010022999 Serine Proteases Proteins 0.000 description 1
- 102100038081 Signal transducer CD24 Human genes 0.000 description 1
- 108020004682 Single-Stranded DNA Proteins 0.000 description 1
- 208000000453 Skin Neoplasms Diseases 0.000 description 1
- 206010041067 Small cell lung cancer Diseases 0.000 description 1
- 108091027967 Small hairpin RNA Proteins 0.000 description 1
- 108020004459 Small interfering RNA Proteins 0.000 description 1
- 108700042076 T-Cell Receptor alpha Genes Proteins 0.000 description 1
- 108700042077 T-Cell Receptor beta Genes Proteins 0.000 description 1
- 101710174757 T-cell immunoglobulin and mucin domain-containing protein 4 Proteins 0.000 description 1
- 206010043276 Teratoma Diseases 0.000 description 1
- 239000004098 Tetracycline Substances 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical class OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- 102000006601 Thymidine Kinase Human genes 0.000 description 1
- 108020004440 Thymidine kinase Proteins 0.000 description 1
- 108010060818 Toll-Like Receptor 9 Proteins 0.000 description 1
- 102100027010 Toll-like receptor 1 Human genes 0.000 description 1
- 102100024324 Toll-like receptor 3 Human genes 0.000 description 1
- 102100039360 Toll-like receptor 4 Human genes 0.000 description 1
- 102100039357 Toll-like receptor 5 Human genes 0.000 description 1
- 102100039387 Toll-like receptor 6 Human genes 0.000 description 1
- 102100039390 Toll-like receptor 7 Human genes 0.000 description 1
- 102100033117 Toll-like receptor 9 Human genes 0.000 description 1
- 102000004887 Transforming Growth Factor beta Human genes 0.000 description 1
- 108090001012 Transforming Growth Factor beta Proteins 0.000 description 1
- 102100023935 Transmembrane glycoprotein NMB Human genes 0.000 description 1
- 101710181056 Tumor necrosis factor ligand superfamily member 13B Proteins 0.000 description 1
- 102100031988 Tumor necrosis factor ligand superfamily member 6 Human genes 0.000 description 1
- 108050002568 Tumor necrosis factor ligand superfamily member 6 Proteins 0.000 description 1
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 1
- 101150117115 V gene Proteins 0.000 description 1
- 102100038929 V-set domain-containing T-cell activation inhibitor 1 Human genes 0.000 description 1
- 102100038282 V-type immunoglobulin domain-containing suppressor of T-cell activation Human genes 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 241000713325 Visna/maedi virus Species 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 208000009956 adenocarcinoma Diseases 0.000 description 1
- 229960005305 adenosine Drugs 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 201000009431 angiokeratoma Diseases 0.000 description 1
- 208000000252 angiomatosis Diseases 0.000 description 1
- 230000003110 anti-inflammatory effect Effects 0.000 description 1
- 230000000692 anti-sense effect Effects 0.000 description 1
- 239000003816 antisense DNA Substances 0.000 description 1
- 230000025194 apoptotic cell clearance Effects 0.000 description 1
- 208000001119 benign fibrous histiocytoma Diseases 0.000 description 1
- 108010081355 beta 2-Microglobulin Proteins 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 230000004071 biological effect Effects 0.000 description 1
- 239000013060 biological fluid Substances 0.000 description 1
- 230000008236 biological pathway Effects 0.000 description 1
- 230000031018 biological processes and functions Effects 0.000 description 1
- 230000008512 biological response Effects 0.000 description 1
- 229960002685 biotin Drugs 0.000 description 1
- 235000020958 biotin Nutrition 0.000 description 1
- 239000011616 biotin Substances 0.000 description 1
- 201000008274 breast adenocarcinoma Diseases 0.000 description 1
- ZEWYCNBZMPELPF-UHFFFAOYSA-J calcium;potassium;sodium;2-hydroxypropanoic acid;sodium;tetrachloride Chemical compound [Na].[Na+].[Cl-].[Cl-].[Cl-].[Cl-].[K+].[Ca+2].CC(O)C(O)=O ZEWYCNBZMPELPF-UHFFFAOYSA-J 0.000 description 1
- 230000036952 cancer formation Effects 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 231100000504 carcinogenesis Toxicity 0.000 description 1
- 230000015556 catabolic process Effects 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000006037 cell lysis Effects 0.000 description 1
- 239000002458 cell surface marker Substances 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 230000004637 cellular stress Effects 0.000 description 1
- 210000001175 cerebrospinal fluid Anatomy 0.000 description 1
- 201000010881 cervical cancer Diseases 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 239000011651 chromium Substances 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 208000009060 clear cell adenocarcinoma Diseases 0.000 description 1
- 238000004581 coalescence Methods 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 208000017763 cutaneous neuroendocrine carcinoma Diseases 0.000 description 1
- 210000005220 cytoplasmic tail Anatomy 0.000 description 1
- 231100000599 cytotoxic agent Toxicity 0.000 description 1
- 239000002619 cytotoxin Substances 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 230000007423 decrease Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000006731 degradation reaction Methods 0.000 description 1
- 239000005547 deoxyribonucleotide Substances 0.000 description 1
- 125000002637 deoxyribonucleotide group Chemical group 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- PGUYAANYCROBRT-UHFFFAOYSA-N dihydroxy-selanyl-selanylidene-lambda5-phosphane Chemical class OP(O)([SeH])=[Se] PGUYAANYCROBRT-UHFFFAOYSA-N 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 230000009266 disease activity Effects 0.000 description 1
- 230000005750 disease progression Effects 0.000 description 1
- NAGJZTKCGNOGPW-UHFFFAOYSA-N dithiophosphoric acid Chemical class OP(O)(S)=S NAGJZTKCGNOGPW-UHFFFAOYSA-N 0.000 description 1
- 230000005782 double-strand break Effects 0.000 description 1
- 229960003722 doxycycline Drugs 0.000 description 1
- 239000003937 drug carrier Substances 0.000 description 1
- 241001493065 dsRNA viruses Species 0.000 description 1
- 230000004064 dysfunction Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 210000001163 endosome Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 230000002708 enhancing effect Effects 0.000 description 1
- 238000003114 enzyme-linked immunosorbent spot assay Methods 0.000 description 1
- OGPBJKLSAFTDLK-UHFFFAOYSA-N europium atom Chemical compound [Eu] OGPBJKLSAFTDLK-UHFFFAOYSA-N 0.000 description 1
- 210000004700 fetal blood Anatomy 0.000 description 1
- 206010016629 fibroma Diseases 0.000 description 1
- 201000008825 fibrosarcoma of bone Diseases 0.000 description 1
- 238000000799 fluorescence microscopy Methods 0.000 description 1
- 108091006047 fluorescent proteins Proteins 0.000 description 1
- 102000034287 fluorescent proteins Human genes 0.000 description 1
- IJJVMEJXYNJXOJ-UHFFFAOYSA-N fluquinconazole Chemical compound C=1C=C(Cl)C=C(Cl)C=1N1C(=O)C2=CC(F)=CC=C2N=C1N1C=NC=N1 IJJVMEJXYNJXOJ-UHFFFAOYSA-N 0.000 description 1
- IRSCQMHQWWYFCW-UHFFFAOYSA-N ganciclovir Chemical compound O=C1NC(N)=NC2=C1N=CN2COC(CO)CO IRSCQMHQWWYFCW-UHFFFAOYSA-N 0.000 description 1
- 229960002963 ganciclovir Drugs 0.000 description 1
- 238000012239 gene modification Methods 0.000 description 1
- 230000004077 genetic alteration Effects 0.000 description 1
- 231100000118 genetic alteration Toxicity 0.000 description 1
- 230000005017 genetic modification Effects 0.000 description 1
- 235000013617 genetically modified food Nutrition 0.000 description 1
- 150000002337 glycosamines Chemical group 0.000 description 1
- 210000002288 golgi apparatus Anatomy 0.000 description 1
- 239000008187 granular material Substances 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 201000011066 hemangioma Diseases 0.000 description 1
- 230000002489 hematologic effect Effects 0.000 description 1
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 description 1
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 1
- 210000003494 hepatocyte Anatomy 0.000 description 1
- 239000000833 heterodimer Substances 0.000 description 1
- 201000009379 histiocytoid hemangioma Diseases 0.000 description 1
- 201000000284 histiocytoma Diseases 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 102000045108 human EGFR Human genes 0.000 description 1
- 102000051539 human HAVCR1 Human genes 0.000 description 1
- 102000045892 human TYROBP Human genes 0.000 description 1
- 102000027596 immune receptors Human genes 0.000 description 1
- 108091008915 immune receptors Proteins 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 230000016784 immunoglobulin production Effects 0.000 description 1
- 229940072221 immunoglobulins Drugs 0.000 description 1
- 239000002955 immunomodulating agent Substances 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000010348 incorporation Methods 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 230000006882 induction of apoptosis Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 229940090044 injection Drugs 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 230000010354 integration Effects 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 108010074108 interleukin-21 Proteins 0.000 description 1
- 201000010982 kidney cancer Diseases 0.000 description 1
- 230000002147 killing effect Effects 0.000 description 1
- 108010025001 leukocyte-associated immunoglobulin-like receptor 1 Proteins 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 206010024627 liposarcoma Diseases 0.000 description 1
- 201000007270 liver cancer Diseases 0.000 description 1
- 208000014018 liver neoplasm Diseases 0.000 description 1
- 201000000966 lung oat cell carcinoma Diseases 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- 210000003738 lymphoid progenitor cell Anatomy 0.000 description 1
- 230000002101 lytic effect Effects 0.000 description 1
- GRPSNTXTTSBKGW-BVGHQBMWSA-J magnesium;potassium;sodium;(3r,4s,5s,6r)-6-(hydroxymethyl)oxane-2,3,4,5-tetrol;triacetate;chloride Chemical compound [Na+].[Mg+2].[Cl-].[K+].CC([O-])=O.CC([O-])=O.CC([O-])=O.OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O GRPSNTXTTSBKGW-BVGHQBMWSA-J 0.000 description 1
- FVVLHONNBARESJ-NTOWJWGLSA-H magnesium;potassium;trisodium;(2r,3s,4r,5r)-2,3,4,5,6-pentahydroxyhexanoate;acetate;tetrachloride;nonahydrate Chemical compound O.O.O.O.O.O.O.O.O.[Na+].[Na+].[Na+].[Mg+2].[Cl-].[Cl-].[Cl-].[Cl-].[K+].CC([O-])=O.OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C([O-])=O FVVLHONNBARESJ-NTOWJWGLSA-H 0.000 description 1
- 230000014759 maintenance of location Effects 0.000 description 1
- 201000006812 malignant histiocytosis Diseases 0.000 description 1
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 description 1
- 238000007726 management method Methods 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 210000003593 megakaryocyte Anatomy 0.000 description 1
- 206010027191 meningioma Diseases 0.000 description 1
- 208000011831 mesonephric neoplasm Diseases 0.000 description 1
- 230000002503 metabolic effect Effects 0.000 description 1
- 229910021645 metal ion Inorganic materials 0.000 description 1
- 108091070501 miRNA Proteins 0.000 description 1
- 239000000693 micelle Substances 0.000 description 1
- 239000002679 microRNA Substances 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 239000000178 monomer Substances 0.000 description 1
- 201000010879 mucinous adenocarcinoma Diseases 0.000 description 1
- 208000001611 myxosarcoma Diseases 0.000 description 1
- DAZSWUUAFHBCGE-KRWDZBQOSA-N n-[(2s)-3-methyl-1-oxo-1-pyrrolidin-1-ylbutan-2-yl]-3-phenylpropanamide Chemical compound N([C@@H](C(C)C)C(=O)N1CCCC1)C(=O)CCC1=CC=CC=C1 DAZSWUUAFHBCGE-KRWDZBQOSA-N 0.000 description 1
- 208000007538 neurilemmoma Diseases 0.000 description 1
- 208000029986 neuroepithelioma Diseases 0.000 description 1
- 201000004931 neurofibromatosis Diseases 0.000 description 1
- 208000004128 odontoma Diseases 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 210000003463 organelle Anatomy 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 201000002528 pancreatic cancer Diseases 0.000 description 1
- 208000008443 pancreatic carcinoma Diseases 0.000 description 1
- 201000010198 papillary carcinoma Diseases 0.000 description 1
- 230000007030 peptide scission Effects 0.000 description 1
- 210000004976 peripheral blood cell Anatomy 0.000 description 1
- 210000003819 peripheral blood mononuclear cell Anatomy 0.000 description 1
- 230000002085 persistent effect Effects 0.000 description 1
- 235000021317 phosphate Nutrition 0.000 description 1
- 150000003904 phospholipids Chemical class 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000006461 physiological response Effects 0.000 description 1
- 208000024724 pineal body neoplasm Diseases 0.000 description 1
- 201000004123 pineal gland cancer Diseases 0.000 description 1
- 210000004910 pleural fluid Anatomy 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- 230000000069 prophylactic effect Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 201000005825 prostate adenocarcinoma Diseases 0.000 description 1
- 230000009873 pyroptotic effect Effects 0.000 description 1
- 238000011002 quantification Methods 0.000 description 1
- 238000007420 radioactive assay Methods 0.000 description 1
- 238000003259 recombinant expression Methods 0.000 description 1
- 238000010188 recombinant method Methods 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- 230000008439 repair process Effects 0.000 description 1
- 230000010076 replication Effects 0.000 description 1
- 201000009410 rhabdomyosarcoma Diseases 0.000 description 1
- 239000002336 ribonucleotide Substances 0.000 description 1
- 125000002652 ribonucleotide group Chemical group 0.000 description 1
- 125000000548 ribosyl group Chemical group C1([C@H](O)[C@H](O)[C@H](O1)CO)* 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 206010039667 schwannoma Diseases 0.000 description 1
- 230000002784 sclerotic effect Effects 0.000 description 1
- JRPHGDYSKGJTKZ-UHFFFAOYSA-N selenophosphoric acid Chemical class OP(O)([SeH])=O JRPHGDYSKGJTKZ-UHFFFAOYSA-N 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 102000035025 signaling receptors Human genes 0.000 description 1
- 108091005475 signaling receptors Proteins 0.000 description 1
- 239000002924 silencing RNA Substances 0.000 description 1
- 230000037432 silent mutation Effects 0.000 description 1
- 201000000849 skin cancer Diseases 0.000 description 1
- 239000004055 small Interfering RNA Substances 0.000 description 1
- 208000000649 small cell carcinoma Diseases 0.000 description 1
- 210000001082 somatic cell Anatomy 0.000 description 1
- 206010041823 squamous cell carcinoma Diseases 0.000 description 1
- 230000006641 stabilisation Effects 0.000 description 1
- 238000011105 stabilization Methods 0.000 description 1
- 238000012289 standard assay Methods 0.000 description 1
- 238000010561 standard procedure Methods 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000011885 synergistic combination Substances 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 229960002180 tetracycline Drugs 0.000 description 1
- 229930101283 tetracycline Natural products 0.000 description 1
- 235000019364 tetracycline Nutrition 0.000 description 1
- 150000003522 tetracyclines Chemical class 0.000 description 1
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 description 1
- 238000011285 therapeutic regimen Methods 0.000 description 1
- 230000002992 thymic effect Effects 0.000 description 1
- 208000008732 thymoma Diseases 0.000 description 1
- 108091006106 transcriptional activators Proteins 0.000 description 1
- 230000002103 transcriptional effect Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 206010044412 transitional cell carcinoma Diseases 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 108091007466 transmembrane glycoproteins Proteins 0.000 description 1
- 230000032258 transport Effects 0.000 description 1
- 230000004222 uncontrolled growth Effects 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0012—Lipids; Lipoproteins
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4184—1,3-Diazoles condensed with carbocyclic rings, e.g. benzimidazoles
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/44—Non condensed pyridines; Hydrogenated derivatives thereof
- A61K31/445—Non condensed piperidines, e.g. piperocaine
- A61K31/4523—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems
- A61K31/454—Non condensed piperidines, e.g. piperocaine containing further heterocyclic ring systems containing a five-membered ring with nitrogen as a ring hetero atom, e.g. pimozide, domperidone
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/502—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with carbocyclic ring systems, e.g. cinnoline, phthalazine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/50—Pyridazines; Hydrogenated pyridazines
- A61K31/5025—Pyridazines; Hydrogenated pyridazines ortho- or peri-condensed with heterocyclic ring systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/55—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having seven-membered rings, e.g. azelastine, pentylenetetrazole
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/0005—Vertebrate antigens
- A61K39/0011—Cancer antigens
- A61K39/001102—Receptors, cell surface antigens or cell surface determinants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K45/00—Medicinal preparations containing active ingredients not provided for in groups A61K31/00 - A61K41/00
- A61K45/06—Mixtures of active ingredients without chemical characterisation, e.g. antiphlogistics and cardiaca
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/705—Receptors; Cell surface antigens; Cell surface determinants
- C07K14/70503—Immunoglobulin superfamily
- C07K14/7051—T-cell receptor (TcR)-CD3 complex
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/80—Vaccine for a specifically defined cancer
- A61K2039/892—Reproductive system [uterus, ovaries, cervix, testes]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/01—Fusion polypeptide containing a localisation/targetting motif
- C07K2319/03—Fusion polypeptide containing a localisation/targetting motif containing a transmembrane segment
Landscapes
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Organic Chemistry (AREA)
- Cell Biology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Toxicology (AREA)
- Mycology (AREA)
- Zoology (AREA)
- Gastroenterology & Hepatology (AREA)
- Biochemistry (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Microbiology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Oncology (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Peptides Or Proteins (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
Abstract
本開示は、キメラTim受容体、キメラTim受容体分子を含むように改変された宿主細胞、およびPAPR阻害剤を含む組合せ療法組成物および方法に関する。The present disclosure relates to combination therapy compositions and methods comprising chimeric Tim receptors, host cells engineered to contain chimeric Tim receptor molecules, and PAPR inhibitors.
Description
配列リストについての申告
本出願に伴う配列リストを、用紙複写物の代わりにテキスト形式において提供し、これによって参照により本明細書に組み込む。配列リストを含有するテキストファイルの名称は、200265_415WO_ST25.txtである。テキストファイルは425KBであり、2021年8月13日に創出され、EFS-Webを介して電子的に提出されている。
STATEMENT FOR SEQUENCE LISTING The Sequence Listing accompanying this application is provided in text form in lieu of a paper copy and is hereby incorporated herein by reference. The name of the text file containing the sequence listing is 200265_415WO_ST25. txt. The text file is 425 KB, was created on August 13, 2021 and has been submitted electronically via EFS-Web.
抗原への曝露に際して、ナイーブ抗原特異的CD8+T細胞は、それらのクローン拡大増殖、分化、および同族抗原を発現する細胞(例えば腫瘍細胞)を死滅させることができる機能的エフェクターT細胞への発達を促進する活性化を受ける。抗原クリアランス後、エフェクターT細胞のうちの大部分がアポトーシスを受け、生存するエフェクターT細胞のサブセットが、抗原再曝露に対する長期的保護を与え得るメモリーT細胞へと分化する。しかしながら、延長された抗原曝露は、T細胞疲弊を引き起こし、腫瘍細胞の持続性を可能にし得る。T細胞疲弊とは、免疫チェックポイント分子(例えばPD-1、CTLA-4、Tim-3)のアップレギュレートされた発現、エフェクター機能の低下、乏しい増殖、および代謝障害によって特徴付けられる持続的TCR刺激を受けるT細胞により獲得される機能不全状態を意味する。キメラ抗原受容体(CAR)を発現する操作されたT細胞もまた、疲弊を発達させ得る。 Upon exposure to antigen, naive antigen-specific CD8+ T cells promote their clonal expansion, differentiation, and development into functional effector T cells capable of killing cells expressing their cognate antigen (e.g., tumor cells). receive activation. After antigen clearance, the majority of effector T cells undergo apoptosis and a subset of surviving effector T cells differentiate into memory T cells that can confer long-term protection against antigen re-exposure. However, prolonged antigen exposure may cause T cell exhaustion and allow tumor cell persistence. T-cell exhaustion is a persistent TCR characterized by upregulated expression of immune checkpoint molecules (eg PD-1, CTLA-4, Tim-3), reduced effector function, poor proliferation, and metabolic disturbances. It refers to a dysfunctional state acquired by stimulated T cells. Engineered T cells expressing chimeric antigen receptors (CARs) can also develop exhaustion.
一態様においては、本開示は、ポリ(ADP-リボース)ポリメラーゼ(PARP)の阻害剤と組み合わせて、キメラ貪食受容体(CER)とも称されるキメラT細胞免疫グロブリンムチンタンパク質(Tim)受容体を用いる、がんの治療のための方法を提供する。別の態様においては、本開示は、キメラTim受容体およびPARP阻害剤を含む医薬組成物または組合せを提供する。本開示の組成物および方法において有用なキメラTim受容体は、キメラTim受容体改変宿主細胞(例えばT細胞)に対して、貪食、細胞傷害性、および/または抗原提示活性を与え、細胞傷害活性は、その標的抗原であるホスファチジルセリンに対するキメラTim受容体の結合に際して誘導される。PARP阻害剤などのDNA損傷剤は、細胞損傷および貪食、細胞傷害性、共刺激活性、抗原提示、またはそれらの組合せなどのキメラTim受容体のエフェクター機能を誘導するホスファチジルセリンの外面化を促進することにより、キメラTim受容体との相乗効果を示し得る。 In one aspect, the present disclosure provides a chimeric T cell immunoglobulin mucin protein (Tim) receptor, also referred to as a chimeric phagocytic receptor (CER), in combination with an inhibitor of poly(ADP-ribose) polymerase (PARP). A method for the treatment of cancer is provided. In another aspect, the disclosure provides pharmaceutical compositions or combinations comprising a chimeric Tim receptor and a PARP inhibitor. Chimeric Tim Receptors useful in the compositions and methods of the present disclosure confer phagocytic, cytotoxic, and/or antigen-presenting activity on chimeric Tim Receptor-modified host cells (e.g., T cells), is induced upon binding of the chimeric Tim receptor to its target antigen, phosphatidylserine. DNA-damaging agents such as PARP inhibitors promote externalization of phosphatidylserine that induces effector functions of chimeric Tim receptors such as cell damage and phagocytosis, cytotoxicity, co-stimulatory activity, antigen presentation, or a combination thereof. Thus, synergistic effects with chimeric Tim receptors can be demonstrated.
本明細書において説明するキメラTim受容体は、(a)(i)Tim1 IgVドメインまたはTim4 IgVドメインと;(ii)Tim1ムチンドメインまたはTim4ムチンドメインとを含む結合ドメインを含む細胞外ドメインと;(b)一次細胞内シグナル伝達ドメインおよび適宜の二次細胞内シグナル伝達ドメインを含む細胞内シグナル伝達ドメインと;(c)細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインとを含む単鎖キメラタンパク質を含む。 The chimeric tim receptors described herein are (a) an extracellular domain comprising a binding domain comprising (i) a Tim1 IgV domain or a Tim4 IgV domain; and (ii) a Tim1 mucin domain or a Tim4 mucin domain; b) an intracellular signaling domain comprising a primary intracellular signaling domain and optionally a secondary intracellular signaling domain; and (c) located between and connecting the extracellular domain and the intracellular signaling domain. A single-chain chimeric protein comprising a transmembrane domain that
ある特定の実施形態においては、本明細書において説明するキメラTim受容体の細胞外ドメインは、結合ドメインと膜貫通ドメインとの間に位置し、かつこれらを接続する細胞外スペーサードメインを含んでもよい。 In certain embodiments, the extracellular domain of the chimeric Tim receptor described herein may comprise an extracellular spacer domain located between and connecting the binding domain and the transmembrane domain. .
ある特定の実施形態においては、キメラTim受容体はまた、「古典的」T細胞共刺激経路(例えばCD28)とは異なるシグナル伝達経路を介して、T細胞を共刺激することもできる場合がある。例えば、ホスファチジルセリンに結合することに加えて、Tim4はまた、活性化T細胞の表面上に発現するTim1に対するリガンドでもある。Tim1もまた、ホスファチジルセリンに結合することができる。Tim4により誘導されるTim1のシグナル伝達が、T細胞増殖および生存を共刺激することが見出されている(Hartt Meyers et al., 2005, Nat. Immunol. 6:455)。したがって、ある特定の実施形態においては、細胞傷害性キメラTim受容体は、少なくとも1つのシグナル伝達経路を介して共刺激性シグナルを提供することにより、T細胞疲弊を低減もしくは阻害するか、または疲弊したT細胞を回復させることができる。ある特定の実施形態においては、細胞傷害性キメラTim受容体は、少なくとも2つの異なるシグナル伝達経路を介して(例えば細胞傷害性キメラTim受容体における選択された共刺激性シグナル伝達ドメインおよびTim1を介して)、共刺激性シグナルを提供する。 In certain embodiments, chimeric Tim receptors may also be able to co-stimulate T cells via signaling pathways distinct from the "classical" T cell co-stimulatory pathway (e.g., CD28). . For example, in addition to binding phosphatidylserine, Tim4 is also a ligand for Tim1 expressed on the surface of activated T cells. Tim1 can also bind to phosphatidylserine. Tim4-induced Tim1 signaling has been found to co-stimulate T cell proliferation and survival (Hartt Meyers et al., 2005, Nat. Immunol. 6:455). Thus, in certain embodiments, a cytotoxic chimeric Tim receptor reduces or inhibits T-cell exhaustion or reduces or inhibits exhaustion by providing a co-stimulatory signal through at least one signaling pathway. damaged T cells can be restored. In certain embodiments, the cytotoxic chimeric Tim receptor is mediated through at least two different signaling pathways (e.g., through a selected co-stimulatory signaling domain in the cytotoxic chimeric Tim receptor and Tim1). ), providing co-stimulatory signals.
ある特定の実施形態においては、宿主細胞において発現される場合、本開示のキメラTim受容体はまた、宿主細胞に対して貪食活性も与える。例えば、ある特定のそのような実施形態においては、ホスファチジルセリン標的に対する宿主細胞において発現されるキメラTim受容体の結合は、宿主細胞による細胞溶解応答および貪食応答の両方を誘導することができる。本明細書において説明する改変宿主細胞の特定の実施形態においては、キメラTim受容体を用いる改変前に、宿主細胞は、天然には貪食表現型を示さない。 In certain embodiments, when expressed in a host cell, the chimeric Tim receptor of the present disclosure also confers phagocytic activity on the host cell. For example, in certain such embodiments, binding of a chimeric Tim receptor expressed in a host cell to a phosphatidylserine target can induce both cytolytic and phagocytic responses by the host cell. In certain embodiments of the modified host cells described herein, the host cell does not naturally display a phagocytic phenotype prior to modification with the chimeric Tim receptor.
実施形態においては、本開示のキメラTim受容体を用いて改変された宿主細胞の投与は、例えばがんの治療のために、表面曝露されたホスファチジルセリンを保持する標的細胞を除去するための方法において用いることができる。正常な健康細胞において、ホスファチジルセリンは、形質膜の内側リーフレット中に位置する。しかしながら、損傷、アポトーシス、壊死、およびストレスなどのある特定の細胞イベントは、細胞表面上にホスファチジルセリンを迅速に曝露させる「スクランブラーゼ」を活性化し、スクランブラーゼは、Tim4またはTim1などの受容体に結合することができる。内因性腫瘍特異的Tエフェクター細胞は、細胞溶解中にターゲティングされる腫瘍細胞の外膜上でのホスファチジルセリンの曝露を誘導することができる。さらに、ある特定のがん療法(例えば化学療法、放射線療法、CAR-T細胞など)は、アポトーシス、細胞ストレス、細胞損傷などを誘導することにより、ターゲティングされた腫瘍細胞または腫瘍微小環境中の細胞上でのホスファチジルセリンの曝露を誘導することができる。本開示のキメラTim受容体を発現する操作された宿主細胞は、表面曝露されたホスファチジルセリンを保持する腫瘍細胞におけるアポトーシスを誘導することにより、表面曝露されたホスファチジルセリンを保持する、損傷腫瘍細胞、ストレスを受けた腫瘍細胞、アポトーシス腫瘍細胞、または壊死腫瘍細胞を一掃することができる。ある特定の実施形態においては、本明細書において開示されるキメラTim受容体を発現する宿主細胞は、アポトーシスを誘導することにより、および貪食により、表面曝露されたホスファチジルセリンを保持する損傷腫瘍細胞、ストレスを受けた腫瘍細胞、アポトーシス腫瘍細胞、または壊死腫瘍細胞を一掃する。別の態様においては、本開示のキメラTim受容体により改変した宿主細胞は、細胞ストレス、損傷、壊死、またはアポトーシスを誘導するPARP阻害剤の効果を向上させるために用いることができる。例えば、PARP阻害剤の投与は、表面ホスファチジルセリンのレベルを増大させ、相乗的組合せをもたらすことができる。本明細書において説明するキメラTim受容体を発現する細胞は、PARP阻害剤の投与から生じる損傷細胞または死滅過程の細胞の外側リーフレット上に曝露されるホスファチジルセリン部分に結合し、かつターゲティング細胞の細胞溶解または細胞溶解と貪食との両方を誘導することができる。 In embodiments, administration of host cells modified with a chimeric Tim receptor of the present disclosure is a method for removing target cells bearing surface-exposed phosphatidylserine, e.g., for the treatment of cancer. can be used in In normal healthy cells, phosphatidylserine is located in the inner leaflet of the plasma membrane. However, certain cellular events such as injury, apoptosis, necrosis, and stress activate 'scramblers' that rapidly expose phosphatidylserine on the cell surface, and scramblase binds to receptors such as Tim4 or Tim1. can be combined. Endogenous tumor-specific T effector cells can induce exposure of phosphatidylserine on the outer membrane of targeted tumor cells during cytolysis. Furthermore, certain cancer therapies (e.g., chemotherapy, radiotherapy, CAR-T cells, etc.) target tumor cells or cells in the tumor microenvironment by inducing apoptosis, cell stress, cell damage, etc. Exposure of phosphatidylserine on can be induced. engineered host cells expressing a chimeric Tim receptor of the present disclosure induce apoptosis in tumor cells that retain surface exposed phosphatidylserine, thereby damaging tumor cells that retain surface exposed phosphatidylserine; Stressed, apoptotic, or necrotic tumor cells can be cleared. In certain embodiments, host cells expressing the chimeric Tim receptors disclosed herein are induced by inducing apoptosis and by phagocytosis into damaged tumor cells that retain surface-exposed phosphatidylserine; Clear out stressed, apoptotic, or necrotic tumor cells. In another aspect, host cells modified with chimeric Tim receptors of the present disclosure can be used to enhance the efficacy of PARP inhibitors to induce cellular stress, injury, necrosis, or apoptosis. For example, administration of a PARP inhibitor can increase surface phosphatidylserine levels, resulting in a synergistic combination. Cells expressing the chimeric Tim receptors described herein bind to phosphatidylserine moieties exposed on the outer leaflet of damaged or dying cells resulting from administration of a PARP inhibitor and cells of the target cell. Lysis or both cell lysis and phagocytosis can be induced.
本説明に記載のキメラTim受容体を含む操作された宿主細胞とPARP阻害剤との組合せは、単独で、または例えば、CAR-T細胞、TCR、抗体、放射線療法、化学療法、小分子、腫瘍溶解性ウイルス、電気パルス療法等を含む、1つまたは複数の追加の治療剤とさらに組み合わせて、対象に投与することができる。 Engineered host cells comprising chimeric Tim receptors described herein in combination with PARP inhibitors can be used alone or for example, in CAR-T cells, TCRs, antibodies, radiotherapy, chemotherapy, small molecules, tumors. It can be administered to a subject in further combination with one or more additional therapeutic agents, including lytic viruses, electrical pulse therapy, and the like.
本開示をより詳細に示す前に、本明細書において使用されるある特定の用語の定義を提供することは本開示の理解に役立ち得る。 Before presenting the disclosure in more detail, it may be helpful to understand the disclosure to provide definitions of certain terms used herein.
本説明において、任意の濃度範囲、割合範囲、比の範囲または整数範囲は、別に示されない限り、列挙される範囲内の任意の整数の値、および適切な場合、その分数(例として整数の10分の1および100分の1)を含むと理解されるべきである。また、任意の物理的特色、例としてポリマーサブユニット、サイズまたは厚さに関する本明細書において列挙される任意の数値範囲は、別に示されない限り、列挙される範囲内の任意の整数を含むと理解されるべきである。本明細書において使用されるとき、「約」という用語は、別に示されない限り、示される範囲、値または構造の±20%を意味する。「a」および「an」という用語は、本明細書において使用されるとき、列挙される成分のうちの「1つまたは複数」を指すことが理解されるべきである。選択肢(例えば「または(or)」)の使用は、選択肢のいずれか1つ、両方またはその任意の組合せを意味すると理解されるべきである。本明細書において使用されるとき、「~を含む(include)」、「~を有する(have)」および「~を含む(comprise)」という用語は、同義的に使用され、その用語およびその変形は、非限定的であると解釈されることが意図される。 In this description, any concentration range, percentage range, ratio range or integer range, unless otherwise indicated, refers to any integer value within the recited range and, where appropriate, fractions thereof (eg integer 10 should be understood to include fractions and hundredths). Also, any numerical range recited herein for any physical feature, such as polymer subunit, size or thickness, is understood to include any integer within the recited range, unless otherwise indicated. It should be. As used herein, the term "about" means ±20% of the indicated range, value or structure, unless otherwise indicated. It should be understood that the terms "a" and "an," as used herein, refer to "one or more" of the listed components. The use of alternatives (eg, "or") should be understood to mean either one, both, or any combination thereof. As used herein, the terms "include," "have," and "comprise" are used interchangeably, and the terms and variations thereof is intended to be construed as non-limiting.
抗体技術の分野における当業者によって理解される用語は各々、本明細書において明確に異なって定義されない限り、当該技術分野において得られる意味を与えられる。「抗体」という用語は、最も広範な意味において使用され、ポリクローナルおよびモノクローナル抗体を含む。「抗体」とは、ジスルフィド結合によって相互接続された少なくとも2つの重鎖(H)および2つの軽鎖(L)を含むインタクトな抗体、および標的分子を結合する能力を有するか、または保持するインタクトな抗体の抗原結合性部分(または抗原結合性ドメイン)を指し得る。抗体は、免疫グロブリンの天然、組換え産生、遺伝子操作または改変形態、例えばイントラボディ、ペプチボディ(peptibody)、ナノボディ、単一ドメイン抗体、SMIP、多重特異性抗体(例えば二重特異性抗体、ディアボディ、トリアボディ、テトラボディ、タンデムジ-scFv、タンデムトリ-scFv、ADAPTIR)であり得る。モノクローナル抗体またはその抗原結合性部分は、非ヒト、キメラ、ヒト化またはヒトモノクローナル抗体またはその抗原結合性部分、好ましくはヒト化またはヒトモノクローナル抗体またはその抗原結合性部分であり得る。免疫グロブリン構造および機能は、例えばHarlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988)において概略されている。インタクトな抗体の「抗原結合性部分」または「抗原結合性ドメイン」は、「抗体断片」を包含することを意味し、これは、インタクトな抗体の一部を示し、インタクトな抗体の抗原性決定可変領域または相補性決定領域を指す。抗体断片の例には、Fab、Fab’、F(ab’)2およびFv断片、Fab’-SH、F(ab’)2、ディアボディ、線形抗体、scFv抗体、VHならびに抗体断片から形成された多重特異性抗体が含まれるが、これらに限定されない。「Fab(fragment antigen binding)」は、抗原に結合する抗体の一部であり、可変性領域と鎖間ジスルフィド結合を介して軽鎖に連結された重鎖のCH1とを含む。抗体は、IgGおよびそのサブクラス(IgG1、IgG2、IgG3、IgG4)、IgM、IgE、IgAならびにIgDを含む任意のクラスまたはサブクラスの抗体であり得る。 Each term understood by those skilled in the art of antibody technology is given the meaning it has in the art, unless explicitly defined differently herein. The term "antibody" is used in its broadest sense and includes polyclonal and monoclonal antibodies. An "antibody" is an intact antibody comprising at least two heavy (H) and two light (L) chains interconnected by disulfide bonds and an intact antibody capable of or retaining the ability to bind a target molecule. can refer to the antigen-binding portion (or antigen-binding domain) of an antibody. Antibodies include naturally occurring, recombinantly produced, genetically engineered or modified forms of immunoglobulins, such as intrabodies, peptibodies, nanobodies, single domain antibodies, SMIPs, multispecific antibodies (e.g. bispecific antibodies, diabodies , triabodies, tetrabodies, tandem di-scFv, tandem tri-scFv, ADAPTIR). A monoclonal antibody or antigen-binding portion thereof may be a non-human, chimeric, humanized or human monoclonal antibody or antigen-binding portion thereof, preferably a humanized or human monoclonal antibody or antigen-binding portion thereof. Immunoglobulin structure and function are reviewed, for example, in Harlow et al., Eds., Antibodies: A Laboratory Manual, Chapter 14 (Cold Spring Harbor Laboratory, Cold Spring Harbor, 1988). An "antigen-binding portion" or "antigen-binding domain" of an intact antibody is meant to encompass an "antibody fragment", which refers to a portion of an intact antibody, which determines the antigenicity of the intact antibody. Refers to variable region or complementarity determining region. Examples of antibody fragments include Fab, Fab', F(ab') 2 and Fv fragments, Fab'-SH, F(ab') 2 , diabodies, linear antibodies, scFv antibodies, VH and antibody fragments formed from including, but not limited to, multispecific antibodies. A "Fab (fragment antigen binding)" is the portion of an antibody that binds to an antigen and comprises the variable region and CH1 of the heavy chain linked to the light chain via an interchain disulfide bond. The antibody can be of any class or subclass, including IgG and its subclasses ( IgG1 , IgG2 , IgG3 , IgG4 ), IgM, IgE, IgA and IgD.
「可変領域」または「可変ドメイン」という用語は、抗体の抗原への結合に関与する抗体重鎖または軽鎖のドメインを指す。ネイティブ抗体の重鎖および軽鎖の可変ドメイン(それぞれ、VHおよびVL)は一般的に、同様の構造を有し、各ドメインは4つの保存されたフレームワーク領域(FR:framework region)および3つのCDRを含む(例えばKindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)を参照のこと)。単一のVHまたはVLドメインは、抗原結合特異性を与えるために十分であり得る。さらに、特定の抗原に結合する抗体は、抗原に結合する抗体からのVHまたはVLドメインを使用して単離され、それぞれ、相補的VLまたはVHドメインのライブラリーをスクリーニングしてもよい。例えばPortolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991)を参照されたい。 The terms "variable region" or "variable domain" refer to the domains of an antibody heavy or light chain that are responsible for binding the antibody to antigen. The heavy and light chain variable domains (VH and VL, respectively) of native antibodies generally have similar structures, with each domain containing four conserved framework regions (FRs) and three including CDRs (see, eg, Kindt et al. Kuby Immunology, 6th ed., W.H. Freeman and Co., page 91 (2007)). A single VH or VL domain may be sufficient to confer antigen-binding specificity. Additionally, antibodies that bind a particular antigen may be isolated using a VH or VL domain from the antibody that binds the antigen, and screening a library of complementary VL or VH domains, respectively. See, eg, Portolano et al., J. Immunol. 150:880-887 (1993); Clarkson et al., Nature 352:624-628 (1991).
「超可変領域」または「HVR」と同義である「相補性決定領域」および「CDR」という用語は、抗原特異性および/または結合親和性を与える、抗体可変領域内のアミノ酸の非連続配列を指すことが当該技術分野において公知である。一般的に、各重鎖可変領域における3つのCDR(HCDR1、HCDR2、HCDR3)および各軽鎖可変領域における3つのCDR(LCDR1、LCDR2、LCDR3)が存在する。 The terms "complementarity determining region" and "CDR", which are synonymous with "hypervariable region" or "HVR", refer to non-contiguous sequences of amino acids within antibody variable regions that confer antigen specificity and/or binding affinity. Pointing is known in the art. Generally, there are three CDRs (HCDR1, HCDR2, HCDR3) in each heavy chain variable region and three CDRs (LCDR1, LCDR2, LCDR3) in each light chain variable region.
本明細書において使用されるとき、「結合ドメイン」、「結合領域」および「結合部分」という用語は、標的分子(例えばホスファチジルセリン)と特異的かつ非共有結合的に結合、会合、合体、認識または合同する能力を有する分子、例としてペプチド、オリゴペプチド、ポリペプチドまたはタンパク質を指す。結合ドメインは、目的の生体分子または他の標的についての任意の天然、合成、半合成または組換え産生結合パートナーを含む。一部の実施形態においては、結合ドメインは、抗原結合性ドメイン、例として抗体またはその機能的結合ドメインもしくは抗原結合性部分である。例示的な結合ドメインには、単鎖抗体可変領域(例えばドメイン抗体、sFv、scFv、Fab)、受容体外部ドメイン(例えばTim4)、リガンド(例えばサイトカイン、ケモカイン)または生体分子に結合する特異的能力について選択される合成ポリペプチドが含まれる。 As used herein, the terms "binding domain," "binding region," and "binding moiety" specifically and non-covalently bind, associate, coalesce, recognize target molecules (e.g., phosphatidylserine). Or refers to molecules, such as peptides, oligopeptides, polypeptides or proteins, that have the ability to combine. A binding domain includes any natural, synthetic, semi-synthetic or recombinantly produced binding partner for a biomolecule or other target of interest. In some embodiments, the binding domain is an antigen-binding domain, such as an antibody or functional binding domain or antigen-binding portion thereof. Exemplary binding domains include single chain antibody variable regions (e.g. domain antibodies, sFv, scFv, Fab), receptor ectodomains (e.g. Tim4), ligands (e.g. cytokines, chemokines) or specific ability to bind biomolecules. Synthetic polypeptides selected for are included.
「T細胞受容体」(TCR:T cell receptor)とは、一般的に主要組織適合抗原複合体(MHC:major histocompatibility complex)分子に結合した抗原を認識することの原因である、T細胞(Tリンパ球とも呼ばれる)の表面上に見られる分子を指す。TCRは一般的に、ほとんどのT細胞において高度に可変性のαおよびβ鎖(それぞれ、TCRαおよびTCRβとしても公知)のジスルフィド結合ヘテロ二量体からなる。T細胞の小サブセットにおいては、TCRは、γおよびδ鎖(それぞれ、TCRγおよびTCRδとしても公知)のヘテロ二量体からなる。TCRの各鎖は、免疫グロブリンスーパーファミリーの一員であり、1つのN末端免疫グロブリン可変ドメイン、1つの免疫グロブリン定常ドメイン、膜貫通領域およびC末端の短い細胞質尾部を有する(Janeway et al., Immunobiology: The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 4:33, 1997を参照のこと)。本開示のTCRは、ヒト、マウス、ラット、ネコ、イヌ、ヤギ、ウマまたは他の哺乳動物を含む様々な動物種からのTCRであり得る。TCRは、細胞結合性(すなわち、膜貫通領域またはドメインを有する)であっても、可溶性形態であってもよい。TCRには、例えばscTCR、可溶性TCR、TCR融合コンストラクト[TRuC(商標);米国特許出願公開第2017/0166622号を参照のこと]を含むTCRの組換え産生、遺伝子操作、融合または改変形態が含まれる。 "T cell receptor" (TCR) generally refers to T cells (T It refers to molecules found on the surface of lymphocytes (also called lymphocytes). TCRs generally consist of disulfide-linked heterodimers of highly variable α and β chains (also known as TCRα and TCRβ, respectively) in most T cells. In a small subset of T cells, the TCR consists of a heterodimer of gamma and delta chains (also known as TCRgamma and TCRdelta, respectively). Each chain of the TCR is a member of the immunoglobulin superfamily and has one N-terminal immunoglobulin variable domain, one immunoglobulin constant domain, a transmembrane region and a short C-terminal cytoplasmic tail (Janeway et al., Immunobiology : The Immune System in Health and Disease, 3rd Ed., Current Biology Publications, p. 4:33, 1997). The TCRs of this disclosure can be TCRs from a variety of animal species, including humans, mice, rats, cats, dogs, goats, horses, or other mammals. TCRs may be cell-associated (ie, having a transmembrane region or domain) or in soluble form. TCRs include recombinantly produced, genetically engineered, fusion or modified forms of TCRs including, for example, scTCRs, soluble TCRs, TCR fusion constructs [TRuC™; see US Patent Application Publication No. 2017/0166622]. be
TCR α鎖(Vα)およびβ鎖(Vβ)、またはγδTCRのVγおよびVδの「可変領域」または「可変ドメイン」という用語は、TCRの抗原への結合に関与する。ネイティブTCRのVαおよびVβは一般的に、同様の構造を有し、各可変ドメインは4つの保存されたFRおよび3つのCDRを含む。Vαドメインは、2つの別々のDNAセグメントである、可変遺伝子セグメント(V遺伝子)および接合遺伝子セグメント(J遺伝子)によってコードされ;Vβドメインは、3つの別々のDNAセグメントである、可変遺伝子セグメント(V遺伝子)、多様性遺伝子セグメント(D遺伝子)および接合遺伝子セグメント(J遺伝子)によってコードされる。単一のVαまたはVβドメインは、抗原結合特異性を与えるために十分であり得る。「主要組織適合抗原複合体分子(MHC分子)」とは、ペプチド抗原を細胞表面へデリバリーする糖タンパク質を指す。MHCクラスI分子は、膜貫通α鎖(3つのαドメインを有する)および非共有結合的に会合したβ2ミクログロブリンからなるヘテロ二量体である。MHCクラスII分子は、2つの膜貫通糖タンパク質、αおよびβからなり、その両方は膜を貫通している。各鎖は、2つのドメインを有する。MHCクラスI分子は、細胞質ゾルに起源を有するペプチドを細胞表面へデリバリーし、細胞表面においてペプチド:MHC複合体は、CD8+T細胞によって認識される。MHCクラスII分子は、小胞系に起源を有するペプチドを細胞表面へデリバリーし、細胞表面においてそれらは、CD4+T細胞によって認識される。MHC分子は、ヒト、マウス、ラットまたは他の哺乳動物を含む様々な動物種からのMHC分子であり得る。 The term "variable region" or "variable domain" of the TCR α-chain (Vα) and β-chain (Vβ) or Vγ and Vδ of the γδTCR are involved in the binding of the TCR to antigen. Native TCR Vα and Vβ generally have similar structures, with each variable domain containing four conserved FRs and three CDRs. The V α domain is encoded by two separate DNA segments, the variable gene segment (V gene) and the junction gene segment (J gene); the V β domain is encoded by three separate DNA segments, the variable gene segment. (V genes), diversity gene segments (D genes) and junctional gene segments (J genes). A single V α or V β domain may be sufficient to confer antigen binding specificity. A "major histocompatibility complex molecule (MHC molecule)" refers to a glycoprotein that delivers peptide antigens to the cell surface. MHC class I molecules are heterodimers consisting of a transmembrane α-chain (with three α-domains) and non-covalently associated β2-microglobulin. MHC class II molecules consist of two transmembrane glycoproteins, α and β, both of which span the membrane. Each chain has two domains. MHC class I molecules deliver peptides of cytosolic origin to the cell surface, where peptide:MHC complexes are recognized by CD8 + T cells. MHC class II molecules deliver peptides of vesicular origin to the cell surface where they are recognized by CD4 + T cells. The MHC molecules can be MHC molecules from various animal species including humans, mice, rats or other mammals.
「キメラ抗原受容体」(CAR)とは、2つまたはそれよりも多い別個のドメインを含むキメラタンパク質を指し、細胞表面上に発現した場合、受容体として機能し得る。CARは一般的に、標的抗原に結合する結合ドメインを含む細胞外ドメイン、適宜の細胞外スペーサードメイン、膜貫通ドメイン、および細胞内シグナル伝達ドメイン[例えば免疫受容体チロシンベース活性化モチーフ(ITAM:immunoreceptor tyrosine-based activation motif)含有T細胞活性化モチーフ、および適宜、細胞内共刺激性ドメイン]からなる。ある特定の実施形態においては、CARの細胞内シグナル伝達ドメインは、ITAM含有T細胞活性化ドメイン(例えばCD3ζ)および細胞内共刺激性ドメイン(例えばCD28)を有する。ある特定の実施形態においては、CARは、単一のポリペプチド鎖として合成されるか、または単鎖ポリペプチドとして核酸分子によってコードされる。 A "chimeric antigen receptor" (CAR) refers to a chimeric protein containing two or more distinct domains, which can function as a receptor when expressed on the cell surface. CARs generally comprise an extracellular domain that includes a binding domain that binds to a target antigen, an optional extracellular spacer domain, a transmembrane domain, and an intracellular signaling domain [e.g. immunoreceptor tyrosine-based activation motif (ITAM). tyrosine-based activation motif) containing a T-cell activation motif, and optionally an intracellular co-stimulatory domain]. In certain embodiments, the intracellular signaling domain of CAR has an ITAM-containing T cell activation domain (eg CD3ζ) and an intracellular co-stimulatory domain (eg CD28). In certain embodiments, the CAR is synthesized as a single polypeptide chain or encoded by a nucleic acid molecule as a single polypeptide chain.
特定の標的に特異的に結合する本開示の結合ドメインを特定するため、および結合ドメイン親和性を決定するための様々なアッセイ、例としてウェスタンブロット、ELISA、およびBIACORE(登録商標)分析が公知である(また、例えばScatchard et al., Ann. N.Y. Acad. Sci. 51:660, 1949;および米国特許第5,283,173号、同第5,468,614号またはその均等物を参照のこと)。本明細書において使用されるとき、「特異的に結合する」とは、結合ドメインまたはその融合タンパク質の、標的分子への、105M-1に等しいか、またはそれよりも大きい親和性またはKa(すなわち、1/Mの単位による特定の結合相互作用の平衡会合定数)による会合または合体であって、一方で、試料中の他の任意の分子または成分とは顕著に会合または合体しないことを指す。 A variety of assays, including Western blot, ELISA, and BIACORE® analysis, are known for identifying binding domains of the present disclosure that specifically bind to particular targets and for determining binding domain affinities. (see also, for example, Scatchard et al., Ann. NY Acad. Sci. 51:660, 1949; and U.S. Pat. Nos. 5,283,173, 5,468,614 or equivalents) ). As used herein , "specifically binds" means an affinity or K association or coalescence according to a (i.e., the equilibrium association constant for a particular binding interaction in units of 1/M), while not significantly associating or coalescing with any other molecule or component in the sample point to
「抗原」および「Ag」という用語は、免疫応答を誘導することができる分子を指す。誘導される免疫応答は、抗体産生、特異的免疫学的コンピテント細胞の活性化またはこの両方を含み得る。タンパク質、糖タンパク質および糖脂質を含む高分子は、抗原として働き得る。抗原は、組換えまたはゲノムDNAに由来し得る。本明細書において企図されるとき、抗原は、(i)遺伝子の全長ヌクレオチド配列によって単独で、または(ii)「遺伝子」によって、コードされる必要は全くない。抗原は生成されても、合成されてもよく、または抗原は生体試料に由来してもよい。そのような生体試料は、組織試料、腫瘍試料、細胞または生体体液を含み得るが、これらに限定されない。 The terms "antigen" and "Ag" refer to molecules capable of inducing an immune response. The immune response induced may involve antibody production, activation of specific immunologically competent cells, or both. Macromolecules, including proteins, glycoproteins and glycolipids, can serve as antigens. Antigens may be derived from recombinant or genomic DNA. As contemplated herein, an antigen need not be (i) encoded solely by the full-length nucleotide sequence of a gene, or (ii) by a "gene". Antigens may be generated or synthesized, or antigens may be derived from a biological sample. Such biological samples may include, but are not limited to tissue samples, tumor samples, cells or biological fluids.
「エピトープ」または「抗原性エピトープ」という用語には、同族免疫結合分子、例として抗体もしくはその断片(例えばscFv)、T細胞受容体(TCR)、キメラTim受容体または他の結合分子、ドメインもしくはタンパク質が特異的に結合する任意の分子、構造、アミノ酸配列または抗原内のタンパク質決定基が含まれる。エピトープ決定基は一般的に、分子の化学的活性表面群、例としてアミノ酸または糖側鎖を含有し、特異的三次元構造特徴および特異的電荷特徴を有し得る。エピトープは、線形エピトープまたはコンフォメーションエピトープであり得る。 The term "epitope" or "antigenic epitope" includes cognate immune binding molecules such as antibodies or fragments thereof (e.g. scFv), T cell receptors (TCR), chimeric Tim receptors or other binding molecules, domains or Included are protein determinants within any molecule, structure, amino acid sequence or antigen to which a protein specifically binds. Epitopic determinants generally contain chemically active surface groupings of molecules such as amino acids or sugar side chains, and may have specific three dimensional structural characteristics, as well as specific charge characteristics. Epitopes can be linear epitopes or conformational epitopes.
本明細書において使用されるとき、「PARP」(ポリ(ADP-リボース)ポリメラーゼ)という用語は、そのそれぞれが単位ポリマー当たり2つのリボース部分および2つのリン酸塩を有するタンパク質のファミリーを指す。PARP1およびPARP2は、DNA修復経路に関与する酵素である。 As used herein, the term "PARP" (poly(ADP-ribose) polymerase) refers to a family of proteins, each of which has two ribose moieties and two phosphates per unit polymer. PARP1 and PARP2 are enzymes involved in DNA repair pathways.
本明細書において使用されるとき、「TimD4」としても知られる「Tim4」(T細胞免疫グロブリンおよびムチンドメイン含有タンパク質4)という用語は、マクロファージおよび樹状細胞などの抗原提示細胞上に典型的に発現されるホスファチジルセリン受容体を指す。Tim4は、細胞膜の外表面(外側)リーフレット上にホスファチジルセリン(PtdSer)を提示する、アポトーシス細胞、壊死細胞、損傷細胞、傷害細胞、またはストレスを受けた細胞の食作用を媒介する。Tim4はまた、T細胞の表面上に発現するTim1に結合し、かつ増殖および生存を誘導することもできる。ある特定の実施形態においては、Tim4とは、ヒトTim4を指す。例示的なヒトTim4タンパク質は、配列番号1のアミノ酸配列を含む。 As used herein, the term "Tim4" (T-cell immunoglobulin and mucin domain-containing protein 4), also known as "TimD4", is typically expressed on antigen-presenting cells such as macrophages and dendritic cells. Refers to expressed phosphatidylserine receptors. Tim4 mediates phagocytosis of apoptotic, necrotic, injured, injured, or stressed cells that present phosphatidylserine (PtdSer) on the outer surface (outer) leaflet of the plasma membrane. Tim4 can also bind to Tim1 expressed on the surface of T cells and induce proliferation and survival. In certain embodiments, Tim4 refers to human Tim4. An exemplary human Tim4 protein comprises the amino acid sequence of SEQ ID NO:1.
本明細書において使用されるとき、「Tim4結合ドメイン」という用語は、PtdSerに選択的に結合する金属イオン依存的ポケットを保有する、Tim4のN末端免疫グロブリンフォールドドメインを指す。例示的なヒトTim4結合ドメインは配列番号2のアミノ酸配列を含み、かつ例示的なマウスTim4結合ドメインは配列番号24のアミノ酸配列を含む。 As used herein, the term "Tim4 binding domain" refers to the N-terminal immunoglobulin fold domain of Tim4, which possesses a metal ion dependent pocket that selectively binds PtdSer. An exemplary human Tim4 binding domain comprises the amino acid sequence of SEQ ID NO:2 and an exemplary mouse Tim4 binding domain comprises the amino acid sequence of SEQ ID NO:24.
Tim4結合ドメインは、可変免疫グロブリン(IgV)様ドメイン(「IgVドメイン」と本明細書において呼ばれる)およびムチン様ドメイン(「ムチンドメイン」と本明細書において呼ばれる)を含む。例示的なヒトTim4 IgVドメインは配列番号34のアミノ酸配列を含み、かつ例示的なヒトTim4ムチンドメインは配列番号35のアミノ酸配列を含む。ある特定の実施形態においては、Tim4結合ドメインは、シグナルペプチドを含まない。例示的なヒトTim4シグナルペプチドは、配列番号11のアミノ酸配列を有する。例示的なマウスTim4シグナルペプチドは、配列番号25のアミノ酸配列を有する。 Tim4-binding domains include variable immunoglobulin (IgV)-like domains (referred to herein as "IgV domains") and mucin-like domains (referred to herein as "mucin domains"). An exemplary human Tim4 IgV domain comprises the amino acid sequence of SEQ ID NO:34 and an exemplary human Tim4 mucin domain comprises the amino acid sequence of SEQ ID NO:35. In certain embodiments, the Tim4 binding domain does not contain a signal peptide. An exemplary human Tim4 signal peptide has the amino acid sequence of SEQ ID NO:11. An exemplary mouse Tim4 signal peptide has the amino acid sequence of SEQ ID NO:25.
本明細書において使用されるとき、「Tim1」(T細胞免疫グロブリンおよびムチンドメイン含有タンパク質1)という用語は、T細胞の表面上に発現するホスファチジルセリン受容体を指す。上記に記載される通りのTim1はまた、抗原提示細胞の表面上に発現するTim4に結合することができる。ある特定の実施形態においては、Tim1とは、ヒトTim1を指す。例示的なヒトTim1タンパク質は、配列番号36のアミノ酸配列を含む。 As used herein, the term "Tim1" (T-cell immunoglobulin and mucin domain-containing protein 1) refers to the phosphatidylserine receptor expressed on the surface of T-cells. Tim1 as described above can also bind Tim4 expressed on the surface of antigen presenting cells. In certain embodiments, Tim1 refers to human Tim1. An exemplary human Tim1 protein comprises the amino acid sequence of SEQ ID NO:36.
本明細書において使用されるとき、「Tim1結合ドメイン」という用語は、PtdSerに選択的に結合するTim1のN末端免疫グロブリンフォールドドメインを指す。例示的なヒトTim1結合ドメインは、配列番号37のアミノ酸配列を含む。 As used herein, the term "Tim1 binding domain" refers to the N-terminal immunoglobulin fold domain of Tim1 that selectively binds to PtdSer. An exemplary human Tim1 binding domain comprises the amino acid sequence of SEQ ID NO:37.
Tim1結合ドメインは、IgVドメインおよびムチンドメインを含む。例示的なヒトTim1 IgVドメインは配列番号38のアミノ酸配列を含み、かつ例示的なヒトTim1ムチンドメインは配列番号39のアミノ酸配列を含む。ある特定の実施形態においては、Tim1結合ドメインは、シグナルペプチドを含まない。例示的なヒトTim1シグナルペプチドは、配列番号40のアミノ酸配列を有する。 A Tim1-binding domain includes an IgV domain and a mucin domain. An exemplary human Tim1 IgV domain comprises the amino acid sequence of SEQ ID NO:38 and an exemplary human Tim1 mucin domain comprises the amino acid sequence of SEQ ID NO:39. In certain embodiments, the Tim1 binding domain does not contain a signal peptide. An exemplary human Tim1 signal peptide has the amino acid sequence of SEQ ID NO:40.
本明細書において使用されるとき、「エフェクタードメイン」は、適切なシグナルを受容した場合エフェクタードメインを発現する細胞内の生物応答または生理応答を直接的または間接的に促進し得る融合タンパク質または受容体の細胞内部分である。ある特定の実施形態においては、エフェクタードメインは、結合した場合シグナルを受容するタンパク質またはタンパク質複合体の部分であるか、またはエフェクタードメインからのシグナルを誘発する標的分子に直接的に結合する。エフェクタードメインは、それが免疫受容体チロシンベース活性化モチーフ(ITAM)などの1つまたは複数のシグナル伝達ドメインまたはモチーフを含有する場合、細胞応答を直接的に促進し得る。他の実施形態においては、エフェクタードメインは、細胞応答を直接的に促進する1つまたは複数の他のタンパク質と会合することによって細胞応答を間接的に促進する。 As used herein, an "effector domain" is a fusion protein or receptor capable of directly or indirectly promoting a biological or physiological response in cells expressing the effector domain upon receipt of an appropriate signal. is the intracellular portion of the In certain embodiments, the effector domain is part of a protein or protein complex that receives a signal when bound or directly binds to a target molecule that elicits a signal from the effector domain. An effector domain can directly promote a cellular response if it contains one or more signaling domains or motifs such as an immunoreceptor tyrosine-based activation motif (ITAM). In other embodiments, the effector domain indirectly promotes a cellular response by associating with one or more other proteins that directly promote the cellular response.
本明細書において使用されるとき、「共刺激性シグナル伝達ドメイン」とは、主要な、または古典的な(例えばITAM駆動)活性化シグナル(例えば、CD3ζ細胞内シグナル伝達ドメインにより提供される)と共に活性化された場合、T細胞応答、例としてT細胞活性化、サイトカイン産生、増殖、分化、生存、エフェクター機能、またはそれらの組合せを促進する、または向上させる、共刺激分子の細胞内シグナル伝達ドメイン、またはその機能的部分を指す。共刺激性シグナル伝達ドメインには、例えばCD27、CD28、CD40L、GITR、NKG2C、CARD1、CD2、CD7、CD27、CD30、CD40、CD54(ICAM)、CD83、CD134(OX-40)、CD137(4-1BB)、CD150(SLAMF1)、CD152(CTLA4)、CD223(LAG3)、CD226、CD270(HVEM)、CD273(PD-L2)、CD274(PD-L1)、CD278(ICOS)、DAP10、LAT、LFA-1、LIGHT、NKG2C、SLP76、TRIM、またはそれらの任意の組合せが含まれる。 As used herein, a "co-stimulatory signaling domain" refers to a primary or canonical (e.g., ITAM-driven) activation signal (e.g., provided by the CD3ζ intracellular signaling domain) An intracellular signaling domain of a costimulatory molecule that, when activated, promotes or enhances a T cell response, including T cell activation, cytokine production, proliferation, differentiation, survival, effector function, or a combination thereof , or any functional part thereof. Costimulatory signaling domains include, for example, CD27, CD28, CD40L, GITR, NKG2C, CARD1, CD2, CD7, CD27, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX-40), CD137 (4- 1BB), CD150 (SLAMF1), CD152 (CTLA4), CD223 (LAG3), CD226, CD270 (HVEM), CD273 (PD-L2), CD274 (PD-L1), CD278 (ICOS), DAP10, LAT, LFA- 1, LIGHT, NKG2C, SLP76, TRIM, or any combination thereof.
本明細書において使用されるとき、「免疫受容体チロシンベース活性化モチーフ(ITAM)活性化ドメイン」とは、免疫細胞受容体もしくは細胞表面マーカー上に天然または内因的に存在し、かつ少なくとも1つの免疫受容体チロシンベース活性化モチーフ(ITAM)を含む細胞内シグナル伝達ドメイン、またはその機能的部分を指す。ITAMとは、YXXL/I-X6-8-YXXL/Iの保存されたモチーフを指す。ある特定の実施形態においては、ITAMシグナル伝達ドメインは、1、2、3、4つまたはそれよりも多いITAMを含有する。ITAMシグナル伝達ドメインは、抗原結合またはリガンドエンゲージメント後、T細胞活性化シグナル伝達を開始し得る。ITAMシグナル伝達ドメインには、例えばCD3γ、CD3δ、CD3ε、CD3ζ、CD79a、およびCD66dの細胞内シグナル伝達ドメインが含まれる。 As used herein, an "immunoreceptor tyrosine-based activation motif (ITAM) activation domain" is naturally or endogenously present on an immune cell receptor or cell surface marker and has at least one Refers to an intracellular signaling domain containing an immunoreceptor tyrosine-based activation motif (ITAM), or a functional portion thereof. ITAM refers to the conserved motif of YXXL/IX 6-8 -YXXL/I. In certain embodiments, the ITAM signaling domain contains 1, 2, 3, 4 or more ITAMs. The ITAM signaling domain can initiate T cell activation signaling following antigen binding or ligand engagement. ITAM signaling domains include, for example, the intracellular signaling domains of CD3γ, CD3δ, CD3ε, CD3ζ, CD79a, and CD66d.
「接合部アミノ酸」または「接合部アミノ酸残基」とは、ポリペプチドの2つの隣接モチーフ、領域またはドメイン間の1つまたは複数の(例えば約2~20個の)アミノ酸残基を指す。接合部アミノ酸は、キメラタンパク質のコンストラクト設計から生じ得る(例えばキメラタンパク質をコードする核酸分子の構築中の制限酵素部位の使用から生じるアミノ酸残基)。 A "junction amino acid" or "junction amino acid residue" refers to one or more (eg, about 2-20) amino acid residues between two adjacent motifs, regions or domains of a polypeptide. Junctional amino acids can result from the construct design of the chimeric protein (eg, amino acid residues resulting from the use of restriction enzyme sites during construction of the nucleic acid molecule encoding the chimeric protein).
「核酸分子」および「ポリヌクレオチド」は、RNA、またはcDNA、ゲノムDNAおよび合成DNAを含むDNAの形態であり得る。核酸分子は、天然ヌクレオチド(例としてデオキシリボヌクレオチドおよびリボヌクレオチド)、天然ヌクレオチドのアナログ(例えば天然ヌクレオチドのα-エナンチオマー形態)またはその両方の組合せからなり得る。修飾ヌクレオチドは、糖部分、またはピリミジンもしくはプリン塩基部分における修飾またはこれらの部分の置換を有し得る。核酸モノマーは、ホスホジエステル結合またはそのような結合のアナログによって連結され得る。ホスホジエステル結合のアナログには、ホスホロチオエート、ホスホロジチオエート、ホスホロセレノエート(phosphoroselenoate)、ホスホロジセレノエート(phosphorodiselenoate)、ホスホロアニロチオエート(phosphoroanilothioate)、ホスホラニリデート(phosphoranilidate)、ホスホラミデート(phosphoramidate)等が含まれる。核酸分子は、二本鎖であっても、一本鎖であってもよく、一本鎖の場合、コード鎖であっても、非コード(アンチセンス鎖)であってもよい。コード分子は、当該技術分野において公知のコード配列と同一のコード配列を有してもよく、または遺伝子コードの重複または縮重の結果として、またはスプライシングによって、同じポリペプチドをコードし得る異なるコード配列を有してもよい。 "Nucleic acid molecule" and "polynucleotide" can be in the form of RNA or DNA, including cDNA, genomic DNA and synthetic DNA. Nucleic acid molecules can consist of naturally occurring nucleotides (eg, deoxyribonucleotides and ribonucleotides), analogs of naturally occurring nucleotides (eg, α-enantiomeric forms of naturally occurring nucleotides), or a combination of both. Modified nucleotides can have modifications in or substitutions of sugar moieties, or pyrimidine or purine base moieties. Nucleic acid monomers can be linked by phosphodiester bonds or analogs of such bonds. Analogs of phosphodiester bonds include phosphorothioates, phosphorodithioates, phosphoroselenoates, phosphorodiselenoates, phosphoroanilothioates, phosphoranilidedates, phosphoramidates. Dates (phosphoramidates) and the like are included. A nucleic acid molecule may be double-stranded or single-stranded, and if single stranded may be the coding strand or non-coding (anti-sense strand). A coding molecule may have the same coding sequence as a coding sequence known in the art, or different coding sequences that may encode the same polypeptide as a result of redundancy or degeneracy of the genetic code, or by splicing. may have
「コードする」とは、特定のポリヌクレオチド配列、例としてDNA、cDNAおよびmRNA配列の、生物学的プロセスにおいて規定のヌクレオチド配列(すなわち、rRNA、tRNAおよびmRNA)または規定のアミノ酸配列のいずれかを有する他のポリマーおよび高分子の合成のための鋳型として働く固有の特性、およびそれから生じる生物学的特性を指す。したがって、ポリヌクレオチドは、細胞または他の生体系においてそのポリヌクレオチドに対応するmRNAの転写および翻訳がタンパク質を産生する場合、タンパク質をコードする。コード鎖および非コード鎖の両方は、タンパク質またはポリヌクレオチドの他の生成物をコードすると言及され得る。別に指定しない限り、「アミノ酸配列をコードするヌクレオチド配列」には、互いの縮重型であり、同じアミノ酸配列をコードする全てのヌクレオチド配列が含まれる。 "Encoding" means either a defined nucleotide sequence (i.e., rRNA, tRNA and mRNA) or a defined amino acid sequence in a biological process of a specific polynucleotide sequence, e.g., DNA, cDNA and mRNA sequences. It refers to the intrinsic properties that serve as templates for the synthesis of other polymers and macromolecules that possess, and the biological properties that result from them. Thus, a polynucleotide encodes a protein if transcription and translation of mRNA corresponding to that polynucleotide in a cell or other biological system produces the protein. Both the coding and non-coding strands can be referred to as encoding proteins or other products of the polynucleotide. Unless otherwise specified, a "nucleotide sequence encoding an amino acid sequence" includes all nucleotide sequences that are degenerate versions of each other and that encode the same amino acid sequence.
本明細書において使用されるとき、「ペプチド」、「ポリペプチド」および「タンパク質」という用語は、互換的に使用され、ペプチド結合によって共有結合されたアミノ酸残基からなる化合物を指す。タンパク質またはペプチドは、少なくとも2つのアミノ酸を含有しなければならず、タンパク質の配列またはペプチドの配列を構成し得るアミノ酸の最大数について限定はない。ポリペプチドには、ペプチド結合によって互いに接合された2つまたはそれよりも多いアミノ酸を含む任意のペプチドまたはタンパク質が含まれる。本明細書において使用されるとき、この用語は、当該技術分野において例えばペプチド、オリゴペプチドおよびオリゴマーとも通常呼ばれる短鎖、および一般的に当該技術分野においてタンパク質と呼ばれ、多くの種類がある長鎖の両方を指す。「ポリペプチド」には、中でも、例えば生物活性断片、実質的同種ポリペプチド、オリゴペプチド、ホモ二量体、ヘテロ二量体、ポリペプチドの変異型、改変ポリペプチド、誘導体、アナログ、融合タンパク質が含まれる。ポリペプチドには、天然ペプチド、組換えペプチド、合成ペプチドまたはそれらの組合せが含まれる。 As used herein, the terms "peptide", "polypeptide" and "protein" are used interchangeably and refer to a compound consisting of amino acid residues covalently linked by peptide bonds. A protein or peptide must contain at least two amino acids, and there is no limit to the maximum number of amino acids that can make up a protein or peptide sequence. A polypeptide includes any peptide or protein comprising two or more amino acids joined together by peptide bonds. As used herein, the term refers to short chains, also commonly referred to in the art as e.g. peptides, oligopeptides and oligomers, and long chains, commonly referred to in the art as proteins, of which there are many types. refers to both "Polypeptides" include, for example, biologically active fragments, substantially homologous polypeptides, oligopeptides, homodimers, heterodimers, variants of polypeptides, modified polypeptides, derivatives, analogs, fusion proteins, among others. included. Polypeptides include natural peptides, recombinant peptides, synthetic peptides, or combinations thereof.
本明細書において使用されるとき、「成熟ポリペプチド」または「成熟タンパク質」という用語は、分泌されるか、または細胞膜に、またはある特定の細胞小器官(例えば小胞体、ゴルジ体またはエンドソーム)内に局在化し、かつN末端シグナルペプチドを含まないタンパク質またはポリペプチドを指す。 As used herein, the term "mature polypeptide" or "mature protein" refers to a protein that is secreted or bound to the cell membrane or within a particular organelle (e.g., endoplasmic reticulum, Golgi apparatus or endosome). It refers to a protein or polypeptide that localizes to and does not contain an N-terminal signal peptide.
「シグナルペプチド」は、「シグナル配列」、「リーダー配列」、「リーダーペプチド」、「局在化シグナル」または「局在化配列」とも呼ばれ、分泌経路に運命付けられた新規合成タンパク質のN末端に存在する短いペプチド(長さが通常15~30個のアミノ酸)である。シグナルペプチドは典型的に、N末端における短い範囲の親水性正電荷アミノ酸、5~15個の残基の中心疎水性ドメインおよびシグナルペプチダーゼのための切断部位を有するC末端領域を含む。真核生物においては、シグナルペプチドは、新規合成タンパク質の小胞体への移行を誘発し、小胞体においてそれはシグナルペプチダーゼによって切断され、成熟タンパク質を創出し、その後成熟タンパク質はその適切な目的地へ進行する。 A "signal peptide", also called a "signal sequence", "leader sequence", "leader peptide", "localization signal" or "localization sequence", is the N of newly synthesized proteins destined for the secretory pathway. It is a short peptide (usually 15-30 amino acids in length) present at the end. A signal peptide typically contains a short stretch of hydrophilic positively charged amino acids at the N-terminus, a central hydrophobic domain of 5-15 residues and a C-terminal region with a cleavage site for the signal peptidase. In eukaryotes, signal peptides induce the translocation of newly synthesized proteins into the endoplasmic reticulum, where they are cleaved by signal peptidases to create mature proteins, which then proceed to their proper destinations. do.
「キメラ」という用語は、内因性ではなく、かつ天然においては通常、互いに接合または連結されたかたちでは見られない、互いに接合または連結された配列を含む、任意の核酸分子またはタンパク質を指す。例えば、キメラ核酸分子は、異なる供給源に由来する調節配列およびコード配列、または同じ供給源に由来するが、天然に見られる様式とは異なる様式において配置されている調節配列およびコード配列を含み得る。 The term "chimera" refers to any nucleic acid molecule or protein that contains sequences fused or linked together that are not endogenous and are not normally found fused or linked together in nature. For example, a chimeric nucleic acid molecule can contain regulatory and coding sequences that are derived from different sources or regulatory and coding sequences that are derived from the same source but arranged in a manner different from that in which they are found in nature. .
本明細書において使用されるとき、「内因性」または「ネイティブ」という用語は、遺伝子、タンパク質、化合物、分子または活性の天然変異型を含む、宿主または宿主細胞に通常存在する遺伝子、タンパク質、化合物、分子または活性を指す。 As used herein, the term "endogenous" or "native" refers to genes, proteins, compounds normally present in the host or host cell, including naturally occurring variants of the gene, protein, compound, molecule or activity. , refers to a molecule or activity.
本明細書において使用されるとき、「同種の」または「ホモログ」とは、宿主細胞からの、例えば同じ宿主細胞からの、異なる宿主細胞からの、異なる生物からの、異なる系統からの、異なる種からの、第2の遺伝子または活性に祖先によって関連する分子または活性を指す。例えば、異種の分子、または分子をコードする異種の遺伝子は、それぞれ、ネイティブ宿主細胞分子または分子をコードする遺伝子と同種である場合があり、変更された構造、配列、発現レベルまたはその任意の組合せを有してもよい。 As used herein, "homologous" or "homolog" refer to different species from a host cell, e.g., from the same host cell, from a different host cell, from a different organism, from a different strain. refers to a molecule or activity that is ancestrally related to a second gene or activity from . For example, the heterologous molecule, or the heterologous gene encoding the molecule, can be homologous to the native host cell molecule or the gene encoding the molecule, respectively, with altered structure, sequence, expression level or any combination thereof. may have
本明細書において使用されるとき、「異種の」核酸分子、コンストラクトまたは配列とは、宿主細胞にとってネイティブではないが、宿主細胞からの核酸分子または核酸分子の部分にとって同種であり得る核酸分子または核酸分子の部分を指す。異種の核酸分子、コンストラクトまたは配列の供給源は、異なる属または種からの供給源であり得る。一部の実施形態においては、異種の核酸分子は、天然ではない。ある特定の実施形態においては、異種の核酸分子は、例えばコンジュゲーション、形質転換、トランスフェクション、形質導入、エレクトロポレーションその他によって、宿主細胞または宿主ゲノムに添加され(すなわち、内因性またはネイティブではなく)、添加された分子は、宿主細胞ゲノムに統合されても、染色体外遺伝子材料として(例えばプラスミドまたは自己複製ベクターの他の形態として)存在してもよく、多数のコピーにおいて存在してもよい。加えて、「異種の」とは、宿主細胞が同種のタンパク質または活性をコードするとしても、宿主細胞に導入された非内因性核酸分子によってコードされる非ネイティブ酵素、タンパク質または他の活性を指す。 As used herein, a "heterologous" nucleic acid molecule, construct or sequence is a nucleic acid molecule or nucleic acid that is not native to the host cell, but may be homologous to the nucleic acid molecule or portion of the nucleic acid molecule from the host cell. Refers to a part of a molecule. The source of heterologous nucleic acid molecule, construct or sequence can be from a different genus or species. In some embodiments, the heterologous nucleic acid molecule is not naturally occurring. In certain embodiments, the heterologous nucleic acid molecule is added to the host cell or host genome (i.e., other than endogenous or native ), the added molecule may be integrated into the host cell genome, present as extrachromosomal genetic material (e.g., as a plasmid or other form of self-replicating vector), or present in multiple copies. . In addition, "heterologous" refers to a non-native enzyme, protein or other activity encoded by a non-endogenous nucleic acid molecule introduced into the host cell, even though the host cell encodes a homologous protein or activity. .
本明細書において使用されるとき、「操作した」、「組換え」、「改変」または「非天然」という用語は、異種の核酸分子の導入によって改変された生物、微生物、細胞、核酸分子またはベクターを指すか、あるいはヒトの介入によって遺伝子操作された、すなわち、異種の核酸分子の導入によって改変された細胞または微生物を指すか、あるいは内因性核酸分子または遺伝子の発現が制御されるか、調節解除されるか、もしくは構成的であるように変更され、そのような変更または改変が遺伝子操作によって導入され得る細胞または微生物を指す。ヒトが生成した遺伝子変更は、例えば、1つまたは複数のタンパク質、キメラ受容体または酵素をコードする核酸分子(プロモーター等の発現制御エレメントを含み得る)を導入する改変;または他の核酸分子の付加、欠失、置換;または細胞の遺伝子材料の他の機能的破壊もしくは細胞の遺伝子材料への付加を含み得る。例示的な改変は、コード領域またはその機能的断片における改変、参照分子または親分子とは異種の、または同種のポリペプチドを含む。追加の例示的な改変には、例えば、改変が遺伝子またはオペロンの発現を変更する、非コード調節領域における改変が含まれる。 As used herein, the terms "engineered," "recombinant," "altered," or "non-naturally occurring" refer to organisms, microorganisms, cells, nucleic acid molecules or nucleic acid molecules that have been altered by the introduction of a heterologous nucleic acid molecule. refers to a vector, or to a cell or microorganism that has been genetically engineered by human intervention, i.e., modified by the introduction of a heterologous nucleic acid molecule, or whose expression of an endogenous nucleic acid molecule or gene is controlled or regulated Refers to a cell or microorganism that has been defused or altered to be constitutive, and such alterations or alterations can be introduced by genetic engineering. Human-generated genetic alterations include, for example, alterations that introduce nucleic acid molecules (which may include expression control elements such as promoters) that encode one or more proteins, chimeric receptors or enzymes; or the addition of other nucleic acid molecules. , deletions, substitutions; or other functional disruptions or additions to the genetic material of the cell. Exemplary modifications include modifications in the coding regions or functional fragments thereof, polypeptides heterologous or homologous to the reference or parent molecule. Additional exemplary modifications include, for example, modifications in non-coding regulatory regions where the modification alters expression of the gene or operon.
本明細書において使用されるとき、「導入遺伝子」という用語は、発現が宿主細胞において所望され、遺伝子操作技術によって細胞に移行された、目的のタンパク質(例えばキメラTim受容体)をコードする遺伝子またはポリヌクレオチドを指す。導入遺伝子は、治療目的のタンパク質、およびレポーター、タグ、マーカー、自殺タンパク質等であるタンパク質をコードし得る。導入遺伝子は、天然供給源からの導入遺伝子、天然遺伝子の改変であってもよく、組換えまたは合成分子であってもよい。ある特定の実施形態においては、導入遺伝子は、ベクターの成分である。 As used herein, the term "transgene" refers to a gene encoding a protein of interest (e.g., a chimeric Tim receptor) whose expression is desired in a host cell and transferred into the cell by genetic engineering techniques or It refers to polynucleotides. Transgenes can encode proteins of therapeutic interest and proteins that are reporters, tags, markers, suicide proteins, and the like. A transgene may be a transgene from a natural source, a modification of a natural gene, or it may be a recombinant or synthetic molecule. In certain embodiments, the transgene is a component of a vector.
「過剰発現した」抗原または抗原の「過剰発現」という用語は、細胞における異常に高レベルの抗原を指す。過剰発現した抗原または抗原の過剰発現は多くの場合、血液系腫瘍、および対象の特定の組織または器官内の固形腫瘍を形成する細胞における疾患状態等の、疾患状態と関連付けられる。腫瘍抗原の過剰発現によって特徴付けられる固形腫瘍または血液系腫瘍は、当該技術分野において公知の標準のアッセイによって決定することができる。 The term "overexpressed" antigen or "overexpression" of an antigen refers to abnormally high levels of the antigen in cells. Overexpressed antigens or overexpression of antigens are often associated with disease states, such as those in hematological tumours, and in cells that form solid tumors within a particular tissue or organ of a subject. Solid tumors or hematologic tumors characterized by overexpression of tumor antigens can be determined by standard assays known in the art.
2つまたはそれよりも多い核酸またはアミノ酸配列間の「同一性パーセント」は、2つまたはそれよりも多い配列の整列を最適化するために導入する必要があるギャップの数および各ギャップの長さを考慮に入れた、それらの配列によって共有される同一の位置の数の関数である(すなわち、同一性%=同一の位置の数/位置の総数x100)。2つまたはそれよりも多い配列間の配列の比較および同一性パーセントの決定は、BLASTおよびGapped BLASTプログラム等の数学的アルゴリズムをそれらのデフォルトパラメータを用いて使用して達成することができる(例えばAltschul et al., J. Mol. Biol. 215:403, 1990;また、www.ncbi.nlm.nih.gov/BLASTのBLASTNを参照のこと)。 A "percent identity" between two or more nucleic acid or amino acid sequences is the number of gaps and length of each gap that must be introduced to optimize alignment of the two or more sequences. (ie % identity = number of identical positions/total number of positions x 100), taking into account the number of identical positions shared by the sequences. The comparison of sequences and determination of percent identity between two or more sequences can be accomplished using mathematical algorithms such as the BLAST and Gapped BLAST programs, using their default parameters (e.g. Altschul et al., J. Mol. Biol. 215:403, 1990; see also BLASTN at www.ncbi.nlm.nih.gov/BLAST).
「保存的置換」は、当該技術分野において、1つのアミノ酸の、同様の特性を有する別のアミノ酸への置換として認識されている。例示的な保存的置換は、当該技術分野において周知である(例えば1997年3月13日公開のWO97/09433、10ページ;Lehninger, Biochemistry, Second Edition; Worth Publishers, Inc. NY:NY (1975), pp.71-77;Lewin, Genes IV, Oxford University Press, NY and Cell Press, Cambridge, MA (1990), p. 8を参照のこと)。 A "conservative substitution" is recognized in the art as the substitution of one amino acid for another amino acid that has similar properties. Exemplary conservative substitutions are well known in the art (eg, WO 97/09433, published March 13, 1997, page 10; Lehninger, Biochemistry, Second Edition; Worth Publishers, Inc. NY:NY (1975)). , pp. 71-77; see Lewin, Genes IV, Oxford University Press, NY and Cell Press, Cambridge, MA (1990), p. 8).
「プロモーター」という用語は、本明細書において使用されるとき、細胞の合成機構によって認識されるか、または合成機構に導入される、ポリヌクレオチド配列の特異的転写を開始するために必要とされるDNA配列として定義される。 The term "promoter" as used herein is required to initiate the specific transcription of a polynucleotide sequence that is recognized by, or introduced into, the synthetic machinery of the cell. Defined as a DNA sequence.
本明細書において使用されるとき、「プロモーター/調節配列」という用語は、プロモーター/調節配列に作動可能に連結された遺伝子産物の発現に必要とされる核酸配列を意味する。一部の場合、この配列は、コアプロモーター配列であってもよく、他の場合、また、この配列は、エンハンサー配列、および遺伝子産物の発現に必要とされる他の調節エレメントを含んでもよい。プロモーター/調節配列は、例えば、組織特異的様式において遺伝子産物を発現するプロモーター/調節配列であってもよい。 As used herein, the term "promoter/regulatory sequence" means a nucleic acid sequence required for expression of a gene product that is operably linked to the promoter/regulatory sequence. In some cases, this sequence may be the core promoter sequence, in other cases it may also include enhancer sequences and other regulatory elements required for expression of the gene product. A promoter/regulatory sequence can be, for example, a promoter/regulatory sequence that expresses a gene product in a tissue-specific manner.
「構成的」プロモーターは、遺伝子産物をコードするか、または特定するポリヌクレオチドと作動可能に連結された場合、細胞のほとんどまたは全ての生理学的条件下において遺伝子産物が細胞内で産生されることをもたらすヌクレオチド配列である。 A "constitutive" promoter encodes a gene product or, when operably linked to a specifying polynucleotide, directs the production of a gene product in a cell under most or all physiological conditions of the cell. is the resulting nucleotide sequence.
「誘導性」プロモーターは、遺伝子産物をコードするか、または特定するポリヌクレオチドと作動可能に連結された場合、実質的にプロモーターに対応するインデューサーが細胞内に存在する場合のみ、遺伝子産物が細胞内で産生されることをもたらすヌクレオチド配列である。 An "inducible" promoter encodes a gene product or, when operably linked to a specifying polynucleotide, is capable of producing a gene product in cells only when an inducer substantially corresponding to the promoter is present in the cell. is a nucleotide sequence resulting in production within.
「組織特異的」プロモーターは、遺伝子をコードするか、または遺伝子によって特定されるポリヌクレオチドと作動可能に連結された場合、実質的に細胞がプロモーターに対応する組織タイプの細胞である場合のみ、遺伝子産物が細胞内で産生されることをもたらすヌクレオチド配列である。 A "tissue-specific" promoter means that, when operably linked to a polynucleotide encoding a gene or specified by the gene, the gene is substantially only if the cell is of the tissue type corresponding to the promoter. A nucleotide sequence that causes a product to be produced intracellularly.
「転写制御下」または「作動可能に連結された」という句は、本明細書において使用されるとき、プロモーターが、RNAポリメラーゼによる転写の開始およびポリヌクレオチドの発現を制御するためにポリヌクレオチドに関して正しい場所および方向において存在することを意味する。 The phrases "under transcriptional control" or "operably linked," as used herein, refer to a polynucleotide in which the promoter controls initiation of transcription by RNA polymerase and expression of the polynucleotide. It means existing in place and direction.
「ベクター」は、別の核酸を輸送することができる核酸分子である。ベクターは、例えばプラスミド、コスミド、ウイルスまたはファージであり得る。また、この用語は、核酸の細胞への移行を促進する非プラスミドおよび非ウイルス化合物を含むと解釈されるべきである。「発現ベクター」は、ベクターが適切な環境に存在する場合、ベクターが有する1つまたは複数の遺伝子によってコードされるタンパク質の発現を方向付けることができるベクターである。 A "vector" is a nucleic acid molecule capable of transporting another nucleic acid. Vectors can be, for example, plasmids, cosmids, viruses or phages. The term should also be construed to include non-plasmid and non-viral compounds that facilitate transfer of nucleic acids into cells. An "expression vector" is a vector capable of directing the expression of a protein encoded by one or more genes it carries when the vector is in the appropriate environment.
ある特定の実施形態においては、ベクターは、ウイルスベクターである。ウイルスベクターの例には、アデノウイルスベクター、アデノ随伴ウイルスベクター、レトロウイルスベクター、ガンマレトロウイルスベクターおよびレンチウイルスベクターが含まれるが、これらに限定されない。「レトロウイルス」は、RNAゲノムを有するウイルスである。「ガンマレトロウイルス」とは、レトロウイルス科ファミリーの属を指す。ガンマレトロウイルスの例には、マウス幹細胞ウイルス、マウス白血病ウイルス、ネコ白血病ウイルス、ネコ肉腫ウイルスおよび鳥類細網内皮症ウイルスが含まれる。「レンチウイルス」とは、分裂細胞および非分裂細胞に感染することができるレトロウイルスの属を指す。レンチウイルスの例には、HIV(human immunodeficiency virus)(HIV1型およびHIV2型を含むヒト免疫不全ウイルス)、ウマ伝染性貧血ウイルス、ネコ免疫不全ウイルス(FIV:feline immunodeficiency virus)、ウシ免疫不全ウイルス(BIV:bovine immune deficiency virus)およびサル免疫不全ウイルス(SIV:simian immunodeficiency virus)が含まれるが、これらに限定されない。 In certain embodiments, the vector is a viral vector. Examples of viral vectors include, but are not limited to, adenoviral vectors, adeno-associated viral vectors, retroviral vectors, gammaretroviral vectors and lentiviral vectors. A "retrovirus" is a virus with an RNA genome. "Gammaretrovirus" refers to a genus of the Retroviridae family. Examples of gammaretroviruses include murine stem cell virus, murine leukemia virus, feline leukemia virus, feline sarcoma virus and avian reticuloendotheliosis virus. "Lentivirus" refers to a genus of retroviruses that are capable of infecting dividing and non-dividing cells. Examples of lentiviruses include human immunodeficiency virus (HIV) (human immunodeficiency virus including HIV 1 and 2), equine infectious anemia virus, feline immunodeficiency virus (FIV), bovine immunodeficiency virus ( BIV (bovine immune deficiency virus) and simian immunodeficiency virus (SIV).
他の実施形態においては、ベクターは、非ウイルスベクターである。非ウイルスベクターの例には、脂質ベースのDNAベクター、修飾mRNA(modRNA)、自己増幅mRNA、閉鎖末端直鎖状二本鎖(CELiD:closed-ended linear duplex)DNAおよびトランスポゾン媒介遺伝子移行(PiggyBac、Sleeping Beauty)が含まれる。非ウイルスデリバリー系が使用される場合、デリバリー媒体は、リポソームであり得る。脂質製剤は、インビトロ、エクスビボまたはインビボで核酸を宿主細胞に導入するために使用され得る。核酸は、リポソームの内部に封入されていてもよく、リポソームの脂質二重層内に散在していてもよく、リポソームおよび核酸の両方と会合する連結分子を介してリポソームに結合していてもよく、ミセルに含有されるか、もしくはミセルと複合体形成していてもよく、別の方法で脂質と会合していてもよい。 In other embodiments, the vector is a non-viral vector. Examples of non-viral vectors include lipid-based DNA vectors, modified mRNA (modRNA), self-amplifying mRNA, closed-ended linear duplex (CELiD) DNA and transposon-mediated gene transfer (PiggyBac, Sleeping Beauty). If a non-viral delivery system is used, the delivery vehicle can be a liposome. Lipid formulations can be used to introduce nucleic acids into host cells in vitro, ex vivo or in vivo. The nucleic acid may be encapsulated inside the liposome, interspersed within the lipid bilayer of the liposome, or attached to the liposome via a linking molecule that associates with both the liposome and the nucleic acid; It may be contained in or complexed with micelles, or may be otherwise associated with lipids.
本明細書において使用されるとき、「貪食」という用語は、直径が100nmを超える内因性または外因性細胞または粒子が、本開示の食細胞または宿主細胞によって内部移行される、受容体媒介プロセスを指す。貪食は典型的に、多ステップ:(1)貪食受容体の、標的細胞または粒子上のプロ貪食マーカーまたは抗原性マーカーへの直接的または間接的(架橋分子を介する)結合を介する標的細胞または粒子の繋留;および(2)標的細胞全体もしくは粒子全体またはそれらの部分の内部移行または貪食からなる。ある特定の実施形態においては、内部移行は、食細胞または宿主細胞の細胞骨格再配置を介して起こり、内部移行された標的を含有する膜結合区画であるファゴソームを形成し得る。貪食は、ファゴソームがますます酸性になり、リソソームと融合する(ファゴリソソームを形成する)ファゴソームの成熟をさらに含む場合があり、これに際して、貪食された標的は分解される(例えば「食作用」)。あるいは、ファゴソーム-リソソーム融合は、貪食において観察されない場合がある。また別の実施形態においては、ファゴソームは、その内容物を、完全な分解前に細胞外環境へ吐き戻すか、または排出し得る。一部の実施形態においては、貪食とは、食作用を指す。一部の実施形態においては、貪食は、本開示の宿主細胞の食細胞による標的細胞または粒子の繋留を含むが、内部移行は含まない。一部の実施形態においては、貪食は、本開示の宿主細胞の食細胞による標的細胞または粒子の繋留、および標的細胞または粒子の部分の内部移行を含む。 As used herein, the term "phagocytosis" refers to a receptor-mediated process in which endogenous or exogenous cells or particles greater than 100 nm in diameter are internalized by phagocytes or host cells of the present disclosure. Point. Phagocytosis is typically multi-step: (1) a target cell or particle via direct or indirect (via a bridging molecule) binding of a phagocytic receptor to a pro-phagocytic or antigenic marker on the target cell or particle; and (2) internalization or phagocytosis of the entire target cell or particle or portions thereof. In certain embodiments, internalization may occur via phagocytic or host cell cytoskeletal rearrangements to form phagosomes, which are membrane-bound compartments containing the internalized target. Phagocytosis may further involve maturation of the phagosome, which becomes more acidic and fuses with the lysosome (forming a phagolysosome), during which the phagocytosed target is degraded (e.g., "phagocytosis"). . Alternatively, phagosome-lysosome fusion may not be observed in phagocytosis. In yet another embodiment, phagosomes may regurgitate or excrete their contents into the extracellular environment prior to complete degradation. In some embodiments, phagocytosis refers to phagocytosis. In some embodiments, phagocytosis includes tethering, but not internalization, of target cells or particles by phagocytic cells of host cells of the present disclosure. In some embodiments, phagocytosis comprises tethering of target cells or particles and internalization of portions of target cells or particles by phagocytic cells of host cells of the present disclosure.
本明細書において使用されるとき、「食作用」という用語は、標的細胞または粒子の繋留、標的細胞または粒子の貪食および内部移行された標的細胞または粒子の分解が起こる、細胞または大粒子(0.5μm以上)の貪食プロセスを指す。ある特定の実施形態においては、食作用は、内部移行された標的細胞または粒子を包含するファゴソームの形成、および中の内容物が分解されるファゴリソソームを形成するリソソームとのファゴソーム融合を含む。ある特定の実施形態においては、食作用中に、標的細胞または粒子によって発現されるホスファチジルセリンへの本開示の宿主細胞上に発現するキメラTim受容体の結合後、食作用シナプスが形成され;食作用シナプスにおいてアクチンリッチ食作用カップが生成し;細胞骨格再配置を通して食作用アームが標的細胞または粒子の周囲に伸長し;最終的に、モータータンパク質によって生成した力を通して標的細胞または粒子が食細胞または宿主細胞に引き込まれる。本明細書において使用されるとき、「食作用」には、非炎症様式におけるアポトーシス細胞または壊死細胞の食作用を特に指す「エフェロサイトーシス」のプロセスが含まれる。 As used herein, the term "phagocytosis" refers to cells or large particles (0 .5 μm or larger) phagocytosis process. In certain embodiments, phagocytosis involves the formation of phagosomes that enclose the internalized target cell or particle, and phagosome fusion with lysosomes to form phagolysosomes whose contents are degraded. In certain embodiments, during phagocytosis, a phagocytic synapse is formed following binding of a chimeric Tim receptor expressed on a host cell of the present disclosure to phosphatidylserine expressed by a target cell or particle; An actin-rich phagocytic cup is generated at the working synapse; the phagocytic arm extends around the target cell or particle through cytoskeletal rearrangement; drawn into the host cell. As used herein, "phagocytosis" includes the process of "efferocytosis," which specifically refers to the phagocytosis of apoptotic or necrotic cells in a non-inflammatory manner.
「免疫系細胞」または「免疫細胞」という用語は、骨髄の造血幹細胞に由来する免疫系の任意の細胞を意味する。造血幹細胞は、2つの主要な系統:骨髄系前駆細胞(骨髄細胞、例として単球、マクロファージ、樹状細胞、巨核球および顆粒球を生じる)およびリンパ球前駆細胞[リンパ球細胞、例としてT細胞、B細胞およびナチュラルキラー(NK)細胞を生じる]を生じる。例示的な免疫系細胞には、CD4+T細胞、CD8+T細胞、CD4-CD8-二種陰性T細胞、γδT細胞、制御性T細胞、ナチュラルキラー細胞および樹状細胞が含まれる。マクロファージおよび樹状細胞は、「抗原提示細胞」または「APC(antigen presenting cell)」とも呼ばれる場合があり、これらは、ペプチドと複合体形成したAPCの表面上の主要組織適合抗原複合体(MHC)受容体が、T細胞の表面上のTCRと相互作用するとき、T細胞を活性化し得る特殊化細胞である。 The term "immune system cell" or "immune cell" means any cell of the immune system that is derived from hematopoietic stem cells of the bone marrow. Hematopoietic stem cells have two main lineages: myeloid progenitors (which give rise to myeloid cells, eg monocytes, macrophages, dendritic cells, megakaryocytes and granulocytes) and lymphocytic progenitors [lymphocytic cells, eg T give rise to cells, B cells and natural killer (NK) cells]. Exemplary immune system cells include CD4+ T cells, CD8+ T cells, CD4-CD8-binary negative T cells, γδ T cells, regulatory T cells, natural killer cells and dendritic cells. Macrophages and dendritic cells, sometimes called "antigen presenting cells" or "antigen presenting cells" (APCs), are the major histocompatibility complexes (MHC) on the surface of APCs complexed with peptides. A receptor is a specialized cell that can activate a T cell when it interacts with the TCR on the surface of the T cell.
「T細胞」という用語は、T細胞系統の細胞を指す。「T細胞系統の細胞」とは、細胞を他のリンパ球および赤血球系統または骨髄系統の細胞から区別する、T細胞またはその前駆体もしくは前駆細胞の少なくとも1つの表現型特徴を示す細胞を指す。そのような表現型特徴は、T細胞に特異的な1つまたは複数のタンパク質(例えばCD3+、CD4+、CD8+)の発現、またはT細胞に特異的な生理学的、形態学的、機能的または免疫学的特色を含み得る。例えば、T細胞系統の細胞は、T細胞系統にコミットされた前駆細胞もしくは前駆体細胞;CD25+未成熟かつ不活性化T細胞;CD4またはCD8系統コミットメントを受けた細胞;CD4+CD8+二種陽性である胸腺前駆細胞;単一陽性CD4+もしくはCD8+;TCRαβもしくはTCRγδ;または成熟かつ機能的もしくは活性化T細胞であり得る。「T細胞」という用語は、ナイーブT細胞(CD45 RA+、CCR7+、CD62L+、CD27+、CD45RO-)、セントラルメモリーT細胞(CD45RO+、CD62L+、CD8+)、エフェクターメモリーT細胞(CD45RA+、CD45RO-、CCR7-、CD62L-、CD27-)、粘膜関連インバリアントT(MAIT)細胞、Treg、ナチュラルキラーT細胞および組織レジデントT細胞を包含する。 The term "T cell" refers to cells of the T cell lineage. A "cell of T cell lineage" refers to a cell that exhibits at least one phenotypic characteristic of a T cell or its progenitor or progenitor that distinguishes the cell from other lymphoid and erythroid or myeloid lineage cells. Such phenotypic characteristics are expression of one or more T cell-specific proteins (e.g., CD3 + , CD4 + , CD8 + ), or T cell-specific physiological, morphological, functional or may include immunological features. For example, cells of the T-cell lineage include progenitor or progenitor cells committed to the T-cell lineage; CD25 + immature and inactivated T cells; cells that have undergone CD4 or CD8 lineage commitment ; thymic progenitor cells that are positive; single positive CD4 + or CD8 + ; TCRαβ or TCRγδ; or mature and functional or activated T cells. The term "T cells" includes naive T cells (CD45 RA+, CCR7+, CD62L+, CD27+, CD45RO-), central memory T cells (CD45RO + , CD62L + , CD8 + ), effector memory T cells (CD45RA+, CD45RO-, CCR7-, CD62L-, CD27-), mucosa-associated invariant T (MAIT) cells, Tregs, natural killer T cells and tissue-resident T cells.
「B細胞」という用語は、B細胞系統の細胞を指す。「B細胞系統の細胞」とは、細胞を他のリンパ球および赤血球系統または骨髄系統の細胞から区別する、B細胞またはその前駆体もしくは前駆細胞の少なくとも1つの表現型特徴を示す細胞を指す。そのような表現型特徴は、B細胞に特異的な1つまたは複数のタンパク質(例えばCD19+、CD72+、CD24+、CD20+)の発現、またはB細胞に特異的な生理学的、形態学的、機能的または免疫学的特色を含み得る。例えば、B細胞系統の細胞は、B細胞系統にコミットされた前駆細胞もしくは前駆体細胞(例えばプレプロB細胞、プロB細胞およびプレB細胞);未成熟かつ不活性化B細胞;または成熟かつ機能的もしくは活性化B細胞であり得る。したがって、「B細胞」は、ナイーブB細胞、形質細胞、制御性B細胞、辺縁帯B細胞、濾胞性B細胞、リンパ形質細胞性細胞、形質芽細胞およびメモリーB細胞(例えばCD27+、IgD-)を包含する。 The term "B-cell" refers to cells of the B-cell lineage. A "B-lineage cell" refers to a cell that exhibits at least one phenotypic characteristic of a B-cell or its progenitor or progenitor that distinguishes the cell from other lymphoid and erythroid or myeloid lineage cells. Such phenotypic characteristics include expression of one or more proteins specific to B cells (e.g., CD19 + , CD72 + , CD24 + , CD20 + ), or physiological, morphological, or functional features specific to B cells. It may include therapeutic or immunological features. For example, cells of the B cell lineage can be progenitor or progenitor cells committed to the B cell lineage (e.g., pre-pro B cells, pro B cells and pre B cells); immature and inactivated B cells; can be active or activated B cells. Thus, "B cells" include naive B cells, plasma cells, regulatory B cells, marginal zone B cells, follicular B cells, lymphoplasmacytic cells, plasmablasts and memory B cells (e.g. CD27 + , IgD - ).
表面上に免疫受容体(例えばTCR)または本開示に記載されるキメラTim受容体を発現する細胞(例えばT細胞またはNK細胞)についての「細胞傷害活性」という用語は、「細胞溶解活性」とも呼ばれ、細胞が、抗原特異的シグナル伝達に際して(例えばTCR、キメラTim受容体を介して)、標的細胞がアポトーシスを受けるように誘導することを意味する。一部の実施形態においては、細胞傷害性細胞は、顆粒からの細胞毒、例としてパーフォリン、グランザイムおよびグラニュライシンの放出を介して標的細胞においてアポトーシスを誘導し得る。パーフォリンは、標的細胞膜に挿入し、水および塩が標的細胞に迅速に入ることを可能にする孔を形成する。グランザイムは、標的細胞においてアポトーシスを誘導するセリンプロテアーゼである。また、グラニュライシンは、標的細胞膜において孔を形成することができ、炎症促進性分子である。一部の実施形態においては、細胞傷害性細胞は、抗原特異的シグナル伝達後にT細胞上でアップレギュレートされるFasリガンドと、標的細胞上に発現されるFas分子との相互作用を介して、標的細胞においてアポトーシスを誘導し得る。Fasは、いくつかの異なる細胞の表面上のアポトーシスシグナル伝達受容体分子である。 The term "cytotoxic activity" for cells (e.g., T cells or NK cells) that express an immune receptor (e.g., TCR) or chimeric Tim receptor described in this disclosure on their surface is also referred to as "cytolytic activity." It means that the cell induces the target cell to undergo apoptosis upon antigen-specific signaling (eg, via the TCR, chimeric Tim receptor). In some embodiments, cytotoxic cells can induce apoptosis in target cells through the release of cytotoxins from granules, such as perforin, granzyme and granulysin. Perforin inserts into the target cell membrane, forming pores that allow water and salts to rapidly enter the target cell. Granzymes are serine proteases that induce apoptosis in target cells. Granulysin can also form pores in target cell membranes and is a pro-inflammatory molecule. In some embodiments, the cytotoxic cells are mediated through the interaction of Fas ligand, which is upregulated on T cells after antigen-specific signaling, with Fas molecules expressed on target cells. It can induce apoptosis in target cells. Fas is an apoptosis signaling receptor molecule on the surface of several different cells.
免疫細胞についての「疲弊」という用語は、乏しいエフェクター機能(例えば低減したサイトカイン産生、低減した細胞傷害活性)、低減した増殖能力、免疫チェックポイント分子の増大した発現、および機能的なエフェクター細胞またはメモリー細胞のものとは異なる転写状態により定義される免疫細胞機能不全の状態を指す。ある特定の実施形態においては、疲弊した免疫細胞は、その標的抗原の存在に対して非応答性となる。免疫細胞疲弊は、標的抗原への慢性的曝露から(例えば慢性感染から生じ得る通り)、またはそれが免疫抑制性環境(例えば腫瘍微小環境)に侵入した場合に、生じ得る。ある特定の実施形態においては、免疫細胞疲弊とは、T細胞疲弊、NK細胞疲弊、またはその両方を指す。ある特定の実施形態においては、疲弊したT細胞は、(a)PD-1、TIGIT、LAG3、TIM3、もしくはそれらの任意の組合せの増大した発現;(b)IFN-γ、IL-2、TNF-α、もしくはそれらの任意の組合せの減少した産生;または(a)と(b)との両方を示す。ある特定の実施形態においては、疲弊したNK細胞は、(a)PD-1、NKG2A、TIM3、もしくはそれらの任意の組合せの増大した発現;(b)IFN-γ、TNF-α、もしくはその両方の減少した産生;または(a)と(b)との両方を示す。 The term "exhaustion" for immune cells refers to poor effector function (e.g., reduced cytokine production, reduced cytotoxic activity), reduced proliferative capacity, increased expression of immune checkpoint molecules, and functional effector cells or memory cells. Refers to a state of immune cell dysfunction defined by a transcriptional state different from that of cells. In certain embodiments, exhausted immune cells become non-responsive to the presence of their target antigen. Immune cell exhaustion can result from chronic exposure to a target antigen (eg, as can result from chronic infection) or when it enters an immunosuppressive environment (eg, the tumor microenvironment). In certain embodiments, immune cell exhaustion refers to T cell exhaustion, NK cell exhaustion, or both. In certain embodiments, exhausted T cells exhibit (a) increased expression of PD-1, TIGIT, LAG3, TIM3, or any combination thereof; (b) IFN-γ, IL-2, TNF - decreased production of α, or any combination thereof; or both (a) and (b). In certain embodiments, exhausted NK cells exhibit (a) increased expression of PD-1, NKG2A, TIM3, or any combination thereof; (b) IFN-γ, TNF-α, or both or both (a) and (b).
「疾患」は、対象が恒常性を維持することができない、かつ疾患が改善しない場合その後、対象の健康が悪化し続ける、対象の健康状態である。対照的に、対象における「障害」または「望ましくない状態」は、対象が恒常性を維持することができるが、対象の健康状態が、それが障害または望ましくない状態の非存在下にある場合よりも好ましくない、健康状態である。処置されないままの場合、障害または望ましくない状態は、対象の健康状態のさらなる減少を必ずしももたらさない。 A "disease" is a health condition in a subject in which the subject is unable to maintain homeostasis and, if the disease does not improve, the subject's health continues to deteriorate thereafter. In contrast, a "disorder" or "undesirable condition" in a subject means that the subject is able to maintain homeostasis, but the subject's health condition is lower than it would be if it were in the absence of the disorder or undesirable condition. It is also an undesirable health condition. A disorder or undesirable condition, if left untreated, does not necessarily result in a further decrease in the subject's health.
「がん」という用語は、本明細書において使用されるとき、異常な細胞の迅速かつ制御されていない増殖によって特徴付けられる疾患として定義される。異常な細胞は、固形腫瘍を形成するか、または血液系腫瘍を構成し得る。がん細胞は、局所的に、または血流およびリンパ系を通して身体の他の部分に広がり得る。様々ながんの例には、乳がん、前立腺がん、卵巣がん、子宮頸がん、皮膚がん、膵がん、結腸直腸がん、腎がん、肝がん、脳がん、リンパ腫、白血病、肺がん等が含まれるが、これらに限定されない。 The term "cancer" as used herein is defined as a disease characterized by rapid and uncontrolled growth of abnormal cells. Abnormal cells can form solid tumors or constitute hematologic malignancies. Cancer cells can spread locally or through the bloodstream and lymphatic system to other parts of the body. Examples of various cancers include breast cancer, prostate cancer, ovarian cancer, cervical cancer, skin cancer, pancreatic cancer, colorectal cancer, kidney cancer, liver cancer, brain cancer, lymphoma , leukemia, lung cancer and the like.
「対象」、「患者」および「個体」という用語は、本明細書において互換的に使用され、免疫応答が誘発され得る生存生物(例えば哺乳動物)を含むと意図される。対象の例には、ヒト、霊長類、ウシ、ウマ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタおよびそのトランスジェニック種が含まれる。 The terms "subject," "patient," and "individual" are used interchangeably herein and are intended to include living organisms (eg, mammals) to which an immune response can be elicited. Examples of subjects include humans, primates, cows, horses, sheep, dogs, cats, mice, rats, rabbits, guinea pigs, pigs and transgenic species thereof.
「養子細胞免疫療法」または「養子免疫療法」は、天然の、または遺伝子操作した、疾患抗原特異的免疫細胞(例えばT細胞)の投与を指す。養子細胞免疫療法は、自家(免疫細胞が受容者からの細胞である)、同種異系(免疫細胞が同じ種のドナーからの細胞である)または同系(免疫細胞が受容者と遺伝的に同一のドナーからの細胞である)であり得る。 "Adoptive cell immunotherapy" or "adoptive immunotherapy" refers to the administration of natural or genetically engineered disease antigen-specific immune cells (eg, T cells). Adoptive cell immunotherapy can be performed using autologous (immune cells are from the recipient), allogeneic (immune cells are from a donor of the same species) or syngeneic (immune cells are genetically identical to the recipient). cells from a donor).
「自家」とは、材料が後に再導入される同じ対象に由来する任意の材料(例えば器官、組織、細胞のグラフト)を指す。 "Autologous" refers to any material (eg, organ, tissue, cell graft) derived from the same subject to which the material is later reintroduced.
「同種異系」とは、同じ種の異なる対象に由来するグラフトを指す。 "Allogeneic" refers to grafts derived from different subjects of the same species.
本開示のキメラタンパク質またはキメラタンパク質を発現する細胞(例えばキメラTim受容体またはキメラTim受容体を発現する細胞)の「治療有効量」または「有効量」とは、治療される疾患、障害または望ましくない状態の1つまたは複数の症状の改善をもたらすために十分なタンパク質または細胞の量を指す。単独で投与される、個々の活性成分、または単一の活性成分を発現する細胞について言及する場合、治療有効用量とは、その成分またはその成分を発現する細胞の単独の効果を指す。組合せについて言及する場合、治療有効用量とは、連続投与されるか、同時投与されるかにかかわらず、治療効果をもたらす、活性成分または組み合わせた付属の活性成分の、活性成分を発現する細胞と組み合わせた量を指す。 A “therapeutically effective amount” or “effective amount” of a chimeric protein of the disclosure or a cell expressing a chimeric protein (e.g., a chimeric Tim receptor or a cell expressing a chimeric Tim receptor) refers to the disease, disorder or desirability being treated. Refers to an amount of protein or cells sufficient to bring about an amelioration of one or more symptoms of a condition. When referring to an individual active ingredient, or cells expressing a single active ingredient, administered alone, a therapeutically effective dose refers to the sole effect of that ingredient or cells expressing that ingredient. When referring to a combination, a therapeutically effective dose is a dose of the active ingredient or ancillary active ingredients in combination with cells expressing the active ingredient that produces a therapeutic effect, whether administered sequentially or co-administered. Refers to combined quantities.
「治療する」または「治療」または「改善する」とは、対象の疾患、障害または望ましくない状態の医療管理を指す。一般的に、本開示のキメラタンパク質を発現する宿主細胞を含む適切な用量または治療レジメンは、治療利益または予防利益を誘発するために十分な量において投与される。治療利益または予防/防止利益には、臨床アウトカムの改善;疾患、障害または望ましくない状態と関連付けられる症状の減少または軽減;症状の発生の減少;クオリティ・オブ・ライフの改善;より長い無疾患状態;疾患、障害または望ましくない状態の程度の縮減;疾患状態の安定化;疾患進行の遅延;寛解;生存;生存延長;またはそれらの任意の組合せが含まれる。 "Treat" or "treatment" or "ameliorate" refers to the medical management of a disease, disorder or undesirable condition in a subject. Generally, a suitable dose or therapeutic regimen involving host cells expressing a chimeric protein of the disclosure is administered in an amount sufficient to elicit a therapeutic or prophylactic benefit. Treatment benefit or prevention/prevention benefit includes improved clinical outcome; reduction or alleviation of symptoms associated with the disease, disorder or undesirable condition; reduced incidence of symptoms; improved quality of life; longer disease-free state. a reduction in the extent of a disease, disorder or undesirable condition; stabilization of a disease state; slowing of disease progression; remission; survival;
「抗腫瘍効果」という用語は、腫瘍容量における減少、腫瘍細胞数の減少、転移数の減少、平均余命の増加またはがん性状態と関連付けられる様々な生理学的症状の改善によって証明され得る生物学的効果を指す。また、「抗腫瘍効果」は、血液系腫瘍または腫瘍形成の予防によって証明され得る。 The term "antitumor effect" can be evidenced by a reduction in tumor volume, a reduction in tumor cell number, a reduction in the number of metastases, an increase in life expectancy or an improvement in various physiological symptoms associated with cancerous conditions. refers to the effect of An "anti-tumor effect" may also be evidenced by prevention of hematological tumors or tumorigenesis.
「自己免疫疾患」とは、自己免疫応答から生じる障害を指す。自己免疫疾患は、自己抗原に対する不適切に過剰な応答の結果である。自己免疫応答は、自己抗体、自己反応性T細胞、またはその両方を生成する自己反応性B細胞を含み得る。本明細書において使用されるとき、「自己抗体」は、これもまた対象により生成される自己抗原に結合する、対象によって生成される抗体である。 "Autoimmune disease" refers to a disorder resulting from an autoimmune response. Autoimmune diseases are the result of inappropriately exaggerated responses to self antigens. An autoimmune response can involve autoreactive B cells that generate autoantibodies, autoreactive T cells, or both. As used herein, an "autoantibody" is an antibody produced by a subject that binds to an autoantigen also produced by the subject.
追加の定義は、本開示全体を通して提供される。 Additional definitions are provided throughout this disclosure.
上記の通り、本開示の方法は、対象においてがんを治療するために有用である。本開示の治療剤(すなわち、キメラTim受容体およびPARP阻害剤)は、一緒にまたは連続的に投与される場合、対象においてがんを治療する(例えば、(i)がんの発達を停止させるか;(ii)がんの退縮を引き起こすか;または(iii)がんから生じる症状を軽減する)。 As noted above, the methods of the present disclosure are useful for treating cancer in a subject. Therapeutic agents of the disclosure (i.e., chimeric Tim receptor and PARP inhibitor), when administered together or sequentially, treat cancer in a subject (e.g., (i) arrest cancer development (ii) cause regression of the cancer; or (iii) alleviate symptoms resulting from the cancer).
実施形態においては、本明細書において開示される治療方法は、対象に有効量のキメラTim受容体およびPARP阻害剤を投与し、それによりがんを治療することを含む。 In embodiments, the therapeutic methods disclosed herein comprise administering to a subject an effective amount of a chimeric Tim receptor and a PARP inhibitor, thereby treating cancer.
キメラTim受容体
本開示は、Tim結合ドメインを含む細胞外ドメインと;第1の共刺激性シグナル伝達ドメインを含む細胞内シグナル伝達ドメインと;細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインとを含む単鎖キメラタンパク質を含む、キメラTim受容体を提供する。ある特定の実施形態においては、本明細書において説明するキメラTim受容体の細胞外ドメインは、結合ドメインと膜貫通ドメインとの間に位置し、かつこれらを接続する細胞外スペーサードメインを含んでもよい。
Chimeric Tim Receptor The present disclosure provides an extracellular domain comprising a Tim binding domain; an intracellular signaling domain comprising a first costimulatory signaling domain; located between the extracellular domain and the intracellular signaling domain. and a transmembrane domain connecting them. In certain embodiments, the extracellular domain of the chimeric Tim receptor described herein may comprise an extracellular spacer domain located between and connecting the binding domain and the transmembrane domain. .
宿主細胞において発現される場合、本開示のキメラTim受容体は、改変された宿主細胞に対して、ホスファチジルセリン特異的細胞傷害表現型を与え得る(例えば、宿主細胞が、その表面上にホスファチジルセリンを発現するストレスを受けた細胞、損傷細胞、傷害細胞、アポトーシス細胞、または壊死細胞に対して細胞傷害性になる)。ある特定の実施形態においては、キメラTim受容体は、グランザイム、パーフォリン、グラニュライシンまたはそれらの任意の組合せの放出を介してターゲティング細胞においてアポトーシスを誘導する。さらなる実施形態においては、本説明に記載のキメラTim受容体を発現する細胞は、ホスファチジルセリン提示細胞に対して特異的な貪食表現型を示す。 When expressed in a host cell, a chimeric Tim receptor of the present disclosure can confer a phosphatidylserine-specific cytotoxic phenotype on an engineered host cell (e.g., when a host cell has phosphatidylserine on its surface). become cytotoxic to stressed, injured, injured, apoptotic, or necrotic cells that express In certain embodiments, chimeric Tim receptors induce apoptosis in targeted cells through the release of granzymes, perforins, granulysins, or any combination thereof. In further embodiments, cells expressing the chimeric Tim receptors described herein exhibit a phagocytic phenotype specific for phosphatidylserine presenting cells.
細胞内シグナル伝達ドメインは、キメラTim受容体の細胞外ドメインのホスファチジルセリンへの結合に応答して、機能的シグナルを細胞に伝達することができる、1つまたは複数のエフェクタードメインを含み得る。細胞内シグナル伝達ドメインによるシグナル伝達は、ホスファチジルセリンへの細胞外ドメインの結合により誘発される。細胞内シグナル伝達ドメインによって伝達されるシグナルは、キメラTim受容体含有細胞のエフェクター機能を促進する。エフェクター機能の例には、細胞傷害活性、サイトカインの分泌、増殖、抗アポトーシスシグナル伝達、持続性、拡大増殖、その表面上にホスファチジルセリンを発現する標的細胞もしくは粒子の貪食、抗原提示、またはそれらの任意の組合せが含まれる。 The intracellular signaling domain can include one or more effector domains that can transmit a functional signal to the cell in response to binding of the extracellular domain of the chimeric Tim receptor to phosphatidylserine. Signal transduction by the intracellular signaling domain is triggered by binding of the extracellular domain to phosphatidylserine. Signals transduced by the intracellular signaling domain promote effector functions of chimeric Tim receptor-containing cells. Examples of effector functions include cytotoxic activity, cytokine secretion, proliferation, anti-apoptotic signaling, persistence, expanded proliferation, phagocytosis of target cells or particles expressing phosphatidylserine on their surface, antigen presentation, or Any combination is included.
ある特定の実施形態においては、細胞内シグナル伝達ドメインは、第1の細胞内シグナル伝達ドメインを含む。さらなる実施形態においては、細胞内シグナル伝達ドメインは、第1の細胞内シグナル伝達ドメインと、第2の細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、第1の細胞内シグナル伝達ドメインと、第2の細胞内シグナル伝達ドメインと、第3の細胞内シグナル伝達ドメインとを含む。本開示に記載のキメラTim受容体は、細胞免疫応答を向上させるか、免疫細胞疲弊を低減させるか、またはその両方を行う共刺激を提供しながら、アポトーシス細胞、壊死細胞、損傷細胞、またはストレスを受けた細胞のクリアランスが有益である、様々な治療方法において用いることができる。 In certain embodiments, the intracellular signaling domain comprises a first intracellular signaling domain. In further embodiments, the intracellular signaling domain comprises a first intracellular signaling domain and a second intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a first intracellular signaling domain, a second intracellular signaling domain, and a third intracellular signaling domain. The chimeric Tim receptors described in this disclosure provide co-stimulation to enhance cellular immune responses, reduce immune cell exhaustion, or both, while treating apoptotic, necrotic, injured, or stressed cells. It can be used in a variety of therapeutic methods where clearance of cells that have undergone cytotoxicity is beneficial.
本開示の融合タンパク質の成分部分は、本明細書において詳細にさらに説明される。 The component parts of the fusion proteins of the present disclosure are further described in detail herein.
細胞外ドメイン
本開示のキメラTim4受容体における使用のために好適なTim4結合ドメインは、ホスファチジルセリンに特異的に結合するTim4分子に由来する任意のポリペプチドまたはペプチドであり得る。ある特定の実施形態においては、Tim4結合ドメインは、ヒトTim4に由来する。例示的なヒトTim4分子は、Uniprot.Ref.Q96H15(配列番号1)において提供される。例示的なヒトTim4結合ドメインは、配列番号2または配列番号2のアミノ酸25~314のアミノ酸配列を含むかまたはからなる。例示的なマウスTim4結合ドメインは、配列番号24または配列番号24のアミノ酸23~279のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4結合ドメインは、配列番号2もしくは配列番号2のアミノ酸25~314、または配列番号24もしくは配列番号24のアミノ酸23~279について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4結合ドメインは、配列番号2もしくは配列番号2のアミノ酸25~314、または配列番号24もしくは配列番号24のアミノ酸23~279のアミノ酸配列について、少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。
Extracellular Domain Tim4 binding domains suitable for use in the chimeric Tim4 receptors of the present disclosure can be any polypeptide or peptide derived from the Tim4 molecule that specifically binds phosphatidylserine. In certain embodiments, the Tim4 binding domain is derived from human Tim4. Exemplary human Tim4 molecules are found in Uniprot. Ref. Provided in Q96H15 (SEQ ID NO: 1). An exemplary human Tim4 binding domain comprises or consists of SEQ ID NO:2 or the amino acid sequence of amino acids 25-314 of SEQ ID NO:2. An exemplary mouse Tim4 binding domain comprises or consists of SEQ ID NO:24 or the amino acid sequence of amino acids 23-279 of SEQ ID NO:24. In certain embodiments, the Tim4 binding domain comprises at least about 75%, 80%, 85% of SEQ ID NO:2 or amino acids 25-314 of SEQ ID NO:2, or SEQ ID NO:24 or amino acids 23-279 of SEQ ID NO:24. , 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% of an amino acid sequence comprising or from Become. In certain embodiments, the Tim4 binding domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (e.g., deletions, additions, substitutions) containing amino acid sequences having
ある特定の実施形態においては、細胞外ドメインは、細胞外非シグナル伝達スペーサーまたはリンカードメインを含んでもよい。含まれる場合、そのようなスペーサーまたはリンカードメインは、結合ドメインを宿主細胞表面から離れるように位置させて、適切な細胞/細胞接触、結合および活性化をさらに可能にし得る。本明細書において説明するキメラ受容体に含められる場合、細胞外スペーサードメインは一般的に、キメラTim4受容体の細胞外結合ドメインと膜貫通ドメインとの間に位置する。細胞外スペーサーの長さは、選択された標的分子、選択された結合エピトープ、結合ドメインサイズおよび親和性に基づいて、標的分子結合を最適化するために変動し得る(例えばGuest et al., J. Immunother. 28:203-11, 2005;PCT公開公報WO2014/031687号を参照のこと)。ある特定の実施形態においては、細胞外スペーサードメインは、免疫グロブリンヒンジ領域(例えばIgG1、IgG2、IgG3、IgG4、IgA、IgD)である。免疫グロブリンヒンジ領域は、野生型免疫グロブリンヒンジ領域、または変更された野生型免疫グロブリンヒンジ領域であり得る。変更されたIgG4ヒンジ領域は、PCT公開公報WO2014/031687号において説明されており、当該ヒンジ領域は、その全体を参照により本明細書に組み込む。特定の実施形態においては、細胞外スペーサードメインは、ESKYGPPCPPCP(配列番号3)のアミノ酸配列を有する改変IgG4ヒンジ領域を含む。本明細書において説明するキメラTim受容体において使用され得るヒンジ領域の他の例には、野生型またはその変異型であり得る1型膜タンパク質、例としてCD8a、CD4、CD28およびCD7の細胞外領域からのヒンジ領域が含まれる。一部の実施形態においては、細胞外スペーサードメインは、配列番号32のアミノ酸配列を有するCD28ヒンジ領域を含む。さらなる実施形態においては、細胞外スペーサードメインは、CH1ドメイン、CH2ドメイン、CH3ドメインまたはそれらの組合せから選択される免疫グロブリンFcドメインの全てまたは一部を含む(例えばPCT公開公報WO2014/031687号を参照されたく、当該スペーサーは、その全体を参照により本明細書に組み込む)。またさらなる実施形態においては、細胞外スペーサードメインは、II型Cレクチンの柄領域(C型レクチンドメインと膜貫通ドメインとの間に位置する細胞外ドメイン)を含み得る。II型Cレクチンには、CD23、CD69、CD72、CD94、NKG2AおよびNKG2Dが含まれる。 In certain embodiments, the extracellular domain may include an extracellular non-signaling spacer or linker domain. If included, such spacer or linker domains may position the binding domain away from the host cell surface to further permit proper cell/cell contact, binding and activation. When included in the chimeric receptors described herein, the extracellular spacer domain is generally located between the extracellular binding domain and the transmembrane domain of the chimeric Tim4 receptor. The length of the extracellular spacer can be varied to optimize target molecule binding based on the selected target molecule, selected binding epitope, binding domain size and affinity (e.g., Guest et al., J. Immunother. 28:203-11, 2005; see PCT Publication No. WO 2014/031687). In certain embodiments, the extracellular spacer domain is an immunoglobulin hinge region (eg, IgG1, IgG2, IgG3, IgG4, IgA, IgD). The immunoglobulin hinge region can be a wild-type immunoglobulin hinge region or an altered wild-type immunoglobulin hinge region. A modified IgG 4 hinge region is described in PCT Publication No. WO2014/031687, which is incorporated herein by reference in its entirety. In certain embodiments, the extracellular spacer domain comprises a modified IgG4 hinge region having the amino acid sequence ESKYGPPCPPCP (SEQ ID NO:3). Other examples of hinge regions that can be used in the chimeric Tim receptors described herein include the extracellular regions of type 1 membrane proteins, such as CD8a, CD4, CD28 and CD7, which can be wild type or mutants thereof. includes the hinge region from In some embodiments, the extracellular spacer domain comprises a CD28 hinge region having the amino acid sequence of SEQ ID NO:32. In a further embodiment, the extracellular spacer domain comprises all or part of an immunoglobulin Fc domain selected from CH1 domain, CH2 domain, CH3 domain or combinations thereof (see e.g. PCT Publication No. WO2014/031687). Please, the spacer is incorporated herein by reference in its entirety). In still further embodiments, the extracellular spacer domain may comprise the stalk region of a type II C lectin (the extracellular domain located between the type C lectin domain and the transmembrane domain). Type II C lectins include CD23, CD69, CD72, CD94, NKG2A and NKG2D.
ある特定の実施形態においては、細胞外ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、それらのトランスジェニック種、またはそれらの任意の組合せを含む任意の哺乳動物種に由来するポリヌクレオチド配列を含む。ある特定の実施形態においては、細胞外ドメインは、マウス、ヒト、またはキメラである。 In certain embodiments, the extracellular domain is human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, transgenic species thereof, or any thereof. including polynucleotide sequences from any mammalian species, including combinations of In certain embodiments, the extracellular domain is murine, human, or chimeric.
本明細書において説明するキメラTim4受容体の細胞内シグナル伝達ドメインは、細胞内エフェクタードメインであり、キメラTim4受容体の細胞外ドメインのホスファチジルセリンへの結合に応答して、機能的シグナルを細胞に伝達することができる。細胞内シグナル伝達ドメインによって伝達されるシグナルは、キメラTim4受容体含有細胞のエフェクター機能を促進する。エフェクター機能の例には、細胞傷害活性、サイトカインの分泌、増殖、抗アポトーシスシグナル伝達、持続性、拡大増殖、その表面上にホスファチジルセリンを発現する標的細胞もしくは粒子の貪食、またはそれらの任意の組合せが含まれる。 The intracellular signaling domain of the chimeric Tim4 receptor described herein is an intracellular effector domain that sends a functional signal to the cell in response to binding of the extracellular domain of the chimeric Tim4 receptor to phosphatidylserine. can be transmitted. Signals transduced by the intracellular signaling domain promote effector functions of chimeric Tim4 receptor-containing cells. Examples of effector functions include cytotoxic activity, cytokine secretion, proliferation, anti-apoptotic signaling, persistence, extended proliferation, phagocytosis of target cells or particles expressing phosphatidylserine on their surface, or any combination thereof. is included.
ある特定の実施形態においては、細胞内シグナル伝達ドメインは、共刺激性シグナル伝達ドメインを含む。共刺激性シグナル伝達ドメインは、十分なシグナル伝達活性を保持する共刺激性シグナル伝達分子の任意の部分であり得る。一部の実施形態においては、共刺激性シグナル伝達分子の全長または全長細胞内成分が使用される。一部の実施形態においては、共刺激性シグナル伝達分子または共刺激性シグナル伝達分子の細胞内成分の切断部分が使用され、但し、その切断部分は十分なシグナル伝達活性を保持する。さらなる実施形態においては、共刺激性シグナル伝達ドメインは、共刺激性シグナル伝達分子の全部分または切断部分の変異型であり、但し、その変異型は十分なシグナル伝達活性を保持する(すなわち、機能的変異型である)。 In certain embodiments, the intracellular signaling domain comprises a co-stimulatory signaling domain. A costimulatory signaling domain can be any portion of a costimulatory signaling molecule that retains sufficient signaling activity. In some embodiments, full-length or full-length intracellular components of co-stimulatory signaling molecules are used. In some embodiments, a truncated portion of a costimulatory signaling molecule or intracellular component of a costimulatory signaling molecule is used, provided that the truncated portion retains sufficient signaling activity. In further embodiments, the costimulatory signaling domain is a variant of a full or truncated portion of a costimulatory signaling molecule, provided that the variant retains sufficient signaling activity (i.e., functional is a mutated type).
ある特定の実施形態においては、共刺激性シグナル伝達ドメインは、CD27、CD28、CD40L、GITR、NKG2C、CARD1、CD2、CD7、CD27、CD30、CD40、CD54(ICAM)、CD83、CD134(OX-40)、CD137(4-1BB)、CD150(SLAMF1)、CD152(CTLA4)、CD223(LAG3)、CD226、CD270(HVEM)、PD-1、CD273(PD-L2)、CD274(PD-L1)、B7-H3(CD276)、ICOS(CD278)、DAP10、LAT、LFA-1(CD11a/CD18)、LIGHT、NKG2C、SLP76、TRIM、またはZAP70シグナル伝達ドメインを含む。特定の実施形態においては、共刺激性シグナル伝達ドメインは、OX40、CD2、CD27、CD28、ICAM-1、LFA-1(CD11a/CD18)、ICOS(CD278)、または4-1BB(CD137)シグナル伝達ドメインを含む。例示的なCD28共刺激性シグナル伝達ドメインは、配列番号118または119のアミノ酸配列を含むかまたはからなる。例示的なOX40共刺激性シグナル伝達ドメインは、配列番号120のアミノ酸配列を含むかまたはからなる。例示的なCD2共刺激性シグナル伝達ドメインは、配列番号121のアミノ酸配列を含むかまたはからなる。例示的な4-1BB共刺激性シグナル伝達ドメインは、配列番号122のアミノ酸配列を含むかまたはからなる。例示的なCD27共刺激性シグナル伝達ドメインは、配列番号123のアミノ酸配列を含むかまたはからなる。例示的なICAM-1共刺激性シグナル伝達ドメインは、配列番号124のアミノ酸配列を含むかまたはからなる。例示的なLFA-1共刺激性シグナル伝達ドメインは、配列番号125のアミノ酸配列を含むかまたはからなる。例示的なICOS共刺激性シグナル伝達ドメインは、配列番号126のアミノ酸配列を含むかまたはからなる。例示的なCD30共刺激性シグナル伝達ドメインは、配列番号127のアミノ酸配列を含むかまたはからなる。例示的なCD40共刺激性シグナル伝達ドメインは、配列番号128のアミノ酸配列を含むかまたはからなる。例示的なPD-1共刺激性シグナル伝達ドメインは、配列番号129のアミノ酸配列を含むかまたはからなる。例示的なCD7共刺激性シグナル伝達ドメインは、配列番号130のアミノ酸配列を含むかまたはからなる。例示的なLIGHT共刺激性シグナル伝達ドメインは、配列番号131のアミノ酸配列を含むかまたはからなる。例示的なNKG2C共刺激性シグナル伝達ドメインは、配列番号132のアミノ酸配列を含むかまたはからなる。例示的なB7-H3共刺激性シグナル伝達ドメインは、配列番号133のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、共刺激性シグナル伝達ドメインは、配列番号118~133のうちのいずれか1つについて少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、共刺激性シグナル伝達ドメインは、配列番号118~133のうちのいずれか1つのアミノ酸配列について、少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。ある特定の実施形態においては、細胞内シグナル伝達は、第2の共刺激性シグナル伝達ドメインを含む。好ましい実施形態においては、第1の共刺激性シグナル伝達ドメインおよび第2の共刺激性シグナル伝達ドメインは、異なる。 In certain embodiments, the co-stimulatory signaling domain is CD27, CD28, CD40L, GITR, NKG2C, CARD1, CD2, CD7, CD27, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX-40 ), CD137 (4-1BB), CD150 (SLAMF1), CD152 (CTLA4), CD223 (LAG3), CD226, CD270 (HVEM), PD-1, CD273 (PD-L2), CD274 (PD-L1), B7 - contains H3 (CD276), ICOS (CD278), DAP10, LAT, LFA-1 (CD11a/CD18), LIGHT, NKG2C, SLP76, TRIM, or ZAP70 signaling domains. In certain embodiments, the co-stimulatory signaling domain is OX40, CD2, CD27, CD28, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), or 4-1BB (CD137) signaling Contains domains. An exemplary CD28 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO: 118 or 119. An exemplary OX40 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:120. An exemplary CD2 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:121. An exemplary 4-1BB co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:122. An exemplary CD27 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:123. An exemplary ICAM-1 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:124. An exemplary LFA-1 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:125. An exemplary ICOS co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:126. An exemplary CD30 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:127. An exemplary CD40 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:128. An exemplary PD-1 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:129. An exemplary CD7 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:130. An exemplary LIGHT co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:131. An exemplary NKG2C co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:132. An exemplary B7-H3 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:133. In certain embodiments, the co-stimulatory signaling domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93% of any one of SEQ ID NOs: 118-133 %, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the co-stimulatory signaling domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, Amino acid sequences with 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included. In certain embodiments, the intracellular signaling comprises a second co-stimulatory signaling domain. In preferred embodiments, the first costimulatory signaling domain and the second costimulatory signaling domain are different.
ある特定の実施形態においては、細胞内シグナル伝達ドメインは、ITAM含有活性化ドメインをさらに含む。ITAM含有活性化ドメインは、内因性TCR複合体とは独立して、TCRシグナル伝達を総括し得る。ある特定の実施形態においては、ITAM含有活性化ドメインを介するシグナル伝達は、非限定的に増殖、活性化、分化その他を含む、T細胞応答の媒介をもたらす。ITAM含有活性化ドメインは、十分なシグナル伝達活性を保持するITAM含有活性化ドメイン分子の任意の部分であり得る。一部の実施形態においては、ITAM含有活性化ドメイン分子の全長または全長細胞内成分が使用される。一部の実施形態においては、ITAM含有活性化ドメイン分子またはITAM含有活性化ドメイン分子の細胞内成分の切断部分が使用され、但し、その切断部分は十分なシグナル伝達活性を保持する。さらなる実施形態においては、ITAM含有活性化ドメインは、ITAM含有活性化ドメイン分子の全部分または切断部分の変異型であり、但し、その変異型は十分なシグナル伝達活性を保持する(すなわち、機能的変異型である)。 In certain embodiments, the intracellular signaling domain further comprises an ITAM-containing activation domain. An ITAM-containing activation domain may orchestrate TCR signaling independently of the endogenous TCR complex. In certain embodiments, signaling through ITAM-containing activation domains results in mediation of T cell responses, including but not limited to proliferation, activation, differentiation, and the like. An ITAM-containing activation domain can be any portion of an ITAM-containing activation domain molecule that retains sufficient signaling activity. In some embodiments, full-length or full-length intracellular components of ITAM-containing activation domain molecules are used. In some embodiments, a cleaved portion of an ITAM-containing activation domain molecule or intracellular component of an ITAM-containing activation domain molecule is used, provided that the cleaved portion retains sufficient signaling activity. In further embodiments, the ITAM-containing activation domain is a variant of a full or truncated portion of an ITAM-containing activation domain molecule provided that the variant retains sufficient signaling activity (i.e., functional variant).
本開示のキメラTim4受容体において使用され得るITAM含有活性化ドメインの例には、CD3ζ、CD3γ、CD3δ、CD3ε、CD5、CD22、CD79a、CD278(ICOS)、およびCD66dに由来するものが含まれる。特定の実施形態においては、ITAM含有活性化ドメインは、CD3ζシグナル伝達ドメインである。例示的なCD3ζシグナル伝達ドメインは、配列番号134または135のアミノ酸配列を含むかまたはからなる。例示的なCD3γシグナル伝達ドメインは、配列番号136のアミノ酸配列を含むかまたはからなる。例示的なCD3δシグナル伝達ドメインは、配列番号137のアミノ酸配列を含むかまたはからなる。例示的なCD3εシグナル伝達ドメインは、配列番号138のアミノ酸配列を含むかまたはからなる。例示的なCD5シグナル伝達ドメインは、配列番号139のアミノ酸配列を含むかまたはからなる。例示的なCD22シグナル伝達ドメインは、配列番号140のアミノ酸配列を含むかまたはからなる。例示的なCD79aシグナル伝達ドメインは、配列番号141のアミノ酸配列を含むかまたはからなる。例示的なCD66dシグナル伝達ドメインは、配列番号143のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、ITAM含有活性化ドメインは、配列番号134~141、および143のうちのいずれか1つについて少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、ITAM含有活性化ドメインは、配列番号134~141、および143のうちのいずれか1つについてアミノ酸配列の少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 Examples of ITAM-containing activation domains that may be used in the chimeric Tim4 receptors of the present disclosure include those derived from CD3ζ, CD3γ, CD3δ, CD3ε, CD5, CD22, CD79a, CD278 (ICOS), and CD66d. In certain embodiments, the ITAM-containing activation domain is the CD3ζ signaling domain. An exemplary CD3ζ signaling domain comprises or consists of the amino acid sequence of SEQ ID NO: 134 or 135. An exemplary CD3γ signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:136. An exemplary CD3delta signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:137. An exemplary CD3ε signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:138. An exemplary CD5 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:139. An exemplary CD22 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:140. An exemplary CD79a signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:141. An exemplary CD66d signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:143. In certain embodiments, the ITAM-containing activation domain is at least about 75%, 80%, 85%, 90%, 91%, 92% of any one of SEQ ID NOS: 134-141, and 143 , 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the ITAM-containing activation domain comprises at least about 1, 2, 3, 4, 5, 6, 7, Amino acid sequences with 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included.
別の実施形態においては、細胞内シグナル伝達ドメインは、CD28共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、4-1BB共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。また別の実施形態においては、細胞内シグナル伝達ドメインは、CD27共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、ICOS共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、LFA-1共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、OX40共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、CD2共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。さらに別の実施形態においては、細胞内シグナル伝達ドメインは、ICAM-1共刺激性シグナル伝達ドメインおよびCD3ζシグナル伝達ドメインを含む。 In another embodiment, the intracellular signaling domain comprises a CD28 co-stimulatory signaling domain and a CD3zeta signaling domain. In another embodiment, the intracellular signaling domain comprises a 4-1BB co-stimulatory signaling domain and a CD3ζ signaling domain. In yet another embodiment, the intracellular signaling domain comprises a CD27 co-stimulatory signaling domain and a CD3zeta signaling domain. In another embodiment, the intracellular signaling domain comprises an ICOS co-stimulatory signaling domain and a CD3ζ signaling domain. In another embodiment, the intracellular signaling domain comprises the LFA-1 co-stimulatory signaling domain and the CD3ζ signaling domain. In another embodiment, the intracellular signaling domain comprises an OX40 co-stimulatory signaling domain and a CD3zeta signaling domain. In another embodiment, the intracellular signaling domain comprises a CD2 co-stimulatory signaling domain and a CD3zeta signaling domain. In yet another embodiment, the intracellular signaling domain comprises an ICAM-1 co-stimulatory signaling domain and a CD3ζ signaling domain.
細胞内シグナル伝達ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、およびそれらのトランスジェニック種を含む哺乳動物種に由来し得る。 The intracellular signaling domain can be derived from any mammalian species including human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, and transgenic species thereof.
キメラTim4受容体の膜貫通ドメインは、細胞外ドメインと細胞内シグナル伝達ドメインとを接続し、かつこれらの間に位置する。膜貫通ドメインは、宿主細胞膜を横断する疎水性アルファヘリックスである。膜貫通ドメインは、結合ドメインに、または存在する場合細胞外スペーサードメインに直接的に融合され得る。ある特定の実施形態においては、膜貫通ドメインは、膜内在性タンパク質[例えば受容体、表面抗原分類(CD:cluster of differentiation)分子、酵素、トランスポーター、細胞接着分子その他]に由来する。一実施形態においては、膜貫通ドメインは、細胞外ドメインが由来する分子と同じ分子から選択される。別の実施形態においては、膜貫通ドメインは、細胞内シグナル伝達ドメインが由来する分子と同じ分子から選択される。例えば、キメラTim4受容体は、Tim4結合ドメインおよびTim4膜貫通ドメインを含み得る。別の例においては、キメラTim4受容体は、CD28膜貫通ドメインおよびCD28共刺激性シグナル伝達ドメインを含み得る。ある特定の実施形態においては、膜貫通ドメインおよび細胞外ドメインが異なる分子に由来するか;膜貫通ドメインおよび細胞内シグナル伝達ドメインが異なる分子に由来するか;または膜貫通ドメイン、細胞外ドメイン、および細胞内シグナル伝達ドメインの全部が異なる分子に由来する。本開示のキメラTim4受容体において使用され得る膜貫通ドメインの例には、Tim4、Tim1、CD3ζ、CD3γ、CD3δ、CD3ε、CD28、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154、CD27、CD28、4-1BB、OX40、CD30、CD40、PD-1、ICOS、LFA-1、CD2、CD7、LIGHT、NKG2C、およびB7-H3に由来する膜貫通ドメインが含まれる。例示的なTim4膜貫通ドメインは、配列番号144または23のアミノ酸配列を含むかまたはからなる。例示的なTim1膜貫通ドメインは、配列番号8のアミノ酸配列を含むかまたはからなる。例示的なCD28膜貫通ドメインは、配列番号145のアミノ酸配列を含むかまたはからなる。例示的な4-1BB膜貫通ドメインは、配列番号146のアミノ酸配列を含むかまたはからなる。例示的なOX40膜貫通ドメインは、配列番号147のアミノ酸配列を含むかまたはからなる。例示的なCD27膜貫通ドメインは、配列番号148のアミノ酸配列を含むかまたはからなる。例示的なICOS膜貫通ドメインは、配列番号149のアミノ酸配列を含むかまたはからなる。例示的なCD2膜貫通ドメインは、配列番号150のアミノ酸配列を含むかまたはからなる。例示的なLFA-1膜貫通ドメインは、配列番号151のアミノ酸配列を含むかまたはからなる。例示的なCD30膜貫通ドメインは、配列番号152のアミノ酸配列を含むかまたはからなる。例示的なCD40膜貫通ドメインは、配列番号153のアミノ酸配列を含むかまたはからなる。例示的なPD-1膜貫通ドメインは、配列番号154のアミノ酸配列を含むかまたはからなる。例示的なCD7膜貫通ドメインは、配列番号155のアミノ酸配列を含むかまたはからなる。例示的なLIGHT膜貫通ドメインは、配列番号156のアミノ酸配列を含むかまたはからなる。例示的なNKG2C膜貫通ドメインは、配列番号157のアミノ酸配列を含むかまたはからなる。例示的なB7-H3膜貫通ドメインは、配列番号158のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、膜貫通ドメインは、配列番号8、23および144~158のうちのいずれか1つについて少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、膜貫通ドメインは、配列番号8、23および144~158のうちのいずれか1つのアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、または10箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 The transmembrane domain of the chimeric Tim4 receptor connects and lies between the extracellular and intracellular signaling domains. A transmembrane domain is a hydrophobic alpha helix that spans the host cell membrane. A transmembrane domain may be fused directly to a binding domain or, if present, to an extracellular spacer domain. In certain embodiments, the transmembrane domain is derived from an integral membrane protein [eg, receptor, cluster of differentiation (CD) molecule, enzyme, transporter, cell adhesion molecule, etc.]. In one embodiment, the transmembrane domain is selected from the same molecule from which the extracellular domain is derived. In another embodiment, the transmembrane domain is selected from the same molecule from which the intracellular signaling domain is derived. For example, a chimeric Tim4 receptor can comprise a Tim4 binding domain and a Tim4 transmembrane domain. In another example, a chimeric Tim4 receptor can include a CD28 transmembrane domain and a CD28 co-stimulatory signaling domain. In certain embodiments, the transmembrane domain and the extracellular domain are derived from different molecules; the transmembrane domain and the intracellular signaling domain are derived from different molecules; or the transmembrane domain, the extracellular domain, and All of the intracellular signaling domains are derived from different molecules. Examples of transmembrane domains that can be used in the chimeric Tim4 receptors of the present disclosure include Tim4, Tim1, CD3ζ, CD3γ, CD3δ, CD3ε, CD28, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37. , CD64, CD80, CD86, CD134, CD137, CD154, CD27, CD28, 4-1BB, OX40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, LIGHT, NKG2C, and B7-H3 A transmembrane domain from which is included. An exemplary Tim4 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO: 144 or 23. An exemplary Tim1 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:8. An exemplary CD28 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:145. An exemplary 4-1BB transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:146. An exemplary OX40 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:147. An exemplary CD27 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:148. An exemplary ICOS transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:149. An exemplary CD2 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:150. An exemplary LFA-1 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:151. An exemplary CD30 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:152. An exemplary CD40 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:153. An exemplary PD-1 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:154. An exemplary CD7 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:155. An exemplary LIGHT transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:156. An exemplary NKG2C transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:157. An exemplary B7-H3 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:158. In certain embodiments, the transmembrane domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, It comprises or consists of an amino acid sequence having 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the transmembrane domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, Includes amino acid sequences with 9 or 10 amino acid alterations (eg, deletions, additions, substitutions).
膜貫通ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタおよびそれらのトランスジェニック種を含む任意の哺乳動物種に由来し得る。 The transmembrane domain can be derived from any mammalian species including human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig and transgenic species thereof.
本開示の例示的な成分、構成およびキメラTim4受容体配列が、表1において提供される。 Exemplary components, constructs and chimeric Tim4 receptor sequences of this disclosure are provided in Table 1.
表1.
本明細書において説明するキメラTim4受容体のさらなる実施形態は、Tim4結合ドメインを含む細胞外ドメインと;第1の共刺激性シグナル伝達ドメインおよびITAM含有活性化ドメインを含む細胞内シグナル伝達ドメインであって、ITAM含有活性化ドメインがDAP12シグナル伝達ドメインを含む細胞内シグナル伝達ドメインと;細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインとを含む単鎖キメラタンパク質を含む。 A further embodiment of the chimeric Tim4 receptor described herein is an extracellular domain comprising a Tim4 binding domain; and an intracellular signaling domain comprising a first costimulatory signaling domain and an ITAM-containing activation domain. a transmembrane domain located between and connecting the extracellular and intracellular signaling domains; Contains chimeric proteins.
本開示のキメラTim4受容体における使用のために好適なTim4結合ドメインは、ホスファチジルセリンに特異的に結合するTim4分子に由来する任意のポリペプチドまたはペプチドであり得る。ある特定の実施形態においては、Tim4結合ドメインは、ヒトTim4に由来する。例示的なヒトTim4分子は、Uniprot.Ref.Q96H15(配列番号1)において提供される。例示的なヒトTim4結合ドメインは、配列番号2または配列番号2のアミノ酸25~314のアミノ酸配列を含むかまたはからなる。例示的なマウスTim4結合ドメインは、配列番号24または配列番号24のアミノ酸23~279のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4結合ドメインは、配列番号2もしくは配列番号2のアミノ酸25~314、または配列番号24もしくは配列番号24のアミノ酸23~279について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4結合ドメインは、配列番号2もしくは配列番号2のアミノ酸25~314、または配列番号24もしくは配列番号24のアミノ酸23~279のアミノ酸配列について、少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 A suitable tim4 binding domain for use in the chimeric tim4 receptors of the present disclosure can be any polypeptide or peptide derived from the tim4 molecule that specifically binds phosphatidylserine. In certain embodiments, the Tim4 binding domain is derived from human Tim4. Exemplary human Tim4 molecules are found in Uniprot. Ref. Provided in Q96H15 (SEQ ID NO: 1). An exemplary human Tim4 binding domain comprises or consists of SEQ ID NO:2 or the amino acid sequence of amino acids 25-314 of SEQ ID NO:2. An exemplary mouse Tim4 binding domain comprises or consists of SEQ ID NO:24 or the amino acid sequence of amino acids 23-279 of SEQ ID NO:24. In certain embodiments, the Tim4 binding domain comprises at least about 75%, 80%, 85% of SEQ ID NO:2 or amino acids 25-314 of SEQ ID NO:2, or SEQ ID NO:24 or amino acids 23-279 of SEQ ID NO:24. , 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% of an amino acid sequence comprising or from Become. In certain embodiments, the Tim4 binding domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (e.g., deletions, additions, substitutions) containing amino acid sequences having
ある特定の実施形態においては、細胞外ドメインは、細胞外非シグナル伝達スペーサーまたはリンカードメインを含んでもよい。含まれる場合、そのようなスペーサーまたはリンカードメインは、結合ドメインを、宿主細胞表面から離れるように位置させて、適切な細胞/細胞接触、結合および活性化をさらに可能にし得る。本明細書において説明するキメラ受容体に含められる場合、細胞外スペーサードメインは一般的に、キメラTim4受容体の細胞外結合ドメインと膜貫通ドメインとの間に位置する。細胞外スペーサーの長さは、選択された標的分子、選択された結合エピトープ、結合ドメインサイズおよび親和性に基づいて、標的分子結合を最適化するために変動し得る(例えばGuest et al., J. Immunother. 28:203-11, 2005;PCT公開公報WO2014/031687号を参照のこと)。ある特定の実施形態においては、細胞外スペーサードメインは、免疫グロブリンヒンジ領域(例えばIgG1、IgG2、IgG3、IgG4、IgA、IgD)である。免疫グロブリンヒンジ領域は、野生型免疫グロブリンヒンジ領域または変更された野生型免疫グロブリンヒンジ領域であり得る。変更されたIgG4ヒンジ領域は、PCT公開公報WO2014/031687号において説明されており、当該ヒンジ領域は、その全体を参照により本明細書に組み込む。特定の実施形態においては、細胞外スペーサードメインは、ESKYGPPCPPCP(配列番号3)のアミノ酸配列を有する改変IgG4ヒンジ領域を含む。本明細書において説明するキメラTim4受容体において使用され得るヒンジ領域の他の例には、野生型またはその変異型であり得る1型膜タンパク質、例としてCD8a、CD4、CD28およびCD7の細胞外領域からのヒンジ領域が含まれる。一部の実施形態においては、細胞外スペーサードメインは、配列番号32のアミノ酸配列を有するCD28ヒンジ領域を含む。さらなる実施形態においては、細胞外スペーサードメインは、CH1ドメイン、CH2ドメイン、CH3ドメインまたはそれらの組合せから選択される免疫グロブリンFcドメインの全てまたは一部を含む(例えばPCT公開公報WO2014/031687号を参照されたく、当該スペーサーは、その全体を参照により本明細書に組み込む)。またさらなる実施形態においては、細胞外スペーサードメインは、II型Cレクチンの柄領域(C型レクチンドメインと膜貫通ドメインとの間に位置する細胞外ドメイン)を含み得る。II型Cレクチンには、CD23、CD69、CD72、CD94、NKG2AおよびNKG2Dが含まれる。 In certain embodiments, the extracellular domain may include an extracellular non-signaling spacer or linker domain. If included, such spacer or linker domains may position the binding domain away from the host cell surface to further permit proper cell/cell contact, binding and activation. When included in the chimeric receptors described herein, the extracellular spacer domain is generally located between the extracellular binding domain and the transmembrane domain of the chimeric Tim4 receptor. The length of the extracellular spacer can be varied to optimize target molecule binding based on the selected target molecule, selected binding epitope, binding domain size and affinity (e.g., Guest et al., J. Immunother. 28:203-11, 2005; see PCT Publication No. WO 2014/031687). In certain embodiments, the extracellular spacer domain is an immunoglobulin hinge region (eg, IgG1, IgG2, IgG3, IgG4, IgA, IgD). The immunoglobulin hinge region can be a wild-type immunoglobulin hinge region or an altered wild-type immunoglobulin hinge region. A modified IgG 4 hinge region is described in PCT Publication No. WO2014/031687, which is incorporated herein by reference in its entirety. In certain embodiments, the extracellular spacer domain comprises a modified IgG4 hinge region having the amino acid sequence ESKYGPPCPPCP (SEQ ID NO:3). Other examples of hinge regions that can be used in the chimeric Tim4 receptors described herein include extracellular regions of type 1 membrane proteins, such as CD8a, CD4, CD28 and CD7, which can be wild type or mutants thereof. includes the hinge region from In some embodiments, the extracellular spacer domain comprises a CD28 hinge region having the amino acid sequence of SEQ ID NO:32. In a further embodiment, the extracellular spacer domain comprises all or part of an immunoglobulin Fc domain selected from CH1 domain, CH2 domain, CH3 domain or combinations thereof (see e.g. PCT Publication No. WO2014/031687). Please, the spacer is incorporated herein by reference in its entirety). In still further embodiments, the extracellular spacer domain may comprise the stalk region of a type II C lectin (the extracellular domain located between the type C lectin domain and the transmembrane domain). Type II C lectins include CD23, CD69, CD72, CD94, NKG2A and NKG2D.
ある特定の実施形態においては、細胞外ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、それらのトランスジェニック種、またはそれらの任意の組合せを含む任意の哺乳動物種に由来するポリヌクレオチド配列を含む。ある特定の実施形態においては、細胞外ドメインは、マウス、ヒト、またはキメラである。 In certain embodiments, the extracellular domain is human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, transgenic species thereof, or any thereof. including polynucleotide sequences from any mammalian species, including combinations of In certain embodiments, the extracellular domain is murine, human, or chimeric.
ある特定の実施形態においては、細胞内シグナル伝達ドメインは、共刺激性シグナル伝達ドメインとITAM含有活性化ドメインとを含み、ITAM含有活性化ドメインは、DAP12シグナル伝達ドメインを含む。共刺激性シグナル伝達ドメインは、十分なシグナル伝達活性を保持する共刺激性シグナル伝達分子の任意の部分であり得る。一部の実施形態においては、共刺激性シグナル伝達分子の全長または全長細胞内成分が使用される。一部の実施形態においては、共刺激性シグナル伝達分子または共刺激性シグナル伝達分子の細胞内成分の切断部分が使用され、但し、その切断部分は十分なシグナル伝達活性を保持する。さらなる実施形態においては、共刺激性シグナル伝達ドメインは、共刺激性シグナル伝達分子の全部分または切断部分の変異型であり、但し、その変異型は十分なシグナル伝達活性を保持する(すなわち、機能的変異型である)。 In certain embodiments, the intracellular signaling domain comprises a costimulatory signaling domain and an ITAM-containing activation domain, wherein the ITAM-containing activation domain comprises a DAP12 signaling domain. A costimulatory signaling domain can be any portion of a costimulatory signaling molecule that retains sufficient signaling activity. In some embodiments, full-length or full-length intracellular components of co-stimulatory signaling molecules are used. In some embodiments, a truncated portion of a costimulatory signaling molecule or intracellular component of a costimulatory signaling molecule is used, provided that the truncated portion retains sufficient signaling activity. In further embodiments, the costimulatory signaling domain is a variant of a full or truncated portion of a costimulatory signaling molecule, provided that the variant retains sufficient signaling activity (i.e., functional is a mutated type).
ある特定の実施形態においては、共刺激性シグナル伝達ドメインは、CD27、CD28、CD40L、GITR、NKG2C、CARD1、CD2、CD7、CD27、CD30、CD40、CD54(ICAM)、CD83、CD134(OX-40)、CD137(4-1BB)、CD150(SLAMF1)、CD152(CTLA4)、CD223(LAG3)、CD226、CD270(HVEM)、PD-1、CD273(PD-L2)、CD274(PD-L1)、B7-H3(CD276)、ICOS(CD278)、DAP10、LAT、LFA-1(CD11a/CD18)、LIGHT、NKG2C、SLP76、またはTRIMシグナル伝達ドメインを含む。特定の実施形態においては、共刺激性シグナル伝達ドメインは、OX40、CD2、CD27、CD28、ICAM-1、LFA-1(CD11a/CD18)、ICOS(CD278)または4-1BB(CD137)シグナル伝達ドメインを含む。例示的なCD28共刺激性シグナル伝達ドメインは、配列番号164または165のアミノ酸配列を含むかまたはからなる。例示的なOX40共刺激性シグナル伝達ドメインは、配列番号166のアミノ酸配列を含むかまたはからなる。例示的なCD2共刺激性シグナル伝達ドメインは、配列番号167のアミノ酸配列を含むかまたはからなる。例示的な4-1BB共刺激性シグナル伝達ドメインは、配列番号168のアミノ酸配列を含むかまたはからなる。例示的なCD27共刺激性シグナル伝達ドメインは、配列番号169のアミノ酸配列を含むかまたはからなる。例示的なICAM-1共刺激性シグナル伝達ドメインは、配列番号170のアミノ酸配列を含むかまたはからなる。例示的なLFA-1共刺激性シグナル伝達ドメインは、配列番号171のアミノ酸配列を含むかまたはからなる。例示的なICOS共刺激性シグナル伝達ドメインは、配列番号172のアミノ酸配列を含むかまたはからなる。例示的なCD30共刺激性シグナル伝達ドメインは、配列番号173のアミノ酸配列を含むかまたはからなる。例示的なCD40共刺激性シグナル伝達ドメインは、配列番号174のアミノ酸配列を含むかまたはからなる。例示的なPD-1共刺激性シグナル伝達ドメインは、配列番号175のアミノ酸配列を含むかまたはからなる。例示的なCD7共刺激性シグナル伝達ドメインは、配列番号176のアミノ酸配列を含むかまたはからなる。例示的なLIGHT共刺激性シグナル伝達ドメインは、配列番号177のアミノ酸配列を含むかまたはからなる。例示的なNKG2C共刺激性シグナル伝達ドメインは、配列番号178のアミノ酸配列を含むかまたはからなる。例示的なB7-H3共刺激性シグナル伝達ドメインは、配列番号179のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、共刺激性シグナル伝達ドメインは、配列番号164~179のうちのいずれか1つについて少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、共刺激性シグナル伝達ドメインは、配列番号164~179のうちのいずれか1つのアミノ酸配列について、少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。ある特定の実施形態においては、細胞内シグナル伝達は、第2の共刺激性シグナル伝達ドメインを含む。好ましい実施形態においては、第1の共刺激性シグナル伝達ドメインおよび第2の共刺激性シグナル伝達ドメインは、異なる。 In certain embodiments, the co-stimulatory signaling domain is CD27, CD28, CD40L, GITR, NKG2C, CARD1, CD2, CD7, CD27, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX-40 ), CD137 (4-1BB), CD150 (SLAMF1), CD152 (CTLA4), CD223 (LAG3), CD226, CD270 (HVEM), PD-1, CD273 (PD-L2), CD274 (PD-L1), B7 - contains H3 (CD276), ICOS (CD278), DAP10, LAT, LFA-1 (CD11a/CD18), LIGHT, NKG2C, SLP76, or TRIM signaling domains. In certain embodiments, the co-stimulatory signaling domain is the OX40, CD2, CD27, CD28, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) or 4-1BB (CD137) signaling domain including. An exemplary CD28 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:164 or 165. An exemplary OX40 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:166. An exemplary CD2 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:167. An exemplary 4-1BB co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:168. An exemplary CD27 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:169. An exemplary ICAM-1 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:170. An exemplary LFA-1 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:171. An exemplary ICOS co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:172. An exemplary CD30 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:173. An exemplary CD40 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:174. An exemplary PD-1 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:175. An exemplary CD7 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:176. An exemplary LIGHT co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:177. An exemplary NKG2C co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:178. An exemplary B7-H3 co-stimulatory signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:179. In certain embodiments, the co-stimulatory signaling domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93% of any one of SEQ ID NOs: 164-179. %, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the co-stimulatory signaling domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, Amino acid sequences with 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included. In certain embodiments, the intracellular signaling comprises a second co-stimulatory signaling domain. In preferred embodiments, the first costimulatory signaling domain and the second costimulatory signaling domain are different.
DAP12シグナル伝達ドメインは、内因性TCR複合体とは独立して、TCRシグナル伝達を総括し得る。ある特定の実施形態においては、DAP12シグナル伝達ドメインを介するシグナル伝達は、非限定的に増殖、活性化、分化その他を含む、T細胞応答の媒介をもたらす。DAP12シグナル伝達ドメインは、十分なシグナル伝達活性を保持するDAP12分子の任意の部分であり得る。一部の実施形態においては、DAP12分子の全長または全長細胞内成分が使用される。一部の実施形態においては、DAP12の切断部分またはDAP12の細胞内成分が使用され、但し、その切断部分は十分なシグナル伝達活性を保持する。さらなる実施形態においては、DAP12シグナル伝達ドメインは、DAP12の全部分または切断部分の変異型であり、但し、その変異型は十分なシグナル伝達活性を保持する(すなわち、機能的変異型である)。 The DAP12 signaling domain may oversee TCR signaling independently of the endogenous TCR complex. In certain embodiments, signaling through the DAP12 signaling domain results in mediation of T cell responses, including but not limited to proliferation, activation, differentiation, and the like. A DAP12 signaling domain can be any portion of the DAP12 molecule that retains sufficient signaling activity. In some embodiments, full-length or full-length intracellular components of the DAP12 molecule are used. In some embodiments, a truncated portion of DAP12 or an intracellular component of DAP12 is used, provided that the truncated portion retains sufficient signaling activity. In further embodiments, the DAP12 signaling domain is a variant of a full or truncated portion of DAP12, provided that the variant retains sufficient signaling activity (ie, is a functional variant).
例示的なヒトDAP12分子は、Uniprot.Ref.O43914において提供される。例示的なDAP12シグナル伝達ドメインは、配列番号180のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、DAP12シグナル伝達ドメインは、配列番号180について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、DAP12シグナル伝達ドメインは、配列番号180についてのアミノ酸配列について、少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 Exemplary human DAP12 molecules are found in Uniprot. Ref. O43914. An exemplary DAP12 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:180. In certain embodiments, the DAP12 signaling domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, It comprises or consists of amino acid sequences having 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the DAP12 signaling domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 , 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions).
別の実施形態においては、細胞内シグナル伝達ドメインは、CD28共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、4-1BB共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。また別の実施形態においては、細胞内シグナル伝達ドメインは、CD27共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、ICOS共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、LFA-1共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。別の実施形態においては、細胞内シグナル伝達ドメインは、OX40共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。また別の実施形態においては、細胞内シグナル伝達ドメインは、CD2共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。さらに別の実施形態においては、細胞内シグナル伝達ドメインは、ICAM-1共刺激性シグナル伝達ドメインとDAP12シグナル伝達ドメインとを含む。 In another embodiment, the intracellular signaling domain comprises a CD28 co-stimulatory signaling domain and a DAP12 signaling domain. In another embodiment, the intracellular signaling domain comprises a 4-1BB co-stimulatory signaling domain and a DAP12 signaling domain. In yet another embodiment, the intracellular signaling domain comprises a CD27 co-stimulatory signaling domain and a DAP12 signaling domain. In another embodiment, the intracellular signaling domain comprises an ICOS co-stimulatory signaling domain and a DAP12 signaling domain. In another embodiment, the intracellular signaling domain comprises an LFA-1 co-stimulatory signaling domain and a DAP12 signaling domain. In another embodiment, the intracellular signaling domain comprises an OX40 co-stimulatory signaling domain and a DAP12 signaling domain. In yet another embodiment, the intracellular signaling domain comprises a CD2 co-stimulatory signaling domain and a DAP12 signaling domain. In yet another embodiment, the intracellular signaling domain comprises an ICAM-1 co-stimulatory signaling domain and a DAP12 signaling domain.
細胞内シグナル伝達ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、およびそれらのトランスジェニック種を含む哺乳動物種に由来し得る。 The intracellular signaling domain can be derived from mammalian species including human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, and transgenic species thereof.
ある特定の実施形態においては、膜貫通ドメインは、膜内在性タンパク質[例えば受容体、表面抗原分類(CD)分子、酵素、トランスポーター、細胞接着分子その他]に由来する。一実施形態においては、膜貫通ドメインは、細胞外ドメインが由来する分子と同じ分子から選択される。別の実施形態においては、膜貫通ドメインは、細胞内シグナル伝達ドメインが由来する分子と同じ分子から選択される。例えば、キメラTim4受容体は、Tim4結合ドメインおよびTim4膜貫通ドメインを含み得る。別の例においては、キメラTim4受容体は、CD28膜貫通ドメインおよびCD28共刺激性シグナル伝達ドメインを含み得る。ある特定の実施形態においては、膜貫通ドメインおよび細胞外ドメインが異なる分子に由来するか;膜貫通ドメインおよび細胞内シグナル伝達ドメインが異なる分子に由来するか;または膜貫通ドメイン、細胞外ドメイン、および細胞内シグナル伝達ドメインの全部が異なる分子に由来する。本開示のキメラTim4受容体において使用され得る膜貫通ドメインの例には、Tim4、CD3ζ、CD3γ、CD3δ、CD3ε、CD28、CD45、CD4、CD5、CD8、CD9、CD16、CD22、CD33、CD37、CD64、CD80、CD86、CD134、CD137、CD154、CD27、CD28、4-1BB、OX40、CD30、CD40、PD-1、ICOS、LFA-1、CD2、CD7、LIGHT、NKG2C、およびB7-H3に由来する膜貫通ドメインが含まれる。例示的なTim4膜貫通ドメインは、配列番号144または23のアミノ酸配列を含むかまたはからなる。例示的なCD28膜貫通ドメインは、配列番号181のアミノ酸配列を含むかまたはからなる。例示的な4-1BB膜貫通ドメインは、配列番号182のアミノ酸配列を含むかまたはからなる。例示的なOX40膜貫通ドメインは、配列番号183のアミノ酸配列を含むかまたはからなる。例示的なCD27膜貫通ドメインは、配列番号184のアミノ酸配列を含むかまたはからなる。例示的なICOS膜貫通ドメインは、配列番号185のアミノ酸配列を含むかまたはからなる。例示的なCD2膜貫通ドメインは、配列番号186のアミノ酸配列を含むかまたはからなる。例示的なLFA-1膜貫通ドメインは、配列番号187のアミノ酸配列を含むかまたはからなる。例示的なCD30膜貫通ドメインは、配列番号188のアミノ酸配列を含むかまたはからなる。例示的なCD40膜貫通ドメインは、配列番号189のアミノ酸配列を含むかまたはからなる。例示的なPD-1膜貫通ドメインは、配列番号190のアミノ酸配列を含むかまたはからなる。例示的なCD7膜貫通ドメインは、配列番号191のアミノ酸配列を含むかまたはからなる。例示的なLIGHT膜貫通ドメインは、配列番号192のアミノ酸配列を含むかまたはからなる。例示的なNKG2C膜貫通ドメインは、配列番号193のアミノ酸配列を含むかまたはからなる。例示的なB7-H3膜貫通ドメインは、配列番号194のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、膜貫通ドメインは、配列番号23、144、および181~194のうちのいずれか1つについて少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、膜貫通ドメインは、配列番号23、144、および181~194のうちのいずれか1つのアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、または10箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 In certain embodiments, the transmembrane domain is derived from an integral membrane protein [eg, receptors, surface antigen class (CD) molecules, enzymes, transporters, cell adhesion molecules, etc.]. In one embodiment, the transmembrane domain is selected from the same molecule from which the extracellular domain is derived. In another embodiment, the transmembrane domain is selected from the same molecule from which the intracellular signaling domain is derived. For example, a chimeric Tim4 receptor can comprise a Tim4 binding domain and a Tim4 transmembrane domain. In another example, a chimeric Tim4 receptor can include a CD28 transmembrane domain and a CD28 co-stimulatory signaling domain. In certain embodiments, the transmembrane domain and the extracellular domain are derived from different molecules; the transmembrane domain and the intracellular signaling domain are derived from different molecules; or the transmembrane domain, the extracellular domain, and All of the intracellular signaling domains are derived from different molecules. Examples of transmembrane domains that can be used in the chimeric Tim4 receptors of the present disclosure include Tim4, CD3ζ, CD3γ, CD3δ, CD3ε, CD28, CD45, CD4, CD5, CD8, CD9, CD16, CD22, CD33, CD37, CD64. , CD80, CD86, CD134, CD137, CD154, CD27, CD28, 4-1BB, OX40, CD30, CD40, PD-1, ICOS, LFA-1, CD2, CD7, LIGHT, NKG2C, and B7-H3 It contains a transmembrane domain. An exemplary Tim4 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO: 144 or 23. An exemplary CD28 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:181. An exemplary 4-1BB transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:182. An exemplary OX40 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:183. An exemplary CD27 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:184. An exemplary ICOS transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:185. An exemplary CD2 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:186. An exemplary LFA-1 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:187. An exemplary CD30 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:188. An exemplary CD40 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:189. An exemplary PD-1 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:190. An exemplary CD7 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:191. An exemplary LIGHT transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:192. An exemplary NKG2C transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:193. An exemplary B7-H3 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:194. In certain embodiments, the transmembrane domain is at least about 75%, 80%, 85%, 90%, 91%, 92% of any one of SEQ ID NOS:23, 144, and 181-194 , 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the transmembrane domain is at least about 1, 2, 3, 4, 5, 6, 7, 8 amino acid sequences of any one of SEQ ID NOS:23, 144, and 181-194 , 9, or 10 amino acid alterations (eg, deletions, additions, substitutions).
膜貫通ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、およびそれらのトランスジェニック種を含む任意の哺乳動物種に由来し得る。 The transmembrane domain can be derived from any mammalian species, including humans, primates, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, and transgenic species thereof.
ある特定の実施形態においては、キメラTim4受容体は、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、それらのトランスジェニック種またはそれらの任意の組合せを含む任意の哺乳動物種に由来するポリヌクレオチド配列を含む。ある特定の実施形態においてはキメラTim4受容体は、マウス、キメラ、ヒトまたはヒト化キメラTim4受容体である。 In certain embodiments, the chimeric Tim4 receptor is human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, transgenic species thereof, or any thereof. including polynucleotide sequences from any mammalian species, including combinations of In certain embodiments, the chimeric Tim4 receptor is a murine, chimeric, human or humanized chimeric Tim4 receptor.
本明細書において説明するキメラTim4受容体の1つのドメインの別のドメインへの直接的融合は、介在性接合部アミノ酸の存在を排除しないと理解される。接合部アミノ酸は、天然または非天然(例えばキメラタンパク質のコンストラクト設計から生じる)であり得る。例えば、接合部アミノ酸は、1つのドメインの別のドメインへの接合またはベクターへのキメラTim4受容体をコードするポリヌクレオチドのクローニングのために用いられる制限酵素部位から生じ得る。 It is understood that the direct fusion of one domain of the chimeric Tim4 receptor described herein to another does not preclude the presence of intervening junctional amino acids. Junctional amino acids can be natural or non-natural (eg, resulting from the construct design of the chimeric protein). For example, junctional amino acids can arise from restriction enzyme sites used for joining one domain to another or cloning a polynucleotide encoding a chimeric Tim4 receptor into a vector.
本開示の例示的な成分、構成およびキメラTim4受容体配列が、表2において提供される。 Exemplary components, constructs and chimeric Tim4 receptor sequences of this disclosure are provided in Table 2.
表2.
実施形態においては、キメラTim受容体は、(a)(i)Tim1 IgVドメインまたはTim4 IgVドメインと;(ii)Tim1ムチンドメインまたはTim4ムチンドメインとを含む結合ドメインを含む細胞外ドメインと;(b)一次細胞内シグナル伝達ドメインおよび適宜の二次細胞内シグナル伝達ドメインを含む細胞内シグナル伝達ドメインと;(c)細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインとを含む単鎖キメラタンパク質を含む。 In embodiments, the chimeric tim receptor comprises (a) an extracellular domain comprising a binding domain comprising (i) a Tim1 IgV domain or a Tim4 IgV domain; and (ii) a Tim1 mucin domain or a Tim4 mucin domain; ) an intracellular signaling domain comprising a primary intracellular signaling domain and optionally a secondary intracellular signaling domain; and (c) located between and connecting the extracellular domain and the intracellular signaling domain. A single-chain chimeric protein comprising a transmembrane domain and a transmembrane domain.
特定の実施形態においては、結合ドメインは、(i)Tim1 IgVドメインおよびTim1ムチンドメイン;(ii)Tim4 IgVドメインおよびTim4ムチンドメイン;(iii)Tim1 IgVドメインおよびTim4ムチンドメイン;または(iv)Tim4 IgVドメインおよびTim1ムチンドメインを含む。ある特定の実施形態においては、本明細書において説明するキメラTim受容体の細胞外ドメインは、結合ドメインと膜貫通ドメインとの間に位置し、かつこれらを接続する細胞外スペーサードメインを含んでもよい。 In certain embodiments, the binding domain is (i) Tim1 IgV domain and Tim1 mucin domain; (ii) Tim4 IgV domain and Tim4 mucin domain; (iii) Tim1 IgV domain and Tim4 mucin domain; or (iv) Tim4 IgV domain and the Tim1 mucin domain. In certain embodiments, the extracellular domain of the chimeric Tim receptor described herein may comprise an extracellular spacer domain located between and connecting the binding domain and the transmembrane domain. .
宿主細胞において発現される場合、本開示のキメラTim受容体は、改変された宿主細胞に対して、ホスファチジルセリン特異的細胞傷害表現型を与え得る(例えば、宿主細胞が、その表面上にホスファチジルセリンを発現するストレスを受けた細胞、損傷細胞、傷害細胞、アポトーシス細胞、または壊死細胞に対して細胞傷害性になる)。ある特定の実施形態においては、キメラTim受容体は、グランザイム、パーフォリン、グラニュライシンまたはそれらの任意の組合せの放出を介してターゲティング細胞においてアポトーシスを誘導する。さらなる実施形態においては、本説明に記載のキメラTim受容体を発現する細胞は、ホスファチジルセリン提示細胞に対して特異的な貪食表現型を示す。 When expressed in a host cell, a chimeric Tim receptor of the present disclosure can confer a phosphatidylserine-specific cytotoxic phenotype on an engineered host cell (e.g., when a host cell has phosphatidylserine on its surface). become cytotoxic to stressed, injured, injured, apoptotic, or necrotic cells that express In certain embodiments, chimeric Tim receptors induce apoptosis in targeted cells through the release of granzymes, perforins, granulysins, or any combination thereof. In further embodiments, cells expressing the chimeric Tim receptors described herein exhibit a phagocytic phenotype specific for phosphatidylserine presenting cells.
細胞内シグナル伝達ドメインは、改変された宿主細胞を共刺激する1つまたは複数のエフェクター(「共刺激性シグナル伝達」とも呼ばれる)ドメインを含み得る。細胞内シグナル伝達ドメインによるシグナル伝達は、ホスファチジルセリンへの細胞外ドメインの結合により誘発される。ある特定の実施形態においては、細胞内シグナル伝達ドメインは、第1の細胞内シグナル伝達ドメインを含む。さらなる実施形態においては、細胞内シグナル伝達ドメインは、第1の細胞内シグナル伝達ドメインと第2の細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、第1の細胞内シグナル伝達ドメインと、第2の細胞内シグナル伝達ドメインと、第3の細胞内シグナル伝達ドメインとを含む。本開示に記載のキメラTim受容体は、細胞免疫応答を向上させるか、免疫細胞疲弊を低減させるか、またはその両方を行う共刺激を提供しながら、アポトーシス細胞、壊死細胞、損傷細胞、またはストレスを受けた細胞のクリアランスが有益である、様々な治療方法において用いることができる。 An intracellular signaling domain may include one or more effector (also called "co-stimulatory signaling") domains that co-stimulate the modified host cell. Signal transduction by the intracellular signaling domain is triggered by binding of the extracellular domain to phosphatidylserine. In certain embodiments, the intracellular signaling domain comprises a first intracellular signaling domain. In further embodiments, the intracellular signaling domain comprises a first intracellular signaling domain and a second intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a first intracellular signaling domain, a second intracellular signaling domain, and a third intracellular signaling domain. The chimeric Tim receptors described in this disclosure provide co-stimulation to enhance cellular immune responses, reduce immune cell exhaustion, or both, while treating apoptotic, necrotic, injured, or stressed cells. It can be used in a variety of therapeutic methods where clearance of cells that have undergone cytotoxicity is beneficial.
本明細書において説明する通り、キメラTim受容体は、Tim結合ドメインを含む細胞外ドメインを含む。Tim結合ドメインは、負に荷電した頭部基を有するリン脂質であり、かつ細胞膜の成分であるホスファチジルセリン(PtdSer)に対する特異性を与える。健康な細胞においては、ホスファチジルセリンは、細胞膜の内側リーフレットにおいて優勢的に見出される。しかしながら、細胞がストレスを受けるか、損傷するかまたはアポトーシスもしくは壊死を受けたとき、ホスファチジルセリンは細胞膜の外側リーフレット上に曝露される。したがって、ホスファチジルセリンは、ストレスを受けた細胞、損傷細胞、アポトーシス細胞、壊死細胞、ピロトーシス細胞、または腫張細胞を区別するためのマーカーとして用いることができる。Tim結合ドメインによるホスファチジルセリンの結合は、ホスファチジルセリンと別の分子との間の相互作用を遮断し、かつ例えば、ホスファチジルセリンのある特定の機能(例えばシグナル伝達)を妨害、低減または除去し得る。一部の実施形態においては、ホスファチジルセリンの結合は、除去のために、ある特定の生物学的経路を誘導するか、またはホスファチジルセリン分子またはホスファチジルセリンを発現する細胞を特定し得る。 As described herein, chimeric Tim receptors contain an extracellular domain that includes a Tim binding domain. The Tim-binding domain confers specificity for phosphatidylserine (PtdSer), a phospholipid with a negatively charged head group and a component of cell membranes. In healthy cells, phosphatidylserine is found predominantly in the inner leaflet of the cell membrane. However, when cells are stressed, injured, or undergo apoptosis or necrosis, phosphatidylserine is exposed on the outer leaflet of the cell membrane. Phosphatidylserine can therefore be used as a marker to distinguish between stressed, damaged, apoptotic, necrotic, pyroptotic, or swollen cells. Binding of phosphatidylserine by the Tim-binding domain blocks interactions between phosphatidylserine and another molecule and can, for example, interfere with, reduce or eliminate certain functions of phosphatidylserine, such as signal transduction. In some embodiments, binding of phosphatidylserine may induce certain biological pathways or identify phosphatidylserine molecules or cells expressing phosphatidylserine for removal.
本開示のキメラTim受容体における使用のために好適なTim結合ドメインは、ホスファチジルセリンに特異的に結合するTim1および/またはTim4分子に由来する任意のポリペプチドまたはペプチドであり得る。実施形態においては、Tim結合ドメインは、Tim1またはTim4に由来するIgVドメイン、およびTim1またはTim4に由来するムチンドメインを含む。例えば、Tim結合ドメインは、Tim1 IgVドメインおよびTim1ムチンドメインを含み得る。別の例においては、Tim結合ドメインは、Tim1 IgVドメインおよびTim4ムチンドメインを含み得る。別の例においては、Tim結合ドメインは、Tim4 IgVドメインおよびTim1ムチンドメインを含み得る。別の例においては、Tim結合ドメインは、Tim4 IgVドメインおよびTim4ムチンドメインを含み得る。 Tim-binding domains suitable for use in the chimeric Tim receptors of the present disclosure can be any polypeptide or peptide derived from Tim1 and/or Tim4 molecules that specifically binds phosphatidylserine. In embodiments, the tim-binding domain comprises an IgV domain derived from Tim1 or Tim4 and a mucin domain derived from Tim1 or Tim4. For example, a Tim-binding domain can include a Tim1 IgV domain and a Tim1 mucin domain. In another example, a Tim-binding domain can include a Tim1 IgV domain and a Tim4 mucin domain. In another example, a Tim-binding domain can include a Tim4 IgV domain and a Tim1 mucin domain. In another example, a Tim-binding domain can include a Tim4 IgV domain and a Tim4 mucin domain.
ホスファチジルセリン結合は一般的に、IgVドメインによって調節される。コアホスファチジルセリン結合ドメインは、IgVドメインにおける4つのアミノ酸配列(例えば配列番号34のアミノ酸95~98または配列番号38のアミノ酸92~95)である。Tim4結合ドメインは、低ホスファチジルセリン密度を有する細胞に最小限に結合する。Tim1結合ドメインは、より低いホスファチジルセリン密度に対して、より強く結合し、応答に対するより低い閾値を生じる。ホスファチジルセリンに対するTim1およびTim4結合の概要が、表3において提供される。Tim1 IgVドメインとTim4ムチンドメイン、またはTim4 IgVドメインとTim1ムチンドメインとを組み合わせることにより、ホスファチジルセリンに対する結合ドメインの結合親和性を変調させることができる。さらに、Tim結合ドメインにおけるそのような組合せはまた、Tim4のホスファチジルセリンに対する感受性とTim1のタンパク質発現における安定性との組合せも提供する。 Phosphatidylserine binding is generally regulated by the IgV domain. The core phosphatidylserine binding domain is a four amino acid sequence in the IgV domain (eg, amino acids 95-98 of SEQ ID NO:34 or amino acids 92-95 of SEQ ID NO:38). The Tim4 binding domain minimally binds to cells with low phosphatidylserine density. The Tim1 binding domain binds more strongly to lower phosphatidylserine densities, resulting in a lower threshold for response. A summary of Tim1 and Tim4 binding to phosphatidylserine is provided in Table 3. By combining the Tim1 IgV domain with the Tim4 mucin domain, or the Tim4 IgV domain with the Tim1 mucin domain, the binding affinity of the binding domain for phosphatidylserine can be modulated. Moreover, such a combination in the Tim-binding domain also provides a combination of Tim4 sensitivity to phosphatidylserine and Tim1 stability in protein expression.
表3.
加えて、IgVドメイン中のRGDドメイン(例えば配列番号34のアミノ酸68~70)は、貪食に関する共受容体として、インテグリン結合を調節し得る。 In addition, the RGD domain in the IgV domain (eg amino acids 68-70 of SEQ ID NO:34) can regulate integrin binding as a co-receptor for phagocytosis.
ある特定の実施形態においては、Tim結合ドメインは、ヒトTim1および/またはTim4に由来する。例示的なヒトTim1分子は、Uniprot.Ref.Q96D42(配列番号36)において提供される。例示的なヒトTim1結合ドメインは、配列番号37または配列番号43のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim1結合ドメインは、配列番号37または配列番号43について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim1結合ドメインは、配列番号37または配列番号43のアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 In certain embodiments, the Tim-binding domain is derived from human Tim1 and/or Tim4. Exemplary human Tim1 molecules are found in Uniprot. Ref. Provided in Q96D42 (SEQ ID NO:36). An exemplary human Tim1 binding domain comprises or consists of the amino acid sequence of SEQ ID NO:37 or SEQ ID NO:43. In certain embodiments, the Tim1 binding domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, It comprises or consists of amino acid sequences having 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the Tim1 binding domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, Amino acid sequences with 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included.
例示的なヒトTim4分子は、Uniprot.Ref.Q96H15(配列番号1)において提供される。例示的なヒトTim4結合ドメインは、配列番号2または配列番号42のアミノ酸配列を含むかまたはからなる。例示的なマウスTim4結合ドメインは、配列番号24または配列番号24のアミノ酸23~279のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4結合ドメインは、配列番号2もしくは配列番号42、または配列番号24もしくは配列番号24のアミノ酸23~279について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4結合ドメインは、配列番号2もしくは配列番号42、または配列番号24もしくは配列番号24のアミノ酸23~279のアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 Exemplary human Tim4 molecules are found in Uniprot. Ref. Provided in Q96H15 (SEQ ID NO: 1). An exemplary human Tim4 binding domain comprises or consists of the amino acid sequence of SEQ ID NO:2 or SEQ ID NO:42. An exemplary mouse Tim4 binding domain comprises or consists of SEQ ID NO:24 or the amino acid sequence of amino acids 23-279 of SEQ ID NO:24. In certain embodiments, the Tim4 binding domain is at least about 75%, 80%, 85%, 90%, 91 for amino acids 23-279 of SEQ ID NO:2 or SEQ ID NO:42, or SEQ ID NO:24 or SEQ ID NO:24. %, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the Tim4-binding domain comprises at least about 1, 2, 3, 4, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5, 5 or 5, respectively, than any other amino acid sequence of amino acids 23-279 of SEQ ID NO: 2 or SEQ ID NO: 42, or SEQ ID NO: 24 or SEQ ID NO: 24. Includes amino acid sequences with 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions).
実施形態においては、Tim結合ドメインは、Tim1由来のIgVドメインを含む。例示的なヒトTim1 IgVドメインは、配列番号38において提供される。一部の実施形態においては、Tim1 IgVドメインは、配列番号38においてR66G置換を含む改変Tim1 IgVドメインである。R66G置換(例えば配列番号34のアミノ酸68~70)は、貪食に関する共受容体としてインテグリン結合を調節し得る、Tim1 IgVドメインにおけるRGDドメインを与える。特定の実施形態においては、改変Tim1 IgVドメインは、配列番号41のアミノ酸配列を含むかまたはからなる。一部の実施形態においては、この改変Tim1ドメインは、Tim1感受性を保存しながら、食作用活性を増大させ得る。ある特定の実施形態においては、Tim1 IgVドメインは、配列番号38、R66G置換を有する配列番号38、または配列番号41について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim1 IgVは、配列番号38、R66G置換を有する配列番号38、または配列番号41のアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 In embodiments, the Tim-binding domain comprises an IgV domain from Tim1. An exemplary human Tim1 IgV domain is provided in SEQ ID NO:38. In some embodiments, the Tim1 IgV domain is a modified Tim1 IgV domain comprising an R66G substitution in SEQ ID NO:38. The R66G substitution (eg amino acids 68-70 of SEQ ID NO:34) confers an RGD domain in the Tim1 IgV domain that can regulate integrin binding as a co-receptor for phagocytosis. In certain embodiments, the modified Tim1 IgV domain comprises or consists of the amino acid sequence of SEQ ID NO:41. In some embodiments, this modified Tim1 domain may increase phagocytic activity while preserving Tim1 sensitivity. In certain embodiments, the Tim1 IgV domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, It comprises or consists of an amino acid sequence having 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the Tim1 IgV has at least about 1, 2, 3, 4, 5, 6, 7, 8, Amino acid sequences with 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included.
他の実施形態においては、Tim結合ドメインは、Tim4由来のIgVドメインを含む。例示的なヒトTim4 IgVドメインは、配列番号34において提供される。ある特定の実施形態においては、Tim4 IgVドメインは、配列番号34について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4 IgVドメインは、配列番号34のアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 In other embodiments, the Tim-binding domain comprises an IgV domain from Tim4. An exemplary human Tim4 IgV domain is provided in SEQ ID NO:34. In certain embodiments, the Tim4 IgV domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% comprising or consisting of amino acid sequences having %, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the Tim4 IgV domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, Amino acid sequences with 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included.
実施形態においては、Tim結合ドメインは、Tim1由来のムチンドメインを含む。例示的なヒトTim1ムチンドメインは、配列番号39において提供される。ある特定の実施形態においては、Tim1ムチンドメインは、配列番号39について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim1ムチンドメインは、配列番号39のアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 In embodiments, the Tim-binding domain comprises a mucin domain from Tim1. An exemplary human Tim1 mucin domain is provided in SEQ ID NO:39. In certain embodiments, the Tim1 mucin domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% of SEQ ID NO:39 comprising or consisting of amino acid sequences having %, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the Tim1 mucin domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, Amino acid sequences with 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included.
他の実施形態においては、Tim結合ドメインは、Tim4由来のムチンドメインを含む。例示的なヒトTim4ムチンドメインは、配列番号35において提供される。ある特定の実施形態においては、Tim4ムチンドメインは、配列番号35について少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、Tim4ムチンドメインは、配列番号35のアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 In other embodiments, the Tim-binding domain comprises a mucin domain from Tim4. An exemplary human Tim4 mucin domain is provided in SEQ ID NO:35. In certain embodiments, the Tim4 mucin domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97% comprising or consisting of amino acid sequences having %, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the Tim4 mucin domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, Amino acid sequences with 15, 16, 17, 18, 19, or 20 amino acid alterations (eg, deletions, additions, substitutions) are included.
一部の実施形態においては、Tim結合ドメインは、Tim1 IgVドメインおよびTim1ムチンドメインを含む。特定の実施形態においては、Tim1 IgVドメインは配列番号38に示されるアミノ酸配列を含み、かつTim1ムチンドメインは配列番号39に示されるアミノ酸配列を含む。別の特定の実施形態においては、Tim1 IgVドメインはR66G置換を有する配列番号38に示されるアミノ酸配列を含み、かつTim1ムチンドメインは配列番号39に示されるアミノ酸配列を含む。さらなる特定の実施形態においては、Tim1 IgVドメインは配列番号41に示されるアミノ酸配列を含み、かつTim1ムチンドメインは配列番号39に示されるアミノ酸配列を含む。一部の実施形態においては、Tim1 IgVドメインとTim1ムチンドメインとが共に、配列番号37または配列番号43に示されるアミノ酸配列を含むかまたはからなる。 In some embodiments, the Tim-binding domain comprises the Tim1 IgV domain and the Tim1 mucin domain. In certain embodiments, the Tim1 IgV domain comprises the amino acid sequence set forth in SEQ ID NO:38 and the Tim1 mucin domain comprises the amino acid sequence set forth in SEQ ID NO:39. In another specific embodiment, the Tim1 IgV domain comprises the amino acid sequence set forth in SEQ ID NO:38 with an R66G substitution and the Tim1 mucin domain comprises the amino acid sequence set forth in SEQ ID NO:39. In a further specific embodiment, the Tim1 IgV domain comprises the amino acid sequence shown in SEQ ID NO:41 and the Tim1 mucin domain comprises the amino acid sequence shown in SEQ ID NO:39. In some embodiments, the Tim1 IgV domain and the Tim1 mucin domain both comprise or consist of the amino acid sequence set forth in SEQ ID NO:37 or SEQ ID NO:43.
一部の実施形態においては、Tim結合ドメインは、Tim4 IgVドメインおよびTim4ムチンドメインを含む。特定の実施形態においては、Tim4 IgVドメインは配列番号34に示されるアミノ酸配列を含み、かつTim4ムチンドメインは配列番号35に示されるアミノ酸配列を含む。一部の実施形態においては、Tim4 IgVドメインとTim4ムチンドメインとが共に、配列番号2または配列番号42に示されるアミノ酸配列を含むかまたはからなる。 In some embodiments, the Tim-binding domain comprises the Tim4 IgV domain and the Tim4 mucin domain. In certain embodiments, the Tim4 IgV domain comprises the amino acid sequence set forth in SEQ ID NO:34 and the Tim4 mucin domain comprises the amino acid sequence set forth in SEQ ID NO:35. In some embodiments, the Tim4 IgV domain and the Tim4 mucin domain both comprise or consist of the amino acid sequence set forth in SEQ ID NO:2 or SEQ ID NO:42.
一部の実施形態においては、Tim結合ドメインは、Tim1 IgVドメインおよびTim4ムチンドメインを含む。特定の実施形態においては、Tim1 IgVドメインは配列番号38に示されるアミノ酸配列を含み、かつTim4ムチンドメインは配列番号35に示されるアミノ酸配列を含む。別の特定の実施形態においては、Tim1 IgVドメインはR66G置換を有する配列番号38に示されるアミノ酸配列を含み、かつTim4ムチンドメインは配列番号35に示されるアミノ酸配列を含む。さらなる特定の実施形態においては、Tim1 IgVドメインは配列番号41に示されるアミノ酸配列を含み、かつTim4ムチンドメインは配列番号35に示されるアミノ酸配列を含む。一部の実施形態においては、Tim1 IgVドメインは、配列番号40のTim1シグナル配列をさらに含む。 In some embodiments, the Tim-binding domain comprises the Tim1 IgV domain and the Tim4 mucin domain. In certain embodiments, the Tim1 IgV domain comprises the amino acid sequence set forth in SEQ ID NO:38 and the Tim4 mucin domain comprises the amino acid sequence set forth in SEQ ID NO:35. In another specific embodiment, the Tim1 IgV domain comprises the amino acid sequence set forth in SEQ ID NO:38 with an R66G substitution and the Tim4 mucin domain comprises the amino acid sequence set forth in SEQ ID NO:35. In a further specific embodiment, the Tim1 IgV domain comprises the amino acid sequence set forth in SEQ ID NO:41 and the Tim4 mucin domain comprises the amino acid sequence set forth in SEQ ID NO:35. In some embodiments, the Tim1 IgV domain further comprises the Tim1 signal sequence of SEQ ID NO:40.
またさらなる実施形態においては、Tim結合ドメインは、Tim4 IgVドメインおよびTim1ムチンドメインを含む。特定の実施形態においては、Tim4 IgVドメインは配列番号34に示されるアミノ酸配列を含み、かつTim1ムチンドメインは配列番号39に示されるアミノ酸配列を含む。一部の実施形態においては、Tim4 IgVドメインは、配列番号11のTim4シグナル配列をさらに含む。 In still further embodiments, the Tim binding domain comprises the Tim4 IgV domain and the Tim1 mucin domain. In certain embodiments, the Tim4 IgV domain comprises the amino acid sequence set forth in SEQ ID NO:34 and the Tim1 mucin domain comprises the amino acid sequence set forth in SEQ ID NO:39. In some embodiments, the Tim4 IgV domain further comprises the Tim4 signal sequence of SEQ ID NO:11.
ある特定の実施形態においては、細胞外ドメインは、細胞外非シグナル伝達スペーサーまたはリンカードメインを含んでもよい。含まれる場合、そのようなスペーサーまたはリンカードメインは、結合ドメインを宿主細胞表面から離れるように位置させて、適切な細胞/細胞接触、結合および活性化をさらに可能にし得る。本明細書において説明するキメラ受容体に含まれる場合、細胞外スペーサードメインは一般的に、キメラTim受容体の細胞外結合ドメインと膜貫通ドメインとの間に位置する。細胞外スペーサーの長さは、選択された標的分子、選択された結合エピトープ、結合ドメインサイズおよび親和性に基づいて、標的分子結合を最適化するために変動し得る(例えばGuest et al., J. Immunother. 28:203-11, 2005;PCT公開公報WO2014/031687号を参照のこと)。ある特定の実施形態においては、細胞外スペーサードメインは、免疫グロブリンヒンジ領域(例えばIgG1、IgG2、IgG3、IgG4、IgA、IgD)である。免疫グロブリンヒンジ領域は、野生型免疫グロブリンヒンジ領域、または変更された野生型免疫グロブリンヒンジ領域であり得る。変更されたIgG4ヒンジ領域は、PCT公開公報WO2014/031687号において説明されており、当該ヒンジ領域は、その全体を参照により本明細書に組み込む。特定の実施形態においては、細胞外スペーサードメインは、ESKYGPPCPPCP(配列番号3)のアミノ酸配列を有する改変IgG4ヒンジ領域を含む。本明細書において説明するキメラTim受容体において使用され得るヒンジ領域の他の例には、野生型またはその変異型であり得る1型膜タンパク質、例としてCD8a、CD4、CD28およびCD7の細胞外領域からのヒンジ領域が含まれる。特定の実施形態においては、細胞外スペーサードメインは、配列番号32のアミノ酸配列を有するCD28ヒンジ領域を含む。さらなる実施形態においては、細胞外スペーサードメインは、CH1ドメイン、CH2ドメイン、CH3ドメインまたはそれらの組合せから選択される免疫グロブリンFcドメインの全てまたは一部を含む(例えばPCT公開公報WO2014/031687号を参照されたく、当該スペーサーは、その全体を参照により本明細書に組み込む)。またさらなる実施形態においては、細胞外スペーサードメインは、II型Cレクチンの柄領域(C型レクチンドメインと膜貫通ドメインとの間に位置する細胞外ドメイン)を含み得る。II型Cレクチンには、CD23、CD69、CD72、CD94、NKG2AおよびNKG2Dが含まれる。 In certain embodiments, the extracellular domain may include an extracellular non-signaling spacer or linker domain. If included, such spacer or linker domains may position the binding domain away from the host cell surface to further permit proper cell/cell contact, binding and activation. When included in the chimeric receptors described herein, the extracellular spacer domain is generally positioned between the extracellular binding domain and the transmembrane domain of the chimeric Tim receptor. The length of the extracellular spacer can be varied to optimize target molecule binding based on the selected target molecule, selected binding epitope, binding domain size and affinity (e.g., Guest et al., J. Immunother. 28:203-11, 2005; see PCT Publication No. WO 2014/031687). In certain embodiments, the extracellular spacer domain is an immunoglobulin hinge region (eg, IgG1, IgG2, IgG3, IgG4, IgA, IgD). The immunoglobulin hinge region can be a wild-type immunoglobulin hinge region or an altered wild-type immunoglobulin hinge region. A modified IgG 4 hinge region is described in PCT Publication No. WO2014/031687, which is incorporated herein by reference in its entirety. In certain embodiments, the extracellular spacer domain comprises a modified IgG4 hinge region having the amino acid sequence ESKYGPPCPPCP (SEQ ID NO:3). Other examples of hinge regions that can be used in the chimeric Tim receptors described herein include the extracellular regions of type 1 membrane proteins, such as CD8a, CD4, CD28 and CD7, which can be wild type or mutants thereof. includes the hinge region from In certain embodiments, the extracellular spacer domain comprises a CD28 hinge region having the amino acid sequence of SEQ ID NO:32. In a further embodiment, the extracellular spacer domain comprises all or part of an immunoglobulin Fc domain selected from CH1 domain, CH2 domain, CH3 domain or combinations thereof (see e.g. PCT Publication No. WO2014/031687). Please, the spacer is incorporated herein by reference in its entirety). In still further embodiments, the extracellular spacer domain may comprise the stalk region of a type II C lectin (the extracellular domain located between the type C lectin domain and the transmembrane domain). Type II C lectins include CD23, CD69, CD72, CD94, NKG2A and NKG2D.
ある特定の実施形態においては、細胞外ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、それらのトランスジェニック種またはそれらの任意の組合せを含む任意の哺乳動物種に由来するアミノ酸配列を含む。ある特定の実施形態においては、細胞外ドメインは、マウス、ヒトまたはキメラである。 In certain embodiments, the extracellular domain is human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, transgenic species thereof, or any of them. Includes amino acid sequences from any mammalian species, including combinations. In certain embodiments, the extracellular domain is murine, human or chimeric.
本明細書において説明するキメラTim受容体の細胞内シグナル伝達ドメインは、細胞内エフェクタードメインであり、キメラTim受容体の細胞外ドメインのホスファチジルセリンへの結合に応答して、機能的シグナルを細胞に伝達することができる。細胞内シグナル伝達ドメインによって伝達されるシグナルは、キメラTim受容体含有細胞のエフェクター機能を促進する。エフェクター機能の例には、細胞傷害活性、サイトカインの分泌、増殖、抗アポトーシスシグナル伝達、持続性、拡大増殖、その表面上にホスファチジルセリンを発現する標的細胞もしくは粒子の貪食、抗原捕捉、抗原プロセシング、抗原提示、またはそれらの任意の組合せが含まれる。 The intracellular signaling domain of the chimeric Tim Receptor described herein is an intracellular effector domain that sends a functional signal to the cell in response to binding of the extracellular domain of the chimeric Tim Receptor to phosphatidylserine. can be transmitted. Signals transduced by the intracellular signaling domain promote effector functions of chimeric Tim receptor-containing cells. Examples of effector functions include cytotoxic activity, cytokine secretion, proliferation, anti-apoptotic signaling, persistence, extended proliferation, phagocytosis of target cells or particles expressing phosphatidylserine on their surface, antigen capture, antigen processing, Antigen presentation, or any combination thereof is included.
細胞内シグナル伝達ドメインは、一次細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、一次細胞内シグナル伝達ドメインと、二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、一次細胞内シグナル伝達ドメインと、二次細胞内シグナル伝達ドメインと、三次細胞内シグナル伝達ドメインとを含む。一次、二次、および/または三次細胞内シグナル伝達ドメインは独立して、十分なシグナル伝達活性を保持するシグナル伝達分子の任意の部分であり得る。一部の実施形態においては、全長シグナル伝達分子またはシグナル伝達分子の全長細胞内成分が使用される。一部の実施形態においては、シグナル伝達分子またはシグナル伝達分子の細胞内成分の切断部分が使用され、但し、その切断部分は十分なシグナル伝達活性を保持する。一部の実施形態においては、シグナル伝達ドメインは、シグナル伝達分子の全部分または切断部分の変異型であり、但し、その変異型は十分なシグナル伝達活性を保持する(すなわち、機能的変異型である)。 Intracellular signaling domains include primary intracellular signaling domains. In some embodiments, the intracellular signaling domain comprises a primary intracellular signaling domain and a secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a primary intracellular signaling domain, a secondary intracellular signaling domain, and a tertiary intracellular signaling domain. Primary, secondary, and/or tertiary intracellular signaling domains may independently be any portion of a signaling molecule that retains sufficient signaling activity. In some embodiments, full-length signaling molecules or full-length intracellular components of signaling molecules are used. In some embodiments, truncated portions of signaling molecules or intracellular components of signaling molecules are used, provided that the truncated portions retain sufficient signaling activity. In some embodiments, the signaling domain is a variant of a whole or truncated portion of a signaling molecule, provided that the variant retains sufficient signaling activity (i.e., is a functional variant). be).
一部の実施形態においては、一次細胞内シグナル伝達ドメインは、Tim1シグナル伝達ドメイン、Tim4シグナル伝達ドメイン、TRAF2シグナル伝達ドメイン、TRAF6シグナル伝達ドメイン、CD28シグナル伝達ドメイン、DAP12シグナル伝達ドメイン、CD3ζシグナル伝達ドメイン、4-1BBシグナル伝達ドメイン、TLR2シグナル伝達ドメイン、またはTLR8シグナル伝達ドメインを含む。 In some embodiments, the primary intracellular signaling domain is Tim1 signaling domain, Tim4 signaling domain, TRAF2 signaling domain, TRAF6 signaling domain, CD28 signaling domain, DAP12 signaling domain, CD3ζ signaling domain , 4-1BB signaling domain, TLR2 signaling domain, or TLR8 signaling domain.
実施形態においては、二次細胞内シグナル伝達ドメインは、Tim1シグナル伝達ドメイン、Tim4シグナル伝達ドメイン、TRAF2シグナル伝達ドメイン、TRAF6シグナル伝達ドメイン、CD28シグナル伝達ドメイン、DAP12シグナル伝達ドメイン、CD3ζシグナル伝達ドメイン、4-1BBシグナル伝達ドメイン、TLR2シグナル伝達ドメイン、またはTLR8シグナル伝達ドメインを含む。 In embodiments, the secondary intracellular signaling domain is a Tim1 signaling domain, a Tim4 signaling domain, a TRAF2 signaling domain, a TRAF6 signaling domain, a CD28 signaling domain, a DAP12 signaling domain, a CD3ζ signaling domain, 4 -1BB signaling domain, TLR2 signaling domain, or TLR8 signaling domain.
一部の実施形態においては、三次細胞内シグナル伝達ドメインは、Tim1シグナル伝達ドメイン、Tim4シグナル伝達ドメイン、TRAF2シグナル伝達ドメイン、TRAF6シグナル伝達ドメイン、CD28シグナル伝達ドメイン、DAP12シグナル伝達ドメイン、CD3ζシグナル伝達ドメイン、4-1BBシグナル伝達ドメイン、TLR2シグナル伝達ドメインまたはTLR8シグナル伝達ドメインを含む。 In some embodiments, the tertiary intracellular signaling domain is Tim1 signaling domain, Tim4 signaling domain, TRAF2 signaling domain, TRAF6 signaling domain, CD28 signaling domain, DAP12 signaling domain, CD3ζ signaling domain , 4-1BB signaling domain, TLR2 signaling domain or TLR8 signaling domain.
一部の実施形態においては、一次細胞内シグナル伝達ドメインは免疫受容体チロシンベース活性化モチーフ(ITAM)含有シグナル伝達ドメインを含み;二次細胞内シグナル伝達ドメインは共刺激性シグナル伝達ドメイン、Tim1シグナル伝達ドメインまたはTim4シグナル伝達ドメインを含み;かつ三次細胞内シグナル伝達ドメインはTLRシグナル伝達ドメインを含む。ITAM含有シグナル伝達ドメインは一般的に、YXXL/I-X6-8-YXXL/Iの保存されたモチーフを指す、少なくとも1つ(1、2、3、4つまたはそれよりも多い)のITAMを含有する。ITAM含有シグナル伝達ドメインは、抗原結合またはリガンドエンゲージメント後、T細胞活性化シグナル伝達を開始し得る。ITAMシグナル伝達ドメインには、例えばCD3γ、CD3δ、CD3ε、CD3ζ、CD5、CD22、CD79a、CD278(ICOS)、DAP12、FcRγ、およびCD66dの細胞内シグナル伝達ドメインが含まれる。共刺激性シグナル伝達ドメインは、主要な、または古典的な(例えばITAM駆動)活性化シグナルと共に活性化された場合、T細胞応答、例としてT細胞活性化、サイトカイン産生、増殖、分化、生存、エフェクター機能またはそれらの組合せを促進する、または向上させる。キメラTim受容体における使用のための共刺激性シグナル伝達ドメインには、例えばCD27、CD28、CD40L、GITR、NKG2C、CARD1、CD2、CD7、CD27、CD30、CD40、CD54(ICAM)、CD83、CD134(OX-40)、CD137(4-1BB)、CD150(SLAMF1)、CD152(CTLA4)、CD223(LAG3)、CD226、CD270(HVEM)、CD273(PD-L2)、CD274(PD-L1)、CD278(ICOS)、DAP10、LAT、LFA-1、LIGHT、NKG2C、SLP76、TRIM、ZAP70またはそれらの任意の組合せが含まれる。一部の実施形態においては、共刺激性シグナル伝達ドメインは、OX40、CD2、CD27、CD28、ICAM-1、LFA-1(CD11a/CD18)、ICOS(CD278)、または4-1BB(CD137)シグナル伝達ドメインを含む。TLRシグナル伝達ドメインは、TLR1、TLR2、TLR3、TLR4、TLR5、TLR6、TLR7、TLR8、またはTLR9シグナル伝達ドメインであり得る。一部の実施形態においては、TLRシグナル伝達ドメインは、TLR2シグナル伝達ドメインまたはTLR8シグナル伝達ドメインである。 In some embodiments, the primary intracellular signaling domain comprises an immunoreceptor tyrosine-based activation motif (ITAM)-containing signaling domain; the secondary intracellular signaling domain is a costimulatory signaling domain, Tim1 signal a transduction domain or a Tim4 signaling domain; and a tertiary intracellular signaling domain comprises a TLR signaling domain. ITAM-containing signaling domains generally include at least one (1, 2, 3, 4 or more) ITAMs that refer to the conserved motif of YXXL/IX 6-8 -YXXL/I contains ITAM-containing signaling domains can initiate T-cell activation signaling following antigen binding or ligand engagement. ITAM signaling domains include, for example, the intracellular signaling domains of CD3γ, CD3δ, CD3ε, CD3ζ, CD5, CD22, CD79a, CD278 (ICOS), DAP12, FcRγ, and CD66d. Costimulatory signaling domains, when activated in conjunction with primary or canonical (e.g., ITAM-driven) activation signals, induce T-cell responses such as T-cell activation, cytokine production, proliferation, differentiation, survival, Promotes or enhances effector functions or combinations thereof. Costimulatory signaling domains for use in chimeric Tim receptors include, for example, CD27, CD28, CD40L, GITR, NKG2C, CARD1, CD2, CD7, CD27, CD30, CD40, CD54 (ICAM), CD83, CD134 ( OX-40), CD137 (4-1BB), CD150 (SLAMF1), CD152 (CTLA4), CD223 (LAG3), CD226, CD270 (HVEM), CD273 (PD-L2), CD274 (PD-L1), CD278 ( ICOS), DAP10, LAT, LFA-1, LIGHT, NKG2C, SLP76, TRIM, ZAP70 or any combination thereof. In some embodiments, the co-stimulatory signaling domain is OX40, CD2, CD27, CD28, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278), or 4-1BB (CD137) signaling Contains the transduction domain. The TLR signaling domain can be a TLR1, TLR2, TLR3, TLR4, TLR5, TLR6, TLR7, TLR8, or TLR9 signaling domain. In some embodiments, the TLR signaling domain is a TLR2 signaling domain or a TLR8 signaling domain.
本明細書において使用されるとき、一次、二次、および三次細胞内シグナル伝達ドメインの指定には、キメラTim受容体の細胞内部分のN末端における一次細胞内シグナル伝達ドメイン、中央における二次細胞内シグナル伝達ドメイン、およびC末端における三次細胞内シグナル伝達ドメインの配置が含まれるが、これらに限定されない。したがって、一次細胞内シグナル伝達ドメインの指定は、キメラTim受容体の細胞内部分のN末端における選択された細胞内シグナル伝達ドメインの使用を限定しない。二次細胞内シグナル伝達ドメインの指定は、キメラTim受容体の細胞内部分の中央における(または2つの細胞内シグナル伝達ドメインのみを有するそれらのキメラTim受容体に関してC末端における)選択された細胞内シグナル伝達ドメインの使用を限定しない。三次細胞内シグナル伝達ドメインの指定は、キメラTim受容体の細胞内部分のC末端における選択された細胞内シグナル伝達ドメインの使用を限定しない。したがって、キメラTim受容体の細胞内部分内の一次、二次、および/または三次細胞内シグナル伝達ドメインの異なる配置が企図される。 As used herein, the designations of primary, secondary, and tertiary intracellular signaling domains include the primary intracellular signaling domain at the N-terminus of the intracellular portion of the chimeric Tim receptor, the secondary cellular signaling domain in the middle, Including, but not limited to, intracellular signaling domains, and placement of tertiary intracellular signaling domains at the C-terminus. Therefore, designation of a primary intracellular signaling domain does not limit the use of a selected intracellular signaling domain at the N-terminus of the intracellular portion of the chimeric Tim receptor. The designation of the secondary intracellular signaling domain is the intracellular domain of choice in the middle of the intracellular portion of the chimeric tim receptor (or at the C-terminus for those chimeric tim receptors with only two intracellular signaling domains). It does not limit the use of signaling domains. The designation of a tertiary intracellular signaling domain does not limit the use of the selected intracellular signaling domain at the C-terminus of the intracellular portion of the chimeric Tim receptor. Accordingly, different arrangements of the primary, secondary, and/or tertiary intracellular signaling domains within the intracellular portion of the chimeric Tim receptor are contemplated.
例示的なTim1シグナル伝達ドメインは、配列番号44のアミノ酸配列を含むかまたはからなる。例示的なTim4シグナル伝達ドメインは、配列番号45、配列番号224、または配列番号225のアミノ酸配列を含むかまたはからなる。例示的なTRAF2シグナル伝達ドメインは、配列番号48のアミノ酸配列を含むかまたはからなる。例示的なTRAF6シグナル伝達ドメインは、配列番号46のアミノ酸配列を含むかまたはからなる。例示的なCD28シグナル伝達ドメインは、配列番号4または26のアミノ酸配列を含むかまたはからなる。例示的なDAP12シグナル伝達ドメインは、配列番号9のアミノ酸配列を含むかまたはからなる。例示的なCD3ζシグナル伝達ドメインは、配列番号27または5のアミノ酸配列を含むかまたはからなる。例示的な4-1BBシグナル伝達ドメインは、配列番号122のアミノ酸配列を含むかまたはからなる。例示的なTLR2シグナル伝達ドメインは、配列番号222のアミノ酸配列を含むかまたはからなる。例示的なTLR8シグナル伝達ドメインは、配列番号47のアミノ酸配列を含むかまたはからなる。 An exemplary Tim1 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:44. Exemplary Tim4 signaling domains comprise or consist of the amino acid sequence of SEQ ID NO:45, SEQ ID NO:224, or SEQ ID NO:225. An exemplary TRAF2 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:48. An exemplary TRAF6 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:46. An exemplary CD28 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:4 or 26. An exemplary DAP12 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:9. An exemplary CD3ζ signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:27 or 5. An exemplary 4-1BB signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:122. An exemplary TLR2 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:222. An exemplary TLR8 signaling domain comprises or consists of the amino acid sequence of SEQ ID NO:47.
特定の実施形態においては、Tim1シグナル伝達ドメインは、配列番号44に示されるアミノ酸配列を含む。別の特定の実施形態においては、Tim4シグナル伝達ドメインは、配列番号45、配列番号224、または配列番号225に示されるアミノ酸配列を含む。別の特定の実施形態においては、TRAF2シグナル伝達ドメインは、配列番号48に示されるアミノ酸配列を含む。別の特定の実施形態においては、TRAF6シグナル伝達ドメインは、配列番号46に示されるアミノ酸配列を含む。別の特定の実施形態においては、CD28シグナル伝達ドメインは、配列番号4に示されるアミノ酸配列を含む。別の特定の実施形態においては、CD28シグナル伝達ドメインは、配列番号26に示されるアミノ酸配列を含む。別の特定の実施形態においては、DAP12シグナル伝達ドメインは、配列番号9に示されるアミノ酸配列を含む。別の特定の実施形態においては、CD3ζシグナル伝達ドメインは、配列番号27に示されるアミノ酸配列を含む。別の特定の実施形態においては、CD3ζシグナル伝達ドメインは、配列番号5に示されるアミノ酸配列を含む。別の特定の実施形態においては、4-1BBシグナル伝達ドメインは、配列番号122のアミノ酸配列を含む。別の特定の実施形態においては、TLR2シグナル伝達ドメインは、配列番号222のアミノ酸配列を含む。別の特定の実施形態においては、TLR8シグナル伝達ドメインは、配列番号47に示されるアミノ酸配列を含む。 In certain embodiments, the Tim1 signaling domain comprises the amino acid sequence set forth in SEQ ID NO:44. In another specific embodiment, the Tim4 signaling domain comprises the amino acid sequence set forth in SEQ ID NO:45, SEQ ID NO:224, or SEQ ID NO:225. In another specific embodiment, the TRAF2 signaling domain comprises the amino acid sequence set forth in SEQ ID NO:48. In another specific embodiment, the TRAF6 signaling domain comprises the amino acid sequence set forth in SEQ ID NO:46. In another specific embodiment, the CD28 signaling domain comprises the amino acid sequence set forth in SEQ ID NO:4. In another specific embodiment, the CD28 signaling domain comprises the amino acid sequence set forth in SEQ ID NO:26. In another specific embodiment, the DAP12 signaling domain comprises the amino acid sequence shown in SEQ ID NO:9. In another specific embodiment, the CD3ζ signaling domain comprises the amino acid sequence shown in SEQ ID NO:27. In another specific embodiment, the CD3ζ signaling domain comprises the amino acid sequence shown in SEQ ID NO:5. In another specific embodiment, the 4-1BB signaling domain comprises the amino acid sequence of SEQ ID NO:122. In another specific embodiment, the TLR2 signaling domain comprises the amino acid sequence of SEQ ID NO:222. In another specific embodiment, the TLR8 signaling domain comprises the amino acid sequence shown in SEQ ID NO:47.
実施形態においては、一次、二次、および/または三次シグナル伝達ドメイン(存在する場合)は、配列番号4、5、9、26、27、または44~48のうちのいずれか1つについて少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、一次、二次、および/または三次シグナル伝達ドメインは、配列番号4、5、9、26、27、44~48、122、および222のうちのいずれか1つのアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、または20箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。実施形態においては、一次シグナル伝達ドメイン、二次、および/または三次細胞内シグナル伝達ドメインは、同じである。一部の実施形態においては、一次、二次、および三次細胞内シグナル伝達ドメインのうちの2つまたは3つは、異なる。 In embodiments, the primary, secondary, and/or tertiary signaling domains (if present) are at least about any one of SEQ ID NOS: 4, 5, 9, 26, 27, or 75%, 80%, 85%, 90%, 91%, 92%, 93%, 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity comprising or consisting of an amino acid sequence having In certain embodiments, the primary, secondary, and/or tertiary signaling domains are amino acids of any one of SEQ ID NOS: 4, 5, 9, 26, 27, 44-48, 122, and 222. At least about 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, or 20 amino acid modifications (e.g. deletions, additions, substitutions). In embodiments, the primary signaling domain, the secondary, and/or the tertiary intracellular signaling domain are the same. In some embodiments, two or three of the primary, secondary, and tertiary intracellular signaling domains are different.
ある特定の実施形態においては、細胞内シグナル伝達ドメインは、Tim1細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、Tim4細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD3ζ細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TRAF6細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TRAF2細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TLR2細胞内シグナル伝達ドメインを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TLR8細胞内シグナル伝達ドメインを含む。 In certain embodiments, the intracellular signaling domain comprises a Tim1 intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a Tim4 intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD3ζ intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TRAF6 intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TRAF2 intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TLR2 intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TLR8 intracellular signaling domain.
ある特定の実施形態においては、細胞内シグナル伝達ドメインは、Tim1一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。他の実施形態においては、細胞内シグナル伝達ドメインは、Tim4一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。他の実施形態においては、細胞内シグナル伝達ドメインは、TLR8一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。他の実施形態においては、細胞内シグナル伝達ドメインは、TLR2一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。他の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、DAP12二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、TLR2二次細胞内シグナル伝達ドメインと、CD3ζ三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインと、TLR2三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、TLR8二次細胞内シグナル伝達ドメインと、CD3ζ三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインと、TLR8三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TLR2一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD3ζ一次細胞内シグナル伝達ドメインと、TLR2二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TLR8一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD3ζ一次細胞内シグナル伝達ドメインと、TLR8二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TRAF6一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD3ζ一次細胞内シグナル伝達ドメインと、TRAF6二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、TLR2二次細胞内シグナル伝達ドメインと、CD3ζ三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインと、TLR2三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、TLR8二次細胞内シグナル伝達ドメインと、CD3ζ三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD28一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインと、TLR8三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD3ζ一次細胞内シグナル伝達ドメインと、TLR2二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TLR2一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD3ζ一次細胞内シグナル伝達ドメインと、TLR8二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TLR8一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、CD3ζ一次細胞内シグナル伝達ドメインと、TRAF6二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、TRAF6一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、Tim4一次細胞内シグナル伝達ドメインと、TLR2二次細胞内シグナル伝達ドメインと、CD3ζ三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、Tim4一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインと、TLR2三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、Tim4一次細胞内シグナル伝達ドメインと、TLR8二次細胞内シグナル伝達ドメインと、CD3ζ三次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、Tim4一次細胞内シグナル伝達ドメインと、CD3ζ二次細胞内シグナル伝達ドメインと、TLR8三次細胞内シグナル伝達ドメインとを含む。 In certain embodiments, the intracellular signaling domain comprises a Tim1 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In other embodiments, the intracellular signaling domain comprises a Tim4 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In other embodiments, the intracellular signaling domain comprises a TLR8 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In other embodiments, the intracellular signaling domain comprises a TLR2 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In other embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain and a DAP12 secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a TLR2 secondary intracellular signaling domain, and a CD3zeta tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a CD3ζ secondary intracellular signaling domain, and a TLR2 tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a TLR8 secondary intracellular signaling domain, and a CD3zeta tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a CD3ζ secondary intracellular signaling domain, and a TLR8 tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TLR2 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD3ζ primary intracellular signaling domain and a TLR2 secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TLR8 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD3ζ primary intracellular signaling domain and a TLR8 secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TRAF6 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD3ζ primary intracellular signaling domain and a TRAF6 secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a TLR2 secondary intracellular signaling domain, and a CD3zeta tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a CD3ζ secondary intracellular signaling domain, and a TLR2 tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a TLR8 secondary intracellular signaling domain, and a CD3zeta tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain, a CD3ζ secondary intracellular signaling domain, and a TLR8 tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD3ζ primary intracellular signaling domain and a TLR2 secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TLR2 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD3ζ primary intracellular signaling domain and a TLR8 secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TLR8 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a CD3ζ primary intracellular signaling domain and a TRAF6 secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a TRAF6 primary intracellular signaling domain and a CD3ζ secondary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a Tim4 primary intracellular signaling domain, a TLR2 secondary intracellular signaling domain, and a CD3zeta tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a Tim4 primary intracellular signaling domain, a CD3ζ secondary intracellular signaling domain, and a TLR2 tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a Tim4 primary intracellular signaling domain, a TLR8 secondary intracellular signaling domain, and a CD3zeta tertiary intracellular signaling domain. In some embodiments, the intracellular signaling domain comprises a Tim4 primary intracellular signaling domain, a CD3ζ secondary intracellular signaling domain, and a TLR8 tertiary intracellular signaling domain.
特定の実施形態においては、細胞内シグナル伝達ドメインは、配列番号44のアミノ酸配列を含むTim1一次細胞内シグナル伝達ドメインと、配列番号27または5のアミノ酸配列を含むCD3ζ二次細胞内シグナル伝達ドメインとを含む。別の特定の実施形態においては、細胞内シグナル伝達ドメインは、配列番号45、配列番号224、または配列番号225のアミノ酸配列を含むTim4一次細胞内シグナル伝達ドメインと、配列番号27または5のアミノ酸配列を含むCD3ζ二次細胞内シグナル伝達ドメインとを含む。さらなる特定の実施形態においては、細胞内シグナル伝達ドメインは、配列番号47のアミノ酸配列を含むTLR8一次細胞内シグナル伝達ドメインと、配列番号27または5のアミノ酸配列を含むCD3ζ二次細胞内シグナル伝達ドメインとを含む。別の特定の実施形態においては、細胞内シグナル伝達ドメインは、配列番号4または26のアミノ酸配列を含むCD28一次細胞内シグナル伝達ドメインと、配列番号9のアミノ酸配列を含むDAP12二次細胞内シグナル伝達ドメインとを含む。一部の実施形態においては、細胞内シグナル伝達ドメインは、表10に示される一次、二次、および適宜の三次細胞内シグナル伝達ドメイン配列の組合せを含む。 In certain embodiments, the intracellular signaling domains are a Tim1 primary intracellular signaling domain comprising the amino acid sequence of SEQ ID NO:44 and a CD3ζ secondary intracellular signaling domain comprising the amino acid sequence of SEQ ID NO:27 or 5. including. In another specific embodiment, the intracellular signaling domain comprises a Tim4 primary intracellular signaling domain comprising the amino acid sequence of SEQ ID NO:45, SEQ ID NO:224, or SEQ ID NO:225 and the amino acid sequence of SEQ ID NO:27 or 5 and a CD3ζ secondary intracellular signaling domain containing In further specific embodiments, the intracellular signaling domain is a TLR8 primary intracellular signaling domain comprising the amino acid sequence of SEQ ID NO:47 and a CD3ζ secondary intracellular signaling domain comprising the amino acid sequence of SEQ ID NO:27 or 5 including. In another specific embodiment, the intracellular signaling domain comprises a CD28 primary intracellular signaling domain comprising the amino acid sequence of SEQ ID NO:4 or 26 and a DAP12 secondary intracellular signaling domain comprising the amino acid sequence of SEQ ID NO:9. including domains. In some embodiments, the intracellular signaling domain comprises a combination of primary, secondary, and optionally tertiary intracellular signaling domain sequences shown in Table 10.
細胞内シグナル伝達ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタおよびそれらのトランスジェニック種を含む哺乳動物種に由来し得る。 The intracellular signaling domain can be derived from mammalian species including human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig and transgenic species thereof.
キメラTim受容体の膜貫通ドメインは、細胞外ドメインと細胞内シグナル伝達ドメインとを接続し、かつこれらの間に位置する。膜貫通ドメインは、宿主細胞膜を横断する疎水性アルファヘリックスである。膜貫通ドメインは、結合ドメインに、または存在する場合細胞外スペーサードメインに直接的に融合され得る。ある特定の実施形態においては、膜貫通ドメインは、膜内在性タンパク質[例えば受容体、表面抗原分類(CD)分子、酵素、トランスポーター、細胞接着分子その他]に由来する。一実施形態では、膜貫通ドメインは、細胞外ドメインが由来する分子と同じ分子から選択される。別の実施形態においては、膜貫通ドメインは、細胞内シグナル伝達ドメインが由来する分子と同じ分子から選択される。例えば、キメラTim受容体は、Tim4結合ドメインおよびTim4膜貫通ドメインを含み得る。別の例においては、キメラTim受容体は、CD28膜貫通ドメインおよびCD28共刺激性シグナル伝達ドメインを含み得る。ある特定の実施形態においては、膜貫通ドメインおよび細胞外ドメインが異なる分子に由来するか;膜貫通ドメインおよび細胞内シグナル伝達ドメインが異なる分子に由来するか;または膜貫通ドメイン、細胞外ドメイン、および細胞内シグナル伝達ドメインの全部が異なる分子に由来する。本開示のキメラTim受容体において使用され得る膜貫通ドメインの例には、Tim1、Tim4、およびCD28に由来する膜貫通ドメインが含まれる。例示的なTim1膜貫通ドメインは、配列番号8のアミノ酸配列を含むかまたはからなる。例示的なTim4膜貫通ドメインは、配列番号6または23のアミノ酸配列を含むかまたはからなる。例示的なCD28膜貫通ドメインは、配列番号7のアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、膜貫通ドメインは、配列番号6~8または23のうちのいずれか1つについて少なくとも約75%、80%、85%、90%、91%、92%、93%、94%、95%、96%、97%、98%、99%、99.5%または100%の同一性を有するアミノ酸配列を含むかまたはからなる。ある特定の実施形態においては、膜貫通ドメインは、配列番号6~8または23のうちのいずれか1つのアミノ酸配列について少なくとも約1、2、3、4、5、6、7、8、9、または10箇所のアミノ酸改変(例えば欠失、付加、置換)を有するアミノ酸配列を含む。 The transmembrane domain of the chimeric Tim receptor connects and lies between the extracellular and intracellular signaling domains. A transmembrane domain is a hydrophobic alpha helix that spans the host cell membrane. A transmembrane domain may be fused directly to a binding domain or, if present, to an extracellular spacer domain. In certain embodiments, the transmembrane domain is derived from an integral membrane protein [eg, receptors, surface antigen class (CD) molecules, enzymes, transporters, cell adhesion molecules, etc.]. In one embodiment, the transmembrane domain is selected from the same molecule from which the extracellular domain is derived. In another embodiment, the transmembrane domain is selected from the same molecule from which the intracellular signaling domain is derived. For example, a chimeric Tim receptor can comprise a Tim4 binding domain and a Tim4 transmembrane domain. In another example, a chimeric Tim receptor can include a CD28 transmembrane domain and a CD28 co-stimulatory signaling domain. In certain embodiments, the transmembrane domain and the extracellular domain are derived from different molecules; the transmembrane domain and the intracellular signaling domain are derived from different molecules; or the transmembrane domain, the extracellular domain, and All of the intracellular signaling domains are derived from different molecules. Examples of transmembrane domains that can be used in the chimeric Tim receptors of the present disclosure include transmembrane domains from Tim1, Tim4, and CD28. An exemplary Tim1 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:8. An exemplary Tim4 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:6 or 23. An exemplary CD28 transmembrane domain comprises or consists of the amino acid sequence of SEQ ID NO:7. In certain embodiments, the transmembrane domain is at least about 75%, 80%, 85%, 90%, 91%, 92%, 93% of any one of SEQ ID NOs:6-8 or 23 , 94%, 95%, 96%, 97%, 98%, 99%, 99.5% or 100% identity. In certain embodiments, the transmembrane domain has at least about 1, 2, 3, 4, 5, 6, 7, 8, 9, or amino acid sequences with 10 amino acid modifications (eg, deletions, additions, substitutions).
膜貫通ドメインは、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、およびそれらのトランスジェニック種を含む任意の哺乳動物種に由来し得る。 The transmembrane domain can be derived from any mammalian species, including humans, primates, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, and transgenic species thereof.
ある特定の実施形態においては、キメラTim受容体は、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、それらのトランスジェニック種またはそれらの任意の組合せを含む任意の哺乳動物種に由来するポリヌクレオチド配列を含む。ある特定の実施形態においては、キメラTim受容体は、マウス、キメラ、ヒトまたはヒト化である。 In certain embodiments, the chimeric Tim receptor is human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, transgenic species thereof, or any thereof. including polynucleotide sequences from any mammalian species, including combinations of In certain embodiments, the chimeric Tim Receptor is murine, chimeric, human or humanized.
本明細書において説明するキメラTim受容体の1つのドメインの別のドメインへの直接的融合は、介在性接合部アミノ酸の存在を排除しないと理解される。接合部アミノ酸は、天然または非天然(例えばキメラタンパク質のコンストラクト設計から生じる)であり得る。例えば、接合部アミノ酸は、1つのドメインの別のドメインへの接合またはベクターへのキメラTim受容体をコードするポリヌクレオチドのクローニングのために用いられる制限酵素部位から生じ得る。 It is understood that the direct fusion of one domain of the chimeric Tim receptor described herein to another does not preclude the presence of intervening junctional amino acids. Junctional amino acids can be natural or non-natural (eg, resulting from the construct design of the chimeric protein). For example, junctional amino acids can arise from restriction enzyme sites used for joining one domain to another or cloning a polynucleotide encoding a chimeric Tim receptor into a vector.
例示的キメラTim受容体
本明細書において開示されるキメラTim受容体の成分部分は、宿主細胞に対する所望の特異性およびエフェクター表現型を提供するために、様々な組合せにおいて選択および配置され得る。
Exemplary Chimeric Tim Receptors The component parts of the chimeric Tim receptors disclosed herein can be selected and arranged in various combinations to provide desired specificity and effector phenotypes for host cells.
本開示の例示的なキメラTim受容体が、表4において説明される。 Exemplary chimeric Tim receptors of the present disclosure are set forth in Table 4.
表4.
さらなる例示的なキメラTim受容体が、表5において説明される。 Additional exemplary chimeric Tim receptors are set forth in Table 5.
表5.
一部の実施形態においては、本開示のキメラTim受容体は、表4のコンストラクトを含む。一部の実施形態においては、本開示のキメラTim受容体は、表5のコンストラクトを含む。 In some embodiments, the chimeric Tim receptor of the present disclosure comprises the constructs of Table 4. In some embodiments, the chimeric Tim receptor of the present disclosure comprises the constructs of Table 5.
一部の実施形態においては、コンストラクト1またはコンストラクト1’のキメラTim受容体は、配列番号49のアミノ酸21~456を含む。一部の実施形態においては、コンストラクト1またはコンストラクト1’のキメラTim受容体は、配列番号49のアミノ酸配列を含む。 In some embodiments, the Construct 1 or Construct 1' chimeric Tim receptor comprises amino acids 21-456 of SEQ ID NO:49. In some embodiments, the Construct 1 or Construct 1' chimeric Tim Receptor comprises the amino acid sequence of SEQ ID NO:49.
一部の実施形態においては、コンストラクト2またはコンストラクト2’のキメラTim受容体は、配列番号50のアミノ酸21~471を含む。一部の実施形態においては、コンストラクト2またはコンストラクト2’のキメラTim受容体は、配列番号50のアミノ酸配列を含む。 In some embodiments, the Construct 2 or Construct 2' chimeric Tim receptor comprises amino acids 21-471 of SEQ ID NO:50. In some embodiments, the Construct 2 or Construct 2' chimeric Tim receptor comprises the amino acid sequence of SEQ ID NO:50.
一部の実施形態においては、コンストラクト3またはコンストラクト3’のキメラTim受容体は、配列番号51のアミノ酸21~363を含む。一部の実施形態においては、コンストラクト3またはコンストラクト3’のキメラTim受容体は、配列番号51のアミノ酸配列を含む。 In some embodiments, the Construct 3 or Construct 3' chimeric Tim receptor comprises amino acids 21-363 of SEQ ID NO:51. In some embodiments, the Construct 3 or Construct 3' chimeric Tim receptor comprises the amino acid sequence of SEQ ID NO:51.
一部の実施形態においては、コンストラクト4またはコンストラクト4’のキメラTim受容体は、配列番号52のアミノ酸21~590を含む。一部の実施形態においては、コンストラクト4またはコンストラクト4’のキメラTim受容体は、配列番号52のアミノ酸配列を含む。 In some embodiments, the Construct 4 or Construct 4' chimeric Tim receptor comprises amino acids 21-590 of SEQ ID NO:52. In some embodiments, the Construct 4 or Construct 4' chimeric Tim receptor comprises the amino acid sequence of SEQ ID NO:52.
一部の実施形態においては、コンストラクト5またはコンストラクト5’のキメラTim受容体は、配列番号53のアミノ酸21~596を含む。一部の実施形態においては、コンストラクト5またはコンストラクト5’のキメラTim受容体は、配列番号53のアミノ酸配列を含む。 In some embodiments, the Construct 5 or Construct 5' chimeric Tim Receptor comprises amino acids 21-596 of SEQ ID NO:53. In some embodiments, the Construct 5 or Construct 5' chimeric Tim Receptor comprises the amino acid sequence of SEQ ID NO:53.
一部の実施形態においては、コンストラクト6またはコンストラクト6’のキメラTim受容体は、配列番号54のアミノ酸21~619を含む。一部の実施形態においては、コンストラクト6またはコンストラクト6’のキメラTim受容体は、配列番号54のアミノ酸配列を含む。 In some embodiments, the Construct 6 or Construct 6' chimeric Tim receptor comprises amino acids 21-619 of SEQ ID NO:54. In some embodiments, the Construct 6 or Construct 6' chimeric Tim Receptor comprises the amino acid sequence of SEQ ID NO:54.
一部の実施形態においては、コンストラクト7またはコンストラクト7’のキメラTim受容体は、配列番号55のアミノ酸21~625を含む。一部の実施形態においては、コンストラクト7またはコンストラクト7’のキメラTim受容体は、配列番号55のアミノ酸配列を含む。 In some embodiments, the Construct 7 or Construct 7' chimeric Tim receptor comprises amino acids 21-625 of SEQ ID NO:55. In some embodiments, the Construct 7 or Construct 7' chimeric Tim Receptor comprises the amino acid sequence of SEQ ID NO:55.
一部の実施形態においては、コンストラクト8またはコンストラクト8’のキメラTim受容体は、配列番号56のアミノ酸21~621を含む。一部の実施形態においては、コンストラクト8またはコンストラクト8’のキメラTim受容体は、配列番号56のアミノ酸配列を含む。 In some embodiments, the Construct 8 or Construct 8' chimeric Tim receptor comprises amino acids 21-621 of SEQ ID NO:56. In some embodiments, the Construct 8 or Construct 8' chimeric Tim Receptor comprises the amino acid sequence of SEQ ID NO:56.
一部の実施形態においては、コンストラクト9またはコンストラクト9’のキメラTim受容体は、配列番号57のアミノ酸21~415を含む。一部の実施形態においては、コンストラクト9またはコンストラクト9’のキメラTim受容体は、配列番号57のアミノ酸配列を含む。 In some embodiments, the Construct 9 or Construct 9' chimeric Tim receptor comprises amino acids 21-415 of SEQ ID NO:57. In some embodiments, the Construct 9 or Construct 9' chimeric Tim receptor comprises the amino acid sequence of SEQ ID NO:57.
一部の実施形態においては、コンストラクト10またはコンストラクト10’のキメラTim受容体は、配列番号58のアミノ酸21~409を含む。一部の実施形態においては、コンストラクト10またはコンストラクト10’のキメラTim受容体は、配列番号58のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 10 or Construct 10' comprises amino acids 21-409 of SEQ ID NO:58. In some embodiments, the chimeric Tim receptor of Construct 10 or Construct 10' comprises the amino acid sequence of SEQ ID NO:58.
本開示のさらなる例示的なキメラTim受容体が、表6において説明される。 Additional exemplary chimeric Tim receptors of the present disclosure are set forth in Table 6.
表6.
さらなる例示的なキメラTim受容体が、表7において説明される。 Additional exemplary chimeric Tim receptors are set forth in Table 7.
表7.
一部の実施形態においては、本開示のキメラTim受容体は、表6のコンストラクトを含む。一部の実施形態においては、本開示のキメラTim受容体は、表7のコンストラクトを含む。 In some embodiments, the chimeric Tim receptor of this disclosure comprises the constructs of Table 6. In some embodiments, the chimeric Tim receptor of this disclosure comprises the constructs of Table 7.
一部の実施形態においては、コンストラクト11またはコンストラクト11’のキメラTim受容体は、配列番号59のアミノ酸25~490を含む。一部の実施形態においては、コンストラクト11またはコンストラクト11’のキメラTim受容体は、配列番号59のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 11 or Construct 11' comprises amino acids 25-490 of SEQ ID NO:59. In some embodiments, the chimeric Tim receptor of Construct 11 or Construct 11' comprises the amino acid sequence of SEQ ID NO:59.
一部の実施形態においては、コンストラクト12またはコンストラクト12’のキメラTim受容体は、配列番号60のアミノ酸25~495を含む。一部の実施形態においては、コンストラクト12またはコンストラクト12’のキメラTim受容体は、配列番号60のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 12 or Construct 12' comprises amino acids 25-495 of SEQ ID NO:60. In some embodiments, the chimeric Tim receptor of Construct 12 or Construct 12' comprises the amino acid sequence of SEQ ID NO:60.
一部の実施形態においては、コンストラクト13またはコンストラクト13’のキメラTim受容体は、配列番号61のアミノ酸25~382を含む。一部の実施形態においては、コンストラクト13またはコンストラクト13’のキメラTim受容体は、配列番号61のアミノ酸配列を含む。 In some embodiments, the Construct 13 or Construct 13' chimeric Tim Receptor comprises amino acids 25-382 of SEQ ID NO:61. In some embodiments, the Construct 13 or Construct 13' chimeric Tim Receptor comprises the amino acid sequence of SEQ ID NO:61.
一部の実施形態においては、コンストラクト13AのキメラTim受容体[TIM4結合ドメイン-CD28 TM-CD28costim-CD3ζ(アミノ酸1~24シグナルペプチド)]は、配列番号71のアミノ酸25~383を含む。一部の実施形態においては、コンストラクト13AのキメラTim受容体は、配列番号71のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of construct 13A [TIM4 binding domain-CD28 TM-CD28costim-CD3ζ (amino acids 1-24 signal peptide)] comprises amino acids 25-383 of SEQ ID NO:71. In some embodiments, the chimeric Tim receptor of Construct 13A comprises the amino acid sequence of SEQ ID NO:71.
一部の実施形態においては、コンストラクト14またはコンストラクト14’のキメラTim受容体は、配列番号62のアミノ酸25~609を含む。一部の実施形態においては、コンストラクト14またはコンストラクト14’のキメラTim受容体は、配列番号62のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 14 or Construct 14' comprises amino acids 25-609 of SEQ ID NO:62. In some embodiments, the chimeric Tim receptor of Construct 14 or Construct 14' comprises the amino acid sequence of SEQ ID NO:62.
一部の実施形態においては、コンストラクト15またはコンストラクト15’のキメラTim受容体は、配列番号63のアミノ酸25~615を含む。一部の実施形態においては、コンストラクト15またはコンストラクト15’のキメラTim受容体は、配列番号63のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 15 or Construct 15' comprises amino acids 25-615 of SEQ ID NO:63. In some embodiments, the chimeric Tim receptor of Construct 15 or Construct 15' comprises the amino acid sequence of SEQ ID NO:63.
一部の実施形態においては、コンストラクト16またはコンストラクト16’のキメラTim受容体は、配列番号64のアミノ酸25~638を含む。一部の実施形態においては、コンストラクト16またはコンストラクト16’のキメラTim受容体は、配列番号64のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 16 or Construct 16' comprises amino acids 25-638 of SEQ ID NO:64. In some embodiments, the chimeric Tim receptor of Construct 16 or Construct 16' comprises the amino acid sequence of SEQ ID NO:64.
一部の実施形態においては、コンストラクト17またはコンストラクト17’のキメラTim受容体は、配列番号65のアミノ酸25~644を含む。一部の実施形態においては、コンストラクト17またはコンストラクト17’のキメラTim受容体は、配列番号65のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 17 or Construct 17' comprises amino acids 25-644 of SEQ ID NO:65. In some embodiments, the chimeric Tim receptor of Construct 17 or Construct 17' comprises the amino acid sequence of SEQ ID NO:65.
一部の実施形態においては、コンストラクト18またはコンストラクト18’のキメラTim受容体は、配列番号66のアミノ酸25~640を含む。一部の実施形態においては、コンストラクト18またはコンストラクト18’のキメラTim受容体は、配列番号66のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 18 or Construct 18' comprises amino acids 25-640 of SEQ ID NO:66. In some embodiments, the chimeric Tim receptor of Construct 18 or Construct 18' comprises the amino acid sequence of SEQ ID NO:66.
本開示のさらなる例示的なキメラTim受容体が、表8において説明される。 Additional exemplary chimeric Tim receptors of the present disclosure are set forth in Table 8.
表8.
さらなる例示的なキメラTim受容体が、表9において説明される。 Additional exemplary chimeric Tim receptors are set forth in Table 9.
表9.
一部の実施形態においては、本開示のキメラTim受容体は、表8のコンストラクトを含む。一部の実施形態においては、本開示のキメラTim受容体は、表9のコンストラクトを含む。 In some embodiments, the chimeric Tim receptor of this disclosure comprises the constructs of Table 8. In some embodiments, the chimeric Tim receptor of this disclosure comprises the constructs of Table 9.
一部の実施形態においては、コンストラクト19またはコンストラクト19’のキメラTim受容体は、配列番号67のアミノ酸25~628を含む。一部の実施形態においては、コンストラクト19またはコンストラクト19’のキメラTim受容体は、配列番号67のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 19 or Construct 19' comprises amino acids 25-628 of SEQ ID NO:67. In some embodiments, the chimeric Tim receptor of Construct 19 or Construct 19' comprises the amino acid sequence of SEQ ID NO:67.
一部の実施形態においては、コンストラクト20またはコンストラクト20’のキメラTim受容体は、配列番号68のアミノ酸25~416を含む。一部の実施形態においては、コンストラクト20またはコンストラクト20’のキメラTim受容体は、配列番号68のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 20 or Construct 20' comprises amino acids 25-416 of SEQ ID NO:68. In some embodiments, the chimeric Tim receptor of Construct 20 or Construct 20' comprises the amino acid sequence of SEQ ID NO:68.
一部の実施形態においては、コンストラクト21またはコンストラクト21’のキメラTim受容体は、配列番号69のアミノ酸25~422を含む。一部の実施形態においては、コンストラクト21またはコンストラクト21’のキメラTim受容体は、配列番号69のアミノ酸配列を含む。 In some embodiments, the chimeric Tim receptor of Construct 21 or Construct 21' comprises amino acids 25-422 of SEQ ID NO:69. In some embodiments, the chimeric Tim receptor of Construct 21 or Construct 21' comprises the amino acid sequence of SEQ ID NO:69.
さらなる例示的なキメラTim受容体が、表10において説明される。一部の実施形態においては、本開示のキメラTim受容体は、表10のコンストラクトを含む。一部の実施形態においては、本開示のキメラTim受容体は、配列番号227、238、249、72、または73のアミノ酸配列を有するキメラTim受容体を含まない。一部の実施形態においては、本開示のキメラTim受容体は、配列番号227、238、249、72、または73のコンストラクトについて説明される成分の組合せを有するキメラTim受容体を含まない。 Additional exemplary chimeric Tim receptors are set forth in Table 10. In some embodiments, the chimeric Tim receptor of the present disclosure comprises the constructs of Table 10. In some embodiments, chimeric Tim receptors of the present disclosure do not include chimeric Tim receptors having the amino acid sequence of SEQ ID NOS:227, 238, 249, 72, or 73. In some embodiments, chimeric Tim receptors of the present disclosure do not include chimeric Tim receptors having a combination of components set forth for constructs of SEQ ID NOS:227, 238, 249, 72, or 73.
一部の実施形態においては、キメラTim4受容体は、配列番号127のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号127のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号128のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号128のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号129のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号129のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号130のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号130のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号131のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号131のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号132のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号132のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号133のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号133のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号134のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号134のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号135のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号135のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号136のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号136のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号137のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号137のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号138のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号138のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号139のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号139のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号140のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号140のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号141のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号141のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号142のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号142のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号143のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号143のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号144のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号144のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号145のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号145のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号146のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号146のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号147のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号147のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号148のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号148のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号149のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号149のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号150のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号150のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号151のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号151のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号152のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号152のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号153のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号153のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号154のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号154のアミノ酸配列を含む。一部の実施形態においては、キメラTim4受容体は、配列番号155のアミノ酸配列またはシグナル配列(アミノ酸1~24)を欠く配列番号155のアミノ酸配列を含む。 In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 127 or the amino acid sequence of SEQ ID NO: 127 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 128 or the amino acid sequence of SEQ ID NO: 128 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 129 or the amino acid sequence of SEQ ID NO: 129 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 130 or the amino acid sequence of SEQ ID NO: 130 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 131 or the amino acid sequence of SEQ ID NO: 131 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 132 or the amino acid sequence of SEQ ID NO: 132 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 133 or the amino acid sequence of SEQ ID NO: 133 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 134 or the amino acid sequence of SEQ ID NO: 134 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 135 or the amino acid sequence of SEQ ID NO: 135 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 136 or the amino acid sequence of SEQ ID NO: 136 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 137 or the amino acid sequence of SEQ ID NO: 137 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 138 or the amino acid sequence of SEQ ID NO: 138 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 139 or the amino acid sequence of SEQ ID NO: 139 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 140 or the amino acid sequence of SEQ ID NO: 140 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 141 or the amino acid sequence of SEQ ID NO: 141 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 142 or the amino acid sequence of SEQ ID NO: 142 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 143 or the amino acid sequence of SEQ ID NO: 143 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 144 or the amino acid sequence of SEQ ID NO: 144 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 145 or the amino acid sequence of SEQ ID NO: 145 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 146 or the amino acid sequence of SEQ ID NO: 146 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 147 or the amino acid sequence of SEQ ID NO: 147 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 148 or the amino acid sequence of SEQ ID NO: 148 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 149 or the amino acid sequence of SEQ ID NO: 149 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 150 or the amino acid sequence of SEQ ID NO: 150 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 151 or the amino acid sequence of SEQ ID NO: 151 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 152 or the amino acid sequence of SEQ ID NO: 152 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 153 or the amino acid sequence of SEQ ID NO: 153 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 154 or the amino acid sequence of SEQ ID NO: 154 lacking the signal sequence (amino acids 1-24). In some embodiments, the chimeric Tim4 receptor comprises the amino acid sequence of SEQ ID NO: 155 or the amino acid sequence of SEQ ID NO: 155 lacking the signal sequence (amino acids 1-24).
表10.
ポリヌクレオチド、ベクターおよび宿主細胞
ある特定の態様においては、本開示は、本明細書において説明するキメラTim受容体のうちの任意の1つまたは複数をコードする核酸分子を提供する。核酸とは、一本鎖または二本鎖DNA、cDNAまたはRNAを指す場合があり、アンチセンスDNA、cDNAおよびRNAを含む互いに相補する核酸の正の鎖および負の鎖を含み得る。核酸は、DNAまたはRNAの天然形態または合成形態であり得る。所望のキメラTim受容体をコードする核酸配列は、例えばSambrook et al. (1989 and 2001 editions; Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY)およびAusubel et al. (Current Protocols in Molecular Biology, 2003)において説明される通り、標準技術を使用する当該技術分野において公知の組換え法を使用して、例として所望の配列またはその一部を発現する細胞からのライブラリーをスクリーニングすることによって、所望の配列またはその一部を含むことが公知のベクターからの配列を派生させることによって、または所望の配列またはその一部を含有する細胞または組織から直接的に配列またはその一部を単離することによって、取得または産生することができる。あるいは、目的の配列は、クローニングするのではなく、合成産生することができる。
Polynucleotides, Vectors and Host Cells In certain aspects, the disclosure provides nucleic acid molecules encoding any one or more of the chimeric Tim receptors described herein. Nucleic acid may refer to single- or double-stranded DNA, cDNA or RNA, and may include positive and negative strands of complementary nucleic acids, including antisense DNA, cDNA and RNA. Nucleic acids can be naturally occurring or synthetic forms of DNA or RNA. Nucleic acid sequences encoding desired chimeric Tim receptors can be found, for example, in Sambrook et al. (1989 and 2001 editions; Molecular Cloning: A Laboratory Manual, Cold Spring Harbor Laboratory Press, NY) and Ausubel et al. (Current Protocols in Molecular Biology). , 2003), using recombinant methods known in the art using standard techniques, for example by screening libraries from cells expressing the desired sequence or a portion thereof. , by deriving the sequence from a vector known to contain the desired sequence or portion thereof, or by isolating the sequence or portion thereof directly from cells or tissues containing the desired sequence or portion thereof. can be obtained or produced by Alternatively, the sequences of interest can be produced synthetically rather than cloned.
本明細書において提供されるキメラTim受容体組成をコードするポリヌクレオチドは、任意の動物、例としてヒト、霊長類、ウシ、ウマ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタまたはそれらの組合せに由来し得る。ある特定の実施形態においては、キメラTim受容体をコードするポリヌクレオチドは、ポリヌクレオチドが挿入される宿主細胞と同じ動物種からのポリヌクレオチドである。 Polynucleotides encoding the chimeric Tim receptor compositions provided herein can be in any animal, including humans, primates, cows, horses, sheep, dogs, cats, mice, rats, rabbits, guinea pigs, pigs or It can be derived from combinations thereof. In certain embodiments, a polynucleotide encoding a chimeric Tim receptor is a polynucleotide from the same animal species as the host cell into which it is inserted.
本開示のキメラTim受容体をコードするポリヌクレオチドは、発現制御配列に作動可能に連結することができる。発現制御配列には、適切な転写開始、終止、プロモーターおよびエンハンサー配列;効率的なRNAプロセシングシグナル、例としてスプライシングおよびポリアデニル化シグナル;細胞質mRNAを安定化する配列;翻訳効率を向上させる配列(すなわち、コザックコンセンサス配列);タンパク質安定性を向上させる配列;および場合によって、タンパク質分泌を向上させる配列が含まれ得る。 A polynucleotide encoding a chimeric Tim receptor of the disclosure can be operably linked to an expression control sequence. Expression control sequences include appropriate transcription initiation, termination, promoter and enhancer sequences; efficient RNA processing signals, such as splicing and polyadenylation signals; sequences that stabilize cytoplasmic mRNA; Kozak consensus sequences); sequences that improve protein stability; and optionally sequences that improve protein secretion.
ある特定の実施形態においては、キメラTim受容体をコードするポリヌクレオチドは、前駆体タンパク質の分泌経路へのターゲティングのための5’末端におけるシグナルペプチド(リーダーペプチドまたはシグナル配列とも呼ばれる)をコードする配列を含む。シグナルペプチドは、細胞プロセシングおよびキメラTim受容体の宿主細胞膜への局在化中に細胞外ドメインのN末端から切断されてもよい。シグナルペプチド配列が切断または除去されたポリペプチドは、成熟ポリペプチドとも呼ばれ得る。本開示のキメラTim受容体において使用され得るシグナルペプチドの例には、例えばGM-CSF(配列番号10のアミノ酸配列)、Tim1(配列番号40のアミノ酸配列)またはTim4(配列番号11または25のアミノ酸配列)を含む、内因性分泌タンパク質由来のシグナルペプチドが含まれる。ある特定の実施形態においては、ポリヌクレオチド配列が成熟キメラTim受容体ポリペプチドをコードするか、またはポリペプチド配列が成熟キメラTim受容体ポリペプチドを含む。シグナルペプチド配列を含む本明細書において開示される配列について、シグナルペプチド配列は、コードされるタンパク質を細胞外膜へ輸送することができる別のシグナルペプチドで置き換えてもよいことが当業者によって理解される。 In certain embodiments, the polynucleotide encoding the chimeric Tim receptor has a sequence encoding a signal peptide (also called leader peptide or signal sequence) at the 5' end for targeting the precursor protein to the secretory pathway. including. A signal peptide may be cleaved from the N-terminus of the extracellular domain during cellular processing and localization of the chimeric Tim receptor to the host cell membrane. A polypeptide with the signal peptide sequence truncated or removed may also be referred to as a mature polypeptide. Examples of signal peptides that can be used in the chimeric Tim receptors of the present disclosure include, for example, GM-CSF (amino acid sequence of SEQ ID NO: 10), Tim1 (amino acid sequence of SEQ ID NO: 40) or Tim4 (amino acid sequence of SEQ ID NO: 11 or 25). A signal peptide from an endogenous secretory protein is included, including the sequence ). In certain embodiments, the polynucleotide sequence encodes or comprises a mature chimeric Tim Receptor polypeptide. For sequences disclosed herein that include a signal peptide sequence, it will be understood by those skilled in the art that the signal peptide sequence may be replaced with another signal peptide capable of transporting the encoded protein to the extracellular membrane. be.
ある特定の実施形態においては、本開示のポリヌクレオチドをコードするキメラTim受容体は、ポリヌクレオチドを含む標的宿主細胞における効率的な発現のためにコドン最適化される(例えばScholten et al., Clin. Immunol. 119:135-145 (2006)を参照のこと)。本明細書において使用されるとき、「コドン最適化した」ポリヌクレオチドは、目的の宿主細胞におけるtRNAの存在量に対応するサイレント変異により改変したコドンを有する異種のポリヌクレオチドを含む。 In certain embodiments, chimeric Tim receptor encoding polynucleotides of the disclosure are codon-optimized for efficient expression in target host cells containing the polynucleotides (e.g., Scholten et al., Clin Immunol. 119:135-145 (2006)). As used herein, "codon-optimized" polynucleotides include heterologous polynucleotides that have altered codons by silent mutations that correspond to the abundance of the tRNA in the intended host cell.
単一のポリヌクレオチド分子が、本明細書において開示される実施形態のうちのいずれかに記載の1つ、2つ、またはそれよりも多いキメラTim受容体をコードし得る。2つ以上の導入遺伝子をコードするポリヌクレオチドは、マルチシストロン性発現のために各遺伝子間に配置される配列(例えばIRES、ウイルス2Aペプチド)を含み得る。 A single polynucleotide molecule can encode one, two, or more chimeric Tim receptors according to any of the embodiments disclosed herein. Polynucleotides encoding two or more transgenes may contain sequences (eg, IRES, viral 2A peptide) interposed between each gene for multicistronic expression.
本開示において提供される少なくとも2つの導入遺伝子(例えばキメラTim受容体およびCAR)をコードするポリヌクレオチドは、タンデム発現カセットを構成するために使用され得る。タンデム発現カセットとは、少なくとも2つの導入遺伝子のタンデム発現または共発現のための、同じ組の調節配列の制御下の、または同じ組の調節配列に作動可能に連結された少なくとも2つの導入遺伝子を含むベクター核酸の成分を指す。本開示のタンデム発現カセットにおいて使用され得る調節配列には、適切な転写開始、終止、プロモーターおよびエンハンサー配列;効率的なRNAプロセシングシグナル、例としてスプライシングおよびポリアデニル化シグナル;細胞質mRNAを安定化する配列;翻訳効率を向上させる配列(すなわち、コザックコンセンサス配列);タンパク質安定性を向上させる配列;タンパク質分泌を向上させる配列;またはそれらの任意の組合せが含まれる。 A polynucleotide encoding at least two transgenes provided in this disclosure (eg, a chimeric Tim receptor and a CAR) can be used to construct a tandem expression cassette. A tandem expression cassette comprises at least two transgenes under the control of or operably linked to the same set of regulatory sequences for tandem expression or co-expression of at least two transgenes. Refers to the component of the vector nucleic acid that contains it. Regulatory sequences that may be used in the tandem expression cassettes of the present disclosure include appropriate transcription initiation, termination, promoter and enhancer sequences; efficient RNA processing signals, such as splicing and polyadenylation signals; sequences that stabilize cytoplasmic mRNA; Sequences that improve translation efficiency (ie, Kozak consensus sequences); sequences that improve protein stability; sequences that improve protein secretion; or any combination thereof.
一態様においては、本開示は、本開示のキメラTim受容体をコードするポリヌクレオチドと、細胞免疫療法剤(例えばCAR、TCR等)をコードするポリヌクレオチドとを含むタンデム発現カセットを提供する。 In one aspect, the disclosure provides a tandem expression cassette comprising a polynucleotide encoding a chimeric Tim receptor of the disclosure and a polynucleotide encoding a cellular immunotherapeutic agent (eg, CAR, TCR, etc.).
ある特定の実施形態においては、タンデム発現カセットは、空間的制御および時間的制御を最適化するように構築され得る。例えば、タンデム発現カセットは、空間的制御および時間的制御を最適化するプロモーターエレメントを含み得る。一部の実施形態においては、タンデム発現カセットは、タンデム発現カセットの器官、細胞種(例えば免疫細胞)または病理学的微小環境、例として腫瘍または感染組織への特異的誘導を可能にする組織特異的プロモーターまたはエンハンサーを含む。「エンハンサー」は、協同的に、または独立して機能して転写を活性化し得る追加のプロモーターエレメントである。ある特定の実施形態においては、タンデム発現カセットは、構成的プロモーターを含む。本開示のタンデム発現カセットにおける使用のための例示的な構成的プロモーターは、EF-1αプロモーターである。ある特定の実施形態においては、タンデム発現カセットは、誘導性プロモーターを含む。ある特定の実施形態においては、タンデム発現カセットは、組織特異的プロモーターを含む。 In certain embodiments, tandem expression cassettes can be constructed to optimize spatial and temporal control. For example, a tandem expression cassette can contain promoter elements that optimize spatial and temporal control. In some embodiments, the tandem expression cassettes are tissue-specific, allowing specific induction of the tandem expression cassettes into organs, cell types (e.g., immune cells) or pathological microenvironments, e.g., tumors or infected tissues. contains a specific promoter or enhancer. An "enhancer" is an additional promoter element that can function either cooperatively or independently to activate transcription. In certain embodiments, a tandem expression cassette comprises a constitutive promoter. An exemplary constitutive promoter for use in the tandem expression cassettes of this disclosure is the EF-1α promoter. In certain embodiments, a tandem expression cassette comprises an inducible promoter. In certain embodiments, a tandem expression cassette includes a tissue-specific promoter.
タンデム発現カセット内に含有される少なくとも2つの導入遺伝子は、任意の順序で存在し得る。例えば、キメラTim受容体をコードするポリヌクレオチドとCARをコードするポリヌクレオチドとを含むタンデム発現カセットは、5’~3’へ:キメラTim受容体-CARまたはCAR-キメラTim受容体のように配置され得る。 The at least two transgenes contained within a tandem expression cassette can be in any order. For example, a tandem expression cassette comprising a polynucleotide encoding a chimeric Tim receptor and a polynucleotide encoding a CAR is arranged 5′ to 3′: chimeric Tim receptor-CAR or CAR-chimeric Tim receptor. can be
ある特定の実施形態においては、会合して多量体または複合体を形成する2つまたはそれよりも多いポリペプチド鎖を含む受容体は、タンデム発現コンストラクト内の2つまたはそれよりも多いポリヌクレオチド分子によってコードされ得る。本開示のタンデム発現コンストラクトにおいて発現のために企図される例示的な多量体受容体には、多重鎖CAR、TCR、TCR-CARおよびTRuC(商標)コンストラクトが含まれる。したがって、キメラTim受容体およびTCRをコードする例示的なタンデム発現カセット実施形態は、キメラTim受容体をコードするポリヌクレオチド、TCRα鎖ポリペプチドをコードするポリヌクレオチドおよびTCRβ鎖ポリペプチドをコードするポリヌクレオチドを含み得る。 In certain embodiments, a receptor comprising two or more polypeptide chains that associate to form a multimer or complex is combined with two or more polynucleotide molecules within a tandem expression construct. can be coded by Exemplary multimeric receptors contemplated for expression in the tandem expression constructs of this disclosure include multi-chain CAR, TCR, TCR-CAR and TRuC™ constructs. Thus, an exemplary tandem expression cassette embodiment encoding a chimeric Tim Receptor and a TCR is a polynucleotide encoding a chimeric Tim Receptor, a polynucleotide encoding a TCR α chain polypeptide and a polynucleotide encoding a TCR β chain polypeptide. can include
ある特定の実施形態においては、本開示のタンデム発現カセットは、単一のmRNAからの多数のタンパク質の共発現を可能にするために、タンデム発現カセット内に含有される各ポリヌクレオチド間に配置される配列内リボソーム進入部位(IRES)またはペプチド切断部位、例としてフューリン切断部位またはウイルス2Aペプチドを含み得る。例えば、IRES、フューリン切断部位またはウイルス2Aペプチドは、タンデム発現カセット内のキメラTim受容体をコードするポリヌクレオチドとCARをコードするポリヌクレオチドとの間に配置され得る。別の例においては、IRES、フューリン切断部位またはウイルス2Aペプチドは、キメラTim受容体をコードするポリヌクレオチド、TCRα鎖ポリペプチドをコードするポリヌクレオチドおよびTCRβ鎖ポリペプチドをコードするポリヌクレオチドの各々の間に配置され得る。ある特定の実施形態においては、ウイルス2Aペプチドは、ブタテッショウウイルス-1(P2A)、トセア・アシグナ(Thosea asigna)ウイルス(T2A)、ウマ鼻炎Aウイルス(E2A)、口蹄疫ウイルス(F2A)またはそれらの変異型である。例示的なT2Aペプチドは、配列番号12、28、29または30のうちのいずれか1つのアミノ酸配列を含む。例示的なP2Aペプチドは、配列番号13または31のアミノ酸配列を含む。例示的なE2Aペプチド配列は、配列番号14のアミノ酸配列を含む。例示的なF2Aペプチド配列は、配列番号15のアミノ酸配列を含む。 In certain embodiments, the tandem expression cassettes of the present disclosure are positioned between each polynucleotide contained within the tandem expression cassette to allow co-expression of multiple proteins from a single mRNA. may contain an internal ribosome entry site (IRES) or peptide cleavage site, such as a furin cleavage site or a viral 2A peptide. For example, an IRES, a furin cleavage site, or a viral 2A peptide can be placed between the polynucleotides encoding the chimeric Tim receptor and the CAR in the tandem expression cassette. In another example, the IRES, furin cleavage site or viral 2A peptide is between each of the polynucleotide encoding the chimeric Tim receptor, the polynucleotide encoding the TCR α chain polypeptide and the polynucleotide encoding the TCR β chain polypeptide. can be placed in In certain embodiments, the viral 2A peptide is porcine tescho virus-1 (P2A), Thosea asigna virus (T2A), equine rhinitis A virus (E2A), foot-and-mouth disease virus (F2A), or is a variant of Exemplary T2A peptides comprise the amino acid sequence of any one of SEQ ID NOS: 12, 28, 29 or 30. An exemplary P2A peptide comprises the amino acid sequence of SEQ ID NO: 13 or 31. An exemplary E2A peptide sequence comprises the amino acid sequence of SEQ ID NO:14. An exemplary F2A peptide sequence comprises the amino acid sequence of SEQ ID NO:15.
本開示のタンデム発現カセットのある特定の実施形態は、標的抗原(例えば腫瘍抗原)に対して特異的なCAR/またはTCRをコードするポリヌクレオチドと、本開示のキメラTim受容体をコードするポリヌクレオチドとを含む。CAR/またはTCRによる標的抗原を発現する標的細胞の結合に際して、そのようなタンデム発現カセットを発現するように改変した細胞は、標的細胞のアポトーシスを誘導する。アポトーシスは、標的細胞上のプロ貪食マーカー、例としてホスファチジルセリンの曝露を誘導し、その後、ホスファチジルセリンは、損傷細胞またはアポトーシス細胞をキメラTim受容体による貪食にターゲティングし得る。 Certain embodiments of the tandem expression cassettes of the disclosure comprise a polynucleotide encoding a CAR/or TCR specific for a target antigen (e.g., a tumor antigen) and a polynucleotide encoding a chimeric Tim receptor of the disclosure including. Upon binding of target cells expressing target antigens by CAR/or TCR, cells modified to express such tandem expression cassettes induce apoptosis of target cells. Apoptosis induces the exposure of pro-phagocytic markers, such as phosphatidylserine, on target cells, which can then target damaged or apoptotic cells for phagocytosis by chimeric Tim receptors.
所望のキメラTim受容体をコードするポリヌクレオチドは、目的の宿主細胞(例えば免疫細胞)への導入のために、適切なベクター、例えばウイルスベクター、非ウイルスプラスミドベクターおよび非ウイルスベクター、例として脂質ベースのDNAベクター、修飾mRNA(modRNA)、自己増幅mRNA、CELiDおよびトランスポゾン媒介遺伝子移行(PiggyBac、Sleeping Beauty)に挿入され得る。本開示のキメラTim受容体をコードするポリヌクレオチドは、任意の好適なベクター、例として発現ベクター、複製ベクター、プローブ生成ベクターまたはシークエンシングベクターにクローニングされ得る。ある特定の実施形態においては、細胞外ドメインをコードするポリヌクレオチド、膜貫通ドメインをコードするポリヌクレオチド、および細胞内シグナル伝達ドメインをコードするポリヌクレオチドは、互いに接合されて単一のポリヌクレオチドになり、その後、ベクターに挿入される。他の実施形態においては、細胞外ドメインをコードするポリヌクレオチド、膜貫通ドメインをコードするポリヌクレオチド、および細胞内シグナル伝達ドメインをコードするポリヌクレオチドは、発現されるアミノ酸配列が機能的キメラTim受容体を産生するように、ベクターに別々に挿入され得る。キメラTim受容体をコードするベクターは、「キメラTim受容体ベクター」と本明細書において呼ばれる。 Polynucleotides encoding the desired chimeric Tim Receptor are placed in suitable vectors, including viral vectors, non-viral plasmid vectors and non-viral vectors, including lipid-based vectors, for introduction into the desired host cells (e.g., immune cells). DNA vectors, modified mRNA (modRNA), self-amplified mRNA, CELiD and transposon-mediated gene transfer (PiggyBac, Sleeping Beauty). A polynucleotide encoding a chimeric Tim receptor of the present disclosure can be cloned into any suitable vector, including expression vectors, replication vectors, probe generation vectors or sequencing vectors. In certain embodiments, a polynucleotide encoding an extracellular domain, a polynucleotide encoding a transmembrane domain, and a polynucleotide encoding an intracellular signaling domain are joined together into a single polynucleotide. , which is then inserted into the vector. In other embodiments, the extracellular domain-encoding polynucleotide, the transmembrane domain-encoding polynucleotide, and the intracellular signaling domain-encoding polynucleotide are such that the expressed amino acid sequence is a functional chimeric Tim receptor. can be separately inserted into vectors so as to produce A vector encoding a chimeric Tim receptor is referred to herein as a "chimeric Tim receptor vector."
ある特定の実施形態においては、ベクターは、1つのキメラTim受容体をコードするポリヌクレオチドを含む。ある特定の実施形態においては、ベクターは、2つまたはそれよりも多いキメラTim受容体をコードする1つのポリヌクレオチドを含む。ある特定の実施形態においては、2つまたはそれよりも多いキメラTim受容体をコードする単一のポリヌクレオチドがクローニング部位にクローニングされ、かつ単一のプロモーターから発現され、各キメラTim受容体配列は、単一のオープンリーディングフレームからの複数遺伝子の共発現を可能にするために(例えばマルチシストロン性ベクター)、配列内リボソーム進入部位(IRES)、フューリン切断部位またはウイルス2Aペプチドによって互いに分離されている。ある特定の実施形態においては、ウイルス2Aペプチドは、ブタテッショウウイルス-1(P2A)、トセア・アシグナ(Thosea asigna)ウイルス(T2A)、ウマ鼻炎Aウイルス(E2A)、口蹄疫ウイルス(F2A)またはそれらの変異型である。例示的なT2Aペプチドは、配列番号12、28、29または30のアミノ酸配列を含む。例示的なP2Aペプチドは、配列番号13または31のアミノ酸配列を含む。例示的なE2Aペプチド配列は、配列番号14のアミノ酸配列を含む。例示的なF2Aペプチド配列は、配列番号15のアミノ酸配列を含む。 In certain embodiments, the vector comprises a polynucleotide encoding one chimeric Tim receptor. In certain embodiments, the vector comprises one polynucleotide encoding two or more chimeric Tim receptors. In certain embodiments, a single polynucleotide encoding two or more chimeric tim receptors is cloned into a cloning site and expressed from a single promoter, each chimeric tim receptor sequence , separated from each other by internal ribosome entry sites (IRES), furin cleavage sites or viral 2A peptides to allow co-expression of multiple genes from a single open reading frame (e.g., multicistronic vectors) . In certain embodiments, the viral 2A peptide is porcine tescho virus-1 (P2A), Thosea asigna virus (T2A), equine rhinitis A virus (E2A), foot-and-mouth disease virus (F2A), or is a variant of Exemplary T2A peptides comprise the amino acid sequence of SEQ ID NOs: 12, 28, 29 or 30. An exemplary P2A peptide comprises the amino acid sequence of SEQ ID NO: 13 or 31. An exemplary E2A peptide sequence comprises the amino acid sequence of SEQ ID NO:14. An exemplary F2A peptide sequence comprises the amino acid sequence of SEQ ID NO:15.
ある特定の実施形態においては、ベクターは、各ポリヌクレオチドがキメラTim受容体をコードする、2つまたはそれよりも多いポリヌクレオチドを含む。キメラTim受容体をコードする2つまたはそれよりも多いポリヌクレオチドは、異なるクローニング部位においてベクターへと連続的にクローニングすることができ、各キメラTim受容体は、異なるプロモーターの調節下で発現される。ある特定の実施形態においては、導入遺伝子の長期統合および娘細胞への伝播を可能にするベクターが利用される。例には、ウイルスベクター、例として、アデノウイルス、アデノ随伴ウイルス、ワクシニアウイルス、ヘルペスウイルス、サイトメガロウイルス、ポックスウイルスまたはレトロウイルス、例としてレンチウイルスベクターが含まれる。レンチウイルスに由来するベクターは、長期遺伝子移行を達成するために使用され、非増殖細胞、例として肝細胞に形質導入する能力、および低免疫原性を含む、ベクターに優る付加利益を有し得る。 In certain embodiments, the vector comprises two or more polynucleotides, each polynucleotide encoding a chimeric Tim receptor. Two or more polynucleotides encoding chimeric Tim Receptors can be sequentially cloned into a vector at different cloning sites, each chimeric Tim Receptor being expressed under the control of a different promoter. . In certain embodiments, vectors are utilized that allow long-term integration of the transgene and its spread to daughter cells. Examples include viral vectors such as adenovirus, adeno-associated virus, vaccinia virus, herpes virus, cytomegalovirus, poxvirus or retrovirus, such as lentiviral vectors. Lentiviral-derived vectors are used to achieve long-term gene transfer and may have additional advantages over vectors, including the ability to transduce non-proliferating cells, such as hepatocytes, and low immunogenicity. .
コアウイルスをコードするベクターは、「ウイルスベクター」と本明細書において呼ばれる。ヒト遺伝子療法適用のために特定されたウイルスベクターを含む、本開示の組成物との使用のために好適な多数の使用可能なウイルスベクターがある(Pfeifer and Verme, Ann. Rev. Genomics Hum. Genet. 2:177, 2001を参照のこと)。好適なウイルスベクターには、RNAウイルスに基づくベクター、例としてレトロウイルス由来ベクター、例えばマロニーマウス白血病ウイルス(MLV:Maloney murine leukemia virus)由来ベクターが含まれ、より複雑なレトロウイルス由来ベクター、例えばレンチウイルス由来ベクターが含まれる。HIV-1由来ベクターは、このカテゴリーに属する。他の例には、HIV-2、FIV、ウマ伝染性貧血ウイルス、SIVおよびマエディビスナウイルス(ヒツジレンチウイルス)に由来するレンチウイルスベクターが含まれる。レトロウイルス性およびレンチウイルス性ウイルスベクターを使用する方法、および哺乳動物宿主細胞にキメラ受容体導入遺伝子を含有するウイルス粒子を形質導入するための細胞をパッケージングする方法は、当該技術分野において公知であり、例えば米国特許第8,119,772号;Walchli et al., PLoS One 6:327930, 2011;Zhao et al., J. Immunol. 174:4415, 2005;Engels et al., Hum. Gene Ther. 14:1155, 2003;Frecha et al., Mol. Ther. 18:1748, 2010;Verhoeyen et al., Methods Mol. Biol. 506:97, 2009において以前に説明されている。また、レトロウイルスベクターおよびレンチウイルスベクターのコンストラクトおよび発現系は、市販されている。 A vector encoding a core virus is referred to herein as a "viral vector." There are a number of available viral vectors suitable for use with the compositions of the present disclosure, including those identified for human gene therapy applications (Pfeifer and Verme, Ann. Rev. Genomics Hum. Genet 2:177, 2001). Suitable viral vectors include RNA virus-based vectors such as retrovirus-derived vectors such as Maloney murine leukemia virus (MLV)-derived vectors, and more complex retroviral-derived vectors such as lentiviruses. A derived vector is included. HIV-1 derived vectors belong to this category. Other examples include lentiviral vectors derived from HIV-2, FIV, equine infectious anemia virus, SIV and maedi visnavirus (ovine lentivirus). Methods for using retroviral and lentiviral viral vectors and packaging cells for transducing viral particles containing chimeric receptor transgenes into mammalian host cells are known in the art. Yes, e.g. U.S. Patent No. 8,119,772; Walchli et al., PLoS One 6:327930, 2011; Zhao et al., J. Immunol. 174:4415, 2005; Engels et al., Hum. 14:1155, 2003; Frecha et al., Mol. Ther. 18:1748, 2010; Verhoeyen et al., Methods Mol. Biol. Retroviral and lentiviral vector constructs and expression systems are also commercially available.
ある特定の実施形態においては、ウイルスベクターは、キメラTim受容体をコードする非内因性ポリヌクレオチドを宿主細胞に導入するために使用される。ウイルスベクターは、レトロウイルスベクターまたはレンチウイルスベクターであり得る。また、ウイルスベクターは、形質導入についてのマーカーをコードする核酸配列を含み得る。ウイルスベクターのための形質導入マーカーは、当該技術分野において公知であり、薬物抵抗性を与え得る選択マーカー、または検出可能なマーカー、例として蛍光マーカー、もしくはフローサイトメトリー等の方法によって検出され得る細胞表面タンパク質を含む。特定の実施形態においては、ウイルスベクターは、蛍光タンパク質(例えば緑色、黄色)を含む形質導入についての遺伝子マーカー、ヒトCD2の細胞外ドメインまたは切断型ヒトEGFR(EGFRtまたはtEGFR;Wang et al., Blood 118:1255, 2011を参照のこと)をさらに含む。例示的なtEGFRは、配列番号16のアミノ酸配列を含む。ウイルスベクターゲノムが単一の転写産物からの別個のタンパク質として宿主細胞において発現される複数の遺伝子を含む場合、ウイルスベクターはまた、マルチシストロン性発現を可能にする2つの(またはそれよりも多い)遺伝子間に追加の配列も含み得る。ウイルスベクターにおいて用いられるそのような配列の例には、配列内リボソーム進入部位(IRES)、フューリン切断部位、ウイルス2Aペプチド(例えばT2A、P2A、E2A、F2A)、またはそれらの任意の組合せが含まれる。 In certain embodiments, viral vectors are used to introduce a non-endogenous polynucleotide encoding a chimeric Tim receptor into host cells. Viral vectors can be retroviral or lentiviral vectors. Viral vectors may also contain nucleic acid sequences that encode markers for transduction. Transduction markers for viral vectors are known in the art, selectable markers that can confer drug resistance, or detectable markers, such as fluorescent markers, or cells that can be detected by methods such as flow cytometry. Contains surface proteins. In certain embodiments, the viral vector comprises a genetic marker for transduction comprising a fluorescent protein (e.g., green, yellow), the extracellular domain of human CD2 or truncated human EGFR (EGFRt or tEGFR; Wang et al., Blood 118:1255, 2011). An exemplary tEGFR comprises the amino acid sequence of SEQ ID NO:16. When the viral vector genome contains multiple genes that are expressed in the host cell as separate proteins from a single transcript, viral vectors also have two (or more) genes that allow multicistronic expression. Additional sequences between genes may also be included. Examples of such sequences used in viral vectors include internal ribosome entry sites (IRES), furin cleavage sites, viral 2A peptides (eg T2A, P2A, E2A, F2A), or any combination thereof. .
また、ポリヌクレオチドデリバリーのために、例えばアデノウイルスベースのベクターおよびアデノ随伴ウイルス(AAV:adeno-associated virus)ベースのベクター;アンプリコンベクター、複製欠損HSVおよび弱毒化HSVを含む単純ヘルペスウイルス(HSV:herpes simplex virus)由来のベクターを含むDNAウイルスベクターを含む他のウイルスベクターを使用することができる(Krisky et al., Gene Ther. 5: 1517, 1998)。 Also, for polynucleotide delivery, for example, adenovirus-based vectors and adeno-associated virus (AAV)-based vectors; amplicon vectors, herpes simplex virus (HSV: Other viral vectors can be used, including DNA viral vectors, including vectors derived from Herpes simplex virus (Krisky et al., Gene Ther. 5: 1517, 1998).
また、遺伝子療法のために最近開発された他のウイルスベクターは、本開示の組成物および方法と共に使用することができる。そのようなベクターには、バキュロウイルスおよびα-ウイルス由来のベクター(Jolly, D J. 1999. Emerging Viral Vectors. pp 209-40, Friedmann T. ed. The Development of Human Gene Therapy. New York: Cold Spring Harbor Lab)またはプラスミドベクター(例としてsleeping beautyまたは他のトランスポゾンベクター)が含まれる。 Other viral vectors recently developed for gene therapy can also be used with the compositions and methods of this disclosure. Such vectors include baculovirus- and alpha-virus-derived vectors (Jolly, D J. 1999. Emerging Viral Vectors. pp 209-40, Friedmann T. ed. The Development of Human Gene Therapy. New York: Cold Spring Harbor Lab) or plasmid vectors (eg sleeping beauty or other transposon vectors).
ある特定の実施形態においては、キメラTim受容体ベクターは、空間的制御および時間的制御を最適化するように構築され得る。例えば、キメラTim受容体ベクターは、空間的制御および時間的制御を最適化するプロモーターエレメントを含み得る。一部の実施形態においては、キメラTim受容体ベクターは、キメラTim受容体の器官、細胞種(例えば免疫細胞)または病理学的微小環境、例として腫瘍または感染組織への特異的誘導を可能にする組織特異的プロモーターまたはエンハンサーを含む。「エンハンサー」は、協同的に、または独立して機能して転写を活性化し得る追加のプロモーターエレメントである。ある特定の実施形態においては、キメラTim受容体ベクターは、構成的プロモーターを含む。ある特定の実施形態においては、キメラTim受容体ベクターは、誘導性プロモーターを含む。ある特定の実施形態においては、キメラTim受容体ベクターは、組織特異的プロモーターを含む。 In certain embodiments, chimeric Tim receptor vectors can be constructed to optimize spatial and temporal control. For example, chimeric Tim acceptor vectors can contain promoter elements that optimize spatial and temporal control. In some embodiments, the chimeric Tim Receptor vector allows specific targeting of the chimeric Tim Receptor to an organ, cell type (e.g., immune cell) or pathological microenvironment, such as a tumor or infected tissue. contains tissue-specific promoters or enhancers that An "enhancer" is an additional promoter element that can function either cooperatively or independently to activate transcription. In certain embodiments, the chimeric Tim acceptor vector contains a constitutive promoter. In certain embodiments, the chimeric Tim acceptor vector contains an inducible promoter. In certain embodiments, the chimeric Tim receptor vector contains a tissue-specific promoter.
ある特定の実施形態においては、キメラTim受容体ベクターは、インビボにおけるホーミングおよび抗腫瘍活性を改善するために、ホーミング受容体、例としてCCR4またはCXCR4をコードする遺伝子を含み得る。 In certain embodiments, chimeric Tim receptor vectors may include genes encoding homing receptors, such as CCR4 or CXCR4, to improve homing and anti-tumor activity in vivo.
時間的な制御が所望される場合、キメラTim受容体ベクターは、形質導入された細胞の誘導性枯渇を可能にするエレメントを含み得る。例えば、そのようなベクターは、誘導性自殺遺伝子を含み得る。自殺遺伝子は、アポトーシス遺伝子または剤(例えば薬物)への感受性を与える遺伝子であり得る。例示的な自殺遺伝子には、化学誘導性カスパーゼ9(iCASP9)(米国特許公開公報第2013/0071414号)、化学誘導性Fas、またはガンシクロビルへの感受性を与える単純ヘルペスウイルスチミジンキナーゼ(HSV-TK)が含まれる。さらなる実施形態においては、キメラTim受容体ベクターは、関連抗体の注入に際して、形質導入された細胞の枯渇を可能にする公知の細胞表面抗原を発現するように設計され得る。形質導入された細胞の枯渇のために使用され得る細胞表面抗原およびそれらの関連抗体の例には、CD20およびリツキシマブ、RQR8(CD34選択および抗CD20枯渇を可能にする混合CD34およびCD20エピトープ)およびリツキシマブ、ならびにEGFRおよびセツキシマブが含まれる。 If temporal control is desired, the chimeric Tim receptor vector can contain elements that allow for inducible depletion of transduced cells. For example, such vectors may contain an inducible suicide gene. A suicide gene can be an apoptotic gene or a gene that confers sensitivity to an agent (eg, drug). Exemplary suicide genes include chemo-inducible caspase 9 (iCASP9) (U.S. Patent Publication No. 2013/0071414), chemo-inducible Fas, or herpes simplex virus thymidine kinase (HSV-TK) that confers sensitivity to ganciclovir. is included. In further embodiments, chimeric Tim receptor vectors can be designed to express known cell surface antigens that allow depletion of transduced cells upon injection of the relevant antibody. Examples of cell surface antigens and their associated antibodies that can be used for depletion of transduced cells include CD20 and rituximab, RQR8 (mixed CD34 and CD20 epitopes allowing CD34 selection and anti-CD20 depletion) and rituximab. , as well as EGFR and cetuximab.
また、誘導性ベクター系、例として、ドキシサイクリンにより導入遺伝子発現を活性化するテトラサイクリン(Tet)-Onベクター系(Heinz et al., Hum. Gene Ther. 2011, 22:166-76)は、誘導性のキメラTim受容体発現のために使用され得る。また、誘導性のキメラTim受容体発現は、キメラTim受容体構造に導入したフックおよびストレプトアビジン結合タンパク質を通して小胞体膜に固定したストレプトアビジンに基づく選択フック(RUSH)系を使用する保持を介して達成することができ、ここでは、ビオチンの系への添加は、小胞体からのキメラTim受容体の放出をもたらす(Agaugue et al., 2015, Mol. Ther. 23(Suppl. 1):S88)。 Inducible vector systems, such as the tetracycline (Tet)-On vector system, which activates transgene expression with doxycycline (Heinz et al., Hum. Gene Ther. 2011, 22:166-76), are also known to be inducible. can be used for chimeric Tim receptor expression. Inducible chimeric tim receptor expression is also mediated via retention using a streptavidin-based selective hook (RUSH) system anchored to the endoplasmic reticulum membrane through hooks and streptavidin-binding proteins introduced into the chimeric tim receptor structure. Here, addition of biotin to the system results in the release of chimeric Tim receptors from the endoplasmic reticulum (Agaugue et al., 2015, Mol. Ther. 23(Suppl. 1):S88). .
ある特定の実施形態においては、対象から得られた免疫細胞等の細胞は、本明細書において説明するキメラTim受容体をコードするポリヌクレオチドを導入することによって、非天然または組換え細胞(例えば非天然または組換え免疫細胞)へと操作される場合があり、それによって、細胞は、細胞表面局在化キメラTim受容体を発現する。ある特定の実施形態においては、宿主細胞は、免疫細胞、例として骨髄系前駆細胞またはリンパ球前駆細胞である。キメラTim受容体をコードするポリヌクレオチドまたはキメラTim受容体をコードするポリヌクレオチドを含むベクターを含むように改変され得る例示的な免疫細胞には、T細胞、ナチュラルキラー細胞、B細胞、リンパ球前駆体細胞、抗原提示細胞、樹状細胞、ランゲルハンス細胞、骨髄系前駆体細胞、成熟骨髄細胞、単球またはマクロファージが含まれる。 In certain embodiments, cells, such as immune cells, obtained from a subject are transformed into non-natural or recombinant cells (e.g., non-human cells) by introducing a polynucleotide encoding a chimeric Tim receptor described herein. natural or recombinant immune cells), whereby the cells express a cell surface-localized chimeric Tim receptor. In certain embodiments, the host cells are immune cells, such as myeloid progenitor cells or lymphoid progenitor cells. Exemplary immune cells that may be modified to contain a polynucleotide encoding a chimeric Tim Receptor or a vector containing a polynucleotide encoding a chimeric Tim Receptor include T cells, natural killer cells, B cells, lymphocyte progenitors. Included are somatic cells, antigen-presenting cells, dendritic cells, Langerhans cells, myeloid progenitor cells, mature myeloid cells, monocytes or macrophages.
ある特定の実施形態においては、B細胞は、1つまたは複数のキメラTim受容体を発現するように遺伝子改変される。B細胞は、炎症部位への輸送、抗原を内部移行および提示することができること、T細胞を共刺激することができること、高増殖性および自己再生性(生涯持続する)を含む宿主細胞として有益であり得るある特定の特性を有する。ある特定の実施形態においては、キメラTim受容体改変B細胞は、貪食された標的細胞または貪食された標的粒子をより小さいペプチドに消化し、それらを、MHC分子を介してT細胞に提示することができる。キメラTim受容体改変B細胞による抗原提示は、免疫応答の非ターゲティング抗原への抗原拡張に寄与し得る。B細胞は、B細胞系統にコミットされた前駆細胞もしくは前駆体細胞(例えばプレプロB細胞、プロB細胞およびプレB細胞);未成熟かつ不活性化B細胞;または成熟かつ機能的もしくは活性化B細胞を含む。ある特定の実施形態においては、B細胞は、ナイーブB細胞、形質細胞、制御性B細胞、辺縁帯B細胞、濾胞性B細胞、リンパ形質細胞性細胞、形質芽細胞、メモリーB細胞またはそれらの任意の組合せであり得る。メモリーB細胞は、ナイーブB細胞においては非存在であるCD27の発現によってナイーブB細胞から区別され得る。ある特定の実施形態においては、B細胞は、ヒト、マウス、ラットまたは他の哺乳動物由来の初代細胞または細胞系であり得る。B細胞系は、当該技術分野において周知である。哺乳動物から得られる場合、B細胞は、血液、骨髄、脾臓、リンパ節または他の組織もしくは体液を含む多くの供給源から得ることができる。B細胞組成物は、富化または精製され得る。 In certain embodiments, B cells are genetically modified to express one or more chimeric Tim receptors. B cells are beneficial as host cells including trafficking to sites of inflammation, ability to internalize and present antigens, ability to co-stimulate T cells, hyperproliferation and self-renewal (sustaining for life). Possibly has certain properties. In certain embodiments, chimeric Tim receptor-modified B cells digest phagocytosed target cells or phagocytosed target particles into smaller peptides and present them to T cells via MHC molecules. can be done. Antigen presentation by chimeric Tim receptor-modified B cells may contribute to antigenic extension of the immune response to non-targeted antigens. B cells are progenitor or progenitor cells committed to the B cell lineage (e.g., pre-pro B cells, pro B cells and pre B cells); immature and inactivated B cells; or mature and functional or activated B cells. Contains cells. In certain embodiments, the B cells are naive B cells, plasma cells, regulatory B cells, marginal zone B cells, follicular B cells, lymphoplasmacytic cells, plasmablasts, memory B cells, or can be any combination of Memory B cells can be distinguished from naive B cells by the expression of CD27, which is absent on naive B cells. In certain embodiments, B cells can be primary cells or cell lines from humans, mice, rats, or other mammals. B cell lineages are well known in the art. When obtained from a mammal, B cells can be obtained from many sources including blood, bone marrow, spleen, lymph nodes or other tissues or fluids. B-cell compositions can be enriched or purified.
ある特定の実施形態においては、T細胞は、1つまたは複数のキメラTim受容体を発現するように遺伝子改変される。例示的なT細胞には、CD4+ヘルパー、CD8+エフェクター(細胞傷害性)、ナイーブ(CD45 RA+、CCR7+、CD62L+、CD27+、CD45RO-)、セントラルメモリー(CD45RO+、CD62L+、CD8+)、エフェクターメモリー(CD45RA+、CD45RO-、CCR7-、CD62L-、CD27-)、Tメモリー幹、制御性、粘膜関連インバリアント(MAIT)、γδ(gd)、組織レジデントT細胞、ナチュラルキラーT細胞またはそれらの任意の組合せが含まれる。ある特定の実施形態においては、T細胞は、ヒト、マウス、ラットまたは他の哺乳動物由来の初代細胞または細胞系であり得る。哺乳動物から得られる場合、T細胞は、血液、骨髄、リンパ節、胸腺または他の組織もしくは体液を含む多くの供給源から得ることができる。T細胞組成物は、富化または精製され得る。T細胞系は、当該技術分野において周知であり、それらのうちの一部は、Sandberg et al., Leukemia 21:230, 2000において説明されている。ある特定の実施形態においては、T細胞は、TCRα遺伝子、TCRβ遺伝子またはそれらの両方の内因性発現を欠く。そのようなT細胞は、TCRαおよびβ鎖の内因性発現を天然に欠いていてもよく、発現を遮断するように(例えば、TCRαおよびβ鎖を発現しないトランスジェニックマウスからのT細胞、またはTCRαおよびβ鎖の発現を阻害するように操作された細胞)、またはTCRα鎖、TCRβ鎖またはそれらの両方の遺伝子をノックアウトするように改変されていてもよい。 In certain embodiments, T cells are genetically modified to express one or more chimeric Tim receptors. Exemplary T cells include CD4 + helper, CD8 + effector (cytotoxic), naive (CD45 RA +, CCR7 +, CD62L +, CD27 +, CD45RO-), central memory (CD45RO + , CD62L + , CD8 + ), effector Memory (CD45RA+, CD45RO-, CCR7-, CD62L-, CD27-), T memory stem, regulatory, mucosa-associated invariant (MAIT), γδ(gd), tissue resident T cells, natural killer T cells or any thereof includes a combination of In certain embodiments, T cells can be primary cells or cell lines from humans, mice, rats, or other mammals. When obtained from a mammal, T cells can be obtained from many sources including blood, bone marrow, lymph nodes, thymus or other tissues or fluids. T cell compositions can be enriched or purified. T cell lines are well known in the art, some of which are described in Sandberg et al., Leukemia 21:230, 2000. In certain embodiments, the T cells lack endogenous expression of the TCRα gene, the TCRβ gene, or both. Such T cells may naturally lack endogenous expression of the TCRα and β chains, and may be induced to block expression (e.g., T cells from transgenic mice that do not express TCRα and β chains, or TCRα and β chains), or modified to knock out genes for the TCR α chain, the TCR β chain, or both.
ある特定の実施形態においては、細胞表面上に本開示のキメラTimタンパク質を発現する宿主細胞は、T細胞またはT細胞系統の細胞ではないが、細胞表面抗CD3を発現するように改変された前駆細胞、幹細胞または細胞である、細胞である。 In certain embodiments, a host cell that expresses a chimeric Tim protein of the present disclosure on its cell surface is not a T cell or cell of the T cell lineage, but a progenitor that has been engineered to express cell surface anti-CD3. A cell that is a cell, a stem cell or a cell.
ある特定の実施形態においては、宿主細胞ゲノムを本開示のキメラTim受容体をコードするポリヌクレオチドを含むように改変するために、遺伝子編集法が使用される。遺伝子編集またはゲノム編集は、遺伝子操作エンドヌクレアーゼを使用してDNAが挿入されるか、置き換えられるか、または宿主細胞のゲノムから除去される遺伝子操作法である。ヌクレアーゼは、ゲノムにおけるターゲティングされた遺伝子座において特異的二本鎖切断を創出する。その後、宿主細胞の内因性DNA修復経路は、例えば非相同末端結合(NHEJ:non-homologous ending joining)および相同組換えによって、誘導された切断(複数可)を修復する。遺伝子編集に有用な例示的なエンドヌクレアーゼには、ジンクフィンガーヌクレアーゼ(ZFN:zinc finger nuclease)、転写アクチベーター様エフェクター(TALE:transcription activator-like effector)ヌクレアーゼ、CRISPR(clustered regularly interspaced short palindromic repeats:クラスター化規則的配置短回文反復配列)/Casヌクレアーゼ系(例えばCRISPR-Cas9)、メガヌクレアーゼまたはそれらの組合せが含まれる。遺伝子編集エンドヌクレアーゼを使用して、B細胞およびT細胞を含む免疫細胞において遺伝子または遺伝子発現を破壊またはノックアウトする方法は、当該技術分野において公知であり、例えばPCT公開公報WO2015/066262号;WO2013/074916号;WO2014/059173号;Cheong et al., Nat. Comm. 2016 7:10934;Chu et al., Proc. Natl. Acad. Sci. USA 2016 113:12514-12519において説明されており、そのうちの各々からの方法は、その全体を参照により本明細書に組み込む。 In certain embodiments, gene editing methods are used to modify the host cell genome to contain a polynucleotide encoding a chimeric Tim receptor of the present disclosure. Gene editing, or genome editing, is a genetic engineering method in which DNA is inserted, replaced, or removed from the genome of a host cell using genetic engineering endonucleases. Nucleases create specific double-strand breaks at targeted loci in the genome. The host cell's endogenous DNA repair pathways then repair the induced break(s) by, for example, non-homologous end joining (NHEJ) and homologous recombination. Exemplary endonucleases useful for gene editing include zinc finger nucleases (ZFNs), transcription activator-like effector (TALE) nucleases, clustered regularly interspaced short p alindromic repeats: cluster Regularly arranged short palindromic repeats)/Cas nuclease systems (eg CRISPR-Cas9), meganucleases or combinations thereof. Methods of using gene-editing endonucleases to disrupt or knock out genes or gene expression in immune cells, including B cells and T cells, are known in the art, e.g. WO2014/059173; Cheong et al., Nat. Comm. 2016 7:10934; Chu et al., Proc. Natl. Acad. The method from each is incorporated herein by reference in its entirety.
ある特定の実施形態においては、宿主細胞の内因性遺伝子の発現は、阻害、ノックダウンまたはノックアウトされる。B細胞において阻害、ノックダウンまたはノックアウトされ得る内因性遺伝子の例には、IGH、IGκ、IGλまたはそれらの任意の組合せが含まれる。T細胞において阻害、ノックダウンまたはノックアウトされ得る内因性遺伝子の例には、TCR遺伝子(TRAまたはTRB)、HLA遺伝子(HLAクラスI遺伝子またはHLAクラスII遺伝子)、免疫チェックポイント分子(PD-L1、PD-L2、CD80、CD86、B7-H3、B7-H4、HVEM、アデノシン、GAL9、VISTA、CEACAM-1、CEACAM-3、CEACAM-5、PVRL2、PD-1、CTLA-4、BTLA、KIR、LAG3、TIM3、A2aR、CD244/2B4、CD160、TIGIT、LAIR-1またはPVRIG/CD112R)またはそれらの任意の組合せが含まれる。内因性遺伝子の発現は、遺伝子レベル、転写レベル、翻訳レベルまたはそれらの組合せにおいて阻害、ノックダウンまたはノックアウトされ得る。内因性遺伝子を阻害、ノックダウンまたはノックアウトする方法は、例えばRNA干渉剤(例えばsiRNA、shRNA、miRNA等)もしくは操作されたエンドヌクレアーゼ[例えばCRISPR/Casヌクレアーゼ系、ジンクフィンガーヌクレアーゼ(ZFN)、転写アクチベーター様エフェクターヌクレアーゼ(TALEN)、メガヌクレアーゼ]またはそれらの任意の組合せによって達成され得る。ある特定の実施形態においては、内因性B細胞遺伝子(例えばIGH、IGκまたはIGλ)は、操作されたエンドヌクレアーゼを介する等の、本開示のキメラTim受容体をコードするポリヌクレオチドの内因性B細胞遺伝子の遺伝子座への挿入によってノックアウトされる。ある特定の実施形態においては、内因性T細胞遺伝子(例えばTCR遺伝子、HLA遺伝子または免疫チェックポイント分子遺伝子)は、操作されたエンドヌクレアーゼを介する等の、本開示のキメラTim受容体をコードするポリヌクレオチドの内因性T細胞遺伝子の遺伝子座への挿入によってノックアウトされる。 In certain embodiments, expression of the host cell's endogenous gene is inhibited, knocked down or knocked out. Examples of endogenous genes that can be inhibited, knocked down or knocked out in B cells include IGH, IGκ, IGλ or any combination thereof. Examples of endogenous genes that can be inhibited, knocked down or knocked out in T cells include TCR genes (TRA or TRB), HLA genes (HLA class I genes or HLA class II genes), immune checkpoint molecules (PD-L1, PD-L2, CD80, CD86, B7-H3, B7-H4, HVEM, adenosine, GAL9, VISTA, CEACAM-1, CEACAM-3, CEACAM-5, PVRL2, PD-1, CTLA-4, BTLA, KIR, LAG3, TIM3, A2aR, CD244/2B4, CD160, TIGIT, LAIR-1 or PVRIG/CD112R) or any combination thereof. Endogenous gene expression can be inhibited, knocked down or knocked out at the gene level, transcription level, translation level or a combination thereof. Methods of inhibiting, knocking down or knocking out endogenous genes include, for example, RNA interfering agents (eg siRNA, shRNA, miRNA, etc.) or engineered endonucleases [eg CRISPR/Cas nuclease systems, zinc finger nucleases (ZFNs), transcriptional activators. beta-like effector nucleases (TALENs), meganucleases] or any combination thereof. In certain embodiments, an endogenous B cell gene (e.g., IGH, IGκ or IGλ) is isolated from a polynucleotide encoding a chimeric Tim receptor of the present disclosure, such as through an engineered endonuclease. The gene is knocked out by insertion into the locus. In certain embodiments, an endogenous T cell gene (e.g., a TCR gene, HLA gene or immune checkpoint molecule gene) is transfected, such as via an engineered endonuclease, to a poly(polyethylene) encoding chimeric Tim receptor of the present disclosure. It is knocked out by insertion of a nucleotide into the endogenous T cell gene locus.
ある特定の実施形態においては、宿主細胞は、1種類のキメラTim受容体を発現するように遺伝子改変することができる。他の実施形態においては、宿主細胞は、少なくとも2つまたはそれよりも多い異なるキメラTim受容体を発現し得る。 In certain embodiments, host cells can be genetically modified to express one chimeric Tim receptor. In other embodiments, the host cell may express at least two or more different chimeric Tim receptors.
また、本開示は、キメラTim受容体改変宿主細胞の集団を含む組成物を提供する。ある特定の実施形態においては、キメラTim受容体改変宿主細胞の集団は、B細胞集団、T細胞集団、ナチュラルキラー細胞集団、リンパ球前駆体細胞集団、抗原提示細胞集団、樹状細胞集団、ランゲルハンス細胞集団、骨髄前駆体細胞集団、成熟骨髄細胞集団またはそれらの任意の組合せであり得る。さらに、特定の細胞種のキメラTim受容体改変宿主細胞の集団は、1つまたは複数のサブタイプからなり得る。例えば、B細胞集団は、キメラTim受容体改変ナイーブB細胞、形質細胞、制御性B細胞、辺縁帯B細胞、濾胞性B細胞、リンパ形質細胞性細胞、形質芽細胞、メモリーB細胞またはそれらの任意の組合せからなり得る。別の例においては、T細胞集団は、キメラTim受容体改変CD4+ヘルパーT細胞、CD8+エフェクター(細胞傷害性)T細胞、ナイーブ(CD45 RA+、CCR7+、CD62L+、CD27+、CD45RO-)T細胞、セントラルメモリー(CD45RO+、CD62L+、CD8+)T細胞、エフェクターメモリー(CD45RA+、CD45RO-、CCR7-、CD62L-、CD27-)T細胞、Tメモリー幹細胞、制御性T細胞、粘膜関連インバリアントT細胞(MAIT)、γδ(gd)細胞、組織レジデントT細胞、ナチュラルキラーT細胞またはそれらの任意の組合せからなり得る。 The disclosure also provides compositions comprising populations of chimeric Tim receptor modified host cells. In certain embodiments, the population of chimeric Tim receptor-modified host cells is a B cell population, a T cell population, a natural killer cell population, a lymphocyte progenitor cell population, an antigen presenting cell population, a dendritic cell population, a Langerhans It can be a cell population, a myeloid progenitor cell population, a mature myeloid cell population or any combination thereof. Furthermore, a population of chimeric Tim receptor-modified host cells of a particular cell type may consist of one or more subtypes. For example, the B cell population may be chimeric Tim receptor modified naive B cells, plasma cells, regulatory B cells, marginal zone B cells, follicular B cells, lymphoplasmacytic cells, plasmablasts, memory B cells or can consist of any combination of In another example, the T cell population is chimeric Tim receptor-modified CD4 + helper T cells, CD8 + effector (cytotoxic) T cells, naive (CD45 RA +, CCR7 +, CD62L +, CD27 +, CD45RO−) T cells, Central memory (CD45RO + , CD62L + , CD8 + ) T cells, effector memory (CD45RA+, CD45RO-, CCR7-, CD62L-, CD27-) T cells, T memory stem cells, regulatory T cells, mucosa-associated invariant T cells (MAIT), γδ (gd) cells, tissue resident T cells, natural killer T cells or any combination thereof.
ある特定の実施形態においては、宿主細胞集団は、各々が同じキメラTim受容体を発現する細胞からなる。他の実施形態においては、宿主細胞集団は、宿主細胞の2つまたはそれよりも多いサブ集団の混合物からなり、各サブ集団は、異なるキメラTim受容体またはキメラTim受容体のセットを発現する。 In certain embodiments, the host cell population consists of cells that each express the same chimeric Tim receptor. In other embodiments, the host cell population consists of a mixture of two or more subpopulations of host cells, each subpopulation expressing a different chimeric Tim receptor or set of chimeric Tim receptors.
ある特定の実施形態においては、キメラTim受容体改変宿主細胞、例えばB細胞またはT細胞を調製する場合、宿主細胞、例えばB細胞またはT細胞の増殖を促進する1つまたは複数の増殖因子サイトカインが、細胞培養物に添加され得る。サイトカインは、ヒトまたは非ヒトサイトカインであり得る。T細胞増殖を促進するために使用され得る例示的な増殖因子サイトカインには、IL-2、IL-15その他が含まれる。B細胞増殖を促進するために使用され得る例示的な増殖因子サイトカインには、CD40L、IL-2、IL-4、IL-15、IL-21、BAFFその他が含まれる。 In certain embodiments, when preparing chimeric Tim receptor-modified host cells, e.g., B cells or T cells, one or more growth factor cytokines that promote proliferation of the host cells, e.g., B cells or T cells, are , can be added to the cell culture. Cytokines can be human or non-human cytokines. Exemplary growth factor cytokines that can be used to promote T cell proliferation include IL-2, IL-15 and others. Exemplary growth factor cytokines that can be used to promote B cell proliferation include CD40L, IL-2, IL-4, IL-15, IL-21, BAFF and others.
宿主細胞のキメラTim受容体ベクターによる遺伝子改変の前に、宿主細胞(例えばT細胞、B細胞、ナチュラルキラー細胞等)の供給源は、対象から得られ(例えば全血、末梢血単核球、骨髄、リンパ節組織、臍帯血、胸腺組織、感染部位からの組織、腹水、胸水、脾臓組織)、これらから宿主細胞が、当該技術分野において公知の方法を使用して単離される。特定の宿主細胞サブセットは、抗体への親和性結合、フローサイトメトリーおよび/または免疫磁気選択等の公知の技術に従って収集され、公知の技術によって富化または枯渇され得る。富化および/または枯渇工程ならびにキメラTim受容体の導入後、公知の技術または当業者に明らかであるその変形に従って、所望の改変宿主細胞のインビトロ拡大増殖を行ってもよい。 Prior to genetic modification of host cells with chimeric Tim receptor vectors, a source of host cells (e.g., T cells, B cells, natural killer cells, etc.) is obtained from a subject (e.g., whole blood, peripheral blood mononuclear cells, Bone marrow, lymph node tissue, cord blood, thymus tissue, tissue from sites of infection, ascites, pleural fluid, spleen tissue) from which host cells are isolated using methods known in the art. Particular host cell subsets can be collected according to known techniques such as affinity binding to antibodies, flow cytometry and/or immunomagnetic selection, and enriched or depleted by known techniques. After the enrichment and/or depletion steps and introduction of the chimeric Tim receptor, in vitro expansion of the desired modified host cells may be performed according to known techniques or variations thereof that will be apparent to those skilled in the art.
本開示のキメラTim受容体は、ホスファチジルセリンに特異的なキメラTim受容体を発現する宿主細胞に対して、細胞傷害活性を与える。したがって、標的細胞の表面上に曝露されたホスファチジルセリンへの結合に際して、キメラTim受容体を発現する宿主細胞は、標的細胞のアポトーシスを誘導することができる。ある特定の実施形態においては、キメラTim受容体を発現する宿主細胞は、グランザイム、パーフォリン、グラニュライシンまたはそれらの任意の組合せの放出;Fasリガンド-Fas相互作用;またはその両方を介して、標的細胞のアポトーシスを誘導する。さらなる実施形態においては、キメラTim受容体は、キメラTim受容体を発現する宿主細胞に対して、ホスファチジルセリン特異的貪食活性をさらに与える。またさらなる実施形態においては、宿主細胞は、キメラTim受容体による改変前に、天然に貪食表現型を示さない。 The chimeric Tim receptors of the present disclosure confer cytotoxic activity against host cells expressing phosphatidylserine-specific chimeric Tim receptors. Thus, upon binding to phosphatidylserine exposed on the surface of target cells, host cells expressing the chimeric Tim receptor can induce apoptosis of target cells. In certain embodiments, a host cell expressing a chimeric Tim Receptor is able to target cells via release of granzyme, perforin, granulysin, or any combination thereof; Fas ligand-Fas interaction; or both. induces apoptosis. In further embodiments, the chimeric Tim Receptor further confers phosphatidylserine-specific phagocytic activity on host cells expressing the chimeric Tim Receptor. In still further embodiments, the host cell does not naturally display a phagocytic phenotype prior to modification with the chimeric Tim receptor.
本開示のキメラTim受容体はまた、少なくとも1つのシグナル伝達経路を介してT細胞を共刺激することもできる場合がある。ある特定の実施形態においては、キメラTim受容体は、少なくとも2つの異なるシグナル伝達経路を介して(例えばキメラTim受容体中の選択された共刺激性シグナル伝達ドメインを介して)、T細胞に共刺激性シグナルを提供する。例えば、CD28共刺激性シグナル伝達ドメインを含むキメラTim受容体は、CD28およびTim1を介して共刺激性シグナルを提供することができる場合がある。ある特定の実施形態においては、キメラTim受容体を発現する宿主免疫細胞は、免疫細胞疲弊の低減または阻害を示す。ある特定の実施形態においては、宿主免疫細胞は、T細胞またはNK細胞である。ある特定の実施形態においては、疲弊したT細胞は、(a)PD-1、TIGIT、LAG3、TIM3、もしくはそれらの任意の組合せの増大した発現;(b)IFN-γ、IL-2、TNF-α、もしくはそれらの任意の組合せの減少した産生;または(a)と(b)との両方を示す。ある特定の実施形態においては、疲弊したNK細胞は、(a)PD-1、NKG2A、TIM3、もしくはそれらの任意の組合せの増大した発現;(b)IFN-γ、TNF-α、もしくはその両方の減少した産生;または(a)と(b)との両方を示す。 A chimeric Tim receptor of the present disclosure may also be capable of co-stimulating T cells via at least one signaling pathway. In certain embodiments, the chimeric Tim Receptor co-activates T cells via at least two different signaling pathways (e.g., via selected co-stimulatory signaling domains in the chimeric Tim Receptor). Provides a stimulatory signal. For example, a chimeric Tim receptor containing a CD28 co-stimulatory signaling domain may be able to provide co-stimulatory signals through CD28 and Tim1. In certain embodiments, host immune cells expressing chimeric Tim receptors exhibit reduced or inhibited immune cell exhaustion. In certain embodiments, host immune cells are T cells or NK cells. In certain embodiments, exhausted T cells exhibit (a) increased expression of PD-1, TIGIT, LAG3, TIM3, or any combination thereof; (b) IFN-γ, IL-2, TNF - decreased production of α, or any combination thereof; or both (a) and (b). In certain embodiments, exhausted NK cells exhibit (a) increased expression of PD-1, NKG2A, TIM3, or any combination thereof; (b) IFN-γ, TNF-α, or both or both (a) and (b).
ある特定の実施形態においては、キメラTim受容体を発現する宿主細胞は、向上されたエフェクター応答(例えば腫瘍特異的)を示す。ある特定の実施形態においては、エフェクター応答は、向上されたT細胞増殖、サイトカイン産生(例えばIFN-γ、IL-2、TNF-α)、細胞傷害活性、持続性、またはそれらの任意の組合せである。 In certain embodiments, host cells expressing chimeric Tim receptors exhibit enhanced effector responses (eg, tumor-specific). In certain embodiments, the effector response is enhanced T cell proliferation, cytokine production (eg, IFN-γ, IL-2, TNF-α), cytotoxic activity, persistence, or any combination thereof. be.
ある特定の実施形態においては、キメラTim受容体を発現する宿主細胞は、ホスファチジルセリンに対する低減した免疫抑制性応答を示す。ホスファチジルセリンは、食細胞に対して「食せよ」というシグナルを送る、主要なアポトーシス性細胞リガンドのうちの1つである。食細胞によるアポトーシス細胞の除去は一般的に、抗炎症性サイトカインIL-10およびTGF-βの分泌、ならびに炎症性サイトカインTNF-α、IL-1β、およびIL-12の分泌の減少を介する炎症性応答を低減させるかまたは妨げる。したがって、ホスファチジルセリンは、アポトーシス細胞のクリアランス中に免疫抑制性シグナルとして作用し得る。ある特定の実施形態においては、ホスファチジルセリンへの結合時に、キメラTim受容体改変宿主細胞は、増大した抗原特異的サイトカイン産生(例えばIFN-γ、IL-2、TNF-α)を示し、それによって、ホスファチジルセリンに対する免疫抑制性応答を低減させる。 In certain embodiments, host cells expressing a chimeric Tim receptor exhibit a reduced immunosuppressive response to phosphatidylserine. Phosphatidylserine is one of the major apoptotic cell ligands that signals phagocytic cells to "eat". Elimination of apoptotic cells by phagocytic cells generally promotes inflammation through decreased secretion of the anti-inflammatory cytokines IL-10 and TGF-β, and the pro-inflammatory cytokines TNF-α, IL-1β, and IL-12. Reduce or prevent response. Phosphatidylserine may therefore act as an immunosuppressive signal during the clearance of apoptotic cells. In certain embodiments, upon binding to phosphatidylserine, chimeric Tim receptor-modified host cells exhibit increased antigen-specific cytokine production (eg, IFN-γ, IL-2, TNF-α), thereby , reduce the immunosuppressive response to phosphatidylserine.
宿主細胞上でのキメラTim受容体の発現は、T細胞結合、活性化または誘導の決定を含む、およびまた、抗原特異的であるT細胞応答の決定を含む、宿主細胞(例えばT細胞)活性をアッセイするための多数の当該技術分野において許容される方法のいずれかに従って機能的に特徴付けてもよい。例は、T細胞増殖、T細胞サイトカイン放出、抗原特異的T細胞刺激、CTL活性(例えば、事前にロードした標的細胞からの51Crまたはユーロピウム放出を検出することによって)、T細胞表現型マーカー発現の変化およびT細胞機能の他の測定値の決定を含む。これらおよび同様のアッセイを行うための手技は、例えばLefkovits (Immunology Methods Manual: The Comprehensive Sourcebook of Techniques, 1998)において見出すことができる。また、Current Protocols in Immunology; Weir, Handbook of Experimental Immunology, Blackwell Scientific, Boston, MA (1986);Mishell and Shigii (eds.) Selected Methods in Cellular Immunology, Freeman Publishing, San Francisco, CA (1979);Green and Reed, Science 281:1309 (1998)およびそれらの中で引用される参考文献を参照されたい。サイトカインレベルは、例えばELISA、ELISPOT、細胞内サイトカイン染色、フローサイトメトリーおよびそれらの任意の組合せ(例えば細胞内サイトカイン染色およびフローサイトメトリー)を含む当該技術分野において公知の方法に従って決定され得る。免疫応答の抗原特異的誘発または刺激から生ずる免疫細胞増殖およびクローン拡大増殖は、末梢血細胞またはリンパ節からの細胞の試料中の循環リンパ球等のリンパ球を単離し、細胞を抗原により刺激し、トリチウム化チミジンの組込みまたはMTTアッセイ等の非放射性アッセイ等による等、サイトカイン産生、細胞増殖および/または細胞生存率を測定することによって決定され得る。 Expression of chimeric Tim receptors on host cells host cell (e.g., T cell) activity, including determination of T cell binding, activation or induction, and also determination of T cell responses that are antigen specific. may be functionally characterized according to any of a number of art-accepted methods for assaying. Examples include T cell proliferation, T cell cytokine release, antigen-specific T cell stimulation, CTL activity (e.g., by detecting 51 Cr or Europium release from preloaded target cells), T cell phenotypic marker expression and determination of other measures of T cell function. Techniques for performing these and similar assays can be found, for example, in Lefkovits (Immunology Methods Manual: The Comprehensive Sourcebook of Techniques, 1998). See also Current Protocols in Immunology; Weir, Handbook of Experimental Immunology, Blackwell Scientific, Boston, MA (1986); Mishell and Shigii (eds.) Selected Methods in Cellular Immunology, Freeman Publishing, San Francisco, CA (1979); See Reed, Science 281:1309 (1998) and references cited therein. Cytokine levels can be determined according to methods known in the art including, for example, ELISA, ELISPOT, intracellular cytokine staining, flow cytometry, and any combination thereof (eg, intracellular cytokine staining and flow cytometry). Immune cell proliferation and clonal expansion resulting from antigen-specific induction or stimulation of an immune response involves isolating lymphocytes, such as circulating lymphocytes in a sample of cells from peripheral blood cells or lymph nodes, stimulating the cells with an antigen, It can be determined by measuring cytokine production, cell proliferation and/or cell viability, such as by incorporation of tritiated thymidine or non-radioactive assays such as the MTT assay.
ある特定の実施形態においては、キメラTim受容体改変宿主細胞は、標的細胞について約20~約1,500の食作用指数を有する。「食作用指数」は、培地中の標的細胞または粒子とキメラTim受容体改変宿主細胞との懸濁液のインキュベーションの設定期間中の、キメラTim受容体改変宿主細胞当たりの摂取された標的細胞または粒子の数をカウントすることによって決定される、形質導入された宿主細胞の食作用活性の測定値である。食作用指数は、[貪食された標的細胞の総数/カウントされたキメラTim受容体改変細胞の総数(例えば食作用頻度)]x[キメラTim受容体+宿主細胞当たりの標的細胞または粒子染色の平均面積x100(例えばハイブリッドキャプチャー)]または[貪食された粒子の総数/カウントされたキメラTim受容体改変宿主細胞の総数]x[貪食された粒子を含有するキメラTim受容体改変宿主細胞数/カウントされたキメラTim受容体+細胞の総数]x100を掛けることによって計算され得る。ある特定の実施形態においては、キメラTim受容体改変細胞は、約30~約1,500;約40~約1,500;約50~約1,500;約75~約1,500;約100~約1,500;約200~約1,500;約300~約1,500;約400~約1,500;約500~約1,500;約20~約1,400;約30~約1,400;約40~約1,400;約50~約1,400;約100~約1,400;約200~約1,400;約300~約1,400;約400~約1,400;約500~約1,400;約20~約1,300;約30~約1,300;約40~約1,300;約50~約1,300;約100~約1,300;約200~約1,300;約300~約1,300;約400~約1,300;約500~約1,300;約20~約1,200;約30~約1,200;約40~約1,200;約50~約1,200;約100~約1,200;約200~約1,200;約300~約1,200;約400~約1,200;約500~約1,200;約20~約1,100;約30~約1,100;約40~約1,100;約50~約1,100;約100~約1,100;約200~約1,100;約300~約1,100;約400~約1,100;または約500~約1,100;約20~約1,000;約30~約1,000;約40~約1,000;約50~約1,000;約100~約1,000;約200~約1,000;約300~約1,000;約400~約1,000;または約500~約1,000;約20~約750;約30~約750;約40~約750;約50~約750;約100~約750;約200~約750;約300~約750;約400~約750;または約500~約750;約20~約500;約30~約500;約40~約500;約50~約500;約100~約500;約200~約500;または約300~約500の食作用指数を有する。さらなる実施形態においては、インキュベーション時間は、約2時間~約4時間、約2時間、約3時間または約4時間である。またさらなる実施形態においては、キメラTim受容体改変細胞は、切断型EGFR対照を形質導入した細胞よりも統計的に有意に高い食作用指数を示す。食作用指数は、フローサイトメトリーまたは蛍光顕微鏡による定量を含む、当該技術分野において公知の、かつ実施例およびPCT出願PCT/US2017/053553号(その全体を参照により本明細書に組み込む)においてさらに説明される方法を使用して計算され得る。 In certain embodiments, the chimeric Tim receptor-modified host cell has a phagocytic index of about 20 to about 1,500 for target cells. A "phagocytic index" is the number of ingested target cells or A measure of phagocytic activity of transduced host cells determined by counting the number of particles. The phagocytosis index is [total number of target cells phagocytosed/total number of chimeric Tim receptor-modified cells counted (e.g., frequency of phagocytosis)] x [mean target cell or particle staining per chimeric Tim receptor + host cell. area x 100 (e.g. hybrid capture)] or [total number of particles phagocytosed/total number of chimeric Tim receptor modified host cells counted] x [number of chimeric Tim receptor modified host cells containing phagocytosed particles/counted total number of chimeric Tim receptor + cells]×100. In certain embodiments, the chimeric Tim receptor-modified cells are about 30 to about 1,500; about 40 to about 1,500; about 50 to about 1,500; about 75 to about 1,500; about 1,500; about 200 to about 1,500; about 300 to about 1,500; about 400 to about 1,500; about 500 to about 1,500; about 40 to about 1,400; about 50 to about 1,400; about 100 to about 1,400; about 200 to about 1,400; about 300 to about 1,400; about 500 to about 1,400; about 20 to about 1,300; about 30 to about 1,300; about 40 to about 1,300; about 50 to about 1,300; about 200 to about 1,300; about 300 to about 1,300; about 400 to about 1,300; about 500 to about 1,300; about 20 to about 1,200; about 1,200; about 50 to about 1,200; about 100 to about 1,200; about 200 to about 1,200; about 300 to about 1,200; about 20 to about 1,100; about 30 to about 1,100; about 40 to about 1,100; about 50 to about 1,100; about 100 to about 1,100; about 300 to about 1,100; about 400 to about 1,100; or about 500 to about 1,100; about 20 to about 1,000; about 30 to about 1,000; from about 50 to about 1,000; from about 100 to about 1,000; from about 200 to about 1,000; from about 300 to about 1,000; from about 400 to about 1,000; about 20 to about 750; about 30 to about 750; about 40 to about 750; about 50 to about 750; about 100 to about 750; about 20 to about 500; about 30 to about 500; about 40 to about 500; about 50 to about 500; about 100 to about 500; has an exponent. In further embodiments, the incubation time is from about 2 hours to about 4 hours, about 2 hours, about 3 hours, or about 4 hours. In still further embodiments, the chimeric Tim receptor-modified cells exhibit a statistically significantly higher phagocytic index than cells transduced with a truncated EGFR control. Phagocytosis index is known in the art and further described in the Examples and PCT Application No. PCT/US2017/053553, which is incorporated herein by reference in its entirety, including quantification by flow cytometry or fluorescence microscopy. can be calculated using the method
宿主細胞は、動物、例としてヒト、霊長類、ウシ、ウマ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタまたはそれらの組合せからの宿主細胞であり得る。好ましい実施形態においては、動物は、ヒトである。宿主細胞は、健康な対象、または抗原の発現または過剰発現と関連付けられる疾患を有する対象から得てもよい。 The host cell can be from an animal, such as a human, primate, bovine, equine, ovine, canine, feline, murine, rat, rabbit, guinea pig, porcine, or combinations thereof. In preferred embodiments, the animal is human. Host cells may be obtained from a healthy subject or a subject with a disease associated with antigen expression or overexpression.
PARP阻害剤
任意の好適なPARP阻害剤が、本開示の組成物および方法において使用され得る。例示的なPARP阻害剤には、タラゾパリブ、ニラパリブ、ルカパリブ、オラパリブ(AZ2281、KU59436)、ベリパリブ(ABT888)、CEP9722、E7016、AG014699、MK4827、BMN-673、およびパミパリブ(Pamiparib)(BGB-290)が含まれる。
PARP Inhibitors Any suitable PARP inhibitor can be used in the compositions and methods of this disclosure. Exemplary PARP inhibitors include talazoparib, niraparib, rucaparib, olaparib (AZ2281, KU59436), veliparib (ABT888), CEP9722, E7016, AG014699, MK4827, BMN-673, and pamiparib (BGB-290). included.
特定の実施形態においては、PARP阻害剤は、ニラパリブを含む。特定の実施形態においては、PARP阻害剤は、タラゾパリブを含む。特定の実施形態においては、PARP阻害剤は、ルカパリブを含む。特定の実施形態においては、PARP阻害剤は、オラパリブを含む。特定の実施形態においては、PARP阻害剤は、ベリパリブを含む。特定の実施形態においては、PARP阻害剤は、CEP9722を含む。特定の実施形態においては、PARP阻害剤は、E7016を含む。特定の実施形態においては、PARP阻害剤は、AG014699を含む。特定の実施形態においては、PARP阻害剤は、MK4827を含む。特定の実施形態においては、PARP阻害剤は、BMN-673を含む。特定の実施形態においては、PARP阻害剤は、パミパリブを含む。 In certain embodiments, the PARP inhibitor comprises niraparib. In certain embodiments, the PARP inhibitor comprises talazoparib. In certain embodiments, the PARP inhibitor comprises rucaparib. In certain embodiments, the PARP inhibitor comprises Olaparib. In certain embodiments, the PARP inhibitor comprises veliparib. In certain embodiments, the PARP inhibitor comprises CEP9722. In certain embodiments, the PARP inhibitor comprises E7016. In certain embodiments, the PARP inhibitor comprises AG014699. In certain embodiments, the PARP inhibitor comprises MK4827. In certain embodiments, the PARP inhibitor comprises BMN-673. In certain embodiments, the PARP inhibitor comprises pamiparib.
治療方法
本明細書において提供される実施形態のいずれかに記載の、PARP阻害剤と組み合わせたキメラTim受容体、キメラTim受容体をコードするポリヌクレオチド、キメラTim受容体ベクター、またはキメラTim受容体を発現する宿主細胞は、疾患、障害または望ましくない状態を患う対象を治療する方法において使用され得る。これらの方法の実施形態は、(i)治療有効量の、本説明に記載の1つもしくは複数のキメラTim受容体、1つもしくは複数のキメラTim受容体をコードするポリヌクレオチド、1つもしくは複数のキメラTim受容体をコードするポリヌクレオチドを含むベクターまたは1つもしくは複数のキメラTim受容体を発現するように遺伝子改変された宿主細胞集団を含む医薬組成物;および(ii)治療有効量の、PARP阻害剤を含む医薬組成物を対象に投与することを含む。
Methods of Treatment A chimeric Tim receptor, a polynucleotide encoding a chimeric Tim receptor, a chimeric Tim receptor vector, or a chimeric Tim receptor in combination with a PARP inhibitor according to any of the embodiments provided herein can be used in methods of treating a subject suffering from a disease, disorder or undesirable condition. These method embodiments comprise (i) a therapeutically effective amount of one or more chimeric tim receptors described in this description, polynucleotides encoding one or more chimeric tim receptors, one or more or a host cell population genetically modified to express one or more chimeric Tim Receptors; and (ii) a therapeutically effective amount of administering to the subject a pharmaceutical composition comprising a PARP inhibitor.
本明細書において説明するキメラTim受容体組成物は、PARP阻害剤療法の前(例えばPARP阻害剤療法の1日~30日前またはそれよりも前)に、PARP阻害剤療法と同時(同日)に、またはPARP阻害剤療法の後(例えばPARP阻害剤療法の1日~30日後またはそれよりも後)に、投与され得る。ある特定の実施形態においては、キメラTim受容体改変細胞は、1つまたは複数の追加の療法の投与後に投与される。さらなる実施形態においては、キメラTim受容体改変細胞は、PARP阻害剤の投与の1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29、または30日後に投与される。またさらなる実施形態においては、キメラTim受容体改変細胞は、PARP阻害剤療法の投与後4週間以内、3週間以内、2週間以内または1週間以内に投与される。PARP阻害剤療法が多数の用量を含む場合、キメラTim受容体改変細胞は、1つもしくは複数の追加の療法の初回用量後に、1つもしくは複数の追加の療法の最終用量後に、または1つもしくは複数の追加の療法の多数の用量間において投与され得る。 The chimeric Tim receptor compositions described herein can be administered prior to PARP inhibitor therapy (eg, from 1 day to 30 days or more prior to PARP inhibitor therapy) and concurrently (on the same day) with PARP inhibitor therapy. , or after PARP inhibitor therapy (eg, 1 to 30 days or more after PARP inhibitor therapy). In certain embodiments, chimeric Tim receptor-modified cells are administered after administration of one or more additional therapies. In a further embodiment, the chimeric Tim receptor-modified cell is administered a PARP inhibitor at 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, or 30 days later. In still further embodiments, the chimeric Tim receptor-modified cell is administered within 4 weeks, 3 weeks, 2 weeks, or 1 week after administration of PARP inhibitor therapy. When the PARP inhibitor therapy comprises multiple doses, the chimeric Tim receptor-modified cells are administered after the first dose of one or more additional therapies, after the final dose of one or more additional therapies, or after one or more Multiple doses of additional therapy may be administered in between.
本開示において説明するキメラTim受容体を発現する細胞により治療され得る疾患は、がんを含む。養子免疫療法および遺伝子療法は、様々な種類のがん(Morgan et al., Science 314:126, 2006;Schmitt et al., Hum. Gene Ther. 20:1240, 2009;June, J. Clin. Invest. 117:1466, 2007)および感染性疾患(Kitchen et al., PLoS One 4:38208, 2009;Rossi et al., Nat. Biotechnol. 25:1444, 2007;Zhang et al., PLoS Pathog. 6:e1001018, 2010;Luo et al., J. Mol. Med. 89:903, 2011)のための有望な治療である。 Diseases that can be treated with cells expressing the chimeric Tim receptor described in this disclosure include cancer. Adoptive immunotherapy and gene therapy have been used to treat various types of cancer (Morgan et al., Science 314:126, 2006; Schmitt et al., Hum. Gene Ther. 20:1240, 2009; June, J. Clin. Invest 117:1466, 2007) and infectious diseases (Kitchen et al., PLoS One 4:38208, 2009; Rossi et al., Nat. Biotechnol. 25:1444, 2007; Zhang et al., PLoS Pathog. 6: e1001018, 2010; Luo et al., J. Mol. Med. 89:903, 2011).
固形腫瘍および白血病を含む多種多様ながんは、本明細書において開示される組成物および方法に適している。本明細書において説明する受容体、改変宿主細胞および組成物を使用して治療され得る例示的ながんには、乳房、前立腺および結腸の腺癌;全ての形態の気管支原性肺癌;骨髄性白血病;黒色腫;肝細胞腫;神経芽細胞腫;乳頭腫;アプドーマ;分離腫;鰓腫;悪性カルチノイド症候群;カルチノイド心疾患;ならびに癌腫(例えば、ウォーカー癌腫、基底細胞癌、基底扁平細胞癌、ブラウン・ピアース癌、腺管癌、エールリッヒ癌、クレブス2癌、メルケル細胞癌、粘液性癌、非小細胞肺癌、燕麦細胞癌、乳頭癌、硬性癌、細気管支癌、気管支原性肺癌、扁平上皮癌および移行上皮癌)が含まれる。本明細書において説明する受容体、改変宿主細胞および組成物を使用して治療され得る追加のがんの種類は、組織球性障害;悪性組織球症;白血病;ホジキン病;免疫増殖性小(immunoproliferative small);非ホジキンリンパ腫;形質細胞腫;多発性骨髄腫;慢性骨髄性白血病(CML);急性骨髄性白血病(AML);形質細胞腫;細網内皮症;黒色腫;軟骨芽細胞腫;軟骨腫;軟骨肉腫;線維腫;線維肉腫;巨細胞腫;組織球腫;脂肪腫;脂肪肉腫;中皮腫;粘液腫;粘液肉腫;骨腫;骨肉腫;脊索腫;頭蓋咽頭腫;未分化胚細胞腫;過誤腫;間葉腫;中腎腫;筋肉腫;エナメル上皮腫;セメント質腫;歯牙腫;奇形腫;胸腺腫;絨毛性腫瘍を含む。さらに、また、以下の種類のがん:腺腫;胆管腫;真珠腫;円柱腫(cyclindroma);嚢胞腺癌;嚢胞腺腫;顆粒膜細胞腫;男性胚腫;肝細胞腫;汗腺腫;膵島腫瘍;ライディッヒ細胞腫;乳頭腫;セルトリ細胞腫;莢膜細胞腫;平滑筋腫(leimyoma);平滑筋肉腫;筋芽細胞腫;筋腫(myomma);筋肉腫;横紋筋腫;横紋筋肉腫;上衣腫;神経節腫;神経膠腫;髄芽腫;髄膜腫;神経鞘腫;神経芽細胞腫;神経上皮腫;神経線維腫;神経腫;傍神経節腫;非クローム親和性傍神経節腫は、本明細書において説明する受容体、改変宿主細胞および組成物を使用する治療に適することが企図される。また、治療され得るがんの種類は、被角血管腫;好酸球増加症を伴う血管リンパ様過形成;硬化性血管腫;血管腫症;グロムス血管腫;血管内皮腫;血管腫;血管外皮腫;血管肉腫;リンパ管腫;リンパ管筋腫;リンパ管肉腫;松果体腫;癌肉腫;軟骨肉腫;葉状嚢胞肉腫;線維肉腫;血管肉腫;平滑筋肉腫;白血肉腫;脂肪肉腫;リンパ管肉腫;筋肉腫;粘液肉腫;卵巣癌;横紋筋肉腫;肉腫;新生物;神経線維腫症(nerofibromatosis);子宮頸部異形成;および腹膜がんを含む。 A wide variety of cancers, including solid tumors and leukemias, are suitable for the compositions and methods disclosed herein. Exemplary cancers that can be treated using the receptors, modified host cells and compositions described herein include adenocarcinoma of the breast, prostate and colon; all forms of bronchogenic lung cancer; melanoma; hepatoma; neuroblastoma; papilloma; apdoma; Brown-Pierce carcinoma, ductal carcinoma, Ehrlich carcinoma, Krebs 2 carcinoma, Merkel cell carcinoma, mucinous carcinoma, non-small cell lung carcinoma, oat cell carcinoma, papillary carcinoma, sclerotic carcinoma, bronchiolar carcinoma, bronchogenic lung carcinoma, squamous cell carcinoma carcinoma and transitional cell carcinoma). Additional cancer types that can be treated using the receptors, modified host cells and compositions described herein include histiocytic disorders; malignant histiocytosis; leukemia; Hodgkin's disease; non-Hodgkin's lymphoma; plasmacytoma; multiple myeloma; chronic myelogenous leukemia (CML); acute myelogenous leukemia (AML); Chondrosarcoma; Fibroma; Fibrosarcoma; Giant cell tumor; Histiocytoma; Lipoma; Liposarcoma; Mesothelioma; mesonephroma; sarcoma; amelocytoma; cementoma; odontoma; teratoma; thymoma; In addition, also the following types of cancer: adenoma; cholangiomas; cholesteatoma; cyclindroma; cystadenoma; cystadenoma; Leydig cell tumor; papilloma; Sertoli tumor; thecacytoma; leimyoma; glioma; medulloblastoma; meningioma; schwannoma; neuroblastoma; neuroepithelioma; neurofibroma; neuroma; It is contemplated that tumors are suitable for treatment using the receptors, modified host cells and compositions described herein. Also, types of cancers that may be treated include angiokeratoma; angiolymphoid hyperplasia with eosinophilia; sclerosing hemangiomas; angiomatosis; glomus hemangioma; Perithelium; angiosarcoma; lymphangioma; lymphangiosarcoma; lymphangiosarcoma; pinealoma; carcinosarcoma; chondrosarcoma; myxosarcoma; ovarian cancer; rhabdomyosarcoma; sarcoma; neoplasm; neurofibromatosis; cervical dysplasia;
一部の実施形態においては、本開示の組成物および方法は、固形腫瘍を治療するために有用である。一部の実施形態においては、固形腫瘍がんは、乳がん、卵巣がん、結腸直腸がん、卵管がん、腹膜がん、または前立腺がんである。一部の実施形態においては、乳がんは、三種陰性乳がんである。一部の実施形態においては、卵巣がんは、進行卵巣がんである。一部の実施形態においては、前立腺がんは。進行前立腺がんである。一部の実施形態においては、固形腫瘍がんは、黒色腫である。一部の実施形態においては、固形腫瘍がんは、肺がんである。一部の実施形態においては、肺がんは、非小細胞肺がんである。 In some embodiments, the compositions and methods of this disclosure are useful for treating solid tumors. In some embodiments, the solid tumor cancer is breast cancer, ovarian cancer, colorectal cancer, fallopian tube cancer, peritoneal cancer, or prostate cancer. In some embodiments, the breast cancer is triple-negative breast cancer. In some embodiments, the ovarian cancer is advanced ovarian cancer. In some embodiments, prostate cancer. You have advanced prostate cancer. In some embodiments, the solid tumor cancer is melanoma. In some embodiments, the solid tumor cancer is lung cancer. In some embodiments, the lung cancer is non-small cell lung cancer.
追加の実施形態においては、がんは、乳がん(Breast cancer;BRCA)変異がんである。特定の実施形態においては、がんは、BRCA1変異がん、BRCA2変異がん、またはその両方である。 In additional embodiments, the cancer is a breast cancer (BRCA) mutated cancer. In certain embodiments, the cancer is a BRCA1 mutated cancer, a BRCA2 mutated cancer, or both.
本開示のキメラTim受容体は、細胞結合形態(例えば標的細胞集団の遺伝子療法)において対象に投与され得る。したがって、例えば、本開示のキメラTim受容体は、それらのサブセットを含むT細胞、ナチュラルキラー細胞、ナチュラルキラーT細胞、B細胞、リンパ球前駆体細胞、抗原提示細胞、樹状細胞、ランゲルハンス細胞、骨髄系前駆体細胞、成熟骨髄細胞、またはそれらの任意の組合せの表面上に発現されて、対象に投与され得る。ある特定の実施形態においては、対象を治療する方法は、有効量のキメラTim受容体改変細胞(すなわち、1つまたは複数のキメラTim受容体を発現する組換え細胞)を投与することを含む。キメラTim受容体改変細胞は、対象にとって異種、同系、同種異系または自家であり得る。 A chimeric Tim receptor of the disclosure can be administered to a subject in a cell-bound form (eg, gene therapy of a target cell population). Thus, for example, the chimeric Tim receptors of the present disclosure can be used for T cells, including subsets thereof, natural killer cells, natural killer T cells, B cells, lymphocyte progenitor cells, antigen presenting cells, dendritic cells, Langerhans cells, The myeloid progenitor cells, mature myeloid cells, or any combination thereof may be expressed on the surface and administered to the subject. In certain embodiments, the method of treating a subject comprises administering an effective amount of chimeric Tim receptor-modified cells (ie, recombinant cells expressing one or more chimeric Tim receptors). Chimeric Tim receptor modified cells can be xenogeneic, syngeneic, allogeneic or autologous to the subject.
キメラTim受容体改変細胞およびPARP阻害剤は、医療分野の熟練者によって決定される通り、治療(または予防)されるべき疾患または状態に適切な様式において投与され得る。組成物の適切な用量、好適な持続期間および投与頻度は、患者の状態、サイズ、体重、体表面積、年齢、性別、疾患の種類および重症度、投与される特定の治療、活性成分の特定の形態、投与時間および方法ならびに同時に投与される他の薬物等の因子によって決定される。本開示は、キメラTim受容体改変細胞および薬学的に許容される担体、希釈剤または賦形剤を含む医薬組成物を提供する。好適な賦形剤には、水、生理食塩水、デキストロース、グリセロールその他およびそれらの組合せが含まれる。他の好適な点滴媒体は、生理食塩水、Normosol R(Abbott)、Plasma-Lyte A(Baxter)、水中の5%デキストロースまたは乳酸リンゲル液を含む任意の等張媒体製剤であり得る。 Chimeric Tim receptor-modified cells and PARP inhibitors can be administered in a manner appropriate to the disease or condition to be treated (or prevented), as determined by those skilled in the medical arts. A suitable dose, suitable duration and frequency of administration of the composition will depend on the patient's condition, size, weight, body surface area, age, sex, type and severity of the disease, the particular therapy to be administered, the particular nature of the active ingredient. It is determined by factors such as form, time and method of administration and other drugs administered at the same time. The disclosure provides pharmaceutical compositions comprising chimeric Tim receptor modified cells and a pharmaceutically acceptable carrier, diluent or excipient. Suitable excipients include water, saline, dextrose, glycerol and the like and combinations thereof. Other suitable infusion vehicles can be any isotonic vehicle formulation including saline, Normosol R (Abbott), Plasma-Lyte A (Baxter), 5% dextrose in water or Ringer's lactate.
医薬組成物中の治療有効量の細胞は、少なくとも1つの細胞(例えば1つのキメラTim受容体改変T細胞)であるか、またはより典型的には102個の細胞よりも多く、例えば最高で106個、最高で107個、最高で108個の細胞、最高で109個の細胞、最高で1010個の細胞もしくは最高で1011個の細胞またはそれよりも多い。ある特定の実施形態においては、細胞は、約106個~約1010個の細胞/m2の範囲内、好ましくは約107個~約109個の細胞/m2の範囲内で投与される。細胞数は、組成物に含まれる細胞種はもちろん、組成物が意図される最終使用に依存する。例えば、キメラTim受容体を含有するように改変された細胞を含む組成物は、約5%~約95%またはそれよりも多くのそのような細胞を含有する細胞集団を含む。ある特定の実施形態においては、キメラTim受容体改変細胞を含む組成物は、少なくとも5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%またはそれよりも多くのそのような細胞を含む細胞集団を含む。本明細書において提供される使用のために、細胞は一般的に、1リットルもしくはそれ未満、500mlもしくはそれ未満、250mlもしくはそれ未満、または100mlもしくはそれ未満の容量において存在する。それゆえ、所望の細胞の密度は典型的に、104個の細胞/mlよりも高く、一般的には107個の細胞/mlよりも高く、一般的に108個の細胞/mlまたはそれよりも高い。細胞は、1回の点滴として、またはある時間範囲にわたる多数回の点滴において投与され得る。キメラTim受容体改変細胞の反復点滴は、日、週、月またはさらには疾患または疾患活性の再発が存在する場合には年単位で分離され得る。臨床関連免疫細胞数は、累積的に106、107、108、109、1010または1011個の細胞に等しいか、またはこれを超える多数回点滴に配分され得る。本明細書において説明する組換え発現ベクターを含む宿主細胞の投与のために好ましい用量は、約107個の細胞/m2、約5x107個の細胞/m2、約108個の細胞/m2、約5x108個の細胞/m2、約109個の細胞/m2、約5x109個の細胞/m2、約1010個の細胞/m2、約5x1010個の細胞/m2または約1011個の細胞/m2である。 A therapeutically effective amount of cells in the pharmaceutical composition is at least one cell (eg, one chimeric Tim receptor-modified T cell), or more typically more than 10 2 cells, eg, up to 10 6 , up to 10 7 , up to 10 8 cells, up to 10 9 cells, up to 10 10 cells or up to 10 11 cells or more. In certain embodiments, cells are administered within the range of about 10 6 to about 10 10 cells/m 2 , preferably within the range of about 10 7 to about 10 9 cells/m 2 . be done. The number of cells will depend on the end use for which the composition is intended as well as the cell types included in the composition. For example, compositions comprising cells that have been modified to contain chimeric Tim receptors include cell populations containing from about 5% to about 95% or more of such cells. In certain embodiments, compositions comprising chimeric Tim receptor-modified cells are at least 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 45%, 50% , 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95% or more of such cells. For the uses provided herein, cells are generally present in volumes of 1 liter or less, 500 ml or less, 250 ml or less, or 100 ml or less. Desired cell densities are therefore typically higher than 10 4 cells/ml, generally higher than 10 7 cells/ml, generally higher than 10 8 cells/ml or higher than that. Cells can be administered as a single infusion or in multiple infusions over a range of times. Repeated infusions of chimeric Tim receptor-modified cells can be separated by days, weeks, months or even years if there is recurrence of disease or disease activity. Clinically relevant immune cell numbers can be allocated to multiple infusions equal to or greater than 10 6 , 10 7 , 10 8 , 10 9 , 10 10 or 10 11 cells cumulatively. Preferred doses for administration of host cells containing the recombinant expression vectors described herein are about 10 7 cells/m 2 , about 5×10 7 cells/m 2 , about 10 8 cells/m 2 , m2 , about 5x108 cells/ m2 , about 109 cells/ m2 , about 5x109 cells/ m2 , about 1010 cells/ m2 , about 5x1010 cells/m2 m 2 or about 10 11 cells/m 2 .
本明細書において説明するキメラTim受容体およびPARP阻害剤は、静脈内に、腹腔内に、鼻内に、腫瘍内に、骨髄中に、リンパ節中に、および/または脳脊髄液中に投与され得る。 The chimeric Tim receptor and PARP inhibitors described herein are administered intravenously, intraperitoneally, intranasally, intratumorally, into bone marrow, into lymph nodes, and/or into cerebrospinal fluid can be
一態様においては、本開示の方法は、本明細書において説明する実施形態のいずれかに記載の少なくとも1つのキメラTim受容体をコードする核酸分子またはキメラTim受容体ベクターを宿主細胞に導入すること;および宿主細胞において少なくとも1つのキメラTim受容体を発現させることを含む、細胞のホスファチジルセリン特異的細胞傷害活性を与えるかまたは向上させることを含み、少なくとも1つのキメラTim受容体は、キメラTim受容体を発現するための改変前の宿主細胞と比較して、宿主細胞のホスファチジルセリン特異的細胞傷害活性を向上させる。ある特定の実施形態においては、宿主細胞の細胞傷害活性は、キメラTim受容体をコードする核酸分子またはキメラTim受容体ベクターによる改変前の宿主細胞と比較して、少なくとも約10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%、200%またはそれよりも多く増大する。一部の実施形態においては、宿主細胞は、免疫細胞である。一部の実施形態においては、宿主細胞は、T細胞またはNK細胞である。宿主細胞、特にT細胞およびNK細胞等の免疫細胞の細胞傷害活性を測定する方法には、標的細胞死およびエフェクター細胞活性を媒介する、クロミウム(51Cr)放出アッセイ、β-galまたはホタルルシフェラーゼ放出アッセイ、フローサイトメトリー法が含まれる(例えばExpert Rev. Vaccines, 2010, 9:601-616を参照のこと)。 In one aspect, a method of the present disclosure comprises introducing into a host cell a nucleic acid molecule encoding at least one chimeric Tim Receptor or a chimeric Tim Receptor vector according to any of the embodiments described herein. and conferring or enhancing the phosphatidylserine-specific cytotoxic activity of the cell comprising expressing at least one chimeric Tim receptor in the host cell, wherein the at least one chimeric Tim receptor is a chimeric Tim receptor enhances the phosphatidylserine-specific cytotoxic activity of the host cell compared to the host cell prior to modification to express the antibody. In certain embodiments, the host cell cytotoxic activity is at least about 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 110% , 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200% or more. In some embodiments, host cells are immune cells. In some embodiments, host cells are T cells or NK cells. Methods for measuring the cytotoxic activity of host cells, particularly immune cells such as T cells and NK cells, include chromium (51Cr) release assays, β-gal or firefly luciferase release assays, which mediate target cell death and effector cell activity. , including flow cytometric methods (see, eg, Expert Rev. Vaccines, 2010, 9:601-616).
ある特定の実施形態においては、細胞のホスファチジルセリン特異的細胞傷害活性を与えるかまたは向上させることを含む本開示の方法は、少なくとも1つのキメラTim受容体を発現する宿主細胞のホスファチジルセリン特異的貪食活性を与えるかまたは向上させることをさらに含む。ある特定のそのような実施形態においては、宿主細胞は、キメラTim受容体による改変前に、天然には貪食表現型を示さない。例えば、ある特定のそのような実施形態においては、宿主細胞の貪食活性は、キメラTim受容体ベクターを発現するための改変前の宿主細胞と比較して、少なくとも約10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%、200%またはそれよりも多く増大する。ある特定の実施形態においては、宿主細胞は、天然には貪食活性を有しない。一部の実施形態においては、宿主細胞は、免疫細胞である。一部の実施形態においては、宿主細胞は、T細胞またはNK細胞である。宿主細胞の貪食活性を測定する方法には、PCT/US2017/053553号(その全体を参照により本明細書に組み込む)に説明される方法が含まれる。 In certain embodiments, the methods of the disclosure comprising conferring or enhancing phosphatidylserine-specific cytotoxic activity of a cell are performed by phosphatidylserine-specific phagocytosis of a host cell expressing at least one chimeric Tim receptor. Further comprising providing or enhancing activity. In certain such embodiments, the host cell does not naturally display a phagocytic phenotype prior to modification with the chimeric Tim receptor. For example, in certain such embodiments, the phagocytic activity of the host cell is at least about 10%, 15%, 20% compared to the host cell prior to modification to express the chimeric Tim receptor vector. , 25%, 30%, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 110%, 120 %, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200% or more. In certain embodiments, the host cell does not naturally have phagocytic activity. In some embodiments, host cells are immune cells. In some embodiments, host cells are T cells or NK cells. Methods for measuring host cell phagocytic activity include those described in PCT/US2017/053553, which is incorporated herein by reference in its entirety.
別の態様においては、本明細書において提供される実施形態のいずれかに記載のキメラTim受容体、キメラTim受容体をコードするポリヌクレオチド、キメラTim受容体ベクター、またはキメラTim受容体を発現する宿主細胞は、宿主細胞のエフェクター機能を向上させる方法において使用され得る。ある特定の実施形態においては、向上されたエフェクター機能は、増大した細胞傷害活性、増大した抗原特異的サイトカイン産生(例えばIFN-γ、IL-2、TNF-αまたはそれらの任意の組合せである)、増大した抗アポトーシスシグナル伝達、増大した持続性、増大した拡大増殖、増大した増殖、またはそれらの任意の組合せを含む。ある特定の実施形態においては、宿主細胞のエフェクター機能は、キメラTim受容体をコードする核酸分子またはキメラTim受容体ベクターにより改変されていない宿主細胞と比較して、少なくとも約10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%、200%またはそれよりも多く向上される。一部の実施形態においては、宿主細胞は、免疫細胞である。ある特定の実施形態においては、宿主細胞は、T細胞またはNK細胞である。 In another aspect, expressing a chimeric Tim receptor, a polynucleotide encoding a chimeric Tim receptor, a chimeric Tim receptor vector, or a chimeric Tim receptor according to any of the embodiments provided herein A host cell can be used in a method to enhance the effector function of a host cell. In certain embodiments, the improved effector function is increased cytotoxic activity, increased antigen-specific cytokine production (eg, IFN-γ, IL-2, TNF-α, or any combination thereof) , increased anti-apoptotic signaling, increased persistence, increased proliferation, increased proliferation, or any combination thereof. In certain embodiments, the effector function of the host cell is at least about 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100%, 110% , 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200% or more. In some embodiments, host cells are immune cells. In certain embodiments, host cells are T cells or NK cells.
別の態様においては、本開示のキメラTim受容体により改変した宿主細胞は、免疫細胞疲弊を阻害または低減するための方法において使用され得る。一部の実施形態においては、免疫細胞は、T細胞またはNK細胞である。ある特定の実施形態においては、T細胞における低減した疲弊は、(a)T細胞におけるPD-1、TIGIT、LAG3、TIM3、もしくはそれらの任意の組合せの減少した発現;(b)T細胞におけるIFN-γ、IL-2、TNF-α、もしくはそれらの任意の組合せの増大した産生;または(a)と(b)との両方を含む。ある特定の実施形態においては、NK細胞における低減した疲弊は、(a)NK細胞におけるPD-1、NKG2A、TIM3、もしくはそれらの任意の組合せの減少した発現;(b)NK細胞におけるIFN-γ、TNF-α、もしくはその両方の増大した産生;または(a)と(b)との両方を含む。ある特定の実施形態においては、免疫チェックポイント分子の発現は、キメラTim受容体をコードする核酸分子またはキメラTim受容体ベクターにより改変されていない宿主免疫細胞と比較して、キメラTim受容体を発現する宿主免疫細胞において少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、または100%減少する。ある特定の実施形態においては、サイトカインの発現は、キメラTim受容体をコードする核酸分子またはキメラTim受容体ベクターにより改変されていない宿主免疫細胞と比較して、キメラTim受容体を発現する宿主免疫細胞において少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%、110%、120%、130%、140%、150%、160%、170%、180%、190%、200%またはそれよりも多く増大する。 In another aspect, host cells modified with chimeric Tim receptors of the present disclosure can be used in methods for inhibiting or reducing immune cell exhaustion. In some embodiments, the immune cells are T cells or NK cells. In certain embodiments, the reduced exhaustion in T cells is (a) reduced expression of PD-1, TIGIT, LAG3, TIM3, or any combination thereof in T cells; (b) IFN in T cells. - increased production of gamma, IL-2, TNF-α, or any combination thereof; or both (a) and (b). In certain embodiments, the reduced exhaustion in NK cells is (a) reduced expression of PD-1, NKG2A, TIM3, or any combination thereof in NK cells; (b) IFN-γ in NK cells. , TNF-α, or both; or both (a) and (b). In certain embodiments, the expression of the immune checkpoint molecule increases the expression of the chimeric Tim Receptor relative to host immune cells that have not been modified by the nucleic acid molecule encoding the chimeric Tim Receptor or the chimeric Tim Receptor vector. at least about 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80% %, 85%, 90%, 95%, or 100%. In certain embodiments, expression of the cytokine increases host immunity expressing the chimeric Tim Receptor relative to host immune cells that have not been modified by the chimeric Tim Receptor-encoding nucleic acid molecule or chimeric Tim Receptor vector. at least about 5%, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85% in cells %, 90%, 95%, 100%, 110%, 120%, 130%, 140%, 150%, 160%, 170%, 180%, 190%, 200% or more.
別の態様においては、本明細書において提供される実施形態のいずれかに記載のキメラTim受容体、キメラTim受容体をコードするポリヌクレオチド、キメラTim受容体ベクター、またはキメラTim受容体を発現する宿主細胞は、宿主細胞においてホスファチジルセリンに対する免疫抑制性応答を低減させる方法において使用され得る。ある特定の実施形態においては、免疫抑制性応答は、抗炎症性サイトカイン(例えばIL-10、TGF-β、またはその両方)の分泌、炎症性サイトカイン(例えばTNF-α、IL-1β、およびIL-12)の分泌の減少、またはその両方を含む。ある特定の実施形態においては、ホスファチジルセリンに対する宿主細胞の免疫抑制性応答は、キメラTim受容体をコードする核酸分子またはキメラTim受容体ベクターにより改変されていない宿主細胞と比較して、少なくとも約5%、10%、15%、20%、25%、30%、35%、40%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%、100%減少する。一部の実施形態においては、宿主細胞は、免疫細胞である。ある特定の実施形態においては、宿主細胞は、T細胞またはNK細胞である。 In another aspect, expressing a chimeric Tim receptor, a polynucleotide encoding a chimeric Tim receptor, a chimeric Tim receptor vector, or a chimeric Tim receptor according to any of the embodiments provided herein A host cell can be used in a method of reducing an immunosuppressive response to phosphatidylserine in a host cell. In certain embodiments, the immunosuppressive response is the secretion of anti-inflammatory cytokines (eg, IL-10, TGF-β, or both), inflammatory cytokines (eg, TNF-α, IL-1β, and IL-1β). -12), or both. In certain embodiments, the host cell's immunosuppressive response to phosphatidylserine is at least about 5% greater than a host cell that has not been modified by a chimeric Tim Receptor-encoding nucleic acid molecule or chimeric Tim Receptor vector. %, 10%, 15%, 20%, 25%, 30%, 35%, 40%, 50%, 55%, 60%, 65%, 70%, 75%, 80%, 85%, 90%, 95%, 100% reduction. In some embodiments, host cells are immune cells. In certain embodiments, host cells are T cells or NK cells.
また別の態様においては、本明細書において提供される実施形態のいずれかに記載のキメラTim受容体、キメラTim受容体をコードするポリヌクレオチド、キメラTim受容体ベクター、またはキメラTim受容体を発現する宿主細胞は、表面曝露されたホスファチジルセリンを保持する標的細胞を除去するための、例えば、表面提示されたホスファチジルセリンを保持するがん細胞を除去するための方法において使用され得る。ある特定の実施形態においては、標的細胞は、表面曝露されたホスファチジルセリンを保持する損傷細胞、ストレスを受けた細胞、アポトーシス細胞、壊死細胞(例えば腫瘍細胞)である。ある特定の実施形態においては、キメラTim受容体を発現する宿主細胞は、アポトーシスを誘導すること、またはアポトーシスおよび貪食の両方を誘導することを介して、表面曝露されたホスファチジルセリンを保持する損傷標的細胞、ストレスを受けた標的細胞、アポトーシス標的細胞、または壊死標的細胞を一掃する。キメラTim受容体を発現する宿主細胞は、単独で、または例えばCAR-T細胞、TCR、抗体、放射線療法、化学療法、小分子、腫瘍溶解性ウイルス、電気パルス療法等を含む他の治療剤と組み合わせて、対象に投与され得る。 In yet another aspect, a chimeric Tim receptor, a polynucleotide encoding a chimeric Tim receptor, a chimeric Tim receptor vector, or expressing a chimeric Tim receptor according to any of the embodiments provided herein Host cells that carry surface-exposed phosphatidylserine can be used in methods to eliminate target cells that retain surface-exposed phosphatidylserine, such as cancer cells that retain surface-displayed phosphatidylserine. In certain embodiments, target cells are damaged cells, stressed cells, apoptotic cells, necrotic cells (eg, tumor cells) that retain surface-exposed phosphatidylserine. In certain embodiments, a host cell expressing a chimeric Tim receptor is a target of injury that retains surface-exposed phosphatidylserine through inducing apoptosis, or both apoptosis and phagocytosis. Clear cells, stressed target cells, apoptotic target cells, or necrotic target cells. Host cells expressing chimeric Tim receptors can be used alone or with other therapeutic agents including, for example, CAR-T cells, TCRs, antibodies, radiotherapy, chemotherapy, small molecules, oncolytic viruses, electrical pulse therapy, etc. Can be administered to a subject in combination.
別の態様においては、本明細書において提供される実施形態のいずれかに記載のキメラTim受容体、キメラTim受容体をコードするポリヌクレオチド、キメラTim受容体ベクター、またはキメラTim受容体を発現する宿主細胞は、細胞ストレス、損傷、壊死、またはアポトーシスを誘導する治療剤の効果を向上させるための方法において使用され得る。ある特定の療法、例として化学療法、放射線療法、UV光療法、電気パルス療法、養子細胞免疫療法(例えばCAR-T細胞、TCR)および腫瘍溶解性ウイルス療法は、腫瘍細胞、疾患細胞、およびそれらの周囲環境における細胞に対して、細胞損傷または細胞死を誘導し得る。キメラTim受容体を発現する細胞は、ターゲティング細胞の外側リーフレット上に曝露されたホスファチジルセリン部分に結合する細胞損傷性/細胞傷害性療法と組み合わせて投与され、かつストレスを受けた細胞、損傷細胞、疾患細胞、アポトーシス細胞、壊死細胞を一掃することができる。 In another aspect, expressing a chimeric Tim receptor, a polynucleotide encoding a chimeric Tim receptor, a chimeric Tim receptor vector, or a chimeric Tim receptor according to any of the embodiments provided herein Host cells can be used in methods to enhance the efficacy of therapeutic agents that induce cellular stress, injury, necrosis, or apoptosis. Certain therapies, such as chemotherapy, radiotherapy, UV light therapy, electrical pulse therapy, adoptive cell immunotherapy (e.g. CAR-T cells, TCR) and oncolytic virus therapy, treat tumor cells, disease cells and their can induce cell damage or cell death to cells in the surrounding environment. Cells expressing chimeric Tim receptors are administered in combination with a cytotoxic/cytotoxic therapy that binds to phosphatidylserine moieties exposed on the outer leaflet of targeted cells, and stressed cells, injured cells, Diseased, apoptotic and necrotic cells can be cleared.
キメラTim受容体およびPARP阻害剤は、1つまたは複数の追加の治療剤と組み合わせて、対象に投与され得る。本説明に記載のキメラTim組成物と組み合わせて投与され得る治療剤の例には、放射線療法、養子細胞免疫療法剤(例えば組換えTCR、高親和性TCR、CAR、TCR-CAR、scTCR融合タンパク質、樹状細胞ワクチン)、抗体療法、免疫チェックポイント分子阻害剤療法、UV光療法、電気パルス療法、高密度焦点式超音波療法、腫瘍溶解性ウイルス療法または医薬療法、例として化学療法剤、治療用ペプチド、ホルモン、アプタマー、抗生物質、抗ウイルス剤、抗真菌剤、抗炎症剤、小分子療法、またはそれらの任意の組合せが含まれる。ある特定の実施形態においては、キメラTim受容体改変宿主細胞は、1つまたは複数の追加の治療剤により誘導される表面ホスファチジルセリンを提示する、ストレスを受けた細胞、損傷細胞、アポトーシス細胞、壊死細胞、感染細胞、死亡細胞を一掃し得る。 A chimeric Tim receptor and PARP inhibitor can be administered to a subject in combination with one or more additional therapeutic agents. Examples of therapeutic agents that can be administered in combination with the chimeric Tim compositions described herein include radiotherapy, adoptive cell immunotherapy agents (eg, recombinant TCR, high affinity TCR, CAR, TCR-CAR, scTCR fusion proteins). , dendritic cell vaccine), antibody therapy, immune checkpoint molecule inhibitor therapy, UV light therapy, electrical pulse therapy, high-intensity focused ultrasound therapy, oncolytic virus therapy or pharmaceutical therapy, such as chemotherapeutic agents, treatment therapeutic peptides, hormones, aptamers, antibiotics, antivirals, antifungals, anti-inflammatory agents, small molecule therapies, or any combination thereof. In certain embodiments, the chimeric Tim receptor-modified host cell presents surface phosphatidylserine induced by one or more additional therapeutic agents. It can clear cells, infected cells, dead cells.
ある特定の実施形態においては、ベクターは、キメラTim受容体をコードするポリヌクレオチドおよび細胞免疫療法剤(例えばキメラ抗原受容体、組換えTCR等)をコードするポリヌクレオチドを含む。ある特定の実施形態においては、キメラTim受容体および細胞免疫療法剤(例えばCAR)をコードする単一のポリヌクレオチドが、クローニング部位にクローニングされ、かつ単一のプロモーターから発現され、キメラTim受容体配列と細胞免疫療法剤(例えばCAR)配列とは、単一のオープンリーディングフレームからの複数遺伝子の共発現を可能にするために(例えばマルチシストロン性ベクター)、配列内リボソーム進入部位(IRES)、フューリン切断部位またはウイルス2Aペプチドによって互いに分離されている。ある特定の実施形態においては、ウイルス2Aペプチドは、ブタテッショウウイルス-1(P2A)、トセア・アシグナウイルス(T2A)、ウマ鼻炎Aウイルス(E2A)、口蹄疫ウイルス(F2A)またはそれらの変異型である。例示的なT2Aペプチドは、配列番号12、28、29または30のアミノ酸配列を含む。例示的なP2Aペプチドは、配列番号13または31のアミノ酸配列を含む。例示的なE2Aペプチド配列は、配列番号14のアミノ酸配列を含む。例示的なF2Aペプチド配列は、配列番号15のアミノ酸配列を含む。 In certain embodiments, a vector comprises a polynucleotide encoding a chimeric Tim receptor and a polynucleotide encoding a cellular immunotherapeutic agent (eg, chimeric antigen receptor, recombinant TCR, etc.). In certain embodiments, a single polynucleotide encoding a chimeric tim receptor and a cellular immunotherapeutic agent (e.g., CAR) is cloned into a cloning site and expressed from a single promoter to produce a chimeric tim receptor Sequences and cellular immunotherapeutic agents (e.g., CAR) sequences include an internal ribosome entry site (IRES), to allow co-expression of multiple genes from a single open reading frame (e.g., multicistronic vectors) They are separated from each other by furin cleavage sites or viral 2A peptides. In certain embodiments, the viral 2A peptide is porcine tessho virus-1 (P2A), Tosea acignavirus (T2A), equine rhinitis A virus (E2A), foot and mouth disease virus (F2A), or variants thereof. is. Exemplary T2A peptides comprise the amino acid sequence of SEQ ID NOs: 12, 28, 29 or 30. An exemplary P2A peptide comprises the amino acid sequence of SEQ ID NO: 13 or 31. An exemplary E2A peptide sequence comprises the amino acid sequence of SEQ ID NO:14. An exemplary F2A peptide sequence comprises the amino acid sequence of SEQ ID NO:15.
ある特定の実施形態においては、キメラTim受容体をコードするポリヌクレオチドおよび細胞免疫療法剤(例えばCAR)結合タンパク質をコードするポリヌクレオチドは、互いに接合されて単一のポリヌクレオチドになり、その後、ベクターに挿入される。他の実施形態においては、CERをコードするポリヌクレオチドおよびCARまたはTCR結合タンパク質をコードするポリヌクレオチドは、発現されるアミノ酸配列が機能的CERおよびCAR/またはTCRを産生するように、同じかまたは異なるクローニング部位においてベクターに別々に挿入され得る。タンデム発現カセットをコードするベクターは、「タンデム発現ベクター」と本明細書において呼ばれる。 In certain embodiments, a polynucleotide encoding a chimeric Tim receptor and a polynucleotide encoding a cellular immunotherapeutic agent (e.g., CAR) binding protein are conjugated together into a single polynucleotide, which is then conjugated to a vector. is inserted into In other embodiments, the polynucleotide encoding the CER and the polynucleotide encoding the CAR or TCR binding protein are the same or different such that the expressed amino acid sequence produces a functional CER and CAR/or TCR. It can be inserted separately into the vector at the cloning site. A vector encoding a tandem expression cassette is referred to herein as a "tandem expression vector."
ある特定の実施形態においては、ベクターは、キメラTim受容体をコードするポリヌクレオチドおよび細胞免疫療法剤(例えばCAR)をコードするポリヌクレオチドを含む。キメラTim受容体および細胞免疫療法剤(例えばCAR)をコードするポリヌクレオチドは、異なるクローニング部位においてベクターに連続的にクローニングすることができ、キメラTim受容体および細胞免疫療法剤(例えばCAR)は、異なるプロモーターの調節下で発現される。 In certain embodiments, a vector comprises a polynucleotide encoding a chimeric Tim receptor and a polynucleotide encoding a cellular immunotherapeutic agent (eg, CAR). A polynucleotide encoding a chimeric Tim receptor and a cellular immunotherapeutic agent (e.g., CAR) can be sequentially cloned into a vector at different cloning sites, wherein the chimeric Tim receptor and cellular immunotherapeutic agent (e.g., CAR) are Expressed under the control of different promoters.
ある特定の実施形態においては、また、キメラTim受容体改変宿主細胞は、1つまたは複数の小GTPアーゼを共発現するように改変され得る。Rho GTPアーゼ、小(約21kDa)シグナル伝達Gタンパク質のファミリーおよびまた、Rasスーパーファミリーのサブファミリーは、様々な細胞種におけるアクチン細胞骨格組織化を調節し、食作用中の偽足伸長およびファゴソーム閉鎖を促進する(例えばCastellano et al., 2000, J. Cell Sci. 113:2955-2961を参照のこと)。貪食は、繋ぎ止められた細胞または粒子の下のF-アクチン動員、および細胞または粒子内部移行をもたらす膜伸長を可能にするF-アクチン再配置を必要とする。Rho GTPアーゼには、RhoA、Rac1、Rac2、RhoGおよびCDC42が含まれる。他の小GTPアーゼ、例としてRap1は、補体媒介食作用の調節に関与する。小GTPアーゼとキメラTim受容体との共発現は、宿主細胞による標的細胞または粒子内部移行および/またはファゴソーム形成を促進し得る。一部の実施形態においては、GTPアーゼをコードする組換え核酸分子は、キメラTim受容体含有ベクターとは別々のベクターにコードされる。他の実施形態においては、GTPアーゼをコードする組換え核酸分子は、キメラTim受容体と同じベクターにコードされる。GTPアーゼおよびキメラTim受容体は、同じベクターの異なるプロモーターの調節下で(例えば異なるマルチクローニング部位において)発現され得る。あるいは、キメラTim受容体およびGTPアーゼは、マルチシストロン性ベクターにおいて1つのプロモーターの調節下で発現され得る。キメラTim受容体をコードするポリヌクレオチド配列および小GTPアーゼをコードするポリヌクレオチド配列は、マルチシストロン性ベクターにおいてIRESまたはウイルス2Aペプチドにより互いに分離され得る。例示的な2Aペプチドには、T2A(配列番号12)、P2A(配列番号13)、E2A(配列番号14)、F2A(配列番号15)が含まれる。キメラTim受容体と共に共発現され得るGTPアーゼの例には、Rac1、Rac2、Rab5(Rab5aとも呼ばれる)、Rab7、Rap1、RhoA、RhoG、CDC42またはそれらの任意の組合せが含まれる。特定の実施形態においては、GTPアーゼは、配列番号17のRac1アミノ酸配列、配列番号18のRab5アミノ酸配列、配列番号19のRab7アミノ酸配列、配列番号20のRap1アミノ酸配列、配列番号21のRhoAアミノ酸配列、配列番号22のCDC42アミノ酸配列またはそれらの任意の組合せと少なくとも90%、少なくとも91%、少なくとも92%、少なくとも93%、少なくとも94%、少なくとも95%、少なくとも96%、少なくとも97%、少なくとも98%、少なくとも99%、少なくとも99.5%または100%同一である配列を含むか、またはその配列である。 In certain embodiments, chimeric Tim receptor engineered host cells can also be engineered to co-express one or more small GTPases. Rho GTPases, a family of small (~21 kDa) signaling G proteins and also a subfamily of the Ras superfamily, regulate actin cytoskeletal organization in various cell types, pseudopodia elongation and phagosome closure during phagocytosis. (see, eg, Castellano et al., 2000, J. Cell Sci. 113:2955-2961). Phagocytosis requires F-actin recruitment beneath tethered cells or particles and F-actin rearrangement to allow membrane elongation leading to cell or particle internalization. Rho GTPases include RhoA, Rac1, Rac2, RhoG and CDC42. Other small GTPases, such as Rap1, are involved in regulating complement-mediated phagocytosis. Co-expression of a small GTPase and a chimeric Tim receptor can facilitate target cell or particle internalization and/or phagosome formation by a host cell. In some embodiments, the GTPase-encoding recombinant nucleic acid molecule is encoded on a separate vector from the chimeric Tim receptor-containing vector. In other embodiments, the recombinant nucleic acid molecule encoding the GTPase is encoded on the same vector as the chimeric Tim receptor. A GTPase and a chimeric Tim receptor can be expressed under the control of different promoters in the same vector (eg at different multiple cloning sites). Alternatively, a chimeric Tim receptor and GTPase can be expressed under the control of a single promoter in a multicistronic vector. The polynucleotide sequence encoding the chimeric Tim receptor and the polynucleotide sequence encoding the small GTPase can be separated from each other by an IRES or viral 2A peptide in a multicistronic vector. Exemplary 2A peptides include T2A (SEQ ID NO:12), P2A (SEQ ID NO:13), E2A (SEQ ID NO:14), F2A (SEQ ID NO:15). Examples of GTPases that can be co-expressed with the chimeric Tim receptor include Racl, Rac2, Rab5 (also called Rab5a), Rab7, Rapl, RhoA, RhoG, CDC42 or any combination thereof. In certain embodiments, the GTPases are the Rac1 amino acid sequence of SEQ ID NO:17, the Rab5 amino acid sequence of SEQ ID NO:18, the Rab7 amino acid sequence of SEQ ID NO:19, the Rap1 amino acid sequence of SEQ ID NO:20, the RhoA amino acid sequence of SEQ ID NO:21 , at least 90%, at least 91%, at least 92%, at least 93%, at least 94%, at least 95%, at least 96%, at least 97%, at least 98% with the CDC42 amino acid sequence of SEQ ID NO: 22 or any combination thereof , includes or is a sequence that is at least 99%, at least 99.5% or 100% identical.
ある特定の実施形態においては、また、キメラTim受容体改変宿主細胞は、細胞免疫療法剤(例えばCAR、TCR等)を共発現するように改変され得る。一部の実施形態においては、細胞免疫療法剤は、キメラ抗原受容体(CAR)を含む。CARは、一般的に:標的抗原に結合する結合ドメインを含む細胞外ドメイン;細胞内シグナル伝達ドメイン(例えば、ITAM含有細胞内シグナル伝達ドメインおよび適宜の細胞内共刺激性ドメインを含む)、および細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインを含む組換え受容体である。 In certain embodiments, chimeric Tim receptor engineered host cells can also be engineered to co-express a cellular immunotherapeutic agent (eg, CAR, TCR, etc.). In some embodiments, the cellular immunotherapeutic agent comprises a chimeric antigen receptor (CAR). CARs generally include: an extracellular domain that includes a binding domain that binds to a target antigen; an intracellular signaling domain (e.g., including an ITAM-containing intracellular signaling domain and an appropriate intracellular co-stimulatory domain); It is a recombinant receptor containing a transmembrane domain located between and connecting the ectodomain and the intracellular signaling domain.
本開示のCARにおける使用のために好適な結合ドメインには、任意の抗原結合性ポリペプチドが含まれる。結合ドメインは、例えば全長重鎖、Fab断片、Fab’、F(ab’)2、sFv、VHドメイン、VLドメイン、dAb、VHH、CDRおよびscFvを含む抗体またはその抗原結合性断片を含み得る。ある特定の実施形態においては、CAR結合ドメインは、マウス、キメラ、ヒトまたはヒト化CAR結合ドメインである。 Suitable binding domains for use in the CARs of the present disclosure include any antigen-binding polypeptide. A binding domain can comprise an antibody or antigen-binding fragment thereof, including, for example, full-length heavy chains, Fab fragments, Fab', F(ab') 2 , sFv, VH domains, VL domains, dAbs, VHHs, CDRs and scFvs. In certain embodiments, the CAR binding domain is a murine, chimeric, human or humanized CAR binding domain.
ある特定の実施形態においては、CARの結合ドメインは、がんまたは腫瘍抗原をターゲティングする。CARがターゲティングし得る例示的な抗原には、CD138、CD38、CD33、CD123、CD72、CD79a、CD79b、メソテリン、PSMA、BCMA、ROR1、MUC-16、L1CAM、CD22、CD19、CD20、CD23、CD24、CD37、CD30、CA125、CD56、c-Met、EGFR、GD-3、HPV E6、HPV E7、MUC-1、HER2、葉酸受容体α、CD97、CD171、CD179a、CD44v6、WT1、VEGF-α、VEGFR1、IL-13Rα1、IL-13Rα2、IL-11Rα、PSA、FcRH5、NKG2Dリガンド、NY-ESO-1、TAG-72、CEA、エフリンA2、エフリンB2、ルイス式A抗原、ルイス式Y抗原、MAGE、MAGE-A1、RAGE-1、葉酸受容体β、EGFRviii、VEGFR-2、LGR5、SSX2、AKAP-4、FLT3、フコシルGM1、GM3、o-アセチル-GD2およびGD2が含まれる。 In certain embodiments, the CAR binding domain targets a cancer or tumor antigen. Exemplary antigens that a CAR can target include CD138, CD38, CD33, CD123, CD72, CD79a, CD79b, mesothelin, PSMA, BCMA, ROR1, MUC-16, L1CAM, CD22, CD19, CD20, CD23, CD24, CD37, CD30, CA125, CD56, c-Met, EGFR, GD-3, HPV E6, HPV E7, MUC-1, HER2, folate receptor alpha, CD97, CD171, CD179a, CD44v6, WT1, VEGF-alpha, VEGFR1 , IL-13Rα1, IL-13Rα2, IL-11Rα, PSA, FcRH5, NKG2D ligand, NY-ESO-1, TAG-72, CEA, EphrinA2, EphrinB2, Lewis formula A antigen, Lewis formula Y antigen, MAGE, Included are MAGE-A1, RAGE-1, folate receptor beta, EGFRviii, VEGFR-2, LGR5, SSX2, AKAP-4, FLT3, fucosyl GM1, GM3, o-acetyl-GD2 and GD2.
ある特定の実施形態においては、本開示において提供されるCARの細胞外ドメインは、細胞外非シグナル伝達スペーサーまたはリンカードメインを含んでもよい。含まれる場合、そのようなスペーサーまたはリンカードメインは、結合ドメインを、宿主細胞表面から離れるように位置させて、適切な細胞-細胞接触、結合および活性化をさらに可能にし得る。細胞外スペーサードメインは一般的に、CARの細胞外結合ドメインと膜貫通ドメインとの間に位置する。細胞外スペーサーの長さは、選択された標的分子、選択された結合エピトープ、結合ドメインサイズおよび親和性に基づいて、標的分子結合を最適化するために変動し得る(例えばGuest et al., J. Immunother. 28:203-11, 2005;PCT公開公報WO2014/031687号を参照のこと)。ある特定の実施形態においては、細胞外スペーサードメインは、免疫グロブリンヒンジ領域(例えばIgG1、IgG2、IgG3、IgG4、IgA、IgD)である。免疫グロブリンヒンジ領域は、野生型免疫グロブリンヒンジ領域または変更された野生型免疫グロブリンヒンジ領域であり得る。変更されたIgG4ヒンジ領域は、PCT公開公報WO2014/031687号において説明されており、当該ヒンジ領域は、その全体を参照により本明細書に組み込む。特定の実施形態においては、細胞外スペーサードメインは、配列番号3のアミノ酸配列を有する改変IgG4ヒンジ領域を含む。 In certain embodiments, the extracellular domains of CARs provided in this disclosure may include extracellular non-signaling spacer or linker domains. If included, such spacer or linker domains may position the binding domain away from the host cell surface to further permit proper cell-cell contact, binding and activation. An extracellular spacer domain is generally located between the extracellular binding domain and the transmembrane domain of the CAR. The length of the extracellular spacer can be varied to optimize target molecule binding based on the selected target molecule, selected binding epitope, binding domain size and affinity (e.g., Guest et al., J. Immunother. 28:203-11, 2005; see PCT Publication No. WO 2014/031687). In certain embodiments, the extracellular spacer domain is an immunoglobulin hinge region (eg, IgG1, IgG2, IgG3, IgG4, IgA, IgD). The immunoglobulin hinge region can be a wild-type immunoglobulin hinge region or an altered wild-type immunoglobulin hinge region. A modified IgG 4 hinge region is described in PCT Publication No. WO2014/031687, which is incorporated herein by reference in its entirety. In certain embodiments, the extracellular spacer domain comprises a modified IgG4 hinge region having the amino acid sequence of SEQ ID NO:3.
本明細書において説明するCARにおいて使用され得るヒンジ領域の他の例には、野生型またはその変異型であり得る1型膜タンパク質、例としてCD8a、CD4、CD28およびCD7の細胞外領域からのヒンジ領域が含まれる。特定の実施形態においては、細胞外スペーサードメインは、配列番号70のアミノ酸配列を有するCD8aヒンジ領域を含む。別の特定の実施形態においては、細胞外スペーサードメインは、配列番号32のアミノ酸配列を有するCD28ヒンジ領域を含む。さらなる実施形態においては、細胞外スペーサードメインは、CH1ドメイン、CH2ドメイン、CH3ドメインまたはそれらの組合せから選択される免疫グロブリンFcドメインの全てまたは一部を含む(例えばPCT公開公報WO2014/031687号を参照されたく、当該スペーサーは、その全体を参照により本明細書に組み込む)。またさらなる実施形態においては、細胞外スペーサードメインは、II型Cレクチンの柄領域(C型レクチンドメインと膜貫通ドメインとの間に位置する細胞外ドメイン)を含み得る。II型Cレクチンには、CD23、CD69、CD72、CD94、NKG2AおよびNKG2Dが含まれる。 Other examples of hinge regions that can be used in the CARs described herein include hinges from the extracellular regions of type 1 membrane proteins, such as CD8a, CD4, CD28 and CD7, which can be wild-type or mutants thereof. area is included. In certain embodiments, the extracellular spacer domain comprises a CD8a hinge region having the amino acid sequence of SEQ ID NO:70. In another specific embodiment, the extracellular spacer domain comprises a CD28 hinge region having the amino acid sequence of SEQ ID NO:32. In a further embodiment, the extracellular spacer domain comprises all or part of an immunoglobulin Fc domain selected from CH1 domain, CH2 domain, CH3 domain or combinations thereof (see e.g. PCT Publication No. WO2014/031687). Please, the spacer is incorporated herein by reference in its entirety). In still further embodiments, the extracellular spacer domain may comprise the stalk region of a type II C lectin (the extracellular domain located between the type C lectin domain and the transmembrane domain). Type II C lectins include CD23, CD69, CD72, CD94, NKG2A and NKG2D.
本開示のCARは、細胞外ドメインと細胞内シグナル伝達ドメインとを接続し、かつこれらの間に位置する膜貫通ドメインを含む。膜貫通ドメインは、約15アミノ酸~約30アミノ酸の長さの範囲である。膜貫通ドメインは、宿主細胞膜を横断し、かつ宿主細胞膜においてCARを固定する疎水性アルファヘリックスである。膜貫通ドメインは、結合ドメインに、または存在する場合細胞外スペーサードメインに直接的に融合され得る。ある特定の実施形態においては、膜貫通ドメインは、膜内在性タンパク質[例えば受容体、表面抗原分類(CD:cluster of differentiation)分子、酵素、トランスポーター、細胞接着分子その他]に由来する。膜貫通ドメインは、細胞外ドメインまたは細胞内シグナル伝達ドメインと同じ分子から選択され得る(例えば、CARはCD28共刺激性シグナル伝達ドメインおよびCD28膜貫通ドメインを含む)。ある特定の実施形態においては、膜貫通ドメインおよび細胞外ドメインは各々、異なる分子から選択される。他の実施形態においては、膜貫通ドメインおよび細胞内シグナル伝達ドメインは各々、異なる分子から選択される。また他の実施形態においては、膜貫通ドメイン、細胞外ドメインおよび細胞内シグナル伝達ドメインは各々、異なる分子から選択される。 The CARs of this disclosure comprise a transmembrane domain that connects and is located between the extracellular domain and the intracellular signaling domain. Transmembrane domains range in length from about 15 amino acids to about 30 amino acids. The transmembrane domain is a hydrophobic alpha helix that traverses the host cell membrane and anchors the CAR in the host cell membrane. A transmembrane domain may be fused directly to a binding domain or, if present, to an extracellular spacer domain. In certain embodiments, the transmembrane domain is derived from an integral membrane protein [eg, receptor, cluster of differentiation (CD) molecule, enzyme, transporter, cell adhesion molecule, etc.]. The transmembrane domain may be selected from the same molecule as the extracellular domain or the intracellular signaling domain (eg, CAR includes CD28 co-stimulatory signaling domain and CD28 transmembrane domain). In certain embodiments, the transmembrane domain and extracellular domain are each selected from different molecules. In other embodiments, the transmembrane domain and intracellular signaling domain are each selected from different molecules. In still other embodiments, the transmembrane domain, extracellular domain and intracellular signaling domain are each selected from different molecules.
本開示のCARにおける使用のための例示的な膜貫通ドメインには、CD28、CD2、CD4、CD8a、CD5、CD3ε、CD3δ、CD3ζ、CD9、CD16、CD22、CD25、CD27、CD33、CD37、CD40、CD45、CD64、CD79A、CD79B、CD80、CD86、CD95(Fas)、CD134(OX40)、CD137(4-1BB)、CD150(SLAMF1)、CD152(CTLA4)、CD154(CD40L)、CD200R、CD223(LAG3)、CD270(HVEM)、CD272(BTLA)、CD273(PD-L2)、CD274(PD-L1)、CD278(ICOS)、CD279(PD-1)、CD300、CD357(GITR)、A2aR、DAP10、FcRα、FcRβ、FcRγ、Fyn、GAL9、KIR、Lck、LAT、LRP、NKG2D、NOTCH1、NOTCH2、NOTCH3、NOTCH4、PTCH2、ROR2、Ryk、Slp76、SIRPα、pTα、TCRα、TCRβ、TIM3、TRIM、LPA5およびZap70膜貫通ドメインが含まれる。例示的なCD28膜貫通ドメインは、配列番号7のアミノ酸配列を含む。特定の実施形態においては、膜貫通ドメインは、配列番号33のアミノ酸配列を有するCD8a膜貫通ドメインを含む。 Exemplary transmembrane domains for use in the CARs of the present disclosure include CD28, CD2, CD4, CD8a, CD5, CD3ε, CD3δ, CD3ζ, CD9, CD16, CD22, CD25, CD27, CD33, CD37, CD40, CD45, CD64, CD79A, CD79B, CD80, CD86, CD95 (Fas), CD134 (OX40), CD137 (4-1BB), CD150 (SLAMF1), CD152 (CTLA4), CD154 (CD40L), CD200R, CD223 (LAG3) , CD270 (HVEM), CD272 (BTLA), CD273 (PD-L2), CD274 (PD-L1), CD278 (ICOS), CD279 (PD-1), CD300, CD357 (GITR), A2aR, DAP10, FcRα, FcRβ, FcRγ, Fyn, GAL9, KIR, Lck, LAT, LRP, NKG2D, NOTCH1, NOTCH2, NOTCH3, NOTCH4, PTCH2, ROR2, Ryk, Slp76, SIRPα, pTα, TCRα, TCRβ, TIM3, TRIM, LPA5 and Zap70 membranes Contains a penetrating domain. An exemplary CD28 transmembrane domain comprises the amino acid sequence of SEQ ID NO:7. In certain embodiments, the transmembrane domain comprises a CD8a transmembrane domain having the amino acid sequence of SEQ ID NO:33.
CARの細胞内シグナル伝達ドメインは、細胞内エフェクタードメインであり、CARの細胞外ドメインの標的分子(例えばがん抗原)への結合に応答して、機能的シグナルを細胞に伝達し、かつCARを発現するように操作された免疫細胞、例えばT細胞の通常のエフェクター機能または応答のうちの少なくとも1つを活性化することができる。一部の実施形態においては、CARは、T細胞の機能、例として、細胞溶解活性またはTヘルパー活性、例として、サイトカインまたは他の因子の分泌を誘導する。細胞内シグナル伝達ドメインは、十分なシグナル伝達活性を保持する細胞内シグナル伝達分子の任意の部分であり得る。一部の実施形態においては、細胞内シグナル伝達ドメインは、抗原受容体成分(例えばTCR)または共刺激性分子から得られる。一部の実施形態においては、抗原受容体または共刺激性分子の全長細胞内シグナル伝達ドメインが使用される。一部の実施形態においては、抗原受容体または共刺激性分子の細胞内シグナル伝達ドメインの切断部分が使用され、但し、その切断部分は十分なシグナル伝達活性を保持する。さらなる実施形態においては、細胞内シグナル伝達ドメインは、抗原受容体共刺激性分子の細胞内シグナル伝達ドメインの全長または切断部分の変異型であり、但し、その変異型は十分なシグナル伝達活性を保持する(すなわち、機能的変異型である)。 The intracellular signaling domain of the CAR is an intracellular effector domain that transduces a functional signal to the cell and activates the CAR in response to binding of the extracellular domain of the CAR to a target molecule (e.g., cancer antigen). The immune cells that have been engineered to express can activate at least one of the normal effector functions or responses of eg T cells. In some embodiments, the CAR induces T cell function, eg, cytolytic or T helper activity, eg, secretion of cytokines or other factors. An intracellular signaling domain can be any portion of an intracellular signaling molecule that retains sufficient signaling activity. In some embodiments, the intracellular signaling domain is derived from an antigen receptor component (eg, TCR) or co-stimulatory molecule. In some embodiments, full-length intracellular signaling domains of antigen receptors or co-stimulatory molecules are used. In some embodiments, a truncated portion of the intracellular signaling domain of the antigen receptor or co-stimulatory molecule is used, provided that the truncated portion retains sufficient signaling activity. In a further embodiment, the intracellular signaling domain is a full-length or truncated variant of the intracellular signaling domain of the antigen receptor co-stimulatory molecule, provided that the variant retains sufficient signaling activity. (i.e., is a functional variant).
ある特定の実施形態においては、CARの細胞内シグナル伝達ドメインは、免疫受容体チロシンベース活性化モチーフ(ITAM)含有シグナル伝達ドメインを含む。ITAM含有シグナル伝達ドメインは一般的に、少なくとも1つの(1、2、3、4つまたはそれよりも多い)ITAMを含有し、これは、YXXL/I-X6-8-YXXL/Iの保存されたモチーフを指す。ITAM含有シグナル伝達ドメインは、抗原結合またはリガンドエンゲージメント後、T細胞活性化シグナル伝達を開始し得る。ITAMシグナル伝達ドメインには、例えばCD3γ、CD3δ、CD3ε、CD3ζ、CD5、CD22、CD79a、CD278(ICOS)、DAP12、FcRγおよびCD66dの細胞内シグナル伝達ドメインが含まれる。本開示のCARにおいて使用され得る例示的なCD3ζシグナル伝達ドメインは、配列番号27または5のアミノ酸配列を含む。 In certain embodiments, the intracellular signaling domain of the CAR comprises an immunoreceptor tyrosine-based activation motif (ITAM)-containing signaling domain. ITAM-containing signaling domains generally contain at least one (1, 2, 3, 4 or more) ITAMs, which are conserved YXXL/IX 6-8 -YXXL/I It refers to the motif that was created. ITAM-containing signaling domains can initiate T-cell activation signaling following antigen binding or ligand engagement. ITAM signaling domains include, for example, the intracellular signaling domains of CD3γ, CD3δ, CD3ε, CD3ζ, CD5, CD22, CD79a, CD278 (ICOS), DAP12, FcRγ and CD66d. Exemplary CD3ζ signaling domains that may be used in the CARs of this disclosure include the amino acid sequences of SEQ ID NOs:27 or 5.
CAR細胞内シグナル伝達ドメインは、主要な、または古典的な(例えばITAM駆動)活性化シグナルと共に活性化された場合、T細胞応答、例としてT細胞活性化、サイトカイン産生、増殖、分化、生存、エフェクター機能またはそれらの組合せを促進する、または向上させる共刺激性シグナル伝達ドメインを含んでもよい。CARにおける使用のための共刺激性シグナル伝達ドメインには、例えばCD27、CD28、CD40L、GITR、NKG2C、CARD1、CD2、CD7、CD27、CD30、CD40、CD54(ICAM)、CD83、CD134(OX-40)、CD137(4-1BB)、CD150(SLAMF1)、CD152(CTLA4)、CD223(LAG3)、CD226、CD270(HVEM)、CD273(PD-L2)、CD274(PD-L1)、CD278(ICOS)、DAP10、LAT、LFA-1、LIGHT、NKG2C、SLP76、TRIM、ZAP70またはそれらの任意の組合せが含まれる。特定の実施形態においては、共刺激性シグナル伝達ドメインは、OX40、CD2、CD27、CD28、ICAM-1、LFA-1(CD11a/CD18)、ICOS(CD278)または4-1BB(CD137)シグナル伝達ドメインを含む。本開示のCARにおいて使用され得る例示的なCD28共刺激性シグナル伝達ドメインは、配列番号26または4のアミノ酸配列を含む。例示的な4-1BB共刺激性シグナル伝達ドメインは、配列番号122のアミノ酸配列を含む。ある特定の実施形態においては、CARは、1、2つまたはそれよりも多い共刺激性シグナル伝達ドメインを含む。 CAR intracellular signaling domains, when activated in conjunction with primary or canonical (e.g., ITAM-driven) activation signals, induce T-cell responses such as T-cell activation, cytokine production, proliferation, differentiation, survival, Costimulatory signaling domains that promote or enhance effector functions or combinations thereof may be included. Costimulatory signaling domains for use in CAR include, for example, CD27, CD28, CD40L, GITR, NKG2C, CARD1, CD2, CD7, CD27, CD30, CD40, CD54 (ICAM), CD83, CD134 (OX-40 ), CD137 (4-1BB), CD150 (SLAMF1), CD152 (CTLA4), CD223 (LAG3), CD226, CD270 (HVEM), CD273 (PD-L2), CD274 (PD-L1), CD278 (ICOS), DAP10, LAT, LFA-1, LIGHT, NKG2C, SLP76, TRIM, ZAP70 or any combination thereof. In certain embodiments, the co-stimulatory signaling domain is the OX40, CD2, CD27, CD28, ICAM-1, LFA-1 (CD11a/CD18), ICOS (CD278) or 4-1BB (CD137) signaling domain including. Exemplary CD28 co-stimulatory signaling domains that may be used in the CARs of the present disclosure comprise the amino acid sequence of SEQ ID NO:26 or 4. An exemplary 4-1BB co-stimulatory signaling domain comprises the amino acid sequence of SEQ ID NO:122. In certain embodiments, the CAR comprises one, two or more co-stimulatory signaling domains.
一部の実施形態においては、CARは、抗体に由来するscFv結合ドメイン、膜貫通ドメイン、および細胞内シグナル伝達ドメインからなる組換え受容体である。一部の実施形態においては、細胞内シグナル伝達ドメインは、TCRに由来する。 In some embodiments, the CAR is a recombinant receptor consisting of an antibody-derived scFv binding domain, a transmembrane domain, and an intracellular signaling domain. In some embodiments, the intracellular signaling domain is derived from a TCR.
ある特定の実施形態においては、キメラ抗原受容体は、ヒト、霊長類、ウシ、ウマ、ヤギ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモット、ブタ、それらのトランスジェニック種またはそれらの任意の組合せを含む任意の哺乳動物種に由来するアミノ酸配列を含む。ある特定の実施形態においては、キメラ抗原受容体は、マウス、キメラ、ヒトまたはヒト化である。 In certain embodiments, the chimeric antigen receptor is human, primate, bovine, horse, goat, sheep, dog, cat, mouse, rat, rabbit, guinea pig, pig, transgenic species thereof, or any thereof. Amino acid sequences from any mammalian species, including combinations of In certain embodiments, the chimeric antigen receptor is murine, chimeric, human or humanized.
ある特定の実施形態においては、CARは、第1世代CAR、第2世代CARまたは第3世代CARである。第1世代CARは一般的に、CD3ζ、FcγRIの細胞内シグナル伝達ドメインまたは他のITAM含有活性化ドメインを含む細胞内シグナル伝達ドメインを有して、T細胞活性化シグナルを提供する。第2世代CARは、共刺激性シグナル伝達ドメイン(例えば内因性T細胞共刺激性受容体、例としてCD28、4-1BBまたはICOSからの共刺激性シグナル伝達ドメイン)をさらに含む。第3世代CARは、ITAM含有活性化ドメイン、第1の共刺激性シグナル伝達ドメインおよび第2の共刺激性シグナル伝達ドメインを含む。 In certain embodiments, the CAR is a first generation CAR, second generation CAR or third generation CAR. First generation CARs generally have intracellular signaling domains, including those of CD3ζ, FcγRI or other ITAM-containing activation domains, to provide T cell activation signals. Second generation CARs further comprise costimulatory signaling domains (eg, costimulatory signaling domains from endogenous T cell costimulatory receptors such as CD28, 4-1BB or ICOS). Third generation CARs contain an ITAM-containing activation domain, a first costimulatory signaling domain and a second costimulatory signaling domain.
一部の実施形態においては、細胞外ドメイン、結合ドメイン、リンカー、膜貫通ドメイン、細胞内シグナル伝達ドメイン、または共刺激性ドメインのうちの1つまたは複数は、接合部アミノ酸を含む。「接合部アミノ酸」または「接合部アミノ酸残基」とは、タンパク質の2つの隣接ドメイン、モチーフ、領域、モジュールまたは断片間、例として結合ドメインと隣接リンカーとの間、膜貫通ドメインと隣接細胞外もしくは細胞内ドメインとの間、あるいは2つのドメイン、モチーフ、領域、モジュールもしくは断片を連結するリンカーの一方または両方の末端(例えばリンカーと隣接結合ドメインとの間またはリンカーと隣接ヒンジとの間)の1つまたは複数の(例えば約2~20個の)アミノ酸残基を指す。接合部アミノ酸は、融合タンパク質のコンストラクト設計から生じ得る(例えば融合タンパク質をコードするポリヌクレオチドの構築中の制限酵素部位または自己切断ペプチド配列の使用から生じるアミノ酸残基)。例えば、融合タンパク質の膜貫通ドメインは、アミノ末端、カルボキシ末端、またはその両方において、1つまたは複数の接合部アミノ酸を有し得る。 In some embodiments, one or more of the extracellular domain, binding domain, linker, transmembrane domain, intracellular signaling domain, or co-stimulatory domain comprises a junctional amino acid. A "junction amino acid" or "junction amino acid residue" is defined between two adjacent domains, motifs, regions, modules or fragments of a protein, e.g. between a binding domain and an adjacent linker, a transmembrane domain and an adjacent extracellular or intracellular domains, or at one or both ends of a linker that joins two domains, motifs, regions, modules or fragments (e.g., between a linker and an adjacent binding domain or between a linker and an adjacent hinge). It refers to one or more (eg, about 2-20) amino acid residues. Junction amino acids may result from the construct design of the fusion protein (eg, amino acid residues resulting from the use of restriction enzyme sites or self-cleaving peptide sequences during construction of the polynucleotide encoding the fusion protein). For example, the transmembrane domain of the fusion protein can have one or more junctional amino acids at the amino terminus, carboxy terminus, or both.
本開示のCARにおける使用のための例示的な結合ドメイン、細胞外スペーサードメイン、膜貫通ドメイン、および細胞内シグナル伝達ドメイン配列は、表11に示される。 Exemplary binding domain, extracellular spacer domain, transmembrane domain, and intracellular signaling domain sequences for use in the CARs of the present disclosure are shown in Table 11.
表11.
ある特定の実施形態においては、キメラTim受容体改変宿主細胞は、組換えTCRを共発現する。組換えTCRタンパク質には、α鎖ポリペプチドとβ鎖ポリペプチドとのヘテロ二量体またはγ鎖ポリペプチドとδ鎖ポリペプチドとのヘテロ二量体からなる「伝統的な」TCR、例えば単鎖TCR、単一ドメインTCR、可溶性TCR融合TCRタンパク質およびTCR融合コンストラクト[TRuC(商標)]を含む、その結合性断片および融合タンパク質が含まれる。ある特定の実施形態においては、タンデム発現カセットは、TCRベータ可変領域およびTCRベータ定常領域を含む組換えTCRベータ鎖をコードするポリヌクレオチドと、TCRアルファ可変領域およびTCRアルファ定常領域を含む組換えTCRアルファ鎖をコードするポリヌクレオチドとを含む。ある特定の実施形態においては、組換えTCRは、高親和性TCRである。一実施形態においては、組換えTCRは、高親和性TCRである。 In certain embodiments, chimeric Tim receptor-modified host cells co-express a recombinant TCR. Recombinant TCR proteins include "traditional" TCRs consisting of heterodimers of α and β chain polypeptides or heterodimers of γ and δ chain polypeptides, e.g. Included are binding fragments and fusion proteins thereof, including TCRs, single domain TCRs, soluble TCR fusion TCR proteins and TCR fusion constructs [TRuC™]. In certain embodiments, the tandem expression cassette is a polynucleotide encoding a recombinant TCR beta chain comprising the TCR beta variable region and the TCR beta constant region and a recombinant TCR comprising the TCR alpha variable region and the TCR alpha constant region and a polynucleotide encoding the alpha chain. In certain embodiments, the recombinant TCR is a high affinity TCR. In one embodiment, the recombinant TCR is a high affinity TCR.
ある特定の実施形態においては、組換えTCR結合タンパク質は、フレキシブルリンカーによってVβに接合されたVαを含む単鎖TCR(scTCR:single chain TCR)である。一部の実施形態においては、scTCRは、Vα-リンカー-Vβポリペプチドを含む。他の実施形態においては、scTCRは、Vβ-リンカー-Vαポリペプチドを含む。 In certain embodiments, the recombinant TCR binding protein is a single chain TCR (scTCR) comprising Vα joined to Vβ by a flexible linker. In some embodiments, the scTCR comprises a Vα-linker-Vβ polypeptide. In other embodiments, the scTCR comprises a Vβ-linker-Vα polypeptide.
ある特定の実施形態においては、また、キメラTim受容体改変宿主細胞は、単鎖TCR(scTCR)融合タンパク質を共発現するように改変され得る。scTCR融合タンパク質は、scTCRを含む結合ドメイン(TCR Vβドメインに連結したTCR Vαドメイン)と、適宜の細胞外スペーサーと、膜貫通ドメインと、T細胞活性化シグナル(例えばCD3ζ ITAM含有活性化ドメイン)および適宜の共刺激性シグナル伝達ドメインを提供する単一の細胞内シグナル伝達ドメインを含む細胞内成分とを含む(Aggen et al., 2012, Gene Ther. 19:365-374;Stone et al., Cancer Immunol. Immunother. 2014, 63:1163-76を参照のこと)。 In certain embodiments, chimeric Tim receptor engineered host cells can also be engineered to co-express a single chain TCR (scTCR) fusion protein. The scTCR fusion protein comprises a binding domain comprising the scTCR (TCR Vα domain linked to the TCR Vβ domain), an appropriate extracellular spacer, a transmembrane domain, a T-cell activation signal (e.g. CD3ζ ITAM-containing activation domain) and and an intracellular component containing a single intracellular signaling domain that provides the appropriate costimulatory signaling domain (Aggen et al., 2012, Gene Ther. 19:365-374; Stone et al., Cancer Immunol. Immunother. 2014, 63:1163-76).
ある特定の実施形態においては、また、キメラTim受容体改変宿主細胞は、T細胞受容体ベースのキメラ抗原受容体(TCR-CAR)を共発現するように改変され得る。TCR-CARは、可溶性TCRを一般的に含むヘテロ二量体融合タンパク質であり(VαドメインおよびCαドメインを含むポリペプチド鎖、およびVβドメインおよびCβドメインを含むポリペプチド鎖)、VβCβポリペプチド鎖は、膜貫通ドメインおよび細胞内シグナル伝達成分(例えばITAM含有活性化ドメインおよび適宜、共刺激性シグナル伝達ドメイン)に連結されている(例えばWalseng et al., 2017 Scientific Reports 7:10713を参照のこと)。 In certain embodiments, chimeric Tim receptor-modified host cells can also be modified to co-express a T-cell receptor-based chimeric antigen receptor (TCR-CAR). TCR-CARs are heterodimeric fusion proteins that generally comprise a soluble TCR (a polypeptide chain comprising Vα and Cα domains, and a polypeptide chain comprising Vβ and Cβ domains), where the VβCβ polypeptide chain is , linked to transmembrane domains and intracellular signaling components (e.g. ITAM-containing activation domains and optionally co-stimulatory signaling domains) (see e.g. Walseng et al., 2017 Scientific Reports 7:10713) .
ある特定の実施形態においては、キメラTim受容体と細胞免疫療法剤(例えばCAR、TCR等)とを共発現する操作された宿主細胞は、キメラTim受容体をコードする組換え核酸および細胞免疫療法剤をコードする組換え核酸分子を、操作された宿主細胞内で別々のベクター上に含む。 In certain embodiments, an engineered host cell that co-expresses a chimeric Tim Receptor and a cellular immunotherapeutic agent (e.g., CAR, TCR, etc.) is a recombinant nucleic acid encoding a chimeric Tim Receptor and a cellular immunotherapeutic agent. A recombinant nucleic acid molecule encoding an agent is contained on a separate vector within an engineered host cell.
一部の実施形態においては、キメラTim受容体と細胞免疫療法剤(例えばCAR、TCR等)とを共発現する操作された宿主細胞は、キメラTim受容体をコードする組換え核酸および細胞免疫療法剤をコードする組換え核酸分子を、操作された宿主細胞内でキメラTim受容体と同じベクター上に含む。キメラTim受容体および細胞免疫療法剤は、同じベクターの異なるプロモーターの調節下で(例えば異なるマルチクローニング部位において)発現され得る。あるいは、キメラTim受容体および細胞免疫療法剤は、マルチシストロン性ベクター(例えばタンデム発現ベクター)において1つのプロモーターの調節下で発現され得る。キメラTim受容体をコードするポリヌクレオチド配列および細胞免疫療法剤をコードするポリヌクレオチド配列は、マルチシストロン性ベクターにおいてIRESまたはウイルス2Aペプチドにより分離され得る。 In some embodiments, an engineered host cell that co-expresses a chimeric Tim Receptor and a cellular immunotherapeutic agent (e.g., CAR, TCR, etc.) is a recombinant nucleic acid encoding a chimeric Tim Receptor and a cellular immunotherapeutic agent. A recombinant nucleic acid molecule encoding an agent is contained on the same vector as the chimeric Tim receptor in an engineered host cell. A chimeric Tim receptor and a cellular immunotherapeutic agent can be expressed under the control of different promoters in the same vector (eg, in different multiple cloning sites). Alternatively, a chimeric Tim receptor and a cellular immunotherapeutic agent can be expressed under the control of a single promoter in a multicistronic vector (eg, a tandem expression vector). A polynucleotide sequence encoding a chimeric Tim receptor and a polynucleotide sequence encoding a cellular immunotherapeutic agent can be separated by an IRES or viral 2A peptide in a multicistronic vector.
タンデム発現カセット、タンデム発現ベクター、およびそれを含む操作された宿主細胞は、その全体を参照により本明細書に組み込む、国際出願公開公報WO2019/191339号において説明されている。 Tandem expression cassettes, tandem expression vectors, and engineered host cells containing same are described in International Application Publication No. WO2019/191339, which is hereby incorporated by reference in its entirety.
キメラTim受容体を発現する宿主細胞は、単独で、または例えばCAR-T細胞、TCR、抗体、放射線療法、化学療法、小分子、腫瘍溶解性ウイルス、電気パルス療法等を含む他の治療剤と組み合わせて、対象に投与され得る。 Host cells expressing chimeric Tim receptors can be used alone or with other therapeutic agents including, for example, CAR-T cells, TCRs, antibodies, radiotherapy, chemotherapy, small molecules, oncolytic viruses, electrical pulse therapy, etc. They can be administered to a subject in combination.
ある特定の実施形態においては、キメラTim受容体および養子細胞免疫療法剤(例えば、上記に説明するCAR、TCR-CAR、TCR等)は、同じ宿主細胞または異なる宿主細胞において対象に投与される。ある特定の実施形態においては、キメラTim受容体および養子細胞免疫療法剤は、同じベクターからまたは別々のベクターから、同じ宿主細胞において発現される。ある特定の実施形態においては、キメラTim受容体および養子細胞免疫療法剤は、マルチシストロン性ベクターから、同じ宿主細胞において発現される。ある特定の実施形態においては、キメラTim受容体は、養子細胞免疫療法剤と同じ宿主細胞種において発現される(例えば、キメラTim受容体がCD4 T細胞において発現され、かつCAR/またはTCRがCD4 T細胞において発現されるか、またはキメラTim受容体がCD8 T細胞において発現され、かつCAR/またはTCRがCD8 T細胞において発現される)。他の実施形態においては、キメラTim受容体は、養子免疫療法剤とは異なる宿主細胞種において発現される(例えば、キメラTim受容体がCD4 T細胞において発現され、かつCAR/またはTCRがCD8 T細胞において発現される)。キメラTim受容体により操作された免疫細胞または細胞サブセットと細胞免疫療法剤(例えばCAR、TCR等)との組合せを含む細胞免疫療法組成物、製造方法、および使用方法は、その全体を参照により本明細書に組み込む、PCT国際公開公報WO2019/191340号において説明されている。 In certain embodiments, a chimeric Tim receptor and an adoptive cell immunotherapy agent (eg, CAR, TCR-CAR, TCR, etc. described above) are administered to a subject in the same host cell or different host cells. In certain embodiments, the chimeric Tim receptor and the adoptive cell immunotherapy agent are expressed in the same host cell from the same vector or from separate vectors. In certain embodiments, a chimeric Tim receptor and an adoptive cell immunotherapy agent are expressed in the same host cell from a multicistronic vector. In certain embodiments, the chimeric Tim Receptor is expressed in the same host cell type as the adoptive immunotherapeutic agent (e.g., the chimeric Tim Receptor is expressed in CD4 T cells and the CAR/or TCR is expressed in CD4 T cells). expressed on T cells, or chimeric Tim receptor expressed on CD8 T cells and CAR/or TCR expressed on CD8 T cells). In other embodiments, the chimeric Tim Receptor is expressed in a different host cell type than the adoptive immunotherapeutic agent (e.g., the chimeric Tim Receptor is expressed in CD4 T cells and the CAR/or TCR is expressed in CD8 T cells). cells). Cellular immunotherapeutic compositions, methods of making, and methods of use comprising combinations of chimeric Tim receptor engineered immune cells or cell subsets and cellular immunotherapeutic agents (e.g., CAR, TCR, etc.) are herein incorporated by reference in their entirety. It is described in PCT International Publication No. WO2019/191340, which is incorporated herein.
組換えTCR、高親和性TCR、CAR、TCR-CAR、またはscTCR融合タンパク質がターゲティングし得る例示的な抗原には、WT-1、メソテリン、MART-1、NY-ESO-1、MAGE-A3、HPV E7、サバイビン、α-フェトプロテインおよび腫瘍特異的新生抗原が含まれる。 Exemplary antigens that a recombinant TCR, high affinity TCR, CAR, TCR-CAR, or scTCR fusion protein may target include WT-1, mesothelin, MART-1, NY-ESO-1, MAGE-A3, Included are HPV E7, survivin, alpha-fetoprotein and tumor-specific neoantigens.
本開示のCARは、ウイルス抗原、細菌抗原、真菌抗原、寄生生物抗原、腫瘍抗原、自己免疫疾患抗原を含む様々な抗原をターゲティングし得る。CARがターゲティングし得る例示的な抗原には、CD138、CD38、CD33、CD123、CD72、CD79a、CD79b、メソテリン、PSMA、BCMA、ROR1、MUC-16、L1CAM、CD22、CD19、CD20、CD23、CD24、CD37、CD30、CA125、CD56、c-Met、EGFR、GD-3、HPV E6、HPV E7、MUC-1、HER2、葉酸受容体α、CD97、CD171、CD179a、CD44v6、WT1、VEGF-α、VEGFR1、IL-13Rα1、IL-13Rα2、IL-11Rα、PSA、FcRH5、NKG2Dリガンド、NY-ESO-1、TAG-72、CEA、エフリンA2、エフリンB2、ルイス式A抗原、ルイス式Y抗原、MAGE、MAGE-A1、RAGE-1、葉酸受容体β、EGFRviii、VEGFR-2、LGR5、SSX2、AKAP-4、FLT3、フコシルGM1、GM3、o-アセチル-GD2およびGD2が含まれる。 CARs of the present disclosure can target a variety of antigens, including viral antigens, bacterial antigens, fungal antigens, parasite antigens, tumor antigens, autoimmune disease antigens. Exemplary antigens that a CAR can target include CD138, CD38, CD33, CD123, CD72, CD79a, CD79b, mesothelin, PSMA, BCMA, ROR1, MUC-16, L1CAM, CD22, CD19, CD20, CD23, CD24, CD37, CD30, CA125, CD56, c-Met, EGFR, GD-3, HPV E6, HPV E7, MUC-1, HER2, folate receptor alpha, CD97, CD171, CD179a, CD44v6, WT1, VEGF-alpha, VEGFR1 , IL-13Rα1, IL-13Rα2, IL-11Rα, PSA, FcRH5, NKG2D ligand, NY-ESO-1, TAG-72, CEA, EphrinA2, EphrinB2, Lewis formula A antigen, Lewis formula Y antigen, MAGE, Included are MAGE-A1, RAGE-1, folate receptor beta, EGFRviii, VEGFR-2, LGR5, SSX2, AKAP-4, FLT3, fucosyl GM1, GM3, o-acetyl-GD2 and GD2.
放射線療法には、体外照射療法(例えば従来型体外照射療法、定位放射線、3次元原体照射療法、強度変調放射線療法、強度変調振子照射療法、粒子線療法、陽子線療法およびオーガー療法)、近接照射療法、体系的放射性同位体療法、手術中の放射線療法またはそれらの任意の組合せが含まれる。 Radiotherapy includes external beam radiation therapy (e.g., conventional external beam radiation therapy, stereotactic radiation therapy, three-dimensional conformal radiation therapy, intensity modulated radiation therapy, intensity modulated pendulum radiation therapy, particle beam therapy, proton therapy and auger therapy), proximity Radiation therapy, systematic radioisotope therapy, perioperative radiation therapy or any combination thereof are included.
本明細書において説明するキメラTim組成物と組み合わせた使用のための例示的な抗体には、リツキシマブ(rituxmab)、ペルツズマブ、トラスツズマブ、アレムツズマブ、イブリツモマブチウキセタン、ブレンツキシマブベドチン、セツキシマブ、ベバシズマブ、アブシキシマブ、アダリムマブ、アレファセプト、バシリキシマブ(basilizimab)、ベリムマブ、ベズロトクスマブ、カナキヌマブ、セルトリズマブペゴル、ダクリズマブ、デノスマブ、エファリズマブ、ゴリムマブ、オララツマブ、パリビズマブ、パニツムマブおよびトシリズマブが含まれる。 Exemplary antibodies for use in combination with the chimeric Tim compositions described herein include rituximab, pertuzumab, trastuzumab, alemtuzumab, ibritumomab tiuxetan, brentuximab vedotin, cetuximab, bevacizumab , abciximab, adalimumab, alefacept, basilizimab, belimumab, bezlotoxumab, canakinumab, certolizumab pegol, daclizumab, denosumab, efalizumab, golimumab, olalatumab, palivizumab, panitumumab and tocilizumab.
本明細書において説明するキメラTim組成物と組み合わせた使用のためであり得る例示的な免疫チェックポイント分子の阻害剤には、PD-L1、PD-L2、CD80、CD86、B7-H3、B7-H4、HVEM、アデノシン、GAL9、VISTA、CEACAM-1、CEACAM-3、CEACAM-5、PVRL2、PD-1、CTLA-4、BTLA、KIR、LAG3、TIM3、A2aR、CD244/2B4、CD160、TIGIT、LAIR-1、PVRIG/CD112Rまたはそれらの任意の組合せをターゲティングするチェックポイント阻害剤が含まれる。ある特定の実施形態においては、免疫チェックポイント阻害剤は、抗体、ペプチド、RNAi剤または小分子であり得る。CTLA-4に特異的な抗体は、イピリムマブまたはトレメリムマブであり得る。PD-1に特異的な抗体は、ピディリズマブ、ニボルマブまたはペンブロリズマブであり得る。PD-L1に特異的な抗体は、デュルバルマブ、アテゾリズマブまたはアベルマブであり得る。 Exemplary inhibitors of immune checkpoint molecules that may be for use in combination with the chimeric Tim compositions described herein include PD-L1, PD-L2, CD80, CD86, B7-H3, B7- H4, HVEM, adenosine, GAL9, VISTA, CEACAM-1, CEACAM-3, CEACAM-5, PVRL2, PD-1, CTLA-4, BTLA, KIR, LAG3, TIM3, A2aR, CD244/2B4, CD160, TIGIT, Included are checkpoint inhibitors that target LAIR-1, PVRIG/CD112R, or any combination thereof. In certain embodiments, immune checkpoint inhibitors can be antibodies, peptides, RNAi agents, or small molecules. The CTLA-4 specific antibody can be ipilimumab or tremelimumab. The PD-1 specific antibody can be pidilizumab, nivolumab or pembrolizumab. The PD-L1 specific antibody can be durvalumab, atezolizumab or avelumab.
本明細書において説明するキメラTim組成物と組み合わせた使用のための例示的な化学療法剤は、アルキル化剤、プラチナベースの剤、細胞傷害剤、クロマチン機能の阻害剤、トポイソメラーゼ阻害剤、微小管阻害薬、DNA損傷剤、代謝拮抗薬(例として葉酸アンタゴニスト、ピリミジンアナログ、プリンアナログおよび糖修飾アナログ)、DNA合成阻害剤、DNA相互作用剤(例として挿入剤)およびDNA修復阻害剤を含み得る。 Exemplary chemotherapeutic agents for use in combination with the chimeric Tim compositions described herein include alkylating agents, platinum-based agents, cytotoxic agents, inhibitors of chromatin function, topoisomerase inhibitors, microtubule May include inhibitors, DNA damaging agents, antimetabolites (eg folic acid antagonists, pyrimidine analogs, purine analogs and sugar modified analogs), DNA synthesis inhibitors, DNA interactors (eg intercalating agents) and DNA repair inhibitors. .
化学療法剤には、有糸分裂または細胞分裂を阻害する非特異的細胞傷害剤、および腫瘍増殖、進行および転移に関与する特定の分子(例えば癌遺伝子)をターゲティングすることによってがん細胞の増殖および広がりを遮断する分子ターゲティング療法が含まれる。本明細書において説明する発現カセット組成物と組み合わせた使用のための例示的な非特異的化学療法剤は、アルキル化剤、プラチナベースの剤、細胞傷害剤、クロマチン機能の阻害剤、トポイソメラーゼ阻害剤、微小管阻害薬、DNA損傷剤、代謝拮抗薬(例として葉酸アンタゴニスト、ピリミジンアナログ、プリンアナログおよび糖修飾アナログ)、DNA合成阻害剤、DNA相互作用剤(例として挿入剤)、低メチル化剤およびDNA修復阻害剤を含み得る。 Chemotherapeutic agents include nonspecific cytotoxic agents that inhibit mitosis or cell division, and cancer cell growth by targeting specific molecules (e.g., oncogenes) involved in tumor growth, progression and metastasis. and molecularly targeted therapies to block spread. Exemplary non-specific chemotherapeutic agents for use in combination with the expression cassette compositions described herein include alkylating agents, platinum-based agents, cytotoxic agents, inhibitors of chromatin function, topoisomerase inhibitors. , microtubule inhibitors, DNA damaging agents, antimetabolites (e.g. folic acid antagonists, pyrimidine analogs, purine analogs and sugar modified analogs), DNA synthesis inhibitors, DNA interacting agents (e.g. intercalating agents), hypomethylating agents and DNA repair inhibitors.
本明細書において企図される組合せ療法における使用のために考えられる化学療法剤の例には、ベムラフェニブ、ダブラフェニブ、トラメチニブ、コビメチニブ、アナストロゾール[アリミデックス(登録商標)]、ビカルタミド[カソデックス(登録商標)]、硫酸ブレオマイシン[ブレノキサン(Blenoxane)(登録商標)]、ブスルファン[ミレラン(登録商標)]、ブスルファン注射[ブスルフェクス(登録商標)]、カペシタビン[ゼローダ(登録商標)]、N4-ペントキシカルボニル-5-デオキシ-5-フルオロシチジン、カルボプラチン[パラプラチン(登録商標)]、カルムスチン[BiCNU(登録商標)]、クロラムブシル[ロイケラン(登録商標)]、シスプラチン[プラチノール(登録商標)]、クラドリビン[ロイスタチン(登録商標)]、シクロホスファミド[シトキサン(登録商標)またはネオサル(Neosar)(登録商標)]、シタラビン、シトシンアラビノシド[シトサル(Cytosar)-U(登録商標)]、シタラビンリポソーム注射[デポサイト(登録商標)]、ダカルバジン[DTIC-Dome(登録商標)]、ダクチノマイシン[アクチノマイシンD、コスメゲン(Cosmegan)]、ダウノルビシン塩酸塩[セルビジン(登録商標)]、クエン酸ダウノルビシンリポソーム注射[ダウノゾーム(DaunoXome)(登録商標)]、デキサメタゾン、ドセタキセル[タキソテール(登録商標)]、ドキソルビシン塩酸塩[アドリアマイシン(登録商標)、ルベックス(Rubex)(登録商標)]、エトポシド[ベプシド(登録商標)]、リン酸フルダラビン[フルダラ(登録商標)]、5-フルオロウラシル[アドルシル(Adrucil)(登録商標)、エフデックス(Efudex)(登録商標)]、フルタミド[ユーレキシン(Eulexin)(登録商標)]、テザシチビン(tezacitibine)、ゲムシタビン(ジフルオロデオキシシチジン)、ヒドロキシ尿素[ハイドレア(登録商標)]、イダルビシン[イダマイシン(登録商標)]、イホスファミド[IFEX(登録商標)]、イリノテカン[カンプト(Camptosar)(登録商標)]、L-アスパラギナーゼ[ELSPAR(登録商標)]、ロイコボリンカルシウム、メルファラン[アルケラン(登録商標)]、6-メルカプトプリン[ピュリネソール(登録商標)]、メトトレキセート[フォレックス(Folex)(登録商標)]、ミトキサントロン[ノバントロン(登録商標)]、マイロターグ、パクリタキセル[タキソール(登録商標)]、フェニックス(イットリウム90/MX-DTPA)、ペントスタチン、ポリフェプロザン20カルムスチンインプラント[ギリアデル(登録商標)]、fdabraクエン酸タモキシフェン[ノルバデックス(登録商標)]、テニポシド[ブモン(Vumon)(登録商標)]、6-チオグアニン、チオテパ、チラパザミン[チラゾン(Tirazone)(登録商標)]、トポテカン塩酸塩注射[ハイカムチン(Hycamptin)(登録商標)]、ビンブラスチン[ベルバン(登録商標)]、ビンクリスチン[オンコビン(登録商標)]、イブルチニブ、ベネトクラクス、クリゾチニブ、アレクチニブ、ブリガチニブ、セリチニブおよびビノレルビン[ナベルビン(登録商標)]が含まれる。 Examples of chemotherapeutic agents contemplated for use in the combination therapy contemplated herein include vemurafenib, dabrafenib, trametinib, cobimetinib, anastrozole [Arimidex®], bicalutamide [Casodex®] ], bleomycin sulfate [Blenoxane®], busulfan [Millelan®], busulfan injection [Busulfex®], capecitabine [Xeloda®], N4-pentoxycarbonyl-5 - deoxy-5-fluorocytidine, carboplatin [Paraplatin®], carmustine [BiCNU®], chlorambucil [Leukeran®], cisplatin [Platinol®], cladribine [Leustatin®] )], cyclophosphamide [Cytoxan® or Neosar®], cytarabine, cytosine arabinoside [Cytosar-U®], cytarabine liposome injection [Depot Cytos ( ®], dacarbazine [DTIC-Dome®], dactinomycin [actinomycin D, Cosmegan], daunorubicin hydrochloride [Servidin®], daunorubicin citrate liposome injection [DaunoXome ) (registered trademark)], dexamethasone, docetaxel [Taxotere®], doxorubicin hydrochloride [Adriamycin®, Rubex®], etoposide [Vepside®], fludarabine phosphate [Fludara®], 5-fluorouracil [Adrucil®, Efudex®], flutamide [Eulexin®], tezacitibine, gemcitabine (difluorodeoxycytidine), hydroxyurea [Hydrea®], idarubicin [Idamycin®], ifosfamide [IFEX®], irinotecan [Camptosar®], L-asparaginase [ ELSPAR®], leucovorin calcium, melphalan [Alkeran®], 6-mercaptopurine [Purinesol®], methotrexate [Folex®], mitoxantrone [Novantron ( ®], Mylotarg, Paclitaxel [Taxol®], Phoenix (Yttrium 90/MX-DTPA), Pentostatin, Polyfeprozane 20 Carmustine Implant [Gliadel®], fdabra tamoxifen citrate [Nolvadex ®], teniposide [Vumon®], 6-thioguanine, thiotepa, tirapazamine [Tirazone®], topotecan hydrochloride injection [Hycamptin®] , vinblastine [Velvan®], vincristine [Oncovin®], ibrutinib, venetoclax, crizotinib, alectinib, brigatinib, ceritinib and vinorelbine [Navelbine®].
本明細書において企図される組合せ療法における使用のための例示的なアルキル化剤には、ナイトロジェンマスタード、エチレンイミン誘導体、アルキルスルホネート、ニトロソ尿素およびトリアゼン:ウラシルマスタード[アミノウラシルマスタード(登録商標)、クロレタミナシル(Chlorethaminacil)(登録商標)、デメチルドパン(Demethyldopan)(登録商標)、デスメチルドパン(Desmethyldopan)(登録商標)、ヘマンタミン(Haemanthamine)(登録商標)、ノルドパン(Nordopan)(登録商標)、ウラシルナイトロジェンマスタード(登録商標)、ウラシロスト(Uracillost)(登録商標)、ウラシルモスタザ(Uracilmostaza)(登録商標)、ウラムスチン(Uramustin)(登録商標)、ウラムスチン(Uramustine)(登録商標)]、クロルメチン[マスタージェン(Mustargen)(登録商標)]、シクロホスファミド[シトキサン(登録商標)、ネオサル(登録商標)、クラフェン(Clafen)(登録商標)、エンドキサン(登録商標)、プロサイトクス(Procytox)(登録商標)、レビミューン(Revimmune)(商標)]、イホスファミド[ミトキサナ(Mitoxana)(登録商標)]、メルファラン[アルケラン(登録商標)]、クロラムブシル[ロイケラン(登録商標)]、ピポブロマン[アメデール(登録商標)、バーサイト(Vercyte)(登録商標)]、トリエチレンメラミン[ヘメル(登録商標)、ヘキサレン(Hexalen)(登録商標)、ヘキサスタット(Hexastat)(登録商標)]、トリエチレンチオホスホラミン、テモゾロミド[テモダール(登録商標)]、チオテパ[チオプレックス(Thioplex)(登録商標)]、ブスルファン[ブシルベックス(Busilvex)(登録商標)、ミレラン(登録商標)]、カルムスチン[BiCNU(登録商標)]、ロムスチン[CeeNU(登録商標)]、ストレプトゾシン[ザノサー(Zanosar)(登録商標)]およびダカルバジン[DTIC-Dome(登録商標)]が含まれる。本明細書において企図される組合せ療法における使用のための追加の例示的なアルキル化剤には、オキサリプラチン[エロキサチン(登録商標)];テモゾロミド[テモダール(Temodar)(登録商標)およびテモダール(Temodal)(登録商標)];ダクチノマイシン[アクチノマイシン-Dとしても公知、コスメゲン(登録商標)];メルファラン[L-PAM、L-サルコリシンおよびフェニルアラニンマスタードとしても公知、アルケラン(登録商標)];アルトレタミン[ヘキサメチルメラミン(HMM:hexamethylmelamine)としても公知、ヘキサレン(登録商標)];カルムスチン[BiCNU(登録商標)];ベンダムスチン[トレアンダ(登録商標)];ブスルファン[ブスルフェクス(登録商標)およびミレラン(登録商標)];カルボプラチン[パラプラチン(登録商標)];ロムスチン[CCNUとしても公知、CeeNU(登録商標)];シスプラチン[CDDPとしても公知、プラチノール(登録商標)およびプラチノール(登録商標)-AQ];クロラムブシル[ロイケラン(登録商標)];シクロホスファミド[シトキサン(登録商標)およびネオサル(登録商標)];ダカルバジン[DTIC、DICおよびイミダゾールカルボキサミドとしても公知、DTIC-Dome(登録商標)];アルトレタミン[ヘキサメチルメラミン(HMM)としても公知、ヘキサレン(登録商標)];イホスファミド[イフェクス(Ifex)(登録商標)];プレドニムスチン(Prednumustine);プロカルバジン[マチュレーン(Matulane)(登録商標)];メクロレタミン[ナイトロジェンマスタード、ムスチンおよびメクロレタミン塩酸塩としても公知、マスタージェン(登録商標)];ストレプトゾシン[ザノサー(登録商標)];チオテパ[チオホスホアミド(thiophosphoamide)、TESPAおよびTSPAとしても公知、チオプレックス(Thioplex)(登録商標)];シクロホスファミド[エンドキサン(登録商標)、シトキサン(登録商標)、ネオサル(登録商標)、プロシトクス(登録商標)、レビミューン(登録商標)];およびベンダムスチンHCl[トレアンダ(登録商標)]が含まれるが、これらに限定されない。 Exemplary alkylating agents for use in combination therapy contemplated herein include nitrogen mustards, ethyleneimine derivatives, alkyl sulfonates, nitrosoureas and triazenes: uracil mustard [aminouracil mustard®, Chlorethaminacil®, Demethyldopan®, Desmethyldopan®, Haemanthamine®, Nordopan®, Uracil Nitrogen Mustard®, Uracilost®, Uracilmostaza®, Uramustin®, Uramustine®], Chlormethine [Mustargen ® ], cyclophosphamide [Cytoxan ® , Neosal ® , Clafen ® , Endoxan ® , Procytox ® , Levimune (Revimmune)], ifosfamide [Mitoxana®], melphalan [Alkeran®], chlorambucil [Leukelan®], pipobroman [Amedale®, Vercite ( Vercyte®], triethylenemelamine [Hemel®, Hexalen®, Hexastat®], triethylenethiophosphoramine, temozolomide [Temodar® )], thiotepa [Thioplex®], busulfan [Busilvex®, Milleran®], carmustine [BiCNU®], lomustine [CeeNU® ], streptozocin [Zanosar®] and dacarbazine [DTIC-Dome®]. Additional exemplary alkylating agents for use in combination therapy contemplated herein include oxaliplatin [Eloxatine®]; temozolomide [Temodar® and Temodal ®]; dactinomycin [also known as actinomycin-D, Cosmogen®]; melphalan [L-PAM, also known as L-sarcolysin and phenylalanine mustard, Alkeran®]; altretamine [also known as hexamethylmelamine (HMM), Hexalene®]; carmustine [BiCNU®]; bendamustine [Treanda®]; busulfan [Busulfex® and Milleran® )]; carboplatin [paraplatin®]; lomustine [also known as CCNU, CeeNU®]; cisplatin [also known as CDDP, Platinol® and Platinol®-AQ]; Leukelan®]; cyclophosphamide [Cytoxan® and Neosal®]; dacarbazine [DTIC, also known as DIC and imidazolecarboxamide, DTIC-Dome®]; altretamine [hexamethyl ifosfamide [Ifex®]; prednumustine; procarbazine [Matulane®]; mechlorethamine [nitrogen mustard, also known as muscin and mechlorethamine hydrochloride, Mastergen®]; streptozocin [Zanosar®]; thiotepa [thiophosphoamide, also known as TESPA and TSPA, Thioplex® ]; cyclophosphamide [Endoxan®, Cytoxan®, Neosal®, Procytox®, Levimune®]; and bendamustine HCl [Treanda®]. include, but are not limited to:
本明細書において企図される組合せ療法における使用のための例示的なプラチナベースの剤には、カルボプラチン、シスプラチン、オキサリプラチン、ネダプラチン、ピコプラチン、サトラプラチン、フェナントリプラチン(phenanthriplatin)およびトリプラチン四硝酸塩(triplatin tetranitrate)が含まれる。 Exemplary platinum-based agents for use in combination therapy contemplated herein include carboplatin, cisplatin, oxaliplatin, nedaplatin, picoplatin, satraplatin, phenanthriplatin and triplatin tetranitrate. ) is included.
組合せ療法における使用のための例示的な低メチル化剤には、アザシチジンおよびデシタビンが含まれる。 Exemplary hypomethylating agents for use in combination therapy include azacitidine and decitabine.
本明細書において説明するキメラTim受容体組成物と組み合わせた使用のための例示的な分子ターゲティング阻害剤には、例えば受容体チロシンキナーゼ阻害剤、RAF阻害剤、BCL-2阻害剤、ABL阻害剤、TRK阻害剤、c-KIT阻害剤、c-MET阻害剤、CDK4/6阻害剤、FAK阻害剤、FGFR阻害剤、FLT3阻害剤、IDH1阻害剤、IDH2阻害剤、PDGFRA阻害剤およびRET阻害剤を含むがん細胞増殖および生存に関与する分子をターゲティングする小分子が含まれる。 Exemplary molecularly targeted inhibitors for use in combination with the chimeric Tim receptor compositions described herein include, for example, receptor tyrosine kinase inhibitors, RAF inhibitors, BCL-2 inhibitors, ABL inhibitors , TRK inhibitors, c-KIT inhibitors, c-MET inhibitors, CDK4/6 inhibitors, FAK inhibitors, FGFR inhibitors, FLT3 inhibitors, IDH1 inhibitors, IDH2 inhibitors, PDGFRA inhibitors and RET inhibitors Included are small molecules that target molecules involved in cancer cell proliferation and survival, including
例示的な分子ターゲティング療法には、ホルモンアンタゴニスト、シグナル伝達阻害剤、遺伝子発現阻害剤(例えば翻訳阻害剤)、アポトーシスインデューサー、血管新生阻害剤(例えばVEGF経路阻害剤)、チロシンキナーゼ阻害剤(例えばEGF/EGFR経路阻害剤)、増殖因子阻害剤、GTPアーゼ阻害剤、セリン/トレオニンキナーゼ阻害剤、転写因子阻害剤、がんと関連付けられるドライバー変異の阻害剤、B-Raf阻害剤、RAF阻害剤、MEK阻害剤、mTOR阻害剤、アデノシン経路阻害剤、EGFR阻害剤、PI3K阻害剤、BCL2阻害剤、VEGFR阻害剤、MET阻害剤、MYC阻害剤、BCR-ABL阻害剤、ABL阻害剤、HER2阻害剤、H-RAS阻害剤、K-RAS阻害剤、PDGFR阻害剤、ALK阻害剤、ROS1阻害剤、BTK阻害剤、TRK阻害剤、c-KIT阻害剤、c-MET阻害剤、CDK4/6阻害剤、FAK阻害剤、FGFR阻害剤、FLT3阻害剤、IDH1阻害剤、IDH2阻害剤、PARP阻害剤、PARP阻害剤、PDGFRA阻害剤およびRET阻害剤が含まれる。ある特定の実施形態においては、分子ターゲティング療法の使用は、分子標的に特異的な分子ターゲティング療法を、分子標的(例えばドライバー癌遺伝子)を有する腫瘍を有すると特定された対象に投与することを含む。ある特定の実施形態においては、分子標的は、活性化変異を有する。ある特定の実施形態においては、分子ターゲティング阻害剤と組み合わせたキメラTim受容体改変細胞の使用は、抗腫瘍応答の大きさ、抗腫瘍応答の持続力またはこれらの両方を増大する。ある特定の実施形態においては、典型的な用量よりも低い分子ターゲティング療法が、キメラTim受容体改変細胞と組み合わせて使用される。 Exemplary molecular targeting therapies include hormone antagonists, signaling inhibitors, gene expression inhibitors (e.g. translation inhibitors), apoptosis inducers, angiogenesis inhibitors (e.g. VEGF pathway inhibitors), tyrosine kinase inhibitors (e.g. EGF/EGFR pathway inhibitors), growth factor inhibitors, GTPase inhibitors, serine/threonine kinase inhibitors, transcription factor inhibitors, inhibitors of driver mutations associated with cancer, B-Raf inhibitors, RAF inhibitors , MEK inhibitors, mTOR inhibitors, adenosine pathway inhibitors, EGFR inhibitors, PI3K inhibitors, BCL2 inhibitors, VEGFR inhibitors, MET inhibitors, MYC inhibitors, BCR-ABL inhibitors, ABL inhibitors, HER2 inhibitors agent, H-RAS inhibitor, K-RAS inhibitor, PDGFR inhibitor, ALK inhibitor, ROS1 inhibitor, BTK inhibitor, TRK inhibitor, c-KIT inhibitor, c-MET inhibitor, CDK4/6 inhibitor agents, FAK inhibitors, FGFR inhibitors, FLT3 inhibitors, IDH1 inhibitors, IDH2 inhibitors, PARP inhibitors, PARP inhibitors, PDGFRA inhibitors and RET inhibitors. In certain embodiments, the use of molecular targeting therapy comprises administering a molecular targeting therapy specific for a molecular target to a subject identified as having a tumor with a molecular target (e.g., a driver oncogene). . In certain embodiments, the molecular target has an activating mutation. In certain embodiments, use of chimeric Tim receptor-modified cells in combination with a molecularly targeted inhibitor increases the magnitude of the anti-tumor response, the persistence of the anti-tumor response, or both. In certain embodiments, lower than typical doses of molecular targeting therapy are used in combination with chimeric Tim receptor-modified cells.
例示的な血管新生阻害剤は、A6(Angstrom Pharmaceuticals)、ABT-510(Abbott Laboratories)、ABT-627(アトラセンタン)(Abbott Laboratories/Xinlay)、ABT-869(Abbott Laboratories)、アクチミド(Actimid)(CC4047、ポマリドマイド)(Celgene Corporation)、AdGVPEDF.11D(GenVec)、ADH-1[エキセリン(Exherin)](Adherex Technologies)、AEE788(Novartis)、AG-013736(アキシチニブ)(Pfizer)、AG3340(プリノマスタット)(Agouron Pharmaceuticals)、AGX1053(AngioGenex)、AGX51(AngioGenex)、ALN-VSP(ALN-VSP O2)(Alnylam Pharmaceuticals)、AMG386(Amgen)、AMG706(Amgen)、アパチニブ(Apatinib)(YN968D1)(Jiangsu Hengrui Medicine)、AP23573(リダフォロリムス/MK8669)(Ariad Pharmaceuticals)、AQ4N(Novavea)、ARQ197(ArQule)、ASA404(Novartis/Antisoma)、アチプリモド(Callisto Pharmaceuticals)、ATN-161(Attenuon)、AV-412(Aveo Pharmaceuticals)、AV-951(Aveo Pharmaceuticals)、アバスチン(ベバシズマブ)(Genentech)、AZD2171[セディラニブ/レセンチン(Recentin)](AstraZeneca)、BAY 57-9352[テラチニブ(Telatinib)](Bayer)、BEZ235(Novartis)、BIBF1120(Boehringer Ingelheim Pharmaceuticals)、BIBW2992(Boehringer Ingelheim Pharmaceuticals)、BMS-275291(Bristol-Myers Squibb)、BMS-582664(ブリバニブ)(Bristol-Myers Squibb)、BMS-690514(Bristol-Myers Squibb)、カルシトリオール、CCI-779(トーリセル)(Wyeth)、CDP-791(ImClone Systems)、セフラトニン(Ceflatonin)(ホモハリントニン/HHT)(ChemGenex Therapeutics)、セレブレックス(セレコキシブ)(Pfizer)、CEP-7055(Cephalon/Sanofi)、CHIR-265(Chiron Corporation)、NGR-TNF、COL-3[メタスタット(Metastat)](Collagenex Pharmaceuticals)、コンブレタスタチン(Oxigene)、CP-751,871(フィギツムマブ)(Pfizer)、CP-547,632(Pfizer)、CS-7017(第一三共)、CT-322[アンジオセプト(Angiocept)](Adnexus)、クルクミン、ダルテパリン(フラグミン)(Pfizer)、ジスルフィラム(Antabuse)、E7820(エーザイ株式会社)、E7080(エーザイ株式会社)、EMD 121974(シレンジタイド)(EMD Pharmaceuticals)、ENMD-1198(EntreMed)、ENMD-2076(EntreMed)、エンドスター(Endostar)(Simcere)、アービタックス(ImClone/Bristol-Myers Squibb)、EZN-2208(Enzon Pharmaceuticals)、EZN-2968(Enzon Pharmaceuticals)、GC1008(Genzyme)、ゲニステイン、GSK1363089[フォレチニブ(Foretinib)](GlaxoSmithKline)、GW786034(パゾパニブ)(GlaxoSmithKline)、GT-111(Vascular Biogenics Ltd.)、IMC-1121B(ラムシルマブ)(ImClone Systems)、IMC-18F1(ImClone Systems)、IMC-3G3(ImClone LLC)、INCB007839(Incyte Corporation)、INGN 241(Introgen Therapeutics)、イレッサ(ZD1839/ゲフィチニブ)、LBH589[ファリダク(Faridak)/パノビノスタット(Panobinostst)](Novartis)、ルセンティス(ラニビズマブ)(Genentech/Novartis)、LY317615(エンザスタウリン)(Eli Lilly and Company)、マクジェン(ペガプタニブ)(Pfizer)、MEDI522[アベグリン(Abegrin)](MedImmune)、MLN518(タンデュチニブ)(Millennium)、ネオバスタット(Neovastat)(AE941/ベネフィン)(Aeterna Zentaris)、ネクサバール(Bayer/Onyx)、NM-3(Genzyme Corporation)、ノスカピン(Cougar Biotechnology)、NPI-2358(Nereus Pharmaceuticals)、OSI-930(OSI)、パロミド(Palomid)529(Paloma Pharmaceuticals,Inc.)、パンゼム(Panzem)カプセル(2ME2)(EntreMed)、パンゼムNCD(2ME2)(EntreMed)、PF-02341066(Pfizer)、PF-04554878(Pfizer)、PI-88(Progen Industries/Medigen Biotechnology)、PKC412(Novartis)、ポリフェノンE(緑茶抽出物)(Polypheno E International,Inc)、PPI-2458(Praecis Pharmaceuticals)、PTC299(PTC Therapeutics)、PTK787(バタラニブ)(Novartis)、PXD101(ベリノスタット)(CuraGen Corporation)、RAD001(エベロリムス)(Novartis)、RAF265(Novartis)、レゴラフェニブ(BAY73-4506)(Bayer)、レブリミド(Celgene)、レタアネ(Retaane)(Alcon Research)、SN38(リポソーム製剤)(Neopharm)、SNS-032(BMS-387032)(Sunesis)、SOM230(パシレオチド)(Novartis)、スクアラミン(Genaera)、スラミン、スーテント(Pfizer)、タルセバ(Genentech)、TB-403(Thrombogenics)、テムポスタチン(Tempostatin)(Collard Biopharmaceuticals)、テトラチオモリブデート(Sigma-Aldrich)、TG100801(TargeGen)、サリドマイド(Celgene Corporation)、チンザパリンナトリウム、TKI258(Novartis)、TRC093(Tracon Pharmaceuticals Inc.)、VEGF Trap(アフリバーセプト)(Regeneron Pharmaceuticals)、VEGF Trap-Eye(Regeneron Pharmaceuticals)、ベグリン(Veglin)(VasGene Therapeutics)、ボルテゾミブ(Millennium)、XL184(Exelixis)、XL647(Exelixis)、XL784(Exelixis)、XL820(Exelixis)、XL999(Exelixis)、ZD6474(AstraZeneca)、ボリノスタット(Merck)およびZSTK474を含むが、これらに限定されない。 Exemplary angiogenesis inhibitors include A6 (Angstrom Pharmaceuticals), ABT-510 (Abbott Laboratories), ABT-627 (Atrasentan) (Abbott Laboratories/Xinlay), ABT-869 (Abbott Laboratories), Actimid ( CC4047, pomalidomide) (Celgene Corporation), AdGVPEDF. 11D (GenVec), ADH-1 [Exherin] (Adherex Technologies), AEE788 (Novartis), AG-013736 (Axitinib) (Pfizer), AG3340 (Prinomastat) (Agouron Pharmaceuticals), AGX 1053 (AngioGenex), AGX51 (AngioGenex), ALN-VSP (ALN-VSP O2) (Alnylam Pharmaceuticals), AMG386 (Amgen), AMG706 (Amgen), Apatinib (YN968D1) (Jiangsu Hengrui Medicine e), AP23573 (ridaforolimus/MK8669) (Ariad Pharmaceuticals), AQ4N (Novavea), ARQ197 (ArQule), ASA404 (Novartis/Antisoma), Atiprimod (Callisto Pharmaceuticals), ATN-161 (Attenuon), AV-412 (Aveo Ph. pharmaceuticals), AV-951 (Aveo Pharmaceuticals) , Avastin (bevacizumab) (Genentech), AZD2171 [cediranib/Recentin] (AstraZeneca), BAY 57-9352 [Telatinib] (Bayer), BEZ235 (Novartis), BIBF1120 (Boehringer Ing Elheim Pharmaceuticals), BIBW2992 ( Boehringer Ingelheim Pharmaceuticals), BMS-275291 (Bristol-Myers Squibb), BMS-582664 (brivanib) (Bristol-Myers Squibb), BMS-690514 (Bristol-Myers Squibb), Cal Citriol, CCI-779 (Toricel) (Wyeth) , CDP-791 (ImClone Systems), Ceflatonin (Homoharringtonine/HHT) (ChemGenex Therapeutics), Celebrex (celecoxib) (Pfizer), CEP-7055 (Cephalon/Sanofi), CHIR-265 (Chiron Corp.) oration), NGR - TNF, COL-3 [Metastat] (Collagenex Pharmaceuticals), combretastatin (Oxigene), CP-751,871 (figitumumab) (Pfizer), CP-547,632 (Pfizer), CS-7017 (Pfizer) Ichisankyo), CT-322 [Angiocept] (Adnexus), Curcumin, Dalteparin (Fragmin) (Pfizer), Disulfiram (Antabuse), E7820 (Eisai Co., Ltd.), E7080 (Eisai Co., Ltd.), EMD 121974 (Cilengitide) (EMD Pharmaceuticals), ENMD-1198 (EntreMed), ENMD-2076 (EntreMed), Endostar (Simcere), Erbitux (ImClone/Bristol-Myers Squibb), EZN-2208 (Enzon P pharmaceuticals), EZN -2968 (Enzon Pharmaceuticals), GC1008 (Genzyme), Genistein, GSK1363089 [Foretinib] (GlaxoSmithKline), GW786034 (Pazopanib) (GlaxoSmithKline), GT-11 1 (Vascular Biogenics Ltd.). ), IMC-1121B (ramucirumab) (ImClone Systems), IMC-18F1 (ImClone Systems), IMC-3G3 (ImClone LLC), INCB007839 (Incyte Corporation), INGN 241 (Introgen Therapeutics), Ressa (ZD1839/gefitinib), LBH589 [Faridak/Panobinostt] (Novartis), Lucentis (ranibizumab) (Genentech/Novartis), LY317615 (enzastaurin) (Eli Lilly and Company), Macugen (pegaptanib) (Pfizer), MEDI522 [ avegulin ( Abegrin)] (MedImmune), MLN518 (tandutinib) (Millennium), Neovastat (AE941/benephine) (Aeterna Zentaris), Nexavar (Bayer/Onyx), NM-3 (Genzyme Corporation), Noscapine ( Cougar Biotechnology) , NPI-2358 (Nereus Pharmaceuticals), OSI-930 (OSI), Palomid 529 (Paloma Pharmaceuticals, Inc.), Panzem Capsules (2ME2) (EntreMed), Panzem NCD (2ME2) (EntreMed), PF-02341066 (Pfizer), PF-04554878 (Pfizer), PI-88 (Progen Industries/Medigen Biotechnology), PKC412 (Novartis), Polyphenon E (green tea extract) (Polypheno E International, Inc), P PI-2458 (Praecis Pharmaceuticals), PTC299 (PTC Therapeutics), PTK787 (Vatalanib) (Novartis), PXD101 (Velinostat) (CuraGen Corporation), RAD001 (Everolimus) (Novartis), RAF265 (Novartis), Regorafenib (BA Y73-4506) (Bayer), Revlimid (Celgene), Retaane (Alcon Research), SN38 (liposome formulation) (Neopharm), SNS-032 (BMS-387032) (Sunesis), SOM230 (pasireotide) (Novartis), Squalamine (Genaera), Suramin, Sutent (Pfizer), Tarceva (Genentech), TB-403 (Thrombogenics), Tempostatin (Collard Biopharmaceuticals), Tetrathiomolybdate (Sigma-Aldrich), TG100801 (TargeGen), Thalidomide (Celgene) Corporation), Tinzaparin Sodium, TKI258 (Novartis), TRC093 (Tracon Pharmaceuticals Inc.). ), VEGF Trap (Aflibercept) (Regeneron Pharmaceuticals), VEGF Trap-Eye (Regeneron Pharmaceuticals), Veglin (VasGene Therapeutics), Bortezomib (Millennium), XL184 (Exelixis), XL647 (Exelixis), XL784 (Exelixis ), XL820 (Exelixis), XL999 (Exelixis), ZD6474 (AstraZeneca), Vorinostat (Merck) and ZSTK474.
例示的なB-Raf阻害剤には、ベムラフェニブ、ダブラフェニブおよびエンコラフェニブが含まれる。 Exemplary B-Raf inhibitors include vemurafenib, dabrafenib and encorafenib.
例示的なMEK阻害剤には、ビニメチニブ、コビメチニブ、レファメチニブ、セルメチニブおよびトラメチニブが含まれる。 Exemplary MEK inhibitors include binimetinib, cobimetinib, lefametinib, selumetinib and trametinib.
例示的なBTK阻害剤には、イブルチニブ、Loxo-305、チラブルチニブ、GDC-0853、アカラブルチニブ、ONO-4059、スペブルチニブ、BGB-3111、HM71224およびM7583が含まれる。 Exemplary BTK inhibitors include ibrutinib, Loxo-305, tirabrutinib, GDC-0853, acalabrutinib, ONO-4059, pebrutinib, BGB-3111, HM71224 and M7583.
例示的なTRK阻害剤には、エヌトレクチニブ、ラロトレクチニブ、CH7057288、ONO-7579、LOXO-101、レスタウルチニブおよびLOXO-195が含まれる。 Exemplary TRK inhibitors include entrectinib, larotrectinib, CH7057288, ONO-7579, LOXO-101, lestaurtinib and LOXO-195.
例示的なc-KIT阻害剤には、イマチニブ(imatinb)、スニチニブ(sunitinb)およびポナチニブが含まれる。 Exemplary c-KIT inhibitors include imatinb, sunitinb and ponatinib.
例示的なc-MET阻害剤には、カプマチニブ、クリゾチニブ、チバンチニブ、オナルツズマブ、INCB28060、AMG-458、サボリチニブおよびテポチニブが含まれる。 Exemplary c-MET inhibitors include capmatinib, crizotinib, tivantinib, onartuzumab, INCB28060, AMG-458, savolitinib and tepotinib.
例示的なCDK4/6阻害剤には、パルボシクリブ、リボシクリブ、アベマシクリブおよびトリラシクリブが含まれる。 Exemplary CDK4/6 inhibitors include palbociclib, ribociclib, abemaciclib and trilaciclib.
例示的なFAK阻害剤には、デファクチニブ、GSK2256098、BI853520およびPF-00562271が含まれる。 Exemplary FAK inhibitors include defactinib, GSK2256098, BI853520 and PF-00562271.
例示的なFGFR阻害剤には、エルダフィチニブ、ペミガチニブ、インフィグラチニブ、ロガラチニブ、AZD4547、BGJ398、FP-1039およびARQ 087が含まれる。 Exemplary FGFR inhibitors include Erdafitinib, Pemigatinib, Infigratinib, Rogaratinib, AZD4547, BGJ398, FP-1039 and ARQ 087.
例示的なFLT-3阻害剤には、キザルチニブ、クレノラニブ、ギルテリチニブ、ミドスタウリンおよびレスタウルチニブが含まれる。 Exemplary FLT-3 inhibitors include quizartinib, crenolanib, gilteritinib, midostaurin and lestaurtinib.
例示的なIDH1阻害剤には、イボシデニブ、BAY-1436032およびAGI-5198が含まれる。 Exemplary IDH1 inhibitors include ivosidenib, BAY-1436032 and AGI-5198.
例示的なIDH2阻害剤には、エナシデニブが含まれる。 Exemplary IDH2 inhibitors include enasidenib.
例示的なPDGFRA阻害剤には、イマチニブ、レゴラフェニブ、クレノラニブおよびオララツマブが含まれる。 Exemplary PDGFRA inhibitors include imatinib, regorafenib, crenolanib and olalatumab.
例示的な汎RAF阻害剤には、ベルバラフェニブ(belvarafenib)、LXH254、LY3009120、INU-152およびHM95573が含まれる。 Exemplary pan-RAF inhibitors include belvarafenib, LXH254, LY3009120, INU-152 and HM95573.
例示的なRET阻害剤には、レンバチニブ、アレクチニブ、バンデタニブ、カボザンチニブ、BLU-667およびLOXO-292が含まれる。 Exemplary RET inhibitors include lenvatinib, alectinib, vandetanib, cabozantinib, BLU-667 and LOXO-292.
例示的なROS1阻害剤には、セリチニブ、ロルラチニブ、エヌトレクチニブ、クリゾチニブ、TPX-0005およびDS-6051bが含まれる。 Exemplary ROS1 inhibitors include ceritinib, lorlatinib, entrectinib, crizotinib, TPX-0005 and DS-6051b.
例示的な血管内皮増殖因子(VEGF:Vascular Endothelial Growth Factor)受容体阻害剤は、ベバシズマブ[アバスチン(登録商標)]、アキシチニブ[インライタ(登録商標)];ブリバニブアラニネート[BMS-582664、(S)-((R)-1-(4-(4-フルオロ-2-メチル-1H-インドール-5-イルオキシ)-5-メチルピロロ[2,1-f][1,2,4]トリアジン-6-イルオキシ)プロパン-2-イル)2-アミノプロパノエート];ソラフェニブ[ネクサバール(登録商標)];パゾパニブ[ヴォトリエント(登録商標)];リンゴ酸スニチニブ[スーテント(登録商標)];セディラニブ(AZD2171、CAS 288383-20-1);バラガテフ(Vargatef)(BIBF1120、CAS 928326-83-4);フォレチニブ(GSK1363089);テラチニブ(BAY57-9352、CAS 332012-40-5);アパチニブ(YN968D1、CAS 811803-05-1);イマチニブ[グリベック(登録商標)];ポナチニブ(AP24534、CAS 943319-70-8);チボザニブ(AV951、CAS 475108-18-0);レゴラフェニブ(BAY73-4506、CAS 755037-03-7);バタラニブ二塩酸塩(PTK787、CAS 212141-51-0);ブリバニブ(BMS-540215、CAS 649735-46-6);バンデタニブ[カプレルサ(登録商標)またはAZD6474];モテサニブ二リン酸塩[AMG706、CAS 857876-30-3、PCT公開公報WO02/066470号において説明されているN-(2,3-ジヒドロ-3,3-ジメチル-1H-インドール-6-イル)-2-[(4-ピリジニルメチル)アミノ]-3-ピリジンカルボキサミド];ドビチニブ二乳酸(Dovitinib dilactic acid)(TKI258、CAS 852433-84-2);リンファニブ(Linfanib)(ABT869、CAS 796967-16-3);カボザンチニブ(XL184、CAS 849217-68-1);レスタウルチニブ(CAS 111358-88-4);N-[5-[[[5-(1,1-ジメチルエチル)-2-オキサゾリル]メチル]チオ]-2-チアゾリル]-4-ピペリジンカルボキサミド(BMS38703、CAS 345627-80-7);(3R,4R)-4-アミノ-1-((4-((3-メトキシフェニル)アミノ)ピロロ[2,1-f][1,2,4]トリアジン-5-イル)メチル)ピペリジン-3-オール(BMS690514);N-(3,4-ジクロロ-2-フルオロフェニル)-6-メトキシ-7-[[(3aα,5β,6aα)-オクタヒドロ-2-メチルシクロペンタ[c]ピロール-5-イル]メトキシ]-4-キナゾリンアミン(XL647、CAS 781613-23-8);4-メチル-3-[[1-メチル-6-(3-ピリジニル)-1H-ピラゾロ[3,4-d]ピリミジン-4-イル]アミノ]-N-[3-(トリフルオロメチル)フェニル]-ベンザミド(BHG712、CAS 940310-85-0);およびアフリバーセプト[アイリーア(登録商標)]を含むが、これらに限定されない。 Exemplary vascular endothelial growth factor (VEGF) receptor inhibitors are bevacizumab [Avastin®], axitinib [Inlyta®]; brivanib alaninate [BMS-582664, (S )-((R)-1-(4-(4-fluoro-2-methyl-1H-indol-5-yloxy)-5-methylpyrrolo[2,1-f][1,2,4]triazine-6 -yloxy)propan-2-yl)2-aminopropanoate]; sorafenib [Nexavar®]; pazopanib [Votrient®]; sunitinib malate [Sutent®]; Vargatef (BIBF1120, CAS 928326-83-4); foretinib (GSK1363089); teratinib (BAY57-9352, CAS 332012-40-5); apatinib (YN968D1, CAS 811803- 05-1); imatinib [Gleevec®]; ponatinib (AP24534, CAS 943319-70-8); tivozanib (AV951, CAS 475108-18-0); ); vatalanib dihydrochloride (PTK787, CAS 212141-51-0); brivanib (BMS-540215, CAS 649735-46-6); vandetanib [Caprelsa® or AZD6474]; motesanib diphosphate [AMG706, CAS 857876-30-3, N-(2,3-dihydro-3,3-dimethyl-1H-indol-6-yl)-2-[(4-pyridinylmethyl) described in PCT publication WO 02/066470 ) amino]-3-pyridinecarboxamide]; Dovitinib dilactic acid (TKI258, CAS 852433-84-2); Linfanib (ABT869, CAS 796967-16-3); Cabozantinib (XL184, CAS 84 9217 -68-1); lestaurtinib (CAS 111358-88-4); N-[5-[[[5-(1,1-dimethylethyl)-2-oxazolyl]methyl]thio]-2-thiazolyl]-4 -piperidinecarboxamide (BMS38703, CAS 345627-80-7); (3R,4R)-4-amino-1-((4-((3-methoxyphenyl)amino)pyrrolo[2,1-f][1, 2,4]triazin-5-yl)methyl)piperidin-3-ol (BMS690514); N-(3,4-dichloro-2-fluorophenyl)-6-methoxy-7-[[(3aα,5β,6aα )-octahydro-2-methylcyclopenta[c]pyrrol-5-yl]methoxy]-4-quinazolinamine (XL647, CAS 781613-23-8); 4-methyl-3-[[1-methyl-6- (3-pyridinyl)-1H-pyrazolo[3,4-d]pyrimidin-4-yl]amino]-N-[3-(trifluoromethyl)phenyl]-benzamide (BHG712, CAS 940310-85-0); and Aflibercept [Eylea®].
例示的なEGF経路阻害剤は、チルホスチン46、EKB-569、エルロチニブ[タルセバ(登録商標)]、ゲフィチニブ[イレッサ(登録商標)]、アービタックス、ニモツズマブ、ラパチニブ[タイケルブ(登録商標)]、セツキシマブ(抗EGFR mAb)、188Re-標識ニモツズマブ(抗EGFR mAb)およびWO97/02266、EP0564409、WO99/03854、EP0520722、EP0566226、EP0787722、EP0837063、米国特許第5,747,498号、WO98/10767、WO97/30034、WO97/49688、WO97/38983およびWO96/33980において一般的かつ特異的に開示されている化合物を含むが、これらに限定されない。例示的なEGFR抗体には、セツキシマブ[アービタックス(登録商標)];パニツムマブ[ベクチビックス(登録商標)];マツズマブ(EMD-72000);トラスツズマブ[ハーセプチン(登録商標)];ニモツズマブ(hR3);ザルツムマブ;TheraCIM h-R3;MDX0447(CAS 339151-96-1);およびch806(mAb-806、CAS 946414-09-1)が含まれるが、これらに限定されない。例示的な上皮増殖因子受容体(EGFR)阻害剤には、エルロチニブ塩酸塩[タルセバ(登録商標)]、セリチニブ、ブリグチニブ、オシメルチニブ(osimeritinib)、イコチニブ、ゲフィチニブ[イレッサ(登録商標)];N-[4-[(3-クロロ-4-フルオロフェニル)アミノ]-7-[[(3’’S’’)-テトラヒドロ-3-フラニル]オキシ]-6-キナゾリニル]-4(ジメチルアミノ)-2-ブテンアミド、トボック(Tovok)(登録商標);バンデタニブ[カプレルサ(登録商標)];ラパチニブ[タイケルブ(登録商標)];(3R,4R)-4-アミノ-1-((4-((3-メトキシフェニル)アミノ)ピロロ[2,1-f][1,2,4]トリアジン-5-イル)メチル)ピペリジン-3-オール(BMS690514);カネルチニブ二塩酸塩(CI-1033);6-[4-[(4-エチル-1-ピペラジニル)メチル]フェニル]-N-[(1R)-1-フェニルエチル]-7H-ピロロ[2,3-d]ピリミジン-4-アミン(AEE788、CAS 497839-62-0);ムブリチニブ(TAK165);ペリチニブ(Pelitinib)(EKB569);アファチニブ(BIBW2992);ネラチニブ(HKI-272);N-[4-[[1-[(3-フルオロフェニル)メチル]-1H-インダゾール-5-イル]アミノ]-5-メチルピロロ[2,1-f][1,2,4]トリアジン-6-イル]-カルバミン酸、(3S)-3-モルホリニルメチルエステル(BMS599626);N-(3,4-ジクロロ-2-フルオロフェニル)-6-メトキシ-7-[[(3aα,5β,6aα)-オクタヒドロ-2-メチルシクロペンタ[c]ピロール-5-イル]メトキシ]-4-キナゾリンアミン(XL647、CAS 781613-23-8);4-[4-[[(1R)-1-フェニルエチル]アミノ]-7H-ピロロ[2,3-d]ピリミジン-6-イル]-フェノール(PKI166、CAS 187724-61-4);ロシレチニブ(rocelitinib)が含まれるが、これらに限定されない。 Exemplary EGF pathway inhibitors include Tyrphostin 46, EKB-569, Erlotinib [Tarceva®], Gefitinib [Iressa®], Erbitux, Nimotuzumab, Lapatinib [Tikerb®], Cetuximab (anti EGFR mAb), 188 Re-labeled nimotuzumab (anti-EGFR mAb) and 10767, WO97/30034 , WO 97/49688, WO 97/38983 and WO 96/33980 generally and specifically disclosed. Exemplary EGFR antibodies include cetuximab [Erbitux®]; panitumumab [Vectibix®]; matuzumab (EMD-72000); trastuzumab [Herceptin®]; MDX0447 (CAS 339151-96-1); and ch806 (mAb-806, CAS 946414-09-1), but not limited to h-R3; Exemplary epidermal growth factor receptor (EGFR) inhibitors include erlotinib hydrochloride [Tarceva®], ceritinib, brigtinib, osimeritinib, icotinib, gefitinib [Iressa®]; 4-[(3-chloro-4-fluorophenyl)amino]-7-[[(3″S″)-tetrahydro-3-furanyl]oxy]-6-quinazolinyl]-4(dimethylamino)-2 -butenamide, Tovok®; vandetanib [Caprelsa®]; lapatinib [Tykerb®]; (3R,4R)-4-amino-1-((4-((3- methoxyphenyl)amino)pyrrolo[2,1-f][1,2,4]triazin-5-yl)methyl)piperidin-3-ol (BMS690514); canertinib dihydrochloride (CI-1033); 6-[ 4-[(4-ethyl-1-piperazinyl)methyl]phenyl]-N-[(1R)-1-phenylethyl]-7H-pyrrolo[2,3-d]pyrimidin-4-amine (AEE788, CAS 497839 Pelitinib (EKB569); Afatinib (BIBW2992); Neratinib (HKI-272); N-[4-[[1-[(3-fluorophenyl)methyl]- 1H-indazol-5-yl]amino]-5-methylpyrrolo[2,1-f][1,2,4]triazin-6-yl]-carbamic acid, (3S)-3-morpholinylmethyl ester ( BMS599626); N-(3,4-dichloro-2-fluorophenyl)-6-methoxy-7-[[(3aα,5β,6aα)-octahydro-2-methylcyclopenta[c]pyrrol-5-yl] Methoxy]-4-quinazolinamine (XL647, CAS 781613-23-8); 4-[4-[[(1R)-1-phenylethyl]amino]-7H-pyrrolo[2,3-d]pyrimidine-6 -yl]-phenol (PKI166, CAS 187724-61-4); rocelitinib;
例示的なmTOR阻害剤は、ラパマイシン[ラパミューン(登録商標)]ならびにそのアナログおよび誘導体;SDZ-RAD;テムシロリムス[トーリセル(登録商標);CCI-779としても公知];リダフォロリムス[デフォロリムス(deferolimus)として以前に公知、(1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S,35R)-1,18-ジヒドロキシ-19,30-ジメトキシ-15,17,21,23,29,35-ヘキサメチル-2,3,10,14,20-ペンタオキソ-11,36-ジオキサ-4-アザトリシクロ[30.3.1.04,9]ヘキサトリアコンタ-16,24,26,28-テトラエン-12-イル]プロピル]-2-メトキシシクロヘキシルジメチルホスフィネート、AP23573およびMK8669としても公知であり、PCT公開公報WO03/064383号において説明されている];エベロリムス[アフィニトール(登録商標)またはRAD001];ラパマイシン[AY22989、シロリムス(登録商標)];シマピモド(Simapimod)(CAS 164301-51-3);(5-{2,4-ビス[(3S)-3-メチルモルホリン-4-イル]ピリド[2,3-d]ピリミジン-7-イル}-2-メトキシフェニル)メタノール(AZD8055);2-アミノ-8-[トランス-4-(2-ヒドロキシエトキシ)シクロヘキシル]-6-(6-メトキシ-3-ピリジニル)-4-メチル-ピリド[2,3-d]ピリミジン-7(8H)-オン(PF04691502、CAS 1013101-36-4);およびN2-[1,4-ジオキソ-[[4-(4-オキソ-8-フェニル-4H-1-ベンゾピラン-2-イル)モルホリニウム-4-イル]メトキシ]ブチル]-L-アルギニルグリシル-L-α-アスパルチルL-セリン-,分子内塩(SF1126、CAS 936487-67-1)を含むが、これらに限定されない。 Exemplary mTOR inhibitors include rapamycin [Rapamune®] and analogs and derivatives thereof; SDZ-RAD; temsirolimus [Toricel®; also known as CCI-779]; ridaforolimus [deferolimus previously known as (1R,2R,4S)-4-[(2R)-2[(1R,9S,12S,15R,16E,18R,19R,21R,23S,24E,26E,28Z,30S,32S ,35R)-1,18-dihydroxy-19,30-dimethoxy-15,17,21,23,29,35-hexamethyl-2,3,10,14,20-pentoxo-11,36-dioxa-4- azatricyclo[30.3.1.0 4,9 ]hexatriacont-16,24,26,28-tetraen-12-yl]propyl]-2-methoxycyclohexyldimethylphosphinate, AP23573 and also known as MK8669 , described in PCT Publication No. WO 03/064383]; everolimus [Afinitor® or RAD001]; rapamycin [AY22989, Sirolimus®]; simapimod (CAS 164301-51-3); (5-{2,4-bis[(3S)-3-methylmorpholin-4-yl]pyrido[2,3-d]pyrimidin-7-yl}-2-methoxyphenyl)methanol (AZD8055); 2- Amino-8-[trans-4-(2-hydroxyethoxy)cyclohexyl]-6-(6-methoxy-3-pyridinyl)-4-methyl-pyrido[2,3-d]pyrimidin-7(8H)-one (PF04691502, CAS 1013101-36-4); and N 2 -[1,4-dioxo-[[4-(4-oxo-8-phenyl-4H-1-benzopyran-2-yl)morpholinium-4-yl ]Methoxy]butyl]-L-arginylglycyl-L-α-aspartyl L-serine-, inner salt (SF1126, CAS 936487-67-1).
例示的なホスホイノシチド3キナーゼ(PI3K)阻害剤は、デュベリシブ、イデラリシブ、4-[2-(1H-インダゾール-4-イル)-6-[[4-(メチルスルホニル)ピペラジン-1-イル]メチル]チエノ[3,2-d]ピリミジン-4-イル]モルホリン(GDC 0941としても公知であり、PCT公開公報WO09/036082号およびWO09/055730号において説明されている);2-メチル-2-[4-[3-メチル-2-オキソ-8-(キノリン-3-イル)-2,3-ジヒドロイミダゾ[4,5-c]キノリン-1-イル]フェニル]プロピオニトリル(BEZ 235またはNVP-BEZ 235としても公知であり、PCT公開公報WO06/122806号において説明されている);4-(トリフルオロメチル)-5-(2,6-ジモルホリノピリミジン-4-イル)ピリジン-2-アミン(BKM120またはNVP-BKM120としても公知であり、PCT公開公報WO2007/084786号において説明されている);トザセルチブ(Tozasertib)(VX680またはMK-0457、CAS 639089-54-6);(5Z)-5-[[4-(4-ピリジニル)-6-キノリニル]メチレン]-2,4-チアゾリジンジオン(GSK1059615、CAS 958852-01-2);(1E,4S,4aR,5R,6aS,9aR)-5-(アセチルオキシ)-1-[(ジ-2-プロペニルアミノ)メチレン]-4,4a,5,6,6a,8,9,9a-オクタヒドロ-11-ヒドロキシ-4-(メトキシメチル)-4a,6a-ジメチル-シクロペンタ[5,6]ナフト[1,2-c]ピラン-2,7,10(1H)-トリオン(PX866、CAS 502632-66-8);および8-フェニル-2-(モルホリン-4-イル)-クロメン-4-オン(LY294002、CAS 154447-36-6)を含むが、これらに限定されない。例示的なタンパク質キナーゼB(PKB:Protein Kinase B)またはAKT阻害剤には、8-[4-(1-アミノシクロブチル)フェニル]-9-フェニル-1,2,4-トリアゾロ[3,4-f][1,6]ナフチリジン-3(2H)-オン(MK-2206、CAS 1032349-93-1);ペリホシン(KRX0401);4-ドデシル-N-1,3,4-チアジアゾール-2-イル-ベンゼンスルホンアミド(PHT-427、CAS 1191951-57-1);4-[2-(4-アミノ-1,2,5-オキサジアゾール-3-イル)-1-エチル-7-[(3S)-3-ピペリジニルメトキシ]-1H-イミダゾ[4,5-c]ピリジン-4-イル]-2-メチル-3-ブチン-2-オール(GSK690693、CAS 937174-76-0);8-(1-ヒドロキシエチル)-2-メトキシ-3-[(4-メトキシフェニル)メトキシ]-6H-ジベンゾ[b,d]ピラン-6-オン(パロミド529、P529またはSG-00529);トリシルビン(Tricirbine)(6-アミノ-4-メチル-8-(β-D-リボフラノシル)-4H,8H-ピロロ[4,3,2-デ]ピリミド[4,5-c]ピリダジン);(αS)-α-[[[5-(3-メチル-1H-インダゾール-5-イル)-3-ピリジニル]オキシ]メチル]-ベンゼンエタンアミン(A674563、CAS 552325-73-2);4-[(4-クロロフェニル)メチル]-1-(7H-ピロロ[2,3-d]ピリミジン-4-イル)-4-ピペリジンアミン(CCT128930、CAS 885499-61-6);4-(4-クロロフェニル)-4-[4-(1Hピラゾール-4-イル)フェニル]-ピペリジン(AT7867、CAS 857531-00-1);およびアルケキシン(Archexin)(RX-0201、CAS 663232-27-7)が含まれるが、これらに限定されない。 Exemplary phosphoinositide 3-kinase (PI3K) inhibitors are duvelisib, idelalisib, 4-[2-(1H-indazol-4-yl)-6-[[4-(methylsulfonyl)piperazin-1-yl]methyl] thieno[3,2-d]pyrimidin-4-yl]morpholine (also known as GDC 0941 and described in PCT publications WO09/036082 and WO09/055730); 2-methyl-2-[ 4-[3-methyl-2-oxo-8-(quinolin-3-yl)-2,3-dihydroimidazo[4,5-c]quinolin-1-yl]phenyl]propionitrile (BEZ 235 or NVP -BEZ 235 and described in PCT Publication No. WO 06/122806); 4-(trifluoromethyl)-5-(2,6-dimorpholinopyrimidin-4-yl)pyridine-2- Amine (also known as BKM120 or NVP-BKM120 and described in PCT Publication No. WO 2007/084786); Tozasertib (VX680 or MK-0457, CAS 639089-54-6); (5Z)- 5-[[4-(4-pyridinyl)-6-quinolinyl]methylene]-2,4-thiazolidinedione (GSK1059615, CAS 958852-01-2); (1E,4S,4aR,5R,6aS,9aR)- 5-(acetyloxy)-1-[(di-2-propenylamino)methylene]-4,4a,5,6,6a,8,9,9a-octahydro-11-hydroxy-4-(methoxymethyl)- 4a,6a-dimethyl-cyclopenta[5,6]naphtho[1,2-c]pyran-2,7,10(1H)-trione (PX866, CAS 502632-66-8); and 8-phenyl-2- (morpholin-4-yl)-chromen-4-one (LY294002, CAS 154447-36-6), including but not limited to; Exemplary Protein Kinase B (PKB) or AKT inhibitors include 8-[4-(1-aminocyclobutyl)phenyl]-9-phenyl-1,2,4-triazolo[3,4 -f][1,6]naphthyridin-3(2H)-one (MK-2206, CAS 1032349-93-1); perifosine (KRX0401); 4-dodecyl-N-1,3,4-thiadiazole-2- yl-benzenesulfonamide (PHT-427, CAS 1191951-57-1); 4-[2-(4-amino-1,2,5-oxadiazol-3-yl)-1-ethyl-7-[ (3S)-3-piperidinylmethoxy]-1H-imidazo[4,5-c]pyridin-4-yl]-2-methyl-3-butyn-2-ol (GSK690693, CAS 937174-76-0) 8-(1-hydroxyethyl)-2-methoxy-3-[(4-methoxyphenyl)methoxy]-6H-dibenzo[b,d]pyran-6-one (Palomide 529, P529 or SG-00529); Tricirbine (6-amino-4-methyl-8-(β-D-ribofuranosyl)-4H,8H-pyrrolo[4,3,2-de]pyrimido[4,5-c]pyridazine); (αS )-α-[[[5-(3-methyl-1H-indazol-5-yl)-3-pyridinyl]oxy]methyl]-benzeneethanamine (A674563, CAS 552325-73-2); 4-[( 4-chlorophenyl)methyl]-1-(7H-pyrrolo[2,3-d]pyrimidin-4-yl)-4-piperidinamine (CCT128930, CAS 885499-61-6); 4-(4-chlorophenyl)- 4-[4-(1Hpyrazol-4-yl)phenyl]-piperidine (AT7867, CAS 857531-00-1); and Archexin (RX-0201, CAS 663232-27-7), but It is not limited to these.
ある特定の実施形態においては、キメラTim受容体改変細胞と組み合わせて使用されるチロシンキナーゼ阻害剤は、未分化リンパ腫キナーゼ(ALK:anaplastic lymphoma kinase)阻害剤である。例示的なALK阻害剤には、クリゾチニブ、セリチニブ、アレクチニブ、ブリガチニブ、ダランテルセプト(dalantercept)、エントレクチニブ(entrectinib)およびロルラチニブが含まれる。 In certain embodiments, the tyrosine kinase inhibitor used in combination with the chimeric Tim receptor-modified cells is an anaplastic lymphoma kinase (ALK) inhibitor. Exemplary ALK inhibitors include crizotinib, ceritinib, alectinib, brigatinib, dalantercept, entrectinib and lorlatinib.
キメラTim受容体改変細胞が1つまたは複数の追加の療法と組み合わせて投与されるある特定の実施形態においては、1つまたは複数の追加の療法は、別の方法で単独療法として投与された場合に治療量未満であると考えられ得る用量において投与され得る。そのような実施形態においては、1つまたは複数の追加の療法がより低い用量において投与され得るように、キメラTim受容体組成物は、相加的または相乗的効果を提供し得る。組合せ療法は、追加の療法の前(例えば追加の療法の1日~30日前またはそれよりも前)の、追加の療法と同時(同日)の、または追加の療法の後(例えば追加の療法の1日~30日後またはそれよりも後)の本明細書において説明するキメラTim受容体組成物の投与を含む。ある特定の実施形態においては、キメラTim受容体改変細胞は、1つまたは複数の追加の療法の投与後に投与される。さらなる実施形態においては、キメラTim受容体改変細胞は、1つまたは複数の追加の療法の投与の1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23、24、25、26、27、28、29または30日後に投与される。またさらなる実施形態においては、キメラTim受容体改変細胞は、1つまたは複数の追加の療法の投与後4週間以内、3週間以内、2週間以内または1週間以内に投与される。1つまたは複数の追加の療法が多数の用量を含む場合、キメラTim受容体改変細胞は、1つまたは複数の追加の療法の初回用量後に、1つまたは複数の追加の療法の最終用量後に、または1つまたは複数の追加の療法の多数の用量間において投与され得る。 In certain embodiments in which chimeric Tim receptor-modified cells are administered in combination with one or more additional therapies, the one or more additional therapies are otherwise administered as monotherapy. can be administered at doses that can be considered sub-therapeutic. In such embodiments, chimeric Tim receptor compositions may provide additive or synergistic effects such that one or more additional therapies may be administered at lower doses. Combination therapy may be administered prior to (e.g., 1 to 30 days prior to or more than) the additional therapy, concurrently (same day) with the additional therapy, or after the additional therapy (e.g., the administration of a chimeric Tim receptor composition described herein after 1 day to 30 days or later). In certain embodiments, chimeric Tim receptor-modified cells are administered after administration of one or more additional therapies. In a further embodiment, the chimeric Tim receptor-modified cell is administered 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13 administrations of one or more additional therapies. , 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29 or 30 days later. In still further embodiments, the chimeric Tim receptor-modified cells are administered within 4 weeks, 3 weeks, 2 weeks, or 1 week after administration of the one or more additional therapies. When the one or more additional therapies comprise multiple doses, the chimeric Tim receptor-modified cells are administered after the first dose of the one or more additional therapies, after the final dose of the one or more additional therapies, Or, one or more additional therapies may be administered among multiple doses.
ある特定の実施形態においては、本開示の方法は、枯渇工程を含む。キメラTim受容体を対象から除去するための枯渇工程は、対象への毒性を軽減するために、治療利益に十分な時間後に行い得る。そのような実施形態においては、キメラTim受容体ベクターは、誘導性自殺遺伝子、例としてiCASP9、誘導性FasまたはHSV-TKを含み得る。同様に、キメラTim受容体ベクターは、関連付けられるモノクローナル抗体(mAb)、例えばCD20についてのリツキシマブまたはEGFRについてのセツキシマブの点滴を通して、形質導入された細胞の枯渇を促進する公知の細胞表面抗原、例としてCD20または切断型EGFR(配列番号16)の発現のために設計され得る。また、成熟リンパ球の表面上に存在するCD52をターゲティングするアレムツズマブは、形質導入されたB細胞、T細胞またはナチュラルキラー細胞を枯渇するために使用され得る。 In certain embodiments, methods of the present disclosure include a depletion step. The depletion step to remove the chimeric Tim receptor from the subject can be performed after a period of time sufficient for therapeutic benefit to reduce toxicity to the subject. In such embodiments, the chimeric Tim receptor vector may contain an inducible suicide gene such as iCASP9, inducible Fas or HSV-TK. Similarly, chimeric Tim receptor vectors are known cell surface antigens, such as May be designed for expression of CD20 or truncated EGFR (SEQ ID NO: 16). Alemtuzumab, which targets CD52 present on the surface of mature lymphocytes, can also be used to deplete transduced B cells, T cells or natural killer cells.
本開示の組成物および方法によって治療され得る対象には、動物、例としてヒト、霊長類、ウシ、ウマ、ヒツジ、イヌ、ネコ、マウス、ラット、ウサギ、モルモットまたはブタが含まれる。対象は、男性であっても、女性であってもよく、幼児、若年、青年、成人および老年の対象を含む任意の好適な年齢であり得る。 Subjects that can be treated by the compositions and methods of the present disclosure include animals such as humans, primates, cows, horses, sheep, dogs, cats, mice, rats, rabbits, guinea pigs or pigs. Subjects may be male or female and may be of any suitable age, including infant, juvenile, adolescent, adult and geriatric subjects.
これらおよび他の変化は、上記に詳述される説明に照らして実施形態についてなされ得る。一般的に、以下の特許請求の範囲において、使用される用語は、特許請求の範囲を、明細書および特許請求の範囲において開示されている特定の実施形態に限定すると解釈されるべきではなく、むしろ、そのような特許請求の範囲が権利を与える均等物の全範囲に沿った全ての可能な実施形態を含むと解釈されるべきである。したがって、特許請求の範囲は、本開示によって限定されない。 These and other changes can be made to the embodiments in light of the above detailed description. In general, the terms used in the following claims should not be construed to limit the claims to the specific embodiments disclosed in the specification and claims; Rather, such claims are to be construed to include all possible embodiments along with the full range of equivalents to which such claims are entitled. Accordingly, the claims are not limited by the disclosure.
[実施例1]
卵巣がんにおける合成致死的PARP阻害剤相乗効果に関するTim-CER-T細胞の評価
mCherry-NLSプラスミドを発現するKuramochi卵巣がん細胞を、0.78~100μMのPARP阻害剤ニラパリブと共にインキュベートした。ウェル当たりのKuramochi細胞数を、画像化を介して追跡した。t=50において、培養中のKuramochi細胞数は、ニラパリブ濃度の増加に伴って単調に減少する。結果を図1Aに示す。
[Example 1]
Evaluation of Tim-CER-T Cells for Synthetic Lethal PARP Inhibitor Synergy in Ovarian Cancer Kuramochi ovarian cancer cells expressing the mCherry-NLS plasmid were incubated with the PARP inhibitor niraparib at 0.78-100 μM. Kuramochi cell numbers per well were tracked via imaging. At t=50, the number of Kuramochi cells in culture decreases monotonically with increasing niraparib concentration. The results are shown in FIG. 1A.
同様の実験を、様々な用量のPARP阻害剤ニラパリブ、オラパリブ、タラゾパリブ、ベリパリブ(Veliperib)およびルカパリブにおいて行い、Kuramochi細胞数を、t=50hにおいてプロットした。タラゾパリブおよびニラパリブは、最も高感度なEC50値を示し、ルカパリブおよびオラパリブがこれに続く。ベリパリブは、試験された5種類のPARP阻害剤のうち、検出されるKuramochi細胞数に対して最も小さな影響を有する。ニラパリブおよびルカパリブは、t=50hまでにKuramochi培養物をほとんど除去する。結果を図1Bに示す。
[実施例2]
Similar experiments were performed with various doses of the PARP inhibitors niraparib, olaparib, talazoparib, veliparib and rucaparib, and Kuramochi cell numbers were plotted at t=50 h. Talazoparib and niraparib showed the most sensitive EC50 values, followed by rucaparib and olaparib. Veliparib has the smallest effect on the number of Kuramochi cells detected among the five PARP inhibitors tested. Niraparib and rucaparib almost eliminate the Kuramochi culture by t=50 h. The results are shown in FIG. 1B.
[Example 2]
PARP阻害剤は表面ホスファチジルセリンをアップレギュレートし、かつCD4/CD8 T細胞に対して無視できる影響を有する
mCherry-NLSプラスミドを発現するKuramochi細胞を、様々な濃度のニラパリブ、Tim4-Fcキメラ、およびAlexa488にコンジュゲートした抗マウスIgG2a抗体と共にインキュベートした。Tim4+Kuramochi細胞(すなわち、緑色の物体)数は、1.56μMニラパリブとのインキュベーションにさえ応答して、IgGのみの対照を超えて顕著に増大する(図2A~図2B)。Kuramochi細胞数は、1.56~12.5μMニラパリブに応答して増加し(図2C)、このことは、PARP阻害が、Kuramochi細胞を死滅させることなく、表面ホスファチジルセリンを誘導することを示す。
PARP inhibitors upregulate surface phosphatidylserine and have negligible effects on CD4/CD8 T cells Incubated with an anti-mouse IgG2a antibody conjugated to Alexa488. The number of Tim4+ Kuramochi cells (ie, green objects) is significantly increased over IgG-only controls in response to even incubation with 1.56 μM niraparib (FIGS. 2A-2B). Kuramochi cell numbers increased in response to 1.56-12.5 μM niraparib (FIG. 2C), indicating that PARP inhibition induces surface phosphatidylserine without killing Kuramochi cells.
初代ヒトCD4+およびCD8+ T細胞の共培養物を、様々な濃度のニラパリブと共にインキュベートし、T細胞生存率、直径および密度を、ニラパリブとのインキュベーション後の1日目、2日目および3日目に対応する、TransActを用いる活性化後の7日目、8日目および9日目に、ViCellセルカウンターを用いて測定した。7日目~9日目のT細胞生存率、平均直径および拡大増殖は、ニラパリブ濃度の関数として、無視できる変化を示す(図3)。
[実施例3]
Co-cultures of primary human CD4+ and CD8+ T cells were incubated with various concentrations of niraparib and T cell viability, diameter and density were measured on days 1, 2 and 3 after incubation with niraparib. Corresponding measurements were made using a ViCell cell counter on days 7, 8 and 9 after activation with TransAct. T cell viability, mean diameter and expanded proliferation on days 7-9 show negligible changes as a function of niraparib concentration (Fig. 3).
[Example 3]
キメラTim受容体/ニラパリブは、異なる用量においてインビトロでKuramochi細胞を相乗的に死滅させる
mCherry-NLSプラスミドを発現するKuramochi細胞を、25、12.5、または6.25μMニラパリブと共に20時間インキュベートした。次の日、ニラパリブ濃度を0.52μMまで低減させ、キメラTim受容体コンストラクト13A(TIM4結合ドメイン-CD28膜貫通ドメイン-CD28共刺激性ドメイン-CD3ζシグナル伝達ドメイン)(配列番号162)を発現する初代ヒトCD4+およびCD8+ T細胞の共培養物を、Kuramochi培養物へと添加した。キメラTim受容体コンストラクト13Aを発現するT細胞培養は、実験条件に応じて、モック形質導入対照(対照-T)よりも低く、培養中のKuramochi細胞数を顕著に低減させる。mCherry-NLSを発現するKuramochi細胞数を、IncuCyteを介してモニタリングした。結果を図4に示す。キメラTim受容体コンストラクト13Aとニラパリブとの組合せ療法は、異なる用量においてKuramochi細胞を相乗的に死滅させる。
Chimeric Tim Receptor/Niraparib Synergistically Kills Kuramochi Cells In Vitro at Different Doses Kuramochi cells expressing the mCherry-NLS plasmid were incubated with 25, 12.5, or 6.25 μM niraparib for 20 hours. The next day, the niraparib concentration was reduced to 0.52 μM and the primary cells expressing chimeric Tim receptor construct 13A (TIM4 binding domain-CD28 transmembrane domain-CD28 co-stimulatory domain-CD3zeta signaling domain) (SEQ ID NO: 162). Co-cultures of human CD4+ and CD8+ T cells were added to Kuramochi cultures. T cell cultures expressing the chimeric Tim receptor construct 13A significantly reduce the number of Kuramochi cells in culture, lower than the mock-transduced control (Control-T), depending on the experimental conditions. The number of Kuramochi cells expressing mCherry-NLS was monitored via IncuCyte. The results are shown in FIG. Combination therapy with chimeric Tim receptor construct 13A and niraparib synergistically kills Kuramochi cells at different doses.
mCherry-NLSプラスミドを発現するKuramochi細胞を、1.56μMニラパリブと共に、約20時間インキュベートした。次の日、培地を細胞から除去し、0μMニラパリブを含む新鮮培地を用いて置き換え、キメラTim受容体CTX140(Tim4結合ドメイン-CD28ヒンジ-CD28膜貫通-CD28共刺激性ドメイン-DAP12)(配列番号195)またはCTX156(tEGFR対照)を発現する初代ヒトCD4+およびCD8+ T細胞を、Kuramochi培養物へと添加した。mCherry-NLSを発現するKuramochi細胞数を、IncuCyteを介してモニタリングした。結果を図5に示す。キメラTim受容体コンストラクトCTX140を発現するT細胞培養は、モック形質導入対照よりも低く、培養中のKuramochi細胞数を顕著に低減させる。 Kuramochi cells expressing the mCherry-NLS plasmid were incubated with 1.56 μM niraparib for approximately 20 hours. The next day, the medium was removed from the cells and replaced with fresh medium containing 0 μM niraparib and the chimeric Tim receptor CTX140 (Tim4 binding domain-CD28 hinge-CD28 transmembrane-CD28 co-stimulatory domain-DAP12) (SEQ ID NO: 195) or primary human CD4+ and CD8+ T cells expressing CTX156 (tEGFR control) were added to Kuramochi cultures. The number of Kuramochi cells expressing mCherry-NLS was monitored via IncuCyte. The results are shown in FIG. T cell cultures expressing the chimeric Tim receptor construct CTX140 significantly reduce the number of Kuramochi cells in culture, lower than mock-transduced controls.
mCherry-NLSプラスミドを発現する2500個のKuramochi卵巣がん細胞を、0日目にプレートした。25、12.5、または6.25μMニラパリブを、約4時間後に細胞培養物に添加した。最初のニラパリブ用量から約20時間後に、キメラTim受容体CTX137(Tim4結合ドメイン-CD28膜貫通-CD28共刺激性ドメイン-DAP12)(配列番号197)またはCTX156(tEGFR対照)を発現する初代ヒトCD4+およびCD8+ T細胞ならびに0.52μMニラパリブの維持用量を添加した。25μMニラパリブ前処理に関する結果を、図6に示す。様々なエフェクター:標的(E:T)比での25、12.5、または6.25μMニラパリブ前処理に関する結果を、図7に示す。キメラTim受容体コンストラクトCTX137を発現するT細胞培養は、モック形質導入対照よりも低く、培養中のKuramochi細胞数を顕著に低減させる。 2500 Kuramochi ovarian cancer cells expressing the mCherry-NLS plasmid were plated on day 0. 25, 12.5, or 6.25 μM niraparib was added to the cell cultures after approximately 4 hours. Approximately 20 hours after the first niraparib dose, primary human CD4+ and CD8+ T cells were added as well as a maintenance dose of 0.52 μM niraparib. Results for 25 μM niraparib pretreatment are shown in FIG. Results for 25, 12.5, or 6.25 μM niraparib pretreatment at various effector:target (E:T) ratios are shown in FIG. T cell cultures expressing the chimeric Tim receptor construct CTX137 significantly reduce the number of Kuramochi cells in culture, lower than mock-transduced controls.
Ptd-Ser曝露を誘導するために、BRCA-2変異Kuramochi細胞株を、治療用量のPARP阻害剤ニラパリブを用いて処理した。ニラパリブへの簡潔な曝露は、用量依存的様式で膜リン脂質対称性における変化を誘発し、Kuramochi細胞の増殖の阻害において有効である(図8A)。低いエフェクター:標的比(1:1)におけるキメラTim4受容体pCTX133(Tim4-TLR2-CD3z)の添加は、形質導入対照と比較して、インビトロでニラパリブの効力を向上させ、このことは、標的細胞に対して直接的な細胞傷害効果を誘発するpCTX133の能力を実証した(図8B)。
[実施例4]
To induce Ptd-Ser exposure, the BRCA-2 mutant Kuramochi cell line was treated with a therapeutic dose of the PARP inhibitor niraparib. Brief exposure to niraparib induces changes in membrane phospholipid symmetry in a dose-dependent manner and is effective in inhibiting proliferation of Kuramochi cells (Fig. 8A). Addition of the chimeric Tim4 receptor pCTX133 (Tim4-TLR2-CD3z) at a low effector:target ratio (1:1) enhanced the potency of niraparib in vitro compared to the transduced control, indicating that the target cells demonstrated the ability of pCTX133 to elicit a direct cytotoxic effect against (Fig. 8B).
[Example 4]
キメラTim受容体/ニラパリブはA2780細胞を相乗的に死滅させる
T細胞形質導入および培養:CD4およびCD8 T細胞を、Miltenyi CD4+およびCD8+単離キットを用いて凍結健康ドナーPBMCから単離した。続いて、CD4およびCD8 T細胞を1:1比で混合し、細胞血清代替物、L-グルタミン、GlutaMAX、ならびにIL-2、IL-7およびIL-15サイトカイン、ならびに1:50に希釈したTransActを添加したOpTmizer培地中で、平底24ウェルプレートにおいて一晩インキュベートした。TransActを用いる活性化の16~24時間後、T細胞を、平底96ウェルプレートにおいて8μg/mLポリブレンおよび1:50TransActを用いて、MOI=10において適切なウイルスを用いて形質導入した。形質導入の約24時間後、T細胞を、細胞血清代替物、L-グルタミン、GlutaMAX、ならびにIL-2、IL-7およびIL-15サイトカインを添加したOpTmizer培地中で、24ウェルGRexプレートへと移した。T細胞をカウントし、その後、概ね2日間毎に新鮮培地を補充した。
Chimeric Tim Receptor/Niraparib Synergistically Kills A2780 Cells T cell transduction and culture: CD4 and CD8 T cells were isolated from frozen healthy donor PBMC using Miltenyi CD4+ and CD8+ isolation kits. Subsequently, CD4 and CD8 T cells were mixed at a 1:1 ratio and treated with cell serum replacement, L-glutamine, GlutaMAX, and IL-2, IL-7 and IL-15 cytokines, and TransAct diluted 1:50. were incubated overnight in flat-bottomed 24-well plates in OpTmizer medium supplemented with 16-24 hours after activation with TransAct, T cells were transduced with the appropriate virus at MOI=10 with 8 μg/mL polybrene and 1:50 TransAct in flat-bottom 96-well plates. Approximately 24 hours after transduction, T cells were transferred to 24-well GRex plates in OpTmizer medium supplemented with cell serum replacement, L-glutamine, GlutaMAX, and IL-2, IL-7 and IL-15 cytokines. moved. T cells were counted and replenished with fresh medium approximately every two days thereafter.
細胞株操作:A2780(ヒト卵巣がん細胞株)およびKuramochi(BRCA欠損ヒト卵巣がん細胞株)細胞を、mCherry-核局在化配列(NLS)遺伝子をコードするレンチウイルスベクターを用いて形質導入し、続いて、mCherry発現に従ってソーティングした。A2780-mCherry-NLS細胞株は、クローン的にソーティングし、拡大増殖させ、かつバンク化し、他方、Kuramochi-mCherry-NLS細胞は、バルクで拡大増殖およびバンク化した。細胞株を解凍し、10%FBSを添加したRPMI1640において約25継代まで培養中で維持した。 Cell line engineering: A2780 (human ovarian cancer cell line) and Kuramochi (BRCA-deficient human ovarian cancer cell line) cells were transduced with a lentiviral vector encoding the mCherry-nuclear localization sequence (NLS) gene. and subsequently sorted according to mCherry expression. The A2780-mCherry-NLS cell line was clonally sorted, expanded and banked, while the Kuramochi-mCherry-NLS cells were expanded and banked in bulk. Cell lines were thawed and maintained in culture in RPMI 1640 supplemented with 10% FBS until approximately 25 passages.
共培養アッセイ:0日目に、2,500個のA2780-mCh-NLSまたはKuramochi-mCh-NLS細胞を、NUNC Edge 96ウェルプレートにプレートし、ニラパリブ(遊離塩基)を、全てRPMI1640+10%FBS中で、適切な濃度において約4時間後に添加した。約20時間後に、培地を除去し、全て細胞血清代替物、L-グルタミン、GlutaMAX、ならびにIL-2、IL-7およびIL-15サイトカインを添加したOpTmizer培地中の、適切な濃度のニラパリブ(遊離塩基)および適切な数のT細胞を用いて置き換えた。A2780-mCh-NLS細胞を用いた場合、上清を遠心分離し、A2780細胞の任意の懸濁成分を保存するために、T細胞培地中に再懸濁した。適切な場合、プレートを直ちにIncuCyteへと移した。 Co-culture assay: On day 0, 2,500 A2780-mCh-NLS or Kuramochi-mCh-NLS cells were plated in NUNC Edge 96-well plates and niraparib (free base), all in RPMI 1640 + 10% FBS. , at the appropriate concentration, was added after about 4 hours. After about 20 hours, the medium was removed and niraparib (free bases) and the appropriate number of T cells. When A2780-mCh-NLS cells were used, the supernatant was centrifuged and resuspended in T cell medium to preserve any suspended components of A2780 cells. When appropriate, plates were immediately transferred to the IncuCyte.
表面PSのフローサイトメトリー測定:A2780-mCh-NLS細胞を、1.56もしくは25μMニラパリブまたは同等の容量のDMSO(対照)を用いて処理した。48時間後、試料をトリプシン処理し、Tim4-Fcおよびそれに続いてTim4-Fcに対する蛍光標識二次抗体を用いて染色した。試料を、フローサイトメトリーを介して直ちに分析した。 Flow cytometry measurement of surface PS: A2780-mCh-NLS cells were treated with 1.56 or 25 μM niraparib or an equivalent volume of DMSO (control). After 48 hours, samples were trypsinized and stained with Tim4-Fc followed by a fluorescently labeled secondary antibody against Tim4-Fc. Samples were analyzed immediately via flow cytometry.
図9A~図9Bに示される通り、キメラTim4受容体pCTX247(Tim4結合ドメイン-CD28膜貫通-CD28シグナル伝達ドメイン-CD3ζシグナル伝達ドメイン;配列番号257)によって改変されたT細胞は、2種類の卵巣がん細胞株において、インビトロ抗腫瘍活性を実証する。図10に示される通り、キメラTim4受容体pCTX797(Tim4結合ドメイン-CD28膜貫通-CD28シグナル伝達ドメイン-CD3ζシグナル伝達ドメイン;配列番号258)によって改変されたT細胞は、A2780卵巣がんモデルにおいて、インビトロ抗腫瘍活性を実証する。 As shown in Figures 9A-B, T cells modified with the chimeric Tim4 receptor pCTX247 (Tim4 binding domain-CD28 transmembrane-CD28 signaling domain-CD3zeta signaling domain; Demonstrate in vitro anti-tumor activity in cancer cell lines. As shown in FIG. 10, T cells modified with the chimeric Tim4 receptor pCTX797 (Tim4 binding domain-CD28 transmembrane-CD28 signaling domain-CD3zeta signaling domain; SEQ ID NO: 258) were induced to: Demonstrate in vitro anti-tumor activity.
図11A~図11Bに示される通り、ホスファチジルセリンは、2種類の卵巣がんモデルにおいて、ニラパリブに応答して細胞表面上に存在する。 As shown in FIGS. 11A-11B, phosphatidylserine is present on the cell surface in response to niraparib in two ovarian cancer models.
図12に示される通り、キメラTim4受容体pCTX797(Tim4結合ドメイン-CD28膜貫通-CD28シグナル伝達ドメイン-CD3ζシグナル伝達ドメイン;配列番号258)は、切断型EGFR(EGFRt)対照(pCTX236)と比較して、追加のPARP阻害剤(ルカパリブ(rucarparib)、オラパリブ、およびニラパリブ)との相乗効果を示す。 As shown in FIG. 12, the chimeric Tim4 receptor pCTX797 (Tim4 binding domain-CD28 transmembrane-CD28 signaling domain-CD3zeta signaling domain; SEQ ID NO:258) compared to the truncated EGFR (EGFRt) control (pCTX236). show synergy with additional PARP inhibitors (rucarparib, olaparib, and niraparib).
上記に説明する様々な実施形態を組み合わせて、さらなる実施形態を提供することができる。非限定的に2020年8月14日出願の米国仮特許出願第63/066,150号、2020年10月2日出願の米国仮特許出願第63/087,049号および2021年7月28日出願の米国仮特許出願第63/226,712号を含む、本明細書において参照および/または出願データシートに列挙される全ての米国特許、米国特許出願公開公報、米国特許出願、外国特許、外国特許出願および非特許刊行物は、その全体を参照により本明細書に組み込む。実施形態の態様は、様々な特許、出願および刊行物の概念を用いて、またさらなる実施形態を提供するために必要な場合、改変され得る。 The various embodiments described above can be combined to provide further embodiments. Without limitation, U.S. Provisional Patent Application No. 63/066,150 filed Aug. 14, 2020, U.S. Provisional Patent Application No. 63/087,049 filed Oct. 2, 2020 and Jul. 28, 2021 All U.S. patents, U.S. patent application publications, U.S. patent applications, foreign patents, foreign Patent applications and non-patent publications are incorporated herein by reference in their entirety. Aspects of the embodiments can be modified, if necessary, using concepts of the various patents, applications and publications to provide still further embodiments.
これらおよび他の変化は、上記に詳述される説明に照らして実施形態についてなされ得る。一般的に、以下の特許請求の範囲において、使用される用語は、特許請求の範囲を、明細書および特許請求の範囲において開示されている特定の実施形態に限定すると解釈されるべきではないが、そのような特許請求の範囲が権利を与える均等物の全範囲に沿った全ての可能な実施形態を含むと解釈されるべきである。したがって、特許請求の範囲は、本開示によって限定されない。 These and other changes can be made to the embodiments in light of the above detailed description. In general, the terms used in the following claims should not be construed to limit the claims to the specific embodiments disclosed in the specification and claims. , is to be construed to include all possible embodiments along with the full range of equivalents to which such claims are entitled. Accordingly, the claims are not limited by the disclosure.
Claims (88)
(a)(i)Tim1 IgVドメインまたはTim4 IgVドメイン;および
(ii)Tim1ムチンドメインまたはTim4ムチンドメイン
を含む、結合ドメインを含む細胞外ドメインと;
(b)一次細胞内シグナル伝達ドメインおよび適宜の二次細胞内シグナル伝達ドメインを含む細胞内シグナル伝達ドメインと;
(c)細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインと
を含む単鎖キメラタンパク質を含む、キメラT細胞免疫グロブリンおよびムチン(Tim)受容体;ならびに
ポリ(ADP-リボース)ポリメラーゼ(PARP)阻害剤
を対象に投与することを含む方法。 A method for treating cancer in a subject in need thereof, wherein the cancer is breast cancer, ovarian cancer, colorectal cancer, fallopian tube cancer, peritoneal cancer, prostate cancer, lung cancer, or melanoma, the method comprising: an effective amount of
(a)(i) a Tim1 IgV domain or a Tim4 IgV domain; and
(ii) an extracellular domain comprising a binding domain, comprising a Tim1 mucin domain or a Tim4 mucin domain;
(b) an intracellular signaling domain comprising a primary intracellular signaling domain and optionally a secondary intracellular signaling domain;
(c) a chimeric T-cell immunoglobulin and mucin (Tim) receptor comprising a single-chain chimeric protein comprising a transmembrane domain located between and connecting an extracellular domain and an intracellular signaling domain; and a method comprising administering to a subject a poly (ADP-ribose) polymerase (PARP) inhibitor.
(ii)結合ドメインがTim4 IgVドメインおよびTim1ムチンドメインを含み、一次細胞内シグナル伝達ドメインがCD28シグナル伝達ドメインを含み、二次細胞内シグナル伝達ドメインがDAP12シグナル伝達ドメインを含み、かつ膜貫通ドメインがTim1膜貫通ドメインを含むか;または
(iii)結合ドメインがTim4 IgVドメインおよびTim1ムチンドメインを含み、一次細胞内シグナル伝達ドメインがCD28シグナル伝達ドメインを含み、二次細胞内シグナル伝達ドメインがDAP12シグナル伝達ドメインを含み、かつ膜貫通ドメインがCD28膜貫通ドメインを含む、
請求項1~52のいずれか一項に記載の方法。 (i) the binding domain comprises the Tim4 IgV domain and the Tim1 mucin domain, the primary intracellular signaling domain comprises the TLR8 signaling domain, the secondary intracellular signaling domain comprises the CD3ζ signaling domain, and the transmembrane domain comprises contains a Tim1 transmembrane domain;
(ii) the binding domain comprises the Tim4 IgV domain and the Tim1 mucin domain, the primary intracellular signaling domain comprises the CD28 signaling domain, the secondary intracellular signaling domain comprises the DAP12 signaling domain, and the transmembrane domain comprises or (iii) the binding domain comprises a Tim4 IgV domain and a Tim1 mucin domain, the primary intracellular signaling domain comprises a CD28 signaling domain, and the secondary intracellular signaling domain comprises DAP12 signaling domain, and the transmembrane domain comprises the CD28 transmembrane domain;
The method of any one of claims 1-52.
(ii)Tim4 IgVドメインが配列番号34のアミノ酸配列を含み、Tim1ムチンドメインが配列番号39のアミノ酸配列を含み、CD28シグナル伝達ドメインが配列番号4のアミノ酸配列を含み、DAP12シグナル伝達ドメインが配列番号9のアミノ酸配列を含み;かつTim1膜貫通ドメインが配列番号8のアミノ酸配列を含むか;または
(iii)Tim4 IgVドメインが配列番号34のアミノ酸配列を含み、Tim1ムチンドメインが配列番号39のアミノ酸配列を含み、CD28シグナル伝達ドメインが配列番号4のアミノ酸配列を含み、DAP12シグナル伝達ドメインが配列番号9のアミノ酸配列を含み;かつCD28膜貫通ドメインが配列番号7のアミノ酸配列を含む、
請求項53に記載の方法。 (i) the Tim4 IgV domain comprises the amino acid sequence of SEQ ID NO:34, the Tim1 mucin domain comprises the amino acid sequence of SEQ ID NO:39, the TLR8 signaling domain comprises the amino acid sequence of SEQ ID NO:47, and the CD3ζ signaling domain comprises SEQ ID NO: 5 or the amino acid sequence of SEQ ID NO:27; and the Tim1 transmembrane domain comprises the amino acid sequence of SEQ ID NO:8;
(ii) the Tim4 IgV domain comprises the amino acid sequence of SEQ ID NO:34, the Tim1 mucin domain comprises the amino acid sequence of SEQ ID NO:39, the CD28 signaling domain comprises the amino acid sequence of SEQ ID NO:4, and the DAP12 signaling domain comprises the amino acid sequence of SEQ ID NO: and the Tim1 transmembrane domain comprises the amino acid sequence of SEQ ID NO:8; or (iii) the Tim4 IgV domain comprises the amino acid sequence of SEQ ID NO:34 and the Tim1 mucin domain comprises the amino acid sequence of SEQ ID NO:39. wherein the CD28 signaling domain comprises the amino acid sequence of SEQ ID NO:4, the DAP12 signaling domain comprises the amino acid sequence of SEQ ID NO:9; and the CD28 transmembrane domain comprises the amino acid sequence of SEQ ID NO:7;
54. The method of claim 53.
(ii)単鎖キメラタンパク質が配列番号68のアミノ酸25~416を含むか;または
(iii)単鎖キメラタンパク質が配列番号69のアミノ酸25~422を含む、
請求項53または54に記載の方法。 (i) whether the single-chain chimeric protein comprises amino acids 25-628 of SEQ ID NO:67;
(ii) the single-chain chimeric protein comprises amino acids 25-416 of SEQ ID NO:68; or (iii) the single-chain chimeric protein comprises amino acids 25-422 of SEQ ID NO:69.
55. A method according to claim 53 or 54.
(ii)単鎖キメラタンパク質が配列番号68のアミノ酸配列を含むか;または
(iii)単鎖キメラタンパク質が配列番号69のアミノ酸配列を含む、
請求項53~55のいずれか一項に記載の方法。 (i) whether the single-chain chimeric protein comprises the amino acid sequence of SEQ ID NO:67;
(ii) the single-chain chimeric protein comprises the amino acid sequence of SEQ ID NO:68; or (iii) the single-chain chimeric protein comprises the amino acid sequence of SEQ ID NO:69.
The method of any one of claims 53-55.
(i)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;Tim1シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、CD3ζシグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン、およびTim1膜貫通ドメインを含む膜貫通ドメイン;
(ii)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン、Tim4シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、CD3ζシグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン;およびTim1膜貫通ドメインを含む膜貫通ドメイン;
(iii)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;CD28シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、およびCD28膜貫通ドメインを含む膜貫通ドメイン;
(iv)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;TRAF6シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、およびTim1膜貫通ドメインを含む膜貫通ドメイン;
(v)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;TRAF6シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、およびCD28膜貫通ドメインを含む膜貫通ドメイン;
(vi)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;TRAF2シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、およびTim1膜貫通ドメインを含む膜貫通ドメイン;
(vii)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;TRAF2シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、およびCD28膜貫通ドメインを含む膜貫通ドメイン;
(viii)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;TLR8シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、CD3ζシグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン、およびTim1膜貫通ドメインを含む膜貫通ドメイン;
(ix)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;CD28シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、DAP12シグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン、およびCD28膜貫通ドメインを含む膜貫通ドメイン;または
(x)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;CD28シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、DAP12シグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン、およびTim1膜貫通ドメインを含む膜貫通ドメイン
を含む、請求項1~52のいずれか一項に記載の方法。 the chimeric receptor
(i) a binding domain comprising the Tim1 IgV domain and the Tim1 mucin domain; a primary intracellular signaling domain comprising the Tim1 signaling domain, a secondary intracellular signaling domain comprising the CD3ζ signaling domain, and a membrane comprising the Tim1 transmembrane domain; a penetrating domain;
(ii) a binding domain comprising the Tim1 IgV domain and the Tim1 mucin domain, a primary intracellular signaling domain comprising the Tim4 signaling domain, a secondary intracellular signaling domain comprising the CD3ζ signaling domain; and a membrane comprising the Tim1 transmembrane domain. penetrating domain;
(iii) a binding domain comprising the Tim1 IgV domain and a Tim1 mucin domain; a primary intracellular signaling domain comprising the CD28 signaling domain, and a transmembrane domain comprising the CD28 transmembrane domain;
(iv) a binding domain comprising the Tim1 IgV domain and the Tim1 mucin domain; a primary intracellular signaling domain comprising the TRAF6 signaling domain, and a transmembrane domain comprising the Tim1 transmembrane domain;
(v) a binding domain comprising the Tim1 IgV domain and a Tim1 mucin domain; a primary intracellular signaling domain comprising the TRAF6 signaling domain, and a transmembrane domain comprising the CD28 transmembrane domain;
(vi) a binding domain comprising the Tim1 IgV domain and a Tim1 mucin domain; a primary intracellular signaling domain comprising the TRAF2 signaling domain, and a transmembrane domain comprising the Tim1 transmembrane domain;
(vii) a binding domain comprising the Tim1 IgV domain and a Tim1 mucin domain; a primary intracellular signaling domain comprising the TRAF2 signaling domain, and a transmembrane domain comprising the CD28 transmembrane domain;
(viii) a binding domain comprising the Tim1 IgV domain and the Tim1 mucin domain; a primary intracellular signaling domain comprising the TLR8 signaling domain, a secondary intracellular signaling domain comprising the CD3ζ signaling domain, and a membrane comprising the Tim1 transmembrane domain; penetrating domain;
(ix) a binding domain comprising the Tim1 IgV domain and the Tim1 mucin domain; a primary intracellular signaling domain comprising the CD28 signaling domain, a secondary intracellular signaling domain comprising the DAP12 signaling domain, and a membrane comprising the CD28 transmembrane domain; or (x) a binding domain comprising a Tim1 IgV domain and a Tim1 mucin domain; a primary intracellular signaling domain comprising a CD28 signaling domain, a secondary intracellular signaling domain comprising a DAP12 signaling domain, and a Tim1 transmembrane 53. The method of any one of claims 1-52, comprising a transmembrane domain comprising domain.
(i)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号44のアミノ酸配列を含むTim1シグナル伝達ドメイン、配列番号4のアミノ酸配列を含むCD3ζシグナル伝達ドメイン、および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン;
(ii)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号45、224もしくは225のアミノ酸配列を含むTim4シグナル伝達ドメイン、配列番号5もしくは配列番号27のアミノ酸配列を含むCD3ζシグナル伝達ドメイン;および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン;
(iii)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号4のアミノ酸配列を含むCD28シグナル伝達ドメイン、および配列番号7のアミノ酸配列を含むCD28膜貫通ドメイン;
(iv)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号46のアミノ酸配列を含むTRAF6シグナル伝達ドメイン、および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン;
(v)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号46のアミノ酸配列を含むTRAF6シグナル伝達ドメイン、および配列番号7のアミノ酸配列を含むCD28膜貫通ドメイン;
(vi)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号48のアミノ酸配列を含むTRAF2シグナル伝達ドメイン、および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン;
(vii)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号48のアミノ酸配列を含むTRAF2シグナル伝達ドメイン、および配列番号7のアミノ酸配列を含むCD28膜貫通ドメイン;
(viii)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号47のアミノ酸配列を含むTLR8シグナル伝達ドメイン、配列番号5もしくは配列番号27のアミノ酸配列を含むCD3ζシグナル伝達ドメイン、および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン;
(ix)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号4のアミノ酸配列を含むCD28シグナル伝達ドメイン、DAP12シグナル伝達ドメイン9、および配列番号7のアミノ酸配列を含むCD28膜貫通ドメイン;または
(x)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号4のアミノ酸配列を含むCD28シグナル伝達ドメイン、配列番号9のアミノ酸配列を含むDAP12シグナル伝達ドメイン、および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン
を含む、請求項57に記載の方法。 A chimeric Tim4 receptor is
(i) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a Tim1 signaling domain comprising the amino acid sequence of SEQ ID NO:44, a CD3ζ signal comprising the amino acid sequence of SEQ ID NO:4. a transduction domain and a Tim1 transmembrane domain comprising the amino acid sequence of SEQ ID NO:8;
(ii) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a Tim4 signaling domain comprising the amino acid sequence of SEQ ID NO:45, 224 or 225, SEQ ID NO:5 or SEQ ID NO: a CD3ζ signaling domain comprising the 27 amino acid sequence; and a Tim1 transmembrane domain comprising the amino acid sequence of SEQ ID NO:8;
(iii) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a CD28 signaling domain comprising the amino acid sequence of SEQ ID NO:4, and a CD28 comprising the amino acid sequence of SEQ ID NO:7 a transmembrane domain;
(iv) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, TRAF6 signaling comprising the amino acid sequence of SEQ ID NO:46 domain, and a Tim1 transmembrane domain comprising the amino acid sequence of SEQ ID NO:8;
(v) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a TRAF6 signaling domain comprising the amino acid sequence of SEQ ID NO:46, and a CD28 comprising the amino acid sequence of SEQ ID NO:7 a transmembrane domain;
(vi) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a TRAF2 signaling domain comprising the amino acid sequence of SEQ ID NO:48, and a Tim1 comprising the amino acid sequence of SEQ ID NO:8 a transmembrane domain;
(vii) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a TRAF2 signaling domain comprising the amino acid sequence of SEQ ID NO:48, and a CD28 comprising the amino acid sequence of SEQ ID NO:7 a transmembrane domain;
(viii) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a TLR8 signaling domain comprising the amino acid sequence of SEQ ID NO:47, an amino acid sequence of SEQ ID NO:5 or SEQ ID NO:27 and a Tim1 transmembrane domain comprising the amino acid sequence of SEQ ID NO:8;
(ix) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a CD28 signaling domain comprising the amino acid sequence of SEQ ID NO:4, a DAP12 signaling domain 9, and SEQ ID NO:7 or (x) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a CD28 signaling domain comprising the amino acid sequence of SEQ ID NO:4. , the DAP12 signaling domain comprising the amino acid sequence of SEQ ID NO:9, and the Tim1 transmembrane domain comprising the amino acid sequence of SEQ ID NO:8.
(i)配列番号49のアミノ酸21~456を含む単鎖キメラタンパク質;
(ii)配列番号50のアミノ酸21~471を含む単鎖キメラタンパク質;
(iii)配列番号51のアミノ酸21~363を含む単鎖キメラタンパク質;
(iv)配列番号52のアミノ酸21~590を含む単鎖キメラタンパク質;
(v)配列番号53のアミノ酸21~596を含む単鎖キメラタンパク質;
(vi)配列番号54のアミノ酸21~619を含む単鎖キメラタンパク質;
(vii)配列番号55のアミノ酸21~625を含む単鎖キメラタンパク質;
(viii)配列番号56のアミノ酸21~621を含む単鎖キメラタンパク質;
(ix)配列番号57のアミノ酸21~415を含む単鎖キメラタンパク質;または
(x)配列番号58のアミノ酸21~409を含む単鎖キメラタンパク質
を含む、請求項1~52のいずれか一項に記載の方法。 A chimeric Tim receptor is
(i) a single-chain chimeric protein comprising amino acids 21-456 of SEQ ID NO:49;
(ii) a single-chain chimeric protein comprising amino acids 21-471 of SEQ ID NO:50;
(iii) a single chain chimeric protein comprising amino acids 21-363 of SEQ ID NO:51;
(iv) a single-chain chimeric protein comprising amino acids 21-590 of SEQ ID NO:52;
(v) a single-chain chimeric protein comprising amino acids 21-596 of SEQ ID NO:53;
(vi) a single-chain chimeric protein comprising amino acids 21-619 of SEQ ID NO:54;
(vii) a single-chain chimeric protein comprising amino acids 21-625 of SEQ ID NO:55;
(viii) a single chain chimeric protein comprising amino acids 21-621 of SEQ ID NO:56;
(ix) a single chain chimeric protein comprising amino acids 21-415 of SEQ ID NO:57; or (x) a single chain chimeric protein comprising amino acids 21-409 of SEQ ID NO:58. described method.
(i)配列番号49のアミノ酸配列を含む単鎖キメラタンパク質;
(ii)配列番号50のアミノ酸配列を含む単鎖キメラタンパク質;
(iii)配列番号51のアミノ酸配列を含む単鎖キメラタンパク質;
(iv)配列番号52のアミノ酸配列を含む単鎖キメラタンパク質;
(v)配列番号53のアミノ酸配列を含む単鎖キメラタンパク質;
(vi)配列番号54のアミノ酸配列を含む単鎖キメラタンパク質;
(vii)配列番号55のアミノ酸配列を含む単鎖キメラタンパク質;
(viii)配列番号56のアミノ酸配列を含む単鎖キメラタンパク質;
(ix)配列番号57のアミノ酸配列を含む単鎖キメラタンパク質;または
(x)配列番号58のアミノ酸配列を含む単鎖キメラタンパク質
を含む、請求項59に記載の方法。 A chimeric Tim receptor is
(i) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:49;
(ii) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:50;
(iii) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:51;
(iv) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:52;
(v) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:53;
(vi) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:54;
(vii) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:55;
(viii) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:56;
60. The method of claim 59, comprising (ix) a single chain chimeric protein comprising the amino acid sequence of SEQ ID NO:57; or (x) a single chain chimeric protein comprising the amino acid sequence of SEQ ID NO:58.
(i)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;Tim1シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、CD3ζシグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン、およびTim1膜貫通ドメインを含む膜貫通ドメイン;
(ii)Tim1 IgVドメインおよびTim1ムチンドメインを含む結合ドメイン;Tim4シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、CD3ζシグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン;およびTim1膜貫通ドメインを含む膜貫通ドメイン;
(iii)Tim4 IgVドメインおよびTim4ムチンドメインを含む結合ドメイン;Tim4シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、CD3ζシグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン;およびTim4膜貫通ドメインを含む膜貫通ドメイン;または
(iv)Tim4 IgVドメインおよびTim4ムチンドメインを含む結合ドメイン;Tim1シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン、CD3ζシグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン;およびTim4膜貫通ドメインを含む膜貫通ドメイン
を含む、請求項1~52のいずれか一項に記載の方法。 A chimeric Tim receptor is
(i) a binding domain comprising the Tim1 IgV domain and the Tim1 mucin domain; a primary intracellular signaling domain comprising the Tim1 signaling domain, a secondary intracellular signaling domain comprising the CD3ζ signaling domain, and a membrane comprising the Tim1 transmembrane domain; penetrating domain;
(ii) a binding domain comprising the Tim1 IgV domain and the Tim1 mucin domain; a primary intracellular signaling domain comprising the Tim4 signaling domain, a secondary intracellular signaling domain comprising the CD3ζ signaling domain; and a membrane comprising the Tim1 transmembrane domain. penetrating domain;
(iii) a binding domain comprising the Tim4 IgV domain and the Tim4 mucin domain; a primary intracellular signaling domain comprising the Tim4 signaling domain, a secondary intracellular signaling domain comprising the CD3ζ signaling domain; and a membrane comprising the Tim4 transmembrane domain. or (iv) a binding domain comprising the Tim4 IgV domain and the Tim4 mucin domain; a primary intracellular signaling domain comprising the Tim1 signaling domain, a secondary intracellular signaling domain comprising the CD3ζ signaling domain; and a Tim4 transmembrane domain. 53. The method of any one of claims 1-52, comprising a transmembrane domain comprising domain.
(i)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号44のアミノ酸配列を含むTim1シグナル伝達ドメイン、配列番号5もしくは配列番号27のアミノ酸配列を含むCD3ζシグナル伝達ドメイン、および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン;
(ii)配列番号38のアミノ酸配列を含むTim1 IgVドメイン、配列番号39のアミノ酸配列を含むTim1ムチンドメイン、配列番号45、224もしくは225のアミノ酸配列を含むTim4シグナル伝達ドメイン、配列番号5もしくは配列番号27のアミノ酸配列を含むCD3ζシグナル伝達ドメイン;および配列番号8のアミノ酸配列を含むTim1膜貫通ドメイン;
(iii)配列番号34のアミノ酸配列を含むTim4 IgVドメイン、配列番号35のアミノ酸配列を含むTim4ムチンドメイン、配列番号45、224もしくは225のアミノ酸配列を含むTim4シグナル伝達ドメイン、配列番号5もしくは配列番号27のアミノ酸配列を含むCD3ζシグナル伝達ドメイン;および配列番号5のアミノ酸配列を含むTim4膜貫通ドメイン;または
(iv)配列番号34のアミノ酸配列を含むTim4 IgVドメイン、配列番号35のアミノ酸配列を含むTim4ムチンドメイン、配列番号44のアミノ酸配列を含むTim1シグナル伝達ドメイン、配列番号5もしくは配列番号27のアミノ酸配列を含むCD3ζシグナル伝達ドメイン;および配列番号6のアミノ酸配列を含むTim4膜貫通ドメイン
を含む、請求項61に記載の方法。 A chimeric Tim receptor is
(i) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a Tim1 signaling domain comprising the amino acid sequence of SEQ ID NO:44, an amino acid sequence of SEQ ID NO:5 or SEQ ID NO:27 and a Tim1 transmembrane domain comprising the amino acid sequence of SEQ ID NO:8;
(ii) a Tim1 IgV domain comprising the amino acid sequence of SEQ ID NO:38, a Tim1 mucin domain comprising the amino acid sequence of SEQ ID NO:39, a Tim4 signaling domain comprising the amino acid sequence of SEQ ID NO:45, 224 or 225, SEQ ID NO:5 or SEQ ID NO: a CD3ζ signaling domain comprising the 27 amino acid sequence; and a Tim1 transmembrane domain comprising the amino acid sequence of SEQ ID NO:8;
(iii) a Tim4 IgV domain comprising the amino acid sequence of SEQ ID NO:34, a Tim4 mucin domain comprising the amino acid sequence of SEQ ID NO:35, a Tim4 signaling domain comprising the amino acid sequence of SEQ ID NO:45, 224 or 225, SEQ ID NO:5 or SEQ ID NO: and a Tim4 transmembrane domain comprising the amino acid sequence of SEQ ID NO:5; or (iv) a Tim4 IgV domain comprising the amino acid sequence of SEQ ID NO:34, Tim4 comprising the amino acid sequence of SEQ ID NO:35. a mucin domain, a Tim1 signaling domain comprising the amino acid sequence of SEQ ID NO:44, a CD3ζ signaling domain comprising the amino acid sequence of SEQ ID NO:5 or SEQ ID NO:27; and a Tim4 transmembrane domain comprising the amino acid sequence of SEQ ID NO:6. 62. The method of Paragraph 61.
(i)配列番号49のアミノ酸21~456を含む単鎖キメラタンパク質;
(ii)配列番号50のアミノ酸21~471を含む単鎖キメラタンパク質;
(iii)配列番号59のアミノ酸25~490を含む単鎖キメラタンパク質;または
(iv)配列番号60のアミノ酸25~495を含む単鎖キメラタンパク質
を含む、請求項61または62に記載の方法。 A chimeric Tim receptor is
(i) a single-chain chimeric protein comprising amino acids 21-456 of SEQ ID NO:49;
(ii) a single-chain chimeric protein comprising amino acids 21-471 of SEQ ID NO:50;
(iii) a single chain chimeric protein comprising amino acids 25-490 of SEQ ID NO:59; or (iv) a single chain chimeric protein comprising amino acids 25-495 of SEQ ID NO:60.
(i)配列番号49のアミノ酸配列を含む単鎖キメラタンパク質;
(ii)配列番号50のアミノ酸配列を含む単鎖キメラタンパク質;
(iii)配列番号59のアミノ酸配列を含む単鎖キメラタンパク質;または
(iv)配列番号60のアミノ酸配列を含む単鎖キメラタンパク質
を含む、請求項61~63のいずれか一項に記載の方法。 A chimeric Tim receptor is
(i) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:49;
(ii) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO:50;
(iii) a single chain chimeric protein comprising the amino acid sequence of SEQ ID NO:59; or (iv) a single chain chimeric protein comprising the amino acid sequence of SEQ ID NO:60.
(i)配列番号195のアミノ酸配列もしくは配列番号195のアミノ酸25~473を含む単鎖キメラタンパク質;
(ii)配列番号196のアミノ酸配列もしくは配列番号196のアミノ酸25~446を含む単鎖キメラタンパク質;
(iii)配列番号197のアミノ酸配列もしくは配列番号197のアミノ酸25~434を含む単鎖キメラタンパク質;または
(iv)配列番号198のアミノ酸配列もしくは配列番号198のアミノ酸25~428を含む単鎖キメラタンパク質
を含む、請求項1~52のいずれか一項に記載の方法。 A chimeric Tim receptor is
(i) a single-chain chimeric protein comprising the amino acid sequence of SEQ ID NO: 195 or amino acids 25-473 of SEQ ID NO: 195;
(ii) a single chain chimeric protein comprising the amino acid sequence of SEQ ID NO: 196 or amino acids 25-446 of SEQ ID NO: 196;
(iii) a single chain chimeric protein comprising the amino acid sequence of SEQ ID NO: 197 or amino acids 25-434 of SEQ ID NO: 197; or (iv) a single chain chimeric protein comprising the amino acid sequence of SEQ ID NO: 198 or amino acids 25-428 of SEQ ID NO: 198 53. The method of any one of claims 1-52, comprising
(a)(i)Tim4 IgVドメインおよびTim4ムチンドメインを含む結合ドメインを含む細胞外ドメインと;
(b)CD28シグナル伝達ドメイン、CD3ζシグナル伝達ドメイン、および4-1BBシグナル伝達ドメインから選択される一次細胞内シグナル伝達ドメイン、およびTLR2シグナル伝達ドメインまたはTLR8シグナル伝達ドメインから選択される二次細胞内シグナル伝達ドメインを含む細胞内シグナル伝達ドメインと;
(c)細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインと
を含む、請求項1~52のいずれか一項に記載の方法。 A chimeric Tim receptor is
(a) (i) an extracellular domain comprising a binding domain comprising a Tim4 IgV domain and a Tim4 mucin domain;
(b) a primary intracellular signaling domain selected from a CD28 signaling domain, a CD3ζ signaling domain, and a 4-1BB signaling domain, and a secondary intracellular signal selected from a TLR2 signaling domain or a TLR8 signaling domain; an intracellular signaling domain comprising a transduction domain;
(c) a transmembrane domain located between and connecting the extracellular domain and the intracellular signaling domain.
(a)(i)Tim4 IgVドメインおよびTim4ムチンドメインを含む結合ドメインを含む細胞外ドメインと;
(b)免疫受容体チロシンベース活性化モチーフ(ITAM)含有シグナル伝達ドメインを含む一次細胞内シグナル伝達ドメイン;共刺激性シグナル伝達ドメイン、Tim1シグナル伝達ドメイン、またはTim4シグナル伝達ドメインを含む二次細胞内シグナル伝達ドメイン;およびTLRシグナル伝達ドメインを含む三次細胞内シグナル伝達ドメインを含む細胞内シグナル伝達ドメインと;
(c)細胞外ドメインと細胞内シグナル伝達ドメインとの間に位置し、かつこれらを接続する膜貫通ドメインと
を含む、請求項1~52のいずれか一項に記載の方法。 A chimeric Tim receptor is
(a) (i) an extracellular domain comprising a binding domain comprising a Tim4 IgV domain and a Tim4 mucin domain;
(b) a primary intracellular signaling domain comprising an immunoreceptor tyrosine-based activation motif (ITAM)-containing signaling domain; a secondary intracellular signaling domain comprising a co-stimulatory signaling domain, a Tim1 signaling domain, or a Tim4 signaling domain; a signaling domain; and an intracellular signaling domain comprising a tertiary intracellular signaling domain comprising a TLR signaling domain;
(c) a transmembrane domain located between and connecting the extracellular domain and the intracellular signaling domain.
Applications Claiming Priority (7)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US202063066150P | 2020-08-14 | 2020-08-14 | |
| US63/066,150 | 2020-08-14 | ||
| US202063087049P | 2020-10-02 | 2020-10-02 | |
| US63/087,049 | 2020-10-02 | ||
| US202163226712P | 2021-07-28 | 2021-07-28 | |
| US63/226,712 | 2021-07-28 | ||
| PCT/US2021/046041 WO2022036285A1 (en) | 2020-08-14 | 2021-08-13 | Compositions and methods for treating cancer with chimeric tim receptors in combination with inhibitors of poly (adp-ribose) polymerase |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2023537762A true JP2023537762A (en) | 2023-09-05 |
| JPWO2022036285A5 JPWO2022036285A5 (en) | 2024-08-20 |
Family
ID=85727270
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2023510448A Pending JP2023537762A (en) | 2020-08-14 | 2021-08-13 | Compositions and methods for treating cancer using chimeric TIM receptors in combination with inhibitors of poly(ADP-ribose) polymerase |
Country Status (3)
| Country | Link |
|---|---|
| EP (1) | EP4196151A1 (en) |
| JP (1) | JP2023537762A (en) |
| CA (1) | CA3189480A1 (en) |
Families Citing this family (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2024124080A1 (en) * | 2022-12-08 | 2024-06-13 | Recursion Pharmaceuticals, Inc. | Rna-binding motif protein 39 (rbm39) degraders for treatment of cancers |
-
2021
- 2021-08-13 EP EP21778257.2A patent/EP4196151A1/en active Pending
- 2021-08-13 CA CA3189480A patent/CA3189480A1/en active Pending
- 2021-08-13 JP JP2023510448A patent/JP2023537762A/en active Pending
Also Published As
| Publication number | Publication date |
|---|---|
| CA3189480A1 (en) | 2022-02-17 |
| EP4196151A1 (en) | 2023-06-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP7444781B2 (en) | Cellular immunotherapy compositions and uses thereof | |
| JP7549533B2 (en) | Expression vectors for chimeric phagocytic receptors, genetically modified host cells and uses thereof - Patents.com | |
| US20240174766A1 (en) | Chimeric engulfment receptor molecules and methods of use | |
| JP2024507996A (en) | Lentiviral vector targeting lymphocytes | |
| US20210087251A1 (en) | Chimeric tim4 receptors and uses thereof | |
| US20240058446A1 (en) | Chimeric tim4 receptors and uses thereof | |
| WO2022036265A1 (en) | Chimeric tim receptors and uses thereof | |
| WO2022036285A1 (en) | Compositions and methods for treating cancer with chimeric tim receptors in combination with inhibitors of poly (adp-ribose) polymerase | |
| WO2022036287A1 (en) | Anti-cd72 chimeric receptors and uses thereof | |
| US20210253696A1 (en) | Bivalent chimeric engulfment receptors and uses thereof | |
| JP2023537762A (en) | Compositions and methods for treating cancer using chimeric TIM receptors in combination with inhibitors of poly(ADP-ribose) polymerase | |
| KR20240119868A (en) | Chimeric TIM4 receptor and its uses | |
| US20240285682A1 (en) | Chimeric tim receptors and uses thereof | |
| US20240285684A1 (en) | Anti-cd72 chimeric receptors and uses thereof | |
| CN117015396A (en) | Compositions and methods for treating cancer with chimeric TIM receptors in combination with poly (ADP-ribose) polymerase inhibitors | |
| CN118043067A (en) | Chimeric TIM4 receptors and uses thereof |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A711 | Notification of change in applicant |
Free format text: JAPANESE INTERMEDIATE CODE: A711 Effective date: 20231027 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A821 Effective date: 20231027 |
|
| RD04 | Notification of resignation of power of attorney |
Free format text: JAPANESE INTERMEDIATE CODE: A7424 Effective date: 20240502 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20240809 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20240809 |