JP2008081461A - ケフィアを用いた薬剤およびその製造方法、健康食品 - Google Patents
ケフィアを用いた薬剤およびその製造方法、健康食品 Download PDFInfo
- Publication number
- JP2008081461A JP2008081461A JP2006265274A JP2006265274A JP2008081461A JP 2008081461 A JP2008081461 A JP 2008081461A JP 2006265274 A JP2006265274 A JP 2006265274A JP 2006265274 A JP2006265274 A JP 2006265274A JP 2008081461 A JP2008081461 A JP 2008081461A
- Authority
- JP
- Japan
- Prior art keywords
- kefir
- sample
- molecular weight
- water
- extract
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 235000015141 kefir Nutrition 0.000 title claims abstract description 369
- 239000003814 drug Substances 0.000 title claims abstract description 66
- 238000004519 manufacturing process Methods 0.000 title claims abstract description 29
- 229940079593 drug Drugs 0.000 title abstract description 13
- 235000001497 healthy food Nutrition 0.000 title abstract 3
- 229940124597 therapeutic agent Drugs 0.000 claims abstract description 53
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims abstract description 38
- 208000001072 type 2 diabetes mellitus Diseases 0.000 claims abstract description 31
- 239000000883 anti-obesity agent Substances 0.000 claims abstract description 24
- 229940125710 antiobesity agent Drugs 0.000 claims abstract description 24
- 239000006228 supernatant Substances 0.000 claims description 74
- 235000013402 health food Nutrition 0.000 claims description 14
- 239000000523 sample Substances 0.000 description 206
- HIMXGTXNXJYFGB-UHFFFAOYSA-N alloxan Chemical compound O=C1NC(=O)C(=O)C(=O)N1 HIMXGTXNXJYFGB-UHFFFAOYSA-N 0.000 description 178
- 210000004027 cell Anatomy 0.000 description 65
- 230000004069 differentiation Effects 0.000 description 58
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 54
- 238000000502 dialysis Methods 0.000 description 53
- 230000000694 effects Effects 0.000 description 53
- 230000014509 gene expression Effects 0.000 description 50
- 241000699670 Mus sp. Species 0.000 description 49
- 210000001789 adipocyte Anatomy 0.000 description 45
- 230000003834 intracellular effect Effects 0.000 description 35
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 34
- 239000002609 medium Substances 0.000 description 32
- 239000012901 Milli-Q water Substances 0.000 description 31
- 230000004190 glucose uptake Effects 0.000 description 29
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 28
- 239000000243 solution Substances 0.000 description 28
- 102000004877 Insulin Human genes 0.000 description 27
- 108090001061 Insulin Proteins 0.000 description 27
- 229940125396 insulin Drugs 0.000 description 27
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 24
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 24
- 238000009395 breeding Methods 0.000 description 23
- 230000001488 breeding effect Effects 0.000 description 23
- 238000000034 method Methods 0.000 description 23
- 108010076365 Adiponectin Proteins 0.000 description 21
- 102000011690 Adiponectin Human genes 0.000 description 21
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 21
- 239000008103 glucose Substances 0.000 description 21
- 238000005119 centrifugation Methods 0.000 description 20
- 108090000623 proteins and genes Proteins 0.000 description 20
- 238000002523 gelfiltration Methods 0.000 description 18
- 230000007423 decrease Effects 0.000 description 17
- 238000005259 measurement Methods 0.000 description 17
- HEDRZPFGACZZDS-UHFFFAOYSA-N Chloroform Chemical compound ClC(Cl)Cl HEDRZPFGACZZDS-UHFFFAOYSA-N 0.000 description 16
- 230000001988 toxicity Effects 0.000 description 16
- 231100000419 toxicity Toxicity 0.000 description 16
- 102000000587 Glycerolphosphate Dehydrogenase Human genes 0.000 description 15
- 108010041921 Glycerolphosphate Dehydrogenase Proteins 0.000 description 15
- 241000699666 Mus <mouse, genus> Species 0.000 description 15
- 239000004480 active ingredient Substances 0.000 description 15
- 102000004169 proteins and genes Human genes 0.000 description 15
- 239000003153 chemical reaction reagent Substances 0.000 description 13
- 206010012601 diabetes mellitus Diseases 0.000 description 13
- 108020004999 messenger RNA Proteins 0.000 description 13
- 230000002829 reductive effect Effects 0.000 description 13
- 210000004369 blood Anatomy 0.000 description 12
- 239000008280 blood Substances 0.000 description 12
- 230000008859 change Effects 0.000 description 12
- 235000015140 cultured milk Nutrition 0.000 description 12
- 108010015181 PPAR delta Proteins 0.000 description 11
- 102000000536 PPAR gamma Human genes 0.000 description 11
- 238000003556 assay Methods 0.000 description 11
- 239000002244 precipitate Substances 0.000 description 11
- 230000001737 promoting effect Effects 0.000 description 11
- 239000003642 reactive oxygen metabolite Substances 0.000 description 11
- 235000000346 sugar Nutrition 0.000 description 11
- 210000002237 B-cell of pancreatic islet Anatomy 0.000 description 10
- 108010016731 PPAR gamma Proteins 0.000 description 10
- 230000002708 enhancing effect Effects 0.000 description 10
- 238000002835 absorbance Methods 0.000 description 9
- 238000009825 accumulation Methods 0.000 description 9
- 230000003833 cell viability Effects 0.000 description 9
- 230000001965 increasing effect Effects 0.000 description 9
- 230000006698 induction Effects 0.000 description 9
- 230000002401 inhibitory effect Effects 0.000 description 9
- 239000012528 membrane Substances 0.000 description 9
- 210000000229 preadipocyte Anatomy 0.000 description 9
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 8
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 8
- 230000003247 decreasing effect Effects 0.000 description 8
- 238000001914 filtration Methods 0.000 description 8
- 239000007788 liquid Substances 0.000 description 8
- 238000001262 western blot Methods 0.000 description 8
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 7
- 102000000344 Sirtuin 1 Human genes 0.000 description 7
- 108010041191 Sirtuin 1 Proteins 0.000 description 7
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 7
- 238000010908 decantation Methods 0.000 description 7
- 230000001939 inductive effect Effects 0.000 description 7
- 230000004130 lipolysis Effects 0.000 description 7
- 229910052760 oxygen Inorganic materials 0.000 description 7
- 239000001301 oxygen Substances 0.000 description 7
- 238000010186 staining Methods 0.000 description 7
- 108090000029 Peroxisome Proliferator-Activated Receptors Proteins 0.000 description 6
- 235000014113 dietary fatty acids Nutrition 0.000 description 6
- 238000002474 experimental method Methods 0.000 description 6
- 229930195729 fatty acid Natural products 0.000 description 6
- 239000000194 fatty acid Substances 0.000 description 6
- 150000004665 fatty acids Chemical class 0.000 description 6
- 239000007924 injection Substances 0.000 description 6
- 238000002347 injection Methods 0.000 description 6
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 6
- 150000002632 lipids Chemical class 0.000 description 6
- 238000007254 oxidation reaction Methods 0.000 description 6
- 238000002360 preparation method Methods 0.000 description 6
- 239000000047 product Substances 0.000 description 6
- 230000000638 stimulation Effects 0.000 description 6
- 239000012981 Hank's balanced salt solution Substances 0.000 description 5
- 108010013563 Lipoprotein Lipase Proteins 0.000 description 5
- 102000043296 Lipoprotein lipases Human genes 0.000 description 5
- 230000009471 action Effects 0.000 description 5
- WORJEOGGNQDSOE-UHFFFAOYSA-N chloroform;methanol Chemical compound OC.ClC(Cl)Cl WORJEOGGNQDSOE-UHFFFAOYSA-N 0.000 description 5
- 238000002485 combustion reaction Methods 0.000 description 5
- 238000012869 ethanol precipitation Methods 0.000 description 5
- 235000012631 food intake Nutrition 0.000 description 5
- 238000001502 gel electrophoresis Methods 0.000 description 5
- 239000000843 powder Substances 0.000 description 5
- 235000013618 yogurt Nutrition 0.000 description 5
- 108090000790 Enzymes Proteins 0.000 description 4
- 102100030431 Fatty acid-binding protein, adipocyte Human genes 0.000 description 4
- WSFSSNUMVMOOMR-UHFFFAOYSA-N Formaldehyde Chemical compound O=C WSFSSNUMVMOOMR-UHFFFAOYSA-N 0.000 description 4
- 101001062864 Homo sapiens Fatty acid-binding protein, adipocyte Proteins 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- 102000003728 Peroxisome Proliferator-Activated Receptors Human genes 0.000 description 4
- 208000027418 Wounds and injury Diseases 0.000 description 4
- 230000004913 activation Effects 0.000 description 4
- 210000000227 basophil cell of anterior lobe of hypophysis Anatomy 0.000 description 4
- 230000037396 body weight Effects 0.000 description 4
- 239000012468 concentrated sample Substances 0.000 description 4
- 230000006378 damage Effects 0.000 description 4
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 4
- 229960003957 dexamethasone Drugs 0.000 description 4
- 239000000385 dialysis solution Substances 0.000 description 4
- 230000037149 energy metabolism Effects 0.000 description 4
- 239000012091 fetal bovine serum Substances 0.000 description 4
- 238000001641 gel filtration chromatography Methods 0.000 description 4
- 102000006602 glyceraldehyde-3-phosphate dehydrogenase Human genes 0.000 description 4
- 108020004445 glyceraldehyde-3-phosphate dehydrogenase Proteins 0.000 description 4
- 239000012535 impurity Substances 0.000 description 4
- 208000014674 injury Diseases 0.000 description 4
- 230000003914 insulin secretion Effects 0.000 description 4
- 230000007935 neutral effect Effects 0.000 description 4
- 238000003757 reverse transcription PCR Methods 0.000 description 4
- 210000002027 skeletal muscle Anatomy 0.000 description 4
- 239000011780 sodium chloride Substances 0.000 description 4
- 239000000126 substance Substances 0.000 description 4
- 238000012360 testing method Methods 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 241000894006 Bacteria Species 0.000 description 3
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 238000005571 anion exchange chromatography Methods 0.000 description 3
- MJAMCTLGWXIKOT-UHFFFAOYSA-M benzyl-dimethyl-[2-[2-[2-methyl-4-(2,4,4-trimethylpentan-2-yl)phenoxy]ethoxy]ethyl]azanium;hydroxide Chemical compound [OH-].CC1=CC(C(C)(C)CC(C)(C)C)=CC=C1OCCOCC[N+](C)(C)CC1=CC=CC=C1 MJAMCTLGWXIKOT-UHFFFAOYSA-M 0.000 description 3
- 238000005277 cation exchange chromatography Methods 0.000 description 3
- 239000003795 chemical substances by application Substances 0.000 description 3
- 239000002299 complementary DNA Substances 0.000 description 3
- 238000012258 culturing Methods 0.000 description 3
- 230000003013 cytotoxicity Effects 0.000 description 3
- 231100000135 cytotoxicity Toxicity 0.000 description 3
- 238000001514 detection method Methods 0.000 description 3
- 238000010790 dilution Methods 0.000 description 3
- 239000012895 dilution Substances 0.000 description 3
- 238000010828 elution Methods 0.000 description 3
- 235000013305 food Nutrition 0.000 description 3
- 239000008187 granular material Substances 0.000 description 3
- 230000000977 initiatory effect Effects 0.000 description 3
- 239000007928 intraperitoneal injection Substances 0.000 description 3
- 239000004310 lactic acid Substances 0.000 description 3
- 235000014655 lactic acid Nutrition 0.000 description 3
- 210000003098 myoblast Anatomy 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 238000012545 processing Methods 0.000 description 3
- 230000002633 protecting effect Effects 0.000 description 3
- 238000003753 real-time PCR Methods 0.000 description 3
- 239000007929 subcutaneous injection Substances 0.000 description 3
- 238000010254 subcutaneous injection Methods 0.000 description 3
- 208000035408 type 1 diabetes mellitus 1 Diseases 0.000 description 3
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 241000283707 Capra Species 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 2
- 102000004142 Trypsin Human genes 0.000 description 2
- 108090000631 Trypsin Proteins 0.000 description 2
- 230000003579 anti-obesity Effects 0.000 description 2
- 230000015572 biosynthetic process Effects 0.000 description 2
- 230000024245 cell differentiation Effects 0.000 description 2
- 230000004663 cell proliferation Effects 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 239000007979 citrate buffer Substances 0.000 description 2
- 239000012141 concentrate Substances 0.000 description 2
- 230000001120 cytoprotective effect Effects 0.000 description 2
- 239000000975 dye Substances 0.000 description 2
- 238000004108 freeze drying Methods 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-M hexadecanoate Chemical compound CCCCCCCCCCCCCCCC([O-])=O IPCSVZSSVZVIGE-UHFFFAOYSA-M 0.000 description 2
- IPCSVZSSVZVIGE-UHFFFAOYSA-N hexadecanoic acid Chemical compound CCCCCCCCCCCCCCCC(O)=O IPCSVZSSVZVIGE-UHFFFAOYSA-N 0.000 description 2
- 235000003642 hunger Nutrition 0.000 description 2
- 238000011534 incubation Methods 0.000 description 2
- 239000004615 ingredient Substances 0.000 description 2
- 230000005764 inhibitory process Effects 0.000 description 2
- 238000012528 insulin ELISA Methods 0.000 description 2
- 238000004255 ion exchange chromatography Methods 0.000 description 2
- 239000006210 lotion Substances 0.000 description 2
- 230000004060 metabolic process Effects 0.000 description 2
- 235000013336 milk Nutrition 0.000 description 2
- 239000008267 milk Substances 0.000 description 2
- 210000004080 milk Anatomy 0.000 description 2
- 210000003205 muscle Anatomy 0.000 description 2
- 230000036542 oxidative stress Effects 0.000 description 2
- 210000000496 pancreas Anatomy 0.000 description 2
- 230000008569 process Effects 0.000 description 2
- 238000011002 quantification Methods 0.000 description 2
- 239000002994 raw material Substances 0.000 description 2
- 238000011084 recovery Methods 0.000 description 2
- 239000001044 red dye Substances 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 210000002363 skeletal muscle cell Anatomy 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 239000012192 staining solution Substances 0.000 description 2
- 230000037351 starvation Effects 0.000 description 2
- 230000001629 suppression Effects 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 208000024891 symptom Diseases 0.000 description 2
- 238000003786 synthesis reaction Methods 0.000 description 2
- 239000012588 trypsin Substances 0.000 description 2
- 238000011144 upstream manufacturing Methods 0.000 description 2
- 230000035899 viability Effects 0.000 description 2
- 238000005406 washing Methods 0.000 description 2
- 230000004580 weight loss Effects 0.000 description 2
- VRYALKFFQXWPIH-PPNYQRBUSA-N (2r,3r,4s,5r)-3,4,5,6-tetrahydroxy-2-tritiohexanal Chemical compound O=C[C@H]([3H])[C@@H](O)[C@H](O)[C@H](O)CO VRYALKFFQXWPIH-PPNYQRBUSA-N 0.000 description 1
- XDFNWJDGWJVGGN-UHFFFAOYSA-N 2-(2,7-dichloro-3,6-dihydroxy-9h-xanthen-9-yl)benzoic acid Chemical compound OC(=O)C1=CC=CC=C1C1C2=CC(Cl)=C(O)C=C2OC2=CC(O)=C(Cl)C=C21 XDFNWJDGWJVGGN-UHFFFAOYSA-N 0.000 description 1
- APIXJSLKIYYUKG-UHFFFAOYSA-N 3 Isobutyl 1 methylxanthine Chemical compound O=C1N(C)C(=O)N(CC(C)C)C2=C1N=CN2 APIXJSLKIYYUKG-UHFFFAOYSA-N 0.000 description 1
- FVFVNNKYKYZTJU-UHFFFAOYSA-N 6-chloro-1,3,5-triazine-2,4-diamine Chemical compound NC1=NC(N)=NC(Cl)=N1 FVFVNNKYKYZTJU-UHFFFAOYSA-N 0.000 description 1
- 102000014777 Adipokines Human genes 0.000 description 1
- 108010078606 Adipokines Proteins 0.000 description 1
- 235000001674 Agaricus brunnescens Nutrition 0.000 description 1
- 108010088751 Albumins Proteins 0.000 description 1
- 102000009027 Albumins Human genes 0.000 description 1
- 241000283690 Bos taurus Species 0.000 description 1
- 102000014914 Carrier Proteins Human genes 0.000 description 1
- 108010038061 Chymotrypsinogen Proteins 0.000 description 1
- 241000699800 Cricetinae Species 0.000 description 1
- 101710088194 Dehydrogenase Proteins 0.000 description 1
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 1
- 108090000371 Esterases Proteins 0.000 description 1
- 102000030914 Fatty Acid-Binding Human genes 0.000 description 1
- 108010001336 Horseradish Peroxidase Proteins 0.000 description 1
- 108060001084 Luciferase Proteins 0.000 description 1
- 239000005089 Luciferase Substances 0.000 description 1
- 101000775476 Mus musculus Adiponectin Proteins 0.000 description 1
- 208000008589 Obesity Diseases 0.000 description 1
- 108010058846 Ovalbumin Proteins 0.000 description 1
- 108091008767 PPARγ2 Proteins 0.000 description 1
- 235000021314 Palmitic acid Nutrition 0.000 description 1
- 108020002230 Pancreatic Ribonuclease Proteins 0.000 description 1
- 102000005891 Pancreatic ribonuclease Human genes 0.000 description 1
- 239000012980 RPMI-1640 medium Substances 0.000 description 1
- 102000040945 Transcription factor Human genes 0.000 description 1
- 108091023040 Transcription factor Proteins 0.000 description 1
- 235000010724 Wisteria floribunda Nutrition 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 150000001298 alcohols Chemical class 0.000 description 1
- 238000004458 analytical method Methods 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 238000005349 anion exchange Methods 0.000 description 1
- 239000003957 anion exchange resin Substances 0.000 description 1
- 238000000137 annealing Methods 0.000 description 1
- 239000003472 antidiabetic agent Substances 0.000 description 1
- 229940125708 antidiabetic agent Drugs 0.000 description 1
- 239000003963 antioxidant agent Substances 0.000 description 1
- 230000003078 antioxidant effect Effects 0.000 description 1
- 238000003149 assay kit Methods 0.000 description 1
- 239000012298 atmosphere Substances 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 235000013361 beverage Nutrition 0.000 description 1
- 108091008324 binding proteins Proteins 0.000 description 1
- 238000009835 boiling Methods 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 238000010804 cDNA synthesis Methods 0.000 description 1
- 239000001569 carbon dioxide Substances 0.000 description 1
- 229910002092 carbon dioxide Inorganic materials 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 238000005341 cation exchange Methods 0.000 description 1
- 238000004113 cell culture Methods 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- XTEGARKTQYYJKE-UHFFFAOYSA-N chloric acid Chemical compound OCl(=O)=O XTEGARKTQYYJKE-UHFFFAOYSA-N 0.000 description 1
- 229940005991 chloric acid Drugs 0.000 description 1
- 239000012228 culture supernatant Substances 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000011161 development Methods 0.000 description 1
- 230000018109 developmental process Effects 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 230000000667 effect on insulin Effects 0.000 description 1
- 239000000839 emulsion Substances 0.000 description 1
- 238000005265 energy consumption Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 230000007613 environmental effect Effects 0.000 description 1
- 230000005284 excitation Effects 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 108091022862 fatty acid binding Proteins 0.000 description 1
- 238000000684 flow cytometry Methods 0.000 description 1
- 235000020251 goat milk Nutrition 0.000 description 1
- 230000036541 health Effects 0.000 description 1
- 230000008821 health effect Effects 0.000 description 1
- 210000002865 immune cell Anatomy 0.000 description 1
- 230000001976 improved effect Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 239000000411 inducer Substances 0.000 description 1
- 210000001596 intra-abdominal fat Anatomy 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 210000004153 islets of langerhan Anatomy 0.000 description 1
- 239000010985 leather Substances 0.000 description 1
- 238000004811 liquid chromatography Methods 0.000 description 1
- 230000007246 mechanism Effects 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 239000000203 mixture Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 210000000663 muscle cell Anatomy 0.000 description 1
- WQEPLUUGTLDZJY-UHFFFAOYSA-N n-Pentadecanoic acid Natural products CCCCCCCCCCCCCCC(O)=O WQEPLUUGTLDZJY-UHFFFAOYSA-N 0.000 description 1
- 229930027945 nicotinamide-adenine dinucleotide Natural products 0.000 description 1
- BOPGDPNILDQYTO-NNYOXOHSSA-N nicotinamide-adenine dinucleotide Chemical compound C1=CCC(C(=O)N)=CN1[C@H]1[C@H](O)[C@H](O)[C@@H](COP(O)(=O)OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=NC=NC(N)=C3N=C2)O)O1 BOPGDPNILDQYTO-NNYOXOHSSA-N 0.000 description 1
- 235000020824 obesity Nutrition 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 229940092253 ovalbumin Drugs 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 230000004792 oxidative damage Effects 0.000 description 1
- 239000003614 peroxisome proliferator Substances 0.000 description 1
- CTYRPMDGLDAWRQ-UHFFFAOYSA-N phenyl hydrogen sulfate Chemical compound OS(=O)(=O)OC1=CC=CC=C1 CTYRPMDGLDAWRQ-UHFFFAOYSA-N 0.000 description 1
- 230000035790 physiological processes and functions Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 102000005962 receptors Human genes 0.000 description 1
- 108020003175 receptors Proteins 0.000 description 1
- 230000004044 response Effects 0.000 description 1
- 230000036186 satiety Effects 0.000 description 1
- 235000019627 satiety Nutrition 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 235000020254 sheep milk Nutrition 0.000 description 1
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000003393 splenic effect Effects 0.000 description 1
- 239000012086 standard solution Substances 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 238000004659 sterilization and disinfection Methods 0.000 description 1
- 238000003756 stirring Methods 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 239000000725 suspension Substances 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 238000012546 transfer Methods 0.000 description 1
- UFTFJSFQGQCHQW-UHFFFAOYSA-N triformin Chemical compound O=COCC(OC=O)COC=O UFTFJSFQGQCHQW-UHFFFAOYSA-N 0.000 description 1
- 239000001226 triphosphate Substances 0.000 description 1
- 235000011178 triphosphate Nutrition 0.000 description 1
- UNXRWKVEANCORM-UHFFFAOYSA-N triphosphoric acid Chemical compound OP(O)(=O)OP(O)(=O)OP(O)(O)=O UNXRWKVEANCORM-UHFFFAOYSA-N 0.000 description 1
Images
Landscapes
- Coloring Foods And Improving Nutritive Qualities (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
【解決手段】分子量14000Da以上のケフィア抽出物を含むインスリン非依存性糖尿病治療剤およびその製造方法。ケフィア水溶性画分(好ましくは分子量1000Da未満のケフィア抽出物)を含むインスリン依存性糖尿病治療剤およびその製造方法。ケフィアを用いた(好ましくはケフィア水溶性画分を含む)抗肥満剤およびその製造方法。分子量14000Da以上のケフィア抽出物を含む健康食品。
【選択図】図1
Description
本発明のインスリン非依存性糖尿病治療剤は、分子量14000Da以上のケフィア抽出物を含むことを特徴とする。分子量14000Da以上のケフィア抽出物は、ヨーグルト状のケフィア発酵乳液を、遠心分離、ろ過、デカンテーションなどの公知の適宜の方法で上清と沈殿物とに分離し、得られた上清から透析、ゲルろ過などの公知の適宜の方法を用いて、分子量14000Da以上の画分を分離することにより得られるケフィア抽出物である。この分子量14000Da以上のケフィア抽出物は、クロロホルム−メタノールなどの有機溶媒によって抽出されない水溶性画分に存在し、糖成分を主体成分とする。また本発明における分子量14000Da以上のケフィア抽出物は、陰イオン交換樹脂に吸着しない2つの成分(分子量31kDaの成分および分子量19kDaの成分)を含む。
本発明はまた、ケフィアから得られた水溶性画分(ケフィア水溶性画分)を用いたインスリン依存性糖尿病治療剤についても提供する。本発明のインスリン依存性糖尿病治療剤に用いられるケフィア水溶性画分は、ヨーグルト状のケフィア発酵乳液を、遠心分離、ろ過、デカンテーションなどの公知の適宜の方法で上清と沈殿物とに分離することで、得ることができる。
後述する実験例2で明らかにされるように、本発明者らは、ケフィアが脂肪前駆細胞の脂肪細胞への分化を抑制し、細胞内脂肪蓄積抑制効果が期待できることを見出した。また本発明者らは、ケフィアが、脂肪合成に関与する酵素であるグリセロール−3リン酸脱水素酵素(GPDH)の活性を抑制し、また脂肪細胞の分化に関係するPPAR(ペルオキシソーム増殖因子活性化レセプター:peroxisome proliferator-activated receptor)γの遺伝子発現を抑制することを確認した。さらにケフィアが、PPAR遺伝子の下流にコードされるaP2、LPLなどの酵素遺伝子の発現を抑制するとともに、PPAR遺伝子の上流にコードされる延命因子などとも呼ばれるSirt1のタンパク量を増加させることを確認した。これらの実験から、ケフィアは、脂肪細胞分化抑制作用を示すことが見出された。
本発明の健康食品は、分子量14000Da以上のケフィア抽出物を含むことを特徴とする。この分子量14000Da以上のケフィア抽出物は、本発明のインスリン非依存性糖尿病治療剤に用いられるケフィア抽出物と同じであり、上述と同様の方法により好適に製造できる。本発明は、この分子量14000Da以上のケフィア抽出物を含む健康食品についても提供するものであり、この本発明の健康食品によってもインスリン非依存性糖尿病(II型糖尿病)の改善または予防の効果が期待できる。本発明の健康食品は、上述のようにして得られた分子量14000Da以上のケフィア抽出物を粉末状または液体状で含有する。健康食品としては、従来公知の適宜の健康食品が揚げられ、特に制限されるものではない。
〔1〕クロロホルム:メタノール処理によるケフィア中の成分変化の検討
(1)分子量14000Da以上のケフィア抽出物の調製
100mlのヨーグルト状のケフィア発酵乳液(日本ケフィア株式会社より提供)を10,000×gで30分間遠心分離し、得られた上清より不純物を取り除くために同容量のエタノールを添加してエタノール沈殿を行った。その後、3,500×gで30分間遠心分離を行い、エタノール沈殿処理により生じた沈殿を除去して得られた上清をケフィア水溶性画分として得た。このケフィア水溶性画分を排出限界分子量14000Daの透析膜を用いて、ケフィア上清50mlあたり、Milli−Q水1Lにて終夜4℃で透析を行った。透析で得られた分子量14000Da以上のケフィア抽出物を含む溶液を凍結乾燥し、ケフィア水溶性画分50ml分の粉末/10ml Milli−Q水の割合に溶解し、分子量14000Da以上のケフィア抽出物を含むサンプル(サンプル1)を調製した。
上記で得られたケフィア水溶性画分に同容量のクロロホルム:メタノール(2:1)を添加し、クロロホルム:メタノール処理を行った。その後、3,000×gで30分間遠心分離を行い、上層の水層の回収を行った。水層を排出限界分子量14000Daの透析膜を用いて、水層50ml/Milli−Q水1Lの割合で終夜4℃で透析を行った。透析で得られた分子量14000Da以上のケフィア抽出物を含む溶液を凍結乾燥により濃縮した後、クロロホルム:メタノール沈殿処理前のケフィア水溶性画分と同容量のMilli−Q水を添加し溶解させて、クロロホルム:メタノール処理した分子量14000Da以上のケフィア抽出物を含むサンプル(サンプル2)を調製した。
(1)マウス由来前駆脂肪細胞3T3−L1の培養
脂肪細胞の一例としてマウス由来前駆脂肪細胞3T3−L1(ヒューマンサイエンス研究資源バンク(HSRRB)より入手)を用いた。細胞培養には、ダルベッコ変法イーグル培地(DMEM)を用いた。また、脂肪細胞への分化誘導試薬として1−メチル−3−イソブチルキサンチン(IBMX)、デキサメタゾン(DEX)およびインスリンを使用した。
上記〔1〕で調製したサンプル1,2を用いて、グルコース取り込み増強活性の検討を行った。まず、上述のようにして分化誘導させた脂肪細胞3T3−L1を1時間無血清培養した後、サンプル1,2を添加した各培地で4時間培養後、100nM インスリン刺激を20分間行った。グルコース取り込み検定は、トリチウム標識2−デオキシ−D−〔1−3H〕グルコースを細胞に取り込ませ、細胞を溶解し、液体シンチレーションカウンターを用いて測定した。またコントロールとして、サンプル1,2を添加しない以外は同様にした場合についてもグルコース取り込み検定を行った。
サンプル1,2について、タンパク質濃度をローリー法、糖濃度をフェノール硫酸法によって定量した。図2(a)は、サンプル1、2のタンパク質濃度を定量した結果を示すグラフであり、図2(b)はサンプル1,2の糖濃度を定量した結果を示すグラフである。図2(a)における縦軸はタンパク質濃度(μg/ml)を示し、また図2(b)における縦軸は糖濃度(μg/ml)を示している。図2から分かるように、クロロホルム:メタノール処理された場合(サンプル2)では、タンパク質量は15%以下に減少しているにもかかわらず、糖濃度は未処理の場合(サンプル1)とほぼ同程度であることが確認された。
グルコース取り込み増強活性成分のイオン性を明らかにするために、サンプル1について、イオン交換クロマトグラフィを行った。図3(a)はサンプル1についての陽イオン交換クロマトグラフィの結果を示すグラフであり、図3(b)はサンプル1についての陰イオン交換クロマトグラフィの結果を示すグラフである。図3(a),(b)において、図中左側の縦軸は280nmにおける吸光度、図中右側の縦軸はNaClのモル濃度(M)、横軸は時間(分)である。また図3(a),(b)において、実線は280nmにおける吸光度をそれぞれ示し、破線はNaClのモル濃度をそれぞれ示している。
グルコース取り込み増強活性成分の単離を行うために、トヨパールHW−55F(東ソー社製)を用い、サンプル1についてゲルろ過クロマトグラフィを行った。図5は、サンプル1についてのゲルろ過クロマトグラフィの結果を示すグラフであり、縦軸は280nmにおける吸光度、横軸は時間(分)である。図5から分かるように、分子量14000Da以上のケフィア抽出物を含むサンプル1から、8つの画分(ゲルろ過画分1〜8)が分取された。
〔1〕ケフィアの脂肪細胞分化抑制効果の検討
(1)細胞染色によるケフィアの細胞内脂肪蓄積抑制効果の検討
脂肪細胞分化における細胞内脂肪蓄積を調べるため、細胞内脂肪滴のオイルレッド(oil red O)染色を行った。まず、前駆脂肪細胞3T3−L1をPBSで2回洗浄した後、10%中性ホルマリンで室温(25℃)にて10分間固定した。固定後PBSで2回洗浄した。細胞を60% 2−プロパノールに1分間置換した後、オイルレッド染色液(1.8mg/ml 60% 2−プロパノール)で15分間、室温で染色を行った。染色後、60% 2−プロパノールで1回、PBSで2回洗浄した。染色したオイルレッド色素を抽出するために、4% Nonidet P−40/2−プロパノール1mlを添加し、15分間室温にて色素を抽出して溶液を回収し、溶出液の490nmにおける吸光度を測定し定量化を行った。
ケフィアの脂肪細胞分化抑制効果を検討するために、脂肪細胞分化に伴い活性が増加するグリセロール−3リン酸脱水素酵素(GPDH)の活性を測定した。前駆脂肪細胞3T3−L1を用い、上述と同様に分化誘導試薬の他、サンプル3,4を培地に対して10%の割合で添加して分化誘導させた。またコントロールとして、PBSを培地に対して10%の割合で添加した。GPDH活性測定は分化開始から、3日目、5日目、7日目、10日目の各日に行い、細胞内脂肪合成活性を経時的に評価した。GPDH活性測定に際しては、細胞をPBSで2回洗浄し、GPDH活性キット(株式会社ホクドー社製)の酵素抽出試薬を加え、室温で10分間反応させた後、超音波処理にて細胞破砕液を作製し、12,800×g、4℃で5分間遠心し、得られた上清を用いた。GPDH活性測定には、GPDH活性測定キットを用い、340nmにおけるNADH吸光度の変化を測定した。
(1)脂肪細胞分化関連分子のmRNA発現量変化の検討
C/EBP(CAAT/エンハンサー結合タンパク:CAAT/enhancer binding protein)ファミリー(C/EBPα、β、δ)とPPAR(ペルオキシソーム増殖因子活性化レセプター:peroxisome proliferator-activated receptor)ファミリーのγ−アイソフォーム(PPARγ1とPPARγ2)は脂肪細胞分化抑制に重要な役割を果たす。そこで、これら転写因子の発現にケフィアがどのように作用するかをRT−PCRによって調べた。また、脂肪細胞マーカー(adipocyte marker)として、aP2(脂肪酸結合タンパク:fatty-acid binding protein)、およびLPL(リポタンパクリパーゼ:lipoprotein lipase)についても、同様に調べた。これらは、PPARγをコードする遺伝子の下流の配列にコードされた酵素である。GAPDH(グリセルアルデヒド−3−リン酸デヒドロゲナーゼ:glyceraldehyde-3-phosphate dehydrogenase)は実験の内部標準として使用した。使用したプライマー、PCRのアニーリング温度、サイクル数などの反応条件を表2に示す。
ケフィア処理によってmRNAレベルで有意な発現量低下を示したPPARγについて、タンパク質レベルでの発現量の変化をウェスタンブロッティングによって検討した。まず、前駆脂肪細胞3T3−L1を用い、上述と同様に分化誘導試薬の他、サンプル4を培地に対して10%の割合で添加して分化誘導させた。コントロールとして、分化誘導試薬のみを添加した場合についても同様にして分化誘導させた。ウェスタンブロッティングは分化開始から3日目、5日目、7日目、10日目の各日に行った。細胞を回収し、SDS−PAGEの後、一次抗体として、抗PPARγ抗体(H−100:sc−7196;Santa Cruz Biotechnology,inc製、200倍希釈)にて処理を行い、二次抗体として、西洋ワサビペルオキシダーゼ標識抗ウサギIgG抗体(アマシャムバイオサイエンス社製、4000倍希釈)、検出にECL plus Westernblotting Detection System(アマシャムバイオサイエンス社製)で化学発光させ、LAS−1000(フジフィルム社製)により検出を行った。図13は、PPARγの経時的なタンパク質発現量変化の結果を示すウェスタンブロッティングである。図13において横軸は分化日数(日)であり、−で示されたレーンはサンプル4を添加しなかった場合、+で示されたレーンはサンプル4を添加した場合である。図13に示されるように、ケフィア処理後5日目に、脂肪細胞特異的に発現するPPARγ2の発現低下が認められた。
(1)ケフィアの脂肪細胞内脂肪の減少効果の検討
0.5倍濃度のケフィア水溶性画分のサンプル(サンプル5)および0.01倍濃度のケフィア脂溶性画分のサンプル(サンプル6)を用いて、ケフィアの脂肪細胞内脂肪に与える効果を検討した。ケフィア水溶性画分のサンプルであるサンプル5は、0.5倍濃度とした以外は上述したサンプル3,4と同様に調製した。ケフィア脂溶性画分のサンプルであるサンプル6については、まず、100mlのヨーグルト状のケフィア発酵乳液(日本ケフィア株式会社より提供)を10,000×gで30分間遠心分離し、得られた沈殿物に5倍容のクロロホルム−メタノール(2:1)を加えて1時間攪拌した。15,000×gで30分間遠心し、上清を回収した。沈殿物に5倍容のクロロホルム−メタノールを加え、上記の工程を繰り返した。回収した上清をエバポレータによって減圧濃縮し、乾燥物を得た。この乾燥物の1/100量をDMSO1mlに溶解したものをケフィア脂溶性画分1倍液とした。
ケフィアが脂肪分解に与える効果を検討するため、脂肪分解に伴い培地中に放出されるグリセロール量をAdipolysis Assay Kit(CHEMICON international Inc製)を用いて行った。分化誘導後の脂肪細胞3T3−L1に24時間ケフィア処理を行った後、培地を除き、100μlのWash Solutionで2回洗浄した。ケフィア処理には、1倍濃度とした以外は上述したサンプル3,4と同様に調製したケフィア水溶性画分のサンプル(サンプル7)または0.01倍濃度のケフィア脂溶性画分のサンプルである上述のサンプル6に、10%FBSを添加したものを用いた。24時間のケフィア処理後、溶液を除き、Incubation Solution+2% BSA中に0.25ml/穴加え、3時間インキュベートした。グリセロールフリーコンテナ中に細胞上清を集めた。グリセロール標準液(0.4μg/ml−26μg/ml)と培養上清25μlを96ウェルプレートに分注し、Free Glycerol Assay Regentを200μlずつ加えた。室温で15分インキュベートし、540nmの吸光度を測定し、グリセロール量の測定を行った。また、ケフィア処理に換えて、10%FBSのみを添加したこと以外は同様にした場合をコントロールとした。
アディポネクチンは脂肪細胞から分泌される代表的なインスリン感受性アディポサイトカインである。アディポネクチンの血中濃度は肥満者において低下し、内臓脂肪の蓄積とともに血中濃度が低下する。アディポネクチンは多くの臓器でエネルギー代謝を正常に働かせる重要な役割を担っている。そこでケフィア処理後のマウスアディポネクチンの発現量をリアルタイムにRT−PCRにより調べた。
アディポネクチンは骨格筋で脂肪酸の燃焼やエネルギー消費を促進し、中性脂肪含量を減少させる。ケフィアが骨格筋細胞におけるエネルギー代謝活性、特に脂肪酸燃焼に及ぼす効果を調べるため、パルミチン酸のβ酸化を測定した。脂肪酸のβ酸化は14C−パルミチン酸を添加し、代謝され生じた14CO2量を測定することにより評価した。
骨格筋細胞の一例としてマウス骨格筋由来筋由来筋芽細胞C2C12を使用した。C2C12筋芽細胞は10% FBS−DMEM培地で培養し、コンフルエントに達するまで1日間培養後、非働化した馬血清を2%含む培地に交換することにより筋管細胞への分化誘導を行い、分化誘導開始から4−10日目の細胞を用いた。
C2C12細胞を25ml容T−フラスコ(BD Falcon、BD Bioscience社製)に4×105cells/2ml播種し、分化誘導後の細胞を用いた。0.5倍濃縮のケフィア水溶性画分のサンプル(サンプル5)または0.01倍濃縮のケフィア脂溶性画分のサンプル(サンプル6)を用いて24時間のケフィア処理を行った後、グルコースフリーのDMEMで1時間プレインキュベートした。80μM Palmitate(1−14C Palmitate、0.2μCi/ml)(第一化学薬品株式会社製)、320μM 脂肪酸フリーウシ血清アルブミンを加え、30分インキュベートした後、培地を50ml容遠沈管に移した。2ml容チューブにHyamine Hydroxide 10−X(パーキンエルマージャパン社製)500μlを入れ、培地の入った50ml遠沈管に培地がチューブ内に侵入しないように注意しながら入れた。次に、培地からCO2を放出させるため、10%か塩素酸を培地に添加し、30分インキュベートし、Hyamine Hydroxide 10−X中にCO2を捕集した。Hyamine Hydroxide 10−Xの250μlを回収し、液体シンチレーションカクテル1mlを加え、液体シンチレーションカウンターで14Cの放射能測定を行った。また、ケフィア処理を行わなかった以外は同様にしたものをコントロールとした。
ケフィアの脂肪酸β酸化促進効果はどのようなメカニズムで起こっているかを調べるため、PPARδの発現量をリアルタイムRT−PCRにより調べた。骨格筋において飢餓時に誘導される遺伝子群はPPARδの活性化に伴い誘導される代謝関連遺伝子と重複する。PPARδの刺激はたとえば飽食下であっても脂肪蓄積ではなく燃焼・消費し、蓄積された脂肪を消費すると考えられた。
〔1〕HIT−T15細胞増殖に対する影響の検討
(1)HIT−T15細胞の培養
脾臓ランゲルハンス島β細胞の一例として、ハムスター由来脾臓β細胞株HIT−T15を使用した。HIT−T15細胞は10% FBS−RPMI1640培地で培養した。また、全ての細胞は37℃の加湿した5%炭酸ガス大気下で培養を行った。
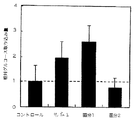
上述したようにして調製したケフィア水溶性画分を含むサンプルを、培地に対して最終濃度が10%、25%および50%となるようにそれぞれ添加した場合についてのHIT−T15細胞増殖を観察した。ケフィア水溶性画分を含むサンプルを添加後、3日目および6日目に細胞数計測器(Sysmex F−300、東亞医用機器株式会社製)を用いて細胞数を測定した。また、ケフィア水溶性画分を含むサンプルを添加しなかったこと以外は同様にしたものをコントロールとした。図21は、最終濃度10%、25%、50%となるようにケフィア水溶性画分を添加した場合およびコントロールについての経時的な細胞数を示すグラフであり、縦軸は細胞数(×10-5cells)、横軸は時間(日)を示している。図21に示されるように、ケフィア水溶性画分を含むサンプルを培地に対して25%、50%添加した場合には、コントロールと比較してHIT−T15細胞増殖を抑制した。一方、ケフィア水溶性画分を含むサンプルを培地に対して10%添加した場合に関しては、HIT−T15細胞の増殖に影響を及ぼさなかった。
(1)HIT−T15細胞生存率に対するアロキサンの効果
アロキサンは膵β細胞に特異的に毒性を及ぼす。アロキサン毒性に対する膵β細胞の感受性は、細胞株ごとで異なっている。そのため、HIT−T15細胞に対するアロキサンの細胞毒性を調べた。アロキサンの添加濃度を0.05mMから5mMまで変えて、アロキサン処理を1時間行い、培地を交換し、24時間後におけるHIT−T15細胞の生存率を評価した。またアロキサンを添加したかったこと以外は同様にした場合をコントロールとした。図22は、各濃度でアロキサンを添加した場合およびコントロールについてのHIT−T15細胞の生存率の測定結果を示すグラフであり、縦軸は細胞生存率(%)を示している。図22に示されるように、培地にアロキサンを添加することによって、アロキサンの濃度依存的にHIT−T15細胞の生存率が減少された。たとえばアロキサン添加濃度が2.5mMの場合には、コントロールと比較して52%の細胞生存率を示した。
アロキサンにより誘導されるHIT−T15細胞生存率の減少に対するケフィア水溶性画分の効果を調べた。ケフィア水溶性画分を含むサンプルとしては、次のようにして分子量1000Da未満のケフィア抽出物を含むサンプル(サンプル8)および分子量1000Da以上のケフィア抽出物を含むサンプル(サンプル9)を調製して用いた。まず、100mlのヨーグルト状のケフィア発酵乳液(日本ケフィア株式会社より提供)を10000×gで30分間遠心分離し、得られた上清を排出限界分子量1000Daの透析膜を用いて、ケフィア上清100mlあたり、Milli−Q水3Lの割合とし、終夜4℃で透析を行った。透析外液である分子量1000Da未満の溶液は、減圧濃縮を行い、凍結乾燥後、Milli Q水に溶解して分子量1000Da未満のケフィア抽出物を含むサンプル(サンプル8)とした。また透析内液はそのまま凍結乾燥した後、Milli Q水に溶解して分子量1000Da以上のケフィア抽出物を含むサンプル(サンプル9)とした。さらに、透析を行う前の上清も、ケフィア水溶性を含むサンプル(サンプル10)として用いた。HIT−T15細胞に2.5mMの濃度でアロキサンを添加し、さらにサンプル8、サンプル9またはサンプル10を最終濃度が10%となるように培地に添加した後、細胞生存率を測定した。また、ケフィア水溶性画分を含むサンプルを添加しなかった場合、アロキサンを添加しなかった場合をコントロールとした。
HIT−T15細胞を2×105cells/mlで24穴プレートに播種し、ケフィア水溶性画分を含むサンプルを添加した培地中で24時間前培養した。ケフィア水溶性画分を含むサンプルとしては、上述と同様、分子量1000Da未満のケフィア抽出物を含むサンプル(サンプル8)、分子量1000Da以上のケフィア抽出物を含むサンプル(サンプル9)および透析前の上清(サンプル10)を用い、最終濃度が10%となるように培地に添加した。その後、2.5mMアロキサンを含むKrebs Ringer bicarbonate buffer(KRB)液、またはアロキサンを含まないKRB液で洗浄後、15mMのグルコースを含むKRB液で1時間、37℃でグルコース刺激を行った。上清を回収し、Insulin ELISA kitによりインスリン放出量を測定した。また、ケフィア水溶性画分を含むサンプルを添加しなかったこと以外は同様にした場合をコントロールとした。
HIT−T15細胞を2×105cells/mlで6穴プレートに播種し、ケフィア水溶性画分を含むサンプルを添加した培地中で24時間前培養した。ケフィア水溶性画分を含むサンプルとしては、上述と同様、分子量1000Da未満のケフィア抽出物を含むサンプル(サンプル8)、分子量1000Da以上のケフィア抽出物を含むサンプル(サンプル9)および透析前の上清(サンプル10)を用い、最終濃度が10%となるように培地に添加した。その後、2.5mMアロキサンを含むKRB液、またはアロキサンを含まないKRB液で30分間、37℃で処理した。KRB液で洗浄後、15mMのグルコースを含むKRB液で37℃、1時間処理し、グルコース刺激を行った。刺激後、トリプシンで細胞を回収し、洗浄後、遠心(200×g、5分間)し、上清を捨てた。4×105cells/mlの細胞密度になるよう10mM Tris−4mM EDTA(pH7.8)を加え、懸濁した。沸騰水中で2分間インキュベートし、遠心(600×g、5分間)し、上清を新しいエッペンドルフチューブに移した。サンプルを50μlとり、ルシフェラーゼ溶液50μlと混合し、素早くルミノメーター(Aloka製、type BLR−301)で測定した。また、ケフィア水溶性画分を含むサンプルを添加しなかったこと以外は同様にした場合をコントロールとした。
フリーラジカルは、膵β細胞におけるアロキサンの細胞毒性に関与しているとされている。そこで、アロキサンで処理したHIT−T15細胞の細胞内酸化還元状態を、ROS感受性プローブであるDCFH−DAを用いて調べた。方法としては、HIT−T15細胞5×106cellsを60mm dishに播種し、ケフィア水溶性画分を含むサンプルを添加したHBSS溶液で24時間培養した。ケフィア水溶性画分を含むサンプルとしては、上述と同様、分子量1000Da未満のケフィア抽出物を含むサンプル(サンプル8)、分子量1000Da以上のケフィア抽出物を含むサンプル(サンプル9)および透析前の上清(サンプル10)を用い、最終濃度が10%となるように添加した。サンプル処理後、2.5mMアロキサンを含むHBSS溶液、またはアロキサンを含まないHBSS溶液で30分間、37℃で処理した。上清を捨て、PBS(−)で洗浄後、5μM DCFH−DAを含むCa2+、Mg2+−free HBSS溶液で15分間、37℃でインキュベートした。トリプシン処理で細胞を回収し、遠心(200×g、5分間)し、上清を捨てた。Ca2+、Mg2+−free HBSS溶液1mlで懸濁後、EPICS XL/XL−MLL System II(BECKMAN COULTER)を用いてDCF蛍光強度のフローサイトメトリー(励起波長:488nm、蛍光波長:530nm(FL1))解析を行った。DCFH−DAは細胞に取り込まれた後、細胞内のエステラーゼで加水分解されて膜非透過性のDCFHになる。さらに、細胞内の活性酸素種(ROS)によって酸化され蛍光物質DCFとなるため、蛍光強度を測定することで細胞内の相対的酸化還元状態を評価できる。また、ケフィア水溶性画分を含むサンプルを添加しなかったこと以外は同様にした場合をコントロールとした。
アロキサン誘導糖尿病マウスに対するケフィア水溶性画分の効果を検討した。この動物実験は、「九州大学大学院農学研究院、大学院生物資源環境科学府及び農学における動物実験指針」、「動物の愛護及び管理に関する法律」(昭和48年10月1日法律第105号)、「実験動物の飼養及び保管等に関する基準」(昭和55年3月27日総理府告示第6号)の規則に基づいて行われた。ICRマウスは日本チャールズ・リバー社から購入した。4週齢より1週間の予備飼育を経た後、5週齢時に無作為にグループ分けを行った。各グループを表4に示す。
Claims (10)
- 分子量14000Da以上のケフィア抽出物を含む、インスリン非依存性糖尿病治療剤。
- ケフィアから得られた水溶性画分を用いた、インスリン依存性糖尿病治療剤。
- 分子量1000Da未満のケフィア抽出物を含むことを特徴とする、請求項2に記載のインスリン依存性糖尿病治療剤。
- ケフィアを用いた抗肥満剤。
- ケフィアから得られた水溶性画分を含む、請求項4に記載の抗肥満剤。
- 分子量14000Da以上のケフィア抽出物を含む健康食品。
- ケフィアから上清を分離する工程と、得られた上清から分子量14000Da以上のケフィア抽出物を得る工程とを含む、インスリン非依存性糖尿病治療剤の製造方法。
- ケフィアから上清を分離する工程を含む、インスリン依存性糖尿病治療剤の製造方法。
- 得られた上清から分子量1000Da未満のケフィア抽出物を得る工程をさらに含む、請求項8に記載のインスリン依存性糖尿病治療剤の製造方法。
- ケフィアから上清を分離する工程を含む、抗肥満剤の製造方法。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006265274A JP4557231B2 (ja) | 2006-09-28 | 2006-09-28 | ケフィアを用いた薬剤およびその製造方法、健康食品 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2006265274A JP4557231B2 (ja) | 2006-09-28 | 2006-09-28 | ケフィアを用いた薬剤およびその製造方法、健康食品 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| JP2008081461A true JP2008081461A (ja) | 2008-04-10 |
| JP4557231B2 JP4557231B2 (ja) | 2010-10-06 |
Family
ID=39352663
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2006265274A Active JP4557231B2 (ja) | 2006-09-28 | 2006-09-28 | ケフィアを用いた薬剤およびその製造方法、健康食品 |
Country Status (1)
| Country | Link |
|---|---|
| JP (1) | JP4557231B2 (ja) |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010037225A (ja) * | 2008-08-01 | 2010-02-18 | Nippon Kefia Kk | 乳清ケフィアを有効成分として含んでなる体脂肪減少剤 |
| KR20190122636A (ko) * | 2019-10-24 | 2019-10-30 | 건국대학교 산학협력단 | 케피어를 포함하는 반려동물용 식품 조성물 및 사료 첨가제 |
| CN116687000A (zh) * | 2023-06-28 | 2023-09-05 | 山东天久生物技术有限公司 | 牡蛎肽和雪莲菌活性肽组合物及其制备方法 |
| TWI818267B (zh) * | 2021-06-03 | 2023-10-11 | 國立中興大學 | 小分子克弗爾胞外多醣萃取物用於治療或預防糖尿病及促進胰島再生與抗發炎之用途 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02219538A (ja) * | 1989-02-20 | 1990-09-03 | Kyodo Nyugyo Kk | 乳酸菌飲料とその製造方法 |
| JPH0838047A (ja) * | 1994-07-26 | 1996-02-13 | Kyodo Nyugyo Kk | 健康食品 |
| JPH0937711A (ja) * | 1995-07-28 | 1997-02-10 | Sennosuke Tokumaru | 健康食品 |
| JPH11346717A (ja) * | 1998-06-15 | 1999-12-21 | Sennosuke Tokumaru | ダイエット健康食品 |
| JP2002104979A (ja) * | 2000-09-29 | 2002-04-10 | Nippon Kefia Kk | ケフィアを用いた糖尿病治療剤とその製造方法、及びケフィアを用いた放射線障害防護剤、並びにケフィアを用いた健康食品 |
| JP2003292448A (ja) * | 2002-03-29 | 2003-10-15 | Nippon Kefia Kk | ケフィアを用いた抗酸化剤、これを用いた糖尿病治療剤、dna修復作用を有する組織修復剤及び健康食品、ケフィアを用いた抗酸化剤の製造方法並びに同定方法 |
-
2006
- 2006-09-28 JP JP2006265274A patent/JP4557231B2/ja active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JPH02219538A (ja) * | 1989-02-20 | 1990-09-03 | Kyodo Nyugyo Kk | 乳酸菌飲料とその製造方法 |
| JPH0838047A (ja) * | 1994-07-26 | 1996-02-13 | Kyodo Nyugyo Kk | 健康食品 |
| JPH0937711A (ja) * | 1995-07-28 | 1997-02-10 | Sennosuke Tokumaru | 健康食品 |
| JPH11346717A (ja) * | 1998-06-15 | 1999-12-21 | Sennosuke Tokumaru | ダイエット健康食品 |
| JP2002104979A (ja) * | 2000-09-29 | 2002-04-10 | Nippon Kefia Kk | ケフィアを用いた糖尿病治療剤とその製造方法、及びケフィアを用いた放射線障害防護剤、並びにケフィアを用いた健康食品 |
| JP2003292448A (ja) * | 2002-03-29 | 2003-10-15 | Nippon Kefia Kk | ケフィアを用いた抗酸化剤、これを用いた糖尿病治療剤、dna修復作用を有する組織修復剤及び健康食品、ケフィアを用いた抗酸化剤の製造方法並びに同定方法 |
Cited By (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010037225A (ja) * | 2008-08-01 | 2010-02-18 | Nippon Kefia Kk | 乳清ケフィアを有効成分として含んでなる体脂肪減少剤 |
| KR20190122636A (ko) * | 2019-10-24 | 2019-10-30 | 건국대학교 산학협력단 | 케피어를 포함하는 반려동물용 식품 조성물 및 사료 첨가제 |
| KR102136559B1 (ko) * | 2019-10-24 | 2020-07-22 | 건국대학교 산학협력단 | 케피어를 포함하는 반려동물용 식품 조성물 및 사료 첨가제 |
| TWI818267B (zh) * | 2021-06-03 | 2023-10-11 | 國立中興大學 | 小分子克弗爾胞外多醣萃取物用於治療或預防糖尿病及促進胰島再生與抗發炎之用途 |
| CN116687000A (zh) * | 2023-06-28 | 2023-09-05 | 山东天久生物技术有限公司 | 牡蛎肽和雪莲菌活性肽组合物及其制备方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| JP4557231B2 (ja) | 2010-10-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| Liu et al. | Anthocyanin increases adiponectin secretion and protects against diabetes-related endothelial dysfunction | |
| Xu et al. | Quercetin‐3‐o‐glucuronide alleviates cognitive deficit and toxicity in Aβ1‐42‐induced ad‐like mice and SH‐SY5Y cells | |
| JP6316501B2 (ja) | アッカーマンシア・ムシニフィラ菌に由来する細胞外小胞を有効成分として含有する代謝疾患の治療または予防用の組成物 | |
| Yang et al. | Myricetin ameliorated prediabetes via immunomodulation and gut microbiota interaction | |
| Li et al. | Phytotherapy using blueberry leaf polyphenols to alleviate non-alcoholic fatty liver disease through improving mitochondrial function and oxidative defense | |
| Chen et al. | Pancreatic lipase inhibition of strictinin isolated from Pu’er tea (Cammelia sinensis) and its anti-obesity effects in C57BL6 mice | |
| CN107949394B (zh) | 黑豆叶提取物在制备用于预防或治疗代谢综合征的药物中的用途 | |
| Ntamo et al. | Epigallocatechin gallate as a nutraceutical to potentially target the metabolic syndrome: Novel insights into therapeutic effects beyond its antioxidant and anti-inflammatory properties | |
| Cao et al. | The protective effects of yellow tea extract against loperamide-induced constipation in mice | |
| Mehmood et al. | Stevia residue extract increases intestinal uric acid excretion via interactions with intestinal urate transporters in hyperuricemic mice | |
| Jiang et al. | Cyanidin-3-O-β-glucoside combined with its metabolite protocatechuic acid attenuated the activation of mice hepatic stellate cells | |
| Kou et al. | Nobiletin activates thermogenesis of brown and white adipose tissue in high‐fat diet‐fed C57BL/6 mice by shaping the gut microbiota | |
| KR101952644B1 (ko) | 양춘사 추출물을 함유하는 비만 예방, 개선 또는 치료 조성물 | |
| An et al. | Antiobesity and antidiabetic effects of the dairy bacterium Propionibacterium freudenreichii MJ2 in high-fat diet-induced obese mice by modulating lipid metabolism | |
| JP4557231B2 (ja) | ケフィアを用いた薬剤およびその製造方法、健康食品 | |
| EP2992933B1 (en) | Ginsenoside f2 for prophylaxis and treatment of liver disease | |
| Mostafa | Effect of green tea and green tea rich with catechin on blood glucose levels, serum lipid profile and liver and kidney functions in diabetic rats | |
| Hussein et al. | Anti-obesity effects of individual or combination treatment with Spirulina platensis and green coffee bean aqueous extracts in high-fat diet-induced obese rats | |
| Fan et al. | Mn (II)-mediated self-assembly of tea polysaccharide nanoparticles and their functional role in mice with type 2 diabetes | |
| Yuan et al. | A polysaccharide from Sargassum pallidum reduces obesity in high-fat diet-induced obese mice by modulating glycolipid metabolism | |
| Khalaf et al. | Effects of bee propolis on blood pressure record and certain biochemical parameter in healthy volunteers | |
| Akalın et al. | In vivo antidiabetic activities of green and black tea polysaccharides using streptozotocin-induced diabetic mice fed with a high-fat diet | |
| He et al. | Lipid-lowering activity of metformin-soluble soybean polysaccharide nanoparticles | |
| Shehata et al. | Effect of curcumin-magnesium oxide nanoparticles conjugate in type-II diabetic rats | |
| JP5783552B2 (ja) | 体脂肪低減剤及び体脂肪低減食品 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20090901 |
|
| A871 | Explanation of circumstances concerning accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A871 Effective date: 20090901 |
|
| A975 | Report on accelerated examination |
Free format text: JAPANESE INTERMEDIATE CODE: A971005 Effective date: 20090930 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20091020 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20091217 |
|
| A02 | Decision of refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A02 Effective date: 20100202 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20100430 |
|
| A911 | Transfer to examiner for re-examination before appeal (zenchi) |
Free format text: JAPANESE INTERMEDIATE CODE: A911 Effective date: 20100610 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20100629 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20100714 |
|
| R150 | Certificate of patent or registration of utility model |
Ref document number: 4557231 Country of ref document: JP Free format text: JAPANESE INTERMEDIATE CODE: R150 Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20130730 Year of fee payment: 3 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| S531 | Written request for registration of change of domicile |
Free format text: JAPANESE INTERMEDIATE CODE: R313531 |
|
| R350 | Written notification of registration of transfer |
Free format text: JAPANESE INTERMEDIATE CODE: R350 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |
|
| R250 | Receipt of annual fees |
Free format text: JAPANESE INTERMEDIATE CODE: R250 |