JP2005502314A - ワクチン - Google Patents
ワクチン Download PDFInfo
- Publication number
- JP2005502314A JP2005502314A JP2002570736A JP2002570736A JP2005502314A JP 2005502314 A JP2005502314 A JP 2005502314A JP 2002570736 A JP2002570736 A JP 2002570736A JP 2002570736 A JP2002570736 A JP 2002570736A JP 2005502314 A JP2005502314 A JP 2005502314A
- Authority
- JP
- Japan
- Prior art keywords
- protein
- mouse
- human
- cil
- sequence
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 229960005486 vaccine Drugs 0.000 title description 47
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 48
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 44
- 229920001184 polypeptide Polymers 0.000 claims abstract description 39
- 238000000034 method Methods 0.000 claims abstract description 34
- 102000004127 Cytokines Human genes 0.000 claims abstract description 20
- 108090000695 Cytokines Proteins 0.000 claims abstract description 20
- 239000003814 drug Substances 0.000 claims abstract description 10
- 239000008194 pharmaceutical composition Substances 0.000 claims abstract description 8
- 108090000623 proteins and genes Proteins 0.000 claims description 156
- 102000004169 proteins and genes Human genes 0.000 claims description 147
- 102000003816 Interleukin-13 Human genes 0.000 claims description 79
- 108090000176 Interleukin-13 Proteins 0.000 claims description 79
- 239000002671 adjuvant Substances 0.000 claims description 44
- 239000000203 mixture Substances 0.000 claims description 36
- 230000035772 mutation Effects 0.000 claims description 33
- 150000001413 amino acids Chemical class 0.000 claims description 30
- 230000003472 neutralizing effect Effects 0.000 claims description 30
- 102000003839 Human Proteins Human genes 0.000 claims description 27
- 108090000144 Human Proteins Proteins 0.000 claims description 27
- 102000040430 polynucleotide Human genes 0.000 claims description 27
- 108091033319 polynucleotide Proteins 0.000 claims description 27
- 239000002157 polynucleotide Substances 0.000 claims description 27
- 238000006467 substitution reaction Methods 0.000 claims description 23
- 230000028993 immune response Effects 0.000 claims description 22
- 208000006673 asthma Diseases 0.000 claims description 21
- 101001076430 Homo sapiens Interleukin-13 Proteins 0.000 claims description 20
- 108090000978 Interleukin-4 Proteins 0.000 claims description 19
- 241001465754 Metazoa Species 0.000 claims description 19
- 108091034117 Oligonucleotide Proteins 0.000 claims description 19
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 19
- 102000019207 human interleukin-13 Human genes 0.000 claims description 19
- 210000003719 b-lymphocyte Anatomy 0.000 claims description 18
- 201000010099 disease Diseases 0.000 claims description 18
- 238000011282 treatment Methods 0.000 claims description 18
- 230000005875 antibody response Effects 0.000 claims description 16
- JLCPHMBAVCMARE-UHFFFAOYSA-N [3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[3-[[3-[[3-[[3-[[3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-[[5-(2-amino-6-oxo-1H-purin-9-yl)-3-hydroxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxyoxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(5-methyl-2,4-dioxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(6-aminopurin-9-yl)oxolan-2-yl]methoxy-hydroxyphosphoryl]oxy-5-(4-amino-2-oxopyrimidin-1-yl)oxolan-2-yl]methyl [5-(6-aminopurin-9-yl)-2-(hydroxymethyl)oxolan-3-yl] hydrogen phosphate Polymers Cc1cn(C2CC(OP(O)(=O)OCC3OC(CC3OP(O)(=O)OCC3OC(CC3O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c3nc(N)[nH]c4=O)C(COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3COP(O)(=O)OC3CC(OC3CO)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3ccc(N)nc3=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cc(C)c(=O)[nH]c3=O)n3cc(C)c(=O)[nH]c3=O)n3ccc(N)nc3=O)n3cc(C)c(=O)[nH]c3=O)n3cnc4c3nc(N)[nH]c4=O)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)n3cnc4c(N)ncnc34)O2)c(=O)[nH]c1=O JLCPHMBAVCMARE-UHFFFAOYSA-N 0.000 claims description 15
- 125000003275 alpha amino acid group Chemical group 0.000 claims description 13
- 239000013598 vector Substances 0.000 claims description 12
- 230000003308 immunostimulating effect Effects 0.000 claims description 7
- 230000001404 mediated effect Effects 0.000 claims description 7
- 238000004519 manufacturing process Methods 0.000 claims description 6
- 241000894007 species Species 0.000 claims description 6
- 239000003937 drug carrier Substances 0.000 claims description 3
- FWMNVWWHGCHHJJ-SKKKGAJSSA-N 4-amino-1-[(2r)-6-amino-2-[[(2r)-2-[[(2r)-2-[[(2r)-2-amino-3-phenylpropanoyl]amino]-3-phenylpropanoyl]amino]-4-methylpentanoyl]amino]hexanoyl]piperidine-4-carboxylic acid Chemical compound C([C@H](C(=O)N[C@H](CC(C)C)C(=O)N[C@H](CCCCN)C(=O)N1CCC(N)(CC1)C(O)=O)NC(=O)[C@H](N)CC=1C=CC=CC=1)C1=CC=CC=C1 FWMNVWWHGCHHJJ-SKKKGAJSSA-N 0.000 claims description 2
- 102000008300 Mutant Proteins Human genes 0.000 claims description 2
- 108010021466 Mutant Proteins Proteins 0.000 claims description 2
- 239000000546 pharmaceutical excipient Substances 0.000 claims description 2
- 238000005215 recombination Methods 0.000 claims 1
- 230000006798 recombination Effects 0.000 claims 1
- 230000003053 immunization Effects 0.000 abstract description 17
- 238000002649 immunization Methods 0.000 abstract description 17
- 239000000427 antigen Substances 0.000 abstract description 16
- 102000036639 antigens Human genes 0.000 abstract description 15
- 108091007433 antigens Proteins 0.000 abstract description 15
- 230000002163 immunogen Effects 0.000 abstract description 15
- 241000282412 Homo Species 0.000 abstract description 12
- 238000002360 preparation method Methods 0.000 abstract description 7
- 150000001875 compounds Chemical class 0.000 abstract description 4
- 238000001727 in vivo Methods 0.000 abstract description 3
- 235000018102 proteins Nutrition 0.000 description 118
- 210000002966 serum Anatomy 0.000 description 60
- 101001076402 Mus musculus Interleukin-13 Proteins 0.000 description 53
- 210000004027 cell Anatomy 0.000 description 51
- 241000699666 Mus <mouse, genus> Species 0.000 description 49
- 235000001014 amino acid Nutrition 0.000 description 33
- 229940024606 amino acid Drugs 0.000 description 29
- 241000699670 Mus sp. Species 0.000 description 25
- 230000004071 biological effect Effects 0.000 description 24
- 101001002703 Mus musculus Interleukin-4 Proteins 0.000 description 22
- 150000007523 nucleic acids Chemical class 0.000 description 22
- 238000010790 dilution Methods 0.000 description 21
- 239000012895 dilution Substances 0.000 description 21
- 230000004044 response Effects 0.000 description 21
- 102000039446 nucleic acids Human genes 0.000 description 20
- 108020004707 nucleic acids Proteins 0.000 description 20
- 108020004414 DNA Proteins 0.000 description 19
- 238000002965 ELISA Methods 0.000 description 19
- 102000004388 Interleukin-4 Human genes 0.000 description 18
- 229940046168 CpG oligodeoxynucleotide Drugs 0.000 description 17
- CTMZLDSMFCVUNX-VMIOUTBZSA-N cytidylyl-(3'->5')-guanosine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@H](O)[C@H](OP(O)(=O)OC[C@@H]2[C@H]([C@@H](O)[C@@H](O2)N2C3=C(C(N=C(N)N3)=O)N=C2)O)[C@@H](CO)O1 CTMZLDSMFCVUNX-VMIOUTBZSA-N 0.000 description 16
- 239000006180 TBST buffer Substances 0.000 description 15
- 238000006386 neutralization reaction Methods 0.000 description 15
- 101000617823 Homo sapiens Solute carrier organic anion transporter family member 6A1 Proteins 0.000 description 13
- 238000000338 in vitro Methods 0.000 description 13
- 230000000694 effects Effects 0.000 description 12
- 238000002255 vaccination Methods 0.000 description 12
- 230000008859 change Effects 0.000 description 11
- 238000003556 assay Methods 0.000 description 10
- 102000005962 receptors Human genes 0.000 description 10
- 108020003175 receptors Proteins 0.000 description 10
- 239000000758 substrate Substances 0.000 description 10
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 9
- AYFVYJQAPQTCCC-GBXIJSLDSA-N L-threonine Chemical compound C[C@@H](O)[C@H](N)C(O)=O AYFVYJQAPQTCCC-GBXIJSLDSA-N 0.000 description 9
- 102000013968 STAT6 Transcription Factor Human genes 0.000 description 9
- 108010011005 STAT6 Transcription Factor Proteins 0.000 description 9
- 238000004166 bioassay Methods 0.000 description 9
- 239000000243 solution Substances 0.000 description 9
- 238000001262 western blot Methods 0.000 description 9
- MTCFGRXMJLQNBG-REOHCLBHSA-N (2S)-2-Amino-3-hydroxypropansäure Chemical compound OC[C@H](N)C(O)=O MTCFGRXMJLQNBG-REOHCLBHSA-N 0.000 description 8
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 8
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 8
- 229940098773 bovine serum albumin Drugs 0.000 description 8
- 239000013604 expression vector Substances 0.000 description 8
- 238000009472 formulation Methods 0.000 description 8
- 108020001507 fusion proteins Proteins 0.000 description 8
- 102000037865 fusion proteins Human genes 0.000 description 8
- 239000002245 particle Substances 0.000 description 8
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 7
- 241000124008 Mammalia Species 0.000 description 7
- 238000004458 analytical method Methods 0.000 description 7
- 238000013459 approach Methods 0.000 description 7
- 238000002474 experimental method Methods 0.000 description 7
- 230000014509 gene expression Effects 0.000 description 7
- -1 IL-14 Proteins 0.000 description 6
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 6
- ZDXPYRJPNDTMRX-VKHMYHEASA-N L-glutamine Chemical compound OC(=O)[C@@H](N)CCC(N)=O ZDXPYRJPNDTMRX-VKHMYHEASA-N 0.000 description 6
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 6
- 108091028043 Nucleic acid sequence Proteins 0.000 description 6
- 108010058846 Ovalbumin Proteins 0.000 description 6
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 6
- 239000002585 base Substances 0.000 description 6
- 238000013461 design Methods 0.000 description 6
- 239000008055 phosphate buffer solution Substances 0.000 description 6
- 239000000725 suspension Substances 0.000 description 6
- 238000005406 washing Methods 0.000 description 6
- 102000014914 Carrier Proteins Human genes 0.000 description 5
- 108010078791 Carrier Proteins Proteins 0.000 description 5
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 5
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 5
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 5
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 5
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 5
- KDXKERNSBIXSRK-UHFFFAOYSA-N Lysine Natural products NCCCCC(N)C(O)=O KDXKERNSBIXSRK-UHFFFAOYSA-N 0.000 description 5
- 201000009961 allergic asthma Diseases 0.000 description 5
- 208000019425 cirrhosis of liver Diseases 0.000 description 5
- 239000007924 injection Substances 0.000 description 5
- 238000002347 injection Methods 0.000 description 5
- 230000003993 interaction Effects 0.000 description 5
- 230000026731 phosphorylation Effects 0.000 description 5
- 238000006366 phosphorylation reaction Methods 0.000 description 5
- 239000013612 plasmid Substances 0.000 description 5
- 239000000047 product Substances 0.000 description 5
- 239000004475 Arginine Substances 0.000 description 4
- DCXYFEDJOCDNAF-UHFFFAOYSA-N Asparagine Natural products OC(=O)C(N)CC(N)=O DCXYFEDJOCDNAF-UHFFFAOYSA-N 0.000 description 4
- 241000588724 Escherichia coli Species 0.000 description 4
- 208000006968 Helminthiasis Diseases 0.000 description 4
- 206010020751 Hypersensitivity Diseases 0.000 description 4
- 108010002350 Interleukin-2 Proteins 0.000 description 4
- 102000000588 Interleukin-2 Human genes 0.000 description 4
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 4
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 4
- 239000004472 Lysine Substances 0.000 description 4
- 108700001237 Nucleic Acid-Based Vaccines Proteins 0.000 description 4
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 4
- 210000001744 T-lymphocyte Anatomy 0.000 description 4
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 4
- 239000004473 Threonine Substances 0.000 description 4
- 108090000190 Thrombin Proteins 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 125000000539 amino acid group Chemical group 0.000 description 4
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 description 4
- 235000009582 asparagine Nutrition 0.000 description 4
- 229960001230 asparagine Drugs 0.000 description 4
- 235000003704 aspartic acid Nutrition 0.000 description 4
- 239000011324 bead Substances 0.000 description 4
- RIIWUGSYXOBDMC-UHFFFAOYSA-N benzene-1,2-diamine;hydron;dichloride Chemical compound Cl.Cl.NC1=CC=CC=C1N RIIWUGSYXOBDMC-UHFFFAOYSA-N 0.000 description 4
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 4
- 239000011545 carbonate/bicarbonate buffer Substances 0.000 description 4
- 238000003776 cleavage reaction Methods 0.000 description 4
- 230000009260 cross reactivity Effects 0.000 description 4
- 230000004927 fusion Effects 0.000 description 4
- 230000002068 genetic effect Effects 0.000 description 4
- 235000013922 glutamic acid Nutrition 0.000 description 4
- 239000004220 glutamic acid Substances 0.000 description 4
- ZDXPYRJPNDTMRX-UHFFFAOYSA-N glutamine Natural products OC(=O)C(N)CCC(N)=O ZDXPYRJPNDTMRX-UHFFFAOYSA-N 0.000 description 4
- DOUYETYNHWVLEO-UHFFFAOYSA-N imiquimod Chemical compound C1=CC=CC2=C3N(CC(C)C)C=NC3=C(N)N=C21 DOUYETYNHWVLEO-UHFFFAOYSA-N 0.000 description 4
- 210000000987 immune system Anatomy 0.000 description 4
- 230000006058 immune tolerance Effects 0.000 description 4
- 238000011534 incubation Methods 0.000 description 4
- AGPKZVBTJJNPAG-UHFFFAOYSA-N isoleucine Natural products CCC(C)C(N)C(O)=O AGPKZVBTJJNPAG-UHFFFAOYSA-N 0.000 description 4
- 229960000310 isoleucine Drugs 0.000 description 4
- 239000006166 lysate Substances 0.000 description 4
- 229940023146 nucleic acid vaccine Drugs 0.000 description 4
- 239000002773 nucleotide Substances 0.000 description 4
- 208000014837 parasitic helminthiasis infectious disease Diseases 0.000 description 4
- 102000013415 peroxidase activity proteins Human genes 0.000 description 4
- 108040007629 peroxidase activity proteins Proteins 0.000 description 4
- 230000008569 process Effects 0.000 description 4
- 230000035755 proliferation Effects 0.000 description 4
- BXNMTOQRYBFHNZ-UHFFFAOYSA-N resiquimod Chemical compound C1=CC=CC2=C(N(C(COCC)=N3)CC(C)(C)O)C3=C(N)N=C21 BXNMTOQRYBFHNZ-UHFFFAOYSA-N 0.000 description 4
- 230000007017 scission Effects 0.000 description 4
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- RYYWUUFWQRZTIU-UHFFFAOYSA-K thiophosphate Chemical compound [O-]P([O-])([O-])=S RYYWUUFWQRZTIU-UHFFFAOYSA-K 0.000 description 4
- 229960004072 thrombin Drugs 0.000 description 4
- 239000004474 valine Substances 0.000 description 4
- 230000003612 virological effect Effects 0.000 description 4
- 108091032973 (ribonucleotides)n+m Proteins 0.000 description 3
- 241000283690 Bos taurus Species 0.000 description 3
- 241000282472 Canis lupus familiaris Species 0.000 description 3
- 241000282693 Cercopithecidae Species 0.000 description 3
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 3
- 206010016654 Fibrosis Diseases 0.000 description 3
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 description 3
- 239000004471 Glycine Substances 0.000 description 3
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 3
- 241000700721 Hepatitis B virus Species 0.000 description 3
- 101001002709 Homo sapiens Interleukin-4 Proteins 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- 108010002616 Interleukin-5 Proteins 0.000 description 3
- 102000000743 Interleukin-5 Human genes 0.000 description 3
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 3
- QNAYBMKLOCPYGJ-REOHCLBHSA-N L-alanine Chemical compound C[C@H](N)C(O)=O QNAYBMKLOCPYGJ-REOHCLBHSA-N 0.000 description 3
- 241001529936 Murinae Species 0.000 description 3
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 3
- 238000002835 absorbance Methods 0.000 description 3
- 235000004279 alanine Nutrition 0.000 description 3
- 229940037003 alum Drugs 0.000 description 3
- 230000000890 antigenic effect Effects 0.000 description 3
- 230000015572 biosynthetic process Effects 0.000 description 3
- 238000005119 centrifugation Methods 0.000 description 3
- 238000006243 chemical reaction Methods 0.000 description 3
- 239000003153 chemical reaction reagent Substances 0.000 description 3
- 230000007882 cirrhosis Effects 0.000 description 3
- 230000000139 costimulatory effect Effects 0.000 description 3
- 230000001186 cumulative effect Effects 0.000 description 3
- 238000012217 deletion Methods 0.000 description 3
- 230000037430 deletion Effects 0.000 description 3
- 239000000839 emulsion Substances 0.000 description 3
- 239000002158 endotoxin Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000003623 enhancer Substances 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- PCHJSUWPFVWCPO-UHFFFAOYSA-N gold Chemical compound [Au] PCHJSUWPFVWCPO-UHFFFAOYSA-N 0.000 description 3
- 239000010931 gold Substances 0.000 description 3
- 229910052737 gold Inorganic materials 0.000 description 3
- 102000055229 human IL4 Human genes 0.000 description 3
- 229960002751 imiquimod Drugs 0.000 description 3
- 239000000411 inducer Substances 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 239000002502 liposome Substances 0.000 description 3
- 210000004072 lung Anatomy 0.000 description 3
- 210000004962 mammalian cell Anatomy 0.000 description 3
- 210000003205 muscle Anatomy 0.000 description 3
- VMGAPWLDMVPYIA-HIDZBRGKSA-N n'-amino-n-iminomethanimidamide Chemical compound N\N=C\N=N VMGAPWLDMVPYIA-HIDZBRGKSA-N 0.000 description 3
- 125000003729 nucleotide group Chemical group 0.000 description 3
- 229940092253 ovalbumin Drugs 0.000 description 3
- 230000007170 pathology Effects 0.000 description 3
- COLNVLDHVKWLRT-UHFFFAOYSA-N phenylalanine Natural products OC(=O)C(N)CC1=CC=CC=C1 COLNVLDHVKWLRT-UHFFFAOYSA-N 0.000 description 3
- 238000011533 pre-incubation Methods 0.000 description 3
- 238000000746 purification Methods 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 3
- 210000002345 respiratory system Anatomy 0.000 description 3
- 208000023504 respiratory system disease Diseases 0.000 description 3
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 3
- GVJHHUAWPYXKBD-IEOSBIPESA-N α-tocopherol Chemical compound OC1=C(C)C(C)=C2O[C@@](CCC[C@H](C)CCC[C@H](C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-IEOSBIPESA-N 0.000 description 3
- YYGNTYWPHWGJRM-UHFFFAOYSA-N (6E,10E,14E,18E)-2,6,10,15,19,23-hexamethyltetracosa-2,6,10,14,18,22-hexaene Chemical compound CC(C)=CCCC(C)=CCCC(C)=CCCC=C(C)CCC=C(C)CCC=C(C)C YYGNTYWPHWGJRM-UHFFFAOYSA-N 0.000 description 2
- AXAVXPMQTGXXJZ-UHFFFAOYSA-N 2-aminoacetic acid;2-amino-2-(hydroxymethyl)propane-1,3-diol Chemical compound NCC(O)=O.OCC(N)(CO)CO AXAVXPMQTGXXJZ-UHFFFAOYSA-N 0.000 description 2
- 108020000946 Bacterial DNA Proteins 0.000 description 2
- 101710132601 Capsid protein Proteins 0.000 description 2
- 108010012236 Chemokines Proteins 0.000 description 2
- 102000019034 Chemokines Human genes 0.000 description 2
- 102000011022 Chorionic Gonadotropin Human genes 0.000 description 2
- 108010062540 Chorionic Gonadotropin Proteins 0.000 description 2
- 206010011224 Cough Diseases 0.000 description 2
- 241000701022 Cytomegalovirus Species 0.000 description 2
- 229940021995 DNA vaccine Drugs 0.000 description 2
- 206010013975 Dyspnoeas Diseases 0.000 description 2
- 108050001049 Extracellular proteins Proteins 0.000 description 2
- 102000012673 Follicle Stimulating Hormone Human genes 0.000 description 2
- 108010079345 Follicle Stimulating Hormone Proteins 0.000 description 2
- 102000005720 Glutathione transferase Human genes 0.000 description 2
- 108010070675 Glutathione transferase Proteins 0.000 description 2
- 101000746373 Homo sapiens Granulocyte-macrophage colony-stimulating factor Proteins 0.000 description 2
- 101000934372 Homo sapiens Macrosialin Proteins 0.000 description 2
- 108090000174 Interleukin-10 Proteins 0.000 description 2
- 102000003814 Interleukin-10 Human genes 0.000 description 2
- 102000013462 Interleukin-12 Human genes 0.000 description 2
- 108010065805 Interleukin-12 Proteins 0.000 description 2
- 102000004559 Interleukin-13 Receptors Human genes 0.000 description 2
- 102000003812 Interleukin-15 Human genes 0.000 description 2
- 108090000172 Interleukin-15 Proteins 0.000 description 2
- 102000003810 Interleukin-18 Human genes 0.000 description 2
- 108090000171 Interleukin-18 Proteins 0.000 description 2
- 108010002386 Interleukin-3 Proteins 0.000 description 2
- 102000000646 Interleukin-3 Human genes 0.000 description 2
- 108090001005 Interleukin-6 Proteins 0.000 description 2
- 102000004889 Interleukin-6 Human genes 0.000 description 2
- 125000000998 L-alanino group Chemical group [H]N([*])[C@](C([H])([H])[H])([H])C(=O)O[H] 0.000 description 2
- FFEARJCKVFRZRR-BYPYZUCNSA-N L-methionine Chemical compound CSCC[C@H](N)C(O)=O FFEARJCKVFRZRR-BYPYZUCNSA-N 0.000 description 2
- QIVBCDIJIAJPQS-VIFPVBQESA-N L-tryptophane Chemical compound C1=CC=C2C(C[C@H](N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-VIFPVBQESA-N 0.000 description 2
- 102000009151 Luteinizing Hormone Human genes 0.000 description 2
- 108010073521 Luteinizing Hormone Proteins 0.000 description 2
- 102100028123 Macrophage colony-stimulating factor 1 Human genes 0.000 description 2
- 101710127797 Macrophage colony-stimulating factor 1 Proteins 0.000 description 2
- 102100025136 Macrosialin Human genes 0.000 description 2
- 101100502152 Mus musculus F5 gene Proteins 0.000 description 2
- 101000731723 Mus musculus Rho guanine nucleotide exchange factor 15 Proteins 0.000 description 2
- 108091005461 Nucleic proteins Proteins 0.000 description 2
- 241000283973 Oryctolagus cuniculus Species 0.000 description 2
- 241001494479 Pecora Species 0.000 description 2
- 229920001213 Polysorbate 20 Polymers 0.000 description 2
- WCUXLLCKKVVCTQ-UHFFFAOYSA-M Potassium chloride Chemical compound [Cl-].[K+] WCUXLLCKKVVCTQ-UHFFFAOYSA-M 0.000 description 2
- ONIBWKKTOPOVIA-UHFFFAOYSA-N Proline Natural products OC(=O)C1CCCN1 ONIBWKKTOPOVIA-UHFFFAOYSA-N 0.000 description 2
- 108010008281 Recombinant Fusion Proteins Proteins 0.000 description 2
- 102000007056 Recombinant Fusion Proteins Human genes 0.000 description 2
- 206010057190 Respiratory tract infections Diseases 0.000 description 2
- 239000002262 Schiff base Substances 0.000 description 2
- 150000004753 Schiff bases Chemical class 0.000 description 2
- BHEOSNUKNHRBNM-UHFFFAOYSA-N Tetramethylsqualene Natural products CC(=C)C(C)CCC(=C)C(C)CCC(C)=CCCC=C(C)CCC(C)C(=C)CCC(C)C(C)=C BHEOSNUKNHRBNM-UHFFFAOYSA-N 0.000 description 2
- QIVBCDIJIAJPQS-UHFFFAOYSA-N Tryptophan Natural products C1=CC=C2C(CC(N)C(O)=O)=CNC2=C1 QIVBCDIJIAJPQS-UHFFFAOYSA-N 0.000 description 2
- 241000700605 Viruses Species 0.000 description 2
- UZQJVUCHXGYFLQ-AYDHOLPZSA-N [(2s,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-4-[(2r,3r,4s,5r,6r)-4-[(2s,3r,4s,5r,6r)-3,5-dihydroxy-6-(hydroxymethyl)-4-[(2s,3r,4s,5s,6r)-3,4,5-trihydroxy-6-(hydroxymethyl)oxan-2-yl]oxyoxan-2-yl]oxy-3,5-dihydroxy-6-(hydroxymethyl)oxan-2-yl]oxy-3,5-dihydroxy-6-(hy Chemical compound O([C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1[C@H](O)[C@@H](CO)O[C@H]([C@@H]1O)O[C@H]1CC[C@]2(C)[C@H]3CC=C4[C@@]([C@@]3(CC[C@H]2[C@@]1(C=O)C)C)(C)CC(O)[C@]1(CCC(CC14)(C)C)C(=O)O[C@H]1[C@@H]([C@@H](O[C@H]2[C@@H]([C@@H](O[C@H]3[C@@H]([C@@H](O[C@H]4[C@@H]([C@@H](O[C@H]5[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O5)O)[C@H](O)[C@@H](CO)O4)O)[C@H](O)[C@@H](CO)O3)O)[C@H](O)[C@@H](CO)O2)O)[C@H](O)[C@@H](CO)O1)O)[C@@H]1O[C@H](CO)[C@@H](O)[C@H](O)[C@H]1O UZQJVUCHXGYFLQ-AYDHOLPZSA-N 0.000 description 2
- LTOCXIVQWDANEX-UXCYUTBZSA-M [Br-].CCCC\C=C/CCCCCCCCOCC(C[N+](C)(C)CCCN)OCCCCCCCC\C=C/CCCC.CC(C)CCCC(C)CCCC(C)CCCC(C)CC(=O)OC[C@H](COP(O)(=O)OCCN)OC(=O)CC(C)CCCC(C)CCCC(C)CCCC(C)C Chemical compound [Br-].CCCC\C=C/CCCCCCCCOCC(C[N+](C)(C)CCCN)OCCCCCCCC\C=C/CCCC.CC(C)CCCC(C)CCCC(C)CCCC(C)CC(=O)OC[C@H](COP(O)(=O)OCCN)OC(=O)CC(C)CCCC(C)CCCC(C)CCCC(C)C LTOCXIVQWDANEX-UXCYUTBZSA-M 0.000 description 2
- 239000000556 agonist Substances 0.000 description 2
- 230000007815 allergy Effects 0.000 description 2
- 230000008827 biological function Effects 0.000 description 2
- 239000013592 cell lysate Substances 0.000 description 2
- HVYWMOMLDIMFJA-DPAQBDIFSA-N cholesterol Chemical compound C1C=C2C[C@@H](O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@H]([C@H](C)CCCC(C)C)[C@@]1(C)CC2 HVYWMOMLDIMFJA-DPAQBDIFSA-N 0.000 description 2
- 229940015047 chorionic gonadotropin Drugs 0.000 description 2
- 230000001684 chronic effect Effects 0.000 description 2
- 238000005352 clarification Methods 0.000 description 2
- 239000002299 complementary DNA Substances 0.000 description 2
- 230000000875 corresponding effect Effects 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 2
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 2
- 229960003957 dexamethasone Drugs 0.000 description 2
- NAGJZTKCGNOGPW-UHFFFAOYSA-K dioxido-sulfanylidene-sulfido-$l^{5}-phosphane Chemical compound [O-]P([O-])([S-])=S NAGJZTKCGNOGPW-UHFFFAOYSA-K 0.000 description 2
- PRAKJMSDJKAYCZ-UHFFFAOYSA-N dodecahydrosqualene Natural products CC(C)CCCC(C)CCCC(C)CCCCC(C)CCCC(C)CCCC(C)C PRAKJMSDJKAYCZ-UHFFFAOYSA-N 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 210000003527 eukaryotic cell Anatomy 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 229940028334 follicle stimulating hormone Drugs 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 238000001415 gene therapy Methods 0.000 description 2
- RWSXRVCMGQZWBV-WDSKDSINSA-N glutathione Chemical compound OC(=O)[C@@H](N)CCC(=O)N[C@@H](CS)C(=O)NCC(O)=O RWSXRVCMGQZWBV-WDSKDSINSA-N 0.000 description 2
- 230000013595 glycosylation Effects 0.000 description 2
- 238000006206 glycosylation reaction Methods 0.000 description 2
- 210000002175 goblet cell Anatomy 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- HNDVDQJCIGZPNO-UHFFFAOYSA-N histidine Natural products OC(=O)C(N)CC1=CN=CN1 HNDVDQJCIGZPNO-UHFFFAOYSA-N 0.000 description 2
- 229940088597 hormone Drugs 0.000 description 2
- 239000005556 hormone Substances 0.000 description 2
- 230000005847 immunogenicity Effects 0.000 description 2
- 230000001939 inductive effect Effects 0.000 description 2
- 238000003780 insertion Methods 0.000 description 2
- 230000037431 insertion Effects 0.000 description 2
- 230000018711 interleukin-13 production Effects 0.000 description 2
- 238000007918 intramuscular administration Methods 0.000 description 2
- 239000003446 ligand Substances 0.000 description 2
- GZQKNULLWNGMCW-PWQABINMSA-N lipid A (E. coli) Chemical compound O1[C@H](CO)[C@@H](OP(O)(O)=O)[C@H](OC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCCCC)[C@@H](NC(=O)C[C@@H](CCCCCCCCCCC)OC(=O)CCCCCCCCCCC)[C@@H]1OC[C@@H]1[C@@H](O)[C@H](OC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](NC(=O)C[C@H](O)CCCCCCCCCCC)[C@@H](OP(O)(O)=O)O1 GZQKNULLWNGMCW-PWQABINMSA-N 0.000 description 2
- 229940040129 luteinizing hormone Drugs 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 229930182817 methionine Natural products 0.000 description 2
- 239000003607 modifier Substances 0.000 description 2
- 229940035032 monophosphoryl lipid a Drugs 0.000 description 2
- 238000002887 multiple sequence alignment Methods 0.000 description 2
- 210000000287 oocyte Anatomy 0.000 description 2
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 2
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 2
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 description 2
- 229920000053 polysorbate 80 Polymers 0.000 description 2
- 239000013641 positive control Substances 0.000 description 2
- 239000012460 protein solution Substances 0.000 description 2
- 229940023143 protein vaccine Drugs 0.000 description 2
- 230000002685 pulmonary effect Effects 0.000 description 2
- 230000000306 recurrent effect Effects 0.000 description 2
- 230000010076 replication Effects 0.000 description 2
- 230000000391 smoking effect Effects 0.000 description 2
- 239000011780 sodium chloride Substances 0.000 description 2
- 229940031439 squalene Drugs 0.000 description 2
- TUHBEKDERLKLEC-UHFFFAOYSA-N squalene Natural products CC(=CCCC(=CCCC(=CCCC=C(/C)CCC=C(/C)CC=C(C)C)C)C)C TUHBEKDERLKLEC-UHFFFAOYSA-N 0.000 description 2
- 230000000638 stimulation Effects 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 235000000346 sugar Nutrition 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- 238000002560 therapeutic procedure Methods 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 229960000984 tocofersolan Drugs 0.000 description 2
- 230000009261 transgenic effect Effects 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 210000003462 vein Anatomy 0.000 description 2
- 239000013603 viral vector Substances 0.000 description 2
- SNKAWJBJQDLSFF-NVKMUCNASA-N 1,2-dioleoyl-sn-glycero-3-phosphocholine Chemical compound CCCCCCCC\C=C/CCCCCCCC(=O)OC[C@H](COP([O-])(=O)OCC[N+](C)(C)C)OC(=O)CCCCCCC\C=C/CCCCCCCC SNKAWJBJQDLSFF-NVKMUCNASA-N 0.000 description 1
- QKNYBSVHEMOAJP-UHFFFAOYSA-N 2-amino-2-(hydroxymethyl)propane-1,3-diol;hydron;chloride Chemical compound Cl.OCC(N)(CO)CO QKNYBSVHEMOAJP-UHFFFAOYSA-N 0.000 description 1
- RHKWIGHJGOEUSM-UHFFFAOYSA-N 3h-imidazo[4,5-h]quinoline Chemical class C1=CN=C2C(N=CN3)=C3C=CC2=C1 RHKWIGHJGOEUSM-UHFFFAOYSA-N 0.000 description 1
- XEDONBRPTABQFB-UHFFFAOYSA-N 4-[(2-formyl-3-hydroxyphenoxy)methyl]benzoic acid Chemical compound C1=CC(C(=O)O)=CC=C1COC1=CC=CC(O)=C1C=O XEDONBRPTABQFB-UHFFFAOYSA-N 0.000 description 1
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 1
- 102000006822 Agouti Signaling Protein Human genes 0.000 description 1
- 108010072151 Agouti Signaling Protein Proteins 0.000 description 1
- 102000054930 Agouti-Related Human genes 0.000 description 1
- 101710127426 Agouti-related protein Proteins 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 241000272478 Aquila Species 0.000 description 1
- 241000271566 Aves Species 0.000 description 1
- 241000894006 Bacteria Species 0.000 description 1
- 206010006458 Bronchitis chronic Diseases 0.000 description 1
- 102100021943 C-C motif chemokine 2 Human genes 0.000 description 1
- 101710155857 C-C motif chemokine 2 Proteins 0.000 description 1
- 108700012434 CCL3 Proteins 0.000 description 1
- 108010029697 CD40 Ligand Proteins 0.000 description 1
- 102100032937 CD40 ligand Human genes 0.000 description 1
- 101100069857 Caenorhabditis elegans hil-4 gene Proteins 0.000 description 1
- 241000283707 Capra Species 0.000 description 1
- 102000000013 Chemokine CCL3 Human genes 0.000 description 1
- 102000001326 Chemokine CCL4 Human genes 0.000 description 1
- 108010055165 Chemokine CCL4 Proteins 0.000 description 1
- 102000001327 Chemokine CCL5 Human genes 0.000 description 1
- 108010055166 Chemokine CCL5 Proteins 0.000 description 1
- 240000006162 Chenopodium quinoa Species 0.000 description 1
- 235000015493 Chenopodium quinoa Nutrition 0.000 description 1
- 206010008469 Chest discomfort Diseases 0.000 description 1
- 108091026890 Coding region Proteins 0.000 description 1
- 241000759568 Corixa Species 0.000 description 1
- 241000484025 Cuniculus Species 0.000 description 1
- LEVWYRKDKASIDU-QWWZWVQMSA-N D-cystine Chemical compound OC(=O)[C@H](N)CSSC[C@@H](N)C(O)=O LEVWYRKDKASIDU-QWWZWVQMSA-N 0.000 description 1
- 235000001815 DL-alpha-tocopherol Nutrition 0.000 description 1
- 239000011627 DL-alpha-tocopherol Substances 0.000 description 1
- 108010041986 DNA Vaccines Proteins 0.000 description 1
- 241000702421 Dependoparvovirus Species 0.000 description 1
- QRLVDLBMBULFAL-UHFFFAOYSA-N Digitonin Natural products CC1CCC2(OC1)OC3C(O)C4C5CCC6CC(OC7OC(CO)C(OC8OC(CO)C(O)C(OC9OCC(O)C(O)C9OC%10OC(CO)C(O)C(OC%11OC(CO)C(O)C(O)C%11O)C%10O)C8O)C(O)C7O)C(O)CC6(C)C5CCC4(C)C3C2C QRLVDLBMBULFAL-UHFFFAOYSA-N 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 208000000059 Dyspnea Diseases 0.000 description 1
- 102000004190 Enzymes Human genes 0.000 description 1
- 108090000790 Enzymes Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- 108010001498 Galectin 1 Proteins 0.000 description 1
- 102100021736 Galectin-1 Human genes 0.000 description 1
- 102100024637 Galectin-10 Human genes 0.000 description 1
- 101001011019 Gallus gallus Gallinacin-10 Proteins 0.000 description 1
- 101001011021 Gallus gallus Gallinacin-12 Proteins 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108010024636 Glutathione Proteins 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- 102100028085 Glycylpeptide N-tetradecanoyltransferase 1 Human genes 0.000 description 1
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 1
- 102000038461 Growth Hormone-Releasing Hormone Human genes 0.000 description 1
- 239000000095 Growth Hormone-Releasing Hormone Substances 0.000 description 1
- 241001316290 Gypsophila Species 0.000 description 1
- 241000238631 Hexapoda Species 0.000 description 1
- 101000578329 Homo sapiens Glycylpeptide N-tetradecanoyltransferase 1 Proteins 0.000 description 1
- 101001128431 Homo sapiens Myeloid-derived growth factor Proteins 0.000 description 1
- 101000914484 Homo sapiens T-lymphocyte activation antigen CD80 Proteins 0.000 description 1
- 241000701024 Human betaherpesvirus 5 Species 0.000 description 1
- 101150102264 IE gene Proteins 0.000 description 1
- 102000008070 Interferon-gamma Human genes 0.000 description 1
- 108010074328 Interferon-gamma Proteins 0.000 description 1
- 108010002352 Interleukin-1 Proteins 0.000 description 1
- 102000000589 Interleukin-1 Human genes 0.000 description 1
- 108090000177 Interleukin-11 Proteins 0.000 description 1
- 108010017511 Interleukin-13 Receptors Proteins 0.000 description 1
- 102000013691 Interleukin-17 Human genes 0.000 description 1
- 108050003558 Interleukin-17 Proteins 0.000 description 1
- 102000010787 Interleukin-4 Receptors Human genes 0.000 description 1
- 108010038486 Interleukin-4 Receptors Proteins 0.000 description 1
- 108010002586 Interleukin-7 Proteins 0.000 description 1
- 108090001007 Interleukin-8 Proteins 0.000 description 1
- 108010002335 Interleukin-9 Proteins 0.000 description 1
- 108091092195 Intron Proteins 0.000 description 1
- 108010092694 L-Selectin Proteins 0.000 description 1
- 125000000393 L-methionino group Chemical group [H]OC(=O)[C@@]([H])(N([H])[*])C([H])([H])C(SC([H])([H])[H])([H])[H] 0.000 description 1
- 125000000174 L-prolyl group Chemical group [H]N1C([H])([H])C([H])([H])C([H])([H])[C@@]1([H])C(*)=O 0.000 description 1
- 102100033467 L-selectin Human genes 0.000 description 1
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 1
- STECJAGHUSJQJN-USLFZFAMSA-N LSM-4015 Chemical compound C1([C@@H](CO)C(=O)OC2C[C@@H]3N([C@H](C2)[C@@H]2[C@H]3O2)C)=CC=CC=C1 STECJAGHUSJQJN-USLFZFAMSA-N 0.000 description 1
- 108091026898 Leader sequence (mRNA) Proteins 0.000 description 1
- 241000713666 Lentivirus Species 0.000 description 1
- 102000004895 Lipoproteins Human genes 0.000 description 1
- 108090001030 Lipoproteins Proteins 0.000 description 1
- 208000019693 Lung disease Diseases 0.000 description 1
- 102000043131 MHC class II family Human genes 0.000 description 1
- 108091054438 MHC class II family Proteins 0.000 description 1
- 101710151321 Melanostatin Proteins 0.000 description 1
- 206010054949 Metaplasia Diseases 0.000 description 1
- 102000016943 Muramidase Human genes 0.000 description 1
- 108010014251 Muramidase Proteins 0.000 description 1
- MSFSPUZXLOGKHJ-UHFFFAOYSA-N Muraminsaeure Natural products OC(=O)C(C)OC1C(N)C(O)OC(CO)C1O MSFSPUZXLOGKHJ-UHFFFAOYSA-N 0.000 description 1
- 241000699660 Mus musculus Species 0.000 description 1
- 101000713102 Mus musculus C-C motif chemokine 1 Proteins 0.000 description 1
- 101100384399 Mus musculus C2 gene Proteins 0.000 description 1
- 101100101272 Mus musculus Tyr gene Proteins 0.000 description 1
- 108010062010 N-Acetylmuramoyl-L-alanine Amidase Proteins 0.000 description 1
- 102100035069 Neuronal vesicle trafficking-associated protein 2 Human genes 0.000 description 1
- 101710085178 Neuronal vesicle trafficking-associated protein 2 Proteins 0.000 description 1
- 102400000064 Neuropeptide Y Human genes 0.000 description 1
- 102000003797 Neuropeptides Human genes 0.000 description 1
- 108090000189 Neuropeptides Proteins 0.000 description 1
- 102100037571 Neurosecretory protein VGF Human genes 0.000 description 1
- 102000019315 Nicotinic acetylcholine receptors Human genes 0.000 description 1
- 108050006807 Nicotinic acetylcholine receptors Proteins 0.000 description 1
- WXOMTJVVIMOXJL-BOBFKVMVSA-A O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)OS(=O)(=O)OC[C@H]1O[C@@H](O[C@]2(COS(=O)(=O)O[Al](O)O)O[C@H](OS(=O)(=O)O[Al](O)O)[C@@H](OS(=O)(=O)O[Al](O)O)[C@@H]2OS(=O)(=O)O[Al](O)O)[C@H](OS(=O)(=O)O[Al](O)O)[C@@H](OS(=O)(=O)O[Al](O)O)[C@@H]1OS(=O)(=O)O[Al](O)O Chemical compound O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)O.O[Al](O)OS(=O)(=O)OC[C@H]1O[C@@H](O[C@]2(COS(=O)(=O)O[Al](O)O)O[C@H](OS(=O)(=O)O[Al](O)O)[C@@H](OS(=O)(=O)O[Al](O)O)[C@@H]2OS(=O)(=O)O[Al](O)O)[C@H](OS(=O)(=O)O[Al](O)O)[C@@H](OS(=O)(=O)O[Al](O)O)[C@@H]1OS(=O)(=O)O[Al](O)O WXOMTJVVIMOXJL-BOBFKVMVSA-A 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 239000002033 PVDF binder Substances 0.000 description 1
- 108010013639 Peptidoglycan Proteins 0.000 description 1
- 108010076504 Protein Sorting Signals Proteins 0.000 description 1
- 239000012979 RPMI medium Substances 0.000 description 1
- 108020004511 Recombinant DNA Proteins 0.000 description 1
- 208000002200 Respiratory Hypersensitivity Diseases 0.000 description 1
- 208000037656 Respiratory Sounds Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 239000006146 Roswell Park Memorial Institute medium Substances 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 229920002684 Sepharose Polymers 0.000 description 1
- 101710142969 Somatoliberin Proteins 0.000 description 1
- 108010057517 Strep-avidin conjugated horseradish peroxidase Proteins 0.000 description 1
- 241000282887 Suidae Species 0.000 description 1
- 102100027222 T-lymphocyte activation antigen CD80 Human genes 0.000 description 1
- RYYWUUFWQRZTIU-UHFFFAOYSA-N Thiophosphoric acid Chemical group OP(O)(S)=O RYYWUUFWQRZTIU-UHFFFAOYSA-N 0.000 description 1
- 108091036066 Three prime untranslated region Proteins 0.000 description 1
- 102000008233 Toll-Like Receptor 4 Human genes 0.000 description 1
- 108010060804 Toll-Like Receptor 4 Proteins 0.000 description 1
- 102000002689 Toll-like receptor Human genes 0.000 description 1
- 108020000411 Toll-like receptor Proteins 0.000 description 1
- 108700029229 Transcriptional Regulatory Elements Proteins 0.000 description 1
- 102000044159 Ubiquitin Human genes 0.000 description 1
- 108090000848 Ubiquitin Proteins 0.000 description 1
- 101800003344 Vaccinia growth factor Proteins 0.000 description 1
- 241000700618 Vaccinia virus Species 0.000 description 1
- 101800001863 Variola growth factor Proteins 0.000 description 1
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 1
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 1
- 108020005202 Viral DNA Proteins 0.000 description 1
- 206010047924 Wheezing Diseases 0.000 description 1
- 241000269368 Xenopus laevis Species 0.000 description 1
- 229960004373 acetylcholine Drugs 0.000 description 1
- 238000007792 addition Methods 0.000 description 1
- 238000001042 affinity chromatography Methods 0.000 description 1
- 230000036428 airway hyperreactivity Effects 0.000 description 1
- 230000010085 airway hyperresponsiveness Effects 0.000 description 1
- 239000013566 allergen Substances 0.000 description 1
- 208000026935 allergic disease Diseases 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 208000030961 allergic reaction Diseases 0.000 description 1
- 229940087168 alpha tocopherol Drugs 0.000 description 1
- 150000001412 amines Chemical class 0.000 description 1
- 230000003698 anagen phase Effects 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 210000000612 antigen-presenting cell Anatomy 0.000 description 1
- 239000007864 aqueous solution Substances 0.000 description 1
- 210000004436 artificial bacterial chromosome Anatomy 0.000 description 1
- 210000001106 artificial yeast chromosome Anatomy 0.000 description 1
- 230000006472 autoimmune response Effects 0.000 description 1
- 230000005812 autoimmune toxicity Effects 0.000 description 1
- 231100001152 autoimmune toxicity Toxicity 0.000 description 1
- 230000001580 bacterial effect Effects 0.000 description 1
- 230000008901 benefit Effects 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 239000012620 biological material Substances 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 206010006451 bronchitis Diseases 0.000 description 1
- 239000007853 buffer solution Substances 0.000 description 1
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 238000012512 characterization method Methods 0.000 description 1
- 239000007795 chemical reaction product Substances 0.000 description 1
- 235000012000 cholesterol Nutrition 0.000 description 1
- 208000007451 chronic bronchitis Diseases 0.000 description 1
- 238000002983 circular dichroism Methods 0.000 description 1
- 239000013599 cloning vector Substances 0.000 description 1
- 238000005094 computer simulation Methods 0.000 description 1
- 238000012790 confirmation Methods 0.000 description 1
- 230000001268 conjugating effect Effects 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 238000010276 construction Methods 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 238000004132 cross linking Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 229960003067 cystine Drugs 0.000 description 1
- GVJHHUAWPYXKBD-UHFFFAOYSA-N d-alpha-tocopherol Natural products OC1=C(C)C(C)=C2OC(CCCC(C)CCCC(C)CCCC(C)C)(C)CCC2=C1C GVJHHUAWPYXKBD-UHFFFAOYSA-N 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 210000004443 dendritic cell Anatomy 0.000 description 1
- 230000001419 dependent effect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 239000008121 dextrose Substances 0.000 description 1
- 150000005690 diesters Chemical class 0.000 description 1
- UVYVLBIGDKGWPX-KUAJCENISA-N digitonin Chemical compound O([C@@H]1[C@@H]([C@]2(CC[C@@H]3[C@@]4(C)C[C@@H](O)[C@H](O[C@H]5[C@@H]([C@@H](O)[C@@H](O[C@H]6[C@@H]([C@@H](O[C@H]7[C@@H]([C@@H](O)[C@H](O)CO7)O)[C@H](O)[C@@H](CO)O6)O[C@H]6[C@@H]([C@@H](O[C@H]7[C@@H]([C@@H](O)[C@H](O)[C@@H](CO)O7)O)[C@@H](O)[C@@H](CO)O6)O)[C@@H](CO)O5)O)C[C@@H]4CC[C@H]3[C@@H]2[C@@H]1O)C)[C@@H]1C)[C@]11CC[C@@H](C)CO1 UVYVLBIGDKGWPX-KUAJCENISA-N 0.000 description 1
- UVYVLBIGDKGWPX-UHFFFAOYSA-N digitonine Natural products CC1C(C2(CCC3C4(C)CC(O)C(OC5C(C(O)C(OC6C(C(OC7C(C(O)C(O)CO7)O)C(O)C(CO)O6)OC6C(C(OC7C(C(O)C(O)C(CO)O7)O)C(O)C(CO)O6)O)C(CO)O5)O)CC4CCC3C2C2O)C)C2OC11CCC(C)CO1 UVYVLBIGDKGWPX-UHFFFAOYSA-N 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 208000035475 disorder Diseases 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 239000000428 dust Substances 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 238000004520 electroporation Methods 0.000 description 1
- 229940088598 enzyme Drugs 0.000 description 1
- 210000003979 eosinophil Anatomy 0.000 description 1
- 229940011399 escin Drugs 0.000 description 1
- 229930186222 escin Natural products 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000001747 exhibiting effect Effects 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- 239000000796 flavoring agent Substances 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 230000005714 functional activity Effects 0.000 description 1
- 102000054766 genetic haplotypes Human genes 0.000 description 1
- 229960003180 glutathione Drugs 0.000 description 1
- 125000003630 glycyl group Chemical group [H]N([H])C([H])([H])C(*)=O 0.000 description 1
- 230000009097 homeostatic mechanism Effects 0.000 description 1
- 230000006801 homologous recombination Effects 0.000 description 1
- 238000002744 homologous recombination Methods 0.000 description 1
- 102000001718 human gonad-specific transporter Human genes 0.000 description 1
- 230000009610 hypersensitivity Effects 0.000 description 1
- 230000007124 immune defense Effects 0.000 description 1
- 230000001900 immune effect Effects 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 239000003999 initiator Substances 0.000 description 1
- 230000000977 initiatory effect Effects 0.000 description 1
- 239000007972 injectable composition Substances 0.000 description 1
- 229910001867 inorganic solvent Inorganic materials 0.000 description 1
- 239000003049 inorganic solvent Substances 0.000 description 1
- 230000002452 interceptive effect Effects 0.000 description 1
- 229960003130 interferon gamma Drugs 0.000 description 1
- 108090000681 interleukin 20 Proteins 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- 239000007928 intraperitoneal injection Substances 0.000 description 1
- 229940065638 intron a Drugs 0.000 description 1
- 230000002427 irreversible effect Effects 0.000 description 1
- 239000002085 irritant Substances 0.000 description 1
- 231100000021 irritant Toxicity 0.000 description 1
- BPHPUYQFMNQIOC-NXRLNHOXSA-N isopropyl beta-D-thiogalactopyranoside Chemical compound CC(C)S[C@@H]1O[C@H](CO)[C@H](O)[C@H](O)[C@H]1O BPHPUYQFMNQIOC-NXRLNHOXSA-N 0.000 description 1
- 239000000644 isotonic solution Substances 0.000 description 1
- 108010045069 keyhole-limpet hemocyanin Proteins 0.000 description 1
- 150000002632 lipids Chemical class 0.000 description 1
- 229960000274 lysozyme Drugs 0.000 description 1
- 239000004325 lysozyme Substances 0.000 description 1
- 235000010335 lysozyme Nutrition 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 239000012528 membrane Substances 0.000 description 1
- 210000004379 membrane Anatomy 0.000 description 1
- 108020004999 messenger RNA Proteins 0.000 description 1
- 229910052751 metal Inorganic materials 0.000 description 1
- 239000002184 metal Substances 0.000 description 1
- 230000015689 metaplastic ossification Effects 0.000 description 1
- 238000000520 microinjection Methods 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 230000003843 mucus production Effects 0.000 description 1
- 206010028417 myasthenia gravis Diseases 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 239000013642 negative control Substances 0.000 description 1
- URPYMXQQVHTUDU-OFGSCBOVSA-N nucleopeptide y Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H]([C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(N)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](C)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(O)=O)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CCCCN)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@@H](N)CC=1C=CC(O)=CC=1)C1=CC=C(O)C=C1 URPYMXQQVHTUDU-OFGSCBOVSA-N 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 230000002018 overexpression Effects 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 239000002304 perfume Substances 0.000 description 1
- 229940021222 peritoneal dialysis isotonic solution Drugs 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 150000004713 phosphodiesters Chemical class 0.000 description 1
- 238000011197 physicochemical method Methods 0.000 description 1
- 230000004962 physiological condition Effects 0.000 description 1
- 230000008488 polyadenylation Effects 0.000 description 1
- 229920002704 polyhistidine Polymers 0.000 description 1
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 description 1
- 229920000136 polysorbate Polymers 0.000 description 1
- 229940068968 polysorbate 80 Drugs 0.000 description 1
- 229920002981 polyvinylidene fluoride Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 239000001103 potassium chloride Substances 0.000 description 1
- 235000011164 potassium chloride Nutrition 0.000 description 1
- 230000003389 potentiating effect Effects 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 230000000750 progressive effect Effects 0.000 description 1
- 210000001236 prokaryotic cell Anatomy 0.000 description 1
- 230000002062 proliferating effect Effects 0.000 description 1
- 230000012846 protein folding Effects 0.000 description 1
- 230000006337 proteolytic cleavage Effects 0.000 description 1
- 230000001105 regulatory effect Effects 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 229950010550 resiquimod Drugs 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 108091008146 restriction endonucleases Proteins 0.000 description 1
- 229930182490 saponin Natural products 0.000 description 1
- 150000007949 saponins Chemical class 0.000 description 1
- 235000017709 saponins Nutrition 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 238000012163 sequencing technique Methods 0.000 description 1
- 230000000405 serological effect Effects 0.000 description 1
- 208000013220 shortness of breath Diseases 0.000 description 1
- 102000034285 signal transducing proteins Human genes 0.000 description 1
- 108091006024 signal transducing proteins Proteins 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 210000002027 skeletal muscle Anatomy 0.000 description 1
- 150000003384 small molecules Chemical class 0.000 description 1
- 238000005063 solubilization Methods 0.000 description 1
- 230000007928 solubilization Effects 0.000 description 1
- 125000006850 spacer group Chemical group 0.000 description 1
- 238000011272 standard treatment Methods 0.000 description 1
- 238000007619 statistical method Methods 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- 150000008163 sugars Chemical class 0.000 description 1
- 230000000153 supplemental effect Effects 0.000 description 1
- 230000008961 swelling Effects 0.000 description 1
- 238000001308 synthesis method Methods 0.000 description 1
- 210000003437 trachea Anatomy 0.000 description 1
- 238000011830 transgenic mouse model Methods 0.000 description 1
- 230000001052 transient effect Effects 0.000 description 1
- 238000011269 treatment regimen Methods 0.000 description 1
- 230000001960 triggered effect Effects 0.000 description 1
- 229950009795 tucaresol Drugs 0.000 description 1
- 238000002604 ultrasonography Methods 0.000 description 1
- 241000701161 unidentified adenovirus Species 0.000 description 1
- 241000701447 unidentified baculovirus Species 0.000 description 1
- 241001529453 unidentified herpesvirus Species 0.000 description 1
- 241001430294 unidentified retrovirus Species 0.000 description 1
- 238000003260 vortexing Methods 0.000 description 1
- 239000008215 water for injection Substances 0.000 description 1
- 238000002424 x-ray crystallography Methods 0.000 description 1
- 239000002076 α-tocopherol Substances 0.000 description 1
- 235000004835 α-tocopherol Nutrition 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/46—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates
- C07K14/47—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from vertebrates from mammals
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
- C07K14/5406—IL-4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/54—Interleukins [IL]
- C07K14/5437—IL-13
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55561—CpG containing adjuvants; Oligonucleotide containing adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Genetics & Genomics (AREA)
- Toxicology (AREA)
- Biophysics (AREA)
- Molecular Biology (AREA)
- Biochemistry (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Gastroenterology & Hepatology (AREA)
- Zoology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Engineering & Computer Science (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pulmonology (AREA)
- Peptides Or Proteins (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Preparation Of Compounds By Using Micro-Organisms (AREA)
- Micro-Organisms Or Cultivation Processes Thereof (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
Abstract
Description
【0001】
本発明は、自己抗原に対する免疫感作のために有用な単離されたポリペプチドに関する。特に本発明は、in vivoで投与した場合に自己抗体を生起させることのできる自己タンパク質に関する。本発明はとりわけ、ヒトにおいてヒトサイトカインを免疫原性にすることに関する。本発明はさらに、そのような化合物を含む医薬組成物および医療におけるそれらの使用、ならびにそれらの調製方法に関する。
【背景技術】
【0002】
喘息は慢性の肺疾患で、気道下部の炎症が原因であり、再発性の呼吸障害を特徴とする。患者の気道は敏感になっており、症状のない時ですら常にある程度腫脹または炎症を起こしている。炎症によって気道の狭窄が起こり、肺を出入りする気流を低減させ、呼吸が困難となり、喘鳴、胸部圧迫感、および咳が出るようになる。喘息はアレルゲン(例えば、塵埃、花粉、カビ)に対する過敏症、刺激物(例えば、喫煙、香水、強い異臭)、呼吸器感染、運動、および乾燥した気候が引き金となる。それらの引き金は気道を刺激し、気道の内壁は腫脹してより炎症が強くなり、粘液は気道を塞ぎ、気道周囲の筋肉は緊張して呼吸が困難でストレスの強いものとなり、喘息の症状が出現する。
【0003】
COPD(慢性閉塞性肺疾患)とは呼吸管の疾患を包括的に示す用語で、喘息と似た症状を呈し、同じ薬物で治療される。COPDは慢性かつ進行性であり、気道の障害は大部分が非可逆的であることを特徴とする。この疾患の経過への個人の寄与は不明であるが、喫煙は90%の症例で原因となっていると考えられている。症状としては、咳、慢性気管支炎、息切れ、および呼吸器感染が含まれる。この疾患は究極的には重篤な能力障害と死に至る。
【0004】
モノクローナル抗体には生産、投与および耐性に関連する種々の問題点があるので、ワクチン接種によって適切な特異性を有する内因性抗体を生成させるために患者自身の免疫系を働かせようとする方法がますます関心を集めている。しかし、哺乳動物はその血清中に存在する自己タンパク質に対して高力価の抗体を通常は産生しないが、それはそのような抗体の産生を防止するホメオスタシスの機作が免疫系に働いているからである。このような免疫寛容の機作の重要性は、重症筋無力症のような疾患で説明することができ、これらの疾患では、骨格筋のニコチン様アセチルコリン受容体に対する自己抗体が脱力および疲労を生じさせる(Drachman, 1994, N. Engl. J. Med. 330:1797-1810)。従って、自己抗体が媒介する病態を引き起こすことなく抗体寛容機作を迂回することのできるワクチンアプローチの必要性がある。
【0005】
許容しがたい自己免疫性の毒性を誘発することなく、B細胞の免疫寛容を起こさせないことを目的として多数の技法がデザインされてきた。しかし、それらの全てに大きな欠点がある。
【0006】
ある技法は、自己タンパク質(またはそれに由来するペプチド)を高度の免疫原性を有する担体タンパク質、例えばキーホールリンペットのヘモシアニンなどと化学的に架橋させることを含んでいる(「抗体:実験室マニュアル」"Antibodies:A laboratory manual", Harlow, E.とLane, D. 1988, Cold Spring Harbor Press)。このアプローチは、免疫原性の低い標的(例えば低分子量の化合物など)に対する抗体を生成させるために広く用いられているハプテン-担体系の変法である。しかし、化学結合させるプロセスは有益な可能性のあるエピトープを破壊して、抗体応答の多くが担体蛋白に対するものとなりうる。さらにこのアプローチはタンパク質を用いたワクチン接種にのみ適応可能であり、核酸を免疫原とするものには用いることができない。
【0007】
担体タンパク質を用いる技法の変法としては、担体タンパク質(例えば、B型肝炎ウイルスのコア抗原)と自己タンパク質の双方を含んでいる融合タンパク質をコードする遺伝子を構築することが含まれる(「免疫原性ペプチドの担体としてのB型肝炎ウイルスのコア抗原」"The core antigen of hepatitis B virus as a carrier for immunogenic peptides", Biological Chemistry, 380(3):277-83, 1999)。この融合遺伝子は核酸ワクチンの一部として直接的に投与することができる。あるいはまた、in vitroで適切な宿主細胞中で発現させ、その遺伝子産物を精製し、アジュバントを用いて、またはアジュバントを用いずに、従来の形のワクチンとして送達させることができる。しかし、大きな担体タンパク質を自己タンパク質と融合させることは自己タンパク質のコンフォメーションを束縛するか、またはゆがめ、天然分子と交差反応性の抗体を産生させる効率を低減させうる。また、旧来の架橋させた担体系と同様に、抗体応答の多くはその融合体の担体部分に対するものとなる。担体に対する抗体応答は、その後に行われるワクチンのブースター投与の有効性を限定するか、またはアレルギー性もしくはアナフィラキシー性の反応が起こる機会を増やしてしまう。
【0008】
より洗練されたアプローチがDalumと共同研究者らによって報告されており、その方法は、単一のクラスII MHC制限エピトープを標的分子中に挿入するものである。彼らはこの方法を用いてユビキチン(Dalumら, 1996, J. Immunol. 157:4796-4804; Dalumら, 1997, Mol. Immunol. 34:1113-1120)およびサイトカインTNF(Dalumら、1999、Nature Biotech. 17:666-669)に対する抗体を引き出すことを実証した。その結果、全てのT細胞ヘルプは、この単一のエピトープまたは接合配列から生じなければならない。このアプローチは、ワクチンがそのためにデザインされた適切なMHCクラスIIハプロタイプを有している被験者、または接合エピトープと結合することのできるクラスII分子を幸いにして有している被験者においてはうまく働くが、正常な交雑集団、例えばヒトに典型的な集団などでは、その集団の大部分の人々でそのワクチンが働かないだろう。さらに、挿入されたエピトープが典型的には、卵アルブミンまたはリゾチームなどの全く関連のないタンパク質からのものであるので、追加した配列が標的タンパク質の折り畳みをある程度妨害する可能性があり、それによって標的タンパク質が完全な天然のコンフォメーションを取ることを妨げられる。
【0009】
上述した全てとは対照的に、本発明は、多数の、可能性のあるT細胞エピトープを提供するが、標的分子を天然型に近いコンフォメーションに保持する。これらの性質のため、本発明のワクチンは、複雑な交雑集団、例えばヒト患者からなる集団などで効果的な免疫原となる。これらの性質は、自己タンパク質に変異を与えて、その位置で、類似のタンパク質に見出される配列を生じさせることにより達成される。
【0010】
いくつかの最近の論文は、アレルギー性喘息の卵白アルブミンモデルにおける病態を駆動する際のTh2サイトカインIL-13の決定的に重要の役割を明らかにしている(Wills-Karpら, 1998; Grunigら, 1998)。この研究では、卵白アルブミンにあらかじめ感作させたマウスに、IL-13と結合してそれを中和する可溶性IL-13レセプターを注射した。治療群ではアセチルコリンチャレンジに対する気道の過剰応答性は完全に除かれた。組織学的分析から、処置マウスは対照で認められた杯細胞化生を逆行させたことが明らかとなった。補足的実験では、肺のIL-13レベルが、トランスジェニックマウスでは過剰発現によって、野生型マウスでは気管内へのタンパク質の定着によって、上昇した。どちらの場合でも、気道の過剰反応性、好酸球の浸潤、および粘液産生の増加が認められた(Zhuら, 1999)。これらのデータは、IL-13活性が十分に確認されたモデルにおいてアレルギー性喘息の主要な臨床的および病理学的特徴のいくつかを作り出すのに必要でかつ十分なものであることを示している。
【0011】
従って、IL-13に対する中和応答を引き出すことのできるワクチンは、ヒトのアレルギー性喘息を治療するための有用な治療薬となりうるものである。そのようなワクチンはまた、ある種の蠕虫感染関連疾患(Brombacher, 2000)、および慢性閉塞性肺疾患などのIL-13産生が線維症に関連している疾患(Chiaramonteら, 1999)の治療にも応用されるであろう。本発明はこのような要求に応えようとするものである。
【0012】
従って、本発明の概念および原理はIL-13に関して示してはいるが、それらは第2の動物種中に類似のタンパク質があるどのような哺乳動物の自己タンパク質に対しても適用することができる。
【発明の開示】
【0013】
本発明は、あるヒトタンパク質に対して30%以上100%未満同一である単離されたポリペプチドを提供し、そのポリペプチドは
(a)類似の非ヒトタンパク質に特徴的な少なくとも1つの変異を含んでおり、
(b)ヒトの体内で抗体を誘導することができ、
(c)該ヒトタンパク質と構造的に十分に類似していて、誘導された抗体が該ヒトタンパク質と該ポリペプチドの両方に結合し、かつ
(d)抗体ではない。
【0014】
従って、本発明は、一実施形態において、哺乳動物の自己抗原由来のB細胞エピトープおよび第2の哺乳動物種由来の類似タンパク質の配列を生じさせる変異を有するタンパク質を提供し、そのタンパク質は、B細胞エピトープが由来したもとの動物種において、そのB細胞エピトープが誘導されたもとの天然タンパク質を認識する免疫応答を引き出すことができるものである。
【0015】
好ましくは、その類似タンパク質の配列は、5個より多い、より好ましくは8個より多い連続したアミノ酸からなる。従って、本発明のタンパク質は、その類似配列と少なくとも5個、好ましくは少なくとも8個の連続したアミノ酸について同一である。別の実施形態においては、第2の哺乳動物種由来の類似タンパク質のフレームワーク中に置換よってグラフトされた自己タンパク質のB細胞エピトープを有するタンパク質が提供され、その結果、そのタンパク質は、該B細胞エピトープが由来したもとの動物種において、そのB細胞エピトープが誘導されたもとの天然タンパク質を認識する免疫応答を引き出すことができるようになる。
【0016】
本発明のタンパク質が抗体ではないことは理解されるであろう。生じた免疫応答は好ましくは抗体を産生する応答であり、最も好ましくは中和抗体を産生する応答である。
【0017】
通常、変異は、表面に露出させた領域が保存されるように、分子の表面に露出していない領域中に導入することが好ましい。表面に露出されている領域は免疫系に接近可能であり、その結果B細胞エピトープを含むことが多い。従って、本発明は、自己タンパク質の表面に露出している保存された領域、および表面に露出していない、変異が導入された領域を含んでなり、その変異は類似のタンパク質の配列を生じさせ、その結果、該タンパク質は自己タンパク質が由来したもとの動物種においてその自己タンパク質に対する免疫応答を引き出すことができるようになる。
【0018】
自己タンパク質は好ましくはヒトタンパク質であるが、自己免疫応答をそれに対して引き出すことを所望するいかなる哺乳動物のタンパク質であってもよい。そのような免疫応答は好ましくは天然のタンパク質および本発明の免疫原に対して特異的なものである。その免疫応答は他の自己タンパク質に対する交差反応性または中和能が最小限となっている。
【0019】
自己抗原は、好ましくはサイトカインであり、より好ましくは4ヘリカルサイトカインであり、さらにより好ましくはIL-4またはIL-13であり、最も好ましくはIL-13である。従って、本発明の好ましい実施形態においては、マウスIL-13バックボーン中にヒトIL-13由来のB細胞エピトープを含んでなるキメラタンパク質を提供する。そのような構築物はヒトの体内で特異的な抗IL-13抗体応答を引き出すことができる。そのような構築物を図9に示してある(配列番号21および22)。同様に、ヒトIL表面領域とマウスフレームワークを含んでなるIL-4構築物は図13に示してある(配列番号25)。
【0020】
本発明はまた、次のものも提供する:
− 本発明のポリヌクレオチドを含んでなり、本発明のポリペプチドを発現することのできる発現ベクター;
− 本発明の発現ベクターを含んでなる宿主細胞;
− 本発明のポリペプチドを産生させる方法であって、本発明の宿主細胞を該ポリペプチドの発現に適した条件下で維持し、該ポリペプチドを単離することを含む上記方法;
− 本発明のポリペプチドまたはポリヌクレオチド、および製薬上許容される担体を含んでなるワクチン組成物。
【0021】
別の形態においては、本発明は本発明のポリペプチドをデザインおよび調製するための方法を提供し、その方法は次のステップを含んでなる:
1. 抗体応答が望まれる自己タンパク質(典型的にはヒトタンパク質)の1以上の領域を同定すること;
2. 該自己タンパク質のアミノ酸配列を同定すること;
3. 類似のタンパク質のアミノ酸配列を同定すること;
ステップ1で同定された標的領域(そのアミノ酸配列はステップ2で同定された配列から得られる)の少なくとも1つ、およびステップ3で同定された配列からの十分な数のアミノ酸を含んでなるキメラ分子を組換えDNA技法により構築し、その結果として得られるタンパク質が自己タンパク質と類似した形状へと折りたたまれることが可能となり、それによって該変異タンパク質が自己タンパク質を認識する免疫応答を引き出すことができるようになる。
【0022】
図面の説明
GST=グルタチオンS-トランスフェラーゼ、rmIL-13=組換えマウスIL-13、rhIL-13=組換えヒトIL-13、cIL-13=キメラIL-13
図1.マウスキメラIL-13ワクチン構築物の配列。下線を付したアミノ酸略号はヒトIL-13配列を示し、下線を付していないアミノ酸略号はマウスIL-13由来のものである。
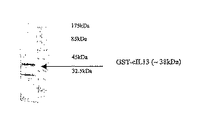
図2.4〜20% Tris-グリシン SDS-PAGEゲル(Novex)によるGST-cIL-13の分析。クーマシーブルーで全タンパク質を染色したもの。
図3.GST-cIL-13のウエスタンブロット分析。
図4.cIL-13およびGST-cIL-13と抗mIL-13ポリクローナル抗体、抗hIL-13ポリクローナル抗体、および抗GSTポリクローナル抗体との相互作用のELISA分析。
図5.cIL-13およびGST-cIL-13とmIL-13レセプター、mIL-13Rα1、およびmIL-13Rα2との相互作用のELISA分析。
図6.A549溶解物の抗ホスホSTAT6ウエスタンブロット。
図7.GST-cIL-13(マウスF5)またはcIL-13(マウスE5)を用いた免疫感作によって誘導された抗体応答。
図8.A549溶解物の抗ホスホSTAT6ウエスタンブロット分析。
図9.ヒトに用いるためのキメラIL-13ワクチン。下線を付したアミノ酸略号はマウスIL-13に存在するものであり、下線を付していない略号はヒトIL-13由来のものである。
図10.cIL-13を種々のアジュバントと組み合わせて投与した後の抗マウスIL-13抗体のプロファイル。
図11.cIL-13投与後のマウス血清中和能。
図12.マウス免疫原として使用するための代替cIL-13。
図13.ヒト抗IL-4ワクチン中で用いるためのキメラIL-4。
【0023】
発明の詳細な説明
本明細書全体および添付の特許請求の範囲を通じて、文脈によって他の意味で読むことを要求しない限りは、「含んでなる」"comprise"および「含む」"include"、またはそれらの変形したものである"comprising"、"comprises"、"including"、"includes"、その他のものは、包括的に解釈すべきもの、すなわち、これらの用語の使用は、個々に特別に列挙していない整数または要素を包含しうることを意味しているものである。
【0024】
本明細書に記載したとおり、本発明は単離されたポリペプチドおよび単離されたポリヌクレオチドに関する。本発明の文脈では「単離された」という用語は、ポリペプチドまたはポリヌクレオチドが、少なくともある程度は精製されたものであるか、または例えば組換え法もしくは機械的合成法によって合成的に調製されたものであって、その天然の状態にはないことを意味している。従って、「単離された」という用語は、該ポリペプチドもしくはポリヌクレオチドが他の生物学的もしくは非生物学的物質(例えば、細胞、細胞もしくは細胞断片の懸濁液、タンパク質、ペプチド、発現ベクター、有機もしくは無機溶剤、またはその他の物質)と適宜に組み合わされて存在している可能性を含むものであるが、該ポリヌクレオチドが天然で見られるような状態にあることは除外するものである。
【0025】
本発明の利点は、本発明のポリペプチドが、抗体応答が所望されている自己(例えばヒト)タンパク質の領域を、類似のタンパク質に特徴的な領域とともに含んでいる点にあり、その類似タンパク質は、優れたT細胞ヘルプを提供するためにヒトタンパク質とは十分に異なっているが、進化によって最適化されてヒトタンパク質と高度に類似した形状へ折りたたまれているものである。このことによって、その自己抗原を認識する抗体の誘導が可能となる。典型的には、誘導された免疫応答には中和抗体応答を生起させることが含まれる。
【0026】
本発明のヒトタンパク質はヒトゲノムによりコードされる完全長のタンパク質、またはヒトゲノムによりコードされる完全長のタンパク質のドメインもしくはサブユニットとすることができる。自己抗原の機能性ドメインもしくはレセプター結合ドメインに対する中和抗体を生じさせることを所望する場合には、これらの領域のみを含んでいるキメラ抗原を調製することができる。従って、このようなドメインの露出されている領域、またはそのようなドメインのB細胞エピトープは保存され、類似タンパク質の変異がB細胞エピトープではないドメインもしくは表面に露出されていないドメイン中に導入される。
【0027】
「タンパク質」という用語は、例えば、ニューロペプチドなどのペプチドと呼ばれることのある、より短いアミノ酸残基の配列を含むことを意図している。ヒトタンパク質は典型的には、グリコシル化、タンパク加水分解による切断、リン酸化、および他の当業者にはよく知られたものなどの翻訳後修飾を受ける。ヒトタンパク質は好ましくはサイトカイン、ホルモン、増殖因子、もしくは細胞外タンパク質で、より好ましくは4-ヘリカルサイトカイン、最も好ましくはIL-13である。サイトカインとしては、例えば、IL-1、IL-2、IL-3、IL-4、IL-5、IL-6、IL-7、IL-8、IL-9、IL-10、IL-11、IL-12、IL-13、IL-14、IL-15、IL-16、IL-17、IL-18、IL-20、IL-21、IL-25、TNF、TGF、GMCSF、MCSF、およびOSMが含まれる。4-ヘリカルサイトカインとしては、IL-2、IL-3、IL-4、IL-5、IL-13、GMCSF、およびMCSFが含まれる。ホルモンとしては、例えば、黄体形成ホルモン(LH)、卵胞刺激ホルモン(FSH)、絨毛性性腺刺激ホルモン(CG)、VGF、成長ホルモン放出ホルモン、アグーティ、アグーティ関連タンパク質、およびニューロペプチドYが含まれる。増殖因子としては、例えば、VEGFが含まれる。細胞外タンパク質としては例えば、APPまたはB-アミロイドが含まれる。
【0028】
類似タンパク質とは、自己タンパク質、例えばヒトタンパク質に対してオルソロガス(orthologus)またはパラロガス(paralogous)なもので、オルソロガスなタンパク質は系統図によって種々の生物体に共通の祖先までたどることができ、従って、種々の生物体中で類似の保存された機能を示すものと考えられる。このようにオルソロガスな遺伝子とは、単一の祖先の遺伝子を起源とした、配列が非常に類似した遺伝子を意味し、従って種々の動物種中で同等な遺伝子であり、共通の祖先から進化してきたものである。特に、ヒトにおいては、オルソロガスなタンパク質はヒト以外の哺乳動物でのものと構造的に同等な分子である。パラロガスなタンパク質とは、ある生物体内に複製イベントによって2以上のコピー数で存在するタンパク質であり(Venter, Science; 1336, vol 291; 2001)、すなわち、遺伝子複製によって多様化した相同な配列(共通の進化の祖先を持つ)である。好ましくは、類似タンパク質はオルソログである。オルソログタンパク質は典型的には、ヒトタンパク質と同じ名称を持ち、典型的には同じ機能を果たし、例えばマウスIL-13はヒトIL-13のオルソログ体である。類似タンパク質は典型的には哺乳動物または鳥類のものであり、例えば、ウシ、ヒツジ、マウスなどのげっ歯類、ブタ、サル、ネコ、イヌ、またはヒトのものである。好ましくは類似タンパク質はマウスのものである。このように本発明の文脈では、マウスIL-13がヒトIL-13に対して類似の(およびオルソロガスな)タンパク質である。同様に、サルIL-4はヒトIL-4に対して類似の(およびオルソロガスな)タンパク質である。
【0029】
本発明のポリペプチドは好ましくは、類似タンパク質に特徴的な変異を2、3、4、5、6、7、8、9、10、11カ所、またはそれ以上含んでなる。より好ましくは該ポリペプチドは少なくとも3カ所の変異を含んでなる。各変異は同一のまたは異なる類似タンパク質の特徴を示すことができる。従って第1の変異はマウス類似体に特徴的で、第2の変異がサル類似体に特徴的なものとすることができる。1つの構成によれば、該ポリペプチドは少なくとも3カ所の変異を含んでなり、各変異は異なる類似体の特徴を示す。しかし、好ましくは、各変異は同じ類似体の特徴を示すものである。1つの変異は該タンパク質のアミノ酸配列の1カ所の変化であり、そのようなものとしては例えば、欠失、挿入、および置換が含まれる。好ましくは、その変異は置換である。2個以上のアミノ酸がそれぞれ表面に露出されていない領域で置換されていることが好ましい。
【0030】
類似タンパク質に特徴的な変異は、ヒトタンパク質の配列が、そのヒトタンパク質を変異させた後では、類似タンパク質の配列に対して同一性の点でより近いものとなるような変異である。例えば、ヒト配列がProProArgValであってマウス類似体の配列がProProTyrValである場合には、該類似タンパク質に特徴的な変異はArgをTyrに置換することである。好ましくは、該変異は、生理学的条件下に水溶液中で折りたたまれた天然の活性タンパク質の表面に存在する残基になされた変異ではない。それらの表面残基、特にループ構造を形成している残基はB細胞エピトープであることが多く、それらの領域の全てが保存されていることが好ましい。このように導入された変異は自己タンパク質の免疫寛容を破壊する機能を有し、かつ変異させていないタンパク質が由来したもとの動物種中で免疫原性があるものである。
【0031】
一つの実施形態においては、本発明のポリペプチドは、あるヒトタンパク質に対して、好ましくはそのヒトタンパク質の全長にわたって、30%以上100%未満の同一性である。好ましくは該ポリペプチドは少なくとも40%、例えば少なくとも50%、そのヒトタンパク質と同一である。より好ましくは、該ポリペプチドは少なくとも60%、例えば少なくとも70%、そのヒトタンパク質と同一である。最も好ましくは、該ポリペプチドは少なくとも85%、例えば少なくとも90%、そのヒトタンパク質と同一である。そのようなタンパク質はそのヒトタンパク質を認識する免疫応答をヒト体内で生起させることができる。
【0032】
例えば、UWGCG PackageはBESTFITプログラムを提供し、それは相同性を計算するために用いることができる(例えば、そのデフォルト設定で用いる)(Devereuxら(1984), Nucleic Acids Research 12, p387-395)。PILEUPおよびBLASTアルゴリズムは相同性を計算するため、または配列をラインアップするために用いることができ(典型的には、それらのデフォルト設定で)、それらについては例えば、Altschul(1993), J. Mol. Evol. 36:290-300; Altschulら(1990), J. Mol. Biol. 215:403-10に述べられている。
【0033】
BLAST分析を行うためのソフトウェアはNational Centre for Biotechnology Information(https://www.ncbi.nlm.nih.gov/)経由で一般に利用できるようになっている。このアルゴリズムではまず最初に、あるワードをデータベース配列中の同じ長さのワードとアラインメントさせたときに正の値の閾値スコアTとマッチする、またはそれを満足する問合せ(query)配列中のWの長さの短いワードを同定することによって高いスコアリングの配列ペア(HSP)を同定することを含む。Tとは隣接するワードスコア閾値を意味する(Altschulら, 1990)。これらの当初の隣接ワードヒットは、それらを含んでいるHSPを見出す目的での検索を開始するためのシーズとして働く。ワードヒットは各配列に沿って両方向に累積アラインメントスコアが増加しうる限り伸長される。両方向へのワードヒットの伸長は次の場合に停止される:累積アラインメントスコアがその最大到達可能値からある量Xだけ落ちた場合;累積スコアが1つ以上の負スコアリング残基アラインメントの蓄積によってゼロ以下となった場合;またはどちらかの配列がその末端に達した場合。BLASTアルゴリズムのパラメーターW、T、およびXはアラインメントの感度およびスピードを定める。BLASTプログラムは、このプログラムがポリヌクレオチドについて用いられる場合には、デフォルトとしてワード長(W)を11、BLOSUM62スコアリングマトリクス(HenikoffおよびHenikoff(1992), Proc. Natl. Acad. Sci. USA, 89:10915-10919)アラインメント(B)を50、期待値(E)を10、M=5、N=4、および二つの鎖の比較を用いる。
【0034】
BLASTアルゴリズムは2つの配列間の類似性についての統計学的解析を行う;例えば、KarlinおよびAltschul(1993), Proc. Natl. Acad. Sci. USA, 90:5873-5787を参照されたい。BLASTアルゴリズムによって提供される類似性の尺度の1つは、smallest sum probability(P(N))であり、それは2つのヌクレオチド配列またはアミノ酸配列間のマッチが偶然に起こる確率を示すものである。例えば、ある配列は、その第1の配列と第2の配列を比較して、もしもそのsmallest sum probabilityが約1未満、好ましくは約0.1未満、より好ましくは約0.01未満、最も好ましくは約0.001未満であれば、別のもう1つの配列と類似であるとみなされる。
【0035】
本発明のポリペプチドの成功を収めたデザインは、例えば、適切な宿主細胞中で発現させたとき、該ポリペプチドが自己タンパク質と十分に類似したコンフォメーションをとり、天然の自己タンパク質と交差反応する抗体を生成することを証明することで確かめられる。このことは免疫学的技法、例えばELISAでのモノクローナルまたはポリクローナル抗体の結合、または円偏光二色性などの物理化学的方法、またはX線結晶解析などの結晶学的技法、またはコンピュータモデリング、または当業者にはよく知られた多数のその他のアプローチを用いて示すことができる。
【0036】
さらに、成功を収めたデザインの確認は、その結果得られたポリペプチドを適切なワクチン接種計画にて自己に投与し、該タンパク質と結合することのできる抗体が誘導されることを観察することによって、行うことができる。このような結合はELISA技法により組換えまたは精製天然タンパク質を用いて、または感受性のある細胞または組織でのそのタンパク質の影響を調べるバイオアッセイによって評価することができる。特に好ましい評価法は、インタクトな宿主中でのそのタンパク質の活性と原因的に関連する現象を観察すること、また、本発明の方法によって誘導される抗体の存在がその現象をモジュレートするかを調べることである。こうして、本発明のタンパク質は、天然のタンパク質が由来したもとの動物中の体内で、天然の抗原に対する抗体を生じさせることができるであろう。
【0037】
本発明のポリペプチドはさらに、所望の性質を付加するため(例えば、精製を容易にするか、または免疫原性を増大させる配列タグを付加するなど)、あるいは望ましくない性質(例えば、レセプターでの望ましくないアゴニスト活性など)または膜貫通ドメインを除去するために、変異、例えばアミノ酸の置換、挿入もしくは欠失によって修飾することができる。特に、本発明は、ポリヒスチジンタグなどの精製を容易にする融合パートナー、または発現を増強させるGST発現パートナーを特定的に意図している。
【0038】
好ましい実施形態においては、マウスIL-13に特徴的な下記の変異の1以上またはその保存的置換を有するヒトIL-13を提供する。下記の番号付けは、IL-13がそのシグナル配列とともに大腸菌中で発現されたIL-13に基づくものである。
R → K 30位
V → S 37位
Y → F 63位
A → V 65位
E → D 68位
E → Y 80位
K → R 81位
M → I 85位
G → H 87位
Q → H 113位
V → I 115位
D → K 117位
【0039】
より好ましくは、ヒトIL-13は少なくとも2カ所、好ましくは3、4、5、6、もしくはそれ以上のカ所の変異、またはそれらの保存的置換を含んでなる。12カ所の変異が全て存在することが好ましい。
【0040】
「保存的置換」とは、あるアミノ酸がそれと類似の性質を有する別のアミノ酸と置換されても、ペプチド化学の当業者であれば予期しうるような、そのペプチドの二次構造およびハイドロパシック(hydropathic)な性質が実質的に変化しないようなものである。
【0041】
例えば、特定のアミノ酸は、抗体の抗原結合領域または基質分子の結合部位などの構造との相互作用的結合能の認めうる低下を伴うことなく、タンパク質構造中の別のアミノ酸と置換することができる。あるタンパク質の生物学的機能活性を定めるものはそのタンパク質の相互作用的能力および性質であるので、あるタンパク質の配列中(もちろん、そのタンパク質のもととなったDNAコード配列中)で特定のアミノ酸配列の置換を行うことができ、それを行っても同様の性質をもつタンパク質を得ることができる。従って、開示した組成物のペプチド配列、またはそのペプチドをコードする対応DNA配列中に、それらの組成物の生物学的有用性または活性の認めうる低下を伴うことなく、種々の変化を導入することができる。
【0042】
そのような変化を起こさせるには、アミノ酸のハイドロパシック・インデックスを考慮しなければならない。タンパク質に相互作用的生物学的機能を与えることにおいてアミノ酸のハイドロパシック・インデックスが重要であることは、当業界で一般的に理解されている(KyteおよびDoolittle, 1982, これは本明細書中に参考として組み入れる)。アミノ酸の相対的なハイドロパシック特性は、得られるタンパク質の二次構造に寄与し、ひいてはそのタンパク質と他の分子、例えば酵素、基質、レセプター、DNA、抗体、抗原などとの相互作用を規定することとなる。各アミノ酸には、その疎水性および電荷特性に基づいてハイドロパシック・インデックスが指定されている(KyteおよびDoolittle, 1982)。それらの値は次のとおりである:イソロイシン(+4.5);バリン(+4.2);ロイシン(+3.8);フェニルアラニン(+2.8);システイン/シスチン(+2.5);メチオニン(+1.9);アラニン(+1.8);グリシン(−0.4):トレオニン(−0.7);セリン(−0.8);トリプトファン(−0.9);チロシン(−1.3);プロリン(−1.6);ヒスチジン(−3.2);グルタミン酸(−3.5);グルタミン(−3.5);アスパラギン酸(−3.5);アスパラギン(−3.5);リジン(−3.9);およびアルギニン(−4.5)。
【0043】
特定のアミノ酸を、それと類似したハイドロパシック・インデックスまたはスコアを有する他のアミノ酸と置換し、置換を行っても依然として類似の生物活性を有するタンパク質がもたらされること、すなわち依然として生物学的な機能が等価のタンパク質が得られることは、当業界では公知である。そのような変化を起こさせるには、ハイドロパシック・インデックスが±2以内であるようなアミノ酸で置換することが好ましく、±1以内が特に好ましく、±0.5以内のものはさらに好ましい。類似のアミノ酸による置換は親水性に基づいて効果的に行いうることも当業界では公知である。米国特許第4,554,101号(その全体を本明細書中に参考として組み入れる)は、タンパク質の最大の局所的平均親水性(それは隣接するアミノ酸の親水性によって支配される)がそのタンパク質の生物学的性質と相関することを述べている。
【0044】
米国特許第4,554,101号に詳細に述べられているように、アミノ酸残基には次のような親水性値が割り当てられている:アルギニン(+3.0);リジン(+3.0);アスパラギン酸(+3.0±1);グルタミン酸(+3.0±1);セリン(+0.3);アスパラギン(+0.2);グルタミン(+0.2);グリシン(0);トレオニン(−0.4);プロリン(−0.5±1);アラニン(−0.5);ヒスチジン(−0.5);システイン(−1.0);メチオニン(−1.3);バリン(−1.5);ロイシン(−1.8);イソロイシン(−1.8);チロシン(−2.3);フェニルアラニン(−2.5);トリプトファン(−3.4)。あるアミノ酸を類似の親水性値を有する別のアミノ酸と置換し、置換を行っても依然として生物学的に等価な、特に免疫学的に等価なタンパク質が得られることは、理解されている。そのような変化を起こさせるに際しては、親水性値が±2以内であるようなアミノ酸で置換することが好ましく、±1以内が特に好ましく、±0.5以内のものはさらに好ましい。
【0045】
上述したとおり、アミノ酸の置換は、通常はアミノ酸の側鎖置換基の相対的な類似性、例えば、疎水性、親水性、電荷、大きさなどに基づくものである。これらの種々の特性を考慮に入れた置換の代表的なものは当業者によく知られており、そのようなものとしては:アルギニンとリジン;グルタミン酸とアスパラギン酸;セリンとトレオニン;グルタミンとアスパラギン;ならびにバリン、ロイシン、およびイソロイシンの間の置換が含まれる。これらは好ましい保存的置換である。
【0046】
アミノ酸の置換はさらに、残基の極性、電荷、溶解性、疎水性、親水性、および/または両親媒性の類似性に基づいて行うことができる。例としては、負に荷電したアミノ酸としてはアスパラギン酸およびグルタミン酸が含まれ;正に荷電したアミノ酸としてはリジンおよびアルギニンが含まれ;荷電されていない極性ヘッド基を有し類似の親水性値を持つアミノ酸としてはロイシン、イソロイシン、およびバリン;グリシンとアラニン;アスパラギンとグルタミン;ならびに、セリン、トレオニン、フェニルアラニン、およびチロシンが挙げられる。保存的変化を示すことのできるアミノ酸の他のグループとしては:(1) ala、pro、gly、glu、asp、gln、asn、ser、thr;(2) cys、ser、tyr、thr;(3) val、ile、leu、met、ala、phe;(4) lys、arg、his;および(5) phe、tyr、trp、hisが含まれる。
【0047】
好ましい実施形態においては、本発明の変異させたIL-13は下記の配列の1以上または保存的置換を含むそれらの改変体を含んでなる:
L K E L I E E L S N; (配列番号1)
F C V A L D S L; (配列番号2)
A I Y R T Q R I L H G; (配列番号3)
K I E V A H F I T K L L; (配列番号4)
【0048】
本発明のポリペプチドは本発明のポリヌクレオチドによってコードされる。当業者であれば遺伝暗号を適用することによって該ポリペプチドをコードするポリヌクレオチドの配列を容易に決定することができよう。ひとたび必要な核酸配列が決定されれば、所望の配列を有するポリヌクレオチドを実施例に記載のとおり産生させることができる。当業者であれば、必要なパラメーター、例えばプライマーおよびPCR条件など、どのようなものについても、容易に適合させることができよう。また、当業者であれば遺伝暗号の縮重により、本発明の1つのタンパク質をコードするポリヌクレオチドが2以上可能であることは理解されよう。
【0049】
本発明のポリヌクレオチドは典型的にはRNA、例えばmRNA、またはDNA、例えばゲノムDNA、cDNA、もしくは合成DNAである。好ましくは、そのポリヌクレオチドはDNAである。特に好ましくは、それはcDNAである。
【0050】
本発明はさらに発現ベクターを提供し、それは核酸構築物であり、本発明のポリヌクレオチドを含んでなるものである。さらに、該核酸構築物は、適切なイニシエーター、プロモーター、エンハンサー、およびその他のエレメント、例えばポリアデニル化シグナルなどを含んでなり、それらは、哺乳動物細胞中でのタンパク質の発現を可能とするために必要であり、正しい方向で位置づけられている。
【0051】
プロモーターは真核生物のプロモーター、例えばCD68プロモーター、Gal1、Gal10、もしくはNMT1プロモーター、原核生物のプロモーター、例えば、Tac、Trc、もしくはLac、またはウイルスのプロモーター、例えば、サイトメガロウイルスプロモーター、SV40プロモーター、ポリヘドリンプロモーター、P10プロモーター、もしくはRSウイルスLTRプロモーターとすることができる。好ましくは該プロモーターはウイルスのプロモーターである。特に好ましいのは、該プロモーターがサイトメガロウイルスの前初期プロモーターで、任意にHCMV IE遺伝子由来のエキソン1を含んでなるものである。
【0052】
転写調節エレメントは、エンハンサー、例えばB型肝炎ウイルス表面抗原3'非翻訳領域、CMVエンハンサー;イントロン、例えばCD68イントロン、もしくはCMVイントロンA、または調節領域、例えばCMV 5'非翻訳領域を含んでなるものである。
【0053】
該ポリヌクレオチドは好ましくは、核酸構築物中でプロモーターと機能しうる形で連結させて、該構築物を哺乳動物細胞中に挿入した場合には、該ポリヌクレオチドが発現されてコードされるポリペプチドを産生するようにする。核酸構築物の骨格はRNAでもDNAでもよく、例えばプラスミドDNA、ウイルスDNA、細菌性DNA、細菌性人工染色体DNA、酵母人工染色体DNA、合成DNAとすることができる。また、核酸構築物を人工的な核酸、例えばホスホロチオエートDNAまたはRNAとすることもできる。好ましくは、該構築物はDNAである。特に好ましくは、それはプラスミドDNAである。
【0054】
本発明はさらに、本発明の発現ベクターを含んでなる宿主細胞を提供する。そのような細胞としては、一過性の、または安定した高等真核細胞系、例えば哺乳動物細胞または、例えばバキュロウイルス発現系を用いる昆虫細胞、酵母などの下等真核細胞、または細菌細胞などの原核細胞が含まれる。本発明に従ってポリペプチドをコードするベクターを挿入することによって改変することのできる細胞の例としてはとりわけ、哺乳動物のHEK293T、CHO、HeLa、NSO、COS細胞が含まれる。好ましくは、選択された細胞系は安定であるのみならず、ポリペプチドの成熟したグリコシル化が可能なものである。発現は形質転換させた卵母細胞で行うことができる。本発明のポリペプチドはヒト以外のトランスジェニック動物、好ましくはマウスの細胞中で発現させることができ、または、より大きな哺乳動物、例えばヤギ、ヒツジ、およびウシの乳汁中に発現させることができる。本発明のポリペプチドを発現しているヒト以外のトランスジェニック動物は本発明の範囲内に含まれるものである。本発明のポリペプチドはまた、アフリカツメガエル(Xenopus laevis)の卵母細胞中で発現させることができる。
【0055】
本発明はまた、医薬組成物またはワクチン組成物をも含み、それは、治療上有効な量の本発明の核酸構築物またはポリペプチドを、任意で製薬上許容される担体と組み合わせて、好ましくはリン酸緩衝溶液(PBS)、生理食塩水、デキストロース、水、グリセロール、エタノール、リポソーム、またはそれらの組合せなどの製薬上許容される賦形剤と組み合わせて、含んでなるものである。ワクチン組成物は、金属ビーズ、好ましくは金ビーズ上に製剤化された、治療上有効な量の本発明の核酸構築物を含んでいてもよい。本発明のワクチン組成物はまた、例えば一実施形態において、イミキモド(imiquimod)、ツカレゾル(tucaresol)、もしくはミョウバンなどのアジュバントを含んでいてもよい。
【0056】
タンパク質とアジュバントとを一緒に用いると、高力価の抗体応答が誘導されるので好ましい。
【0057】
好ましくは、アジュバントは本発明のものと同時に投与され、好ましい実施形態においては一緒に製剤化される。本発明で考えられているアジュバント剤としては、それらが全てではなく他のアジュバント剤を排除するものではないが、イミキモド[S-26308, R-837]などの合成イミダゾキノリン類(Harrisonら, 「イミキモド単独または糖タンパク質ワクチンと組み合わせたものを用いた再発性HSV疾患の低減」"Reduction of recurrent HSV disease using imiquimod alone or combined with a glycoprotein vaccine", Vaccine 19:1820-1826,(2001));およびレシキモド(resiquimod) [S-28463, R-848](Vasilakosら, 「免疫応答改変剤R-848のアジュバント活性: CpG ODNとの比較」"Adjuvant activities of immune response modifier R-848: Compaison with CpG ODN", Cellular Immunology 204: 64-74(2000))、カルボニルおよびアミンのシッフ塩基で、抗原提示細胞上およびT細胞表面で構成的に発現されるもの、例えばツカレゾル(Rhodes, J.ら, 「共刺激性シッフ塩基形成性薬物による免疫系の治療的増強」"Therapeutic potentiation of the immune system by costimulatory Schiff-base-forming drugs", Nature 377:71-75(1995))、サイトカイン、ケモカインおよび共刺激分子、Th1インデューサー(例えば、インターフェロンγ、IL-2、IL-12、IL-15、およびIL-18)、Th2インデューサー(例えば、IL-4、IL-5、IL-6、IL-10、およびIL-13)、ならびにその他のケモカインおよび共刺激遺伝子(例えば、MCP-1、MIP-1α、MIP-1β、RANTES、TCA-3、CD80、CD86、およびCD40L)、その他の免疫刺激性のターゲッティングリガンド(例えば、CTLA-4およびL-セレクチン)、アポトーシス刺激性タンパク質およびペプチド(例えば、Fas、(49))、合成脂質ベースのアジュバント、例えば、バクスフェクチン(vaxfectin)(Reyesら,「Vaxfectinは抗原特異的抗体価を高め、プラスミドDNAでの免疫感作に対してTh1タイプの免疫応答を維持する」"Vexfectin enhances antigen specific antibody titres and maintains Th1 type immune responses to plasmid DNA immunization", Vaccine 19:3778-3786)、スクアレン、α-トコフェロール、ポリソルベート80、DOPCおよびコレステロール、エンドトキシン、[LPS]、(Beutler, B., 「エンドトキシン:Toll様レセプター4、および先天性免疫の求心性肢」"Endotoxin, "Toll-like receptor 4, and the afferent limb of innnate immunity", Current Opinion in Microbiology 3:23-30(2000));CpGオリゴ-およびジ-ヌクレオチド、Sato, Y.ら, 「効果的な皮内免疫感作に必要な免疫刺激性DNA配列」"Immunostimulatory DNA sequences necessary for effective intradermal immunization" Science 273(5273):352-354(1996), Hemmi, Hら, 「Toll様レセプターは細菌のDNAを認識する」"A Toll-like receptor recognizes bacterial DNA", Nature 408: 740-745 (2000)、ならびにTollレセプターの引き金を引いてTh1誘導サイトカイン、例えば合成マイコバクテリアリポタンパク質、マイコバクテリアタンパク質p19、ペプチドグリカン、テイコ酸、およびリピドAなどを産生させるその他のリガンドとなりうるものが含まれる。
【0058】
Th1タイプの応答を主に引き出す特定の好ましいアジュバントとしては、例えば、モノホスホリルリピドA、または好ましくは3-de-O-アシル化モノホスホリルリピドAなどのリピドA誘導体が含まれる。MPL(登録商標)アジュバントはCorixa Corporationから入手できる(Seatle, WA; 例えば米国特許第4,436,727号、第4,877,611号、第4,866,034号、および第4,912,094号を参照)。CpG含有オリゴヌクレオチド(その中ではCpGジヌクレオチドはメチル化されていない)も主としてTh1応答を誘導する。そのようなオリゴヌクレオチドはよく知られており、例えば、WO 96/02555、WO 99/33488、ならびに米国特許第6,008,200号および第5,856,462号に述べられている。免疫刺激性のDNA配列についても、例えば、Satoら, Science 273:352, (1996)によって報告されている。別の好ましいアジュバントとしては、Quil A、もしくはQS21やQS7を含むQuil A誘導体(Aquila Biopharmaceuticals Inc., Framingham, MA);Escin;ジギトニン;またはGypsophilaもしくはChenopodium quinoaのサポニンが含まれる。
【0059】
本発明はまた、IL-13が媒介する疾患、それに伴う何らかの症状もしくは疾患を治療もしくは防止する方法をも提供し、その方法は本発明のタンパク質、ポリヌクレオチド、ベクター、もしくは医薬組成物の有効量を投与することを含んでなるものである。医薬組成物の投与は1以上の個々の投与形態、例えば、「初回−ブースト」治療ワクチン接種法の形態を取ることができる。ある場合には「初回」ワクチン接種は、好ましくはプラスミド由来のベクター中に組み入れた形の、本発明のポリヌクレオチドの粒子媒介DNA送達を介して行われ、「ブースト」は同じポリヌクレオチド配列を含む組換えウイルスベクターの投与によるか、または該タンパク質をアジュバント中に入れたものを用いてブーストする。逆に、プライミングを上述のウイルスベクターまたはタンパク質製剤、典型的にはアジュバント中に製剤化されたタンパク質を用いて行い、ブーストには本発明のDNAワクチンを用いることができる。
【0060】
自己抗原(例えばIL-13)が媒介する疾患の治療のためには、アジュバントがTh1応答のインデューサーであることが好ましい。とりわけ、アジュバントは免疫刺激性CpGオリゴヌクレオチド、例えばWO 96/02555に開示されているものを含むものである。典型的な免疫刺激性オリゴヌクレオチドはその長さが8〜100塩基のもので、一般式X1CpGX2(式中、X1およびX2はヌクレオチド塩基、CおよびGはメチル化していないものである)で表されるものである。
【0061】
本発明のアジュバントまたはワクチンに用いるのに好適なオリゴヌクレオチドは、好ましくは3個以上、より好ましくは6個以上のヌクレオチドで分離されている、2個以上のジヌクレオチドCpGモチーフを含むことが好ましい。本発明のオリゴヌクレオチドは典型的にはデオキシヌクレオチドである。好ましい実施形態においては、該オリゴヌクレオチドのヌクレオチド間結合はホスホロジチオエート、より好ましくはホスホロチオエート結合であるが、混合ヌクレオチド間結合を有するオリゴヌクレオチド(例えば、混合ホスホロチオエート/ホスホジエステル)を含めて、ホスホジエステルおよび他のヌクレオチド間結合も本発明の範囲内に含まれるものである。オリゴヌクレオチドを安定化させる他のヌクレオチド間結合を用いることもできる。ホスホロチオエートオリゴヌクレオチドまたはホスホロジチオエートを調製する方法は、米国特許第5,666,153号、第5,278,302号、およびWO 95/26204に記載されている。
【0062】
好ましいオリゴヌクレオチドの例は下記の配列を有している。それらの配列は好ましくはホスホロチオエートで改変されたヌクレオチド間結合を含んでいる。
オリゴ1: TCC ATG ACG TTC CTG ACG TT (CpG 1826) (配列番号5)
オリゴ2: TCT CCC AGC GTG CGC CAT (CpG 1758) (配列番号6)
オリゴ3: ACC GAT GAC GTC GCC GGT GAC GGC ACC ACG (配列番号7)
オリゴ4: TCG TCG TTT TGT CGT TTT GTC GTT (CpG 2006) (配列番号8)
オリゴ5: TCC ATG ACG TTC CTG ATG CT (CpG 1668) (配列番号9)
【0063】
別のCpGオリゴヌクレオチドは上述の好ましい配列を含んでなり、それらは大きな意味のない欠失または付加を有する。本発明で用いられるCpGオリゴヌクレオチドは当業界で公知の方法(例えばEP 468520)で合成することができる。都合のよいことに、そのようなオリゴヌクレオチドは自動合成機を用いて合成することができる。CpGオリゴヌクレオチドを含むアジュバント製剤は、Qiagenから「ImmunEasy」という商標名で購入することができる。
【0064】
本発明の組成物は予防と治療の双方に用いることができる。本発明は医薬品に使用するための本発明のポリペプチドまたはポリヌクレオチドを提供する。本発明はさらに、本発明のポリペプチドまたはポリヌクレオチドの、アレルギー、喘息およびCOPDなどの呼吸器疾患、蠕虫感染関連疾患、肝臓の線維症または肝硬変の治療のための医薬の製造における使用を提供する。
【0065】
本発明はまた、ワクチン接種の方法をも提供し、その方法は本発明のワクチン組成物の有効量を患者に投与し、そのワクチン組成物に対する免疫応答を引き出すことを含んでなる。
【0066】
本発明はまた、アレルギー、呼吸器疾患、蠕虫感染関連疾患、肝臓の線維症または肝硬変などのIL-13が媒介する疾患に対する哺乳動物のワクチン接種に用いるための本明細書に記載のワクチン組成物を提供する。呼吸器疾患としては、例えば、アレルギー性喘息などの喘息、および慢性閉塞性肺疾患(COPD)が含まれる。特に、IL-13に対する中和応答を誘導しうるワクチン組成物は、ヒトでの喘息、特にアレルギー性喘息の治療のための有用な治療薬となるであろう。本発明のワクチン組成物はまた、蠕虫感染関連疾患(Brombacher, 2000 Bioessays 22:646-656)、およびIL-13産生が線維症に関連している疾患(Chiaramonteら, 1999, J Clin Inv 104:777-785)、例えば慢性閉塞性肺疾患(COPD)および肝硬変の治療に適用することができる。
【0067】
本発明のワクチン組成物は種々の方法、例えば口腔および鼻腔などの粘膜経由;肺、筋肉内、皮下、または皮内の経路を経由して投与することができる。抗原がタンパク質をベースとしたワクチンとして投与される場合には、そのワクチンは典型的にはアジュバントを用いて製剤化され、凍結乾燥したものを使用前に注射用水に再懸濁して用いることができる。そのような組成物は注射用組成物として、例えば無菌の水性分散液、好ましくは等張液として、投与することができる。典型的にはそのような組成物は筋肉内投与されるが、その他の投与経路も可能である。
【0068】
皮内投与の方法としては、粒子射撃法(particle bombardment)(これはまた「遺伝子銃」としても知られており、それは米国特許第5,371,015号に記載されている)がある。タンパク質は糖を用いて製剤化して小粒子となし、または、該抗原をコードするDNAを不活性な粒子(例えば金ビーズ)上にコーティングして、レシピエントの表面(例えば皮膚)からそれらを、例えば射出器具から高圧下で放出させるなどによって、突入させるために十分なスピードに加速する。(本発明の核酸ワクチン構築物でコーティングした粒子およびタンパク質糖粒子は本発明の範囲内に含まれ、そのような粒子をロードした器具も同様に含まれる。)核酸構築物、または該構築物を含有する組成物を直接的にレシピエントに投与する他の方法としては、超音波、電気的刺激、電気穿孔法、および米国特許第5,697,901号に記載されているマイクロシーディング(microseeding)が含まれる。
【0069】
本発明の核酸構築物はまた、遺伝子治療で有用な特別な送達ベクターで投与することができる。遺伝子治療のアプローチは例えば、Vermeら, Nature 1997, 389:239-242に述べられている。ウイルス系および非ウイルス系の双方を用いることができる。ウイルスをベースとした系としては、レトロウイルス、レンチウイルス、アデノウイルス、アデノ随伴ウイルス、ヘルペスウイルス、およびワクシニアウイルスをベースとした系が含まれる。ウイルス以外のものをベースとした系としては、核酸の直接投与及びリポソームをベースとした系が含まれる。例えば、ベクターはリポソームで被包するか、またはポリアクチドコ-グリコリド(PLG)粒子内に入れることができる。
【0070】
本発明の核酸構築物はまた、形質転換した宿主細胞によって投与することもできる。そのような細胞としては、被験者から採取した細胞が含まれる。核酸ワクチン構築物はそのような細胞中にin vitroで導入することができ、その形質転換細胞はその後に被験者に戻すことができる。本発明の核酸構築物は細胞中に既に存在している核酸中に相同組換えによって組み込むことができる。所望により形質転換細胞をin vitroで増殖させて、その結果得られた細胞の1つ以上を本発明に用いることができる。細胞を患者の適切な部位に、公知の外科的技法または微小外科的技法(例えば、グラフティング、マイクロインジェクション、その他)によって供給することができる。適切な細胞としては、樹状細胞が含まれる。
【0071】
送達されるワクチン組成物の量は、免疫しようとする哺乳動物の種および体重、治療/防護しようとする病状の性質、適用するワクチン接種プロトコル(すなわち、単回投与対反復投与)、投与経路、選択したアジュバント化合物の効力および用量の如何によって大きく変わる。これらの変動要因に基づいて、医師または獣医師は適切な投与量のレベルを容易に決定することができようが、例えばそのワクチンが核酸の場合には、投与量は0.5〜5μg/kgの核酸構築物またはそれを含む組成物となろう。特に、投与量は投与経路の如何によって変わる。例えば、金ビーズの皮内投与を用いる場合には、総投与量は好ましくは1μg〜10ng、特に好ましくは総投与量は10μg〜1ngの間である。核酸構築物が直接投与される場合には、総投与量は通常はより多くなり、例えば、50μg〜1mg以上の間の量となる。上述の投与量は平均的な症例の代表的な値を示している。
【0072】
タンパク質ワクチンでは、各ワクチン投与でのタンパク質の量は、典型的なワクチン接種者に顕著な副作用を起こすことなく免疫防御応答を誘導する量として選択される。そのような量は、どの特定の免疫原が用いられるか、それがどのように提示されるかによって変わる。通常は、各投与は1〜1000μgのタンパク質を含んでなり、好ましくは1〜500μg、より好ましくは1〜100μg、最も好ましくは1〜50μgである。ある特定のワクチンについての最適な量は、ワクチン接種者における適切な免疫応答の観察を含む標準的な研究によって確かめることができる。初回のワクチン接種後に、被験者は適切な期間をおいて1または数回のブースター免疫を受けることができる。そのようなワクチン製剤は初回または追加ワクチン接種計画のいずれに適用してもよく;例えば経皮、皮下、もしくは筋肉内経路で全身的に投与したり、また、例えば鼻腔内もしくは口腔経路で粘膜表面に適用することができる。
【0073】
もちろん、被験者それぞれによっては、より高いまたは低い投与量の範囲とすることが有利である場合もありうるが、そのようなものも本発明の範囲内に含まれる。
【0074】
ワクチン組成物は1回限りの投与とすることができ、または反復して、例えば、1〜7回、好ましくは1〜4回、約1日から約18ヶ月、好ましくは1ヶ月の間隔をあけて投与することができる。その後、任意で1〜12ヶ月間の定期的な間隔をあけて、最も長くはその患者の生涯にわたって投与することができる。一実施形態においては、患者は初回-ブースト接種計画で異なる形態の抗原の投与を受けるだろう。従って例えば、ある抗原が最初はDNAをベースとしたワクチンとして投与され、次いでタンパク質-アジュバントをベースとした製剤として投与される。しかし、再度言及するが、この治療計画は投与される動物の大きさおよび動物種、投与される核酸ワクチンおよび/またはタンパク質組成物の量、投与経路、用いたアジュバント化合物の効力と用量、ならびにその他の精通した獣医師または医師であれば明白な要因の如何によって大きく変わる。
【0075】
下記の実施例は本発明の理論をヒトではなくマウスで説明するものであるので、タンパク質はヒトタンパク質に特徴的な変異を有するマウスのものであるが、そのタンパク質がマウスに特徴的な変異を有するヒト由来のB細胞エピトープを有するもの、またはその他の類似のタンパク質であれば、その結果はヒトへの治療に容易に外挿することができる。
【0076】
下記の実施例を通じて、分子生物学および細胞生物学の分野で広く知られていて実施されている種々の技法が用いられている。それらの実際的な面での詳細は多数の教科書中に見出すことができるが、そのようなものとしてはSambrookら(1989, 第2版 Cold Spring Harbor Press: New York)のものが含まれる。アミノ酸の配列または名称は一文字表記または三文字表記のいずれかで示される。用語の前に付けられた「h」はタンパク質または遺伝子がヒト由来であることを示し、「m」はマウス由来、「c」はキメラ構築物、「r」は組換えタンパク質であることを示すために用いられる。
【実施例】
【0077】
実施例1: マウス IL-13 に対するワクチンのデザイン
IL-13は、SCOP(Murzinら, 1995, J. Mol. Biol. 247:536-540)により規定された4-ヘリカルサイトカインフォールドファミリーに属している。このフォールドスーパーファミリーの個々のメンバーは構造的に関連しているが、配列レベルではアラインメント(整列)させることが困難である。IL-13の3D構造はまだ決定されていないが、他のいくつかの4-ヘリカルサイトカインについては構造が描かれている。IL-13オルソログについてタンパク質多重配列アラインメントを作成し、また、少なくとも1つのメンバーの構造が決定されていた、この折りたたみ(フォールド)を示す他のいくつかのサイトカイン(IL-4、GM-CSF、IL-5、およびIL-2)についてもアラインメントを作成した。IL-13タンパク質多重配列アラインメントについてDSC (KingおよびSternberg, 1996, Prot. Sci. 5:2298-2310)、SIMPA96 (Levin, 1997, Prot. Eng. 7:771-776)およびPred2ary (ChandoniaおよびKarplus, 1995, Prot. Sci. 4:275-285)を用いて二次構造予測を行った。個々のサイトカインのタンパク質多重配列アラインメントを、配列情報と(既知の結晶構造および二次構造予測から得られた)構造情報の双方を用いて、互いにアラインメントさせた。
【0078】
抗原性部位、特にB細胞エピトープは、マウスIL-13についてCameleonソフトウェア(Oxford Molecular)を用いて予測し、それらを、タンパク質多重配列アラインメントを用いてIL-4構造(Brookhavenデータベースでの登録番号1RCB)上にマップして、抗原性部位が構造的にIL-13のどこに位置しているのか調べた。この分析から、抗原性を有している可能性があり、かつレセプターの結合に関与している可能性のある露出領域が選択された。
【0079】
このモデルからキメラIL-13配列をデザインしたが、ここでは推定上の抗原性ループの配列をマウスIL-13から取得し、推定上の構造領域(主としてヘリカル領域)の配列をヒトIL-13から取得した。このデザインの目的は、中和抗体を生じさせるマウスIL-13由来の標的エピトープを同定し、それらのエピトープを、天然のタンパク質と構造上類似しているが、1個以上のCD4 Tヘルパーエピトープが確実に存在することとなるように天然の(マウス)タンパク質とは十分な配列変異を有しているフレームワーク上に提示することであった。本実施例のキメラIL-13ワクチンのために選択された核酸及びタンパク質の配列を図1に示す(配列番号19および20)。下線を付した配列はヒトのオルソログに見出される配列に対応している。図1に示す配列とするために12個のアミノ酸を置換した。遺伝暗号の縮重により、全く同一のタンパク質をコードしうる多数の核酸配列が可能であることを理解すべきである。さらに、本発明の範囲内で、非露出領域中に他のオルソロガスな変異を有するような、キメラIL-13ワクチンの別のデザインもありうることが理解されよう。
【0080】
1.2 キメラ IL-13 の調製
キメラIL-13(cIL-13)DNA配列は、部分的にオーバーラップしている一連のDNAオリゴヌクレオチドから合成した。これらの配列cIL-13-1からcIL-13-6を表1に示してある。それらのオリゴヌクレオチドをアニーリングし、PCRにより94℃で1分、続いて94℃で30秒、55℃で1分、および72℃で2分のサイクルを25回行ってcIL-13 DNAを生成した。その後72℃で7分間処理し、その終了時には4℃まで冷却した。反応産物は予期された361塩基対の大きさのバンドであり、これをT/AクローニングベクターpCR2.1 (Invitrogen, Groningen, Netherlands)中にサブクローン化してpCR2,1-cIL-13を作成した。pCR2,1-cIL-13をBamH1およびXho1で消化して得たcIL-13フラグメントをpGEX4T3 (Amersham Pharmacia, Amersham, Bucks, UK)中のBamH1とXho1部位中にサブクローン化してpGEX4T3-cIL-13/1を作成した。pGEX4T3-cIL-13/1構築物の塩基配列を決定した際に、GSTとcIL-13の配列間に39塩基対の余分なDNA配列(pCR2.1ベクター由来のもの)が存在することを見出した。これを修正するために、pGEX4T3-cIL-13/1とプライマーcIL-13FnewおよびcIL-13Rを用いてcIL-13についてのPCRを繰り返した。得られたPCR産物をpGEX4T3中にBamH1とXho1制限酵素部位を用いて再びクローン化して、発現ベクターpGEX4T3-cIL-13を作成した。この構築物の配列はジデオキシターミネーターシークエンシングで確かめた。このベクターはグルタチオン-S-トランスフェラーゼとcIL-13からなる遺伝的融合タンパク質(GST-cIL-13)をコードしている。このタンパク質の2つの部分は短いスペーサーで連結されており、そのスペーサーにはトロンビンの認識部位が含まれている。この融合タンパク質はグルタチオンセファロースアフィニティークロマトグラフィーで容易に精製することができ、その後直接的に用いるか、またはトロンビンで切断して作成した遊離のcIL-13の調製物を用いることができる。
【表1】
【0081】
pGEX4T3-cIL-13発現ベクターを用いて大腸菌(E.coli)BLR株(Novagen, Cambridge Bioscience, Cambridge, UKから供給されたもの)を形質転換した。GST-cIL-13の発現は、対数増殖期に0.5mMのIPTGを培養物に添加して37℃で4時間おくことによって誘導した。次いでその大腸菌を遠心して回収し、それからGST-cIL-13を、類似のGST-ヒトIL-13融合タンパク質の精製法として既に報告されている方法(McKenzieら, 1993, Proc. Natn. Acad. Sci. 90:3735-3739)で精製した。
【0082】
cIL-13 の特性決定
精製したGST-cIL-13のサンプルをSDS-PAGE電気泳動で分析した。図2は、精製した調製物にGST-cIL-13について予期された大きさのタンパク質が含まれていることを示している。下方のバンドは、融合タンパク質の調製の際に部分的に切断されて生成した少量のGSTを示している。
【0083】
精製タンパク質がGST-cIL-13であることを確認するために、サンプルをSDS-PAGEで分離し、PVDF膜上にブロットし、ウエスタンブロッティングでIL-13とGSTの免疫反応性の存在を分析した。cIL-13はヒトおよびマウスのIL-13の双方からの配列を含んでいるので、ヒトIL-13またはマウスIL-13に特異的な抗血清によって認識されると予想された。ブロットを0.05% Tween 20含有TBS(50mM 塩酸trizma、138mM 塩化ナトリウム、2.7mM 塩化カリウム、pH8.0) (TBST)中の3%ウシ血清アルブミン(BSA)で4℃にて1晩ブロックし、一次抗体と共に室温(RT)で1時間振盪しつつインキュベートし、次いでTBSTで4回洗った。二次抗体を添加して室温で1時間振盪した後、4回洗い、SuperSignal化学発光試薬 (Pierce, Rockford, Illinois, USA)により検出した。
【0084】
図3(説明は下記のとおり)は、この分析の結果であり、この精製タンパク質が、ヒトIL-13、マウスIL-13およびGSTに対する抗体により認識されることを示しており、予期していた構造であることが確認された。
【0085】
【0086】
この実験で用いた一次抗体は次のとおりであった:抗hIL-13(カタログ番号AF-213-NA, R&D Systems, Abingdon, Oxford, UK)、1μg/mLで使用;抗mIL-13(カタログ番号AF-213-NA, R&D Systems)、1μg/mLで使用;および抗GST(カタログ番号27-4590D, Pharmacia)、1/200で使用。この実験で用いた二次抗体は次のとおりであった:HRPをコンジュゲートさせた抗ヤギIgG(カタログ番号A-5420, Sigma-Aldrich Company Ltd, Poole, Dorset, UK)、1/40,000で使用。
【0087】
タンパク質サンプルは、GST-cIL-13(実施例2に記載のとおり調製したもの)、組換えヒトIL-13(rhIL-13)(カタログ番号CH1-013, Cambridge Bioscience, Cambridge, UK)、組換えマウスIL-13(rmIL-13)(カタログ番号413-ML-025, R&D Systems)、ならびにGST(空のpGEX4T3ベクターでトランスフェクトされた大腸菌から、報告(Sambrookら, 1989, 第2版, Cold Spring Harbor Press: New York)されているとおりに調製したもの)。
【0088】
1.3 キメラ IL-13 のコンフォメーション
GST-cIL-13が溶液中で天然のIL-13と類似したコンフォメーションをとることを確かめるために、GST-cIL-13およびcIL-13(GST-cIL-13からトロンビン切断によって生成したもの)のサンプルをELISAで分析した。96ウエルのMaxisorpプレート(Life Technologies Ltd, Paisley, UK)に、炭酸塩-重炭酸塩バッファー中のcIL-13、GST-cIL-13、mIL-13、hIL-13、またはgstを4℃で一晩コーティングした。次いでプレートを3% BSA/TBSTにより室温で1時間ブロックし、TBST中で3回洗い、一次抗体と共に室温で1時間インキュベートした後TBST中で3回洗った。二次抗体を添加して1時間置き、TBST中で3回洗い、次いでo-フェニレンジアミン二塩酸塩ペルオキシダーゼ基質(OPD, Sigma Aldrich)で30分間発現させた。この実験で使用した一次抗体と二次抗体は上述のとおりであった。図4に示すとおり、GST-cIL-13およびcIL-13はヒトIL-13およびマウスIL-13に対する抗体によって特異的に認識された。これらのデータはキメラ化プロセスがこのタンパク質のコンフォメーションを大きく変えることはないことを示している。
【0089】
1.4 キメラ IL-13 のレセプターへの結合
cIL-13が既知のマウスIL-13レセプター(mIL-13R1またはmIL-13R2)と結合しうるかを調べるためにELISAを行った。96ウエルのMaxisorpプレートに、炭酸塩-重炭酸塩バッファー中の抗ヒトIgG(カタログ番号I-3382, Sigma Aldrich)を4℃で一晩コーティングした。次いでプレートを3% BSA/TBSTにより室温で1時間ブロックし、TBST中で3回洗い、mIL-13R1-FcまたはmIL-13R2-Fc(それぞれカタログ番号491-IR-200および539-IR-100, R+D Systems)と共に室温で1時間インキュベートした。洗浄後、プレートをmIL-13またはcIL-13またはGST-cIL-13の希釈物と室温で1時間インキュベートし、再度洗い、ビオチン化抗mIL-13(カタログ番号BAF413, R+D Systems)とインキュベートした。さらに洗い、ストレプトアビジンをコンジュゲートさせた西洋ワサビペルオキシダーゼと共にインキュベートした後、プレートをo-フェニレンジアミン二塩酸塩ペルオキシダーゼ基質により30分間発現させた。図5に示すとおり、cIL-13とGST-cIL-13は双方ともmIL-13レセプターのいずれかと結合することができる。ここでも、これらのデータはキメラ化プロセスがこのタンパク質のコンフォメーションを大きく変えることはないことを示している。
【0090】
1.5 キメラ IL-13 の生物活性
GST-cIL-13の生物活性は、このタンパク質がヒトの肺線維芽細胞系A549中でSTAT6をリン酸化する能力を調べて評価した。これらの細胞はIL-4およびIL-13の双方に応答性のヒトタイプ2 IL-4レセプターを発現している。これらの細胞をhIL-4、hIL-13、またはmIL-13で刺激すると、シグナル伝達タンパク質STAT6のリン酸化が誘導される。5 x 105個のA549細胞を60mmの組織培養皿(Life Technologies)上のRPMI(Life Technologies)中にまき、70%コンフルエンスとなるまで増殖させた。次いで細胞を2〜150ng/mLの間のサイトカイン、または精製cIL-13と共に37℃で15分間インキュベートした。融合パートナーとしてのGSTが存在するためにサイトカインの生物活性が変わる可能性があるので、このキメラIL-13はGST-cIL-13融合タンパク質として、およびその融合タンパク質からトロンビン切断により遊離したcIL-13としてもアッセイした。対照として、rmIL-13およびGSTも試験した。次いで、細胞溶解物を調製し、ウサギ抗ホスホSTAT6ポリクローナル抗体(NEB, Hitchin, Herts, UK. カタログ番号9361S)を用いてホスホSTAT6の存在についてウエスタンブロットで分析した。ブロットを5% BSA/TBST中に一晩置いてブロックし(一次抗体がホスホ特異的であるので、BSAはSigma製のA-7906でなければならない、0.1% Tween 20)、一次抗体を1/1000で添加し室温で1時間置き、次いでTBSTで3回洗った。抗ウサギHRPコンジュゲート二次抗体(A-4914, Sigma Aldrich)を1/5000で添加して室温で1時間置き、TBSTで4回洗った後、HRP化学発光基質であるECL試薬(Amersham Pharmacia)で発現させた。この実験の結果を図6に示す。
【0091】
各レーンには下記のタンパク質をローディングした:
組換えタンパク質試薬は図3に記載したとおりであった。
【0092】
A549細胞を50または10ng/mL(2ng/mLではない)のrmIL-13で処理するとSTAT6のリン酸化が誘導され、このことは生物活性があることを示している。A549細胞を50ng/mL(10または2ng/mLではない)のcIL-13で処理するとSTAT6のリン酸化が誘導され、このことは生物活性があることを示している。同様にして、150ng/mLのGST-cIL-13(これはモル濃度で言えば50ng/mLのcIL-13とほぼ等価である)は生物活性を有するが、30および6ng/mLでは有しない。従ってcIL-13はこのレセプターのアゴニストであるが、これらの実験条件下ではmIL-13と比較するとその生物活性は5分の1である。
【0093】
1.6 cIL-13 による免疫感作
次いで、Balb/cマウスにおいてマウスIL-13に対する自己抗体の形成を誘導するために、cIL-13とGST-cIL-13を免疫原として用いた。6〜8週齢の雌マウスに、フロイント完全アジュバント(CFA)中の約30μgのタンパク質を尾の基部に1回皮下注射した。その後同じ部位に3回ブースター免疫を施し、その各回は約10μgのタンパク質を不完全フロイントアジュバント(IFA)中に入れたものである。各処置群は5匹のマウスからなり、それらのマウスは表2のプロトコルに従って免疫した。
【表2】
【0094】
血清サンプルは表2に示した時点で尾静脈の静脈穿刺によって得た。遠心して澄明化した後、マウスIL-13、ヒトIL-13、およびGSTに対する特異的IgG応答の有無についてサンプルをELISAでアッセイした。A〜D群の動物は、抗マウスIL-13抗体をどの時点でも有していなかった。B、D、およびF群の動物は全てGSTに対して強いIgG応答を示した(E群の動物もGSTに対して強い応答を示したが、これはE群の動物を免疫するために用いたcIL-13サンプル中にGSTが残存していたためである)。抗マウスIL-13抗体応答はF群の動物では5匹中5匹に、E群の動物では5匹中4匹に誘導された。図7(aおよびb)は、F群のうちの1匹およびE群のうちの1匹(7b)の血清学的分析結果を示している(それぞれGST-cIL-13で免疫、およびcIL-13で免疫)。これらの結果は、GST-cIL-13またはcIL-13で免疫するとmIL-13に対する免疫寛容を壊し、マウス抗mIL-13抗体を生じることを示している。
【0095】
強い抗mIL-13 IgG応答を示した2匹のマウス(F1d70およびF5d97)から得た血清について、A549/ホスホSTAT6アッセイでrmIL-13の生物活性を中和する能力があるかを試験した。20ng/mLまたは10ng/mLのrmIL-13(R&D Systems)を、無血清のRPMI培地中の1%血清と室温で15分間インキュベートし、その後A549細胞と共に37℃で15分間インキュベートした。細胞溶解物を調製し、ホスホSTAT6の存在を前述のとおりウエスタンブロットで分析した。陰性対照として、GST-hIL-13で免疫したBalb/cマウスから抗hIL-13血清を得て、ELISAで分析したところ、強い抗hIL-13 IgG応答が認められたが、抗mIL-13抗体は認められなかった。陽性対照として正常マウス血清を抗mIL-13中和抗体(R&D Systems, カタログ番号AF-413-NA)でスパイクして最終濃度を1μg/mLとした。
【0096】
この実験の結果は図8に示すが、この実験では次のものを試験した:
【0097】
本発明のキメラIL-13免疫原による免疫感作によってマウスIL-13に対する自己抗体の産生が誘導され、その抗体はマウスIL-13の生物活性を中和することができ(レーン4、5、12、13)、その中和は外因的に添加した抗マウスIL-13抗体でのものに比肩するものである(レーン15、16)。この活性は正常マウス血清中には存在せず(レーン1、2)、またGST-hIL-13で免疫したマウスの血清中にも認められない(レーン7、8)。
【0098】
これらのデータは、IL-13依存性病態のある哺乳動物にcIL-13ワクチンを接種して内因性の中和抗体活性を誘導することにより、該病態の哺乳動物を治療するための基礎を提供するものである。
【0099】
1.7 代替構築物
1.7.1 6 his をタグ付けした cIL-13 のデザイン
GST-cIL-13は細菌において産生されたタンパク質であり、不溶性であり、可溶化とin vitroでの再折りたたみを必要とする。サイズ排除クロマトグラフィーの結果は再折りたたみのプロセスでいくつかの異なる折りたたみの形態が生じることを示しており、そのことは免疫応答の一部分が天然型のマウスIL-13とは結合しない無関係の抗体を生じる可能性のある形態に向けられた応答であることを示唆している。
【0100】
従って、この候補は最も強力な中和活性のある抗マウスIL-13抗体応答を引き出さないかもしれない。
【0101】
このため、6 his-cIL-13を哺乳動物の発現ベクター中にクローン化した。哺乳動物で発現させた6 his-cIL-13は可溶性で、in vitroでの再折りたたみを必要としない。
【0102】
1.7.2 図12(配列番号23および24)は種々の類似の変異を導入したワクチン抗原を示している。タンパク質配列の番号付けは「GPVPR」配列中のグリシン残基を残基1としたスキームに従ったものである。一重下線の配列は改変構造モデルから推定されたヘリカル領域に対応している。二重下線の太字の残基はマウス配列に変異を導入した位置を示している。
【0103】
11 マウスのLeuをVal(ラット)に変更
21 マウスのSerをThr(オルソロガスでないもの)に変更
63 マウスのTyrをPhe(オルソロガスでないもの)に変更
71 マウスのGlyをAla(イヌ/ブタ/ウシ)に変更
100 マウスのSerをThr(イヌ)に変更
104 マウスのGlnをAsn(オルソロガスでないもの)に変更
108 マウスのHisをArg(オルソロガスでないもの)に変更
【0104】
1.8 ヒトの治療への適用
図9は、ヒトでの抗ヒトIL-13抗体の産生に向けられた、可能性のある本発明に従うワクチン抗原の1つを示している。このものは、過剰または不適切なIL-13を特徴とする疾患(例えば喘息)の治療に有用であろう。マウスIL-13に対応する配列は下線を付している。この構築物はマウスIL-13と類似した12カ所のアミノ酸置換を含んでいる。それらは次のとおりである:
R → K 30位
V → S 37位
Y → F 63位
A → V 65位
E → D 68位
E → Y 80位
K → R 81位
M → I 85位
G → H 87位
Q → H 113位
V → I 115位
D → K 117位
【0105】
図13(配列番号25)はキメラIL-4をベースとしたヒト用に可能性のあるワクチンである。これはキメラなヒトIL-4ワクチンタンパク質の例である。下線を付したアミノ酸残基はαヘリカル構造領域を含んでおり、マウスIL-4由来のもので、アミノ酸21が最初のヘリックス中に含まれている。下線のないアミノ酸残基はヒトIL-4由来のものである。αヘリカル領域の位置は、Zuegg, J.ら, (2001) Immunol. and Cell Biol. 79:332-339から得られたものである。
【0106】
実施例2: GST-cIL-13 に対する免疫応答はマウス IL-13 に特異的で、マウス IL-4 とは交 差反応しない
マウスIL-13はマウスIL-4と構造的に類似しているので、GST-cIL-13で免疫したマウスから得た血清(それは高力価の抗マウスIL-13自己抗体を含むことが既に示されている)を、抗マウスIL-4 ELISAおよびin vitro mIL-4中和バイオアッセイを用いて、マウスIL-4との交差反応性を分析した。
【0107】
2.1 抗マウス IL-4 ELISA
96ウエルのMaxisorpプレートに、炭酸塩-重炭酸塩バッファー中の抗マウスIL-4モノクローナル抗体(カタログ番号MAB404, R+D Systems)を4℃で一晩コーティングした。次いでプレートを3% BSA/TBSTにより室温で1時間ブロックし、TBST中で3回洗い、マウスIL-4(カタログ番号404-ML-005, R+D Systems)と共に室温で1時間インキュベートした。洗浄後、プレートをマウス血清と室温で1時間インキュベートし、再度洗浄し、HRPをコンジュゲートさせた抗マウスIgGポリクローナル抗体(カタログ番号A-9309, SIGMA)とインキュベートした。さらに洗浄した後、プレートをo-フェニレンジアミン二塩酸塩ペルオキシダーゼ基質により30分間発現させた。
【0108】
その血清中の抗マウスIL-4抗体のレベルはエンドポイント力価で表した。エンドポイント力価はELISAのバックグラウンドの読み取り値の2倍に等しくなる血清の希釈度と定義される。
【0109】
【0110】
この血清サンプルでは非常に低いレベルのマウスIL-4交差反応性しか検出されなかった。対照的に、この血清サンプルでは、抗マウスIL-13抗体ELISAを用いて、非常に高い抗マウスIL-13抗体エンドポイント力価が得られていた。このELISAで測定されたマウスIL-4交差反応性のレベルは、in vivoにおいてマウスIL-4中和効果をもつことが期待されるようなレベルではない。この血清サンプルをマウスIL-4中和能についてin vitroマウスIL-4バイオアッセイで調べた。
【0111】
2.2 in vitro でのマウス IL-4 中和のバイオアッセイ
マウスIL-4はin vitroでCTLL細胞の増殖を刺激する。従って、GST-cIL-13によるワクチン接種を受けたマウスから得た血清のマウスIL-4中和能を評価するためのアッセイ法をこれらの細胞で開発した。
【0112】
マウスCTLL細胞(カタログ番号87031904, ECACC)に対する組換えマウスIL-4の生物活性を中和するマウス血清の能力を測定するために、3ng/mLの組換えマウスIL-4を種々の濃度の血清と共に96ウエルの培養プレート(Invitrogen)において37℃で1時間インキュベートした。このプレインキュベーション後、CTLL細胞を添加した。種々の希釈度の血清、組換えマウスIL-4、およびCTLL細胞を含んでいるアッセイ混合物を、加湿CO2インキュベーター中にて37℃で70時間インキュベートした。MTT基質(カタログ番号G4000, Promega)を最後の4時間のインキュベーション中に添加し、その後、反応を酸溶液で停止させて、代謝されたブルーホルマザン産物を可溶化した。各ウエル中の溶液の吸光度を96ウエルプレートリーダーで570nmの波長にて測定した。
【0113】
このアッセイでマウスIL-4中和能を測定できるのは、血清の希釈度が1/100に等しいかそれより高いもののみであることに注意されたい。血清の希釈度が1/100より低い場合はCTLL細胞において非特異的増殖効果が誘導される。
【0114】
この血清がマウスIL-4の生物活性を中和する能力は、ある定められた量のマウスIL-4の生物活性を50%中和するために必要な(ND50)血清の希釈度として表される。必要とされる血清サンプルが希釈されればされるほど、中和能が強力であることを意味する。
【0115】
試験したマウスC2血清の最高濃度は1/100希釈であった。これは3ng/mLのマウスIL-4の生物活性を50%中和しなかったので、ND50は<1/100希釈であると表される。
【0116】
【0117】
試験した血清の希釈度では、この血清サンプルにおいてマウスIL-4中和能は検出されなかった。これに対して(マウスIL-13中和能を調べると)、この血清サンプルはマウスIL-13の生物活性を強力に中和した。
【0118】
これらのデータは、抗マウスIL-4抗体ELISAでこの血清中に非常に低いレベルのマウスIL-4交差反応性が測定されるとはいえ、それに伴うようなマウスIL-4中和能は見られないことを示している。
【0119】
2.3 マウス血清サンプルのマウス IL-13 中和能を評価するための新規マウス IL-13 中和バイオアッセイ
これまでのGST-cIL-13生物活性およびマウスIL-13中和能のデータは、A549細胞におけるSTAT6リン酸化リードアウトを用いて得たものであった。このアッセイは煩雑で、定量的データを得るにも容易に適応できない。マウスIL-13はin vitroでTF-1細胞の増殖を刺激する。従って、GST-cIL-13ワクチンを接種されたマウスから得た血清のマウスIL-13中和能を評価するためのアッセイ法をこれらの細胞で開発した。
【0120】
2.4 in vitro でのマウス IL-13 中和バイオアッセイ
ヒトTF-1細胞(所内で入手)に対する組換えマウスIL-13の生物活性を中和するマウス血清の能力を測定するために、5ng/mLの組換えマウスIL-13を種々の濃度の血清と共に96ウエルの培養プレート(Invitrogen)にて37℃で1時間インキュベートした。このプレインキュベーション後、TF-1細胞を添加した。種々の希釈度の血清、組換えマウスIL-13、およびTF-1細胞を含んでいるアッセイ混合物を加湿CO2インキュベーター中にて37℃で70時間インキュベートした。MTT基質(カタログ番号G4000, Promega)を最後の4時間のインキュベーション中に添加し、その後、反応を酸溶液で停止させて、代謝されたブルーホルマザン産物を可溶化した。各ウエル中の溶液の吸光度を96ウエルプレートリーダーで570nmの波長にて測定した。
【0121】
このアッセイでマウスIL-13中和能を測定できるのは、血清の希釈度が1/100に等しいかそれより高いもののみであることに注意されたい。血清の希釈度が1/100より低い場合は、TF-1細胞において非特異的な増殖効果が誘導される。
【0122】
この血清がマウスIL-13の生物活性を中和する能力は、ある定められた量のマウスIL-13の生物活性を50%中和するために必要な(ND50)血清の希釈度として表される。必要とされる血清サンプルが希釈されればされるほど、中和能が強力であることを意味する。
【0123】
GST-cIL-13で免疫したマウスから得た血清のマウスIL-13中和能を上述の方法で測定した。下記に示すとおり強力な中和応答が見られた。
【0124】
【0125】
2.5 「卵アルブミンチャレンジ」マウス喘息モデルで有効性を示すために必要なマウス IL-13 中和のレベルの決定
喘息治療のために必要なIL-13自己ワクチンの効力の基準を定めるために、「卵アルブミンチャレンジ」マウス喘息モデルで、卵アルブミンチャレンジの間に、マウスを種々の投与量のウサギ抗マウスIL-13ポリクローナル抗体で処置した(腹腔内注射により受動的に投与した)。気道の過剰応答(AHR)、杯細胞の異形成(GCM)、および肺の炎症性細胞内容物などのモデルパラメーターをこの実験の終了時に測定した。このモデルでの有効性は、マウス血清で得られたマウスIL-13中和のレベルと相関していた。血清サンプル中のマウスIL-13中和レベルの測定には、マウスIL-13中和バイオアッセイを用いた。
【0126】
最も高い3段階の投与量の抗体を投与された処置群は全て同様の反応を示した。これらの3群の全てが、このモデルで用いられた標準とされている治療法(腹腔内経路でデキサメタゾンを3 x 1.5mg/kg投与)と同等(AHRに対して)またはより良好(GCMに対して)な効力を示した。最も低い投与量の抗体を投与された群は、デキサメタゾンと「無処置」の陽性対照群との中間の効力を示した。
【0127】
従って、「中間投与量」での処置を受けた群で得られたIL-13中和のレベルは、この動物モデルにおけるIL-13自己ワクチンに必要とされる効力の閾値を示している。効力の閾値は、喘息モデルで100%の効力を示すために必要とされる(=ED100)マウス血清中のIL-13中和の最低レベルと定義される。したがって1x ED100は1/476のND50に等しい。
【0128】
定義された効力閾値の意義
「卵アルブミンチャレンジ」マウス喘息モデルで効力を示すのに必要なIL-13中和のレベルは既に上記で定義した。GST-cIL-13によりマウスC1-3およびC5で誘導されたIL-13中和のレベルは、喘息モデルで効力を示すために必要とされた効力の閾値を超えている。これらの結果を図11に示す。
【0129】
従って、GST-cIL-13ワクチンはマウス喘息モデルで効力を示すものと期待される。
【0130】
実施例3: 種々のアジュバントと組み合わせた GST-cIL-13 の免疫原性プロファイル
3.1 免疫感作プロトコル
Balb/cマウスでマウスIL-13に対する自己抗体の形成を誘導するために免疫原としてGST-cIL-13を用いた。6〜8週齢の雌マウスにアジュバント中の約100μgのタンパク質を1回注射した。その後、各回アジュバント中の50μgのタンパク質で4回のブースター免疫を行った(免疫原+アジュバント製剤については下記参照)。各処置群は5匹のマウスからなるものとし、下記の表のプロトコルに従って免疫した。
【0131】
血清サンプルは表2に示した時点で尾静脈の静脈穿刺によって得た。遠心して澄明化した後、マウスIL-13に対する特異的IgG応答の有無についてサンプルをELISAでアッセイした。
【0132】
【0133】
3.2 免疫原+アジュバント製剤
乳剤アジュバント AS03 の調製
Tween 80をリン酸緩衝溶液(PBS)中に溶解してPBS中に2%の溶液を調製する。2倍濃縮乳剤100mLを提供するために、5gのDL-α-トコフェロールおよび5mLのスクアレンをボルテックスして十分に混合する。90mLのPBS/Tween溶液を添加して十分に混合する。この結果得られた乳剤を、シリンジを通過させ、最終的にM110Sマイクロフルイディクス装置を用いて微小流体とする。この結果得られた油滴はその大きさが約180nmである。アジュバントをタンパク質溶液と1:1で混合し、軽くボルテックスし(中程度の速度で10秒間)、軌道振盪機上にて室温で10分間インキュベートする。注射前に軽くボルテックスし、1匹のマウスあたり全100μLの懸濁液を筋肉内の2カ所の部位に投与する(すなわち、1匹のマウスあたり2 x 50μL、各四頭筋に1回注射)。各免疫の前に新たに調製すること。
【0134】
ミョウバン
SIGMAから供給されるもの(カタログ番号A-1577)。PBS中に2mg/mLのミョウバンを含む懸濁液を調製する。アジュバントをタンパク質溶液と1:1で混合し、軽くボルテックスし、緩徐に振盪しつつ室温で10分間インキュベートする。注射前に軽くボルテックスし、1匹のマウスあたり全100μLの懸濁液を腹腔内投与する。各免疫の前に新たに調製すること。
【0135】
CpG-ImmunEasy
Quiagenから供給されるもの(カタログ番号303101)。ストック容器のアジュバントを穏やかなボルテックスにより混合し、次いでアジュバントとタンパク質を1:1で緩徐にピペッティングを5回上下させて行うことによって混合する。室温で15分間インキュベートする。その混合物を緩徐にピペットで5回上下させ、1匹のマウスあたり100μLの懸濁液を筋肉内の2カ所の部位に投与する(すなわち、1匹のマウスあたり2 x 50μL、各四頭筋に1回注射)。各免疫の前に新たに調製すること。
【0136】
CFA/IFA
SIGMAから供給されるもの(カタログ番号F-5881, F-5506)。あらかじめ混合したCFAと1:1で製剤化したものを初回免疫用に、また、IFAと1:1で製剤化したものをブースター用にする。サンプルをwhirlimixで処理してCFA/IFAとの均一で白色の懸濁液とする。使用前に少なくとも30分間氷上に保存し、投与前に十分にwhirlimixで処理する。
【0137】
3.3 抗マウス IL-13 抗体応答
血清サンプル中の抗マウスIL-13抗体応答は、抗マウスIL-13抗体検出ELISAを用いてモニターした。
【0138】
96ウエルのMaxisorpプレートに、炭酸塩-重炭酸塩バッファー中の抗マウスIL-13モノクローナル抗体(カタログ番号MAB, R+D Systems)を4℃で一晩コーティングした。次いでプレートを3% BSA/TBSTにて室温で1時間ブロックし、TBST中で3回洗い、マウスIL-13(カタログ番号413-ML-025, R+D Systems)と共に室温で1時間インキュベートした。洗浄後、プレートをマウス血清と室温で1時間インキュベートし、再度洗浄し、HRPをコンジュゲートさせた抗マウスIgGポリクローナル抗体(カタログ番号A-9309, SIGMA)とインキュベートした。さらに洗浄した後、プレートをo-フェニレンジアミン二塩酸塩ペルオキシダーゼ基質により30分間発現させた。
【0139】
その血清中の抗マウスIL-13抗体のレベルはエンドポイント力価で表した。エンドポイント力価はELISAバックグラウンド読み取り値の2倍に等しくなる血清の希釈度と定義される。
【0140】
【0141】
図10は、125日目の種々の処置群での1/100に希釈した血清サンプルの抗マウスIL-13抗体プロファイルを示す。
【0142】
CpGアジュバントと組み合わせたGST-cIL-13で免疫した5匹のマウスは全て強い抗マウスIL-13自己抗体応答を生起した。このことは、他のアジュバントでは各群を通じて応答が一定せず、マウスによっては非常に弱い応答しか認められなかったことと対照的である。
【0143】
これらの結果は、CpGアジュバントが高力価の抗マウスIL-13自己抗体応答を常に生じさせることにおいて、試験した他のアジュバントと比べてはるかに有効であることを示している。
【0144】
これらの血清サンプルをin vitroでのIL-13中和バイオアッセイでIL-13中和活性について分析した。
【0145】
3.4 IL-13 中和能
ヒトTF-1細胞(ATCCカタログ番号CRL-2003)において組換えマウスIL-13の生物活性を中和するマウス血清の能力を測定するために、5ng/mLの組換えマウスIL-13を種々の濃度の血清と96ウエルの培養プレート(Gibco BRL)にて37℃で1時間インキュベートした。このプレインキュベーション後、TF-1細胞を添加した。種々の希釈度の血清、組換えマウスIL-13、およびTF-1細胞を含んでいるアッセイ混合物を加湿CO2インキュベーター中にて37℃で70時間インキュベートした。MTT基質(カタログ番号G4000, Promega)を最後の4時間のインキュベーション中に添加し、その後、反応を酸溶液で停止させて、代謝されたブルーホルマザン産物を可溶化した。各ウエル中の溶液の吸光度を96ウエルプレートリーダーで570nmの波長にて測定した。
【0146】
このアッセイでマウスIL-13中和能を測定できるのは血清の希釈度が1/100に等しいかこれより高いもののみであることに注意されたい。血清の希釈度が1/100より低い場合はTF-1細胞において非特異的な増殖効果が誘導される。
【0147】
マウスIL-13の生物活性を中和するこの血清の能力は、5ng/mLのマウスIL-13の生物活性を50%中和するために必要な(=ND50)血清の希釈度として表される。必要とされる血清サンプルが希釈されればされるほど、中和能が強力であることを意味する。
【0148】
試験したマウスD5血清の最高濃度は1/100希釈であった。これは5ng/mLのマウスIL-13の生物活性を50%中和しなかったので、ND50は<1/100希釈と表される。
【0149】
【0150】
CpGアジュバントと組み合わせたGST-cIL-13で免疫した5匹のマウスから得た125日目の血清サンプルの全てが、in vitroバイオアッセイでマウスIL-13の生物活性を強力に中和することができた。これに対して、マウスD5(CFA/IFA中のGST-cIL-13で免疫)から得た125日目の血清サンプルは、試験した全ての希釈度でマウスIL-13の生物活性を中和することができなかった。
【0151】
これらの結果は、中和能を持つ抗マウスIL-13自己抗体応答を引き出すには、CpGアジュバントが、ここで試験した他のアジュバントと比較して、はるかに有効であることを示している。
【図面の簡単な説明】
【0152】
【図1】マウスキメラIL-13ワクチン構築物の配列。
【図2】4〜20% Tris-グリシン SDS-PAGEゲル(Novex)によるGST-cIL-13の分析。
【図3】GST-cIL-13のウエスタンブロット分析。
【図4】cIL-13およびGST-cIL-13と抗mIL-13ポリクローナル抗体、抗hIL-13ポリクローナル抗体、および抗GSTポリクローナル抗体との相互作用のELISA分析。
【図5】cIL-13およびGST-cIL-13とmIL-13レセプター、mIL-13Rα1、およびmIL-13Rα2との相互作用のELISA分析。
【図6】A549溶解物の抗ホスホSTAT6ウエスタンブロット。
【図7】GST-cIL-13(マウスF5)またはcIL-13(マウスE5)を用いた免疫感作によって誘導された抗体応答。
【図8】A549溶解物の抗ホスホSTAT6ウエスタンブロット分析。
【図9】ヒトに用いるためのキメラIL-13ワクチン。下線を付したアミノ酸略号はマウスIL-13に存在するものであり、下線を付していない略号はヒトIL-13由来のものである。
【図10】cIL-13を種々のアジュバントと組み合わせて投与した後の抗マウスIL-13抗体のプロファイル。
【図11】cIL-13投与後のマウス血清中和能。
【図12】マウス免疫原として用いるための代替cIL-13。
【図13】ヒト抗IL-4ワクチン中で用いるためのキメラIL-4。
Claims (25)
- あるヒトタンパク質に対して30%以上100%未満同一である単離されたタンパク質であって、そのポリペプチドが、
(a)類似の非ヒトタンパク質に特徴的な少なくとも1つの変異を含んでおり、
(b)ヒトの体内で抗体を生起させることができ、
(c)該ヒトタンパク質と構造的に十分に類似していて、該抗体が該ヒトタンパク質と該ポリペプチドの両方に結合するものであり、
そして該タンパク質は抗体ではない、上記タンパク質。 - 哺乳動物の自己抗原由来のB細胞エピトープおよび第2の哺乳動物種の類似したタンパク質の配列を生じさせる変異を有するタンパク質であって、B細胞エピトープの起源となった動物種において、B細胞エピトープが誘導された天然タンパク質を認識する免疫応答を引き出すことができる、上記タンパク質。
- 自己タンパク質のB細胞エピトープが第2の哺乳動物種由来の類似タンパク質のフレームワーク中に置換によってグラフトされているタンパク質であって、B細胞エピトープの起源となった動物種において、B細胞エピトープが誘導された天然タンパク質を認識する免疫応答を引き出すことができる、上記タンパク質。
- 表面に露出していない領域に導入された保存された表面領域を含んでなり、前記変異が類似したタンパク質の配列を生じさせ、それによって前記タンパク質が、自己タンパク質の起源となった該動物種において、自己タンパク質に対する免疫応答を引き出すことができるようになる、請求項1〜3のいずれか1項に記載のタンパク質。
- 前記免疫応答が中和抗体応答である、請求項1〜4のいずれか1項に記載のタンパク質。
- 前記ヒトタンパク質、またはB細胞エピトープがサイトカイン由来のものである、請求項1〜5のいずれか1項に記載のタンパク質。
- 4-ヘリカルサイトカインである、請求項6に記載のサイトカイン。
- IL-4またはIL-13である、請求項7に記載のサイトカイン。
- 下記の1以上の置換またはその保存的置換を含む置換を有する変異型ヒトIL-13。
R → K 30位
V → S 37位
Y → F 63位
A → V 65位
E → D 68位
E → Y 80位
K → R 81位
M → I 85位
G → H 87位
Q → H 113位
V → I 115位
D → K 117位 - 複数の請求項9で示した置換を有する、請求項9に記載の変異型ヒトIL-13。
- 下記の1以上の配列:
L K E L I E E L S N
F C V A L D S L
A I Y R T Q R I L H G
K I E V A H F I T K L L
または1以上の保存的置換を含んでなる該配列の改変体を有する、請求項9または10に記載の変異型ヒトIL-13。 - 図9に示す変異型ヒトIL-13。
- 請求項1〜12に記載のタンパク質をコードするポリヌクレオチド。
- DNAであり、プロモーターと機能的に連結されている、請求項13に記載のポリヌクレオチド。
- 請求項13または14に記載のポリヌクレオチドを含有するベクター。
- 請求項13もしくは14に記載のポリヌクレオチド、または請求項15に記載のベクターにより形質転換された宿主。
- 請求項1〜15のいずれか1項に記載のタンパク質、ポリヌクレオチド、ベクターを、製薬上許容される担体または賦形剤と共に含んでなる医薬組成物。
- さらにアジュバントをも含んでなる、請求項17に記載の医薬組成物。
- 請求項1〜12のいずれか1項に記載のタンパク質および免疫刺激性オリゴヌクレオチドを含んでなる、請求項18に記載の医薬組成物。
- 免疫刺激性オリゴヌクレオチドが次の群:
オリゴ1(配列番号1): TCC ATG ACG TTC CTG ACG TT (CpG 1826)
オリゴ2(配列番号2): TCT CCC AGC GTG CGC CAT (CpG 1758)
オリゴ3(配列番号3): ACC GAT GAC GTC GCC GGT GAC GGC ACC ACG
オリゴ4(配列番号4): TCG TCG TTT TGT CGT TTT GTC GTT (CpG 2006)
オリゴ5(配列番号5): TCC ATG ACG TTC CTG ATG CT (CpG 1668)
から選択されたものである、請求項19に記載の医薬組成物。 - 医療において使用するための、請求項1〜20のいずれか1項に記載のタンパク質、ポリヌクレオチド、ベクター、宿主、または組成物。
- IL-13が媒介する疾患の治療用医薬の製造における、請求項1〜12のいずれか1項に記載のタンパク質の使用。
- 喘息治療用である、請求項22に記載の使用。
- 請求項17〜20のいずれか1項に記載の組成物の安全かつ有効な量を、それを必要とする患者に投与することを含んでなる、IL-13が媒介する疾患の治療または予防方法。
- 請求項1〜12のいずれか1項に記載のタンパク質の調製方法であって、
1. 抗体応答が望まれる自己(典型的にはヒト)タンパク質の1以上の領域を同定すること;
2. 該自己タンパク質のアミノ酸配列を同定すること;
3. 類似のタンパク質のアミノ酸配列を同定すること;
ステップ1で同定された標的領域(そのアミノ酸配列はステップ2で同定された配列から得られる)の少なくとも1つ、およびステップ3で同定された配列からの十分なアミノ酸を含んでなるキメラ分子を組換えDNA技法により構築することを含んでなり、その結果として得られるタンパク質が自己タンパク質と類似した形状へと折りたたまれることが可能となり、それによって該変異タンパク質が自己タンパク質を認識する免疫応答を引き出すことができるようになる、上記方法。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GBGB0105360.2A GB0105360D0 (en) | 2001-03-03 | 2001-03-03 | Chimaeric immunogens |
| PCT/GB2002/000900 WO2002070711A1 (en) | 2001-03-03 | 2002-03-01 | Vaccine |
Publications (3)
| Publication Number | Publication Date |
|---|---|
| JP2005502314A true JP2005502314A (ja) | 2005-01-27 |
| JP2005502314A5 JP2005502314A5 (ja) | 2005-12-22 |
| JP4238031B2 JP4238031B2 (ja) | 2009-03-11 |
Family
ID=9909970
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| JP2002570736A Expired - Fee Related JP4238031B2 (ja) | 2001-03-03 | 2002-03-01 | ワクチン |
Country Status (18)
| Country | Link |
|---|---|
| US (3) | US20050260216A1 (ja) |
| EP (1) | EP1368477A1 (ja) |
| JP (1) | JP4238031B2 (ja) |
| KR (1) | KR20030081490A (ja) |
| CN (1) | CN1543504A (ja) |
| AU (1) | AU2002233560B2 (ja) |
| BR (1) | BR0207819A (ja) |
| CA (1) | CA2439628A1 (ja) |
| CZ (1) | CZ20032373A3 (ja) |
| GB (1) | GB0105360D0 (ja) |
| HU (1) | HUP0303372A3 (ja) |
| IL (1) | IL157498A0 (ja) |
| MX (1) | MXPA03007915A (ja) |
| NO (1) | NO20033882L (ja) |
| NZ (1) | NZ527873A (ja) |
| PL (1) | PL365066A1 (ja) |
| WO (1) | WO2002070711A1 (ja) |
| ZA (1) | ZA200306647B (ja) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010527633A (ja) * | 2007-05-25 | 2010-08-19 | セントコア・オーソ・バイオテツク・インコーポレーテツド | Toll様受容体3モジュレーター及びその使用 |
Families Citing this family (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NZ517929A (en) * | 1999-09-25 | 2004-02-27 | Univ Iowa Res Found | Immunostimulatory nucleic acids |
| US7560534B2 (en) | 2000-05-08 | 2009-07-14 | Celldex Research Corporation | Molecular conjugates comprising human monoclonal antibodies to dendritic cells |
| TW200407162A (en) * | 2002-08-30 | 2004-05-16 | Glaxo Group Ltd | Vaccine |
| AU2003259374A1 (en) * | 2002-08-30 | 2004-03-19 | Glaxo Group Limited | Vaccine comprising il-13 and an adjuvant |
| CA2498739A1 (en) * | 2002-09-12 | 2004-03-25 | Pharmexa A/S | Immunization against autologous ghrelin |
| US9259459B2 (en) * | 2003-01-31 | 2016-02-16 | Celldex Therapeutics Inc. | Antibody vaccine conjugates and uses therefor |
| ZA200506202B (en) * | 2003-01-31 | 2006-10-25 | Celldex Therapeutics Inc | Antibody vaccine conjugates and uses therefor |
| JP2007525436A (ja) * | 2003-03-24 | 2007-09-06 | マーシア・ファーマ・インコーポレイテッド | 炎症症状を処置および予防するための方法および組成物 |
| WO2004096849A2 (en) * | 2003-04-25 | 2004-11-11 | University Of Manitoba | Peptide-based cytokine/chemokine vaccines against allergy |
| US20090098142A1 (en) * | 2004-06-09 | 2009-04-16 | Kasaian Marion T | Methods and compositions for treating and monitoring treatment of IL-13-associated disorders |
| US7501121B2 (en) * | 2004-06-17 | 2009-03-10 | Wyeth | IL-13 binding agents |
| AR049390A1 (es) * | 2004-06-09 | 2006-07-26 | Wyeth Corp | Anticuerpos contra la interleuquina-13 humana y usos de los mismos |
| ES2389080T3 (es) | 2004-06-11 | 2012-10-23 | Riken | Fármaco que presenta un ligando de células reguladoras contenido en el liposoma |
| TWI307630B (en) | 2004-07-01 | 2009-03-21 | Glaxo Group Ltd | Immunoglobulins |
| PL2468300T3 (pl) | 2006-09-26 | 2018-04-30 | Infectious Disease Research Institute | Kompozycja szczepionki zawierająca syntetyczny adiuwant |
| US20090181078A1 (en) * | 2006-09-26 | 2009-07-16 | Infectious Disease Research Institute | Vaccine composition containing synthetic adjuvant |
| EP2137215A2 (en) * | 2007-04-23 | 2009-12-30 | Wyeth | Methods and compositions for treating and monitoring treatment of il-13-associated disorders |
| EA026990B1 (ru) | 2007-11-07 | 2017-06-30 | Селлдекс Терапьютикс Инк. | Антитела, связывающиеся с человеческой клеткой dec-205 |
| ES2787455T3 (es) | 2012-05-16 | 2020-10-16 | Immune Design Corp | Vacunas para el VHS-2 |
| US8957047B2 (en) | 2013-04-18 | 2015-02-17 | Immune Design Corp. | GLA monotherapy for use in cancer treatment |
| US9463198B2 (en) | 2013-06-04 | 2016-10-11 | Infectious Disease Research Institute | Compositions and methods for reducing or preventing metastasis |
| WO2022162205A1 (en) * | 2021-01-29 | 2022-08-04 | Bayer Animal Health Gmbh | Vaccine composition for breaking self-tolerance |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993010235A1 (de) * | 1991-11-13 | 1993-05-27 | Bayer Aktiengesellschaft | Menschliche il-4 mutantenproteine |
| WO1996002555A1 (en) * | 1994-07-15 | 1996-02-01 | The University Of Iowa Research Foundation | Immunomodulatory oligonucleotides |
| WO1996004306A2 (en) * | 1994-08-01 | 1996-02-15 | Schering Corporation | Muteins of mammalian cytokines |
| WO1996004388A1 (en) * | 1994-07-29 | 1996-02-15 | Smithkline Beecham Plc | Novel compounds |
| EP0759468A1 (en) * | 1995-08-10 | 1997-02-26 | Laboratoires Virbac | Feline interleukin-4 |
Family Cites Families (22)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US4554101A (en) * | 1981-01-09 | 1985-11-19 | New York Blood Center, Inc. | Identification and preparation of epitopes on antigens and allergens on the basis of hydrophilicity |
| US4436727A (en) * | 1982-05-26 | 1984-03-13 | Ribi Immunochem Research, Inc. | Refined detoxified endotoxin product |
| US4866034A (en) * | 1982-05-26 | 1989-09-12 | Ribi Immunochem Research Inc. | Refined detoxified endotoxin |
| US4945050A (en) * | 1984-11-13 | 1990-07-31 | Cornell Research Foundation, Inc. | Method for transporting substances into living cells and tissues and apparatus therefor |
| US4877611A (en) * | 1986-04-15 | 1989-10-31 | Ribi Immunochem Research Inc. | Vaccine containing tumor antigens and adjuvants |
| US5278302A (en) * | 1988-05-26 | 1994-01-11 | University Patents, Inc. | Polynucleotide phosphorodithioates |
| US4912094B1 (en) * | 1988-06-29 | 1994-02-15 | Ribi Immunochem Research Inc. | Modified lipopolysaccharides and process of preparation |
| US5697901A (en) * | 1989-12-14 | 1997-12-16 | Elof Eriksson | Gene delivery by microneedle injection |
| AU661684B2 (en) * | 1991-06-18 | 1995-08-03 | Regents Of The University Of California, The | Cloned glutamic acid decarboxylase |
| ATE364701T1 (de) * | 1995-02-20 | 2007-07-15 | Inst Medical W & E Hall | Immunoreaktive und immunotherapeutische moleküle welche in individuen mit insulin-abhängiger diabetes mellitus interagieren |
| US6518061B1 (en) * | 1995-03-15 | 2003-02-11 | The United States Of America As Represented By The Department Of Health And Human Services | IL-13 receptor specific chimeric proteins and uses thereof |
| US5614191A (en) * | 1995-03-15 | 1997-03-25 | The United States Of America As Represented By The Department Of Health And Human Services | IL-13 receptor specific chimeric proteins and uses thereof |
| US5666153A (en) * | 1995-10-03 | 1997-09-09 | Virtual Shopping, Inc. | Retractable teleconferencing apparatus |
| US6664227B1 (en) * | 1996-03-01 | 2003-12-16 | Genetics Institute, Llc | Treatment of fibrosis by antagonism of IL-13 and IL-13 receptor chains |
| US5843449A (en) * | 1996-03-25 | 1998-12-01 | Akzo Nobel N.V. | Proteins and novel peptides derived from autoantigen for use in immunotherapy of autoimmune diseases |
| US5856462A (en) * | 1996-09-10 | 1999-01-05 | Hybridon Incorporated | Oligonucleotides having modified CpG dinucleosides |
| US6608183B1 (en) * | 1997-07-14 | 2003-08-19 | Bolder Biotechnology, Inc. | Derivatives of growth hormone and related proteins |
| EP0911401A1 (en) * | 1997-10-21 | 1999-04-28 | Bayer Ag | Muteins of interleukin 4 showing low-affinity and short-term interaction with the common gamma chain |
| WO1999046992A1 (en) * | 1998-03-20 | 1999-09-23 | Genzyme Corporation | Induction of immunity against tumor self-antigens |
| US6576232B1 (en) * | 1998-04-03 | 2003-06-10 | The Penn State Research Foundation | IL13 mutants |
| WO2000078334A1 (en) * | 1999-06-17 | 2000-12-28 | University Of Maryland Biotechnology Institute | Chimeric chemokine-antigen polypeptides and uses therefor |
| CA2404763A1 (en) * | 1999-11-11 | 2001-05-17 | Raj K. Puri | Mutated il-13 molecules and their uses |
-
2001
- 2001-03-03 GB GBGB0105360.2A patent/GB0105360D0/en not_active Ceased
-
2002
- 2002-03-01 NZ NZ527873A patent/NZ527873A/en unknown
- 2002-03-01 HU HU0303372A patent/HUP0303372A3/hu unknown
- 2002-03-01 CA CA002439628A patent/CA2439628A1/en not_active Abandoned
- 2002-03-01 IL IL15749802A patent/IL157498A0/xx unknown
- 2002-03-01 PL PL02365066A patent/PL365066A1/xx unknown
- 2002-03-01 EP EP02700490A patent/EP1368477A1/en not_active Withdrawn
- 2002-03-01 KR KR10-2003-7011573A patent/KR20030081490A/ko not_active Application Discontinuation
- 2002-03-01 WO PCT/GB2002/000900 patent/WO2002070711A1/en not_active Application Discontinuation
- 2002-03-01 CN CNA028093240A patent/CN1543504A/zh active Pending
- 2002-03-01 MX MXPA03007915A patent/MXPA03007915A/es not_active Application Discontinuation
- 2002-03-01 AU AU2002233560A patent/AU2002233560B2/en not_active Ceased
- 2002-03-01 CZ CZ20032373A patent/CZ20032373A3/cs unknown
- 2002-03-01 JP JP2002570736A patent/JP4238031B2/ja not_active Expired - Fee Related
- 2002-03-01 US US10/469,561 patent/US20050260216A1/en not_active Abandoned
- 2002-03-01 BR BR0207819-8A patent/BR0207819A/pt not_active IP Right Cessation
- 2002-09-03 US US10/233,902 patent/US20030194391A1/en not_active Abandoned
-
2003
- 2003-08-26 ZA ZA200306647A patent/ZA200306647B/en unknown
- 2003-09-02 NO NO20033882A patent/NO20033882L/no not_active Application Discontinuation
-
2005
- 2005-01-24 US US11/041,636 patent/US20050186209A1/en not_active Abandoned
Patent Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO1993010235A1 (de) * | 1991-11-13 | 1993-05-27 | Bayer Aktiengesellschaft | Menschliche il-4 mutantenproteine |
| WO1996002555A1 (en) * | 1994-07-15 | 1996-02-01 | The University Of Iowa Research Foundation | Immunomodulatory oligonucleotides |
| WO1996004388A1 (en) * | 1994-07-29 | 1996-02-15 | Smithkline Beecham Plc | Novel compounds |
| WO1996004306A2 (en) * | 1994-08-01 | 1996-02-15 | Schering Corporation | Muteins of mammalian cytokines |
| EP0759468A1 (en) * | 1995-08-10 | 1997-02-26 | Laboratoires Virbac | Feline interleukin-4 |
Non-Patent Citations (3)
| Title |
|---|
| HUMAN MOLECULAR GENETICS, vol. 9, no. 4, JPN6008023970, 2000, pages 549 - 559, ISSN: 0001193461 * |
| IMMUNOGENETICS, vol. 49, JPN6008023968, 1999, pages 872 - 878, ISSN: 0001045471 * |
| THE JOURNAL OF IMMUNOLOGY, vol. 150, no. 12, JPN6008023971, 1993, pages 5436 - 5444, ISSN: 0001193460 * |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2010527633A (ja) * | 2007-05-25 | 2010-08-19 | セントコア・オーソ・バイオテツク・インコーポレーテツド | Toll様受容体3モジュレーター及びその使用 |
Also Published As
| Publication number | Publication date |
|---|---|
| BR0207819A (pt) | 2004-03-02 |
| GB0105360D0 (en) | 2001-04-18 |
| AU2002233560B2 (en) | 2006-09-07 |
| US20030194391A1 (en) | 2003-10-16 |
| CN1543504A (zh) | 2004-11-03 |
| PL365066A1 (en) | 2004-12-27 |
| CZ20032373A3 (cs) | 2004-01-14 |
| ZA200306647B (en) | 2004-11-26 |
| CA2439628A1 (en) | 2002-09-12 |
| NO20033882L (no) | 2003-10-31 |
| KR20030081490A (ko) | 2003-10-17 |
| HUP0303372A3 (en) | 2008-06-30 |
| US20050260216A1 (en) | 2005-11-24 |
| NZ527873A (en) | 2005-12-23 |
| WO2002070711A1 (en) | 2002-09-12 |
| MXPA03007915A (es) | 2003-12-04 |
| IL157498A0 (en) | 2004-03-28 |
| HUP0303372A2 (hu) | 2004-01-28 |
| JP4238031B2 (ja) | 2009-03-11 |
| EP1368477A1 (en) | 2003-12-10 |
| NO20033882D0 (no) | 2003-09-02 |
| US20050186209A1 (en) | 2005-08-25 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP4238031B2 (ja) | ワクチン | |
| AU2002233560A1 (en) | Vaccine | |
| ES2527410T3 (es) | Inmunoconjugados de miostatina para el tratamiento de atrofia muscular progresiva | |
| KR100671036B1 (ko) | 오스테오프로테게린 리간드 활성을 하향-조절하는 방법 | |
| JP6987744B2 (ja) | 虫刺され過敏症の治療 | |
| CZ9903657A3 (cs) | Modifikované molekuly TNFalfa, DNA kódující takové modifikované molekuly TNFalfa a vakcíny obsahující uvedené modifikované molekuly TNFalfa | |
| KR19990022654A (ko) | 보호 면역 반응을 증강시키는 방법 | |
| JP2005503320A (ja) | CpG−含有ポリヌクレオチドで自己免疫疾患を処置または防止する方法 | |
| CZ20013709A3 (cs) | Analog interleukinu 5, fragment nukleové kyseliny, vektor, buňka, přípravky a pouľití | |
| US20060147417A1 (en) | Immunogenic composition comprising an il-13 element and t cell epitopes, and its therapeutic use | |
| KR101101004B1 (ko) | 신규한 펩티드 및 그들의 치료 용도 | |
| JP2022513452A (ja) | 融合によって修飾されたcmvのウイルス様粒子 | |
| JP2006503018A (ja) | ワクチン | |
| CA2421274A1 (en) | Method for down-regulating ige | |
| MÉVÉLEC et al. | Mapping of B epitopes in GRA4, a dense granule antigen of Toxoplasma gondii and protection studies using recombinant proteins administered by the oral route. | |
| JP2003517042A (ja) | 単純ヘルペスウイルスワクチンに対する免疫応答を強化する方法 | |
| US20010044418A1 (en) | Treatment of allergies | |
| US20130122026A1 (en) | Dna vaccine for alzheimer's disease | |
| JP2005529091A (ja) | エオタキシン伝達炎症状態の処置および予防方法および組成物 | |
| WO2024220728A1 (en) | Compositions and methods for raising mucosal and systemic immune responses against complement anaphylatoxins for inflammatory disease | |
| KR20060010730A (ko) | 염증 상태를 치료하고 예방하기 위한 방법과 조성물 | |
| JP2002516875A (ja) | 動物の繁殖行動を抑制する方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20050209 |
|
| A621 | Written request for application examination |
Free format text: JAPANESE INTERMEDIATE CODE: A621 Effective date: 20050209 |
|
| A131 | Notification of reasons for refusal |
Free format text: JAPANESE INTERMEDIATE CODE: A131 Effective date: 20080520 |
|
| A521 | Request for written amendment filed |
Free format text: JAPANESE INTERMEDIATE CODE: A523 Effective date: 20080820 |
|
| TRDD | Decision of grant or rejection written | ||
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 Effective date: 20081202 |
|
| A01 | Written decision to grant a patent or to grant a registration (utility model) |
Free format text: JAPANESE INTERMEDIATE CODE: A01 |
|
| A61 | First payment of annual fees (during grant procedure) |
Free format text: JAPANESE INTERMEDIATE CODE: A61 Effective date: 20081219 |
|
| R150 | Certificate of patent or registration of utility model |
Free format text: JAPANESE INTERMEDIATE CODE: R150 |
|
| FPAY | Renewal fee payment (event date is renewal date of database) |
Free format text: PAYMENT UNTIL: 20111226 Year of fee payment: 3 |
|
| LAPS | Cancellation because of no payment of annual fees |