FR2647440A1 - Procede de bromation d'un derive du phenol - Google Patents
Procede de bromation d'un derive du phenol Download PDFInfo
- Publication number
- FR2647440A1 FR2647440A1 FR8906842A FR8906842A FR2647440A1 FR 2647440 A1 FR2647440 A1 FR 2647440A1 FR 8906842 A FR8906842 A FR 8906842A FR 8906842 A FR8906842 A FR 8906842A FR 2647440 A1 FR2647440 A1 FR 2647440A1
- Authority
- FR
- France
- Prior art keywords
- formula
- bromination
- substrate
- hypobromite
- reacted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C41/00—Preparation of ethers; Preparation of compounds having groups, groups or groups
- C07C41/01—Preparation of ethers
- C07C41/18—Preparation of ethers by reactions not forming ether-oxygen bonds
- C07C41/22—Preparation of ethers by reactions not forming ether-oxygen bonds by introduction of halogens; by substitution of halogen atoms by other halogen atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
L'invention concerne la bromation en ortho de dérivés du phénol du type gaacol par exemple. Cette bromation s'effectue en faisant réagir le produit à bromer avec un hypobromite éventuellement en présence d'une amine primaire ou secondaire.
Description
PROCèDE DE BROMATION D'UN DERIVE DU PHENOL
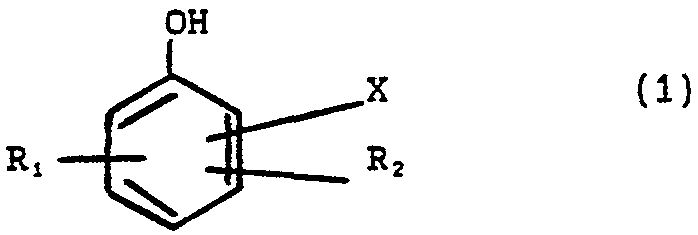
La présente invention concerne la bromation d'un dérivé du phénol de formule (i)
dans laquelle X représente l'hydrogène, OH, un radical alcoxy CH2 OH, CHO, CO2R, R etant un radical alkyle, alcényle, alkyloxy, ces radicaux pouvant être linéaires ou ramifiés, cycloalkyle, cycloalcényle, alkylcycloalcényle, benzyle, amine, terpénique, ou un radical alcoxy, R, et R2 sont identiques ou différents et représentent l'hydrogène, un halogène, un radical alkyle, acyle ou alcoxy, au moins un de X, Rf, R2 n'étant pas l'hydrogène.
La présente invention concerne la bromation d'un dérivé du phénol de formule (i)
dans laquelle X représente l'hydrogène, OH, un radical alcoxy CH2 OH, CHO, CO2R, R etant un radical alkyle, alcényle, alkyloxy, ces radicaux pouvant être linéaires ou ramifiés, cycloalkyle, cycloalcényle, alkylcycloalcényle, benzyle, amine, terpénique, ou un radical alcoxy, R, et R2 sont identiques ou différents et représentent l'hydrogène, un halogène, un radical alkyle, acyle ou alcoxy, au moins un de X, Rf, R2 n'étant pas l'hydrogène.
Le probléme qui se pose pour la bromation de tels produits est double. D'une-part, en effet, on veut obtenir généralement un dérivé nonobromé et non pas bromé. D'autre part, cette bromation doit être régio-sélective car on désire préparer essentiellement le dérivé bronzé en ortho. on peut indiquer à ce sujet qu'une bromation d'un produit tel que le gaïacol par le brome donne 80 t de dérivé bromé en para et 20 t de dérivé bromé en ortho seulement.
L'objet principal de l'invention est donc un procédé permettant en particulier une monobromation en ortho avec un rendement acceptable. Or, la Demanderesse s'est aperçue que le problème pouvait être résolu en utilisant un agent bromant spécifique.
Dans ce but, le procédé selon l'invention de bromation d'un dérivé du phénol est caractérisé en ce qu'on fait réagir avec un hypobromite un substrat de formule
dans laquelle X représente l'hydrogène, OH, un radical alcoxy, CH2 OH, CHO, CO2R, R étant un radical alkyle, alcényle, alkyloxy, ces radicaux pouvant être linéaires ou ramifiés, cycloalkyle, cycloalcényle, alkylcycloalcényle, benzyle, amine, terpénique, Rt et
R2 sont identiques ou différents et représentent l'hydrogène, un halogène, un radical alkyle, acyle ou alcoxy, au moins un de X, Rt et R2 n'étant pas l'hydrogène.
dans laquelle X représente l'hydrogène, OH, un radical alcoxy, CH2 OH, CHO, CO2R, R étant un radical alkyle, alcényle, alkyloxy, ces radicaux pouvant être linéaires ou ramifiés, cycloalkyle, cycloalcényle, alkylcycloalcényle, benzyle, amine, terpénique, Rt et
R2 sont identiques ou différents et représentent l'hydrogène, un halogène, un radical alkyle, acyle ou alcoxy, au moins un de X, Rt et R2 n'étant pas l'hydrogène.
Dans ces conditions, on obtient un dérivé monobromé en ortho avec un rendement d'au moins 30% et d'au moins 40% selon des modes de réalisation préférés de l'invention.
D'autres caractéristiques, détails et avantages de l'invention seront mieux compris à la lecture de la description et des exemples concrets qui vont suivre.
Le produit ou substrat de départ est un dérivé du phénol répondant à la formule 1 ci-dessus.
L'invention s'applique particulièrement bien aux produits pour lesquels Rl et R2 sont en position méta et aussi à ceux pour lesquels RX et R2 représentent tous les deux l'hydrogène.
On notera, que comme produit de départ particulièrement intéressant on peut utiliser ceux pour lesquels X est un radical alcoxy, et entre autres ceux pour lesquels R1 et R2 sont l'hydrogène, et plus particulièrement ceux pour lesquels X est en position ortho, notamment parmi ceux-ci le gaïacol (X = Oc2).
Comme autres produits de départ intéressants, on peut mentionner aussi les salicylates, c'est-8-dire les produits pour lesquels X dans la formule (1) est un radical CO2R, R étant tel que défini plus haut.
On peut citer à titre d'exemple les produits pour lesquels R1 et R2 sont tous les deux l'hydrogène et notamment les salicylates de n-hexyle, de benzyle, de méthyle, d'amyle, d'isoamyle, d'éthyl-2 hexyle, de cis-hexen-3 yle-1, de glycol, de prenyle, d'éthyl-2 butyle, de méthyl-2 pentyle, de monométhylamine, de triméthyl 3,3,5 cyclohexyle, d'isopropyl-2 cyclohexyle, de béta-isopropoxyéthyle, de bronyle.
Une caractéristique essentielle du procédé de l'invention est la nature de l'agent bromant.
Selon l'invention, cet agent bromant est un hypobromite.
Généralement, on utilise un hypobromite d'un métal alcalin plus particulièrement l'hypobromite de sodium.
Par ailleurs, il existe une variante de l'invention qui permet d'augmenter le rendement en produit bromé.
Cette variante consiste à conduire la réaction de bromation en présence de l'hypobromite et d'un composé supplémentaire.
Ce composé peut étre choisi tout d'abord dans le groupe des amines primaires ou secondaires notamment des amines aliphatiques, plus particulièrement des alkylamines. On citera à titre d'exemple de ces dernières celles pour lesquelles le radical ou les radicaux alkyles sont le méthyle, l'éthyle, le n-propyle, le n-butyle, l'isobutyle, le cyclohexyle, le tertiobutyle.
Ce composé peut aussi être choisi dans le groupe des imides, des lactames, des amides ainsi que les dérivés de l'urée et les acides cyanurique et isocyanurique.
En ce qui concerne les imides, on peut citer le succinimide, le phtalimide, la saccharine.
Pour les lactames, on peut mentionner le caprolactame.
Parmi les amides, on peut utiliser plus particulièrement l'acétamide, les sulfonamides comme la tosylsulfonamide.
Pour les dérivés de l'urée, on peut employer des uréines, des uréides ou des dérivés cycliques de ceux-ci comme l'hydantoïne.
Généralement, la réaction est conduite en milieu aqueux, l'hypobromite étant généralement introduit sous forme d'une solution aqueuse.
Toutefois, il est possible de travailler dans un milieu biphasique.
Le produit & bromer est présent en solution dans un solvant, la seconde phase, phase aqueuse, étant par exemple celle de la solution aqueuse d'hypobromite.
Comme solvant on pourra utiliser les hydrocarbures aliphatiques halogénés, les hydrocarbures aromatiques halogénés ou non, les éthers.
On peut citer à ce sujet le tétrachlorure de carbone, le dichlo rométhane, le chloroéthane, le dichlorobenzène.
Pour les éthers, on peut mentionner plus particulièrement l'éther isopropylique, l'oxyde de butyle, l'oxyde d'hexyre.
Un mode de réalisation particulière peut étre mentionné. Il consiste à former un milieu biphasique comprenant d'une part le solvant du type ci-dessus et le substrat de départ, et d'autre part comme deuxième phase de l'eau et le composé supplémentaire décrit précédemment. La réaction est mise en oeuvre en injectant l'hypobromite dans la phase aqueuse.
De préférence, on maintient la phase aqueuse à un pH voisin de la neutralité.
Un autre mode de réalisation consiste à former un milieu biphasique comprenant un solvant organique du type précité et une phase aqueuse avec l'hypobromite et le composé supplémentaire. La réaction est mise en oeuvre en introduisant dans le solvant le produit à brome.
La réaction se fait généralement à une température voisine de l'ambiante.
La concentration en dérivé du phénol (produit de départ) est habituellement comprise entre 5,1 et 10 moles/l.
Le procédé de l'invention est particulièrement avantageux pour réaliser une monobromation auquel cas on utilise en général une quantité d'agent bromant comprise entre 0,8 et 1,2 équivalent de brome réactif.
D'une manière générale, la quantité de composé supplémentaire utilisé avec l'hypobromite peut varier dans de larges proportions.
Cette quantité peut ainsi aller de 0,01 à 10 moles plus particulièrement 0,1 à 1 mole par mole de produit de départ à bromer.
Ce procédé est aussi très avantageux pour effectuer la bromation en ortho des substrats de formule (1) pour lesquels bien entendu il existe une position libre en ortho du groupement OH.
Une fois la réaction terminée, on peut séparer le produit du milieu réactionnel par tout moyen connu après, le cas échéant, traitement classique pour le passage de sa forme sel å la forme recherchée. Un exemple de traitement consiste à ajouter une solution acide au milieu réactionnel et à augmenter la température afin d'hydrolyser le précipité formé au cours de la réaction.
Des exemples concrets mais non limitatifs vont maintenant entre donnés.
Dans ces exemples, T T désigne le Taux de Transformation, c'est- & dire le rapport :
nombre de moles transformées
nombre de moles engagées
Il définit la quantité de produit de départ transformé lors de la réaction.
nombre de moles transformées
nombre de moles engagées
Il définit la quantité de produit de départ transformé lors de la réaction.
R R désigne le Rendement de la réaction, c'est-à-dire le rapport
nombre de moles obtenues
nombre de moles théoriques
Il indique le pourcentage d'un composé présent dans le mélange réactionnel.
nombre de moles obtenues
nombre de moles théoriques
Il indique le pourcentage d'un composé présent dans le mélange réactionnel.
R T désigne le Rendement par rapport au produit transformé soit le rapport
RR
TT
Il traduit la sélectivité d'une réaction pour un composé.
RR
TT
Il traduit la sélectivité d'une réaction pour un composé.
EXEMPLE 1
On additionne une solution d'hypobromite de sodium contenant 0,075 moles de Dr (dosé par iodométrie) à une solution de 9,3 g (0,075 moles) de gaïacol dissous dans 100 ml d'éther isopropylique.
On additionne une solution d'hypobromite de sodium contenant 0,075 moles de Dr (dosé par iodométrie) à une solution de 9,3 g (0,075 moles) de gaïacol dissous dans 100 ml d'éther isopropylique.
L'agitation est maintenue pendant quatre heures & une température comprise entre 15.et 2O0C. Le mélange est traité avec 100 ml d'acide sulfurique 2N & 5O0C. La phase organique est lavée et séchée une nuit sur chlorure de calcium.
On obtient un liquide brun qui est analysé par HPLC et CPG. Les résultats sont les suivants
T T = 63,2%
Bromo-6 gaïacol R R = 20,8% R T = 32,9%
Bromo-4 gaiacol R R = 3,8%
On peut noter que le rapport bromo-6 est de 5,47
bromo-4
Il s'agit d'une valeur intéressante dans la mesure où il s'agit de produits dont la séparation pose le plus de problemes.
T T = 63,2%
Bromo-6 gaïacol R R = 20,8% R T = 32,9%
Bromo-4 gaiacol R R = 3,8%
On peut noter que le rapport bromo-6 est de 5,47
bromo-4
Il s'agit d'une valeur intéressante dans la mesure où il s'agit de produits dont la séparation pose le plus de problemes.
EXEMPLE 2
Ct exemple décrit une bromation en présence d'une amine.
Ct exemple décrit une bromation en présence d'une amine.
La bromation se fait en milieu biphasique, en présence de différentes concentrations molaires en tertiobutylamine et en utilisant l'hypobromite de sodium comme agent bromant.
0,075 moles (9,3 g) de gaïacol plus différentes quantités de tertiobutylamine sont solubilisées dans 100 ml d'éther isopropylique et 20 ml d'eau.
0,075 moles d'hypobromite sont additionnées goutte à goutte. On laisse sous agitation pendant 4 heures.
La température est maintenue entre 15 et 200C. Le composé est hydrolysé avec 50 cm3 d'acide sulfurique 4N à 500C.
La phase organique est lavée et séchée sur chlorure de calcium.
Les produits sont séparés par CPG et HPLC et identifiés par interprétation des spectres RMN.
Pour 1/8 de mole d'amine par mole de gaïacol, les résultats sont les suivants
T T = 64,1%
Bromo-6 gaïacol R R = 27% R T = 42%
Bromo-4 gaïacol R R = 6,9%
Pour 1/4 de mole d'amine par mole de gaïacol, les résultats sont les suivants :
T T = 66,7%
Bromo-6 gaïacol R R = 30,9% R T = 46,4%
Bromo-4 gaïacol R R = 6,7%
Pour 1/2 mole d'amine par mole de gaïacol, les résultats sont les suivants :
T T = 79%
Bromo-6 gaiacol R R = 44,1% R T = 55,8%
Bromo-4 gaiacol R R = 11%
EXEMPLE 3
Cet exemple décrit une réaction par addition du gaïacol à une solution d'hypobromite contenant une amine.
T T = 64,1%
Bromo-6 gaïacol R R = 27% R T = 42%
Bromo-4 gaïacol R R = 6,9%
Pour 1/4 de mole d'amine par mole de gaïacol, les résultats sont les suivants :
T T = 66,7%
Bromo-6 gaïacol R R = 30,9% R T = 46,4%
Bromo-4 gaïacol R R = 6,7%
Pour 1/2 mole d'amine par mole de gaïacol, les résultats sont les suivants :
T T = 79%
Bromo-6 gaiacol R R = 44,1% R T = 55,8%
Bromo-4 gaiacol R R = 11%
EXEMPLE 3
Cet exemple décrit une réaction par addition du gaïacol à une solution d'hypobromite contenant une amine.
Une solution aqueuse d'hypobromite contenant 0,075 mole de Br et 30 ml d'éther isopropylique est refroidie à OOC. On y ajoute d'abord 0,7 g de tertiobutylamine, puis 9,3 g de gaïacol, celui-ci étant solubilisé dans 70 ml d'éther isopropylique. La température est maintenue & OOC. L'excès de brome réactif est neutralisé par du sulfite de sodium å 10%. Le mélange est traité avec 50 ml d'acide sulfurique 4N à 500C. la phase organique est lavée et séchée une nuit sur chlorure de calcium. Elle est ensuite analysée par CPG.
On obtient pour le bromo-6 galacol un R T de 61,8%.
Claims (10)
1. Procédé de bromation d'un phénol ou d'un dérivé du phénol
caractérisé en ce qu'on fait réagir avec un hypobromite un
substrat de formule
ou alcoxy, au moins un de X, R, et R2 n'étant pas l'hydrogène.
représentent l'hydrogène, un halogène, un radical alkyle, acyle
glycolique, Rl et R2 sont identiques ou différents et
cycloalcényle, alkylcycloalcényle, benzyle, amine, terpénique,
ces radicaux pouvant étre linéaires ou ramifiés, cycloalkyle,
CH2OH,CHO, COUR, R étant un radical alkyle, alcényle, alkyloxy,
dans laquelle X représente l'hydrogène, OH, un radical alcoxy,
2. Procédé selon la revendication 1, caractérisé en ce qu'on
utilise un hypobromite d'un métal alcalin notamment de sodium.
3. Procédé selon la revendication 1 ou 2, caractérisé en ce qu'on
conduit la réaction de bromation en présence en outre d'un
composé supplémentaire choisi dans le groupe comprenant les
amines primaires ou secondaires.
4. Procédé selon l'une des revendications 1 ou 2, caractérisé en ce
qu'on conduit la réaction de bromation en présence en outre d'un
composé supplémentaire choisi dans le groupe comprenant les
imides, les lactames, les amides, les dérivés de l'urée et les
acides cyanurique et isocyanurique.
5. Procédé selon l'une des revendications précédentes, caractérisé
en ce quton conduit la réaction de bromation dans un milieu
biphasique comprenant un solvant et de l'eau.
6. Procédé selon l'une des revendications précédentes, caractérisé
en ce qu'on réalise une bromation en ortho du substrat de
formule (1).
7. Procédé selon l'une des revendications précédentes, caractérisé
en ce qu'on fait réagir un substrat de formule (1) dans laquelle
R, et R2 sont en position méta.
8. Procédé selon l'une des revendications précédentes, caractérisé
en ce qu'on fait réagir un substrat de formule (1) dans laquelle
Rl r R2 = H.
9. Procédé selon l'une des revendications précédentes, caractérisé
en ce qu'on fait réagir un substrat de formule (1) dans laquelle
X est un radical alcoxy.
10. Procédé selon l'une des revendications précédentes, caractérisé
en ce qu'on fait réagir un substrat de formule (1) dans laquelle
X est en position ortho.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8906842A FR2647440B1 (fr) | 1989-05-25 | 1989-05-25 | Procede de bromation d'un derive du phenol |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8906842A FR2647440B1 (fr) | 1989-05-25 | 1989-05-25 | Procede de bromation d'un derive du phenol |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| FR2647440A1 true FR2647440A1 (fr) | 1990-11-30 |
| FR2647440B1 FR2647440B1 (fr) | 1991-09-06 |
Family
ID=9381998
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR8906842A Expired - Lifetime FR2647440B1 (fr) | 1989-05-25 | 1989-05-25 | Procede de bromation d'un derive du phenol |
Country Status (1)
| Country | Link |
|---|---|
| FR (1) | FR2647440B1 (fr) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5756851A (en) * | 1996-10-21 | 1998-05-26 | Albemarle Corporation | Production of nabumetone or precursors thereof |
| WO2005023738A1 (fr) * | 2003-08-28 | 2005-03-17 | General Electric Company | Bromation de composes hydroxyaromatiques |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB537033A (en) * | 1939-12-06 | 1941-06-05 | Thomas Hebron Sanders | Improvements in and relating to chlorinated phenolic compositions |
| US4431847A (en) * | 1982-07-29 | 1984-02-14 | Ethyl Corporation | Method for removing brominated phenolic waste |
-
1989
- 1989-05-25 FR FR8906842A patent/FR2647440B1/fr not_active Expired - Lifetime
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB537033A (en) * | 1939-12-06 | 1941-06-05 | Thomas Hebron Sanders | Improvements in and relating to chlorinated phenolic compositions |
| US4431847A (en) * | 1982-07-29 | 1984-02-14 | Ethyl Corporation | Method for removing brominated phenolic waste |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5756851A (en) * | 1996-10-21 | 1998-05-26 | Albemarle Corporation | Production of nabumetone or precursors thereof |
| US5907069A (en) * | 1996-10-21 | 1999-05-25 | Albemarle Corporation | Production of nabumetone or precursors thereof |
| WO2005023738A1 (fr) * | 2003-08-28 | 2005-03-17 | General Electric Company | Bromation de composes hydroxyaromatiques |
| CN100383098C (zh) * | 2003-08-28 | 2008-04-23 | 通用电气公司 | 羟芳族化合物的溴化 |
Also Published As
| Publication number | Publication date |
|---|---|
| FR2647440B1 (fr) | 1991-09-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| FR1465165A (fr) | Procédé de préparation d'amines aromatiques | |
| EP0021868A1 (fr) | Procédé de préparation d'éthers diaryliques | |
| EP0016673B1 (fr) | Procédé de solubilisation de sels organiques ou minéraux dans des solvants organiques et complexes de sels organiques ou minéraux | |
| CA2081115A1 (fr) | Procede de preparation de sulfates cycliques | |
| EP0021927B1 (fr) | Procédé de préparation d'éthers aryliques | |
| EP0147279B1 (fr) | Nouveau procédé de préparation de diamine-alcools | |
| FR2647440A1 (fr) | Procede de bromation d'un derive du phenol | |
| EP0049186B1 (fr) | Procédé de préparation de fluorobenzonitriles | |
| FR2707289A1 (fr) | Procédé de préparation d'un composé hydroxylé d'amine secondaire ou tertiaire. | |
| EP0020281B1 (fr) | Préparation de benzoxazolone | |
| EP0060171B1 (fr) | Procédé de N-alkylation de composés organiques azotés | |
| CA1331496C (fr) | Composes guanidiniques comprenant un ion tetraphenylborate, procede d'obtention de ces composes et utilisation des composes lors de la synthese peptidique | |
| CA1170280A (fr) | Procede d'isomerisation de bromohalogenobenzenes | |
| EP0338898B1 (fr) | Procédé de préparation d'un dérivé mono-bromé en ortho du phénol | |
| CA1099292A (fr) | Preparation du nitro-2 methyl-2 propanol-1 | |
| JPS59122456A (ja) | ジシクロヘキシルジスルフイドの製造法 | |
| EP0326455B1 (fr) | Procédé de préparation de chloranil | |
| FR2647109A1 (fr) | Procede de preparation de cyanures d'acyle en milieu anhydre | |
| EP0098783A1 (fr) | Procédé de préparation de halogéno anilines | |
| FR2647441A1 (fr) | Procede de bromation du noyau aromatique de phenols ou de phenols substitues a chaines ethyleniques | |
| EP1259521B1 (fr) | Procede de preparation du tris-trifluoromethanesulfonate de bismuth | |
| FR2505327A1 (fr) | Procede d'halogenation en meta de n-(o,o'-dialkyl phenyl) alaninates et homologues | |
| EP0047206A1 (fr) | Procédé de préparation d'aminoalcools polyoxaalkylés ou polyoxaarylés et leur application comme agents de complexation de cations | |
| EP0084743A1 (fr) | Procédé de préparation de alpha,alpha-difluoroalkoxy ou alpha,alpha-difluoroalkylthiophenyl sulfones | |
| EP0322279A2 (fr) | Procédé d'acylation d'un N,N-diallylaniline |