FR2647440A1 - Process for the bromination of a phenol derivative - Google Patents
Process for the bromination of a phenol derivative Download PDFInfo
- Publication number
- FR2647440A1 FR2647440A1 FR8906842A FR8906842A FR2647440A1 FR 2647440 A1 FR2647440 A1 FR 2647440A1 FR 8906842 A FR8906842 A FR 8906842A FR 8906842 A FR8906842 A FR 8906842A FR 2647440 A1 FR2647440 A1 FR 2647440A1
- Authority
- FR
- France
- Prior art keywords
- formula
- bromination
- substrate
- hypobromite
- reacted
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C41/00—Preparation of ethers; Preparation of compounds having groups, groups or groups
- C07C41/01—Preparation of ethers
- C07C41/18—Preparation of ethers by reactions not forming ether-oxygen bonds
- C07C41/22—Preparation of ethers by reactions not forming ether-oxygen bonds by introduction of halogens; by substitution of halogen atoms by other halogen atoms
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
PROCèDE DE BROMATION D'UN DERIVE DU PHENOL
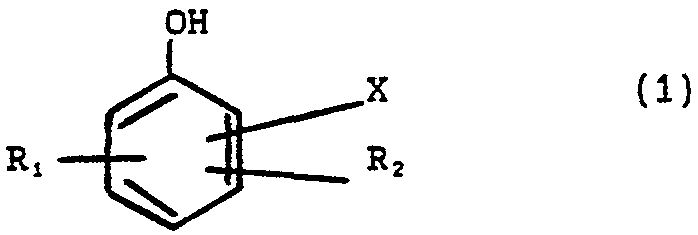
La présente invention concerne la bromation d'un dérivé du phénol de formule (i)
dans laquelle X représente l'hydrogène, OH, un radical alcoxy CH2 OH, CHO, CO2R, R etant un radical alkyle, alcényle, alkyloxy, ces radicaux pouvant être linéaires ou ramifiés, cycloalkyle, cycloalcényle, alkylcycloalcényle, benzyle, amine, terpénique, ou un radical alcoxy, R, et R2 sont identiques ou différents et représentent l'hydrogène, un halogène, un radical alkyle, acyle ou alcoxy, au moins un de X, Rf, R2 n'étant pas l'hydrogène.PROCESS FOR BROMINATING A PHENOL DERIVATIVE
The present invention relates to the bromination of a phenol derivative of formula (i)
in which X represents hydrogen, OH, an alkoxy radical CH2 OH, CHO, CO2R, R being an alkyl, alkenyl or alkyloxy radical, these radicals being able to be linear or branched, cycloalkyl, cycloalkenyl, alkylcycloalkenyl, benzyl, amine, terpenic, or an alkoxy radical, R, and R2 are identical or different and represent hydrogen, a halogen, an alkyl, acyl or alkoxy radical, at least one of X, Rf, R2 not being hydrogen.
Le probléme qui se pose pour la bromation de tels produits est double. D'une-part, en effet, on veut obtenir généralement un dérivé nonobromé et non pas bromé. D'autre part, cette bromation doit être régio-sélective car on désire préparer essentiellement le dérivé bronzé en ortho. on peut indiquer à ce sujet qu'une bromation d'un produit tel que le gaïacol par le brome donne 80 t de dérivé bromé en para et 20 t de dérivé bromé en ortho seulement. The problem which arises for the bromination of such products is twofold. On the one hand, in fact, we generally want to obtain an unobrominated and not brominated derivative. On the other hand, this bromination must be regio-selective because it is desired essentially to prepare the bronzed derivative in ortho. we can indicate on this subject that a bromination of a product such as guaiacol by bromine gives 80 t of brominated derivative in para and 20 t of brominated derivative in ortho only.
L'objet principal de l'invention est donc un procédé permettant en particulier une monobromation en ortho avec un rendement acceptable. Or, la Demanderesse s'est aperçue que le problème pouvait être résolu en utilisant un agent bromant spécifique. The main object of the invention is therefore a process allowing in particular monobromation in ortho with an acceptable yield. However, the Applicant has realized that the problem could be resolved by using a specific brominating agent.
Dans ce but, le procédé selon l'invention de bromation d'un dérivé du phénol est caractérisé en ce qu'on fait réagir avec un hypobromite un substrat de formule
dans laquelle X représente l'hydrogène, OH, un radical alcoxy, CH2 OH, CHO, CO2R, R étant un radical alkyle, alcényle, alkyloxy, ces radicaux pouvant être linéaires ou ramifiés, cycloalkyle, cycloalcényle, alkylcycloalcényle, benzyle, amine, terpénique, Rt et
R2 sont identiques ou différents et représentent l'hydrogène, un halogène, un radical alkyle, acyle ou alcoxy, au moins un de X, Rt et R2 n'étant pas l'hydrogène.For this purpose, the process according to the invention for bromination of a phenol derivative is characterized in that a substrate of formula is reacted with a hypobromite
in which X represents hydrogen, OH, an alkoxy radical, CH2 OH, CHO, CO2R, R being an alkyl, alkenyl or alkyloxy radical, these radicals being able to be linear or branched, cycloalkyl, cycloalkenyl, alkylcycloalkenyl, benzyl, amine, terpenic , Rt and
R2 are identical or different and represent hydrogen, a halogen, an alkyl, acyl or alkoxy radical, at least one of X, Rt and R2 not being hydrogen.
Dans ces conditions, on obtient un dérivé monobromé en ortho avec un rendement d'au moins 30% et d'au moins 40% selon des modes de réalisation préférés de l'invention. Under these conditions, a monobromo derivative in ortho is obtained with a yield of at least 30% and at least 40% according to preferred embodiments of the invention.
D'autres caractéristiques, détails et avantages de l'invention seront mieux compris à la lecture de la description et des exemples concrets qui vont suivre. Other characteristics, details and advantages of the invention will be better understood on reading the description and the concrete examples which will follow.
Le produit ou substrat de départ est un dérivé du phénol répondant à la formule 1 ci-dessus. The starting product or substrate is a phenol derivative corresponding to formula 1 above.
L'invention s'applique particulièrement bien aux produits pour lesquels Rl et R2 sont en position méta et aussi à ceux pour lesquels RX et R2 représentent tous les deux l'hydrogène. The invention applies particularly well to products for which R1 and R2 are in the meta position and also to those for which RX and R2 both represent hydrogen.
On notera, que comme produit de départ particulièrement intéressant on peut utiliser ceux pour lesquels X est un radical alcoxy, et entre autres ceux pour lesquels R1 et R2 sont l'hydrogène, et plus particulièrement ceux pour lesquels X est en position ortho, notamment parmi ceux-ci le gaïacol (X = Oc2). It will be noted that, as a particularly advantageous starting product, it is possible to use those for which X is an alkoxy radical, and inter alia those for which R1 and R2 are hydrogen, and more particularly those for which X is in the ortho position, in particular among these guaiacol (X = Oc2).
Comme autres produits de départ intéressants, on peut mentionner aussi les salicylates, c'est-8-dire les produits pour lesquels X dans la formule (1) est un radical CO2R, R étant tel que défini plus haut. As other interesting starting materials, salicylates can also be mentioned, that is to say the products for which X in the formula (1) is a CO2R radical, R being as defined above.
On peut citer à titre d'exemple les produits pour lesquels R1 et R2 sont tous les deux l'hydrogène et notamment les salicylates de n-hexyle, de benzyle, de méthyle, d'amyle, d'isoamyle, d'éthyl-2 hexyle, de cis-hexen-3 yle-1, de glycol, de prenyle, d'éthyl-2 butyle, de méthyl-2 pentyle, de monométhylamine, de triméthyl 3,3,5 cyclohexyle, d'isopropyl-2 cyclohexyle, de béta-isopropoxyéthyle, de bronyle. By way of example, mention may be made of the products for which R1 and R2 are both hydrogen and in particular the salicylates of n-hexyl, of benzyl, of methyl, of amyl, of isoamyl, of ethyl-2 hexyl, cis-hexen-3 yl-1, glycol, prenyl, 2-ethyl butyl, 2-methyl pentyl, monomethylamine, 3,3,5 trimethyl cyclohexyl, 2-isopropyl cyclohexyl, beta-isopropoxyethyl, bronyl.
Une caractéristique essentielle du procédé de l'invention est la nature de l'agent bromant. An essential characteristic of the process of the invention is the nature of the brominating agent.
Selon l'invention, cet agent bromant est un hypobromite. According to the invention, this brominating agent is a hypobromite.
Généralement, on utilise un hypobromite d'un métal alcalin plus particulièrement l'hypobromite de sodium.Generally, an alkali metal hypobromite is used, more particularly sodium hypobromite.
Par ailleurs, il existe une variante de l'invention qui permet d'augmenter le rendement en produit bromé. Furthermore, there is a variant of the invention which makes it possible to increase the yield of brominated product.
Cette variante consiste à conduire la réaction de bromation en présence de l'hypobromite et d'un composé supplémentaire. This variant consists in carrying out the bromination reaction in the presence of the hypobromite and of an additional compound.
Ce composé peut étre choisi tout d'abord dans le groupe des amines primaires ou secondaires notamment des amines aliphatiques, plus particulièrement des alkylamines. On citera à titre d'exemple de ces dernières celles pour lesquelles le radical ou les radicaux alkyles sont le méthyle, l'éthyle, le n-propyle, le n-butyle, l'isobutyle, le cyclohexyle, le tertiobutyle. This compound can be chosen first of all from the group of primary or secondary amines, in particular aliphatic amines, more particularly alkylamines. Examples of the latter are those for which the alkyl radical or radicals are methyl, ethyl, n-propyl, n-butyl, isobutyl, cyclohexyl, tert-butyl.
Ce composé peut aussi être choisi dans le groupe des imides, des lactames, des amides ainsi que les dérivés de l'urée et les acides cyanurique et isocyanurique. This compound can also be chosen from the group of imides, lactams, amides as well as urea derivatives and cyanuric and isocyanuric acids.
En ce qui concerne les imides, on peut citer le succinimide, le phtalimide, la saccharine. As regards the imides, mention may be made of succinimide, phthalimide, saccharin.
Pour les lactames, on peut mentionner le caprolactame. For lactams, caprolactam can be mentioned.
Parmi les amides, on peut utiliser plus particulièrement l'acétamide, les sulfonamides comme la tosylsulfonamide. Among the amides, acetamide can be used, sulfonamides such as tosylsulfonamide.
Pour les dérivés de l'urée, on peut employer des uréines, des uréides ou des dérivés cycliques de ceux-ci comme l'hydantoïne. For urea derivatives, ureines, ureides or cyclic derivatives thereof such as hydantoin can be used.
Généralement, la réaction est conduite en milieu aqueux, l'hypobromite étant généralement introduit sous forme d'une solution aqueuse. Generally, the reaction is carried out in an aqueous medium, the hypobromite generally being introduced in the form of an aqueous solution.
Toutefois, il est possible de travailler dans un milieu biphasique. However, it is possible to work in a two-phase environment.
Le produit & bromer est présent en solution dans un solvant, la seconde phase, phase aqueuse, étant par exemple celle de la solution aqueuse d'hypobromite. The product & bromer is present in solution in a solvent, the second phase, aqueous phase, being for example that of the aqueous hypobromite solution.
Comme solvant on pourra utiliser les hydrocarbures aliphatiques halogénés, les hydrocarbures aromatiques halogénés ou non, les éthers. As solvent, it is possible to use halogenated aliphatic hydrocarbons, aromatic hydrocarbons, halogenated or not, ethers.
On peut citer à ce sujet le tétrachlorure de carbone, le dichlo rométhane, le chloroéthane, le dichlorobenzène. Mention may be made in this connection of carbon tetrachloride, dichlo romethane, chloroethane, dichlorobenzene.
Pour les éthers, on peut mentionner plus particulièrement l'éther isopropylique, l'oxyde de butyle, l'oxyde d'hexyre. For ethers, mention may more particularly be made of isopropyl ether, butyl oxide and hexyxide.
Un mode de réalisation particulière peut étre mentionné. Il consiste à former un milieu biphasique comprenant d'une part le solvant du type ci-dessus et le substrat de départ, et d'autre part comme deuxième phase de l'eau et le composé supplémentaire décrit précédemment. La réaction est mise en oeuvre en injectant l'hypobromite dans la phase aqueuse. A particular embodiment can be mentioned. It consists in forming a two-phase medium comprising on the one hand the solvent of the above type and the starting substrate, and on the other hand as the second phase of water and the additional compound described above. The reaction is carried out by injecting the hypobromite into the aqueous phase.
De préférence, on maintient la phase aqueuse à un pH voisin de la neutralité. Preferably, the aqueous phase is maintained at a pH close to neutrality.
Un autre mode de réalisation consiste à former un milieu biphasique comprenant un solvant organique du type précité et une phase aqueuse avec l'hypobromite et le composé supplémentaire. La réaction est mise en oeuvre en introduisant dans le solvant le produit à brome. Another embodiment consists in forming a two-phase medium comprising an organic solvent of the aforementioned type and an aqueous phase with the hypobromite and the additional compound. The reaction is carried out by introducing the bromine product into the solvent.
La réaction se fait généralement à une température voisine de l'ambiante. The reaction is generally carried out at a temperature close to ambient.
La concentration en dérivé du phénol (produit de départ) est habituellement comprise entre 5,1 et 10 moles/l. The concentration of phenol derivative (starting product) is usually between 5.1 and 10 moles / l.
Le procédé de l'invention est particulièrement avantageux pour réaliser une monobromation auquel cas on utilise en général une quantité d'agent bromant comprise entre 0,8 et 1,2 équivalent de brome réactif. The process of the invention is particularly advantageous for carrying out a monobromation in which case a quantity of brominating agent between 0.8 and 1.2 equivalent of reactive bromine is generally used.
D'une manière générale, la quantité de composé supplémentaire utilisé avec l'hypobromite peut varier dans de larges proportions. Generally, the amount of additional compound used with hypobromite can vary widely.
Cette quantité peut ainsi aller de 0,01 à 10 moles plus particulièrement 0,1 à 1 mole par mole de produit de départ à bromer.This amount can thus range from 0.01 to 10 moles, more particularly 0.1 to 1 mole per mole of starting material to be brominated.
Ce procédé est aussi très avantageux pour effectuer la bromation en ortho des substrats de formule (1) pour lesquels bien entendu il existe une position libre en ortho du groupement OH. This process is also very advantageous for carrying out bromination in ortho of the substrates of formula (1) for which of course there is a free position in ortho of the OH group.
Une fois la réaction terminée, on peut séparer le produit du milieu réactionnel par tout moyen connu après, le cas échéant, traitement classique pour le passage de sa forme sel å la forme recherchée. Un exemple de traitement consiste à ajouter une solution acide au milieu réactionnel et à augmenter la température afin d'hydrolyser le précipité formé au cours de la réaction. Once the reaction is complete, the product can be separated from the reaction medium by any known means after, if necessary, conventional treatment for the transition from its salt form to the desired form. An example of treatment consists in adding an acid solution to the reaction medium and in increasing the temperature in order to hydrolyze the precipitate formed during the reaction.
Des exemples concrets mais non limitatifs vont maintenant entre donnés. Concrete but non-limiting examples now go between data.
Dans ces exemples, T T désigne le Taux de Transformation, c'est- & dire le rapport :
nombre de moles transformées
nombre de moles engagées
Il définit la quantité de produit de départ transformé lors de la réaction.In these examples, TT denotes the Rate of Transformation, i.e. the ratio:
number of moles transformed
number of moles entered
It defines the quantity of starting product transformed during the reaction.
R R désigne le Rendement de la réaction, c'est-à-dire le rapport
nombre de moles obtenues
nombre de moles théoriques
Il indique le pourcentage d'un composé présent dans le mélange réactionnel.RR denotes the yield of the reaction, i.e. the ratio
number of moles obtained
number of theoretical moles
It indicates the percentage of a compound present in the reaction mixture.
R T désigne le Rendement par rapport au produit transformé soit le rapport
RR
TT
Il traduit la sélectivité d'une réaction pour un composé.RT denotes the Yield compared to the processed product or the ratio
RR
TT
It reflects the selectivity of a reaction for a compound.
EXEMPLE 1
On additionne une solution d'hypobromite de sodium contenant 0,075 moles de Dr (dosé par iodométrie) à une solution de 9,3 g (0,075 moles) de gaïacol dissous dans 100 ml d'éther isopropylique.EXAMPLE 1
A solution of sodium hypobromite containing 0.075 moles of Dr (measured by iodometry) is added to a solution of 9.3 g (0.075 moles) of guaiacol dissolved in 100 ml of isopropyl ether.
L'agitation est maintenue pendant quatre heures & une température comprise entre 15.et 2O0C. Le mélange est traité avec 100 ml d'acide sulfurique 2N & 5O0C. La phase organique est lavée et séchée une nuit sur chlorure de calcium. Stirring is continued for four hours at a temperature between 15 and 20 ° C. The mixture is treated with 100 ml of 2N & 5O0C sulfuric acid. The organic phase is washed and dried overnight over calcium chloride.
On obtient un liquide brun qui est analysé par HPLC et CPG. Les résultats sont les suivants
T T = 63,2%
Bromo-6 gaïacol R R = 20,8% R T = 32,9%
Bromo-4 gaiacol R R = 3,8%
On peut noter que le rapport bromo-6 est de 5,47
bromo-4
Il s'agit d'une valeur intéressante dans la mesure où il s'agit de produits dont la séparation pose le plus de problemes.A brown liquid is obtained which is analyzed by HPLC and CPG. The results are as follows:
TT = 63.2%
Bromo-6 guaiacol RR = 20.8% RT = 32.9%
Bromo-4 gaiacol RR = 3.8%
It can be noted that the bromo-6 ratio is 5.47
bromo-4
This is an interesting value insofar as these are products whose separation poses the most problems.
EXEMPLE 2
Ct exemple décrit une bromation en présence d'une amine.EXAMPLE 2
This example describes a bromination in the presence of an amine.
La bromation se fait en milieu biphasique, en présence de différentes concentrations molaires en tertiobutylamine et en utilisant l'hypobromite de sodium comme agent bromant. Bromination is carried out in a two-phase medium, in the presence of different molar concentrations of tert-butylamine and using sodium hypobromite as a brominating agent.
0,075 moles (9,3 g) de gaïacol plus différentes quantités de tertiobutylamine sont solubilisées dans 100 ml d'éther isopropylique et 20 ml d'eau. 0.075 moles (9.3 g) of guaiacol plus different amounts of tert-butylamine are dissolved in 100 ml of isopropyl ether and 20 ml of water.
0,075 moles d'hypobromite sont additionnées goutte à goutte. On laisse sous agitation pendant 4 heures. 0.075 moles of hypobromite are added dropwise. The mixture is left stirring for 4 hours.
La température est maintenue entre 15 et 200C. Le composé est hydrolysé avec 50 cm3 d'acide sulfurique 4N à 500C. The temperature is maintained between 15 and 200C. The compound is hydrolyzed with 50 cm3 of 4N sulfuric acid at 500C.
La phase organique est lavée et séchée sur chlorure de calcium. The organic phase is washed and dried over calcium chloride.
Les produits sont séparés par CPG et HPLC et identifiés par interprétation des spectres RMN. The products are separated by CPG and HPLC and identified by interpretation of the NMR spectra.
Pour 1/8 de mole d'amine par mole de gaïacol, les résultats sont les suivants
T T = 64,1%
Bromo-6 gaïacol R R = 27% R T = 42%
Bromo-4 gaïacol R R = 6,9%
Pour 1/4 de mole d'amine par mole de gaïacol, les résultats sont les suivants :
T T = 66,7%
Bromo-6 gaïacol R R = 30,9% R T = 46,4%
Bromo-4 gaïacol R R = 6,7%
Pour 1/2 mole d'amine par mole de gaïacol, les résultats sont les suivants :
T T = 79%
Bromo-6 gaiacol R R = 44,1% R T = 55,8%
Bromo-4 gaiacol R R = 11%
EXEMPLE 3
Cet exemple décrit une réaction par addition du gaïacol à une solution d'hypobromite contenant une amine.For 1/8 mole of amine per mole of guaiacol, the results are as follows
TT = 64.1%
Bromo-6 guaiacol RR = 27% RT = 42%
Bromo-4 guaiacol RR = 6.9%
For 1/4 mole of amine per mole of guaiacol, the results are as follows:
TT = 66.7%
Bromo-6 guaiacol RR = 30.9% RT = 46.4%
Bromo-4 guaiacol RR = 6.7%
For 1/2 mole of amine per mole of guaiacol, the results are as follows:
TT = 79%
Bromo-6 gaiacol RR = 44.1% RT = 55.8%
Bromo-4 gaiacol RR = 11%
EXAMPLE 3
This example describes a reaction by adding guaiacol to a hypobromite solution containing an amine.
Une solution aqueuse d'hypobromite contenant 0,075 mole de Br et 30 ml d'éther isopropylique est refroidie à OOC. On y ajoute d'abord 0,7 g de tertiobutylamine, puis 9,3 g de gaïacol, celui-ci étant solubilisé dans 70 ml d'éther isopropylique. La température est maintenue & OOC. L'excès de brome réactif est neutralisé par du sulfite de sodium å 10%. Le mélange est traité avec 50 ml d'acide sulfurique 4N à 500C. la phase organique est lavée et séchée une nuit sur chlorure de calcium. Elle est ensuite analysée par CPG. An aqueous hypobromite solution containing 0.075 mole of Br and 30 ml of isopropyl ether is cooled to OOC. First 0.7 g of tert-butylamine is added thereto, then 9.3 g of guaiacol, the latter being dissolved in 70 ml of isopropyl ether. The temperature is maintained & OOC. Excess reactive bromine is neutralized with 10% sodium sulfite. The mixture is treated with 50 ml of 4N sulfuric acid at 500C. the organic phase is washed and dried overnight over calcium chloride. It is then analyzed by CPG.
On obtient pour le bromo-6 galacol un R T de 61,8%. An R T of 61.8% is obtained for 6-bromo galacol.
Claims (10)
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8906842A FR2647440B1 (en) | 1989-05-25 | 1989-05-25 | PROCESS FOR BROMINATING A PHENOL DERIVATIVE |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR8906842A FR2647440B1 (en) | 1989-05-25 | 1989-05-25 | PROCESS FOR BROMINATING A PHENOL DERIVATIVE |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| FR2647440A1 true FR2647440A1 (en) | 1990-11-30 |
| FR2647440B1 FR2647440B1 (en) | 1991-09-06 |
Family
ID=9381998
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| FR8906842A Expired - Lifetime FR2647440B1 (en) | 1989-05-25 | 1989-05-25 | PROCESS FOR BROMINATING A PHENOL DERIVATIVE |
Country Status (1)
| Country | Link |
|---|---|
| FR (1) | FR2647440B1 (en) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5756851A (en) * | 1996-10-21 | 1998-05-26 | Albemarle Corporation | Production of nabumetone or precursors thereof |
| WO2005023738A1 (en) * | 2003-08-28 | 2005-03-17 | General Electric Company | Bromination of hydroxyaromatic compounds |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB537033A (en) * | 1939-12-06 | 1941-06-05 | Thomas Hebron Sanders | Improvements in and relating to chlorinated phenolic compositions |
| US4431847A (en) * | 1982-07-29 | 1984-02-14 | Ethyl Corporation | Method for removing brominated phenolic waste |
-
1989
- 1989-05-25 FR FR8906842A patent/FR2647440B1/en not_active Expired - Lifetime
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| GB537033A (en) * | 1939-12-06 | 1941-06-05 | Thomas Hebron Sanders | Improvements in and relating to chlorinated phenolic compositions |
| US4431847A (en) * | 1982-07-29 | 1984-02-14 | Ethyl Corporation | Method for removing brominated phenolic waste |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5756851A (en) * | 1996-10-21 | 1998-05-26 | Albemarle Corporation | Production of nabumetone or precursors thereof |
| US5907069A (en) * | 1996-10-21 | 1999-05-25 | Albemarle Corporation | Production of nabumetone or precursors thereof |
| WO2005023738A1 (en) * | 2003-08-28 | 2005-03-17 | General Electric Company | Bromination of hydroxyaromatic compounds |
| CN100383098C (en) * | 2003-08-28 | 2008-04-23 | 通用电气公司 | Bromination of hydroxyaromatic compounds |
Also Published As
| Publication number | Publication date |
|---|---|
| FR2647440B1 (en) | 1991-09-06 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| FR1465165A (en) | Process for preparing aromatic amines | |
| EP0021868A1 (en) | Process for the preparation of diaryl ethers | |
| EP0016673B1 (en) | Process for the solubilization of organic or mineral salts in organic solvents and complexes of organic or mineral salts | |
| CA2081115A1 (en) | Process for the preparation of cyclic sulphates | |
| EP0021927B1 (en) | Process for the preparation of aryl ethers | |
| EP0147279B1 (en) | Process for the preparation of diamino-alcohols | |
| FR2647440A1 (en) | Process for the bromination of a phenol derivative | |
| EP0049186B1 (en) | Process for the preparation of fluorobenzonitriles | |
| FR2707289A1 (en) | Process for the preparation of a hydroxylated compound of secondary or tertiary amine. | |
| EP0020281B1 (en) | Preparation of benzoxazolone | |
| EP0060171B1 (en) | Process for the n-alkylation of organic nitrogen compounds | |
| CA1331496C (en) | Guanidic compounds comprising a tetraphenylborate ion, process to prepare such compounds and their use for the synthesis of peptides | |
| CA1170280A (en) | Isomerization of bromohalogenobenzenes and process | |
| EP0338898B1 (en) | Process for the preparation of an ortho-substituted mono-brominated derivative of phenol | |
| CA1099292A (en) | Preparation of 2-nitro-2-methyl-1-propanol | |
| JPS59122456A (en) | Preparation of dicyclohexyl disulfide | |
| EP0326455B1 (en) | Method of producing chloranil | |
| FR2647109A1 (en) | PROCESS FOR THE PREPARATION OF ACYL CYANIDES IN ANHYDROUS | |
| EP0098783A1 (en) | Process for the preparation of halogen anilines | |
| FR2647441A1 (en) | Process for the bromination of the aromatic ring of phenols or substituted phenols containing ethylene chains | |
| EP1259521B1 (en) | Method for preparing bismuth tris-trifluoromethanesulphonate | |
| FR2505327A1 (en) | PROCESS FOR THE METAL HALOGENATION OF N- (O, O'-DIALKYL PHENYL) ALANINATES AND APPROVALS | |
| EP0047206A1 (en) | Process for preparation of aminoalcohols polyoxa-alkylated or polyoxa-arylated and their use as cation complexing agents | |
| EP0084743A1 (en) | Process for the preparation of alpha, alpha-difluoroalkoxy or alpha, alphadifluoroalkylthiophenyl sulfones | |
| EP0322279A2 (en) | Process for the acylation of N,N-diallyl aniline |