-
GEBIET DER ERFINDUNG
-
Die
vorliegende Erfindung betrifft bestimmte Mischungen von kondensierten
Pyrimidinonen und Dinitrophenol-Verbindungen, deren landwirtschaftlich
geeignete Salze sowie Verfahren zu ihrer Verwendung als Fungizide.
-
HINTERGRUND DER ERFINDUNG
-
Die
Kontrolle von Pflanzenkrankheiten, die durch pilzliche Pflanzenpathogene
hervorgerufen werden, ist bei der Erzielung hoher Ertragsleitung
außerordentlich
wichtig. Schäden
durch Pflanzenkrankheiten an Zierpflanzen, Gemüse, Feldfrüchten und Obstkulturen können zu
einer erheblichen Verringerung der Produktivität führen und dadurch für den Verbraucher
zu erhöhten
Kosten. Von Züchtern
sind daher Fungizide, mit denen Pflanzenkrankheiten wirksam kontrolliert
werden können,
dauerhaft nachgefragt. Für
diese Aufgaben sind zahlreiche Produkte kommerziell verfügbar. Es
setzt sich allerdings ein Bedarf nach neuen Produkten fort, die wirksamer
sind, kostengünstiger,
weniger toxisch, ökologisch
sicherer und/oder die unterschiedliche Wirkungsprinzipien haben.
Pflanzenkrankheiten sind in hohem Maße schädlich, schwer zu bekämpfen, und
es wird gegenüber
kommerziellen Fungiziden schnell eine Resistenz entwickelt. Oftmals
werden zur Erleichterung der KrankheitsKontrolle Kombinationen von
Pestiziden verwendet, um das Spektrum der Kontrolle breiter zu machen
und die Resistenzentwicklung zu verzögern (siehe hierzu z.B. die
WO 98/33381). Auf dem Fachgebiet gilt als anerkannt, dass die Vorteile
bestimmter Pestizidkombinationen oftmals in Abhängigkeit solcher Faktoren variieren
können,
wie die spezielle Pflanze und Pflanzenkrankheit, die behandelt werden
soll, sowie die Behandlungsbedingungen. Dementsprechend ist man
auf einer ständigen
Suche nach vorteilhaften Kombinationen von Pestiziden.
-
ZUSAMMENFASSUNG DER ERFINDUNG
-
Die
vorliegende Erfindung betrifft synergistisch fungizide Kombinationen
(z.B. Mischungen), aufweisend:
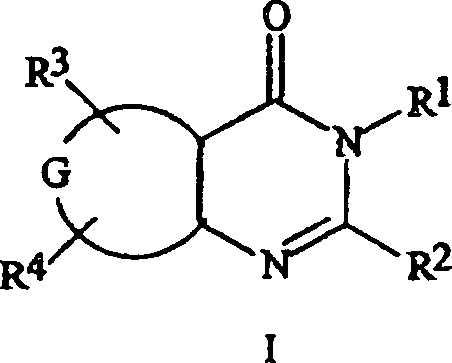
- (1) mindestens
eine Verbindung, die ausgewählt
ist aus kondensierten Pyrimidonen der Formel I, N-Oxiden und geeigneten
Salzen davon: worin sind:
G ein kondensierter
Phenyl-, Thiophen- oder Pyridinring;
R1 ein
C1-C6-Alkyl oder
C4-C7-Cycloalkylalky;
R2 ein C1-C6-Alkyl, C1-C6-Alkoxy oder C1-C6-Alkylthio;
R3 Halogen
und
R4 Wasserstoff oder Halogen; sowie
- (2) mindestens eine Dinitrophenol-Verbindung, ausgewählt aus
der Gruppe, bestehend aus Verbindungen der Formel II und Verbindungen
der Formel III: worin sind:
J C1-C6-Alkyl, C1-C6-Alkoxy oder
G2-C6-Alkenyl und
R5 ist C1-C8-Alkyl
-
Die
vorliegende Erfindung gewährt
landwirtschaftliche Zusammensetzungen, die diese Kombinationen enthalten.
Außerdem
gewährt
die Erfindung ein Verfahren zum Bekämpfen von Pflanzenkrankheiten,
die durch pilzliche Pflanzenpathogene hervorgerufen werden (speziell
durch Mehltau), welches Verfahren das Aufbringen einer fungizid
wirksamen Menge dieser Kombinationen (z.B. einer Zusammensetzung,
wie sie hierin beschrieben ist) auf die Pflanze oder einen Teil
davon oder auf den Pflanzensamen oder Sämling.
-
EINZELHEITEN DER ERFINDUNG
-
Pyrimidinon-Fungizide
der Formel I sind beschrieben in der Internationalen Patentanmeldung
WO 94/26722, der US-P-6 066 638, US-P-6 245 770, US-P-6 262 058
und US-P-6 277 858. Siehe in diesen fünf Stellen die Methoden zur
Herstellung von Verbindungen der Komponente (1). Die Verbindungen
der Formel I lassen sich auch bezeichnen als 2-(R2)-3-(R1)-Pyrimidin-4(3H)-one, die in den Stellungen
5 und 6 mit G(R3)(R4) kondensiert
sind.
-
Die
Dinitrophenol-Verbindungen der Formel II können auch bezeichnet werden
als 1,3-Dinitro-5-R5-Benzole, die ferner in 4-Stellung substituiert
sind mit -OC(=O)J. Die Dinitrophenol-Verbindungen der Formel III
können
auch bezeichnet werden als 1,3-Dinitro-5-R5-Benzole,
die ferner substituiert sind in 2-Stellung mit -OC(=O)J.
-
Dinitrophenol-Verbindungen
der Formel II schließen
eine Mischung ein, die diese Verbindung der Formel II aufweist,
worin J 1-Propenyl ist und R
5 Octyl ist,
worin "Octyl" eine Mischung ist
von 1-Methylheptyl, 1-Ethylhexyl
und 1-Propylpentyl (Formel IIa). Eine Verbindung der Formel IIa
ist eine einzelne Verbindung, die mit dem Chemical Abstracts-Name
bekannt ist (E)-2-(1-Methylheptyl)-4,6-dinitrophenyl-2-butenoat (CAS Registernummer
[131-72-6]) und die Mischung von Octyl-Isomeren mit ungesättigter
Stereochemie mit der CAS Registernummer [39300-45-3].
- IIa, worin n 0,1
oder 2 ist.
-
Die
Verbindungen der Formel IIa sind kommerziell verfügbar in
einer Mischung, die 2,0 bis 2,5 Teile der Formel IIa aufweist, zu
1,0 Teilen der Formel IIIa, die die allgemeine Bezeichnung Dinocap
hat und die IUPAC-Bezeichnung 2,6-Dinitro-4-octylphenylcrotonate
und 2,4-Dinitro-6-octylphenylcrotonate, worin es sich bei "Octyl" um eine Mischung
von 1-Methylheptyl-, 1-Ethylhexyl- und 1-Propylpentyl-Gruppen handelt.
- IIIa, worin n 0,1
oder 2 ist.
-
Dementsprechend
kann Komponente (2) durch Dinocap bereitgestellt werden. Zu beachten
sind Zusammensetzungen (z.B. Mischungen, die Dinocap aufweisen),
die eine Verbindung der Formel II und eine Verbindung der Formel
III aufweisen. Dinocap wurde offenbart in den US-P-2 526 660 und
2 810 767 als ein Fungizid und Akarizid.
-
Dinitrophenol-Verbindungen
der Formel II schließen
ebenfalls eine Verbindung der Formel II ein, worin J OCH(CH3)2 ist und R5 CH(CH3)CH2CH3 (Formel IIb)
ist. Formel IIb ist auch mit der Chemical Abstracts Bezeichnung
bekannt als 1-Methylethyl-2-(1-methylpropyl)-4,6-dinitrophenylcarbonat
(CAS Registernummer [973-21-7]), wobei die IUPAC-Bezeichnung 2-sec-Butyl-4,6-dinitrophenylisopropylcarbonat
ist und die übliche Bezeichnung
Dinobuton ist.
-
-
Dinobuton
ist in der GB-P-1 019 451 als ein Fungizid und Akarizid offenbart.
-
In
den vorgenannten Fundstellen schließt der Begriff "Alkyl", der entweder allein
oder in Verbindungswörtern
verwendet wird, wie beispielsweise "Alkylthio", schließt geradkettiges oder verzweigtes
Alkyl ein, wie beispielsweise Methyl, Ethyl, n-Propyl, Isopropyl
oder die verschiedenen Butyl-Pentyl-
oder Hexyl-Isomere. "Alkenyl" schließt geradkettige
oder verzweigte Alkene ein, wie beispielsweise Ethenyl, 1-Propenyl,
2-Propenyl, und die verschiedenen Butenyl-, Pentenyl- und Hexenyl-Isomere. "Alkenyl" schließt auch
Polyene ein, wie beispielsweise 1,2-Propadienyl und 2,4-Hexadienyl. "Alkoxy" schließt beispielsweise
Methoxy, Ethoxy, n-Propyloxy, Isopropyloxy und die verschiedenen
Butoxy-, Pentoxy- und Hexyloxy-Isomere ein. "Alkylthio" schließt verzweigte oder geradkettige
Alkylthio-Reste
ein, beispielsweise als Methylthio, Ethylthio, und die verschiedenen
Propylthio-, Butylthio-, Pentylthio- und Hexylthio-Isomere. "Cycloalkyl" schließt beispielsweise
Cyclopropyl, Cyclobutyl, Cyclopentyl und Cyclohexyl ein. "Cycloalkylalkyl" schließt Alkyl-Gruppen
ein, die substituiert sind mit Cycloalkyl-Gruppen, wie beispielsweise
Cyclopropylmethyl, Cyclopropylethyl und Cyclohexylmethyl.
-
Der
Begriff "Halogen" schließt Fluor,
Chlor, Brom oder Iod ein.
-
Die
Gesamtzahl der Kohlenstoffatome in einer Substituentengruppe wird
angegeben mit dem Präfix "Ci-Cj",
worin i und j Zahlen von 1 bis 8 sind. Wenn eine Verbindung mit
einem Substituenten substituiert ist, der einen Index hat, der die
Zahl der Substituenten größer als
1 anzeigt, so sind die Substituenten (wenn die Zahl 1 überschritten
wird) unabhängig
ausgewählt
aus der Gruppe der festgelegten Substituenten. Wenn der Index ferner
einen Zahlenbereich angibt, z.B. (R)i-j,
so kann die Zahl der Substituenten aus den zwischen i und j einschließlich liegenden
ganzen Zahlen ausgewählt
werden.
-
Wenn
eine Gruppe einen Substituenten enthält, der Wasserstoff sein kann,
wie beispielsweise R4, dann gilt, wenn dieser
Substituent als Wasserstoff genommen wird, als selbstverständlich,
dass dieses gleichwertig ist mit der Gruppe, die unsubstituiert
ist.
-
Die
für die
Verwendung gemäß der vorliegenden
Erfindung geeigneten Verbindungen können als ein oder mehrere Stereoisomere
bestehen. Die verschiedenen Stereoisomere schließen ein: Enantiomere, Diastereomere,
Atropisomere und geometrische Isomere. Für den Durchschnittsfachmann
auf dem Gebiet ist selbstverständlich,
dass das eine Stereoisomer aktiver sein kann und/oder vorteilhafte
Wirkungen zeigen kann, wenn es in Bezug auf das/die andere(n) Stereoisomer(e)
angereichert oder von dem/den Stereoisomer(en) getrennt ist. Darüber hinaus
ist dem Fachmann auf dem Gebiet bekannt, wie diese Stereoisomere
getrennt, angereichert und/oder selektiv hergestellt werden können. Dementsprechend
umfasst die vorliegende Erfindung Verbindungen der Formel I, N-Oxide
und geeignete Salze davon sowie Formel II. Die Verbindungen können als
Mischung von Stereoisomeren, als einzelne Stereoisomere oder optisch
aktive Formen vorliegen.
-
Für den Fachmann
auf dem Gebiet ist offensichtlich, dass nicht alle Stickstoff enthaltenden
Heterocyclen N-Oxide bilden können,
da das Stickstoff ein für
die Oxidation zu dem Oxid verfügbares,
freies Elektronenpaar erfordert; wobei der Fachmann auf dem Gebiet
solche Stickstoff enthaltenden Heterocyclen erkennt, die N-Oxide
bilden können.
Der Durchschnittsfachmann auf dem Gebiet wird außerdem erkennen, dass tertiäre Amine
N-Oxide bilden können.
Synthesemethoden für
die Herstellung von N-Oxiden von Heterocyclen und tertiäre Amine
sind in der Fachwelt gut bekannt und schließen die Oxidation von Heterocyclen
und tertiären Aminen
mit Peroxysäuren
ein, wie beispielsweise Peressigsäure und m-Chlorperbenzoesäure (MCPBA),
Wasserstoffperoxid, Alkylhydroperoxide, wie beispielsweise tert-Butylhydroperoxid,
Natriumperborat und Dioxirane, wie beispielsweise Dimethyldioxiran.
Diese Methoden für
die Herstellung von N-Oxiden sind ausgiebig beschrieben worden und
zusammengestellt worden in der Literatur, wie beispielsweise: T.L.
Gilchrist in Comprehensive Organic Synthesis, Band 7, S. 748–750, S.
V. Ley, Herausg., Pergamon Press; M. Tisler und B. Stanovnik in
Comprehensive Heterocyclic Chemistry, Band 3, S. 18–20, A.
J. Boulton und A. McKillop, Herausg., Pergamon Press; M. R. Grimmett
und B. R. T. Keene in Advances in Heterocyclic Chemistry, Band 43,
S. 149–161,
A. R. Katritzky, Herausg., Academic Press; M. Tisler und B. Stanovnik
in Advances in Heterocyclic Chemistry, Band 9, S. 285–291, A.
R. Katritzky und A. J. Boulton, Herausg., Academic Press; und G.
W. H. Cheeseman und E. S. G. Werstiuk in Advance in Heterocyclic
Chemistry, Band 22, S. 390–392,
A. R. Katritzky und A. J. Boulton, Herausg., Academic Press.
-
Die
Salze der Verbindungen, die die vorliegende Erfindung umfasst, schließen Säureadditionssalze ein
mit anorganischen oder organischen Säuren, wie beispielsweise Bromwasserstoffsäure, Chlorwasserstoffsäure, Salpetersäure, Phosphorsäure, Schwefelsäure. Essigsäure, Butansäure, Fumarsäure, Milchsäure, Maleinsäure, Malonsäure, Oxalsäure, Propionsäure, Salicylsäure, Weinsäure, 4-Toluolsulfonsäure und
Pentansäure.
Die Salze der Verbindungen, die die vorliegende Erfindung umfasst,
schließen
ebenfalls solche ein, die mit organischen Basen gebildet werden
(z.B. Pyridin, Ammoniak oder Triethylamin) oder mit anorganischen Basen
(z.B. Hydride, Hydroxide oder Carbonate von Natrium, Kalium, Lithium,
Calcium, Magnesium oder Barium), wenn die Verbindung eine Säuregruppe
enthält,
wie beispielsweise Carbonsäure
oder Phenol.
-
Bevorzugte
Zusammensetzungen hinsichtlich der Kosten, der leichten Synthese
und/oder der biologischen Wirksamkeit sind:
Bevorzugt 1: Zusammensetzungen,
die als Komponente (1) die vorgenannte Formel I aufweisen und geeignete
Salze davon, worin R1 Propyl oder Cyclopropylmethyl
ist; und R2 ist Propyloxy oder Propylthio.
-
Von
Bedeutung sind Pyrimidinon-Fungizide der Formel I, ausgewählt aus
der Gruppe, bestehend aus:
6-Brom-3-propyl-2-propyloxy-4(3H)-n-chinazolinon,
6,8-Diod-3-propyl-2-propyloxy-4(3H)-chinazolinon,
6-Iod-3-propyl-2-propyloxy-4(3H)-chinazolinon,
6-Chlor-2-propoxy-3-propylthieno[2,3-d]pyrimidin-4(3H)-on,
6-Brom-2-propoxy-3-propylthieno[2,3-d]pyrimidin-4(3H)-on,
7-Brom-2-propoxy-3-propylthieno[3,2-d]pyrimidin-4(3H)-on,
6-Brom-2-propoxy-3-propylpyrido[2,3-d]pyrimidin-4(3H)-on,
6,7-Dibrom-2-propoxy-3-propylthieno[3,2-d]pyrimidin-4(3H)-on
und
3-(Cyclopropylmethyl)-6-iod-2-(propylthio)pyrido[2,3-d]pyrimidin-4(3H)-on.
-
Bevorzugt
2: Zusammensetzungen von bevorzugt 1, worin Komponente (2) bereitgestellt
wird durch Dinocap.
-
Bevorzugt
3: Zusammensetzungen von bevorzugt 2, worin G eine kondensierter
Phenyl- oder Thiophenring ist; R1 ist Propyl;
R2 ist Propyloxy; R3 ist
Cl, Br oder I in 6-Stellung; und R4 ist
Wasserstoff.
-
Bevorzugt
4: Zusammensetzungen von bevorzugt 2, worin Komponente (1) aufweist:
6-Iod-3-propyl-2-propyloxy-4(3H)-chinazolinon oder 6-Chlor-2-propoxy-3-propylthieno[2,3-d]pyrimidin-4(3H)-one.
-
Bevorzugt
5: Zusammensetzungen von bevorzugt 4, worin Komponente (1) aufweist:
6-Iod-3-propyl-2-propyloxy-4(3H)-chinazolinon oder
-
Zusammensetzungen
einschließlich
solcher, wo Komponente (1) und Komponente (2) in einer fungizid wirksamen
Menge und einem Gewichtsverhältnis
von Komponente (1) zu Komponente (2) von etwa 1:100 bis 1:5.000
vorliegen. Diese Zusammensetzungen werden als besonders wirksam
zur Kontrolle von Mehltau angesehen. Von Bedeutung sind Zusammensetzungen,
bei denen das Gewichtsverhältnis
von Komponente (1) zu Komponente (2) etwa 1:125 bis 1:4000 beträgt.
-
Die
vorliegende Erfindung betrifft ebenfalls Methoden zum Bekämpfen von
Pflanzenkrankheiten, die durch pilzliche Pflanzenpathogene hervorgerufen
werden, umfassend das Ausbringen fungizid wirksamer Mengen der erfindungsgemäßen Zusammensetzungen
(z.B. als Zusammensetzung, wie sie hierin beschrieben wird) auf
die Pflanze oder einen Teil davon oder auf den Pflanzensamen oder
Sämling.
Die bevorzugten Methoden zur Verwendung schließen solche ein, bei denen die
vorgenannten bevorzugten Zusammensetzungen beteiligt sind, wobei
die Krankheiten mit besonderer Wirksamkeit und einschließlich Mehltau-Erkrankungen
behandelt werden. Es können
die erfindungsgemäß verwendeten
Fungizide als Kombinationen angewendet werden, um die KrankheitsKontrolle
zu erleichtern und die Resistenzentwicklung zu verzögern.
-
SYNERGISTISCHE
WIRKUNGEN
-
Von
Seiten der Züchter
besteht eine dauerhafte Nachfrage nach Fungiziden, die pflanzliche
Pilze und speziell Weizenmehltau (Erysiphe graminis) wirksam bekämpfen. Oftmals
werden Kombinationen von Fungiziden verwendet, um die KrankheitsKontrolle
zu erleichtern und die Resistenzentwicklung zu verzögern. Mischungen
von Fungiziden können
eine deutlich bessere KrankheitsKontrolle bewerkstelligen, als sich
auf Grund der Wirksamkeit der einzelnen Komponenten vorhersagen
ließe.
Dieser Synergismus ist beschrieben worden als "kooperative Wirkung zweier Komponenten
einer Mischung derart, dass die Gesamtwirkung größer oder länger anhaltend ist, als die
Summe der Wirkungen zweier (oder mehrerer), die unabhängig genommen werden" (siehe Tames, P.
M. L., Neth. J. Plant Pathology, (1964), 70, 73–80). Es ist nachgewiesen worden, dass
Verbindungen enthaltende Zusammensetzungen synergistische Wirkungen
zeigen.
-
Das
Vorhandensein einer synergistischen Wirkung zwischen zwei aktiven
Bestandteilen wurde mit Hilfe der Gleichung nach Colby ermittelt
(siehe Colby, S. R. In Calculating Synergistic and Antagonistic
Responses of Herbicide Combinations, Weeds, (1967), 15, 20–22):
-
Unter
Anwendung der Methoden nach Colby wird das Vorhandensein einer synergistischen
Wechselwirkung zwischen zwei Wirkstoffen ermittelt, indem zuerst
die vorhergesagte Wirkung, p, der Mischung auf der Grundlage der
Wirkungen der zwei allein angewendeten Komponenten berechnet wird.
Wenn "p" kleiner ist als die
experimentell ermittelte Wirkung, so ist ein Synergismus aufgetreten.
In der vorgenannten Gleichung ist A die fungizide Wirksamkeit in
der relativen Kontrolle einer aufgebrachten Komponente allein mit
einer Rate von x. Der Begriff B ist die fungizide Wirksamkeit in
der relativen Kontrolle der zweiten Komponente, die mit einer Rate
y aufgebracht wird. Die Gleichung ergibt p als die fungizide Wirksamkeit
der Mischung von A mit einer Rate x mit B mit einer Rate y, wenn
deren Wirkungen exakt additiv sind und keine Wechselwirkung aufgetreten ist.
-
Die
Colby-Gleichung für
eine dreikomponentige Mischung lautet:
worin A, B und C die fungiziden
Wirksamkeiten der jeweiligen drei Komponenten sind.
-
Gemäß der vorliegenden
Erfindung werden Zusammensetzungen bereitgestellt, die Anteile von
Komponente (1) und Komponente (2) aufweisen, die besonders verwendbar
zur Kontrolle spezieller pilzlicher Erkrankungen sind. Diese Zusammensetzungen
werden als besonders nützlich
bei der Kontrolle von Weizenmehltau (Erysiphe graminis) angesehen.
-
In
der vorliegenden Patentanmeldung werden fungizide Wirksamkeiten,
die von Zusammensetzungen der Komponente (1) (Verbindungen der Formel
I) und Komponente (2) (Verbindungen der Formel II) allein bereitgestellt
werden, verglichen mit derjenigen von Zusammensetzungen von Komponente
(1) und Komponente (2) gemeinsam. Auf der Grundlage der Beschreibung
des Synergismus, wie er von Colby entwickelt wurde, werden Zusammensetzungen
der vorliegenden Erfindung als synergistisch nützlich betrachtet. Dementsprechend
gewährt
die vorliegende Erfindung eine verbesserte Methode zur Kontrolle
von Mehltau-Erkrankungen, wie beispielsweise Weizenmehltau (Erysiphe
graminis) in Ernteerträgen
und speziell Getreidepflanzen.
-
FORMULIERUNG/NUTZEN
-
Die
vorliegende Erfindung gewährt
fungizide Zusammensetzungen, die fungizid wirksame Mengen der Kombinationen
der Erfindung und mindestens eine zusätzliche Komponente aufweisen,
die ausgewählt
ist aus der Gruppe, bestehend aus Tensiden, flüssigen Streckmitteln oder festen
Streckmitteln und/oder mindestens einem anderen Fungizid mit einem
anderen Wirkungsprinzip.
-
Die
fungiziden Zusammensetzungen der vorliegenden Erfindung weisen eine
wirksame Menge einer Mischung der Verbindungen(en) von Komponente
(1) (z.B. 6-Iod-3-propyl-2-propyloxy-4(3H)-chinazolinon-Verbindung 1 der nachfolgenden
Indextabelle und die Verbindung(en) von Komponente (2) (z.B. Dinocap). Die
Mischungen der vorliegenden Erfindung werden im typischen Fall als
eine Formulierung oder Zusammensetzung mit einem landwirtschaftlich
geeigneten Träger
verwendet, der mindestens ein flüssiges
Streckmittel, ein festes Streckmittel oder ein Tensid aufweist.
Dementsprechend werden die Zusammensetzungen so bereitgestellt,
dass sie zusätzlich
zu der fungizid wirksamen Mengen an der aktiven Verbindungen) mindestens eine
zusätzliche
Komponente aufweisen, die ausgewählt
ist aus der Gruppe, bestehend aus Tensiden, festen Streckmitteln
und flüssigen
Streckmitteln. Die Bestandteile der Formulierung oder Zusammensetzung
sind so ausgewählt,
dass sie mit den physikalischen Eigenschaften des Wirkstoffes, der
Aufbringungsart und der ökologischen
Faktoren verträglich
sind, wie beispielsweise Bodentyp, Feuchtigkeit und Temperatur.
Verwendbare Formulierungen schließen Flüssigkeiten ein, wie beispielsweise
Lösungen
(einschließlich
emulgierbare Konzentrate) Suspensionen, Emulsionen (einschließlich Mikroemulsionen
und/oder Suspoemulsionen) und dergleichen, die wahlweise zu Gelen
eingedickt sein können.
Verwendbare Formulierungen schließen ebenfalls Feststoffe ein,
wie beispielsweise Stäube,
Pulver, Granalien, Pellets, Tabletten, Filme und dergleichen, die wasserdispergierbar
("benetzbar") oder wasserlöslich sein
können.
Wirkstoffe können
(mikro-) verkapselt sein und weiter zu einer Suspension oder festen
Formulierung ausgebildet sein; wobei alternativ die gesamte Formulierung
der Wirkstoffe verkapselt (oder "überzogen") sein kann. Die
Verkapselung kann die Freisetzung der Wirkstoffe steuern oder verzögern. Spritzbare
Formulierungen können
in geeigneten Medien gestreckt sein und mit Spritzvolumina von etwa
einem bis zu mehreren hundert Litern pro Hektar verwendet werden.
Hochfeste Zusammensetzungen werden hauptsächlich als Intermediate für die weitere
Formulierung verwendet.
-
Die
Formulierungen werden im typischen Fall wirksame Mengen von Wirkstoffen,
Streckmittel und/oder Tensid innerhalb der folgenden geeigneten
Bereiche enthalten, die auf 100 Gewichtsprozent zu rechnen sind.
-
-
Typische
feste Streckmittel werden beschrieben in Watkins, Ethylenglykol
al., Handbook of Insecticide Dust Diluents and Carriers, 2. Auflage,
Dorland Books, Caldwell, New Jersey. Typische flüssige Streckmittel werden beschrieben
in Marsden, Solvents Guide, 2. Auflage, Interscience, New York,
1950. McCutcheon's
Detergents and Emulsifiers Annual, Allured Publ. Corp., Ridgewood,
New Jersey, so wie bei Sisley and Wood, ncyclopedia of Surface Active
Agents, Chemical Publ. Copolymer., Inc., New York, 1964, Listen
von Tensiden und empfohlene Anwendungen. Alle Formulierungen können geringfügige Mengen
von Additiven enthalten, um Schaumbildung, Zusammenbacken, Korrosion,
mikrobiologisches Wachstum und dergleichen zu reduzieren, oder Eindickungsmittel
zur Erhöhung
der Viskosität.
-
Tenside
schließen
beispielsweise ein: Polyethoxylierte Alkohole, polyethoxylierte
Alkylphenole, polyethoxylierte Sorbitan-Fettsäurester, Dialkylsulfosuccinate,
Alkylsulfate, Alkylbenzolsulfonate, Organosilicone, N,N-Dialkyltaurate,
Ligninsulfonate, Naphthalensulfonat-Formaldehyd-Kondensate, Polycarboxylate
und Polyoxyethylen/Polyoxypropylen-Blockcopolymere. Feste Streckmittel
schließen
beispielsweise ein: Tone, z.B. Bentonit, Montmorrillonit, Attapulgit
und Kaolin; Stärke;
Zucker, Silica, Talkum, Kieselgur, Harnstoff, Calciumcarbonat, Natriumcarbonat
und -hydrogencarbonat sowie Natriumsulfat. Flüssige Streckmittel schließen beispielsweise
ein: Wasser, N,N,-Dimethylformamid, Dimethylsulfoxid, N-Alkylpyrrolidon,
Ethylenglykol, Polypropylenglykol, Paraffine, Alkylbenzole, Alkylnaphthalenen,
Olivenöle,
Rizinus, Leinsamenöl,
Walrat, Sesamöl, Maisöl, Erdnussöl, Baumwollsamenöl, Sojabohnenöl, Rapssamenöl und Kokosöl (das methyliert
sein kann); Fettsäureester;
Ketone, wie beispielsweise Cyclohexanon, 2-Heptanon, Isophoron und
4-Hydroxy-4-methyl-2-pentanon sowie Alkohole, wie beispielsweise
Methanol, Cyclohexanol, Decanol und Tetrahydrofurfurylalkohol.
-
Lösungen,
unter denen emulgierbare Konzentrate eingeschlossen sind, können durch
einfaches Mischen der Bestandteile hergestellt werden. Stäube und
Pulver können
hergestellt werden durch Abmischen und normalerweise Mahlen, wie
beispielsweise in einer Hammermühle
oder Strahlmühle.
-
Suspensionen
werden normalerweise durch Nassmahlen hergestellt; siehe beispielsweise
die US-P-3 060 084. Granalien und Pellets können hergestellt werden, indem
die aktiven Materialien auf vorgeformte granulare Träger gesprüht werden
oder mit Hilfe von Agglomerationsmethoden. Siehe hierzu Browning, "Agglomeration", Chemical Engineering,
4. Dezember, 1967, S. 147–48,
Perry's Chemical
Engineers's Handbook,
4. Aufl., McGraw-Hill, New York, 1963 S. 8–57 und nachfolgende sowie
die WO 91/13546. Pellets können
hergestellt werden entsprechend der Beschreibung in der US-P-4 172
714. Wasserdispergierbare und wasserlösliche Granalien können entsprechend
der Lehren in den US-P-4 144 050, 3 920 442 und DE-P-3 246 493 hergestellt
werden. Tabletten können
entsprechend der Lehren in den US-P-S 180 587, 5 232 701 und 5 208
030 hergestellt werden. Filme können
hergestellt werden entsprechend der Lehre in der GB-P-2 095 558
und der US-P-3 299 566.
-
Weiterführende Information
im Zusammenhang mit der Technik der Formulierung siehe bei T. S. Woods, "The Formulater's Toolbox-Product
Forms for Modern Agriculture" in
Pesticide Chemistry and Bioscience; The Food-Environment Challenge,
T. Brooks und T.R. Roberts, Herausg., Proceedings of the 9th International
Congress on Pesticide Chemistry, The Royal Society of Chemistry,
Cambridge, 1999, S. 120–133.
Siehe auch die US-P-3 235 361, Spalte 6, Zeile 16 bis Spalte 7,
Zeile 19 sowie die Beispiele 10 bis 41; die US-P-3 309 192, Spalte
5, Zeile 43 bis Spalte 7, Zeile 62 sowie die Beispiele 8, 12, 15,
39, 41, 52, 53, 58, 132, 138 bis 140, 162 bis 164, 166, 167 und
169 bis 182; die US-P-2 891 855, Spalte 3, Zeile 66 bis Spalte 5,
Zeile 17 sowie die Beispiele 1 bis 4; Klingman, Weed Control as
a Science, John Wiley und Söhne,
Inc. New York, 1961, S.81–96;
und Hance et al., Weed Control Handbook, 8. Aufl., Blackwell Scientific
Publications, Oxford, 1989.
-
In
den folgenden "Beispielen" sind alle Prozentangaben
auf Gewicht bezogen und alle Formulierungen in konventioneller Weise
angesetzt worden. BEISPIEL
A Spritzpulver
| Wirkstoffe | 65,0
% |
| Dodecylphenolpolyethylenglykolether | 2,0
% |
| Natriumligninsulfonat | 4,0
% |
| Natriumsilicoaluminat | 6,0
% |
| Montmorillonit
(calciniert) | 23,0
% |
BEISPIEL
B Granalien
| Wirkstoffe | 10,0
% |
| Attapulgitgranalien
(schwerflüchtige
Substanz Siebe mit 0,71/0,30 mm, USS-Nr. 25 bis 50) | 90,0
% |
BEISPIEL
C Extrudierte
Pellets
| Wirkstoffe | 25,0
% |
| wasserfreies
Natriumsulfat | 10,0
% |
| rohes
Calciumligninsulfonat | 5,0
% |
| Natriumalkylnaphthalensulfonat | 1,0
% |
| Calcium/Magnesiumbentonit | 59,0
% |
BEISPIEL
D Emulgierbares
Konzentrat
| Wirkstoffe | 20,0
% |
| Gemisch
von öllöslichen
Sulfonaten und Polyoxyethylenethern | 10,0
% |
| Isophoron | 70,0
% |
-
In
die Zusammensetzungen der vorliegenden Erfindung können eine
oder mehrere andere einbezogen sein: Insektizide, Fungizide, Nematozide,
Bakterizide, Akarizide, Wachstumsregler, Chemosterilisationsmittel,
Semiochemikalien, Abschreckmittel, Lockstoffe, Pheromone, Fraßlockstoffe
oder andere biologisch wirksame Verbindungen um ein mehrkomponentiges
Pestizid zu erzeugen, das ein noch breiteres Spektrum des landwirtschaftlichen
Schutzes bietet. Beispiele für
derartige landwirtschaftliche Schutzmittel, mit denen die Zusammensetzungen
der vorliegenden Erfindung angesetzt werden können, sind: Insektizide, wie
beispielsweise Abamectin, Acephat, Azinphos-Methyl, Bifenthrin,
Buprofezin, Carbofuran, Chlorphenapyr, Chlorpyrifos, Chlorpyrifos-Methyl,
Cyfluthrin, beta-Cyfluthrin, Cyhalothrin, λ-Cyhalothrin, Deltamethrin,
Diafenthiuron, Diazinon, Diflubenzoron, Dimethoat, Esfenvalerat,
Ethiprol, Fenoxycarb, Fenpropathrin, Fenvalerat, Fipronil, Flucythrinat,
t-Fluvalinat, Fonophos, Imidacloprid, Indoxacarb, Isofenphos, Malathion,
Metaldehyd, Methamidophos, Methomyl, Methopren, Methoxychlor, Monocrotophos,
Oxamyl, Parathion, Parathion-Methyl, Permetrin, Phorat, Phosalon,
Phosmet, Phosphamidon, Pirimicarb, Profenofos, Rotenon, Sulprofos,
Tebufenozid, Tefluthrin, Terbufos, Tetrachlorvinphos, Thiodicarb,
Tralometrin, Trichlorfon und Triflumoron; Fungizide, wie beispielsweise:
Acibenzolar, Azoxystrobin, Benomyl, Blasticidin-S, Bordeaux-Mischung
(dreibasisches Kupfersulfat), Bromuconazol, Buthiobat, Carpropamid
(KTU 3616), Captafol, Captan, Carbendazim, Chloroneb, Chlorothalonil,
Clotrimazol, Kupferoxychlorid, Kupfersalze, Cymoxanil, Cyflufenamid,
Cyproconazol, Cyprodinil (CGA 219417), (S)-3,5-Dichloro-N-(3-chlor-1-ethyl-1-methyl-2-oxopropyl)-4-methylbenzamid (RH
7281), Diclocymet (S-2900), Diclomecin, Dicloran, Difenoconazol,
(S)-3,5-Dihydro-5-methyl-2-(methylthio)-5-phenyl-3-(phenylamino)-4H-imidazol-4-one
(RP 407213), Dimethomorph, Dimoxystrobin (SSF-129), Diniconazol,
Diniconazol-M, Dodin, Econazol, Edifenphos, Epoxiconazol (BAS 480F),
Famoxadon, Fenarimol, Fenbuconazol, Fencaramid (SZX0722), Fenpiclonil,
Fenpropidin, Fenpropimorph, Fentinacetat, Fentinhydroxid, Fluazinam,
Fludioxonil, Flumetover (RPA 403397), Fluoxastrobin, Fluchinconazol,
Flusilazol, Flutolanil, Flutriafol, Folpet, Fosetyl-Aluminium, Furalaxyl,
Furametapyr (S-82658), Hexaconazol, Imazalil, 6-Iod-3-propyl-2-propyloxy-4(3H)-chinazolinon,
Ipconazol, Iprobenfos, Iprodion, Isoconazol, Isoprothiolan, Kasugamycin,
Kresoxim-Methyl, Mancozeb, Maneb, Mefenoxam, Mepronil, Metalaxyl,
Metconazol, Metominostrobin/Fenominostrobin (SSF-126), Metrafenon,
Miconazol, Myclobutanil, Neo-Asocin(Eisen(III)methanarsonat), Nicobifen,
Nuarimol, Orysastrobin, Oxadixyl, Penconacozol, Pencycuron, Picoxystrobin,
Probenazol, Prochloraz, Propamocarb, Propiconazol, Pyraclostrobin,
Pyrifenox, Pyrimethanil, Prochloraz, Prothioconazol, Pyrifenox,
Pyrochilon, Chinoxyfen, Spiroxamin, Schwefel, Tebuconazol, Tetraconazol,
Thiabendazol, Thifluzamid, Thiophanat-Methyl, Thiram, Triadimefon, Triadimenol,
Triarimol, Tricyclazol, Triforin, Triticonazol, Uniconazol und Validamycin;
Nematocide, wie beispielsweise Aldoxycarb und Fenamiphos: Bakterizide,
wie beispielsweise Streptomycin; Akarizide, wie beispielsweise Amitraz,
Chinomethionat, Chlorobenzilat, Cyhexatin, Dicofol, Dienochlor, Etoxazol,
Fenazachin, Fenbutatinoxid, Fenpropathrin, Fenpyroximat, Hexythiazox,
Propargit, Pyridaben und Tebufenpyrad; und biologische Mittel, wie
beispielsweise Bacillus thuringiensis einschließend ssp. aizawai und kurstaki,
Bacillus thuringiensis delta Endoxin, Baculovirus und entomopathogene
Bakterien, Virus und Fungi. Beschreibungen der verschiedenen kommerziell
verfügbaren
Verbindungen, die vorstehend zusammengestellt sind, finden sich
in "The Pesticide
Manual", zwölfte Ausgabe,
C.D.S. Tomlin, Herausg., British Crop Protection Council, 2000.
Bei Ausführungen,
bei denen ein oder mehrere dieser verschiedenen Mischungspartner verwendet
werden, beträgt
das Gewichtsverhältnis
dieser verschiedenen Mischungspartner (in der Summe) zu der Gesamtmenge
an Komponente (1) und Komponente (2) im typischen Fall zwischen
100:1 und 1:3000. Von Bedeutung sind Gewichtsverhältnisse
zwischen 30:1 und 1:300 (beispielsweise Verhältnisse zwischen 1:1 und 1:30).
Es wird offensichtlich sein, dass unter Einbeziehung dieser zusätzlichen
Komponenten das Spektrum der Krankheiten, die kontrolliert werden, über das
Spektrum hinaus, das durch Kombination von Komponente (1) und Komponente
(2) allein kontrolliert wird, erweitert ist.
-
Man
ist der Ansicht, dass die Verbindungen von Komponente (1) (z.B.
Verbindung 1) der vorliegenden Erfindung das Pflanzenpathogen über eine
wirksame, differzierungsspezifische Hemmung des Befallvorganges
bekämpfen.
Von den Verbindungen der Komponente (2) (z.B. Dinocap) der vorliegenden
Erfindung nimmt man an, dass sie die mitochondrische, oxidative
Phosphorylierung entkoppeln. In bestimmten Fällen werden Kombinationen mit
anderen Fungiziden, die einen anderen Wirkungsmechanismus haben,
besonders vorteilhaft für
die Beherrschung der Resistenz sein (speziell dann, wenn das andere
Fungizid ebenfalls ein ähnliches Kontrollesspektrum
hat). Von besonderer Bedeutung sind Zusammensetzungen, in die zusätzlich zu
Komponente (1) und Komponente (2) mindestens (3) ein anderes Fungizid
einbezogen ist, das zum Bekämpfen
einer Mehltau-Erkrankung nützlich
ist, jedoch über
einen anderen Wirkungsmechanismus gegenüber dem von Komponente (1)
und Komponente (2) verfügt.
Beispiele für
andere Fungizide, die andere Wirkungsmechanismen haben, schließen Verbindungen
ein, die am bc1-Komplex der pilzlich-mitochondrischen,
respiratorischen Elektronentransferstelle angreifen, Verbindungen,
die an dem Demethylase-Enzym des Sterol-Biosyntheseweges angreifen
und Morpholin- und
Piperidin-Verbindungen, die an dem Sterol-Biosyntheseweg angreifen.
-
DIE bc1-KOMPLEX-FUNGIZIDE
-
Von
Bedeutung sind Kombinationen unter Einbeziehung von Komponente (1),
Komponente (2) und mindestens einem Strobilurin-Fungizid. Strobilurin-Fungizide,
wie beispielsweise Azoxystrobin, Dimoxystrobin (SSF-129), Fluoxastrobin,
Kresoxim-Methyl, Metominostrobin/Fenominostrobin (SSF-126), Orysastrobin,
Picoxystrobin, Pyraclostrobin und Trifloxystrobin sind dafür bekannt,
dass sie einen fungiziden Wirkungsmechanismus haben, der den Cytochrom-bc1-Komplex in der mitochondrischen Respirationskette
hemmt (Angew. Chem. Int. Ed., 1999, 38, 1328–1349). Methyl(E)-2-[[6-(2-cyanophenoxy)-4-pyrimidinyl]oxy]-α-(methoxyimino)benzenacetat
(auch bekannt als Azoxystrobin) wird als ein bc1-Komplexhemmer
in den Biochemical Society Transactions 1993, 22, 68S beschrieben.
Methyl(E)-α-(methoxyimino)-2-[(2methylphenoxy)methyl]benzenacetat
(auch bekannt als Kresoxim-Methyl)
wird als bc1-Komplexhemmer beschrieben in
den Biochemical Society Transactions 1993, 22, 64S. (E)-2-[(2,5-Dimethylphenoxy)methyl]-α-(methoxyimino)-N-methylbenzenacetamid
wird als bc1-Komplexhemmer beschrieben in Biochemistry
and Cell Biology 1995, 85(3), 306–311.
-
Famoxadon
und Fenamidone sind andere Verbindungen, die den bc1-Komplex
in der mitochondrischen Respirationskette hemmen. Von Bedeutung
sind Kombinationen unter Einbeziehung von Komponente (1), Komponente
(2) und mindestens einer Verbindung, die ausgewählt ist aus der Gruppe, bestehend
aus Famoxadon und Fenamidon.
-
In
der Literatur der Biochemie wird der bc1-Komplex
gelegentlich mit anderen Namen bezeichnet, einschließlich Komplex
III der Elektronentransferkette und Ubihydrochinon:Cytochrom c-Oxidoreduktase.
Dieser ist eindeutig identifiziert mit der Enzymklassifizierungsnummer
EC1.10.2.2. Der bc1-Komplex wurde beispielsweise
beschrieben in J. Biol. Chem. 1989, 264, 14543–38; Methods Enzymol. 1986,
126, 253–71;
und den darin zitierten Fundstellen. Das "Fungicide Resistance Action Committee
(FRAC) der Global Crop Protection Federation (GCPF)" befasst sich mit
Verbindungen, die den bc1-Komplex als Qo-Hemmer (QoI) hemmen,
da sie alle als die Chinol-"äußere" (Qo) Bindungsstelle
des Cytochrom- bc1-Komplexes wirken.
-
DIE STEROL-BIOSYNTHESEHEMMER
(SBI)-FUNGIZIDE
-
Die
Klasse der Sterol-Biosynthesehemmer schließt DMI- und non-DMI-Verbindungen
ein, die die Pilze durch Hemmen der Enzyme in dem Sterol-Biosyntheseweg
bekämpfen.
Das FRAC gruppiert diese Fungizide mit den SBI-Fungiziden zusammen.
DMI-Fungizide haben eine gemeinsame Wirkungsstelle innerhalb des
fungalen Sterol-Biosyntheseweges, das heißt eine Hemmung der Demethylierung
in der Position 14 von Lanosterol oder 24-Methylendihydrolanosterol,
bei denen es sich um Präkursoren
zu Sterolen in Pilzen handelt. Verbindungen, die an dieser Stelle
wirken, werden oftmals bezeichnet als Demethylase-Hemmer, DMI-Fungizide oder
DMIs. In der Literatur der Biochemie wird das Demethylase-Enzym gelegentlich
mit anderen Namen bezeichnet, einschließlich Cytochrom P-450 (14DM).
Das Demethylase-Enzym wurde beispielsweise beschrieben in J. Biol.
Chem. 1992, 267, 13175–79
und in den darin zitierten Fundstellen. DMI-Fungizide gehören zu verschiedenen
Klassen: Azole (einschließlich
Triazole und Imidazole), Pyrimidine, Piperazine und Pyridine. In die
Triazole einbezogen sind: Bromuconazol, Cyproconazol, Difenoconazol,
Diniconazol, Epoxiconazol, Fenbuconazol, Fluchinconazol, Flusidazol,
Flutriafol, Hexaconazol, Ipconazol, Metconazol, Penconazol, Propiconazol,
Prothioconazol, Tebuconazol, Tetraconazol, Triadimefon, Triadimenol,
Triticonazol, und Uniconazol. Die Imidazole schließen ein:
Clotrimazol, Econazol, Imazalil, Isoconazol, Miconazol und Prochloraz.
Von besonderer Bedeutung sind Kombinationen unter Einbeziehung von
Komponente (1), Komponente (2) und mindestens einem Azol-Fungizid.
Die Pyrimidine schließen
Fenarimol, Nuarimol und Triarimol ein. Die Piperazine schließen Triforin
ein. Die Pyridine schließen
Buthiobat und Pyrifenox ein. Biochemische Untersuchungen haben gezeigt,
dass alle obengenannten Fungizide DMI-Fungizide entsprechend der
Beschreibung von K. H. Kuck, Ethylenglykol al. in Modern Selektive
Fungicids-Properties, Applications and Mechanisms organischen Fasern Action,
Lyr, H., Herausg.; Gustav Fischer Verlag: New York, 1995, 205–258 sind.
-
Die
DMI-Fungizide wurden in Gruppen zusammengefasst, um sie von den
anderen Sterol-Biosynthesehemmern
zu unterscheiden, wie beispielsweise den Morpholin- und Piperidin-Fungiziden
und Spiroxamin (von der FRAC im Allgemeinen zusammengefasst als
die sogenannten "Morpholin"-Fungizide). Die Morpholine schließen Aldimorph,
Dodemorph, Fenpropimorph, Tridemorph und Trimorphamid ein. Die Piperidine schließen Fenpropidin
ein. Spiroxamin ist ein Spiroketalamin. Die "Morpholine" sind ebenfalls Sterol-Biosynthesehemmer,
haben jedoch gezeigt, dass sie andere Schritte in dem Sterol-Biosyntheseweg
hemmen. Biochemische Untersuchungen haben gezeigt, dass alle vorgenannten "Morpholin"-Fungizide fungizide
Sterol-Biosynthesehemmer sind, wie sie beschrieben wurden von K.
H. Kuck, et al. in Modern Selektiv Fungicides-Properties, Applications
and Mechanism of Action, Lyr, H., Herausg.; Gustav Fischer Verlag:
New York, 1995, 185–204.
Sie hemmen in einem variablen Grad die D8®D7-Isomerase- und D 14 Reduktaseenzyme in
dem Sterol-Biosyntheseweg. Von Bedeutung sind Kombinationen unter
Einbeziehung von Komponente (1), Komponente (2) und mindestens einem "Morpholin"-Fungizid.
-
Von
Bedeutung sind Kombinationen von Komponente (1) (z.B. Verbindung
1) und Komponente (2) (z.B. Dinocap) mit: Azoxystrobin, Fluoxastrobin,
Kesoxim-Methyl, Trifloxystrobi, Pyraclostrobin, Picoxystrobin, Dimoxystrobin
(SSF-129), Metominostrobin/Fenominostrobin (SSF126), Carbendazim,
Chlorothalonil, Cyprodinil, Chinoxyfen, Metrafenon, Cyflufenamid,
Fenpropidin, Fenpropimorph, Spiroxamin, Bromuconazol, Cyproconazol,
Difenoconazol, Epoxiconazol, Fenbuconazol, Fluquinconazol, Flusilazol,
Hexaconazol, Ipconazol, Metconazol, Penconazol, Propiconazol, Tebuconazol,
Triticonazol, Prochloraz oder Nicobifen.
-
Für die Kontrolle
von Pflanzenkrankheiten, die durch pilzliche Pflanzenpathogene hervorgerufen
werden (z.B. eine geringere Anwendungsrate oder ein breiteres Spektrum
von Pflanzenpathogenen, die kontrolliert werden) oder das Resistenzmanagement
sind Mischungen von Komponente (1) (z.B. Verbindung 1) und Komponente
(2) (z.B. Dinocap) mit einem Fungizid, das ausgewählt ist
aus der Gruppe, bestehend aus: Azoxystrobin, Kesoxim-Methyl, Trifloxystrobin,
Pyraclostrobin, Picoxystrobin, Dimoxystrobin (SSF-129), Metominostrobin/Fenominostrobin
(SSF-126), Chinoxyfen, Metrafenon, Cyflufenamid, Fenpropidin, Fempropimorpf Spiroxamin,
Cyproconazol, Epoxiconazol, Fluquinconazol, Flusilazol, Metconazol,
Propiconazol, Tebuconazol und Triticonazol.
-
Die
Zusammensetzungen der vorliegenden Erfindung sind als Mittel zur
Kontrolle von Pflanzenkrankheiten verwendbar. Die vorliegende Erfindung
umfasst daher eine Methode zur Kontrolle von Pflanzenkrankheiten,
die durch pilzliche Pflanzenpathogene hervorgerufen werden, und
umfasst das Aufbringen einer wirksamen Menge einer erfindungsgemäßen Zusammensetzung
auf die Pflanze oder einen Teil davon, die geschützt werden soll, oder auf den
Pflanzensamen oder Sämling,
die geschützt
werden sollen. Die Zusammensetzungen sind besonders wirksam zur
Kontrolle von Mehltau-Erkrankungen, die durch pilzliche Pflanzenpathogene
hervorgerufen werden. Mehltau-Erkrankungen schließen Mehltau
in Äpfeln,
Steinobst, Zitrusfrüchten, Weichobst,
Kletterpflanzen (einschließlich
Wein), Baumwolle, Kürbisgewächse, Zierpflanzen,
Tabak, Hopfen, Erdbeeren und bestimmte Gemüsearten ein, sowie Amerikanischer
Stachelbeermehltau in Stachelbeeren und Johannisbeeren. Von Bedeutung
sind Methoden zur Kontrolle von Weizenmehltau, die das Aufbringen
einer Zusammensetzung der vorliegenden Erfindung umfassen. Die pilzlichen
Pathogene, die diese Erkrankungen hervorrufen, schließen ein:
Erysiphe graminis (der Erreger für
Getreidemehltau in Getreidefrüchten,
wie beispielsweise Weizen, Hafer und Gerste), und Uncinular nacatur
(der Erreger für
Mehltau in Weintrauben), Sphaerotheca fuliginea (der Erreger für Mehltau
in Kürbisgewächsen) und
verwandte Mehltauarten in den Gattungen und Species Erysiphe, Sphaerotheca,
Microsphaera und Podosphaera. Von Bedeutung sind Methoden zum Bekämpfen von
Erysiphe graminis, die das Aufbringen einer Zusammensetzung der
vorliegenden Erfindung umfassen. Insbesondere wenn Komponente (1)
und Komponente (2) mit zusätzlichen
fungiziden Komponenten gemischt werden, können die Zusammensetzungen
der vorliegenden Erfindung auch eine Kontrolle von Krankheiten ermöglichen,
die von einem breiteren Spektrum pilzlicher Pflanzenpathogene in
den Klassen Basidiomycetes, Ascomycetes, Oomycetes und Deuteromycetes
hervorgerufen werden. Sie können
bei der Kontrolle eines breiten Spektrums von Pflanzenkrankheiten
wirksam sein und speziell bei Blattpathogenen von Zierpflanzen,
Gemüse-Pflanzen,
Feldfrüchten,
Getreide und Obst. Diese Pathogene schließen ein: Plasmopara viticola,
Phytophthora infestans, Pronospora tabacina, Pseudoperonospora cubensis,
Pythium aphanidermatum, Alternaria brassicae, Septoria nodorum,
Septoria tritici, Cercosporidium personatum, Cercospora arachidicola,
Pseudocercosporella herpotrichoides, Cercospora beticola, Botrytis
cinerea, Monilinia fructicola, Pyricularia oryzae, Podosphaera leucotricha,
Venturia inaequalis, Erysiphe graminis, Uncinula necatur, Puccinia recondita,
Puccinia graminis, Hemileia vastatrix, Puccinia arachidis, Rhizoctonia
solani, Sphaerotheca fuliginea, Fusarium oxysporum, Verticillium
dahliae, Pythium aphanidermatum, Phytophthora megasperma, Sclerotinia
sclerotiorum, Sclerotium rolfsii, Erysiphe polygoni, Pyrenophora
teres, Gaeumannomyces graminis, Rynchosporium secalis, Fusariu roseum,
Bremia lactucae und andere Gattungen und Species, die mit diesen Pathogenen
eng verwandt sind.
-
Die
vorliegende Erfindung gewährt
beispielsweise Verfahren zur Kontrolle von Pflanzenkrankheiten, die
durch pilzliche Pflanzenpathogene hervorgerufen werden, wobei die
Verfahren das Aufbringen auf die Pflanze oder einen Teil davon oder
auf den Pflanzensamen oder -keim, die geschützt werden sollen, eines der folgenden
umfasst:
- A) eine wirksame Menge einer fungiziden
Zusammensetzung, welche aufweist: Komponente (1), eine Komponente
(2) und mindestens eine zusätzliche
Komponente, die ausgewählt
ist aus der Gruppe, bestehend aus Tensiden, festen Streckmitteln
oder flüssigen
Streckmitteln; oder
- B) eine wirksame Menge einer physikalischen Mischung aus (i)
einer wirksamen Menge einer ersten Zusammensetzung, die die Komponente
(1) aufweist sowie mindestens eine zusätzliche Komponente, die ausgewählt ist
aus der Gruppe, bestehend aus Tensiden, festen Streckmitteln oder
flüssigen
Streckmitteln; und aus (ii) einer wirksamen Menge einer zweiten
Zusammensetzung, die die Komponente (2) aufweist sowie mindestens
eine zusätzliche
Komponente, die ausgewählt
ist aus der Gruppe, bestehend aus Tensiden, festen Streckmitteln
oder flüssigen
Streckmitteln.
-
Die
(vorliegende) Erfindung gewährt
außerdem
ein Verfahren zur Kontrolle von Pflanzenkrankheiten, die durch pilzliche
Pflanzenpathogene hervorgerufen werden, wobei das Verfahren das
Aufbringen auf die Pflanze oder einen Teil davon oder auf den Pflanzensamen
oder -keim einer wirksamen Menge einer Kombination von Komponente
(1) und Komponente (2) sowie mindestens eines anderen Fungizides
mit anderem Wirkungsmechanismus.
-
Vorteilhafte
Verfahren schließen
solche ein, bei denen die Komponente (1) und Komponente (2) in ausreichenden
Mengen zugesetzt werden, um für
eine fungizide Wirksamkeit zu sorgen, die größer ist als die Summe der fungiziden
Wirksamkeiten, die von solchen Mengen einzeln genommen gewährt werden.
-
Die
Kontrolle von Pflanzenkrankheiten erfolgt üblicher Weise durch Ausbringen
einer wirksamen Menge der Zusammensetzung der vorliegenden Erfindung
entweder vor oder nach dem Befall auf einen Teil der zu schützenden
Pflanze, wie beispielsweise Wurzeln, Stiele, Blatt, Frucht, Samen,
Knollen oder Zwiebeln oder auf das Substrat (Boden oder Sand), worin
die Pflanzen, die geschützt
werden sollen, aufgezogen werden. Die Zusammensetzungen können auch
auf den Samen aufgebracht werden, um den Same und Sämling zu
schützen.
Die Zusammensetzungen der vorliegenden Erfindung sind besonders
verwendbar, wenn sie vor dem Befall aufgebracht werden. Die fungiziden
Zusammensetzungen der vorliegenden Erfindung können auch (zusätzlich dazu,
dass sie fungizid wirksame Mengen der Kombination von Komponente
(1) und Komponente (2) aufweisen) mindestens eine zusätzliche
Komponente aufweisen, die ausgewählt
ist aus der Gruppe, bestehend aus Tensiden, festen Streckmitteln
oder flüssigen
Streckmitteln und/oder mindestens ein anderes Fungizid mit einem
anderen Wirkungsmechanismus.
-
Die
Aufbringungsraten für
diese Zusammensetzungen lassen sich durch zahlreiche Faktoren der
Umgebung beeinflussen und sollten unter realen Anwendungsbedingungen
ermittelt werden. Die Blattmasse kann normalerweise geschützt werden
bei Behandlung mit einer Rate von weniger als 1g/ha bis 5000 g/ha
Wirkstoff. Saat und Sämlinge
können
normalerweise geschützt
werden, wenn der Samen mit einer Rate von 0,1 bis 10 g pro Kilogramm
Samen behandelt wird.
-
Zur
Beschreibung der Verbindungen der ausgewählten Komponente (1) siehe
die Indextabelle A. INDEX
TABELLE A
-
Verbindungen
der Komponente (2) sind kommerziell verfügbar und im typischen Fall
in Form einer Formulierung. Besonders zu verweisen ist auf Dinocap,
das kommerziell als 19,5%ige Spritzpulverformulierung verfügbar ist
und bekannt ist als Karathane®.
-
Ohne
weitere Ausführungen
zu machen, kann davon ausgegangen werden, dass der Durchschnittsfachmann
auf dem Gebiet unter Anwendung der vorangegangenen Beschreibung
die vorliegende Erfindung im vollen Umfang nutzen kann. Das folgende "Beispiel" ist daher lediglich
veranschaulichend und nicht als die Offenbarung in irgendeiner Weise
einschränkend
zu betrachten. Sofern nicht anders angegeben, sind Prozentangaben
auf Gewicht bezogen.
-
BEISPIEL 1
-
In
den folgenden "Tests" wird die Wirksamkeit
der Verbindungen der vorliegenden Erfindung zur Kontrolle eines
speziellen Pathogens demonstriert. Der mit Hilfe der Verbindungen
herbeigeführte
Schutz in der Pathogen-Kontrolle ist jedoch auf diese Spezies nicht
beschränkt.
-
Es
wurden Testlösungen
oder -suspensionen, die einen einzelnen Wirkstoff aufwiesen, gespritzt,
um die Wirksamkeit der Kontrolle des einzelnen Wirkstoffes zu demonstrieren.
Um die Wirksamkeit der Kontrolle mit einer Kombination zu demonstrieren
können
(a) die Wirkstoffe in geeigneten Mengen in einer einzigen Testsuspension
kombiniert werden, (b) Stammlösungen
mit dem einzelnen Wirkstoff als Bestandteile angesetzt werden und
anschließend
in dem geeigneten Verhältnis
kombiniert und auf die gewünschte
Endkonzentration verdünnt
werden, um eine Testsuspension zu erzeugen, oder (c) Testsuspensionen,
die die einzelnen Wirkstoffe aufweisen, die nacheinander in dem
gewünschten
Verhältnis
gespritzt werden.
-
Allgemeines
Protokoll zum Ansetzen von Testsuspensionen:
Die Verbindungen
der Komponente (1) können
vor dem Aufbringen in diesen Tests formuliert werden. Eine beispielhafte
Formulierung ist das Beispiel E. BEISPIEL
E Emulgierbares
Konzentrat
| Verbindung
1 in technischer Reinheit (97%) | 21,1
% |
| methyliertes
Samenöl | 68,6 |
| anionisches/nichtionisches
Emulgiermittelgemisch | 10,3 |
-
Die
Formulierung, die eine Verbindung der Komponente (1) enthielt, wurde
in Wasser zur Erzeugung einer Stammlösung aufgelöst. Zum Testen der einzelnen
Komponente (1) wurde die Stammlösung
zu der gewünschten
Endkonzentration unter Erzeugung der Testlösung verdünnt. Beispielsweise wurden
Zusammensetzungen der Komponente (1) (z.B. Verbindung 1 in Indextabelle
A) entweder allein oder in Kombination mit 0,08 oder 0,4 ppm bis
zum Ablauf hin auf die Testpflanzen entsprechend einer Rate von
0,2 bzw. 1 g/ha gespritzt.
-
Die
kommerziell verfügbare
Formulierung von Komponente (2) (z.B. das Karathane® als
19,5%ige Spritzpulverformulierung von Dinocap) wurde in Wasser unter
Erzeugung einer Stammsuspension suspendiert. Zum Testen der einzelnen
Komponente (2) wurde die Stammsuspension bis zu der gewünschten
Endkonzentration unter Erzeugung einer Testsuspension verdünnt. Beispielsweise
wurde Dinocap entweder allein oder in Kombination mit 10, 40 bzw.
200 ppm bis zum Ablaufen auf die Testpflanzen entsprechend einer
Rate von 25, 100 bzw. 500 g/ha gespritzt.
-
Für die Test-Kombinationen
wurden die Stammsuspensionen der einzelnen Wirkstoffe, wie sie vorstehend
angesetzt wurden, sodann in dem entsprechenden Verhältnis vereint
und bis zu der gewünschten
Endkonzentration unter Erzeugung einer Testsuspension verdünnt.
-
Die
resultierenden Testsuspensionen wurden sodann in den folgenden Tests
verwendet. Die Testsuspensionen wurden bis zum Ablaufen auf die
Testpflanzen mit den nachfolgend beschriebenen Raten der Wirkstoffe
gespritzt. Die Tests wurden dreifach ausgeführt und die Ergebnisse als
Mittelwert der drei Wiederholungen aufgezeichnet.
-
TEST A
-
Die
Testsuspension wurde bis zum Ablaufen auf Weizensämlinge gespritzt.
Am darauffolgenden Tag wurden die Sämlinge mit einem Sporenpulver
von Erysiphe graminis f. sp. tritici (der Erreger von Weizenmehltau)
geimpft und in einer Wachstumskammer für 8 Tage bei 20° C inkubiert,
wonach die Bewertungen der Erkrankung vorgenommen wurden.
-
Die
Ergebnisse für
Test A sind in Tabelle A zusammengestellt. In der Tabelle gibt eine
Bewertung von 100 eine 100%ige Kontrolle der Erkrankung und eine
Bewertung von null keine Kontrolle der Erkrankung wieder (relativ
zu den Kontrollen). Die Spalte mit der Überschrift "beobachtete Kontrolle der Erkrankung" gibt den Mittelwert
von drei Wiederholungen an. Die Spalte mit der Überschrift "erwartete Kontrolle der Erkrankung" gibt den Erwartungswert
für die
jeweilige Behandlungsmischung unter Anwendung der Colby-Gleichung
an. Die Formulierung "--" gibt an, dass unter
Anwendung der Colby-Gleichung
für Tests
der einzelnen Verbindung kein Erwartungswert berechnet wurde. Die
Tests, die eine stärkere
Kontrolle als erwartet gezeigt haben, sind mit * gekennzeichnet.
-
TABELLE A
-
-
Auf
der Grundlage der Beschreibung des Synergismus wie sie von Colby
entwickelt wurde, sind die Zusammensetzungen der vorliegenden Erfindung
als synergistisch nützlich
anzusehen. Dementsprechend gewährt
die vorliegende Erfindung ein verbessertes Verfahren zum Bekämpfen von
Mehltau-Erkrankungen, wie beispielsweise Weizenmehltau (Erysiphe
graminis) in Ernteerträgen
und speziell Getreiden.