CN1694889A - 用于调节lgE和抑制细胞增殖的苯基-氮杂-苯并咪唑化合物 - Google Patents
用于调节lgE和抑制细胞增殖的苯基-氮杂-苯并咪唑化合物 Download PDFInfo
- Publication number
- CN1694889A CN1694889A CNA038250934A CN03825093A CN1694889A CN 1694889 A CN1694889 A CN 1694889A CN A038250934 A CNA038250934 A CN A038250934A CN 03825093 A CN03825093 A CN 03825093A CN 1694889 A CN1694889 A CN 1694889A
- Authority
- CN
- China
- Prior art keywords
- replacement
- group
- alkyl
- heteroaryl
- compound
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 230000004663 cell proliferation Effects 0.000 title claims abstract description 30
- BVNWQSXXRMNYKH-UHFFFAOYSA-N 4-phenyl-2h-benzotriazole Chemical class C1=CC=CC=C1C1=CC=CC2=C1NN=N2 BVNWQSXXRMNYKH-UHFFFAOYSA-N 0.000 title abstract 2
- 230000002401 inhibitory effect Effects 0.000 title 1
- 239000003112 inhibitor Substances 0.000 claims abstract description 55
- 238000011282 treatment Methods 0.000 claims abstract description 48
- 208000006673 asthma Diseases 0.000 claims abstract description 35
- 108090000695 Cytokines Proteins 0.000 claims abstract description 8
- 102000004127 Cytokines Human genes 0.000 claims abstract description 8
- 125000001072 heteroaryl group Chemical group 0.000 claims description 578
- 125000000217 alkyl group Chemical group 0.000 claims description 497
- 150000001875 compounds Chemical class 0.000 claims description 419
- 125000001624 naphthyl group Chemical group 0.000 claims description 320
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 320
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 claims description 260
- 125000005842 heteroatom Chemical group 0.000 claims description 258
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 256
- 238000006243 chemical reaction Methods 0.000 claims description 204
- 229910052736 halogen Inorganic materials 0.000 claims description 188
- 150000002367 halogens Chemical class 0.000 claims description 188
- 125000003545 alkoxy group Chemical group 0.000 claims description 177
- 229910052757 nitrogen Inorganic materials 0.000 claims description 156
- 238000000034 method Methods 0.000 claims description 145
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 claims description 128
- 239000005864 Sulphur Substances 0.000 claims description 128
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 128
- 229910052760 oxygen Inorganic materials 0.000 claims description 128
- 239000001301 oxygen Substances 0.000 claims description 128
- 125000003118 aryl group Chemical group 0.000 claims description 98
- 229910052799 carbon Inorganic materials 0.000 claims description 91
- -1 replacement Chemical group 0.000 claims description 81
- 229910052739 hydrogen Inorganic materials 0.000 claims description 75
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 64
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 64
- 125000004985 dialkyl amino alkyl group Chemical group 0.000 claims description 64
- 125000002768 hydroxyalkyl group Chemical group 0.000 claims description 64
- 125000000896 monocarboxylic acid group Chemical group 0.000 claims description 64
- 238000002360 preparation method Methods 0.000 claims description 52
- 125000003282 alkyl amino group Chemical group 0.000 claims description 49
- 125000006297 carbonyl amino group Chemical group [H]N([*:2])C([*:1])=O 0.000 claims description 49
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 49
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 49
- 125000000449 nitro group Chemical group [O-][N+](*)=O 0.000 claims description 49
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 49
- 239000000203 mixture Substances 0.000 claims description 43
- 230000000694 effects Effects 0.000 claims description 39
- 150000003839 salts Chemical class 0.000 claims description 36
- 210000004027 cell Anatomy 0.000 claims description 28
- 239000002253 acid Substances 0.000 claims description 27
- 239000003795 chemical substances by application Substances 0.000 claims description 26
- 239000003814 drug Substances 0.000 claims description 26
- 230000009466 transformation Effects 0.000 claims description 21
- 241000124008 Mammalia Species 0.000 claims description 18
- 239000008194 pharmaceutical composition Substances 0.000 claims description 18
- 239000000126 substance Substances 0.000 claims description 16
- 238000002560 therapeutic procedure Methods 0.000 claims description 16
- 208000024891 symptom Diseases 0.000 claims description 15
- 239000000048 adrenergic agonist Substances 0.000 claims description 12
- 231100000614 poison Toxicity 0.000 claims description 12
- 230000007096 poisonous effect Effects 0.000 claims description 12
- 230000003203 everyday effect Effects 0.000 claims description 11
- 230000037396 body weight Effects 0.000 claims description 10
- 230000001387 anti-histamine Effects 0.000 claims description 8
- 239000003005 anticarcinogenic agent Substances 0.000 claims description 8
- 239000000739 antihistaminic agent Substances 0.000 claims description 8
- 230000009467 reduction Effects 0.000 claims description 8
- VEXZGXHMUGYJMC-UHFFFAOYSA-M Chloride anion Chemical compound [Cl-] VEXZGXHMUGYJMC-UHFFFAOYSA-M 0.000 claims description 7
- 230000002757 inflammatory effect Effects 0.000 claims description 7
- 230000005855 radiation Effects 0.000 claims description 7
- 230000000630 rising effect Effects 0.000 claims description 7
- 229940099471 Phosphodiesterase inhibitor Drugs 0.000 claims description 6
- 230000001078 anti-cholinergic effect Effects 0.000 claims description 6
- 239000002571 phosphodiesterase inhibitor Substances 0.000 claims description 6
- 229940100198 alkylating agent Drugs 0.000 claims description 5
- 239000002168 alkylating agent Substances 0.000 claims description 5
- 102000003915 DNA Topoisomerases Human genes 0.000 claims description 4
- 108090000323 DNA Topoisomerases Proteins 0.000 claims description 4
- 102000007537 Type II DNA Topoisomerases Human genes 0.000 claims description 4
- 108010046308 Type II DNA Topoisomerases Proteins 0.000 claims description 4
- 230000000340 anti-metabolite Effects 0.000 claims description 4
- 239000003429 antifungal agent Substances 0.000 claims description 4
- 229940100197 antimetabolite Drugs 0.000 claims description 4
- 239000002256 antimetabolite Substances 0.000 claims description 4
- 239000003443 antiviral agent Substances 0.000 claims description 4
- 238000001415 gene therapy Methods 0.000 claims description 4
- 238000009169 immunotherapy Methods 0.000 claims description 4
- 230000001976 improved effect Effects 0.000 claims description 3
- 230000000172 allergic effect Effects 0.000 claims description 2
- 208000010668 atopic eczema Diseases 0.000 claims description 2
- VHUUQVKOLVNVRT-UHFFFAOYSA-N Ammonium hydroxide Chemical compound [NH4+].[OH-] VHUUQVKOLVNVRT-UHFFFAOYSA-N 0.000 claims 8
- QGZKDVFQNNGYKY-UHFFFAOYSA-O ammonium group Chemical group [NH4+] QGZKDVFQNNGYKY-UHFFFAOYSA-O 0.000 claims 8
- 239000000908 ammonium hydroxide Substances 0.000 claims 8
- 238000005987 sulfurization reaction Methods 0.000 claims 8
- 239000000306 component Substances 0.000 claims 4
- FCEHBMOGCRZNNI-UHFFFAOYSA-N 1-benzothiophene Chemical compound C1=CC=C2SC=CC2=C1 FCEHBMOGCRZNNI-UHFFFAOYSA-N 0.000 claims 2
- SMWDFEZZVXVKRB-UHFFFAOYSA-N Quinoline Chemical compound N1=CC=CC2=CC=CC=C21 SMWDFEZZVXVKRB-UHFFFAOYSA-N 0.000 claims 2
- YTPLMLYBLZKORZ-UHFFFAOYSA-N Thiophene Chemical compound C=1C=CSC=1 YTPLMLYBLZKORZ-UHFFFAOYSA-N 0.000 claims 2
- 229940124650 anti-cancer therapies Drugs 0.000 claims 2
- 238000011319 anticancer therapy Methods 0.000 claims 2
- 210000004962 mammalian cell Anatomy 0.000 claims 2
- RQMWVVBHJMUJNZ-UHFFFAOYSA-N 4-chloropyridin-2-amine Chemical group NC1=CC(Cl)=CC=N1 RQMWVVBHJMUJNZ-UHFFFAOYSA-N 0.000 claims 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 claims 1
- 150000008371 chromenes Chemical class 0.000 claims 1
- 150000001907 coumarones Chemical class 0.000 claims 1
- 150000002240 furans Chemical class 0.000 claims 1
- 125000000623 heterocyclic group Chemical group 0.000 claims 1
- 150000002460 imidazoles Chemical class 0.000 claims 1
- 150000002475 indoles Chemical class 0.000 claims 1
- CTAPFRYPJLPFDF-UHFFFAOYSA-N isoxazole Chemical compound C=1C=NOC=1 CTAPFRYPJLPFDF-UHFFFAOYSA-N 0.000 claims 1
- 230000001527 leucocytic effect Effects 0.000 claims 1
- 150000002780 morpholines Chemical class 0.000 claims 1
- 125000002347 octyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 claims 1
- 150000004880 oxines Chemical class 0.000 claims 1
- KJKJUXGEMYCCJN-UHFFFAOYSA-N parathiazine Chemical class C12=CC=CC=C2SC2=CC=CC=C2N1CCN1CCCC1 KJKJUXGEMYCCJN-UHFFFAOYSA-N 0.000 claims 1
- 150000004885 piperazines Chemical class 0.000 claims 1
- 150000003217 pyrazoles Chemical class 0.000 claims 1
- 150000004892 pyridazines Chemical class 0.000 claims 1
- 150000003235 pyrrolidines Chemical class 0.000 claims 1
- 150000003557 thiazoles Chemical class 0.000 claims 1
- 150000004886 thiomorpholines Chemical class 0.000 claims 1
- 229930192474 thiophene Natural products 0.000 claims 1
- 150000003384 small molecules Chemical class 0.000 abstract description 45
- 201000010099 disease Diseases 0.000 abstract description 28
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 abstract description 28
- 230000004044 response Effects 0.000 abstract description 3
- 206010020751 Hypersensitivity Diseases 0.000 abstract description 2
- 208000026935 allergic disease Diseases 0.000 abstract description 2
- 230000007815 allergy Effects 0.000 abstract description 2
- 239000013566 allergen Substances 0.000 abstract 1
- 239000002246 antineoplastic agent Substances 0.000 abstract 1
- 210000000265 leukocyte Anatomy 0.000 abstract 1
- 230000001717 pathogenic effect Effects 0.000 abstract 1
- 239000002585 base Substances 0.000 description 161
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 90
- 239000007787 solid Substances 0.000 description 84
- 229920000728 polyester Polymers 0.000 description 81
- 125000006239 protecting group Chemical group 0.000 description 68
- 239000000243 solution Substances 0.000 description 56
- 238000002451 electron ionisation mass spectrometry Methods 0.000 description 37
- JUJWROOIHBZHMG-UHFFFAOYSA-N pyridine Substances C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 36
- 238000003786 synthesis reaction Methods 0.000 description 34
- 238000005160 1H NMR spectroscopy Methods 0.000 description 30
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 28
- 239000000047 product Substances 0.000 description 26
- 238000001914 filtration Methods 0.000 description 25
- 230000008569 process Effects 0.000 description 25
- 238000012360 testing method Methods 0.000 description 25
- 239000002994 raw material Substances 0.000 description 24
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 23
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 20
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 20
- 206010028980 Neoplasm Diseases 0.000 description 19
- 230000008859 change Effects 0.000 description 19
- 239000003153 chemical reaction reagent Substances 0.000 description 19
- 239000002904 solvent Substances 0.000 description 19
- 238000003756 stirring Methods 0.000 description 19
- 150000001412 amines Chemical class 0.000 description 18
- 230000002194 synthesizing effect Effects 0.000 description 18
- 239000003513 alkali Substances 0.000 description 17
- 238000004364 calculation method Methods 0.000 description 17
- 239000007795 chemical reaction product Substances 0.000 description 17
- 238000007796 conventional method Methods 0.000 description 17
- 230000008878 coupling Effects 0.000 description 17
- 238000010168 coupling process Methods 0.000 description 17
- 238000005859 coupling reaction Methods 0.000 description 17
- 238000004821 distillation Methods 0.000 description 17
- 238000000605 extraction Methods 0.000 description 17
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 17
- 229940079593 drug Drugs 0.000 description 15
- 201000011510 cancer Diseases 0.000 description 14
- NZNMSOFKMUBTKW-UHFFFAOYSA-N cyclohexanecarboxylic acid Chemical compound OC(=O)C1CCCCC1 NZNMSOFKMUBTKW-UHFFFAOYSA-N 0.000 description 14
- 229960001866 silicon dioxide Drugs 0.000 description 14
- 230000001028 anti-proliverative effect Effects 0.000 description 13
- 238000005481 NMR spectroscopy Methods 0.000 description 12
- 239000000460 chlorine Substances 0.000 description 12
- 239000000725 suspension Substances 0.000 description 12
- DDKMFOUTRRODRE-UHFFFAOYSA-N chloromethanone Chemical compound Cl[C]=O DDKMFOUTRRODRE-UHFFFAOYSA-N 0.000 description 11
- 238000010438 heat treatment Methods 0.000 description 11
- 230000001737 promoting effect Effects 0.000 description 11
- 239000000427 antigen Substances 0.000 description 10
- 108091007433 antigens Proteins 0.000 description 10
- 102000036639 antigens Human genes 0.000 description 10
- 235000019439 ethyl acetate Nutrition 0.000 description 10
- INCZNJHQABFQPB-UHFFFAOYSA-N 6-nitro-2-(4-nitrophenyl)-1h-imidazo[4,5-b]pyridine Chemical compound C1=CC([N+](=O)[O-])=CC=C1C1=NC2=CC([N+]([O-])=O)=CN=C2N1 INCZNJHQABFQPB-UHFFFAOYSA-N 0.000 description 9
- 239000007868 Raney catalyst Substances 0.000 description 9
- NPXOKRUENSOPAO-UHFFFAOYSA-N Raney nickel Chemical compound [Al].[Ni] NPXOKRUENSOPAO-UHFFFAOYSA-N 0.000 description 9
- 229910000564 Raney nickel Inorganic materials 0.000 description 9
- DCFLDKSHKLPIQA-UHFFFAOYSA-N methyl 6-amino-5-nitropyridine-3-carboxylate Chemical compound COC(=O)C1=CN=C(N)C([N+]([O-])=O)=C1 DCFLDKSHKLPIQA-UHFFFAOYSA-N 0.000 description 9
- QNZDCKBBTJYQDT-UHFFFAOYSA-N 3,5-dinitropyridin-2-amine Chemical compound NC1=NC=C([N+]([O-])=O)C=C1[N+]([O-])=O QNZDCKBBTJYQDT-UHFFFAOYSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 8
- 238000002965 ELISA Methods 0.000 description 8
- 108090000978 Interleukin-4 Proteins 0.000 description 8
- 239000007864 aqueous solution Substances 0.000 description 8
- 238000001727 in vivo Methods 0.000 description 8
- 239000000825 pharmaceutical preparation Substances 0.000 description 8
- 239000000741 silica gel Substances 0.000 description 8
- 229910002027 silica gel Inorganic materials 0.000 description 8
- DFCLRRPFEZEWMS-UHFFFAOYSA-N C1CCCCC1NC1=CC=C(C=2NC3=CC(NC4CCCCC4)=CN=C3N=2)C=C1 Chemical compound C1CCCCC1NC1=CC=C(C=2NC3=CC(NC4CCCCC4)=CN=C3N=2)C=C1 DFCLRRPFEZEWMS-UHFFFAOYSA-N 0.000 description 7
- VZFUCHSFHOYXIS-UHFFFAOYSA-N Cycloheptanecarboxylic acid Chemical compound OC(=O)C1CCCCCC1 VZFUCHSFHOYXIS-UHFFFAOYSA-N 0.000 description 7
- 230000005764 inhibitory process Effects 0.000 description 7
- YNCOATDODXGVSH-UHFFFAOYSA-N 2-(4-nitrophenyl)-1h-imidazo[4,5-b]pyridine-6-carboxylic acid Chemical compound N1C2=CC(C(=O)O)=CN=C2N=C1C1=CC=C([N+]([O-])=O)C=C1 YNCOATDODXGVSH-UHFFFAOYSA-N 0.000 description 6
- LYCAIKOWRPUZTN-UHFFFAOYSA-N Ethylene glycol Chemical compound OCCO LYCAIKOWRPUZTN-UHFFFAOYSA-N 0.000 description 6
- 108010057466 NF-kappa B Proteins 0.000 description 6
- 102000003945 NF-kappa B Human genes 0.000 description 6
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 6
- 230000006835 compression Effects 0.000 description 6
- 238000007906 compression Methods 0.000 description 6
- ZICQBHNGXDOVJF-UHFFFAOYSA-N diamantane Chemical compound C1C2C3CC(C4)CC2C2C4C3CC1C2 ZICQBHNGXDOVJF-UHFFFAOYSA-N 0.000 description 6
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 6
- SIOXPEMLGUPBBT-UHFFFAOYSA-N picolinic acid Chemical compound OC(=O)C1=CC=CC=N1 SIOXPEMLGUPBBT-UHFFFAOYSA-N 0.000 description 6
- 239000000377 silicon dioxide Substances 0.000 description 6
- 235000012239 silicon dioxide Nutrition 0.000 description 6
- 210000001519 tissue Anatomy 0.000 description 6
- 210000004881 tumor cell Anatomy 0.000 description 6
- 108020004414 DNA Proteins 0.000 description 5
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 5
- 206010027336 Menstruation delayed Diseases 0.000 description 5
- 241000699666 Mus <mouse, genus> Species 0.000 description 5
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 5
- 230000002159 abnormal effect Effects 0.000 description 5
- ZLWLTDZLUVBSRJ-UHFFFAOYSA-K chembl2360149 Chemical compound [Na+].[Na+].[Na+].O=C1C(N=NC=2C=CC(=CC=2)S([O-])(=O)=O)=C(C(=O)[O-])NN1C1=CC=C(S([O-])(=O)=O)C=C1 ZLWLTDZLUVBSRJ-UHFFFAOYSA-K 0.000 description 5
- 238000001035 drying Methods 0.000 description 5
- 238000011010 flushing procedure Methods 0.000 description 5
- 230000002062 proliferating effect Effects 0.000 description 5
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 4
- BLBDTBCGPHPIJK-UHFFFAOYSA-N 4-Amino-2-chloropyridine Chemical class NC1=CC=NC(Cl)=C1 BLBDTBCGPHPIJK-UHFFFAOYSA-N 0.000 description 4
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 4
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 4
- 206010066091 Bronchial Hyperreactivity Diseases 0.000 description 4
- 206010006487 Bronchostenosis Diseases 0.000 description 4
- VCIOWMHJEYNCLV-UHFFFAOYSA-N C1CCCCC1NC1=CC=C(C=2NC3=CC=C(NC4CCCCC4)N=C3N=2)C=C1 Chemical compound C1CCCCC1NC1=CC=C(C=2NC3=CC=C(NC4CCCCC4)N=C3N=2)C=C1 VCIOWMHJEYNCLV-UHFFFAOYSA-N 0.000 description 4
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 4
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 4
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 4
- AOJJSUZBOXZQNB-TZSSRYMLSA-N Doxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-TZSSRYMLSA-N 0.000 description 4
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 4
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 4
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 4
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 4
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 4
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 4
- 239000004480 active ingredient Substances 0.000 description 4
- OIRDTQYFTABQOQ-KQYNXXCUSA-N adenosine Chemical compound C1=NC=2C(N)=NC=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@H]1O OIRDTQYFTABQOQ-KQYNXXCUSA-N 0.000 description 4
- 238000004458 analytical method Methods 0.000 description 4
- 210000003719 b-lymphocyte Anatomy 0.000 description 4
- 230000036427 bronchial hyperreactivity Effects 0.000 description 4
- VSJKWCGYPAHWDS-FQEVSTJZSA-N camptothecin Chemical compound C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-FQEVSTJZSA-N 0.000 description 4
- 229960005243 carmustine Drugs 0.000 description 4
- 239000012141 concentrate Substances 0.000 description 4
- 235000008504 concentrate Nutrition 0.000 description 4
- 238000011262 co‐therapy Methods 0.000 description 4
- 238000002425 crystallisation Methods 0.000 description 4
- 239000012228 culture supernatant Substances 0.000 description 4
- 229960000975 daunorubicin Drugs 0.000 description 4
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 4
- 229960003668 docetaxel Drugs 0.000 description 4
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 4
- 229960005420 etoposide Drugs 0.000 description 4
- 238000002474 experimental method Methods 0.000 description 4
- 229960005304 fludarabine phosphate Drugs 0.000 description 4
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 4
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 4
- 229960005277 gemcitabine Drugs 0.000 description 4
- 229960000908 idarubicin Drugs 0.000 description 4
- 229960001101 ifosfamide Drugs 0.000 description 4
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 4
- 230000028709 inflammatory response Effects 0.000 description 4
- 238000002347 injection Methods 0.000 description 4
- 239000007924 injection Substances 0.000 description 4
- 229960002247 lomustine Drugs 0.000 description 4
- 210000004698 lymphocyte Anatomy 0.000 description 4
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 4
- 229960001924 melphalan Drugs 0.000 description 4
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 4
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 4
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 4
- 229960001156 mitoxantrone Drugs 0.000 description 4
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 4
- 229960002340 pentostatin Drugs 0.000 description 4
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 4
- 229960003171 plicamycin Drugs 0.000 description 4
- 239000011541 reaction mixture Substances 0.000 description 4
- 238000010992 reflux Methods 0.000 description 4
- 229960001052 streptozocin Drugs 0.000 description 4
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 4
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 4
- 229960001278 teniposide Drugs 0.000 description 4
- NOYPYLRCIDNJJB-UHFFFAOYSA-N trimetrexate Chemical compound COC1=C(OC)C(OC)=CC(NCC=2C(=C3C(N)=NC(N)=NC3=CC=2)C)=C1 NOYPYLRCIDNJJB-UHFFFAOYSA-N 0.000 description 4
- 229960001099 trimetrexate Drugs 0.000 description 4
- 229960001055 uracil mustard Drugs 0.000 description 4
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 4
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 4
- XWTYSIMOBUGWOL-UHFFFAOYSA-N (+-)-Terbutaline Chemical compound CC(C)(C)NCC(O)C1=CC(O)=CC(O)=C1 XWTYSIMOBUGWOL-UHFFFAOYSA-N 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 3
- ZCVMWBYGMWKGHF-UHFFFAOYSA-N Ketotifene Chemical compound C1CN(C)CCC1=C1C2=CC=CC=C2CC(=O)C2=C1C=CS2 ZCVMWBYGMWKGHF-UHFFFAOYSA-N 0.000 description 3
- GIIZNNXWQWCKIB-UHFFFAOYSA-N Serevent Chemical compound C1=C(O)C(CO)=CC(C(O)CNCCCCCCOCCCCC=2C=CC=CC=2)=C1 GIIZNNXWQWCKIB-UHFFFAOYSA-N 0.000 description 3
- 229910004298 SiO 2 Inorganic materials 0.000 description 3
- NDAUXUAQIAJITI-UHFFFAOYSA-N albuterol Chemical compound CC(C)(C)NCC(O)C1=CC=C(O)C(CO)=C1 NDAUXUAQIAJITI-UHFFFAOYSA-N 0.000 description 3
- 229940037003 alum Drugs 0.000 description 3
- 150000001408 amides Chemical class 0.000 description 3
- 229910052801 chlorine Inorganic materials 0.000 description 3
- 230000008025 crystallization Effects 0.000 description 3
- 230000034994 death Effects 0.000 description 3
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 3
- 210000000222 eosinocyte Anatomy 0.000 description 3
- 102000015694 estrogen receptors Human genes 0.000 description 3
- 108010038795 estrogen receptors Proteins 0.000 description 3
- 239000000706 filtrate Substances 0.000 description 3
- 229960002848 formoterol Drugs 0.000 description 3
- BPZSYCZIITTYBL-UHFFFAOYSA-N formoterol Chemical compound C1=CC(OC)=CC=C1CC(C)NCC(O)C1=CC=C(O)C(NC=O)=C1 BPZSYCZIITTYBL-UHFFFAOYSA-N 0.000 description 3
- 239000007789 gas Substances 0.000 description 3
- 239000003292 glue Substances 0.000 description 3
- 230000036541 health Effects 0.000 description 3
- 238000007912 intraperitoneal administration Methods 0.000 description 3
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 3
- 229960004768 irinotecan Drugs 0.000 description 3
- 229960004958 ketotifen Drugs 0.000 description 3
- 229960003088 loratadine Drugs 0.000 description 3
- JCCNYMKQOSZNPW-UHFFFAOYSA-N loratadine Chemical compound C1CN(C(=O)OCC)CCC1=C1C2=NC=CC=C2CCC2=CC(Cl)=CC=C21 JCCNYMKQOSZNPW-UHFFFAOYSA-N 0.000 description 3
- 230000004060 metabolic process Effects 0.000 description 3
- 239000010813 municipal solid waste Substances 0.000 description 3
- CCVKPWUMYBYHCD-UHFFFAOYSA-N oxolane;pyridine Chemical compound C1CCOC1.C1=CC=NC=C1 CCVKPWUMYBYHCD-UHFFFAOYSA-N 0.000 description 3
- 239000002953 phosphate buffered saline Substances 0.000 description 3
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 3
- 238000006722 reduction reaction Methods 0.000 description 3
- 229960004017 salmeterol Drugs 0.000 description 3
- 229920006395 saturated elastomer Polymers 0.000 description 3
- 210000000952 spleen Anatomy 0.000 description 3
- 210000004988 splenocyte Anatomy 0.000 description 3
- 125000001424 substituent group Chemical group 0.000 description 3
- 150000003456 sulfonamides Chemical class 0.000 description 3
- 229960000195 terbutaline Drugs 0.000 description 3
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 3
- 238000005406 washing Methods 0.000 description 3
- POCJOGNVFHPZNS-ZJUUUORDSA-N (6S,7R)-2-azaspiro[5.5]undecan-7-ol Chemical compound O[C@@H]1CCCC[C@]11CNCCC1 POCJOGNVFHPZNS-ZJUUUORDSA-N 0.000 description 2
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 2
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 2
- PPOWFBGNGQQPSB-UHFFFAOYSA-N 2-(4-aminophenyl)-1h-imidazo[4,5-b]pyridin-6-amine Chemical class C1=CC(N)=CC=C1C1=NC2=CC(N)=CN=C2N1 PPOWFBGNGQQPSB-UHFFFAOYSA-N 0.000 description 2
- ICSNLGPSRYBMBD-UHFFFAOYSA-N 2-aminopyridine Chemical compound NC1=CC=CC=N1 ICSNLGPSRYBMBD-UHFFFAOYSA-N 0.000 description 2
- YKWBEPUOVBMENG-UHFFFAOYSA-N 2-chloro-5-nitropyridin-4-amine Chemical compound NC1=CC(Cl)=NC=C1[N+]([O-])=O YKWBEPUOVBMENG-UHFFFAOYSA-N 0.000 description 2
- SKDHHIUENRGTHK-UHFFFAOYSA-N 4-nitrobenzoyl chloride Chemical compound [O-][N+](=O)C1=CC=C(C(Cl)=O)C=C1 SKDHHIUENRGTHK-UHFFFAOYSA-N 0.000 description 2
- JOQJNCSAEMIZOU-UHFFFAOYSA-N 5-nitropyridine-2,3-diamine Chemical compound NC1=CC([N+]([O-])=O)=CN=C1N JOQJNCSAEMIZOU-UHFFFAOYSA-N 0.000 description 2
- WYWHKKSPHMUBEB-UHFFFAOYSA-N 6-Mercaptoguanine Natural products N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 2
- JDDGLUVPISQPKN-UHFFFAOYSA-N 6-amino-5-nitropyridine-3-carboxylic acid Chemical compound NC1=NC=C(C(O)=O)C=C1[N+]([O-])=O JDDGLUVPISQPKN-UHFFFAOYSA-N 0.000 description 2
- LRFVTYWOQMYALW-UHFFFAOYSA-N 9H-xanthine Chemical compound O=C1NC(=O)NC2=C1NC=N2 LRFVTYWOQMYALW-UHFFFAOYSA-N 0.000 description 2
- QTBSBXVTEAMEQO-UHFFFAOYSA-M Acetate Chemical compound CC([O-])=O QTBSBXVTEAMEQO-UHFFFAOYSA-M 0.000 description 2
- XKRFYHLGVUSROY-UHFFFAOYSA-N Argon Chemical compound [Ar] XKRFYHLGVUSROY-UHFFFAOYSA-N 0.000 description 2
- 238000011731 BALB/cByJ (JAX™ mouse strain) Methods 0.000 description 2
- 108010006654 Bleomycin Proteins 0.000 description 2
- 206010006187 Breast cancer Diseases 0.000 description 2
- 208000026310 Breast neoplasm Diseases 0.000 description 2
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 2
- COMPKNJNNPWTIQ-UHFFFAOYSA-N C1=CC=NC=C1.OC(=O)C1=CC=CN=C1 Chemical compound C1=CC=NC=C1.OC(=O)C1=CC=CN=C1 COMPKNJNNPWTIQ-UHFFFAOYSA-N 0.000 description 2
- KLWPJMFMVPTNCC-UHFFFAOYSA-N Camptothecin Natural products CCC1(O)C(=O)OCC2=C1C=C3C4Nc5ccccc5C=C4CN3C2=O KLWPJMFMVPTNCC-UHFFFAOYSA-N 0.000 description 2
- CURLTUGMZLYLDI-UHFFFAOYSA-N Carbon dioxide Chemical compound O=C=O CURLTUGMZLYLDI-UHFFFAOYSA-N 0.000 description 2
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 2
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 108010092160 Dactinomycin Proteins 0.000 description 2
- 102000009024 Epidermal Growth Factor Human genes 0.000 description 2
- 101800003838 Epidermal growth factor Proteins 0.000 description 2
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 2
- OAKJQQAXSVQMHS-UHFFFAOYSA-N Hydrazine Chemical compound NN OAKJQQAXSVQMHS-UHFFFAOYSA-N 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 108010002616 Interleukin-5 Proteins 0.000 description 2
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 2
- 244000178870 Lavandula angustifolia Species 0.000 description 2
- 235000010663 Lavandula angustifolia Nutrition 0.000 description 2
- 241001465754 Metazoa Species 0.000 description 2
- 229930192392 Mitomycin Natural products 0.000 description 2
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 2
- BSPUVYFGURDFHE-UHFFFAOYSA-N Nitramine Natural products CC1C(O)CCC2CCCNC12 BSPUVYFGURDFHE-UHFFFAOYSA-N 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- 206010070834 Sensitisation Diseases 0.000 description 2
- PXIPVTKHYLBLMZ-UHFFFAOYSA-N Sodium azide Chemical compound [Na+].[N-]=[N+]=[N-] PXIPVTKHYLBLMZ-UHFFFAOYSA-N 0.000 description 2
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 2
- 210000001744 T-lymphocyte Anatomy 0.000 description 2
- YEEZWCHGZNKEEK-UHFFFAOYSA-N Zafirlukast Chemical compound COC1=CC(C(=O)NS(=O)(=O)C=2C(=CC=CC=2)C)=CC=C1CC(C1=C2)=CN(C)C1=CC=C2NC(=O)OC1CCCC1 YEEZWCHGZNKEEK-UHFFFAOYSA-N 0.000 description 2
- IERHLVCPSMICTF-CCXZUQQUSA-N [(2r,3s,4s,5r)-5-(4-amino-2-oxopyrimidin-1-yl)-3,4-dihydroxyoxolan-2-yl]methyl dihydrogen phosphate Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](COP(O)(O)=O)O1 IERHLVCPSMICTF-CCXZUQQUSA-N 0.000 description 2
- 230000009102 absorption Effects 0.000 description 2
- 238000010521 absorption reaction Methods 0.000 description 2
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 2
- JIMXXGFJRDUSRO-UHFFFAOYSA-N adamantane-1-carboxylic acid Chemical compound C1C(C2)CC3CC2CC1(C(=O)O)C3 JIMXXGFJRDUSRO-UHFFFAOYSA-N 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 229960000473 altretamine Drugs 0.000 description 2
- 230000003266 anti-allergic effect Effects 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 2
- 229960001561 bleomycin Drugs 0.000 description 2
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 2
- 210000004369 blood Anatomy 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 2
- 229910052794 bromium Inorganic materials 0.000 description 2
- 229960002092 busulfan Drugs 0.000 description 2
- 229940127093 camptothecin Drugs 0.000 description 2
- 235000011089 carbon dioxide Nutrition 0.000 description 2
- 229960004562 carboplatin Drugs 0.000 description 2
- 238000004113 cell culture Methods 0.000 description 2
- 230000001413 cellular effect Effects 0.000 description 2
- 238000002512 chemotherapy Methods 0.000 description 2
- 229960004630 chlorambucil Drugs 0.000 description 2
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 2
- 238000011097 chromatography purification Methods 0.000 description 2
- 238000001816 cooling Methods 0.000 description 2
- 229960000265 cromoglicic acid Drugs 0.000 description 2
- IMZMKUWMOSJXDT-UHFFFAOYSA-N cromoglycic acid Chemical compound O1C(C(O)=O)=CC(=O)C2=C1C=CC=C2OCC(O)COC1=CC=CC2=C1C(=O)C=C(C(O)=O)O2 IMZMKUWMOSJXDT-UHFFFAOYSA-N 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 239000013078 crystal Substances 0.000 description 2
- DMEGYFMYUHOHGS-UHFFFAOYSA-N cycloheptane Chemical compound C1CCCCCC1 DMEGYFMYUHOHGS-UHFFFAOYSA-N 0.000 description 2
- 230000009089 cytolysis Effects 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 229960003901 dacarbazine Drugs 0.000 description 2
- 229960000640 dactinomycin Drugs 0.000 description 2
- CFCUWKMKBJTWLW-UHFFFAOYSA-N deoliosyl-3C-alpha-L-digitoxosyl-MTM Natural products CC=1C(O)=C2C(O)=C3C(=O)C(OC4OC(C)C(O)C(OC5OC(C)C(O)C(OC6OC(C)C(O)C(C)(O)C6)C5)C4)C(C(OC)C(=O)C(O)C(C)O)CC3=CC2=CC=1OC(OC(C)C1O)CC1OC1CC(O)C(O)C(C)O1 CFCUWKMKBJTWLW-UHFFFAOYSA-N 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000007865 diluting Methods 0.000 description 2
- VSJKWCGYPAHWDS-UHFFFAOYSA-N dl-camptothecin Natural products C1=CC=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)C5(O)CC)C4=NC2=C1 VSJKWCGYPAHWDS-UHFFFAOYSA-N 0.000 description 2
- 231100000673 dose–response relationship Toxicity 0.000 description 2
- 229960004679 doxorubicin Drugs 0.000 description 2
- 239000003480 eluent Substances 0.000 description 2
- 229940116977 epidermal growth factor Drugs 0.000 description 2
- 238000001704 evaporation Methods 0.000 description 2
- 206010016629 fibroma Diseases 0.000 description 2
- ODKNJVUHOIMIIZ-RRKCRQDMSA-N floxuridine Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(=O)NC(=O)C(F)=C1 ODKNJVUHOIMIIZ-RRKCRQDMSA-N 0.000 description 2
- 229960000961 floxuridine Drugs 0.000 description 2
- 230000012010 growth Effects 0.000 description 2
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 2
- 229960001340 histamine Drugs 0.000 description 2
- 210000003630 histaminocyte Anatomy 0.000 description 2
- 229940088013 hycamtin Drugs 0.000 description 2
- 125000004435 hydrogen atom Chemical group [H]* 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 238000010253 intravenous injection Methods 0.000 description 2
- PGHMRUGBZOYCAA-ADZNBVRBSA-N ionomycin Chemical compound O1[C@H](C[C@H](O)[C@H](C)[C@H](O)[C@H](C)/C=C/C[C@@H](C)C[C@@H](C)C(/O)=C/C(=O)[C@@H](C)C[C@@H](C)C[C@@H](CCC(O)=O)C)CC[C@@]1(C)[C@@H]1O[C@](C)([C@@H](C)O)CC1 PGHMRUGBZOYCAA-ADZNBVRBSA-N 0.000 description 2
- PGHMRUGBZOYCAA-UHFFFAOYSA-N ionomycin Natural products O1C(CC(O)C(C)C(O)C(C)C=CCC(C)CC(C)C(O)=CC(=O)C(C)CC(C)CC(CCC(O)=O)C)CCC1(C)C1OC(C)(C(C)O)CC1 PGHMRUGBZOYCAA-UHFFFAOYSA-N 0.000 description 2
- POCJOGNVFHPZNS-UHFFFAOYSA-N isonitramine Natural products OC1CCCCC11CNCCC1 POCJOGNVFHPZNS-UHFFFAOYSA-N 0.000 description 2
- 239000001102 lavandula vera Substances 0.000 description 2
- 235000018219 lavender Nutrition 0.000 description 2
- 150000002617 leukotrienes Chemical class 0.000 description 2
- 230000007246 mechanism Effects 0.000 description 2
- 229960004961 mechlorethamine Drugs 0.000 description 2
- 229960001428 mercaptopurine Drugs 0.000 description 2
- 229960000485 methotrexate Drugs 0.000 description 2
- NHXXZAASXSCAEM-UHFFFAOYSA-N methyl 6-amino-5-[(4-nitrobenzoyl)amino]pyridine-3-carboxylate Chemical compound COC(=O)C1=CN=C(N)C(NC(=O)C=2C=CC(=CC=2)[N+]([O-])=O)=C1 NHXXZAASXSCAEM-UHFFFAOYSA-N 0.000 description 2
- 229960004857 mitomycin Drugs 0.000 description 2
- 229960000350 mitotane Drugs 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 239000002808 molecular sieve Substances 0.000 description 2
- 229940087004 mustargen Drugs 0.000 description 2
- MVLSZQLZJOEHOT-UHFFFAOYSA-N n-(2-amino-5-nitropyridin-3-yl)-4-nitrobenzamide Chemical compound NC1=NC=C([N+]([O-])=O)C=C1NC(=O)C1=CC=C([N+]([O-])=O)C=C1 MVLSZQLZJOEHOT-UHFFFAOYSA-N 0.000 description 2
- 229940086322 navelbine Drugs 0.000 description 2
- 229960004398 nedocromil Drugs 0.000 description 2
- RQTOOFIXOKYGAN-UHFFFAOYSA-N nedocromil Chemical compound CCN1C(C(O)=O)=CC(=O)C2=C1C(CCC)=C1OC(C(O)=O)=CC(=O)C1=C2 RQTOOFIXOKYGAN-UHFFFAOYSA-N 0.000 description 2
- 238000006386 neutralization reaction Methods 0.000 description 2
- 230000000474 nursing effect Effects 0.000 description 2
- 238000005457 optimization Methods 0.000 description 2
- 210000000056 organ Anatomy 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 239000002245 particle Substances 0.000 description 2
- 238000001050 pharmacotherapy Methods 0.000 description 2
- 230000036470 plasma concentration Effects 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 229960000624 procarbazine Drugs 0.000 description 2
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- CZIIDUIQNLSXOJ-UHFFFAOYSA-N pyridine-2,4,5-triamine Chemical compound NC1=CC(N)=C(N)C=N1 CZIIDUIQNLSXOJ-UHFFFAOYSA-N 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229960002052 salbutamol Drugs 0.000 description 2
- 239000012266 salt solution Substances 0.000 description 2
- 230000008313 sensitization Effects 0.000 description 2
- 210000002966 serum Anatomy 0.000 description 2
- URGAHOPLAPQHLN-UHFFFAOYSA-N sodium aluminosilicate Chemical compound [Na+].[Al+3].[O-][Si]([O-])=O.[O-][Si]([O-])=O URGAHOPLAPQHLN-UHFFFAOYSA-N 0.000 description 2
- 210000004989 spleen cell Anatomy 0.000 description 2
- 238000007920 subcutaneous administration Methods 0.000 description 2
- 230000008685 targeting Effects 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- ZFXYFBGIUFBOJW-UHFFFAOYSA-N theophylline Chemical compound O=C1N(C)C(=O)N(C)C2=C1NC=N2 ZFXYFBGIUFBOJW-UHFFFAOYSA-N 0.000 description 2
- 238000011287 therapeutic dose Methods 0.000 description 2
- 229960003087 tioguanine Drugs 0.000 description 2
- MNRILEROXIRVNJ-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=NC=N[C]21 MNRILEROXIRVNJ-UHFFFAOYSA-N 0.000 description 2
- 229950001353 tretamine Drugs 0.000 description 2
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 2
- 229960004528 vincristine Drugs 0.000 description 2
- CILBMBUYJCWATM-PYGJLNRPSA-N vinorelbine ditartrate Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O.OC(=O)[C@H](O)[C@@H](O)C(O)=O.C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC CILBMBUYJCWATM-PYGJLNRPSA-N 0.000 description 2
- DGVVWUTYPXICAM-UHFFFAOYSA-N β‐Mercaptoethanol Chemical compound OCCS DGVVWUTYPXICAM-UHFFFAOYSA-N 0.000 description 2
- QGVLYPPODPLXMB-UBTYZVCOSA-N (1aR,1bS,4aR,7aS,7bS,8R,9R,9aS)-4a,7b,9,9a-tetrahydroxy-3-(hydroxymethyl)-1,1,6,8-tetramethyl-1,1a,1b,4,4a,7a,7b,8,9,9a-decahydro-5H-cyclopropa[3,4]benzo[1,2-e]azulen-5-one Chemical compound C1=C(CO)C[C@]2(O)C(=O)C(C)=C[C@H]2[C@@]2(O)[C@H](C)[C@@H](O)[C@@]3(O)C(C)(C)[C@H]3[C@@H]21 QGVLYPPODPLXMB-UBTYZVCOSA-N 0.000 description 1
- NWZSZGALRFJKBT-KNIFDHDWSA-N (2s)-2,6-diaminohexanoic acid;(2s)-2-hydroxybutanedioic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O.NCCCC[C@H](N)C(O)=O NWZSZGALRFJKBT-KNIFDHDWSA-N 0.000 description 1
- LQWHPYPUHPQSRX-UHFFFAOYSA-N 1,1'-biphenyl;pyridine Chemical compound C1=CC=NC=C1.C1=CC=CC=C1C1=CC=CC=C1 LQWHPYPUHPQSRX-UHFFFAOYSA-N 0.000 description 1
- ZOESYPWVCKOZBH-UHFFFAOYSA-N 1h-imidazo[4,5-b]pyridine-6-carboxylic acid Chemical compound OC(=O)C1=CN=C2N=CNC2=C1 ZOESYPWVCKOZBH-UHFFFAOYSA-N 0.000 description 1
- SNEPVAQSJPTXCK-UHFFFAOYSA-N 2-(4-nitrophenyl)-1h-imidazo[4,5-b]pyridine Chemical compound C1=CC([N+](=O)[O-])=CC=C1C1=NC2=NC=CC=C2N1 SNEPVAQSJPTXCK-UHFFFAOYSA-N 0.000 description 1
- PDQAWJXOYURKPI-UHFFFAOYSA-N 2-chloro-3-nitropyridin-4-amine Chemical compound NC1=CC=NC(Cl)=C1[N+]([O-])=O PDQAWJXOYURKPI-UHFFFAOYSA-N 0.000 description 1
- RBGDLYUEXLWQBZ-UHFFFAOYSA-N 2-chlorobenzamide Chemical compound NC(=O)C1=CC=CC=C1Cl RBGDLYUEXLWQBZ-UHFFFAOYSA-N 0.000 description 1
- OMSBSIXAZZRIRW-UHFFFAOYSA-N 2-methylpyridine;hydrochloride Chemical compound Cl.CC1=CC=CC=N1 OMSBSIXAZZRIRW-UHFFFAOYSA-N 0.000 description 1
- QLILRKBRWXALIE-UHFFFAOYSA-N 3-nitropyridine Chemical compound [O-][N+](=O)C1=CC=CN=C1 QLILRKBRWXALIE-UHFFFAOYSA-N 0.000 description 1
- BXRFQSNOROATLV-UHFFFAOYSA-N 4-nitrobenzaldehyde Chemical compound [O-][N+](=O)C1=CC=C(C=O)C=C1 BXRFQSNOROATLV-UHFFFAOYSA-N 0.000 description 1
- OTLNPYWUJOZPPA-UHFFFAOYSA-N 4-nitrobenzoic acid Chemical compound OC(=O)C1=CC=C([N+]([O-])=O)C=C1 OTLNPYWUJOZPPA-UHFFFAOYSA-N 0.000 description 1
- SXBHXFMYNOLWEC-UHFFFAOYSA-N 5-nitropyridine-2,4-diamine Chemical compound NC1=CC(N)=C([N+]([O-])=O)C=N1 SXBHXFMYNOLWEC-UHFFFAOYSA-N 0.000 description 1
- ZCIFWRHIEBXBOY-UHFFFAOYSA-N 6-aminonicotinic acid Chemical compound NC1=CC=C(C(O)=O)C=N1 ZCIFWRHIEBXBOY-UHFFFAOYSA-N 0.000 description 1
- 206010002198 Anaphylactic reaction Diseases 0.000 description 1
- 206010003445 Ascites Diseases 0.000 description 1
- 201000001320 Atherosclerosis Diseases 0.000 description 1
- MBUVEWMHONZEQD-UHFFFAOYSA-N Azeptin Chemical compound C1CN(C)CCCC1N1C(=O)C2=CC=CC=C2C(CC=2C=CC(Cl)=CC=2)=N1 MBUVEWMHONZEQD-UHFFFAOYSA-N 0.000 description 1
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 1
- VOVIALXJUBGFJZ-KWVAZRHASA-N Budesonide Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@@H]2[C@@H]1[C@@H]1C[C@H]3OC(CCC)O[C@@]3(C(=O)CO)[C@@]1(C)C[C@@H]2O VOVIALXJUBGFJZ-KWVAZRHASA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 206010008190 Cerebrovascular accident Diseases 0.000 description 1
- MHZGKXUYDGKKIU-UHFFFAOYSA-N Decylamine Chemical compound CCCCCCCCCCN MHZGKXUYDGKKIU-UHFFFAOYSA-N 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 208000000059 Dyspnea Diseases 0.000 description 1
- 206010013975 Dyspnoeas Diseases 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 229910004373 HOAc Inorganic materials 0.000 description 1
- 101500025419 Homo sapiens Epidermal growth factor Proteins 0.000 description 1
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 1
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 1
- 206010025323 Lymphomas Diseases 0.000 description 1
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 241000237502 Ostreidae Species 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- 208000006399 Premature Obstetric Labor Diseases 0.000 description 1
- 206010036600 Premature labour Diseases 0.000 description 1
- 206010039085 Rhinitis allergic Diseases 0.000 description 1
- 206010039101 Rhinorrhoea Diseases 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- 230000006052 T cell proliferation Effects 0.000 description 1
- 208000007536 Thrombosis Diseases 0.000 description 1
- IQFYYKKMVGJFEH-XLPZGREQSA-N Thymidine Chemical class O=C1NC(=O)C(C)=CN1[C@@H]1O[C@H](CO)[C@@H](O)C1 IQFYYKKMVGJFEH-XLPZGREQSA-N 0.000 description 1
- 229940020697 accolate Drugs 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 208000024716 acute asthma Diseases 0.000 description 1
- 230000001154 acute effect Effects 0.000 description 1
- 208000037883 airway inflammation Diseases 0.000 description 1
- 201000009961 allergic asthma Diseases 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 230000003321 amplification Effects 0.000 description 1
- 230000036783 anaphylactic response Effects 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 229940045799 anthracyclines and related substance Drugs 0.000 description 1
- 230000001088 anti-asthma Effects 0.000 description 1
- 230000002634 anti-blastic effect Effects 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000000924 antiasthmatic agent Substances 0.000 description 1
- 230000005875 antibody response Effects 0.000 description 1
- 230000000890 antigenic effect Effects 0.000 description 1
- 229910052786 argon Inorganic materials 0.000 description 1
- 229960004574 azelastine Drugs 0.000 description 1
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 1
- 229940124748 beta 2 agonist Drugs 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004204 blood vessel Anatomy 0.000 description 1
- 210000001185 bone marrow Anatomy 0.000 description 1
- 229940098773 bovine serum albumin Drugs 0.000 description 1
- 239000012267 brine Substances 0.000 description 1
- 229940124630 bronchodilator Drugs 0.000 description 1
- 230000005587 bubbling Effects 0.000 description 1
- 229960004436 budesonide Drugs 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 244000309466 calf Species 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000000038 chest Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000029078 coronary artery disease Diseases 0.000 description 1
- 239000003246 corticosteroid Substances 0.000 description 1
- 230000009260 cross reactivity Effects 0.000 description 1
- 230000006378 damage Effects 0.000 description 1
- 239000000850 decongestant Substances 0.000 description 1
- 239000003405 delayed action preparation Substances 0.000 description 1
- 230000001066 destructive effect Effects 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000003085 diluting agent Substances 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 230000000857 drug effect Effects 0.000 description 1
- 230000008030 elimination Effects 0.000 description 1
- 238000003379 elimination reaction Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000002702 enteric coating Substances 0.000 description 1
- 238000009505 enteric coating Methods 0.000 description 1
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 description 1
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 description 1
- OAMZXMDZZWGPMH-UHFFFAOYSA-N ethyl acetate;toluene Chemical compound CCOC(C)=O.CC1=CC=CC=C1 OAMZXMDZZWGPMH-UHFFFAOYSA-N 0.000 description 1
- 238000011156 evaluation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 208000024711 extrinsic asthma Diseases 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 230000004992 fission Effects 0.000 description 1
- 235000003599 food sweetener Nutrition 0.000 description 1
- 230000006870 function Effects 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- 239000011521 glass Substances 0.000 description 1
- 230000000004 hemodynamic effect Effects 0.000 description 1
- 231100000652 hormesis Toxicity 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 229940116978 human epidermal growth factor Drugs 0.000 description 1
- IKDUDTNKRLTJSI-UHFFFAOYSA-N hydrazine monohydrate Substances O.NN IKDUDTNKRLTJSI-UHFFFAOYSA-N 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 238000005984 hydrogenation reaction Methods 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- 230000036039 immunity Effects 0.000 description 1
- 230000005847 immunogenicity Effects 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 238000002513 implantation Methods 0.000 description 1
- 230000008676 import Effects 0.000 description 1
- 230000006872 improvement Effects 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 230000002779 inactivation Effects 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 239000003701 inert diluent Substances 0.000 description 1
- 230000008595 infiltration Effects 0.000 description 1
- 238000001764 infiltration Methods 0.000 description 1
- 210000004969 inflammatory cell Anatomy 0.000 description 1
- 230000006749 inflammatory damage Effects 0.000 description 1
- 208000027866 inflammatory disease Diseases 0.000 description 1
- 229910003480 inorganic solid Inorganic materials 0.000 description 1
- 238000009413 insulation Methods 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 229960001361 ipratropium bromide Drugs 0.000 description 1
- KEWHKYJURDBRMN-ZEODDXGYSA-M ipratropium bromide hydrate Chemical compound O.[Br-].O([C@H]1C[C@H]2CC[C@@H](C1)[N@@+]2(C)C(C)C)C(=O)C(CO)C1=CC=CC=C1 KEWHKYJURDBRMN-ZEODDXGYSA-M 0.000 description 1
- 230000007794 irritation Effects 0.000 description 1
- 238000002386 leaching Methods 0.000 description 1
- 201000010260 leiomyoma Diseases 0.000 description 1
- 239000003446 ligand Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 239000000463 material Substances 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 description 1
- KZFTZZIOEVUOOT-UHFFFAOYSA-N methyl 5,6-diaminopyridine-3-carboxylate Chemical compound COC(=O)C1=CN=C(N)C(N)=C1 KZFTZZIOEVUOOT-UHFFFAOYSA-N 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- 230000000394 mitotic effect Effects 0.000 description 1
- 239000012452 mother liquor Substances 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000003097 mucus Anatomy 0.000 description 1
- 208000010125 myocardial infarction Diseases 0.000 description 1
- DRJOOIQTFYPKPR-UHFFFAOYSA-N n-(2-chloropyridin-4-yl)nitramide Chemical compound [O-][N+](=O)NC1=CC=NC(Cl)=C1 DRJOOIQTFYPKPR-UHFFFAOYSA-N 0.000 description 1
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 description 1
- 150000002790 naphthalenes Chemical class 0.000 description 1
- 229930014626 natural product Natural products 0.000 description 1
- 230000035407 negative regulation of cell proliferation Effects 0.000 description 1
- GVUGOAYIVIDWIO-UFWWTJHBSA-N nepidermin Chemical compound C([C@@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCCN)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)NC(=O)CNC(=O)[C@@H](NC(=O)[C@@H](NC(=O)[C@H](CS)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CS)NC(=O)[C@H](C)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCCCN)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](C)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C(C)C)C(C)C)C1=CC=C(O)C=C1 GVUGOAYIVIDWIO-UFWWTJHBSA-N 0.000 description 1
- 230000000802 nitrating effect Effects 0.000 description 1
- LQNUZADURLCDLV-UHFFFAOYSA-N nitrobenzene Chemical compound [O-][N+](=O)C1=CC=CC=C1 LQNUZADURLCDLV-UHFFFAOYSA-N 0.000 description 1
- 238000003199 nucleic acid amplification method Methods 0.000 description 1
- 229940026778 other chemotherapeutics in atc Drugs 0.000 description 1
- 230000001151 other effect Effects 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 235000020636 oyster Nutrition 0.000 description 1
- 229910052763 palladium Inorganic materials 0.000 description 1
- 238000002638 palliative care Methods 0.000 description 1
- 230000008506 pathogenesis Effects 0.000 description 1
- 230000035778 pathophysiological process Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 239000000546 pharmaceutical excipient Substances 0.000 description 1
- QGVLYPPODPLXMB-QXYKVGAMSA-N phorbol Natural products C[C@@H]1[C@@H](O)[C@]2(O)[C@H]([C@H]3C=C(CO)C[C@@]4(O)[C@H](C=C(C)C4=O)[C@@]13O)C2(C)C QGVLYPPODPLXMB-QXYKVGAMSA-N 0.000 description 1
- 239000000902 placebo Substances 0.000 description 1
- 229940068196 placebo Drugs 0.000 description 1
- 210000002381 plasma Anatomy 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 239000002244 precipitate Substances 0.000 description 1
- 230000001376 precipitating effect Effects 0.000 description 1
- 238000001556 precipitation Methods 0.000 description 1
- 208000026440 premature labor Diseases 0.000 description 1
- 239000000955 prescription drug Substances 0.000 description 1
- 230000002265 prevention Effects 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 230000037452 priming Effects 0.000 description 1
- 230000009696 proliferative response Effects 0.000 description 1
- 239000003223 protective agent Substances 0.000 description 1
- 230000001185 psoriatic effect Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- IRNVCLJBFOZEPK-UHFFFAOYSA-N pyridine-2,3,6-triamine Chemical compound NC1=CC=C(N)C(N)=N1 IRNVCLJBFOZEPK-UHFFFAOYSA-N 0.000 description 1
- 150000003222 pyridines Chemical class 0.000 description 1
- 238000012207 quantitative assay Methods 0.000 description 1
- 238000001959 radiotherapy Methods 0.000 description 1
- 238000001953 recrystallisation Methods 0.000 description 1
- 230000000452 restraining effect Effects 0.000 description 1
- 238000012216 screening Methods 0.000 description 1
- 238000007789 sealing Methods 0.000 description 1
- 238000004062 sedimentation Methods 0.000 description 1
- 210000000582 semen Anatomy 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 239000002002 slurry Substances 0.000 description 1
- HPALAKNZSZLMCH-UHFFFAOYSA-M sodium;chloride;hydrate Chemical compound O.[Na+].[Cl-] HPALAKNZSZLMCH-UHFFFAOYSA-M 0.000 description 1
- 239000008247 solid mixture Substances 0.000 description 1
- 230000003393 splenic effect Effects 0.000 description 1
- 230000004936 stimulating effect Effects 0.000 description 1
- QTENRWWVYAAPBI-YCRXJPFRSA-N streptomycin sulfate Chemical compound OS(O)(=O)=O.OS(O)(=O)=O.OS(O)(=O)=O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](N=C(N)N)[C@H](O)[C@@H](N=C(N)N)[C@H](O)[C@H]1O.CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](N=C(N)N)[C@H](O)[C@@H](N=C(N)N)[C@H](O)[C@H]1O QTENRWWVYAAPBI-YCRXJPFRSA-N 0.000 description 1
- 239000000758 substrate Substances 0.000 description 1
- 229940124530 sulfonamide Drugs 0.000 description 1
- 229910052717 sulfur Inorganic materials 0.000 description 1
- 239000006228 supernatant Substances 0.000 description 1
- 239000003765 sweetening agent Substances 0.000 description 1
- 239000006188 syrup Substances 0.000 description 1
- 235000020357 syrup Nutrition 0.000 description 1
- 229960000278 theophylline Drugs 0.000 description 1
- 230000001225 therapeutic effect Effects 0.000 description 1
- 229940104230 thymidine Drugs 0.000 description 1
- 229960000303 topotecan Drugs 0.000 description 1
- 108091006106 transcriptional activators Proteins 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 125000000876 trifluoromethoxy group Chemical group FC(F)(F)O* 0.000 description 1
- 230000002476 tumorcidal effect Effects 0.000 description 1
- VBEQCZHXXJYVRD-GACYYNSASA-N uroanthelone Chemical compound C([C@@H](C(=O)N[C@H](C(=O)N[C@@H](CS)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CS)C(=O)N[C@H](C(=O)N[C@@H]([C@@H](C)CC)C(=O)NCC(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(=O)N[C@@H](CO)C(=O)NCC(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CS)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCNC(N)=N)C(O)=O)C(C)C)[C@@H](C)O)NC(=O)[C@H](CO)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@@H](NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H](CCSC)NC(=O)[C@H](CS)NC(=O)[C@@H](NC(=O)CNC(=O)CNC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CS)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)CNC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@H](CO)NC(=O)[C@H]1N(CCC1)C(=O)[C@H](CS)NC(=O)CNC(=O)[C@H]1N(CCC1)C(=O)[C@H](CC=1C=CC(O)=CC=1)NC(=O)[C@H](CO)NC(=O)[C@@H](N)CC(N)=O)C(C)C)[C@@H](C)CC)C1=CC=C(O)C=C1 VBEQCZHXXJYVRD-GACYYNSASA-N 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 230000003442 weekly effect Effects 0.000 description 1
- 238000001262 western blot Methods 0.000 description 1
- 229940075420 xanthine Drugs 0.000 description 1
- 229960004764 zafirlukast Drugs 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/41—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having five-membered rings with two or more ring hetero atoms, at least one of which being nitrogen, e.g. tetrazole
- A61K31/4164—1,3-Diazoles
- A61K31/4188—1,3-Diazoles condensed with other heterocyclic ring systems, e.g. biotin, sorbinil
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/437—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system containing a five-membered ring having nitrogen as a ring hetero atom, e.g. indolizine, beta-carboline
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D515/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen, oxygen, and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00
- C07D515/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen, oxygen, and sulfur atoms as the only ring hetero atoms, not provided for in groups C07D463/00, C07D477/00 or C07D499/00 - C07D507/00 in which the condensed system contains two hetero rings
- C07D515/04—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pulmonology (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明涉及对过敏原的IgE反应的小分子抑制剂,它们用于治疗变态反应和/或哮喘或其中IgE为病原的任意疾病。本发明还涉及为细胞增殖抑制剂且由此用作抗癌药的苯基-氮杂-苯并咪唑分子。本发明进一步涉及抑制细胞因子和白细胞的小分子。
Description
发明背景
发明领域
本发明涉及对过敏原的IgE反应的小分子抑制剂,它们用于治疗变态反应和/或哮喘或其中IgE为病原的任意疾病。本发明还涉及为增殖抑制剂且由此用作抗癌药的的小分子。本发明进一步涉及抑制细胞因子和白细胞的小分子。
相关领域的描述
变态反应和哮喘
据估计在美国有1千万人患有哮喘,大约占人口的5%。据估计在美国有关哮喘的支出超过了60亿美元。约25%患有哮喘的请求急救护理的患者需要住院治疗且对哮喘的最大的单纯直接医疗支出成为针对住院患者的医院服务(急救护理),成本超过16亿美元。处方药物的成本在1985年至1990年间增加了54%,接近11亿美元(Kelly,《药物疗法》(Pharmacotherapy)12:13S-21S(1997))。
根据国家非卧床医疗护理调查机构(National Ambulatory Medical CareSurvey)的调查,哮喘占全部非卧床护理访问的1%且该疾病持续成为儿童失学的重要原因。尽管对该病的过程和较好药物的了解有了增加,但是哮喘的发病率和死亡率在该国和全世界中持续升高(《美国健康和人体护理部》(U.S.Department of Health and Human Services);1991,公开号91-3042)。因此,哮喘构成了显著的公众健康问题。
可以将伴随哮喘发作发生的病理生理过程分成两个主要阶段,它们均以支气管狭窄为标志,导致喘鸣、胸闷和呼吸困难。首先,早期哮喘反应由过敏原、刺激物或运动引起。过敏原交联结合在肥大细胞上的受体的免疫球蛋白E(IgE)分子,使它们释放大量预先形成的炎性介体,包括组胺。其它触发剂包括运动后气道组织中的渗透性改变或吸入干冷空气。其次,随后的晚期反应的特征在于活化的嗜酸性粒细胞和其它炎性细胞浸润入气道组织、上皮脱落(desquamonon)和气道内存在高粘性粘液。这种炎性反应导致的损害使气道″已接触过抗原″或致敏,使得需要少量触发剂就可引起随后的哮喘症状。
一些药物用于哮喘的治标疗法;然而,其功效明显是变化的。长期作为哮喘疗法的主要手段的短效β2-肾上腺素能激动剂,特布他林和沙丁胺醇在早期过程中主要起支气管扩张药的作用。较新的长效β2-肾上腺素能激动剂,沙美特罗和福莫特罗可以减少晚期支气管狭窄成分。然而,因为β2-激动剂不具有显著的抗炎活性,所以它们对支气管高反应性没有作用。
大量其它药物靶向早期或晚期哮喘反应的特定方面。例如,抗组胺药、如氯雷他定抑制早期组胺介导的炎性反应。某些较新的抗组胺药、诸如氮_斯汀和酮替芬均具有抗炎和弱的支气管扩张作用,但它们目前尚未在哮喘治疗中具有任何确立的功效。磷酸二酯酶抑制剂、如茶碱/黄嘌呤可以减轻晚期的炎性反应,但尚没有这些化合物减轻支气管高反应性的证据。用于急性哮喘情况以抑制严重支气管狭窄的抗胆碱能药、如异丙托溴铵对早期或晚期炎症没有作用、对支气管高反应性没有作用且由此基本上在长期疗法中没有作用。
皮质类固醇药物,如布地奈德是最有效的抗炎药。炎性介体释放抑制剂、如色甘酸和奈多罗米通过稳定肥大细胞起作用且由此抑制对过敏原的晚期炎性反应。因此,色甘酸和奈多罗米以及皮质类固醇均通过将炎性损害对气道的致敏作用减至最低来减轻支气管高反应性。令人遗憾的是,这些抗炎药无法产生支气管扩张作用。
已经研发了几种抑制哮喘炎症的特定方面的新活性剂。例如,白三烯受体拮抗剂(ICI-204,219,安可来)特别抑制白三烯介导的作用。白三烯涉及气道炎症和支气管狭窄的产生。
因此,尽管目前可得到用于治疗哮喘的大量药物,但是这些化合物主要是治标的和/或存在明显的副作用。因此,非常需要靶向主要原因而非症状串联的新治疗手段。哮喘和变态反应对IgE-介导的结果共有通常的依赖性。实际上,已知过量IgE产生一般是变态反应且特别是变应性哮喘的主要原因(Duplantier和Cheng,Ann.Rep.Med.Chem.29:73-81(1994))。因此,降低IgE水平的化合物可以有效治疗哮喘和变态反应的根本原因。
目前疗法中没有一种可消除过量循环的IgE。通过近来使用嵌合抗-IgE抗体CGP-51901和重组人源化单克隆抗体rhuMAB-E25的临床结果证实了降低血浆IgE可以减轻过敏反应这一推定。实际上,三个公司TanoxBiosystems,Inc.,Genentech Inc.和Novartis AG合作研发了通过中和过量IgE治疗变态反应和哮喘的人源化抗-IgE抗体(Bio World_ Today,2月26日,1997年,p.2)。Tanox已经成功地测试了抗-IgE抗体CGP-51901,它在155位患者中进行的II期试验中减轻了过敏性鼻炎鼻部症状的严重程度和期限(Scrip#2080,11月,24,1995,p.26)。Genentech近来公开了其人源化单克隆抗体rhuMAB-E25在536位患者II/III期试验中产生的阳性结果(BioWorld_ Today,11月,10,1998,p.1)。通过注射给予的抗体rhuMAB-E25(根据需要,每2-4周最高剂量300mg)与安慰剂相比使患者需要其它″缓解″药物(抗组胺药和减充血药)的天数减少了50%。近来,在Denver,Colorado的“国家犹太人医疗和研究中心”(National JewishMedical and Research Center)的Dr.Henry Milgrom等公布了rhuMAB-25在中度至重度哮喘患者中的临床结果(317位患者,12周,每2周进行一次静脉内注射)推定该药物″即将成为突破″(《新英格兰药物杂志》(NewEngland Journal of Medicine),12月,23,1999)。Novartis PharmaceuticalsCorporation、TanoxInc.和Genentech,Inc.已经共同于2000年6月将该产品的生物学许可申请(A Biologies License Application)(BLA)提交给了FDA。从抗-IgE抗体试验的得出的阳性结果提示目的在于IgE下调的治疗策略可能是有效的。
癌症和过度增殖疾病
细胞增殖是对大部分生物过程的正常起作用至关重要的正常过程。细胞增殖在所有的活生物体中发生且包括两个主要过程:核分裂(有丝分裂)和胞质分裂(胞质分裂)。因为生物体持续生长和替换细胞,所以细胞增殖对健康细胞的生命力而言是必需的。正常细胞增殖的破坏可以导致各种疾病。例如,细胞过度增殖可以导致银屑病、血栓形成、动脉粥样硬化、冠心病、心肌梗死、中风、平滑肌瘤、子宫纤维瘤或纤维瘤以及血管移植物和植入器官的闭塞性疾病。异常细胞增殖最通常地与肿瘤形成和癌症相关。
癌症是主要的疾病且在美国和国际上均是死亡率的主要原因。实际上,在美国癌症是第二位致死原因。根据国家健康研究院(National Instituteof Health)的分析,癌症的总年度消耗成本接近1070亿美元,包括370亿美元用于直接的医疗成本,110亿美元用于因疾病导致的生产能力丧失的间接成本和590亿美元用于因早产死亡导致的生产能力丧失的间接成本。并不令人意外的是,正在进行相当程度的努力来研发新的治疗和预防措施以抗击这种毁灭性的疾病。
目前,主要使用手术、放疗和化疗的联合疗法治疗癌症。化疗包括使用化学活性剂破坏癌细胞的复制和代谢。目前用于治疗癌症的化疗剂可以分成5种主要的类型:天然产物及其衍生物;蒽环霉素类(anthacyclines);烷化剂;抗增殖药;和激素药。
发明概述
本发明几个实施方案的一个目的在于提供氮杂-苯并咪唑化合物及其调节IgE的方法。另一个目的在于提供氮杂-苯并咪唑组合物和抑制细胞增殖的方法。本发明几个实施方案的另一个目的在于抑制细胞因子和白细胞,包括、但不限于IL-4、IL-5、嗜酸性粒细胞和淋巴细胞。
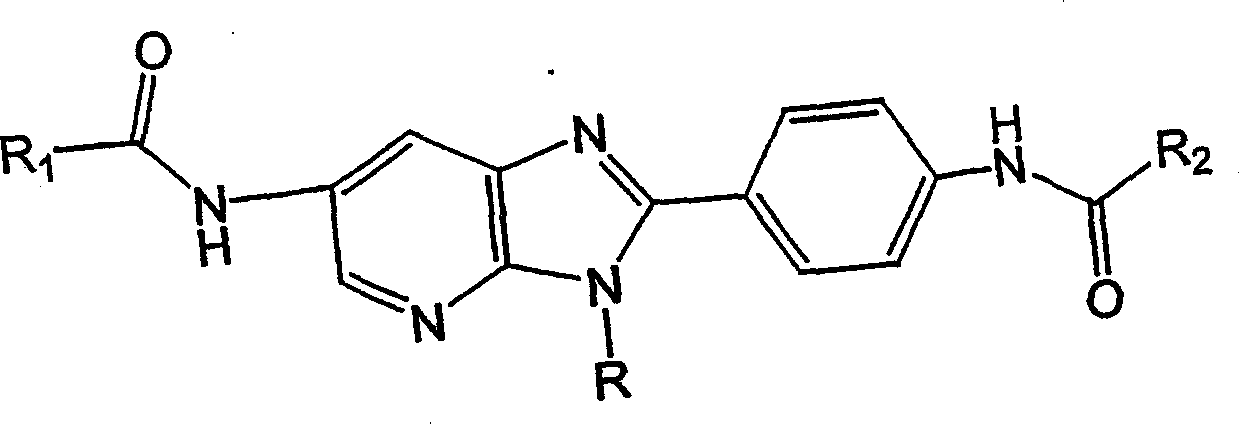
发现副标题超类A-D和A1-A5、B1-B4、C1-C4和D1-D4类下鉴定的以下各系列的化合物在离体和体内模型中都是IgE的有效抑制剂。这些化合物还表现出抗增殖作用,且照此可以用作治疗过度增殖性疾病、包括癌症的活性剂。
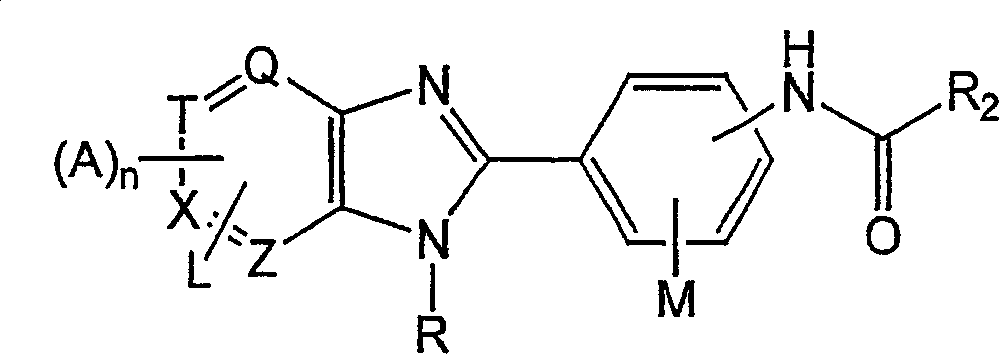
下列超类定义了小分子IgE抑制剂家族,包括超类A(A1-A5类)、超类B(B1-B4类)、超类C(C1-C4类)和超类D(D1-D4类):
超类A;
超类B;
超类C;和
超类D;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选的实施方案包括其中的R1和R2为脂族基的种类。优选的实施方案包括超类A和D的种类,如式S-1-S-25所示。
下类定义了几个实施方案的一家族小分子(A1类):
A1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(A2类):
A2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(A3类):
A3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(A4类):
A4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(A5类):
A5类
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H和卤素组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(B1类):
B1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(B2类):
B2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(B3类):
B3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(B4类):
B4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(C1类):
C1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(C2类):
C2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(C3类):
C3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(C4类):
C4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(D1类):
D1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(D2类):
D2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(D3类):
D3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
下类定义了优选实施方案的一家族小分子IgE抑制剂(D4类):
D4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的一亚类包括如亚类D2a中所示的下列化合物的任意一种或多种:
亚类D2a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如亚类D1a中所示的下列化合物中任意一种或多种:
亚类D1a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如下列亚类D4a中所示化合物中任意一种或多种:
亚类D4a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如下列亚类B1a中所示化合物中任意一种或多种:
亚类B1a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如下列亚类A1a中所示化合物中任意一种或多种:
亚类A1a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
就本文公开的各化学结构而言,为清楚起见,杂原子上的氢原子已经被省略。如果显示杂原子上的开放式化合价,那么可以推定这些化合价被氢原子填充。
还公开了治疗哺乳动物与过量IgE和/或异常细胞增殖(即癌症)相关的疾病情况的方法。在一个方面中,该方法包括对哺乳动物给予抑制IgE用量或抗细胞增殖用量的药物制剂的步骤,该药物制剂包括来自上述公开的小分子家族的至少一种氮杂-苯并咪唑化合物。
按照所述治疗方法的变化形式,可以将抑制IgE的小分子化合物与至少另一种活性剂一起联合给药,所述的另一种活性剂可以减轻与变态反应相关的症状。在一个实施方案中,可以将小分子抑制剂与至少另一种活性组分混合成药物组合物。另一方面,可以将小分子抑制剂与至少另一种活性组分同时或按照不同的治疗方案共同给药。
所述的至少另一种活性组分可以为:选自特布他林(terbutaline)和沙丁胺醇(albuterol)组成的组的短效β2-肾上腺素能激动剂;选自沙美特罗(salmeterol)和福莫特罗(formoterol)组成的组的长效β2-肾上腺素能激动剂;选自氯雷他定(loratadine)、氮_斯汀(azelastine)和酮替芬(ketotifen)组成的组的抗组胺药;磷酸二酯酶抑制剂;抗胆碱能药;皮质类固醇;炎性介体释放抑制剂;或白三烯受体拮抗剂。
在另一个实施方案中,可以将氮杂-苯并咪唑化合物与至少另一种活性剂一起联合给药。这些活性剂包括抗真菌药、抗病毒药、抗生素、抗炎药和抗癌药。抗癌药包括、但不限于:烷化剂(洛莫司汀(lomustine)、卡莫司汀(carmustine)、链佐星(streptozocin)、氮芥(mechlorethamine)、美法仑(melphalan)、尿嘧啶氮芥(uracil nitrogen mustard)、苯丁酸氮芥环磷酰胺、异环磷酰胺(iphosphamide)、顺铂、卡铂丝裂霉素塞替派达卡巴嗪丙卡巴肼、六甲蜜胺、三亚乙基蜜胺、白消安、派泊溴烷,和米托坦);抗代谢药(甲氨蝶呤、三甲曲沙喷司他丁(trimetrexate pentostatin)、阿糖胞苷、ara-CMP、磷酸氟达拉滨(fludarabine phosphate)、羟基脲、氟尿嘧啶、氟尿苷、氯脱氧腺苷、吉西他滨(gemcitabine)、硫鸟嘌呤和6-巯嘌呤)、DNA切割剂(博来霉素);拓扑异构酶I毒物(托泊替康伊立替康(topotecanirinotecan)和喜树碱(camptothecin));拓扑异构酶II毒物(柔红霉素(daunorubicin)、多柔比星(doxorubicin)、伊达比星(idarubicin)、米托蒽醌(mitoxantrone)、替尼泊苷(teniposide)和依托泊苷(etoposide))、DNA结合剂(放线菌素D和普卡霉素(mithramycin));和纺锤体毒物(长春碱、长春新碱、诺维本(navelbine)、紫杉醇和多西他赛(docetaxel))。
在另一个实施方案中,可以将优选实施方案的氮杂-苯并咪唑化合物与一种或多种其它疗法联合给予。这些疗法包括、但不限于放射、免疫疗法、基因疗法和手术。可以将这些联合疗法同时或依次给予。例如,可以将放射与氮杂-苯并咪唑化合物的给药一起给予或可以在给予氮杂-苯并咪唑化合物之前或之后的任意时间时给予放射。
优选将约0.01mg-约100mg/kg体重/天剂量的小分子IgE抑制化合物每天以分次剂量给药。
还公开了治疗哺乳动物与过量IgE或异常细胞增殖相关的疾病情况的方法,该方法包括对哺乳动物给予治疗量的药物制剂的步骤,该药物制剂包括至少一种选自超类A-D的化合物。
本文提供的用于治疗由不需要的、不受控制的或异常的细胞增殖介导的疾病和过程、诸如癌症的方法,包括对哺乳动物给予本文公开的氮杂-苯并咪唑化合物的组合物以抑制细胞增殖。该方法特别用于预防或治疗肿瘤形成和发展。在优选的实施方案中,公开的化合物和方法尤其用于治疗雌激素受体阳性和雌激素受体阴性型乳腺癌。
参照下面的详细描述可以更完整地理解本发明范围内的其它变化形式。
优选实施方案的详细描述
优选实施方案涉及用于治疗变态反应和/或哮喘或IgE为病原的任意疾病的小分子IgE抑制剂。这些抑制剂可以影响IgE的合成、活性、释放、代谢、降解、清除和/或药动学特性。本文公开的特定化合物通过其在离外(ex vivo)和体内试验中抑制IgE水平的能力而得到确定。优选实施方案中公开的化合物还用于治疗与异常细胞增殖相关的疾病,包括、但不限于:肿瘤发生和其它增殖性疾病,诸如癌症;炎性疾病;和循环疾病。本领域技术人员可以参照下述离体和体内试验监测临床治疗方案的发展并使其最优化。此外,本发明的几个实施方案涉及氮杂-苯并咪唑化合物,它们抑制细胞因子和白细胞,包括、但不限于IL-4、IL-5、嗜酸性粒细胞和淋巴细胞。
离体试验
该系统开始于体内抗原引发(priming)并测定体外二次抗体应答。记录基础方案并对于一定范围的参数最优化,包括:引发的抗原剂量和引发后时间范围,体外培养的细胞的数量,体外引起二次IgE(和其它Ig′s)应答的抗原浓度,使体外产生最佳IgE反应的胎牛血清(FBS)批量(batch);引发的CD4+T细胞和半抗原特异性B细胞的重要性;和ELISA试验对IgE的特异性(Marcelletti和Katz,《细胞免疫学》(Cellular Immunology)135:471-489(1991);引入本文作为参考)。
使用于该计划的实际方案适应于更高的流通量分析。通过腹膜内给予10μg吸附在4mg明矾上的DNP-KLH给BALB/cByj小鼠进行免疫接种并在15天后处死动物。切除脾并在组织研磨机中匀化、洗涤两次并维持在补充了10%FBS、100U/ml青霉素、100ug/ml链霉素和0.0005%2-巯基乙醇的DMEM中。在有或没有DNP-KLH(10ng/ml)存在的情况下建立脾细胞培养物(2-3百万个细胞/ml,0.2ml/孔,一式四份,96-孔平板)。向含有抗原的脾细胞培养物中加入测试化合物(2ug/ml和50ng/ml)并在37℃下和10%CO2空气环境中保温8天。
8天后收集培养物上清液并通过Marcelletti和Katz(上文)所述的特异性同型-选择性ELISA试验的改进方法测定Ig′s。改进该试验以有利于高通量。通过用DNP-KLH或DNP-OVA包被过夜制备ELISA平板。在用牛血清清蛋白(BSA)封闭后,稀释各培养物上清液的等分试样(按1∶4在含BSA、叠氮化钠和Tween 20的磷酸盐缓冲盐水(PBS)稀释)、加入到ELISA平板中并在4℃下的加湿箱内保温过夜。在依次与生物素化-山羊抗小鼠IgE(b-GAME)、AP-链霉抗生物素和底物一起保温后对IgE水平进行定量。
类似地测定抗原特异性IgG1,但将培养物上清液稀释200-倍并用生物素化-山羊抗小鼠IgG1(b-GAMG1)取代b-GAME。在按照1∶20稀释培养物上清液并与生物素化-山羊抗小鼠IgG2a(b-GAMG2a)一起保温后测定包被了DNP-KLH的ELISA平板中的IgG2a。通过与标准曲线比较定量测定各同型。所有抗体的可检测性的水平约为200-400pg/ml且在对IgE的ELISA中存在低于0.001%的与任意其它Ig同型的交叉反应性。
体内试验
进一步测试那些在离体试验(上述)中被发现具有活性的化合物在体内抑制IgE反应中的活性。在免疫接种载体前接受低剂量放射的小鼠对7天后用抗原攻击表现出增强的IgE应答。在抗原致敏之前和之后即刻给予测试化合物,测定了该药物抑制IgE应答的能力。比较抗原特异性IgE、IgG1和IgG2a在血清中的水平。
在开始每天的光照周期后7小时,用250拉德将雌性BALB/cByj小鼠照射。2小时后,经腹膜内给小鼠免疫接种在4mg明矾中的2ug KLH。6天后开始连续2-7天的药物注射,每天一次或两次。一般来说,作为在含有10%乙醇和0.25%甲基纤维素的盐水中的混悬液给予腹膜内注射和口腔管饲(150ul/注射)。每个治疗组由5-6只小鼠组成。在给药的第2天,在早晨注射药物后立即经腹膜内给予在4mg明矾中的2ug DNP-KLH。在DNP-KLH攻击后7-21天给小鼠放血。
通过ELISA测定抗原特异性IgE、IgG1和IgG2a抗体。以14,000rpm将眶周放出的血离心10分钟,用盐水将上清液稀释5-倍并再次离心。通过对4种稀释液(一式三份)进行ELISA测定各流出血液的抗体浓度并与标准曲线比较:抗-DNP IgE(1∶100-1∶800);抗-DNP IgG2a(1∶100-1∶800);和抗-DNP IgG1(1∶1600-1∶12800)。
优选实施方案的活性化合物
发现副标题超类A-D和A1-A5、B1-B4、C1-C4和D1-D4类下鉴定的以下各系列的化合物在离体和体内模型中都是有效IgE抑制剂。这些化合物还表现出抗增殖作用且照此可以用作治疗过度增殖性疾病、包括癌症的活性剂。
下列超类定义了小分子IgE抑制剂家族,包括超类A(A1-A5类)、超类B(B1-B4类)、超类C(C1-C4类)和超类D(D1-D4类):
超类A;
超类B;
超类C;和
超类D;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
A1类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(A1类):
A1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如下列亚类A1a中所示化合物中任意一种或多种:
亚类A1a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成A1类化合物。合成的实例包括下列反应,命名为合成方案1和2:
合成方案1
合成方案2
A1类化合物的合成
合成方案1和2表示了可以用于制备A1类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成A1类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案1和2化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案1和2的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案1和2的化合物反应制备上述合成方案1和2的化合物的盐。
A2类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(A2类):
A2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成A2类化合物。合成的实例包括下列反应,命名为合成方案3和4:
合成方案3
合成方案4
A2类化合物的合成
合成方案3和4表示了可以用于制备A2类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成A2类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案3和4化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案3和4的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案3和4的化合物反应制备上述合成方案3和4的化合物的盐。
A2类化合物的实例如下阵列中所示。可以按照上述方法合成优选化合物。
方案II
| R1 | ||
| R2 | 12345678910111213141516171819 | 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
| 20 |
可以制备具有方案II中所示通式的一家族化合物。取代基R1和R2可以选自如下所示的取代基1-20。
A3类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(A3类):
A3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成A3类化合物。合成的实例包括下列反应,命名为合成方案5和6:
合成方案5
合成方案6
A3类化合物的合成
合成方案5和6表示了可以用于制备A3类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成A3类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案5和6化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案5和6的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案5和6的化合物反应制备上述合成方案5和6的化合物的盐。
A4类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(A4类):
A4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成A4类化合物。合成的实例包括下列反应,命名为合成方案7和8:
合成方案7
合成方案8
A4类化合物的合成
合成方案7和8表示了可以用于制备A4类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成A4类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案7和8化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案7和8的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案7和8的化合物反应制备上述合成方案7和8的化合物的盐。
A5类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(A5类):
A5类
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H和卤素组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成A5类化合物。合成的实例包括下列反应,命名为合成方案9和10:
合成方案9
合成方案10
A5类化合物的合成
合成方案9和10表示了可以用于制备A5类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成A5类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案9和10化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案9和10的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案9和10的化合物反应制备上述合成方案9和10的化合物的盐。
B1类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(B1类):
B1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如下亚类B1a所示的化合物:
B1a类;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成B1类化合物。合成的实例包括下列反应,命名为合成方案11和12:
合成方案11
合成方案12
B1类化合物的合成
合成方案11和12表示了可以用于制备B1类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成B1类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案11和12化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案11和12的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案11和12的化合物反应制备上述合成方案11和12的化合物的盐。
B2类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(B2类):
B2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成B2类化合物。合成的实例包括下列反应,命名为合成方案13和14:
合成方案13
合成方案14
B2类化合物的合成
合成方案13和14表示了可以用于制备B2类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成B1类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案13和14化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案13和14的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案13和14的化合物反应制备上述合成方案13和14的化合物的盐。
B3类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(B3类):
B3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成B3类化合物。合成的实例包括下列反应,命名为合成方案15和16:
合成方案15
合成方案16
B3类化合物的合成
合成方案15和16表示了可以用于制备B3类化合物的方法。本领域
技术人员可以理解可以将许多不同的合成反应用于合成B1类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案15和16化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案15和16的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案15和16的化合物反应制备上述合成方案15和16的化合物的盐。
B4类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(B4类):
B4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成B4类化合物。合成的实例包括下列反应,命名为合成方案17和18:
合成方案17
合成方案18
B4类化合物的合成
合成方案17和18表示了可以用于制备B4类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成B4类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案17和18化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案17和18的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案17和18的化合物反应制备上述合成方案17和18的化合物的盐。
C1类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(C1类):
C1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成C1类化合物。合成的实例包括下列反应,命名为合成方案19和20:
合成方案19
合成方案20
C1类化合物的合成
合成方案19和20表示了可以用于制备C1类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成C1类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案19和20化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案19和20的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案19和20的化合物反应制备上述合成方案19和20的化合物的盐。
C2类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(C2类):
C2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成C2类化合物。合成的实例包括下列反应,命名为合成方案21和22:
合成方案21
合成方案22
C2类化合物的合成
合成方案21和22表示了可以用于制备C2类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成C2类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案21和22化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案21和22的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案21和22的化合物反应制备上述合成方案21和22的化合物的盐。
C3类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(C3类):
C3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成C3类化合物。合成的实例包括下列反应,命名为合成方案23和24:
合成方案23
合成方案24
C3类化合物的合成
合成方案23和24表示了可以用于制备C3类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成C3类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案23和24化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案23和24的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案23和24的化合物反应制备上述合成方案23和24的化合物的盐。
C4类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(C4类):
C4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成C4类化合物。合成的实例包括下列反应,命名为合成方案25和26:
合成方案25
合成方案26
C4类化合物的合成
合成方案25和26表示了可以用于制备C4类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成C4类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案25和26化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案25和26的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案25和26的化合物反应制备上述合成方案25和26的化合物的盐。
D1类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(D1类):
D1类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如下亚类D1a所示的化合物:
D1a类;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成D1类化合物。合成的实例包括下列反应,命名为合成方案27和28:
合成方案27
合成方案28
D1类化合物的合成
合成方案27和28表示了可以用于制备D1类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成D1类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案27和28化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案27和28的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案27和28的化合物反应制备上述合成方案27和28的化合物的盐。
D2类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(D2类):
D2类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括如下亚类D2a所示的化合物:
D2a类;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成D2类化合物。合成的实例包括下列反应,命名为合成方案29和30:
合成方案29
合成方案30
D2类化合物的合成
合成方案29和30表示了可以用于制备D3类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成D3类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案29和30化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案29和30的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案29和30的化合物反应制备上述合成方案29和30的化合物的盐。
D2类化合物的实例如下阵列中所示。可以按照上述方法合成优选化合物。
方案III
| R1 | ||
| R2 | 12345678910111213141516171819 | 1 2 3 4 5 6 7 8 9 10 11 12 13 14 15 16 17 18 19 20 |
| 20 |
可以制备具有方案II中所示通式的一家族化合物。取代基R1和R2可以选自如下所示的取代基1-20。
D3类化合物
下类定义了一家族小分子IgE抑制剂(D3类):
D3类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成D3类化合物。合成的实例包括下列反应,命名为合成方案31和32:
合成方案31
合成方案32
D3类化合物的合成
合成方案31和32表示了可以用于制备D3类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成D3类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可来自所示或其它已知可以适用于上述制备合成方案31和32化合物方法的类似反应的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案31和32的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案31和32的化合物反应制备上述合成方案31和32的化合物的盐。
D4类化合物
下类定义了几个实施方案的一家族小分子IgE抑制剂(D4类):
A4类
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
优选实施方案的另一亚类包括下列如亚类D4a所示的化合物:
亚类D4a
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
可以通过本领域中公知的任意常规反应合成D4类化合物。合成的实例包括下列反应,命名为合成方案33和34:
合成方案33
合成方案34
D4类化合物的合成
合成方案33和34表示了可以用于制备D4类化合物的方法。本领域技术人员可以理解可以将许多不同的合成反应用于合成D4类化合物。此外,本领域技术人员理解可以将许多不同的溶剂、偶联试剂和反应条件用于合成反应而得到相差无几的结果。
本领域技术人员会理解顺序的改变且进一步认可与所示或其它已知可以适用于上述制备合成方案33和34化合物方法的反应类似的适宜反应条件的变化形式。
在本文所述用于制备优选实施方案的合成方案33和34的化合物的方法中,有机化学领域的普通技术人员一般充分认可需要保护基且由此本文方案过程必然意味着使用适宜的保护基,不过,并未对这类基团进行特别的举例说明。引入和除去这类保护基是有机化学领域众所周知的;例如,参见T.W.Greene《有机合成中的保护基》(″Protective Groups in OrganicSynthesis″),Wiley(New York),1981。
通过常规方式、诸如提取、蒸馏、色谱等分离本文所述的反应产物。
本文未描述的原料是商购的、已知的或可以通过本领域中公知的方法制备。
通过使适宜的碱或酸与化学计算当量的合成方案33和34的化合物反应制备上述合成方案33和34的化合物的盐。
优选实施方案包括其中R1和R2为脂族基团的种类。在超类A-D中,R1和R2的优选取代基独立地选自下列基团:
更优选,R1和R2的取代基选自取代基1-5和13。
合成下列具体化合物并发现它们在体内和离体试验中具有活性。这些化合物包括在超类A和D中。
优选化合物包括S-4-S-8、S-11、S-13、S-15-S-17、S-19-S-21和S-24-S-25。优选实施方案的特定化合物为S-7。
实施例1
优选实施方案的合成
方案35
2-氨基-3,5-二硝基吡啶(2)。将2-氯-3,5-二硝基吡啶(2g,9.83mmol)悬浮于EtOH(15mL)中并在室温下和搅拌的同时在20分钟内加入NH4OH(28%水溶液,6mL)。将该混合物在室温下再搅拌20分钟且然后在冰浴中冷却至0℃。通过过滤收集产生的黄色固体并在80℃的真空中干燥至得到1.745g(9.5mmol,97%)黄色固体。
1H NMR(500MHz,DMSO-d6)δ8.69(br s,1H),8.96(d,J=2.83Hz,1H),9.17(d,J=2.06Hz,1H),9.26(br s,1H).EIMS M+1 185.6。
2,3-二氨基-5-硝基吡啶(3)。在室温下和20分钟内向搅拌的2-氨基-3,5-二硝基吡啶(2)(1.62g,8.8mmol)在MeOH(75mL)中的混悬液中滴加(NH4)2S(20%,15mL,44mmol)的水溶液。将该混合物在室温下再搅拌30分钟且然后在回流状态下加热30分钟。将该任意冷却至室温并通过过滤收集固体、用冷MeOH(2×20mL)冲洗并在室温下和真空中干燥至得到3,为红色固体(0.812g,5.27mmol,60%)。
1H NMR(500MHz,DMSO-d6)δ5.31(s,2H),6.98(s,2H),7.35(d,J=2.55Hz,1H),8.28(d,J=2.91Hz,1H).EIMS M+1 155.1。
6-硝基-2-(4-硝基苯基)-3H-咪唑并[4,5]吡啶(4)。向2,3-二氨基-5-硝基吡啶(3)(400mg,2.6mmol)在硝基苯(50mL)中的搅拌溶液中加入4-硝基苯甲醛(393mg,2.6mmol)并将该混合物在175℃下加热24小时。通过在减压条件下蒸馏除去溶剂并通过使用CH3CN的过滤收集产生的橙色固体。用乙醚洗涤滤饼并风干至得到4,为橙色固体(0.614g,2.1mmol,83%),将其不经进一步纯化使用。
1H NMR(500MHz,DMSO-d6)δ14.58(br s,1H),9.28(表观d,1H),8.88(br s,1H),8.51(d,J=8.39Hz,2H),8.45(d,J=8.28Hz,2H).EIMS M-1 284.3.Rf=0.55(二氧化硅,19∶1 DCM/MeOH)
N-[2-(4-环己基氨基苯基)-3H-咪唑并[4,5-b]吡啶-6-基]-环己基酰胺(5)。向在安装了冷凝器的氩气净化的烧瓶内搅拌的6-硝基-2-(4-硝基苯基)-3H-咪唑并[4,5]吡啶(4)(101mg,0.353mmol)在EtOH(10mL)中的混悬液中加入Pd/C(10%Pd/碳,20mg)并排空仪器且用H2气净化。将该混合物在80℃下和H2气环境中加热3小时,然后通过C盐垫进行热过滤。在减压条件下蒸发滤液而得到绿色油状物(88mg,0.35mmol),因其快速氧化而不经分析使用。将该绿色油状物溶于无水的DMF(5ml)和吡啶(10eq,0.3g,3.8mmol,0.31mL)并通过注射器加入环己烷羰基氯(2.2eq,0.836mmol,122.6mg,112μL)且在室温下将该混合物搅拌15小时。向其中加入H2O(50mL)并将该混合物搅拌15分钟。通过过滤收集产生的固体并通过使用CH2Cl2/MeOH的硅胶急骤色谱法纯化。进行结晶得到5,为白色固体(28mg,0.063mmol,17%)1H NMR(500MHz,DMSO-d6)δ13.06(表观d,1H),10.00(m,2H),8.33(m,2H),8.12(d,J=8.7Hz,2H),8.06(d,J=8.7Hz,2H),7.78(m,2H),2.37(m,2H),1.79(m,7H),1.66(m,2H),1.44(m,4H),1.28(m,6H).TLC Rf=0.35(二氧化硅,19∶1 DCM/MeOH).EIMS m/z M+1 446.4.分析(C26H31N5O2+0.19CH3OH+0.0002H2O)
方案36
2-氨基-3,5-二硝基吡啶(2)。将2-氯-3,5-二硝基吡啶(5.38,26.4mmol)悬浮于EtOH(75mL)中并在室温下和搅拌的同时在25分钟内加入NH4OH(28%水溶液,30mL)。将该混合物在室温下再搅拌20分钟且然后在冰浴中冷却至0℃。通过过滤收集产生的黄色固体并在80℃的真空中干燥至得到4.42g(26mmol,98%)黄色固体。1H NMR(500MHz,DMSO-d6)δ8.69(br s,1H),8.96(d,J=2.83Hz,1H),9.17(d,J=2.06Hz,1H),9.26(br s,1H)。EIMS M+1 185.6。
2,3-二氨基-5-硝基吡啶(3)。在室温下和20分钟内向搅拌的2-氨基-3,5-二硝基吡啶(2)(2g,10.8mmol)在MeOH(75mL)中的混悬液中滴加(NH4)2S(20%,19mL)的水溶液。将该混合物在室温下再搅拌30分钟且然后在回流状态下加热30分钟。将该任意冷却至室温并通过过滤收集固体、用冷MeOH(2×20mL)冲洗并在室温下和真空中干燥至得到3,为红色固体(1.31g,8.5mmol,79%)。1H NMR(500MHz,DMSO-d6)δ5.31(s,2H),6.98(s,2H),7.35(d,J=2.55Hz,1H),8.28(d,J=2.91Hz,1H).EIMS M+1 155.1。
N-(2-氨基-5-硝基吡啶-3-基)-4-硝基苯甲酰胺(6)。向2,3-二氨基-5-硝基吡啶(3)在无水的吡啶(85mL)中的溶液中加入4-硝基苯甲酰氯(0.875g,4.7mmol)并将该混合物在室温下搅拌20小时。然后将该混合物倾入H2O(250mL)并搅拌30分钟。通过过滤收集产生的黄色固体并用H2O冲洗至无吡啶遗留。在80℃下的真空中干燥固体至得到6,为黄色固体(1.15g,3.8mmol,81%)。1H NMR(500MHz,DMSO-d6)δ10.12(br s,1H),8.83(d,J=2.55Hz,1H),8.84(d,J=8.5Hz,2H),8.35(d,J=2.45Hz,2H),8.24(d,J=8.7Hz,2H),7.62(br s,2H).EIMS M-1 302.3。
6-硝基-2-(4-硝基苯基)-3H-咪唑并[4,5]吡啶(4)。向搅拌的N-(2-氨基-5-硝基吡啶-3-基)-4-硝基苯甲酰胺(6)(1.15g,3.8mmol)在乙二醇(75mL)中的混悬液中加入HCl(浓,3滴)并将该混合物在160℃下加热6小时。将该溶液冷却至室温并倾入H2O(200mL)且通过过滤收集产生的固体、用H2O冲洗并在80℃下的真空中干燥至得到4,为淡黄色固体(1g,3.5mmol,92%)。1H NMR(500MHz,DMSO-d6)δ14.58(br s,1H),9.28(表观d,1H),8.88(brs,1H),8.51(d,J=8.39Hz,2H),8.45(d,J=8.28Hz,2H).EIMS M-1 284.3。Rf=0.55(二氧化硅,19∶1 DCM/MeOH)
6-氨基-2-(4-氨基苯基)-3H-咪唑并[4,5-b]吡啶(5)。向搅拌的6-硝基-2-(4-硝基苯基)-3H-咪唑并[4,5-b]吡啶(4)(0.5g,1.75mmol)在EtOH(40mL)中的混悬液中加入阮内镍(1g,在H2O中的淤浆),随后在5分钟内滴加肼水合物(2mL)。将该反应混合物在室温下搅拌至该反应体系沉降且然后在100℃下加热1小时。将该热溶液通过C盐过滤并在减压条件下浓缩滤液。向残余物中加入水,产生黄白色固体,通过过滤收集该固体、用H2O冲洗并风干。然后在室温下和真空中干燥固体而得到5,为淡棕色固体(0.318g,1.4mmol,81%)1H NMR(500MHz,DMSO-d6)δ12.27(表观d,1H),7.77(br s,2H),7.70(br s,1H)6.97(br s,1H),6.63(d,J=8.51Hz,2H),5.57(br s,2H),4.97(br s,2H)
N-[2-(4-苯甲酰氨基苯基)-3H-咪唑并[4,5-b]吡啶-6-基]-苄基酰胺(7)。向6-氨基-2-(4-氨基苯基)-3H-咪唑并[4,5-b]吡啶(5)(100mg,0.444mmol)在无水的DMF(15mL)中的溶液中加入吡啶(10eq,179μL)和分子筛。加入苯甲酰氯(2.2eq,1.0mmol,141mg,116μL)并将该混合物搅拌过夜。将该混合物倾入H2O(150mL)并通过过滤收集固体。将产生的滤饼溶于热THF(25mL)并过滤以除去分子筛。在减压条件下浓缩滤液并使残余物从CH2Cl2/MeOH/THF中结晶而得到7,为白色固体(26.8mg,0.062mmol,14%)。1H NMR(500MHz,DMSO-d6)δ13.22(表观d,J=210.95Hz,1H),10.48(m,1H),8.63(dd,J=15.4Hz,1.5Hz,1H),8.47(表观d,J=46.47Hz,1H),8.23(d,J=8.58Hz,1H),8.18(d,J=8.36Hz,1H),8.00(m,6H),7.60(m,6H).EIMS M+1 434.4。Rf=0.50(二氧化硅,10∶1 DCM/MeOH)分析值C26H19O2N5+2.734H2O
按照类似方式以(5)为原料合成下列化合物:
N-[2-(4-金刚烷基氨基苯基)-3H-咪唑并[4,5-b]吡啶-6-基]-金刚烷基酰胺。白色固体(20mg,0.036mmol,9%).Mp:400℃,分解。1H NMR(500MHz,DMSO-d6)δ13.05(表观d,1H),9.31(m,2H),8.48(表观d,2H),8.33(表观d,2H),8.33(s,1H),8.23(s,1H),8.11(dd,J=8.15Hz,23.4Hz 2H),7.87(m,2H),2.04(m,8H),1.95(m,6H),1.73(m,7H).TLC Rf=0.35(二氧化硅,19∶1DCM/MeOH)。EIMS m/z M+1 550.8。分析值(C34H19N5O2+1.5H2O+0.2CH3OH)
N-[2-(4-环己基氨基苯基)-3H-咪唑并[4,5-b]吡啶-6-基]-环庚基酰胺。白色固体(100mg,0.212mmol,48%).Mp:374℃,分解。1H NMR(500MHz,DMSO-d6)δ13.06(表观d,1H),9.98(表观d,2H),8.38(m,2H),8.27(s,1H),8.12(dd,J=8.3Hz,25.8Hz,4H),7.77(t,4H),1.95-1.4(系列m 22H).TLCRf=0.35(二氧化硅,19∶1 DCM/MeOH)。EIMS m/z M+1 474.6。分析值(C28H35N5O2+0.27H2O
N-[2-(4-(3,4-二氯苯基)氨基-苯基)-3H-咪唑并[4,5-b]吡啶-6-基]-3,4-二氯-苯甲酰胺。灰白色固体(150mg,0.26mmol,65%)。Mp:372-374℃,分解。1H NMR(500MHz,DMSO-d6)δ13.29(表观d,2H),10.64(表观d,2H),8.63(m,1H),8.46(m,1H),8.29(m,4H),8.24(m,1H),8.00(m 5H),7.88(m,3H),EIMS m/z M-1 571.3。分析值(C26H15Cl4N5O2+2.05H2O+0.1DMF)
N-[2-(4-(4-氯苯基)氨基-苯基)-3H-咪唑并[4,5-b]吡啶-6-基]-(4-氯苯基)-苯甲酰胺。白色固体(42mg,0.084mmol,19%).Mp:>400℃,分解。1HNMR(500MHz,DMSO-d6)δ13.24(表观d,2H),10.54(m,2H),8.62(m,2H),8.44(表观d,2H),8.20(dd,J=8.7Hz,24.8Hz,4H),8.02(m,6H),8.03(d,J=8.45Hz 4H),EIMS m/z M+1 502.8。分析值(C26H17Cl2N5O2+0.385H2O+0.01DMF)
N-[2-(4-(4-甲氧基苯基)氨基-苯基)-3H-咪唑并[4,5-b]吡啶-6-基]-(4-甲氧基苯基)-苯甲酰胺。白色固体(118mg,0.24mmol,54%)。Mp:332℃,分解。1H NMR(500MHz,DMSO-d6)δ13.17(表观d,2H),10.30(表观d,4H),8.61(d,J=15Hz,2H),8.44(表观d,2H),8.18(dd,J=8.25Hz,24.65Hz,4H),8.00(m,6H),7.08(d,4H),3.86(s,3H),EIMS m/z M+1 494.6.分析值(C28H23Cl2N5O4+0.29H2O+0.1DMF)
方案37
2氯-4-氨基吡啶(1):由商购来源得到。
2-氯-4-硝氨基吡啶(2):在0℃下将2-氯-4氨基吡啶1(15g)缓慢加入到浓H2SO4(30ml)中。然后在40分钟期限内缓慢加入浓H2SO4和发烟硝酸(12ml+12ml)。将该反应混合物在室温下搅拌过夜并倾倒在碎冰上且用28%NH4OH处理至pH3.0。过滤该淡黄色固体并用冷水洗涤且风干(2,17.6g,89%)1H NMR(DMSO-d6,500MHz):δ8.40(1H,d,J=5.5Hz);7.52(1H,brs),7.39(1H,dd,J=5.5和1.6Hz);EIMS m/z:196(M+Na+)和173(M+)。
4-氨基-2氯-3-硝基吡啶(3)和4-氨基-2-氯-5-硝基吡啶(4):将小颗粒2-氯-4-硝胺2(12.5g)谨慎溶于浓H2SO4(100ml)并在100℃下加热1小时。在将该溶液冷却至室温后,将其倾倒在碎冰(0.300g)上并用28%NH4OH处理至pH3。使用丙酮-干冰浴将温度保持低于20℃。过滤黄色固体并用冷冰水洗涤且风干(11g,89%)。在连续搅拌的同时使干燥产物与C6H6(0.500L)一起沸腾。将该溶液冷却至RT5小时并过滤黄色固体的主要异构体3(6.0g,55%).1H NMR(DMSO-d6,500MHz):δ7.89(1H,d,J=6.10Hz),7.33(1H,brs);6.82(1H,d,J=6.10Hz),EIMS:172.9(M-1)。
用SiO2胶柱(30g)纯化母液,用(甲苯-EtOAc(85∶15)洗脱而得到所需的少量异构体4(1.0g,9%)。1H NMR(DMSO-d6,500MHz):δ8.83(1H,s),8.10(1H,brs),6.95(1H,s);EIMS m/z:174.8(M+1),172.8(M-1)。
2,4-二氨基-5-硝基吡啶(5):将4-氨基-2-氯-5-硝基吡啶(4)(1.0g,5.76mmol)在50ml 28%NH4OH中的溶液在120℃下的密封管内加热过夜。在将该反应混合物冷却至室温后得到橙红色固体5(0.770g,77%)。1H NMR(DMSO-d6,500MHz):δ8.66(1H,s),7.35(1H,br s),6.73(1H,brs),5.67(1H,s);EIMS m/z:155.2(M+1),153.2(M-1)
2,4,5-三氨基吡啶(6):将5(0.540g,3.5mmol)在EtOH(50ml)和阮内镍(0.600ml)中的溶液在室温下和H2气环境中搅拌3小时。通过C盐过滤使产物不含催化剂而得到6(0.428g,98%);1H NMR(DMSO-d6,500MHz):δ7.11(1H,s),5.65(1H,s)5.12(2H,brs),4.64(2H,brs)3.34(2H,brs);EIMSm/z:125(M+1),并将其用于下一步。
方案38
将2-(4-硝基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基胺(8):2,4,5-三氨基吡啶(6,0.660g,5.32mmol)、对-硝基苯甲酸(7,0.888mg 5.32mmol)溶于PPA(30g)并在180℃下加热7小时。将该反应混合物冷却至室温并倾倒在碎冰上。通过分步添加固体K2CO3(小心)谨慎中和过量的PPA,直到起泡终止。过滤淡棕绿色沉淀并用水洗涤且干燥。将固体溶于(CH2Cl2∶MeOH∶THF∶NH4OH 50∶30∶17∶3)混合物并过滤(将该过程重复3-4次)。除去溶剂并用EtOAc沉淀硝胺而得到8(0.575g,56%)。1H NMR(DMSO-d6,500MHz):δ11.10(1H,brs),8.77(1H,s),8.45-8.25(4H m),6.50(1H,s),5.67(2H,brs);EIMS m/z:256.4(M+1)和290(M+Cl-);
环己烷羧酸[2-(4-硝基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(9):向8(0.116g,0.45mmol)在无水的THF和吡啶(10ml/0.300ml)中的搅拌溶液中加入环己烷羰基氯(0.100ml,0.68mmol)并在室温下搅拌4小时。通过加入水使反应猝灭并过滤黄色固体、风干并溶于EtOAc并通过硅胶床。用EtOAc洗脱而得到所需产物9(0.095g,58%)。1H NMR(DMSO-d6,500MHz):δ13.49(1H,s),10.38(1H,s,NH),8.76(1H,s),8.41(4H,dd,J=15和5Hz);8.34(1H,s),2.53(1H,m),1.80-1.20(10,m);MS m/z:366(M+1),364(M-1)。将产物用于下一步。
环己烷羧酸[2-(4-氨基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(10)。将9(0.095g,0.26mmol)在EtOH(10ml)中的溶液与阮内镍(0.300ml)一起在氢气环境中和80℃下搅拌30分钟。TLC显示无原料,通过C盐过滤使产物不含催化剂而得到胺10(0.080g,92%),将其用于下一步。
环己烷羧酸[2-(4-环己烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(11):向10(0.080g,0.24mmol)在无水的THF和吡啶(10ml/0.300ml)中的搅拌溶液中加入环己烷羰基氯(0.060ml,0.38mmol)并在室温下搅拌4小时。用水使反应猝灭并搅拌30分钟。过滤黄色固体、干燥并通过硅胶床纯化。用乙酸乙酯洗脱而得到所需产物11,为淡黄色固体0.055g(51%)Mp:235℃;1HNMR(DMSO-d,500MHz):δ12.99(1H,brs,NH),10.27(1H,brs,NH),10.07(1H,brs,NH),8.61(1H,brs),8.27(1H,brs),8.07(2H,d,J=8.0Hz),7.79(2H,d,J=9.0Hz);2.52(1H,m),2.36(1H,m),1.83-1.17(20H,m);EIMS m/z:446.5(M+1),444.6(M-1)。分析值(C26H31N5O2.0.91H2O)C,H,N
环己烷羧酸[2-(4-环己烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺二甲烷磺酰胺盐(12):向11(0.100g,0.225mmol)在MeOH(5ml)中的溶液中加入甲磺酸(0.050ml)并在室温下搅拌2小时。在减压条件下除去溶剂并加入丙酮和乙醚。通过过滤收集固体而得到产物12(0.075g,52%).M.p.258-268℃,1H NMR(DMSO-d6,500MHz):δ11.49(1H,brs,NH),10.25(1H,brs,NH),8.79(1H,s),8.165(2H,d,J=9.0Hz),7.87(2H,d,J=9.0Hz),8.78(1H,s),2.40(6H,s),2.37(2H,m),1.91-1.20(20H,m);EIMS m/z:541.1(M+CH3SO3H),446.5(M+1);分析值(C28H39N5O8S2×2.20H2O)C,H,N,S
方案39
金刚烷羧酸[2-(4-硝基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(13):向硝胺8(0.240g,0.94mmol)在无水的THF-吡啶(15ml/0.400ml)中的搅拌溶液中加入金刚烷羰基氯(0.280g,1.41mmol)并将该混合物在室温下搅拌3小时。通过添加水使反应猝灭并过滤产生的黄色固体其使其通过硅胶,将EtOAc用作洗脱液而得到13(0.265g,67%)。1H NMR(DMSO-d6,500MHz):δ13.51(1H,brs,NH),9.60(1H,brs,NH),8.78(1H,s),8.45-8.40(4H,m),8.32(1H,s),2.00-1.60(15H,m);EIMS m/z:418.5(M+1)和416(M-1)。
金刚烷羧酸[2-(4-氨基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(14):将13(0.200g,0.48mmol)和阮内镍(0.200ml)在EtOH(10ml)中的溶液在80℃下和H2气环境中搅拌90分钟。TLC显示无原料。通过C盐垫过滤使产物不含催化剂并蒸发至干而得到胺14(0.200g,100%),将其用于下一步。
金刚烷-1-羧酸[2-(4-金刚烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(15):向胺14(0.200g,0.50mmol)在无水的THF-吡啶(10ml/0.400ml)中的溶液中加入金刚烷羰基氯(0.150g,0.75mmol)并在室温下和氩气环境中搅拌过夜。用水使反应猝灭并在室温下搅拌30分钟。过滤黄色固体并使其通过硅胶,将CH2Cl2∶MeOH(95∶5)用作洗脱液而得到所需产物15(0.150g,50%)。M.p.265℃;1H NMR(DMSO-d6,500MHz):δ13.02(1H,brs,NH),9.48(1H,brs,NH),9.37(1H,brs,NH),8.64(1H,s),8.24(1H,s),8.08(2H,d,J=5.0Hz),7.88(2H,d,J=5.0Hz),2.03-1.60(30H,m).EIMS m/z:449.6(M+1);分析值(C34H39N5O2×0.85H2O)C,H,N
金刚烷-1-羧酸[2-(4-(4-酮基金刚烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基)-酰胺(16):向室温下的胺14(0.110g,0.28mmol)在无水的吡啶(10ml)中的溶液中加入4-酮基金刚烷羰基氯(0.090g,0.42mmol)并在室温下和氩气环境中搅拌过夜。进行常规操作(如15中所述)而得到所需产物16(0.025g,16%)。M.p.250℃;1H NMR(DMSO-d6,500MHz):δ13.05(1H,brs,NH),9.56(1H,brs,NH),9.46(1H,brs,NH),8.26(1H,brs),8.24(1H,brs),8.11(2H,d,J=10.0Hz),7.87(2H,d,J=10.0Hz),2.20-1.80(28H,m);EIMS m/z:564(M+1);分析值(C34H37N5O3×1.36H2O)
金刚烷-1-羧酸[2-(4-(4-羟基金刚烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基)-酰胺(17):向16(0.065mg,0.115mmol)在EtOH(10ml)中的溶液中加入NaBH4(0.020g,0.53mmol)并将该混合物在80℃下搅拌1小时。除去乙醇并用水洗涤残余物。将产物溶于MeOH和THF并过滤以除去任何无机物固体。用MeOH和EtOAc沉淀产物17并过滤0.011mg(14%)。1H NMR(DMSO-d6,500MHz):δ13.05(1H,brs,NH),9.36(2H,brs,NH),8.59(1H,brs),8.29(1H,brs),8.10(2H,d,J=8.3Hz),7.85(2H,brd,J=8.3Hz),4.70(1H,brs,OH),3.72-3.60(1H,br s),2.20-1.40(28H,m);EIMS m/z:566.6(M+1),601.5(M+Cl-);分析值(C34H39N5O3×3.5H2O)C,H,N
方案40
环庚烷羧酸[2-(4-硝基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(18):将胺8(0.200g,0.78mmol)在无水的吡啶(5ml)和环庚烷羰基氯(0.200ml,1.24mmol)中的溶液在80℃下加热2小时。通过添加水使反应猝灭并过滤黄色产物、风干并使其通过硅胶柱。用己烷∶EtOAc(6∶4)洗脱而得到所需产物18(0.088g,30%);1H NMR(DMSO-d6,500MHz):δ10.38(1H,brs,NH),8.76(1H,brs,NH),8.44-8.39(4H,m),8.33(1H,brs),2.92(1H,m),1.86-145(12H,m),EIMS m/z:380(M+1),739.1(M+)。
环庚烷羧酸[2-(4-氨基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(19):将18(0.138g,0.36mmol)和阮内镍(0.400ml)在EtOH(20ml)中的溶液在80℃下和H2气环境中加热90分钟。TLC显示无原料,通过经C盐垫过滤使胺19中不含催化剂并蒸发溶剂而得到固体0.094g(75%)。将其用于下一步。
环庚烷羧酸[2-(4-环庚烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(20):将胺19(0.094g,0.27mmol)溶于无水的吡啶(5ml)并加入环庚烷羰基氯(0.100ml,0.622mmol)且将该溶液在室温下搅拌过夜。加入水,随后加入饱和NaHCO3溶液。将该混合物在室温下搅拌1小时。过滤固体、干燥并使其通过硅胶柱,用乙酸乙酯洗脱而得到白色固体20(0.050g,39%)。M.p.194℃,1H NMR(DMSO-d6,500MHz):δ13.40(1H,brs,NH),10.09(2H,s,NH),8.81(1H,brs),8.145(2H,d,J=9.0MHz),7.82(2H,d,J=9.0Hz),2.74(1H,m),2.49(1H,m),1.91-1.25(24H,m);EIMS m/z:474.4(M+1)和472.6(M-1);分析值(C28H35N5O2)C,H,N.
方案41
吡啶-2-甲酸[2-(4-硝基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(21):将胺8(0.145g,0.57mmol)和皮考啉酰基氯盐酸盐(0.180g,1.01mmol)在无水的吡啶(5ml)中的溶液在室温下搅拌过夜。在加入水后,过滤褐色固体并使其通过SiO2胶,用CH2Cl2∶MeOH(100∶5)洗脱而得到所需产物21(0.065g,31%)。
吡啶-2-甲酸[2-(4-氨基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(22):将酰胺21(0.80g,0.222mmol)在THF/MeOH(5ml/15ml)中的溶液与阮内镍(0.150ml)一起在室温下和H2气环境中搅拌2小时。通过经C盐过滤使胺不含催化剂而得到22(0.065g,88%)、干燥并用于下一步。
吡啶-2-甲酸[2-(4-环己烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(23):将胺22(0.040g,0.12mmol)和环己烷羰基氯(0.100ml,0.68mmol)在无水的THF-吡啶(10ml/0.300ml)中的溶液在室温下搅拌过夜。进行如上所述常规操作而得到二酰胺23(0.025g,47%)。M.p.258℃;1H NMR(DMSO-d6,500MHz):δ13.5(1H,brs,NH),10.60(1H,brs,NH),10.13(1H,brs,NH),8.78(1H,d,J=5.0Hz),8.74(1H,brs),8.46(1H,brs),8.24(1H,d,J=12.5Hz),8.115(2H,d,J=8.0Hz),7.81(2H,d,J=8.0Hz),7.74(1H,dt,J=10.0和13.5Hz),2.37(1H,m),1.84-1.18(10H,m);EIMS m/z:441.4(M+1),439.6(M-1);分析值(C25H24N6O2×1.10H2O)C,H,N
吡啶-2-甲酸[2-(4-金刚烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基]-酰胺(24):将22(0.065g,0.197mmol)、金刚烷羰基氯(0.060g,0.30mmol)在无水的吡啶(5ml)中的溶液在80℃下搅拌2小时。进行常规操作后,用10%K2CO3将固体处理1小时。过滤固体并使其通过SiO2胶,用EtOAc洗脱而得到二酰胺24(0.039g,40%)。M.p.305℃;1H NMR(DMSO-d6,500MHz):δ13.19(1H,brs,NH),10.47(1H,brs,NH),9.39(1H,brs),8.765(1H,d,J=4.5Hz),8.73(1H,brs),8.45(1H,brs),8.24(1H,d,J=8.0Hz),8.14-8.09(2H,m),7.89(2H,d,J=8.5Hz),7.72(1H,dt,J=5.0和7.5Hz),2.0(3H,brs),1.92(6H,brs),1.72(6H,brs);EIMS m/z:493.5(M+1);分析值(C29H28N6O2×1.23H2O)C,H,N
吡啶-2-甲酸[2-(4-(4-酮基金刚烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基)-酰胺(25):将22(0.077g,0.234mmol)、4-酮基金刚烷羰基氯(0.098g,0.46mmol)在无水的吡啶(5ml)中的溶液在室温下搅拌过夜。在进行常规操作后,用饱和NaHCO3处理固体。将固体通过烧结玻板漏斗过滤,用MeOH/乙酸乙酯和己烷洗涤沉淀而得到固体25(0.085g,70%)。M.p.235℃;1HNMR(DMSO-d6,500MHz):δ13.19(1H,brs,NH),10.48(1H,brs,NH),9.57(1H,brs,NH),8.765(1H,d,J=5.0Hz),8.72(1H,brs),8.46(1H,brs),8.24(1H,d,J=7.5Hz),8.12(2H,d,J=8.0Hz),7.87(2H,d,J=8.0Hz),7.72(1H,t,J=6.5Hz),2.24-1.90(13H,m);EIMS m/z:507.5(M+1),529.5(M+1+Na+),505.6(M-1);分析值(C29H26N6O3×1.05H2O)C,H,N
吡啶-2-甲酸[2-(4-(4-羟基金刚烷羰基-苯基)-3H-咪唑并[4,5-c]吡啶-6-基)-酰胺(26):向25(0.057g,0.112mmol)在EtOH(10ml)中的溶液中加入NaBH4(0.020g,0.53mmol)并将该溶液在80℃下搅拌2小时。在进行常规操作(上述)后得到羟基化合物26,为白色固体0.045g(79%)。M.p.260℃;1H NMR(DMSO-d6,500MHz):δ3.24和13.19(1H,各brs,NH)10.48 &10.42(1H,各brs,NH),9.39 & 9.33(1H各brs,NH),8.77(1H,d,J=5.0Hz),8.72(1H,brs),8.64(1H,s),8.49 & 8.46(1H,各s),8.245(1H,d,J=8.0Hz),8.15-8.11(4H,m),7.90-7.87(4H,m),7.73(2H,m),4.67(1H各s,OH),3.72& 3.64(1H,各,brs),2.49-1.38(26Hz,m);EIMS m/z:509.6(M+1),507.6(M-1);分析值(C29H28N6O3×1.77H2O)C,H,N
方案42
2-{4-[(金刚烷-1-羰基)-氨基]-苯基}-1H-吡咯并[2,3-b]吡啶-5-甲酸吡啶-2-基
酰胺
6-氨基-5-硝基-烟酸(2)。在1小时内向6-氨基烟酸(1,15g,109mmol)在H2SO4(浓,30ml)中的溶液中滴加H2SO4(浓,7.5ml)/HNO3(浓,7.5ml)溶液。在此过程中该溶液变浓稠的乳白色。在室温下持续搅拌1.5小时,此后将该混合物倾入冰/H2O(1L)并搅拌20分钟,然后使其保持稳定。通过过滤收集白色固体、用H2O冲洗并干燥至得到18.7克白色固体。
将该固体悬浮于H2SO4(浓,60ml)中并在100℃下加热1.5小时。使用NaOH水溶液将红色溶液调节至pH~3-4并通过过滤收集黄色固体且在真空中干燥至得到产物,为黄色固体(15.2g,82.5mmol,76%),将其不经进一步纯化使用。
6-氨基-5-硝基-烟酸甲酯(3)。将6-氨基-5-硝基-烟酸(2)(15.2g,82.5mmol)在MeOH(250ml)和H2SO4(浓,25ml)中的溶液在回流状态下加热5小时。在真空中浓缩该溶液并用饱和NaHCO3水溶液处理残余物至呈适度碱性。通过过滤收集产生的固体、用H2O冲洗并在真空中干燥至得到产物,为黄色固体(4.8g,25mmol,30%),将其不经进一步纯化使用。对该固体在DCM/MeOH(19∶1)中的溶液进行TLC证实与基线原料相比在Rf=0.5处极性较低的化合物。
5,6-二氨基-烟酸甲酯(4)。向6-氨基-5-硝基-烟酸甲酯(3)(5g,25mmol)在MeOH(150ml)中的混悬液中加入阮内镍。用H2将该混合物净化5次并在80℃下和H2环境中加热4小时。将该溶液通过C盐过滤并在真空中浓缩至得到产物,为棕色固体(3.2g,19mmol,76%),将其不经进一步纯化使用。对在DCM/MeOH(19∶1)中的该产物进行TLC证实Rf=0.026处斑点的极性较高。
6-氨基-5-(4-硝基-苯甲酰氨基)-烟酸甲酯(5)。向5,6-二氨基-烟酸甲酯(4)(3.22g,19mmol)在无水的吡啶(100ml)中的混悬液中加入4-硝基苯甲酰氯(3.5g,19mmol)并将该混合物搅拌18小时。将该混合物倾入H2O并通过过滤收集产生的固体、在真空中干燥至得到产物,为黄色固体(4.05g,13mmol,66%)。1H NMR(500MHz,DMSO-d6):δ9.98(s,1H),8.47(s,1H),8.36(d,J=8.7Hz,2H),8.23(d,J=8.7Hz,2H),8.0(s,1H),6.92(s,2H),3.79(s,3H),EIMS m/z M-1 315.4。
2-(4-硝基-苯基)-1H-咪唑并[4,5-b]吡啶-6-甲酸(6)。向6-氨基-5-(4-硝基-苯甲酰氨基)-烟酸甲酯(5)(4.05g,13mmol)在乙二醇(300ml)中的混悬液中加入浓HCl(20滴)并将该混合物在160℃下加热5小时。在DCM/MeOH(19∶1)中的TLC显示不存在原料。将该溶液冷却并倾入H2O且通过过滤收集固体并风干。1H NMR(500MHz,DMSO-d6)δ14.08(br s,1H),8.97(s,1H),8.51(br s,1H),8.49(d,J=8.7Hz,2H),8.43(d,J=8.7Hz,2H),3.92(s,3H)。EIMS m/z M-1 297.3
将使湿固体悬浮于EtOH(200ml)中,加入NaOH(水溶液,3%,100ml)并将该溶液在回流状态下加热3小时。浓缩该混合物并用乙酸酸化残余物。收集产生的固体并在真空中干燥至得到产物,为淡黄色固体(2.7g,9.6mmol,75%),将其不经进一步纯化使用。1H NMR(500MHz,DMSO-d6)δ8.97(d,J=1.43Hz,1H),8.51(m,3H),8.45(d,J=8.82Hz,2H)。EIMS m/zM-1 283.4
2-{4-[(金刚烷-1-羰基)-氨基]-苯基}-1H-吡咯并[2,3-b]吡啶-5-甲酸吡啶-2-基酰胺(7)。向2-(4-硝基-苯基)-1H-咪唑并[4,5-b]吡啶-6-甲酸(500mg,1.8mmol)在无水的CH2Cl2(200ml)中的溶液中加入(COCl)2(3eq,5.4mmol,463ul)并将该溶液在室温下搅拌18小时。在减压条件下浓缩该混合物而得到酰基氯,为残余物。
向残余物在无水的吡啶(25ml)中的溶液中加入作为固体的2-氨基吡啶(1.8mmol,166mg)并将该混合物在室温下搅拌18小时。将该混合物倾入H2O(200ml)并搅拌15分钟。通过过滤收集产生的固体并干燥至得到粗的不纯固体,将其不经纯化用于下面的还原反应。
向残余物粗品在MeOH/THF中的溶液中加入阮内镍。将该溶液在真空中用H2净化5次并在80℃下和H2环境中加热18小时。将该溶液通过C盐过滤并浓缩至得到粗产物,为黄色固体(208mg,0.63mmol),将其不经纯化用于下面的反应。
向粗胺在无水的吡啶(15ml)中的溶液中加入金刚烷1-羰基氯(1.2eq,0.76mmol,151mg)并将该溶液在室温下搅拌18小时。将该溶液倾入H2O并搅拌15分钟。通过过滤收集产生的固体并风干。通过硅胶急骤色谱法进行纯化,使用DCM/MeOH作为洗脱液而得到产物,为淡黄色固体/粉末(21mg,0.043mmol,2.4%,4步)Mp:394-396℃,分解。1H NMR(500MHz,DMSO-d6)δ13.56(表观d,2H),11.01(s,1H),9.43(s,1H),8.95(s,1H),8.59(m,1H),8.415(m,1H),8.21(m,3H),7.88(m,3H),7.19(dd,J=6Hz,7.2Hz1H),2.04(s,3H),1.95(s,6H),1.72(s,6H),EIMS m/z M+1 493.6.分析值(C29H28N6O2×0.4H2O)
方案43
N-[2-(4-环己基氨基-苯基)-1H-咪唑并[4,5-b]吡啶-5-基]-环己基酰胺
2,3,6-三氨基吡啶(2)。在氢化容器内向4,4’-双(4-羟基偶氮苯)-3,3’-二硝基联苯吡啶(1,12.5g,50mmol)在HCl(25ml,浓)和H2O(100ml)中的溶液中加入 Pt/C(2.5g)并将该混合物在H2(50psi)中振摇35分钟。在减压条件下浓缩该混合物至50ml并使固体在室温下结晶18小时。收集固体并使其从恒定沸点的HCl(21%在H2O中的HCl)中重结晶而得到产物,为淡紫色固体(4g,32.5mmol,65%)。将该固体不经进一步纯化使用。
2-(4-硝基-苯基)-1H-咪唑并[4,5-b]吡啶-5-基胺(3)。将2,3,6-三氨基吡啶(2,2g,1.6mmol)与4-硝基苯甲酸(2.7g,1.6mmol)混组合导入烧瓶。向该固体混合物中加入PPA(40g)并将该混合物在180℃下加热4小时。将该物质倾入冰冷的10%Na2CO3水溶液(1000ml)并通过过滤收集产生的固体。使产生的黑色/红色固体从DMF/H2O结晶并在过滤后用H2O冲洗。在真空中将湿固体干燥至得到产物,为红棕色固体(2.61g,1.02mmol,64%)。1HNMR(500MHz,DMSO-d6):δ13.10(宽峰S,1H),11.12(宽峰s,1H),8.32(m,2H),7.08(dd,J=8.67Hz,636Hz,4H),6.16(宽峰s,1H),EIMS m/z M+1 256.3。
N-[2-(4-环己基氨基-苯基)-1H-咪唑并[4,5-b]吡啶-5-基]-环己基酰胺(7)。向2-(4-硝基-苯基)-1H-咪唑并[4,5-b]吡啶-5-基胺(3)(255mg,1mmol)在吡啶(25ml)中的溶液中加入环己烷羧酸氯化物(1eq,1mmol,135ul)并将该混合物在125℃下加热18小时。将该溶液冷却并倾入H2O(300ml)。通过过滤收集产生的绿色固体并在真空中干燥至得到产物,为绿色固体(248mg)。将该固体不经进一步纯化使用。
向环己烷羧酸[2-(4-硝基-苯基)-1H-咪唑并[4,5-b]吡啶-5-基]-酰胺(0.68mmol,248mg)在甲醇/THF中的溶液中加入阮内镍并将该混合物在80℃下和H2气环境中加热1.5小时。在DCM/甲醇(95/5)中的TLC显示不再有原料和极性更强的荧光斑点。将该混合物通过C盐过滤并浓缩至得到棕色油状物。
将棕色油状物溶于无水的吡啶并加热环己烷羧酸氯化物(100ul,109mg)且将该混合物在室温下搅拌4小时、倾入H2O并通过过滤收集产生的固体。通过急骤色谱法纯化,将DCM/甲醇(95/5)用作洗脱液而得到产物,为淡紫色/棕色固体(54mg,0.12mmol,18%)Mp:332-334℃。1H NMR(500MHz,DMSO-d6):δ12.93(表观d,1H),10.14(m,2H),8.09(m,1H),7.93(m,2H),7.75(m,2H),2.36(m,1H),1.8-1.1(m,14H),EIMS m/z M+1 446.5。分析值(C26H31N5O2+0.1H2O+0.51CH3OH)
方案44
就方案44而言,从第一步反应的5g放大,开始的晶体产量为2.0g纯的2+另外混有约5g KCl的1g 2。
使用100ml水作为溶剂还原10g等级的1而得到2,通过NMR证实其纯净。
尝试在9∶1 TFA∶三氟甲磺酸中进行2-4的单罐硝化和重排以避免操作大量硫酸。硝化成功,但重排没有发生。加入Yb(OTr)3没有帮助。(参见Leslie Deady,《澳大利亚化学杂志》(Australian Journal of Chemistry),1982,vol.35,pp 20525-20534。)
使用1当量的HNO3和极少量的H2SO4(7ml H2SO4/克2)实现2到4的单罐反应。使用该步骤,1.76g 2得到2.30g 4,通过NMR证实其纯度约为85%。通过使用KNO3作为硝化试剂可能改善纯度,从而可以测定精确化学计算量。
还原200-g等级的4(Pd/C,H2HOAc,40℃,2小时)得到纯净的5。
实施例2
IgE反应的抑制
使用如上所述的离体和体内试验检测优选的实施方案的小分子的抑制活性。上述提供的所有化合物都具有抑制IgE反应的活性。在离体试验中,超类A-D中的化合物在1pM-100μM的浓度产生50%抑制作用。在体内试验中,当以分次剂量给药(例如每天2-4次)至少连续2-7天时,这些化合物的有效浓度在小于约0.01mg/mg/天-约100mg/kg/天的范围。因此,将优选实施方案的小分子抑制剂公开为可用于降低抗原诱导的IgE浓度的增加且由此用于治疗IgE-依赖性过程,诸如一般的变态反应且特别是过敏性哮喘。
实施例3
对细胞增殖的作用
进行各种试验以致力于测定苯基-氮杂-苯并咪唑化合物对细胞增殖的作用。这些实验最终测定了引入增殖细胞DNA的3H-胸苷。这些具体步骤随细胞和刺激物的不同而改变。以3百万/ml培养来源于小鼠脾的细胞;以0.1-1百万/ml接种细胞系。通过T细胞消耗分离脾的B细胞并用乙酸肉豆蔻佛波醇(PMA)(10ng/ml)+离子霉素(100nM),或IL-4(10ng/ml)+抗-CD40 Ab(100ng/ml)刺激。在培养前通过将脾细胞首先与抗-Thy1腹水(10%)、抗-CD4 Ab(0.5μg/ml)和抗-CD8 Ab(0.5μg/ml)的混合物一起保温、随后与豚鼠补体(吸附的)一起保温耗尽T细胞。不用或用人表皮生长因子(EGF)(100ng/ml)刺激细胞系。将全部细胞在96-孔平板中培养2-3天并用50μl 3H-胸苷(50μCi/ml)脉冲6-14小时。
在脾细胞中,优选实施方案的某些化合物抑制对PMA/离子霉素和IL-4/抗-CD40Ab的B细胞增殖反应,其功效与其在体外抑制对IL-4/抗-CD40Ab的IgE反应大致相同。对优选实施方案的某些化合物而言,在ConA-刺激的T细胞增殖和LPS-刺激的B细胞增殖(由MDS Pharma预成的)中获得了相似的抑制功效,提示这些药物的作用没有特异性。另一方面,使用优选实施方案的某些化合物进行的一组免疫试验证实除抑制ConA-刺激的细胞因子释放外几乎没有其它作用。
在肿瘤细胞中,使用脾淋巴细胞的结果导致了对细胞增殖进行进一步分析,其通过在有这些药物存在下测定肿瘤细胞生长来进行。使用未用或用IL-4/抗-CD40 Ab刺激的鼠M12.4.1淋巴瘤细胞进行初始分析。优选实施方案的某些化合物抑制M12.4.1细胞增殖,但在刺激的脾细胞中观察到的功效较低。然而,当将细胞与IL-4/抗-CD40 Ab一起培养时,优选实施方案的某些化合物的功效增加。已知这种刺激作用诱导NF-κB在M12.4.1细胞中的活性。
将类似的手段用于建立抗增殖活性的选择性,其通过测试来源于各种组织、大部分来源于人的一组肿瘤品系来进行。尝试从选择的各组织中产生来自至少2种细胞系的增殖数据。用100nM或100nM以下的各化合物仅抑制了少数细胞系,而大部分其余的细胞需要高得多的浓度。由于某些测试细胞系的已知特性和使用所述化合物得到的在前的蛋白质印迹结果,所以有证据提示NF-κB抑制与药物作用之间的相关性。乳腺癌细胞为测试这种现象提供了良好模型,因为它们主要有2种类型:雌激素受体(ER)-阳性和ER-阴性。后一种细胞倾向于较少分化、具有较高的EGF受体表达密度且对治疗更具弹性。ER-阴性/EGFR-阳性细胞的增殖也倾向于被NF-κB驱动且由此测试选择的这些细胞在体外对药物的增殖反应。优选实施方案的化合物在体外可有效抑制所有EGF-反应性细胞系的增殖。相反,药物仅可有效抑制5种ER-阳性细胞系中的2种。
优选实施方案的某些化合物对体外接触各种免疫原性刺激物的T和B淋巴细胞可发挥抗增殖活性。这些作用非常有效且与其IgE-抑制活性相似。尽管对这种作用的机理尚不了解,但是对有关IL-4/抗-CD40 Ab-诱导的IgE产生的机理了解得很多。在这种反应中的主要因子为转录激活物NF-κB。这种因子参与许多肿瘤细胞的增殖且由此测试这些药物在体外对不同肿瘤细胞系增殖的活性。我们的实验揭示出大量肿瘤细胞对优选实施方案的化合物的作用敏感且许多这些敏感品系的增殖可以由NF-κB因子驱动。然而,已知其它细胞系由非NF-κB的因子驱动(例如ER-阳性HCC1500和ZR-75-1)。因此,优选实施方案的某些化合物看起来选择性地对某些肿瘤细胞起作用。还预计本发明的其它化合物表现出相似的特征,特别是那些在结构上与优选实施方案的某些化合物相似的化合物。
治疗方案
可以有效治疗特定变态反应或用作抗增殖药的氮杂-苯并咪唑化合物的用量取决于疾病的性质且可以通过标准临床技术测定。在指定情况中使用的确切剂量也取决于选择的化合物和疾病的严重程度且应根据医师的判断和患者各自的情况来决定。
作为抗变态反应疗法,医师可以基于患者IgE水平与肺和血液动力学改变的标准指数之间的剂量反应相关性确定和调整适宜的剂量。此外,本领域技术人员可以理解可以通过如下方法无需经过多实验而测定剂量范围:通过本文对离体和体内筛选公开的方案(参见,例如,Hasegawa等《药物化学杂志》(J.Med.Chem.)40:395-407(1997)和Ohmori等,《国际免疫药理学杂志》(Int.J.Immunopharmacol.)15:573-579(1993);使用测定萘衍生物的IgE抑制的剂量反应相关性的相似的离体和体内试验;引入本文作为参考)。
为了发挥抗变态反应或抗哮喘作用,化合物的适宜剂量开始一般在约0.001mg-约300mg/kg体重/天,分次剂量,更优选约0.01mg-100mg/kg体重/天,分次剂量。优选将化合物作为适合于诸如口服、气溶胶、静脉内、皮下这类途经的药物制剂或通过可以有效提供活性化合物全身给药的任意其它途经全身给药。药物制剂的组合物是本领域众所周知的。治疗方案优选包括定期给药。此外,在变态反应看起来因连续接触过敏原而引起的情况下,长期疗法可能是需要的。当连续进行2-7天时,每天给药或每天两次给药可有效抑制对动物中单一抗原攻击的IgE反应。因此,在优选的实施方案中,在定期间隔将化合物至少连续给药2天。然而,本领域技术人员可以确定包括给药频率和治疗期限在内的治疗方案且根据需要改进以提供最佳IgE增量调节,这取决于过敏原的性质、剂量、频率和接触过敏原的期限以及标准临床指数。
在优选的实施方案中,可以将抑制IgE的化合物与一种或多种公开的其它小分子抑制剂联合给药以便产生对患者IgE反应的最佳下调。此外,预计可以将优选实施方案的一种或多种化合物与已知的或后来发现可治疗变态反应或哮喘的根本原因和急性症状的其它药物联合给药。本发明范围内预计的这些联合疗法包括将一种或多种小分子IgE-抑制剂与一种或多种已知可有效减轻所述疾病的至少一种症状的其它组分混合。在变化形式中,可以将本文公开的小分子IgE-抑制剂与其它药物在相同的疾病过程中分开给药,其中按照其独立的有效治疗方案给予IgE-抑制剂和治标化合物。
作为抗增殖的疗法,本领域技术人员可以确定本文公开的氮杂-苯并咪唑化合物的适宜剂量。药理学家和肿瘤学家易于不经过多实验而基于用于其它抗增殖和化疗剂的标准治疗技术确定各患者所需的适宜剂量。
抗增殖氮杂-苯并咪唑化合物的适宜剂量一般开始在约0.001mg-约300mg/kg体重/天,分次剂量,更优选约0.01mg-100mg/kg体重/天,分次剂量。为了发挥抗癌作用,最优选剂量在约1mg-100mg/kg体重/天的范围。优选将化合物作为适合于诸如口服、气溶胶、静脉内、皮下这类途经的药物制剂或通过可以有效提供活性化合物全身给药的任意其它途经全身给药。
理想的情况是,应给予一种或多种优选实施方案的氮杂-苯并咪唑化合物以获得活性剂的峰值血浆浓度,正如本领域技术人员所测定的。为了获得足够的血浆浓度,可以通过静脉内注射适宜溶液形式,诸如作为盐水溶液的药物制剂或作为活性组分的大丸剂(bolus)给药。
优选实施方案所用的治疗方案优选包括定期给药。此外,作为与其它化疗剂共同使用的,可能需要长期疗法。对某些患者而言,可能需要每周、每天或每天两次给药,期限为1-3年。因此,在优选的实施方案中,可以在定期间隔将所述化合物给药至少6个月。然而,本领域技术人员可以确定包括给药频率和治疗期限在内的治疗方案且根据需要改进以提供最佳抗增殖作用,这取决于疾病的性质、异常细胞生长的程度、癌症类型、受侵害的组织和标准临床指数。
本领域技术人员可以理解抗增殖化合物在制剂中的理想浓度取决于几个药动学参数,诸如药物的吸收、失活、代谢和清除率以及其它已知因素。本领域技术人员还可以理解浓度随所治疗疾病的严重程度而改变。可能影响治疗剂量的其它因素包括肿瘤的位置、患者年龄和性别、其它疾病、在先接触其它药物等。本领域技术人员会理解对任何特定患者而言,可以按照各患者的需求并根据给予治疗的医师的专业判断评价和调整具体的治疗方案。
在一个优选的实施方案中,口服给予化合物。优选,口服制剂包括惰性稀释剂或可食用载体。可以将口服剂量包囊在明胶中并制成片剂。还可以通过使用颗粒、晶粒或粉末、糖浆剂、混悬液或溶液进行口服给药。本领域技术人员理解可以按照优选实施方案使用许多可接受的口服组合物。例如,可以将活性化合物与标准赋形剂、辅剂、润滑剂、增甜剂、肠溶衣、缓冲剂、稳定剂等组合。
在另一个实施方案中,可以修饰活性化合物以包括在活性位置上靶向或集中化合物的靶向部分。靶向部分包括、但不限于抗体、抗体片段或衍生物、细胞因子和受体配体,其在所治疗细胞上表达。
在优选的实施方案中,将化合物与其它活性剂联合给药,所述的其它活性剂可以补充或有利于氮杂-苯并咪唑化合物的作用或产生其它独立的改善作用。这些其它活性剂包括、但不限于抗真菌药、抗病毒药、抗生素、抗炎药和抗癌药。还可以使用防护剂,包括防止活性苯并咪唑化合物快速代谢、降解或消除的载体或试剂。按照优选的实施方案,还可以使用控释制剂。
在另一个实施方案中,可以将一种或多种抗增殖化合物与一种或多种其它抗癌药或疗法联合给予以产生最佳抗增殖作用。抗癌药包括、但不限于:烷化剂(洛莫司汀(lomustine)、卡莫司汀(carmustine)、链佐星(streptozocin)、氮芥(mechlorethamine)、美法仑(melphalan)、尿嘧啶氮芥(uracil nitrogen mustard)、苯丁酸氮芥环磷酰胺、异环磷酰胺(iphosphamide)、顺铂、卡铂丝裂霉素塞替派达卡巴嗪丙卡巴肼、六甲蜜胺、三亚乙基蜜胺、白消安、派泊溴烷和米托坦);抗代谢药(甲氨蝶呤、三甲曲沙喷司他丁(trimetrexate pentostatin)、阿糖胞苷、ara-CMP、磷酸氟达拉滨(fludarabine phosphate)、羟基脲、氟尿嘧啶、氟尿苷、氯脱氧腺苷、吉西他滨(gemcitabine)、硫鸟嘌呤和6-巯嘌呤)、DNA切割剂(博来霉素);拓扑异构酶I毒物(托泊替康伊立替康(topotecan irinotecan)和喜树碱(camptothecin));拓扑异构酶II毒物(柔红霉素(daunorubicin)、多柔比星(doxorubicin)、伊达比星(idarubicin)、米托蒽醌(mitoxantrone)、替尼泊苷(teniposide)和依托泊苷(etoposide))、DNA结合剂(放线菌素D和普卡霉素(mithramycin));和纺锤体毒物(长春碱、长春新碱、诺维本(navelbine)、紫杉醇和多西他赛(docetaxel))。
此外,预计可以将优选实施方案的一种或多种化合物与诸如放射、免疫疗法、基因疗法和手术的其它疗法联合给予以便治疗过度增殖性疾病,包括癌症。本发明范围内预计的这类联合疗法包括将一种或多种氮杂-苯并咪唑化合物与一种或多种已知有效减轻疾病情况中的至少一种症状的其它组分混合。在变化形式中,可以将本文公开的氮杂-苯并咪唑化合物与其它药物在相同的疾病过程中分别给药,其中按照其独立的有效治疗方案给予氮杂-苯并咪唑化合物和治标化合物(palliative compounds)。
尽管详细描述了许多优选实施方案及其变化形式,但是其它改进和使用方法对本领域技术人员是显然易见的。因此,应理解可以进行等同的各种应用、修改和替换而不会脱离本发明的实质或权利要求的范围。
Claims (67)
1.用于治疗或预防哺乳动物与升高的IgE水平相关的变态反应或抑制其细胞增殖的药物组合物,包括任意一种或多种如下化合物中:
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N:
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR′COR′、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
2.权利要求1的药物组合物,其中超类A-D由下式表示:
A4类;
B1类;
B2类;
B4类;
C1类;
C2类;
D2类;
D3类;和
D4类;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H和卤素组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
3.权利要求1所述的药物组合物,其中所述的多环脂族基选自金刚烷基、二环庚基、樟脑基、二环[2,2,2]辛基和降冰片基组成的组。
4.权利要求1所述的药物组合物,其中所述的杂芳基和所述的取代的杂芳基选自吡啶类、噻唑类、异噻唑类、噁唑类、嘧啶类、哌嗪类、呋喃类、噻吩类、异噁唑类、吡咯类、哒嗪类、1,2,3-三嗪类、1,2,4-三嗪类、1,3,5-三嗪类、吡唑类、咪唑类、吲哚类、喹啉类、异喹啉类、苯并噻吩类、苯并呋喃类、对噻嗪类、吡喃类、色烯类、吡咯烷类、吡唑烷类、咪唑烷类、吗啉类、硫代吗啉类和相应的杂环族化合物组成的组。
5.权利要求1所述的药物组合物,进一步包括至少一种另外的组分,它具有减轻至少一种与所述变态反应、细胞增殖和/或抑制细胞因子或白细胞的活性相关的症状。
6.权利要求1所述的药物组合物,其中R1和R2独立地选自下列基团组成的组:
7.权利要求1所述的药物组合物,包括选自化合物S-1-S-25组成的组的化合物。
8.用于治疗或预防哺乳动物与升高的IgE水平相关的变态反应或抑制其细胞增殖的药物组合物,包括如下化合物中的任意一种或多种:
亚类D2a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
9.权利要求8所述的药物组合物,包括选自化合物S-4、S-5、S-6、S-7、S-8、S-11、S-13、S-15和S-16组成的组的化合物。
10.权利要求9所述的药物组合物,包括化合物S-7。
11.用于治疗或预防哺乳动物与升高的IgE水平相关的变态反应或抑制其细胞增殖的药物组合物,包括如下化合物中的任意一种或多种:
亚类D1a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
12.权利要求11所述的药物组合物,包括选自化合物S-17、S-19、S-20和S-21组成的组的化合物。
13.用于治疗或预防哺乳动物与升高的IgE水平相关的变态反应或抑制其细胞增殖的药物组合物,包括如下化合物中的任意一种或多种:
亚类D4a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
14.权利要求13所述的药物组合物,包括化合物S-24。
15.用于治疗或预防哺乳动物与升高的IgE水平相关的变态反应或抑制细胞增殖的药物组合物,包括如下化合物中的任意一种或多种:
亚类B1a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
16.权利要求15所述的药物组合物,包括化合物S-25。
17.用于治疗或预防哺乳动物与升高的IgE水平相关的变态反应或抑制其细胞增殖的药物组合物,包括如下化合物中的任意一种或多种:
亚类A1a;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
18.权利要求1的至少一种化合物在制备用于治疗患有或易感变态反应的哺乳动物和/或用于抑制哺乳动物的细胞因子或白细胞的药物中的应用。
19.权利要求18所述的应用,进一步包括给予至少一种另外的组分,该组分具有减轻至少一种与所述的变态反应相关的症状的活性。
20.权利要求19所述的应用,其中所述的至少一种另外的组分选自短效β2-肾上腺素能激动剂、长效β2-肾上腺素能激动剂、抗组胺药、磷酸二酯酶抑制剂、抗胆碱能药、皮质类固醇、炎性介体释放抑制剂和白三烯受体拮抗剂组成的组。
21.权利要求19所述的应用,其中将所述的至少一种另外的组分与所述的至少一种化合物在药物上可接受的稀释剂中组合并对哺乳动物共同给药。
22.权利要求18-21中任意一项所述的应用,其中所述的至少一种化合物的给药剂量约为0.01mg-约100mg/kg体重/天。
23.权利要求22所述的应用,其中在定期间隔以分次剂量给予所述的剂量。
24.权利要求23所述的应用,其中所述的定期间隔每天存在。
25.权利要求1的至少一种化合物在制备用于治疗患有或易感哮喘的哺乳动物的药物中的应用。
26.权利要求25所述的应用,进一步包括给予至少一种另外的组分,该组分具有减轻至少一种与所述的哮喘相关的症状的活性。
27.权利要求26所述的应用,其中所述的另外的组分选自短效β2-肾上腺素能激动剂、长效β2-肾上腺素能激动剂、抗组胺药、磷酸二酯酶抑制剂、抗胆碱能药、皮质类固醇、炎性介体释放抑制剂和白三烯受体拮抗剂组成的组。
28.用于抑制哺乳动物细胞增殖的应用,包括给予一定用量的至少一种权利要求1的化合物。
29.权利要求28所述的应用,进一步包括给予至少一种另外的组分,该组分具有减轻至少一种与所述的细胞增殖相关的症状的活性。
30.权利要求29所述的应用,其中所述的至少一种另外的组分选自抗真菌药、抗病毒药、抗生素、抗炎药和抗癌药组成的组。
31.权利要求29所述的应用,其中所述的至少一种另外的组分选自烷化剂、抗代谢药、DNA切割剂、拓扑异构酶I毒物、拓扑异构酶II毒物、DNA结合剂和纺锤体毒物组成的组。
32.权利要求29-31中任意一项所述的应用,其中将所述的至少一种另外的组分与权利要求1所述的至少一种化合物在药物上可接受的稀释剂中组合并对哺乳动物共同给药。
33.权利要求28-32中任意一项所述的应用,其中权所述的利要求1至少一种化合物的给药剂量约为0.01mg-约100mg/kg体重/天。
34.权利要求33所述的应用,其中在定期间隔以分次剂量给予所述的剂量。
35.权利要求34所述的应用,其中所述的定期间隔每天存在。
36.权利要求28所述的应用,进一步包括给予至少一种另外的疗法,该疗法可有效改善至少一种与细胞过度增殖相关的症状。
37.权利要求34所述的应用,其中所述的疗法为抗癌疗法。
38.权利要求36所述的应用,其中所述的疗法选自放射、免疫疗法、基因疗法和手术组成的组。
39.用于治疗或预防哺乳动物变态反应和/或抑制其细胞因子或白细胞的方法,包括给予有效量的如下化合物中的任意一种或多种的步骤:
超类A;
超类B;
超类C;和
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
40.权利要求39所述的方法,进一步包括给予至少一种另外的组分,该组分具有减轻至少一种与所述的变态反应相关的症状的活性。
41.权利要求40所述的方法,其中所述的至少一种另外的组分选自短效β2-肾上腺素能激动剂、长效β2-肾上腺素能激动剂、抗组胺药、磷酸二酯酶抑制剂、抗胆碱能药、皮质类固醇、炎性介体释放抑制剂和白三烯受体拮抗剂组成的组。
42.权利要求41所述的方法,其中将所述的至少一种另外的组分与所述的化合物在药物上可接受的稀释剂中组合并对哺乳动物共同给药。
43.权利要求39所述的方法,其中所述的化合物的给药剂量约为0.01mg-约100mg/kg体重/天。
44.权利要求43所述的方法,其中在定期间隔以分次剂量给予所述的剂量。
45.权利要求44所述的应用,其中所述的定期间隔每天存在。
46.用于治疗或预防哺乳动物哮喘的方法,包括给予IgE-抑制用量的任意一种或多种如下化合物:
超类A;
超类B;
超类D;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
47.权利要求46所述的方法,进一步包括给予至少一种另外的组分,该组分具有减轻至少一种与所述的哮喘相关的症状的活性。
48.权利要求47所述的方法,其中所述的至少一种另外的组分选自短效β2-肾上腺素能激动剂、长效β2-肾上腺素能激动剂、抗组胺药、磷酸二酯酶抑制剂、抗胆碱能药、皮质类固醇、炎性介体释放抑制剂和白三烯受体拮抗剂组成的组。
49.用于抑制哺乳动物细胞增殖的方法,包括给予一定量的如下化合物中的任意一种或多种的步骤:
超类A;
超类B;
超类C;和
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组。
50.权利要求49所述的方法,进一步包括给予至少一种另外的组分,该组分具有减轻至少一种与所述的细胞增殖相关的症状的活性。
51.权利要求50所述的方法,其中所述的至少一种另外的组分选自抗真菌药、抗病毒药、抗生素、抗炎药和抗癌药组成的组。
52.权利要求50所述的方法,其中将所述的至少一种另外的组分选自烷化剂、抗代谢药、DNA切割剂、拓扑异构酶I毒物、拓扑异构酶II毒物、DNA结合剂和纺锤体毒物组成的组。
53.权利要求50所述的方法,其中将所述的至少一种另外的组分与所述的化合物在药物上可接受的稀释剂中组合并对哺乳动物共同给药。
54.权利要求49所述的方法,其中所述的化合物的给药剂量约为0.01mg-约100mg/kg体重/天。
55.权利要求54所述的方法,其中在定期间隔以分次剂量给予所述的剂量。
56.权利要求49所述的方法,其中所述的定期间隔每天存在。
57.权利要求49所述的方法,进一步包括给予至少一种另外的疗法,该疗法可有效改善至少一种与细胞过度增殖相关的症状。
58.权利要求57所述的方法,其中所述的疗法为抗癌疗法。
59.权利要求57所述的方法,其中所述的疗法选自放射、免疫疗法、基因疗法和手术组成的组。
60.制备具有如下通式的化合物或其盐的方法:
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
的化合物;
使具有通式:
化合物与硫化二铵反应而生成具有通式:
的化合物;
使具有通式:
使用酸环化具有通式:
的化合物;
还原具有通式:
的化合物而生成具有通式:
的化合物;和
使具有通式:
61.制备具有如下通式的化合物或其盐的方法:
超类A;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中A选自H、卤素和CONHR1组成的组;
其中n为1-4的数字;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
的化合物;
使具有通式:
化合物与硫化二铵反应而生成具有通式:
使具有通式:
化合物与具有通式:
的化合物反应而生成具有通式:
还原具有通式:
的化合物而生成具有通式:
使具有通式:
的化合物与酰基氯反应而生成超类A的化合物。
62.制备具有如下通式的化合物或其盐的方法:
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
化合物与氢氧化铵反应而生成具有通式:
的化合物;
使具有通式:
使具有通式:
化合物与具有通式:
的化合物反应而生成具有通式:
使具有通式:
63.制备具有如下通式的化合物或其盐的方法:
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
化合物与氢氧化铵反应而生成具有通式:
的化合物;
使具有通式:
使具有通式:
化合物与具有通式:
的化合物反应而生成超类B的化合物。
64.制备具有如下通式的化合物或其盐的方法:
超类C;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
使具有通式:
的化合物;
使具有通式:
的化合物反应而生成具有通式:
使用酸将具有通式:
的化合物环化成具有通式:
还原具有通式:
的化合物而生成具有通式:
使具有通式:
的化合物与酰基氯反应而生成超类C的化合物。
65.制备具有如下通式的化合物或其盐的方法:
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
使具有通式:
化合物与硫化二铵反应而生成具有通式:
使具有通式:
还原具有通式:
的化合物而生成具有通式:
使具有通式:
66.制备具有如下通式的化合物或其盐的方法:
超类D;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
的化合物;
使具有通式:
化合物与硫化二铵反应而生成具有通式:
的化合物;
使具有通式:
使用酸将具有通式:
的化合物环化成具有通式:
还原具有通式:
的化合物而生成具有通式:
的化合物;和
使具有通式:
的化合物与酰基氯反应而生成超类D的化合物。
67.制备具有如下通式的化合物或其盐的方法:
超类D;
其中Q、T、X和Z独立地选自N或C且其中Q、T、X和Z之一为N;
其中L和M独立地选自H、烷基、烷氧基、芳基、取代的芳基、羟基、卤素、氨基、烷基氨基、硝基、氰基、CF3、OCF3、CONH2、CONHR和NHCOR1组成的组;
其中R选自H、C1-C5烷基、苄基、对-氟苄基和二-烷基氨基烷基组成的组,其中所述的C1-C5烷基选自直链、支链或环状烷基组成的组;
其中R1和R2独立地选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族基、取代的多环脂族基、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的取代的多环脂族基、取代的苯基、取代的萘基和取代的杂芳基含有1-3个取代基,其中所述的取代基选自H、卤素、多卤素、烷氧基、取代的烷氧基、烷基、取代的烷基、二烷基氨基烷基、羟基烷基、羰基、OH、OCH3、COOH、COOR’COR’、CN、CF3、OCF3、NO2、NR′R′、NHCOR′和CONR′R′组成的组;且
其中R′选自H、烷基、取代的烷基、C3-C9环烷基、取代的C3-C9环烷基、多环脂族化合物、苯基、取代的苯基、萘基、取代的萘基、杂芳基和取代的杂芳基组成的组,其中所述的杂芳基和所述的取代的杂芳基含有1-3个杂原子,其中所述的杂原子独立地选自氮、氧和硫组成的组;
其中所述的方法包括下列步骤:
使具有通式:
的化合物;
使具有通式:
化合物与硫化二铵反应而生成具有通式:
使具有通式:
的化合物反应而生成具有通式:
的化合物;
还原具有通式:
的化合物而生成具有通式:
的化合物;和
使具有通式:
的化合物与酰基氯反应而生成超类D的化合物。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US41076102P | 2002-09-12 | 2002-09-12 | |
| US60/410,761 | 2002-09-12 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN1694889A true CN1694889A (zh) | 2005-11-09 |
Family
ID=31994198
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CNA038250934A Pending CN1694889A (zh) | 2002-09-12 | 2003-09-12 | 用于调节lgE和抑制细胞增殖的苯基-氮杂-苯并咪唑化合物 |
Country Status (17)
| Country | Link |
|---|---|
| US (1) | US7256287B2 (zh) |
| EP (1) | EP1546157A4 (zh) |
| JP (1) | JP2006503048A (zh) |
| KR (1) | KR20050050102A (zh) |
| CN (1) | CN1694889A (zh) |
| AR (1) | AR041252A1 (zh) |
| AU (1) | AU2003279729A1 (zh) |
| BR (1) | BR0314235A (zh) |
| CA (1) | CA2498495A1 (zh) |
| MX (1) | MXJL05000010A (zh) |
| NZ (1) | NZ538547A (zh) |
| PE (1) | PE20050036A1 (zh) |
| PL (1) | PL375811A1 (zh) |
| RU (1) | RU2005109911A (zh) |
| TW (1) | TWI276631B (zh) |
| WO (1) | WO2004024897A2 (zh) |
| ZA (1) | ZA200502738B (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103819398A (zh) * | 2014-01-24 | 2014-05-28 | 河北科技大学 | 4-氨基-2-氯-3-硝基吡啶的合成方法 |
Families Citing this family (40)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US6911462B2 (en) * | 1998-05-22 | 2005-06-28 | Avanir Pharmaceuticals | Benzimidazole compounds for regulating IgE |
| US6919366B2 (en) * | 1998-05-22 | 2005-07-19 | Avanir Pharmaceuticals | Benzimidazole derivatives as modulators of IgE |
| NZ528835A (en) * | 2001-03-12 | 2005-05-27 | Avanir Pharmaceuticals | Benzimidazole compounds for modulating IgE and inhibiting cellular proliferation |
| TW200304820A (en) * | 2002-03-25 | 2003-10-16 | Avanir Pharmaceuticals | Use of benzimidazole analogs in the treatment of cell proliferation |
| AU2003270426A1 (en) | 2002-09-12 | 2004-04-30 | Avanir Pharmaceuticals | PHENYL-INDOLE COMPOUNDS FOR MODULATING IgE AND INHIBITING CELLULAR PROLIFERATION |
| WO2005013950A2 (en) * | 2003-08-08 | 2005-02-17 | Avanir Pharmaceuticals | Selective pharmacologic inhibition of protein trafficking and related methods of treating human diseases |
| EP1694671A2 (en) | 2003-12-04 | 2006-08-30 | Vertex Pharmaceuticals Incorporated | Quinoxalines useful as inhibitors of protein kinases |
| ES2300054T3 (es) * | 2004-10-13 | 2008-06-01 | Merck Patent Gmbh | Derivados de la n,n'- difenilurea adecuados como inhibidores de cinasas. |
| EP1833829A2 (en) * | 2004-12-23 | 2007-09-19 | F. Hoffmann-Roche AG | Benzamide substituted imidazo- and pyrrolo-pyridines as protein kinase inhibitors |
| JP2008521768A (ja) * | 2004-12-23 | 2008-06-26 | エフ.ホフマン−ラ ロシュ アーゲー | ヘテロ環式カルバミン酸誘導体、それらの製造及び医薬品としての使用 |
| KR20060087386A (ko) | 2005-01-28 | 2006-08-02 | 주식회사 대웅제약 | 신규 벤조이미다졸 유도체 및 이를 함유하는 약제학적조성물 |
| WO2007014707A1 (en) | 2005-08-01 | 2007-02-08 | F. Hoffmann-La Roche Ag | Heterocyclic benzylamino derivatives, their manufacture and use as pharmaceutical agents |
| CA2662031A1 (en) | 2006-09-06 | 2008-03-13 | F. Hoffmann-La Roche Ag | Heteroaryl derivatives as protein kinase inhibitors |
| CL2009000447A1 (es) | 2008-02-29 | 2010-01-04 | Array Biopharma Inc Y Genentech Inc | Compuestos derivados de (1h-pirrolo{2,3-b}piridin-5-il)-sulfonamido-benzamida sustituida; procedimiento de preparacion; composicion farmaceutica; y su uso en el tratamiento del cancer, a travez de la inhibicion de raf. |
| CN105073744B (zh) | 2012-12-21 | 2019-11-08 | 齐尼思表观遗传学有限公司 | 作为溴结构域抑制剂的新型杂环化合物 |
| GB201302927D0 (en) | 2013-02-20 | 2013-04-03 | Cancer Therapeutics Crc Pty Ltd | Compounds |
| WO2014151630A2 (en) | 2013-03-15 | 2014-09-25 | Irm Llc | Compounds and compositions for the treatment of parasitic diseases |
| US9186361B2 (en) | 2013-03-15 | 2015-11-17 | Novartis Ag | Compounds and compositions for the treatment of parasitic diseases |
| US9296754B2 (en) | 2013-03-15 | 2016-03-29 | Novartis Ag | Compounds and compositions for the treatment of parasitic diseases |
| CN105473581B (zh) | 2013-06-21 | 2019-04-23 | 齐尼思表观遗传学有限公司 | 作为溴结构域抑制剂的新取代的双环化合物 |
| BR112015031073B1 (pt) | 2013-06-21 | 2022-11-29 | Zenith Epigenetics Ltd | Compostos inibidores bicíclicos de bromodomínio e composição farmacêutica contendo os referidos compostos |
| WO2015015318A2 (en) | 2013-07-31 | 2015-02-05 | Zenith Epigenetics Corp. | Novel quinazolinones as bromodomain inhibitors |
| CA2932870C (en) | 2013-12-19 | 2021-11-09 | Novartis Ag | [1,2,4]triazolo[1,5-a]pyrimidine derivatives as protozoan proteasome inhibitors for the treatment of parasitic diseases such as leishmaniasis |
| GB201415573D0 (en) | 2014-09-03 | 2014-10-15 | Cancer Therapeutics Crc Pty Ltd | Compounds |
| EP3189041B1 (en) | 2014-09-03 | 2021-04-28 | Ctxt Pty Ltd | Tetrahydroisoquinoline derived prmt5-inhibitors |
| WO2016034671A1 (en) | 2014-09-03 | 2016-03-10 | Ctxt Pty Ltd | Aminoindane-, aminotetrahydronaphthalene- and aminobenzocyclobutane-derived prmt5-inhibitors |
| EP3227281A4 (en) | 2014-12-01 | 2018-05-30 | Zenith Epigenetics Ltd. | Substituted pyridinones as bromodomain inhibitors |
| CA2966303A1 (en) | 2014-12-01 | 2016-06-09 | Zenith Epigenetics Ltd. | Substituted pyridines as bromodomain inhibitors |
| EP3230277B1 (en) | 2014-12-11 | 2019-09-18 | Zenith Epigenetics Ltd. | Substituted heterocycles as bromodomain inhibitors |
| WO2016097863A1 (en) | 2014-12-17 | 2016-06-23 | Zenith Epigenetics Corp. | Inhibitors of bromodomains |
| CA3007168A1 (en) * | 2015-12-14 | 2017-06-22 | Zenith Epigenetics Ltd. | 1h-imidazo[4,5-b]pyridinyl and 2-oxo-2,3-dihydro-1h-imidazo[4,5-b]pyridinyl heterocyclic bet bromodomain inhibitors |
| GB201604030D0 (en) | 2016-03-09 | 2016-04-20 | Ctxt Pty Ltd | Compounds |
| GB201604027D0 (en) | 2016-03-09 | 2016-04-20 | Ctxt Pty Ltd | Compounds |
| GB201604031D0 (en) | 2016-03-09 | 2016-04-20 | Ctxt Pty Ltd | Compounds |
| GB201604022D0 (en) | 2016-03-09 | 2016-04-20 | Ctxt Pty Ltd | Compounds |
| GB201604020D0 (en) | 2016-03-09 | 2016-04-20 | Ctxt Pty Ltd | Compounds |
| GB201604029D0 (en) | 2016-03-09 | 2016-04-20 | Ctxt Pty Ltd | Compounds |
| US11548867B2 (en) | 2017-07-19 | 2023-01-10 | Idea Ya Biosciences, Inc. | Amido compounds as AhR modulators |
| AU2021358123A1 (en) | 2020-10-05 | 2023-06-08 | Enliven Inc. | 5- and 6-azaindole compounds for inhibition of bcr-abl tyrosine kinases |
| US20220127231A1 (en) * | 2020-10-27 | 2022-04-28 | Shilpa Medicare Ltd | Process for the prepartion of amifampridine phosphate |
Family Cites Families (64)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3985891A (en) * | 1973-02-03 | 1976-10-12 | Boehringer Ingelheim Gmbh | 2-Phenyl-imidazo (4,5-b)pyridines and salts thereof |
| DE3224512A1 (de) | 1982-07-01 | 1984-01-05 | Dr. Karl Thomae Gmbh, 7950 Biberach | Neue imidazolderivate, ihre herstellung und diese verbindungen enthaltende arzneimittel |
| US4510158A (en) * | 1984-03-05 | 1985-04-09 | Sterling Drug Inc. | 2-Phenylindole derivatives, their use as complement inhibitors |
| EP0221146B1 (en) | 1985-05-03 | 1991-07-31 | The Foxboro Company | Distillation cut point control |
| US4939133A (en) | 1985-10-01 | 1990-07-03 | Warner-Lambert Company | N-substituted-2-hydroxy-α-oxo-benzeneacetamides and pharmaceutical compositions having activity as modulators of the arachidonic acid cascade |
| LU86258A1 (fr) | 1986-01-21 | 1987-09-03 | Rech Dermatologiques C I R D S | Composes benzamido aromatique,leur procede de preparation et leur utilisation en medecine humaine ou veterinaire et en cosmetique |
| US5206257A (en) * | 1987-03-05 | 1993-04-27 | May & Baker Limited | Pesticidal method using 2-phenylimidazole derivatives |
| JP2630432B2 (ja) * | 1987-08-24 | 1997-07-16 | コニカ株式会社 | 新規なシアンカプラーを含有するハロゲン化銀カラー写真感光材料 |
| JPH03500050A (ja) | 1988-02-02 | 1991-01-10 | シェリング・バイオテック・コーポレーション | 免疫グロブリンeの応答を減少させる方法 |
| JP2700475B2 (ja) | 1988-07-30 | 1998-01-21 | コニカ株式会社 | 非線形光学材料および非線形光学素子 |
| IT1232252B (it) | 1989-02-22 | 1992-01-28 | Rotta Research Lab | Derivati della n fenil benzamide ad attivita' antiulcera ed antiallerica e procedimento per la loro preparazione |
| FR2643903A1 (fr) | 1989-03-03 | 1990-09-07 | Union Pharma Scient Appl | Nouveaux derives de benzimidazole, leurs procedes de preparation, intermediaires de synthese, compositions pharmaceutiques les contenant, utiles notamment pour le traitement des maladies cardiovasculaires, et des ulceres duodenaux |
| EP0415886A3 (en) | 1989-08-30 | 1991-10-23 | Ciba-Geigy Ag | Aza compounds |
| FR2658511B1 (fr) * | 1990-02-16 | 1992-06-19 | Union Pharma Scient Appl | Nouveaux derives de benzimidazole et d'azabenzimidazole, antagonistes des recepteurs au thromboxane; leurs procedes de preparation, compositions pharmaceutiques les contenant. |
| AU8225991A (en) | 1990-07-31 | 1992-03-02 | Teikoku Hormone Mfg. Co., Ltd. | 2-phenylindole derivative |
| EP0469477B1 (en) | 1990-08-02 | 1995-09-20 | F. Hoffmann-La Roche Ag | Antiallergic combination |
| US5656762A (en) * | 1990-12-28 | 1997-08-12 | Neurogen Corporation | 4-piperidino-and piperazinomethyl-2-phenylimidazole derivatives, dopamine receptor subtype specific ligands |
| JPH06263993A (ja) | 1991-01-21 | 1994-09-20 | Konica Corp | アゾメチン系染料、インドアニリン系染料及びインドフェノール系染料の製造法 |
| IE71647B1 (en) | 1991-01-28 | 1997-02-26 | Rhone Poulenc Rorer Ltd | Benzamide derivatives |
| EP0607373B1 (en) | 1992-06-15 | 1997-03-19 | Celltech Therapeutics Limited | Trisubstituted phenyl derivatives as selective phosphodiesterase iv inhibitors |
| US5733740A (en) * | 1992-10-13 | 1998-03-31 | Vanderbilt University | Taga gene and methods for detecting predisposition to peptic ulceration and gastric carcinoma |
| US5322847A (en) * | 1992-11-05 | 1994-06-21 | Pfizer Inc. | Azabenzimidazoles in the treatment of asthma, arthritis and related diseases |
| NZ270985A (en) | 1994-04-29 | 1997-06-24 | Lilly Co Eli | Substituted benzimidazole derivatives; medicaments and preparation of medicaments |
| US5643893A (en) * | 1994-06-22 | 1997-07-01 | Macronex, Inc. | N-substituted-(Dihydroxyboryl)alkyl purine, indole and pyrimidine derivatives, useful as inhibitors of inflammatory cytokines |
| DE4426625A1 (de) * | 1994-07-27 | 1996-03-14 | Schering Ag | 2-Phenylindole, Verfahren zu deren Herstellung, diese enthaltende pharmazeutische Präparate sowie deren Verwendung zur Herstellung von Arzneimitteln |
| US5496826A (en) | 1994-09-02 | 1996-03-05 | Bristol-Myers Squibb Company | Pharmaceutical methods of using heterocyclic derivatives of N-phenylamides |
| US5821258A (en) | 1994-12-27 | 1998-10-13 | Mitsui Chemicals, Inc. | Phenylbenzimidazole derivatives |
| DE19503160A1 (de) * | 1995-02-01 | 1996-08-08 | Bayer Ag | Verwendung von Phenylcyclohexylcarbonsäureamiden |
| BR9610051A (pt) * | 1995-08-02 | 1999-12-21 | Univ Newcastle Ventures Ltd | Uso de um composto, processo de preparação do mesmo, formulação ou composição farmacêutica contendo um composto, composição farmacêutica, e, processo de tratamento terapeutico |
| US6387938B1 (en) * | 1996-07-05 | 2002-05-14 | Mochida Pharmaceutical Co., Ltd. | Benzimidazole derivatives |
| TW467902B (en) * | 1996-07-31 | 2001-12-11 | Bristol Myers Squibb Co | Diphenyl heterocycles as potassium channel modulators |
| EP0973513A4 (en) | 1996-10-23 | 2003-03-19 | Zymogenetics Inc | COMPOSITIONS AND METHODS FOR TREATING CONDITIONS ASSOCIATED WITH BONE DEFICIT |
| US6153631A (en) | 1996-10-23 | 2000-11-28 | Zymogenetics, Inc. | Compositions and methods for treating bone deficit conditions |
| CA2232467A1 (en) * | 1997-03-20 | 1998-09-20 | Richard A. Glennon | Imidazoles with serotonin receptor binding activity |
| US6034256A (en) | 1997-04-21 | 2000-03-07 | G.D. Searle & Co. | Substituted benzopyran derivatives for the treatment of inflammation |
| SK171499A3 (en) | 1997-06-10 | 2000-08-14 | Glaxo Group Ltd | Benzimidazole derivatives, process for their production pharmaceutical composition containing said derivatives and use of said derivatives |
| GB9718833D0 (en) | 1997-09-04 | 1997-11-12 | Merck Sharp & Dohme | Therapeutic agents |
| DK1017384T3 (da) * | 1997-09-26 | 2005-01-31 | Zentaris Gmbh | Azabenzimidazolbaserede forbindelser til modulation af serin/threoninproteinkinasefunktion |
| US6100282A (en) * | 1998-01-02 | 2000-08-08 | Hoffman-La Roche Inc. | Thiazole derivatives |
| US6369091B1 (en) * | 1998-05-22 | 2002-04-09 | Avanir Pharmaceuticals | Benzimidazole analogs as down-regulators of IgE |
| UA67774C2 (uk) | 1998-05-22 | 2004-07-15 | Аванір Фармасьютикелз | ФАРМАЦЕВТИЧНА КОМПОЗИЦІЯ ДЛЯ ЛІКУВАННЯ АБО ЗАПОБІГАННЯ АЛЕРГІЧНІЙ РЕАКЦІЇ, ПОВ'ЯЗАНІЙ З ПІДВИЩЕНИМИ РІВНЯМИ IgЕ У ССАВЦЯ |
| US6911462B2 (en) * | 1998-05-22 | 2005-06-28 | Avanir Pharmaceuticals | Benzimidazole compounds for regulating IgE |
| US6919366B2 (en) * | 1998-05-22 | 2005-07-19 | Avanir Pharmaceuticals | Benzimidazole derivatives as modulators of IgE |
| US6303645B1 (en) * | 1998-05-22 | 2001-10-16 | Avanir Pharmaceuticals | Benzimidazole derivatives as modulators of IgE |
| JP2000095767A (ja) | 1998-09-28 | 2000-04-04 | Takeda Chem Ind Ltd | 性腺刺激ホルモン放出ホルモン拮抗剤 |
| KR20010100977A (ko) | 1998-11-03 | 2001-11-14 | 스타르크, 카르크 | 치환된 2-페닐벤즈이미다졸, 그의 제조 및 그의 용도 |
| KR20010080474A (ko) | 1998-11-17 | 2001-08-22 | 스타르크, 카르크 | 2-페닐벤즈이미다졸 및 2-페닐인돌, 이들의 제법 및 용도 |
| HUP0200749A3 (en) | 1998-11-27 | 2003-03-28 | Basf Ag | Substituted benzimidazoles and their use as parp inhibitors and process for their preparation |
| DE19918211A1 (de) | 1999-04-22 | 2000-10-26 | Basf Ag | Cycloalkylsubstituierte Benzimidazole, deren Herstellung und Anwendung |
| DE19920936A1 (de) | 1999-05-07 | 2000-11-09 | Basf Ag | Heterozyklisch substituierte Benzimidazole, deren Herstellung und Anwendung |
| US6423734B1 (en) | 1999-08-13 | 2002-07-23 | The Procter & Gamble Company | Method of preventing cancer |
| DE19939463A1 (de) | 1999-08-20 | 2001-02-22 | Boehringer Ingelheim Pharma | Aminocarbonyl-substituierte Benzimidazolderivate, Verfahren zu ihrer Herstellung und ihre Verwendung als Arzneimittel |
| US6759425B2 (en) * | 1999-10-21 | 2004-07-06 | Avanir Pharmaceuticals | Benzimidazole compounds for modulating IgE and inhibiting cellular proliferation |
| US6242461B1 (en) | 2000-01-25 | 2001-06-05 | Pfizer Inc. | Use of aryl substituted azabenzimidazoles in the treatment of HIV and AIDS related diseases |
| GB0007405D0 (en) | 2000-03-27 | 2000-05-17 | Smithkline Beecham Corp | Compounds |
| US6537994B2 (en) * | 2000-07-17 | 2003-03-25 | Wyeth | Heterocyclic β3 adrenergic receptor agonists |
| NZ528835A (en) * | 2001-03-12 | 2005-05-27 | Avanir Pharmaceuticals | Benzimidazole compounds for modulating IgE and inhibiting cellular proliferation |
| EE05247B1 (et) | 2001-03-12 | 2009-12-15 | Janssen Pharmaceutica N.V. | Meetod imidasoolhendite valmistamiseks |
| US6777442B2 (en) | 2001-03-12 | 2004-08-17 | Bayer Aktiengesellschaft | Diphenyl derivatives |
| EP1482928B1 (en) * | 2001-07-27 | 2009-09-23 | Curis, Inc. | Mediators of hedgehog signaling pathways,compositions and uses related thereto |
| TW200304820A (en) * | 2002-03-25 | 2003-10-16 | Avanir Pharmaceuticals | Use of benzimidazole analogs in the treatment of cell proliferation |
| AU2003270426A1 (en) * | 2002-09-12 | 2004-04-30 | Avanir Pharmaceuticals | PHENYL-INDOLE COMPOUNDS FOR MODULATING IgE AND INHIBITING CELLULAR PROLIFERATION |
| MXJL05000041A (es) * | 2003-04-10 | 2005-12-22 | Avanir Pharmaceuticals | Compuestos de imidazol para el tratamiento de padecimientos alergicos e hiperproliferativos. |
| WO2005013950A2 (en) * | 2003-08-08 | 2005-02-17 | Avanir Pharmaceuticals | Selective pharmacologic inhibition of protein trafficking and related methods of treating human diseases |
-
2003
- 2003-09-10 TW TW092124975A patent/TWI276631B/zh not_active IP Right Cessation
- 2003-09-12 CA CA002498495A patent/CA2498495A1/en not_active Abandoned
- 2003-09-12 MX MXJL05000010A patent/MXJL05000010A/es not_active Application Discontinuation
- 2003-09-12 KR KR1020057004331A patent/KR20050050102A/ko not_active Application Discontinuation
- 2003-09-12 CN CNA038250934A patent/CN1694889A/zh active Pending
- 2003-09-12 US US10/661,296 patent/US7256287B2/en not_active Expired - Fee Related
- 2003-09-12 AR ARP030103321A patent/AR041252A1/es not_active Application Discontinuation
- 2003-09-12 RU RU2005109911/04A patent/RU2005109911A/ru not_active Application Discontinuation
- 2003-09-12 BR BR0314235-3A patent/BR0314235A/pt not_active IP Right Cessation
- 2003-09-12 AU AU2003279729A patent/AU2003279729A1/en not_active Abandoned
- 2003-09-12 PE PE2003000933A patent/PE20050036A1/es not_active Application Discontinuation
- 2003-09-12 PL PL03375811A patent/PL375811A1/xx not_active Application Discontinuation
- 2003-09-12 NZ NZ538547A patent/NZ538547A/en unknown
- 2003-09-12 JP JP2004536644A patent/JP2006503048A/ja not_active Withdrawn
- 2003-09-12 EP EP03773067A patent/EP1546157A4/en not_active Withdrawn
- 2003-09-12 WO PCT/US2003/030962 patent/WO2004024897A2/en active Application Filing
-
2005
- 2005-04-05 ZA ZA200502738A patent/ZA200502738B/en unknown
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103819398A (zh) * | 2014-01-24 | 2014-05-28 | 河北科技大学 | 4-氨基-2-氯-3-硝基吡啶的合成方法 |
| CN103819398B (zh) * | 2014-01-24 | 2016-05-04 | 河北科技大学 | 4-氨基-2-氯-3-硝基吡啶的合成方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| US20040116466A1 (en) | 2004-06-17 |
| US7256287B2 (en) | 2007-08-14 |
| ZA200502738B (en) | 2007-04-25 |
| AU2003279729A1 (en) | 2004-04-30 |
| MXJL05000010A (es) | 2005-06-07 |
| PL375811A1 (en) | 2005-12-12 |
| BR0314235A (pt) | 2005-08-09 |
| WO2004024897A2 (en) | 2004-03-25 |
| EP1546157A4 (en) | 2007-02-28 |
| KR20050050102A (ko) | 2005-05-27 |
| TWI276631B (en) | 2007-03-21 |
| CA2498495A1 (en) | 2004-03-25 |
| AR041252A1 (es) | 2005-05-11 |
| RU2005109911A (ru) | 2006-04-27 |
| TW200404784A (en) | 2004-04-01 |
| JP2006503048A (ja) | 2006-01-26 |
| NZ538547A (en) | 2007-05-31 |
| PE20050036A1 (es) | 2005-01-24 |
| WO2004024897A3 (en) | 2004-08-26 |
| EP1546157A2 (en) | 2005-06-29 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN1694889A (zh) | 用于调节lgE和抑制细胞增殖的苯基-氮杂-苯并咪唑化合物 | |
| CN1282640C (zh) | N-芳基苯乙酰胺衍生物及包含所述化合物的药物组合物 | |
| CN1296346C (zh) | 酰化的6,7,8,9-四氢-5h-苯并环庚烯基胺和它们作为药物的用途 | |
| CN1078889C (zh) | 非肽类速激肽受体拮抗剂 | |
| CN1303066C (zh) | 2-氧代-1-吡咯烷衍生物、其制备方法和用途 | |
| CN100338061C (zh) | 炔-芳基磷酸二酯酶-4抑制剂 | |
| CN1149204C (zh) | 1-杂环取代的二芳基胺 | |
| CN1247567C (zh) | 2-氨基-3-烷基嘧啶酮衍生物作为GSK3β抑制剂 | |
| CN1694868A (zh) | 用于调节IgE和抑制细胞增殖的苯基-吲哚化合物 | |
| CN1741999A (zh) | 用作GSK-3β抑制剂的哒嗪酮衍生物 | |
| CN1161341C (zh) | cGMP磷酸二酯酶的稠合吡啶并哒嗪抑制剂 | |
| CN1582277A (zh) | 用作糖原合酶激酶3β抑制剂的酰胺衍生物 | |
| CN1309720C (zh) | 哌嗪化合物 | |
| CN1684964A (zh) | 一些新的咪唑并吡啶及其用途 | |
| CN1934091A (zh) | 治疗神经变性障碍的咪唑化合物 | |
| CN1930126A (zh) | 吡啶酮衍生物 | |
| CN1290165A (zh) | 苯并噻唑蛋白酪氨酸激酶抑制剂 | |
| CN1582285A (zh) | 用作糖原合酶激酶3β抑制剂(GSK3抑制剂)的杂芳胺化合物 | |
| CN1050539A (zh) | 联苯甲烷衍生物及其药用 | |
| CN1688583A (zh) | 用作治疗醛固酮介导的病症的药物的有机化合物 | |
| CN1711266A (zh) | 具有抗增殖活性的嘧啶并化合物(ⅱ) | |
| CN1703405A (zh) | 用作糖原合酶激酶3β抑制剂的氨基苯甲酰胺衍生物 | |
| CN1496257A (zh) | 调控免疫球蛋白e及抑制细胞增殖的苯并咪唑化合物 | |
| CN1871244A (zh) | 作为腺苷受体配体的噻唑并吡啶衍生物 | |
| CN1142226A (zh) | 新的杂环化合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| AD01 | Patent right deemed abandoned | ||
| C20 | Patent right or utility model deemed to be abandoned or is abandoned |