CN116138287A - 一种复配酶制剂及其制备方法 - Google Patents
一种复配酶制剂及其制备方法 Download PDFInfo
- Publication number
- CN116138287A CN116138287A CN202310051459.3A CN202310051459A CN116138287A CN 116138287 A CN116138287 A CN 116138287A CN 202310051459 A CN202310051459 A CN 202310051459A CN 116138287 A CN116138287 A CN 116138287A
- Authority
- CN
- China
- Prior art keywords
- catalase
- solution
- enzyme preparation
- amylase
- parts
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 238000002360 preparation method Methods 0.000 title claims abstract description 111
- 102000004190 Enzymes Human genes 0.000 title claims abstract description 59
- 108090000790 Enzymes Proteins 0.000 title claims abstract description 59
- 102000016938 Catalase Human genes 0.000 claims abstract description 115
- 108010053835 Catalase Proteins 0.000 claims abstract description 115
- 229940105657 catalase Drugs 0.000 claims abstract description 115
- 229940088598 enzyme Drugs 0.000 claims abstract description 58
- 239000003094 microcapsule Substances 0.000 claims abstract description 55
- 102000004139 alpha-Amylases Human genes 0.000 claims abstract description 28
- 108090000637 alpha-Amylases Proteins 0.000 claims abstract description 28
- 229940024171 alpha-amylase Drugs 0.000 claims abstract description 28
- 102000004882 Lipase Human genes 0.000 claims abstract description 26
- 108090001060 Lipase Proteins 0.000 claims abstract description 26
- 235000013312 flour Nutrition 0.000 claims abstract description 25
- 239000004367 Lipase Substances 0.000 claims abstract description 22
- 235000019421 lipase Nutrition 0.000 claims abstract description 22
- 150000001875 compounds Chemical class 0.000 claims abstract description 18
- 108010015776 Glucose oxidase Proteins 0.000 claims abstract description 14
- 239000004366 Glucose oxidase Substances 0.000 claims abstract description 14
- 229940116332 glucose oxidase Drugs 0.000 claims abstract description 14
- 235000019420 glucose oxidase Nutrition 0.000 claims abstract description 14
- 241000209140 Triticum Species 0.000 claims abstract description 12
- 235000021307 Triticum Nutrition 0.000 claims abstract description 12
- 108010068370 Glutens Proteins 0.000 claims abstract description 11
- 235000021312 gluten Nutrition 0.000 claims abstract description 11
- 101710121765 Endo-1,4-beta-xylanase Proteins 0.000 claims abstract description 9
- 108010061330 glucan 1,4-alpha-maltohydrolase Proteins 0.000 claims abstract description 9
- 239000002994 raw material Substances 0.000 claims abstract description 8
- 239000000243 solution Substances 0.000 claims description 64
- 239000005995 Aluminium silicate Substances 0.000 claims description 45
- 235000012211 aluminium silicate Nutrition 0.000 claims description 45
- NLYAJNPCOHFWQQ-UHFFFAOYSA-N kaolin Chemical compound O.O.O=[Al]O[Si](=O)O[Si](=O)O[Al]=O NLYAJNPCOHFWQQ-UHFFFAOYSA-N 0.000 claims description 45
- 229920001661 Chitosan Polymers 0.000 claims description 38
- 238000002156 mixing Methods 0.000 claims description 36
- 238000003756 stirring Methods 0.000 claims description 30
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 claims description 22
- 229940072056 alginate Drugs 0.000 claims description 22
- 235000010443 alginic acid Nutrition 0.000 claims description 22
- 229920000615 alginic acid Polymers 0.000 claims description 22
- 239000002245 particle Substances 0.000 claims description 21
- 235000010410 calcium alginate Nutrition 0.000 claims description 20
- 239000000648 calcium alginate Substances 0.000 claims description 20
- 229960002681 calcium alginate Drugs 0.000 claims description 20
- OKHHGHGGPDJQHR-YMOPUZKJSA-L calcium;(2s,3s,4s,5s,6r)-6-[(2r,3s,4r,5s,6r)-2-carboxy-6-[(2r,3s,4r,5s,6r)-2-carboxylato-4,5,6-trihydroxyoxan-3-yl]oxy-4,5-dihydroxyoxan-3-yl]oxy-3,4,5-trihydroxyoxane-2-carboxylate Chemical compound [Ca+2].O[C@@H]1[C@H](O)[C@H](O)O[C@@H](C([O-])=O)[C@H]1O[C@H]1[C@@H](O)[C@@H](O)[C@H](O[C@H]2[C@H]([C@@H](O)[C@H](O)[C@H](O2)C([O-])=O)O)[C@H](C(O)=O)O1 OKHHGHGGPDJQHR-YMOPUZKJSA-L 0.000 claims description 20
- 239000011259 mixed solution Substances 0.000 claims description 19
- 239000000843 powder Substances 0.000 claims description 19
- PEDCQBHIVMGVHV-UHFFFAOYSA-N Glycerine Chemical compound OCC(O)CO PEDCQBHIVMGVHV-UHFFFAOYSA-N 0.000 claims description 17
- 238000005406 washing Methods 0.000 claims description 15
- 239000000203 mixture Substances 0.000 claims description 14
- 239000007974 sodium acetate buffer Substances 0.000 claims description 12
- 238000000034 method Methods 0.000 claims description 10
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 claims description 8
- 239000001110 calcium chloride Substances 0.000 claims description 8
- 229910001628 calcium chloride Inorganic materials 0.000 claims description 8
- 238000001035 drying Methods 0.000 claims description 8
- 238000004108 freeze drying Methods 0.000 claims description 7
- 230000002538 fungal effect Effects 0.000 claims description 7
- 235000011187 glycerol Nutrition 0.000 claims description 7
- 239000004005 microsphere Substances 0.000 claims description 7
- 230000001580 bacterial effect Effects 0.000 claims description 6
- ZIIUUSVHCHPIQD-UHFFFAOYSA-N 2,4,6-trimethyl-N-[3-(trifluoromethyl)phenyl]benzenesulfonamide Chemical compound CC1=CC(C)=CC(C)=C1S(=O)(=O)NC1=CC=CC(C(F)(F)F)=C1 ZIIUUSVHCHPIQD-UHFFFAOYSA-N 0.000 claims description 4
- 102000015439 Phospholipases Human genes 0.000 claims description 4
- 108010064785 Phospholipases Proteins 0.000 claims description 4
- 239000007788 liquid Substances 0.000 claims description 4
- WQZGKKKJIJFFOK-PHYPRBDBSA-N alpha-D-galactose Chemical compound OC[C@H]1O[C@H](O)[C@H](O)[C@@H](O)[C@H]1O WQZGKKKJIJFFOK-PHYPRBDBSA-N 0.000 claims description 2
- 229930182830 galactose Natural products 0.000 claims description 2
- 238000000926 separation method Methods 0.000 claims description 2
- 239000002131 composite material Substances 0.000 claims 1
- MHAJPDPJQMAIIY-UHFFFAOYSA-N Hydrogen peroxide Chemical compound OO MHAJPDPJQMAIIY-UHFFFAOYSA-N 0.000 abstract description 65
- 239000000049 pigment Substances 0.000 abstract description 13
- 238000012545 processing Methods 0.000 abstract description 4
- 239000003607 modifier Substances 0.000 abstract 1
- 230000000694 effects Effects 0.000 description 35
- 230000000052 comparative effect Effects 0.000 description 32
- 239000000706 filtrate Substances 0.000 description 27
- 238000011068 loading method Methods 0.000 description 18
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 13
- 230000014759 maintenance of location Effects 0.000 description 12
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 8
- 235000008429 bread Nutrition 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 238000010025 steaming Methods 0.000 description 8
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 7
- 238000006243 chemical reaction Methods 0.000 description 7
- 239000001301 oxygen Substances 0.000 description 7
- 229910052760 oxygen Inorganic materials 0.000 description 7
- UPYKUZBSLRQECL-UKMVMLAPSA-N Lycopene Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1C(=C)CCCC1(C)C)C=CC=C(/C)C=CC2C(=C)CCCC2(C)C UPYKUZBSLRQECL-UKMVMLAPSA-N 0.000 description 6
- 150000001746 carotenes Chemical class 0.000 description 6
- 235000005473 carotenes Nutrition 0.000 description 6
- 238000001914 filtration Methods 0.000 description 6
- KBPHJBAIARWVSC-RGZFRNHPSA-N lutein Chemical compound C([C@H](O)CC=1C)C(C)(C)C=1\C=C\C(\C)=C\C=C\C(\C)=C\C=C\C=C(/C)\C=C\C=C(/C)\C=C\[C@H]1C(C)=C[C@H](O)CC1(C)C KBPHJBAIARWVSC-RGZFRNHPSA-N 0.000 description 6
- 229960005375 lutein Drugs 0.000 description 6
- ORAKUVXRZWMARG-WZLJTJAWSA-N lutein Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CCCC1(C)C)C=CC=C(/C)C=CC2C(=CC(O)CC2(C)C)C ORAKUVXRZWMARG-WZLJTJAWSA-N 0.000 description 6
- 235000012680 lutein Nutrition 0.000 description 6
- 239000001656 lutein Substances 0.000 description 6
- KBPHJBAIARWVSC-XQIHNALSSA-N trans-lutein Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2C(=CC(O)CC2(C)C)C KBPHJBAIARWVSC-XQIHNALSSA-N 0.000 description 6
- NCYCYZXNIZJOKI-UHFFFAOYSA-N vitamin A aldehyde Natural products O=CC=C(C)C=CC=C(C)C=CC1=C(C)CCCC1(C)C NCYCYZXNIZJOKI-UHFFFAOYSA-N 0.000 description 6
- FJHBOVDFOQMZRV-XQIHNALSSA-N xanthophyll Natural products CC(=C/C=C/C=C(C)/C=C/C=C(C)/C=C/C1=C(C)CC(O)CC1(C)C)C=CC=C(/C)C=CC2C=C(C)C(O)CC2(C)C FJHBOVDFOQMZRV-XQIHNALSSA-N 0.000 description 6
- IXPNQXFRVYWDDI-UHFFFAOYSA-N 1-methyl-2,4-dioxo-1,3-diazinane-5-carboximidamide Chemical compound CN1CC(C(N)=N)C(=O)NC1=O IXPNQXFRVYWDDI-UHFFFAOYSA-N 0.000 description 5
- 239000012467 final product Substances 0.000 description 5
- 235000010413 sodium alginate Nutrition 0.000 description 5
- 239000000661 sodium alginate Substances 0.000 description 5
- 229940005550 sodium alginate Drugs 0.000 description 5
- 229960000583 acetic acid Drugs 0.000 description 4
- 230000006196 deacetylation Effects 0.000 description 4
- 238000003381 deacetylation reaction Methods 0.000 description 4
- 235000013305 food Nutrition 0.000 description 4
- 239000012362 glacial acetic acid Substances 0.000 description 4
- 239000004519 grease Substances 0.000 description 4
- 235000018102 proteins Nutrition 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 108090000623 proteins and genes Proteins 0.000 description 4
- 239000002775 capsule Substances 0.000 description 3
- 239000000463 material Substances 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- LDVVTQMJQSCDMK-UHFFFAOYSA-N 1,3-dihydroxypropan-2-yl formate Chemical compound OCC(CO)OC=O LDVVTQMJQSCDMK-UHFFFAOYSA-N 0.000 description 2
- CIWBSHSKHKDKBQ-JLAZNSOCSA-N Ascorbic acid Chemical compound OC[C@H](O)[C@H]1OC(=O)C(O)=C1O CIWBSHSKHKDKBQ-JLAZNSOCSA-N 0.000 description 2
- 108091003079 Bovine Serum Albumin Proteins 0.000 description 2
- 108010093096 Immobilized Enzymes Proteins 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 229940098773 bovine serum albumin Drugs 0.000 description 2
- 239000013043 chemical agent Substances 0.000 description 2
- 235000014113 dietary fatty acids Nutrition 0.000 description 2
- 239000000194 fatty acid Substances 0.000 description 2
- 229930195729 fatty acid Natural products 0.000 description 2
- 150000004665 fatty acids Chemical class 0.000 description 2
- 230000002000 scavenging effect Effects 0.000 description 2
- DNISEZBAYYIQFB-PHDIDXHHSA-N (2r,3r)-2,3-diacetyloxybutanedioic acid Chemical compound CC(=O)O[C@@H](C(O)=O)[C@H](C(O)=O)OC(C)=O DNISEZBAYYIQFB-PHDIDXHHSA-N 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 229920001353 Dextrin Polymers 0.000 description 1
- 239000004375 Dextrin Substances 0.000 description 1
- 241000196324 Embryophyta Species 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 240000004808 Saccharomyces cerevisiae Species 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 230000002378 acidificating effect Effects 0.000 description 1
- 229960005070 ascorbic acid Drugs 0.000 description 1
- 235000010323 ascorbic acid Nutrition 0.000 description 1
- 239000011668 ascorbic acid Substances 0.000 description 1
- 235000012970 cakes Nutrition 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 239000003638 chemical reducing agent Substances 0.000 description 1
- 238000001816 cooling Methods 0.000 description 1
- 239000006071 cream Substances 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000007547 defect Effects 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 235000019425 dextrin Nutrition 0.000 description 1
- 229940079919 digestives enzyme preparation Drugs 0.000 description 1
- 238000007599 discharging Methods 0.000 description 1
- 239000012153 distilled water Substances 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 239000003995 emulsifying agent Substances 0.000 description 1
- -1 enzyme preparations Substances 0.000 description 1
- 238000000605 extraction Methods 0.000 description 1
- 235000010037 flour treatment agent Nutrition 0.000 description 1
- 238000009472 formulation Methods 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 150000004676 glycans Chemical class 0.000 description 1
- 235000021552 granulated sugar Nutrition 0.000 description 1
- 210000005260 human cell Anatomy 0.000 description 1
- 239000001257 hydrogen Substances 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 230000003100 immobilizing effect Effects 0.000 description 1
- 238000012423 maintenance Methods 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 235000013336 milk Nutrition 0.000 description 1
- 239000008267 milk Substances 0.000 description 1
- 210000004080 milk Anatomy 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 231100000252 nontoxic Toxicity 0.000 description 1
- 230000003000 nontoxic effect Effects 0.000 description 1
- 239000007800 oxidant agent Substances 0.000 description 1
- 230000003647 oxidation Effects 0.000 description 1
- 238000007254 oxidation reaction Methods 0.000 description 1
- 230000001590 oxidative effect Effects 0.000 description 1
- 235000015927 pasta Nutrition 0.000 description 1
- 238000011056 performance test Methods 0.000 description 1
- 238000005375 photometry Methods 0.000 description 1
- 229920001282 polysaccharide Polymers 0.000 description 1
- 239000005017 polysaccharide Substances 0.000 description 1
- 239000011148 porous material Substances 0.000 description 1
- 150000003839 salts Chemical class 0.000 description 1
- 238000002791 soaking Methods 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 230000002195 synergetic effect Effects 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
Classifications
-
- A—HUMAN NECESSITIES
- A21—BAKING; EDIBLE DOUGHS
- A21D—TREATMENT, e.g. PRESERVATION, OF FLOUR OR DOUGH, e.g. BY ADDITION OF MATERIALS; BAKING; BAKERY PRODUCTS; PRESERVATION THEREOF
- A21D8/00—Methods for preparing or baking dough
- A21D8/02—Methods for preparing dough; Treating dough prior to baking
- A21D8/04—Methods for preparing dough; Treating dough prior to baking treating dough with microorganisms or enzymes
- A21D8/042—Methods for preparing dough; Treating dough prior to baking treating dough with microorganisms or enzymes with enzymes
Landscapes
- Life Sciences & Earth Sciences (AREA)
- Microbiology (AREA)
- Engineering & Computer Science (AREA)
- Food Science & Technology (AREA)
- Enzymes And Modification Thereof (AREA)
Abstract
本申请涉及面粉加工改良剂领域,具体公开了一种复配酶制剂及其制备方法,复配酶制剂由如下重量份数的原料组成:高筋小麦粉92‑97份;麦芽糖淀粉酶0.02‑1份;木聚糖酶0.05‑1.5份;α‑淀粉酶0.05‑1.2份;脂肪酶0.5‑1.5份;葡萄糖氧化酶0.5‑2份;过氧化氢酶微胶囊0.5‑1份。本申请的复配酶制剂能够减少面粉制品中的色素且降低过氧化氢残留量,增强面团延伸性,使产品体积增大。
Description
技术领域
本发明涉及面粉加工改良剂领域,尤其是涉及一种复配酶制剂及其制备方法。
背景技术
面粉改良剂是用于改善面制品品质、改善面团流变学特性和机械加工性能的物质,一般会制成组合物,主要包括氧化剂、还原剂、酶制剂、乳化剂等。酶制剂是指从生物中提取的具有酶特性的一类物质,主要作用是催化食品加工过程中各种化学反应,改进食品加工方法。
相关技术中公开了一种面包改良剂,由以下重量份数的原料组分组成:20~65份的单甘酯、3~12份的双乙酰酒石酸单甘酯、0.1~0.8份的脂肪酶、0.03~0.12份的果胶酶、0.02~0.15份的抗坏血酸和10~45份的谷朊粉。
针对上述相关技术,由于在采用面粉和酶制剂加工糕点、面包、面食时,面粉和食用油中含有胡萝卜素、叶黄素等天然色素,会影响产品的色泽,如果加入化学试剂清除天然色素又会造成化学试剂残留。
发明内容
为了减少面粉制品中的色素且降低化学试剂残留量,本申请提供一种复配酶制剂及其制备方法。
第一方面,本申请提供一种复配酶制剂,采用如下的技术方案:
一种复配酶制剂,由如下重量份数的原料组成:
高筋小麦粉92-97份;
麦芽糖淀粉酶0.02-1份;
木聚糖酶0.05-1.5份;
α-淀粉酶0.05-1.2份;
脂肪酶0.5-1.5份;
葡萄糖氧化酶0.5-2份;
过氧化氢酶微胶囊0.5-1份。
通过采用上述技术方案,脂肪酶能够水解脂肪产生脂肪酸,脂肪酸在面团中被氧气及氧化物质氧化为过氧化氢,过氧化氢将面粉、油脂中的胡萝卜素、叶黄素等色素氧化,从而降低天然色素含量,增加白度;葡萄糖氧化酶与小麦粉中的葡萄糖反应生成过氧化氢,过氧化氢能够氧化面粉、油脂中的胡萝卜素、叶黄素等植物色素,进一步降低天然色素含量,增加白度;由于脂肪酶和葡萄糖氧化酶参与反应后都会生成过氧化氢,残留的过氧化氢能够对人体细胞造成损害,且过氧化氢分解后会产生氧气导致食品氧化,因此,需要去除残留的过氧化氢;过氧化氢酶微胶囊将过氧化氢酶包裹在内,在和面和醒发阶段,过氧化氢酶不会损失,也不会参与反应,当面团在烘烤或蒸制前期,部分过氧化氢酶微胶囊会发生破损释放过氧化氢酶,部分过氧化氢酶微胶囊的囊壁上通孔变大,小分子量的过氧化氢能够从囊壁上的通孔进入,与过氧化氢酶接触后被分解为水和氧气,水和氧气再通过囊壁上的通孔排出,过氧化氢酶微胶囊既可以除去残留的过氧化氢,生成的氧气在排出时会形成新的孔结构,增加孔隙率,又可以增加面团的持气能力,生成的少量水在面团中均匀分布,能够软化面团,增强面团延伸性,使产品体积增大,而且过氧化氢酶在高温烘烤或蒸制阶段会失活,不会影响最终产品的特性。
可选的,所述过氧化氢酶微胶囊包括海藻酸钙颗粒和壳聚糖外壳,所述海藻酸钙颗粒吸附有高岭土和过氧化氢酶。
通过采用上述技术方案,海藻酸钙无毒、成本低、耐微生物侵袭,但是也存在机械强度低、孔径大和酶泄露的缺点;海藻酸盐与钙离子交联形成海藻酸钙凝胶后能够吸附包裹过氧化氢酶,高岭土作为一种多孔的支撑材料,能够降低的过氧化氢酶泄露概率,提高微胶囊机械强度和耐热性;壳聚糖外壳包裹在海藻酸钙颗粒表面,对过氧化氢酶起到保护作用,控制过氧化氢酶在前期基本不会参与分解过氧化氢的反应,在烘烤或蒸制前期,部分微胶囊的壳聚糖外壳被破坏,部分过氧化氢从微胶囊的通孔进入微胶囊,过氧化氢与过氧化氢酶接触后被分解为水和氧气,烘烤或蒸制后期,温度继续升高后,使过氧化氢酶失活。
可选的,所述过氧化氢酶微胶囊的制备方法包括以下步骤:
S1,将高岭土溶解于0.05-0.15mol/L的乙酸钠缓冲液中,混合均匀,得到高岭土溶液,再加入海藻酸盐粉,混合均匀,加入甘油,混合均匀,得到混合液;
S2,将过氧化氢酶溶液与混合液混合均匀,加入氯化钙,氯化钙的加入量为1.5-2.5mol/L,硬化后,固液分离,收集微球,用乙酸钠缓冲液洗涤,干燥,得到载酶颗粒;
S3,将载酶颗粒加入至壳聚糖溶液中,搅拌均匀,离心,冷冻干燥,得到过氧化氢酶微胶囊。
通过采用上述技术方案,海藻酸盐与高岭土之间存在分子间氢键和静电力,氯化钙与海藻酸盐交联形成凝胶从而包裹过氧化氢酶,由于海藻酸钙具有多孔性和吸附性,能够将大量的过氧化氢酶吸附在其表面和网孔内部,高岭土还可以提高过氧化氢酶的装载效率和固定化收率,壳聚糖为碱性多糖,在酸性环境下带有大量正电荷,能够与带有负电荷的海藻酸钙聚合,从而包裹载酶颗粒;冷冻干燥工艺温度低,与其他高温干燥的工艺相比,能够降低过氧化氢酶失活的概率,使过氧化氢酶保持更高的活性。
可选的,所述S1中高岭土溶液的质量浓度为1.5-2.5%W/V。
通过采用上述技术方案,高岭土在上述质量浓度范围内时,能够获得较佳的酶装载效率和酶固定化收率。
可选的,所述S1中海藻酸盐粉与高岭土的质量比为1:(0.9-1.1)。
通过采用上述技术方案,海藻酸盐浓度会会影响固定化收率,在上述配比下,过氧化氢酶的负载效率和固定化收率较高。
可选的,所述S2中过氧化氢酶溶液的质量浓度为2.5-3%W/V。
通过采用上述技术方案,过氧化氢酶溶液的质量浓度太低,过氧化氢酶微胶囊中负载的过氧化氢酶太少,不足以清除残留的过氧化氢;过氧化氢酶溶液的质量浓度太高,部分过氧化氢酶难以被完全吸附,造成浪费。
可选的,所述S3中壳聚糖溶液的pH为3.5-4,壳聚糖的质量浓度为2.5-3%W/V。
通过采用上述技术方案,在上述pH范围下,壳聚糖能够更好地包裹载酶颗粒;壳聚糖质量浓度太低,难以完全包裹载酶颗粒;壳聚糖质量浓度太高,粘度过大,难以搅拌均匀。
可选的,所述脂肪酶选自甘油三酯脂肪酶、磷脂酶和半乳糖脂肪酶中的至少一种。
通过采用上述技术方案,上述的脂肪酶均可以氧化胡萝卜素、叶黄素,降低天然色素含量,但是,需要根据面制品的配方和工艺选择脂肪酶的种类,从而改善面团性质。
可选的,所述α-淀粉酶选自真菌α-淀粉酶、细菌α-淀粉酶中的至少一种。
通过采用上述技术方案,真菌α-淀粉酶的热稳定性较差,大部分在淀粉开始糊化之前就已经失活,不会使最终产品中产生过量糊精导致发粘;细菌α-淀粉酶耐热性较好,在面包烘焙过程中不易失活,但是会导致最终产品发粘,因此,需要根据产品的特性选择α-淀粉酶种类,也可以将真菌α-淀粉酶、细菌α-淀粉酶复配使用。
第二方面,本申请提供一种复配酶制剂的制备方法,采用如下的技术方案:
一种复配酶制剂的制备方法,包括以下步骤:
步骤一,将高筋小麦粉和脂肪酶混合均匀,得到第一混合物;
步骤二,将麦芽糖淀粉酶、木聚糖酶、α-淀粉酶、葡萄糖氧化酶、过氧化氢酶微胶囊混合均匀,得到第二混合物;
步骤三,将第一混合物和第二混合物混合均匀,得到复配酶制剂。
通过采用上述技术方案,脂肪酶和葡萄糖氧化酶能够参与反应将面粉、油脂中的胡萝卜素、叶黄素等色素氧化,降低天然色素含量,增加白度;过氧化氢酶微胶囊既可以除去残留的过氧化氢,又可以增加面团的持气能力,生成的少量水在面团中均匀分布,能够软化面团,增强面团延伸性,使产品体积增大,而且过氧化氢酶在高温烘烤或蒸制阶段会失活,不会影响最终产品的特性。
综上所述,本申请具有以下有益效果:
1、由于本申请采用脂肪酶、葡萄糖氧化酶和过氧化氢酶微胶囊复配,脂肪酶和葡萄糖氧化酶能够参与反应将面粉、油脂中的胡萝卜素、叶黄素等色素氧化,降低天然色素含量,增加白度;过氧化氢酶微胶囊既可以除去残留的过氧化氢,又可以增加面团的持气能力,生成的少量水在面团中均匀分布,能够软化面团,增强面团延伸性,使产品体积增大,而且过氧化氢酶在高温烘烤或蒸制阶段会失活,不会影响最终产品的特性。
2、本申请中优选采用高岭土微胶囊的支撑材料,能够降低的过氧化氢酶泄露概率,提高微胶囊机械强度和耐热性;壳聚糖外壳包裹在海藻酸钙颗粒表面,对过氧化氢酶起到保护作用,控制过氧化氢酶在前期基本不会参与分解过氧化氢的反应,在烘烤或蒸制前期,部分微胶囊的壳聚糖外壳被破坏,部分过氧化氢从微胶囊的通孔进入微胶囊,过氧化氢与过氧化氢酶接触后被分解为水和氧气,烘烤或蒸制后期,温度继续升高后,使过氧化氢酶失活。
具体实施方式
以下结合实施例对本申请作进一步详细说明。
过氧化氢酶微胶囊的制备例
制备例1
过氧化氢酶微胶囊,其制备方法包括以下步骤:
S1,将1.5g食品级高岭土溶解于摩尔浓度为0.05mol/L、pH为5的乙酸钠缓冲液中,混合搅拌均匀,得到质量浓度为1.5%W/V的高岭土溶液,再加入海藻酸盐粉,海藻酸盐粉为海藻酸钠,海藻酸盐粉与高岭土的质量比为1:1.1,混合搅拌均匀,加入2.5mL甘油,混合搅拌均匀,得到混合液;
S2,将100mL质量浓度为2.5%W/V的过氧化氢酶溶液与混合液混合搅拌均匀,得到酶混液,加入氯化钙,氯化钙在酶混液中的摩尔浓度为1.5mol/L,硬化3h后,过滤,得到的第一滤液备用,收集微球,用摩尔浓度为0.05mol/L、pH为5的乙酸钠缓冲液洗涤3次,洗涤液备用,干燥,得到载酶颗粒,在4℃的条件下保存;
S3,将分子量450000、脱乙酰度为91%的壳聚糖加入质量浓度为1%W/V的冰醋酸水溶液中,生成浓度为2.5%W/V、pH为3.5的透明的壳聚糖溶液,将载酶颗粒加入至200mL壳聚糖溶液中,搅拌均匀,离心,得到的第二滤液备用,冷冻干燥,得到过氧化氢酶微胶囊,第二滤液与第一滤液、洗涤液合并得到总滤液。
其中,本申请中1%W/V的含义是每100mL溶液中含有1g溶质。
制备例2
与制备例1的不同之处在于,高岭土溶液的质量浓度为2%W/V。
制备例3
与制备例1的不同之处在于,高岭土溶液的质量浓度为2.5%W/V。
制备例4
与制备例1的不同之处在于,高岭土溶液的质量浓度为1%W/V。
制备例5
与制备例1的不同之处在于,高岭土溶液的质量浓度为3%W/V。
制备例6
与制备例2的不同之处在于,海藻酸盐粉与高岭土的质量比为1:1。
制备例7
与制备例2的不同之处在于,海藻酸盐粉与高岭土的质量比为1:0.9。
制备例8
与制备例2的不同之处在于,海藻酸盐粉与高岭土的质量比为1:0.5。
制备例9
与制备例2的不同之处在于,海藻酸盐粉与高岭土的质量比为1:1.5。
制备例10
与制备例6的不同之处在于,S2中过氧化氢酶溶液的质量浓度为2.8%W/V。
制备例11
与制备例6的不同之处在于,S2中过氧化氢酶溶液的质量浓度为3%W/V。
制备例12
与制备例6的不同之处在于,S2中过氧化氢酶溶液的质量浓度为2%W/V。
制备例13
与制备例6的不同之处在于,S2中过氧化氢酶溶液的质量浓度为3.5%W/V。
制备例14
与制备例10的不同之处在于,过氧化氢酶微胶囊,其制备方法包括以下步骤:
S1,将1.5g食品级高岭土溶解于摩尔浓度为0.15mol/L、pH为5的乙酸钠缓冲液中,混合搅拌均匀,得到质量浓度为1.5%W/V的高岭土溶液,再加入海藻酸盐粉,海藻酸盐粉为海藻酸钠,海藻酸盐粉与高岭土的质量比为1:1.1,混合搅拌均匀,加入3mL甘油,混合搅拌均匀,得到混合液;
S2,将100mL质量浓度为2.5%W/V的过氧化氢酶溶液与混合液混合搅拌均匀,得到酶混液,加入氯化钙,氯化钙在酶混液中的摩尔浓度为2.5mol/L,硬化3h后,过滤,得到的第一滤液备用,收集微球,用摩尔浓度为0.05mol/L、pH为5的乙酸钠缓冲液洗涤4次,洗涤液备用,干燥,得到载酶颗粒,在4℃的条件下保存;
S3,将分子量450000、脱乙酰度为91%的壳聚糖加入质量浓度为1%W/V的冰醋酸水溶液中,生成浓度为3%W/V、pH为4的透明的壳聚糖溶液,将载酶颗粒加入至200mL壳聚糖溶液中,搅拌均匀,离心,得到的第二滤液备用,冷冻干燥,得到过氧化氢酶微胶囊,第二滤液与第一滤液、洗涤液合并得到总滤液。
对比制备例1
过氧化氢酶微胶囊,其制备方法包括以下步骤:
S1,将分子量450000、脱乙酰度为91%的壳聚糖加入质量浓度为1%W/V的冰醋酸水溶液中,生成浓度为2.5%W/V、pH为3.5的透明的壳聚糖溶液,再加入海藻酸盐粉,海藻酸盐粉为海藻酸钠,海藻酸盐粉与壳聚糖的质量比为1:1.1,混合搅拌均匀,加入2.5mL甘油,混合搅拌均匀,得到混合液;
S2,将100mL质量浓度为2.5%W/V的过氧化氢酶溶液与混合液混合搅拌均匀,得到酶混液,加入氯化钙,氯化钙在酶混液中的摩尔浓度为1.5mol/L,硬化3h后,过滤,得到的第一滤液备用,收集微球,用摩尔浓度为0.05mol/L、pH为5的乙酸钠缓冲液洗涤3次,干燥,得到过氧化氢酶微胶囊,洗涤液备用,第一滤液和洗涤液合并得到总滤液。
对比制备例2
过氧化氢酶微胶囊,其制备方法包括以下步骤:
S1,将分子量450000、脱乙酰度为91%的壳聚糖加入质量浓度为1%W/V的冰醋酸水溶液中,生成浓度为2.5%W/V、pH为3.5的透明的壳聚糖溶液,再加入海藻酸盐粉,海藻酸盐粉为海藻酸钠,海藻酸盐粉与壳聚糖的质量比为1:1.1,混合搅拌均匀,加入2.5mL甘油,混合搅拌均匀,得到混合液;
S2,将100mL质量浓度为2.5%W/V的过氧化氢酶溶液与混合液混合搅拌均匀,得到酶混液,加入氯化钙,氯化钙在酶混液中的摩尔浓度为1.5mol/L,硬化3h后,过滤,得到的第一滤液备用,收集微球,用摩尔浓度为0.05mol/L、pH为5的乙酸钠缓冲液洗涤3次,洗涤液备用,干燥,得到载酶颗粒,在4℃的条件下保存;
S3,将载酶颗粒加入至200mL壳聚糖溶液中,搅拌均匀,离心,得到的第二滤液备用,冷冻干燥,得到过氧化氢酶微胶囊,第二滤液与第一滤液、洗涤液合并得到总滤液。
对比制备例3
过氧化氢酶微胶囊,其制备方法包括以下步骤:
S1,将1.5g食品级高岭土溶解于摩尔浓度为0.05mol/L、pH为5的乙酸钠缓冲液中,混合搅拌均匀,得到质量浓度为1.5%W/V的高岭土溶液,再加入海藻酸盐粉,海藻酸盐粉为海藻酸钠,海藻酸盐粉与高岭土的质量比为1:1.1,混合搅拌均匀,加入2.5mL甘油,混合搅拌均匀,得到混合液;
S2,将100mL质量浓度为2.5%W/V的过氧化氢酶溶液与混合液混合搅拌均匀,得到酶混液,加入氯化钙,氯化钙在酶混液中的摩尔浓度为1.5mol/L,硬化3h后,过滤,得到的第一滤液备用,收集微球,用摩尔浓度为0.05mol/L、pH为5的乙酸钠缓冲液洗涤3次,干燥,得到过氧化氢酶微胶囊,洗涤液备用,第一滤液和洗涤液合并得到总滤液。
实施例
实施例1
一种复配酶制剂,由如下重量份数的原料组成:
高筋小麦粉92g;
麦芽糖淀粉酶1g;
木聚糖酶1.5g;
α-淀粉酶0.05g,α-淀粉酶是真菌α-淀粉酶;
脂肪酶1.5g,脂肪酶是甘油三酯脂肪酶;
葡萄糖氧化酶0.5g;
过氧化氢酶微胶囊1g,过氧化氢酶微胶囊由制备例1制得;
复配酶制剂的制备方法,包括以下步骤:
步骤一,将高筋小麦粉和脂肪酶混合搅拌均匀,得到第一混合物;
步骤二,将麦芽糖淀粉酶、木聚糖酶、α-淀粉酶、葡萄糖氧化酶、过氧化氢酶微胶囊混合搅拌均匀,得到第二混合物;
步骤三,将第一混合物和第二混合物混合搅拌均匀,得到复配酶制剂。
实施例2-14
与实施例1的不同之处在于,过氧化氢酶微胶囊依次由制备例2-14制得。
实施例15
与实施例1的不同之处在于,复配酶制剂由如下重量份数的原料组成:
高筋小麦粉95g;
麦芽糖淀粉酶0.5g;
木聚糖酶0.8g;
α-淀粉酶0.6g,α-淀粉酶是细菌α-淀粉酶;
脂肪酶1g,脂肪酶是磷脂酶;
葡萄糖氧化酶1.2g;
过氧化氢酶微胶囊0.7g。
实施例16
与实施例1的不同之处在于,复配酶制剂由如下重量份数的原料组成:
高筋小麦粉97g;
麦芽糖淀粉酶0.02g;
木聚糖酶0.05g;
α-淀粉酶1.2g,α-淀粉酶由质量比为2:1的真菌α-淀粉酶和细菌α-淀粉酶组成;脂肪酶0.5g,脂肪酶由质量比为1:1的甘油三酯脂肪酶和磷脂酶组成;
葡萄糖氧化酶2g;
过氧化氢酶微胶囊0.5g。
对比例
对比例1
与实施例1的不同之处在于,将过氧化氢酶微胶替换为等重量的高筋小麦粉。
对比例2
与实施例1的不同之处在于,将过氧化氢酶微胶囊替换为等重量的过氧化氢酶。
对比例3-5
与实施例1的不同之处在于,过氧化氢酶微胶囊依次由对比制备例1-3制得。
性能检测试验
检测方法
(1)分别测试计算制备例1-14和对比制备例1-3的装载效率,记录在表1中;以牛血清白蛋白(BSA)为标准,采用Lowry法测定过氧化氢酶溶液的初始蛋白浓度和总滤液中的蛋白质浓度,装载效率(%)=(CiVi-CfVf)/CiVi*100%,其中,Ci是过氧化氢酶溶液的初始蛋白浓度(mg/mL),Vi是过氧化氢酶溶液的初始体积(mL),Cf是总滤液中的蛋白质浓度(mg/mL),Vf是总滤液的体积(mL)。
(2)分别测试计算制备例1-14和对比制备例1-3的固定化收率,记录在表1中;固定化收率(%)=Aimm/Afree*100%,Aimm是过氧化氢酶微胶囊的固定化酶比活,Afree是总滤液中的游离酶比活,采用紫外吸收法分别测试过氧化氢酶微胶囊中固定的过氧化氢酶的酶活力和总滤液中的游离酶活力,再转换为固定化酶比活和游离酶比活,酶比活=每毫升过氧化氢酶溶液中酶活力单位数/每毫升过氧化氢酶溶液中蛋白质含量。
(3)分别将制备例1-14和对比制备例1-3中的过氧化氢酶微胶囊采用高压均质机破碎,提取其中的过氧化氢酶,测试提取的过氧化氢酶的活力,计算酶活性保持率,酶活性保持率(%)=1g过氧化氢酶微胶囊提取后的过氧化氢酶的活力/1g过氧化氢酶微胶囊固定的过氧化氢酶原本的活力*100%。
(4)依次采用实施例2、6、10、15、16和对比例1-5中的过氧化氢酶微胶囊制作面包,面包的配方如下:面包粉500g、奶粉15g、酵母5g、白砂糖100g、盐6g、全蛋50g、水250g、奶油60g、过氧化氢酶微胶囊2.5g,面包的制备方法如下:把所有原料投入搅拌机中,200rpm搅拌3分钟,500rpm搅拌1分钟,200rpm搅拌3分钟,至面团成熟,将面团分割成60g,静置10分钟搓成圆形,在温度36-38℃、湿度80-85%条件下发酵时间120分钟,180℃烘焙12分钟,冷却至面包中心温度为30-40℃;
测试方法:将10g面包样品粉碎,加入至500mL蒸馏水中,搅拌均匀后,浸泡30min,过滤,滤液作为待测样品;采用荧光光度法测试待测样品中过氧化氢的含量,记录在表2中。
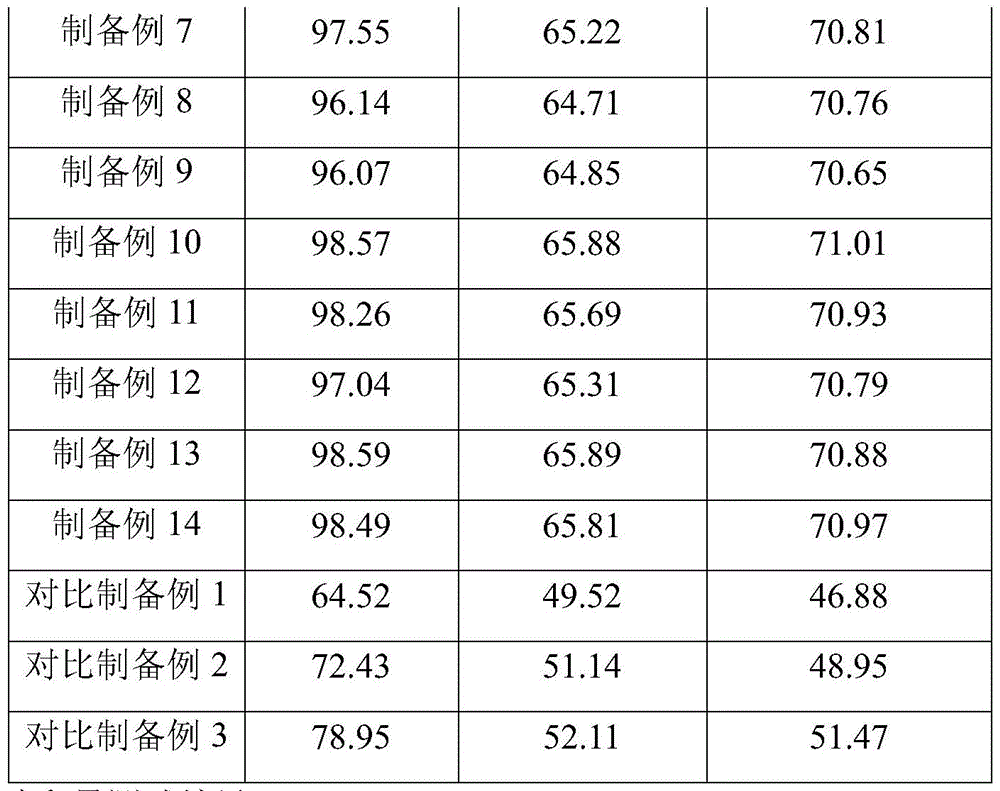
表1装载效率、固定化收率和酶活性保持率测试结果
表2过氧化氢残留量测试结果
结合制备例1-14和对比制备例1-3并结合表1可以看出,对比制备例1仅采用海藻酸钙固定过氧化氢酶,装载效率、固定化收率和酶活性保持率最低,对比制备例2在对比制备例1的基础上再包裹一层壳聚糖外壳,装载效率、固定化收率和酶活性保持率均大幅提高,说明壳聚糖外壳能够保护过氧化氢酶且降低酶的损失,使被固定的过氧化氢酶仍然保持较高的活性;对比制备例3在对比制备例1的基础上加入了高岭土,装载效率、固定化收率和酶活性保持率均大幅提高,且高于对比制备例2,说明高岭土能够与海藻酸钙配合提高过氧化氢酶的装载效率、固定化收率,而且使被固定的过氧化氢酶保持较高的活性,综合效果优于壳聚糖外壳;制备例1在对比制备例1的基础上既加入了高岭土还包裹了壳聚糖外壳,装载效率、固定化收率和酶活性保持率均大幅提高,且装载效率、固定化收率和酶活性保持率提高值大于对比制备例2和3的提高值之和,说明采用高岭土、海藻酸钙和壳聚糖配合固定过氧化氢酶,具有协同增效的作用,且获得了预料不到的技术效果。制备例2-5分别改变了高岭土溶液的质量浓度,其中,制备例4虽然高岭土溶液质量浓度低,固定化收率较高,但是装载效率下降较多,因此,制备例2的综合效果最好,制备例4和制备例5的装载效率、固定化收率和酶活性保持率较低,说明高岭土溶液的质量浓度优选为1.5-2.5%W/V;制备例6-9在制备例2的基础上改变了海藻酸盐粉与高岭土的质量比,其中,制备例6的综合效果最好,制备例8和9的装载效率、固定化收率和酶活性保持率较低,说明海藻酸盐粉与高岭土的质量比优选为1:(0.9-1.1);制备例10-13在制备例6的基础上分别改变了过氧化氢酶溶液的质量浓度,其中,制备例10的综合效果最好,制备例12的装载效率、固定化收率和酶活性保持率较低,制备例13的综合效果没有明显提升,反而成本较高,因此,过氧化氢酶溶液的质量浓度优选为2.5-3%W/V;制备例14改变了部分制备参数,装载效率、固定化收率和酶活性保持率均发生了变化,说明每个步骤的参数均对装载效率、固定化收率和酶活性保持率有一定的影响。
结合实施例2、6、10、15、16和对比例1-5并结合表2可以看出,对比例1在没有加入过氧化氢酶时,过氧化氢残留量为350ppm,而食品中的过氧化氢残留量一般要求不超过100ppm,对比例2直接加入过氧化氢酶,过氧化氢残留量虽有降低,但是仍然较高,说明直接加入过氧化氢酶对清除残留的过氧化氢作用不大;对比例3仅采用海藻酸钙固定过氧化氢酶,过氧化氢残留量大幅降低,且低于对比例2,说明采用海藻酸钙固定过氧化氢酶有利于清除残留的过氧化氢;对比例4在对比例3的基础上再包裹一层壳聚糖外壳,过氧化氢残留量大幅降低,且低于对比例3,说明采用壳聚糖外壳能够降低过氧化氢酶的损失,有利于清除残留的过氧化氢;对比例5在对比例3的基础上加入了高岭土,过氧化氢残留量大幅降低,且低于对比例4,说明高岭土使被固定的过氧化氢酶保持较高的活性,清除残留的过氧化氢的效果优于壳聚糖外壳,实施例2、6、10、15、16采用既有高岭土又有壳聚糖外壳的过氧化氢酶微胶囊,过氧化氢残留量均低于100ppm,说明采用高岭土、海藻酸钙和壳聚糖配合的过氧化氢酶微胶囊能够有效除去残留的过氧化氢。
本具体实施例仅仅是对本申请的解释,其并不是对本申请的限制,本领域技术人员在阅读完本说明书后可以根据需要对本实施例做出没有创造性贡献的修改,但只要在本申请的权利要求范围内都受到专利法的保护。
Claims (10)
1.一种复配酶制剂,其特征在于:由如下重量份数的原料组成:
高筋小麦粉92-97份;
麦芽糖淀粉酶0.02-1份;
木聚糖酶0.05-1.5份;
α-淀粉酶0.05-1.2份;
脂肪酶0.5-1.5份;
葡萄糖氧化酶0.5-2份;
过氧化氢酶微胶囊0.5-1份。
2.根据权利要求1所述的一种复配酶制剂,其特征在于:所述过氧化氢酶微胶囊包括海藻酸钙颗粒和壳聚糖外壳,所述海藻酸钙颗粒吸附有高岭土和过氧化氢酶。
3.根据权利要求2所述的一种复配酶制剂,其特征在于:所述过氧化氢酶微胶囊的制备方法包括以下步骤:
S1,将高岭土溶解于0.05-0.15mol/L的乙酸钠缓冲液中,混合均匀,得到高岭土溶液,再加入海藻酸盐粉,混合均匀,加入甘油,混合均匀,得到混合液;
S2, 将过氧化氢酶溶液与混合液混合均匀,加入氯化钙,氯化钙的加入量为1.5-2.5mol/L,硬化后,固液分离,收集微球,用乙酸钠缓冲液洗涤,干燥,得到载酶颗粒;
S3,将载酶颗粒加入至壳聚糖溶液中,搅拌均匀,离心,冷冻干燥,得到过氧化氢酶微胶囊。
4.根据权利要求3所述的一种复配酶制剂,其特征在于:所述S1中高岭土溶液的质量浓度为1.5-2.5%W/V。
5.根据权利要求3所述的一种复配酶制剂,其特征在于:所述S1中海藻酸盐粉与高岭土的质量比为1:(0.9-1.1)。
6.根据权利要求3所述的一种复配酶制剂,其特征在于:所述S2中过氧化氢酶溶液的质量浓度为2.5-3%W/V。
7.根据权利要求3所述的一种复配酶制剂,其特征在于:所述S3中壳聚糖溶液的pH为3.5-4,壳聚糖的质量浓度为2.5-3%W/V。
8.根据权利要求1所述的一种复配酶制剂,其特征在于:所述脂肪酶选自甘油三酯脂肪酶、磷脂酶和半乳糖脂肪酶中的至少一种。
9.根据权利要求1所述的一种复配酶制剂,其特征在于:所述α-淀粉酶选自真菌α-淀粉酶、细菌α-淀粉酶中的至少一种。
10.权利要求1-9任一项所述的复配酶制剂的制备方法,其特征在于:包括以下步骤:
步骤一,将高筋小麦粉和脂肪酶混合均匀,得到第一混合物;
步骤二,将麦芽糖淀粉酶、木聚糖酶、α-淀粉酶、葡萄糖氧化酶、过氧化氢酶微胶囊混合均匀,得到第二混合物;
步骤三,将第一混合物和第二混合物混合均匀,得到复配酶制剂。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202310051459.3A CN116138287A (zh) | 2023-02-02 | 2023-02-02 | 一种复配酶制剂及其制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202310051459.3A CN116138287A (zh) | 2023-02-02 | 2023-02-02 | 一种复配酶制剂及其制备方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN116138287A true CN116138287A (zh) | 2023-05-23 |
Family
ID=86350245
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202310051459.3A Pending CN116138287A (zh) | 2023-02-02 | 2023-02-02 | 一种复配酶制剂及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN116138287A (zh) |
Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0468731A1 (en) * | 1990-07-26 | 1992-01-29 | Oriental Yeast Co., Ltd. | Bread improver and method of producing bread |
| CN101358186A (zh) * | 2008-09-19 | 2009-02-04 | 哈尔滨理工大学 | 海藻酸钠-壳聚糖微囊固定腈水合酶菌株的方法 |
| CN106070416A (zh) * | 2016-07-28 | 2016-11-09 | 柳州中品科技有限公司 | 一种面包用面粉生物改良剂 |
| CN110200036A (zh) * | 2019-06-11 | 2019-09-06 | 青岛品品好食品发展有限公司 | 一种面包改良剂及其制备方法 |
| CN111073878A (zh) * | 2019-12-31 | 2020-04-28 | 惠民县邦德生物科技有限公司 | 一种复配酶制剂的制备方法 |
| US20200205431A1 (en) * | 2017-06-15 | 2020-07-02 | Dsm Ip Assets B.V. | Frozen enzyme pellets |
| CN114287456A (zh) * | 2021-12-31 | 2022-04-08 | 武汉市仟吉食品有限公司 | 复配酶制剂及清洁标签面包 |
| CN115530200A (zh) * | 2022-10-10 | 2022-12-30 | 上海早苗食品有限公司 | 一种面包改良剂及其制备方法和应用 |
-
2023
- 2023-02-02 CN CN202310051459.3A patent/CN116138287A/zh active Pending
Patent Citations (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| EP0468731A1 (en) * | 1990-07-26 | 1992-01-29 | Oriental Yeast Co., Ltd. | Bread improver and method of producing bread |
| CN101358186A (zh) * | 2008-09-19 | 2009-02-04 | 哈尔滨理工大学 | 海藻酸钠-壳聚糖微囊固定腈水合酶菌株的方法 |
| CN106070416A (zh) * | 2016-07-28 | 2016-11-09 | 柳州中品科技有限公司 | 一种面包用面粉生物改良剂 |
| US20200205431A1 (en) * | 2017-06-15 | 2020-07-02 | Dsm Ip Assets B.V. | Frozen enzyme pellets |
| CN110200036A (zh) * | 2019-06-11 | 2019-09-06 | 青岛品品好食品发展有限公司 | 一种面包改良剂及其制备方法 |
| CN111073878A (zh) * | 2019-12-31 | 2020-04-28 | 惠民县邦德生物科技有限公司 | 一种复配酶制剂的制备方法 |
| CN114287456A (zh) * | 2021-12-31 | 2022-04-08 | 武汉市仟吉食品有限公司 | 复配酶制剂及清洁标签面包 |
| CN115530200A (zh) * | 2022-10-10 | 2022-12-30 | 上海早苗食品有限公司 | 一种面包改良剂及其制备方法和应用 |
Non-Patent Citations (2)
| Title |
|---|
| 刘持标等: "微胶囊固定化过氧化氢酶的制取及对H2O2的分解作用", 生物化学杂志, vol. 13, no. 4, 31 December 1997 (1997-12-31), pages 478 - 482 * |
| 黄家岭等: "细菌脂肪酶的固定化研究", 安徽农业科学, vol. 37, no. 25, 31 December 2009 (2009-12-31), pages 11849 * |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| JP3055693B2 (ja) | 抗老化プロセスおよび薬剤 | |
| US5716654A (en) | Dry yeast compositions and processes for preparing the same | |
| EP0833563B2 (en) | A method of improving the properties of a flour dough | |
| USRE43341E1 (en) | Method of improving the properties of a flour dough, a flour dough improving composition and improved food products | |
| RU2182424C2 (ru) | Способ снижения сиропности в охлажденных составах теста (варианты), способ ингибирования ферментативного разложения арабиноксиланов в охлажденных составах, состав теста, выпечное изделие | |
| ES2554107T3 (es) | Un método para mejorar las propiedades reológicas de una masa de harina refinada | |
| CN116138287A (zh) | 一种复配酶制剂及其制备方法 | |
| EP1613176B1 (en) | Method of improving the hydration of pasta and preparation of pasta products | |
| CN110003534B (zh) | 一种提高淀粉中sds和rs含量的方法 | |
| EP0999752B1 (en) | A composition comprising an enzyme having galactose oxidase activity and use thereof | |
| D'Souza et al. | Removal of glucose from egg prior to spray drying by fermentation with immobilized yeast cells | |
| JPH0675461B2 (ja) | 小麦粉生地改質用油脂組成物 | |
| JPS63185931A (ja) | 精製小麦麩の製造法 | |
| CN114431271A (zh) | 一种面包专用脂肪氧化酶及其制备方法 | |
| AU742362B2 (en) | Dry yeast compositions | |
| AU710097B2 (en) | Oat extract and process for producing it | |
| CN114190480A (zh) | 一种超氧化物歧化酶微胶囊及其制备方法和应用 | |
| JPH0626516B2 (ja) | キトサン醤油の製造法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |