CN114853680A - 芳香六元环并咪唑类衍生物及其制备方法和应用 - Google Patents
芳香六元环并咪唑类衍生物及其制备方法和应用 Download PDFInfo
- Publication number
- CN114853680A CN114853680A CN202210630523.9A CN202210630523A CN114853680A CN 114853680 A CN114853680 A CN 114853680A CN 202210630523 A CN202210630523 A CN 202210630523A CN 114853680 A CN114853680 A CN 114853680A
- Authority
- CN
- China
- Prior art keywords
- tolyl
- reaction
- benzo
- carboxamide
- cyanophenyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D235/00—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings
- C07D235/02—Heterocyclic compounds containing 1,3-diazole or hydrogenated 1,3-diazole rings, condensed with other rings condensed with carbocyclic rings or ring systems
- C07D235/04—Benzimidazoles; Hydrogenated benzimidazoles
- C07D235/18—Benzimidazoles; Hydrogenated benzimidazoles with aryl radicals directly attached in position 2
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/06—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a carbon chain containing only aliphatic carbon atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Life Sciences & Earth Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
芳香六元环并咪唑类衍生物及其制备方法和应用,属于药物合成领域,具体涉及通式(I)所示的芳香六元环并咪唑类衍生物及其制备方法,同时其作为LSD1抑制剂的应用。本发明提供的化合物在体外酶水平表现出较好的活性,区别于现有的反苯基环丙胺母核结构的不可逆抑制剂,本发明为LSD1抑制剂研究领域,提供了新骨架化合物。本发明所采用的合成路线原料价廉易得,所用试剂为常用试剂,反应条件温和,后处理简单,可高效制备该类型化合物。本发明提供的化合物可单独或联合用药,作为赖氨酸特异性脱甲基酶‑1抑制剂,用于多种肿瘤疾病的治疗。
Description
技术领域
本发明属于药物合成领域,具体涉及一类新型芳香六元环并咪唑类衍生物及其制备方法以及其作为赖氨酸特异性去甲基化酶1抑制剂的用途。
背景技术
表观遗传在生命中起着关键作用,控制基因表达和转录,并有助于各种细胞过程,包括细胞分化、增殖和迁移。在多种表观遗传修饰中,组蛋白赖氨酸特异性去甲基化酶1(LSD1)是第一个鉴定的组蛋白去甲基化酶,通过酶促氧化特异性去除单甲基化和二甲基化H3K4和H3K9中的甲基,并有助于下游基因转录。通过调节基因表达,LSD1与肿瘤发生、干细胞生物学、神经退行性疾病、病毒感染、糖尿病和纤维化密切相关。同时许多研究结果支持LSD1的异常表达与前列腺癌、胃癌、乳腺癌、肺癌和血癌等恶性肿瘤的进展密切相关,并且抑制LSD1的生物学作用会产生抗癌效果,这表明LSD1是一种有潜力的癌症治疗靶点。因此,LSD1抑制剂的开发有利于抗肿瘤药物的研发,可以单独或者与其他药物组合用于癌症的治疗。
在过去的几十年中,已经做出了巨大的努力来开发具有生物活性的LSD1抑制剂,根据其作用机制可分为不可逆性抑制剂和可逆性抑制剂两种类型。不可逆性抑制剂可以与辅因子FAD形成共价结合,阻断FAD参与去甲基的循环,从而发挥LSD1抑制活性。到目前为止,尚无用于肿瘤治疗的LSD1抑制剂上市。
处于临床研究阶段的代表性LSD1抑制剂ORY-1001、ORY-2001、GSK-2879552、IMG-7289均以反苯基环丙胺为结构母核的不可逆抑制剂。目前已公布结构的抑制剂中只有Utah大学原研、Salarius制药公司推进临床试验的Seclidemstat mesylate和Celgene制药公司开发的CC-90011作为可逆性LSD1抑制剂处于临床研究阶段,适应症均为肿瘤。
目前对于LSD1抑制剂的研发多数以反苯基环丙胺类化合物展开,开发更多新骨架LSD1抑制剂是目前抗肿瘤领域的研究热点。
发明内容
本发明的首要目的在于提供一种通式(Ⅰ)所示的芳香六元环并咪唑类衍生物或其在药学上可接受的盐、水合物、溶剂化物、立体异构体、互变异构体、消旋体、代谢产物、代谢前体或前药;
其中:
W,X各自独立地为C或N,且其中一个为C时,另一个只能为N;
R1和R2各自独立地选自芳基、杂芳基、环烷基、烷基、杂环基、环烷基烷基、杂环基烷基、芳烷基、杂芳基烷基;其中,所述的芳基、杂芳基、环烷基、烷基、杂环基、环烷基烷基、杂环基烷基、芳烷基、杂芳基、烷基可含有一个或多个取代基;
R3为-CH2-、羰基或硫代羰基;
R4为被取代的N-杂环基、被取代的-N(H)-杂环基烷基、被取代的-N(Me)-杂环基烷基或-N(R5)2;
R5选自氢、C1~C7脂肪伯胺、C1~C7脂肪仲胺、C1~C7脂肪叔胺,优选为丙胺、N-甲基丙胺或N,N-二甲基丙胺。
进一步的,本发明通式(Ⅰ)所示的芳香六元环并咪唑类衍生物或其药学上可接受的盐、水合物、溶剂化物、立体异构体、互变异构体、消旋体、代谢产物、代谢前体或前药;
其中,R5为以下结构中任一种:
更进一步的,本发明通式(Ⅰ)所示芳香六元环并咪唑类衍生物或其药学上可接受的盐、水合物、溶剂化物、立体异构体、互变异构体、消旋体、代谢产物、代谢前体或前药,为以下46个化合物中任一种:
N-(2-氨基乙基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(5-(3-甲基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(吗啉-4-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(3-氨基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
N-(3-氨基丙基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(哌啶-4-基甲基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(哌啶-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(5-(4-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
2-(4-氰基苯基)-N-(哌啶-4-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(吡咯烷-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(5-(4-甲基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(2-甲基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
2-(4-氰基苯基)-N,N-二甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(2-(甲基氨基)乙基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(R)-2-(4-氰基苯基)-N-(吡咯烷-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(R)-2-(4-氰基苯基)-N-(哌啶-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(R)-4-(5-(2-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
(S)-4-(5-(2-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(2-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
N-(6-氨基己基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-甲基-N-(2-(甲基氨基)乙基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(4-氨基丁基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-2-(4-氰基苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(S)-4-(5-(3-氨基吡咯烷-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
(R)-2-(4-氰基苯基)-N-(吡咯烷-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-2-(4-氟苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-N-甲基-2-(4-硝基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-([1,1'-联苯]-4-基)-N-(2-氨基乙基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-N-甲基-1-(对甲苯基)-2-(4-(三氟甲基)苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-N-甲基-2-(4-(甲基磺酰基)苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(6-(哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-(哌啶-4-基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
4-(6-(4-氨基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
N-(4-氨基丁基)-3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
N-(2-氨基乙基)-3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
4-(6-(3-氨基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-(哌啶-4-基甲基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
3-(4-氰基苯基)-N-(哌啶-3-基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
(R)-4-(6-(3-氨基吡咯烷-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-(2-(甲基氨基)乙基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
(R)-4-(6-(2-甲基哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
(S)-4-(6-(2-甲基哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
4-(6-(4-甲基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
4-(6-(2-甲基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
本发明中通式(Ⅰ)所示化合物在药学上可接受的盐是指,本发明所述芳香六元环并咪唑类衍生物与酸生成的在药学上可接受的加成盐。所述加成盐包括无机酸和有机酸加成盐,优选的无机酸和有机酸为:盐酸、氢溴酸、硫酸、磷酸、甲磺酸、乙磺酸、对甲苯磺酸、苯磺酸、萘二磺酸、乙酸、丙酸、乳酸、三氟乙酸、马来酸、柠檬酸、富马酸、草酸、酒石酸或苯甲酸。
本发明中“卤素”是指氟、氯、溴或碘;本发明中“烷基”是指直链或支链的烷基;“亚烷基”是指直链或支链的亚烷基;“芳基”是指除去芳烃中的一个或不同位置的两个氢原子而得到的有机基团,如苯基、萘基;“芳杂基”是指含有一个或多个选自N、O、S杂原子的单环或多环的环状体系,该环状体系是指具有芳香性的,并且除去环状体系中的一个或不同位置的多个氢原子而得到的有机基团,如噻唑基,咪唑基、吡啶基、吡唑基、(1,2,3)-和(1,2,4)-三唑基、呋喃基、噻吩基、吡咯基、吲哚基、苯并噻唑基、噁唑基、异噁唑基、萘基、喹啉基、异喹啉基、苯并咪唑基、苯并噁唑基;“杂环烷基”是指含有一个或多个选自N、O、S的杂原子的单环的环状体系,如四氢吡咯烷基、吗啉基、哌嗪基、哌啶基、四氢吡唑烷基、四氢咪唑烷基和四氢唑啉基。
本发明还提供一种药物组合物,其含有通式(Ⅰ)所示的芳香六元环并咪唑类衍生物,或其药学上可接受的盐作为活性成分,与药学上可接受的载体或赋型剂混合制备而成,并制备成临床上可接受的剂型。所述药学上可接受的赋型剂是指任何可用于药学领域的稀释剂、辅助剂和/或载体。本发明的芳香六元环并咪唑类衍生物可以与其他活性成份组合使用,只要它们不产生其他毒副作用。
所述46个芳香六元环并咪唑类衍生物,按照路线一、路线二和路线三的方法制备得到。
路线一:起始原料A-1通过酯化反应得到中间体A-2,反应条件a为强酸催化下成酯,或是以酰化试剂酰化成酯,或是以二环己基碳二亚胺(DCC)和4-二甲氨基吡啶(DMAP)催化下成酯;反应溶剂为甲醇、乙醇或丙醇,优选甲醇;反应温度65-85℃。中间体A-2和取代的芳香胺或脂肪胺通过亲核取代反应得到中间体A-3,反应条件b为有机碱或无机碱做缚酸剂的情况下进行,所述有机碱包括三乙胺、N,N-二异丙基乙胺,无机碱包括碳酸钠、碳酸钾、碳酸铯、磷酸钠、氢氧化钠、氢氧化钾。中间体A-3经过还原反应得到中间体A-4,反应条件c为钯类催化剂下的氢化还原,或是采用还原性金属与无机酸组合进行还原,所述还原性金属与无机酸组合包括铁粉/氯化铵、铁粉/盐酸、锌粉/醋酸;反应溶剂为四氢呋喃、甲醇、乙醇、二氯甲烷、水中的任一种或是两种以上的混合溶剂;催化氢化条件优选10%Pd/C做催化剂、甲醇做溶剂、反应温度为室温,还原性金属与无机酸组合进行还原时,优选铁粉/氯化铵体系,水和乙醇的混合溶剂作为反应溶剂,反应温度为60-80℃。中间体A-4与取代的芳香醛或脂肪醛发生亲核加成脱水反应得到中间体A-5,反应条件d为醋酸、对甲苯磺酸或路易斯酸催化下进行;反应溶剂为四氢呋喃、甲醇、乙醇、二氯甲烷或甲苯,优选乙醇;反应温度为80-100℃。中间体A-5在碘催化下经过成环反应得到中间体A-6,反应条件e为碘、N-碘代丁二酰亚胺(NIS)或氯化碘催化下进行;反应溶剂为甲醇、乙醇、丙醇、三氟乙醇、丙酮、N,N-二甲基甲酰胺或二甲基亚砜;优选反应条件为N-碘代丁二酰亚胺做催化剂,三氟乙醇做溶剂,25-60℃反应。中间体A-6通过酯水解反应得到中间体A-7,反应条件f为有机碱或无机碱催化的情况下进行,所述的有机碱包括三乙胺、N,N-二异丙基乙胺,无机碱包括碳酸钠、碳酸钾、碳酸铯、磷酸钠、氢氧化钠、氢氧化钾;反应溶剂为包括甲醇、乙醇、丙醇、丙酮、N,N-二甲基甲酰胺、二甲基亚砜的极性溶剂;优选反应条件为氢氧化钠做缚酸剂,乙醇做溶剂,80℃反应。中间体A-7和取代的脂肪胺发生酰化反应得到中间体A-8,反应条件g为2-(7-氧化苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯(HATU)、O-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(HBTU)、O-(5-氯苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐(HCTU)、O-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓四氟硼酸盐(TBTU)、O-(N-丁二酰亚胺基)-二(二甲胺基)碳鎓四氟硼酸盐(TSTU)、O-(N-endo-5-降莰烯-2,3-二碳二酰亚胺)-二(二甲胺基)碳鎓四氟硼酸盐(TNTU)、二苯基磷酰氯(DPP-Cl)、氰代磷酸二乙酯(DECP)、叠氮化磷酸二苯酯(DPPA)、硫代二甲基磷酰基叠氮(MPTA)、二(2-氧-3-唑烷基)磷酰氯(BOP-Cl)或2,4,6-三丙基-1,3,5,2,4,6-三氧三磷酸-2,4,6-三氧化物(T3P)做缩合剂的情况下进行;反应溶剂为包括甲醇、乙醇、丙醇、丙酮、N,N-二甲基甲酰胺、二甲基亚砜的极性溶剂;优选反应条件为N,N-二甲基甲酰胺做溶剂,HATU做缩合剂。中间体A-8通过脱除Boc保护基反应得到目标产物A-9,反应条件h为酸催化下,加热4-12h;酸为三氟乙酸、盐酸,优选为盐酸;反应溶剂为甲醇、乙醇、异丙醇、N,N-二甲基甲酰胺、1,4-二氧六环、乙酸乙酯或二甲基亚砜,优选酸/溶剂为盐酸/乙酸乙酯;反应温度为25-80℃。
路线二:路线二中的反应条件和操作方法采用路线一中的相应反应条件和操作方法。
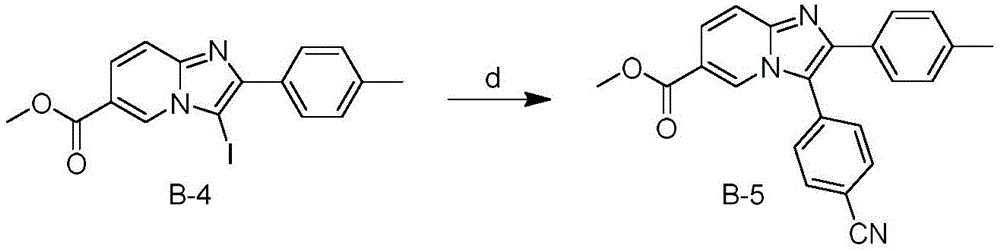
路线三:起始原料B-1通过酯化反应得到中间体B-2,反应条件a为强酸催化下成酯,或是酰化试剂酰化成酯,或是二环己基碳二亚胺(DCC)和4-二甲氨基吡啶(DMAP)催化下成酯;反应溶剂为甲醇、乙醇或丙醇,优选甲醇;反应温度为80℃。中间体B-2和取代的α-卤代饱和羰基化合物通过成环反应得到中间体B-3,反应条件b为有机碱或无机碱做缚酸剂的情况下进行,所述有机碱包括三乙胺、N,N-二异丙基乙胺,无机碱包括碳酸钠、碳酸钾、碳酸铯、磷酸钠、氢氧化钠、氢氧化钾;反应溶剂为包括甲醇、乙醇、丙醇、丙酮、N,N-二甲基甲酰胺、二甲基亚砜的极性溶剂;优选反应条件为碳酸钾做缚酸剂,乙醇做溶剂,80℃反应。中间体B-3通过碘化反应得到中间体B-4,反应条件c为碘、N-碘代丁二酰亚胺(NIS)或氯化碘催化下碘化;反应溶剂为甲醇、乙醇、丙醇、三氟乙醇、乙腈、丙酮、四氢呋喃、N,N-二甲基甲酰胺或二甲基亚砜;优选反应条件为N-碘代丁二酰亚胺做催化剂,三氟乙醇做溶剂,25-60℃反应。中间体B-4与取代的芳基硼酸或脂肪硼酸经铃木反应得中间体B-5,反应条件d为钯配合物催化、无机碱和无氧条件下加热反应;钯配合物为Pd(PPh3)4、PdCl2、PdCl2(dppf)、Pd(OAc)2或Pd(PPh3)2Cl2,优选PdCl2(dppf);无机碱为碳酸钾、碳酸钠、碳酸锂、碳酸铯或氟化钾,优选碳酸钾;反应溶剂为乙醇、1,4-二氧六环、四氢呋喃、甲苯、N,N-二甲基甲酰胺、二甲基亚砜、水和乙二醇二甲醚中的任一种或两种以上的混合溶剂,溶剂优选1,4-二氧六环和水以体积比4:1得到的混合溶剂;反应温度为80-140℃。中间体B-5酯水解反应得到中间体B-6,反应条件e为有机碱或无机碱催化的情况下进行,所述有机碱包括三乙胺、N,N-二异丙基乙胺,无机碱包括碳酸钠、碳酸钾、碳酸铯、磷酸钠、氢氧化钠、氢氧化钾;反应溶剂为甲醇、乙醇、丙醇、丙酮、N,N-二甲基甲酰胺或二甲基亚砜;优选反应条件为氢氧化钠做缚酸剂,乙醇做溶剂,80℃反应。中间体B-6和取代的脂肪胺发生酰化反应得到中间体B-7,反应条件f采用路线一中反应路线g的反应条件。中间体B-7通过脱除Boc保护基反应得到目标产物B-8,反应条件g采用路线一中反应路线h的反应条件。
本发明还提供所述芳香六元环并咪唑类衍生物或其在药学上可接受的盐,或包含该衍生物的药物组合物作为赖氨酸特异性去甲基化酶1抑制剂的应用。
本发明还提供所述芳香六元环并咪唑类衍生物或其在药学上可接受的盐,或包含该衍生物的药物组合物用于制备肿瘤疾病治疗的药物。
本发明的优点:
1)本发明提供的46个优选的芳香六元环并咪唑类衍生物作为LSD1抑制剂,在体外酶水平表现出较好的活性。
2)区别于现有的反苯基环丙胺母核结构的不可逆抑制剂,本发明为LSD1抑制剂研究领域,提供了新骨架化合物。
3)本发明所采用的合成路线原料价廉易得,所用试剂为常用试剂,反应条件温和,后处理简单,可高效制备该类型化合物。
具体实施方式
实施例旨在阐述而不是限制本发明的范围。化合物的核磁共振氢谱用BrukerARX-400测定,质谱用Agilent 1100LC/MSD测定;所用试剂均为分析纯或化学纯。
表1.实施例结构式、化学名、相对分子质量
实施例1
N-(2-氨基乙基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺的合成,采用路线一的制备路线
步骤1:4-氯-3-硝基苯甲酸甲酯(A-2)的制备
将4-氯-3-硝基苯甲酸(10g,49.6mmol)加入到500mL单口反应瓶中,加入250mL甲醇,室温下搅拌使其溶解完全。随后将浓硫酸10mL缓慢滴加到反应液中,加毕,升温至65℃继续反应4h。冷却反应液至室温,将反应液减压浓缩,搅拌下加入400mL水,析出白色固体,抽滤并用水润洗滤饼,干燥,得粗品白色固体10.2g,收率95.4%。
步骤2:3-硝基-4-(对甲苯基氨基)苯甲酸甲酯(A-3)的制备
将A-2(5.4g,25mmol)和4-甲基苯胺(8g,75mmol)加入到250mL反应瓶中,加入50mL二甲基亚砜,升温至70℃反应12h。冷却反应液至室温,加入100mL水,析出橙色固体,抽滤并用水润洗滤饼,干燥,得粗品橙色固体6.2g,收率86.7%。
步骤3:3-氨基-4-(对甲苯基氨基)苯甲酸甲酯(A-4)的制备
将A-3(2g,7mmol)和10%钯碳(0.2g)加入到100mL反应瓶中,加入40mL甲醇。氢气条件下,室温反应12h。过滤,将滤液减压浓缩,得粗品淡黄色固体1.7g,收率94.9%。
步骤4:(E)-3-((4-氰基亚苄基)氨基)-4-(对甲苯基氨基)苯甲酸甲酯(A-5)的制备
将A-4(1.5g,5.9mmol)和4-氰基苯甲醛(1g,7.6mmol)加入到100mL反应瓶中,滴加0.5mL醋酸,加入30mL乙醇,升温至80℃反应12h。冷却反应液至室温,将反应液减压浓缩得到粗品黄色固体1.6g,不需处理直接用于下一步反应,收率73.5%。
步骤5:2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-羧酸甲酯(A-6)的制备
将A-5(1.6g,4.3mmol)加入到100mL反应瓶中,加入30mL三氟乙醇,在搅拌下缓慢加入N-碘代丁二酰亚胺(1.8g,8mmol),升温至50℃反应2h。减压浓缩反应液,加入饱和硫代硫酸钠溶液,用乙酸乙酯(40mL×3)萃取,饱和氯化钠溶液(40mL×3)洗涤。将乙酸乙酯相用无水硫酸钠干燥,减压浓缩。经硅胶柱层析纯化得白色固体0.95g,收率60.2%。
步骤6:2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-羧酸(A-7)的制备
将A-6(5g,13.6mmol)和氢氧化钠(1.6g,40.8mmol)加入到250mL反应瓶中,加入100mL乙醇,80℃反应3h。冷却反应液至室温,将反应液浓缩,加水稀释后抽滤除去不溶物,用1N的盐酸将pH调节至2,析出白色固体,干燥,得粗品白色固体4.3g,收率89.6%。
步骤7:(2-(2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺基)乙基)氨基甲酸叔丁酯(A-8)的制备
将A-7(0.35g,1mmol)、N-叔丁氧羰基-1,2-乙二胺(0.4g,2.5mmol)和HATU(0.38g,1.0mmol)加入50mL反应瓶中,加入10mL无水N,N-二甲基甲酰胺和0.19mL N,N-二异丙基乙胺,40℃反应12h。将反应液倒入50mL水中,用二氯甲烷(30mL×3)萃取,饱和氯化钠溶液(30mL×3)洗涤,合并有机相,用无水硫酸钠干燥,减压浓缩。经硅胶柱层析纯化得白色固体0.4g,收率80.7%。
步骤8:N-(2-氨基乙基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺(A-9)的制备
将A-8(0.25g,0.5mmol)加入50mL反应瓶中,加入20mL 2N盐酸/乙酸乙酯溶液,室温下搅拌反应2h。减压浓缩反应液,加入5mL水,用5N氢氧化钠溶液调节pH至10。用二氯甲烷(10mL×3)萃取,饱和氯化钠溶液(10mL×3)洗涤,合并有机相,用无水硫酸钠干燥,减压浓缩得白色固体0.18g,收率93.1%。
实施例2-26采用实施例1中的制备方法,制备表1所示相应化合物。
实施例27
N-(2-氨基乙基)-2-(4-氟苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺的合成,采用路线二的制备路线
步骤1:3-硝基-4-(对甲苯胺)苯甲酸(A-10)的制备
按照实施例1中步骤6的操作方法,由化合物A-3合成3-硝基-4-(对甲苯胺)苯甲酸(A-10)。
步骤2:(2-(N-甲基-3-硝基-4-(对甲苯基氨基)苯甲酰胺基)乙基)氨基甲酸叔丁酯(A-11)的制备
按照实施例1中步骤7的操作方法,由化合物A-10合成(2-(N-甲基-3-硝基-4-(对甲苯基氨基)苯甲酰胺基)乙基)氨基甲酸叔丁酯(A-11)。
步骤3:(2-(3-氨基-N-甲基-4-(对甲苯基氨基)苯甲酰胺基)乙基)氨基甲酸叔丁酯(A-12)的制备
按照实施例1中步骤3的操作方法,由化合物A-11合成(2-(3-氨基-N-甲基-4-(对甲苯基氨基)苯甲酰胺基)乙基)氨基甲酸叔丁酯(A-12)。
步骤4:(E)-(2-(3-((4-氟亚苄基)氨基)-N-甲基-4-(对甲苯基氨基)苯甲酰氨基)乙基)氨基甲酸叔丁酯(A-13)的制备
按照实施例1中步骤4的操作方法,由化合物A-12合成(E)-(2-(3-((4-氟亚苄基)氨基)-N-甲基-4-(对甲苯基氨基)苯甲酰氨基)乙基)氨基甲酸叔丁酯(A-13)。
步骤5:(2-(2-(4-氟苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺基)乙基)氨基甲酸叔丁酯(A-14)的制备
按照实施例1中步骤5的操作方法,由化合物A-13合成(2-(2-(4-氟苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺基)乙基)氨基甲酸叔丁酯(A-14)。
步骤6:N-(2-氨基乙基)-2-(4-氟苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺(A-15)的制备
按照实施例1中步骤8的操作方法,由化合物A-14合成N-(2-氨基乙基)-2-(4-氟苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺(A-15)。
实施例28-31采用实施例27中的制备方法,制备表1所示相应的化合物。
实施例32
4-(6-(哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈的合成,采用路线三的制备路线
步骤1:6-氨基烟酸甲酯(B-2)的制备
按照实施例1中步骤1的操作方法,由6-氨基烟酸合成得到6-氨基烟酸甲酯(B-2)。
步骤2:2-(对甲苯基)咪唑并[1,2-a]吡啶-6-羧酸甲酯(B-3)的制备
将B-2(10g,65.8mmol)、2-溴-4'-甲基苯乙酮(13.9g,65.8mmol)和碳酸钾(9.1g,65.8mmol)加入500mL反应瓶中,加入200mL乙醇,80℃反应5h。冷却反应液至室温,减压浓缩反应液,经硅胶柱层析纯化得黄色固体9.8g,收率56%。
步骤3:3-碘-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-羧酸甲酯(B-4)的制备
将B-3(8g,30.1mmol)加入到250mL反应瓶中,加入100mL乙腈,在搅拌下缓慢加入N-碘代丁二酰亚胺(7.4g,32.9mmol),室温反应1h。减压浓缩反应液,将反应液倒入100mL水中,析出黄色固体,抽滤并用水润洗滤饼,干燥,得粗品黄色固体11.3g,收率95.8%。
步骤4:3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-羧酸甲酯(B-5)的制备
将B-4(5g,12.8mmol)、Pd(dppf)Cl2(0.5g,0.7mmol)、碳酸钾(5.3g,38.4mmol)和4-氰基苯硼酸(2.3g,15.6mmol)加入100mL反应瓶中,加入二氧六环30mL和水7.5mL。在氩气保护下90℃反应12h。冷却反应液,浓缩反应液,加入40mL水,用乙酸乙酯(40mL×3)萃取,饱和食盐水(40mL×3)洗涤。将乙酸乙酯相用无水硫酸钠干燥,减压浓缩。经硅胶柱层析纯化得黄色固体3.4g,收率72.3%。
步骤5:3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-羧酸(B-6)的制备
按照实施例1中步骤6的操作方法,由化合物B-5合成得到3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-羧酸(B-6)。
步骤6:4-(3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-羰基)哌嗪-1-羧酸叔丁酯(B-7)的制备
按照实施例1中步骤7的操作方法,合成得到4-(3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-羰基)哌嗪-1-羧酸叔丁酯(B-7)。
步骤7:4-(6-(哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈(B-8)的制备
按照实施例1中步骤8的操作方法,由化合物B-7合成得到4-(6-(哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈(B-8)。
实施例33-46采用实施例32中的制备方法,制备表1所示相应化合物。
本发明部分产物的体外药理测试
本发明采购Cayman公司的700120试剂盒对上述实施例1-46中所有化合物的LSD1抑制活性进行检测,具体操作步骤如下:
(1)检测设置100%活性孔、背景孔、阳性对照孔和化合物孔。每组设三个复孔。
(2)100%活性孔:依次加入120μL LSD1 Buffer溶液、10μL溶液(与溶解化合物和阳性药相同成分的溶液)、20μL LSD1酶、20μL LSD1检测肽。
(3)测试孔和阳性对照孔:依次加入120μL LSD1 Buffer溶液、10μL待测化合物溶液、20μL LSD1酶、20μL LSD1检测肽。
(4)背景孔:依次加入140μL LSD1 Buffer溶液、10μL溶液(与溶解化合物和阳性药相同成分的溶液)、20μL LSD1酶。
(5)加溶液过程中将96孔板置于冰袋上降温,防止酶促反应的进行。加毕,避光,室温孵育30min。
(6)孵育30min后,依次向每个孔加入20μL辣根过氧化物酶溶液、10μL荧光底物溶液。避光,室温孵育10min。
(7)酶标仪530nM波长下激发,检测590nM的发射荧光的强弱。
抑制率%=(100%活性孔–样品孔)/100%活性孔*100
表2.实施例1-46中制得化合物的核磁氢谱、酶抑制活性数据
本发明中通式(Ⅰ)所示的芳香六元环并咪唑衍生物及其药学上可接受的盐可单独施用,但通常是和药用载体混合物给予,所述药用载体的选择要根据所需用药途径和标准药物实践,下面分别用该类化合物的各种药物剂型,例如片剂、胶囊剂、注射剂、气雾剂、栓剂、膜剂、滴丸剂、外用搽剂和软膏剂的制备方法,说明其在制药领域中的新应用。
实施例47
片剂
含有实施例1中制得的芳香六元环并咪唑衍生物10g,按照药剂学一般压片法加辅料20g混匀后,压制成100片,每片重300mg。
实施例48
胶囊剂
含有实施例2中制得的芳香六元环并咪唑衍生物10g,按照药剂学胶囊剂的要求将辅料20g混匀后,装入空心胶囊,每个胶囊重300mg。
实施例49
注射剂
含有实施例3中制得的芳香六元环并咪唑衍生物10g,按照药剂学常规方法,进行活性炭吸附,经0.65μm微孔滤膜过滤后,填入氮气罐制成水针制剂,每只装2mL,共灌装100瓶。
实施例50
气雾剂
含有实施例1中制得的芳香六元环并咪唑衍生物10g,用适量丙二醇溶解后,加入蒸馏水及其他辐料后,制成500mL的澄清溶液即得。
实施例51
栓剂
含有实施例1中制得的芳香六元环并咪唑衍生物10g,将之研细加入甘油适量,研匀后加入已熔化的甘油明胶,研磨均匀,倾入已涂润滑剂的模型中,制得栓剂50颗
实施例52
膜剂
将聚乙烯醇、药用甘油、水搅拌膨胀后加热溶解,80目筛网过滤,将含有实施例18中制得的芳香六元环并咪唑衍生物10g加入到滤液中搅拌溶解,涂膜机制膜100片。
实施例53
滴丸剂
含有实施例5中制得的芳香六元环并咪唑衍生物10g,与明胶等基质50g加热熔化混匀后,滴入低温液体石蜡中,共制得滴丸1000丸。
实施例54
外用搽剂
含有实施例5中制得的芳香六元环并咪唑衍生物10g,按照常规药剂学方法与乳化剂等辅料2.5g混合研磨,再加蒸馏水至200mL制得。
实施例55
软膏剂
含有实施例35中制得的芳香六元环并咪唑衍生物10g,研细后与凡士林等油性基质500g研匀制得。
尽管已经通过特定实施方案描述了本发明,但修改和等价变化对于精通此领域的技术人员而言是显见的,且它们都包含在本发明范围。
Claims (9)
1.一种芳香六元环并咪唑类衍生物或其在药学上可接受的盐,其特征在于,所述芳香六元环并咪唑类衍生物结构通式为;
其中:
W,X各自独立地为C或N,且其中一个为C时,另一个只能为N;
R1和R2各自独立地选自芳基、杂芳基、环烷基、烷基、杂环基、环烷基烷基、杂环基烷基、芳烷基、杂芳基烷基;其中,所述的芳基、杂芳基、环烷基、烷基、杂环基、环烷基烷基、杂环基烷基、芳烷基、杂芳基、烷基可含有一个或多个取代基;
R3为-CH2-、羰基或硫代羰基;
R4为被取代的N-杂环基、被取代的-N(H)-杂环基烷基、被取代的-N(Me)-杂环基烷基或-N(R5)2;
R5选自氢、C1~C7脂肪伯胺、C1~C7脂肪仲胺、C1~C7脂肪叔胺,优选为丙胺、N-甲基丙胺或N,N-二甲基丙胺。
3.根据权利要求1所述的芳香六元环并咪唑类衍生物或其在药学上可接受的盐,其特征在于,所示芳香六元环并咪唑类衍生物为以下46个化合物中任一种:
N-(2-氨基乙基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(5-(3-甲基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(吗啉-4-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(3-氨基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
N-(3-氨基丙基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(哌啶-4-基甲基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(哌啶-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(5-(4-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
2-(4-氰基苯基)-N-(哌啶-4-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(吡咯烷-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(5-(4-甲基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(2-甲基哌啶-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
2-(4-氰基苯基)-N,N-二甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-(2-(甲基氨基)乙基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(R)-2-(4-氰基苯基)-N-(吡咯烷-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(R)-2-(4-氰基苯基)-N-(哌啶-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(R)-4-(5-(2-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
(S)-4-(5-(2-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
4-(5-(2-甲基哌嗪-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
N-(6-氨基己基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-(4-氰基苯基)-N-甲基-N-(2-(甲基氨基)乙基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(4-氨基丁基)-2-(4-氰基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-2-(4-氰基苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
(S)-4-(5-(3-氨基吡咯烷-1-羰基)-1-(对甲苯基)-1H-苯并[d]咪唑-2-基)苯甲腈
(R)-2-(4-氰基苯基)-N-(吡咯烷-3-基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-2-(4-氟苯基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-N-甲基-2-(4-硝基苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
2-([1,1'-联苯]-4-基)-N-(2-氨基乙基)-N-甲基-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-N-甲基-1-(对甲苯基)-2-(4-(三氟甲基)苯基)-1H-苯并[d]咪唑-5-甲酰胺
N-(2-氨基乙基)-N-甲基-2-(4-(甲基磺酰基)苯基)-1-(对甲苯基)-1H-苯并[d]咪唑-5-甲酰胺
4-(6-(哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-(哌啶-4-基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
4-(6-(4-氨基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
N-(4-氨基丁基)-3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
N-(2-氨基乙基)-3-(4-氰基苯基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
4-(6-(3-氨基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-(哌啶-4-基甲基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
3-(4-氰基苯基)-N-(哌啶-3-基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
(R)-4-(6-(3-氨基吡咯烷-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-(2-(甲基氨基)乙基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺
(R)-4-(6-(2-甲基哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
(S)-4-(6-(2-甲基哌嗪-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
4-(6-(4-甲基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
4-(6-(2-甲基哌啶-1-羰基)-2-(对甲苯基)咪唑并[1,2-a]吡啶-3-基)苯甲腈
3-(4-氰基苯基)-N-甲基-2-(对甲苯基)咪唑并[1,2-a]吡啶-6-甲酰胺。
4.一种药物组合物,其特征在于,以权利要求1-3任一项所述的芳香六元环并咪唑类衍生物或其药学上可接受的盐作为活性成分,与药学上可接受的载体或赋型剂混合制备而成,并制备成临床上可接受的剂型。
5.一种权利要求3所述芳香六元环并咪唑类衍生物或其在药学上可接受的盐的制备方法,其特征在于,所述芳香六元环并咪唑类衍生物的制备方法包括如下步骤:
路线一:起始原料A-1通过酯化反应得到中间体A-2,反应条件a为强酸催化下成酯,或是以酰化试剂酰化成酯,或是以二环己基碳二亚胺和4-二甲氨基吡啶催化下成酯,反应温度为65-85℃;中间体A-2和取代的芳香胺或脂肪胺通过亲核取代反应得到中间体A-3,反应条件b为有机碱或无机碱做缚酸剂的情况下进行;中间体A-3经过还原反应得到中间体A-4,反应条件c为钯类催化剂下的氢化还原,或是采用还原性金属与无机酸组合进行还原,所述还原性金属与无机酸组合包括铁粉/氯化铵、铁粉/盐酸、锌粉/醋酸;中间体A-4与取代的芳香醛或脂肪醛发生亲核加成脱水反应得到中间体A-5,反应条件d为醋酸、对甲苯磺酸或路易斯酸催化下进行,反应温度为80-100℃;中间体A-5在碘催化下经过成环反应得到中间体A-6,反应条件e为碘、N-碘代丁二酰亚胺或氯化碘催化下进行;中间体A-6通过酯水解反应得到中间体A-7,反应条件f为有机碱或无机碱催化的情况下进行;中间体A-7和取代的脂肪胺发生酰化反应得到中间体A-8,反应条件g为在缩合剂的情况下进行;中间体A-8通过脱除Boc保护基反应得到目标产物A-9,反应条件h为酸催化下,加热4-12h;酸为三氟乙酸或盐酸,反应温度为25-80℃;
路线二:路线二中的反应条件和操作方法采用路线一中的相应反应条件和操作方法;
路线三:起始原料B-1通过酯化反应得到中间体B-2,反应条件a为强酸催化下成酯,或是酰化试剂酰化成酯,或是二环己基碳二亚胺和4-二甲氨基吡啶催化下成酯;中间体B-2和取代的α-卤代饱和羰基化合物通过成环反应得到中间体B-3,反应条件b为有机碱或无机碱做缚酸剂的情况下进行;中间体B-3通过碘化反应得到中间体B-4,反应条件c为碘、N-碘代丁二酰亚胺或氯化碘催化下碘化;中间体B-4与取代的芳基硼酸或脂肪硼酸经铃木反应得中间体B-5,反应条件d为钯配合物催化、无机碱和无氧条件下加热反应,反应温度为80-140℃;中间体B-5酯水解反应得到中间体B-6,反应条件e为有机碱或无机碱催化的情况下进行;中间体B-6和取代的脂肪胺发生酰化反应得到中间体B-7,反应条件f采用路线一中反应路线g的反应条件;中间体B-7通过脱除Boc保护基反应得到目标产物B-8,反应条件g采用路线一中反应路线h的反应条件。
6.根据权利要求5所述芳香六元环并咪唑类衍生物的制备方法,其特征在于,所述路线一中,所述有机碱包括三乙胺、N,N-二异丙基乙胺,无机碱包括碳酸钠、碳酸钾、碳酸铯、磷酸钠、氢氧化钠、氢氧化钾;所述反应溶剂为甲醇、乙醇、丙醇、异丙醇、四氢呋喃、二氯甲烷、甲苯、水、三氟乙醇、丙酮、1,4-二氧六环、乙酸乙酯、N,N-二甲基甲酰胺、二甲基亚砜中的任一种或是两种以上的混合溶剂;所述缩合剂为2-(7-氧化苯并三氮唑)-N,N,N',N'-四甲基脲六氟磷酸酯、O-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐、O-(5-氯苯并三氮唑-1-基)-二(二甲胺基)碳鎓六氟磷酸盐、O-(苯并三氮唑-1-基)-二(二甲胺基)碳鎓四氟硼酸盐、O-(N-丁二酰亚胺基)-二(二甲胺基)碳鎓四氟硼酸盐、O-(N-endo-5-降莰烯-2,3-二碳二酰亚胺)-二(二甲胺基)碳鎓四氟硼酸盐、二苯基磷酰氯、氰代磷酸二乙酯、叠氮化磷酸二苯酯、硫代二甲基磷酰基叠氮、二(2-氧-3-唑烷基)磷酰氯或2,4,6-三丙基-1,3,5,2,4,6-三氧三磷酸-2,4,6-三氧化物。
7.根据权利要求5所述芳香六元环并咪唑类衍生物的制备方法,其特征在于,所述路线三中,所述有机碱包括三乙胺、N,N-二异丙基乙胺,无机碱包括碳酸钠、碳酸钾、碳酸锂、碳酸铯、磷酸钠、氢氧化钠、氢氧化钾、氟化钾;所述反应溶剂为甲醇、乙醇、丙醇、丙酮、1,4-二氧六环、四氢呋喃、甲苯、N,N-二甲基甲酰胺、二甲基亚砜、三氟乙醇、乙腈、水和乙二醇二甲醚中的任一种或两种以上的混合溶剂;所述钯配合物为Pd(PPh3)4、PdCl2、PdCl2(dppf)、Pd(OAc)2或Pd(PPh3)2Cl2。
8.一种权利要求1-3任一项所述芳香六元环并咪唑类衍生物或其在药学上可接受的盐,或权利要求4所述药物组合物作为赖氨酸特异性去甲基化酶1抑制剂的应用。
9.一种权利要求1-3任一项所述芳香六元环并咪唑类衍生物或其在药学上可接受的盐,或权利要求4所述药物组合物在制备肿瘤疾病治疗药物中的应用。
Priority Applications (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202210630523.9A CN114853680A (zh) | 2022-06-06 | 2022-06-06 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
| CN202310062072.8A CN116120239A (zh) | 2022-06-06 | 2023-01-16 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
| PCT/CN2023/097215 WO2023236820A1 (zh) | 2022-06-06 | 2023-05-30 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202210630523.9A CN114853680A (zh) | 2022-06-06 | 2022-06-06 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN114853680A true CN114853680A (zh) | 2022-08-05 |
Family
ID=82624920
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210630523.9A Pending CN114853680A (zh) | 2022-06-06 | 2022-06-06 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
| CN202310062072.8A Pending CN116120239A (zh) | 2022-06-06 | 2023-01-16 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202310062072.8A Pending CN116120239A (zh) | 2022-06-06 | 2023-01-16 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
Country Status (2)
| Country | Link |
|---|---|
| CN (2) | CN114853680A (zh) |
| WO (1) | WO2023236820A1 (zh) |
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023236820A1 (zh) * | 2022-06-06 | 2023-12-14 | 沈阳药科大学 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2007086080A2 (en) * | 2006-01-30 | 2007-08-02 | Glenmark Pharmaceuticals Limited | NOVEL IMIDAZO[1,2-a]PYRIDINE CANNABINOID RECEPTOR LIGANDS AND PHARMACEUTICAL COMPOSITIONS CONTAINING THEM |
| WO2009119776A1 (ja) * | 2008-03-27 | 2009-10-01 | 武田薬品工業株式会社 | 縮合複素環誘導体およびその用途 |
| EP2358202B1 (en) * | 2008-11-03 | 2016-06-15 | Merck Sharp & Dohme Corp. | Benzimidazole and aza-benzimidazole carboxamides |
| WO2011035941A1 (en) * | 2009-09-25 | 2011-03-31 | Oryzon Genomics S.A. | Lysine specific demethylase-1 inhibitors and their use |
| WO2021007350A1 (en) * | 2019-07-09 | 2021-01-14 | Icagen, Llc | Bcat modulation |
| US20230234943A1 (en) * | 2020-06-26 | 2023-07-27 | Tempest Therapeutics, Inc. | Trex1 inhibitors and uses thereof |
| CN114853680A (zh) * | 2022-06-06 | 2022-08-05 | 沈阳药科大学 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
-
2022
- 2022-06-06 CN CN202210630523.9A patent/CN114853680A/zh active Pending
-
2023
- 2023-01-16 CN CN202310062072.8A patent/CN116120239A/zh active Pending
- 2023-05-30 WO PCT/CN2023/097215 patent/WO2023236820A1/zh unknown
Cited By (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2023236820A1 (zh) * | 2022-06-06 | 2023-12-14 | 沈阳药科大学 | 芳香六元环并咪唑类衍生物及其制备方法和应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2023236820A1 (zh) | 2023-12-14 |
| CN116120239A (zh) | 2023-05-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN114555586B (zh) | Krasg12c蛋白抑制剂及其制备方法和用途 | |
| CN114340740A (zh) | β肾上腺素能激动剂及其使用方法 | |
| CN112341451B (zh) | 一种免疫调节剂 | |
| CN110563703B (zh) | 基于crbn配体诱导parp-1降解的化合物及制备方法和应用 | |
| CN113354622B (zh) | 对苯二胺类lsd1抑制剂及其制备方法 | |
| CN112110936B (zh) | 四氢喹啉类衍生物及其制备方法和应用 | |
| KR20220012248A (ko) | 퀴나졸린 화합물 및 이의 의약품에서의 응용 | |
| EA029497B1 (ru) | Производные бензимидазолона в качестве ингибиторов бромодомена | |
| CN114805261B (zh) | 苯并呋喃类lsd1抑制剂及其制备方法 | |
| KR20170033339A (ko) | 새로운 인돌리진 유도체 및 신경변성 질환에서의 이들의 용도 | |
| AU2010212560A1 (en) | Derivatives of azaindoles as inhibitors of protein kinases Abl and Src | |
| CA3173510A1 (en) | Novel benzimidazole derivative | |
| CN114853680A (zh) | 芳香六元环并咪唑类衍生物及其制备方法和应用 | |
| JP6673932B2 (ja) | インドール及びアザインドール誘導体、並びに神経変性疾患におけるそれらの使用 | |
| CN111606888B (zh) | 吡咯类衍生物及其制备方法与应用 | |
| CN108017639B (zh) | Ido抑制剂及其制备方法和应用 | |
| CN111777626B (zh) | 一类维奈妥拉与二氢青蒿素拼合物及其制备与应用 | |
| CN115340502B (zh) | Bcl-xl抑制剂及其制备方法和用途 | |
| RU2809821C2 (ru) | Соединения на основе триазолопиримидина и их соли, композиции на их основе и пути их применения | |
| CN114573567B (zh) | 一种吲唑环联三氮唑类化合物及其制备方法和应用 | |
| CN115073547B (zh) | 一种甾体咔啉衍生物及其制备方法和应用、抗肿瘤药物组合物 | |
| CN114728965B (zh) | 吡啶并杂环类化合物、其制备方法及用途 | |
| CN118724908A (zh) | 杂环化合物及其用途 | |
| CN118724869A (zh) | 联苯化合物及其用途 | |
| CN117327065A (zh) | 作为多巴胺d2/3受体调节剂的咔唑类衍生物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| WD01 | Invention patent application deemed withdrawn after publication | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20220805 |