CN110903374A - 丝素蛋白提取方法、基于丝素蛋白/松萝酸的复合皮肤支架及其制备方法 - Google Patents
丝素蛋白提取方法、基于丝素蛋白/松萝酸的复合皮肤支架及其制备方法 Download PDFInfo
- Publication number
- CN110903374A CN110903374A CN201911322819.9A CN201911322819A CN110903374A CN 110903374 A CN110903374 A CN 110903374A CN 201911322819 A CN201911322819 A CN 201911322819A CN 110903374 A CN110903374 A CN 110903374A
- Authority
- CN
- China
- Prior art keywords
- silk fibroin
- solution
- usnic acid
- composite skin
- aqueous solution
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/43504—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates
- C07K14/43563—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from insects
- C07K14/43586—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans from invertebrates from insects from silkworms
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/14—Macromolecular materials
- A61L27/22—Polypeptides or derivatives thereof, e.g. degradation products
- A61L27/227—Other specific proteins or polypeptides not covered by A61L27/222, A61L27/225 or A61L27/24
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/54—Biologically active materials, e.g. therapeutic substances
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/58—Materials at least partially resorbable by the body
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L27/00—Materials for grafts or prostheses or for coating grafts or prostheses
- A61L27/50—Materials characterised by their function or physical properties, e.g. injectable or lubricating compositions, shape-memory materials, surface modified materials
- A61L27/60—Materials for use in artificial skin
-
- D—TEXTILES; PAPER
- D01—NATURAL OR MAN-MADE THREADS OR FIBRES; SPINNING
- D01F—CHEMICAL FEATURES IN THE MANUFACTURE OF ARTIFICIAL FILAMENTS, THREADS, FIBRES, BRISTLES OR RIBBONS; APPARATUS SPECIALLY ADAPTED FOR THE MANUFACTURE OF CARBON FILAMENTS
- D01F1/00—General methods for the manufacture of artificial filaments or the like
- D01F1/02—Addition of substances to the spinning solution or to the melt
- D01F1/10—Other agents for modifying properties
- D01F1/103—Agents inhibiting growth of microorganisms
-
- D—TEXTILES; PAPER
- D01—NATURAL OR MAN-MADE THREADS OR FIBRES; SPINNING
- D01F—CHEMICAL FEATURES IN THE MANUFACTURE OF ARTIFICIAL FILAMENTS, THREADS, FIBRES, BRISTLES OR RIBBONS; APPARATUS SPECIALLY ADAPTED FOR THE MANUFACTURE OF CARBON FILAMENTS
- D01F4/00—Monocomponent artificial filaments or the like of proteins; Manufacture thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/404—Biocides, antimicrobial agents, antiseptic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/40—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a specific therapeutic activity or mode of action
- A61L2300/412—Tissue-regenerating or healing or proliferative agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61L—METHODS OR APPARATUS FOR STERILISING MATERIALS OR OBJECTS IN GENERAL; DISINFECTION, STERILISATION OR DEODORISATION OF AIR; CHEMICAL ASPECTS OF BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES; MATERIALS FOR BANDAGES, DRESSINGS, ABSORBENT PADS OR SURGICAL ARTICLES
- A61L2300/00—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices
- A61L2300/60—Biologically active materials used in bandages, wound dressings, absorbent pads or medical devices characterised by a special physical form
- A61L2300/602—Type of release, e.g. controlled, sustained, slow
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Medicinal Chemistry (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Dermatology (AREA)
- Transplantation (AREA)
- Epidemiology (AREA)
- Oral & Maxillofacial Surgery (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Engineering & Computer Science (AREA)
- Zoology (AREA)
- Textile Engineering (AREA)
- Molecular Biology (AREA)
- General Chemical & Material Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Tropical Medicine & Parasitology (AREA)
- Genetics & Genomics (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Biochemistry (AREA)
- Gastroenterology & Hepatology (AREA)
- Toxicology (AREA)
- Insects & Arthropods (AREA)
- Manufacturing & Machinery (AREA)
- Biomedical Technology (AREA)
- Peptides Or Proteins (AREA)
- Materials For Medical Uses (AREA)
Abstract
本发明公开了一种丝素蛋白水溶液的提取方法:1)蚕茧剪碎清洗,碳酸钠脱胶,冲洗烘干得到丝素蛋白;2)将丝素蛋白置于溴化锂水溶液中得到丝素蛋白溶解液;3)剪取透析袋并置于碳酸氢钠和EDTA的混合溶液中沸腾处理,再放入EDTA溶液中沸腾处理;4)将溶解液倒入透析袋中透析,冷冻离心即得。还公开了一种基于丝素蛋白/松萝酸的复合皮肤支架和其制备方法:1)按前述方法提取丝素蛋白;2)取丝素蛋白水溶液烘干成丝素蛋白膜,碾碎,加入甲酸,搅拌,冷冻离心,得到丝素蛋白/甲酸完全溶解液;3)取松萝酸固体粉末与丝素蛋白/甲酸完全溶解液混合得到丝素蛋白/松萝酸混合液;4)取丝素蛋白/松萝酸混合液进行静电纺丝,即得。
Description
技术领域
本发明属于生物材料技术领域,具体涉及一种丝素蛋白提取方法、基于丝素蛋白/松萝酸的复合皮肤支架及其制备方法。
背景技术
近年来,越来越多的组织工程领域引入了基于天然柔性聚合物的复合型伤口敷料,其中研究最多的当是丝素蛋白。丝素蛋白(silk fibroin简称SF),是从蚕丝中提取的天然的,生物相容良好的,可生物降解的低成本聚合物纤维蛋白。家蚕茧中的SF是由甘氨酸,丙氨酸,丝氨酸,酪氨酸,缬氨酸组成的5263个氨基酸残基,而其它15种氨基酸仅占4.7%。其机械强度高、弹性好、生物相容性优良、可生物降解、高水和氧摄取、低免疫原性、成膜容易并可以保持良好的形态,非常适用于制备人工皮肤,因此丝素蛋白作为一种性能优秀的天然生物材料,在组织工程领域受到越来越多的关注。
蚕茧中主要含有的两种蛋白分别为丝素蛋白与丝胶蛋白,两种蛋白以一种复合体形式存在,丝胶蛋白包裹着丝素蛋白。有研究表明这种复合形式存在的蛋白质会在体内产生获得性免疫反应,当丝胶蛋白被脱去后,余下的丝素蛋白不会产生此免疫原性。丝素蛋白的传统提取方法包括使用盐酸/甲酸,甲酸/氯化钙,甲酸/溴化锂和HFIP(六氟异丙醇)做溶剂,得到丝素蛋白溶液。虽然此种方式只破坏少量氢键,可以极大的保护天然丝素蛋白的纤维结构与性能,但是其中存在大量的缺点,在甲酸/氯化钙体系中不能保持水溶液状态,加水会导致蛋白析出;在甲酸/溴化锂体系中,得到的水溶液必须保存在4℃的环境中,避免过早成胶;而HFIP是有毒试剂。另一种常见的提取方式是使用无机盐(溴化锂,氯化钙/乙醇/水),高浓度酸和高离子浓度的溶液经过溶解、透析和离心后得到丝素蛋白水溶液。使用此种方式溶解会让绝大部分无机盐离子进入丝素蛋白内部,切断大部分原始氢键的同时对丝素蛋白进行剪切从而使其充分溶解,避免了在温和环境下的溶解所造成的丝素蛋白水溶液不稳定等一系列缺点。但是传统的透析方式很难将溶解在溶解液中的无机盐离子及其他杂质离子彻底清除,这给后续对丝素蛋白水溶液的保存以及加工等各方面带来了极大的不便。综上所述,利用传统的透析方式提取出的丝素蛋白水溶液在不同方面有着不同的局限性,因此需要一种新型的提取方式。
皮肤作为人体中最大的器官,在感知外界刺激、调节体温、调控水分蒸发损失、保护体内各种组织和器官免受物理性或化学性损害、抵御病原微生物的侵袭等过程中发挥着重要作用。皮肤参与人体的新陈代谢过程,对于保持人体内环境的稳定,维持机体正常的生理功能具有重要意义。然而,由皮肤病变或烧伤、烫伤等外界伤害引起的皮肤破损和溃烂,常常由于缺乏可移植的自体皮肤致使皮肤修复缓慢,且严重影响了皮肤的各种生理功能。
细菌感染是影响皮肤伤口愈合的主要原因之一,伤口渗出液中含有的大量炎症因子、蛋白酶和自由基都会减缓伤口的愈合速度。此时,新型的皮肤敷料需要优异的抗菌性能,可在创面起到保护、防止体液/蛋白质流失、防止细菌侵入引起炎症的作用,而且还能通过在皮肤敷料中加入抗生素或生长因子等生物活性成分来抑制创面细菌感染,以促进伤口愈合。
目前人们大多通过对创面局部应用广谱抗生素或在敷料中添加抗生素来防治感染,这样不仅会产生细菌耐药,甚至一些抗菌剂还存在着一定的生物毒性,例如万古霉素可引起过敏反应、肾毒性等。临床上也通过添加纳米金属和抗生素等功能成分以增强敷料的抗菌性,但会引发细胞毒性与抗药性,威胁生物体安全。此外,也常将抗菌材料与棉织物复合使用,此类伤口敷料生物相容性差,不适宜与皮肤直接接触,在长期的使用过程中很有可能会引起身体的排异以及炎症反应,不利于创面的愈合及修复。因此,制备出一种能同时克服以上全部缺点的皮肤支架对伤口愈合具有重要意义。
已有研究表明,丝素蛋白可以作为载体用于如伤口功能敷料、药物缓释剂等;载有特定物质(如抗生素等)的丝素蛋白功能敷料对伤口的抗菌及修复具有一定程度的促进作用。迄今为止,除了由纯丝素蛋白制备的敷料外,已研制出由许多天然和合成聚合物、金属离子、抗微生物剂等生物活性物质与丝素蛋白支架混合而成的敷料,并广泛用于皮肤组织工程,比如壳聚糖、聚乙烯醇、银离子等。但现有的敷料或多或少都存在这样那样的问题,所以需要一种新型的制备方式。
松萝酸在抗菌、抗病毒、抗耐药菌生物膜、抗肿瘤等方面的活性作用机理研究不断有新的突破,利用松萝酸对抗白色念珠菌及其形成的生物膜,结果显示松萝酸对二者均具有超高的对抗性。此外,由松萝酸与丙烯酸树脂和聚乙烯吡咯烷酮制备的抗菌材料,其体外抗菌研究结果显示出此纤维支架对金黄色葡萄球菌的高度抑制作用。但由于松萝酸的溶解度极低,不溶于绝大多数溶剂,这很大程度上限制了松萝酸的应用。因此,选取一种合适的方式将其与丝素蛋白均匀混合就显得尤为重要。
发明内容
本发明的目的在于针对上述问题,提供一种丝素蛋白提取方法、丝素蛋白/松萝酸复合皮肤支架及其制备方法。
本发明实现其目的采用的技术方案是:
一种丝素蛋白水溶液的提取方法,包括如下步骤:
1)将蚕茧剪碎,超声清洗,放入碳酸钠溶液中沸腾脱胶,去离子水冲洗,烘干,得到脱胶丝素蛋白;
2)配制溴化锂水溶液,将步骤1)得到的脱胶丝素蛋白置于溴化锂水溶液中得到丝素蛋白溶解液;
3)分别配制EDTA溶液和碳酸氢钠溶液,取碳酸氢钠溶液与部分EDTA溶液混合得到碳酸氢钠和EDTA的混合溶液,剪取透析袋并置于碳酸氢钠和EDTA的混合溶液中沸腾处理8~12min,然后取出透析袋再放入EDTA溶液中沸腾处理6~10min,液封备用;
4)将步骤2)得到的溶解液倒入步骤3)处理好的透析袋中,利用纯水在磁力搅拌的条件下透析,结束后取出透析液进行冷冻离心,取上清液低温保存,得到丝素蛋白水溶液。
所述步骤3)中配制的EDTA溶液的浓度为1mM,碳酸氢钠溶液的浓度为0.02g/ml,取EDTA溶液和碳酸氢钠溶液按体积比1:0.8~1.2混合。
所述步骤3)中的EDTA溶液需首先使用氢氧化钠溶液调节其pH为7.8~8.0。
所述步骤4)中将步骤2)得到的溶解液倒入步骤3)处理好的透析袋中利用纯水透析的时间为48~60h,冷冻离心的时间为15~20min。
一种基于丝素蛋白/松萝酸的复合皮肤支架的制备方法,包括如下步骤:
1)采用上述方法提取丝素蛋白水溶液;
2)取步骤1)的丝素蛋白水溶液烘干成丝素蛋白膜,碾碎,按照丝素蛋白与甲酸的质量体积比为18%~20%加入甲酸,搅拌至丝素蛋白膜完全溶解,结束后将溶解液冷冻离心10~15min,得到丝素蛋白/甲酸完全溶解液;
3)取松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液混合,搅拌至松萝酸与丝素蛋白/甲酸完全溶解液充分混匀,松萝酸终浓度为0.5~5mg/ml,得到丝素蛋白/松萝酸混合液;
4)取丝素蛋白/松萝酸混合液进行静电纺丝,得到基于丝素蛋白/松萝酸的复合皮肤支架。
所述步骤2)中丝素蛋白膜溶解的条件为室温下180~200rpm磁力搅拌溶解,搅拌时间为48~72h。
所述步骤3)中搅拌条件为室温下140~160rpm磁力搅拌混合,搅拌时间为24~36h。
所述步骤4)调节静电纺丝参数具体指的是:外部施加电压为18~22kV,针头与接收板之间的距离为11~15cm,注射泵的推进速度为0.006~0.01ml/min,温度为22~24℃,相对湿度为40~45%,静电纺丝持续时间为3~4.5h。
一种基于丝素蛋白/松萝酸的复合皮肤支架,是采用前述的方法制备得到。
本发明的有益效果是:本发明提取出的丝素蛋白水溶液纯度极高,新型的透析方式避免了传统透析后溶液中残余的少量杂质离子对丝素蛋白水溶液在长期保存过程中的稳定性的影响,以及在后续加工等方面都给操作者带来的极大的便利。此丝素蛋白水溶液除了具有丝素蛋白所固有的优异的生物相容性和生物可降解性以外,经过长时间的沸腾脱胶和新型的透析方式提取出的丝素蛋白水溶液保证了丝胶蛋白的彻底脱离,丝素蛋白水溶液作为天然高分子聚合物柔性基底,克服了现有商用敷料基底对伤口产生的炎症反应、免疫反应等一系列的排异反应。
本发明的复合皮肤支架的制备方法首先解决了松萝酸不溶于绝大多数溶剂而使其分散不均匀所带来的一系列问题,本发明方法制备的丝素蛋白/松萝酸柔性皮肤支架,不仅具有良好的力学拉伸,而且高比表面积和孔隙率,将保证该丝素蛋白基底具备超高的松萝酸负载能力,且松萝酸在支架内均匀分布。本发明的丝素蛋白/松萝酸复合皮肤支架具有丝素蛋白优良的生物可降解性能,克服了现有商用纱布等敷料在移除时给患者带来的二次伤害等一系列问题,敷料中载有的松萝酸粉末具有优异的抗菌性能,其释放缓慢且持久,克服了一般敷料中药物的爆发式释放,具有持久抗菌的功效,更有益于伤口愈合;不管是对革兰氏阳性菌还是对革兰氏阴性菌的生长均具有明显的抑制作用,克服了单一抗菌的问题;且具有通透性好,质地柔软的优异性能,使该支架与伤口间存在相互作用:吸收伤口渗液,与伤口间无缝贴合,自身具有活性,能促进活性物质发挥作用,加速伤口愈合;本发明的复合皮肤支架在生物传感器、药物传递/释放、组织工程和生物医学方面有着重要应用前景。
附图说明
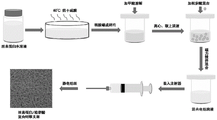
图1是本发明的基于丝素蛋白/松萝酸的复合皮肤支架的制备原理图。
图2是本发明的由不同浓度的丝素蛋白制备的复合皮肤支架的电镜扫描图,其中,a是复合皮肤支架样品5,b是复合皮肤支架样品1。
图3是本发明方法制得的复合皮肤支架在甲醇处理前后二级结构变化图,其中,a是甲醇处理前的复合皮肤支架的二级结构,b是甲醇处理后的复合皮肤支架的二级结构变化。
图4是本发明方法制备的复合皮肤支架的机械性能测试图
图5是本发明方法制备的复合皮肤支架的降解性能检测图。
图6是利用本发明的复合皮肤支架进行抗菌性能测试,其中a、b、c、d分别是复合皮肤支架对金黄色葡萄球菌、化脓性链球菌、大肠杆菌和绿脓杆菌生长的抑制作用。
图7是利用本发明的复合皮肤支架进行细胞相容性测试的结果。
具体实施方式
下面结合实施例对本发明作进一步说明,但并不因此而限制本发明。
下述实施例中的实验方法,如无特别说明,均为常规方法。
实施例1丝素蛋白水溶液的提取
一、制备丝素蛋白水溶液样品1
提取丝素蛋白水溶液,按照如下步骤操作:
1)取15个大小均匀的蚕茧,每个蚕茧剪成4份,超声清洗5min,重复2次,拧干之后置于60℃烘箱中烘干;将烘干的蚕茧置于0.02M的碳酸钠溶液中沸腾脱胶30min,取出脱胶丝先进行超声清洗,重复2次,每次时间至少为10min,再用超纯水彻底冲洗,烘干,得到丝素蛋白。
2)配制9.3M的溴化锂溶液备用,取出3g由步骤1)得到的丝素蛋白,紧压于50ml烧杯底部,加入12ml浓度为9.3M的溴化锂溶液,保鲜膜封口,放置于60℃的水浴锅中持续溶解4.5h。
3)配制1mM的EDTA溶液200ml,并用0.1M的氢氧化钠调节pH为7.8,取其中的100ml与80ml浓度为0.02g/ml的碳酸氢钠溶液混合,剪取13cm的透析袋(透析袋截留分子量为7000KDA)于此混合溶液中沸腾处理12min,再置于剩下的100ml EDTA溶液中沸腾处理10min,液封备用。
4)将步骤2)得到的溶解液倒入步骤3)处理好的透析袋中,用透析夹固定透析袋,置于超纯水中磁力搅拌透析60h,结束后取出透析液进行10000rpm、4℃冷冻离心20min,即得到浓度在0.065g/ml左右的丝素蛋白水溶液。
二、制备丝素蛋白水溶液样品2
提取丝素蛋白水溶液,按照如下步骤操作:
1)取15个大小均匀的蚕茧,每个蚕茧剪成4份,超声清洗5min,重复2次,拧干之后置于60℃烘箱中烘干;将烘干的蚕茧置于0.02M的碳酸钠溶液中沸腾脱胶45min,取出脱胶丝先进行超声清洗,重复2次,每次时间至少为10min,再用超纯水彻底冲洗,烘干,得到丝素蛋白。
2)配制9.3M的溴化锂溶液备用,取出3g由步骤1)得到的丝素蛋白,紧压于50ml烧杯底部,加入11ml浓度为9.3M的溴化锂溶液,保鲜膜封口,放置于60℃的水浴锅中持续溶解4h。
3)配制1mM的EDTA溶液200ml,并用0.1M的氢氧化钠调节pH为7.9,取其中的100ml与100ml浓度为0.02g/ml的碳酸氢钠溶液混合,剪取13cm的透析袋(透析袋截留分子量为7000KDA)于此混合溶液中沸腾处理10min,再置于剩下的100ml EDTA溶液中沸腾处理8min,液封备用。
4)将步骤2)得到的溶解液倒入步骤3)处理好的透析袋中,用透析夹固定透析袋,置于超纯水中磁力搅拌透析54h,结束后取出透析液进行8500rpm、4℃冷冻离心18min,即得到浓度在0.063g/ml左右的丝素蛋白水溶液。
三、制备丝素蛋白水溶液样品3
提取丝素蛋白水溶液,按照如下步骤操作:
1)取15个大小均匀的蚕茧,每个蚕茧剪成4份,超声清洗5min,重复2次,拧干之后置于60℃烘箱中烘干;将烘干的蚕茧置于0.02M的碳酸钠溶液中沸腾脱胶60min,取出脱胶丝先进行超声清洗,重复2次,每次时间至少为10min,再用超纯水彻底冲洗,烘干,得到丝素蛋白。
2)配制9.3M的溴化锂溶液备用,取出3g由步骤1)得到的丝素蛋白,紧压于50ml烧杯底部,加入10.5ml浓度为9.3M的溴化锂溶液,保鲜膜封口,放置于60℃的水浴锅中持续溶解3.5h。
3)配制1mM的EDTA溶液200ml,并用0.1M的氢氧化钠调节pH为8.0,取其中的100ml与120ml浓度为0.02g/ml的碳酸氢钠溶液混合,剪取13cm的透析袋(透析袋截留分子量为7000KDA)于此混合溶液中沸腾处理8min,再置于剩下的100ml EDTA溶液中沸腾处理6min,液封备用。
4)将步骤2)得到的溶解液倒入步骤3)处理好的透析袋中,用透析夹固定透析袋,置于超纯水中磁力搅拌透析48h,结束后取出透析液进行7000rpm、4℃冷冻离心15min,即得到浓度在0.062g/ml左右的丝素蛋白水溶液。
利用实施例1中的溶解方法和新型透析方式制备得到的丝素蛋白水溶液具有以下两大优点:一是浓度稳定。由于脱胶丝素蛋白在高浓度的溴化锂水溶液中溶解的环境较为恶劣,能使丝素蛋白内部所具有的绝大部分氢键断裂,使其几乎达到“完全溶解”的程度,这就避免了在其他溶解体系下的“部分不溶解”问题,进而避免了在离心过程中“不溶物”以沉淀形式存在,从而在很大程度上保证了丝素蛋白水溶液浓度的稳定性。二是纯度高。由于新的透析方式能在极大程度上去除丝素蛋白溶解液中近乎全部的杂质离子,使丝素蛋白水溶液的纯度相当高,在其长期保存过程中很难甚至不会在溶液内部出现各种反应,这给后续的操作带来极大的便利。
实施例2基于丝素蛋白/松萝酸的复合皮肤支架的制备
一种基于丝素蛋白/松萝酸的复合皮肤支架的制备方法,按照以下步骤操作(图1是本方法的原理图):
一、制备丝素蛋白/松萝酸复合皮肤支架样品1
1)按照实施例1中的方法制备丝素蛋白水溶液样品1;
2)取40ml丝素蛋白水溶液样品1置于直径为10cm玻璃培养皿中,45℃烘干成丝素蛋白膜,碾碎并置于烧杯中,按照丝素蛋白与甲酸的质量体积比为20%(即丝素蛋白为20g时,甲酸取100ml)加入甲酸,烧杯封口,在200rpm磁力搅拌条件下溶解72h,结束后将溶解液4℃冷冻离心15min,取上清液得到丝素蛋白/甲酸完全溶解液;
3)按照松萝酸终浓度为0.5mg/ml称取一定质量的松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液通过160rpm磁力搅拌混合36h,得到丝素蛋白/松萝酸混合液;
4)取4ml丝素蛋白/松萝酸混合液于10ml的一次性注射器中,调节静电纺丝各项参数如下:外部施加电压为22kV,针头与接收板之间的距离为15cm,注射泵的推进速度为0.01ml/min,温度为22℃,相对湿度为45%,静电纺丝持续时间为3h;
5)待静电纺丝结束后取下接收装置并置于温度为23℃的真空干燥箱中持续干燥26h。随后从接收板表面取下复合纤维支架,然后切割,得到大小均匀、厚度一致的小圆块复合皮肤支架。
二、制备丝素蛋白/松萝酸复合皮肤支架样品2
1)按照实施例1中的方法制备丝素蛋白水溶液样品1;
2)取40ml丝素蛋白水溶液样品1置于直径为10cm玻璃培养皿中,45℃烘干成丝素蛋白膜,碾碎并置于烧杯中,按照丝素蛋白与甲酸的质量体积比为20%(即丝素蛋白为20g时,甲酸取100ml)加入甲酸,烧杯封口,在200rpm磁力搅拌条件下溶解72h,结束后将溶解液4℃冷冻离心15min,取上清液得到丝素蛋白/甲酸完全溶解液;
3)按照松萝酸终浓度为1mg/ml称取一定质量的松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液通过160rpm磁力搅拌混合36h,得到丝素蛋白/松萝酸混合液;
4)取4ml丝素蛋白/松萝酸混合液于10ml的一次性注射器中,调节静电纺丝各项参数如下:外部施加电压为22kV,针头与接收板之间的距离为15cm,注射泵的推进速度为0.01ml/min,温度为22℃,相对湿度为45%,静电纺丝持续时间为3h;
5)待静电纺丝结束后取下接收装置并置于温度为23℃的真空干燥箱中持续干燥26h。随后从接收板表面取下复合纤维支架,然后切割,得到大小均匀、厚度一致的小圆块复合皮肤支架。
三、制备丝素蛋白/松萝酸复合皮肤支架3
1)按照实施例1中的方法制备丝素蛋白水溶液样品2;
2)取40ml丝素蛋白水溶液样品2置于直径为10cm玻璃培养皿中,45℃烘干成丝素蛋白膜,碾碎并置于烧杯中,按照丝素蛋白与甲酸的质量体积比为19%(即丝素蛋白为19g时,甲酸取100ml)加入甲酸,烧杯封口,在190rpm磁力搅拌条件下溶解60h,结束后将溶解液4℃冷冻离心13min,取上清液得到丝素蛋白/甲酸完全溶解液;
3)按照松萝酸终浓度为2mg/ml称取一定质量的松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液通过150rpm磁力搅拌混合30h,得到丝素蛋白/松萝酸混合液;
4)取5ml丝素蛋白/松萝酸混合液于10ml的一次性注射器中,调节静电纺丝各项参数如下:外部施加电压为20kV,针头与接收板之间的距离为13cm,注射泵的推进速度为0.008ml/min,温度为23℃,相对湿度为43%,静电纺丝持续时间为3.8h;
5)待静电纺丝结束后取下接收装置并置于温度为24℃的真空干燥箱中持续干燥24h。随后从接收板表面取下复合纤维支架,然后切割,得到大小均匀、厚度一致的小圆块复合皮肤支架。
四、制备丝素蛋白/松萝酸复合皮肤支架4
1)按照实施例1中的方法制备丝素蛋白水溶液样品2。
2)取40ml丝素蛋白水溶液样品2置于直径为10cm玻璃培养皿中,45℃烘干成丝素蛋白膜,碾碎并置于烧杯中,按照丝素蛋白与甲酸的质量体积比为19%(即丝素蛋白为19g时,甲酸取100ml)加入甲酸,烧杯封口,在190rpm磁力搅拌条件下溶解60h,结束后将溶解液4℃冷冻离心13min,取上清液得到丝素蛋白/甲酸完全溶解液;
3)按照松萝酸终浓度为3mg/ml称取一定质量的松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液通过150rpm磁力搅拌混合30h,得到丝素蛋白/松萝酸混合液;
4)取5ml丝素蛋白/松萝酸混合液于10ml的一次性注射器中,调节静电纺丝各项参数如下:外部施加电压为20kV,针头与接收板之间的距离为13cm,注射泵的推进速度为0.008ml/min,温度为23℃,相对湿度为43%,静电纺丝持续时间为3.8h;
5)待静电纺丝结束后取下接收装置并置于温度为24℃的真空干燥箱中持续干燥24h。随后从接收板表面取下复合纤维支架,然后切割,得到大小均匀、厚度一致的小圆块复合皮肤支架。
五、制备丝素蛋白/松萝酸复合皮肤支架5
1)按照实施例1中的方法制备丝素蛋白水溶液样品3。
2)取40ml丝素蛋白水溶液样品3置于直径为10cm玻璃培养皿中,45℃烘干成丝素蛋白膜,碾碎并置于烧杯中,按照丝素蛋白与甲酸的质量体积比为18%(即丝素蛋白为18g时,甲酸取100ml)加入甲酸,烧杯封口,在180rpm磁力搅拌条件下溶解48h,结束后将溶解液4℃冷冻离心10min,取上清液得到丝素蛋白/甲酸完全溶解液;
3)按照松萝酸终浓度为4mg/ml称取一定质量的松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液通过140rpm磁力搅拌混合24h,得到丝素蛋白/松萝酸混合液;
4)取6ml丝素蛋白/松萝酸混合液于10ml的一次性注射器中,调节静电纺丝各项参数如下:外部施加电压为18kV,针头与接收板之间的距离为11cm,注射泵的推进速度为0.006ml/min,温度为24℃,相对湿度为40%,静电纺丝持续时间为4.5h;
5)待静电纺丝结束后取下接收装置并置于温度为25℃的真空干燥箱中持续干燥23h。随后从接收板表面取下复合纤维支架,然后切割,得到大小均匀、厚度一致的小圆块复合皮肤支架。
六、制备丝素蛋白/松萝酸复合皮肤支架6
1)按照实施例1中的方法制备丝素蛋白水溶液样品3。
2)取40ml丝素蛋白水溶液样品3置于直径为10cm玻璃培养皿中,45℃烘干成丝素蛋白膜,碾碎并置于烧杯中,按照丝素蛋白与甲酸的质量体积比为18%(即丝素蛋白为18g时,甲酸取100ml)加入甲酸,烧杯封口,在180rpm磁力搅拌条件下溶解48h,结束后将溶解液4℃冷冻离心10min,取上清液得到丝素蛋白/甲酸完全溶解液;
3)按照松萝酸终浓度为5mg/ml称取一定质量的松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液通过140rpm磁力搅拌混合24h,得到丝素蛋白/松萝酸混合液;
4)取6ml丝素蛋白/松萝酸混合液于10ml的一次性注射器中,调节静电纺丝各项参数如下:外部施加电压为18kV,针头与接收板之间的距离为11cm,注射泵的推进速度为0.006ml/min,温度为24℃,相对湿度为40%,静电纺丝持续时间为4.5h;
5)待静电纺丝结束后取下接收装置并置于温度为25℃的真空干燥箱中持续干燥23h。随后从接收板表面取下复合纤维支架,然后切割,得到大小均匀、厚度一致的小圆块复合皮肤支架。
观察得到的支架的微观表面结构,图2是不同浓度的丝素蛋白通过静电纺丝得到的复合支架的电镜扫描图,其中,图2a是复合皮肤支架样品5,图2b是复合皮肤支架样品1,从图中可见复合皮肤支架表面微观结构是纳米纤维层层均匀堆积、纤维大小均匀、多孔状结构,表明支架具有良好的通透性,可以看出纤维直径与丝素蛋白的浓度有关,随丝素蛋白浓度的增加,纤维直径增加,三维结构更加明显,表明制备的复合支架具有三维多孔交联结构。
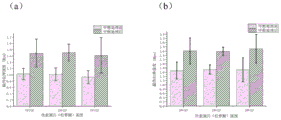
对得到的复合皮肤支架样品进行甲醇处理:采用无水甲醇(相对分子质量32.04)浸泡15min,然后用纯水彻底浸泡并涮洗,取出复合皮肤支架室温自然干燥。图3是复合皮肤支架样品1在甲醇处理前后的二级结构变化图,其中,图3a是甲醇处理前支架的内部的β-sheet含量图,图3b是甲醇处理后支架的内部的β-sheet含量图,表明制得的复合皮肤支架在经过甲醇处理后其内部结构发生变化,β-sheet含量增多,解决了“遇水即溶”的问题。
图4是本发明方法制备的各支架的机械性能测试图,表明松萝酸的加入不会改变支架的机械性能,其机械性能只与丝素蛋白的浓度有关,且随丝素蛋白的浓度增加而增强。
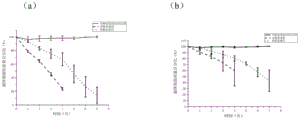
图5是本发明方法制备的各支架的降解性能检测图,其中,图5a是复合皮肤支架样品5,图5b是复合皮肤支架样品1。图4与图5表明本发明方法制备的支架基底具有优异的力学性能和生物可降解性能。
实施例3应用实例
一、丝素蛋白/松萝酸复合皮肤支架用于抑制不同种类的细菌生长:
按照实施例2中复合皮肤支架样品1的制备方法制备含不同浓度松萝酸的复合皮肤支架,并设置对照,支架中使用的丝素蛋白与甲酸的质量体积比为20%,松萝酸的浓度分别为0mg/ml(对照组)、0.5mg/ml、1mg/ml、2mg/ml、3mg/ml、4mg/ml、5mg/ml。
图6a和图6b展示的是复合皮肤支架对革兰氏阳性菌(分别为金黄色葡萄球菌和化脓性链球菌)、图6c和图6d展示的是复合皮肤支架对革兰氏阴性菌(分别为大肠杆菌和绿脓杆菌)生长的抑制作用,革兰氏阳性菌中松萝酸使用量0、0.5mg/ml、1mg/ml、2mg/ml、3mg/ml的支架在各图中分别对应的位置是正中间、右上、左上、右下和左下,革兰氏阴性菌中松萝酸使用量0、2mg/ml、3mg/ml、4mg/ml、5mg/ml的支架在各图中分别对应的位置是正中间、右上、左上、右下和左下。由平板表面的支架周围的抑菌光圈的大小可以直观的看出,不同浓度的松萝酸对四种不同种类的细菌的生长都具有明显的抑制作用,根据支架内部所含松萝酸浓度的不同,所展示出的抗菌光圈的大小不同,并且抗菌光圈的大小与松萝酸的浓度成正相关。
二、丝素蛋白/松萝酸复合皮肤支架的细胞相容性检测:
将前面的复合皮肤支架样品1、2和6分别置于细胞完全培养基中,在细胞孵育箱中浸泡一段时间以后,取出支架中松萝酸浓度为0.5mg/ml、1mg/ml和5mg/ml的浸泡液分别作为低浓度、中等浓度和高浓度实验组培养液对NIH3T3成纤维细胞进行正常培养,一段时间后观察细胞生长形态,如图7a所示,利用CCK-8对细胞进行计数测量,可以看出在各浓度浸泡液中培养的细胞在数量没有显著性差异,也说明该敷料不会影响细胞的正常生长,图7b、图7c、图7d、图7e和图7f分别展示的是利用普通细胞培养基、松萝酸浓度为0、0.5mg/ml、1mg/ml和5mg/ml培养基复合皮肤支架浸泡液对NIH3T3成纤维细胞进行正常培养,一段时间后观察细胞生长形态,表明在细胞形态上没有显著性差异,该抗菌敷料具有很好的细胞相容性。
Claims (9)
1.一种丝素蛋白水溶液的提取方法,其特征在于,包括如下步骤:
1)将蚕茧剪碎,超声清洗,放入碳酸钠溶液中沸腾脱胶,去离子水冲洗,烘干,得到脱胶丝素蛋白;
2)配制溴化锂水溶液,将步骤1)得到的脱胶丝素蛋白置于溴化锂水溶液中溶解得到丝素蛋白溶解液;
3)分别配制EDTA溶液和碳酸氢钠溶液,取碳酸氢钠溶液与部分EDTA溶液混合得到碳酸氢钠和EDTA的混合溶液,剪取透析袋并置于碳酸氢钠和EDTA的混合溶液中沸腾处理8~12min,然后取出透析袋再放入EDTA溶液中沸腾处理6~10min,液封备用;
4)将步骤2)得到的溶解液倒入步骤3)处理好的透析袋中,利用纯水在磁力搅拌的条件下透析,结束后取出透析液进行冷冻离心,取上清液低温保存,得到丝素蛋白水溶液。
2.如权利要求1所述的丝素蛋白水溶液的提取方法,其特征在于,所述步骤3)中配制的EDTA溶液的浓度为1mM,碳酸氢钠溶液的浓度为0.02g/ml,取EDTA溶液和碳酸氢钠溶液按体积比1:0.8~1.2混合。
3.如权利要求1所述的丝素蛋白水溶液的提取方法,其特征在于,所述步骤3)中的EDTA溶液需首先使用氢氧化钠溶液调节其pH为7.8~8.0。
4.如权利要求1所述的丝素蛋白水溶液的提取方法,其特征在于,所述步骤4)中将步骤2)得到的溶解液倒入步骤3)处理好的透析袋中利用纯水透析的时间为48~60h,冷冻离心的时间为15~20min。
5.一种基于丝素蛋白/松萝酸的复合皮肤支架的制备方法,其特征在于,包括如下步骤:
1)采用权利要求1的方法提取丝素蛋白水溶液;
2)取步骤1)的丝素蛋白水溶液烘干成丝素蛋白膜,碾碎,按照丝素蛋白与甲酸的质量体积比为18%~20%加入甲酸,搅拌至丝素蛋白膜完全溶解,结束后将溶解液冷冻离心10~15min,得到丝素蛋白/甲酸完全溶解液;
3)取松萝酸固体粉末与步骤2)得到的丝素蛋白/甲酸完全溶解液混合,搅拌至松萝酸与丝素蛋白/甲酸完全溶解液充分混匀,松萝酸终浓度为0.5~5mg/ml,得到丝素蛋白/松萝酸混合液;
4)取丝素蛋白/松萝酸混合液进行静电纺丝,得到基于丝素蛋白/松萝酸的复合皮肤支架。
6.如权利要求5所述的基于丝素蛋白/松萝酸的复合皮肤支架的制备方法,其特征在于,所述步骤2)中丝素蛋白膜溶解的条件为室温下180~200rpm磁力搅拌溶解,搅拌时间为48~72h。
7.如权利要求5所述的基于丝素蛋白/松萝酸的复合皮肤支架的制备方法,其特征在于,所述步骤3)中搅拌条件为室温下140~160rpm磁力搅拌混合,搅拌时间为24~36h。
8.如权利要求5所述的基于丝素蛋白/松萝酸的复合皮肤支架的制备方法,其特征在于,所述步骤4)调节静电纺丝参数具体指的是:外部施加电压为18~22kV,针头与接收板之间的距离为11~15cm,注射泵的推进速度为0.006~0.01ml/min,温度为22~24℃,相对湿度为40~45%,静电纺丝持续时间为3~4.5h。
9.一种基于丝素蛋白/松萝酸的复合皮肤支架,其特征在于,是采用权利要求5至8中的任意一种方法制备得到。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201911322819.9A CN110903374A (zh) | 2019-12-20 | 2019-12-20 | 丝素蛋白提取方法、基于丝素蛋白/松萝酸的复合皮肤支架及其制备方法 |
Applications Claiming Priority (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN201911322819.9A CN110903374A (zh) | 2019-12-20 | 2019-12-20 | 丝素蛋白提取方法、基于丝素蛋白/松萝酸的复合皮肤支架及其制备方法 |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN110903374A true CN110903374A (zh) | 2020-03-24 |
Family
ID=69826764
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201911322819.9A Pending CN110903374A (zh) | 2019-12-20 | 2019-12-20 | 丝素蛋白提取方法、基于丝素蛋白/松萝酸的复合皮肤支架及其制备方法 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN110903374A (zh) |
Cited By (10)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112326743A (zh) * | 2020-11-05 | 2021-02-05 | 重庆医科大学 | 基于丝素蛋白的c-sf-fa柔性导电薄膜和可穿戴式伤口监测传感器及其制备方法 |
| CN112931611A (zh) * | 2021-02-03 | 2021-06-11 | 中国科学院上海微系统与信息技术研究所 | 一种丝素蛋白溶液及其制备方法和食品保鲜方法 |
| CN113249876A (zh) * | 2021-06-10 | 2021-08-13 | 上海科技大学 | 一种离子导体材料及其制备方法和用途 |
| CN114699556A (zh) * | 2022-04-08 | 2022-07-05 | 深圳高性能医疗器械国家研究院有限公司 | 丝素蛋白修复补片的制备方法以及丝素蛋白修复补片 |
| CN114748683A (zh) * | 2022-04-26 | 2022-07-15 | 深圳湾实验室 | 用于制备烧创伤敷料的组合物及其制剂和制备方法 |
| CN114748682A (zh) * | 2022-04-26 | 2022-07-15 | 深圳湾实验室 | 用于制备烧创伤敷料的组合物及其制剂和制备方法 |
| CN114832144A (zh) * | 2022-04-26 | 2022-08-02 | 深圳湾实验室 | 广谱抗菌抗氧化丝素蛋白创可贴及其制备和应用 |
| CN114831967A (zh) * | 2022-04-26 | 2022-08-02 | 深圳湾实验室 | 广谱抗氧化丝素蛋白创口贴及其制备和应用 |
| CN115778936A (zh) * | 2022-12-16 | 2023-03-14 | 中国农业大学 | 松萝酸协同增效多黏菌素在抗革兰氏阴性细菌感染中的应用 |
| WO2023206055A1 (zh) * | 2022-04-26 | 2023-11-02 | 深圳湾实验室 | 丝素蛋白的改性及应用 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109706531A (zh) * | 2019-01-16 | 2019-05-03 | 南通纺织丝绸产业技术研究院 | 再生丝素蛋白/羟丙基甲基纤维素纳米纤维的制备方法 |
| CN110453378A (zh) * | 2019-07-03 | 2019-11-15 | 上海大学 | 一种磺酸基量子点/丝素蛋白复合纳米纤维膜及其制备方法和应用 |
-
2019
- 2019-12-20 CN CN201911322819.9A patent/CN110903374A/zh active Pending
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN109706531A (zh) * | 2019-01-16 | 2019-05-03 | 南通纺织丝绸产业技术研究院 | 再生丝素蛋白/羟丙基甲基纤维素纳米纤维的制备方法 |
| CN110453378A (zh) * | 2019-07-03 | 2019-11-15 | 上海大学 | 一种磺酸基量子点/丝素蛋白复合纳米纤维膜及其制备方法和应用 |
Non-Patent Citations (4)
| Title |
|---|
| SEMIH ÇALAMAK,ET AL: "Silk fibroin based antibacterial bionanotextiles as wound", 《MATERIALS SCIENCE AND ENGINEERING C》 * |
| 张锴: "静电纺超细纤维的形态结构控制及其在水净化领域的应用研究", 《中国优秀博硕士学位论文全文数据库(博士) 工程科技I辑》 * |
| 李冰冰等: "《生化与分子生物学实验指导》", 30 August 2014 * |
| 罗姮等: "松萝酸-丝素蛋白膜新型抗菌生物敷料的制备及性能研究", 《第七届全国地衣生物学研讨会》 * |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN112326743A (zh) * | 2020-11-05 | 2021-02-05 | 重庆医科大学 | 基于丝素蛋白的c-sf-fa柔性导电薄膜和可穿戴式伤口监测传感器及其制备方法 |
| CN112326743B (zh) * | 2020-11-05 | 2024-01-16 | 重庆医科大学 | 基于丝素蛋白的c-sf-fa柔性导电薄膜和可穿戴式伤口监测传感器及其制备方法 |
| CN112931611A (zh) * | 2021-02-03 | 2021-06-11 | 中国科学院上海微系统与信息技术研究所 | 一种丝素蛋白溶液及其制备方法和食品保鲜方法 |
| CN113249876A (zh) * | 2021-06-10 | 2021-08-13 | 上海科技大学 | 一种离子导体材料及其制备方法和用途 |
| CN114699556A (zh) * | 2022-04-08 | 2022-07-05 | 深圳高性能医疗器械国家研究院有限公司 | 丝素蛋白修复补片的制备方法以及丝素蛋白修复补片 |
| CN114748683A (zh) * | 2022-04-26 | 2022-07-15 | 深圳湾实验室 | 用于制备烧创伤敷料的组合物及其制剂和制备方法 |
| CN114748682A (zh) * | 2022-04-26 | 2022-07-15 | 深圳湾实验室 | 用于制备烧创伤敷料的组合物及其制剂和制备方法 |
| CN114832144A (zh) * | 2022-04-26 | 2022-08-02 | 深圳湾实验室 | 广谱抗菌抗氧化丝素蛋白创可贴及其制备和应用 |
| CN114831967A (zh) * | 2022-04-26 | 2022-08-02 | 深圳湾实验室 | 广谱抗氧化丝素蛋白创口贴及其制备和应用 |
| WO2023206055A1 (zh) * | 2022-04-26 | 2023-11-02 | 深圳湾实验室 | 丝素蛋白的改性及应用 |
| CN115778936A (zh) * | 2022-12-16 | 2023-03-14 | 中国农业大学 | 松萝酸协同增效多黏菌素在抗革兰氏阴性细菌感染中的应用 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN110903374A (zh) | 丝素蛋白提取方法、基于丝素蛋白/松萝酸的复合皮肤支架及其制备方法 | |
| Gholipourmalekabadi et al. | Silk fibroin for skin injury repair: where do things stand? | |
| Yao et al. | Novel bilayer wound dressing based on electrospun gelatin/keratin nanofibrous mats for skin wound repair | |
| Divyashri et al. | Applications of hydrogel‐based delivery systems in wound care and treatment: an up‐to‐date review | |
| Liu et al. | Magnesium oxide-incorporated electrospun membranes inhibit bacterial infections and promote the healing process of infected wounds | |
| Zhang et al. | Advances in wound dressing based on electrospinning nanofibers | |
| US20090162439A1 (en) | Silk fibroin coating | |
| CN110639050A (zh) | 丝素纳米纤维和基于丝素纳米纤维的载银抗菌敷料的制备方法 | |
| RU2422133C1 (ru) | Гидрофильный гель, способ его получения (варианты), раневое покрытие и перевязочное средство на его основе | |
| CN112480434B (zh) | 一种铜离子抗菌水凝胶及制备方法和应用 | |
| Alam et al. | Surface modified thin film from silk and gelatin for sustained drug release to heal wound | |
| CN115124738B (zh) | 一种双层仿生载药水凝胶及其制备与应用 | |
| Ajmal et al. | PLGA/Gelatin-based electrospun nanofiber scaffold encapsulating antibacterial and antioxidant molecules for accelerated tissue regeneration | |
| Chandika et al. | Enhanced wound-healing capability with inherent antimicrobial activities of usnic acid incorporated poly (ε-caprolactone)/decellularized extracellular matrix nanofibrous scaffold | |
| Wang et al. | Sustained release of EGF/bFGF growth factors achieved by mussel-inspired core–shell nanofibers with hemostatic and anti-inflammatory effects for promoting wound healing | |
| Li et al. | Chitosan-based injectable hydrogel with multifunction for wound healing: A critical review | |
| Seifi et al. | A novel multifunctional chitosan-gelatin/carboxymethyl cellulose-alginate bilayer hydrogel containing human placenta extract for accelerating full-thickness wound healing | |
| CN107469137B (zh) | 一种可注射止血水凝胶材料及制备方法和应用 | |
| TWI814462B (zh) | 止血材料的製備方法及其所製備的止血材料 | |
| CN114288464B (zh) | 一种抗菌促愈合水凝胶敷料及其制备方法和应用 | |
| Davis et al. | Passive and interactive dressing materials | |
| CN115850733B (zh) | 一种可注射用纳米粘土水凝胶及其制备方法和应用 | |
| KR100608192B1 (ko) | 창상 피복재 및 조직공학 구조체용 중화 키토산 스폰지제조방법 및 이에 의해 제조된 중화 키토산 스폰지 | |
| CN115584034B (zh) | 一种用于伤口修复的可注射水凝胶材料及其制备方法 | |
| KR100546793B1 (ko) | 키토산을 이용한 폼 드레싱재 및 이의 제조방법 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination |