CN110835305A - 一种含二苯并环庚烯的有机化合物及其制备方法和其应用 - Google Patents
一种含二苯并环庚烯的有机化合物及其制备方法和其应用 Download PDFInfo
- Publication number
- CN110835305A CN110835305A CN201910552085.7A CN201910552085A CN110835305A CN 110835305 A CN110835305 A CN 110835305A CN 201910552085 A CN201910552085 A CN 201910552085A CN 110835305 A CN110835305 A CN 110835305A
- Authority
- CN
- China
- Prior art keywords
- group
- substituted
- unsubstituted
- compound
- represented
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 150000002894 organic compounds Chemical class 0.000 title claims abstract description 18
- 238000002360 preparation method Methods 0.000 title claims abstract description 17
- 239000000463 material Substances 0.000 claims abstract description 81
- 239000010410 layer Substances 0.000 claims abstract description 64
- 150000001875 compounds Chemical class 0.000 claims abstract description 42
- 239000002346 layers by function Substances 0.000 claims abstract description 4
- YXFVVABEGXRONW-UHFFFAOYSA-N Toluene Chemical compound CC1=CC=CC=C1 YXFVVABEGXRONW-UHFFFAOYSA-N 0.000 claims description 42
- 239000000376 reactant Substances 0.000 claims description 35
- 238000006243 chemical reaction Methods 0.000 claims description 31
- MFRIHAYPQRLWNB-UHFFFAOYSA-N sodium tert-butoxide Substances [Na+].CC(C)(C)[O-] MFRIHAYPQRLWNB-UHFFFAOYSA-N 0.000 claims description 28
- 125000004093 cyano group Chemical group *C#N 0.000 claims description 14
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 14
- 125000000999 tert-butyl group Chemical group [H]C([H])([H])C(*)(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 14
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 claims description 13
- 238000001816 cooling Methods 0.000 claims description 13
- 239000000706 filtrate Substances 0.000 claims description 13
- 238000001914 filtration Methods 0.000 claims description 13
- 239000000741 silica gel Substances 0.000 claims description 13
- 229910002027 silica gel Inorganic materials 0.000 claims description 13
- 125000005842 heteroatom Chemical group 0.000 claims description 12
- 125000001624 naphthyl group Chemical group 0.000 claims description 12
- 239000000047 product Substances 0.000 claims description 12
- 125000004076 pyridyl group Chemical group 0.000 claims description 12
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 claims description 10
- 239000012298 atmosphere Substances 0.000 claims description 10
- 125000006267 biphenyl group Chemical group 0.000 claims description 10
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 10
- 125000004435 hydrogen atom Chemical group [H]* 0.000 claims description 10
- 125000001449 isopropyl group Chemical group [H]C([H])([H])C([H])(*)C([H])([H])[H] 0.000 claims description 10
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 10
- 125000001147 pentyl group Chemical group C(CCCC)* 0.000 claims description 10
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 claims description 10
- 239000000243 solution Substances 0.000 claims description 10
- 238000002390 rotary evaporation Methods 0.000 claims description 9
- -1 amine compound Chemical class 0.000 claims description 8
- 125000003118 aryl group Chemical group 0.000 claims description 8
- 229910052794 bromium Inorganic materials 0.000 claims description 8
- 229910052801 chlorine Inorganic materials 0.000 claims description 8
- 229910052731 fluorine Inorganic materials 0.000 claims description 8
- 125000001153 fluoro group Chemical group F* 0.000 claims description 8
- 125000001072 heteroaryl group Chemical group 0.000 claims description 8
- 229910052740 iodine Inorganic materials 0.000 claims description 8
- 239000011259 mixed solution Substances 0.000 claims description 8
- 229910052757 nitrogen Inorganic materials 0.000 claims description 8
- 238000005303 weighing Methods 0.000 claims description 8
- 239000007864 aqueous solution Substances 0.000 claims description 6
- 238000000034 method Methods 0.000 claims description 5
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 claims description 5
- 239000004327 boric acid Substances 0.000 claims description 4
- 125000000609 carbazolyl group Chemical group C1(=CC=CC=2C3=CC=CC=C3NC12)* 0.000 claims description 4
- PJQCANLCUDUPRF-UHFFFAOYSA-N dibenzocycloheptene Chemical compound C1CC2=CC=CC=C2CC2=CC=CC=C12 PJQCANLCUDUPRF-UHFFFAOYSA-N 0.000 claims description 4
- ZUOUZKKEUPVFJK-UHFFFAOYSA-N diphenyl Chemical compound C1=CC=CC=C1C1=CC=CC=C1 ZUOUZKKEUPVFJK-UHFFFAOYSA-N 0.000 claims description 4
- 125000002541 furyl group Chemical group 0.000 claims description 4
- 229910052736 halogen Inorganic materials 0.000 claims description 4
- 125000005843 halogen group Chemical group 0.000 claims description 4
- 150000002367 halogens Chemical class 0.000 claims description 4
- 229910052739 hydrogen Inorganic materials 0.000 claims description 4
- 239000012046 mixed solvent Substances 0.000 claims description 4
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 4
- 229910052705 radium Inorganic materials 0.000 claims description 4
- 239000011734 sodium Substances 0.000 claims description 4
- 125000001424 substituent group Chemical group 0.000 claims description 4
- 230000008569 process Effects 0.000 claims description 3
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 claims description 2
- 125000000732 arylene group Chemical group 0.000 claims description 2
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 claims description 2
- 239000004305 biphenyl Substances 0.000 claims description 2
- 235000010290 biphenyl Nutrition 0.000 claims description 2
- 150000001616 biphenylenes Chemical group 0.000 claims description 2
- 229910052799 carbon Inorganic materials 0.000 claims description 2
- 125000004432 carbon atom Chemical group C* 0.000 claims description 2
- 125000005549 heteroarylene group Chemical group 0.000 claims description 2
- 125000004957 naphthylene group Chemical group 0.000 claims description 2
- 125000004430 oxygen atom Chemical group O* 0.000 claims description 2
- 125000005561 phenanthryl group Chemical group 0.000 claims description 2
- 125000000843 phenylene group Chemical group C1(=C(C=CC=C1)*)* 0.000 claims description 2
- 125000005551 pyridylene group Chemical group 0.000 claims description 2
- 229910052717 sulfur Inorganic materials 0.000 claims description 2
- 125000004434 sulfur atom Chemical group 0.000 claims description 2
- 125000001544 thienyl group Chemical group 0.000 claims description 2
- 238000002347 injection Methods 0.000 abstract description 20
- 239000007924 injection Substances 0.000 abstract description 20
- 230000000903 blocking effect Effects 0.000 abstract description 18
- 238000004770 highest occupied molecular orbital Methods 0.000 abstract description 8
- 230000005540 biological transmission Effects 0.000 abstract description 7
- 238000004768 lowest unoccupied molecular orbital Methods 0.000 abstract description 4
- 230000006798 recombination Effects 0.000 abstract description 2
- 238000005215 recombination Methods 0.000 abstract description 2
- 239000004065 semiconductor Substances 0.000 abstract description 2
- 230000005855 radiation Effects 0.000 abstract 1
- 239000000543 intermediate Substances 0.000 description 82
- 239000007858 starting material Substances 0.000 description 33
- 238000012360 testing method Methods 0.000 description 29
- 230000015572 biosynthetic process Effects 0.000 description 27
- 238000003786 synthesis reaction Methods 0.000 description 27
- 238000000921 elemental analysis Methods 0.000 description 26
- 238000000589 high-performance liquid chromatography-mass spectrometry Methods 0.000 description 25
- 229940125904 compound 1 Drugs 0.000 description 24
- 238000010189 synthetic method Methods 0.000 description 22
- 239000002994 raw material Substances 0.000 description 13
- 238000001704 evaporation Methods 0.000 description 10
- IJGRMHOSHXDMSA-UHFFFAOYSA-N nitrogen Substances N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 10
- 230000005525 hole transport Effects 0.000 description 9
- SCVFZCLFOSHCOH-UHFFFAOYSA-M potassium acetate Chemical compound [K+].CC([O-])=O SCVFZCLFOSHCOH-UHFFFAOYSA-M 0.000 description 8
- 230000000052 comparative effect Effects 0.000 description 7
- 230000006872 improvement Effects 0.000 description 6
- 239000008204 material by function Substances 0.000 description 6
- 238000005859 coupling reaction Methods 0.000 description 5
- 238000004128 high performance liquid chromatography Methods 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
- 230000007935 neutral effect Effects 0.000 description 5
- 238000005070 sampling Methods 0.000 description 5
- 238000006467 substitution reaction Methods 0.000 description 5
- 230000009477 glass transition Effects 0.000 description 4
- 238000010438 heat treatment Methods 0.000 description 4
- 235000011056 potassium acetate Nutrition 0.000 description 4
- 238000007738 vacuum evaporation Methods 0.000 description 4
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 3
- CPELXLSAUQHCOX-UHFFFAOYSA-M Bromide Chemical compound [Br-] CPELXLSAUQHCOX-UHFFFAOYSA-M 0.000 description 3
- IPWKHHSGDUIRAH-UHFFFAOYSA-N bis(pinacolato)diboron Chemical compound O1C(C)(C)C(C)(C)OB1B1OC(C)(C)C(C)(C)O1 IPWKHHSGDUIRAH-UHFFFAOYSA-N 0.000 description 3
- DKHNGUNXLDCATP-UHFFFAOYSA-N dipyrazino[2,3-f:2',3'-h]quinoxaline-2,3,6,7,10,11-hexacarbonitrile Chemical compound C12=NC(C#N)=C(C#N)N=C2C2=NC(C#N)=C(C#N)N=C2C2=C1N=C(C#N)C(C#N)=N2 DKHNGUNXLDCATP-UHFFFAOYSA-N 0.000 description 3
- 230000000694 effects Effects 0.000 description 3
- 239000007772 electrode material Substances 0.000 description 3
- 238000002156 mixing Methods 0.000 description 3
- 238000010992 reflux Methods 0.000 description 3
- 238000003756 stirring Methods 0.000 description 3
- 239000000758 substrate Substances 0.000 description 3
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 2
- 238000004140 cleaning Methods 0.000 description 2
- 239000012043 crude product Substances 0.000 description 2
- 238000011161 development Methods 0.000 description 2
- 238000002330 electrospray ionisation mass spectrometry Methods 0.000 description 2
- QJGQUHMNIGDVPM-UHFFFAOYSA-N nitrogen(.) Chemical compound [N] QJGQUHMNIGDVPM-UHFFFAOYSA-N 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- YQOLEILXOBUDMU-KRWDZBQOSA-N (4R)-5-[(6-bromo-3-methyl-2-pyrrolidin-1-ylquinoline-4-carbonyl)amino]-4-(2-chlorophenyl)pentanoic acid Chemical compound CC1=C(C2=C(C=CC(=C2)Br)N=C1N3CCCC3)C(=O)NC[C@H](CCC(=O)O)C4=CC=CC=C4Cl YQOLEILXOBUDMU-KRWDZBQOSA-N 0.000 description 1
- WZZBNLYBHUDSHF-DHLKQENFSA-N 1-[(3s,4s)-4-[8-(2-chloro-4-pyrimidin-2-yloxyphenyl)-7-fluoro-2-methylimidazo[4,5-c]quinolin-1-yl]-3-fluoropiperidin-1-yl]-2-hydroxyethanone Chemical compound CC1=NC2=CN=C3C=C(F)C(C=4C(=CC(OC=5N=CC=CN=5)=CC=4)Cl)=CC3=C2N1[C@H]1CCN(C(=O)CO)C[C@@H]1F WZZBNLYBHUDSHF-DHLKQENFSA-N 0.000 description 1
- ONBQEOIKXPHGMB-VBSBHUPXSA-N 1-[2-[(2s,3r,4s,5r)-3,4-dihydroxy-5-(hydroxymethyl)oxolan-2-yl]oxy-4,6-dihydroxyphenyl]-3-(4-hydroxyphenyl)propan-1-one Chemical compound O[C@@H]1[C@H](O)[C@@H](CO)O[C@H]1OC1=CC(O)=CC(O)=C1C(=O)CCC1=CC=C(O)C=C1 ONBQEOIKXPHGMB-VBSBHUPXSA-N 0.000 description 1
- QEBYEVQKHRUYPE-UHFFFAOYSA-N 2-(2-chlorophenyl)-5-[(1-methylpyrazol-3-yl)methyl]-4-[[methyl(pyridin-3-ylmethyl)amino]methyl]-1h-pyrazolo[4,3-c]pyridine-3,6-dione Chemical compound C1=CN(C)N=C1CN1C(=O)C=C2NN(C=3C(=CC=CC=3)Cl)C(=O)C2=C1CN(C)CC1=CC=CN=C1 QEBYEVQKHRUYPE-UHFFFAOYSA-N 0.000 description 1
- GSDQYSSLIKJJOG-UHFFFAOYSA-N 4-chloro-2-(3-chloroanilino)benzoic acid Chemical compound OC(=O)C1=CC=C(Cl)C=C1NC1=CC=CC(Cl)=C1 GSDQYSSLIKJJOG-UHFFFAOYSA-N 0.000 description 1
- 101100072645 Arabidopsis thaliana IPS3 gene Proteins 0.000 description 1
- IYHHRZBKXXKDDY-UHFFFAOYSA-N BI-605906 Chemical compound N=1C=2SC(C(N)=O)=C(N)C=2C(C(F)(F)CC)=CC=1N1CCC(S(C)(=O)=O)CC1 IYHHRZBKXXKDDY-UHFFFAOYSA-N 0.000 description 1
- NUGPIZCTELGDOS-QHCPKHFHSA-N N-[(1S)-3-[4-(3-methyl-5-propan-2-yl-1,2,4-triazol-4-yl)piperidin-1-yl]-1-pyridin-3-ylpropyl]cyclopentanecarboxamide Chemical compound C(C)(C)C1=NN=C(N1C1CCN(CC1)CC[C@@H](C=1C=NC=CC=1)NC(=O)C1CCCC1)C NUGPIZCTELGDOS-QHCPKHFHSA-N 0.000 description 1
- QOVYHDHLFPKQQG-NDEPHWFRSA-N N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O Chemical compound N[C@@H](CCC(=O)N1CCC(CC1)NC1=C2C=CC=CC2=NC(NCC2=CN(CCCNCCCNC3CCCCC3)N=N2)=N1)C(O)=O QOVYHDHLFPKQQG-NDEPHWFRSA-N 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- 229940126142 compound 16 Drugs 0.000 description 1
- 229940125810 compound 20 Drugs 0.000 description 1
- 229940125844 compound 46 Drugs 0.000 description 1
- 230000021615 conjugation Effects 0.000 description 1
- 239000008367 deionised water Substances 0.000 description 1
- 229910021641 deionized water Inorganic materials 0.000 description 1
- 238000011982 device technology Methods 0.000 description 1
- 238000010586 diagram Methods 0.000 description 1
- 238000000113 differential scanning calorimetry Methods 0.000 description 1
- 238000009826 distribution Methods 0.000 description 1
- 230000005684 electric field Effects 0.000 description 1
- 238000005401 electroluminescence Methods 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- GWNFQAKCJYEJEW-UHFFFAOYSA-N ethyl 3-[8-[[4-methyl-5-[(3-methyl-4-oxophthalazin-1-yl)methyl]-1,2,4-triazol-3-yl]sulfanyl]octanoylamino]benzoate Chemical compound CCOC(=O)C1=CC(NC(=O)CCCCCCCSC2=NN=C(CC3=NN(C)C(=O)C4=CC=CC=C34)N2C)=CC=C1 GWNFQAKCJYEJEW-UHFFFAOYSA-N 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- JAXFJECJQZDFJS-XHEPKHHKSA-N gtpl8555 Chemical compound OC(=O)C[C@H](N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](C(C)C)C(=O)N1CCC[C@@H]1C(=O)N[C@H](B1O[C@@]2(C)[C@H]3C[C@H](C3(C)C)C[C@H]2O1)CCC1=CC=C(F)C=C1 JAXFJECJQZDFJS-XHEPKHHKSA-N 0.000 description 1
- 238000005286 illumination Methods 0.000 description 1
- 238000012994 industrial processing Methods 0.000 description 1
- 238000007689 inspection Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 239000004973 liquid crystal related substance Substances 0.000 description 1
- 238000012986 modification Methods 0.000 description 1
- 230000004048 modification Effects 0.000 description 1
- 239000012299 nitrogen atmosphere Substances 0.000 description 1
- 238000005457 optimization Methods 0.000 description 1
- 239000012044 organic layer Substances 0.000 description 1
- 239000011368 organic material Substances 0.000 description 1
- 238000011056 performance test Methods 0.000 description 1
- 238000001420 photoelectron spectroscopy Methods 0.000 description 1
- 230000002035 prolonged effect Effects 0.000 description 1
- 238000010025 steaming Methods 0.000 description 1
- 125000005259 triarylamine group Chemical group 0.000 description 1
- 230000004580 weight loss Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/43—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
- C07C211/57—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton
- C07C211/61—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings being part of condensed ring systems of the carbon skeleton with at least one of the condensed ring systems formed by three or more rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07C—ACYCLIC OR CARBOCYCLIC COMPOUNDS
- C07C211/00—Compounds containing amino groups bound to a carbon skeleton
- C07C211/43—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton
- C07C211/54—Compounds containing amino groups bound to a carbon skeleton having amino groups bound to carbon atoms of six-membered aromatic rings of the carbon skeleton having amino groups bound to two or three six-membered aromatic rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/56—Ring systems containing three or more rings
- C07D209/80—[b, c]- or [b, d]-condensed
- C07D209/82—Carbazoles; Hydrogenated carbazoles
- C07D209/86—Carbazoles; Hydrogenated carbazoles with only hydrogen atoms, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D209/00—Heterocyclic compounds containing five-membered rings, condensed with other rings, with one nitrogen atom as the only ring hetero atom
- C07D209/56—Ring systems containing three or more rings
- C07D209/80—[b, c]- or [b, d]-condensed
- C07D209/82—Carbazoles; Hydrogenated carbazoles
- C07D209/88—Carbazoles; Hydrogenated carbazoles with hetero atoms or with carbon atoms having three bonds to hetero atoms with at the most one bond to halogen, e.g. ester or nitrile radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D219/00—Heterocyclic compounds containing acridine or hydrogenated acridine ring systems
- C07D219/02—Heterocyclic compounds containing acridine or hydrogenated acridine ring systems with only hydrogen, hydrocarbon or substituted hydrocarbon radicals, directly attached to carbon atoms of the ring system
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/04—Ortho- or peri-condensed ring systems
- C07D221/06—Ring systems of three rings
- C07D221/08—Aza-anthracenes
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D221/00—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00
- C07D221/02—Heterocyclic compounds containing six-membered rings having one nitrogen atom as the only ring hetero atom, not provided for by groups C07D211/00 - C07D219/00 condensed with carbocyclic rings or ring systems
- C07D221/20—Spiro-condensed ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D307/00—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom
- C07D307/77—Heterocyclic compounds containing five-membered rings having one oxygen atom as the only ring hetero atom ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D307/91—Dibenzofurans; Hydrogenated dibenzofurans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/02—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings ortho- or peri-condensed with carbocyclic rings or ring systems
- C07D311/78—Ring systems having three or more relevant rings
- C07D311/80—Dibenzopyrans; Hydrogenated dibenzopyrans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D311/00—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings
- C07D311/96—Heterocyclic compounds containing six-membered rings having one oxygen atom as the only hetero atom, condensed with other rings spiro-condensed with carbocyclic rings or ring systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K11/00—Luminescent, e.g. electroluminescent, chemiluminescent materials
- C09K11/06—Luminescent, e.g. electroluminescent, chemiluminescent materials containing organic luminescent materials
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/14—Carrier transporting layers
- H10K50/15—Hole transporting layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K50/00—Organic light-emitting devices
- H10K50/10—OLEDs or polymer light-emitting diodes [PLED]
- H10K50/18—Carrier blocking layers
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/622—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing four rings, e.g. pyrene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/615—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene
- H10K85/626—Polycyclic condensed aromatic hydrocarbons, e.g. anthracene containing more than one polycyclic condensed aromatic rings, e.g. bis-anthracene
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/633—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising polycyclic condensed aromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/631—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine
- H10K85/636—Amine compounds having at least two aryl rest on at least one amine-nitrogen atom, e.g. triphenylamine comprising heteroaromatic hydrocarbons as substituents on the nitrogen atom
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6572—Polycyclic condensed heteroaromatic hydrocarbons comprising only nitrogen in the heteroaromatic polycondensed ring system, e.g. phenanthroline or carbazole
-
- H—ELECTRICITY
- H10—SEMICONDUCTOR DEVICES; ELECTRIC SOLID-STATE DEVICES NOT OTHERWISE PROVIDED FOR
- H10K—ORGANIC ELECTRIC SOLID-STATE DEVICES
- H10K85/00—Organic materials used in the body or electrodes of devices covered by this subclass
- H10K85/60—Organic compounds having low molecular weight
- H10K85/649—Aromatic compounds comprising a hetero atom
- H10K85/657—Polycyclic condensed heteroaromatic hydrocarbons
- H10K85/6574—Polycyclic condensed heteroaromatic hydrocarbons comprising only oxygen in the heteroaromatic polycondensed ring system, e.g. cumarine dyes
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1007—Non-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1011—Condensed systems
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1003—Carbocyclic compounds
- C09K2211/1014—Carbocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1022—Heterocyclic compounds bridged by heteroatoms, e.g. N, P, Si or B
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1029—Heterocyclic compounds characterised by ligands containing one nitrogen atom as the heteroatom
-
- C—CHEMISTRY; METALLURGY
- C09—DYES; PAINTS; POLISHES; NATURAL RESINS; ADHESIVES; COMPOSITIONS NOT OTHERWISE PROVIDED FOR; APPLICATIONS OF MATERIALS NOT OTHERWISE PROVIDED FOR
- C09K—MATERIALS FOR MISCELLANEOUS APPLICATIONS, NOT PROVIDED FOR ELSEWHERE
- C09K2211/00—Chemical nature of organic luminescent or tenebrescent compounds
- C09K2211/10—Non-macromolecular compounds
- C09K2211/1018—Heterocyclic compounds
- C09K2211/1025—Heterocyclic compounds characterised by ligands
- C09K2211/1088—Heterocyclic compounds characterised by ligands containing oxygen as the only heteroatom
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Physics & Mathematics (AREA)
- Engineering & Computer Science (AREA)
- Materials Engineering (AREA)
- Spectroscopy & Molecular Physics (AREA)
- Optics & Photonics (AREA)
- Electroluminescent Light Sources (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
Abstract
Description
技术领域
本发明涉及半导体技术领域,尤其涉及一种含二苯并环庚希的有机化合物及其制备方法和其应用。
背景技术
有机电致发光(OLED:Organic Light Emission Diodes)器件技术既可以用来制造新型显示产品,也可以用于制作新型照明产品,有望替代现有的液晶显示和荧光灯照明,应用前景十分广泛。OLED发光器件犹如三明治的结构,包括电极材料膜层,以及夹在不同电极膜层之间的有机功能材料,各种不同功能材料根据用途相互叠加在一起共同组成OLED发光器件。作为电流器件,当对OLED发光器件的两端电极施加电压,并通过电场作用有机层功能材料膜层中的正负电荷,正负电荷进一步在发光层中复合,即产生OLED电致发光。
当前,OLED显示技术已经在智能手机,平板电脑等领域获得应用,进一步还将向电视等大尺寸应用领域扩展,但是,和实际的产品应用要求相比,OLED器件的发光效率,使用寿命等性能还需要进一步提升。对于OLED发光器件提高性能的研究包括:降低器件的驱动电压,提高器件的发光效率,提高器件的使用寿命等。为了实现OLED器件的性能的不断提升,不但需要从OLED器件结构和制作工艺的创新,更需要OLED光电功能材料不断研究和创新,创制出更高性能OLED的功能材料。
应用于OLED器件的OLED光电功能材料从用途上可划分为两大类,即电荷注入传输材料和发光材料,进一步,还可将电荷注入传输材料分为电子注入传输材料、电子阻挡材料、空穴注入传输材料和空穴阻挡材料,还可以将发光材料分为主体发光材料和掺杂材料。
为了制作高性能的OLED发光器件,要求各种有机功能材料具备良好的光电特性,譬如,作为电荷传输材料,要求具有良好的载流子迁移率,高玻璃化转化温度等,作为发光层的主体材料要求材料具有良好双极性,适当的HOMO/LUMO能阶等。
构成OLED器件的OLED光电功能材料膜层至少包括两层以上结构,产业上应用的OLED器件结构,则包括空穴注入层、空穴传输层、电子阻挡层、发光层、空穴阻挡层、电子传输层、电子注入层等多种膜层,也就是说应用于OLED器件的光电功能材料至少包含空穴注入材料,空穴传输材料,发光材料,电子传输材料等,材料类型和搭配形式具有丰富性和多样性的特点。另外,对于不同结构的OLED器件搭配而言,所使用的光电功能材料具有较强的选择性,相同的材料在不同结构器件中的性能表现,也可能完全迥异。
因此,针对当前OLED器件的产业应用要求,以及OLED器件的不同功能膜层,器件的光电特性需求,必须选择更适合,具有高性能的OLED功能材料或材料组合,才能实现器件的高效率、长寿命和低电压的综合特性。就当前OLED显示照明产业的实际需求而言,目前OLED材料的发展还远远不够,落后于面板制造企业的要求,作为材料企业开发更高性能的有机功能材料显得尤为重要。
发明内容
针对现有技术存在的上述问题,本发明提供了一种以二苯并环庚烯为核心的有机化合物及其制备方法和其在有机电致发光器件上的应用。本发明提供的有机化合物不易结晶,其具有良好的成膜性、热稳定性和较高的玻璃化温度,同时具有合适的HOMO和LUMO能级,采用本发明提供的有机化合物的器件通过结构优化,可有效提升OLED器件的光电性能以及OLED器件的寿命,从而更好的适应和满足面板制造企业的应用要求。
具体技术方案如下:一种含二苯并环庚烯的有机化合物,该化合物的结构如通式(1)所示:
其中,-----表示为两个基团连接或不连接;
a、b、c、d分别表示为数字1或2;
R1、R2、R3、R4、R5、R6、R7、R8分别独立地表示为氢原子、氰基、卤素、C1-20的烷基、取代或未取代的C6-30芳基、含有一个或多个杂原子的取代或未取代的5至30元杂芳基或通式(2)所示结构;R1、R2、R3、R4相同或者不同,且R1、R2、R3、R4至少有一个表示为通式(2)所示结构;且当-----表示为两个基团连接时,R7、R8不表示为通式(2)所示结构;
通式(2)中,所述L、L1、L2分别独立的表示为单键、取代或未取代的C6-30亚芳基、含有一个或多个杂原子的取代或未取代的5至30元亚杂芳基中的一种;
所述R9、R10分别独立的表示为取代或未取代的苯基、取代或未取代的萘基、取代或未取代的联苯基、取代或未取代的蒽基、取代或未取代的菲基、取代或未取代的吡啶基、通式(3)或通式(4)所示结构;且当R9或R10表示为通式(4)所示结构时,L1或L2不表示为单键;且当L1、L2表示为单键时,R9和R10不同时为苯基;
所述X1、X2、X3分别独立的表示为-O-、-S-、-C(R12)(R13)-、-N(R14)-或-Si(R15)(R16)-;X2、X3还可以表示为单键;
所述Z1分别独立的表示氮原子或C-R17;且当L1或L2与Z1键合的情况下,所述基团Z1表示为碳原子;
所述R12~R16分别独立的表示C1-20的烷基、取代或未取代的C6-30芳基、含有一个或多个杂原子的取代或未取代的5至30元杂芳基中的一种;R12与R13、R15与R16可相互连接成环;
所述R17表示为氢原子、氰基、卤素、C1-20的烷基、C2-20的烯烃基、取代或未取代的C6-30芳基、含有一个或多个杂原子的取代或未取代的5至30元杂芳基中的一种;相邻两个或多个R17还可相互键结成环;
其中取代上述可取代基团的取代基任选自卤素、氰基、C1-20的烷基、C6-30芳基、含有一个或多个杂原子的5至30元杂芳基中的一种或多种;
其中所述杂原子任选自氧原子、硫原子或氮原子中的一种或多种。
作为本发明的进一步改进,所述R1、R2、R3、R4分别独立地表示为氢原子、氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基、吡啶基或通式(2)所示结构中的一种;
所述R5、R6、R7、R8分别独立地表示为氢原子、氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基或吡啶基;
所述L、L1、L2分别独立的表示为单键、取代或未取代的亚苯基、取代或未取代的亚萘基、取代或未取代的亚联苯基、取代或未取代的亚吡啶基、取代或未取代的亚苯并呋喃基、取代或未取代的亚咔唑基;
所述R12~R16分别独立的表示为甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基或吡啶基;R12与R13、R15与R16可相互连接成环;
所述R17表示为氢原子、氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基、吡啶基、呋喃基、苯并呋喃基、咔唑基或噻吩基;相邻两个或多个R17可相互键结成环;
所述取代基团的可取代基任选自氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基、吡啶基或呋喃基中的一种或多种。
作为本发明的进一步改进,所述化合物可表示为下列通式:
优选方案,通式(1)可以表示为如下结构,但不仅限于此:
以下结构中出现的R1、R2和R3为通式(2)所述结构
优选方案,通式(2)可以表示为如下结构,但不仅限于此:
作为本发明的进一步改进,所述化合物具体结构为:
本发明的第二个方面是提供一种上述的有机化合物的制备方法,具有这样的特征,
当通式(2)中L表示为单键时,通式(1)所示化合物的制备反应方程式如下所示:
上式中,Ra、Rb、Rc、Rd分别独立的选自H、Cl、Br或I中的一种,且Ra、Rb、Rc、Rd中至少有一个表示为Cl、Br或I;中间体B胺基化合物选自R1-H、R2-H、R3-H或R4-H;
上述反应式的具体制备方法为:称取反应物A和中间体B,用甲苯溶解;再加入Pd2(dba)3、P(t-Bu)3、叔丁醇钠;在惰性气氛下,将上述反应物的混合溶液于95-110℃下反应10-24小时,冷却并过滤反应溶液,滤液旋蒸,过硅胶柱,得产物D;反应物A与中间体B的摩尔比为1:(1.2-3.0),Pd2(dba)3与反应物A的摩尔比为(0.006-0.02):1,P(t-Bu)3与反应物A的摩尔比为(0.006-0.02):1,叔丁醇钠与反应物A的摩尔比为(1.0-3.0):1;
其中,中间体B的制备方法为:
上述反应中中间体B代表R1-H、R2-H、R3-H或R4-H;
上述反应的具体制备方法为:称取原料1和原料2用甲苯溶解,再加入Pd2(dba)3、P(t-Bu)3和叔丁醇钠;在惰性气氛下,将上述反应物的混合溶液于反应温度90-110℃下反应10-24小时,冷却、过滤反应溶液,滤液旋蒸,过硅胶柱,得到中间体B;原料1与原料2的摩尔比为1:(1.3-3.0);Pd2(dba)3与原料1的摩尔比为(0.006-0.02):1,叔丁醇钠与原料1的摩尔比为(1.0-3.0):1;P(t-Bu)3与原料1的摩尔比为(0.006-0.02):1;
本发明中上述反应主要利用的是胺基化合物与卤素原子之间的取代反应,其各物质的用量均为一次取代反应时的用量,当存在多次取代反应时按一次取代反应改变胺基化合物结构并多次重复一次取代反应即可;
当通式(2)中的L不表示为单键时,通式(1)所示化合物的制备反应方程式如下所示:
上述反应式的具体制备方法为:称取反应物A、中间体C,用体积比为2:1:1的甲苯与乙醇和水的混合溶剂溶解;在惰性气氛下,再加入Na2CO3水溶液、Pd(PPh3)4;将上述反应物的混合溶液于反应温度95-110℃,反应10-24小时,冷却并过滤反应溶液,滤液旋蒸,过硅胶柱,得到产物D;所述反应物A与中间体C的摩尔比为1:1.0-2.0;水溶液中Na2CO3与反应物A的摩尔比为(1.0-3.0):1;Pd(PPh3)4与反应物A的摩尔比为(0.006-0.02):1;
其中,中间体C的制备方法为:
上述反应中中间体C表示
上述反应的具体制备方法为:称取中间体B和原料3,用甲苯溶解;再加入Pd2(dba)3、P(t-Bu)3、叔丁醇钠;在惰性气氛下,将上述反应物的混合溶液于95-110℃下反应10-24小时,冷却并过滤反应溶液,滤液旋蒸,过硅胶柱,得到中间体X;中间体B与原料3的摩尔比为1:(1.2-3.0),Pd2(dba)3与中间体B的摩尔比为(0.006-0.02):1,P(t-Bu)3与中间体B的摩尔比为(0.006-0.02):1,叔丁醇钠与中间体B的摩尔比为(1.0-3.0):1;
在氮气的气氛下,称取中间体X、双(频哪醇合)二硼、Pd(dppf)Cl2、醋酸钾溶于甲苯中,100-120℃下反应12-24小时,取样点板,反应完全,自然冷却,过滤,滤液旋蒸,得到粗产品,过中性硅胶柱得到中间体C;中间体X与双(频哪醇合)二硼的摩尔比为2:(1-1.5),中间体X与Pd(dppf)Cl2的摩尔比为1:(0.01-0.05),中间体X与醋酸钾的摩尔比为1:(2-2.5);
本发明中上述反应式主要利用的是硼酸类化合物与卤素原子之间的偶联反应,其各物质的用量均为一次偶联反应时的用量,当存在多次偶联反应时按一次偶联反应改变硼酸类化合物结构多次重复一次偶联反应即可。
本发明的第三个方面是提供上述含二苯并环庚烯的有机化合物在制备有机电致发光器件中的应用。
本发明的第四个方面是提供一种有机电致发光器件,具有这样的特征,上述有机电致发光器件包括至少一层功能层,上述功能层含有上述含二苯并环庚烯的有机化合物。
本发明的第五个方面是提供一种有机电致发光器件,包括空穴传输层或电子阻挡层,具有这样的特征,上述空穴传输层或电子阻挡层含有上述含二苯并环庚烯的有机化合物。
本发明的第六个方面是提供一种照明或显示元件,具有这样的特征,包括上述的有机电致发光器件。
上述方案的有益效果是:
本发明提供的化合物中π共轭效应使得其有很强的空穴传输能力,高的空穴传输速率能够降低器件的起始电压,提高有机电致发光器件的效率;且其中不对称的三芳胺结构能够降低分子的结晶性,降低分子的平面性,增强分子的刚性,从而提高分子的热稳定性;同时,本发明提供的化合物的结构使得电子和空穴在发光层的分布更加平衡,在恰当的HOMO能级下,提升了空穴注入和传输性能;在合适的LUMO能级下,又起到了电子阻挡的作用,提升激子在发光层中的复合效率。
而本发明化合物母核在被取代后,使得分子间的距离变大,分子间相互作用力减弱,所以具有了较低的蒸镀温度,从而使得材料的工业加工窗口变宽。
本发明的化合物在OLED器件应用时,通过器件结构优化,可保持高的膜层稳定性,可有效提升OLED器件的光电性能以及OLED器件的寿命。本发明化合物在OLED发光器件中具有良好的应用效果和产业化前景。
附图说明
图1为本发明所列举的材料应用于OLED器件的结构示意图;
图2为本发明制备的器件和对比器件在不同温度下测量的效率曲线图。
附图中:1为透明基板层,2为ITO阳极层,3为空穴注入层,4为空穴传输,5为电子阻挡层,6为发光层,7为电子传输或空穴阻挡层,8为电子注入层,9为阴极反射电极层。
具体实施方式
下面将结合本发明实施例中的附图,对本发明实施例中的技术方案进行清楚、完整地描述,显然,所描述的实施例仅仅是本发明一部分实施例,而不是全部的实施例。基于本发明中的实施例,本领域普通技术人员在没有作出创造性劳动的前提下所获得的所有其他实施例,都属于本发明保护的范围。
需要说明的是,在不冲突的情况下,本发明中的实施例及实施例中的特征可以相互组合。下面结合附图和具体实施例对本发明作进一步说明,但不作为本发明的限定。
实施例1:中间体B1的合成:
在250ml的三口瓶中,通氮气保护下,加入0.01mol原料1-1,0.012mol原料2-1,150ml甲苯搅拌混合,然后加入5×10-5molPd2(dba)3,5×10-5mol P(t-Bu)3,0.03mol叔丁醇钠,加热至105℃,回流反应24小时,取样点板,显示无溴代物剩余,反应完全;自然冷却至室温,过滤,滤液旋蒸至无馏分,过中性硅胶柱,得到目标产物中间体B1;HPLC纯度99.37%,收率73.4%;元素分析结构(分子式C24H19N):理论值C,89.68;H,5.96;N,4.36;测试值:C,89.65;H,5.99;N,4.37。ESI-MS(m/z)(M+):理论值为321.42,实测值为321.38。
实施例2:中间体C1的合成:
在250ml的三口瓶中,通氮气保护下,加入0.01mol的中间体B12,0.012mol原料3-1,150ml甲苯搅拌混合,然后加入5×10-5molPd2(dba)3,5×10-5mol P(t-Bu)3,0.03mol叔丁醇钠,加热至105℃,回流反应24小时,取样点板,显示无溴代物剩余,反应完全;自然冷却至室温,过滤,滤液旋蒸至无馏分,过中性硅胶柱,得到目标产物中间体X1;
在氮气的气氛下,称取0.02mol中间体X1、0.012mol双(频哪醇合)二硼、0.0002molPd(dppf)Cl2、0.05mol醋酸钾溶于甲苯中,100-120℃下反应12-24小时,取样点板,反应完全,自然冷却,过滤,滤液旋蒸,得到粗产品,过中性硅胶柱得到中间体C1;HPLC纯度98.99%,收率73.5%;元素分析结构(分子式C36H32BNO2):理论值C,82.92;H,6.19;B,2.07;N,2.69;O,6.14;测试值:C,82.94;H,6.21;B,2.05;N,2.67;O,6.15。ESI-MS(m/z)(M+):理论值为521.47,实测值为521.44。
实施例中所需的中间体B和中间体C的合成原料如表1:表1
实施例3:化合物1的合成:
在250ml的三口瓶中,通氮气保护下,加入0.01mol原料A1,0.012mol中间体B1,150ml甲苯搅拌混合,然后加入5×10-5molPd2(dba)3,5×10-5mol P(t-Bu)3,0.03mol叔丁醇钠,加热至105℃,回流反应24小时,取样点板,显示无溴代物剩余,反应完全;自然冷却至室温,过滤,滤液旋蒸至无馏分,过中性硅胶柱,得到目标产物,HPLC纯度99.76%,收率76.1%。元素分析结构(分子式C52H35N):理论值:C,92.69;H,5.24;N,2.08;测试值C,92.67;H,5.23;N,2.12。HPLC-MS:材料分子量为673.28,实测分子量673.32。
实施例4:化合物7的合成:
按实施例3中化合物1的合成方法制备,不同点在于用中间体B2代替中间体B1;元素分析结构(分子式C55H39N):理论值:C,92.53;H,5.51;N,1.96;测试值:C,92.55;H,5.52;N,1.93。HPLC-MS:材料分子量为713.31,实测分子量713.35。
实施例5:化合物9的合成:
按实施例3中化合物1的合成方法制备,不同点在于用中间体B3代替中间体B1;元素分析结构(分子式C55H39N):理论值:C,92.53;H,5.51;N,1.96;测试值:C,92.54;H,5.52;N,1.93。HPLC-MS:材料分子量为713.31,实测分子量713.33。
实施例6:化合物16的合成:
按实施例3中化合物1的合成方法制备,不同点在于用中间体B4代替中间体B1;元素分析结构(分子式C58H38N2):理论值:C,91.31;H,5.02;N,3.67;测试值:C,91.32;H,5.03;N,3.65。HPLC-MS:材料分子量为762.30,实测分子量762.11。
实施例7:化合物20的合成:
按实施例3中化合物1的合成方法制备,不同点在于用中间体B5代替中间体B1;元素分析结构(分子式C58H39N):理论值:C,92.89;H,5.24;N,1.87;测试值:C,92.87;H,5.23;N,1.90。HPLC-MS:材料分子量为749.31,实测分子量749.34。
实施例8:化合物30的合成:
按实施例3中化合物1的合成方法制备,不同点在于用中间体B6代替中间体B1;元素分析结构(分子式C58H39N):理论值:C,92.89;H,5.24;N,1.87;测试值:C,92.88;H,5.22;N,1.90。HPLC-MS:材料分子量为749.31,实测分子量749.28。
实施例9:化合物46的合成:
按实施例3中化合物1的合成方法制备,不同点在于用中间体B7代替中间体B1;元素分析结构(分子式C65H43N):理论值:C,93.16;H,5.17;N,1.67;测试值:C,93.18;H,5.15;N,1.68。HPLC-MS:材料分子量为837.34,实测分子量837.36。
实施例10:化合物63的合成:
按实施例3中化合物1的合成方法制备,不同点在于用中间体B8代替中间体B1;元素分析结构(分子式C59H39NO):理论值:C,91.09;H,5.05;N,1.80;O,2.06;测试值:C,91.08;H,5.06;N,1.81;O,2.05。HPLC-MS:材料分子量为777.30,实测分子量777.35。
实施例11:化合物76的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A2替换原料A1,用中间体B2代替中间体B1;元素分析结构(分子式C63H55N):理论值:C,91.59;H,6.71;N,1.70;测试值:C,91.61;H,6.70;N,1.72。HPLC-MS:材料分子量为825.43,实测分子量825.38。
实施例12:化合物78的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A2替换原料A1,用中间体B3代替中间体B1;元素分析结构(分子式C63H55N):理论值:C,91.59;H,6.71;N,1.70;测试值:C,91.60;H,6.73;N,1.67。HPLC-MS:材料分子量为825.43,实测分子量825.37。
实施例13:化合物87的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A3替换原料A1,用中间体B9代替中间体B1;元素分析结构(分子式C62H46N2):理论值;C,90.92;H,5.66;N,3.42;测试值:C,90.91;5.65;N,3.44。HPLC-MS:材料分子量为818.37,实测分子量818.32。
实施例14:化合物115的合成:
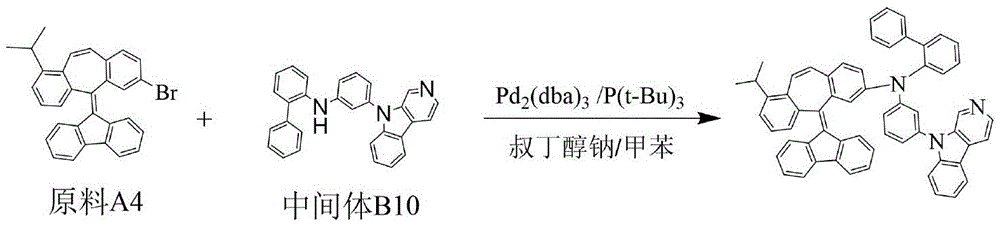
按实施例3中化合物1的合成方法制备,不同点在于用原料A4替换原料A1,用中间体B10代替中间体B1;元素分析结构(分子式C60H43N3):理论值:C,89.41;H,5.38;N,5.21;测试值:C,89.42;H,5.37;N,5.21。HPLC-MS:材料分子量为805.35,实测分子量805.41。
实施例15:化合物131的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A5替换原料A1,用中间体B13代替中间体B1;元素分析结构(分子式C52H37N):理论值:C,92.41;H,5.52;N,2.07;测试值:C,92.42;H,5.53;N,2.05。HPLC-MS:材料分子量为675.29,实测分子量675.25。
实施例16:化合物135的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A5替换原料A1,用中间体B3代替中间体B1;元素分析结构(分子式C55H41N):理论值:C,92.27;H,5.77;N,1.96;测试值:C,92.26;H,5.75;N,1.99。HPLC-MS:材料分子量为715.32,实测分子量715.34。
实施例17:化合物140的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A5替换原料A1,用中间体B14代替中间体B1;元素分析结构(分子式C52H35NO):理论值:C,90.54;H,5.11;N,2.03;O,2.32;测试值:C,90.56;H,5.12;N,2.04;O,2.34。HPLC-MS:材料分子量为689.27,实测分子量689.19。
实施例18:化合物156的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A5替换原料A1,用中间体B6代替中间体B1;元素分析结构(分子式C58H41N):理论值:C,92.64;H,5.50;N,1.86;测试值:C,92.65;H,5.52;N,1.83。HPLC-MS:材料分子量为751.32,实测分子量751.41。
实施例19:化合物171的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A5代替原料A1,用中间体B15代替中间体B1;元素分析结构(分子式C65H45N):理论值:C,92.93;H,5.40;N,1.67;测试值:C,92.94;H,5.38;N,1.63。HPLC-MS:材料分子量为839.36,实测分子量839.41。
实施例20:化合物213的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A6代替原料A1,用中间体B12代替中间体B1;元素分析结构(分子式C62H53N):理论值:C,91.70;H,6.58;N,1.72;测试值:C,91.73;H,6.57;N,1.70。HPLC-MS:材料分子量为811.42,实测分子量811.39。
实施例21:化合物222的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A7代替原料A1,用中间体B17代替中间体B1;元素分析结构(分子式C66H57N):理论值:C,91.73;H,6.65;N,1.62;测试值:C,91.75;H,6.64;N,1.61。HPLC-MS:材料分子量为863.45,实测分子量863.42。
实施例22:化合物249的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A8代替原料A1,用中间体B2代替中间体B1;元素分析结构(分子式C55H41N):理论值:C,92.27;H,5.77;N,1.96;测试值:C,92.25;H,5.76;N,1.99。HPLC-MS:材料分子量为715.32,实测分子量715.39。
实施例22:化合物287的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A9代替原料A1,用中间体B2代替中间体B1;元素分析结构(分子式C63H55N):理论值:C,91.59;H,6.71;N,1.70;测试值:C,91.61;H,6.70;N,1.69。HPLC-MS:材料分子量为825.43,实测分子量825.38。
实施例23:化合物290的合成:
在250ml的三口瓶中,加入中间体0.01mol原料A10、0.015mol中间体C1,用体积比为2:1:1的甲苯、乙醇和水的混合溶剂溶解;在惰性气氛下,再加入0.02mol Na2CO3水溶液(2M)、0.0001mol Pd(PPh3)4;将上述反应物的混合溶液于反应温度100℃,反应24小时,冷却并过滤反应溶液,滤液旋蒸,过硅胶柱,得到目标产物,HPLC纯度99.64%,收率70.9%。元素分析结构(分子式C64H47N):理论值:C,92.61;H,5.71;N,1.69;测试值C,92.63;H,5.72;N,1.66。HPLC-MS:材料分子量为829.37,实测分子量829.36。
实施例24:化合物300的合成:
在250ml的三口瓶中,加入中间体0.01mol原料A1、0.015mol中间体C2,用体积比为2:1:1的甲苯、乙醇和水的混合溶剂溶解;在惰性气氛下,再加入0.02mol Na2CO3水溶液(2M)、0.0001mol Pd(PPh3)4;将上述反应物的混合溶液于反应温度100℃,反应24小时,冷却并过滤反应溶液,滤液旋蒸,过硅胶柱,得到目标产物,HPLC纯度99.61%,收率69.7%。元素分析结构(分子式C58H37NO):理论值:C,91.19;H,4.88;N,1.83;O,2.09;测试值C,91.21;H,4.89;N,1.82;O,2.07。HPLC-MS:材料分子量为763.29,实测分子量763.32。
实施例25:化合物295的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A11代替原料A1,用中间体B17代替中间体B1;元素分析结构(分子式C58H39N):理论值:C,92.89;H,5.24;N,1.87;测试值:C,92.91;H,5.23;N,1.86。HPLC-MS:材料分子量为749.31,实测分子量749.35。
实施例26:化合物311的合成:
按实施例3中化合物1的合成方法制备,不同点在于用原料A12代替原料A1;元素分析结构(分子式C60H53N):理论值:C,91.44;H,6.78;N,1.78;测试值:C,91.45;H,6.79;N,1.80。HPLC-MS:材料分子量为787.42,实测分子量787.38。
本发明化合物在发光器件中使用,可以作为电子阻挡层材料,也可以作为空穴传输层材料使用。对本发明上述实施例制备的化合物分别进行热性能、T1能级、HOMO能级的测试,检测结果如表2所示:
表2
注:玻璃化温度Tg由示差扫描量热法(DSC,德国耐驰公司DSC204F1示差扫描量热仪)测定,升温速率10℃/min;热失重温度Td是在氮气气氛中失重1%的温度,在日本岛津公司的TGA-50H热重分析仪上进行测定,氮气流量为20mL/min;三线态能级T1是由日立的F4600荧光光谱仪测试,材料的测试条件为2*10-5的甲苯溶液;最高占据分子轨道HOMO能级是由IPS3设备(真空光电子能谱),测试为真空环境。
由上表数据可知,本发明的有机化合物具有高的玻璃转化温度,可提高材料膜相态稳定性,进一步提高器件使用寿命;具有高的T1能级,可以阻挡发光层能量损失,从而提升器件发光效率;合适的HOMO能级可以解决载流子的注入问题,可降低器件电压。因此,本发明含二苯并环庚烯的有机化合物用于OLED器件的不同功能层后,可有效提高器件的发光效率及使用寿命。
以下通过器件实施例1-25和比较例1详细说明本发明合成的OLED材料在器件中的应用效果。本发明器件实施例2-25和比较例1与器件实施例1相比器件的制作工艺完全相同,并且采用了相同的基板材料和电极材料,电极材料的膜厚也保持一致,所不同的是对器件中的空穴传输层材料或电子阻挡层材料做了更换。各实施例所得器件的性能测试结果如表3所示。
器件实施例1
如图1所示,一种电致发光器件,其制备步骤包括:a)清洗透明基板层1上的ITO阳极层2,分别用去离子水、丙酮、乙醇超声清洗各15分钟,然后在等离子体清洗器中处理2分钟;b)在ITO阳极层2上,通过真空蒸镀方式蒸镀空穴注入层材料HAT-CN,厚度为10nm,这层作为空穴注入层3;c)在空穴注入层3上,通过真空蒸镀方式蒸镀空穴传输材料化合物1,厚度为60nm,该层为空穴传输层4;d)在空穴传输层4上,通过真空蒸镀方式蒸镀电子阻挡材料EB-1,厚度为20nm,该层为电子阻挡层5;e)在电子阻挡层5之上蒸镀发光层6,主体材料为化合物GH-2和化合物GH-1,掺杂材料为GD-1,化合物GH-2、GH-1和GD-1三者质量比为45:45:10,厚度为30nm;f)在发光层6之上,通过真空蒸镀方式蒸镀电子传输材料ET-1和Liq,ET-1和Liq的质量比为1:1,厚度为40nm,这层有机材料作为空穴阻挡/电子传输层7使用;g)在空穴阻挡/电子传输层7之上,真空蒸镀电子注入层LiF,厚度为1nm,该层为电子注入层8;h)在电子注入层8之上,真空蒸镀阴极Al(100nm),该层为阴极反射电极层9;按照上述步骤完成电致发光器件的制作后,测量器件的驱动电压,电流效率,其结果见表4所示。相关现有材料的分子结构式如下所示:
表3
所得电致发光器件的检测数据见表4所示。
表4
由表4的结果可以看出本发明有机化合物可应用于OLED发光器件制作,并且与比较例相比,效率比已知OLED材料获得较大改观。
进一步的本发明材料制备的OLED器件在低温下工作时效率也比较稳定,将器件实施例3、11、24与器件比较例1和器件比较例2在-10~80℃区间进行效率测试,所得结果如表5和图2所示。
表5
从表5和图2的数据可知,器件实施例3、11、24为本发明材料和已知材料搭配的器件结构,和器件比较例1、器件比较例2相比,不仅低温效率高,而且在温度升高过程中,效率平稳升高。
以上所述仅为本发明的较佳实施例,并不用以限制本发明,凡在本发明的精神和原则之内,所作的任何修改、等同替换、改进等,均应包含在本发明的保护范围之内。
Claims (8)
1.一种含二苯并环庚烯的有机化合物,其特征在于,该化合物的结构如通式(1)所示:
a、b、c、d分别表示为数字1或2;
R1、R2、R3、R4、R5、R6、R7、R8分别独立地表示为氢原子、氰基、卤素、C1-20的烷基、取代或未取代的C6-30芳基、含有一个或多个杂原子的取代或未取代的5至30元杂芳基或通式(2)所示结构;R1、R2、R3、R4相同或者不同,且R1、R2、R3、R4至少有一个表示为通式(2)所示结构;且当表示为两个基团连接时,R7、R8不表示为通式(2)所示结构;
通式(2)中,所述L、L1、L2分别独立的表示为单键、取代或未取代的C6-30亚芳基、含有一个或多个杂原子的取代或未取代的5至30元亚杂芳基中的一种;
所述R9、R10分别独立的表示为取代或未取代的苯基、取代或未取代的萘基、取代或未取代的联苯基、取代或未取代的蒽基、取代或未取代的菲基、取代或未取代的吡啶基、通式(3)或通式(4)所示结构;且当R9或R10表示为通式(4)所示结构时,L1或L2不表示为单键;且当L1、L2表示为单键时,R9和R10不同时为苯基;
所述X1、X2、X3分别独立的表示为-O-、-S-、-C(R12)(R13)-、-N(R14)-或-Si(R15)(R16)-;X2、X3还可以表示为单键;
所述Z1分别独立的表示氮原子或C-R17;且当L1或L2与Z1键合的情况下,所述基团Z1表示为碳原子;
所述R12~R16分别独立的表示C1-20的烷基、取代或未取代的C6-30芳基、含有一个或多个杂原子的取代或未取代的5至30元杂芳基中的一种;R12与R13、R15与R16可相互连接成环;
所述R17表示为氢原子、氰基、卤素、C1-20的烷基、C2-20的烯烃基、取代或未取代的C6-30芳基、含有一个或多个杂原子的取代或未取代的5至30元杂芳基中的一种;相邻两个或多个R17还可相互键结成环;
其中取代上述可取代基团的取代基任选自卤素、氰基、C1-20的烷基、C6-30芳基、含有一个或多个杂原子的5至30元杂芳基中的一种或多种;
其中所述杂原子任选自氧原子、硫原子或氮原子中的一种或多种。
2.根据权利要求1所述的有机化合物,其特征在于,所述R1、R2、R3、R4分别独立地表示为氢原子、氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基、吡啶基或通式(2)所示结构中的一种;
所述R5、R6、R7、R8分别独立地表示为氢原子、氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基或吡啶基;
所述L、L1、L2分别独立的表示为单键、取代或未取代的亚苯基、取代或未取代的亚萘基、取代或未取代的亚联苯基、取代或未取代的亚吡啶基、取代或未取代的亚苯并呋喃基、取代或未取代的亚咔唑基;
所述R12~R16分别独立的表示为甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基或吡啶基;R12与R13、R15与R16可相互连接成环;
所述R17表示为氢原子、氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基、吡啶基、呋喃基、苯并呋喃基、咔唑基或噻吩基;相邻两个或多个R17可相互键结成环;
所述取代基团的可取代基任选自氟原子、氰基、甲基、乙基、丙基、异丙基、叔丁基、戊基、苯基、萘基、联苯基、吡啶基或呋喃基中的一种或多种。
5.一种权利要求1-4任一项所述的有机化合物的制备方法,其特征在于,
当通式(2)中L表示为单键时,通式(1)所示化合物的制备方法为:
上式中,Ra、Rb、Rc、Rd分别独立的选自H、Cl、Br、I中的一种,且Ra、Rb、Rc、Rd中至少有一个表示为Cl、Br或I;中间体B胺基化合物选自R1-H、R2-H、R3-H或R4-H;
上述反应式的具体制备方法为:称取反应物A和中间体B,用甲苯溶解;再加入Pd2(dba)3、P(t-Bu)3、叔丁醇钠;在惰性气氛下,将上述反应物的混合溶液于95-110℃下反应10-24小时,冷却并过滤反应溶液,滤液旋蒸,过硅胶柱,得产物D;所述反应物A与中间体B的摩尔比为1:(1.2-3.0),Pd2(dba)3与反应物A的摩尔比为(0.006-0.02):1,P(t-Bu)3与反应物A的摩尔比为(0.006-0.02):1,叔丁醇钠与反应物A的摩尔比为(1.0-3.0):1;
当通式(2)中的L不表示为单键时,通式(1)所示化合物的制备方法为:
上式中,Ra、Rb、Rc、Rd分别独立的选自H、Cl、Br、I中的一种,且Ra、Rb、Rc、Rd中至少有一个表示为Cl、Br或I;中间体C硼酸类化合物选自
上述反应式的具体制备方法为:称取反应物A、中间体C,用体积比为2:1:1的甲苯、乙醇与水的混合溶剂溶解;在惰性气氛下,再加入Na2CO3水溶液、Pd(PPh3)4;将上述反应物的混合溶液于反应温度95-110℃,反应10-24小时,冷却并过滤反应溶液,滤液旋蒸,过硅胶柱,得到产物D;所述反应物A与中间体C的摩尔比为1:(1.0-2.0);水溶液中Na2CO3与反应物A的摩尔比为(1.0-3.0):1;Pd(PPh3)4与反应物A的摩尔比为(0.006-0.02):1。
6.一种有机电致发光器件,其特征在于,至少一层功能层含有权利要求1-4任一项所述含二苯并环庚烯的化合物。
7.一种有机电致发光器件,包括空穴传输或电子阻挡层,其特征在于,所述有机电致发光器件的电子阻挡层或空穴传输层材料含有权利要求1-4任一项所述含二苯并环庚烯的化合物。
8.一种照明或显示元件,其特征在于,包括权利要求6-7任一项所述的有机电致发光器件。
Applications Claiming Priority (2)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN2018109404460 | 2018-08-17 | ||
| CN201810940446 | 2018-08-17 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN110835305A true CN110835305A (zh) | 2020-02-25 |
| CN110835305B CN110835305B (zh) | 2022-12-02 |
Family
ID=69574440
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201910552085.7A Active CN110835305B (zh) | 2018-08-17 | 2019-06-25 | 一种含二苯并环庚烯的有机化合物及其制备方法和其应用 |
Country Status (1)
| Country | Link |
|---|---|
| CN (1) | CN110835305B (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110551135A (zh) * | 2018-05-31 | 2019-12-10 | 江苏三月光电科技有限公司 | 一种含有氮杂五元并环的化合物及其在有机电致发光器件上的应用 |
| CN110964021A (zh) * | 2018-09-30 | 2020-04-07 | 江苏三月光电科技有限公司 | 一种以芴为核心的化合物、制备方法及其应用 |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150104259A (ko) * | 2014-03-04 | 2015-09-15 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| CN106467468A (zh) * | 2016-06-13 | 2017-03-01 | 江苏三月光电科技有限公司 | 一种具有二苯并庚烯结构的有机化合物及其应用 |
| CN107021926A (zh) * | 2017-06-12 | 2017-08-08 | 江苏三月光电科技有限公司 | 一种含有氮杂螺芴和含氮六元杂环的化合物及其在oled上的应用 |
| CN107602397A (zh) * | 2017-09-29 | 2018-01-19 | 江苏三月光电科技有限公司 | 一种以二苯并环庚烯为核心的化合物及其应用 |
| CN111362954A (zh) * | 2018-12-25 | 2020-07-03 | 江苏三月光电科技有限公司 | 一种以含烯键七元环的结构为核心的化合物及其应用 |
| CN111362936A (zh) * | 2018-12-25 | 2020-07-03 | 江苏三月光电科技有限公司 | 一种以含烯键七元环为核心的化合物及其应用 |
-
2019
- 2019-06-25 CN CN201910552085.7A patent/CN110835305B/zh active Active
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| KR20150104259A (ko) * | 2014-03-04 | 2015-09-15 | 삼성디스플레이 주식회사 | 유기 발광 소자 |
| CN106467468A (zh) * | 2016-06-13 | 2017-03-01 | 江苏三月光电科技有限公司 | 一种具有二苯并庚烯结构的有机化合物及其应用 |
| CN107021926A (zh) * | 2017-06-12 | 2017-08-08 | 江苏三月光电科技有限公司 | 一种含有氮杂螺芴和含氮六元杂环的化合物及其在oled上的应用 |
| CN107602397A (zh) * | 2017-09-29 | 2018-01-19 | 江苏三月光电科技有限公司 | 一种以二苯并环庚烯为核心的化合物及其应用 |
| CN111362954A (zh) * | 2018-12-25 | 2020-07-03 | 江苏三月光电科技有限公司 | 一种以含烯键七元环的结构为核心的化合物及其应用 |
| CN111362936A (zh) * | 2018-12-25 | 2020-07-03 | 江苏三月光电科技有限公司 | 一种以含烯键七元环为核心的化合物及其应用 |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN110551135A (zh) * | 2018-05-31 | 2019-12-10 | 江苏三月光电科技有限公司 | 一种含有氮杂五元并环的化合物及其在有机电致发光器件上的应用 |
| CN110964021A (zh) * | 2018-09-30 | 2020-04-07 | 江苏三月光电科技有限公司 | 一种以芴为核心的化合物、制备方法及其应用 |
Also Published As
| Publication number | Publication date |
|---|---|
| CN110835305B (zh) | 2022-12-02 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN107021926B (zh) | 一种含有氮杂螺芴和含氮六元杂环的化合物及其在oled上的应用 | |
| CN107586261B (zh) | 一种含有螺二苯并环庚烯芴的有机化合物及其应用 | |
| CN111662258A (zh) | 一种含芘的有机化合物及其在oled上的应用 | |
| CN109928886B (zh) | 一种含有三芳胺和芴的化合物及其应用 | |
| CN110835318B (zh) | 一种以氮杂芴为核心的有机化合物及其制备方法与应用 | |
| CN110835304A (zh) | 一种以螺芴烯结构为核心的化合物及其制备方法和其应用 | |
| CN111662225A (zh) | 一种含芘的有机化合物及其应用 | |
| CN111662259A (zh) | 一种含芘的有机化合物及其在有机电致发光器件上的应用 | |
| CN110551135A (zh) | 一种含有氮杂五元并环的化合物及其在有机电致发光器件上的应用 | |
| CN107602542B (zh) | 一种含有二苯并六元环的有机化合物及其应用 | |
| CN110885338A (zh) | 一种以三芳胺为核心的有机化合物及其制备方法和其应用 | |
| CN110885334A (zh) | 一种以苯并[1,2-b:3,4-b’]二苯并呋喃为核心的有机化合物及其应用 | |
| CN110642732B (zh) | 一种含螺芴蒽酮结构的有机化合物及其应用 | |
| CN111662187A (zh) | 一种含胺基的有机化合物及其应用 | |
| CN111377957A (zh) | 一种含硼的化合物及其在有机电致发光器件上的应用 | |
| CN110526825B (zh) | 一种以异屈与三芳胺结构为核心的化合物及其应用 | |
| CN107602397B (zh) | 一种以二苯并环庚烯为核心的化合物及其应用 | |
| CN113135903A (zh) | 一种芳香族二苯并呋喃类衍生物及其应用 | |
| CN110577523B (zh) | 一种含三芳胺结构的化合物及其制备的有机电致发光器件 | |
| CN109796450B (zh) | 一种以吡啶并吲哚为核心的化合物及其在电致发光器件上的应用 | |
| CN113135928A (zh) | 一种有机化合物及包含其的有机电致发光器件 | |
| CN110835305B (zh) | 一种含二苯并环庚烯的有机化合物及其制备方法和其应用 | |
| CN109574908B (zh) | 一种含螺二甲基蒽芴的化合物及其在有机电致发光器件上的应用 | |
| CN112479978A (zh) | 一种以咔唑衍生物为核心的有机化合物及其应用 | |
| CN114057660B (zh) | 一种含双三嗪结构的化合物及其应用 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| CB02 | Change of applicant information | ||
| CB02 | Change of applicant information |
Address after: 214112 No.210 Xinzhou Road, Wuxi City, Jiangsu Province Applicant after: Jiangsu March Technology Co.,Ltd. Address before: 214112 No.210 Xinzhou Road, New District, Wuxi City, Jiangsu Province Applicant before: JIANGSU SUNERA TECHNOLOGY Co.,Ltd. |
|
| GR01 | Patent grant | ||
| GR01 | Patent grant |