CN108473502B - 用于治疗癌症的4,6二氢吡咯并[3,4-c]吡唑-5(1h)-腈衍生物 - Google Patents
用于治疗癌症的4,6二氢吡咯并[3,4-c]吡唑-5(1h)-腈衍生物 Download PDFInfo
- Publication number
- CN108473502B CN108473502B CN201780007893.4A CN201780007893A CN108473502B CN 108473502 B CN108473502 B CN 108473502B CN 201780007893 A CN201780007893 A CN 201780007893A CN 108473502 B CN108473502 B CN 108473502B
- Authority
- CN
- China
- Prior art keywords
- dihydropyrrolo
- pyrazole
- carbonitrile
- phenyl
- pyrazol
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D519/00—Heterocyclic compounds containing more than one system of two or more relevant hetero rings condensed among themselves or condensed with a common carbocyclic ring system not provided for in groups C07D453/00 or C07D455/00
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
本发明涉及新的化合物和制备脱泛素化酶(DUBs)和/或脱小泛素修饰分子酶的抑制剂的方法。尤其是,本发明涉及抑制泛素C‑端水解酶7或泛素特异性肽酶7(USP7)。本发明还涉及DUB或脱小泛素修饰分子抑制剂在治疗癌症中的应用。本文描述的是式I化合物或其药学上可接受的盐,其中R1a,R1b,R1c和R1d各自独立地代表氢,任选经取代的C1‑C6烷基,或R1a和R1b一起形成任选经取代的C3‑C6环烷基环,或R1c和R1d一起形成任选经取代的C3‑C6环烷基环;A是5元含氮芳族环和用至少一个通过任选的连接体附着的任选经取代的5至10元单环或双环的杂芳基或芳基环取代。
Description
本发明涉及新的化合物和制备脱泛素化酶(DUBs)和/或脱小泛素修饰分子酶的抑制剂的方法。尤其是,本发明涉及抑制泛素C-端水解酶7或泛素特异性肽酶7(USP7)。本发明还涉及DUB或脱小泛素修饰分子抑制剂在治疗癌症中的应用。
背景技术
在本说明书列举或讨论显得在先公开的文献不一定应视为承认该文献是现有技术的一部分或是一般常识。
泛素是由76个氨基酸组成的小蛋白质,其对于在细胞中调节蛋白质功能是重要的。除了泛素之外,还存在数量越来越多的结构有关的泛素状分子(UBLs),其在平行但是不同的细胞途径中修饰底物。这些蛋白质包括但不限于小泛素状调节剂(SUMO),干扰素-刺激基因15(ISG15),泛素-相关的调节剂-1(URM1),神经元-前体-细胞-表达的发展性下调的蛋白-8(NEDD8),人类白细胞抗原F相关的(FAT10),自体吞噬-8(ATG8)和-12(ATG12),少泛素状蛋白(FUB1),膜-锚定的UBL(MUB),泛素折叠-调节剂-1(UFM1)和泛素状蛋白-5(UBL5)。泛素和UBLs的泛素化和脱泛素化是酶促介导的过程,泛素或UBLs借助该过程通过泛素化酶和脱泛素化酶(DUBs)共价结合靶标蛋白或从靶标蛋白裂解。包括Sentrin特异性蛋白酶(SENPs)在内,人类细胞中存在大约95种DUBs,基于序列同源性分为亚族。它们中最大的是USP家族,其表征为共同的Cys和His盒,含有对于DUB活性关键的Cys和His残基。泛素化和脱泛素化过程已牵涉于许多细胞功能的调节中,包括细胞循环进展,细胞凋亡,细胞表面受体的修饰,DNA转录和DNA修复的调节。从而,泛素系统已牵涉于许多疾病状态的发病机理中,包括炎症,病毒感染,代谢功能障碍,CNS障碍,和肿瘤生成。
USP7是具有强肿瘤学联系的DUB从而是已树立的抗癌靶标。在靶向USP7背后的原理主要是由于其在调节多种癌基因、肿瘤抑制基因、病毒蛋白和表观遗传调节剂包括磷酸酶和张力蛋白同源体(PTEN)、Forkhead盒蛋白质O4(FOXO4)、p53:HDM2轴和DNA(胞嘧啶-5)-甲基转移酶1(DNMT1)中充分确证的作用。USP7的抑制导致人双微体2同源染色体(HDM2)的降解,p53的稳定和肿瘤细胞中细胞凋亡的活化。这意味着其是癌症的潜在靶标,所述癌症中存在脱调节的HDM2表达(~7%的全部癌症)和/或野生型p53(~50%的全部癌症)。此外,USP7抑制也经显示降低调节T-细胞的免疫-抑制能力。从而,USP7抑制剂可以具有增效的抗癌效果,其是借助促进宿主免疫系统对癌细胞的监视和杀灭。
在批准蛋白酶体抑制剂硼替佐米用于治疗多发性骨髓瘤之后,泛素-蛋白酶体系统已成为有意义的癌症治疗靶标。用硼替佐米的扩展治疗受到与其有关的毒性和药物抗性的限制。然而,靶向蛋白酶体上游的泛素-蛋白酶体途径的特定方面比如DUBs的治疗策略经预测具有更佳的耐受。尽管在该领域存在强烈兴趣,DUB抑制剂还并未进入市场(Kemp M,Progress in Medicinal Chemistry 2016;55:140-192)。从而,需要抑制DUBs比如USP7的化合物和药物组合物,用于治疗其中观察到DUB活性的适应症,包括但不限于癌症。
WO2013044865描述了化合物(4-(5-氰基-5,6-二氢吡咯并[3,4-d][1,2,3]三唑-2(4H)-基)-3-氟苯基)氨基甲酸苄酯和2-(2-氟-4-硝基苯基)-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈作为制备抗生素化合物的方法中的中间体。这些化合物可以从所附权利要求中排除。
发明概要
本文描述的是式I化合物:
或其药学上可接受的盐,其中
R1a,R1b,R1c和R1d各自独立地代表氢,任选经取代的C1-C6烷基,或R1a和R1b一起形成任选经取代的C3-C6环烷基环,或R1c和R1d一起形成任选经取代的C3-C6环烷基环;
A是5元含氮芳族环并且用至少一个通过任选的连接体附着的任选经取代的5至10元单环或双环的杂芳基或芳基环取代。
在一种实施方式中,A是用-Q1-B和(-Q2-(D)m)n取代的;
m代表0或1;
n代表0,1或2;
Q1代表共价键或连接体,选自氧原子,硫原子,-OR4-,-SO-,-SO2-,-C(O)-,-C(O)O-,-C0-C3-亚烷基-C(O)NR2-C0-C3亚烷基,-C0-C3-亚烷基-NR2-C0-C3-亚烷基-,-C0-C3-亚烷基-NR2C(O)-C0-C3-亚烷基,-NR2C(O)NR3-,-SO2NR2-,NR2SO2-,-NR2SO2NR3-,-NR2C(O)O-,-NR2C(O)OR4-,任选经取代的-C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
B代表任选经取代的5至10元单环或双环的芳基或杂芳基环;
R2和R3各自独立地代表氢或任选经取代的C1-C6烷基;
R4代表任选经取代的C1-C6亚烷基;
Q2的各具体值独立地代表卤素,氰基,硝基,羟基,-SR5,-NR5R6,-CONR5R6,-C0-C3-亚烷基-NR5COR6-,-NR5CONR6R6a,-COR5,-C(O)OR5,-SO2R5,-SO2NR5R6,-NR5SO2R6,-NR5SO2NR6R6a,-NR5C(O)OR6,任选经取代的-C1-C6烷基,任选经取代的-C2-C6烯基,共价键,氧原子,硫原子,-OR7-,-SO-,-SO2-,-CO-,-C(O)O-,-C0-C3-亚烷基-C(O)NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5C(O)-C0-C3亚烷基,-NR5CONR6-,-SO2NR5-,NR5SO2-,-NR5SO2NR6-,-NR5C(O)O-,-NR5C(O)OR7-,任选经取代的C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
D的各具体值独立地代表任选经取代的3至10元单环或双环的杂环基,杂芳基,环烷基或芳基环;
R5,R6和R6a各自独立地代表氢或任选经取代的C1-C6烷基;
R7代表任选经取代的C1-C6亚烷基。
本发明也涉及药物组合物,包含本发明化合物和一种或多种药学上可接受的赋形剂。
本发明化合物可用于治疗癌症。
附图描述
图1提供纯化自哺乳动物细胞的FLAG-USP7图像。FLAG-纯化的蛋白质或指出的BSA浓度通过SDS-PAGE分离并用Imperial Protein Stain(Pierce Biotechnology)染色。
图2是用荧光偏振测试显示纯化的FLAG-USP7的蛋白水解活性的图。各体积的纯化USP7如所指与经由异肽键连接至泛素的TAMRA标记的肽温育。
发明详述
下述定义和解释适用于在该文献通篇中的术语,包括说明书和权利要求。提及如本文描述的化合物(例如式I化合物),包括提及式I和II,包括其任何子类实施方式。
在式I化合物的任何基团已称为任选经取代的情况下,该基团可以是取代的或未经取代的。取代可以是被一个或多个指定的取代基取代,其可以是相同或不同的。应认识到选择取代基的数量和性质以避免任何立体上不希望的组合。
在本说明书的上下文中,除非另有说明,烷基、亚烷基、烷氧基、烯基、或炔基取代基(或连接体)基团或取代基中的烷基、烯基部分可以是线性或支化的。烷基,亚烷基,烯基和亚烯基链还可以包括介入杂原子比如氧。
Cx-Cy烷基是指具有x-y个碳原子的饱和脂族烃基团,其可以是线性或支化的。例如C1-C6烷基含有1至6个碳原子和包括C1,C2,C3,C4,C5和C6。"支化的"意指基团中存在至少一个碳分支点。例如,叔丁基和异丙基都是支化的基团。C1-C6烷基的实例包括甲基,乙基,丙基,2-甲基-1-丙基,2-甲基-2-丙基,2-甲基-1-丁基,3-甲基-1-丁基,2-甲基-3-丁基,2,2-二甲基-1-丙基,2-甲基-戊基,3-甲基-1-戊基,4-甲基-1-戊基,2-甲基-2-戊基,3-甲基-2-戊基,4-甲基-2-戊基,2,2-二甲基-1-丁基,3,3-二甲基-1-丁基,2-乙基-1-丁基,正丁基,异丁基,叔丁基,正戊基,异戊基,新戊基和正己基。C1-C6烷基,C1-C4烷基和C1-C3烷基在R1a,R1b,R1c,R1d,R2,R3,R5,R6,R6a,R11,R12,R12a,R14,R15,R15a,Q2的定义中和在B和D的取代基的定义中可以是未经取代的或用一个或多个本文定义的取代基取代。取代的C1-C6烷基的实例因此包括CF3,CH2CF3,CH2CN,CH2OH和CH2CH2OH。
Cx-Cy亚烷基或部分可以是线性或支化的并且是指二价烃基团,具有比前文所定义的Cx-Cy烷基少一个的氢原子。C1-C6亚烷基可以包括介入杂原子比如氧,和因此包括亚烷基氧基。亚烷基氧基如本文所用也拓展至实施方式,其中所述氧原子或氧原子(例如单个氧原子)位于亚烷基链当中,例如CH2CH2OCH2或CH2OCH2。C1-C6亚烷基的实例包括亚甲基,亚甲基氧基,亚乙基,亚乙基氧基,正亚丙基,正亚丙基氧基,正亚丁基,正亚丁氧基,甲基亚甲基和二甲基亚甲基。除非另有说明,C1-C6亚烷基,C1-C4亚烷基和C1-C3亚烷基在R4,R7,Q1,Q2,Q3a,Q3b,Q4a,Q4b的定义中可以是未经取代的或用一个或多个本文定义的取代基取代。
C2-C6烯基是指线性或支化的烃链残基,含有至少两个碳原子和至少一个双键,并且包括C2-C4烯基。烯基的实例包括乙烯基,丙烯基,2-丙烯基,1-丁烯基,2-丁烯基,1-己烯基,2-甲基-1-丙烯基,1,2-丁二烯基,1,3-戊二烯基,1,4-戊二烯基和1-己二烯基。除非另有说明,C2-C6烯基和C2-C4烯基在Q2的定义中和在B和D的取代基的定义中可以是未经取代的或用一个或多个本文定义的取代基取代。
C2-C6亚烯基是指线性或支化的烃基团,具有比前文所定义的C2-C6烯基少一个的氢原子。C2-C6亚烯基的实例包括亚乙烯基,亚丙烯基和亚丁烯基。除非另有说明,C2-C6亚烯基和C2-C4亚烯基在Q1、Q2、Q3a、Q3b和Q4a、Q4b取代基的定义中可以是未经取代的或被一个或多个本文定义的取代基取代。
C2-C6炔基是指线性或支化的烃链残基,含有至少两个碳原子和至少一个三键。烯基的实例包括乙炔基,丙炔基,2-丙炔基,1-丁炔基,2-丁炔基和1-己炔基。除非另有指定,C2-C6炔基在B和D取代基的定义中可以是未经取代的或被一个或多个本文定义的取代基取代。
C1-C6烷氧基是指基团或基团部分,具有根据上文Cx-Cy烷基定义的-O-Cx-Cy烷基。C1-C6烷氧基含有1至6个碳原子和包括C1、C2、C3、C4、C5和C6。C1-C6烷氧基的实例包括甲氧基,乙氧基,丙氧基,异丙氧基,丁氧基,戊氧基和己氧基。烷氧基如本文所用也拓展至实施方式,其中所述氧原子或氧原子(例如单个氧原子)位于烷基链中,例如CH2CH2OCH3或CH2OCH3。从而,烷氧基可以通过碳连接至分子的其余部分例如-CH2CH2OCH3,或另选地,烷氧基通过氧连接至分子的其余部分例如-OC1-6烷基。在某些情况下,烷氧基可以通过氧连接至分子的其余部分,但是烷氧基含有其它氧原子,例如-OCH2CH2OCH3。除非另有指定,C1-C6烷氧基和C1-C3烷氧基在Q2的定义中和在B和D取代基的定义中可以是未经取代的或被一个或多个本文定义的取代基取代。取代的C1-C6烷氧基的实例因此包括OCF3,OCHF2,OCH2CF3,CH2CH2OCH3和CH2CH2OCH2CH3。
术语"卤素"或"卤代"是指氯,溴,氟或碘原子,尤其是氯或氟原子。
术语"氧代"意指=O。
为了避免疑问,应理解环烷基、杂环基、芳基和杂芳基环在本文公开中和在R1a、R1b、R1c、R1d、R13、R16、R12、B和D的定义中不包括任何不稳定的环结构,或在杂芳基和杂环系的情况下不包括任何O-O、O-S或S-S键。环系可以是单环或双环。双环环系包括桥连、稠合和螺环系。取代基如果存在可以连接至任何适宜的环原子,其可以是碳原子,或在杂芳基和杂环系的情况下是杂原子。环上的取代还可以包括取代位的环原子变化。例如,苯基环上的取代可以包括取代位的环原子从碳变为氮,获得吡啶环。
"环烷基"是指单环饱和的或部分不饱和的非芳族环,其中全部环原子是碳,和具有所指的环原子数。例如C3-C10环烷基是指单环或二环烃环,含有3至10个碳原子。C3-C10环烷基的实例是环丙基,环丁基,环戊基,环己基,环庚基,环辛基和十氢萘基。双环环烷基包括桥连环系比如二环庚烷和二环辛烷。除非另有指定,环烷基在R1a、R1b、R1c、R1d、R13、R16、D的定义中可以是未经取代的或被一个或多个本文定义的取代基取代。
"芳基"基团/部分是指任意单环或二环烃基团,包含至少一个芳族基团和具有5至10个碳原子环成员。芳基的实例包括苯基和萘基。双环环可以是稠合芳族环,其中两个环均是芳族,例如萘基。优选的芳基是苯基和萘基,更优选苯基。除非另有指定,芳基在R13,R16,B和D的定义中可以是未经取代的或用一个或多个本文定义的取代基取代。
"杂芳基"如本文所用意指多不饱和的、单环或双环的5至10元芳族部分,含有至少1个且多至5个杂原子,特别是1、2或3个选自N、O和S的杂原子,并且剩余环原子是碳原子,呈技术人员已知的稳定组合。杂芳基环氮和硫原子是任选氧化的,而氮原子是任选季铵化的。杂芳基环能够是单个芳族环或稠合双环,其中双环环系能够是芳族,或稠环之一是芳族而另一个是至少部分饱和的。在一个实例中,双环杂芳基中整个稠合环系是芳族。双环杂芳基能够在稠环之一中具有至少一个杂原子。例如,双环环,其中芳族环稠合至部分饱和的环,可以在芳族环或部分饱和的环中含有至少一个杂原子。双环环到基团的附着是可以经由含杂原子的环或仅含碳的环的取代基。杂芳基到基团的附着点是能够经由碳原子或杂原子(例如氮)的取代基。杂芳基环的实例包括吡啶基,吡嗪基,嘧啶基,哒嗪基,呋喃基,吡咯基,噁唑基,噻唑基,吡唑基,三唑基,四唑基,吲哚基,吲嗪基,异吲哚基,嘌呤基,呋咱基,咪唑基,吲唑基,异噻唑基,异噁唑基,噁二唑基,四唑基,噻二唑基,苯并呋喃基,异苯并呋喃基,苯并噻吩基,异苯并噻吩基,苯并咪唑基,苯并噻唑基,萘啶基,蝶啶基,吡嗪基,喹啉基,异喹啉基,噌啉基,酞嗪基,喹唑啉基,咪唑并吡啶基,吡唑并吡啶基,噻唑并吡啶基,三嗪基,二氢吡啶基,二氢吡咯并吡啶基,喹喔啉基和二氢苯并噁嗪基。除非另有指定,杂芳基在R13,R16,B和D的定义中可以是未经取代的或用一个或多个本文定义的取代基取代。
"杂环基"或"杂环"如本文描述环所用意指,除非另有说明,单环饱和的或部分不饱和的、非芳族环或双环饱和的或部分不饱和的环,其中双环环系是非芳族,单环或双环环具有例如3至10个成员,其中至少1个成员和多至5个成员,特别是1、2或3个环成员是选自N、O和S的杂原子,和剩余环原子是碳原子,呈本领域技术人员已知的稳定组合。杂环氮和硫原子是任选氧化的,而氮原子是任选季铵化的。如本文所用,杂环可以是与又一环系的稠环以形成双环,也即杂环碳中的一个或两个与另一环系共用。在其中杂环基是双环环的情况下,第二环能够是芳族例如稠合的苯基、吡啶基、吡唑基等。杂环基可以通过碳或杂原子连接至分子的其余部分和在其中杂环基是双环环的情况下,连接可以经由含杂原子的环或稠合的环。杂环基的实例包括氮杂环丁烷基,吡咯烷基,哌啶基,氮杂环庚烷基,二氮杂环庚烷基,二氢呋喃基(例如2,3-二氢呋喃基,2,5-二氢呋喃基),二氧杂环戊烷基,吗啉基,噁唑烷基,噁嗪烷基,吲哚啉基,异吲哚啉基,哌嗪基,四氢呋喃基,硫吗啉基,二氢吡喃基(例如3,4-二氢吡喃基,3,6-二氢吡喃基),高哌嗪基,二噁烷基,六氢嘧啶基,吡唑啉基,吡唑烷基,4H-喹嗪基,奎宁环基,四氢吡喃基,四氢吡啶基,四氢嘧啶基,四氢噻吩基,噻唑烷基,苯并吡喃基,四氢喹啉基,二氢吡咯并吡啶基,二氢苯并噁嗪基和四氢异喹啉基。除非另有指定,杂环基在R13,R16,B和D的定义中可以是未经取代的或用一个或多个本文定义的取代基取代。取代的杂环基环的实例包括例如4,5-二氢-1H-马来酰亚胺基,四亚甲基亚砜和乙内酰脲基。
用于任何基团的"任选经取代的"意指所述基团如果希望可以被一个或多个可以是相同或不同的取代基(例如1、2、3或4个取代基)取代。
"取代的"和"任选经取代的"C1-C6烷基(包括C1-C4烷基,C1-C3烷基和C1-C2烷基)和C1-C6烷氧基(包括C1-C4烷氧基,C1-C3烷氧基和C1-C2烷氧基)和C2-C6烯基(包括C2-C4烯基)和C2-C6炔基(包括C2-C4炔基),例如在R1a、R1b、R1c、R1d、R2、R3、R5、R6、R6a、R11、R12、R12a、R14、R15、R15a,Q2的定义中和在B和D的取代基的定义中,和C1-C6亚烷基(包括C1-C3亚烷基)和C2-C6亚烯基,例如在R5、R9、R12、R15、Q1、Q2、Q3a、Q3b、Q4a、Q4b的定义中的适宜取代基的实例包括卤素,氰基,氧代,硝基,氨基,酰胺基,羟基,C1-C6烷基或C1-C3烷基,C1-C6烷氧基或C1-C3烷氧基,芳基,杂芳基,杂环基,C3-C6环烷基,C1-3烷基氨基,C2-6烯基氨基,二-C1-C3烷基氨基,C1-C3酰基氨基,二-C1-C3酰基氨基,羧基,C1-C3烷氧羰基,甲酰胺基,氨基甲酰基,一-C1-3氨基甲酰基,二-C1-3氨基甲酰基,或上述中的任意种,其中烃基部分本身被卤素例如氟,羟基,氰基,氨基,硝基或SF5(已知模拟硝基)取代。尤其是,适宜取代基可以选自卤素、羟基、硫醇、氰基、氨基、酰胺基、硝基和SF5(已知模拟硝基),尤其是卤素(优选氟或氯)、羟基和氰基。
对于全部剩余的"取代的"和"任选经取代的"部分,包括在R1a、R1b、R1c、R1d、R2、R6、R12、R15的定义中的环烷基、杂环基、芳基和杂芳基环,来说适宜取代基的实例包括卤素,氰基,氧代,硝基,氨基,酰胺基,羟基,酰胺基,C1-C6烷基或C1-C3烷基,C1-C6烷氧基或C1-C3烷氧基,芳基,杂芳基,杂环基,C3-C6环烷基,C1-3烷基氨基,C2-6烯基氨基,二-C1-C3烷基氨基,C1-C3酰基氨基,二-C1-C3酰基氨基,羧基,C1-C3烷氧羰基,羧酰胺基,氨基甲酰基,一-C1-3氨基甲酰基,二-C1-3氨基甲酰基或上述中的任意种,其中烃基部分本身被卤素例如氟、羟基、氰基、氨基、酰胺基、硝基或SF5(已知模拟硝基)取代。
对于"取代的"和"任选经取代的"环来说适宜取代基的实例包括尤其是,氟,氯,氧代,氰基,C1-C3烷基,C1-C3烷氧基,杂环基,环烷基,杂芳基或芳基,其中烷基或烷氧基任选被一个或多个(例如1、2或3个)取代基取代,所述取代基选自卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。
取代的基团从而包括例如Br,Cl,F,CN,Me,Et,Pr,叔-Bu,OMe,OEt,OPr,C(CH3)3,CH(CH3)2,CF3,OCF3,C(O)NHCH3,环丙基,苯基,等。在芳基的情况下,取代可以呈芳基环中相邻碳原子的环形式,例如环状缩醛比如O-CH2-O。
在含有氧原子的取代的基团比如羟基和烷氧基中,氧原子能够用硫替换形成基团比如巯基(SH)和硫烷基(S-烷基)。可选取代基因此包括基团比如S-甲基。在硫烷基中,硫原子可以被进一步氧化形成亚砜或砜,和从而可选取代基因此包括基团比如S(O)-烷基和S(O)2-烷基。
术语"治疗"或"处理"或"疗法"包括预防和意指改善、减轻症状,暂时或永久消除症状的原因,或预防或减缓指名障碍或病况的症状出现。本发明化合物用于治疗人类和非人类动物。
化合物的剂量是量,其有效预防患者所患障碍的症状出现或治疗患者所患障碍的某些症状。"有效量"或"治疗有效量"或"有效剂量"意指量,其足以引起希望的药理学或治疗效果,从而引起障碍的有效预防或治疗。预防障碍表现为,以医学显著的程度延缓障碍的症状发作。治疗障碍表现为,与障碍有关的症状减少或改善障碍症状的复发。
本发明化合物的药学上可接受的盐包括但不限于加成盐(例如磷酸盐,硝酸盐,硫酸盐,硼酸盐,乙酸盐,马来酸盐,柠檬酸盐,富马酸盐,琥珀酸盐,甲磺酸盐,苯甲酸盐,水杨酸盐和氢卤化物),衍生自有机碱的盐(比如锂、钾和钠),氨基酸(比如甘氨酸,丙氨酸,缬氨酸,亮氨酸,异亮氨酸,半胱氨酸,甲硫氨酸和脯氨酸)的盐,无机碱(比如三乙胺,氢氧化物,胆碱,维生素B1和N-N’-二乙酰基乙二胺)。其它药学上可接受的盐包括铵盐,取代的铵盐和铝盐。其它药学上可接受的盐包括本发明化合物的季铵盐。
制备盐的一般方法是本领域技术人员熟知的。所述盐可以通过常规手段形成,例如将化合物的游离酸或游离碱形式与一个或多个当量的适当酸或碱反应,任选在溶剂中或在盐不溶的介质中进行,随后用标准技术(例如减压、冻干或过滤)除去所述溶剂或所述介质。盐还可以制备如下:将化合物的平衡离子以盐形式与又一平衡离子交换,例如用适宜的离子交换树脂。
在本发明化合物存在不同的对映体的和/或非对映异构体的形式的情况下,本发明涉及制备为异构混合物或外消旋体的这些化合物,其以光学纯形式存在或是与其它异构体的混合物。对映体的区别仅在于它们以相反方向的相等量旋转平面偏振光的能力和分别表示为(+)/(S)或(-)/(R)形式。单独的对映体或异构体可以通过本领域已知的方法制备,比如旋光拆分产品或中间体(例如手性色谱分离例如手性HPLC或不对称合成途径)。类似地,在本发明化合物作为备择互变异构体形式例如酮/烯醇、酰胺/亚胺酸存在的情况下,本发明涉及分离的单独互变异构体和全部比例的互变异构体的混合物。
同位素
本文描述的化合物可以含有一种或多种同位素取代,并且提及特定元素包括该元素的全部同位素。例如,提及氢包括1H、2H(D)和3H(T)。类似地,提及碳和氧分别包括12C,13C和14C以及16O和18O。同位素的实例包括2H,3H,11C,13C,14C,36Cl,18F,123I,125I,13N,15N,15O,17O,18O,32P和35S。
以类似方式,提及特别的官能团也包括同位素变型,除非上下文另有所指。例如,提及烷基比如乙基也涵盖变型,其中该基团中的一个或多个氢原子呈氘或氚同位素形式,例如在乙基中全部五个氢原子呈氘同位素形式(全氘化乙基)。氘元素可以全部称为"氘"。
同位素可以是放射性的或非放射性的。在一种实施方式中,化合物不含放射性的同位素。所述化合物优选用于治疗用途。在又一实施方式中,然而,化合物可以含有一种或多种放射性同位素。含有所述放射性同位素的化合物可以用于诊断领域。
某些同位素标记的式(I)化合物,例如掺入放射性同位素的那些,用于药物和/或基底组织分布研究。放射性同位素也即3H和14C对于该意图特别有用,原因是它们易于掺入和易于检测。用更重的同位素也即2H取代可以提供某些治疗优势,导致更高的代谢稳定性,例如增加的体内半衰期或降低的剂量要求,于是可以在某些环境下是优选的。用正电子发射同位素比如11C、18F、15O和13N取代能够用于正电子发射断层照相(PET)研究,以检查受体占有率。同位素标记的式(I)化合物能够一般通过本领域技术人员已知的常规技术或者通过类似所附实例和制备中描述的那些的过程制备,用适当的同位素标记的试剂代替原先所用非标记的试剂。
晶型和无定形形式
式(I)化合物可以以晶型或无定形形式存在和某些晶型可以作为多晶型物存在,其包括在本发明范围内。式(I)化合物的多晶型形式可以用许多常规分析技术表征和区分,包括但不限于近红外谱,拉曼谱,X射线粉末衍射,示差扫描量热法,热重分析和固态核磁共振。
相应地,在进一步的实施方式中,本发明提供根据任意所描述的实施方式的化合物,其呈晶型。化合物可以是50%至100%结晶的,和更特别至少50%结晶的,或至少60%结晶的,或至少70%结晶的,或至少80%结晶的,或至少90%结晶的,或至少95%结晶的,或至少98%结晶的,或至少99%结晶的,或至少99.5%结晶的,或至少99.9%结晶的,例如100%结晶的。化合物可以另选呈无定形形式。
本文描述的发明涉及任意所公开化合物的全部晶型,溶剂化物和水合物,无论怎样制备。在任意本文公开化合物具有酸或碱性中心比如羧酸或氨基的情况下,则本文包括所述化合物的全部盐形式。在药物应用的情况下,盐应视为药学上可接受的盐。
本发明涉及化合物及其盐的任何溶剂化物。优选的溶剂化物是如下形成的溶剂化物:向本发明化合物的固态结构(例如晶体结构)掺入非毒性的药学上可接受的溶剂分子(下文称为溶剂化溶剂)。所述溶剂的实例包括水,醇(比如乙醇、异丙醇和丁醇)和二甲亚砜。溶剂化物能够制备如下:将本发明化合物与含有溶剂化溶剂的溶剂或溶剂混合物重结晶。溶剂化物在任何给定情况下是否已形成能够如下确定:用熟知和标准技术比如热重分析(TGE)、示差扫描量热法(DSC)和X射线晶体学分析化合物晶体。
溶剂化物能够是化学计量的或非化学计量的溶剂化物。特别的溶剂化物可以是水合物,和水合物实例包括半水合物、一水合物和二水合物。关于溶剂化物和用来制备和表征它们的方法的更详细讨论参见Bryn等人,Solid-State Chemistry of Drugs,SecondEdition,published by SSCI,Inc of West Lafayette,IN,USA,1999,ISBN 0-967-06710-3。
本发明涉及如本文所定义的化合物的药学功能衍生物包括酯衍生物和/或衍生物,其具有或提供与任意有关本发明化合物相同的生物学功能和/或活性。从而,出于本发明意图,术语也包括如本文所定义的化合物的前药。
有关化合物的术语"前药"包括任意化合物,其在口服或肠胃外给药之后和在预先确定的时间内例如6至24小时的给药间隔内(也即1至4次/日)在体内代谢形成实验可检测量的所述化合物。
化合物的前药可以通过修饰化合物上存在的官能团制备,其中在所述前药给予哺乳动物受试者的情况下该修饰在体内裂解。修饰一般地通过合成带前药取代基的母体化合物实现。前药包括化合物,其中化合物中的羟基、氨基、氢硫基、羧基或羰基键合至可以在体内裂解以分别再产生所述游离羟基、氨基、氢硫基、羧基或羰基的任意基团。
前药的实例包括但不限于羟基官能团的酯和氨基甲酸酯,羧基官能团的酯基团,N-酰基衍生物和N-曼尼希碱。前药的一般信息可以参见例如Bundegaard,H."Design ofProdrugs"p.1-92,Elsevier,New York-Oxford(1985)。
本发明化合物可以在体内代谢。式(I)化合物的代谢物也属于本发明范围内。术语‘代谢物’是指在细胞或有机体优选哺乳动物中衍生自任何本发明化合物的全部分子。优选该术语涉及分子,其不同于在生理学条件下在任意所述细胞或有机体中存在的任何分子。
本文定义的治疗可以作为唯一疗法应用或者除了本发明化合物之外还可以牵涉常规手术或放射疗法或化学疗法。另外,式(I)化合物还能够与治疗剂组合使用,所述治疗剂是治疗与癌症有关的病况的现有治疗剂,包括小分子治疗剂或基于抗体。
本发明化合物的特征在于形成自与5元芳族环稠合的氰基吡咯烷核心的8元双环环结构,其中所述芳族环含有至少一个氮杂原子。
根据本发明的第一方面,提供式I化合物:
或其药学上可接受的盐,其中:
R1a,R1b,R1c和R1d各自独立地代表氢,任选经取代的C1-C6烷基,或R1a和R1b一起形成任选经取代的C3-C6环烷基环,或R1c和R1d一起形成任选经取代的C3-C6环烷基环;
A是5元含氮芳族环和用至少一个通过任选的连接体附着的任选经取代的5至10元单环或双环的杂芳基或芳基环取代。
在一种实施方式中,A是用-Q1-B和(-Q2-(D)m)n取代的;
m代表0或1;
n代表0,1或2;
Q1代表共价键,氧原子,硫原子,-OR4-,-SO-,-SO2-,-C(O)-,-C(O)O-,-C0-C3-亚烷基-C(O)NR2-C0-C3亚烷基,-C0-C3-亚烷基-NR2-C0-C3-亚烷基-,-C0-C3-亚烷基-NR2C(O)-C0-C3-亚烷基,-NR2C(O)NR3-,-SO2NR2-,NR2SO2-,-NR2SO2NR3-,-NR2C(O)O-,-NR2C(O)OR4-,任选经取代的-C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
B代表任选经取代的5至10元单环或双环的芳基或杂芳基环;
R2和R3各自独立地代表氢或任选经取代的C1-C6烷基;
R4代表任选经取代的C1-C6亚烷基;
Q2的各具体值独立地代表卤素,氰基,硝基,羟基,-SR5,-NR5R6,-CONR5R6,-C0-C3-亚烷基-NR5COR6-,-NR5CONR6R6a,-COR5,-C(O)OR5,-SO2R5,-SO2NR5R6,-NR5SO2R6,-NR5SO2NR6R6a,-NR5C(O)OR6,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,共价键,氧原子,硫原子,-OR7-,-SO-,-SO2-,-CO-,-C(O)O-,-C0-C3-亚烷基-C(O)NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5C(O)-C0-C3亚烷基,-NR5CONR6-,-SO2NR5-,NR5SO2-,-NR5SO2NR6-,-NR5C(O)O-,-NR5C(O)OR7-,任选经取代的C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
D的各具体值独立地代表任选经取代的3至10元单环或双环的杂环基,杂芳基,环烷基或芳基环;
R5,R6和R6a各自独立地代表氢或任选经取代的C1-C6烷基;
R7代表任选经取代的C1-C6亚烷基。
环A含有1至3个氮原子。在一种实施方式中,环A含有1个氮原子。在一种实施方式中,环A含有2个氮原子。在又一实施方式中,环A含有3个氮原子。优选,环A含有2个氮原子。
环A可以选自下述结构及其互变异构体:
尤其是,稠合的芳族环是:
(IA)或其互变异构体。
其中*代表与氰基吡咯烷核心共享以形成8元双环环的环原子。该环可以用取代-Q1-B和(-Q2-(D)m)n取代,其中Q1,Q2,B,D,m和n如本文所定义。
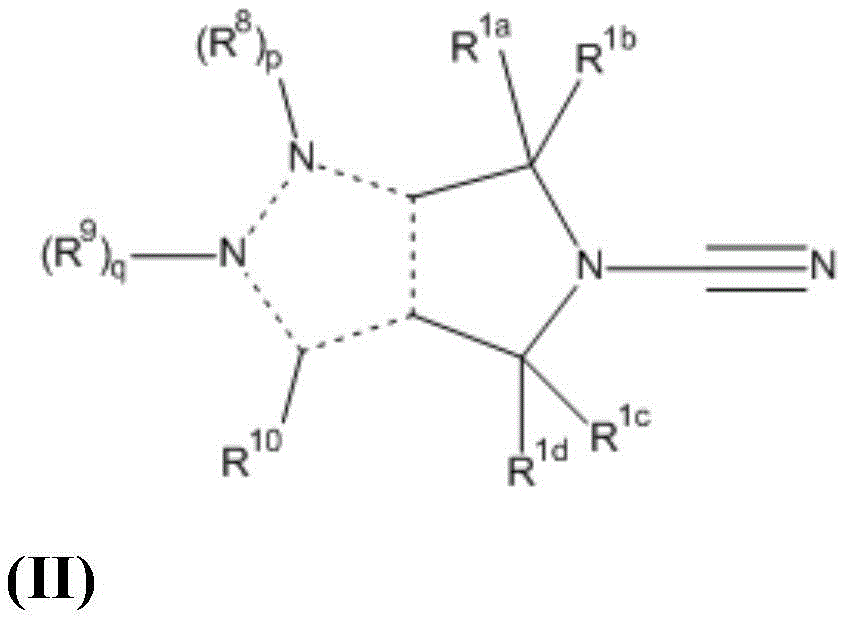
本发明的又一方面提供式II化合物:
或其药学上可接受的盐,其中
R1a,R1b,R1c和R1d各自独立地代表氢,任选经取代的C1-C6烷基,或R1a和R1b一起形成任选经取代的C3-C6环烷基环,或R1c和R1d一起形成任选经取代的C3-C6环烷基环;
p是0或1;
q是0或1;
其中p和q不都是0且p和q中仅一个能够是1;
R8代表氢,-Q1-B或-Q2-(D)m;
R9代表氢或任选经取代的C1-C6烷基;
R10代表氢,-Q1-B或-Q2-(D)m;
其中R8或R10之一代表-Q1-B;
Q1代表共价键,氧原子,硫原子,-OR4-,-SO-,-SO2-,-C(O)-,-C(O)O-,-C0-C3-亚烷基-C(O)NR2-C0-C3-亚烷基,-C0-C3-亚烷基-NR2-C0-C3-亚烷基,-C0-C3-亚烷基-NR2C(O)-C0-C3-亚烷基,-NR2C(O)NR3-,-SO2NR2-,NR2SO2-,-NR2SO2NR3-,-NR2C(O)O-,-NR2C(O)OR4-,任选经取代的-C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
B代表任选经取代的5至10元单环或双环的芳基或杂芳基环;
R2和R3各自独立地代表氢或任选经取代的C1-C6烷基;
R4代表任选经取代的C1-C6亚烷基;
Q2代表卤素,氰基,硝基,羟基,-SR5,-NR5R6,-CONR5R6,-C0-C3-亚烷基-NR5COR6-,-NR5CONR6R6a,-COR5,-C(O)OR5,-SO2R5,-SO2NR5R6,-NR5SO2R6,-NR5SO2NR6R6a,-NR5C(O)OR6,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,共价键,氧原子,硫原子,-OR7-,-SO-,-SO2-,-CO-,-C(O)O-,-C0-C3-亚烷基-C(O)NR5-C0-C3-亚烷基,-C0-C3-亚烷基-NR5-C0-C3-亚烷基,-C0-C3-亚烷基-NR5C(O)-C0-C3-亚烷基,-NR5CONR6-,-SO2NR5-,NR5SO2-,-NR5SO2NR6-,-NR5C(O)O-,-NR5C(O)OR7-,任选经取代的C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
D的各具体值独立地代表任选经取代的3至10元单环或双环的杂环基,杂芳基,环烷基或芳基环;
R5,R6和R6a各自独立地代表氢或任选经取代的C1-C6烷基;
R7代表任选经取代的C1-C6亚烷基。
在本文描述的全部情况下,R1a,R1b,R1c和R1d可以各自独立地代表氢,任选经取代的C1-C6烷基,或R1a与R1b一起形成任选经取代的C3-C6环烷基,或R1c和与R1d一起形成任选经取代的C3-C6环烷基。尤其是,R1a,R1b,R1c和R1d可以各自独立地代表氢或C1-C3烷基(例如甲基或乙基)。R1a可以是氢或C1-C3烷基和R1b可以是氢。R1c可以是氢或C1-C3烷基和R1d可以是氢。尤其是,R1a,R1b,R1c和R1d各自代表氢。烷基在R1a、R1b、R1c和R1d的定义中可以是未经取代的或被一个或多个取代基取代,所述取代基选自:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,烷基可以被氟取代。
R1a可以代表氢。R1a可以代表C1-C6烷基。R1a可以代表C1-C3烷基,例如甲基或乙基。在R1a代表C1-C6烷基的情况下,R1b,R1c和R1d可以各自代表氢。烷基在R1a的定义中可以是未经取代的或被一个或多个取代基取代,所述取代基选自:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,烷基可以被氟取代。
R1b可以代表氢。R1b可以代表C1-C6烷基。R1b可以代表C1-C3烷基,例如甲基或乙基。在R1b代表C1-C6烷基的情况下,R1a,R1c和R1d可以各自代表氢。烷基在R1b的定义中可以是未经取代的或被一个或多个取代基取代,所述取代基选自:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,烷基可以被氟取代。
R1c可以代表氢。R1c可以代表C1-C6烷基。R1c可以代表C1-C3烷基,例如甲基或乙基。在R1c代表C1-C6烷基的情况下,R1a,R1b和R1d可以各自代表氢。烷基在R1c的定义中可以是未经取代的或被一个或多个取代基取代,所述取代基选自:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,烷基可以被氟取代。
R1d可以代表氢。R1d可以代表C1-C6烷基。R1d可以代表C1-C3烷基,例如甲基或乙基。在R1d代表C1-C6烷基的情况下,R1a,R1b和R1c可以各自代表氢。烷基在R1d的定义中可以是未经取代的或被一个或多个取代基取代,所述取代基选自:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,烷基可以被氟取代。
另选地,R1a和R1c可以一起形成环烷基环。此外或另选地,R1c和R1d可以一起形成环烷基环。在R1a和R1b一起形成环烷基环的情况下,R1c和R1d可以各自独立地代表氢或任选经取代的C1-C6烷基。在R1c和R1d一起形成环烷基环的情况下,R1a和R1b可以各自独立地代表氢或任选经取代的C1-C6烷基。环烷基环在R1a,R1b,R1c和R1d的定义中能够含有3,4,5,或6个碳环原子,尤其是3或4个碳环原子。环烷基环连接至氰基吡咯烷核心作为螺环,也即它们共享一个环原子。环烷基环可以是未经取代的或被取代基取代,所述取代基选自:C1-C3烷基,C1-C3烷氧基,卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5,其中烷基和烷氧基可以任选被卤素取代。
化合物可以呈其中R1a,R1b,R1c和R1d各自氢的形式。在这种情况下,化合物可以为式:
或其药学上可接受的盐,其中
p是0或1;
q是0或1;
其中p和q不都是0且仅p和q之一能够是1;
R8代表氢,-Q1-B或-Q2-(D)m;
R9代表氢或任选经取代的C1-C6烷基;
R10代表氢,-Q1-B或-Q2-(D)m;
其中R8或R10之一代表-Q1-B;
Q1代表共价键,氧原子,硫原子,-OR4-,-SO-,-SO2-,-C(O)-,-C(O)O-,-C0-C3-亚烷基-C(O)NR2-C0-C3-亚烷基,-C0-C3-亚烷基-NR2-C0-C3-亚烷基,-C0-C3-亚烷基-NR2C(O)-C0-C3-亚烷基,-NR2C(O)NR3-,-SO2NR2-,NR2SO2-,-NR2SO2NR3-,-NR2C(O)O-,-NR2C(O)OR4-,任选经取代的-C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
B代表任选经取代的5至10元单环或双环的芳基或杂芳基环;
R2和R3各自独立地代表氢或任选经取代的C1-C6烷基;
R4代表任选经取代的C1-C6亚烷基;
Q2代表卤素,氰基,硝基,羟基,-SR5,-NR5R6,-CONR5R6,-C0-C3-亚烷基-NR5COR6-,-NR5CONR6R6a,-COR5,-C(O)OR5,-SO2R5,-SO2NR5R6,-NR5SO2R6,-NR5SO2NR6R6a,-NR5C(O)OR6,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,共价键,氧原子,硫原子,-OR7-,-SO-,-SO2-,-CO-,-C(O)O-,-C0-C3-亚烷基-C(O)NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5C(O)-C0-C3亚烷基,-NR5CONR6-,-SO2NR5-,NR5SO2-,-NR5SO2NR6-,-NR5C(O)O-,-NR5C(O)OR7-,任选经取代的C1-C6亚烷基,或任选经取代的-C2-C6亚烯基;
D的各具体值独立地代表任选经取代的3至10元单环或双环的杂环基,杂芳基,环烷基或芳基环;
R5和R6各自独立地代表氢或任选经取代的C1-C6烷基;
R7代表任选经取代的C1-C6亚烷基。
在本文描述的全部情况中,p是0或1而q是0或1,其中p和q不都是0且仅p和q之一是1,也即p和q不能均是1。
在一种实施方式中,p是1而q是0。
在p是1而q是0的情况下,R8可以代表-Q1-B,其中Q1和B如本文定义,和R10可以是氢或-Q2-(D)m,其中m是0或1而Q2和D如本文定义。在一种实施方式中,R10可以是氢或-Q2-(D)m,其中m是0而Q2如本文定义。在又一实施方式中,R10可以是-Q2-(D)m,其中m是1而Q2和D如本文定义。
另选地,在p是1而q是0的情况下,R8可以代表氢或-Q2-(D)m,其中m是0或1而Q2和D如本文定义,和R10代表-Q1-B,其中Q1和B如本文定义。在一种实施方式中,R8可以代表氢或-Q2-(D)m,其中m是0而Q2如本文定义。在又一实施方式中,R8可以代表-Q2-(D)m,其中m是1而Q2和D如本文定义。
在又一实施方式中,p是0而q是1。
在p是0而q是1的情况下,R9代表氢或任选经取代的C1-C6烷基,和R10代表-Q1-B,其中Q1和B如本文定义。烷基可以任选被下述取代:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5。尤其是,R9是氢或甲基。更特别地,R9是甲基。
在本文描述的全部情况中,Q1可以选自共价键,氧原子,硫原子,-OR4-,-SO-,-SO2-,-C(O)-,-C(O)O-,-C0-C3-亚烷基-C(O)NR2-C0-C3-亚烷基,-C0-C3-亚烷基-NR2-C0-C3-亚烷基(例如甲基氨基),-C0-C3-亚烷基-NR2C(O)-C0-C3-亚烷基,-NR2C(O)NR3-,-SO2NR2-,NR2SO2-,-NR2SO2NR3-,-NR2C(O)O-,-NR2C(O)OR4-,任选经取代的-C1-C6亚烷基(例如亚甲基或亚乙基)或任选经取代的-C2-C6亚烯基(例如乙烯基)。
R2和R3各自独立地代表氢或C1-C6烷基,C1-C4烷基,或C1-C2烷基。烷基可以任选被下述取代:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5。
R4代表C1-C6亚烷基,C1-C4亚烷基或C1-C2亚烷基。亚烷基可以任选被下述取代:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5。
尤其是,Q1可以选自共价键,-C0-C3亚烷基-NR2C(O)-C0-C3亚烷基,-C0-C3-亚烷基-NR2-C0-C3-亚烷基或任选经取代的-C1-C6亚烷基,和R2代表氢或C1-C3烷基,其中所述烷基可以是未经取代的或用卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5取代。
在一种实施方式中,Q1选自共价键,C1亚烷基-NHC(O)-,-NH-,亚甲基或亚甲基-NHC(O)-亚甲基。在又一种实施方式中,Q1是共价键。
在本文描述的全部情况中,B代表任选经取代的5至10元(例如5、6、7、8、9或10元)单环或双环的芳基或杂芳基环。
B可以代表任选经取代的5或6元单环芳基或杂芳基环。
另选地,B可以代表任选经取代的9或10元双环芳基或杂芳基环。
B可以选自萘基,萘基,吡啶基,吡嗪基,嘧啶基,哒嗪基,呋喃基,吡咯基,噁唑基,噻唑基,吡唑基,四唑基,吲哚基,吲嗪基,异吲哚基,吲哚啉基,嘌呤基,呋咱基,咪唑基,吲唑基,异噻唑基,异噁唑基,噁二唑基,四唑基,噻二唑基,苯并呋喃基,异苯并呋喃基,苯并噻吩基,异苯并噻吩基,苯并咪唑基,苯并噻唑基,萘啶基,蝶啶基,吡嗪基,喹啉基,异喹啉基,噌啉基,酞嗪基,喹唑啉基,咪唑并吡啶基,吡唑并吡啶基,噻唑并吡啶基,异吲哚啉基,三嗪基,二氢吡啶基,喹喔啉基,二氢苯并噁嗪基和二氢吡咯并吡啶基。
尤其是,B选自苯基,喹啉基,吡啶基,吡唑基,吲唑基,咪唑基和异喹啉基。更特别地,B是苯基。
在p是1和R8代表-Q1-B的情况下,B可以选自苯基,吲唑基或吡唑基。尤其是,B可以是吲唑基。
在本文描述的全部情况中,B可以是未经取代的或被一个或多个非环取代基和/或环取代基取代。
因此,B可以是未经取代的或用一个或多个(例如1、2、3或4个)取代基取代,所述取代基选自卤素,氰基,氧代,硝基,羟基,-SR11,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,任选经取代的-C2-C6炔基,-Q3a-R13,-Q3a-O-Q3b-R13,-Q3a-S-Q3b-R13,-Q3a-SO-Q3b-R13,-Q3a-NR11CONR12R12a,-Q3a-NR11CONR12-Q3a-R13,-Q3a-NR11R12,-Q3a-NR11-Q3b-R13,-Q3a-COR11,-Q3a-CO-Q3b-R13,-Q3a-NR11COR12,-Q3a-NR11CO-Q3b-R13,-Q3a-NR11C(O)OR12,-Q3a-NR11C(O)O-Q3b-R13,-Q3a-SO2R11,-Q3a-SO2-Q3b-R13,Q3a-CONR11R12,-Q3a-CONR11-Q3b-R13,-Q3a-CO2R11,-Q3a-CO2-Q3b-R13,-Q3a-SO2NR11R12,-Q3a-SO2NR11-Q3b-R13,-Q3a-NR11SO2R12,-Q3a-NR11SO2-Q3b-R13和-Q3a-NR11SO2NR12R12a,-Q3a-NR11SO2NR12-Q3b-R13。
Q3a和Q3b各自独立地代表共价键,C1-C6亚烷基,C1-C4亚烷基,C1-C2亚烷基或C2-C6亚烯基或C2-C4亚烯基。亚烷基或亚烯基可以被下述取代:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5。
R11,R12和R12a各自独立地代表氢或C1-C6烷基,C1-C4烷基或C1-C2烷基。烷基可以任选被下述取代:卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5。
R13代表任选经取代的杂环基,任选经取代的杂芳基,任选经取代的芳基,或任选经取代的环烷基。
非环取代基可以选自卤素,氰基,氧代,硝基,羟基,-SR11,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,任选经取代的-C2-C6炔基,-Q3a-NR11CONR12R12a,-Q3a-NR11R12,-Q3a-COR11,-Q3a-NR11COR12,-Q3a-NR11C(O)OR12,-Q3a-SO2R11,-Q3a-CONR11R12,-Q3a-CO2R11,-Q3a-SO2NR11R12,-Q3a-NR11SO2R12和-Q3a-NR11SO2NR12R12a。
除了非环取代基之外或另选地,B可以用一个或多个尤其是仅一个环取代基取代,其可以选自-Q3a-R13,-Q3a-O-Q3b-R13,-Q3a-S-Q3b-R13,-Q3a-SO-Q3b-R13,-Q3a-NR11CONR12-Q3a-R13,-Q3a-NR11-Q3b-R13,-Q3a-CO-Q3b-R13,-Q3a-NR11CO-Q3b-R13,-Q3a-NR11C(O)O-Q3b-R13,-Q3a-SO2-Q3b-R13,-Q3a-CONR11-Q3b-R13,-Q3a-CO2-Q3b-R13,-Q3a-SO2NR11-Q3b-R13,-Q3a-NR11SO2-Q3b-R13和-Q3a-NR11SO2NR12-Q3b-R13。
B可以用一个或多个取代基取代,所述取代基选自卤素,氰基,任选经取代的C1-C6烷基,任选经取代的C1-C6烷氧基,-Q3a-R13,-Q3a-O-Q3b-R13,-Q3a-CONR11R12,-Q3a-CONR11-Q3b-R12,-Q3a-NR11CO-Q3b-R13,-Q3a-SO2NR11R12,-Q3a-SO2NR11-Q3b-R13和-Q3a-NR11SO2-Q3b-R13。
尤其是,Q3a是共价键或任选经取代的C1-C3亚烷基。Q3a可以是共价键,亚甲基或亚乙基。
尤其是,Q3b是共价键或任选经取代的C1-C3亚烷基。Q3b可以是共价键,亚甲基或亚乙基。
尤其是R11,R12和R12a各自独立地代表氢或任选经取代的C1-C3烷基。烷基的可选取代基可以选自卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,可选取代基选自氟。
R13可以是任选经取代的3至10元单环或双环的杂环基,杂芳基,环烷基或芳基环。R13可以是3至6元环。另选地,R13可以是9或10元环。
R13可以用额外的任选经取代的3至10元杂环基,杂芳基,芳基或环烷基环取代,所述基团直接或经由连接基团附着。连接基团可以是氧,羰基或任选经取代的C1-C6亚烷基链。连接基团可以是氧,-CO-或C1-C6亚烷基。在一种实施方式中,连接基团可以是羰基或亚烷基链,例如-CO-或C1-C3亚烷基。
尤其是,R13是未经取代的或用一个或多个取代基取代,所述取代基选自卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基,SF5,C1-C3烷基或C1-C3烷氧基,其中所述烷基或烷氧基可以任选用羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5取代,尤其是所述取代基是C1-C3烷基。在一种实施方式中,R13是未经取代的。更特别地,R13是未经取代的或取代的单环3或6元杂环基,杂芳基,环烷基或芳基环。环可以是未经取代的或用卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基,SF5,C1-C3烷基或C1-C3烷氧基取代,其中所述烷基或烷氧基可以任选用羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5取代。更特别地,R13是未经取代的或一取代的。更特别地,R13是未经取代的或用C1-C3烷基取代。
R13可以是任选经取代的3至6元单环杂环基,杂芳基,环烷基或芳基环。R13可以选自苯基,吡啶基,哌嗪基和环丙基。尤其是,R13可以选自苯基或环丙基。
烷基和烷氧基在B和R11,R12和R12a的定义中的可选取代基可以选自卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,可选取代基是氟。
更特别地,B可以用一个或多个取代基取代,所述取代基选自氟;氯;氰基;甲基;丙基;CF3;甲氧基;丙氧基;OCF3;-C(O)NH2,-C(O)NHCH3,-C(O)N(CH3)2(也即-Q3a-C(O)R11R12其中Q3a是共价键而R11和R12各自独立地是氢或甲基);-SO2N(CH3)2(也即-Q3a-SO2NR11R12其中Q3a是共价键而R11和R12均是甲基);-R13,亚甲基-R13(也即-Q3a-R13其中Q3a是共价键或亚甲基);-C(O)NH-R13(也即-Q3a-C(O)NR11-Q3b-R13其中Q3a和Q3b均代表共价键而R11是氢);-C(O)NH-亚甲基-R13(也即-Q3a-C(O)NR11-Q3b-R13其中Q3a是共价键,Q3b是亚甲基和R11是氢);-NHC(O)-C2亚烷基-R13(也即-Q3a-NR11C(O)-Q3b-R13其中Q3a是共价键,Q3b是C2亚烷基和R11是氢);-C(O)NH-亚乙基-R13(也即-Q3a-C(O)NR11-Q3b-R13其中Q3a是共价键,Q3b是亚乙基和R11是氢;-O-亚甲基-R13,-O-R13(也即-Q3a-O-Q3b-R13其中Q3a是共价键而Q3b是亚甲基或共价键),-C(O)-R13(也即-Q3a-C(O)-Q3b-R13其中Q3a和Q3b均代表共价键),-SO2NH-R13(也即-Q3a-SO2NR11-Q3b-R13其中Q3a和Q3b均代表共价键而R11是氢),-NHSO2-R13(也即-Q3a-NR11SO2-Q3b-R13其中Q3a和Q3b均代表共价键而R11是氢),其中R13选自苯基,吡啶基,哌嗪基和环丙基。
在p是1和R8代表-Q1-B的情况下,B可以是未经取代的或用卤素,C1-C6烷氧基,-CONR11R12或-Q3a-R13取代,其中R11,R12,R13和Q3a如本文定义。尤其是,B可以用下述取代:氟,甲基,甲氧基,-C(O)NH2,-C(O)NHMe,Q3a-苯基,其中Q3a是共价键或-CONH-C1-C2亚烷基。在一种实施方式中,B是未经取代的或用Q3a-苯基取代,其中Q3a是-CONH-C1亚烷基。
在一种实施方式中,B是未经取代的,一取代的,二取代的或三取代的。尤其是,B是未经取代的,一取代的或二取代的。例如,B是未经取代的或一取代的。在某些实施方式中,B是未经取代的。
在某些情况下,B选自苯基,萘基,萘基,吡啶基,吡嗪基,嘧啶基,哒嗪基,呋喃基,吡咯基,噁唑基,噻唑基,吡唑基,四唑基,吲哚基,吲嗪基,异吲哚基,吲哚啉基,嘌呤基,呋咱基,咪唑基,吲唑基,异噻唑基,异噁唑基,噁二唑基,四唑基,噻二唑基,苯并呋喃基,异苯并呋喃基,苯并噻吩基,异苯并噻吩基,苯并咪唑基,苯并噻唑基,萘啶基,蝶啶基,吡嗪基,喹啉基,异喹啉基,噌啉基,酞嗪基,喹唑啉基,咪唑并吡啶基,吡唑并吡啶基,噻唑并吡啶基,异吲哚啉基,三嗪基,二氢吡啶基,喹喔啉基,二氢苯并噁嗪基,二氢吡咯并吡啶基,其是未经取代的或用一个或多个取代基取代,所述取代基选自卤素,氰基,氧代,硝基,羟基,-SR11,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,任选经取代的-C2-C6炔基,-Q3a-R13,-Q3a-O-Q3b-R13,-Q3a-S-Q3b-R13,-Q3a-SO-Q3b-R13,-Q3a-NR11CONR12R12a,-Q3a-NR11CONR12-Q3a-R13,-Q3a-NR11R12,-Q3a-NR11-Q3b-R13,-Q3a-COR11,-Q3a-CO-Q3b-R13,-Q3a-NR11COR12,-Q3a-NR11CO-Q3b-R13,-Q3a-NR11C(O)OR12,-Q3a-NR11C(O)O-Q3b-R13,-Q3a-SO2R11,-Q3a-SO2-Q3b-R13,Q3a-CONR11R12,-Q3a-CONR11-Q3b-R13,-Q3a-CO2R11,-Q3a-CO2-Q3b-R13,-Q3a-SO2NR11R12,-Q3a-SO2NR11-Q3b-R13,-Q3a-NR11SO2R12,-Q3a-NR11SO2-Q3b-R13和-Q3a-NR11SO2NR12R12a,-Q3a-NR11SO2NR12-Q3b-R13;其中Q3a和Q3b各自独立地代表共价键,任选经取代的C1-C6亚烷基或任选经取代的C2-C6亚烯基;R11,R12和R12a各自独立地代表氢或任选经取代的C1-C6烷基;和R13代表任选经取代的杂环基,任选经取代的杂芳基,任选经取代的芳基,或任选经取代的环烷基。
B可以代表环,选自苯基,喹啉基,吡啶基,吡唑基,吲唑基,咪唑基和异喹啉基,其可以是未经取代的或用一个或多个取代基取代,所述取代基选自卤素,氰基,氧代,硝基,羟基,-SR11,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,任选经取代的-C2-C6炔基,-Q3a-R13,-Q3a-O-Q3b-R13,-Q3a-S-Q3b-R13,-Q3a-SO-Q3b-R13,-Q3a-NR11CONR12R12a,-Q3a-NR11CONR12-Q3a-R13,-Q3a-NR11R12,-Q3a-NR11-Q3b-R13,-Q3a-COR11,-Q3a-CO-Q3b-R13,-Q3a-NR11COR12,-Q3a-NR11CO-Q3b-R13,-Q3a-NR11C(O)OR12,-Q3a-NR11C(O)O-Q3b-R13,-Q3a-SO2R11,-Q3a-SO2-Q3b-R13,Q3a-CONR11R12,-Q3a-CONR11-Q3b-R13,-Q3a-CO2R11,-Q3a-CO2-Q3b-R13,-Q3a-SO2NR11R12,-Q3a-SO2NR11-Q3b-R13,-Q3a-NR11SO2R12,-Q3a-NR11SO2-Q3b-R13和-Q3a-NR11SO2NR12R12a,-Q3a-NR11SO2NR12-Q3b-R13;其中Q3a和Q3b各自独立地代表共价键,任选经取代的C1-C6亚烷基或任选经取代的C2-C6亚烯基;R11,R12和R12a各自独立地代表氢或任选经取代的C1-C6烷基;和R13代表任选经取代的杂环基,任选经取代的杂芳基,任选经取代的芳基,或任选经取代的环烷基。
B可以代表环,选自喹啉基,吡啶基,吡唑基,吲唑基,咪唑基和异喹啉基,其可以是未经取代的或用一个或多个(例如1、2或3个)取代基取代,所述取代基选自氟,氯,氰基,甲基,丙基,CF3,甲氧基,丙氧基,OCF3,-C(O)NH2,-C(O)NHCH3,-C(O)N(CH3)2,-SO2N(CH3)2,-R13,-C(O)NH-R13,-C(O)NH-亚甲基-R13,-C(O)NH-亚乙基-R13,-O-亚甲基-R13,-O-R13,-C(O)-R13,亚甲基-R13,-SO2NH-R13,-NHSO2-R13,其中R13选自苯基,吡啶基,哌嗪基和环丙基。
在本文描述的全部情况中,Q2代表卤素,氰基,硝基,羟基,-SR5,-NR5R6,-CONR5R6,-C0-C3-亚烷基-NR5COR6,-NR5CONR6R6a,-COR5,-C(O)OR5,-SO2R5,-SO2NR5R6,-NR5SO2R6,-NR5SO2NR6R6a,-NR5C(O)OR6,任选经取代的-C1-C6烷基,任选经取代的C1-C6烷氧基,任选经取代的-C2-C6烯基,共价键,氧原子,硫原子,-OR7-,-SO-,-SO2-,-CO-,-C(O)O-,-C0-C3-亚烷基-C(O)NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5-C0-C3亚烷基,-C0-C3-亚烷基-NR5C(O)-C0-C3亚烷基,-NR5CONR6-,-SO2NR5-,NR5SO2-,-NR5SO2NR6-,-NR5C(O)O-,-NR5C(O)OR7-,任选经取代的C1-C6亚烷基,或任选经取代的-C2-C6亚烯基,其中R5、R6和R6a各自独立地代表氢或任选经取代的C1-C6烷基而R7代表任选经取代的C1-C6亚烷基。
尤其是,Q2代表任选经取代的C1-C6烷基,-C0-C3-亚烷基-NR5COR6,共价键,C1-C6亚烷基,-C0-C3-亚烷基-NR5-C0-C3亚烷基或-C0-C3-亚烷基-NR5C(O)-C0-C3亚烷基,其中R5是氢或C1-C3烷基。
尤其是,Q2代表甲基,异丙基,-NHC(O)CH3,共价键,亚甲基,-NH-或亚甲基-NR5C(O)-。
在m是1的情况下,D代表任选经取代的3至10元单环或双环的杂环基,杂芳基,环烷基或芳基环(在m是0的情况下,Q2存在而D不存在)。
D可以代表任选5或6元的单环杂环基,杂芳基或芳基环。
另选地,D可以代表任选经取代的9或10元双环杂环基,杂芳基或芳基环。
D可以选自环丙基,环丁基,环戊基,环己基,环庚基,环辛基,十氢萘基,苯基,萘基,萘基,吡啶基,吡嗪基,嘧啶基,哒嗪基,呋喃基,吡咯基,噁唑基,噻唑基,吡唑基,四唑基,吲哚基,吲嗪基,异吲哚基,吲哚啉基,嘌呤基,呋咱基,咪唑基,吲唑基,异噻唑基,异噁唑基,噁二唑基,四唑基,噻二唑基,苯并呋喃基,异苯并呋喃基,苯并噻吩基,异苯并噻吩基,苯并咪唑基,苯并噻唑基,萘啶基,蝶啶基,吡嗪基,喹啉基,异喹啉基,噌啉基,酞嗪基,喹唑啉基,咪唑并吡啶基,吡唑并吡啶基,噻唑并吡啶基,异吲哚啉基,三嗪基,二氢吡啶基,喹喔啉基,二氢苯并噁嗪基,二氢吡咯并吡啶基,氮杂环丁烷基,吡咯烷基,哌啶基,氮杂环庚烷基,二氮杂环庚烷基,二氢呋喃基(例如2,3-二氢呋喃基,2,5-二氢呋喃基),二氧杂环戊烷基,吗啉基,噁唑烷基,噁嗪烷基,吲哚啉基,异吲哚啉基,哌嗪基,四氢呋喃基,硫吗啉基,二氢吡喃基(例如3,4-二氢吡喃基,3,6-二氢吡喃基),高哌嗪基,二噁烷基,六氢嘧啶基,吡唑啉基,吡唑烷基,4H-喹嗪基,奎宁环基,四氢吡喃基,四氢吡啶基,四氢嘧啶基,四氢噻吩基,噻唑烷基,苯并吡喃基,四氢喹啉基,二氢苯并噁嗪基和四氢异喹啉基。
尤其是,D选自苯基,异喹啉基和吡啶基。更特别地,D是苯基。
在本文描述的全部情况中,D可以是未经取代的或用一个或多个(例如1、2、3或4)个取代基取代,所述取代基选自卤素,氰基,氧代,硝基,羟基,-SR14,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,任选经取代的-C2-C6炔基,-Q4a-R16,-Q4a-O-Q4b-R16,-Q4a-S-Q4b-R16,-Q4a-SO-Q4b-R16,-Q4a-NR14CONR15R15a,-Q4a-NR14CONR15-Q4b-R16,-Q4a-NR14R15,-Q4a-NR14-Q4b-R16,-Q4a-COR14,-Q4a-CO-Q4b-R16,-Q4a-NR14COR15,-Q4a-NR14CO-Q4b-R16,-Q4a-NR14C(O)OR15,-Q4a-NR14C(O)O-Q4b-R16,-Q4a-SO2R14,-Q4a-SO2-Q4b-R16,Q4a-CONR14R15,-Q4a-CONR14-Q4b-R16,-Q4a-CO2R14,-Q4a-CO2-Q4b-R16,-Q4a-SO2NR14R15,-Q4a-SO2NR14-Q4b-R16,-Q4a-NR14SO2R15,-Q4a-NR14SO2-Q4b-R16和-Q4a-NR14SO2NR15R15a,-Q4a-NR14SO2NR15-Q4b-R16;其中
Q4a和Q4b独立地代表共价键,任选经取代的C1-C6亚烷基或任选经取代的C2-C6亚烯基;
R14,R15和R15a各自独立地代表氢或任选经取代的C1-C6烷基;和R16代表任选经取代的杂环基,任选经取代的杂芳基,任选经取代的芳基,或任选经取代的环烷基。
R16可以用额外的任选经取代的3至10元杂环基,杂芳基,芳基或环烷基环取代,所述环直接或经由连接基团附着。连接基团可以是氧,羰基或任选经取代的C1-C6亚烷基链。连接基团可以是氧,-CO-或C1-C6亚烷基。在一种实施方式中,连接基团可以是羰基或亚烷基链,例如-CO-或C1-C6亚烷基。尤其是,R16是未经取代的或用一个或多个取代基取代,所述取代基选自卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基,SF5,C1-C3烷基或C1-C3烷氧基,其中烷基或烷氧基可以任选用羟基,硫醇,氰基,氨基,酰胺基,硝基或SF5取代。优选,R16是未经取代的。
尤其是,D可以用一个或多个取代基取代,所述取代基选自任选经取代的C1-C6烷基,任选经取代的C1-C6烷氧基和-CONR14R15(也即-Q4a-CONR14R14其中Q4a是共价键),其中R14和R15如前文所定义。
更特别地,D可以是未经取代的或用甲基,异丙基,甲氧基或-C(O)NH2取代。
烷基和烷氧基在D和R14,R15和R15a的定义中的可选取代基可以选自卤素,羟基,硫醇,氰基,氨基,酰胺基,硝基和SF5。尤其是,可选取代基是氟。
在一种实施方式中,D是未经取代的,一取代的,二取代的或三取代的。尤其是,D是未经取代的,一取代的或二取代的。例如,D是未经取代的或一取代的。在某些实施方式中,D是未经取代的。
在某些情况下,D选自苯基,萘基,萘基,吡啶基,吡嗪基,嘧啶基,哒嗪基,呋喃基,吡咯基,噁唑基,噻唑基,吡唑基,四唑基,吲哚基,吲嗪基,异吲哚基,吲哚啉基,嘌呤基,呋咱基,咪唑基,吲唑基,异噻唑基,异噁唑基,噁二唑基,四唑基,噻二唑基,苯并呋喃基,异苯并呋喃基,苯并噻吩基,异苯并噻吩基,苯并咪唑基,苯并噻唑基,萘啶基,蝶啶基,吡嗪基,喹啉基,异喹啉基,噌啉基,酞嗪基,喹唑啉基,咪唑并吡啶基,吡唑并吡啶基,噻唑并吡啶基,异吲哚啉基,三嗪基,二氢吡啶基,喹喔啉基,二氢苯并噁嗪基,二氢吡咯并吡啶基,其是未经取代的或用一个或多个取代基取代,所述取代基选自卤素,氰基,氧代,硝基,羟基,-SR14,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,任选经取代的-C2-C6炔基,-Q4a-R16,-Q4a-O-Q4b-R16,-Q4a-S-Q4b-R16,-Q4a-SO-Q4b-R16,-Q4a-NR14CONR15R15a,-Q4a-NR14CONR15-Q4b-R16,-Q4a-NR14R15,-Q4a-NR14-Q4b-R16,-Q4a-COR14,-Q4a-CO-Q4b-R16,-Q4a-NR14COR15,-Q4a-NR14CO-Q4b-R16,-Q4a-NR14C(O)OR15,-Q4a-NR14C(O)O-Q4b-R16,-Q4a-SO2R14,-Q4a-SO2-Q4b-R16,Q4a-CONR14R15,-Q4a-CONR14-Q4b-R16,-Q4a-CO2R14,-Q4a-CO2-Q4b-R16,-Q4a-SO2NR14R15,-Q4a-SO2NR14-Q4b-R16,-Q4a-NR14SO2R15,-Q4a-NR14SO2-Q4b-R16和-Q4a-NR14SO2NR15R15a,-Q4a-NR14SO2NR15-Q4b-R16;其中Q4a和Q4b独立地代表共价键,任选经取代的C1-C6亚烷基或任选经取代的C2-C6亚烯基;R14,R15和R15a各自独立地代表氢或任选经取代的C1-C6烷基;和R16代表任选经取代的杂环基,任选经取代的杂芳基,任选经取代的芳基,或任选经取代的环烷基。
D可以代表环,选自苯基,异喹啉基和吡啶基,其可以是未经取代的或用一个或多个取代基取代,所述取代基选自卤素,氰基,氧代,硝基,羟基,-SR14,任选经取代的-C1-C6烷基,任选经取代的-C1-C6烷氧基,任选经取代的-C2-C6烯基,任选经取代的-C2-C6炔基,-Q4a-R16,-Q4a-O-Q4b-R16,-Q4a-S-Q4b-R16,-Q4a-SO-Q4b-R16,-Q4a-NR14CONR15R15a,-Q4a-NR14CONR15-Q4b-R16,-Q4a-NR14R15,-Q4a-NR14-Q4b-R16,-Q4a-COR14,-Q4a-CO-Q4b-R16,-Q4a-NR14COR15,-Q4a-NR14CO-Q4b-R16,-Q4a-NR14C(O)OR15,-Q4a-NR14C(O)O-Q4b-R16,-Q4a-SO2R14,-Q4a-SO2-Q4b-R16,Q4a-CONR14R15,-Q4a-CONR14-Q4b-R16,-Q4a-CO2R14,-Q4a-CO2-Q4b-R16,-Q4a-SO2NR14R15,-Q4a-SO2NR14-Q4b-R16,-Q4a-NR14SO2R15,-Q4a-NR14SO2-Q4b-R16和-Q4a-NR14SO2NR15R15a,-Q4a-NR14SO2NR15-Q4b-R16;其中Q4a和Q4b独立地代表共价键,任选经取代的C1-C6亚烷基或任选经取代的C2-C6亚烯基;R14,R15和R15a各自独立地代表氢或任选经取代的C1-C6烷基;和R16代表任选经取代的杂环基,任选经取代的杂芳基,任选经取代的芳基,或任选经取代的环烷基。
D可以代表环,选自苯基,异喹啉基和吡啶基,其可以是未经取代的或用一个或多个(例如1、2或3个)取代基取代,所述取代基选自任选经取代的C1-C6烷基,任选经取代的C1-C6烷氧基和-CONR14R15,其中R14和R15各自独立地代表氢或任选经取代的C1-C6烷基。
在一种实施方式中,提供如前文所定义的式I化合物或其药学上可接受的盐,其中所述化合物不是:
(4-(5-氰基-5,6-二氢吡咯并[3,4-d][1,2,3]三唑-2(4H)-基)-3-氟苯基)氨基甲酸苄酯。
在一种实施方式中,提供如前文所定义的式I化合物或其药学上可接受的盐,其中所述化合物不是:
2-(2-氟-4-硝基苯基)-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈。
式I新化合物的实例包括:
1-(4-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-(4-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-(2-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
4-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺;
1-(喹啉-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-(3-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-(1-苯基-1H-吡唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-(1-苯基-1H-咪唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-甲基-1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
N-苄基-3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺;
3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-(1-苯基乙基)苯甲酰胺;
3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-(吡啶-2-基甲基)苯甲酰胺;
4-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-(吡啶-2-基甲基)苯甲酰胺;
4-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-甲基苯甲酰胺;
4-(5-氰基-3-甲基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺;
1-(1-甲基-1H-吲唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
5-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-2-甲氧基-N-甲基苯甲酰胺;
1-(1H-吲唑-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-(3-苯基-1H-吡唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-甲基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
2-甲基-3-苯基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
1-异丙基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-苄基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-苄基-3-(5-异丙基-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(5-异丙基-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氟-5-甲基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
5-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-1H-吡唑-3-甲酰胺;
3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(异喹啉-3-基氨基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(异喹啉-3-基氨基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
1-苄基-3-(异喹啉-3-基氨基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
4-(5-氰基-3-(吡啶-2-基氨基)-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺;
N-((5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-3-苯基-1H-吡唑-5-甲酰胺;
N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-4-甲基苯甲酰胺;
N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)乙酰胺;
3-(4-(苄氧基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-氰基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(1-甲基-1H-吡唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-(三氟甲氧基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-苯氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-氰基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氟-4-(三氟甲基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氯-5-(三氟甲氧基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
5-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-N-甲基吡啶酰胺;
3-(6-甲氧基吡啶-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-N,N-二甲基苯磺酰胺;
3-(5-氟-2-异丙氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
N-苄基-4-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)苯甲酰胺;
3-(6-异丙氧基吡啶-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-(4-甲基哌嗪-1-羰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(1-甲基-1H-吲唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(1-苄基-1H-吡唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(5-甲基-1H-吲唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-N-环丙基苯磺酰胺;
N-(3-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)苯基)环丙烷磺酰胺;
3-(3-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氟-5-甲基苯基)-1-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氟-5-甲基苯基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(5-异丙基-2-甲氧基苯基)-1-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(5-异丙基-2-甲氧基苯基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(5-乙基-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
6-氯-N-((5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)咪唑并[1,2-a]吡啶-2-甲酰胺;
3-(4-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-氯-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(6-(4-甲基哌嗪-1-基)吡啶-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-甲氧基-4-(1H-吡唑-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(3-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-吗啉代苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氟-4-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-甲基-4-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-(2-氧代噁唑烷-3-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-(2-氧代吡咯烷-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(5-氯-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
N-(3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯基)环丙烷磺酰胺;和
N-苄基-4-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-3-氟苯甲酰胺。
应注意上文所列的各化合物代表本发明的特别和独立的方面。
根据本发明的又一方面,提供制备式I化合物或其药学上可接受的盐或者式II化合物或其药学上可接受的盐的方法,包括将式III或式IV胺分别与溴化氰反应以形成N-CN化合物的步骤:
其中R1a,R1b,R1c,R1d和A如本文定义。
其中R1a,R1b,R1c,R1d,R8,R9,R10p和q如本文所定义。
根据本发明的又一方面,提供包含本发明化合物的药物组合物。
本发明化合物可以用于治疗涉及DUB或脱小泛素修饰分子抑制特别是USP7的障碍和疾病。
根据本发明的又一方面,提供式(I)化合物或其药物组合物,用于治疗中。尤其是,本发明化合物用于治疗癌症和更特别地治疗与DUB或脱小泛素修饰分子活性有关联的癌症。本发明化合物可以用于针对任何DUB或脱小泛素修饰分子酶,包括但不限于USP7,USP30,USP47,SENP2和SENP6。
本文描述的化合物可以用于制备药物,所述药物用于治疗与DUB或脱小泛素修饰分子活性有关联的癌症。
在本发明的又一方面中,提供治疗或预防与USP7活性有关联的癌症的方法,所述方法包括将药学有效量的本发明化合物或其药物组合物给药患有与USP7活性有关联的癌症的个体。
本文公开的化合物或组合物可以用来治疗癌症。提及"癌"或"肿瘤"包括但不限于乳腺,卵巢,前列腺,肺,肾,胃,结肠,睾丸,头和颈,胰,脑,黑色素瘤,骨,肝,软组织或组织器官的其它癌症和血液细胞癌症比如淋巴瘤和白血病。特别的癌症包括淋巴瘤,多发性骨髓瘤,CML,AML,外套细胞淋巴瘤,成神经细胞瘤,结直肠癌,黑色素瘤,软组织肉瘤包括脂肪肉瘤、成纤维细胞肉瘤和平滑肌肉瘤,肝细胞癌,骨肉瘤,食道癌和非小细胞肺癌。
本文公开的化合物或组合物可以用来治疗与USP7活性有关联的其它疾病。
如本文描述的本发明化合物或其药物组合物可以与一种或多种额外试剂组合。化合物可以与一种或多种额外的抗肿瘤治疗剂组合,例如化疗药物、免疫检查点抑制剂或其它调节蛋白的抑制剂。在一种实施方式中,所述一种或多种抗肿瘤试剂是化疗药剂。化疗药剂可以选自奥拉帕尼,丝裂霉素C,顺铂,卡铂,奥沙利铂,离子化辐射(IR),喜树碱,伊立替康,托泊替康,替莫唑胺,紫杉类药物,5-氟嘧啶,吉西他滨,和多柔比星。在又一实施方式中,额外的抗肿瘤治疗剂是BH-3模拟物。在又一实施方式中,BH-3模拟物可以选自但不限于ABT-737,ABT-199,ABT-263和奥巴克拉中的一种或多种。
如上文所讨论,本发明化合物可以用于治疗涉及USP30抑制的障碍和疾病。本发明化合物可以因此用于治疗障碍或疾病,其具有涉及线粒体功能障碍的组分。
线粒体是专门的亚细胞器,为以ATP形式产生能量所需。在线粒体功能障碍的情况,细胞不能产生充足的ATP,引起细胞损伤或死亡。线粒体疾病最通常出现在能量要求很高的器官比如脑、心脏、肝、骨骼肌肉、肾和内分泌系统和呼吸系统中。
牵涉线粒体功能障碍的病况可以选自牵涉线粒体自噬缺陷的病况,牵涉线粒体DNA突变的病况,牵涉线粒体氧化应激的病况,牵涉线粒体膜电势缺陷的病况,线粒体生物起源,牵涉线粒体形状或形态缺陷的病况,和牵涉溶酶体贮藏缺陷的病况。
尤其是,牵涉线粒体功能障碍的病况可以选自神经变性疾病;多发性硬化(MS),线粒体肌病,脑病,乳酸性酸中毒,和似卒中发作(MELAS)综合征;Leber氏遗传性视神经病(LHON);癌症;神经病,共济失调,视网膜色素变性-母系遗传Leigh综合征(NARP-MILS);Danon病;糖尿病;糖尿病性肾病;代谢性疾病;心力衰竭;导致心肌梗死的缺血性心脏病;精神病学疾病例如精神分裂症;多硫酸酯酶缺乏症(MSD);粘脂病II(ML II);粘脂病III(MLIII);粘脂病IV(ML IV);GMl-神经节苷脂沉积症(GM1);神经元腊样脂褐质症(NCL1);Alpers病;Barth综合征;Beta-氧化缺陷;卡尼汀-酰基-卡尼汀缺乏症;卡尼汀缺乏症;肌酸缺乏综合征;辅酶Q10缺乏症;复合体I缺乏症;复合体II缺乏症;复合体III缺乏症;复合体IV缺乏症;复合体V缺乏症;COX缺乏症;慢性进行性外部眼肌麻痹综合征(CPEO);CPT I缺乏症;CPT II缺乏症;戊二酸尿类型II;Kearns-Sayre综合征;乳酸性酸中毒;长链酰基-CoA脱氢酶缺乏症(LCHAD);Leigh病或综合征;致死性婴儿心肌病(LIC);Luft病;戊二酸尿类型II;中链酰基-CoA脱氢酶缺乏症(MCAD);肌阵挛性癫痫伴破碎红纤维(MERRF)综合征;线粒体细胞病;线粒体隐性共济失调综合征;线粒体DNA耗尽综合征;肌神经胃肠道障碍和脑病;Pearson综合征;丙酮酸脱氢酶缺乏症;丙酮酸羧化酶缺乏症;POLG突变;中链/短链3-羟基酰基-CoA脱氢酶(M/SCHAD)缺乏症;和超长链酰基-CoA脱氢酶(VLCAD)缺乏症。
牵涉线粒体功能障碍的病况可以是CNS障碍,例如神经变性疾病。神经变性疾病包括但不限于帕金森病,阿尔茨海默氏病,肌萎缩性侧索硬化(ALS),亨廷顿舞蹈病,缺血,卒中,具有Lewy体的痴呆,和额颞性痴呆。
剂型
本发明的药物组合物可以设计用于口服、肠胃外或粘膜途径给药,并且组合物的选择或特定形式取决于给药途径。从而,对于口服给药,组合物可以呈例如片剂,糖锭,锭剂,薄膜,粉末,酏剂,糖浆剂,液体制剂包括分散液、悬浮液、乳液、溶液或喷雾剂,扁囊剂,颗粒剂,胶囊等形式。对于给药至粘膜,组合物可以呈喷雾剂,吸入剂,分散液,悬浮液,乳液,溶液,凝胶,贴剂,薄膜,软膏剂,霜剂,洗剂,栓剂等形式。对于肠胃外给药,组合物呈液体制剂形式,比如溶液、分散液、乳液或悬浮液,包括脂质体组合物。
根据本发明用于肠胃外给药的制剂包括无菌含水的、含水有机的和有机的溶液、悬浮液和乳液。
所述剂型根据药物配制剂领域已知的技术制备。在呈喷雾剂或吸入剂形式的情况下药物组合物可以鼻部给予。该意图的适宜配制剂是本领域技术人员已知的。
本发明的药物组合物可以通过注射给予和可以呈用于注射的无菌液体制剂形式,包括脂质体制剂。本发明的药物组合物还可以呈用于直肠给药的栓剂形式。它们的配制使得药物组合物在室温是固体且在体温是液体,允许活性化合物的释放。
剂量可以取决于患者需求、待治疗的病症严重性和所用的化合物而变化。对于特定情况确定合适的剂量是本领域技术人员的能力。一般地,用小于化合物最佳剂量的较小剂量开始治疗。此后,小量增加剂量直至达到在这种情况下的最佳效果。
化合物有效剂量的大小当然随着待治疗病况的严重性和特定化合物和其给药途径而变化。选择适当剂量是本领域技术人员的能力,而无过度负担。日剂量范围是约10μg至约100mg每kg人类和非人类动物体重,和通常可以是约10μg至30mg每kg体重每剂。上述剂量可以每天给予1次至3次。
合成方法
本发明化合物可以经由各种合成路线制备。某些本发明化合物的示范性途径如下所示。代表性的本发明化合物能够按照描述如下的一般合成方法合成,并且在后续方案中更特别地说明。由于方案为一种示例,本发明不应解释为受到所表示的化学反应和条件的限制。制备方案中所用的各种原料也完全属于本领域技术人员的能力。本领域技术人员理解方案中的单步转化能够视情况以不同的顺序完成。下述方案描述一般合成方法,借此可以制备中间体和本发明靶标化合物。额外的代表性化合物及其立体异构体,外消旋混合物,非对映体和对映体能够用下述合成:按照一般方案制备的中间体和本领域技术人员已知的其它物质、化合物和试剂。全部所述化合物、其立体异构体、外消旋混合物、非对映体和对映体期望涵盖在本发明范围内。
全部化合物由液相色谱-质谱(LCMS)或1H NMR或两者表征。
缩写:
AcOH 乙酸
Ar 芳基
BEH 亚乙基桥连的合成物
Boc 叔丁氧基羰基
br 宽(NMR信号)
d 二重峰(NMR信号)
dba 二亚苄基丙酮
DCM 二氯甲烷
DIPEA 二异丙基乙胺
DMAP 4-二甲基氨基吡啶
DMA-DMA N,N-二甲基乙酰胺二甲基缩醛
DMF N,N-二甲基甲酰胺
DMF-DMA N,N-二甲基甲酰胺二甲基缩醛
DMSO 二甲亚砜
Dppf 1,1'-二(二苯基膦基)二茂铁
ES 电喷雾
EtOAc 乙酸乙酯
EtOH 乙醇
g 克
h 小时
HATU 1-[二(二甲基氨基)亚甲基]-1H-1,2,3-三唑并[4,5-b]吡啶鎓3-氧化物六氟磷酸盐
m 多重峰(NMR信号)
M 摩尔浓度
MeCN 乙腈
MeOH 甲醇
min 分
ml 毫升
mm 毫米
mM 毫摩尔
mmol 毫摩尔
μm 微米
μM 微摩尔每升
NCS N-氯代琥珀酰亚胺
PE 石油醚
Ruphos 2-二环己基膦基-2′,6′-二异丙氧基联苯
rt 室温
RT 保留时间
s 单峰(NMR信号)
t 三重峰(NMR信号)
TEA 三乙胺
TFA 三氟乙酸
THF 四氢呋喃
TLC 薄层色谱
中间体A(Z)-3-((二甲基氨基)亚甲基)-4-氧代吡咯烷-1-羧酸叔丁酯
在rt向3-氧代吡咯烷-1-羧酸叔丁酯(CAS号101385-93-7,获自Combi Blocks)(5.00g,27.0mmol)的1,4-二噁烷(50ml)溶液加入DMF-DMA(4.79g,40.0mmol)。反应混合物在100℃加热4小时。所得反应混合物冷却至rt和减压浓缩。所得残余物与正己烷共蒸(25ml)。所得残余物与正己烷研磨(2x 5ml)和最终干燥,产生(Z)-3-((二甲基氨基)亚甲基)-4-氧代吡咯烷-1-羧酸叔丁酯(4.530g,18.87mmol)。该物质直接用于后续步骤不加进一步纯化。LCMS:方法1,1.843分钟,MS:ES+241.23;1H NMR(400MHz,DMSO-d6)δppm 7.21(s,1H),4.47(d,J=9.60Hz,2H),3.59(d,J=11.20Hz,2H),3.06(s,6H),1.42(d,J=6.00Hz,9H)。
中间体B(Z)-3-(1-(二甲基氨基)乙亚基)-4-氧代吡咯烷-1-羧酸叔丁酯
将1-N-Boc-3-吡咯烷酮(CAS号101385-93-7,获自Combi Blocks)(1.0g,5.399mmol)的DMF-DMA(3ml)溶液在80℃加热3小时。所得反应混合物冷却至rt和减压浓缩,产生(Z)-3-(1-(二甲基氨基)乙亚基)-4-氧代-吡咯烷-1-羧酸叔丁酯(0.80g,3.137mmol)。LCMS:方法1,1.720分钟。
中间体C 4-肼基-1-苯基-1H-咪唑盐酸盐
步骤a.在rt向4-溴-1H-咪唑(CAS号2302-25-2,获自Combi Blocks)(5.0g,34.01mmol)的MeOH(10ml)溶液加入苯基取代硼酸(10.36g,85.03mmol),NaOH(2.04g,51.0mmol)和氯化铜(II)(0.55g,4.08mmol)。反应混合物用氧吹扫。所得反应混合物在65℃加热3小时,同时连续缓慢氧吹扫。所得反应混合物冷却至rt,倾至水中(30ml)和用EtOAc萃取(6x 20ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(0.5%MeOH/DCM)纯化,产生4-溴-1-苯基-1H-咪唑(2.0g,9.049mmol)。LCMS:方法1,1.898分钟,MS:ES+223.1。
步骤b.在rt向4-溴-1-苯基-1H-咪唑(2.0g,9.010mmol)的1,4-二噁烷(5ml)溶液加入肼基二羧酸二叔丁酯(1.84g,8.144mmol),N,N-二甲基乙二胺(0.16g,1.809mmol),K3PO4(7.67g,36.198mmol)和CuI(0.34g,1.809mmol)。所得反应混合物在100℃加热3小时。所得反应混合物倾至水中(20ml)和用EtOAc萃取(4x 20ml)。收集经合并的有机相,在Na2SO4上干燥,过滤和减压浓缩,产生1-(1-苯基-1H-咪唑-4-基)肼-1,2-二羧酸二叔丁酯(1.0g,2.67mmol)。LCMS:方法1,2.238分钟,MS:ES+375.0。
步骤c.将1-(1-苯基-1H-咪唑-4-基)肼-1,2-二羧酸二叔丁酯(1.15g,3.073mmol)在4M HCl的1,4-二噁烷溶液(5ml)中在rt搅拌30分钟。减压浓缩所得反应混合物,产生4-肼基-1-苯基-1H-咪唑HCl盐(1.15g,定量)。LCMS:方法1,1.507分钟,MS:ES+175.19。
中间体D 4-肼基-1-苯基-1H-吡唑
步骤a.向4-硝基-1H-吡唑(CAS号2075-46-9获自Combi Blocks)(4.000g,35.4mmol)的MeOH(30ml)溶液加入苯基取代硼酸(7.700g,63.7mmol)。在rt将TEA(1.43g,14.16mmol)加入反应混合物。反应混合物在rt用氧吹扫15分钟。将Cu2O(0.500g,3.506mmol)加入反应混合物。反应混合物在65℃加热34小时,同时连续吹扫氧。所得反应混合物冷却至rt,过滤通过C盐床和用DCM:MeOH(1:1,2x 100ml)洗涤。经合并的滤液在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过柱色谱法(100%DCM)纯化,产生4-硝基-1-苯基-1H-吡唑(3.400g,17.89mmol)。LCMS:方法1,2.071分钟。未观察到质量离子。该物质直接用于后续步骤不加进一步纯化。
步骤b.向4-硝基-1-苯基-1H-吡唑(0.600g,3.174mmol)的EtOH:水(1:1,10ml)溶液加入Fe粉(0.495g,9.52mmol)。在rt将AcOH(0.942g,15.7mmol)加入反应混合物。反应混合物在80℃加热2小时。所得反应混合物冷却至rt,过滤通过C盐床和用MeOH洗涤(2x10ml)。减压浓缩经合并的滤液,产生1-苯基-1H-吡唑-4-胺(0.500g,3.144mmol)。LCMS:方法1,1.341分钟,MS:ES+160.14。该物质直接用于后续步骤不加进一步纯化。
步骤c.在0℃向1-苯基-1H-吡唑-4-胺(0.500g,3.144mmol)的浓HCl(5ml)溶液加入NaNO2(0.260g,3.768mmol)的水(2ml)溶液。所得反应混合物在0℃搅拌1小时。将SnCl2.2H2O(1.780g,9.418mmol)的浓HCl(5ml)溶液在0℃加入上述反应混合物。所得反应混合物在rt搅拌2小时。过滤收集获得的沉淀和减压干燥,产生4-肼基-1-苯基-1H-吡唑(1.000g,定量)。LCMS:方法1,1.339分钟,MS:ES+175.19。该物质直接用于后续步骤不加进一步纯化。
中间体E 1-(3-氟-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-4-甲基-哌嗪
步骤a.在rt向4-溴-3-氟苯胺(CAS号656-65-5;1.000g,5.292mmol)的EtOH(30ml)溶液加入TEA(2.21ml,15.9mmol)、随后盐酸氮芥(CAS号55-86-7;2.037g,10.58mmol)。反应混合物在100℃加热18小时。反应混合物与通过等同方法以相同规模制备的另一批次合并。所得混合物冷却至rt,过滤和减压浓缩滤液。残余物通过快速柱色谱法纯化(90%EtOAc/正己烷和进一步的10%MeOH/DCM),产生1-(4-溴-3-氟苯基)-4-甲基哌嗪(0.680g,2.500mmol)。LCMS:方法1,1.470分钟,MS:ES+273.28,275.28。
步骤b.在rt向搅拌的1-(4-溴-3-氟苯基)-4-甲基哌嗪(0.680g,2.50mmol)的甲苯(30ml)溶液加入K2CO3(0.690g,5.00mmol)和二频那醇基二硼(0.950g,3.75mmol)。反应混合物脱气10分钟,随后在rt加入Pd(PPh3)4(0.289g,0.250mmol)。反应混合物在100℃加热8小时。所得混合物冷却至rt,减压过滤和减压浓缩滤液。残余物通过快速柱色谱法纯化(100%正己烷),产生1-(3-氟-4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)-4-甲基哌嗪(0.980g,定量)。LCMS:方法1,1.554分钟,MS:ES+321.53。
中间体F 3-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)噁唑烷-2-酮
在rt向搅拌的3-(3-溴苯基)噁唑烷-2-酮(CAS号1086221-37-5;0.600g,2.489mmol)的1,4-二噁烷(10ml)溶液加入KOAc(0.488g,4.98mmol)和二频那醇基二硼(0.948g,3.734mmol)。反应混合物脱气15分钟,随后在rt加入PdCl2(dppf)(0.181g,0.248mmol)。所得反应混合物在100℃加热2小时。反应混合物与通过等同方法以相同规模制备的1个其它批次合并。反应混合物冷却至rt和倾至水中(70ml)。所得混合物用EtOAc萃取(3x 50ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩,产生3-(3-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)苯基)噁唑烷-2-酮(1.500g)。该物质直接用于后续步骤不加进一步纯化。
方案1
试剂和条件:a)Ar-NHNH2,EtOH,催化量AcOH;b)4M HCl/1,4-二噁烷;c)BrCN,K2CO3。
实施例1 1-(4-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
根据方案1合成
步骤a.在rt向(Z)-3-((二甲基氨基)亚甲基)-4-氧代吡咯烷-1-羧酸叔丁酯(中间体A,0.3g,1.250mmol)和(4-甲氧基苯基)肼盐酸盐(CAS号19501-58-7,获自Spectrochem)(0.66g,3.750mmol)的EtOH(10ml)溶液加入AcOH(0.1ml)。在rt搅拌反应混合物10分钟,然后在80℃加热4小时。所得反应混合物冷却至rt,用水稀释(50ml)和用EtOAc萃取(2x50ml)。经合并的有机相用盐水洗涤(30ml)和在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(30%EtOAc/己烷)纯化,产生1-(4-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.20g,0.634mmol)。LCMS:方法1,2.314分钟,MS:ES+316.33。
步骤b.将1-(4-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.15g,0.474mmol)在4M HCl/1,4-二噁烷(5ml)中的溶液在rt搅拌30分钟。减压浓缩所得反应混合物。获得的残余物与二乙醚共沸蒸馏(20ml)和在高真空下干燥,产生1-(4-甲氧基苯基)-1,4,5,6-四氢吡咯并[3,4-c]吡唑HCl盐(0.08g,0.318mmol)。LCMS:方法1,1.416分钟,MS:ES+216.23。
步骤c.向1-(4-甲氧基苯基)-1,4,5,6-四氢吡咯并[3,4-c]吡唑HCl盐(0.075g,0.347mmol)在THF:MeOH(10ml+1ml)混合物中的溶液加入K2CO3(0.14g,1.041mmol)在rt。在rt搅拌反应混合物10分钟。在rt将溴化氰(0.074g,0.694mmol)加入反应混合物。在rt搅拌反应混合物1小时。所得反应混合物倾至饱和NaHCO3溶液中(20ml)和用EtOAc萃取(2x30ml)。经合并的有机相用盐水洗涤(20ml),在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法纯化(15%EtOAc/正己烷),产生标题化合物(0.025g,0.104mmol)。LCMS:方法3,5.586分钟,MS:ES+241.15;1H NMR(400MHz,DMSO-d6)δppm 7.51-7.54(m,3H),7.054(d,J=8.8Hz,2H),4.97(s,2H),4.58(s,2H),3.79(s,3H)。
表1化合物用与实施例1所描述类似的程序合成。
表1
实施例10 3-甲基-1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
用与实施例1类似的程序合成,用中间体B代替中间体A。LCMS方法4,4.038分钟,MS:ES+225.05。
方案2
试剂和条件:a)浓HCl,NaNO2,SnCl2;b)Ar-NHNH2,EtOH,催化量的AcOH;c)R1R2NH,Me3Al,DIPEA,THF;d)TFA,DCM;e)BrCN,K2CO3。
实施例11N-苄基-3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺
根据方案2合成
步骤a.将3-氨基苯甲酸甲酯(CAS号4518-10-9,获自Combi Blocks)(8g,52.9mmol)在浓HCl(70ml)中的混合物冷却至0℃。将NaNO2(4.38g,63.4mmol)的水(5ml)溶液在0℃加入反应混合物,搅拌30分钟。将SnCl2(30g,158mmol)在HCl(30ml)中的混合物在0℃加入反应混合物。在0至10℃的温度搅拌反应混合物2小时。减压滤出所得固体,用二乙醚洗涤(2x 5ml)和最终干燥,产生3-肼基苯甲酸甲酯(30g,粗制)。LCMS:方法4,2.806分钟,MS:ES+167.07。该物质直接用于后续步骤不加进一步纯化。
步骤b.在rt向(Z)-3-((二甲基氨基)亚甲基)-4-氧代吡咯烷-1-羧酸叔丁酯(中间体A,6g,25mmol)的EtOH(30ml)溶液加入3-肼基苯甲酸甲酯(4.98g,30mmol)。在rt将冰AcOH(2ml)加入反应混合物。反应混合物在80℃加热16小时。所得反应混合物冷却至rt和倾至饱和NaHCO3水溶液中(80ml)。获得的混合物用EtOAc萃取(2x 50ml)。经合并的有机相用盐水洗涤(100ml),在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过柱色谱法(20%EtOAc/己烷)纯化,产生1-(3-(甲氧羰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.7g,4.95mmol)。LCMS:方法1,2.423分钟,MS:ES+344.3
步骤c.在0℃向1-(3-(甲氧羰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.7g,2.04mmol)的THF(10ml)溶液加入DIPEA(0.17ml,1.02mmol)。在0℃将三甲基铝(2M,在甲苯中;5.10ml,10.20mmol)加入反应混合物和搅拌15分钟。在0℃将苄胺(0.27g,2.44mmol)加入反应混合物。反应混合物在50℃加热6小时。所得反应混合物冷却至rt和倾至饱和NaHCO3溶液中(80ml)和用EtOAc萃取(2x 20ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过柱色谱法(37%EtOAc/己烷)纯化,产生1-(3-(苄基氨基甲酰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.15g,0.35mmol)。LCMS:方法1,2.342分钟,MS:ES+419.33
步骤d.在0℃向1-(3-(苄基氨基甲酰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.15g,0.35mmol)的DCM(5ml)溶液加入TFA(1.5ml)。在rt搅拌反应混合物4小时。减压浓缩所得反应混合物,产生N-苄基-3-(5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺TFA盐(0.3g,定量)。LCMS:方法1,1.541分钟,MS:ES+319.23。该物质直接用于后续步骤不加进一步纯化。
步骤e.在0℃向N-苄基-3-(5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺TFA盐(0.3g,0.69mmol)的THF(5ml)溶液加入K2CO3(0.52g,3.77mmol)。在0℃将溴化氰(0.099g,0.94mmol)加入。在rt搅拌反应混合物1小时。所得反应混合物倾至水中(20ml)和用EtOAc萃取(2x 5ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过柱色谱法(62%EtOAc/己烷)纯化,产生N-苄基-3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺(0.042g,0.122mmol)。LCMS:方法4,3.993分钟,MS:ES+343.9;1H NMR(400MHz,DMSO-d6)δppm9.24(t,J=6Hz,1H),8.11(s,1H),7.85(d,J=8Hz,1H),7.72(dd,J=1.2,8Hz,1H),7.59-7.65(m,2H),7.31-7.40(m,4H),7.24-7.27(m,1H),5.08(s,2H),4.60(s,2H),4.51(d,J=5.6Hz,2H)。
表2化合物用与实施例11类似的程序合成,变化在步骤c中所用的胺。
表2
表3化合物用与实施例11类似的程序合成,在步骤a中用4-氨基苯甲酸甲酯(CAS号619-45-4)。
表3
实施例16 4-(5-氰基-3-甲基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺
用与实施例11类似的程序合成,在步骤a中用4-氨基苯甲酸乙酯,在步骤b中用中间体B和在步骤c中用甲醇/氨。LCMS:方法1,1.729分钟,MS:ES+268.18。
方案3
试剂和条件:a)浓HCl,NaNO2,SnCl2.2H2O;b)EtOH,催化量的AcOH;c)4M HCl/1,4-二噁烷;d)BrCN,K2CO3。
表4化合物根据方案3合成,步骤a用与实施例12步骤a类似的程序,而步骤b-d用与实施例1步骤a-c描述类似的程序。
表4
方案4
试剂和条件:a)i)BnNHNH2,EtOH,催化量的AcOH;ii)Boc2O,TEA;b)CuBr2,异戊基腈,MeCN;c)ArB(OH)2,Pd(PPh3)4,1,4-二噁烷,水;d)聚甲基羟基硅烷20%Pd(OH)2/C,EtOH;e)RBr,Cs2CO3,DMF f)TFA,DCM;g)BrCN,K2CO3。
实施例21 1-甲基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
根据方案4合成
步骤a.将3-氰基-4-氧代吡咯烷-1-羧酸叔丁酯(CAS号175463-32-8,获自CombiBlocks)(5.0g,23.81mmol)和苄基肼二-盐酸盐(CAS号20570-96-1,获自Combi Blocks)(9.27g,47.62mmol)的EtOH(50ml)溶液在70℃加热1小时。所得反应混合物冷却至rt。在rt将(Boc)2O(10.39g,47.62mmol)和TEA(7.2g,71.43mmol)加入反应混合物。在rt搅拌反应混合物1小时。所得反应混合物倾至饱和NaHCO3溶液中(25ml)和用EtOAc萃取(2x 100ml)。收集经合并的有机相,在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(2%MeOH/DCM)纯化,产生3-氨基-1-苄基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(3.0g,9.55mmol)。LCMS:方法1,2.126分钟,MS:ES+314.9;1H NMR(400MHz,DMSO-d6)δppm7.29-7.32(m,2H),7.22-7.25(m,1H),7.14-7.16(m,2H),5.47(s,2H),5.07(d,J=3.2Hz,2H),4.17(s,2H),4.14(d,J=6.4Hz,2H),1.43(s,9H)。
步骤b.在rt在氩气氛下向3-氨基-1-苄基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.0g,3.182mmol)的MeCN(10ml)溶液加入CuBr2(1.06g,4.774mmol)。在rt搅拌反应混合物15分钟。在rt将亚硝酸异戊酯(0.6g,4.774mmol)加入反应混合物。在rt搅拌反应混合物3小时。所得反应混合物与通过等同方法以相同规模制备的2个其它批次合并。所得反应混合物用2M HCl猝灭(10ml)和用EtOAc萃取(2x 50ml)。经合并的有机相用盐水(10ml)、饱和NaHCO3溶液洗涤,在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(50%EtOAc/己烷)纯化,产生1-苄基-3-溴-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.5g,3.978mmol)。LCMS:方法1,2.760分钟,MS:ES+378.2;1H NMR(400MHz,CDCl3)δppm7.23-7.39(m,5H),5.33(d,J=14.8Hz,2H),4.50(d,J=24.8Hz,2H),4.39(d,J=11.2Hz,2H),1.52(s,9H)。
步骤c.在rt将1-苄基-3-溴-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.5g,3.978mmol)和苯基取代硼酸(0.72g,5.967mmol)的1,4-二噁烷:水(8:2)(20ml)溶液用氮脱气30分钟。在rt将四(三苯基膦)钯(0)(0.91g,0.795mmol)和K2CO3(1.14g,9.94mmol)加入反应混合物。反应混合物在90℃加热6小时。所得反应混合物冷却至rt。所得反应混合物倾至水中(20ml)和用EtOAc萃取(3x 50ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(20%EtOAc/己烷)纯化,产生1-苄基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.5g,定量)。LCMS:方法1,2.840分钟,MS:ES+376.40。
步骤d.在rt向1-苄基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.5g,1.3mmol)的EtOH(10ml)溶液加入20%Pd(OH)2(50%水分)(0.25g)。在0℃将聚(甲基氢硅氧烷)(0.5g)加入反应混合物和在rt搅拌反应混合物24小时。所得反应混合物与通过等同方法以相同规模制备的2个批次合并。反应混合物过滤通过C盐垫和用EtOH洗涤(5ml)。减压浓缩所得滤液。所得残余物通过快速色谱法(10%MeOH/DCM)纯化,产生3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.10g,3.86mmol)。LCMS:方法1,2.131分钟,MS:ES+286.63。
步骤e.在rt向3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.5g,1.754mmol)的DMF(5ml)溶液加入Cs2CO3(1.14g,3.508mmol)。在0℃将碘甲烷(0.33ml,5.26mmol)滴加至反应混合物。在rt搅拌反应混合物1小时。所得反应混合物用水稀释(100ml)和用EtOAc萃取(2x 75ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。残余物通过快速色谱法(10-11%EtOAc/己烷)纯化,产生2个区域异构产品;1-甲基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.04g,0.133mmol):LCMS:方法1,2.355分钟,MS:ES+300.42;1H NMR(400MHz,DMSO-d6)δppm 7.59(t,J=6.8Hz,2H),7.39-7.43(m,2H),7.27-7.31(m,1H),4.48-4.57(m,4H),3.80(d,J=2.8Hz,3H),1.47(s,9H)和2-甲基-3-苯基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-羧酸叔丁酯(0.04g,0.133mmol):LCMS:方法1,2.346分钟,MS:ES+300.42;1H NMR(400MHz,DMSO-d6)δppm 7.23-7.59(m,5H),4.42(d,J=8.4Hz,2H),4.37(d,J=9.2Hz,2H),3.86(d,J=3.2Hz,3H),1,45(d,J=6Hz,9H)。区域化学由NOE分析确认。
步骤f.在rt向1-甲基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.035g,0.120mmol)的DCM(3ml)溶液加入TFA(0.35ml)。在rt搅拌反应混合物1小时。减压浓缩所得反应混合物。获得的残余物与二乙醚共沸蒸馏(2ml),与二乙醚研磨(3ml)和最终在高真空下干燥,产生1-甲基-3-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑TFA盐(0.03g,0.095mmol)。LCMS:方法1,1.547分钟,MS:ES+200.77。该物质直接用于后续步骤不加进一步纯化。
步骤g.在rt向1-甲基-3-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑TFA盐(0.03g,0.095mmol)的THF(3ml)溶液加入K2CO3(0.03g,0.210mmol)。在rt将溴化氰(0.01g,0.096mmol)加入反应混合物。在rt搅拌反应混合物30分钟。所得反应混合物倾至水中(30ml)和用EtOAc萃取(2x 25ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(2%MeOH/DCM)纯化,产生标题化合物(0.021g,0.093mmol)。LCMS:方法4,3.826分钟,MS:ES+225.01;1H NMR(400MHz,DMSO-d6)δppm 7.58(d,J=7.6Hz,2H),7.40(t,J=7.6Hz,2H),7.31(t,J=7.2Hz,2H),4.79(s,2H),4.69(S,2H),3.79(3H)。
实施例22 2-甲基-3-苯基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈
用与实施例21类似的程序合成,用2-甲基-3-苯基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-羧酸叔丁酯(如实施例21步骤a-e的描述制备)。LCMS:方法4,3.857分钟,MS:ES+225.01;1H NMR(400MHz,DMSO-d6)δppm 7.50-7.55(m,4H),7.45-7.47(m,1H),4.65(s,2H),4.58(s,2H),3.87(s,3H)。
实施例23 1-异丙基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
用与实施例21类似的程序合成,在步骤e中用2-溴丙烷。LCMS:方法4,4.515分钟,MS:ES+253.0。
表5化合物用与实施例21所描述类似的程序合成,省略步骤e。
表5
表6化合物用与实施例21类似的程序合成,省略步骤d和e:
表6
实施例28 5-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-1H-吡唑-3-甲酰胺
步骤a.在rt向5-硝基-1H-吡唑-3-羧酸甲酯(CAS号181585-93-3,获自ArkPharma)(0.200g,1.168mmol)的MeOH(10ml)溶液加入10%Pd/C(0.020g,10%w/w)。反应混合物在rt用氢气吹扫1h。所得反应混合物仔细地过滤通过C盐hyflow。C盐床用MeOH洗涤(2x5ml)和减压浓缩经合并的滤液。所得残余物用戊烷洗涤(2x 5ml)和减压干燥,产生5-氨基-1H-吡唑-3-羧酸甲酯(0.185g,1.312mmol)。该物质直接用于后续步骤不加进一步纯化。LCMS:方法4,1.713分钟,MS:ES+141.88
步骤b.在0℃向5-氨基-1H-吡唑-3-羧酸甲酯(0.150g,1.063mmol)的浓HCl(2ml)溶液加入NaNO2(0.074g,1.084mmol)的水(1.5ml)溶液。所得反应混合物在0℃搅拌30分钟。在0℃将SnCl2(0.403g,2.126mmol)的浓HCl(3.3ml)溶液加入上述所得混合物。在rt搅拌反应混合物2小时。减压浓缩所得反应混合物和与EtOH共蒸(2x 5ml),产生5-肼基-1H-吡唑-3-羧酸甲酯(0.158g,1.012mmol)。该物质直接用于后续步骤不加进一步纯化。LCMS:方法1,0.269分钟,MS:ES+157.0
步骤c.在rt向(Z)-3-((二甲基氨基)亚甲基)-4-氧代吡咯烷-1-羧酸叔丁酯(中间体A,0.200g,0.835mmol)的EtOH(4ml)溶液加入5-肼基-1H-吡唑-3-羧酸甲酯(0.156g,1.000mmol)。在rt将叔丁醇钠(0.170g,2.507mmol)加入反应混合物。反应混合物在80℃加热8小时。所得反应混合物冷却至rt和减压浓缩。所得残余物与正戊烷研磨(2ml),干燥和通过柱色谱法纯化(40%EtOAc/己烷),产生1-(3-(甲氧羰基)-1H-吡唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.110g,0.330mmol)。LCMS:方法1,2.040分钟,MS:ES+334.35。
步骤d-e.这些用与实施例11步骤d-e描述类似的程序进行。LCMS:方法4,1.82分钟,MS:ES+243.96。
实施例29 3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
步骤a.在rt向3-氰基-4-氧代吡咯烷-1-羧酸叔丁酯(CAS号175463-32-8;8.00g,38.1mmol)的EtOH(85ml)溶液加入NH2NH2.2HCl(4.40g,41.9mmol)。反应混合物在80℃加热30min。减压浓缩所得混合物。残余物倾至饱和NaHCO3溶液中(400ml)和用EtOAc萃取(3x200ml)。经合并的有机层在Na2SO4上干燥,过滤和减压浓缩。残余物通过快速色谱法(4-5%MeOH/DCM)纯化,产生3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(2.600g,11.607mmol)。LCMS:方法1,1.657,1.665分钟,MS:ES+225.29。
步骤b.在0℃向3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(2.600g,11.607mmol)的THF(30ml)溶液加入DIPEA(11.8ml,69.6mmol)。在0℃将氯甲酸乙酯(1.11ml,11.72mmol)滴加至反应混合物。在0℃搅拌反应混合物10分钟,然后在rt搅拌2小时。反应混合物倾至水中(60ml)和用EtOAc萃取(3x 60ml)。经合并的有机层在Na2SO4上干燥,过滤和减压浓缩。残余物通过快速色谱法(2-3%MeOH/DCM)纯化,产生5-叔丁基1-乙基3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸酯(3.200g,10.81mmol)。LCMS:方法1,1.986,MS:ES+297.43。
步骤c.在rt向碘(3.330g,13.120mmol)的DCM(35ml)溶液加入亚硝酸异戊酯(2.95ml,21.99mmol)。在rt将5-叔丁基1-乙基3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸酯(3.200g,10.81mmol)加入反应混合物。在rt搅拌反应混合物1小时。所得反应混合物倾至饱和Na2S2O3水溶液中(150ml)和用DCM萃取(3x 150ml)。经合并的有机层在Na2SO4上干燥,过滤和减压浓缩。残余物通过柱色谱法(20-30%EtOAc/己烷)纯化,产生5-叔丁基1-乙基3-碘-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸酯(1.980g,4.86mmol)。LCMS:方法1,2.543分钟,MS:ES+408.50步骤d.在rt向5-叔丁基1-乙基3-碘-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸酯(1.98g,4.86mmol)的MeOH(16ml)溶液加入TEA(4ml)。在rt搅拌反应混合物30分钟。减压浓缩所得反应混合物,产生3-碘-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.630g,4.865mmol)。该物质直接用于后续步骤不加进一步纯化。LCMS:方法1,2.029分钟,MS:ES+336.20;1H NMR(400MHz,MeOD)δppm 4.49-4.51(m,2H),4.31-4.34(m,2H),1.53(s,9H)。
步骤e.在0℃向3-碘-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(1.630g,4.865mmol)的DCM(18ml)溶液加入DMAP(0.891g,7.29mmol)。在0℃将Boc酸酐(1.27g,5.82mmol)加入反应混合物和搅拌10分钟。反应混合物然后在rt搅拌30分钟。所得反应混合物倾至水中(100ml)和用DCM萃取(3x 50ml)。经合并的有机层在Na2SO4上干燥,过滤和减压浓缩。残余物通过快速色谱法(20-30%EtOAc/己烷)纯化,产生3-碘-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(1.070g,2.454mmol)。LCMS:方法1,2.772分钟,MS:ES+436.50;1H NMR(400MHz,CDCl3)δppm 4.69-4.72(m,2H),4.33-4.36(m,2H),1.53-1.65(m,18H)。
步骤f.在rt向在微波管中制备的3-碘-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(0.500g,1.147mmol)的1,4-二噁烷:水(4.5:0.5,5ml)溶液加入苯基取代硼酸(0.419g,3.434mmol)。在rt将K2CO3(0.747g,3.435mmol)加入反应混合物。反应混合物脱气10-15分钟。在rt将四(三苯基膦)钯(0)(0.132g,0.114mmol)加入反应混合物。将管密封和反应混合物在微波中在100℃加热2小时。所得混合物冷却至rt,倾至水中(30ml)和用EtOAc萃取(3x 30ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(3-4%MeOH/DCM)纯化,产生3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.170g,0.440mmol)。LCMS:方法1,2.165分钟,MS:ES+286.29(M-100);1H NMR(400MHz,DMSO-d6)δppm 13.11-13.21(m,1H),7.59-7.62(m,2H),7.46-7.50(m,2H),7.31-7.41(m,1H),4.34-4.38(m,2H),4.21-4.13(m,2H),1.44-1.48(m,9H)。
步骤g.在0℃向3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(0.170g,0.44mmol)的DCM(6ml)溶液加入TFA(3.5ml)。在0℃搅拌反应混合物10分钟。在rt搅拌反应混合物2小时。减压蒸发所得反应混合物。残余物与DCM共蒸(2x 2ml),然后与二乙醚研磨(2x 2ml)和干燥,产生3-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑TFA盐(0.241g,定量)。该物质直接用于后续步骤不加进一步纯化。LCMS:方法1,1.447分钟,MS:ES+186 07。
步骤h.在0℃向3-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑TFA盐(0.246g,0.596mmol)的THF(5ml)溶液加入K2CO3(0.250g,1.812mmol)。在0℃将溴化氰(0.069g,0.651mmol)加入反应混合物。在0℃搅拌反应混合物1小时。所得反应混合物倾至冰冷水中(20ml)和用EtOAc萃取(3x 20ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。残余物通过制备型TLC纯化,用2.5%MeOH/DCM作流动相,产生标题化合物(0.042g,0.20mmol)。LCMS:方法6,3.23分钟,MS:ES+211.11;1H NMR(400MHz,DMSO-d6)δppm 13.34(s,1H),7.58-7.65(m,3H),7.53-7.55(m,2H),7.38-7.49(m,1H),4.79(d,2H),4.57(s,2H)。
方案5
试剂和条件:a)RNHNH2,EtOH;b)ArCl,Ruphos,Pd2(dba)3,KtBuO,甲苯;c)TFA,DCM;d)BrCN,K2CO3。
实施例30 3-(异喹啉-3-基氨基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈
根据方案5合成
步骤a.在rt向3-氰基-4-氧代吡咯烷-1-羧酸叔丁酯(CAS号175463-32-8获自Combi Blocks)(2.00g,9.52mmol)的EtOH(20ml)溶液加入甲基肼(0.44g,9.52mmol)。反应混合物在80℃加热10小时。所得反应混合物冷却至rt和减压浓缩。残余物通过柱色谱法(42%EtOAc/己烷)纯化,产生3-氨基-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-羧酸叔丁酯(0.600g,2.521mmol)。LCMS:方法1,2.00分钟,MS:ES+239.23;1H NMR(400MHz,DMSO-d6)δppm 4.97(s,2H),4.20(d,J=7.6Hz,2H),4.09(d,J=10.8Hz,2H),3.18(d,J=6.8Hz,3H),1.41(s,9H)。LCMS分析显示大约8:1的区域异构体比率,有利于希望异构体,由NOE分析确认。
步骤b.在rt向3-氨基-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-羧酸叔丁酯(0.700g,2.944mmol)的甲苯(5ml)溶液加入3-氯异喹啉(CAS号19493-45-9;0.400g,2.453mmol),叔丁醇钾(0.549g,4.906mmol)和Ru-Phos(0.114g,0.245mmol)。反应混合物脱气15分钟,随后加入Pd2(dba)3(0.224g,0.245mmol)。反应混合物在110℃加热2.5小时。所得反应混合物冷却至rt。反应混合物倾至水中(50ml)和用EtOAc萃取(4x 20ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过柱色谱法(62%EtOAc/己烷)纯化,产生3-(异喹啉-3-基氨基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-羧酸叔丁酯(0.400g,1.095mmol)。LCMS:方法1,2.295分钟,MS:ES+366.33。
步骤c,d.从上述中间体用与实施例29步骤g和h描述类似的程序合成标题化合物。LCMS:方法6,3.530分钟,MS:ES+290.80;1H NMR(400MHz,DMSO-d6)δppm 9.45(s,1H),8.99(s,1H),7.89(d,J=8.4Hz,1H),7.66(d,J=8.4Hz,1H),7.53-7.57(m,1H),7.38(s,1H),7.27-7.30(m,1H),4.64(d,4H),3.66(s,3H)。
实施例31 3-(异喹啉-3-基氨基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
步骤a.在rt向3-氰基-4-氧代吡咯烷-1-羧酸叔丁酯(CAS号175463-32-8;0.400g,1.904mmol)的EtOH(5ml)溶液加入4-甲氧基苄基肼HCl盐(CAS号2011-48-5;0.718g,3.805mmol)。所得反应混合物在70℃加热1小时。所得反应混合物冷却至0℃,用饱和NaHCO3溶液中和(15ml)。减压浓缩所得反应混合物以除去EtOH。残余物用水稀释(20ml)和用EtOAc萃取(2x 20ml)。经合并的有机相用盐水溶液洗涤(20ml),在Na2SO4上干燥,过滤和减压浓缩,产生3-氨基-1-(4-甲氧基苄基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.500g,1.453mmol)。LCMS:方法1,1.962,MS:ES+345.50。该物质直接用于后续步骤不加进一步纯化。
步骤b.这用上述中间体通过与实施例30步骤b描述类似的程序进行,提供3-(异喹啉-3-基氨基)-1-(4-甲氧基苄基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯
步骤c.将3-氨基-1-(4-甲氧基苄基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.200g,0.424mmol)的TFA(2.0ml)溶液在70℃加热16小时。所得反应混合物冷却至rt和减压浓缩。所得残余物与DCM共蒸(2x 5ml)。获得的残余物与二乙醚研磨(2x 10ml)和最终在高真空下干燥,产生N-(1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)异喹啉-3-胺(0.150g,0.410mmol)。LCMS:方法1,1.632分钟,MS:ES+252.18。
步骤d.标题化合物用上述中间体通过与实施例29步骤h描述类似的程序合成。LCMS:方法1,1.946分钟,MS:ES+277.18;1H NMR(400MHz,DMSO-d6)δppm 12.09-12.32(m,1H),9.45-9.56(m,1H),9.00-9.05(m,1H),7.91-7.93(m,1H),7.65-7.75(m,1H),7.44-7.57(m,2H),7.30-7.35(m,1H),4.51-4.63(m,4H)。
实施例32 1-苄基-3-(异喹啉-3-基氨基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
标题化合物用与实施例31类似的程序合成。LCMS:方法1RT2.302分钟,MS:ES+367.48。
实施例33 4-(5-氰基-3-(吡啶-2-基氨基)-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺
步骤a.这用4-甲酰胺基苯肼通过与实施例31步骤a描述类似的程序进行。
步骤b.在15℃向3-氨基-1-(4-氨基甲酰基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.200g,0.583mmol)的DMSO(7ml)溶液分批加入NaH(60%,在石蜡油中的分散液,0.070g,2.92mmol)。所得反应混合物在rt搅拌30分钟。将2-碘吡啶(0.143g,0.70mmol)加入,反应混合物在130℃加热12小时。所得反应混合物冷却至rt,倾至水中(30ml)和用EtOAc萃取(3x 30ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。残余物通过快速色谱法纯化(10%MeOH/DCM),产生1-(4-氨基甲酰基苯基)-3-(吡啶-2-基氨基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.073g,0.173mmol)。LCMS:方法1,1.816分钟,MS:ES+421.70。
步骤c,d.这些通过与实施例31步骤c和d描述类似的程序进行,提供标题化合物。LCMS:方法6,2.951分钟,MS:ES+346.62;1H NMR(400MHz,DMSO-d6)δppm 9.22(s,1H),8.16(d,J=4.0Hz,1H),8.06(s,1H),7.99(d,J=8.8Hz,2H),7.64(d,J=8.8Hz,2H),7.58(t,J=7.2Hz,1H),7.45(s,1H),6.79-6.82(m,2H),4.60(d,J=12.0Hz,4H)。
实施例34N-((5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-3-苯基-1H-吡唑-5-甲酰胺
步骤a.向3-苯基吡唑-5-羧酸(CAS号5071-61-4,0.2mmol)的DCM(1ml)溶液加入HATU(0.2mmol)。在0℃搅拌反应混合物20分钟。在rt将吡咯并[3,4-c]吡唑-5(1H)-羧酸,3-(氨基甲基)-4,6-二氢-,1,1-二甲基乙基酯(CAS号1251002-81-9,获自Wuxi,0.2mmol)和DIPEA(0.6mmol)加入反应混合物。在rt搅拌反应混合物16小时。减压浓缩所得混合物。所得残余物通过制备型-TLC(PE/EtOAc)纯化。
步骤b.向步骤a产品的EtOAc(1ml)溶液加入HCl/EtOAc(4M,1ml)。在rt搅拌反应混合物2h。减压浓缩所得混合物。残余物直接用于后续步骤不加进一步纯化。
步骤c.向步骤b产品的EtOH(2ml)溶液加入溴化氰(0.2mmol)和NaHCO3(0.6mmol)。在rt搅拌反应混合物16小时。减压浓缩所得混合物。粗制物通过制备型反相HPLC纯化(A:0.078%CH3COONH4/水,B:MeCN),获得所希望的化合物。LCMS方法7,RT 2.283分钟,MS:ES+334
实施例65 6-氯-N-((5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-咪唑并[1,2-a]吡啶-2-甲酰胺
这用与实施例34类似的程序合成,在步骤a中用6-氯咪唑并[1,2-a]吡啶-2-羧酸(CAS号182181-19-7)。LCMS:方法9,2.011分钟,MS:ES+342。
实施例35N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-4-甲基苯甲酰胺
步骤a.在rt向3-(氨基甲基)-4,6-二氢-1H-吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(200mg,0.84mmol)的DMF(4ml)溶液加入HATU(351mg,0.92mmol),TEA(93mg,0.92mmol,0.13ml),然后加入4-甲基苯甲酸(114mg,0.84mmol),搅拌反应混合物16小时。反应混合物用水稀释(20ml)和用EtOAc萃取(20ml x 2)。经合并的有机层用水洗涤(20ml),在Na2SO4上干燥,过滤和减压浓缩。残余物通过柱色谱法纯化(SiO2,PE:EtOAc=10:1至3:1),提供3-[[(4-甲基苯甲酰基)-氨基]甲基]-4,6-二氢-1H-吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(150mg,0.42mmol,50%收率),是浅黄色油状物。
步骤b.在rt向3-[[(4-甲基苯甲酰基)-氨基]甲基]-4,6-二氢-1H-吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(180mg,0.505mmol),苯基取代硼酸(92mg,0.757mmol)的DCM(5ml)溶液加入Cu(OAc)2(138mg,0.757mmol),吡啶(80mg,1.01mmol,0.08ml),在O2下搅拌反应混合物16小时。减压浓缩反应混合物除去溶剂。残余物用水稀释(40ml)和用EtOAc萃取(30ml x2)。经合并的有机层用盐水洗涤(30ml),在Na2SO4上干燥,过滤和减压浓缩,提供残余物。残余物通过制备型-TLC纯化(SiO2,PE:EtOAc=8:1),获得3-[[(4-甲基苯甲酰基)氨基]甲基]-1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(20mg,46μmol,9.16%收率),是白色固体。
步骤c.向3-[[(4-甲基苯甲酰基)氨基]甲基]-1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(20mg,46μmol)的EtOAc(1ml)溶液加入HCl/EtOAc(4M,1ml)。在rt搅拌反应混合物2小时。减压浓缩所得混合物。残余物4-甲基-N-((1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)苯甲酰胺直接用于后续步骤不加进一步纯化。
步骤d.向4-甲基-N-((1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)苯甲酰胺的EtOH(2ml)溶液加入溴化氰(0.2mmol)和NaHCO3(0.6mmol)。在rt搅拌反应混合物16小时。减压浓缩所得混合物。粗制物通过制备型反相HPLC纯化(A:0.078%CH3COONH4/水,B:MeCN),提供N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-4-甲基苯甲酰胺(5.2mg,14.5umol)。LCMS:方法7,2.841分钟,MS:ES+358.1
实施例36N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)乙酰胺
步骤a.向3-(乙酰氨基甲基)-4,6-二氢-1H-吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(500mg,1.78mmol,1.00当量)的DCM(3ml)溶液加入吡啶(66mg,0.84mmol),然后在0℃缓慢加入溶于DCM(1ml)的乙酸酐(43mg,0.42mmol),在0℃搅拌反应混合物30分钟。反应混合物倾至水中(20ml)和用DCM萃取(20ml x 2),有机相用盐水洗涤(20ml),在Na2SO4上干燥和浓缩,提供3-(乙酰氨基甲基)-4,6-二氢-1H-吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(100mg,粗制),是白色固体,粗制产品用于后续步骤不加进一步纯化。LCMS确认结构。MS:ES+281.3
步骤b.在rt向3-(乙酰氨基甲基)-4,6-二氢-1H-吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(500mg,1.78mmol)的DCM(10ml)溶液加入苯基取代硼酸(217mg,1.78mmol),吡啶(282mg,3.56mmol),Cu(OAc)2(485mg,2.67mmol),搅拌反应混合物16小时。减压浓缩反应混合物。残余物通过制备型-HPLC纯化(A:0.01%TFA/水,B:MeCN),提供3-(乙酰氨基甲基)-1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(80mg,粗制),是白色固体。1H NMR(400MHz,DMSO-d6)δppm 7.50-7.60(m,4H),7.30-7.49(m,2H),4.77(s,2H),4.24-4.31(m,4H),3.75(d,J=4.8Hz,3H),1.47(s,9H)。
步骤c.向3-(乙酰氨基甲基)-1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(80mg,粗制)的EtOAc(1ml)溶液加入HCl/EtOAc(4M,1ml)。在rt搅拌反应混合物2小时。减压浓缩所得混合物。残余物N-((1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)乙酰胺直接用于后续步骤不加进一步纯化。
步骤d.向N-((1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)乙酰胺的EtOH(2ml)溶液加入溴化氰(0.2mmol)和NaHCO3(0.6mmol)。在rt搅拌反应混合物16小时。减压浓缩所得混合物。粗制物通过制备型反相HPLC纯化(A:0.078%CH3COONH4/水,B:MeCN),提供N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)乙酰胺(3.6mg,12.6μmol)。LCMS:方法9,1.750分钟,MS:ES+282.1;1H NMR(400MHz,MeOD)δppm 7.48-7.57(m,4H),7.32-7.36(m,1H),4.93(d,J=2.8Hz,2H),4.57(d,J=7.2Hz,2H),4.38(S,2H),2.02(s,3H)。
方案6
试剂和条件:a)肼水合物,AcOH,EtOH,85℃,16小时;b)(Boc)2O,DCM,THF,rt,16小时;c)亚硝酸异戊酯,碘,rt,1小时;d)Pd(PPh3)4,Cs2CO3,1,4-二噁烷,水,100℃,16小时;e)HCl/EtOAc,rt,2小时;f)溴化氰,NaHCO3,EtOH,rt,16小时
步骤a.将肼水合物(951mmol)滴加至3-氰基-4-氧代吡咯烷-1-羧酸叔丁酯(190mmol)和AcOH(1.5mol)的EtOH(800ml)溶液,在85℃搅拌反应混合物16小时。蒸发溶剂和残余物分散于EtOAc(600ml)和水(400ml)中,用固体K2CO3将两相混合物碱化至pH=8,分层,水层进一步用EtOAc萃取(2×400ml)。经合并的有机萃取物用盐水洗涤(2x 300ml),在Na2SO4上干燥,浓缩,获得3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(178mmol),是浅黄色固体。MS:ES+225.0
步骤b.向3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(267.6mmol)的DCM(1.6L)溶液滴加(Boc)2O(294.3mmol)的THF(400ml)溶液。在rt搅拌反应混合物16小时。浓缩反应混合物,提供3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(231.2mmol)。MS:ES+325.0
步骤c.将3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(92.5mmol)的DCM(80ml)溶液加入碘(110.9mmol)和亚硝酸异戊酯(184.9mmol)的DCM(600ml)溶液。在rt搅拌反应混合物1小时。反应混合物倾至饱和Na2S2O3(150ml)溶液中,分离反应混合物,水层用DCM萃取(100ml x 2),有机层用盐水洗涤(150ml),然后在Na2SO4上干燥,过滤和蒸发。残余物通过柱色谱法纯化(SiO2,PE:EtOAc=30:1至10:1),提供3-碘-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(27.6mmol)。1H NMR(400MHz,DMSO-d6)δppm 1.40-1.60(m,2H),4.23(d,J=1.6Hz,2H),4.38-4.62(m,2H)。
步骤d.在rt在氮下向3-碘吡咯并[3,4-c]吡唑-1,5(4H,6H)-二羧酸二叔丁酯(0.2mmol),化合物5(0.2mmol)和Cs2CO3(0.6mmol,3eq)的1,4-二噁烷(1ml)和水(0.2ml)溶液加入四(三苯基膦)钯(0)(0.2当量)。在100℃搅拌反应混合物16小时。减压浓缩所得混合物。所得残余物通过制备型-TLC(PE/EtOAc=1:1)纯化,产生化合物6。
步骤e.向化合物6的EtOAc(1ml)溶液加入HCl/EtOAc(4M,1ml)。在rt搅拌反应混合物2小时。减压浓缩所得混合物。残余物化合物7直接用于后续步骤不加进一步纯化。
步骤f.向化合物7的EtOH(2ml)溶液加入溴化氰(0.2mmol)和NaHCO3(0.6mmol)。在rt搅拌反应混合物16小时。减压浓缩所得混合物。粗制物通过制备型反相HPLC(A:0.078%CH3COONH4/水,B:MeCN)纯化,提供化合物8。
表7化合物根据方案6合成。
表7
方案7
试剂和条件:a)碘,K2CO3,DMF;b)ArB(OH)2,Pd(PPh3)4,Cs2CO3,1,4-二噁烷/水;c)TFA,DCM;d)BrCN,TEA,THF。
实施例57 3-(3-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
根据方案7合成
步骤a.在氮气氛下将搅拌的4,6-二氢-1H-吡咯并[3,4-c]吡唑-5-羧酸叔丁酯(1.00g,4.78mmol),碘(2.43g,9.57mmol)和K2CO3(1.32g,9.57mmol)在DMF(15ml)中的混合物加热至75℃持续18小时。混合物冷却至rt,用EtOAc稀释(50ml)和用10%Na2S2O3洗涤(50ml)。将分离的水层用EtOAc萃取(50ml),经合并的有机萃取物在Na2SO4上干燥和蒸发。固体残余物与DCM研磨(2x 20ml),提供3-碘-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(628mg,1.87mmol,39%),是白色固体。LCMS:方法1,3.34分钟,MS:ES+336;1H NMR(400MHz,MeOD)δppm 4.48(d,J=8.3Hz,2H),4.31(d,J=8.3Hz,2H),1.51(s,9H)。
步骤b.将3-碘-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(200mg,0.60mmol),3-氟苯取代硼酸(125mg,0.90mmol)和Cs2CO3(487mg,1.49mmol)在1,4-二噁烷/水(4:1,10ml)中的混合物通过氮鼓泡脱气10分钟。加入四(三苯基膦)钯(0)(104mg,0.09mmol)和继续脱气10分钟。搅拌的混合物在回流下加热18小时,然后冷却至rt。依次加入水(10ml)和盐水(5ml),混合物用EtOAc(2x 50ml)和DCM(2x 15ml)萃取。经合并的有机萃取物在Na2SO4上干燥和蒸发。固体残余物部分溶于DCM/MeOH和通过快速柱色谱法用(10-50%EtOAc/己烷)梯度纯化,提供3-(3-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(105mg,0.35mmol,58%),是白色固体。LCMS:方法1,3.36分钟,MS:ES+304;1H NMR(400MHz,CDCl3+MeOD)δppm 7.40-7.46(m,1H),7.26-7.35(m,2H),7.02-7.08(m,1H),4.62(s,2H),4.48(s,2H),1.53(s,9H)。
步骤c.将TFA(0.5ml,6.53mmol)加入搅拌的3-(3-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(105mg,0.35mmol)的DCM(3ml)悬浮液。所得黄色溶液在rt搅拌2小时。蒸发混合物和与甲苯:MeCN(1:1混合物,3x 20ml)共沸,提供3-(3-氟苯基)-1,4,5,6-四氢吡咯并[3,4-c]吡唑2,2,2-三氟乙酸盐(128mg,0.40mmol,定量),是淡黄色油性固体。LCMS:方法1,0.64分钟,MS:ES+204;1H NMR(400MHz,CDCl3+MeOD)δppm 7.40-7.48(m,1H),7.20-7.30(m,2H),7.02-7.08(m,1H),4.40(s,2H),3.67(s,1H),3.31(s,1H)。
步骤d.在氮气氛下将TEA(0.15ml,1.05mmol)加入搅拌的3-(3-氟苯基)-1,4,5,6-四氢吡咯并[3,4-c]吡唑2,2,2-三氟乙酸盐(128mg,0.35mmol)的THF(5ml)悬浮液。加入额外TEA(0.15ml,1.05mmol)溶解全部固体。所得黄色溶液冷却至0℃,缓慢加入溴化氰(5M,在MeCN中,0.08ml,0.42mmol),提供橙色悬浮液。在0℃继续搅拌2小时。加入水(10ml)和盐水(5ml),混合物用EtOAc萃取(2x 30ml)。经合并的有机萃取物在Na2SO4上干燥和蒸发。固体残余物部分溶于DCM/EtOAc和通过快速柱色谱法用10-50%EtOAc/己烷梯度纯化,提供白色固体(22mg),其含有小量三甲胺盐。将其与MeCN研磨(x3),提供3-(3-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈(20mg,0.087mmol,2步25%),是白色固体。LCMS:方法14,3.70分钟,MS:ES+229;1H NMR(400MHz,DMSO-d6)δppm 8.04(1H,s),7.61-7.64(m,1H),7.50-7.58(m,2H),7.22-7.30(m,1H),4.84(s,4H)。
表8化合物用与实施例57所描述类似的程序合成。
表8
实施例60 3-(2-氟-5-甲基苯基)-1-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
步骤a,b.按照与实施例57步骤a和b相似程序,在步骤b中用2-氟-5-甲基苯取代硼酸(CAS号166328-16-1),提供3-(2-氟-5-甲基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯。
步骤c.在氮气氛下将NaH(60%w/w,在油中的分散液,55mg,1.36mmol)加入搅拌的3-(2-氟-5-甲基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(360mg,1.14mmol)的DMF(10ml)溶液。在30分钟之后,加入碘甲烷(194mg,1.36mmol),在rt搅拌溶液6小时。加入水(10ml)、随后盐水(20ml),混合物用EtOAc萃取(2x 50ml)。经合并的有机萃取物在Na2SO4上干燥和蒸发,余留黄色油性固体(330mg)。其通过快速柱色谱法(10-50%EtOAc/己烷)纯化,提供极性更低的次要异构体:3-(2-氟-5-甲基苯基)-2-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯,是黄色油状物(38mg)。LCMS:方法3,5.34分钟,MS:ES+332;1H NMR(400MHz,CDCl3)δppm 7.22-7.18(m,1H),7.04-7.10(m,2H),4.54-4.39(m,4H),3.81(s,3H),2.37(m,3H),1.50(m,9H)和极性更高的主要异构体,3-(2-氟-5-甲基苯基)-1-甲基-4,6-二氢-吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯,是灰白固体(210mg)。总收率(248mg,66%)。LCMS:方法3,5.26分钟,MS:ES+332;1H NMR(400MHz,CDCl3)δppm 7.75-7.70(m,1H),7.10-7.04(m,1H),6.98-6.95(m,1H),4.60-4.50(m,4H),3.88(s,3H),2.35(s,3H),1.52(s,9H)
步骤d,e.标题化合物合成自3-(2-氟-5-甲基苯基)-1-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯,使用与实施例57步骤c和d描述类似的程序。LCMS:方法14,5.07分钟,MS:ES+257。
实施例61 3-(2-氟-5-甲基苯基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈
用与实施例60类似的程序合成,用3-(2-氟-5-甲基苯基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(如实施例60步骤a-c的描述制备)。LCMS:方法14,4.97分钟,MS:ES+257。
实施例62 3-(5-异丙基-2-甲氧基苯基)-1-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
用与实施例60/61类似的程序合成,用5-异丙基-2-甲氧基苯基取代硼酸(CAS号216393-63-4)。LCMS:方法4,4.925分钟,MS:ES+296.91
实施例63 3-(5-异丙基-2-甲氧基苯基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈
用与实施例60/61类似的程序合成,用5-异丙基-2-甲氧基苯基取代硼酸(CAS号216393-63-4)。LCMS:方法4,4.836分钟,MS:ES+296.91。
实施例78N-(3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯基)环丙烷磺酰胺
步骤a.将N-Boc-3-吡咯烷酮(CAS号101385-93-7;5.0g,27.0mmol)的DMF-DMA(32.17g,270mmol)溶液在100℃加热1.5小时。所得混合物冷却至rt和减压浓缩。获得的残余物与正戊烷研磨(100ml)。所得固体在高真空下干燥,产生3-((二甲基氨基)亚甲基)-4-氧代吡咯烷-1-羧酸叔丁酯(4.700g,19.58mmol)。LCMS:方法1,1.556分钟,MS:ES+241.43。
步骤b.在rt向3-((二甲基氨基)亚甲基)-4-氧代吡咯烷-1-羧酸叔丁酯(1.250g,5.208mmol)的EtOH(12ml)溶液加入3-硝基苯肼盐酸盐(CAS号636-95-3;0.987g,5.21mmol)和AcOH(0.5ml)。反应混合物在85℃加热2小时。所得反应混合物与通过等同方法以相同规模制备的1个批次合并。所得混合物冷却至rt和减压浓缩。所得残余物通过快速色谱法纯化(10%EtOAc/正己烷),产生1-(3-硝基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.866g,2.624mmol)。LCMS:方法1,2.336分钟,MS:ES+331.40。
步骤c.在rt向1-(3-硝基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.866g,2.624mmol)的MeOH(10ml)溶液加入10%无水Pd/C(0.130g)。所得反应混合物用H2吹扫3小时。反应混合物过滤通过C盐垫和用EtOH洗涤(4x 10ml)。减压浓缩经合并的滤液,产生1-(3-氨基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.530g,1.766mmol)。LCMS:方法1,1.927分钟,MS:ES+301.48。
步骤d.在0℃向1-(3-氨基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.300g,1.000mmol)的DCM(3ml)溶液加入吡啶(0.396g,5.000mmol)。在0℃搅拌反应混合物15分钟。在0℃将环丙烷磺酰氯(CAS号139631-62-2,0.155g,1.100mmol)加入反应混合物。所得混合物在rt搅拌3小时。所得反应混合物倾至水中(10ml)和用EtOAc萃取(3x10ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。残余物通过快速色谱法(20%EtOAc/己烷)纯化,产生1-(3-(环丙烷磺酰氨基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.285g,0.705mmol)。LCMS:方法1,2.055分钟,MS:ES+405.38;1H NMR(400MHz,DMSO-d6)δppm 10.01(s,1H),7.60-7.56(m,2H),7.47-7.42(m,1H),7.35-7.28(m,1H),7.16(t,J=8.4Hz,1H),4.77(s,2H),4.37(d,J=11.2Hz,2H),2.69(t,J=5.2Hz,1H),1.47(s,9H),0.96(d,J=8.0Hz,4H)。
步骤e.在0℃向1-(3-(环丙烷磺酰氨基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.285g,0.705mmol)的DCM(3ml)溶液加入TFA(0.402g,3.527mmol)。在rt搅拌反应混合物15分钟。减压浓缩所得反应混合物。获得的残余物与DCM共蒸(4x 5ml)。获得的残余物在高真空下干燥,产生N-(3-(5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯基)-环丙烷磺酰胺TFA盐(0.170g,0.406mmol)。LCMS:方法1,1.341分钟,MS:ES+305.48。该物质直接用于后续步骤不加进一步纯化。
步骤f.在0℃向N-(3-(5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯基)-环丙烷-磺酰胺TFA盐(0.150g,0.358mmol)的THF(3ml)溶液加入K2CO3(0.099g,0.717mmol)。在0℃搅拌反应混合物5分钟。在0℃将溴化氰(0.038g,0.358mmol)加入反应混合物。在rt搅拌反应混合物15分钟。所得反应混合物倾至水中(10ml)和用EtOAc萃取(3x 10ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。所得残余物通过快速色谱法(2%MeOH/DCM)纯化,产生标题化合物(0.115g,0.349mmol)。LCMS:方法4,3.593分钟,MS:ES+330.02;1H NMR(400MHz,DMSO-d6)δppm 10.00(s,1H),7.61(s,1H),7.56(t,J=2.0Hz,1H),7.44(t,J=8.0Hz,1H),7.26(dd,J=1.2Hz,1.6Hz,1H),7.18(dd,J=1.2Hz,1.2Hz,1H),5.00(t,J=2.0Hz,2H),4.59(d,J=2.4Hz,2H),2.72-2.67(m,1H),0.96(t,J=2.8Hz,4H)。
实施例79N-苄基-4-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-3-氟苯甲酰胺
步骤a.在rt向3-氰基-4-氧代吡咯烷-1-羧酸叔丁酯(CAS号175463-32-8;30.00g,142.7mmol)的EtOH(600ml)溶液加入AcOH(57ml,1000mmol)和肼水合物99%(35ml,714mmol)。反应混合物在85℃加热14小时。反应混合物冷却至rt和减压浓缩。残余物用EtOAc(400ml)和水(400ml)稀释,通过分批加入固体Na2CO3将pH调节多至~8。所得混合物用EtOAc萃取(2x 400ml)。收集经合并的有机相,在Na2SO4上干燥,过滤和减压浓缩。残余物通过柱色谱法(5%MeOH/DCM)纯化,产生3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(18.0g,80.357mmol)。LCMS:方法1,1.707分钟,MS:ES+225.33。
步骤b.在rt向3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(5.000g,22.32mmol)的DCM:THF(4:1,50ml)溶液加入(Boc)2O(5.352g,24.55mmol)。所得反应混合物在rt搅拌18小时。所得反应混合物与通过等同方法以相同规模制备的1个其它批次合并。减压浓缩所得混合物。残余物通过柱色谱法纯化(40至60%EtOAc/正己烷),产生3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(17.8g,定量)。LCMS:方法1,2.269分钟,MS:ES+325.43;1H NMR(400MHz,DMSO-d6)δppm 6.51(d,J=9.6Hz,2H),4.19(d,J=5.2Hz,2H),4.13(d,J=19.2Hz,2H),1.54(s,9H),1.43(s,9H)。
步骤c.在rt在30分钟内向碘(1.880g,7.407mmol)和亚硝酸异戊酯(1.68ml,12.3mmol)在DCM(10ml)中的混合物加入3-氨基-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(2.000g,6.165mmol)的DCM(40ml)溶液。在rt搅拌反应混合物14小时。所得反应混合物倾至饱和Na2S2O3溶液中(20ml)和用DCM萃取(2x 20ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。残余物通过柱色谱法(7-10%EtOAc/己烷)纯化,产生3-碘-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(0.730g,1.678mmol)。LCMS:方法1,2.558分钟,MS:ES+436.38;1H NMR(400MHz,DMSO-d6)δppm 4.41(d,J=8.0Hz,2H),4.23(d,J=15.6Hz,2H),4.39(d,J=11.2Hz,2H),1.58(s,9H),1.45(s,9H)。
步骤d.在rt将3-碘-4,6-二氢吡咯并[3,4-c]吡唑-1,5-二羧酸二叔丁酯(0.400g,0.918mmol),2-氟-4-(甲氧羰基)苯基取代硼酸(CAS号603122-84-5;0.218g,1.102mmol)和NaHCO3(0.154g,1.837mmol)在DMF:水(9:1)(8ml)中的混合物用氮脱气10分钟,随后加入PdCl2(dppf)DCM复合物(0.91g,0.795mmol)。反应混合物在100℃加热4小时。所得反应混合物冷却至rt和倾至冰冷的水中(20ml)。所得沉淀通过过滤收集和在高真空下干燥。所得固体通过快速色谱法(2-3%MeOH/DCM)纯化,产生3-(2-氟-4-(甲氧羰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.220g,0.609mmol)。LCMS:方法1,2.219分钟,MS:ES+362.43。
步骤e.在rt向3-(2-氟-4-(甲氧羰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.180g,0.498mmol)的MeOH(5ml)溶液加入LiOH.H2O(0.837,1.994mmol)。反应混合物在85℃加热12小时。反应混合物冷却至rt和减压浓缩。获得的粗制物用水稀释(10ml)和用EtOAc萃取(2x 10ml)。分开水层,用10%柠檬酸溶液酸化至~4pH,用EtOAc萃取(2x 10ml)。减压浓缩经合并的有机相。残余物通过用二乙醚(2x 5ml)研磨纯化,产生4-(5-(叔丁氧基羰基)-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-3-氟苯甲酸(0.145g,0.417mmol)。LCMS:方法1,1.874分钟,MS:ES+348.38
步骤f.在0℃向4-(5-(叔丁氧基羰基)-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-3-氟苯甲酸(0.145g,0.417mmol)的DMF(5ml)溶液加入HATU(0.476g,1.253mmol)和DIPEA(0.215ml,1.253mmol)。在0℃搅拌反应混合物30分钟,随后加入苄胺(0.053g,0.501mmol)。所得反应混合物在rt搅拌12小时。反应混合物用水稀释(10ml)和用EtOAc萃取(3x 10ml)。经合并的有机相在Na2SO4上干燥,过滤和减压浓缩。残余物通过快速色谱法纯化(3.5至4%MeOH/DCM),产生3-(4-(苄基氨基甲酰基)-2-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-羧酸叔丁酯(0.105g,0.240mmol)。LCMS:方法1,2.173分钟,MS:ES+436.12;
步骤g和h以与实施例78相似的方式进行。LCMS:方法4,3.867分钟,MS:ES+362.08;1H NMR(400MHz,DMSO-d6)δppm 13.46(s,1H),9.20(t,J=5.6Hz,1H),7.85-7.79(m,3H),7.34-7.25(m,5H),4.72(s,2H),4.61(s,2H),4.50(d,J=5.6Hz,2H)。
本发明化合物的生物学活性
缩写:
TAMRA 羧基四甲基若丹明
PCR 聚合酶链反应
PBS 磷酸缓冲盐水
EDTA 乙二胺四乙酸
Tris 2-氨基-2-(羟基甲基)-1,3-丙二醇
NP40 Nonidet P-40,辛基苯氧基聚乙氧基乙醇
BSA 牛血清白蛋白
体外USP7抑制测试
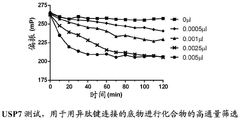
USP7的表达和纯化
将USP7构建体PCR放大和克隆为pFLAG-CMV-6a载体(Sigma-Aldrich),具有N-端FLAG标签。根据生产商的说明使用TransIT-LT1转染剂(Mirus),用FLAG-USP7转染HEK293T细胞。在转染之后40小时收获细胞。细胞用PBS洗涤一次并刮拭于裂解缓冲剂中(50mMTris,pH 7.5,150mM NaCl,3mM EDTA,0.5%NP40,10%甘油,5mMβ-巯基乙醇,蛋白酶抑制剂(complete mini,Roche)和磷酸酶抑制剂(PhosSTOP mini,Roche)。裂解物在冰上温育30分钟,在4℃于4000rpm离心10分钟。将可溶的上清液加入在低盐缓冲剂(20mM Tris,pH 7.5,150mM NaCl,0.5mM EDTA,5mMβ-巯基乙醇)中平衡的FLAG亲和力树脂(EZview Rad ANTI-FLAG M2亲和力凝胶,Sigma-Aldrich)并且于4℃旋转温育3小时。树脂于2000rpm旋转2分钟,除去上清液。将树脂用低盐缓冲剂和蛋白酶抑制剂(complete mini,Roche)和磷酸酶抑制剂(PhosSTOP mini,Roche)洗涤2次,和用高盐缓冲剂(20mM Tris,pH 7.5,500mM NaCl,0.5mM EDTA,5mMβ-巯基乙醇,蛋白酶抑制剂(complete mini,Roche)和磷酸酶抑制剂(PhosSTOP mini,Roche)洗涤1次。为了洗脱结合的USP7,将洗脱缓冲剂(10mM Tris,pH7.5,150mM NaCl,0.5mM EDTA,10%甘油,0.5%NP40,5mMβ-巯基乙醇,0.15mg/ml 3X FLAG肽(Sigma-Aldrich))加入树脂和于4℃旋转温育2.5小时。将树脂于4000rpm离心30秒,移除含有纯化的FLAG-USP7的上清液和在-80℃储存。
USP7生物化学动力学测试
在黑色384孔板(小体积,Greiner 784076)中以21μl的最终反应体积重复进行反应。将USP7稀释于反应缓冲剂(20mM Tris,pH 7.5,100mM NaCl,0.05%吐温20,0.5mg/mlBSA,5mM-β巯基乙醇),相当于0,0.0005,0.001,0.0025和0.005μl/孔。优化缓冲液的最佳温度,pH,还原剂,盐,温育时间和洗涤剂。加入作为荧光偏振底物的50nM的TAMRA标记的肽引发反应,所述肽经由异肽键连接至泛素。反应在室温下温育和每2分钟读取,持续120分钟。读数在Pherastar Plus(BMG Labtech)上进行。激发λ为540nm;发射λ为590nm。
USP7生物化学IC50测试
在96孔聚丙烯V底型板(Greiner#651201)中,以最终浓度的21倍(对于100μM的最终浓度为2100μM)在50%DMSO中制备稀释板。典型8点稀释系列将是100,30,10,3,1,0.3,0.1,0.03μM(最终)。在黑色384孔板(小体积,Greiner 784076)中以21μl的最终反应体积重复进行反应。将1μl的50%DMSO或稀释化合物加入板中。将USP7稀释于反应缓冲剂(20mMTris,pH 7.5,100mM NaCl,0.05%吐温20,0.5mg/ml BSA,5mM-β巯基乙醇)中,相当于0.0025μl/孔,和将10μl的稀释USP7加入化合物。将酶和化合物在室温温育30分钟。加入作为荧光偏振底物的50nM的TAMRA标记的肽引发反应,所述肽经由异肽键连接至泛素。在加入底物之后立即和在室温下温育2小时之后读取反应。读数在Pherastar Plus(BMG Labtech)上进行。激发λ为540nm;发射λ为590nm。
在USP7生物化学IC50测试中示范性化合物的活性
范围:
A<10μM;
10μM<B<30μM;
30μM<C<100μM
Claims (20)
1.式II的化合物:
或其药学上可接受的盐,其中
R1a,R1b,R1c和R1d各自独立地是氢或C1-C6烷基;
p是0或1;
q是0或1;
其中p和q不都是0且p和q之一是1;
R8是氢,-Q1-B或-Q2-(D)m;
R9是氢或C1-C6烷基;
R10是氢,-Q1-B或-Q2-(D)m;
其中R8或R10之一代表-Q1-B;
m是0或1;
Q1是共价键,-C1-C6亚烷基,-C0-C3-亚烷基-NR2-C0-C3-亚烷基-,或-C0-C3-亚烷基-NR2C(O)-C0-C3-亚烷基;
R2是氢;
B是苯基或5至10元单环或双环的杂芳基环,其中所述杂芳基环包含1、2或3个各自独立选自N、O和S的杂原子;
其中B是未经取代的或用1至4个取代基取代,所述取代基各自独立选自卤素,氰基,-C1-C6烷基,-C1-C6烷氧基,-Q3a-R13,-Q3a-O-Q3b-R13,-Q3a-CO-Q3b-R13,-Q3a-CONR11R12,-Q3a-CONR11-Q3b-R13,-Q3a-SO2NR11R12,-Q3a-SO2NR11-Q3b-R13,和-Q3a-NR11SO2-Q3b-R13,其中所述C1-C6烷基和C1-C6烷氧基任选被1至4个卤素取代;
其中Q3a和Q3b各自独立地是共价键或C1-C6亚烷基;
R11和R12各自独立地是氢或C1-C6烷基;
R13是苯基,3至6元环烷基或5至6元杂环基或杂芳基环,其中所述杂环基和杂芳基环包含1、2或3个各自独立选自N、O和S的杂原子;
其中R13是未经取代的或用1个取代基取代,所述取代基选自卤素,羟基和C1-C3烷基;
Q2各自独立地是-CONR5R6,-C0-C3-亚烷基-NR5COR6-,-NR5CONR6R6a,-C1-C6烷基,共价键,-C0-C3-亚烷基-NR5-C0-C3亚烷基或C1-C6亚烷基;
R5,R6和R6a各自独立地是氢或C1-C6烷基;和
D各自是苯基或5至6元杂芳基环,其中所述杂芳基环包含1、2或3个各自独立选自N、O和S的杂原子。
2.根据权利要求1的化合物,其中R8是-Q1-B;而R10是氢或-Q2-(D)m。
3.根据权利要求1的化合物,其中R8是氢或-Q2-(D)m;而R10是-Q1-B。
4.根据权利要求1的化合物,其中Q1选自共价键,CH2NHC(O),NH,CH2或CH2NHC(O)CH2。
5.根据权利要求1的化合物,其中B选自苯基,喹啉基,吡啶基,吡唑基,吲唑基,咪唑基,异喹啉基和咪唑并吡啶基;其中B是未取代的或用1至4个如权利要求1定义的取代基取代。
6.根据权利要求1的化合物,其中B用1至4个取代基取代,所述取代基各自独立地选自氟,氯,氰基,甲基,丙基,CF3,甲氧基,丙氧基,OCF3,C(O)NH2,C(O)NHCH3,C(O)N(CH3)2,SO2N(CH3)2,R13,CH2R13,C(O)NHR13,C(O)NHCH2R13,C(O)NH-亚乙基-R13,OCH2R13,OR13,C(O)R13,SO2NHR13和NHSO2R13;其中R13选自苯基,吡啶基,哌嗪基和环丙基。
7.根据权利要求1的化合物,其中Q2的各具体值独立地选自共价键,甲基,异丙基,CH2或NH。
8.根据权利要求1的化合物,其中D选自苯基和吡啶基。
9.根据权利要求1的化合物,其中R1a,R1b,R1c和R1d各自代表氢。
10.化合物,选自:
1-(4-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-(4-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-(2-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
4-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺
1-(喹啉-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-(3-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-(1-苯基-1H-吡唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-(1-苯基-1H-咪唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-甲基-1-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
N-苄基-3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺
3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-(1-苯基乙基)苯甲酰胺
3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-(吡啶-2-基甲基)苯甲酰胺
4-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-(吡啶-2-基甲基)苯甲酰胺
4-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-N-甲基苯甲酰胺
4-(5-氰基-3-甲基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺
1-(1-甲基-1H-吲唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
5-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-2-甲氧基-N-甲基苯甲酰胺
1-(1H-吲唑-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-(3-苯基-1H-吡唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-甲基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
2-甲基-3-苯基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈
1-异丙基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-苄基-3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-苄基-3-(5-异丙基-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(5-异丙基-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(2-氟-5-甲基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
5-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)-1H-吡唑-3-甲酰胺
3-苯基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(异喹啉-3-基氨基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈
3-(异喹啉-3-基氨基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
1-苄基-3-(异喹啉-3-基氨基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
4-(5-氰基-3-(吡啶-2-基氨基)-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯甲酰胺
N-((5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-3-苯基-1H-吡唑-5-甲酰胺
N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)-4-甲基苯甲酰胺
N-((5-氰基-1-苯基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)乙酰胺
3-(4-(苄氧基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(3-氰基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(1-甲基-1H-吡唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(3-(三氟甲氧基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(4-苯氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(4-氰基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(2-氟-4-(三氟甲基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(2-氯-5-(三氟甲氧基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
5-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-N-甲基吡啶酰胺
3-(6-甲氧基吡啶-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-N,N-二甲基苯磺酰胺
3-(5-氟-2-异丙氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
N-苄基-4-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)苯甲酰胺
3-(6-异丙氧基吡啶-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(4-(4-甲基哌嗪-1-羰基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(1-甲基-1H-吲唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(1-苄基-1H-吡唑-5-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(5-甲基-1H-吲唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-N-环丙基苯磺酰胺
N-(3-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)苯基)环丙烷磺酰胺
3-(3-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(2-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(4-氟苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(2-氟-5-甲基苯基)-1-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(2-氟-5-甲基苯基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈
3-(5-异丙基-2-甲氧基苯基)-1-甲基-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈
3-(5-异丙基-2-甲氧基苯基)-2-甲基-2,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(5-乙基-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
6-氯-N-((5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)甲基)咪唑并[1,2-a]吡啶-2-甲酰胺;
3-(4-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-氯-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(1-(1-甲基哌啶-4-基)-1H-吡唑-4-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(6-(4-甲基哌嗪-1-基)吡啶-3-基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-甲氧基-4-(1H-吡唑-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
3-(3-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(4-吗啉代苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(2-氟-4-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-甲基-4-(4-甲基哌嗪-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-(2-氧代噁唑烷-3-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(3-(2-氧代吡咯烷-1-基)苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(1H)-腈;
3-(5-氯-2-甲氧基苯基)-4,6-二氢吡咯并[3,4-c]吡唑-5(4H)-腈;
N-(3-(5-氰基-5,6-二氢吡咯并[3,4-c]吡唑-1(4H)-基)苯基)环丙烷磺酰胺;和
N-苄基-4-(5-氰基-1,4,5,6-四氢吡咯并[3,4-c]吡唑-3-基)-3-氟苯甲酰胺;
或其药学上可接受的盐。
11.根据权利要求1至10中任一项的化合物、其药学上可接受的盐用于制备药物的用途,所述药物用于治疗癌症或牵涉线粒体功能障碍的病况。
12.根据权利要求11的用途,其中所述癌症选自乳腺,卵巢,前列腺,肺,肾,胃,结肠,睾丸,头和颈,胰,脑,黑色素瘤,骨,肝,软组织,血液细胞癌症,成神经细胞瘤,食道癌和淋巴瘤。
13.根据权利要求11的用途,其中所述癌症是组织器官癌症。
14.根据权利要求11的用途,其中所述癌症是软组织肉瘤。
15.根据权利要求11的用途,其中所述癌症选自外套细胞淋巴瘤,脂肪肉瘤,成纤维细胞肉瘤,平滑肌肉瘤,肝细胞癌,骨肉瘤,多发性骨髓瘤,结直肠癌和非小细胞肺癌。
16.根据权利要求11的用途,其中所述癌症是白血病。
17.根据权利要求11的用途,其中所述癌症选自CML和AML。
18.根据权利要求11的用途,其中所述牵涉线粒体功能障碍的病况选自帕金森病;阿尔茨海默氏病;肌萎缩性侧索硬化;亨廷顿舞蹈病;缺血;卒中;具有Lewy体的痴呆;额颞性痴呆;多发性硬化;线粒体脑病,乳酸性酸中毒和似卒中发作综合征;Leber氏遗传性视神经病;神经病,共济失调,视网膜色素变性-母系遗传Leigh综合征;Danon病;糖尿病性肾病;代谢性疾病;心力衰竭;导致心肌梗死的缺血性心脏病;精神分裂症;多硫酸酯酶缺乏症;粘脂病II;粘脂病III;粘脂病IV;GMl-神经节苷脂沉积症;神经元腊样脂褐质症;Alpers病;Barth综合征;Beta-氧化缺陷;卡尼汀-酰基-卡尼汀缺乏症;卡尼汀缺乏症;肌酸缺乏综合征;辅酶Q10缺乏症;复合体I缺乏症;复合体II缺乏症;复合体III缺乏症;复合体IV缺乏症;复合体V缺乏症;COX缺乏症;慢性进行性外部眼肌麻痹综合征;CPTI缺乏症;CPTII缺乏症;戊二酸尿类型II;Kearns-Sayre综合征;长链酰基-CoA脱氢酶缺乏症;Leigh病或综合征;致死性婴儿心肌病;Luft病;中链酰基-CoA脱氢酶缺乏症;肌阵挛性癫痫伴破碎红纤维综合征;线粒体细胞病;线粒体隐性共济失调综合征;线粒体DNA耗尽综合征;肌神经胃肠道障碍和脑病;Pearson综合征;丙酮酸脱氢酶缺乏症;丙酮酸羧化酶缺乏症;POLG突变;中链/短链3-羟基酰基-CoA脱氢酶(M/SCHAD)缺乏症;和超长链酰基-CoA脱氢酶(VLCAD)缺乏症。
19.根据权利要求11的用途,其中所述牵涉线粒体功能障碍的病况是糖尿病。
20.药物组合物,包含根据权利要求1至10中任一项的化合物、其药学上可接受的盐,以及一种或多种药学上可接受的赋形剂。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| GB1604638.5 | 2016-03-18 | ||
| GBGB1604638.5A GB201604638D0 (en) | 2016-03-18 | 2016-03-18 | Novel compounds |
| PCT/GB2017/050755 WO2017158381A1 (en) | 2016-03-18 | 2017-03-17 | 4,6 dihydropyrrolo [3,4-c] pyrazole-5 (1h)-carbonitrile derivates for trating cancer |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108473502A CN108473502A (zh) | 2018-08-31 |
| CN108473502B true CN108473502B (zh) | 2022-04-26 |
Family
ID=55968542
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201780007893.4A Active CN108473502B (zh) | 2016-03-18 | 2017-03-17 | 用于治疗癌症的4,6二氢吡咯并[3,4-c]吡唑-5(1h)-腈衍生物 |
Country Status (7)
| Country | Link |
|---|---|
| US (1) | US11306096B2 (zh) |
| EP (1) | EP3430012B1 (zh) |
| JP (1) | JP6959248B2 (zh) |
| CN (1) | CN108473502B (zh) |
| GB (1) | GB201604638D0 (zh) |
| MA (1) | MA43745A (zh) |
| WO (1) | WO2017158381A1 (zh) |
Families Citing this family (36)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2864950T3 (es) | 2015-03-30 | 2021-10-14 | Compuestos de 1-ciano-pirrolidina como inhibidores de USP30 | |
| JP6802251B2 (ja) | 2015-07-14 | 2020-12-16 | ミッション セラピューティクス リミティド | 癌の処置のためのdub阻害剤としてのシアノピロリジン |
| GB201521109D0 (en) | 2015-11-30 | 2016-01-13 | Mission Therapeutics Ltd | Novel compounds |
| GB201522267D0 (en) | 2015-12-17 | 2016-02-03 | Mission Therapeutics Ltd | Novel compounds |
| GB201522768D0 (en) | 2015-12-23 | 2016-02-03 | Mission Therapeutics Ltd | Novel compounds |
| GB201602854D0 (en) | 2016-02-18 | 2016-04-06 | Mission Therapeutics Ltd | Novel compounds |
| GB201603779D0 (en) | 2016-03-04 | 2016-04-20 | Mission Therapeutics Ltd | Novel compounds |
| GB201604647D0 (en) | 2016-03-18 | 2016-05-04 | Mission Therapeutics Ltd | Novel compounds |
| JP6959252B2 (ja) | 2016-03-24 | 2021-11-02 | ミッション セラピューティクス リミティド | Dub阻害剤としての1−シアノピロリジン誘導体 |
| WO2018060689A1 (en) | 2016-09-27 | 2018-04-05 | Mission Therapeutics Limited | Cyanopyrrolidine derivatives with activity as inhibitors of usp30 |
| GB201616511D0 (en) | 2016-09-29 | 2016-11-16 | Mission Therapeutics Limited | Novel compounds |
| GB201616627D0 (en) * | 2016-09-30 | 2016-11-16 | Mission Therapeutics Limited | Novel compounds |
| TWI771327B (zh) | 2016-10-05 | 2022-07-21 | 英商使命醫療公司 | 新穎化合物 |
| GB201617758D0 (en) | 2016-10-20 | 2016-12-07 | Almac Discovery Limited | Pharmaceutical compounds |
| GB201708652D0 (en) | 2017-05-31 | 2017-07-12 | Mission Therapeutics Ltd | Novel compounds and uses |
| EP3642196B1 (en) | 2017-06-20 | 2022-08-17 | Mission Therapeutics Limited | Substituted cyanopyrrolidines with activity as dub inhibitors |
| EA202090871A1 (ru) | 2017-10-06 | 2020-07-03 | Форма Терапьютикс, Инк. | Ингибирование убиквитин-специфической пептидазы 30 |
| ES2955354T3 (es) | 2018-04-25 | 2023-11-30 | Bayer Ag | Nuevos compuestos de heteroaril-triazol y heteroaril-tetrazol como pesticidas |
| IL278291B2 (en) | 2018-05-17 | 2023-10-01 | Forma Therapeutics Inc | Condensed bicyclic compounds are useful as ubiquitin-specific peptidase 30 inhibitors |
| EP3837262A1 (en) | 2018-08-14 | 2021-06-23 | Amgen Inc. | N-cyano-7-azanorbornane derivatives and uses thereof |
| DK3860989T3 (da) | 2018-10-05 | 2023-05-01 | Forma Therapeutics Inc | Kondenserede pyrroliner der fungerer som inhibitorer af ubiquitin-specifik protease 30 (usp30) |
| EP3897631A4 (en) | 2018-12-20 | 2022-11-23 | C4 Therapeutics, Inc. | TARGETED PROTEIN DEGRADATION |
| GB201905371D0 (en) | 2019-04-16 | 2019-05-29 | Mission Therapeutics Ltd | Novel compounds |
| GB201905375D0 (en) | 2019-04-16 | 2019-05-29 | Mission Therapeutics Ltd | Novel compounds |
| GB201912674D0 (en) | 2019-09-04 | 2019-10-16 | Mission Therapeutics Ltd | Novel compounds |
| CA3164134A1 (en) | 2019-12-06 | 2021-06-10 | Vertex Pharmaceuticals Incorporated | Substituted tetrahydrofurans as modulators of sodium channels |
| JP2023512038A (ja) * | 2020-01-29 | 2023-03-23 | フォグホーン セラピューティクス インコーポレイテッド | 化合物及びその使用 |
| GB202001980D0 (en) | 2020-02-13 | 2020-04-01 | Almac Discovery Ltd | Therapeutic mentods |
| JP2023520727A (ja) | 2020-04-08 | 2023-05-18 | ミッション セラピューティクス リミティド | Usp30阻害剤として活性を有するn-シアノピロリジン |
| MX2022014429A (es) | 2020-05-28 | 2022-12-07 | Mission Therapeutics Ltd | N-cianopirrolidinas con actividad como inhibidores de usp30. |
| US20230303547A1 (en) | 2020-06-04 | 2023-09-28 | Mission Therapeutics Limited | N-cyanopyrrolidines with activity as usp30 inhibitors |
| AU2021286831A1 (en) | 2020-06-08 | 2023-02-02 | Mission Therapeutics Limited | 1-(5-(2-cyanopyridin-4-yl)oxazole-2-carbonyl)-4- methylhexahydropyrrolo[3,4-b]pyrrole-5(1H)-carbonitrile as USP30 inhibitor for use in the treatment of mitochondrial dysfunction, cancer and fibrosis |
| GB202016800D0 (en) | 2020-10-22 | 2020-12-09 | Mission Therapeutics Ltd | Novel compounds |
| TW202313593A (zh) | 2021-06-04 | 2023-04-01 | 美商維泰克斯製藥公司 | 作為鈉通道調節劑之n—(羥基烷基(雜)芳基)四氫呋喃甲醯胺 |
| WO2023099561A1 (en) | 2021-12-01 | 2023-06-08 | Mission Therapeutics Limited | Substituted n-cyanopyrrolidines with activity as usp30 inhibitors |
| GB202200753D0 (en) | 2022-01-21 | 2022-03-09 | Almac Discovery Ltd | Pharmaceutical compounds |
Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103261169A (zh) * | 2010-09-24 | 2013-08-21 | 密歇根大学董事会 | 脱泛素酶抑制剂及其应用方法 |
| EP2762480A1 (en) * | 2011-09-30 | 2014-08-06 | Xuanzhu Pharma Co., Ltd. | Oxazolidinone antibiotics containing fused ring |
| WO2015168286A1 (en) * | 2014-04-30 | 2015-11-05 | The Trustees Of Columbia University In The City Of New York | Substituted 4-phenylpiperidines, their preparaiton and use |
Family Cites Families (20)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2003530384A (ja) | 2000-04-06 | 2003-10-14 | メルク フロスト カナダ アンド カンパニー | カテプシンシステインプロテアーゼ阻害薬 |
| CA2785488A1 (en) | 2009-12-22 | 2011-07-21 | Merck Sharp & Dohme Corp. | Fused tricyclic compounds and methods of use thereof for the treatment of viral diseases |
| EP2721029B1 (en) | 2011-06-16 | 2018-07-18 | Merck Sharp & Dohme Corp. | Imidazopyridin-2-one derivatives |
| EP2565186A1 (en) | 2011-09-02 | 2013-03-06 | Hybrigenics S.A. | Selective and reversible inhibitors of ubiquitin specific protease 7 |
| EP2938610A2 (en) * | 2012-12-28 | 2015-11-04 | The U.S.A. as represented by the Secretary, Department of Health and Human Services | Inhibitors of the usp1/uaf1 deubiquitinase complex and uses thereof |
| SG10201809260XA (en) | 2014-04-04 | 2018-11-29 | Syros Pharmaceuticals Inc | Inhibitors of cyclin-dependent kinase 7 (cdk7) |
| GB201416754D0 (en) | 2014-09-23 | 2014-11-05 | Mission Therapeutics Ltd | Novel compounds |
| ES2864950T3 (es) * | 2015-03-30 | 2021-10-14 | Compuestos de 1-ciano-pirrolidina como inhibidores de USP30 | |
| JP6802251B2 (ja) | 2015-07-14 | 2020-12-16 | ミッション セラピューティクス リミティド | 癌の処置のためのdub阻害剤としてのシアノピロリジン |
| GB201521109D0 (en) | 2015-11-30 | 2016-01-13 | Mission Therapeutics Ltd | Novel compounds |
| GB201522267D0 (en) | 2015-12-17 | 2016-02-03 | Mission Therapeutics Ltd | Novel compounds |
| GB201522768D0 (en) | 2015-12-23 | 2016-02-03 | Mission Therapeutics Ltd | Novel compounds |
| GB201602854D0 (en) | 2016-02-18 | 2016-04-06 | Mission Therapeutics Ltd | Novel compounds |
| GB201603779D0 (en) | 2016-03-04 | 2016-04-20 | Mission Therapeutics Ltd | Novel compounds |
| GB201604647D0 (en) | 2016-03-18 | 2016-05-04 | Mission Therapeutics Ltd | Novel compounds |
| JP6959252B2 (ja) | 2016-03-24 | 2021-11-02 | ミッション セラピューティクス リミティド | Dub阻害剤としての1−シアノピロリジン誘導体 |
| WO2018060689A1 (en) | 2016-09-27 | 2018-04-05 | Mission Therapeutics Limited | Cyanopyrrolidine derivatives with activity as inhibitors of usp30 |
| GB201616511D0 (en) | 2016-09-29 | 2016-11-16 | Mission Therapeutics Limited | Novel compounds |
| GB201616627D0 (en) | 2016-09-30 | 2016-11-16 | Mission Therapeutics Limited | Novel compounds |
| TWI771327B (zh) | 2016-10-05 | 2022-07-21 | 英商使命醫療公司 | 新穎化合物 |
-
2016
- 2016-03-18 GB GBGB1604638.5A patent/GB201604638D0/en not_active Ceased
-
2017
- 2017-03-17 CN CN201780007893.4A patent/CN108473502B/zh active Active
- 2017-03-17 JP JP2018548677A patent/JP6959248B2/ja active Active
- 2017-03-17 WO PCT/GB2017/050755 patent/WO2017158381A1/en active Application Filing
- 2017-03-17 US US16/080,229 patent/US11306096B2/en active Active
- 2017-03-17 MA MA043745A patent/MA43745A/fr unknown
- 2017-03-17 EP EP17713402.0A patent/EP3430012B1/en active Active
Patent Citations (3)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103261169A (zh) * | 2010-09-24 | 2013-08-21 | 密歇根大学董事会 | 脱泛素酶抑制剂及其应用方法 |
| EP2762480A1 (en) * | 2011-09-30 | 2014-08-06 | Xuanzhu Pharma Co., Ltd. | Oxazolidinone antibiotics containing fused ring |
| WO2015168286A1 (en) * | 2014-04-30 | 2015-11-05 | The Trustees Of Columbia University In The City Of New York | Substituted 4-phenylpiperidines, their preparaiton and use |
Also Published As
| Publication number | Publication date |
|---|---|
| GB201604638D0 (en) | 2016-05-04 |
| JP2019508462A (ja) | 2019-03-28 |
| EP3430012B1 (en) | 2021-06-16 |
| US20210221813A1 (en) | 2021-07-22 |
| EP3430012A1 (en) | 2019-01-23 |
| WO2017158381A1 (en) | 2017-09-21 |
| JP6959248B2 (ja) | 2021-11-02 |
| MA43745A (fr) | 2018-11-28 |
| CN108473502A (zh) | 2018-08-31 |
| US11306096B2 (en) | 2022-04-19 |
| WO2017158381A8 (en) | 2018-01-11 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108473502B (zh) | 用于治疗癌症的4,6二氢吡咯并[3,4-c]吡唑-5(1h)-腈衍生物 | |
| JP7389856B2 (ja) | Usp30阻害剤としての1-シアノ-ピロリジン化合物 | |
| CN108368089B (zh) | 一种去泛素化酶抑制剂 | |
| US11319287B2 (en) | Cyanopyrrolidines as dub inhibitors for the treatment of cancer | |
| CN108698992B (zh) | 用于治疗癌症的2-氰基异吲哚啉衍生物 | |
| TWI766882B (zh) | 新穎化合物類 | |
| CN108290872B (zh) | 作为DUBs抑制剂的氰基吡咯烷衍生物 | |
| ES2798473T3 (es) | Compuestos nuevos | |
| JP2023527025A (ja) | ミトコンドリア機能不全の治療のためのusp30阻害剤としてのn-(1-シアノ-ピロリジン-3-イル)-5-(3-(トリフルオロメチル)フェニル)オキサゾール-2-カルボキサミド誘導体及び対応するオキサジアゾール誘導体 | |
| JP2023529570A (ja) | Usp30阻害剤としての活性を有するn-シアノピロリジン | |
| BR122023020299A2 (pt) | Composto, uso de um composto, composição farmacêutica e processo para preparação de um composto |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |