CN108430458B - 还原和氧化的多糖及其使用方法 - Google Patents
还原和氧化的多糖及其使用方法 Download PDFInfo
- Publication number
- CN108430458B CN108430458B CN201680062497.7A CN201680062497A CN108430458B CN 108430458 B CN108430458 B CN 108430458B CN 201680062497 A CN201680062497 A CN 201680062497A CN 108430458 B CN108430458 B CN 108430458B
- Authority
- CN
- China
- Prior art keywords
- alginate
- hydrogel
- oxidized
- aldehyde
- conjugated
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Active
Links
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08B—POLYSACCHARIDES; DERIVATIVES THEREOF
- C08B37/00—Preparation of polysaccharides not provided for in groups C08B1/00 - C08B35/00; Derivatives thereof
- C08B37/006—Heteroglycans, i.e. polysaccharides having more than one sugar residue in the main chain in either alternating or less regular sequence; Gellans; Succinoglycans; Arabinogalactans; Tragacanth or gum tragacanth or traganth from Astragalus; Gum Karaya from Sterculia urens; Gum Ghatti from Anogeissus latifolia; Derivatives thereof
- C08B37/0084—Guluromannuronans, e.g. alginic acid, i.e. D-mannuronic acid and D-guluronic acid units linked with alternating alpha- and beta-1,4-glycosidic bonds; Derivatives thereof, e.g. alginates
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/30—Macromolecular organic or inorganic compounds, e.g. inorganic polyphosphates
- A61K47/36—Polysaccharides; Derivatives thereof, e.g. gums, starch, alginate, dextrin, hyaluronic acid, chitosan, inulin, agar or pectin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/69—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit
- A61K47/6903—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the conjugate being characterised by physical or galenical forms, e.g. emulsion, particle, inclusion complex, stent or kit the form being semi-solid, e.g. an ointment, a gel, a hydrogel or a solidifying gel
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0046—Ear
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/0012—Galenical forms characterised by the site of application
- A61K9/0048—Eye, e.g. artificial tears
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/06—Ointments; Bases therefor; Other semi-solid forms, e.g. creams, sticks, gels
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/10—Dispersions; Emulsions
- A61K9/127—Liposomes
- A61K9/1271—Non-conventional liposomes, e.g. PEGylated liposomes, liposomes coated with polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/14—Particulate form, e.g. powders, Processes for size reducing of pure drugs or the resulting products, Pure drug nanoparticles
- A61K9/16—Agglomerates; Granulates; Microbeadlets ; Microspheres; Pellets; Solid products obtained by spray drying, spray freeze drying, spray congealing,(multiple) emulsion solvent evaporation or extraction
- A61K9/1605—Excipients; Inactive ingredients
- A61K9/1629—Organic macromolecular compounds
- A61K9/1652—Polysaccharides, e.g. alginate, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/5005—Wall or coating material
- A61K9/5021—Organic macromolecular compounds
- A61K9/5036—Polysaccharides, e.g. gums, alginate; Cyclodextrin
- A61K9/5042—Cellulose; Cellulose derivatives, e.g. phthalate or acetate succinate esters of hydroxypropyl methylcellulose
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K9/00—Medicinal preparations characterised by special physical form
- A61K9/48—Preparations in capsules, e.g. of gelatin, of chocolate
- A61K9/50—Microcapsules having a gas, liquid or semi-solid filling; Solid microparticles or pellets surrounded by a distinct coating layer, e.g. coated microspheres, coated drug crystals
- A61K9/51—Nanocapsules; Nanoparticles
- A61K9/5107—Excipients; Inactive ingredients
- A61K9/513—Organic macromolecular compounds; Dendrimers
- A61K9/5161—Polysaccharides, e.g. alginate, chitosan, cellulose derivatives; Cyclodextrin
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J3/00—Processes of treating or compounding macromolecular substances
- C08J3/02—Making solutions, dispersions, lattices or gels by other methods than by solution, emulsion or suspension polymerisation techniques
- C08J3/03—Making solutions, dispersions, lattices or gels by other methods than by solution, emulsion or suspension polymerisation techniques in aqueous media
- C08J3/075—Macromolecular gels
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08L—COMPOSITIONS OF MACROMOLECULAR COMPOUNDS
- C08L5/00—Compositions of polysaccharides or of their derivatives not provided for in groups C08L1/00 or C08L3/00
- C08L5/04—Alginic acid; Derivatives thereof
-
- C—CHEMISTRY; METALLURGY
- C08—ORGANIC MACROMOLECULAR COMPOUNDS; THEIR PREPARATION OR CHEMICAL WORKING-UP; COMPOSITIONS BASED THEREON
- C08J—WORKING-UP; GENERAL PROCESSES OF COMPOUNDING; AFTER-TREATMENT NOT COVERED BY SUBCLASSES C08B, C08C, C08F, C08G or C08H
- C08J2305/00—Characterised by the use of polysaccharides or of their derivatives not provided for in groups C08J2301/00 or C08J2303/00
- C08J2305/04—Alginic acid; Derivatives thereof
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Pharmacology & Pharmacy (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Epidemiology (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Organic Chemistry (AREA)
- Dispersion Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Polymers & Plastics (AREA)
- Ophthalmology & Optometry (AREA)
- Inorganic Chemistry (AREA)
- Materials Engineering (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Physics & Mathematics (AREA)
- Optics & Photonics (AREA)
- Nanotechnology (AREA)
- Biomedical Technology (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Medicinal Preparation (AREA)
- Polysaccharides And Polysaccharide Derivatives (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicines Containing Material From Animals Or Micro-Organisms (AREA)
- Materials For Medical Uses (AREA)
- Organic Low-Molecular-Weight Compounds And Preparation Thereof (AREA)
- Processes Of Treating Macromolecular Substances (AREA)
Abstract
本发明涉及还原的和高度氧化的多糖,例如藻酸盐,其可用于包封治疗剂或诊断剂、或者包封治疗剂或诊断剂的基于脂质的纳米颗粒如脂质体或病毒体(在它们递送入受试者之前),本发明还涉及制造和使用它们的方法。
Description
相关申请
本申请要求于2015年10月26日提交的美国临时申请号62/246,462以及于2016年6月16日提交的美国临时申请号62/351,162的优先权。上述临时申请中的每一个的全部内容通过引用并入本文。
背景技术
水凝胶是包含交联聚合物链的网络的聚合物凝胶。水凝胶的网络结构使其能够吸收大量的水。一些水凝胶是高度伸缩性和弹性的;其他的则是粘弹性的。水凝胶已用于治疗应用,例如作为体内递送治疗剂如小分子、细胞和生物制剂的载体。
水凝胶通常由多糖如藻酸盐制成。可以化学操纵多糖来调节它们的性质以及所得水凝胶的性质。例如,通过使多糖与将多糖中的醇转化为醛的氧化剂反应来氧化的多糖,其显著增加了所得水凝胶的生物降解性。然而,多糖的氧化也与不希望的副作用相关。例如,通过氧化产生的醛可以与存在于蛋白质或其他分子上的氨基反应,从而造成体内毒性和/或对可由氧化的多糖产生的水凝胶所包封的治疗剂(货物(cargo))造成损害。存在于氧化的多糖中的醛还可以与多糖附近可能存在的各种化学部分(例如点击试剂)反应,导致其降解。因此,本领域需要可用于制备无毒、无反应性和生物可降解的水凝胶的生物可降解多糖。本领域还需要可用于制备用于包封小分子量治疗剂的具有足够小孔径的水凝胶的多糖。本领域还需要可用于制备能够包封和保留脂质体并将脂质体递送至体内所需位置的水凝胶的多糖。
发明内容
本发明提供了包含某些还原的和某些高度氧化的多糖的组合物。令人惊讶地发现,这些还原的和高度氧化的多糖特别适合于生产可用于包封治疗剂或诊断剂或者用于包封基于脂质的纳米颗粒如脂质体或病毒体以用于递送至受试者的水凝胶,所述纳米颗粒用于包封治疗剂或诊断剂。使用还原的和/或高度氧化的多糖生产的本发明水凝胶是可生物降解的,并且比本领域先前已知的水凝胶具有更低的毒性和反应性。
因此,在一些实施方式中,本发明提供了包含还原的多糖的组合物,其中还原的多糖包含少于2%的残余醛。
在一些实施方式中,本发明还提供了包含还原的多糖的组合物,其中还原的多糖包含少于3%的残余醛;其中还原的多糖是通过如下产生:使多糖与二醇特异性氧化剂反应,由此产生包含0.1%或更多的摩尔氧化度(oxidation)的氧化的多糖;随后使所述氧化的多糖与水溶性醛特异性还原剂反应以产生还原的多糖。
在一些方面中,还原的多糖通过如下产生:使多糖与二醇特异性氧化剂反应,由此产生包含0.1%或更多的摩尔氧化度的含有二醇的氧化的多糖;随后使所述氧化的多糖与水溶性醛特异性还原剂反应以产生所述还原的多糖。
在一些方面中,还提供了包含还原的多糖的组合物,其中还原的多糖通过如下产生:使多糖与二醇特异性氧化剂反应,由此产生含有二醇的氧化的多糖;随后使氧化的多糖与水溶性醛特异性还原剂反应以产生所述还原的多糖。在一些方面中,多糖包含小于15%的残余醛,例如14%,13%,12%,11%,10%,9%,8%,7%,6%,5%,4%,3%,2%,1%,0.5%或0.1%。
在一些实施方式中,多糖选自藻酸盐、琼脂糖、普鲁兰多糖、硬葡聚糖、壳聚糖、爱生兰(elsinan)、黄原胶、葡聚糖、甘露糖、结冷胶、左聚糖、纤维素、透明质酸、硫酸软骨素A、硫酸软骨素C、硫酸软骨素E和β-d-葡聚糖。在一个实施方式中,多糖是藻酸盐。在一个实施方式中,还原的多糖包含具有以下结构的藻氧醇(algoxinol):
在一些方面中,醛特异性水溶性还原剂选自硼氢化钠(NaBH4);氰基硼氢化钠(NaCNBH3);催化剂存在下的氢气(H2);氨硼烷(H3NBH3);和硼烷复合物。在一个具体实施方式中,醛特异性水溶性还原剂是氨硼烷。在另一个具体实施方式中,二醇特异性氧化剂是高碘酸钠。
在一些实施方式中,组合物还包含连接至还原的多糖的交联剂。在一些方面中,交联剂是点击试剂,例如点击试剂选自叠氮化物、二苯并环辛炔(DBCO)、反式环辛烯、四嗪和降冰片烯及其变体。
在一些实施方式中,本发明还提供了包含还原的多糖和连接至还原的多糖的交联剂的组合物。在一些方面中,多糖是藻酸盐聚合物。在一些实施方式中,还原的多糖包含具有以下结构的藻氧醇:
在一些实施方式中,还原的多糖是通过包括以下步骤的方法生产的:使多糖与二醇特异性氧化剂反应以产生含醛的氧化的多糖;和使氧化的多糖与水溶性醛特异性还原剂反应以产生还原的多糖。
在一些实施方式中,二醇特异性氧化剂是高碘酸钠。在一些实施方式中,水溶性醛特异性还原剂是氨硼烷。
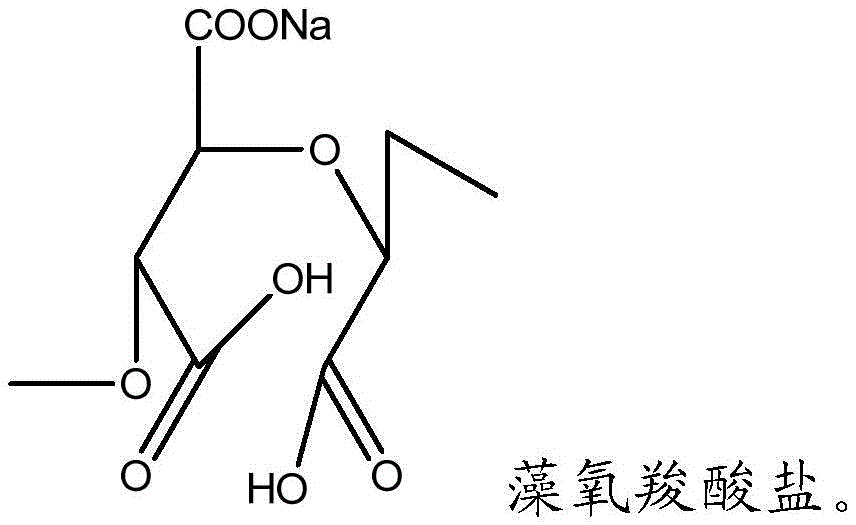
在一些方面中,提供了包含高度氧化的多糖和连接至高度氧化的多糖的交联剂的组合物。在一些实施方式中,多糖是藻酸盐聚合物。在一些方面中,高度氧化的多糖包含具有以下结构的藻氧羧酸盐(algoxalate):
在一些实施方式中,高度氧化的多糖是通过包括以下步骤的方法生产的:使多糖与二醇特异性氧化剂反应以产生含醛的氧化的多糖;和使氧化的多糖与将醛转化成羧酸的第二氧化剂反应以产生所述高度氧化的多糖。
在一个方面中,二醇特异性氧化剂是高碘酸钠。在另一个方面中,第二氧化剂是亚氯酸钠。
在一些实施方式中,交联剂为点击试剂,例如选自叠氮化物、二苯并环辛炔(DBCO)、反式环辛烯、四嗪和降冰片烯及其变体的点击试剂。
在一些实施方式中,本发明还提供了包含本发明组合物的水凝胶。
在一些方面中,水凝胶还可包含例如选自细胞、小分子和生物制剂的治疗剂。在一些实施方式中,生物制剂选自肽、DNA分子、RNA分子和PNA分子。在一个实施方式中,生物制剂是肽,例如血管生成因子,例如选自FGF、VEGF、VEGFR、IGF、NRP-1、Ang1、Ang2、PDGF、PDGFR、TGF-β、内皮糖蛋白(endoglin)、TGF-β受体、MCP-1、整合素、VE-钙粘蛋白、CD31、肝配蛋白、纤溶酶原激活物、纤溶酶原激活物抑制剂-1、eNOS、COX-2、AC133、ID1、ID3和HGF。在一个具体方面中,血管生成因子是VEGF。
在一些实施方式中,本发明的水凝胶还包含细胞,例如哺乳动物细胞,如人间充质干细胞(hMSC)。
在一些方面中,本发明提供了包含彼此交联的多个还原的和/或氧化的多糖的水凝胶,其中水凝胶包含约10nm或更小,例如约10nm、约9nm、约8nm、约7nm、约6nm、约5nm、约4nm、约3nm、约2nm或约1nm或更小的目径(mesh size)。
在一些实施方式中,氧化的多糖是高度氧化的藻酸盐聚合物。在一些实施方式中,高度氧化的藻酸盐聚合物是通过包括以下步骤的方法生产的:使藻酸盐与二醇特异性氧化剂反应以产生含醛的氧化的藻酸盐;和使含醛的氧化的藻酸盐与将醛转化成羧酸的第二氧化剂反应,由此产生所述高度氧化的藻酸盐聚合物。
在一个实施方式中,二醇特异性氧化剂是高碘酸钠。在另一个实施方式中,第二氧化剂是亚氯酸钠。
在一些实施方式中,氧化的藻酸盐聚合物为约0.1%、1%、5%、10%、15%、20%、25%、30%、35%、40%、45%、50%、55%、60%、65%、70%、75%、80%、85%、90%、95%或99%氧化的。
在一些实施方式中,还原的多糖是还原的藻酸盐聚合物。在一些实施方式中,所述还原的藻酸盐聚合物是通过包括以下步骤的方法生产的:使藻酸盐与二醇特异性氧化剂反应以产生含醛的氧化的藻酸盐;和使含醛的氧化的藻酸盐与水溶性醛特异性还原剂反应,由此产生所述还原的藻酸盐聚合物。
在一个实施方式中,二醇特异性氧化剂是高碘酸钠。在另一个实施方式中,水溶性醛特异性还原剂是氨硼烷。
在一些方面中,本发明的水凝胶包含约10nm至约1nm、约10nm至约4nm、约7nm至约3nm、约5nm至约1nm、约4nm至约2nm、或约3nm至约0.5nm的平均目径。
在一些方面中,本发明的水凝胶还包含治疗剂或诊断剂,例如细胞、小分子和生物制剂。在一些方面中,生物制剂选自肽、DNA分子、RNA分子和PNA分子。
在一些实施方式中,生物制品是肽。在一些实施方式中,肽具有500kDa或更小,例如约450kDa或更小、约300kDa或更小、约150kDa或更小、约100kDa或更小、约50kDa或更小、约25kDa或更小或者约10kDa或更小的分子量。
在一些方面中,肽是血管生成因子,例如FGF、VEGF、VEGFR、NRP-1、Ang1、Ang2、PDGF、PDGFR、IGF、TGF-β、内皮糖蛋白、TGF-β受体、MCP-1、整合素、整合素配体、VE-钙粘蛋白、CD31、肝配蛋白、纤溶酶原激活物、纤溶酶原激活物抑制剂-1、eNOS、COX-2、AC133、ID1、ID3和HGF。在一个具体实施方式中,血管生成因子是VEGF。
在一些实施方式中,细胞是哺乳动物细胞,例如人间充质干细胞(hMSC)。
在一些实施方式中,多糖包含连接至多糖的交联剂。在一些方面中,交联剂是点击试剂,例如叠氮化物、二苯并环辛炔、反式环辛烯、四嗪和降冰片烯及其变体。
在一些实施方式中,本发明还提供了包含本发明水凝胶的可植入或可注射装置。
在一些方面中,本发明还提供了生产还原的多糖的方法,该方法包括以下步骤:使多糖与二醇特异性氧化剂反应以产生含醛的氧化的多糖;和使含醛的氧化的多糖与醛特异性水溶性还原剂反应,由此产生还原的多糖。
在一些实施方式中,醛特异性水溶性还原剂是硼氢化钠(NaBH4);氰基硼氢化钠(NaCNBH3);催化剂如镍(Ni)、铂(P1)或钯(Pd)催化剂存在下的氢气(H2);氨硼烷(H3NBH3);或硼烷复合物,例如双碳酸盐硼烷复合物([(BH3)2CO2]2-·2Na+),硼烷二甲胺复合物[(CH3)2NH·BH3];硼烷叔丁胺复合物[(CH3)3CNH2·BH3];或硼烷-嘧啶复合物。在一个具体实施方式中,醛特异性水溶性还原剂是氨硼烷。在另一个具体实施方式中,二醇特异性氧化剂是高碘酸钠。
在一些实施方式中,该方法还包括使所述多糖与交联剂反应。在一些方面中,交联试剂是点击试剂,例如叠氮化物、二苯并环辛炔(DBCO)、反式环辛烯、四嗪和降冰片烯及其变体。在一个具体实施方式中,多糖是藻酸盐聚合物。在一个实施方式中,藻酸盐聚合物具有小于500kDa的分子量。在一个实施方式中,还原的多糖包含具有以下结构的藻氧醇:
在一些方面中,本发明还提供了生产共价连接至交联剂的高度氧化的多糖的方法,该方法包括以下步骤:使多糖与二醇特异性氧化剂反应以产生含醛的氧化的多糖;使含醛的氧化的多糖与将醛转化成羧酸的第二氧化剂反应,由此产生高度氧化的多糖;和使多糖与交联剂反应。
在一些方面中,第二氧化剂选自亚氯酸钠、溴、稀硝酸(NHO3)、氧化银、铜(II)配合物、高锰酸钾(KMnO4)和过氧化氢(H2O2)。在一个具体实施方式中,第二氧化剂是亚氯酸钠。
在一些实施方式中,交联剂是点击试剂,例如叠氮化物、二苯并环辛炔(DBCO)、反式环辛烯、四嗪和降冰片烯及其变体。
在一些方面中,多糖是藻酸盐聚合物。在一个方面中,藻酸盐聚合物具有小于500kDa的分子量。
在一个实施方式中,高度氧化的聚合物包含具有以下结构的藻氧羧酸盐:
本发明还提供了一种药物递送组合物,其包含包封治疗剂或诊断剂的基于脂质的纳米颗粒;和包封基于脂质的纳米颗粒的本发明水凝胶。在一个实施方式中,基于脂质的纳米颗粒是脂质体或病毒体。
在一些实施方式中,基于脂质的纳米颗粒保持包封在水凝胶中至少1天、至少10天、至少15天、至少20天、至少25天、至少30天、至少35天、至少40天、至少45天、至少50天、至少55天、至少60天、至少65天、至少70天、至少75天或至少80天。
在一些方面中,治疗剂或诊断剂选自细胞、小分子和生物制剂。在一些方面中,生物制剂选自肽、抗体或其片段、疫苗、DNA分子、RNA分子和PNA分子。在一些方面中,治疗剂或诊断剂选自STING佐剂、CRISPR-Cas9试剂和佐剂负载的源自经破坏癌细胞的亚细胞囊泡。在一些方面中,治疗剂或诊断剂是疫苗。
在一些方面中,本发明还提供了药物递送组合物,其包含包封治疗剂或诊断剂的基于脂质的纳米颗粒;和包封基于脂质的纳米颗粒的点击物缀合的聚合物水凝胶,其中该点击物缀合的聚合物水凝胶包含生物可降解聚合物;并且其中聚合物不易被宿主内源性酶降解。在一个实施方式中,基于脂质的纳米颗粒是脂质体或病毒体。
在一些实施方式中,药物递送组合物允许将完整的基于脂质的纳米颗粒持续递送至宿主中的期望位置。
在一些实施方式中,多糖选自藻酸盐、琼脂糖、普鲁兰多糖、硬葡聚糖,壳聚糖、爱生兰、黄原胶、葡聚糖、甘露糖、结冷胶、左聚糖、纤维素、透明质酸、硫酸软骨素A、硫酸软骨素C、硫酸软骨素E和β-d-葡聚糖。在一个具体实施方式中,多糖是藻酸盐。
在一些方面中,通过使用选自叠氮化物、二苯并环辛炔、反式环辛烯、四嗪和降冰片烯及其变体的至少一种点击试剂来产生点击物缀合的聚合物水凝胶。
在一些实施方式中,藻酸盐包含约0.01%至约99%,例如约0.01%至约0.05%、约0.02%至约0.1%、约0.05%至约0.5%、约0.1%至约1%、约0.5%至约15%、约5%至约10%、约2%至约20%、约15%至约40%、约30%至约50%、约40%至约70%、约50%至约80%或约60%至约99%的点击取代度。在一些方面中,点击物缀合的聚合物水凝胶包含约0.1%至约99%氧化的,例如约0.1%至约0.5%、约0.2%至约1%、约0.5%至约10%、约5%至约20%、约15%至约40%、约25%至约50%、约40%至约70%、约50%至约80%或约75%至约99%氧化的藻酸盐。
在一些方面中,点击物缀合的的藻酸盐水凝胶已经由以约1%至约99%w/v,例如约1%至约5%、约2%至约10%、约5%至约20%、约10%至约30%、约20%至约50%、约40%至约70%、约60%至约80%或约75%至约99%w/v的浓度存在的藻酸盐制备。在一些实施方式中,基于脂质的纳米颗粒保持包封在点击物缀合的聚合物水凝胶中至少1天,至少10天,至少15天,至少20天,至少25天,至少30天,至少35天,至少40天,至少45天,至少50天,至少55天,至少60天,至少65天,至少70天,至少75天或至少80天。
在一些方面中,本发明还提供了药物递送组合物,其包含包封治疗剂或诊断剂的基于脂质的纳米颗粒;和包封该基于脂质的纳米颗粒的藻酸盐水凝胶,其中该水凝胶包含藻酸盐,该藻酸盐包含约50%或更少的摩尔氧化度,例如约45%或更少、约40%或更少、约35%或更少、约30%或更少、约25%或更少、约20%或更少、约15%或更少、约10%或更少、约5%或更少、约1%或更少、约0.5%或更少或者约0.1%或更少。在一个实施方式中,基于脂质的纳米颗粒是脂质体或病毒体。在一个方面中,组合物允许将完整的基于脂质的纳米颗粒持续递送至宿主中的期望位置。
在一些方面中,通过使用至少一种选自叠氮化物、二苯并环辛炔、反式环辛烯、四嗪和降冰片烯及其变体的点击试剂来产生点击物缀合的聚合物水凝胶。在一些方面中,藻酸盐与点击试剂缀合,并且其中藻酸盐包含约0.01%至约90%的点击取代度。
在一些方面中,点击物缀合的聚合物水凝胶包含约0.1%至约99%氧化的藻酸盐。
在一些实施方式中,藻酸盐水凝胶已由以约1%至约80%w/v的浓度存在的藻酸盐制备。在一些实施方式中,基于脂质的纳米颗粒保持包封在水凝胶中至少1天、至少10天、至少15天、至少20天、至少25天、至少30天、至少35天、在至少40天、至少45天、至少50天、至少55天、至少60天、至少65天、至少70天、至少75天或至少80天。
在一些方面中,治疗剂或诊断剂选自细胞、小分子和生物制剂。在一些实施方式中,生物制剂选自肽、抗体或其片段、疫苗、DNA分子、RNA分子和PNA分子。在一些实施方式中,RNA分子选自mRNA、RNAi、siRNA、shRNA、microRNA、isRNA、lncRNA和反义RNA。
在一些方面中,治疗剂或诊断剂选自STING佐剂、CRISPR-Cas9试剂和佐剂负载的源自经破坏癌细胞的亚细胞囊泡。
在一些实施方式中,脂质体是阳离子脂质体。在一些方面中,期望的位置是细胞的胞液。
在一些实施方式中,本发明还提供了用于治疗有需要的受试者的方法,该方法包括向受试者施用有效量的本发明的水凝胶、可植入或可注射装置或者药物递送组合物,由此治疗所述受试者。
在一些方面中,受试者患有选自局部缺血、眼睛相关的病症或耳部相关的病症的疾病或症状。
在一些实施方式中,本发明还提供了在有需要的受试者中治疗慢性局部缺血或增强移植组织的移植成活率(engraftment)的方法,该方法包括向所述受试者施用有效量的本发明的水凝胶、可植入或可注射装置或者药物递送组合物,由此在所述受试者中治疗所述慢性局部缺血或增强所述移植组织的移植成活率。
在一些方面中,将水凝胶或者或可植入或可注射装置或者药物递送组合物局部施用至例如局部缺血部位,或在移植之前和/或之后局部施用至进行移植的组织。
在一些方面中,当以可溶形式递送肽时,水凝胶或者可植入或可注射装置或者药物递送组合物以比所述肽的推荐肽剂量小至少约10倍,例如小约15倍、小约20倍、小约50倍的剂量包含所述肽。
在一个具体方面中,肽是VEGF和IGF。在一个实施例中,受试者是人。
通过以下详细描述和附图进一步说明本发明。
附图说明
图1a是显示点击试剂与未氧化的藻酸盐缀合的示意图。
图1b是显示点击试剂与氧化的藻酸盐缀合的示意图,示出了不利于进一步共价点击交联的不稳定(可水解的)亚胺键的形成。
图1c是显示点击试剂与高度氧化的藻酸盐缀合的示意图,示出了可用于点击缀合的所产生的另外羧酸基团。
图2a是显示如通过ELISA测定的随着暴露于氧化藻酸的盐而变化的VEGF生物活性损失的条形图。
图2b是孵育后含有与Tz和Nb缀合的氧化的藻酸盐的小瓶的图片,示出由于氧化的藻酸盐中存在的醛而导致的点击缀合物的明显变化。
图3a是显示藻酸盐氧化以产生含反应性醛的氧化的藻酸盐;随后将氧化的藻酸盐选择性还原或氧化以消除反应性醛的化学方案。
图3b是显示用氨硼烷或硼氢化钠进一步还原,或用亚氯酸钠进一步氧化的氧化的藻酸盐中残余氧化度%的条形图。
图4a是显示在EBM中孵育5天后通过ELISA测量的VEGF生物活性%变化的条形图,示出了随着暴露于氧化的或还原的藻酸盐而变化的VEGF生物活性损失。
图4b是显示在1%BSA溶液中孵育5天后通过ELISA测量的VEGF生物活性%变化的条形图,示出了随着暴露于氧化的藻酸盐而变化的VEGF生物活性损失。
图5a是在第0天含有与Tz和Nb缀合的HighOx藻酸盐的小瓶(上图)和在第0天含有与Tz和Nb缀合的HighOx Sc藻酸盐的小瓶(下图)的两幅图,示出了由于氧化的藻酸盐中醛的存在而导致的点击缀合物的明显变化,以及在含有藻氧醇和藻氧羧酸盐的缀合物中没有变化。
图5b是显示如通过NMR测量的存在于HighOx和HighOx SC藻酸盐中的Tz的相对量的条形图,示出了经由另外的羧酸部分点击缀合含藻氧羧酸盐的藻酸盐的额外潜能。
图6a是在第28天具有20-50%氧化度的Tz-缀合的HighOx藻酸盐材料的紫外-可见光谱(上图)和在第14天含有20%和30%缀合的用亚氯酸钠处理的Tz-缀合的HighOx藻酸盐材料的紫外-可见光谱。图6a示出由点击部分与存在于氧化藻酸盐材料中的藻酸盐醛的反应引起的Tz UV-可见光谱的变化。
图6b是含有用氨硼烷处理的Tz-缀合的HighOx藻酸盐材料和用亚氯酸钠处理的HighOx藻酸盐材料的小瓶的两幅图。图6b示出了由点击部分与氧化的藻酸盐材料中存在的藻酸盐醛的反应引起的Tz溶液颜色的变化。
图6c是在第28天具有20-50%氧化度的Nb-缀合的HighOx藻酸盐材料的紫外-可见光谱(上图)和在第14天含有20%-50%缀合的用亚氯酸钠处理的Nb-缀合的HighOx藻酸盐材料的紫外-可见光谱。图6c示出了由点击部分与氧化的藻酸盐材料中存在的藻酸盐醛的反应引起的Nb紫外-可见光谱的变化。
图6d是在第28天具有20-50%氧化度的Nb-缀合的HighOx藻酸盐材料(上图)和在第14天含有20%-50%缀合的用亚氯酸钠处理的Nb-缀合的HighOx藻酸盐材料的小瓶(下图)的两幅图。图6d示出了由点击部分与氧化的藻酸盐材料中存在的藻酸盐醛的反应引起的Nb溶液颜色的变化。
图6e是用高碘酸钠氧化的Nb-缀合的藻酸盐材料的NMR谱,显示了Nb峰的展宽以及醛峰的存在。
图6f是已经用高碘酸钠氧化的Tz-缀合的藻酸盐材料的NMR谱,显示了Nb峰的展宽和醛峰的存在。
图6g是已经用高碘酸钠氧化并且随后用亚氯酸钠进一步氧化的Nb-缀合的藻酸盐材料的NMR谱,显示Nb峰未变宽且没有醛峰。
图6h是已经用高碘酸钠氧化并且随后用亚氯酸钠进一步氧化的Tz-缀合的藻酸盐材料的NMR谱,显示Nb峰未变宽且没有醛峰。
图6i是藻酸盐材料的代表性FTIR光谱,证明了在用亚氯酸钠处理后产生了羧酸峰。
图6j是第15天Tz-缀合和Nb-缀合的藻酸盐材料的紫外-可见光谱,显示了含有藻氧醇和藻氧羧酸盐的点击物缀合的藻酸盐没有颜色变化。
图6k是用高碘酸钠氧化并用亚氯酸钠进一步氧化的藻酸盐材料的NMR谱,显示不存在醛相关的峰(~≥5.1ppm)。
图7a是显示具有20%氧化度(左图)和50%氧化度(右图)的Tz-缀合和Nb-缀合的MVG藻酸盐(约250kDa起始MW)的降解的两幅图,显示了随时间变化的藻酸盐聚合物骨架的水解。
图7b是显示对于未处理的藻酸盐(左上图)、用氨硼烷还原处理的藻酸盐(右上图)、用硼氢化钠还原处理的藻酸盐(左下图)和用氨硼烷(还原处理的藻酸盐(右下图)的在37℃下含有0%-50%氧化度的VLVG(30kDa起始MW)藻酸盐的降解的四幅图,显示了随时间变化的藻酸盐聚合物骨架的水解。
图7c是含有具有20%氧化度的MVG和VLVG材料的50%w/v溶液和用于比较的50%w/v的未氧化的VLVG的小瓶的照片。与母体藻酸盐不同,含藻氧醇和藻氧羧酸盐的藻酸盐材料显示出增加的溶解度。
图8是显示Tz-缀合的藻酸盐材料相对于缀合等同物在515nm处的紫外-可见吸收的图。
图9是显示在孵育2天后在含有0-50%氧化度的氧化的藻酸盐存在下的相对细胞活力的条形图。
图10是显示分子量为250kDa的未氧化的藻酸盐(MVG,左条);分子量为30kDa的未氧化的藻酸盐(VLVG,中心条);和被氧化至20%,然后通过使用亚氯酸钠进一步氧化并与点击物(Tz或Nb,右条)缀合的VLVG材料的溶解度(%w/v)上限的条形图。图10说明与未氧化的藻酸盐相比之下,氧化的VLVG材料可溶至至少50%w/v。
图11a是显示使用Tz和Nb对MVG和VLVG材料实现的缀合潜能的条形图。
图11b是显示VLVG材料在515nm处的紫外-可见吸光度随Tz的摩尔当量变化的图。
图12a是显示VLVG材料在不同取代度和恒定藻酸盐浓度(%w/v)下储能模量(G')随时间增加的图。
图12b是显示在不同取代度和恒定藻酸盐浓度(%w/v)下VLVG材料的储能模量(G')的最大值(来自图13a)的条形图。
图12c是显示由图13b中描绘的最大储能模量(G')得出的VLGG材料在不同取代度和恒定藻酸盐浓度(%w/v)下的网孔尺寸值的条形图。
图12d是显示被氧化至10%氧化度、用氨硼烷还原且然后使用250摩尔当量的Nb和Tz与Nb或Tz缀合的MVG材料在5%w/v、10%w/v或15%w/v的还原的藻酸盐浓度下的储能模量(G')随时间增加的图。
图12e是显示被氧化至20%氧化度、用氨硼烷还原且然后使用250摩尔当量的Nb和Tz与Nb或Tz缀合的MVG材料在5%w/v、10%w/v、15%w/v或20%w/v的还原的藻酸盐浓度下的储能模量(G')随时间增加的图。
图12f是显示被氧化至20%氧化度、用氨硼烷还原且然后使用1000摩尔当量的Nb和Tz与Nb或Tz缀合的LF 20/40材料在5%w/v、10%w/v、15%w/v或20%w/v的还原的藻酸盐浓度下的储能模量(G')随时间增加的图。
图13a是显示荧光素缀合的胰岛素从使用具有不同点击缀合度和恒定藻酸盐浓度(%w/v)的点击物缀合的VLVG材料产生的水凝胶累积释放(以微克计)的图。
图13b是显示图14a中曲线的对应于水凝胶形成期间2500摩尔当量的Nb或Tz和5%浓度的Alg-N和Alg-T(2500eq 5%VLVG)的非平台区和线性拟合的图。
图13c是显示荧光素缀合的BSA从使用具有不同点击缀合度和恒定藻酸盐浓度(%w/v)的点击物缀合的VLVG材料产生的水凝胶累积释放(以微克计)的图。
图13d是显示图14c中曲线的对应于水凝胶形成期间2500摩尔当量的Nb或Tz以及5%浓度的Alg-N和Alg-T(2500eq 5%VLVG)的非平台区和线性拟合的图。
图13e是显示荧光素缀合的IgG从使用具有不同点击缀合度和恒定藻酸盐浓度(%w/v)的点击物缀合的VLVG材料产生的水凝胶累积释放(以微克计)的图。
图13f是显示图14e中曲线的对应于水凝胶形成期间2500摩尔当量的Nb或Tz和5%浓度的Alg-N和Alg-T(2500eq 5%VLVG)的非平台区和线性拟合的图。
图13g是显示荧光素缀合的胰岛素、BSA和IgG从通过Ca2+介导的交联产生的水凝胶累积释放(以微克计)的图,在前1-3天内显示显著的爆发释放(若未完全)。
图14a是显示荧光素缀合的胰岛素从使用被氧化至5%或10%且然后用AB还原处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图14b是显示荧光素缀合的胰岛素从使用被氧化至5%或10%且然后用SC氧化处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图14c是显示荧光素缀合的IgG从使用被氧化至5%或10%且然后用AB还原处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图14d是显示荧光素缀合的IgG从使用被氧化至5%或10%且然后用SC氧化处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图15a是在0分钟、40分钟、21.5小时和67.5小时之后拍摄的在2.3%戊二醛存在下含有与Nb(左小瓶)和Tz(右小瓶)缀合的4%MVG材料的玻璃小瓶的一系列图片,其显示出显著的颜色变化,表明点击部分的修饰。
图15b是在0分钟、40分钟、20小时和69小时后拍摄的含有作为对照的水(左小瓶)或与DBCO(中间小瓶)或叠氮化物(右小瓶)缀合的2%MVG材料的玻璃小瓶的一系列图片,其显示出显著的颜色变化,表明点击部分的修饰。
图16a是显示在PBS++(含有Ca2+和Mg2+离子的PBS缓冲液)中50天期间内中性脂质体(DOPC:胆固醇)从Ca2+交联藻酸盐和从非氧化的点击物缀合的藻酸盐累积释放(%负载)的图。
图16b是显示在PBS++(含有Ca2+和Mg2+离子的PBS缓冲液)中中性脂质体(DOPC:胆固醇)从Ca2+交联藻酸盐水凝胶、非氧化的点击物缀合的藻酸盐水凝胶和点击明胶水凝胶累积释放(%负载)的图。
图16c是显示在28天期间内中性脂质体(DOPC:胆固醇)从以5%w/v藻酸盐浓度制备的Ca2+交联藻酸盐和非氧化的点击物缀合的藻酸盐水凝胶累积释放(%负载)的图。在作为不含Ca2+或Mg2+离子的PBS缓冲液的PBS--中体外测量了脂质体释放曲线,并且证明点击缀合凝胶能够保留包封的脂质体(扩散受限),而脂质体能够扩散出钙交联凝胶。
图16d是显示在8天期间内中性脂质体(DOPC:胆固醇)从未氧化的点击物缀合的藻酸盐水凝胶和点击物缀合的明胶水凝胶累积释放(%负载)的图。第8天分别用藻酸盐裂解酶或胶原酶消化凝胶以显示回收和质量平衡。
图17a是包封在图17d中描绘的凝胶中的脂质体原料的动态光散射(DLS)迹线。
图17b是如图17d所示8天后从用藻酸盐裂解酶消化的非氧化的点击物缀合的藻酸盐水凝胶释放的脂质体的DLS迹线,显示出与存在于储备液中的脂质体的平均直径的最小差异。
图17c是28天后从以PBS-缓冲液中5%w/v的藻酸盐浓度制备的未氧化的点击物缀合的藻酸盐水凝胶释放的脂质体的DLS迹线,显示出与存在于储备液中的脂质体的平均直径的最小差异。
图17d是8天后从胶原酶消化的点击物缀合的明胶水凝胶释放的脂质体的DLS迹线。
图17e是3天后从PBS-缓冲液中制备的钙交联藻酸盐释放的脂质体的DLS迹线,显示出释放的脂质体比脂质体标准品更加多分散且直径更大。
图17f是28天后从以PBS-缓冲液中5%w/v的藻酸盐浓度制备的钙交联水凝胶释放的脂质体的DLS迹线,显示出释放的脂质体比脂质体标准品更加多分散且直径更大。
图18是显示在PBS中75天内脂质体从在点击缀合之前被氧化至0%、5%和10%总氧化度并用AB还原处理的点击物缀合的藻酸盐水凝胶累积释放(%负载)的图。
图19a是含有包封脂质体的藻酸盐水凝胶和上清液的管在第0天的图片。为了制备藻酸盐水凝胶,将藻酸盐氧化至20%,然后用氨硼烷还原。将凝胶在柠檬酸钠缓冲液(pH5;左边两个小瓶)或硼烷钠(pH9;右边两个小瓶)中于37℃下孵育。
图19b是含有包封脂质体的藻酸盐水凝胶和上清液的管在第1天的图片。为了制备藻酸盐水凝胶,将藻酸盐氧化至20%,然后用氨硼烷还原。将凝胶在柠檬酸钠缓冲液(pH5;左边两个小瓶)或硼烷钠(pH9;右边两个小瓶)中于37℃下孵育。
图19c是含有包封脂质体的藻酸盐水凝胶和上清液的管在第7天的照片。为了制备藻酸盐水凝胶,将藻酸盐氧化至20%,然后用氨硼烷还原。将凝胶在柠檬酸钠缓冲液(pH5;左边两个小瓶)或硼烷钠(pH9;右边两个小瓶)中于37℃下孵育。图片显示pH 9样品在7天后降解,而pH 5样品仍然在一定程度上完整。
图19d是包封脂质体的藻酸盐水凝胶和上清液的管在第14天的图片。为了制备藻酸盐水凝胶,将藻酸盐氧化至20%,然后用氨硼烷还原。将凝胶在柠檬酸钠缓冲液(pH5;左边两个小瓶)或硼烷钠(pH9;右边两个小瓶)中于37℃下孵育。图像表明14天后样品在pH 5和pH 9均降解。
图19e是显示中性脂质体(DOPC:胆固醇)从通过将藻酸盐氧化至20%并随后将其用氨硼烷还原而产生的藻酸盐水凝胶的基于降解的释放的图。样品在pH6.5的MES缓冲液中释放以模拟瘤周微环境。
图20a是挤出之前的DOTAP:Hydro Soy PC脂质体的DLS迹线。
图20b是挤出之后的DOTAP:Hydro Soy PC脂质体的DLS迹线。
图20c是显示17天期间阳离子脂质体(图20a)从Ca2+交联藻酸盐和非氧化的点击物缀合的藻酸盐水凝胶累积释放(%负载)的图。图21b显示点击物交联的凝胶能够保留包封的脂质体(扩散受限),而脂质体能够扩散出钙交联凝胶。
图21a是显示IGF-1从使用各种藻酸盐组合物制备的点击物缀合的藻酸盐水凝胶释放的图。
图21b是显示VEGF165从使用各种藻酸盐组合物制备的点击藻酸盐水凝胶释放的图。
图22是显示在不同藻酸盐浓度(%w/v)、氧化程度和用亚氯酸钠或氨硼烷处理下各种藻酸盐溶液的相对粘度的条形图。数据显示,与未经氧化的MVG的点击缀合不会导致粘度的实质性差异,而在点击缀合至含有藻氧醇或藻氧羧酸盐的藻酸盐的情况下,粘度实质性降低,并且与水的粘度相当(0.890cPa,25℃下)。
具体实施方式
I.本发明的还原的和高度氧化的多糖
本发明涉及包含还原的多糖的组合物,其中还原的多糖包含少于2%的残余醛。本发明还涉及包含还原的多糖的组合物,其中还原的多糖包含少于3%的残余醛,并且其中该多糖通过如下生成:使多糖与二醇特异性氧化剂反应,由此产生包含以摩尔计15%或更多的氧化度的氧化的多糖,随后使氧化的多糖与水溶性醛特异性还原剂反应以产生还原的多糖。
本发明组合物中包含的还原的多糖可用于制备水凝胶。这些多糖是通过两步法生成的。第一步包括使多糖例如藻酸盐与二醇特异性氧化剂反应以产生含醛的氧化的多糖,例如含醛的氧化的藻酸盐。第二步包括进一步还原处理含醛的氧化的多糖以产生还原的多糖。还原过程包括还原存在于氧化的多糖中的醛部分以产生醇部分。因此,如本文所用,术语“还原的多糖”包括含有醇部分的多糖。在一些实施方式中,还原的多糖的产生是通过使用二醇特异性氧化剂氧化多糖以产生含醛的多糖;然后例如通过使用水溶性醛特异还原剂对氧化的多糖进行还原处理以产生还原的多糖。在某些实例中,还原的多糖包含具有开环醇的单体亚单元,所述开环醇具有以下结构:
如本说明书中使用的术语“多糖”是指由通过糖苷键连接在一起的单糖单元链组成的任何聚合糖类分子。例如,藻酸盐是包含两种不同的单体亚单位:β-D-甘露糖醛酸盐(M)和其C-5差向异构体α-L-古洛糖醛酸盐(G)的多糖,所述亚单位是(1-4)连接的。
多糖链可以是直链或支链的。术语“多糖”还意在包括寡糖。多糖可以是仅含有一种单体单元(例如葡萄糖)的均多糖或含有不同种类单体单元(例如葡萄糖和果糖)的杂多糖。在一个实施方式中,术语“多糖”是指含有二醇,即存在于相邻碳上的两个羟基的聚合糖类分子。含二醇的多糖的非限制性实例包括藻酸盐、普鲁兰多糖、硬葡聚糖、壳聚糖、爱生兰、黄原胶、葡聚糖、甘露糖、结冷胶、左聚糖、纤维素、透明质酸、硫酸软骨素A、硫酸软骨素C、硫酸软骨素E和β-d-葡聚糖。
在一个具体实施方式中,含二醇的多糖是藻酸盐聚合物。藻酸盐聚合物由两种不同的单体单元:(1-4)-连接的β-D-甘露糖醛酸(M单元)和αL-古洛糖醛酸(G单元)组成,所述单体单元可以沿着聚合物链按比例和顺序分布而变化。藻酸盐聚合物是对二价阳离子(例如Ca+2、Mg+2、Ba+2)具有强亲和力,并在暴露于这些分子时形成稳定水凝胶的聚电解质体系(参见Martinsen A.等,Biotech.&Bioeng,33(1989)79-89)。例如,钙交联的藻酸盐水凝胶可用于牙科应用、伤口敷料、软骨细胞移植和作为其他细胞类型的基质。不希望受理论束缚,据信G单元优选使用钙交联进行交联,而基于点击反应的交联相对于G单元或M单元是更加无差别的(即,G和M单元均可通过点击化学来交联)。
与术语“藻酸盐聚合物”可互换使用的术语“藻酸盐”包括未改性的藻酸盐、氧化的藻酸盐(例如,包含一个或多个藻氧羧酸盐单体单元)和/或还原的藻酸盐(例如,包含一个或多个藻氧醇单体单元)。在一些实施方式中,氧化的藻酸盐包括含有一个或多个醛基的藻酸盐,或含有一个或多个羧酸根基团的藻酸盐。在其他实施方式中,氧化的藻酸盐包含高度氧化的藻酸盐,例如包含一个或多个藻氧羧酸盐单元的高度氧化的藻酸盐。氧化的藻酸盐还可以包含相对少量的醛基(例如,少于15%,例如14%、13%、12%、11%、10%、9%、8%、7%、6%5%、4%、3%、2%、1%、0.9%、0.8%、0.7%、0.6%、0.5%、0.4%、0.3%、0.2%、0.1%或更少的醛基或氧化度,以摩尔计)。术语“藻酸盐”或“藻酸盐聚合物”还可包括与如下所述的至少一种点击试剂缀合的藻酸盐,例如未改性的藻酸盐、氧化的藻酸盐或还原的藻酸盐。
用于本发明上下文中的藻酸盐聚合物的平均分子量可为约20kDa至约500kDa,例如约20kDa至约40kDa,约30kDa至约70kDa,约50kDa至约150kDa,约130kDa至约300kDa,约230kDa至约400kDa,约300kDa至约450kDa或约320kDa至约500kDa。在一个实例中,可用于本发明的藻酸盐聚合物可具有约32kDa的平均分子量。在另一个实例中,可用于本发明的藻酸盐聚合物可具有约265kDa的平均分子量。在一些实施方式中,藻酸盐聚合物的分子量小于约1000kDa,例如小于约900kDa,小于约800kDa,小于约700kDa,小于约600kDa,小于约500kDa,小于约400kDa,小于约300kDa,小于约200kDa,小于约100kDa,小于约50kDa,小于约40kDa,小于约30kDa或小于约25kDa。在一些实施方式中,藻酸盐聚合物的分子量为约1000kDa,例如约900Kda,约800kDa,约700kDa,约600kDa,约500kDa,约400kDa,约300kDa,约200kDa,约100kDa,约50kDa,约40kDa,约30kDa或约25kDa。在一个实施方式中,藻酸盐聚合物的分子量为约20kDa。
"GGGGRGDSP"公开为SEQ ID NO:12。
多糖,例如含二醇的多糖如藻酸盐,可以在第一步中与二醇特异性氧化剂反应。术语“二醇特异性氧化剂”是指与二醇部分(例如存在于多糖中的二醇部分)特异性反应,并且不氧化也可存在于多糖中的其他官能团(例如醇)的氧化剂。二醇特异性氧化剂的非限制性实例包括高碘酸钠(NaIO4)、高碘酸(HIO4)、四乙酸铅(PB(OAc)4)、仲高碘酸钠(Na3H2IO6)和高碘酸钾(KIO4)。在一个具体实施方式中,二醇特异性氧化剂是高碘酸钠(NaIO4)。
二醇特异性氧化剂与二醇反应以裂解碳-碳键并产生两个醛部分。在某些实施方式中,该反应产生的氧化的多糖是至少约0.1%、0.5%、1%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%、约50%、约55%、约60%、约65%、约70%、约75%、约80%、约85%、约90%、约95%、约99%或约100%氧化的。所列举值的中间范围也旨在是本发明的一部分。例如,在某些实施方式中,该反应产生的氧化的多糖可以是约1%至约5%、约3%至约10%、约5%至约20%、约10%至约15%、约12%至约25%、约15%至约30%、约20%至约25%、约25%至约45%、约30%至约50%、约45%至约60%、约50%至约70%、约55%至约75%、约60%至约80%、约65%至约80%、约70%至约90%或约85%至约100%氧化的。
如本说明书通篇使用的术语“氧化的多糖”,例如“氧化的藻酸盐”是指已被氧化,例如与氧化剂如二醇特异性氧化剂反应的多糖。氧化的多糖例如藻酸盐,包含由多糖的氧化产生的醛部分。氧化的多糖可为约0.1%至约100%氧化的,例如约0.1%至约5%、约1%至约10%、约5%至约20%、约15%至约40%、约25%至约60%、约40%至约70%、约55%至约90%或约75%至约100%氧化的。在一些实施方式中,氧化的多糖可为小于约15%氧化的,例如小于约14%、小于约13%、小于约12%、小于约11%、小于约10%、小于约9%、小于约8%、小于约7%、小于约6%、小于约5%、小于约4%、小于约3%、小于约2%、小于约1%、小于约0.9%、小于约0.8%、小于约0.7%、小于约0.6%、小于约0.5%、小于约0.4%、小于约0.3%、小于约0.2%或小于约0.1%氧化的。
与术语“%摩尔氧化度”可互换使用的术语“%氧化度”或“%氧化的”、“氧化水平”或“%氧化水平”是指单体亚单元在含二醇的多糖例如藻酸盐中的%摩尔分数,所述多糖由于氧化而是开环的。在一些情况下,多糖是已经与二醇特异性氧化剂如高碘酸钠反应的含二醇的多糖。可用于测量多糖的%氧化度的方法是本领域普通技术人员已知的,并且可以包括例如qNMR。
例如,术语“%氧化度”可以有关于例如被二醇特异性氧化剂氧化并且含有包含醛部分的开环单体亚单元的多糖而使用。以下显示了例如藻酸盐中的这样的单体亚单元的一个实例:
术语“%氧化度”还可以有关于例如被二醇特异性氧化剂氧化,且随后例如通过水溶性醛特异性还原剂而还原,并且含有包含醇部分的开环单体亚单元的多糖而使用。以下显示了这样的单体亚单元(例如藻氧醇)的一个实例:
术语“%氧化度”还可以有关于例如被二醇特异性氧化剂氧化,且随后例如被第二氧化剂进一步氧化,并且含有包含羧酸部分的开环单体亚单元的多糖而使用。以下显示了这样的单体亚单元(例如藻氧羧酸盐)的一个实例:
如本文所用,术语“%醛”是指存在于多糖例如含二醇的多糖如藻酸盐的开环单体亚单元中的醛的%摩尔分数。
术语“%残余氧化度”、“残余氧化水平”、“%残余氧化水平”、“%残余摩尔氧化度”或“%残余醛”是指残余醛的%摩尔分数,所述残余醛即为在如下所述的多糖与二醇特异性氧化剂反应且然后用醛特异性水溶性还原剂还原以产生还原的多糖之后保留在多糖中的醛部分。在一些实施方式中,还原的多糖(例如还原的藻酸盐)可包含约0.01%至约3%的残余醛,例如约0.01%至约1%、约0.05%至约1.5%或约1%至约3%的残余醛。例如,还原的多糖可包含约2%的残余醛或约3%的残余醛。该术语还可以指残余醛的%摩尔分数,所述残余醛即为在如下所述的多糖与二醇特异性氧化剂反应且然后例如用第二氧化剂进一步氧化以产生高度氧化的多糖之后保留在多糖中的醛部分。在一些实施方式中,高度氧化的多糖(例如高度氧化的藻酸盐)可包含约0.01%至约3%的残余醛,例如约0.01%至约1%、约0.05至约1.5%或约1%至约3%的残余醛。例如,高度氧化的多糖可以包含约2%的残余醛或约3%的残余醛。
多糖的单体单元之间的示例性反应是藻酸盐和二醇特异性氧化剂高碘酸钠之间的反应,其在方案1中示出:
方案1.
在本发明方法的第二步中进一步还原处理含醛的氧化的多糖包括含醛的氧化的多糖与醛特异性水溶性还原剂的反应。术语“醛特异性水溶性还原剂”是指将醛(例如由于二醇特异性氧化剂的氧化而存在于多糖中的醛)特异性氧化并将其转化为醇的还原剂。在某些实施方式中,醛特异性水溶性试剂是无毒的和/或是绿色试剂。醛特异性水溶性还原剂的非限制性实例包括硼氢化钠(NaBH4);氰基硼氢化钠(NaCNBH3);催化剂如镍(Ni)、铂(P1)或钯(Pd)催化剂存在下的氢气(H2);氨硼烷(H3NBH3);或硼烷复合物,例如双碳酸盐硼烷复合物([(BH3)2CO2]2-·2Na+),硼烷二甲胺复合物[(CH3)2NH·BH3];硼烷叔丁胺复合物[(CH3)3CNH2·BH3];或硼烷-嘧啶复合物。在一个具体实例中,醛特异性水溶性还原剂是氨硼烷。在一个实施方式中,醛特异性水溶性还原剂不是硼氢化钠。
方案2中例示了方案1中所示反应的产物氧化葡萄糖醛酸与水溶性醛特异性还原剂氨硼烷的示例性反应。
方案2.
在本发明的上下文中,术语“残余醛”是指用醛特异性水溶性还原剂如氨硼烷完成对氧化的多糖如氧化的藻酸盐完成还原之后保留在还原的多糖中的醛。存在于多糖中的醛的量,例如用水溶性醛特异性还原剂还原后存在于多糖中的残余醛的量可以通过本领域技术人员已知的任何方法测量。例如,可以通过定量NMR测量存在于多糖中的残余醛的量,其中将藻酸盐(1.5%w/v)醛峰(>5.1ppm)的积分与内标二甲基丙二酸(2.5mg/mL)进行比较,并且可以表示为残余醛的%。
本发明人惊奇地发现,水溶性醛特异性还原剂如氨硼烷对于还原氧化的多糖如藻酸盐聚合物中存在的醛,并将其转化为醇而言是特别有效的。因此,通过与水溶性醛特异性还原剂例如氨硼烷的反应使氧化的多糖进一步还原处理而获得的还原的多糖含有出乎意料的低残余醛水平。在一些实施方式中,还原的多糖含有少于2%的残余醛,例如少于1.5%、少于1%或少于0.5%的残余醛。在其他实施方式中,还原的多糖含有少于3%残余醛,例如少于3%、少于2.5%、少于2%、少于1.5%、少于1%或少于0.5%的残余醛。
希望在用于制备水凝胶的多糖如藻酸盐中具有低水平的醛,因为醛能够对存在于多糖附近的蛋白质和其他分子造成损害,由此增加水凝胶的毒性。另外,使用水溶性醛特异性还原剂是特别有利的,因为这些试剂不产生有毒的副产物并且不需要进一步处理多糖物质。水溶性醛特异还原剂如氨硼烷也是无毒的和/或被认为是“绿色试剂”。
本发明还利用高度氧化的多糖,例如高度氧化的藻酸盐聚合物。这些高度带电的氧化的多糖比氧化的多糖更易溶于水,使得其操作更简单。高度氧化的多糖可以分两步制备。如上所述,第一步包括使多糖如藻酸盐聚合物与二醇特异性氧化剂反应以产生含醛的氧化的多糖,例如含醛的氧化的藻酸盐聚合物。第二步包括对含醛的氧化的多糖进一步氧化处理以产生高度氧化的多糖。氧化的多糖的进一步氧化处理包括将存在于氧化的多糖中的醛部分转化为羧酸部分。因此,如本文所用,术语“高度氧化的多糖”包括每单体亚单元包含至少一个,例如两个另外的羧酸部分的多糖。例如,高度氧化的多糖可以包含单体亚单元,其是含有开环羧酸的藻酸盐或具有以下结构的藻氧羧酸盐:
含醛的氧化的多糖如藻酸盐聚合物的进一步氧化处理包括含醛的氧化的多糖与第二氧化剂的反应。如本说明书中使用的术语“第二氧化剂”是指将醛部分特异性转化为羧酸部分,从而产生高度氧化的多糖的任何氧化剂。第二氧化剂的非限制性实例包括亚氯酸钠;溴;稀硝酸(NHO3);氧化银,例如Tollens试剂([Ag(NH3)2]+或AgNO3);铜(II)配合物,例如Fehling试剂(酒石酸铜(II)溶液)或Benedict试剂(柠檬酸铜(II)溶液);高锰酸钾(KMnO4);和过氧化氢(H2O2)。在一个具体实施方式中,第二氧化剂是亚氯酸钠。
多糖的氧化的单体单元的示例性反应是方案1中所示反应的产物,即氧化的藻酸盐与第二氧化剂亚氯酸钠的反应,其示于方案3中。
方案3.
令人惊奇地发现,还原的多糖,例如由氧化的多糖与水溶性醛特异性还原剂(例如氨硼烷)的反应得到的还原的多糖,例如包含藻氧醇的多糖,以及高度氧化的多糖,例如由氧化的多糖与第二氧化剂的反应得到的多糖,例如包含藻氧羧酸盐的多糖,以上二者均特别可用于制备水凝胶。由还原的和高度氧化的多糖例如还原的和高度氧化的藻酸盐聚合物制备的水凝胶是可生物降解的,并且可用作药物递送载体。
在一些实施方式中,还原的和/或高度氧化的多糖例如还原的和/或高度氧化的藻酸盐(例如包含藻氧醇和/或藻氧羧酸盐的藻酸盐)的溶解度高于未改性的藻酸盐的溶解度。多糖如还原的和/或高度氧化的多糖的溶解度可以以%w/v或以mg/mL表示,其中1%w/v相当于10mg/mL的多糖。例如,还原的和/或高度氧化的多糖的溶解度可以为约10-20%w/v,15-30%w/v,20-40%w/v,30-50%w/v,40-65%w/v,50-75%w/v或60-90%w/v。例如,本发明的还原的和/或高度氧化的多糖的溶解度可以为约10%w/v,约15%w/v,约20%,约25%w/v,约30%w/v,约35%w/v,约40%w/v,约45%w/v,约50%w/v,约55%w/v,约60%w/v,约65%w/v,约70%w/v,约75%w/v,约80%w/v或约90%w/v。
在一些实施方式中,本发明的多糖是可生物降解的。例如,氧化的、还原的和高度氧化的藻酸盐是可生物降解的。藻酸盐,例如氧化的、还原的和高度氧化的藻酸盐不易被宿主内源性酶(如可能存在于人体中的内源性酶)降解。藻酸盐,例如氧化的、还原的和高度氧化的藻酸盐可以在暴露于酸性或碱性条件下时发生化学降解,例如水解。酸性条件包含6.5或更低的pH,而碱性条件包含8或更高的pH。
II.缀合至点击试剂的本发明多糖
本发明的还原的和高度氧化的多糖例如藻酸盐可以与点击试剂缀合。在本说明书中与术语“点击化学试剂”可互换使用的术语“点击试剂”是在温和条件下在水溶液中能够快速并选择性地与其对应的点击试剂反应(“点击”)的试剂。温和条件包括中性pH,水溶液和环境温度,连同低反应物浓度。示例性的点击成对试剂对于本领域技术人员而言是公知的,并且包括但不限于具有下示结构的叠氮化物和二苯并环辛炔(DBCO)、四嗪和反式环辛烯以及四嗪和降冰片烯。
在一些实施方式中,点击试剂是四嗪(Tz)。如本文所用,术语“四嗪”和“四嗪部分”包括以下分子,该分子包含被用于连接至聚合物的合适间隔基(例如,烷基胺如甲胺或戊胺)取代,且任选还被一个或多个取代基在任何可用位置取代的1,2,4,5-四嗪。适用于本公开的组合物和方法的示例性四嗪部分包括但不限于以下所示的结构(参见例如Karver等,(2011)Bioconjugate Chem.22:2263-2270和WO2014/065860,其各自的全部内容通过引用并入本文):
四嗪的配对试剂之一是降冰片烯(Nb)。如本文所用,术语“降冰片烯”和“降冰片烯部分”包括但不限于降冰片二烯和降冰片烯基团,所述基团还包含用于连接至多糖的合适间隔基(例如,烷基胺如甲胺或戊胺),且任选还被一个或多个取代基在任何可用位置上取代。这样的部分包括例如降冰片烯-5-甲胺和降冰片二烯甲胺。
点击试剂通常通过羧基部分缀合至多糖如藻酸盐。在图1a所示的一个具体实例中,点击试剂可以通过藻酸盐中存在于葡糖醛酸中的羧酸酯部分与藻酸盐聚合物缀合。因此,在未处理的藻酸盐中,每个葡萄糖醛酸酯可以缀合一个点击分子。用高碘酸钠氧化藻酸盐后,每个葡萄糖醛酸酯产生两个醛。每个醛部分可以通过亚胺键与点击试剂缀合(图1b)。点击试剂与氧化的藻酸盐的这种缀合是次优的,因为在缀合后残留在藻酸盐中的残余醛可能对货物造成毒性和损害,并造成点击试剂的降解(也参见实施例1和3)。此外,醛和点击试剂之间的亚胺键易于水解,导致点击试剂从藻酸盐损失。如图1c中所示,存在于氧化的藻酸盐中的醛的进一步氧化将这些醛转化为羧酸,从而为点击缀合提供了两个另外的位点。
已经令人惊讶地发现,某些高度氧化的多糖如高度氧化的藻酸盐聚合物相比于氧化的多糖是用于点击试剂缀合的更好的底物,因为它们含有可用于点击缀合的额外位点。还发现还原的多糖如还原的藻酸盐相比于氧化的多糖更好地适合于点击试剂缀合,因为它们含有较少量的可与点击试剂反应而造成其降解的醛。
在一些实施方式中,与本发明的多糖例如藻酸盐缀合的点击试剂也可以与其配对的点击试剂反应,所述配对的点击试剂进而又与一个部分连接,从而使该部分与多糖缀合。使用点击试剂可将任何部分缀合至本发明的多糖。这样的部分的非限制性实例包括小有机分子,小无机分子;糖精;单糖;二糖;三糖;寡糖;多糖;肽;蛋白质,肽类似物,肽衍生物;拟肽;抗体(多克隆或单克隆);抗体的抗原结合片段;核酸,例如寡核苷酸,反义寡核苷酸,siRNA,shRNA,核酶,适体,microRNA,前microRNA,iRNA,质粒DNA(例如缩合质粒DNA),改性RNA和核酸类似物或衍生物。在一些实施方式中,该部分是治疗剂。
在其他实施方式中,缀合至本发明的多糖如藻酸盐的点击试剂可以用作交联剂,如下面详细描述的。
在某些实施方式中,本发明的多糖如藻酸盐可以缀合至两种或更多种属于不同点击对的点击试剂。例如,在其中本发明的多糖缀合至属于两种不同点击对的两种点击试剂的实施方式中,缀合至多糖的第一点击试剂可以是来自叠氮化物-二苯并环辛炔(叠氮化物-DBCO)点击对的叠氮化物,并且缀合至多糖的第二点击试剂可以是来自四嗪-降冰片烯点击对的四嗪。在这样的多糖中,两种点击试剂可以用于不同的功能。例如,如上所述,第一点击试剂可用于促进多糖的交联以形成水凝胶,并且第二交联剂可用于将一个部分缀合至多糖。在一个具体实施方式中,当本发明的多糖与两种或更多种点击试剂缀合时,与多糖缀合的点击试剂不交叉反应,即不彼此反应,而是仅与它们的点击对反应。
III.缀合至交联剂的本发明多糖
本发明的还原的和高度氧化的多糖可以与交联剂缀合。交联剂可以离子地、共价地或物理地连接至氧化的多糖。在一个实施方式中,交联剂共价或非共价连接至本发明的还原的多糖,例如还原的藻酸盐聚合物。在另一个实施方式中,交联剂共价或非共价连接至本发明的高度氧化的多糖,例如高度氧化的藻酸盐聚合物。
如在本说明书中使用的术语“交联剂”是可影响和促进多糖交联至特定位置(如受试者细胞或组织内的位置),或可以促进多糖例如藻酸盐聚合物的交联的任何试剂。在某些实施方式中,交联剂例如通过共价键与多糖连接。在某些实施方式中,交联剂仅与一个聚合物链偶联并用作侧基。
在一些实施方式中,交联剂是点击试剂。可用于交联本发明多糖的示例性的点击试剂对包括但不限于具有如上所示结构的叠氮化物和二苯并环辛炔(DBCO),四嗪和反式环辛烯以及四嗪和降冰片烯。
用点击试剂修饰的本发明的还原的和/或高度氧化的多糖,例如缀合至点击试剂的藻酸盐,可以共价交联以形成点击交联的水凝胶,例如点击藻酸盐水凝胶。通过点击化学形成水凝胶描述于Desai等(2015)Biomaterials 50:30-37中,其全部内容在此通过引用并入本文。交联反应之前已被其他人表明为具有高度特异性、生物正交性和快速性(参见例如Devaraj等(2008),Bioconjugate Chem.19(12):2297-2299;Karver(2011)BioconjugateChem.22(11):2263-2270;和Alge等(2013)Biomacromol.14(4):949-953),允许并入具有高包封后生存力的细胞。
例如,为了从本发明的点击物缀合的多糖例如包含藻氧醇和/或藻氧羧酸盐的点击物缀合的藻酸盐生成水凝胶,与点击对的一个成员如Nb缀合的多糖可以与缀合至点击对的第二成员如Tz的多糖混合,并在温和条件下孵育以产生水凝胶。这样的水凝胶的性质,例如水凝胶的硬度、凝胶化时间或水凝胶的平均孔径可以通过改变多种参数来调节,所述参数包括多糖的点击缀合度;多糖氧化度,即存在于多糖中的%残余醛;和在水凝胶形成过程中点击物缀合的多糖的浓度,例如即将形成水凝胶之前存在于溶液中的藻酸盐物质的%w/v。
可与术语“取代度”或“DS”互换使用的术语“点击缀合度”是指多糖的每个单体单元的点击试剂的平均数目,例如藻酸盐中每个单体单元的点击试剂的平均数目。点击取代度可以通过改变点击缀合反应中点击试剂对藻酸盐单体摩尔数的摩尔当量数而变化。例如,点击缀合反应可包含约1至约5000摩尔当量的点击试剂,例如约1、约5、约10、约20、约50、约100、约150、约200、约250、约300、约350、约400、约450、约500、约550、约600、约650、约700、约750、约800、约850、约900、约950、约1000、约1200、约1500、约1800、约2000、约2200、约2500、约2800、约3000、约3200、约3500、约4000、约4200、约4500或约5000摩尔当量的点击试剂。所列举值的中间范围也旨在是本发明的一部分。例如,点击缀合反应可以包含约1至约50、约10至约100、约150至约250、约200至约500、约400至约800、约700至约1000、约1200至约1600、约1500至约2000、约1800至约3500、或约3200至约5000摩尔当量的点击试剂。
在一些实施方式中,与点击试剂缀合的本发明多糖包含约0.01%至约100%,例如约0.01%至约0.5%、约0.1%至约5%、约1%至约10%、约5%至约15%、约10%至约20%、约15%至约25%、约20%至约35%、约30%至约40%、约35%至约50%、约40%至约60%、约50%至约75%、约70%至约90%或约85%至约100%的点击取代度。例如,与点击试剂缀合的本发明多糖可以为约0.01%,约0.05%,约0.1%,约0.5%,约1%,约5%,约10%,约15%,约20%,约25%,约30%,约35%,约40%,约45%,约50%,约55%,约60%,约65%,约70%,约75%,约80%,约85%,约90%,约95%或约100%。
在一些实施方式中,水凝胶形成过程中点击缀合的多糖的浓度,例如即将形成水凝胶前存在于溶液中的藻酸盐物质的浓度可为约0.01%至约50%w/v,例如约0.01%至约10%w/v,约0.1%至约5%w/v,约1%至约15%w/v,约10%至约30%w/v,约12%至约35%w/v,约15%至约25%w/v,约20%至约45%w/v或约35%至约50%w/v。例如,即将形成水凝胶之前存在于溶液中的藻酸盐物质的浓度可以为约0.01%,约0.05%,约1%,约0.5%,约1%,约2%,约3%,约4%,约5%,约10%,约15%,约20%,约25%,约30%,约35%,约40%,约45%或约50%。
水凝胶的刚度可取决于点击取代度,并且可通过测量弹性模量(或储能模量)G'来确定。例如,当在1Hz下在1%应变下测量时,本发明水凝胶的G'可从约0至约40000Pa变化,例如约0至约100Pa,约50至约300Pa,约100至约450Pa,约130至约600Pa,约300至约450Pa,约500至约900Pa,约600至约1500Pa,约1200至约2000Pa或约1900至约40000Pa。例如,当在1Hz下在1%应变下测量时,本发明水凝胶的G′可为约100Pa,约200Pa,约500Pa,约1000Pa,约1500Pa,约2000Pa,约2200Pa,约2500Pa或约3000Pa。
在一些实施方式中,交联剂是肽,例如细胞粘附肽。因此,本发明的还原的和/或高度氧化的多糖,例如还原的和/或高度氧化的藻酸盐聚合物,可以通过细胞粘附肽如细胞外细胞基质(ECM)组分进行修饰。细胞粘附肽可以包含例如氨基酸序列精氨酸-甘氨酸-天冬氨酸(RGD)。实例包括氨基酸序列精氨酸-甘氨酸-天冬氨酸-半胱氨酸(RGDC)(SEQ ID NO:1)和精氨酸-甘氨酸-天冬氨酸-丝氨酸(RGDS)(SEQ ID NO:2)。在其他实例中,细胞粘附肽包含赖氨酸-谷氨酰胺-丙氨酸-甘氨酸-天冬氨酸-缬氨酸(KQAGDV)(SEQ ID NO:3)或缬氨酸-丙氨酸-脯氨酸-甘氨酸(VAPG)(SEQ ID NO:4)的氨基酸序列。在一些实例中,细胞粘附肽是CGGGGRGDSP(SEQ ID NO:5)。其他细胞粘附肽可以基于期望的应用而使用,并且对于本领域技术人员而言将是显而易见的。
在一些情况下,细胞粘附肽通过巯基-烯反应,例如通过巯基-烯光化学共价连接至还原的和/或高度氧化的多糖。例如,在多糖交联以形成水凝胶之前或之后,细胞粘附肽可以与多糖(例如藻酸盐聚合物)共价连接。巯基-烯反应将细胞粘附肽共价连接至多糖的这种用途比先前公开的方法(如使用羧基活化剂(例如EDC)以将肽偶联至聚合物的方法)显著更快和更有效。
IV.本发明的水凝胶
本文所述的还原的和/或高度氧化的多糖可用于制备用于治疗应用的水凝胶。与由氧化的多糖例如氧化的藻酸盐制备的水凝胶相比,由还原的和/或高度氧化的多糖例如还原的和/或高度氧化的藻酸盐制备的水凝胶是可生物降解的且无毒的。在一些实施方式中,当使用本发明的还原的和/或高度氧化的多糖制备的水凝胶包封细胞时,与由氧化的多糖制备的水凝胶相比,观察到更少的细胞毒性。在其中由本发明的还原的和/或高度氧化的多糖产生的水凝胶用于包封治疗剂例如蛋白质的其他实施方式中,与由氧化的多糖制备的水凝胶相比,观察到更少的蛋白质损伤。在其中由本发明的还原的和/或高度氧化的多糖产生的水凝胶用于包封基于脂质的纳米颗粒例如脂质体或病毒体的实施方式中,基于脂质的纳米颗粒完整地递送至宿主内的期望位置。
本发明的水凝胶可用于制备包含由本发明的水凝胶包封的治疗剂或诊断剂的剂型。本发明的水凝胶还可用于制备可包含治疗剂或诊断剂的可植入装置。本发明的水凝胶还可用于制备药物递送组合物,所述药物递送组合物包含包封治疗剂或诊断剂的基于脂质的纳米颗粒例如脂质体或病毒体,以及包封该基于脂质的纳米颗粒的本发明的水凝胶。
目前发现,本发明的还原的和/或高度氧化的多糖可用于制备其中作为平均孔径测量的平均目径在相对宽的范围内变化的水凝胶。例如,使用本发明的还原的和/或高度氧化的多糖制备的水凝胶所具有的孔的平均直径范围可为约0.5nm至约500nm,例如约0.5nm至约1nm,约0.5nm至约5nm,约1nm至约20nm,约10nm至约50nm,约25nm至约80nm,约50nm至约100nm,约70nm至约150nm,约100nm至约250nm,约200nm至约350nm,约250nm至约400nm或约350nm至约500nm。在一些实施方式中,本发明的水凝胶所具有的孔的平均直径可为约0.5nm,约1nm,约5nm,约10nm,约15nm,约20nm,约25nm,约30nm,约35nm,约40nm,约45nm,约50nm,约55nm,约60nm,约65nm,约70nm,约75nm,约80nm,约85nm,约90nm,约95nm,约100nm,约150nm,约200nm,约250nm,约300nm,约350nm,约400nm,约450nm或约500nm。所列举值的中间范围也旨在为本发明的一部分。
在一个实例中,本发明的水凝胶具有出乎意料的小平均孔径,例如约10nm或更小的平均直径。在一些实施方式中,本发明的水凝胶中孔的直径为约10.00nm或更小,约9.5nm或更小,约9.0nm或更小,约8.5nm或更小,约8.0nm或更小,约7.5nm或更小,约7.0nm或更小,约6.5nm或更小,约6.0nm或更小,约5.5nm或更小,约5.0nm或更小,约4.5nm或更小,约4.0nm或更小,约3.5nm或更小,约3.0nm或更小,约2.5nm或更小,约2.0nm或更小,约1.5nm或更小或者约1nm或更小。例如,本发明的水凝胶可以包含平均直径为约10nm至约1nm、约10nm至约4nm、约7nm至约3nm、约5nm至约1nm、约4nm至约2nm、或约3nm至约0.5nm的孔。所列举值的中间范围也旨在为本发明的一部分。
因此,本发明的水凝胶可用于包封治疗剂或诊断剂,或者包封包含小分子量的治疗剂或诊断剂的基于脂质的纳米颗粒如脂质体或病毒体。例如,本发明的水凝胶可以用于包封治疗剂或诊断剂或基于脂质的纳米颗粒如脂质体或病毒体,所述基于脂质的纳米颗粒包封治疗剂或诊断剂如多肽,所述多肽的分子量为1000kDa或者更小,例如950kDa或更小,900kDa或更小,850kDa或更小,800kDa或更小,750kDa或更小,700kDa或更小,650kDa或更小,600kDa或更小,550kDa或更小,500kDa或更小,450kDa或更小,400kDa或更小,350kDa或更小,300kDa或更小,250kDa或更小,200kDa或更小,150kDa或更小,100kDa或更小,90kDa或更小,80kDa或更小,70kDa或更小,60kDa或更小,50kDa或更小,40kDa或更小,30kDa或更小,20kDa或更小,10kDa或更小,8kDa或更小,6kDa或更小,4kDa或更小,2kDa或更小,1kDa或更小,0.8kDa或更小,0.6kDa或更小,0.4kDa或更小,0.2kDa或更小,或者0.1kDa或更小。
在一些实施方式中,可由本发明的水凝胶包封的,或由本发明的水凝胶包封的基于脂质的纳米颗粒如脂质体或病毒体包封的治疗剂或诊断剂不会扩散通过水凝胶的孔,因为水凝胶的孔与治疗剂的尺寸相比足够小。因此,当受试者体内的水凝胶生物降解时,逐渐发生自水凝胶中释放治疗剂。这提供了治疗剂或诊断剂,或者包封治疗剂或诊断剂的基于脂质的纳米颗粒如脂质体或病毒体在受试者如人中的持续释放。
如本文所用,由本发明的水凝胶包封的术语“治疗剂或诊断剂”包括可用于治疗、预防或诊断有需要的受试者中的病症的任何药剂。治疗剂或诊断剂可以是细胞,例如哺乳动物细胞如人间充质干细胞(hMSC)、小分子或生物制剂。生物制剂可以是肽、蛋白质、DNA分子、RNA分子、PNA分子、抗体或疫苗。示例性的治疗剂包括但不限于在以下中出现的治疗剂:哈里森内科学原理(Harrison’s Principles of Internal Medicine),第13版,T.R.Harrison等编,McGraw-Hill N.Y.,NY;医师参考手册(Physicians'Desk Reference),第50版,1997,Oradell New Jersey,Medical Economics Co.;治疗的药理学基础(Pharmacological Basis of Therapeutics),第8版,Goodman和Gilman,1990;美国药典(United States Pharmacopeia),国家处方集(The National Formulary),USP XII NFXVII,1990;Goodman和Oilman的治疗学的药理学基础的最新版;和默克索引(Merck Index)的最新版,所有这些的全部内容通过引用并入本文。
在一些实施方式中,由本发明的水凝胶包封的,或由本发明的水凝胶包封的基于脂质的纳米颗粒例如脂质体或病毒体包封的治疗剂或诊断剂可包含选自以下的化合物:小有机分子、小无机分子;糖精;单糖;二糖;三糖;寡糖;多糖;肽;蛋白质;肽类似物;肽衍生物;拟肽;抗体(多克隆或单克隆);抗体的抗原结合片段;核酸,例如寡核苷酸、反义寡核苷酸、siRNA、shRNA、核酶、适体、microRNA、前microRNA、iRNA、质粒DNA(例如缩合质粒DNA)、改性RNA、核酸类似物或衍生物;由生物材料如细菌、植物、真菌或动物细胞制成的提取物;动物组织;天然存在或合成的组合物;及其任何组合。核酸可以包含一种或多种非天然核苷酸。肽或蛋白质可以包含一种或多种非天然氨基酸。
如本文所用,术语“小分子”可以指“天然产物样”的化合物,然而,术语“小分子”不限于“天然产物样”化合物。而是,小分子的典型特征在于其含有若干碳-碳键,并且具有小于5000道尔顿(5kD)、优选小于3kD、还更优选小于2kD、最优选小于1kD的分子量。在一些情况下,优选小分子具有等于或小于700道尔顿的分子量。
如本文所用,术语“肽”以其最广泛的含义用来指含有氨基酸、氨基酸等价物或其他非氨基,同时仍保持所需的肽功能活性的化合物。通过用相关的有机酸(例如PABA)、氨基酸等取代一个或多个氨基酸,或者取代或修饰侧链或官能团,肽等价物可以与常规肽不同。肽可以是线性或环状的。肽可经修饰以包括以下中的一种或多种:D-氨基酸、β-氨基酸、化学改性的氨基酸、天然存在的非成蛋白性氨基酸、稀有氨基酸,和具有本领域已知为氨基酸特性的性质的化学合成化合物。
如本文所用,术语“核酸”或“寡核苷酸”意指共价连接在一起的至少两个核苷酸,包括其类似物或衍生物。示例性的寡核苷酸包括但不限于单链和双链siRNA和其他RNA干扰试剂(RNAi试剂或iRNA试剂)、shRNA(短发夹RNA)、反义寡核苷酸、适体、核酶和microRNA(miRNA)。核酸可以是单链或双链的。核酸可以是DNA、RNA或杂交体,其中核酸含有脱氧核糖核苷酸和核糖核苷酸的任何组合,以及尿嘧啶、腺嘌呤、胸腺嘧啶、胞嘧啶和鸟嘌呤的任何组合。RNA分子可以选自mRNA、RNAi、siRNA、shRNA、microRNA、isRNA、lncRNA和反义RNA。
核酸还可以包含一种或多种非天然核苷酸。例如,核酸可以包含本领域已知的一种或多种核酸修饰。例如,核酸可包含一种或多种骨架修饰,例如磷酰胺(Beaucage等,Tetrahedron 49(10):1925(1993)及其中的参考文献;Letsinger,J.Org.Chem.35:3800(1970))、硫代磷酸酯、二硫代磷酸酯、O-甲基亚磷酰胺键(参见Eckstein,Oligonucleotides and Analogues:A Practical Approach,牛津大学出版社)或肽核酸键(参见Egholm,J.Am.Chem.Soc.114:1895(1992));Meier等,Chem.Int.Ed.Engl.31:1008(1992);和Nielsen,Nature,365:566(1993),所有这些的全部内容通过引用并入本文。核酸还可以包括对核苷酸的核碱基和/或糖部分的修饰。在糖部分的示例性糖修饰包括用卤素(例如氟)、O-甲基,O-甲氧基乙基、NH2、SH和S-甲基取代2’-OH。
在一些实施方式中,术语“治疗剂或诊断剂”包含生物材料,例如细胞外基质材料如纤连蛋白,玻连蛋白和层粘连蛋白;细胞因子;生长因子;分化因子,核酸;蛋白质;肽;抗体或其片段或其抗原结合部分,或细胞。
可并入本发明水凝胶中的合适的生长因子和细胞因子包括但不限于干细胞因子(SCF)、粒细胞集落刺激因子(G-CSF)、粒细胞巨噬细胞刺激因子(GM-CSF)、基质细胞衍生因子-1、青灰因子、VEGF、TGFβ、血小板衍生生长因子(PDGF)、血管生成素(Ang)、表皮生长因子(EGF)、bFGF、HNF、NGF、骨形态发生蛋白(BMP)、成纤维细胞生长因子(FGF)、肝细胞生长因子、胰岛素样生长因子(IGF-1)、白介素(IL)-3、IL-1α、IL-1β、IL-6、IL-7、IL-8、IL-11和IL-13、集落刺激因子、血小板生成素,促红细胞生成素、fit3-配体和肿瘤坏死因子α(TNFα)。其他实例描述于以下中:Dijke等,“Growth Factors for Wound Healing”,Bio/Technology,7:793-798(1989);Mulder GD,Haberer PA,Jeter KF编,Clinicians'Pocket Guide toChronic Wound Repair,第4版,Springhouse,PA:Springhouse公司;1998:85;ZieglerT.R.,Pierce,G.F.和Herndon,D.N.,1997,International Symposium on Growth Factorsand Wound Healing:Basic Science&Potential Clinical Applications(Boston,1995,Serono Symposia USA),出版商:Springer Verlag。
可并入本发明的水凝胶中或并入由本发明的水凝胶包封的基于脂质的纳米颗粒如脂质体或病毒体中的治疗剂或诊断剂的实例包括但不限于麻醉性镇痛药;金盐;糖皮质激素;激素;抗疟药物;吲哚衍生物;用于关节炎治疗的药物;抗生素,包括四环素、青霉素、链霉素和金霉素;抗蠕虫药和犬瘟热药,应用于家畜和大型牛,例如吩噻嗪;基于硫的药物,例如亚硫唑;抗肿瘤药物;监督成瘾的药物,如控制酒精成瘾的药物和控制烟草成瘾的药物;药物成瘾的拮抗剂,如美沙酮;体重控制药物;甲状腺控制药物;止痛药;控制受精的药物或避孕激素;安非他明;抗高血压药物;抗炎剂;镇咳药;镇静药;神经肌肉松弛剂;抗癫痫药物;抗抑郁药;抗心律失常药物;血管舒张药物;抗高血压利尿剂;抗糖尿病药物;抗凝血剂;抗结核药物;抗精神病药物;激素和肽。应当理解的是,以上清单并不完整,并且简单地表示可能包含在组合物中的治疗剂的广泛多样化。在一些实施方式中,治疗剂是米托蒽醌、肽、多克隆抗体、单克隆抗体、抗体的抗原结合片段、蛋白质(例如VEGF)或质粒DNA。
本领域普通技术人员将认识到可并入本发明的水凝胶中或者并入由本发明的水凝胶包封的基于脂质的纳米颗粒如脂质体或病毒体中的许多其他治疗剂或诊断剂。实例包括放射增敏剂、类固醇、黄嘌呤、β-2-激动剂支气管扩张剂、抗炎剂、镇痛剂、钙拮抗剂、血管紧张素转换酶抑制剂、β-阻断剂、中枢活性α-激动剂、α-1-拮抗剂、抗胆碱能/抗痉挛剂、加压素类似物、抗心律不齐药、抗帕金森病药、抗心绞痛/抗高血压药、抗凝血剂、抗血小板药、镇静剂、溶菌剂、肽药剂、生物聚合物剂、抗肿瘤剂、轻泻剂、止泻剂、抗微生物剂、抗真菌剂、疫苗、蛋白质或核酸。在另一个方面中,药物活性剂可以是香豆素、白蛋白、类固醇如倍他米松、地塞米松、甲基泼尼松龙、泼尼松龙、泼尼松、曲安西龙、布地奈德、氢化可的松和药学上可接受的氢化可的松衍生物;黄嘌呤如茶碱和多索茶碱;β-2-激动剂支气管扩张药,例如沙丁胺醇、酚丙喘宁(fenterol)、克仑特罗、班布特罗、沙美特罗、非诺特罗;抗炎剂,包括抗哮喘抗炎剂、抗关节炎抗炎剂和非甾体抗炎剂,其实例包括但不限于硫化物、美沙拉嗪、布地奈德、沙雷佐平、双氯芬酸、药学上可接受的双氯芬酸盐、尼美舒利、萘普生、对乙酰氨基酚、布洛芬、酮洛芬和吡罗昔康;止痛剂如水杨酸盐;钙通道阻滞剂如硝苯地平、氨氯地平和尼卡地平;血管紧张素转换酶抑制剂如卡托普利、盐酸贝那普利、福辛普利钠、群多普利、雷米普利、赖诺普利、依那普利、盐酸喹那普利和盐酸莫昔普利;β-阻断剂(即β-肾上腺素能阻断剂)如盐酸索他洛尔、马来酸噻吗洛尔、盐酸艾司洛尔、卡替洛尔、盐酸普萘洛尔、盐酸倍他洛尔、硫酸喷托洛尔、酒石酸美托洛尔、琥珀酸美托洛尔、盐酸醋丁洛尔、阿替洛尔、吲哚洛尔和富马酸比索洛尔;中枢活性的α-2-激动剂如可乐定;α-1-拮抗剂如多沙唑嗪和哌唑嗪;抗胆碱能/抗痉挛剂如盐酸双环胺、氢溴酸东莨菪碱、格隆溴铵、克利溴铵、黄酮哌酯和奥昔布宁;加压素类似物如加压素和去氨加压素;抗心律失常药,例如奎尼丁、利多卡因、盐酸托克奈德、盐酸美西律、地高辛、盐酸维拉帕米、盐酸普罗帕酮、乙酸氟卡尼、盐酸普鲁卡因酰胺、盐酸莫雷西嗪和磷酸丙吡胺;抗帕金森病药,例如多巴胺、L-多巴/卡比多巴、司来吉兰、二氢麦角隐亭、培高利特、麦角乙脲、阿扑吗啡和溴隐亭;抗心绞痛药和抗高血压药,例如单硝酸异山梨酯、硝酸异山梨酯、普萘洛尔、阿替洛尔和维拉帕米;抗凝血剂和抗血小板药如香豆素、华法林、乙酰水杨酸和噻氯匹定;镇静剂如苯并二氮卓和巴比妥类;解痉剂,如劳拉西泮、溴西泮和地西泮;肽和生物聚合物剂如降钙素、亮丙瑞林和其他LHRH激动剂、水蛭素、环孢菌素、胰岛素、生长抑素、普罗瑞林、干扰素、去氨加压素、生长激素、胸腺五肽、匹多莫德、促红细胞生成素、白细胞介素、褪黑激素、粒细胞/巨噬细胞-CSF和肝素;抗肿瘤药物,例如依托泊苷、磷酸依托泊苷、环磷酰胺、甲氨喋呤、5-氟尿嘧啶、长春新碱、阿霉素、顺铂、羟基脲、亚叶酸钙、他莫昔芬、氟他胺、天冬酰胺酶、六联胺、米托坦和盐酸丙卡巴肼;轻泻剂如番泻叶浓缩液、菊蒿醇、比沙可啶和吡硫酸钠;止泻剂,如盐酸菲诺烯(difenoxinehydrochloride),盐酸洛哌丁胺、呋喃唑酮、盐酸苯乙哌啶和微生物;疫苗如细菌和病毒疫苗;抗菌剂如青霉素、头孢菌素和大环内酯,抗真菌剂如咪唑和三唑衍生物;和核酸如编码生物蛋白质的DNA序列和反义寡核苷酸。
抗癌剂包括烷化剂、铂剂、抗代谢剂、拓扑异构酶抑制剂、抗肿瘤抗生素、抗有丝分裂剂、芳香酶抑制剂、胸苷酸合酶抑制剂、DNA拮抗剂、法尼基转移酶抑制剂、泵抑制剂、组蛋白乙酰转移酶抑制剂、金属蛋白酶抑制剂、核糖核苷还原酶抑制剂、TNFα激动剂/拮抗剂、内皮素A受体拮抗剂、视黄酸受体激动剂、免疫调节剂、激素和抗激素剂、光动力剂和酪氨酸激酶抑制剂。
抗生素包括氨基糖苷类(例如庆大霉素、妥布霉素、奈替米星、链霉素、阿米卡星、新霉素)、杆菌肽、碳青霉烯类(例如亚胺培南/西司他丁)、头孢菌素、粘菌素、乌洛托品、单环胺(例如氨曲南)、青霉素(例如,青霉素G、青霉素V、甲氧西林、纳他西林、苯唑西林、氯唑西林、双氯西林、氨苄西林、阿莫西林、羧苄青霉素、替卡西林、哌拉西林、美洛西林、阿洛西林)、多粘菌素B、喹诺酮类和万古霉素;和抑菌剂例如氯霉素、克林霉素、大环内酯类(例如红霉素,阿奇霉素,克拉霉素)、林可霉素、呋喃妥因、磺胺类、四环素类(例如四环素、多西环素、米诺环素、去甲环素)和甲氧苄啶。还包括甲硝哒唑、氟喹诺酮类和利托菌素。
酶抑制剂是抑制酶促反应的物质。酶抑制剂的实例包括:氯化埃坡平、N-甲基膦氯吡啶、溴化新斯的明、毒扁豆碱硫酸盐、他克林、他克林、1-羟基马来酸盐、碘抗结核菌素、对溴四甲基茴香醚、盐酸10-(α-二乙氨基丙酰)-吩噻嗪、氯化卡米达佐、密胆碱-3,3,5-二硝基邻苯二酚、二酰基甘油激酶抑制剂I、二酰基甘油激酶抑制剂II、3-苯基炔丙基胺、N°-单甲基-醋酸L精氨酸、卡比多巴、3-羟基苄基肼、肼苯哒嗪、氯吉兰、司来吉兰、羟胺、异烟酰磷酸酯、6-MeO-四氢-9H-吡啶并吲哚、尼亚拉胺、帕吉林、奎纳克林、氨基脲、反苯环丙胺、N,N-二乙基氨基乙基-2,2-二苯基戊酸酯盐酸盐、3-异丁基-1-甲基蒽、罂粟碱、吲哚美辛、2-环辛基-2-羟基乙胺盐酸盐、2,3-二氯-α-甲基苄胺(DCMB)、8,9-二氯-2,3,4,5-四氢-1H-2-苯并氮杂盐酸盐、对氨基丁二酰亚胺、对氨基苯乙哌啶酮酒石酸盐、3-碘酪氨酸、α-甲基酪氨酸、乙酰唑胺、二氯苯酰胺、6-羟基-2-苯并噻唑磺酰胺和别嘌呤醇。
抗组胺剂包括吡拉明、氯苯那敏和四氢唑啉等。
抗炎剂包括皮质类固醇、非类固醇抗炎药(例如阿司匹林、保泰松、吲哚美辛、舒林酸、托美丁、布洛芬、吡罗昔康和芬那酸酯)、对乙酰氨基酚、非那西丁、金盐、氯喹、D-青霉胺、甲氨蝶呤、秋水仙碱、别嘌呤醇、丙磺舒和磺吡酮。
肌肉松弛剂包括美芬新、美索巴莫、盐酸环苯扎林、盐酸三己基苯基醚、左旋多巴/卡比多巴和比哌立登。
抗痉挛药物包括阿托品、东莨菪碱、奥昔芬和罂粟碱。
镇痛药包括阿司匹林、苯基保泰松、艾杜美辛、苏灵大、托麦汀、布洛芬、吡罗昔康、芬那酸酯、对乙酰氨基酚、非那西丁、硫酸吗啡、硫酸可待因、哌替啶、纳洛芬、阿片样物质(例如硫酸可待因、柠檬酸芬太尼、二酒石酸氢可酮、洛派丁胺、硫酸吗啡、那可丁、去甲可待因、去甲吗啡、二甲基吗啡、nor-binaltorphimine,丁丙诺啡、chlomaltrexamine、富纳曲胺(funaltrexamione)、纳布啡、纳洛芬、纳洛酮、纳洛肼、纳曲酮和纳曲吲哚)、普鲁卡因、利多卡因、丁卡因和二丁卡因。
眼药包括荧光素钠、玫瑰红、乙酰甲胆碱、肾上腺素、可卡因、阿托品、α-胰凝乳蛋白酶、透明质酸酶、贝沙洛尔、毛果芸香碱、噻吗洛尔、噻吗洛尔盐及其组合。
前列腺素是本领域公认的,并且是具有多种生物学效应的一类天然存在的化学相关的长链羟基脂肪酸。
抗抑郁药是能够预防或缓解抑郁症的物质。抗抑郁药的实例包括丙咪嗪、阿米替林、去甲替林、普罗替林、地昔帕明、阿莫沙平、多塞平、马普替林、反苯环丙胺、苯乙肼和异卡波肼。
营养因子是持续存在改善细胞活力或寿命的因子。营养因子包括但不限于血小板衍生生长因子(PDGP)、嗜中性粒细胞活化蛋白、单核细胞趋化蛋白、巨噬细胞炎症蛋白、血小板因子、血小板碱性蛋白和黑素瘤生长刺激活性;表皮生长因子、转化生长因子(α)、成纤维细胞生长因子、血小板衍生内皮细胞生长因子、胰岛素样生长因子、神经胶质衍生生长神经营养因子、睫状神经营养因子、神经生长因子、骨生长/软骨诱导因子(α和β)、骨形态发生蛋白、白细胞介素(例如白细胞介素抑制剂或白细胞介素受体,包括白介素1至白介素10)、干扰素(例如干扰素α、β和γ)、造血因子,包括促红细胞生成素、粒细胞集落刺激因子、巨噬细胞集落刺激因子和粒细胞巨噬细胞集落刺激因子;肿瘤坏死因子和转化生长因子(β),包括β-1、β-2、β-3,抑制素和激活素。
激素包括雌激素(例如雌二醇、雌酮、雌三醇、乙烯雌酚、炔雌醇、氯三氮烯、炔雌醇、美雌醇)、抗雌激素(例如克罗米酚、他莫昔芬)、孕激素(例如甲羟孕酮、炔诺酮、羟孕酮、炔诺孕酮)、抗孕激素(米非司酮)、雄激素(例如,环戊丙酸睾酮、氟甲睾酮、达那唑、睾内酯)、抗雄激素(例如醋酸环丙孕酮、氟他胺)、甲状腺激素(例如三碘甲状腺素、甲状腺素、丙基硫氧嘧啶、甲巯咪唑和碘代甲代)和垂体激素(例如促肾上腺皮质激素、生长激素、催产素和加压素)。激素通常用于激素替代疗法和/或用于控制生育的目的。类固醇激素,如泼尼松,也用作免疫抑制剂和抗炎剂。
治疗剂或诊断剂可以是成骨蛋白。因此,在一些实施方式中,治疗剂或诊断剂选自称为转化生长因子β(TGF-β)蛋白质超家族的蛋白质家族,其包括活化素、抑制素和骨形态发生蛋白质(BMP)。最优选地,活性剂包括选自通常称为BMP的蛋白质亚类的至少一种蛋白质,该蛋白质亚类已被公开具有成骨活性以及其他生长和分化类型的活性。这些BMP包括BMP蛋白BMP-2、BMP-3、BMP-4、BMP5、BMP-6和BMP-7,例如公开于美国专利号5,108,922;5,013,649;5,116,738;5,106,748;5,187,076和5,141,905中;BMP-8,公开于PCT公开WO91/18098中;和BMP-9,公开于PCT公开WO93/00432中;BMP-10,公开于PCT申请WO94/26893中;BMP-11,公开于PCT申请WO94/26892中,或BMP-12或BMP-13,公开于PCT申请WO95/16035中;BMP-14;BMP-15,公开于美国专利号5,635,372中;或BMP-16,公开于美国专利号5,965,403中。可以使用的其他TGF-β蛋白包括Vgr-2,Jones等,Mol.Endocrinol.611961(1992),和任何生长和分化因子(GDF),包括在PCT申请WO94/15965;WO94/15949;WO95/01801;WO95/01802;WO94/21681;WO94/15966;WO95/10539;WO96/01845;WO96/02559等中描述的那些。在本发明中也可以使用在WO94/01557中公开的BIP;在JP公开号:7-250688中公开的HP00269;和在PCT申请WO93/16099中公开的BMP-14(也称为MP52、CDMP1和GDF5)。所有上述申请的公开内容通过引用并入本文。可以使用的BMP的亚群包括BMP-2、BMP-3、BMP-3b、BMP-4、BMP-5、BMP-6、BMP-7、BMP-8、BMP-9、BMP-10、BMP-11、BMP-12、BMP-13、BMP-14、BMP-15、BMP-16、BMP-17和BMP18。也可以使用本领域已知的其他成骨试剂,例如特立帕肽(FORTEOTM)、前列腺素E2或LIM蛋白等。
治疗剂或诊断剂例如蛋白质或肽可以重组产生,或从蛋白质组合物中纯化。活性剂如果是TGF-β如BMP或其他二聚体蛋白,则可以是同型二聚体,或者可以是与其他BMP的异质二聚体(例如由BMP-2和BMP-6各自的一个单体组成的异质二聚体)或与TGF-β超家族的其他成员如激活素、抑制素和TGF-β1的异质二聚体(例如,由BMP和TGF-β超家族相关成员各自的一个单体组成的异质二聚体)。例如在公开的PCT专利申请WO 93/09229中描述了这样的异质二聚体蛋白质的实例,其内容通过引用并入本文。
治疗剂或诊断剂还可以指其他试剂,例如Hedgehog、Frazzled、Chordin、Noggin、Cerberus和Follistatin蛋白。这些蛋白质家族一般描述于Sasai等,(1994)Cell 791779-790(Chordin);PCT专利公开WO94/05800(Noggin);和Fukui等,Devel.Biol.159:1-31(1993)(Follistatin)中。Hedgehog蛋白描述于WO96/16668;WO96/17924;和WO95/18856中。Frazzled蛋白质家族是最近发现的蛋白质家族,其与被称为Frizzled的受体蛋白质家族的胞外结合域高度同源。基因和蛋白质的Frizzled家族描述于Wang等,Biol.Chem.271:44684476(1996)中。活性剂还可以包括其他可溶性受体,例如PCT专利公开WO95/07982中公开的截短的可溶性受体。由WO95/07982的教导,本领域技术人员将认识到,可以针对许多其他受体蛋白质制备截短的可溶性受体。上述公开在此通过引用并入本文。
本发明的水凝胶可以包含细胞。顺适于被本发明的水凝胶包封的细胞包括但不限于干细胞(胚胎干细胞、间充质干细胞、骨髓衍生干细胞和造血干细胞)、软骨细胞祖细胞、胰祖细胞、成肌细胞、成纤维细胞、角质形成细胞、神经元细胞、神经胶质细胞、星形胶质细胞、前脂肪细胞、脂肪细胞、血管内皮细胞、毛囊干细胞、内皮祖细胞、间充质细胞、神经干细胞和平滑肌祖细胞。
在一些实施方式中,细胞是基因修饰的细胞。细胞可以经基因修饰以表达和分泌期望的化合物,例如生物活性剂、生长因子、分化因子、细胞因子等。基因修饰用于表达和分泌感兴趣化合物的细胞的方法在本领域中是已知的,并且易于被本领域技术人员所适用。
也可以使用已再编程为干细胞的分化细胞。例如,通过转导Oct3/4、Sox2、c-Myc和Klf4将人皮肤细胞再编程为胚胎干细胞(Junying Yu等,Science,2007,318:1917-1920和Takahashi K.等,Cell,2007,131:1-12)。
用于并入组合物中的细胞可以来自任何来源,例如哺乳动物。例如,细胞可以来自人、大鼠或小鼠。人细胞包括但不限于人心肌细胞-成人(HCMa)、人皮肤成纤维细胞-胎儿(HDF-f)、人表皮角质形成细胞(HEK)、人间充质干细胞-骨髓、人脐带间充质干细胞、人毛囊内根鞘细胞、人脐静脉内皮细胞(HUVEC)和人脐静脉平滑肌细胞(HUVSMC)、人内皮祖细胞、人成肌细胞、人毛细血管内皮细胞和人神经干细胞。
示例性的大鼠和小鼠细胞包括但不限于RN-h(大鼠神经元-海马)、RN-c(大鼠神经元-皮层)、RA(大鼠星形胶质细胞)、大鼠背根神经节细胞、大鼠神经祖细胞、小鼠胚胎干细胞(mESC)、小鼠神经前体细胞、小鼠胰腺祖细胞、小鼠间充质细胞和小鼠内胚层细胞。
在一些实施方式中,组织培养细胞系可用于本文所述的水凝胶中。细胞系的实例包括但不限于C166细胞(胚胎期第12天小鼠卵黄)、C6胶质瘤细胞系、HL1(心肌细胞系)、AML12(非转化肝细胞)、HeLa细胞(宫颈癌细胞系)和中国仓鼠卵巢细胞(CHO细胞)。
本领域普通技术人员可以定位、分离和扩增这样的细胞。此外,细胞培养的基本原理以及定位、分离和扩增和制备用于组织工程的细胞的方法在“Culture of Cells forTissue Engineering”,编辑:Gordana Vunjak-Novakovic,R.Ian Freshney,2006JohnWiley&Sons,Inc.,和Heath C.A.,Trends in Biotechnology,2000,18:17-19中描述,两者的内容通过引用整体并入本文。
在一个实施方式中,生物制剂可以是肽,例如分子量为250kDa或更小的肽。在另一个实施方式中,所述肽是血管生成因子,例如FGF、VEGF、VEGFR、IGF、NRP-1、Ang1、Ang2、PDGF、PDGFR、TGF-β、内皮糖蛋白、TGF-β受体、MCP-1、整合素,整合素配体(例如RGD肽)、VE-钙粘蛋白、CD31、肝配蛋白、纤溶酶原激活物、纤溶酶原激活物抑制剂-1、eNOS、COX-2、AC133、ID1或ID3。在一个具体实施方式中,由本发明的水凝胶包封的肽是VEGF。
生物制剂如多核苷酸、多肽或其他试剂(例如抗原)是纯化的和/或分离的。具体而言,如本文所用,“分离的”或“纯化的”核酸分子、多核苷酸、多肽或蛋白质当通过重组技术产生时基本上不含其他细胞材料或培养基,或当当化学合成时基本上不含化学前体或其他化学物质。纯化的化合物按重量计为目标化合物的至少60%(干重)。本文中的制剂按重量计也可以是目标化合物的至少75%,更优选至少约90%,最优选至少约99%。例如,纯化的化合物是这样的化合物,其按重量计是所需化合物的至少约90%、约91%、约92%、约93%、约94%、约95%、约98%、约99%或约100%(w/w)。通过任何适当的标准方法,例如通过柱层析、薄层层析或高效液相色谱(HPLC)分析来测量纯度。纯化或分离的多核苷酸(核糖核酸(RNA)或脱氧核糖核酸(DNA))不含在其天然发生状态下位于其侧翼的基因或序列。纯化还限定了对于施用于人受试者而言是安全的无菌程度,例如没有传染性或毒性试剂。
类似地,“基本上纯的”是指核苷酸、多肽或其他化合物已经从天然伴随其的组分中分离出来。典型地,当核苷酸和多肽按重量计至少约60%、约70%、约80%、约90%、约95%、约99%或甚至100%不含与它们天然相关的蛋白质和天然存在的有机分子时,它们是基本上纯的。实例包括合成的化合物、重组化合物(例如,肽、蛋白质、核酸)或纯化的化合物,例如通过包括色谱法的标准程序纯化的化合物。
“分离的核酸”是如下的核酸,其结构与任何天然存在的核酸的结构不同,或与跨越超过三个单独基因的天然存在的基因组核酸的任何片段的结构不同。该术语涵盖,例如:(a)如下的DNA,其是天然存在的基因组DNA分子的一部分,但未被将天然出现的有机体基因组中分子的所述部分侧翼化的两种核酸序列侧翼化;(b)如下的核酸,其并入载体或并入原核生物或真核生物的基因组DNA中,其方式使得所得分子与任何天然存在的载体或基因组DNA不同;(c)单独的分子,例如cDNA、基因组片段、通过聚合酶链式反应(PCR)产生的片段、或限制性片段;和(d)作为杂合基因即编码融合蛋白的基因的一部分的重组核苷酸序列。根据本公开的分离的核酸分子还包括合成产生的分子,以及任何进行化学改造和/或进行骨架修饰的核酸。
可以包封在本发明的水凝胶中,或包封在本发明的水凝胶中包封的脂质体中的治疗剂或诊断剂可以是STING佐剂,CRISPR-Cas9试剂和佐剂负载的源自经破坏癌细胞的亚细胞囊泡。
在一个实施方式中,治疗剂或诊断剂也可以是疫苗。
水凝胶的聚合物(例如藻酸盐聚合物)可以是约1-90%交联的,例如至少约1%、约10%、约20%、约30%、约40%、约50%、约60%或约70%交联的。所列举值的中间范围也旨在为本发明的一部分。例如,水凝胶的聚合物可以是约1%至约10%、约7%至约15%、约12%至约20%、约15%至约30%、约20%至约40%、约30%至约50%、约45%至约65%或者约50%至约90%交联的。
与术语“交联密度”可互换使用的术语“%交联”是指每摩尔彼此反应的藻酸盐单体缀合的点击部分的摩尔数。
聚合物(例如藻酸盐)可以是氧化的(例如高度氧化的)、还原的、或者是其混合物。例如,本发明的水凝胶可以包含多糖聚合物如藻酸盐聚合物的混合物,所述藻酸盐聚合物包含藻氧醇和藻氧羧酸盐。在一些情况下,氧化的聚合物或部分氧化的聚合物是可生物降解的。例如,包含氧化的或部分氧化的藻酸盐的水凝胶是可生物降解的。
治疗剂或诊断剂,或者包封治疗剂或诊断剂的基于脂质的纳米颗粒例如脂质体或病毒体以持续释放的方式,例如以恒定的速率,在给定的小时数例如1、2、3、4、5、6、7、8、9、10、11、12、13、14、15、16、17、18、19、20、21、22、23或24小时;或天数例如1、2、3、4、5、6、7或8天;或周数例如1、2、3、4、5、6、7或8周;或月数例如1、2、3、4、5、6、7、8、9、10、11或12个月期间自本发明的水凝胶释放。当治疗或诊断剂,或者包封治疗剂或诊断剂的基于脂质的纳米颗粒例如脂质体或病毒体以恒定速率自本发明的水凝胶释放时,在给定的时段内自水凝胶中释放的治疗剂或诊断剂的量或者基于脂质的纳米颗粒的量与在所述给定时间段即刻之前或之后的时段期间自水凝胶中释放的治疗剂或诊断剂或者基于脂质的纳米颗粒的量大约相同,例如在约0%至约20%内。
治疗剂或诊断剂,或者包封治疗剂或诊断剂的基于脂质的纳米颗粒的释放速率可以通过在制备水凝胶期间改变一个或多个参数来调节。这样的参数包括但不限于点击取代度;%多糖氧化度;交联反应(凝胶化)期间点击缀合的多糖的浓度;或周围环境的pH。
点击取代度可以通过改变点击缀合反应中的点击试剂与氧化的和还原的或高度氧化的多糖例如藻氧醇或藻氧羧酸盐的摩尔当量数来调节。例如,可以通过增加点击缀合反应中点击试剂的摩尔当量数来增加与本发明的多糖缀合的点击分子的数量。在另一个实例中,可以通过降低点击缀合反应中点击试剂的摩尔当量数来减少与本发明的多糖缀合的点击分子的数量。在一个实施方式中,点击缀合反应可包含约1至约2000摩尔当量的点击试剂,例如约1、约5、约10、约20、约50、约100、约150、约200、约250、约300、约350、约400、约450、约500、约550、约600、约650、约700、约750、约800、约850、约900、约950或约1000摩尔当量的点击试剂。所列举值的中间范围也旨在为本发明的一部分。例如,点击缀合反应可以包含约1至约5、约2至约10、约5至约10、约10至约50、约40至约150、约100至约400、约300至约500、约400至约1000、约500至约1500或约1500至约2000摩尔当量的点击试剂。
在一个实施方式中,多糖例如氧化的和还原的或高度氧化的多糖,例如包含藻氧醇或藻氧羧酸盐的多糖,可以包含约0.01%至约90%,例如约0.01、约0.05%、约0.1%、约0.5%、约1%、约5%、约10%、约15%、约20%、约25%、约30%、约35%、约40%、约45%或约90%的点击取代度。所列举值的中间范围也旨在为本发明的一部分。例如,多糖可以是约0.01%至约0.05%、约0.01%至约1%、约0.1%至约5%、约5%至约15%、约10%至约20%、约15%至约25%、约20%至约35%、约30%至约40%或约35%至约50%点击取代的。
还可以通过调节多糖的%氧化度来调节与本发明的多糖缀合的点击分子的数量。例如,多糖在例如用氨硼烷还原之前或者在其进一步例如用亚氯酸钠氧化之前的更高的%氧化度可以产生额外的醛部分,所述醛部分在通过还原转化为醇部分或通过进一步氧化转化为羧酸部分时,可以用作点击试剂缀合的位点。
调节本发明多糖的点击取代度可允许调节胶凝时间或点击缀合的多糖交联和产生水凝胶所花费的时间。例如,更高的点击取代度可能导致更短的胶凝时间。
调节点击取代度还允许调节所得水凝胶中孔的交联密度和平均直径,即所得水凝胶的目径。例如,更高的点击取代度可能导致水凝胶的更小的平均孔径或目径,这可导致治疗剂或诊断剂或者包含治疗剂或诊断剂的基于脂质的纳米颗粒例如脂质体或病毒体的释放速率降低。更高的点击取代度也可导致包含治疗剂或诊断剂的基于脂质的纳米颗粒在水凝胶中更长的滞留。
在又一个实例中,交联反应过程中本发明多糖的浓度可以变化。例如,在点击缀合反应中,多糖例如点击缀合的多糖的更高浓度可导致所得水凝胶的更小目径,这继而可以导致治疗剂或诊断剂或者包含治疗剂或诊断剂的基于脂质的纳米颗粒如脂质体或病毒体自本发明的水凝胶释放的速率降低。更高的点击取代度也可导致包含治疗剂或诊断剂的基于脂质的纳米颗粒在水凝胶中更长的滞留。在一些实施方式中,水凝胶形成过程中点击缀合的多糖的浓度,例如在即刻形成水凝胶之前存在于溶液中的藻酸盐物质的浓度可以为约0.01%至约50%w/v,例如约0.01%至约10%w/v、约0.1%至约5%w/v、约1%至约15%w/v、约10%至约30%w/v、约12%至约35%w/v、约15%至约25%w/v、约20%至约45%w/v或约35%至约50%w/v。
本发明的水凝胶,例如包含藻酸盐的水凝胶,例如包含藻氧醇和/或藻氧羧酸盐的水凝胶,不被存在于宿主或受试者例如人中的内源性酶降解。当暴露于酸性或碱性条件时,本发明的水凝胶可被化学降解,例如水解。酸性条件包括pH 6.5或更低,而碱性条件包括pH8或更高。不希望被理论所束缚,据信本发明的水凝胶的化学降解速率是pH依赖性的。例如,本发明的水凝胶在pH 2下的化学降解速率高于在pH 6下的化学降解速率,并且本发明的水凝胶在pH 8下的化学降解速率高于在pH 12下的化学降解速率。
当本发明的水凝胶暴露于酸性或碱性条件时,与其在中性pH例如7.4的pH下的释放速率相比,包含在水凝胶中的货物例如治疗剂或诊断剂或者包封治疗剂或诊断剂的基于脂质的纳米颗粒例如脂质体或病毒体以增加的速率自水凝胶释放。例如,因为肿瘤内环境可以以6.5或更低的酸性pH为特征,因此货物自本发明水凝胶的释放速率可以在肿瘤内环境中增加,由此允许抗癌剂的持续和靶向递送。
V.本发明水凝胶中包封的基于脂质的纳米颗粒
本发明还提供了包含包封治疗剂或诊断剂的基于脂质的纳米颗粒以及包封脂质体的本发明水凝胶的药物递送组合物。如本文所用的术语“基于脂质的纳米颗粒”是指包含脂质并且可用于将治疗剂或诊断剂递送至受试者的任何纳米颗粒。在一个实施方式中,基于脂质的纳米颗粒是脂质体。在另一个实施方式中,基于脂质的纳米颗粒是病毒体。
在脂质体中递送治疗剂或诊断剂可为合乎需要的,因为脂质体可以提供此种制剂免于全身性酶促降解的保护,或者可以用于模拟抗原呈递细胞(APC)。然而,存在与脂质体药物递送相关的挑战。例如,脂质体的组成可能对负载效率、脂质体包封的治疗剂或诊断剂的功效以及脂质体包封的治疗剂或诊断剂的系统毒性有很大影响。因此,需要持续的、局部的脂质体药物递送,其可以降低全身毒性并提供药物货物向靶组织的定位。然而,目前可用的脂质体递送组合物不能保留脂质体货物,在数小时或数天内释放脂质体货物。本领域目前可用的组合物也不能将完整的脂质体递送至目标位置,例如在货物需要完整的脂质体来穿过细胞膜以用于胞液递送的情况下。
令人惊奇地发现,本发明的还原的和/或高度氧化的多糖,例如包含藻氧醇和/或藻氧羧酸盐的多糖,例如使用本文所述的方法制备的多糖,特别可用于制备可用于包封脂质体的水凝胶。具体而言,令人惊奇地发现,本发明的水凝胶,例如由包含藻氧醇和/或藻氧羧酸盐的缀合至点击试剂的藻酸盐制备的水凝胶,可以长时期保留完整的脂质体,并且可以将完整的脂质体递送至受试者中的期望位置如细胞的胞液中。
如本文所用,术语“完整的脂质体”包括如下的脂质体,其在被水凝胶包封或在被递送至宿主或受试者如人内的期望位置的过程中时保留其尺寸例如平均直径。完整的脂质体是如下的脂质体,其类似于治疗输入,并且不与其他脂质体聚结以产生更大尺寸例如更大平均直径的多分散脂质体,也不片段化为更小的脂质体或胶束。
在包封脂质体的水凝胶在宿主例如受试者如人内部降解后,脂质体可以以完整的形式递送至期望的位置,例如递送至细胞的胞液。在一个实例中,水凝胶包含不易被宿主内源性酶降解的藻酸盐,例如藻氧醇或藻氧羧酸盐。因为藻酸盐例如藻氧醇或藻氧羧酸盐不易被宿主内源性酶降解,所以包含藻酸盐的水凝胶能够长时期保留脂质体。例如,本发明的脂质体可保持包封在水凝胶中至少5天、至少10天、至少15天、至少20天、至少25天、至少30天、至少35天、至少40天、至少45天、至少50天、至少55天、至少60天、至少65天、至少70天、至少75天或至少80天。
在递送到宿主或受试者内的期望位置期间保持完整的脂质体是在递送期间保持其平均尺寸例如平均直径的脂质体。例如,已被本发明的水凝胶包封的完整脂质体的平均直径是在同一脂质体包封前的平均直径的约50%,例如约49%、约48%、约47%、约46%、约45%、约44%、约43%、约42%、约41%、约40%、约39%、约38%、约37%、约36%、约35%、约34%、约33%、约32%、约31%、约30%、约29%、约28%、约27%、约26%、约25%、约24%、约23%、约22%、约21%、约20%、约19、约18%、约17%、约16%、约15%、约14%、约13%、约12%、约11%、约10%、约9%、约8%、约7%、约6%、约5%、约4%、约3%、约2%或约1%内,或者是在标准品的平均直径的约25%,例如约24%、约23%、约22%、约21%、约20%、约19%、约18%、约17%、约16%、约15%、约14%、约13%、约12%、约11%、约10%、约9%、约8%、约7%、约6%、约5%、约4%、3%、约2%或约1%内。标准品可以是以与用于采用水凝胶包封的脂质体相同的方式制备的脂质体。脂质体的大小可以通过本领域技术人员已知的任何方法,例如通过动态光散射(DLS)来测量。
可用于本发明背景下的脂质体可以是本领域已知的可用于递送治疗剂或诊断剂的任何脂质体。例如,脂质体可以是中性脂质体,例如包含不带电脂质的脂质体(Niosome)。这样的脂质的实例包括但不限于1,2-二油酰-sn-甘油-3-磷酸胆碱(DOPC)和胆固醇(CHOL)。脂质体还可以是带电的脂质体,例如包含例如带正电荷或带负电荷的脂质的阳离子或阴离子脂质体。带正电的脂质的非限制性实例包括N-[1-(2,3-二油酰氧基)丙基]-N,N,N-三甲基甲基硫酸铵(DOTAP)和氢化大豆磷脂酰胆碱(Hydro Soy PC)。带负电的脂质的非限制性实例包括1,2-二油酰-sn-甘油基-3-磷酸-(1'-rac-甘油)(DOPG)。在一些实施方式中,可用于本发明背景下的脂质体是治疗性脂质体或诊断脂质体,例如包含如上所述的治疗剂或诊断剂的脂质体。
病毒体是由单层磷脂膜(单层或双层)囊泡组成的药物或疫苗递送机制,所述囊泡并入了允许病毒体与靶细胞融合的病毒衍生蛋白。病毒体不能复制,但是是纯的融合活性囊泡。可用于本发明背景下的病毒体可以是本领域已知的可用于递送任何病毒衍生蛋白的任何病毒体。在一些实施方式中,病毒体可以包含源自流感病毒的蛋白质,例如血球凝集素或神经氨酸酶。在一些实施方式中,病毒体是治疗性或诊断性病毒体,例如包含如上所述的治疗剂或诊断剂的病毒体。在一些实施方式中,病毒体包含疫苗。
VI.本发明的药物组合物
为了施用于受试者,本发明的水凝胶可以以药学上可接受的(例如无菌)组合物提供。因此,本文中描述的另一个方面是包含水凝胶和药学上可接受的载体的药物组合物。这些药学上可接受的组合物包含与一种或多种药学上可接受的载体(添加剂)和/或稀释剂一起配制的水凝胶。如下面详细描述的,本公开的药物组合物可以经具体配制用于以固体或液体形式施用,包括适用于以下的那些:(1)口服施用,例如浸剂(水溶液或非水溶液或悬浮液)、锭剂、糖衣丸、胶囊剂、丸剂、片剂(例如靶向用于口腔、舌下和/或全身吸收的那些)、大丸剂、粉剂、颗粒剂、糊剂,用于施用至舌;(2)肠胃外施用,例如通过皮下、肌内、静脉内(例如推注或输注)或硬膜外注射,作为例如无菌溶液或悬浮液或持续释放制剂;(3)局部施用,例如作为乳膏、软膏或控释贴剂或施用于皮肤的喷雾剂;(4)阴道内或直肠内,例如作为阴道栓、乳膏或泡沫剂;(5)舌下;(6)眼睛;(7)透皮;(8)透粘膜;或(9)鼻。另外,可以将化合物植入患者体内或使用药物递送系统注射。例如参见Urquhart等,Ann.Rev.Pharmacol.Toxicol.24:199-236(1984);Lewis编,“Controlled Release ofPesticides and Pharmaceuticals”(Plenum Press,New York,1981);美国专利号3,773,919;和美国专利号35 3,270,960,所有这些的内容通过引用并入本文。
如本文所用,术语“药学上可接受的”或“药理学上可接受的”是指在合理的医学判断范围内适用于与人类和动物的组织接触而没有过度的毒性、刺激、过敏反应或其他与合理的利益/风险比相称的问题或并发症的那些化合物、材料、组合物和/或剂型。此外,对于动物(例如人类)施用,应理解组合物应满足FDA生物标准局所要求的无菌性、致热原性、一般安全性和纯度标准。
如本文所用,术语“药学上可接受的”是指在将主体化合物从一个器官或身体的一部分携带或输送到另一个器官或身体的一部分时涉及的药学上可接受的材料、组合物或载体,例如液体或固体填充剂、稀释剂、赋形剂、制造助剂(例如润滑剂,滑石、硬脂酸镁、钙或锌、或硬脂酸)或溶剂包封材料。每种载体在与制剂的其他成分相容且对患者无害的意义上必须是“可接受的”。可以用作药学上可接受的载体的材料的一些实例包括:(1)糖,例如乳糖、葡萄糖和蔗糖;(2)淀粉,如玉米淀粉和马铃薯淀粉;(3)纤维素及其衍生物,如羧甲基纤维素钠、甲基纤维素、乙基纤维素、微晶纤维素和醋酸纤维素;(4)粉状黄蓍胶;(5)麦芽;(6)明胶;(7)润滑剂,如硬脂酸镁、月桂基硫酸钠和滑石;(8)赋形剂,如可可脂和栓剂蜡;(9)油,如花生油、棉籽油、红花油、芝麻油、橄榄油、玉米油和大豆油;(10)二醇类,如丙二醇;(11)多元醇,如甘油、山梨糖醇、甘露醇、聚乙二醇(PEG);(12)酯,如油酸乙酯和月桂酸乙酯;(13)琼脂;(14)缓冲剂,如氢氧化镁和氢氧化铝;(15)藻酸;(16)无热原水;(17)等渗盐水;(18)林格氏溶液;(19)乙醇;(20)pH缓冲溶液;(21)聚酯、聚碳酸酯和/或聚酐;(22)填充剂,如多肽和氨基酸;(23)血清组分,如血清白蛋白、HDL和LDL;(22)C2-C12醇,如乙醇;和(23)药物制剂中使用的其他无毒相容物质。润湿剂、着色剂、脱模剂、包衣剂、崩解剂、粘合剂、甜味剂、调味剂、芳香剂、蛋白酶抑制剂、增塑剂、乳化剂、稳定剂、增粘剂、成膜剂、增溶剂、表面活性剂、防腐剂和抗氧化剂也可以存在于制剂中。术语如“赋形剂”、“载体”、“药学上可接受的载体”等在本文中可互换使用。
包含治疗剂的本发明水凝胶可被递送至受试者中的体内部位。示例性的体内部位包括但不限于伤口、创伤或疾病的位点。通过例如将组合物植入受试者中可以将水凝胶递送至体内部位。要植入的水凝胶(即可植入装置)可另外包含一种或多种添加剂。添加剂可以是分解(可生物降解的)聚合物、甘露醇、淀粉糖、纤维糖、山梨醇、葡萄糖、乳糖、蔗糖、氯化钠、氯化钙、氨基酸、氯化镁、柠檬酸、乙酸、羟基丁二酸、磷酸、葡糖醛酸、葡糖酸、聚山梨醇、乙酸钠、柠檬酸钠、磷酸钠、硬脂酸锌、硬脂酸铝、硬脂酸镁、碳酸钠、碳酸氢钠、氢氧化钠、聚乙烯吡咯烷酮、聚乙二醇、羧甲基纤维素、甲基纤维素、淀粉或其混合物。
可植入装置实际上可具有任何规则或不规则形状,包括但不限于球体、立方体、多面体、棱柱体、圆柱体、杆、圆盘或其他几何形状。因此,在一些实施方式中,植入物是直径为约0.5至约10mm且长度为约0.5至约10cm的圆柱体形式。优选地,其直径为约1至约5mm且长度为约1至约5cm。
在一些实施方式中,可植入装置是球形的。当可植入装置呈球形时,其直径可以在约0.5至约50mm的范围内。在一些实施方式中,球形植入物的直径为约5至约30mm。优选直径为约10至约25mm。
在一些实施方式中,本发明的水凝胶可用于制备药物递送装置或药物贮库。药物递送装置也可以是可生物降解的和可再填充的。例如,在PCT/US2015/024540和美国申请号14/878,578中描述了可再填充的生物可降解药物递送装置,其各自的全部内容在此通过引用并入本文。可再填充的生物可降解药物递送装置包含能够与靶相互作用的缀合至药物再填充物的靶识别部分。
在一些实施方式中,用于制备可再填充的生物可降解药物递送装置的本发明水凝胶可以包含与至少两种属于如上所述的两种不同点击对的点击试剂缀合的多糖。例如,多糖可以包含第一点击试剂,所述第一点击试剂通过与其缀合至药物再填充物的点击对进行反应而用作药物递送装置的靶识别部分。多糖还可以包含第二点击试剂,所述第二点击试剂起到如上所述的交联剂的作用,或起到将部分(例如治疗剂)缀合至多糖的作用。在一个实施方式中,第一点击试剂和第二点击试剂不交叉反应,即彼此不反应,而仅与它们的点击对反应。
在其他实施方式中,本发明的水凝胶可用于制备如上所述的可再填充的生物可降解药物递送装置的药物再填充物。用于制备药物再填充物的水凝胶可以包含缀合至如上所述的至少两种点击试剂的多糖,其中至少一种点击试剂可以通过与其缀合至药物递送装置的点击对反应而用作靶。
VII.使用本发明水凝胶的治疗方法
本发明还涉及治疗有此需要的受试者的方法。该方法包括向受试者施用有效量的本发明的水凝胶、剂型、药物组合物或可植入的药物递送装置。
如本文所用,术语“施用”是指通过一种方法或途径将组合物置入受试者中,该方法或途径导致组合物在所需部位至少部分定位以使得产生期望的效果。本文所述的化合物或组合物可以通过本领域已知的任何适当途径施用,所述途径包括但不限于口服或肠胃外途径,包括静脉内、肌内、皮下、透皮、气道(气雾剂)、肺部、鼻部、直肠和局部(包括口腔和舌下)施用。
示例性的施用模式包括但不限于注射、输注、滴注、吸入或摄入。“注射”包括但不限于静脉内、肌内、动脉内、鞘内、心室内、囊内、眼眶内、心内、皮内、腹膜内、经气管、皮下、表皮下、关节内、包膜下、蛛网膜下、脊柱内、脑脊内和胸骨内注射和输注。在优选的实施方式中,组合物通过静脉内输注或注射而施用。
施用也可以通过透粘膜或透皮方式。对于透粘膜或透皮施用,在制剂中使用适合渗透屏障的渗透剂。这样的渗透剂在本领域中通常是已知的,并且包括例如透粘膜施用、洗涤剂、胆汁盐和夫西地酸衍生物。透粘膜施用可以通过使用鼻腔喷雾剂或栓剂来完成。对于透皮施用,将化合物配制成本领域通常已知的软膏剂、药膏,凝胶剂或乳膏剂。
在一些实施方式中,施用包括将本文描述的组合物例如水凝胶植入受试者中。
如本文所用,术语“治疗有效量”是指在受试者中至少一个细胞亚群中以适用于任何医学治疗的合理利益/风险比产生一些期望治疗效果的包含本文所述化合物的复合物、材料或组合物的量。因此,“治疗有效量”是指当向受试者施用以用于治疗疾病时足以实现该疾病的此种治疗的量。
有效量的确定完全是在本领域技术人员的能力范围内。通常,实际有效量可随具体化合物、使用或应用技术、所需效果、作用持续时间和副作用、受试者的病史、年龄、状况、性别以及受试者中医学病症的严重性和类型、以及其他药学活性剂的施用而变化。因此,本文所述化合物的有效剂量是足以在受试者中产生至少一些所需治疗效果的量。
从细胞培养测定和动物研究获得的数据可用于配制用于人类的剂量范围。这些化合物的剂量优选在包括ED50而毒性很小或没有毒性的循环浓度范围内。剂量可根据所使用的剂型和利用的使用或施用途径而在该范围内变化。
有效剂量可以由细胞培养实验来初步评估。可以在动物模型中制定剂量以达到包括如在细胞培养中测定的IC50(即实现症状的半数最大抑制的治疗剂的浓度)的循环血浆浓度范围。例如,可以通过高效液相色谱测量血浆中的水平。任何特定剂量的效果可以通过合适的生物测定来监测。
通常,术语“治疗(treatment)”或“治疗(treating)”被定义为向患者施加或施用治疗剂,或向自患者分离的组织或细胞系施加或施用治疗剂,所述患者具有疾病、疾病症状或患病倾向,其目的是治疗、治愈、减轻、缓解、改变、补救、改进、改善或影响该疾病、疾病症状或患病倾向。因此,治疗可以包括制止、抑制、预防、治疗或其组合。治疗尤其指增加持续进展的时间、加快缓解、诱导缓解、增加缓解、加速恢复、增加替代疗法的效力或减少对替代疗法的抗性或其组合。“制止”或“抑制”尤其是指延缓症状的发作、防止疾病复发、降低复发发作的的数量或频率、增加症状发作之间的潜伏期、降低症状的严重程度、降低急性发作的严重程度、减少症状的数量、减少疾病相关症状的发生率、减少症状的潜伏期、改善症状、减少继发性症状、减少继发性感染、延长患者存活或其组合。在一个实施方式中,症状是原发的,而在另一个实施方式中,症状是继发的。“原发”是指为病症如糖尿病的直接结果的症状,而继发是指由原发原因产生或引起的症状。症状可以是疾病或病理状况的任何表现。
因此,如本文所用,术语“治疗”包括本文所述化合物的任何施用,并且包括:(i)预防疾病在可能易患疾病但尚未经历或显示疾病的病理或症状的受试者中发生;(ii)抑制正在经历或显示病变的病理或症状的受试者中的疾病(即阻止病理和/或症状的进一步发展);或(iii)改善正在经历或显示患病病理或症状的受试者中的疾病(即逆转病理和/或症状)。
疾病或病症的“治疗”、“预防”或“改善”是指延迟或预防此类疾病或病症的发作,逆转、缓解、改善、抑制、减缓或停止与这种疾病或病症相关的状况的发展、恶化或劣化或严重程度。在一个实施方式中,疾病或病症的症状减轻了至少5%、至少10%、至少20%、至少30%、至少40%或至少50%。
与任何已知的用于诊断病症的方法联合来确定治疗的功效。减轻病症的一种或多种症状表明该化合物赋予临床益处。以上描述的任何治疗方法可以应用于任何合适的受试者,包括例如哺乳动物,例如狗、猫、牛、马、兔、猴,最优选人。
如本文所用,术语“受试者”包括可受益于施用本发明的水凝胶或可植入药物递送装置的任何受试者。术语“受试者”包括动物,例如脊椎动物、两栖动物、鱼、哺乳动物、非人动物,包括人和灵长类动物,例如黑猩猩、猴子等。在本发明的一个实施方式中,受试者是人。
术语“受试者”还包括农业生产性牲畜,例如牛、绵羊、山羊、马、猪、驴、骆驼、水牛、兔、鸡、火鸡、鸭、鹅和蜜蜂;和家养宠物,例如狗、猫、笼养鸟和水族鱼,以及所谓的测试动物,例如仓鼠、豚鼠、大鼠和小鼠。
在一个实施方式中,本发明提供了用于治疗耳相关病症的方法。该方法包括向有需要的受试者施用用于治疗耳相关病症如耳炎的水凝胶或剂型。将这样的剂型施用于需要其的受试者的外耳道中。剂型可以包含多种治疗剂,例如至少一种抗生素。例如在US2014/0107423中描述了用于将治疗剂递送入耳中的药物递送装置,其全部内容在此通过引用并入本文。
在另一个实施方式中,本发明还提供了用于治疗眼睛相关病症的水凝胶或剂型。该方法包括向有需要的受试者的眼中施用本发明的水凝胶或剂型。本发明的水凝胶或剂型可以包含至少一种治疗剂。可用于眼科剂型的治疗剂的非限制性实例包括例如药学有效浓度的抗生素、皮质激素、局部麻醉剂、减充血剂、非甾体消炎剂、病毒生长抑制剂、防腐剂、可的松、抗过敏活性物质、前列腺素类似物、来自抗组胺剂和皮质类固醇活性物质类的活性物质、抗过敏活性物质、泛酸衍生物、非甾体抗炎药、血管收缩剂和/或抗青光眼活性物质。例如在US20150139973中描述了用于眼内施用的合适剂型,其全部内容在此通过引用并入本文。
本发明还提供了用于治疗有需要的受试者中的慢性局部缺血的方法。该方法包括向受试者施用有效量的本发明的水凝胶、剂型或可植入装置。在一个实施方式中,本发明的水凝胶、剂型或可植入装置包含VEGF。
先前已经发现将VEGF局部递送至局部缺血位点可以增加受试者体内VEGF的半衰期并减少治疗相关的副作用。因此,在一个实施方式中,将水凝胶、剂型或可植入装置局部施用至局部缺血位点。在一些实施方式中,在移植之前和/或之后将水凝胶、剂型或可植入装置施用至待移植的组织。
本发明还提供了用于再生有需要的受试者中的组织的方法。该方法包括向受试者施用有效量的还包含细胞的本发明的水凝胶、剂型或可植入装置。例如,细胞可以是哺乳动物细胞,组织可以是哺乳动物组织。在一些实施方式中,哺乳动物细胞与待再生的组织类型相同。在其他实施方式中,哺乳动物细胞是干细胞。本文提供的方法的实施方式包括使哺乳动物组织与还包含细胞的本发明的水凝胶、剂型或可植入装置接触。
在另一个实例中,用于再生受试者中的组织的方法包括提供本文所述的水凝胶、剂型或可植入装置,其中水凝胶包含固定在水凝胶内的细胞(即,细胞长时间保留在水凝胶内而不离开水凝胶)。该方法包括使组织与水凝胶接触,其中细胞被固定在水凝胶内。在一些实施方式中,细胞是后代细胞。在一些实施方式中,水凝胶保持稳定并且不允许宿主细胞浸润。
在一个实施方式中,本文所述的水凝胶可用作免疫保护屏障,例如用于胰岛移植。在一些情况下,胰岛移植是用于糖尿病如I型糖尿病的治疗。诸如胰岛的移植细胞可以通过免疫反应而被破坏,而本发明的水凝胶能够在水凝胶的植入/注射之前包封诸如胰岛细胞的细胞。这样,水凝胶充当受试者中的免疫保护屏障并使移植的细胞和组织的免疫排斥最小化。
通过以下实施例进一步说明本发明,这些实施例不应被解释为限制性的。本申请通篇引用的所有参考文献的全部内容在此明确地通过引用并入本文。
实施例
实施例1:存在于藻酸盐中的醛可以与货物蛋白和点击试剂反应的。
高分子量和低分子量的藻酸盐通过与高碘酸钠反应而被氧化。为此,将MW为~265kDa(MVG或Protanol LF 20/40,FMC Technologies;I-1G或I-8,Kimica公司)和MW为~32kDa(VLVG,FMC Technologies)的藻酸盐以1%w/v的浓度溶解于ddH2O中。将高碘酸钠(Sigma-Aldrich)以基于相对于藻酸盐单体摩尔数的摩尔百分比的量加入到溶液中。然后使溶液在室温下避光反应过夜。向溶液中加入氯化钠至浓度为0.3M,氧化产物通过切向流过滤(TFF)进行纯化或使用12-14kDa MWCO透析管(Spectrum Lab)透析过夜,在diH2O中对抗从150mM至0mM NaCl的下降盐梯度具有大量水交换。
将含有0%-50%醛的氧化藻酸盐与VEGF一起孵育。孵育5天后通过ELISA(R&DSystems目录号DVE00)测量可溶性未变性VEGF(2%w/v藻酸盐,4mcg/mL VEGF)的百分比变化。如图2a中所示,醛%的增加与VEGF的%变化直接相关,其中含有50%醛的藻酸盐导致VEGF的50%变化。数据表明,与氧化的藻酸盐孵育的醛可以与VEGF反应。
含有20%-50%醛的氧化藻酸盐还与点击试剂四嗪(Tz)和降冰片烯(Nb)缀合。在室温下再悬后,氧化的藻酸盐显示出显著的颜色变化,指示醛浓度对降解的依赖性。图2b中示出的是再悬后含有与Tz和Nb缀合的氧化藻酸盐的小瓶的图。从左到右显示的是:
-与Tz缀合的具有20%醛的藻酸盐;
-与Nb缀合的具有20%醛的藻酸盐;
-与Tz缀合的具有30%醛的藻酸盐;
-与Nb缀合的具有30%醛的藻酸盐;
-与Tz缀合的具有40%醛的藻酸盐;
-与Nb缀合的具有40%醛的藻酸盐;
-与Tz缀合的具有50%醛的藻酸盐;
-与Nb缀合的具有50%醛的藻酸盐。
数据表明,醛也能以取决于醛浓度的方式与点击试剂反应以形成有色产物和亚胺。这些颜色变化代表了点击部分的不期望的变化。在酸性条件下,亚胺可以水解回醛。
实施例2.藻酸盐醛的还原
本实验的目的是测定已与硼氢化钠(NaBH4)、氨硼烷(BH3NH3)和亚氯酸钠(NaClO2)反应的氧化藻酸盐中残留醛的含量。如图3a中所示,硼氢化钠和氨硼烷二者与存在于藻酸盐中的醛反应以形成醇,而亚氯酸钠与醛反应以形成羧酸。
用高碘酸钠氧化藻酸盐,使其含有5-50%的残余醛。然后使氧化的藻酸盐与硼氢化钠、氨硼烷和亚氯酸钠反应,并且在每次反应后使用qNMR定量残余醛的%。
使用如实施例1中所述的程序进行藻酸盐的高碘酸钠氧化。
为了用硼氢化钠还原氧化的藻酸盐,将藻酸盐溶液用硼氢化钠(SB,Sigma-Aldrich)以>1.5:1的SB对藻酸盐氧化单体的摩尔比进行处理。使反应在室温下进行过夜。向溶液中加入氯化钠以达到0.3M的浓度,且SB处理的产物通过切向流过滤(TFF)纯化或使用12-14kDa MWCO透析管(Spectrum Labs)透析过夜,在diH2O中对抗从150mM至0mM NaCl的下降盐梯度具有大量水交换。然后将含有还原的藻酸盐的溶液冷冻并冻干至干燥。
为了用氨硼烷还原氧化的藻酸盐,将藻酸盐溶液用氨硼烷(AB)复合物(Sigma-Aldrich)以>1.5:1的AB对藻酸盐醛的摩尔比进行处理。使反应在室温下进行过夜。向溶液中加入氯化钠以达到0.3M的浓度,且AB处理的产物通过切向流过滤(TFF)纯化或使用12-14kDa MWCO透析管(Spectrum Labs)透析过夜,在diH2O中对抗从150mM至0mM NaCl的下降盐梯度具有大量水交换。然后将含有还原的藻酸盐的溶液冷冻并冻干至干燥。
为了进一步氧化氧化的藻酸盐,将藻酸盐溶液用亚氯酸钠(SC)以>1.5:1的SC对藻酸盐醛的摩尔比进行处理。在加入亚氯酸钠之前,将二甲亚砜(DMSO;Sigma-Aldrich)以5:1的DMSO对亚氯酸钠的摩尔比加入溶液中并混合直至溶液变均质。使反应在室温下进行过夜。然后向该溶液中加入氯化钠以达到0.3M的浓度,且SC处理的产物通过切向流过滤(TFF)纯化或者使用12-14kDa MWCO透析管(Spectrum Labs)透析过夜,在diH2O中对抗从150mM至0mM NaCl的下降盐梯度具有大量水交换。然后将含有高度氧化的藻酸盐的溶液冷冻并冻干至干燥。
图3b是显示已用氨硼烷或硼氢化钠进一步还原或者已用亚氯酸钠进一步氧化的氧化藻酸盐中的%残余氧化度的柱状图。数据表明,氨硼烷在其还原醛的能力上优于硼氢化钠,并产生含有最低水平残余醛的藻酸盐。这种效果对于具有较高氧化水平的藻酸盐尤其明显。该数据还表明,在“最初的DMSO反应条件”(1:1的水:DMSO)下,醛的亚氯酸钠氧化未达到完成。如图6k中所示,可以通过将反应条件改变为33:1的水:DMSO来消除残余的醛。
实施例3.氧化的藻酸盐的还原处理降低了醛对货物蛋白的影响。
本实验的目的是评估氧化的藻酸盐中存在的醛对VEGF的生物学活性的影响。为此,藻酸盐通过与高碘酸钠反应而被氧化,以产生含有0%-50%醛的氧化的藻酸盐。然后使氧化的藻酸盐与硼氢化钠(NaBH4)、氨硼烷(BH3NH3)和亚氯酸钠(NaClO2)反应。将不同的藻酸盐与VEGF以20mg/mL的藻酸盐浓度和4μg/mL的VEGF浓度在含有1%BSA的PBS中37℃下孵育。在EBM细胞培养基或含有1%BSA的溶液中孵育5天后,通过ELISA(R&D System目录号DVE00)测量可溶性未变性VEGF(2%w/v藻酸盐,4mcg/mL VEGF)的百分比变化。
数据显示在图4a和4b中。图4a显示了在EBM中孵育5天后测量的VEGF的%变化。该数据表明,对于未进一步处理的氧化的藻酸盐,VEGF的%变化与藻酸盐中所含醛的百分比直接相关(参见左起前7个条,标记为“0”、“1”、“5”、“10”、“15”、“25”和“50”)。对于含有25%和50%醛的藻酸盐,VEGF的%变化达到100%。数据还表明,对于已经与氨硼烷反应的氧化的藻酸盐(参见标记为“AB5”、“AB10”、“AB15”、“AB25”和“AB50”的条),VEGF的%变化显著降低,对于含有15%醛的藻酸盐,观察到VEGF的约60%的最高%变化。采用硼氢化钠还原在保护VEGF方面没有如此有效,对于每个研究的藻酸盐材料(参见标记为“SB5”、“SB10”、“SB15”、“SB25”和“SB50”的条)观察到VEGF的较高%变化。对于所有研究样品(参见标记为“SC5”、“SC10”、“SC15”、“SC25”和“SC50”的条),用亚氯酸钠氧化导致所测得的显著%变化,这是因为当时(最初的DMSO反应条件)由反应低效所保持的残余醛所导致的。
图4b显示了在1%BSA溶液中孵育5天后测量的VEGF的%变化。数据表明,对于未进一步处理的氧化的藻酸盐材料,VEGF的%变化可以达到超过30%(参见左起前7个条,标记为“0%Ox”、“1%Ox”、“5%Ox”、“10%Ox”、“15%Ox”、“25%Ox”和“50%Ox”)。采用氨硼烷(参见标记为“AB5”、“AB10”、“AB15”、“AB25”和“AB50”的条)或硼氢化钠(参见标记为“SC5”、“SC10”、“SC15”、“SC25”和“SC50”的条)的还原性处理降低了VEGF的%变化,硼氢化钠比氨硼烷更为有效。与对照相比,采用亚氯酸钠的氧化性处理(初始DMSO反应条件)导致VEGF的%变化增加(参见标记为“SC5”、“SC10”、“SC15”、“SC25”和“SC50”的条)。
图4a和4b中显示的数据表明,各种经处理的藻酸盐的保护蛋白质货物的能力存在差异。
实施例4.与亚氯酸钠反应后,氧化的藻酸盐的点击试剂取代度增加。
本实验的目的是确定氧化的藻酸盐与亚氯酸钠反应后,与点击试剂的点击试剂缀合度是否会增加。如图1a中所示,点击试剂通常可以经由藻酸盐中的葡糖醛酸中存在的羧酸酯部分与藻酸盐缀合,从而导致每个藻酸盐单体有一个点击分子。用高碘酸钠氧化藻酸盐后,每个藻酸盐单体产生两个醛试剂,其也可以经由亚胺键与点击试剂缀合(图1b)。点击试剂与氧化的藻酸盐的这种缀合是次优的,因为缀合后保留在藻酸盐中的残余醛可能对货物造成毒性和损害,以及点击试剂的降解(参见实施例1和3)。此外,醛和点击试剂之间的亚胺键易于水解,导致点击试剂自藻酸盐的损失。然而,如图1c中所示,存在于氧化的藻酸盐中的醛的进一步氧化将这些醛转化成羧酸,为点击缀合提供了两个额外位点。
为了确定氧化的藻酸盐的进一步氧化是否可以增加点击缀合,将仅与高碘酸钠反应的藻酸盐、或用高碘酸钠氧化(HighOx藻酸盐)并用亚氯酸钠进一步氧化的藻酸盐(含有藻氧羧酸盐的藻酸盐)与点击试剂四嗪(Tz)和降冰片烯(Nb)缀合,并对缀合的四嗪和降冰片烯的相对量进行比较。为此,使用实施例1和2中描述的程序,使用高碘酸钠和SC氧化藻酸盐。然后用1-二环[2.2.1]庚-5-烯-2-基甲胺(降冰片烯甲胺;TCI)或3-(对苄基氨基)-1,2,4,5-四嗪对这些产物进行修饰。首先,将经SC处理的藻酸盐溶于含有0.1M MES、0.3M NaCl、pH6.5的浓度为0.5%w/v的搅拌缓冲液中。接下来,以存在于藻酸盐上的羧酸基团的5倍摩尔过量加入N-羟基琥珀酰亚胺(NHS;Sigma-Aldrich)和1-乙基-3-(3-二甲基氨基丙基)-碳化二亚胺盐酸盐(EDC;Sigma-Aldrich)。然后将降冰片烯(Nb)或四嗪(Tz)以Nb或Tz对藻酸盐单体的限定摩尔比加入以分别得到Alg-N或Alg-T。在室温下搅拌偶联反应过夜,产物通过切向流过滤(TFF)纯化或使用12-14kDa MWCO透析管(Spectrum Lab)透析过夜,在diH2O中对抗从150mM至0mM NaCl的下降盐梯度具有大量水交换。然后将纯化的Alg-N和Alg-T聚合物用活性炭处理,无菌过滤(0.22mm),并冷冻干燥。这导致具有藻酸盐可用羧酸基的不同取代度的纯化的Alg-N或Alg-T聚合物。
图5a显示了在第0天含有与Tz和Nb缀合的HighOx藻酸盐(上图)和在第0天含有与Tz和Nb缀合的HighOx Sc藻酸盐(下图)的小瓶的图。Tz-和Nz-缀合材料名义上分别是粉红色/红色和略微不清澈的。图5b显示了通过NMR测量的存在于HighOx和HighOx SC藻酸盐中的Tz的相对量。数据表明,对于含有20-50%氧化度的藻酸盐,Tz分子缀合至HighOx SC藻酸盐比缀合至HighOx藻酸盐多1.4至2.3倍,表明含有藻氧羧酸盐的藻酸盐具有扩展的缀合潜力。
实施例5.点击物缀合的氧化的藻酸盐的表征。
本实验的目的是表征点击物缀合的HighOx SC藻酸盐材料的性质,并将其与点击物缀合的HighOx藻酸盐材料的性质进行比较。通过紫外-可见光谱分析研究两种藻酸盐材料的稳定性。Tz缀合材料的数据示于图6a和6b中。图6a示出了在第28天具有20-50%氧化度的Tz-缀合的HighOx藻酸盐材料的紫外-可见光谱(上图)和在第14天具有20%和30%缀合的Tz-缀合的HighOx SC材料的紫外-可见光谱。图6b还显示了含有这些Tz-缀合的HighOx和HighOx SC藻酸盐材料的小瓶的图片。数据表明,四嗪缀合的HighOx藻酸盐材料在28天时在515nm处丧失了特征性Tz峰,而在含有20%和30%氧化度的HighOx SC藻酸盐材料中,该峰在第14天仍然存在。这些数据表明,经亚氯酸钠处理的四嗪缀合的材料在溶液中表现出更高的稳定性。
在第15天的Tz-缀合和Nb-缀合的HighOx(20%和50%醛)氨硼烷(AB)、硼氢化钠(SB)和亚氯酸钠(SC)藻酸盐材料(在室温下储存的4%w/v溶液)的紫外-可见光谱示于图6j中。光谱表明,15天后,Tz-缀合的HighOx材料在515nm处的峰得到保留,且Nb-缀合的HighOx材料在300nm处无吸收。该数据表明藻酸盐醛的还原或进一步氧化赋予了溶液中点击物缀合部分更高的稳定性。
还通过定量NMR研究Tz-缀合和Nb-缀合的HighOx和HighOx SC材料以确定它们的醛含量。在Varian 400MHz上通过将>~5.1ppm处的由高碘酸钠产生的质子峰与内标二甲基丙二酸(DMMA;6H1.3pmm;Sigma-Aldrich)进行比较来进行醛含量的定量。样品在15mg/mL藻酸盐和2.5mg/mL DMMA的氧化氘(D2O;Sigma-Aldrich)中制备。在氧化氘(D2O;Sigma-Aldrich)中以15mg/mL的藻酸盐和2.5mg/mL的DMMA制备样品。
结果示于图6e、6f、6g和6h中。具体而言,图6e和6f分别显示与Nb和Tz缀合的具有50%氧化度的HighOx藻酸盐材料的NMR谱。图6g和6h分别显示与Nb和Tz缀合的具有50%醛的HighOx SC藻酸盐材料的NMR谱。数据表明,在HighOx醛藻酸盐材料中具有明显的峰展宽,表明这种材料更具动态性。HighOx藻酸盐材料的NMR谱也含有指示残余醛的存在的峰。相反,HighOx SC藻酸盐材料的NMR谱显示出尖锐的峰,表明HighOx SC材料具有更高的清晰度,并且几乎不存在残余醛。HighOx SC藻酸盐材料中不存在残余醛也可通过FTIR分析来确认,FTIR光谱示于图6i中。总体而言,数据表明点击物缀合的HighOx SC藻酸盐材料的动态性更小,化学上稳定,并且仅含有少量的残余醛。
评估氧化的藻酸盐与亚氯酸钠的反应条件。用于产生图3b中所示数据的初始反应条件使用水:DMSO的1:1混合物作为溶剂,其中DMSO用作副产物次氯酸(HOCl)的清除剂。通过将混合物中的DMSO含量改变为33:1的水:DMSO,驱使反应进一步完成。在图6k中显示了在最佳条件下生产的HighOx SC藻酸盐材料的NMR谱,表明在这些条件下用亚氯酸钠进一步处理醛后,在具有20%和50%氧化度的材料中没有任何显著的残余醛。
实施例6.点击物缀合的氧化的藻酸盐的胶凝。
对具有20-50%氧化度的点击物缀合HighOx和HighOx SC材料形成水凝胶的能力进行研究。以10%(w/v)制备互补氧化度的制剂(例如20%醛-TZ和20%醛-Nb)、混合并使其凝胶化20分钟。图8a和8b证明了高碘酸盐氧化、还原(AB,SB)和进一步氧化(SC)的材料在溶液中随时间(例如透析驻留时间)降解,这限制了水凝胶的形成。因此,为了增强胶凝作用,该方法已被改造为用切向流过滤(TFF)代替透析以使溶液驻留时间最小化。
图8c表明,HighOx和HighOx SC材料的溶解度随%氧化度的变化而增加,并且对于HighOx SC材料而言最高。
实施例7.氧化的和还原的藻酸盐的体外降解和溶解度。
本实验的目的是在进一步还原处理(即,与硼氢化钠或氨硼烷反应)或氧化处理(即,用亚氯酸钠还原)之后,研究具有或不具有点击物缀合的氧化的藻酸盐的降解和溶解度。
通过使藻酸盐与高碘酸钠反应,然后用四氢呋喃(THF)沉淀来制备点击物缀合的藻酸盐材料(MVG藻酸盐,280kDa)。然后将沉淀材料通过与硼氢化钠或氨硼烷反应而还原,或通过与亚氯酸钠反应而进一步氧化,并且另外透析1天。然后将其与Tz或Nb缀合,并再次透析1天。
通过使藻酸盐与高碘酸钠反应,然后进行3天透析来制备未与点击物缀合的对照藻酸盐材料(VLVG藻酸盐,30kDa)。然后将透析后的材料通过与硼氢化钠或氨硼烷反应而还原,或通过与亚氯酸钠反应而进一步氧化,并且另外透析3天。
然后将MVG和VLVG藻酸盐材料在37℃下孵育长达29天,并通过凝胶渗透色谱法(GPC)分析以确定藻酸盐材料的平均分子量。为此,以2mg/mL的藻酸盐材料浓度在PBS中制备样品。然后使用配有G4000PWxl和G5000PWxl串联柱的Agilent 1260HPLC分析样品。使用100μL注射进样(流速为0.5mL/min),0.1M硝酸钠(Sigma-Aldrich)流动相进行分析,柱温和检测器温度均为35℃。使用三重检测将样品与校准的PEO标准品(34kDa;AgilentTechnologies)进行比较。
结果示于图7a和7b中。具体而言,图7a显示了具有20%氧化度(左图)和50%氧化度(右图)的Tz-缀合和Nb-缀合的MVG藻酸盐的降解。数据表明,还原处理的MVG藻酸盐(AB,SB)和进一步氧化(SC)的材料均表现出可降解性。
对于未处理的藻酸盐(左上图)、用氨硼烷还原处理的藻酸盐(右上图)、用硼氢化钠还原处理的藻酸盐(左下图)和用亚氯酸钠处理的藻酸盐(右下图),图7b显示了含有0%-50%氧化度的VLVG藻酸盐在37℃下的降解。数据表明,还原的和进一步氧化的材料表现出与高碘酸盐氧化的材料对照相似的降解曲线。
图7c是含有用氨硼烷或亚氯酸钠处理的具有20%氧化度的MVG(280kDa)材料的50%w/v溶液的小瓶的图片。提供50%(w/v)的未氧化的VLVG(30kDa)作为对照。未氧化的MVG仅可溶至~5%w/v,而未氧化的VLVG可溶至~10%w/v。令人惊奇的是,该照片显示氨硼烷和亚氯酸钠处理的材料(具有类似于VLVG的分子量,参见图8a)均易于以50%w/v溶解。数据表明,用亚氯酸钠进一步氧化的Tz-缀合和Nb-缀合的MVG材料最为可溶。
实施例8.四嗪和降冰片烯点击物缀合的上限。
本实验的目的是确定如实施例7中所述制备的VLVG材料的点击物缀合的上限。同样如实施例7中所述制备的MVG材料在缀合反应中使用250摩尔当量的点击材料以获得约5%取代度(DS),所述取代度定义为每单体单元的点击部分的数量,其中对于Tz的上限为约7.5%,而对于Nb的上限为20%。在本实验中,未氧化的VLVG材料与不同当量的Tz或Nb反应,并且通过qNMR测量%DS。数据显示在下表中。在较高摩尔当量下,降冰片烯NMR峰显著扩宽,因此假定对于降冰片烯的值是超出报道的(OR)。
| 点击试剂的当量 | 通过qNMR确定的%DS |
| 600当量四嗪 | 12.0 |
| 600当量降冰片烯 | 37.1(OR) |
| 900当量四嗪 | 12.9 |
| 900当量降冰片烯 | 72.9(OR) |
| 1200当量四嗪 | 21.8 |
| 1200当量降冰片烯 | 97.0(OR) |
如图8中所示,还使用紫外-可见光谱测量四嗪缀合。数据表明,四嗪的取代度对于具有600-1200四嗪当量的反应是线性的。这些数据表明,使用较低分子量的藻酸盐可以获得更大的取代度,并且尚未达到上限。将本实验扩展至还原的和进一步氧化的材料以确定它们的潜力潜能的上限,并由此确定交联密度。
实施例9.存在于氧化的藻酸盐中的醛对细胞活力的影响。
本实验的目标是确定在存在于氧化的藻酸盐中的醛的存在下的相对细胞活力。为此,用高碘酸钠氧化藻酸盐以生成具有0-50%氧化度的含醛藻酸盐材料。随后,将10mg该材料与5×105的小鼠白血病细胞(ATCC CCL-219,n=1)在具有10%马血清的DMEM中直接孵育2天。使用MUSE细胞计数和活力测定试剂盒对活细胞数进行定量。归一化至0%氧化度的数据显示在下表中,并且也在图9中以图形方式显示。
| 样品(%氧化度) | 2-天活细胞计数 | 相对细胞活力 |
| 0%ox | 7.91×10<sup>5</sup> | 1.00 |
| 5%ox | 8.06×10<sup>5</sup> | 1.02 |
| 15%ox | 8.16×10<sup>5</sup> | 1.03 |
| 25%ox | 6.78×10<sup>5</sup> | 0.86 |
| 50%ox | 2.58×10<sup>5</sup> | 0.33 |
数据表明,细胞活力不受高达15%氧化度的醛的影响,并且在25%和50%氧化度下开始快速下降。
实施例10.氧化的藻酸盐的溶解度
本实验的目的是将具有点击物缀合的氧化的藻酸盐的溶解度与未氧化的藻酸盐的溶解度进行比较。图10是显示以下藻酸盐的溶解度(%w/v)的条形图:分子量为250kDa的未氧化的藻酸盐(MVG);分子量为30kDa的未氧化的藻酸盐(VLVG);和分子量为30kDa的藻酸盐(MVG)(VLVG),其被氧化至20%,然后通过使用亚氯酸钠进一步氧化并与点击物(Tz或Nb)缀合以产生分子量为约30kDa的最终产物。在本实验中使用的VLVG材料显示在图7c的小瓶5中。在本实验中使用的点击物缀合和钠处理的藻酸盐材料显示在图7c的小瓶3和4中。
图10中呈现的数据表明未氧化的MVG仅可溶至~5%w/v,未氧化的VLVG可溶至~10%w/v;点击物缀合的亚氯酸钠处理的藻酸盐可溶至~50%。数据表明,含有藻氧羧酸盐的藻酸盐,以及在略微较小程度上的含有algoxalol的藻酸盐,其特征在于与未氧化的藻酸盐相比溶解度显著增加。
实施例11.藻酸盐的溶解度对交联潜能的影响
本实验的目的是确定分子量为250kDa(MVG)和30kDa(VLVG)的未氧化的藻酸盐的Tz缀合的上限。由于其较高的分子量,MVG材料比VLVG材料更粘稠且溶解性更低。使用如实施例8中所述的实验程序进行本实验。
图11a是显示MVG和VLVG材料所实现的Tz缀合的上限的柱状图。图11a中的数据表明可溶性较小的MVG材料可以与最大~500摩尔当量的Tz缀合,而可溶性较大的VLVG材料可以与最大~2500摩尔当量的Tz缀合。因此,VLVG材料增加的溶解度(由于较低的分子量)允许更大的点击取代度。由于其甚至更低的粘度,通过使用含algoxanol和/或藻氧羧酸盐的藻酸盐,可以进一步扩展该缀合潜能。
图11b是显示VLVG材料的取代度随Tz的摩尔当量变化的图。所研究的材料是与500、1000、1500、2000和2500摩尔当量的Tz反应的VLVG。它证明VLVG材料的Tz缀合的上限是在~2500当量的Tz下实现的。
实施例12.藻酸盐浓度和点击取代度对点击物缀合的藻酸盐材料的凝胶化动力学的影响
本实验的目的是使用流变学测定来研究点击物缀合的藻酸盐材料的随藻酸盐浓度、氧化程度和点击取代度变化的凝胶化动力学。本实验使用非氧化的VLVG材料,所述材料使用含有500、1500和2500摩尔当量的Nb或Tz的缀合反应而与Nb和Tz缀合。本实验还使用MVG材料,所述材料使用高碘酸钠氧化至10%或20%的氧化度,用氨硼烷还原处理,然后在缀合反应中使用250摩尔当量的Nb和Tz与Nb和Tz缀合。在本实验中还使用LF 20/40藻酸盐材料,所述材料使用高碘酸钠氧化至20%的氧化度,用氨硼烷还原处理,然后在缀合反应中使用1000摩尔当量的Nb和Tz与Nb或Tz缀合。
通过使用流变学测定测量弹性模量G’的值来确定点击物缀合的藻酸盐材料的胶凝。为此,将所需最终浓度(PBS中5%、10%、15%或20%w/v)的Alg-N和Alg-T溶液以1:1的比例混合并直接移液到TA Instrument ARG2流变仪的底板上,所述流变仪配有20mm的平坦上平板几何结构和400微米的几何间隙。使用珀尔帖冷却器来控制温度依赖性实验的温度,并且将贮水器盖放置在凝胶上以防止水凝胶在测试期间干燥。在1Hz下使水凝胶样品经受1%应变,并监测储存和损耗模量(G’和G”)1小时。
图12a是显示不同的经研究VLVG材料的弹性模量G'随时间增加的图。该数据有效地证明了不同材料凝胶化所花费的时间,平稳表明凝胶样状态已经实现。数据表明增加点击取代度导致更快的凝胶化。
图12b是显示不同的经研究VLVG材料的弹性模量G'的值的条形图。左侧黑色并标记为“2%1:3MVG:VLVG”的条形图对应于对照材料,其为钙交联的MVG:VLVG的1:3混合物的2%w溶液。
图12c是显示不同的经研究VLVG材料的目径值的条形图。左侧黑色并标记为“2%1:3MVG:VLVG”的条形图对应于对照材料,其为钙交联的MVG:VLVG的1:3混合物的2%w溶液。
图12b和12c中显示的数据表明,增加点击取代度导致材料的不同流变性质,如弹性模量G'增加和孔径减小所表现的。
图12d是显示MVG材料的弹性模量G'相对于时间增加的图,所述MVG材料被氧化至10%氧化度,用氨硼烷还原,然后使用250摩尔当量的Nb和Tz与Nb或Tz缀合。以5%w/v、10%w/v或15%w/v的点击物缀合的还原的藻酸盐的浓度产生水凝胶。图12e是显示MVG材料的弹性模量G'相对于时间增加的图,所述MVG材料被氧化至20%氧化度,用氨硼烷还原,然后用250摩尔当量的Nb和Tz与Nb或Tz缀合。在5%w/v、10%w/v、15%w/v或20%w/v的点击物缀合的还原的藻酸盐的浓度下产生水凝胶。图12f是显示LF 20/40材料的弹性模量G'相对于时间增加的图,所述LF 20/40材料被氧化至20%氧化度,用氨硼烷还原,然后使用1000摩尔当量的Nb和Tz与Nb或Tz缀合。在5%w/v、10%w/v、15%w/v或20%w/v的点击物缀合的还原的藻酸盐的浓度下产生水凝胶。
图12d、图12e和图12f中的数据表明,增加还原的藻酸盐的浓度减少了点击物缀合的藻酸盐的凝胶化时间。结果表明,可以通过改变点击缀合反应中藻酸盐氧化的程度、点击试剂的相对量和藻酸盐的浓度来调节点击物缀合的藻酸盐的凝胶化过程。
实施例13.点击取代度对蛋白质释放速率的影响
本实验的目的是研究点击取代度对点击藻酸盐水凝胶中包封的各种蛋白质的释放速率的影响。本实验利用如实施例11中所述产生的与Nb或Tz缀合的未氧化的VLVG和MVG材料。具体地,未氧化的VLVG材料与Nb或Tz在250、500、1000、1500、2000和2500摩尔当量的Nb或Tz下缀合以产生Nb和Tz缀合的藻酸盐(Alg-N和Alg-T)。未氧化的MVG材料与Nb或Tz在250摩尔当量的Nb或Tz下缀合。本实验还利用了具有不同分子量的蛋白质,例如胰岛素(~3.5kDa的MW)。牛血清白蛋白(BSA,MW~67kDa)和IgG(MW~150kDa)。
通过将萤光素标记的胰岛素(Sigma-Aldrich)、牛血清白蛋白(BSA;Sigma-Aldrich)和人免疫球蛋白G(IgG;Sigma-Aldrich)包封在点击物缀合的藻酸盐中来评估蛋白质释放曲线。通过首先将各种取代度的冷冻干燥的Alg-N和Alg-T聚合物分别溶解于PBS中至最终所需浓度(4%和5%w/v)来制备样品。加入目标蛋白质并与Alg-N溶液以1:10(Alg-N+Alg-T,v/v)的蛋白质:藻酸盐的比率混合。然后将该溶液与Alg-T溶液彻底混合,使混合物凝胶化至少30分钟。通过向各个凝胶添加1mL PBS并在37℃孵育来创建样品。在各个时间点收集样品,并在每个时间点替换上清液。使用平板读数器相对于标准曲线对上清液中的蛋白质含量进行定量,所述平板读数器具有492nm处的荧光激发和518nm处的发射。
图13a是显示荧光素缀合的胰岛素从使用具有不同点击缀合度的点击物缀合的VLVG材料产生的水凝胶累积释放(以微克计)的图。图13b是显示图13a中曲线的对应于水凝胶形成期间2500摩尔当量的Nb或Tz和5%浓度的Alg-N和Alg-T(2500eq 5%VLVG)的非平台区和线性拟合的图。图13c是显示荧光素缀合的BSA从使用具有不同点击缀合度的点击物缀合的VLVG材料产生的水凝胶累积释放(以微克计)的图。图13d是显示图13c中曲线的对应于水凝胶形成期间2500摩尔当量的Nb或Tz以及5%浓度的Alg-N和Alg-T(2500eq 5%VLVG)的非平台区和线性拟合的图。图13e是显示荧光素缀合的IgG从使用具有不同点击缀合度的点击物缀合的VLVG材料产生的水凝胶累积释放(以微克计)的图。图13f是显示图13e中曲线的对应于水凝胶形成期间2500摩尔当量的Nb或Tz和5%浓度的Alg-N和Alg-T(2500eq 5%VLVG)的非平台区和线性拟合的图。图13g是显示荧光素缀合的胰岛素、BSA和IgG从通过Ca2+介导交联产生的水凝胶累积释放(以微克计)的图。
图13a-13g中显示的数据表明,蛋白质自藻酸盐水凝胶的释放曲线可能受到藻酸盐的点击取代度的影响。具体而言,数据显示较高的点击取代度降低了蛋白质从水凝胶的“初始爆发”。使用具有较高点击取代度的藻酸盐允许产生具有较小“目径”的水凝胶,其继而允许实现较长的蛋白质释放时间。例如,如图13b、13d和13f所示,具有最高点击取代度(2500当量)的藻酸盐产生在数天内提供线性蛋白质释放速率的水凝胶。相比之下,自其他材料制备的水凝胶提供数小时而非数天内的非线性的“爆发式”蛋白释放。其他材料的势力描述于例如KS Anseth等,Biomed.Mater.Res.A,2009,90:720-729;PP Kundu等,Carbohydrate Polymers,2014,112:627-637;T.Bal等,J.Biomed.Mater.Res.Part A,2014.102A:487-495;C.E.Schmidt等,Biomaterials,2005,26:125-135;Y.M.Lee等,Macromol.Research,2006.14:87-93;C.P.Covas等,Mat.Sci.App.2011.2:509-520;W.F.Mieler等,Trans.Am.Ophtalmol.Soc.,2008.106:206-214;W.M.Tian等,ControlledRelease,2005.102:13-22中。
实施例14.藻酸盐氧化程度和藻酸盐浓度对蛋白质释放速率的影响
本实验的目的是研究凝胶化过程中藻酸盐氧化程度和藻酸盐浓度对点击藻酸盐水凝胶中包封的各种蛋白质的释放速率的影响。本实验利用如实施例1中所述最初被高碘酸钠氧化至5%或10%氧化度的LF 20/40藻酸盐材料。随后,使用实施例2中描述的程序,将氧化的LF 20/40藻酸盐用氨硼烷(AB)还原处理或用亚氯酸钠(SC)进一步氧化。然后使用2000摩尔当量的Nb或Tz一级实施例4中描述的程序使该材料与Nb或Tz缀合。随后,将该材料用于制备水凝胶和以5%或10%w/v藻酸盐浓度包封胰岛素或IgG。如实施例13所述监测蛋白质释放曲线。
图14a是显示荧光素缀合的胰岛素从使用被氧化至5%或10%且然后用AB还原处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图14b是显示荧光素缀合的胰岛素从使用被氧化至5%或10%且然后用SC氧化处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图14c是显示荧光素缀合的IgG从使用被氧化至5%或10%且然后用AB还原处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图14d是显示荧光素缀合的IgG从使用被氧化至5%或10%且然后用SC氧化处理的浓度为5%w/v的点击物缀合的LF 20/40藻酸盐产生的水凝胶累积释放(以微克计)的图。
图14a-14d中的数据表明,通过在凝胶化过程期间改变用于经Ab和SC处理材料的藻酸盐氧化程度和藻酸盐材料的浓度,可以实现对蛋白质释放曲线的调节。
实施例15.存在于氧化的藻酸盐中的醛对点击部分的影响。
本实验的目标是确定缀合至藻酸盐的点击部分在醛存在下的稳定性。为此,将未氧化的MVG材料在使用250当量点击材料的缀合反应中与Nb或Tz缀合,并随后暴露于2.3%的戊二醛。观察小瓶的颜色变化长达69小时。图15a是在0分钟、40分钟、21.5小时和67.5小时之后拍摄的在2.3%戊二醛存在下含有与Nb(左小瓶)和Tz(右小瓶)缀合的4%MVG材料的玻璃小瓶的一系列图片。图15b是在0分钟、40分钟、20小时和69小时后拍摄的含有作为对照的水(左小瓶)或与DBCO(中间小瓶)或叠氮化物(右小瓶)缀合的2%MVG材料的玻璃小瓶的一系列图片。图15a中的数据表明在暴露于醛40分钟后观察到Nb和Tz的降解。DBCO和叠氮化物的降解需要更长的时间,但可以在20小时后观察到,如图15b中的数据所证明。因为醛是在藻酸盐氧化时产生的,所以该实验表明,与藻酸盐缀合的点击部分预期将会在藻酸盐氧化时降解。因此,为了保持点击部分的稳定性,醛必须例如用氨硼烷还原来还原消除,或者例如用亚氯酸钠进一步氧化来氧化消除。
实施例16.藻酸盐水凝胶包封和保留脂质体
本实验的目的是研究由点击物缀合的藻酸盐产生的水凝胶包封脂质体并提供完整脂质体在体内持续和局部递送的能力。本实验使用由1,2-二油酰-sn-甘油-3-磷酸胆碱(DOPC)和胆固醇(CHOL)以55:45的DOPC/CHOL比制备,且总脂质浓度为50mM的市售脂质体。脂质体还含有浓度为0.5mM(0.47mg/mL)的荧光染料1,1'-二十八烷基-3,3,3',3'-四甲基吲哚羰花青高氯酸盐(Dil),并具有133nm的平均直径。通过在CaSO4和脂质体存在下以2%或5%w/v的藻酸盐浓度交联,将脂质体包封在由未氧化的MVG材料制备的水凝胶中。还将脂质体包封在由未氧化的MVG材料制备的水凝胶中并使其在脂质体存在下以5%w/v的藻酸盐浓度凝胶化,所述MVG材料使用250摩尔当量的Nb或Tz而与Nb或Tz缀合。最后,还将脂质体包封在由如例如Koshy等,Advanced Healthcare Materials 2016,第5卷,第5期,第541-547页中所述制备的点击物缀合的明胶制备的水凝胶中。通过测量上清液中Dil荧光的增加来体外监测自水凝胶的脂质体释放。使用平板读数器相对于标准曲线对上清液蛋白质含量进行定量,所述平板读数器在550nm处具有荧光激发且在580nm处发射。
图16a是显示在50天期间内脂质体从Ca2+交联藻酸盐和从非氧化的点击物缀合的藻酸盐累积释放(%负载)的图。图16b是显示脂质体从Ca2+交联藻酸盐水凝胶、非氧化的点击物缀合的藻酸盐水凝胶和点击明胶水凝胶累积释放(%负载)的图。这些结果表明,在30天后观察到脂质体从点击明胶水凝胶的定量释放。相反,藻酸盐水凝胶在保留脂质体方面更有效。具体而言,未氧化的点击物缀合的的藻酸盐水凝胶在50天后保留了至少约95%的脂质体负载,而Ca2+交联的藻酸盐水凝胶在40天后保留了约85%的脂质体负载。该数据表明,在所研究的水凝胶中,未氧化的点击物缀合的藻酸盐水凝胶在40天或更多天内保留脂质体方面是最有效的。
图16c是显示在28天期间内脂质体从以5%w/v藻酸盐浓度制备的Ca2+交联藻酸盐和非氧化的点击物缀合的藻酸盐水凝胶累积释放(%负载)的图。在PBS--中体外测量脂质体释放曲线,PBS--是不含Ca2+或Mg2+离子的PBS缓冲液。
图16c中的数据表明在28天后约60%的脂质体负载从Ca2+交联的藻酸盐水凝胶释放。藻酸盐在脂质体存在下的钙交联对封装的脂质体造成显著的异质性和剪切应力,导致脂质体释放。相反,未氧化的点击物缀合的藻酸盐水凝胶能够保持其脂质体负载至少20天。
图16d是显示在8天期间内脂质体从未氧化的点击物缀合的藻酸盐水凝胶和点击物缀合的明胶水凝胶累积释放(%负载)的图。添加能够消化藻酸盐的藻酸盐裂解酶导致脂质体从未氧化的点击物缀合的藻酸盐水凝胶中快速释放。添加能够消化明胶的胶原酶导致脂质体从点击物缀合的明胶水凝胶中快速释放。由于胶原酶在体内(例如在人体内)无处不在,所以预期点击物缀合的明胶水凝胶会在体内降解。相比之下,藻酸盐裂解酶在体内并不普遍,因此如果未被氧化,则预期藻酸盐水凝胶在体内保持完整。伴随氧化,藻酸盐降解是pH依赖性的。
实施例17.封装后脂质体的完整性
本实验的目的是评估脂质体保持完整(例如在包封后保持其直径并从不同水凝胶中回收)的能力。在本实验中研究的水凝胶包括如实施例16中所述的钙交联的藻酸盐水凝胶、未氧化的点击物缀合的藻酸盐水凝胶和点击物缀合的明胶水凝胶。通过动态光散射(DLS)测量脂质体的尺寸。
图17a是脂质体标准品的动态光散射(DLS)迹线。
图17b是8天后从用藻酸盐裂解酶消化的未氧化的点击物缀合的藻酸盐水凝胶释放的脂质体的DLS迹线。
图17c是28天后从以PBS-缓冲液中5%w/v的藻酸盐浓度制备的未氧化的点击物缀合的藻酸盐水凝胶释放的脂质体的DLS迹线。
图17d是8天后从用胶原酶消化的点击物缀合的明胶水凝胶释放的脂质体的DLS迹线。
图17e是3天后从PBS-缓冲液中制备的钙交联藻酸盐释放的脂质体的DLS迹线。
图17f是28天后从以PBS-缓冲液中5%w/v的藻酸盐浓度制备的钙交联水凝胶释放的脂质体的DLS迹线。
图17a-17f中的数据表明,从点击物缀合的藻酸盐或明胶水凝胶释放的脂质体与脂质体标准品具有相似的大小,这表明它们在28天后保持完整。相比之下,从钙盐交联的藻酸盐水凝胶释放的脂质体比脂质体标准品具有明显更大的尺寸范围。这表明在钙交联过程中,脂质体由于剪切力而被撕裂,随后在溶液中经历聚集,导致更大尺寸的脂质体粒子。由于钙分布不均,钙交联还引入显著的不均匀性。
实施例18.藻酸盐氧化程度对藻酸盐水凝胶保留脂质体的能力的影响
本实验的目的是评估藻酸盐水凝胶中藻酸盐氧化程度对其保留包封的脂质体的能力的影响。本实验利用由MVG藻酸盐材料制备的藻酸盐水凝胶,所述藻酸盐材料在点击缀合反应中使用250当量的Nb或Tz交联至Nb或Tz。在点击物缀合之前,藻酸盐被氧化至0%、5%或10%的总氧化度,然后使用如实施例1和2所述的程序采用AB还原处理。将实施例16中所述的脂质体包封在水凝胶中,并通过在75天期间内测量上清液中Dil荧光的增加来体外监测它们的释放。
图18是显示在75天内脂质体从在点击物缀合之前被氧化至0%、5%和10%总氧化度并用AB还原处理的点击物缀合的藻酸盐水凝胶累积释放(%负载)的图。图18中的结果表明,在点击物缀合之前将藻酸盐氧化至5%或10%并随后将藻酸盐还原允许脂质体在75天期间内保留,具有可检测的脂质体释放,而未氧化的藻酸盐在75天内释放约3%的脂质体。因此,藻酸盐的氧化改善了藻酸盐水凝胶对脂质体的保留。
实施例19.pH对藻酸盐水凝胶稳定性的影响
本实验的目的是研究脂质体货物从藻酸盐水凝胶的释放随pH的变化。因为藻酸盐生物降解是酸或碱介导的,所以在14天内在pH 5(在0.1M柠檬酸钠缓冲液中)和pH 9(在0.1M硼酸钠缓冲液中)下监测脂质体货物从藻酸盐水凝胶中的释放。通过首先将MVG藻酸盐氧化至20%氧化度并随后使用氨硼烷将材料还原来制备样品。7天后,pH 9样品大部分被降解,14天后,发现pH 5样品也降解。
图19a是含有具有包封的脂质体的水凝胶、水凝胶和上清液的管在第0天的图片,所述水凝胶包含用氨硼烷还原的20%氧化MVG。图19b是含有具有包封的脂质体的水凝胶和上清液的管在第1天的图片,所述水凝胶使用已经用氨硼烷还原的20%氧化MVG来制备。图19c是含有具有包封的脂质体的水凝胶和上清液的管在第7天的图片,所述水凝胶使用已经用氨硼烷还原的20%氧化MVG来制备。图19d是含有具有包封的脂质体的水凝胶和上清液的管在第14天的图片,所述水凝胶使用已经用氨硼烷还原的20%氧化MVG来制备。图19e是显示中性脂质体(DOPC:胆固醇)从通过将藻酸盐氧化至20%并随后将其用氨硼烷还原而产生的藻酸盐水凝胶的基于降解的释放的图。样品在pH6.5的MES缓冲液中释放以模拟瘤周微环境。
图19a-19d中的结果表明藻酸盐被降解,并且脂质体在酸性pH(pH 5)或碱性pH(pH9)下扩散到上清液中,但未在中性pH(7)下扩散到上清液中。因此,自点击藻酸盐水凝胶的脂质体释放是pH敏感的,并且允许脂质体货物的降解介导的释放。
实施例20.藻酸盐水凝胶包封和保留阳离子脂质体
先前的实验(例如,实施例16中所述的实验)利用了中性的DOPC/CHOL脂质体。本实验的目的是研究藻酸盐水凝胶包封和保留带电脂质体如阳离子脂质体的能力。本实验利用平均直径为133nm的含有N-[1-(2,3-二油酰氧基)丙基]-N,N,N-三甲基甲基硫酸铵(DOTAP)和氢化大豆磷脂酰胆碱(Hydro Soy PC)的阳离子脂质体。脂质体还含有荧光染料1,1'-二十八烷基-3,3,3',3'-四甲基吲哚羰花青高氯酸盐(Dil)。将这些脂质体包封在钙交联的藻酸盐材料中以及未氧化的点击物缀合的藻酸盐中,所述未氧化的点击物缀合的藻酸盐在缀合反应中使用250摩尔当量的点击试剂。如实施例16所述监测阳离子脂质体从水凝胶中的释放。
图20a是挤出之前的DOTAP:Hydro Soy PC脂质体的DLS迹线,而图20b是挤出之后的同一脂质体的DLS迹线。图20a和20b证明可以使用挤出制备尺寸均匀的阳离子脂质体。
图20c是显示17天期间阳离子脂质体从Ca2+交联藻酸盐和未氧化的点击物缀合的藻酸盐水凝胶累积释放(%负载)的图。图20c中的结果表明,点击物缀合的藻酸盐水凝胶可以在17天的时间内包封并有效保留阳离子脂质体。相反,阳离子脂质体从钙交联的藻酸盐水凝胶中的释放仅在2天后即为明显的。
实施例21.藻氧醇和藻氧羧酸盐复合点击水凝胶的蛋白质释放曲线
本实验的目标是评估不同的蛋白质从使用已经点击物缀合的不同氧化的和还原的藻酸盐材料制备的水凝胶释放的曲线。用于制备藻酸盐水凝胶的组合物包括:a)等份的以下MVG:已被氧化至50%且随后用亚氯酸钠氧化并与2000当量的Tz缀合的10%w/v MVG,和已被氧化至10%且随后用氨硼烷还原并与2000当量的Nb缀合的10%w/v MVG;b)等份的以下MVG:已被氧化至50%且随后用氨硼烷还原并与250当量的Tz缀合的10%w/v MVG,和已被氧化至10%且随后用氨硼烷还原并与250当量的Nb缀合的10%w/v MVG;c)7份已被氧化至10%且随后用氨硼烷还原并与2000当量的Nb缀合的10%w/v MVG,和3份已被氧化至50%且随后用氨硼烷还原并与2000当量的Tz缀合的10%w/v MVG;和d)3份MVG和1份已与硫酸钙交联的MVG。
通过将人IGF和人VEGF(R&D Systems)包封在各种点击水凝胶中来评估蛋白质释放曲线。通过首先将各种取代度的冷冻干燥的Alg-N和Alg-T聚合物分别溶解于PBS中至最终所需浓度(w/v)来制备样品。加入蛋白质并与Alg-N溶液混合以达到2μg/凝胶(100μL)最终浓度。将蛋白-Alg-N溶液与Alg-T溶液彻底混合并使其凝胶化至少30分钟。通过向各凝胶添加1mL具有1%BSA的PBS并在37℃孵育来产生样品。在各个时间点收集样品,并在每个时间点替换上清液。使用可比样品基质(分别为PBS w/1%BSA和PBS w/5%Tween 20)的标准曲线,用人VEGF和IGF Quantikine ELISA试剂盒(R&D Systems)对具有VEGF和IGF的上清液蛋白含量进行定量。
图21a是显示IGF-1从使用各种藻酸盐组合物制备的点击物缀合的藻酸盐水凝胶释放的图。图21b是显示VEGF165从使用各种藻酸盐组合物制备的点击藻酸盐水凝胶释放的图。
图21a和21b中的数据显示出使用点击凝胶调节IGF-1和VEGF165的爆发释放的能力,所述点击凝胶使用不同的藻酸盐组合物制备。相反,钙交联的藻酸盐水凝胶不能调节扩散。该实施例表明,可能通过含有藻氧醇和藻氧羧酸盐的藻酸盐、藻酸盐取代度,藻酸盐浓度、以及Nb对Tz的比率的各种组合来调节蛋白质释放。
实施例22.藻酸盐溶液的粘度
本实验的目标是研究随藻酸盐氧化和/或还原变化的点击物缀合的藻酸盐溶液的粘度。为此,通过首先分别将冻干的Alg-N和Alg-T聚合物溶解在ddH2O中至最终所需浓度(w/v)来评估点击藻酸盐溶液的相对粘度。将溶液直接移液到TA Instruments ARG2流变仪的底板上,所述流变仪配有20mm的平坦上平板几何结构和400微米的几何间隙。使用珀尔帖冷却器来控制温度(20℃)。藻酸盐样品经受0.1和1Hz之间的应变。
图22是显示在不同藻酸盐浓度(%w/v)、氧化程度和用亚氯酸钠或氨硼烷处理下各种藻酸盐溶液的相对粘度的条形图。这些数据表明,与未经氧化的MVG的点击缀合不会导致粘度的显著差异,而在点击缀合至含有藻氧醇或藻氧羧酸盐的藻酸盐的情况下,粘度大幅度降低,并且与水的粘度相当(0.890cPa,25℃)。
Claims (51)
2.权利要求1所述的组合物,其中所述还原的藻酸盐是通过以下产生的:使藻酸盐与二醇特异性氧化剂反应,由此产生包含0.1%或更多的摩尔氧化度的含有二醇的氧化的藻酸盐;
随后使所述氧化的藻酸盐与水溶性醛特异性还原剂反应以产生所述还原的藻酸盐,其中所述水溶性醛特异性还原剂不是硼氢化钠(NaBH4)。
3.权利要求2所述的组合物,其中所述水溶性醛特异性还原剂选自氰基硼氢化钠(NaCNBH3);催化剂存在下的氢气(H2);氨硼烷(H3NBH3);和硼烷复合物。
4.权利要求3所述的组合物,其中所述水溶性醛特异性还原剂是氨硼烷。
5.权利要求2所述的组合物,其中所述二醇特异性氧化剂是高碘酸钠。
6.权利要求1-5中任一项所述的组合物,其中所述组合物还包含连接至所述还原的藻酸盐的交联剂。
7.权利要求6所述的组合物,其中所述交联剂是点击试剂。
8.权利要求7所述的组合物,其中所述点击试剂选自叠氮化物、二苯并环辛炔(DBCO)、反式环辛烯、四嗪和降冰片烯及其变体。
10.权利要求9所述的水凝胶,其中所述还原的藻酸盐聚合物是通过包括以下步骤的方法产生的:
使藻酸盐与二醇特异性氧化剂反应以产生含醛的氧化的藻酸盐;和
使所述含醛的氧化的藻酸盐与水溶性醛特异性还原剂反应,由此产生所述还原的藻酸盐聚合物。
11.权利要求10所述的水凝胶,其中所述二醇特异性氧化剂是高碘酸钠。
12.权利要求10所述的水凝胶,其中所述水溶性醛特异性还原剂是氨硼烷。
13.权利要求9所述的水凝胶,其中所述水凝胶包含10nm至1nm的平均目径。
14.权利要求13所述的水凝胶,其还包含治疗剂或诊断剂。
15.权利要求14所述的水凝胶,其中所述治疗剂或诊断剂选自细胞、小分子和生物制剂。
16.权利要求15所述的水凝胶,其中所述生物制剂选自肽、DNA分子、RNA分子和PNA分子。
17.权利要求16所述的水凝胶,其中所述生物制剂是肽。
18.权利要求17所述的水凝胶,其中所述肽具有500kDa或更小的分子量。
19.权利要求17所述的水凝胶,其中所述肽是血管生成因子。
20.权利要求19所述的水凝胶,其中所述血管生成因子选自FGF、VEGF、VEGFR、NRP-1、Ang1、Ang2、PDGF、PDGFR、IGF、TGF-β、内皮糖蛋白、TGF-β受体、MCP-1、整合素、整合素配体、VE-钙粘蛋白、CD31、肝配蛋白、纤溶酶原激活物、纤溶酶原激活物抑制剂-1、eNOS、COX-2、AC133、ID1、ID3和HGF。
21.权利要求20所述的水凝胶,其中所述血管生成因子是VEGF。
22.权利要求15所述的水凝胶,其中所述细胞是哺乳动物细胞。
23.权利要求22所述的水凝胶,其中所述哺乳动物细胞是人间充质干细胞(hMSC)。
24.权利要求9所述的水凝胶,其中所述藻酸盐聚合物包含连接至所述藻酸盐聚合物的交联剂。
25.权利要求24所述的水凝胶,其中所述交联剂是点击试剂。
26.权利要求25所述的水凝胶,其中所述点击试剂选自叠氮化物,二苯并环辛炔,反式环辛烯,四嗪和降冰片烯及其变体。
27.包含权利要求9所述的水凝胶的可植入或可注射装置。
29.权利要求28所述的方法,其中所述醛特异性水溶性还原剂选自氰基硼氢化钠(NaCNBH3);催化剂存在下的氢气(H2);氨硼烷(H3NBH3);或硼烷复合物。
30.权利要求29所述的方法,其中所述醛特异性水溶性还原剂是氨硼烷。
31.权利要求28所述的方法,其中所述二醇特异性氧化剂是高碘酸钠。
32.权利要求28所述的方法,其还包括使所述还原的藻酸盐与交联剂反应。
33.权利要求32所述的方法,其中所述交联试剂是点击试剂。
34.权利要求33所述的方法,其中所述点击试剂选自叠氮化物、二苯并环辛炔(DBCO)、反式环辛烯、四嗪和降冰片烯及其变体。
35.权利要求28所述的方法,其中所述藻酸盐具有小于500kDa的分子量。
36.一种药物递送组合物,其包含
包封治疗剂或诊断剂的基于脂质的纳米颗粒;和
包封所述基于脂质的纳米颗粒的权利要求9所述的水凝胶。
37.权利要求36所述的药物递送组合物,其中所述基于脂质的纳米颗粒是脂质体。
38.权利要求37所述的药物递送组合物,其中所述基于脂质的纳米颗粒是病毒体。
39.权利要求36所述的药物递送组合物,其中所述基于脂质的纳米颗粒保持包封在所述水凝胶中至少1天。
40.权利要求36所述的药物递送组合物,其中所述治疗剂或诊断剂选自细胞、小分子和生物制剂。
41.权利要求40所述的药物递送组合物,其中所述生物制剂选自肽、抗体或其片段、疫苗、DNA分子、RNA分子和PNA分子。
42.权利要求36所述的药物递送组合物,其中所述治疗剂或诊断剂选自STING佐剂、CRISPR-Cas9试剂和佐剂负载的源自经破坏癌细胞的亚细胞囊泡。
43.权利要求36所述的药物递送组合物,其中所述治疗剂或诊断剂是疫苗。
44.有效量的权利要求9-26中任一项所述的水凝胶、权利要求27所述的可植入或可注射装置或者权利要求36-43中任一项所述的药物递送组合物在制备用于治疗有需要的受试者的药物中的用途。
45.根据权利要求44所述的用途,其中所述受试者患有选自以下的疾病或病症:局部缺血、眼睛相关的病症或耳部相关的病症。
46.有效量的权利要求9-26中任一项所述的水凝胶、权利要求27所述的可植入或可注射装置或者权利要求36-43中任一项所述的药物递送组合物在制备用于在有需要的受试者中治疗慢性局部缺血或增强移植组织的移植成活率的药物中的用途。
47.权利要求44-46中任一项所述的用途,其中所述水凝胶或者所述可植入或可注射装置或者所述药物递送组合物为局部施用。
48.权利要求47所述的用途,其中将所述水凝胶或者所述可植入或可注射装置或者所述药物递送组合物局部注射至局部缺血部位,或在移植之前和/或之后局部注射至进行移植的组织。
49.权利要求48所述的用途,其中当以可溶形式递送肽时,所述水凝胶或者所述可植入或可注射装置或者所述药物递送组合物以比所述肽的推荐剂量小至少10倍的剂量包含所述肽。
50.权利要求49所述的用途,其中所述肽是VEGF和IGF。
51.权利要求44所述的用途,其中所述受试者是人。
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| CN202210460332.2A CN115073625B (zh) | 2015-10-26 | 2016-10-26 | 还原和氧化的多糖及其使用方法 |
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US201562246462P | 2015-10-26 | 2015-10-26 | |
| US62/246,462 | 2015-10-26 | ||
| US201662351162P | 2016-06-16 | 2016-06-16 | |
| US62/351,162 | 2016-06-16 | ||
| PCT/US2016/058866 WO2017075055A1 (en) | 2015-10-26 | 2016-10-26 | Reduced and oxidized polysaccharides and methods of use thereof |
Related Child Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210460332.2A Division CN115073625B (zh) | 2015-10-26 | 2016-10-26 | 还原和氧化的多糖及其使用方法 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN108430458A CN108430458A (zh) | 2018-08-21 |
| CN108430458B true CN108430458B (zh) | 2022-05-10 |
Family
ID=58630738
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201680062497.7A Active CN108430458B (zh) | 2015-10-26 | 2016-10-26 | 还原和氧化的多糖及其使用方法 |
| CN202210460332.2A Active CN115073625B (zh) | 2015-10-26 | 2016-10-26 | 还原和氧化的多糖及其使用方法 |
Family Applications After (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN202210460332.2A Active CN115073625B (zh) | 2015-10-26 | 2016-10-26 | 还原和氧化的多糖及其使用方法 |
Country Status (6)
| Country | Link |
|---|---|
| US (2) | US10780171B2 (zh) |
| EP (2) | EP3821880A1 (zh) |
| JP (2) | JP7025021B2 (zh) |
| CN (2) | CN108430458B (zh) |
| ES (1) | ES2846848T3 (zh) |
| WO (1) | WO2017075055A1 (zh) |
Families Citing this family (19)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2015168379A2 (en) | 2014-04-30 | 2015-11-05 | President And Fellows Of Harvard College | Combination vaccine devices and methods of killing cancer cells |
| CN108430458B (zh) | 2015-10-26 | 2022-05-10 | 哈佛学院院长等 | 还原和氧化的多糖及其使用方法 |
| WO2017136837A1 (en) | 2016-02-06 | 2017-08-10 | President And Fellows Of Harvard College | Recapitulating the hematopoietic niche to reconstitute immunity |
| CN109789092A (zh) | 2016-07-13 | 2019-05-21 | 哈佛学院院长等 | 抗原呈递细胞模拟支架及其制备和使用方法 |
| MA40103B1 (fr) * | 2017-03-08 | 2018-11-30 | Mustapha Benmoussa | Procédé de préparation d'un revêtement pour améliorer l'efficacité et la qualité des engrais. |
| US10485253B2 (en) | 2017-08-21 | 2019-11-26 | Mustapha Benmoussa | Method of microalgal biomass processing for high-value chemicals production, the resulting composition of butyrogenic algal slowly fermenting dietary fiber, and a way to improve colon health using a slowly fermenting butyrogenic algal dietary fiber |
| BR112020026670A2 (pt) | 2018-06-28 | 2021-03-30 | Hallura Ltd. | Polissacarídeos policarboxilados reticulados e métodos de uso dos mesmos |
| CN110433335B (zh) * | 2019-08-19 | 2021-12-03 | 江苏地韵医疗科技有限公司 | 梯度密度型软骨修复用水凝胶及其制备方法 |
| CN110954514B (zh) * | 2019-12-02 | 2022-06-21 | 上海交通大学 | 适用于研究脂质体体内外分布的荧光示踪系统和方法 |
| CN114929754A (zh) * | 2019-12-18 | 2022-08-19 | 持田制药株式会社 | 新型交联海藻酸 |
| WO2021155297A1 (en) * | 2020-01-29 | 2021-08-05 | President And Fellows Of Harvard College | Methods for labeling and targeting cells |
| CN111603608B (zh) * | 2020-05-15 | 2021-12-10 | 南通大学 | 普鲁兰多糖-透明质酸-微纤维脊髓支架及其制备方法 |
| CN111743857A (zh) * | 2020-07-30 | 2020-10-09 | 瑞希(重庆)生物科技有限公司 | 一种壳聚糖水凝胶及其制备方法 |
| CN112321745A (zh) * | 2020-11-18 | 2021-02-05 | 华东理工大学 | 降冰片烯衍生物改性海藻酸钠 |
| US20240156839A1 (en) * | 2021-03-05 | 2024-05-16 | Taiwan Liposome Company, Ltd. | Pharmaceutical compositions with reduced side effect and methods of using the same |
| CN113512133B (zh) * | 2021-05-26 | 2022-09-13 | 江苏诺瓦立医疗用品有限公司 | 生物组织粘合剂的制备方法 |
| CN115414382B (zh) * | 2022-06-23 | 2024-03-26 | 南京邮电大学 | 级联放大气体治疗平台及其制备方法和应用 |
| CN115260341B (zh) * | 2022-07-29 | 2023-05-02 | 国药集团化学试剂有限公司 | 一种高质量琼脂糖及其制备方法 |
| WO2024104186A1 (zh) * | 2022-11-17 | 2024-05-23 | 菲鹏生物股份有限公司 | 化合物及其制备方法和封闭剂 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1301179A (zh) * | 1998-03-31 | 2001-06-27 | 赫姆索尔公司 | 血红蛋白-多糖缀合物 |
| US20040028745A1 (en) * | 1998-10-09 | 2004-02-12 | The Regents Of The University Of Michigan | Hydrogels and water soluble polymeric carriers for durg delivery |
Family Cites Families (64)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US3270960A (en) | 1964-09-11 | 1966-09-06 | Sperry Rand Corp | Fluid sensor |
| US3516838A (en) * | 1966-07-14 | 1970-06-23 | Gen Foods Corp | Intermediate moisture foodstuffs containing reduced polysaccharides |
| US3773919A (en) | 1969-10-23 | 1973-11-20 | Du Pont | Polylactide-drug mixtures |
| US3784475A (en) | 1971-11-17 | 1974-01-08 | Procter & Gamble | Detergent compositions containing oxidized polysaccharide builders |
| JPS5840477B2 (ja) * | 1978-08-11 | 1983-09-06 | 名糖産業株式会社 | 新規β−1,3−グルカン、その製法及び利用 |
| US5108922A (en) | 1986-07-01 | 1992-04-28 | Genetics Institute, Inc. | DNA sequences encoding BMP-1 products |
| US5106748A (en) | 1986-07-01 | 1992-04-21 | Genetics Institute, Inc. | Dna sequences encoding 5 proteins |
| US5187076A (en) | 1986-07-01 | 1993-02-16 | Genetics Institute, Inc. | DNA sequences encoding BMP-6 proteins |
| US5013649A (en) | 1986-07-01 | 1991-05-07 | Genetics Institute, Inc. | DNA sequences encoding osteoinductive products |
| ZA874681B (en) | 1986-07-01 | 1988-04-27 | Genetics Inst | Novel osteoinductive factors |
| ATE209251T1 (de) | 1990-05-16 | 2001-12-15 | Genetics Inst | Knochen- und knorpel-bildung hervorrufende proteine |
| CA2029006C (en) | 1990-07-27 | 2001-07-17 | Michael R. Detty | Dicarboxylic acid oxidation products |
| DE69228118T2 (de) | 1991-06-25 | 1999-08-19 | Genetics Institute | Bmp-9 zusammensetzungen |
| JP3504263B2 (ja) | 1991-11-04 | 2004-03-08 | ジェネティックス・インスチチュート・リミテッド・ライアビリティ・カンパニー | 組み換え型骨形態形成蛋白ヘテロダイマー、組成物および使用法 |
| KR0172186B1 (ko) | 1992-02-12 | 1999-02-01 | 미하엘 파울리스타 | 신규의 성장/분화인자를 암호화하는 dna 서열 |
| IL106278A0 (en) | 1992-07-13 | 1993-11-15 | Sumitomo Metal Ind | Bone formation-inducing protein |
| WO1994004567A1 (en) * | 1992-08-21 | 1994-03-03 | La Jolla Cancer Research Foundation | A matrix-associating dna-protein, nucleic acids encoding the same and methods for detecting the nucleic acids |
| DK0662146T3 (da) | 1992-09-03 | 2000-11-13 | Univ California | Dorsalvævpåvirkende faktor og præparat |
| EP0678101A4 (en) | 1993-01-12 | 1997-07-16 | Univ Johns Hopkins Med | GROWTH DIFFERENTIATION FACTOR-9. |
| EP1439190A1 (en) | 1993-01-12 | 2004-07-21 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-5 |
| JPH08505771A (ja) | 1993-01-12 | 1996-06-25 | ジョーンズ ホプキンス ユニバーシティー スクール オブ メディシン | 増殖分化因子−3 |
| EP1333035A3 (en) | 1993-03-19 | 2004-07-07 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-8 |
| EP1378572B1 (en) | 1993-05-12 | 2006-10-25 | Genetics Institute, LLC | Bmp-11 compositions |
| JPH09501305A (ja) | 1993-05-12 | 1997-02-10 | ジェネティックス・インスティテュート・インコーポレイテッド | Bmp−10組成物 |
| EP0717633A4 (en) | 1993-07-09 | 1998-05-20 | Univ Johns Hopkins Med | GROWTH DIFFERENTIATION FACTOR-7 |
| EP0804214A4 (en) | 1993-07-09 | 1998-05-20 | Univ Johns Hopkins Med | FACTOR 6 OF CELL GROWTH AND DIFFERENTIATION |
| US6291206B1 (en) | 1993-09-17 | 2001-09-18 | Genetics Institute, Inc. | BMP receptor proteins |
| EP1559726A3 (en) | 1993-10-08 | 2006-01-25 | The Johns Hopkins University School Of Medicine | Growth differentiation factor-10 |
| JP3717930B2 (ja) | 1993-12-07 | 2005-11-16 | ジェネティックス・インスチチュート・リミテッド・ライアビリティ・カンパニー | Bmp−12、bmp−13およびそれらの腱誘導組成物 |
| AU704178B2 (en) | 1993-12-30 | 1999-04-15 | Imperial Cancer Research Technology Ltd | Vertebrate embryonic pattern-inducing hedgehog-like proteins |
| JPH07250688A (ja) | 1994-01-28 | 1995-10-03 | Sagami Chem Res Center | TGF−βスーパーファミリー蛋白質をコードするヒト新規cDNA |
| ATE305036T1 (de) | 1994-07-08 | 2005-10-15 | Univ Johns Hopkins Med | Wachstums-differenzierungsfaktor-11 |
| US5929213A (en) | 1994-07-13 | 1999-07-27 | The Johns Hopkins University School Of Medicine | Antibodies to growth differentiation factor-12 |
| US5502042A (en) * | 1994-07-22 | 1996-03-26 | United States Surgical Corporation | Methods and compositions for treating wounds |
| US6281332B1 (en) | 1994-12-02 | 2001-08-28 | The Johns Hopkins University School Of Medicine | Hedgehog-derived polypeptides |
| US5635372A (en) | 1995-05-18 | 1997-06-03 | Genetics Institute, Inc. | BMP-15 compositions |
| US5965403A (en) | 1996-09-18 | 1999-10-12 | Genetics Institute, Inc. | Nucleic acids encoding bone morphogenic protein-16 (BMP-16) |
| AU733716B2 (en) | 1996-09-19 | 2001-05-24 | Regents Of The University Of Michigan, The | Polymers containing polysaccharides such as alginates or modified alginates |
| GB2320502B (en) * | 1996-12-20 | 2000-09-20 | Johnson & Johnson Medical | Bioresorbable alginate derivatives |
| JP4247846B2 (ja) * | 1997-07-03 | 2009-04-02 | デュピュイ・スパイン・インコーポレーテッド | 架橋ポリサッカリド薬物キャリア |
| DE69840673D1 (de) * | 1997-12-09 | 2009-04-30 | Biomed Frontiers Inc | Modifizierte polysaccharide mit veränderter biologischer erkennung |
| JP4186294B2 (ja) | 1999-02-26 | 2008-11-26 | セイコーエプソン株式会社 | ポリグルロン酸の製造方法 |
| JP4192467B2 (ja) * | 2001-12-17 | 2008-12-10 | 凸版印刷株式会社 | 酸化多糖類材料の製造方法及び酸化多糖類材料 |
| WO2003072155A1 (en) | 2002-02-21 | 2003-09-04 | Encelle, Inc. | Cross-linked bioactive hydrogel matrices |
| JP2006016519A (ja) * | 2004-07-02 | 2006-01-19 | Toppan Printing Co Ltd | 架橋重合体及びその製造方法 |
| US20070243130A1 (en) * | 2006-04-18 | 2007-10-18 | Weiliam Chen | Biopolymer system for tissue sealing |
| FR2919189A1 (fr) * | 2007-07-26 | 2009-01-30 | Cyclopharma Sa Lab | Nouvelles compositions a base de polyosides greffes par des composes polyamines ou polysoufres. |
| WO2009079537A1 (en) | 2007-12-17 | 2009-06-25 | New World Pharmaceuticals, Llc | Sustained release of nutrients in vivo |
| US8563066B2 (en) | 2007-12-17 | 2013-10-22 | New World Pharmaceuticals, Llc | Sustained release of nutrients in vivo |
| CA2722145A1 (en) * | 2008-04-24 | 2009-10-29 | Medtronic, Inc. | Rehydratable thiolated polysaccharide particles and sponge |
| US8273373B2 (en) * | 2008-12-30 | 2012-09-25 | Case Western Reserve University | Photocrosslinked biodegradable hydrogel |
| EP2542230A4 (en) | 2010-03-05 | 2013-08-28 | Harvard College | ENHANCEMENT OF SKELETAL MUSCLE STRAIN CELL GRAFT WITH DUAL DELIVERY OF VEGF AND IGF-1 |
| ES2773858T3 (es) * | 2010-10-06 | 2020-07-15 | Harvard College | Hidrogeles formadores de poros inyectables para terapias celulares basadas en materiales |
| DE102011080202A1 (de) | 2011-08-01 | 2013-02-07 | Gebr. Schmid Gmbh | Vorrichtung und Verfahren zur Herstellung von dünnen Schichten |
| EP2755546A4 (en) | 2011-09-15 | 2015-08-12 | Yoseph Yaacobi | SYSTEMS AND METHODS FOR TREATMENT OF HEARING DISORDERS |
| EP2664329A1 (de) | 2012-05-15 | 2013-11-20 | F. Holzer GmbH | Ophthalmologisches Vehikelsystem |
| FR2991328B1 (fr) * | 2012-06-04 | 2014-05-23 | Symatese | Materiau solide a base de cellulose oxydee, son procede d'obtention et son utilisation comme compresse |
| US20140105960A1 (en) * | 2012-10-12 | 2014-04-17 | Children's Medical Center Corporation | Hydrogels for tissue regeneration |
| US9902705B2 (en) | 2012-10-24 | 2018-02-27 | The General Hospital Corporation | Functionalized 1,2,4,5-tetrazine compounds for use in bioorthogonal coupling reactions |
| AU2014274377A1 (en) * | 2013-05-28 | 2015-11-12 | Momenta Pharmaceuticals, Inc. | Pharmaceutical compositions |
| JP6787789B2 (ja) * | 2014-04-04 | 2020-11-18 | プレジデント アンド フェローズ オブ ハーバード カレッジ | 詰め替え可能な薬物送達デバイスおよびその使用方法 |
| ES2811301T3 (es) * | 2014-04-04 | 2021-03-11 | Harvard College | Hidrogeles reticulados por química clic y métodos de uso |
| WO2016160740A1 (en) * | 2015-04-03 | 2016-10-06 | E I Du Pont De Nemours And Company | Oxidized soy polysaccharide |
| CN108430458B (zh) | 2015-10-26 | 2022-05-10 | 哈佛学院院长等 | 还原和氧化的多糖及其使用方法 |
-
2016
- 2016-10-26 CN CN201680062497.7A patent/CN108430458B/zh active Active
- 2016-10-26 JP JP2018521255A patent/JP7025021B2/ja active Active
- 2016-10-26 ES ES16860689T patent/ES2846848T3/es active Active
- 2016-10-26 CN CN202210460332.2A patent/CN115073625B/zh active Active
- 2016-10-26 EP EP20201770.3A patent/EP3821880A1/en active Pending
- 2016-10-26 WO PCT/US2016/058866 patent/WO2017075055A1/en active Application Filing
- 2016-10-26 US US15/770,937 patent/US10780171B2/en active Active
- 2016-10-26 EP EP16860689.5A patent/EP3368016B1/en active Active
-
2020
- 2020-08-13 US US16/992,385 patent/US11771767B2/en active Active
-
2021
- 2021-12-24 JP JP2021210761A patent/JP7274783B2/ja active Active
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1301179A (zh) * | 1998-03-31 | 2001-06-27 | 赫姆索尔公司 | 血红蛋白-多糖缀合物 |
| US20040028745A1 (en) * | 1998-10-09 | 2004-02-12 | The Regents Of The University Of Michigan | Hydrogels and water soluble polymeric carriers for durg delivery |
Also Published As
| Publication number | Publication date |
|---|---|
| EP3368016B1 (en) | 2020-10-21 |
| US10780171B2 (en) | 2020-09-22 |
| EP3368016A1 (en) | 2018-09-05 |
| CN115073625A (zh) | 2022-09-20 |
| US20180326073A1 (en) | 2018-11-15 |
| JP2019502652A (ja) | 2019-01-31 |
| WO2017075055A9 (en) | 2017-10-05 |
| EP3821880A1 (en) | 2021-05-19 |
| CN115073625B (zh) | 2024-01-16 |
| ES2846848T3 (es) | 2021-07-29 |
| US20200368359A1 (en) | 2020-11-26 |
| US11771767B2 (en) | 2023-10-03 |
| JP7025021B2 (ja) | 2022-02-24 |
| JP7274783B2 (ja) | 2023-05-17 |
| JP2022046645A (ja) | 2022-03-23 |
| WO2017075055A1 (en) | 2017-05-04 |
| EP3368016A4 (en) | 2019-05-22 |
| CN108430458A (zh) | 2018-08-21 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN108430458B (zh) | 还原和氧化的多糖及其使用方法 | |
| Yun et al. | Hyaluronan microspheres for sustained gene delivery and site-specific targeting | |
| US10500157B2 (en) | Nanoparticle-mediated delivery of cytokines for maintenance of the regulatory T cell phenotype | |
| Bi et al. | Reactive oxygen species-responsive gel-based microneedle patches for prolonged and intelligent psoriasis management | |
| DE60124929T2 (de) | Elastomerische, funktionelle, bioabbaubare copolyesteramide und copolyesterurethane | |
| US20230020948A1 (en) | Nanofibrous mat containing ceramic particles with releasable dopant | |
| JP5784142B2 (ja) | ヒアルロン酸−タンパク質コンジュゲート及びその製造方法 | |
| CN102171234A (zh) | 光交联核酸水凝胶 | |
| CN101925347A (zh) | 多糖凝胶组合物及持续递送药物的方法 | |
| WO2013142611A2 (en) | Silk reservoirs for drug delivery | |
| MX2007003789A (es) | Suministro ocular de formulaciones polimericas para suministro. | |
| Sanjanwala et al. | Polysaccharide-based hydrogels for drug delivery and wound management: a review | |
| CN113710806A (zh) | 用于眼部施用治疗剂的药物递送组合物以及其使用方法 | |
| WO2022183126A1 (en) | Microneedles and methods for treating the skin | |
| KR100848712B1 (ko) | 광가교 가능한 온도 감응성 수화겔 조성물 및 이의제조방법 | |
| CN112933038A (zh) | 一种载药温敏性水凝胶递送体系及其制备方法与应用 | |
| CN114652699A (zh) | 一种尺寸转变型纳米递药载体及其制备方法和应用 | |
| EP4212178A1 (en) | Complex | |
| WO2020243602A1 (en) | Bioerodible cross-linked hydrogel implants and related methods of use | |
| CN116898813B (zh) | 用于药物长效缓释的微球、载药微球、载药微球的制备方法及应用 | |
| KR20240120735A (ko) | 네오에피토프 백신 전달 비히클 및 이의 제조 방법 | |
| EP4221758A1 (en) | New combinations of boron compounds and adjuvants for the treatment of pathophysiological conditions and cancer and for muscle regeneration | |
| CN118541164A (zh) | 核酸组合物及其用途 | |
| Holden | MODIFIED PAMAM DENDRIMERS IN TUNABLE DRUG-DELIVERY SYSTEMS: A SUSTAINED-RELEASE DENDRIMER HYDROGEL FOR ANTI-GLAUCOMA DRUGS AND SURFACE-ENGINEERED MACROPHAGES AS NANOPARTICLE CARRIERS FOR TARGETED ANTI-CANCER THERAPY |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| PB01 | Publication | ||
| PB01 | Publication | ||
| SE01 | Entry into force of request for substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| GR01 | Patent grant | ||
| GR01 | Patent grant |