CN102725290A - 作为离子通道调节剂的稠合杂环化合物 - Google Patents
作为离子通道调节剂的稠合杂环化合物 Download PDFInfo
- Publication number
- CN102725290A CN102725290A CN2010800431040A CN201080043104A CN102725290A CN 102725290 A CN102725290 A CN 102725290A CN 2010800431040 A CN2010800431040 A CN 2010800431040A CN 201080043104 A CN201080043104 A CN 201080043104A CN 102725290 A CN102725290 A CN 102725290A
- Authority
- CN
- China
- Prior art keywords
- triazolo
- phenyl
- pyridine
- trifluoromethoxy
- trifluoromethyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 0 C*c1nnc2[n]1cc(-c(cc1)ccc1Oc1ccccc1)nc2 Chemical compound C*c1nnc2[n]1cc(-c(cc1)ccc1Oc1ccccc1)nc2 0.000 description 2
- QVCYDEDGSMIUBP-IKVHAALSSA-N C/C(/c(cc1)ccc1OC(F)(F)F)=C(/CO)\N(C)/C(/C(F)(F)F)=N\C Chemical compound C/C(/c(cc1)ccc1OC(F)(F)F)=C(/CO)\N(C)/C(/C(F)(F)F)=N\C QVCYDEDGSMIUBP-IKVHAALSSA-N 0.000 description 1
- AIYQDVRRFGVHKR-UHFFFAOYSA-N CC(C)c1nnc(c(N)c2)[n]1cc2Br Chemical compound CC(C)c1nnc(c(N)c2)[n]1cc2Br AIYQDVRRFGVHKR-UHFFFAOYSA-N 0.000 description 1
- UMLIEVKNPBVFBJ-UHFFFAOYSA-N CC(C)c1nnc(c([N+]([O-])=O)c2)[n]1cc2Br Chemical compound CC(C)c1nnc(c([N+]([O-])=O)c2)[n]1cc2Br UMLIEVKNPBVFBJ-UHFFFAOYSA-N 0.000 description 1
- SORYZUZFCWVNBT-UHFFFAOYSA-N CC(C)c1nnc(cc2)[n]1nc2Cl Chemical compound CC(C)c1nnc(cc2)[n]1nc2Cl SORYZUZFCWVNBT-UHFFFAOYSA-N 0.000 description 1
- WPJSKCZNKRGKAG-UHFFFAOYSA-N CC(c1nnc(cc2)[n]1cc2-c(cc1)ccc1OC(F)(F)F)O Chemical compound CC(c1nnc(cc2)[n]1cc2-c(cc1)ccc1OC(F)(F)F)O WPJSKCZNKRGKAG-UHFFFAOYSA-N 0.000 description 1
- GFMZZOPKDURPMS-UHFFFAOYSA-N CN1N=C(C(F)(F)F)NC(CO)=C1Cl Chemical compound CN1N=C(C(F)(F)F)NC(CO)=C1Cl GFMZZOPKDURPMS-UHFFFAOYSA-N 0.000 description 1
- GKYYMXQCYVIIJJ-UHFFFAOYSA-N COCC(C(OC)=O)(F)F Chemical compound COCC(C(OC)=O)(F)F GKYYMXQCYVIIJJ-UHFFFAOYSA-N 0.000 description 1
- DGEKYAGJCLYPHT-UHFFFAOYSA-N Cc1cc(-c(cc2)ccc2OC(F)(F)F)c[n]2nnnc12 Chemical compound Cc1cc(-c(cc2)ccc2OC(F)(F)F)c[n]2nnnc12 DGEKYAGJCLYPHT-UHFFFAOYSA-N 0.000 description 1
- FRQNAFVNRKNWGC-UHFFFAOYSA-N FC(C(c1ccccc1)Nc(cc1)ccc1-c(cc1)c[n]2c1nnc2C(F)(F)F)(F)F Chemical compound FC(C(c1ccccc1)Nc(cc1)ccc1-c(cc1)c[n]2c1nnc2C(F)(F)F)(F)F FRQNAFVNRKNWGC-UHFFFAOYSA-N 0.000 description 1
- XPGRHLPPEVQVBM-UHFFFAOYSA-N FC(Oc(cc1)ccc1-c(cc1)c[n]2c1nnc2COCc(cccc1)c1F)(F)F Chemical compound FC(Oc(cc1)ccc1-c(cc1)c[n]2c1nnc2COCc(cccc1)c1F)(F)F XPGRHLPPEVQVBM-UHFFFAOYSA-N 0.000 description 1
- OCTLUVGKKIWCRI-UHFFFAOYSA-O N=C(CO)N(C=C(C=C1)c(cc2)ccc2OC(F)(F)F)C1=[NH2+] Chemical compound N=C(CO)N(C=C(C=C1)c(cc2)ccc2OC(F)(F)F)C1=[NH2+] OCTLUVGKKIWCRI-UHFFFAOYSA-O 0.000 description 1
- VFHMTQPRCOVQBN-UHFFFAOYSA-N NNc1ncc(-c(cc2)ccc2Oc2ccccc2)nc1 Chemical compound NNc1ncc(-c(cc2)ccc2Oc2ccccc2)nc1 VFHMTQPRCOVQBN-UHFFFAOYSA-N 0.000 description 1
- GHNSJCISUUPCLC-UHFFFAOYSA-N O=Cc1nnc(cc2)[n]1cc2-c(cc1)ccc1OC(F)(F)F Chemical compound O=Cc1nnc(cc2)[n]1cc2-c(cc1)ccc1OC(F)(F)F GHNSJCISUUPCLC-UHFFFAOYSA-N 0.000 description 1
- VNOMEAQPOMDWSR-UHFFFAOYSA-N OC(C(F)(F)F)c1ccccc1 Chemical compound OC(C(F)(F)F)c1ccccc1 VNOMEAQPOMDWSR-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D487/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00
- C07D487/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, not provided for by groups C07D451/00 - C07D477/00 in which the condensed system contains two hetero rings
- C07D487/04—Ortho-condensed systems
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
Landscapes
- Health & Medical Sciences (AREA)
- Organic Chemistry (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Diabetes (AREA)
- Neurology (AREA)
- Pain & Pain Management (AREA)
- Neurosurgery (AREA)
- Cardiology (AREA)
- Biomedical Technology (AREA)
- Heart & Thoracic Surgery (AREA)
- Rheumatology (AREA)
- Vascular Medicine (AREA)
- Urology & Nephrology (AREA)
- Obesity (AREA)
- Hematology (AREA)
- Endocrinology (AREA)
- Emergency Medicine (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen And Oxygen Or Sulfur-Condensed Heterocyclic Ring Systems (AREA)
- Crystals, And After-Treatments Of Crystals (AREA)
- Pyridine Compounds (AREA)
- Optical Modulation, Optical Deflection, Nonlinear Optics, Optical Demodulation, Optical Logic Elements (AREA)
Abstract
本发明涉及钠通道抑制剂化合物以及它们在治疗各种疾病状态中的用途,包括心血管疾病和糖尿病。在具体实施方式中,化合物的结构由式I给出:其中W1、W2、W3、R1、Q、X1、X2和X3如本发明所述,还涉及其制备方法以及化合物的用途和含有其的药物组合物。
Description
技术领域
本发明涉及新的化合物以及它们在治疗各种疾病状态中的用途,包括心血管疾病和糖尿病。本发明还涉及其制备方法,以及含有这样的化合物的药物组合物。
背景技术
晚钠电流(晚钠离子流)(INaL)是心肌细胞和神经元的快速Na+电流。许多常见神经和心脏病症与异常(INaL)增加有关,其对哺乳动物的电和收缩功能障碍(contactile dysfunction)二者的发病有作用。参见,例如,Pathophysiology and Pharmacology of the Cardiac“Late Sodium Current”,Pharmacology and Therapeutics 119(2008)326-339。因此,在哺乳动物中选择性抑制(INaL)的药物化合物在治疗这样的病症中是有用的。
发明内容
因此,在典型的实施方式中,本发明提供了起晚钠通道阻断剂作用的新型化合物。在典型的实施方式中,本发明提供式I化合物:
其中:
R1是芳基或杂芳基,
其中所述芳基或杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、CN、-SF5、-Si(CH3)3-O-CF3、-O-R20、-S-R20、-C(O)-R20、C(O)OH、-N(R20)(R22)、-C(O)-N(R20)(R22)、-N(R20)-C(O)-R22、-N(R20)-S(=O)2-R26、-S(=O)2-R20、-S(=O)2-N(R20)(R22)、C1-C3烷氧基、C1-4烷基、C2-4烯基、C2-4炔基、环烷基、杂芳基和杂环基;
其中所述烷氧基、烷基、烯基、炔基、杂芳基、环烷基、或杂环基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20,
W1是N或CR2,其中R2独立地选自由以下构成的组中:氢、可选取代的烷基、氨基、可选取代的烷氧基、-CF3、-O-CF3、-CN、和-N(R20)C(O)-R22;
W2是N或CR3,其中R3独立地选自由以下构成的组中:氢、可选取代的烷基、-CF3、-卤素、和-O-R24;
W3是N或CR4,其中R4独立地选自由以下构成的组中:氢、羟基、卤素、C1-4烷基、C1-C3烷氧基、-R25-N(R20)(R22)、-R25-O-R20、-R25-C(O)-O-R20、-R25-C(O)-N(R20)(R22)、-R25-C(O)-O-N(R20)(R22)、-R25-N(R20)-C(O)-R22、和-R25-O-C(O)-N(R20)(R22),
其中所述烷基可选地用1个、2个、或3个独立地选自由羟基、卤素构成的组中的取代基取代,
Q选自共价键或C2-4亚炔基;
X1是N或CRa,其中
Ra是氢、C1-15烷基、C1-4烷氧基、-C(O)-O-R26、-C(O)-N(R26)(R28)、-N(R20)-S(=O)2-R20、环烷基、芳基、杂芳基、杂环基,
其中所述烷基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CHF2、环烷基、-CN、和C1-4烷氧基;和
所述烷氧基、环烷基、芳基、杂环基、或杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CHF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20;或
Ra是-Y-Z-R25-R23-R20,其中
Y是共价键或选自可选用1个或2个C1-C3烷基或氟基取代的C1-C3亚烷基;
Z是C2-4亚炔基、-O-、-S-、-NR”、-NR5’-C(O)-、-NR”-C(O)-NR5’-、或-C(O)-NR3-、其中每个R”和R5’独立地是氢或C1-6低级烷基;和
进一步其中所述烷基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20,
X2是N或CRb;
Rb选自由以下构成的组中:氢、取代的烷基、-CF3、-O-CF3、-O-R20、-S-R20、-N(R20)(R22)、-N(R20)-C(O)-R22、-CF2-R20、-CF2-C(O)-O-R20、-CF2-C(O)-N(R20)-S(=O)2-R26、-CF2-四唑基、-C(O)-N(R20)-S(=O)2-R26、-N(R20)-C(O)-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、和-N(R20)-S(=O)2-R26、-R25-可选取代的杂芳基、-R25-可选取代的芳基;
R20和R22在每种情况下独立地选自由以下构成的组中:氢、C1-C15烷基、C2-C15烯基、C2-C15炔基、环烷基、杂环基、芳基、和杂芳基,
其中所述烷基、烯基、炔基、杂环基、芳基、和杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、-OCF3、芳基、环烷基、和杂芳基;或
当R20和R22连接至一共用氮原子,R20和R22可以连接形成一杂环环,其进而可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、和-OCF3、芳基、环烷基;
R23是共价键或选自由以下构成的组中:亚环烷基、亚杂环基、亚芳基、和杂亚芳基,
其中所述亚环烷基、亚杂环基、亚芳基、和杂亚芳基可选地用1个至3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、-OCF3、芳基、环烷基、和杂芳基;
R24在每种情况下独立地选自烷基或芳基,其每一个可以可选地用1、2、或3个独立地选自以下的取代基取代:羟基,-OCF3,卤素,C1-C3烷氧基,-O-R20,或可选用以下基团取代的烷基:卤素、-NO2、-CF3、-O-CF3、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、或-O-R20;
R25在每种情况下独立地是共价键或选自可选用1个或2个C1-C3烷基基团取代的C1-C3亚烷基;以及
R26和R28在每种情况下独立地选自氢、烷基、或环烷基,其中所述烷基、苯基和环烷基可以进一步用1至3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、C1-4烷氧基、-CF3、和-OCF3;
或其药用盐、酯、前药、或溶剂化物,
条件是
a.当X1是CRa,Ra是-Y-Z-R25-R23-R20,Y不是共价键,且Z是-O-、-S-、-SO2-、-C(O)-NR3-、-NR5’-C(O)-、或NR”-时,则R25不能是键;
b.当X1是CRa,Ra是-Y-Z-R25-R23-R20,Y是共价键,且Z是-O-、-S-、-SO2-、或NR”-时,则R25是共价键,而R23不是亚环烷基;
c.当Z是-NR5’-C(O)-时,则Y不是共价键;
d.R23和R25不能都是共价键;
e.当X1是CRa,Q是键,R1是杂芳基,且W1、W2、和W3都是CH时,则所述R1杂芳基可以不进一步用苯基取代;
f.当W1、W2、和W3都不是N,R2是取代的烷基,X1是CRa,且X2是N时,则Ra不是烷基、环烷基、或杂环基;和
g.当Q是共价键,R1是苯基,W1、W2、和W3是CH,X1是CRa,且X2是N时,则Ra不是C1-3未取代的烷基;
h.当Q是共价键,W1和W2是CH,W3是NH,X1是CRa,且X2是N时,则R1不是用芳基取代的杂芳基。
一些实施方式提供使用式I化合物治疗哺乳动物疾病或病症的方法,其属于通过晚钠通道阻断剂(阻滞剂)治疗。本发明的化合物及其药用盐、酯、互变异构形式潜在地用作药物用于治疗某些疾病,例如,心血管疾病如房性和室性心律失常、心力衰竭(包括充血性心力衰竭、舒张性心力衰竭、收缩性心力衰竭、急性心力衰竭)、变异型心绞痛(Prinzmetal’s(variant)angina)、稳定型和不稳定型心绞痛、运动诱发的心绞痛、充血性心脏病、(局部)缺血、复发性缺血、脑缺血、中风、肾缺血、与器官移植相关的缺血、再灌注损伤、心肌梗死、急性冠脉综合征、外周动脉病以及间歇性跛行。这样的疾病还可以包括糖尿病,例如,与糖尿病相关的病症,例如,糖尿病性周围神经病变。这样的疾病还包括影响神经肌肉系统导致癫痫、疼痛、惊厥或麻痹的病症。
在某些实施方式中本发明提供了药物制剂,包括治疗有效量的本发明的化合物(例如式I化合物)以及至少一种药用赋形剂。
目前,用于本发明的优选化合物包括但不限于:
7-甲基-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶;
6-(3-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[4-(三氟甲基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(2,4-二氯苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-[4-(二氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-苯氧基苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(3-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-氯-3-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(4-氯-3-氟苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡嗪;
6-(4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡嗪;
7-甲基-6-[3-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(二氟甲基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡嗪;
{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙酸;
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-苯基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡嗪;
6-(4-叔丁基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
6-[2-甲基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(三氟甲基)-6-[4-(三甲基硅烷基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(2,2,2-三氟乙氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-(4-甲氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-甲氧基苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-(4-苯氧基苯基)-3-(2,2,2-三氟乙基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(4-苯氧基苯基)-3-(丙-2-基)[1,2,4]三唑并[4,3-b]哒嗪;
6-[2-甲基-4-(三氟甲氧基)苯基]-3-(丙-2-基)[1,2,4]三唑并[4,3-b]哒嗪;
1-苯基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
3-叔丁基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
3-叔丁基-6-[4-(2,2,2-三氟乙氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
6-[4-(2,2,2-三氟乙氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-乙基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
3-环丙基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
4-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
4-{6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
3-(1-甲基-1H-吡唑-4-基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
4-[6-(4-甲氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
3-[6-(4-甲氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲酸甲酯;
3-[4-(甲基磺酰基)苯基]-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
2-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}丙-2-醇;
3-{6-[6-(吗啉-4-基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
6-(4-苯氧基苯基)-3-[4-(2H-四唑-5-基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
3-[6-(4-氟苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
3-苯基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺;
4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲腈;
6-[2-(1H-四唑-5-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3,6-二[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(丙-2-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(联苯基-4-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
(2E)-3-{6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基}丙-2-烯酸甲酯;
6-(1-甲基-1H-吲唑-5-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
2-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]丙-2-醇;
6-[4-(1H-1,2,4-三唑-1-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-羧酸甲酯;
N-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-羧酰胺;
6-[4-(4-氟苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氯苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
2-甲基-2-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}丙腈;
6-[3-甲基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(丙-2-基磺酰基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺;
3-甲基-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺;
6-[4-(5-甲基-1,3,4-噁二唑-2-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-(吗啉-4-基甲基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯磺酰胺;
3-(1,1-二氟-2-甲氧基乙基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
N-(4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯基)甲磺酰胺;
N-{3-甲基-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-基}乙酰胺;
6-(4-乙氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-叔丁氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酰胺;
3,3′-[1,2,4]三唑并[4,3-a]吡啶-3,6-二基二苯甲酸二乙酯;
6-{3-[(4-甲基哌啶-1-基)甲基]-4-(三氟甲氧基)苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(1-甲基-1H-吡唑-4-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
N,N-二甲基-1-{2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}甲胺;
2-({2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苄基}氨基)乙醇;
N-{3-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-基}丙酰胺;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酸乙酯;
3-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酸乙酯;
6-(6-环丙基吡啶-3-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(2-环丙基嘧啶-5-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-环丙基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
N-(2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯基)甲磺酰胺;
6-[4-(吡嗪-2-基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
N-({6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲基)甲磺酰胺;
6-(5-环丙基-1,3,4-噻二唑-2-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-苯氧基苯基)四唑并[1,5-a]吡啶;
6-[4-(三氟甲氧基)苯基]四唑并[1,5-a]吡啶;
N-甲基-3-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酰胺;
6-[4-(吡啶-3-基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[6-(甲基磺酰基)吡啶-3-基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-[4-(环丙基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
8-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
7-甲氧基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-甲氧基-4-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(萘-2-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-(3,4,5-三甲氧基苯基)[1,2,4]三唑并[4,3-a]吡啶;
8-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]喹啉;
6-(3,5-二氟-4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氟-2-硝基苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
2,2-二氟-2-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶-3-基]乙醇;
6-[4-(2-氟苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(吡啶-4-基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
N-苯基-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
N-(2,2,2-三氟乙基)-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
N-[5-(三氟甲氧基)-2-{3-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-6-基}苯基]乙酰胺;
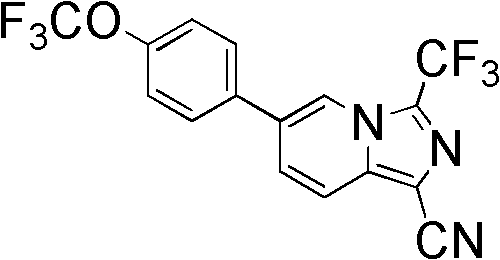
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-腈(carbonitrile);
3,6-二[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
6-[4-(苯基硫烷基(phenylsulfanyl))苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(萘-1-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[6-(三氟甲基)哒嗪-3-基][1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[2-(三氟甲基)嘧啶-5-基][1,2,4]三唑并[4,3-a]吡啶;
4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]-N-(2,2,2-三氟-1-苯基乙基)苯胺;
6-[2-溴-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
{6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基}甲醇;
3-(二氟甲基)-8-甲氧基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(苄氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(环丙基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(2,2,2-三氟乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲醇;
6-[2-(2-甲氧基嘧啶-5-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-(吡啶-3-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
1-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
1-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}环戊腈;
3-(1,1-二氟-2-甲氧基乙基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氯苯氧基)苯基]-3-(1,1-二氟-2-甲氧基乙基)[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[4-(4-氟苯氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[1,1-二氟-2-(吡啶-3-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(2-甲氧基乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(3-甲基氧杂环丁烷(oxetan)-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-苯氧基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
6-[2-氟-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-氟-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-甲基-1,2,4-噁二唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(苄氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(吡啶-4-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
2-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-N,N-二甲基乙胺;
6-[4-(环丙基甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-甲氧基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-(1,3,4-噁二唑-2-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
1-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)乙酮;
2,2,2-三氟-1-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙醇;
(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)乙腈;
2-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)乙醇;
1-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)丙-2-醇;
3-{6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
3-(2-氯-1,1-二氟乙基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
5-(三氟甲氧基)-8-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]喹啉;
6-[4-(2-甲基-1,3-二氧杂环戊烷-2-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(苯基乙炔基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-氯-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
1,1-二氟-1-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}丙-2-醇;
1-环丙基-2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙醇;
(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)乙酸乙酯;
N,N-二甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-胺;
(2E)-3-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}丁-2-烯腈;
3-(苯基硫烷基(phenylsulfanyl))-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(环丙基乙炔基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[1,1-二氟-2-(吡啶-2-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
2-甲基-4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}丁-3-炔-2-醇;
N-甲基-2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲酰胺;
N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)甲磺酰胺;
1,1-二氟-2-甲基-1-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}丙-2-醇;
3-(三氟甲基)-6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;
6-[2-(2-甲氧基乙氧基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-[6-(环丙基氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
{5-(三氟甲氧基)-2-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯氧基}乙腈;
6-[3-(3-甲基-1,2,4-噁二唑-5-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(1,3-噁唑-2-基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)吡啶-2-羧酰胺;
3-甲氧基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(2,2,2-三氟乙氧基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)哒嗪-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[3-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)-3-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{2-[(3,4-二氟苄基)氧基]-1,1-二氟乙基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(1,3-噻唑-2-基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-(苯基乙炔基)[1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-甲基-1,2-噁唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-苯基-3-(三氟甲基)咪唑并[1,5-a]吡啶;
1-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}环丙腈;
2-[3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基]-1,3-苯并噁唑;
3-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲基)戊-3-醇;
2,2-二氟-2-(6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶-3-基)乙醇;
6-[2,4-二(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(3,5-二氟-4-苯氧基苯基)-3-(丙-2-基)[1,2,4]三唑并[4,3-b]哒嗪;
5-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(丙-2-基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪;
3-[二氟(吡啶-3-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-2-甲基丙-2-醇;
3-{[(5-环丙基-1,2,4-噁二唑-3-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[5-(2-甲基丙基)-1,2,4-噁二唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[5-(丙-2-基)-1,2,4-噁二唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[3-氟-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(3,5-二氟-4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
3-[二氟(吡啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹啉;
2-[3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基]-1,3-苯并噻唑;
3-[(环丙基甲氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-苯基-1H-1,2,3-三唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(哒嗪-3-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[1-(4-氟苯基)乙氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氯苯氧基)苯基]四唑并[1,5-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]四唑并[1,5-a]吡啶;
6-[4-(2-甲氧基丙-2-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-[2-乙氧基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-(丙-2-基氧基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-5-苯基-1H-吡唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,2-二氟-1,3-苯并间二氧杂环戊烯-5-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-({[4-(三氟甲基)苄基]氧基}甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{[(4-氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,5-二甲基-1,3-噁唑-4-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-甲基-2-苯基-1,3-噁唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[1-(吡啶-2-基)乙氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[1-(4-氯苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[3-氟-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-(3,5-二氟-4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;
3-(2-{[3-(4-氯苯基)-1,2-噁唑-5-基]甲氧基}-1,1-二氟乙基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氯苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪;
3-{[(2-氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-({[2-(三氟甲基)苄基]氧基}甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,4-二氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(4-氯苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-({[4-(三氟甲氧基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)苯甲酰胺;
3-[(吡啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(嘧啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(1-苯基乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[1-(2,4-二氯苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]环丁醇;
3-{1-[二氟(吡啶-3-基)甲氧基]乙基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,4-二氯苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,4-二甲基苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(5-甲基吡啶-2-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟甲基)-6-[3-氟-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
4-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}四氢-2H-吡喃-4-腈;
3-[1-(吡啶-2-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
(2S)-2-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]吡咯烷-1-羧酸叔丁基酯;
3-{[二氟(吡啶-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-[3-(三氟甲基)苯氧基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(5-环丁基-1,2,4-噁二唑-3-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(4,4-二氟哌啶-1-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]苯甲腈;
3-(二氟{3-[(2-甲氧基苯基)磺酰基]-2-甲基丙氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(1-{3-[4-(三氟甲基)苯基]-1,2-噁唑-5-基}乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)-3-苯基脲;
3-(二氟{2-[4-(4-甲氧基苯基)哌啶-1-基]乙氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-羧酰胺;
3-{[(3-环丙基-1-甲基-1H-吡唑-5-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-(2-氯苯氧基)-3-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)丙-2-醇;
8-甲基-6-[4-(三氟甲氧基)苯基]四唑并[1,5-a]吡啶;
5-甲基-6-[4-(三氟甲氧基)苯基]四唑并[1,5-a]吡啶;
6-[4-(4-氯苯氧基)苯基]四唑并[1,5-b]哒嗪;
6-{4-[二氟(吡啶-3-基)甲氧基]苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-{4-[二氟(苯基)甲氧基]苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(2-甲基苯氧基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-3-(2,5-二甲基苯氧基)丙-2-醇;
3-[(环丙基甲氧基)(二氟)甲基]-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
5-氯-2-({4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}氨基)苯甲腈;
5-(甲氧基甲基)-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
N-甲基-N-苯基-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
({6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-5-基}甲氧基)乙腈;
4-(二氟{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯氧基}甲基)苯甲腈;
5-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹啉;
3-[1-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)乙基]喹啉;
4-氯-N-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}苯胺;
4-氟-N-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}苯胺;
3-{[2-(2,6-二甲基苯氧基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(五氟-λ~6~-磺酰基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-苯基-1H-吡唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟({2-[4-(三氟甲基)苯基]-1,3-噁唑-4-基}甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-2-甲基喹啉;
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-2-(三氟甲基)喹啉;
6-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹喔啉;
6-(2-氯-4-硝基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-[(丁-2-炔-1-基氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,2-二氟环丙基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(3-苯基丙-2-炔-1-基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-1H-苯并咪唑-2-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(1-苄基-1H-1,2,3-三唑-4-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-苯基-1,2-噁唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(2-苯基-1,3-噁唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-甲基-2-苯基-2H-1,2,3-三唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-1H-吡唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[{[1-(4-氯苯基)-5-甲基-1H-吡唑-3-基]甲氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(3,3-二苯基丙氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-苯氧基-6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[3-(嘧啶-2-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[3-(吡啶-3-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-1H-吲唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[氯(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-{[4-(三氟甲氧基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[(4-氟苯基)乙炔基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-(1H-1,2,4-三唑-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-(2-甲基-1H-咪唑并l-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-苯基-5-(三氟甲基)-1,3-噁唑-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[1-苯基-3-(三氟甲基)-1H-吡唑-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[6-(1H-吡唑-1-基)吡啶-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-环丙基-2′-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-3,4′-联吡啶;
3-[{[3-(4-环丙基-1H-咪唑-1-基)苄基]氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[5-(4-氟苯基)-1,2-噁唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-苯基-1,2-噁唑-3-基)甲氧基]甲基}-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-(哌啶-1-基)吡啶-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,2-二甲基-2,3-二氢-1-苯并呋喃-7-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[2-(2,6-二氟苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-苯基-1,2,4-噁二唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-苯基-1,2-噁唑-3-基)甲氧基]甲基}-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
3-[{[2-(6-环丙基吡啶-3-基)苄基]氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[{[5-(2-氯苯基)-1,2-噁唑-3-基]甲氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-(吡啶-3-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;以及
3-(二氟{[2-(1H-吡唑-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶。
具体实施方式
定义和一般参数
如在本发明书中所使用的,以下单词和短语通常意在具有如下阐明的含义,除非使用这些单词和短语的上下文另外指明。
术语“烷基”是指具有1至20个碳原子的单价基支链(支化)的或无支链(非支化)的饱和烃链。该术语通过基团如甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基、正癸基、十四烷基等加以说明。
术语“取代的烷基”是指:
1)如上文所定义的烷基基团,具有1、2、3、4或5个取代基(通常1至3个取代基),该取代基选自由烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基(硫羰基)、羧基、羧基烷基、芳硫基、杂芳硫基、杂环硫基、硫羟基(巯基,thiol)、烷硫基、芳基、芳氧基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基组成的组。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个取代基取代,该取代基选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR,其中R是烷基、芳基、或杂芳基以及n是0、1或2;或
2)如上所定义的烷基基团,该基团被1-10个(例如,1、2、3、4或5个)独立地选自氧、硫以及NRa-的原子中断,其中Ra选自氢、烷基、环烷基、烯基、环烯基、炔基、芳基、杂芳基以及杂环基。所有取代基可以可选地进一步被烷基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、或-S(O)nR取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2;或
3)如上所定义的烷基基团,该基团具有如上所定义的1、2、3、4或5个取代基并且还被如上所定义的1-10个原子(例如,1、2、3、4或5个原子)中断。
术语“低级烷基”是指具有1、2、3、4、5、或6个碳原子的单价基支链或无支链的饱和烃链。该术语通过基团如甲基、乙基、正丙基、异丙基、正丁基、异丁基、叔丁基、正己基等加以说明。
术语“取代的低级烷基”是指如上所定义的具有1至5个取代基(通常1、2、或3个取代基)的低级烷基,如针对取代的烷基所定义的;或如上所定义的被如针对取代的烷基所定义的1、2、3、4、或5个原子所中断的低级烷基基团;或如上所定义的低级烷基基团,其具有如上所定义的1、2、3、4或5个取代基并且被如上所定义的1、2、3、4、或5个原子所中断。
术语“亚烷基”是指支链或无支链的饱和烃链的二价基,其具有1至20个碳原子(例如1-10个碳原子,或者1、2、3、4、5或6个碳原子)。该术语通过基团如亚甲基(-CH2-)、亚乙基(-CH2CH2-)、亚丙基异构体(例如,-CH2CH2CH2-和-CH(CH3)CH2-)等加以说明。
术语“低级亚烷基”是指支链或无支链饱和烃链的二价基,其通常具有1、2、3、4、5、或6个碳原子。
术语“取代的亚烷基”是指:
(1)如上所定义的具有1、2、3、4、或5个取代基(通常1、2或3个取代基)的亚烷基基团,其中取代基选自由烷基、烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳硫基、杂芳硫基、杂环硫基、硫羟基、烷硫基、芳基、芳氧基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基组成的组。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2;或
(2)如上所定义的亚烷基基团,该基团被l-10个(例如,1、2、3、4或5个基团)独立地选自-O-、-S-、磺酰基、C(O)-、-C(O)O-、-C(O)N-以及NRa-的基团所中断,其中Ra选自氢、可选取代的烷基、环烷基、环烯基、芳基、杂芳基以及杂环基;或
(3)如上所定义的亚烷基基团,该亚烷基基团具有1、2、3、4或5个如上所定义的取代基并且被如上所定义的1-10个基团所中断。取代的亚烷基的实例是氯亚甲基(-CH(Cl)-)、氨基亚乙基(-CH(NH2)CH2-)、甲氨基亚乙基(-CH(NHMe)CH2-)、2-羧基亚丙基异构体(-CH2CH(CO2H)CH2-)、乙氧基乙基(-CH2CH2O-CH2CH2-)、乙基甲氨基乙基(-CH2CH2N(CH3)CH2CH2-)、1-乙氧基-2-(2-乙氧基-乙氧基)乙烷(-CH2CH2O-CH2CH2-OCH2CH2-OCH2CH2-)等。
术语“芳烷基”是指共价连接于亚烷基基团的芳基基团,其中芳基和亚烷基在本文中定义。“可选取代的芳烷基”是指共价连接于可选取代的亚烷基基团的可选取代的芳基基团。这样的芳烷基基团实例为苄基、苯乙基、3-(4-甲氧基苯基)丙基等。
术语“烷氧基”是指基团R-O-,其中R是可选取代的烷基或可选取代的环烷基,或R是基团-Y-Z,其中Y是可选取代的亚烷基而Z是可选取代的烯基、可选取代的炔基;或可选取代的环烯基,其中烷基、烯基、炔基、环烷基以及环烯基如本文中所定义。典型的烷氧基基团是烷基-O-并且包括例如甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、叔丁氧基、仲丁氧基、正戊氧基、正己氧基、1,2-二甲基丁氧基等。
术语“低级烷氧基”是指基团R-O-,其中R是如上所定义的可选取代的低级烷基。该术语通过如下基团举例说明,如甲氧基、乙氧基、正丙氧基、异丙氧基、正丁氧基、异丁氧基、叔丁氧基、正己氧基等。
术语“烷硫基”是指基团R-S-,其中R如针对烷氧基所定义。
术语“烯基”是指通常具有2至20个碳原子(更典型的2至10个碳原子以及例如2至6个碳原子)并且具有1-6个碳碳双键、例如1、2或3个碳碳双键的支链或无支链的不饱和烃基团的单价基。典型的烯基基团包括乙烯基(或乙烯基,即-CH=CH2)、1-丙烯基(或烯丙基,-CH2CH=CH2)、异丙烯基(-C(CH3)=CH2)、双环[2.2.1]庚烯等。在烯基连接于氮的情况下,双键不能在氮的α位。
术语“低级烯基”是指如上所定义的具有2至6个碳原子的烯基。
术语“取代的烯基”是指如上所定义的具有1、2、3、4或5个取代基(通常1、2、或3个取代基)的烯基基团,其中所述取代基选自由以下组成的组:烷基、烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳硫基、杂芳硫基、杂环硫基、硫羟基、烷硫基、芳基、芳氧基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“炔基”是指不饱和烃的单价基,其通常具有2至20个碳原子,(更典型地2至10个碳原子,例如2至6个碳原子)并且具有1-6个碳碳三键,例如1、2或3个碳碳三键。典型的炔基基团包括乙炔基(-C≡CH)、炔丙基(或丙炔基(propynyl),-C≡CCH3)等。在炔基连接于氮的情况下,三键不能在氮的α位。
术语“取代的炔基”是指如上所定义的具有1、2、3、4或5个取代基(通常1、2、或3个取代基)的炔基基团,其中所述取代基选自由烷基、烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳硫基、杂芳硫基、杂环硫基、硫羟基、烷硫基、芳基、芳氧基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基组成的组。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“氨羰基”是指基团-C(O)NRR,其中每个R独立地是氢、烷基、环烷基、芳基、杂芳基、杂环基,或其中两个R基团相连以形成杂环基团(例如,吗啉基)。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“酯”或“羧酸酯”是指基团-C(O)OR,其中R为烷基、环烷基、芳基、杂芳基或杂环基,其可以可选地进一步被烷基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、或-S(O)nRa,其中Ra是烷基、芳基、或杂芳基以及n是0、1或2;
术语“酰氨基”是指基团-NRC(O)R,其中每个R独立地是氢、烷基、芳基、杂芳基、或杂环基。所有取代基可以可选地进一步被烷基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“酰氧基”是指基团-O(O)C-烷基、-O(O)C-环烷基、-O(O)C-芳基、-O(O)C-杂芳基、以及-O(O)C-杂环基。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、或-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“芳基”是指具有单环(例如,苯基)或多环(例如,联苯基)、或多个稠环(例如,萘基或蒽基)的6至20个碳原子的芳香碳环基团。典型的芳基包括苯基、芴基、萘基、蒽基等。
除非另外通过针对芳基取代基的定义进行限定,否则这样的芳基基团可以可选地被1、2、3、4或5个取代基(典型1至3个取代基)取代,所述取代基选自由烷基、烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳硫基、杂芳硫基、杂环硫基、硫羟基、烷硫基、芳基、芳氧基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基组成的组。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“芳氧基”是指基团芳基-O-,其中芳基基团如上所定义,并且包括同样如上所定义的可选取代的芳基基团。术语“芳硫基”是指基团R-S-,其中R是如针对芳基所定义的。
术语“氨基”是指基团-NH2。
术语“取代的氨基”是指基团-NRR,其中每个R独立地选自由氢、烷基、环烷基、芳基、杂芳基以及杂环基组成的组,条件是两个R基团不都是氢,或基团-Y-Z,其中Y是可选取代的亚烷基而Z是烯基、环烯基、或炔基。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“羧基烷基”是指基团-C(O)O-烷基或-C(O)O-环烷基,其中烷基和环烷基如本文中所定义并且可以可选地进一步被烷基、烯基、炔基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、或-S(O)nR取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“环烷基”是指具有单环或多个稠环的3至20个碳原子的环状烷基基团。这样的环烷基基团包括例如单环结构如环丙基、环丁基、环戊基、环辛基等,或多环结构如金刚烷基、双环[2.2.1]庚烷,或与芳基基团稠合的环状烷基基团,例如茚满等。
术语“取代的环烷基”是指具有1、2、3、4或5个取代基(典型1、2、或3个取代基)的环烷基基团,所述取代基选自由烷基、烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳硫基、杂芳硫基、杂环硫基、硫羟基、烷硫基、芳基、芳氧基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基组成的组。术语“取代的环烷基”还包括环烷基基团,其中环烷基的一个或多个环碳原子为羰基基团(即,氧原子为连接至环的氧代基)。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基以及n是0、1或2。
术语“卤素”或“卤基”是指氟基、溴基、氯基、以及碘基。
术语“酰基”是指基团-C(O)R,其中R是氢、可选取代的烷基、可选取代的环烷基、可选取代的杂环基、可选取代的芳基、以及可选取代的杂芳基。
术语“杂芳基”是指包括1至15个碳原子以及在至少一个环内的1至4个选自氧、氮以及硫的杂原子的基团。术语“杂芳基”通常指术语“芳香杂芳基”和“部分饱和杂芳基”。术语“芳香杂芳基”是指其中至少一个环是芳香性的杂芳基。芳香杂芳基的实例包括吡咯、噻吩、嘧啶、喹啉、蝶啶。术语“部分饱和杂芳基”是指具有对应于基础芳香杂芳基结构的杂芳基,其在饱和的基础芳香杂芳基的芳香环中具有一个或多个双键。部分饱和杂芳基的实例包括二氢吡咯、二氢吡啶、1,2,3,4-四氢化萘。
除非另外通过针对杂芳基取代基的定义进行限制,否则这样的杂芳基基团可以可选地被1至5个取代基(典型地1至3个取代基)取代,所述取代基选自由烷基、烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基(烷基酯)、芳硫基、杂芳硫基、杂环硫基、硫羟基、烷硫基、芳基、芳氧基、芳烷基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基组成的组。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基而n是0、1或2。这样的杂芳基基团可以具有单环(例如,吡啶基或呋喃基)或多个稠环(例如,吲哚嗪基(indolizinyl)、苯并噻唑基、或苯并噻吩基)。氮杂环基或杂芳基的实例包括但不限于吡咯、咪唑、吡唑、吡啶、吡嗪、嘧啶、哒嗪、吲嗪(吲哚嗪,indolizine)、异吲哚、吲哚、吲唑、嘌呤、喹嗪、异喹啉、喹啉、酞嗪(phthalazine)、萘基吡啶、喹喔啉、喹唑啉、噌啉、蝶啶、咔唑、咔啉、菲啶、吖啶、菲咯啉(phenanthroline)、异噻唑、吩嗪、异噁唑、吩噁嗪、吩噻嗪、咪唑烷(imidazolidine)、咪唑啉等以及含N-烷氧-氮的杂芳基化合物。
术语“杂芳氧基”是指基团杂芳基-O-。
术语“杂环基”是指具有单环或多个稠环的单价饱和或部分不饱和基团,在环内具有1至40个碳原子以及1至10个杂原子,优选1至4个杂原子,该杂原子选自氮、硫、磷、和/或氧。
除非另外通过针对杂环取代基的定义进行限定,否则这样的杂环基团可以可选地被1至5个取代基(典型地1、2或3个取代基)取代,所述取代基选自由烷基、烯基、炔基、烷氧基、环烷基、环烯基、酰基、酰氨基、酰氧基、氨基、氨羰基、烷氧羰基氨基、叠氮基、氰基、卤素、羟基、酮基、硫代羰基、羧基、羧基烷基、芳硫基、杂芳硫基、杂环硫基、硫羟基、烷硫基、芳基、芳氧基、杂芳基、氨基磺酰基、氨羰基氨基、杂芳氧基、杂环基、杂环氧基、羟氨基、烷氧基氨基、硝基、-SO-烷基、-SO-芳基、-SO-杂芳基、-SO2-烷基、SO2-芳基以及-SO2-杂芳基组成的组。除非另外通过定义限定,否则所有取代基可以可选地进一步被1、2、或3个选自烷基、羧基、羧基烷基、氨羰基、羟基、烷氧基、卤素、CF3、氨基、取代的氨基、氰基、以及-S(O)nR的取代基取代,其中R是烷基、芳基、或杂芳基而n是0、1或2。杂环基团可以具有单环或多个稠环。优选的杂环包括四氢呋喃基、吗啉基(吗啉代)、哌啶基等。
术语“硫羟基(thiol)”是指基团-SH。
术语“取代的烷硫基”是指基团-S-取代的烷基。
术语“杂芳硫基”是指基团-S-杂芳基,其中杂芳基基团是如上所定义的,包括同样如上所定义的可选取代的杂芳基基团。
术语“亚砜”是指基团-S(O)R,其中R是烷基、芳基、或杂芳基。“取代的亚砜”是指基团-S(O)R,其中R是取代的烷基、取代的芳基、或取代的杂芳基,如本文中所定义。
术语“砜”是指基团-S(O)2R,其中R是烷基、芳基、或杂芳基。“取代的砜”是指基团-S(O)2R,其中R是取代的烷基、取代的芳基、或取代的杂芳基,如本文中所定义。
术语“酮基”是指基团-C(O)-。术语“硫代羰基”是指基团-C(S)-。术语“羧基”是指基团-C(O)-OH。
“可选”或“可选的(地)”是指随后描述的事件或情况可能发生或可能不发生,并且该描述包括其中所述事件或情况发生的实例以及其中它不发生的实例。
“取代的”基团包括其中单价取代基连接至取代的基团的单个原子(例如,形成支链)的实施方式,也包括其中取代基可以是键连至取代的基团的两个相邻的原子的二价基桥接基团,从而在取代的基团上形成稠合环的实施方式。
给定化学式的化合物(例如“化学式I的化合物”)用于涵盖如所披露的本发明的化合物,以及这样的化合物的药用盐、药用酯、水合物、多晶型物(polymorph)以及前药。另外,本发明的化合物可以具有一个或多个不对称中心,并且可以作为外消旋混合物或作为单独的对映体或非对映异构体产生。在任何给定的化学式的化合物中存在的立体异构体的数目取决于存在的不对称中心的数目(存在2n种可能的立体异构体,其中n是不对称中心的数目)。单独的立体异构体可以通过拆分处于合成的某一合适阶段的中间体的外消旋或非外消旋混合物,或者通过常规方式拆分化合物来获得。单独的立体异构体(包括单独的对映体和非对映异构体)以及立体异构体的外消旋和非外消旋混合物包括在本发明的范围内,除非另有明确指明,否则所有这些旨在通过本说明书的结构来描述。
“异构体”是具有相同分子式的不同的化合物。
“立体异构体”是仅原子的空间排列方式不同的异构体。
“对映体”是一对彼此不能重叠的镜像的立体异构体。一对对映体的1∶1混合物是“外消旋”混合物。在适当的情况下,术语“(±)”用来表示外消旋混合物。
“非对映异构体”是这样的立体异构体,其具有至少两个不对称原子,但其彼此不是镜像。
绝对立体化学(stereochemistry)是按照顺序规则系统(Cahn-Ingold-Prelog R-S system)规定的。当化合物是纯对映体时,可以用R或S来规定在每个手性碳处的立体化学。其绝对构型未知的拆分化合物依赖于它们在钠D线的波长处旋转偏振光的平面的方向(右旋-或左旋)指定为(+)或(-)。
本文所给出的任何化学式或结构,包括式I化合物,也意在表示化合物未标记形式以及同位素标记的形式。同位素标记的化合物具有本文所给出的化学式所表示的结构,只不过一个或多个原子被具有所选的原子质量或质量数的原子所替代。能够结合到本发明的化合物的同位素的实例包括氢、碳、氮、氧、磷、氟、和氯的同位素,例如,但不限于2H(氘,D)、3H(氚)、11C、13C、14C、15N、18F、31P、32P、35S、36Cl以及125I。本发明的各种同位素标记的化合物,例如放射性同位素如3H、13C、14C并入到这些化合物中。这样的同位素标记的化合物可以用于代谢研究、反应动力学研究、检测或成像技术,如正电子断层扫描成像(PET)或单光子发射计算机断层成像术(SPECT),包括药物或底物组织分布分析,或在患者中放射性治疗。
本发明氘标记的或取代的治疗化合物具有改善的DMPK(药物代谢及药物动力学)性能,涉及分布、代谢、以及排泄(ADME)。用较重的同位素如氘取代可以提供因更高的代谢稳定性而产生某种治疗优点,例如,体内半衰期增加或所需的剂量减少。18F标记的化合物对PET或SPECT是有用的。本发明同位素标记的化合物通常能够通过以下制备:实施在如下所述的反应方案或实施例以及制备例中披露的步骤(程序),用容易获得的同位素标记的试剂代替非同位素标记的试剂。另外,用较重的同位素,尤其是氘(即,2H或D),可以提供更高的代谢稳定性而产生某种治疗优点,例如,体内半衰期增加或所需的剂量减少或治疗因子改善。应当理解,在本文中的氘被认为在式(I)化合物中的取代基。
这样的较重同位素(尤其是氘)的浓度能够通过同位素富集因子来定义。在本发明的化合物中,任何没有明确指明为具体同位素的原子是指该原子的任何合适的同位素。除非另外指明,当一个位置明确指出为“H”或“氢”时,该位置理解为以其天然丰度同位素组成具有氢。因此,在本发明的化合物中,任何原子明确指明为氘(D)的原子是指氘。
术语“治疗有效量”是指如下面所定义的,当给予需要这样的治疗的哺乳动物时,其足以实施治疗的的量。治疗有效量将随着待治疗的主体以及疾病情况,以及患者的重量和年龄、疾病情况的严重性、给药方式等,这能够由本领域普通技术人员容易地确定。
术语“治疗”或“治疗”是指对哺乳动物疾病的任何治疗,包括:
(i)预防疾病,即,使疾病的临床症状不发展;
(ii)抑制疾病,即,阻止临床症状的发展;和/或
(iii)缓解疾病,即,使临床症状消退。
在许多情况下,本发明的化合物借助于氨基和/或羧基基团或与其类似基团的存在能够形成酸式盐和/或碱式盐。
给定化合物的术语“药用盐”是指这样的盐,其保留给定化合物的生物有效性和性能,并且在生物学上或在其它方面不是不期望的。药用碱加成盐可以由无机碱和有机碱来制备。衍生自无机碱的盐包括(仅举例说明)钠盐、钾盐、锂盐、铵盐、钙盐以及镁盐。衍生自有机碱的盐包括但不限于伯胺、仲胺以及叔胺(tertiary amine)的盐,如烷基胺、二烷基胺、三烷基胺、取代的烷基胺、二(取代的烷基)胺、三(取代的烷基)胺、烯基胺、二烯基胺、三烯基胺、取代的烯基胺、二(取代的烯基)胺、三(取代的烯基)胺、环烷基胺、二(环烷基)胺、三(环烷基)胺、取代的环烷基胺、二取代的环烷基胺、三取代的环烷基胺、环烯基胺、二(环烯基)胺、三(环烯基)胺、取代的环烯基胺、二取代的环烯基胺、三取代的环烯基胺、芳基胺、二芳基胺、三芳基胺、杂芳基胺、二杂芳基胺、三杂芳基胺、杂环胺、二杂环胺、三杂环胺、混合的二胺和三胺,其中在胺上的取代基中的至少两个是不同的并且选自由烷基、取代的烷基、烯基、取代的烯基、环烷基、取代的环烷基、环烯基、取代的环烯基、芳基、杂芳基、杂环等组成的组。还包括其中两个或三个取代基与氨基氮一起形成杂环或杂芳基基团的胺。
合适的胺的具体实例包括(仅通过举例说明)异丙胺、三甲胺、二乙胺、三(异丙)胺、三(正丙)胺、乙醇胺、2-二甲基氨基乙醇、氨丁三醇(缓血酸胺,tromethamine)、赖氨酸、精氨酸、组氨酸、咖啡因、普鲁卡因、海巴明(hydrabamine)、胆碱、甜菜碱、乙二胺、葡糖胺、N-烷基葡糖胺、可可碱、嘌呤、哌嗪、哌啶、吗啉、N-乙基哌啶等。
药用酸加成盐可以由无机酸和有机酸来制备。从其可以衍生盐的无机酸包括盐酸、氢溴酸、硫酸、硝酸、磷酸等。从其可以衍生盐的有机酸包括醋酸、丙酸、乙醇酸、丙酮酸、草酸、苹果酸、丙二酸、丁二酸、马来酸、富马酸、酒石酸、柠檬酸、苯甲酸、肉桂酸、扁桃酸、甲磺酸、乙磺酸、对甲苯磺酸、水杨酸等。
如本文中所使用的,“药用载体”包括任何和所有溶剂、分散介质、涂层、抗菌药以及抗真菌药、等渗剂以及吸收延迟剂等。这样的介质和药剂用于药物活性物质在本领域中是众所周知的。除非任何常规的介质或药剂与活性组分不相容,否则可以预期其用于治疗组合物。辅助的活性组分也可以加入(结合)到组合物中。
“冠心病(Coronary diseases)”或“心血管疾病”是由例如以下中的任一个或多于一个产生的心血管系统的疾病:心力衰竭(包括充血性心力衰竭、舒张性心力衰竭以及收缩性心力衰竭)、急性心力衰竭、局部缺血、复发性缺血、心肌梗死、心律失常、心绞痛(包括运动引起的心绞痛、变异型心绞痛、稳定型心绞痛和不稳定型心绞痛)、急性冠脉综合征、糖尿病以及间歇性跛行。
“间歇性跛行”是指与外周动脉病(周围动脉疾病)相关的疼痛。“外周动脉病(周围动脉疾病)”或PAD是指周围血管闭塞性疾病(PVD)类型。PAD影响心脏和脑外的动脉。PAD的最常见症状是当行走、爬梯或运动时髋、大腿或小腿的疼痛痉挛。该疼痛称为间歇性跛行。当列出症状间歇性跛行时,其意在包括PAD和PVD。
心律失常是指任何失常的心律。心动过缓是指异常缓慢的心律而心动过速是指异常快速的心律。如本文所使用的,治疗心律失常旨在包括治疗室上性心动过速(supra ventricular tachycardias)如心房颤动、心房扑动、房室结折返性心动过速(AV nodal reentrant tachycardia)、房性心动过速(atrial tachycardia)、室性心动过速(VT),包括特发性室性心动过速(idiopathic ventricular tachycardia)、心室纤颤(ventricular fibrillation)、预激综合症(pre-excitation syndrome)、尖端扭转型室性心动过速(Torsadede Pointes)(TdP)。
其中作为连接至第二基团的给定的基团(部分)描述在本文中,连接的位置不明确(explicit)时,该给定的基团可以在该给定基团任何可用的位置连接到第二基团的任何可用的位置。例如,“低级烷基取代的苯基”,其中连接位置没有明确,可以使低级烷基任何可用的位置连接至苯基基团任何可用的位置。在这方面,“可用的位置”是该基团的氢可以被取代基替代的基团位置。
命名法
本发明的化合物的名称使用用于命名化学化合物的ACD/命名软件(Advanced Chemistry Development,Inc.,Toronto)提供。其他化合物或基团命名为通用名或系统命名或非系统命名。本发明的化合物的命名和编号用式I所示的化合物举例说明:
其命名为6-(3-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶。
式I化合物
因此,在典型的实施方式中,本发明提供了发明提供了起晚钠通道阻断剂作用的新型化合物。在典型的实施方式中,本发明提供式I化合物:
其中:
R1是芳基或杂芳基,
其中所述芳基或杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、CN、-SF5、-Si(CH3)3-O-CF3、-O-R20、-S-R20、-C(O)-R20、C(O)OH、-N(R20)(R22)、-C(O)-N(R20)(R22)、-N(R20)-C(O)-R22、-N(R20)-S(=O)2-R26、-S(=O)2-R20、-S(=O)2-N(R20)(R22)、C1-C3烷氧基、C1-4烷基、C2-4烯基、C2-4炔基、环烷基、杂芳基和杂环基;
其中所述烷氧基、烷基、烯基、炔基、杂芳基、环烷基、或杂环基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20,
W1是N或CR2,其中R2独立地选自由以下构成的组中:氢、可选取代的烷基、氨基、可选取代的烷氧基、-CF3、-O-CF3、-CN、和-N(R20)C(O)-R22;
W2是N或CR3,其中R3独立地选自由以下构成的组中:氢、可选取代的烷基、-CF3、-卤素、和-O-R24;
W3是N或CR4,其中R4独立地选自由以下构成的组中:氢、羟基、卤素、C1-4烷基、C1-C3烷氧基、-R25-N(R20)(R22)、-R25-O-R20、-R25-C(O)-O-R20、-R25-C(O)-N(R20)(R22)、-R25-C(O)-O-N(R20)(R22)、-R25-N(R20)-C(O)-R22、和-R25-O-C(O)-N(R20)(R22),
其中所述烷基可选地用1个、2个、或3个独立地选自由羟基、卤素构成的组中的取代基取代,
Q选自共价键或C2-4亚炔基;
X1是N或CRa,其中
Ra是氢、C1-15烷基、C1-4烷氧基、-C(O)-O-R26、-C(O)-N(R26)(R28)、-N(R20)-S(=O)2-R20、环烷基、芳基、杂芳基、杂环基,
其中所述烷基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CHF2、环烷基、-CN、和C1-4烷氧基;和
所述烷氧基、环烷基、芳基、杂环基、或杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CHF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20;或
Ra是-Y-Z-R25-R23-R20,其中
Y是共价键或选自可选用1个或2个C1-C3烷基或氟基取代的C1-C3亚烷基;
Z是C2-4亚炔基、-O-、-S-、-NR”、-NR5’-C(O)-、-NR”-C(O)-NR5’-、或-C(O)-NR3-、其中每个R”和R5’独立地是氢或C1-6低级烷基;和
进一步其中所述烷基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20,
X2是N或CRb;
Rb选自由以下构成的组中:氢、取代的烷基、-CF3、-O-CF3、-O-R20、-S-R20、-N(R20)(R22)、-N(R20)-C(O)-R22、-CF2-R20、-CF2-C(O)-O-R20、-CF2-C(O)-N(R20)-S(=O)2-R26、-CF2-四唑基、-C(O)-N(R20)-S(=O)2-R26、-N(R20)-C(O)-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、和-N(R20)-S(=O)2-R26、-R25-可选取代的杂芳基、-R25-可选取代的芳基;
R20和R22在每种情况下独立地选自由以下构成的组中:氢、C1-C15烷基、C2-C15烯基、C2-C15炔基、环烷基、杂环基、芳基、和杂芳基,
其中所述烷基、烯基、炔基、杂环基、芳基、和杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、-OCF3、芳基、环烷基、和杂芳基;或
当R20和R22连接至一共用氮原子,R20和R22可以连接形成一杂环环,其进而可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、和-OCF3、芳基、环烷基;
R23是共价键或选自由以下构成的组中:亚环烷基、亚杂环基、亚芳基、和杂亚芳基,
其中所述亚环烷基、亚杂环基、亚芳基、和杂亚芳基可选地用1个至3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、-OCF3、芳基、环烷基、和杂芳基;
R24在每种情况下独立地选自烷基或芳基,其每一个可以可选地用1、2、或3个独立地选自以下的取代基取代:羟基,-OCF3,卤素,C1-C3烷氧基,-O-R20,或可选用以下基团取代的烷基:卤素、-NO2、-CF3、-O-CF3、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、或-O-R20;
R25在每种情况下独立地是共价键或选自可选用1个或2个C1-C3烷基基团取代的C1-C3亚烷基;以及
R26和R28在每种情况下独立地选自氢、烷基、或环烷基,其中所述烷基、苯基和环烷基可以进一步用1至3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、C1-4烷氧基、-CF3、和-OCF3;
或其药用盐、酯、前药、或溶剂化物,
条件是
a.当X1是CRa,Ra是-Y-Z-R25-R23-R20,Y不是共价键,且Z是-O-、-S-、-SO2-、-C(O)-NR3-、-NR5’-C(O)-、或NR”-时,则R25不能是键;
b.当X1是CRa,Ra是-Y-Z-R25-R23-R20,Y是共价键,且Z是-O-、-S-、-SO2-、或NR”-时,则R25是共价键,而R23不是亚环烷基;
c.当Z是-NR5’-C(O)-时,则Y不是共价键;
d.R23和R25不能都是共价键;
e.当X1是CRa,Q是键,R1是杂芳基,且W1、W2、和W3都是CH时,则所述R1杂芳基可以不进一步用苯基取代;
f.当W1、W2、和W3都不是N,R2是取代的烷基,X1是CRa,且X2是N时,则Ra不是烷基、环烷基、或杂环基;和
g.当Q是共价键,R1是苯基,W1、W2、和W3是CH,X1是CRa,且X2是N时,则Ra不是C1-3未取代的烷基;
h.当Q是共价键,W1和W2是CH,W3是NH,X1是CRa,且X2是N时,则R1不是用芳基取代的杂芳基。
在一组实施方式中,W1是CR2,W2是CR3,W3是CR4,Q是共价键,R1是取代的苯基,产生的化合物具有式II的结构:
其中:
R30、R32、以及R34独立地选自由以下构成的组:氢、羟基、-OCF3、卤素、C1-C3烷氧基、-O-R20、或可选地被卤素、-NO2、-CF3、-O-CF3、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、或-O-R20取代的烷基,
条件是R30、R32、和R34中的至少一个不是氢;以及
R2、R4、R5、R20、R22、X1、X2、以及X3是如上所定义的。
在另一组实施方式中,W1是CR2、W2是CR3、W3是CR4、X2是氮以及X1是CRa,产生的化合物具有式III的结构:
其中R1、R2、R4、R5、Ra、以及Q是如上所定义的。
在又一组实施方式中,W1是CR2,W2是CR3,W3是CR4,Q是共价键,R1是取代的苯基,X2以及X3均为氮以及X1是CRa,产生的化合物具有式IV的结构:
其中R2、R4、R5、R20、Ra、R22、R30、R32、以及R34是如上所定义的。
典型的R1芳基以及杂芳基取代基具有1至3个选自O、N、以及S的杂原子的单环或双环。示例性R1部分包括但不限于以下基团:
在许多实施方式中,R1部分被1至3个如上定义的取代基进一步取代。例如,当R1是取代的芳基,如取代的苯基时,则共用取代基如R30、R32和R34。在R1环结构上的共用取代基包括但不限于氢;甲基、乙基、正丙基、异丙基、叔丁基,卤素;氨基,烷基氨基,如甲基氨基,二烷基氨基如二甲基氨基,氨基烷基,烷基氨基烷基,二烷基氨基烷基,芳氧基,如苯氧基,卤素取代的烷基,如CF3和CHF2;甲氧基,乙氧基、丙氧基、异丙氧基、叔丁氧基、甲硫基、乙硫基、丙硫基,以及卤素取代的烷氧基,如三氟甲氧基和二氟甲氧基。其他典型的取代基包括但不限于以下基团:
当W1是CR2时,共用R2基团包括但不限于氢、卤素、甲基、甲氧基、羟基甲基、CF3、氰基、氨基、乙酰胺基、烷基酰氨基(alkylamido)、以及环烷基甲酰胺基(cycloalkylcarboxamido)。
当W2是CR3时,典型的R3部分包括但不限于氢、甲氧基和甲基。
当W3是CR4时,共用R4基团包括但不限于氢、卤素、甲基、甲氧基、羟基甲基、(吗啉-4-羰基氧基)甲基、(二甲基氨基甲酰基氧基)甲基((dimethylcarbamoyloxy)methyl)、(氰基甲氧基)甲基、甲氧基甲基、氨基、二甲基氨基以及环烷基甲酰胺基。
当X1是CRa和/或X2是CRb时,共用Ra和Rb部分包括但不限于氢、甲基、氨基、二甲基氨基、-CF3、-OCF3、-OCH3、-OCH2COOH、-NHCH2CH3、-CONHCH3、-CH2CONH2、-CH2CONHCH3、-CH2CON(CH3)2、-CH2CONH(CH2)2OH、-CH2NHSO2CH3、-CH2COOH、-COOCH2CH3、-CH2COOCH2CH3、-CH2OH、-COOH、羧基苯基、甲氧基羰基苯基。各种共用的Ra和Rb部分是氢、-CF3、-OCF3。示例性Ra和Rb部分包括但不限于以下基团:
进一步的实施方式
在典型的实施方式中,本发明提供的化合物在治疗响应于给予晚钠通道阻断剂的已知症状中是有效的,包括但不限于心血管疾病如房性和室性心律失常,包括心房颤动,变异型心绞痛,稳定型心绞痛,不稳定型心绞痛,在心脏、肾脏、肝脏和脑中的局部缺血以及再灌注损伤,运动诱发的心绞痛、肺性高血压,充血性心脏病,包括舒张性和收缩性心力衰竭,以及心肌梗死。在一些实施方式中,本发明提供的起晚钠通道阻断剂作用的化合物可以用于治疗影响神经肌肉系统导致疼痛、瘙痒、惊厥(发作,seizures)或麻痹(paralysis)的病症,或用于治疗糖尿病或胰岛素敏感性降低,以及与糖尿病相关的疾病状态,如糖尿病性周围神经病变。
本发明的某些化合物还具有足够的活性以调节神经元钠通道,即,Nav1.1.、1.2、1.7和/或1.8,并且可以具有合适的药物代谢动力学性能使得它们在中枢神经和/或周围神经系统方面是有活性的。因此,本发明的一些化合物还可以用于治疗神经源性癫痫或疼痛或瘙痒。
在典型的实施方式中,本发明意在包括这样的化合物的药用盐、药用酯、互变异构形式、多晶型物以及前药。在一些实施方式中,本发明包括本文描述的化合物(例如式I化合物)的药用加成盐、药用酯、加成盐的水合物、互变异构形式、多晶型物、对映体、对映体的混合物、立体异构体或立体异构体的混合物(纯的或作为外消旋或非外消旋混合物),如本发明所命名的式(I)化合物。
药物组合物和给药
根据本发明提供的化合物通常以药物组合物的形式给予(给药)。因而本发明提供药物组合物,其含有:作为活性成分,一种或多种所述的化合物、或其药用盐或酯,以及一种或多种药用赋形剂,载体,包括惰性固态稀释剂和填料;稀释剂,包括无菌水溶液和各种有机溶剂;渗透增强剂;增溶剂;以及佐剂。本发明的化合物可以单独给予或与其他治疗剂共同给予。这样的组合物以制药技术领域中的公知方式进行制备(参见,例如,Remington’s Pharmaceutical Sciences,Mace Publishing Co.,Philadelphia,PA17thEd.(1985)以及“Modern Pharmaceutics”,Marcel Dekker,Inc.3rdEd.(G.S.Banker&C.T.Rhodes,Eds.))。
药物组合物可以通过任何具有类似效用的药剂可接受的给药方式以单剂量或多剂量给予,例如,正如在那些结合于本文作为参考的专利和专利申请中所描述的,包括直肠、口腔、鼻内、和经皮途径,通过动脉内注射、静脉内给药、腹膜内给药、胃肠道外给药、肌内给药、皮下给药、口服、局部给药、作为吸入剂,或经过浸渍或涂布装置如支架,例如,或插入动脉的圆柱状聚合物。
一种给药方式为胃肠外给药,尤其是通过注射。本发明的新型组合物可结合于其中用于注射给药的形式,包括水或油悬浮液、或乳液,采用芝麻油、玉米油、棉子油、或花生油、以及酏剂、甘露醇、右旋糖、或无菌水溶液,以及类似的药物载体。通常也将盐水溶液用于注射,但在本发明上下文中是较少优选的。也可以使用乙醇、丙三醇、丙二醇、液态聚乙二醇、及其类似物(以及其合适的混合物)、环糊精衍生物、和植物油。适当的流动性可以通过如下方法来保持,例如,通过包衣的使用,如卵磷脂,在分散的情况下通过保持所需要的颗粒尺寸,以及通过使用表面活性剂。可通过使用各种抗菌剂和抗真菌剂来达成预防微生物的作用,例如,对羟基苯甲酸酯类、氯代丁醇、苯酚、山梨酸、硫柳汞(乙基汞硫代水杨酸钠,thimerosal)、及其类似物。
可注射的无菌溶液的制备如下:在具有如上文所列举的各种其它成分的适当溶剂中加入所需量的根据本发明的化合物,如果需要的话,接着通过过滤灭菌。一般,分散剂的制备如下:将各种经灭菌的活性成分加入无菌载体中,其包含基本的分散介质和以上所列举的所需的其它成分。在无菌粉末用于制备可注射无菌溶液的情况下,优选的制备方法是采用真空干燥和冷冻干燥技术,其由先前无菌过滤的溶液产生活性成分粉末以及任何额外的所需成分的粉末。
口服给药是给予根据本发明的化合物的另一种途径。给药可通过胶囊或肠溶衣片剂、或类似物。在制备包括本文所述的至少一种化合物的药物组合物时,活性成分通常用赋形剂稀释和/或封装在这样的载体中,以致可以呈现胶囊剂、小药囊、纸、或其它包装物形式。当赋形剂用作稀释剂时,它可以是固体、半固体、或液体材料(如上所述),就活性成分而言,其起到赋形剂、载体、或介质的作用。因此,该组合物的形式可以是片剂、丸剂、散剂、锭剂、小药囊、扁囊剂、酏剂、悬浮剂、乳剂、溶液、糖浆剂、气雾剂(作为固体或在液体介质中)、含有例如高达10%重量的活性化合物的软膏剂、软胶囊剂和硬胶囊剂、可注射无菌溶液、以及无菌封装的散剂。
合适赋形剂的一些例子包括乳糖、右旋糖、蔗糖、山梨糖醇、甘露醇、淀粉、阿拉伯树胶、磷酸钙、藻酸盐、黄芪胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、无菌水、糖浆、以及甲基纤维素。配制剂也包括润滑剂如滑石粉、硬脂酸镁、和矿物油;润湿剂;乳化剂和悬浮剂;防腐剂如羟苯甲酯和羟苯丙酯;甜味剂;以及增香剂。
通过采用本领域已知的方法可以配制出本发明的组合物,在对患者给药后,可提供活性成分的快速、持续、或延缓释放。用于口服给药的控释递送系统包括含有聚合物涂布的贮囊或药物-聚合物基体配制剂的渗透泵系统和溶解系统。控释系统的实例在美国专利第3,845,770号、第4,326,525号、第4,902,514号、第5,616,345号中给出。本发明使用方法的另一种配制剂采用透皮递药装置(“贴剂”)。这类透皮贴剂可用于提供本发明化合物在受控量下的连续或不连续注入。用于递药的透皮贴剂的结构和使用是本领域熟知的。例如,参见美国专利第5,023,252号、第4,992,445号、和第5,001,139号。这类贴剂构成用于连续、脉冲、或按需要给药。
组合物优选配制成单位剂型。术语“单位剂型”是指物理上分离的单位,适用于人类对象和其它哺乳动物的单位剂量,每个单位包括预定量的活性材料,其经计算以产生所需要的治疗效应,结合合适的药物赋形剂(例如,片剂、胶囊剂、和针剂)。化合物通常给予有效药物量。优选地,对于口服给药而言,每剂量单位含有1mg至2g的本文所述的化合物,而对于胃肠外给药来说,优选的是0.1至700mg的本文所述的化合物。然而,需要理解的是,实际给予的化合物的量将由医生根据相关的情况决定,包括要治疗的疾病、选择的给药途径、给予的实际化合物及其相对活性、每个患者的年龄、体重和反应、患者症状的严重程度以及类似情况。
为了制备诸如片剂这样的固体组合物,主要的活性成分与药物赋形剂混合形成含有本发明化合物的均相混合物的固体预制剂组合物。当提到这些预制剂组合物为均相时,它是指活性成分均匀地分散到整个组合物中,从而使该组合物可以容易地细分成等效的单位剂型,如片剂、丸剂、和胶囊剂。
本发明的片剂或丸剂可以进行包衣或通过其它方式进行混合以提供剂型,其具有作用时间长,或保护免受胃的酸性条件的作用的优点。例如,片剂或丸剂可包括内部剂量成分和外部剂量成分,后者以包封的形式裹住前者。这两种成分可用肠溶层隔开,该肠溶层用于阻止成分在胃中的崩解并使得内部成分完整无损地送入十二指肠或被延缓释放。各种材料都可用于肠溶层或包衣,这些材料包括许多高分子酸以及高分子酸与这样的材料如紫胶、十六烷醇、和乙酸纤维素的混合物。
用于吸入剂或吹入剂的组合物包括药用溶液和悬浮液,水性或有机溶剂、或其混合物、以及粉末。液体或固体组合物可以包含适当的如上文所述的药用赋形剂。优选地,这些组合物可通过口服或鼻吸入途径给予,产生局部或系统的效应。优选的药用溶剂中的组合物可通过使用惰性气体进行雾化。雾化的溶液可通过雾化装置直接吸入或者雾化装置与面罩吸入器、或间歇式正压呼吸机相连。从以适当方式递送成分的装置可给予溶液、悬浮剂、或粉末组合物,优选口服或鼻内给药。
联合治疗
通过给予本发明的晚钠通道阻断剂治疗的患者通常呈现的疾病或病症能从用其他治疗剂治疗获益。这些疾病或病症具有心血管特性或涉及肺病、代谢紊乱、胃肠道病症等。另外,通过给予本发明的晚钠通道阻断剂治疗的一些冠心病患者呈现的疾病或病症能从用为抗生素、止痛药、和/或抗抑郁药以及抗焦虑药的治疗剂治疗获益。
心血管药剂联合治疗
能够从本发明的晚钠通道阻断剂与其他治疗剂联合治疗获益的心血管相关疾病或病症包括但不限于,心绞痛,包括稳定型心绞痛、不稳定型心绞痛(UA),运动诱发的心绞痛、变异型心绞痛,心律失常,间歇性跛行,心肌梗死,包括非STE心肌梗死(NSTEMI),肺性高血压,包括肺性动脉高血压,心力衰竭,包括充血性(或急性)心力衰竭和舒张性心力衰竭以及具有保留射血分数的心力衰竭(舒张功能不全),急性心力衰竭,或复发性缺血。
适合于治疗心血管相关疾病或病症的治疗剂包括抗心绞痛药、心力衰竭药、抗血栓药、抗心律失常药、抗高血压药、以及降脂药。
本发明的晚钠通道阻断剂与适合于治疗心血管相关病症的治疗剂的共同给予使得能够提高目前所接受的患者的护理治疗标准。
抗心绞痛药
抗心绞痛药包括β-阻断剂、钙通道阻断剂和硝酸酯。β-阻断剂减少心脏对氧的需要,通过减少其工作负载导致心律降低和较少的强心肌收缩。β-阻断剂的实例包括醋丁洛尔(Sectral)、阿替洛尔(天诺敏(Tenormin))、倍他洛尔(卡尔仑(Kerlone))、比索洛尔/氢氯噻嗪(Ziac)、比索洛尔(富马酸比索洛尔(Zebeta))、卡替洛尔(Cartrol)、艾司洛尔(esmolol)(Brevibloc)、拉贝洛尔(labetalol)(盐酸拉贝洛尔(Normodyne),盐酸拉贝洛尔(Trandate))、美托洛尔(metoprolol)(酒石酸美托洛尔(Lopressor),酒石酸美托洛尔(Toprol XL))、纳多洛尔(nadolol)(酒石酸美托洛尔(Corgard))、普萘洛尔(propranolol)(心得安(Inderal))、索他洛尔(sotalol)(盐酸索他洛尔制剂(Betapace))、以及噻吗咯尔(timolol)(盐酸索他洛尔制剂(Blocadren))。
硝酸酯扩张动脉和静脉,从而提高冠状动脉血流量并降低血压。硝酸酯的实例包括硝酸甘油、硝酸酯贴剂(nitrate patches)、硝酸异山梨酯(isosorbide dinitrate)、以及5-单硝酸异山梨酯(isosorbide-5-mononitrate)。
钙通道阻断剂防止钙的正常流量进入心脏和血管的细胞,导致血管松弛,从而提高血液和氧供应到心脏。钙通道阻断剂的实例包括氨氯地平(amlodipine)(络活喜(Norvasc),氨氯地平和盐酸贝那普利胶囊剂(Lotrel))、苄普地尔(bepridil)(伐斯可(Vascor))、地尔硫卓(diltiazem)(合心爽(Cardizem),盐酸地尔硫卓缓释胶囊剂(Tiazac))、非洛地平(felodipine)(波依定(Plendil))、硝苯吡啶(nifedipine)(拜新同(Adalat),心痛定制剂(Procardia))、尼莫地平(nimodipine)(尼膜同(Nimotop))、尼索地平(nisoldipine)(尼索地平缓释片剂(Sular))、维拉帕米(verapamil)(卡兰(Calan),异搏定(Isoptin),盐酸维拉帕米缓释胶囊剂(Verelan))、以及尼卡地平(nicardipine)。
心力衰竭药剂
用于治疗心力衰竭的药剂包括利尿剂、ACE抑制剂、血管扩张剂、以及强心苷类(cardiac glycosides)。利尿剂消除在组织和循环系统中的过量流体,从而缓解许多心力衰竭的症状。利尿剂的实例包括氢氯噻嗪、美托拉宗(metolazone)(Zaroxolyn)、呋塞米(furosemide)(Lasix)、布美他尼(Bumex)、螺内酯(spironolactone)(安体舒通(Aldactone))、以及依普利酮(eplerenone)(Inspra)。
血管紧张素转换酶(ACE)抑制剂通过扩张血管和降低对血流的阻力而减少心脏的工作负荷。ACE抑制剂的实例包括贝那普利(benazepril)(洛汀新(Lotensin))、卡托普利(captopril)(开博通(Capoten))、依那普利(enalapril)(Vasotec)、福辛普利(fosinopril)(蒙诺(Monopril))、赖诺普利(lisinopril)(Prinivil、捷赐瑞(Zestril))、莫昔普利(moexipril)(盐酸莫昔普利片剂(Univasc))、培哚普利(perindopril)(Aceon)、喹那普利(quinapril)(Accupril)、雷米普利(ramipril)(Altace)、以及群多普利(trandolapril)(Mavik)。
血管扩张剂通过使血管松弛和扩张而减少对血管的压力。血管扩张剂的实例包括肼苯哒嗪(hydralazine)、二氮嗪(diazoxide)、哌唑嗪(prazosin)、可乐定(clonidine)、以及甲基多巴(methyldopa)。ACE抑制剂、硝酸酯、钾通道活性剂以及钙通道阻断剂也起到血管扩张剂的作用。
强心苷类是提高心脏收缩力量的化合物。这些化合物增强心脏的泵送能力并改善心跳不规则的活动。强心苷类的实例包括洋地黄(digitalis)、地高辛(digoxin、以及洋地黄毒苷(digitoxin)。
抗血栓药
抗血栓药抑制血液的凝血能力。有三种主要类型的抗血栓药——血小板抑制剂、抗凝血药(anticoagulants)、和溶血栓药(thrombolytic agents)。血小板抑制剂的实例包括乙酰水杨酸(阿司匹林(aspirin))、噻氯匹定(ticlopidine)、氯吡格雷(clopidogrel)(波利维(plavix))、双嘧达莫(dipyridamole)、西洛他唑(cilostazol)、潘生丁(persantine)磺吡酮(sulfinpyrazone)、双嘧达莫(dipyridamole)、吲哚美辛(indomethacin)、以及糖蛋白llb/llla抑制剂、如阿昔单抗(abciximab)、替罗非班(tirofiban)、以及依替巴肽(eptifibatide)(引替瑞林(Integrelin))。β-阻断剂和钙通道阻断剂也具有血小板抑制作用。
抗凝血药(Anticoagulants)防止血凝块生长更大并防止新凝块的形成。抗凝血药的实例包括比伐卢定(bivalirudin)(Angiomax)、华法林(warfarin)(可密定(Coumadin))、未分段肝素(unfractionated heparin)、低分子量肝素、达那肝素(danaparoid)、来匹卢定(lepirudin)、以及阿加曲班(argatroban)。
溶血栓药作用是分解存在的血凝块。溶血栓药的实例包括链激酶(streptokinase)、尿激酶(urokinase)、和替奈普酶(tenecteplase)(TNK)、和组织型纤溶酶原激活物(tissue plasminogen activator)(t-PA)。
抗心律失常药
抗心律失常药用于治疗心律和节奏的障碍。抗心律失常药的实例包括胺碘酮(amiodarone)、决奈达隆(dronedarone)、奎尼丁(quinidine)、普鲁卡因胺(procainamide)、利多卡因(lidocaine)、和普罗帕酮(propafenone)。强心苷类和β-阻断剂也用作抗心律失常药。
与胺碘酮和决奈达隆的联用是尤其有意义的,因最近发现晚钠通道阻断剂雷诺嗪和胺碘酮(amioarone)和决奈达隆的协同效应。参见美国专利申请公开号No.20100056536和美国临时申请61/288,739,其全文合并于此。
抗高血压药
抗高血压药用于治疗高血压,其中血压持续高于正常值的病症。高血压与心血管疾病的许多方面有关,包括充血性心力衰竭、动脉粥样硬化以及凝块形成。抗高血压药的实例包括α-1-肾上腺素能拮抗剂,如哌唑嗪(脉宁平(Minipress))、甲磺酸多沙唑嗪(可多华(Cardura))、盐酸哌唑嗪(脉宁平(Minipress))、哌唑嗪、泊利噻嗪(Minizide)、和盐酸特拉唑嗪(高特灵(Hytrin));β-肾上腺素能拮抗剂,如普萘洛尔(心得安(Inderal))、纳多洛尔(Corgard)、噻吗洛尔(Blocadren)、美托洛尔(Lopressor)、和吲哚洛尔(心得静片剂(Visken));中枢α-肾上腺素能拮抗剂,如盐酸可乐定(Catapres)、和氯噻酮(Clorpres、Combipres)、胍那苄醋酸盐(guanabenzAcetate)(氯压胍(Wytensin))、胍法辛盐酸盐(Tenex)、甲基多巴(爱道美(Aldomet))、甲基多巴和氯噻嗪(Aldoclor)、甲基多巴和氢氯噻嗪(Aldoril);复合α/β-肾上腺素能拮抗剂,如拉贝洛尔(Normodyne,Trandate)、卡维地洛(Coreg);肾上腺素能神经元阻滞剂,如胍乙啶(依斯迈林(Ismelin))、利血平(Serpasil);中枢神经系统作用抗高血压药,如可乐定(Catapres)、甲基多巴(爱道美(Aldomet))、胍那苄(Wytensin);抗血管紧张素II药剂;ACE抑制剂,如培哚普利(Aceon)卡托普利(Capoten)、依那普利(Vasotec)、赖诺普利(Prinivil、捷赐瑞(Zestril));抗血管紧张素-II受体拮抗剂,如坎地沙坦(Atacand)、依普罗沙坦(Teveten)、厄贝沙坦(Avapro)、氯沙坦(科素亚(Cozaar))、替米沙坦(美卡素(Micardis))、缬沙坦(Diovan);钙通道阻断剂,如维拉帕米(卡兰(Calan)、异搏定(Isoptin))、地尔硫卓(合心爽(Cardizem))、硝苯吡啶(拜新同(Adalat),心痛定制剂(Procardia));利尿剂;直接血管扩张剂,如硝普钠(Nipride)、二氮嗪(Hyperstat IV)、肼苯哒嗪(阿比西林(Apresoline))、米诺地尔(长压定(Loniten))、维拉帕米;和钾通道活化剂,如阿普卡林、比卡林、色满卡林、依马卡林、尼可地尔、和吡那地尔。
降脂药
降脂药用于降低血液中存在的胆固醇或脂肪糖(fatty sugars)的量。降脂药的实例包括苯扎贝特(必降脂(Bezalip))、环丙贝特(Modalim)、和他汀类药物,如阿托伐他汀(立普妥(Lipitor))、氟伐他汀(来适可(Lescol))、洛伐他汀(美降脂(Mevacor)、庚胺醇(Altocor))、美伐他汀、匹伐他汀(Livalo、Pitava)、普伐他汀(Lipostat)、罗舒伐他汀(可定(Crestor))、和辛伐他汀(舒降之(Zocor))。
在本发明中,呈现急性冠心病的患者甚至经常患有第二医学病症,如代谢紊乱、肺病、外周血管障碍、或胃肠道病症中的一种或多种。这样的患者可以受益于联合治疗,包括与至少一种治疗剂联合给予患者雷诺嗪。
肺痛联合治疗
肺病是指与肺相关的任何疾病或病症。肺病的实例包括但不限于哮喘、慢性阻塞性肺疾病(COPD)、支气管炎、和肺气肿。
用于治疗肺病的治疗剂的实例包括支气管扩张剂,包括β2-激动剂和抗胆碱药、皮质类固醇、和电解质补充剂。用于治疗肺病的治疗剂的具体实例包括肾上腺素、特布他林(硫酸特布他林吸入剂(Brethaire),博利康尼(Bricanyl))、沙丁胺醇(舒喘宁(Proventil))、沙美特罗(施立稳(Serevent)、Serevent Diskus)、茶碱、异丙托溴铵(爱喘乐(Atrovent))、噻托溴铵(Spiriva)、甲泼尼龙(甲强龙(Solu-Medrol)、美卓乐(Medrol))、镁、和钾。
代谢紊乱联合治疗
代谢紊乱的实例包括不限于糖尿病,包括I型和II型糖尿病、代谢综合征、血脂异常、肥胖、葡糖耐受不良、高血压、升高的血清胆固醇、和升高的甘油三酯。
用于治疗代谢紊乱的治疗剂的实例包括抗高血压药和降脂药,如上述“心血管药剂联合治疗”部分中所描述的。用于治疗代谢紊乱的治疗剂的其他实例包括胰岛素、磺酰脲类药物、双胍类、α-葡萄糖苷酶抑制剂、和肠降血糖素类似物(incretin mimetics)。
周围血管疾病联合治疗
周围血管疾病是与位于心脏和脑外部的血管(动脉和静脉)相关的疾病,包括,例如外周动脉病(周围动脉疾病)(PAD),当供应血液到内部器官、臂和腿的动脉因为动脉粥样硬化而变得完全或部分堵塞时产生的病症。
胃肠道病症(消化系统疾病)联合治疗
胃肠道病症(消化系统疾病)是指与胃肠道相关的疾病和病症。胃肠道病症的实例包括胃食管返流疾病(GERD)、炎性肠病(IBD)、胃肠炎、胃炎和消化性溃疡病、和胰腺炎。
用于治疗胃肠道病症的治疗剂的实例包括质子泵抑制剂,如泮托拉唑(Protonix)、兰索拉唑(Prevacid)、艾美拉唑(耐信(Nexium))、奥美拉唑(Prilosec)、雷贝拉唑;H2阻断剂,如西咪替丁(泰胃美(Tagamet))、雷尼替丁(善胃得(Zantac))、法莫替丁(Pepcid)、法莫替丁(爱希(Axid));前列腺素类,如米索前列醇(喜克溃(Cytotec));硫糖铝;和抗酸药。
抗生素、止痛药、抗抑郁药和抗焦虑药联合治疗
患有急性冠状动脉疾病事件的患者也会呈现一种或多种治疗剂(其为抗生素、止痛药、抗抑郁药和抗焦虑药)与雷诺嗪联合给予而受益的病症。
抗生素
抗生素是杀死微生物(包括细菌和真菌)或使其停止生长的治疗剂。抗生素的实例包括β-内酰胺抗生素类,包括青霉素类(阿莫西林(amoxicillin)),头孢菌素类,如头孢唑林、头孢呋辛、头孢羟氨苄(Duricef)、头孢氨苄(头孢力新(Keflex))、头孢拉定(泛捷复(Velosef))、头孢克洛(希刻劳(Ceclor)、头孢呋辛酯(cefuroxime axtel)(新菌灵(Ceftin))、头孢丙烯(施复捷(Cefzil))、氯碳头孢(乐君毕(Lorabid))、头孢克肟(Suprax)、头孢泊肟酯(Vantin)、头孢泊肟酯(先力腾(Cedax))、头孢地尼(Omnicef)、头孢曲松(罗氏芬(Rocephin)),碳青霉烯类(carbapenems),和单菌胺类;四环素类,如四环素;大环内酯类抗生素,如红霉素;氨基糖苷类,如庆大霉素、妥布霉素、阿米卡星;喹诺酮类如环丙沙星;环肽类,如万古霉素,链阳菌素类,多黏菌素类;林可胺类,如克林霉素;噁唑烷酮类(oxazolidinoes),如利奈唑胺;和磺胺抗生素类(sulfaantibiotics),如磺胺异噁唑。
止痛药
止痛药是用于缓解疼痛的治疗剂。止痛药的实例包括阿片类和拟吗啡样药物(morphinomimetics),如芬太尼和吗啡;对乙酰氨基酚;非类固醇性抗炎药(NSAIDs),和COX-2抑制剂。对于本发明的晚钠通道阻断剂通过抑制Nav 1.7和1.8钠通道治疗神经病变性疼痛,与止痛药联合是特别希望的。参见美国专利申请20090203707。
抗抑郁药和抗焦虑药
抗抑郁药和抗焦虑药包括用于治疗焦虑疾病、抑郁的那些以及用作镇静药和安定药(tranquillers)的那些。抗抑郁药和抗焦虑药的实例包括苯二氮卓类(benzodiazepines),如地西泮、劳拉西泮、和劳拉西泮;苯二氮卓类(enzodiazepines);巴比妥酸盐类;格鲁米特;水合氯醛;甲丙氨酯;舍曲林(左洛复(Zoloft)、Lustral、Apo-Sertral、Asentra、Gladem、Serlift、Stimuloton);依他普仑(来士普(Lexapro)、Cipralex);氟西汀(百忧解(Prozac)、Sarafem、Fluctin、Fontex、Prodep、Fludep、Lovan);文拉法辛(郁复伸XR(Effexor XR)、Efexor);西酞普兰(Celexa)、喜普妙(Cipramil)、Talohexane);帕罗西汀(Paxil、赛乐特(Seroxat)、Aropax);曲唑酮(Desyrel);阿米替林(Elavil);和安非他酮(Wellbutrin、Zyban)。
因此,本发明的一个方面提供了一种组合物,其包括本发明的晚钠通道阻断剂和至少一种治疗剂。在可替换的实施方式中,该组合物包括本发明的晚钠通道阻断剂和至少两种治疗剂。在另一种可替换的实施方式中,该组合物包括本发明的晚钠通道阻断剂和至少三种治疗剂,本发明的晚钠通道阻断剂和至少四种治疗剂,或本发明的晚钠通道阻断剂和至少五种治疗剂。
联合治疗的方法包括:共同给予包含本发明的晚钠通道阻断剂和一种或多种治疗剂的单一配制剂,基本上同时给予多于一种包含本发明的晚钠通道阻断剂和一种或多种治疗剂的配制剂,以任何顺序连续给予本发明的晚钠通道阻断剂和一种或多种治疗剂,其中优选存在本发明的晚钠通道阻断剂和一种或多种治疗剂同时发挥其治疗作用的时间段。
示例化合物的合成
本发明的化合物可以利用本文中披露的方法及在给出本文的公开内容之下显而易见的它们的路线变换以及本领域熟知的方法进行制备。除了本文教导的之外,可以使用常规和熟知的合成方法。本文描述的典型化合物,例如具有通过一个或多个式I描述的结构的化合物的合成,可以如在以下实施例中所描述的那样实现。如果可利用,试剂可以,例如从SigmaAldrich或其他化学品供应商商购。
一般合成:
依据本发明的化合物的典型实施方式可以利用以下描述的一般反应方案进行合成。给出本文中的描述之下,显而易见的是,这些一般方案可以通过将所述起始原料用具有类似结构的其他材料替换而使得产生相应的不同产物。合成的描述接着提供这些起始原料如何可以进行变化以提供相应产物的大量实例。给出取代基被定义的期望产物,必要的起始原料通常可以通过检验而确定。起始原料典型地获自商业来源或利用公开的方法进行合成。对于合成作为本发明实施方式的化合物,待合成化合物的结构的检验将提供各个取代基的特性(鉴别)。给出本文中的实施例下,终产物的特性通过简单的检验过程将通常使得必要的起始原料的特性显而易见。
合成反应参数
术语“溶剂”、“惰性有机溶剂”或“惰性溶剂”是指在结合其进行描述的反应条件下是惰性的溶剂(包括,例如,苯、甲苯、乙腈、四氢呋喃(“THF”)、二甲基甲酰胺(“DMF”)、氯仿、二氯甲烷(或甲叉二氯)、二乙醚、甲醇、吡啶等)。除非有相反规定,在本发明的反应中使用的溶剂是惰性有机溶剂,并且反应在惰性气体,优选氮气下进行。
术语“q.s(足量)”是指添加足够的量以实现所描述的功能,例如,使溶液达到期望的体积(即100%)。
式(I)的化合物的合成
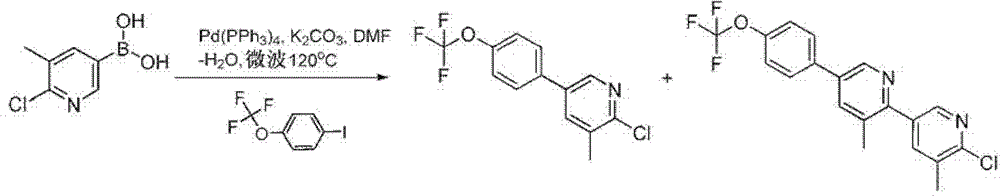
式I的化合物典型地制备如下:首先提供分子核(1),其可以商购获得,例如6-溴-[1,2,4]三唑并[4,3-a]吡啶、6-溴-3-甲基-[1,2,4]三唑并[4,3-a]吡啶、6-溴-N-乙基-[1,2,4]三唑并[4,3-a]吡啶-3-胺等,或从头合成,然后利用称为铃木偶联(Suzuki coupling)的条件连接期望的R1Q取代基。这个过程在以下用于式IA的化合物的反应方案I中示出。
反应方案I
总体上,式(1)的卤代化合物,在这种情况下是溴化化合物,在弱碱例如碳酸氢钠存在下,在惰性溶剂例如含水N,N-二甲基甲酰胺中,与适当取代的式R1-Q-B(OH)2的硼酸衍生物反应。该反应典型地在约120-170℃的温度下,在具有适当配体的金属催化剂例如二氯双(三苯基膦)合钯(II)存在下,进行约10分钟至约1小时。当反应基本上完成时,通过常规方式分离式I的产物。
应当理解,在添加R1Q部分之前或之后,可以更改或添加各种R取代基。例如,在某些实施方式中,当X1是CRa时,Ra部分可以在添加R1Q取代基之前偶联至所述核。而且,在其中Ra取代基含有杂芳基环的情况下,该环可以在添加R1Q部分之前或之后合成和环化。
还应当理解,任何取代基的添加可以导致产生大量的异构产物,该异构产物的任何或全部可以利用常规技术进行分离和纯化。
可选的核合成
当式(1)的化合物从头合成时,该化合物的各种W和X部分典型地通过对核合成选择适当的反应物进行构建。另外的改性以提供期望的R1、R2、R3、R4、Ra或Rb取代基可以利用常规技术后续地进行。
下表1举例说明了用于合成式(1)的典型化合物的方法。
表1:式(1)核化合物方法
包括以下实施例以显示本发明的优选实施方式。本领域技术人员应当理解,以下实施例中披露的技术代表本发明发明人发现的在本发明实施中良好起作用的技术,并因此可以认为构成用于本发明实施的优选模式。然而,依照本发明公开内容,本领域技术人员应当理解,在所披露的具体实施方式中可以形成许多改变并且仍然获得相同或相似的结果,而没有背离本发明的精神和范围。
实施例1
式I化合物的制备,其中W
1
、W
2
和W
3
是CH,X
1
是CR
a
且X
2
是N
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,Q是共价键, W 1 、W 2 和W 3 是CH,X 1 是CCF 3 ,且X 2 是N
步骤1:一种式(1)的化合物,6-溴-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]
吡啶的制备。
将5-溴-2-肼基吡啶(Frontier Scientific,Salt Lake City,UT)(2.092g)放入装有回流冷凝器的100mL圆底烧瓶中。缓慢地加入三氟乙酸酐(50mL)并将反应混合物加热至回流3天以上,浓缩,并用甲苯共沸干燥。梯度色谱(乙酸乙酯/己烷)获得棕褐色固体。
1H NMR(400MHz,CDCl3):δ8.39(br s,1H);7.83(dd,J=9.8,1.0Hz,1H);7.54(dd,J=9.8,1.6Hz,1H)。
可替换的步骤1:一种式(1)的化合物,6-溴-3-(三氟甲基)-[1,2,4]三
唑并[4,3-a]吡啶的制备。
向在可密封烧瓶中、在0℃下在丁腈中的酰肼(35.0g,0.186mol)的悬液中,经由注射器以使得内部温度维持在35℃以下的速率加入三氟乙酸酐(79mL,0.558mol)。密封烧瓶并加热至135℃过夜。反应冷却,并在减压下浓缩。向残留物中加入H2O(100ml)并用NaHCO3(水溶液)中和混合物。加入CH2Cl2(200ml),分离各个层,并且有机层用盐水(100ml)洗涤。有机物用MgSO4干燥,过滤,并浓缩至褐色固体。将这些固体悬浮在己烷/(乙)醚混合物(2∶1,100ml)中,超声处理直至均匀,并过滤。这些固体用冷己烷/(乙)醚混合物(10∶1,2x 50ml)洗涤并干燥而获得产物。
可替换的步骤1:一种式(1)的化合物,6-溴-3-(三氟甲基)-[1,2,4]三
唑并[4,3-a]吡啶的制备。
将在原乙酸三甲酯(三甲基原乙酸酯,trimethylorthoacetate)(20mL)中的5-溴-3-硝基-2-肼基吡啶(hydrazinopyridine)(2.0g,8.58mmol)的悬液在80℃加热20h。冷却后,蒸掉溶剂,将残留物溶解在乙酸乙酯(200mL)中,用水、盐水洗涤,用硫酸钠干燥并浓缩而提供产物6-溴-3-甲基-8-硝基-[1,2,4]三唑并[4,3-a]吡啶。
步骤2:6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶
的制备。
在100mL圆底烧瓶中,将6-溴-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶(2.124g)、4-三氟甲氧基苯基硼酸(2.466g)和碳酸钠(0.635g)悬浮在DMF(81mL)和去离子水(9mL)的混合物(其用氮气脱气)中。加入四(三苯基膦)合钯(0.462g)并将反应混合物在90℃下搅拌过夜,浓缩,残留物溶解在乙酸乙酯中,并用水(2×)和浓NaHCO3洗涤。合并的有机相用MgSO4干燥并浓缩,然后经受梯度色谱(乙酸乙酯/己烷)而产生黑灰色固体。将该固体从乙酸乙酯/己烷中再结晶以产生灰白色物质。
1H NMR(400MHz,CDCl3):δ8.32(s,1H);8.03(d,J=9.7Hz,1H);7.69(d,J=9.7,1H);7.62(d,J=7.7Hz,2H);7.41(d,J=7.7,2H)。
19F NMR(377MHz,CDCl3):δ-57.81(s,1F);-62.99(s,1F)。
MS(ES+,m/z)348.0(基峰,M+H+);370.0(M+Na+);717.0(2M+Na+)。
可替换的步骤2:6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶。
在5mL瓶中,将6-溴-[1,2,4]三唑并[4,3-a]吡啶(93mg)、4-三氟甲氧基苯基硼酸(115mg)和碳酸钾(187mg)悬浮在之前用氮气脱气的DMF(2mL)中。加入四(三苯基膦)合钯(20mg)并在微波反应器中在150℃下将反应混合物加热30min,过滤,并浓缩。残留物经受梯度色谱(MeOH/二氯甲烷)以产生白色粉末,56.4mg(43%收率)。
1H NMR(400MHz,CDCl3):δ8.89(s,1H),8.27(br s,1H);7.89(d,J=9.2Hz,1H);7.59(d,J=8.4,2H);7.52(d,J=9.6Hz,1H);7.36(d,J=7.6,2H)。
MS(ES+,m/z)280.0(基峰,M+H+);581.0(2M+Na+)。
可替换的步骤2:6-(4-环丙基苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]
吡啶的制备。
将在脱气甲苯(1mL)、脱气水(0.5mL)和脱气乙醇(0.5mL)中的6-溴-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶(50mg,0.19mmol)、4-环丙基苯基硼酸(34mg,0.21mmol)、dppf(Pd)Cl2(6.9mg,0.094mmol)、碳酸钾(52mg,0.62mmol)的悬液在90℃加热1小时。分离各个层,浓缩有机层并且残留物通过柱色谱纯化以提供作为白色粉末的6-(4-环丙基苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶。
304.2(M+1)。
1H NMR(DMSO)δ8.29(s,1H),8.01(d,J=9.6Hz,1H),7.74(dd,J=1.2,9.6Hz,1H),7.46(d,J=8Hz,2H),7.26(s,1H),7.22(d,J=8.4Hz,1H),1.94-1.97(m,1H),1.05-1.09(m,2H),0.75-0.79(m,1H)。
可选的步骤3:N-甲基-3-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]
吡啶-3-基)苯甲酰胺的制备。
将如上所述制备的3-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)苯甲酸乙酯,在密封管中,在60℃下,在H2O(2.5mL)和EtOH(1.5mL)的40%CH3NH2中搅拌过夜。浓缩反应混合物并通过HPLC纯化,接着用制备-TLC(5%MeOH/CH2Cl2)进一步纯化而获得N-甲基-3-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)苯甲酰胺。
MS m/z 413.0(M+H)。
B、式I的化合物的制备,其中改变R 1 和X 1
类似地,依照以上实施例1A的程序,但可选地用其他硼酸或频那醇酯(pinacolate ester)替换4-三氟甲氧基苯基硼酸和/或利用其他的式(1)化合物(如在本文中的各个实施例中披露所制得的或商购的和/或不同酸酐制备的不同式(1)前体)替换式(1)的化合物,制得以下式I的化合物:
3-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
N-乙基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-胺;
6-(4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-甲基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-甲氧基-5-(三氟甲基)苯基]-3-甲基[1,2,4]三唑并[4,3-a]吡啶;
N-乙基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶-3-胺,
331.1(基峰,M+H+);683.3(2M+Na+);
N-(4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯基)甲磺酰胺
MS m/z 449.0(M+H)
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酰胺
MS m/z 399.0(M+H)
3,3′-[1,2,4]三唑并[4,3-a]吡啶-3,6-二基二苯甲酸二乙酯
MS m/z 416.1(M+H)
3-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酸乙酯
MS m/z 428.0(M+H)
N-(2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯基)甲磺酰胺
MS m/z 449.0(M+H)
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯磺酰胺
MS m/z 435.0(M+H)
N-乙基-6-(3-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶-3-胺,
331.1(基峰,M+H+);684.3(2M+Na+);
7-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[4-(三氟甲基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(2,4-二氯苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(二氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(3-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-氯-3-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-氯-3-氟苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;和
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[1,5-a]吡啶;
6-(3-苯氧基苯基)[1,2,4]三唑并[1,5-a]吡啶;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酸乙酯
1H-NMR(DMSO-d6)δ8.74(s,1H),8.17(s,4H),8.01(dd,1H),7.91(dd,2H),7.82(dd,1H),7.49(d,2H),4.36(q,2H),1.35(t,3H);
MS m/z 428.0(M+H)
3-苯基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)356.14(基峰,M+H+);
3-(三氟甲基)-6-[4-(三氟甲基)苯基][1,2,4]三唑并[4,3-a]吡啶
1H NMR :8.18(s,1H);7.98(d,1H);7.42(d,1H);7.50(d,2H);7.21(s,1H);7.18(d,1H),
19F NMR :-58.24(s,1F);-63.57(s,1F);
6-(4-苯氧基苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶,
MS(ESI+)329.9(基峰,M+H+);680.9(2M+Na+);
6-(2,4-二氯苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)331.9[基峰,M(35Cl2)+H+];333.9[M(35Cl37Cl)+H+];335.9[M(37Cl2)+H+];353.9;686.8。
6-(3-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶
MS(ESI+)347.9(基峰,M+H+);369.9(M+Na+);716.9(2M+Na+);
7-甲基-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶,
1H NMR :8.45(s,1H);7.95(s,1H);7.70(d,2H);7.54(d,2H);2.39(d,3H),
19F NMR :-58.50(s,1F);-63.44(s,1F);
6-[4-(五氟-λ~6~-硫烷基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶(6-[4-(pentafluoro-lambda~6~-sulfanyl)phenyl]-3-(trifluoromethyl)[1,2,4]triazolo[4,3-a]pyridine)
MS(ESI+)389.9(基峰,M+H+)。
1-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)乙酮
MS(ESI+)306.0(基峰,M+H+);328.0(M+Na+);633.1(2M+Na+)。
6-(4-叔丁氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶
MS(ESI+)336.0(基峰,M+H+);693.1(2M+Na+);
6-[4-(5-甲基-1,3,4-噁二唑-2-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)346.0(基峰,M+H+);368.0(M+Na+);713.1(2M+Na+);
6-[4-(丙-2-基磺酰基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶
MS(ESI+)370.0(基峰,M+H+);392.0(M+Na+);761.0(2M+Na+);
6-[3-甲基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)362.0(基峰,M+H+);384.0(M+Na+);745.1(2M+Na+);
2-甲基-2-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}丙腈,
MS(ESI+)331.0(基峰,M+H+);353.0(M+Na+);683.1(2M+Na+);
6-(1-甲基-1H-吲唑-5-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)318.0(基峰,M+H+);340.0(M+Na+);657.1(2M+Na+);
6-(联苯基-4-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)340.1(基峰,M+H+);701.1(2M+Na+);
4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲酸甲酯;
3-(三氟甲基)-6-[4-(三甲基硅烷基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)336.0(基峰,M+H+);358.0(M+Na+);693.1(2M+Na+);
6-(4-叔丁基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)320.2(基峰,M+H+);
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)330.2(基峰,M+H+);
6-(4-氯-3-氟苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)315.9(基峰,M+H+);
6-[4-氯-3-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)365.9(基峰,M+H+);
6-(3-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)356.0(基峰,M+H+);377.9(M+Na+);733.0(2M+Na+);
7-甲基-6-[3-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)361.9(基峰,M+H+);383.9(M+Na+);744.9(2M+Na+);
7-甲氧基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)378.0(基峰,M+H+);400.0(M+Na+);777.1(2M+Na+);
6-(4-甲氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
1H NMR:8.22(s,1H);7.92(d,1H);7.63(d,1H);7.44(d,2H);7.00(d,2H);3.85(s,3H);
6-[4-(2,2,2-三氟乙氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)362.0(基峰,M+H+);384.0(M+Na+);745.0(2M+Na+);
6-(2-甲基-4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)361.9(基峰,M+H+);383.9(M+Na+);
2-甲基-6-(3-苯氧基苯基)[1,2,4]三唑并[1,5-a]吡啶;
8-甲基-6-(4-苯氧基苯基)[1,2,4]三唑并[1,5-a]吡啶;
5-甲基-6-[4-(三氟甲基)苯基][1,2,4]三唑并[1,5-a]吡啶;
4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯酚;
4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯胺;
3-(丙-2-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)322.0(基峰,M+H+);
6-(4-甲氧基苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶,
LCMS(EI:70eV)293(M++1);
6-(6-(2,2,2-三氟乙氧基)吡啶-3-基)-3-(三氟甲基)咪唑并[1,5-a]吡啶,
LCMS(EI:70eV)362(M++1);
6-苯基-3-(三氟甲基)咪唑并[1,5-a]吡啶,
LCMS(EI:70eV)263(M++1);
6-(4-(2,2,2-三氟乙氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶,
LCMS(EI:70eV)293(M++1);
6-(6-(甲硫基)吡啶-3-基)-3-(三氟甲基)咪唑并[1,5-a]吡啶(6-(6-(methylthio)pyridin-3-yl)-3-(trifluoromethyl)imidazo[1,5-a]pyridine),
LCMS(EI:70eV)310(M++1);
3-(三氟甲基)-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶
MS(ESI+)333.1(M+1);
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)363.1(M+1);
6-[2-甲氧基-4-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)362.1(M+1);
8-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]喹啉,
MS(ESI+)399.1(M+1);
N-苯基-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺,
MS(ESI+)355.3(M+1);
6-[4-(苯基硫基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶(6-[4-(phenylsulfanyl)phenyl]-3-(trifluoromethyl)[1,2,4]triazolo[4,3-a]pyridine),
MS(ESI+)372.1(M+1),
1H NMR(CDCl3)δ8.33(s,1H),8.08-8.19(m,1H),7.83(d,J=6.8Hz,1H),7.66-7.72(m,2H),7.43-7.53(m,4H),7.37-7.45(m,3H);
6-[4-(环丙基甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)334.2(M+1);以及
5-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)362.2(M+1),
1H NMR(CDCl3)δ7.87(d,J=9.2Hz,1H),7.32-7.42(m,5H),2.68(s,3H)。
C、式I的化合物的制备,其中改变R 1 、R 2 和R 3
类似地,依照以上实施例1A的程序,但可选地用其他硼酸或频那醇酯(pinacolate ester)替换4-三氟甲氧基苯基硼酸和/或用其他的式(1)化合物(商购获得的或利用不同式(1)前体或不同酸酐制备的)替换式(1)的化合物,可以制备式I的其他化合物。
实施例2
式I化合物的制备,其中W
1
和W
2
是CH,W
3
是N,且X
1
是CR
a
,
以及X
2
是N
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,Q是共价键, W 1 和W 2 是CH,W 3 是N,以及X 1 是CCF 3 ,并且X 2 是N
步骤1:一种式(1)的化合物,6-氯-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]
哒嗪的制备。
在厚壁压力管中,将在甲苯(10mL)中的3-氯-6-肼基哒嗪(6.90mmol)和三氟乙酸酐(7.59mmol)的悬液在110℃加热2小时。浓缩反应混合物,残留物溶解在二氯甲烷中并用饱和NaHCO3洗涤。有机萃取物用Na2SO4干燥并在真空下蒸发而获得棕褐色化合物6-氯-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]哒嗪。
步骤2:6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]哒
嗪的制备。
向圆底烧瓶中加入6-氯-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]哒嗪(0.982mmol)、4-(三氟甲氧基)苯基硼酸(1.18mmol)、四(三苯基膦)合钯(0.0491mmol)、2M Na2CO3(2mL)和1,2-二甲氧基乙烷(3mL)。所得混合物在85℃下加热2小时。反应混合物用乙酸乙酯稀释并通过赛力特硅藻土(celite)过滤。滤液用水洗涤。有机萃取物用Na2SO4干燥并在真空下蒸发。粗残留物通过制备性HPLC纯化而得到6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]哒嗪。
1H-NMR(DMSO)7.65(d,2H,J=8.0Hz),8.25(d,1H,J=8.0Hz),8.26(d,2H,J=8.0Hz),8.74(d,1H,J,=8.0Hz),MS m/z 348.9(M+)。
可替换的步骤2:3-异丙基-6-(2-甲基-4-(三氟甲氧基)苯基)-[1,2,4]三唑
并[4,3-b]哒嗪的制备
向微波反应管中加入如在以上步骤1中制得的6-氯-3-异丙基-[1,2,4]三唑并[4,3-b]哒嗪(1.28mmol)、2-甲基-4-(三氟甲氧基)苯基硼酸(1.40mmol)、四(三苯基膦)合钯(0.064mmol)、2M Na2CO3(1mL)和DMF(3mL)。所得反应混合物在130℃下在微波中加热10min。反应混合物用乙酸乙酯稀释并通过赛力特硅藻土过滤。滤液用水洗涤。有机萃取物用Na2SO4干燥并真空下蒸发。粗残留物通过制备性HPLC纯化而获得3-异丙基-6-(2-甲基-4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-b]哒嗪。
MS m/z 337(M+)。
1H-NMR(DMSO)8.375-8.408(d,1H),7.667-7.695(d,1H),7.525-7.557(d,1H),7.405-7.441(m,2H),3.460-3.645(m,1H),1.420-1.444(m,6H)。
B、式I化合物的制备,其中改变R 1 、X 1 和X 2
类似地,依照以上实施例4A的程序,但可选地用其他硼酸或频那醇酯替换4-三氟甲氧基苯基硼酸和/或用其他化合物(商购获得的或利用本领域已知的常规方法或本文披露的方法制得的)替换式(1)的化合物,制备以下式I的化合物:
6-(4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 405.0(M+);
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 281.0(M+);
3-(1-甲基-1H-吡唑-4-基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 360.1(M+);
N-[5-(三氟甲氧基)-2-{3-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-6-基}苯基]乙酰胺,
MS m/z 497.1(M+);
3,6-二[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 441.1(M+);
6-[2-甲基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 363(M+),
1H-NMR(DMSO)8.671-8.703(s,1H),7.847-7.880(s,1H),7.691-7.719(s,1H),7.400-7.459(m,2H),2.442-2.494(m,3H);
6-(4-苯氧基苯基)-3-(丙-2-基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 331(M+),
1H-NMR(DMSO)8.361-8.393(d,1H),8.126-8.154(d,2H),7.875-7.907(d,1H),7.429-7.454(t,2H),7.113-7.222(m,5H),3.600-3.645(m,1H),1.155-1.477(m,6H);
2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺,
MS m/z 363.1(M+);
6-(3,5-二氟-4-苯氧基苯基)-3-(丙烷-2-基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 367.1(M+);
3-(丙-2-基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 338.1(M+);
6-[3-氟-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 367.1(M+),
1H-NMR(DMSO)8.749-8.782(d,1H),8.248-8.281(d,2H),8.072-8.100(d,1H),7.800-7.825(t,1H);
6-(3,5-二氟-4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 393.1(M+);
6-[4-(4-氯苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 392.1(M+);
3-(二氟甲基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 346.1(M+);
3-(二氟甲基)-6-[3-氟-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 349.1(M+);
3-叔丁基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 345.1(M+);
3-叔丁基-6-[4-(2,2,2-三氟乙氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 351.1(M+);
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 364.1(M+)。
1H-NMR(DMSO)8.992(s,1H),8.703-8.734(d,1H),8.483-8.514(d,1H),8.256-8.288(d,1H),7.245-7.273(d,1H),5.105-5.135(q,2H);
3-乙基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪,以及
MS m/z 317.1(M+),
1H-NMR(DMSO)8.358-8.390(d,1H),8.127-8.155(d,2H),7.871-7.903(d,1H),7.426-7.479(m,2H),7.110-7.245(m,5H),3.138-3.163(m,2H),1.392-1.442(t,3H)。
C、式I的化合物的制备,其中改变R 1 、X 1 和X 2
类似地,依照以上实施例4A的程序,但可选地用其他硼酸或频那醇酯替换4-三氟甲氧基苯基硼酸的和/或用式(1)的其他化合物(商购获得或利用不同式(1)前体或不同酸酐制得的)替换式(1)化合物,可以制备式I的其他化合物。
实施例3
式I化合物的制备,其中W
1
和W
2
是CH,W
3
是N,以及X
1
是CR
a
,并
且X
2
是N
A、式I化合物的制备,其中R 1 是4-甲基磺酰基苯基,Q是共价键, W 1 和W 2 是CH,W 3 是N,以及X 1 是CR a ,R a 是4-氯苄基,并且X 2 是N
步骤1:一种式(1)前体化合物,N-(4-(6-氯哒嗪-3-基)苯基)甲磺酰
胺的制备。
向圆底烧瓶中,加入3,6-二氯哒嗪(20.1mmol)、4-(甲基磺酰氨基)苯基硼酸(20.1mmol)、四(三苯基膦)合钯(1.00mmol)、2M Na2CO3(30mL)、和1,2-二甲氧基乙烷(120mL)。所得反应混合物在85℃加热22小时。反应混合物用乙酸乙酯稀释并通过赛力特硅藻土过滤。滤液用水洗涤。有机萃取物用Na2SO4干燥并真空下蒸发。粗残留物通过biotage柱色谱(用4∶1的乙酸乙酯/己烷混合物洗脱)纯化而获得N-(4-(6-氯哒嗪-3-基)苯基)甲磺酰胺。
步骤2:N-(4-(6-肼基哒嗪-3-基)苯基)甲磺酰胺的制备。
将在一水合肼(6mL)中的N-(4-(6-氯哒嗪-3-基)苯基)甲磺酰胺(2.82mmol)的悬液在120℃下加热1小时并在真空下蒸发。残留物溶解在二氯甲烷中,用水洗涤,用Na2SO4干燥,并在真空下蒸发而获得N-(4-(6-肼基哒嗪-3-基)苯基)甲磺酰胺。
步骤3:N-(4-(6-(2-(2-(4-氯苯基)乙酰基)肼基)哒嗪-3-基)苯基)甲磺酰
胺的制备
向在DMF(7mL)中的2-(4-氯苯基)乙酸(1.07mmol)、HOBT(1.07mmol)和EDCI氢氯化物(1.61mmol)的悬液中加入在10mL的DMF中的N-(4-(6-肼基哒嗪-3-基)苯基)甲磺酰胺(1.07mmol),接着加入二异丙基乙胺(3.77mmol)。所得混合物在室温下搅拌22小时并在真空下蒸发。期望的产物N-(4-(6-(2-(2-(4-氯苯基)乙酰基)肼基)哒嗪-3-基)苯基)甲磺酰胺从水中析出。
步骤4:一种式I的化合物,N-(4-(6-(2-(2-(4-氯苯基)乙酰基)肼基)哒
嗪-3-基)苯基)甲磺酰胺的制备。
向圆底烧瓶中,加入N-(4-(6-(2-(2-(4-氯苯基)乙酰基)肼基)哒嗪-3-基)苯基)甲磺酰胺(0.928mmol)、三苯基膦(3.25mmol)、叠氮三甲基硅烷(3.25mmol)、叠氮羧酸二乙酯(4.18mmol)和THF(13mL)。所得混合物在室温下搅拌22小时。反应混合物用二氯甲烷稀释并用饱和NaHCO3和盐水洗涤。有机萃取物用Na2SO4干燥并在真空下蒸发。粗产物用二氯甲烷和甲醇洗涤。黄色固体通过用DMF和水重结晶而进一步纯化,从而得到N-(4-(3-(4-氯苄基)-[1,2,4]三唑并[4,3-b]哒嗪-6-基)苯基)甲磺酰胺。
1H-NMR(DMSO)3.10(s,3H),4.58(s,2H),7.36-7.44(m,6H),7.90-7.93(d,1H,J,=12Hz),8.08-8.11(d,2H,J,=12Hz),8.39-8.42(d,1H,J,=12Hz),10.24(s,1H),
MS m/z 413.9(M+)。
B、式I化合物的制备,其中改变R 1
类似地,依照以上实施例3A的程序,但用其他硼酸或频那醇酯替换4-(甲基磺酰氨基)苯基硼酸,制备以下式I的化合物:
N-(4-{3-[4-(三氟甲基)苄基][1,2,4]三唑并[4,3-b]哒嗪-6-基}苯基)甲磺酰胺;和
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡嗪,
MS m/z 331(M+),
1H-NMR(DMSO)9.683(s,1H),9.227(s,1H),8.236-8.265(d,2H),8.013-7.669(t,1H)。
C、式I化合物的制备,其中改变R 1 和R a
类似地,依照以上实施例3A的程序,但可选地用其他硼酸或频那醇酯替换4-(甲基磺酰氨基)苯基硼酸和/或用其他化合物CRa酸衍生物替换叠氮羧酸二乙酯,可以制备式I的其他化合物。
实施例4
式I的化合物的制备,其中W
1
和W
2
是CH,W
3
是N,以及X
1
是CR
a
,
并且X
2
是N
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,O是共价键, W 1 和W 2 是CH,W 3 是N,以及X 1 是CCH 2 CF 3 ,并且X 2 是N
步骤1:3,3,3-三氟-N′-(6-(4-苯氧基苯基)哒嗪-3-基)丙酰肼
(propanehydrazide)的制备。
向在DCM(10mL)中的3,3,3-三氟丙酸(2.07mmol)的溶液中加入EDCI HCl(3.02mmol)和HOBt(2.07mmol)。该溶液在室温下搅拌0.5小时,接着加入在30mL的DCM中的3-肼基-6-(4-苯氧基苯基)哒嗪A(如实施例3中披露而制得的)(2.07mmol)和EDIPA(7.24mmol)。偶联反应也与1,3-环己基碳二亚胺和作为溶剂的DCM或EDCI HCl以及作为溶剂的甲醇发生。所得反应混合物在室温下搅拌过夜。该混合物用饱和NaHCO3水溶液稀释。有机萃取物用H2O洗涤并用Na2SO4干燥,然后在真空下蒸发。粗产物用制备性TLC(用5%甲醇和二氯甲烷混合物洗脱)纯化,而获得B。
步骤2:一种式I的化合物,6-(4-苯氧基苯基)-3-(2,2,2-三氟乙基)-[1,2,4]
三唑并[4,3-b]哒嗪的制备。
向在乙腈中的B(0.67mmol)的溶液中加入三苯基膦二氯化物(4.02mmol)。反应混合物在85℃下加热过夜。反应混合物在真空下蒸发。残留物用DCM稀释,用水洗涤并通过制备性HPLC纯化,而获得6-(4-苯氧基苯基)-3-(2,2,2-三氟乙基)-[1,2,4]三唑并[4,3-b]哒嗪。
MS m/z 371(M+)。
1H-NMR(DMSO)8.477-8.509(d,1H),8.185-8.214(d,2H),7.997-8.030(d,1H),7.431-7.483(t,2H),7.118-7.229(m,5H),4.400-4.588(m,2H)。
可选的步骤3:经由铃木偶联添加R
1
部分
利用通过使3-(6-氯-[1,2,4]三唑并[4,3-b]哒嗪-3-基)苯甲腈(利用实施例3中披露的方法制得的)与根据实施例2(可替换的步骤2)中披露的方法的2-甲基-4-(三氟甲氧基)苯基硼酸反应,制备化合物3-(6-(2-甲基-4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-b]哒嗪-3-基)苯甲腈。
B、式I化合物的制备,其中改变R 1
类似地,依照以上实施例4A的程序,但用其他肼撑哒嗪替换3-肼基-6-(4-苯氧基苯基)哒嗪的或用其他酸替换3,3,3-三氟丙酸,制得以下式I的化合物:
3-环丙基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 329.1(M+);
3-(1-甲基-1H-吡唑-4-基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 369.1(M+);
3-[4-(甲基磺酰基)苯基]-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪,
MS m/z 443.1(M+);
6-溴-3-(1-甲基-1H-吡唑-4-基)-[1,2,4]三唑并[4,3-a]吡啶;
3-[6-(4-氟苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈,
MS m/z 316(M+);
3-[6-(4-甲氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈,
MS m/z328.1(M+);
4-[6-(4-甲氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈,
MS m/z 328.1(M+);
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈,
MS m/z 382.0(M+);
4-{6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈,
MS m/z 396.1(M+);
4-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈,
MS m/z 390(M+);
6-溴-3-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶;
6-溴-3-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-b]哒嗪;和
2-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]丙-2-醇,
MS m/z 347.1(M+)。
C、式I化合物的制备,其中改变R 1 和R a
类似地,依照以上实施例4A的程序,但用其他肼撑哒嗪替换3-肼基-6-(4-苯氧基苯基)哒嗪的或用其他酸替换3,3,3-三氟丙酸,可以制备式I的其他化合物。
实施例5
式I化合物的制备,其中R
1
是取代苯基,W
1
和W
2
是CH,W
3
是N,以
及X
1
是CR
a
,并且X
2
是N
A、式I化合物的制备,其中R
1
是4-(吡啶-3-基氧基)苯基)-3-(三氟甲
基),Q是共价键,W
1
、W
2
和W
3
是CH,以及X
1
是CCH
2
CF
3
,并且X
2
是N
步骤1-三唑并吡啶硼酸中间体的制备
向芳基溴(如实施例1中披露制备的)(10g,38mmol)、联硼酸双频那醇酯(双(戊酰)二硼,bis(pinacolato)diboron)(14.3g,56mmol)、Pd(dppf)Cl2(1.1g,1.5mmol)和KOAc(6.6g,68mmol)的混合物中加入脱气的二噁烷(90mL)。反应加热至75℃达4小时并加入AcOH(684mg,114mmol)和H2O(30mL),搅拌10分钟并冷却。残留物在2N NaOH和Et2O之间分配,分离各层并且含水层用Et2O再洗涤一次。含水层用1NHCl酸化至pH=~2,并形成沉淀物。过滤含水层,且固体连续地用CH3CN/H2O(1∶1)、CH3CN和Et2O洗涤。干燥固体并收集,得到所述硼酸。
步骤2-式I的化合物的制备
将在脱气甲苯(1mL)、脱气水(0.5mL)和脱气乙醇(0.5mL)中的3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基硼酸(80mg,0.35mmol)、2-(4-溴苯氧基)吡啶(79mg,0.32mmol)、dppf(Pd)Cl2(12mg,0.016mmol)、碳酸钾(87mg,0.63mmol)的悬液在90℃加热1小时。除去溶剂并且残留物通过RP-HPLC纯化而提供作为白色粉末的产物。
357.1(M+1)。
可替换的步骤2-式I化合物的制备
将在脱气甲苯(4mL)、脱气水(2mL)和脱氢乙醇(2mL)中的硼酸(360mg,1.6mmol)、2-溴-1-碘-4-(三氟甲氧基)苯(575mg,1.6mmol)、dppf(Pd)Cl2(57mg,0.078mmol)、碳酸钾(433mg,3.1mmol)的悬液在45℃加热3小时。分离各层并浓缩有机物并且通过柱色谱纯化而提供期望的产物。
426.0(M+1)。
1H NMR(CDCl3)δ8.23(s,1H),7.99(s,1H),7.64(s,1H),7.30-7.53(m,3H)。
可替换的步骤2-式I化合物的制备
将3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基硼酸(56.2mg,0.217mmol)、4-溴-2-氟-1-(三氟甲氧基)苯(50.0mg,0.217mmol,1.0当量)和Pd(PPh3)4(12.6mg,0.0109mmol,0.05当量)在氮气气氛下放入50mL圆底烧瓶中。随后在环境温度下向该烧瓶中加入2M Na2CO3(1.0mL,2.0mmol)和DMF(4mL)。混合物在110℃加热1小时。该混合物通过赛力特硅藻土(3g)过滤并且赛力特硅藻土用EtOAc(70mL)洗涤。有机层用盐水(30mL)洗涤并用Na2SO4干燥。减压下除去溶剂。获得粗混合物通过柱色谱(SiO2=25g,EtOAc/己烷=1∶3至1∶1,Rf=0.3,其中EtOAc/己烷=1∶1)纯化而得到作为无色晶体的6-(3-氟-4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶。
LCMS(EI:70eV)366(M++1)
1 H-NMR(300MHz,CDCl3):7.43-7.66(3H,m),7.76(1H,d,J=9.6Hz),8.13(1H,d,J=9.6Hz),8.42(1H,s)。
B、R 1 溴基团的可选二次改性(次级变换,modification)
化合物6-(2-(吡啶-3-基)-4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶利用实施例1中披露的方法制备。
MS m/z 425.1(M+1)。
C、式I化合物的制备,其中改变R 1
类似地,依照以上实施例5A或5B的程序,但替换为其他的对-芳基溴或其他溴化R1部分,制得以下式I的化合物:
6-(2-(2-甲氧基嘧啶-5-基)-4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 456.2(M+1);
6-(3-氯-4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶,
LCMS(EI:70eV)382(M++1),
1H-NMR(300MHz,CDCl3):7.51(1H,br s),7.64-7.76(2H,m),8.12(1H,d,J=9.6Hz),8.33(1H,s);
5-(三氟甲氧基)-8-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)喹啉,
1H-NMR(300MHz,CDCl3):7.59(1H,d,J=9.6Hz),7.63(1H,dd,J=8.4,4.3Hz),7.83(1H,d,J=8.4Hz),7.84(1H,dd,J=8.4,1.7Hz),8.00(1H,d,J=9.6Hz),8.54(1H,s),8.59(1H,d,J=8.4Hz),9.01(1H,dd,J=4.3,1.7Hz);
6-(2-氟-4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶,
LCMS(EI:70eV)366(M++1),
1H-NMR(300MHz,CDCl3):7.17(1H,d,J=10.8Hz),7.22(1H,d,J=8.4Hz),7.55(1H,t,J=8.4Hz),7.62(1H,d,J=9.6Hz),8.01(1H,d,J=9.6Hz),8.36(1H,s);
6-[4-(吡啶-4-基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 357.1(M+1);和
6-[4-(环丙氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 320.1(M+1)。
D、式I化合物的制备,其中改变R 1
类似地,依照以上实施例5A或5B的程序,但替换为其他芳基溴或其他溴化R1部分,可以制备式I的其他化合物。
实施例6
式I化合物的可替换制备,其中W
1
和W
2
是CH,W
3
是N,以及X
1
是CR
a
,
并且X
2
是N
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,Q是共价键, W 1 和W 2 是CH,W 3 是N,以及X 1 是CCF 3 ,并且X 2 是N
步骤1:一种式(1)的化合物,6-氯-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]
哒嗪的制备。
向在1,2-二甲氧基乙烷(9mL)中的2,5-二氯吡嗪(2.91mmol)的溶液中加入4-(苯氧基苯基)硼酸(3.49mmol)和四(三苯基膦)合钯(0.145mmol),接着加入2MNa2CO3(3mL)。所得混合物在85℃加热2小时。反应混合物用乙酸乙酯稀释并通过赛力特硅藻土过滤。有机萃取物用Na2SO4干燥并在真空下蒸发。粗产物通过biotage色谱然后用制备性TLC(用5%乙酸乙酯和己烷混合物洗脱)纯化,而获得2-氯-5-(4-苯氧基苯基)吡嗪。
步骤2:2-肼基-5-(4-苯氧基苯基)吡嗪的制备
向在2mL乙醇中的2-氯-5-(4-苯氧基苯基)吡嗪的溶液中加入一水合肼(2mL)。反应混合物在110℃加热2小时并在真空下蒸发。残留物溶解在二氯甲烷中,用水洗涤,用Na2SO4干燥并在真空下蒸发,而获得2-肼基-5-(4-苯氧基苯基)吡嗪。
步骤3:6-(4-苯氧基苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡嗪的制
备。
在厚壁压力管中,将在甲苯(10mL)中的2-肼基-5-(4-苯氧基苯基)吡嗪(0.827mmol)和三氟乙酸酐(0.993mmol)的悬液在110℃加热2小时。反应混合物在真空下蒸发并通过制备性HPLC纯化而获得6-(4-苯氧基苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡嗪。
1H-NMR(DMSO)7.12(t,2H,J=8.0Hz),7.15(d,2H,J=8.0Hz),7.21(t,1H,J,=8.0Hz),7.45(t,2H,J=8.0Hz),8.20(d,2H,J=8.0Hz),8.95(s,1H),9.75(s,1H),(MS m/z 357.0(M+)。
B、式I化合物的制备,其中改变R 1
类似地,依照以上实施例6A的程序,但用其他4-(苯氧基苯基)硼酸替换4-三氟甲氧基苯基硼酸,制得以下式I的化合物:
6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡嗪。
C、式I化合物的制备,其中改变R 1 和X 1
类似地,依照以上实施例6A的程序,但可选地用其他硼酸或频那醇酯替换4-(苯氧基苯基)硼酸和/或用式(1)的其他化合物(商购获得或利用不同式(1)前体或不同酸酐制得的)替换,可以制备式I的其他化合物。
实施例7
式I化合物的制备,其中W
1
、W
2
和W
3
是CH,X
1
是CR
a
,以及X
2
是CR
b
A、式I化合物的制备,其中R 1 是4-三氟甲基苯基,Q是共价键, W 1 、W 2 和W 3 是CH,X 1 是CCF 3 ,并且X 2 是CH
步骤1:一种式(1)的化合物,6-溴-3-(三氟甲基)咪唑并[1,5-a]吡啶
的制备。
在50mL圆底烧瓶中,在室温下将5-溴-2-氨甲基吡啶(113.8mg,0.608mmol)溶解在CH2Cl2(2mL)中。随后加入三乙胺(0.5mL)和三氟乙酸酐(TFAA,300.0mg,1.428mmol,2.35当量)。在相同温度下搅拌1h后,向反应混合物中加入POCl3(1mL)。该混合物在室温下搅拌18h,在160℃搅拌1h然后在180℃搅拌5h。在冰水浴冷却下将反应混合物倒入饱和NaHCO3水溶液(50mL)中。混合物用EtOAc萃取(30mL x 3)。合并的有机层用盐水洗涤(30mL x 2)并用Na2SO4干燥。减压下除去溶剂而获得粗物质(褐色油,141.4mg)。粗产物通过硅胶柱色谱(SiO2=25g,EtOAc/己烷=1∶3,Rf=0.4)纯化而获得期望的产物6-溴-3-(三氟甲基)咪唑并[1,5-a]吡啶,一种式(1)的化合物。
步骤2:R
1
偶联-一种式I的化合物,3-乙基-5-((6-(4-苯氧基苯基)
咪唑并[1,2-a]吡啶-2-基)甲基)-1,2,4-噁二唑的制备。
将6-溴-3-(三氟甲基)咪唑并[1,5-a]吡啶、4-三氟甲基苯基硼酸(127.7mg,0.620mmol,1.5当量)和Pd(PPh3)4(24.3mg,0.021mmol,0.05当量)在氮气气氛下放入50mL圆底烧瓶中。在环境温度下随后向该烧瓶加入2M Na2CO3(1.0mL,2.0mmol,4.8当量)和DMF(4mL)。该混合物在110℃下加热2小时。混合物通过赛力特硅藻土(3g)过滤并且赛力特硅藻土用EtOAc(70mL)洗涤。减压下除去溶剂。获得的粗混合物通过柱色谱(SiO2=25g,EtOAc/己烷=1∶3,Rf=0.35)纯化。含有期望产物的馏分通过旋转蒸发仪浓缩而得到污染物。该污染物溶解在CH2Cl2(50mL)中并且该溶液用2N NaOH水溶液(30mL)洗涤而获得作为无色晶体的期望产物6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶。
TLC:Rf0.35(SiO2,EtOAc/己烷=1∶3),
LCMS(EI:70eV)347(M+),
1H-NMR(400MHz,CDCl3):7.18(1H,d,J=9.6Hz),7.36(2H,d,J=8.0Hz),7.58(1H,s),7.60(2H,d,J=8.0Hz),7.67(1H,d,J=9.6Hz),8.25(1H,s)。
B、式I化合物的可替换制备,其中R 1 是杂芳基
将6-溴-3-(三氟甲基)咪唑并[1,5-a]吡啶(如实施例1中披露制备的)(46.7mg,0.176mmol)、4-三氟甲基苯基硼酸(107.8mg,0.264mmol,1.5当量)和Pd(PPh3)4(10.2mg,0.0088mmol,0.05当量)在氮气气氛下放入50mL圆底烧瓶中。在环境温度下向该烧瓶中加入DMF(4mL)中。混合物在110℃加热1小时。混合物通过赛力特硅藻土(3g)过滤并且赛力特硅藻土用EtOAc(70mL)洗涤。滤液用盐水(30mL)洗涤并用Na2SO4干燥。减压下除去溶剂。获得的粗混合物通过柱色谱(SiO2=25g,EtOAc/己烷=1∶3,Rf=0.37)纯化。含有期望产物的馏分通过旋转蒸发仪浓缩而获得有机锡残留物的污染物。将该污染物悬浮在己烷(5mL)中并过滤该悬液而获得作为无色晶体的期望产物,2-(3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基)苯并[d]噁唑。
C、式I化合物的制备,其中改变R 1
类似地,依照以上实施例7A或7B的程序,但用其他硼酸或频那醇酯替换4-三氟甲基苯基硼酸,制得以下式I的化合物:
6-(4-苯氧基苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
2-(3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基)苯并[d]噻唑,
LCMS(EI:70eV)320(M++1);
2-(3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基)苯并[d]噁唑,
1 H-NMR(300MHz,CDCl3):7.36-7.50(2H,m),7.58-7.84(5H,m),7.58(1H,s),9.04(1H,s);
2-(3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基)噻唑,
LCMS(EI:70eV)270(M++1);和
2-(3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基)噁唑,
LCMS(EI:70eV)254(M++1)。
C、式I化合物的制备,其中改变R 1 、R 2 和R 3
类似地,依照以上实施例7A的程序,但可选地用其他硼酸或频那醇酯替换4-三氟甲氧基苯基硼酸和/或用式(1)的其他化合物(商购获得的或利用不同式(1)前体制得的)替换,可以制备式I的其他化合物。
实施例8
式I化合物的制备,其中W
1
是CR
2
,R
2
是甲基,W
2
和W
3
是CH,以及X
1
和X
2
是N
A、式I化合物的制备,其中W 1 是CR 2 ,R 2 是甲基,W 2 和W 3 是CH, 以及X 1 和X 2 是N
步骤1:一种式(1)前体化合物,2-氯-3-甲基-5-(4-(三氟甲氧基)苯基)
吡啶的制备。
向在DMF(2mL)中的1-碘-4-(三氟甲氧基)苯(288mg,1.0mmol)和6-氯-5-甲基吡啶-3-基硼酸(223mg,1.3mmol)的溶液中加入K2CO3(552mg,4.0mmol)和H2O(0.5mL)。反应混合物在干燥N2气氛下搅拌5min。加入Pd(PPh3)4(10mg,0.009mmol),并使反应混合物在120℃经受辐照10min。冷却,用EtOAc(20mL)稀释,通过一层赛力特硅藻土过滤,用在EtOAc(50mL)中的10%DMF洗涤,转移到分离漏斗,有机相用2N Na2CO3(20mL,4.00mmol)、H2O(20mL)、30%NH4Cl水溶液(50mL)和盐水(50mL)洗涤,并干燥和浓缩。粗混合物经过制备性HPLC(具有含0.1%TFA的梯度MeCN/H2O(5%至98%)),而获得2-氯-3-甲基-5-(4-(三氟甲氧基)苯基)吡啶,
MS m/z 288.0(M+H),HPLC纯度>97%。
步骤2:一种式I的化合物,8-甲基-6-(4-(三氟甲氧基)苯基)四唑并[1,5-a]
吡啶的制备。
将在无水DMF(2.0mL)中的2-氯-3-甲基-5-(4-(三氟甲氧基)苯基)吡啶(如上所述制得的)(58mg,0.20mmol)、叠氮化钠(21mg,0.30mmol)和4-甲基苯磺酸吡啶(5mg,0.02mmol)的混合物封闭在Biotage微波反应瓶中并在160℃经受辐照30min。冷却,通过打开盖子释放压力,加入另外的叠氮化钠(65mg,1.00mmol)和4-甲基苯磺酸吡啶(52mg,0.20mmol),封盖,并在200℃经受辐照30min。冷却后,混合物在真空下浓缩,用DMF(1.0mL)和MeOH(2.0mL)稀释,过滤,并经过制备性HPLC(具有含0.1%TFA的梯度MeCN/H2O(5%至98%),而获得8-甲基-6-(4-(三氟甲氧基)苯基)四唑并[1,5-a]吡啶。
MS m/z 295.0(M+H),HPLC纯度>97%。
1H NMR(400MHz;丙酮-d6)δ9.27(d,J=0.8Hz,1H),7.98(m,3H);7.52(d,J=8.2Hz,2H);2.77(s,3H)。
B、式I化合物的制备,其中改变R 1 、W 1 和W 2
类似地,依照以上实施例8A的程序,但用其他前体替换1-碘-4-(三氟甲氧基)苯或用其他硼酸替换6-氯-5-甲基吡啶-3-基硼酸,制得以下式I的化合物:
6-(4-苯氧基苯基)四唑并[1,5-a]吡啶;
6-(4-(三氟甲氧基)苯基)四唑并[1,5-a]吡啶;
6-(4-(4-氯苯氧基)苯基)四唑并[1,5-a]吡啶;
6-(4-硝基苯基)四唑并[1,5-a]吡啶;
6-(4-(4-氟-2-硝基苯氧基)苯基)四唑并[1,5-a]吡啶;
N,N-二甲基-6-(4-(三氟甲氧基)苯基)四唑并[1,5-a]吡啶-5-胺;
6-(4-(4-氯苯氧基)苯基)四唑并[1,5-b]哒嗪;
5-甲基-6-(6-甲基-5-(4-(三氟甲氧基)苯基)吡啶-2-基)四唑并[1,5-a]吡啶;
6-(4-(4-氯苯氧基)苯基)四唑并[1,5-a]吡啶-5-胺;
6-(2-甲氧基-5-(三氟甲氧基)苯基)四唑并[1,5-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]四唑并[1,5-a]吡啶;
5-甲基-6-(4-(三氟甲氧基)苯基)四唑并[1,5-a]吡啶;和
8-甲基-6-(3-甲基-5-(4-(三氟甲氧基)苯基)吡啶-2-基)四唑并[1,5-a]吡啶。
C、式I化合物的制备,其中改变R 1 、W 1 和W 2
类似地,依照以上实施例8的程序,但用其他前体替换1-碘-4-(三氟甲氧基)苯或用其他硼酸替换6-氯-5-甲基吡啶-3-基硼酸,可以制备式I的其他化合物。
实施例9
式I化合物的制备,其中W
1
、W
2
和W
3
是CH,X
1
是CR
a
,并且X
2
是N
A、式I化合物的制备,其中R 1 是4-苯氧基苯基,Q是共价键,W 1 是N,W2和W3是CH,X1是异丙基,并且X2是N
步骤1:一种式(1)的化合物,6-溴-3-异丙基-[1,2,4]三唑并[4,3-a]嘧
啶的制备。
向圆底烧瓶中,加入在二氯甲烷(40mL)中的5-溴-2-肼基嘧啶(5-bromo-2-hydrazinopyrimidine)(2.65mmol)。向该溶液中加入异丁醛(2.65mmol),接着加入2滴乙酸。反应混合物在室温下搅拌2小时,之后加入二乙酸碘苯(2.77mmol)。所得反应混合物在室温下再搅拌2小时。混合物在真空下蒸发并通过制备性TLC(用5%甲醇和二氯甲烷混合物洗脱)纯化,而获得6-溴-3-异丙基-[1,2,4]三唑并[4,3-a]嘧啶。
MS m/z 330.1(M+)。
步骤2:3-异丙基-6-(4-苯氧基苯基)-[1,2,4]三唑并[4,3-a]嘧啶。
终产物的形成利用如在实施例1A的步骤2中披露的那些方法实现。
MS m/z 330.1(M+)。
B、式I化合物的制备,其中改变R 1 和X 1
类似地,依照以上实施例9A的程序,但可选地用其他硼酸或频那醇酯替换4-三氟甲氧基苯基硼酸和/或替换为式(1)的其他化合物(商购获得的或利用不同式(1)前体或不同酸酐制得的),可以制备式I的其他化合物。
实施例10
式I化合物的制备
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,Q是共价键,W1、W2和W3是CH,X1是1,1-二氟-2-羟乙基,并且X2是N
步骤1:二氟羟甲基中间体的制备。
在可密封烧瓶中,混合酰肼(3.84g,20.4mmol)、2,2-二氟-3-羟基丙酸乙酯(3.15g,20.4mmol)和对甲苯磺酸吡啶(775mg,3.06mmol)并加热至135℃。注意:由于EtOH放出而产生大量的压力。将所得固体饼悬浮在EtOAc中,用超声处理均化,并过滤而提供期望产物,2-(6-溴-[1,2,4]三唑并[4,3-a]吡啶-3-基)-2,2-二氟乙醇。
步骤2:添加R
1
部分。
终产物的形成利用如实施例1A的步骤2中披露的那些方法实现,而获得终产物2,2-二氟-2-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)乙醇。
MS m/z 375.2(M+1)。
B、R a 醇部分的可选二次改性。
向该醇(55mg,0.153mmol)、NaH(24mg,0.60mmol,60%,分散在矿物油中)和3-(溴甲基)吡啶氢溴化物(58mg,0.23mmol)的混合物中加入DMF(1mL)。反应在室温下搅拌几小时并浓缩。残留物通过RP-HPLC纯化以提供产物,作为白色粉末的3-(1,1-二氟-2-(吡啶-3-基甲氧基)乙基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶。
451.1(M+1)。
C、R a 醇部分的可选二次改性
步骤1
向在CH2Cl2(60mL)中的该醇(400mg,1.24mmol)的溶液中加入戴斯-马丁氧化剂(戴斯-马丁试剂,Dess Martin periodinane)(610mg,1.42mmol),并且反应搅拌1小时。加入在NaHCO3水溶液中的Na2S2O3(430mg,2.8mmol)并搅拌1小时。分离各层并且含水层用CH2Cl2(2x 25mL)洗涤。合并的有机层用MgSO4干燥,过滤并浓缩而获得产物,作为白色固体的6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-甲醛(carbaldehyde)。
步骤2
在0℃,向在THF(1mL)中的该醛(65mg,0.21mmol)的溶液中加入甲基溴化镁(75μL,0.25mmol,在THF中的3.0M溶液)。反应搅拌10分钟,升至室温,并通过加入水而淬灭。混合物用EtOAc稀释,分离各层,浓缩有机物并且残留物通过柱色谱(Rf=0.55,EtOAc/10%MeOH)纯化而获得产物,作为白色固体的1-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)乙醇。
324.1(M+1)。
可替换的步骤2
向该醛(62mg,0.20mmol)的溶液中加入TMS-CF3(57μL,0.36mmol)并且反应搅拌1小时。加入1N HCl(2mL),搅拌1小时并且反应用Et2O和水稀释。分离各层,浓缩有机物,并且残留物通过RP-HPLC纯化而获得产物,作为白色粉末的2,2,2-三氟-1-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)乙醇。
378.1(M+1)。
可替换的步骤2
向该醛(70mg,0.23mmol)、吡咯烷(38μL,0.46mmol)和MeOH(1mL)的混合物中加入三乙酰氧基硼氢化钠(72mg,0.34mmol)并且反应搅拌过夜。浓缩混合物,并且残留物通过RP-HPLC纯化以提供产物,作为白色粉末的3-(吡咯烷-1-基甲基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶。
363.1(M+1)。
D、R a 醇部分的可选二次改性
步骤1
在50mL圆底烧瓶中,将(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲醇(50.0mg,0.162mmol)溶解在DMF(3mL)中。该溶液在室温下用NaH(60%,在矿物油中,9.7mg,0.243mmol,1.5当量)处理20min。然后将4-氟苄基溴(61.2mg,0.324mmol,2.0当量)加入到反应混合物中。在相同温度下将该混合物搅拌1h。向反应混合物中加入H2O(30mL)并且整体用EtOAc(30mL x 3)萃取。合并的有机层用盐水(30mL)洗涤并用Na2SO4干燥。减压下除去溶剂。获得的粗混合物通过柱色谱(SiO2=25g,EtOAc/己烷=1∶1至EtOAc至5%MeOH/EtOAc,用EtOAc Rf=0.2)纯化,而获得作为无色油的期望产物。
LCMS(EI:70eV)418(M++1)。
E、R a 醇部分的可选二次改性以提供R a 氨基
步骤1
向在CH2Cl2(7mL)中的乙醇(240mg,0.68mmol)和Et3N(120μL,0.88mmol)的溶液中加入Tf2O(140μL,0.81mmol),并且反应在室温下搅拌30分钟。浓缩混合物,残留物溶解在DMF(2mL)中,并加入NaN3(176mg,2.7mmol)。反应搅拌1小时,浓缩,并且残留物通过柱色谱(Rf=0.43,1∶1己烷/EtOAc)纯化而获得产物,作为褐色固体的3-(2-叠氮基-1,1-二氟乙基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶。
步骤2
向以上分离的物质(172mg,0.45mmol)中加入10%Pd/C(22mg,50mg/mmol),烧瓶用N2回充并加入EtOAc(5mL)。反应用H2吹扫并搅拌4小时。混合物通过赛力特硅藻土过滤并且滤液在减压下浓缩至(残留)所述胺,作为褐色固体的2,2-二氟-2-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)乙胺。
359.2(M+1)。
可选的步骤3-R
a
氨基的改性
向在CH2Cl2中的该胺(34mg,0.095mmol)的溶液中加入Et3N(40μL,0.28mmol)和MsCl(甲基硫酰氯)(18μL,0.23mmol),并且反应搅拌30分钟。浓缩混合物,并且残留物通过RP-HPLC纯化而提供作为白色粉末的产物。
437.0(M+1)。
可选的步骤3-R
a
氨基的改性
向该胺(49mg,0.14mmol)、2-吡啶甲酸(picolinic acid)(19mg,0.15mmol)、HATU(63mg,0.16mmol)和NMM(18μL,0.16mmol)的混合物中加入DMF(1mL)并且反应搅拌1小时。浓缩混合物,加入CH3CN和H2O并且通过过滤收集固体而获得所述酰胺,作为白色固体的N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)吡啶-2-羧酰胺。可替换地,该产物可以通过RP-HPLC纯化。
464.3(M+1)。
可选的步骤3-R
a
氨基的改性以形成脲键
向在CH2Cl2(1mL)中的该胺(46mg,0.15mmol)的溶液中加入异氰酸苯酯(18μL,0.16mmol)并且立即形成沉淀。通过过滤收集固体而提供脲,作为白色固体的1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)-3-苯基脲。可替换地,该产物可以通过RP-HPLC纯化。
478.0(M+1)。
F、式I化合物的制备,其中改变R 1 和X 1
类似地,依照以上实施例10A-10E的程序,但利用其他前体或二次反应物,制得以下式I的其他化合物:
2-(6-(6-环丙基吡啶-3-基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)-2,2-二氟乙醇,
317.0(M+1);
3-苄基-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶,
370.2(M+1),
1H NMR(DMSO)δ8.73(s,1H),7.83-7.87(m,3H),7.71(dd,J=1.2,9.6Hz,1H),7.52(d,J=8.0Hz,2H),7.28-7.36(m,4H),7.21-7.25(m,1H),4.64(s,2H);
(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲醇;
3-[(1-苯基乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
1H-NMR(丙酮)δ8.54(s,1H),7.71-7.85(m,4H),7.52(d,2H),7.27-7.41(m,5H),5.03(s,2H),4.67(q,1H),2.80(d,3H);
MS m/z 414.1(M+H)
3-{[二氟(吡啶-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS m/z 437.0(M+H)
2-(2,2-二氟-2-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)乙氧基)乙酸乙酯;
2-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-N,N-二甲基乙胺,
431.2(M+1)。
N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)苯甲酰胺,
463.0(M+1)。
3-[1-(吡啶-2-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
415.0(M+1)。
3-(二氟(吡啶-2-基甲氧基)甲基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶,
LCMS(EI:70eV)451(M++1)。
2-(二氟(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲氧基)乙酸乙酯,
LCMS(EI:70eV)446(M++1)。
2-(二氟(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲氧基)乙腈,
LCMS(EI:70eV)399(M++1)。
6-(4-(三氟甲氧基)苯基)-3-((4-(三氟甲基)苄基氧)甲基)-[1,2,4]三唑并[4,3-a]吡啶,
LCMS(EI:70eV)468(M++1)。
3-((吡啶-2-基甲氧基)甲基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶,
LCMS(EI:70eV)401(M++1)。
3-[1-(吡啶-2-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
415.0(M+1)。
3-({[4-(三氟甲氧基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
484(M++1)。
3-{[(4-氯苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
434(M+1)。
D、式I化合物的制备,其中改变R 1 和X 1
类似地,依照以上实施例10A-10D的程序,但利用其他前体或二次试剂,可以制备式I的其他化合物。
实施例11
式I化合物的制备
A、式I化合物的制备
在0℃下,向在THF(1mL)中的如在实施例10中披露制得的酯(50mg,0.11mmol)的溶液中加入甲基溴化镁(94μl,0.28mmol,在THF中的3.0M溶液)。反应搅拌10分钟,升至室温,并通过加入水淬灭。混合物用EtOAc稀释,分离各层,浓缩有机物并且残留物通过RP-HPLC纯化而提供作为白色粉末的产物V。
MS m/z 432.1.1(M+1)。
B、式I其他化合物的制备
类似地,依照以上实施例11A的程序,但替换为其他酯化合物,可以制得式I的其他化合物。
实施例12
式I化合物的制备,其中W
3
是C-R
4
A、式I化合物的制备,其中R 4 是羟甲基
步骤1-羟甲基基团的形成
向在0℃下在MeOH(50mL)中的商购获得的酯(2.1g,10mmol)的溶液中经过30分钟分批加入NaBH4(570mg,0.15mmol)。反应搅拌另外30分钟并且通过加入水淬灭。用EtOAc(100mL)稀释反应,并且用NaHCO3和盐水洗涤有机物。用MgSO4干燥有机层,过滤并浓缩以提供作为黄色油的醇。
步骤2-羟基基团的保护
向在DMF(8mL)中的在步骤1中制备的醇(775mg,434mmol)和苄基溴(570μL,4.8mmol)的混合物中加入NaH(522mg,13mmol,在矿物油中的60%分散体)。将反应搅拌2小时并用EtOAc(50mL)稀释,用盐水(2x)洗涤,用MgSO4干燥有机物,过滤并浓缩。通过柱色谱(Rf=0.5,5∶1己烷/EtOAc)来纯化残留物以提供产物。
步骤3-肼链的添加
密封烧瓶装载有如在步骤2中制备的2-(苄氧基甲基)-3,6-二氯吡啶(950mg,3.5mmol),加入水合肼(1mL),并且将反应加热至120℃过夜。冷却后,通过过滤来收集固体以提供2-(苄氧基甲基)-3-氯-6-肼基吡啶。
步骤4-核的环化
使用与在实施例1A,步骤1中披露的那些方法相同的方法来实现氯化核的形成。
步骤5-羟基基团的去保护
向如在步骤4中所描述制备的5-(苄氧基甲基)-6-氯-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶(700mg,2.1mmol)的溶液中加入甲磺酸(2mL,在水中70%),并且将反应加热至回流过夜。将反应浓缩并通过快速色谱来纯化残留物以获得(6-氯-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-5-基)甲醇。
步骤6-R
1
部分的添加
使用与在实施例1A,步骤2中披露的那些方法相同的方法来实现最终产物的形成。
MS m/z 378.1(M+1)。
可选的步骤7-R
4
羟基基团的改性
按照实施例10B中披露的方法来实现最终产物5-(甲氧基甲基)-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶的形成。
MS m/z 392.2(M+1)。
B、式I化合物的制备,改变R 4
类似地,按照上面实施例12A的程序,但是利用其他前体或次级反应物(secondary reactants),制备式I的以下化合物:
({6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-5-基}甲氧基)乙腈,
MS m/z 416.3(M+1)。
C、式I化合物的制备,改变R 1 、R 4 和X 1
类似地,按照上面实施例12A的程序,但是利用其他前体或次级反应物(secondary reactants),制备式I的其他化合物。
实施例13
式I化合物的制备,其中R
1
是2-(吗啉基甲基)-3-(三氟甲氧基)苯基,
W
1
、W
2
和W
3
是CH,且X
1
是CHCF
3
,并且X
2
是N
A、式I化合物的制备,其中R 1 是2-(吗啉基甲基)-3-(三氟甲氧基)苯 基,W 1 、W 2 和W 3 是CH,且X 1 是CHCF 3 ,并且X 2 是N
向圆底烧瓶中加入在DMF(3mL)中的3-溴甲基-4-三氟甲氧基苯基硼酸频那醇酯(0.420mmol)。向该溶液中加入碳酸钾(0.840mmol),接着加入吗啉(0.84mmol)。将悬浮液在室温下搅拌4小时,之后,将反应混合物转移至微波反应管。向该混合物中加入四(三苯基膦)合钯(0.021mmol)和1mL的水,接着加入6-溴-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]吡啶(0.462mmol)。将所得的反应混合物在微波中在130℃下加热10分钟。用乙酸乙酯稀释反应混合物并且通过赛力特硅藻土过滤。用水洗涤滤液。用Na2SO4干燥有机提取物,并且在真空中蒸发。通过制备性HPLC来纯化粗残留物以获得4-(2-(三氟甲氧基)-5-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苄基)吗啉。
MS m/z 447.1(M+)。
B、式I化合物的制备,改变R 1 、W 1 、和W 2
类似地,按照上面实施例13A的程序,但是用其他前体替换6-溴-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]吡啶或者用其他硼酸替换3-溴甲基-4-三氟甲氧基苯基硼酸频那醇酯,制备式I的以下化合物:
6-{3-[(4-甲基哌嗪-1-基)甲基]-4-(三氟甲氧基)苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 460.1(M+);以及
2-({2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苄基}氨基)乙醇,
MS m/z 421.1(M+)。
C、式I化合物的制备,改变R 1
类似地,按照上面实施例13A的程序,但是用其他前体替换6-溴-3-(三氟甲基)-[1,2,4]三唑并[4,3-b]吡啶或者用其他硼酸替换3-溴甲基-4-三氟甲氧基苯基硼酸频那醇酯,可以制备式I的其他化合物。
实施例14
式I化合物的制备,其中R
2
是氨基
A、式I化合物的制备,其中R 1 是4-三氟甲基苯基,W 1 、W 2 和W 3 是CH,R 2 是NH 2 ,并且X 1 是CHR a ,R a 是异丙基,且X 2 是N
步骤1-硝基基团的还原以形成胺
在60℃下在锌粉(3.89mmol)存在的情况下,通过加热在乙酸(6mL)中的如在实施例9A,步骤1中所描述制备的A,6-溴-3-异丙基-8-硝基-[1,2,4]三唑并[4,3-a]吡啶(0.777mmol)来制备化合物B。然后用甲醇稀释反应混合物并用赛力特硅藻土过滤。对滤液进行浓缩,然后通过硅胶首先用乙酸乙酯然后用甲醇和二氯甲烷的1∶4混合物来过滤残留物。将滤液在真空下蒸发以获得B,6-溴-3-异丙基-[1,2,4]三唑并[4,3-a]吡啶-8-胺。
步骤2.R
1
部分的添加
使用与在实施例1A,步骤2中披露的那些方法相同的方法来实现最终产物的形成,以提供最终产物3-异丙基-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-8-胺。
MS m/z 337.1(M+)。
B、R 2 氨基基团的可选二次改性
在厚壁压力管中(heavy-wall pressure tube)加入在甲苯中的在9A中制备的3-异丙基-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-8-胺。向该悬液中加入乙酸酐(0.1mL),接着加入三乙胺(0.1mL)。将该混合物在110℃油浴中加热12小时。在真空中蒸发反应混合物并且通过制备性HPLC纯化以提供N-(3-异丙基-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-8-基)乙酰胺。
MS m/z 379.1(M+)。
C、式I化合物的制备,改变R 1 、R 2 、X 1 和X 2
类似地,按照上面实施例14A和B的程序,但是用其他硝基前体替换6-溴-3-异丙基-8-硝基-[1,2,4]三唑并[4,3-a]吡啶,用其他硼酸替换4-(三氟甲氧基)苯基硼酸,或者用其他酸酐替换乙酸酐,制备式I的以下化合物。
N-{3-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-基}丙酰胺,
MS m/z 365(M+);
3-甲基-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺,
MS m/z 323(M+);
3-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺,
MS m/z 309(M+);
3-苯基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺。
MS m/z 371.1(M+);以及
N-{3-甲基-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-基}乙酰胺,
MS m/z 365(M+)。
D、式I化合物的制备,改变R 1 、R 2 、X 1 和X 2
类似地,按照上面实施例14A和B的程序,但是用其他硝基前体替换6-溴-3-异丙基-8-硝基-[1,2,4]三唑并[4,3-a]吡啶,用其他硼酸替换4-(三氟甲氧基)苯基硼酸,或者用其他酸酐替换乙酸酐,可以制备式I的其他化合物。
实施例15
式I化合物的制备,其中R
1
是3-(1,3,4-噁二唑-2-基)-4-(三氟甲氧基)苯基,
W
1
、W
2
和W
3
是CH,且X
1
是CHCF
3
,并且X
2
是N
A、式I化合物的制备,其中R 1 是3-(1,3,4-噁二唑-2-基)-4-(三氟甲氧 基)苯基,W 1 、W 2 和W 3 是CH,且X 1 是CHCF 3 ,并且X 2 是N
向圆底烧瓶中加入在乙醇(10mL)中的5-溴-2-(三氟甲氧基)苯甲酸乙酯(0.638mmol)。向该溶液中加入1mL的一水合肼,并且将所得的混合物回流过夜。在真空中蒸发反应混合物以获得A。在厚壁压力管中向A中加入原甲酸三甲酯(trimethylorthoformate)。将该所得的混合物在100℃下加热18小时。将反应混合物浓缩并通过制备性TLC纯化以提供B,使用上面披露的方法使B与3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基硼酸偶联,以获得2-(2-(三氟甲氧基)-5-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)-1,3,4-噁二唑。
MS m/z 416.1(M+)。
B、式I化合物的制备,改变R 1 、W 1 和W 2
类似地,按照上面实施例15A的程序,但是用其他前体替换5-溴-2-(三氟甲氧基)苯甲酸乙酯或者用其他硼酸替换3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基硼酸,可以制备式I的其他化合物。
实施例16
式I化合物的制备,其中R
1
是3-(甲基氨基甲酰基)-4-(三氟甲氧基)苯基,
W
1
、W
2
和W
3
是CH,且X
1
是CHCF
3
,并且X
2
是N
A、式I化合物的制备,其中R 1 是3-(甲基氨基甲酰基)-4-(三氟甲氧基) 苯基,W 1 、W 2 和W 3 是CH,且X 1 是CHCF 3 ,并且X 2 是N
在厚壁压力管中加入5-溴-2-(三氟甲氧基)苯甲酸乙酯(0.3mL)和甲胺(1.5mL)。将混合物在60C下加热2小时。将反应混合物浓缩以提供A,使用上面披露的方法使A与3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基硼酸偶联以提供N-甲基-2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲酰胺。
MS m/z 405.1(M+)。
B、式I化合物的制备,改变R 1 、W 1 和W 2
类似地,按照上面实施例16A的程序,但是用其他前体替换5-溴-2-(三氟甲氧基)苯甲酸乙酯或者用其他硼酸替换3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基硼酸,可以制备式I的其他化合物。
实施例17
式I化合物的制备,其中R
1
被噁二唑-5-基取代
A、式I化合物的制备,其中R 1 是3-(3-甲基-1,2,4-噁二唑-5-基)-4-(三 氟甲氧基)苯基,W 1 、W 2 和W 3 是CH,且X 1 是CHCF 3 ,并且X 2 是N
步骤1-酸前体的形成
向圆底烧瓶中加入在乙醇(12mL)中的5-溴-2-(三氟甲氧基)苯甲酸乙酯(1.59mmol)和氢氧化钠(3.99mmol)。将反应混合物回流18小时。将混合物浓缩并用水稀释,然后用二氯甲烷洗涤。含水层用1N HCl处理至pH 4。对沉淀物进行过滤并空气干燥过夜以提供A。
步骤2-环状链的添加
向圆底烧瓶中加入在DMF(3mL)中的A(0.484)和1,1-羰基二咪唑(CDI)(0.964mmol)。将混合物在室温下搅拌30分钟,接着加入羟基乙酰亚氨基酰胺(hydroacetimidamide)。所得的混合物在室温下搅拌另外18小时。将反应混合物浓缩并通过制备性TLC纯化以提供B。
步骤3-噁二唑环的环化并偶联于化合物核
向圆底烧瓶中加入在THF(3mL)中的B(0.322mmol)和四丁基氟化铵水合物(0.645mmol)。将反应混合物在室温下搅拌过夜。将反应混合物浓缩并通过制备性TLC纯化以提供C,然后使C与期望的硼酸偶联以提供6-[3-(3-甲基-1,2,4-噁二唑-5-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶。
MS m/z 430.1(M+)。
B、式I的化合物的制备,改变R 1 、W 1 和W 2
类似地,按照上面实施例17A的程序,但是用其他前体替换5-溴-2-(三氟甲氧基)苯甲酸乙酯或1,1-羰基二咪唑或者用其他硼酸替换3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基硼酸,可以制备式I的其他化合物。
实施例18
式I化合物的制备,其中R
1
是4-(三氟甲氧基)苯基,W
1
、W
2
和W
3
是CH,
并且X
1
是CH-R
a
,R
a
是2-氟苄氧基)甲基且X
2
是N
A、式I化合物的制备
向圆底烧瓶中加入在DMF中的如在实施例10中披露的制备的A,(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲醇(0.162mmol)和2-氟苄基溴(0.324mmol),接着加入氢化钠。将反应混合物在室温下搅拌1小时。将混合物用1N HCl处理。过滤沉淀物,3-{[(2-氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,并且通过制备性HPLC纯化。
MS m/z 418.1(M+)。
1H-NMR(DMSO)8.694(s,1H),7.764-7.913(m,4H),7.526-7.554(d,2H),7.200-7.411(m,2H),7.123-7.173(m,2H),5.169(s,2H),4.665(s,2H)。
B、式I化合物的制备,改变R a
类似地,按照上面实施例18A的程序,但是用其他前体替换2-氟苄基溴,制备式I的以下化合物:
3-(1,1-二氟-2-(环氧乙烷(氧杂环丙烷,oxiran)-2-基甲氧基)乙基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-({[2-(三氟甲基)苄基]氧基}甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 468.1(M+),
1H-NMR(DMSO)8.771(s,1H),7.513-7.930(m,10H),5.225(s,2H),4.782(s,2H);
3-{[(2,4-二氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS m/z 436.1(M+),
1H-NMR(DMSO)8.681(s,1H),7.763-7.911(m,4H),7.451-7.555(m,3H),7.200-7.311(t,1H),7.000-7.173(t,1H),5.158(s,2H),4.630(s,2H);
3-{[(2-氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS m/z 469.1(M+),
1H-NMR(DMSO)8.741(s,1H),7.803-7.889(m,4H),7.402-7.549(m,5H),5.212(s,2H),4.668(s,2H);
3-{[(2,4-二甲基苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS m/z 428.1(M+),
1H-NMR(DMSO)8.657(s,1H),7.827-7.883(m,4H),7.519-7.546(d,2H),7.119-7.911(d,1H),6.856-7.000(m,1H),5.113(s,2H),4.546(s,2H),2.162-2.208(m,6H);
3-{[(5-甲基吡啶-2-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS m/z 415.1(M+);
3-[(苄氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
400.1(M+1);
3-[(环丙基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
364.1(M+1);以及
3-[(2,2,2-三氟乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
392.1(M+1)。
C、式I化合物的制备,改变R 1
类似地,按照上面实施例18A的程序,但是用其他前体替换2-氟苄基溴,或者用其他醇取代的核替换(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲醇,可以制备式I的其他化合物。
实施例19
式I化合物的制备,其中R 1 是4-(三氟甲氧基)苯基,X 1 是CH-R a ,R a 是 1,1-二氟-2-(环氧乙烷-2-基甲氧基)乙基,W 1 、W 2 和W 3 是CH,并且X2是N
A、式I化合物的制备
向圆底烧瓶中加入在丙酮中的如在实施例15中所描述制备的3-(1,1-二氟-2-(环氧乙烷-2-基甲氧基)乙基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶和2-氯酚,接着加入碳酸钾(室温下在DMF中的氢化钠也会起作用)。将反应混合物回流过夜。过滤出碳酸钾。将滤液浓缩并通过制备性TLC,接着通过制备性HPLC纯化,以提供1-(2-氯苯氧基)-3-(2,2-二氟-2-(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)乙氧基)丙-2-醇。
MS m/z 545.1(M+)。
B、式I化合物的制备,改变R a
类似地,按照上面实施例19A的程序,但是用其他羟基取代的化合物替换2-氯酚,制备式I的以下化合物:
1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-3-(2,5-二甲基苯氧基)丙-2-醇,
MS m/z 538.1(M+)。
C、式I化合物的制备,改变R 1 、W 1 和W 2
类似地,按照上面实施例19A的程序,但是用其他羟基取代的化合物替换2-氯酚,或者用其他环氧乙烷-2-基取代的化合物替换3-(1,1-二氟-2-(环氧乙烷-2-基甲氧基)乙基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶,可以制备式I的其他化合物。
实施例20
式I化合物的制备-R
1
羟基基团的改性
A、式I化合物的制备
在密封烧瓶中,将如在实施例1中描述制备的苯酚,4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯酚(47mg,0.17mmol)、杂芳基氯(39mg,0.34mmol)、Cs2CO3(111mg,0.34mmol)、丁腈(1mL)加热至140℃过夜。将反应浓缩并通过RP-HPLC纯化以提供期望的产物,6-(4-(哒嗪-3-基氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶。
MS m/z 358.1(M+1)。
B、可替换的式I化合物的制备
向如在实施例1中描述制备的苯酚(40mg,0.11mmol)、NaH(8mg,0.33mmol,在矿物油中的60%分散体)、和1-溴-2-甲氧基乙烷(16μL,0.17mmol)的混合物中加入DMF(1mL)。将反应在室温下搅拌几小时并浓缩。通过RP-HPLC来纯化残留物以提供作为白色粉末的产物6-[2-(2-甲氧基乙氧基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶。
MS m/z 422.4(M+1)。
C、可替换的式I化合物的制备
向如在实施例1中描述制备的苯酚(50mg,0.18mmol)、K2CO3(75mg,0.54mmol)和3-(氯二氟甲基)吡啶(147mg,0.90mmol)的混合物中加入DMF(1mL)。将反应在100-140℃下搅拌过夜(对于更少的反应底物(反应基质,reactive substrates),需要更高的温度范围的端值)。用EtOAC和水稀释反应,分离层,并且浓缩有机物。通过RP-HPLC过滤残留物以提供作为白色粉末的产物,6-{4-[二氟(吡啶-3-基)甲氧基]苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶。
MS m/z 407.2(M+1)。
D、式I化合物的制备
在密封烧瓶中,将如在实施例1中描述制备的苯酚,4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯酚(47mg,0.17mmol)、芳基卤(46mg,0.29mmol)、Cs2CO3(132mg,0.41mmol)、2-氧代环己烷羧酸乙酯(62μL,0.039mmol)、CuBr(2.8mg,0.019mmol)和DMSO(1mL)的悬浮液加热至100℃过夜。将反应浓缩并通过RP-HPLC纯化以提供20mg的期望产物,6-(4-(吡啶-3-基氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶。
357.1(M+1)。
D、式I化合物的制备,改变R 1
类似地,按照上面实施例20A、B、C或D的程序,但是用其他卤化物化合物替换R1羟基化合物,制备式I的以下化合物:
6-(4-(吡嗪-2-基氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 358.1(M+1);
{5-(三氟甲氧基)-2-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯氧基}乙腈,
MS m/z 403.2(M+1);
6-[6-(甲基硫烷基)吡啶-3-基]-3-(三氟甲基)咪唑并[1,5-a]吡啶(6-[6-(methylsulfanyl)pyridin-3-yl]-3-(trifluoromethyl)imidazo[1,5-a]pyridine),
MS m/z 434.1(M+1);
6-[2-乙氧基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 392.3(M+1),
1H NMR(CDCl3)δ8.47(s,1H),7.95(d,J=7.6Hz,1H),7.65(d,J=8.0Hz,1H),7.41(d,J=8.4Hz,1H),6.97(d,J=7.2Hz,1H),6.87(s,1H),4.11(q,J=6.8Hz,1H),1.42(t,J=6.8Hz,3H);
6-{4-[二氟(苯基)甲氧基]苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 406.2(M+1),
1H NMR(DMSO)8.74(s,1H),8.16(dd,J=1.2,10.0Hz,1H),8.01(dd,J=1.2,9.6Hz,1H),7.90(t,J=4.8Hz,1H),7.88(t,J=4.8Hz,1H),7.79-7.83(m,2H),7.57-7.66(m,3H),7.48(t,J=8.4Hz,2H);
4-(二氟{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯氧基}甲基)苯甲腈,
MS m/z 431.2(M+1),
1H NMR(DMSO)8.73(s,1H),8.15(d,J=9.6Hz,1H),8.08(d,J=8.4Hz,2H),7.89-8.04(m,3H),7.89(d,J=8.4Hz,2H),7.49(d,J=8.4Hz,2H);以及
6-[2-(丙-2-基氧基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶
MS m/z 406.1(M+1),
1H NMR(CDCl3)δ8.47(s,1H),7.94(s,1H),7.63(s,1H),7.40(d,J=8.4Hz,1H),6.95(d,J=7.6Hz,1H),6.87(s,1H),4.64(sept,J=6.0Hz,1H),1.35(d,J=6.0Hz,6H)。
F、式I化合物的制备,改变R 1 、W 1 和W 2
类似地,按照上面实施例20A、B、C或D的程序,但是用其他卤化物化合物替换R1羟基化合物,可以制备式I的其他化合物。
实施例21
式I化合物的制备-R
1
氨基基团的改性
A、式I化合物的制备
向在CH2Cl2(2mL)中的在实施例1中制备的苯胺(104mg,0.37mmol)的悬浮液中加入三氟乙酸酐(58μL,0.41mmol),并且立即进行反应。加入CH2Cl2(10mL)并且通过过滤来收集固体以获得122mg的固体。向在THF(2mL)中的收集固体的悬浮液中加入BH3·二甲硫醚(硼烷二甲硫醚,BH3·dimethylsulfide)(48μL,0.48mmol)的10.1M溶液。将反应加热至90℃持续90分钟,加入另外的硼烷溶液(16μL,0.16mmol)的等分部分并搅拌30分钟。将反应冷却,加入1N HCl(1mL)和MeOH(1mL),并且将反应加热至60℃持续15分钟。将反应浓缩并通过RP-HPLC纯化残留物以提供作为白色粉末的产物,N-(2,2,2-三氟乙基)-4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯胺。
MS m/z 361.1(M+1)。
B、式I化合物的制备
使在密封烧瓶中的在实施例1中制备的苯胺(50mg,0.18mmol)、5-氯-2-碘代苯甲腈(72mg,0.27mmol)、Pd2(dba)3(8.2mg,0.0090mmol)、4,5-二(二苯基膦基)-9,9-二甲基夹氧杂蒽(三环二苯并吡喃,xanthene)(16mg,0.030mmol)和KOtBu(28mg,0.25mmol)的混合物充入N2,加热至100℃并搅拌过夜。将反应浓缩并通过RP-HPLC纯化残留物以提供作为白色粉末的产物,5-氯-2-({4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}氨基)苯甲腈。
MS m/z 414.2(M+1)。
C、式I化合物的制备
将在环己烷(1mL)中的α-三氟甲基苄醇(73μL,0.54mmol)和2,6-二甲基吡啶(2,6lutidine)(100μL,0.81mmol)的溶液冷却至0℃并加入三氟乙酸酐(140μL,0.78mmol)。将混合物搅拌30分钟,温热至室温,并且加入水(5mL)和环己烷(5mL)。分离各层并且用盐水洗涤有机层,用MgSO4干燥、过滤并浓缩。向在环己烷(1mL)中的浓缩物质的溶液中加入苯胺,如在实施例1中制备的4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯胺(90mg,0.33mmol)、K2CO3(90mg,0.66mmo1)和DMF(1mL)。将反应搅拌过夜,浓缩,并且通过RP-HPLC纯化残留物以提供作为白色粉末的产物,N-(2,2,2-三氟-1-苯基乙基)-4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯胺。
437.2(M+1)。
D、式I化合物的制备-R 1 氨基基团的烷基化
向在实施例1中制备的苯胺(20mg,0.056mmol)、NaH(7mg,0.11mmol,在矿物油中的60%分散体)和碘代甲烷(11μL,0.11mmol)的混合物中加入DMF(0.5mL)。将反应在室温下搅拌2小时并浓缩。通过柱色谱(Rf=0.53,1∶1己烷/EtOAc)来纯化残留物以提供产物N-甲基-N-苯基-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺。
MS m/z 369.2(M+1)。
1H NMR(DMSO)8.57(s,1H),8.11(d,J=9.6Hz,1H),7.98(dd,J=1.6,9.6Hz,1H),7.68(d,J=8.8Hz,2H),7.38(t,J=7.6Hz,2H),7.18(d,J=8.0Hz,2H),7.10(t,J=7.6Hz,1H),7.03(d,J=8.8Hz,2H),3.33(s,3H)。
R
1
氨基基团的替代烷基化
将N-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)甲磺酰胺(10mg)溶解在DMF(1mL)中并且在85℃下与碳酸钾(39mg)和甲基碘(40mg)一起加热2小时。将反应混合物过滤、浓缩并且使用在二氯甲烷中的2%MeOH作为洗脱剂通过色谱进行纯化。获得作为白色固体的N-甲基-N-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)甲磺酰胺。
1H NMR(400MHz,CDCl3):8.61(s,1H);8.03(d,1H);7.69(d,1H);7.68(d,1H);7.58(m,4H),3.40(s,3H),2.91(s,3H)。
MS(ES+,m/z)371.0(基峰,M+H+);763.0(2M+Na+)。
E、式I化合物的制备,改变R 1
类似地,按照上面实施例21A、B或C的程序,但是用其他卤化物或酸酐化合物替换其他R1氨基化合物,制备式I的以下其他化合物。
4-氯-N-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}苯胺,
MS m/z 389.2(M+1);以及
4-氟-N-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}苯胺,
MS m/z 373.2(M+1)。
F、式I的化合物的制备,改变R 1 、W 1 和W 2
类似地,按照上面实施例21A、B或C的程序,但是用其他卤化物或酸酐化合物替换其他R1氨基化合物,可以制备式I的其他化合物。
实施例22
式I化合物的制备
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,Q是共价键, W 1 、W 2 和W 3 是CH,X 1 是CCF 2 Cl,并且X 2 是N
步骤1.一种式(1)的化合物,6-溴-3-(氯-二氟-甲基)-[1,2,4]三唑并[4,3-a]
吡啶的制备。
将在氯二氟乙酸酐(11mL)中的(5-溴-吡啶-2-基)-肼(5.0g,26.5mmol)在微波中在小心监控压力的情况下在160℃下加热1小时。在用针小心通气(vent)之前将反应冷却至室温。将反应缓慢加入到碳酸氢钠(250mL)的搅拌饱和溶液中,用乙酸乙酯萃取并且干燥,之后通过快速色谱(rf=0.5在1∶1己烷/乙酸乙酯中)来纯化以获得作为浅黄色粉末的6-溴-3-(氯-二氟-甲基)-[1,2,4]三唑并[4,3-a]吡啶。
M+1=282/284。
步骤2.一种式I的化合物,3-(氯-二氟-甲基)-6-(4-三氟甲氧基-苯
基)-[1,2,4]三唑并[4,3-a]吡啶的制备。
在氮气的气氛下将6-溴-3-(氯-二氟-甲基)-[1,2,4]三唑并[4,3-a]吡啶(2.76g,9.8mmol)、4-三氟甲氧基苯基硼酸(2.5g,12.1mmol)、dppfPdCl2(二氯化(1,1′-二(二苯基膦基)二茂铁合钯)(350mg,0.5mmol)和碳酸钾(2.76g,20mmol)悬浮在脱气甲苯(20mL)、脱气异丙醇(10mL)和脱气水(10mL)中。将反应混合物在70℃下加热1小时,之后冷却至室温。将含水相丢弃并且对有机相进行浓缩并通过快速色谱(rf=0.5在1∶1己烷/乙酸乙酯中)纯化以获得作为浅橙色粉末的3-(氯-二氟-甲基)-6-(4-三氟甲氧基-苯基)-[1,2,4]三唑并[4,3-a]吡啶。
M+1=364。
可选的步骤3.一种式I的化合物,4-((二氟(6-(4-(三氟甲氧基)苯
基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲氧基)甲基)-2-苯基-5-(三氟甲基)噁唑
的制备
在5mL的微波瓶中在氮气氛下,将在DMF(3ml)中的3-(氯-二氟-甲基)-6-(4-三氟甲氧基-苯基)-[1,2,4]三唑并[4,3-a]吡啶(100mg,0.275mmol)、(2-苯基-5-(三氟甲基)噁唑-4-基)甲醇(107mg,0.440mmol)和NaH(39mg,0.96mmol)合并,然后搅拌10分钟。将反应混合物用1M HCl淬灭,并浓缩,之后通过制备性HPLC纯化产物,4-((二氟(6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶-3-基)甲氧基)甲基)-2-苯基-5-(三氟甲基)噁唑(HCl)。
571.1(M+1)。
B、式I化合物的制备,改变R 1 和R a
类似地,按照上面实施例22A的程序,但是用其他醇替换(2-苯基-5-(三氟甲基)噁唑-4-基)甲醇或者用其他硼酸替换4-三氟甲氧基苯基硼酸,制备式I的以下化合物:
3-[二氟(甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
360.1(M+1)。
1H NMR(DMSO)δ8.64(s,1H),8.09(dd,J=9.2,1.2Hz,1H),7.90(m,3H),7.55(d,J=8.0Hz,2H),3.88(s,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-70.1(s,2F)。
3-[二氟(2-甲氧基乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
404.1(M+1)。
1H NMR(DMSO)δ8.69(s,1H),8.10(dd,J=9.6,1.2Hz,1H),7.94(dd,J=8.0,1.6Hz,1H),7.87(m,2H),7.56(dd,J 8.8,0.8Hz,2H),4.34(m,2H),3.67(m,2H),3.27(s,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.6(s,2F)。
3-{二氟[(3-甲基氧杂环丁烷(methyloxetan)-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
430.1(M+1)。
1H NMR(DMSO)δ8.68(s,1H),8.11(d,J=8.0Hz,1H),7.95(d,J=8.0Hz,1H),7.86(d,J=8.0Hz,2H),7.54(d,J=8.0Hz,2H),4.53(m,2H),4.35(m,4H),1.27(s,3H)。
19F NMR(DMSO)δ-57.2(s,3F),-66.7(s,2F)。
3-{二氟[2-(吗啉-4-基)乙氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
459.1(M+1)。
1H NMR(DMSO)δ10.45(br,1H),8.74(s,1H),8.12(d,J=8.8Hz,1H),7.92(m,3H),7.55(d,J=8.0Hz,2H),4.67(m,2H),3.95(m,2H),3.10-3.80(m,8H)。
19F NMR(DMSO)δ-57.3(s,3F),-69.0(s,2F)。
3-{二氟[(5-甲基-1,2,4-噁二唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
442.1(M+1)。
1H NMR(DMSO)δ8.90(s,1H),8.11(dd,J=9.6,1.6Hz,1H),7.96(dd,J=9.6,1.6Hz,1H),7.91(dd,J=6.8,2.0Hz,2H),7.57(d,J=8.4Hz,2H),5.52(s,2H),2.57(s,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-68.9(s,2F)。
3-[(苄氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
436.1(M+1)。
1H NMR(DMSO)δ8.51(s,1H),8.09(dd,J=9.6,1.2Hz,1H),7.91(dd,J=9.6,1.2Hz,1H),7.75(m,2H),7.53(m,4H),7.41(m,3H),5.32(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-66.8(s,2F)。
3-[二氟(吡啶-4-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
437.1(M+1)。
1H NMR(DMSO)δ8.63(m,3H),8.11(m,1H),7.93(dd,J=9.6,2.0Hz,1H),7.83(m,2H),7.53(m,4H),5.41(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.4(s,2F)。
2-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)乙醇
390.1(M+1)。
1H NMR(DMSO)δ8.83(s,1H0,8.09(dd,J=9.6,2.0Hz,1H0,7.93(m,3H),7.52(dd,J=8.8,1.0Hz,2H),5.14(m,1H),4.24(m,2H),3.75(m,2H)。
19F NMR(DMSO)δ-57.2(s,3F),-67.4(s,2F)。
1-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)丙-2-醇
404.1(M+1)。
1H NMR(DMSO)δ8.85(s,1H),8.09(dd,J=9.6,1.2Hz,1H),7.91(m,3H),7.53(dd,J=9.2,1.2Hz,2H),5.14(d,J=4.4Hz,1H),4.14(m,1H),4.00(m,2H),1.15(d,J=6.0Hz,3H)。
19F NMR(DMSO)δ-57.2(s,3F),-67.4(s,2F)。
3-[二氟(吡啶-3-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
437.1(M+1)。
1H NMR(DMSO)δ8.80(s,1H),8.65(m,1H),8.59(s,1H),8.13(d,J=8.0Hz,1H),8.09(d,J=9.6Hz,1H),7.93(m,1H),7.81(m,2H),7.59(m,1H),7.54(d,J=8.4Hz,2H),5.43(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.3(s,2F)。
3-{[(5-环丙基-1,2,4-噁二唑-3-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
468.1(M+1)。
1H NMR(DMSO)δ8.84(s,1H),8.12(dd,J=9.6,1.6Hz,1H),7.95(dd,J=9.6,1.6Hz,1H),7.90(m,2H),7.56(d,J=8.0Hz,2H),5.46(s,2H),2.31(m,1H),1.19(m,2H),1.01(m,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-68.8(s,2F)。
3-(二氟{[5-(2-甲基丙基)-1,2,4-噁二唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
484.1(M+1)。
1H NMR(DMSO)δ8.90(s,1H),8.11(dd,J=9.6,1.6Hz,1H),7.96(dd,J=9.6,1.6Hz,1H),7.91(m,2H),7.56(d,J=8.0Hz,2H),5.54(s,2H),2.79(d,J=6.8,2H),2.01(sept,J=6.8Hz,1H),0.84(d,J=6.8Hz,6H)。
19F NMR(DMSO)δ-57.3(s,3F),-68.8(s,2F)。3-(二氟{[5-(丙-2-基)-1,2,4-噁二唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
470.1(M+1)。
1H NMR(DMSO)δ8.86(s,1H),8.22(dd,J=9.6,1.6Hz,1H),7.95(dd,J=9.6,1.6Hz,1H),7.90(m,2H),7.55(d,J=8.0Hz,2H),5.52(s,2H),3.24(sept,J=6.8Hz,1H),1.22(d,J=6.8Hz,6H)。
19F NMR(DMSO)δ-57.3(s,3F),-68.8(s,2F)。
3-[二氟(吡啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
437.1(M+1)。
1H NMR(DMSO)δ8.94(s,1H),8.56(m,1H),8.09(dd,J=9.6,1.6Hz,1H),7.88(m,4H),7.60(m,3H),7.42(m,1H),5.41(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.4(s,2F)。
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹啉
487.1(M+1)。
1H NMR(DMSO)δ8.92(d,J=4.8Hz,1H),8.44(s,1H),8.24(d,J=7.2Hz,1H),8.07(d,J=8.4Hz,2H),7.87(dd,J=9.6,1.6Hz,1H),7.77(m,1H),7.64(m,4H),7.47(d,J=8.4Hz,2H),5.88(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.6(s,2F)。
3-[(环丙基甲氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
400.1(M+1)。
1H NMR(DMSO)δ8.66(s,1H),8.10(dd,J=9.6,1.6Hz,1H),7.94(dd,J=9.6,1.6Hz,1H),7.88(m,2H),7.55(d,J=8.0Hz,2H),4.09(d,J=7.6Hz,2H),1.27(m,1H),0.60(m,2H),0.38(m,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-66.7(s,2F)。
3-{二氟[(1-苯基-1H-1,2,3-三唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
503.1(M+1)。
1H NMR(DMSO)δ9.03(s,1H),8.66(s,1H),8.08(dd,J=9.6,1.2Hz,1H),7.90(m,5H),7.60(m,2H),7.53(m,1H),7.41(d,J=8.0Hz,2H),5.51(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.7(s,2F)。
3-[二氟(哒嗪-3-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
438.1(M+1)。
1H NMR(DMSO)δ9.30(m,1H),9.02(s,1H),8.10(dd,J=9.6,1.2Hz,1H),7.95(m,4H),7.81(m,1H),7.55(dd,J=9.2,0.8Hz,2H),5.65(s,2H)。
19F NMR(DMSO)δ-57.2(s,3F),-67.6(s,2F)。
3-{二氟[(1-甲基-5-苯基-1H-吡唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
516.1(M+1)。
1H NMR(DMSO)δ8.62(s,1H),8.07(dd,J=9.6,1.2Hz,1H),7.91(dd,J=9.6,1.6Hz,1H),7.80(m,2H),7.48(m,5H),7.38(d,J=8.0Hz,2H),6.58(s,1H),5.25(s,2H),3.74(s,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.3(s,2F)。
3-{[(2,2-二氟-1,3-苯并间二氧杂环戊烯(benzodioxol)-5-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
516.1(M+1)。
1H NMR(DMSO)δ8.52(s,1H),8.08(d,J=9.2Hz,1H),7.91(d,J=9.6Hz,1H),7.78(m,2H),7.66(s,1H),7.51(d,J=8.4Hz,2H),7.45(d,J=8.4Hz,1H),7.39(m,1H),5.32(s,2H)。
19F NMR(DMSO)δ-49.7(s,2H),-57.3(s,3F),-66.9(s,2F)。
3-{[(2,5-二甲基-1,3-噁唑-4-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
455.1(M+1)。
1H NMR(DMSO)δ8.64(s,1H),8.08(dd,J=9.6,1.2Hz,1H),7.92(dd,J=9.6,1.6Hz,1H),7.87(m,2H),7.56(d,J=8.0Hz,2H),5.13(s,2H),2.28(s,3H),2.21(s,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.6(s,2F)。
3-{二氟[(5-甲基-2-苯基-1,3-噁唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
517.1(M+1)。
1H NMR(DMSO)δ8.57(s,1H),8.06(dd,J=9.6,1.2Hz,1H),7.85(m,3H),7.72(m,2H),7.48(m,3H),7.23(d,J=8.0Hz,2H),5.26(s,2H),2.43(s,3H)。
19F NMR(DMSO)δ-57.2(s,3F),-67.4(s,2F)。
3-{二氟[1-(吡啶-2-基)乙氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
451.1(M+1)。
1H NMR(DMSO)δ8.82(s,1H),8.50(d,J=4.8Hz,1H),8.07(d,J=9.6Hz,1H),7.92(dd,J=10.0,1.6Hz,1H),7.85(m,3H),7.59(m,3H),7.36(m,1H),5.85(q,J=6.4Hz,1H),1.68(d,J=6.4Hz,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-63.5(d,J=155Hz,1F),-68.1(d,J=155Hz,1F)。
3-{[1-(4-氯苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
484.1(M+1)。
1H NMR(DMSO)δ8.19(s,1H),8.06(dd,J=9.2,1.2Hz,1H),7.90(dd,J=9.2,1.2Hz,1H),7.71(m,2H),7.53(m,4H),7.40(m,2H),5.80(q,J=6.8Hz,1H),1.67(d,J=6.8Hz,3H)。
19F NMR(DMSO)δ-57.2(s,3F),-65.1(d,J=155Hz,1F),-66.6(d,J=155Hz,1F)。
3-[二氟(嘧啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
438.1(M+1)。
1H NMR(DMSO)δ9.43(s,1H),8.83(d,J=5.2Hz,2),8.11(dd,J=9.2,1.2Hz,1H),7.96(dd,J=9.6,1.6Hz,1H),7.92(m,3H),7.63(d,J=8.0Hz,1H0,7.56(t,J=5.2Hz,1H),5.52(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.7(s,2F)。
3-{[(5-环丁基-1,2,4-噁二唑-3-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
482.1(M+1)。
1H NMR(DMSO)δ8.87(s,1H),8.11(dd,J=9.6,1.2Hz,1H),7.95(dd,J=9.6,1.6Hz,1H),7.90(m,2H),7.56(d,J=8.0Hz,2H),5.52(s,2H),3.81(quint,J=8.0Hz,1H),2.30(m,4H),2.04(m,1H),1.87(m,1H)。
19F NMR(DMSO)δ-57.3(s,3F),-68.8(s,2F)。
3-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]苯甲腈
461.1(M+1)。
1H NMR(DMSO)δ8.59(s,1H),8.09(m,2H),7.90(m,3H),7.80(d,J=8.8Hz,2H),7.63(t,J=8.0Hz,1H),7.54(d,J=8.0Hz,2H),5.38(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.2(s,2F)。
3-[(环丙基甲氧基)(二氟)甲基]-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶
385.1(M+1)。
1H NMR(DMSO)δ9.16(d,J=2.4Hz,1H),8.87(s,1H),8.48(dd,J=8.0,2.4Hz,1H),8.17(dd,J=9.6,1.2Hz,1H),8.09(d,J=8.4Hz,1H),8.02(dd,J=9.6,1.6Hz,1H),4.10(d,J=7.2Hz,2H),1.28(m,1H),0.59(m,2H),0.40(m,2H)。
19F NMR(DMSO)δ-66.7(s,2F),-66.9(s,3F)。
5-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹啉
487.1(M+1)。
1H NMR(DMSO)δ8.90(d,J=4.0Hz,1H),8.68(d,J=8.4Hz,1H),8.28(s,1H),8.05(m,2H),7.83(d,J=9.6Hz,1H),7.76(m,2H),7.57(dd,J=8.4,4.4Hz,1H),7.48(m,4H),5.83(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.1(s,2F)。
3-[1-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)乙基]喹啉
501.1(M+1)。
1H NMR(DMSO)δ9.04(d,J=2.4Hz,1H),8.48(d,J=1.6Hz,1H),8.23(s,1H),8.01(m,2H),7.95(m,1H),7.80(m,2H),7.62(m,3H),7.34(dd,J=9.2,1.0Hz,2H),6.06(q,J=6.8Hz,1H),1.84(d,J=6.8Hz,3H)。
19F NMR(DMSO)δ-57.2(s,3F),-65.2(d,J=157Hz,1F),-66.6(d,J=157Hz,1F)。
3-{[2-(2,6-二甲基苯氧基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
494.1(M+1)。
1H NMR(DMSO)δ8.82(s,1H),8.11(d,J=9.6Hz,1H),7.94(d,J=9.6,1.6Hz,1H),7.77(d,J=8.8Hz,2H),7.23(d,J=8.0Hz,2H),6.92(m,3H),4.55(m,2H),4.12(m,2H),2.10(s,6H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.7(s,2F)。
3-{二氟[(1-苯基-1H-吡唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
502.1(M+1)。
1H NMR(DMSO)δ8.74(s,1H),8.51(s,1H),8..06(d,J=9.6Hz,1H),7.89(m,2H),7.81(d,J=8.4Hz,2H),7.73(d,J=8.4Hz,2H),7.50(m,2H),7.34(m,3H),5.31(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.0(s,2F)。
3-[二氟({2-[4-(三氟甲基)苯基]-1,3-噁唑-4-基}甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
571.1(M+1)。
1H NMR(DMSO)δ8.58(s,1H),8.46(s,1H),8.09(m,4H),7.88(m,4H),7.70(d,J=8.0Hz,2H),7.21(d,J=8.0Hz,2H),5.33(s,2H)。
19F NMR(DMSO)δ-57.5(s,3F),62.3(s,3H),-67.5(s,2F)。
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-2-甲基喹啉
501.1(M+1)。
1H NMR(DMSO)δ8.59(s,1H),8.35(d,J=8.0Hz,1H),8.28(d,J=8.0Hz,1H),8.07(d,J=9.6Hz,1H),7.98(m,1H),7.90(m,2H),7.80(m,1H),7.71(d,J=8.0Hz,2H),7.47(d,J=8.0Hz,2H),6.03(s,2H),1.73(s,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.8(s,2F)。
6-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹喔啉
488.1(M+1)。
1H NMR(DMSO)δ8.98(s,2H),8.60(s,1H),8.26(d,J=1.6Hz,1H),8.15(d,J=8.4Hz,1H),8.07(dd,J=9.6,1.2Hz,1H),8.01(dd,J=9.6,1.6Hz,1H),7.90(dd,9.6,1.6Hz,1H),7.76(m,2H),7.45(d,J=8.0Hz,2H),5.61(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-67.0(s,2F)。
3-[(丁-2-炔-1-基氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
398.1(M+1)。
1H NMR(DMSO)δ8.63(s,1H),8.10(d,J=9.6Hz,1H),7.93(dd,J=9.6,1.6Hz,1H),7.88(m,2H),7.56(d,J=8.0Hz,2H),4.94(q,J=2.4Hz,2H),1.79(t,J=2.4Hz,3H)。
19F NMR(DMSO)δ-57.3(s,3F),-68.6(s,2F)。
3-{[(2,2-二氟环丙基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
436.1(M+1)。
1H NMR(DMSO)δ8.64(s,1H),8.10(d,J=9.2Hz,1H),7.94(d,J=9.6Hz,1H),7.88(d,J=8.8Hz,2H),7.54(d,J=8.0Hz,2H),4.43(m,1H),4.23(m,1H),2.31(m,1H),1.77(m,1H),1.62(m,1H).δ-57.3(s,3F),-68.0(m,2F),128.7(m,1F),142.6(m,1F)。
3-{二氟[(3-苯基丙-2-炔-1-基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
460.1(M+1)。
1H NMR(DMSO)δ8.67(s,1H),8.09(d,J=8.8Hz,1H),7.91(dd,J=9.6,1.6Hz,1H),7.84(m,2H),7.40(m,7H),5.26(s,2H).δ-57.3(s,3F),-68.5(m,2F)。
3-{二氟[(1-甲基-1H-苯并咪唑-2-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
490.1(M+1)。
3-{[(1-苄基-1H-1,2,3-三唑-4-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
517.1(M+1)。
3-{二氟[(5-苯基-1,2-噁唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
503.1(M+1)。
1H NMR(DMSO)δ8.78(s,1H),8.01(d,J=9.2Hz,1H),7.90(m,5H),7.55(m,3H),7.38(d,J=8.4Hz,2H),7.39(s,1H),5.52(s,2H)。
19F NMR(DMSO)δ-57.3(s,3F),-68.1(s,2F)。
3-{二氟[(2-苯基-1,3-噁唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
503.1(M+1)。
3-{二氟[(5-甲基-2-苯基-2H-1,2,3-三唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
517.1(M+1)。
3-[{[1-(4-氯苯基)-5-甲基-1H-吡唑-3-基]甲氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
550.1(M+1)。
3-[(3,3-二苯基丙氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
540.1(M+1)。
3-(二氟{[3-(嘧啶-2-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
514.1(M+1)。
3-(二氟{[3-(吡啶-3-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
513.1(M+1)。
3-{二氟[(1-甲基-1H-吲唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
490.1(M+1)。
1H NMR(DMSO)δ8.45(s,1H),8.05(d,J=8.8Hz,1H),7.87(m,2H),7.63(m,3H),7.47(d,J=8.4Hz,2H),7.41(t,J=8.8Hz,1H),7.14(t,J=8.0Hz,1H),5.65(s,2H),3.96(s,3H)。
19F NMR(DMSO-d6)δ-57.3(s,3F),-67.3(s,2F)。
3-(二氟{[2-(1H-1,2,4-三唑-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
503.1(M+1)。
3-(二氟{[2-(2-甲基-1H-咪唑-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧)苯基][1,2,4]三唑并[4,3-a]吡啶
516.1(M+1)。
3-(二氟{[2-苯基-5-(三氟甲基)-1,3-噁唑-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
571.1(M+1)。
3-(二氟{[6-(1H-吡唑-1-基)吡啶-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
503.1(M+1)。
6-环丙基-2′-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-3,4′-联吡啶
554.1(M+1)。
3-[{[3-(4-环丙基-1H-咪唑-1-基)苄基]氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
521.1(M+1)。
3-(二氟{[2-(哌啶-1-基)吡啶-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
520.1(M+1)。
3-{[(2,2-二甲基-2,3-二氢-1-苯并呋喃-7-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
506.1(M+1)。
3-{[2-(2,6-二氟苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
486.1(M+1)。
3-{二氟[(5-苯基-1,2,4-噁二唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
504.1(M+1)。
1H NMR(DMSO)δ8.87(s,1H),8.11(dd,J=9.6,1.2Hz,1H),8.04(m,2H),7.94(dd,J=9.6,1.6Hz,1H),7.86(m,2H),7.72(m,1H),7.60(m,2H),7.41(d,J=8.0Hz,2H),5.63(s,2H)。
19F NMR(DMSO)δ-57.2(s,3F),-68.6(s,2F)。
3-[{[2-(6-环丙基吡啶-3-基)苄基]氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
553.1(M+1)。
3-(二氟(3-(2-甲氧基苯基硫)-2-甲基丙氧基)甲基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶:
LCMS(EI:70eV)540(M++1)
3-(二氟(2-(4-(4-甲氧基苯基)哌嗪-1-基)乙氧基)甲基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶:
LCMS(EI:70eV)564(M++1)
3-(((3-环丙基-1-甲基-1H-吡唑-5-基)甲氧基)二氟甲基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶:
LCMS(EI:70eV)480(M++1)。
C、式I化合物的制备,改变R 1 和X 1
类似地,按照上面实施例22A的程序,但是可选地用其他硼酸或频那醇酯(pinacolate esters)替换4-三氟甲氧基苯基硼酸和/或用其他醇替换(2-苯基-5-(三氟甲基)噁唑-4-基)甲醇,可以制备式I的其他化合物。
实施例23
式I化合物的制备
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,O是共价键, W 1 、W 2 和W 3 是CH,X 1 是CCF 2 Cl,并且X 2 是N
步骤1.R
a
基团和环状链的添加
将5-溴-2-肼基吡啶(1.83g,9.73mmol)和2,2-二氟-3-甲氧基丙酸甲酯(1.00g,6.49mmol)在甲苯(35mL)中回流过夜。将反应混合物浓缩并通过色谱(EtOAc∶己烷=1∶4)纯化,以获得N′-(5-溴吡啶-2-基)-2,2-二氟-3-甲氧基丙酰肼(methoXypropanehydrazide)。
步骤2.环化
将在1,4-二噁烷(3.5mL)中的N′-(5-溴吡啶-2-基)-2,2-二氟-3-甲氧基丙酰肼(methoxypropanehydrazide)(0.25g,0.81mmol)和对甲苯磺酸一水合物(0.12g,0.65mmol)在置于微波上160℃下80分钟。用EtOAc稀释反应混合物,并且顺序用NaHCO3水溶液和盐水洗涤。用Na2SO4干燥有机层。蒸发溶剂并通过HPLC的纯化获得6-溴-3-(1,1-二氟-2-甲氧基乙基)-[1,2,4]三唑并[4,3-a]吡啶。
可选的步骤3.“Q”亚炔基(Alenkynylene)接头的形成和R
1
基团的添
加
向在THF(5mL)中的6-溴-3-(1,1-二氟-2-甲氧基乙基)-[1,2,4]三唑并[4,3-a]吡啶(46mg,0.16mmol)的搅拌溶液中加入催化量的二氯二(三苯基膦)合钯(II)(11mg)和碘化亚铜(I)(3mg),接着加入1-乙炔基-4-(三氟甲基)苯(41mg,0.24mmol)。用N2冲洗反应混合物,并且加入Et3N(2mL))。在70℃下搅拌反应混合物过夜,并且通过制备性TLC(EtOAc:己烷=2∶3),接着通过HPLC纯化以提供3-(1,1-二氟-2-甲氧基乙基)-6-((4-(三氟甲基)苯基)乙炔基)-[1,2,4]三唑并[4,3-a]吡啶。
MS m/z 382.0(M+H)
1H-NMR(丙酮)δ8.81(s,1H),7.94(dd,1H),7.83(dd,4H),7.65(dd,1H),4.36(t,2H),3.52(s,3H);
B、式I化合物的制备,改变R 1 和R a
类似地,按照上面实施例23A的程序,但是用其他前体替换2,2-二氟-3-甲氧基丙酸甲酯,或者用其他炔基R1化合物替换1-乙炔基-4-(三氟甲基)苯,制备式I的以下化合物:
3-(三氟甲基)-6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 356.0(M+H);
3-(1,1-二氟-2-甲氧基乙基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS m/z 374.0(M+H);
6-[4-(4-氯苯氧基)苯基]-3-(1,1-二氟-2-甲氧基乙基)[1,2,4]三唑并[4,3-a]吡啶
MS m/z 416.0(M+H)
3-(1,1-二氟-2-甲氧基乙基)-6-[4-(4-氟苯氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
MS m/z 400.0(M+H)
3-(1,1-二氟-2-甲氧基乙基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶
MS m/z 389.0(M+H)
3-(1,1-二氟-2-甲氧基乙基)-6-[3-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
MS m/z 388.0(M+H)
3-(1,1-二氟-2-甲氧基乙基)-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
MS m/z 388.0(M+H)
3-(1,1-二氟-2-甲氧基乙基)-6-[3-氟-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
MS m/z 392.0(M+H)
3-(1,1-二氟-2-甲氧基乙基)-6-(3,5-二氟-4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶
MS m/z 418.0(M+H)
3-(1,1-二氟-2-甲氧基乙基)-6-(苯基乙炔基)[1,2,4]三唑并[4,3-a]吡啶,
MS m/z 314.1(M+H);以及
2,2-二氟-2-(6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶-3-基)乙醇,
MS m/z 368.0(M+H)。
C、式I化合物的制备,改变R 1 和R a
类似地,按照上面实施例23A的程序,但是用其他前体替换2,2-二氟-3-甲氧基丙酸甲酯,或者用其他炔基R1化合物替换1-乙炔基-4-(三氟甲基)苯,可以制备式I的其他化合物。
实施例24
式I化合物的制备,其中X
2
是C-R
b
A、式I化合物的制备,其中X 2 是C-R b
步骤1-卤化物中间体的形成
在250mL圆底烧瓶中将6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶(1.2001g,3.466mmol)溶解在CH2Cl2(20mL)中。在0℃下用NBS(925.4mg,5.199mmol,1.5当量)处理溶液30分钟。然后,通过旋转蒸发除去溶剂以获得粗混合物。通过柱色谱(SiO2=80g,EtOAc/己烷=1∶7Rf=0.5)来纯化获得的粗混合物以获得作为无色油的1-溴-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶。
步骤2-R
b
部分的添加
将1-溴-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶(50.0mg,0.118mmol)、NaCN(7.0mg,0.142mmol,1.2当量)、CuI(2.2mg,0.0118mmol,0.1当量)和KI(3.9mg,0.0236mmol,0.2当量)顺序置于5mL斯密斯反应瓶(Samith vial)中。向该瓶中加入在甲苯(5mL)中的N,N’-二甲基乙二胺(10.4mg,0.118mmol,1.0当量)的溶液。通过微波反应器(Biotage,Personal Chemistry)在130℃下加热悬浮液60分钟。使用EtOAc(70mL)通过赛力特硅藻土(3g)来过滤悬浮液。在降低的压力下从滤液中除去溶剂以获得粗混合物。通过制备性TLC(SiO2=1板,EtOAc/己烷=1∶7,Rf=0.1)来纯化粗混合物以获得作为无色晶体的6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-腈。
LCMS(EI:70eV)372(M++1),
1 H-NMR(300MHz,CDCl3):7.40(2H,d,J=8.4Hz),7.57(1H,d,J=9.6Hz),7.61(2H,d,J=8.4Hz),7.93(1H,d,J=9.6Hz),8.35(1H,s)。
可替换的步骤2-经由锂化添加R
b
部分
在氮气氛下在50mL圆底烧瓶中,将1-溴-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶(50.0mg,0.118mmol)溶解在(乙)醚(2mL)中。将溶液冷却至-78℃并用叔丁基锂(t-BuLi)(1.7M戊烷溶液,0.15mL,0.255mmol,2.2当量)处理5分钟。向混合物中加入在(乙)醚(1mL)中的MeI(65.8mg,0.464mmol,4.0当量)的溶液。使反应温热至室温持续30分钟。向混合物中加入H2O(30mL)并且整个用EtOAc(30mL x 3)萃取。用盐水(30mL)洗涤合并的有机层并且用Na2SO4干燥。在降低的压力下除去溶剂以获得粗混合物。通过制备性TLC(SiO2=1板,醚/己烷=1∶3,Rf=0.4)来纯化粗混合物以获得作为淡黄色晶体的1-甲基-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶。
LCMS(EI:70eV)361(M++1)。
可替换的步骤2-R
b
烷氧羰基部分的添加
在氮气氛下,将1-溴-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶(50.0mg,0.118mmol)、Pd(AcO)2(2.6mg,0.0118mmol,0.1当量)和P(o-tol)3(三(邻甲基苯基)膦)(14.4mg,0.0472mmol,0.4当量)置于50mL圆底烧瓶中。向该烧瓶中加入DMF(1mL),顺序加入在DMF(1mL)中的Et3N(30.0mg,0.295mmol,2.5当量)的溶液和丙酸甲酯(50.8mg,0.59mmol,5.0当量)的溶液。将该混合物在80℃下加热19小时。然后,从反应混合物中除去溶剂以获得粗混合物。通过柱色谱(SiO2=25g,EtOAc/己烷=1∶7至1∶3,Rf=0.1其中EtOAc/己烷=1∶7)来纯化粗混合物以获得作为淡黄色晶体的(E)-3-(6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基)丙酸甲酯。
LCMS(EI:70eV)431(M++1)。
可选的步骤3-R
b
烷氧羰基烯基部分的饱和
在氮气氛下,将(E)-3-(6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基)丙酸甲酯(25.6mg,0.0595mmol)和10%Pd/C(25.6mg)置于100mL圆底烧瓶中。向该烧瓶中加入THF(5mL)。然后,用氢气置换氮气。在室温下搅拌反应混合物。在17小时(57%转化率)之后,通过过滤使用赛力特硅藻土(3g)除去Pd催化剂。在氢气气氛下在45℃下利用Pd/C(25.6mg)开始反应。在4小时(100%转化率)之后,以类似的方式除去Pd催化剂。在降低的压力下从滤液中除去溶剂以获得粗混合物。通过柱色谱(SiO2=25g,EtOAc/己烷=1∶7至1∶3,Rf=0.4其中EtOAc/己烷=1∶3)来纯化该粗混合物以获得作为无色晶体的3-(6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基)丙酸酯。
LCMS(EI:70eV)433(M++1)。
B、式I化合物的制备,改变R
b
类似地,按照上面实施例24A的程序,但是用其他亲电子试剂替换MeI,制备式I的以下化合物:
6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基)甲醇,
LCMS(EI:70eV)377(M++1)。
C、式I化合物的制备,改变R b
类似地,按照上面实施例24A的程序,但是用其他亲电子试剂替换MeI,或者用其他Rb未取代的核替换6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶,可以制备式I的其他化合物。
实施例25
通过向核中添加R
a
来制备式I的化合物
A、式I化合物的制备,其中R 1 是4-三氟甲氧基苯基,Q是共价键, W 1 、W 2 和W 3 是CH,X 1 是O-(4-Py),并且X 2 和X 3 是N
步骤1.3-氯-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶(1)的
制备。
将6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶(0.6g)置于50mL圆底烧瓶中并且溶解在10mL的DMF中。加入NCS(0.43g),并且将反应混合物加热至50℃持续1小时,用EtOAc(100mL)稀释,用水、盐水洗涤3次,用Na2SO4干燥,并且浓缩以提供包含3-氯-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶和痕量的琥珀酸亚胺(<5wt%)的橙色固体。
1H NMR(400MHz,CDCl3):δ8.11(t,1H);7.62(dd,1H);7.62(d,2H),7.57(dd,1H),7.38(d,2H)。
步骤2.通过S
N
Ar反应来制备3-(吡啶-4-基氧基)-6-(4-(三氟甲氧基)
苯基)-[1,2,4]三唑并[4,3-a]吡啶
在15mL的圆底烧瓶中,将3-氯-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶(100mg)、4-羟基吡啶(60mg)和碳酸钾(88mg)悬浮在DMA(3mL)中。将反应混合物在150℃下搅拌6小时,浓缩,并使残留物经受梯度色谱(MeOH/二氯甲烷)从而产生作为琥珀色油的3-(吡啶-4-基氧基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶(28mg,24%)。
1H NMR(400MHz,CDCl3):δ7.99(s,1H);7.88(d,J=9.6Hz,1H);7.63-7.53(m,5H);7.30(d,J=8.0Hz,2H);6.59(d,J=7.2Hz,2H)。
MS(ES+,m/z)373.0(基峰,M+H
+
);767.1(2M+Na
+
)。
可替换的步骤2.通过乌尔曼(Ullmann)偶联来制备3-(吡啶-4-基氧
基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶。
在15mL圆底烧瓶中,向在DMF(3mL)中的三氟乙醇(0.072mL)的溶液中加入NaH(60wt%,40mg)。在10分钟后,加入按照在步骤1中披露的方法制备的3-碘-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶(100mg)和CuI(48mg)。在90℃下搅拌反应混合物4小时,浓缩,使残留物经受梯度色谱(乙酸乙酯/己烷)。使所得的混合物经受氢解(环己烯/Pd碳(碳载Pd),10%在EtOAc中),并且首先使用在二氯甲烷中的3%MeOH,然后使用1∶1EtOAc/己烷使所得的混合物再经受色谱,以产生作为琥珀色油的3-(吡啶-4-基氧基)-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶(3.4mg,3.6%)。
1H NMR(400MHz,CDCl3):δ8.02(s,1H);7.82(d,1H);7.63-7.53(m,3H);7.39(d,2H)。
19F NMR(377MHz,CDCl3):δ-58.39(s,1F);-74.48(t,1F)。
MS(ES+,m/z)378.0(基峰,M+H+);777.1(2M+Na+)。
B、式I化合物的制备,改变R 1 、X 1 和X 2
类似地,按照上面实施例25A对于上面SNAr或乌尔曼(Ullmann)反应的程序,但是可选地用其他O-、N-或S-亲核试剂替换4-羟基吡啶和/或用N-溴琥珀酰亚胺或N-碘琥珀酰亚胺替换N-氯琥珀酰亚胺并且利用相应的3-溴-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶或3-碘-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶,制备式I的以下化合物:
3-(苯硫基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶
MS(ESI+)388.0(基峰,M+H+);797.1(2M+Na+);
N,N-二甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-胺,
MS(ESI+)323.0(基峰,M+H+);667.1(2M+Na+);
3-苯氧基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)365.0(基峰,M+H+);751.1(2M+Na+);
6-[4-(三氟甲氧基)苯基]-3-[3-(三氟甲基)苯氧基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)440.0(基峰,M+H+);
3-(4,4-二氟哌啶-1-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)399.2(基峰,M+H+);以及
3-(2-甲基苯氧基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶,
MS(ESI+)386.1(基峰,M+H+);793.1(2M+Na+)。
C、式I化合物的制备,改变R 1 、X 1 和X 2
类似地,按照上面实施例25A对于上面SNAr或乌尔曼(Ullmann)反应的程序,但是可选地用其他O-、N-或S-亲核试剂替换4-羟基吡啶和/或用N-溴琥珀酰亚胺或N-碘琥珀酰亚胺替换N-氯琥珀酰亚胺并且利用相应的3-溴-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶或3-碘-6-(4-(三氟甲氧基)苯基)-[1,2,4]三唑并[4,3-a]吡啶,可以制备式I的其他化合物。
实施例26
式I化合物的制备-R1甲基酯基团的改性
A、式I化合物的制备
将4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯甲酸酯(33mg)溶于THF(1mL)中并冷却至-78℃。将甲基锂(在(乙)醚中1.6M)作为一份加入。用1mL其中加入2滴1N HCl的水淬灭。用EtOAc萃取并通过色谱利用1∶1己烷/乙酸乙酯作为洗脱液纯化。分离11mg的2-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)丙-2-醇(33%)。
1H NMR(400MHz,CDCl3):δ8.32(s,1H);7.99(d,J=9.6Hz,1H);7.73(dd,J=10.8,1.5Hz,1H);7.66(d,J=8.4Hz,2H);7.55(d,J=8.4,2H);1.91(s,1H);1.65(s,6H)。
MS(ES+,m/z)322.1(基峰,M+H+);665.1(2M+Na+)。
羟基基团的可选的次级改性
在10-mL装备有磁力搅拌棒的球形烧瓶中,将2-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)丙-2-醇(28mg)溶解于干燥的THF(1mL)中,并加入NaH(60%悬浮在矿物油中,20当量)和MeI(50当量)。将反应混合物在室温下搅拌过夜。用水和EtOAc萃取,有机层用MgSO4干燥,浓缩,并通过色谱纯化(在二氯甲烷中的3%MeOH)。分离期望的6-(4-(2-甲氧基丙-2-基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶。
1H NMR(400MHz,CDCl3):δ8.27(s,1H);7.95(d,1H);7.70(d,1H);7.53(br s,4H);3.09(s,3H);1.54(s,6H)。
MS(ES+,m/z)336.1(基峰,M+H+);358.1(M+Na+);693.1(2M+Na+)。
B、式I化合物的制备
步骤1
将4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯甲酸甲酯(12mg)溶于二噁烷中(1.5mL)。将氢氧化锂(在水中1M,0.5mL)作为一份加入。24h之后,用1N HCl淬灭。用二氯甲烷萃取,用MgSO4干燥,并浓缩。分离11mg的4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯甲酸(~100%)。
步骤2
将4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯甲酸(52mg)溶于DMF(2mL)中。后续加入3,3-二氟氮杂环丁烷盐酸盐(3,3-diflouroazetidine hydrochloride)(26mg)、二异丙基乙基胺(35μL)和HATU(93mg)。24h之后,加入另外量的二异丙基乙基胺(105μL)和HATU(279mg)。当反应基本上完成时,用乙酸乙酯/水淬灭,用0.1NHCl和浓NaHCO3洗涤。在制备-TLC板上利用5%MeOH/二氯甲烷纯化。分离37mg的(3,3-二氟氮杂环丁烷-1-基)(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)甲酮(57%)。
1H NMR(400MHz,CDCl3):δ8.35(s,1H);8.01(d,J=9.2Hz,1H);7.80(d,J=8.4Hz,2H);7.71(dd,J=9.2,1.2Hz,1H);7.66(d,J=8.4,2H);4.57(t,J=11.8Hz)。
19F NMR(377MHz,CDCl3):δ-63(s,3F);-100(五重峰,2F)。
MS(ES+,m/z)383.2(基峰,M+H+)。
C、式I化合物的制备,改变R 1
类似地,依照上面的程序,但可选地将3,3-二氟氮杂环丁烷盐酸盐替换为4,4-二氟嘧啶盐酸盐,制备以下的式I化合物
(4,4-二氟嘧啶-1-基)(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)甲酮,
19F NMR;-63.49(s,3F);-98.47(m,2F)。
D、式I化合物的制备,改变R 1 、X 1 和X 2
类似地,依照以上的实施例26A或B的程序,但可选地用其它苯甲酸酯替换4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯甲酸甲酯或者用其它化合物替换甲基锂、氢氧化锂、或4,4-二氟嘧啶盐酸盐,可以制备其它的式I化合物。
实施例27
式I化合物的制备-甲基酯乙酮(Methy EsterEthanone)基团的改性
A、式I化合物的制备
在50-mL装备有磁力搅拌棒的圆底烧瓶中,将1-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)乙酮(50mg)溶解于干燥的甲苯(1mL)中,并加入乙二醇(0.1mL)和樟脑磺酸(camphorsulfonic acid)(少许晶体)。在回流温度下将反应混合物搅拌过夜。用浓NaHCO3和EtOAc萃取,有机层用MgSO4干燥,浓缩,并通过色谱纯化(1∶1己烷/EtOAc)。分离期望的6-(4-(2-甲基-1,3-二氧杂环戊烷-2-基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶。
1H NMR(400MHz,CDCl3):δ8.38(s,1H);8.02(d,1H);7.75(d,1H);7.70(d,2H);7.57(d,2H);4.12(t,2H);3.83(t,2H)。
MS(ES+,m/z)350.0(基峰,M+H+);721.1(2M+Na+)。
B、式I化合物的制备
在50-mL装备有磁力搅拌棒的圆底烧瓶中,将氰基甲基磷酸乙酯(ethyl cyanomethylphosphonate)(73mg)与在4mL的MeOH中的NaOMe(0.1mL,在MeOH中25wt.%)混合,并在室温下搅拌15min。向该混合物中加入作为在MeOH(1mL)中溶液的1-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)乙酮(104mg)和干燥的THF(3mL)。在回流温度下将反应混合物搅拌过夜。用水和二氯甲烷萃取,有机层用MgSO4干燥,浓缩,并通过反相色谱(C(18),ACN/水)分离混合物。
分离(Z)-3-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)丁-2-烯腈,并实测为~100%的纯度。
1H NMR(400MHz,CDCl3):δ8.35(s,1H);8.03(d,J=9.6Hz,1H);7.75(d,J=8.4Hz,1H);7.64(s,4H);5.72(s,1H);2.54(s,3H)。
MS(ES+,m/z)329.0(基峰,M+H+);351.0(M+Na+);679.1(2M+Na+)。
将(E)-3-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)丁-2-烯腈分离为与(Z)-3-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)丁-2-烯腈为5∶1的混合物。
1H NMR(400MHz,CDCl3):δ8.35(s,1H);8.03(d,J=9.6Hz,1H);7.75-7.70(m,3H);7.64(d,J=8.8Hz,2H);5.49(s,1H);2.34(s,3H)。
MS(ES+,m/z)329.0(基峰,M+H+);351.0(M+Na+);679.1(2M+Na+)。
A、式I化合物的制备,改变R 1 、X 1 和X 2
类似地,依照以上的实施例27A或B的程序,但可选地用其它乙酮替换1-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)乙酮或者用其它化合物替换乙二醇或氰基甲基磷酸乙酯(ethylcyanomethylphosphonate),可以制备其它的式I化合物。
实施例28
制备含有以下成份的硬胶囊:
将以上成份混合并填充入硬胶囊。
实施例29
利用以下成份制备式(I)的片剂:
将各组分掺混并压制以形成片剂。
实施例30
制备含有以下成份的干粉吸入制剂:
成份 重量%
活性成份 5
乳糖 95
将活性成份与乳糖混合,并将混合物添加入干粉吸入装置(appliance)中。
实施例31
制备如下的片剂,每片含有30mg的活性成份:
将活性成份、淀粉和纤维素通过20目的美国标准筛,并充分混合。将聚乙烯吡咯烷酮溶液与得到的粉末混合,其接着通过16目的美国标准筛。将如此生产的颗粒在50℃至60℃下干燥,并通过16目的美国标准筛。将羟甲基淀粉钠和之前通过30目的美国标准筛的滑石接着加入至上述颗粒中,其在混合之后在压片机上压制以生产每片重量为120mg的片剂。
实施例32
制备如下的栓剂,每个含有25mg活性成份:
成份 量
活性成份 25mg
饱和脂肪酸甘油酯至 2,000mg
将活性成份通过60目的美国标准筛,并悬浮在之前利用最小的必需热量熔融的饱和脂肪酸甘油酯中。然后将混合物倾倒入标称2.0g容量的栓剂模中,并使其冷却。
实施例33
制备如下的栓剂,每个含有每5.0mL剂量50mg活性成份:
将活性成份、蔗糖和黄原胶掺混,通过10目的美国标准筛,接着与之前制备的微晶纤维素和羟甲基纤维素钠的水溶液混合。将苯甲酸钠、香料和着色剂用一些水稀释并在搅拌下添加。然后加入充分的水以生产所需要的体积。
实施例34
可以制备如下的皮下制剂:
成份 量
活性成份 5.0mg
玉米油 1.0mL
实施例35
制备具有以下组成的可注射制剂:
实施例36
制备具有以下组成的局部用制剂:
将以上除水之外的所有的成份合并,并在搅拌下加热至60℃。然后在强烈搅拌下加入60℃的水以乳化各成份,接着加入足量的水至100g。
实施例37
持续释放组合物
本发明的持续释放制剂如下制备:化合物和pH-依赖粘合剂以及任何可选的赋形剂直接混合(干掺混)。然后将干掺混的混合物在强碱水溶液的存在下造粒,该强碱被喷入掺混的粉末中。将颗粒干燥,过筛,与可选的润滑剂(如滑石或硬脂酸镁)混合,并压制成片剂。强碱的优选水溶液是碱金属氢氧化物(如氢氧化钠或氢氧化钾,优选氢氧化钠)在水中的溶液(可选含有可达25%的水混溶性溶剂如低级醇类)。
得到的片剂可以用可选的成膜剂包衣,用于辨识、遮味(taste-masking)的目的和用以提高吞咽的适宜性。成膜剂将典型地以片剂重量的2%至4%的量的范围存在。适宜的成膜剂是本领域熟知的,包括羟丙基甲基纤维素、阳离子型甲基丙烯酸酯共聚物(甲基丙烯酸二甲胺乙酯/甲基丙烯酸甲基-丁基酯共聚物-E-Pharma)等。这些成膜剂可以可选地包含色素、增塑剂、和其它补充成份。
压制的片剂优选具有足以承受8Kp压缩的硬度。片剂大小将主要取决于片剂中的化合物的量。片剂将包括300至1100mg的化合物游离碱。优选地,片剂将包括范围为400-600mg,650-850mg,和900-1100mg的化合物游离碱的量。
为了影响溶解速率(溶出率),控制在该期间含有粉末的化合物被湿混合的时间。优选地,总粉末混合时间,即在该期间粉末暴露于氢氧化钠溶液的时间,范围将在1-10分钟,优选在2-5分钟。在造粒之后,将颗粒物从造粒机中移出并置于流化床干燥器中用于在大约60℃下干燥。
实施例38
在以下实施例中利用本文中描述的方法以及本领域熟知的那些方法进行活性测定。
钠电流筛选实验(筛选测定):
晚钠电流(晚INa,Late INa)测定和峰值钠电流(峰INa,Peak INa)测定在自动电生理学平台PatchXpress 7000A(MDS Analytical Technologies,Sunnyvale,CA)上实施,其使用全细胞膜片钳技术(whole cell patch clamptechnique)以测量一次通过多达16个细胞的细胞膜的电流。该测定使用HEK293(人胚肾)细胞系,其异源表达野生型人心脏钠通道,hNav1.5,购自Millipore(Billerica,MA)。没有β-亚单位与Na通道α-亚单位共表达。细胞用标准组织培养程序维持,且稳定的通道表达用在培养基中的400μg/ml遗传霉素维持。将分离用于在PatchXpress上使用的细胞在维尔烯(乙二胺四乙酸,Versene)1X中孵育5分钟,接着在0.0125%胰蛋白酶-EDTA中孵育2分钟(均在37℃下)以确保80-90%的细胞是单个的而非细胞群集的一部分。实验在24-27℃下进行。
对于晚INa(Late INa)测定和峰INa(Peak INa)测定二者,串联电阻补偿设定为50%,且全细胞补偿自动实施。各个电流在10kHz下低通滤波且在31.25kHz下数字化。通过开放钠通道的各个电流被自动记录且储存于DataXpress2数据库(MDS Analytical Technologies,Sunnyvale,CA)。分析利用DataXpress2分析软件进行,且数据以Excel编辑。
化合物原料常规地在玻璃瓶中在二甲亚砜(DMSO)中制成为10mM。在一些情况下,当化合物在DMSO中不稳定时,它们在100%乙醇中制成。如果需要,将原料超声处理。用于筛选晚INa(Late INa)的细胞外溶液由以下组成:140mM NaCl、4mM KCl、1.8mM CaCl2、0.75mM MgCl2和5mM HEPES,具有利用NaOH调节至7.4的pH。用于筛选峰INa Peak INa)的细胞外溶液由以下组成:20mM NaCl、120mM N-甲基-D-葡萄糖胺、4mM KCl、1.8mM CaCl2、0.75mM MgCl2和5mM HEPES,具有利用HCl调节至7.4的pH。用以灌注到细胞内部的针对晚INa(Late INa)测定和峰INa(Peak INa)测定的细胞内溶液含有:120mM CsF、20mM CsCl、5mM EGTA、5mM HEPES,且pH用CsOH调节至7.4。化合物在玻璃小瓶中在细胞外溶液中被稀释至10μM,接着在利用机器人添加至细胞之前转移至玻璃孔板中。在针对晚INa(Late INa)测定和峰INa(Peak INa)测定的每个实验的最后使用的以测量基线电流的0Na细胞外溶液含有:140mM N-甲基-D-葡萄糖胺、4mM KCl、1.8mM CaCl2、0.75mM MgCl2、5mM HEPES,且pH用HCl调节至7.4。
晚INa(Late INa)筛选实验(筛选测定):
针对晚INa(Late INa)测定,钠通道通过使细胞膜从-120mV的保持电位(holding potential)去极化至-20mV持续250毫秒(ms)而每10秒(0.1Hz)被启动。响应于-20mV电压阶跃,典型的Nav1.5钠电流迅速激活至负峰电流(peak negative current)然后在3-4ms内接近完全失活(去活,inactivate)。
测试所有的化合物以确定它们在阻断(阻滞)晚钠电流中的活性。晚INa(Late INa)电流通过向细胞外溶液中加入10μM七氟菊酯(Tefluthrin)(拟除虫菊酯(pyrethroid))同时记录Na电流而产生。对于一些实验,使用50nM ATX II(海葵毒素)、另外的晚INa(late INa)激活剂以产生晚成分(后电位,late component)。两种激活剂都产生足够大的晚成分(latecomponent),通过化合物的晚成分的阻断能够被很容易地测量。针对筛选目的,晚INa(late INa)被定义为在步进(stepping)至-20mV以启动钠通道之后在225ms至250ms之间的平均电流。在建立全细胞记录模式(全细胞记录配置,whole cell recording configuration)之后,向每一孔在16-17分钟的期间加入4次晚INa(late INa)激活剂,使得Na电流的晚成分(后电位)达到一稳定值。然后在晚INa激活剂存在下加入化合物(典型地以10μM),在7或8分钟的期间加入3次。测量典型地在暴露于第三次化合物添加的结束时进行。测量在暴露于第三次化合物添加的结束时进行,并且各个值被归一化为当所有Na+在0Na-ECF两次添加之后从细胞外溶液中除去时的电流水平。结果报告为晚INa的阻断百分比。
hERG筛选实验:
筛选化合物以测试它们在阻断hERG钾通道中的活性。hERG通道在CHO(中国仓鼠卵巢)细胞系中异源表达。细胞用标准组织培养程序维持,且稳定的通道表达用在培养基中的500μg/ml G418维持。收获细胞用于在PatchXpress带有Accumax的自动膜片钳上(Innovative Cell Technologies,San Diego,CA)测试以分离单个细胞。
使用以下溶液用于电生理记录。外部溶液含有:2mM CaCl2、2mMMgCl2、4mM KCl、150mM NaCl、10mM葡萄糖、10mM HEPES(用1M NaOH(调节)pH 7.4,渗透性)。内部溶液含有140mM KCl、10mMMgCl2、6mM EGTA、5mM HEPES、5mMATP(用KOH调节pH至7.25)。
当电压从-80mV保持电位(holding potential)步进至+20mV时HERG通道被启动。在+20mV处的5秒步进期间,通道激活接着很大程度上失活,使得电流相对较低。一旦从+20mV返回至-50mV,由于失活迅速除去且接着通道关闭,hERG电流短暂地变得非常大。第一步骤(梯阶)至-50mV持续300ms被用作用于测量在通道激活之后至-50mV的步骤(步长)期间的峰值(peak amplitude)的基线在-50mV处的峰值电流在对照条件下和添加化合物之后二者都被测量。
在玻璃瓶中将所有化合物制备成10mM DMSO储备液。储备溶液(stock solution)通过在室温下激烈涡旋并超声处理大约2分钟而混合。为了测试,将化合物在玻璃瓶中利用在纯DMSO中的中间稀释步骤而稀释,接着进一步稀释至在外部溶液中的工作浓度。在使用前不超过20分钟配制稀释物。
在完成全细胞模式(配置)之后,监测细胞90秒以评估稳定性,并用外部溶液洗涤66秒。将以上描述的电压方案(voltage protocol)接着每12秒施加于细胞并贯穿整个程序。仅有带有稳定记录参数并满足规定的健康标准的细胞被允许进入化合物添加程序。
含有0.1%DMSO(媒介物)的外部溶液被施加至细胞首先以建立对照峰值电流幅度。在使得电流稳定3-5分钟之后,施加1μM接着10μM测试化合物。每种化合物浓度添加4次,且细胞保留在测试溶液中直至化合物的效力达到稳定状态或持续最大12分钟。在添加测试化合物之后,添加阳性对照(1μM西沙必利),且必须阻断>95%的用于被认为是有效的实验的电流。在外部溶液隔室中实施冲洗,直至电流的恢复达到稳定状态。利用DataXpress,Clampfit(Molecular Devices,Inc.,Sunnyvale)和Origin7(Originlab Corp.)分析数据。
L-型钙通道活性孔板实验:
细胞培养:IMR-32(人神经母细胞瘤)细胞获自美国典型培养物保藏中心(TheAmerican Type Culture Collection)。细胞保持在补充有10%胎牛血清、2mM的L-谷氨酰胺、100IU/ml的青霉素、50μg/ml的链霉素、1%的丙酮酸钠、1%的碳酸氢钠和1%的非必需氨基酸的MEM中。细胞在37℃在增湿的5%CO2/95%空气培养箱中培养。培养基每两天更换,且当细胞达到70-80%汇合时进行细胞再培养。
实验(测定):将IMR-32细胞以200,000细胞/孔的密度接种在微实验96-孔测定板(BD FALCONTM)上的200μl培养基中过夜。将培养基除去并以在含有2mM丙磺舒的HBSS(1x汉克平衡盐溶液加20mM HEPES,pH 7.4)中的120μl Ca-4染料(MDS Analytical Technologies,Sunnyvale,CA)替换。然后将细胞在培养箱中在37下孵育1小时。在HBSS中将测试化合物从5μM-50μM稀释,并在测定之前在细胞中加入40μl。L-型钙通道活性(最大-最小)在添加测试化合物之后立即添加40μl的1μM(-)Bay K 8644加上50mM KCl(终浓度)之后利用FlexStation(MolecularDevices)测量。然后计算对于化合物的L-型钙通道活性的抑制。
测试化合物并找出利用所描述的测定方法以1μM和10μM的浓度在晚INa(late INa)测定和峰INa(Peak INa)测定中、以及以1μM和10μM对于hERG测定和L-型钙通道测定中具有效应的化合物。测定结果表明经测试化合物显示作为晚钠电流的调节剂活性,例如通过抑制(或降低)晚钠电流。
利用所描述的测定方法测试化合物。数据通过测试所列出的化合物以10μM和1μM浓度在晚INa(late INa)测定中、以及以1μM和10μM对于hERG测定和L-型钙通道测定而得到。对于那些通过以10μM浓度抑制晚INa(late INa)至少10%的化合物的数据示出在表1中。
表1:晚INa实验结果
上表1中所述的实验结果示出了作为晚钠电流调节剂的所示的测试化合物的活性,例如通过抑制(或减少)晚钠电流。
在一些实施方式中,式I的化合物的效果对于晚钠电流是特异性的并且相对于其他离子通道而言表现出很小的活性或无活性。因此,在一些实施方式中,具有减小晚钠电流活性的化合物相对于峰值钠电流而言也表现出很小的活性或无活性。在特定的实施方式中,具有减小晚钠电流活性的化合物相对于hERG钾通道也表现出很小的活性或无活性。在一些实施方式中,具有减小晚钠电流活性的化合物相对于L-型钙通道而言也表现出很小的活性或无活性。例如,在本文所描述的实验中,给定的化合物可提供30%(或更大,例如大于40%,大于50%,大于60%,大于70%,大于80%)的晚钠电流减小,并且该化合物对于峰值钠电流、hERG钾通道、和L-型钙通道中的一种或多种可表现出很小的活性或无活性。这样,当利用本文中所描述的实验进行测量时,具有“很小的”效果的化合物通常会表现出给定活性(例如峰值INa、hERG、L-型钙)的少于30%的减少(例如,少于20%的减少,少于15%的减少,少于10%的减少)。这样,“无”效果意味着所测量的任何活性均不同于通过少于所述测量方法的标准误差的对照值。这样,所进行的测量活性的实验应该如上文所描述,用浓度为10μM(或溶解度的上限,如果该溶解度的上限较小的话)的该化合物进行。
L-型Ca2+通道实验-ChanTest(实验)
筛选所选择的化合物以用于阻断心脏L-型Ca2+通道(hCav1.2,由人CACNA1C基因编码并与以下亚基共表达:β2-亚基,由人CACNB2基因编码,以及α2Δ1,由CACNA2D1基因编码)。该Ca2+通道在CHO(中华仓鼠卵巢)细胞系中被异源表达。在以下的标准组织培养程序后保持细胞,并在培养基中用适当选择的抗生素保持稳定的通道表达。收获细胞以用于在PatchXpress自动化膜片钳(Model 7000A,Molecular Devices,Sunnyvale,CA)上进行测试,用汉克平衡盐溶液(Hank’s Balanced Salt Solution)洗涤两次,用胰蛋白酶处理该细胞,并将细胞重悬浮于培养基中(20mL培养基中4-6×106个细胞)。使悬浮液中的细胞在37℃,湿度为95%的空气,5%CO2气氛的组织培养箱中复原10分钟。
使用以下的溶液进行电生理学记录。外部溶液(external solution)含有(mM):137NaCl、4KCl、1.8CaCl2、1MgCl2、10葡萄糖、10HEPES(用NaOH调至pH 7.4)。内部溶液(internal solution)含有(mM):130天冬氨酸铯、5MgCl2、5EGTA、4ATP、0.1GTP、10HEPES(用N-甲基-D-葡萄糖胺将pH调节至7.2)。
将载体施加于稚细胞(n≥2,其中n=细胞数)持续5-10分钟的暴露间隔。每一次溶液替换都平行进行四次。在每次试验结束时,加入饱和浓度的硝苯地平(10μM)以阻断hCav1.2电流。从总膜电流记录中数字上扣除漏电流。
通过加入二甲亚砜(DMSO)并冷冻保存来制备测试化合物储备溶液。每一测试化合物DMSO储备液都在环境室温下进行超声处理(Model2510/5510,Branson Ultrasonics,Danbury,CT)至少20分钟以促进溶解。通过每天将储备溶液溶解于标准的胞外生理盐水溶液(参见上文)来制备测试化合物浓聚物。与化合物一起加入的DMSO的最大百分比为0.1%。在装载到PatchXpress之前,将所有的测试化合物和对照溶液置于搪瓷(glass-lined)的96孔化合物板中。
利用一次性聚乙烯微量加样器吸头以五(5)分钟的间隔向稚细胞(n≥2,其中n=细胞数/浓度)施加一种或两种浓度(1μM、10μM)的每一种测试化合物。每一种测试化合物平行四次施加于细胞。暴露于每一种测试化合物浓度的总时间为5分钟。
以10s的间隔从-80mV保持电位hCav1.2的开始和稳态阻断(利用由去极化实验脉冲(持续时间,200ms;振幅,10mV)构成的激励电压波形(stimulus voltage pattern)测量α1C/β2/α2δ通道)。以10mV的步长测量峰值电流。
实施例39
Na
v
1.7筛选实验:
有证据支持河豚毒素敏感性Nav1.7在疼痛的发病机制中的作用。在该实验中,使用全细胞膜片钳技术来确定式(I)化合物对在HEK293细胞中表达的人Nav1.7(hNav1.7+β1-亚基)的影响。通过用人Nav1.7α-亚基和β1-亚基稳定转染HEK293细胞来制备Nav1.7细胞系。通过膜片钳技术来分析稳定表达huNav1.7的HEK293细胞,并且发现其具有-400pA至-1800pA的Na+电流(在未转染的细胞中没有记录到电流)。通过具有10-74nmol/L的IC50值的河豚毒素(TTX)来阻断这些细胞中的Na+电流。通过使用膜电位敏感性染料获得了类似的结果。
在使用前在DMSO中制备浓度为40mmol/L的式I化合物(“测试化合物”)的储备溶液。每一种测试化合物以100μM平行测试两次,然后1∶4连续稀释以得到8个用于测试的浓度。使用TTX作为Nav1.7电流的对照抑制剂。
利用获自Molecular Devices(加利福尼亚,USA)的荧光染料类的膜电位实验试剂盒(#R8123)来测试化合物减小Nav1.7Na+电流的作用。简言之,在实验前24小时将细胞接种于多聚-D-赖氨酸预涂覆的透明底96孔Biocoat板的黑色孔中的100μl生长培养基中。在实验当日制备膜电位染料并用Hepes-HBSS预热至37℃。向每个孔中加入100μl染料并在37℃温育60分钟。向每个孔中加入藜芦定(veratridine)以达到50μmol/L的终浓度。然后以所需的浓度向每个孔中加入测试化合物,并记录荧光值。对于每一测试化合物数据组,基于所产生的测定点来计算IC50值。
在特定的实施方式中,与一种或多种其他离子通道中的活性相比,化合物会表现出对于晚钠电流调节活性的高选择性。可通过测定由该化合物引起的晚钠电流的减小百分比来确定化合物的选择性,如通过上文所述的实验来测量。如上文所述来确定由该化合物引起的一种其他的离子通道活性的减小百分比,例如hERG钾通道或L-型钙通道。通过获取(晚钠电流的减小百分比)与(一种其他的离子通道活性的减小百分比)之比来确定选择性。这样,为了测量活性而进行的实验应该如上文所描述,利用浓度为10μM(或溶解度的上限,如果该溶解度的上限较小的话)的化合物来进行。在特定的实施方式中,当晚钠电流中的减小百分比与峰值钠电流、hERG钾通道电流、或L-型钙通道之一的减小百分比进行比较时,本发明化合物的选择性为至少5∶1,例如至少6∶1,至少7∶1,至少8∶1,至少9∶1,至少10∶1,至少12∶1,至少15∶1,至少20∶1,或至少25∶1。
实施例40
材料和方法
人Nav1.1cDNA的表达
我们的实验室之前已经研究了所有的野生型(WT)和突变型构建体(Kahlig,2008;Lossin,2002;Rhodes,2004)并且如前所描述实施了cDNA表达(Kahlig,2008)。简言之,已通过利用Qiagen Superfect试剂瞬时转染实现了NaV1.1的表达(以对于α1∶β1∶β2的质粒质量比为10∶1∶1转染5.5μg的DNA)。将人β1和β2cDNA克隆到含有标记基因DsRed(DsRed-IRES2-hβ1)或EGFP(EGFP-IRES2-hβ2)以及内核糖体进入位点(IRES)的质粒中。除非另外提及,所有的试剂均购自Sigma-Aldrich(StLouis,MO,U.S.A.)。
电生理学
如上文所描述,利用全细胞电压钳记录来测量WT和突变型Nav1.1通道的生理学特性(Kahlig,2008)。简言之,电极内液(pipette solution)由110CsF、10NaF、20CsCl、2EGTA、10HEPES组成(以mM计),pH 7.35且渗透量(osmolarity)为300mOsmol/kg。槽(对照)溶液(bath(control)solution)含有(以mM计)145NaCl、4KCl、1.8CaCl2、1MgCl2、10葡萄糖、10HEPES,pH 7.35且渗透量(osmolarity)为310mOsmol/kg。在建立全细胞模式(全细胞配制,whole-cell configuration)之后,测量电流之前,使细胞稳定化10分钟。串联电阻补偿设定为90%以保证钳制电位(指令电位)达到微秒的范围内,且电压误差<2mV。通过利用在线P/4程序扣除漏电流并且所有的电流以5kHz进行Bessel低通滤波并以50kHz被数字化。为了清楚起见,对代表性的斜率电流以50kHz进行离线低通滤波。
如插图中所示使用评价通道活性、快速失活以及在重复刺激过程中的可用性的具体电压钳实验方案。由通过GNa=INa/(V-ENa)放大和归一化为-80mV至+20mV的最大电导的峰值电流计算得到全细胞电导。将电导-电压和稳态通道可用性曲线与玻尔兹曼函数拟合以确定半数最大激活/失活的电压(V1/2)和坡度因子(k)。从失活的时间依赖性进入和复活是通过将峰值电流恢复与以下双指数函数相拟合来评价的:I/Imax=Af×[1-exp(-t/τf)]+As×[1-exp(-t/τs)],其中τf和τs表示时间常数(分别表示快分量和慢分量),Af和As表示快分数振幅和慢分数振幅。
对于用途依赖性研究(功能依赖性研究,use-dependent studies),用来自-120mV保持电位的去极化脉冲串(-10mV,5ms,300次脉冲,10Hz)刺激细胞。然后将电流归一化为响应于每一频率串中的第一次脉冲记录的峰值电流。对于紧张性阻断(tonic block)研究,在存在和不存在0.5μM河豚毒素(TTX)的情况下所记录的电流的数字减影(数字扣减,digitalsubtraction)之后响应于200ms去极化至-10mV(0.2Hz)来评价峰值电流和持续电流。在200ms步长的最后10ms中计算持续电流。利用Clampfit9.2(Axon Instruments,Union City,CA,U.S.A)、Excel 2002(Microsoft,Seattle,WA,U.S.A.)、和OriginPro 7.0(OriginLab,Northampton,MA,U.S.A)软件进行数据分析。结果以平均值±SEM来表示。除非另外指出,在参照WT-Nav1.1的Tukey事后检验(post-hoc test)之后,利用单向ANOVA进行统计学比较。
体外药理学
在0.1M HCl中制备20mM雷诺嗪(Gilead,Foster City,CA)的储备溶液。在每个实验日制备槽溶液中的式IA或式IB化合物的新鲜稀释液并将pH重新调节至7.35。利用Perfusion Pencil系统(Automate,Berkeley,CA)将灌注溶液直接施加于被钳制细胞。通过利用250微米尖端以350μL/min的流速通过重力来驱动直接细胞灌注。这种系统将灌注流中的被钳制细胞隔离并且能够在1秒内完成溶液替换。在建立全细胞模式(whole-cellconfiguration)后立即启动继续灌注被钳制细胞。在对照溶液灌注过程中测量对照电流。
在记录电流之前灌注含有本发明化合物的溶液三分钟以达到平衡态(紧张性)药物阻断。测量来自该稳态条件下的峰值电流和持续电流的紧张性阻断。将三个顺序的电流迹线平均化以获得对于每一记录条件的平均电流(对照、雷诺嗪和TTX)。该平均电流迹线被用于离线减影(离线扣减,offline subtraction)和分析。在来自-120mV保持电位的脉冲串的脉冲数为300(-10mV,5ms,300次脉冲,10Hz)时,测量峰值电流的用途(功能)依赖性阻断。将两个连续脉冲串刺激同时平均化以获得每一记录条件的平均电流迹线,然后将该平均电流迹线用于离线减影(离线扣减)和分析。通过电压每30s受激的以20mV/s的速率从-120mV的保持电位升高至+20mV来评价坡度电流(ramp current)的阻断。为了使时间依赖性电流漂移最小化,仅分析对照、本发明的化合物、或TTX表面灌流过程之一所记录的迹线。TTX在雷诺嗪的存在下施加。用希尔方程(Hillequation)来拟合浓度抑制曲线:I/Imax=1/[1+10^(logIC50-I)*k],其中IC50为产生半数抑制的浓度,而k为希尔坡度因子(Hillslope factor)。
体内药理学
使用实施了颈静脉插管的雄性SD大鼠(250-350g,Charles RiverLaboratories,Hollister,CA)来研究本发明的化合物的体内脑渗透。动物是经公共动物保健和使用委员会(Institutional Animal Care and UseCommittee,Gilead Sciences)的批准后使用的。每组三只大鼠以85.5μg/kg/min静脉灌注溶解于盐水中的本发明化合物。在1小时、2.5小时或5小时后,将动物处死以用于收集血浆和脑,并通过液相色谱法与串联质谱法的结合(LC-MS/MS)来测量本发明化合物的浓度。在1%2N HCl酸化的5%氟化钠中均质化(将最终的匀浆稀释3倍)。将血浆和脑匀浆样品与作为内标的氘化D3-雷诺嗪一起沉淀、涡旋并离心。转移上清液(50μL)并在注射(10μl)前用水(450μl)稀释。利用岛沣(Shimadzu)LC-10AD液相色谱仪以及装有由含0.1%甲酸的水(溶液A)和乙腈(溶液B)组成的流动相的Luna C18(2),3μm,20x 2.0mm柱在等度洗脱条件下(75%溶液A、25%溶液B;流速0.300ml/min)实施高效液相色谱分析。利用在具有MRM跃迁428.1>98的阳离子模式下操作的API3000质谱仪来(Applied Biosystems,Foster City,CA)进行质谱分析。计算对于每一样品的脑与血浆的雷诺嗪之比,结果以ng雷诺嗪/g脑除以ng雷诺嗪/ml血浆表示。
结果
利用上述方法能够证明,本发明的化合物具有抑制WT-Nav1.1和一组与癫痫症和偏头痛综合征GEFS+、SMEI和FHM3有关的Na-v1.1突变体通道的能力,这表明本发明的化合物能够优先阻断由这些突变体通道带来的异常增加的持续电流。利用上述方法也可以确定本发明化合物穿过血脑屏障的能力。
实施例41
方法和材料
人Nav1.2cDNA的表哒
使用稳定转染在中华仓鼠卵巢(CHO)细胞中的野生型(WT)cDNA来记录Na+电流。除非另外提到,所有的试剂购自Sigma-Aldrich(St Louis,MO,U.S.A.)。
电生理学
利用全细胞电位钳记录来测量WT的生物生理学特性。简言之,电极内液(以mM计)由110CsF、10NaF、20CsCl、2EGTA、10HEPES组成,pH 7.35且渗透量为300mOsmol/kg。槽(对照)溶液含有(以mM计):145NaCl、4KCl、1.8CaCl2、1MgCl2、10葡萄糖、10HEPES,pH 7.35且渗透量为310mOsmol/kg。在建立全细胞模式之后,测量电流之前,将细胞稳定化10分钟。串联电阻补偿设定为90%以保证钳制电位(指令电位)达到微秒的范围内,且电压误差<2mV。通过利用在线P/4程序扣除漏电流并且所有的电流以5kHz进行Bessel低通滤波并以50kHz被数字化。
为了清楚起见,对代表性的斜率电流以50kHz进行离线低通滤波。使用用于评价通道活化、快速失活和重复刺激过程中的可用性的特定电压钳实验方案。结果表示为平均值±SEM,并且除非另外指出,利用单向ANOVA进行统计学比较。
测量峰值电流的紧张性阻断。利用平均电流迹线来进行离线减影(离线扣减)和分析。在脉冲串的脉冲数为300(-10mV,5ms,300脉冲)时,以来自-120mV的保持电位的10Hz至135Hz的频率测量峰值电流的用途(功能)依赖性阻断。将两个连续脉冲串刺激同时平均化以获得每一记录条件的平均电流迹线,然后将该平均电流迹线用于离线减影(扣减)和分析。
使用用于评价通道活化、快速失活和重复刺激过程中的可用性的特定电压钳实验方案。由通过GNa=INa/(V-ENa)放大和归一化为-80mV至+20mV的最大电导的峰值电流计算得到全细胞电导。将电导-电压和稳态通道可用性曲线与玻尔兹曼函数拟合以确定半数最大激活/失活的电压(V1/2)和坡度因子(k)。从失活的时间依赖性进入和复活是通过将峰值电流恢复与以下双指数函数相拟合来评价的:I/Imax=Af×[1-exp(-t/τf)]+As×[1-exp(-t/τs)],其中τf和τs表示时间常数(分别表示快分量和慢分量),Af和As表示快分数振幅和慢分数振幅。
对于用途(功能)依赖性研究,用来自-120mV的保持电位的去极化脉冲串(-10mV,5ms,300次脉冲,10Hz)刺激细胞。然后将电流归一化为响应于每一频率串中的第一次脉冲记录的峰值电流。对于紧张性阻断研究,在存在和不存在0.5μM河豚毒素(TTX)的情况下记录的电流的数字减影(数字扣减)之后,响应于200ms去极化至-10mV(0.2Hz)来评价峰值电流和持续电流。在200ms步长的最后10ms中记录持续电流。利用Clampfit 9.2(Axon Instruments,Union City,CA,U.S.A)、Excel 2002(Microsoft,Seattle,WA,U.S.A.)、和OriginPro 7.0(OriginLab,Northampton,MA,U.S.A)软件进行数据分析。结果以平均值±SEM来表示。除非另外指出,在参照WT-Nav1.2的Tukey事后检验(post-hoc test)之后,利用单向ANOVA进行统计学比较。
体外药理学
在0.1M HCl中制备20mM本发明化合物的储备溶液(Gilead,FosterCity,CA)。在每个实验日制备槽溶液中的本发明化合物的新鲜稀释液并将pH重新调节至7.35。利用Perfusion Pencil系统(Automate,Berkeley,CA)将灌注溶液直接施加于被钳制细胞。通过利用250微米尖端以350μL/min的流速通过重力来驱动直接细胞灌注。这种系统将灌注流中的被钳制细胞隔离并且能够在1秒内完成溶液替换。在建立全细胞模式后立即启动继续灌注被钳制细胞。在对照溶液灌注过程中测量对照电流。
在记录电流之前灌注含有雷诺嗪的溶液三分钟以使得达到平衡态(紧张性)药物阻断。测量来自该稳态条件下的峰值电流和持续电流的紧张性阻断。将三个顺序的电流迹线平均化以获得对于每一记录条件的平均电流(对照、本发明的化合物和TTX)。该平均电流迹线被用于离线减影(离线扣减,offline subtraction)和分析。在来自-120mV保持电位的脉冲串的脉冲数为300(-10mV,5ms,300次脉冲,10Hz)时,测量峰值电流的用途(功能)依赖性阻断。将两个连续脉冲串刺激同时平均化以获得每-记录条件的平均电流迹线,然后将该平均电流迹线用于离线减影(扣减)和分析。通过电压每30s受激的以20mV/s的速率从-120mV的保持电位升高至+20mV来评价坡度电流(ramp current)的阻断。为了使时间依赖性电流漂移最小化,仅分析对照、本发明的化合物、或TTX表面灌流过程中之一所记录的迹线。TTX在本发明化合物的存在下施加。用希尔方程来拟合浓度抑制曲线:I/Imax=1/[1+10^(logIC50-I)*k],其中IC50为产生半数抑制的浓度,而k为希尔坡度因子。
结果
结果表明,本发明的化合物具有抑制WT-Nav1.2的能力,这表示本发明的化合物能够优先阻断由该通道带来的异常增加的持续电流。
Claims (32)
1.一种式I化学式的化合物:
其中:
R1是芳基或杂芳基,
其中所述芳基或杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、CN、-SF5、-Si(CH3)3-O-CF3、-O-R20、-S-R20、-C(O)-R20、C(O)OH、-N(R20)(R22)、-C(O)-N(R20)(R22)、-N(R20)-C(O)-R22、-N(R20)-S(=O)2-R26、-S(=O)2-R20、-S(=O)2-N(R20)(R22)、C1-C3烷氧基、C1-4烷基、C2-4烯基、C2-4炔基、环烷基、杂芳基、和杂环基;
其中所述烷氧基、烷基、烯基、炔基、杂芳基、环烷基、或杂环基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20,
W1是N或CR2,其中R2独立地选自由以下构成的组中:氢、可选取代的烷基、氨基、可选取代的烷氧基、-CF3、-O-CF3、-CN、和-N(R20)C(O)-R22;
W2是N或CR3,其中R3独立地选自由以下构成的组中:氢、可选取代的烷基、-CF3、-卤素、和-O-R24;
W3是N或CR4,其中R4独立地选自由以下构成的组中:氢、羟基、卤素、C1-4烷基、C1-C3烷氧基、-R25-N(R20)(R22)、-R25-O-R20、-R25-C(O)-O-R20、-R25-C(O)-N(R20)(R22)、-R25-C(O)-O-N(R20)(R22)、-R25-N(R20)-C(O)-R22、和-R25-O-C(O)-N(R20)(R22),
其中所述烷基可选地用1个、2个、或3个独立地选自由羟基、卤素构成的组中的取代基取代,
Q选自共价键或C2-4亚炔基;
X1是N或CRa,其中
Ra是氢、C1-15烷基、C1-4烷氧基、-C(O)-O-R26、-C(O)-N(R26)(R28)、-N(R20)-S(=O)2-R20、环烷基、芳基、杂芳基、杂环基,
其中所述烷基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CHF2、环烷基、-CN、和C1-4烷氧基;和
所述烷氧基、环烷基、芳基、杂环基、或杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CHF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20;或
Ra是-Y-Z-R25-R23-R20,其中
Y是共价键或选自可选用1个或2个C1-C3烷基或氟基取代的C1-C3亚烷基;
Z是C2-4亚炔基、-O-、-S-、-NR’、-NR5’-C(O)-、-NR”-C(O)-NR5’、或-C(O)-NR3-、其中每个R”和R5’独立地是氢或C1-6低级烷基;和
进一步其中所述烷基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、-NO2、-O-CF3、-O-CF2、苯基、杂环基、杂芳基、环烷基、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、和-O-R20,
X2是N或CRb;
Rb选自由以下构成的组中:氢、取代的烷基、-CF3、-O-CF3、-O-R20、-S-R20、-N(R20)(R22)、-N(R20)-C(O)-R22、-CF2-R20、-CF2-C(O)-O-R20、-CF2-C(O)-N(R20)-S(=O)2-R26、-CF2-四唑基、-C(O)-N(R20)-S(=O)2-R26、-N(R20)-C(O)-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、和-N(R20)-S(=O)2-R26、-R25-可选取代的杂芳基、-R25-可选取代的芳基;
R20和R22在每种情况下独立地选自由以下构成的组中:氢、C1-C15烷基、C2-C15烯基、C2-C15炔基、环烷基、杂环基、芳基、和杂芳基,
其中所述烷基、烯基、炔基、杂环基、芳基、和杂芳基可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、-OCF3、芳基、环烷基、和杂芳基;或
当R20和R22连接至一共用碳原子,R20和R22可以连接形成一杂环环,其进而可选地用1个、2个、或3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、和-OCF3、芳基、环烷基;
R23是共价键或选自由以下构成的组中:亚环烷基、亚杂环基、亚芳基、和杂亚芳基,
其中所述亚环烷基、亚杂环基、亚芳基、和杂亚芳基可选地用1个至3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、烷基、单-或二烷基氨基、烷基或芳基或杂芳基酰胺、-NO2、-SO2R26、-CN、C1-3烷氧基、-CF3、-OCF3、芳基、环烷基、和杂芳基;
R24在每种情况下独立地选自烷基或芳基,其每一个可以可选地用1、2、或3个独立地选自以下的取代基取代:羟基,-OCF3,卤素,C1-C3烷氧基,-O-R20,或可选用以下基团取代的烷基:卤素、-NO2、-CF3、-O-CF3、-N(R20)(R22)、-C(O)-R20、-C(O)-O-R20、-C(O)-N(R20)(R22)、-CN、或-O-R20;
R25在每种情况下独立地是共价键或选自可选用1个或2个C1-C3烷基基团取代的C1-C3亚烷基;以及
R26和R28在每种情况下独立地选自氢、烷基、或环烷基,其中所述烷基、苯基和环烷基可以进一步用1至3个独立地选自由以下构成的组中的取代基取代:羟基、卤素、C1-4烷氧基、-CF3、和-OCF3;
或其药用盐、酯、前药、或溶剂化物,
条件是
a.当X1是CRa,Ra是-Y-Z-R25-R23-R20,Y不是共价键,且Z是-O-、-S-、-SO2-、-C(O)-NR3-、-NR5’-C(O)-、或NR”-时,则R25不能是键;
b.当X1是CRa,Ra是-Y-Z-R25-R23-R20,Y是共价键,且Z是-O-、-S-、-SO2-、或NR”-时,则R25是共价键,而R23不是亚环烷基;
c.当Z是-NR5’-C(O)-时,则Y不是共价键;
d.R23和R25不能一起是共价键;
e.当X1是CRa,Q是键,R1是杂芳基,且W1、W2、和W3都是CH时,则所述R1杂芳基可以不进一步用苯基取代;
f.当W1、W2、和W3都不是N,R2是取代的烷基,X1是CRa,且X2是N时,则Ra不是烷基、环烷基、或杂环基;和
g.当Q是共价键,R1是苯基,W1、W2、和W3是CH,X1是
CRa,且X2是N时,则Ra不是C1-3未取代的烷基;
h.当Q是共价键,W1和W2是CH,W3是NH,X1是CRa,且
X2是N时,则R1不是用芳基取代的杂芳基。
2.权利要求1的化合物,其中Q是C2-4亚炔基。
3.权利要求2的化合物,选自以下构成的组中:
6-(苯基乙炔基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-(苯基乙炔基)[1,2,4]三唑并[4,3-a]吡啶;
2,2-二氟-2-(6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶-3-基)乙醇;
3-(1,1-二氟-2-甲氧基乙基)-6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;
3-苯氧基-6-{[4-(三氟甲基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-{[4-(三氟甲氧基)苯基]乙炔基}[1,2,4]三唑并[4,3-a]吡啶;和
3-(1,1-二氟-2-甲氧基乙基)-6-[(4-氟苯基)乙炔基][1,2,4]三唑并[4,3-a]吡啶。
4.权利要求1的化合物,其中R1是杂芳基。
5.权利要求4的化合物,选自以下构成的组中:
6-(6-环丙基吡啶-3-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(2-环丙基嘧啶-5-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(5-环丙基-1,3,4-噻二唑-2-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[6-(三氟甲基)哒嗪-3-基][1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[2-(三氟甲基)嘧啶-5-基][1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
6-[6-(环丙基氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)哒嗪-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-[(环丙基甲氧基)(二氟)甲基]-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;
GS-4665533-{二氟[(5-苯基-1,2-噁唑-3-基)甲氧基]甲基}-6-[6-(三氟甲基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶;和
GS-4666543-{二氟[(5-苯基-1,2-噁唑-3-基)甲氧基]甲基}-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-a]吡啶。
6.权利要求1的化合物,其中W3和X2都是N。
7.权利要求6的化合物,选自以下构成的组中:
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
6-[2-甲基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(4-苯氧基苯基)-3-(2,2,2-三氟乙基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(4-苯氧基苯基)-3-(丙烷-2-基)[1,2,4]三唑并[4,3-b]哒嗪;
6-[2-甲基-4-(三氟甲氧基)苯基]-3-(丙烷-2-基)[1,2,4]三唑并[4,3-b]哒嗪;
3-叔丁基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
3-叔丁基-6-[4-(2,2,2-三氟乙氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
3-乙基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
3-环丙基-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
4-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
4-{6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
3-(1-甲基-1H-吡唑-4-基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
4-[6-(4-甲氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
3-[6-(4-甲氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
3-[4-(甲基磺酰基)苯基]-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪;
3-{6-[6-(吗啉-4-基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
6-(4-苯氧基苯基)-3-[4-(2H-四唑-5-基)苯基][1,2,4]三唑并[4,3-b]哒嗪;和
3-[6-(4-氟苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]苯甲腈;
2-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-b]哒嗪-3-基]丙烷-2-醇;
3,6-二[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪;
3-{6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪-3-基}苯甲腈;
6-(3,5-二氟-4-苯氧基苯基)-3-(丙烷-2-基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(丙烷-2-基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪;
6-[3-氟-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-(3,5-二氟-4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
6-[4-(4-氯苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-[6-(2,2,2-三氟乙氧基)吡啶-3-基][1,2,4]三唑并[4,3-b]哒嗪;
3-(二氟甲基)-6-[3-氟-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-b]哒嗪。
8.权利要求1的化合物,其中W2和X2都是N。
9.权利要求8的化合物,选自以下构成的组中:
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡嗪;
6-(4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡嗪;
3-(二氟甲基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡嗪;和
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡嗪。
10.权利要求1的化合物,其中X1和X2都是N。
11.权利要求10的化合物,选自以下构成的组中:
6-(4-苯氧基苯基)四唑并[1,5-a]吡啶;
6-[4-(三氟甲氧基)苯基]四唑并[1,5-a]吡啶;
6-[4-(4-氯苯氧基)苯基]四唑并[1,5-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]四唑并[1,5-a]吡啶;
8-甲基-6-[4-(三氟甲氧基)苯基]四唑并[1,5-a]吡啶;和
5-甲基-6-[4-(三氟甲氧基)苯基]四唑并[1,5-a]吡啶。
12.权利要求1的化合物,其中X1是Ra而X2是Rb。
13.权利要求12的化合物,选自以下构成的组中:
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-(4-苯氧基苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-[4-(2,2,2-三氟乙氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-(4-甲氧基苯基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
1-苯基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
(2E)-3-{6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基}丙-2-烯酸甲酯;
6-[6-(甲基磺酰基)吡啶-3-基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-腈;
{6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶-1-基}甲醇;
1-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-[6-(2,2,2-三氟乙氧基)吡啶-3-基]-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-(1,3-噁唑-2-基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-(1,3-噻唑-2-基)-3-(三氟甲基)咪唑并[1,5-a]吡啶;
6-苯基-3-(三氟甲基)咪唑并[1,5-a]吡啶;
2-[3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基]-1,3-苯并噁唑;和
2-[3-(三氟甲基)咪唑并[1,5-a]吡啶-6-基]-1,3-苯并噻唑。
14.权利要求1的化合物,其中X1、X2和W3都是N。
15.权利要求14的化合物,即6-[4-(4-氯苯氧基)苯基]四唑并[1,5-b]哒嗪。
16.权利要求1的化合物,其中X2是N而X1是Ra。
17.权利要求16的化合物,其中Ra是芳基。
18.权利要求17的化合物,选自以下构成的组中:
3-苯基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-苯基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺;
3,6-二[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯磺酰胺;
N-(4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯基)甲磺酰胺;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酰胺;
3,3′-[1,2,4]三唑并[4,3-a]吡啶-3,6-二基二苯甲酸二乙酯;
4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酸乙酯;
3-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酸乙酯;
N-(2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯基)甲磺酰胺;
N-甲基-3-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}苯甲酰胺;和
N-[5-(三氟甲氧基)-2-{3-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-6-基}苯基]乙酰胺。
19.权利要求16的化合物,其中Ra是-Y-Z-R25-R23-R20。
20.权利要求19的化合物,其中Y是-CF2-而Z是O。
21.权利要求20的化合物,选自以下构成的组中:
3-[二氟(甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(2-甲氧基乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(3-甲基氧杂环丁烷-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-甲基-1,2,4-噁二唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(苄氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(吡啶-4-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
2-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)乙醇;
1-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)丙-2-醇;
3-{二氟[(5-甲基-1,2-噁唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(吡啶-3-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(5-环丙基-1,2,4-噁二唑-3-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[5-(2-甲基丙基)-1,2,4-噁二唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[5-(丙烷-2-基)-1,2,4-噁二唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(吡啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹啉;
3-[(环丙基甲氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-苯基-1H-1,2,3-三唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(哒嗪-3-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[1-(4-氟苯基)乙氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-5-苯基-1H-吡唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,2-二氟-1,3-苯并间二氧杂环戊烯-5-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,5-二甲基-1,3-噁唑-4-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-甲基-2-苯基-1,3-噁唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[1-(吡啶-2-基)乙氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[1-(4-氯苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(嘧啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[1-(2,4-二氯苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]环丁醇;
(2S)-2-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]吡咯烷-1-羧酸叔丁基酯;
3-{[(5-环丁基-1,2,4-噁二唑-3-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]苯甲腈;
3-(二氟{3-[(2-甲氧基苯基)磺酰基]-2-甲基丙氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟(1-{3-[4-(三氟甲基)苯基]-1,2-噁唑-5-基}乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{2-[4-(4-甲氧基苯基)哌啶-1-基]乙氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(3-环丙基-1-甲基-1H-吡唑-5-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
5-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹啉;
3-[1-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)乙基]喹啉;
3-{[2-(2,6-二甲基苯氧基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-苯基-1H-吡唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[二氟({2-[4-(三氟甲基)苯基]-1,3-噁唑-4-基}甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-2-甲基喹啉;
4-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-2-(三氟甲基)喹啉;
6-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]喹喔啉;
3-[(丁-2-炔-1-基氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,2-二氟环丙基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(3-苯基丙-2-炔-1-基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-1H-苯并咪唑-2-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(1-苄基-1H-1,2,3-三唑-4-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-苯基-1,2-噁唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(2-苯基-1,3-噁唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-甲基-2-苯基-2H-1,2,3-三唑-4-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-1H-吡唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[{[1-(4-氯苯基)-5-甲基-1H-吡唑-3-基]甲氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(3,3-二苯基丙氧基)(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[3-(嘧啶-2-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[3-(吡啶-3-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(1-甲基-1H-吲唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-(1H-1,2,4-三唑-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-(2-甲基-1H-咪唑-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-苯基-5-(三氟甲基)-1,3-噁唑-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[1-苯基-3-(三氟甲基)-1H-吡唑-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[6-(1H-吡唑-1-基)吡啶-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-环丙基-2′-[(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲氧基)甲基]-3,4′-联吡啶;
3-[{[3-(4-环丙基-1H-咪唑-1-基)苄基]氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[5-(4-氟苯基)-1,2-噁唑-3-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{[2-(哌啶-1-基)吡啶-4-基]甲氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,2-二甲基-2,3-二氢-1-苯并呋喃-7-基)甲氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[2-(2,6-二氟苯基)乙氧基](二氟)甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{二氟[(5-苯基-1,2,4-噁二唑-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[{[2-(6-环丙基吡啶-3-基)苄基]氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[{[5-(2-氯苯基)-1,2-噁唑-3-基]甲氧基}(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
GS-4667383-(二氟{[2-(吡啶-3-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;和
GS-4667393-(二氟{[2-(1H-吡唑-1-基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶。
22.权利要求19的化合物,其中Y是-CF2-而Z是O。
23.权利要求22的化合物,选自以下构成的组中:
3-(1,1-二氟-2-甲氧基乙基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
2,2-二氟-2-[6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶-3-基]乙醇;
3-(1,1-二氟-2-甲氧基乙基)-6-(4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氯苯氧基)苯基]-3-(1,1-二氟-2-甲氧基乙基)[1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-[4-(4-氟苯氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[1,1-二氟-2-(吡啶-3-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
2-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-N,N-二甲基乙胺;
(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)乙腈;
1,1-二氟-1-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}丙-2-醇;
1-环丙基-2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙醇;
(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)乙酸乙酯;
3-[1,1-二氟-2-(吡啶-2-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1,1-二氟-2-甲基-1-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}丙-2-醇;
3-(1,1-二氟-2-甲氧基乙基)-6-[3-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{2-[(3,4-二氟苄基)氧基]-1,1-二氟乙基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(二氟{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲基)戊-3-醇;和
3-(1,1-二氟-2-甲氧基乙基)-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-2-甲基丙-2-醇;
3-(1,1-二氟-2-甲氧基乙基)-6-[3-氟-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(1,1-二氟-2-甲氧基乙基)-6-(3,5-二氟-4-苯氧基苯基)[1,2,4]三唑并[4,3-a]吡啶;
3-(2-{[3-(4-氯苯基)-1,2-噁唑-5-基]甲氧基}-1,1-二氟乙基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-(2-氯苯氧基)-3-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)丙-2-醇;
1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙氧基)-3-(2,5-二甲基苯氧基)丙-2-醇。
24.权利要求16的化合物,其中Ra是可选地用卤素、羟基、环丙基、甲氧基、或氨基取代的C1-15烷基。
25.权利要求24的化合物,选自以下构成的组中:
7-甲基-6-(4-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶;
6-(3-(三氟甲氧基)苯基)-3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[4-(三氟甲基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(2,4-二氯苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(二氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(3-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-氯-3-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-氯-3-氟苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
7-甲基-6-[3-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-叔丁基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-[4-(三甲基硅烷基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-(4-甲氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(2,2,2-三氟乙氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲酸甲酯;
2-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}丙-2-醇;
4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲腈;
6-[2-(1H-四唑-5-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(联苯基-4-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(1-甲基-1H-吲唑-5-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(1H-1,2,4-三唑-1-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氟苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氯苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
2-甲基-2-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}丙腈;
6-[3-甲基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(丙-2-基磺酰基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(5-甲基-1,3,4-噁二唑-2-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-(吗啉-4-基甲基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-乙氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(4-叔丁氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-{3-[(4-甲基哌啶-1-基)甲基]-4-(三氟甲氧基)苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
N,N-二甲基-1-{2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}甲胺;
2-({2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苄基}氨基)乙醇;
6-(4-环丙基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(吡嗪-2-基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(吡啶-3-基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(环丙氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
8-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
7-甲氧基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-甲氧基-4-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(萘-2-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-(三氟甲基)-6-(3,4,5-三甲氧基苯基)[1,2,4]三唑并[4,3-a]吡啶;
8-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]喹啉;
6-(3,5-二氟-4-苯氧基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(4-氟-2-硝基苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(2-氟苯氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(吡啶-4-基氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
N-苯基-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
N-(2,2,2-三氟乙基)-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
6-[4-(苯磺酰基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(萘-1-基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]-N-(2,2,2-三氟-1-苯基乙基)苯胺;
6-[2-溴-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-(2-甲氧基嘧啶-5-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-(吡啶-3-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
1-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}环戊腈;
6-[2-氟-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-氟-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(环丙基甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-甲氧基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-(1,3,4-噁二唑-2-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
1-(4-(3-(三氟甲基)-[1,2,4]三唑并[4,3-a]吡啶-6-基)苯基)乙酮;
5-(三氟甲氧基)-8-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]喹啉;
6-[4-(2-甲基-1,3-二氧杂环戊烷-2-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[3-氯-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
(2E)-3-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}丁-2-烯腈;
N-甲基-2-(三氟甲氧基)-5-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯甲酰胺;
6-[2-(2-甲氧基乙氧基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
{5-(三氟甲氧基)-2-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯氧基}乙腈;
6-[3-(3-甲基-1,2,4-噁二唑-5-基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)-3-(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
1-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}环丙腈;
6-[2,4-双(三氟甲基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
5-甲基-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[4-(2-甲氧基丙-2-基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-乙氧基-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-[2-(丙-2-基氧基)-4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
4-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}四氢-2H-吡喃-4-腈;
6-{4-[二氟(吡啶-3-基)甲氧基]苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-{4-[二氟(苯基)甲氧基]苯基}-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
5-氯-2-({4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}氨基)苯甲腈;
5-(甲氧基甲基)-6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
N-甲基-N-苯基-4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯胺;
({6-[4-(三氟甲氧基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-5-基}甲氧基)乙腈;
4-(二氟{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯氧基}甲基)苯甲腈;
4-氯-N-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}苯胺;
4-氟-N-{4-[3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶-6-基]苯基}苯胺;
6-[4-(五氟-λ~6~硫烷基)苯基]-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶;
6-(2-氯-4-硝基苯基)-3-(三氟甲基)[1,2,4]三唑并[4,3-a]吡啶。
26.权利要求16的化合物,其中R1是可选用卤素、羟基、甲氧基、乙氧基、-OCF3、或氨基取代的芳基。
27.权利要求26的化合物,选自以下构成的组中:
{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙酸;
3-(二氟甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(丙-2-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-羧酸甲酯;
N-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-羧酰胺;
3-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺;
3-甲基-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-胺;
N-{3-甲基-6-[2-甲基-4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-基}乙酰胺;
3-(1-甲基-1H-吡唑-4-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
N-{3-甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-8-基}丙酰胺;
N-({6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲基)甲磺酰胺;
3-(二氟甲基)-8-甲氧基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(苄氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(环丙基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(2,2,2-三氟乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}甲醇;
3-苯氧基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
2,2,2-三氟-1-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙醇;
3-(2-氯-1,1-二氟乙基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
N,N-二甲基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-胺;
3-(苯基硫烷基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(环丙基乙炔基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
2-甲基-4-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}丁-3-炔-2-醇;
N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)甲磺酰胺;
N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)吡啶-2-羧酰胺;
3-甲氧基-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-(2,2,2-三氟乙氧基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-({[4-(三氟甲基)苄基]氧基}甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{[(4-氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2-氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-({[2-(三氟甲基)苄基]氧基}甲基)[1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,4-二氟苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(4-氯苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-({[4-(三氟甲氧基)苄基]氧基}甲基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
N-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)苯甲酰胺;
3-[(吡啶-2-基甲氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[(1-苯基乙氧基)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{1-[二氟(吡啶-3-基)甲氧基]乙基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,4-二氯苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(2,4-二甲基苄基)氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[(5-甲基吡啶-2-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-[1-(吡啶-2-基甲氧基)乙基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
3-{[二氟(吡啶-3-基)甲氧基]甲基}-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
6-[4-(三氟甲氧基)苯基]-3-[3-(三氟甲基)苯氧基][1,2,4]三唑并[4,3-a]吡啶;
3-(4,4-二氟哌啶-1-基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;
1-(2,2-二氟-2-{6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-基}乙基)-3-苯基脲;
6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶-3-羧酰胺;
3-(2-甲基苯氧基)-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶;和
3-[氯(二氟)甲基]-6-[4-(三氟甲氧基)苯基][1,2,4]三唑并[4,3-a]吡啶。
28.一种治疗哺乳动物中的疾病状态的方法,所述疾病状态可通过利用能够降低后钠电流的药剂治疗而缓解,包括给予需要其的哺乳动物治疗有效剂量的权利要求1的化合物。
29.权利要求28所述的方法,其中所述疾病状态是选自以下的一种或多种心血管疾病:房性和室性心律失常,心力衰竭(包括充血性心力衰竭、舒张性心力衰竭、收缩性心力衰竭、急性心力衰竭),变异型心绞痛,稳定型和不稳定型心绞痛,运动诱发的心绞痛,充血性心脏病,缺血,复发性缺血,脑缺血,中风,肾缺血,与器官移植相关的缺血,再灌注损伤,心肌梗死,急性冠脉综合征,外周动脉病,肺性高血压和间歇性跛行。
30.权利要求29所述的方法,其中所述疾病状态是糖尿病或糖尿病性周围神经病变。
31.权利要求29所述的方法,其中所述疾病状态导致神经性疼痛、癫痫、惊厥、或麻痹中的一种或多种。
32.一种药物组合物,包括药用赋形剂和治疗有效量的权利要求1所述的化合物或其药用盐、酯、前药、或水合物。
Applications Claiming Priority (5)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US22886409P | 2009-07-27 | 2009-07-27 | |
| US61/228,864 | 2009-07-27 | ||
| US36003710P | 2010-06-30 | 2010-06-30 | |
| US61/360,037 | 2010-06-30 | ||
| PCT/US2010/043264 WO2011014462A1 (en) | 2009-07-27 | 2010-07-26 | Fused heterocyclic compounds as ion channel modulators |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN102725290A true CN102725290A (zh) | 2012-10-10 |
| CN102725290B CN102725290B (zh) | 2016-03-09 |
Family
ID=42751632
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201080043104.0A Active CN102725290B (zh) | 2009-07-27 | 2010-07-26 | 作为离子通道调节剂的稠合杂环化合物 |
Country Status (22)
| Country | Link |
|---|---|
| US (2) | US8952034B2 (zh) |
| EP (1) | EP2464645B1 (zh) |
| CN (1) | CN102725290B (zh) |
| AR (1) | AR077598A1 (zh) |
| AU (1) | AU2010276537B2 (zh) |
| CA (1) | CA2774715C (zh) |
| CY (1) | CY1119584T1 (zh) |
| DK (1) | DK2464645T3 (zh) |
| EA (1) | EA025824B1 (zh) |
| ES (1) | ES2642586T3 (zh) |
| HR (1) | HRP20171454T8 (zh) |
| HU (1) | HUE034911T2 (zh) |
| LT (1) | LT2464645T (zh) |
| ME (1) | ME02847B (zh) |
| NZ (1) | NZ598942A (zh) |
| PL (1) | PL2464645T3 (zh) |
| PT (1) | PT2464645T (zh) |
| RS (1) | RS56410B1 (zh) |
| SI (1) | SI2464645T1 (zh) |
| TW (2) | TWI542587B (zh) |
| UY (1) | UY32805A (zh) |
| WO (1) | WO2011014462A1 (zh) |
Cited By (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105263490A (zh) * | 2013-03-14 | 2016-01-20 | 基因泰克公司 | 取代的三唑并吡啶及其使用方法 |
| CN105814058A (zh) * | 2013-12-09 | 2016-07-27 | Ucb生物制药私人有限公司 | 用作tnf活性调节剂的三唑并哒嗪衍生物 |
| CN105980380A (zh) * | 2014-02-13 | 2016-09-28 | 吉利德科学公司 | 离子通道调节剂的固体形式 |
| CN113573713A (zh) * | 2018-09-28 | 2021-10-29 | 普拉克西斯精密药物股份有限公司 | 离子通道调节剂 |
| CN114980899A (zh) * | 2019-11-26 | 2022-08-30 | 普拉西斯精密医药公司 | 离子通道调节剂 |
| CN115768757A (zh) * | 2019-12-19 | 2023-03-07 | 美利坚合众国,由健康及人类服务部部长代表 | Cd206调节剂及其用途和制备方法 |
Families Citing this family (45)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ME02847B (me) | 2009-07-27 | 2018-01-20 | Gilead Sciences Inc | Fuzionisana heterociklična jedinjenja kao modulatori jonskih kanala |
| EA026385B9 (ru) | 2010-07-02 | 2017-08-31 | Джилид Сайэнс, Инк. | Конденсированные гетероциклические соединения в качестве модуляторов ионных каналов |
| WO2012065297A1 (en) * | 2010-11-16 | 2012-05-24 | Impact Therapeutics, Inc. | 3-ARYL-6-ARYL-[1,2,4]TRIAZOLO[4,3-a]PYRIDINES AS INHIBITORS OF CELL PROLIFERATION AND THE USE THEREOF |
| JP5934787B2 (ja) | 2011-05-10 | 2016-06-15 | ギリアード サイエンシーズ, インコーポレイテッド | イオンチャネルモジュレーターとしての縮合複素環式化合物 |
| UY34171A (es) | 2011-07-01 | 2013-01-31 | Gilead Sciences Inc | Compuestos heterocíclicos fusionados como moduladores del canal iónico |
| NO3175985T3 (zh) | 2011-07-01 | 2018-04-28 | ||
| CA2848809A1 (en) | 2011-09-15 | 2013-03-21 | Novartis Ag | 6-substituted 3-(quinolin-6-ylthio)-[1,2,4]triazolo[4,3-a]pyradines as c-met tyrosine kinase |
| US20140221286A1 (en) * | 2011-09-21 | 2014-08-07 | Gilead Sciences, Inc. | Sodium channel blockers reduce glucagon secretion |
| CA2848518C (en) | 2011-09-27 | 2019-06-18 | Genfit | Derivatives of 6-substituted triazolopyridazines as rev-erb agonists |
| BR112014010368A2 (pt) | 2011-10-31 | 2017-04-25 | Xenon Pharmaceuticals Inc | biaril éter sulfonamidas e seu uso como agentes terapêuticos |
| EP2773637B1 (en) | 2011-10-31 | 2016-06-08 | Xenon Pharmaceuticals Inc. | Benzenesulfonamide compounds and their use as therapeutic agents |
| JP2015504923A (ja) | 2012-01-27 | 2015-02-16 | ギリアード サイエンシーズ, インコーポレイテッド | 後期ナトリウムイオンチャネル遮断剤およびカリウムイオンチャネル遮断剤を使用する併用療法 |
| SG11201408284VA (en) | 2012-05-22 | 2015-02-27 | Xenon Pharmaceuticals Inc | N-substituted benzamides and their use in the treatment of pain |
| WO2014008458A2 (en) | 2012-07-06 | 2014-01-09 | Genentech, Inc. | N-substituted benzamides and methods of use thereof |
| WO2014144545A2 (en) | 2013-03-15 | 2014-09-18 | Genentech, Inc. | Substituted benzoxazoles and methods of use thereof |
| EP2818471A1 (en) * | 2013-06-27 | 2014-12-31 | Max-Planck-Gesellschaft zur Förderung der Wissenschaften e.V. | Nitrogen bicyclic compounds as inhibitors for Scyl1 and Grk5 |
| JO3367B1 (ar) * | 2013-09-06 | 2019-03-13 | Janssen Pharmaceutica Nv | مركبات 2،1، 4- ثلاثي زولو [3،4-a] بيريدين واستخدامها بصفة منظمات تفارغية موجبة لمستقبلات ميجلور 2 |
| CR20160296A (es) | 2013-11-27 | 2016-09-20 | Genentech Inc | Benzamidas sustituidas y métodos para usarlas |
| GB201321742D0 (en) * | 2013-12-09 | 2014-01-22 | Ucb Pharma Sa | Therapeutic agents |
| CA2934456C (en) * | 2013-12-20 | 2019-01-29 | Gilead Sciences, Inc. | Fused heterocyclic compounds as ion channel modulators |
| KR102414246B1 (ko) | 2014-01-21 | 2022-06-27 | 얀센 파마슈티카 엔.브이. | 대사 조절형 글루탐산 작동성 수용체 제2아형의 양성 알로스테릭 조절제 또는 오르토스테릭 작동제를 포함하는 조합 및 그 용도 |
| HUE053734T2 (hu) | 2014-01-21 | 2021-07-28 | Janssen Pharmaceutica Nv | 2-es altípusú metabotróp glutamáterg receptor pozitív allosztérikus modulátorait tartalmazó kombinációk és alkalmazásuk |
| JP2017525677A (ja) | 2014-07-07 | 2017-09-07 | ジェネンテック, インコーポレイテッド | 治療用化合物及びその使用方法 |
| NZ737536A (en) | 2015-05-22 | 2019-04-26 | Genentech Inc | Substituted benzamides and methods of use thereof |
| GB201511790D0 (en) | 2015-07-06 | 2015-08-19 | Iomet Pharma Ltd | Pharmaceutical compound |
| CN108137477A (zh) | 2015-08-27 | 2018-06-08 | 基因泰克公司 | 治疗化合物及其使用方法 |
| PE20181003A1 (es) | 2015-09-28 | 2018-06-26 | Genentech Inc | Compuestos terapeuticos y sus metodos de uso |
| CN108495851A (zh) | 2015-11-25 | 2018-09-04 | 基因泰克公司 | 取代的苯甲酰胺及其使用方法 |
| EP3436432B1 (en) | 2016-03-30 | 2021-01-27 | Genentech, Inc. | Substituted benzamides and methods of use thereof |
| WO2018013430A2 (en) | 2016-07-12 | 2018-01-18 | Arisan Therapeutics Inc. | Heterocyclic compounds for the treatment of arenavirus infection |
| KR20190078587A (ko) | 2016-10-17 | 2019-07-04 | 제넨테크, 인크. | 치료 화합물 및 그의 사용 방법 |
| CN116763791A (zh) | 2016-11-28 | 2023-09-19 | 普拉克西斯精密药物股份有限公司 | 化合物以及它们的使用方法 |
| US11261188B2 (en) | 2016-11-28 | 2022-03-01 | Praxis Precision Medicines, Inc. | Fused heteroaryl compounds, and methods thereof for treating diseases, disorders, and conditions relating to aberrant function of a sodium channel |
| US11492345B2 (en) | 2017-02-13 | 2022-11-08 | Praxis Precision Medicines, Inc. | Compounds and their methods of use |
| JP2020511511A (ja) | 2017-03-24 | 2020-04-16 | ジェネンテック, インコーポレイテッド | ナトリウムチャネル阻害剤としての4−ピペリジン−n−(ピリミジン−4−イル)クロマン−7−スルホンアミド誘導体 |
| US11731966B2 (en) | 2017-04-04 | 2023-08-22 | Praxis Precision Medicines, Inc. | Compounds and their methods of use |
| WO2019035951A1 (en) | 2017-08-15 | 2019-02-21 | Praxis Precision Medicines, Inc. | COMPOUNDS AND THEIR METHODS OF USE |
| TW202000651A (zh) | 2018-02-26 | 2020-01-01 | 美商建南德克公司 | 治療性組成物及其使用方法 |
| JP2021519788A (ja) | 2018-03-30 | 2021-08-12 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | ナトリウムチャネル阻害剤としての縮合環ヒドロピリド化合物 |
| JP7359847B2 (ja) | 2018-05-30 | 2023-10-11 | プラクシス プレシジョン メディシンズ, インコーポレイテッド | イオンチャネルモジュレーター |
| US11773099B2 (en) | 2019-05-28 | 2023-10-03 | Praxis Precision Medicines, Inc. | Compounds and their methods of use |
| US11279700B2 (en) | 2019-05-31 | 2022-03-22 | Praxis Precision Medicines, Inc. | Ion channel modulators |
| US11505554B2 (en) | 2019-05-31 | 2022-11-22 | Praxis Precision Medicines, Inc. | Substituted pyridines as ion channel modulators |
| US11767325B2 (en) | 2019-11-26 | 2023-09-26 | Praxis Precision Medicines, Inc. | Substituted [1,2,4]triazolo[4,3-a]pyrazines as ion channel modulators |
| WO2023211852A1 (en) * | 2022-04-26 | 2023-11-02 | Praxis Precision Medicines, Inc. | Treatment of neurological disorders |
Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004020440A1 (en) * | 2002-08-30 | 2004-03-11 | Pfizer Products Inc. | Di and trifluoro-triazolo-pyridines anti-inflammatory compounds |
| WO2004096767A1 (en) * | 2003-04-25 | 2004-11-11 | H. Lundbeck A/S | Sustituted indoline and indole derivatives |
| WO2005002520A2 (en) * | 2003-07-01 | 2005-01-13 | Merck & Co., Inc. | Ophthalmic compositions for treating ocular hypertension |
| WO2005014558A1 (en) * | 2003-08-05 | 2005-02-17 | Vertex Pharmaceuticals Incorporated | Condensed pyramidine compounds as inhibitors of voltage-gated ion channels |
| WO2007113226A1 (en) * | 2006-03-31 | 2007-10-11 | Novartis Ag | Organic compounds |
| WO2007146284A2 (en) * | 2006-06-12 | 2007-12-21 | Vertex Pharmaceuticals Incorporated | Thienopyrimidines useful as modulators of ion channels |
Family Cites Families (159)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| NL128591C (zh) * | 1965-07-02 | |||
| US3845770A (en) | 1972-06-05 | 1974-11-05 | Alza Corp | Osmatic dispensing device for releasing beneficial agent |
| US4230705A (en) | 1976-09-22 | 1980-10-28 | American Cyanamid Company | 6-Phenyl-1,2,4-triazolo[4,3-b]pyridazines and their uses in treating anxiety |
| US4242515A (en) | 1979-03-28 | 1980-12-30 | American Cyanamid Company | Substituted 3-alkyl-6-phenyl-1,2,4-triazolo-[4,3-a]pyridines |
| US4244953A (en) | 1979-10-24 | 1981-01-13 | American Cyanamid Company | Substituted 6-phenyl-5,6,7,8-tetrahydro-1,2,4-triazolo-[4,3-a]pyridines |
| US4326525A (en) | 1980-10-14 | 1982-04-27 | Alza Corporation | Osmotic device that improves delivery properties of agent in situ |
| US4812565A (en) | 1982-09-30 | 1989-03-14 | A. H. Robins Company, Incorporated | Fused aromatic oxazepinones, thiazepinones, diazepinones and sulfur analogs thereof |
| US5364620A (en) | 1983-12-22 | 1994-11-15 | Elan Corporation, Plc | Controlled absorption diltiazem formulation for once daily administration |
| US4654343A (en) | 1985-10-31 | 1987-03-31 | American Cyanamid Company | N-substituted-N[3-(1,2,4-triazolo[4,3-b]pyridazin-6-yl)phenyl]alkanamides, carbamates and ureas |
| US5023252A (en) | 1985-12-04 | 1991-06-11 | Conrex Pharmaceutical Corporation | Transdermal and trans-membrane delivery of drugs |
| US4746655A (en) | 1987-06-10 | 1988-05-24 | A. H. Robins Company, Incorporated | Fused aromatic-spiropiperidine oxazepinones(and thiones) |
| US4992445A (en) | 1987-06-12 | 1991-02-12 | American Cyanamid Co. | Transdermal delivery of pharmaceuticals |
| US5001139A (en) | 1987-06-12 | 1991-03-19 | American Cyanamid Company | Enchancers for the transdermal flux of nivadipine |
| US4902514A (en) | 1988-07-21 | 1990-02-20 | Alza Corporation | Dosage form for administering nilvadipine for treating cardiovascular symptoms |
| DE4010488A1 (de) | 1990-03-31 | 1991-10-02 | Hoechst Ag | Benzoxazinderivate, verfahren zu ihrer herstellung und ihre verwendung zum behandeln oder zur prophylaxe von krankheiten |
| CA2044564A1 (en) * | 1990-06-28 | 1991-12-29 | Quirico Branca | Amino acid derivatives |
| CN1060467A (zh) | 1990-09-25 | 1992-04-22 | 武田药品工业株式会社 | 1,3-苯并嗪衍生物、其生产方法和用途 |
| JPH04209692A (ja) | 1990-12-03 | 1992-07-31 | Asahi Glass Co Ltd | フォトクロミック材料 |
| ATE136296T1 (de) | 1991-05-10 | 1996-04-15 | Takeda Chemical Industries Ltd | Pyridinderivate, deren herstellung und anwendung |
| US5939412A (en) | 1992-06-26 | 1999-08-17 | Smithkline Beecham Corporation | Bicyclic fibrinogen antagonists |
| JP3497164B2 (ja) | 1991-06-28 | 2004-02-16 | スミスクライン・ビーチャム・コーポレイション | 二環式フィブリノーゲン拮抗薬 |
| US5674863A (en) | 1991-10-18 | 1997-10-07 | Genentech, Inc. | Nonpeptidyl integrin inhibitors having specificity for the GPIIb IIIa receptor |
| US5250679A (en) | 1991-10-18 | 1993-10-05 | Genentech, Inc. | Nonpeptidyl platelet aggregation inhibitors having specificity for the GPIIb III.sub. receptor |
| US5272158A (en) | 1991-10-29 | 1993-12-21 | Merck & Co., Inc. | Fibrinogen receptor antagonists |
| JPH06107647A (ja) | 1992-08-12 | 1994-04-19 | Takeda Chem Ind Ltd | 1,3−ベンゾオキサジン誘導体の製造法 |
| US6011150A (en) | 1992-11-13 | 2000-01-04 | Tanabe Seiyaku Co., Ltd. | Azetidinone compound and process for preparation thereof |
| US5442055A (en) | 1992-11-13 | 1995-08-15 | Tanabe Seiyaku Co., Ltd. | Azetidinone compound and process for preparation thereof |
| GB9225860D0 (en) | 1992-12-11 | 1993-02-03 | Smithkline Beecham Plc | Novel treatment |
| GB9226302D0 (en) | 1992-12-17 | 1993-02-10 | Smithkline Beecham Plc | Pharmaceuticals |
| US5550229A (en) | 1993-06-23 | 1996-08-27 | Tanabe Seiyaku Co., Ltd. | Alkylation process for preparing azetidinone compound and starting compound therefor |
| DE19526173A1 (de) | 1995-07-18 | 1997-01-30 | Hoechst Ag | Polyfullerenaddukte, Verfahren zu ihrer regioselektiven Herstellung und deren Verwendung |
| JPH09157262A (ja) | 1995-12-08 | 1997-06-17 | Tanabe Seiyaku Co Ltd | アゼチジノン誘導体及びその合成中間体の製法 |
| GB9619492D0 (en) | 1996-09-18 | 1996-10-30 | Smithkline Beecham Plc | Novel treatment |
| JP2001526643A (ja) | 1997-04-18 | 2001-12-18 | スミスクライン・ビーチャム・パブリック・リミテッド・カンパニー | 5ht1a、5ht1bおよび5ht1d受容体アンタゴニスト活性を合わせ持つ化合物を含む二環式アリールまたは二環式複素環 |
| JP3964053B2 (ja) | 1997-07-10 | 2007-08-22 | 三井化学株式会社 | 遷移金属化合物からなるオレフィン重合用触媒ならびに重合方法 |
| CN1131887C (zh) | 1997-09-08 | 2003-12-24 | 尤尼利弗公司 | 促进酶活性的方法 |
| US6579875B1 (en) * | 1998-01-21 | 2003-06-17 | Merck Sharp & Dohme Limited | Triazolo-pyridazine derivatives as ligands for GABA receptors |
| EP1054877A1 (en) | 1998-02-11 | 2000-11-29 | Du Pont Pharmaceuticals Company | Novel cyclic sulfonamide derivatives as metalloproteinase inhibitors |
| IL137720A0 (en) | 1998-02-18 | 2001-10-31 | Neurosearch As | Compounds and their use as positive ampa receptor modulators |
| AU755855B2 (en) * | 1998-06-16 | 2002-12-19 | Merck Sharp & Dohme Limited | Triazolo-pyridine derivatives as ligands for GABA receptors |
| WO2000023451A1 (en) | 1998-10-21 | 2000-04-27 | Novo Nordisk A/S | New compounds, their preparation and use |
| EP1182195A4 (en) | 1999-05-07 | 2003-03-26 | Takeda Chemical Industries Ltd | CYCLIC CONNECTIONS AND APPLICATIONS THEREOF |
| WO2001016263A2 (en) | 1999-08-27 | 2001-03-08 | The Procter & Gamble Company | Controlled availability of formulation components, compositions and laundry methods employing same |
| WO2001016110A1 (en) | 1999-08-27 | 2001-03-08 | The Procter & Gamble Company | Bleach boosting components, compositions and laundry methods |
| CA2382023A1 (en) | 1999-08-27 | 2001-03-08 | The Procter & Gamble Company | Stable formulation components, compositions and laundry methods employing same |
| AU6935600A (en) | 1999-08-27 | 2001-03-26 | Procter & Gamble Company, The | Color safe laundry methods employing cationic formulation components |
| CA2382119A1 (en) | 1999-08-27 | 2001-03-08 | The Procter & Gamble Company | Fast-acting formulation components, compositions and laundry methods employing same |
| EP1206518A1 (en) | 1999-08-27 | 2002-05-22 | The Procter & Gamble Company | Color safe laundry methods employing zwitterionic formulation components |
| MXPA02002124A (es) | 1999-08-27 | 2002-09-18 | Procter & Gamble | Componentes de formulacion de incremento de estabilidad y composiciones y metodos de lavanderia que emplean los mismos. |
| EP1286994A1 (en) | 2000-05-15 | 2003-03-05 | Darwin Discovery Limited | Hydroxamic and carboxylic acid derivatives having mmp and tnf inhibitory activity |
| IL154082A0 (en) | 2000-08-01 | 2003-07-31 | Ono Pharmaceutical Co | 3,4-dihydroisoquinoline derivative compounds and drugs containing these compounds as the active ingredient |
| WO2002018377A1 (en) | 2000-08-29 | 2002-03-07 | Pharmacia Corporation | Compounds containing a bicyclic ring system useful as alpha v beta 3 antagonists |
| JP2002205992A (ja) | 2000-11-08 | 2002-07-23 | Takeda Chem Ind Ltd | 二環式トリアゾロン誘導体およびそれを含有する除草剤 |
| WO2002051441A1 (fr) | 2000-12-26 | 2002-07-04 | Sankyo Company, Limited | Compositions medicinales contenant un diuretique et un agent renforçant la resistance a l'insuline |
| DE60210755T2 (de) | 2001-03-09 | 2006-11-16 | Pfizer Products Inc., Groton | Triazolopyridine als entzündungshemmende mittel |
| US6998408B2 (en) | 2001-03-23 | 2006-02-14 | Bristol-Myers Squibb Pharma Company | 6-5, 6-6, or 6-7 Heterobicycles as factor Xa inhibitors |
| US20030114448A1 (en) | 2001-05-31 | 2003-06-19 | Millennium Pharmaceuticals, Inc. | Inhibitors of factor Xa |
| JP2005089298A (ja) | 2001-09-18 | 2005-04-07 | Japan Tobacco Inc | ナフタレン化合物及びその医薬用途 |
| US7196108B2 (en) | 2002-03-08 | 2007-03-27 | Incyte San Diego Inc. | Bicyclic heterocycles for the treatment of diabetes and other diseases |
| JP2003277384A (ja) | 2002-03-26 | 2003-10-02 | Kyorin Pharmaceut Co Ltd | 縮合ニ環式ピリジン誘導体 |
| JP2003321461A (ja) | 2002-04-25 | 2003-11-11 | Kyorin Pharmaceut Co Ltd | 縮合ビフェニル誘導体 |
| JP2005539020A (ja) | 2002-08-13 | 2005-12-22 | ワーナー−ランバート カンパニー リミティド ライアビリティー カンパニー | マトリクスメタロプロテイナーゼ阻害物質としてのクロモン誘導体 |
| US7005523B2 (en) * | 2002-08-30 | 2006-02-28 | Pfizer Inc. | Cycloalkyl-[4-(trifluorophenyl)-oxazol-5yl]-triazolo-pyridines |
| JPWO2004026292A1 (ja) | 2002-09-20 | 2006-01-12 | 株式会社ツムラ | 鎮咳薬 |
| US20040204404A1 (en) | 2002-09-30 | 2004-10-14 | Robert Zelle | Human N-type calcium channel blockers |
| WO2004037192A2 (en) | 2002-10-22 | 2004-05-06 | The Trustees Of The University Of Pennsylvania | Identification of antimycobacterial targets and the inhibition thereof as a treatment for infectious diseases |
| MXPA05004890A (es) | 2002-11-07 | 2005-07-22 | Merck & Co Inc | Derivados de fenilalanina como inhibidores de dipeptidilpeptidasa para el tratamiento o prevencion de diabetes. |
| MXPA05007389A (es) | 2003-01-13 | 2006-02-10 | Cortex Pharma Inc | Metodo para el tratamiento de la deficiencia cognitiva debido a la privacion de sueno y estres. |
| AR044503A1 (es) | 2003-03-18 | 2005-09-14 | Merck & Co Inc | Triazoles sustituidos con biarilo como bloqueantes del canal de sodio |
| DE10317526A1 (de) | 2003-04-16 | 2004-11-04 | Degussa Ag | Verfahren zum Delignifizieren von ligninhaltigen Faserstoffen |
| CA2521625A1 (en) | 2003-04-17 | 2004-11-04 | Merck & Co., Inc. | Heterocyclic cyclopentyl tetrahydroisoquinoline and tetrahydropyridopyridine modulators of chemokine receptor activity |
| US20050239767A1 (en) | 2003-10-28 | 2005-10-27 | Chan Michael K | Intermolecular SNAr of the heterocycle-activated nitro and fluoro groups-application in the synthesis of polyazamacrocyclic ligands |
| WO2005060967A1 (en) | 2003-12-18 | 2005-07-07 | Pfizer Products Inc. | METHODS OF TREATING ACUTE INFLAMMATION IN ANIMALS WITH p38 MAP KINASE INHIBITORS |
| US7306631B2 (en) | 2004-03-30 | 2007-12-11 | The Procter & Gamble Company | Keratin dyeing compounds, keratin dyeing compositions containing them, and use thereof |
| GB0412986D0 (en) | 2004-06-10 | 2004-07-14 | Xention Discovery Ltd | Compounds |
| WO2006002470A1 (en) | 2004-06-30 | 2006-01-12 | Monash University | Chiral ligands for asymmetric catalysis |
| JP2006063064A (ja) | 2004-07-27 | 2006-03-09 | Takeda Chem Ind Ltd | 受容体作動剤 |
| JP2007297283A (ja) | 2004-07-28 | 2007-11-15 | Santen Pharmaceut Co Ltd | 新規桂皮酸関連化合物 |
| US7572783B2 (en) | 2004-08-13 | 2009-08-11 | Amgen Inc. | Substituted benzofused heterocycles |
| US7521457B2 (en) | 2004-08-20 | 2009-04-21 | Boehringer Ingelheim International Gmbh | Pyrimidines as PLK inhibitors |
| US7625888B2 (en) | 2004-08-23 | 2009-12-01 | Merck & Co., Inc. | Fused triazole derivatives as dipeptidyl peptidase-IV inhibitors for the treatment or prevention of diabetes |
| CN101076527B (zh) | 2004-09-13 | 2011-11-30 | 默沙东公司 | 三环酰苯胺螺乙内酰脲cgrp受体拮抗剂 |
| WO2006048727A1 (en) | 2004-11-02 | 2006-05-11 | Pfizer Products Inc. | Piperazinylphenalkyl lactam/amine ligands for the 5ht1b receptor |
| WO2006091897A2 (en) | 2005-02-25 | 2006-08-31 | Adenosine Therapeutics, Llc | Derivatives of 8-substituted xanthines |
| TW200643015A (en) | 2005-03-11 | 2006-12-16 | Akzo Nobel Nv | 2-(4-oxo-4H-quinazolin-3-yl)acetamide derivatives |
| AR056317A1 (es) | 2005-04-20 | 2007-10-03 | Xenon Pharmaceuticals Inc | Compuestos de oxindol y composicion farmaceutica |
| CN101175488B (zh) | 2005-05-17 | 2012-04-18 | 萨可德公司 | 治疗眼病的组合物和方法 |
| TW200714597A (en) | 2005-05-27 | 2007-04-16 | Astrazeneca Ab | Chemical compounds |
| US7572807B2 (en) | 2005-06-09 | 2009-08-11 | Bristol-Myers Squibb Company | Heteroaryl 11-beta-hydroxysteroid dehydrogenase type I inhibitors |
| WO2006138549A1 (en) | 2005-06-17 | 2006-12-28 | Wyeth | Tricyclic compounds useful as serotonin inhibitors and 5-ht1a agonists and antagonists |
| US7632837B2 (en) | 2005-06-17 | 2009-12-15 | Bristol-Myers Squibb Company | Bicyclic heterocycles as cannabinoid-1 receptor modulators |
| US7572808B2 (en) | 2005-06-17 | 2009-08-11 | Bristol-Myers Squibb Company | Triazolopyridine cannabinoid receptor 1 antagonists |
| WO2007004028A2 (en) | 2005-06-30 | 2007-01-11 | Ranbaxy Laboratories Limited | Processes for the preparation of penems and its intermediate |
| GB0516963D0 (en) * | 2005-08-18 | 2005-09-28 | Carbonite Corp | Liquid dispensers |
| WO2007023750A1 (ja) | 2005-08-26 | 2007-03-01 | National University Corporation University Of Toyama | 乾燥羊膜及び羊膜の乾燥処理方法 |
| JP2009508963A (ja) | 2005-09-21 | 2009-03-05 | インサイト・コーポレイション | アミド化合物および医薬組成物としてのその使用 |
| CN101309925A (zh) | 2005-09-23 | 2008-11-19 | 先灵公司 | 作为治疗药物的稠合四环类代谢型谷氨酸受体1拮抗剂 |
| WO2007047604A2 (en) | 2005-10-18 | 2007-04-26 | Elixir Pharmaceuticals, Inc. | Sirt1 inhibition |
| TW200804290A (en) | 2005-11-15 | 2008-01-16 | Astrazeneca Ab | Compounds and uses thereof |
| EP1954268B1 (en) | 2005-11-18 | 2012-09-26 | Merck Sharp & Dohme Corp. | Spirolactam bicyclic cgrp receptor antagonists |
| JP2009515972A (ja) | 2005-11-18 | 2009-04-16 | メルク エンド カムパニー インコーポレーテッド | スピロラクタムアリールcgrp受容体アンタゴニスト |
| TW200734342A (en) | 2005-12-15 | 2007-09-16 | Astrazeneca Ab | New compounds for the treatment of cardiac arrhythmias |
| KR20080082618A (ko) * | 2005-12-16 | 2008-09-11 | 알콘, 인코퍼레이티드 | Alk5 조절제를 사용한 안압의 조절 |
| US8013073B2 (en) | 2005-12-30 | 2011-09-06 | Chevron Oronite Company Llc | Method for preparing polyolefins containing vinylidine end groups using nonaromatic heterocyclic compounds |
| WO2008005338A1 (en) | 2006-06-29 | 2008-01-10 | Arena Pharmaceuticals, Inc. | Modulators of the histamine h3-receptor useful for the treatment of disorders related thereto |
| US8778977B2 (en) | 2006-06-30 | 2014-07-15 | Sunesis Pharmaceuticals, Inc. | Pyridinonyl PDK1 inhibitors |
| US20090318412A1 (en) | 2006-07-11 | 2009-12-24 | Takahiro Matsumoto | Tricyclic heterocyclic compound and use thereof |
| WO2008006540A1 (en) | 2006-07-12 | 2008-01-17 | Syngenta Participations Ag | Triazolopyridine derivatives as herbicides |
| PE20121506A1 (es) * | 2006-07-14 | 2012-11-26 | Amgen Inc | Compuestos triazolopiridinas como inhibidores de c-met |
| US8217177B2 (en) | 2006-07-14 | 2012-07-10 | Amgen Inc. | Fused heterocyclic derivatives and methods of use |
| CN101553224A (zh) * | 2006-10-06 | 2009-10-07 | 艾博特公司 | 新型咪唑并噻唑和咪唑并唑 |
| WO2008118141A2 (en) | 2006-10-17 | 2008-10-02 | Acadia Pharmaceuticals Inc. | Use of cannabinoid modulating compounds in combination with other therapeutic compounds for adjunctive therapy |
| ES2555803T3 (es) | 2006-10-23 | 2016-01-08 | Cephalon, Inc. | Fusión de derivados bicíclicos 2,4-diaminopirimidina como utilizar inhibidores ALK y c-Met |
| US8399452B2 (en) | 2006-10-28 | 2013-03-19 | Methylgene Inc. | Dibenzo[b,f][1,4]oxazepin-11-yl-N-hydroxybenzamides as HDAC inhibitors |
| US20100099676A1 (en) | 2006-11-02 | 2010-04-22 | Shionogi & Co., Ltd. | Sulfonylurea derivative capable of selectively inhibiting mmp-13 |
| JP2010514696A (ja) | 2006-12-21 | 2010-05-06 | ギリアード・パロ・アルト・インコーポレイテッド | 心血管症状の低減 |
| US8076350B2 (en) | 2006-12-22 | 2011-12-13 | Abbott Laboratories | Spirocyclic azaadamantane derivatives and methods of use |
| TW200836743A (en) | 2007-01-29 | 2008-09-16 | Xenon Pharmaceuticals Inc | Quinazolinone and fused pyrimidinone compounds and their use in treating sodium channel-mediated diseases or conditions |
| EP2131657A1 (en) | 2007-02-28 | 2009-12-16 | Merck & Co., Inc. | Substituted benzodiazepinones, benzoxazepinones and benzothiazepinones as sodium channel blockers |
| WO2008108445A1 (ja) | 2007-03-07 | 2008-09-12 | Takeda Pharmaceutical Company Limited | ベンゾオキサゼピン誘導体およびその用途 |
| GB0706072D0 (en) | 2007-03-28 | 2007-05-09 | Sterix Ltd | Compound |
| WO2008134553A1 (en) | 2007-04-26 | 2008-11-06 | Xenon Pharmaceuticals Inc. | Methods of using bicyclic compounds in treating sodium channel-mediated diseases |
| WO2008144483A2 (en) | 2007-05-18 | 2008-11-27 | Armgo Pharma, Inc. | Agents for treating disorders involving modulation of ryanodine receptors |
| WO2009005675A1 (en) | 2007-06-28 | 2009-01-08 | Abbott Laboratories | Novel triazolopyridazines |
| US20110263569A1 (en) | 2007-08-22 | 2011-10-27 | President And Fellows Of Harvard College | Ryanodine channel binders and uses thereof |
| EA201000316A1 (ru) | 2007-09-12 | 2010-10-29 | ВАЙЕТ ЭлЭлСи | Производные изохинолинила и изоиндолинила в качестве антагонистов гистаминовых рецепторов 3 подтипа |
| US8119658B2 (en) | 2007-10-01 | 2012-02-21 | Bristol-Myers Squibb Company | Triazolopyridine 11-beta hydroxysteroid dehydrogenase type I inhibitors |
| US8293763B2 (en) | 2007-12-19 | 2012-10-23 | Genentech, Inc. | 8-anilinoimidazopyridines and their use as anti-cancer and/or anti-inflammatory agents |
| EP2231669A1 (en) | 2008-01-09 | 2010-09-29 | The U.S.A. As Represented By The Secretary, Department Of Health And Human Services | Phosphodiesterase inhibitors |
| WO2009100380A1 (en) | 2008-02-06 | 2009-08-13 | Cv Therapeutics, Inc. | Use of ranolazine for treating pain |
| WO2009137499A1 (en) | 2008-05-05 | 2009-11-12 | Envivo Pharmaceuticals, Inc. | Inhibitors of histone deacetylase |
| US20110288070A1 (en) | 2008-05-05 | 2011-11-24 | ROGERS Kathryn | Methods for treating cognitive disorders using inhibitors of histone deacetylase |
| DE102008024182A1 (de) | 2008-05-19 | 2009-11-26 | Merck Patent Gmbh | Verbindungen für organische elektronische Vorrichtung |
| KR101695501B1 (ko) | 2008-06-17 | 2017-01-11 | 아스트라제네카 아베 | 피리딘 화합물 |
| JP2011527708A (ja) | 2008-07-11 | 2011-11-04 | ニュメディックス | 減少した抗菌活性および神経保護作用の利点を有するテトラサイクリン誘導体 |
| JP5303561B2 (ja) | 2008-08-12 | 2013-10-02 | 日本曹達株式会社 | 含窒素ヘテロ環誘導体および農園芸用殺菌剤 |
| CA2734449A1 (en) | 2008-08-18 | 2010-02-25 | Ube Industries, Ltd. | Methods for preparing fluoroalkyl arylsulfinyl compounds and fluorinated compounds thereto |
| US20100056536A1 (en) | 2008-09-04 | 2010-03-04 | Charles Antzelevitch | Method of treating atrial fibrillation |
| US20100113461A1 (en) | 2008-10-29 | 2010-05-06 | Gilead Palo Alto, Inc. | Substituted heterocyclic compounds |
| US8389500B2 (en) | 2008-10-30 | 2013-03-05 | Gilead Sciences, Inc. | Fused heterocyclic compounds as ion channel modulators |
| RU2016116516A (ru) | 2008-12-08 | 2018-12-07 | Мандифарма Интернэшнл Корпорейшн Лимитед | Композиции ингибиторов тирозинкиназных рецепторов белков |
| AU2009333543A1 (en) | 2008-12-08 | 2011-07-07 | Sirtris Pharmaceuticals, Inc. | Isoindolinone and related analogs as sirtuin modulators |
| FR2943342B1 (fr) | 2009-03-20 | 2011-03-04 | Servier Lab | Nouveaux derives de benzothiadiazepines,leur procede de preparation et les compositions pharmaceutiques qui les contiennent. |
| CA2755658A1 (en) | 2009-03-27 | 2010-09-30 | Presidio Pharmaceuticals, Inc. | Fused ring inhibitors of hepatitis c |
| WO2010118208A1 (en) | 2009-04-09 | 2010-10-14 | Exelixis, Inc. | Benzoxazepin-4- (5h) -yl derivatives and their use to treat cancer |
| ME02847B (me) | 2009-07-27 | 2018-01-20 | Gilead Sciences Inc | Fuzionisana heterociklična jedinjenja kao modulatori jonskih kanala |
| EP2845592A1 (en) | 2009-09-28 | 2015-03-11 | F. Hoffmann-La Roche AG | Benzoxazepin PI3K inhibitor compounds and methods of use |
| CN104530079B (zh) | 2009-12-18 | 2017-10-20 | 北京凯因科技股份有限公司 | C型肝炎病毒复制的新型抑制剂 |
| TWI508726B (zh) | 2009-12-21 | 2015-11-21 | Gilead Sciences Inc | 治療心房纖維性顫動之方法 |
| EA026385B9 (ru) | 2010-07-02 | 2017-08-31 | Джилид Сайэнс, Инк. | Конденсированные гетероциклические соединения в качестве модуляторов ионных каналов |
| WO2012019071A1 (en) | 2010-08-06 | 2012-02-09 | The Trustees Of Columbia University In The City Of New York | Methods of preventing and treating sarcopenia |
| WO2012019076A1 (en) | 2010-08-06 | 2012-02-09 | The Trustees Of Columbia University In The City Of New York | Compositions and methods for preventing and treating cardiac ischemia/reperfusion injury |
| WO2012037105A1 (en) | 2010-09-14 | 2012-03-22 | The Trustees Of Columbia University In The City Of New York | Methods of treating, ameliorating or preventing stress-induced neuronal disorders and diseases |
| WO2012050918A2 (en) | 2010-09-29 | 2012-04-19 | Presidio Pharmaceutical, Inc. | Tricyclic fused ring inhibitors of hepatitis c |
| EP2643316A2 (en) | 2010-11-24 | 2013-10-02 | Exelixis, Inc. | Benzoxazepines as inhibitors of p13k/mtor and methods of their use and manufacture |
| JP5934787B2 (ja) | 2011-05-10 | 2016-06-15 | ギリアード サイエンシーズ, インコーポレイテッド | イオンチャネルモジュレーターとしての縮合複素環式化合物 |
| NO3175985T3 (zh) | 2011-07-01 | 2018-04-28 | ||
| UY34171A (es) | 2011-07-01 | 2013-01-31 | Gilead Sciences Inc | Compuestos heterocíclicos fusionados como moduladores del canal iónico |
| JP2015504923A (ja) | 2012-01-27 | 2015-02-16 | ギリアード サイエンシーズ, インコーポレイテッド | 後期ナトリウムイオンチャネル遮断剤およびカリウムイオンチャネル遮断剤を使用する併用療法 |
-
2010
- 2010-07-26 ME MEP-2017-235A patent/ME02847B/me unknown
- 2010-07-26 EA EA201290121A patent/EA025824B1/ru unknown
- 2010-07-26 WO PCT/US2010/043264 patent/WO2011014462A1/en active Application Filing
- 2010-07-26 ES ES10737724.4T patent/ES2642586T3/es active Active
- 2010-07-26 AU AU2010276537A patent/AU2010276537B2/en active Active
- 2010-07-26 NZ NZ598942A patent/NZ598942A/en active Application Filing
- 2010-07-26 SI SI201031540T patent/SI2464645T1/sl unknown
- 2010-07-26 RS RS20170990A patent/RS56410B1/sr unknown
- 2010-07-26 LT LTEP10737724.4T patent/LT2464645T/lt unknown
- 2010-07-26 DK DK10737724.4T patent/DK2464645T3/en active
- 2010-07-26 EP EP10737724.4A patent/EP2464645B1/en active Active
- 2010-07-26 CA CA2774715A patent/CA2774715C/en active Active
- 2010-07-26 PL PL10737724T patent/PL2464645T3/pl unknown
- 2010-07-26 CN CN201080043104.0A patent/CN102725290B/zh active Active
- 2010-07-26 US US12/843,702 patent/US8952034B2/en active Active
- 2010-07-26 HU HUE10737724A patent/HUE034911T2/hu unknown
- 2010-07-26 PT PT107377244T patent/PT2464645T/pt unknown
- 2010-07-27 TW TW104112388A patent/TWI542587B/zh active
- 2010-07-27 TW TW099124710A patent/TWI490217B/zh active
- 2010-07-27 UY UY0001032805A patent/UY32805A/es not_active Application Discontinuation
- 2010-07-27 AR ARP100102716A patent/AR077598A1/es not_active Application Discontinuation
-
2014
- 2014-05-09 US US14/274,422 patent/US9371329B2/en active Active
-
2017
- 2017-09-28 HR HRP20171454TT patent/HRP20171454T8/hr unknown
- 2017-10-04 CY CY20171101028T patent/CY1119584T1/el unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2004020440A1 (en) * | 2002-08-30 | 2004-03-11 | Pfizer Products Inc. | Di and trifluoro-triazolo-pyridines anti-inflammatory compounds |
| WO2004096767A1 (en) * | 2003-04-25 | 2004-11-11 | H. Lundbeck A/S | Sustituted indoline and indole derivatives |
| WO2005002520A2 (en) * | 2003-07-01 | 2005-01-13 | Merck & Co., Inc. | Ophthalmic compositions for treating ocular hypertension |
| WO2005014558A1 (en) * | 2003-08-05 | 2005-02-17 | Vertex Pharmaceuticals Incorporated | Condensed pyramidine compounds as inhibitors of voltage-gated ion channels |
| WO2007113226A1 (en) * | 2006-03-31 | 2007-10-11 | Novartis Ag | Organic compounds |
| WO2007146284A2 (en) * | 2006-06-12 | 2007-12-21 | Vertex Pharmaceuticals Incorporated | Thienopyrimidines useful as modulators of ion channels |
Cited By (8)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN105263490A (zh) * | 2013-03-14 | 2016-01-20 | 基因泰克公司 | 取代的三唑并吡啶及其使用方法 |
| CN105263490B (zh) * | 2013-03-14 | 2018-05-22 | 基因泰克公司 | 取代的三唑并吡啶及其使用方法 |
| CN105814058A (zh) * | 2013-12-09 | 2016-07-27 | Ucb生物制药私人有限公司 | 用作tnf活性调节剂的三唑并哒嗪衍生物 |
| CN105814058B (zh) * | 2013-12-09 | 2018-11-23 | Ucb生物制药私人有限公司 | 用作tnf活性调节剂的三唑并哒嗪衍生物 |
| CN105980380A (zh) * | 2014-02-13 | 2016-09-28 | 吉利德科学公司 | 离子通道调节剂的固体形式 |
| CN113573713A (zh) * | 2018-09-28 | 2021-10-29 | 普拉克西斯精密药物股份有限公司 | 离子通道调节剂 |
| CN114980899A (zh) * | 2019-11-26 | 2022-08-30 | 普拉西斯精密医药公司 | 离子通道调节剂 |
| CN115768757A (zh) * | 2019-12-19 | 2023-03-07 | 美利坚合众国,由健康及人类服务部部长代表 | Cd206调节剂及其用途和制备方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| TW201116528A (en) | 2011-05-16 |
| AR077598A1 (es) | 2011-09-07 |
| TWI542587B (zh) | 2016-07-21 |
| EP2464645B1 (en) | 2017-07-05 |
| TW201542545A (zh) | 2015-11-16 |
| NZ598942A (en) | 2014-02-28 |
| AU2010276537B2 (en) | 2015-04-16 |
| US20140303158A1 (en) | 2014-10-09 |
| UY32805A (es) | 2011-02-28 |
| AU2010276537A1 (en) | 2012-05-24 |
| CA2774715C (en) | 2018-04-03 |
| DK2464645T3 (en) | 2017-10-23 |
| HUE034911T2 (hu) | 2018-03-28 |
| TWI490217B (zh) | 2015-07-01 |
| CA2774715A1 (en) | 2011-02-03 |
| HRP20171454T1 (hr) | 2017-12-01 |
| US8952034B2 (en) | 2015-02-10 |
| EA025824B1 (ru) | 2017-02-28 |
| ES2642586T3 (es) | 2017-11-16 |
| US20110021521A1 (en) | 2011-01-27 |
| ME02847B (me) | 2018-01-20 |
| PL2464645T3 (pl) | 2017-12-29 |
| US9371329B2 (en) | 2016-06-21 |
| CY1119584T1 (el) | 2018-03-07 |
| PT2464645T (pt) | 2017-10-11 |
| WO2011014462A1 (en) | 2011-02-03 |
| CN102725290B (zh) | 2016-03-09 |
| LT2464645T (lt) | 2017-10-25 |
| RS56410B1 (sr) | 2018-01-31 |
| SI2464645T1 (sl) | 2017-10-30 |
| EA201290121A1 (ru) | 2012-10-30 |
| HRP20171454T8 (hr) | 2018-01-12 |
| EP2464645A1 (en) | 2012-06-20 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102725290A (zh) | 作为离子通道调节剂的稠合杂环化合物 | |
| KR101911560B1 (ko) | 이온 채널 조정제로서의 융합된 헤테로시클릭 화합물 | |
| EP2707361B1 (en) | Fused heterocyclic compounds as sodium channel modulators | |
| TWI466873B (zh) | 作為離子通道調節劑之稠合雜環化合物 | |
| EP3083608B1 (en) | Fused heterocyclic compounds as ion channel modulators | |
| TW201020239A (en) | Substituted heterocyclic compounds | |
| TW201028382A (en) | Fused heterocyclic compounds as ion channel modulators | |
| AU2015224425B2 (en) | Fused benzoxazepinones as ion channel modulators | |
| EP3092234A1 (en) | Fused heterocyclic compounds as ion channel modulators | |
| OA20251A (en) | Fused benzoxazepinones as ion channel modulators |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant |