CN102459583A - 凝血酶原复合体组合物 - Google Patents
凝血酶原复合体组合物 Download PDFInfo
- Publication number
- CN102459583A CN102459583A CN2010800250346A CN201080025034A CN102459583A CN 102459583 A CN102459583 A CN 102459583A CN 2010800250346 A CN2010800250346 A CN 2010800250346A CN 201080025034 A CN201080025034 A CN 201080025034A CN 102459583 A CN102459583 A CN 102459583A
- Authority
- CN
- China
- Prior art keywords
- protein
- factor
- eluate
- compsn
- concentration
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 239000000203 mixture Substances 0.000 title claims abstract description 24
- 102000004169 proteins and genes Human genes 0.000 claims abstract description 94
- 108090000623 proteins and genes Proteins 0.000 claims abstract description 94
- 238000000034 method Methods 0.000 claims abstract description 83
- XYJRXVWERLGGKC-UHFFFAOYSA-D pentacalcium;hydroxide;triphosphate Chemical compound [OH-].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O XYJRXVWERLGGKC-UHFFFAOYSA-D 0.000 claims abstract description 66
- 239000006228 supernatant Substances 0.000 claims abstract description 30
- 229910052588 hydroxylapatite Inorganic materials 0.000 claims abstract description 19
- 108010094028 Prothrombin Proteins 0.000 claims description 71
- 238000001728 nano-filtration Methods 0.000 claims description 42
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 claims description 40
- 230000000694 effects Effects 0.000 claims description 38
- AGVAZMGAQJOSFJ-WZHZPDAFSA-M cobalt(2+);[(2r,3s,4r,5s)-5-(5,6-dimethylbenzimidazol-1-yl)-4-hydroxy-2-(hydroxymethyl)oxolan-3-yl] [(2r)-1-[3-[(1r,2r,3r,4z,7s,9z,12s,13s,14z,17s,18s,19r)-2,13,18-tris(2-amino-2-oxoethyl)-7,12,17-tris(3-amino-3-oxopropyl)-3,5,8,8,13,15,18,19-octamethyl-2 Chemical compound [Co+2].N#[C-].[N-]([C@@H]1[C@H](CC(N)=O)[C@@]2(C)CCC(=O)NC[C@@H](C)OP(O)(=O)O[C@H]3[C@H]([C@H](O[C@@H]3CO)N3C4=CC(C)=C(C)C=C4N=C3)O)\C2=C(C)/C([C@H](C\2(C)C)CCC(N)=O)=N/C/2=C\C([C@H]([C@@]/2(CC(N)=O)C)CCC(N)=O)=N\C\2=C(C)/C2=N[C@]1(C)[C@@](C)(CC(N)=O)[C@@H]2CCC(N)=O AGVAZMGAQJOSFJ-WZHZPDAFSA-M 0.000 claims description 37
- 239000011347 resin Substances 0.000 claims description 36
- 229920005989 resin Polymers 0.000 claims description 36
- 108010014173 Factor X Proteins 0.000 claims description 34
- 102100027378 Prothrombin Human genes 0.000 claims description 33
- 241000700605 Viruses Species 0.000 claims description 33
- 229940039716 prothrombin Drugs 0.000 claims description 33
- 108010023321 Factor VII Proteins 0.000 claims description 31
- 229940046010 vitamin k Drugs 0.000 claims description 31
- 229930003448 Vitamin K Natural products 0.000 claims description 28
- SHUZOJHMOBOZST-UHFFFAOYSA-N phylloquinone Natural products CC(C)CCCCC(C)CCC(C)CCCC(=CCC1=C(C)C(=O)c2ccccc2C1=O)C SHUZOJHMOBOZST-UHFFFAOYSA-N 0.000 claims description 28
- 235000019168 vitamin K Nutrition 0.000 claims description 28
- 239000011712 vitamin K Substances 0.000 claims description 28
- 150000003721 vitamin K derivatives Chemical class 0.000 claims description 28
- 230000002779 inactivation Effects 0.000 claims description 25
- 229940012426 factor x Drugs 0.000 claims description 22
- 238000002360 preparation method Methods 0.000 claims description 22
- 239000011780 sodium chloride Substances 0.000 claims description 20
- 102100023804 Coagulation factor VII Human genes 0.000 claims description 19
- 229940122388 Thrombin inhibitor Drugs 0.000 claims description 19
- 229940012413 factor vii Drugs 0.000 claims description 19
- 239000003868 thrombin inhibitor Substances 0.000 claims description 19
- 239000012530 fluid Substances 0.000 claims description 18
- 210000002381 plasma Anatomy 0.000 claims description 18
- 238000013016 damping Methods 0.000 claims description 17
- HTTJABKRGRZYRN-UHFFFAOYSA-N Heparin Chemical compound OC1C(NC(=O)C)C(O)OC(COS(O)(=O)=O)C1OC1C(OS(O)(=O)=O)C(O)C(OC2C(C(OS(O)(=O)=O)C(OC3C(C(O)C(O)C(O3)C(O)=O)OS(O)(=O)=O)C(CO)O2)NS(O)(=O)=O)C(C(O)=O)O1 HTTJABKRGRZYRN-UHFFFAOYSA-N 0.000 claims description 15
- 229960002897 heparin Drugs 0.000 claims description 15
- 229920000669 heparin Polymers 0.000 claims description 15
- 238000000108 ultra-filtration Methods 0.000 claims description 15
- 238000005406 washing Methods 0.000 claims description 15
- 201000002282 venous insufficiency Diseases 0.000 claims description 14
- 239000003795 chemical substances by application Substances 0.000 claims description 13
- 108010025221 plasma protein Z Proteins 0.000 claims description 13
- 101000712605 Theromyzon tessulatum Theromin Proteins 0.000 claims description 12
- 101800004937 Protein C Proteins 0.000 claims description 11
- 102000017975 Protein C Human genes 0.000 claims description 11
- 229940096437 Protein S Drugs 0.000 claims description 11
- 101800001700 Saposin-D Proteins 0.000 claims description 11
- 229960000856 protein c Drugs 0.000 claims description 11
- 239000003814 drug Substances 0.000 claims description 9
- 108010049003 Fibrinogen Proteins 0.000 claims description 8
- 102000008946 Fibrinogen Human genes 0.000 claims description 8
- 108010067306 Fibronectins Proteins 0.000 claims description 8
- 229940012952 fibrinogen Drugs 0.000 claims description 8
- 229920000136 polysorbate Polymers 0.000 claims description 8
- 239000008057 potassium phosphate buffer Substances 0.000 claims description 7
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 claims description 6
- 230000000295 complement effect Effects 0.000 claims description 6
- 230000002008 hemorrhagic effect Effects 0.000 claims description 6
- 239000000244 polyoxyethylene sorbitan monooleate Substances 0.000 claims description 6
- 235000010482 polyoxyethylene sorbitan monooleate Nutrition 0.000 claims description 6
- 229920000053 polysorbate 80 Polymers 0.000 claims description 6
- 229940068968 polysorbate 80 Drugs 0.000 claims description 6
- 229950008882 polysorbate Drugs 0.000 claims description 5
- WIHIUTUAHOZVLE-UHFFFAOYSA-N 1,3-diethoxypropan-2-ol Chemical group CCOCC(O)COCC WIHIUTUAHOZVLE-UHFFFAOYSA-N 0.000 claims description 3
- OTMSDBZUPAUEDD-UHFFFAOYSA-N Ethane Chemical compound CC OTMSDBZUPAUEDD-UHFFFAOYSA-N 0.000 claims description 3
- 108010066124 Protein S Proteins 0.000 claims description 3
- 102000029301 Protein S Human genes 0.000 claims description 3
- 239000002671 adjuvant Substances 0.000 claims description 3
- 239000003698 antivitamin K Substances 0.000 claims description 3
- 238000004108 freeze drying Methods 0.000 claims description 3
- 230000002265 prevention Effects 0.000 claims description 3
- 150000001450 anions Chemical group 0.000 claims description 2
- 239000001488 sodium phosphate Substances 0.000 claims description 2
- 229910000162 sodium phosphate Inorganic materials 0.000 claims description 2
- RYFMWSXOAZQYPI-UHFFFAOYSA-K trisodium phosphate Chemical compound [Na+].[Na+].[Na+].[O-]P([O-])([O-])=O RYFMWSXOAZQYPI-UHFFFAOYSA-K 0.000 claims description 2
- 102100037362 Fibronectin Human genes 0.000 claims 1
- 239000003937 drug carrier Substances 0.000 claims 1
- 239000012141 concentrate Substances 0.000 abstract description 14
- 108010039209 Blood Coagulation Factors Proteins 0.000 abstract description 3
- 102000015081 Blood Coagulation Factors Human genes 0.000 abstract description 3
- 239000003114 blood coagulation factor Substances 0.000 abstract description 3
- 239000003957 anion exchange resin Substances 0.000 abstract 1
- 238000004587 chromatography analysis Methods 0.000 description 37
- 239000000463 material Substances 0.000 description 36
- 108090000190 Thrombin Proteins 0.000 description 35
- 238000012360 testing method Methods 0.000 description 35
- 229960004072 thrombin Drugs 0.000 description 35
- 239000000499 gel Substances 0.000 description 26
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 21
- 238000001914 filtration Methods 0.000 description 21
- 230000008569 process Effects 0.000 description 18
- 108010012557 prothrombin complex concentrates Proteins 0.000 description 18
- 229920005654 Sephadex Polymers 0.000 description 15
- 239000012507 Sephadex™ Substances 0.000 description 15
- 230000000875 corresponding effect Effects 0.000 description 14
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 14
- 108010076282 Factor IX Proteins 0.000 description 13
- 238000000746 purification Methods 0.000 description 13
- 239000000047 product Substances 0.000 description 12
- 238000000502 dialysis Methods 0.000 description 11
- 239000000243 solution Substances 0.000 description 11
- -1 Tegeline Proteins 0.000 description 8
- 239000000872 buffer Substances 0.000 description 8
- 239000001509 sodium citrate Substances 0.000 description 8
- STCOOQWBFONSKY-UHFFFAOYSA-N tributyl phosphate Chemical compound CCCCOP(=O)(OCCCC)OCCCC STCOOQWBFONSKY-UHFFFAOYSA-N 0.000 description 8
- HRXKRNGNAMMEHJ-UHFFFAOYSA-K trisodium citrate Chemical compound [Na+].[Na+].[Na+].[O-]C(=O)CC(O)(CC([O-])=O)C([O-])=O HRXKRNGNAMMEHJ-UHFFFAOYSA-K 0.000 description 8
- 235000019263 trisodium citrate Nutrition 0.000 description 8
- 102000016359 Fibronectins Human genes 0.000 description 7
- 239000004019 antithrombin Substances 0.000 description 7
- 239000000919 ceramic Substances 0.000 description 7
- 229910000160 potassium phosphate Inorganic materials 0.000 description 7
- 229940093916 potassium phosphate Drugs 0.000 description 7
- 235000011009 potassium phosphates Nutrition 0.000 description 7
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 7
- 235000011121 sodium hydroxide Nutrition 0.000 description 7
- 229940038773 trisodium citrate Drugs 0.000 description 7
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 6
- 229930195725 Mannitol Natural products 0.000 description 6
- 108010064129 Thrombogen Proteins 0.000 description 6
- PXXJHWLDUBFPOL-UHFFFAOYSA-N benzamidine Chemical compound NC(=N)C1=CC=CC=C1 PXXJHWLDUBFPOL-UHFFFAOYSA-N 0.000 description 6
- 230000008859 change Effects 0.000 description 6
- 238000011210 chromatographic step Methods 0.000 description 6
- 239000000594 mannitol Substances 0.000 description 6
- 235000010355 mannitol Nutrition 0.000 description 6
- ODKSFYDXXFIFQN-BYPYZUCNSA-N L-arginine Chemical compound OC(=O)[C@@H](N)CCCN=C(N)N ODKSFYDXXFIFQN-BYPYZUCNSA-N 0.000 description 5
- 239000003599 detergent Substances 0.000 description 5
- LOKCTEFSRHRXRJ-UHFFFAOYSA-I dipotassium trisodium dihydrogen phosphate hydrogen phosphate dichloride Chemical compound P(=O)(O)(O)[O-].[K+].P(=O)(O)([O-])[O-].[Na+].[Na+].[Cl-].[K+].[Cl-].[Na+] LOKCTEFSRHRXRJ-UHFFFAOYSA-I 0.000 description 5
- 238000002474 experimental method Methods 0.000 description 5
- 239000002953 phosphate buffered saline Substances 0.000 description 5
- 238000012545 processing Methods 0.000 description 5
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 4
- 239000001506 calcium phosphate Substances 0.000 description 4
- 239000012466 permeate Substances 0.000 description 4
- 238000000926 separation method Methods 0.000 description 4
- 239000000741 silica gel Substances 0.000 description 4
- 229910002027 silica gel Inorganic materials 0.000 description 4
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 4
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Chemical compound O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 4
- 239000008215 water for injection Substances 0.000 description 4
- 229920002271 DEAE-Sepharose Polymers 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- XUYPXLNMDZIRQH-LURJTMIESA-N N-acetyl-L-methionine Chemical compound CSCC[C@@H](C(O)=O)NC(C)=O XUYPXLNMDZIRQH-LURJTMIESA-N 0.000 description 3
- 238000010521 absorption reaction Methods 0.000 description 3
- BFNBIHQBYMNNAN-UHFFFAOYSA-N ammonium sulfate Chemical compound N.N.OS(O)(=O)=O BFNBIHQBYMNNAN-UHFFFAOYSA-N 0.000 description 3
- 229910052921 ammonium sulfate Inorganic materials 0.000 description 3
- 235000011130 ammonium sulphate Nutrition 0.000 description 3
- 238000004364 calculation method Methods 0.000 description 3
- 239000003593 chromogenic compound Substances 0.000 description 3
- 230000001419 dependent effect Effects 0.000 description 3
- 238000001962 electrophoresis Methods 0.000 description 3
- 239000012149 elution buffer Substances 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 238000011049 filling Methods 0.000 description 3
- 238000003119 immunoblot Methods 0.000 description 3
- 238000007689 inspection Methods 0.000 description 3
- 229930182817 methionine Natural products 0.000 description 3
- 244000309711 non-enveloped viruses Species 0.000 description 3
- 150000003016 phosphoric acids Chemical class 0.000 description 3
- 238000001179 sorption measurement Methods 0.000 description 3
- 239000002512 suppressor factor Substances 0.000 description 3
- 229910000391 tricalcium phosphate Inorganic materials 0.000 description 3
- 235000019731 tricalcium phosphate Nutrition 0.000 description 3
- 229940078499 tricalcium phosphate Drugs 0.000 description 3
- 230000003612 virological effect Effects 0.000 description 3
- KWTQSFXGGICVPE-WCCKRBBISA-N Arginine hydrochloride Chemical compound Cl.OC(=O)[C@@H](N)CCCN=C(N)N KWTQSFXGGICVPE-WCCKRBBISA-N 0.000 description 2
- 102000004506 Blood Proteins Human genes 0.000 description 2
- 108010017384 Blood Proteins Proteins 0.000 description 2
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 2
- NTYJJOPFIAHURM-UHFFFAOYSA-N Histamine Chemical compound NCCC1=CN=CN1 NTYJJOPFIAHURM-UHFFFAOYSA-N 0.000 description 2
- BVHLGVCQOALMSV-JEDNCBNOSA-N L-lysine hydrochloride Chemical compound Cl.NCCCC[C@H](N)C(O)=O BVHLGVCQOALMSV-JEDNCBNOSA-N 0.000 description 2
- 108091005804 Peptidases Proteins 0.000 description 2
- 239000004365 Protease Substances 0.000 description 2
- 102100037486 Reverse transcriptase/ribonuclease H Human genes 0.000 description 2
- 108091005605 Vitamin K-dependent proteins Proteins 0.000 description 2
- 230000004913 activation Effects 0.000 description 2
- 238000004458 analytical method Methods 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- 239000008280 blood Substances 0.000 description 2
- 239000007795 chemical reaction product Substances 0.000 description 2
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 229960004222 factor ix Drugs 0.000 description 2
- 239000000835 fiber Substances 0.000 description 2
- 239000012634 fragment Substances 0.000 description 2
- 239000013067 intermediate product Substances 0.000 description 2
- 239000007788 liquid Substances 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 239000000843 powder Substances 0.000 description 2
- 235000019419 proteases Nutrition 0.000 description 2
- 238000010926 purge Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 230000000717 retained effect Effects 0.000 description 2
- 230000009291 secondary effect Effects 0.000 description 2
- 239000002904 solvent Substances 0.000 description 2
- 238000003756 stirring Methods 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- YDMBNDUHUNWWRP-VJBWXMMDSA-N (2s)-1-[(2r)-2-amino-3-phenylpropanoyl]-n-[(2s)-5-(diaminomethylideneamino)-1-(4-nitroanilino)-1-oxopentan-2-yl]piperidine-2-carboxamide Chemical compound C([C@@H](N)C(=O)N1[C@@H](CCCC1)C(=O)N[C@@H](CCCN=C(N)N)C(=O)NC=1C=CC(=CC=1)[N+]([O-])=O)C1=CC=CC=C1 YDMBNDUHUNWWRP-VJBWXMMDSA-N 0.000 description 1
- NWUYHJFMYQTDRP-UHFFFAOYSA-N 1,2-bis(ethenyl)benzene;1-ethenyl-2-ethylbenzene;styrene Chemical compound C=CC1=CC=CC=C1.CCC1=CC=CC=C1C=C.C=CC1=CC=CC=C1C=C NWUYHJFMYQTDRP-UHFFFAOYSA-N 0.000 description 1
- QFVHZQCOUORWEI-UHFFFAOYSA-N 4-[(4-anilino-5-sulfonaphthalen-1-yl)diazenyl]-5-hydroxynaphthalene-2,7-disulfonic acid Chemical compound C=12C(O)=CC(S(O)(=O)=O)=CC2=CC(S(O)(=O)=O)=CC=1N=NC(C1=CC=CC(=C11)S(O)(=O)=O)=CC=C1NC1=CC=CC=C1 QFVHZQCOUORWEI-UHFFFAOYSA-N 0.000 description 1
- 206010002199 Anaphylactic shock Diseases 0.000 description 1
- 206010006482 Bronchospasm Diseases 0.000 description 1
- 102100037084 C4b-binding protein alpha chain Human genes 0.000 description 1
- 101710159767 C4b-binding protein alpha chain Proteins 0.000 description 1
- BHPQYMZQTOCNFJ-UHFFFAOYSA-N Calcium cation Chemical compound [Ca+2] BHPQYMZQTOCNFJ-UHFFFAOYSA-N 0.000 description 1
- 241001146702 Candidatus Entotheonella factor Species 0.000 description 1
- 102100022641 Coagulation factor IX Human genes 0.000 description 1
- 102000000989 Complement System Proteins Human genes 0.000 description 1
- 108010069112 Complement System Proteins Proteins 0.000 description 1
- 102100031673 Corneodesmosin Human genes 0.000 description 1
- 101710139375 Corneodesmosin Proteins 0.000 description 1
- 238000002965 ELISA Methods 0.000 description 1
- 241000991587 Enterovirus C Species 0.000 description 1
- 108010080865 Factor XII Proteins 0.000 description 1
- 208000032843 Hemorrhage Diseases 0.000 description 1
- 108060003951 Immunoglobulin Proteins 0.000 description 1
- 206010061218 Inflammation Diseases 0.000 description 1
- 208000022120 Jeavons syndrome Diseases 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 102000003992 Peroxidases Human genes 0.000 description 1
- 241000125945 Protoparvovirus Species 0.000 description 1
- 108010039286 S 2238 Proteins 0.000 description 1
- 229910000831 Steel Inorganic materials 0.000 description 1
- 229920004890 Triton X-100 Polymers 0.000 description 1
- NNLVGZFZQQXQNW-ADJNRHBOSA-N [(2r,3r,4s,5r,6s)-4,5-diacetyloxy-3-[(2s,3r,4s,5r,6r)-3,4,5-triacetyloxy-6-(acetyloxymethyl)oxan-2-yl]oxy-6-[(2r,3r,4s,5r,6s)-4,5,6-triacetyloxy-2-(acetyloxymethyl)oxan-3-yl]oxyoxan-2-yl]methyl acetate Chemical compound O([C@@H]1O[C@@H]([C@H]([C@H](OC(C)=O)[C@H]1OC(C)=O)O[C@H]1[C@@H]([C@@H](OC(C)=O)[C@H](OC(C)=O)[C@@H](COC(C)=O)O1)OC(C)=O)COC(=O)C)[C@@H]1[C@@H](COC(C)=O)O[C@@H](OC(C)=O)[C@H](OC(C)=O)[C@H]1OC(C)=O NNLVGZFZQQXQNW-ADJNRHBOSA-N 0.000 description 1
- DPDMMXDBJGCCQC-UHFFFAOYSA-N [Na].[Cl] Chemical compound [Na].[Cl] DPDMMXDBJGCCQC-UHFFFAOYSA-N 0.000 description 1
- 208000003455 anaphylaxis Diseases 0.000 description 1
- 125000000129 anionic group Chemical group 0.000 description 1
- 239000000427 antigen Substances 0.000 description 1
- 108091007433 antigens Proteins 0.000 description 1
- 102000036639 antigens Human genes 0.000 description 1
- 238000003556 assay Methods 0.000 description 1
- 229940089003 atryn Drugs 0.000 description 1
- 229940126587 biotherapeutics Drugs 0.000 description 1
- 210000004369 blood Anatomy 0.000 description 1
- 230000007885 bronchoconstriction Effects 0.000 description 1
- 230000002308 calcification Effects 0.000 description 1
- 229910001424 calcium ion Inorganic materials 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 230000004856 capillary permeability Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 238000006243 chemical reaction Methods 0.000 description 1
- 229940099352 cholate Drugs 0.000 description 1
- BHQCQFFYRZLCQQ-OELDTZBJSA-N cholic acid Chemical compound C([C@H]1C[C@H]2O)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 BHQCQFFYRZLCQQ-OELDTZBJSA-N 0.000 description 1
- 239000007979 citrate buffer Substances 0.000 description 1
- 238000005352 clarification Methods 0.000 description 1
- 230000015271 coagulation Effects 0.000 description 1
- 238000005345 coagulation Methods 0.000 description 1
- 239000000084 colloidal system Substances 0.000 description 1
- 230000004154 complement system Effects 0.000 description 1
- 230000006835 compression Effects 0.000 description 1
- 238000007906 compression Methods 0.000 description 1
- 230000001276 controlling effect Effects 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000009849 deactivation Effects 0.000 description 1
- 230000007812 deficiency Effects 0.000 description 1
- 238000010612 desalination reaction Methods 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 238000010790 dilution Methods 0.000 description 1
- 239000012895 dilution Substances 0.000 description 1
- 230000008034 disappearance Effects 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 238000011067 equilibration Methods 0.000 description 1
- 230000001723 fibrinogenic effect Effects 0.000 description 1
- 238000012061 filter integrity test Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 229960001340 histamine Drugs 0.000 description 1
- 210000003630 histaminocyte Anatomy 0.000 description 1
- 230000036571 hydration Effects 0.000 description 1
- 238000006703 hydration reaction Methods 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 102000018358 immunoglobulin Human genes 0.000 description 1
- 238000011534 incubation Methods 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 208000015181 infectious disease Diseases 0.000 description 1
- 230000002458 infectious effect Effects 0.000 description 1
- 230000002757 inflammatory effect Effects 0.000 description 1
- 230000004054 inflammatory process Effects 0.000 description 1
- 239000003112 inhibitor Substances 0.000 description 1
- 230000005764 inhibitory process Effects 0.000 description 1
- 229910052500 inorganic mineral Inorganic materials 0.000 description 1
- 238000005342 ion exchange Methods 0.000 description 1
- 238000004255 ion exchange chromatography Methods 0.000 description 1
- 239000003456 ion exchange resin Substances 0.000 description 1
- 229920003303 ion-exchange polymer Polymers 0.000 description 1
- 238000002372 labelling Methods 0.000 description 1
- 150000002617 leukotrienes Chemical class 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 238000005259 measurement Methods 0.000 description 1
- 235000010755 mineral Nutrition 0.000 description 1
- 239000011707 mineral Substances 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 230000003287 optical effect Effects 0.000 description 1
- 239000002245 particle Substances 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 108040007629 peroxidase activity proteins Proteins 0.000 description 1
- NBIIXXVUZAFLBC-UHFFFAOYSA-K phosphate Chemical compound [O-]P([O-])([O-])=O NBIIXXVUZAFLBC-UHFFFAOYSA-K 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 229920002492 poly(sulfone) Polymers 0.000 description 1
- 239000002243 precursor Substances 0.000 description 1
- 238000003825 pressing Methods 0.000 description 1
- 238000002203 pretreatment Methods 0.000 description 1
- 230000003449 preventive effect Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 238000001742 protein purification Methods 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 238000011084 recovery Methods 0.000 description 1
- 238000004064 recycling Methods 0.000 description 1
- 230000009467 reduction Effects 0.000 description 1
- 230000001172 regenerating effect Effects 0.000 description 1
- 230000008929 regeneration Effects 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 231100000916 relative toxicity Toxicity 0.000 description 1
- 238000011160 research Methods 0.000 description 1
- 239000012465 retentate Substances 0.000 description 1
- 229920006395 saturated elastomer Polymers 0.000 description 1
- 229940083608 sodium hydroxide Drugs 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 239000010959 steel Substances 0.000 description 1
- 239000000126 substance Substances 0.000 description 1
- 238000010257 thawing Methods 0.000 description 1
- 229960003766 thrombin (human) Drugs 0.000 description 1
- 230000036962 time dependent Effects 0.000 description 1
- 230000001196 vasorelaxation Effects 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K1/00—General methods for the preparation of peptides, i.e. processes for the organic chemical preparation of peptides or proteins of any length
- C07K1/14—Extraction; Separation; Purification
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/644—Coagulation factor IXa (3.4.21.22)
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/04—Antihaemorrhagics; Procoagulants; Haemostatic agents; Antifibrinolytic agents
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/745—Blood coagulation or fibrinolysis factors
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N7/00—Viruses; Bacteriophages; Compositions thereof; Preparation or purification thereof
- C12N7/04—Inactivation or attenuation; Producing viral sub-units
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6429—Thrombin (3.4.21.5)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6432—Coagulation factor Xa (3.4.21.6)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6437—Coagulation factor VIIa (3.4.21.21)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/6464—Protein C (3.4.21.69)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N9/00—Enzymes; Proenzymes; Compositions thereof; Processes for preparing, activating, inhibiting, separating or purifying enzymes
- C12N9/14—Hydrolases (3)
- C12N9/48—Hydrolases (3) acting on peptide bonds (3.4)
- C12N9/50—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25)
- C12N9/64—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue
- C12N9/6421—Proteinases, e.g. Endopeptidases (3.4.21-3.4.25) derived from animal tissue from mammals
- C12N9/6424—Serine endopeptidases (3.4.21)
- C12N9/647—Blood coagulation factors not provided for in a preceding group or according to more than one of the proceeding groups
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Q—MEASURING OR TESTING PROCESSES INVOLVING ENZYMES, NUCLEIC ACIDS OR MICROORGANISMS; COMPOSITIONS OR TEST PAPERS THEREFOR; PROCESSES OF PREPARING SUCH COMPOSITIONS; CONDITION-RESPONSIVE CONTROL IN MICROBIOLOGICAL OR ENZYMOLOGICAL PROCESSES
- C12Q1/00—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions
- C12Q1/56—Measuring or testing processes involving enzymes, nucleic acids or microorganisms; Compositions therefor; Processes of preparing such compositions involving blood clotting factors, e.g. involving thrombin, thromboplastin, fibrinogen
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21005—Thrombin (3.4.21.5)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21006—Coagulation factor Xa (3.4.21.6)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21021—Coagulation factor VIIa (3.4.21.21)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21022—Coagulation factor IXa (3.4.21.22)
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12Y—ENZYMES
- C12Y304/00—Hydrolases acting on peptide bonds, i.e. peptidases (3.4)
- C12Y304/21—Serine endopeptidases (3.4.21)
- C12Y304/21069—Protein C activated (3.4.21.69)
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Organic Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Genetics & Genomics (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- General Health & Medical Sciences (AREA)
- Biochemistry (AREA)
- Biomedical Technology (AREA)
- General Engineering & Computer Science (AREA)
- Medicinal Chemistry (AREA)
- Molecular Biology (AREA)
- Biotechnology (AREA)
- Microbiology (AREA)
- Hematology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Immunology (AREA)
- Analytical Chemistry (AREA)
- General Chemical & Material Sciences (AREA)
- Animal Behavior & Ethology (AREA)
- Diabetes (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Toxicology (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Pharmacology & Pharmacy (AREA)
- Virology (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Gastroenterology & Hepatology (AREA)
- Neurosurgery (AREA)
- Physics & Mathematics (AREA)
- Peptides Or Proteins (AREA)
- Medicines That Contain Protein Lipid Enzymes And Other Medicines (AREA)
Abstract
本发明涉及用于制备包含II、VII、IX和X凝血因子的凝血酶原复合体的组合物或浓缩物的方法,其中该方法包括以下步骤:提供血浆冷沉物的上清液;将该上清液应用在阴离子交换树脂上,以产生包含该复合体和具有高分子量的蛋白质的洗脱物;将该洗脱物应用在羟基磷灰石柱上,以产生包含该复合体的第二洗脱物。本发明还涉及可以通过该方法产生的组合物。
Description
技术领域
本发明涉及用于制备包含凝血因子II、VII、IX和X的凝血酶原复合体的组合物或浓缩物的方法。本发明还提供可通过此方法获得的组合物。
背景技术
制备依赖于维生素K的蛋白质的浓缩物,更尤其是包含凝血因子II、VII、IX和X的凝血酶原复合体(也称为PPSB)的浓缩物是在患有一种或多种凝血因子缺乏和/或患有某些高分子量蛋白质缺乏的血友病患者中预防或治疗出血性事故的基础。
在出血期过程中,患者经受PPSB治疗,并因此接受大剂量的通常与PPSB共纯化的血浆蛋白质,其可以导致出现继发效应,如过敏性休克、炎症型反应和耐受问题。免疫球蛋白M和产生自因子C3、C4、C5的活化的因子C3a、C4a或C5a(也称为过敏毒素)的情况尤其如此。因子C3a、C4a和C5a(尤其是C3a)参与变应性炎症。补体片段C5a和C3a对肥大细胞和嗜碱性粒细胞的活化实际导致白三烯和组胺的释放,这也是毛细血管通透性增加、支气管收缩增加和血管舒张增加的起因。
为了避免在用于纯化维生素K依赖性因子的方法过程中形成这些片段,因此优选去除它们各自的前体,即补体系统的因子C3、C4或C5。
除了组成PPSB的因子II、VII、IX和X外,至今市售的PPSB浓缩物,如Kaskadil(来自“Laboratoire du Fractionnement et desBiotechnologies”)全都包含大比例(约80%)的污染蛋白质。浓度最大的维生素K依赖性蛋白质是凝血酶原或因子II(就Kaskadil中约35-45Mg/mL的总蛋白质浓度而言,其浓度在4.5Mg/mL的等级)。
因此,存在对允许更高的PPSB纯度,且能够保留组成它的因子II、VII、IX和X的活性和各自比例的方法的明显需要。
文件EP-A-0528701(“Association pour l’essor de la transfusionsanguine”)描述了用于制备预期用于治疗用途的人凝血酶,且包括在DEAE-SephadexA50树脂上纯化血浆冷沉物上清液、再钙化和病毒灭活包含PPSB的洗脱物的连续步骤的方法。
文件US-P-4411794描述了用于纯化凝血因子II、VII、IX和X的方法,其包括在存在钙离子的情况下用羟基磷灰石型矿物支持物上的硫酸铵吸附血浆沉淀物上清液的步骤,随后是硅胶上的纯化步骤和透析。但是,由此产生的PPSB浓缩物似乎包含许多污染蛋白质,不具有所需要的纯度来满足关于血液衍生产品的健康安全性的现有标准。硫酸铵尤其不适合用于治疗用途,且具有相对毒性。
文件US-P-4272523描述了用于从血浆冷沉物上清液分级分离血浆的方法。此专利尤其描述了通过累加硅胶上的冷沉物上清液吸附步骤、透析/超滤、羟基磷灰石型磷酸三钙上的吸附和DEAE-Sephadex型阴离子交换树脂上的吸附来制备PPSB浓缩物。但是,用来去除诸如纤维蛋白原的高分子量蛋白质的硅胶上的纯化步骤和磷酸三钙上的纯化步骤似乎以分批吸附(批次)的形式发生,该实施由于其低的可重复性及其自动化的困难而证明难以应用在工业规模上。事实上,磷酸三钙难于控制,因为它表现为对湿度测量法敏感的粉末和包括可以取决于批次而变的内在特征。因此,文件US-P-4272523的方法证明不适合用于大规模制备预期用于治疗用途的PPSB浓缩物。
文件EP-A-0832200描述了用于纯化重组FXI的组合物的方法,其包括在阴离子交换树脂上、在肝素树脂上和然后在羟基磷灰石树脂上的连续层析步骤。此文件未涉及凝血酶原复合体的因子,且起始产物是重组因子的组合物,且不是人来源的。
文件WO2006/075664描述了用于纯化重组FVII的方法,其包括羟基磷灰石上的层析步骤,不预处理包含重组FVII的组合物。
发明内容
申请人惊奇地发现,组合了用于制备血浆冷沉物上清液、阴离子交换树脂上的层析和羟基磷灰石上的层析的步骤用于纯化依赖于维生素K的蛋白质,尤其是凝血酶原复合体的浓缩物的方法允许工业制备具有高纯度的PPSB浓缩物。通过本发明制备的PPSB基本上无任何污染蛋白质,且它所包含的因子II、VII、IX和X具有高比活性。本发明的方法最尤其是因所实施的纯化步骤的减少的数目和可重复性,及因用羟基磷灰石层析包含诸如纤维蛋白原、纤连蛋白、免疫球蛋白、补体蛋白质的高分子量蛋白质的洗脱物而区别于至今已知的纯化方法。
本发明的目的是用于制备凝血酶原复合体组合物的方法,其包括以下步骤:
a)提供血浆冷沉物的上清液;
b)将该上清液应用在阴离子交换树脂上,并洗脱在包含该复合体和高分子量蛋白质的洗脱物中;
c)将产生自步骤b)的洗脱物应用在羟基磷灰石柱上;
d)洗脱在包含该复合体的洗脱液中。
在优选实施方案中,本发明的方法包括附加的预洗脱步骤c1),优选用尤其是浓度为从0.005至0.05M、有利地从0.01至0.05M、有利地从0.02至0.05M和优选为0.03M的磷酸钠或磷酸钾缓冲液,在包含在6.5和8.5之间、优选约为8的pH值下进行该预洗脱,该缓冲液还包含0.25M NaCl。
更优选地,用优选0.5M的磷酸钾缓冲液、0.075M NaCl、pH 8进行步骤d)的洗脱。
有利地,本发明的方法包括用于产生自步骤b)的洗脱物和/或产生自步骤d)的洗脱物的病毒灭活的至少一个附加步骤。在优选实施方案中,优选在存在吐温(聚山梨酸酯80)-TnBP混合物的情况下,优选用1%(v/v)聚山梨酸酯80-0.3%(v/v)TnBP混合物,以溶剂-去垢剂处理的形式对产生自步骤b)的洗脱物进行该至少一个病毒灭活步骤。在具体实施方案中,以UV-C(紫外线C)处理、辛酸盐离子处理和/或干热处理进行该至少一个病毒灭活步骤。有利地,通过以具有包含在例如15nm和100nm之间的孔隙度的一个或几个滤器上、优选具有例如15nm孔隙度的至少一个滤器上、尤其是来自Asahi的Planova 15N滤器上的纳米过滤,例如一次或几次纳米过滤,对产生自步骤d)的洗脱物进行的病毒去除步骤来完成该至少一个病毒灭活步骤,
在具体实施方案中,本发明的方法在步骤b)之后和/或步骤d)之后包括至少一个附加的渗滤-超滤步骤。
在具体实施方案中,本发明的方法的步骤b)包括在两种不同阴离子交换树脂上实施的两个亚步骤。
在具体实施方案中,步骤b)的阴离子交换树脂具有选自二乙氨基乙烷(DEAE)、聚乙烯亚胺(PEI)和四级氨基乙烷(QAE)的带正电荷的基团,该阴离子交换树脂优选属于DEAE型。
在具体实施方案中,本发明的方法包括在步骤b)之后或步骤d)之后加入凝血酶抑制剂,优选抗凝血酶III或抗凝血酶III和肝素的混合物。
在一个实施方案中,通过本发明的方法制备的组合物进一步包含依赖于维生素K的其他蛋白质,如蛋白质C、S和Z。
在具体实施方案中,本发明的方法包括最终的附加配制步骤,优选通过冻干和/或加入可药用佐剂或载体。
本发明还涉及凝血酶原复合体的组合物,其可通过本发明的方法获得,且其免疫球蛋白浓度、优选IgM浓度低于0.1%,和/或其纤维蛋白原浓度低于0.1%,和/或其纤连蛋白浓度低于0.1%,和/或其补体因子浓度低于0.1%。
在具体实施方案中,本发明的凝血酶原复合体组合物中FIX的平均比活性为每毫克蛋白质至少4IU。
在具体实施方案中,本发明的凝血酶原复合体的组合物进一步包含蛋白质C、蛋白质S和蛋白质Z。
在具体实施方案中,由本发明的凝血酶原复合体组合物的因子II(FII)、因子VII(FVII)、因子IX(FIX)、因子X(FX)、蛋白质C、蛋白质S和蛋白质Z组成的依赖于维生素K的蛋白质占该组合物总蛋白质的最大80%、优选85%和更优选90%。
本发明还涉及本发明的凝血酶原复合体组合物作为药物、优选作为用于治疗和预防与依赖于维生素K的因子的缺乏或抗维生素K的超剂量相关的出血性事故的药物、或作为用于治疗和预防与因子II或因子X的组成性或获得性缺乏相关的出血性事故的药物的用途。
附图说明
图1:因子II、IX、VII和X的洗脱产率对沉积在羟基磷灰石柱上的蛋白质负载。
图2:未保留在羟基磷灰石柱上的因子II、IX、VII和X的量对所引入的蛋白质负载。
图3:未结合的FII和FIX的百分比变化对沉积在羟基磷灰石柱上的蛋白质负载。
图4:对应于在羟基磷灰石上层析期间预洗脱过程中去除的蛋白质的量的SDS-PAGE凝胶。对应于来自HA Biorad上的层析的预洗脱物和洗脱物的12%SDS-PAGE凝胶——非还原——沉积物:10μg蛋白质。孔1和10:分子量标准。孔2:PI-1。孔3:测试3预洗脱物0.25M NaCl。孔4:测试3洗脱物。孔5:测试5预洗脱物0.25M NaCl;30mM磷酸盐。孔6:测试5洗脱物。孔7:PI-1。孔8:测试6预洗脱物0.25M NaCl;30mM磷酸盐。孔9:测试6洗脱物。
图5:过滤压力对时间的变化。
图6:过滤流速对滤过重量的变化。
图7:无任何还原剂的4-12%SDS-PAGE Novex上的电泳——胶体考马斯蓝染色。孔1:97E 0801-PI-1。孔2:97E 0801-未吸附的HA陶瓷。孔3:97E 0801-预洗脱。孔4:97E 0801-洗脱。孔5:97E 0801-透析洗脱10kDa。孔6:97E 0901-15nm过滤后。孔7:97E 1401-15nm过滤后。孔8:97E 1601-15nm过滤后。孔9:97E 1601-最终的15nm存留物。孔10:Novex分子量对照。
图8:因子IX的免疫印迹表征。孔1:97E 1106-纳米过滤前透析的HA洗脱物。孔2和3:97E 1106-PI-1。孔4:97E 1504-15nm滤过物。孔5:因子IX HP对照。因子IX HP是高纯度的因子IX,即具有高于100U/mg的比活性(表示为每毫克蛋白质的FIX单位)的因子IX浓缩物。
具体实施方式
本发明的用于纯化依赖于维生素K的蛋白质,尤其是凝血酶原复合体的方法包括以下步骤:
a)提供血浆冷沉物的上清液。在具体实施方案中,可以通过Cohn分级分离获得该血浆冷沉物上清液。在此具体情况下,证明有必要避免乙醇变性蛋白质,因此有必要在低温下操作或在进行到蛋白质吸附在羟基磷灰石上之前去除醇。在另一实施方案中,可以通过用硫酸铵盐分级分离来获得该血浆冷沉物上清液。在此具体情况下,证明有必要进行透析,以处于吸附在羟基磷灰石上的最适条件之下;
b)将该上清液应用在阴离子交换树脂上,并洗脱在包含该复合体和高分子量蛋白质的洗脱物中;
c)将产生自步骤b)的洗脱物应用在羟基磷灰石柱上;
d)洗脱在包含该复合体的洗脱液中。
高分子量蛋白质是具有超过300、优选超过200、尤其是超过160或甚至超过100的以kDa表示的MW的蛋白质。
用于本发明中的羟基磷灰石树脂可以是例如陶瓷-羟基磷灰石(陶瓷HA)、Biogel HT等。
在优选实施方案中,本发明的方法包括附加的预洗脱步骤c1),优选用0.01M磷酸钾缓冲液、0.25M NaCl、pH 8.0或0.03M磷酸钾缓冲液、0.25M NaCl、pH 8.0在室温下进行该预洗脱。预洗脱缓冲液的磷酸钾浓度优选从0.02至0.05M变动,且优选等于0.03M。预洗脱缓冲液的pH值优选从pH 6.5至pH 8.5变动,且优选等于pH 8。
优选地,用0.5M磷酸钾缓冲液、0.075M NaCl、pH 8进行步骤d)的洗脱。洗脱缓冲液的pH值优选从pH 6.5至pH 8.5变动,且优选等于pH 8。洗脱缓冲液的磷酸钾浓度优选从0.1M至0.5M变动,且优选等于0.25M。
通过羟基磷灰石柱上,且优选陶瓷羟基磷灰石柱(HA-Biorad)上的层析,有可能去除阴离子交换树脂上的层析步骤b)过程中随依赖于维生素K的蛋白质(尤其是凝血酶原复合体)洗脱的高分子量蛋白质。通过去除这些高分子量蛋白质,有可能降低或优选去除一般产生自凝血酶原复合体溶液的治疗用途的继发效应。事实上,在羟基磷灰石上的层析过程中去除的高分子量污染蛋白质例如包含补体的某些因子(如C4),其直接或间接(例如在以过敏毒素的形式切割后)降低患者对目前市售凝血酶原复合体溶液的耐受。申请人惊奇地发现,通过羟基磷灰石上的单个层析步骤,有可能在无需诸如硅胶上的纯化的预先实施的情况下去除包含在血浆冷沉物上清液中的大部分高分子量污染蛋白质,例如,还去除了诸如纤维蛋白原、纤连蛋白、Ig的蛋白质。
羟基磷灰石上的层析还提供了在它们的纯化过程中不改变依赖于维生素K的因子各自的比例的可能性,因为通过本发明的方法获得的凝血酶原复合体浓缩物中因子II、VII、IX或X之间的比值与见于天然血浆中的比值极其可比。
结果是,产生自羟基磷灰石上的层析的凝血酶原复合体组合物(依赖于维生素K的蛋白质的浓缩物)被显著富集。相对于蛋白质含量,此凝血酶原复合体组合物或蛋白质浓缩物的含量是约60%、优选约70%和更优选约80%,且因子II、VII、IX、X的比活性相对于市售凝血酶原浓缩物,例如Kaskadil显著提高(高4至8倍,优选高5倍)。
此外,在羟基磷灰石上的层析过程中去除高分子量蛋白质是工业优势,因为从此以后,它允许通过具有15nm等级孔隙度的滤器上的纳米过滤来对依赖于维生素K的蛋白质的浓缩物进行病毒灭活。否则滤器将由于这类高分子量蛋白质在待过滤的溶液中的存在而快速堵塞。最后,在步骤b)的阴离子交换树脂上的层析和步骤d)的羟基磷灰石上的层析之间进行通过溶剂-去垢剂处理的病毒灭活时,通过羟基磷灰石上的纯化,有可能基本上去除存在于负载在羟基磷灰石上的蛋白质浓缩物中的全部溶剂和去垢剂。
在优选实施方案中,本发明的方法包括用于产生自步骤b)的洗脱物和/或产生自步骤d)的洗脱物的病毒灭活的至少一个附加步骤。优选地,对产生自步骤b)的洗脱物进行的病毒灭活步骤对应优选存在吐温(聚山梨酸酯80)-TnBP混合物的情况下、优选使用1%(v/v)聚山梨酸酯80-0.3%(v/v)TnBP混合物的溶剂-去垢剂处理。在具体实施方案中,以UV-C(紫外线C)处理、辛酸盐离子处理的形式和/或通过干热来进行该至少一个病毒灭活步骤。优选地,本发明的方法可以包括对产生自步骤d)的洗脱物进行,且对应于优选至少在具有15nm孔隙度的滤器上、优选Planova15N滤器(Asahi)上的至少一次纳米过滤的用于病毒去除的第二步骤。
可以藉此去除有包膜病毒和无包膜病毒。
因此,本发明的方法可以包括至少一个病毒灭活步骤,该步骤旨在从病毒学的观点保障预期用于治疗性施用的终产物的安全。
可以在该方法的任意阶段、且优选在阴离子交换树脂上的纯化后实施用溶剂-去垢剂混合物处理、且允许灭活有包膜病毒的第一病毒灭活步骤。所使用的溶剂-去垢剂混合物可以对应于本领域技术人员已知的任意适宜的混合物,且优选按上文所示组成。溶剂-去垢剂病毒灭活处理一般在基本上为室温的温度(例如25±1℃)下进行几小时(例如7小时)的时间。
此外,本发明的方法还可以包括通过至少一个具有低孔隙度的滤器上,例如至少一个具有包含在15nm和100nm之间的孔隙度的滤器上的纳米过滤的至少一个病毒去除步骤。通过这种纳米过滤步骤,更尤其可能就无包膜病毒(脊髓灰质炎病毒或细小病毒类型的病毒)和非常规感染性物质(阮病毒类型)保障终产物的安全。在本发明的方法的范围内,在至少一个具有15nm孔隙度的滤器上、优选在至少一个Planova 15N滤器(Asahi)上进行纳米过滤。在具体实施方案中,在至少两个具有不同孔隙度、优选递减孔隙度的滤器上进行纳米过滤。优选在羟基磷灰石上的层析后进行此纳米过滤,因为显著浓度的高分子量蛋白质(例如纤维蛋白原、纤连蛋白或IgM)在待过滤的蛋白质提取物中的存在一般导致滤器的堵塞,在工业规模上实施该方法时更甚。
产生自包括前述两个病毒灭活步骤的方法的PPSB浓缩物证明符合EMEA或FDA就血浆和生物技术制品提出的国际建议,因为它符合无包膜病毒和裸病毒二者所需的安全性条件。
在优选实施方案中,本发明的方法在步骤b)之后和/或步骤d)之后包括至少一个附加的渗滤-超滤步骤。
在优选实施方案中,本发明的方法包括阴离子交换树脂上的两个层析亚步骤。然后存在附加的步骤b2),该步骤包括将步骤b)的洗脱物应用于第二阴离子交换树脂上,并洗脱包含高分子量蛋白质的依赖于维生素K的蛋白质的浓缩物。优选地,该第二阴离子交换树脂是DEAE-Sepharose型树脂,且优选DEAE-Sepharose FF(Amersham)。DEAE-Sepharose树脂具有耐受压力以及通常用来消毒和再生凝胶的氢氧化钠处理的优点。
在优选实施方案中,本发明的方法包括最终的附加配制步骤,其优选通过冻干和/或加入可药用佐剂或载体。在一个实施方案中,配制后获得的产物包含0.13M NaCl、2g/L精氨酸、2g/L赖氨酸、3g/L柠檬酸钠,且具有从6.9至7.1的pH值。在另一实施方案中,配制后获得的产物包含10g/L精氨酸、35g/L甘露醇,且具有从6.9至7.1的pH值。在另一实施方案中,配制后获得的产物包含45g/L甘露醇,且具有从6.9至7.1的pH值。在另一实施方案中,配制后获得的产物包含1g/L柠檬酸钠、35g/L甘露醇,且具有从6.9至7.1的pH值。
在优选实施方案中,本发明的方法包括加入凝血酶抑制剂,优选抗凝血酶III或抗凝血酶III和肝素的混合物的步骤。抗凝血酶可以来源于人血浆或具有重组人来源,例如由GTC Biotherapeutics销售的Atryn可以在步骤b)之后和/或步骤d)之后进行此加入。优选地,在产生自步骤b)的洗脱物的溶剂-去垢剂处理之后,或在产生自步骤d)的洗脱物的纳米过滤之前进行凝血酶抑制剂的加入。还可以以与针对抗凝血酶提出的那些相同的浓度将肝素的辅因子II用作凝血酶抑制剂。
通过加入凝血酶抑制剂,有利地有可能防止或限制凝血酶原(FII)在本发明的方法过程中实施的纯化步骤中活化为凝血酶。通过本发明的方法获得的依赖于维生素K的蛋白质的浓缩物中凝血酶活性的缺乏使得它与在人类中用作治疗性或预防性药物相容,且允许令人满意地保存此浓缩物。
优选地,本发明的方法的步骤b)的阴离子交换树脂具有选自二乙氨基乙烷(DEAE)、聚乙烯亚胺(PEI)和四级氨基乙烷(QAE)的带正电荷的基团。此阴离子交换树脂更优选是由GE Healthcare销售的DEAE-Sephadex A-50通过步骤b)的层析,有可能去除由清蛋白、免疫球蛋白(在某种程度上除了某些Ig,如IgM)、抗凝血酶III和α-抗胰蛋白酶组成的蛋白质的一部分(其可以是显著的)。通过逐渐增加离子力来进行吸附在阴离子交换树脂上的血浆蛋白质的回收。
在具体实施方案中,然后可以用本领域技术人员熟知的技术,例如在亲和凝胶上独立纯化步骤d)之后获得的维生素K依赖性蛋白质。
本发明还涉及凝血酶原因子(可通过上文所述的方法获得的依赖于维生素K的蛋白质)的浓缩物。此蛋白质浓缩物优选包含因子II、VII、IX和X,且具有低于0.1%(基于浓缩物总蛋白质水平的百分比)的IgM浓度、低于0.1%(基于浓缩物总蛋白质水平的百分比)的纤维蛋白原浓度、低于0.1%的纤连蛋白浓度和低于0.1%的补体因子浓度。优选地,本发明的浓缩物还包含蛋白质C、S和Z,且具有至少4IU/毫克蛋白质的平均FIX比活性。
最后,本发明涉及可通过本发明的方法获得的凝血酶原因子的浓缩物作为药物,且更尤其是作为用于治疗和预防与依赖于维生素K的因子的缺乏,如因子II或因子X的组成性缺乏,或抗维生素K的超剂量相关的出血性事故的药物的用途。
通过以下实施例以更详细的方式阐述本发明的方法。这些实施例描述本发明的具体实施方案,不能认为其限制本发明的范围。
实施例
实施例1:纯化依赖于维生素K的蛋白质的浓缩物所实施的实验条件。
A-血浆冷沉物上清液的制备
作为起始材料,使用了血浆冷沉物上清液,其是通过在0-3℃下冷冻-解冻和离心冷冻的新鲜血浆获得的。
为了在低于4°的温度下分离主要由因子VIII、纤连蛋白和纤维蛋白原组成的不可溶性冷沉物,在低于2℃的温度下在血浆分级分离上游完成冷沉。
通过在接近+4℃的温度下连续离心来从上清液分离冷沉物。将离心上清液称为冷上清液(cryosupernatant)。
冷上清液基本上包含清蛋白、免疫球蛋白以及包括由凝血酶原(因子II)、因子VII、因子IX、因子X、蛋白质C、蛋白质S和蛋白质Z组成的维生素K依赖性因子的其他凝血因子。
B-阴离子交换树脂上的层析
以下步骤包括在吸附在弱阴离子交换凝胶DEAE Sephadex A-50(二乙氨乙基Sephadex)上后制备富集维生素K依赖性因子的级分。
将冷上清液加热至+10℃的最低温度(+16至18℃最佳)。在DEAE-Sephadex凝胶上纯化此冷上清液之前,若有必要,可以在1μm滤器上和然后在0.5μm滤器上对其进行澄清过滤。
纯化的冷上清液的体积通常从2,000至3,000升。每升纯化的冷上清液使用约1.5g干DEAE-Sephadex。
纯化前,膨胀DEAE-Sephadex粉末(3次洗涤),每次洗涤后在不锈钢网上筛选凝胶。在具有搅拌桨和可以使流体逃逸但保留DEAE-Sephadex球珠的罐底删档(筛)的容器中,在0.075M氯化钠溶液中进行DEAE-Sephadex的制备、膨胀和平衡。在室温(15-25℃)下进行DEAE-Sephadex的膨胀操作。
通过测量流出物的重量摩尔渗透压浓度来控制最终的凝胶平衡。
在平衡所提供的流速后,以400kg/小时的流速将17±1℃的优选温度下的冷上清液连续送至经膨胀和平衡的DEAE-Sephadex上。
从而伴随连续搅拌,使全部冷上清液与DEAE-Sephadex接触,允许依赖于维生素K的因子在凝胶上不断结合。
然后以每2,200升纯化的冷上清液140升缓冲液的量用包含0.2MNaCl、10mM柠檬酸,pH 7的缓冲液洗涤凝胶3次。
以每2,200升纯化的冷上清液75升缓冲液的量,利用2M NaCl、10mM柠檬酸、pH 7的缓冲液完成依赖于维生素K的蛋白质(和与它们共纯化的高分子量蛋白质)的洗脱。
然后通过常规手段脱盐洗脱过程中获得的蛋白质级分,即通过用具有10kDa和可选地30kDa截留阈值的盒超滤,并对pH 7的0.15M NaCl、10mM柠檬酸缓冲液透析。
在本申请的范围内,将产生自DEAE-Sephadex上的纯化的蛋白质洗脱物称为“PPSB中间产物1”或“PPSB-PI-1”。
在纯化方法的此阶段,证明有可能冷冻PPSB-PI-1,同时等待此阶段的产生自DEAE-Sephadex的洗脱物的其他纯化步骤的实施。
C-溶剂-去垢剂处理病毒灭活
然后通过用溶剂-去垢剂混合物处理,更具体而言,通过用(1%v/v)聚山梨酸酯80-(0.3%v/v)磷酸三正丁酯(TnBP)处理来对PPSB-PI-1进行病毒灭活。在从24至25℃的温度下进行病毒灭活处理至少6小时的时间。
在15~30℃但优选约25℃的温度下,在存在TnBP的情况下,可以将其他去垢剂用作聚山梨酸酯的替代物,如浓度在0.5~2%的范围内的胆酸酯或辛苯聚醇(Triton X100)。进行病毒灭活的最少孵育时间是4小时,但此孵育可以延长至12小时。一般应用的pH值在6~8的范围内,总蛋白质浓度在10~40g/L的范围内。
D-羟基磷灰石HA上的层析
D.1-凝胶的填充
所使用的层析凝胶是具有40微米的粒径的大量制备陶瓷羟基磷灰石(Biorad)。将干凝胶悬浮在pH 6.8的0.4M磷酸盐缓冲液中,然后转入Pharmacia K50/30柱。以100cm/h的流速完成填充。所使用的量是30g干凝胶,其提供50mL填充凝胶的柱。用5个柱体积的2M NaOH漂洗柱,并保存在2M NaOH中。
D.2-待注射至柱上的PPSB-PI-1的制备
若有必要,解冻PPSB-PI-1,并在存在1%聚山梨酸酯80和0.3%TnBP的情况下进行3小时的病毒灭活。然后可选地用20mM苄脒溶液1/2稀释经病毒灭活的PPSB-PI-1;用0.1M NaOH调节溶液pH值至8。
D.3-层析:
将柱连接至具有工业检测单元的Pharmacia UV检测器,并在280nm记录流出物的光密度。用5体积的预平衡缓冲液(0.4M磷酸钾、pH 6.8)洗涤保存在2M NaOH中的凝胶。
然后用15体积的平衡缓冲液(0.01M磷酸钾、0.075M NaCl、10mM苄脒(可选)、pH 8)平衡柱。然后以100cm/h的流速注入PPSB溶液,并用平衡缓冲液洗涤柱,直至回到基线。
用预洗脱缓冲液(0.01M磷酸钾、0.25M NaCl、10mM苄脒、pH 8或0.03M磷酸钾、0.25M NaCl、苄脒10mM(可选)、pH 8)以相同的流速进行预洗脱,并收集5个柱体积的预洗脱物。然后用15体积的相同缓冲液洗涤凝胶。
用洗脱缓冲液(0.5M磷酸钾、0.075M NaCl、10mM苄脒(可选)、pH 8)以相同的流速进行洗脱,并收集5个柱体积的洗脱物。用5个柱体积的2M NaOH再生凝胶,并保存在2M NaOH中。
E-超滤和透析
对产生自羟基磷灰石上的层析的洗脱物进行在具有10kDa截留阈值的0.1m2 Sartorius ultrasart slice聚砜盒上完成的超滤。
将洗脱物浓缩3倍,并以恒定体积对纯化注射用水(pwi)透析,直至获得70欧姆的电阻率(盒上的入口压力为0.5巴,超滤流速为45mL/分钟),然后以恒定体积对5体积的透析缓冲液(3g/L柠檬酸三钠、0.13MNaCl、2g/L赖氨酸、2g/L精氨酸、pH 7)透析。然后再浓缩产物两次,并用透析缓冲液漂洗盒,以获得等于起始体积的80%的终体积。最后冷冻产物并保存在-40℃,若需要,随后可以在具有15nm孔隙度的滤器上过滤。
F-测定
测定(通过测量诱导凝固的能力)组成凝血酶原复合体(或PPSB)的凝血因子II(FII)、因子VII(FVII)、因子IX(FIX)和因子X(FX)的量和/或浓度,并测量凝血酶活性。
利用由Stago销售的试剂盒AsserachromVII:Ag、AsserachromIX:Ag、AsserachromX:Ag、AsserachromProtein Z,通过ELISA完成因子VII、IX、X和蛋白质Z的抗原测定。
测量了聚山梨酸酯80和TnBP的量和/或浓度。
实施例2:实验结果
A:柱容量的研究
在与上文所述的那些相同的实验条件下,用每毫升凝胶3、5、7和9mL经病毒灭活的PPSB-PI-1的剂量测试了羟基磷灰石柱的容量。未进行预洗脱。
针对各因子计算的产率对应于产生自羟基磷灰石的洗脱物中的凝固单位总量与PPSB-PI-1中的凝固单位总量之比。按照负载获得的产率详述于以下表I中:
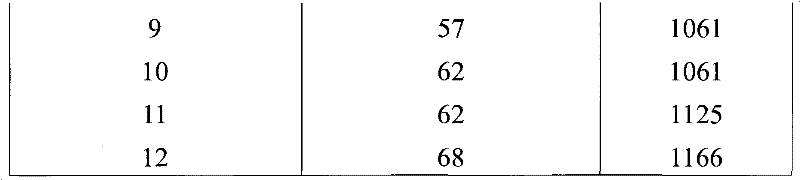
表I-因子II、IX、VII和X取决于凝胶上的负载的洗脱产率
这些数据图示在图1中。观察到了FX的结合对负载的明显减少。
针对各因子计算的未结合的因子的百分比对应于未结合级分中的凝固单位总量与起始PPSB-PI-1中的凝固单位总量之比。未结合的因子的百分比总结在表II中。
表II:未保留在凝胶上的因子II、IX、VII和X的量对负载。
这些数据图示在图2中。在此图中,FII和FX是在羟基磷灰石柱上结合较少的因子似乎更明显。
此外,图3显示,对于这两种因子(FII和FX),未结合的因子的百分比随负载线性变化。保留了FII和FX的结合仍可接受的每毫升凝胶5mL PPSB-PI-1负载。
B-预洗脱的影响
以去除尽可能多的污染蛋白质为目的,测试了30mM磷酸盐缓冲液的预洗脱。优选用20~40mM、更优选30mM的磷酸盐缓冲液进行这种预洗脱,以至于已从50mM的磷酸盐浓度观察到了因子II和VII的洗脱。操作条件与上文所述的那些一致,所使用的蛋白质负载是每毫升凝胶5mL PPSB-PI-1。
在预洗脱物中未能检测到凝血因子。因此,如以下结果所示,产率不受此预洗脱影响。
表III:洗脱物中因子II、XII、VII和X的量对所完成的预洗脱的类型
表IV:磷酸盐预洗脱过程中去除的共纯化蛋白质的量。
如SDS-PAGE凝胶(见图4)所示,用30mM磷酸盐缓冲液进行的预洗脱进一步允许去除大量伴随蛋白质,尤其是高分子量(100~200kD)蛋白质。
E-加入抗凝血酶和肝素的影响
为了在纯化过程中保持蛋白质提取物中的低凝血酶活性,超滤前向羟基磷灰石层析洗脱物中加入浓度为0.5U/mL(优选浓度为0.1-0.04单位抗凝血酶/单位FIX)的纯化的抗凝血酶和2U/mL的肝素。实验条件与上文所述的条件相同,在30mM磷酸盐缓冲液中进行预洗脱。柱负载为每毫升凝胶5mL PPSB。
E1-羟基磷灰石上纯化后透析的洗脱物中的FII、FX、FVII和X活性
表V:羟基磷灰石上纯化后的洗脱物中因子II、IX、VII和X的活性及凝血酶活性。
所进行的测试在它们之间是可重复的,在6小时和24小时时测量的凝血酶活性几乎为零,因此顺应依赖于维生素K的蛋白质的浓缩物随后的治疗用途(6小时及以上的凝血酶活性对应于非常小的凝血酶量,少于0.001NIH单位)。
E2-羟基磷灰石上纯化后透析的洗脱物中FII、FX、FVII和X的产率
表VI:羟基磷灰石上纯化后透析或超滤的洗脱物中因子II、IX、VII和X的产率及凝血酶活性。
对于因子II和IX,产率在70%的等级,对于因子VII和X,产率平均在60%和64%的等级。
表VII:超滤产生自羟基磷灰石的洗脱物后因子II、IX、VII和X的产率。
超滤后所有因子的产率在70~80%的等级。
表VIII:羟基磷灰石后透析的洗脱物中特异性因子II、X、VII和IX的活性。
相对于通过应用阴离子交换树脂上的层析替代本发明的羟基磷灰石获得的FII、FVII、FIX和FX的浓缩物,针对各因子计算的比活性提高了约5倍。
F-关于羟基磷灰石上的纯化步骤的结论
与离子交换凝胶相比,依赖于维生素K的凝血因子在基于磷酸钙(羟基磷灰石型)的表面上的结合似乎更特异,这解释了所获得的产物的纯度。在羟基磷灰石凝胶上洗脱后回收的蛋白质的分析显示,包含在目的蛋白质浓缩物中的蛋白质具有包含在75~50kDa之间的分子量,这对应于依赖于维生素K的蛋白质的分子量,尤其是对应于组成凝血酶原复合体的不同凝血因子的分子量。
以下表IX显示存在于病毒灭活后通过阴离子交换树脂上的纯化(作为本发明的羟基磷灰石上的纯化的替代)获得的蛋白质浓缩物中的蛋白质列表。应注意,在这种浓缩物中,依赖于维生素K的蛋白质(FII、FVII、FIX、FX、蛋白质C、蛋白质S、蛋白质Z)的总量代表了总蛋白质的17%。
表IX:存在于产生自阴离子交换树脂上的单次纯化或产生自包括第一阴离子交换树脂和第二阴离子交换树脂作为本发明的羟基磷灰石上的层析的替代的纯化的浓缩物中的蛋白质列表和相对比例。
| 蛋白质 | % | MW |
| IgM | 0.30至0.40 | 900 |
| C4bp | 1.60至2 | 590 |
| 纤连蛋白 | 0.45至0.65 | 440 |
| 纤维蛋白原 | 0.65至1 | 330 |
| C4 | 9至13 | 206 |
| C3 | 0.55至0.75 | 180 |
| C3c | 0.45至0.65 | 180 |
| C5 | 0.05至0.1 | 180 |
| 蛋白质S | 0.90至1.15 | 75 |
| 凝血酶原(FII) | 12至15 | 68.7 |
| 清蛋白 | 2.10至2.5 | 68 |
| 抗凝血酶III | 0.05至1.5 | 65 |
| 因子X | 1.25至1.75 | 59 |
| 蛋白质C | 0.20至0.50 | 57 |
| 因子IX | 0.15至0.45 | 55.4 |
| 蛋白质Z | 0.05至0.20 | 55 |
| 因子VII | 0.01至0.05 | 50 |
相反,产生自本发明的方法,尤其是羟基磷灰石上的纯化步骤后获得的蛋白质浓缩物包含比例在总蛋白质的90~95%等级的依赖于维生素K的蛋白质(FII、FVII、FIX、FX、蛋白质C、蛋白质S、蛋白质Z)。
相对于产生自阴离子交换树脂上的层析的中间产物1,产生自此羟基磷灰石上的层析的浓缩物具有提高了5至7倍的比活性。此外,其他测量显示,羟基磷灰石上的层析还允许有效去除病毒灭活步骤过程中使用的聚山梨酸酯80和TnBP。
最后,在羟基磷灰石层析洗脱物中加入抗凝血酶III和肝素提供了系统获得在24小时时无任何凝血酶活性的产物的可能性。
最后,大部分污染蛋白质、尤其是高分子量污染蛋白质的去除允许通过使用可接受的过滤表面来在具有15nm孔隙度的膜上过滤产物(每平方米膜约10升产物)。
G-羟基磷灰石上层析后获得的浓缩物的纳米过滤
G.1-纳米过滤的实验实施
所使用的滤器是具有参考的滤器Planova 15N(Asahi)。所使用的滤器由亲水性纤维素铜铵中的中空纤维组成,其孔额定尺寸为15±2nm。
滤器的平衡缓冲液由0.13M氯化钠、3g/L二水合柠檬酸三钠、2g/L赖氨酸盐酸盐、2g/L精氨酸盐酸盐和纯化注射用水(pwi)组成。在20~25℃的温度下将缓冲液调节至7.0±0.05的pH值、75Ω.cm的电阻率和314mosmol/kg H2O的重量摩尔渗透压浓度。
单独制备滤器,在500毫巴等级的压力下用纯化注射用水(pwi)漂洗。用纯化注射用水(pwi)漂洗后在使用前控制滤器的完整性。通过进行空气渗漏试验或“密封性试验”,在1,000±50毫巴的空气压力下在外套中检查无空气穿过纤维。(Asahi Planova滤器完整性试验SOP)。过滤溶液前,利用配制缓冲液平衡滤器。在具体实施方案中,配制缓冲液由0.13M NaCl、2g/L精氨酸、2g/L赖氨酸、3g/L柠檬酸钠组成,且具有从6.9至7.1的pH值。在另一实施方案中,配制缓冲液由10g/L精氨酸、35g/L甘露醇组成,且具有6.9至7.1的pH值。在另一实施方案中,配制缓冲液由45g/L甘露醇组成,且具有6.9至7.1的pH值。在另一实施方案中,配制缓冲液由1g/L柠檬酸钠、35g/L甘露醇组成,且具有从6.9至7.1的pH值。
检查15nm滤过物的pH值和电阻率(pH 7.0±0.1——重量摩尔渗透压浓度314±10mosmol/kg H2O)。
在37℃±2℃的水浴中解冻产生自上文所述的陶瓷羟基磷灰石上的纯化,并可选地透析的一瓶洗脱物。在Planova 15N 15nm滤器上过滤之前,可选地在0.2μm三醋酸纤维素滤器(Sartolab P-Sartorius)上完成预过滤。
在500±50毫巴的恒定压缩空气压力下进行洗脱物的过滤。利用数字压力计在15nm滤器入口处进行压力测量。在滤器的下部出口处将产生自15nm滤器上的过滤的洗脱物收集在置于天平上的瓶中。按固定的时间间隔进行滤过重量的读数,以测定过滤流速。所完成的过滤是正面的(frontal),无任何再循环。
过滤结束时,在填充滤器的外套后进行空气渗漏试验(“气密性试验”),以检查膜的完整性和验证过滤步骤。
为了测试纳米过滤步骤的可重复性,通过应用表X中详述的标准化操作条件来进行测试。
表X:15nm纳米过滤过程中应用的操作条件和参数。
| 操作参数 | 值 |
| 温度℃ | 20±2 |
| 应用压力毫巴 | 500±50 |
| 总蛋白质g/L | 5.0±1.0 |
| 因子IX:C总IU | 约3,200 |
| 平均蛋白质负载g/m2 | 50±10 |
| 体积负载l/m2 | 10.0±1 |
纳米过滤后,通过本领域技术人员已知的常规技术测量凝血因子FII、FVII、FIX和FX的量和/或浓度。相同的情况也适用于总蛋白质水平的测定。
G.2-产生自羟基磷灰石的洗脱物的纳米过滤后获得的结果
G.2.1-跟踪纳米过滤参数
在过滤测试过程中维持过滤压力在平均为500±100毫巴的范围内(见图5)。
在纳米过滤过程中测量过滤流速的变化(见图6)。观察到了过滤流速取决于滤过重量的有规律降低。就所进行的所有测试获得了类似的谱。
表XI:跟踪纳米过滤流速
按照Asahi滤器供应商的建议,最终过滤流速应大于起始流速的10%。对于小于10%的流速比,认为滤器堵塞,尤其是对于直径较小的孔。过滤的继续实际上可以促进潜在的病毒穿过膜的较宽的孔。
进行的所有测试的最终/起始纳米过滤流速比是顺应的。
表XII:跟踪过滤参数
平均过滤时间在2小时的等级。平均体积容量在10L/m2膜的等级,这对应于约47.9±4.7g蛋白质/m2的容量。
G.2.2-纳米过滤后总蛋白质和凝血因子的结余
表XIII:总蛋白质结余
注意到值超过90%的良好的总蛋白质纳米过滤产率。
从来自不同批次的原料进行了测试,并证明完美地可重复。
表XIV:15nm纳米过滤步骤过程中的凝血因子结余。
针对所有凝血因子注意到不同测试的良好的可重复性。
陶瓷羟基磷灰石上的层析步骤允许良好地回收依赖于维生素K的所有因子。注意到15nm纳米过滤之前和之后的浓度非常接近,从而显示四种凝血因子的高过滤产率。
表XV:15nm纳米过滤过程中比活性的时间依赖性变化。
对于纳米过滤之前和之后进行的所有测试,针对所有凝血因子测定的比活性在相同的等级。对于所进行的所有测试,相对于因子IX测定的比活性大于5。
表XVI:15nm纳米过滤后的凝血因子产率。
对于所进行的各测试,针对所有凝血因子观察到了相同等级(且大于90%)的产率。
G.2.3-凝血酶活性的测定
在通过样品的浑浊化来检测凝块的存在的自动化仪器上完成凝血酶活性的测定。
所进行的分析对应于凝固试验,其敏感性允许检测样品中的小量残余凝血酶。如果在37℃下6小时后和在24℃下24小时后获得凝固的缺乏,则结果是顺应的。
在产生自羟基磷灰石的洗脱物的纳米过滤过程中未观察到凝血酶产生。凝血酶活性的测定显示在37℃下6小时后凝固的缺乏。但是,所进行的测试显示,在24小时时可以观察到凝块形成的起始,通过通常在水浴中进行的测试确认了此结果。
进行了实验来确定诸如例如抗凝血酶III的蛋白酶抑制剂的加入是否导致在24小时时观察到的残余凝血酶活性的消失。
通过使用特异性生色底物,通过分光光度法完成蛋白酶活性的测定。蛋白酶水解特异性生色底物实际上伴随着在405nm下检测的黄色分子的释放,其发生率与所测试的溶液的酶浓度成比例。
表XVII:用生色底物S2238测定凝血酶活性
底物S2238是凝血酶的特异性底物。注意到在缺乏抑制剂的情况下,在所测试的所有样品中观察到了凝血酶类型的残余活性。凝血酶抑制剂i2581的加入和同等地在抗凝血酶III(AT-III)和肝素的混合物的存在下基本上抑制了此活性。因此,可以在存在肝素的情况下通过它的生理抑制剂AT-III来有效中和凝血酶。
通过使用生色底物的凝血酶活性测试测量的残余凝血酶活性对应于15nm滤过物中低于0.1IU/mL的活性。
抑酶肽也显示抑制残余蛋白酶的良好效率。但是,此抑制剂的牛来源不允许它在预期在人类中用于治疗用途的产物的纯化范围内使用。
G.2.4-蛋白质浓缩物的SDS-PAGE电泳表征
如图7中可见,已在来自HA陶瓷羟基磷灰石上的层析的未吸附级分中去除了大多数高分子量蛋白质。在15nm纳米过滤步骤中未注意到显著的组成差异,15nm滤过物证明在每一点上都与纳米过滤前的蛋白质浓缩物类似。
66kDa的主条带基本上对应于凝血酶原,其本身代表了蛋白质浓缩物总蛋白质的约60%。
G.2.5-因子IX的免疫印迹表征
在无任何还原剂的均质10%SDS-PAGE凝胶上电泳后产生免疫印迹。转移至硝酸纤维素上并用清蛋白饱和后,完成与抗因子IX单克隆第一抗体(Sigma Ref.F1020)的接触。在通过ECL技术在放射自显影胶片(Pierce)上显色前,进行过氧化物酶标记的抗小鼠第二抗体(BioRad)标记。结果显示在图8中。在对应于PI-1的孔中观察到了非特异性条带的存在。
相反,来自陶瓷羟基磷灰石柱的透析洗脱物仅显示单个均质条带。此外,15nm纳米过滤后未注意到可见的差异,用因子IX HP作为对照也未注意到。
G.2.6-结论
通过按照标准化操作条件来以可重复的方式进行产生自陶瓷羟基磷灰石上的层析的透析洗脱物在Planova Asahi 15nm滤器上的纳米过滤。
以可重复的方式注意到与滤过重量成比例的流速降低。滤器的平均体积容量在10L/m2膜的等级,对于所进行的测试,其对应于47.9±4.7g蛋白质的平均容量。
总蛋白质结余提供91.1±14.0%的平均产率,这与FII:C的99.4±22.2、因子VII:C的91.5±18.2、因子IX:C的95.8±16.1和因子X:C的90.5±15.1的凝血因子产率相当。
纳米过滤之前和之后,各种因子的比活性在相同的等级。
通过用SDS-PAGE电泳表征未注意到15nm过滤之前和之后的显著差异。
H-用于在生产过程中优化溶液的稳定性的测试
以获得可以在15nm上过滤,且具有非常低或不存在的凝血酶活性含量的产生自羟基磷灰石的洗脱物为目的,通过改变不同参数来进行了互补测试。
表XVIII:为稳定陶瓷羟基磷灰石洗脱物而进行的测试的列表。
*在层析前的溶剂-去垢剂处理时加入的AT-III。
**超滤前加入的AT-III。
配方a:0.13M NaCl-0.010M柠檬酸钠、2.0g/L赖氨酸盐酸盐、2.0g/L精氨酸盐酸盐、pH 7.0±0.1。
配方b:0.13M NaCl、0.010M柠檬酸钠、pH 7.0±0.1。
为了能够将测试的结果相互比较,未改变进行纳米过滤步骤的参数。
在97E 1806测试中,在缓冲液中加入50mM苄脒,并在15nm纳米过滤步骤前加入2IU/mL肝素。产生自具有15nm孔隙度的滤器上的纳米过滤的蛋白质浓缩物不具有任何凝血酶活性。
在测试97E 1007过程中,在溶剂-去垢剂处理时和羟基磷灰石上的层析步骤前加入5IU/mL肝素和2U/mL AT-III,观察到12.5L/m2的良好过滤能力和凝固(因此凝血酶活性)的缺乏。
在97E 2312和97E 3012测试中,在超滤步骤前直接将2IU/mL肝素和0.5IU/mL AT-III加入产生自羟基磷灰石上的层析的洗脱物中。产生自具有15nm孔隙度的滤器上的纳米过滤的蛋白质浓缩物不具有任何凝血酶活性。
在98E 0801和98E 1301测试中,超滤前在缺乏肝素的情况下将0.5IU/mL AT-III加入产生自羟基磷灰石上的层析的洗脱物中。在这两种情况下,产生自具有15nm孔隙度的滤器上的纳米过滤的蛋白质浓缩物都不显示任何凝血酶活性。
因此,抗凝血酶III形成本发明的包含凝血酶原复合体的蛋白质浓缩物的凝血酶活性的良好抑制剂。肝素似乎还作为AT-III的辅因子起作用,增强后者的抑制活性。从而在将后者加入羟基磷灰石层析洗脱物中时获得抗凝血酶的最佳效率。事实上,抗凝血酶似乎只非常少量地结合至羟基磷灰石上。
I-通过本发明的方法获得的蛋白质浓缩物和通过包括离子交换树脂上的层析作为羟基磷灰石上的层析的替代的方法获得的浓缩物之间的比较。
表XIX:用离子交换层析作为羟基磷灰石上的层析的替代纯化的PPSB的组合物和本发明的经15N纳米过滤的浓缩物的比较。
表XIX的结果显示,在本发明的范围内进行的陶瓷羟基磷灰石上的层析提供了获得比用第二阴离子交换树脂作为本发明的羟基磷灰石的替代获得的水平大得多的依赖于维生素K的蛋白质的纯化水平。此外,与可通过用第二阴离子交换树脂作为羟基磷灰石的替代产生的浓缩物的仅15%至17%相对,依赖于维生素K的全部因子代表了通过本发明的方法获得的经纳米过滤的浓缩物的总蛋白质的70~80%。
还注意到,组成凝血酶原复合体的凝血因子各自的比值在通过前述两种方法获得的浓缩物中是可比的。
Claims (19)
1.用于制备凝血酶原复合体组合物的方法,其包括以下步骤:
a)提供血浆冷沉物的上清液;
b)将所述上清液应用在阴离子交换树脂上,并洗脱在包含所述复合体和具有高分子量的蛋白质的洗脱物中;
c)将产生自步骤b)的洗脱物应用在羟基磷灰石柱上;
d)洗脱在包含所述复合体的洗脱液中。
2.权利要求1的方法,其包括附加的预洗脱步骤c1),优选用尤其是浓度从0.005~0.05M、有利地从0.01~0.05M、有利地从0.02~0.05M和优选为0.03M的磷酸钠或磷酸钾缓冲液,在包含于6.5和8.5之间、优选约为8的pH值下进行所述预洗脱,所述缓冲液还优选有利地以0.25M的浓度包含NaCl。
3.前述权利要求中任一项的方法,其中用优选0.5M的磷酸钾缓冲液、0.075M NaCl、pH 8进行步骤d)的洗脱。
4.前述权利要求中任一项的方法,其包括至少一个用于产生自步骤b)的洗脱物和/或产生自步骤d)的洗脱物的病毒灭活的附加步骤。
5.权利要求4的方法,其中优选在存在吐温(聚山梨酸酯80)-TnBP混合物的情况下,优选用1%(v/v)聚山梨酸酯80-0.3%(v/v)TnBP混合物,以溶剂-去垢剂处理的形式对产生自步骤b)的洗脱物进行所述至少一个病毒灭活步骤。
6.权利要求4或5中任一项的方法,其包括优选在具有15至100nm孔隙度的滤器上、优选在具有15nm孔隙度的滤器上以纳米过滤的形式对产生自步骤d)的洗脱物进行的至少一个附加的病毒去除步骤。
7.前述权利要求中任一项的方法,其在步骤b)之后和/或步骤d)之后包括至少一个附加的渗滤-超滤步骤。
8.前述权利要求中任一项的方法,其中步骤b)包括在两种不同阴离子交换树脂上实施的两个亚步骤。
9.前述权利要求中任一项的方法,其中步骤b)的阴离子交换树脂具有选自二乙氨基乙烷(DEAE)、聚乙烯亚胺(PEI)和四级氨基乙烷(QAE)的带正电荷的基团,所述阴离子交换树脂优选属于DEAE型。
10.前述权利要求中任一项的方法,其包括在步骤b)之后或步骤d)之后加入凝血酶抑制剂,优选抗凝血酶III或抗凝血酶III和肝素的混合物。
11.前述权利要求中任一项的方法,其中所述组合物进一步包含依赖于维生素K的其他蛋白质,如蛋白质C、S和Z。
12.前述权利要求中任一项的方法,其包括最终的附加配制步骤,优选通过冻干和/或加入佐剂或可药用载体。
13.凝血酶原复合体组合物,其可通过权利要求1至11中任一项的方法获得,且其免疫球蛋白、优选IgM的浓度低于0.1%,和/或其纤维蛋白原浓度低于0.1%,和/或其纤连蛋白浓度低于0.1%,和/或其补体因子浓度低于0.1%。
14.权利要求13的凝血酶原复合体组合物,其FIX的平均比活性为每毫克蛋白质至少4IU。
15.权利要求13或14中任一项的凝血酶原复合体组合物,其进一步包含蛋白质C、蛋白质S和蛋白质Z。
16.权利要求15的凝血酶原复合体组合物,其中,由因子II(FII)、因子VII(FVII)、因子IX(FIX)、因子X(FX)、蛋白质C、蛋白质S和蛋白质Z组成的依赖于维生素K的蛋白质代表了所述组合物总蛋白质的至少80%、优选85%和更优选90%。
17.权利要求13至16中任一项的凝血酶原复合体组合物,其作为药物。
18.权利要求13至16中任一项的凝血酶原复合体组合物,其作为用于治疗和预防与依赖于维生素K的因子的缺乏或与抗维生素K的超剂量相关的出血性事故的药物。
19.权利要求13至16中任一项的凝血酶原复合体组合物,其作为用于治疗和预防与因子II或因子X的组成性或获得性缺乏相关的出血性事故的药物。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| FR09/02723 | 2009-06-05 | ||
| FR0902723A FR2946348B1 (fr) | 2009-06-05 | 2009-06-05 | Procede de preparation d'une composition de complexe prothrombique a haut degre de purete |
| PCT/IB2010/052497 WO2010140140A1 (fr) | 2009-06-05 | 2010-06-04 | Composition de complexe prothrombique |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102459583A true CN102459583A (zh) | 2012-05-16 |
Family
ID=41531870
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2010800250346A Pending CN102459583A (zh) | 2009-06-05 | 2010-06-04 | 凝血酶原复合体组合物 |
Country Status (11)
| Country | Link |
|---|---|
| US (1) | US20120087907A1 (zh) |
| EP (1) | EP2438165A1 (zh) |
| JP (1) | JP2012528850A (zh) |
| KR (1) | KR20120047216A (zh) |
| CN (1) | CN102459583A (zh) |
| AU (1) | AU2010255377A1 (zh) |
| BR (1) | BRPI1009641A2 (zh) |
| CA (1) | CA2764584A1 (zh) |
| FR (1) | FR2946348B1 (zh) |
| IL (1) | IL216395A0 (zh) |
| WO (1) | WO2010140140A1 (zh) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103351432A (zh) * | 2013-07-09 | 2013-10-16 | 武汉中原瑞德生物制品有限责任公司 | 从血浆组分沉淀中提取人凝血因子ⅷ和人纤维蛋白原的工艺 |
| CN105440127A (zh) * | 2015-12-30 | 2016-03-30 | 上海莱士血液制品股份有限公司 | 一种以人血浆Cohn组分III为原料的FEIBA的制备方法 |
| CN106139935A (zh) * | 2016-06-23 | 2016-11-23 | 广州新克力生物科技有限公司 | 一种白细胞和血小板的过滤膜及其制备方法 |
| CN108472406A (zh) * | 2016-01-07 | 2018-08-31 | 艾欧生物医学有限责任公司 | 减少组织粘连的方法、组合物和试剂盒 |
| CN109593747A (zh) * | 2018-12-25 | 2019-04-09 | 山东泰邦生物制品有限公司 | 一种人凝血酶原复合物中间产品液态保存的方法 |
| CN109943554A (zh) * | 2017-12-21 | 2019-06-28 | 舒泰神(北京)生物制药股份有限公司 | 一种从蛇毒中提取凝血因子x激活剂的方法 |
| CN110114074A (zh) * | 2017-02-09 | 2019-08-09 | 德国杰特贝林生物制品有限公司 | 用于治疗或预防出血的凝血因子替代产品 |
Families Citing this family (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| TWI641382B (zh) * | 2013-01-31 | 2018-11-21 | 韓美藥品股份有限公司 | 於包含因子vii之組成物中使病毒失活之方法 |
| CN110835626B (zh) * | 2019-12-04 | 2021-12-21 | 长春雷允上药业有限公司 | 一种凝血酶的制备方法 |
Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101098883A (zh) * | 2004-12-23 | 2008-01-02 | 诺和诺德医疗保健公司 | 减少含有目的维生素k依赖性蛋白质的组合物中的蛋白质污染物的含量 |
| CN101160133A (zh) * | 2004-11-05 | 2008-04-09 | 普罗瑟拉生物公司 | 治疗用途的来自人血浆的内-α抑制剂蛋白质的制备和组合物 |
Family Cites Families (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| DE2902158A1 (de) | 1979-01-20 | 1980-07-31 | Biotest Serum Institut Gmbh | Verfahren zur herstellung von fibrinogen, einem die gerinnungsfaktoren ii, vii, ix und x enthaltenden prothrombinkomplex, antithrombin iii und einer loesung von lagerstabilen serumproteinen |
| DE3101752A1 (de) | 1981-01-21 | 1982-08-26 | Behringwerke Ag, 3550 Marburg | "verfahren zur reinigung der blutgerinnungsfaktoren ii, vii, ix und/oder x und danach hergestellte praeparationen" |
| FR2632524B1 (fr) * | 1988-06-09 | 1992-03-13 | Fondation Nale Transfusion San | Procede de preparation d'une fraction concentree en facteur viia et son application a titre de medicament |
| FR2679251B1 (fr) | 1991-07-18 | 1993-11-12 | Nord Assoc Essor Transfusion San | Procede de preparation d'un concentre de thrombine humaine destine a un usage therapeutique. |
| US5714583A (en) | 1995-06-07 | 1998-02-03 | Genetics Institute, Inc. | Factor IX purification methods |
| ES2241030T3 (es) * | 1996-03-20 | 2005-10-16 | Baxter Aktiengesellschaft | Preparado farmaceutico para el tratamiento de alteraciones de la coagulacion sanguinea. |
| JP2006197464A (ja) | 2005-01-17 | 2006-07-27 | Sharp Corp | 電話システム |
-
2009
- 2009-06-05 FR FR0902723A patent/FR2946348B1/fr not_active Expired - Fee Related
-
2010
- 2010-06-04 US US13/376,316 patent/US20120087907A1/en not_active Abandoned
- 2010-06-04 EP EP10728330A patent/EP2438165A1/fr not_active Withdrawn
- 2010-06-04 CA CA2764584A patent/CA2764584A1/fr not_active Abandoned
- 2010-06-04 KR KR1020117031284A patent/KR20120047216A/ko not_active Application Discontinuation
- 2010-06-04 CN CN2010800250346A patent/CN102459583A/zh active Pending
- 2010-06-04 WO PCT/IB2010/052497 patent/WO2010140140A1/fr active Application Filing
- 2010-06-04 JP JP2012513730A patent/JP2012528850A/ja active Pending
- 2010-06-04 BR BRPI1009641-8A patent/BRPI1009641A2/pt not_active Application Discontinuation
- 2010-06-04 AU AU2010255377A patent/AU2010255377A1/en not_active Abandoned
-
2011
- 2011-11-16 IL IL216395A patent/IL216395A0/en unknown
Patent Citations (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN101160133A (zh) * | 2004-11-05 | 2008-04-09 | 普罗瑟拉生物公司 | 治疗用途的来自人血浆的内-α抑制剂蛋白质的制备和组合物 |
| CN101098883A (zh) * | 2004-12-23 | 2008-01-02 | 诺和诺德医疗保健公司 | 减少含有目的维生素k依赖性蛋白质的组合物中的蛋白质污染物的含量 |
Non-Patent Citations (2)
| Title |
|---|
| KARL B.MCCANN ET AL: "Evaluation of expanded bed adsorption chromatography for extraction of prothrombin complex from cohn supernatant I", 《BIOLOGICALS》, vol. 36, no. 4, 10 March 2008 (2008-03-10), pages 227 - 233, XP022795225, DOI: 10.1016/j.biologicals.2008.01.002 * |
| 刘欣晏 等: "采用两步凝胶吸附法制备人凝血酶原复合物的工艺研究", 《中国生化药物杂志》, vol. 29, no. 1, 31 December 2008 (2008-12-31), pages 26 - 29 * |
Cited By (11)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103351432A (zh) * | 2013-07-09 | 2013-10-16 | 武汉中原瑞德生物制品有限责任公司 | 从血浆组分沉淀中提取人凝血因子ⅷ和人纤维蛋白原的工艺 |
| CN105440127A (zh) * | 2015-12-30 | 2016-03-30 | 上海莱士血液制品股份有限公司 | 一种以人血浆Cohn组分III为原料的FEIBA的制备方法 |
| CN105440127B (zh) * | 2015-12-30 | 2018-10-16 | 上海莱士血液制品股份有限公司 | 一种以人血浆Cohn组分III为原料的FEIBA的制备方法 |
| CN108472406A (zh) * | 2016-01-07 | 2018-08-31 | 艾欧生物医学有限责任公司 | 减少组织粘连的方法、组合物和试剂盒 |
| CN106139935A (zh) * | 2016-06-23 | 2016-11-23 | 广州新克力生物科技有限公司 | 一种白细胞和血小板的过滤膜及其制备方法 |
| CN110114074A (zh) * | 2017-02-09 | 2019-08-09 | 德国杰特贝林生物制品有限公司 | 用于治疗或预防出血的凝血因子替代产品 |
| US11744880B2 (en) | 2017-02-09 | 2023-09-05 | Csl Behring Gmbh | Blood coagulation factor replacement product for use in the treatment or prophylaxis of bleedings |
| CN110114074B (zh) * | 2017-02-09 | 2024-05-28 | 德国杰特贝林生物制品有限公司 | 用于治疗或预防出血的凝血因子替代产品 |
| CN109943554A (zh) * | 2017-12-21 | 2019-06-28 | 舒泰神(北京)生物制药股份有限公司 | 一种从蛇毒中提取凝血因子x激活剂的方法 |
| CN109593747A (zh) * | 2018-12-25 | 2019-04-09 | 山东泰邦生物制品有限公司 | 一种人凝血酶原复合物中间产品液态保存的方法 |
| CN109593747B (zh) * | 2018-12-25 | 2021-08-10 | 山东泰邦生物制品有限公司 | 一种人凝血酶原复合物中间产品液态保存的方法 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2010140140A1 (fr) | 2010-12-09 |
| KR20120047216A (ko) | 2012-05-11 |
| CA2764584A1 (fr) | 2010-12-09 |
| US20120087907A1 (en) | 2012-04-12 |
| EP2438165A1 (fr) | 2012-04-11 |
| AU2010255377A1 (en) | 2011-12-15 |
| JP2012528850A (ja) | 2012-11-15 |
| BRPI1009641A2 (pt) | 2015-08-18 |
| IL216395A0 (en) | 2012-01-31 |
| FR2946348A1 (fr) | 2010-12-10 |
| FR2946348B1 (fr) | 2011-08-05 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102459583A (zh) | 凝血酶原复合体组合物 | |
| AU2010277491B2 (en) | Method for purifying recombinant ADAMTS13 and other proteins and compositions thereof | |
| JP4101309B2 (ja) | 治療的用途のためのヒトトロンビン濃厚液の製造法 | |
| AU645172B2 (en) | Process for an industrial-scale preparation of a standardized human von Willebrand factor concentrate of very high purity and suitable for therapeutic use | |
| EP2129686B1 (en) | Methods for industrial scale production of therapeutic complement factor h preparations from human plasma | |
| EP2928905B1 (en) | A method of purifying therapeutic proteins | |
| JPS62289182A (ja) | 新規なプラズミノゲン活性化物 | |
| JP3976351B2 (ja) | 免疫寛容プロトロンビン複合体の調製 | |
| WO1996013274A1 (en) | Process for production of inhibited forms of activated blood factors | |
| AU743102B2 (en) | Pharmaceutical substance containing various vitamin K-dependent factors | |
| EP2152867B1 (en) | Methods for preparing Factor X, activated Factor X, inactivated Factor X and inactivated Factor Xa | |
| Michalski et al. | Preparation and properties of a therapeutic inter-alpha-trypsin inhibitor concentrate from human plasma | |
| EP0573605B1 (en) | Preparation of factor ix | |
| US6034222A (en) | Method for the separation of recombinant pro-factor IX from recombinant factor IX | |
| DK147408B (da) | Fremgangsmaade til udvinding af thrombinagtige enzymer fra slangegifte eller slangegiftfraktioner | |
| MX2007014571A (es) | Purificacion de trombina. | |
| WO2014089954A1 (zh) | 一种制备抗凝血酶的方法 | |
| TW565453B (en) | Method for purifying antithrombin-III | |
| Wickerhauser et al. | A Single‐Step Method for the Isolation of Antithrombin III 1, 2 | |
| CN103893135B (zh) | 一种人血浆蛋白c的冻干稳定剂组合物及其用途 | |
| US9181323B2 (en) | Method for preparing a concentrate of factor XI | |
| RU2814332C1 (ru) | Способ криоконсервации промежуточного продукта фактора viii свертывания крови | |
| CN114395032A (zh) | 一种从血浆中提取人抗凝血酶ⅲ的方法 | |
| Grancha et al. | Factor IX | |
| WO2000043412A1 (fr) | Compositions contenant du cofacteur ii de l'heparine hautement purifie et technique de separation associee |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20120516 |