CN102369195B - 自分泌运动因子抑制剂 - Google Patents
自分泌运动因子抑制剂 Download PDFInfo
- Publication number
- CN102369195B CN102369195B CN201080015468.8A CN201080015468A CN102369195B CN 102369195 B CN102369195 B CN 102369195B CN 201080015468 A CN201080015468 A CN 201080015468A CN 102369195 B CN102369195 B CN 102369195B
- Authority
- CN
- China
- Prior art keywords
- phenyl
- compound
- acid
- chloro
- cancer
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Expired - Fee Related
Links
- JIZOIALDBBFIQI-UHFFFAOYSA-N Cc1ccc2nc(NC)[s]c2c1 Chemical compound Cc1ccc2nc(NC)[s]c2c1 JIZOIALDBBFIQI-UHFFFAOYSA-N 0.000 description 2
- QBMOHSQEEHHIAG-UHFFFAOYSA-N Cc(cc1)cc2c1c(C(N)=O)c(N)[nH]2 Chemical compound Cc(cc1)cc2c1c(C(N)=O)c(N)[nH]2 QBMOHSQEEHHIAG-UHFFFAOYSA-N 0.000 description 1
- KOIFCAYHHFHORZ-UHFFFAOYSA-N Cc1ccc2c(C(N)=O)c(NC)[nH]c2c1 Chemical compound Cc1ccc2c(C(N)=O)c(NC)[nH]c2c1 KOIFCAYHHFHORZ-UHFFFAOYSA-N 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/435—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom
- A61K31/4353—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems
- A61K31/4365—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with one nitrogen as the only ring hetero atom ortho- or peri-condensed with heterocyclic ring systems the heterocyclic ring system having sulfur as a ring hetero atom, e.g. ticlopidine
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/04—Ortho-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D495/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms
- C07D495/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having sulfur atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D495/04—Ortho-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Animal Behavior & Ethology (AREA)
- Life Sciences & Earth Sciences (AREA)
- Pharmacology & Pharmacy (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Immunology (AREA)
- Neurology (AREA)
- Biomedical Technology (AREA)
- Neurosurgery (AREA)
- Heart & Thoracic Surgery (AREA)
- Cardiology (AREA)
- Rheumatology (AREA)
- Ophthalmology & Optometry (AREA)
- Dermatology (AREA)
- Hospice & Palliative Care (AREA)
- Oncology (AREA)
- Hematology (AREA)
- Psychiatry (AREA)
- Transplantation (AREA)
- Pain & Pain Management (AREA)
- Urology & Nephrology (AREA)
- Vascular Medicine (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Epidemiology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Heterocyclic Carbon Compounds Containing A Hetero Ring Having Oxygen Or Sulfur (AREA)
- Plural Heterocyclic Compounds (AREA)
- Nitrogen Condensed Heterocyclic Rings (AREA)
Abstract
本发明涉及作为自分泌运动因子抑制剂的式(I)化合物以及所述化合物在治疗和/或预防生理和/或病理状况中的用途,所述状况由溶血磷脂酸水平升高和/或自分泌运动因子的活化引起、介导和/或传播,尤其是不同的癌症。
Description
说明
技术领域
本发明涉及作为自分泌运动因子抑制剂的化合物和所述化合物在治疗和/或预防生理和/或病理状况中的用途,所述状况由溶血磷脂酸水平升高和/或自分泌运动因子的活化引起、介导和/或传播,尤其是不同的癌症。
现有技术
自分泌运动因子(ATX)是对卵巢癌患者腹水和血浆中溶血磷脂酸(LPA)水平的升高显然负有责任的酶(Xu等人,Clinical Cancer Research1995,1:1223;Xu等人,Biochem.J.1995,309:933),因为其将溶血磷脂胆碱(LPC)转化为LPA(Tokumura等人,J.Biol.Chem.2002,277:39436;Umezu-Gozo等人,J.Biol.Chem.2002,158:227)。
LPA是细胞内脂类介质,其影响多种生物和生化过程,例如平滑肌收缩、血小板聚集和细胞凋亡(Tigyi等人,Prog.Lipid Res.2003,42:498;Mills等人,Nat.Rev.Cancer 2003,3:582;Lynch等人,Prost.Lipid Med.2001,64:33)。此外,还可在来自早期和晚期卵巢癌患者的血浆和腹水中发现浓度升高的LPA。
LPA已显示能促进肿瘤细胞增殖、生存、转移和对相邻组织的侵入(其可导致转移灶的形成)(Xu等人,Clinical Cancer Research 1995,1:1223;Xu等人,Biochem.J.1995,309:933)。这些生物学和病理生物学过程由LPA活化G蛋白偶联受体而开启(Contos等人,Mol.Pharm.2000,58:1188)。
LPA水平升高、改变的受体表达和改变的LPA响应可导致卵巢癌的起始、进展和成形。此外LPA也可能与前列腺癌、乳腺癌、黑色素瘤、头颈癌、肠癌和甲状腺癌有关。
由于这些原因,在治疗肿瘤患者过程中降低LPA水平是合乎需要的。这可通过抑制参与LPA生物合成的酶而实现,所述酶例如是自分泌运动因子(ATX,Sano等,2002,J.Biol.Chem.第277卷,第21197页和Aoki等,2003,J.Biol.Chem.第277卷,第48737页)。
ATX属于核苷酸焦磷酸酶和磷酸二酯酶家族(Goding等人,Immunol.Rev.1998,161:11),代表了抗肿瘤治疗的一个重要起点(Mills等人,Nat.Rev.Cancer 2003,3:582;Goto等人,J.Cell.Biochem.2004,92:1115),因为它在肿瘤中表达升高并且引起肿瘤细胞增殖及侵入相邻组织,其可导致转移灶的形成(Nam等人,2000,Oncogene,卷19Seite 241)。此外,ATX与其它抗血管生成因子一起导致血管生成期间的血管形成(Nam等人,Cancer Res.2001,61:6938)。血管生成是肿瘤生长中的重要过程,其保证了肿瘤的营养供应。由于这一原因,抑制血管生成是癌症和肿瘤治疗中的重要起点,通过它可使肿瘤饥饿(Folkman,Nature Reviews Drug Discovery2007,6:273-286)。
诱变研究表明ATX的PDE结构域在产生LPA中的必要功能。虽然该PDE结构域与其他已知的PDE基本上不具有同源性,但认为是可通过NCE制药的。
在本文中,当与伤口愈合有关的LPA通过另一种途径产生时,预期ATX的抑制不会产生严重的不良反应。
由于ATX是一个相对较新的靶点,关于蛋白形成、体内和体外试验的临床数据量相对有限。尚未描述过靶点依赖的细胞模型,但LPA本身是ATX体内和体外抑制的良好生物标记物。还没有结构信息或参照化合物。
Peng等人(Bioorganic&Medicinal Chemistry Letters 2007,17:1634-1640)描述了能够抑制自分泌运动因子的化合物。在该文中描述的化合物是脂质类似物,其与本发明的化合物不具有任何结构相似性。
其他现有技术文件如下:
DE 19834751涉及作为凝血酶抑制剂、抗凝血剂或中间体的杂双环取代的(杂)芳族脒类或腈类。该专利申请未提及自分泌运动因子的抑制。
WO 99/24035公开了作为蛋白质酪氨酸激酶抑制剂的苯并噻唑羧酰胺。该专利申请未提及自分泌运动因子的抑制。
WO 2002/102380描述了作为因子Xa抑制剂的单环或双环碳环和杂环。该专利申请未提及自分泌运动因子的抑制。
WO 2003/097615涉及诸如糖尿病性神经病变的纤维增殖性疾病的治疗,包括鉴定选择性结合转化生长因子β激酶受体的非肽类小分子,并将该分子施用给个体。该专利申请未提及自分泌运动因子的抑制。
US 2003/0139431涉及喹唑啉和喹啉-胍衍生物在治疗欲望性尿失禁、疼痛、记忆障碍、内分泌障碍、精神病行为、糖尿病、高血压和胃肠道障碍中的用途。该专利申请未提及自分泌运动因子的抑制。
WO 2004/099192描述了杂环取代的羧酸,其可用于治疗代谢障碍。该专利申请未提及自分泌运动因子的抑制。
WO 2005/003100涉及喹唑啉衍生物在治疗微管蛋白抑制剂介导的疾病中的用途,所述疾病例如癌症、自身免疫病、自身免疫淋巴细胞增生综合症、炎症和病毒感染。该专利申请未提及自分泌运动因子的抑制。
WO 2005/023761涉及可用于治疗类风湿性关节炎和溃疡性结肠炎的细胞因子抑制剂。该专利申请未提及自分泌运动因子的抑制。
WO 2006/062972公开了作为凝血连锁的丝氨酸蛋白酶的选择性抑制剂的杂环化合物,可用于治疗动脉心血管血栓性障碍、血栓障碍、不稳定心绞痛和急性冠状动脉综合症。该专利申请未提及自分泌运动因子的抑制。
WO 2006/066879涉及作为电压门控钾通道调节剂的苯并杂环化合物。该专利申请未提及自分泌运动因子的抑制。
WO 2006/072828涉及作为PDE抑制剂、尤其是PDE10抑制剂的杂芳族喹啉化合物。这些化合物可用于治疗中枢神经系统障碍,例如精神障碍、焦虑症、运动失调、心境障碍和神经变性障碍。该专利申请未提及自分泌运动因子的抑制。
WO 2006/074147描述了作为caspase-3级联活化剂的4-芳基氨基-喹唑啉,可用于治疗癌症、自身免疫病、自身免疫淋巴细胞增生综合症、滑膜细胞增生、炎症和病毒感染。该专利申请未提及自分泌运动因子的抑制。
WO 2006/099379公开了作为β分泌酶抑制剂的苯并咪唑、苯并噁唑和苯并噻唑衍生物。该专利申请未提及自分泌运动因子的抑制。
WO 2006/108107涉及作为类固醇激素核受体调节剂的二芳基胺衍生物,其可用于治疗低钾血症、高血压、充血性心力衰竭、肾衰竭、动脉粥样硬化和肥胖。该专利申请未提及自分泌运动因子的抑制。
WO 2007/030582涉及作为钾通道1功能抑制剂的烷基胺化合物,其可用于治疗心律失常、心房颤动、心房扑动、室上性心律失常、胃肠道障碍、食管炎和哮喘。该专利申请未提及自分泌运动因子的抑制。
WO 2007/076034描述了作为丙型肝炎病毒复制抑制剂的稠合双环芳烃化合物,其可用于治疗丙型肝炎或其他病毒感染。该专利申请未提及自分泌运动因子的抑制。
WO 2007/110868公开了具有多巴胺受体、优选D4受体拮抗活性和/或PDE5抑制活性的新杂环化合物。这些化合物可用于治疗性欲下降、性高潮障碍和勃起障碍。该专利申请未提及自分泌运动因子的抑制。
WO 2008/038051涉及用于治疗炎症或免疫性疾病、例如囊性纤维化的杂环化合物,该专利申请未提及自分泌运动因子的抑制。
WO 2008/038053涉及作为电压依赖的钾通道抑制剂的杂环化合物。该专利申请未提及自分泌运动因子的抑制。
WO 2008/060621涉及作为趋化因子受体拮抗剂的氨基吡咯烷。该专利申请未提及自分泌运动因子的抑制。
WO 2008/091580涉及用于控制由真菌病原体引起的植物病的杀菌酰胺。该专利申请未提及自分泌运动因子的抑制。
本申请中对任何参考文献的引用不表示该参考文献是本申请相关的现有技术。
发明内容
本发明的目的是提供新的自分泌运动因子抑制剂。
在一方面,令人惊讶的,通过提供式(I)的化合物,本发明的目的得以解决
其中:
W1、W2一起独立形成“-N=N-、-C(O)-O-、-C(O)-S-、-C(O)-N(R5)-、-C(O)-C(R6)(R7)-、-N=C[N(R8)(R9)]-”;
Y1独立的选自“-C(O)-、-C(S)-、-N(R10)-C(O)-、-C(O)-N(R11)-、-C(R12)(R13)-、单键”;
Y2独立的选自“-C(R14)(R15)-、-O-、-N(R16)-、-C(O)-NH-、单键”;
Z1独立的选自“O、S、N(R17)”;
L独立的选自下列基团:
B独立的选自“环烷基、杂环基、芳基、杂芳基”,其中“环烷基、杂环基、芳基、杂芳基”可被一个或多个下列相同或不同的取代基独立地取代:“(i),,氢、烷基、(C9-C30)烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、芳基、芳基烷基、杂芳基、杂芳基烷基、卤素、-F、-Cl、-Br、-I、-CN、-CF3、-N3、-NH2、-NHX1、-NX2X3、-NO2、-OH、-OCF3、-SCF3、-SH、-O-SO3H、-OP(O)(OH)2、-CHO、-COOH、-C(O)NH2、-SO3H、-P(O)(OH)2、-C(O)-X4、-C(O)O-X5、-C(O)NH-X6、-C(O)NX7X8、-O-X9、-O(-X10-O)a-H(a=1、2、3、4、5)、-O(-X11-O)b-X12(b=1、2、3、4、5)、-OC(O)-X13、-OC(O)-O-X14、-OC(O)-NHX15、-O-C(O)-NX16X17、-OP(O)(OX18)(OX19)、-OSi(X20)(X21)(X22)、-OS(O2)-X23、-NHC(O)-NH2、-NHC(O)-X24、-NX25C(O)-X26、-NH-C(O)-O-X27、-NH-C(O)-NH-X28、-NH-C(O)-NX29X30、-NX31-C(O)-O-X32、-NX33-C(O)-NH-X34、-NX35-C(O)-NX36X37、-NHS(O2)-X38、-NX39S(O2)-X40、-S-X41、-S(O)-X42、-S(O2)-X43、-S(O2)NH-X44、-S(O2)NX45X46、-S(O2)O-X47、-P(O)(OX48)(OX49)、-Si(X50)(X51)(X52)、-C(NH)-NH2、-C(NX53)-NH2、-C(NH)-NHX54、-C(NH)-NX55X56、-C(NX57)-NHX58、-C(NX59)-NX60X61、-NH-C(O)-NH-O-X62、-NH-C(O)-NX63-O-X64、-NX65-C(O)-NX66-O-X67、-N(-C(O)-NH-O-X68)2、-N(-C(O)-NX69-O-X70)2、-N(-C(O)-NH-O-X71)(-C(O)-NX72-O-X73)、-C(S)-X74、-C(S)-O-X75、-C(S)-NH-X76、-C(S)-NX77X78、-C(O)-NH-O-X79、-C(O)-NX80-O-X81、-C(S)-NH-O-X82、-C(S)-NX83-O-X84、-C(O)-NH-NH-X85、-C(O)-NH-NX86X87、-C(O)-NX88-NX89X90、-C(S)-NH-NH-X91、-C(S)-NH-NX92X93、-C(S)-NX94-NX95X96、-C(O)-C(O)-O-X97、-C(O)-C(O)-NH2、-C(O)-C(O)-NHX98、-C(O)-C(O)-NX99X100、-C(S)-C(O)-O-X101、-C(O)-C(S)-O-X102、-C(S)-C(S)-O-X103、-C(S)-C(O)-NH2、-C(S)-C(O)-NHX104、-C(S)-C(O)-NX105X106、-C(S)-C(S)-NH2、-C(S)-C(S)-NHX107、-C(S)-C(S)-NX108X109、-C(O)-C(S)-NH2、-C(O)-C(S)-NHX110、-C(O)-C(S)-NX111X112”;
其中X1、X2、X3、X4、X5、X6、X7、X8、X9、X10、X11、X12、X13、X14、X15、X16、X17、X18、X19、X20、X21、X22、X23、X24、X25、X26、X27、X28、X29、X30、X31、X32、X33、X34、X35、X36、X37、X38、X39、X40、X41、X42、X43、X44、X45、X46、X47、X48、X49、X50、X51、X52、X53、X54、X55、X56、X57、X58、X59、X60、X61、X62、X63、X64、X65、X66、X67、X68、X69、X70、X71、X72、X73、X74、X75、X76、X77、X78、X79、X80、X81、X82、X83、X84、X85、X86、X87、X88、X89、X90、X91、X92、X93、X94、X95、X96、X97、X98、X99、X100、X101、X102、X103、X104、X105、X106、X107、X108、X109、X110、X111、X112各自独立的选自:“烷基、(C9-C30)烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、芳基、芳基烷基、杂芳基、杂芳基烷基”,并且其中可选的,X7、X8和/或X16、X17和/或X29、X30和/或X36、X37和/或X45、X46和/或X55、X56和/或X60、X61和/或X77、X78和/或X86、X87和/或X89、X90和/或X92、X93和/或X95、X96和/或X99、X100和/或X105、X106和/或X108、X109和/或X111、X112各自可一起形成“杂环基”;
其中任选的,上述取代基组(i)的取代基可彼此独立地再被一个或多个相同或不同的取代基V取代:
R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13、R14、R15、R16、R17各自独立的选自基团:“V”;
V独立的选自:“(i),,氢、烷基、(C9-C30)烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、芳基、芳基烷基、杂芳基、杂芳基烷基、卤素、-F、-Cl、-Br、-I、-CN、-CF3、-N3、-NH2、-NHA1、-NA2A3、-NO2、-OH、-OCF3、-SCF3、-SH、-O-SO3H、-OP(O)(OH)2、-CHO、-COOH、-C(O)NH2、-SO3H、-P(O)(OH)2、-C(O)-A4、-C(O)O-A5、-C(O)NH-A6、-C(O)NA7A8、-O-A9、-O(-A10-O)a-H(a=1、2、3、4、5)、-O(-A11-O)b-A12(b=1、2、3、4、5)、-OC(O)-A13、-OC(O)-O-A14、-OC(O)-NHA15、-O-C(O)-NA16A17、-OP(O)(OA18)(OA19)、-OSi(A20)(A21)(A22)、-OS(O2)-A23、-NHC(O)-NH2、-NHC(O)-A24、-NA25C(O)-A26、-NH-C(O)-O-A27、-NH-C(O)-NH-A28、-NH-C(O)-NA29A30、-NA31-C(O)-O-A32、-NA33-C(O)-NH-A34、-NA35-C(O)-NA36A37、-NHS(O2)-A38、-NA39S(O2)-A40、-S-A41、-S(O)-A42、-S(O2)-A43、-S(O2)NH-A44、-S(O2)NA45A46、-S(O2)O-A47、-P(O)(OA48)(OA49)、-Si(A50)(A51)(A52)、-C(NH)-NH2、-C(NA53)-NH2、-C(NH)-NHA54、-C(NH)-NA55A56、-C(NA57)-NHA58、-C(NA59)-NA60A61、-NH-C(O)-NH-O-A62、-NH-C(O)-NA63-O-A64、-NA65-C(O)-NA66-O-A67、-N(-C(O)-NH-O-A68)2、-N(-C(O)-NA69-O-A70)2、-N(-C(O)-NH-O-A71)(-C(O)-NA72-O-A73)、-C(S)-A74、-C(S)-O-A75、-C(S)-NH-A76、-C(S)-NA77A78、-C(O)-NH-O-A79、-C(O)-NA80-O-A81、-C(S)-NH-O-A82、-C(S)-NA83-O-A84、-C(O)-NH-NH-A85、-C(O)-NH-NA86A87、-C(O)-NA88-NA89A90、-C(S)-NH-NH-A91、-C(S)-NH-NA92A93、-C(S)-NA94-NA95A96、-C(O)-C(O)-O-A97、-C(O)-C(O)-NH2、-C(O)-C(O)-NHA98、-C(O)-C(O)-NA99A100、-C(S)-C(O)-O-A101、-C(O)-C(S)-O-A102、-C(S)-C(S)-O-A103、-C(S)-C(O)-NH2、-C(S)-C(O)-NHA104、-C(S)-C(O)-NA105A106、-C(S)-C(S)-NH2、-C(S)-C(S)-NHA107、-C(S)-C(S)-NA108A109、-C(O)-C(S)-NH2、-C(O)-C(S)-NHA110、-C(O)-C(S)-NA111A112”;
其中A1、A2、A3、A4、A5、A6、A7、A8、A9、A10、A11、A12、A13、A14、A15、A16、A17、A18、A19、A20、A21、A22、A23、A24、A25、A26、A27、A28、A29、A30、A31、A32、A33、A34、A35、A36、A37、A38、A39、A40、A41、A42、A43、A44、A45、A46、A47、A48、A49、A50、A51、A52、A53、A54、A55、A56、A57、A58、A59、A60、A61、A62、A63、A64、A65、A66、A67、A68、A69、A70、A71、A72、A73、A74、A75、A76、A77、A78、A79、A80、A81、A82、A83、A84、A85、A86、A87、A88、A89、A90、A91、A92、A93、A94、A95、A96、A97、A98、A99、A100、A101、A102、A103、A104、A105、A106、A107、A108、A109、A110、A111、A112各自独立的选自:“烷基、(C9-C30)烷基、环烷基、环烷基烷基、杂环基、杂环基烷基、芳基、芳基烷基、杂芳基、杂芳基烷基”,并且其中可选的,A7、A8和/或A16、A17和/或A29、A30和/或A36、A37和/或A45、A46和/或A55、A56和/或A60、A61和/或A77、A78和/或A86、A87和/或A89、A90和/或A92、A93和/或A95、A96和/或A99、A100和/或A105、A106和/或A108、A109和/或A111、A112各自可一起形成“杂环基”;
其中任选的,上述取代基组(i)的取代基可彼此独立地再被一个或多个相同或不同的取代基V取代;
n独立的为0、1、2、3或4;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
被选自下列的化学基团独立的取代:
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
W1、W2一起独立的构成“-N=N-、-C(O)-O-”;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
Y1独立的选自“-C(O)-、-N(R10)-C(O)-、-C(O)-N(R11)-、-OC(O)-、单键”;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
Z1独立的是“O”;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
B独立的选自“4-氯-苯基、3-三氟甲基-苯基、4-三氟甲基-苯基、4-三氟甲基硫基-苯基、4-三氟甲氧基-苯基、3-氯-4-三氟甲氧基-苯基、3,5-双-三氟甲基-苯基、4-异丙基苯基、4-叔丁基-苯基、3,5-二氯-苯基、4-氯-2-氟-苯基、3-氯-苯基、2-氟-5-三氟甲基-苯基、3-氯-4-三氟甲基-苯基、3,4-二氯-苯基、2,5-二氯-苯基、2-甲氧基-苯基、4-甲氧基-苯基、4-硝基-苯基、4-溴-苯基、5-氯-2-甲氧基-苯基、4-氟-苯基、3-溴-4-氟-苯基、6-甲氧基-1,2,3,4-四氢-萘-2-基”;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13、R14、R15各自独立的选自:“氢、烷基、甲基、异丙基、叔丁基、卤素、-F、-Br、-Cl、-CN、-CF3、-SF3、-OF3、-O-烷基、-O-甲基、-NO2、-S(O)2-甲基”;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
V独立的选自“氢、烷基、甲基、异丙基、叔丁基、卤素、-F、-Br、-Cl、-CN、-CF3、-SF3、-OH、-O-烷基、-O-甲基、-NO2、-S(O)2-甲基”;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
n独立的是0、1或2;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在另一个优选的实施方案中,提供了根据式(I)和上述实施方案的化合物,其中:
W1、W2一起独立的构成“-N=N-、-C(O)-O-”;
Y1独立的选自“-C(O)-、-N(R10)-C(O)-、-C(O)-N(R11)-、-OC(O)-、单键”;
Z1独立的是“O”;
B独立的选自“4-氯-苯基、3-三氟甲基-苯基、4-三氟甲基-苯基、4-三氟甲基硫基-苯基、4-三氟甲氧基-苯基、3-氯-4-三氟甲氧基-苯基、3,5-双-三氟甲基-苯基、4-异丙基苯基、4-叔丁基-苯基、3,5-二氯-苯基、4-氯-2-氟-苯基、3-氯-苯基、2-氟-5-三氟甲基-苯基、3-氯-4-三氟甲基-苯基、3,4-二氯-苯基、2,5-二氯-苯基、2-甲氧基-苯基、4-甲氧基-苯基、4-硝基-苯基、4-溴-苯基、5-氯-2-甲氧基-苯基、4-氟-苯基、3-溴-4-氟-苯基、6-甲氧基-1,2,3,4-四氢-萘-2-基”;
R1、R2、R3、R4、R5、R6、R7、R8、R9、R10、R11、R12、R13、R14、R15各自独立的选自“氢、烷基、甲基、异丙基、叔丁基、卤素、-F、-Br、-Cl、-CN、-CF3、-SF3、-OF3、-O-烷基、-O-甲基、-NO2、-S(O)2-甲基”;
V独立的选自“氢、烷基、甲基、异丙基、叔丁基、卤素、-F、-Br、-Cl、-CN、-CF3、-SF3、-OH、-O-烷基、-O-甲基、-NO2、-S(O)2-甲基”;
n独立的是0、1或2;
及其生理上可接受的盐、衍生物、前药、溶剂化物和立体异构体,包括它们所有比例的混合物。
在另一方面,令人惊讶的,通过提供选自下列的化合物,本发明的目的得以解决:
为避免疑问,如果上述化合物的化学名称和化学结构不对应,则以化学结构来正确定义所述化合物。
所有上述一般或具体公开的化合物,包括本文公开的的式(I)和化合物1-63的优选的亚组/实施方案在下文中是指本发明的化合物。
本文中用于定义化合物、尤其是本发明化合物的命名总体上基于IUPAC组织关于化学化合物、尤其是有机化合物的规则。
除非在说明书或权利要求书中另外说明,本发明中用于解释上述化合物的术语具有以下含义:
术语“未取代的”表示相应的基团或部分没有取代基。
术语“被取代的”表示相应的基团或部分具有一个或多个取代基,当一个基团具有多个取代基,并说明了对不同取代基的具体选择时,取代基的选择彼此独立,不必是相同的。
本发明中,术语“烷基”或“A”以及其他具有前缀“alk”的基团是指非环状的饱和或不饱和烃基,其可以是直链或支链的,优选含有1-8个碳原子,即C1-C8-链烷基、C2-C8-链烯基和C2-C8-炔基。链烯基具有至少一个C-C双键,炔基具有至少一个C-C叁键。炔基还可具有至少一个额外的C-C双键。适当的烷基的实例有甲基、乙基、正丙基、异丙基、正丁基、异丁基、仲丁基、叔丁基、正戊基、异戊基、新戊基、叔戊基、2-或3-甲基-戊基、正己基、2-己基、异己基、正庚基、正辛基、正壬基、正癸基、正十一烷基、正十二烷基、正十四烷基、正十六烷基、正十八烷基、正二十烷基、正二十二烷基、乙烯基、丙烯基(-CH2CH=CH2;-CH=CH-CH3;-C(=CH2)-CH3)、丁烯基、戊烯基、己烯基、庚烯基、辛烯基、辛二烯基、十八碳烯基、十八碳-9-烯基、二十碳烯基、二十碳-11-烯基、(Z)-二十碳-11-烯基、二十二碳烯基、二十二碳-13-烯基、(Z)-二十二碳-13-烯基、乙炔基、丙炔基(-CH2-C≡CH、-C≡C-CH3)、丁炔基、戊炔基、己炔基、庚炔基、辛炔基。尤其优选的是C1-4-烷基。C1-4-烷基例如为甲基、乙基、丙基、异丙基、丁基、异丁基、叔丁基。
当用于本发明中,术语“(C9-C30)烷基”是指非环状的饱和或不饱和烃基,其可以是支链或直链的,具有9-30个碳原子,即C9-30-链烷基、C9-30-链烯基和C9-30-炔基。C9-30-链烯基具有至少一个C-C双键,C9-30-炔基具有至少一个C-C叁键。C9-30-炔基还可具有至少一个额外的C-C双键。适当的(C9-C30)烷基实例有十四烷基、十六烷基、十八烷基、二十烷基、顺-13-二十二碳烯基(芥醇基)、反-13-二十二碳烯基(巴惟醇基)、顺-15-二十四碳烯基(神经苷脂基)和反-15-二十四碳烯基。
当用于本发明中,术语“环烷基”是指饱和与部分不饱和的非芳族的环烃基团/基,具有1-3个环,含有3-20、优选3-12、最优选3-8个碳原子。环烷基也可以是双环或多环系统的部分,其中,例如所述环烷基与本文所述芳基、杂芳基或杂环基通过任何可能和需要的环成员进行稠合。与所述通式的化合物的结合可通过环烷基的任意可能的环成员进行。适当的环烷基的例子有环丙基、环丁基、环戊基、环己基、环庚基、环辛基、环癸基、环己烯基、环戊烯基、环辛二烯基。尤其优选的是C3-C9-环烷基和C4-C8-环烷基。C4-C8-环烷基例如为环丁基、环戊基、环己基、环庚基、环辛基。
当用于本发明中,术语“杂环基”是指3-20、优选5或6至14个环原子的单或多环系统,所述环原子包括碳原子和1、2、3、4或5个杂原子,尤其是氮、氧和/或硫,其是相同或不同的。环系统可以是饱和的、单或多不饱和的,但不能是芳族的。在所述环系统包含至少两个环时,所述环可以稠合或螺合或以其他方式连接。这种“杂环基”可以通过任何环成员连接。术语“杂环基”还包括杂环是双或多环饱和、部分不饱和和/或芳族系统中的一部分的系统,例如杂环基与本文定义的“芳基”、“环烷基”、“杂芳基”或“杂环基”通过所述杂环基任何需要的和可能的环成员进行连接。与所述通式的化合物结合可通过杂环基的任意可能的环成员进行。合适的“杂环基”的实例有吡咯烷基、硫杂吡咯烷基、哌啶基、哌嗪基、氧杂哌嗪基、氧杂哌啶基、噁二唑基、四氢呋喃基、咪唑烷基、噻唑烷基、四氢吡喃基、吗啉基、四氢噻吩基、二氢吡喃基、二氢吲哚基、二氢吲哚基甲基、咪唑烷基、2-氮杂-双环[2.2.2]辛烷基。
当用于本发明中,术语“芳基”是指具有3-14、优选5-14、更优选6-10个碳原子的单环或多环芳烃系统。术语“芳基”还包括芳环是双或多环饱和、部分不饱和和/或芳族系统中的一部分的系统,例如芳环与本文定义的“芳基”、“环烷基”、“杂芳基”或“杂环基”通过所述芳基任何需要的和可能的环成员进行连接。与所述通式的化合物结合可通过芳基的任意可能的环成员进行。适当的芳基实例有苯基、联苯基、萘基、1-萘基、2-萘基和蒽基、以及茚满基、茚基或1,2,3,4-四氢萘基。最优选的芳基是苯基。
当用于本发明中,术语“杂芳基”是指具有3-15、优选5-14、更优选5-、6-、7-元单环或多环芳烃系统,其包含至少一个,在适当的时候2、3、4或5个杂原子,优选是氮、氧和/或硫,所述杂原子是相同或不同的。氮原子的数目优选为0、1、2或3,氧和硫原子的数目独立地为0或1。术语“杂芳基”还包括芳环是双或多环饱和、部分不饱和和/或芳族系统中的一部分的系统,例如芳环与本文定义的“芳基”、“环烷基”、“杂芳基”或“杂环基”通过所述杂芳基任何需要的和可能的环成员进行连接。与所述通式的化合物结合可通过杂芳基的任意可能的环成员进行。适当的杂芳基实例有吖啶基、苯并二噁烯基、苯并咪唑基、苯并异噁唑基、苯并二氧杂环戊烯基、苯并呋喃基、苯并噻二唑基、苯并噻唑基、苯并噻吩基、苯并噁唑基、卡唑基、噌啉基、二苯并呋喃基、二氢苯并噻吩基、呋喃基、呋咱基、呋喃基、咪唑基、吲唑基、二氢吲哚基、吲嗪基、吲哚基、异苄基呋喃基、异吲哚基、异喹啉基、异喹啉基、异噻唑基、异噁唑基、萘啶基、噁二唑基、噁唑基、吩嗪基、吩噻嗪基、吩噁嗪基、酞嗪基、蝶啶基、嘌呤基、吡嗪基、吡唑基、哒嗪基、吡啶基、吡啶基、嘧啶基、嘧啶基、吡咯基、喹唑啉基、喹啉基、喹啉基、喹喔啉基、四唑基、噻二唑基、噻唑基、噻吩基、噻吩基、三嗪基、三唑基。
当用于本发明中,术语“烷基-环烷基”、“环烷基烷基”、“烷基-杂环基”、“杂环基烷基”、“烷基-芳基”、“芳基烷基”、“烷基-杂芳基”和“杂芳基烷基”表示烷基、环烷基、杂环基、芳基和杂芳基如前文所定义,并且所述环烷基、杂环基、芳基和杂芳基通过烷基与所述通式的化合物连接,所述烷基优选C1-C8-烷基,更优选C1-C4-烷基。
当用于本发明中,术语“烷基氧基”或“烷氧基”是指与氧原子相连的前文所定义的烷基。其与所述通式化合物的连接通过氧原子进行。实例有甲氧基、乙氧基和正丙氧基、丙氧基、异丙氧基。优选的是具有所述碳原子数的“C1-C4-烷氧基”。
当用于本发明中,术语“环烷基氧基”或“环烷氧基”是指与氧原子连接的前文所定义的环烷基。其与所述通式化合物的连接通过氧原子进行。实例有环丙氧基、环丁氧基、环戊氧基、环己氧基、环庚氧基、环辛氧基。优选的是具有所述碳原子数的“C3-C9环烷氧基”。
当用于本发明中,术语“杂环氧基”是指与氧原子连接的前文所定义的杂环基。其与所述通式化合物的连接通过氧原子进行。实例有吡咯烷氧基、硫杂吡咯烷氧基、哌啶氧基、哌嗪氧基。
当用于本发明中,术语“芳氧基”是指与氧原子连接的前文所定义的芳基。其与所述通式化合物的连接通过氧原子进行。实例有苯氧基、2-萘氧基、1-萘氧基、联苯氧基、茚满氧基。优选的是苯氧基。
当用于本发明中,术语“杂芳氧基”是指与氧原子连接的前文所定义的杂芳基。其与所述通式化合物的连接通过氧原子进行。实例有吡咯基氧基、噻吩基氧基、呋喃基氧基、咪唑基氧基、噻唑基氧基。
当用于本发明中,术语“羰基”或“羰基部分”是指-C(O)-基团。
当用于本发明中,术语“烷基羰基”是指“烷基-C(O)-”基团,其中烷基如本文所定义。
当用于本发明中,术语“烷氧基羰基”或“烷基氧基羰基”是指“烷基-O-C(O)-”基团,其中烷基如本文所定义。
当用于本发明中,术语“烷氧基烷基”是指“烷基-O-烷基-”基团,其中烷基如本文所定义。
当用于本发明中,术语“卤代烷基”是指包含至少一个被至少一个本文定义的卤素所取代的碳原子的本文所定义的烷基。
当用于本发明中,术语“卤素”、“卤素原子”、“卤素取代基”或“Hal”,是指一个或在适当时多个氟(F)、溴(Br)、氯(Cl)、碘(I)原子。表述“二卤素”、“三卤素”和“全卤素”分别指2、3和4个取代基,其中各取代基独立的选自氟、氯、溴和碘。“卤素”优选为氟、氯或溴原子。当在烷基(卤代烷基)或烷氧基上被卤素取代时,氟是最优选的(例如CF3和CF3O)。
术语羟基表示OH基团。
当用于本发明中,药物组合物中的术语“组合物”包括这样的产品,其包含活性成分和构成载体的惰性成分,以及通过组合、混合或聚集任意两种或多种成分,或通过一种或多种成分的解离,或通过一种或多种成分其他类型的反应或相互作用产生的任何产物。因此,本发明的药物组合物包括任何通过混合本发明的化合物和可药用的载体制备的组合物。
术语“施用”和“给药”应当理解为表示向需要的个体提供本发明的化合物或本发明化合物的前药。
当用于本文中,术语“有效量”表示在组织、系统、动物或人体内引起例如研究者或医师所寻求或希望的生物学或医学响应的药物或药学活性成分的量。此外,术语“治疗有效量”表示(与没有接受该量的相应个体相比)具有以下结果的量:改善治疗、痊愈、预防或消除疾病、病症或副作用、或者减缓疾病或病症的进展速度。该术语还包括有效增强正常生理学功能的量。
本发明还涉及所述化合物的所有立体异构体,不论是混合物还是纯或基本纯的形式。本发明的化合物可以在任何碳原子处具有不对称中心。因此,其可以以外消旋体形式、纯对映体形式和/或非对映体形式或这些对映体和/或非对映体的混合物形式存在。所述混合物可具有任何需要的混合比例的立体异构体。
因此,例如可通过已知的方法将以外消旋体或非对映体混合物形式存在的具有一个或多个手性中心的本发明化合物分离为光学纯的异构体,即对映体或非对映体。本发明化合物的分离可使用手性或非手性相的柱分离,或通过从任选光学活性溶剂中重结晶分离,或使用光学活性酸或碱分离,或使用光学活性试剂例如光学活性醇衍生化后去除所述取代基获得。
本发明的化合物可以其双键异构体的形式,例如“纯”的E或Z异构体存在,或以这些双键异构体的混合物形式存在。
可能的情况下,本发明的化合物可以互变异构体的形式存在,例如酮-醇互变异构体。
同样,本发明的化合物可以任何需要的前药形式存在,例如酯、碳酸酯、氨基甲酸酯、脲、酰胺或磷酸酯,其中实际的生物活性形式通过代谢释放。任何能在体内转化提供生物活性剂(即本发明的化合物)的化合物均为本发明范围和意义内的前药。
各种形式的前药在本领域是公知的,例如描述于:
(i)Wermuth CG等人,第31章:671-696,The Practice of MedicinalChemistry,Academic Press 1996;
(ii)Bundgaard H,Design of Prodrugs,Elsevier 1985;和
(iii)Bundgaard H,第5章:131-191,A Textbook of Drug Design andDevelopment,Harwood Academic Publishers 1991。
所述参考文献引入本文作为参考。
进一步已知所述化学物在体内转化为代谢产物,其在适当的时候产生需要的生物学效应——某些时候甚至更为显著。
所有在体内通过本发明的任意化合物代谢转化的生物活性化合物均为本发明范围和意义上的代谢产物。
若本发明的化合物具有足够碱性的基团,例如仲或叔胺,其可以通过无机和有机酸转化为盐类。本发明化合物的可药用盐优选使用盐酸、氢溴酸、碘酸、硫酸、磷酸、甲磺酸、对甲苯磺酸、碳酸、甲酸、乙酸、磺基乙酸、三氟乙酸、草酸、丙二酸、马来酸、琥珀酸、酒石酸、外消旋酸、苹果酸、双羟萘酸、扁桃酸、富马酸、乳酸、柠檬酸、牛磺胆酸、戊二酸、硬脂酸、谷氨酸或天冬氨酸形成。所形成的盐尤其是盐酸盐、氯化物、氢溴化物、溴化物、碘化物、硫酸盐、磷酸盐、甲磺酸盐、甲苯磺酸盐、碳酸盐、碳酸氢盐、甲酸盐、乙酸盐、磺基乙酸盐、三氟乙酸盐、草酸盐、丙二酸盐、马来酸盐、琥珀酸盐、酒石酸盐、苹果酸盐、双羟萘酸盐、扁桃酸盐、富马酸盐、乳酸盐、柠檬酸盐、戊二酸盐、硬脂酸盐、天冬氨酸盐和谷氨酸盐。从本发明化合物形成的盐的化学量可以是1的整数或非整数倍。
若本发明的化合物具有足够酸性的基团,例如羧基、磺酸、磷酸或酚基,其可以通过无机或有机碱转化成生理上相容的盐。适当的无机碱的实例包括铵、氢氧化钠、氢氧化钾、氢氧化钙,有机碱的实例有乙醇胺、二乙醇胺、三乙醇胺、乙二胺、叔丁基胺、叔辛基胺、去氢枞胺、环己胺、二苄基乙二胺和赖氨酸。从本发明化合物形成的盐的化学量可以是1的整数或非整数倍。
同样本发明的化合物可以是其溶剂化物形式,尤其是水合物,其可以通过例如从溶剂或水溶液中结晶获得。此外,本发明的化合物可以与一个、两个、三个或任意数目的溶剂或水分子结合形成溶剂化物和水合物。
术语“溶剂化物”是指水合物、醇合物,或结晶的其他溶剂化物。
已知化学物形成的固体以不同的顺序存在,其称为多晶形式或变体。多晶物质的各种变体可能在其物理性质方面差异很大。本发明的化合物可以以多种多晶形式存在,某些变体可能是不稳定的。所述化合物的所有这些多晶形式也包括在本发明之内。
令人惊讶的,本发明的化合物对自分泌运动因子具有强的和/或选择性的抑制。
由于其令人惊讶的有效和/或选择性酶抑制,本发明的化合物可以相对于现有技术中其他效果或选择性较低的抑制剂更低的剂量方便地施用,而依然能获得相同或甚至更好的生物学效应。此外,所述剂量的减小有利于导致不良反应更少或甚至消失。此外,在不考虑所用剂量的情况下,本发明化合物的高抑制选择性本身可导致不良反应的下降。
作为自分泌运动因子抑制剂的本发明化合物通常具有低于约30μM的抑制常数IC50,优选低于约5μM。
令人惊讶的,通过提供使用本发明的化合物作为自分泌运动因子抑制剂,本发明的目的在另一方面得以解决。
术语“抑制和/或阻滞”在本发明中是指如下含义:部分或完全抑制和/或阻滞。在这种情况中,本领域技术人员能够通过常规的测量方法测量和确定所述抑制和/或阻滞。因此,例如可测量部分抑制和/或阻滞,确定与之相关的完全抑制和/或阻滞。
令人惊讶的,通过提供制备本发明的化合物的方法,本发明的目的在另一方面得以解决。所述方法包括如下步骤:
(a)将式(II)的化合物,
其中W1、W2、R1、R2具有本文所述的含义,与式(III)的化合物反应,
其中L选自基团:
并且其中Z1、Y2、R3、R4、B、n具有本文所定义的含义,得到本文所述的式(I)化合物,其中Y1代表“-C(O)-”;
或者
(b)将式(II)的化合物
其中W1、W2、R1、R2具有本文所述定义,与选自下列的化合物L反应:
产生式(IIa)的化合物
其中W1、W2、R1、R2具有本文所述定义;
进一步将式(IIa)的化合物与式(IV)的化合物反应
其中R3、R4、B、n具有本文所述定义,产生本文所述的式(I)化合物,其中Z1代表“O”,Y2代表“-N(R16)-“,并且R16代表“H”;
或者
(c)将式(Va)或(Vb)的化合物
其中m和n独立为0,1或2,与式(III)的化合物反应
其中L选自下列基团:
并且其中Z1、Y2、R3、R4、B、n具有权利要求1中所述含义,产生权利要求1或2中所述的式(I)化合物,其中Y1代表“-C(R12)(R13)-并且R12、R13均代表“H”或Y1代表“-C(O)-”,
或者
(d)将式(VI)的化合物
HO(O)C-L(VI)
其中L选自下列基团:
与式(VII)的化合物反应
其中W1、W2、R1、R2具有本文所述定义,产生式(VIII)的化合物
其中W1、W2、R1、R2具有本文所述定义;
进一步将式(VIII)的化合物与式(IV)的化合物反应
其中R3、R4、B、n具有本文所述定义,产生本文所述的式(I)化合物,其中Y1代表“-N(R10)-C(O)-”,R10代表“H”,Z1代表“O”,Y2代表“-N(R16)-”并且R16代表“H”;
或者
(e)将式(IX)的化合物
其中L选自下列基团:
并且其中Z1、Y2、R3、R4、B、n具有权利要求1中所述含义,与式
(VII)的化合物反应
其中W1、W2、R1、R2具有本文所述定义,产生本文所述的式(I)化合物,其中Y1代表“-N(R10)-C(O)-”,R10代表“H”,
或者
(f) 将式(X)的化合物
其中W1、W2、R1、R2、Y1具有本文所述定义,L选自基团
与式(XI)的化合物反应,
其中R3、R4、B、n具有本文所述定义,产生本文所述的式(I)化合物,其中Z1代表“O”,Y2代表“-N(R16)-”,并且R16代表“H”。
所有的粗产物分别使用溶剂混合物进行标准色谱洗脱,所述溶剂混合物含有甲醇、乙醇、异丙醇、正己烷、环己烷或石油醚。
为进一步详述所述制备方法,请参照实施例和下列优选条件的一般性描述。
本发明化合物生理上可接受的盐也可通过用酸或碱经所述反应处理和/或分离本发明的化合物获得。
本发明的化合物以及用于制备它们的原料是通过文献中(例如标准教科书如Houben-Weyl,Methoden der organischen Chemie[有机化学方法],Georg-Thieme-Verlag,Stuttgart,有机反应,John Wiley&Sons,Inc.,NewYork)中所述的本身已知的方法、准确地说在已知的且适合于所述反应的反应条件下制备的。在此也能使用本文未更详细提及的本身已知的变通方法。
如果需要,所述方法的原料还可以通过不从反应混合物中分离,而是即刻将它们进一步转化成本发明化合物的方式在原位形成。另一方面,可以分步进行反应。
优选的,所述化合物的反应在适当溶剂存在下进行,其优选为在各反应条件下惰性的溶剂。适合的惰性溶剂的实例有:烃类,如己烷、石油醚、苯、甲苯或二甲苯;氯代烃类,如三氯乙烯、1,2-二氯乙烷、四氯化碳、氯仿或二氯甲烷;醇类,如甲醇、乙醇、异丙醇、正-丙醇、正-丁醇或叔-丁醇;醚类,如乙醚、二异丙基醚、四氢呋喃(THF)或二烷;乙二醇醚类,如乙二醇单甲醚或单乙醚、乙二醇二甲醚(二甘醇二甲醚);酮类,如丙酮或丁酮;酰胺类,如乙酰胺、二甲基乙酰胺或二甲基甲酰胺(DMF)或N-甲基吡咯烷酮(NMP);腈类,如乙腈;亚砜类,如二甲亚砜(DMSO);硝基化合物,如硝基甲烷或硝基苯;酯类,如乙酸乙酯,或所述溶剂的混合物或与水的混合物。通常优选极性溶剂。适合的极性溶剂有氯化烃、醇类、乙二醇醚类、腈类、酰胺类和亚砜类或其混合物。更优选的是酰胺类,尤其是二甲基甲酰胺(DMF)。
如前所述,反应温度介于约-100℃至300℃,依赖于所用的反应步骤和条件。
反应时间通常在数分钟至数天,依赖于各化合物的反应性和各反应条件。适当的反应时间可通过本领域已知的方法方便的确定,例如反应监测。基于上述给出的反应温度,适当的反应时间通常在10分钟至48小时。
本发明化合物的碱可使用酸转化成相关的酸加成盐,例如通过使等量的碱和酸在优选的惰性溶剂中,例如乙醇中反应后蒸发获得。用于该反应的适当的酸尤其是能形成生理上可接受的盐的酸。因此,可使用无机酸,例如硫酸、亚硫酸、连二硫酸、硝酸、氢卤酸(例如盐酸或氢溴酸)、磷酸(例如正磷酸、氨基磺酸);有机酸,尤其是脂肪族、脂环族、芳香族、芳环族或杂环一元或多元羧酸、磺酸或硫酸,例如甲酸、乙酸、丙酸、己酸、辛酸、癸酸、十六烷酸、硬脂酸、新戊酸、二乙基乙酸、丙二酸、琥珀酸、庚二酸、富马酸、马来酸、乳酸、酒石酸、苹果酸、柠檬酸、葡糖酸、抗坏血酸、烟酸、异烟酸、甲或乙磺酸、乙二磺酸、2-羟基乙磺酸、苯磺酸、三甲氧基苯甲酸、金刚烷甲酸、对甲苯磺酸、羟基乙酸、双羟萘酸、氯苯氧乙酸、天冬氨酸、谷氨酸、脯氨酸、乙二醛酸、棕榈酸、对氯苯氧基异丁酸、环己烷甲酸、葡萄糖1-磷酸盐、萘单和双磺酸或月桂基硫酸。
生理上不可接受的酸的盐,例如苦味酸盐可用于分离和/或纯化本发明的化合物。
另一方面,本发明的化合物可使用碱(例如氢氧化钠、氢氧化钾、碳酸钠或碳酸钾)转化成相应的金属盐类,尤其是碱金属或碱土金属盐类,或转化成相应的铵盐。适当的盐类还包括取代的铵盐,例如二甲基、二乙基和二异丙基铵盐,单乙醇、二乙醇和二异丙醇铵盐,环己基和二环己基铵盐,二苄基乙二铵盐,此外还包括与精氨酸或赖氨酸形成的盐。
如果需要,本发明化合物的游离碱可通过用强碱处理从其盐中释放出来,例如氢氧化钠、氢氧化钾、碳酸钠或碳酸钾,只要分子中没有其他酸性基团。当本发明的化合物具有游离酸基团时,可通过用碱处理形成盐。适当的碱有碱金属氢氧化物,碱土金属氢氧化物,以伯胺、仲胺或叔胺形式存在的有机碱。
本文所述的各反应步骤后可任选的进行后处理程序和/或分离程序。适当的所述程序是本领域已知的,例如标准教科书如Houben-Weyl,Methoden der organischen Chemie[有机化学方法],Georg-Thieme-Verlag,Stuttgart)。所述程序的实例包括但不限于,蒸发溶剂、蒸馏、结晶、分步结晶、萃取程序、洗涤程序、消化程序、过滤程序、色谱分离、HPLC色谱分离和干燥程序,尤其是真空和/或升高温度的干燥程序。
令人惊讶的,通过提供包含至少一种本发明化合物的药物,本发明的目的在另一方面得以解决。
令人惊讶的,通过提供用于治疗和/或预防生理和/或病理状况的包含至少一种本发明化合物的药物,本发明的目的在另一方面得以解决,所述状况由溶血磷脂酸水平的升高和/或自分泌运动因子的活化引起、介导和/或传播。相应的在制备用于治疗和/或预防上述病症的药物中的用途也包括在内。
令人惊讶的,通过提供用于治疗和/或预防以下生理和/或病理状况的包含至少一种本发明化合物的药物,本发明的目的在另一方面得以解决:癌症、肿瘤、恶性肿瘤、良性肿瘤、实体瘤、肉瘤、癌、过度增殖性病症、类癌瘤、尤因肉瘤、卡波西肉瘤、脑瘤、来源于脑和/或神经系统和/或脑膜的肿瘤、神经胶质瘤、胶质母细胞瘤、成神经细胞瘤、胃癌、肾癌、肾细胞癌、前列腺癌、前列腺癌、结缔组织肿瘤、软组织肉瘤、胰腺肿瘤、肝肿瘤、头部肿瘤、颈部肿瘤、喉癌、食管癌、甲状腺癌、骨肉瘤、视网膜母细胞瘤、胸腺瘤、睾丸癌、肺癌、肺腺癌、小细胞肺癌、支气管癌、乳腺癌、乳房癌、肠癌、结肠直肠癌、结肠癌、直肠癌、妇科肿瘤、卵巢肿瘤、子宫癌、宫颈癌、子宫颈癌、子宫体癌、子宫体癌、子宫内膜癌、膀胱癌、泌尿生殖道癌、膀胱癌、皮肤癌、上皮肿瘤、鳞状上皮癌、基底细胞癌、spinaliomas、黑素瘤、眼内黑素瘤、白血病、单核细胞白血病、慢性白血病、慢性粒细胞白血病、慢性淋巴性白血病、急性白血病、急性粒细胞白血病、急性淋巴性白血病、淋巴瘤、血管发生、动脉硬化、眼部疾病、脉络膜新生血管化、糖尿病性视网膜病、炎性疾病、关节炎、神经变性、再狭窄、创伤愈合和/或移植排斥。相应的在制备用于治疗和/或预防上述病症的药物中的用途也包括在内。
本发明的化合物可与一种或多种其他活性物质(成分、药物)组合,用于治疗、预防、抑制或改善其中本发明的化合物或其他物质有用的疾病或症状。通常所述药物的组合比药物单用更安全或更有效,或所述组合比基于单个药物的累加性质更安全或更有效。所述其他药物可以通过常规剂量和途径与本发明的化合物同时或依次施用。当本发明的化合物与一种或多种其他药物同时施用时,优选含有所述其他药物和本发明化合物的组合产品。然而,组合治疗还包括本发明的化合物和一种或多种其他药物在不同日程施用的治疗。应当理解,当与其他活性成分组合施用时,本发明的化合物或其他活性成分或两者可以比单独施用时更低的剂量有效施用。因此,本发明的药物组合物包括除本发明的化合物以外,含有一种或多种其他活性成分的那些。
可与本发明的化合物组合,分别或在同一药物组合物中施用的其他活性物质(成分、药物)的实例包括但不限于表1中所列的化合物种类和具体的化合物:
在一个优选的实施方案中,本发明的化合物与一种或多种已知的抗肿瘤剂组合施用,例如以下试剂:雌激素受体调节剂,雄激素受体调节剂,类视色素受体调节剂,细胞毒性剂,抗增殖剂,异戊二烯基蛋白转移酶抑制剂,HMG-CoA还原酶抑制剂,HIV蛋白酶抑制剂,逆录酶抑制剂和血管生成抑制剂。
本发明的化合物特别适合于与放疗同时施用。本领域技术人员已知抑制VEGF与放疗联用的协同作用(参见WO 00/61186)。
本发明中术语“雌激素受体调节剂”是指干扰或抑制雌激素与受体结合、不论机理如何的化合物。雌激素受体调节剂的实例包括、但不限于他莫昔芬、雷洛昔芬、艾多昔芬、LY353381、LY 117081、托瑞米芬、氟维司群、4-[7-(2,2-二甲基-1-氧代丙氧基-4-甲基-2-[4-[2-(1-哌啶基)乙氧基]苯基]-2H-1-苯并吡喃-3-基]苯基2,2-二甲基丙酸酯、4,4′-二羟基二苯酮-2,4-二硝基苯腙和SH646。
本发明中术语“雄激素受体调节剂”是指干扰或抑制雄激素与受体结合、不论机理如何的化合物。雄激素受体调节剂的非限制性实例包括非那雄胺和其它5α-还原酶抑制剂、尼鲁米特、氟他胺、比卡鲁胺、利阿唑和醋酸阿比特龙。
本发明中术语“类视色素受体调节剂”是指干扰或抑制类视色素与受体结合、不论机理如何的化合物。这种类视色素受体调节剂的非限制性实例包括贝沙罗汀、维甲酸、13-顺式-维甲酸、9-顺式-维甲酸、α-二氟甲基鸟氨酸、ILX23-7553,反式-N-(4′-羟基苯基)视黄酰胺和N-4-羧基苯基视黄酰胺。
本发明中术语“细胞毒性剂”是指主要通过直接对细胞功能起作用或抑制或干扰细胞有丝分裂而导致细胞死亡的化合物,包括烷化剂、肿瘤坏死因子、嵌入剂、微管蛋白抑制剂和拓扑异构酶抑制剂。细胞毒性剂的非限制性实例包括但不限于替拉扎明、sertenef、恶病质素、异环磷酰胺、他索那敏、氯尼达明、卡铂、六甲蜜胺、泼尼莫司汀、二溴卫矛醇、雷莫司汀、福莫司汀、奈达铂、奥沙利铂、替莫唑胺、依铂、雌氮芥、甲苯磺酸英丙舒凡、曲磷胺、尼莫司汀、二溴螺氯铵、嘌嘧替派、洛铂、沙铂、甲基丝裂霉素、顺铂、伊罗夫文、右异环磷酰胺、顺式-胺二氯(2-甲基吡啶)铂、苄基鸟嘌呤、葡磷酰胺、GPX100、(反式,反式,反式)双-mu-(己-1,6-二胺)-mu-[二胺铂(II)]双[二胺(氯)铂(II)]四氯化物、二氮丙啶基精胺、三氧化二砷、1-(11-十二烷基氨基-10-羟基十一烷基)-3,7--二甲基黄嘌呤、佐柔比星、伊达比星、柔红霉素、比生群、米托蒽醌、吡柔比星、吡萘非特、戊柔比星、氨柔比星、antineoplastone、3′-脱氨基-3′-吗啉代-13-脱氧-10-羟基洋红霉素、annamycin、加柔比星、依利奈法德、MEN10755和4-脱甲氧基-3-脱氨基-3-氮丙啶基-4-甲基磺酰基柔红霉素(参见WO 00/50032)。
微管蛋白抑制剂的非限制性实例包括紫杉醇、硫酸长春地辛、3′,4′-双脱氢-4′-脱氧-8′-去甲基长春碱、多西他赛、根霉素、多拉司他汀、羟乙基磺酸米伏布林、auristatin、西马多丁、RPR109881、BMS184476、长春氟宁、cryptophycin、2,3,4,5,6-五氟-N-(3-氟-4-甲氧基苯基)苯磺酰胺、脱水长春碱、N,N-二甲基-L-缬氨酰-L-缬氨酰-N-甲基-L-缬氨酰-L-脯氨酰-L-脯氨酸-叔丁基酰胺、TDX258和BMS188797。
拓扑异构酶抑制剂的非限制性实例是托泊替康、hycaptamine、伊立替康、卢比替康、6-乙氧基丙酰基-3′,4′-O-外亚苄基教酒菌素、9-甲氧基-N,N-二甲基-5-硝基吡唑并[3,4,5-kl]吖啶-2-(6H)丙胺、1-氨基-9-乙基-5-氟-2,3-二氢-9-羟基-4-甲基-1H,12H-苯并[de]吡唑并[3′,4′:b,7]吲嗪并[1,2b]喹啉-10,13(9H,15H)二酮、勒托替康、7-[2-(N-异丙基氨基)乙基]-(20S)喜树碱、BNP1350、BNPI1100、BN80915、BN80942、磷酸依托泊苷、替尼泊苷、索布佐生、2′-二甲基氨基-2′-脱氧依托泊苷、GL331、N-[2-(二甲基氨基)乙基]-9-羟基-5,6-二甲基-6H-吡啶并[4,3-b]咔唑-1-甲酰胺、asulacrine、(5a,5aB,8aa,9b)-9-[2-[N-[2-(二甲基氨基)乙基]-N-甲基氨基]乙基]-5-[4-羟基-3,5-二甲氧基苯基]-5,5a,6,8,8a,9-六氢呋喃并(3′,4′:6,7)萘并(2,3-d)-1,3-二氧杂环戊烯-6-酮、2,3-(亚甲二氧基)-5-甲基-7-羟基-8-甲氧基苯并[c]菲啶6,9-双[(2-氨基乙基)氨基]苯并[g]异喹啉-5,10-二酮、5-(3-氨基丙基氨基)-7,10-二羟基-2-(2-羟基乙基氨基甲基)-6H-吡唑并[4,5,1-de]吖啶-6-酮、N-[1-[2(二乙基氨基)乙基氨基]-7-甲氧基-9-氧代-9H-噻吨-4-基甲基]甲酰胺、N-(2-(二甲基氨基)乙基)吖啶-4-甲酰胺、6-[[2-(二甲基氨基)乙基]氨基]-3-羟基-7H-茚并[2,1-c]喹啉-7-酮和地美司钠。
抗增殖剂的非限制性实例包括反义RNA和DNA寡核苷酸例如G3139、ODN698、RVASKRAS、GEM231和INX3001,和抗代谢药例如依诺他滨、卡莫氟、替加氟、喷司他丁、去氧氟尿苷、三甲曲沙、氟达拉滨、卡培他滨、加洛他滨、阿糖胞苷十八烷基磷酸钠、fosteabine sodiumhydrate、雷替曲塞、paltitrexid、乙嘧替氟、噻唑羧胺核苷、地西他滨、诺拉曲塞、培美曲塞、内扎拉滨、2′-脱氧-2′-次甲基胞嘧啶核苷,2′-氟亚甲基-2′-脱氧胞苷、N-[5-(2,3-二氢苯并呋喃基)磺酰基]-N′-(3,4-二氯苯基)脲、N6-[4-脱氧-4-[N2-[2(E),4(E)-十四二烯酰基]甘氨酰基氨基]-L-甘油-B-L-甘露庚吡喃糖基]腺嘌呤、aplidine、海鞘素、曲沙他滨、4-[2-氨基-4-氧代-4,6,7,8-四氢-3H-嘧啶并[5,4-b]-1,4-噻嗪-6-基-(S)-乙基]-2,5-噻吩酰基-L-谷氨酸、氨基蝶呤、5-氟尿嘧啶、阿拉诺新、11-乙酰基-8-(氨基甲酰氧基甲基)-4-甲酰基-6-甲氧基-14-氧杂-1,11-二氮杂四环(7.4.1.0.0)十四-2,4,6-三烯-9-基乙酸酯、苦马豆素、洛美曲索、右雷佐生、甲硫氨酸酶、2′-氰基-2′-脱氧-N4-棕榈酰基-1-B-D-阿拉伯呋喃糖基胞嘧啶和3-氨基吡啶-2-甲醛缩氨基硫脲。
“抗增殖剂”还包括“血管生成抑制剂”中所列那些之外的抗生长因子的单克隆抗体,例如曲妥珠单抗,和肿瘤抑制基因,例如p53。
在本发明的另一方面,提供了根据上述方面和实施方案的药物,其中所述药物包含至少一种额外的药理学活性物质(药物、成分)。
在一个优选的实施方案中,至少一种药理学活性物质是本文所述的物质。
在本发明的另一方面,提供了根据上述方面和实施方案的药物,其中所述药物在用至少一种额外的药理学活性物质治疗前和/或同时和/或后应用。
在一个优选的实施方案中,所述至少一种药理学活性物质是本文所述的物质。
在本发明的另一方面,提供了包含治疗有效量的至少一种本发明化合物的药物组合物。
在一个优选的实施方案中,所述药物组合物含有至少一种额外的化合物,其选自生理上可接受的赋形剂、辅料、佐剂、稀释剂、载体和/或除本发明化合物以外的额外的药理学活性物质。
在另一方面,公开了药物组合物,其包含至少一种本发明的化合物,至少一种除本发明的化合物以外的本文所述药理学活性物质;以及可药用的载体。
本发明的另一个实施方案是制备所述药物组合物的方法,其特征在于将本发明的一种或多种化合物和一种或多种选自固体、液体或半液体赋形剂、辅料、佐剂、稀释剂、载体和除本发明化合物外的药物活性剂的化合物转化为适当的剂型。
在本发明的另一方面,提供了药盒,其包含治疗有效量的至少一种本发明化合物和/或至少一种本文所述药物组合物和治疗有效量的至少一种除本发明化合物外的其他药理学活性物质。
本发明的药物组合物可通过任何途径施用以达到所预期的目的。例如,施用可通过口服、胃肠外、局部、肠内、静脉内、肌内、吸入、经鼻、关节内、脊柱内、经气管、经眼、皮下、腹膜内、经皮、或口腔途径施用。可选的,或通过口服途径同时施用。施用的剂量依赖于年龄、健康、受者体重、同时治疗的种类(如果有的话),以及治疗频率和想要达到的效果。优选胃肠外施用。尤其优选口服施用。
适当的剂型包括但不限于,胶囊、片剂、丸剂、锭剂、半固体、粉末、颗粒、栓剂、软膏、乳剂、洗剂、吸入剂、注射剂、泥敷剂、凝胶剂、绷带、眼药水、溶液、糖浆剂、气溶胶、混悬剂、乳液,其可以根据本领域已知的方法制备,例如下文所述:
片剂:混合活性成分和辅料,将所述混合物压缩成片剂(直接压缩),任选在压缩前对部分混合物制粒。
胶囊剂:混合活性成分和辅料获得可流动的粉末,任选粉末制粒,将粉末/颗粒填充到开放的胶囊,以及封闭胶囊。
半固体(软膏,凝胶,乳剂):将活性成分溶解/分散于水性或脂肪载体中;随后用互补的脂肪/水相混合水/脂肪相,匀浆(仅乳剂)。
栓剂(直肠和阴道):将活性成分溶解/分散于加热液化的载体材料中(直肠:载体材料通常为蜡;阴道:载体材料通常为胶凝剂的加热溶液),将所述混合物浇铸成栓剂形式,退火并从所述形式中取出栓剂。
气溶胶:将活性成分溶解/分散于抛射剂中,将所述混合物装入喷雾器。
一般而言,制备药物组合物和/或药物制剂的非化学途径包括用本领域已知的适当机械方法加工的步骤,所述方法可将本发明的一种或多种化合物转化成适于向需要治疗的患者施用的适当剂型。通常,一种或多种本发明化合物转化为剂型包括加入一种或多种化合物,其选自载体、赋形剂、辅料和除本发明化合物外的药物活性成分。适当的加工步骤包括但不限于,合并、研磨、混合、制粒、溶解、分散、匀浆、浇铸和/或压缩各活性和非活性成分。用于所述加工步骤的机械方法是本领域已知的,例如来自Ullmann′s Encyclopedia of Industrial Chemistry,第5版。在这方面,活性成分优选为至少一种本发明的化合物和一种或多种除本发明化合物外的其他化合物,其具有有价值的药理学性质,优选是本文所公开的除本发明化合物以外的药物活性剂。
尤其适于口服使用的是片剂、丸剂、包衣片剂、胶囊、粉末、颗粒、糖浆、果汁或滴剂,适于直肠使用的是栓剂,适于胃肠外使用的是溶液(优选基于油的或水溶液)、混悬剂、乳液或埋植剂,适于局部使用的是软膏、乳剂或粉末。本发明的化合物也可冻干并使用冻干物,例如用于制备注射制剂。所述制剂可以被灭菌和/或包含助剂,例如润滑剂、防腐剂、稳定剂和/或湿润剂、乳化剂、用于调节渗透压的盐,缓冲物质、染料、矫味剂和/或多种其他活性成分,例如一种或多种维生素。
适当的赋形剂是有机或无机物质,其适于胃肠内(例如口服)、胃肠外或局部施用,而不与本发明的化合物反应,例如水、植物油、苄醇、亚烷基甘油、聚乙二醇、甘油三醋酸酯、明胶、碳水化合物,例如乳糖、蔗糖、甘露醇、山梨醇或淀粉(玉米淀粉、小麦淀粉、米淀粉、土豆淀粉)、纤维素制品和/或磷酸钙,例如磷酸三钙或磷酸氢钙、硬脂酸镁、滑石、明胶、西黄蓍胶、甲基纤维素、羟丙基甲基纤维素、羧甲基纤维素钠、聚乙烯吡咯烷酮和/或凡士林。
如果需要,可加入崩解剂,例如上述淀粉和羧甲基淀粉、交联的聚乙烯吡咯烷酮、琼脂或海藻酸或其盐,例如海藻酸钠。辅料包括但不限于,流动调节剂和润滑剂,例如硅石、滑石、硬脂酸或其盐,例如硬脂酸镁或硬脂酸钙,和/或聚乙二醇。锭剂核心提供了适当的包衣,其对胃液具有抗性(如果需要的话)。为此可使用浓缩的糖溶液,其任选含有阿拉伯胶、滑石、聚乙烯吡咯烷酮、聚乙二醇和/或二氧化钛、漆溶液和适当的有机溶剂或溶剂混合物。为产生对胃液抗性的包衣或提供具有延长作用优点的剂型,所述片剂、锭剂或丸剂可包含内部剂量和外部剂量成分,后者是前者的外壳形式。两种成分可被肠层分离,其用于抵抗胃中的分解,使内部成分完整的进入十二指肠或延迟释放。多种材料可用于所述肠层或包衣,例如包括多种聚酸和聚酸与诸如虫胶、乙酰醇、适当纤维素制剂的溶液(例如乙酰基纤维素邻苯二甲酸酯、纤维素醋酸酯或羟丙基甲基纤维素邻苯二甲酸酯)材料的混合物。染料或颜料可加入片剂或锭剂包衣,例如用于标识或鉴别活性化合物剂量的组合。
适当的载体物质是适于胃肠内(例如口服)或胃肠外施用或局部应用的有机或无机物质,其不与新的化合物反应。例如水、植物油、苄基醇、聚乙二醇、明胶、诸如乳糖或淀粉的碳水化合物、硬脂酸镁、滑石和石油凝胶。具体而言,片剂、包衣片剂、胶囊、糖浆、混悬剂、滴剂或栓剂被用于肠内施用,溶液、优选油或水性溶液、其他混悬液、乳液或埋植剂用于胃肠外施用,软膏、乳剂或粉末被用于局部应用。本发明的化合物也可冻干,使用获得的冻干物,例如用于制备注射制剂。
所述制剂可以被灭菌和/或含有赋形剂,例如润滑剂、防腐剂、稳定剂和/或湿润剂、乳化剂、影响渗透压的盐、缓冲物、着色剂、矫味剂和/或芳香剂。需要时它们也可含有一种或多种其他活性化合物,例如一种或多种维生素。
其他可口服的药物制剂包括推-适明胶胶囊,以及软密封明胶胶囊以及诸如甘油或山梨醇的增塑剂。所述推-适胶囊可含有颗粒形式的活性化合物,其可以与诸如乳糖的填充剂、诸如淀粉的粘合剂和/或诸如滑石或硬脂酸镁的润滑剂以及任选的稳定剂混合。在软胶囊中,活性化合物优选溶解或混悬于适当的液体中,例如脂肪油或液体石蜡。此外,可加入稳定剂。
包含本发明的新的组合物的用于口服施用的液体形式包括水溶液,优选矫味糖浆、水性或油混悬液以及含食用油,例如棉籽油、芝麻油、椰子油或花生油的矫味乳液,以及酏剂和类似的可药用载体。用于水性混悬液的适当的分散或混悬剂包括合成和天然的树胶,例如西黄蓍胶、阿拉伯胶、藻酸盐、葡聚糖、羧甲基纤维素钠、甲基纤维素、聚乙烯吡咯烷酮或明胶。
用于胃肠外施用的适当制剂包括水溶形式的活性化合物的水溶液,例如水溶性盐和碱溶液。此外,活性化合物的混悬液可作为适当的油注射混悬液施用。适当的亲脂溶剂或载体包括脂肪油,例如芝麻油,或合成脂肪酸酯,例如油酸乙酯或甘油三酯或聚乙二醇400(化合物在PEG-400中可溶)。
水性注射混悬液可含有增加混悬液粘度的物质,包括例如羧甲基纤维素钠、山梨醇和/或葡聚糖,任选的,所述混悬液也可含有稳定剂。
作为吸入喷雾剂施用时,可使用这样的喷雾剂,其中活性成分溶解或混悬于抛射剂气体或抛射剂气体混合物(例如CO2或含氯氟烃)。活性成分在这里以微粉化形式方便的使用,其中可含有一种或多种额外的生理上可接受的溶剂,例如乙醇。吸入剂溶液可在常规吸入器的辅助下施用。
可直肠施用的可能药物制剂包括,例如栓剂,其由一种或多种活性化合物与栓剂基质的组合构成。适当的栓剂基质有,例如天然或合成的甘油三酯,或石蜡烃。此外,可使用明胶直肠胶囊,其由活性化合物与基质的组合构成。可能的基质材料包括,例如液态甘油三酯、聚乙二醇或石蜡烃。
为用作药物,本发明的化合物是可药用盐的形式。然而其他的盐可用于制备本发明的化合物及其可药用盐。适当的本发明化合物的可药用盐包括酸加成盐,其例如通过混合本发明化合物的溶液与可药用酸(例如盐酸、硫酸、甲磺酸、富马酸、马来酸、琥珀酸、乙酸、苯甲酸、草酸、柠檬酸、酒石酸、碳酸或磷酸)的溶液形成。此外,当本发明的化合物具有酸性基团时,适当的可药用盐可包括碱金属盐,例如钠盐或钾盐;碱土金属盐,例如钙盐或镁盐;以及与适当的有机碱形成的盐,例如季铵盐。
所述药物制剂可用作人和兽医学中的药物。如本文所述,术语“有效量”表示在组织、系统、动物或人中导致例如研究人员或医师所寻求或期望的生物学或医学响应的药物或药物活性成分的量。此外,术语“治疗有效量”表示与相应的未接受该量的个体相比具有如下结果的量:疾病、病症或副作用的改善治疗、愈合、预防或消除,或者还有疾病、不适或障碍的进展减少。该术语还包括就增加正常生理功能而言有效的量。本发明一种或多种化合物的治疗有效量是本领域技术人员已知的,或易于通过本领域已知的标准方法确定。
本发明的化合物以及额外的活性物质通常类似于商用制剂施用。通常,治疗有效的适当剂量为每单位剂量0.0005mg至1000mg,优选0.005mg至500mg,尤其是0.5mg至100mg。日剂量优选为约0.001mg/kg至10mg/kg体重。
本领域技术人员可理解,所述剂量水平将根据特定化合物的功能、症状的严重程度和患者对副作用的易感性而变化。某些特定的化合物比其他的更为有效。给定化合物的优选剂量可由本领域技术人员通过多种方法方便的确定。优选的方法是测定所给定化合物的生理效价。
当用于本发明时,所有的哺乳动物种类均包括在内。在一个优选的实施方案中,所述哺乳动物选自灵长类、人、啮齿类、马、牛、狗、猫、家养动物、牛、家畜类、宠物、奶牛、绵羊、猪、山羊、马、矮马、驴、駃騠、骡子、野兔、家兔、猫、狗、豚鼠、仓鼠、大鼠、小鼠。更优选的,所述哺乳动物是人。动物模型受到实验研究关注,其中它们提供了治疗人类疾病的模型。
个体患者的具体剂量依赖于多种因素,例如所用具体化合物的效果、年龄、体重、健康状况、性别、饮食种类、施用的时间和途径、排泄率、施用的剂型和使用方式、药物组合以及所述治疗涉及的具体疾病的严重性。个体患者的具体治疗有效量可由实施或参加该治疗的医生或内科医师通过常规试验方便的确定。
在许多疾病的情况下,特定细胞对所述化合物的处理的易感性可通过体外试验确定。通常,将细胞培养物与不同浓度的本发明化合物混合足以使活性剂诱导显示出相关反应的时间,通常约1小时到1周。就体外试验而言,可以使用来自活检样品的培养细胞。
即使没有进一步详述,本领域技术人员应当能够在最宽泛的范围内利用上述说明书。因此优选的实施方案仅认为是描述性的公开,其绝对不以任何方式构成限制。
在上下文中,所有温度均以℃表示。在下列实施例中,“常规后处理”是指:如果必要的话,除去溶剂;如果必要的话,加入水;如果必要的话,将pH调节至2-10,这取决于终产物的构成,用乙酸乙酯或二氯甲烷萃取混合物,分离各相,将有机相用饱和NaHCO3洗涤,如果需要,用水和饱和氯化钠溶液洗涤,硫酸钠干燥,过滤蒸发,通过制备HPLC硅胶色谱法和/或通过结晶法纯化产物。经纯化的化合物根据需要进行冻干。
质谱(MS):ESI(电喷雾离子化)(M+H)+
缩写和首字母缩写列表:
AcOH乙酸,anh无水,atm大气压,BOC叔丁氧羰基,CDI 1,1′-羰基二咪唑,conc浓缩的,d天,dec分解,DMAC NN-二甲基乙酰胺,DMPU 1,3-二甲基-3,4,5,6-四氢-2(1H)-嘧啶酮,DMF NN-二甲基甲酰胺,DMSO二甲亚砜,DPPA二苯基磷酰基叠氮化物,EDCI 1-(3-二甲基氨基丙基)-3-乙基碳化二亚胺,EtOAc乙酸乙酯,EtOH乙醇(100%),Et2O乙醚,Et3N三乙胺,h小时,MeOH甲醇,pet.石油醚(沸程30-60℃),temp.温度,THF四氢呋喃,TFA三氟乙酸,Tf三氟甲磺酰基。
所有引用的参考文献的内容整体引入本文作为参考。本发明通过下述实施例进行更详细的解释,但不限于此。
实施例
I.本发明选择的化合物的合成
合成并鉴定了以下化合物。然而,本领域技术人员知晓以不同的方式制备和鉴别这些化合物。
实施例1
6-(1H-苯并三唑-5-羰基)-2-[3-(4-氯-苯基)-脲基]-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺6的合成
a.2-氨基-3-氨基甲酰基-4,7-二氢-5H-噻吩并[2,3-c]吡啶-6-甲酸叔丁基酯的合成(3)
将原材料1(25g,125mmol)在250ml烧瓶中混悬于125ml无水乙醇中,与原材料2(10.5g,125mmol)和硫(4.023g,125mmol)混合。向黄色混悬液中滴加12.9ml(125mmol)二乙基胺,随后变成橙色。反应混合物在环境温度下搅拌过夜。第二天,真空浓缩带红色的溶液,粗产物在甲醇中重结晶。分离所需的产物3,其为红棕色固体(40.7g,116mmol,93%)。
b.3-氨基甲酰基-2-[3-(4-氯-苯基)-脲基]-4,7-二氢-5H-噻吩并[2,3-c]吡啶-6-甲酸叔丁基酯的合成(4)
将化合物3(1.5g,4.3mmol)和对氯苯基异氰酸酯(724mg,4.7mmol)溶于吡啶(12ml),在室温下搅拌过夜。加入另一等份的异氰酸酯(724mg,4.7mmol),混合物搅拌过周末。真空减少溶剂,粗产物(2.3g,4mmol;淡棕色固体)未经进一步纯化直接用于下一反应(含量:根据UV,79%化合物4)。
c.2-[3-(4-氯-苯基)-脲基]-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(5)
将原材料4(2.3g,4.1mmol)混悬于20ml DCM中,与三氟乙酸混合(TFA,7.9ml,102mmol)。将所得棕色溶液在室温下搅拌50分钟。真空减少溶剂,粗产物通过制备HPLC纯化(方法1)。
合并产物组分,减少溶剂,最后冻干产物获得淡棕色固体状的5(850mg,2.4mmol,59%)。
d.6-(1H-苯并三唑-5-羰基)-2-[3-(4-氯-苯基)-脲基]-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(6)
将原材料5(847mg,2.4mmol)混悬于DMF中(8ml),加入1H-1,2,3-苯并三唑-5-甲酸(473mg,2.9mmol)、无水HOBt(427mg,2.9mmol)和EDCI(606mg,2.9mmol)。在环境温度下搅拌棕色混悬液过周末。由于反应尚未完全,继续在80℃搅拌反应物4小时。由此形成棕色的溶液。真空蒸发溶剂,粗产物通过制备HPLC进一步纯化(方法1)。合并产物组分,蒸发溶剂冻干产物。由此分离获得淡棕色固体状的310mg需要的产物6(0.635mmol,28%),以及另外58mg含量为76%的同一产物,其可以进一步纯化。
或者,5可以通过使用Alloc保护的原材料代替BOC保护的材料制备:
e.2-氨基-3-氨基甲酰基-4,7-二氢-5H-噻吩并[2,3-c]吡啶-6-甲酸烯丙基酯的制备(8)
在烧瓶中称取原材料7(4g,22mmol)、2(1.8g,22mmol)和硫(700mg,22mmol),加入16ml乙醇。向黄色混悬液中滴加二乙胺(2.2ml,22mmol)。反应物搅拌过夜。过滤橙色的沉淀,鉴定为产物8(4g,11.8mmol,含量83%,产率54%),其可不经过进一步纯化使用。
f.3-氨基甲酰基-2-[3-(4-氯-苯基)-脲基]-4,7-二氢-5H-噻吩并[2,3-c]吡啶-6-甲酸烯丙基酯的合成(9)
将原材料8(1g,3.6mmol)溶于12ml吡啶,加入对氯苯基异氰酸酯(546mg,3.6mmol)。红色溶液搅拌过周末。真空离心减少溶剂。粗产物不经进一步纯化即使用(绿-棕色固体,1.13g,9的含量65%,产率46%)。
g.2-[3-(4-氯-苯基)-脲基]-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(5)
在二颈瓶中将原材料9(750mg,1.7mmol)在氮气下溶于10ml DCM中,加入吗啉(3ml,34.5mmol)在34.5ml DCM中的溶液。搅拌所述溶液5分钟,随后加入四(三苯基膦)-钯(0)(199mg,0.2mmol)在17.2ml DCM中的溶液。约8分钟后形成棕色混悬液。反应物在环境温度下搅拌40分钟。减少溶剂,产物5由此分离成2个组分:非常纯的白色晶体(246mg,0.7mmol,41%)和56%含量的棕色固体(250mg,56%Gehalt an 5,0.4mmol),其含有副产物,但可通过制备HPLC纯化(方法2)。合并纯化的产物,减少溶剂,冻干产物。
或者,如实施例2中所述,最终产物可不使用任何保护基团制备:
实施例2
1-[6-(1H-苯并三唑-5-羰基)-3-(吡咯烷-1-羰基)-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-2-基]-3-(4-氯-苯基)-脲的合成(14)
a.(2-氨基-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-基)-吡咯烷-1-基-甲酮的合成(12)
在一个带滴液漏斗的100ml烧瓶中将哌啶酮-(4)(原材料10,1g,10.1mmol)溶于50ml无水乙醇中。随后加入原材料11(1.4g,10.1mmol)和硫(0.3g,10.1mmol)。向黄色混悬液中滴加入2ml二乙胺(20.2mmol)(在20分钟内),产生棕色溶液。反应物在室温下搅拌过夜。加入另1ml的二乙胺(10.1mmol),再搅拌反应物7小时。真空浓缩反应物。由此分离所需产物12,为粘稠棕色物(3.2g,12的含量75%,产率95%),其可不经过进一步纯化而使用。
b.[2-氨基-6-(1H-苯并三唑-5-羰基)-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-基]-吡咯烷-1-基-甲酮的合成(13)
将原材料12(1.6g,6.4mmol)溶于20ml DMF中,随后加入EDCI(1.46g,7.6mmol)和HOBt(1.3g,9.5mmol)。现在加入一半的1.04g(6.4mmol)1H-1,2,3-苯并三唑-5-甲酸。反应混合物在环境温度下搅拌过夜。随后加入另一半的1H-1,2,3-苯并三唑-5-甲酸,再次将反应混合物在环境温度下搅拌过夜。真空浓缩反应混合物产生7g粗产物。将其溶于乙酸乙酯和水,分层。有机相用水洗涤,合并的水相用乙酸乙酯洗涤。合并的有机相用盐水洗涤,MgSO4干燥并真空浓缩。分离所需的产物13,为棕色油状物(1.2g,20%含量,10%产率)。
c.1-[6-(1H-苯并三唑-5-羰基)-3-(吡咯烷-1-羰基)-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-2-基]-3-(4-氯-苯基)-脲的合成(14)
将原材料13(1.2g,20%含量,0.6mmol)溶于5ml吡啶,加入一半的112mg(0.7mmol)对氯苯基异氰酸酯。反应混合物在环境温度下搅拌过夜。随后加入另一半对氯苯基异氰酸酯,再次将反应物在环境温度下搅拌过夜。现在真空浓缩反应物,将分离的粗产物溶于7ml DMSO,通过制备HPLC纯化(方法3)。合并纯化的组分,减少溶剂,最后冻干产物。由此分离需要的产物14,为黄色固体状(16.2mg,4%;另有17mg的84%含量的14,4%产率)。
类似于实施例2-a,将哌啶酮(4)-盐酸盐(15)与氰基乙酸甲酯(16)反应:
a.’2-氨基-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸甲酯盐酸盐的合成(17)
将哌啶酮-(4)的盐酸盐(15,154g,1.1mol)、氰基乙酸甲酯(16,84g,0.8mol)和硫(32g,1mol)混悬于500ml甲醇中。随后加入二乙胺(150ml,1.4mol)。将混合物在室温下搅拌5小时。过滤所得晶体,用异丙醇和甲醇的混合物洗涤,干燥。真空减少母液至50%体积,放置过夜。再次过滤所得晶体,用异丙醇洗涤并干燥。总共分离了133g所需产物17(0.54mol,47%),经NMR鉴定,在类似于12的反应中使用。
还合成了酰胺而非脲:
实施例3:
6-(1H-苯并三唑-5-羰基)-2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成
a.3-氨基甲酰基-2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-4,7-二氢-5H-噻吩并[2,3-c]吡啶-6-甲酸叔丁基酯的合成(19)
将原材料3(1g,2.9mmol)混悬于11ml DMF中,加入原材料18(593mg,3.1mmol)、无水HOBt(505mg,3.1mmol)和EDCI(657mg,3.4mmol)。将棕色的混悬液在环境温度下搅拌过周末,随后将反应物加热至80℃过夜,真空离心减少溶剂,粗产物(棕色油)不经进一步纯化即使用(3.2g,22%含量的19,53%产率)。
b.2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(20)
将原材料19(3.2g,22%含量,1.5mmol)溶于25ml无水DCM,加入三氟乙酸(TFA,8.0ml,104mmol)。在环境温度下搅拌反应物30分钟。真空减少溶剂,粗产物用Flashmaster纯化(方法1)。分离的产物不够纯,因此用制备HPLC再次纯化(方法4)。合并纯化的组分,减少溶剂。由此分离所需产物20,其为棕色固体(236mg,42%)。
c.6-(1H-苯并三唑-5-羰基)-2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(21)
将原材料20(118mg,0.3mmol)混悬于2ml无水DMF中,加入1H-1,2,3-苯并三唑-5-甲酸(63mg,0.4mmol,1.2当量)、无水HOBt(52mg,0.4mmol)和EDCI(74mg,0.4mmol)。将棕色混悬液在80℃搅拌过夜。随后加入另半当量的1H-1,2,3-苯并三唑-5-甲酸,反应物继续在80℃搅拌6小时。真空减少溶剂,剩余的粗产物通过制备HPLC进一步纯化(方法3)。合并纯化的组分,减少溶剂。冻干剩余的产物,产生淡棕色固体状的所需产物21(20mg,0.04mmol,12%)。
类似的,可引入其他取代基代替1H-1,2,3-苯并三唑-5-甲酸制备酰胺:
实施例4:
2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-6-吡啶-4-基甲基-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(23)
2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-6-吡啶-4-基甲基-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(23)
将胺20(168mg,0.5mmol)和醛22(0.1ml,0.5mmol)溶于1,2-二氯乙烷(5ml)和无水THF(5ml)中。加入51μl冰醋酸(0.9mmol),在环境温度下搅拌混悬液3小时。现在加入305mg NaB(OAc)3(1.4mmol)和另51μl冰醋酸(0.9mmol),将反应物在室温下搅拌过夜。过滤所得固体,浓缩含有产物的母液,产生400mg粗产物,其通过制备HPLC进一步纯化(方法4)。分离得到26mg所需产物23,为棕色无定形固体(12%)。
实施例5:
2-[3-(4-氯-苯基)-脲基]-1H-吲哚-3,6-二甲酸3-酰胺6-[(2-氧代-2,3-二氢-苯并噁唑-6-基)-酰胺]的合成(32)
a.4-氟-3-硝基-苯甲酸甲酯的合成(25)
将原材料24(10g,54mmol)放置在60ml甲醇中,滴加0.5ml硫酸。将反应物在80℃搅拌过夜。随后在水和乙酸乙酯间分配反应混合物。合并的有机相用MgSO4干燥,过滤并浓缩,定量地产生无定形固体状的需要的产物25(10.8g,54mmol)。
b.4-(氨基甲酰基-氰基-甲基)-3-硝基-苯甲酸甲酯的合成(27)
将原材料25(10g,50mmol)和氰基乙酰胺(26,8.4g,100mmol)溶于无水THF,加入NaH(60%ig,4g,100mmol)。将反应物在环境温度下搅拌过夜。降温至0℃,加入4N HCl/二噁烷。真空浓缩反应混合物,固体残余物用400ml异丙基乙基醚结晶,过滤并干燥所得晶体。随后所述晶体用水洗涤,再次过滤和干燥。由此分离获得8.9g需要的产物27(67%,34mmol)。
c.4-氟-3-氨基-苯甲酸甲酯的合成(28)
将原材料27(7g,26.6mmol)溶于700ml甲醇中。所述溶液在H-管(Thales Nanotechnology)中分批氢化。
参数:
流速:3,0ml/分钟
模式:全H2
催化剂:兰尼镍THS 01122
T/℃:室温
p/巴:环境压力
合并氢化的溶液,真空下浓缩。由此分离的产物(28,5.5g,23.5mmol,89%)不需要进一步纯化即使用。
d.2-氨基-3-氨基甲酰基-1H-吲哚-6-甲酸的合成(29)
将原材料28(5.5g,23.5mmol)溶于200ml无水THF中,室温下加入2N NaOH(45ml,90mmol)。搅拌后,溶液变黑,形成固体沉淀物。浓缩混悬液至约100ml,用400ml乙酸乙酯萃取三次。真空浓缩水相,用乙酸乙酯处理2次,随后结晶所需产物29(1.1g,5.5mmol,21%)。
e.2-氨基-1H-吲哚-3,6-二甲酸3-酰胺6-[(2-氧代-2,3-二氢-苯并噁唑-6-基)-酰胺]的合成(31)
将原材料29(500mg,2.3mmol)溶于2ml无水DMF。随后加入EDCI(575mg,3mmol)和HOBt(322mg,2.4mmol)。环境温度下搅拌所述反应物过夜。随后将反应混合物倒入水中,过滤并干燥所得沉淀。该中间体鉴定为原材料29的HOBT酯(645mg,1.9mmol,84%),其不需要进一步纯化即可使用:
将500mg(1.5mmol)所述中间体和300.3mg(2mmol)6-氨基-3H-苯并噁唑-2-酮(制备见下文)溶于无水DMF(2ml)。随后加入383mg(2mmol)EDCI,将反应混合物在60℃搅拌过夜。随后将溶液加入水中,过滤并干燥所得黑色沉淀,获得400mg(0.85mmol)所需产物31,产率43%(从使用的中间体计算)。
f.2-[3-(4-氯-苯基)-脲基]-1H-吲哚-3,6-二甲酸3-酰胺6-[(2-氧代-2,3-二氢-苯并噁唑-6-基)-酰胺]的合成(32)
将原材料31(100mg,0.3mmol)溶于1ml无水吡啶。随后加入4-氯苯基异氰酸酯(46mg,0.3mmol),在环境温度下搅拌混合物。随后加入另40mg(0.29mmol)4-氯苯基异氰酸酯,在50℃搅拌反应混合物。数小时后真空浓缩反应物,制备HPLC纯化。浓缩纯组分后分离得到10mg(0.02mmol,7%)所需产物32。
g.6-氨基-3H-苯并噁唑-2-酮的合成(30)
将5g(26.9mmol)6-硝基苯并噁唑-2(3H)-酮溶于100ml THF,加入1gPd-C-5%(含有50.5%水)。将反应物用氢气氢化16小时。随后硅藻土过滤反应混合物,真空浓缩。由此分离得到红棕色固体状的所需产物30(2.6g,17.4mmol,65%)。
实施例6:
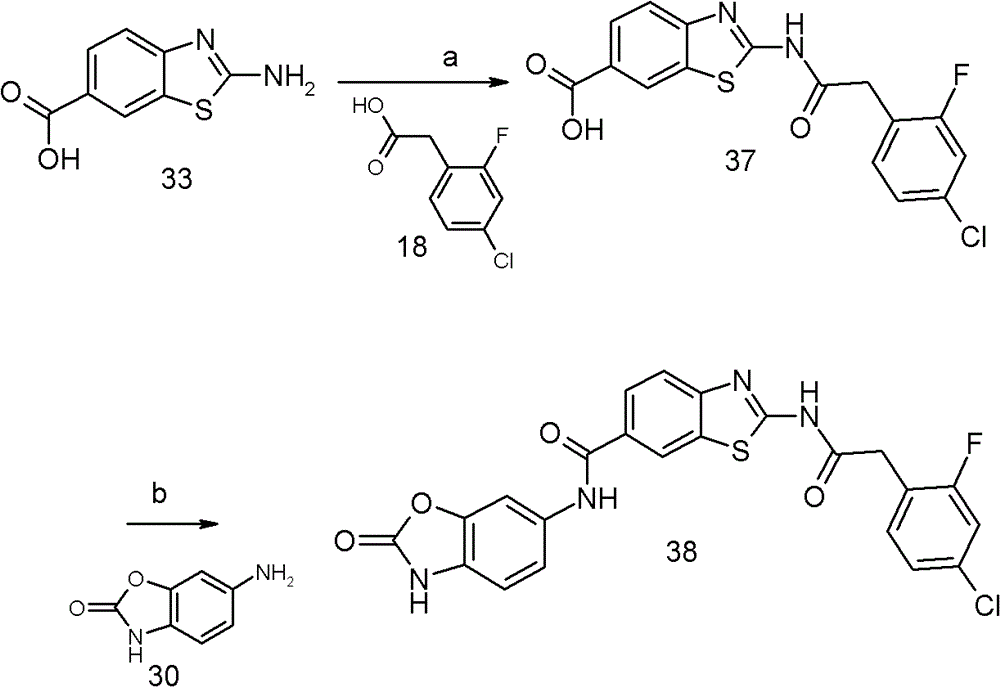
2-[3-(4-氯-苯基)-脲基]-苯并噻唑-6-甲酸(2-氧代-2,3-二氢-苯并噁唑-6-基)-酰胺的合成(36)
a.2-[3-(4-氯-苯基)-脲基]-苯并噻唑-6-甲酸乙基酯的合成(34)
将原材料33(400mg,1.8mmol)溶于无水吡啶(1ml)。加入4-氯苯基异氰酸酯(307mg,2mmol),在环境温度下搅拌反应物过夜。随后将反应混合物加入1N的HCl,过滤所得沉淀,用水洗涤并干燥。由此分离所需的产物36(710mg,1.58mmol,88%)。
b.2-[3-(4-氯-苯基)-脲基]-苯并噻唑-6-甲酸的合成(35)
将505mg(4.5mmol)叔丁醇钾放置在烧瓶中,加入90ml水,产生均匀分散的KOH。向混悬液中加入原材料34(710mg,1.6mmol),在环境温度下搅拌混合物。3小时后将反应混合物加热到60℃过夜。随后向混悬液中加入4.5ml 1N HCl,真空浓缩混合物,产生固体。由此分离得到产物35与NaCl的混合物(800mg,45%含量,1.035mmol,65%产率),其不需要进一步纯化即可使用。
c.2-[3-(4-氯-苯基)-脲基]-苯并噻唑-6-甲酸(2-氧代-2,3-二氢-苯并噁唑-6-基)-酰胺的合成(36)
将原材料35(300mg,45%含量,0.4mmol)和6-氨基-3H-苯并噁唑-2-酮(30,58mg,0.4mmol)溶于2ml无水DMF中,随后加入EDCI(96mg,0.5mmol)和HOBt(76mg,0.5mmol)。在环境温度下搅拌反应物过夜。随后倒入水中,过滤所得沉淀。分离的沉淀随后在100ml热甲醇中搅拌,过滤不溶性晶体,用甲醇洗涤。由此分离所需产物36(130mg,0.271mmol,70%)。
实施例7:
2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-苯并噻唑-6-甲酸(2-氧代-2,3-二氢-苯并噁唑-6-基)-酰胺的合成(38)
a.2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-苯并噻唑-6-甲酸的合成(37)
将原材料18(100mg,0.5mmol)溶于2ml DMF。加入EDCI(125mg,0.7mmol)和HOBt(99mg,0.7mmol)。在室温下搅拌3小时后,加入原材料33(103mg,0.5mmol),将反应物在室温下搅拌48小时。将溶液倒入1N HCl中,过滤所得沉淀,干燥产生需要的产物37(60mg,0.2mmol,70%含量,31%产率)。
b.2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-苯并噻唑-6-甲酸(2-氧代-2,3-二氢-苯并噁唑-6-基)-酰胺的合成(38)
将原材料37(60mg,0.2mmol,70%含量)和6-氨基-3H-苯并噁唑-2-酮(30,25mg,0.2mmol)溶于2ml DMF中。随后加入EDCI(38mg,0.2mmol)和HOBt(31mg,0.2mmol)。将反应物在环境温度下搅拌过夜,真空浓缩,制备HPLC纯化(方法1)。通过浓缩纯化的组分,可以分离需要的产物38(23mg,0.04mmol,24%)。
实施例8:
6-(1H-苯并三唑-5-羰基)-4,5,6,7-四氢-2H-吡唑并[3,4-c]吡啶-3-甲酸[2-(4-氯-苯基)-乙基]-酰胺的合成(43)
a.6-(1H-苯并三唑-5-羰基)-4,5,6,7-四氢-2H-吡唑并[3,4-c]吡啶-3-甲酸乙基酯的合成(40)
将原材料39(1.7g,6.4mmol)、4-甲基吗啉(700μL,6.4mmol)和1H-1,2,3-苯并三唑-5-甲酸(1g,6.4mmol)溶于15ml DMF。随后加入EDCI(1.2g,6.4mmol)和HOBt(0.9g,6.4mmol)。将反应物在环境温度下搅拌过夜。随后向反应混合物中加入水,继续搅拌。由于未形成沉淀,加入乙酸乙酯,分离各相。水相用乙酸乙酯洗涤2次。合并的有机相用Na2SO4干燥,过滤并真空浓缩。
定量分离需要的产物40(2.6g,6.4mmol),不用进一步纯化即使用。
b.6-(1H-苯并三唑-5-羰基)-4,5,6,7-四氢-2H-吡唑并[3,4-c]吡啶-3-甲酸的合成(41)
将原材料40(2.6g,6.4mmol)与2N NaOH(15ml)和乙醇(15ml)混合,在环境温度下搅拌。加入15ml 2N NaOH。反应完全后,蒸发混合物至干,将固体溶于水,用2N的HCl调节pH至2,过滤并干燥所得沉淀。由此分离固体状的产物41(1.4g,4.4mmol,57%)。
c.6-(1H-苯并三唑-5-羰基)-4,5,6,7-四氢-2H-吡唑并[3,4-c]吡啶-3-甲酸[2-(4-氯-苯基)-乙基]-酰胺的合成(43)
将原材料41(171.3mg,0.5mmol)、4-甲基吗啉(60,3μL,0.5mmol)和原材料42(85mg,0.5mmol)溶于5ml DMF。道后加入EDCI(105mg,0.5mmol)和HOBt(74mg,0.5mmol)。将反应物在环境温度下搅拌过夜。
将反应混合物倒入水中,过滤所得沉淀。将其在甲基叔丁基醚中搅拌,再次过滤。通过带有“配对物”的色谱进一步纯化(方法1)。
浓缩纯化的组分,在甲基叔丁基醚中搅拌并过滤。由此分离所需的产物43(45.6mg,0.1mmol,18%)。
实施例9:
[2-(1H-苯并三唑-5-羰基)-1,2,3,4-四氢-异喹啉-6-基]-氨基甲酸3,5-二氯-苄基酯的合成(48)
a.6-(3,5-二氯-苄氧基羰基氨基)-3,4-二氢-1H-异喹啉-2-甲酸叔丁基酯的合成(46)
将原材料45(250mg,1.4mmol)和1,1’-羰基二咪唑(275mg,1.7mmol)溶于2ml DCM,在室温下搅拌3小时。随后加入原材料44(350mg,1.4mmol),在室温下将所得混合物搅拌过夜。反应混合物用乙酸乙酯稀释,有机相用水洗涤3次,Na2SO4干燥,过滤并真空浓缩。剩余的固体通过制备HPLC纯化(方法1),合并纯化的组分,真空浓缩,产生棕色固体状的所需产物46(170mg,0.377mmol,27%)。
b.(1,2,3,4-四氢-异喹啉-6-基)-氨基甲酸3,5-二氯-苄基酯的合成(47)
将原材料46(170mg,0.4mmol)溶于5ml丙醇中。随后加入1ml HCl在2-丙醇中的溶液(5-6N),在环境温度下搅拌混合物过夜。随后用乙醚稀释反应混合物,真空浓缩并用乙醚搅拌,重复倾析。最后过滤固体残余物,45℃真空干燥。由此分离得到棕色晶体状的所需产物47(46mg,0.1mmol,35%)。
c.[2-(1H-苯并三唑-5-羰基)-1,2,3,4-四氢-异喹啉-6-基]-氨基甲酸3,5-二氯-苄基酯的合成(48)
将原材料47(46mg,0.1mmol)、1H-1,2,3-苯并三唑-5-甲酸(22mg,0.1mmol)和4-甲基吗啉(40μL,0.4mmol)溶于2ml DMF。随后加入EDCI(38mg,0.2mmol)和HOBt(26mg,0.2mmol),将混合物在环境温度下搅拌过夜。反应混合物与水混合,过滤所得沉淀,45℃真空干燥。由此分离得到淡棕色固体状的所需产物48(34mg,0.07mmol,52%)。
实施例10:
2-[2-(4-氯-2-氟-苯基)-乙酰基氨基]-6-(2-吡啶-3-基-乙酰基)-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸酰胺的合成(50)
将原材料49(37mg,0.3mmol)溶于2ml无水DMF中,随后加入EDCI(94mg,0.5mmol)和HOBt(48mg,0.3mmol),产生黄色溶液,加入100mg原材料20(0.3mmol)。随后将混合物加热至100℃30分钟。将反应混合物冷却至环境温度,与水混合,过滤并干燥所得沉淀。该粗产物用制备HPLC进一步纯化(方法4),产生淡棕色固体状的所需产物50(53mg,0.1mmol,37%)。
一般性说明:
类似的,对氯苯基异氰酸酯被下列异氰酸酯替换:
类似的,(4-氯-2-氟-苯基)-乙酸(18)被下列酸替换:
类似的,1H-1,2,3-苯并三唑-5-甲酸被下列酸替换:
类似的,吡啶-3-基-乙酸(49)被下列酸替换:
类似的,吡啶-4-甲醛(22)被下列醛替换:
类似的,6-氨基-3H-苯并噁唑-2-酮(30)被下列胺替换:
类似的,2-(4-氯-苯基)-乙基胺(42)被下列胺替换:
表2和3列出了其他类似合成的本发明化合物的概述(包括本发明所有化合物的物理化学参数)。
表2
表3
下文中列出了本发明选择的化合物的1H-NMR数据:
化合物33,C21H17Cl2N7O2
1H NMR(500MHz,DMSO-d6)δ[ppm]=13.15(s,1H),8.75(s,1H),8.03(s,1H),7.99(d,J=8.4,1H),7.50(d,J=8.4,1H),7.47(s,1H),7.34(s,2H),4.79(s,2H),4.40(s,2H),4.12-3.65(m,2H),2.95-2.60(m,3H).
化合物37,C22H19Cl2N7O2
1H NMR(500MHz,DMSO-d6)δ[ppm]=16.08(s,1H),13.22-12.55(m,1H),8.18-7.92(m,3H),7.60-7.52(m,3H),7.22(d,J=8.0,1H),4.90-4.45(m,2H),3.85(s,1H),3.60-3.40(m,3H),2.84(t,J=12.3,2H),2.76(s,2H).
化合物48,C24H19Cl2N5O3
1H NMR(500MHz,DMSO-d6)δ[ppm]=9.76(s,1H),8.05-7.87(m,2H),7.58(s,1H),7.49(s,3H),7.35-7.12(m,3H),5.15(s,2H),4.82-4.40(m,2H),4.02-3.50(m,2H),2.84(s,2H),2.35-2.20(m,1H).
化合物19,C21H18ClN5O3S
1H NMR(500MHz,DMSO)δ[ppm]=10.86(s,1H),10.20(s,1H),8.71(d,J=4.5,2H),7.91(s,1H),7.52(m,3H),7.35(d,J=8.1,2H),7.6-7.2(b r.s,1H),6.98(b r.s,1H),4.74(s,0.67x 2H)和4.56(s,0.33x 2H),3.90(s,0.33x 2H)和3.55(s,0.67x 2H),2.91(s,2H).
化合物7,C26H25N5O5S
1H NMR(500MHz,DMSO)δ[ppm]=11.86(s,1H),10.76(s,1H),9.95(s,1H),7.41(s,1H),7.39(d,J=8.3,2H),7.29(d,J=7.9,1H),7.17(m,3H),7.6-7.1(b r.s,1H),7.00(b r.s,1H),4.65(s,2H),3.54(m,2H),3.06-2.69(m,3H),1.19(d,J=6.9,6H).
化合物29,C23H14ClFN4O4S
1H NMR(400MHz,DMSO)δ[ppm]=12.83(s,1H),11.54(s,1H),10.33(s,1H),8.59(d,J=1.7,1H),8.03(dd,J=8.5,1.7,1H),7.86(t,J=8.5,1H),7.83(d,J=1.7,1H),7.54-7.41(m,3H),7.30(dd,J=8.2,1.9,1H),7.08(d,J=8.4,1H),3.97(s,2H).
化合物31,C22H14ClN5O4S
1H NMR(400MHz,DMSO)δ[ppm]=11.58(s,1H),10.33(s,1H),9.36(s,1H),8.53(s,1H),8.03-7.94(m,1H),7.84(d,J=1.9,1H),7.80-7.66(m,2H),7.59(m,2H),7.51(dd,J=8.5,1.9,1H),7.44-7.36(m,2H),7.09(d,J=8.4,1H).
2-氨基-4,5,6,7-四氢-噻吩并[2,3-c]吡啶-3-甲酸甲酯盐酸盐(17),C9H12N2O2S*HCl
1H NMR(400MHz,DMSO)δ[ppm]=7.35(s,2H),4.59(s,2H),3.77(s,2H),3.68(s,3H),3.04(t,J=5.9,2H),2.73-2.66(m,2H).
化合物50
1H NMR(500MHz,DMSO)δ=15.53(s,1H),13.22(s,1H),10.25(s,1H),8.47(s,1H),7.89(s,1H),7.83-7.68(m,3H),7.63(d,J=8.0,2H),5.25(s,2H),4.72-4.58(m,2H),3.72(s,2H),2.85(s,2H).
化合物51
1H NMR(500MHz,DMSO)δ=15.87(s,1H),13.10(s,1H),8.69(s,1H),8.07-7.90(m,2H),7.61(s,1H),7.49(d,J=8.5,1H),7.40-7.24(m,2H),4.77(s,2H),4.38(s,2H),3.81(s,1H),3.53(s,1H),2.79(s,2H).
化合物52
1H NMR(500MHz,DMSO,d-TFA交换,C21H14D3Cl2N7O3)δ=8.48(d,J=1.6,1H),7.82(d,J=9.0,1H),7.68(dd,J=9.0,1.6,1H),7.35-7.27(m,3H),5.06(s,2H),4.65-4.53(m,2H),3.64(s,2H),2.82(t,J=5.3,2H).
化合物53
1H NMR(500MHz,DMSO)δ=15.54(s,1H),13.22(s,1H),10.24(s,1H),8.46(s,1H),8.13-8.07(m,3H),7.89(d,J=7.9,1H),7.75(s,1H),5.32(s,2H),4.72-4.57(m,2H),3.71(s,2H),2.84(s,2H).
化合物54
1H NMR(500MHz,DMSO)δ=15.50(s,0H,1H),13.22(s,1H),10.24(s,1H),8.46(s,1H),7.89(d,J=8.2,2H),7.79-7.70(m,2H),7.58(d,J=8.2,1H),5.24(s,2H),4.75-4.60(m,2H),3.79-3.63(m,2H),2.86(s,2H).
化合物55
1H NMR(500MHz,DMSO)δ=15.50(s,1H),13.20(s,1H),10.22(s,1H),8.45(s,1H),7.88(d,J=7.9,1H),7.78-7.66(m,4H),7.63(t,J=7.7,1H),5.23(s,2H),4.62(s,2H),3.69(s,2H),2.83(t,J=5.4,2H).
化合物58
1H NMR(500MHz,DMSO)δ=15.54(s,1H),13.22(s,1H),10.25(s,1H),8.47(s,1H),7.89(s,1H),7.80-7.73(m,2H),7.60(d,J=8.7,1H),7.52(dd,J=8.5,1.9,1H),5.18(s,2H),4.70-4-58(m,2H),3.70(s,2H),2.85(s,2H).
化合物60
1H NMR(500MHz,DMSO)δ=15.75(s,1H),13.09(s,1H),8.65(s,1H),8.07-7.92(m,2H),7.49(d,J=8.5,1H),7.42(d,J=8.4,2H),7.30(d,J=8.2,2H),4.88-4.55(m,2H),4.42(d,J=5.2,2H),3.99--3.45(m,2H),2.80(s,2H).
以下分析方法被用于测定上述物理-化学参数:
ESI:电喷雾离子化质谱(M+H)+
分析色谱方法:
A HPLC-方法:1_100_2速度(仪器:LaChrom)
柱:Chromolith Performance RP18e 100-3mm
流速:2ml/分钟(泵:L-7100)
溶剂A:水+0.01%TFA
溶剂B:乙腈+0.01%TFA
波长(WL):220nm(检测器:L-7455)
0-0,2100%A,0,2-3,7到100%B,3,7-4,4100%B,4,5-5,0100%A
B LC-MS-方法:polar.M(仪器:Agilent1100Series)
柱:Chromolith Speed Rod RP18e-50-4.6
流速:2.4ml/分钟
溶剂A:水+0,1%TFA
溶剂B:乙腈+0,1%TFA
WL:220nm
梯度:0-2.6分钟:4%B到100%B,2.6-3.3分钟:100%B
C LC-MS-方法:polar.M(仪器:Agilent1100Series)
柱:Chromolith Speed Rod RP18e-50-4.6
流速:2.4ml/分钟
溶剂A:水+0,05%HCOOH
溶剂B:乙腈+0,04%HCOOH
WL:220nm
梯度:0-2.8分钟:4%B到100%B,2.8-3.3分钟:100%B
D HPLC-方法:1_100_2(仪器:LaChrom)
柱:Chromolith Performance RP18e 100-3mm
流速:2ml/分钟(泵:L-7100)
溶剂A:水+0.01%HCOOH
溶剂B:乙腈+0.01%HCOOH
WL:220nm(检测器:L-7455)
0-0,2100%A,0,2-3,7到100%B,3,7-4,4100%B,4,5-5,0 100%A
E HPLC/MS-方法(极性)
溶剂A:水+0,05%HCOOH
溶剂B:乙腈+0,04%HCOOH
流速:2,4ml/分钟,WL:220nm
梯度:0,0分钟4%B
2,8分钟100%B
3,3分钟100%B
3,4分钟4%B
F HPLC-方法(非极性)
溶剂A:水+0,1%TFA
溶剂B:乙腈+0,08%TFA
流速:1,5ml/分钟
梯度:0,0分钟20%B
5,0分钟100%B
5,5分钟100%B
6,0分钟20%B
6,5分钟20%B
柱:Chromolith Performance RP18e 100-3
G HPLC/MS-方法
溶剂A:乙腈+0,1%HCOOH
溶剂B:水+0,1%HCOOH
流速:1ml/分钟,WL:254nm
梯度:0,0分钟1%A
1,7分钟99%A
2,0分钟99%A
柱温:60℃
制备色谱方法:
制备HPLC方法1:
仪器:Agilent 1100Series
柱:Chromolith Prep Rod RP18e
流速:50ml/分钟
溶剂A:乙腈+0,1%TFA
溶剂B:水+0,1%TFA
WL:220nm
梯度:2分钟内从1到20%ACN,8分钟内从20到40%ACN,从2分钟到11分钟收集。
制备HPLC方法2:
仪器:Agilent 1100Series
柱:Chromolith Prep Rod RP18e
流速:50ml/分钟
溶剂A:乙腈+0,1%TFA
溶剂B:水+0,1%TFA
WL:220nm
梯度:10分钟内从1到30%ACN,从2分钟到11分钟收集。
制备HPLC方法3:
仪器:Agilent 1100Series
柱:Chromolith Prep Rod RP18e
流速:50ml/分钟
溶剂A:乙腈+0,1%TFA
溶剂B:水+0,1%TFA
WL:220nm
梯度:2分钟内从1到25%ACN,8分钟内从25到50%ACN,从2分钟到11分钟收集。
制备HPLC方法4:
仪器:Agilent 1100Series
柱:Chromolith Prep Rod RP18e
流速:50ml/分钟
溶剂A:乙腈+0,1%TFA
溶剂B:水+0,1%TFA
WL:220nm
梯度:2分钟内从1到15%ACN,8分钟内从15到35%ACN,从2分钟到11分钟收集。
Flashmaster方法1:
仪器:Flashmaster
柱材料:Chromolith NH2
溶剂:乙酸乙酯(EE)/MeOH
梯度:100%EE 5分钟,在15分钟内到达3%MeOH,在16分钟内到达4%MeOH,在15分钟内到达10%MeOH,15分钟MeOH冲洗。
II.自分泌运动因子试验
试验描述
使用Amplex Red试剂间接测定自分泌运动因子活性。此处将AmplexRed作为形成的H2O2的荧光指示剂进行测定。自分泌运动因子将底物溶血磷脂酰胆碱(LPC)转化成磷酸胆碱和溶血磷脂酸(LPA)。该反应后,磷酸胆碱与碱性磷酸酶反应生成无机磷酸盐和胆碱。在下一步中,胆碱被胆碱氧化酶氧化成甜菜碱,其中形成H2O2。H2O2与Amplex Red试剂在过氧化物酶(辣根过氧化物酶)存在下按照1∶1化学计算量反应并且形成高度荧光的试卤灵。按照反应依赖型动力学模式测定产生的荧光值,以便可以从总的测定荧光中去除未参与反应的可能的其它荧光物质的荧光信号。
进行试验的方法
将1.5μl本发明化合物的标准溶液以各浓度溶于20mM Hepes pH 7.2的含有最高浓度为7.7%DMSO的溶液中。将所得溶液与10μl(16ng)高度纯化的重组自分泌运动因子一起在384孔的黑色微量滴定板中在22℃预孵育30分钟。然后通过添加5μl L-a-溶血磷脂酰胆碱(LPC)启动反应,其中LPC终浓度是75μM。将该混合物在37℃下孵育90分钟。孵育后,加入Amplex Red试剂、过氧化物酶(辣根过氧化物酶)和胆碱氧化酶,立刻使用激发波长485nm的“Tecan Ultra Multimode”荧光读数器在612nm处测定荧光。通过检测形成的H2O2的量间接计算自分泌运动因子活性。
对于IC50分析,每种化合物从30μM开始进行10个系列的1∶3稀释,一式两份进行。
根据标准化后的数据计算IC50值,对于标准化,在各试验板中加入对照孔,将未抑制的对照孔的信号设定为100%,而被500μM C14LPA,(Avanti Polar Lipids,Cat#857120P)抑制的信号设定为0%。拟合曲线,使用适当的分析软件通过下列模型计算IC50值:
Y=底部+(100-底部)/(1+10^((LogIC50-X)*Hill斜率))
其中X是浓度的对数,Y是响应;Y在底部启动,以S形到达顶部。
材料
微量滴定板:PS微量板,384孔,小体积,黑色Corning,,Cat#3677
蛋白质:重组自分泌运动因子(杆状病毒Hi5表达)
底物:L-α-溶血磷脂酰胆碱(鸡蛋);Avanti Polar Lipids#830071P
标准品:C14LPA,Avanti Polar Lipids,Cat#857120P
检测试剂:Amplex Red试剂,Invitrogen#A12222,溶于1.923mlDMSO;过氧化物酶VI-A型(辣根过氧化物酶),来自Sigma#P6782,溶于7.45ml测试缓冲液中;胆碱氧化酶,Sigma#C5896,溶于2.47ml测试缓冲液中。
检测试剂混合物:Amplex Red试剂在测试缓冲液中的1∶100稀释液
测试缓冲液:200mM Tris HCl,Merck,Cat#1.08219,pH 7.9,0.1%BSA,无脂质,Roche Cat#775835
表4
Claims (13)
1.式(I)的化合物
其中:
W1、W2一起独立形成“–N=N–、–C(O)–O–”;
Y1独立的选自“–C(O)–、–NH–C(O)–、单键”;
Y2独立的选自“–CH2–、–O–、–NH–、单键”;
Z1是O;
L独立的选自下列基团:
B独立的选自下述基团:
“4-氯-苯基、3-三氟甲基-苯基、4-三氟甲基-苯基、4-三氟甲基硫基-苯基、4-三氟甲氧基-苯基、3-氯-4-三氟甲氧基-苯基、3,5-双-三氟甲基-苯基、4-异丙基苯基、3,5-二氯-苯基、4-氯-2-氟-苯基、3-氯-苯基、2-氟-5-三氟甲基-苯基、3-氯-4-三氟甲基-苯基、3,4-二氯-苯基、2,5-二氯-苯基、2-甲氧基-苯基、4-硝基-苯基、4-溴-苯基、5-氯-2-甲氧基-苯基、4-氟-苯基、3-溴-4-氟-苯基、6-甲氧基-1,2,3,4-四氢-萘-2-基”;
R1是氢;
R2是氢;
R3、R4是氢;
n独立的为0、1或2;
及其生理上可接受的盐,包括它们所有比例的混合物。
5.包含至少一种权利要求1-3任一项所述的化合物的药物。
6.包含至少一种权利要求1-3任一项所述的化合物的药物,其用于治疗和/或预防生理和/或病理状况,所述状况由溶血磷脂酸水平的升高和/或自分泌运动因子的活化引起、介导和/或传播。
7.包含至少一种权利要求1-3任一项所述的化合物的药物,其用于治疗和/或预防选自以下的生理和/或病理状况:癌症、血管发生、眼部疾病、炎性疾病、神经变性和/或移植排斥。
8.包含至少一种权利要求1-3任一项所述的化合物的药物,其用于治疗和/或预防选自以下的生理和/或病理状况:尤因肉瘤、卡波西肉瘤、神经胶质瘤、胶质母细胞瘤、成神经细胞瘤、胃癌、肾细胞癌、前列腺癌、结缔组织肿瘤、软组织肉瘤、胰腺肿瘤、肝肿瘤、头部肿瘤、颈部肿瘤、喉癌、食管癌、甲状腺癌、骨肉瘤、视网膜母细胞瘤、胸腺瘤、睾丸癌、肺腺癌、小细胞肺癌、支气管癌、乳腺癌、肠癌、卵巢肿瘤、子宫癌、宫颈癌、膀胱癌、泌尿生殖道癌、鳞状上皮癌、基底细胞癌、spinaliomas、黑素瘤、单核细胞白血病、慢性粒细胞白血病、慢性淋巴性白血病、急性粒细胞白血病、急性淋巴性白血病、淋巴瘤、动脉硬化、脉络膜新生血管化、糖尿病性视网膜病、关节炎和/或再狭窄。
9.权利要求5-8任一项的药物,其中所述药物还包括至少一种其他药理学活性物质。
10.药物组合物,包含治疗有效量的至少一种权利要求1-3任一项所述的化合物。
11.权利要求10所述的药物组合物,还包括至少一种其他化合物,所述其他化合物选自生理上可接受的佐剂和/或除权利要求1-3任一项所述化合物以外的额外的药理学活性物质。
12.权利要求11所述的药物组合物,其中所述生理上可接受的佐剂选自赋形剂或载体。
13.药盒,其包含治疗有效量的至少一种权利要求1-3任一项所述化合物和/或至少一种权利要求10-12任一项所述药物组合物和治疗有效量的至少一种除权利要求1-3任一项所述化合物以外的其他药理学活性物质。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| EP09004866.1 | 2009-04-02 | ||
| EP09004866 | 2009-04-02 | ||
| PCT/EP2010/001457 WO2010112124A1 (en) | 2009-04-02 | 2010-03-09 | Autotaxin inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN102369195A CN102369195A (zh) | 2012-03-07 |
| CN102369195B true CN102369195B (zh) | 2014-04-16 |
Family
ID=42235629
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201080015468.8A Expired - Fee Related CN102369195B (zh) | 2009-04-02 | 2010-03-09 | 自分泌运动因子抑制剂 |
Country Status (14)
| Country | Link |
|---|---|
| US (2) | US8329907B2 (zh) |
| EP (1) | EP2414346B1 (zh) |
| JP (1) | JP5779172B2 (zh) |
| KR (1) | KR20120004483A (zh) |
| CN (1) | CN102369195B (zh) |
| AR (1) | AR076007A1 (zh) |
| AU (1) | AU2010230585B2 (zh) |
| CA (1) | CA2757415C (zh) |
| EA (1) | EA201101396A1 (zh) |
| ES (1) | ES2547124T3 (zh) |
| IL (1) | IL215259A (zh) |
| MX (1) | MX2011010218A (zh) |
| SG (1) | SG174518A1 (zh) |
| WO (1) | WO2010112124A1 (zh) |
Families Citing this family (44)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US8598156B2 (en) | 2010-03-25 | 2013-12-03 | Glaxosmithkline Llc | Chemical compounds |
| CN102358742B (zh) * | 2011-08-24 | 2014-04-09 | 天津药物研究院 | 具有抗肿瘤活性的噻唑类化合物 |
| NZ702334A (en) | 2012-06-13 | 2016-11-25 | Hoffmann La Roche | New diazaspirocycloalkane and azaspirocycloalkane |
| CN102702135B (zh) * | 2012-06-15 | 2014-05-28 | 中国农业大学 | 一种含苯并噻唑结构的苯甲酰基硫脲类化合物及其制备方法和应用 |
| UA116547C2 (uk) | 2012-09-25 | 2018-04-10 | Ф. Хоффманн-Ля Рош Аг | Біциклічні похідні |
| BR112015014372A8 (pt) | 2012-12-19 | 2019-10-29 | Novartis Ag | inibidores de autotaxina, seus usos, e composição e combinação farmacêuticas". |
| US9409895B2 (en) | 2012-12-19 | 2016-08-09 | Novartis Ag | Autotaxin inhibitors |
| JPWO2014133112A1 (ja) * | 2013-03-01 | 2017-02-02 | 国立大学法人 東京大学 | オートタキシン阻害活性を有する8−置換イミダゾピリミジノン誘導体 |
| AR095079A1 (es) * | 2013-03-12 | 2015-09-16 | Hoffmann La Roche | Derivados de octahidro-pirrolo[3,4-c]-pirrol y piridina-fenilo |
| PL2970255T3 (pl) | 2013-03-14 | 2017-10-31 | Galapagos Nv | Związki i ich kompozycje farmaceutyczne do leczenia zaburzeń zapalnych |
| EP3046905A4 (en) | 2013-09-17 | 2017-03-22 | Pharmakea Inc. | Vinyl autotaxin inhibitor compounds |
| WO2015042052A1 (en) * | 2013-09-17 | 2015-03-26 | Pharmakea, Inc. | Heterocyclic vinyl autotaxin inhibitor compounds |
| WO2015048301A1 (en) * | 2013-09-26 | 2015-04-02 | Pharmakea, Inc. | Autotaxin inhibitor compounds |
| CR20160290A (es) | 2013-11-22 | 2016-09-28 | Pharmakea Inc | Inhibidores tetracíclicos de autotaxina |
| MX2016006623A (es) * | 2013-11-22 | 2017-03-10 | Pharmakea Inc | Compuestos de inhibidor de autotaxina. |
| PL3074400T3 (pl) * | 2013-11-26 | 2018-03-30 | F.Hoffmann-La Roche Ag | Pochodne oktahydrocyklobuta[1,2-c;3,4-c']dipirolu jako inhibitory autotaksyny |
| DK3122750T3 (da) * | 2014-03-26 | 2019-11-04 | Hoffmann La Roche | Bicykliske forbindelser som autotaxin (ATX)- og lysofosfatidsyre (LPA)-produktionshæmmere |
| PE20161223A1 (es) | 2014-03-26 | 2016-11-12 | Hoffmann La Roche | Compuestos condensados de [1,4]diazepina como inhibidores de la produccion de autotaxina (atx) y acido lisofosfatidico (lpa) |
| AU2015240519B2 (en) | 2014-04-04 | 2019-08-15 | X-Rx, Inc. | Substituted spirocyclic inhibitors of autotaxin |
| US20170037030A1 (en) | 2014-04-24 | 2017-02-09 | Novartis Ag | Autotaxin inhibitors |
| US9051320B1 (en) | 2014-08-18 | 2015-06-09 | Pharmakea, Inc. | Methods for the treatment of metabolic disorders by a selective small molecule autotaxin inhibitor |
| GB201501870D0 (en) | 2015-02-04 | 2015-03-18 | Cancer Rec Tech Ltd | Autotaxin inhibitors |
| GB201502020D0 (en) | 2015-02-06 | 2015-03-25 | Cancer Rec Tech Ltd | Autotaxin inhibitory compounds |
| MA41898A (fr) | 2015-04-10 | 2018-02-13 | Hoffmann La Roche | Dérivés de quinazolinone bicyclique |
| WO2016191427A1 (en) | 2015-05-27 | 2016-12-01 | Pharmakea, Inc. | Autotaxin inhibitors and uses thereof |
| EP3302465A1 (en) | 2015-06-05 | 2018-04-11 | Vertex Pharmaceuticals Incorporated | Triazoles for the treatment of demyelinating diseases |
| PE20180479A1 (es) | 2015-09-04 | 2018-03-07 | Hoffmann La Roche | Nuevos derivados de fenoximetilo |
| JP6846414B2 (ja) | 2015-09-24 | 2021-03-24 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | Atx阻害剤としての二環式化合物 |
| EP3353178B1 (en) | 2015-09-24 | 2021-07-14 | F. Hoffmann-La Roche AG | Bicyclic compounds as dual atx/ca inhibitors |
| JP6845230B2 (ja) | 2015-09-24 | 2021-03-17 | エフ.ホフマン−ラ ロシュ アーゲーF. Hoffmann−La Roche Aktiengesellschaft | デュアルatx/ca阻害剤としての新規な二環式化合物 |
| MX2018001890A (es) | 2015-09-24 | 2018-06-20 | Hoffmann La Roche | Compuestos biciclicos como inhibidores de autotaxina (atx). |
| EP3182211A1 (fr) * | 2015-12-17 | 2017-06-21 | Nivarox-FAR S.A. | Pièce composite avec moyens élastiques sous contrainte |
| JOP20190024A1 (ar) | 2016-08-26 | 2019-02-19 | Gilead Sciences Inc | مركبات بيروليزين بها استبدال واستخداماتها |
| WO2018106641A1 (en) | 2016-12-06 | 2018-06-14 | Vertex Pharmaceuticals Incorporated | Pyrazoles for the treatment of demyelinating diseases |
| WO2018106646A1 (en) | 2016-12-06 | 2018-06-14 | Vertex Pharmaceuticals Incorporated | Aminotriazoles for the treatment of demyelinating diseases |
| WO2018106643A1 (en) | 2016-12-06 | 2018-06-14 | Vertex Pharmaceuticals Incorporated | Heterocyclic azoles for the treatment of demyelinating diseases |
| CR20190423A (es) | 2017-03-16 | 2019-11-01 | Hoffmann La Roche | Nuevos compuestos biciclícos como inhibidores dobles de atx/ca |
| JP7090099B2 (ja) * | 2017-03-16 | 2022-06-23 | エフ.ホフマン-ラ ロシュ アーゲー | Atxインヒビターとしての新規二環式化合物 |
| US10836769B2 (en) | 2018-02-26 | 2020-11-17 | Gilead Sciences, Inc. | Substituted pyrrolizine compounds and uses thereof |
| BR112022000325A2 (pt) | 2019-07-11 | 2022-03-15 | Escape Bio Inc | Indazois e azaindazois como inibidores de lrrk2 |
| CN112778274B (zh) * | 2019-11-05 | 2022-02-15 | 四川海思科制药有限公司 | 一种含氮杂环衍生物及其制备 |
| CN111454278B (zh) * | 2020-05-15 | 2021-03-19 | 四川大学 | Pak1抑制剂及其合成和在制备抗肿瘤药物中的应用 |
| EP4405349A1 (en) * | 2021-09-21 | 2024-07-31 | Universität Münster | Autotaxin-inhibitors |
| KR102502940B1 (ko) * | 2021-11-30 | 2023-02-24 | 주식회사 넥스트젠바이오사이언스 | 오토탁신 저해제로서의 신규 화합물 및 이의 용도 |
Family Cites Families (26)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2309319A1 (en) * | 1997-11-10 | 1999-05-20 | Bristol-Myers Squibb Company | Benzothiazole protein tyrosine kinase inhibitors |
| DE19834751A1 (de) | 1998-08-01 | 2000-02-03 | Boehringer Ingelheim Pharma | Disubstituierte bicyclische Heterocyclen, ihre Herstellung und ihre Verwendung als Arzneimittel |
| GB9904387D0 (en) | 1999-02-25 | 1999-04-21 | Pharmacia & Upjohn Spa | Antitumour synergistic composition |
| EP1187633A4 (en) | 1999-04-08 | 2005-05-11 | Arch Dev Corp | USE OF ANTI-VEGF ANTIBODY FOR INCREASING IRRADIATION IN CANCER THERAPY |
| US6710058B2 (en) | 2000-11-06 | 2004-03-23 | Bristol-Myers Squibb Pharma Company | Monocyclic or bicyclic carbocycles and heterocycles as factor Xa inhibitors |
| US20030139431A1 (en) | 2001-09-24 | 2003-07-24 | Kawakami Joel K. | Guanidines which are agonist/antagonist ligands for neuropeptide FF (NPFF) receptors |
| AU2003229305A1 (en) | 2002-05-17 | 2003-12-02 | Scios, Inc. | TREATMENT OF FIBROPROLIFERATIVE DISORDERS USING TGF-Beta INHIBITORS |
| AU2004236249A1 (en) | 2003-04-30 | 2004-11-18 | The Institutes Of Pharmaceutical Discovery, Llc | Heterocycle substituted carboxylic acids as inhibitors of protein tyrosine phosphatase-1B |
| CA2531327A1 (en) | 2003-07-03 | 2005-01-13 | Myriad Genetics, Inc. | Compounds and therapeutical use thereof |
| JP4895811B2 (ja) | 2003-09-11 | 2012-03-14 | ケミア,インコーポレイテッド | サイトカイン阻害剤 |
| AU2005225471B2 (en) * | 2004-03-26 | 2011-05-12 | Methylgene Inc. | Inhibitors of histone deacetylase |
| EP1828152B1 (en) | 2004-12-08 | 2008-08-20 | Bristol-Myers Squibb Company | Heterocyclic compounds as inhibitors of factor viia |
| AU2005318465A1 (en) | 2004-12-21 | 2006-06-29 | Devgen N.V. | Compounds with Kv4 ion channel activity |
| CA2592900A1 (en) | 2005-01-03 | 2006-07-13 | Myriad Genetics Inc. | Nitrogen containing bicyclic compounds and therapeutical use thereof |
| WO2006072828A2 (en) | 2005-01-07 | 2006-07-13 | Pfizer Products Inc. | Heteroaromatic quinoline compounds and their use as pde10 inhibitors |
| JP5066514B2 (ja) | 2005-03-14 | 2012-11-07 | ハイ ポイント ファーマシューティカルズ,エルエルシー | ベンズアゾール誘導体、組成物及びβ−セクレターゼ阻害剤としての使用方法 |
| KR100926399B1 (ko) | 2005-04-06 | 2009-11-12 | 아이알엠 엘엘씨 | 디아릴아민―함유 화합물 및 조성물, 및 스테로이드 호르몬핵 수용체의 조절제로서의 그들의 용도 |
| WO2006124874A2 (en) * | 2005-05-12 | 2006-11-23 | Kalypsys, Inc. | Inhibitors of b-raf kinase |
| WO2007030582A2 (en) | 2005-09-09 | 2007-03-15 | Bristol-Myers Squibb Company | Acyclic ikur inhibitors |
| US7910595B2 (en) | 2005-12-21 | 2011-03-22 | Abbott Laboratories | Anti-viral compounds |
| EP2233472B1 (en) | 2006-03-28 | 2014-01-15 | Atir Holding S.A. | Heterocyclic compounds and uses thereof in the treatment of sexual disorders |
| WO2008014286A1 (en) | 2006-07-24 | 2008-01-31 | University Of Virginia Patent Foundation | Vinyl phosphonate lysophosphatidic acid receptor antagonists |
| GB0619176D0 (en) | 2006-09-29 | 2006-11-08 | Lectus Therapeutics Ltd | Ion channel modulators & uses thereof |
| JP2010510224A (ja) | 2006-11-17 | 2010-04-02 | アボット・ラボラトリーズ | ケモカイン受容体拮抗薬としてのアミノピロリジン類 |
| ES2531256T3 (es) | 2007-01-25 | 2015-03-12 | Du Pont | Amidas fungicidas |
| WO2008124393A1 (en) * | 2007-04-04 | 2008-10-16 | Irm Llc | Benzothiazole derivatives and their use as protein kinase inhibitors |
-
2010
- 2010-03-09 CN CN201080015468.8A patent/CN102369195B/zh not_active Expired - Fee Related
- 2010-03-09 CA CA2757415A patent/CA2757415C/en not_active Expired - Fee Related
- 2010-03-09 EA EA201101396A patent/EA201101396A1/ru unknown
- 2010-03-09 AU AU2010230585A patent/AU2010230585B2/en not_active Ceased
- 2010-03-09 ES ES10707839T patent/ES2547124T3/es active Active
- 2010-03-09 JP JP2012502481A patent/JP5779172B2/ja not_active Expired - Fee Related
- 2010-03-09 WO PCT/EP2010/001457 patent/WO2010112124A1/en active Application Filing
- 2010-03-09 MX MX2011010218A patent/MX2011010218A/es not_active Application Discontinuation
- 2010-03-09 US US13/258,077 patent/US8329907B2/en active Active
- 2010-03-09 KR KR1020117025496A patent/KR20120004483A/ko not_active Application Discontinuation
- 2010-03-09 EP EP10707839.6A patent/EP2414346B1/en not_active Not-in-force
- 2010-03-09 SG SG2011068616A patent/SG174518A1/en unknown
- 2010-03-31 AR ARP100101049A patent/AR076007A1/es unknown
-
2011
- 2011-09-20 IL IL215259A patent/IL215259A/en active IP Right Grant
-
2012
- 2012-09-14 US US13/617,406 patent/US8497283B2/en not_active Expired - Fee Related
Non-Patent Citations (3)
| Title |
|---|
| Medicinal Chemistry Letters》.2007,第17卷1634-1640. * |
| Peng Cui, et al.Synthesis and biological evaluation of phosphonate derivatives as autotaxin (ATX) inhibitors.《Bioorganic & Medicinal Chemistry Letters》.2007,第17卷1634-1640. |
| Peng Cui, et al.Synthesis and biological evaluation of phosphonate derivatives as autotaxin (ATX) inhibitors.《Bioorganic & * |
Also Published As
| Publication number | Publication date |
|---|---|
| EP2414346A1 (en) | 2012-02-08 |
| US20130023556A1 (en) | 2013-01-24 |
| JP2012522734A (ja) | 2012-09-27 |
| WO2010112124A1 (en) | 2010-10-07 |
| CN102369195A (zh) | 2012-03-07 |
| IL215259A0 (en) | 2011-12-29 |
| SG174518A1 (en) | 2011-10-28 |
| EA201101396A1 (ru) | 2012-09-28 |
| CA2757415C (en) | 2018-02-06 |
| US8329907B2 (en) | 2012-12-11 |
| US20120015976A1 (en) | 2012-01-19 |
| IL215259A (en) | 2016-05-31 |
| MX2011010218A (es) | 2011-10-10 |
| EP2414346B1 (en) | 2015-06-24 |
| KR20120004483A (ko) | 2012-01-12 |
| AU2010230585B2 (en) | 2016-03-24 |
| AU2010230585A1 (en) | 2011-11-17 |
| US8497283B2 (en) | 2013-07-30 |
| ES2547124T3 (es) | 2015-10-01 |
| CA2757415A1 (en) | 2010-10-07 |
| AU2010230585A8 (en) | 2012-01-19 |
| AR076007A1 (es) | 2011-05-11 |
| JP5779172B2 (ja) | 2015-09-16 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102369195B (zh) | 自分泌运动因子抑制剂 | |
| CN102369186B (zh) | 作为自分泌运动因子抑制剂的哌啶和哌嗪衍生物 | |
| CN102216299B (zh) | 作为自体毒素抑制剂的2,5-二氨基取代的吡啶并[4,3-d]嘧啶化合物 | |
| CN102822171B (zh) | 作为自分泌运动因子抑制剂的苯并萘啶胺类 | |
| CN102365271B (zh) | 作为自分泌运动因子抑制剂的杂环化合物 | |
| KR102120513B1 (ko) | 이미다조피리딘 화합물 및 이의 용도 | |
| CA2799640C (en) | 5,6-dihydro-2h-[1,4]oxazin-3-yl-amine derivatives useful as inhibitors of beta-secretase (bace) | |
| TWI642667B (zh) | 吡啶並嘧啶類衍生物、其製備方法及其在醫藥上的應用 | |
| KR101829595B1 (ko) | 3-(1-{3-[5-(1-메틸-피페리딘-4일메톡시)-피리미딘-2-일]-벤질}-6-옥소-1,6-디히드로-피리다진-3-일)-벤조니트릴 히드로클로라이드 염의 신규한 다형체 및 이의 제조 방법 | |
| CN102712604B (zh) | 用于肿瘤治疗的亚砜衍生物 | |
| CN104053442A (zh) | 某些化学实体、组合物及方法 | |
| WO2007132841A1 (ja) | 縮合複素環化合物およびその用途 | |
| HUE032436T2 (en) | Combinations for the treatment of diseases involving cell proliferation | |
| CN107848974A (zh) | 芳族磺酰胺衍生物 | |
| CN104080335B (zh) | 某些化学实体、组合物及方法 | |
| ES2842289T3 (es) | Compuestos para tratar el síndrome del dolor y otros trastornos | |
| ES2971063T3 (es) | Nuevos usos terapéuticos de ligandos H3 | |
| EP1611126B1 (de) | Chromenonindole | |
| CN102264729B (zh) | 6-(1-甲基-1h-吡唑-4-基)-2-{3-[5-(2-吗啉-4-基-乙氧基)-嘧啶-2-基]-苄基}-2h-哒嗪-3-酮磷酸二氢盐的多晶型物及其制备方法 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: DE Ref document number: 1166793 Country of ref document: HK |
|
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| REG | Reference to a national code |
Ref country code: HK Ref legal event code: WD Ref document number: 1166793 Country of ref document: HK |
|
| CF01 | Termination of patent right due to non-payment of annual fee |
Granted publication date: 20140416 Termination date: 20210309 |
|
| CF01 | Termination of patent right due to non-payment of annual fee |