CN102333541A - 免疫原性组合物 - Google Patents
免疫原性组合物 Download PDFInfo
- Publication number
- CN102333541A CN102333541A CN2010800095800A CN201080009580A CN102333541A CN 102333541 A CN102333541 A CN 102333541A CN 2010800095800 A CN2010800095800 A CN 2010800095800A CN 201080009580 A CN201080009580 A CN 201080009580A CN 102333541 A CN102333541 A CN 102333541A
- Authority
- CN
- China
- Prior art keywords
- antigen
- adjuvant
- immunogenic composition
- granule
- plga
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
Images
Classifications
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/39—Medicinal preparations containing antigens or antibodies characterised by the immunostimulating additives, e.g. chemical adjuvants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/59—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes
- A61K47/60—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule obtained otherwise than by reactions only involving carbon-to-carbon unsaturated bonds, e.g. polyureas or polyurethanes the organic macromolecular compound being a polyoxyalkylene oligomer, polymer or dendrimer, e.g. PEG, PPG, PEO or polyglycerol
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K47/00—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient
- A61K47/50—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates
- A61K47/51—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent
- A61K47/56—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule
- A61K47/61—Medicinal preparations characterised by the non-active ingredients used, e.g. carriers or inert additives; Targeting or modifying agents chemically bound to the active ingredient the non-active ingredient being chemically bound to the active ingredient, e.g. polymer-drug conjugates the non-active ingredient being a modifying agent the modifying agent being an organic macromolecular compound, e.g. an oligomeric, polymeric or dendrimeric molecule the organic macromolecular compound being a polysaccharide or a derivative thereof
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/545—Medicinal preparations containing antigens or antibodies characterised by the dose, timing or administration schedule
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/555—Medicinal preparations containing antigens or antibodies characterised by a specific combination antigen/adjuvant
- A61K2039/55511—Organic adjuvants
- A61K2039/55555—Liposomes; Vesicles, e.g. nanoparticles; Spheres, e.g. nanospheres; Polymers
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/60—Medicinal preparations containing antigens or antibodies characteristics by the carrier linked to the antigen
- A61K2039/6025—Nucleotides
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Veterinary Medicine (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Public Health (AREA)
- Epidemiology (AREA)
- Immunology (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Microbiology (AREA)
- Mycology (AREA)
- Organic Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Medicines Containing Antibodies Or Antigens For Use As Internal Diagnostic Agents (AREA)
- Medicinal Preparation (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
Abstract
本发明提供一种抗原-佐剂微粒复合物和含有该复合物缔合而成的颗粒作为有效成分的免疫原性组合物,所述抗原包埋在佐剂微粒中,所述佐剂微粒包含疏水性链段为聚(羟基酸)的两亲性聚合物。所述抗原-佐剂微粒复合物和所述免疫原性组合物由于以少量的抗原、少次给药能够诱导对抗原的高免疫应答,所以作为对感染性疾病、癌等的治疗和预防有效的疫苗是有用的。
Description
技术领域
本发明涉及一种含有抗原-佐剂微粒复合物作为有效成分的免疫原性组合物,所述抗原包埋在佐剂微粒中,所述佐剂微粒包含两亲性聚合物。
背景技术
为了提高抗原的免疫活化能,与抗原一起使用佐剂。作为佐剂,已知其效果高的佐剂是弗氏完全佐剂(CFA),但由死菌和油乳液形成的CFA具有很强的副作用,在给药部位发生强的炎症反应和形成溃疡性的肿胀(肉芽肿)等,所以有安全上的忧虑,不允许用于人。允许对人给药的佐剂有限。允许对人给药的佐剂有氢氧化铝佐剂,但该佐剂的免疫活化能力很难说是充分的,为了获得免疫,需要反复给药。为此,期待开发出一种能够用于人的、使用了效率好且效力大的佐剂的免疫原性组合物。
对于以高的免疫活化能作为目标的新型佐剂的开发,尝试了将抗原包埋在微粒中的方法。据报道,通过将抗原制成微粒后给药,与抗原单独给药时相比,产生抗体等的免疫反应增强,但其效果未必高,仅报告了具有与上述的氢氧化铝佐剂同程度的效果。认为其原因是,迄今为止所研究的微粒、例如由疏水性的聚乳酸-聚乙醇酸共聚聚合物构成的微粒难以将蛋白等亲水性的抗原分子高效率地在保持了结构的状态下包埋(非专利文献1)。
近年来,报告了利用两亲性聚合物能以高效率封入高分子量蛋白质的新型微粒技术(专利文献1、2)。对于新型的微粒,对药物的缓释性能做了研究,但对于包埋有抗原时的佐剂功能完全没有做研究。进而,对于包含抗原的微粒作为佐剂发挥功能的机制,认为与对抗原分子缓释的功能相组合,包含抗原的微粒连同颗粒被免疫细胞摄取后在细胞内将抗原游离的机制是重要的,并认为药物从颗粒中释放的功能与作为佐剂的性能是不一致的,所以难以从颗粒的缓释性能推测佐剂功能,尽管期待开发出具有远远超过铝佐剂的性能的有效的佐剂,但使用了现有的微粒的技术中迄今为止没有实现这种佐剂。
专利文献1:WO2006/095668号
专利文献2:日本特开2008-088158号公报
非专利文献
非专利文献1:Advanced Drug Delivery Reviews、2005年57号、391-410页
发明内容
本发明的目的在于提供一种在抗原量少、给药次数少的情况下具有高的免疫活化能的免疫原性组合物。
为了克服上述课题,本发明人等研究了使用少量的抗原以少次给药能够引起较强的免疫活化的方法,结果发现在佐剂微粒内包埋了抗原的抗原-佐剂微粒复合物在生物体内具有高的免疫活化能。即,本发明具有以下那样的构成。
(1)一种免疫原性组合物,其含有抗原-佐剂微粒复合物作为有效成分,所述抗原包埋在佐剂微粒中,所述佐剂微粒包含疏水性链段为聚(羟基酸)的两亲性聚合物。
(2)如(1)所述的免疫原性组合物,其中,该免疫原性组合物含有抗原-佐剂微粒复合物缔合而成的颗粒作为有效成分。
(3)如(1)或(2)所述的免疫原性组合物,其特征在于,佐剂微粒在内部具有包含两亲性聚合物的亲水性链段的亲水性部分,并具有包含两亲性聚合物的疏水性链段的疏水部分的外层。
(4)如(1)~(3)中任一项所述的免疫原性组合物,其中,两亲性聚合物的亲水性链段为多糖或聚乙二醇。
(5)如(1)~(4)中任一项所述的免疫原性组合物,其中,两亲性聚合物为包含多糖主链和聚(羟基酸)接枝链的接枝型两亲性聚合物。
(6)如(4)或(5)所述的免疫原性组合物,其中,多糖为葡聚糖。
(7)如(1)~(4)中任一项所述的免疫原性组合物,其中,两亲性聚合物为包含聚(羟基酸)和聚乙二醇的嵌段聚合物。
(8)如(1)~(7)中任一项所述的免疫原性组合物,其中,聚(羟基酸)为聚(乳酸-乙醇酸)。
(9)如(1)~(8)中任一项所述的免疫原性组合物,其中,在佐剂微粒的聚(羟基酸)上结合有表面改性剂。
(10)如(1)~(9)中任一项所述的免疫原性组合物,其中,抗原-佐剂微粒复合物或抗原-佐剂微粒复合物缔合而成的颗粒的平均粒径为0.1~50μm。
(11)如(1)~(10)中任一项所述的免疫原性组合物,其中,该组合物进一步含有免疫活性物质。
(12)如(11)所述的免疫原性组合物,其中,免疫活性物质为核酸。
(13)如(11)或(12)所述的免疫原性组合物,其中,免疫活性物质为CpG。
通过本发明,提供一种比以往效力强大的在生物体内可免疫活化的免疫原性组合物。
附图说明
图1为含OVA的免疫原性组合物的免疫评价1。
图2为含CEA的免疫原性组合物的免疫评价(全IgG)。
图3为含CEA的免疫原性组合物的免疫评价(IgG2a)。
图4为含OVA的免疫原性组合物的免疫评价2。
图5为含OVA的免疫原性组合物的免疫评价3。
图6为含HCV构成蛋白的免疫原性组合物的免疫评价。
图7为含CEA的免疫原性组合物的免疫评价2。
图8为含CEA的免疫原性组合物的免疫评价3。
图9为含OVA的免疫原性组合物的免疫评价4。
图10为含CEA的免疫原性组合物的免疫评价4。
图11为含CEA的免疫原性组合物的免疫评价(IgG2a/IgG1比例)。
具体实施方式
本发明涉及一种含有抗原-佐剂微粒复合物的免疫原性组合物,所述抗原包埋在佐剂微粒中,所述佐剂微粒包含疏水性链段为聚(羟基酸)的两亲性聚合物。
首先,对于构成佐剂微粒的两亲性聚合物进行说明。两亲性是指具有亲水性和疏水性这两种性质,因而,对于亲水性,任意部位对水的溶解度都比其他部位的高时,称该部位为亲水性的。亲水部位优选可溶于水,但即使难溶,对水的溶解度也比其他部位的高即可。并且,对于疏水性,任意部位对水的溶解度都比其他部位的低时,称该段为疏水性的。疏水性部位优选不溶于水,但即使可溶,对水的溶解度也比其他部位的低即可。
所谓的两亲性聚合物是作为分子整体具有上述两亲性的聚合物。所谓的聚合物表示两亲性聚合物的亲水性链段或疏水性链段或这两段通过最小单元(单体)的重复结构来构成的分子结构。本发明中的两亲性聚合物只要为具有亲水性链段和疏水性链段的结构即可,既可以为亲水性链段和疏水性链段连接在一起的直链状的嵌段聚合物,也可以为因存在多个亲水性链段或疏水性链段或这两段而导致具备支链的支链聚合物、在亲水性链段上接枝有多个疏水性链段或在疏水性链段上接枝有多个亲水性链段的接枝聚合物。优选为具有1个亲水性链段的聚合物,最优选为具有亲水性链段、疏水性链段各1个的直链状嵌段聚合物或在亲水性链段主链上接枝有多个疏水性链段的接枝聚合物。
只要具有作为佐剂微粒的性质,构成免疫原性组合物的两亲性聚合物也可以为由亲水部分、疏水部分或这两部分不同的构成聚合物组成的多种两亲性聚合物、构成聚合物相同但具有多种连接方式的两亲性聚合物的集合,但是为了发挥稳定的性能、提高生产率,理想的是由较少种类的两亲性聚合物构成的集合,优选主要由两种以下两亲性聚合物的集合,更理想的是主要由单一种类的两亲性聚合物构成。
本发明中,以两亲性聚合物的疏水性链段为聚(羟基酸)作为特征。只要为聚(羟基酸),就没有特别限定,然而优选为给药时对生物体不带来显著的有害影响的生物体相容性聚合物。在此所说的生物体相容性是指将该聚合物对大鼠口服给药时的LD50为2,000mg/kg以上。并且,也可以为多种羟基酸的共聚物,但优选为两种以下羟基酸的聚合物。作为优选的聚(羟基酸)的具体例,可举出聚乙醇酸、聚乳酸、聚(2-羟基丁酸)、聚(2-羟基戊酸)、聚(2-羟基己酸)、聚(2-羟基癸酸)、聚(苹果酸)或它们的高分子化合物的衍生物以及共聚物,更优选聚乳酸、聚乙醇酸或聚(乳酸-乙醇酸)的共聚物。并且,聚(羟基酸)为聚(乳酸-乙醇酸)时,对于聚(乳酸-乙醇酸)的组成比(乳酸/乙醇酸)(摩尔/摩尔%)只要可达成本发明的目的就没有特别限定,然而优选为100/0~30/70,更优选为60/40~40/60。
对于两亲性聚合物的亲水性链段,没有特别限定,然而优选与疏水性链段同样为生物体相容性聚合物。并且,优选为在哺乳类或鸟类的生物体内或细胞内难以分解的难分解性聚合物,以对包含两亲性聚合物的佐剂微粒赋予持续的佐剂能。作为生物体相容性分子中的难分解性聚合物的具体例,可举出聚乙二醇、聚乙烯吡咯烷酮、聚乙烯醇、聚乙烯亚胺、聚丙烯酸、聚甲基丙烯酸、聚-1,3-二氧戊环、2-甲基丙烯酰氧基乙基磷酰胆碱聚合物、聚-1,3,6-三氧杂环己烷、聚氨基酸或难分解性的多糖(例如,纤维素、壳多糖、壳聚糖、结冷胶、藻酸、透明质酸、支链淀粉(pullulan)或葡聚糖),亲水性链段为聚乙二醇、聚乙烯吡咯烷酮、聚乙烯醇、聚乙烯亚胺、聚丙烯酸、聚甲基丙烯酸、聚-1,3-二氧戊环、2-甲基丙烯酰氧基乙基磷酰胆碱聚合物、聚-1,3,6-三氧杂环己烷或聚氨基酸时,两亲性聚合物优选为具有亲水性链段和疏水性链段各一个的直链状嵌段聚合物;亲水性链段为多糖时,两亲性聚合物优选为在亲水性链段主链上接枝有多个疏水性链段的接枝聚合物。并且,作为两亲性聚合物的亲水性链段,优选为聚乙二醇或难分解性的多糖,作为多糖更优选葡聚糖。
包含上述聚(羟基酸)的疏水性链段和亲水性链段的两亲性聚合物优选作为聚合物整体具有与水不混合的性质,以使免疫原性组合物的抗原包埋性和生物体给药时的持续性提高。
对两亲性聚合物中的亲水性链段的平均分子量没有特别限定,然而在亲水性链段和疏水性链段直链状键合得到的嵌段聚合物的情况下,亲水性链段的平均分子量优选为1,000~50,000,更优选为2,000~15,000。此处,术语“嵌段”是指聚合物分子的一部分,该部分由至少5个以上的单体单元构成,并且该部分与其所相邻的其他部分在化学结构上或立体配置上不同,将至少2个以上嵌段进行线状连接而成的聚合物称为嵌段聚合物。构成嵌段聚合物的各嵌段本身由两种以上的单体单元构成,可以为无规、交替、梯度聚合物。在本发明中,优选为形成亲水性链段的聚合物和聚羟基酸分别各一个连接而成的嵌段聚合物。
并且,在亲水性链段主链上接枝有疏水性链段的接枝聚合物的情况下,亲水性链段的平均分子量优选为1,000~100,000,更优选为2,000~50,000,进一步优选为10,000~40,000。并且,接枝链的链数优选为2至50。接枝链数能够从通过1H-NMR测定得到的亲水性链段主链与疏水性链段主链的比例和疏水性链段的平均分子量、以及使用的亲水性链段主链的平均分子量来求出。
疏水性链段与亲水性链段的优选的平均分子量比根据两亲性聚合物的不同而不同,但是在疏水性链段与亲水性链段直链状连接在一起的嵌段聚合物的情况下,亲水性链段与疏水性链段的平均分子量比优选为1∶1以上,更优选为1∶2以上,进一步优选为1∶4以上,特别优选为1∶4以上且为1∶25以下。
在亲水性链段主链上键合有多个疏水性链段接枝链的接枝聚合物的情况下,优选亲水性链段主链部与疏水性链段接枝链全体的平均分子量比为1∶3以上且各接枝链的平均分子量为2,500~40,000,更优选所述与全体接枝链的平均分子量比为1∶5以上、各接枝链的平均分子量为5,000~40,000。
需要说明的是,只要不特别说明,上述的平均分子量就指数均分子量。数均分子量是指用未考虑分子大小的加权的方法计算出的平均分子量,两亲性聚合物和构成两亲性聚合物的亲水性链段的聚合物的数均分子量能够作为通过凝胶渗透色谱法(GPC)测定的经聚苯乙烯或支链淀粉换算的分子量求出。并且,聚(羟基酸)的平均分子量能够通过核磁共振(NMR)测定由末端残基的峰积分值与末端残基以外的峰积分值的比求出。
本发明所使用的两亲性聚合物用已知的方法合成即可,作为例子可举出在成为亲水性链段的聚合物中加入聚(羟基酸)聚合物进行缩合反应来制造的方法、在成为亲水性链段的聚合物中加入羟基酸活化单体进行聚合反应来制造的方法、或者相反在作为聚(羟基酸)聚合物的疏水性链段中加入构成亲水性链段的单体进行聚合反应的方法。
如果是例如由聚乙二醇和聚(羟基酸)构成的两亲性聚合物,则能够通过这样的方法制造,在锡催化剂存在下在聚乙二醇中加入羟基酸活化单体进行聚合反应,通过导入聚(羟基酸),制造两亲性嵌段聚合物[Journal of Controlled Release,71,p.203-211(2001年)]。
并且,如果是例如由多糖和聚(羟基酸)接枝链构成的接枝型两亲性聚合物,则能够如以下(1)、(2)或(3)那样制造。
(1)在锡催化剂存在下在多糖中加入羟基酸活化单体进行聚合反应,通过导入聚(羟基酸),制造接枝型两亲性聚合物的方法[Macromolecules,31,p.1032-1039(1998年)]
(2)对大部分羟基被取代基保护了的多糖用碱将一部分未保护的羟基活化后,加入羟基酸活化单体,导入由聚(羟基酸)形成的接枝链,最后去掉保护基,由此制造接枝型两亲性聚合物的方法[Polymer,44,p.3927-3933,(2003年)]
(3)通过使用脱水剂和/或官能团的活化剂使聚(羟基酸)的共聚物相对于多糖进行缩合反应,制造接枝型两亲性聚合物的方法[Macromolecules,33,p.3680-3685(2000年)]。
其次,对于佐剂微粒进行说明。佐剂微粒是指具有佐剂能的微粒,佐剂能表示能够引起在生物体内给予抗原时的免疫应答比单独给予抗原时提高的能力。并且,在本发明中,佐剂微粒的特征在于,其为包含两亲性聚合物的微粒,进而佐剂微粒的特征在于,通过包埋抗原,形成抗原-佐剂微粒复合物,该复合物成为本发明免疫原性组合物的有效成分。
作为佐剂微粒的结构,没有特别限定,然而在取在佐剂微粒的内侧具有两亲性聚合物的亲水性链段,具有两亲性聚合物的疏水性链段的外层的结构时,可稳定保持所包埋的抗原,所以是优选的。作为制造该结构的佐剂微粒的方法,没有限定,举例来说,能够通过包括下述工序的方法制造:(a)通过将水系溶剂A和溶解有两亲性聚合物的与水不混合的有机溶剂B混合,形成反相乳液的工序;和(b)从反相乳液中除去溶剂得到佐剂微粒的工序。此时,通过使水系溶剂A含有抗原,能够构成包埋有抗原的抗原-佐剂微粒复合物。以下,对于工序(a)和(b)进行说明。
工序(a)中的水性溶剂A使用水或含有水溶性成分的水溶液。作为该水溶性成分,可举出例如无机盐类、糖类、有机盐类、氨基酸等。
并且,工序(a)中的与水不混合的有机溶剂B优选该两亲性聚合物的聚(羟基酸)为可溶的且构成亲水性链段的聚合物为难溶或不溶的,进一步优选能够通过冷冻干燥挥散除去。该与水不混合的有机溶剂B对水的溶解度优选为30g(与水不混合的有机溶剂B)/100ml(水)以下。作为与水不混合的有机溶剂B的具体例,可举出乙酸乙酯、乙酸异丙酯、乙酸丁酯、碳酸二甲酯、碳酸二乙酯、二氯甲烷、氯仿。
水性溶剂A与水不混合性有机溶剂B的比为1,000∶1~1∶1、优选为100∶1~1∶1。该水不混合性有机溶剂B中的两亲性聚合物的浓度根据水不混合性有机溶剂B、两亲性聚合物的种类的不同而不同,但是为0.01~90%(w/w)、优选为0.1~50%(w/w)、更优选为1~20%(w/w)。
在利用工序(a)中的水性溶剂A、溶解有两亲性聚合物的水不混合性有机溶剂B来形成反相乳液的工序中,可以根据制剂学目的,利用2种以上的溶解有两亲性聚合物的水不混合性有机溶剂B来形成反相乳液。
在工序(a)中,为了对反相乳液的形成进行辅助,形成均一且微小的反相乳液的目的,能够添加辅助表面活性剂。作为辅助表面活性剂,优选从碳原子数为3至6的烷基醇、碳原子数为3至6的烷基胺、碳原子数为3至6的烷基羧酸中选择的化合物。对这些辅助表面活性剂的烷基链的结构没有特别限定,可以为直链结构,也可以为支链结构,可以为饱和烷基,也可以为不饱和烷基。在本发明中,作为辅助表面活性剂,特别优选叔丁醇、异丙醇、戊醇。
工序(b)中,对从反相乳液中除去溶剂的方法没有特别限定,例如可举出加热、减压干燥、透析、冷冻干燥、离心操作、过滤、再沉淀和它们的组合。上述从反相乳液中除去溶剂的方法中,冷冻干燥较少发生反相乳液中的颗粒合一等所致的结构变化,所以是优选的。作为冷冻干燥的条件、装置,其包含冷冻过程和减压下的干燥工序,特别优选的工序是经历作为冷冻干燥的常规方法的预冷冻、在减压和低温下的一次干燥、减压下的二次干燥的工序。例如在获得抗原-佐剂微粒复合物的水不混合性溶剂分散体时,在构成反相乳液的水性溶剂A和水不混合性有机溶剂B的熔点以下冷却、冷冻,接下来减压干燥,由此可得到冷冻干燥的佐剂微粒。作为预冷冻的温度,由溶剂组成适宜地根据实验决定即可,但优选为-20℃以下。并且,干燥过程中的真空度也由溶剂组成适宜地根据实验决定即可,但优选为3,000Pa以下,在500Pa以下时干燥时间缩短,所以是更优选的。冷冻干燥中优选使用具备冷阱可与真空泵连接的实验用冷冻干燥机、医药品的制造等中所使用的棚式真空冷冻干燥机,用液氮、制冷剂等预冷冻后,在冷却下或在室温用真空泵等减压装置进行减压干燥即可。
对于包埋在佐剂微粒中的抗原的种类没有特别限定,为肽、蛋白质、糖蛋白质、糖脂质、脂质、碳水化合物、核酸、多糖类和含有这些物质的病毒、菌体、过敏原物质、组织、细胞等即可。举出具体例的话,有来源于花粉的抗原、来源于A型肝炎病毒的抗原、来源于B型肝炎病毒的抗原、来源于C型肝炎病毒的抗原、来源于D型肝炎病毒的抗原、来源于E型肝炎病毒的抗原、来源于F型肝炎病毒的抗原、来源于HIV病毒的抗原、来源于流行性感冒病毒的抗原、来源于疱疹病毒(HSV-1、HSV-2)的抗原、来源于炭疽菌的抗原、来源于衣原体的抗原、来源于肺炎球菌的抗原、来源于日本脑炎病毒的抗原、来源于麻疹病毒的抗原、来源于风疹病毒的抗原、来源于破伤风菌的抗原、来源于水痘病毒的抗原、来源于SARS病毒的抗原、来源于EB病毒的抗原、来源于乳头瘤病毒的抗原、来源于幽门螺杆菌(Helicobacter pylori)的抗原、来源于狂犬病病毒的抗原、来源于西尼罗河病毒的抗原、来源于汉坦病毒的抗原、来源于链球菌的抗原、来源于葡萄球菌的抗原、来源于百日咳博德特氏菌(Bordetella pertussis)的抗原、来源于结核分枝杆菌(Mycobacteriumtuberculosis)的抗原、来源于疟原虫(Plasmodium)的抗原、来源于脊髓灰质炎病毒的抗原、来源于各种人畜共通感染性疾病的抗原、癌抗原、通过各种食物过敏而得到的抗原等。
包埋的抗原不需要为单一的抗原。这是因为在考虑到本发明的应用的情况下,有时并不是对单独的蛋白或肽引起免疫应答,而是对由癌细胞、细菌、病毒等多种构成物构成的物质引起免疫应答,此时抗原也可以为可引起免疫应答的多个种类的蛋白质等或种类不能确定的混合物。并且,以积极地对多个种类的抗原引起免疫应答为目的,含有多个种类的抗原也是本发明的免疫原性组合物的一个利用形态。优选3个种类以下、更优选单一种类的抗原包埋在佐剂微粒中。
本发明中的抗原-佐剂微粒复合物可根据构成佐剂微粒的聚合物的种类和制备方法改变含有的抗原的保持性。作为本发明中的抗原-佐剂微粒复合物产生免疫原性的机理,认为是从佐剂微粒释放的抗原被免疫担当细胞识别的过程、连同佐剂微粒也被免疫担当细胞识别的过程等多个过程,通过这些过程的协同效应也可获得较高的效果。
对于抗原-佐剂微粒复合物使免疫担当细胞识别抗原的过程,每个该过程所引起的免疫反应的种类也不相同,根据想要产生的免疫反应的种类、给药部位选择优选的过程即可。即,抗原无需一定从抗原-佐剂微粒复合物中被释放,优选的使用方法是根据抗原和想要活化的免疫反应的种类最优化为具有作为目标的最好的免疫原性的形态。但是抗原被明显地快速地从抗原-佐剂微粒复合物释放时,得不到作为本发明良好性质的长期且持续的免疫活化作用,所以优选抗原-佐剂微粒复合物中的抗原的10%以上在生物体内给药1周后还作为复合物保持,更优选在给药1周后抗原的50%以上被包埋。这些释放行动也如实施例中所示,能够通过模拟生物体内环境的体内(in vitro)评价来确认。
并且,抗原-佐剂微粒复合物即使处于该复合物缔合的颗粒状态也作为本发明免疫原性组合物的有效成分发挥良好的效果,在此所说的缔合是指,2个以上颗粒通过颗粒间力或其他物质结合,形成集合体。对颗粒间力没有特别限定,可举出疏水性相互作用、氢键、范德华力。缔合不限于微粒彼此相接的状态,可以在微粒间存在与微粒具有亲和性的物质,也可以在基质中分散微粒。作为对微粒具有亲和性的物质、基质,优选聚合物,更优选疏水性部分为聚(羟基酸)的两亲性聚合物中构成成分与佐剂微粒相同的聚合物,作为具体例可举出由多糖主链和聚(羟基酸)接枝链构成的两亲性聚合物、由聚乙二醇和聚(羟基酸)构成的嵌段聚合物或聚(羟基酸)。
抗原-佐剂微粒复合物的缔合既可以为使用时发生再分离的状态,也可以为不发生再分离的状态。另外,抗原-佐剂微粒复合物缔合而成的颗粒的形态即使为不确定该复合物缔合了的状态,在其制造工序中包含使该复合物缔合的工序时,也认为是该复合物缔合了的颗粒。
对使抗原-佐剂微粒复合物缔合的工序没有特别限制,作为具体例,可举出将抗原-佐剂微粒复合物或该复合物分散液导入含有表面改性剂的液相C中,除去分散介质,从而使复合物缔合的工序,对于该工序进行说明。
在使抗原-佐剂微粒复合物分散在分散介质中制备该复合物分散液时,作为分散介质,没有特别限定,但是在佐剂微粒在内部具有包含两亲性聚合物亲水性链段的亲水性部分、在外层具有包含两亲性聚合物疏水性链段的疏水部分时,为了保护其结构,分散介质优选为两亲性聚合物的聚(羟基酸)可溶且构成亲水性链段的聚合物实质上不溶解的溶剂,此时可以为水不混合性有机溶剂,也可以为水混合性有机溶剂。作为两亲性聚合物的聚(羟基酸)可溶且构成亲水性链段的聚合物实质上不溶解的溶剂的具体例,可举出乙酸乙酯、乙酸异丙酯、乙酸丁酯、碳酸二甲酯、碳酸二乙酯、二氯甲烷、氯仿、二氧杂环己烷、甲苯、二甲苯等。
作为液相C,优选可溶解表面改性剂且具有比分散介质高的沸点,可以为水性溶剂、水不混合性有机溶剂、水混合性有机溶剂的任一种。作为此处所说的水性溶剂,优选水或含有水溶性成分的水溶液,作为该水溶性成分,可举出例如无机盐类、糖类、有机盐类、氨基酸等。作为水不混合性有机溶剂,可举出例如硅油、芝麻油、大豆油、玉米油、棉籽油、椰子油、亚麻子油、矿物油、蓖麻油、氢化蓖麻油、液体石蜡、正己烷、正庚烷、甘油、油酸等。作为水混合性有机溶剂,可举出例如甘油、丙酮、乙醇、乙酸、双丙甘醇、三乙醇胺、三甘醇等。其中,在本发明中,液相C优选为水性溶剂或水混合性有机溶剂。在液相C为水性溶剂且分散介质为水不混合性有机溶剂的情况下,所得到的抗原-佐剂微粒复合物悬浮液形成所谓的水包油包固体(S/O/W)型乳液,在液相C为水不混合性有机溶剂或水混合性有机溶剂且不与分散介质混合的情况下,形成油包油包固体(S/O1/O2)型乳液。
作为表面改性剂,优选为使S/O/W型乳液的水-油界面或S/O1/O2型乳液的油-油界面稳定化的物质,并且,优选为具有使抗原-佐剂微粒复合物缔合而成的颗粒的胶体稳定性提高的性质的化合物。在此使胶体稳定性提高是指,防止抗原-佐剂微粒复合物缔合而成的颗粒在溶剂中凝集或使该凝集延迟。并且,表面改性剂可以为1种,也可以为多种的混合物。
本发明所使用的表面改性剂优选为亲水性聚合物或两亲性化合物。
对于作为表面改性剂的亲水性聚合物,优选为聚乙二醇、聚乙烯吡咯烷酮、聚乙烯醇、聚乙烯亚胺、聚丙烯酸、聚甲基丙烯酸、聚-1,3-二氧戊环、2-甲基丙烯酰氧基乙基磷酰胆碱聚合物、聚-1,3,6-三氧杂环己烷、聚氨基酸、肽、蛋白质、糖类多糖类或这些聚合物中的任一个的类似物。作为该亲水性聚合物的类似物,可举出对亲水性聚合物的长链烷基等疏水基进行部分修饰等而得到的表面活性剂,但并不限于这些。
对于作为表面改性剂的聚乙二醇类似物,优选由BASF公司市售的“Pluronic”(BASF公司的注册商标)或其同等品。
对于作为表面改性剂的聚氨基酸,优选聚天冬氨酸或聚谷氨酸或它们的类似物,更优选在聚天冬氨酸或聚谷氨酸的一部分中导入了长链烷基的类似物。
作为表面改性剂肽,可举出碱性肽,作为表面改性剂的蛋白质,明胶、酪蛋白或白蛋白由于提高颗粒的分散性,所以是优选的。此外,蛋白质还可举出抗体作为优选的一例。
对于作为表面改性剂的糖类,优选单糖类、寡糖类、多糖类。作为多糖类,优选纤维素、壳多糖、壳聚糖、结冷胶、藻酸、透明质酸、支链淀粉或葡聚糖,胆固醇化支链淀粉由于提高颗粒的分散性,所以是特别优选的,并且优选纤维素、壳多糖、壳聚糖、结冷胶、藻酸、透明质酸、支链淀粉或葡聚糖中的任一多糖的类似物。
作为表面改性剂的这些肽、蛋白质或糖类特别优选为对长链烷基等疏水基进行部分修饰等而得到的类似物、对上述的亲水性聚合物或两亲性化合物进行修饰而得到的类似物。
对于作为表面改性剂的两亲性化合物,可举出脂质或表面活性剂。作为表面活性剂,优选聚氧乙烯聚丙二醇共聚物、蔗糖脂肪酸酯、聚乙二醇脂肪酸酯、聚氧乙烯山梨糖醇酐单脂肪酸酯、聚氧乙烯山梨糖醇酐二脂肪酸酯、聚氧乙烯甘油单脂肪酸酯、聚氧乙烯甘油二脂肪酸酯、聚甘油脂肪酸酯、聚氧乙烯蓖麻油、聚氧乙烯氢化蓖麻油等非离子性活性剂;十二烷基硫酸钠、十二烷基硫酸铵、十八烷基硫酸钠等烷基硫酸盐;或卵磷脂。
液相C相对于分散抗原-佐剂微粒复合物的分散介质的体积比为1,000∶1~1∶1,000、优选为100∶1~1∶100。需要说明的是,所得到抗原-佐剂微粒复合物的缔合数根据该体积比而变化,液相C的比例越高,得到抗原-佐剂微粒复合物越多地缔合而成的颗粒的水分散体,并且,液相C少时缔合数变少,在液相C的比例小于溶液比1∶4时,大部分形成由一个抗原-佐剂微粒复合物构成的颗粒的水分散体,所以在制造抗原-佐剂微粒复合物缔合而成的颗粒的一系列过程中,通过调整液相C的体积比,能够区分制作抗原-佐剂微粒复合物和该复合物缔合而成的颗粒。
在使含有抗原-佐剂微粒复合物的分散介质混合在液相C中时,必要的话,可以使用例如磁力搅拌器等搅拌装置、涡轮型搅拌机、均化器、装备有多孔膜的膜乳化装置等。
根据制剂学目的,除表面改性剂外在液相C中也可以含有各种添加物,例如缓冲剂、抗氧化剂、盐、聚合物或糖等。并且,为了调节该复合物的分解或崩解所致的所包埋的抗原的释放速度,在使抗原-佐剂微粒复合物分散的分散介质中也可以含有可溶于分散介质的各种添加剂,例如酸性化合物、碱性化合物、两亲性聚合物或生物降解性聚合物等。
此外,为了制造更微细的抗原-佐剂微粒复合物缔合而成的颗粒,也可以对所形成的水包油包固体(S/O/W)型乳液或油包油包固体(S/O1/O2)型乳液进行乳化操作。乳化方法只要是能够制备稳定的乳液的方法,就没有特别限定,例如可举出搅拌的方法、使用高压均质机、高速均相混合机等的方法等。
在使抗原-佐剂微粒复合物暂且分散在分散介质中,将得到的分散液添加在含有表面改性剂的液相C中的情况下,通过除去分散介质,可得到所期望的佐剂微粒缔合而成的颗粒的悬浮液。对除去分散介质的方法没有特别限定,可举出例如液中干燥、透析、冷冻干燥、离心操作、过滤、再沉淀,特别优选液中干燥、冷冻干燥。在使用水性溶剂作为液相C时,通过本工序,可得到抗原-佐剂微粒复合物缔合而成的颗粒的水性分散体。
需要说明的是,表面改性剂结合在抗原-佐剂微粒复合物或抗原-佐剂微粒复合物缔合而成的颗粒上也是一种优选方式。此处所说的结合可以为非共价结合,也可以为共价结合。非共价结合优选为疏水性相互作用,可以为静电相互作用、氢键、范德华力,也可以为这些作用组合起来的结合。在非共价结合中,优选包含两亲性聚合物的微粒的聚(羟基酸)与表面改性剂的疏水部分通过疏水性相互作用结合,此时,优选为抗原-佐剂微粒复合物的分散介质为水、缓冲液、生理盐水、表面改性剂水溶液或亲水性溶剂的微粒分散体。
如上得到的、抗原-佐剂微粒复合物或该复合物缔合而成的颗粒的平均粒径优选为0.1~50μm,更优选为0.1~10μm。特别地,抗原-佐剂微粒复合物的平均粒径优选为0.1~1μm、更优选为0.1~0.5μm,抗原-佐剂微粒复合物缔合而成的颗粒的平均粒径优选为0.1~50μm、更优选为0.1~10μm、进一步优选为1~10μm。抗原-佐剂微粒复合物或该复合物缔合而成的颗粒的平均粒径能够使用利用扫描型电子显微镜(SEM:例如株式会社日立制作所制造的S-4800)进行的图像解析法直接测定平均粒径。
本发明中的免疫原性组合物是指在生物体内可引起免疫应答的组合物,含有上述抗原-佐剂微粒复合物作为免疫原性物质。对免疫原性组合物所产生的免疫应答的种类没有限定。作为所产生的免疫应答的种类,有Th1型免疫应答、Th2型免疫应答,已知根据抗原、给药部位、给药方法的种类产生任一占优势的免疫应答,本发明可产生Th1型、Th2型两种类型的免疫应答。Th1型的免疫反应如实施例中所示能够通过小粒径的本发明的抗原-佐剂微粒复合物或该复合物缔合而成的颗粒有效引发。有关Th1型免疫应答和Th2免疫应答的程度,能够用已知的各种方法评价。举例来说,对于小鼠,作为Th1型免疫应答的指标获知IgG2a抗体的产生量。并且,作为Th2型免疫应答的指标获知IgG1抗体的量、IgG抗体总量。
并且,本发明的免疫原性组合物由于含有抗原-佐剂微粒复合物或该复合物缔合而成的颗粒作为有效成分,所以具有佐剂能,进而通过含有免疫活性物质,能够实现高活性的免疫活性。这些免疫活性物质可以在佐剂微粒外,也可以被包埋在佐剂微粒中,但优选被包埋在佐剂微粒中。作为免疫活性物质,举例来说,只要为油类、铝盐、钙盐、凝胶性高分子、免疫活性细胞因子、TLR受体配体等可作为免疫活性物质发挥功能的物质就没有限定,然而优选免疫活性细胞因子或TLR受体配体。
作为免疫活性细胞因子,可举出白细胞介素12、干扰素α、白细胞介素18、TNFα、白细胞介素6、NO、干扰素γ、干扰素β。
作为TLR受体配体,为脂蛋白、polyI:C、polyI:CLC等双链RNA、鞭毛蛋白、单链RNA、CpG、抑制蛋白、MPL、QS21、TDM,优选为双链RNA、单链RNA、CpG等核酸,更优选为CpG。在此CpG表示在病毒、细菌等中存在的非甲基化CpG(胞嘧啶-鸟嘌呤)基序(motif)DNA(参照日本特表2001-503254号公报)。对于CpG基序,报道了各种有效序列,只要具有免疫活化能,对序列的种类就没有限制,可以为使用了碱基类似物的序列,也可以为各种修饰体。
将本发明的免疫原性组合物用作医药品组合物或疫苗时,除两亲性聚合物、亲水性活性物质、表面改性剂、分散介质外,也可以含有制剂学上有用的各种添加剂,作为能够添加的添加物,优选为缓冲剂、抗氧化剂、盐、聚合物或糖。
对于使用本发明免疫原性组合物引起免疫应答的方法没有限定,既可以将免疫原性组合物对生物体给药,也可以使免疫原性组合物与取出到生物体外的免疫担当细胞接触。作为将免疫原性组合物对生物体给药的方法,没有限定,但举例来说,有皮下给药、皮内给药、肌肉内给药、经鼻给药、经肺给药、口服给药、经皮给药、舌下给药、阴道内给药、腹腔内给药、淋巴节给药等,优选为皮内给药或皮下给药。
对于使用本发明免疫原性组合物引起免疫应答时的使用量,根据抗原的种类、给药方法、给药次数适宜对产生目标免疫反应所需的抗原量进行设定,例如将本发明的免疫原性组合物对人皮下给药诱导免疫应答时,作为含在免疫原性组合物中的抗原量,每1次给药0.01~1,000μg。并且,对于给药次数,也与使用量同样地适宜设定,但由于本发明的免疫原性组合物具有持续产生免疫应答的作用,所以通过1~10次给药可以诱导免疫应答。
给药的生物体可以为人,也可以为人以外的动物,但优选为人或作为家畜、宠物或实验动物饲养的猪、牛、鸟、羊、马、驴、山羊或骆驼、狗、猫、鼬、兔子、猴、大鼠、小鼠、豚鼠。
实施例
以下给出实施例,但本发明不受这些实施例的限定。
实施例1葡聚糖-聚(乳酸-乙醇酸)(PLGA)的合成
(1-1)TMS-葡聚糖的合成
将葡聚糖(Nacalai Tesque株式会社、Nacalai规格特级合格品、数均分子量13,000、5.0g)加入甲酰胺(100ml)中,加热到80℃。用20分钟在该溶液中滴加1,1,1,3,3,3-六甲基二硅氨烷(100ml)。滴加结束后,于80℃搅拌2小时。反应结束后,将反应溶液放回室温,用分液漏斗将2层分离。将上层在减压下浓缩后,加入甲醇(300ml),将得到的固体过滤、干燥,作为白色固体得到TMS-葡聚糖(化合物(1))(11.4g)。
用相同的方法,使用葡聚糖(Sigma公司制造、平均分子量1,500以下)制备化合物(2)和(3),使用葡聚糖(SERVA公司制造、平均分子量5,000)制备化合物(4)和(5),使用葡聚糖(与制备化合物(1)时相同的葡聚糖)制备化合物(6),使用葡聚糖(Nacalai Tesque公司制造、平均分子量40,000)制备化合物(7)、(8)和(9)。
(1-2)葡聚糖-PLGA(化合物(12)~(23))的合成
将化合物(1)(0.5g)和叔丁醇钾(35mg)在加热减压下干燥2小时后,加入四氢呋喃(10ml),于室温搅拌1.5小时。在该溶液中滴加(DL)-丙交酯(0.56g)和乙交酯(0.45g)的四氢呋喃(15ml)溶液,搅拌5分钟后,加2滴乙酸,使反应停止。反应结束后,减压下浓缩溶剂,通过用氯仿-甲醇体系和氯仿-乙醚体系进行再沉淀精制得到白色固体,将该白色固体溶解在氯仿(9ml)中。在该溶液中加入三氟乙酸(1.0ml),于室温搅拌30分钟。反应结束后,减压下蒸馏除去溶剂,然后将残渣溶解在氯仿(10ml)中,滴加冷却为0℃的乙醚,将得到的产物过滤,由此作为白色固体得到葡聚糖-PLGA(化合物(12))。用同样的方法以(DL)-丙交酯(0.78g)和乙交酯(0.63g)的投料量合成化合物(13),用同样的方法以(DL)-丙交酯(1.12g)和乙交酯(0.9g)的投料量合成化合物(14),用同样的方法以(DL)-丙交酯(1.67g)和乙交酯(1.35g)的投料量合成化合物(15)。
并且,使用化合物(2)以(DL)-丙交酯(0.56g)和乙交酯(0.45g)的投料量合成化合物(16),使用化合物(3)以(DL)-丙交酯(0.67g)和乙交酯(0.54g)的投料量合成化合物(17),使用化合物(4)以(DL)-丙交酯(0.78g)和乙交酯(0.63g)的投料量合成化合物(18),使用化合物(5)以(DL)-丙交酯(0.89g)和乙交酯(0.72g)的投料量合成化合物(19),使用化合物(6)以(DL)-丙交酯(0.78g)和乙交酯(0.63g)的投料量合成化合物(20),使用化合物(7)以(DL)-丙交酯(0.78g)和乙交酯(0.63g)的投料量合成化合物(21),使用化合物(8)以(DL)-丙交酯(1.12g)和乙交酯(0.9g)的投料量合成化合物(22),使用化合物(9)以(DL)-丙交酯(1.12g)和乙交酯(0.9g)的投料量合成化合物(23)。
化合物(12)~(15)的聚合物的重均分子量、数均分子量通过GPC测定(柱:东曹株式会社制造的TSK-gelα-5000两根、DMF类溶剂、检测器:RI、标准品:支链淀粉)来决定。并且,化合物(12)~(23)的接枝链的数均分子量、接枝链数通过1H-NMR测定来决定(表1)。
【表1】
表1:制成的Dex-g-PLGA聚合物的评价结果
实施例2PEG-PLGA的合成(化合物(10)、(11))
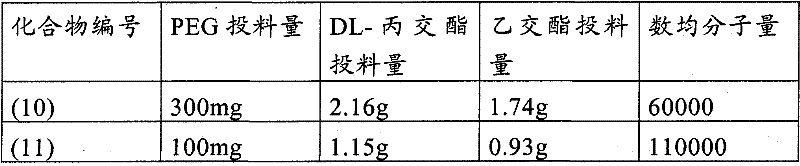
将聚乙二醇单甲醚(日本油脂株式会社制造的SUNBRIGHTMEH-20H、数均分子量5,128、Mw/Mn=1.02)、(DL)-丙交酯和乙交酯以表2的投料量混合,加热到140℃。搅拌20分钟后,加入辛酸锡(II)(相对于聚乙二醇单甲醚为0.05重量%),于180℃搅拌3小时。将反应液放回室温后,溶解在氯仿(形成约100mg/ml浓度)中,用冷却到0℃的乙醚进行再沉淀精制,对得到的固体滤出、减压干燥,由此作为白色或淡茶色的固体得到PEG-PLGA聚合物。本聚合物的数均分子量由1H-NMR求出(表2)。
【表2】
表2:制成的PEG-PLGA聚合物的评价结果
实施例3使用了Dex-g-PLGA聚合物的抗原-佐剂微粒复合物的制备(Dex-g-PLGA颗粒(1)~(28))
将实施例1的葡聚糖-聚(乳酸-乙醇酸)(PLGA)(化合物(12)~(23))5mg溶解在碳酸二甲酯100μl中,制备50mg/ml的聚合物溶液。在该聚合物溶液中添加叔丁醇20μl后,以表3中记载的浓度滴加50μl表3的包埋抗原((OVA(卵清蛋白)(Sigma公司)或CEA(癌胚抗原)(COSMO BIO公司))和免疫活性物质(CpG),用VORTEX混合器搅拌,制备反相乳液。作为CpG,使用5’gggggggCGACGATCGTCAgG-3’(序列中的小文字表示硫代磷酸修饰碱基)(委托Sigma-Genosys公司合成)。
将该反相乳液用液氮预冷冻后,用冷冻干燥机(EYELA、FREEZEDRYER FD-1000)以冷阱冷却温度-45℃、真空度20Pa冷冻干燥24小时。使得到的固体成分分散在表3所述量的分散溶剂中,制备S/O悬浮液。将该S/O悬浮液滴加在含10%Pluronic F-68的水溶液2ml中,用表3中记载的搅拌方法搅拌、使其乳化,制备S/O/W型乳液。通过液中干燥从该S/O/W型乳液中除去水不混合性有机溶剂,制成抗原-佐剂微粒复合物分散液。将该分散液用液氮预冷冻后,用冷冻干燥机(EYELA、FREEZE DRYER FD-1000)以冷阱冷却温度-45℃、真空度20Pa冷冻干燥24小时,由此得到抗原-佐剂微粒复合物(平均粒径0.4μm)和抗原-佐剂微粒复合物缔合而成的颗粒(平均粒径5~40μm)干燥粉末。利用扫描型电子显微镜(SEM:株式会社日立制作所制造的S-4800)进行观察,计算出所得到的颗粒的平均粒径,结果示于表3。
【表3】
表3:Dex-g-PLGA颗粒的制备配方和平均粒径
实施例4使用了PEG-PLGA聚合物的抗原-佐剂微粒复合物的制备(PEG-PLGA颗粒(1)~(4))
将实施例2中制作的PEG-PLGA聚合物(化合物(10)、(11))5mg溶解在碳酸二甲酯100μl中,制备50mg/ml的聚合物溶液。在该聚合物溶液中添加叔丁醇20μl后,加入表4所示的含抗原的溶液50μl,搅拌,由此制造反相乳液溶液。将该反相乳液溶液用液氮预冷冻后,用冷冻干燥机(EYELA、FREEZE DRYER FD-1000)以冷阱冷却温度-45℃、真空度20Pa冷冻干燥24小时。使所得到的固体成分分散在表4所示的量的乙酸乙酯中,制备S/O悬浮液。将该S/O悬浮液滴加在含10%Pluronic F-68的水溶液2ml中,用VORTEX混合器搅拌、使其乳化,制备S/O/W型乳液。通过液中干燥从该S/O/W型乳液中除去水不混合性有机溶剂,制成抗原-佐剂微粒复合物分散液。将该分散液用液氮预冷冻后,用冷冻干燥机(EYELA、FREEZEDRYER FD-1000)以冷阱冷却温度-45℃、真空度20Pa冷冻干燥24小时,由此得到抗原-佐剂微粒复合物干燥粉末。利用扫描型电子显微镜(SEM:株式会社日立制作所制造的S-4800)进行观察,计算出抗原-佐剂微粒复合物的平均粒径,结果示于表4。
【表4】
表4:PEG-PLGA颗粒的制备配方和平均粒径
比较例1含有抗原的PLGA均聚物颗粒(PLGA颗粒(1)、(2))的制作
有关含有抗原的PLGA颗粒,使用已知的技术(InternationalJournal of Pharmaceutics(国际药剂学杂志)、2007年、334号、137-148页)制备。使PLGA(SIGMA公司制造、平均分子量40,000-75,000)200mg溶解在二氯甲烷15ml中,制备13.3mg/ml的PLGA溶液。在以19,000rpm(Polytron公司制造的均化器)搅拌的状态下将5mg/ml的OVA水溶液100μl添加在该聚合物溶液2ml中,进而同样地搅拌5分钟,由此制造W/O溶液。在以19,000rpm搅拌的状态下将该W/O溶液添加在1%聚乙烯醇水溶液20mL中,进而同样地搅拌5分钟,由此制造W/O/W溶液。将该W/O/W溶液以200rpm搅拌12小时后,用液氮预冷冻,用冷冻干燥机(EYELA、FREEZEDRYER FD-1000)以冷阱冷却温度-45℃、真空度20Pa冷冻干燥12小时,由此得到含有抗原的PLGA颗粒。利用扫描型电子显微镜(SEM:株式会社日立制作所制造的S-4800)对所得到的颗粒进行观察,计算出平均粒径为2μm。并且,用相同的方法使用CEA水溶液(0.25mg/ml)制作PLGA颗粒(2),同样地用SEM计算出平均粒径为2μm。
实施例5CEA-佐剂微粒复合物或其缔合颗粒中的抗原包埋率和抗原保持性的测定
<方法>
在1.5ml Eppendorf管中称量以实施例3和4的方法制作的CEA-佐剂微粒复合物或其缔合颗粒(以下称为CEA包埋颗粒)20mg,溶解在1ml的缓冲液A(含有0.1%牛血清白蛋白、0.1%Pluronic F-68和0.02%叠氮化钠的PBS)中,以18,000×g离心10分钟,分离成颗粒(沉淀)和上清。将上清回收到其他管中后,将颗粒再次悬浮在1ml的缓冲液中,通过上述条件下的离心再次进行颗粒和上清的分离。再重复一次该清洗操作(共计3次离心),使用ELISA试剂盒(HopeLaboratories公司制造的TM-201)测定各离心所回收的上清中的CEA浓度。
从颗粒制作时加入的CEA量(相对于20mg重量的CEA包埋颗粒)减去3次离心上清中的CEA总量,通过以下的式子计算出包埋率。
对于抗原的释放性的测定,使进行了3次清洗的颗粒悬浮分散在1.2ml的缓冲液A中。从该溶液中转移一部分(40μl)至其他管中,以18,000×g离心10分钟,使颗粒沉淀,将上清30μl回收到其他管中(0小时样品)。使用旋转器以6rpm的速度使残余的颗粒悬浊液在1.5ml Eppendorf管中于37℃培育箱内缓慢地转倒混合。随时间推移从该溶液中分别取出少量(40μl),与上述同样地通过离心进行上清分离。用上述的ELISA法测定各时刻回收的上清样品中的CEA浓度,通过下式计算出释放量(%)。
<结果>
CEA包埋颗粒的抗原包埋率如表5所示,任一CEA包埋颗粒都以高效率包埋有抗原。抗原的保持性方面,疏水接枝链短的Dex-g-PLGA颗粒(7)的抗原保持性低,1周之间释放了包埋的抗原的67.3%。另一方面,随着疏水接枝链变长,抗原的保持性升高,疏水接枝链长的Dex-g-PLGA颗粒在1周后仍含有投料抗原的90%左右。PEG-PLGA颗粒1周释放4%左右的抗原并停留于此,也显示高抗原保持性。
【表5】
表5:CEA包埋颗粒的包埋率和抗原保持性
实施例6含OVA的免疫原性组合物的小鼠皮下给药(1)
<方法>
使实施例3和4中制作的OVA-佐剂微粒复合物缔合颗粒(以下称为OVA包埋缔合颗粒)或OVA-佐剂微粒复合物(以下称为OVA包埋颗粒)中,疏水链的长度不同的OVA包埋缔合颗粒(Dex-g-PLGA颗粒(2)、(3)、(4))、粒径与Dex-g-PLGA颗粒(3)不同的OVA包埋缔合颗粒和OVA包埋颗粒(Dex-g-PLGA颗粒(5)、(6))、PEG-PLGA颗粒(3)分别40mg(抗原投料量50μg)悬浮分散在3ml的磷酸生理缓冲液(PBS)中,以80×g离心5分钟来使颗粒沉淀,将上清转移至其他管中。再次以80×g对上清离心5分钟,使残存的颗粒沉淀,除去上清。将第1次的离心沉淀和第2次的离心沉淀合并,再次分散于1ml的PBS中,重复3次同样的离心清洗操作,从而除去没有包埋在颗粒中的抗原。最后,将沉淀再次分散在150μl的PBS中,制成给药溶液。将本溶液对9周龄的雄Balb/C小鼠(日本SLC社)的背部皮下单次注射给药。作为比较例,仅将比较例1中制造的PLGA颗粒或抗原溶液(50μl)单次注射给药,进而,作为参考例,将抗原溶液50μl与作为佐剂的“Imject Alum”(Thermo Scientific公司制造,以下也称为Alum)50μl混合而成的溶液单次注射给药。将各条件的免疫原性组合物都对4只小鼠给药,图1中给出抗体效价的平均值。
在可自由进食和饮水的环境下饲养给药后的小鼠,经时性地从尾静脉采血。对所采血液添加最终浓度为3.3IU/ml的肝素,以5,000rpm离心5分钟,回收血浆,测定血浆中的相对于OVA的抗体效价。
抗体效价用以下的方法进行测定。在96微孔板(Nunc公司制造的MaxiSorp)中加入含1μg/ml的OVA的PBS溶液100μl,于4℃静置1夜。弃去溶液,加入含0.5%BSA的PBS 400μl,于室温进行2小时的封闭(blocking)。用清洗液(含0.05%Tween20的PBS)400μl将孔清洗1次后,加入100μl用稀释液(含0.25%BSA、0.05%Tween20的PBS)进行了1,000倍至100,000倍稀释的血浆样品,于室温进行40分钟振荡反应。用清洗液将孔清洗3次后,加入HRP(辣根过氧化物酶)标识抗小鼠IgG抗体(Zymed公司)(用稀释液稀释10,000倍)100μl,于室温进行20分钟振荡反应。用清洗液将孔清洗3次后,加入显色液(含0.006%过氧化氢、0.2mg/ml四甲基联苯胺的0.1M乙酸-柠檬酸钠缓冲液(pH4.5))100μl,于室温进行10分钟振荡反应。加入1N硫酸100μl停止反应,使用酶标仪测定450nm的吸光度。作为标准样品,对连续稀释后的抗OVA单克隆抗体(Antibody Shop公司制造的HYB 094-05)同时进行测定,将其制作标准曲线,将各样品中的抗体量换算成重量浓度(ng/ml)。
<结果>
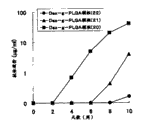
血浆中的抗OVA抗体效价的平均值的经时变化见图1。使用了Dex-g-PLGA的OVA包埋颗粒或OVA包埋缔合颗粒(Dex-g-PLGA颗粒(2)、(3)、(4)、(5)、(6))、使用了PEG-PLGA的OVA包埋缔合颗粒(PEG-PLGA颗粒(3))在6周以上显示持续的抗体效价升高效果,大大超出作为比较例的仅PLGA颗粒或抗原的给药、作为参考例的抗原+Alum的给药。需要说明的是,粒径小的Dex-g-PLGA颗粒(6)显示具有最强的抗体效价升高效果的倾向。
实施例7含CEA的免疫原性组合物的小鼠皮下给药
<方法>
对于用实施例3和4的方法制作的CEA-佐剂微粒复合物(以下称为CEA包埋颗粒)或其缔合颗粒(以下称为CEA包埋缔合颗粒),用与实施例6相同的方法进行评价。每只小鼠的给药量设定为1mg(抗原5μg),将其单次注射给药。作为CEA包埋颗粒和CEA包埋缔合颗粒,对疏水接枝链的长度不同的Dex-g-PLGA颗粒(8)、颗粒(9)、颗粒(10)、用与Dex-g-PLGA颗粒(9)相同的化合物(4)制备的粒径不同的Dex-g-PLGA颗粒(11)、颗粒(12)、在Dex-g-PLGA颗粒(9)中与其抗原一起含有25μg CpG的Dex-g-PLGA颗粒(13)、PEG-PLGA颗粒(4)进行评价。并且,作为比较例,将含5μg抗原的水溶液50μl单次注射给药,作为参考例,将含有5μg抗原的水溶液50μl和Alum50μl混合进行单次注射给药。将各条件的免疫原性组合物都对4只小鼠给药,在图2和图3中给出各组的平均值。
相对于CEA的抗体效价用以下的方法进行测定。在96微孔板(Nunc公司制造的MaxiSorp)中加入含1μg/ml的CEA蛋白的PBS溶液100μl,于4℃静置一夜。弃去溶液,加入含0.5%BSA的PBS400μl,于室温进行2小时封闭。用清洗液(含0.05%Tween20的PBS)400μl将孔清洗1次后,加入100μl用稀释液(含0.25%BSA、0.05%Tween20的PBS)进行了1,000倍至100,000倍稀释的血浆样品,于室温进行40分钟振荡反应。用清洗液将孔清洗3次后,加入HRP(辣根过氧化物酶)标识抗小鼠IgG抗体(Zymed公司)(用稀释液稀释10,000倍)100μl,于室温进行20分钟振荡反应。用清洗液将孔清洗3次后,加入显色液(含0.006%过氧化氢、0.2mg/ml四甲基联苯胺的0.1M乙酸-柠檬酸钠缓冲液(pH4.5))100μl,于室温进行10分钟振荡反应。加入1N硫酸100μl停止反应,使用酶标仪测定450nm的吸光度。作为标准样品,对连续稀释后的抗CEA单克隆抗体(Affinity Bioreagents公司制造的MA1-5308)同时进行测定,将其制作标准曲线,将各样品中的抗体量换算成重量浓度(ng/ml)。IgG2a抗体效价的测定中,使用HRP标识抗小鼠IgG2a抗体(Bethyl公司制造的A90-107P)代替HRP标识抗小鼠IgG抗体,用抗体效价升高了的1只小鼠的血浆样品作为基准样品,以将其连续稀释后的样品作为标准制作标准曲线,将64,000倍稀释样品所相当的抗体效价表示为1U。
<结果>
使用了Dex-g-PLGA的CEA包埋颗粒或CEA包埋缔合颗粒(Dex-g-PLGA颗粒(8)、(9)、(10)、(11)、(12)、PEG-PLGA颗粒(4))在大约6周中显示持续的抗体效价升高,这些中作为粒径小的颗粒的CEA包埋颗粒(Dex-g-PLGA颗粒(12))显示最强的抗体效价升高效果。并且,在Dex-g-PLGA颗粒(9)中与其抗原一起含有CpG的Dex-g-PLGA颗粒(13)显示比Dex-g-PLGA颗粒(9)强的抗体效价升高效果(图2)。
在Dex-g-PLGA颗粒(8)、(9)、(10)、(11)、(12)和PEG-PLGA颗粒(4)中确认到抗IgG2a抗体效价持续升高。在Dex-g-PLGA颗粒(9)中与其抗原一起含有CpG的Dex-g-PLGA颗粒(13)显示比Dex-g-PLGA颗粒(9)强的抗体效价升高效果。另一方面,作为参考例的将抗原和Alum混合后给药的情况下,虽然观察到抗体效价持续升高,但与其他的Dex-g-PLGA颗粒相比,其效果弱。确认到本发明的免疫原性组合物持续地长期地活化了细胞性免疫,所获知的小鼠IgG2a效价升高是细胞性免疫的指标(图3)。
实施例8含OVA的免疫原性组合物的小鼠皮下给药(2)
<方法>
用与实施例1的化合物(4)相同的方法制备Dex-g-PLGA聚合物,使用该聚合物用与实施例3的Dex-g-PLGA颗粒(3)相同的方法制备颗粒(Dex-g-PLGA颗粒(A)),对所制备的颗粒用实施例6中记载的方法进行评价。设定每只小鼠的给药量为16mg(包埋OVA量20μg),将其单次注射给药。并且,作为参考例,将含有20μg的OVA抗原的水溶液50μl与Alum 50μl混合,将混合溶液1次注射给药,或每隔1周共3次注射给药。将各条件的免疫原性组合物都对2只小鼠给药,图4中抗体效价的平均值记载的是450nm的吸光度测定值的数值。
<结果>
血浆中的抗OVA抗体的经时变化见图4。在将Alum和抗原的混合溶液仅1次给药的参考例中,几乎未见抗体效价的升高。在将Alum和抗原3次给药的参考例中,从第3次给药开始观察到抗体效价急剧升高,但升高是暂时性的,在35天以后没有观察到抗体效价升高。对于单次注射给药本发明免疫原性组合物(Dex-g-PLGA颗粒(A))的小鼠,从给药第2周开始可见抗体效价持续升高,直至56天后确认到持续的抗体效价升高。
实施例9含OVA的免疫原性组合物的小鼠皮下给药(3)
<方法>
用与实施例6相同的方法进行评价。将给药量都设定为每一只小鼠给予OVA包埋缔合颗粒10mg(抗原投料量12.5μg),单次注射给药下述颗粒:使用以与实施例1的化合物(4)相同的方法制备的Dex-g-PLGA聚合物,通过与实施例3的Dex-g-PLGA颗粒(3)相同的方法,制备的颗粒(Dex-g-PLGA颗粒(B));使用以与实施例1的化合物(4)相同的方法制备的Dex-g-PLGA聚合物进行实施例3的Dex-g-PLGA颗粒(3)的制备时,与OVA一起使颗粒含有每一只小鼠的给药量为6.25μg的CpG,从而得到的颗粒(Dex-g-PLGA颗粒(C));PEG-PLGA颗粒(1);和PEG-PLGA颗粒(2)。作为比较例,将抗原12.5μg单次注射给药,作为参考例,将抗原12.5μg和CpG 6.25μg混合后单次注射给药。从给药后第4周开始每周采血,用与实施例6相同的方法测定抗体效价。将各条件的免疫原性组合物都对2只小鼠给药,图5中给出了抗体效价的平均值。
<结果>
OVA包埋缔合颗粒(PEG-PLGA颗粒(1)、(2)、Dex-g-PLGA颗粒(B)、(C))都在给药后6周以上使给药动物的抗体效价升高。Dex-g-PLGA颗粒显示比PEG-PLGA颗粒高的免疫活化能。并且,包埋有CpG的OVA包埋颗粒(Dex-g-PLGA颗粒(C))显示比不含CpG的OVA包埋颗粒(Dex-g-PLGA颗粒(B))强的抗体效价升高效果。
实施例10含HCV构成蛋白质的免疫原性组合物的小鼠皮下给药
<方法>
用与实施例1的化合物(4)相同的方法制备Dex-g-PLGA聚合物,使用该聚合物通过与实施例3的Dex-g-PLGA颗粒(3)同样的制备方法制备含有HCV构成蛋白质的HCV构成蛋白质-佐剂微粒复合物缔合而成的颗粒Dex-g-PLGA颗粒(D)(以下称为HCV-E2包埋缔合颗粒),用与实施例6相同的方法单次注射给药。作为HCV构成蛋白质,使用由基于日本特愿2008-254338所记载的方法制备的来源于J6CF株的E2蛋白质和人IgG的Fc蛋白质形成的嵌合体蛋白质。每一只小鼠的给药量设定为80mg(抗原1.5μg)。并且,将CpG 25μg与Dex-g-PLGA颗粒(D)混合,将CpG 25μg和Alum 50μl与Dex-g-PLGA颗粒(D)混合,将各混合物单次注射给药。作为比较例,仅将1.5μg抗原单次注射给药,作为参考例,将含有抗原1.5μg和CpG 25μg的水溶液100μl、含有抗原1.5μg和Alum 50μl的水溶液100μl、或含有抗原1.5μg、Alum 50μl和CpG 25μg的水溶液100μl单次注射给药。将各条件的免疫原性组合物都对2只小鼠给药。
相对于HCV构成蛋白质的抗体效价用以下的方法进行测定。在96微孔板(Nunc公司制造的MaxiSorp)中加入含有0.5μg/ml的HCV构成蛋白质的PBS溶液100μl,于4℃静置一夜。弃去溶液,加入含0.5%BSA的PBS 400μl,于室温进行2小时封闭。用清洗液(含0.05%Tween20的PBS)400μl将孔清洗1次后,加入100μl用稀释液(含0.25%BSA、0.05%Tween20的PBS)进行了1,000倍至100,000倍稀释的血浆样品,于室温进行40分钟振荡反应。用清洗液将孔清洗3次后,加入HRP(辣根过氧化物酶)标识抗小鼠IgG抗体(Zymed公司)(用稀释液稀释10,000倍)100μl,于室温进行20分钟振荡反应。用清洗液将孔清洗3次后,加入显色液(含0.006%过氧化氢、0.2mg/ml四甲基联苯胺的0.1M乙酸-柠檬酸钠缓冲液(pH4.5))100μl,于室温进行10分钟振荡反应。加入1N硫酸100μl停止反应,用酶标仪测定450nm的吸光度。图6中抗体效价的平均值记载的是450nm的吸光度测定值的数值。
<结果>
HCV-E2包埋缔合颗粒(Dex-g-PLGA颗粒(D))在7周中显示持续的抗体效价升高效果。并且,在HCV-E2包埋缔合颗粒中混合有CpG时和在HCV-E2包埋缔合颗粒中混合有CpG和Alum时,显示出比HCV-E2包埋缔合颗粒单独给药时强的抗体效价升高效果。仅给予抗原的比较例中,几乎没有观察到抗体效价的升高。在分别将抗原和Alum、抗原和CpG、或者抗原、CpG和Alum混合后给药的参考例中,与抗原单独给药时相比,抗体效价升高效果提高,但与HCV-E2包埋缔合颗粒给药时相比,仅显示出相差甚远的弱的抗体效价升高效果。
实施例11含CEA的免疫原性组合物的小鼠皮下给药(2)
<方法>
对于用实施例3和4的方法制作的CEA-佐剂微粒复合物缔合颗粒(以下称为CEA包埋缔合颗粒),用与实施例7相同的方法进行评价。每一只小鼠的给药量设定为400g(抗原1μg),将其在第0周和第4周给药。作为CEA包埋缔合颗粒,对以分子量1,500的葡聚糖为亲水链的Dex-g-PLGA颗粒(14)、(15)、以分子量5,000的葡聚糖为亲水链的Dex-g-PLGA颗粒(16)、(17)、以分子量175,000的葡聚糖为亲水链的Dex-g-PLGA颗粒(18)、以分子量40,000的葡聚糖为亲水链的Dex-g-PLGA颗粒(19)进行评价。将各条件的免疫原性组合物都对5只小鼠给药,图7中给出各组的平均值。相对于CEA的抗体效价用与实施例7相同的方法测定。
<结果>
使用了Dex-g-PLGA的CEA包埋缔合颗粒(Dex-g-PLGA颗粒(14)、(15)、(16)、(17)、(18)、(19))显示出持续的抗体效价的升高。其中,由分子量175,000的葡聚糖和分子量40,000的葡聚糖构成的CEA包埋缔合颗粒(Dex-g-PLGA颗粒(18)、(19))显示出比由分子量1,500的葡聚糖亲水链和分子量5,000的葡聚糖亲水链构成的CEA包埋缔合颗粒(Dex-g-PLGA颗粒(14)、(15)、(16)、(17))强的抗体效价升高效果(图7)。
实施例12含CEA的免疫原性组合物的小鼠皮下给药(3)
<方法>
对于用实施例3和4的方法制作的CEA-佐剂微粒复合物缔合颗粒(以下称为CEA包埋缔合颗粒),用与实施例7相同的方法进行评价。每一只小鼠的给药量设定为400μg(抗原1μg),将其在第0周和第4周给药。作为CEA包埋缔合颗粒,对使用同一聚合物但制备成不同粒径的3种类型的颗粒(Dex-g-PLGA颗粒(20)(粒径0.4μm)、Dex-g-PLGA颗粒(21)(粒径5μm)、Dex-g-PLGA颗粒(粒径40μm)进行评价。将各条件的免疫原性组合物都对5只小鼠给药,图8中给出各组的平均值。相对于CEA的抗体效价用与实施例7相同的方法测定。
<结果>
使用了Dex-g-PLGA的CEA包埋颗粒和CEA包埋缔合颗粒(Dex-g-PLGA颗粒(20)、(21)、(22))显示出持续的抗体效价的升高。这些中,平均粒径0.4μm的Dex-g-PLGA颗粒(20)显示出最强的抗体效价升高效果,其次是平均粒径5μm的Dex-g-PLGA颗粒(21),然后是平均粒径40μm的Dex-g-PLGA颗粒(22)显示出最低的抗体效价升高效果(图8)。
实施例13含OVA的免疫原性组合物的小鼠皮下给药(4)
<方法>
用与实施例9相同的方法进行评价。对于给药量,将每1次给药的抗原量都设定为20μg,进行3次抗原给药分别在第0周、第2周、第4周。评价时,对将OVA 20μg与不含抗原的Dex-g-PLGA颗粒(24)(与聚合物量16mg相当的量)混合后给药的情况、将含有OVA 20μg的Dex-g-PLGA颗粒(23)(与聚合物量16mg相当的量)给药的情况、将OVA 20μg和Alum 50μl混合后给药的情况、将OVA20μg和不含抗原的Dex-g-PLGA颗粒(24)对不同部位给药的情况进行比较。用与实施例9相同的方法测定血中的抗体效价。将各条件的免疫原性组合物都对2只小鼠给药,图9中给出抗体效价的平均值。
<结果>
任一颗粒都显示抗体效价升高效果。与将OVA和不含抗原的颗粒(Dex-g-PLGA颗粒(24))混合后给药的情况以及将OVA和Dex-g-PLGA颗粒(24)对不同部位给药的情况相比,OVA包埋缔合颗粒(Dex-g-PLGA颗粒(23))显示出较强的抗体效价升高效果。
实施例14含CEA的免疫原性组合物的小鼠皮下给药(4)
<方法>
用与实施例7相同的方法进行评价。仅在将CEA和Alum混合后给药的情况下进行3次给药,分别在第0周、第2周、第4周给药,其他的CEA包埋颗粒和CEA包埋缔合颗粒在第0周单次给药。评价中,将使用同一聚合物制备的粒径不同的颗粒、Dex-g-PLGA颗粒(25)(粒径0.4μm、聚合物含量4mg、抗原给药量10μg)、Dex-g-PLGA颗粒(26)(粒径5μm、聚合物含量4mg、抗原给药量10μg)、Dex-g-PLGA颗粒(27)(粒径40μm、聚合物含量4mg、抗原给药量10μg)、Dex-g-PLGA颗粒(28)(粒径0.4μm、聚合物含量4mg、抗原给药量1μg)进行比较。并且,有关Dex-g-PLGA颗粒(25),与给药量减少为十分之一(聚合物含量400μg、抗原给药量1μg)、百分之一(聚合物含量40μg、抗原给药量0.1μg)进行给药时做比较。作为比较例,对包埋CEA制备的PLGA颗粒(2)进行评价。将各项目的免疫原性组合物都对6只小鼠给药,血中的抗体效价和IgG1、IgG2a用与实施例7相同的方法进行测定,图10、图11中给出了其平均值。
<结果>
平均粒径0.4μm和平均粒径5μm的CEA包埋颗粒(Dex-g-PLGA颗粒(25)、(26))显示出比平均粒径40μm的CEA包埋颗粒(Dex-g-PLGA颗粒(27))强的抗体效价升高效果。与Dex-g-PLGA颗粒(25)显示强的抗体效价升高效果相对,其给药量减小为十分之一、百分之一时,抗体效价升高效果降低,给药量设定为百分之一的颗粒仅具有弱的抗体效价升高效果。在抗原给药量设定为1μg的、Dex-g-PLGA颗粒(25)十分之一量的给药与Dex-g-PLGA颗粒(28)的比较中,给药聚合物量多时显示出较强的抗体效价诱导效果(图10)。
并且,有关第6周的血液,通过与实施例7相同的方法测定IgG2a抗体效价,通过与IgG2a抗体效价测定相同的方法用IgG1抗体测定IgG1抗体效价,计算其比值,将Alum和抗原混合后给药时显示较低的IgG2a/IgG1值,与此相对,Dex-g-PLGA颗粒(25)、(26)、(27)显示较高的IgG2a/IgG1值,并观察到粒径越小IgG2a/IgG1值越高的倾向(图11)。
产业上的可利用性
本发明的免疫原性组合物能够用作用于治疗和/或预防感染性疾病和癌等的疫苗。
Claims (13)
1.一种免疫原性组合物,其含有抗原-佐剂微粒复合物作为有效成分,所述抗原包埋在佐剂微粒中,所述佐剂微粒包含疏水性链段为聚(羟基酸)的两亲性聚合物。
2.如权利要求1所述的免疫原性组合物,其中,所述免疫原性组合物含有抗原-佐剂微粒复合物缔合而成的颗粒作为有效成分。
3.如权利要求1或2所述的免疫原性组合物,其特征在于,佐剂微粒在内部具有包含两亲性聚合物亲水性链段的亲水性部分,并具有包含两亲性聚合物疏水性链段的疏水部分的外层。
4.如权利要求1~3中任一项所述的免疫原性组合物,其中,两亲性聚合物的亲水性链段为多糖或聚乙二醇。
5.如权利要求1~4中任一项所述的免疫原性组合物,其中,两亲性聚合物为包含多糖主链和聚(羟基酸)接枝链的接枝型两亲性聚合物。
6.如权利要求4或5所述的免疫原性组合物,其中,多糖为葡聚糖。
7.如权利要求1~4中任一项所述的免疫原性组合物,其中,两亲性聚合物为包含聚(羟基酸)和聚乙二醇的嵌段聚合物。
8.如权利要求1~7中任一项所述的免疫原性组合物,其中,聚(羟基酸)为聚(乳酸-乙醇酸)。
9.如权利要求1~8中任一项所述的免疫原性组合物,其中,在佐剂微粒的聚(羟基酸)上结合有表面改性剂。
10.如权利要求1~9中任一项所述的免疫原性组合物,其中,抗原-佐剂微粒复合物或抗原-佐剂微粒复合物缔合而成的颗粒的平均粒径为0.1~50μm。
11.如权利要求1~10中任一项所述的免疫原性组合物,其中,所述组合物进一步含有免疫活性物质作为有效成分。
12.如权利要求11所述的免疫原性组合物,其中,免疫活性物质为核酸。
13.如权利要求11或12所述的免疫原性组合物,其中,免疫活性物质为CpG。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| JP2009-045555 | 2009-02-27 | ||
| JP2009045555 | 2009-02-27 | ||
| PCT/JP2010/053055 WO2010098432A1 (ja) | 2009-02-27 | 2010-02-26 | 免疫原性組成物 |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN102333541A true CN102333541A (zh) | 2012-01-25 |
| CN102333541B CN102333541B (zh) | 2014-09-03 |
Family
ID=42665636
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN201080009580.0A Active CN102333541B (zh) | 2009-02-27 | 2010-02-26 | 免疫原性组合物 |
Country Status (15)
| Country | Link |
|---|---|
| US (1) | US9056095B2 (zh) |
| EP (1) | EP2402032B1 (zh) |
| JP (1) | JP6008345B2 (zh) |
| KR (1) | KR20110128284A (zh) |
| CN (1) | CN102333541B (zh) |
| AU (1) | AU2010218752B2 (zh) |
| BR (1) | BRPI1005919B1 (zh) |
| CA (1) | CA2753567C (zh) |
| DK (1) | DK2402032T3 (zh) |
| ES (1) | ES2755361T3 (zh) |
| HU (1) | HUE046865T2 (zh) |
| MX (1) | MX2011008923A (zh) |
| PL (1) | PL2402032T3 (zh) |
| PT (1) | PT2402032T (zh) |
| WO (1) | WO2010098432A1 (zh) |
Cited By (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102988981A (zh) * | 2012-12-13 | 2013-03-27 | 中国水产科学研究院黄海水产研究所 | 一种增强爱德华氏菌疫苗免疫接种效果的佐剂及使用方法 |
| CN106232106A (zh) * | 2014-04-18 | 2016-12-14 | 奥本大学 | 用于诱导先天性和适应性免疫力的颗粒状疫苗制剂 |
Families Citing this family (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CA2960846C (en) | 2008-06-27 | 2020-08-25 | Zoetis Services Llc | Adjuvants containing deae dextran, immunostimulatory oligonucleotide and oil |
| AU2011294244B2 (en) * | 2010-08-26 | 2014-06-12 | Toray Industries, Inc. | Immunogenic composition |
| JPWO2013085021A1 (ja) * | 2011-12-09 | 2015-04-27 | 株式会社林原 | 抗体産生増強用の組成物 |
| AU2013318338B2 (en) | 2012-09-21 | 2017-05-25 | Intensity Therapeutics, Inc | Method of treating cancer |
| NZ757210A (en) | 2013-09-19 | 2022-12-23 | Zoetis Services Llc | Oil-based adjuvants |
| MX2016004328A (es) * | 2013-10-09 | 2016-07-11 | Toray Industries | Inmunopotenciador. |
| US10293044B2 (en) | 2014-04-18 | 2019-05-21 | Auburn University | Particulate formulations for improving feed conversion rate in a subject |
| CN114699518B (zh) | 2015-01-16 | 2024-07-02 | 硕腾服务有限责任公司 | 口蹄疫疫苗 |
| GB201918963D0 (en) | 2019-12-20 | 2020-02-05 | Provost Fellows Scholars And Other Members Of Board Of Trinity College Dublin | Polymeric nanoparticles as vaccine adjuvants |
| EP4397315A1 (en) | 2021-08-30 | 2024-07-10 | Toray Industries, Inc. | Composition for enhancing immunogenicity |
| JPWO2023032892A1 (zh) | 2021-08-30 | 2023-03-09 | ||
| CN118159285A (zh) | 2021-09-16 | 2024-06-07 | 东丽株式会社 | 用于癌的治疗和/或预防的药品 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008088158A (ja) * | 2006-09-05 | 2008-04-17 | Toray Ind Inc | 親水性活性物質含有微粒子の製造方法 |
Family Cites Families (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| ES2241042T3 (es) | 1996-10-11 | 2005-10-16 | The Regents Of The University Of California | Conjugados de polinucleotido inmunoestimulador/ molecula inmunomoduladora. |
| CN101137700B (zh) | 2005-03-09 | 2012-07-18 | 东丽株式会社 | 微粒及医药组合物 |
| JP2008254338A (ja) | 2007-04-05 | 2008-10-23 | Bridgestone Corp | タイヤの製造方法およびその装置 |
| WO2010038789A1 (ja) | 2008-09-30 | 2010-04-08 | 東レ株式会社 | C型肝炎ウイルスのエンベロープタンパク質2に結合する抗体及びそれを用いたc型肝炎ウイルスの遺伝子型の同定方法 |
-
2010
- 2010-02-26 PT PT107463119T patent/PT2402032T/pt unknown
- 2010-02-26 CN CN201080009580.0A patent/CN102333541B/zh active Active
- 2010-02-26 AU AU2010218752A patent/AU2010218752B2/en not_active Ceased
- 2010-02-26 PL PL10746311T patent/PL2402032T3/pl unknown
- 2010-02-26 WO PCT/JP2010/053055 patent/WO2010098432A1/ja active Application Filing
- 2010-02-26 MX MX2011008923A patent/MX2011008923A/es active IP Right Grant
- 2010-02-26 JP JP2010508657A patent/JP6008345B2/ja active Active
- 2010-02-26 CA CA2753567A patent/CA2753567C/en active Active
- 2010-02-26 ES ES10746311T patent/ES2755361T3/es active Active
- 2010-02-26 US US13/202,336 patent/US9056095B2/en active Active
- 2010-02-26 EP EP10746311.9A patent/EP2402032B1/en active Active
- 2010-02-26 HU HUE10746311A patent/HUE046865T2/hu unknown
- 2010-02-26 BR BRPI1005919-9A patent/BRPI1005919B1/pt active IP Right Grant
- 2010-02-26 KR KR1020117020493A patent/KR20110128284A/ko not_active Application Discontinuation
- 2010-02-26 DK DK10746311T patent/DK2402032T3/da active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2008088158A (ja) * | 2006-09-05 | 2008-04-17 | Toray Ind Inc | 親水性活性物質含有微粒子の製造方法 |
Non-Patent Citations (5)
| Title |
|---|
| K.S. JAGANATHAN ET AL: "Strong systemic and mucosal immune responses to surface-modified PLGA microspheres containing recombinant Hepatitis B antigen administered intranasally", 《VACCINE》, vol. 24, 18 January 2006 (2006-01-18), pages 4201 - 4211, XP028010821, DOI: doi:10.1016/j.vaccine.2006.01.011 * |
| M.TOBIO ET AL: "Stealth PLA-PEG Nanoparticles as Protein Carriers for Nasal Administration", 《PHARMACEUTICAL RESEARCH》, vol. 15, no. 2, 31 December 1998 (1998-12-31), pages 270 - 275, XP002999249, DOI: doi:10.1023/A:1011922819926 * |
| QIANG WEI ET AL: "Preparation of uniform-sized PELA microspheres with high encapsulation efficiency of antigen by premix membrane emulsification", 《JOURNAL OF COLLOID AND INTERFACE SCIENCE》, vol. 323, 30 April 2008 (2008-04-30), pages 267 - 273, XP022703032, DOI: doi:10.1016/j.jcis.2008.04.058 * |
| X.M. DENG ET AL.: "Optimization of preparative conditions for poly-DL-lactide-polyethylene glycol microspheres with entrapped Vibrio Cholera antigens", 《JOURNAL OF CONTROLLED RELEASE》, vol. 58, 31 December 1999 (1999-12-31), pages 123 - 131, XP004164084, DOI: doi:10.1016/S0168-3659(98)00147-3 * |
| XUEQING ZHANG: "A Comparative Study of the Antigen-Specific Immune Response Induced by Co-Delivery of CpG ODN and Antigen Using Fusion Molecules or Biodegradable Microparticles", 《JOURNAL OF PHARMACEUTICAL SCIENCES》, vol. 96, no. 12, 31 December 2007 (2007-12-31), pages 3283 - 3292, XP002559998, DOI: doi:10.1002/jps.20978 * |
Cited By (4)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN102988981A (zh) * | 2012-12-13 | 2013-03-27 | 中国水产科学研究院黄海水产研究所 | 一种增强爱德华氏菌疫苗免疫接种效果的佐剂及使用方法 |
| CN102988981B (zh) * | 2012-12-13 | 2015-03-04 | 中国水产科学研究院黄海水产研究所 | 一种增强爱德华氏菌疫苗免疫接种效果的佐剂及使用方法 |
| CN106232106A (zh) * | 2014-04-18 | 2016-12-14 | 奥本大学 | 用于诱导先天性和适应性免疫力的颗粒状疫苗制剂 |
| CN106232106B (zh) * | 2014-04-18 | 2020-08-11 | 奥本大学 | 用于诱导先天性和适应性免疫力的颗粒状疫苗制剂 |
Also Published As
| Publication number | Publication date |
|---|---|
| ES2755361T3 (es) | 2020-04-22 |
| CA2753567C (en) | 2019-12-31 |
| HUE046865T2 (hu) | 2020-03-30 |
| CA2753567A1 (en) | 2010-09-02 |
| CN102333541B (zh) | 2014-09-03 |
| MX2011008923A (es) | 2011-09-09 |
| AU2010218752A1 (en) | 2011-08-25 |
| EP2402032A1 (en) | 2012-01-04 |
| KR20110128284A (ko) | 2011-11-29 |
| US20110300223A1 (en) | 2011-12-08 |
| US9056095B2 (en) | 2015-06-16 |
| JPWO2010098432A1 (ja) | 2012-09-06 |
| AU2010218752B2 (en) | 2015-05-28 |
| EP2402032B1 (en) | 2019-08-14 |
| PL2402032T3 (pl) | 2020-03-31 |
| PT2402032T (pt) | 2019-11-19 |
| JP6008345B2 (ja) | 2016-10-19 |
| WO2010098432A1 (ja) | 2010-09-02 |
| EP2402032A4 (en) | 2013-05-01 |
| BRPI1005919A2 (pt) | 2016-02-10 |
| BRPI1005919B1 (pt) | 2021-06-22 |
| DK2402032T3 (da) | 2019-11-04 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102333541B (zh) | 免疫原性组合物 | |
| CN103052402B (zh) | 免疫原性组合物 | |
| Silva et al. | Poly-(lactic-co-glycolic-acid)-based particulate vaccines: particle uptake by dendritic cells is a key parameter for immune activation | |
| Kumar et al. | Pathogen-mimicking vaccine delivery system designed with a bioactive polymer (inulin acetate) for robust humoral and cellular immune responses | |
| CN103079589A (zh) | 用于诱导对抗原的免疫应答的靶向多表位剂型 | |
| Joshi et al. | Characterizing the antitumor response in mice treated with antigen-loaded polyanhydride microparticles | |
| CN113995834A (zh) | 一种基于环糊精接枝壳聚糖的疫苗、制备方法及应用 | |
| CN105611936B (zh) | 免疫增强剂 | |
| KR101595949B1 (ko) | 아주번트 조성물 및 백신 조성물의 제조 방법 | |
| US20100297192A1 (en) | Use of microparticles for vaccines and the release of biologically active molecules | |
| Sunasee et al. | Carbohydrate nanotechnology applied to vaccine development | |
| JP4095696B2 (ja) | 鳥類腸管リンパ組織への取込目的物搬送用の微粒子及び搬送方法 | |
| CN116832151A (zh) | 一种纳米颗粒佐剂的制备方法及其产品和应用 | |
| CN117813113A (zh) | 免疫原性增强用组合物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant |