CN102239150A - 作为用于增殖性疾病治疗的蛋白激酶抑制剂的新型吲唑衍生物或其药学上可接受的盐以及含有其作为活性成分的药物组合物 - Google Patents
作为用于增殖性疾病治疗的蛋白激酶抑制剂的新型吲唑衍生物或其药学上可接受的盐以及含有其作为活性成分的药物组合物 Download PDFInfo
- Publication number
- CN102239150A CN102239150A CN2009801489968A CN200980148996A CN102239150A CN 102239150 A CN102239150 A CN 102239150A CN 2009801489968 A CN2009801489968 A CN 2009801489968A CN 200980148996 A CN200980148996 A CN 200980148996A CN 102239150 A CN102239150 A CN 102239150A
- Authority
- CN
- China
- Prior art keywords
- phenyl
- indazole
- trifluoromethyl
- amide
- ethyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Pending
Links
- 150000003839 salts Chemical class 0.000 title claims abstract description 22
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 title claims abstract description 18
- 201000010099 disease Diseases 0.000 title claims abstract description 17
- 239000008194 pharmaceutical composition Substances 0.000 title claims abstract description 12
- 239000004480 active ingredient Substances 0.000 title claims abstract description 8
- 125000003453 indazolyl group Chemical class N1N=C(C2=C1C=CC=C2)* 0.000 title claims abstract description 5
- 238000011282 treatment Methods 0.000 title abstract description 8
- 230000002062 proliferating effect Effects 0.000 title abstract description 5
- 239000003909 protein kinase inhibitor Substances 0.000 title description 2
- 229940045988 antineoplastic drug protein kinase inhibitors Drugs 0.000 title 1
- -1 b-raf Proteins 0.000 claims abstract description 126
- 239000000126 substance Substances 0.000 claims abstract description 47
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 claims abstract description 19
- 230000004663 cell proliferation Effects 0.000 claims abstract description 12
- 101100481410 Mus musculus Tek gene Proteins 0.000 claims abstract description 11
- 102000001253 Protein Kinase Human genes 0.000 claims abstract description 11
- 230000002159 abnormal effect Effects 0.000 claims abstract description 11
- 108060006633 protein kinase Proteins 0.000 claims abstract description 11
- 101100481408 Danio rerio tie2 gene Proteins 0.000 claims abstract description 10
- 101150053778 CSF1R gene Proteins 0.000 claims abstract description 5
- 101150077555 Ret gene Proteins 0.000 claims abstract description 5
- 101150060629 def gene Proteins 0.000 claims abstract description 5
- 108700012928 MAPK14 Proteins 0.000 claims abstract description 4
- 102000054819 Mitogen-activated protein kinase 14 Human genes 0.000 claims abstract description 4
- 150000002473 indoazoles Chemical class 0.000 claims description 31
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 27
- 206010028980 Neoplasm Diseases 0.000 claims description 16
- 239000001257 hydrogen Substances 0.000 claims description 13
- 229910052739 hydrogen Inorganic materials 0.000 claims description 13
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 12
- 201000001441 melanoma Diseases 0.000 claims description 12
- 201000011510 cancer Diseases 0.000 claims description 11
- 125000002541 furyl group Chemical group 0.000 claims description 8
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 claims description 7
- 125000002023 trifluoromethyl group Chemical group FC(F)(F)* 0.000 claims description 7
- ROSDSFDQCJNGOL-UHFFFAOYSA-N Dimethylamine Chemical compound CNC ROSDSFDQCJNGOL-UHFFFAOYSA-N 0.000 claims description 6
- 150000002431 hydrogen Chemical class 0.000 claims description 6
- FQKWLUSQWAHBPI-UHFFFAOYSA-N ethyl 6-[4-[[3-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CC=CC(C(F)(F)F)=C1 FQKWLUSQWAHBPI-UHFFFAOYSA-N 0.000 claims description 5
- BUYIUTFGOYEYBQ-UHFFFAOYSA-N n-methyl-6-[4-[[3-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CC=CC(C(F)(F)F)=C1 BUYIUTFGOYEYBQ-UHFFFAOYSA-N 0.000 claims description 5
- 125000001544 thienyl group Chemical group 0.000 claims description 5
- 125000006570 (C5-C6) heteroaryl group Chemical group 0.000 claims description 4
- 206010025323 Lymphomas Diseases 0.000 claims description 4
- 208000006265 Renal cell carcinoma Diseases 0.000 claims description 4
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 claims description 4
- ULSQYLNKQIQSKO-UHFFFAOYSA-N ethyl 6-[4-[(3,4-dichlorophenyl)carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)NC1=CC=C(Cl)C(Cl)=C1 ULSQYLNKQIQSKO-UHFFFAOYSA-N 0.000 claims description 4
- 201000005787 hematologic cancer Diseases 0.000 claims description 4
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 claims description 4
- 125000001072 heteroaryl group Chemical group 0.000 claims description 4
- 201000007270 liver cancer Diseases 0.000 claims description 4
- 208000014018 liver neoplasm Diseases 0.000 claims description 4
- UIEOHPPHWLOFFY-UHFFFAOYSA-N methyl 6-[3-[(2,4-dimethylphenyl)carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=C(C)C=C1C UIEOHPPHWLOFFY-UHFFFAOYSA-N 0.000 claims description 4
- 125000001624 naphthyl group Chemical group 0.000 claims description 4
- 125000003373 pyrazinyl group Chemical group 0.000 claims description 4
- 125000003226 pyrazolyl group Chemical group 0.000 claims description 4
- 125000002098 pyridazinyl group Chemical group 0.000 claims description 4
- 125000004076 pyridyl group Chemical group 0.000 claims description 4
- 125000000335 thiazolyl group Chemical group 0.000 claims description 4
- SHCHLFHYEPDFRO-UHFFFAOYSA-N 1-[4-chloro-3-(trifluoromethyl)phenyl]-3-[3-[3-(hydroxymethyl)-2h-indazol-6-yl]phenyl]urea Chemical compound C=1C=C2C(CO)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=C(Cl)C(C(F)(F)F)=C1 SHCHLFHYEPDFRO-UHFFFAOYSA-N 0.000 claims description 3
- 206010009944 Colon cancer Diseases 0.000 claims description 3
- 208000001333 Colorectal Neoplasms Diseases 0.000 claims description 3
- 206010061902 Pancreatic neoplasm Diseases 0.000 claims description 3
- 208000024770 Thyroid neoplasm Diseases 0.000 claims description 3
- TVLFFALFRRBQDI-UHFFFAOYSA-N ethyl 6-[3-[(2,3-dichlorophenyl)carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=CC(Cl)=C1Cl TVLFFALFRRBQDI-UHFFFAOYSA-N 0.000 claims description 3
- FPCHNDPPENYRBW-UHFFFAOYSA-N ethyl 6-[3-[(3,4-dichlorophenyl)carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=C(Cl)C(Cl)=C1 FPCHNDPPENYRBW-UHFFFAOYSA-N 0.000 claims description 3
- ZZTSDLBNIHSXAN-UHFFFAOYSA-N ethyl 6-[3-[[2-(3,4-dimethoxyphenyl)acetyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)CC1=CC=C(OC)C(OC)=C1 ZZTSDLBNIHSXAN-UHFFFAOYSA-N 0.000 claims description 3
- MOWFCYGLJBYQDQ-UHFFFAOYSA-N ethyl 6-[3-[[3-(4-hydroxypiperidin-1-yl)-5-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)C(C=C(C=1)C(F)(F)F)=CC=1N1CCC(O)CC1 MOWFCYGLJBYQDQ-UHFFFAOYSA-N 0.000 claims description 3
- MXWDASTWMGSSKE-UHFFFAOYSA-N ethyl 6-[3-[[3-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)C1=CC=CC(C(F)(F)F)=C1 MXWDASTWMGSSKE-UHFFFAOYSA-N 0.000 claims description 3
- MTVUQKLAMIJXII-UHFFFAOYSA-N ethyl 6-[4-(pyrazine-2-carbonylamino)phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CN=CC=N1 MTVUQKLAMIJXII-UHFFFAOYSA-N 0.000 claims description 3
- INQNKHZONRHHBB-UHFFFAOYSA-N ethyl 6-[4-[(2,5-dimethylfuran-3-carbonyl)amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C=1C=C(C)OC=1C INQNKHZONRHHBB-UHFFFAOYSA-N 0.000 claims description 3
- HQVOYPOPVRAPQK-UHFFFAOYSA-N ethyl 6-[4-[(2-pyridin-4-yl-1,3-thiazole-4-carbonyl)amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C(N=1)=CSC=1C1=CC=NC=C1 HQVOYPOPVRAPQK-UHFFFAOYSA-N 0.000 claims description 3
- PMADYXJCPUWBKT-UHFFFAOYSA-N ethyl 6-[4-[(3-chloropyridine-4-carbonyl)amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CC=NC=C1Cl PMADYXJCPUWBKT-UHFFFAOYSA-N 0.000 claims description 3
- NVHFRUYBKFZOPL-UHFFFAOYSA-N ethyl 6-[4-[(4,7-dimethoxynaphthalene-1-carbonyl)amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C1=C(OC)C=C2C(C(=O)NC3=CC=C(C=C3)C=3C=C4NN=C(C4=CC=3)C(=O)OCC)=CC=C(OC)C2=C1 NVHFRUYBKFZOPL-UHFFFAOYSA-N 0.000 claims description 3
- IMXGEBMCSJVJTP-UHFFFAOYSA-N ethyl 6-[4-[[2-(3,4-dimethoxyphenyl)acetyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)CC1=CC=C(OC)C(OC)=C1 IMXGEBMCSJVJTP-UHFFFAOYSA-N 0.000 claims description 3
- AAIHTFYOYVGRRY-UHFFFAOYSA-N ethyl 6-[4-[[3,5-bis(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)NC1=CC(C(F)(F)F)=CC(C(F)(F)F)=C1 AAIHTFYOYVGRRY-UHFFFAOYSA-N 0.000 claims description 3
- JXEIMMLGCFKJRY-UHFFFAOYSA-N ethyl 6-[4-[[3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)NC1=CC=CC(C(F)(F)F)=C1 JXEIMMLGCFKJRY-UHFFFAOYSA-N 0.000 claims description 3
- XCMOQOYPBDNXOI-UHFFFAOYSA-N ethyl 6-[4-[[4-chloro-3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)NC1=CC=C(Cl)C(C(F)(F)F)=C1 XCMOQOYPBDNXOI-UHFFFAOYSA-N 0.000 claims description 3
- QPJCBZHXJLRLML-UHFFFAOYSA-N ethyl 6-[4-[[4-nitro-3-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 QPJCBZHXJLRLML-UHFFFAOYSA-N 0.000 claims description 3
- ZBLKXAOVSUXKFH-UHFFFAOYSA-N ethyl 6-[4-[[5-(4-methoxyphenyl)furan-2-carbonyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C(O1)=CC=C1C1=CC=C(OC)C=C1 ZBLKXAOVSUXKFH-UHFFFAOYSA-N 0.000 claims description 3
- 125000002887 hydroxy group Chemical group [H]O* 0.000 claims description 3
- 208000032839 leukemia Diseases 0.000 claims description 3
- 208000015486 malignant pancreatic neoplasm Diseases 0.000 claims description 3
- AFBJECMZWBRQRE-UHFFFAOYSA-N methyl 5-[4-[[4-chloro-3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C1=C2C(C(=O)OC)=NNC2=CC=C1C(C=C1)=CC=C1NC(=O)NC1=CC=C(Cl)C(C(F)(F)F)=C1 AFBJECMZWBRQRE-UHFFFAOYSA-N 0.000 claims description 3
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 3
- 125000002757 morpholinyl group Chemical group 0.000 claims description 3
- LPVSUPHDLGBMOZ-UHFFFAOYSA-N n-methyl-6-[4-[[3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)NC1=CC=CC(C(F)(F)F)=C1 LPVSUPHDLGBMOZ-UHFFFAOYSA-N 0.000 claims description 3
- 201000002528 pancreatic cancer Diseases 0.000 claims description 3
- 208000008443 pancreatic carcinoma Diseases 0.000 claims description 3
- 201000002510 thyroid cancer Diseases 0.000 claims description 3
- LKYNGTHMKCTTQC-UHFFFAOYSA-N 1,2-oxazole-3-carboxamide Chemical compound NC(=O)C=1C=CON=1 LKYNGTHMKCTTQC-UHFFFAOYSA-N 0.000 claims description 2
- 125000004189 3,4-dichlorophenyl group Chemical group [H]C1=C([H])C(Cl)=C(Cl)C([H])=C1* 0.000 claims description 2
- 125000002774 3,4-dimethoxybenzyl group Chemical group [H]C1=C([H])C(=C([H])C(OC([H])([H])[H])=C1OC([H])([H])[H])C([H])([H])* 0.000 claims description 2
- 125000003762 3,4-dimethoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C(OC([H])([H])[H])C([H])=C1* 0.000 claims description 2
- 125000004172 4-methoxyphenyl group Chemical group [H]C1=C([H])C(OC([H])([H])[H])=C([H])C([H])=C1* 0.000 claims description 2
- CNKZSJYJWZKENN-UHFFFAOYSA-N 6-(5-amino-2-methylphenyl)-1H-indazole-3-carboxylic acid Chemical compound CC1=CC=C(N)C=C1C1=CC=C(C(=NN2)C(O)=O)C2=C1 CNKZSJYJWZKENN-UHFFFAOYSA-N 0.000 claims description 2
- 206010001233 Adenoma benign Diseases 0.000 claims description 2
- 206010005003 Bladder cancer Diseases 0.000 claims description 2
- 206010005949 Bone cancer Diseases 0.000 claims description 2
- 208000018084 Bone neoplasm Diseases 0.000 claims description 2
- 208000003174 Brain Neoplasms Diseases 0.000 claims description 2
- 206010006187 Breast cancer Diseases 0.000 claims description 2
- 208000026310 Breast neoplasm Diseases 0.000 claims description 2
- 206010008342 Cervix carcinoma Diseases 0.000 claims description 2
- 208000000461 Esophageal Neoplasms Diseases 0.000 claims description 2
- 208000007659 Fibroadenoma Diseases 0.000 claims description 2
- 208000017604 Hodgkin disease Diseases 0.000 claims description 2
- 208000010747 Hodgkins lymphoma Diseases 0.000 claims description 2
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 2
- 208000034578 Multiple myelomas Diseases 0.000 claims description 2
- 201000003793 Myelodysplastic syndrome Diseases 0.000 claims description 2
- 208000015914 Non-Hodgkin lymphomas Diseases 0.000 claims description 2
- 206010030155 Oesophageal carcinoma Diseases 0.000 claims description 2
- 208000000821 Parathyroid Neoplasms Diseases 0.000 claims description 2
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 2
- 206010060862 Prostate cancer Diseases 0.000 claims description 2
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 2
- 201000004681 Psoriasis Diseases 0.000 claims description 2
- 208000005718 Stomach Neoplasms Diseases 0.000 claims description 2
- 208000026911 Tuberous sclerosis complex Diseases 0.000 claims description 2
- 208000007097 Urinary Bladder Neoplasms Diseases 0.000 claims description 2
- 208000006593 Urologic Neoplasms Diseases 0.000 claims description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 claims description 2
- 208000002495 Uterine Neoplasms Diseases 0.000 claims description 2
- 125000000217 alkyl group Chemical group 0.000 claims description 2
- 125000003118 aryl group Chemical group 0.000 claims description 2
- 125000003785 benzimidazolyl group Chemical group N1=C(NC2=C1C=CC=C2)* 0.000 claims description 2
- 125000002047 benzodioxolyl group Chemical group O1OC(C2=C1C=CC=C2)* 0.000 claims description 2
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 claims description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 claims description 2
- 201000003149 breast fibroadenoma Diseases 0.000 claims description 2
- 201000010881 cervical cancer Diseases 0.000 claims description 2
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 2
- 125000000723 dihydrobenzofuranyl group Chemical group O1C(CC2=C1C=CC=C2)* 0.000 claims description 2
- 125000005054 dihydropyrrolyl group Chemical group [H]C1=C([H])C([H])([H])C([H])([H])N1* 0.000 claims description 2
- 201000004101 esophageal cancer Diseases 0.000 claims description 2
- DYFFMGAYEQTGLX-UHFFFAOYSA-N ethyl 6-[2-methyl-5-[[3-(4-methylimidazol-1-yl)-5-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C(=CC=1)C)=CC=1NC(=O)NC(C=C(C=1)C(F)(F)F)=CC=1N1C=NC(C)=C1 DYFFMGAYEQTGLX-UHFFFAOYSA-N 0.000 claims description 2
- PSNPDPMUXLBIJL-UHFFFAOYSA-N ethyl 6-[2-methyl-5-[[4-(4-methylpiperazin-1-yl)-3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C(=CC=1)C)=CC=1NC(=O)NC(C=C1C(F)(F)F)=CC=C1N1CCN(C)CC1 PSNPDPMUXLBIJL-UHFFFAOYSA-N 0.000 claims description 2
- HMFCPYHVZCEBTL-UHFFFAOYSA-N ethyl 6-[4-[[3-(4-methylimidazol-1-yl)-5-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C(C=C(C=1)C(F)(F)F)=CC=1N1C=NC(C)=C1 HMFCPYHVZCEBTL-UHFFFAOYSA-N 0.000 claims description 2
- ARJLIOWFDFFKEF-UHFFFAOYSA-N ethyl 6-[4-[[5-[2-chloro-5-(trifluoromethyl)phenyl]furan-2-carbonyl]amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C(O1)=CC=C1C1=CC(C(F)(F)F)=CC=C1Cl ARJLIOWFDFFKEF-UHFFFAOYSA-N 0.000 claims description 2
- NCHSVLRPULTCQK-UHFFFAOYSA-N ethyl 6-[5-[[4-chloro-3-(trifluoromethyl)phenyl]carbamoylamino]-2-methylphenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C(=CC=1)C)=CC=1NC(=O)NC1=CC=C(Cl)C(C(F)(F)F)=C1 NCHSVLRPULTCQK-UHFFFAOYSA-N 0.000 claims description 2
- 206010017758 gastric cancer Diseases 0.000 claims description 2
- 201000010536 head and neck cancer Diseases 0.000 claims description 2
- 208000014829 head and neck neoplasm Diseases 0.000 claims description 2
- 125000002883 imidazolyl group Chemical group 0.000 claims description 2
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 claims description 2
- 125000001041 indolyl group Chemical group 0.000 claims description 2
- 125000001786 isothiazolyl group Chemical group 0.000 claims description 2
- 201000005202 lung cancer Diseases 0.000 claims description 2
- 208000020816 lung neoplasm Diseases 0.000 claims description 2
- 208000026045 malignant tumor of parathyroid gland Diseases 0.000 claims description 2
- 125000000956 methoxy group Chemical group [H]C([H])([H])O* 0.000 claims description 2
- LGJQYLJXCJRMOC-UHFFFAOYSA-N methyl 6-[3-[[4-(4-methylpiperazin-1-yl)-3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC(C=C1C(F)(F)F)=CC=C1N1CCN(C)CC1 LGJQYLJXCJRMOC-UHFFFAOYSA-N 0.000 claims description 2
- LGHLCYOONLTCOV-UHFFFAOYSA-N n-methyl-6-[2-methyl-5-[[3-(4-methylimidazol-1-yl)-5-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C(=CC=1)C)=CC=1NC(=O)C(C=C(C=1)C(F)(F)F)=CC=1N1C=NC(C)=C1 LGHLCYOONLTCOV-UHFFFAOYSA-N 0.000 claims description 2
- MOCUWCJJHKREMK-UHFFFAOYSA-N n-methyl-6-[2-methyl-5-[[3-(4-methylimidazol-1-yl)-5-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C(=CC=1)C)=CC=1NC(=O)NC(C=C(C=1)C(F)(F)F)=CC=1N1C=NC(C)=C1 MOCUWCJJHKREMK-UHFFFAOYSA-N 0.000 claims description 2
- IVPWYIFFYYDAIL-UHFFFAOYSA-N n-methyl-6-[4-[[3-(4-methylimidazol-1-yl)-5-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C(C=C(C=1)C(F)(F)F)=CC=1N1C=NC(C)=C1 IVPWYIFFYYDAIL-UHFFFAOYSA-N 0.000 claims description 2
- JQOUDTNFXNCHDM-UHFFFAOYSA-N n-methyl-6-[4-[[4-(1-methylpiperidin-4-yl)oxy-3-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C(C=C1C(F)(F)F)=CC=C1OC1CCN(C)CC1 JQOUDTNFXNCHDM-UHFFFAOYSA-N 0.000 claims description 2
- 201000008968 osteosarcoma Diseases 0.000 claims description 2
- 125000002971 oxazolyl group Chemical group 0.000 claims description 2
- 125000000714 pyrimidinyl group Chemical group 0.000 claims description 2
- 125000000168 pyrrolyl group Chemical group 0.000 claims description 2
- 125000002943 quinolinyl group Chemical group N1=C(C=CC2=CC=CC=C12)* 0.000 claims description 2
- 201000011549 stomach cancer Diseases 0.000 claims description 2
- 125000001424 substituent group Chemical group 0.000 claims description 2
- 125000000147 tetrahydroquinolinyl group Chemical group N1(CCCC2=CC=CC=C12)* 0.000 claims description 2
- 125000001113 thiadiazolyl group Chemical group 0.000 claims description 2
- 125000001425 triazolyl group Chemical group 0.000 claims description 2
- 208000009999 tuberous sclerosis Diseases 0.000 claims description 2
- 201000005112 urinary bladder cancer Diseases 0.000 claims description 2
- 206010046766 uterine cancer Diseases 0.000 claims description 2
- 125000006201 3-phenylpropyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])([H])C([H])([H])* 0.000 claims 1
- SYFXUFVZOAIYJY-UHFFFAOYSA-N FC(C=1C=C(C=CC=1)N1N=C(C2=CC=CC=C12)C(=O)N)(F)F Chemical compound FC(C=1C=C(C=CC=1)N1N=C(C2=CC=CC=C12)C(=O)N)(F)F SYFXUFVZOAIYJY-UHFFFAOYSA-N 0.000 claims 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 claims 1
- 230000002401 inhibitory effect Effects 0.000 abstract description 8
- 230000003389 potentiating effect Effects 0.000 abstract description 3
- 230000002265 prevention Effects 0.000 abstract description 3
- 150000004677 hydrates Chemical class 0.000 abstract description 2
- 239000012453 solvate Substances 0.000 abstract description 2
- 230000001939 inductive effect Effects 0.000 abstract 1
- IAZDPXIOMUYVGZ-WFGJKAKNSA-N Dimethyl sulfoxide Chemical compound [2H]C([2H])([2H])S(=O)C([2H])([2H])[2H] IAZDPXIOMUYVGZ-WFGJKAKNSA-N 0.000 description 172
- 150000001875 compounds Chemical class 0.000 description 110
- 238000002360 preparation method Methods 0.000 description 94
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 90
- 238000005160 1H NMR spectroscopy Methods 0.000 description 87
- 238000000034 method Methods 0.000 description 84
- 239000000243 solution Substances 0.000 description 39
- 239000000203 mixture Substances 0.000 description 33
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 26
- 210000004027 cell Anatomy 0.000 description 25
- CSNNHWWHGAXBCP-UHFFFAOYSA-L Magnesium sulfate Chemical compound [Mg+2].[O-][S+2]([O-])([O-])[O-] CSNNHWWHGAXBCP-UHFFFAOYSA-L 0.000 description 24
- 108091000080 Phosphotransferase Proteins 0.000 description 24
- 102000020233 phosphotransferase Human genes 0.000 description 24
- KKVYYGGCHJGEFJ-UHFFFAOYSA-N 1-n-(4-chlorophenyl)-6-methyl-5-n-[3-(7h-purin-6-yl)pyridin-2-yl]isoquinoline-1,5-diamine Chemical compound N=1C=CC2=C(NC=3C(=CC=CN=3)C=3C=4N=CNC=4N=CN=3)C(C)=CC=C2C=1NC1=CC=C(Cl)C=C1 KKVYYGGCHJGEFJ-UHFFFAOYSA-N 0.000 description 21
- 101100381978 Mus musculus Braf gene Proteins 0.000 description 21
- ZMXDDKWLCZADIW-UHFFFAOYSA-N N,N-Dimethylformamide Chemical compound CN(C)C=O ZMXDDKWLCZADIW-UHFFFAOYSA-N 0.000 description 18
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 18
- 239000012044 organic layer Substances 0.000 description 18
- 238000003756 stirring Methods 0.000 description 17
- MLDQJTXFUGDVEO-UHFFFAOYSA-N BAY-43-9006 Chemical compound C1=NC(C(=O)NC)=CC(OC=2C=CC(NC(=O)NC=3C=C(C(Cl)=CC=3)C(F)(F)F)=CC=2)=C1 MLDQJTXFUGDVEO-UHFFFAOYSA-N 0.000 description 16
- 239000005511 L01XE05 - Sorafenib Substances 0.000 description 15
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 description 15
- 229960003787 sorafenib Drugs 0.000 description 15
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 15
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 description 14
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 12
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 12
- 102100033479 RAF proto-oncogene serine/threonine-protein kinase Human genes 0.000 description 12
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 12
- 102000005789 Vascular Endothelial Growth Factors Human genes 0.000 description 12
- 108010019530 Vascular Endothelial Growth Factors Proteins 0.000 description 12
- 230000000694 effects Effects 0.000 description 12
- 229910052943 magnesium sulfate Inorganic materials 0.000 description 12
- 235000019341 magnesium sulphate Nutrition 0.000 description 12
- 238000006243 chemical reaction Methods 0.000 description 11
- 230000035772 mutation Effects 0.000 description 11
- 108090000623 proteins and genes Proteins 0.000 description 11
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 10
- 101710141955 RAF proto-oncogene serine/threonine-protein kinase Proteins 0.000 description 10
- 108010073929 Vascular Endothelial Growth Factor A Proteins 0.000 description 10
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 10
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 10
- HEMHJVSKTPXQMS-UHFFFAOYSA-M Sodium hydroxide Chemical compound [OH-].[Na+] HEMHJVSKTPXQMS-UHFFFAOYSA-M 0.000 description 9
- 230000033115 angiogenesis Effects 0.000 description 9
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 8
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 8
- 102000043136 MAP kinase family Human genes 0.000 description 8
- 108091054455 MAP kinase family Proteins 0.000 description 8
- MTCFGRXMJLQNBG-UHFFFAOYSA-N Serine Natural products OCC(N)C(O)=O MTCFGRXMJLQNBG-UHFFFAOYSA-N 0.000 description 8
- 239000003112 inhibitor Substances 0.000 description 8
- 230000026731 phosphorylation Effects 0.000 description 8
- 238000006366 phosphorylation reaction Methods 0.000 description 8
- 102000004169 proteins and genes Human genes 0.000 description 8
- 102000004232 Mitogen-Activated Protein Kinase Kinases Human genes 0.000 description 7
- 108090000744 Mitogen-Activated Protein Kinase Kinases Proteins 0.000 description 7
- 150000001408 amides Chemical class 0.000 description 7
- 239000010410 layer Substances 0.000 description 7
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 6
- 230000004913 activation Effects 0.000 description 6
- 235000018102 proteins Nutrition 0.000 description 6
- 230000019491 signal transduction Effects 0.000 description 6
- LMDZBCPBFSXMTL-UHFFFAOYSA-N 1-Ethyl-3-(3-dimethylaminopropyl)carbodiimide Substances CCN=C=NCCCN(C)C LMDZBCPBFSXMTL-UHFFFAOYSA-N 0.000 description 5
- FPQQSJJWHUJYPU-UHFFFAOYSA-N 3-(dimethylamino)propyliminomethylidene-ethylazanium;chloride Chemical compound Cl.CCN=C=NCCCN(C)C FPQQSJJWHUJYPU-UHFFFAOYSA-N 0.000 description 5
- GFCLRZCWMRQHLM-UHFFFAOYSA-N 6-[4-[[3-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxylic acid Chemical compound C=1C=C2C(C(=O)O)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CC=CC(C(F)(F)F)=C1 GFCLRZCWMRQHLM-UHFFFAOYSA-N 0.000 description 5
- CJLAENXXSIYPBH-UHFFFAOYSA-N ethyl 6-(4-aminophenyl)-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C1=CC=C(N)C=C1 CJLAENXXSIYPBH-UHFFFAOYSA-N 0.000 description 5
- NPZTUJOABDZTLV-UHFFFAOYSA-N hydroxybenzotriazole Substances O=C1C=CC=C2NNN=C12 NPZTUJOABDZTLV-UHFFFAOYSA-N 0.000 description 5
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 5
- 230000005764 inhibitory process Effects 0.000 description 5
- 238000004519 manufacturing process Methods 0.000 description 5
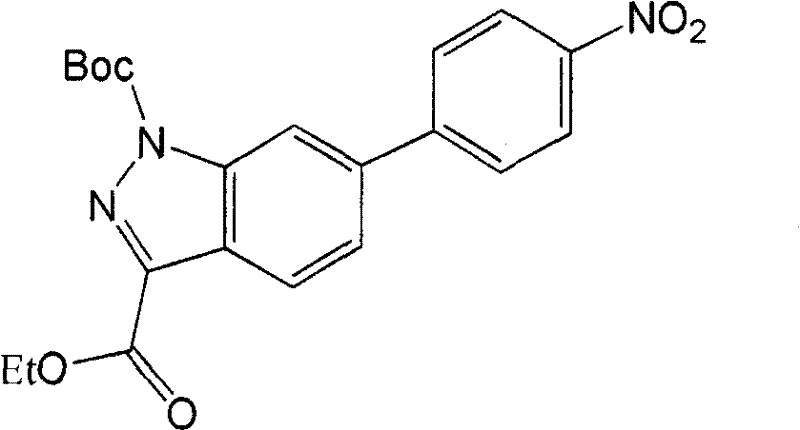
- FOFMDEAQAYZDBF-UHFFFAOYSA-N 1-o-tert-butyl 3-o-ethyl 6-(4-nitrophenyl)indazole-1,3-dicarboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NN(C(=O)OC(C)(C)C)C2=CC=1C1=CC=C([N+]([O-])=O)C=C1 FOFMDEAQAYZDBF-UHFFFAOYSA-N 0.000 description 4
- DITBWPUMEUDVLU-UHFFFAOYSA-N 1h-indazole-3-carboxamide Chemical class C1=CC=C2C(C(=O)N)=NNC2=C1 DITBWPUMEUDVLU-UHFFFAOYSA-N 0.000 description 4
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 description 4
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 4
- TWRXJAOTZQYOKJ-UHFFFAOYSA-L Magnesium chloride Chemical compound [Mg+2].[Cl-].[Cl-] TWRXJAOTZQYOKJ-UHFFFAOYSA-L 0.000 description 4
- NBIIXXVUZAFLBC-UHFFFAOYSA-N Phosphoric acid Chemical compound OP(O)(O)=O NBIIXXVUZAFLBC-UHFFFAOYSA-N 0.000 description 4
- 102000001708 Protein Isoforms Human genes 0.000 description 4
- 108010029485 Protein Isoforms Proteins 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- PMZURENOXWZQFD-UHFFFAOYSA-L Sodium Sulfate Chemical compound [Na+].[Na+].[O-]S([O-])(=O)=O PMZURENOXWZQFD-UHFFFAOYSA-L 0.000 description 4
- QAOWNCQODCNURD-UHFFFAOYSA-N Sulfuric acid Chemical compound OS(O)(=O)=O QAOWNCQODCNURD-UHFFFAOYSA-N 0.000 description 4
- 108010053096 Vascular Endothelial Growth Factor Receptor-1 Proteins 0.000 description 4
- 102100033178 Vascular endothelial growth factor receptor 1 Human genes 0.000 description 4
- 239000002253 acid Substances 0.000 description 4
- 230000001028 anti-proliverative effect Effects 0.000 description 4
- 125000005605 benzo group Chemical group 0.000 description 4
- 239000003814 drug Substances 0.000 description 4
- 238000003818 flash chromatography Methods 0.000 description 4
- 229940080856 gleevec Drugs 0.000 description 4
- 239000003446 ligand Substances 0.000 description 4
- 210000004940 nucleus Anatomy 0.000 description 4
- 229910052938 sodium sulfate Inorganic materials 0.000 description 4
- 235000011152 sodium sulphate Nutrition 0.000 description 4
- 235000002374 tyrosine Nutrition 0.000 description 4
- RYHBNJHYFVUHQT-UHFFFAOYSA-N 1,4-Dioxane Chemical compound C1COCCO1 RYHBNJHYFVUHQT-UHFFFAOYSA-N 0.000 description 3
- ZKXZOFFIRRPITF-UHFFFAOYSA-N 1-o-tert-butyl 3-o-ethyl 6-bromoindazole-1,3-dicarboxylate Chemical compound BrC1=CC=C2C(C(=O)OCC)=NN(C(=O)OC(C)(C)C)C2=C1 ZKXZOFFIRRPITF-UHFFFAOYSA-N 0.000 description 3
- AKWIAIDKXNKXDI-UHFFFAOYSA-N 1h-pyrrole-3-carboxamide Chemical class NC(=O)C=1C=CNC=1 AKWIAIDKXNKXDI-UHFFFAOYSA-N 0.000 description 3
- KISWVXRQTGLFGD-UHFFFAOYSA-N 2-[[2-[[6-amino-2-[[2-[[2-[[5-amino-2-[[2-[[1-[2-[[6-amino-2-[(2,5-diamino-5-oxopentanoyl)amino]hexanoyl]amino]-5-(diaminomethylideneamino)pentanoyl]pyrrolidine-2-carbonyl]amino]-3-hydroxypropanoyl]amino]-5-oxopentanoyl]amino]-5-(diaminomethylideneamino)p Chemical compound C1CCN(C(=O)C(CCCN=C(N)N)NC(=O)C(CCCCN)NC(=O)C(N)CCC(N)=O)C1C(=O)NC(CO)C(=O)NC(CCC(N)=O)C(=O)NC(CCCN=C(N)N)C(=O)NC(CO)C(=O)NC(CCCCN)C(=O)NC(C(=O)NC(CC(C)C)C(O)=O)CC1=CC=C(O)C=C1 KISWVXRQTGLFGD-UHFFFAOYSA-N 0.000 description 3
- BHNHNBCKSZWYBV-UHFFFAOYSA-N 6-(4-aminophenyl)-n-methyl-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C1=CC=C(N)C=C1 BHNHNBCKSZWYBV-UHFFFAOYSA-N 0.000 description 3
- RPFYMEMCWURYDR-UHFFFAOYSA-N 6-(4-nitrophenyl)-1h-indazole-3-carboxylic acid Chemical compound C=1C=C2C(C(=O)O)=NNC2=CC=1C1=CC=C([N+]([O-])=O)C=C1 RPFYMEMCWURYDR-UHFFFAOYSA-N 0.000 description 3
- QTBSBXVTEAMEQO-UHFFFAOYSA-N Acetic acid Chemical compound CC(O)=O QTBSBXVTEAMEQO-UHFFFAOYSA-N 0.000 description 3
- 102100021569 Apoptosis regulator Bcl-2 Human genes 0.000 description 3
- KCXVZYZYPLLWCC-UHFFFAOYSA-N EDTA Chemical compound OC(=O)CN(CC(O)=O)CCN(CC(O)=O)CC(O)=O KCXVZYZYPLLWCC-UHFFFAOYSA-N 0.000 description 3
- 101000971171 Homo sapiens Apoptosis regulator Bcl-2 Proteins 0.000 description 3
- WHUUTDBJXJRKMK-VKHMYHEASA-N L-glutamic acid Chemical compound OC(=O)[C@@H](N)CCC(O)=O WHUUTDBJXJRKMK-VKHMYHEASA-N 0.000 description 3
- MUBZPKHOEPUJKR-UHFFFAOYSA-N Oxalic acid Chemical compound OC(=O)C(O)=O MUBZPKHOEPUJKR-UHFFFAOYSA-N 0.000 description 3
- OFOBLEOULBTSOW-UHFFFAOYSA-N Propanedioic acid Natural products OC(=O)CC(O)=O OFOBLEOULBTSOW-UHFFFAOYSA-N 0.000 description 3
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 3
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 3
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 3
- AYFVYJQAPQTCCC-UHFFFAOYSA-N Threonine Natural products CC(O)C(N)C(O)=O AYFVYJQAPQTCCC-UHFFFAOYSA-N 0.000 description 3
- 239000004473 Threonine Substances 0.000 description 3
- 239000007983 Tris buffer Substances 0.000 description 3
- 239000007864 aqueous solution Substances 0.000 description 3
- 230000035578 autophosphorylation Effects 0.000 description 3
- KRKNYBCHXYNGOX-UHFFFAOYSA-N citric acid Chemical compound OC(=O)CC(O)(C(O)=O)CC(O)=O KRKNYBCHXYNGOX-UHFFFAOYSA-N 0.000 description 3
- 230000001086 cytosolic effect Effects 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- RMULHZIERLZKBH-UHFFFAOYSA-N ethyl 6-(3-aminophenyl)-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C1=CC=CC(N)=C1 RMULHZIERLZKBH-UHFFFAOYSA-N 0.000 description 3
- QJWRLFKJCOFQIS-UHFFFAOYSA-N ethyl 6-bromo-1h-indazole-3-carboxylate Chemical compound BrC1=CC=C2C(C(=O)OCC)=NNC2=C1 QJWRLFKJCOFQIS-UHFFFAOYSA-N 0.000 description 3
- 206010073071 hepatocellular carcinoma Diseases 0.000 description 3
- 231100000844 hepatocellular carcinoma Toxicity 0.000 description 3
- 230000009545 invasion Effects 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- QVJQVFQJAWROJG-UHFFFAOYSA-N n-methyl-6-(4-nitrophenyl)-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C1=CC=C([N+]([O-])=O)C=C1 QVJQVFQJAWROJG-UHFFFAOYSA-N 0.000 description 3
- 230000008569 process Effects 0.000 description 3
- 102000016914 ras Proteins Human genes 0.000 description 3
- 108010014186 ras Proteins Proteins 0.000 description 3
- 230000009467 reduction Effects 0.000 description 3
- 238000011160 research Methods 0.000 description 3
- 230000011664 signaling Effects 0.000 description 3
- 239000000741 silica gel Substances 0.000 description 3
- 229910002027 silica gel Inorganic materials 0.000 description 3
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 description 3
- 238000001262 western blot Methods 0.000 description 3
- KZPYGQFFRCFCPP-UHFFFAOYSA-N 1,1'-bis(diphenylphosphino)ferrocene Chemical compound [Fe+2].C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1.C1=CC=C[C-]1P(C=1C=CC=CC=1)C1=CC=CC=C1 KZPYGQFFRCFCPP-UHFFFAOYSA-N 0.000 description 2
- YABJJWZLRMPFSI-UHFFFAOYSA-N 1-methyl-5-[[2-[5-(trifluoromethyl)-1H-imidazol-2-yl]-4-pyridinyl]oxy]-N-[4-(trifluoromethyl)phenyl]-2-benzimidazolamine Chemical compound N=1C2=CC(OC=3C=C(N=CC=3)C=3NC(=CN=3)C(F)(F)F)=CC=C2N(C)C=1NC1=CC=C(C(F)(F)F)C=C1 YABJJWZLRMPFSI-UHFFFAOYSA-N 0.000 description 2
- 102000004899 14-3-3 Proteins Human genes 0.000 description 2
- 101710112812 14-3-3 protein Proteins 0.000 description 2
- KWTCVAHCQGKXAZ-UHFFFAOYSA-N 1H-indazole-3-carboxylic acid methyl ester Chemical compound C1=CC=C2C(C(=O)OC)=NNC2=C1 KWTCVAHCQGKXAZ-UHFFFAOYSA-N 0.000 description 2
- MVXVYAKCVDQRLW-UHFFFAOYSA-N 1h-pyrrolo[2,3-b]pyridine Chemical class C1=CN=C2NC=CC2=C1 MVXVYAKCVDQRLW-UHFFFAOYSA-N 0.000 description 2
- AZKSAVLVSZKNRD-UHFFFAOYSA-M 3-(4,5-dimethylthiazol-2-yl)-2,5-diphenyltetrazolium bromide Chemical compound [Br-].S1C(C)=C(C)N=C1[N+]1=NC(C=2C=CC=CC=2)=NN1C1=CC=CC=C1 AZKSAVLVSZKNRD-UHFFFAOYSA-M 0.000 description 2
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 2
- QDQJIDDXPACPKY-UHFFFAOYSA-N 6-bromo-1h-indazole-3-carboxylic acid Chemical compound BrC1=CC=C2C(C(=O)O)=NNC2=C1 QDQJIDDXPACPKY-UHFFFAOYSA-N 0.000 description 2
- HVPQMLZLINVIHW-UHFFFAOYSA-N 6-bromo-1h-indole-2,3-dione Chemical compound BrC1=CC=C2C(=O)C(=O)NC2=C1 HVPQMLZLINVIHW-UHFFFAOYSA-N 0.000 description 2
- 101150019464 ARAF gene Proteins 0.000 description 2
- CJLHTKGWEUGORV-UHFFFAOYSA-N Artemin Chemical compound C1CC2(C)C(O)CCC(=C)C2(O)C2C1C(C)C(=O)O2 CJLHTKGWEUGORV-UHFFFAOYSA-N 0.000 description 2
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 description 2
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 description 2
- RGHNJXZEOKUKBD-SQOUGZDYSA-N D-gluconic acid Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@@H](O)C(O)=O RGHNJXZEOKUKBD-SQOUGZDYSA-N 0.000 description 2
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-OWOJBTEDSA-N Fumaric acid Chemical compound OC(=O)\C=C\C(O)=O VZCYOOQTPOCHFL-OWOJBTEDSA-N 0.000 description 2
- 102000034615 Glial cell line-derived neurotrophic factor Human genes 0.000 description 2
- 108091010837 Glial cell line-derived neurotrophic factor Proteins 0.000 description 2
- WHUUTDBJXJRKMK-UHFFFAOYSA-N Glutamic acid Natural products OC(=O)C(N)CCC(O)=O WHUUTDBJXJRKMK-UHFFFAOYSA-N 0.000 description 2
- 239000004471 Glycine Substances 0.000 description 2
- 102000009465 Growth Factor Receptors Human genes 0.000 description 2
- 108010009202 Growth Factor Receptors Proteins 0.000 description 2
- 101000924552 Homo sapiens Angiopoietin-1 Proteins 0.000 description 2
- 206010061218 Inflammation Diseases 0.000 description 2
- 208000008839 Kidney Neoplasms Diseases 0.000 description 2
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 2
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 2
- 239000005536 L01XE08 - Nilotinib Substances 0.000 description 2
- 102000001291 MAP Kinase Kinase Kinase Human genes 0.000 description 2
- 108060006687 MAP kinase kinase kinase Proteins 0.000 description 2
- 101150024075 Mapk1 gene Proteins 0.000 description 2
- AFVFQIVMOAPDHO-UHFFFAOYSA-N Methanesulfonic acid Chemical compound CS(O)(=O)=O AFVFQIVMOAPDHO-UHFFFAOYSA-N 0.000 description 2
- 102100024193 Mitogen-activated protein kinase 1 Human genes 0.000 description 2
- 101710166115 Mitogen-activated protein kinase 2 Proteins 0.000 description 2
- 101710166076 Mitogen-activated protein kinase 5 Proteins 0.000 description 2
- 102000047918 Myelin Basic Human genes 0.000 description 2
- 101710107068 Myelin basic protein Proteins 0.000 description 2
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 description 2
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 2
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 2
- 206010038389 Renal cancer Diseases 0.000 description 2
- 208000000453 Skin Neoplasms Diseases 0.000 description 2
- FAPWRFPIFSIZLT-UHFFFAOYSA-M Sodium chloride Chemical compound [Na+].[Cl-] FAPWRFPIFSIZLT-UHFFFAOYSA-M 0.000 description 2
- DBMJMQXJHONAFJ-UHFFFAOYSA-M Sodium laurylsulphate Chemical compound [Na+].CCCCCCCCCCCCOS([O-])(=O)=O DBMJMQXJHONAFJ-UHFFFAOYSA-M 0.000 description 2
- 102000040945 Transcription factor Human genes 0.000 description 2
- 108091023040 Transcription factor Proteins 0.000 description 2
- HEDRZPFGACZZDS-MICDWDOJSA-N Trichloro(2H)methane Chemical compound [2H]C(Cl)(Cl)Cl HEDRZPFGACZZDS-MICDWDOJSA-N 0.000 description 2
- XSQUKJJJFZCRTK-UHFFFAOYSA-N Urea Chemical compound NC(N)=O XSQUKJJJFZCRTK-UHFFFAOYSA-N 0.000 description 2
- 102000009524 Vascular Endothelial Growth Factor A Human genes 0.000 description 2
- 108010073923 Vascular Endothelial Growth Factor C Proteins 0.000 description 2
- 102000016549 Vascular Endothelial Growth Factor Receptor-2 Human genes 0.000 description 2
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 description 2
- 102100038232 Vascular endothelial growth factor C Human genes 0.000 description 2
- 238000002835 absorbance Methods 0.000 description 2
- 150000007513 acids Chemical class 0.000 description 2
- 229910000147 aluminium phosphate Inorganic materials 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 239000004037 angiogenesis inhibitor Substances 0.000 description 2
- 238000003556 assay Methods 0.000 description 2
- 230000001908 autoinhibitory effect Effects 0.000 description 2
- 230000008901 benefit Effects 0.000 description 2
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 description 2
- 210000004204 blood vessel Anatomy 0.000 description 2
- 210000000349 chromosome Anatomy 0.000 description 2
- 235000018417 cysteine Nutrition 0.000 description 2
- 210000000805 cytoplasm Anatomy 0.000 description 2
- 229960002448 dasatinib Drugs 0.000 description 2
- 238000010511 deprotection reaction Methods 0.000 description 2
- 238000010790 dilution Methods 0.000 description 2
- 239000012895 dilution Substances 0.000 description 2
- 239000013024 dilution buffer Substances 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 229950005627 embonate Drugs 0.000 description 2
- YLKPTYMNELPKOL-UHFFFAOYSA-N ethyl 1h-indazole-3-carboxylate Chemical compound C1=CC=C2C(C(=O)OCC)=NNC2=C1 YLKPTYMNELPKOL-UHFFFAOYSA-N 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 239000012458 free base Substances 0.000 description 2
- 230000006870 function Effects 0.000 description 2
- 239000000499 gel Substances 0.000 description 2
- 230000014509 gene expression Effects 0.000 description 2
- 239000004220 glutamic acid Substances 0.000 description 2
- 235000013922 glutamic acid Nutrition 0.000 description 2
- 239000003102 growth factor Substances 0.000 description 2
- 230000007062 hydrolysis Effects 0.000 description 2
- 238000006460 hydrolysis reaction Methods 0.000 description 2
- 230000004054 inflammatory process Effects 0.000 description 2
- 210000003734 kidney Anatomy 0.000 description 2
- 201000010982 kidney cancer Diseases 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- 229910001629 magnesium chloride Inorganic materials 0.000 description 2
- 231100000682 maximum tolerated dose Toxicity 0.000 description 2
- NQMRYBIKMRVZLB-UHFFFAOYSA-N methylamine hydrochloride Chemical compound [Cl-].[NH3+]C NQMRYBIKMRVZLB-UHFFFAOYSA-N 0.000 description 2
- 229960001346 nilotinib Drugs 0.000 description 2
- HHZIURLSWUIHRB-UHFFFAOYSA-N nilotinib Chemical compound C1=NC(C)=CN1C1=CC(NC(=O)C=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)=CC(C(F)(F)F)=C1 HHZIURLSWUIHRB-UHFFFAOYSA-N 0.000 description 2
- 231100000590 oncogenic Toxicity 0.000 description 2
- 230000002246 oncogenic effect Effects 0.000 description 2
- 238000011275 oncology therapy Methods 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 230000002018 overexpression Effects 0.000 description 2
- VLTRZXGMWDSKGL-UHFFFAOYSA-N perchloric acid Chemical compound OCl(=O)(=O)=O VLTRZXGMWDSKGL-UHFFFAOYSA-N 0.000 description 2
- XNGIFLGASWRNHJ-UHFFFAOYSA-N phthalic acid Chemical compound OC(=O)C1=CC=CC=C1C(O)=O XNGIFLGASWRNHJ-UHFFFAOYSA-N 0.000 description 2
- BWHMMNNQKKPAPP-UHFFFAOYSA-L potassium carbonate Chemical compound [K+].[K+].[O-]C([O-])=O BWHMMNNQKKPAPP-UHFFFAOYSA-L 0.000 description 2
- 238000000746 purification Methods 0.000 description 2
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 2
- 102000005962 receptors Human genes 0.000 description 2
- 108020003175 receptors Proteins 0.000 description 2
- YGSDEFSMJLZEOE-UHFFFAOYSA-N salicylic acid Chemical compound OC(=O)C1=CC=CC=C1O YGSDEFSMJLZEOE-UHFFFAOYSA-N 0.000 description 2
- 229920006395 saturated elastomer Polymers 0.000 description 2
- 238000013207 serial dilution Methods 0.000 description 2
- 201000000849 skin cancer Diseases 0.000 description 2
- 150000003384 small molecules Chemical class 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 238000002415 sodium dodecyl sulfate polyacrylamide gel electrophoresis Methods 0.000 description 2
- LPXPTNMVRIOKMN-UHFFFAOYSA-M sodium nitrite Chemical compound [Na+].[O-]N=O LPXPTNMVRIOKMN-UHFFFAOYSA-M 0.000 description 2
- 239000007787 solid Substances 0.000 description 2
- 241000894007 species Species 0.000 description 2
- UCSJYZPVAKXKNQ-HZYVHMACSA-N streptomycin Chemical compound CN[C@H]1[C@H](O)[C@@H](O)[C@H](CO)O[C@H]1O[C@@H]1[C@](C=O)(O)[C@H](C)O[C@H]1O[C@@H]1[C@@H](NC(N)=N)[C@H](O)[C@@H](NC(N)=N)[C@H](O)[C@H]1O UCSJYZPVAKXKNQ-HZYVHMACSA-N 0.000 description 2
- 230000004083 survival effect Effects 0.000 description 2
- 229940124597 therapeutic agent Drugs 0.000 description 2
- 230000001225 therapeutic effect Effects 0.000 description 2
- FYSNRJHAOHDILO-UHFFFAOYSA-N thionyl chloride Chemical compound ClS(Cl)=O FYSNRJHAOHDILO-UHFFFAOYSA-N 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 2
- VZCYOOQTPOCHFL-UHFFFAOYSA-N trans-butenedioic acid Natural products OC(=O)C=CC(O)=O VZCYOOQTPOCHFL-UHFFFAOYSA-N 0.000 description 2
- LENZDBCJOHFCAS-UHFFFAOYSA-N tris Chemical compound OCC(N)(CO)CO LENZDBCJOHFCAS-UHFFFAOYSA-N 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 150000003668 tyrosines Chemical class 0.000 description 2
- 210000003556 vascular endothelial cell Anatomy 0.000 description 2
- VEEGZPWAAPPXRB-BJMVGYQFSA-N (3e)-3-(1h-imidazol-5-ylmethylidene)-1h-indol-2-one Chemical compound O=C1NC2=CC=CC=C2\C1=C/C1=CN=CN1 VEEGZPWAAPPXRB-BJMVGYQFSA-N 0.000 description 1
- NXLNNXIXOYSCMB-UHFFFAOYSA-N (4-nitrophenyl) carbonochloridate Chemical compound [O-][N+](=O)C1=CC=C(OC(Cl)=O)C=C1 NXLNNXIXOYSCMB-UHFFFAOYSA-N 0.000 description 1
- NSFJAFZHYOAMHL-UHFFFAOYSA-N (4-nitrophenyl)boronic acid Chemical compound OB(O)C1=CC=C([N+]([O-])=O)C=C1 NSFJAFZHYOAMHL-UHFFFAOYSA-N 0.000 description 1
- BJEPYKJPYRNKOW-REOHCLBHSA-N (S)-malic acid Chemical compound OC(=O)[C@@H](O)CC(O)=O BJEPYKJPYRNKOW-REOHCLBHSA-N 0.000 description 1
- TTXOHSURMRJLRU-UHFFFAOYSA-N 1h-pyrrole-3-carboxamide;hydrochloride Chemical compound Cl.NC(=O)C=1C=CNC=1 TTXOHSURMRJLRU-UHFFFAOYSA-N 0.000 description 1
- MFUVCHZWGSJKEQ-UHFFFAOYSA-N 3,4-dichlorphenylisocyanate Chemical compound ClC1=CC=C(N=C=O)C=C1Cl MFUVCHZWGSJKEQ-UHFFFAOYSA-N 0.000 description 1
- ONCAZCNPWWQQMW-UHFFFAOYSA-N 3-(trifluoromethyl)benzenesulfonyl chloride Chemical compound FC(F)(F)C1=CC=CC(S(Cl)(=O)=O)=C1 ONCAZCNPWWQQMW-UHFFFAOYSA-N 0.000 description 1
- FQXQBFUUVCDIRK-UHFFFAOYSA-N 3-trifluoromethylbenzoic acid Chemical compound OC(=O)C1=CC=CC(C(F)(F)F)=C1 FQXQBFUUVCDIRK-UHFFFAOYSA-N 0.000 description 1
- ZYWCDXFRHUHFNV-UHFFFAOYSA-N 4-[(4-ethylpiperazin-1-yl)methyl]-3-(trifluoromethyl)aniline Chemical compound C1CN(CC)CCN1CC1=CC=C(N)C=C1C(F)(F)F ZYWCDXFRHUHFNV-UHFFFAOYSA-N 0.000 description 1
- UYNVMODNBIQBMV-UHFFFAOYSA-N 4-[1-hydroxy-2-[4-(phenylmethyl)-1-piperidinyl]propyl]phenol Chemical compound C1CC(CC=2C=CC=CC=2)CCN1C(C)C(O)C1=CC=C(O)C=C1 UYNVMODNBIQBMV-UHFFFAOYSA-N 0.000 description 1
- GIGYSSKIUAMHMU-UHFFFAOYSA-N 6-[3-[(2,3-dichlorophenyl)carbamoylamino]phenyl]-n-ethyl-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=CC(Cl)=C1Cl GIGYSSKIUAMHMU-UHFFFAOYSA-N 0.000 description 1
- LKMHXRCUWUMUNW-UHFFFAOYSA-N 6-[3-[(2,4-dimethylphenyl)carbamoylamino]phenyl]-n-ethyl-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=C(C)C=C1C LKMHXRCUWUMUNW-UHFFFAOYSA-N 0.000 description 1
- ZWQKPJLUSBYPNF-UHFFFAOYSA-N 6-[3-[(3,4-dichlorophenyl)carbamoylamino]phenyl]-n-ethyl-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=C(Cl)C(Cl)=C1 ZWQKPJLUSBYPNF-UHFFFAOYSA-N 0.000 description 1
- FJCBDKXSILUHLJ-UHFFFAOYSA-N 6-[4-[(2,5-dimethylfuran-3-carbonyl)amino]phenyl]-n-(2-morpholin-4-ylethyl)-1h-indazole-3-carboxamide Chemical compound O1C(C)=CC(C(=O)NC=2C=CC(=CC=2)C=2C=C3NN=C(C3=CC=2)C(=O)NCCN2CCOCC2)=C1C FJCBDKXSILUHLJ-UHFFFAOYSA-N 0.000 description 1
- QMFXOBHTOOEMIG-UHFFFAOYSA-N 6-[4-[(2,5-dimethylfuran-3-carbonyl)amino]phenyl]-n-(2-morpholin-4-ylethyl)-1h-indazole-3-carboxamide;hydrochloride Chemical compound Cl.O1C(C)=CC(C(=O)NC=2C=CC(=CC=2)C=2C=C3NN=C(C3=CC=2)C(=O)NCCN2CCOCC2)=C1C QMFXOBHTOOEMIG-UHFFFAOYSA-N 0.000 description 1
- QHUKQYYYWSJIHT-UHFFFAOYSA-N 6-[4-[(5-bromothiophene-2-carbonyl)amino]phenyl]-n-methyl-1h-indazole-3-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CC=C(Br)S1 QHUKQYYYWSJIHT-UHFFFAOYSA-N 0.000 description 1
- 241000714175 Abelson murine leukemia virus Species 0.000 description 1
- HRPVXLWXLXDGHG-UHFFFAOYSA-N Acrylamide Chemical compound NC(=O)C=C HRPVXLWXLXDGHG-UHFFFAOYSA-N 0.000 description 1
- 102100034594 Angiopoietin-1 Human genes 0.000 description 1
- 101100455868 Arabidopsis thaliana MKK2 gene Proteins 0.000 description 1
- 102100026376 Artemin Human genes 0.000 description 1
- 101710205806 Artemin Proteins 0.000 description 1
- 239000005711 Benzoic acid Substances 0.000 description 1
- 206010055113 Breast cancer metastatic Diseases 0.000 description 1
- QULOAIIABODCJI-UHFFFAOYSA-N C=C(c1n[nH]c2cc(-c(cc3)ccc3NC(c3cccc(C(F)(F)F)c3)=O)ccc12)NCCN1CCOCC1 Chemical compound C=C(c1n[nH]c2cc(-c(cc3)ccc3NC(c3cccc(C(F)(F)F)c3)=O)ccc12)NCCN1CCOCC1 QULOAIIABODCJI-UHFFFAOYSA-N 0.000 description 1
- DDPRYTUJYNYJKV-UHFFFAOYSA-N CCN1CCN(CC)CC1 Chemical compound CCN1CCN(CC)CC1 DDPRYTUJYNYJKV-UHFFFAOYSA-N 0.000 description 1
- QDTSZDWRXNFKDC-UHFFFAOYSA-N CCOC(c1n[nH]c2c1ccc(-c(cc1)ccc1NC(Nc1cc(C(F)(F)F)ccc1)=O)c2)O Chemical compound CCOC(c1n[nH]c2c1ccc(-c(cc1)ccc1NC(Nc1cc(C(F)(F)F)ccc1)=O)c2)O QDTSZDWRXNFKDC-UHFFFAOYSA-N 0.000 description 1
- VMQWRWXBJRABBJ-UHFFFAOYSA-N CCOC(c1n[nH]c2c1ccc(-c(cc1)ccc1NC(c1ccc(C3C=CC(OC)=CC3)[o]1)=O)c2)=O Chemical compound CCOC(c1n[nH]c2c1ccc(-c(cc1)ccc1NC(c1ccc(C3C=CC(OC)=CC3)[o]1)=O)c2)=O VMQWRWXBJRABBJ-UHFFFAOYSA-N 0.000 description 1
- PEHIYFYRLYNTPV-UHFFFAOYSA-N CCOC(c1n[nH]c2c1ccc(-c(cc1)ccc1NC(c1n[o]c(C)c1)=O)c2)=O Chemical compound CCOC(c1n[nH]c2c1ccc(-c(cc1)ccc1NC(c1n[o]c(C)c1)=O)c2)=O PEHIYFYRLYNTPV-UHFFFAOYSA-N 0.000 description 1
- LVIKANBJIMNRLO-UHFFFAOYSA-N CCOC(c1n[nH]c2c1ccc(-c1c(C)ccc(NC(Nc(cc3)cc(C(F)(F)F)c3N3CCN(C)CC3)=O)c1)c2)=N Chemical compound CCOC(c1n[nH]c2c1ccc(-c1c(C)ccc(NC(Nc(cc3)cc(C(F)(F)F)c3N3CCN(C)CC3)=O)c1)c2)=N LVIKANBJIMNRLO-UHFFFAOYSA-N 0.000 description 1
- BAUWRHPMUVYFOD-UHFFFAOYSA-N CN(CC1)CCC1O Chemical compound CN(CC1)CCC1O BAUWRHPMUVYFOD-UHFFFAOYSA-N 0.000 description 1
- YZMIRCBSCFJIFB-UHFFFAOYSA-N CN(CC1)CCC1OC Chemical compound CN(CC1)CCC1OC YZMIRCBSCFJIFB-UHFFFAOYSA-N 0.000 description 1
- XFECRAFFORPPHQ-UHFFFAOYSA-N CN(CC1)CCC1Oc(cc1)c(C(F)(F)F)cc1C(Nc1cccc(-c2ccc3c(C(OC)=O)n[nH]c3c2)c1)=O Chemical compound CN(CC1)CCC1Oc(cc1)c(C(F)(F)F)cc1C(Nc1cccc(-c2ccc3c(C(OC)=O)n[nH]c3c2)c1)=O XFECRAFFORPPHQ-UHFFFAOYSA-N 0.000 description 1
- RXYPXQSKLGGKOL-UHFFFAOYSA-N CN1CCN(C)CC1 Chemical compound CN1CCN(C)CC1 RXYPXQSKLGGKOL-UHFFFAOYSA-N 0.000 description 1
- SJRJJKPEHAURKC-UHFFFAOYSA-N CN1CCOCC1 Chemical compound CN1CCOCC1 SJRJJKPEHAURKC-UHFFFAOYSA-N 0.000 description 1
- 102000000905 Cadherin Human genes 0.000 description 1
- 108050007957 Cadherin Proteins 0.000 description 1
- 101100381481 Caenorhabditis elegans baz-2 gene Proteins 0.000 description 1
- 102000005701 Calcium-Binding Proteins Human genes 0.000 description 1
- 108010045403 Calcium-Binding Proteins Proteins 0.000 description 1
- ZIWHJZAPIYYSPN-UHFFFAOYSA-N Cc(cc(C(F)(F)F)cc1)c1Cl Chemical compound Cc(cc(C(F)(F)F)cc1)c1Cl ZIWHJZAPIYYSPN-UHFFFAOYSA-N 0.000 description 1
- CHLICZRVGGXEOD-UHFFFAOYSA-N Cc(cc1)ccc1OC Chemical compound Cc(cc1)ccc1OC CHLICZRVGGXEOD-UHFFFAOYSA-N 0.000 description 1
- BLHTXORQJNCSII-UHFFFAOYSA-N Cc1c[n](C)cn1 Chemical compound Cc1c[n](C)cn1 BLHTXORQJNCSII-UHFFFAOYSA-N 0.000 description 1
- 241001227713 Chiron Species 0.000 description 1
- 206010010356 Congenital anomaly Diseases 0.000 description 1
- 206010010539 Congenital megacolon Diseases 0.000 description 1
- RGHNJXZEOKUKBD-UHFFFAOYSA-N D-gluconic acid Natural products OCC(O)C(O)C(O)C(O)C(O)=O RGHNJXZEOKUKBD-UHFFFAOYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 102100031480 Dual specificity mitogen-activated protein kinase kinase 1 Human genes 0.000 description 1
- 101710146526 Dual specificity mitogen-activated protein kinase kinase 1 Proteins 0.000 description 1
- 239000006144 Dulbecco’s modified Eagle's medium Substances 0.000 description 1
- 102100030013 Endoribonuclease Human genes 0.000 description 1
- 101710199605 Endoribonuclease Proteins 0.000 description 1
- 206010015150 Erythema Diseases 0.000 description 1
- 102000007665 Extracellular Signal-Regulated MAP Kinases Human genes 0.000 description 1
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 description 1
- 108091008794 FGF receptors Proteins 0.000 description 1
- 102000044168 Fibroblast Growth Factor Receptor Human genes 0.000 description 1
- 208000003098 Ganglion Cysts Diseases 0.000 description 1
- JRZJKWGQFNTSRN-UHFFFAOYSA-N Geldanamycin Natural products C1C(C)CC(OC)C(O)C(C)C=C(C)C(OC(N)=O)C(OC)CCC=C(C)C(=O)NC2=CC(=O)C(OC)=C1C2=O JRZJKWGQFNTSRN-UHFFFAOYSA-N 0.000 description 1
- 208000010412 Glaucoma Diseases 0.000 description 1
- 208000002375 Hand-Foot Syndrome Diseases 0.000 description 1
- 101710113864 Heat shock protein 90 Proteins 0.000 description 1
- 102100034051 Heat shock protein HSP 90-alpha Human genes 0.000 description 1
- 229920002971 Heparan sulfate Polymers 0.000 description 1
- 208000004592 Hirschsprung disease Diseases 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000684275 Homo sapiens ADP-ribosylation factor 3 Proteins 0.000 description 1
- 101000916644 Homo sapiens Macrophage colony-stimulating factor 1 receptor Proteins 0.000 description 1
- 101000950669 Homo sapiens Mitogen-activated protein kinase 9 Proteins 0.000 description 1
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 description 1
- 101001130437 Homo sapiens Ras-related protein Rap-2b Proteins 0.000 description 1
- 108090000144 Human Proteins Proteins 0.000 description 1
- 102000003839 Human Proteins Human genes 0.000 description 1
- 206010021143 Hypoxia Diseases 0.000 description 1
- 102000000521 Immunophilins Human genes 0.000 description 1
- 108010016648 Immunophilins Proteins 0.000 description 1
- 102000015696 Interleukins Human genes 0.000 description 1
- 108010063738 Interleukins Proteins 0.000 description 1
- CKLJMWTZIZZHCS-REOHCLBHSA-N L-aspartic acid Chemical compound OC(=O)[C@@H](N)CC(O)=O CKLJMWTZIZZHCS-REOHCLBHSA-N 0.000 description 1
- 125000002842 L-seryl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])O[H] 0.000 description 1
- KZSNJWFQEVHDMF-BYPYZUCNSA-N L-valine Chemical compound CC(C)[C@H](N)C(O)=O KZSNJWFQEVHDMF-BYPYZUCNSA-N 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- 239000012448 Lithium borohydride Substances 0.000 description 1
- 229940124647 MEK inhibitor Drugs 0.000 description 1
- 238000000134 MTT assay Methods 0.000 description 1
- 231100000002 MTT assay Toxicity 0.000 description 1
- 102100028198 Macrophage colony-stimulating factor 1 receptor Human genes 0.000 description 1
- 206010026749 Mania Diseases 0.000 description 1
- 208000026680 Metabolic Brain disease Diseases 0.000 description 1
- 206010027476 Metastases Diseases 0.000 description 1
- 102100037809 Mitogen-activated protein kinase 9 Human genes 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100335081 Mus musculus Flt3 gene Proteins 0.000 description 1
- 241000699670 Mus sp. Species 0.000 description 1
- KWYHDKDOAIKMQN-UHFFFAOYSA-N N,N,N',N'-tetramethylethylenediamine Chemical compound CN(C)CCN(C)C KWYHDKDOAIKMQN-UHFFFAOYSA-N 0.000 description 1
- 102000002111 Neuropilin Human genes 0.000 description 1
- 108050009450 Neuropilin Proteins 0.000 description 1
- 102100021584 Neurturin Human genes 0.000 description 1
- 108010015406 Neurturin Proteins 0.000 description 1
- GRYLNZFGIOXLOG-UHFFFAOYSA-N Nitric acid Chemical compound O[N+]([O-])=O GRYLNZFGIOXLOG-UHFFFAOYSA-N 0.000 description 1
- 239000000020 Nitrocellulose Substances 0.000 description 1
- NMKSYFAVBUPIJF-UHFFFAOYSA-N OC(c1n[nH]c2c1ccc(-c1cccc(NC(c3cc(C(F)(F)F)ccc3)=O)c1)c2)NCCN1CCOCC1 Chemical compound OC(c1n[nH]c2c1ccc(-c1cccc(NC(c3cc(C(F)(F)F)ccc3)=O)c1)c2)NCCN1CCOCC1 NMKSYFAVBUPIJF-UHFFFAOYSA-N 0.000 description 1
- 206010030113 Oedema Diseases 0.000 description 1
- 108700020796 Oncogene Proteins 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 108091008606 PDGF receptors Proteins 0.000 description 1
- YZDJQTHVDDOVHR-UHFFFAOYSA-N PLX-4720 Chemical compound CCCS(=O)(=O)NC1=CC=C(F)C(C(=O)C=2C3=CC(Cl)=CN=C3NC=2)=C1F YZDJQTHVDDOVHR-UHFFFAOYSA-N 0.000 description 1
- 229910019142 PO4 Inorganic materials 0.000 description 1
- 206010033701 Papillary thyroid cancer Diseases 0.000 description 1
- 229930182555 Penicillin Natural products 0.000 description 1
- JGSARLDLIJGVTE-MBNYWOFBSA-N Penicillin G Chemical compound N([C@H]1[C@H]2SC([C@@H](N2C1=O)C(O)=O)(C)C)C(=O)CC1=CC=CC=C1 JGSARLDLIJGVTE-MBNYWOFBSA-N 0.000 description 1
- 102100036660 Persephin Human genes 0.000 description 1
- 229940122907 Phosphatase inhibitor Drugs 0.000 description 1
- 102000004160 Phosphoric Monoester Hydrolases Human genes 0.000 description 1
- 108090000608 Phosphoric Monoester Hydrolases Proteins 0.000 description 1
- 102000011653 Platelet-Derived Growth Factor Receptors Human genes 0.000 description 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 1
- 229920001213 Polysorbate 20 Polymers 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-N Propionic acid Chemical compound CCC(O)=O XBDQKXXYIPTUBI-UHFFFAOYSA-N 0.000 description 1
- 108700020978 Proto-Oncogene Proteins 0.000 description 1
- 102000052575 Proto-Oncogene Human genes 0.000 description 1
- 108010024221 Proto-Oncogene Proteins c-bcr Proteins 0.000 description 1
- 102000015690 Proto-Oncogene Proteins c-bcr Human genes 0.000 description 1
- 108010029869 Proto-Oncogene Proteins c-raf Proteins 0.000 description 1
- 239000012083 RIPA buffer Substances 0.000 description 1
- 101150062264 Raf gene Proteins 0.000 description 1
- 102100031421 Ras-related protein Rap-2b Human genes 0.000 description 1
- 101100372762 Rattus norvegicus Flt1 gene Proteins 0.000 description 1
- 208000015634 Rectal Neoplasms Diseases 0.000 description 1
- 101000744436 Saccharomyces cerevisiae (strain ATCC 204508 / S288c) Trans-acting factor D Proteins 0.000 description 1
- 101710113029 Serine/threonine-protein kinase Proteins 0.000 description 1
- KDYFGRWQOYBRFD-UHFFFAOYSA-N Succinic acid Natural products OC(=O)CCC(O)=O KDYFGRWQOYBRFD-UHFFFAOYSA-N 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 208000005400 Synovial Cyst Diseases 0.000 description 1
- 239000006180 TBST buffer Substances 0.000 description 1
- 102000012753 TIE-2 Receptor Human genes 0.000 description 1
- 108010090091 TIE-2 Receptor Proteins 0.000 description 1
- FEWJPZIEWOKRBE-UHFFFAOYSA-N Tartaric acid Natural products [H+].[H+].[O-]C(=O)C(O)C(O)C([O-])=O FEWJPZIEWOKRBE-UHFFFAOYSA-N 0.000 description 1
- 229910021626 Tin(II) chloride Inorganic materials 0.000 description 1
- 101710103851 Tyrosine-protein kinase transforming protein Abl Proteins 0.000 description 1
- 108091008605 VEGF receptors Proteins 0.000 description 1
- 229940091171 VEGFR-2 tyrosine kinase inhibitor Drugs 0.000 description 1
- KZSNJWFQEVHDMF-UHFFFAOYSA-N Valine Natural products CC(C)C(N)C(O)=O KZSNJWFQEVHDMF-UHFFFAOYSA-N 0.000 description 1
- 108010073925 Vascular Endothelial Growth Factor B Proteins 0.000 description 1
- 108010073919 Vascular Endothelial Growth Factor D Proteins 0.000 description 1
- 102000016663 Vascular Endothelial Growth Factor Receptor-3 Human genes 0.000 description 1
- 102000009484 Vascular Endothelial Growth Factor Receptors Human genes 0.000 description 1
- 102100038217 Vascular endothelial growth factor B Human genes 0.000 description 1
- 102100038234 Vascular endothelial growth factor D Human genes 0.000 description 1
- 102100033179 Vascular endothelial growth factor receptor 3 Human genes 0.000 description 1
- 238000010263 activity profiling Methods 0.000 description 1
- BJEPYKJPYRNKOW-UHFFFAOYSA-N alpha-hydroxysuccinic acid Natural products OC(=O)C(O)CC(O)=O BJEPYKJPYRNKOW-UHFFFAOYSA-N 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 229940121369 angiogenesis inhibitor Drugs 0.000 description 1
- 230000002491 angiogenic effect Effects 0.000 description 1
- 230000006909 anti-apoptosis Effects 0.000 description 1
- 230000002424 anti-apoptotic effect Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 230000006907 apoptotic process Effects 0.000 description 1
- 235000003704 aspartic acid Nutrition 0.000 description 1
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 description 1
- 210000003719 b-lymphocyte Anatomy 0.000 description 1
- 108010007734 bcl-Associated Death Protein Proteins 0.000 description 1
- 102000007348 bcl-Associated Death Protein Human genes 0.000 description 1
- 102000004441 bcr-abl Fusion Proteins Human genes 0.000 description 1
- 108010056708 bcr-abl Fusion Proteins Proteins 0.000 description 1
- 235000010233 benzoic acid Nutrition 0.000 description 1
- OQFSQFPPLPISGP-UHFFFAOYSA-N beta-carboxyaspartic acid Natural products OC(=O)C(N)C(C(O)=O)C(O)=O OQFSQFPPLPISGP-UHFFFAOYSA-N 0.000 description 1
- 230000008827 biological function Effects 0.000 description 1
- 230000033228 biological regulation Effects 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- SXDBWCPKPHAZSM-UHFFFAOYSA-N bromic acid Chemical compound OBr(=O)=O SXDBWCPKPHAZSM-UHFFFAOYSA-N 0.000 description 1
- KDYFGRWQOYBRFD-NUQCWPJISA-N butanedioic acid Chemical compound O[14C](=O)CC[14C](O)=O KDYFGRWQOYBRFD-NUQCWPJISA-N 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 239000004202 carbamide Substances 0.000 description 1
- 125000001951 carbamoylamino group Chemical group C(N)(=O)N* 0.000 description 1
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 1
- 230000003197 catalytic effect Effects 0.000 description 1
- 230000030833 cell death Effects 0.000 description 1
- 230000010261 cell growth Effects 0.000 description 1
- 210000000170 cell membrane Anatomy 0.000 description 1
- 230000003833 cell viability Effects 0.000 description 1
- 230000005754 cellular signaling Effects 0.000 description 1
- 239000003153 chemical reaction reagent Substances 0.000 description 1
- 230000002759 chromosomal effect Effects 0.000 description 1
- 235000015165 citric acid Nutrition 0.000 description 1
- 210000001072 colon Anatomy 0.000 description 1
- 238000007796 conventional method Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 208000035250 cutaneous malignant susceptibility to 1 melanoma Diseases 0.000 description 1
- NXQGGXCHGDYOHB-UHFFFAOYSA-L cyclopenta-1,4-dien-1-yl(diphenyl)phosphane;dichloropalladium;iron(2+) Chemical compound [Fe+2].Cl[Pd]Cl.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1.[CH-]1C=CC(P(C=2C=CC=CC=2)C=2C=CC=CC=2)=C1 NXQGGXCHGDYOHB-UHFFFAOYSA-L 0.000 description 1
- XUJNEKJLAYXESH-UHFFFAOYSA-N cysteine Natural products SCC(N)C(O)=O XUJNEKJLAYXESH-UHFFFAOYSA-N 0.000 description 1
- 150000001945 cysteines Chemical class 0.000 description 1
- 231100000433 cytotoxic Toxicity 0.000 description 1
- 230000001472 cytotoxic effect Effects 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000003247 decreasing effect Effects 0.000 description 1
- 229960003964 deoxycholic acid Drugs 0.000 description 1
- KXGVEGMKQFWNSR-LLQZFEROSA-N deoxycholic acid Chemical compound C([C@H]1CC2)[C@H](O)CC[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H]([C@@H](CCC(O)=O)C)[C@@]2(C)[C@@H](O)C1 KXGVEGMKQFWNSR-LLQZFEROSA-N 0.000 description 1
- 230000004069 differentiation Effects 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 1
- 229940042399 direct acting antivirals protease inhibitors Drugs 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 238000001962 electrophoresis Methods 0.000 description 1
- 210000003989 endothelium vascular Anatomy 0.000 description 1
- 238000005516 engineering process Methods 0.000 description 1
- 239000003623 enhancer Substances 0.000 description 1
- 210000000105 enteric nervous system Anatomy 0.000 description 1
- 238000001952 enzyme assay Methods 0.000 description 1
- 231100000321 erythema Toxicity 0.000 description 1
- 230000032050 esterification Effects 0.000 description 1
- 238000005886 esterification reaction Methods 0.000 description 1
- 150000002148 esters Chemical class 0.000 description 1
- CCIVGXIOQKPBKL-UHFFFAOYSA-M ethanesulfonate Chemical compound CCS([O-])(=O)=O CCIVGXIOQKPBKL-UHFFFAOYSA-M 0.000 description 1
- HWCBPRNHXYDDKR-UHFFFAOYSA-N ethyl 6-(5-amino-2-methylphenyl)-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C1=CC(N)=CC=C1C HWCBPRNHXYDDKR-UHFFFAOYSA-N 0.000 description 1
- BUDDDZUGBKLBRP-UHFFFAOYSA-N ethyl 6-[3-[(5-bromothiophene-2-carbonyl)amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)C1=CC=C(Br)S1 BUDDDZUGBKLBRP-UHFFFAOYSA-N 0.000 description 1
- KHENEJUQLKAVPJ-UHFFFAOYSA-N ethyl 6-[3-[[4-[(4-ethylpiperazin-1-yl)methyl]-3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC(C=C1C(F)(F)F)=CC=C1CN1CCN(CC)CC1 KHENEJUQLKAVPJ-UHFFFAOYSA-N 0.000 description 1
- YEOSOHNZSLZXPJ-UHFFFAOYSA-N ethyl 6-[3-[[4-chloro-3-(trifluoromethyl)phenyl]carbamoylamino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=1)=CC=CC=1NC(=O)NC1=CC=C(Cl)C(C(F)(F)F)=C1 YEOSOHNZSLZXPJ-UHFFFAOYSA-N 0.000 description 1
- GFFKOLMSOJNQOU-UHFFFAOYSA-N ethyl 6-[4-(1,3-thiazole-4-carbonylamino)phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CSC=N1 GFFKOLMSOJNQOU-UHFFFAOYSA-N 0.000 description 1
- YNTBLLCQFVAEQL-UHFFFAOYSA-N ethyl 6-[4-[(5-bromothiophene-2-carbonyl)amino]phenyl]-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OCC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CC=C(Br)S1 YNTBLLCQFVAEQL-UHFFFAOYSA-N 0.000 description 1
- 125000004494 ethyl ester group Chemical group 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 230000008020 evaporation Effects 0.000 description 1
- 230000001605 fetal effect Effects 0.000 description 1
- 239000012530 fluid Substances 0.000 description 1
- 239000001530 fumaric acid Substances 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 230000004927 fusion Effects 0.000 description 1
- 210000001035 gastrointestinal tract Anatomy 0.000 description 1
- QTQAWLPCGQOSGP-GBTDJJJQSA-N geldanamycin Chemical compound N1C(=O)\C(C)=C/C=C\[C@@H](OC)[C@H](OC(N)=O)\C(C)=C/[C@@H](C)[C@@H](O)[C@H](OC)C[C@@H](C)CC2=C(OC)C(=O)C=C1C2=O QTQAWLPCGQOSGP-GBTDJJJQSA-N 0.000 description 1
- 210000001654 germ layer Anatomy 0.000 description 1
- 239000000174 gluconic acid Substances 0.000 description 1
- 235000012208 gluconic acid Nutrition 0.000 description 1
- 229930195712 glutamate Natural products 0.000 description 1
- 238000006206 glycosylation reaction Methods 0.000 description 1
- 230000003394 haemopoietic effect Effects 0.000 description 1
- 239000003481 heat shock protein 90 inhibitor Substances 0.000 description 1
- XLYOFNOQVPJJNP-ZSJDYOACSA-N heavy water Substances [2H]O[2H] XLYOFNOQVPJJNP-ZSJDYOACSA-N 0.000 description 1
- 208000013210 hematogenous Diseases 0.000 description 1
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 1
- 230000013632 homeostatic process Effects 0.000 description 1
- 229940088597 hormone Drugs 0.000 description 1
- 239000005556 hormone Substances 0.000 description 1
- 230000001146 hypoxic effect Effects 0.000 description 1
- 229960003998 ifenprodil Drugs 0.000 description 1
- 230000028993 immune response Effects 0.000 description 1
- 239000012133 immunoprecipitate Substances 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 102000006495 integrins Human genes 0.000 description 1
- 108010044426 integrins Proteins 0.000 description 1
- 229940047122 interleukins Drugs 0.000 description 1
- 230000003834 intracellular effect Effects 0.000 description 1
- 238000011835 investigation Methods 0.000 description 1
- 229940043355 kinase inhibitor Drugs 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 210000004185 liver Anatomy 0.000 description 1
- 230000001926 lymphatic effect Effects 0.000 description 1
- 210000004324 lymphatic system Anatomy 0.000 description 1
- VZCYOOQTPOCHFL-UPHRSURJSA-N maleic acid Chemical compound OC(=O)\C=C/C(O)=O VZCYOOQTPOCHFL-UPHRSURJSA-N 0.000 description 1
- 239000011976 maleic acid Substances 0.000 description 1
- 239000001630 malic acid Substances 0.000 description 1
- 235000011090 malic acid Nutrition 0.000 description 1
- 230000001404 mediated effect Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 208000030159 metabolic disease Diseases 0.000 description 1
- 230000009401 metastasis Effects 0.000 description 1
- 208000010658 metastatic prostate carcinoma Diseases 0.000 description 1
- 229940098779 methanesulfonic acid Drugs 0.000 description 1
- FXSREKNLDCDZGM-UHFFFAOYSA-N methyl 5-(4-aminophenyl)-1h-indazole-3-carboxylate Chemical compound C1=C2C(C(=O)OC)=NNC2=CC=C1C1=CC=C(N)C=C1 FXSREKNLDCDZGM-UHFFFAOYSA-N 0.000 description 1
- NOLDFMOWNOOJPS-UHFFFAOYSA-N methyl 6-(3-aminophenyl)-1h-indazole-3-carboxylate Chemical compound C=1C=C2C(C(=O)OC)=NNC2=CC=1C1=CC=CC(N)=C1 NOLDFMOWNOOJPS-UHFFFAOYSA-N 0.000 description 1
- 150000004702 methyl esters Chemical class 0.000 description 1
- 210000003470 mitochondria Anatomy 0.000 description 1
- 238000011242 molecular targeted therapy Methods 0.000 description 1
- 125000006203 morpholinoethyl group Chemical group [H]C([H])(*)C([H])([H])N1C([H])([H])C([H])([H])OC([H])([H])C1([H])[H] 0.000 description 1
- PSHKMPUSSFXUIA-UHFFFAOYSA-N n,n-dimethylpyridin-2-amine Chemical compound CN(C)C1=CC=CC=N1 PSHKMPUSSFXUIA-UHFFFAOYSA-N 0.000 description 1
- WHBNZXBMOJOKNO-UHFFFAOYSA-N n-(2-morpholin-4-ylethyl)-6-[4-[[3-(trifluoromethyl)benzoyl]amino]phenyl]-1h-indazole-3-carboxamide Chemical compound FC(F)(F)C1=CC=CC(C(=O)NC=2C=CC(=CC=2)C=2C=C3NN=C(C3=CC=2)C(=O)NCCN2CCOCC2)=C1 WHBNZXBMOJOKNO-UHFFFAOYSA-N 0.000 description 1
- CCLWAKKLHCJJQK-UHFFFAOYSA-N n-[4-[3-(methylcarbamoyl)-1h-indazol-6-yl]phenyl]-1,3-thiazole-4-carboxamide Chemical compound C=1C=C2C(C(=O)NC)=NNC2=CC=1C(C=C1)=CC=C1NC(=O)C1=CSC=N1 CCLWAKKLHCJJQK-UHFFFAOYSA-N 0.000 description 1
- RWIVICVCHVMHMU-UHFFFAOYSA-N n-aminoethylmorpholine Chemical compound NCCN1CCOCC1 RWIVICVCHVMHMU-UHFFFAOYSA-N 0.000 description 1
- XGXNTJHZPBRBHJ-UHFFFAOYSA-N n-phenylpyrimidin-2-amine Chemical compound N=1C=CC=NC=1NC1=CC=CC=C1 XGXNTJHZPBRBHJ-UHFFFAOYSA-N 0.000 description 1
- 201000003142 neovascular glaucoma Diseases 0.000 description 1
- 210000005036 nerve Anatomy 0.000 description 1
- 229940080607 nexavar Drugs 0.000 description 1
- 229910017604 nitric acid Inorganic materials 0.000 description 1
- 229920001220 nitrocellulos Polymers 0.000 description 1
- 102000037979 non-receptor tyrosine kinases Human genes 0.000 description 1
- 108091008046 non-receptor tyrosine kinases Proteins 0.000 description 1
- 208000002154 non-small cell lung carcinoma Diseases 0.000 description 1
- 235000015097 nutrients Nutrition 0.000 description 1
- 210000000056 organ Anatomy 0.000 description 1
- 239000003960 organic solvent Substances 0.000 description 1
- 235000006408 oxalic acid Nutrition 0.000 description 1
- 239000001301 oxygen Substances 0.000 description 1
- 229910052760 oxygen Inorganic materials 0.000 description 1
- KDLHZDBZIXYQEI-UHFFFAOYSA-N palladium Substances [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 1
- FJKROLUGYXJWQN-UHFFFAOYSA-N papa-hydroxy-benzoic acid Natural products OC(=O)C1=CC=C(O)C=C1 FJKROLUGYXJWQN-UHFFFAOYSA-N 0.000 description 1
- 230000001734 parasympathetic effect Effects 0.000 description 1
- 210000001002 parasympathetic nervous system Anatomy 0.000 description 1
- 230000001575 pathological effect Effects 0.000 description 1
- 230000037361 pathway Effects 0.000 description 1
- 229940049954 penicillin Drugs 0.000 description 1
- 239000000137 peptide hydrolase inhibitor Substances 0.000 description 1
- 230000011340 peptidyl-tyrosine autophosphorylation Effects 0.000 description 1
- 108010070453 persephin Proteins 0.000 description 1
- 210000004214 philadelphia chromosome Anatomy 0.000 description 1
- 239000010452 phosphate Substances 0.000 description 1
- 125000002467 phosphate group Chemical group [H]OP(=O)(O[H])O[*] 0.000 description 1
- 150000003013 phosphoric acid derivatives Chemical class 0.000 description 1
- 239000000256 polyoxyethylene sorbitan monolaurate Substances 0.000 description 1
- 235000010486 polyoxyethylene sorbitan monolaurate Nutrition 0.000 description 1
- 229910000027 potassium carbonate Inorganic materials 0.000 description 1
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- JUSIWJONLKBPDU-UHFFFAOYSA-N pyridazine-4-carboxylic acid Chemical compound OC(=O)C1=CC=NN=C1 JUSIWJONLKBPDU-UHFFFAOYSA-N 0.000 description 1
- 108700042226 ras Genes Proteins 0.000 description 1
- 206010038038 rectal cancer Diseases 0.000 description 1
- 201000001275 rectum cancer Diseases 0.000 description 1
- 230000022532 regulation of transcription, DNA-dependent Effects 0.000 description 1
- BOLDJAUMGUJJKM-LSDHHAIUSA-N renifolin D Natural products CC(=C)[C@@H]1Cc2c(O)c(O)ccc2[C@H]1CC(=O)c3ccc(O)cc3O BOLDJAUMGUJJKM-LSDHHAIUSA-N 0.000 description 1
- 238000012552 review Methods 0.000 description 1
- 206010039073 rheumatoid arthritis Diseases 0.000 description 1
- 229960004889 salicylic acid Drugs 0.000 description 1
- 239000012488 sample solution Substances 0.000 description 1
- 230000035945 sensitivity Effects 0.000 description 1
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 description 1
- 239000011780 sodium chloride Substances 0.000 description 1
- 235000010288 sodium nitrite Nutrition 0.000 description 1
- 210000000952 spleen Anatomy 0.000 description 1
- 230000000638 stimulation Effects 0.000 description 1
- 239000011550 stock solution Substances 0.000 description 1
- 239000012089 stop solution Substances 0.000 description 1
- 229960005322 streptomycin Drugs 0.000 description 1
- 210000002536 stromal cell Anatomy 0.000 description 1
- 238000006467 substitution reaction Methods 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- 208000024891 symptom Diseases 0.000 description 1
- 239000011975 tartaric acid Substances 0.000 description 1
- 235000002906 tartaric acid Nutrition 0.000 description 1
- 125000005931 tert-butyloxycarbonyl group Chemical group [H]C([H])([H])C(OC(*)=O)(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 238000012360 testing method Methods 0.000 description 1
- AXZWODMDQAVCJE-UHFFFAOYSA-L tin(II) chloride (anhydrous) Chemical compound [Cl-].[Cl-].[Sn+2] AXZWODMDQAVCJE-UHFFFAOYSA-L 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 230000002463 transducing effect Effects 0.000 description 1
- 238000001890 transfection Methods 0.000 description 1
- 230000005945 translocation Effects 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 230000005747 tumor angiogenesis Effects 0.000 description 1
- 230000004614 tumor growth Effects 0.000 description 1
- 208000029729 tumor suppressor gene on chromosome 11 Diseases 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 239000005483 tyrosine kinase inhibitor Substances 0.000 description 1
- 210000002229 urogenital system Anatomy 0.000 description 1
- 210000004291 uterus Anatomy 0.000 description 1
- 239000004474 valine Substances 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D231/00—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings
- C07D231/54—Heterocyclic compounds containing 1,2-diazole or hydrogenated 1,2-diazole rings condensed with carbocyclic rings or ring systems
- C07D231/56—Benzopyrazoles; Hydrogenated benzopyrazoles
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings
- C07D401/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/12—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/02—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings
- C07D405/12—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D407/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00
- C07D407/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings
- C07D407/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having oxygen atoms as the only ring hetero atoms, not provided for by group C07D405/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/04—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings
- C07D409/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings
- C07D413/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/02—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings
- C07D417/12—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing two hetero rings linked by a chain containing hetero atoms as chain links
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- Public Health (AREA)
- General Chemical & Material Sciences (AREA)
- Medicinal Chemistry (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Chemical Kinetics & Catalysis (AREA)
- Pharmacology & Pharmacy (AREA)
- Veterinary Medicine (AREA)
- Animal Behavior & Ethology (AREA)
- General Health & Medical Sciences (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Engineering & Computer Science (AREA)
- Hematology (AREA)
- Oncology (AREA)
- Dermatology (AREA)
- Pharmaceuticals Containing Other Organic And Inorganic Compounds (AREA)
- Plural Heterocyclic Compounds (AREA)
Abstract
公开了由下面的化学式1表示的新型吲唑衍生物或其药学上可接受的盐、水合物或溶剂合物以及含有其作为活性成分的用于预防或治疗增殖性疾病的药物组合物。由于对诸如b-raf、KDR、Fms、Tie2、SAPK2a和Ret的蛋白激酶(这些蛋白激酶诱发由异常细胞增殖引起的疾病)具有有效的抑制作用,所以该新型吲唑衍生物可以用于预防或治疗由异常细胞增殖引起的疾病。
Description
技术领域
本发明涉及新型吲唑衍生物、其药学上可接受的盐、其制备方法和含有其作为活性成分的用于预防和治疗增殖性疾病的药物组合物。
背景技术
对位于蛋白的酪氨酸和丝氨酸/苏氨酸残基中的羟基的磷酸化起催化作用的蛋白激酶起着对细胞的增殖、分化、存活、移植和入侵重要的作用。蛋白激酶是用于控制生物体内的信号转导系统的最重要指令者之一。
活细胞中的信号转导系统应当适当地且顺畅地启动,并用来维持生物体的体内稳态。但是特异的蛋白激酶的突变或过表达引起的坍塌的信号转导系统诱发各种疾病,例如癌、炎症、代谢性疾病、大脑紊乱等。
至今已经确定或提出了518种人类蛋白激酶,这相当于人类总基因存在的大约1.7%。其分为酪氨酸蛋白激酶(超过90种)和丝氨酸/苏氨酸蛋白激酶。酪氨酸蛋白激酶可以分为由58种组成的作为受体酪氨酸激酶的20个亚族和由32种组成的属于细胞质/非受体酪氨酸激酶的10个亚族(Manning等,Science,2002,298,1912)。受体酪氨酸激酶的细胞外结构域可容纳它们的配体,例如生长因子,位于细胞质中的它们的激酶结构域可以使特异的酪氨酸磷酸化。一旦配体正在结合到受体酪氨酸激酶的细胞外结构域,受体酪氨酸激酶便被二聚化,且细胞质结构域中的特异的酪氨酸变为自磷酸化。继而,信令经历细胞质和细胞核中的下游蛋白的连续磷酸化,该连续信令最终导致引起癌的转录因子被激活且过表达。
属于丝氨酸/苏氨酸(Ser/Thr)蛋白激酶族的Raf负责将从细胞膜中的激活生长因子受体产生的信号转导至细胞核。首先确定的raf基因是致癌的v-raf(Mark GE等,1984)。源自丝裂原活化的蛋白激酶(MAPK)的信号转导系统对于细胞增殖、分裂、存活、死亡和入侵以及转录调节和发展来说是必需的。MAPK信令系统主要通过MAPK激酶激酶(MAPKKK)、MAPK激酶(MAPKK)和MAPK的顺序磷酸化过程来工作。Raf、MEK和ERK(细胞外信号调节激酶)分别对应于MAPK激酶激酶(MAPKKK,MAP3K)、MAPK激酶(MAPKK、MAP2K)和MAPK。
Ras(即,由来自生长因子受体的信号激活的小GTP结合蛋白)使得Raf-MEK-ERK顺序地磷酸化,最后,顺序的MAPK信令转导至细胞核。Raf族激酶由A-raf、B-raf和c-raf(raf-1)组成。对于这三种Raf异形体,已经最广泛地研究了Raf-1。在结构上为活性的Ras肿瘤基因(特别是k-Ras)证实与胰腺癌(大约90%)、直肠癌(大约45%)、肝癌(大约30%)、3种非小细胞肺癌(大约35%)、肾癌(大约10%)和其它各种实性肿瘤有关。
一旦Raf-1的丝氨酸338被磷酸化,与激活的Ras结合的Raf-1便可以被激活(Avruch,J.等,Recent Progress in Hormone Research,2001,56,127)。相反,与丝氨酸259被磷酸化的Raf-1组合的14-3-3蛋白使得Raf-1失活。
Raf还涉及到信令通路的NF-kB(激活的B细胞的核因子κ-轻链增强子),并且在免疫反应和炎症方面起着重要作用(Caraglia,M.等,Annals ofOncology,2006,17,124)。Raf使失活的IκBs(κB的抑制子)蛋白磷酸化,并诱发NFkB位于细胞核中,并最终上调抑制细胞死亡的转录因子。
Raf的抗凋亡的不同机理如下。Raf结合到Bcl-2,从而形成Raf-Bcl-2二聚物,并位移至线粒体。如果它在该位置使得Bad蛋白磷酸化,则Bcl-2的抗凋亡功能发挥作用。Raf与Bcl-2发生免疫沉淀(Yuryev,A.等,Mol.Cell.Biol.2000,20,4870)。Raf蛋白的三种亚型(A-Raf、B-Raf、C-Raf/Raf-1)承载N端控制域,且在C端激酶结构域保存三个结构域(CR1、CR2、CR3)。CR1包括存在大量半胱氨酸的Ras结合域。另外,CR2具有用于14-3-3蛋白(即,Raf-1的丝氨酸259)的结合位点。CR3包含催化结构域(Tran等,J BiolChem,2005,280,16244),并拥有将被完全激活的自磷酸化位点。例如,Raf-1的苏氨酸491和丝氨酸494的磷酸化(Wellbrock,C.Nature ReviewsMolecular Cell Biology,2004,5,875)能够使Raf-1被最大限度地激活。
Raf蛋白的三种亚型在不同组织中被过表达。C-Raf无所不在地几乎在所有组织中被表达,另一方面,A-Raf主要在泌尿生殖系统(肾、子宫和前列腺)中被表达,B-Raf主要在神经、脾和造血器官中被发现(Jaiswal,R.K.等,J.Biol.Chem.,1966,271,23626)。
B-Raf突变与人类的全部癌的大约7%有关。特别地,频繁地观察到B-Raf的突变,其在作为一种皮肤癌的黑素瘤中比较普遍(大约70%)。在黑素瘤中主要发现B-raf-V600E突变种(大约90%),在B-raf-V600E突变种中,位于Exon 15中的缬氨酸600由于点突变被谷氨酸取代(Davies,H.等,Nature2002,417,949)。B-raf-V600E的体外激酶活性是野生型B-Raf的体外激酶活性的大约500倍高。因此,B-raf-V600E使得MAPK激酶信号转导系统被过激活,并诱发各种类型的癌。B-raf-V600E的激酶活性比野生型B-raf的激酶活性高的原因如下。位于B-Raf激活段中的点突变的谷氨酸600的行为类似于磷酸化位点之间的磷酸盐基(苏氨酸598至丝氨酸601)。这种磷酸盐模仿诱发了构形变化,从而导致B-Raf激酶结构域在结构上被激活(Tuveson,D.A.,Cancer Cell,2003,4,95)。其间,到现在才确定出的B-raf突变种有大约40种。这些突变主要出现在存在大量甘氨酸的G环和激活段。除了V600E之外的其它突变种的产生频率显著地低。在结直肠癌中,在激酶结构域的G环中产生B-Raf突变种的大约10%(Rajagopalan等,Nature 2002 418,934)。
自体抑制(自动抑制)结构域存在于B-Raf的N端中。然而,一旦激活的H-Ras结合到B-Raf,B-Raf就变得总是活性的。这是通过丝氨酸445的磷酸化而形成的,这对应于C-Raf丝氨酸338的磷酸化。B-Raf V600E突变种妨碍B-Raf的自体抑制,并致使B-Raf在结构上是活性的。
此外,频繁地检测到B-Raf-V600E突变种,其在乳头状甲状腺癌中比较普遍(大约50%)(Salvatore,G.J.Clin.Endocrinol.Metab.2004,89,5175)。B-Raf-V600E突变种还与结肠癌(大约20%)和子宫癌(大约30%)有关。同时,在没有突变种的表达的情况下,分别以大约50%和几乎100%的频率在肾癌(肾细胞癌)和肝癌(HCC)中观察到C-Raf的过度活性。
由Bayer和Onyx公司开发的Sorafenib(索拉非尼)(BAY 43-9006/商标Nexavar)强力地抑制了C-Raf、野生型B-Raf或突变种B-Raf。此外,索拉非尼抑制包括血小板源生长因子受体、血管内皮生长因子(血管内皮生长因子受体1/2/3)、纤维原细胞生长因子受体、Flt-3、c-Kit、RET等的若干受体酪氨酸激酶的激酶活性。索拉非尼通过如下机理来抑制激酶活性,即,在所述机理中,索拉非尼使激酶结构域的DGF基元稳定化,从而具有失活的构形(非活性构形)(Wan,P.T.等,Cell,2004,116,855)。索拉非尼在2005年从FDA获得批准,作为用于进展期肾细胞癌的治疗剂。然而,与soley Raf抑制相比,索拉非尼治疗的临床优点是由包括血管内皮生长因子(血管内皮生长因子受体1/2/3)的若干激酶的复合抑制引起的。在二期临床调查中,索拉非尼的MTD(最大耐受剂量)为一天两次共400mg。一天两次600mg索拉非尼的给药诱发3级的皮肤毒性副作用。手和足的皮肤脱皮,且索拉非尼的常见副作用是红斑以及水肿症状的手足综合症。
同时,索拉非尼在2008年获得批准作为肝细胞癌(HCC)治疗剂。此外,在二期临床试验中,索拉非尼针对甲状腺癌、转移性前列腺癌和乳腺癌展现出合理的功效。同时,索拉非尼针对作为一种皮肤癌的黑素瘤显示出温和的治疗功效。同时,由Plexxikon开发的PLX4-720(即,7-吖吲哚衍生物)诱使诸如1205Lu(raf-V660E过表达细胞株)的黑素瘤细胞系的细胞凋亡(Tsai,J.等,PNAS,2008,105,3041)。PLX-4720强力地抑制Raf-V660E的激酶活性,其中IC50值为13nM,并针对A375黑素瘤细胞系(raf-V660E过表达细胞株)展现出良好的抗增殖活性(IC50=0.5μM)。由Norvatis/Chiron开发的CHIR-265强力地抑制若干种激酶,如B-Raf-V600E(IC50=19nM)、KDR(IC50=70nM)、PDGFR-b(IC50=30nM)和c-Kit(IC50=20nM)。CHIR-265在用于黑素瘤治疗的一期临床调查下。
近来,Raf抑制剂的抗药性问题浮现出来。Montagut和同事培育了在Raf抑制剂(AZ628)的存在下携带B-Raf-V600E突变种的M14细胞株(人体黑素瘤细胞系),并获得耐Raf抑制剂(AZ628)的克隆体。他们基于该实验解释了发生Raf抑制剂的耐药性的机理。如果抑制了B-Raf,则C-Raf的蛋白表达水平提高,并且对B-Raf-V600E的药物抑制活性下降。但是格尔德霉素即HSP90抑制剂的敏感性在耐Raf抑制剂(AZ628)的黑素瘤细胞系上增加。因此,HSP90抑制可以克服Raf抑制剂的耐药性问题(Montagut,C.CancerResearch,2008,68,4853)。
还被称作KDR/Flk-1(含有激酶插入结构域的受体/胎肝激酶)的VEGFR-2(血管内皮生长因子受体-2)属于受体酪氨酸激酶的III族类别,并且与最终导致从既存的血管形成新的血管的血管生成过程密切相关。血管生成与诸如癌、风湿性关节炎、糖尿病视网膜病变和新生血管性青光眼的病理状况相关。众所周知,VEGFR-2的抑制作用抑制血管生成,VEGFR-2已经被视为用于癌症治疗的有前景的分子靶。
VEGF主要在血管内皮细胞、生血细胞和基质细胞中在缺氧状态下且通过TGF、白介素和细胞生长因子如PDGF的刺激而生成。VEGF结合到VEGF受体(VEGFR)-1、-2和-3。VEGFR的信号特异性更加细致地由神经菌毛素(neurophilin)、硫酸乙酰肝素、包括钙粘素和整合素的共同受体(辅助受体)来控制。
VEGF的生物学功能通过III型RTK、VEGFR-1(Flt-1)、VEGFR-2(KDR/Flk-1)和VEGFR-3(Flt-4)介导。VEGFR变得与Fms、Kit和PDGFR密切相关。然而,VEGF-A联合体与VEGFR-1和-2组合,VEGF-C结合到VEGF-2和-3。然而,对于血管生成,优先地需要VEGF-A和-B,VEGF-C和-D对于淋巴血管生成是必需的。新生血管起到用于将营养物质和氧提供到肿瘤的通路角色,并起到癌细胞转移的作用,癌细胞转移对于癌细胞的增殖和入侵来说是必要的。在正常细胞的情况下,通过血管生成加速的物质(血管生成刺激物)和抑制血管生成的物质(血管生成抑制物)的相互调节,使血管生成在生物体内达到平衡,但是在癌细胞的情况下,这种平衡被破坏,且VEGFR被VEGF(血管内皮生长因子)激活,VEGF大多数对血管内皮细胞造成大的影响。已经在多方面研究和开发了对诸如VEGFR的受体酪氨酸激酶起到抑制作用的小分子抑制剂,发现这些抗血管生成剂能够用于治疗大多数实性肿瘤的可能性非常大。另外,与细胞毒素抗癌剂相比,它们的优点在于具有预期治疗功效,且副作用相对较小。
已经确定并推行了大量小分子VEGFR-2抑制剂,这些中的一些当前正在临床研究中(Schenone等,Curr.Med.Chem.2007;14:2495.)。作为包括VEGFR-2抑制的多靶点酪氨酸激酶抑制剂的索拉非尼和苏尼替尼(Sunitinb)已经展开。
与血管生成有关的另一受体酪氨酸激酶是主要在血管内皮上表达的Tie-2。还在造血细胞中发现Tie-2。发现血管生成素Ang1和Ang 2作为Tie-2配体(Davis等,Cell 1996;87:1161.)。结合到Tie-2的细胞外结构域的Ang 1引起Tie-2激酶结构域的自磷酸化,但奇怪的是没有激活MAPK,也没有刺激有丝分裂发生。看起来Ang 2在淋巴管系统中起到关键作用。已经证实,利用显性负的Tie-2受体的Tie-2抑制减少了小鼠的肿瘤血管生成和生长(Lin等,Proc.Natl.Acad.Sci.USA 1998;95:8829.)。
主要在神经和排泄系统中表达的RET(在转染期间重排的)原癌基因属于受体酪氨酸激酶族。RET的N端细胞外结构域由四个类钙粘素重复、钙结合位点、9个N-糖基化位点和半胱氨酸富集区域构成(Airaksinen等,Nat.Rev.Neurosci.2002;3:383.)。至少12个酪氨酸自磷酸化位点位于RET异形体的细胞质结构域中(Liu,J.Biol.Chem.1996;271:5309.)。例如,在RET9异形体的细胞内激酶结构域中存在16种酪氨酸。结合到RET的细胞外部分的GFL/GFR-α复合体致使RET的激酶结构域自磷酸化和激活(Aiaksinen等,Nat.Rev.Neurosci.2002;3:383.)。GNDF((源自神经胶质的亲神经因子)族配体,即GFL由GDNF、artemin、neurturin和persephin构成。由4个亚型(GFR-α1-4)构成的GNDF族受体即GFR-α表示糖基化磷脂酰肌醇锚定共同受体。已经报道了RET对小鼠的副交感神经和肠神经系统以及肾的发育起到重要作用(Pachnis等,Development 1993;119:1005.)。失去由胚层突变引起的功能的RET与先天性巨结肠疾病相关(Manie等,Trends Genet.2001;17:580.),先天性巨结肠疾病被定义为末端肠道的先天性无神经节细胞症。相比之下,发现功能RET突变的获得与人类癌(例如,多发性内分泌瘤2A型(MEN2A)、MEN2B和家族性甲状腺髓样癌(FMTC))相关联。具体地说,RET证明是甲状腺癌治疗的有希望的分子靶(Cote和Gagel,N.Engl.J.Med.2003;349:1566.)。
作为致癌融合酪氨酸激酶的Bcr-Abl由位于染色体22上的Bcr(断点簇区域)基因和来自染色体9的Abl(V-abl Abelson鼠科白血病病毒致癌基因同源体)基因的异常移位产生。这种典型的染色体移位被称为Philadelphia染色体(Nowell和Hungerford,J.Natl.Cancer Inst.1960;25:85.)。Bcr-Abl融合蛋白的尺寸由Bcr室的断点来确定。除了与白血病有关的Bcr-Abl的三种异形体(190、210、230kDa)之外,p210Bcr-Abl已经证实足以引起CML(慢性骨髓白血病)。化学型为苯氨嘧啶(PAP)的Gleevec(甲磺酸伊马替尼(Imatinib mesylate))在药物研发领域中开创了新纪元,因为Gleevec是用于分子靶向治疗的首选药物。可惜Gleevec近来具有获得性耐药的缺点,主要是由于已经在Abl的激酶结构域中出现的若干种点突变。虽然诸如Nilotinib和Dasatinib的第二代Gleevec已经投入市场,但是,下一代Gleevec明显需要通过抑制包括T315I-Bcr-Abl的所有临床相关的点突变来克服Gleevec耐药性。不幸的是,Nilotinib和Dasatinib对包括被证实是在临床上最严重的点突变的T315I-Bcr-Abl在内的点突变是无活性的。
发明内容
技术问题
因此,本发明的一个目的在于提供抑制诸如RAF、KDR、FMS、Ret、Tie-2和SAPK的蛋白激酶并具有用于癌症治疗的抗增殖活性的吲唑衍生物或其药学上可接受的盐。
本发明的另一目的在于提供用于制备新型吲唑衍生物或其药学上可接受的盐的方法。
本发明的进一步的目的在于提供一种含有吲唑衍生物或其药学上可接受的盐作为活性成分的用于预防或治疗增殖性疾病的药物组合物。
技术方案
为了实现以上目的,本发明提供了新型吲唑衍生物、其药学上可接受的盐、用于制备新型吲唑衍生物的方法。
在本发明的另一方面,本发明提供了一种含有新型吲唑衍生物或其药学上可接受的盐作为活性成分的药物组合物。
有益效果
发现本发明的吲唑衍生物对诸如b-raf、KDR、Fms、Tie2、SAPK2a和Ret的蛋白激酶(这些蛋白激酶诱发由异常细胞增殖引起的疾病)具有有效的抑制活性,所述新型吲唑衍生物可以用于预防或治疗由异常细胞增殖引起的疾病。
附图说明
图1提供了根据本发明的新型吲唑化合物的蛋白印迹(western blotting)的图像。
用于实施本发明的最佳方式
本发明提供了由下面的化学式1表示的新型吲唑衍生物和其药学上可接受的盐:
[化学式1]
其中,
R2为氢、羟基、C1-C3烷氧基或R3-(CH2)n-NH-;
R3为氢、二甲胺、吗啉基、苯基、杂芳基、取代有CF3的苯基,或C3-C6环烷基;
A为取代有R4和LR5的5-6元芳基或杂芳基;
R4为氢或C1-C3烷基;
L为-NH-或-C(O)NH-;
R5为氢、-C(O)-R6、-C(O)NH-R6或-S(O)2-R6;
R6是从由苯基、苯甲基、5元或6元杂芳基、萘基和苯并噻吩基组成的组中选择的一种,其中,每一种取代有从由以下取代基组成的组中选择的一个或两个取代基:氢、-CH3、-CF3、-OCH3、-Br、-Cl、-NO2、
n为0、1或2。
更优选地,R6为苯基、(三氟甲基)苯基、4-硝基-3-(三氟甲基)苯基、3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯基、4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯基、3,4-二氯苯基、4-氯-3-(三氟甲基)苯基、3,5-二(三氟甲基)苯基、3,4-二甲氧基苯基、3-吗啉代-5-(三氟甲基)苯基、2,3-二氯苯基、2,4-二甲基苯基、4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基、4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基、3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯基、4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯基、苯甲基、3,4-二甲氧基苯甲基、噻吩基、5-溴噻吩基、吡嗪基、呋喃基、2,5-二甲基呋喃基、5-(4-甲氧基苯基)呋喃基、5-(2-氯-5-(三氟甲基)苯基)呋喃基、异唑基、5-甲基异唑基、吡唑基、1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑基、哒嗪基、吡啶基、3-氯吡啶基、噻唑基、4-(2-(吡啶-4-基)噻唑基、萘基、4,7-二甲氧基萘基、苯并[b]噻吩基、嘧啶基、咪唑基、吡咯基、二氢吡咯基、唑基、三唑基、噻二唑基、苯并咪唑基、喹啉基、四氢喹啉基、苯并噻唑基、苯并噻唑苯基、苯并间二氧杂环戊烯基、吲唑基、吲哚基、吲哚基、二氢吲哚基或二氢苯并呋喃基。
根据本发明的吲唑衍生物的具体示例如下:
1)6-(4-氨基苯基)-1H-吲唑-3-羧酸乙酯;
2)6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
3)6-(4-(5-溴噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
4)6-(4-(吡嗪-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
5)6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
6)6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
8)6-(4-(1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
9)6-(4-(4-硝基-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
10)6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
11)6-(4-(2-(3,4-二甲氧基苯基)乙酰氨基)苯基)-1H-吲唑-3-羧酸乙酯;
12)6-(4-(5-(4-甲氧基苯基)呋喃-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
13)6-(4-(3-氯异烟酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
14)6-(4-(噻唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
15)6-(4-(4,7-二甲氧基-1-萘甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
16)6-(4-(5-(2-氯-5-(三氟甲基)苯基)呋喃-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
17)6-(4-(2-(吡啶-4-基)噻唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
18)6-(4-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
19)6-(4-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
20)6-(4-(3-(3,4-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
21)6-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
22)6-(4-(3-(3,5-二(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
23)6-(4-(3-(3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
24)N-甲基-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
25)6-(4-(5-(4-甲氧基苯基)呋喃-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺;
26)6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺;
27)6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺;
28)6-(4-(3-(3,5-二(三氟甲基)苯基)脲基)苯基)-N-甲基-1H-吲唑-3-酰胺;
29)N-甲基-6-(4-(3-(3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-酰胺;
30)N-(2-吗啉代乙基)-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
31)6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
32)6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
33)6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
34)6-(4-(1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑-4-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
35)6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-(3-(三氟甲基)苯基)-1H-吲唑-3-酰胺;
36)6-(4-(3-(3,4-二氯苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
37)N-甲基-6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-酰胺;
39)N-甲基-6-(4-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
40)N-甲基-6-(4-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
41)N-(4-(3-(甲基氨基甲酰基)-1H-吲唑-6-基)苯基)噻唑-4-酰胺;
42)5-(4-氨基苯基)-1H-吲唑-3-羧酸甲酯;
43)5-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯;
44)6-(3-氨基苯基)-1H-吲唑-3-羧酸乙酯;
45)6-(3-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
47)6-(3-(苯并[b]噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
48)6-(3-(2-(3,4-二甲氧基苯基)乙酰氨基)苯基)-1H-吲唑-3-羧酸乙酯;
49)6-(3-(5-溴噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
50)N-(2-吗啉代乙基)-6-(3-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
51)6-(3-氨基苯基)-1H-吲唑-3-羧酸甲酯;
52)6-(3-(3-吗啉代-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸甲酯;
53)6-(5-氨基-2-甲基苯基)-1H-吲唑-3-羧酸乙酯;
54)6-(3-(3-(2,3-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
55)6-(3-(3-(3,4-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
56)6-(3-(3-(2,4-二甲基苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯;
57)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-1H-吲唑-3-羧酸乙酯;
58)6-(3-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
59)6-(3-(3-吗啉代-5-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
60)6-(3-(3-(2,3-二氯苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
61)6-(3-(3-(2,3-二氯苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺;
62)6-(3-(3-(3,4-二氯苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺;
63)6-(3-(3-(2,4-二甲基苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺;
64)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
65)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-(2-(二甲基氨基)乙基)-1H-吲唑-3-酰胺;
66)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-环丙基-1H-吲唑-3-酰胺;
67)6-(2-甲基-5-(3-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
68)6-(3-(3-(三氟甲基)苯基亚磺酰氨基)苯基)-1H-吲唑-3-羧酸乙酯;
69)6-(3-(3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
70)6-(3-(3-(4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯;
71)6-(2-甲基-5-(3-(4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
72)5-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
73)N-甲基-6-(2-甲基-5-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
74)6-(2-甲基-5-(3-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
75)N-甲基-6-(2-甲基-5-(3-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-酰胺;
76)6-(3-(3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
77)6-(3-(3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
78)6-(3-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸甲酯;
79)1-(4-氯-3-(三氟甲基)苯基)-3-(3-(3-(羟基甲基)-1H-吲唑-6-基)苯基)脲;
80)6-(5-(3-(三氟甲基)苯基氨基甲酰基)噻吩-3-基)-1H-吲唑-3-羧酸乙酯;或
81)6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺盐酸盐。
可以以药学上可接受的盐的形式使用本发明的由化学式1表示的吲唑衍生物。具有药学上可接受的游离酸的酸加成盐是有用的。游离酸可以是无机的或有机的。有用的无机游离酸的示例包括盐酸、硝酸、磷酸、硫酸、高氯酸、溴酸。作为有机酸,可以使用乙酸、甲磺酸、乙磺酸、对甲苯磺酸、富马酸、马来酸、丙二酸、苯二甲酸、琥珀酸、乳酸、柠檬酸、葡糖酸、酒石酸、水杨酸、苹果酸、草酸、苯甲酸、恩波酸(embonate)、天冬氨酸或谷氨酸。
另外,本发明的由化学式1表示的吲唑衍生物可以是传统上可生产的其盐、水合物和溶剂合物以及药学上可接受的盐的形式。
可以使用传统的方法来制备根据本发明的加成盐。例如,它们可以如下制备:将化学式1的化合物溶于可与水混溶的有机溶剂诸如丙酮、甲醇、乙醇或1,4-二氧杂环己烷中;加入过量的有机酸或过量的游离碱,以使盐沉淀或结晶。在示例81中描述了游离碱的制备方法。
此外,本发明提供了用于制备新型吲唑衍生物或其药学上可接受的盐的方法。优选地,可以通过在下面的反应式中描述的方法来制备由所述化学式1描述的吲唑衍生物或其药学上可接受的盐,但是这些方法不受这些反应式的限制。特别地,本领域技术人员可以理解,可以使用在本领域中已知的技术通过多种方式来制备由所述化学式1描述的吲唑衍生物或其药学上可接受的盐。
根据本发明的实施例,如由下面的反应方案1示出的用于制备化学式5的中间体的方法包括:
通过3步反应从化学式2的化合物制备化学式3的化合物(步骤1);
通过酯化作用从步骤1的化学式3的化合物制备化学式4的化合物(步骤2);
通过步骤2的化学式4的化合物的官能团的保护制备化学式5的化合物(步骤3):
[反应方案1]
其中,Boc为叔丁氧羰基。
根据本发明的另一实施例,如由下面的反应方案2示出的用于制备化学式1a的新型吲唑衍生物的方法包括:
通过Suzuki交叉偶联反应从化学式5的化合物和化学式6的化合物制备化学式7的化合物(步骤1);
通过步骤1的化学式7的化合物的去保护和还原来制备化学式8的化合物(步骤2);
通过步骤2的化学式8的化合物的取代来制备化学式9的化合物(步骤3);
通过步骤3的化学式9的化合物的水解来制备化学式10的化合物(步骤4);
通过步骤4的化学式10的化合物与胺(R3-(CH2)n-NH)的偶联反应(酰胺化)来制备化学式1a的化合物(步骤5):
[反应方案2]
其中,R3、R4、R5、A和n如在化学式1中所定义的;化学式1a的化合物属于化学式1的化合物;Pd(dppf)Cl2是1,1′-双(二苯基膦基)二茂铁二氯化钯。
根据本发明的进一步的实施例,如由下面的反应方案3示出的用于制备化学式1b的新型吲唑衍生物的方法包括:
通过化学式7的化合物的去保护和水解来制备化学式11的化合物(步骤1);
通过步骤1的化学式11的化合物与胺(R3-(CH2)n-NH)的偶联反应(酰胺化)来制备化学式12的化合物(步骤2);
通过步骤2的化学式12的化合物的还原来制备化学式13的化合物(步骤3);
通过步骤3的化学式13的化合物与羧酸的偶联反应来制备化学式1b的化合物(步骤4):
[反应方案3]
其中,R3、R4、R5、A和n如在化学式1中所定义,化学式1b的化合物属于化学式1的化合物。
此外,本发明提供了一种含有由化学式1表示的吲唑衍生物或其药学上可接受的盐作为活性成分的用于预防或治疗由异常细胞增殖引起的疾病的药物组合物。
由于对诸如b-raf、KDR、Fms、Tie2、SAPK2a和Ret的蛋白激酶(这些蛋白激酶诱发由异常细胞增殖引起的疾病)具有有效的抑制作用,所以该新型吲唑衍生物可以用于预防或治疗由异常细胞增殖引起的疾病。
由异常细胞增殖引起的疾病选自于由胃癌、肺癌、肝癌、结直肠癌、胰腺癌、脑癌、骨癌、黑素瘤癌、乳腺癌、结节性硬化病、子宫癌、子宫颈癌、头颈癌、食道癌、甲状腺癌、甲状旁腺癌、肾细胞癌、骨肉瘤、前列腺癌、尿道癌、膀胱癌、血癌、淋巴瘤、牛皮癣和纤维腺瘤组成的组。
血癌选自于由白血病、多发性骨髓瘤和骨髓增生异常综合症组成的组。
淋巴瘤是霍奇金病或非霍奇金淋巴瘤。
用于本发明的方式
可以通过下面举例阐述的示例获得本发明的更好的理解,但是不应当将下面的示例解释为限制本发明。
示例1:6-(4-氨基苯基)-1H-吲唑-3-羧酸乙酯的制备
步骤1:6-溴-1H-吲唑-3-羧酸的制备
在50℃下将6-溴靛红(10g,22mmol)溶于1N NaOH水溶液(48mL)中的溶液搅拌1小时。将该混合物冷却至0℃。在0℃下以15分钟逐滴加入亚硝酸钠(3g,22mmol)的水(11mL)溶液。在0℃下以15分钟将该混合物加入到水(90mL)和硫酸(4.6mL)的溶液中。将该混合物加入到浓盐酸(40mL)和SnCl2·2H2O(24g,53mmol)的溶液中。在1小时之后,过滤该混合物,并用水进行洗涤。通过空气流来干燥固体,从而得到题述的化合物(8.98g)。
1H NMR(300MHz,DMSO-d6)δ13.76(bs,1H),7.87(s,1H),7.55(d,J=8Hz,1H),7.27(d,J=8Hz,1H),2.44(s,3H)。
步骤2:6-溴-1H-吲唑-3-羧酸乙酯的制备
在搅拌状态下,将亚硫酰氯(8mL,104mmol;SOCl2)加入到6-溴-1H-吲唑-3-羧酸(5g,21mmol)的乙醇(160mL)溶液中。将该混合物回流3小时,冷却至室温,并在减压下浓缩。加入乙酸乙酯。用饱和碳酸氢钠溶液洗涤有机层,通过硫酸镁进行干燥,并在减压下浓缩。通过快速柱色谱(硅胶,DCM∶MeOH=9∶1)将剩余物纯化,从而得到6-溴-1H-吲唑-3-羧酸乙酯(2.8g)。
1H NMR(300MHz,CDCl3)δ14.04(br s,1H),8.00(d,J=8.4Hz,1H),7.91(d,J=1.2Hz,1H),7.45(dd,J=1.5,8.7Hz,1H),4.39(q,J=7.2Hz,2H),1.35(t,J=7.2Hz,3H)。
步骤3:6-溴-1H-吲唑-1,3-二羧酸1-叔丁酯3-乙酯的制备
在搅拌状态下,在0℃下向6-溴-1H-吲唑-3-羧酸乙酯(1.68g,6.6mmol)的二氯甲烷(44mL)溶液中连续地加入N,N-二甲基氨基吡啶(20mg,0.66mmol)、三乙胺(0.26mL,7.3mmol)和(Boc)2O(0.76mL,1.65mmol)。在1小时后,将混合物加热至室温,保持3小时,并加入二氯甲烷。用水洗涤有机层,通过硫酸镁进行干燥,并在减压下浓缩。通过快速柱色谱(硅胶,Hex/EA=4∶1)将剩余物纯化,从而得到6-溴-1H-吲唑-1,3-二羧酸1-叔丁酯3-乙酯(2.2g)。
1H NMR(400MHz,DMSO-d6)δ8.29(d,J=1.6Hz,1H),8.06(d,J=8.8Hz,1H),7.67(dd,J=1.6,8.8Hz,1H),4.47(q,J=7.2Hz,2H),1.41(t,J=7.2Hz,3H)。
步骤4:6-(4-硝基苯基)-1H-吲唑-1,3-二羧酸1-叔丁酯3-乙酯的制备
在室温下将6-溴-1H-吲唑-1,3-二羧酸1-叔丁酯3-乙酯(1.3g)、对硝基苯基硼酸(666mg)、Pd(dppf)Cl2(92mg)和碳酸钾(1g)与N,N-二甲基甲酰胺/水(4∶1,20mL)的混合物搅拌24小时。加入乙酸乙酯和水。分离有机层,用水进行洗涤,通过硫酸镁进行干燥,并在减压下进行浓缩。通过快速柱色谱(硅胶,只有EA)将剩余物纯化,从而得到6-(4-硝基苯基)-1H-吲唑-1,3-二羧酸1-叔丁酯3-乙酯(1.3g)。
1H NMR(400MHz,DMSO-d6)δ8.48(s,1H),8.38(d,J=8.8Hz,2H),8.29(d,J=8.4Hz,1H),8.06(d,J=8.8Hz,2H),7.93(dd,J=1.6,8.4Hz,1H),4.48(q,J=7.2Hz,2H),1.42(t,J=7.2Hz,3H)。
步骤5:6-(4-氨基苯基)-1H-吲唑-3-羧酸乙酯的制备
在搅拌状态下,向6-(4-硝基苯基)-1H-吲唑-1,3-二羧酸1-叔丁酯3-乙酯(879mg,2.14mmol)的乙醇(40mL)溶液中加入SnCl2(2.4g,10.7mmol),并在80℃下将该混合物搅拌3小时。将该混合物冷却至室温,并加入饱和碳酸氢钠水溶液。将有机层萃取三次,并通过硫酸钠干燥汇集的有机层,并且在减压下浓缩。将剩余物在乙酸乙酯和己烷中磨碎,从而得到6-(4-氨基苯基)-1H-吲唑-3-羧酸乙酯(442mg)。
1H NMR(400MHz,DMSO-d6)δ13.80(s,1H),8.03(d,J=8.4Hz,1H),7.66(s,1H),7.53(dd,J=1.2,8.4Hz,1H),7.44(d,J=8.4Hz,2H),6.67(d,J=8.4Hz,1H),5.30(s,2H),4.39(q,J=7.2Hz,2H),1.38(t,J=7.2Hz,3H)。
示例2:6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
在搅拌状态下,向6-(4-氨基苯基)-1H-吲唑-3-羧酸乙酯(40mg)、3-三氟甲基-苯甲酸(35.2mg)、三乙胺(40μL)和HOBt(25mg)的N,N-二甲基甲酰胺溶液中加入EDCI(40.6mg)。在70℃下将该混合物搅拌12小时。将该混合物冷却至室温,并加入乙酸乙酯和水。用乙酸乙酯将该混合物萃取三次。用饱和碳酸氢钠溶液洗涤汇集的有机层,通过硫酸钠进行干燥,并在减压下进行浓缩。通过乙酸乙酯/己烷磨碎剩余物,从而得到6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯(46.6mg)。
1H NMR(400MHz,DMSO-d6)δ13.98(s,1H),10.62(s,1H),8.34(s,1H),8.30(d,J=8Hz,1H),8.13(d,J=8.8Hz,1H),7.99(d,J=8Hz,1H),7.93(d,J=8.8Hz,2H),7.86(s,1H),7.81(t,J=7.2Hz,1H),7.80(d,8.8Hz,2H),7.65(br d,J=8.8Hz,1H),4.41(q,J=6.8Hz,2H),1.40(t,J=6.8Hz,3H)。
示例3:6-(4-(5-溴噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.98(br s,1H),10.42(s,1H),8.12(d,J=8.4Hz,1H),7.90(d,J=4Hz,1H),7.85(d,J=8.4Hz,2H),7.84(s,1H),7.78(d,J=8.4Hz,2H),7.65(d,J=8.4Hz,1H),7.39(d,J=4Hz,1H),4.41(q,J=7.2Hz,2H),1.40(t,J=7.2Hz,3H)。
示例4:6-(4-(吡嗪-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.99(br s,1H),10.91(s,1H),9.33(s,1H),8.95(s,1H),8.84(s,1H),8.12(d,J=8.4Hz,1H),8.06(d,J=8.4Hz,2H),7.86(s,1H),7.80(d,J=8.4Hz,2H),7.66(d,J=8.4Hz,1H),4.41(q,J=7.2Hz,2H),1.40(t,J=7.2Hz,3H)。
示例5:6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.99(s,1H),10.73(s,1H),8.41(s,1H),8.13(d,J=8.8Hz,1H),8.07(d,J=8.8Hz,1H),8.03(d,J=6.8Hz,1H),7.93(d,J=8.8Hz,2H),7.86(s,1H),7.81(d,J=8.8Hz,2H),7.66(d,J=8.4Hz,1H),7.53-7.48(m,2H),4.42(q,J=8.8Hz,2H),1.40(t,J=8.8Hz,3H)。
示例6:6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制
备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ14.01(br s,1H),9.72(s,1H),8.11(d,J=8.8Hz,1H),7.86(d,J=8.8Hz,2H),7.83(s,1H),7.74(d,J=8.8Hz,2H),7.64(dd,J=1.2,8.8Hz,1H)6.69(s,1H),4.41(q,J=6.8Hz,2H),2.52(s,3H),2.28(s,3H),1.39(t,J=6.8Hz,3H)。
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.96(br s,1H),10.79(s,1H),8.12(d,J=11.2Hz,1H),7.93(d,J=11.6Hz,2H),7.85(s,1H),7.77(d,J=11.6Hz,2H),7.65(d,J=11.2Hz,1H),6.69(s,1H),4.41(q,J=9.6Hz,2H),1.39(t,J=9.6Hz,3H)。
示例8:6-(4-(1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑-4-酰胺基)苯
基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.88(br s,1H),10.65(s,1H),8.29(s,1H),8.12(d,J=10.8Hz,1H),8.03(d,J=11.2Hz,2H),7.84(s,1H),7.78(d,J=11.2Hz,2H),7.65(d,J=9.6Hz,1H),7.47(d,J=11.6Hz,2H),7.13(d,J=12Hz,2H),4.41(q,J=9.6Hz,2H),3.86(s,3H),1.40(t,J=9.6Hz,3H)。
示例9:6-(4-(4-硝基-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯
的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(300MHz,DMSO-d6)δ13.99(s,1H),10.81(s,1H),8.53(s,1H),8.51(d,J=8.4Hz,1H),8.35(d,J=8.4Hz,1H),7.93(d,J=8.1Hz,2H),7.88(s,1H),7.86(d,J=8.1Hz,2H),7.67(d,J=8.4Hz,1H),4.41(q,J=6.9Hz,2H),1.39(t,J=6.9)。
示例10:6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.94(br s,1H),10.92(br s,1H),9.68(s,1H),9.51(dd,J=1.6,7.2Hz,1H),8.16(d,J=7.2Hz,1H),8.13(d,J=11.6Hz,1H),7.92(d,J=11.6Hz,2H),7.87(s,1H),7.82(d,J=11.6Hz,2H),7.66(dd,J=2,11.6Hz,1H),4.41(q,J=9.2Hz,2H),1.40(t,J=9.2Hz,3H)。
示例11:6-(4-(2-(3,4-二甲氧基苯基)乙酰氨基)苯基)-1H-吲唑-3-羧酸乙酯
的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.95(br s,1H),10.24(br s,1H),8.10(d,J=11.6Hz,1H),7.80(s,1H),7.72(br s,4H),7.61(dd,J=1.6,11.6Hz,1H),6.96(d,J=2.4Hz,1H),6.91(d,J=11.2Hz,1H),6.86(dd,J=2.4,10.8Hz,1H),4.41(q,J=9.6Hz,2H),3.75(s,3H),3.72(s,3H),3.60(s,2H),1.39(t,J=9.6Hz,3H)。
示例12:6-(4-(5-(4-甲氧基苯基)呋喃-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙
酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.99(br s,1H),10.26(s,1H),8.12(d,J=11.6Hz,1H),7.92(d,J=12Hz,4H),7.86(s,1H),7.80(d,J=12Hz,2H),7.67(d,J=11.6Hz,1H),7.42(d,J=4.8Hz,1H),7.07(d,J=12.8Hz,2H),7.03(d,J=5.2Hz,1H),4.41(q,J=9.2Hz,2H),3.83(s,3H),1.40(t,J=9.2Hz,3H)。
示例13:6-(4-(3-氯异烟酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.99(s,1H),10.85(s,1H),8.81(s,1H),8.69(d,J=6.4Hz,1H),8.13(d,J=11.6hz,1H),7.82(m,5H),7.70(d,J=6.4Hz,1H),7.65(d,J=10Hz,1H),4.41(q,J=9.6Hz,2H),1.40(t,J=9.6Hz,3H)。
示例14:6-(4-(噻唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.97(br s,1H),10.51(s,1H),9.29(d,J=2.4Hz,1H),8.54(d,J=2.8Hz,1H),8.12(d,J=11.2Hz,1H),8.01(d,J=11.6hz,2H),7.85(s,1H),7.77(d,J=11.6Hz,2H),7.65(dd,J=1.6,11.2Hz,1H),4.41(q,J=9.6Hz,2H),1.39(t,J=9.2Hz,3H)。
示例15:6-(4-(4,7-二甲氧基-1-萘甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的
制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ1.40(t,3H),3.82(s,3H),4.03(s,3H),4.42(q,2H),6.94(dd,1H),7.23(dd,1H),7.66(dd,1H),7.79(m,4H),7.85(s,1H),7.94(dd,2H),8.14(m,2H),10.53(s,1H)。
示例16:6-(4-(5-(2-氯-5-(三氟甲基)苯基)呋喃-2-酰胺基)苯基)-1H-吲唑
-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ1.40(t,3H),4.42(q,2H),7.51(m,2H),7.65(dd,1H),7.80(dd,3H),7.86(dd,2H),7.91(dd,2H),8.12(dd,1H),8.49(s,1H),10.52(s,1H)。
示例17:6-(4-(2-(吡啶-4-基)噻唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的
制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ1.40(t,3H),4.42(q,2H),7.66(dd,1H),7.83(d,2H),7.92(s,1H),8.03(dd,2H),8.13(m,3H),8.67(s,1H),8.79(dd,2H),10.45(s,1H)。
示例18:6-(4-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)苯
基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.96(br s,1H),10.65(s,1H),8.48(s,1H),8.42(s,1H),8.26(s,1H),8.20(s,1H),8.14(d,J=8.8Hz,1H),7.93(d,J=8.4Hz,2H),7.87(s,1H),7.83(d,J=8.4Hz,2H),7.73(s,1H),7.67(d,J=8.8Hz,1H),4.42(q,J=7.2Hz,2H),2.20(s,3H),1.40(t,J=7.2Hz,3H)。
示例19:6-(4-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-
吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ14.01(s,1H),10.43(s,1H),8.27(s,1H),8.25(d,J=8.4Hz,1H),8.13(d,J=8.8Hz,1H),7.91(d,J=8.4Hz,2H),7.85(s,1H),7.80(s,1H),7.78(d,J=8.4Hz,2H),7.57(d,J=9.2Hz,1H),7.48(d,J=9.2Hz,1H),4.79(m,1H),4.41(q,J=7.2Hz,2H),2.31(m,4H),2.18(s,3H),1.97(m,2H),1.75(m,2H),1.40(t,J=6.8Hz,3H)。
示例20:6-(4-(3-(3,4-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯的制备
在室温下将6-(4-氨基苯基)-1H-吲唑-3-羧酸乙酯(40mg)和3,4-二氯苯基异氰酸酯与四氢呋喃(3mL;THF)的混合物搅拌24小时。加入乙酸乙酯和饱和碳酸氢钠溶液。用乙酸乙酯萃取水层,并通过硫酸镁干燥汇集的有机层,并且在减压下浓缩。通过THF/己烷将剩余物磨碎,从而得到6-(4-(3-(3,4-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯(17.4mg)。
1H NMR(400MHz,DMSO-d6)δ1.39(t,3H),4.40(q,2H),7.59(m,4H),7.71(m,2H),7.81(s,1H),8.12(m,3H),9.51(s,1H),9.21(s,1H),13.95(s,1H)。
示例21:6-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯
的制备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.97(br s,1H),9.65(br s,1H),9.42(brs,1H),8.15(d,J=2.4Hz,1H),8.10(d,J=8.4Hz,1H),7.81(s,1H),7.70(d,J=8.8Hz,2H),7.66(br s,1H),7.62(br d,J=8.8Hz,4H),4.41(q,J=7.2Hz,2H),1.39(t,J=7.2Hz,3H)。
示例22:6-(4-(3-(3,5-二(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯
的制备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ1.39(t,3H),4.40(q,2H),7.34(dd,1H),7.52(d,1H),7.61(m,3H),7.70(dd,2H),7.80(s,1H),7.90(d,1H),8.09(d,1H),9.13(br,2H),13.94(s,1H)。
示例23:6-(4-(3-(3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯的制
备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ1.39(t,3H),4.39(q,2H),7.33(d,1H),7.62(m,5H),7.70(d,2H),7.81(s,1H),8.04(s,1H),8.12(d,1H),9.00(s,1H),9.14(s,1H),13.96(s,1H)。
示例24:N-甲基-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺的
制备
步骤1:6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸的制备
在搅拌状态下,向6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯(12mg,25μmol)的THF/水/甲醇(10/1/1,2.5mL)溶液加入1N氢氧化钠水溶液(1.3mL)。将该混合物在70℃下搅拌12小时,并冷却至室温。用1N盐酸水溶液将溶液的pH调节至4-5。用乙酸乙酯萃取水溶液,并用水洗涤汇集的有机层,通过硫酸镁进行干燥,并且在减压下进行浓缩,从而得到不需纯化就用于下一个步骤的6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸(13.5mg)。
步骤2:N-甲基-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺的
制备
在搅拌状态下,向6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸(26mg,61μmol)、盐酸甲胺(6.2mg,92μmol)、HOBt(12mg,92μmol)和三乙胺(43μL,0.3mmol)的N,N-二甲基甲酰胺(0.6mL)溶液中加入EDCI(18mg,92μmol)。在70℃下将该混合物搅拌12小时之后,将该混合物冷却至室温,并加入乙酸乙酯和饱和碳酸氢钠溶液。用乙酸乙酯萃取水层,并通过硫酸镁干燥汇集的有机层,并且在减压下进行浓缩。在乙酸乙酯/己烷中磨碎剩余物,从而得到N-甲基-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺(20mg)。
1H NMR(400MHz,DMSO-d6)δ13.62(br s,1H),10.61(s,1H),8.37(q,J=4.8Hz,1H),8.32(s,1H),8.30(d,J=7.6Hz,1H),8.22(d,J=8.4Hz,1H),7.99(d,J=8Hz,1H),7.92(d,J=8.8Hz,2H),7.80(m,4H),7.58(d,J=8.8Hz,1H),2.82(d,J=4.8Hz,3H)。
示例25:6-(4-(5-(4-甲氧基苯基)呋喃-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-
酰胺的制备
通过重复在示例24中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.62(br s,1H),10.26(s,1H),8.39(q,J=6Hz,1H),8.22(d,J=11.2Hz,1H),7.93(d,J=12Hz,2H),7.91(d,J=11.6Hz,2H),7.80(s,1H),7.79(d,J=11.6Hz,2H),7.59(d,J=11.6Hz,1H),7.42(d,J=4.8Hz,1H),7.07(d,J=12Hz,2H),7.05(d,J=5.6Hz,1H),3.83(s,3H),2.83(d,J=6.4Hz,3H)。
示例26:6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺的制备
通过重复在示例24中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.61(brs,1H),10.42(s,1H),8.38(q,J=4.5Hz,1H),8.21(d,J=8.4Hz,1H),7.90(d,J=3.9Hz,1H),7.85(d,J=8.7Hz,2H),7.79(s,1H),7.77(d,J=8.7Hz,2H),7.57(d,J=8.4Hz,1H),7.39(d,J=4.2Hz,1H),2.82(d,J=4.5Hz,3H)。
示例27:6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺的制
备
通过重复在示例24中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.62(br s,1H),10.67(s,1H),8.41(s,1H),8.38(m,1H),8.22(d,J=8.4Hz,1H),8.07-8.00(m,3H),7.93(d,J=8.7Hz,2H),7.80(d,J=8.7Hz,2H),7.80(s,1H),7.69(d,J=8.4Hz,1H),7.54-7.44(m,2H),2.83(d,J=4.8Hz,3H)。
示例28:6-(4-(3-(3,5-二(三氟甲基)苯基)脲基)苯基)-N-甲基-1H-吲唑-3-
酰胺的制备
通过重复在示例24中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ2.81(d,3H),7.36(dd,1H ),7.52(m,3H),7.58(m,2H),7.68(dd,2H),7.74(s,1H),7.90(d,1H),8.18(d,1H),8.35(q,1H),9.20(s,1H),9.30(s,1H),13.94(s,1H)1H),8.09(d,1H),9.13(宽,2H),13.94(s,1H)。
示例29:N-甲基-6-(4-(3-(3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-酰胺
的制备
通过重复在示例24中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ2.83(d,3H),7.30(q,1H),7.52(m,2H),7.60(m,3H),7.69(dd,2H),7.74(s,1H),8.04(s,1H),8.19(d,1H)8.35(q,1H),9.12(s,1H),9.27(s,1H),13.56(s,1H)。
示例30:N-(2-吗啉代乙基)-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲
唑-3-酰胺的制备
步骤1:6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸的制备
通过重复在示例24中的步骤1中描述的过程来制备题述化合物。
步骤2:N-(2-吗啉代乙基)-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑
-3-酰胺的制备
在搅拌状态下,向6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸(6mg,14μmol)、吗啉代乙胺(3μL,17μmol)、HOBt(3mg,17μmol)和三乙胺(4μL,28μmol)的N,N-二甲基甲酰胺(0.3mL)溶液中加入EDCI(4mg,21μmol)。在70℃下将该混合物搅拌12小时,将该混合物冷却至室温,并加入乙酸乙酯和饱和碳酸氢钠溶液。用乙酸乙酯萃取水层,并通过硫酸镁干燥汇集的有机层,并且在减压下进行浓缩。在乙酸乙酯/己烷中将剩余物磨碎,从而得到N-(2-吗啉代乙基)-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺(4mg)。
1H NMR(400MHz,DMSO-d6)δ13.61(br s,1H),10.60(s,1H),8.32(s,1H),8.30(d,J=7.6Hz,1H),8.26(t,J=8Hz,1H),8.22(d,J=8.4Hz,1H),7.99(d,J=8Hz,1H),7.92(d,J=8.8Hz,2H),7.80(m,4H),7.58(d,J=8.8Hz,1H),3.60-3.57(m,4H),3.37-3.33(m,2H),2.47(m,6H)。
示例31:6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-
酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.62(s,1H),10.41(s,1H),8.25(t,J=5.6Hz,1H),8.21(d,J=8.8Hz,1H),7.90(d,J=4Hz,1H),7.84(d,J=8.8Hz,2H),7.79(s,1H),7.77(d,J=8.8Hz,2H),7.57(dd,J=1.2,8.4Hz,1H),7.39(d,J=4Hz,1H),3.60-3.57(m,4H),3.37-3.33(m,2H),2.47(m,6H)。
示例32:6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-
酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.63(s,1H),10.66(s,1H),8.41(s,1H),8.26(t,J=5.6Hz,1H),8.22(d,J=8.4Hz,1H),8.07(br d,J=8.8Hz,2H),8.03(br d,J=7.2Hz,1H),7.92(d,J=8.8Hz,2H),7.81(s,1H),7.80(d,J=8.8Hz,2H),7.59(br d,J=8.4Hz,1H),7.52-7.48(m,2H),3.59(br t,J=4.4Hz,4H),3.47-3.42(m,2H),2.46-2.44(m,6H)。
示例33:6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲
唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(300MHz,DMSO-d6)δ13.61(br s,1H),9.72(s,1H),8.26(t,J=6Hz,1H),8.21(d,J=6.3Hz,1H),7.86(d,J=6.3Hz,2H),7.78(s,1H),7.73(d,J=6.3Hz,2H),7.56(d,J=6.3Hz,1H),6.69(s,1H),3.58(m,4H),3.45(m,2H),2.52(s,3H),2.45(m,6H),2.28(s,3H)。
示例34:6-(4-(1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑-4-酰胺基)苯
基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(300MHz,DMSO-d6)δ13.67(br s,1H),10.65(s,1H),8.29(s,1H),8.27(t,J=5.7Hz,1H),8.22(d,J=9Hz,1H),7.85(d,J=8.7Hz,2H),7.79(s,1H),7.78(d,J=8.7Hz,2H),7.57(d,J=8.4Hz,1H),7.47(d,J=8.7Hz,2H),7.13(d,J=8.7Hz,2H),3.85(s,3H),3.59(m,4H),3.44(m,2H),2.49(m,6H)。
示例35:6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-(3-(三氟甲基)苯基)-1H-吲唑
-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.94(br s,1H),10.78(s,1H),10.43(s,1H),8.45(s,1H),8.28(d,J=8.4Hz,1H),8.18(br d,J=8Hz,1H),7.91(d,J=4Hz,1H),7.87(d,J=8.8Hz,2H),7.86(s,1H),7.81(d,J=8.8Hz,2H),7.65(d,J=8.8Hz,1H),7.60(t,J=8Hz,1H),7.45(d,J=7.2Hz,1H),7.40(d,J=4Hz,1H)。
示例36:6-(4-(3-(3,4-二氯苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-
酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ2.47(m,6H),3.37-3.33(m,2H),3.60-3.57(m,4H),7.48(dd,1H),7.67(m,5H),7.75(s,1H),8.18(m,3H),8.24(m,1H),9.63(s,1H),10.00(s,1H),13.59(s,1H)。
示例37:N-甲基-6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-酰胺的制备
步骤1:6-(4-硝基苯基)-1H-吲唑-3-羧酸的制备
在搅拌状态下,向6-(4-硝基苯基)-1H-吲唑-1,3-二羧酸1-叔丁酯3-乙酯(200mg,0.49mmol)的THF/水/甲醇(10/1/1,44mL)溶液中加入1N氢氧化钠水溶液(24mL)。在70℃下将该混合物搅拌12小时,并冷却至室温。用1N盐酸水溶液将溶液的pH调节至4-5。用乙酸乙酯萃取水溶液,并用水洗涤汇集的有机层,通过硫酸镁进行干燥,并在减压下进行浓缩,从而得到无需纯化就用于下一个步骤中的6-(4-硝基苯基)-1H-吲唑-3-羧酸(127mg)。
步骤2:N-甲基-6-(4-硝基苯基)-1H-吲唑-3-酰胺的制备
在搅拌状态下,向6-(4-硝基苯基)-1H-吲唑-3-羧酸(140mg,0.5mmol)、盐酸甲胺(45mg,0.6mmol)、HOBt(80mg,0.6mmol)和三乙胺(0.3mL,2mmol)的N,N-二甲基甲酰胺(5mL)溶液中加入EDCI(142mg,0.7mmol)。在70℃下将该混合物搅拌12小时之后,将该混合物冷却至室温,并加入乙酸乙酯和饱和碳酸氢钠溶液。用乙酸乙酯萃取水层,并通过硫酸镁干燥汇集的有机层,并且在减压下浓缩,从而得到N-甲基-6-(4-硝基苯基)-1H-吲唑-3-酰胺(70mg)。
1H NMR(400MHz,DMSO-d6)δ13.78(s,1H),8.41(q,J=4.8Hz,1H),8.34(d,J=8.8Hz,2H),8.29(d,J=8Hz,1H),8.06(d,J=8.8Hz,2H),7.96(s,1H),7.65(dd,J=1.2,8.8Hz,1H),2.83(d,J=4.8Hz,3H)。
步骤3:6-(4-氨基苯基)-N-甲基-1H-吲唑-3-酰胺的制备
在搅拌状态下,向N-甲基-6-(4-硝基苯基)-1H-吲唑-3-酰胺(154mg,0.52mmol)的乙醇(10mL)溶液中加入SnCl2(588mg,2.6mmol),并在80℃下将该混合物搅拌3小时。将该混合物冷却至室温,并加入饱和碳酸氢钠水溶液。将有机层萃取三次,并通过硫酸钠将汇集的有机层干燥,并且在减压下进行浓缩。在乙酸乙酯和己烷中磨碎剩余物,从而得到6-(4-氨基苯基)-N-甲基-1H-吲唑-3-酰胺(130mg)。
1H NMR(400MHz,DMSO-d6)δ13.43(s,1H),8.31(q,J=4.8Hz,1H),8.12(d,J=8.8Hz,1H),7.66(s,1H),7.45(d,J=8.4Hz,1H),7.44(d,J=8.4Hz,2H),6.66(d,J=8Hz,2H),2.81(d,J=4Hz,3H)。
步骤4:N-甲基-6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-酰胺的制备
在搅拌状态下,向6-(4-氨基苯基)-N-甲基-1H-吲唑-3-酰胺(15mg,56μmol)、哒嗪-4-羧酸(9mg,73μmol)、三乙胺(24μL,169μmol)和HOBt(10mg,73μmol)的N,N-二甲基甲酰胺(0.6mL)溶液中加入EDCI(16mg,85μmol)。在70℃下将该混合物搅拌12小时。将该混合物冷却至室温,并加入乙酸乙酯和水。用乙酸乙酯将该混合物萃取三次。用饱和碳酸氢钠溶液洗涤汇集的有机层,通过硫酸钠进行干燥,并在减压下进行浓缩。通过乙酸乙酯/己烷磨碎剩余物,从而得到N-甲基-6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-酰胺(12mg)。
1H NMR(400MHz,DMSO-d6)δ13.61(br s,1H),10.84(br s,1H),9.68(s,1H),9.51(d,J=4Hz,1H),8.38(q,J=4.4Hz,1H),8.22(d,J=8.4Hz,1H),8.15(dd,J=2.4,5.2Hz,1H),7.91(d,J=8.4Hz,2H),7.81(d,J=8.4Hz,2H),7.80(s,1H),7.58(dd,J=1.2,8.4Hz,1H),2.83(d,J=4.8Hz,3H)。
通过重复在示例37中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.59(br s,1H),10.78(s,1H),8.37(q,J=4.4Hz,1H),8.21(d,J=8.4Hz,1H),7.92(d,J=8.4Hz,2H),7.78(s,1H),7.77(d,J=8.4Hz,2H),7.56(d,J=8.4Hz,1H),6.69(s,1H),2.82(d,J=4.4Hz,3H),2.51(s,3H)
示例39:N-甲基-6-(4-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)
苯基)-1H-吲唑-3-酰胺的制备
通过重复在示例38中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.58(br s,1H),10.64(s,1H),8.48(s,1H),8.42(s,1H),8.37(q,J=4.8Hz,1H),8.26(s,1H),8.22(d,J=8.4Hz,1H),8.20(s,1H),7.92(d,J=8.8Hz,2H),7.82(d,J=8.8Hz,2H),7.81(s,1H),7.74(s,1H),7.59(d,J=8.4Hz,1H),2.83(d,J=4.8Hz,3H),2.20(s,3H)。
示例40:N-甲基-6-(4-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)
苯基)-1H-吲唑-3-酰胺的制备
通过重复在示例37中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.59(s,1H),10.42(s,1H),8.27(s,1H),8.26(d,J=7.6Hz,1H),8.22(d,J=8Hz,1H),7.90(d,J=8.8Hz,2H),7.78(s,1H),7.77(d,J=8.8Hz,2H),7.57(d,J=9.2Hz,1H),7.49(d,J=9.2Hz,1H),4.79(m,1H),2.83(d,J=4.8Hz,3H),2.31(m,4H),2.21(s,3H),1.98(m,2H),1.75(m,2H)。
示例41:N-(4-(3-(甲基氨基甲酰基)-1H-吲唑-6-基)苯基)噻唑-4-酰胺的制
备
通过重复在示例37中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.61(br s,1H),10.50(s,1H),9.29(d,J=2Hz,1H),8.53(d,J=1.6Hz,1H),8.38(q,J=4.4Hz,1H),8.21(d,J=8.4Hz,1H),8.00(d,J=8.8Hz,2H),7.79(s,1H),7.76(d,J=8.4Hz,2H),7.57(dd,J=1.6,8.4Hz,1H),2.82(d,J=4.8Hz,3H)。
示例42:5-(4-氨基苯基)-1H-吲唑-3-羧酸甲酯的制备
通过重复在示例1中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.88(s,1H),8.11(s,1H),7.65(s,2H),7.38(d,J=8.4Hz,2H),6.67(d,J=8.4Hz,2H),5.23(s,2H),3.93(s,3H)。
示例43:5-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯
的制备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.97(s,1H),9.26(s,1H),9.08(s,1H),8.45(d,J=8Hz,1H),8.42(d,J=2.4Hz,1H),8.36(s,1H),8.18(d,J=8.4Hz,1H),8.14(s,1H),8.04(d,J=8Hz,1H),7.75(d,J=8.8Hz,1H),7.65(m,3H),4.05(s,3H)。
示例44:6-(3-氨基苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例1中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.80(s,1H),8.03(d,J=8.4Hz,1H),7.66(s,1H),7.53(dd,J=1.2,8.4Hz,1H),7.44(d,J=8.4Hz,2H),6.67(d,J=8.4Hz,1H),5.30(s,2H),4.39(q,J=7.2Hz,2H),1.38(t,J=7.2Hz,3H)。
示例45:6-(3-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制
备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ0.60(s,1H),8.34(s,1H),8.30(d,J=8.8Hz,1H),8.18(s,1H),8.16(d,J=8.4Hz,1H),7.97(d,J=7.2Hz,1H),7.86-7.79(m,3H),7.63(d,J=8.8Hz,1H),7.52(m,2H),4.43(q,J=7.2Hz,2H),1.39(t,J=7.2Hz,3H)。
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ14.02(s,1H),10.76(s,1H),8.21(s,1H),8.15(d,J=8.8Hz,1H),7.83(s,1H),7.62(d,J=8.4Hz,1H),7.51(m,3H),6.69(s,1H),4.40(q,J=7.2Hz,2H),2.51(s,3H),1.39(t,J=7.2Hz,3H)。
示例47:6-(3-(苯并[b]噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ14.03(s,1H),10.66(s,1H),8.41(s,1H),8.20(s,1H),8.17(d,J=8.4Hz,1H),8.07(d,J=6.8Hz,1H),8.03(d,J=6.8Hz,1H),7.86(s,1H),7.83(m,1H),7.64(d,J=9.6Hz,1H),7.50(m,4H),4.42(q,J=6.8Hz,2H),1.40(t,J=6.8Hz,3H)。
示例48:6-(3-(2-(3,4-二甲氧基苯基)乙酰氨基)苯基)-1H-吲唑-3-羧酸乙酯
的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.98(s,1H),10.25(s,1H),8.13(d,J=8.4Hz,1H),8.02(s,1H),7.78(s,1H),7.57(d,J=8.4Hz,1H),7.42(d,J=5.2Hz,2H),6.96(s,1H),6.89(t,J=8.4Hz,1H),6.86(d,J=8.4Hz,1H),4.41(q,J=7.2Hz,2H),3.75(s,3H),3.72(s,3H),3.59(s,2H),1.39(t,J=7.2Hz,3H)。
示例49:6-(3-(5-溴噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ14.01(s,1H),10.42(s,1H),8.15(d,J=8.4Hz,1H),8.11(s,1H),7.91(d,J=4.4Hz,1H),7.83(s,1H),7.76(br d,J=4.8Hz,1H),7.62(br d,J=8.8Hz,1H),7.51(m,2H),7.40(d,J=4Hz,1H),4.41(q,J=7.2Hz,2H),1.39(t,J=7.2Hz,3H)。
示例50:N-(2-吗啉代乙基)-6-(3-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲
唑-3-酰胺的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.67(s,1H),10.48(s,1H),8.29-8.24(m,2H),8.15(s,1H),7.84(br d,J=7.2Hz,1H),7.79(s,1H),7.76(s,1H),7.69(s,1H ),7.57-7.52(m,2H),7.41(s,1H),3.78(m,4H),3.58(m,4H),3.44(m,2H),3.32(m,4H),2.43(m,6H)。
示例51:6-(3-氨基苯基)-1H-吲唑-3-羧酸甲酯的制备
通过重复在示例1中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.95(s,1H),8.09(d,J=8.4Hz,1H),7.71(s,1H),7.53(dd,J=1.6,8.8Hz,1H),7.13(t,J=8Hz,1H),6.91(br s,1H),6.85(d,J=8.4Hz,1H),6.60(br d,J=7.2Hz,1H),5.22(br s,2H),3.93(s,3H)。
示例52:6-(3-(3-吗啉代-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸
甲酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(300MHz,DMSO-d6)δ14.05(br s,1H),10.50(s,1H),8.16(d,J=8.7Hz,1H),8.15(s,1H),7.85(br s,2H),7.76(s,1H),7.69(s,1H),7.64(d,J=8.7Hz,1H),7.50(m,2H),7.41(s,1H),3.94(s,3H),3.77(m,4H),3.31(m,4H)。
示例53:6-(5-氨基-2-甲基苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例1中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.89(s,1H),8.06(d,J=8.4Hz,1H),7.46(s,1H),7.24(d,J=8.4Hz,1H),6.95(d,J=8Hz,1H),6.51(d,J=8Hz,1H),6.50(s,1H),4.96(br s,1H),4.40(q,J=7.2Hz,2H),2.05(s,3H),1.38(t,J=7.2Hz,3H)。
示例54:6-(3-(3-(2,3-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.99(s,1H),9.67(s,1H),8.54(s,1H),8.19(dd,J=1.6,8Hz,1H),8.14(d,J=8.8Hz,1H),7.93(s,1H),7.82(s,1H),7.60(d,J=8.8Hz,1H),7.45-7.29(m,5H),4.41(q,J=7.2Hz,2H),1.39(t,J=7.2Hz,3H)。
示例55:6-(3-(3-(3,4-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.97(s,1H),9.14(s,1H),9.03(s,1H),8.15(d,J=8.4Hz,1H),7.93(d,J=8.8Hz,2H),7.82(s,1H),7.60(d,J=8.4Hz,1H),7.53(d,J=8.8Hz,1H),7.37(m,4H),4.41(q,J=7.2Hz,2H),1.41(t,J=7.2Hz,3H)。
示例56:6-(3-(3-(2,4-二甲基苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯的制备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ14.04(br s,1H),9.13(s,1H),8.13(d,J=8.4Hz,1H),7.92(s,2H),7.81(s,1H),7.67(d,J=8Hz,1H),7.60(d,J=8.8Hz,1H),7.41(s,1H),7.40(t,J=8Hz,1H),6.99(s,1H),6.95(d,J=8Hz,1H),3.94(s,3H),2.23(s,3H),2.21(s,3H)。
示例57:6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-1H-吲唑-3-
羧酸乙酯的制备
通过重复在示例20中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.95(s,1H),9.17(s,1H),8.86(s,1H),8.11(d,J=8Hz,1H),8.10(s,1H),7.62-7.58(m,2H),7.54(s,1H),7.46(d,J=2Hz,1H),7.36(dd,J=2.4,8.4Hz,1H),7.30(d,J=8.4Hz,1H),7.24(d,J=8.4Hz,1H),4.41(q,J=7.2Hz,2H),2.18(s,3H),1.39(t,J=7.2Hz,3H)。
示例58:6-(3-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-N-(2-吗啉代乙
基)-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.61(s,1H),8.25-8.22(m,2H),8.16(s,1H),7.96(s,1H),7.75(s,1H),7.70(d,J=11.2Hz,1H),7.60(d,J=8.8Hz,1H),7.52(d,J=8.4Hz,1H),7.46(d,J=8Hz,1H),7.41(d,J=7.6Hz,1H),7.36(t,J=7.6Hz,1H),3.58(m,4H),3.36(m,2H),2.40(m,6H)。
示例59:6-(3-(3-吗啉代-5-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙
基)-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.67(s,1H),10.48(s,1H),8.29-8.24(m,2H),8.15(s,1H),7.84(br d,J=7.2Hz,1H),7.79(s,1H),7.76(s,1H),7.56(br d,J=8.1Hz,1H),7.52(s,1H),7.51(d,J=7.6Hz,1H),7.41(s,1H),3.78(m,4H),3.58(m,4H),3.44(m,2H),3.33(m,4H),2.43(m,6H)。
示例60:6-(3-(3-(2,3-二氯苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-
酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.98(s,1H),9.66(s,1H),8.54(s,1H),8.19(dd,J=1.6,8Hz,1H),8.14(d,J=8.8Hz,1H),7.93(s,1H),7.82(s,1H),7.61(d,J=8.8Hz,1H),7.45-7.30(m,5H),4.41(q,J=7.2Hz,2H),1.39(t,J=7.2Hz,3H)。
示例61:6-(3-(3-(2,3-二氯苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺的制
备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.61(s,1H),9.65(s,1H),8.53(s,1H),8.43(br s,1H),8.23(m,2H),7.93(s,1H),7.76(s,1H),7.53-7.28(m,5H),6.86(s,1H),3.60(br s,2H),1.13(br s,3H)。
示例62:6-(3-(3-(3,4-二氯苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺的制
备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.60(s,1H),9.25(br s,1H),9.13(br s,1H),8.43(br t,J=5.2Hz,1H),8.26(d,J=9.2Hz,1H),7.93(br d,J=7.2Hz,2H),7.75(s,1H),7.52(br d,J=8.4Hz,2H),7.38(m,4H),3.31(q,J=7.2Hz,2H),1.15(t,J=7.2Hz,3H)。
示例63:6-(3-(3-(2,4-二甲基苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺的
制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.72(br s,1H),9.15(s,1H),8.42(t,J=6Hz,1H),8.22(d,J=8.4Hz,1H),7.99(br s,1H),7.92(s,1H),7.74(s,1H),7.67(d,J=8.4Hz,1H),7.51(d,J=8.8Hz,1H),7.38(m,2H),7.29(br s,1H),6.96(s,1H),6.93(d,J=8.8Hz,1H),3.33(br q,J=7.2Hz,2H),2.23(s,3H),2.21(s,3H),1.15(t,J=7.2Hz,3H)。
示例64:6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-(2-吗啉代
乙基)-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.57(s,1H),9.16(s,1H),8.85(s,1H),8.27(br t,J=5.6Hz,1H),8.20(d,J=8.4Hz,1H),8.10(d,J=2.8Hz,1H),7.62(d,J=2Hz,1H),7.60(s,1H),7.49(s,1H),7.45(d,J=3Hz,1H),7.35(dd,J=2,8Hz,1H),7.24(d,J=8.4Hz,1H),7.21(dd,J=1.6,8.4Hz,1H),3.58(br t,J=4.4Hz,4H),3.45(m,2H),2.46(m,6H),2.18(s,3H)。
示例65:6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-(2-(二甲基
氨基)乙基)-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.58(s,1H),9.25(s,1H),8.93(s,1H),8.18(m,2H),8.10(d,J=2Hz,1H),7.62(m,2H),7.49(s,1H),7.45(d,J=2.5Hz,1H),7.35(dd,J=2.4,8.4Hz,1H),7.23(d,J=9.6Hz,1H),7.21(dd,J=1.5,8.4Hz,1H),3.41(q,J=6.8Hz,2H),2.44(t,J=6.8Hz,2H),2.20(s,6H),2.18(s,3H)。
示例66:6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-环丙基
-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.57(s,1H),9.18(s,1H),8.86(s,1H),8.44(d,J=4.4Hz,1H),8.19(d,J=8.4Hz,1H),8.10(s,1H),7.61(m,2H),7.47(s,1H),7.44(s,1H),7.35(d,J=8.8Hz,1H),7.23(d,J=9.6Hz,1H),7.21(d,J=9.2Hz,1H),3.32(m,1H),2.18(s,3H),1.23(m,1H),0.64(m,3H)。
示例67:6-(2-甲基-5-(3-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙
基)-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.70(s,1H),10.48(s,1H),8.30(s,1H),8.26(d,J=8Hz,1H),7.96(d,J=7.6Hz,1H),7.78(t,J=8Hz,1H),7.73(s,2H),7.52(s,1H),7.33(d,J=8.4Hz,1H),7.24(d,J=8.8Hz,1H),3.59(br s,4J),2.44(m,2.23(s,3H)。
示例68:6-(3-(3-(三氟甲基)苯基亚磺酰氨基)苯基)-1H-吲唑-3-羧酸乙酯
的制备
在搅拌状态下,在室温下向6-(3-氨基苯基)-1H-吲唑-3-羧酸乙酯(10mg)的吡啶(1mL)溶液中加入3-三氟甲基苯磺酰氯(6.3μL)。3小时后,通过蒸发去除吡啶。加入乙酸乙酯和水,并用乙酸乙酯将水层萃取三次。通过硫酸镁将汇集的有机层进行干燥,并在减压下进行浓缩。在乙酸乙酯/己烷中将磨碎剩余物,从而得到6-(3-(3-(三氟甲基)苯基亚磺酰氨基)苯基)-1H-吲唑-3-羧酸乙酯(8.6mg)。
1H NMR(400MHz,DMSO-d6)δ14.11(s,1H),10.64(s,1H),8.08(m,4H),7.83(t,J=8Hz,1H),7.43(m,4H),7.12(d,J=8.4Hz,1H),4.40(q,J=7.2Hz,2H),1.39(t,J=7.2Hz,3H)。
示例69:6-(3-(3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲基)苯
基)-1H-吲唑-3-羧酸乙酯的制备
在搅拌状态下,在室温下向4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯胺(30.6mg)的1,4-二氧杂环己烷(1mL)溶液中加入4-硝基苯基氯甲酸酯(21.6mg)。在60℃下保持1小时之后,将该混合物冷却至室温,并加入6-(3-氨基苯基)-1H-吲唑-3-羧酸乙酯(30mg)。在90℃下将该混合物搅拌12小时。加入乙酸乙酯和水,并用乙酸乙酯将水层萃取三次。通过硫酸镁将汇集的有机层进行干燥,并在减压下进行浓缩。在乙酸乙酯/己烷中磨碎剩余物,从而得到6-(3-(3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯(16.2mg)。
1H NMR(400MHz,DMSO-d6)δ13.98(s,1H),9.09(s,1H),8.93(s,1H),8.15(8.4Hz,1H),7.99(s,1H),7.93(s,1H),7.81(s,1H),7.62(m,3H),7.43(br d,J=4.4Hz,2H),7.28(m,1H),4.41(q,J=7.2Hz,2H),3.54(s,2H),2.49(m,10H),1.39(t,J=7.2Hz,3H)。
示例70:6-(3-(3-(4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基)脲基)苯基)-1H-
吲唑-3-羧酸甲酯的制备
通过重复在示例69中描述的过程来制备题述化合物。
1H NMR(300MHz,DMSO-d6)δ14.01(s,1H),9.32(br s,1H),9.21(br s,1H),8.14(d,J=8.4Hz,1H),7.93(s,1H),7.81(s,1H),7.59(br d,J=8.4Hz,1H),7.52-7.23(m,4H),6.86(s,1H),3.94(s,3H),3.61(br s,4H),2.81(br s,4H),2.21(s,3H)。
示例71:6-(2-甲基-5-(3-(4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基)脲基)苯
基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例69中描述的过程来制备题述化合物。
1H NMR(300MHz,DMSO-d6)δ13.95(s,1H),8.93(s,1H),8.74(s,1H),8.11(m,1H ),7.89(d,J=2.4Hz,1H),7.56(dd,1H),7.48(d,J=8.8Hz,1H),7.46(d,J=2.4Hz,1H),7.34(dd,J=2.4,8.4Hz,1H),7.30(dd,J=1.2,8.4Hz,1H),7.23(d,J=8.4Hz,1H),6.92(d,J=9.2Hz,1H),4.41(q,J=7.2Hz,2H),2.80(m,4H),2.44(m,4H),2.22(s,3H),2.17(s,3H),1.39(t,J=7.2Hz,3H)。
示例72:5-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-N-(2-吗啉代乙
基)-1H-吲唑-3-酰胺的制备
通过重复在示例30中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.60(s,1H),9.20(s,1H),8.98(s,1H),8.36(s,1H),8.27(br t,J=6Hz,1H),8.14(d,J=2.4Hz,1H),7.72-7.52(m,8H),3.58(br t,J=4.4Hz,4H),3.44(m,2H),2.44(m,6H),1.98(s,3H)。
示例73:N-甲基-6-(2-甲基-5-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲
酰胺基)苯基)-1H-吲唑-3-酰胺的制备
通过重复在示例24中描述的过程来制备题述化合物。
1H NMR(300MHz,DMSO-d6)δ13.92(s,1H),10.54(s,1H),8.46(s,1H),8.39(m,2H),8.23(s,1H),8.20(s,1H),8.17(s,1H),7.78(d,J=9.3Hz,1H),7.71(br s,2H),7.51(s,1H),7.35(d,J=8.4Hz,1H),7.24(d,J=8.4Hz,1H),2.83(d,J=4.5Hz,3H),2.24(s,3H),2.18(s,3H)。
示例74:6-(2-甲基-5-(3-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯基)脲基)
苯基)-1H-吲唑-3-羧酸乙酯的制备
通过重复在示例69中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.94(s,1H),9.17(s,1H),8.98(s,1H),8.18(s,1H),8.11(d,J=8.4Hz,1H),7.83(br s,2H),7.55(s,2H),7.49(d,J=2.4Hz,1H),7.47(s,1H),7.36(dd,J=2,8.4Hz,1H),7.30(d,J=8.4Hz,1H),7.25(d,J=8Hz,1H),4.42(q,J=7.2Hz,2H),2.18(s,3H),2.16(s,3H),1.39(t,J=7.2Hz,3H)。
示例75:N-甲基-6-(2-甲基-5-(3-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)
苯基)脲基)苯基)-1H-吲唑-3-酰胺的制备
通过重复在示例24中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.57(s,1H),9.21(s,1H),9.01(s,1H),8.38(m,1H),8.20(m,2H),7.84(s,2H),7.55(s,1H),7.48(m,3H),7.37(d,J=8.4Hz,1H),7.23(m,2H),6.86(s,1H),2.82(d,J=4.8Hz,3H),2.18(s,3H),2.16(s,3H)。
示例76:6-(3-(3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-
吲唑-3-羧酸乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ10.49(s,1H),8.15(m,2H),7.85(br s,2H),7.74(s,1H),7.63(m,2H),7.51(m,2H),7.36(s,1H),3.68(m,1H),1.98(m,4H),1.41(m,4H)。
示例77:6-(3-(3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-N-(2-
吗啉代乙基)-1H-吲唑-3-酰胺的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.66(s,1H),10.45(s,1H),8.27(m,2H),8.15(s,1H),7.83(d,J=7.2Hz,1H),7.79(s,1H),7.74(s,1H),7.60-7.49(m,4H),7.36(s,1H),3.71(m,4H),3.67(m,1H),3.45(m,2H),2.44(m,6H),1.83(m,4H),1.47(m,4H)。
示例78:6-(3-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-
吲唑-3-羧酸甲酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ13.99(s,1H),10.43(s,1H),8.28(m,2H),8.16(br s,2H),7.84(br s,2H),7.63(m,1H),7.47(m,3H),4.79(m,1H),3.95(s,3H),2.31(m,4H),2.17(s,3H),1.94(m,4H)。
示例79:1-(4-氯-3-(三氟甲基)苯基)-3-(3-(3-(羟基甲基)-1H-吲唑-6-基)苯
基)脲的制备
在搅拌状态下,在室温下向6-(3-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯(73.7mg)的四氢呋喃(5mL)溶液中加入氢硼化锂(0.44mL;LiBH4),然后在70℃下将该混合物搅拌12小时。加入饱和碳酸氢钠溶液和乙酸乙酯。用乙酸乙酯萃取水层,并通过硫酸镁干燥汇集的有机层,并且在减压下进行浓缩。通过快速柱色谱将剩余物纯化,从而得到1-(4-氯-3-(三氟甲基)苯基)-3-(3-(3-(羟基甲基)-1H-吲唑-6-基)苯基)脲(32.1mg)。
1H NMR(400MHz,DMSO-d6)δ12.85(s,1H),9.32(s,1H),9.09(s,1H),8.12(s,1H),7.92(m,2H),7.69-7.61(m,3H),7.41-7.36(m,4H),5.26(t,J=6Hz,1H),4.79(d,J=6Hz,2H)
示例80:6-(5-(3-(三氟甲基)苯基氨基甲酰基)噻吩-3-基)-1H-吲唑-3-羧酸
乙酯的制备
通过重复在示例2中描述的过程来制备题述化合物。
1H NMR(400MHz,DMSO-d6)δ10.64(s,1H),8.60(s,1H),8.36(m,1H),8.20(s,1H),8.05(d,J=8Hz,1H),7.94(s,2H),7.85(s,1H),7.65(t,J=8Hz,1H),7.49(d,J=5.6Hz,1H),4.39(q,J=7.2Hz,2H),1.39(t,J=7.2Hz,3H)。
示例81:6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲
唑-3-酰胺盐酸盐的制备
在搅拌状态下,在室温下向6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺(38mg,78μmol)的四氢呋喃(1mL)溶液中加入4N盐酸的二氧杂环己烷(20μL)溶液。在30分钟后,将得到的固体进行过滤并干燥,从而得到6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺盐酸盐(35mg)。
1H NMR(300MHz,DMSO-d6)δ13.79(s,1H),10.26(br s,1H),9.74(s,1H),8.77(t,J=5.6Hz,1H),8.21(d,J=8.8Hz,1H),7.87(d,J=8.8Hz,2H),7.80(s,1H),7.73(d,J=8.8Hz,2H),7.59(d,J=8.8Hz,1H),6.71(s,1H),3.98(br d,J=8.0Hz,2H),3.73(m,4H),3.59(m,2H),3.15(m,4H),2.52(s,3H),2.27(s,3H)。
实验示例1:B-Raf激酶酶化验
<1-1>MAP激酶2/Erk2由B-raf激活
将10μL氯化镁/ATP溶液(500μM ATP,75mM氯化镁)种植在艾芬道夫(eppendorf)管中。将2.5μL B-Raf-V600E种植在艾芬道失管中(最终浓度1ng),并用1.6μL灭活的MEK1(最终浓度0.4μg)进行处理。用4μL灭活的MAP激酶2/Erk2(最终浓度1.0μg)处理该混合物。并且使用溶于有序稀释的二甲亚砜中的1μL样品溶液(10mM)处理该混合物。然后,向其中加入化验稀释缓冲液I(ADBII)(最终体积38μL),从而使最终体积为38μL,并使其在30℃下反应30分钟。使用5μL的所得溶液用于下面的实验。
<1-2>髓磷脂碱性蛋白(MBP)的磷酸化
使用10μL化验稀释缓冲液来处理5μL上述得到的溶液,然后使用10μL髓磷脂碱性蛋白(MBP,2mg/mL)进行处理。在30℃下使用经过稀释的10μL稀释的(1/10)[γ32P]ATP(100μCi/管)将该混合物溶液处理10分钟。将25μL该混合物溶液沾到P81纸上,并在闪烁管中使用0.75%磷酸将纸洗涤10分钟4次,并使用丙酮洗涤5分钟1次。在闪烁管中加入5mL闪烁液(scintillationcocktail solution)之后,通过闪烁计数器来分析信号。
示例的所述化合物具有B-Raf-V600E激酶的抑制活性,并且IC50的范围为0.035-20μM。在下面的表1中示出了关于B-Raf-V600E激酶的代表性示例的激酶活性。
表1
另外,如上所述,我们使用激酶活性谱型服务(profiling service)(Millipore UK Ltd Gemini Crescent,Dundee Technology Park,Dundee DD21SW,UK)来测试示例的代表性化合物的激酶活性。在下面的表2中示出了结果。
表2
实验示例2:对A375P细胞系(恶性黑素瘤)的抗增殖活性
从美国标准菌种收藏中心(American Type Culture Collection(ATCC,Rockville,MD,US))购得A375P细胞,并在37℃的具有5%CO2的潮湿环境中保持在补充有10%FBS(Welgene)和1%青霉素/链霉素(Welgene)的DMEM介质(Welgene,Daegu,Korea)中。从具有0.05%胰岛素-0.02%EDTA的培养基取出A375P细胞,并以5×103细胞/孔的密度涂在96孔板中,然后在各种浓度的试验化合物(三倍系列稀释,12点)的处理之前,在具有5%CO2的潮湿环境中在37℃培育24小时。通过常规的3-(4,5-二甲基噻唑-2-基)-2,5-二苯基溴化四唑(MTT)还原化验来估测A357P细胞生存能力。根据制造商的用法说明,使用Cell Titer 96(Promega)来实施MTT化验。
1天后,向其中加入示例的0.5μL代表性化合物。通过10mM储备液在DMSO中的三倍系列稀释(12点)(最终浓度DMSO 0.5%)来准备示例的代表性化合物。然后,在每个孔中加入15μL染料。2小时后,将100μL停止液加入到每个孔中。24小时后,测量吸光度。使用EnVision2103(PerkinElmer;Boston,MA,US)记录590nm下的吸光度。使用GraphPad Prism 4.0软件计算IC50值。
本发明中的化合物对A375P(即,b-raf-V600E突变种被过表达的人黑素瘤细胞系)显示出1nM至10μM的范围内的GI50值。
在下面的表3中示出了代表性示例对A375P的抗增殖活性。
表3
实验示例3:蛋白印迹
使用本发明的示例64的化合物执行蛋白印迹。
通过使用含有磷酸酶抑制剂(磷酸酶抑制剂混合液(Phosphatase inhibitorcocktail)I&II)和蛋白酶抑制剂(Complete,Mini,不含EDTA;Roche AppliedScience)的RIPA缓冲液(50mM tris pH 7.4,150mM NaCl,1mM EDTA,1%NP-40,0.25%脱氧胆酸钠)来裂解A375P细胞系,并以13000rpm离心分离10分钟。总蛋白使用Bio-Rad剂(bio-rad#500-0006)进行染色,并通过与BSA(阳性对照)进行比较来量化。通过使用30%丙烯酰胺、1.5M Tris(pH8.8)、10%SDS溶液、10%PAS溶液和TEMED来制备12%凝胶。在凝胶的每一个泳道负载100μg蛋白之后,通过十二烷基硫酸钠聚丙烯酰胺凝胶电泳(SDS-PAGE,250mM Tris碱,2.5M甘氨酸,0.1%SDS,140V,电泳2小时)分离蛋白,并在200mA下以2小时转移至硝化纤维过滤器。使所得物在4℃下与抗体[兔抗-Map激酶(Zymed#61-7400)和磷-p44/42 MAP激酶(Thr202/Tyr204)(细胞信号传导#9101)]发生弱反应达1天。此外,使用含有0.05%吐温20的TBST缓冲液将其洗涤4次,每次5分钟。使所得物在室温下与二抗体[抗兔IgG(Amersham#NA934V)]发生弱反应达1小时,并通过相同方式进行洗涤。使用照相设备(Gelliance)识别蛋白区带。在图1中示出了结果。
Claims (13)
1.一种由下面的化学式1表示的吲唑衍生物或其药学上可接受的盐:
[化学式1]
其中,
R2为氢、羟基、C1-C3烷氧基或R3-(CH2)n-NH-;
R3为氢、二甲胺、吗啉基、苯基、杂芳基、取代有CF3的苯基,或C3-C6环烷基;
A为取代有R4和LR5的5-6元芳基或杂芳基;
R4为氢或C1-C3烷基;
L为-NH-或-C(O)NH-;
R5为氢、-C(O)-R6、-C(O)NH-R6或-S(O)2-R6;
R6是从由苯基、苯甲基、5元或6元杂芳基、萘基和苯并噻吩基组成的组中选择的一种,其中,每一种取代有从由以下取代基组成的组中选择的一个或两个取代基:氢、-CH3、-CF3、-OCH3、-Br、-Cl、-NO2、
n为0、1或2。
2.根据权利要求1所述的吲唑衍生物,其中,R2为氢、羟基、甲氧基、乙氧基或R3-(CH2)n-NH-。
3.根据权利要求1所述的吲唑衍生物,其中,R3为氢、二甲胺、吗啉基、苯基、取代有CF3的苯基,或环丙基。
4.根据权利要求1所述的吲唑衍生物,其中,A为取代有R4和-NHR5的苯基或噻吩基。
5.根据权利要求1所述的吲唑衍生物,其中,R4为氢或甲基。
7.根据权利要求1所述的吲唑衍生物,其中,所述R6是苯基、(三氟甲基)苯基、4-硝基-3-(三氟甲基)苯基、3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯基、4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯基、3,4-二氯苯基、4-氯-3-(三氟甲基)苯基、3,5-二(三氟甲基)苯基、3,4-二甲氧基苯基、3-吗啉代-5-(三氟甲基)苯基、2,3-二氯苯基、2,4-二甲基苯基、4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基、4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基、3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯基、4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯基、苯甲基、3,4-二甲氧基苯甲基、噻吩基、5-溴噻吩基、吡嗪基、呋喃基、2,5-二甲基呋喃基、5-(4-甲氧基苯基)呋喃基、5-(2-氯-5-(三氟甲基)苯基)呋喃基、异唑基、5-甲基异唑基、吡唑基、1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑基、哒嗪基、吡啶基、3-氯吡啶基、噻唑基、4-(2-(吡啶-4-基)噻唑基、萘基、4,7-二甲氧基萘基、苯并[b]噻吩基、嘧啶基、咪唑基、吡咯基、二氢吡咯基、唑基、三唑基、噻二唑基、苯并咪唑基、喹啉基、四氢喹啉基、苯并噻唑基、苯并噻唑苯基、苯并间二氧杂环戊烯基、吲唑基、吲哚基、吲哚基、二氢吲哚基或二氢苯并呋喃基。
8.根据权利要求1所述的吲唑衍生物,所述吲唑衍生物选自于由以下物质组成的组:
1)6-(4-氨基苯基)-1H-吲唑-3-羧酸乙酯;
2)6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
3)6-(4-(5-溴噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
4)6-(4-(吡嗪-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
5)6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
6)6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
8)6-(4-(1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
9)6-(4-(4-硝基-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
10)6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
11)6-(4-(2-(3,4-二甲氧基苯基)乙酰氨基)苯基)-1H-吲唑-3-羧酸乙酯;
12)6-(4-(5-(4-甲氧基苯基)呋喃-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
13)6-(4-(3-氯异烟酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
14)6-(4-(噻唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
15)6-(4-(4,7-二甲氧基-1-萘甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
16)6-(4-(5-(2-氯-5-(三氟甲基)苯基)呋喃-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
17)6-(4-(2-(吡啶-4-基)噻唑-4-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
18)6-(4-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
19)6-(4-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
20)6-(4-(3-(3,4-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
21)6-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
22)6-(4-(3-(3,5-二(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
23)6-(4-(3-(3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
24)N-甲基-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
25)6-(4-(5-(4-甲氧基苯基)呋喃-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺;
26)6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺;
27)6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-N-甲基-1H-吲唑-3-酰胺;
28)6-(4-(3-(3,5-二(三氟甲基)苯基)脲基)苯基)-N-甲基-1H-吲唑-3-酰胺;
29)N-甲基-6-(4-(3-(3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-酰胺;
30)N-(2-吗啉代乙基)-6-(4-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
31)6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
32)6-(4-(苯并[b]噻吩-2-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
33)6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
34)6-(4-(1-(4-甲氧基苯基)-5-(三氟甲基)-1H-吡唑-4-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
35)6-(4-(5-溴噻吩-2-酰胺基)苯基)-N-(3-(三氟甲基)苯基)-1H-吲唑-3-酰胺;
36)6-(4-(3-(3,4-二氯苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
37)N-甲基-6-(4-(哒嗪-4-酰胺基)苯基)-1H-吲唑-3-酰胺;
39)N-甲基-6-(4-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
40)N-甲基-6-(4-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
41)N-(4-(3-(甲基氨基甲酰基)-1H-吲唑-6-基)苯基)噻唑-4-酰胺;
42)5-(4-氨基苯基)-1H-吲唑-3-羧酸甲酯;
43)5-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯;
44)6-(3-氨基苯基)-1H-吲唑-3-羧酸乙酯;
45)6-(3-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
47)6-(3-(苯并[b]噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
48)6-(3-(2-(3,4-二甲氧基苯基)乙酰氨基)苯基)-1H-吲唑-3-羧酸乙酯;
49)6-(3-(5-溴噻吩-2-酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
50)N-(2-吗啉代乙基)-6-(3-(3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
51)6-(3-氨基苯基)-1H-吲唑-3-羧酸甲酯;
52)6-(3-(3-吗啉代-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸甲酯;
53)6-(5-氨基-2-甲基苯基)-1H-吲唑-3-羧酸乙酯;
54)6-(3-(3-(2,3-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
55)6-(3-(3-(3,4-二氯苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
56)6-(3-(3-(2,4-二甲基苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯;
57)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-1H-吲唑-3-羧酸乙酯;
58)6-(3-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
59)6-(3-(3-吗啉代-5-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
60)6-(3-(3-(2,3-二氯苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
61)6-(3-(3-(2,3-二氯苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺;
62)6-(3-(3-(3,4-二氯苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺;
63)6-(3-(3-(2,4-二甲基苯基)脲基)苯基)-N-乙基-1H-吲唑-3-酰胺;
64)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
65)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-(2-(二甲基氨基)乙基)-1H-吲唑-3-酰胺;
66)6-(5-(3-(4-氯-3-(三氟甲基)苯基)脲基)-2-甲基苯基)-N-环丙基-1H-吲唑-3-酰胺;
67)6-(2-甲基-5-(3-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
68)6-(3-(3-(三氟甲基)苯基亚磺酰氨基)苯基)-1H-吲唑-3-羧酸乙酯;
69)6-(3-(3-(4-((4-乙基哌嗪-1-基)甲基)-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
70)6-(3-(3-(4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸甲酯;
71)6-(2-甲基-5-(3-(4-(4-甲基哌嗪-1-基)-3-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
72)5-(4-(3-(4-氯-3-(三氟甲基)苯基)脲基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
73)N-甲基-6-(2-甲基-5-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-酰胺;
74)6-(2-甲基-5-(3-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-羧酸乙酯;
75)N-甲基-6-(2-甲基-5-(3-(3-(4-甲基-1H-咪唑-1-基)-5-(三氟甲基)苯基)脲基)苯基)-1H-吲唑-3-酰胺;
76)6-(3-(3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸乙酯;
77)6-(3-(3-(4-羟基哌啶-1-基)-5-(三氟甲基)苯甲酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺;
78)6-(3-(4-(1-甲基哌啶-4-基氧)-3-(三氟甲基)苯甲酰胺基)苯基)-1H-吲唑-3-羧酸甲酯;
79)1-(4-氯-3-(三氟甲基)苯基)-3-(3-(3-(羟基甲基)-1H-吲唑-6-基)苯基)脲;
80)6-(5-(3-(三氟甲基)苯基氨基甲酰基)噻吩-3-基)-1H-吲唑-3-羧酸乙酯;或
81)6-(4-(2,5-二甲基呋喃-3-酰胺基)苯基)-N-(2-吗啉代乙基)-1H-吲唑-3-酰胺盐酸盐。
9.一种含有由权利要求1中的化学式1表示的吲唑衍生物或其药学上可接受的盐作为活性成分的用于预防或治疗由异常细胞增殖引起的疾病的药物组合物。
10.根据权利要求9所述的药物组合物,其中,所述吲唑衍生物抑制从由b-raf、KDR、Fms、Tie2、SAPK2a和Ret组成的组中选择的蛋白激酶。
11.根据权利要求9所述的药物组合物,其中,由异常细胞增殖引起的疾病选自于由胃癌、肺癌、肝癌、结直肠癌、胰腺癌、脑癌、骨癌、黑素瘤癌、乳腺癌、结节性硬化病、子宫癌、子宫颈癌、头颈癌、食道癌、甲状腺癌、甲状旁腺癌、肾细胞癌、骨肉瘤、前列腺癌、尿道癌、膀胱癌、血癌、淋巴瘤、牛皮癣和纤维腺瘤组成的组。
12.根据权利要求11所述的药物组合物,其中,所述血癌选自于由白血病、多发性骨髓瘤和骨髓增生异常综合症组成的组。
13.根据权利要求11所述的药物组合物,其中,所述淋巴瘤是霍奇金病或非霍奇金淋巴瘤。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| KR10-2008-0122999 | 2008-12-05 | ||
| KR1020080122999A KR101061599B1 (ko) | 2008-12-05 | 2008-12-05 | 비정상 세포 성장 질환의 치료를 위한 단백질 키나아제 저해제인 신규 인다졸 유도체, 이의 약학적으로 허용가능한염 및 이를 유효성분으로 함유하는 약학적 조성물 |
| PCT/KR2009/007247 WO2010064875A2 (en) | 2008-12-05 | 2009-12-04 | Novel indazole derivatives or pharmaceutically acceptable salts thereof as protein kinase inhibitors for proliferative diseases treatment, and a pharmaceutical composition containing the same as an active ingredient |
Publications (1)
| Publication Number | Publication Date |
|---|---|
| CN102239150A true CN102239150A (zh) | 2011-11-09 |
Family
ID=42233759
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN2009801489968A Pending CN102239150A (zh) | 2008-12-05 | 2009-12-04 | 作为用于增殖性疾病治疗的蛋白激酶抑制剂的新型吲唑衍生物或其药学上可接受的盐以及含有其作为活性成分的药物组合物 |
Country Status (5)
| Country | Link |
|---|---|
| US (1) | US8754209B2 (zh) |
| JP (1) | JP5537561B2 (zh) |
| KR (1) | KR101061599B1 (zh) |
| CN (1) | CN102239150A (zh) |
| WO (1) | WO2010064875A2 (zh) |
Cited By (7)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104045625A (zh) * | 2013-03-15 | 2014-09-17 | 辉瑞大药厂 | 活化ampk 的吲哚类和吲唑类化合物 |
| CN104245688A (zh) * | 2012-04-10 | 2014-12-24 | 辉瑞大药厂 | 活化ampk的吲哚和吲唑类化合物 |
| WO2019119481A1 (zh) * | 2017-12-21 | 2019-06-27 | 中国科学院合肥物质科学研究院 | 吲唑类衍生物激酶抑制剂 |
| CN110291084A (zh) * | 2016-12-15 | 2019-09-27 | 加利福尼亚大学董事会 | 用于治疗癌症的组合物和方法 |
| CN111138426A (zh) * | 2018-11-02 | 2020-05-12 | 安徽中科拓苒药物科学研究有限公司 | 吲唑类激酶抑制剂及其用途 |
| CN112135821A (zh) * | 2018-05-07 | 2020-12-25 | 方济各安吉利克化学联合股份有限公司 | 作为糖原合酶激酶3β抑制剂的1H-吲唑-3-甲酰胺化合物 |
| CN115650985A (zh) * | 2016-04-15 | 2023-01-31 | 癌症研究科技有限公司 | 作为ret激酶抑制剂的杂环化合物 |
Families Citing this family (88)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| PE20091623A1 (es) * | 2008-02-29 | 2009-11-19 | Array Biopharma Inc | DERIVADOS DE 1H-PIRAZOLO[3,4-b]PIRIDINA COMO INHIBIDORES DE RAF QUINASA |
| US20110003859A1 (en) * | 2008-02-29 | 2011-01-06 | Array Biopharma Inc. | N- (6-aminopyridin-3-yl) -3- (sulfonamido) benzamide derivatives as b-raf inhibitors for the treatment of cancer |
| US20110003809A1 (en) * | 2008-02-29 | 2011-01-06 | Array Biopharma Inc. | Imidazo [4,5-b] pyridine derivatives used as raf inhibitors |
| MX2010009410A (es) * | 2008-02-29 | 2010-11-30 | Array Biopharma Inc | Compuestos del inhibidor de raf y métodos de uso de los mismos. |
| EP3001903B1 (en) | 2009-12-21 | 2017-10-25 | Samumed, LLC | 1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| MY191934A (en) | 2010-05-20 | 2022-07-19 | Array Biopharma Inc | Macrocyclic compounds as trk kinase inhibitors |
| WO2012088266A2 (en) | 2010-12-22 | 2012-06-28 | Incyte Corporation | Substituted imidazopyridazines and benzimidazoles as inhibitors of fgfr3 |
| PE20141678A1 (es) | 2011-09-14 | 2014-11-21 | Samumed Llc | Indazol-3-carboxamidas y su uso como inhibidores de la ruta de senalizacion de wnt/b-catenina |
| KR20130077390A (ko) * | 2011-12-29 | 2013-07-09 | 제이더블유중외제약 주식회사 | 단백질 키나아제 저해활성을 가지는 6-아미노-3-카복스아미도인다졸 유도체 |
| BR112014018450A8 (pt) * | 2012-01-25 | 2017-07-11 | Bayer Ip Gmbh | Fenilimidazopirazoles substituídos e sua utilização |
| PH12017500997A1 (en) | 2012-04-04 | 2018-02-19 | Samumed Llc | Indazole inhibitors of the wnt signal pathway and therapeutic uses thereof |
| EP3593800A1 (en) | 2012-05-04 | 2020-01-15 | Samumed, LLC | 1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| SG10201610416TA (en) | 2012-06-13 | 2017-01-27 | Incyte Corp | Substituted tricyclic compounds as fgfr inhibitors |
| WO2014026125A1 (en) | 2012-08-10 | 2014-02-13 | Incyte Corporation | Pyrazine derivatives as fgfr inhibitors |
| US9266892B2 (en) | 2012-12-19 | 2016-02-23 | Incyte Holdings Corporation | Fused pyrazoles as FGFR inhibitors |
| CN105120862A (zh) | 2013-01-08 | 2015-12-02 | 萨穆梅德有限公司 | Wnt信号途径的3-(苯并咪唑-2-基)-吲唑抑制剂及其治疗应用 |
| HUE036571T2 (hu) | 2013-04-19 | 2018-07-30 | Incyte Holdings Corp | Biciklusos heterociklusok mint FGFR inhibitorok |
| WO2014172639A1 (en) * | 2013-04-19 | 2014-10-23 | Ruga Corporation | Raf kinase inhibitors |
| JP6489658B2 (ja) * | 2013-04-25 | 2019-03-27 | シービーエス バイオサイエンス,カンパニー,リミテッド | 肝細胞癌において分子標的治療の感受性を増加させるための分析方法 |
| CN103739550B (zh) * | 2014-01-02 | 2016-06-01 | 中国药科大学 | 2,3-二甲基-6-脲-2h-吲唑类化合物及其制备方法与应用 |
| WO2016040182A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 2-(1h-indazol-3-yl)-1h-imidazo[4,5-c]pyridine and therapeutic uses thereof |
| WO2016040185A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 2-(1h-indazol-3-yl)-3h-imidazo[4,5-b]pyridine and therapeutic uses thereof |
| WO2016040190A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| WO2016040193A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridine and therapeutic uses thereof |
| WO2016040184A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040181A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040180A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(1h-benzo[d]imidazol-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| WO2016040188A1 (en) | 2014-09-08 | 2016-03-17 | Samumed, Llc | 3-(3h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridine and therapeutic uses thereof |
| US10851105B2 (en) | 2014-10-22 | 2020-12-01 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| US10336707B2 (en) | 2014-12-16 | 2019-07-02 | Eudendron S.R.L. | Heterocyclic derivatives modulating activity of certain protein kinases |
| EP3259269B9 (en) | 2015-02-20 | 2020-03-04 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| MA41551A (fr) | 2015-02-20 | 2017-12-26 | Incyte Corp | Hétérocycles bicycliques utilisés en tant qu'inhibiteurs de fgfr4 |
| US9580423B2 (en) | 2015-02-20 | 2017-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR4 inhibitors |
| KR20180041135A (ko) | 2015-07-16 | 2018-04-23 | 어레이 바이오파마 인크. | Ret 키나아제 억제제로서 치환된 피라졸로[1,5-a]피리딘 화합물 |
| WO2017023980A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017024004A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10206908B2 (en) | 2015-08-03 | 2019-02-19 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-pyrazolo[3,4-C]pyridines and therapeutic uses thereof |
| US10329309B2 (en) | 2015-08-03 | 2019-06-25 | Samumed, Llc | 3-(3H-imidazo[4,5-B]pyridin-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| WO2017024003A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-pyrrolo[3,2-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10226453B2 (en) | 2015-08-03 | 2019-03-12 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-pyrazolo[4,3-B]pyridines and therapeutic uses thereof |
| US10350199B2 (en) | 2015-08-03 | 2019-07-16 | Samumed, Llc | 3-(1h-pyrrolo[2,3-b]pyridin-2-yl)-1h-indazoles and therapeutic uses thereof |
| WO2017023972A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| US10285983B2 (en) | 2015-08-03 | 2019-05-14 | Samumed, Llc | 3-(1H-pyrrolo[2,3-B]pyridin-2-yl)-1H-pyrazolo[3,4-B] pyridines and therapeutic uses thereof |
| US10604512B2 (en) | 2015-08-03 | 2020-03-31 | Samumed, Llc | 3-(1H-indol-2-yl)-1H-indazoles and therapeutic uses thereof |
| US10463651B2 (en) | 2015-08-03 | 2019-11-05 | Samumed, Llc | 3-(1H-pyrrolo[3,2-C]pyridin-2-YL)-1H-indazoles and therapeutic uses thereof |
| WO2017023989A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-benzo[d]imidazol-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| WO2017023988A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(3h-imidazo[4,5-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| WO2017024025A1 (en) | 2015-08-03 | 2017-02-09 | Sunil Kumar Kc | 3-(1h-pyrrolo[2,3-c]pyridin-2-yl)-1h-pyrazolo[4,3-b]pyridines and therapeutic uses thereof |
| WO2017024026A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc | 3-(1h-indol-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017023975A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[2,3-c]pyridin-2-yl)-1h-pyrazolo[3,4-c]pyridines and therapeutic uses thereof |
| WO2017023987A1 (en) | 2015-08-03 | 2017-02-09 | Samumed, Llc. | 3-(1h-pyrrolo[3,2-c]pyridin-2-yl)-1h-pyrazolo[3,4-b]pyridines and therapeutic uses thereof |
| JP6982748B2 (ja) | 2015-11-06 | 2021-12-17 | バイオスプライス セラピューティクス インコーポレイテッド | 2−(1H−インダゾール−3−イル)−3H−イミダゾ[4,5−c]ピリジンおよびそれらの抗炎症的使用 |
| AU2017228398A1 (en) | 2016-03-03 | 2018-10-18 | Cornell University | Small molecule IRE1-alpha inhibitors |
| US10844067B2 (en) * | 2016-04-15 | 2020-11-24 | Cancer Research Technology Limited | Heterocyclic compounds as RET kinase inhibitors |
| EP3464285B1 (en) | 2016-06-01 | 2022-09-21 | BioSplice Therapeutics, Inc. | Process for preparing n-(5-(3-(7-(3-fluorophenyl)-3h-imidazo[4,5-c]pyridin-2-yl)-1h-indazol-5-yl)pyridin-3-yl)-3-methylbutanamide |
| JOP20190077A1 (ar) | 2016-10-10 | 2019-04-09 | Array Biopharma Inc | مركبات بيرازولو [1، 5-a]بيريدين بها استبدال كمثبطات كيناز ret |
| TWI704148B (zh) | 2016-10-10 | 2020-09-11 | 美商亞雷生物製藥股份有限公司 | 作為ret激酶抑制劑之經取代吡唑并[1,5-a]吡啶化合物 |
| MX2019004616A (es) | 2016-10-21 | 2019-11-21 | Samumed Llc | Métodos de uso de indazol-3-carboxamidas y su uso como inhibidores de la ruta de señalización de wnt/b-catenina. |
| MA46696A (fr) | 2016-11-07 | 2019-09-11 | Samumed Llc | Formulations injectables à dose unique prêtes à l'emploi |
| TWI795381B (zh) | 2016-12-21 | 2023-03-11 | 比利時商健生藥品公司 | 作為malt1抑制劑之吡唑衍生物 |
| WO2018136663A1 (en) | 2017-01-18 | 2018-07-26 | Array Biopharma, Inc. | Ret inhibitors |
| US11168090B2 (en) | 2017-01-18 | 2021-11-09 | Array Biopharma Inc. | Substituted pyrazolo[1,5-a]pyrazines as RET kinase inhibitors |
| JOP20190213A1 (ar) | 2017-03-16 | 2019-09-16 | Array Biopharma Inc | مركبات حلقية ضخمة كمثبطات لكيناز ros1 |
| GB201705971D0 (en) | 2017-04-13 | 2017-05-31 | Cancer Res Tech Ltd | Inhibitor compounds |
| AR111960A1 (es) | 2017-05-26 | 2019-09-04 | Incyte Corp | Formas cristalinas de un inhibidor de fgfr y procesos para su preparación |
| WO2019018562A1 (en) | 2017-07-19 | 2019-01-24 | Ideaya Biosciences, Inc. | AMIDO COMPOUND AS MODULATORS OF AHR |
| TWI791053B (zh) | 2017-10-10 | 2023-02-01 | 美商亞雷生物製藥股份有限公司 | 6-(2-羥基-2-甲基丙氧基)-4-(6-(6-((6-甲氧基吡啶-3-基)甲基)-3,6-二氮雜雙環[3.1.1]庚-3-基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈之結晶形式及其醫藥組合物 |
| TW202410896A (zh) | 2017-10-10 | 2024-03-16 | 美商絡速藥業公司 | 6-(2-羥基-2-甲基丙氧基)-4-(6-(6-((6-甲氧基吡啶-3-基)甲基)-3,6-二氮雜雙環[3.1.1]庚-3-基)吡啶-3-基)吡唑并[1,5-a]吡啶-3-甲腈之調配物 |
| WO2019143977A1 (en) | 2018-01-18 | 2019-07-25 | Array Biopharma Inc. | Substituted pyrrolo[2,3-d]pyrimidines compounds as ret kinase inhibitors |
| WO2019143991A1 (en) | 2018-01-18 | 2019-07-25 | Array Biopharma Inc. | SUBSTITUTED PYRAZOLO[3,4-d]PYRIMIDINE COMPOUNDS AS RET KINASE INHIBITORS |
| EP3740486A1 (en) | 2018-01-18 | 2020-11-25 | Array Biopharma, Inc. | Substituted pyrazolyl[4,3-c]pyridinecompounds as ret kinase inhibitors |
| JP2021523121A (ja) | 2018-05-04 | 2021-09-02 | インサイト・コーポレイションIncyte Corporation | Fgfr阻害剤の固体形態及びその調製プロセス |
| MX2020011639A (es) | 2018-05-04 | 2021-02-15 | Incyte Corp | Sales de un inhibidor de receptores de factor de crecimiento de fibroblastos (fgfr). |
| JP7296408B2 (ja) * | 2018-06-18 | 2023-06-22 | ヤンセン ファーマシューティカ エヌ.ベー. | Malt1阻害剤としてのピラゾール誘導体 |
| WO2020055672A1 (en) | 2018-09-10 | 2020-03-19 | Array Biopharma Inc. | Fused heterocyclic compounds as ret kinase inhibitors |
| CN112673001B (zh) | 2018-09-13 | 2024-06-25 | 百时美施贵宝公司 | 作为激酶抑制剂的吲唑甲酰胺 |
| US11628162B2 (en) | 2019-03-08 | 2023-04-18 | Incyte Corporation | Methods of treating cancer with an FGFR inhibitor |
| US20220388964A1 (en) * | 2019-04-12 | 2022-12-08 | Hibercell, Inc. | (aza)indazolyl-aryl sulfonamide and related compounds and their use in treating medical conditions |
| US11591329B2 (en) | 2019-07-09 | 2023-02-28 | Incyte Corporation | Bicyclic heterocycles as FGFR inhibitors |
| WO2021067374A1 (en) | 2019-10-01 | 2021-04-08 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| PE20221085A1 (es) | 2019-10-14 | 2022-07-05 | Incyte Corp | Heterociclos biciclicos como inhibidores de fgfr |
| WO2021076728A1 (en) | 2019-10-16 | 2021-04-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| CN112794820B (zh) * | 2019-11-14 | 2022-06-07 | 四川大学 | 吲唑类衍生物及其制备方法和用途 |
| PE20221504A1 (es) | 2019-12-04 | 2022-09-30 | Incyte Corp | Derivados de un inhibidor de fgfr |
| US11897891B2 (en) | 2019-12-04 | 2024-02-13 | Incyte Corporation | Tricyclic heterocycles as FGFR inhibitors |
| WO2021146424A1 (en) | 2020-01-15 | 2021-07-22 | Incyte Corporation | Bicyclic heterocycles as fgfr inhibitors |
| US12065494B2 (en) | 2021-04-12 | 2024-08-20 | Incyte Corporation | Combination therapy comprising an FGFR inhibitor and a Nectin-4 targeting agent |
| JP2024522189A (ja) | 2021-06-09 | 2024-06-11 | インサイト・コーポレイション | Fgfr阻害剤としての三環式ヘテロ環 |
Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1980918A (zh) * | 2004-06-04 | 2007-06-13 | 艾文蒂斯药品公司 | 取代的吲唑,含有它们的组合物,制备方法与用途 |
Family Cites Families (2)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2003051847A1 (en) * | 2001-12-19 | 2003-06-26 | Smithkline Beecham P.L.C. | (1-h-indazol-3-yl) -amide derivatives as gsk-3 inhibitors |
| FR2845382A1 (fr) * | 2002-10-02 | 2004-04-09 | Sanofi Synthelabo | Derives d'indazolecarboxamides, leur preparation et leur utilisation en therapeutique |
-
2008
- 2008-12-05 KR KR1020080122999A patent/KR101061599B1/ko active IP Right Grant
-
2009
- 2009-12-04 WO PCT/KR2009/007247 patent/WO2010064875A2/en active Application Filing
- 2009-12-04 JP JP2011539453A patent/JP5537561B2/ja not_active Expired - Fee Related
- 2009-12-04 CN CN2009801489968A patent/CN102239150A/zh active Pending
- 2009-12-04 US US13/132,772 patent/US8754209B2/en active Active
Patent Citations (1)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN1980918A (zh) * | 2004-06-04 | 2007-06-13 | 艾文蒂斯药品公司 | 取代的吲唑,含有它们的组合物,制备方法与用途 |
Cited By (12)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN104245688A (zh) * | 2012-04-10 | 2014-12-24 | 辉瑞大药厂 | 活化ampk的吲哚和吲唑类化合物 |
| CN104045625A (zh) * | 2013-03-15 | 2014-09-17 | 辉瑞大药厂 | 活化ampk 的吲哚类和吲唑类化合物 |
| CN115650985A (zh) * | 2016-04-15 | 2023-01-31 | 癌症研究科技有限公司 | 作为ret激酶抑制剂的杂环化合物 |
| CN110291084A (zh) * | 2016-12-15 | 2019-09-27 | 加利福尼亚大学董事会 | 用于治疗癌症的组合物和方法 |
| US12077507B2 (en) | 2016-12-15 | 2024-09-03 | The Regents Of The University Of California | Compositions and methods for treating cancer |
| WO2019119481A1 (zh) * | 2017-12-21 | 2019-06-27 | 中国科学院合肥物质科学研究院 | 吲唑类衍生物激酶抑制剂 |
| CN109942544A (zh) * | 2017-12-21 | 2019-06-28 | 中国科学院合肥物质科学研究院 | 一类新型吲唑类衍生物激酶抑制剂 |
| CN109942544B (zh) * | 2017-12-21 | 2021-06-11 | 中国科学院合肥物质科学研究院 | 一类新型吲唑类衍生物激酶抑制剂 |
| CN112135821A (zh) * | 2018-05-07 | 2020-12-25 | 方济各安吉利克化学联合股份有限公司 | 作为糖原合酶激酶3β抑制剂的1H-吲唑-3-甲酰胺化合物 |
| CN112135821B (zh) * | 2018-05-07 | 2024-05-31 | 方济各安吉利克化学联合股份有限公司 | 作为糖原合酶激酶3β抑制剂的1H-吲唑-3-甲酰胺化合物 |
| CN111138426A (zh) * | 2018-11-02 | 2020-05-12 | 安徽中科拓苒药物科学研究有限公司 | 吲唑类激酶抑制剂及其用途 |
| CN111138426B (zh) * | 2018-11-02 | 2023-03-10 | 安徽中科拓苒药物科学研究有限公司 | 吲唑类激酶抑制剂及其用途 |
Also Published As
| Publication number | Publication date |
|---|---|
| WO2010064875A3 (en) | 2010-09-10 |
| KR101061599B1 (ko) | 2011-09-02 |
| US8754209B2 (en) | 2014-06-17 |
| JP2012510989A (ja) | 2012-05-17 |
| JP5537561B2 (ja) | 2014-07-02 |
| WO2010064875A2 (en) | 2010-06-10 |
| KR20100064520A (ko) | 2010-06-15 |
| US20120130069A1 (en) | 2012-05-24 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN102239150A (zh) | 作为用于增殖性疾病治疗的蛋白激酶抑制剂的新型吲唑衍生物或其药学上可接受的盐以及含有其作为活性成分的药物组合物 | |
| CA2592118C (en) | Urea derivatives as enzyme modulators | |
| US8143293B2 (en) | Kinase inhibitors useful for the treatment of myleoprolific diseases and other proliferative diseases | |
| CN100515419C (zh) | 取代的吲哚及其作为Raf激酶抑制剂的应用 | |
| RU2559895C2 (ru) | Азотосодержащие производные гетероарилов | |
| CN103153980B (zh) | 吡唑并苯基苯磺酰胺化合物的衍生物及其作为抗肿瘤药的用途 | |
| WO2010038465A1 (ja) | 8位置換イソキノリン誘導体及びその用途 | |
| JP2016518328A (ja) | 癌治療のための化合物 | |
| WO2012034363A1 (zh) | 作为hedgehog通路抑制剂的化合物以及包含该化合物的药物组合物及其应用 | |
| WO2014040549A1 (zh) | 炔杂芳环化合物及其应用 | |
| CN109415341A (zh) | 作为TGF-βR1抑制剂的苯并三氮唑衍生的α,β不饱和酰胺类化合物 | |
| JP2005519074A (ja) | 治療用の置換インダゾール誘導体 | |
| CN110156803A (zh) | 二噁烷并喹啉类化合物及其制备方法与应用 | |
| WO2020156283A1 (zh) | 炔基嘧啶或炔基吡啶类化合物、及其组合物与应用 | |
| WO2021079962A1 (ja) | 難聴の予防および/または治療用医薬組成物 | |
| CN110563697A (zh) | 2-吡啶甲酰胺类化合物的制备及应用 | |
| EP3297991B1 (en) | Novel amidoheteroaryl aroyl hydrazide ethynes | |
| CN110835333B (zh) | 苯并咪唑取代唑类化合物及其用途 | |
| TW201309669A (zh) | 吡唑啶-3-酮衍生物 | |
| KR100744826B1 (ko) | 이미다졸기가 치환된 퀴놀리논 유도체 | |
| CN110759900B (zh) | 噻吩类化合物的制备方法和用途 | |
| KR101254546B1 (ko) | 신규 메틸이소퀴놀리논 치환된 트리아졸로피리다진 유도체 또는 이의 약학적으로 허용 가능한 염, 이의 제조방법 및 이를 유효성분으로 함유하는 이상세포 성장 질환의 예방 또는 치료용 약학적 조성물 | |
| CN106565682A (zh) | 取代吲哚满酮衍生物及其用途 | |
| US20230027716A1 (en) | Novel pyridinyltriazine derivative having protein kinase inhibitory activity, and pharmaceutical composition for preventing, ameliorating, or treating cancer comprising same | |
| CN105801584A (zh) | 新型芳酰胺类Raf激酶抑制剂及其制备方法和用途 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C02 | Deemed withdrawal of patent application after publication (patent law 2001) | ||
| WD01 | Invention patent application deemed withdrawn after publication |
Application publication date: 20111109 |