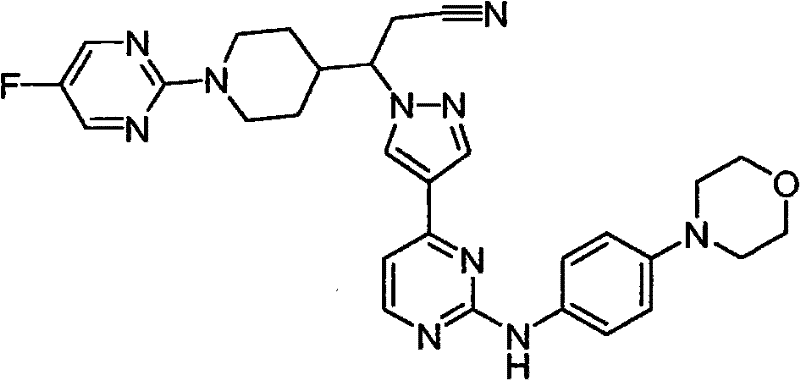
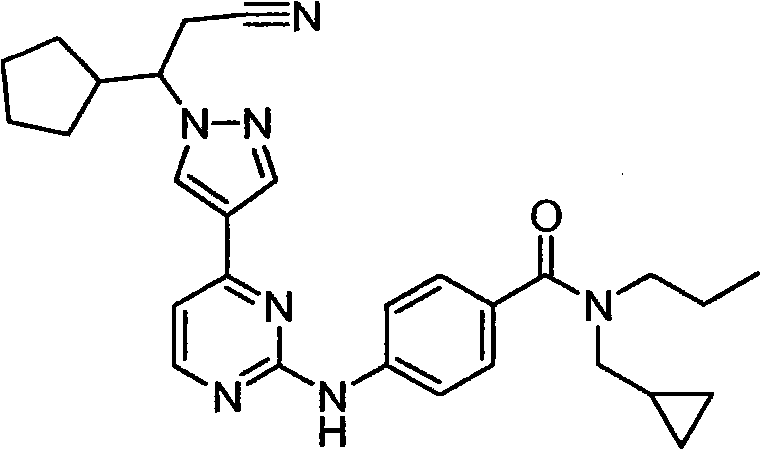
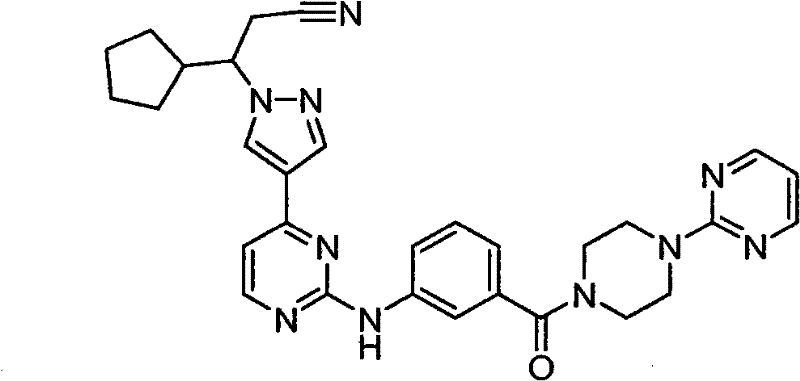
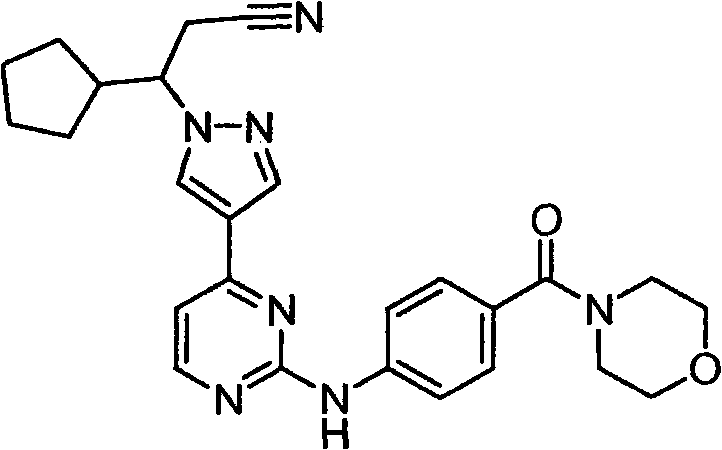
CN101910152A - 作为janus激酶抑制剂的4-吡唑基-n-芳基嘧啶-2-胺和4-吡唑基-n-杂芳基嘧啶-2-胺 - Google Patents
作为janus激酶抑制剂的4-吡唑基-n-芳基嘧啶-2-胺和4-吡唑基-n-杂芳基嘧啶-2-胺 Download PDFInfo
- Publication number
- CN101910152A CN101910152A CN2008801237892A CN200880123789A CN101910152A CN 101910152 A CN101910152 A CN 101910152A CN 2008801237892 A CN2008801237892 A CN 2008801237892A CN 200880123789 A CN200880123789 A CN 200880123789A CN 101910152 A CN101910152 A CN 101910152A
- Authority
- CN
- China
- Prior art keywords
- pyrimidine
- amino
- pyrazol
- phenyl
- cyclopentyl
- Prior art date
- Legal status (The legal status is an assumption and is not a legal conclusion. Google has not performed a legal analysis and makes no representation as to the accuracy of the status listed.)
- Granted
Links
- 229940122245 Janus kinase inhibitor Drugs 0.000 title description 3
- 108091000080 Phosphotransferase Proteins 0.000 claims abstract description 127
- 102000020233 phosphotransferase Human genes 0.000 claims abstract description 127
- 201000010099 disease Diseases 0.000 claims abstract description 87
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims abstract description 87
- 206010028980 Neoplasm Diseases 0.000 claims abstract description 46
- 201000011510 cancer Diseases 0.000 claims abstract description 40
- 230000000694 effects Effects 0.000 claims abstract description 37
- 208000014767 Myeloproliferative disease Diseases 0.000 claims abstract description 15
- 239000000203 mixture Substances 0.000 claims description 407
- 150000001875 compounds Chemical class 0.000 claims description 371
- 238000000034 method Methods 0.000 claims description 319
- WEVYAHXRMPXWCK-UHFFFAOYSA-N methyl cyanide Natural products CC#N WEVYAHXRMPXWCK-UHFFFAOYSA-N 0.000 claims description 219
- FVSKHRXBFJPNKK-UHFFFAOYSA-N propionitrile Chemical compound CCC#N FVSKHRXBFJPNKK-UHFFFAOYSA-N 0.000 claims description 148
- 150000003839 salts Chemical class 0.000 claims description 109
- WYURNTSHIVDZCO-UHFFFAOYSA-N Tetrahydrofuran Chemical compound C1CCOC1 WYURNTSHIVDZCO-UHFFFAOYSA-N 0.000 claims description 105
- -1 methoxyl group Chemical group 0.000 claims description 99
- 125000002924 primary amino group Chemical group [H]N([H])* 0.000 claims description 92
- KXDAEFPNCMNJSK-UHFFFAOYSA-N Benzamide Chemical compound NC(=O)C1=CC=CC=C1 KXDAEFPNCMNJSK-UHFFFAOYSA-N 0.000 claims description 72
- 125000003601 C2-C6 alkynyl group Chemical group 0.000 claims description 68
- 125000001997 phenyl group Chemical group [H]C1=C([H])C([H])=C(*)C([H])=C1[H] 0.000 claims description 63
- 125000000171 (C1-C6) haloalkyl group Chemical group 0.000 claims description 62
- 229910052736 halogen Inorganic materials 0.000 claims description 62
- 150000002367 halogens Chemical class 0.000 claims description 62
- 125000004415 heterocyclylalkyl group Chemical group 0.000 claims description 62
- LELOWRISYMNNSU-UHFFFAOYSA-N hydrogen cyanide Chemical compound N#C LELOWRISYMNNSU-UHFFFAOYSA-N 0.000 claims description 59
- DLFVBJFMPXGRIB-UHFFFAOYSA-N Acetamide Chemical compound CC(N)=O DLFVBJFMPXGRIB-UHFFFAOYSA-N 0.000 claims description 58
- 125000001072 heteroaryl group Chemical group 0.000 claims description 57
- 125000002490 anilino group Chemical group [H]N(*)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 56
- YLQBMQCUIZJEEH-UHFFFAOYSA-N tetrahydrofuran Natural products C=1C=COC=1 YLQBMQCUIZJEEH-UHFFFAOYSA-N 0.000 claims description 54
- KVNRLNFWIYMESJ-UHFFFAOYSA-N butyronitrile Chemical compound CCCC#N KVNRLNFWIYMESJ-UHFFFAOYSA-N 0.000 claims description 52
- 125000003118 aryl group Chemical group 0.000 claims description 47
- 125000004482 piperidin-4-yl group Chemical group N1CCC(CC1)* 0.000 claims description 45
- 125000000753 cycloalkyl group Chemical group 0.000 claims description 42
- 101000823316 Homo sapiens Tyrosine-protein kinase ABL1 Proteins 0.000 claims description 39
- 102100022596 Tyrosine-protein kinase ABL1 Human genes 0.000 claims description 38
- 238000011282 treatment Methods 0.000 claims description 37
- CFHIDWOYWUOIHU-UHFFFAOYSA-N oxomethyl Chemical compound O=[CH] CFHIDWOYWUOIHU-UHFFFAOYSA-N 0.000 claims description 35
- 101000783817 Agaricus bisporus lectin Proteins 0.000 claims description 33
- 101000588130 Homo sapiens Microsomal triglyceride transfer protein large subunit Proteins 0.000 claims description 33
- 125000004390 alkyl sulfonyl group Chemical group 0.000 claims description 26
- IMNDHOCGZLYMRO-UHFFFAOYSA-N n,n-dimethylbenzamide Chemical compound CN(C)C(=O)C1=CC=CC=C1 IMNDHOCGZLYMRO-UHFFFAOYSA-N 0.000 claims description 26
- 230000008859 change Effects 0.000 claims description 24
- 125000003236 benzoyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C(*)=O 0.000 claims description 23
- 229940043355 kinase inhibitor Drugs 0.000 claims description 21
- 239000003757 phosphotransferase inhibitor Substances 0.000 claims description 21
- 125000002915 carbonyl group Chemical group [*:2]C([*:1])=O 0.000 claims description 19
- 229910052760 oxygen Inorganic materials 0.000 claims description 19
- QVGXLLKOCUKJST-UHFFFAOYSA-N atomic oxygen Chemical compound [O] QVGXLLKOCUKJST-UHFFFAOYSA-N 0.000 claims description 18
- 239000001301 oxygen Substances 0.000 claims description 18
- 229910052717 sulfur Inorganic materials 0.000 claims description 18
- 201000007224 Myeloproliferative neoplasm Diseases 0.000 claims description 16
- 102000001253 Protein Kinase Human genes 0.000 claims description 16
- 208000027866 inflammatory disease Diseases 0.000 claims description 16
- 108060006633 protein kinase Proteins 0.000 claims description 16
- 230000001225 therapeutic effect Effects 0.000 claims description 16
- 102000042838 JAK family Human genes 0.000 claims description 15
- 108091082332 JAK family Proteins 0.000 claims description 15
- 208000032791 BCR-ABL1 positive chronic myelogenous leukemia Diseases 0.000 claims description 14
- 208000010833 Chronic myeloid leukaemia Diseases 0.000 claims description 14
- 125000003710 aryl alkyl group Chemical group 0.000 claims description 14
- WPYMKLBDIGXBTP-UHFFFAOYSA-N benzoic acid Chemical compound OC(=O)C1=CC=CC=C1 WPYMKLBDIGXBTP-UHFFFAOYSA-N 0.000 claims description 14
- 229910052799 carbon Inorganic materials 0.000 claims description 14
- 229910052739 hydrogen Inorganic materials 0.000 claims description 14
- 125000002842 L-seryl group Chemical group O=C([*])[C@](N([H])[H])([H])C([H])([H])O[H] 0.000 claims description 13
- 125000001316 cycloalkyl alkyl group Chemical group 0.000 claims description 13
- 125000004475 heteroaralkyl group Chemical group 0.000 claims description 13
- ZEOWTGPWHLSLOG-UHFFFAOYSA-N Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F Chemical compound Cc1ccc(cc1-c1ccc2c(n[nH]c2c1)-c1cnn(c1)C1CC1)C(=O)Nc1cccc(c1)C(F)(F)F ZEOWTGPWHLSLOG-UHFFFAOYSA-N 0.000 claims description 12
- 102100023593 Fibroblast growth factor receptor 1 Human genes 0.000 claims description 12
- 101710182386 Fibroblast growth factor receptor 1 Proteins 0.000 claims description 12
- 206010035226 Plasma cell myeloma Diseases 0.000 claims description 12
- 230000008591 skin barrier function Effects 0.000 claims description 12
- 208000032027 Essential Thrombocythemia Diseases 0.000 claims description 11
- 208000017733 acquired polycythemia vera Diseases 0.000 claims description 11
- 125000003545 alkoxy group Chemical group 0.000 claims description 11
- 208000037244 polycythemia vera Diseases 0.000 claims description 11
- 102100033177 Vascular endothelial growth factor receptor 2 Human genes 0.000 claims description 10
- 125000000113 cyclohexyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C([H])([H])C1([H])[H] 0.000 claims description 10
- 229940124530 sulfonamide Drugs 0.000 claims description 10
- 208000023275 Autoimmune disease Diseases 0.000 claims description 9
- 208000034578 Multiple myelomas Diseases 0.000 claims description 9
- 125000001495 ethyl group Chemical group [H]C([H])([H])C([H])([H])* 0.000 claims description 9
- 125000002496 methyl group Chemical group [H]C([H])([H])* 0.000 claims description 9
- 229910052757 nitrogen Inorganic materials 0.000 claims description 9
- 206010070834 Sensitisation Diseases 0.000 claims description 8
- 230000008313 sensitization Effects 0.000 claims description 8
- 208000033761 Myelogenous Chronic BCR-ABL Positive Leukemia Diseases 0.000 claims description 7
- 208000024908 graft versus host disease Diseases 0.000 claims description 7
- 230000002757 inflammatory effect Effects 0.000 claims description 7
- 125000004433 nitrogen atom Chemical group N* 0.000 claims description 7
- 230000001185 psoriatic effect Effects 0.000 claims description 7
- 102000005962 receptors Human genes 0.000 claims description 7
- 108020003175 receptors Proteins 0.000 claims description 7
- 210000002345 respiratory system Anatomy 0.000 claims description 7
- 210000003491 skin Anatomy 0.000 claims description 7
- KTFDYVNEGTXQCV-UHFFFAOYSA-N 2-Thiophenesulfonamide Chemical compound NS(=O)(=O)C1=CC=CS1 KTFDYVNEGTXQCV-UHFFFAOYSA-N 0.000 claims description 6
- 102100027842 Fibroblast growth factor receptor 3 Human genes 0.000 claims description 6
- 101710182396 Fibroblast growth factor receptor 3 Proteins 0.000 claims description 6
- 102000043136 MAP kinase family Human genes 0.000 claims description 6
- 108091054455 MAP kinase family Proteins 0.000 claims description 6
- 201000008736 Systemic mastocytosis Diseases 0.000 claims description 6
- 108010053099 Vascular Endothelial Growth Factor Receptor-2 Proteins 0.000 claims description 6
- 230000002159 abnormal effect Effects 0.000 claims description 6
- JFDZBHWFFUWGJE-UHFFFAOYSA-N benzonitrile Chemical compound N#CC1=CC=CC=C1 JFDZBHWFFUWGJE-UHFFFAOYSA-N 0.000 claims description 6
- 201000010902 chronic myelomonocytic leukemia Diseases 0.000 claims description 6
- RCFKEIREOSXLET-UHFFFAOYSA-N disulfamide Chemical compound CC1=CC(Cl)=C(S(N)(=O)=O)C=C1S(N)(=O)=O RCFKEIREOSXLET-UHFFFAOYSA-N 0.000 claims description 6
- 210000002615 epidermis Anatomy 0.000 claims description 6
- 206010012442 Dermatitis contact Diseases 0.000 claims description 5
- 102100031968 Ephrin type-B receptor 2 Human genes 0.000 claims description 5
- 101000932478 Homo sapiens Receptor-type tyrosine-protein kinase FLT3 Proteins 0.000 claims description 5
- 102100020718 Receptor-type tyrosine-protein kinase FLT3 Human genes 0.000 claims description 5
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 5
- 241000700605 Viruses Species 0.000 claims description 5
- 230000005784 autoimmunity Effects 0.000 claims description 5
- 102000052116 epidermal growth factor receptor activity proteins Human genes 0.000 claims description 5
- 108700015053 epidermal growth factor receptor activity proteins Proteins 0.000 claims description 5
- 208000032839 leukemia Diseases 0.000 claims description 5
- YOHYSYJDKVYCJI-UHFFFAOYSA-N n-[3-[[6-[3-(trifluoromethyl)anilino]pyrimidin-4-yl]amino]phenyl]cyclopropanecarboxamide Chemical compound FC(F)(F)C1=CC=CC(NC=2N=CN=C(NC=3C=C(NC(=O)C4CC4)C=CC=3)C=2)=C1 YOHYSYJDKVYCJI-UHFFFAOYSA-N 0.000 claims description 5
- QDDSLSJFVBRVQN-UHFFFAOYSA-N 3-[4-[2-(4-aminoanilino)pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound C1=CC(N)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 QDDSLSJFVBRVQN-UHFFFAOYSA-N 0.000 claims description 4
- 206010006895 Cachexia Diseases 0.000 claims description 4
- 101100481408 Danio rerio tie2 gene Proteins 0.000 claims description 4
- 101001012157 Homo sapiens Receptor tyrosine-protein kinase erbB-2 Proteins 0.000 claims description 4
- 101000892986 Homo sapiens Tyrosine-protein kinase FRK Proteins 0.000 claims description 4
- 241000701085 Human alphaherpesvirus 3 Species 0.000 claims description 4
- 241000701044 Human gammaherpesvirus 4 Species 0.000 claims description 4
- 241000701806 Human papillomavirus Species 0.000 claims description 4
- 101100481410 Mus musculus Tek gene Proteins 0.000 claims description 4
- 208000009525 Myocarditis Diseases 0.000 claims description 4
- 102100029166 NT-3 growth factor receptor Human genes 0.000 claims description 4
- 101150117329 NTRK3 gene Proteins 0.000 claims description 4
- 206010034277 Pemphigoid Diseases 0.000 claims description 4
- 201000011152 Pemphigus Diseases 0.000 claims description 4
- 206010060862 Prostate cancer Diseases 0.000 claims description 4
- 208000000236 Prostatic Neoplasms Diseases 0.000 claims description 4
- 108091008611 Protein Kinase B Proteins 0.000 claims description 4
- 102100030086 Receptor tyrosine-protein kinase erbB-2 Human genes 0.000 claims description 4
- 108010065917 TOR Serine-Threonine Kinases Proteins 0.000 claims description 4
- 102000013530 TOR Serine-Threonine Kinases Human genes 0.000 claims description 4
- 102100040959 Tyrosine-protein kinase FRK Human genes 0.000 claims description 4
- 108091008605 VEGF receptors Proteins 0.000 claims description 4
- 208000000594 bullous pemphigoid Diseases 0.000 claims description 4
- 208000010247 contact dermatitis Diseases 0.000 claims description 4
- 239000003937 drug carrier Substances 0.000 claims description 4
- 208000026500 emaciation Diseases 0.000 claims description 4
- 239000011737 fluorine Substances 0.000 claims description 4
- 229910052731 fluorine Inorganic materials 0.000 claims description 4
- IAGUPODHENSJEZ-UHFFFAOYSA-N methyl n-phenylcarbamate Chemical class COC(=O)NC1=CC=CC=C1 IAGUPODHENSJEZ-UHFFFAOYSA-N 0.000 claims description 4
- 201000006417 multiple sclerosis Diseases 0.000 claims description 4
- 201000001976 pemphigus vulgaris Diseases 0.000 claims description 4
- QQVIHTHCMHWDBS-UHFFFAOYSA-N perisophthalic acid Natural products OC(=O)C1=CC=CC(C(O)=O)=C1 QQVIHTHCMHWDBS-UHFFFAOYSA-N 0.000 claims description 4
- BSCCSDNZEIHXOK-UHFFFAOYSA-N phenyl carbamate Chemical compound NC(=O)OC1=CC=CC=C1 BSCCSDNZEIHXOK-UHFFFAOYSA-N 0.000 claims description 4
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 4
- 230000000699 topical effect Effects 0.000 claims description 4
- 208000024893 Acute lymphoblastic leukemia Diseases 0.000 claims description 3
- 101100381481 Caenorhabditis elegans baz-2 gene Proteins 0.000 claims description 3
- 206010010741 Conjunctivitis Diseases 0.000 claims description 3
- 208000011231 Crohn disease Diseases 0.000 claims description 3
- 206010012438 Dermatitis atopic Diseases 0.000 claims description 3
- 206010053177 Epidermolysis Diseases 0.000 claims description 3
- 108010007457 Extracellular Signal-Regulated MAP Kinases Proteins 0.000 claims description 3
- 102100023600 Fibroblast growth factor receptor 2 Human genes 0.000 claims description 3
- 101710182389 Fibroblast growth factor receptor 2 Proteins 0.000 claims description 3
- 102100027844 Fibroblast growth factor receptor 4 Human genes 0.000 claims description 3
- 208000009329 Graft vs Host Disease Diseases 0.000 claims description 3
- 102100035108 High affinity nerve growth factor receptor Human genes 0.000 claims description 3
- 101000917134 Homo sapiens Fibroblast growth factor receptor 4 Proteins 0.000 claims description 3
- 101000596894 Homo sapiens High affinity nerve growth factor receptor Proteins 0.000 claims description 3
- 101000934996 Homo sapiens Tyrosine-protein kinase JAK3 Proteins 0.000 claims description 3
- 206010058467 Lung neoplasm malignant Diseases 0.000 claims description 3
- 206010025323 Lymphomas Diseases 0.000 claims description 3
- 102000001291 MAP Kinase Kinase Kinase Human genes 0.000 claims description 3
- 108060006687 MAP kinase kinase kinase Proteins 0.000 claims description 3
- 206010028561 Myeloid metaplasia Diseases 0.000 claims description 3
- 102000014750 Phosphorylase Kinase Human genes 0.000 claims description 3
- 108010064071 Phosphorylase Kinase Proteins 0.000 claims description 3
- 101100372762 Rattus norvegicus Flt1 gene Proteins 0.000 claims description 3
- 102100029986 Receptor tyrosine-protein kinase erbB-3 Human genes 0.000 claims description 3
- 101710100969 Receptor tyrosine-protein kinase erbB-3 Proteins 0.000 claims description 3
- 102100029981 Receptor tyrosine-protein kinase erbB-4 Human genes 0.000 claims description 3
- 101710100963 Receptor tyrosine-protein kinase erbB-4 Proteins 0.000 claims description 3
- 206010039705 Scleritis Diseases 0.000 claims description 3
- 208000000453 Skin Neoplasms Diseases 0.000 claims description 3
- 206010040880 Skin irritation Diseases 0.000 claims description 3
- 206010042971 T-cell lymphoma Diseases 0.000 claims description 3
- 208000027585 T-cell non-Hodgkin lymphoma Diseases 0.000 claims description 3
- 102100025387 Tyrosine-protein kinase JAK3 Human genes 0.000 claims description 3
- 206010046851 Uveitis Diseases 0.000 claims description 3
- 201000008937 atopic dermatitis Diseases 0.000 claims description 3
- 125000000043 benzamido group Chemical group [H]N([*])C(=O)C1=C([H])C([H])=C([H])C([H])=C1[H] 0.000 claims description 3
- 230000000994 depressogenic effect Effects 0.000 claims description 3
- 201000005787 hematologic cancer Diseases 0.000 claims description 3
- 201000004614 iritis Diseases 0.000 claims description 3
- 210000003734 kidney Anatomy 0.000 claims description 3
- YDTFRJLNMPSCFM-YDALLXLXSA-M levothyroxine sodium anhydrous Chemical compound [Na+].IC1=CC(C[C@H](N)C([O-])=O)=CC(I)=C1OC1=CC(I)=C(O)C(I)=C1 YDTFRJLNMPSCFM-YDALLXLXSA-M 0.000 claims description 3
- 201000005202 lung cancer Diseases 0.000 claims description 3
- 208000020816 lung neoplasm Diseases 0.000 claims description 3
- 206010028417 myasthenia gravis Diseases 0.000 claims description 3
- 206010028537 myelofibrosis Diseases 0.000 claims description 3
- 125000003226 pyrazolyl group Chemical group 0.000 claims description 3
- 125000004076 pyridyl group Chemical group 0.000 claims description 3
- 201000000849 skin cancer Diseases 0.000 claims description 3
- 230000036556 skin irritation Effects 0.000 claims description 3
- 231100000475 skin irritation Toxicity 0.000 claims description 3
- ZRKFYGHZFMAOKI-QMGMOQQFSA-N tgfbeta Chemical compound C([C@H](NC(=O)[C@H](C(C)C)NC(=O)CNC(=O)[C@H](CCC(O)=O)NC(=O)[C@H](CCCNC(N)=N)NC(=O)[C@H](CC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CCC(O)=O)NC(=O)[C@H]([C@@H](C)O)NC(=O)[C@H](CC(C)C)NC(=O)CNC(=O)[C@H](C)NC(=O)[C@H](CO)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](NC(=O)[C@H](C)NC(=O)[C@H](C)NC(=O)[C@@H](NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](N)CCSC)C(C)C)[C@@H](C)CC)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](C(C)C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](C)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H]([C@@H](C)O)C(=O)N[C@@H](CC(N)=O)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](C)C(=O)N[C@@H](CC=1C=CC=CC=1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](C)C(=O)N[C@@H](CC(C)C)C(=O)N1[C@@H](CCC1)C(=O)N1[C@@H](CCC1)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CCC(O)=O)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CO)C(=O)N[C@@H](CCCNC(N)=N)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CC(C)C)C(O)=O)C1=CC=C(O)C=C1 ZRKFYGHZFMAOKI-QMGMOQQFSA-N 0.000 claims description 3
- 239000004408 titanium dioxide Substances 0.000 claims description 3
- GWEVSGVZZGPLCZ-UHFFFAOYSA-N titanium dioxide Inorganic materials O=[Ti]=O GWEVSGVZZGPLCZ-UHFFFAOYSA-N 0.000 claims description 3
- PMBDVIAOZNRBNW-UHFFFAOYSA-N 3-[4-[2-(3-aminoanilino)pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound NC1=CC=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=C1 PMBDVIAOZNRBNW-UHFFFAOYSA-N 0.000 claims description 2
- PMHIPXIZGOIPOS-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-(4-nitroanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=CC([N+](=O)[O-])=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 PMHIPXIZGOIPOS-UHFFFAOYSA-N 0.000 claims description 2
- 208000003950 B-cell lymphoma Diseases 0.000 claims description 2
- 102100035080 BDNF/NT-3 growth factors receptor Human genes 0.000 claims description 2
- 206010006187 Breast cancer Diseases 0.000 claims description 2
- 208000026310 Breast neoplasm Diseases 0.000 claims description 2
- 108010055196 EphA2 Receptor Proteins 0.000 claims description 2
- 108010055191 EphA3 Receptor Proteins 0.000 claims description 2
- 108010055334 EphB2 Receptor Proteins 0.000 claims description 2
- 102100030322 Ephrin type-A receptor 1 Human genes 0.000 claims description 2
- 102100030340 Ephrin type-A receptor 2 Human genes 0.000 claims description 2
- 102100030324 Ephrin type-A receptor 3 Human genes 0.000 claims description 2
- 102100031983 Ephrin type-B receptor 4 Human genes 0.000 claims description 2
- 101150009958 FLT4 gene Proteins 0.000 claims description 2
- 208000005176 Hepatitis C Diseases 0.000 claims description 2
- 101000596896 Homo sapiens BDNF/NT-3 growth factors receptor Proteins 0.000 claims description 2
- 101000938354 Homo sapiens Ephrin type-A receptor 1 Proteins 0.000 claims description 2
- 108060003951 Immunoglobulin Proteins 0.000 claims description 2
- 208000003456 Juvenile Arthritis Diseases 0.000 claims description 2
- 206010059176 Juvenile idiopathic arthritis Diseases 0.000 claims description 2
- 208000007766 Kaposi sarcoma Diseases 0.000 claims description 2
- 208000033833 Myelomonocytic Chronic Leukemia Diseases 0.000 claims description 2
- 201000002481 Myositis Diseases 0.000 claims description 2
- 102000004887 Transforming Growth Factor beta Human genes 0.000 claims description 2
- 108090001012 Transforming Growth Factor beta Proteins 0.000 claims description 2
- 102000016663 Vascular Endothelial Growth Factor Receptor-3 Human genes 0.000 claims description 2
- 208000022531 anorexia Diseases 0.000 claims description 2
- 206010061428 decreased appetite Diseases 0.000 claims description 2
- ZCRZCMUDOWDGOB-UHFFFAOYSA-N ethanesulfonimidic acid Chemical compound CCS(N)(=O)=O ZCRZCMUDOWDGOB-UHFFFAOYSA-N 0.000 claims description 2
- 208000021045 exocrine pancreatic carcinoma Diseases 0.000 claims description 2
- 208000024200 hematopoietic and lymphoid system neoplasm Diseases 0.000 claims description 2
- 208000002672 hepatitis B Diseases 0.000 claims description 2
- 102000018358 immunoglobulin Human genes 0.000 claims description 2
- 208000028867 ischemia Diseases 0.000 claims description 2
- 230000000302 ischemic effect Effects 0.000 claims description 2
- 230000000366 juvenile effect Effects 0.000 claims description 2
- 201000007270 liver cancer Diseases 0.000 claims description 2
- 208000014018 liver neoplasm Diseases 0.000 claims description 2
- 206010025135 lupus erythematosus Diseases 0.000 claims description 2
- 125000000250 methylamino group Chemical group [H]N(*)C([H])([H])[H] 0.000 claims description 2
- 208000013077 thyroid gland carcinoma Diseases 0.000 claims description 2
- 125000000383 tetramethylene group Chemical group [H]C([H])([*:1])C([H])([H])C([H])([H])C([H])([H])[*:2] 0.000 claims 15
- 101000997832 Homo sapiens Tyrosine-protein kinase JAK2 Proteins 0.000 claims 13
- 102100033444 Tyrosine-protein kinase JAK2 Human genes 0.000 claims 13
- 101000997835 Homo sapiens Tyrosine-protein kinase JAK1 Proteins 0.000 claims 3
- 102100033438 Tyrosine-protein kinase JAK1 Human genes 0.000 claims 3
- 125000003968 arylidene group Chemical group [H]C(c)=* 0.000 claims 3
- 101000844245 Homo sapiens Non-receptor tyrosine-protein kinase TYK2 Proteins 0.000 claims 2
- 102100032028 Non-receptor tyrosine-protein kinase TYK2 Human genes 0.000 claims 2
- 208000003476 primary myelofibrosis Diseases 0.000 claims 2
- KQVLZPZAHVQPTM-UHFFFAOYSA-N 2-[1-(1,2-oxazole-5-carbonyl)-4-[4-[2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]piperidin-4-yl]acetonitrile Chemical compound C=1C=NOC=1C(=O)N(CC1)CCC1(CC#N)N(N=C1)C=C1C(N=1)=CC=NC=1NC(C=C1)=CC=C1N1C=CC=N1 KQVLZPZAHVQPTM-UHFFFAOYSA-N 0.000 claims 1
- FOZPZMPMNHAJNG-UHFFFAOYSA-N 2-[1-(1,2-oxazole-5-carbonyl)-4-[4-[2-[3-(2h-tetrazol-5-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]piperidin-4-yl]acetonitrile Chemical compound C=1C=NOC=1C(=O)N(CC1)CCC1(CC#N)N(N=C1)C=C1C(N=1)=CC=NC=1NC(C=1)=CC=CC=1C1=NN=NN1 FOZPZMPMNHAJNG-UHFFFAOYSA-N 0.000 claims 1
- LQFLIQQHDWBCFY-UHFFFAOYSA-N 2-[1-ethylsulfonyl-3-[4-[2-[4-(3-fluoropyrrolidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]azetidin-3-yl]acetonitrile Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)C(=O)N3CC(F)CC3)N=CC=2)=C1 LQFLIQQHDWBCFY-UHFFFAOYSA-N 0.000 claims 1
- HJPCBQMEWVBKFN-UHFFFAOYSA-N 2-[1-ethylsulfonyl-3-[4-[2-[4-(3-hydroxypyrrolidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]azetidin-3-yl]acetonitrile Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)C(=O)N3CC(O)CC3)N=CC=2)=C1 HJPCBQMEWVBKFN-UHFFFAOYSA-N 0.000 claims 1
- RMIJTYXDQDKHKH-UHFFFAOYSA-N 2-[1-ethylsulfonyl-3-[4-[2-[4-(4-hydroxypiperidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]azetidin-3-yl]acetonitrile Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)C(=O)N3CCC(O)CC3)N=CC=2)=C1 RMIJTYXDQDKHKH-UHFFFAOYSA-N 0.000 claims 1
- LBIJRXSOUPRMQH-UHFFFAOYSA-N 2-[1-ethylsulfonyl-3-[4-[2-[4-(4-methylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]azetidin-3-yl]acetonitrile Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)C(=O)N3CCN(C)CC3)N=CC=2)=C1 LBIJRXSOUPRMQH-UHFFFAOYSA-N 0.000 claims 1
- QZTTVFJXTAGTRG-UHFFFAOYSA-N 2-[1-ethylsulfonyl-3-[4-[2-[4-(morpholine-4-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]azetidin-3-yl]acetonitrile Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)C(=O)N3CCOCC3)N=CC=2)=C1 QZTTVFJXTAGTRG-UHFFFAOYSA-N 0.000 claims 1
- XBIRBQCIETXSPO-UHFFFAOYSA-N 2-[3-[4-[2-[4-(4-acetylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-1-ethylsulfonylazetidin-3-yl]acetonitrile Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)C(=O)N3CCN(CC3)C(C)=O)N=CC=2)=C1 XBIRBQCIETXSPO-UHFFFAOYSA-N 0.000 claims 1
- NBPQKEMQAHIRBO-UHFFFAOYSA-N 2-[3-[4-[2-[4-(azetidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-1-ethylsulfonylazetidin-3-yl]acetonitrile Chemical compound C1N(S(=O)(=O)CC)CC1(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)C(=O)N3CCC3)N=CC=2)=C1 NBPQKEMQAHIRBO-UHFFFAOYSA-N 0.000 claims 1
- AEEHJAFTKANGJV-UHFFFAOYSA-N 2-[4-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]-1-(1,2-oxazole-5-carbonyl)piperidin-4-yl]acetonitrile Chemical compound C=1C=NOC=1C(=O)N(CC1)CCC1(CC#N)N(N=C1)C=C1C(N=1)=CC=NC=1NC(C=C1)=CC=C1N1CCOCC1 AEEHJAFTKANGJV-UHFFFAOYSA-N 0.000 claims 1
- DFDRGYVYKUITGO-UHFFFAOYSA-N 3-(1-acetylpiperidin-4-yl)-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(C(=O)C)CCC1C(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)N3CCOCC3)N=CC=2)=C1 DFDRGYVYKUITGO-UHFFFAOYSA-N 0.000 claims 1
- UOPBPOWWYUKMLY-UHFFFAOYSA-N 3-(1-benzoylpiperidin-4-yl)-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=CC=CC=1C(=O)N(CC1)CCC1C(CC#N)N(N=C1)C=C1C(N=1)=CC=NC=1NC(C=C1)=CC=C1N1CCOCC1 UOPBPOWWYUKMLY-UHFFFAOYSA-N 0.000 claims 1
- BIXLVPFTHJJKJI-UHFFFAOYSA-N 3-(1-methylsulfonylpiperidin-4-yl)-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(S(=O)(=O)C)CCC1C(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)N3CCOCC3)N=CC=2)=C1 BIXLVPFTHJJKJI-UHFFFAOYSA-N 0.000 claims 1
- LJGHYPLBDBRCRZ-UHFFFAOYSA-N 3-(3-aminophenyl)sulfonylaniline Chemical group NC1=CC=CC(S(=O)(=O)C=2C=C(N)C=CC=2)=C1 LJGHYPLBDBRCRZ-UHFFFAOYSA-N 0.000 claims 1
- FLVHJFQSLRMYHZ-UHFFFAOYSA-N 3-[1-(benzenesulfonyl)piperidin-4-yl]-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=CC=CC=1S(=O)(=O)N(CC1)CCC1C(CC#N)N(N=C1)C=C1C(N=1)=CC=NC=1NC(C=C1)=CC=C1N1CCOCC1 FLVHJFQSLRMYHZ-UHFFFAOYSA-N 0.000 claims 1
- CVWDFNRUDREXSK-UHFFFAOYSA-N 3-[4-(2-anilino-5-methylpyrimidin-4-yl)pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC1=CC=CC=C1 CVWDFNRUDREXSK-UHFFFAOYSA-N 0.000 claims 1
- XTXZKWRQOPXKQQ-UHFFFAOYSA-N 3-[4-(2-anilino-5-methylpyrimidin-4-yl)pyrazol-1-yl]-4-(1-ethylsulfonylpiperidin-4-yl)butanenitrile Chemical compound C1CN(S(=O)(=O)CC)CCC1CC(CC#N)N1N=CC(C=2C(=CN=C(NC=3C=CC=CC=3)N=2)C)=C1 XTXZKWRQOPXKQQ-UHFFFAOYSA-N 0.000 claims 1
- PMFXXLLJWOYZGO-UHFFFAOYSA-N 3-[4-(2-anilinopyrimidin-4-yl)pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC=CC=3)N=CC=2)C=NN1C(CC#N)C1CCCC1 PMFXXLLJWOYZGO-UHFFFAOYSA-N 0.000 claims 1
- FGMXCSXEHYWHIX-UHFFFAOYSA-N 3-[4-(2-anilinopyrimidin-4-yl)pyrazol-1-yl]-4-(1-ethylsulfonylpiperidin-4-yl)butanenitrile Chemical compound C1CN(S(=O)(=O)CC)CCC1CC(CC#N)N1N=CC(C=2N=C(NC=3C=CC=CC=3)N=CC=2)=C1 FGMXCSXEHYWHIX-UHFFFAOYSA-N 0.000 claims 1
- ZZVIWMSIASFQDT-UHFFFAOYSA-N 3-[4-[2-(4-aminoanilino)-5-methylpyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC1=CC=C(N)C=C1 ZZVIWMSIASFQDT-UHFFFAOYSA-N 0.000 claims 1
- SODDADMBLIPYBD-UHFFFAOYSA-N 3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]-3-piperidin-4-ylpropanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3CCOCC3)N=CC=2)C=NN1C(CC#N)C1CCNCC1 SODDADMBLIPYBD-UHFFFAOYSA-N 0.000 claims 1
- BCKLVUAZXISNIL-UHFFFAOYSA-N 3-[4-[2-[3-(4-acetylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound C1CN(C(=O)C)CCN1C(=O)C1=CC=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=C1 BCKLVUAZXISNIL-UHFFFAOYSA-N 0.000 claims 1
- ODURMAIJGWIWSW-UHFFFAOYSA-N 3-[4-[2-[3-(4-benzyl-4-hydroxypiperidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound C1CN(C(=O)C=2C=C(NC=3N=C(C=CN=3)C3=CN(N=C3)C(CC#N)C3CCCC3)C=CC=2)CCC1(O)CC1=CC=CC=C1 ODURMAIJGWIWSW-UHFFFAOYSA-N 0.000 claims 1
- NNJUQNBQLMBKGW-UHFFFAOYSA-N 3-[4-[2-[3-(azetidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound C=1C=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=CC=1C(=O)N1CCC1 NNJUQNBQLMBKGW-UHFFFAOYSA-N 0.000 claims 1
- RIZSFOCKBCTUGC-UHFFFAOYSA-N 3-[4-[2-[4-(3-oxomorpholin-4-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-4-piperidin-4-ylbutanenitrile Chemical compound O=C1COCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)CC2CCNCC2)=N1 RIZSFOCKBCTUGC-UHFFFAOYSA-N 0.000 claims 1
- JJXMYGFSVKQKED-UHFFFAOYSA-N 3-[4-[2-[4-(4-acetylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound C1CN(C(=O)C)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 JJXMYGFSVKQKED-UHFFFAOYSA-N 0.000 claims 1
- NIYQOFMBILWWRH-UHFFFAOYSA-N 3-[4-[2-[4-(4-acetylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopropylpropanenitrile Chemical compound C1CN(C(=O)C)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CC2)=N1 NIYQOFMBILWWRH-UHFFFAOYSA-N 0.000 claims 1
- VOGNYTSBPYUXLI-UHFFFAOYSA-N 3-[4-[2-[4-(azetidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound C=1C=C(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)C=CC=1C(=O)N1CCC1 VOGNYTSBPYUXLI-UHFFFAOYSA-N 0.000 claims 1
- VUPTUFXNTWGUGM-UHFFFAOYSA-N 3-[4-[2-[4-(azetidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]-3-cyclopropylpropanenitrile Chemical compound C=1C=C(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CC2)C=CC=1C(=O)N1CCC1 VUPTUFXNTWGUGM-UHFFFAOYSA-N 0.000 claims 1
- BMKRHADDSFEBFX-UHFFFAOYSA-N 3-cyclobutyl-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3CCOCC3)N=CC=2)C=NN1C(CC#N)C1CCC1 BMKRHADDSFEBFX-UHFFFAOYSA-N 0.000 claims 1
- IHJUPNUUEYUMRA-UHFFFAOYSA-N 3-cyclobutyl-3-[4-[2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3N=CC=C3)N=CC=2)C=NN1C(CC#N)C1CCC1 IHJUPNUUEYUMRA-UHFFFAOYSA-N 0.000 claims 1
- KKNHKRKMGQNNQO-UHFFFAOYSA-N 3-cyclobutyl-3-[4-[2-[3-(1,3-oxazol-5-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=C(C=CC=3)C=3OC=NC=3)N=CC=2)C=NN1C(CC#N)C1CCC1 KKNHKRKMGQNNQO-UHFFFAOYSA-N 0.000 claims 1
- WUXHXIMDBWXUSL-UHFFFAOYSA-N 3-cyclobutyl-3-[4-[2-[4-(2-oxopiperidin-1-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound O=C1CCCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCC2)=N1 WUXHXIMDBWXUSL-UHFFFAOYSA-N 0.000 claims 1
- VTUMVAXXLXMZFQ-UHFFFAOYSA-N 3-cyclobutyl-3-[4-[2-[4-(3-oxomorpholin-4-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound O=C1COCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCC2)=N1 VTUMVAXXLXMZFQ-UHFFFAOYSA-N 0.000 claims 1
- WYBHBCCCCQHNQK-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-(3-nitroanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound [O-][N+](=O)C1=CC=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=C1 WYBHBCCCCQHNQK-UHFFFAOYSA-N 0.000 claims 1
- ASBBYPFPMXRIMC-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3CCOCC3)N=CC=2)C=NN1C(CC#N)C1CCCC1 ASBBYPFPMXRIMC-UHFFFAOYSA-N 0.000 claims 1
- QBEUVHRYIIXYRF-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-(4-piperazin-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3CCNCC3)N=CC=2)C=NN1C(CC#N)C1CCCC1 QBEUVHRYIIXYRF-UHFFFAOYSA-N 0.000 claims 1
- VJMLLGIKASLFQL-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3N=CC=C3)N=CC=2)C=NN1C(CC#N)C1CCCC1 VJMLLGIKASLFQL-UHFFFAOYSA-N 0.000 claims 1
- OLHBLPFMECINKZ-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(1,3-oxazol-5-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=C(C=CC=3)C=3OC=NC=3)N=CC=2)C=NN1C(CC#N)C1CCCC1 OLHBLPFMECINKZ-UHFFFAOYSA-N 0.000 claims 1
- MURCSSMTBLEHPM-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(2-methylpyrimidin-4-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound CC1=NC=CC(C=2C=C(NC=3N=C(C=CN=3)C3=CN(N=C3)C(CC#N)C3CCCC3)C=CC=2)=N1 MURCSSMTBLEHPM-UHFFFAOYSA-N 0.000 claims 1
- VRNFZDXDQKNCKQ-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(3-hydroxypyrrolidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1C(O)CCN1C(=O)C1=CC=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=C1 VRNFZDXDQKNCKQ-UHFFFAOYSA-N 0.000 claims 1
- DGRVCQUETTYODD-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(3-oxopiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=CC=1C(=O)N1CCNC(=O)C1 DGRVCQUETTYODD-UHFFFAOYSA-N 0.000 claims 1
- MAYBTVDZWPTQQG-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(4-hydroxy-4-phenylpiperidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CC(O)(C=2C=CC=CC=2)CCN1C(=O)C(C=1)=CC=CC=1NC(N=1)=NC=CC=1C(=C1)C=NN1C(CC#N)C1CCCC1 MAYBTVDZWPTQQG-UHFFFAOYSA-N 0.000 claims 1
- XYNXBUCQFVEZJN-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(4-hydroxypiperidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CC(O)CCN1C(=O)C1=CC=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=C1 XYNXBUCQFVEZJN-UHFFFAOYSA-N 0.000 claims 1
- BWOVVUYBRNFOBO-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(4-methylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(C)CCN1C(=O)C1=CC=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=C1 BWOVVUYBRNFOBO-UHFFFAOYSA-N 0.000 claims 1
- HVHMONJIZKFGDJ-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(4-phenylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=CC=1C(=O)N(CC1)CCN1C1=CC=CC=C1 HVHMONJIZKFGDJ-UHFFFAOYSA-N 0.000 claims 1
- PWYRKGARXFZNFG-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(4-phenylpiperidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=CC=1C(=O)N(CC1)CCC1C1=CC=CC=C1 PWYRKGARXFZNFG-UHFFFAOYSA-N 0.000 claims 1
- FZKYVHHSIZRNPY-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-(morpholine-4-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=CC=1C(=O)N1CCOCC1 FZKYVHHSIZRNPY-UHFFFAOYSA-N 0.000 claims 1
- XYMPNIRFOUWRIZ-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[3-[4-(2-hydroxyethyl)piperazine-1-carbonyl]anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(CCO)CCN1C(=O)C1=CC=CC(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)=C1 XYMPNIRFOUWRIZ-UHFFFAOYSA-N 0.000 claims 1
- JRAIRBUPJGFEOF-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(2-oxopiperidin-1-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound O=C1CCCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 JRAIRBUPJGFEOF-UHFFFAOYSA-N 0.000 claims 1
- CEZDMUDSNVKYKX-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(2-oxopyrrolidin-1-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound O=C1CCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 CEZDMUDSNVKYKX-UHFFFAOYSA-N 0.000 claims 1
- OOFCWWDIXDSJNO-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(3-fluoropyrrolidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1C(F)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 OOFCWWDIXDSJNO-UHFFFAOYSA-N 0.000 claims 1
- CECZGXXLOPRLPN-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(3-hydroxypyrrolidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1C(O)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 CECZGXXLOPRLPN-UHFFFAOYSA-N 0.000 claims 1
- MXXPKDDYDFGPPV-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(3-oxo-2,8-diazaspiro[4.5]decane-8-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=C(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)C=CC=1C(=O)N(CC1)CCC21CNC(=O)C2 MXXPKDDYDFGPPV-UHFFFAOYSA-N 0.000 claims 1
- ZIZDCYNTDFEGGK-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(3-oxomorpholin-4-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound O=C1COCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 ZIZDCYNTDFEGGK-UHFFFAOYSA-N 0.000 claims 1
- OFPXPVDCVSJUSE-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(3-oxopiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=C(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)C=CC=1C(=O)N1CCNC(=O)C1 OFPXPVDCVSJUSE-UHFFFAOYSA-N 0.000 claims 1
- YUULWPPFUDUFNV-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(4,4-dimethyl-1-oxa-7-azaspiro[4.4]nonane-7-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound CC1(C)CCOC11CN(C(=O)C=2C=CC(NC=3N=C(C=CN=3)C3=CN(N=C3)C(CC#N)C3CCCC3)=CC=2)CC1 YUULWPPFUDUFNV-UHFFFAOYSA-N 0.000 claims 1
- XJELTSSDYNWFTC-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(4-hydroxypiperidine-1-carbonyl)anilino]-5-methylpyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC(C=C1)=CC=C1C(=O)N1CCC(O)CC1 XJELTSSDYNWFTC-UHFFFAOYSA-N 0.000 claims 1
- WCBYXBHQMBNWPT-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(4-hydroxypiperidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CC(O)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 WCBYXBHQMBNWPT-UHFFFAOYSA-N 0.000 claims 1
- ZJOLNFJQICWTRB-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(4-methylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(C)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 ZJOLNFJQICWTRB-UHFFFAOYSA-N 0.000 claims 1
- LKBZCMOFBKANLQ-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(4-methylsulfonylpiperazin-1-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(S(=O)(=O)C)CCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 LKBZCMOFBKANLQ-UHFFFAOYSA-N 0.000 claims 1
- HEKGNXPGUKSZNJ-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(diethylamino)anilino]-5-methylpyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=CC(N(CC)CC)=CC=C1NC1=NC=C(C)C(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 HEKGNXPGUKSZNJ-UHFFFAOYSA-N 0.000 claims 1
- HBTHWGNTZZEKTD-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-(morpholine-4-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=C(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CCCC2)C=CC=1C(=O)N1CCOCC1 HBTHWGNTZZEKTD-UHFFFAOYSA-N 0.000 claims 1
- QLPWYTTYWKLDPT-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-[4-(2-hydroxyethyl)piperazine-1-carbonyl]anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(CCO)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 QLPWYTTYWKLDPT-UHFFFAOYSA-N 0.000 claims 1
- DZDQXOFFNNWYIF-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[2-[4-[ethyl(3-hydroxypropyl)amino]anilino]-5-methylpyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=CC(N(CCCO)CC)=CC=C1NC1=NC=C(C)C(C2=CN(N=C2)C(CC#N)C2CCCC2)=N1 DZDQXOFFNNWYIF-UHFFFAOYSA-N 0.000 claims 1
- JVQZTPJFONQCHK-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[5-methoxy-2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(OC)=CN=C1NC(C=C1)=CC=C1N1C=CC=N1 JVQZTPJFONQCHK-UHFFFAOYSA-N 0.000 claims 1
- RPYUGOVKBFEYPF-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[5-methyl-2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC(C=C1)=CC=C1N1CCOCC1 RPYUGOVKBFEYPF-UHFFFAOYSA-N 0.000 claims 1
- QGNWHGSTOITNFT-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[5-methyl-2-(4-nitroanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC1=CC=C([N+]([O-])=O)C=C1 QGNWHGSTOITNFT-UHFFFAOYSA-N 0.000 claims 1
- YJBQCBZFSPYDDB-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[5-methyl-2-(4-piperazin-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC(C=C1)=CC=C1N1CCNCC1 YJBQCBZFSPYDDB-UHFFFAOYSA-N 0.000 claims 1
- MJVFBYKMNCMFPM-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[5-methyl-2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC(C=C1)=CC=C1N1C=CC=N1 MJVFBYKMNCMFPM-UHFFFAOYSA-N 0.000 claims 1
- LCONUHDOICLBRI-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[5-methyl-2-[3-(1,3-oxazol-5-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC(C=1)=CC=CC=1C1=CN=CO1 LCONUHDOICLBRI-UHFFFAOYSA-N 0.000 claims 1
- FDMSHXBCXVGYBT-UHFFFAOYSA-N 3-cyclopentyl-3-[4-[5-methyl-2-[4-(1,3-oxazol-5-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound N1=C(C2=CN(N=C2)C(CC#N)C2CCCC2)C(C)=CN=C1NC(C=C1)=CC=C1C1=CN=CO1 FDMSHXBCXVGYBT-UHFFFAOYSA-N 0.000 claims 1
- AXBJVUNWVKQOIM-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3CCOCC3)N=CC=2)C=NN1C(CC#N)C1CC1 AXBJVUNWVKQOIM-UHFFFAOYSA-N 0.000 claims 1
- NJFJFXJAGCVZPY-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=CC(=CC=3)N3N=CC=C3)N=CC=2)C=NN1C(CC#N)C1CC1 NJFJFXJAGCVZPY-UHFFFAOYSA-N 0.000 claims 1
- XVUVUQQQBKVUTM-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[3-(1,3-oxazol-5-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1=C(C=2N=C(NC=3C=C(C=CC=3)C=3OC=NC=3)N=CC=2)C=NN1C(CC#N)C1CC1 XVUVUQQQBKVUTM-UHFFFAOYSA-N 0.000 claims 1
- SODVVSSBQBTZMK-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[4-(2-oxopiperidin-1-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound O=C1CCCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CC2)=N1 SODVVSSBQBTZMK-UHFFFAOYSA-N 0.000 claims 1
- VLAMQWPDPICALA-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[4-(3-fluoropyrrolidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1C(F)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CC2)=N1 VLAMQWPDPICALA-UHFFFAOYSA-N 0.000 claims 1
- FHBUYAMWUYPDCW-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[4-(3-hydroxypyrrolidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1C(O)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CC2)=N1 FHBUYAMWUYPDCW-UHFFFAOYSA-N 0.000 claims 1
- KJISWTLKZBSQLK-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[4-(3-oxomorpholin-4-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound O=C1COCCN1C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CC2)=N1 KJISWTLKZBSQLK-UHFFFAOYSA-N 0.000 claims 1
- OYSPEILBMGTDEP-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[4-(4-hydroxypiperidine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CC(O)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CC2)=N1 OYSPEILBMGTDEP-UHFFFAOYSA-N 0.000 claims 1
- WSXAZBCOKNZEQJ-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[4-(4-methylpiperazine-1-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C1CN(C)CCN1C(=O)C(C=C1)=CC=C1NC1=NC=CC(C2=CN(N=C2)C(CC#N)C2CC2)=N1 WSXAZBCOKNZEQJ-UHFFFAOYSA-N 0.000 claims 1
- SMQORXYBUBYFBG-UHFFFAOYSA-N 3-cyclopropyl-3-[4-[2-[4-(morpholine-4-carbonyl)anilino]pyrimidin-4-yl]pyrazol-1-yl]propanenitrile Chemical compound C=1C=C(NC=2N=C(C=CN=2)C2=CN(N=C2)C(CC#N)C2CC2)C=CC=1C(=O)N1CCOCC1 SMQORXYBUBYFBG-UHFFFAOYSA-N 0.000 claims 1
- PYDKHNPWIWPHGS-UHFFFAOYSA-N 4-(1-ethylsulfonylpiperidin-4-yl)-3-[4-[2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]butanenitrile Chemical compound C1CN(S(=O)(=O)CC)CCC1CC(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)N3CCOCC3)N=CC=2)=C1 PYDKHNPWIWPHGS-UHFFFAOYSA-N 0.000 claims 1
- BVSZMZYJGHSNLV-UHFFFAOYSA-N 4-(1-ethylsulfonylpiperidin-4-yl)-3-[4-[2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]butanenitrile Chemical compound C1CN(S(=O)(=O)CC)CCC1CC(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)N3N=CC=C3)N=CC=2)=C1 BVSZMZYJGHSNLV-UHFFFAOYSA-N 0.000 claims 1
- GVMQMKWMNPPHPB-UHFFFAOYSA-N 4-(1-ethylsulfonylpiperidin-4-yl)-3-[4-[2-[4-(3-oxomorpholin-4-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]butanenitrile Chemical compound C1CN(S(=O)(=O)CC)CCC1CC(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)N3C(COCC3)=O)N=CC=2)=C1 GVMQMKWMNPPHPB-UHFFFAOYSA-N 0.000 claims 1
- UREICTHQAMFDNQ-UHFFFAOYSA-N 4-(1-ethylsulfonylpiperidin-4-yl)-3-[4-[5-methyl-2-(4-morpholin-4-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]butanenitrile Chemical compound C1CN(S(=O)(=O)CC)CCC1CC(CC#N)N1N=CC(C=2C(=CN=C(NC=3C=CC(=CC=3)N3CCOCC3)N=2)C)=C1 UREICTHQAMFDNQ-UHFFFAOYSA-N 0.000 claims 1
- KPVGHOQGOGEKSL-UHFFFAOYSA-N 4-(1-ethylsulfonylpiperidin-4-yl)-3-[4-[5-methyl-2-(4-pyrazol-1-ylanilino)pyrimidin-4-yl]pyrazol-1-yl]butanenitrile Chemical compound C1CN(S(=O)(=O)CC)CCC1CC(CC#N)N1N=CC(C=2C(=CN=C(NC=3C=CC(=CC=3)N3N=CC=C3)N=2)C)=C1 KPVGHOQGOGEKSL-UHFFFAOYSA-N 0.000 claims 1
- REDZXEHHLLQUQH-UHFFFAOYSA-N 4-(1-methylsulfonylpiperidin-4-yl)-3-[4-[2-[4-(3-oxomorpholin-4-yl)anilino]pyrimidin-4-yl]pyrazol-1-yl]butanenitrile Chemical compound C1CN(S(=O)(=O)C)CCC1CC(CC#N)N1N=CC(C=2N=C(NC=3C=CC(=CC=3)N3C(COCC3)=O)N=CC=2)=C1 REDZXEHHLLQUQH-UHFFFAOYSA-N 0.000 claims 1
- 208000037398 BCR-ABL1 negative atypical chronic myeloid leukemia Diseases 0.000 claims 1
- JNHFDKBZAKZCOV-UHFFFAOYSA-N C(=O)OCC.NN1CCCCC1 Chemical compound C(=O)OCC.NN1CCCCC1 JNHFDKBZAKZCOV-UHFFFAOYSA-N 0.000 claims 1
- 208000033781 Thyroid carcinoma Diseases 0.000 claims 1
- 208000024770 Thyroid neoplasm Diseases 0.000 claims 1
- 201000004892 atypical chronic myeloid leukemia Diseases 0.000 claims 1
- 230000010410 reperfusion Effects 0.000 claims 1
- 201000002510 thyroid cancer Diseases 0.000 claims 1
- 208000017520 skin disease Diseases 0.000 abstract 1
- 238000004895 liquid chromatography mass spectrometry Methods 0.000 description 286
- 238000002360 preparation method Methods 0.000 description 212
- PAYRUJLWNCNPSJ-UHFFFAOYSA-N Aniline Chemical compound NC1=CC=CC=C1 PAYRUJLWNCNPSJ-UHFFFAOYSA-N 0.000 description 164
- 239000002585 base Substances 0.000 description 115
- XEKOWRVHYACXOJ-UHFFFAOYSA-N Ethyl acetate Chemical compound CCOC(C)=O XEKOWRVHYACXOJ-UHFFFAOYSA-N 0.000 description 87
- XLYOFNOQVPJJNP-UHFFFAOYSA-N water Substances O XLYOFNOQVPJJNP-UHFFFAOYSA-N 0.000 description 76
- VLKZOEOYAKHREP-UHFFFAOYSA-N n-Hexane Chemical compound CCCCCC VLKZOEOYAKHREP-UHFFFAOYSA-N 0.000 description 69
- 239000000047 product Substances 0.000 description 61
- 238000001035 drying Methods 0.000 description 49
- 102000015617 Janus Kinases Human genes 0.000 description 45
- 108010024121 Janus Kinases Proteins 0.000 description 45
- ZMANZCXQSJIPKH-UHFFFAOYSA-N Triethylamine Chemical compound CCN(CC)CC ZMANZCXQSJIPKH-UHFFFAOYSA-N 0.000 description 45
- 238000006243 chemical reaction Methods 0.000 description 44
- 235000019439 ethyl acetate Nutrition 0.000 description 43
- AJXBTRZGLDTSST-UHFFFAOYSA-N amino 2-methylprop-2-enoate Chemical compound CC(=C)C(=O)ON AJXBTRZGLDTSST-UHFFFAOYSA-N 0.000 description 40
- QIKYZXDTTPVVAC-UHFFFAOYSA-N 4-Aminobenzamide Chemical compound NC(=O)C1=CC=C(N)C=C1 QIKYZXDTTPVVAC-UHFFFAOYSA-N 0.000 description 35
- PVOAHINGSUIXLS-UHFFFAOYSA-N 1-Methylpiperazine Chemical compound CN1CCNCC1 PVOAHINGSUIXLS-UHFFFAOYSA-N 0.000 description 34
- 239000000243 solution Substances 0.000 description 33
- 238000003756 stirring Methods 0.000 description 33
- YMWUJEATGCHHMB-UHFFFAOYSA-N Dichloromethane Chemical compound ClCCl YMWUJEATGCHHMB-UHFFFAOYSA-N 0.000 description 31
- VYPSYNLAJGMNEJ-UHFFFAOYSA-N Silicium dioxide Chemical compound O=[Si]=O VYPSYNLAJGMNEJ-UHFFFAOYSA-N 0.000 description 30
- 239000000741 silica gel Substances 0.000 description 29
- 229910002027 silica gel Inorganic materials 0.000 description 29
- 238000005406 washing Methods 0.000 description 29
- KDLHZDBZIXYQEI-UHFFFAOYSA-N Palladium Chemical compound [Pd] KDLHZDBZIXYQEI-UHFFFAOYSA-N 0.000 description 28
- 238000004007 reversed phase HPLC Methods 0.000 description 28
- 229910052796 boron Inorganic materials 0.000 description 27
- 239000003814 drug Substances 0.000 description 26
- CSFIQHZIFKIQNO-UHFFFAOYSA-N 4-pyrazol-1-ylaniline Chemical compound C1=CC(N)=CC=C1N1N=CC=C1 CSFIQHZIFKIQNO-UHFFFAOYSA-N 0.000 description 24
- 210000004027 cell Anatomy 0.000 description 24
- FRYHCSODNHYDPU-UHFFFAOYSA-N ethanesulfonyl chloride Chemical compound CCS(Cl)(=O)=O FRYHCSODNHYDPU-UHFFFAOYSA-N 0.000 description 23
- RIOQSEWOXXDEQQ-UHFFFAOYSA-N triphenylphosphine Chemical compound C1=CC=CC=C1P(C=1C=CC=CC=1)C1=CC=CC=C1 RIOQSEWOXXDEQQ-UHFFFAOYSA-N 0.000 description 22
- OKKJLVBELUTLKV-UHFFFAOYSA-N Methanol Chemical compound OC OKKJLVBELUTLKV-UHFFFAOYSA-N 0.000 description 21
- RWRDLPDLKQPQOW-UHFFFAOYSA-N Pyrrolidine Chemical compound C1CCNC1 RWRDLPDLKQPQOW-UHFFFAOYSA-N 0.000 description 20
- LWIHDJKSTIGBAC-UHFFFAOYSA-K tripotassium phosphate Chemical compound [K+].[K+].[K+].[O-]P([O-])([O-])=O LWIHDJKSTIGBAC-UHFFFAOYSA-K 0.000 description 20
- 239000003795 chemical substances by application Substances 0.000 description 19
- 239000003112 inhibitor Substances 0.000 description 19
- 239000002253 acid Substances 0.000 description 18
- 239000002904 solvent Substances 0.000 description 18
- VEXZGXHMUGYJMC-UHFFFAOYSA-N Hydrochloric acid Chemical compound Cl VEXZGXHMUGYJMC-UHFFFAOYSA-N 0.000 description 17
- AYDQIZKZTQHYIY-UHFFFAOYSA-N OC(=O)C1(C)CC(C(O)=O)=CC=C1 Chemical compound OC(=O)C1(C)CC(C(O)=O)=CC=C1 AYDQIZKZTQHYIY-UHFFFAOYSA-N 0.000 description 15
- 125000000217 alkyl group Chemical group 0.000 description 15
- 102000004127 Cytokines Human genes 0.000 description 14
- 108090000695 Cytokines Proteins 0.000 description 14
- BFAKENXZKHGIGE-UHFFFAOYSA-N bis(2,3,5,6-tetrafluoro-4-iodophenyl)diazene Chemical compound FC1=C(C(=C(C(=C1F)I)F)F)N=NC1=C(C(=C(C(=C1F)F)I)F)F BFAKENXZKHGIGE-UHFFFAOYSA-N 0.000 description 14
- 125000004432 carbon atom Chemical group C* 0.000 description 14
- 108090000623 proteins and genes Proteins 0.000 description 14
- 238000010992 reflux Methods 0.000 description 14
- JOXIMZWYDAKGHI-UHFFFAOYSA-N toluene-4-sulfonic acid Chemical compound CC1=CC=C(S(O)(=O)=O)C=C1 JOXIMZWYDAKGHI-UHFFFAOYSA-N 0.000 description 14
- LEZUBHVVTQZWET-UHFFFAOYSA-N C(=O)Cl.FC1=CC=CC(=C1)F Chemical compound C(=O)Cl.FC1=CC=CC(=C1)F LEZUBHVVTQZWET-UHFFFAOYSA-N 0.000 description 13
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 13
- 230000004913 activation Effects 0.000 description 13
- 239000012044 organic layer Substances 0.000 description 13
- CDBYLPFSWZWCQE-UHFFFAOYSA-L Sodium Carbonate Chemical compound [Na+].[Na+].[O-]C([O-])=O CDBYLPFSWZWCQE-UHFFFAOYSA-L 0.000 description 12
- 238000013459 approach Methods 0.000 description 12
- 230000001105 regulatory effect Effects 0.000 description 12
- 125000004429 atom Chemical group 0.000 description 11
- 239000000843 powder Substances 0.000 description 11
- 239000011541 reaction mixture Substances 0.000 description 11
- LFQSCWFLJHTTHZ-UHFFFAOYSA-N Ethanol Chemical compound CCO LFQSCWFLJHTTHZ-UHFFFAOYSA-N 0.000 description 10
- 102000004022 Protein-Tyrosine Kinases Human genes 0.000 description 10
- 229910052763 palladium Inorganic materials 0.000 description 10
- 239000000546 pharmaceutical excipient Substances 0.000 description 10
- 229940093916 potassium phosphate Drugs 0.000 description 10
- 229910000160 potassium phosphate Inorganic materials 0.000 description 10
- 235000011009 potassium phosphates Nutrition 0.000 description 10
- MHCRLDZZHOVFEE-UHFFFAOYSA-N 4-(4-aminophenyl)morpholin-3-one Chemical compound C1=CC(N)=CC=C1N1C(=O)COCC1 MHCRLDZZHOVFEE-UHFFFAOYSA-N 0.000 description 9
- CSCPPACGZOOCGX-UHFFFAOYSA-N Acetone Chemical compound CC(C)=O CSCPPACGZOOCGX-UHFFFAOYSA-N 0.000 description 9
- 108090000412 Protein-Tyrosine Kinases Proteins 0.000 description 9
- 239000012141 concentrate Substances 0.000 description 9
- 235000008504 concentrate Nutrition 0.000 description 9
- 238000010790 dilution Methods 0.000 description 9
- 239000012895 dilution Substances 0.000 description 9
- 230000004927 fusion Effects 0.000 description 9
- QARBMVPHQWIHKH-UHFFFAOYSA-N methanesulfonyl chloride Chemical compound CS(Cl)(=O)=O QARBMVPHQWIHKH-UHFFFAOYSA-N 0.000 description 9
- 230000026731 phosphorylation Effects 0.000 description 9
- 238000006366 phosphorylation reaction Methods 0.000 description 9
- 125000001436 propyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])[H] 0.000 description 9
- 108091008598 receptor tyrosine kinases Proteins 0.000 description 9
- 102000027426 receptor tyrosine kinases Human genes 0.000 description 9
- 230000011664 signaling Effects 0.000 description 9
- APSBXTVYXVQYAB-UHFFFAOYSA-M sodium docusate Chemical compound [Na+].CCCCC(CC)COC(=O)CC(S([O-])(=O)=O)C(=O)OCC(CC)CCCC APSBXTVYXVQYAB-UHFFFAOYSA-M 0.000 description 9
- 239000000126 substance Substances 0.000 description 9
- AIELNJDAOGTASK-UHFFFAOYSA-N 3-(1,3-oxazol-5-yl)aniline Chemical compound NC1=CC=CC(C=2OC=NC=2)=C1 AIELNJDAOGTASK-UHFFFAOYSA-N 0.000 description 8
- UIIMBOGNXHQVGW-UHFFFAOYSA-M Sodium bicarbonate Chemical class [Na+].OC([O-])=O UIIMBOGNXHQVGW-UHFFFAOYSA-M 0.000 description 8
- DTQVDTLACAAQTR-UHFFFAOYSA-N Trifluoroacetic acid Chemical compound OC(=O)C(F)(F)F DTQVDTLACAAQTR-UHFFFAOYSA-N 0.000 description 8
- CHMBIJAOCISYEW-UHFFFAOYSA-N n-(4-aminophenyl)acetamide Chemical compound CC(=O)NC1=CC=C(N)C=C1 CHMBIJAOCISYEW-UHFFFAOYSA-N 0.000 description 8
- RTZKZFJDLAIYFH-UHFFFAOYSA-N Diethyl ether Chemical compound CCOCC RTZKZFJDLAIYFH-UHFFFAOYSA-N 0.000 description 7
- 239000003513 alkali Substances 0.000 description 7
- 125000000484 butyl group Chemical group [H]C([*])([H])C([H])([H])C([H])([H])C([H])([H])[H] 0.000 description 7
- 239000000463 material Substances 0.000 description 7
- 229960001924 melphalan Drugs 0.000 description 7
- SGDBTWWWUNNDEQ-LBPRGKRZSA-N melphalan Chemical compound OC(=O)[C@@H](N)CC1=CC=C(N(CCCl)CCCl)C=C1 SGDBTWWWUNNDEQ-LBPRGKRZSA-N 0.000 description 7
- 230000019491 signal transduction Effects 0.000 description 7
- 239000011734 sodium Substances 0.000 description 7
- 239000007787 solid Substances 0.000 description 7
- 102000008986 Janus Human genes 0.000 description 6
- 108050000950 Janus Proteins 0.000 description 6
- 239000005517 L01XE01 - Imatinib Substances 0.000 description 6
- 239000007864 aqueous solution Substances 0.000 description 6
- 208000006673 asthma Diseases 0.000 description 6
- AKUXORNKVIRDKN-UHFFFAOYSA-N azetidine tert-butyl formate Chemical compound C(C)(C)(C)OC=O.N1CCC1 AKUXORNKVIRDKN-UHFFFAOYSA-N 0.000 description 6
- 108010057085 cytokine receptors Proteins 0.000 description 6
- 102000003675 cytokine receptors Human genes 0.000 description 6
- 239000000706 filtrate Substances 0.000 description 6
- 238000009472 formulation Methods 0.000 description 6
- 230000014509 gene expression Effects 0.000 description 6
- 239000001257 hydrogen Substances 0.000 description 6
- 230000028993 immune response Effects 0.000 description 6
- 230000036039 immunity Effects 0.000 description 6
- 239000007788 liquid Substances 0.000 description 6
- 230000014759 maintenance of location Effects 0.000 description 6
- 230000002969 morbid Effects 0.000 description 6
- LPNYRYFBWFDTMA-UHFFFAOYSA-N potassium tert-butoxide Chemical compound [K+].CC(C)(C)[O-] LPNYRYFBWFDTMA-UHFFFAOYSA-N 0.000 description 6
- 230000004044 response Effects 0.000 description 6
- 235000017550 sodium carbonate Nutrition 0.000 description 6
- 229910000029 sodium carbonate Inorganic materials 0.000 description 6
- YBBRCQOCSYXUOC-UHFFFAOYSA-N sulfuryl dichloride Chemical compound ClS(Cl)(=O)=O YBBRCQOCSYXUOC-UHFFFAOYSA-N 0.000 description 6
- 239000003826 tablet Substances 0.000 description 6
- OGWKCGZFUXNPDA-XQKSVPLYSA-N vincristine Chemical compound C([N@]1C[C@@H](C[C@]2(C(=O)OC)C=3C(=CC4=C([C@]56[C@H]([C@@]([C@H](OC(C)=O)[C@]7(CC)C=CCN([C@H]67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)C[C@@](C1)(O)CC)CC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-XQKSVPLYSA-N 0.000 description 6
- OGWKCGZFUXNPDA-UHFFFAOYSA-N vincristine Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(OC(C)=O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C=O)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 OGWKCGZFUXNPDA-UHFFFAOYSA-N 0.000 description 6
- XWDUBOSLSYWJTR-UHFFFAOYSA-N 1-(4-aminophenyl)piperidin-2-one Chemical group C1=CC(N)=CC=C1N1C(=O)CCCC1 XWDUBOSLSYWJTR-UHFFFAOYSA-N 0.000 description 5
- QEPGWLBMAAEBCP-UHFFFAOYSA-N 4-amino-n,n-dimethylbenzamide Chemical compound CN(C)C(=O)C1=CC=C(N)C=C1 QEPGWLBMAAEBCP-UHFFFAOYSA-N 0.000 description 5
- RXILKNAPURJHSO-UHFFFAOYSA-N C(#N)C(C)(OP(OCC)(O)=O)C Chemical compound C(#N)C(C)(OP(OCC)(O)=O)C RXILKNAPURJHSO-UHFFFAOYSA-N 0.000 description 5
- 102000004889 Interleukin-6 Human genes 0.000 description 5
- 108090001005 Interleukin-6 Proteins 0.000 description 5
- BZORFPDSXLZWJF-UHFFFAOYSA-N N,N-dimethyl-1,4-phenylenediamine Chemical compound CN(C)C1=CC=C(N)C=C1 BZORFPDSXLZWJF-UHFFFAOYSA-N 0.000 description 5
- 125000000304 alkynyl group Chemical group 0.000 description 5
- GXJABQQUPOEUTA-RDJZCZTQSA-N bortezomib Chemical compound C([C@@H](C(=O)N[C@@H](CC(C)C)B(O)O)NC(=O)C=1N=CC=NC=1)C1=CC=CC=C1 GXJABQQUPOEUTA-RDJZCZTQSA-N 0.000 description 5
- 239000000460 chlorine Substances 0.000 description 5
- 229960003957 dexamethasone Drugs 0.000 description 5
- UREBDLICKHMUKA-CXSFZGCWSA-N dexamethasone Chemical compound C1CC2=CC(=O)C=C[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1C[C@@H](C)[C@@](C(=O)CO)(O)[C@@]1(C)C[C@@H]2O UREBDLICKHMUKA-CXSFZGCWSA-N 0.000 description 5
- 125000000118 dimethyl group Chemical group [H]C([H])([H])* 0.000 description 5
- 150000002148 esters Chemical class 0.000 description 5
- 230000006870 function Effects 0.000 description 5
- 125000005842 heteroatom Chemical group 0.000 description 5
- 125000001181 organosilyl group Chemical group [SiH3]* 0.000 description 5
- 230000007170 pathology Effects 0.000 description 5
- HDOWRFHMPULYOA-UHFFFAOYSA-N piperidin-4-ol Chemical compound OC1CCNCC1 HDOWRFHMPULYOA-UHFFFAOYSA-N 0.000 description 5
- 125000003003 spiro group Chemical group 0.000 description 5
- 125000002769 thiazolinyl group Chemical group 0.000 description 5
- JHHZLHWJQPUNKB-SCSAIBSYSA-N (3r)-pyrrolidin-3-ol Chemical compound O[C@@H]1CCNC1 JHHZLHWJQPUNKB-SCSAIBSYSA-N 0.000 description 4
- MXFPACNADGXIQY-UHFFFAOYSA-N 2-cyclohexylacetonitrile Chemical compound N#CCC1CCCCC1 MXFPACNADGXIQY-UHFFFAOYSA-N 0.000 description 4
- VHYFNPMBLIVWCW-UHFFFAOYSA-N 4-Dimethylaminopyridine Chemical compound CN(C)C1=CC=NC=C1 VHYFNPMBLIVWCW-UHFFFAOYSA-N 0.000 description 4
- ALYNCZNDIQEVRV-UHFFFAOYSA-N 4-aminobenzoic acid Chemical group NC1=CC=C(C(O)=O)C=C1 ALYNCZNDIQEVRV-UHFFFAOYSA-N 0.000 description 4
- IJGRMHOSHXDMSA-UHFFFAOYSA-N Atomic nitrogen Chemical compound N#N IJGRMHOSHXDMSA-UHFFFAOYSA-N 0.000 description 4
- CMSMOCZEIVJLDB-UHFFFAOYSA-N Cyclophosphamide Chemical compound ClCCN(CCCl)P1(=O)NCCCO1 CMSMOCZEIVJLDB-UHFFFAOYSA-N 0.000 description 4
- UFHFLCQGNIYNRP-UHFFFAOYSA-N Hydrogen Chemical compound [H][H] UFHFLCQGNIYNRP-UHFFFAOYSA-N 0.000 description 4
- 108090000723 Insulin-Like Growth Factor I Proteins 0.000 description 4
- 239000005551 L01XE03 - Erlotinib Substances 0.000 description 4
- 241001465754 Metazoa Species 0.000 description 4
- BAVYZALUXZFZLV-UHFFFAOYSA-N Methylamine Chemical compound NC BAVYZALUXZFZLV-UHFFFAOYSA-N 0.000 description 4
- 241000699670 Mus sp. Species 0.000 description 4
- JGFZNNIVVJXRND-UHFFFAOYSA-N N,N-diisopropylethylamine Substances CCN(C(C)C)C(C)C JGFZNNIVVJXRND-UHFFFAOYSA-N 0.000 description 4
- 201000004681 Psoriasis Diseases 0.000 description 4
- JUJWROOIHBZHMG-UHFFFAOYSA-N Pyridine Chemical compound C1=CC=NC=C1 JUJWROOIHBZHMG-UHFFFAOYSA-N 0.000 description 4
- 102000013275 Somatomedins Human genes 0.000 description 4
- 150000004646 arylidenes Chemical group 0.000 description 4
- 230000008901 benefit Effects 0.000 description 4
- 230000015572 biosynthetic process Effects 0.000 description 4
- 150000001721 carbon Chemical group 0.000 description 4
- 239000003153 chemical reaction reagent Substances 0.000 description 4
- 229910052801 chlorine Inorganic materials 0.000 description 4
- 238000002648 combination therapy Methods 0.000 description 4
- IGSKHXTUVXSOMB-UHFFFAOYSA-N cyclopropylmethanamine Chemical compound NCC1CC1 IGSKHXTUVXSOMB-UHFFFAOYSA-N 0.000 description 4
- 229940079593 drug Drugs 0.000 description 4
- AAKJLRGGTJKAMG-UHFFFAOYSA-N erlotinib Chemical compound C=12C=C(OCCOC)C(OCCOC)=CC2=NC=NC=1NC1=CC=CC(C#C)=C1 AAKJLRGGTJKAMG-UHFFFAOYSA-N 0.000 description 4
- 230000036541 health Effects 0.000 description 4
- 238000004128 high performance liquid chromatography Methods 0.000 description 4
- 150000003840 hydrochlorides Chemical class 0.000 description 4
- 238000005984 hydrogenation reaction Methods 0.000 description 4
- KTUFNOKKBVMGRW-UHFFFAOYSA-N imatinib Chemical compound C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 KTUFNOKKBVMGRW-UHFFFAOYSA-N 0.000 description 4
- 229960002411 imatinib Drugs 0.000 description 4
- 230000005764 inhibitory process Effects 0.000 description 4
- 229940100601 interleukin-6 Drugs 0.000 description 4
- HZVOZRGWRWCICA-UHFFFAOYSA-N methanediyl Chemical compound [CH2] HZVOZRGWRWCICA-UHFFFAOYSA-N 0.000 description 4
- 210000001331 nose Anatomy 0.000 description 4
- 230000037361 pathway Effects 0.000 description 4
- 239000006187 pill Substances 0.000 description 4
- 102000004169 proteins and genes Human genes 0.000 description 4
- 230000002829 reductive effect Effects 0.000 description 4
- 230000000452 restraining effect Effects 0.000 description 4
- 208000024891 symptom Diseases 0.000 description 4
- 238000003786 synthesis reaction Methods 0.000 description 4
- 210000001519 tissue Anatomy 0.000 description 4
- DYLIWHYUXAJDOJ-OWOJBTEDSA-N (e)-4-(6-aminopurin-9-yl)but-2-en-1-ol Chemical compound NC1=NC=NC2=C1N=CN2C\C=C\CO DYLIWHYUXAJDOJ-OWOJBTEDSA-N 0.000 description 3
- WFCSWCVEJLETKA-UHFFFAOYSA-N 2-piperazin-1-ylethanol Chemical compound OCCN1CCNCC1 WFCSWCVEJLETKA-UHFFFAOYSA-N 0.000 description 3
- DMWKPJRZFGLSAX-UHFFFAOYSA-N 3-(2-methylpyrimidin-4-yl)aniline Chemical compound CC1=NC=CC(C=2C=C(N)C=CC=2)=N1 DMWKPJRZFGLSAX-UHFFFAOYSA-N 0.000 description 3
- SLJBMRSOKUTXDF-UHFFFAOYSA-N 4-(1,3-oxazol-5-yl)aniline Chemical compound C1=CC(N)=CC=C1C1=CN=CO1 SLJBMRSOKUTXDF-UHFFFAOYSA-N 0.000 description 3
- 208000016683 Adult T-cell leukemia/lymphoma Diseases 0.000 description 3
- NLXLAEXVIDQMFP-UHFFFAOYSA-N Ammonia chloride Chemical compound [NH4+].[Cl-] NLXLAEXVIDQMFP-UHFFFAOYSA-N 0.000 description 3
- 206010002198 Anaphylactic reaction Diseases 0.000 description 3
- DLGOEMSEDOSKAD-UHFFFAOYSA-N Carmustine Chemical compound ClCCNC(=O)N(N=O)CCCl DLGOEMSEDOSKAD-UHFFFAOYSA-N 0.000 description 3
- ZAMOUSCENKQFHK-UHFFFAOYSA-N Chlorine atom Chemical compound [Cl] ZAMOUSCENKQFHK-UHFFFAOYSA-N 0.000 description 3
- 108020004414 DNA Proteins 0.000 description 3
- 206010012735 Diarrhoea Diseases 0.000 description 3
- GHASVSINZRGABV-UHFFFAOYSA-N Fluorouracil Chemical compound FC1=CNC(=O)NC1=O GHASVSINZRGABV-UHFFFAOYSA-N 0.000 description 3
- 206010061218 Inflammation Diseases 0.000 description 3
- 108010065805 Interleukin-12 Proteins 0.000 description 3
- 102000013462 Interleukin-12 Human genes 0.000 description 3
- 101100335081 Mus musculus Flt3 gene Proteins 0.000 description 3
- WTKZEGDFNFYCGP-UHFFFAOYSA-N Pyrazole Chemical class C=1C=NNC=1 WTKZEGDFNFYCGP-UHFFFAOYSA-N 0.000 description 3
- 210000001744 T-lymphocyte Anatomy 0.000 description 3
- 102100025093 Zinc fingers and homeoboxes protein 2 Human genes 0.000 description 3
- 239000012190 activator Substances 0.000 description 3
- 201000006966 adult T-cell leukemia Diseases 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 230000036783 anaphylactic response Effects 0.000 description 3
- 208000003455 anaphylaxis Diseases 0.000 description 3
- 210000004369 blood Anatomy 0.000 description 3
- 239000008280 blood Substances 0.000 description 3
- 229960001467 bortezomib Drugs 0.000 description 3
- 229960005243 carmustine Drugs 0.000 description 3
- 230000003197 catalytic effect Effects 0.000 description 3
- 230000004663 cell proliferation Effects 0.000 description 3
- 210000000349 chromosome Anatomy 0.000 description 3
- 239000012043 crude product Substances 0.000 description 3
- 230000002950 deficient Effects 0.000 description 3
- 210000004443 dendritic cell Anatomy 0.000 description 3
- 238000011161 development Methods 0.000 description 3
- 230000018109 developmental process Effects 0.000 description 3
- 206010012601 diabetes mellitus Diseases 0.000 description 3
- 230000004069 differentiation Effects 0.000 description 3
- 125000002147 dimethylamino group Chemical group [H]C([H])([H])N(*)C([H])([H])[H] 0.000 description 3
- 238000005516 engineering process Methods 0.000 description 3
- 239000012055 enteric layer Substances 0.000 description 3
- VJJPUSNTGOMMGY-MRVIYFEKSA-N etoposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@H](C)OC[C@H]4O3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 VJJPUSNTGOMMGY-MRVIYFEKSA-N 0.000 description 3
- 229960005420 etoposide Drugs 0.000 description 3
- YLMAHDNUQAMNNX-UHFFFAOYSA-N imatinib methanesulfonate Chemical compound CS(O)(=O)=O.C1CN(C)CCN1CC1=CC=C(C(=O)NC=2C=C(NC=3N=C(C=CN=3)C=3C=NC=CC=3)C(C)=CC=2)C=C1 YLMAHDNUQAMNNX-UHFFFAOYSA-N 0.000 description 3
- 239000003018 immunosuppressive agent Substances 0.000 description 3
- 230000004054 inflammatory process Effects 0.000 description 3
- 230000028709 inflammatory response Effects 0.000 description 3
- 239000010410 layer Substances 0.000 description 3
- 238000002386 leaching Methods 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000001404 mediated effect Effects 0.000 description 3
- 125000004573 morpholin-4-yl group Chemical group N1(CCOCC1)* 0.000 description 3
- 201000000050 myeloid neoplasm Diseases 0.000 description 3
- 210000000056 organ Anatomy 0.000 description 3
- 239000002245 particle Substances 0.000 description 3
- FPVKHBSQESCIEP-JQCXWYLXSA-N pentostatin Chemical compound C1[C@H](O)[C@@H](CO)O[C@H]1N1C(N=CNC[C@H]2O)=C2N=C1 FPVKHBSQESCIEP-JQCXWYLXSA-N 0.000 description 3
- XYFCBTPGUUZFHI-UHFFFAOYSA-O phosphonium Chemical compound [PH4+] XYFCBTPGUUZFHI-UHFFFAOYSA-O 0.000 description 3
- BASFCYQUMIYNBI-UHFFFAOYSA-N platinum Substances [Pt] BASFCYQUMIYNBI-UHFFFAOYSA-N 0.000 description 3
- 229960004618 prednisone Drugs 0.000 description 3
- XOFYZVNMUHMLCC-ZPOLXVRWSA-N prednisone Chemical compound O=C1C=C[C@]2(C)[C@H]3C(=O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 XOFYZVNMUHMLCC-ZPOLXVRWSA-N 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 238000010298 pulverizing process Methods 0.000 description 3
- 230000002441 reversible effect Effects 0.000 description 3
- 230000000638 stimulation Effects 0.000 description 3
- 238000006467 substitution reaction Methods 0.000 description 3
- 230000004083 survival effect Effects 0.000 description 3
- 239000000725 suspension Substances 0.000 description 3
- 239000006188 syrup Substances 0.000 description 3
- 235000020357 syrup Nutrition 0.000 description 3
- 229940120982 tarceva Drugs 0.000 description 3
- 238000012360 testing method Methods 0.000 description 3
- 238000013518 transcription Methods 0.000 description 3
- 230000035897 transcription Effects 0.000 description 3
- 230000005945 translocation Effects 0.000 description 3
- 229960000575 trastuzumab Drugs 0.000 description 3
- 229960004528 vincristine Drugs 0.000 description 3
- 229920002554 vinyl polymer Polymers 0.000 description 3
- KWGRBVOPPLSCSI-WPRPVWTQSA-N (-)-ephedrine Chemical compound CN[C@@H](C)[C@H](O)C1=CC=CC=C1 KWGRBVOPPLSCSI-WPRPVWTQSA-N 0.000 description 2
- IOMOVAPYJQVJDK-UHFFFAOYSA-N 1-(4-aminophenyl)pyrrolidin-2-one Chemical group C1=CC(N)=CC=C1N1C(=O)CCC1 IOMOVAPYJQVJDK-UHFFFAOYSA-N 0.000 description 2
- PKDPUENCROCRCH-UHFFFAOYSA-N 1-piperazin-1-ylethanone Chemical compound CC(=O)N1CCNCC1 PKDPUENCROCRCH-UHFFFAOYSA-N 0.000 description 2
- UEJJHQNACJXSKW-UHFFFAOYSA-N 2-(2,6-dioxopiperidin-3-yl)-1H-isoindole-1,3(2H)-dione Chemical compound O=C1C2=CC=CC=C2C(=O)N1C1CCC(=O)NC1=O UEJJHQNACJXSKW-UHFFFAOYSA-N 0.000 description 2
- APRMCBSTMFKLEI-UHFFFAOYSA-N 2-chloro-5-methylpyrimidine Chemical class CC1=CN=C(Cl)N=C1 APRMCBSTMFKLEI-UHFFFAOYSA-N 0.000 description 2
- ZVTFIBQPABQXLK-UHFFFAOYSA-N 2-piperidin-4-ylacetonitrile Chemical compound N#CCC1CCNCC1 ZVTFIBQPABQXLK-UHFFFAOYSA-N 0.000 description 2
- XPYQFIISZQCINN-QVXDJYSKSA-N 4-amino-1-[(2r,3e,4s,5r)-3-(fluoromethylidene)-4-hydroxy-5-(hydroxymethyl)oxolan-2-yl]pyrimidin-2-one;hydrate Chemical compound O.O=C1N=C(N)C=CN1[C@H]1C(=C/F)/[C@H](O)[C@@H](CO)O1 XPYQFIISZQCINN-QVXDJYSKSA-N 0.000 description 2
- YECHMIOBPCMIGF-UHFFFAOYSA-N 4-amino-n-(2-hydroxyethyl)benzamide Chemical compound NC1=CC=C(C(=O)NCCO)C=C1 YECHMIOBPCMIGF-UHFFFAOYSA-N 0.000 description 2
- NSPMIYGKQJPBQR-UHFFFAOYSA-N 4H-1,2,4-triazole Chemical compound C=1N=CNN=1 NSPMIYGKQJPBQR-UHFFFAOYSA-N 0.000 description 2
- 102000042899 ABL family Human genes 0.000 description 2
- 108091082323 ABL family Proteins 0.000 description 2
- 208000014697 Acute lymphocytic leukaemia Diseases 0.000 description 2
- 208000031261 Acute myeloid leukaemia Diseases 0.000 description 2
- ZOXJGFHDIHLPTG-UHFFFAOYSA-N Boron Chemical compound [B] ZOXJGFHDIHLPTG-UHFFFAOYSA-N 0.000 description 2
- GAGWJHPBXLXJQN-UORFTKCHSA-N Capecitabine Chemical compound C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1[C@H]1[C@H](O)[C@H](O)[C@@H](C)O1 GAGWJHPBXLXJQN-UORFTKCHSA-N 0.000 description 2
- KXDHJXZQYSOELW-UHFFFAOYSA-M Carbamate Chemical compound NC([O-])=O KXDHJXZQYSOELW-UHFFFAOYSA-M 0.000 description 2
- 206010008342 Cervix carcinoma Diseases 0.000 description 2
- VGCXGMAHQTYDJK-UHFFFAOYSA-N Chloroacetyl chloride Chemical compound ClCC(Cl)=O VGCXGMAHQTYDJK-UHFFFAOYSA-N 0.000 description 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 description 2
- QCDFBFJGMNKBDO-UHFFFAOYSA-N Clioquinol Chemical compound C1=CN=C2C(O)=C(I)C=C(Cl)C2=C1 QCDFBFJGMNKBDO-UHFFFAOYSA-N 0.000 description 2
- 206010010099 Combined immunodeficiency Diseases 0.000 description 2
- UHDGCWIWMRVCDJ-CCXZUQQUSA-N Cytarabine Chemical compound O=C1N=C(N)C=CN1[C@H]1[C@@H](O)[C@H](O)[C@@H](CO)O1 UHDGCWIWMRVCDJ-CCXZUQQUSA-N 0.000 description 2
- 230000004544 DNA amplification Effects 0.000 description 2
- ZBNZXTGUTAYRHI-UHFFFAOYSA-N Dasatinib Chemical compound C=1C(N2CCN(CCO)CC2)=NC(C)=NC=1NC(S1)=NC=C1C(=O)NC1=C(C)C=CC=C1Cl ZBNZXTGUTAYRHI-UHFFFAOYSA-N 0.000 description 2
- 201000004624 Dermatitis Diseases 0.000 description 2
- QMMFVYPAHWMCMS-UHFFFAOYSA-N Dimethyl sulfide Chemical compound CSC QMMFVYPAHWMCMS-UHFFFAOYSA-N 0.000 description 2
- 241000196324 Embryophyta Species 0.000 description 2
- 206010014759 Endometrial neoplasm Diseases 0.000 description 2
- 102000004190 Enzymes Human genes 0.000 description 2
- 108090000790 Enzymes Proteins 0.000 description 2
- QUSNBJAOOMFDIB-UHFFFAOYSA-N Ethylamine Chemical compound CCN QUSNBJAOOMFDIB-UHFFFAOYSA-N 0.000 description 2
- 208000010201 Exanthema Diseases 0.000 description 2
- 206010016654 Fibrosis Diseases 0.000 description 2
- 102100037813 Focal adhesion kinase 1 Human genes 0.000 description 2
- VWUXBMIQPBEWFH-WCCTWKNTSA-N Fulvestrant Chemical compound OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3[C@H](CCCCCCCCCS(=O)CCCC(F)(F)C(F)(F)F)CC2=C1 VWUXBMIQPBEWFH-WCCTWKNTSA-N 0.000 description 2
- 108010017213 Granulocyte-Macrophage Colony-Stimulating Factor Proteins 0.000 description 2
- 102100039620 Granulocyte-macrophage colony-stimulating factor Human genes 0.000 description 2
- 101000996563 Homo sapiens Nuclear pore complex protein Nup214 Proteins 0.000 description 2
- 101000850794 Homo sapiens Tropomyosin alpha-3 chain Proteins 0.000 description 2
- 101000604583 Homo sapiens Tyrosine-protein kinase SYK Proteins 0.000 description 2
- 206010020651 Hyperkinesia Diseases 0.000 description 2
- 208000000269 Hyperkinesis Diseases 0.000 description 2
- 102000004877 Insulin Human genes 0.000 description 2
- 108090001061 Insulin Proteins 0.000 description 2
- 102000004388 Interleukin-4 Human genes 0.000 description 2
- 108090000978 Interleukin-4 Proteins 0.000 description 2
- 229940123241 Janus kinase 3 inhibitor Drugs 0.000 description 2
- 239000005411 L01XE02 - Gefitinib Substances 0.000 description 2
- 239000002067 L01XE06 - Dasatinib Substances 0.000 description 2
- 102000016267 Leptin Human genes 0.000 description 2
- 108010092277 Leptin Proteins 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- YNAVUWVOSKDBBP-UHFFFAOYSA-N Morpholine Chemical compound C1COCCN1 YNAVUWVOSKDBBP-UHFFFAOYSA-N 0.000 description 2
- ZDZOTLJHXYCWBA-VCVYQWHSSA-N N-debenzoyl-N-(tert-butoxycarbonyl)-10-deacetyltaxol Chemical compound O([C@H]1[C@H]2[C@@](C([C@H](O)C3=C(C)[C@@H](OC(=O)[C@H](O)[C@@H](NC(=O)OC(C)(C)C)C=4C=CC=CC=4)C[C@]1(O)C3(C)C)=O)(C)[C@@H](O)C[C@H]1OC[C@]12OC(=O)C)C(=O)C1=CC=CC=C1 ZDZOTLJHXYCWBA-VCVYQWHSSA-N 0.000 description 2
- 102100033819 Nuclear pore complex protein Nup214 Human genes 0.000 description 2
- 108700020796 Oncogene Proteins 0.000 description 2
- 229930012538 Paclitaxel Natural products 0.000 description 2
- ISWSIDIOOBJBQZ-UHFFFAOYSA-N Phenol Chemical compound OC1=CC=CC=C1 ISWSIDIOOBJBQZ-UHFFFAOYSA-N 0.000 description 2
- NQRYJNQNLNOLGT-UHFFFAOYSA-N Piperidine Chemical compound C1CCNCC1 NQRYJNQNLNOLGT-UHFFFAOYSA-N 0.000 description 2
- 208000006664 Precursor Cell Lymphoblastic Leukemia-Lymphoma Diseases 0.000 description 2
- QOSMNYMQXIVWKY-UHFFFAOYSA-N Propyl levulinate Chemical compound CCCOC(=O)CCC(C)=O QOSMNYMQXIVWKY-UHFFFAOYSA-N 0.000 description 2
- CZPWVGJYEJSRLH-UHFFFAOYSA-N Pyrimidine Chemical compound C1=CN=CN=C1 CZPWVGJYEJSRLH-UHFFFAOYSA-N 0.000 description 2
- 108010017324 STAT3 Transcription Factor Proteins 0.000 description 2
- 102000005886 STAT4 Transcription Factor Human genes 0.000 description 2
- 108010019992 STAT4 Transcription Factor Proteins 0.000 description 2
- 108010011005 STAT6 Transcription Factor Proteins 0.000 description 2
- 206010039710 Scleroderma Diseases 0.000 description 2
- 102100024040 Signal transducer and activator of transcription 3 Human genes 0.000 description 2
- 102100023980 Signal transducer and activator of transcription 6 Human genes 0.000 description 2
- 206010051379 Systemic Inflammatory Response Syndrome Diseases 0.000 description 2
- NKANXQFJJICGDU-QPLCGJKRSA-N Tamoxifen Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=CC(OCCN(C)C)=CC=1)/C1=CC=CC=C1 NKANXQFJJICGDU-QPLCGJKRSA-N 0.000 description 2
- MUMGGOZAMZWBJJ-DYKIIFRCSA-N Testostosterone Chemical compound O=C1CC[C@]2(C)[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 MUMGGOZAMZWBJJ-DYKIIFRCSA-N 0.000 description 2
- 102100038183 Tyrosine-protein kinase SYK Human genes 0.000 description 2
- 208000006105 Uterine Cervical Neoplasms Diseases 0.000 description 2
- XMYKNCNAZKMVQN-NYYWCZLTSA-N [(e)-(3-aminopyridin-2-yl)methylideneamino]thiourea Chemical compound NC(=S)N\N=C\C1=NC=CC=C1N XMYKNCNAZKMVQN-NYYWCZLTSA-N 0.000 description 2
- WETWJCDKMRHUPV-UHFFFAOYSA-N acetyl chloride Chemical compound CC(Cl)=O WETWJCDKMRHUPV-UHFFFAOYSA-N 0.000 description 2
- 239000012346 acetyl chloride Substances 0.000 description 2
- 230000002378 acidificating effect Effects 0.000 description 2
- RJURFGZVJUQBHK-UHFFFAOYSA-N actinomycin D Natural products CC1OC(=O)C(C(C)C)N(C)C(=O)CN(C)C(=O)C2CCCN2C(=O)C(C(C)C)NC(=O)C1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)NC4C(=O)NC(C(N5CCCC5C(=O)N(C)CC(=O)N(C)C(C(C)C)C(=O)OC4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-UHFFFAOYSA-N 0.000 description 2
- 239000000443 aerosol Substances 0.000 description 2
- 125000001118 alkylidene group Chemical group 0.000 description 2
- 229960000473 altretamine Drugs 0.000 description 2
- 150000001412 amines Chemical class 0.000 description 2
- 230000003110 anti-inflammatory effect Effects 0.000 description 2
- 230000006907 apoptotic process Effects 0.000 description 2
- 125000006615 aromatic heterocyclic group Chemical group 0.000 description 2
- 208000010668 atopic eczema Diseases 0.000 description 2
- 229940120638 avastin Drugs 0.000 description 2
- HGQULGDOROIPJN-UHFFFAOYSA-N azetidin-1-ium;chloride Chemical compound Cl.C1CNC1 HGQULGDOROIPJN-UHFFFAOYSA-N 0.000 description 2
- 125000004196 benzothienyl group Chemical group S1C(=CC2=C1C=CC=C2)* 0.000 description 2
- PASDCCFISLVPSO-UHFFFAOYSA-N benzoyl chloride Chemical compound ClC(=O)C1=CC=CC=C1 PASDCCFISLVPSO-UHFFFAOYSA-N 0.000 description 2
- 230000037396 body weight Effects 0.000 description 2
- 238000009835 boiling Methods 0.000 description 2
- 206010006451 bronchitis Diseases 0.000 description 2
- 239000002775 capsule Substances 0.000 description 2
- 150000001732 carboxylic acid derivatives Chemical class 0.000 description 2
- 230000006369 cell cycle progression Effects 0.000 description 2
- 230000010261 cell growth Effects 0.000 description 2
- 201000010881 cervical cancer Diseases 0.000 description 2
- 239000011248 coating agent Substances 0.000 description 2
- 238000000576 coating method Methods 0.000 description 2
- 125000000596 cyclohexenyl group Chemical group C1(=CCCCC1)* 0.000 description 2
- FNIATMYXUPOJRW-UHFFFAOYSA-N cyclohexylidene Chemical group [C]1CCCCC1 FNIATMYXUPOJRW-UHFFFAOYSA-N 0.000 description 2
- 125000002433 cyclopentenyl group Chemical group C1(=CCCC1)* 0.000 description 2
- GVBDCMFQDYOTDV-UHFFFAOYSA-N cyclopropane;sulfuryl dichloride Chemical compound C1CC1.ClS(Cl)(=O)=O GVBDCMFQDYOTDV-UHFFFAOYSA-N 0.000 description 2
- 230000006378 damage Effects 0.000 description 2
- 229960002448 dasatinib Drugs 0.000 description 2
- OYKIERKRPUDEIV-UHFFFAOYSA-N decane;hydrochloride Chemical compound Cl.CCCCCCCCCC OYKIERKRPUDEIV-UHFFFAOYSA-N 0.000 description 2
- 230000001419 dependent effect Effects 0.000 description 2
- 238000013461 design Methods 0.000 description 2
- DXPIZCZNFUTPEI-UHFFFAOYSA-N diphenylphosphane;azide Chemical compound [N-]=[N+]=[N-].C=1C=CC=CC=1PC1=CC=CC=C1 DXPIZCZNFUTPEI-UHFFFAOYSA-N 0.000 description 2
- 229960003668 docetaxel Drugs 0.000 description 2
- 239000000839 emulsion Substances 0.000 description 2
- 229940088598 enzyme Drugs 0.000 description 2
- 229940082789 erbitux Drugs 0.000 description 2
- 230000010437 erythropoiesis Effects 0.000 description 2
- OAYLNYINCPYISS-UHFFFAOYSA-N ethyl acetate;hexane Chemical compound CCCCCC.CCOC(C)=O OAYLNYINCPYISS-UHFFFAOYSA-N 0.000 description 2
- 201000005884 exanthem Diseases 0.000 description 2
- 239000000284 extract Substances 0.000 description 2
- 238000000605 extraction Methods 0.000 description 2
- 230000004761 fibrosis Effects 0.000 description 2
- 238000001914 filtration Methods 0.000 description 2
- GIUYCYHIANZCFB-FJFJXFQQSA-N fludarabine phosphate Chemical compound C1=NC=2C(N)=NC(F)=NC=2N1[C@@H]1O[C@H](COP(O)(O)=O)[C@@H](O)[C@@H]1O GIUYCYHIANZCFB-FJFJXFQQSA-N 0.000 description 2
- 235000013305 food Nutrition 0.000 description 2
- 238000010575 fractional recrystallization Methods 0.000 description 2
- 229960002258 fulvestrant Drugs 0.000 description 2
- 239000007789 gas Substances 0.000 description 2
- XGALLCVXEZPNRQ-UHFFFAOYSA-N gefitinib Chemical compound C=12C=C(OCCCN3CCOCC3)C(OC)=CC2=NC=NC=1NC1=CC=C(F)C(Cl)=C1 XGALLCVXEZPNRQ-UHFFFAOYSA-N 0.000 description 2
- 229940080856 gleevec Drugs 0.000 description 2
- 125000001188 haloalkyl group Chemical group 0.000 description 2
- 210000003958 hematopoietic stem cell Anatomy 0.000 description 2
- UUVWYPNAQBNQJQ-UHFFFAOYSA-N hexamethylmelamine Chemical compound CN(C)C1=NC(N(C)C)=NC(N(C)C)=N1 UUVWYPNAQBNQJQ-UHFFFAOYSA-N 0.000 description 2
- 125000002887 hydroxy group Chemical group [H]O* 0.000 description 2
- 208000013403 hyperactivity Diseases 0.000 description 2
- 229960001101 ifosfamide Drugs 0.000 description 2
- HOMGKSMUEGBAAB-UHFFFAOYSA-N ifosfamide Chemical compound ClCCNP1(=O)OCCCN1CCCl HOMGKSMUEGBAAB-UHFFFAOYSA-N 0.000 description 2
- 238000002649 immunization Methods 0.000 description 2
- 230000003053 immunization Effects 0.000 description 2
- 230000001506 immunosuppresive effect Effects 0.000 description 2
- 238000001802 infusion Methods 0.000 description 2
- NOESYZHRGYRDHS-UHFFFAOYSA-N insulin Chemical compound N1C(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(NC(=O)CN)C(C)CC)CSSCC(C(NC(CO)C(=O)NC(CC(C)C)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CCC(N)=O)C(=O)NC(CC(C)C)C(=O)NC(CCC(O)=O)C(=O)NC(CC(N)=O)C(=O)NC(CC=2C=CC(O)=CC=2)C(=O)NC(CSSCC(NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2C=CC(O)=CC=2)NC(=O)C(CC(C)C)NC(=O)C(C)NC(=O)C(CCC(O)=O)NC(=O)C(C(C)C)NC(=O)C(CC(C)C)NC(=O)C(CC=2NC=NC=2)NC(=O)C(CO)NC(=O)CNC2=O)C(=O)NCC(=O)NC(CCC(O)=O)C(=O)NC(CCCNC(N)=N)C(=O)NCC(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC=CC=3)C(=O)NC(CC=3C=CC(O)=CC=3)C(=O)NC(C(C)O)C(=O)N3C(CCC3)C(=O)NC(CCCCN)C(=O)NC(C)C(O)=O)C(=O)NC(CC(N)=O)C(O)=O)=O)NC(=O)C(C(C)CC)NC(=O)C(CO)NC(=O)C(C(C)O)NC(=O)C1CSSCC2NC(=O)C(CC(C)C)NC(=O)C(NC(=O)C(CCC(N)=O)NC(=O)C(CC(N)=O)NC(=O)C(NC(=O)C(N)CC=1C=CC=CC=1)C(C)C)CC1=CN=CN1 NOESYZHRGYRDHS-UHFFFAOYSA-N 0.000 description 2
- 230000003834 intracellular effect Effects 0.000 description 2
- 229940084651 iressa Drugs 0.000 description 2
- JVTAAEKCZFNVCJ-UHFFFAOYSA-N lactic acid Chemical compound CC(O)C(O)=O JVTAAEKCZFNVCJ-UHFFFAOYSA-N 0.000 description 2
- GOTYRUGSSMKFNF-UHFFFAOYSA-N lenalidomide Chemical compound C1C=2C(N)=CC=CC=2C(=O)N1C1CCC(=O)NC1=O GOTYRUGSSMKFNF-UHFFFAOYSA-N 0.000 description 2
- NRYBAZVQPHGZNS-ZSOCWYAHSA-N leptin Chemical compound O=C([C@H](CO)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC(C)C)NC(=O)[C@@H](NC(=O)[C@H](CC(O)=O)NC(=O)[C@H](CCC(N)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CO)NC(=O)CNC(=O)[C@H](CCC(N)=O)NC(=O)[C@@H](N)CC(C)C)CCSC)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CS)C(O)=O NRYBAZVQPHGZNS-ZSOCWYAHSA-N 0.000 description 2
- 229940039781 leptin Drugs 0.000 description 2
- 229960003881 letrozole Drugs 0.000 description 2
- HPJKCIUCZWXJDR-UHFFFAOYSA-N letrozole Chemical compound C1=CC(C#N)=CC=C1C(N1N=CN=C1)C1=CC=C(C#N)C=C1 HPJKCIUCZWXJDR-UHFFFAOYSA-N 0.000 description 2
- 125000005647 linker group Chemical group 0.000 description 2
- 210000004185 liver Anatomy 0.000 description 2
- HQKMJHAJHXVSDF-UHFFFAOYSA-L magnesium stearate Chemical compound [Mg+2].CCCCCCCCCCCCCCCCCC([O-])=O.CCCCCCCCCCCCCCCCCC([O-])=O HQKMJHAJHXVSDF-UHFFFAOYSA-L 0.000 description 2
- GLVAUDGFNGKCSF-UHFFFAOYSA-N mercaptopurine Chemical compound S=C1NC=NC2=C1NC=N2 GLVAUDGFNGKCSF-UHFFFAOYSA-N 0.000 description 2
- QPJVMBTYPHYUOC-UHFFFAOYSA-N methyl benzoate Chemical compound COC(=O)C1=CC=CC=C1 QPJVMBTYPHYUOC-UHFFFAOYSA-N 0.000 description 2
- XMJHPCRAQCTCFT-UHFFFAOYSA-N methyl chloroformate Chemical compound COC(Cl)=O XMJHPCRAQCTCFT-UHFFFAOYSA-N 0.000 description 2
- 230000004048 modification Effects 0.000 description 2
- 238000012986 modification Methods 0.000 description 2
- 238000012544 monitoring process Methods 0.000 description 2
- 238000010172 mouse model Methods 0.000 description 2
- 230000035772 mutation Effects 0.000 description 2
- 201000005962 mycosis fungoides Diseases 0.000 description 2
- HDCCJUCOIKLZNM-ZCFIWIBFSA-N n-[(3r)-pyrrolidin-3-yl]acetamide Chemical compound CC(=O)N[C@@H]1CCNC1 HDCCJUCOIKLZNM-ZCFIWIBFSA-N 0.000 description 2
- 125000000740 n-pentyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])C([H])([H])C([H])([H])* 0.000 description 2
- 231100000252 nontoxic Toxicity 0.000 description 2
- 230000003000 nontoxic effect Effects 0.000 description 2
- 239000002674 ointment Substances 0.000 description 2
- 150000007524 organic acids Chemical class 0.000 description 2
- 239000012074 organic phase Substances 0.000 description 2
- 239000003960 organic solvent Substances 0.000 description 2
- CTSLXHKWHWQRSH-UHFFFAOYSA-N oxalyl chloride Chemical compound ClC(=O)C(Cl)=O CTSLXHKWHWQRSH-UHFFFAOYSA-N 0.000 description 2
- 229960001592 paclitaxel Drugs 0.000 description 2
- 229960002340 pentostatin Drugs 0.000 description 2
- 239000008194 pharmaceutical composition Substances 0.000 description 2
- 210000004214 philadelphia chromosome Anatomy 0.000 description 2
- IWELDVXSEVIIGI-UHFFFAOYSA-N piperazin-2-one Chemical compound O=C1CNCCN1 IWELDVXSEVIIGI-UHFFFAOYSA-N 0.000 description 2
- 125000005936 piperidyl group Chemical group 0.000 description 2
- 229910052697 platinum Inorganic materials 0.000 description 2
- 229920000642 polymer Polymers 0.000 description 2
- 208000005069 pulmonary fibrosis Diseases 0.000 description 2
- 150000003217 pyrazoles Chemical class 0.000 description 2
- 206010037844 rash Diseases 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 229940120975 revlimid Drugs 0.000 description 2
- 206010039083 rhinitis Diseases 0.000 description 2
- 229960004641 rituximab Drugs 0.000 description 2
- 238000000926 separation method Methods 0.000 description 2
- 201000009890 sinusitis Diseases 0.000 description 2
- 235000017557 sodium bicarbonate Nutrition 0.000 description 2
- 229910000030 sodium bicarbonate Inorganic materials 0.000 description 2
- 239000012453 solvate Substances 0.000 description 2
- 238000005507 spraying Methods 0.000 description 2
- 238000004659 sterilization and disinfection Methods 0.000 description 2
- 125000001424 substituent group Chemical group 0.000 description 2
- 239000000758 substrate Substances 0.000 description 2
- 239000000829 suppository Substances 0.000 description 2
- 208000011580 syndromic disease Diseases 0.000 description 2
- RCINICONZNJXQF-MZXODVADSA-N taxol Chemical compound O([C@@H]1[C@@]2(C[C@@H](C(C)=C(C2(C)C)[C@H](C([C@]2(C)[C@@H](O)C[C@H]3OC[C@]3([C@H]21)OC(C)=O)=O)OC(=O)C)OC(=O)[C@H](O)[C@@H](NC(=O)C=1C=CC=CC=1)C=1C=CC=CC=1)O)C(=O)C1=CC=CC=C1 RCINICONZNJXQF-MZXODVADSA-N 0.000 description 2
- 229960003433 thalidomide Drugs 0.000 description 2
- 125000001544 thienyl group Chemical group 0.000 description 2
- 125000004149 thio group Chemical group *S* 0.000 description 2
- 230000017423 tissue regeneration Effects 0.000 description 2
- 231100000419 toxicity Toxicity 0.000 description 2
- 230000001988 toxicity Effects 0.000 description 2
- 230000009466 transformation Effects 0.000 description 2
- 229960005526 triapine Drugs 0.000 description 2
- OUYCCCASQSFEME-UHFFFAOYSA-N tyrosine Natural products OC(=O)C(N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-UHFFFAOYSA-N 0.000 description 2
- 125000001493 tyrosinyl group Chemical group [H]OC1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])C([H])(N([H])[H])C(*)=O 0.000 description 2
- TUCIOBMMDDOEMM-RIYZIHGNSA-N tyrphostin B42 Chemical compound C1=C(O)C(O)=CC=C1\C=C(/C#N)C(=O)NCC1=CC=CC=C1 TUCIOBMMDDOEMM-RIYZIHGNSA-N 0.000 description 2
- 239000003981 vehicle Substances 0.000 description 2
- 229940099039 velcade Drugs 0.000 description 2
- 239000003643 water by type Substances 0.000 description 2
- FMCGSUUBYTWNDP-ONGXEEELSA-N (1R,2S)-2-(dimethylamino)-1-phenyl-1-propanol Chemical compound CN(C)[C@@H](C)[C@H](O)C1=CC=CC=C1 FMCGSUUBYTWNDP-ONGXEEELSA-N 0.000 description 1
- HFQTYOGWDNGZMS-XCBNKYQSSA-N (1S,4S)-4,7,7-trimethylbicyclo[2.2.1]heptan-2-one Chemical compound C1C[C@@]2(C)CC(=O)[C@@H]1C2(C)C HFQTYOGWDNGZMS-XCBNKYQSSA-N 0.000 description 1
- MEIRRNXMZYDVDW-MQQKCMAXSA-N (2E,4E)-2,4-hexadien-1-ol Chemical compound C\C=C\C=C\CO MEIRRNXMZYDVDW-MQQKCMAXSA-N 0.000 description 1
- LENYOXXELREKGZ-WCCKRBBISA-N (3s)-3-fluoropyrrolidin-1-ium;chloride Chemical compound Cl.F[C@H]1CCNC1 LENYOXXELREKGZ-WCCKRBBISA-N 0.000 description 1
- QYAPHLRPFNSDNH-MRFRVZCGSA-N (4s,4as,5as,6s,12ar)-7-chloro-4-(dimethylamino)-1,6,10,11,12a-pentahydroxy-6-methyl-3,12-dioxo-4,4a,5,5a-tetrahydrotetracene-2-carboxamide;hydrochloride Chemical compound Cl.C1=CC(Cl)=C2[C@](O)(C)[C@H]3C[C@H]4[C@H](N(C)C)C(=O)C(C(N)=O)=C(O)[C@@]4(O)C(=O)C3=C(O)C2=C1O QYAPHLRPFNSDNH-MRFRVZCGSA-N 0.000 description 1
- FPVKHBSQESCIEP-UHFFFAOYSA-N (8S)-3-(2-deoxy-beta-D-erythro-pentofuranosyl)-3,6,7,8-tetrahydroimidazo[4,5-d][1,3]diazepin-8-ol Natural products C1C(O)C(CO)OC1N1C(NC=NCC2O)=C2N=C1 FPVKHBSQESCIEP-UHFFFAOYSA-N 0.000 description 1
- FDKXTQMXEQVLRF-ZHACJKMWSA-N (E)-dacarbazine Chemical compound CN(C)\N=N\c1[nH]cnc1C(N)=O FDKXTQMXEQVLRF-ZHACJKMWSA-N 0.000 description 1
- MIOPJNTWMNEORI-GMSGAONNSA-N (S)-camphorsulfonic acid Chemical compound C1C[C@@]2(CS(O)(=O)=O)C(=O)C[C@@H]1C2(C)C MIOPJNTWMNEORI-GMSGAONNSA-N 0.000 description 1
- BOOTUGDAUWQTPJ-GORDUTHDSA-N (e)-3-cyclobutylprop-2-enenitrile Chemical compound N#C\C=C\C1CCC1 BOOTUGDAUWQTPJ-GORDUTHDSA-N 0.000 description 1
- AHJKTMQDOYBLSR-OWOJBTEDSA-N (e)-3-cyclopropylprop-2-enenitrile Chemical compound N#C\C=C\C1CC1 AHJKTMQDOYBLSR-OWOJBTEDSA-N 0.000 description 1
- 125000004514 1,2,4-thiadiazolyl group Chemical group 0.000 description 1
- NASLINFISOTVJJ-UHFFFAOYSA-N 1,2-oxazole-5-carbonyl chloride Chemical compound ClC(=O)C1=CC=NO1 NASLINFISOTVJJ-UHFFFAOYSA-N 0.000 description 1
- FTNJQNQLEGKTGD-UHFFFAOYSA-N 1,3-benzodioxole Chemical compound C1=CC=C2OCOC2=C1 FTNJQNQLEGKTGD-UHFFFAOYSA-N 0.000 description 1
- CBCKQZAAMUWICA-UHFFFAOYSA-N 1,4-phenylenediamine Chemical compound NC1=CC=C(N)C=C1 CBCKQZAAMUWICA-UHFFFAOYSA-N 0.000 description 1
- GJESQJQIJJOFBG-UHFFFAOYSA-N 1-(2,4-dihydroxyphenyl)-2-(4-methoxyphenoxy)ethanone Chemical compound C1=CC(OC)=CC=C1OCC(=O)C1=CC=C(O)C=C1O GJESQJQIJJOFBG-UHFFFAOYSA-N 0.000 description 1
- MRBFGEHILMYPTF-UHFFFAOYSA-N 1-(2-Pyrimidyl)piperazine Chemical compound C1CNCCN1C1=NC=CC=N1 MRBFGEHILMYPTF-UHFFFAOYSA-N 0.000 description 1
- 102100025573 1-alkyl-2-acetylglycerophosphocholine esterase Human genes 0.000 description 1
- LOYZVRIHVZEDMW-UHFFFAOYSA-N 1-bromo-3-methylbut-2-ene Chemical compound CC(C)=CCBr LOYZVRIHVZEDMW-UHFFFAOYSA-N 0.000 description 1
- VSNHCAURESNICA-NJFSPNSNSA-N 1-oxidanylurea Chemical compound N[14C](=O)NO VSNHCAURESNICA-NJFSPNSNSA-N 0.000 description 1
- RQEUFEKYXDPUSK-UHFFFAOYSA-N 1-phenylethylamine Chemical compound CC(N)C1=CC=CC=C1 RQEUFEKYXDPUSK-UHFFFAOYSA-N 0.000 description 1
- DBPWSSGDRRHUNT-CEGNMAFCSA-N 17α-hydroxyprogesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@@H]2[C@@H]1[C@@H]1CC[C@@](C(=O)C)(O)[C@@]1(C)CC2 DBPWSSGDRRHUNT-CEGNMAFCSA-N 0.000 description 1
- QWENRTYMTSOGBR-UHFFFAOYSA-N 1H-1,2,3-Triazole Chemical compound C=1C=NNN=1 QWENRTYMTSOGBR-UHFFFAOYSA-N 0.000 description 1
- RAXXELZNTBOGNW-UHFFFAOYSA-N 1H-imidazole Chemical class C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 1
- LFHLEABTNIQIQO-UHFFFAOYSA-N 1H-isoindole Chemical compound C1=CC=C2CN=CC2=C1 LFHLEABTNIQIQO-UHFFFAOYSA-N 0.000 description 1
- KVCXYSXBZUHWKN-UHFFFAOYSA-N 2-(3-hydroxy-1-phenylmethoxycarbonylpyrrolidin-3-yl)-2-methylpropanoic acid Chemical compound C1C(C(C)(C(O)=O)C)(O)CCN1C(=O)OCC1=CC=CC=C1 KVCXYSXBZUHWKN-UHFFFAOYSA-N 0.000 description 1
- UZYQSNQJLWTICD-UHFFFAOYSA-N 2-(n-benzoylanilino)-2,2-dinitroacetic acid Chemical compound C=1C=CC=CC=1N(C(C(=O)O)([N+]([O-])=O)[N+]([O-])=O)C(=O)C1=CC=CC=C1 UZYQSNQJLWTICD-UHFFFAOYSA-N 0.000 description 1
- QQZOPKMRPOGIEB-UHFFFAOYSA-N 2-Oxohexane Chemical compound CCCCC(C)=O QQZOPKMRPOGIEB-UHFFFAOYSA-N 0.000 description 1
- RTQWWZBSTRGEAV-PKHIMPSTSA-N 2-[[(2s)-2-[bis(carboxymethyl)amino]-3-[4-(methylcarbamoylamino)phenyl]propyl]-[2-[bis(carboxymethyl)amino]propyl]amino]acetic acid Chemical compound CNC(=O)NC1=CC=C(C[C@@H](CN(CC(C)N(CC(O)=O)CC(O)=O)CC(O)=O)N(CC(O)=O)CC(O)=O)C=C1 RTQWWZBSTRGEAV-PKHIMPSTSA-N 0.000 description 1
- IJXJGQCXFSSHNL-UHFFFAOYSA-N 2-amino-2-phenylethanol Chemical compound OCC(N)C1=CC=CC=C1 IJXJGQCXFSSHNL-UHFFFAOYSA-N 0.000 description 1
- KMGUEILFFWDGFV-UHFFFAOYSA-N 2-benzoyl-2-benzoyloxy-3-hydroxybutanedioic acid Chemical compound C=1C=CC=CC=1C(=O)C(C(C(O)=O)O)(C(O)=O)OC(=O)C1=CC=CC=C1 KMGUEILFFWDGFV-UHFFFAOYSA-N 0.000 description 1
- CBIAKDAYHRWZCU-UHFFFAOYSA-N 2-bromo-4-[(6,7-dimethoxyquinazolin-4-yl)amino]phenol Chemical compound C=12C=C(OC)C(OC)=CC2=NC=NC=1NC1=CC=C(O)C(Br)=C1 CBIAKDAYHRWZCU-UHFFFAOYSA-N 0.000 description 1
- RSUBGBZOMBTDTI-UHFFFAOYSA-N 2-chloro-5-methoxypyrimidine Chemical class COC1=CN=C(Cl)N=C1 RSUBGBZOMBTDTI-UHFFFAOYSA-N 0.000 description 1
- ZZPNDIHOQDQVNU-UHFFFAOYSA-N 2-hydroxy-4,4,5,5-tetramethyl-1,3,2-dioxaborolane Chemical compound CC1(C)OB(O)OC1(C)C ZZPNDIHOQDQVNU-UHFFFAOYSA-N 0.000 description 1
- STXABSODTGKUAK-UHFFFAOYSA-N 2-pyrrolidin-3-ylpyridine Chemical compound C1NCCC1C1=CC=CC=N1 STXABSODTGKUAK-UHFFFAOYSA-N 0.000 description 1
- VHMICKWLTGFITH-UHFFFAOYSA-N 2H-isoindole Chemical compound C1=CC=CC2=CNC=C21 VHMICKWLTGFITH-UHFFFAOYSA-N 0.000 description 1
- NDMPLJNOPCLANR-UHFFFAOYSA-N 3,4-dihydroxy-15-(4-hydroxy-18-methoxycarbonyl-5,18-seco-ibogamin-18-yl)-16-methoxy-1-methyl-6,7-didehydro-aspidospermidine-3-carboxylic acid methyl ester Natural products C1C(CC)(O)CC(CC2(C(=O)OC)C=3C(=CC4=C(C56C(C(C(O)C7(CC)C=CCN(C67)CC5)(O)C(=O)OC)N4C)C=3)OC)CN1CCC1=C2NC2=CC=CC=C12 NDMPLJNOPCLANR-UHFFFAOYSA-N 0.000 description 1
- JHUUPUMBZGWODW-UHFFFAOYSA-N 3,6-dihydro-1,2-dioxine Chemical compound C1OOCC=C1 JHUUPUMBZGWODW-UHFFFAOYSA-N 0.000 description 1
- IPBNQTRHMAXPRJ-UHFFFAOYSA-N 3-(2-aminoethyl)-1h-imidazol-2-one Chemical compound NCCN1C=CNC1=O IPBNQTRHMAXPRJ-UHFFFAOYSA-N 0.000 description 1
- AJHPGXZOIAYYDW-UHFFFAOYSA-N 3-(2-cyanophenyl)-2-[(2-methylpropan-2-yl)oxycarbonylamino]propanoic acid Chemical group CC(C)(C)OC(=O)NC(C(O)=O)CC1=CC=CC=C1C#N AJHPGXZOIAYYDW-UHFFFAOYSA-N 0.000 description 1
- FLGISLVJQPPAMV-UHFFFAOYSA-N 3-(2h-tetrazol-5-yl)aniline Chemical compound NC1=CC=CC(C2=NNN=N2)=C1 FLGISLVJQPPAMV-UHFFFAOYSA-N 0.000 description 1
- XTZPWXGGWOLFQY-UHFFFAOYSA-N 3-[4-(2-chloro-5-methoxypyrimidin-4-yl)pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound COC1=CN=C(Cl)N=C1C1=CN(C(CC#N)C2CCCC2)N=C1 XTZPWXGGWOLFQY-UHFFFAOYSA-N 0.000 description 1
- OZOWDKMCYYHTLN-UHFFFAOYSA-N 3-[4-(2-chloro-5-methylpyrimidin-4-yl)pyrazol-1-yl]-3-cyclopentylpropanenitrile Chemical compound CC1=CN=C(Cl)N=C1C1=CN(C(CC#N)C2CCCC2)N=C1 OZOWDKMCYYHTLN-UHFFFAOYSA-N 0.000 description 1
- WEVYNIUIFUYDGI-UHFFFAOYSA-N 3-[6-[4-(trifluoromethoxy)anilino]-4-pyrimidinyl]benzamide Chemical compound NC(=O)C1=CC=CC(C=2N=CN=C(NC=3C=CC(OC(F)(F)F)=CC=3)C=2)=C1 WEVYNIUIFUYDGI-UHFFFAOYSA-N 0.000 description 1
- VMELXYJYSXXORF-UHFFFAOYSA-N 3-cyclopentylprop-2-enenitrile Chemical compound N#CC=CC1CCCC1 VMELXYJYSXXORF-UHFFFAOYSA-N 0.000 description 1
- PPUBMRYNGIUSBF-UHFFFAOYSA-N 3-cyclopentylpropanenitrile Chemical compound N#CCCC1CCCC1 PPUBMRYNGIUSBF-UHFFFAOYSA-N 0.000 description 1
- AOJJSUZBOXZQNB-VTZDEGQISA-N 4'-epidoxorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(=O)CO)[C@H]1C[C@H](N)[C@@H](O)[C@H](C)O1 AOJJSUZBOXZQNB-VTZDEGQISA-N 0.000 description 1
- VPFIQJZJPGVXNY-UHFFFAOYSA-N 4,4-dimethyl-1-oxa-7-azaspiro[4.4]nonane Chemical compound CC1(C)CCOC11CNCC1 VPFIQJZJPGVXNY-UHFFFAOYSA-N 0.000 description 1
- HOZUXBLMYUPGPZ-UHFFFAOYSA-N 4-[(6,7-dimethoxyquinazolin-4-yl)amino]phenol Chemical compound C=12C=C(OC)C(OC)=CC2=NC=NC=1NC1=CC=C(O)C=C1 HOZUXBLMYUPGPZ-UHFFFAOYSA-N 0.000 description 1
- 229960000549 4-dimethylaminophenol Drugs 0.000 description 1
- PHNDZBFLOPIMSM-UHFFFAOYSA-N 4-morpholin-4-ylaniline Chemical compound C1=CC(N)=CC=C1N1CCOCC1 PHNDZBFLOPIMSM-UHFFFAOYSA-N 0.000 description 1
- TYMLOMAKGOJONV-UHFFFAOYSA-N 4-nitroaniline Chemical compound NC1=CC=C([N+]([O-])=O)C=C1 TYMLOMAKGOJONV-UHFFFAOYSA-N 0.000 description 1
- KBYPITRKIJKGMD-UHFFFAOYSA-N 4-phenoxypiperidine Chemical class C1CNCCC1OC1=CC=CC=C1 KBYPITRKIJKGMD-UHFFFAOYSA-N 0.000 description 1
- 229940044174 4-phenylenediamine Drugs 0.000 description 1
- UTBULQCHEUWJNV-UHFFFAOYSA-N 4-phenylpiperidine Chemical compound C1CNCCC1C1=CC=CC=C1 UTBULQCHEUWJNV-UHFFFAOYSA-N 0.000 description 1
- VAVOYRCCWLRTMS-UHFFFAOYSA-N 4-piperazin-1-ylaniline Chemical compound C1=CC(N)=CC=C1N1CCNCC1 VAVOYRCCWLRTMS-UHFFFAOYSA-N 0.000 description 1
- DJJNYEXRPRQXPD-UHFFFAOYSA-N 4-piperazin-1-ylbenzonitrile Chemical compound C1=CC(C#N)=CC=C1N1CCNCC1 DJJNYEXRPRQXPD-UHFFFAOYSA-N 0.000 description 1
- JTSFIVQMXUDGAB-UHFFFAOYSA-N 4-thiomorpholin-4-ylmorpholine Chemical compound C1COCCN1N1CCSCC1 JTSFIVQMXUDGAB-UHFFFAOYSA-N 0.000 description 1
- IDPUKCWIGUEADI-UHFFFAOYSA-N 5-[bis(2-chloroethyl)amino]uracil Chemical compound ClCCN(CCCl)C1=CNC(=O)NC1=O IDPUKCWIGUEADI-UHFFFAOYSA-N 0.000 description 1
- FHVDTGUDJYJELY-UHFFFAOYSA-N 6-{[2-carboxy-4,5-dihydroxy-6-(phosphanyloxy)oxan-3-yl]oxy}-4,5-dihydroxy-3-phosphanyloxane-2-carboxylic acid Chemical compound O1C(C(O)=O)C(P)C(O)C(O)C1OC1C(C(O)=O)OC(OP)C(O)C1O FHVDTGUDJYJELY-UHFFFAOYSA-N 0.000 description 1
- STQGQHZAVUOBTE-UHFFFAOYSA-N 7-Cyan-hept-2t-en-4,6-diinsaeure Natural products C1=2C(O)=C3C(=O)C=4C(OC)=CC=CC=4C(=O)C3=C(O)C=2CC(O)(C(C)=O)CC1OC1CC(N)C(O)C(C)O1 STQGQHZAVUOBTE-UHFFFAOYSA-N 0.000 description 1
- ZCYVEMRRCGMTRW-UHFFFAOYSA-N 7553-56-2 Chemical compound [I] ZCYVEMRRCGMTRW-UHFFFAOYSA-N 0.000 description 1
- 244000215068 Acacia senegal Species 0.000 description 1
- 208000002874 Acne Vulgaris Diseases 0.000 description 1
- 206010069754 Acquired gene mutation Diseases 0.000 description 1
- NIXOWILDQLNWCW-UHFFFAOYSA-M Acrylate Chemical compound [O-]C(=O)C=C NIXOWILDQLNWCW-UHFFFAOYSA-M 0.000 description 1
- NLHHRLWOUZZQLW-UHFFFAOYSA-N Acrylonitrile Chemical compound C=CC#N NLHHRLWOUZZQLW-UHFFFAOYSA-N 0.000 description 1
- GUBGYTABKSRVRQ-XLOQQCSPSA-N Alpha-Lactose Chemical compound O[C@@H]1[C@@H](O)[C@@H](O)[C@@H](CO)O[C@H]1O[C@@H]1[C@@H](CO)O[C@H](O)[C@H](O)[C@H]1O GUBGYTABKSRVRQ-XLOQQCSPSA-N 0.000 description 1
- ITPDYQOUSLNIHG-UHFFFAOYSA-N Amiodarone hydrochloride Chemical compound [Cl-].CCCCC=1OC2=CC=CC=C2C=1C(=O)C1=CC(I)=C(OCC[NH+](CC)CC)C(I)=C1 ITPDYQOUSLNIHG-UHFFFAOYSA-N 0.000 description 1
- 206010073478 Anaplastic large-cell lymphoma Diseases 0.000 description 1
- BFYIZQONLCFLEV-DAELLWKTSA-N Aromasine Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(C(CC4)=O)[C@@H]4[C@@H]3CC(=C)C2=C1 BFYIZQONLCFLEV-DAELLWKTSA-N 0.000 description 1
- GOLCXWYRSKYTSP-UHFFFAOYSA-N Arsenious Acid Chemical compound O1[As]2O[As]1O2 GOLCXWYRSKYTSP-UHFFFAOYSA-N 0.000 description 1
- 108010024976 Asparaginase Proteins 0.000 description 1
- 206010004446 Benign prostatic hyperplasia Diseases 0.000 description 1
- 108010006654 Bleomycin Proteins 0.000 description 1
- 102000004506 Blood Proteins Human genes 0.000 description 1
- 108010017384 Blood Proteins Proteins 0.000 description 1
- WKBOTKDWSSQWDR-UHFFFAOYSA-N Bromine atom Chemical compound [Br] WKBOTKDWSSQWDR-UHFFFAOYSA-N 0.000 description 1
- 206010006458 Bronchitis chronic Diseases 0.000 description 1
- COVZYZSDYWQREU-UHFFFAOYSA-N Busulfan Chemical compound CS(=O)(=O)OCCCCOS(C)(=O)=O COVZYZSDYWQREU-UHFFFAOYSA-N 0.000 description 1
- HBNBTPCAFFOGLN-UHFFFAOYSA-N C(=O)OC(C)(C)C.C(=O)C1CCNCC1 Chemical compound C(=O)OC(C)(C)C.C(=O)C1CCNCC1 HBNBTPCAFFOGLN-UHFFFAOYSA-N 0.000 description 1
- BZCAISBKVRRZCA-UHFFFAOYSA-N C(=O)OCC1=CC=CC=C1.O=C1CNCC1 Chemical compound C(=O)OCC1=CC=CC=C1.O=C1CNCC1 BZCAISBKVRRZCA-UHFFFAOYSA-N 0.000 description 1
- MSSXWJOLWBWZSQ-UHFFFAOYSA-N C(=O)OCC1=CC=CC=C1.OC1CNCC1 Chemical compound C(=O)OCC1=CC=CC=C1.OC1CNCC1 MSSXWJOLWBWZSQ-UHFFFAOYSA-N 0.000 description 1
- RDPFAKWCVQTEQU-SNVBAGLBSA-N C1C[C@@H](OC1)C2=CC=C(C=C2)[N+](=O)[O-] Chemical compound C1C[C@@H](OC1)C2=CC=C(C=C2)[N+](=O)[O-] RDPFAKWCVQTEQU-SNVBAGLBSA-N 0.000 description 1
- CMFFGADDAKGOOJ-UHFFFAOYSA-N CC1=CC(=O)[N]O1 Chemical compound CC1=CC(=O)[N]O1 CMFFGADDAKGOOJ-UHFFFAOYSA-N 0.000 description 1
- 101150013553 CD40 gene Proteins 0.000 description 1
- UXVMQQNJUSDDNG-UHFFFAOYSA-L Calcium chloride Chemical compound [Cl-].[Cl-].[Ca+2] UXVMQQNJUSDDNG-UHFFFAOYSA-L 0.000 description 1
- GAGWJHPBXLXJQN-UHFFFAOYSA-N Capecitabine Natural products C1=C(F)C(NC(=O)OCCCCC)=NC(=O)N1C1C(O)C(O)C(C)O1 GAGWJHPBXLXJQN-UHFFFAOYSA-N 0.000 description 1
- OKTJSMMVPCPJKN-UHFFFAOYSA-N Carbon Chemical compound [C] OKTJSMMVPCPJKN-UHFFFAOYSA-N 0.000 description 1
- 201000009030 Carcinoma Diseases 0.000 description 1
- 206010007559 Cardiac failure congestive Diseases 0.000 description 1
- 102100027426 Centriolar coiled-coil protein of 110 kDa Human genes 0.000 description 1
- 101710125996 Centriolar coiled-coil protein of 110 kDa Proteins 0.000 description 1
- 101710109973 Centriolin Proteins 0.000 description 1
- 206010008190 Cerebrovascular accident Diseases 0.000 description 1
- 102000019034 Chemokines Human genes 0.000 description 1
- 108010012236 Chemokines Proteins 0.000 description 1
- JWBOIMRXGHLCPP-UHFFFAOYSA-N Chloditan Chemical compound C=1C=CC=C(Cl)C=1C(C(Cl)Cl)C1=CC=C(Cl)C=C1 JWBOIMRXGHLCPP-UHFFFAOYSA-N 0.000 description 1
- PTOAARAWEBMLNO-KVQBGUIXSA-N Cladribine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@H]1C[C@H](O)[C@@H](CO)O1 PTOAARAWEBMLNO-KVQBGUIXSA-N 0.000 description 1
- 102100026127 Clathrin heavy chain 1 Human genes 0.000 description 1
- 206010009900 Colitis ulcerative Diseases 0.000 description 1
- XDTMQSROBMDMFD-UHFFFAOYSA-N Cyclohexane Chemical compound C1CCCCC1 XDTMQSROBMDMFD-UHFFFAOYSA-N 0.000 description 1
- FBPFZTCFMRRESA-KVTDHHQDSA-N D-Mannitol Chemical compound OC[C@@H](O)[C@@H](O)[C@H](O)[C@H](O)CO FBPFZTCFMRRESA-KVTDHHQDSA-N 0.000 description 1
- 108010092160 Dactinomycin Proteins 0.000 description 1
- 206010011953 Decreased activity Diseases 0.000 description 1
- YZCKVEUIGOORGS-OUBTZVSYSA-N Deuterium Chemical compound [2H] YZCKVEUIGOORGS-OUBTZVSYSA-N 0.000 description 1
- FEWJPZIEWOKRBE-JCYAYHJZSA-N Dextrotartaric acid Chemical compound OC(=O)[C@H](O)[C@@H](O)C(O)=O FEWJPZIEWOKRBE-JCYAYHJZSA-N 0.000 description 1
- 206010012689 Diabetic retinopathy Diseases 0.000 description 1
- 101000876610 Dictyostelium discoideum Extracellular signal-regulated kinase 2 Proteins 0.000 description 1
- IAZDPXIOMUYVGZ-UHFFFAOYSA-N Dimethylsulphoxide Chemical compound CS(C)=O IAZDPXIOMUYVGZ-UHFFFAOYSA-N 0.000 description 1
- ZQZFYGIXNQKOAV-OCEACIFDSA-N Droloxifene Chemical compound C=1C=CC=CC=1C(/CC)=C(C=1C=C(O)C=CC=1)\C1=CC=C(OCCN(C)C)C=C1 ZQZFYGIXNQKOAV-OCEACIFDSA-N 0.000 description 1
- 206010058314 Dysplasia Diseases 0.000 description 1
- 102100038912 E3 SUMO-protein ligase RanBP2 Human genes 0.000 description 1
- 102100027418 E3 ubiquitin-protein ligase RNF213 Human genes 0.000 description 1
- HTIJFSOGRVMCQR-UHFFFAOYSA-N Epirubicin Natural products COc1cccc2C(=O)c3c(O)c4CC(O)(CC(OC5CC(N)C(=O)C(C)O5)c4c(O)c3C(=O)c12)C(=O)CO HTIJFSOGRVMCQR-UHFFFAOYSA-N 0.000 description 1
- 241000283073 Equus caballus Species 0.000 description 1
- 108700024394 Exon Proteins 0.000 description 1
- 108050001049 Extracellular proteins Proteins 0.000 description 1
- 229940124783 FAK inhibitor Drugs 0.000 description 1
- 108091008794 FGF receptors Proteins 0.000 description 1
- 241000282326 Felis catus Species 0.000 description 1
- PXGOKWXKJXAPGV-UHFFFAOYSA-N Fluorine Chemical compound FF PXGOKWXKJXAPGV-UHFFFAOYSA-N 0.000 description 1
- BDAGIHXWWSANSR-UHFFFAOYSA-N Formic acid Chemical compound OC=O BDAGIHXWWSANSR-UHFFFAOYSA-N 0.000 description 1
- 108010010803 Gelatin Proteins 0.000 description 1
- 206010018341 Gliosis Diseases 0.000 description 1
- WQZGKKKJIJFFOK-GASJEMHNSA-N Glucose Natural products OC[C@H]1OC(O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-GASJEMHNSA-N 0.000 description 1
- 108090000288 Glycoproteins Proteins 0.000 description 1
- 102000003886 Glycoproteins Human genes 0.000 description 1
- BLCLNMBMMGCOAS-URPVMXJPSA-N Goserelin Chemical compound C([C@@H](C(=O)N[C@H](COC(C)(C)C)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCCN=C(N)N)C(=O)N1[C@@H](CCC1)C(=O)NNC(N)=O)NC(=O)[C@H](CO)NC(=O)[C@H](CC=1C2=CC=CC=C2NC=1)NC(=O)[C@H](CC=1NC=NC=1)NC(=O)[C@H]1NC(=O)CC1)C1=CC=C(O)C=C1 BLCLNMBMMGCOAS-URPVMXJPSA-N 0.000 description 1
- 108010069236 Goserelin Proteins 0.000 description 1
- 201000005569 Gout Diseases 0.000 description 1
- 102000009465 Growth Factor Receptors Human genes 0.000 description 1
- 108010009202 Growth Factor Receptors Proteins 0.000 description 1
- 229920000084 Gum arabic Polymers 0.000 description 1
- 208000010496 Heart Arrest Diseases 0.000 description 1
- 101000912851 Homo sapiens Clathrin heavy chain 1 Proteins 0.000 description 1
- 101000650316 Homo sapiens E3 ubiquitin-protein ligase RNF213 Proteins 0.000 description 1
- 101000581507 Homo sapiens Methyl-CpG-binding domain protein 1 Proteins 0.000 description 1
- 101001052493 Homo sapiens Mitogen-activated protein kinase 1 Proteins 0.000 description 1
- 101001030232 Homo sapiens Myosin-9 Proteins 0.000 description 1
- 101001134861 Homo sapiens Pericentriolar material 1 protein Proteins 0.000 description 1
- 101000692455 Homo sapiens Platelet-derived growth factor receptor beta Proteins 0.000 description 1
- 101000956094 Homo sapiens Protein Daple Proteins 0.000 description 1
- 101000617830 Homo sapiens Sterol O-acyltransferase 1 Proteins 0.000 description 1
- 101000649022 Homo sapiens Thyroid receptor-interacting protein 11 Proteins 0.000 description 1
- 101000830781 Homo sapiens Tropomyosin alpha-4 chain Proteins 0.000 description 1
- 101000788669 Homo sapiens Zinc finger MYM-type protein 2 Proteins 0.000 description 1
- 101150106931 IFNG gene Proteins 0.000 description 1
- 108010007666 IMP cyclohydrolase Proteins 0.000 description 1
- 238000004566 IR spectroscopy Methods 0.000 description 1
- XDXDZDZNSLXDNA-TZNDIEGXSA-N Idarubicin Chemical compound C1[C@H](N)[C@H](O)[C@H](C)O[C@H]1O[C@@H]1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2C[C@@](O)(C(C)=O)C1 XDXDZDZNSLXDNA-TZNDIEGXSA-N 0.000 description 1
- XDXDZDZNSLXDNA-UHFFFAOYSA-N Idarubicin Natural products C1C(N)C(O)C(C)OC1OC1C2=C(O)C(C(=O)C3=CC=CC=C3C3=O)=C3C(O)=C2CC(O)(C(C)=O)C1 XDXDZDZNSLXDNA-UHFFFAOYSA-N 0.000 description 1
- 206010061598 Immunodeficiency Diseases 0.000 description 1
- 208000029462 Immunodeficiency disease Diseases 0.000 description 1
- 206010062016 Immunosuppression Diseases 0.000 description 1
- 102100020796 Inosine 5'-monophosphate cyclohydrolase Human genes 0.000 description 1
- 102000003812 Interleukin-15 Human genes 0.000 description 1
- 108090000172 Interleukin-15 Proteins 0.000 description 1
- 108090000171 Interleukin-18 Proteins 0.000 description 1
- 102000003810 Interleukin-18 Human genes 0.000 description 1
- 108010002350 Interleukin-2 Proteins 0.000 description 1
- 102000000588 Interleukin-2 Human genes 0.000 description 1
- 108010065637 Interleukin-23 Proteins 0.000 description 1
- 102000013264 Interleukin-23 Human genes 0.000 description 1
- 108010002586 Interleukin-7 Proteins 0.000 description 1
- 102000000704 Interleukin-7 Human genes 0.000 description 1
- KFZMGEQAYNKOFK-UHFFFAOYSA-N Isopropanol Chemical compound CC(C)O KFZMGEQAYNKOFK-UHFFFAOYSA-N 0.000 description 1
- 230000004163 JAK-STAT signaling pathway Effects 0.000 description 1
- FBOZXECLQNJBKD-ZDUSSCGKSA-N L-methotrexate Chemical compound C=1N=C2N=C(N)N=C(N)C2=NC=1CN(C)C1=CC=C(C(=O)N[C@@H](CCC(O)=O)C(O)=O)C=C1 FBOZXECLQNJBKD-ZDUSSCGKSA-N 0.000 description 1
- 239000002147 L01XE04 - Sunitinib Substances 0.000 description 1
- GUBGYTABKSRVRQ-QKKXKWKRSA-N Lactose Natural products OC[C@H]1O[C@@H](O[C@H]2[C@H](O)[C@@H](O)C(O)O[C@@H]2CO)[C@H](O)[C@@H](O)[C@H]1O GUBGYTABKSRVRQ-QKKXKWKRSA-N 0.000 description 1
- 108010000817 Leuprolide Proteins 0.000 description 1
- HLFSDGLLUJUHTE-SNVBAGLBSA-N Levamisole Chemical compound C1([C@H]2CN3CCSC3=N2)=CC=CC=C1 HLFSDGLLUJUHTE-SNVBAGLBSA-N 0.000 description 1
- GQYIWUVLTXOXAJ-UHFFFAOYSA-N Lomustine Chemical compound ClCCN(N=O)C(=O)NC1CCCCC1 GQYIWUVLTXOXAJ-UHFFFAOYSA-N 0.000 description 1
- 229930195725 Mannitol Natural products 0.000 description 1
- 102100027383 Methyl-CpG-binding domain protein 1 Human genes 0.000 description 1
- FQISKWAFAHGMGT-SGJOWKDISA-M Methylprednisolone sodium succinate Chemical compound [Na+].C([C@@]12C)=CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2[C@@H](O)C[C@]2(C)[C@@](O)(C(=O)COC(=O)CCC([O-])=O)CC[C@H]21 FQISKWAFAHGMGT-SGJOWKDISA-M 0.000 description 1
- 229920000168 Microcrystalline cellulose Polymers 0.000 description 1
- 102100024193 Mitogen-activated protein kinase 1 Human genes 0.000 description 1
- 238000006751 Mitsunobu reaction Methods 0.000 description 1
- 241000699666 Mus <mouse, genus> Species 0.000 description 1
- 101100294184 Mus musculus Ninl gene Proteins 0.000 description 1
- 208000007727 Muscle Tissue Neoplasms Diseases 0.000 description 1
- 208000033776 Myeloid Acute Leukemia Diseases 0.000 description 1
- 102100038938 Myosin-9 Human genes 0.000 description 1
- NWIBSHFKIJFRCO-WUDYKRTCSA-N Mytomycin Chemical compound C1N2C(C(C(C)=C(N)C3=O)=O)=C3[C@@H](COC(N)=O)[C@@]2(OC)[C@@H]2[C@H]1N2 NWIBSHFKIJFRCO-WUDYKRTCSA-N 0.000 description 1
- QJMCKEPOKRERLN-UHFFFAOYSA-N N-3,4-tridhydroxybenzamide Chemical compound ONC(=O)C1=CC=C(O)C(O)=C1 QJMCKEPOKRERLN-UHFFFAOYSA-N 0.000 description 1
- FMCGSUUBYTWNDP-UHFFFAOYSA-N N-Methylephedrine Natural products CN(C)C(C)C(O)C1=CC=CC=C1 FMCGSUUBYTWNDP-UHFFFAOYSA-N 0.000 description 1
- LOROHMDAZAZSSM-UHFFFAOYSA-N NC(C=C1)=CC=C1N([CH-]OC1)C1=O Chemical compound NC(C=C1)=CC=C1N([CH-]OC1)C1=O LOROHMDAZAZSSM-UHFFFAOYSA-N 0.000 description 1
- 238000005481 NMR spectroscopy Methods 0.000 description 1
- BPQQTUXANYXVAA-UHFFFAOYSA-N Orthosilicate Chemical compound [O-][Si]([O-])([O-])[O-] BPQQTUXANYXVAA-UHFFFAOYSA-N 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 101150054473 PTK2 gene Proteins 0.000 description 1
- 235000019483 Peanut oil Nutrition 0.000 description 1
- 241001494479 Pecora Species 0.000 description 1
- 208000001300 Perinatal Death Diseases 0.000 description 1
- 208000027190 Peripheral T-cell lymphomas Diseases 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- QZVCTJOXCFMACW-UHFFFAOYSA-N Phenoxybenzamine Chemical compound C=1C=CC=CC=1CN(CCCl)C(C)COC1=CC=CC=C1 QZVCTJOXCFMACW-UHFFFAOYSA-N 0.000 description 1
- 102000001393 Platelet-Derived Growth Factor alpha Receptor Human genes 0.000 description 1
- 108010068588 Platelet-Derived Growth Factor alpha Receptor Proteins 0.000 description 1
- 102100026547 Platelet-derived growth factor receptor beta Human genes 0.000 description 1
- 208000031951 Primary immunodeficiency Diseases 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- XBDQKXXYIPTUBI-UHFFFAOYSA-M Propionate Chemical compound CCC([O-])=O XBDQKXXYIPTUBI-UHFFFAOYSA-M 0.000 description 1
- 208000004403 Prostatic Hyperplasia Diseases 0.000 description 1
- 102100038589 Protein Daple Human genes 0.000 description 1
- 108010014608 Proto-Oncogene Proteins c-kit Proteins 0.000 description 1
- 102000016971 Proto-Oncogene Proteins c-kit Human genes 0.000 description 1
- 201000001263 Psoriatic Arthritis Diseases 0.000 description 1
- 208000036824 Psoriatic arthropathy Diseases 0.000 description 1
- KDCGOANMDULRCW-UHFFFAOYSA-N Purine Natural products N1=CNC2=NC=NC2=C1 KDCGOANMDULRCW-UHFFFAOYSA-N 0.000 description 1
- 206010063837 Reperfusion injury Diseases 0.000 description 1
- 206010039085 Rhinitis allergic Diseases 0.000 description 1
- 241000283984 Rodentia Species 0.000 description 1
- 206010040070 Septic Shock Diseases 0.000 description 1
- 208000009359 Sezary Syndrome Diseases 0.000 description 1
- 208000021388 Sezary disease Diseases 0.000 description 1
- 229920001800 Shellac Polymers 0.000 description 1
- 229920002472 Starch Polymers 0.000 description 1
- 102100021993 Sterol O-acyltransferase 1 Human genes 0.000 description 1
- 208000005718 Stomach Neoplasms Diseases 0.000 description 1
- 101000697584 Streptomyces lavendulae Streptothricin acetyltransferase Proteins 0.000 description 1
- 208000006011 Stroke Diseases 0.000 description 1
- CZMRCDWAGMRECN-UGDNZRGBSA-N Sucrose Chemical compound O[C@H]1[C@H](O)[C@@H](CO)O[C@@]1(CO)O[C@@H]1[C@H](O)[C@@H](O)[C@H](O)[C@@H](CO)O1 CZMRCDWAGMRECN-UGDNZRGBSA-N 0.000 description 1
- 229930006000 Sucrose Natural products 0.000 description 1
- NINIDFKCEFEMDL-UHFFFAOYSA-N Sulfur Chemical compound [S] NINIDFKCEFEMDL-UHFFFAOYSA-N 0.000 description 1
- 239000005864 Sulphur Substances 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 238000006069 Suzuki reaction reaction Methods 0.000 description 1
- 208000031672 T-Cell Peripheral Lymphoma Diseases 0.000 description 1
- BPEGJWRSRHCHSN-UHFFFAOYSA-N Temozolomide Chemical compound O=C1N(C)N=NC2=C(C(N)=O)N=CN21 BPEGJWRSRHCHSN-UHFFFAOYSA-N 0.000 description 1
- 102100028094 Thyroid receptor-interacting protein 11 Human genes 0.000 description 1
- 229920001615 Tragacanth Polymers 0.000 description 1
- 102100022011 Transcription intermediary factor 1-alpha Human genes 0.000 description 1
- MSLJYSGFUMYUDX-UHFFFAOYSA-N Trimidox Chemical compound ON=C(N)C1=CC(O)=C(O)C(O)=C1 MSLJYSGFUMYUDX-UHFFFAOYSA-N 0.000 description 1
- YZCKVEUIGOORGS-NJFSPNSNSA-N Tritium Chemical compound [3H] YZCKVEUIGOORGS-NJFSPNSNSA-N 0.000 description 1
- 102100033080 Tropomyosin alpha-3 chain Human genes 0.000 description 1
- 102100024944 Tropomyosin alpha-4 chain Human genes 0.000 description 1
- 102100040245 Tumor necrosis factor receptor superfamily member 5 Human genes 0.000 description 1
- 201000006704 Ulcerative Colitis Diseases 0.000 description 1
- 108010053100 Vascular Endothelial Growth Factor Receptor-3 Proteins 0.000 description 1
- 102100033179 Vascular endothelial growth factor receptor 3 Human genes 0.000 description 1
- HCHKCACWOHOZIP-UHFFFAOYSA-N Zinc Chemical compound [Zn] HCHKCACWOHOZIP-UHFFFAOYSA-N 0.000 description 1
- 102100025085 Zinc finger MYM-type protein 2 Human genes 0.000 description 1
- 239000000205 acacia gum Substances 0.000 description 1
- 235000010489 acacia gum Nutrition 0.000 description 1
- 238000007171 acid catalysis Methods 0.000 description 1
- 239000003377 acid catalyst Substances 0.000 description 1
- 206010000496 acne Diseases 0.000 description 1
- RJURFGZVJUQBHK-IIXSONLDSA-N actinomycin D Chemical compound C[C@H]1OC(=O)[C@H](C(C)C)N(C)C(=O)CN(C)C(=O)[C@@H]2CCCN2C(=O)[C@@H](C(C)C)NC(=O)[C@H]1NC(=O)C1=C(N)C(=O)C(C)=C2OC(C(C)=CC=C3C(=O)N[C@@H]4C(=O)N[C@@H](C(N5CCC[C@H]5C(=O)N(C)CC(=O)N(C)[C@@H](C(C)C)C(=O)O[C@@H]4C)=O)C(C)C)=C3N=C21 RJURFGZVJUQBHK-IIXSONLDSA-N 0.000 description 1
- 230000009471 action Effects 0.000 description 1
- 230000003213 activating effect Effects 0.000 description 1
- 239000013543 active substance Substances 0.000 description 1
- 125000005073 adamantyl group Chemical group C12(CC3CC(CC(C1)C3)C2)* 0.000 description 1
- 208000037883 airway inflammation Diseases 0.000 description 1
- 150000001299 aldehydes Chemical class 0.000 description 1
- 229940072056 alginate Drugs 0.000 description 1
- 235000010443 alginic acid Nutrition 0.000 description 1
- 229920000615 alginic acid Polymers 0.000 description 1
- 150000001336 alkenes Chemical class 0.000 description 1
- 125000004450 alkenylene group Chemical group 0.000 description 1
- 125000004419 alkynylene group Chemical group 0.000 description 1
- 208000002029 allergic contact dermatitis Diseases 0.000 description 1
- 230000000172 allergic effect Effects 0.000 description 1
- 201000010105 allergic rhinitis Diseases 0.000 description 1
- 230000000735 allogeneic effect Effects 0.000 description 1
- HSFWRNGVRCDJHI-UHFFFAOYSA-N alpha-acetylene Natural products C#C HSFWRNGVRCDJHI-UHFFFAOYSA-N 0.000 description 1
- 125000003368 amide group Chemical group 0.000 description 1
- 229960004050 aminobenzoic acid Drugs 0.000 description 1
- ROBVIMPUHSLWNV-UHFFFAOYSA-N aminoglutethimide Chemical compound C=1C=C(N)C=CC=1C1(CC)CCC(=O)NC1=O ROBVIMPUHSLWNV-UHFFFAOYSA-N 0.000 description 1
- 229960003437 aminoglutethimide Drugs 0.000 description 1
- 235000019270 ammonium chloride Nutrition 0.000 description 1
- 229960001220 amsacrine Drugs 0.000 description 1
- XCPGHVQEEXUHNC-UHFFFAOYSA-N amsacrine Chemical compound COC1=CC(NS(C)(=O)=O)=CC=C1NC1=C(C=CC=C2)C2=NC2=CC=CC=C12 XCPGHVQEEXUHNC-UHFFFAOYSA-N 0.000 description 1
- 229960002932 anastrozole Drugs 0.000 description 1
- YBBLVLTVTVSKRW-UHFFFAOYSA-N anastrozole Chemical compound N#CC(C)(C)C1=CC(C(C)(C#N)C)=CC(CN2N=CN=C2)=C1 YBBLVLTVTVSKRW-UHFFFAOYSA-N 0.000 description 1
- 208000007502 anemia Diseases 0.000 description 1
- 238000010171 animal model Methods 0.000 description 1
- 125000005428 anthryl group Chemical group [H]C1=C([H])C([H])=C2C([H])=C3C(*)=C([H])C([H])=C([H])C3=C([H])C2=C1[H] 0.000 description 1
- 229940121363 anti-inflammatory agent Drugs 0.000 description 1
- 239000002260 anti-inflammatory agent Substances 0.000 description 1
- 230000000259 anti-tumor effect Effects 0.000 description 1
- 239000002246 antineoplastic agent Substances 0.000 description 1
- 239000007900 aqueous suspension Substances 0.000 description 1
- 150000004945 aromatic hydrocarbons Chemical class 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 150000001501 aryl fluorides Chemical class 0.000 description 1
- 125000000732 arylene group Chemical group 0.000 description 1
- 238000009455 aseptic packaging Methods 0.000 description 1
- 239000000305 astragalus gummifer gum Substances 0.000 description 1
- 208000037875 astrocytosis Diseases 0.000 description 1
- 230000007341 astrogliosis Effects 0.000 description 1
- 239000005441 aurora Substances 0.000 description 1
- 230000001363 autoimmune Effects 0.000 description 1
- VSRXQHXAPYXROS-UHFFFAOYSA-N azanide;cyclobutane-1,1-dicarboxylic acid;platinum(2+) Chemical compound [NH2-].[NH2-].[Pt+2].OC(=O)C1(C(O)=O)CCC1 VSRXQHXAPYXROS-UHFFFAOYSA-N 0.000 description 1
- 150000001540 azides Chemical class 0.000 description 1
- 150000003851 azoles Chemical class 0.000 description 1
- 230000009286 beneficial effect Effects 0.000 description 1
- CSKNSYBAZOQPLR-UHFFFAOYSA-N benzenesulfonyl chloride Chemical compound ClS(=O)(=O)C1=CC=CC=C1 CSKNSYBAZOQPLR-UHFFFAOYSA-N 0.000 description 1
- 125000005605 benzo group Chemical group 0.000 description 1
- 125000004618 benzofuryl group Chemical group O1C(=CC2=C1C=CC=C2)* 0.000 description 1
- 125000001164 benzothiazolyl group Chemical group S1C(=NC2=C1C=CC=C2)* 0.000 description 1
- 125000001797 benzyl group Chemical group [H]C1=C([H])C([H])=C(C([H])=C1[H])C([H])([H])* 0.000 description 1
- 125000001584 benzyloxycarbonyl group Chemical group C(=O)(OCC1=CC=CC=C1)* 0.000 description 1
- 102000012740 beta Adrenergic Receptors Human genes 0.000 description 1
- 108010079452 beta Adrenergic Receptors Proteins 0.000 description 1
- WQZGKKKJIJFFOK-VFUOTHLCSA-N beta-D-glucose Chemical compound OC[C@H]1O[C@@H](O)[C@H](O)[C@@H](O)[C@@H]1O WQZGKKKJIJFFOK-VFUOTHLCSA-N 0.000 description 1
- 229960001561 bleomycin Drugs 0.000 description 1
- OYVAGSVQBOHSSS-UAPAGMARSA-O bleomycin A2 Chemical compound N([C@H](C(=O)N[C@H](C)[C@@H](O)[C@H](C)C(=O)N[C@@H]([C@H](O)C)C(=O)NCCC=1SC=C(N=1)C=1SC=C(N=1)C(=O)NCCC[S+](C)C)[C@@H](O[C@H]1[C@H]([C@@H](O)[C@H](O)[C@H](CO)O1)O[C@@H]1[C@H]([C@@H](OC(N)=O)[C@H](O)[C@@H](CO)O1)O)C=1N=CNC=1)C(=O)C1=NC([C@H](CC(N)=O)NC[C@H](N)C(N)=O)=NC(N)=C1C OYVAGSVQBOHSSS-UAPAGMARSA-O 0.000 description 1
- 230000000903 blocking effect Effects 0.000 description 1
- 238000010322 bone marrow transplantation Methods 0.000 description 1
- 239000004327 boric acid Substances 0.000 description 1
- GDTBXPJZTBHREO-UHFFFAOYSA-N bromine Substances BrBr GDTBXPJZTBHREO-UHFFFAOYSA-N 0.000 description 1
- 229910052794 bromium Inorganic materials 0.000 description 1
- 239000000872 buffer Substances 0.000 description 1
- 229960002092 busulfan Drugs 0.000 description 1
- 239000001110 calcium chloride Substances 0.000 description 1
- 229910001628 calcium chloride Inorganic materials 0.000 description 1
- 239000001506 calcium phosphate Substances 0.000 description 1
- 229960001714 calcium phosphate Drugs 0.000 description 1
- 229910000389 calcium phosphate Inorganic materials 0.000 description 1
- 235000011010 calcium phosphates Nutrition 0.000 description 1
- 229940112129 campath Drugs 0.000 description 1
- 230000005907 cancer growth Effects 0.000 description 1
- 208000035269 cancer or benign tumor Diseases 0.000 description 1
- 229960004117 capecitabine Drugs 0.000 description 1
- 229960004562 carboplatin Drugs 0.000 description 1
- 239000000969 carrier Substances 0.000 description 1
- 230000025084 cell cycle arrest Effects 0.000 description 1
- 230000003915 cell function Effects 0.000 description 1
- 230000001413 cellular effect Effects 0.000 description 1
- 239000001913 cellulose Substances 0.000 description 1
- 235000010980 cellulose Nutrition 0.000 description 1
- 229920002678 cellulose Polymers 0.000 description 1
- 229920002301 cellulose acetate Polymers 0.000 description 1
- 229960005395 cetuximab Drugs 0.000 description 1
- 125000003636 chemical group Chemical group 0.000 description 1
- 230000000973 chemotherapeutic effect Effects 0.000 description 1
- 229960004630 chlorambucil Drugs 0.000 description 1
- JCKYGMPEJWAADB-UHFFFAOYSA-N chlorambucil Chemical compound OC(=O)CCCC1=CC=C(N(CCCl)CCCl)C=C1 JCKYGMPEJWAADB-UHFFFAOYSA-N 0.000 description 1
- AOGYCOYQMAVAFD-UHFFFAOYSA-N chlorocarbonic acid Chemical compound OC(Cl)=O AOGYCOYQMAVAFD-UHFFFAOYSA-N 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 208000007451 chronic bronchitis Diseases 0.000 description 1
- 230000001684 chronic effect Effects 0.000 description 1
- 210000003040 circulating cell Anatomy 0.000 description 1
- 229940121657 clinical drug Drugs 0.000 description 1
- 229960000928 clofarabine Drugs 0.000 description 1
- WDDPHFBMKLOVOX-AYQXTPAHSA-N clofarabine Chemical compound C1=NC=2C(N)=NC(Cl)=NC=2N1[C@@H]1O[C@H](CO)[C@@H](O)[C@@H]1F WDDPHFBMKLOVOX-AYQXTPAHSA-N 0.000 description 1
- 238000013329 compounding Methods 0.000 description 1
- 230000001143 conditioned effect Effects 0.000 description 1
- 239000012059 conventional drug carrier Substances 0.000 description 1
- 230000002596 correlated effect Effects 0.000 description 1
- 230000008878 coupling Effects 0.000 description 1
- 238000010168 coupling process Methods 0.000 description 1
- 238000005859 coupling reaction Methods 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002425 crystallisation Methods 0.000 description 1
- 230000008025 crystallization Effects 0.000 description 1
- 125000004122 cyclic group Chemical group 0.000 description 1
- 125000001995 cyclobutyl group Chemical group [H]C1([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- CHVJITGCYZJHLR-UHFFFAOYSA-N cyclohepta-1,3,5-triene Chemical compound C1C=CC=CC=C1 CHVJITGCYZJHLR-UHFFFAOYSA-N 0.000 description 1
- 125000003678 cyclohexadienyl group Chemical group C1(=CC=CCC1)* 0.000 description 1
- UKJLNMAFNRKWGR-UHFFFAOYSA-N cyclohexatrienamine Chemical group NC1=CC=C=C[CH]1 UKJLNMAFNRKWGR-UHFFFAOYSA-N 0.000 description 1
- NISGSNTVMOOSJQ-UHFFFAOYSA-N cyclopentanamine Chemical compound NC1CCCC1 NISGSNTVMOOSJQ-UHFFFAOYSA-N 0.000 description 1
- 125000001511 cyclopentyl group Chemical group [H]C1([H])C([H])([H])C([H])([H])C([H])(*)C1([H])[H] 0.000 description 1
- PFWWSGFPICCWGU-UHFFFAOYSA-N cyclopropanesulfonyl chloride Chemical compound ClS(=O)(=O)C1CC1 PFWWSGFPICCWGU-UHFFFAOYSA-N 0.000 description 1
- 125000001559 cyclopropyl group Chemical group [H]C1([H])C([H])([H])C1([H])* 0.000 description 1
- 230000001086 cytosolic effect Effects 0.000 description 1
- 239000000824 cytostatic agent Substances 0.000 description 1
- KWGRBVOPPLSCSI-UHFFFAOYSA-N d-ephedrine Natural products CNC(C)C(O)C1=CC=CC=C1 KWGRBVOPPLSCSI-UHFFFAOYSA-N 0.000 description 1
- 229960003901 dacarbazine Drugs 0.000 description 1
- 229960000640 dactinomycin Drugs 0.000 description 1
- STQGQHZAVUOBTE-VGBVRHCVSA-N daunorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(C)=O)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 STQGQHZAVUOBTE-VGBVRHCVSA-N 0.000 description 1
- 229960000975 daunorubicin Drugs 0.000 description 1
- 230000034994 death Effects 0.000 description 1
- 230000007123 defense Effects 0.000 description 1
- 230000003111 delayed effect Effects 0.000 description 1
- CFCUWKMKBJTWLW-UHFFFAOYSA-N deoliosyl-3C-alpha-L-digitoxosyl-MTM Natural products CC=1C(O)=C2C(O)=C3C(=O)C(OC4OC(C)C(O)C(OC5OC(C)C(O)C(OC6OC(C)C(O)C(C)(O)C6)C5)C4)C(C(OC)C(=O)C(O)C(C)O)CC3=CC2=CC=1OC(OC(C)C1O)CC1OC1CC(O)C(O)C(C)O1 CFCUWKMKBJTWLW-UHFFFAOYSA-N 0.000 description 1
- 238000001514 detection method Methods 0.000 description 1
- 229910052805 deuterium Inorganic materials 0.000 description 1
- ORYOIBJWFDNIPD-UHFFFAOYSA-N diacetyl 2,3-dihydroxybutanedioate Chemical compound CC(=O)OC(=O)C(O)C(O)C(=O)OC(C)=O ORYOIBJWFDNIPD-UHFFFAOYSA-N 0.000 description 1
- RGLYKWWBQGJZGM-ISLYRVAYSA-N diethylstilbestrol Chemical compound C=1C=C(O)C=CC=1C(/CC)=C(\CC)C1=CC=C(O)C=C1 RGLYKWWBQGJZGM-ISLYRVAYSA-N 0.000 description 1
- 238000009792 diffusion process Methods 0.000 description 1
- 239000000539 dimer Substances 0.000 description 1
- IQDGSYLLQPDQDV-UHFFFAOYSA-N dimethylazanium;chloride Chemical compound Cl.CNC IQDGSYLLQPDQDV-UHFFFAOYSA-N 0.000 description 1
- FPAFDBFIGPHWGO-UHFFFAOYSA-N dioxosilane;oxomagnesium;hydrate Chemical group O.[Mg]=O.[Mg]=O.[Mg]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O.O=[Si]=O FPAFDBFIGPHWGO-UHFFFAOYSA-N 0.000 description 1
- 239000006185 dispersion Substances 0.000 description 1
- DLNKOYKMWOXYQA-UHFFFAOYSA-N dl-pseudophenylpropanolamine Natural products CC(N)C(O)C1=CC=CC=C1 DLNKOYKMWOXYQA-UHFFFAOYSA-N 0.000 description 1
- 230000005059 dormancy Effects 0.000 description 1
- 239000002552 dosage form Substances 0.000 description 1
- 231100000673 dose–response relationship Toxicity 0.000 description 1
- 229950004203 droloxifene Drugs 0.000 description 1
- NOTIQUSPUUHHEH-UXOVVSIBSA-N dromostanolone propionate Chemical compound C([C@@H]1CC2)C(=O)[C@H](C)C[C@]1(C)[C@@H]1[C@@H]2[C@@H]2CC[C@H](OC(=O)CC)[C@@]2(C)CC1 NOTIQUSPUUHHEH-UXOVVSIBSA-N 0.000 description 1
- 239000006196 drop Substances 0.000 description 1
- 229950004683 drostanolone propionate Drugs 0.000 description 1
- 238000001647 drug administration Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 210000001198 duodenum Anatomy 0.000 description 1
- 238000004043 dyeing Methods 0.000 description 1
- 239000008157 edible vegetable oil Substances 0.000 description 1
- 229920001971 elastomer Polymers 0.000 description 1
- 229940120655 eloxatin Drugs 0.000 description 1
- 238000010828 elution Methods 0.000 description 1
- 238000004945 emulsification Methods 0.000 description 1
- 230000002124 endocrine Effects 0.000 description 1
- 201000003914 endometrial carcinoma Diseases 0.000 description 1
- 229960002179 ephedrine Drugs 0.000 description 1
- 229960001904 epirubicin Drugs 0.000 description 1
- 229930013356 epothilone Natural products 0.000 description 1
- HESCAJZNRMSMJG-KKQRBIROSA-N epothilone A Chemical class C/C([C@@H]1C[C@@H]2O[C@@H]2CCC[C@@H]([C@@H]([C@@H](C)C(=O)C(C)(C)[C@@H](O)CC(=O)O1)O)C)=C\C1=CSC(C)=N1 HESCAJZNRMSMJG-KKQRBIROSA-N 0.000 description 1
- 229960001433 erlotinib Drugs 0.000 description 1
- 229960001842 estramustine Drugs 0.000 description 1
- FRPJXPJMRWBBIH-RBRWEJTLSA-N estramustine Chemical compound ClCCN(CCCl)C(=O)OC1=CC=C2[C@H]3CC[C@](C)([C@H](CC4)O)[C@@H]4[C@@H]3CCC2=C1 FRPJXPJMRWBBIH-RBRWEJTLSA-N 0.000 description 1
- 125000000031 ethylamino group Chemical group [H]C([H])([H])C([H])([H])N([H])[*] 0.000 description 1
- 125000002534 ethynyl group Chemical group [H]C#C* 0.000 description 1
- 238000001704 evaporation Methods 0.000 description 1
- 229960000255 exemestane Drugs 0.000 description 1
- 239000000835 fiber Substances 0.000 description 1
- 230000003176 fibrotic effect Effects 0.000 description 1
- 239000012065 filter cake Substances 0.000 description 1
- 230000004992 fission Effects 0.000 description 1
- 229960000390 fludarabine Drugs 0.000 description 1
- 229960005304 fludarabine phosphate Drugs 0.000 description 1
- 229960002949 fluorouracil Drugs 0.000 description 1
- YLRFCQOZQXIBAB-RBZZARIASA-N fluoxymesterone Chemical compound C1CC2=CC(=O)CC[C@]2(C)[C@]2(F)[C@@H]1[C@@H]1CC[C@](C)(O)[C@@]1(C)C[C@@H]2O YLRFCQOZQXIBAB-RBZZARIASA-N 0.000 description 1
- 229960001751 fluoxymesterone Drugs 0.000 description 1
- MKXKFYHWDHIYRV-UHFFFAOYSA-N flutamide Chemical compound CC(C)C(=O)NC1=CC=C([N+]([O-])=O)C(C(F)(F)F)=C1 MKXKFYHWDHIYRV-UHFFFAOYSA-N 0.000 description 1
- 229960002074 flutamide Drugs 0.000 description 1
- WBJINCZRORDGAQ-UHFFFAOYSA-N formic acid ethyl ester Natural products CCOC=O WBJINCZRORDGAQ-UHFFFAOYSA-N 0.000 description 1
- 238000005194 fractionation Methods 0.000 description 1
- 238000004108 freeze drying Methods 0.000 description 1
- 238000007710 freezing Methods 0.000 description 1
- 230000008014 freezing Effects 0.000 description 1
- 125000000524 functional group Chemical group 0.000 description 1
- 125000002541 furyl group Chemical group 0.000 description 1
- 229920000159 gelatin Polymers 0.000 description 1
- 239000008273 gelatin Substances 0.000 description 1
- 239000007903 gelatin capsule Substances 0.000 description 1
- 235000019322 gelatine Nutrition 0.000 description 1
- 235000011852 gelatine desserts Nutrition 0.000 description 1
- SDUQYLNIPVEERB-QPPQHZFASA-N gemcitabine Chemical compound O=C1N=C(N)C=CN1[C@H]1C(F)(F)[C@H](O)[C@@H](CO)O1 SDUQYLNIPVEERB-QPPQHZFASA-N 0.000 description 1
- 229960005277 gemcitabine Drugs 0.000 description 1
- 208000005017 glioblastoma Diseases 0.000 description 1
- 239000008103 glucose Substances 0.000 description 1
- 229960002913 goserelin Drugs 0.000 description 1
- 210000003714 granulocyte Anatomy 0.000 description 1
- 230000012010 growth Effects 0.000 description 1
- 239000003102 growth factor Substances 0.000 description 1
- 125000005843 halogen group Chemical group 0.000 description 1
- 238000010438 heat treatment Methods 0.000 description 1
- 210000002443 helper t lymphocyte Anatomy 0.000 description 1
- 210000001357 hemopoietic progenitor cell Anatomy 0.000 description 1
- 125000000623 heterocyclic group Chemical group 0.000 description 1
- 125000000592 heterocycloalkyl group Chemical group 0.000 description 1
- BXWNKGSJHAJOGX-UHFFFAOYSA-N hexadecan-1-ol Chemical compound CCCCCCCCCCCCCCCCO BXWNKGSJHAJOGX-UHFFFAOYSA-N 0.000 description 1
- 229940088013 hycamtin Drugs 0.000 description 1
- 125000001183 hydrocarbyl group Chemical group 0.000 description 1
- 150000002431 hydrogen Chemical class 0.000 description 1
- XMBWDFGMSWQBCA-UHFFFAOYSA-N hydrogen iodide Chemical compound I XMBWDFGMSWQBCA-UHFFFAOYSA-N 0.000 description 1
- 230000007062 hydrolysis Effects 0.000 description 1
- 238000006460 hydrolysis reaction Methods 0.000 description 1
- 229960002899 hydroxyprogesterone Drugs 0.000 description 1
- 229960001001 ibritumomab tiuxetan Drugs 0.000 description 1
- 229960000908 idarubicin Drugs 0.000 description 1
- 229960003685 imatinib mesylate Drugs 0.000 description 1
- 125000002883 imidazolyl group Chemical group 0.000 description 1
- 208000026278 immune system disease Diseases 0.000 description 1
- 230000007813 immunodeficiency Effects 0.000 description 1
- 230000007365 immunoregulation Effects 0.000 description 1
- 230000004957 immunoregulator effect Effects 0.000 description 1
- 238000002650 immunosuppressive therapy Methods 0.000 description 1
- 238000000338 in vitro Methods 0.000 description 1
- 208000033065 inborn errors of immunity Diseases 0.000 description 1
- 125000003392 indanyl group Chemical group C1(CCC2=CC=CC=C12)* 0.000 description 1
- 125000003453 indazolyl group Chemical group N1N=C(C2=C1C=CC=C2)* 0.000 description 1
- 125000003454 indenyl group Chemical group C1(C=CC2=CC=CC=C12)* 0.000 description 1
- 125000003387 indolinyl group Chemical group N1(CCC2=CC=CC=C12)* 0.000 description 1
- 230000006698 induction Effects 0.000 description 1
- 230000001939 inductive effect Effects 0.000 description 1
- 230000002401 inhibitory effect Effects 0.000 description 1
- 238000002347 injection Methods 0.000 description 1
- 239000007924 injection Substances 0.000 description 1
- 229940125396 insulin Drugs 0.000 description 1
- 238000001361 intraarterial administration Methods 0.000 description 1
- 230000031146 intracellular signal transduction Effects 0.000 description 1
- 238000007912 intraperitoneal administration Methods 0.000 description 1
- ICIWUVCWSCSTAQ-UHFFFAOYSA-M iodate Chemical compound [O-]I(=O)=O ICIWUVCWSCSTAQ-UHFFFAOYSA-M 0.000 description 1
- 239000011630 iodine Substances 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- UWKQSNNFCGGAFS-XIFFEERXSA-N irinotecan Chemical compound C1=C2C(CC)=C3CN(C(C4=C([C@@](C(=O)OC4)(O)CC)C=4)=O)C=4C3=NC2=CC=C1OC(=O)N(CC1)CCC1N1CCCCC1 UWKQSNNFCGGAFS-XIFFEERXSA-N 0.000 description 1
- 229960004768 irinotecan Drugs 0.000 description 1
- 125000001972 isopentyl group Chemical group [H]C([H])([H])C([H])(C([H])([H])[H])C([H])([H])C([H])([H])* 0.000 description 1
- 125000003253 isopropoxy group Chemical group [H]C([H])([H])C([H])(O*)C([H])([H])[H] 0.000 description 1
- 125000005956 isoquinolyl group Chemical group 0.000 description 1
- 125000001786 isothiazolyl group Chemical group 0.000 description 1
- 125000000842 isoxazolyl group Chemical group 0.000 description 1
- 210000002510 keratinocyte Anatomy 0.000 description 1
- 230000006651 lactation Effects 0.000 description 1
- 239000004310 lactic acid Substances 0.000 description 1
- 235000014655 lactic acid Nutrition 0.000 description 1
- 239000008101 lactose Substances 0.000 description 1
- 229960001614 levamisole Drugs 0.000 description 1
- 230000000670 limiting effect Effects 0.000 description 1
- 239000002502 liposome Substances 0.000 description 1
- 229960002247 lomustine Drugs 0.000 description 1
- 239000006210 lotion Substances 0.000 description 1
- 239000007937 lozenge Substances 0.000 description 1
- 239000000314 lubricant Substances 0.000 description 1
- 210000004072 lung Anatomy 0.000 description 1
- 210000004698 lymphocyte Anatomy 0.000 description 1
- 230000000527 lymphocytic effect Effects 0.000 description 1
- 235000019359 magnesium stearate Nutrition 0.000 description 1
- IWYDHOAUDWTVEP-UHFFFAOYSA-N mandelic acid Chemical compound OC(=O)C(O)C1=CC=CC=C1 IWYDHOAUDWTVEP-UHFFFAOYSA-N 0.000 description 1
- 229960002510 mandelic acid Drugs 0.000 description 1
- 239000000594 mannitol Substances 0.000 description 1
- 235000010355 mannitol Nutrition 0.000 description 1
- 238000004519 manufacturing process Methods 0.000 description 1
- 238000004949 mass spectrometry Methods 0.000 description 1
- 239000011159 matrix material Substances 0.000 description 1
- 230000035800 maturation Effects 0.000 description 1
- 208000020968 mature T-cell and NK-cell non-Hodgkin lymphoma Diseases 0.000 description 1
- HAWPXGHAZFHHAD-UHFFFAOYSA-N mechlorethamine Chemical compound ClCCN(C)CCCl HAWPXGHAZFHHAD-UHFFFAOYSA-N 0.000 description 1
- PSGAAPLEWMOORI-PEINSRQWSA-N medroxyprogesterone acetate Chemical compound C([C@@]12C)CC(=O)C=C1[C@@H](C)C[C@@H]1[C@@H]2CC[C@]2(C)[C@@](OC(C)=O)(C(C)=O)CC[C@H]21 PSGAAPLEWMOORI-PEINSRQWSA-N 0.000 description 1
- 229960002985 medroxyprogesterone acetate Drugs 0.000 description 1
- 201000001441 melanoma Diseases 0.000 description 1
- 229960001428 mercaptopurine Drugs 0.000 description 1
- 230000004060 metabolic process Effects 0.000 description 1
- VNWKTOKETHGBQD-UHFFFAOYSA-N methane Natural products C VNWKTOKETHGBQD-UHFFFAOYSA-N 0.000 description 1
- 229960000485 methotrexate Drugs 0.000 description 1
- UZKWTJUDCOPSNM-UHFFFAOYSA-N methoxybenzene Substances CCCCOC=C UZKWTJUDCOPSNM-UHFFFAOYSA-N 0.000 description 1
- 229940095102 methyl benzoate Drugs 0.000 description 1
- 229920000609 methyl cellulose Polymers 0.000 description 1
- 239000001923 methylcellulose Substances 0.000 description 1
- WPHGSKGZRAQSGP-UHFFFAOYSA-N methylenecyclohexane Natural products C1CCCC2CC21 WPHGSKGZRAQSGP-UHFFFAOYSA-N 0.000 description 1
- 229960004584 methylprednisolone Drugs 0.000 description 1
- DQDYGBSUPOHHMW-UHFFFAOYSA-N methylsulfonylmethanesulfonyl chloride Chemical compound CS(=O)(=O)CS(Cl)(=O)=O DQDYGBSUPOHHMW-UHFFFAOYSA-N 0.000 description 1
- 229940016286 microcrystalline cellulose Drugs 0.000 description 1
- 235000019813 microcrystalline cellulose Nutrition 0.000 description 1
- 239000008108 microcrystalline cellulose Substances 0.000 description 1
- 239000002480 mineral oil Substances 0.000 description 1
- 235000010446 mineral oil Nutrition 0.000 description 1
- 150000007522 mineralic acids Chemical class 0.000 description 1
- CFCUWKMKBJTWLW-BKHRDMLASA-N mithramycin Chemical compound O([C@@H]1C[C@@H](O[C@H](C)[C@H]1O)OC=1C=C2C=C3C[C@H]([C@@H](C(=O)C3=C(O)C2=C(O)C=1C)O[C@@H]1O[C@H](C)[C@@H](O)[C@H](O[C@@H]2O[C@H](C)[C@H](O)[C@H](O[C@@H]3O[C@H](C)[C@@H](O)[C@@](C)(O)C3)C2)C1)[C@H](OC)C(=O)[C@@H](O)[C@@H](C)O)[C@H]1C[C@@H](O)[C@H](O)[C@@H](C)O1 CFCUWKMKBJTWLW-BKHRDMLASA-N 0.000 description 1
- 239000003226 mitogen Substances 0.000 description 1
- 229960000350 mitotane Drugs 0.000 description 1
- 229960001156 mitoxantrone Drugs 0.000 description 1
- KKZJGLLVHKMTCM-UHFFFAOYSA-N mitoxantrone Chemical compound O=C1C2=C(O)C=CC(O)=C2C(=O)C2=C1C(NCCNCCO)=CC=C2NCCNCCO KKZJGLLVHKMTCM-UHFFFAOYSA-N 0.000 description 1
- 238000002156 mixing Methods 0.000 description 1
- 238000003032 molecular docking Methods 0.000 description 1
- 210000001616 monocyte Anatomy 0.000 description 1
- 210000000214 mouth Anatomy 0.000 description 1
- 210000004877 mucosa Anatomy 0.000 description 1
- 229940087004 mustargen Drugs 0.000 description 1
- 230000002071 myeloproliferative effect Effects 0.000 description 1
- 208000024305 myofibroblastoma Diseases 0.000 description 1
- 229940073569 n-methylephedrine Drugs 0.000 description 1
- 125000004123 n-propyl group Chemical group [H]C([H])([H])C([H])([H])C([H])([H])* 0.000 description 1
- 239000002105 nanoparticle Substances 0.000 description 1
- 125000001624 naphthyl group Chemical group 0.000 description 1
- 230000010352 nasal breathing Effects 0.000 description 1
- 210000003928 nasal cavity Anatomy 0.000 description 1
- 125000001971 neopentyl group Chemical group [H]C([*])([H])C(C([H])([H])[H])(C([H])([H])[H])C([H])([H])[H] 0.000 description 1
- 230000004770 neurodegeneration Effects 0.000 description 1
- 150000002825 nitriles Chemical class 0.000 description 1
- 102000037979 non-receptor tyrosine kinases Human genes 0.000 description 1
- 108091008046 non-receptor tyrosine kinases Proteins 0.000 description 1
- 125000005482 norpinyl group Chemical group 0.000 description 1
- 238000010534 nucleophilic substitution reaction Methods 0.000 description 1
- 210000004940 nucleus Anatomy 0.000 description 1
- 239000003921 oil Substances 0.000 description 1
- 239000012053 oil suspension Substances 0.000 description 1
- 235000019198 oils Nutrition 0.000 description 1
- 238000011275 oncology therapy Methods 0.000 description 1
- 201000008482 osteoarthritis Diseases 0.000 description 1
- DWAFYCQODLXJNR-BNTLRKBRSA-L oxaliplatin Chemical compound O1C(=O)C(=O)O[Pt]11N[C@@H]2CCCC[C@H]2N1 DWAFYCQODLXJNR-BNTLRKBRSA-L 0.000 description 1
- 229960001756 oxaliplatin Drugs 0.000 description 1
- 125000000160 oxazolidinyl group Chemical group 0.000 description 1
- 125000002971 oxazolyl group Chemical group 0.000 description 1
- 125000004430 oxygen atom Chemical group O* 0.000 description 1
- BHAAPTBBJKJZER-UHFFFAOYSA-N p-anisidine Chemical compound COC1=CC=C(N)C=C1 BHAAPTBBJKJZER-UHFFFAOYSA-N 0.000 description 1
- 238000004806 packaging method and process Methods 0.000 description 1
- 229960001972 panitumumab Drugs 0.000 description 1
- 239000003182 parenteral nutrition solution Substances 0.000 description 1
- 230000001717 pathogenic effect Effects 0.000 description 1
- 239000000312 peanut oil Substances 0.000 description 1
- RGSFGYAAUTVSQA-UHFFFAOYSA-N pentamethylene Natural products C1CCCC1 RGSFGYAAUTVSQA-UHFFFAOYSA-N 0.000 description 1
- 210000005105 peripheral blood lymphocyte Anatomy 0.000 description 1
- 238000005502 peroxidation Methods 0.000 description 1
- 239000000825 pharmaceutical preparation Substances 0.000 description 1
- 125000005561 phenanthryl group Chemical group 0.000 description 1
- 229960003418 phenoxybenzamine Drugs 0.000 description 1
- YZTJYBJCZXZGCT-UHFFFAOYSA-N phenylpiperazine Chemical compound C1CNCCN1C1=CC=CC=C1 YZTJYBJCZXZGCT-UHFFFAOYSA-N 0.000 description 1
- DLNKOYKMWOXYQA-APPZFPTMSA-N phenylpropanolamine Chemical compound C[C@@H](N)[C@H](O)C1=CC=CC=C1 DLNKOYKMWOXYQA-APPZFPTMSA-N 0.000 description 1
- 229960000395 phenylpropanolamine Drugs 0.000 description 1
- DCWXELXMIBXGTH-QMMMGPOBSA-N phosphonotyrosine Chemical group OC(=O)[C@@H](N)CC1=CC=C(OP(O)(O)=O)C=C1 DCWXELXMIBXGTH-QMMMGPOBSA-N 0.000 description 1
- 125000005544 phthalimido group Chemical group 0.000 description 1
- 125000005545 phthalimidyl group Chemical group 0.000 description 1
- 125000004193 piperazinyl group Chemical group 0.000 description 1
- NJBFOOCLYDNZJN-UHFFFAOYSA-N pipobroman Chemical compound BrCCC(=O)N1CCN(C(=O)CCBr)CC1 NJBFOOCLYDNZJN-UHFFFAOYSA-N 0.000 description 1
- 229960000952 pipobroman Drugs 0.000 description 1
- 229960003171 plicamycin Drugs 0.000 description 1
- 229920001184 polypeptide Polymers 0.000 description 1
- 239000001267 polyvinylpyrrolidone Substances 0.000 description 1
- 235000013855 polyvinylpyrrolidone Nutrition 0.000 description 1
- 229920000036 polyvinylpyrrolidone Polymers 0.000 description 1
- 239000012286 potassium permanganate Substances 0.000 description 1
- 229960005205 prednisolone Drugs 0.000 description 1
- OIGNJSKKLXVSLS-VWUMJDOOSA-N prednisolone Chemical compound O=C1C=C[C@]2(C)[C@H]3[C@@H](O)C[C@](C)([C@@](CC4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 OIGNJSKKLXVSLS-VWUMJDOOSA-N 0.000 description 1
- 208000028529 primary immunodeficiency disease Diseases 0.000 description 1
- 229960000624 procarbazine Drugs 0.000 description 1
- CPTBDICYNRMXFX-UHFFFAOYSA-N procarbazine Chemical compound CNNCC1=CC=C(C(=O)NC(C)C)C=C1 CPTBDICYNRMXFX-UHFFFAOYSA-N 0.000 description 1
- 230000008569 process Effects 0.000 description 1
- 108090000765 processed proteins & peptides Proteins 0.000 description 1
- 102000004196 processed proteins & peptides Human genes 0.000 description 1
- 238000012545 processing Methods 0.000 description 1
- 229940002612 prodrug Drugs 0.000 description 1
- 239000000651 prodrug Substances 0.000 description 1
- 238000004393 prognosis Methods 0.000 description 1
- 230000000770 proinflammatory effect Effects 0.000 description 1
- 230000035755 proliferation Effects 0.000 description 1
- 230000001737 promoting effect Effects 0.000 description 1
- VVWRJUBEIPHGQF-MDZDMXLPSA-N propan-2-yl (ne)-n-propan-2-yloxycarbonyliminocarbamate Chemical compound CC(C)OC(=O)\N=N\C(=O)OC(C)C VVWRJUBEIPHGQF-MDZDMXLPSA-N 0.000 description 1
- 125000004368 propenyl group Chemical group C(=CC)* 0.000 description 1
- XJMOSONTPMZWPB-UHFFFAOYSA-M propidium iodide Chemical compound [I-].[I-].C12=CC(N)=CC=C2C2=CC=C(N)C=C2[N+](CCC[N+](C)(CC)CC)=C1C1=CC=CC=C1 XJMOSONTPMZWPB-UHFFFAOYSA-M 0.000 description 1
- 125000002572 propoxy group Chemical group [*]OC([H])([H])C(C([H])([H])[H])([H])[H] 0.000 description 1
- 210000002307 prostate Anatomy 0.000 description 1
- 125000006239 protecting group Chemical group 0.000 description 1
- 230000001681 protective effect Effects 0.000 description 1
- 229940121649 protein inhibitor Drugs 0.000 description 1
- 239000012268 protein inhibitor Substances 0.000 description 1
- 230000005588 protonation Effects 0.000 description 1
- 125000003373 pyrazinyl group Chemical group 0.000 description 1
- 125000002098 pyridazinyl group Chemical group 0.000 description 1
- HDOUGSFASVGDCS-UHFFFAOYSA-N pyridin-3-ylmethanamine Chemical compound NCC1=CC=CN=C1 HDOUGSFASVGDCS-UHFFFAOYSA-N 0.000 description 1
- UMJSCPRVCHMLSP-UHFFFAOYSA-N pyridine Natural products COC1=CC=CN=C1 UMJSCPRVCHMLSP-UHFFFAOYSA-N 0.000 description 1
- 125000000714 pyrimidinyl group Chemical group 0.000 description 1
- 125000005493 quinolyl group Chemical group 0.000 description 1
- 102000007575 rab5 GTP-Binding Proteins Human genes 0.000 description 1
- 108010032037 rab5 GTP-Binding Proteins Proteins 0.000 description 1
- 229960004622 raloxifene Drugs 0.000 description 1
- GZUITABIAKMVPG-UHFFFAOYSA-N raloxifene Chemical compound C1=CC(O)=CC=C1C1=C(C(=O)C=2C=CC(OCCN3CCCCC3)=CC=2)C2=CC=C(O)C=C2S1 GZUITABIAKMVPG-UHFFFAOYSA-N 0.000 description 1
- 108010062219 ran-binding protein 2 Proteins 0.000 description 1
- 229960003876 ranibizumab Drugs 0.000 description 1
- 239000002994 raw material Substances 0.000 description 1
- 210000000664 rectum Anatomy 0.000 description 1
- 238000011069 regeneration method Methods 0.000 description 1
- 230000009711 regulatory function Effects 0.000 description 1
- 230000000241 respiratory effect Effects 0.000 description 1
- 208000037803 restenosis Diseases 0.000 description 1
- 125000002914 sec-butyl group Chemical group [H]C([H])([H])C([H])([H])C([H])(*)C([H])([H])[H] 0.000 description 1
- 230000036303 septic shock Effects 0.000 description 1
- 239000008159 sesame oil Substances 0.000 description 1
- 235000011803 sesame oil Nutrition 0.000 description 1
- 230000001568 sexual effect Effects 0.000 description 1
- ZLGIYFNHBLSMPS-ATJNOEHPSA-N shellac Chemical compound OCCCCCC(O)C(O)CCCCCCCC(O)=O.C1C23[C@H](C(O)=O)CCC2[C@](C)(CO)[C@@H]1C(C(O)=O)=C[C@@H]3O ZLGIYFNHBLSMPS-ATJNOEHPSA-N 0.000 description 1
- 239000004208 shellac Substances 0.000 description 1
- 229940113147 shellac Drugs 0.000 description 1
- 235000013874 shellac Nutrition 0.000 description 1
- 230000037439 somatic mutation Effects 0.000 description 1
- 238000002798 spectrophotometry method Methods 0.000 description 1
- 238000001228 spectrum Methods 0.000 description 1
- 239000007921 spray Substances 0.000 description 1
- 239000008107 starch Substances 0.000 description 1
- 235000019698 starch Nutrition 0.000 description 1
- 238000011476 stem cell transplantation Methods 0.000 description 1
- 238000011146 sterile filtration Methods 0.000 description 1
- 230000001954 sterilising effect Effects 0.000 description 1
- 210000002784 stomach Anatomy 0.000 description 1
- 201000000498 stomach carcinoma Diseases 0.000 description 1
- 238000003860 storage Methods 0.000 description 1
- 229960001052 streptozocin Drugs 0.000 description 1
- ZSJLQEPLLKMAKR-GKHCUFPYSA-N streptozocin Chemical compound O=NN(C)C(=O)N[C@H]1[C@@H](O)O[C@H](CO)[C@@H](O)[C@@H]1O ZSJLQEPLLKMAKR-GKHCUFPYSA-N 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 239000005720 sucrose Substances 0.000 description 1
- FDDDEECHVMSUSB-UHFFFAOYSA-N sulfanilamide Chemical compound NC1=CC=C(S(N)(=O)=O)C=C1 FDDDEECHVMSUSB-UHFFFAOYSA-N 0.000 description 1
- 125000004646 sulfenyl group Chemical group S(*)* 0.000 description 1
- 125000004089 sulfido group Chemical group [S-]* 0.000 description 1
- 125000004434 sulfur atom Chemical group 0.000 description 1
- WINHZLLDWRZWRT-ATVHPVEESA-N sunitinib Chemical compound CCN(CC)CCNC(=O)C1=C(C)NC(\C=C/2C3=CC(F)=CC=C3NC\2=O)=C1C WINHZLLDWRZWRT-ATVHPVEESA-N 0.000 description 1
- 229960001796 sunitinib Drugs 0.000 description 1
- 239000000375 suspending agent Substances 0.000 description 1
- 238000010189 synthetic method Methods 0.000 description 1
- 201000000596 systemic lupus erythematosus Diseases 0.000 description 1
- 229960001603 tamoxifen Drugs 0.000 description 1
- 230000008685 targeting Effects 0.000 description 1
- 229940095064 tartrate Drugs 0.000 description 1
- 229960004964 temozolomide Drugs 0.000 description 1
- NRUKOCRGYNPUPR-QBPJDGROSA-N teniposide Chemical compound COC1=C(O)C(OC)=CC([C@@H]2C3=CC=4OCOC=4C=C3[C@@H](O[C@H]3[C@@H]([C@@H](O)[C@@H]4O[C@@H](OC[C@H]4O3)C=3SC=CC=3)O)[C@@H]3[C@@H]2C(OC3)=O)=C1 NRUKOCRGYNPUPR-QBPJDGROSA-N 0.000 description 1
- 229960001278 teniposide Drugs 0.000 description 1
- FQFILJKFZCVHNH-UHFFFAOYSA-N tert-butyl n-[3-[(5-bromo-2-chloropyrimidin-4-yl)amino]propyl]carbamate Chemical compound CC(C)(C)OC(=O)NCCCNC1=NC(Cl)=NC=C1Br FQFILJKFZCVHNH-UHFFFAOYSA-N 0.000 description 1
- BPEWUONYVDABNZ-DZBHQSCQSA-N testolactone Chemical compound O=C1C=C[C@]2(C)[C@H]3CC[C@](C)(OC(=O)CC4)[C@@H]4[C@@H]3CCC2=C1 BPEWUONYVDABNZ-DZBHQSCQSA-N 0.000 description 1
- 229960005353 testolactone Drugs 0.000 description 1
- 229960003604 testosterone Drugs 0.000 description 1
- 125000005958 tetrahydrothienyl group Chemical group 0.000 description 1
- 229950006410 tezacitabine Drugs 0.000 description 1
- 238000011287 therapeutic dose Methods 0.000 description 1
- 125000000335 thiazolyl group Chemical group 0.000 description 1
- 230000008719 thickening Effects 0.000 description 1
- 206010043778 thyroiditis Diseases 0.000 description 1
- WYWHKKSPHMUBEB-UHFFFAOYSA-N tioguanine Chemical compound N1C(N)=NC(=S)C2=C1N=CN2 WYWHKKSPHMUBEB-UHFFFAOYSA-N 0.000 description 1
- UCFGDBYHRUNTLO-QHCPKHFHSA-N topotecan Chemical compound C1=C(O)C(CN(C)C)=C2C=C(CN3C4=CC5=C(C3=O)COC(=O)[C@]5(O)CC)C4=NC2=C1 UCFGDBYHRUNTLO-QHCPKHFHSA-N 0.000 description 1
- XFCLJVABOIYOMF-QPLCGJKRSA-N toremifene Chemical compound C1=CC(OCCN(C)C)=CC=C1C(\C=1C=CC=CC=1)=C(\CCCl)C1=CC=CC=C1 XFCLJVABOIYOMF-QPLCGJKRSA-N 0.000 description 1
- 229960005026 toremifene Drugs 0.000 description 1
- 229960005267 tositumomab Drugs 0.000 description 1
- 231100000331 toxic Toxicity 0.000 description 1
- 230000002588 toxic effect Effects 0.000 description 1
- 108010071511 transcriptional intermediary factor 1 Proteins 0.000 description 1
- 238000002054 transplantation Methods 0.000 description 1
- 229950001353 tretamine Drugs 0.000 description 1
- IUCJMVBFZDHPDX-UHFFFAOYSA-N tretamine Chemical compound C1CN1C1=NC(N2CC2)=NC(N2CC2)=N1 IUCJMVBFZDHPDX-UHFFFAOYSA-N 0.000 description 1
- 229960005294 triamcinolone Drugs 0.000 description 1
- GFNANZIMVAIWHM-OBYCQNJPSA-N triamcinolone Chemical compound O=C1C=C[C@]2(C)[C@@]3(F)[C@@H](O)C[C@](C)([C@@]([C@H](O)C4)(O)C(=O)CO)[C@@H]4[C@@H]3CCC2=C1 GFNANZIMVAIWHM-OBYCQNJPSA-N 0.000 description 1
- 125000004306 triazinyl group Chemical group 0.000 description 1
- 125000001425 triazolyl group Chemical group 0.000 description 1
- QORWJWZARLRLPR-UHFFFAOYSA-H tricalcium bis(phosphate) Chemical compound [Ca+2].[Ca+2].[Ca+2].[O-]P([O-])([O-])=O.[O-]P([O-])([O-])=O QORWJWZARLRLPR-UHFFFAOYSA-H 0.000 description 1
- ITMCEJHCFYSIIV-UHFFFAOYSA-N triflic acid Chemical compound OS(=O)(=O)C(F)(F)F ITMCEJHCFYSIIV-UHFFFAOYSA-N 0.000 description 1
- 229940086984 trisenox Drugs 0.000 description 1
- 229910052722 tritium Inorganic materials 0.000 description 1
- 210000004881 tumor cell Anatomy 0.000 description 1
- 229940121358 tyrosine kinase inhibitor Drugs 0.000 description 1
- 229960001055 uracil mustard Drugs 0.000 description 1
- 210000001215 vagina Anatomy 0.000 description 1
- 210000005166 vasculature Anatomy 0.000 description 1
- 230000007998 vessel formation Effects 0.000 description 1
- UGGWPQSBPIFKDZ-KOTLKJBCSA-N vindesine Chemical compound C([C@@H](C[C@]1(C(=O)OC)C=2C(=CC3=C([C@]45[C@H]([C@@]([C@H](O)[C@]6(CC)C=CCN([C@H]56)CC4)(O)C(N)=O)N3C)C=2)OC)C[C@@](C2)(O)CC)N2CCC2=C1N=C1[C]2C=CC=C1 UGGWPQSBPIFKDZ-KOTLKJBCSA-N 0.000 description 1
- 229960004355 vindesine Drugs 0.000 description 1
- 229960002066 vinorelbine Drugs 0.000 description 1
- GBABOYUKABKIAF-GHYRFKGUSA-N vinorelbine Chemical compound C1N(CC=2C3=CC=CC=C3NC=22)CC(CC)=C[C@H]1C[C@]2(C(=O)OC)C1=CC([C@]23[C@H]([C@]([C@H](OC(C)=O)[C@]4(CC)C=CCN([C@H]34)CC2)(O)C(=O)OC)N2C)=C2C=C1OC GBABOYUKABKIAF-GHYRFKGUSA-N 0.000 description 1
- 125000000391 vinyl group Chemical group [H]C([*])=C([H])[H] 0.000 description 1
- 238000010792 warming Methods 0.000 description 1
- 239000000080 wetting agent Substances 0.000 description 1
- 229940053867 xeloda Drugs 0.000 description 1
- 229910052725 zinc Inorganic materials 0.000 description 1
- 239000011701 zinc Substances 0.000 description 1
- FBTUMDXHSRTGRV-ALTNURHMSA-N zorubicin Chemical compound O([C@H]1C[C@@](O)(CC=2C(O)=C3C(=O)C=4C=CC=C(C=4C(=O)C3=C(O)C=21)OC)C(\C)=N\NC(=O)C=1C=CC=CC=1)[C@H]1C[C@H](N)[C@H](O)[C@H](C)O1 FBTUMDXHSRTGRV-ALTNURHMSA-N 0.000 description 1
- 229960000641 zorubicin Drugs 0.000 description 1
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing three or more hetero rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K31/00—Medicinal preparations containing organic active ingredients
- A61K31/33—Heterocyclic compounds
- A61K31/395—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins
- A61K31/495—Heterocyclic compounds having nitrogen as a ring hetero atom, e.g. guanethidine or rifamycins having six-membered rings with two or more nitrogen atoms as the only ring heteroatoms, e.g. piperazine or tetrazines
- A61K31/505—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim
- A61K31/506—Pyrimidines; Hydrogenated pyrimidines, e.g. trimethoprim not condensed and containing further heterocyclic rings
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
- A61P27/14—Decongestants or antiallergics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/20—Antivirals for DNA viruses
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
- A61P35/02—Antineoplastic agents specific for leukemia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D401/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom
- C07D401/14—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, at least one ring being a six-membered ring with only one nitrogen atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D403/00—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00
- C07D403/02—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings
- C07D403/04—Heterocyclic compounds containing two or more hetero rings, having nitrogen atoms as the only ring hetero atoms, not provided for by group C07D401/00 containing two hetero rings directly linked by a ring-member-to-ring-member bond
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D405/00—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom
- C07D405/14—Heterocyclic compounds containing both one or more hetero rings having oxygen atoms as the only ring hetero atoms, and one or more rings having nitrogen as the only ring hetero atom containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D409/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms
- C07D409/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having sulfur atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D413/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D413/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and oxygen atoms as the only ring hetero atoms containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D417/00—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00
- C07D417/14—Heterocyclic compounds containing two or more hetero rings, at least one ring having nitrogen and sulfur atoms as the only ring hetero atoms, not provided for by group C07D415/00 containing three or more hetero rings
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D451/00—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof
- C07D451/02—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof
- C07D451/04—Heterocyclic compounds containing 8-azabicyclo [3.2.1] octane, 9-azabicyclo [3.3.1] nonane, or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane or granatane alkaloids, scopolamine; Cyclic acetals thereof containing not further condensed 8-azabicyclo [3.2.1] octane or 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring systems, e.g. tropane; Cyclic acetals thereof with hetero atoms directly attached in position 3 of the 8-azabicyclo [3.2.1] octane or in position 7 of the 3-oxa-9-azatricyclo [3.3.1.0<2,4>] nonane ring system
- C07D451/06—Oxygen atoms
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D471/00—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00
- C07D471/02—Heterocyclic compounds containing nitrogen atoms as the only ring hetero atoms in the condensed system, at least one ring being a six-membered ring with one nitrogen atom, not provided for by groups C07D451/00 - C07D463/00 in which the condensed system contains two hetero rings
- C07D471/10—Spiro-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/02—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains two hetero rings
- C07D491/10—Spiro-condensed systems
- C07D491/107—Spiro-condensed systems with only one oxygen atom as ring hetero atom in the oxygen-containing ring
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D491/00—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00
- C07D491/12—Heterocyclic compounds containing in the condensed ring system both one or more rings having oxygen atoms as the only ring hetero atoms and one or more rings having nitrogen atoms as the only ring hetero atoms, not provided for by groups C07D451/00 - C07D459/00, C07D463/00, C07D477/00 or C07D489/00 in which the condensed system contains three hetero rings
- C07D491/16—Peri-condensed systems
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07D—HETEROCYCLIC COMPOUNDS
- C07D498/00—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms
- C07D498/02—Heterocyclic compounds containing in the condensed system at least one hetero ring having nitrogen and oxygen atoms as the only ring hetero atoms in which the condensed system contains two hetero rings
- C07D498/10—Spiro-condensed systems
Landscapes
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Health & Medical Sciences (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Veterinary Medicine (AREA)
- Public Health (AREA)
- Medicinal Chemistry (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Virology (AREA)
- Immunology (AREA)
- Oncology (AREA)
- Diabetes (AREA)
- Communicable Diseases (AREA)
- Orthopedic Medicine & Surgery (AREA)
- Physical Education & Sports Medicine (AREA)
- Molecular Biology (AREA)
- Neurology (AREA)
- Hematology (AREA)
- Ophthalmology & Optometry (AREA)
- Dermatology (AREA)
- Pulmonology (AREA)
- Cardiology (AREA)
- Heart & Thoracic Surgery (AREA)
- Urology & Nephrology (AREA)
- Endocrinology (AREA)
- Rheumatology (AREA)
- Epidemiology (AREA)
- Tropical Medicine & Parasitology (AREA)
- AIDS & HIV (AREA)
- Neurosurgery (AREA)
- Biomedical Technology (AREA)
- Obesity (AREA)
- Biotechnology (AREA)
Abstract
本发明提供了取代的双环杂芳基化合物,包括,例如,4-吡唑基-N-芳基嘧啶-2-胺和4-吡唑基-N-杂芳基嘧啶-2-胺,其调节激酶的活性,并且可用于治疗与激酶活性相关的疾病包括,例如,免疫相关疾病、皮肤障碍、骨髓增生障碍、癌症和其它疾病。
Description
技术领域
本发明提供了取代的双环杂芳基化合物,包括,例如,4-吡唑基-N-芳基嘧啶-2-胺和4-吡唑基-N-杂芳基嘧啶-2-胺,其调节激酶的活性,并且可用于治疗与激酶活性相关的疾病包括,例如,免疫相关疾病、皮肤障碍、骨髓增生障碍、癌症和其它疾病。
背景技术
蛋白激酶(PK)是一组酶,它们调节不同的、重要的生物学过程,包括细胞生长、存活和分化,器官形成和形态发生、新生血管形成、组织修复和再生及其它。蛋白激酶通过催化蛋白(或底物)的磷酸化从而调节在各种生物学环境中底物的细胞活性来发挥它们的生理学功能。除了在正常组织/器官中的功能以外,许多蛋白激酶还在许多人类疾病例如癌症中挥着更特别的作用。蛋白激酶的亚组(亦称为致癌性蛋白激酶)在失调时,可引起肿瘤形成和生长,并且进一步有助于肿瘤维持和发展(Blume-Jensen P et al,Nature 2001,411(6835):355-365)。迄今为止,致癌性蛋白激酶代表了用于癌症干预和药物开发的蛋白靶标的最大和最有吸引力的群组之一。
蛋白激酶可分类为受体型和非受体型,并且对于磷酸化Ser/Thr残基或Tyr残基显示出特异性。因此,激酶可以被描述成为Ser/Thr激酶(例如,受体Ser/Thr激酶或非受体Ser/Thr激酶)或Tyr激酶(例如,受体Tyr激酶或非受体Tyr激酶)。结合来自生长因子的TGFβ家族的配体的受体是Ser/Thr激酶,并称为TGFβR。非受体Ser/Thr激酶的实例包括PKA、PKG、PKC、CaM-激酶、磷酸化酶激酶、MAPK(ERK)、MEKK、Akt和mTOR。
受体Tyr激酶(RTK)具有细胞外蛋白、跨膜区和细胞内蛋白,而非受体酪氨酸激酶完全是细胞内的。RTK介导的信号转导通常是由与特异性生长因子(配体)的细胞外相互作用、通常接着受体二聚化、内在蛋白酪氨酸激酶活性的刺激、和受体反向磷酸化而引起的。从而结合位点产生细胞内信号转导分子,并导致形成具有细胞质信号分子光谱的复合物,该复合物促进了适当的分子应答例如细胞分裂、分化、代谢作用和细胞外微环境的变化。
目前,至少十九(19)种不同的RTK亚族已被鉴定。一种RTK亚族,称为HER亚族,包括EGFR、HER2、HER3和HER4。RTK的第二族,称为胰岛素亚族,包括INS-R、IGF-1R和IR-R。第三族,″PDGF″亚族,包括PDGFα和β受体、CSFIR、c-kit和FLK-II。RTK的另一亚族,称为FLK亚族,包括激酶插入区域-受体胎肝激酶-1(KDR/FLK-1)、胎肝激酶4(FLK-4)和fms-样酪氨酸激酶1(flt-1)。RTK的两种其它亚族已被命名为FGF受体家族(FGFR1、FGFR2、FGFR3和FGFR4)和Met亚族(c-Met、Ron和Sea)。其它的RTK是VEGFR/Flt2、FLT4、Eph族RTKs(A1、A2、A3、B2、B4)和Tie2。对于蛋白激酶的详细讨论,参见例如,Blume-Jensen,P.et al.,Nature.2001,411(6835):355-365,以及Manning,G.et al.,Science.2002,298(5600):1912-1934。TRK家族激酶的综述可见于Cancer Letter 169(2001)107-114,其通过引用并入本文。Eph家族激酶的综述可见于Genes & Development,17:1429-1450,并通过引用并入本文。Tie2激酶的信息可见于K.G.Peters et al.″Functional Significance ofTie2 Signaling in the Adult Vasculature″,2004,The Endocrine Society。
非受体Tyr激酶可以分为若干亚族,包括Src、Btk、ABL、Fak和JAK。这些亚族的每一种可进一步细分成多个成员,它们通常与肿瘤生成有关。ABL家族包括ABL1和ARG(AB L2)。JAK家族包括JAK1、JAK2、JAK3和TYK2。Src家族是最大的,并且包括Src、Fyn、Lck和Fgr及其它。这些激酶的详细讨论参见Bolen JB.Nonreceptor tyrosineprotein kinases.Oncogene.1993,8(8):2025-31。
激酶活性的不适当调节会促进疾病状态。已知发生脱调节的激酶活性是通过突变(例如由染色体易位导致的基因融合、影响激酶活性的点突变)或者激酶基因表达的变化(例如通过基因扩增的表达增加)。40种以上的染色体易位(它们导致基因融合和12种不同Tyr激酶的脱调节)与各种血液恶变有关。与血液恶变有关的蛋白酪氨酸激酶包括ABL(ABL1)、ARG(ABL2)、PDGFβR、PDGFαR、JAK2、SYK、TRKC、FGFR1、FGFR3、FLT3和FRK。在这些激酶中与突变有关的疾病范围包括骨髓增生障碍,MPD;慢性髓细胞样白血病,CML;急性髓细胞样白血病,AML;急性成淋巴细胞性白血病,ALL;慢性骨髓单核细胞性白血病,DMML;8pl3骨髓增生综合征,EMS;间变性大细胞淋巴瘤,ALCL;炎性成肌纤维胞瘤,IMF;外周T-细胞淋巴瘤,PTL;真性红细胞增多,PV;和特发性血小板增多症,ET(Y.Chalandon and J.Schwaller,Haematologica,2005;90(7):949-968)。多种激酶的小分子抑制剂已成功地用于治疗疾病状态。蛋白酪氨酸激酶ABL、ALK、PDGFαR、PDGFβR、KIT、FLT3、FGFR1和FGFR3的小分子抑制剂被用于治疗血液恶变(Y.Chalandon and J.Schwaller,Haematologica,2005;90(7):949-968)。
特别地,ABL和JAK非受体Tyr激酶的不恰当的活性与人类疾病有关。不恰当的ABL激酶活性是癌症的标志,并且可促进骨髓增生障碍和纤维变性病症例如肺纤维化(Daniels CE et al.,J Clin Invest,2004Nov;l 14(9):1308-16)。不恰当的JAK激酶活性促进癌症、骨髓增生障碍和免疫系统障碍。
非受体Tyr激酶的ABL家族包括ABL1和ARG(AB L2)(Kruh GD etal.,PNAS,1990 Aug;87(l 5)5802-6)。因此,该ABL家族可简称为ABL。ABL1的研究已被证实涉及多种信号途径,包括Ras-依赖性、Rac-依赖性、JNK-依赖性、PI3K-依赖性、PKC-依赖性、mTOR和JAK/STAT。这些信号途径调节包括下列的过程:细胞周期进程、细胞周期停滞、细胞生长、细胞分化、和凋亡(MG Kharas and DA Fruman,Cancer Research,65:2047-2053;X.Zou and K.Calame,J.Biol.Chem.,274(26):18141-18144)。
ABL激酶活性的脱调节与疾病有关,并且可通过基因扩增和突变而发生。例如,ABL激酶的基因融合与血液癌症有关。ABL1与TEL、NUP214、EMS和SFQ的融合与CML和ALL有关联,而ARG(ABL2)与BCR和TEL的融合与CML有关联(Y.Chalandon and J.Schwaller,Haematologica,2005;90(7):949-968)。BCR/ABL1融合基因,其由生成费城染色体的染色体易位引起,该融合基因被广泛地认为是白血病的诱发因素:费城染色体,其与95%的CML病倒和10%的ALL病例有关(X.Zou and K.Calame,J.Biol.Chem.,274(26):18141-18144)。
小分子抑制剂甲磺酸伊马替尼(GleevecTM),一种ABL1激酶活性的小分子抑制剂,已广泛用于治疗CML。然而,对伊马替尼的临床耐药的问题逐渐增加。耐药最常见的是通过在BCR/ABL1的激酶区别中突变的克服扩张而发生的(Gorre ME et al.,Science,293(5531):876-80)。许多突变已从临床隔离群反映出来,包括T315D、F359D、D276G、E255K、M351T、G250E、H396R、Q252H、Y253H、E355G、F317L、G250E、Y253F、F359V、Q252R、L387M、M244V、M343T/F382L和V379I(ShahNP et al.,Cancer Cell,2:117-25)。因此,需要有针对伊马替尼耐药ABL1突变的另外的小分子抑制剂。此外,与多种针对ABL1的小分子抑制剂组合治疗有望降低通过ABL1的突变有单细胞中产生耐药的可能性以及后续的克隆扩张。
包括蛋白酪氨酸激酶的Janus激酶家族(JAKs)以及信号传导与转录活化因子(STAT)的途径参与广泛的细胞因子和生长因子的发信号。细胞因子是低分子量的多肽或糖蛋白,它们事实上在所有细胞类型中刺激生物学应答。例如,细胞因子调节许多与宿主对脓毒症的炎症应答有关的途径。细胞因子影响细胞分化、增殖和活化,并且它们可调节促炎症反应和抗炎应答,以使该宿主适当地对病原体作出反应。通常,细胞因子受体不具有内在的酪氨酸激酶活性,并因此需要受体相关的激酶以传播磷酸化级联。JAK实现了这种功能。细胞因子结合它们的受体,引起受体二聚化,并且这样使得JAK能够相互磷酸化和细胞因子受体中特定酪氨酸基序。识别这些磷酸酪氨酸基序的STAT补充该受体,然后它们自己通过JAK-依赖性酪氨酸磷酸化事件而被活化。在活化后,STAT与受体、二聚体分离并易位到细胞核以结合结合特定的DNA位点并改变转录(Scott,M.J.,C.J.Godshall,et al.(2002).″JAKs,STATs,Cytokines,andSepsis.″Clin Diagn Lab Immunol 9(6):1153-9)。
JAK家族在参与免疫应答的细胞增殖和功能的细胞因子-依赖性调节中发挥作用。目前,有四种已知的哺乳动物JAK家族成员:JAK1(亦称为Janus激酶-1)、JAK2(亦称为Janus激酶-2)、JAK3(亦称为Janus激酶、白血球;JAK1;L-JAK和Janus激酶-3)和TYK2(亦称为蛋白-酪氨酸激酶2)。该JAK蛋白大小范围为120至140kDa,并且包括7个保守的JAK同源(JH)区域;其中一个是官能化催化性激酶区域,另一个是假激酶,其可能提供调节功能和/或用作STAT的停泊位点(Scott,Godshall et al.2002,同上)。虽然JAK1、JAK2和TYK2无处不在地表达,据报道JAK3优先表达于淋巴细胞。
细胞因子刺激的免疫和炎症应答不但会促进正常的宿主防御反应,而且它们还在疾病发病机制中发挥作用:例如重度联合免疫缺陷症(SCID)的病状产生于免疫系统的活动减退和抑制,而活动过度或者不恰当的免疫/炎症应答会促进自身免疫性疾病的病状,例如类风湿性和银屑病关节炎、哮喘和全身性红斑狼疮、炎性肠病、多发性硬化、I型糖尿病、重症肌无力、甲状腺炎、疫球蛋白肾病、心肌炎以及例如硬皮病和骨关节炎的疾病(Ortmann,R.A.,T.Cheng,et al.(2000).″Janus kinasesand signal transducers and activators of transcription:their roles in cytokinesignaling,development and immunoregulation.″Arthritis Res 2(1):16-32)。此外,具有自身免疫和免疫缺陷疾病的混合表象的综合征是非常常见的(Candotti,F.,L.Notarangelo,et al.(2002).″Molecular aspects of primaryimmunodeficiencies:lessons from cytokine and other signaling pathways.″JClin Invest 109(10):1261-9)。因此,相应地,治疗剂通常针对免疫和炎症途径的增大和抑制。
JAK家族成员表达的缺乏与疾病状态有关。JAK1-/-小鼠在出生时发育不良,不能哺乳,并在围产期死亡(Rodig,S.J.,M.A.Meraz,et al.(1998).″Disruption of the JAK1 gene demonstrates obligatory andnonredundant roles of the JAKs in cytokine-induced biologic responses.″Cell 93(3):373-83)。JAK2-/-小鼠胚胎贫血,并且在性交后约12.5天死亡,因为缺乏最终的红细胞生成。JAK2-缺陷成纤维细胞对IFNγ无应答,尽管对IFNα/β和IL-6的应答不受影响。在细胞因子受体的特定组的信号转导中,JAK2功能要求最终的红细胞生成(Neubauer,H.,A.Cumano,et al.(1998).Cell 93(3):397-409;Parganas,E.,D.Wang,et al.(1998).Cell93(3):385-95.)。JAK3显示出在B和T淋巴细胞的正常发育和功能中发挥作用。据报道JAK3的突变在人类中对常染色体隐性重度联合免疫缺陷症(SCID)负责(Candotti,F.,S.A.Oakes,et al.(1997).″Structural andfunctional basis for JAK3-deficient severe combined immunodeficiency.″Blood 90(10):3996-4003)。
JAK/STAT途径,特别是JAK家族全部四个成员,据认为在哮喘性应答的发病、慢性阻塞性肺病、支气管炎和其它下呼吸道的相关炎性疾病中发挥作用。例如特征是哮喘的不恰当的免疫应答是由称为T辅助细胞2(Th2)细胞的CD4+T辅助细胞的亚组特别安排的。通过细胞因子受体IL-4发信号会刺激JAK1和JAK3以激活STAT6,而通过细胞因子受体IL-12发信号会刺激JAK2和TYK2活化以及后续STAT4的磷酸化。STAT4和STAT6控制CD4+T辅助细胞分化的多个方面(Pernis,A.B.and P.B.Rothman(2002).″JAK-STAT signaling in asthma.″J Clin Invest109(10):1279-83)。此外,已发现TYK2-缺陷小鼠会增强Th2细胞介导的过敏性气道炎症(Seto,Y.,H.Nakajima,et al.(2003).″Enhanced Th2cell-mediated allergic inflammation in Tyk2-deficient mice.″J Immunol170(2):1077-83)。此外,通过JAK激酶发信号的多种细胞因子与炎性疾病或上呼吸道病症例如影响鼻和窦的那些(例如,鼻炎、窦炎)有关,而不论是否是经典的过敏性反应。
还已提示JAK/STAT途径在眼的炎性疾病/病症中发挥作用,该炎性疾病或病症包括但不限于虹膜炎、葡萄膜炎、巩膜炎、结膜炎以及慢性过敏性应答。因此,JAK激酶的抑制作用在这些疾病的治疗中具有有益作用。
JAK/STAT途径亦与癌症有关。STAT3的活化已在子宫内膜癌和子宫颈癌中报道(C.L.Chen et al.(2007).British Journal of Cancer 96:591-599)。此外,JAK/STAT途径组分特别是JAK3,在免疫系统的癌症中发挥作用。在成人型T细胞性白血病/淋巴瘤(ATLL)中,人CD4+T细胞获得了转化的表型,这是一种与JAK和STAT的组成性磷酸化的获得有关的事件。此外,JAK3与STAT-I、STAT-3和STAT-5活化之间的联系以及细胞周期进程由碘化丙锭(propidium iodide)染色和溴脱氧尿苷掺入到四个测试的ATLL患者细胞中所证实。这会产生这样的暗示,即JAK/STAT活化与白血病细胞的复制有关,并且认为针对JAK/STAT抑制作用的治疗方法会使瘤生长停止(Takemoto,S.,J.C.Mulloy,et al.(1997).″Proliferation of adult T cell leukemia/lymphoma cells is associatedwith the constitutive activation of JAK/STAT proteins.″Proc Natl Acad SciUSA 94(25):13897-902)。
于JAK激酶的水平阻断信号转导保持了对于开发人癌症治疗法的希望。白细胞介素6(IL-6)家族的细胞因子,其活化信号转导物gp130,是人类多发性骨髓瘤(MM)细胞的主要存活和生长因子。gp130的信号转导据认为涉及JAK1、JAK2和Tyk,以及下游效应子STAT3和分裂素-活化的蛋白激酶(MAPK)途径。在用JAK2酪氨酸磷酸化抑制剂AG490治疗的IL-6-依赖性MM细胞系中,JAK2激酶活性以及ERK2和STAT3磷酸化被抑制。此外,细胞增殖被抑制,细胞凋亡被诱导(De Vos,J.,M.Jourdan,et al.(2000).″JAK2 tyrosine kinase inhibitor tyrphostin AG490downregulates the mitogen-activated protein kinase(MAPK)and signaltransducer and activator of transcription(STAT)pathways and inducesapoptosis in myeloma cells.″Br J Haematol 109(4):823-8)。然而,在一些情况下,AG490可诱导肿瘤细胞休眠,然后事实上保护它们避免死亡。
癌症中JAK/STAT的活化可通过包括细胞因子刺激(例如,IL-6或GM-CSF)的多种机制而发生,或者通过减少内源性JAK发信号的抑制剂例如SOCS(细胞因子发信号的抑制剂)或PIAS(活化的STAT的蛋白抑制剂)而发生(Boudny,V.,and Kovarik,J.,Neoplasm.49:349-355,2002)。重要的是,STAT发信号的活化,以及JAK的其它下游途径(例如,Akt)已在许多癌症类型中与差的预后不良相关联(Bowman,T.,et al.Oncogene 19:2474-2488,2000)。此外,通过JAK/STAT信号的高水平循环细胞因子可能不利地影响患者健康,因为据认为它们在恶病质和/或慢性疲劳中发挥因果性作用。这样,JAK抑制作用可治疗性的用于癌症患者的治疗,原因是扩散超过了潜在的抗肿瘤活性。认识到饱食因子来普汀(leptin)通过JAK发信号,恶病质征候可获得进一步的理论支持。
靶向Janus激酶3(JAK3)的药理学已成功用于控制同种异体移植物排斥和移植物抗宿主病(GVHD)。除了其涉及细胞因子受体的发信号外,JAK3还参与外周血单核细胞的CD40发信号途径。在CD40-诱导的骨髓树状突细胞(DC)的成熟作用期间,JAK3活性被诱导,并且发现辅助刺激分子表达、IL-12生成和有效的同种异体刺激能力的增加。合理设计的JAK3抑制剂WHI-P-154防止在发良不完全的水平上阻止DC的作用,表明针对酪氨酸激酶JAK3的免疫抑制疗法亦可影响骨髓细胞的功能(Saemann,M.D.,C.Diakos,et al.(2003).″Prevention of CD40-triggereddendritic cell maturation and induction of T-cell hyporeactivity by targetingof Janus kinase 3.″Am J Transplant 3(11):1341-9)。在小鼠模型系统中,还显示JAK3是一种用于治疗自身免疫性胰岛素依赖性(1型)糖尿病的重要分子靶。合理设计的JAK3抑制剂JANEX-1显示出有效的免疫调节活性,并延迟在自身免疫性1型糖尿病的NOD小鼠模型中糖尿病的发病(Cetkovic-Cvrlje,M.,A.L.Dragt,et al.(2003).″Targeting JAK3 withJANEX-I for prevention of autoimmune type 1 diabetes in NOD mice.″ClinImmunol 106(3):213-25)。
已经提出,JAK2酪氨酸激酶的抑制作用对骨髓增生障碍患者是有益的(Levine,et al,Cancer Cell,vol.7,2005:387-397)。骨髓增生障碍(MPD)包括真性红细胞增多(PV)、特发性血小板增多症(ET)、伴有骨髓纤维变性的髓样化生(MMM)、慢性髓细胞性白血病(CML)、慢性骨髓单核细胞性白血病(CMML)、嗜酸细胞过多综合征(HES)和系统性肥大细胞病(SMCD)。尽管认为骨髓增生障碍(例如PV、ET和MMM)是由造血祖细胞中的获得性体细胞突变引起的,但这些疾病的遗传基础尚不知晓。然而,已有报道,来自大部分PV患者和大量ET和MMM患者的造血细胞在JAK2酪氨酸激酶中具有再发性体细胞激活突变。还有报道,用小分子抑制剂抑制JAK2V617F激酶会导致造血细胞增殖的抑制,这表明在PV、ET和MMM患者中JAK2酪氨酸激酶是药理学抑制的可能靶标。
还认为JAK激酶的抑制作用在罹患例如银屑病和皮肤致敏的皮肤免疫障碍的患者中具有治疗益处。在寻常型银屑病(其为银屑病的最常见形式)中,普遍认为活化的T淋巴细胞对于维持疾病及其相关银屑病性蚀斑是重要的(Gottlieb,A.B.,et al,Nat Rev Drug Disc,4:19-34)。银屑病性蚀斑含有重要的免疫浸润,包括粒细胞和单核细胞,以及具有角质化细胞增殖增加的多重表皮层。虽然在银屑病中免疫细胞的初始活化是通过确定机制的疾病发生的,但是,除了各种趋化因子和生长因子外,据信该维持作用对于许多炎症细胞因子是依赖性的(JCI,113:1664-1675)。这些中的许多(包括白细胞介素-2、-4、-6、-7、-12、-15、-18和-23,以及GM-CSF和IFNg),通过Janus(JAK)激酶发信号(Adv Pharmacol.2000;47:113-74)。这样,于JAK激酶水平阻断信号转导可在银屑病或其它皮肤免疫障碍的患者中产生治疗益处。
已经知道,某些治疗会在某些患者中引起免疫反应例如皮疹或腹泻。例如,施用一些新的靶向抗癌剂例如Iressa、Erbitux和Tarceva会在一些患者中引发痤疮样疹。另一实例是,局部使用的一些治疗会引发皮肤刺激、皮疹、接触性皮炎或过敏性接触性致敏。对于一些患者,这些免疫反应可能是令人讨厌的,但是对于其它患者,这些免疫反应例如疹或腹泻可能导致不能持续治疗。尽管这些免疫反应背后的驱动力在目前尚未完全阐明,但这些免疫反应可能与免疫浸润有关。
广泛地寻找了Janus激酶或相关激酶的抑制剂,并且一些出版物报道了有效类别的化合物。例如,某些抑制剂被报道于WO 99/65909,US2004/0198737;WO 2004/099204;WO 2004/099205;和WO 01/42246。杂芳基取代的吡咯类化合物和其它化合物被报道于WO 2004/72063和WO 99/62908。
因此,持续需要有抑制激酶的新或改善的药剂,部分地,应对耐药突变。组合治疗(使用新鉴别的药剂)可能降低开发耐药激酶突变体的机会,并且需要新药剂治疗存在的耐药激酶突变体(例如ABL1突变体,其对伊马替尼耐药)。仍然需要有抑制JAK激酶的药剂,其充当用于器官移植的免疫抑制剂,以及用于预防和治疗自身免疫性疾病(例如,多发性硬化、类风湿性关节炎、哮喘、I型糖尿病、炎性肠病、克罗恩病、自身免疫性甲状腺障碍、阿耳茨海默氏病)、包括活动过度免疫应答的疾病(例如,湿疹)、变态反应、癌症(例如,前列腺癌、白血病、多发性骨髓瘤)和一些由其它治疗引起的免疫反应(例如,皮疹或接触性皮炎或腹泻)的药剂,为数较少。本文描述的化合物、组合物和方法直接针对这些需求和其它目标。
发明概述
本发明提供了式I化合物:
或药学可接受的盐形式,其中各组成成员在本文定义。
本发明进一步提供了组合物,其包含式I化合物或其药学可接受的盐,以及至少一种药学可接受的载体。
本发明进一步提供了调节一种或多种激酶活性的方法,其包括使该激酶与式I化合物或其药学可接受的盐接触。
本发明进一步提供了调节JAK活性的方法,其包括使JAK与式I化合物或其药学可接受的盐接触。
本发明进一步提供了治疗患者中的疾病的方法,其中该疾病与异常JAK活性相关,该方法包括给该患者施用治疗有效量的式I化合物或其药学可接受的盐。
本发明进一步提供了用于治疗的式I化合物或其药学可接受的盐。
本发明进一步提供了式I化合物或其药学可接受的盐用于制备用于治疗的医药的用途。
发明详述
本发明提供了,特别是,调节一种或多种JAK活性的化合物,并且可用于例如治疗各种疾病,例如与JAK表达或活性有关的那些疾病。本发明化合物具有式I:
包括其药学可接受的盐形式或前药,其中:
环A是芳基或杂芳基;
L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)p-(亚芳基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q、(CR5R6)p-(亚杂芳基)-(CR5R6)q、(CR5R6)pO(CR5R6)q、(CR5R6)pS(CR5R6)q、(CR5R6)pC(O)(CR5R6)q、(CR5R6)pC(O)NRc(CR5R6)q、(CR5R6)pC(O)O(CR5R6)q、(CR5R6)pOC(O)(CR5R6)q、(CR5R6)pOC(O)NRc(CR5R6)q、(CR5R6)pNRc(CR5R6)q、(CR5R6)pNRcC(O)NRd(CR5R6)q、(CR5R6)pS(O)(CR5R6)q、(CR5R6)pS(O)NRc(CR5R6)q、(CR5R6)pS(O)2(CR5R6)q或(CR5R6)pS(O)2NRc(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基、亚芳基、C1-10亚杂环烷基或亚杂芳基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd;
Q是H、Cy1、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1,其中所述C1-6烷基、C2-6烯基或C2-6炔基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1;
X是H、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb或S(O)2NRcRd;
Y是H、Cy2、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1,其中所述C1-6烷基、C2-6烯基、C2-6炔基或C1-6卤代烷基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1;
R1、R2、R3、R4、R5和R6独立地选自H、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、(CH2)mCN、NO2、ORa、(CH2)mORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、NRcRd、(CH2)mNRcRd、NRcC(O)Rb、NRcS(O)2Rb和S(O)2NRcRd;
Cy1和Cy2独立地选自芳基、环烷基、杂芳基和杂环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1,其中所述在Cy1或Cy2上取代的C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基或杂环烷基进一步任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1;
Ra、Rb、Rc和Rd独立地选自H、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基和杂环烷基烷基,其中所述C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基或杂环烷基烷基任选被1、2、3、4或5个独立地选自下列的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
或者Rc和Rd与它们连接的N原子一起形成4-、5-、6-或7-元杂环烷基或杂芳基,各自任选被1、2或3个独立地选自以下的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
Ra1、Rb1、Rc1和Rd1独立地选自H、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基和杂环烷基烷基,其中所述C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基或杂环烷基烷基任选被1、2、3、4或5个独立地选自下列的取代基取代:C1-6烷基、卤素、CN、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)NRc2Rd2、NRc2C(O)ORa2、C(=NRg)NRc2Rd2、NRc2C(=NRg)NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、NRc2S(O)2Rb2和S(O)2NRc2Rd2;
或者Rc1和Rd1与它们连接的N原子一起形成4-、5-、6-或7-元杂环烷基或杂芳基,各自任选被1、2或3个独立地选自以下的取代基取代:C1-6烷基、卤素、CN、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)NRc2Rd2、NRc2C(O)ORa2、C(=NRg)NRc2Rd2、NRc2C(=NRg)NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、NRc2S(O)2Rb2和S(O)2NRc2Rd2;
Ra2、Rb2、Rc2和Rd2独立地选自H、C1-6烷基、C1-6卤代烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基和杂环烷基烷基,其中所述C1-6烷基、C1-6卤代烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基或杂环烷基烷基任选被1、2或3个独立地选自以下的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
或者Rc2和Rd2与它们连接的N原子一起形成4-、5-、6-或7-元杂环烷基或杂芳基,各自任选被1、2或3个独立地选自以下的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
Rg是H、CN或NO2;
m是0、1、2或3;
n是0或1;
p是0、1、2、3、4、5或6;和
q是0、1、2、3、4、5或6。
在一些实施方案中,A是芳基。
在一些实施方案中,A是苯基。
在一些实施方案中,A是杂芳基。
在一些实施方案中,A是吡唑基。
在一些实施方案中,A是吡啶基。
在一些实施方案中,L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)p-(亚芳基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q、(CR5R6)p-(亚杂芳基)-(CR5R6)q、(CR5R6)pO(CR5R6)q、(CR5R6)pS(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基、亚芳基、C1-10亚杂环烷基或亚杂芳基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
在一些实施方案中,L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)p-(亚芳基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q、(CR5R6)p-(亚杂芳基)-(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基、亚芳基、C1-10亚杂环烷基或亚杂芳基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
在一些实施方案中,L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基或C1-10亚杂环烷基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
在一些实施方案中,L是C1-8亚烷基或(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q,其中所述C1-8亚烷基或C1-10亚杂环烷基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
在一些实施方案中,L是C1-8亚烷基,其任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
在一些实施方案中,L是(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q,其任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
在一些实施方案中,L是(CR5R6)pC(O)(CR5R6)q、(CR5R6)pC(O)NRc(CR5R6)q、(CR5R6)pC(O)O(CR5R6)q、(CR5R6)pOC(O)(CR5R6)q、(CR5R6)pOC(O)NRc(CR5R6)q、(CR5R6)pNRc(CR5R6)q、(CR5R6)pNRcC(O)NRd(CR5R6)q、(CR5R6)pS(O)(CR5R6)q、(CR5R6)pS(O)NRc(CR5R6)q、(CR5R6)pS(O)2(CR5R6)q或(CR5R6)pS(O)2NRc(CR5R6)q。
在一些实施方案中,Q是H、Cy1、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa1或Sa1,其中所述C1-6烷基、C2-6烯基或C2-6炔基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
在一些实施方案中,Q是C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1。
在一些实施方案中,Q是Cy1、C(O)Rb1、S(O)2Rb1或ORa1。
在一些实施方案中,Cy1是芳基或环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
在一些实施方案中,Cy1是杂芳基或杂环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
在一些实施方案中,R1是H。
在一些实施方案中,R2是H。
在一些实施方案中,R2是C1-6烷基。
在一些实施方案中,R2是甲基。
在一些实施方案中,R2是C1-6烷氧基。
在一些实施方案中,R2是甲氧基。
在一些实施方案中,其中R3是H。
在一些实施方案中,R4是H。
在一些实施方案中,R5是H。
在一些实施方案中,R6是H。
在一些实施方案中,该化合物具有以下式IIa、IIb、IIc、IId、IIe、IIf或IIg:
在一些实施方案中,X是H、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、SRa、C(O)Rb、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcC(O)NRcRd、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd或S(O)2Rb。
在一些实施方案中,X是NO2、ORa、C(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)ORa、NRcS(O)2Rb或S(O)2NRcRd。
在一些实施方案中,X是OCH3、OC6H5、NO2、NH2或N(CH2CH3)2。
在一些实施方案中,X是H。
在一些实施方案中,Y是C1-6烷基、C2-6烯基、C2-6炔基或C1-6卤代烷基,其中所述C1-6烷基、C2-6烯基或C2-6炔基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
在一些实施方案中,Y是H、Cy2、卤素、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1。
在一些实施方案中,Y是H。
在一些实施方案中,Cy2是芳基或环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1R、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NR01S(O)2R和S(O)2NRc1Rd1。
在一些实施方案中,Cy2是杂芳基或杂环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
在一些实施方案中,该化合物具有以下式IIIa、IIIb或IIIc:
在本说明书各处,按类别或范围公开本发明化合物的取代基。本发明包括此类基团成员和范围的各个以及每一个单个分组合(subcombination),这一意图很明确。例如,术语“C1-6烷基”具体意欲表示单独的甲基、乙基、C3烷基、C4烷基、C5烷基和C6烷基。
还应当理解,为了清楚起见描述于多个单独的实施方案上下文中的本发明的某些特点也可以组合的方式提供在单个的实施方案中。相反,为了简明起见描述于单个实施方案中的本发明的某些特点也可单独或以任何适合的分组合的方式提供。
在本说明书各处,描述了连接取代基。明显的意图是,各个连接取代基包括正向和反向形式的连接取代基。例如,-NR(CR′R″)n-包括-NR(CR′R″)n-和-(CR′R″)nNR-。当该结构清楚地需要连接基团时,对于该基团所列举的马库什变量理解为连接基。例如,如果该结构需要连接基团并且针对该变量的马库什基团定义列举了“烷基”或“芳基”,则应当理解,该“烷基”或“芳基”分别表示连接亚烷基基团或者亚芳基基团。
术语“n元”,其中n为整数,通常描述基团部分中成环原子的数目,其中成环原子的数目为n。例如,哌啶基是6元杂环烷基环的一个实例,而1,2,3,4-四氢-萘是10元环烷基的一个实例。
本文所用术语“烷基”指直链或支链饱和烃基。烷基的实例包括甲基(Me)、乙基(Et)、丙基(例如正丙基和异丙基)、丁基(例如正丁基、异丁基、仲丁基、叔丁基)、戊基(例如正戊基、异戊基、仲戊基、新戊基)等。烷基可含有1-约20个、2-约20个、1-约10个、1-约8个、1-约6个、1-约4个或1-约3个碳原子。连接烷基在本文称为“亚烷基”。
本文所用“烯基”指具有一个或多个碳-碳双键的烷基。烯基的实例包括乙烯基、丙烯基、环己烯基等。烯基可含有2-约20个、3-约15个、2-约10个、2-约8个、2-约6个、2-约4个或2-约3个碳原子。连接烯基在本文称为“亚烯基”。
本文所用“炔基”指具有一个或多个碳-碳三键的烷基。炔基的实例包括乙炔基、丙炔基等。炔基可含有2-约20个、3-约15个、2-约10个、2-约8个、2-约6个、2-约4个或2-约3个碳原子。连接炔基在本文称为“亚炔基”。
本文所用“卤代烷基”指具有一个或多个卤素取代基的烷基。卤代烷基的实例包括CF3、C2F5、CHF2、CCl3、CHCl2、C2Cl5等。
本文所用″卤代硫烷基″指具有一个或多个卤素取代基的硫基。卤代硫烷基的实例包括五卤代硫烷基例如SF5。
本文所用“芳基”指单环或多环(例如具有2个、3个或4个稠环)芳烃,例如苯基、萘基、蒽基、菲基、茚满基、茚基等。在某些实施方案中,芳基具有6-约20个碳原子、6-约15个碳原子、或6-约10个碳原子。连接芳基在本文称为“亚芳基”。
本文所用“环烷基”指非芳族环烃,包括环化的烷基、烯基和炔基。环烷基可包括单环或多环(例如具有2个、3个或4个稠环)基团以及螺环。环烷基的成环碳原子可任选被氧代基或硫代基(sulfido)取代。环烷基还包括亚环烷基。环烷基的实例包括环丙基、环丁基、环戊基、环己基、环庚基、环戊烯基、环己烯基、环己二烯基、环庚三烯基、降冰片烷基、降蒎烷基(norpinyl)、降蒈烷基(norcarnvl)、金刚烷基等。环烷基定义中还包括具有一个或多个与环烷基环稠合(即具有共用键)的芳环的部分,例如环戊烷、环戊烯、环己烷等的苯并或噻吩基衍生物。含有稠合芳环的环烷基可以通过任一成环原子包括该稠合芳环的成环原子连接。环烷基可含有3-约20个、3-约15个、3-约10个、3-约8个、3-约7个、3-约6个、4-约7个碳原子。连接环烷基在本文称为“亚环烷基”。
本文中使用的“杂芳基”是指具有至少一个杂原子环成员例如硫、氧或氮的芳族杂环。杂芳基包括单环和多环(例如具有2、3或4个稠合环)系统。杂芳基的实例包括但不限于吡啶基、嘧啶基、吡嗪基、哒嗪基、三嗪基、呋喃基、喹啉基、异喹啉基、噻吩基、咪唑基、噻唑基、吲哚基、吡咯基、噁唑基、苯并呋喃基、苯并噻吩基、苯并噻唑基、异噁唑基、吡唑基、三唑基、四唑基、吲唑基、1,2,4-噻二唑基、异噻唑基、苯并噻吩基、嘌呤基、咔唑基、苯并咪唑基、二氢吲哚基等。在一些实施方案中,杂芳基部分中的任何成环N可以被氧代基取代。在某些实施方案中,杂芳基具有1-约20个碳原子,在另一些其他的实施方案中,具有约3-约20个碳原子、约3-约10个碳原子、约3-约5个碳原子。在某些实施方案中,杂芳基含3-约14个、4-约14个、3-约7个或5-6个成环原子。在某些实施方案中,杂芳基具有1-约4个、1-约3个或1-2个杂原子。连接杂芳基在本文称为“亚杂芳基”。
本文所用“杂环烷基”指非芳族杂环,其具有一个或多个成环杂原子例如O、N或S原子。杂环烷基包括是单环和多环(例如具有2、3或4个稠合环)系统以及螺环。“杂环烷基”的实例包括吗啉代、硫代吗啉代、哌嗪基、四氢呋喃基、四氢噻吩基、2,3-二氢苯并呋喃基、1,3-苯并二氧杂环戊烯、苯并-1,4-二氧杂环己烷、哌啶基、吡咯烷基、异噁唑烷基、异噻唑烷基、吡唑烷基、噁唑烷基、噻唑烷基、咪唑烷基等。杂环烷基的成环碳原子和杂原子可任选被一个或多个氧代基或硫代基取代。杂环烷基的定义还包括具有一个或多个与非芳族杂环稠合(即具有共用键)的芳环部分,例如苯二甲酰亚氨基(phthalimidyl)、萘二甲酰亚氨基和杂环的苯并衍生物。该杂环烷基可通过成环碳原子或成环杂原子连接。含有稠合芳环的杂环烷基可通过任何成环原子包括该稠合芳环的成环原子连接。在某些实施方案中,杂环烷基具有1-约20个碳原子,在其它实施方案中,具有约3-约20个碳原子。在某些实施方案中,杂环烷基含有3-约14、4-约14、3-约7或5-6个成环原子。在某些实施方案中,杂环烷基具有1-约4、1-约3或1-2个杂原子。杂环烷基可含有1-约20个、1-约15个、1-约10个、1-约8个、1-约7个、1-约6或1-约5个碳原子。在某些实施方案中,杂环烷基含有0-3个双键或叁键。在某些实施方案中,杂环烷基含有0-2个双键或叁键。连接杂环烷基在本文称为“亚杂环烷基”。
本文所用“卤代”或“卤素”包括氟、氯、溴和碘。
本文所用″芳烷基″是指被芳基取代的烷基,″环烷基烷基″是指被环烷基取代的烷基。芳烷基的实例是苄基。
本文所用″杂芳烷基″是指被杂芳基取代的烷基,″杂环烷基烷基″是指被杂环烷基取代的烷基。
本文所用″氨基″是指NH2。
本文所用“烷氧基”指-O-烷基。烷氧基的实例包括甲氧基、乙氧基、丙氧基(例如正丙氧基和异丙氧基)、叔丁氧基等。
本文所用″卤代烷氧基″是指-O-(卤代烷基)基团。
本文所述化合物可以是不对称的(例如具有一个或多个立体中心)。除非另外指出,否则意欲包括所有立体异构体例如对映体和非对映体。可将含有不对称的取代的碳原子的本发明化合物分离为旋光体或外消旋形式。如何从旋光活性原料制备旋光体的方法已为本领域所知,例如通过拆分外消旋混合物,或通过立体选择性合成。本文所述化合物也可存在多种烯烃、C=N双键等的几何异构体,本发明涵盖所有这样的稳定的异构体。阐述了本发明化合物的顺式和反式几何异构体,并且可以将其分离为以异构体混合物或分离的异构体的形式。
可通过本领域已知多种方法中的任一种对化合物的外消旋混合物进行拆分。例示性方法包括用手性拆分酸(其为具有旋光活性、成盐的有机酸)进行分级重结晶。例如,用于分级重结晶法的合适的拆分试剂为旋光活性酸,例如D型和L型的酒石酸、二乙酰基酒石酸、二苯甲酰基酒石酸、扁桃酸、苹果酸、乳酸或各种旋光活性的樟脑磺酸(例如β-樟脑磺酸)。用于分级结晶法的其他合适的拆分试剂包括α-甲基苄胺(例如S和R形式或非对映异构体纯形式)、2-苯基甘氨醇、去甲麻黄碱、麻黄碱、N-甲基麻黄碱、环己基乙胺、1,2-二氨基环己烷等的立体异构纯形式。
也可通过在装有旋光活性拆分试剂(例如二硝基苯甲酰基苯甘氨酸)的柱上洗脱来进行拆分外消旋混合物。本领域技术人员可决定适宜的洗脱溶剂组成。
本发明化合物还包括互变体形式。互变体形式由单键与邻近的双键交换同时伴随质子迁移而产生。互变体形式包括质子移变互变体,其为具有同样实验式和总电荷的异构体的质子化状态。质子移变互变体的实例包括酮-烯醇对、酰胺-亚胺酸对、内酰胺-内酰亚胺对、酰胺-亚胺酸对、烯胺-亚胺对和环形形式,在环形形式中质子可占据杂环系统的2个或更多个位置,例如1H-和3H-咪唑、1H-、2H-和4H-1,2,4-三唑、1H-和2H-异吲哚以及1H-和2H-吡唑。互变体形式可处于平衡状态,或通过合适取代锁定于一种空间形式。
本发明化合物还包括水合物和溶剂化物以及无水和非溶剂化形式。
本发明化合物可还包括出现在中间体或最终化合物中的原子的所有同位素。同位素包括那些具有相同原子序数但不同质量数的原子。例如,氢的同位素包括氚和氘。
本文文使用的术语“化合物”表示包括所有立体异构体、几何异构体、互变异构体和描绘的结构的同位素。
所有化合物及其药学可接受的盐可以与其它物质例如水和溶剂一起被发现(例如水合物和溶剂合物),或者可以被分离。
在一些实施方案中,本发明化合物及其盐是基本分离的。所谓“基本分离的”是指将本发明化合物从其形成或检测的环境中至少部分或基本上分离出来。部分分离可包括例如富集了本发明化合物的组合物。基本上分离可包括含有至少约50%、至少约60%、至少约70%、至少约80%、至少约90%、至少约95%、至少约97%或至少约99%重量的本发明化合物或其盐的组合物。分离化合物及其盐的方法在本领域中是常规的。
本文所用短语“药学可接受的”是指在合理医疗判断范围内适于与人类和动物的组织接触,没有过多的毒性、刺激、变态反应或其他问题或并发症且具有相称的合理利益/风险比率的那些化合物、物质、组合物和/或剂型。
本文所用的表述″环境温度″和″室温″是本领域理解的,并且通常是指一个温度例如反应温度,其大约为在进行反应的房间内的温度,例如,温度为20℃至约30℃。
本发明还包括本文中所述化合物的药学可接受的盐。本文中使用的“药学可接受的盐”是指本公开化合物的衍生物,其中通过将母体化合物已有的酸或碱部分转化为其盐形式而被修饰。药学可接受的盐的实例包括但不限于碱性残基例如胺的无机或有机酸盐;酸性残基例如羧酸的碱或有机盐等。本发明药学可接受的盐包括例如由无毒的无机或有机酸形成的母体化合物的常规无毒的盐。可通过常规化学方法,由含有碱性或酸性部分的母体化合物合成本发明药学可接受的盐。通常,可通过使这些化合物的游离酸或碱形式与化学计量量的适宜碱或酸在水或有机溶剂或两者的混合物中反应,制备此类盐;通常,优选非水溶媒如乙醚、乙酸乙酯、乙醇、异丙醇或乙腈(ACN)。合适的盐的例举可在Remington′sPharmaceutical Sciences、17th ed.,Mack Publishing Company,Easton,Pa.,1985,p.1418以及Journal of Pharmaceutical Science,66,2(1977)中找到,各自全文引入本文作为参考。
合成
本发明化合物包括其盐可使用已知有机合成技术来制备,并且可根据任何多种可能的合成途径来合成。
制备本发明化合物的反应可以在适宜的溶剂中进行,该溶剂可以容易地由有机合成领域技术人员选择。合适的溶剂在反应发生的温度(例如介于溶剂冻结温度和溶剂沸腾温度之间的温度)下基本上不与原料(反应试剂)、中间体或产物反应。给定的反应可在一种溶剂或一种以上溶剂的混合物中进行。根据特定反应步骤,本领域技术人员可选择用于特定反应步骤的适宜溶剂。
本发明化合物的制备物可包括多种化学基团的保护和去保护。本领域技术人员可以很容易地决定是否需要保护和去保护并选择合适的保护基。例如,保护基团的化学法可参见T.W.Greene and P.G.M.Wuts,Protective Groups in Organic Synthesis,3rd Ed.,Wiley & Sons,Inc.,NewYork(1999),将其全文引用作为参考。
可以按照本领域已知的任何合适的方法监测反应。例如,可通过光谱手段例如核磁共振光谱法(例如1H或13C)、红外光谱法、分光光度法(例如UV-可见光)或质谱法,或通过色谱法例如高效液相色谱(HPLC)或薄层色谱法(TLC)监控产物形成。
制备本发明化合物的示例性合成方法提供于以下反应方案中。例如,本发明化合物可通过反应方案1所示一般合成操作法制备。使式1的吡唑-4-硼酸频哪醇酯与5-取代的-2,4-二氯嘧啶在Suzuki偶合条件下反应,得到式2的4-吡唑-取代的-2-氢嘧啶。后者用式NH2-A-D-E-G的苯胺进行酸催化氯取代,得到式3化合物。当是NH2-A-D-E-G胺类时,该取代反应可直接通过将2和该胺的混合物加热来实现,而不需要存在酸催化剂。
反应方案1
如反应方案2所示的,式1的吡唑-4-硼酸频哪醇酯可以通过商业可得的吡唑-4-硼酸频哪醇酯与L-(Y)n-Z在碱性条件下反应来制备,其中L表示离去基团例如卤素、三氟甲基磺酸根等。
式1的N-芳基吡唑(其中Y是芳香性的)可以通过使4-吡唑-4-硼酸频哪醇酯与适当取代的芳基硼酸在溶剂例如二氯甲烷(DCM)中、在乙酸酮和吡啶存在下进行反应来制备。或者,式1的N-芳基吡唑(其中Y是芳香性的)可以通过使吡唑-4-硼酸频哪醇酯与适当取代的芳基氟在溶剂例如DMF中、在高温下进行反应来制备。
式1的取代的吡唑化合物(其中Z是例如腈或酯的基团,并且Y是至少两个碳)亦可以通过使吡唑-4-硼酸频哪醇酯与适当取代的丙烯酸酯、丙烯腈或其它Michael-类受体在溶剂例如乙腈(ACN)中、在碱例如1,8-二氮杂双环[5.4.0]十一碳-7-烯(DBU)或三乙胺(TEA)存在下、在低于溶剂沸点的温度下进行反应来制备。
反应方案2
应当指出,在本文描述的所有反应方案中,如果在取代基例如Y、Z、R、R1、R5等上存在官能团,如果适合或者需要,则可进行其它修饰。例如CN基团可以水解得到酰胺基;羧酸可以转化成酯,其接着可以还原为醇,其接着可以进一步被修饰。在另一实例中,OH基团可以转化为更好的离去基团例如甲酸磺酯,其接着适合于亲核取代,例如通过CN。此外OH基团可以与酚或者杂芳基醇经历Mitsunobu反应条件,得到芳基或杂芳基醚化合物。本领域技术人员理解其它修饰。
还应当指出,以上描述的反应顺序可以被修饰成适用于不同的目标分子。例如,4-吡唑硼酸频哪醇酯首先可以与取代的-1,4-二氯嘧啶反应,得到Suzuki产物。然后该Suzuki产物的吡唑NH基团可以如反应方案2所述进一步被官能化。
方法
本发明化合物可调节一种或多种不同激酶例如Janus激酶(JAK)的活性。术语“调节”是指增加或减少激酶活性的能力。因此,本发明化合物可用于通过使激酶与任何一种或多种本文中所述化合物或组合物接触来调节激酶例如JAK激酶的方法。在某些实施方案中,本发明化合物可起一种或多种激酶的抑制剂的作用。在另一些其他的实施方案中,通过施用调节量的本发明化合物,本发明化合物可用于调节需要调节受体的个体中激酶的活性。
假定癌细胞生长和存活可受多重发信号途径影响,本发明可用于治疗特征为耐药激酶突变体的疾病状态。此外,不同的激酶抑制剂(在它们所调节的激酶中表现出不同性能)可以组合使用。此方法在通过靶向多重发信号途径的治疗疾病状态中可能证明高度有效,减小了细胞中出现耐药的可能性,并且减小了疾病治疗的毒性。
本发明化合物结合和/或调节的激酶包括受体和非受体Ser/Thr激酶,例如TGF-βR、PKA、PKG、PKC、CaM-激酶、磷酸化酶激酶、MEKK、ERK、MAPK、Akt和mTOR;受体Tyr激酶例如EGFR、HER2、HER3、HER4、INS-R、IGF-1R、IR-R、PDGFαR、PDGFβR、CSFIR、KIT、FLK-II、KDR/FLK-1、FLK-4、flt-1、FGFR1、FGFR2、FGFR3、FGFR4、c-Met、Ron、Sea、TRKA、TRKB、TRKC、FLT3、VEGFR/Flt2、Flt4、EphA1、EphA2、EphA3、EphB2、EphB4、Tie2;和非受体Tyr激酶例如Src、Fyn、Lck、Fgr、Btk、Fak、SYK、FRK、JAK或ABL。某些JAK包括JAK1、JAK2、JAK3或TYK2。在一些实施方案中,该JAK是JAK1或JAK2。在一些实施方案中,该JAK是JAK2。在一些实施方案中,该JAK是突变体。在一些实施方案中,该突变体JAK携带V617F、F537-K539delinsL、H538QK539L、K539L或在JAK2的突变中的N542-E543del。在一些实施方案中,该非受体Tyr激酶是ABL例如ABL1或ARG(ABL2)。在一些实施方案中,该ABL是突变体。在一些实施方案中,该突变体ABL携带T315I突变。在一些实施方案中,该突变体ABL携带T315D、F359D、D276G、E255K、M351T、G250E、H396R、Q252H、Y253H、E355G、F317L、G250E、Y253F、F359V、Q252R、L387M、M244V、M343T/F382L或V379I突变。在一些实施方案中,JAK和ABL激酶二者活性被调节。在一些实施方案中,该激酶产生于多重基因的融合,例如该融合在下列的两种基因之间融合:BCR/ABL1、TEL/ABL1、NUP214/ABL1、EMS/ABL1、SFQ/ABL1、BCR/ARG、TEL/ARG、TEL/PDGFβR、HIPl/PDGFβR、RAB5/PDGFβR、H4/PDGFβR、Myomegalm/PDGFβR、CEV14/PDGFβR、NINl/PDGFβR、HCMOGT/PDGFβR、KIAA1509/PDGFβR、TP53BPl/PDGFβR、FIIPlLl/PDGFαR、BCR/PDGFαR、BCR/JAK2、TEL/JAK2、PCM1/JAK2、TEL/SYK、TEL/TRKC、ZNF198/FGFR1、FOP/FGFR1、CEP110/FGFR1、HERVK/FGFR1、BCR/FGFR1、FGFR10P2/FGFR1、TIF1/FGFR1、TEL/FGFR3、TEL/FLT3、TEL/FRK、NPM/ALK、TPM3/ALK、TFG/ALK、ATIC/ALK、CLTC/ALK、MSN/ALK、TPM4/ALK、ALO17/ALK、RANBP2/ALK、MYH9/ALK、CARS/ALK。
本发明化合物结合和/或调节的激酶包括JAK家族的任何成员。在一些实施方案中,该JAK是JAK1、JAK2、JAK3或TYK2。在一些实施方案中,该JAK是JAK1或JAK2。在一些实施方案中,该JAK是JAK2。在一些实施方案中,该JAK是JAK3。
在一些实施方案中,一种以上的本发明化合物可用于抑制一种激酶的活性(例如,JAK2)。
在一些实施方案中,一种以上的本发明化合物可用于抑制一种以上激酶(例如,JAK2),例如至少两种激酶(例如,ABL1和JAK2)。
在一些实施方案中,该化合物可用于与另一激酶抑制剂组合以抑制一种激酶的活性(例如,JAK2)。
在一些实施方案中,该化合物可用于与另一激酶抑制剂组合以抑制一种以上激酶的活性(例如,JAK2),例如至少两种激酶。
本发明化合物可以是选择性的。″选择性″表示与至少一种其它激酶相比,该化合物分别以更大的亲和力或效能结合或抑制。在一些实施方案中,该本发明化合物是JAK1或JAK2的优于JAK3和/或TYK2的选择性抑制剂。在一些实施方案中,该本发明化合物JAK2(例如,优于JAK1、JAK3和TYK2)的选择性抑制剂。不希望受理论的束缚,由于JAK3的抑制剂可能导致免疫抑制作用,对JAK2优于对JAK3具有选择性并且其可用于治疗癌症(例如多发性骨髓瘤)的化合物可其它另外的优点,具有较少的免疫抑制副作用。选择性可以为至少约5-倍、至少约10-倍、至少约20-倍、至少约50-倍、至少约100-倍、至少约200-倍、至少约500-倍或至少约1000-倍。选择性可以通过本领域常规方法测定。在一些实施方案中,选择性可以在各种酶的Km ATP浓度下测试。在一些实施方案中,本发明化合物对JAK2优于对JAK3的选择性可以在细胞ATP浓度下测定。在一些实施方案中,本发明化合物的选择性可通过与特定JAK激酶活性相关的细胞分析法测定。
本发明另一方面涉及在个体(例如,患者)中治疗激酶相关的疾病或障碍的方法,其方式是给需要有此治疗的该个体施用治疗有效量或者剂量的本发明化合物或其药物组合物。激酶相关的疾病可包括任何疾病、障碍或病症,其直接或间接与激酶的表达或活化相关联,包括过表达和/或异常活性水平。异常活性水平可通过使正常、健康组织或细胞与患病细胞中的活性水平相比较来测定。激酶相关的疾病还可包括任何疾病、障碍或病症,其可通过调节激酶活性而被预防、改善或治愈。在一些实施方案中,该疾病的特征是JAK、ABL或此二者的异常活性。在一些实施方案中,该疾病的特征是突变体JAK2,例如其中该突变位于假-激酶区域。在一些实施方案中,该疾病的特征是突变体ABL,例如其中该突变位于激酶区域。
激酶相关的疾病的实例包括包括涉及免疫系统的疾病,例如,器官移植排斥(例如,同种异体移植物排斥和移植物抗宿主病)。
激酶相关的疾病的其它实例包括自身免疫性疾病,例如皮肤障碍、多发性硬化、类风湿性关节炎、幼年型关节炎、I型糖尿病、狼疮、银屑病、炎性肠病、溃疡性结肠炎、克罗恩病、重症肌无力、免疫球蛋白肾病、自身免疫性甲状腺障碍等。在一些实施方案中,该自身免疫性疾病是自身免疫大疱性皮肤障碍例如寻常天疱疮(PV)或大疱性类天疱疮(BP)。
激酶相关的疾病的其它实例包括过敏性病症例如哮喘、食物过敏、特应性皮炎和鼻炎。激酶相关的疾病的其它实例包括病毒例如EB病毒(EBV)、乙型肝炎、丙型肝炎、HIV、HTLV1、水痘-带状疱疹病毒(VZV)和人乳头状瘤病毒(HPV)。
激酶相关的疾病或病症的其它实例包括皮肤障碍例如银屑病(例如、寻常型银屑病)、特应性皮炎、皮疹、皮肤刺激、皮肤致敏(例如,接触性皮炎或过敏性接触性皮炎)。例如,某此物质包括某些药物在局部施用时会引起皮肤致敏。在一些实施方案中,共同施用或顺序施用至少一种本发明激酶抑制剂以及引起不需要的致敏的药剂可有助于治疗此种不需要的致敏或皮炎。在一些实施方案中,该皮肤障碍可通过局部施用至少一种本发明激酶抑制剂来治疗。
在进一步的实施方案中,该激酶相关的疾病是包括以下特征的癌症:实体瘤(例如,前列腺癌、肾癌、肝癌、胰腺癌、胃癌、乳癌、肺癌、头颈癌、甲状腺癌、成胶质细胞瘤、卡波西肉瘤、卡斯尔曼氏病、黑素瘤等)、血液性癌症(例如,淋巴瘤、白血病例如急性成淋巴细胞性白血病或多发性骨髓瘤)和皮肤癌症例如表皮T-细胞淋巴瘤(CTCL)和表皮B-细胞淋巴瘤。表皮T-细胞淋巴瘤的实例包括塞扎里综合征和蕈样肉芽肿病。在进一步的实施方案中,该激酶相关的疾病是子宫内膜癌和子宫颈癌。
激酶相关的疾病可进一步包括特征为存在导致由JAK激酶发信号增加的突变(遗传的或后天的)的那些。这些包括具有突变的细胞因子和生长因子受体(例如,突变体EpoR或MPL)的疾病。此外,可导致JAK通路活化净增加的突变下游JAK(例如,SOCS或PIAS蛋白)亦应当认为是与激酶相关的。
激酶相关的疾病可进一步包括特征为表达突变体激酶的那些。这些包括特征为表达突变体JAK2的疾病,例如在假-激酶区域中(例如,JAK2V617F)或接近于假-激酶区域(外显子12)具有至少一种突变体的那些(NEJM,356:459-468;2007)),以及特征为表达突变体ABL1(例如,BCR-ABL或ABL1T315I)的疾病。
激酶相关的疾病可进一步包括骨髓增生障碍(MPDs)例如真性红细胞增多(PV)、特发性血小板增多症(ET)、伴有骨髓纤维变性的髓样化生(MMM)、慢性髓细胞性白血病(CML)、慢性骨髓单核细胞性白血病(CMML)、嗜酸细胞过多综合征(HES)、系统性肥大细胞病(SMCD)等。
其它激酶相关的疾病包括炎症和炎性疾病。炎性疾病的实例包括眼的炎性疾病(例如,虹膜炎、葡萄膜炎、巩膜炎、结膜炎或相关疾病)、呼吸道的炎性疾病(例如,上呼吸道包括鼻和窦例如鼻炎或窦炎,或者下呼吸道包括支气管炎、慢性阻塞性肺病等)、炎性肌病例如心肌炎、及其它炎性疾病。
本文所述的激酶抑制剂可进一步用于治疗局部缺血再灌注损伤或者与炎性局部缺血性事件有关的疾病或病症例如中风或心脏停搏。本文描述的该激酶抑制剂可进一步用于治疗食欲缺乏、恶病质或疲劳例如起因于癌症或与癌症有关的的那些。本文所述的激酶抑制剂可进一步用于治疗再狭窄、硬皮病(sclerodermitis)或纤维化。纤维化的实例是肾纤维形成和肺纤维化。本文所述的激酶抑制剂可进一步用于治疗与缺氧或astrogliosis有关的病症,例如,糖尿病性视网膜病、癌症或神经变性。参见,例如,Dudley,A.C.et al.Biochem.J.2005,390(Pt 2):427-36以及Sriram,K.et al.J.Biol.Chem.2004,279(19):19936-47.Epub 2004 Mar 2。
进一步提供了治疗患者自身免疫性疾病、皮肤障碍、病毒病、癌症或骨髓增生障碍的方法,其方式是向该患者施用治疗有效量的本发明化合物(例如,一种以上化合物)。在一些实施方案中,本发明化合物可以与其它激酶抑制剂组合施用。
进一步提供了通过施用本发明化合物治疗痛风、全身炎症反应综合征(SIRS)和败血症性休克的方法。本发明还提供了通过施用本发明化合物治疗由于良性前列腺肥大或良性前列腺增生而前列腺大小增加的方法。
本文所用术语“接触”是指使体外系统或体内系统中的指定部分集合在一起。例如,使激酶与本发明化合物“接触”包括施用具有激酶的个体或患者(例如人)本发明化合物,以及例如将本发明化合物加入含有细胞制备物或纯化制备物(含有该激酶)的样品中。
本文中使用的术语“个体”或“患者”可互换使用,指包括哺乳动物在内的任何动物,优选小鼠、大鼠、其它啮齿类动物、兔、狗、猫、猪、牛、羊、马或灵长类动物,最优选人。本文所用术语″幼年个体″是指人类患者,其中疾病状态或障碍的发生是在18岁以前出现的。
本文中使用的短语“治疗有效量”是指研究人员、兽医、医师或其它临床人员正在寻找的,引起组织、系统、动物、个体或人生物学或医学反应的活性化合物或药物的量。
本文所用术语“治疗(treating)”或“治疗(treatment)”是指1)预防疾病,例如在易患疾病、病症或障碍但是还没有经历或表现疾病的病理学或症状学的个体中预防疾病、病症或障碍;2)抑制疾病,例如,在经历或表现疾病、病症或障碍的病理学或症状学的个体中抑制疾病、病症或障碍(即阻止病理学和/或症状学的进一步发展),或者3)改善疾病,例如,在经历或表现疾病、病症或障碍的病理学或症状学的个体中改善疾病、病症或障碍(即使病理学和/或症状学逆转)。
组合治疗
一种或多种另外的药剂,例如,化剂治疗剂、抗炎剂、甾族化合物、免疫抑制剂,以及BCR-ABL1、Flt-3、EGFR、HER2、c-MET、VEGFR、PDGFR、cKit、IGF-1R、RAF和FAK激酶抑制剂,例如,WO 2006/056399中所述的那些,或者可以与本发明化合物组合使用以治疗激酶相关的疾病、障碍或病症的其它药物。该一种或多种另外的药剂可同时或者顺序施用于患者。治疗性抗体可以与本发明化合物组合使用以治疗激酶相关的疾病、障碍或病症。
用于组合治疗的示例性抗体包括但不限于曲妥单抗(例如,抗-HER2)、Ranibizumab(例如,抗-VEGF-A)、贝伐单抗(商品名Avastin,例如抗-VEGF、Panitumumab(例如,抗-EGFR)、西妥昔单抗(例如,抗-EGFR)以及针对c-MET的抗体。
示例性的化剂治疗剂包括蛋白体抑制剂(例如,bortezomib)、沙利度胺、revlimid,以及DNA损伤剂例如美法仑、多柔比星、环磷酰胺、长春新碱、依托泊苷、卡莫司汀等。
以下药剂的一种或多种可用于与本发明化合物组合并以非限制性的列举提供:细胞生长抑制剂、顺铂、多柔比星、多西紫杉醇、紫杉醇、依托泊苷、伊立替康、camptostar、托泊替康、紫杉醇、多西紫杉醇、epothilones、他莫昔芬、5-氟尿嘧啶、甲氨蝶呤、替莫唑胺、环磷酰胺、SCH 66336、Rl 15777、L778,123、BMS 214662、Iressa、Tarceva、针对EGFR的抗体、GleevecTM、intron、ara-C、阿霉素、环磷酰胺、吉西他滨、乌拉莫司汀、氮芥、异环磷酰胺、美法仑、苯丁酸氮芥、哌泊溴烷、曲他胺、Triethylenethiophosphoramine、白消安、卡莫司汀、洛莫司汀、链佐星、达卡巴嗪、氟脲嘧啶脱氧核苷、阿糖胞苷、6-巯嘌呤、6-硫鸟嘌呤、磷酸氟达拉滨、奥沙利铂、leucovirin、ELOXATIN.TM.、Pentostatine、长春碱、长春新碱、长春地辛、博来霉素、放线菌素D、柔红霉素、多柔比星、表柔比星、伊达比星、光神霉素、脱氧柯福霉素、丝裂霉素C、L-门冬酰胺酶、替尼泊苷17.α.-炔雌醇、己烯雌酚、睾酮、泼尼松、氟甲睾酮、丙酸甲雄烷酮、睾内酯、醋酸甲地孕酮、甲泼尼龙、甲睾酮、泼尼松龙、曲安西龙、氯烯雌醚、羟孕酮、氨鲁米特、雌莫司汀、醋酸甲羟孕酮、亮丙瑞林、氟他胺、托瑞米芬、戈舍瑞林、顺铂、卡铂、羟基脲、安吖啶、丙卡巴肼、米托坦、米托蒽醌、左旋咪唑、诺维本、阿那曲唑、来曲唑、卡培他滨、雷洛昔芬、屈洛昔芬、六甲蜜胺、Avastin、赫赛汀、Bexxar、Velcade、Zevalin、三氧二砷、希罗达、长春瑞滨、卟菲尔钠、Erbitux、脂质体(Liposomal)、塞替派、六甲蜜胺、美法仑、曲妥单抗、Lerozole、Fulvestrant、Exemestane、Fulvestrant、异环磷酰胺、利妥昔单抗、C225、Campath、Clofarabine、克拉屈滨、aphidicolon、rituxan、sunitinib、dasatinib、tezacitabine、Sm11、氟达拉滨、喷司他丁、triapine、didox、trimidox、amidox、3-AP和MDL-101,731。
示例性的化剂治疗剂包括蛋白体抑制剂(例如,bortezomib)、沙利度胺、revlimid,以及DNA损伤剂例如美法仑、多柔比星、环磷酰胺、长春新碱、依托泊苷、卡莫司汀等。
示例性的甾族化合物包括皮质激素例如地塞米松或泼尼松。
示例性的Bcr-ABL1抑制剂包括美国专利No.5,521,184、WO04/005281、EP2005/009967、EP2005/010408和U.S.序列号No.60/578,491中公开的类和种的化合物及其药学可接受的盐。
示例性的适宜的Flt-3抑制剂包括WO 03/037347、WO 03/099771和WO 04/046120中公开的化合物及其药学可接受的盐。
示例性的适宜的RAF抑制剂包括WO 00/09495和WO 05/028444中公开的化合物及其药学可接受的盐。
示例性的适宜的FAK抑制剂包括WO 04/080980、WO 04/056786、WO 03/024967、WO 01/064655、WO 00/053595和WO 01/014402中公开的化合物及其药学可接受的盐。
在一些实施方案中,一种或多种本发明激酶抑制剂可以在癌症的治疗中与化剂治疗剂组合使用,并且与单独使用化剂治疗剂的应答相比可改善治疗应答,而没有加重其毒性作用。用于治疗癌症例如多发性骨髓瘤的另外的药剂的实例可包括但不限于美法仑、美法仑加泼尼松[MP]、多柔比星、地塞米松和Velcade(bortezomib)。用于治疗多发性骨髓瘤的其它另外的药剂包括Bcr-ABL1、Flt-3、RAF和FAK激酶抑制剂。增效作用或协同作用是本发明激酶抑制剂与另外的药剂组合的希望结果。此外,癌细胞(例如,多发性骨髓瘤、肺癌等)对治疗剂(例如,地塞米松、美法仑、erlotinib/Tarceva、伊马替尼、dasatinib等)的抗药性可以在用本发明激酶抑制剂治疗时逆转。这些药剂可以在单个或连续剂型中与本发明化合物组合,或者这些药剂可以作为分离的剂型同时或顺序施用。
在一些实施方案中,皮质激素例如地塞米松与至少一种激酶抑制剂组合施用于患者,其中该地塞米松或其它治疗剂与连续施用相反,其是间歇施用。
在一些进一步的实施方案中,一种或多种本发明激酶抑制剂与其它治疗剂的组合可以在骨髓移植或干细胞移植之前、期间、和/或之后施用于患者。
药物制剂和剂型
当用作药物时,可按药用组合物的形式施用本发明化合物。可按照药剂领域中熟知的方法制备这些组合物,且可通过多种途径给药,这些途径取决于需要局部还是全身治疗以及欲治疗的区域。可通过局部(包括经皮、经表皮、眼,以及给包括鼻内、阴道和直肠递药在内的粘膜给药)、肺(例如通过吸入或吹入粉末或气雾剂,包括通过喷雾器;气管内、鼻内)、口腔或肠胃外给药。肠胃外给药包括静脉内、动脉内、皮下、腹膜内或肌内注射或输注;或颅内例如鞘内或心室内给药。肠胃外给药可以是单次大剂量,或可通过例如连续输注泵给药。局部给药的药用组合物和制剂式可包括透皮贴剂、软膏剂、洗剂、霜剂、凝胶剂、滴剂、栓剂、喷雾剂、液体和粉末。可能必须使用或需要常规药用载体、水、粉末或油基质、增稠剂等。还可以使用包裹的橡皮套、手套等。
本发明还包括药用组合物,该组合物含有用作活性成分的一种或多种以上本发明化合物和与其混合的一种或多种可药用载体(赋形剂)。在制备本发明组合物中,通常使活性成分与赋型剂混合,通过赋型剂稀释,或装入例如胶囊、小药囊、纸或其它容器形式的此类载体中。当赋型剂用作稀释剂时,其可以是固体、半固体或液体物质,其作用是作为活性成分的赋型剂、载体或溶媒。因此,所述组合物可以为片剂、丸剂、散剂、锭剂、小药囊、扁囊剂、酏剂、混悬剂、乳剂、溶液剂、糖浆、气雾剂(固体或在液体溶媒中)、含例如高达10%重量活性化合物的软膏剂、软和硬明胶胶囊剂、栓剂、无菌注射液和无菌包装粉末。
在制备制剂中,可在与其它成分混合前,将活性化合物粉碎,以提供适宜粒径的粉末。如果活性化合物基本上不溶,可将它粉碎为粒径小于200目的粉末。如果活性化合物基本上溶于水,可通过粉碎调节粒径例如约40目,以提供在制剂中基本上均匀分布的粉末。
本发明化合物可以使用已知粉碎操作法例如湿式粉碎法粉碎,以获得适宜片剂形成和其它制剂类型的粒度。本发明化合物的细微分散的(纳米粒)制剂可以通过本领域已知的操作法制备,例如参见InternationalPatent Pub.No.WO 2002/000196。
合适的赋型剂的某些实例包括乳糖、葡萄糖、蔗糖、山梨醇、甘露醇、淀粉、阿拉伯胶、磷酸钙、藻酸盐、黄蓍胶、明胶、硅酸钙、微晶纤维素、聚乙烯吡咯烷酮、纤维素、水、糖浆和甲基纤维素。制剂还可包含:润滑剂例如滑石粉、硬脂酸镁和矿物油;湿润剂;乳化和悬浮剂;防腐剂例如苯甲酸甲酯和尼伯金丙酯;甜味剂;和矫味剂。可用本领域中已知方法,配制给予患者后可提供快速、缓慢和延迟释放活性成分的本发明组合物。
可按单位剂型配制组合物,每一剂量含约5-约1000mg(1g),更通常约100-约500mg活性成分。术语“单位剂型”是指作为适用于人患者和其它哺乳动物的单元剂量的物理上分离的单位,每一单位含有经计算可产生所需疗效的预定量的活性物质和与其混合的适宜的药用赋型剂。
活性化合物可在很大剂量范围中有效,通常按药物有效量给药。但应理解,实际给予化合物的量通常由医师根据相关情况决定,包括所治疗的病症、选择的给药途径、给予的具体化合物、个体患者的年龄、重量和反应、患者症状的严重性等。
对于制备固体组合物例如片剂,使主要的活性成分与药用赋型剂混合,形成含有本发明化合物的均匀混合物的预制剂固体组合物。当这些预制剂组合物被称为均匀时,活性成分通常均匀地分散在整个组合物中,便于可容易地将该组合物细分为同等有效的单位剂型,例如片剂、丸剂和胶囊剂。然后将该固体预制剂细分为含例如0.1-约1000mg的本发明活性成分的上述类型的单位剂型。
可将本发明的片剂或丸剂包衣或配混,以便得到提供长效作用优点的剂型。例如,片剂或丸剂可含有内层剂量和外层剂量组分,后者以被膜的形式附在前者的表面。这两种组分可被肠溶层隔离,肠溶层用于阻止胃中崩解和让内层组分完整无缺地通过并进入十二指肠,或延迟内层组分释放。多种物质可用作此类肠溶层或包衣剂,此类物质包括多种高分子酸和高分子酸与此类物质例如虫胶、鲸蜡醇和醋酸纤维素的混合物。
其中可掺入本发明化合物和组合物,用于口服或注射给药的液体形式包括水溶液、适当矫味的糖浆、水或油混悬液和用食用油例如棉子油、芝麻油、椰子油或花生油矫味的乳液;酏剂和类似的药用载体。
用于吸入或吹入的组合物包括在可药用水和有机溶剂或其混合物中的溶液和混悬液及粉末。该液体和固体组合物可含有上述适宜的可药用赋型剂。在某些实施方案中,通过可产生全身或局部作用的口服或鼻呼吸途径给予所述组合物。可通过使用惰性气体将组合物雾化。可直接从喷雾装置或可与面罩篷(tent)连接的喷雾装置或间歇式正压呼吸机吸入雾化液。可口服或由按适当方式递送制剂的装置通过鼻腔给予溶液、混悬液或粉末组合物。
给予患者的化合物或组合物的量可不同,这取决于给药的对象、给药的目的例如预防或治疗、患者的状态、给药的方式等。在治疗应用中,可给予已患有疾病的患者足以治愈或至少部分抑制该疾病的症状及其并发症的量的组合物。有效剂量将取决于所治疗的疾病状况,和主治医师根据例如该疾病的严重性、患者的年龄、重量和一般状态等因素所作的判断。
给予患者的组合物可以是上述药用组合物形式。可通过常规消毒技术将这些组合物灭菌或无菌过滤。可将水溶液包装在用于原样使用的包装容器中,或将它冻干,临用前,使该冻干制剂与无菌水载体结合。所述化合物制剂的pH通常为3-11,更优选5-9,最优选7-8。应理解,使用某些前述赋型剂、载体或稳定剂可导致形成药用盐。
本发明化合物的治疗剂量可根据例如进行治疗的具体用法、给予化合物的方式、患者的健康和病症、处方医师判断而定。本发明化合物在药用组合物中的比例或浓度可依多种因素而异,包括剂量、化学特性(例如疏水性)和给药途径。例如,可通过含约0.1-约10%w/v化合物的用于肠胃外给药的生理缓冲水溶液给予本发明化合物。某些典型的剂量范围为约1μg/kg-约1g/kg体重/日。在某些实施方案中,剂量范围为约0.01mg/kg-约100mg/kg体重/日。该剂量很可能取决于此类变量,如具体患者的疾病或病症的种类和进展的程度、一般健康状况、所选择的化合物的相对生物效力、赋型剂的组成及其给药途径。可由通过体外或动物模型试验系统得到的剂量-反应曲线推断有效剂量。
本发明组合物还可包括一种或多种其它药剂,例如化学治疗剂、甾族化合物、抗炎化合物、免疫抑制剂、上文所列的实例。
将通过具体实施例更详细地说明本发明。为了说明目的,提供以下实施例,但不应视为以任何方式限制本发明。本领域技术人员会容易意识到,可改变或改进多个非关键性参数,但得到的结果基本相同。根据本文中提供的至少一种分析法,发现本发明实施例化合物是JAK抑制剂。
实施例
总的来说,示例性化合物是在Waters Xbridge反相HPLC(RP-HPLC)柱(C18,19x100mm,5μM)上纯化的,注射体积2mL,流速30mL/min,洗脱使用梯度乙腈/含0.15%NH4OH的水。在特别说明是酸性制备型HPLC条件下,将该产物用梯度乙腈/含0.01%三氟乙酸(TFA)的水洗脱。
分析型LCMS是在Waters SunFire RP-HPLC柱(C18,2.1x50mm,5μM)上进行的,注射体积2μL,流速3mL/min,洗脱使用在3分钟内2至80%B的梯度(A=含0.025%TFA的水;B=乙腈)。
(3-桥)-8-氮杂双环[3.2.1]辛烷-3-醇盐酸盐和2-氧杂-6-氮杂三环[3.3.1.13,7]癸烷盐酸盐是根据WO 2007/089683所述操作法制备的。4,4-二甲基-1-氧杂-7-氮杂螺[4.4]壬烷TFA盐是根据WO 2005/110992所述操作法制备的。
实施例1:3-(4-(2-(4-(1H-咪唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈
步骤1:4-(2-氧代乙基)哌啶-1-甲酸叔丁酯
在-78℃下将二甲亚砜(7.43mL,0.105mol)加至在二氯甲烷(244.2mL)中的草酰氯(5.53mL,0.0654mol)中。10min之后,加入在二氯甲烷(488.4mL)中的4-(2-羟乙基)哌啶-1-甲酸叔丁酯(10.0g,0.0436mol),再将所得混合物在-78℃下搅拌30min。然后加入三乙胺(30.4mL,0.218mol),再将该混合物在使温度逐渐地温热到室温的温度下搅拌5h。用水猝灭后,使该混合物用二氯甲烷猝取。合并有机层,用盐水洗涤,用MgSO4干燥,蒸发至干燥,再直接用于下一步骤。LCMS(M+Na)250.0。
步骤2:4-(3-氰基丙-2-烯-1-基)哌啶-1-甲酸叔丁酯
在0℃下,向1.0M的叔丁醇钾在四氢呋喃中的溶液(45.8mL)中滴加氰基甲基磷酸二乙酯(7.77mL,0.0480mol)在四氢呋喃(58.39mL)中的溶液。使反应温热至室温,然后再次冷却至0℃。向该反应混合物中加入4-(2-氧代乙基)哌啶-1-甲酸叔丁酯(9.91g,0.0436mol)在四氢呋喃(11.7mL)中的溶液。使反应温热至室温,并在室温下搅拌过夜。用水猝灭后,使该混合物用EtOAc猝取。将合并的有机层用盐水洗涤,干燥,再蒸发至干燥。将该粗制混合物在硅胶上纯化,洗脱使用0至40%EtOAc/己烷,得到需要的产物(8.22g,75%,2个步骤)。LCMS(M+Na)273.0。
步骤3:4-(3-氰基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙基)哌啶-1-甲酸叔丁酯
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(1.28g,6.60mmol)在乙腈(33.0mL)中的溶液中加入4-(3-氰基丙-2-烯-1-基)哌啶-1-甲酸叔丁酯(3.30g,13.2mmol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(0.987mL,6.60mmol)。使所得混合物在室温下搅拌过夜。将反应混合物蒸发至干燥之后,将残余物在硅胶上纯化,洗脱使用0-50%EtOAc/己烷,得到需要的产物(2.35g,80%)。LCMS(M+H)445.2
步骤4:4-(2-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-氰基丙基)哌啶-1-甲酸叔丁酯
将2,4-二氯嘧啶(0.26g,1.7mmol),4-3-氰基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙基哌啶-1-甲酸叔丁酯(0.76g,1.7mmol)、四(三苯膦)钯(0.1g,0.1mmol)和磷酸钾(1.1g,5.2mmol)在1,4-二噁烷(5mL)和水(0.5mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,再蒸发至干燥。将残余物在硅胶上纯化,洗脱使用0至100%EtOAc/己烷,得到需要的产物(277mg,37%)。LCMS(M+Na)453.0。
步骤5:3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈
向4-2-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-氰基丙基哌啶-1-甲酸叔丁酯(0.277g,0.643mmol)在2mL的二噁烷中的混合物中加入4mL的4M HCl/二噁烷。使反应在室温下搅拌30min,然后蒸发至干燥。向在二氯甲烷(5.0mL)中的所得粗制HCl盐中加入三乙胺(0.269mL,1.93mmol),接着加入2,4-二氟苯甲酰氯(0.0948mL,0.771mmol)。使该混合物在室温下搅拌30min,用饱和碳酸氢钠洗涤,干燥,再蒸发至干燥。获得的粗产物直接用于下一步骤(300mg,99%)。LCMS(M+H)471.0。
步骤6:3-(4-(2-(4-(1H-咪唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈
使3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈(30mg,0.06mmol)、4-(1H-咪唑-1-基)苯胺(15.2mg,0.0956mmol)和对甲苯磺酸(9.3mg,0.054mmol)在干燥的1,4-二噁烷(0.5mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(25mg,71%)。LCMS(M+H)594.1。
实施例2:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-(哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,在步骤6中将4-(1H-咪唑-1-基)苯胺替换为1-(4-氨基-苯基)-哌嗪-4-甲酸叔丁酯。LCMS(M+H)611.2。
实施例3:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-甲氧基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用对甲氧基苯胺代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)558.2。
实施例4:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用苯胺代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)528.1。
实施例5:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用4-(4-吗啉基)-苯胺代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)613.3。
实施例6:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用4-(1H-吡唑-1-基)苯胺代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)594.2。
实施例7:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用3-(5-噁唑基)-苯胺代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)595.2。
实施例8:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(1-甲基-1H-吡唑-3-基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-胺代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)532.1。
实施例11:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-苯氧基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用对苯氧基苯胺代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)620.2。
实施例12:2-(4-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(异噁唑-5-羰基)哌啶-4-基)乙腈
步骤1:4-(氰基亚甲基)哌啶-1-甲酸叔丁酯
向1.0M的叔丁醇钾在四氢呋喃(26.3mL)中的溶液在0℃下滴加氰基甲基磷酸二乙酯(4.47mL,0.0276mol)在四氢呋喃(33.61mL)中的溶液。使反应温热至室温,然后再次冷却至0℃。向该反应混合物中加入4-氧代-1-哌啶甲酸叔丁酯(5.0g,0.025mol)在四氢呋喃(6.72mL)中的溶液。使反应温热至室温,并在室温下搅拌过夜。用水猝灭后,使该混合物用EtOAc猝取。将合并的有机层用盐水洗涤,干燥,再蒸发至干燥。将该粗制混合物在硅胶上纯化,洗脱使用0至60%EtOAc/己烷,得到需要的产物(5.40g,97%)。LCMS(M+Na)244.9。
步骤2:4-(氰基甲基)-4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(4.3g,0.022mol)在乙腈(50mL)中的溶液中加入4-(氰基亚甲基)哌啶-1-甲酸叔丁酯(4.9g,0.022mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(3.3mL,0.022mol)。使所得混合物在室温下搅拌过夜。蒸发至干燥后,将残余物在硅胶上纯化,洗脱使用0-100%EtOAc/己烷,得到需要的产物(5.62g,61%)。LCMS(M+H)417.1。
步骤3:4-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-(氰基甲基)哌啶-1-甲酸叔丁酯
将2,4-二氯嘧啶(1.00g,6.71mmol)、4-(氰基甲基)-4-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)哌啶-1-甲酸叔丁酯(2.8g,6.7mol)、四(三苯膦)钯(0.5g,0.4mmol)和磷酸钾(4.3g,20mmol)在1,4-二噁烷(20mL)和水(2mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩,将残余物在硅胶上纯化,洗脱使用0至100%EtOAc/己烷,得到需要的产物(2.19g,82%)。LCMS(M+H)403.0。
步骤4:(4-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(异噁唑-5-基羰基)哌啶-4-基)乙腈
向4-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-(氰基甲基)哌啶-1-甲酸叔丁酯(0.259g,0.643mmol)在2mL的二噁烷中的混合物中加入4M HCl/二噁烷(4.0mL)。使反应在室温下搅拌30min,然后蒸发至干燥。向在二氯甲烷(5.0mL)中的所得粗制HCl盐中加入三乙胺(0.269mL,1.93mmol),接着加入异噁唑-5-羰基氯(0.0744mL,0.771mmol)。使该混合物在室温下搅拌30min,用饱和碳酸氢钠洗涤,干燥,再蒸发至干燥。该残余物直接用于下一步骤(233mg,91%)。LCMS(M+H)398.0。
步骤5:1-(异噁唑-5-基羰基)-4-(4-(2-(4-(1H-吡唑-1-基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基乙腈
将(4-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(异噁唑-5-基羰基)哌啶-4-基)乙腈(30mg,0.08mmol)、4-(1H-吡唑-1-基)苯胺(18.9mg,0.119mmol)和对甲苯磺酸(12mg,0.067mmol)在干燥的1,4-二噁烷(0.6mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(22mg,52%)。LCMS(M+H)521.1。
实施例13:2-(1-(异噁唑-5-羰基)-4-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈
此化合物是根据实施例12所述操作法以外消旋混合物制备的,其中使用3-(5-噁唑基)-苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)522.1。
实施例14:2-(4-(4-(2-(3-(1H-四唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(异噁唑-5-羰基)哌啶-4-基)乙腈
此化合物是根据实施例12所述操作法以外消旋混合物制备的,其中使用3-(2H-四唑-5-基)-苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)523.0。
实施例15:2-(1-(异噁唑-5-羰基)-4-(4-(2-(4-(吗啉代磺酰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈
此化合物是根据实施例12所述操作法以外消旋混合物制备的,其中使用4-(4-吗啉基磺酰基)-苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)604.2。
实施例16:2-(1-(异噁唑-5-羰基)-4-(4-(2-(6-甲氧基吡啶-3-基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈
此化合物是根据实施例12所述操作法以外消旋混合物制备的,其中使用6-甲氧基-3-吡啶胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)486.1。
实施例17:2-(3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)氮杂环丁烷-3-基)乙腈
步骤1:3-(氰基亚甲基)氮杂环丁烷-1-甲酸叔丁酯
向1.0M的叔丁醇钾在四氢呋喃(30.7mL)中的溶液在0℃下滴加氰基甲基磷酸二乙酯(5.20mL,0.0322mol)在四氢呋喃(39.12mL)中的溶液。使反应温热至室温,然后再次冷却至0℃。向该反应混合物中加入3-氧代氮杂环丁烷-1-甲酸叔丁酯(5.0g,0.029mol)在四氢呋喃(7.82mL)中的溶液。使反应温热至室温,并在室温下搅拌过夜。用水猝灭后,使该混合物用EtOAc猝取。将合并的有机层用盐水洗涤,干燥,再蒸发至干燥。将该粗制混合物在硅胶上纯化,洗脱使用0至70%EtOAc/己烷,得到需要的产物(5.40g,95%)。LCMS(M+Na)217.1。
步骤2:3-(氰基甲基)-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)氮杂环丁烷-1-甲酸叔丁酯
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(3.06g,0.0158mol)在乙腈(50mL)中的溶液中加入3-(氰基亚甲基)氮杂环丁烷-1-甲酸叔丁酯(3.06g,0.0158mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(2.36mL,0.0158mol)。使所得混合物在室温下搅拌过夜。蒸发至干燥后,将残余物在硅胶上纯化,洗脱使用0-100%EtOAc/己烷,得到需要的产物(5.40g,88%)。LCMS(M+H)389.1。
步骤3:3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)氮杂环丁烷-1-甲酸叔丁酯
将2,4-二氯嘧啶(1.0g,6.7mmol)、3-(氰基甲基)-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)氮杂环丁烷-1-甲酸叔丁酯(2.6g,6.7mmol)、四(三苯膦)钯(0.5g,0.4mmol)和磷酸钾(4.3g,20mmol)在1,4-二噁烷(20mL)和水(2mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至100%EtOAc/己烷,得到需要的产物。(2.10g,83%)。LCMS(M+H)375.0。
步骤4:(3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)氮杂环丁烷-3-基)乙腈
向3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)氮杂环丁烷-1-甲酸叔丁酯(0.241g,0.643mmol)在2mL的二噁烷中的混合物中加入4M HCl/二噁烷(4.0mL)。使反应在室温下搅拌30min,然后蒸发至干燥。向在二氯甲烷(5.0mL)中的所得粗制HCl盐中加入三乙胺(0.269mL,1.93mmol)接着加入环丙烷磺酰氯(0.0786mL,0.771mmol)。使该混合物在室温下搅拌30min,用饱和碳酸氢钠洗涤,干燥,再蒸发至干燥。该残余物直接用于下一步骤(229mg,94%)。LCMS(M+H)379.0。
步骤5:1-(环丙基磺酰基)-3-(4-(2-(4-(1H-吡唑-1-基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基乙腈
使(3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)氮杂环丁烷-3-基)乙腈(30mg,0.08mmol)、4-(1H-吡唑-1-基)苯胺(18.9mg,0.119mmol)和对甲苯磺酸(12mg,0.067mmol)在干燥的1,4-二噁烷(0.6mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(17.6mg,44%)。LCMS(M+H)502.0。
实施例18:2-(1-(环丙基磺酰基)-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例17所述操作法制备的,其中使用3-(5-噁唑基)-苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)503.1。
实施例19:N-(4-(4-(1-(3-(氰基甲基)-1-(环丙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例17所述操作法制备的,其中使用N-(4-氨基苯基)-乙酰胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)493.0。
实施例20:2-(1-(环丙基磺酰基)-3-(4-(2-(3-(2-甲基嘧啶-4-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例17所述操作法制备的,其中使用3-(2-甲基-4-嘧啶基)-苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)528.2。
实施例21:2-(1-(环丙基磺酰基)-3-(4-(2-(4-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例17所述操作法制备的,其中使用4-(5-噁唑基)-苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)503.0。
实施例22:3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(哌啶-4-基)丙腈
步骤1:4-(2-氰基乙烯基)哌啶-1-甲酸叔丁酯
向1.0M的叔丁醇钾在四氢呋喃(24.6mL)中的溶液中在0℃下滴加氰基甲基磷酸二乙酯(4.18mL,0.0258mol)在四氢呋喃(31.40mL)中的溶液。使反应温热至室温,然后再次冷却至0℃。向该反应混合物中加入4-甲酰基哌啶-1-甲酸叔丁酯(5.0g,0.023mol)在四氢呋喃(6.28mL)中的溶液。使反应温热至室温,并在室温下搅拌过夜。用水猝灭后,使该混合物用EtOAc猝取。将合并的有机层用盐水洗涤,干燥,再蒸发至干燥。将该粗制混合物在硅胶上纯化,洗脱使用0至50%EtOAc/己烷,得到需要的产物(5.10g,92%)。LCMS(M+Na)259.0。
步骤2:4-2-氰基-1-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)乙基哌啶-1-甲酸叔丁酯
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(4.11g,0.0212mol)在乙腈(70mL)中的溶液中加入4-(2-氰基乙烯基)哌啶-1-甲酸叔丁酯(5.00g,0.0212mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(3.16mL,0.0212mol)。使所得混合物在室温下搅拌过夜。蒸发至干燥后,将残余物在硅胶上纯化,洗脱使用0-100%EtOAc/己烷,得到需要的产物。(6.11g,67%)。LCMS(M+H)431.2。
步骤3:4-1-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-2-氰基乙基哌啶-1-甲酸叔丁酯
将2,4-二氯嘧啶(1.04g,6.98mmol)、4-2-氰基-1-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)乙基哌啶-1-甲酸叔丁酯(2.98g,6.93mmol)、四(三苯膦)钯(0.5g,0.4mmol)和磷酸钾(4.4g,0.021mol)在1,4-二噁烷(20mL)和水(2mL)中的混合物在100℃下加热过夜。冷却至室温后,将该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至100%EtOAc/己烷,得到需要的产物。(2.23g,77%)。LCMS(M+H)417.1。
步骤4.3-(4-2-((4-吗啉-4-基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-哌啶-4-基丙腈
将4-1-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-2-氰基乙基哌啶-1-甲酸叔丁酯(800mg,0.002mol)、4-吗啉-4-基苯胺(500mg,0.003mol)和对甲苯磺酸(270mg,0.0016mol)在干燥的1,4-二噁烷(10mL)中的混合物回流过夜。将该混合物用水稀释,用EtOAc萃取,再将合并的有机层用盐水洗涤,干燥,再蒸发至干燥。将残余物在硅胶上纯化,洗脱使用0至20%MeOH/二氯甲烷,得到需要的产物为外消旋混合物(30mg,4%)。LCMS(M+H)459.1。
实施例23:3-(1-(5-氟嘧啶-2-基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
将3-(4-2-((4-吗啉-4-基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-哌啶-4-基丙腈(0.030g,0.065mmol)、2-氯-5-氟嘧啶(0.013g,0.098mmol)和N,N-二异丙基乙胺(0.023mL,0.13mmol)在乙醇(0.5mL)中的混合物在120℃下在密封管中加热2h。蒸发至干燥后,使该残余物在RP-HPLC上纯化,得到需要的产物为外消旋混合物(12mg,33%).,LCMS(M+H)555.2。
实施例24:3-(1-(甲基磺酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
向3-(4-2-((4-吗啉-4-基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-哌啶-4-基丙腈三盐酸盐(30mg,0.05mmol)在1.0M碳酸钠水溶液(0.25mL)和四氢呋喃(0.25mL)中的混合物中加入甲磺酰氯(6.1μL,0.079mmol)。使反应在室渐下振摇30min。将该混合物用水和乙腈稀释,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐)。LCMS(M+H)537.1。
实施例25:3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(1-(苯基磺酰基)哌啶-4-基)丙腈
此化合物是根据实施例24所述操作法以外消旋混合物制备的,其中使用苯磺酰氯代替甲磺酰氯。LCMS(M+H)599.1。
实施例26:3-(1-乙酰基哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例24所述操作法以外消旋混合物制备的,其中使用乙酰氯代替甲磺酰氯。LCMS(M+H)501.2。
实施例27:3-(1-苯甲酰基哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例24所述操作法以外消旋混合物制备的,其中使用苯甲酰氯代替甲磺酰氯。LCMS(M+H)563.2。
实施例28:2-(4-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)哌啶-4-基)乙腈
步骤1:(4-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)哌啶-4-基)乙腈
向4-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-(氰基甲基)哌啶-1-甲酸叔丁酯(0.487g,1.21mmol)在2mL的二噁烷中的混合物中加入4M HCl/二噁烷(4.0mL)。使反应在室温下搅拌30min,然后蒸发至干燥。向在二氯甲烷(9.4mL)中的所得粗制HCl盐中加入三乙胺(0.505mL,3.62mmol),接着加入环丙烷磺酰氯(0.148mL,1.45mmol)。使该混合物在室温下搅拌30min,用饱和碳酸氢钠洗涤,干燥,再蒸发至干燥。该残余物直接用于下一步骤(402mg,82%)。LCMS(M+H)407.0。
步骤2:1-(环丙基磺酰基)-4-(4-(2-(4-(1H-吡唑-1-基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基乙腈
将(4-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)哌啶-4-基)乙腈(30mg,0.08mmol)、4-(1H-吡唑-1-基)苯胺(18.9mg,0.119mol)和对甲苯磺酸(12mg,0.067mmol)在干燥的1,4-二噁烷(0.6mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 10纯化,得到需要的产物为游离碱(30mg,72%)。LCMS(M+H)530.1。
实施例29:2-(1-(环丙基磺酰基)-4-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈
此化合物是根据实施例28所述操作法制备的,其中使用4-吗啉-4-基苯胺代替步骤2中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)549.1。
实施例30:4-(4-(1-(4-(氰基甲基)-1-(环丙基磺酰基)哌啶-4-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺
此化合物是根据实施例28所述操作法制备的,其中使用4-氨基-苯甲酰胺代替步骤2中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)507.0。
实施例31:4-(4-(1-(4-(氰基甲基)-1-(环丙基磺酰基)哌啶-4-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-羟乙基)苯甲酰胺
此化合物是根据实施例28所述操作法制备的,其中使用4-氨基-N-(2-羟乙基)-苯甲酰胺代替步骤2中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)551.0。
实施例32:4-(4-(1-(4-(氰基甲基)-1-(环丙基磺酰基)哌啶-4-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例28所述操作法制备的,其中使用4-氨基-N,N-二甲基-苯甲酰胺代替步骤2中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)535.2。
实施例33:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺
步骤1:3-环戊基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(2.00g,0.0103mol)在乙腈(30mL)中的溶液中加入3-环戊基丙烯腈(1.25g,0.0103mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(1.54mL,0.0103mol)。将所得混合物在60℃下搅拌过夜,然后蒸发至干燥。将残余物在硅胶上纯化,洗脱使用0至50%EtOAc/己烷,得到需要的产物(2.36g,73%)。LCMS(M+H)316.1。
步骤2:3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
将2,4-二氯嘧啶(0.28g,1.9mmol)、3-环戊基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈(0.500g,1.59mmol)、四(三苯膦)钯(100mg,0.1mmol)和磷酸钾(1.0g,4.8mmol)在1,4-二噁烷(5mL)和水(0.5mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至80%EtOAc/己烷,得到需要的产物(323mg,67%)。LCMS(M+H)302.0。
步骤3:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺
将3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(30mg,0.1mmol)、4-氨基-苯甲酰胺(20.3mg,0.149mmol)和对甲苯磺酸(14mg,0.084mmol)在干燥的1,4-二噁烷(0.8mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 1纯化,得到需要的产物为外消旋混合物(TFA盐,38mg,75%)。LCMS(M+H)402.1。
实施例34:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用4-(1H-吡唑-1-基)苯胺代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)425.0。
实施例35:3-环戊基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用4-吗啉-4-基苯胺代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)444.1。
实施例36:3-环戊基-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用苯胺代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)359.0。
实施例37:3-环戊基-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用3-(5-噁唑基)-苯胺代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)426.0。
实施例38:3-环戊基-3-(4-(2-(4-甲氧基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用对甲氧基苯胺代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)389.1。
实施例39:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用N-(4-氨基苯基)-乙酰胺代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)416.0。
实施例40:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用4-氨基-N,N-二甲基-苯甲酰胺代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)430.1。
实施例41:3-环戊基-3-(4-(2-(4-(哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用1-(4-氨基-苯基)-哌嗪-4-甲酸叔丁酯代替步骤3中的4-氨基-苯甲酰胺。LCMS(M+H)443.1。
实施例42:4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用乙磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用4-吗啉-4-基苯胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)565.1。
实施例43:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(乙基磺酰基)哌啶-4-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用乙磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用4-(1H-吡唑-1-基)苯胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)546.2。
实施例44:4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用乙磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用苯胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)480.1。
实施例45:N-(4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用N-(4-氨基苯基)-乙酰胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)589.1。
实施例46:4-(4-(1-(1-氰基-3-(1-(乙基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用乙磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用4-氨基-N,N-二甲基-苯甲酰胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)551.2。
实施例47:4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用4-氨基苯甲酰胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)575.1。
实施例48:4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
步骤1:4-(2-(4-(2-氯-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-氰基丙基)哌啶-1-甲酸叔丁酯
将2,4-二氯-5-甲基嘧啶(0.44g,2.7mmol)、4-3-氰基-2-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙基哌啶-1-甲酸叔丁酯(1.00g,2.25mol)、四(三苯膦)钯(0.2g,0.1mmol)和磷酸钾(1.4g,6.8mmol)在1,4-二噁烷(7mL)和水(0.7mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至100%,得到需要的产物(652mg,65%)。LCMS(M+Na)467.0。
步骤2:4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
将4-(2-(4-(2-氯-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-氰基丙基)哌啶-1-甲酸叔丁酯(30mg,0.07mmol)、4-吗啉-4-基苯胺(18.0mg,0.101mmol)和对甲苯磺酸(9.9mg,0.057mmol)在干燥的1,4-二噁烷(0.5mL)中的混合物回流过夜,得到失去Boc基团的胺化产物。LCMS(M+H)487.2。
向以上混合物中加入1.0M碳酸钠水溶液(0.5mL),接着加入乙磺酰氯(0.013mL,0.13mmol)。使反应在室温下搅拌1h。分离有机相,再在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐,30mg,62%)。LCMS(M+H)579.2。
实施例49:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(乙基磺酰基)哌啶-4-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用4-(1H-吡唑-1-基)苯胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)560.1。
实施例50:4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用苯胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)494.1。
实施例51:N-(4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤1中的乙磺酰氯,并用N-(4-氨基苯基)-乙酰胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)603.0。
实施例52:4-(4-(1-(1-氰基-3-(1-(乙基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用4-氨基-N,N-二甲基-苯甲酰胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)565.1。
实施例53:4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酰胺
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤1中的乙磺酰氯,并用4-氨基苯甲酰胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)589.2。
实施例54:3-环戊基-3-(4-(2-(4-(4-(甲基磺酰基)哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
将3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(30mg,0.1mmol)、4-(哌嗪-1-基)苯胺(28.5mg,0.149mmol)和对甲苯磺酸(14mg,0.084mmol)在干燥的1,4-二噁烷(0.8mL)中的混合物回流过夜,然后冷却至室温。向所得混合物中加入1.0M碳酸钠水溶液(0.8mL),接着加入甲磺酰氯(0.015mL,0.20mmol)。使反应在室温下搅拌30min,再使各相分离。将有机相在RP-HPLC上以pH 10纯化,得到需要的产物为外消旋混合物(33mg,63%)。LCMS(M+H)521.1。
实施例55:4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用4-吗啉-4-基苯胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)617.2。
实施例56:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用4-(1H-吡唑-1-基)苯胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)598.1。
实施例57:4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用苯胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)532.1。
实施例58:4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤5中的2,4-二氟苯甲酰氯,并用4-氨基-N,N-二甲基-苯甲酰胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)603.1。
实施例59:4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用4-氨基-N,N-二甲基-苯甲酰胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)599.1。
实施例60:N-(4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用N-(4-氨基苯基)-乙酰胺代替步骤6中的4-(1H-咪唑基-1-基)苯胺。LCMS(M+H)585.1。
实施例61:4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤1中的乙磺酰氯。LCMS(M+H)631.1。
实施例62:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用2,4-二氟苯甲酰氯代替步骤1中的乙磺酰氯。LCMS(M+H)627.1。
实施例63:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤1中的乙磺酰氯,并用4-(1H-吡唑-1-基)苯胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)612.1。
实施例64:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用2,4-二氟苯甲酰氯代替步骤1中的乙磺酰氯,并用4-(1H-吡唑-1-基)苯胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)608.1。
实施例65:4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤1中的乙磺酰氯,并用苯胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)546.1。
实施例66:4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用2,4-二氟苯甲酰氯代替步骤1中的乙磺酰氯,并用苯胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)542.1。
实施例67:4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤1中的乙磺酰氯,并用4-氨基-N,N-二甲基-苯甲酰胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)617.2。
实施例68:4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用2,4-二氟苯甲酰氯代替步骤1中的乙磺酰氯,并用4-氨基-N,N-二甲基-苯甲酰胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)613.1。
实施例69:N-(4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例48所述操作法以外消旋混合物制备的,其中使用2,4-二氟苯甲酰氯代替步骤1中的乙磺酰氯,并用N-(4-氨基苯基)-乙酰胺代替步骤2中的4-吗啉-4-基苯胺。LCMS(M+H)599.1。
实施例70:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酰胺
步骤1:3-(4-(2-氯-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
将2,4-二氯-5-甲基嘧啶(0.62g,3.8mmol)、3-环戊基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈(1.0g,3.17mmol)、四(三苯膦)钯(200mg,0.2mmol)和磷酸钾(2.0g,9.6mmol)在1,4-二噁烷(9mL)和水(0.9mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至80%EtOAc-己烷,得到需要的产物(780mg,78%)。LCMS(M+H)316.0。
步骤2:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酰胺
将3-(4-(2-氯-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(30mg,0.1mmol)、4-氨基-苯甲酰胺(20.3mg,0.149mmol)和对甲苯磺酸(14mg,0.084mmol)在干燥的1,4-二噁烷(0.8mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 1纯化,得到需要的产物为外消旋混合物(TFA盐,32mg,60%)。LCMS(M+H)416.0。
实施例71:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-(1H-吡唑-1-基)苯胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)439.1。
实施例72:3-环戊基-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-吗啉-4-基苯胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)458.1。
实施例73:3-环戊基-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用苯胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)373.0。
实施例74:3-环戊基-3-(4-(5-甲基-2-(4-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-(5-噁唑基)-苯胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)440.0。
实施例75:3-环戊基-3-(4-(2-(4-甲氧基苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-甲氧基苯胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)403.1。
实施例76:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用N-(4-氨基苯基)-乙酰胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)430.1。
实施例77:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-氨基-N,N-二甲基-苯甲酰胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)444.1。
实施例78:3-环戊基-3-(4-(5-甲基-2-(4-(哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用1-(4-氨基-苯基)-哌嗪-4-甲酸叔丁酯代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)457.1。
实施例79:3-环戊基-3-(4-(2-(4-(二乙基氨基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用N1,N1-二乙基-1,4-苯二胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)444.1。
实施例80:3-环戊基-3-(4-(2-(4-(乙基(3-羟基丙基)氨基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用2-[(4-氨基苯基)乙基氨基]-乙醇代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)460.1。
实施例81:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酸
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-氨基苯甲酸代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)417.2。
实施例82:3-环戊基-3-(4-(5-甲基-2-(4-硝基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-硝基苯胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)418.1。
实施例83:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N-(2-羟基乙基)苯甲酰胺
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用4-氨基-N-(2-羟乙基)-苯甲酰胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)460.2。
实施例84:3-环戊基-3-(4-(5-甲基-2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例70所述操作法以外消旋混合物制备的,其中使用3-(5-噁唑基)-苯胺代替步骤2中的4-氨基-苯甲酰胺。LCMS(M+H)440.0。
实施例85:3-(4-(2-(4-氨基苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
将3-环戊基-3-(4-5-甲基-2-((4-硝基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)丙腈(0.020g,0.048mmol)(游离碱)在10mL甲醇中的混合物在10%Pd/C存在下,在氢气瓶压力下氢化过夜。滤出催化剂后,将滤液蒸发至干燥,得到需要的产物为外消旋混合物(18mg,97%)。LCMS(M+H)388.0。
实施例86:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N-甲基苯甲酰胺
向4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酸(10mg,0.02mmol)、甲基氯化铵(2.4mg,0.036mmol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(16mg,0.036mmol)在N,N-二甲基甲酰胺(0.5mL)中的混合物中加入N,N-二异丙基乙胺(0.019mL,0.11mmol)。使该混合物在室温下搅拌过夜,用1N HCl猝灭,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐,9mg,85%)。LCMS(M+H)430.1。
实施例87:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N-(1-甲氧基丙烷-2-基)苯甲酰胺
此化合物是根据实施例86所述操作法以非对映异构体混合物制备的,其中使用1-甲氧基-2-丙胺代替甲基氯化铵。LCMS(M+H)488.1。
实施例88:3-环戊基-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例86所述操作法以外消旋混合物制备的,其中使用4-羟基哌啶代替甲基氯化铵。LCMS(M+H)500.1。
实施例89:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)甲磺酰胺
向3-(4-2-((4-氨基苯基)氨基)-5-甲基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈(10mg,0.02mmol)在四氢呋喃(0.5mL)中的混合物中加入三乙胺(7.2μL,0.052mmol),接着加入甲磺酰氯(3.0μL,0.039mmol)。使反应在室温下搅拌1h,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA,9mg,80%)。LCMS(M+H)466.1。
实施例90:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基氨基甲酸甲酯
此化合物是根据实施例89所述操作法以外消旋混合物制备的,其中使用氯甲酸甲酯代替甲磺酰氯。LCMS(M+H)446.1。
实施例91:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)-2-(吡咯烷-1-基)乙酰胺
向3-(4-2-((4-氨基苯基)氨基)-5-甲基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈(10mg,0.02mmol)在四氢呋喃(0.5mL)中的混合物中加入三乙胺(7.2μL,0.052mmol),接着加入氯乙酰氯(3.1μL,0.039mmol)。使反应在室温下搅拌1h,然后在室温下用吡咯烷(4.3μL,0.052mmol)处理另外的1h。使所得混合物用1N HCl猝灭,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐,6mg,54%)。LCMS(M+H)499.1。
实施例92:3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(哌啶-4-基)丁腈
此化合物是以外消旋混合物制备的,其方式是通过使4-(2-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-氰基丙基哌啶-1-甲酸叔丁酯(来自实施例1步骤4)与4-(4-氨基苯基)-3-吗啉酮(来自Affinitis Pharma)根据实施例1步骤6所述操作法偶合。LCMS(M+H)487.1。
实施例93:2-(1-(环丙基磺酰基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例17所述操作法制备的,其中使用4-吗啉-4-基苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)521.0。
实施例94:2-(1-(异噁唑-5-羰基)-4-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈
此化合物是根据实施例12所述操作法制备的,其中使用4-吗啉-4-基苯胺代替步骤5中的4-(1H-吡唑-1-基)苯胺。LCMS(M+H)540.1。
实施例95:4-(1-(甲基磺酰基)哌啶-4-基)-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用甲磺酰氯代替步骤5中的2,4-二氟苯甲酰氯;并用4-(4-氨基苯基)-3-吗啉酮代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)565.2。
实施例96:4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用乙磺酰氯代替步骤5中的2,4-二氟苯甲酰氯;并用4-(4-氨基苯基)-3-吗啉酮代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)579.1。
实施例97:4-(1-(环丙基磺酰基)哌啶-4-基)-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈
此化合物是根据实施例1所述操作法以外消旋混合物制备的,其中使用环丙基磺酰氯代替步骤5中的2,4-二氟苯甲酰氯;并用4-(4-氨基苯基)-3-吗啉酮代替步骤6中的4-(1H-咪唑-1-基)苯胺。LCMS(M+H)591.1。
实施例98:3-环戊基-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用4-(4-氨基苯基)-3-吗啉酮代替步骤3中的4-氨基苯甲酰胺。LCMS(M+H)458.0。
实施例99:3-环戊基-3-(4-(2-(3-(2-甲基嘧啶-4-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用3-(2-甲基-4-嘧啶基)-苯胺代替步骤3中的4-氨基苯甲酰胺。LCMS(M+H)454.1。
实施例100:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用3-氨基苯甲酸代替步骤3中的4-氨基苯甲酰胺。LCMS(M+H)403.1。
实施例101:3-环戊基-3-(4-(5-甲氧基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
步骤1:3-(4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
将2,4-二氯-5-甲氧基嘧啶(0.68g,3.8mmol),3-环戊基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈(1.0g,3.17mmol)、四(三苯膦)钯(200mg,0.2mmol)和磷酸钾(2.0g,9.6mmol)在1,4-二噁烷(9mL)和水(0.9mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至60%EtOAc-己烷,得到需要的产物(860mg,82%)。LCMS(M+H)331.9。
步骤2:3-环戊基-3-(4-5-甲氧基-2-((4-吗啉-4-基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)丙腈
将3-(4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(20mg,0.06mmol)、4-吗啉-4-基苯胺(16.1mg,0.0904mmol)和对甲苯磺酸(8.8mg,0.051mmol)在干燥的1,4-二噁烷(0.5mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 1纯化,得到需要的产物为外消旋混合物(TFA盐,16mg,45%)。LCMS(M+H)474.2。
实施例102:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为4-(1H-吡唑-1-基)苯胺。LCMS(M+H)455.0。
实施例103:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为N-(4-氨基苯基)-乙酰胺。LCMS(M+H)446.0。
实施例104:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为4-氨基-N,N-二甲基-苯甲酰胺。LCMS(M+H)460.0。
实施例105:3-环戊基-3-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中在步骤3中将4-氨基苯甲酰胺替换为1-(4-氨基苯基)-2-哌啶酮(来自Aurora Fine Chemicals)。LCMS(M+H)456.1。
实施例106:3-环戊基-3-(4-(2-(4-(2-氧代-1,3-氧杂氮杂环己烷-3-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
步骤1.3-(4-硝基苯基)-1,3-氧杂氮杂环己烷-2-酮
向对硝基苯胺(0.50g,0.0036mol)和4-二甲基氨基吡啶(DMAP,0.531g,0.00434mol)在四氢呋喃(10mL,0.1mol)中的混合物中加入氯甲酸3-氯丙酯(0.480mL,0.00398mol)。使该混合物在室温下搅拌1h,然后用1.0M的叔丁醇钾/四氢呋喃(7.96mL,0.00796mol)在室温下处理2h,然后用氯化铵水溶液猝灭,用EtOAc萃取。将合并的有机层用水、盐水洗涤,干燥,再蒸发至干燥。将残余物在硅胶上纯化,洗脱使用0至10%MeOH/二氯甲烷,得到产物(260mg,32.32%)。LCMS(M+H)222.9。
步骤2.3-(4-氨基苯基)-1,3-氧杂氮杂环己烷-2-酮
将3-(4-硝基苯基)-1,3-氧杂氮杂环己烷-2-酮(0.10g,0.00045mol)在5mL甲醇中的混合物在10%Pd/C存在下,在氢气瓶压力下氢化过夜。滤出催化剂后,将滤液蒸发至干燥,再直接用于下一步骤。LCMS(M+H)193.0。
步骤3.3-环戊基-3-(4-(2-(4-(2-氧代-1,3-氧杂氮杂环己烷-3-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,在步骤3中将4-氨基苯甲酰胺替换为3-(4-氨基苯基)-1,3-氧杂氮杂环己烷-2-酮。LCMS(M+H)458.0。
实施例107:3-环戊基-3-(4-(2-(4-(2-氧代噁唑烷-3-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,在步骤3中将4-氨基苯甲酰胺替换为3-(4-氨基苯基)-2-噁唑烷酮。LCMS(M+H)444.0。
实施例108:3-(4-(2-(3-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
将3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸(228mg,0.566mmol)和叠氮化二苯基磷(diphenylphosphonic azide,0.18mL,0.85mmol)、三乙胺(0.16mL,1.1mmol)在1,4-二噁烷(4.2mL)中的混合物在室温下搅拌过夜。向所得混合物中加入水(0.36mL)。使反应回流过夜。将该粗制的外消旋混合物直接用于下一步骤。通过RP-HPLC(pH 2)获得分析纯样品。LCMS(M+H)374.1。
实施例109:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-甲基苯甲酰胺
向3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸(20mg,0.05mmol)和甲基氯化铵(5.0mg,0.074mmol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(33mg,0.074mmol)在N,N-二甲基甲酰胺(0.5mL)中的混合物中加入N,N-二异丙基乙胺(0.039mL,0.22mol)。使反应在室温下搅拌2h,用1N HCl猝灭,在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐,22mg,82%)。LCMS(M+H)416.0。
实施例110:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为二甲基胺HCl盐。LCMS(M+H)430.1。
实施例111:3-环戊基-3-(4-(2-(3-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为4-羟基哌啶。LCMS(M+H)486.1。
实施例112:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-羟乙基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为2-氨基乙醇。LCMS(M+H)446.1。
实施例113:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-甲氧基丙烷-2-基)苯甲酰胺
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,将甲基氯化铵替换为1-甲氧基-2-丙胺。LCMS(M+H)474.1。
实施例114:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙磺酰胺
向3-(4-(2-(3-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈(30mg,0.08mmol)在1,4-二噁烷(0.5mL)中的混合物中加入1.0M碳酸钠水溶液(0.5mL),接着加入乙磺酰氯(20μL,0.2mmol)。使反应在室温下搅拌1h,然后在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐,38mg,84%)。LCMS(M+H)466.0。
实施例115:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)甲磺酰胺
此化合物是根据实施例114所述操作法以外消旋混合物制备的,其中使用甲磺酰氯代替乙磺酰氯。LCMS(M+H)452.1。
实施例116:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基氨基甲酸甲酯
此化合物是根据实施例114所述操作法以外消旋混合物制备的,其中使用氯甲酸甲酯代替乙磺酰氯。LCMS(M+H)432.1。
实施例117:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺
此化合物是根据实施例114所述操作法以外消旋混合物制备的,其中使用乙酰氯代替乙磺酰氯。LCMS(M+H)416.1。
实施例118:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(吡咯烷-1-基)乙酰胺
向3-(4-(2-(3-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈(30mg,0.08mmol)在1,4-二噁烷(0.5mL)中的混合物中加入1.0M碳酸钠水溶液(0.5mL),接着加入氯乙酰氯(9.6μL,0.12mmol)。使该混合物在室温下搅拌1h,然后用吡咯烷(0.017g,0.24mmol)在室温下处理过夜。使所得混合物在RP-HPLC上以pH 10纯化,得到需要的产物为外消旋混合物(20mg,52%)。LCMS(M+H)485.2。
实施例119:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸
将3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(500.0mg,0.001657mol)、对氨基苯甲酸(341mg,0.00248mol)和对甲苯磺酸(240mg,0.0014mol)在干燥的1,4-二噁烷(10mL)中的混合物回流过夜。使该混合物冷却至室温。将所得固体过滤,用二噁烷洗涤,再风干,得到需要的产物为外消旋混合物(460mg,69%)。LCMS(M+H)403.1。
实施例120:3-环戊基-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
向4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸(30mg,0.07mmol)、1-甲基-哌嗪(8.3μL,0.074mmol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(0.4mg,0.089mmol)在N,N-二甲基甲酰胺(0.5mL)中的混合物中加入N,N-二异丙基乙胺(31μL,0.18mmol)。使反应在室温下搅拌1h,用水猝灭,在HPLC上纯化,得到需要的产物为外消旋混合物(28mg,82%)。LCMS(M+H)485.5。
实施例121:3-环戊基-3-(4-(2-(4-(4-(2-羟乙基)哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,将1-甲基-哌嗪替换为1-哌嗪乙醇。LCMS(M+H)515.5。
实施例122:3-环戊基-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,将1-甲基-哌嗪替换为吡咯烷。LCMS(M+H)456.45
实施例123:3-环戊基-3-(4-(2-(4-(3-氧代哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,将1-甲基-哌嗪替换为3-氧代哌嗪。LCMS(M+H)485.4。
实施例124:3-环戊基-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,将1-甲基-哌嗪替换为4-羟基哌啶。LCMS(M+H)486.5。
实施例125:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(环丙基甲基)-N-丙基苯甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,将1-甲基-哌嗪替换为N-丙基环丙烷甲胺。LCMS(M+H)498.5。
实施例126:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(环丙基甲基)苯甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,将1-甲基-哌嗪替换为环丙烷甲胺。LCMS(M+H)456.4。
实施例127:3-环戊基-3-(4-(2-(4-((R)-3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,将1-甲基-哌嗪替换为(R)-3-羟基吡咯烷。LCMS(M+H)472.45
实施例128:3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,将1-甲基-哌嗪替换为氮杂环丁烷HCl盐。LCMS(M+H)442.4。
实施例129:3-环戊基-3-(4-(2-(4-(2-氧代吡咯烷-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,在步骤3中将4-氨基苯甲酰胺替换为1-(4-氨基苯基)-2-吡咯烷酮(来自Ryan Scientific)。LCMS(M+H)442.4。
实施例130:3-环戊基-3-(4-(5-甲氧基-2-(4-(2-氧代吡咯烷-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为1-(4-氨基苯基)-2-吡咯烷酮。LCMS(M+H)472.4。
实施例131:3-环戊基-3-(4-(5-甲氧基-2-(4-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为4-(5-噁唑基)-苯胺。LCMS(M+H)456.4。
实施例132:3-环戊基-3-(4-(5-甲氧基-2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为3-(5-噁唑基)-苯胺。LCMS(M+H)456.4。
实施例133:3-环戊基-3-(4-(5-甲氧基-2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为4-(4-氨基苯基)-3-吗啉酮。LCMS(M+H)488.4。
实施例134:3-环戊基-3-(4-(5-甲氧基-2-(3-(2-甲基嘧啶-4-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为3-(2-甲基-4-嘧啶基)-苯胺。LCMS(M+H)481.4。
实施例135:3-环戊基-3-(4-(5-甲氧基-2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为1-(4-氨基苯基)-2-哌啶酮。LCMS(M+H)486.45
实施例136:3-环戊基-3-(4-(5-甲氧基-2-(4-(2-氧代噁唑烷-3-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例101所述操作法以外消旋混合物制备的,其中在步骤2中将4-吗啉-4-基苯胺替换为3-(4-氨基苯基)-2-噁唑烷酮。LCMS(M+H)474.4。
实施例137:3-环戊基-3-(4-(2-(3-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为1-甲基哌嗪。LCMS(M+H)485.2。
实施例138:3-环戊基-3-(4-(2-(3-(4-(2-羟乙基)哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为1-哌嗪乙醇。LCMS(M+H)515.5。
实施例139:3-环戊基-3-(4-(2-(3-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为吡咯烷。LCMS(M+H)456.2。
实施例140:3-环戊基-3-(4-(2-(3-(3-氧代哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为3-氧代哌嗪。LCMS(M+H)485.4。
实施例141:3-环戊基-3-(4-(2-(3-((R)-3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,将甲基氯化铵替换为3-(R)-羟基吡咯烷。LCMS(M+H)472.2。
实施例142:3-(4-(2-(3-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为氮杂环丁烷HCl盐。LCMS(M+H)442.2。
实施例143:3-(4-(2-(3-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为1-乙酰基哌嗪。LCMS(M+H)513.2。
实施例144:3-环戊基-3-(4-(2-(3-(4-(吡啶-3-基甲基)哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为3-(4-哌啶基甲基)-吡啶。LCMS(M+H)561.2。
实施例145:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((R)-1-(3-甲氧基苯基)乙基)苯甲酰胺
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,将甲基氯化铵替换为(αR)-3-甲氧基-α-甲基-苯甲胺。LCMS(M+H)536.2。
实施例146:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(吡啶-3-基甲基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为3-吡啶甲胺。LCMS(M+H)493.2。
实施例147:3-环戊基-3-(4-(2-(3-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为吗啉。LCMS(M+H)472.5。
实施例148:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((5-甲基异噁唑-3-基)甲基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,将甲基氯化铵替换为5-甲基-3-异噁唑甲胺。LCMS(M+H)497.4。
实施例149:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-(1-甲基吡咯烷-2-基)乙基)苯甲酰胺
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,将甲基氯化铵替换为1-甲基-2-吡咯烷乙胺。LCMS(M+H)513.2。
实施例150:3-环戊基-3-(4-(2-(3-(4-羟基-4-苯基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用4-苯基-4-哌啶醇代替甲基氯化铵。LCMS(M+H)562.2。
实施例151:3-(4-(2-(3-(4-苄基-4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用4-苄基-4-哌啶醇代替甲基氯化铵。LCMS(M+H)576.2。
实施例152:3-环戊基-3-(4-(2-(3-(3-(吡啶-2-基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,其中使用2-(3-吡咯烷基)-吡啶代替甲基氯化铵。LCMS(M+H)533.5。
实施例153:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((四氢-2H-吡喃-4-基)甲基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用4-氨基甲基四氢吡喃代替甲基氯化铵。LCMS(M+H)500.5。
实施例154:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-甲基哌啶-4-基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用1-甲基-4-哌啶胺代替甲基氯化铵。LCMS(M+H)499.5。
实施例155:3-环戊基-3-(4-(2-(3-(4-苯基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用4-苯基哌啶代替甲基氯化铵。LCMS(M+H)546.5。
实施例156:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(吡啶-2-基)乙基)苯甲酰胺
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,其中使用α-甲基-2-吡啶甲胺代替甲基氯化铵。LCMS(M+H)507.5。
实施例157:3-环戊基-3-(4-(2-(3-(3-(3-氟苯基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,其中使用3-(3-氟苯基)-吡咯烷代替甲基氯化铵。LCMS(M+H)550.5。
实施例158:N-((3R)-1-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,其中使用N-(3R)-3-吡咯烷基-乙酰胺代替甲基氯化铵。LCMS(M+H)513.5。
实施例159:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-(2-氧代咪唑啉-1-基)乙基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用1-(2-氨基乙基)-2-咪唑啉酮代替甲基氯化铵。LCMS(M+H)514.5。
实施例160:3-环戊基-3-(4-(2-(3-(4-(嘧啶-2-基)哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用2-(1-哌嗪基)-嘧啶代替甲基氯化铵。LCMS(M+H)549.2。
实施例161:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-(吡啶-3-基)乙基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用3-吡啶乙胺代替甲基氯化铵。LCMS(M+H)507.2。
实施例162:3-环戊基-3-(4-(2-(3-((R)-2-(甲氧基甲基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,其中使用(R)-2-甲氧基甲基-吡咯烷代替甲基氯化铵。LCMS(M+H)500.2。
实施例163:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-甲氧基苄基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用2-甲氧基苯甲胺代替甲基氯化铵。LCMS(M+H)522.4。
实施例164:3-环戊基-3-(4-(2-(3-(4-苯氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用4-苯氧基哌啶代替甲基氯化铵。LCMS(M+H)562.5。
实施例165:3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(羟基甲基)环戊基)苯甲酰胺
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用1-氨基环戊烷甲醇代替甲基氯化铵。LCMS(M+H)500.2。
实施例166:4-(4-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)哌嗪-1-基)苄腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用4-(1-哌嗪基)-苄腈代替甲基氯化铵.LCMS
(M+H)572.2。
实施例167:N-((S)-1-苄基吡咯烷-3-基)-3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺
此化合物是根据实施例109所述操作法以非对映异构体混合物制备的,其中使用(3S)-1-(苯基甲基)-3-吡咯烷胺代替甲基氯化铵。LCMS(M+H)561.3。
实施例168:3-环戊基-3-(4-(2-(3-(4-苯基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例109所述操作法以外消旋混合物制备的,其中使用1-苯基哌嗪代替甲基氯化铵。LCMS(M+H)547.2。
实施例169:3-环戊基-3-(4-(2-(3-硝基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用3-硝基苯胺代替步骤3中的4-氨基苯甲酰胺。LCMS(M+H)404.4。
实施例170:3-环戊基-3-(4-(2-(4-硝基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例33所述操作法以外消旋混合物制备的,其中使用4-硝基苯胺代替步骤3中的4-氨基苯甲酰胺。LCMS(M+H)404.4。
实施例171:3-环丁基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
步骤1:3-环丁基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(9.63g,0.0496mol)在乙腈(124mL,2.37mol)中的溶液中加入(E)-3-环丁基丙烯腈(5.30g,0.0495mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(3.70mL,0.0248mol)。使所得混合物在室温下搅拌过夜,然后蒸发至干燥。使该混合物在硅胶上纯化,洗脱使用0至80%EtOAc/己烷,得到需要的产物为外消旋混合物(11.2g,75.2%)。LCMS(M+H)302.4。
步骤2:3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环丁基丙腈
将2,4-二氯嘧啶(4.8g,0.032mol)、3-环丁基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈(8.10g,0.0269mol)、四(三苯膦)钯(2.0g,0.002mol)和磷酸钾(17g,0.081mol)在1,4-二噁烷(80mL)和水(8mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至80%,得到需要的产物(5.51g,71.2%)。LCMS(M+H)288.3。
步骤3:3-环丁基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
将3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环丁基丙腈(30mg,0.1mmol)、4-吗啉-4-基苯胺(26.6mg,0.149mmol)和对甲苯磺酸(14mg,0.084mmol)在干燥的1,4-二噁烷(0.8mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 1纯化,得到需要的产物为外消旋混合物(TFA盐)(33mg,61%)。LCMS(M+H)430.4。
实施例172:3-(4-(2-(4-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
将3-环戊基-3-(4-(2-(4-硝基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈(1.00g,0.00248mol)在20mL甲醇中的混合物在催化量的10%Pd/C存在下,在气瓶压力下氢化过夜。滤出催化剂,再将滤液蒸发至干燥。该粗产物直接用于下一步骤(900mg,97.2%)。通过RP-HPLC获得分析纯样品为外消旋混合物。LCMS(M+H)374.4。
实施例173:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丁基丙腈
此化合物是根据实施例171所述操作法以外消旋混合物制备的,在步骤3中将4-吗啉-4-基苯胺替换为4-(1H-吡唑-1-基)苯胺。LCMS(M+H)411.1。
实施例174:3-环丁基-3-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例171所述操作法以外消旋混合物制备的,在步骤3中将4-吗啉-4-基苯胺替换为1-(4-氨基苯基)-2-哌啶酮。LCMS(M+H)442.4。
实施例175:3-环丁基-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例171所述操作法以外消旋混合物制备的,在步骤3中将4-吗啉-4-基苯胺替换为4-(4-氨基苯基)-3-吗啉酮。LCMS(M+H)444.4。
实施例176:3-环丁基-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例171所述操作法以外消旋混合物制备的,在步骤3中将4-吗啉-4-基苯胺替换为3-(5-噁唑基)-苯胺。LCMS(M+H)412.4。
实施例177:3-环丙基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
步骤1:3-环丙基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(10.0g,0.0515mol)在乙腈(129mL,2.46mol)中的溶液中加入(E)-3-环丙基丙烯腈(5.75g,0.0617mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(3.85mL,0.0258mol)。使所得混合物在室温下搅拌过夜,再蒸发至干燥。使该混合物在硅胶上纯化,洗脱使用0至80%EtOAc/己烷,得到需要的产物为外消旋混合物(10.8g,73.0%)。LCMS(M+H)288.4。
步骤2.3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈
将2,4-二氯嘧啶(2.8g,0.019mol)、3-环丙基-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)丙腈(4.50g,0.0157mol)、四(三苯膦)钯(1.0g,0.9mmol)和磷酸钾(0.1g,0.047mol)在1,4-二噁烷(50mL)和水(5mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至100%EtOAc/己烷,得到需要的产物为外消旋混合物(3.08g,71.81%)。LCMS(M+H)274.3。
步骤3.3-环丙基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
使3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈(30mg,0.1mmol)、4-吗啉-4-基苯胺(26.6mg,0.149mmol)和对甲苯磺酸(14mg,0.084mmol)在干燥的1,4-二噁烷(0.8mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 1.0纯化,得到需要的产物为外消旋混合物(TFA盐)。LCMS(M+H)416.2。
实施例178:3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈
此化合物是根据实施例177所述操作法以外消旋混合物制备的,在步骤3中将4-吗啉-4-基苯胺替换为4-(1H-吡唑-1-基)苯胺。LCMS(M+H)397.1。
实施例179:3-环丙基-3-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例177所述操作法以外消旋混合物制备的,在步骤3中将4-吗啉-4-基苯胺替换为1-(4-氨基苯基)-2-哌啶酮。LCMS(M+H)428.4。
实施例180:3-环丙基-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例177所述操作法以外消旋混合物制备的,在
步骤3中将4-吗啉-4-基苯胺替换为4-(4-氨基苯基)-3-吗啉酮。LCMS(M+H)430.1。
实施例181:3-环丙基-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例177所述操作法以外消旋混合物制备的,在步骤3中将4-吗啉-4-基苯胺替换为3-(5-噁唑基)-苯胺。LCMS(M+H)398.4
实施例182:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-(顺式)-2,6-二甲基吗啉-4-磺酰胺
步骤1.(顺式)-2,6-二甲基吗啉-4-磺酰氯
在0℃下向磺酰氯(0.773mL,0.00955mol)在二氯甲烷(2.39mL,0.0372mol)中的搅拌的溶液中加入三乙胺(0.666mL,0.00478mol)和顺式-2,6-二甲基吗啉(0.55g,0.0048mol)的混合物,加入速度为使温度低于20℃。使反应混合物在室温下搅拌2h,然后倾入到冰水(5g,0.3mol),再用二氯甲烷萃取。将合并的有机层用10%HCl、冷水、盐水洗涤,用氯化钙干燥,蒸发至干燥。使该粗制的氨磺酰氯直接用于下一步骤。
步骤2.N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-(顺式)-2,6-二甲基吗啉-4-磺酰胺
向3-(4-(2-(4-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(实施例172,30mg,0.08mmol)在1,4-二噁烷(0.5mL)中的混合物中加入1.0M碳酸钠水溶液(0.5mL),接着加入顺式-2,6-二甲基吗啉-4-磺酰氯(26mg,0.12mmol)。使反应混合物在室温下搅拌1h,然后在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐,30mg,57%)。LCMS(M+H)551.2。
实施例183:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)苯甲酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用苯甲酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)478.5。
实施例184:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-1-(甲基磺酰基)甲磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用1-(甲基磺酰基)-甲磺酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)530.1。
实施例185:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-3,5-二氟苯甲酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用3,5-二氟苯甲酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)514.4。
实施例186:N’-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-N,N-二甲基磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用N,N-二甲基-氨磺酰基氯化物代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)481.2。
实施例187:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-5-甲基异噁唑-3-甲酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用5-甲基-3-异噁唑羰基氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)483.2。
实施例188:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)异噁唑-5-甲酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用5-异噁唑羰基氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)469.1。
实施例189:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-3,5-二甲基异噁唑-4-甲酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用3,5-二甲基-4-异噁唑羰基氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)497.2。
实施例190:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-1-甲基-1H-吡唑-3-磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)518.1。
实施例191:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2,5-二氟苯甲酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用2,4-二氟苯甲酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)514.3。
实施例192:3-环戊基-3-(4-(2-(4-(1,1-二氧化异噻唑烷-2-基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)丙腈
向3-(4-(2-(4-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(90.0mg,0.241mmol)在1,4-二噁烷(2mL)中的混合物中加入三乙胺(0.2mL,1mmol),接着加入3-氯丙烷-1-磺酰氯(0.044mL,0.36mmol)。使反应在室温下搅拌1h,用1N HCl猝灭。使该混合物用EtOAc猝取。分离有机层,用盐水洗涤,用MgSO4干燥,再蒸发至干燥,得到磺酰基化中间体。LCMS(M+H)514。
使以上制备的粗制中间体溶解于N,N-二甲基甲酰胺(0.75mL)和三乙胺(0.3mL,0.002mol)中。使反应混合物在80℃下加热过夜。冷却至室温之后,使该混合物蒸发至干燥。使该残余物在RP-HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐,41mg,35.62%)。LCMS(M+H)478.1。
实施例193:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-5-(2-甲基噻唑-4-基)噻吩-2-磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用5-(2-甲基-4-噻唑基)-2-噻吩磺酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)617.1。
实施例194:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-6-甲基吡啶-2-磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用6-甲基-2-吡啶磺酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)529.1。
实施例195:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-5-(吡啶-2-基)噻吩-2-磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用5-(2-吡啶基)-2-噻吩磺酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)597.1。
实施例196:5-氯-N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)噻吩-2-磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用5-氯-2-噻吩磺酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)554.1。
实施例197:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-6-吗啉代吡啶-3-磺酰胺
此化合物是根据实施例182所述操作法以外消旋混合物制备的,其中使用6-(4-吗啉基)-3-吡啶磺酰氯代替步骤2中的顺式-2,6-二甲基吗啉-4-磺酰氯。LCMS(M+H)600.2。
实施例199:(R)-四氢呋喃-3-基4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基氨基甲酸酯
向3-(4-(2-(4-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(30mg,0.08mmol)在1,4-二噁烷(0.5mL)中的混合物中加入三乙胺(0.03mL,0.2mmol),接着加入(R)-4-硝基苯基四氢呋喃-3-基甲酸酯(30mg,0.12mmol)。使反应在室温下搅拌1h,然后在RP-HPLC上纯化,得到需要的产物为非对映异构体混合物(TFA盐,27mg,56%)。LCMS(M+H)488.2。
实施例200:(R)-四氢呋喃-3-基3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基氨基甲酸酯
此化合物是根据实施例199所述操作法以非对映异构体混合物制备的,其中使用3-(4-(2-(3-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(4-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈。LCMS(M+H)488.2。
实施例201:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-1-甲基-1H-吡唑-3-磺酰胺
此化合物是根据实施例114所述操作法以外消旋混合物制备的,其中使用1-甲基-1H-吡唑-3-磺酰氯代替乙磺酰氯。LCMS(M+H)518.2。
实施例202:N’-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-N,N-二甲基磺酰胺
此化合物是根据实施例114所述操作法以外消旋混合物制备的,其中使用N,N-二甲基-氨磺酰基氯化物代替乙磺酰氯。LCMS(M+H)481.2。
实施例203:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(吡咯烷-1-基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈。LCMS(M+H)485.2。
实施例204:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-((R)-3-羟基吡咯烷-1-基)乙酰胺
此化合物是根据实施例118所述操作法以非对映异构体混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用(R)-3-吡咯烷醇代替吡咯烷。LCMS(M+H)501.2。
实施例205:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-羟基哌啶-1-基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用4-羟基哌啶代替吡咯烷。LCMS(M+H)515.2。
实施例206:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(3-氧代哌嗪-1-基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用2-哌嗪酮代替吡咯烷。LCMS(M+H)514.2。
实施例207:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-吗啉代乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用吗啉代替吡咯烷。LCMS(M+H)501.5
实施例208:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-((四氢-2H-吡喃-4-基)甲基氨基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用4-氨基甲基四氢吡喃代替吡咯烷。LCMS(M+H)529.5。
实施例209:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-((R)-2-(甲氧基甲基)吡咯烷-1-基)乙酰胺
此化合物是根据实施例118所述操作法以非对映异构体混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用(R)-2-甲氧基甲基-吡咯烷代替吡咯烷。LCMS(M+H)529.5。
实施例210:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(环丙基甲基氨基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用环丙烷甲胺代替吡咯烷。LCMS(M+H)485.5。
实施例211:N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(1-甲氧基丙烷-2-基氨基)乙酰胺
此化合物是根据实施例118所述操作法以非对映异构体混合物制备的,其中使用3-(4-(2-(4-氨基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈代替3-(4-(2-(3-氨基苯基)氨基嘧啶-4-基-1H-吡唑-1-基)-3-环戊基丙腈,并使用1-甲氧基-2-丙胺代替吡咯烷。LCMS(M+H)503.2。
实施例212:2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈
步骤1.(4-(叔丁基(二甲基)甲硅烷基)氧基环己叉)乙腈
在0℃下向1.0M的叔丁醇钾在四氢呋喃中的溶液(46.0mL)中滴加氰基甲基磷酸二乙酯(7.80mL,0.0482mol)在四氢呋喃(80mL)中的溶液。使反应温热至室温,然后再次冷却至0℃。向该反应混合物中加入4-(叔丁基(二甲基)甲硅烷基)氧基环己酮(10.0g,0.04378mol)在四氢呋喃(40mL)中的溶液。使反应温热至室温,并搅拌过夜。用水猝灭后,将该混合物用醚萃取。将合并的有机层用水、盐水洗涤,用MgSO4干燥,再蒸发至干燥。将该粗制混合物在硅胶上纯化,洗脱使用0至20%EtOAc/己烷,得到需要的产物(8.54g,77.58%)。LCMS(M+H)252.4。
步骤2.4-{叔丁基(二甲基)甲硅烷基)氧基-1-{4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)环己基乙腈
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(3.09g,0.0159mol)在乙腈(39.8mL)中的溶液中加入(4-(叔丁基(二甲基)甲硅烷基)氧基环己叉)乙腈(4.80g,0.0191mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(1.19mL,0.00797mol)。使所得混合物在室温下搅拌过夜,然后蒸发至干燥。使该混合物在硅胶上纯化,洗脱使用0至20%EtOAc/己烷,得到需要的产物为顺式-和反式-混合物(2.33g,33%)。LCMS(M+H)446.3。
步骤3.1-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-羟基环己基乙腈
向4-(叔丁基(二甲基)甲硅烷基)氧基-1-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)环己基乙腈(1.8g,0.0042mol)在乙腈(69.74mL)中的混合物中加入氟硅酸(2.0M,在水中,4.17mL)。使该混合物在室温下搅拌过夜。蒸发掉大部分溶剂后,将该混合物用碳酸氢钠水溶液中和,用醚萃取。合并有机层,用盐水洗涤,用MgSO4干燥,,再浓缩至干燥。该残余物(顺式-和反式-异构体的1∶3.5混合物)直接用于下一步骤(1.20g,90.6%)。LCMS(M+H)318.3。
步骤4.1-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-((5-甲基异噁唑-3-基)氧基)环己基乙腈
向1-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-羟基环己基乙腈(0.6g,0.00189mol)在四氢呋喃(9mL)中的溶液中加入5-甲基异噁唑-3-醇(0.22g,0.0023mol)、三苯膦(0.594g,0.00226mol),接着加入偶氮二甲酸二异丙酯(0.446mL,0.00226mol)。将该混合物在70℃下加热过夜。蒸发至干燥后,将残余物在硅胶上纯化,洗脱使用0至80%EtOAc/己烷,得到需要的产物。LCMS(M+H)399.1。
步骤5.{4-{(5-甲基异噁唑-3-基)氧基)-1-(4-2-{(4-吗啉-4-基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基)环己基)乙腈
将1-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-4-((5-甲基异噁唑-3-基)氧基)环己基乙腈(30mg,0.08mmol)、4-吗啉-4-基苯胺(20.1mg,0.113mmol)和对甲苯磺酸(11mg,0.064mmol)在干燥的1,4-二噁烷(0.6mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 1.0纯化,得到两种需要的产物为TFA盐。第一峰保留时间1.618min,LCMS(M+H)541.5;第二峰保留时间1.641min,LCMS(M+H)541.5。
实施例213:3-环戊基-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用吗啉代替1-甲基哌嗪。LCMS(M+H)472.2。
实施例214:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((四氢-2H-吡喃-4-基)甲基)苯甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用4-氨基甲基四氢吡喃代替1-甲基哌嗪。LCMS(M+H)500.2。
实施例215:3-环戊基-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用(3-桥)-8-氮杂双环[3.2.1]辛烷-3-醇盐酸盐代替1-甲基哌嗪。LCMS(M+H)512.2。
实施例216:3-环戊基-3-(4-(2-(4-(2-氧杂-6-氮杂三环[3.3.1.1(3,7)]癸-6-基羰基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用2-氧杂-6-氮杂三环[3.3.1.13,7]癸烷盐酸盐代替1-甲基哌嗪。LCMS(M+H)524.2。
实施例217:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(顺式-4-羟基环己基)-N-甲基苯甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用顺式-4-(甲基氨基)-环己醇盐酸盐代替1-甲基哌嗪。LCMS(M+H)514.2。
实施例218:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-甲基-N-(四氢-2H-吡喃-4-基)苯甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用四氢-N-甲基-2H-吡喃-4-胺代替1-甲基哌嗪。LCMS(M+H)500.2。
实施例219:3-环戊基-3-(4-(2-(4-((S*)-4,4-二甲基-2-氧代-1-氧杂-3,7-二氮杂螺[4.4]壬烷-7-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
步骤1.3-(1,1-二甲基丙-2-烯-1-基)-3-羟基吡咯烷-1-甲酸苄酯
在室温下向3-氧代吡咯烷-1-甲酸苄酯(4.50g,0.0205mol),4-溴-2-甲基-2-丁烯(4.75mL,0.0412mol)在25.0mL饱和氯化铵和四氢呋喃(4.75mL,0.0586mol)中的混悬液中加入锌(2.70g,0.0412mol)。刚开始搅拌时就放出气体和热。在30至45min之后,使所得淡灰色混合物通过硅藻土过滤。将滤液用EtOAc萃取。合并有机层,用盐水洗涤,干燥,再蒸发至干燥。将残余物在硅胶上纯化,洗脱使用0至40%EtOAc/己烷,得到需要的产物(5.22g,87.89%)。LCMS(M+H)290.2。
步骤2.3-(1,1-二甲基-2-氧代乙基)-3-羟基吡咯烷-1-甲酸苄酯
将3-(1,1-二甲基丙-2-烯-1-基)-3-羟基吡咯烷-1-甲酸苄酯(20.00g,0.06912mol)在二氯甲烷(500.0mL,7.8mol)中的溶液在-78℃下用臭氧处理,直到溶液变蓝。将该混合物用氢吹扫1min,用二甲基硫化物(15.2mL,0.207mol)猝来,再使之逐渐温热至室温。LCMS显示过氧化中间体(M+H)338.2。向该混合物中加入另外10mL的二甲基硫化物,再使该混合物在室温下搅拌过夜。蒸发至干燥后,使该残余物直接上硅胶(洗脱使用0至80%EtOAc/己烷),得到醛产物(14.1g,70.07%)。LCMS(M+H)292.2。
步骤3.2-{1-[(苯甲氧基)羰基]-3-羟基吡咯烷-3-基}-2-甲基丙酸
将3-(1,1-二甲基-2-氧代乙基)-3-羟基吡咯烷-1-甲酸苄酯(12.70g,0.04359mol)溶解于丙酮(179.5mL,2.444mol),并冷却至15℃,滴加1.0M的氯化氢水溶液(65.39mL,0.06539mol)。添加完HCl之后,滴加在丙酮(493.6mL,6.722mol)中的高锰酸钾(11.0g,0.0697mol)溶液。使反应混合物在室温下搅拌6h,过滤,滤饼用丙酮洗涤。在真空中蒸发滤液,用二氯甲烷稀释,干燥,过滤,在真空下蒸发溶剂,得到粗产物,其直接用于下一步骤。LCMS(M+H)308.2。
步骤4.4,4-二甲基-2-氧代-1-氧杂-3,7-二氮杂螺[4.4]壬烷-7-甲酸苄酯
向2-{1-[(苯甲氧基)羰基]-3-羟基吡咯烷-3-基}-2-甲基丙酸(13.40g,0.04360mol)在四氢呋喃(170.2mL,2.099mo1)中的溶液中加入叠氮化二苯基磷(9.40mL,0.0436mol)和三乙胺(6.08mL,0.0436mol),再将该混合物在氮气下回流4h。然后使该反应混合物在减压下浓缩,用EtOAc稀释,用碳酸氢钠水溶液洗涤。合并有机层,用盐水洗涤,干燥,再蒸发至干燥。在硅胶上纯化,洗脱使用0至100%EtOAc/己烷,得到环状氨基甲酸酯(2.53g,19.07%)。LCMS(M+H)305.2。将该外消旋的氨基甲酸酯使用手性HPLC分离,得到两种对映体。
步骤5.4,4-二甲基-1-氧杂-3,7-二氮杂螺[4.4]壬烷-2-酮
将4,4-二甲基-2-氧代-1-氧杂-3,7-二氮杂螺[4.4]壬烷-7-甲酸苄酯(0.50g,0.0016mol)(手性分离的第二个峰)在20mL的MeOH中的混合物在10%Pd/C存在下在氢气瓶压力下氢化2h。滤出催化剂后,将滤液浓缩至干燥,再将所得残余物直接用于下一步骤。LCMS(M+H)171.2。
步骤6.3-环戊基-3-(4-(2-(4-((S*)-4,4-二甲基-2-氧代-1-氧杂-3,7-二氮杂螺[4.4]壬烷-7-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用4,4-二甲基-1-氧杂-3,7-二氮杂螺[4.4]壬烷-2-酮代替1-甲基哌嗪。LCMS(M+H)555.2。
实施例220:3-环戊基-3-(4-(2-(4-(4,4-二甲基-1-氧杂-7-氮杂螺[4.4]壬烷-7-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用4,4-二甲基-1-氧杂-7-氮杂螺[4.4]壬烷TFA盐代替1-甲基哌嗪。LCMS(M+H)540.5。
实施例221:3-环戊基-3-(4-(2-(4-(4-甲氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用4-甲氧基哌啶盐酸盐代替1-甲基哌嗪。LCMS(M+H)500.2。
实施例222:N-((3S)-1-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用N-(3R)-3-吡咯烷基-乙酰胺代替1-甲基哌嗪。LCMS(M+H)513.2。
实施例223:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(顺式-4-羟基环己基)苯甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用顺式-4-氨基-环己醇盐酸盐代替1-甲基哌嗪。LCMS(M+H)500.2。
实施例224:3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用1-乙酰基哌嗪代替1-甲基哌嗪。LCMS(M+H)513.2。
实施例225:(3S)-1-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用(S)-3-吡咯烷甲腈盐酸盐代替1-甲基哌嗪。LCMS(M+H)481.4。
实施例226:3-环戊基-3-(4-(2-(4-((S)-3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-甲氧基-吡咯烷盐酸盐代替1-甲基哌嗪。LCMS(M+H)486.2。
实施例227:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-甲基哌啶-4-基)苯甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用1-甲基-4-哌啶胺代替1-甲基哌嗪。LCMS(M+H)499.3。
实施例228:3-环戊基-3-(4-(2-(4-(3-氧代-2,8-二氮杂螺[4.5]癸烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用2,8-二氮杂螺[4.5]癸烷-3-酮代替1-甲基哌嗪。LCMS(M+H)539.2。
实施例229:3-环戊基-3-(4-(2-(4-((S)-3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-氟-吡咯烷盐酸盐代替1-甲基哌嗪。LCMS(M+H)474.4。
实施例230:3-环戊基-3-(4-(2-(4-(3-(二甲基氨基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用N,N-二甲基-3-吡咯烷胺代替1-甲基哌嗪。LCMS(M+H)499.5。
实施例231:4-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰氨基)哌啶-1-甲酸乙酯
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用4-氨基-1-哌啶甲酸乙酯代替1-甲基哌嗪。LCMS(M+H)557.5。
实施例232:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(吡啶-2-基)吡咯烷-3-基)苯甲酰胺
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用1-(2-吡啶基)-3-吡咯烷胺代替1-甲基哌嗪。LCMS(M+H)548.4。
实施例233:3-环戊基-3-(4-(2-(4-(3-(吡啶-2-基氧基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用2-(3-吡咯烷基氧基)-吡啶代替1-甲基哌嗪。LCMS(M+H)549.2。
实施例234:1-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)-N,N-二甲基哌啶-4-甲酰胺
此化合物是根据实施例120所述操作法以外消旋混合物制备的,其中使用N,N-二甲基-4-哌啶甲酰胺代替1-甲基哌嗪。LCMS(M+H)541.2。
实施例235:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((S)-1-(二甲基氨基)-1-氧代丁烷-2-基)苯甲酰胺
此化合物是根据实施例120所述操作法以非对映异构体混合物制备的,其中使用(2S)-2-氨基-N,N-二甲基-丁酰胺盐酸盐代替1-甲基哌嗪。LCMS(M+H)515.2。
实施例236:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-甲基哌嗪-1-基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用1-甲基哌嗪代替吡咯烷。LCMS(M+H)514.2。
实施例237:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-((R)-3-羟基吡咯烷-1-基)乙酰胺
此化合物是根据实施例118所述操作法以非对映异构体混合物制备的,其中使用(3R)-3-吡咯烷醇代替吡咯烷。LCMS(M+H)501.2。
实施例238:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(3-氧代哌嗪-1-基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用2-哌嗪酮代替吡咯烷。LCMS(M+H)514.2。
实施例239:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-羟基哌啶-1-基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用4-羟基哌啶代替吡咯烷。LCMS(M+H)515.5。
实施例240:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-(2-羟乙基)哌嗪-1-基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用1-哌嗪乙醇代替吡咯烷。LCMS(M+H)544.2。
实施例241:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(环丙基甲基氨基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用环丙烷甲胺代替吡咯烷。LCMS(M+H)485.5。
实施例242:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-吗啉代乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用吗啉代替吡咯烷。LCMS(M+H)501.2。
实施例243:N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(乙基氨基)乙酰胺
此化合物是根据实施例118所述操作法以外消旋混合物制备的,其中使用乙胺代替吡咯烷。LCMS(M+H)459.4。
实施例244:2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈
标题化合物的顺式-和反式-异构体是根据实施例212所述操作法制备的,在步骤5中将4-吗啉-4-基苯胺替换为4-(4-氨基苯基)-3-吗啉酮。第一峰保留时间1.663min,LCMS(M+H)555.5;第二峰保留时间1.694min,LCMS(M+H)555.5。
实施例245:2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈
标题化合物的顺式-和反式-异构体是根据实施例212所述操作法制备的,在步骤5中将4-吗啉-4-基苯胺替换为1-(4-氨基苯基)-2-哌啶酮。一个异构体的保留时间1.762min,LCMS(M+H)553.5;另一个异构体的保留时间1.737min,LCMS(M+H)553.2。
实施例246:2-(1-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(5-甲基异噁唑-3-基氧基)环己基)乙腈
标题化合物的顺式-和反式-异构体是根据实施例212所述操作法制备的,在步骤5中将4-吗啉-4-基苯胺替换为4-(1H-吡唑-1-基)苯胺。第一峰保留时间1.954min,LCMS(M+H)522.2;第二峰保留时间1.964min,LCMS(M+H)522.2。
实施例247:2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈
标题化合物的顺式-和反式-异构体是根据实施例212所述操作法制备的,在步骤5中将4-吗啉-4-基苯胺替换为3-(5-噁唑基)-苯胺。第一峰保留时间1.999min,LCMS(M+H)523.4;第二峰保留时间2.022min,LCMS(M+H)523.4.。
实施例248:3-(氰基甲基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
步骤1.3-氧代环丁烷甲腈
将3-亚甲基环丁烷甲腈(10.0g,0.1074mol)和0.2M的在水(2mL)中的四氧化锇在水(100mL)和1,4-二噁烷(300mL)中的混合物搅拌5min,在此期间,该混合物变为棕色。在使温度保持在室温下,在30min的期间分批加入高碘酸钠(48.2g,0.225mol)。使该混合物搅拌另外的1.5h。将该混合物用EtOAc萃取,再将合并的有机层用MgSO4干燥。除去溶剂后,该粗制产物直接用于下一步骤(7.10g,69.5%)。
步骤2.3-(氰基亚甲基)环丁烷甲腈
在0℃下向1.0M的叔丁醇钾在四氢呋喃(78.4mL)中的溶液中滴加氰基甲基磷酸二乙酯(13.3mL,0.0822mol)在四氢呋喃(100mL,2mol)中的溶液。使反应温热至室温,然后再次冷却至0℃。向该反应混合物中加入3-氧代环丁烷甲腈(7.10g,0.0746mol)在四氢呋喃(70mL)中的溶液。使反应温热至室温,并搅拌过夜。用水猝灭后,将该混合物用醚萃取。将合并的有机层用水、盐水洗涤,MgSO4干燥,再蒸发至干燥。将该粗制混合物在硅胶上纯化,洗脱使用0至40%EtOAc/己烷,得到需要的产物(2.05g,23.2%)。
步骤3.3-(氰基甲基)-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)环丁烷甲腈
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(1.73g,0.00890mol)在乙腈(22.2mL)中的溶液中加入3-(氰基亚甲基)环丁烷甲腈(1.05g,0.00889mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(0.666mL,0.00445mol)。使所得混合物在室温下搅拌过夜,然后蒸发至干燥。使该混合物在硅胶上纯化,洗脱使用0至80%EtOAc/己烷,得到需要的产物为外消旋混合物(320mg,11.5%)。LCMS(M+H)313.4。
步骤4.3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)环丁烷甲腈
将2,4-二氯嘧啶(0.916g,0.00615mol)、3-(氰基甲基)-3-(4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基)环丁烷甲腈(1.60g,0.00512mol)、四(三苯膦)钯(400mg,0.3mmol)和磷酸钾(3.3g,0.015mol)在1,4-二噁烷(20mL)和水(2mL)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至100%,得到需要的产物(1.15g,75.1%)。LCMS(M+H)299.3。
步骤5.3-(氰基甲基)-3-(4-2-((4-吗啉-4-基苯基)氨基)嘧啶-4-基-1H-吡唑-1-基]环丁烷甲腈
将3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)环丁烷甲腈(30mg,0.1mmol)、4-吗啉-4-基苯胺(26.8mg,0.151mmol)和对甲苯磺酸(15mg,0.085mmol)在干燥的1,4-二噁烷(0.8mL)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 1.0纯化,得到两个需要的顺式-和反式-产物为TFA盐。第一峰保留时间1.267min,LCMS(M+H)441.4;第二峰保留时间1.296min,LCMS(M+H)441.4。
实施例249:4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸
步骤1.(3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈
在0℃下,向3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基乙腈盐酸盐(1.42g,0.00456mol)在二氯甲烷(30mL)中的混合物中加入三乙胺(1.59mL,0.0114mol),接着加入乙磺酰氯(0.497mL,0.00525mol)。使反应在室温下搅拌1h,用1N HCl猝灭。分离有机层,用碳酸氢钠水溶液洗涤,用硫酸钠干燥,再蒸发至干燥。该粗产物直接用于下一步骤(1.26g,75.3%)。LCMS(M+H)367.3。
步骤2.4-((4-1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基嘧啶-2-基)氨基)苯甲酸
将(3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈(0.926g,0.00252mol)、对氨基苯甲酸(0.519g,0.00379mol)和对甲苯磺酸(0.37g,0.0021mol)在干燥的1,4-二噁烷(20mL)中的混合物回流过夜。使该混合物冷却至室温,过滤。将该固体用二噁烷洗涤,风干,得到需要的产物(812mg,68.8%)。LCMS(M+H)468.4。
实施例250:4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸
将3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈(2.74g,0.0100mol)、对氨基苯甲酸(2.06g,0.0150mol)和对甲苯磺酸(1.5g,0.0085mol)在干燥的1,4-二噁烷(80mL)中的混合物回流过夜。使该混合物冷却至室温,过滤。将该固体用二噁烷洗涤,风干,得到需要的产物为外消旋混合物(3.02g,80.58%)。LCMS(M+H)375.3。
实施例251:3-环丙基-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
向4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸(30mg,0.07mmol)、4-羟基哌啶(7.5mg,0.074mmol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(40mg,0.089mmol)在N,N-二甲基甲酰胺(0.5mL)中的混合物中加入N,N-二异丙基乙胺(31μL,0.18mmol)。使反应在室温下搅拌1h,用水猝灭,在HPLC上纯化,得到需要的产物为外消旋混合物(TFA盐)。LCMS(M+H)458.2。
实施例252:3-环丙基-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用(3-桥)-8-氮杂双环[3.2.1]辛烷-3-醇盐酸盐代替4-羟基哌啶。LCMS(M+H)484.2。
实施例253:3-环丙基-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用吡咯烷代替4-羟基哌啶。LCMS(M+H)428.2。
实施例254:4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用四氢-2H-吡喃-4-胺代替4-羟基哌啶。LCMS(M+H)458.4。
实施例255:2-(1-(乙基磺酰基)-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
向4-((4-1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基嘧啶-2-基)氨基)苯甲酸(30mg,0.07mmol)、吗啉(0.0065g,0.074mmol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(40mg,0.089mmol)在N,N-二甲基甲酰胺(0.5mL)中的混合物中加入N,N-二异丙基乙胺(31μL,0.18mmol)。使反应在室温下搅拌1h,用水猝灭,在HPLC上纯化,得到需要的产物为TFA盐。LCMS(M+H)537.5。
实施例256:2-(1-(乙基磺酰基)-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用4-羟基哌啶代替吗啉。LCMS(M+H)551.2。
实施例257:2-(1-(乙基磺酰基)-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用(3-桥)-8-氮杂双环[3.2.1]辛烷-3-醇盐酸盐代替吗啉。LCMS(M+H)577.2。
实施例258:2-(1-(乙基磺酰基)-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用吡咯烷代替吗啉。LCMS(M+H)521.1。
实施例259:4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺
此化合物是根据实施例255所述操作法制备的,其中使用四氢-2H-吡喃-4-胺代替吗啉。LCMS(M+H)551.1。
实施例260:3-环丙基-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用吗啉代替4-羟基哌啶。LCMS(M+H)444.1
实施例261:3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用氮杂环丁烷盐酸盐代替4-羟基哌啶。LCMS(M+H)414.2。
实施例262:3-环丙基-3-(4-(2-(4-(2-氧杂-6-氮杂三环[3.3.1.1(3,7)]癸-6-基羰基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用2-氧杂-6-氮杂三环[3.3.1.13,7]癸烷盐酸盐代替4-羟基哌啶。LCMS(M+H)496.2。
实施例263:3-环丙基-3-(4-(2-(4-(4-甲氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用4-甲氧基哌啶盐酸盐代替4-羟基哌啶。LCMS(M+H)472.2。
实施例264:(3R)-1-(4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈
此化合物是根据实施例251所述操作法以非对映异构体混合物制备的,其中使用(3R)-3-吡咯烷甲腈盐酸盐代替4-羟基哌啶。LCMS(M+H)453.2。
实施例265:3-环丙基-3-(4-(2-(4-((S)-3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-甲氧基-吡咯烷盐酸盐代替4-羟基哌啶。LCMS(M+H)458.1。
实施例266:3-环丙基-3-(4-(2-(4-((R)-3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以非对映异构体混合物制备的,其中使用(3R)-3-吡咯烷醇代替4-羟基哌啶。LCMS(M+H)444.2。
实施例267:3-环丙基-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用1-甲基哌嗪代替4-羟基哌啶。LCMS(M+H)457.2。
实施例268:N-((3R)-1-(4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺
此化合物是根据实施例251所述操作法以非对映异构体混合物制备的,其中使用N-(3R)-3-吡咯烷基-乙酰胺代替4-羟基哌啶。LCMS(M+H)485.2。
实施例269:3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用1-乙酰基哌嗪代替4-羟基哌啶。LCMS(M+H)485.4。
实施例270:3-环丙基-3-(4-(2-(4-(3-(二甲基氨基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以非对映异构体混合物制备的,其中使用N,N-二甲基-3-吡咯烷胺代替4-羟基哌啶。LCMS(M+H)471.5。
实施例271:3-环丙基-3-(4-(2-(4-((S)-3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例251所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-氟-吡咯烷盐酸盐代替4-羟基哌啶。LCMS(M+H)446.1。
实施例272:4-(4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)氨基哌啶-1-甲酸乙酯
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用4-氨基-1-哌啶甲酸乙酯代替4-羟基哌啶。LCMS(M+H)529.2。
实施例273:2-(3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用氮杂环丁烷盐酸盐代替吗啉。LCMS(M+H)507.1。
实施例274:1-(乙基磺酰基)-3-(4-(2-(4-(2-氧杂-6-氮杂三环[3.3.1.1(3,7)]癸-6-基羰基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基乙腈
此化合物是根据实施例255所述操作法制备的,其中使用2-氧杂-6-氮杂三环[3.3.1.13,7]癸烷盐酸盐代替吗啉。LCMS(M+H)589.4。
实施例275:(1-(乙基磺酰基)-3-4-(2-(4-((4-甲氧基哌啶-1-基)羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用4-甲氧基哌啶盐酸盐代替吗啉。LCMS(M+H)565.4。
实施例276:(R)-1-(4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈
此化合物是根据实施例255所述操作法制备的,其中使用(3R)-3-吡咯烷甲腈盐酸盐代替吗啉。LCMS(M+H)546.4。
实施例277:(S)-2-(1-(乙基磺酰基)-3-(4-(2-(4-(3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用(3S)-3-甲氧基-吡咯烷盐酸盐代替吗啉。LCMS(M+H)551.2。
实施例278:(R)-2-(1-(乙基磺酰基)-3-(4-(2-(4-(3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用(3R)-3-吡咯烷醇代替吗啉。LCMS(M+H)537.3。
实施例279:2-(1-(乙基磺酰基)-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用1-甲基哌嗪代替吗啉。LCMS(M+H)550.2。
实施例280:(R)-N-(1-(4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺
此化合物是根据实施例255所述操作法制备的,其中使用N-(3R)-3-吡咯烷基-乙酰胺代替吗啉。LCMS(M+H)578.2。
实施例281:2-(3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用1-乙酰基哌嗪代替吗啉。LCMS(M+H)578.2。
实施例282:2-(3-(4-(2-(4-(3-(二甲基氨基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法以外消旋混合物制备的,其中使用N,N-二甲基-3-吡咯烷胺代替吗啉。LCMS(M+H)564.4。
实施例283:(S)-2-(1-(乙基磺酰基)-3-(4-(2-(4-(3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈
此化合物是根据实施例255所述操作法制备的,其中使用(3S)-3-氟-吡咯烷盐酸盐代替吗啉。LCMS(M+H)539.1。
实施例284:4-(4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰氨基)哌啶-1-甲酸乙酯
此化合物是根据实施例255所述操作法制备的,其中使用4-氨基-1-哌啶甲酸乙酯代替吗啉。LCMS(M+H)622.2。
实施例285:4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸
将3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)-环丁烷甲腈(300mg,0.00100mol)、对氨基苯甲酸(206mg,0.00151mol)和对甲苯磺酸(150mg,0.00085mol)在干燥的1,4-二噁烷(8mL)中的混合物回流过夜,冷却至室温。将该固体过滤、收集,得到标题化合物为顺式-和反式-异构体混合物,其直接用于下一步骤(310mg,77.3%)。LCMS(M+H)400.4。
实施例286:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)苯甲酸
将3-(4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈(120mg,0.36mmol)、对氨基苯甲酸(74.4mg,0.542mmol)和对甲苯磺酸(53mg,0.31mmol)在干燥的1,4-二噁烷(3mL)中的混合物回流过夜。使该混合物冷却至室温。将所得固体过滤,用二噁烷洗涤,得到需要的产物为外消旋混合物(120mg,76.7%)。LCMS(M+H)433.3。
实施例287:3-(氰基甲基)-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
向4-((4-1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基嘧啶-2-基)氨基)苯甲酸(30mg,0.07mmol)、吗啉(6.5μL,0.074mmol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(40mg,0.089mol)在N,N-二甲基甲酰胺(0.5mL)中的混合物中加入N,N-二异丙基乙胺(31μL,0.18mol)。使反应在室温下搅拌1h,用水猝灭,在HPLC上纯化,得到需要的顺式-和反式-产物为游离碱。第一峰保留时间1.421min,LCMS(M+H)469.4;第二峰保留时间1.452min,LCMS(M+H)469.4。
实施例288:3-(氰基甲基)-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用吡咯烷代替吗啉。第一峰保留时间1.566min,LCMS(M+H)453.4;第二峰保留时间1.599min,LCMS(M+H)453.4。
实施例289:4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用四氢-2H-吡喃-4-胺代替吗啉。第一峰保留时间1.468min,LCMS(M+H)483.4;第二峰保留时间1.490min,LCMS(M+H)483.4。
实施例290:(R)-3-(氰基甲基)-3-(4-(2-(4-(3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用(3R)-3-吡咯烷醇代替吗啉。第一峰保留时间1.205min,LCMS(M+H)469.1;第二峰保留时间1.228min,LCMS(M+H)469.1。
实施例291:4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((S-甲基异噁唑-S-基)甲基]苯甲酰胺
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用5-甲基-3-异噁唑甲胺代替吗啉。第一峰保留时间494.4;第二峰保留时间1.637min,LCMS(M+H)494.4。
实施例292:3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用氮杂环丁烷盐酸盐代替吗啉。第一峰保留时间1.498min,LCMS(M+H)439.4;第二峰保留时间1.525min,LCMS(M+H)439.4。
实施例293:3-(氰基甲基)-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用1-甲基哌嗪代替吗啉。第一峰保留时间1.032min,LCMS(M+H)482.4;第二峰保留时间1.041min,LCMS(M+H)482.4。
实施例294:(S)-3-(氰基甲基)-3-(4-(2-(4-(3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用(3S)-3-氟-吡咯烷盐酸盐代替吗啉。第一峰保留时间1.529min,LCMS(M+H)471.4;第二峰保留时间1.561min,LCMS(M+H)471.4。
实施例295:3-(氰基甲基)-3-(4-(2-(4-(4-甲氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用4-甲氧基哌啶盐酸盐代替吗啉。第一峰保留时间1.550min,LCMS(M+H)497.4;第二峰保留时间1.583min,LCMS(M+H)497.4。
实施例296:(S)-3-(氰基甲基)-3-(4-(2-(4-(3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用(3S)-3-甲氧基-吡咯烷盐酸盐代替吗啉。第一峰保留时间1.480min,LCMS(M+H)483.5;第二峰保留时间1.511min,LCMS(M+H)483.4。
实施例297:(R)-1-(4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用(3R)-3-吡咯烷甲腈盐酸盐代替吗啉。第一异构体保留时间1.474min,LCMS(M+H)478.4;第二异构体保留时间1.505min,LCMS(M+H)478.4。
实施例298:3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用1-乙酰基哌嗪代替吗啉。第一异构体保留时间1.331min,LCMS(M+H)510.4;第二异构体保留时间1.355min,LCMS(M+H)510.4。
实施例299:(R)-N-(1-(4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用N-(3R)-3-吡咯烷基-乙酰胺代替吗啉。第一异构体保留时间1.226min,LCMS(M+H)510.1;第二异构体保留时间1.252min,LCMS(M+H)510.1。
实施例300:3-(氰基甲基)-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用(3-桥)-8-氮杂双环[3.2.1]辛烷-3-醇盐酸盐代替吗啉。第一异构体保留时间1.411min,LCMS(M+H)509.4;第二异构体保留时间1.440min,LCMS(M+H)509.4。
实施例301:3-(氰基甲基)-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例287所述操作法制备的,其中使用4-羟基哌啶代替吗啉。第一异构体保留时间1.195min,LCMS(M+H)483.1;第二异构体保留时间1.220min,LCMS(M+H)483.1。
实施例302:3-环戊基-3-(4-(5-甲氧基-2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
向4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)苯甲酸(25mg,0.058mmol)、吗啉(5.0μL,0.058mmol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(31mg,0.069mmol)在N,N-二甲基甲酰胺(0.4mL)中的混合物中加入N,N-二异丙基乙胺(24μL,0.14mmol)。使反应在室温下搅拌1h,用水猝灭,在HPLC上纯化,得到需要的产物为外消旋混合物。LCMS(M+H)502.5。
实施例303:3-环戊基-3-(4-(5-甲氧基-2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例302所述操作法以外消旋混合物制备的,其中使用吡咯烷代替吗啉。LCMS(M+H)486.5。
实施例304:3-环戊基-3-(4-(5-甲氧基-2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈
此化合物是根据实施例302所述操作法以外消旋混合物制备的,其中使用1-甲基哌嗪代替吗啉。LCMS(M+H)515.5。
实施例305:4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺
此化合物是根据实施例302所述操作法以外消旋混合物制备的,其中使用四氢-2H-吡喃-4-胺代替吗啉。LCMS(M+H)516.4。
实施例306:3-环戊基-3-[4-(2-{[4-(2-吡咯烷-1-基乙基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈
步骤1.4-(2-吡咯烷-1-基乙基)苯胺
将1-[2-(4-硝基苯氧基)乙基]吡咯烷(来自Combi-Blocks,LLC,5.00g,0.0212mol)在100mL的MeOH中的混合物在0.5g 10%Pd/C存在下、在氢气瓶压力下氢化过夜。滤出催化剂后,将滤液蒸发至干燥,再直接用于下一步骤(4.36g,99.88%)。LCMS(M+H)207.4。
步骤2.3-环戊基-3-[4-(2-{[4-(2-吡咯烷-1-基乙基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈
使3-[4-(2-氯嘧啶-4-基)-1H-吡唑-1-基]-3-环戊基丙腈(根据实施例33,步骤2所述操作法制备;0.030g,0.000099mol)和4-(2-吡咯烷-1-基乙基)苯胺(0.0308g,0.000149mol)在乙酸(0.7mL,0.01mol)中的混合物回流过夜。蒸发至干燥后,将该残余物用EtOAc稀释,用碳酸氢钠水溶液、盐水洗涤,干燥,浓缩。使残余物进行RP-HPLC,获得需要的产物为外消旋混合物(游离碱)。LCMS(M+H)472.4。
实施例307:3-(氰基甲基)-3-[4-(2-{[4-(2-吡咯烷-1-基乙基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例306所述操作法以外消旋混合物制备的,其中使用3-(4-(2-氯嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)-环丁烷甲腈和1-[2-(4-硝基苯氧基)乙基]吡咯烷作为起始物质。第一异构体保留时间1.055min,LCMS(M+H)469.4。第二峰保留时间1.072min,LCMS(M+H)469.4。
实施例308:3-(4-{2-[(4-吗啉-4-基苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)-3-(四氢-2H-吡喃-4-基)丙腈
步骤1.(2E)-3-(四氢-2H-吡喃-4-基)丙烯腈
向1.0M的叔丁醇钾在四氢呋喃中的溶液(9.20mL,0.00920mol)在0℃下滴加氰基甲基磷酸二乙酯(1.56mL,0.00965mol)在四氢呋喃(11.73mL,0.1447mol)中的溶液。使反应温热至室温,然后再次冷却至0℃。向该反应混合物中加入四氢-2H-吡喃-4-甲醛(1.0g,0.0088mol)在四氢呋喃(2.35mL,0.0289mol))中的溶液。使反应温热至室温,并搅拌过夜。用水猝灭后,使该混合物用EtOAc猝取。将合并的有机层用盐水洗涤,干燥,再蒸发至干燥。该粗制混合物直接用于下一步骤。LCMS(M+H)138.0。
步骤2.3-(四氢-2H-吡喃-4-基)-3-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基]丙腈
向4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑(1.25g,0.00644mol)在乙腈(20mL,0.4mol)中的溶液中加入(2E)-3-(四氢-2H-吡喃-4-基)丙烯腈(1.00g,0.00729mol),接着加入1,8-二氮杂双环[5.4.0]十一碳-7-烯(1.09mL,0.00729mol)。使所得混合物在室温下搅拌过夜。蒸发至干燥后,将残余物在硅胶上纯化,洗脱使用0-100%EtOAc/己烷,得到需要的产物(1.30g,60.93%)。LCMS(M+H)332.4。
步骤3.3-[4-(2-氯嘧啶-4-基)-1H-吡唑-1-基]-3-(四氢-2H-吡喃-4-基)丙腈
将2,4-二氯嘧啶(0.589g,0.00395mol)、3-(四氢-2H-吡喃-4-基)-3-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基]丙腈(1.30g,0.00392mol)、四(三苯膦)钯(0)(0.3g,0.0002mol)和磷酸钾(2.5g,0.012mol)在1,4-二噁烷(10mL,0.1mol)和水(1mL,0.06mol)中的混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,过滤,浓缩。将残余物在硅胶上纯化,洗脱使用0至100%EtOAc/己烷,得到需要的产物(890mg,71.36%)。LCMS(M+H)318.3
步骤4.3-(4-{2-[(4-吗啉-4-基苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)-3-(四氢-2H-吡喃-4-基)丙腈
将3-[4-(2-氯嘧啶-4-基)-1H-吡唑-1-基]-3-(四氢-2H-吡喃-4-基)丙腈(20mg,0.00008mol)、4-吗啉-4-基苯胺(20.1mg,0.000113mol)和对甲苯磺酸(11mg,0.000064mol)在干燥的1,4-二噁烷(0.5mL,0.006mol)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 10纯化,得到需要的产物为外消旋混合物(游离碱)。LCMS(M+H)460.4。
实施例309:4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]-N-(四氢-2H-吡喃-4-基)苯甲酰胺
步骤1.4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酸
将3-[4-(2-氯嘧啶-4-基)-1H-吡唑-1-基]-3-(四氢-2H-吡喃-4-基)丙腈(来自实施例308步骤3,140mg,0.00044mol)、对氨基苯甲酸(90.6mg,0.000661mol)和对甲苯磺酸(64mg,0.00037mol)在干燥的1,4-二噁烷(3mL,0.04mol))中的混合物回流过夜,冷却至室温。需要的产物沉出,再通过过滤收集(180mg,97.64%)。LCMS(M+H)419.3。
步骤2.4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]-N-(四氢-2H-吡喃-4-基)苯甲酰胺
向4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酸(20mg,0.00005mol)、四氢-2H-吡喃-4-胺(4.8mg,0.000048mol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(25mg,0.000057mol)在N,N-二甲基甲酰胺(0.3mL,0.004mol)中的混合物中加入N,N-二异丙基乙胺(20μL,0.00011mol)。使反应在室温下搅拌1h,用水猝灭,在HPLC上纯化,获得需要的产物为外消旋混合物(游离碱)。LCMS(M+H)502.4。
实施例310:3-[4-(2-{[4-(吡咯烷-1-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]-3-(四氢-2H-吡喃-4-基)丙腈
此化合物是根据实施例309所述操作法以外消旋混合物制备的,其中使用吡咯烷代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)472.4。
实施例311:3-[4-(2-{[4-(吗啉-4-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]-3-(四氢-2H-吡喃-4-基)丙腈
此化合物是根据实施例309所述操作法以外消旋混合物制备的,其中使用吗啉代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)488.4。
实施例312:3-{4-[2-({4-[(4-羟基哌啶-1-基)羰基]苯基}氨基)嘧啶-4-基]-1H-吡唑-1-基}-3-(四氢-2H-吡喃-4-基)丙腈
此化合物是根据实施例309所述操作法以外消旋混合物制备的,其中使用4-羟基哌啶代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)502.4。
实施例313:3-{4-[2-({4-[(4-甲氧基哌啶-1-基)羰基]苯基}氨基)嘧啶-4-基]-1H-吡唑-1-基}-3-(四氢-2H-吡喃-4-基)丙腈
此化合物是根据实施例309所述操作法以外消旋混合物制备的,其中使用4-甲氧基哌啶盐酸盐代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)516.4。
实施例314:1-{4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酰基}哌啶-4-甲腈
此化合物是根据实施例309所述操作法以外消旋混合物制备的,其中使用4-氰基哌啶盐酸盐代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)511.4。
实施例315:3-(4-{2-[(4-{[(3R)-3-羟基吡咯烷-1-基]羰基}苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)-3-(四氢-2H-吡喃-4-基)丙腈
此化合物是根据实施例309所述操作法以非对映异构体混合物制备的,其中使用(3R)-3-吡咯烷醇代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)488.4。
实施例316:3-(4-{2-[(4-{[(3S)-3-甲氧基吡咯烷-1-基]羰基}苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)-3-(四氢-2H-吡喃-4-基)丙腈
此化合物是根据实施例309所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-甲氧基吡咯烷代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)502.4。
实施例317:(3S)-1-{4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酰基}吡咯烷-3-甲腈
此化合物是根据实施例309所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-氰基吡咯烷代替步骤2中的四氢-2H-吡喃-4-胺。LCMS(M+H)497.4。
实施例318:1-[4-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]嘧啶-2-基}氨基)苯甲酰基]哌啶-4-甲腈
此化合物是根据实施例251所述操作法以外消旋混合物制备的,其中使用4-氰基哌啶盐酸盐代替4-羟基哌啶。LCMS(M+H)467.4。
实施例319:1-{4-[(4-{1-[3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酰基}哌啶-4-甲腈
此化合物是根据实施例255所述操作法以外消旋混合物制备的,其中使用4-氰基哌啶盐酸盐代替吗啉。LCMS(M+H)560.4。
实施例320:3-环丙基-3-[4-(5-甲氧基-2-{[3-(1,3-噁唑-5-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈
步骤1.3-[4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-环丙基丙腈
将2,4-二氯-5-甲氧基嘧啶(来自Aldrich Chemicals,1.47g,0.00821mol)、3-环丙基-3-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基]丙腈(来自实施例177步骤1,2.34g,0.00815mol)、四(三苯膦)钯(0)(0.6g,0.0005mol)和磷酸钾(5.2g,0.025mol)在1,4-二噁烷(20mL,0.3mol)和水(2mL,0.1mol)中的混合物在100℃下加热过夜。冷却至室温后,将该混合物用AcOEt稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至60%,得到需要的产物(580mg,23.43%)。LCMS(M+H)304.3。
步骤2.3-环丙基-3-[4-(5-甲氧基-2-{[3-(1,3-噁唑-5-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈
将3-[4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-环丙基丙腈(20mg,0.00008mol)、3-(1,3-噁唑-5-基)苯胺(18.1mg,0.000113mol)和对甲苯磺酸(11mg,0.000064mol)在干燥的1,4-二噁烷(0.5mL,0.006mol)中的混合物回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH10纯化,得到需要的产物为外消旋混合物(游离碱)。LCMS(M+H)428.1。
实施例321:3-环丙基-3-(4-{5-甲氧基-2-[(3-硝基苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)丙腈
将3-[4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-环丙基丙腈(来自实施例320步骤1,60mg,0.0002mol)、间硝基苯胺(40.9mg,0.000296mol)和对甲苯磺酸(29mg,0.00017mol)的混合物在干燥的1,4-二噁烷(1mL,0.02mol)中的溶液回流过夜。将该混合物用乙腈和水稀释,在RP-HPLC上以pH 10纯化,得到需要的产物为外消旋混合物(游离碱)。LCMS(M+H)406.2。
实施例323:3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺
步骤1.3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)苯甲酸
将3-[4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-环丙基丙腈(来自实施例320步骤1,250mg,0.00082mol)、3-氨基苯甲酸(169mg,0.00123mol)和对甲苯磺酸(120mg,0.00070mol)在干燥的1,4-二噁烷(5mL,0.07mol)中的混合物回流过夜,然后冷却至室温。滤出不溶物质。将该过滤物蒸发至干燥,得到粗制产物(330mg,99.14%)。LCMS(M+H)405.3。
步骤2.3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺
向3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)苯甲酸(30mg,0.00007mol)、四氢-2H-吡喃-4-胺(7.5mg,0.000074mol)和苯并三唑-1-基氧基三(二甲基氨基)鏻六氟磷酸酯(39mg,0.000089mol)在N,N-二甲基甲酰胺(0.5mL,0.006mol)中的混合物中加入N,N-二异丙基乙胺(31μL,0.00018mol)。使反应在室温下搅拌1h,用水猝灭,在HPLC上纯化,得到需要的产物为为非对映异构体混合物(游离碱)。LCMS(M+H)488.2。
实施例324:3-环丙基-3-[4-(5-甲氧基-2-{[3-(吡咯烷-1-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用吡咯烷代替四氢-2H-吡喃-4-胺。LCMS(M+H)458.3。
实施例325:3-环丙基-3-(4-{2-[(3-{[(3R)-3-羟基吡咯烷-1-基]羰基}苯基)氨基]-5-甲氧基嘧啶-4-基}-1H-吡唑-1-基)丙腈
此化合物是根据实施例323所述操作法以非对映异构体混合物制备的,其中使用(3R)-3-吡咯烷醇代替四氢-2H-吡喃-4-胺。LCMS(M+H)474.3。
实施例326:3-环丙基-3-(4-{5-甲氧基-2-[(3-{[(3S)-3-甲氧基吡咯烷-1-基]羰基}苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)丙腈
此化合物是根据实施例323所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-甲氧基吡咯烷盐酸盐代替四氢-2H-吡喃-4-胺。LCMS(M+H)488.3。
实施例327:(3S)-1-[3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)苯甲酰基]吡咯烷-3-甲腈
此化合物是根据实施例323所述操作法以非对映异构体混合物制备的,其中使用(3S)-3-氰基吡咯烷代替四氢-2H-吡喃-4-胺。LCMS(M+H)483.2。
实施例328:3-环丙基-3-[4-(5-甲氧基-2-{[3-(吗啉-4-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用吗啉代替四氢-2H-吡喃-4-胺。LCMS(M+H)474.3。
实施例329:3-环丙基-3-{4-[2-({3-[(4-羟基哌啶-1-基)羰基]苯基}氨基)-5-甲氧基嘧啶-4-基]-1H-吡唑-1-基}丙腈
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用4-羟基哌啶代替四氢-2H-吡喃-4-胺。LCMS(M+H)488.3。
实施例330:3-环丙基-3-{4-[5-甲氧基-2-({3-[(4-甲氧基哌啶-1-基)羰基]苯基}氨基)嘧啶-4-基]-1H-吡唑-1-基}丙腈
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用4-甲氧基哌啶盐酸盐代替四氢-2H-吡喃-4-胺。LCMS(M+H)502.3。
实施例331:1-[3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)苯甲酰基]哌啶-4-甲腈
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用4-氰基哌啶盐酸盐代替四氢-2H-吡喃-4-胺。LCMS(M+H)497.2。
实施例332:3-环丙基-3-(4-{2-[(3-{[(3-桥)-3-羟基-8-氮杂双环[3.2.1]辛-8-基]羰基}苯基)氨基]-5-甲氧基嘧啶-4-基}-1H-吡唑-1-基)丙腈
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用(3-桥)-8-氮杂双环[3.2.1]辛烷-3-醇盐酸盐代替四氢-2H-吡喃-4-胺。LCMS(M+H)514.1。
实施例333:3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)-N-[(5-甲基异噁唑-3-基)甲基]苯甲酰胺
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用5-甲基-3-异噁唑甲胺代替四氢-2H-吡喃-4-胺。LCMS(M+H)499.1。
实施例334:3-[4-(2-{[3-(氮杂环丁烷-1-基羰基)苯基]氨基}-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-环丙基丙腈
此化合物是根据实施例323所述操作法以外消旋混合物制备的,其中使用氮杂环丁烷盐酸盐代替四氢-2H-吡喃-4-胺。LCMS(M+H)444.1。
实施例336:3-(氰基甲基)-3-[4-(2-{[4-(2-氧代哌啶-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用1-(4-氨基苯基)-2-哌啶酮代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.315min,LCMS(M+H)453.3。第二峰保留时间1.340,LCMS(M+H)453.3。
实施例337:3-(氰基甲基)-3-[4-(2-{[4-(2-氧代-1,3-氧杂氮杂环己烷-3-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用3-(4-氨基苯基)-1,3-氧杂氮杂环己烷-2-酮代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.196min,LCMS(M+H)455.2。第二峰保留时间1.231,LCMS(M+H)455.2。
实施例338:3-(氰基甲基)-3-[4-(2-{[4-(3-氧代吗啉-4-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用4-(4-氨基苯基)-3-吗啉酮代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.205min,LCMS(M+H)455.3。第二峰保留时间1.238,LCMS(M+H)455.3。
实施例339:3-(氰基甲基)-3-[4-(2-{[4-(2-氧代-1,3-噁唑烷-3-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用3-(4-氨基苯基)-2-噁唑烷酮代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.271min,LCMS(M+H)441.1。第二峰保留时间1.294min,LCMS(M+H)441.1。
实施例340:3-(氰基甲基)-3-[4-(2-{[4-(2-氧代吡咯烷-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用1-(4-氨基苯基)-2-吡咯烷酮代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.434min,LCMS(M+H)439.4。第二峰保留时间1.467,LCMS(M+H)439.4。
实施例341:3-(氰基甲基)-3-[4-(2-{[4-(1H-吡唑-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用4-(1H-吡唑-1-基)苯胺代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.683min,LCMS(M+H)422.4。第二峰保留时间1.718min,LCMS(M+H)422.4。
实施例342:3-(氰基甲基)-3-[4-(2-{[4-(1,3-噁唑-5-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用4-(5-噁唑基)-苯胺代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.592min,LCMS(M+H)423.4。第二峰保留时间1.720min,LCMS(M+H)423.3。
实施例343:3-(氰基甲基)-3-[4-(2-{[3-(1,3-噁唑-5-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用3-(5-噁唑基)-苯胺代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.670min,LCMS(M+H)423.4。第二峰保留时间1.703min,LCMS(M+H)423.3。
实施例344:3-(氰基甲基)-3-[4-(2-{[4-(吗啉-4-基磺酰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用4-(4-吗啉基磺酰基)-苯胺代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.747min,LCMS(M+H)505.3。第二峰保留时间1.782min,LCMS(M+H)505.3。
实施例345:3-(4-{2-[(3-氨基苯基)氨基]-5-甲氧基嘧啶-4-基}-1H-吡唑-1-基)-3-环丙基丙腈
将3-环丙基-3-(4-{5-甲氧基-2-[(3-硝基苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)丙腈(来自实施例321,0.010g,0.000025mol)在2mL的MeOH中的混合物在10%Pd/C存在下、在氢气瓶压力下氢化2h。滤出催化剂后,将滤液蒸发至干燥,得到需要的产物为外消旋混合物(8mg,86.39%)。LCMS(M+H)376.1。
实施例346:3-环丙基-3-[4-(2-{[3-(1,1-二氧化异噻唑烷-2-基)苯基]氨基}-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]丙腈
步骤1.3-氯-N-(3-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)苯基)丙烷-1-磺酰胺
向3-(4-{2-[(3-氨基苯基)氨基]-5-甲氧基嘧啶-4-基}-1H-吡唑-1-基)-3-环丙基丙腈(根据实施例345制备,8.0mg,0.000021mol)在1,4-二噁烷(0.1mL,0.002mol)中的混合物中加入三乙胺(0.02mL,0.0001mol),接着加入3-氯丙烷-1-磺酰氯(0.0039mL,0.000032mol)。使反应在室温下搅拌1h,用1N HCl猝灭。将该混合物用EtOAc萃取,再分离有机层。将合并的有机层用盐水洗涤,用MgSO4干燥,蒸发至干燥,得到需要的磺酰化中间体。
步骤2.3-环丙基-3-[4-(2-{[3-(1,1-二氧化异噻唑烷-2-基)苯基]′氨基}-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]丙腈
将以上制备的粗制产物溶解于N,N-二甲基甲酰胺(0.066mL,0.00086mol)和三乙胺(0.03mL,0.0002mol)中。将反应混合物在80℃下加热过夜。冷却至室温之后,使该混合物蒸发至干燥。使该残余物在RP-HPLC上以pH 10纯化,得到需要的产物为外消旋混合物(游离碱)。LCMS(M+H)480.3。
实施例347:4-[1-(2,4-二氟苯甲酰基)哌啶-4-基]-3-{4-[5-甲氧基-2-(吡啶-3-基氨基)嘧啶-4-基]-1H-吡唑-1-基}丁腈
步骤1.4-{2-[4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-氰基丙基}哌啶-1-甲酸叔丁酯
向2,4-二氯-5-甲氧基嘧啶(0.967g,0.00540mol)和4-{3-氰基-2-[4-(4,4,5,5-四甲基-1,3,2-二氧杂硼杂环戊烷-2-基)-1H-吡唑-1-基]丙基}哌啶-1-甲酸叔丁酯(来自实施例1步骤3,2.00g,0.00450mol)在1,4-二噁烷(40mL,0.5mol)中的混合物中加入1M碳酸钠(0.954g,0.00900mol)在水(8.99mL,0.499mol)中的溶液和四(三苯膦)钯(0)(0.4g,0.0003mol)。使反应混合物在100℃下加热过夜。冷却至室温后,使该混合物用EtOAc稀释,用水、盐水洗涤,用MgSO4干燥,浓缩。将残余物在硅胶上纯化,洗脱使用0至80%EtOAc/己烷,得到需要的产物(1.59g,76.64%)。LCMS(M+Na)483.4。
步骤2.3-(4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基)-4-(哌啶-4-基)丁腈
将4-{2-[4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-氰基丙基}哌啶-1-甲酸叔丁酯(0.030g,0.000065mol)和0.5mL的TFA的混合物在室温下搅拌1h。蒸发至干燥后,该残余物直接用于下一步骤。
步骤3.3-(4-(2-氯-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈
向以上制备的TFA盐和二氯甲烷(0.5mL,0.008mol)的混合物中加入2,4-二氟苯甲酰氯(9.99μL,0.0000814mol),接着加入三乙胺(0.027mL,0.00020mol)。使反应混合物在室温下搅拌1h,用碳酸氢钠水溶液猝灭,再用EtOAc萃取。将合并的有机层用水、盐水洗涤,MgSO4干燥,再蒸发至干燥。该残余物未经进一步纯化即直接用于下一步骤。LCMS(M+H)501.3。
步骤4.4-[1-(2,4-二氟苯甲酰基)哌啶-4-基]-3-{4-[5-甲氧基-2-(吡啶-3-基氨基)嘧啶-4-基]-1H-吡唑-1-基]丁腈
使粗制的胺(来自步骤3)、对甲苯磺酸一水合物(0.0105g,0.0000553mol)和2-吡啶胺(0.00919g,0.0000976mol)溶解于0.5mL的二噁烷,并在100℃下加热5h。将反应混合物在pH 2下进行RP-HPLC,得到所需产物的外消旋混合物,为TFA盐。LCMS(M+H)559.4。
实施例348:3-(氰基甲基)-3-[4-(2-{[3-(2-氧代吡咯烷-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈
标题化合物的顺式-和反式-异构体是根据实施例248所述操作法制备的,其中使用1-(3-氨基苯基)-2-吡咯烷酮(来自Matrix Scientific)代替步骤5中的4-吗啉-4-基苯胺。第一峰保留时间1.526min,LCMS(M+H)439.3。第二峰保留时间1.575min,LCMS(M+H)439.3。
选择的实施例的NMR数据表:
|  实施例 |   <sup>1</sup>H NMR(400MHz)δ(ppm) |
|  5 (CD<sub>3</sub>OD) |   8.63(1H,d,J=9.6Hz),8.28(1H,s),8.20(1H,d,J=6.4Hz),7.59(2H,d,J=8.8Hz),  7.40(1H,m),7.23(3H,m),7.06(2H,m),4.85(1H,m),4.58(1H,m),3.92(4H,m),  3.48(1H,m),3.45(4H,m),3.08(3H,m),2.77(1H,m),2.17(1H,m),1.81(2H,m),  1.34~1.20(4H,m). |
|  24 (CD<sub>3</sub>OD) |   8.58(1H,s),8.31(1H,s),8.20(1H,d,J=6.4Hz),7.60(2H,m),7.25(3H,m),4.54  (1H,m),3.92(4H,m),3.79(1H,m),3.66(1H,m),3.37(4H,m),3.22(2H,m),2.80  (3H,s),2.76(1H,dt,J=2.4和12.0Hz),2.63(1H,dt,J=2.4和12.0Hz),2.13(1H,  m),1.98(1H,d,J=12.8),1.42~1.33(2H,m),1.27(1H,m). |
|  25 (CD<sub>3</sub>OD) |   8.54(1H,s),8.26(1H,s),8.19(1H,d,J=6.0Hz),7.74(2H,m),7.65(1H,m),7.59  (4H,m),7.22(3H,m),4.48(1H,m),3.92(4H,m),3.84(1H,m),3.73(1H,m),3.36  (4H,m),3.15(2H,m),2.29(1H,m),2.16(1H,m),1.90(2H,m),1.35(2H,m),1.22(1H  ,m). |
|  29 (CD<sub>3</sub>OD) |   8.61(1H,s),8.28(1H,d,J=5.6Hz),8.21(1H,s),7.57(2H,m),7.02(1H,d,J=5.6  Hz),6.98(2H,m),3.84(2H,m),3.67(2H,m),3.31(2H,s),3.10(6H,m),3.01(2H,t,J  =11.2Hz),2.85(2H,d,J=14.8Hz),2.39(1H,m),2.19(2H,m),1.00(2H,m),0.93  (2H,m). |
|  35 (CD<sub>3</sub>OD) |   8.59(1H,s),8.27(1H,s),8.18(1H,d,J=6.4Hz),7.58(2H,d,J=8.8Hz),7.23(3H,  m),4.46(1H,dt,J=4.0和10.0Hz),3.91(4H,m),3.33(4H,m),3.22~3.08(2H,m),  2.51(1H,m),1.94(1H,m),1.74~1.53(4H,m),1.38(2H,m),1.21(1H,m). |
|  42 (CD<sub>3</sub>OD) |   8.63(1H,s),8.28(1H,s),8.21(1H,d,J=6.4Hz),7.60(2H,d,J=8.8Hz),7.22(3H,  m),4.84(1H,m),3.92(4H,m),3.70(1H,m),3.64(1H,m),3.35(4H,m),3.08(2H,m),  2.95(2H,q,J=7.2Hz),2.69(1H,dt,J=2.4和12.0Hz),2.16(1H,m),1.93(1H,m),  1.80(1H,m),1.58(1H,m),1.26(3H,t,J=7.2Hz),1.72~1.17(4H,m). |
|  55 (CD<sub>3</sub>OD) |   8.59(1H,s),8.25(1H,s),8.19(1H,d,J=6.0Hz),7.69(1H,d,J=2.4Hz),7.59(2H,d,  J=8.8Hz),7.24(2H,d,J=8.8Hz),7.20(1H,d,J=6.0Hz),6.59(1H,d,J=2.4Hz),  4.83(1H,m),3.92(4H,m),3.91(3H,s),3.73(1H,m),3.66(1H,m),3.53(4H,m),3.06  (2H,m),2.33(2H,t,J=12.4Hz),2.11(1H,m),1.91(1H,m),1.76(1H,m),1.55(1H,  m),1.30(2H,m),1.00(1H,m). |
|  93 (CD<sub>3</sub>OD) |   8.81(1H,s),8.31(1H,s),8.25(1H,d,J=6.0Hz),7.64(2H,d,J=8.8Hz),7.27(2H,d,  J=8.8Hz),7.23(1H,d,J=6.0Hz),4.60(2H,d,J=9.2Hz),4.32(2H,d,J=9.2Hz),  3.93(4H,m),3.58(2H,s),3.38(4H,m),2.65(1H,m),1.10(4H,m). |
|  94 (CD<sub>3</sub>OD) |   8.85(1H,s),8.53(1H,d,J=2.0Hz),8.33(1H,s),8.21(1H,d,J=6.4Hz),7.60(2H,d,  J=8.8Hz),7.27(3H,m),6.85(1H,d,J=2.0Hz),4.38(1H,d,J=15.6Hz),4.00(1H,  d,J=15.6Hz),3.92(4H,m),3.41(1H,m),3.36(4H,m),3.21(1H,m),3.16(2H,s),  2.84(2H,m),2.23(2H,m). |
|  101 (CD<sub>3</sub>OD) |   8.60(1H,s),8.35(1H,s),8.06(1H,s),7.68(2H,m),7.31(2H,m),4.47(1H,dt,J=3.2  和.9.6Hz),4.02(3H,s),3.95(4H,m),3.41(4H,m),3.22~3.07(2H,m),2.51(1H,m),  1.93(1H,m),1.73~1.54(4H,m),1.39(2H,m),1.22(1H,m). |
|  122 (CD<sub>3</sub>OD) |   8.46(1H,s),8.38(1H,d,J=5.2Hz),8.20(1H,s),7.87(2H,d,J=8.8Hz),7.54(2H,d,  J=8.8Hz),7.10(1H,d,J=5.2Hz),4.43(1H,dt,J=4.4和10.4Hz),3.59(4H,m),  3.14(2H,m),2.51(1H,m),1.99(2H,m),1.92(2H,m),1.55(4H,m),1.45~1.23(4H,  m). |
|  124 (CD<sub>3</sub>OD) |   8.45(1H,s),8.38(1H,d,J=5.2Hz),8.20(1H,s),7.87(2H,dd,J=2.0和7.2Hz),  7.41(2H,dd,J=2.0和7.2Hz),7.09(1H,d,J=5.2Hz),4.43(1H,dt,J=10.0和1.1  Hz),4.17(1H,m),3.89(1H,m),3.80(1H,m),3.32(2H,m),3.13(2H,m),2.50(1H,  m),1.93(3H,m),1.74~1.23(9H,m). |
|   132  (CD<sub>3</sub>OD) |   8.58(1H,s),8.41(1H,s),8.30(2H,m),8.21(1H,s),7.57(1H,m),7.52(1H,s),7.42  (1H,m),7.39(1H,m),4.47(1H,m),4.03(3H,s),3.16(2H,m),2.51(1H,m),  1.92~1.22(8H,m). |
|   171  (CD<sub>3</sub>OD) |   8.57(1H,s),8.26(1H,s),8.17(1H,d,J=6.0Hz),7.58(2H,d,J=9.2Hz),7.23(3H,  m),4.65(1H,m),3.92(4H,m),3.34(4H,m),3.03(2H,m),2.97(1H,m),2.20(1H,m),  1.94~1.81(5H,m). |
|   177  (CD<sub>3</sub>OD) |   8.63(1H,s),8.28(1H,s),8.17(1H,d,J=6.4Hz),7.57(2H,d,J=9.2Hz),7.24(2H,d,  J=9.2Hz),7.23(1H,d,J=6.4Hz),3.96(1H,m),3.91(4H,t,J=5.2Hz),3.34(4H,t,  J=5.2Hz),3.27(2H,m),1.50(1H,m),0.84(1H,m),0.66(1H,m),0.57(1H,m),0.48  (1H,m). |
|   212  第1异构体  (CD<sub>3</sub>OD) |   8.81(1H,s),8.31(1H,s),8.18(1H,d,J=6.4Hz),7.59(2H,d,J=9.2Hz),7.29(1H,d,  J=6.4Hz),7.23(2H,d,J=9.2Hz),5.73(1H,s),4.67(1H,m),3.91(4H,t,J=4.8Hz),  3.33(4H,t,J=4.8Hz),3.10(2H,s),2.79(2H,m),2.30(3H,s),2.18~2.06(4H,m),  1.61(2H,m). |
|   212  第2异构体  (CD<sub>3</sub>OD) |   8.77(1H,s),8.29(1H,s),8.19(1H,d,J=6.2Hz),7.57(2H,m),7.27(1H,d,J=6.2  Hz),7.21(2H,m),5.82(1H,s),4.73(1H,m),3.90(4H,br s),3.21(4H,br s),3.09(2H,  s),2.59(2H,m),2.33(3H,s),2.08(4H,m),1.74(2H,m). |
|   213  (CD<sub>3</sub>OD) |   8.56(1H,s),8.33(1H,d,J=6.0Hz),8.26(1H,s),7.81(2H,d,J=8.8Hz),7.50(2H,d,  J=8.8Hz),7.24(1H,d,J=6.0Hz),4.46(1H,dt,J=3.6和9.6Hz),3.71(8H,m),  3.22~3.07(2H,m),3.51(1H,m),1.93(1H,m),1.74~1.54(4H,m),1.39(2H,m),1.23  (1H,m). |
|   221  (CD<sub>3</sub>OD) |   8.57(1H,s),8.32(1H,d,J=6.0Hz),8.26(1H,s),7.80(2H,d,J=8.8Hz),7.48(2H,d,  J=8.4Hz),7.25(1H,d,J=6.0Hz),4.46(1H,dt,J=4.4和10.0Hz),4.01(1H,m),  3.61(1H,m),3.54(1H,m),3.44(1H,m),3.37(3H,s),3.22~3.07(3H,m),2.51(1H,  m),1.93(3H,m),1.74~1.54(6H,m),1.38(2H,m),1.23(1H,m). |
|   225  (CD<sub>3</sub>OD) |   8.57(1H,s),8.33(1H,d,J=6.0Hz),8.27(1H,s),7.81(2H,d,J=8.8Hz),7.63(2H,d,  J=8.8Hz),7.26(1H,d,J=6.0Hz),4.66(1H,dt,J=4.0和10.0Hz),3.91(1H,m),  3.82(2H,m),3.71(1H,m),3.22~3.08(3H,m),2.51(1H,m),2.32(2H,m),1.93(1H,  m),1.73~1.54(4H,m),1.39(2H,m),1.22(1H,m). |
|   226  (CD<sub>3</sub>OD) |   8.56(1H,s),8.33(1H,d,J=5.6Hz),8.26(1H,s),7.81(2H,dd,J=1.6和8.8Hz),  7.59(2H,dd,J=1.6和8.8Hz),7.23(1H,d,J=5.6Hz),4.46(1H,dt,J=4.4和10.0  Hz),3.68(3H,s),3.68(1H,m),3.57(1H,m),3.14(2H,m),2.51(1H,m),2.12(2H,m),  1.94(2H,m),1.74~1.54(6H,m),1.39(2H,m),1.23(1H,m). |
|   227  (CD<sub>3</sub>OD) |   8.53(1H,s),8.36(1H,d,J=6.0Hz),8.25(1H,s),7.86(4H,m),7.23(1H,d,J=6.0  Hz),4.46(1H,dt,J=10.0和4.0Hz),4.15(1H,m),3.59(1H,br d,J=12.8Hz),3.40  (1H,m),3.14(4H,m),2.89(3H,s),2.51(1H,m),2.25(2H,br d,J=12.8Hz),1.92(3  H,m),1.74~1.54(4H,m),1.40(2H,m),1.23(1H,m). |
|   248  第1异构体  (CD<sub>3</sub>OD) |   8.74(1H,s),8.31(1H,s),8.20(1H,d,J=6.4Hz),7.61(2H,d,J=8.8Hz),7.25(3H,  m),3.92(4H,m),3.40(2H,s),3.36(4H,m),3.17(3H,m),3.00(2H,m). |
|   248  第2异构体  (CD<sub>3</sub>OD) |   8.77(1H,s),8.30(1H,s),8.22(1H,d,J=6.4Hz),7.61(1H,d,J=6.4Hz),7.25(3H,  m),3.92(4H,m),3.47(1H,m),3.40(2H,s),3.36(4H,m),3.18(2H,m),2.96(2H,m). |
|   251  (CD<sub>3</sub>OD) |   8.48(1H,s),8.38(1H,d,J=5.2Hz),8.20(1H,s),7.87(2H,m),7.40(2H,m),7.10  (1H,d,J=5.2Hz),4.18(1H,m),3.90(2H,m),3.80(1H,m),3.26(4H,m),1.91(2H,  m),1.51(3H,m),0.83(1H,m),0.66(1H,m),0.57(1H,m),0.50(1H,m). |
|   253  (CD<sub>3</sub>OD) |   8.60(1H,s),8.32(1H,d,J=6.0Hz),8.26(1H,s),7.78(2H,d,J=8.8Hz),7.60(2H,  d,J=8.8Hz),7.26(1H,d,J=6.0Hz),3.95(1H,m),3.58(4H,td,J=6.8和18.8Hz),  3.27(2H,m),1.96(4H,m),1.50(1H,m),0.84(1H,m),0.66(1H,m),0.58(1H,m),  0.49(1H,m). |
|  254 (CD<sub>3</sub>OD) |   8.60(1H,s),8.34(1H,d,J=5.6Hz),8.27(1H,s),7.99(2H,d,J=8.4Hz),7.79(2H,d,  J=8.4Hz),7.28(1H,d,J=5.6Hz),4.85(1H,m),4.12(1H,m),3.98(3H,m),3.53  (2H,m),3.26(1H,m),1.91(2H,m),1.69(2H,m),1.51(1H,m),0.85(1H,m),0.66  (1H,m),0.58(1H,m),0.49(1H,m). |
|  255 (CD<sub>3</sub>OD) |   8.67(1H,s),8.40(1H,d,J=5.2Hz),8.27(1H,s),7.88(2H,m),7.44(2H,m),7.13  (1H,d,J=5.2Hz),4.60(2H,d,J=9.2Hz),4.26(2H,J=9.2Hz),3.70(8H,m),3.57  (2H,s),3.03(2H,q,J=7.2Hz),1.36(3H,t,J=7.4Hz). |
|  258 (CD<sub>3</sub>OD) |   8.67(1H,s),8.41(1H,d,J=5.2Hz),8.27(1H,s),7.86(2H,d,J=8.8Hz),7.54(2H,d,  J=8.8Hz),7.13(1H,d,J=5.2Hz),4.60(2H,d,J=9.6Hz),4.26(2H,d,J=9.6Hz),  3.58(4H,m),3.57(2H,s),3.16(2H,q,J=7.6Hz),1.98(2H,m),1.92(2H,m),1.36  (3H,t,J=7.6Hz). |
|  259 (CD<sub>3</sub>OD) |   8.67(1H,s),8.42(1H,d,J=5.6Hz),8.27(1H,s),7.85(4H,m),7.15(1H,d,J=5.6  Hz),4.59(2H,d,J=9.6Hz),4.27(2H,d,J=9.6Hz),4.00(1H,m),3.57(2H,s),  3.34~3.13(6H,m),1.90(1H,m),1.65(1H,m),1.36(3H,t,J=7.2Hz),1.29(2H,m). |
|  260 (CD<sub>3</sub>OD) |   8.49(1H,s),8.38(1H,d,J=4.8Hz),8.20(1H,s),7.88(2H,m),7.43(2H,m),7.10  (1H,d,J=5.2Hz),3.94(1H,m),3.70(8H,m),3.26(2H,m),1.50(1H,m),0.84(1H,  m),0.66(1H,m),0.57(1H,m),0.49(1H,m). |
|  263 (CD<sub>3</sub>OD) |   8.48(1H,s),8.38(1H,d,J=5.2Hz),8.20(1H,s),7.87(2H,d,J=8.4Hz),7.40(2H,d,  J=8.4Hz),7.10(1H,d,J=5.2Hz),4.0(1H,br s),3.94(1H,m),3.75(1H,br s),3.53  (1H,m),3.42(1H,br s),3.37(3H,s),3.26(2H,m),1.92(2H,br s),1.59(2H,br s),  1.49(1H,m),1.29(1H,d,J=6.8Hz),0.83(1H,m),0.65(1H,m),0.56(1H,m),0.49  (1H,m). |
|  265 (CD<sub>3</sub>OD) |   8.63(1H,s),8.30(1H,d,J=6.0Hz),8.29(1H,s),7.60(2H,m),7.63(2H,m),7.32  (1H,d,J=6.0Hz),3.97(1H,m),3.68(4H,m),3.55(1H,m),3.29(3H,s),3.27(2H,  m),2.18~1.98(2H,m),1.50(1H,m),0.85(1H,m),0.65(1H,m),0.58(1H,m),0.49  (1H,m). |
|  266 (DMSO-d<sub>6</sub>) |   9.80(1H,s),8.56(1H,s),8.45(1H,d,J=5.2Hz),8.23(1H,s),7.88(2H,d,J=8.8  Hz),7.50(2H,m),7.16(2H,d,J=8.8Hz),4.96(1H,dd,J=30.4和3.2Hz),4.26  (1H,br d,J=30.6Hz),4.03(1H,m),3.63(1H,m),3.55(1H,m),3.48(1H,m),3.28  (2H,t,J=8.0Hz),1.90(1H,m),1.79(1H,m),1.39(1H,m),0.70(1H,m),0.52(2H,  m),0.43(1H,m) |
|  276 (CD<sub>3</sub>OD) |   8.71(1H,s),8.40(2H,d,J=5.6Hz),8.29(1H,s),7.87(2H,d,J=8.4Hz),7.59(2H,d,  J=8.4Hz),7.19(2H,d,J=5.6Hz),4.60(2H,d,J=9.2Hz),4.26(2H,d,J=9.2Hz),  3.94~3.70(5H,m),3.58(2H,s),3.16(2H,q,J=7.2Hz),1.36(3H,t,J=7.2Hz). |
|  277 (CD<sub>3</sub>OD) |   8.74(1H,s),8.37(1H,d,J=5.6Hz),8.30(1H,s),7.82(2H,m),7.58(2H,m),7.22  (1H,d,J=5.6Hz),4.59(2H,d,J=9.6Hz),4.26(2H,d,J=9.6Hz),3.69(4H,m),3.59  (1H,m),3.58(3H,s),3.38(2H,s),3.16(2H,q,J=7.5Hz),2.10(2H,m),1.36(3H,t,J  =7.6Hz). |
|  290 第1异构体 (CD<sub>3</sub>OD) |   8.59(1H,s),8.40(1H,d,J=5.2Hz),8.25(1H,s),7.87(2H,m),7.55(2H,m),7.13  (1H,d,J=5.2Hz),3.78~3.52(3H,m),3.48(2H,m),3.38(2H,s),3.35(1H,m),3.18  (2H,m),2.97(2H,m),2.02(1H,m),1.30(1H,m). |
|  290 第2异构体 (CD<sub>3</sub>OD) |   8.63(1H,s),8.40(1H,d,J=5.2Hz),8.25(1H,s),7.86(2H,m),7.55(2H,dd,J=6.8  和8.4Hz),7.12(1H,d,J=5.2Hz),3.80~3.43(6H,m),3.94(2H,m),3.38(2H,s),  3.34(1H,m),2.01(2H,m),1.26(1H,m). |
|  293 第1异构体 (CD<sub>3</sub>OD) |   8.59(1H,s),8.39(1H,d,J=5.6Hz),8.25(1H,s),7.89(2H,d,J=8.8Hz),7.45(2H,d,  J=8.8Hz),7.14(1H,d,J=5.6Hz),3.77(4H,m),3.48(1H,t,J=8.8Hz),3.39(2H,  s),3.19(2H,m),2.97(2H,m),2.83(4H,m),2.58(3H,s). |
|  293 第2异构体 (CD<sub>3</sub>OD) |   8.63(1H,s),8.40(2H,d,J=5.2Hz),8.25(1H,s),7.88(2H,d,J=8.4Hz),7.44(2H,d,  J=8.4Hz),7.13(1H,d,J=5.2Hz),3.73(4H,m),3.47(1H,m),3.38(2H,s),3.34(2H,  m),2.95(2H,m),2.70(4H,m),2.49(3H,s). |
|   295  第1异构体  (CD<sub>3</sub>OD) |   8.58(1H,s),8.39(1H,d,J=5.2Hz),8.25(1H,s),7.87(2H,d,J=8.8Hz),7.41(2H,d,  J=8.8Hz),7.13(1H,d,J=5.2Hz),3.54~3.35(6H,m),3.38(3H,s),3.37(2H,s),3.18  (2H,m),2.97(2H,m),1.93(1H,m),1.61(1H,m),1.25(2H,m). |
|   295  第2异构体  (CD<sub>3</sub>OD) |   8.63(1H,s),8.39(1H,d,J=5.2Hz),8.25(1H,s),7.87(2H,m),7.40(2H,m),7.12  (1H,d,J=5.2Hz),3.51(1H,m),3.45(2H,m),3.40(1H,m),3.38(3H,s),3.33(2H,s),  3.32(2H,m),3.25(2H,m),2.95(2H,m),1.92(1H,m),1.60(1H,m),1.26(2H,m). |
|   296  第1异构体  (CD<sub>3</sub>OD) |   8.59(1H,s),8.40(1H,d,J=5.2Hz),8.25(1H,s),7.87(2H,d,J=8.4Hz),7.54(2H,d,  J=8.4Hz),7.13(1H,d,J=5.2Hz),3.75~3.56(3H,m),3.47(1H,m),3.38(3H,s),  3.22(2H,s),3.18(2H,m),2.98(2H,m),2.10(2H,m),1.22(2H,m). |
|   296  第2异构体  (CD<sub>3</sub>OD) |   8.63(1H,s),8.40(1H,d,J=5.2Hz),8.25(1H,s),7.87(2H,d,J=8.4Hz),7.54(2H,d,  J=8.4Hz),7.13(1H,d,J=5.2Hz),3.72~3.45(6H,m),3.38(3H,s),3.34(1H,m),  3.27(2H,s),2.95(2H,m),2.10(2H,m),1.25(1H,m). |
|   297  第1异构体  (CD<sub>3</sub>OD) |   8.59(1H,s),8.40(1H,d,J=5.2Hz),8.25(1H,s),7.89(2H,d,J=8.0Hz),7.57(2H,d,  J=8.8Hz),7.14(1H,d,J=5.2Hz),3.93~3.73(4H,m),3.50~3.43(2H,m),3.38(2H,  s),3.19(2H,m),2.97(2H,m),1.25(2H,m). |
|   297  第2异构体  (CD<sub>3</sub>OD) |   8.63(1H,s),8.40(1H,d,J=5.2Hz),8.25(1H,s),7.88(2H,d,J=8.4Hz),7.56(2H,d,  J=8.4Hz),7.13(1H,d,J=5.2Hz),3.81(3H,m),3.47(2H,m),3.38(2H,s),3.36(1H,  m),3.26(2H,m),2.95(2H,m),1.27(2H,m). |
|   308  (DMSO-d<sub>6</sub>) |   9.24(1H,s),8.44(1H,s),8.29(1H,d,J=5.2Hz),8.14(1H,s),7.61(2H,d,J=8.8  Hz),6.96(1H,d,J=5.2Hz),6.85(2H,d,J=8.8Hz),4.47(1H,m),3.81(1H,dd,J=  11.6和3.2Hz),3.70(1H,dd,J=11.6和3.2Hz),3.67(4H,m),3.28(1H,m),  3.23~3.06(4H,m),2.97(4H,m),2.01(1H,m),1.62(1H,m),1.17(2H,m),0.82(1H,br  d,J=12.4Hz). |
|   309  (DMSO-d<sub>6</sub>) |   9.78(1H,s),8.50(1H,s),8.41(2H,d,J=5.2Hz),8.20(1H,s),8.06(1H,d,J=7.6  Hz),7.85(2H,d,J=8.8Hz),7.76(2H,d,J=8.8Hz),7.12(1H,d,7.6Hz),4.50(1H,  m),3.93(1H,m),3.82(3H,m),3.71(1H,dd,J=11.6和5.8Hz),3.31(2H,m),  3.24~3.07(5H,m),2.03(1H,m),1.67(3H,m),1.51(2H,qd,J=13.2和4.8Hz),1.18  (2H,m),0.83(1H,br d,J=12.4Hz). |
|   310  (DMSO-d<sub>6</sub>) |   9.75(1H,s),8.50(1H,s),8.40(1H,d,J=4.8Hz),8.20(1H,s),7.83(2H,d,J=8.8  Hz),7.46(2H,d,J=8.8Hz),7.10(1H,d,J=4.8Hz),4.49(1H,m),3.82(1H,dd,J=  16.2和2.8Hz),3.71(1H,dd,J=11.6和2.8Hz),3.40(4H,m),3.24~3.07(4H,m),  2.03(1H,m),1.77(4H,m),1.63(1H,br d,J=12.0Hz),1.18(2H,m),0.88~0.82(2H,  m). |
|   312  (DMSO-d<sub>6</sub>) |   9.74(1H,s),8.50(1H,s),8.40(1H,d,J=5.2Hz),8.20(1H,s),7.83(2H,d,J=8.4  Hz),7.29(2H,d,J=8.4Hz),7.10(1H,d,J=5.2Hz),4.74(1H,d,J=3.6Hz),4.49  (1H,m),3.82(1H,dd,J=11.2和2.4Hz),3.71(1H,d d,J=11.2和2.4Hz),3.67  (2H,m),3.23~3.07(7H,m),2.03(1H,m),1.64(3H,m),1.27(2H,m),1.18(2H,m),  0.83(1H,br d,J=12.0Hz). |
|   336  第1异构体  (DMSO-d<sub>6</sub>) |   9.62(1H,s),8.72(1H,s),8.44(1H,d,J=5.2Hz),8.24(1H,s),7.79(2H,d,J=8.4  Hz),7.15(3H,m),3.55(3H,m),3.33(2H,s),3.08(2H,m),2.82(2H,m),2.36(2H,t,J  =6.8Hz),1.82(4H,m). |
|   336  第2异构体  (DMSO-d<sub>6</sub>) |   9.56(1H,s),8.71(1H,s),8.39(1H,d,J=5.2Hz),8.20(1H,s),7.74(2H,d,J=9.2  Hz),7.10(3H,m),3.49(3H,m),3.40(2H,s),3.10(2H,m),2.84(2H,m),2.30(2H,t,J  =6.4Hz),1.78(4H,m). |
|   347  (DMSO-d<sub>6</sub>) |   9.31(1H,t,J=2.0Hz),9.24(1H,dd,J=6.0和1.2Hz),8.92(1H,d,J=14.4Hz),  8.81(1H,s),8.55(1H,d,J=2.8Hz),7.89(1H,m),7.82(1H,m),7.41(1H,m),7.34  (1H,m),7.15(1H,m),6.88(1H,br s),4.92(1H,m),4.42(1H,m),4.34(1H,m),4.18  (3H,s),3.28(1H,m),3.16(2H,m),2.89(1H,m),2.65(1H,m),2.02(1H,m),1.92(1H,  m),1.74(2H,m),1.23(1H,m),1.06(2H,m). |
|   348 |   9.61(1H,s),8.94(1H,s),8.80(1H,m),8.44(1H,d,J=5.2Hz),8.34(1H,s),7.24(2H, |
|  第1异构体 (DMSO-d<sub>6</sub>) |   m),7.18(1H,d,J=5.2Hz),7.01(1H,d,J=7.2Hz),3.85(2H,t,J=7.2Hz),3.57(1H,  dd,J=8.8和8.8Hz),3.33(2H,s),3.14(2H,m),2.83(2H,m),2.54(2H,t,J=7.6  Hz),2.07(2H,m). |
|  348 第2异构体 (DMSO-d<sub>6</sub>) |   9.56(1H,s),8.93(1H,s),8.77(1H,m),8.38(1H,d,J=5.2Hz),8.30(1H,s),7.19(2H,  m),7.12(1H,d,J=5.2Hz),6.95(1H,d,J=7.6Hz),3.80(2H,t,J=7.2Hz),3.49(1H,  m),3.27(2H,s),3.16(2H,m),2.85(2H,m),2.48(2H,t,J=7.6Hz),2.02(2H,m). |
实施例A:体外JAK激酶分析
根据以下Park et ah,Analytical Biochemistry 1999,269,94-104中描述的体外分析,针对JAK靶的抑制活性测试本发明化合物。使用杆状病毒在昆虫细胞中表达具有N-末端His标记的人JAK1(a.a.837-1142),JAK2(a.a.828-1132)和JAK3(a.a.781-1124)的催化域,再纯化。JAK1、JAK2或JAK3的催化活性是通过测定生物素化肽的磷酸化来分析的。该磷酸化肽是通过均时解析荧光法(homogenous time resolvedfluorescence,HTRF)检测的。针对每种激酶在反应物中测定化合物的IC50,所述反应物含有酶、ATP和500nM肽,在含有100mM NaCl、5mM DTT和0.1mg/mL(0.01%)BSA的50mM Tris(pH 7.8)缓冲溶液中。反应中的ATP浓度,JAK1为90μM,Jak2为30μM,JAK3为3μM。使反应在室温下进行1hr,然后用20μL的45mM EDTA、300nMSA-APC、6nM Eu-Py20的分析缓冲溶液(Perkin Elmer,Boston,MA)中止。与铕抗体结合进行40分钟,再在Fusion读板器(Perkin Elmer,Boston,MA)中测定HTRF信号。一些上述化合物根据此分析法测试。针对任一个上述JAK靶,具有100μM或更少的IC50的化合物被认为是有活性的。
激酶分析法的IC50数据表
实施例B:细胞分析
根据至少一种以下细胞分析针对JAK靶的抑制活性测试一种或多种本发明化合物。
为了生长,使依赖于细胞活素类以及由此JAK/STAT信号转导的癌细胞系在RPMI 1640、10%FBS和1nG/mL的适宜细胞活素中以6000细胞每孔辅板(96孔板格)。将化合物加至在DMSO/介质(最终浓度0.2%DMSO)中的细胞中,再在37℃、5%CO2孵育72小时。化合物对细胞存活力的作用使用CellTiter-Glo Luminescent细胞存活力分析(Promega)接着使用TopCount(Perkin Elmer,Boston,MA)定量进行评价的。化合物的可能的脱靶作用(off-target effect)是使用非-JAK驱动细胞系用相同分析读数器平行测定的。具有10μM或更少的IC50、具有针对JAK驱动增殖选择性的化合物被认为是有活性的。全部试验以双份进行。
以上细胞系亦可用于检测化合物对JAK激酶或潜在的下游底物例如STAT蛋白、Akt、Shp2或Erk的磷酸化的作用。这些试验可以在细胞因子因子整夜饥饿之后进行,接着与化合物短暂预孵育(2小时或更少),再进行1小时或更少的细胞因子刺激。然后从细胞中萃取蛋白,再通过类似于本领域训练的技术分析,包括西式印迹法或使用抗体的ELISA,所述抗体可以区分磷酸化蛋白和总蛋白。这些试验可使用正常细胞或癌症细胞,以研究化合物对肿瘤细胞存活生物学或者对炎性疾病介质的活性。例如,就后者而言,例如IL-6、IL-12、IL-23或IFN的细胞因子可用于刺激JAK活化,导致STAT蛋白的磷酸化,并且会可能导致转录模式化(通过阵列或qPCR技术评价)或者蛋白例如IL-17的产生和/或分泌。化合物抑制这些细胞因子介导的作用的能力可使用本领域常规技术测定。
本文的化合物在细胞模型上测试,该细胞模型设计用于评价它们抑制突变体JAK的效能和活性,例如在骨髓增生障碍中所见到的JAK2V617F突变体。这些试验通常使用血液系统的细胞因子依赖性细胞(例如BaF/3),在这些细胞中异位表达野生型或突变型JAK激酶(James,C,et al.Nature 434:1144-1148;Staerk,J.,et al.J.Biol.Chem.280:41893-41899)。终点包括化合物对细胞存活、增殖和磷酸化JAK、STAT、Akt或Erk蛋白的作用。
已经或者可以针对它们抑制T-细胞增殖的活性来评价本文的某些化合物。例如可以考虑第二细胞因子(例如JAK)驱动增殖分析的分析法,以及免疫抑制或者免疫活化抑制的简化分析法。以下简述此试验是如何进行的。外周血单核细胞(PBMC)是从人全血样品使用Ficoll Hypaque分离法制备的,T-细胞(级分2000)可从PBMC通过淘洗获得。新鲜分离的人T-细胞可以维持在培养介质中(RPMI 1640,补充10%胎牛血清、100U/ml青霉素、100μg/ml链霉素),密度为2x106细胞/ml,37℃,至多达2天。对于IL-2刺激的细胞增殖分析,首先将T-细胞用终浓度为10μg/mL的植物凝集素(PHA)处理72hr。用PBS洗涤一次之后,将6000细胞/孔辅板到96-孔板,再在培养介质中在100U/mL人IL-2(ProSpec-Tany TechnoGene;Rehovot,Israel)存在下用不同浓度的化合物处理。在37℃下将该板孵育72h,再使用CellTiter-Glo Luminescent试剂根据制造商建议的方案(Promega;Madison,WI)评价增殖指数。
实施例C:体内抗肿瘤效能
本发明化合物可以在免疫缺陷小鼠的人肿瘤移植物模型中进行评价。例如,INA-6浆细胞瘤细胞系的致瘤突变体可以用于移植到SCID小鼠皮下(Burger,R.,et al.Hematol J.2:42-53,2001)。然后可以将荷瘤动物随机分成药物或载剂治疗组,可以通过任意数目的常规途径包括口服、i.p.或使用植入泵的连续输注来施用不同剂量的化合物。使用测径器经时跟踪肿瘤生长。此外,可以在开始针对上述分析(实施例B)治疗之后任何时间采集肿瘤样品,以评价化合物对JAK活性和下游发信号途径的作用。此外,化合物的选择性可以使用通过其它已知激酶(例如BCR-ABL1)驱动的移植肿瘤模型例如K562肿瘤模型进行评价。
实施例D:鼠科动物皮肤接触迟发性超敏感性应答测试
还可针对它们在T细胞驱动的鼠科动物迟发性超敏感性测试模型中的效能测试本发明化合物。鼠科动物皮肤接触迟发型超敏感性(DTH)应答据认为是一种临床接触性皮炎以及其它T-淋巴细胞介导的皮肝免疫障碍例如银屑病的有效模型(Immunol Today.1998 Jan;19(1):37-44)。鼠科动物DTH具有银屑病的多种特征,包括免疫浸润、伴有炎性细胞因子增加、以及角质化细胞过度增殖。此外,临床上治疗银屑病有效的许多种药物亦是小鼠DTH应答的有效抑制剂(Agents Actions.1993Jan;38(1-2):116-21)。
在第0和1天,向它们剃过的腹部局部施用抗原2,4-二硝基-氟苯(DNFB)来使Balb/c小鼠致敏。在第5天,使用工程千分卡测定耳的厚度。记录测定结果并且用作基线。然后将两种动物的耳均通过局部施用浓度0.2%、总量20μL(内耳10μL,外耳10μL)的DNFB来激发。激发后24-72小时,再次测定耳。在两个致敏和激发期(第-1天至第7天)或者之前以及在整个激发期(通常是第4至7天的下午)给予测试化合物治疗。测试化合物(不同浓度)治疗是全身或者局部施用(治疗耳是局部施用)。与无治疗情况下相比,通过耳肿胀的减小来表征测试化合物的效能。引起20%或更多的减小的化合物被认为是有效的。在一些试验中,对小鼠激发但不致敏(阴性对照)。
测试化合物的抑制作用(抑制JAK-STAT途径的活性)可通过免疫组织化学分析进行确证。JAK-STAT途径的活化导致功能性转录因子的形成和易位。此外,免疫细胞的流入量和角质化细胞增殖增加亦将在耳中产生独特的表型变化,这是可以研究和定量的。使用与磷酸化STAT3(克隆58E12,Cell Signaling Technologies)的特异性相互作用的抗体,将甲醛固定和石蜡包埋的耳切片(在DTH模型的激发期之后采集)进行免疫组织化学分析。将小鼠耳用测试化合物、载剂或地塞米松(临床有效的银屑病治疗法)治疗,或者在供比较的DTH模型中不用任何治疗。测试化合物和地塞米松可在质和量上产生类似的转录变化,并且测试化合物和地塞米松均可减少浸润细胞的数目。全身和局部施用测试化合物可产生抑制作用,即,减少浸润细胞的数目和抑制转录变化。
实施例E:体内抗炎活性
本发明化合物可以或者已经在啮齿动物或非啮齿动物模型中进行评价,该模型设计用于复制简单或复杂的炎症应答。例如关节炎的啮齿动物模型可用于评价预防或治疗给予的化合物的治疗效果。这些模型包括但不限于小鼠或大鼠胶原诱导的关节炎、大鼠佐剂诱导的关节炎、和胶原抗体诱导的关节炎。自身免疫性疾病(包括但不限于多发性硬化、I型糖尿病、葡萄膜视网膜炎(uveoretinitis)、甲状腺病(thyroditis)、重症肌无力、免疫球蛋白肾病、心肌炎、气道过敏(哮喘)、狼疮或结肠炎)亦可用于评价本发明化合物的治疗效果。这些模型已大研究团体中建立并且是本领域技术人员熟知的(Current Protocols in Immunology,VoI 3.,Coligan,J.E.et al.,Wiley Press.;Methods in Molecular Biology:Vol.225,Inflammation Protocols.,Winyard,P.G.and Willoughby,D.A.,HumanaPress,2003.)。
实施例F:基于ABL1和T315I细胞的分析
可以将增殖和存活依赖于ABL1激酶的癌细胞系在RPMI 1640和10%FBS中以3000细胞/孔(96孔板格)辅板。可以将化合物添加到在DMSO/介质(终浓度0.2%DMSO)的细胞中,再在37℃、5%CO2下孵育72小时。化合物对细胞存活力的作用是使用CellTiter-Glo Luminescent细胞存活力分析法(Promega)接着使用TopCount(Perkin Elmer,Boston,MA)定量进行评价的。ABL1-依赖性细胞系可以包括天然依赖于ABL1活性的那些,或者设计依赖于ABL1活性的那些,或者设计依赖于ABL1活性的那些(例如BaF/3细胞)。后者可使用野生型ABL1或突变型ABL1(例如T315I ABL1)产生,从而可以评价化合物抑制ABL1激酶的不同突变体的活性。用相同的分析读数器,使用非-ABL1驱动的细胞系平行测试化合物的潜在的脱靶作用。具有IC50为10μM或更小并且针对JAK驱动增殖的选择性的化合物被认为是有效的。全部试验以双份或更多份进行。
以上细胞系可用于测试化合物对磷酸化of ABL1和/或ABL1底物例如STAT蛋白、Akt、Erk或Crkl的磷酸化的作用。在细胞与化合物孵育不同时间(通常为10分钟至4小时)之后进行这些试验,这取决于许多因素(例如感兴趣的磷-蛋白的半衰期)。然后从细胞中提取蛋白,再通过本领域技术人员熟知的技术分析,所述技术包括西式印迹法或者使用可区分磷酸化和总蛋白的抗体的ELISA。这些试验可使用正常细胞或者癌细胞以评价化合物对癌细胞或正常细胞的活性。
这些相同的细胞系可以用于检测以独特的或相同的化合物抑制ABL和JAK激酶的作用。例如,表达BCR-ABL1的BaF/3细胞(突变体或野生型)可用于评价化合物对由ABL1-激酶驱动的细胞的生长、存活和发信号的影响。然而,如果这些相同的细胞在活化JAK激酶的特定细胞因子(例如IL-3)存在下生长,则化合物的影响可以在ABL和JAK激酶均会有助于肿瘤细胞存活力和增殖的的细胞中进行评价。
实施例G:ABL1和T315I ABL1 HTRF分析
可以如下文所述针对ABL1激酶(野生型和T315I突变型)的抑制活性测试本文描述的化合物。ABL1激酶的催化域(残基27至C-末端)可是以N-末端His标记的并且通过杆状病毒在昆虫细胞中表达和纯化。它们可以以纯化形式购自Upstate Cell Signaling Solutions。ABL1和T315IABL1催化p28的磷酸化。该磷酸化的p28可通过均时解析荧光法(HTRF)检测。可以针对各种激酶在反应物中测定化合物的IC50,所述反应物含有:1-2nM ABL1或T3151 ABL1、500nM肽、35μM ATP(对于ABL1)和10μM ATP(对于T3151 ABL1)、在含有50mM Tris的pH 7.8分析缓冲溶液中的2.0%DMSO、100mM NaCl、10mM MgCl2、5mM DTT、0.6mg/mL BSA。反应通过在室温下进行一个半小时,并且可通过添加20μL另外的在分析缓冲溶液中的50mM NaCl、0.4mg/mL BSA、45mMEDTA、200nM SA-APC、4nM Eu-Py20来中止。可以将板在室温下孵育40min,然而可以在读板器上测定HTRF。
其它激酶分析可以以类似方式进行,其中使用商业可得的激酶和底物和/或通过服务提供商例如Invitrogen、Cerep或Upstate Biosciences的合约。
实施例H:体内抗肿瘤效能
本发明化合物可以在有免疫能力的小鼠或者免疫缺陷的小鼠中的人肿瘤移植物模型中进行评价。例如,已经用BCR-ABL1(野生型或突变型)转化的BaF/3细胞系的致瘤突变体可以用于皮下或静脉移植Balb/c或Balb/c nu/nu小鼠。然后可以将荷瘤细胞的动物随机分为药物治疗组和载剂治疗组,可以通过任何数目的常规途径施用不同剂量的化合物,所述常规途径包括口服、i.p.或使用植入泵连续输注。使用测径器经时跟踪瘤细胞生长(对于皮下接种),还可以跟踪动物存活(对于静脉接种)。此外,为了上述分析可以在治疗开始之后的任何时间采集瘤细胞样品,以评价化合物对激酶活性(JAK、ABL或其它)和下游信号途径的作用。此外,可以使用异种移植物肿瘤模型评价化合物的选择性,该型是通过其它′脱靶′激酶驱动的。
除了本文中所述那些外,根据前述说明书,本领域技术人员可理解本发明的各种改进形式。此类改进也意欲落入权利要求书的范围内。在本申请中引用的包括所有专利、专利申请和公开文献在内的各篇参考文献全文引入本文作为参考。
Claims (113)
1.式I化合物:
或其药学可接受的盐,其中:
环A是芳基或杂芳基;
L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)p-(亚芳基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q、(CR5R6)p-(亚杂芳基)-(CR5R6)q、(CR5R6)pO(CR5R6)q、(CR5R6)pS(CR5R6)q、(CR5R6)pC(O)(CR5R6)q、(CR5R6)pC(O)NRc(CR5R6)q、(CR5R6)pC(O)O(CR5R6)q、(CR5R6)pOC(O)(CR5R6)q、(CR5R6)pOC(O)NRc(CR5R6)q、(CR5R6)pNRc(CR5R6)q、(CR5R6)pNRcC(O)NRd(CR5R6)q、(CR5R6)pS(O)(CR5R6)q、(CR5R6)pS(O)NRc(CR5R6)q、(CR5R6)pS(O)2(CR5R6)q或(CR5R6)pS(O)2NRc(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基、亚芳基、C1-10亚杂环烷基或亚杂芳基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd;
Q是H、Cy1、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1,其中所述C1-6烷基、C2-6烯基或C2-6炔基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rbb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1;
X是H、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb或S(O)2NRcRd;
Y是H、Cy2、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1,其中所述C1-6烷基、C2-6烯基、C2-6炔基或C1-6卤代烷基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1;
R1、R2、R3、R4、R5和R6独立地选自H、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、(CH2)mCN、NO2、ORa、(CH2)mORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、NRcRd、(CH2)mNRcRd、NRcC(O)Rb、NRcS(O)2Rb和S(O)2NRcRd;
Cy1和Cy2独立地选自芳基、环烷基、杂芳基和杂环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1,其中所述在Cy1或Cy2上取代的C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基或杂环烷基进一步任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1;
Ra、Rb、Rc和Rd独立地选自H、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基和杂环烷基烷基,其中所述C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基或杂环烷基烷基任选被1、2、3、4或5个独立地选自下列的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
或者Rc和Rd与它们连接的N原子一起形成4-、5-、6-或7-元杂环烷基或杂芳基,各自任选被1、2或3个独立地选自以下的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
Ra1、Rb1、Rc1和Rd1独立地选自H、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基和杂环烷基烷基,其中所述C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基或杂环烷基烷基任选被1、2、3、4或5个独立地选自下列的取代基取代:C1-6烷基、卤素、CN、ORa、SRa、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)NRc2Rd2、NRc2C(O)ORa2、C(=NRg)NRc2Rd2、NRc2C(=NRg)NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、N&#160;RRcc22SS((OO))22RR1b2和S(O)2NRc2Rd2;
或者Rc1和Rd1与它们连接的N原子一起形成4-、5-、6-或7-元杂环烷基或杂芳基,各自任选被1、2或3个独立地选自以下的取代基取代:C1-6烷基、卤素、CN、ORa2、SRa2、C(O)Rb2、C(O)NRc2Rd2、C(O)ORa2、OC(O)Rb2、OC(O)NRc2Rd2、NRc2Rd2、NRc2C(O)Rb2、NRc2C(O)NRc2Rd2、NRc2C(O)ORa2、C(=NRg)NRc2Rd2、NRc2C(=NRg)NRc2Rd2、S(O)Rb2、S(O)NRc2Rd2、S(O)2Rb2、NRc2S(O)2Rb2和S(O)2NRc2Rd2;
Ra2、Rb2、Rc2和Rd2独立地选自H、C1-6烷基、C1-6卤代烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基和杂环烷基烷基,其中所述C1-6烷基、C1-6卤代烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、芳烷基、杂芳烷基、环烷基烷基或杂环烷基烷基任选被1、2或3个独立地选自以下的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
或者Rc2和Rd2与它们连接的N原子一起形成4-、5-、6-或7-元杂环烷基或杂芳基,各自任选被1、2或3个独立地选自以下的取代基取代:OH、CN、氨基、卤素、C1-6烷基、C1-6烷氧基、C1-6卤代烷基和C1-6卤代烷氧基;
Rg是H、CN或NO2;
m是0、1、2或3;
n是0或1;
p是0、1、2、3、4、5或6;和
q是0、1、2、3、4、5或6。
2.权利要求1的化合物或其药学可接受的盐,其中A是芳基。
3.权利要求1的化合物或其药学可接受的盐,其中A是苯基。
4.权利要求1的化合物或其药学可接受的盐,其中A是杂芳基。
5.权利要求1的化合物或其药学可接受的盐,其中A是吡唑基。
6.权利要求1的化合物或其药学可接受的盐,其中A是吡啶基。
7.权利要求1-6任一项的化合物或其药学可接受的盐,其中L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)P-(亚芳基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q、(CR5R6)p-(亚杂芳基)-(CR5R6)q、(CR5R6)pO(CR5R6)q、(CR5R6)pS(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基、亚芳基、C1-10亚杂环烷基或亚杂芳基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
8.权利要求1-6任一项的化合物或其药学可接受的盐,其中L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)P-(亚芳基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q、(CR5R6)p-(亚杂芳基)-(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基、亚芳基、C1-10亚杂环烷基或亚杂芳基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
9.权利要求1-6任一项的化合物或其药学可接受的盐,其中L是C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、(CR5R6)p-(C3-10亚环烷基)-(CR5R6)q、(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q,其中所述C1-8亚烷基、C2-8亚烯基、C2-8亚炔基、C3-10亚环烷基或C1-10亚杂环烷基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
10.权利要求1-6任一项的化合物或其药学可接受的盐,其中L是C1-8亚烷基或(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q,其中所述C1-8亚烷基或C3-10亚杂环烷基任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
11.权利要求1-6任一项的化合物或其药学可接受的盐,其中L是C1-8亚烷基,其任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
12.权利要求1-6任一项的化合物或其药学可接受的盐,其中L是(CR5R6)p-(C1-10亚杂环烷基)-(CR5R6)q,其任选被1、2或3个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、ORa、SRa、C(O)Rb、C(O)NRcRd、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)NRcRd、NRcC(O)ORa、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd、S(O)2Rb、NRcS(O)2Rb和S(O)2NRcRd。
13.权利要求1-6任一项的化合物或其药学可接受的盐,其中L是(CR5R6)pC(O)(CR5R6)q、(CR5R6)pC(O)NRc(CR5R6)q、(CR5R6)pC(O)O(CR5R6)q、(CR5R6)pOC(O)(CR5R6)q、(CR5R6)pOC(O)NRc(CR5R6)q、(CR5R6)pNRc(CR5R6)q、(CR5R6)pNRcC(O)NRd(CR5R6)q、(CR5R6)pS(O)(CR5R6)q、(CR5R6)pS(O)NRc(CR5R6)q、(CR5R6)pS(O)2(CR5R6)q或(CR5R6)pS(O)2NRc(CR5R6)q。
14.权利要求1-13任一项的化合物或其药学可接受的盐,其中Q是H、Cy1、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、NO2、ORa1或SRa1,其中所述C1-6烷基、C2-6烯基或C2-6炔基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
15.权利要求1-13任一项的化合物或其药学可接受的盐,其中Q是C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1。
16.权利要求1-13任一项的化合物或其药学可接受的盐,其中Q是Cy1、C(O)Rb1、S(O)2Rb1或ORa1。
17.权利要求1-16任一项的化合物或其药学可接受的盐,其中Cy1是芳基或环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
18.权利要求1-16任一项的化合物或其药学可接受的盐,其中Cy1是杂芳基或杂环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
19.权利要求1-18任一项的化合物或其药学可接受的盐,其中R1是H。
20.权利要求1-19任一项的化合物或其药学可接受的盐,其中R2是H。
21.权利要求1-19任一项的化合物或其药学可接受的盐,其中R2是C1-6烷基。
22.权利要求1-19任一项的化合物或其药学可接受的盐,其中R2是甲基。
23.权利要求1-19任一项的化合物或其药学可接受的盐,其中R2是C1-6烷氧基。
24.权利要求1-19任一项的化合物或其药学可接受的盐,其中R2是甲氧基。
25.权利要求1-24任一项的化合物或其药学可接受的盐,其中R3是H。
26.权利要求1-25任一项的化合物或其药学可接受的盐,其中R4是H。
27.权利要求1-26任一项的化合物或其药学可接受的盐,其中R5是H。
28.权利要求1-27任一项的化合物或其药学可接受的盐,其中R6是H。
30.权利要求1-29任一项的化合物或其药学可接受的盐,其中X是H、卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、CN、SRa、C(O)Rb、C(O)ORa、OC(O)Rb、OC(O)NRcRd、NRcC(O)NRcRd、C(=NRg)NRcRd、NRcC(=NRg)NRcRd、S(O)Rb、S(O)NRcRd或S(O)2Rb。
31.权利要求1-29任一项的化合物或其药学可接受的盐,其中X是NO2、ORa、C(O)NRcRd、NRcRd、NRcC(O)Rb、NRcC(O)ORa、NRcS(O)2Rb或S(O)2NRcRd。
32.权利要求1-29任一项的化合物或其药学可接受的盐,其中X是OCH3、OC6H5、NO2、NH2或N(CH2CH3)2。
33.权利要求1-29任一项的化合物或其药学可接受的盐,其中X是H。
34.权利要求1-33任一项的化合物或其药学可接受的盐,其中Y是C1-6烷基、C2-6烯基、C2-6炔基或C1-6卤代烷基,其中所述C1-6烷基、C2-6烯基或C2-6炔基任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
35.权利要求1-33任一项的化合物或其药学可接受的盐,其中Y是H、Cy2、卤素、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1或S(O)2NRc1Rd1。
36.权利要求1-33任一项的化合物或其药学可接受的盐,其中Y是H。
37.权利要求1-36任一项的化合物或其药学可接受的盐,其中Cy2是芳基或环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
38.权利要求1-36任一项的化合物或其药学可接受的盐,其中Cy是杂芳基或杂环烷基,各自任选被1、2、3、4或5个独立地选自以下的取代基取代:卤素、C1-6烷基、C2-6烯基、C2-6炔基、芳基、环烷基、杂芳基、杂环烷基、C1-6卤代烷基、卤代硫烷基、CN、NO2、ORa1、SRa1、C(O)Rb1、C(O)NRc1Rd1、C(O)ORa1、OC(O)Rb1、OC(O)NRc1Rd1、NRc1Rd1、NRc1C(O)Rb1、NRc1C(O)NRc1Rd1、NRc1C(O)ORa1、C(=NRg)NRc1Rd1、NRc1C(=NRg)NRc1Rd1、S(O)Rb1、S(O)NRc1Rd1、S(O)2Rb1、NRc1S(O)2Rb1和S(O)2NRc1Rd1。
39.权利要求1的化合物或其药学可接受的盐,其具有式IIIa、IIIb或IIIc:
40.权利要求1的化合物,其选自:
3-(4-(2-(4-(1H-咪唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-(哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-甲氧基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(1-甲基-1H-吡唑-3-基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(2-(4-苯氧基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
2-(4-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(异噁唑-5-羰基)哌啶-4-基)乙腈;
2-(1-(异噁唑-5-羰基)-4-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈;
2-(4-(4-(2-(3-(1H-四唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(异噁唑-5-羰基)哌啶-4-基)乙腈;
2-(1-(异噁唑-5-羰基)-4-(4-(2-(4-(吗啉代磺酰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈;
2-(1-(异噁唑-5-羰基)-4-(4-(2-(6-甲氧基吡啶-3-基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈;
2-(3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)氮杂环丁烷-3-基)乙腈;
2-(1-(环丙基磺酰基)-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
N-(4-(4-(1-(3-(氰基甲基)-1-(环丙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺;
2-(1-(环丙基磺酰基)-3-(4-(2-(3-(2-甲基嘧啶-4-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
2-(1-(环丙基磺酰基)-3-(4-(2-(4-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(哌啶-4-基)丙腈;
3-(1-(5-氟嘧啶-2-基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(1-(甲基磺酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(1-(苯基磺酰基)哌啶-4-基)丙腈;
3-(1-乙酰基哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(1-苯甲酰基哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
2-(4-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(环丙基磺酰基)哌啶-4-基)乙腈;
2-(1-(环丙基磺酰基)-4-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈;
4-(4-(1-(4-(氰基甲基)-1-(环丙基磺酰基)哌啶-4-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺;
4-(4-(1-(4-(氰基甲基)-1-(环丙基磺酰基)哌啶-4-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-羟乙基)苯甲酰胺;
4-(4-(1-(4-(氰基甲基)-1-(环丙基磺酰基)哌啶-4-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-环戊基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-甲氧基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
3-环戊基-3-(4-(2-(4-(哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(乙基磺酰基)哌啶-4-基)丁腈;
4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
N-(4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺;
4-(4-(1-(1-氰基-3-(1-(乙基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺;
4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(乙基磺酰基)哌啶-4-基)丁腈;
4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
N-(4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)乙酰胺;
4-(4-(1-(1-氰基-3-(1-(乙基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酰胺;
3-环戊基-3-(4-(2-(4-(4-(甲基磺酰基)哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丁腈;
4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
N-(4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺;
4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丁腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丁腈;
4-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(2,4-二氟苯甲酰基)哌啶-4-基)-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(4-(1-(1-氰基-3-(1-(1-甲基-1H-吡唑-3-基磺酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
N-(4-(4-(1-(1-氰基-3-(1-(2,4-二氟苯甲酰基)哌啶-4-基)丙烷-2-基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)乙酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酰胺;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-环戊基-3-(4-(5-甲基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲基-2-(苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲基-2-(4-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-甲氧基苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲基-2-(4-(哌嗪-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(二乙基氨基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(乙基(3-羟基丙基)氨基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯甲酸;
3-环戊基-3-(4-(5-甲基-2-(4-硝基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N-(2-羟乙基)苯甲酰胺;
3-环戊基-3-(4-(5-甲基-2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(4-氨基苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N-甲基苯甲酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)-N-(1-甲氧基丙烷-2-基)苯甲酰胺;
3-环戊基-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)-5-甲基嘧啶-4-基)-1H-吡唑-1-基)丙腈;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)甲磺酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基氨基甲酸甲酯;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲基嘧啶-2-基氨基)苯基)-2-(吡咯烷-1-基)乙酰胺;
3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(哌啶-4-基)丁腈;
2-(1-(环丙基磺酰基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
2-(1-(异噁唑-5-羰基)-4-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)哌啶-4-基)乙腈;
4-(1-(甲基磺酰基)哌啶-4-基)-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(乙基磺酰基)哌啶-4-基)-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
4-(1-(环丙基磺酰基)哌啶-4-基)-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丁腈;
3-环戊基-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-(2-甲基嘧啶-4-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸;
3-环戊基-3-(4-(5-甲氧基-2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)苯基)乙酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
3-环戊基-3-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(2-氧代-1,3-氧杂氮杂环己烷-3-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(2-氧代噁唑烷-3-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(3-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-甲基苯甲酰胺;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N,N-二甲基苯甲酰胺;
3-环戊基-3-(4-(2-(3-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-羟乙基)苯甲酰胺;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-甲氧基丙烷-2-基)苯甲酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙磺酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)甲磺酰胺;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基氨基甲酸甲酯;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(吡咯烷-1-基)乙酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸;
3-环戊基-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(4-(2-羟乙基)哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(3-氧代哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(环丙基甲基)-N-丙基苯甲酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(环丙基甲基)苯甲酰胺;
3-环戊基-3-(4-(2-(4-(3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-环戊基-3-(4-(2-(4-(2-氧代吡咯烷-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(2-氧代吡咯烷-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(3-(2-甲基嘧啶-4-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(2-氧代噁唑烷-3-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-(4-(2-羟乙基)哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-(3-氧代哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-(3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(3-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-(4-(2-(3-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-环戊基-3-(4-(2-(3-(4-(吡啶-3-基甲基)哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(3-甲氧基苯基)乙基)苯甲酰胺;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(吡啶-3-基甲基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((5-甲基异噁唑-3-基)甲基)苯甲酰胺;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-(1-甲基吡咯烷-2-基)乙基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(4-羟基-4-苯基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(3-(4-苄基-4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-环戊基-3-(4-(2-(3-(3-(吡啶-2-基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((四氢-2H-吡喃-4-基)甲基)苯甲酰胺;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-甲基哌啶-4-基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(4-苯基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(吡啶-2-基)乙基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(3-(3-氟苯基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
N-((3R)-1-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-(2-氧代咪唑啉-1-基)乙基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(4-(嘧啶-2-基)哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-(吡啶-3-基)乙基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(2-(甲氧基甲基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(2-甲氧基苄基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(4-苯氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(羟基甲基)环戊基)苯甲酰胺;
4-(4-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)哌嗪-1-基)苄腈;
N-(1-苄基吡咯烷-3-基)-3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰胺;
3-环戊基-3-(4-(2-(3-(4-苯基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(3-硝基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-硝基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丁基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(4-氨基苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丁基丙腈;
3-环丁基-3-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丁基-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丁基-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(4-(1H-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈;
3-环丙基-3-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2,6-(顺式)-二甲基吗啉-4-磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)苯甲酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-1-(甲基磺酰基)甲磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-3,5-二氟苯甲酰胺;
N’-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-N,N-二甲基磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-5-甲基异噁唑-3-甲酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)异噁唑-5-甲酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-3,5-二甲基异噁唑-4-甲酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-1-甲基-1H-吡唑-3-磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2,5-二氟苯甲酰胺;
3-环戊基-3-(4-(2-(4-(1,1-二氧化异噻唑烷-2-基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)丙腈;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-5-(2-甲基噻唑-4-基)噻吩-2-磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-6-甲基吡啶-2-磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-5-(吡啶-2-基)噻吩-2-磺酰胺;
5-氯-N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)噻吩-2-磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-6-吗啉代吡啶-3-磺酰胺;
四氢呋喃-3-基4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基氨基甲酸酯;
四氢呋喃-3-基3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基氨基甲酸酯;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-1-甲基-1H-吡唑-3-磺酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-N,N-二甲基磺酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(吡咯烷-1-基)乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(3-羟基吡咯烷-1-基)乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-羟基哌啶-1-基)乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(3-氧代哌嗪-1-基)乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-吗啉代乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-((四氢-2H-吡喃-4-基)甲基氨基)乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(2-(甲氧基甲基)吡咯烷-1-基)乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(环丙基甲基氨基)乙酰胺;
N-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(1-甲氧基丙烷-2-基氨基)乙酰胺;
2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈;
3-环戊基-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((四氢-2H-吡喃-4-基)甲基)苯甲酰胺;
3-环戊基-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(2-氧杂-6-氮杂三环[3.3.1.1(3,7)]癸-6-基羰基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(顺式-4-羟基环己基)-N-甲基苯甲酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-甲基-N-(四氢-2H-吡喃-4-基)苯甲酰胺;
3-环戊基-3-(4-(2-(4-(S*)-(4,4-二甲基-2-氧代-1-氧杂-3,7-二氮杂螺[4.4]壬烷-7-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(4,4-二甲基-1-氧杂-7-氮杂螺[4.4]壬烷-7-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(4-甲氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
N-((3S)-1-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(顺式-4-羟基环己基)苯甲酰胺;
3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环戊基丙腈;
(3S)-1-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈;
3-环戊基-3-(4-(2-(4-(3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-甲基哌啶-4-基)苯甲酰胺;
3-环戊基-3-(4-(2-(4-(3-氧代-2,8-二氮杂螺[4.5]癸烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(2-(4-(3-(二甲基氨基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰氨基)哌啶-1-甲酸乙酯;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(吡啶-2-基)吡咯烷-3-基)苯甲酰胺;
3-环戊基-3-(4-(2-(4-(3-(吡啶-2-基氧基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
1-(4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)-N,N-二甲基哌啶-4-甲酰胺;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(1-(二甲基氨基)-1-氧代丁烷-2-基)苯甲酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-甲基哌嗪-1-基)乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(3-羟基吡咯烷-1-基)乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(3-氧代哌嗪-1-基)乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-羟基哌啶-1-基)乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(4-(2-羟乙基)哌嗪-1-基)乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(环丙基甲基氨基)乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-吗啉代乙酰胺;
N-(3-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯基)-2-(乙基氨基)乙酰胺;
2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(4-(3-氧代吗啉代)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈;
2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(4-(2-氧代哌啶-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈;
2-(1-(4-(2-(4-(IH-吡唑-1-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-4-(5-甲基异噁唑-3-基氧基)环己基)乙腈;
2-(4-(5-甲基异噁唑-3-基氧基)-1-(4-(2-(3-(噁唑-5-基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环己基)乙腈;
3-(氰基甲基)-3-(4-(2-(4-吗啉代苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸;
4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸;
3-环丙基-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺;
2-(1-(乙基磺酰基)-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
2-(1-(乙基磺酰基)-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
2-(1-(乙基磺酰基)-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
2-(1-(乙基磺酰基)-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺;
3-环丙基-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈;
3-环丙基-3-(4-(2-(4-(2-氧杂-6-氮杂三环[3.3.1.1(3,7)]癸-6-基羰基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-(4-甲氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
(3R)-1-(4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈;
3-环丙基-3-(4-(2-(4-(3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-(3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
N-((3R)-1-(4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺;
3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-环丙基丙腈;
3-环丙基-3-(4-(2-(4-(3-(二甲基氨基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-(2-(4-(3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(4-(1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)氨基哌啶-1-甲酸乙酯;
2-(3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈;
1-(乙基磺酰基)-3-(4-(2-(4-(2-氧杂-6-氮杂三环[3.3.1.1(3,7)]癸-6-基羰基)苯基)氨基嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基乙腈;
(1-(乙基磺酰基)-3-4-(2-(4-((4-甲氧基哌啶-1-基)羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基氮杂环丁烷-3-基)乙腈;
1-(4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈;
2-(1-(乙基磺酰基)-3-(4-(2-(4-(3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
2-(1-(乙基磺酰基)-3-(4-(2-(4-(3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
2-(1-(乙基磺酰基)-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
N-(1-(4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺;
2-(3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈;
2-(3-(4-(2-(4-(3-(二甲基氨基)吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-1-(乙基磺酰基)氮杂环丁烷-3-基)乙腈;
2-(1-(乙基磺酰基)-3-(4-(2-(4-(3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)氮杂环丁烷-3-基)乙腈;
4-(4-(4-(1-(3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰氨基)哌啶-1-甲酸乙酯;
4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酸;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)苯甲酸;
3-(氰基甲基)-3-(4-(2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
3-(氰基甲基)-3-(4-(2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺;
3-(氰基甲基)-3-(4-(2-(4-(3-羟基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)-N-((5-甲基异噁唑-3-基)甲基)苯甲酰胺;
3-(4-(2-(4-(氮杂环丁烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)环丁烷甲腈;
3-(氰基甲基)-3-(4-(2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
3-(氰基甲基)-3-(4-(2-(4-(3-氟吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
3-(氰基甲基)-3-(4-(2-(4-(4-甲氧基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
3-(氰基甲基)-3-(4-(2-(4-(3-甲氧基吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
1-(4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-甲腈;
3-(4-(2-(4-(4-乙酰基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)-3-(氰基甲基)环丁烷甲腈;
N-(1-(4-(4-(1-(3-氰基-1-(氰基甲基)环丁基)-1H-吡唑-4-基)嘧啶-2-基氨基)苯甲酰基)吡咯烷-3-基)乙酰胺;
3-(氰基甲基)-3-(4-(2-(4-((3-桥)-3-羟基-8-氮杂双环[3.2.1]辛烷-8-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
3-(氰基甲基)-3-(4-(2-(4-(4-羟基哌啶-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)环丁烷甲腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(吗啉-4-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(吡咯烷-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
3-环戊基-3-(4-(5-甲氧基-2-(4-(4-甲基哌嗪-1-羰基)苯基氨基)嘧啶-4-基)-1H-吡唑-1-基)丙腈;
4-(4-(1-(2-氰基-1-环戊基乙基)-1H-吡唑-4-基)-5-甲氧基嘧啶-2-基氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺;
3-环戊基-3-[4-(2-{[4-(2-吡咯烷-1-基乙基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈;
3-(氰基甲基)-3-[4-(2-{[4-(2-吡咯烷-1-基乙基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(4-{2-[(4-吗啉-4-基苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)-3-(四氢-2H-吡喃-4-基)丙腈;
4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]-N-(四氢-2H-吡喃-4-基)苯甲酰胺;
3-[4-(2-{[4-(吡咯烷-1-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]-3-(四氢-2H-吡喃-4-基)丙腈;
3-[4-(2-{[4-(吗啉-4-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]-3-(四氢-2H-吡喃-4-基)丙腈;
3-{4-[2-({4-[(4-羟基哌啶-1-基)羰基]苯基}氨基)嘧啶-4-基]-1H-吡唑-1-基}-3-(四氢-2H-吡喃-4-基)丙腈;
3-{4-[2-({4-[(4-甲氧基哌啶-1-基)羰基]苯基}氨基)嘧啶-4-基]-1H-吡唑-1-基}-3-(四氢-2H-吡喃-4-基)丙腈;
1-{4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酰基}哌啶-4-甲腈;
3-(4-{2-[(4-{[(3R)-3-羟基吡咯烷-1-基]羰基}苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)-3-(四氢-2H-吡喃-4-基)丙腈;
3-(4-{2-[(4-{[(3S)-3-甲氧基吡咯烷-1-基]羰基}苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)-3-(四氢-2H-吡喃-4-基)丙腈;
(3S)-1-{4-[(4-{1-[2-氰基-1-(四氢-2H-吡喃-4-基)乙基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酰基}吡咯烷-3-甲腈;
1-[4-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]嘧啶-2-基}氨基)苯甲酰基]哌啶-4-甲腈;
1-{4-[(4-{1-[3-(氰基甲基)-1-(乙基磺酰基)氮杂环丁烷-3-基]-1H-吡唑-4-基}嘧啶-2-基)氨基]苯甲酰基}哌啶-4-甲腈;
3-环丙基-3-[4-(5-甲氧基-2-{[3-(1,3-噁唑-5-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈;
3-环丙基-3-(4-{5-甲氧基-2-[(3-硝基苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)丙腈;
3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)-N-(四氢-2H-吡喃-4-基)苯甲酰胺;
3-环丙基-3-[4-(5-甲氧基-2-{[3-(吡咯烷-1-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈;
3-环丙基-3-(4-{2-[(3-{[(3R)-3-羟基吡咯烷-1-基]羰基}苯基)氨基]-5-甲氧基嘧啶-4-基}-1H-吡唑-1-基)丙腈;
3-环丙基-3-(4-{5-甲氧基-2-[(3-{[(3S)-3-甲氧基吡咯烷-1-基]羰基}苯基)氨基]嘧啶-4-基}-1H-吡唑-1-基)丙腈;
(3S)-1-[3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)苯甲酰基]吡咯烷-3-甲腈;
3-环丙基-3-[4-(5-甲氧基-2-{[3-(吗啉-4-基羰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]丙腈;
3-环丙基-3-{4-[2-({3-[(4-羟基哌啶-1-基)羰基]苯基}氨基)-5-甲氧基嘧啶-4-基]-1H-吡唑-1-基]丙腈;
3-环丙基-3-{4-[5-甲氧基-2-({3-[(4-甲氧基哌啶-1-基)羰基]苯基}氨基)嘧啶-4-基]-1H-吡唑-1-基}丙腈;
1-[3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)苯甲酰基]哌啶-4-甲腈;
3-环丙基-3-(4-{2-[(3-{[(3-桥)-3-羟基-8-氮杂双环[3.2.1]辛-8-基]羰基}苯基)氨基]-5-甲氧基嘧啶-4-基}-1H-吡唑-1-基)丙腈;
3-({4-[1-(2-氰基-1-环丙基乙基)-1H-吡唑-4-基]-5-甲氧基嘧啶-2-基}氨基)-N-[(5-甲基异噁唑-3-基)甲基]苯甲酰胺;
3-[4-(2-{[3-(氮杂环丁烷-1-基羰基)苯基]氨基}-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]-3-环丙基丙腈;
3-(氰基甲基)-3-[4-(2-{[4-(2-氧代哌啶-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[4-(2-氧代-1,3-氧杂氮杂环己烷-3-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[4-(3-氧代吗啉-4-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[4-(2-氧代-1,3-噁唑烷-3-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[4-(2-氧代吡咯烷-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[4-(1H-吡唑-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[4-(1,3-噁唑-5-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[3-(1,3-噁唑-5-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(氰基甲基)-3-[4-(2-{[4-(吗啉-4-基磺酰基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈;
3-(4-{2-[(3-氨基苯基)氨基]-5-甲氧基嘧啶-4-基}-1H-吡唑-1-基)-3-环丙基丙腈;
3-环丙基-3-[4-(2-{[3-(1,1-二氧化异噻唑烷-2-基)苯基]氨基}-5-甲氧基嘧啶-4-基)-1H-吡唑-1-基]丙腈;
4-[1-(2,4-二氟苯甲酰基)哌啶-4-基]-3-{4-[5-甲氧基-2-(吡啶-3-基氨基)嘧啶-4-基]-1H-吡唑-1-基]丁腈;和
3-(氰基甲基)-3-[4-(2-{[3-(2-氧代吡咯烷-1-基)苯基]氨基}嘧啶-4-基)-1H-吡唑-1-基]环丁烷甲腈,
或其药学可接受的盐。
41.一种组合物,其包含权利要求1至40任一项的化合物或其药学可接受的盐,以及至少一种药学可接受的载体。
42.权利要求41的组合物,其适用于局部施用。
43.调节一种或多种激酶活性的方法,该方法包括使该激酶与权利要求1至40任一项的化合物接触。
44.权利要求43的方法,其中至少一种激酶是Ser/Thr激酶。
45.权利要求44的方法,其中该Ser/Thr激酶是受体Ser/Thr激酶。
46.权利要求44的方法,其中该Ser/Thr激酶是非受体Ser/Thr激酶。
47.权利要求44的方法,其中该Ser/Thr激酶是TGF-βR、PKA、PKG、PKC、CaM-激酶、磷酸化酶激酶、MEKK、ERK、MAPK、Akt或mTOR。
48.权利要求43的方法,其中至少一种激酶是Tyr激酶。
49.权利要求48的方法,其中该Tyr激酶是受体Tyr激酶。
50.权利要求49的方法,其中该受体Tyr激酶是EGFR、HER2、HER3、HER4、INS-R、IGF-1R、IR-R、PDGFαR、PDGFβR、CSFIR、KIT、FLK-II、KDR/FLK-1、FLK-4、flt-1、FGFR1、FGFR2、FGFR3、FGFR4、c-Met、Ron、Sea、TRKA、TRKB、TRKC、FLT3、VEGFR/Flt2、Flt4、EphA1、EphA2、EphA3、EphB2、EphB4或Tie2。
51.权利要求48的方法,其中该Tyr激酶是非受体Tyr激酶。
52.权利要求51的方法,其中该非受体Tyr激酶是Src、Fyn、Lck、Fgr、Btk、Fak、SYK、FRK、JAK或ABL。
53.权利要求52的方法,其中该非受体Tyr激酶是JAK。
54.权利要求53的方法,其中所述JAK是JAK1、JAK2、JAK3或TYK2。
55.权利要求53的方法,其中所述JAK是JAK1或JAK2。
56.权利要求53的方法,其中所述JAK是JAK2。
57.权利要求53的方法,其中所述JAK是突变体。
58.权利要求57的方法,其中所述突变体JAK携带V617F、F537-K539delinsL、H538QK539L、K539L或在JAK2的突变中的N542-E543del。
59.权利要求43的方法,其中所述调节是抑制。
60.权利要求43的方法,其中所述化合物是一种激酶超过另一种激酶的选择性抑制剂。
61.权利要求43的方法,其中所述化合物是JAK2超过JAK1、JAK3和TYK2的选择性抑制剂。
62.权利要求43的方法,其中该化合物抑制JAK2。
63.权利要求43的方法,其中一种以上的式I化合物用于抑制一种激酶的活性。
64.权利要求63的方法,其中该激酶是JAK2。
65.权利要求43的方法,其中一种以上的式I化合物用于抑制一种以上激酶。
66.权利要求65的方法,其中至少一种激酶是JAK2。
67.权利要求43的方法,其中该化合物与另一种激酶抑制剂组合使用以抑制一种激酶的活性。
68.权利要求67的方法,其中该激酶是JAK2。
69.权利要求43的方法,其中其中该化合物与另一种激酶抑制剂组合使用以抑制一种以上激酶的活性。
70.权利要求69的方法,其中至少一种激酶是JAK2。
71.权利要求69的方法,其中至少两种激酶是ABL1和JAK2。
72.治疗患者疾病的方法,其中所述疾病与一种或多种激酶的异常活性有关,该方法包括给所述患者施用治疗有效量的权利要求1至40任一项的化合物。
73.权利要求72的方法,其中该疾病的特征是JAK的异常活性。
74.权利要求72的方法,其中施用一种以上式I化合物。
75.权利要求72的方法,其中该化合物与另一激酶抑制剂组合施用。
76.权利要求72的方法,其中所述疾病是同种异体移植物排斥或移植物抗宿主病。
77.权利要求72的方法,其中所述疾病是自身免疫性疾病。
78.权利要求77的方法,其中所述自身免疫性疾病是皮肤障碍、多发性硬化、类风湿性关节炎、幼年型关节炎、I型糖尿病、狼疮、炎性肠病、克罗恩病、重症肌无力、免疫球蛋白肾病、心肌炎或自身免疫性甲状腺障碍。
79.权利要求77的方法,其中所述自身免疫性疾病是大疱性皮肤障碍。
80.权利要求79的方法,其中所述大疱性皮肤障碍是寻常天疱疮(PV)或大疱性类天疱疮(BP)。
81.权利要求77的方法,其中所述疾病是皮肤障碍。
82.权利要求81的方法,其中所述皮肤障碍是特应性皮炎、银屑病、皮肤致敏、皮肤刺激、皮疹、接触性皮炎或过敏性接触性致敏。
83.权利要求77的方法,其中所述疾病是病毒病。
84.权利要求83的方法,其中所述病毒病是EB病毒(EBV)、乙型肝炎、丙型肝炎、HIV、HTLV1、水痘-带状疱疹病毒(VZV)或人乳头状瘤病毒(HPV)。
85.权利要求77的方法,其中所述疾病是癌症。
86.权利要求85的方法,其中所述癌症是实体瘤。
87.权利要求85的方法,其中所述癌症是前列腺癌、肾癌、肝癌、乳癌、肺癌、甲状腺癌、卡波西肉瘤、卡斯尔曼氏病或胰腺癌。
88.权利要求85的方法,其中所述癌症是前列腺癌。
89.权利要求85的方法,其中所述癌症是血液性癌症。
90.权利要求85的方法,其中所述癌症是淋巴瘤、白血病或多发性骨髓瘤。
91.权利要求85的方法,其中所述癌症是急性成淋巴细胞性白血病(ALL)、慢性骨髓单核细胞性白血病(CMML)、慢性髓细胞样白血病(CML)、非典型性CML或非典型性CMML。
92.权利要求72的方法,其中所述患者是幼年个体。
93.权利要求85的方法,其中所述癌症是皮肤癌症。
94.权利要求93的方法,其中所述皮肤癌症是表皮T-细胞淋巴瘤或表皮B-细胞淋巴瘤。
95.权利要求85的方法,其中所述癌症是多发性骨髓瘤。
96.权利要求77的方法,其中所述疾病的特征是突变体JAK2。
97.权利要求96的方法,其中所述突变体JAK2的至少一种突变位于所述JAK2的假-激酶区域。
98.权利要求77的方法,其中所述疾病是骨髓增生障碍。
99.权利要求98的方法,其中所述骨髓增生障碍(MPD)是真性红细胞增多(PV)、特发性血小板增多症(ET)、伴有骨髓纤维变性的髓样化生(MMM)、慢性髓细胞性白血病(CML)、慢性骨髓单核细胞性白血病(CMML)、嗜酸细胞过多综合征(HES)、特发性骨髓纤维变性(IMF)或系统性肥大细胞病(SMCD)。
100.权利要求77的方法,其中所述疾病是炎性疾病。
101.权利要求100的方法,其中所述疾病是眼的炎性疾病。
102.权利要求101的方法,其中所述疾病是虹膜炎、葡萄膜炎、巩膜炎或结膜炎。
103.权利要求100的方法,其中所述疾病是呼吸道的炎性疾病。
104.权利要求103的方法,其中所述炎性疾病与上呼吸道有关。
105.权利要求100的方法,其中所述炎性疾病与下呼吸道有关。
106.权利要求100的方法,其中所述炎性疾病是炎性肌病。
107.权利要求100的方法,其中所述炎性疾病是心肌炎。
108.权利要求77的方法,其中所述疾病是局部缺血再灌注或与局部缺血性事件有关的。
109.权利要求77的方法,其中所述疾病是起因于癌症或与癌症有关的食欲缺乏或恶病质。
110.权利要求77的方法,其中所述疾病是起因于癌症或与癌症有关的疲劳。
111.治疗患者自身免疫性疾病、皮肤障碍、病毒病、癌症或骨髓增生障碍的方法,该方法包括给所述患者施用治疗有效量的权利要求1至40任一项的化合物。
112.权利要求111的方法,其中施用一种以上式I化合物。
113.权利要求111的方法,其中该式I化合物与其它激酶抑制剂组合施用。
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US98860607P | 2007-11-16 | 2007-11-16 | |
| US60/988606 | 2007-11-16 | ||
| PCT/US2008/083319 WO2009064835A1 (en) | 2007-11-16 | 2008-11-13 | 4-pyrazolyl-n-arylpyrimidin-2-amines and 4-pyrazolyl-n-heteroarylpyrimidin-2-amines as janus kinase inhibitors |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| CN101910152A true CN101910152A (zh) | 2010-12-08 |
| CN101910152B CN101910152B (zh) | 2014-08-06 |
Family
ID=40380038
Family Applications (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| CN200880123789.2A Active CN101910152B (zh) | 2007-11-16 | 2008-11-13 | 作为janus激酶抑制剂的4-吡唑基-n-芳基嘧啶-2-胺和4-吡唑基-n-杂芳基嘧啶-2-胺 |
Country Status (21)
| Country | Link |
|---|---|
| US (1) | US8309718B2 (zh) |
| EP (1) | EP2220068B1 (zh) |
| JP (1) | JP5480813B2 (zh) |
| KR (1) | KR101580482B1 (zh) |
| CN (1) | CN101910152B (zh) |
| AU (1) | AU2008321046B2 (zh) |
| BR (1) | BRPI0820544A2 (zh) |
| CA (1) | CA2704599C (zh) |
| CO (1) | CO6280420A2 (zh) |
| CR (1) | CR11430A (zh) |
| EA (1) | EA020777B1 (zh) |
| EC (1) | ECSP10010263A (zh) |
| ES (1) | ES2569528T3 (zh) |
| HK (1) | HK1147476A1 (zh) |
| IL (1) | IL205571A (zh) |
| MX (1) | MX2010005300A (zh) |
| MY (1) | MY152948A (zh) |
| NZ (1) | NZ585139A (zh) |
| UA (1) | UA104849C2 (zh) |
| WO (1) | WO2009064835A1 (zh) |
| ZA (1) | ZA201004055B (zh) |
Cited By (18)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103102359A (zh) * | 2011-11-15 | 2013-05-15 | 江苏先声药物研究有限公司 | 嘧啶类化合物及其应用 |
| WO2014075318A1 (zh) * | 2012-11-19 | 2014-05-22 | 江苏先声药业有限公司 | 嘧啶类化合物及其应用 |
| CN104583216A (zh) * | 2012-06-29 | 2015-04-29 | Ym生物科学澳大利亚股份有限公司 | 苯基氨基嘧啶双环化合物及其用途 |
| CN104860941A (zh) * | 2014-02-25 | 2015-08-26 | 上海海雁医药科技有限公司 | 2,4-二取代苯-1,5-二胺衍生物及其应用以及由其制备的药物组合物和药用组合物 |
| CN105189509A (zh) * | 2013-03-06 | 2015-12-23 | 因赛特公司 | 用于制备jak抑制剂的方法及中间体 |
| WO2017016463A1 (zh) * | 2015-07-24 | 2017-02-02 | 上海海雁医药科技有限公司 | Egfr抑制剂及其药学上可接受的盐和多晶型物及其应用 |
| CN105452239B (zh) * | 2013-05-17 | 2017-11-21 | 因赛特公司 | 作为jak抑制剂的联吡唑衍生物 |
| CN112142731A (zh) * | 2019-06-28 | 2020-12-29 | 成都赜灵生物医药科技有限公司 | 一种2,4-二取代嘧啶衍生物及其制备方法和用途 |
| WO2020259683A1 (zh) * | 2019-06-28 | 2020-12-30 | 成都赜灵生物医药科技有限公司 | 2,4-二取代嘧啶衍生物及其制备方法和用途 |
| CN114181199A (zh) * | 2020-09-15 | 2022-03-15 | 成都赜灵生物医药科技有限公司 | 2,4-二取代嘧啶衍生物及其制备方法和用途 |
| US11304949B2 (en) | 2018-03-30 | 2022-04-19 | Incyte Corporation | Treatment of hidradenitis suppurativa using JAK inhibitors |
| CN114874189A (zh) * | 2021-02-05 | 2022-08-09 | 深圳市塔吉瑞生物医药有限公司 | 取代的杂芳基衍生物及其组合物及用途 |
| CN115413278A (zh) * | 2020-03-23 | 2022-11-29 | 丸仁制药株式会社 | 新型嘧啶衍生物以及包含其的神经退行性疾病和癌症的预防或治疗用组合物 |
| CN115594664A (zh) * | 2022-11-25 | 2023-01-13 | 英矽智能科技(上海)有限公司(Cn) | 一类螺环衍生物作为kif18a抑制剂 |
| US11685731B2 (en) | 2020-06-02 | 2023-06-27 | Incyte Corporation | Processes of preparing a JAK1 inhibitor |
| US11833152B2 (en) | 2018-02-16 | 2023-12-05 | Incyte Corporation | JAK1 pathway inhibitors for the treatment of cytokine-related disorders |
| WO2024041397A1 (en) * | 2022-08-22 | 2024-02-29 | Hangzhou Highlightll Pharmaceutical Co., Ltd | Jak1/jak2/tyk2 inhibitors for topical treatment of dermatological diseases |
| US11957661B2 (en) | 2020-12-08 | 2024-04-16 | Incyte Corporation | JAK1 pathway inhibitors for the treatment of vitiligo |
Families Citing this family (88)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2005105814A1 (en) * | 2004-04-28 | 2005-11-10 | Incyte Corporation | Tetracyclic inhibitors of janus kinases |
| SI2474545T1 (sl) | 2005-12-13 | 2017-03-31 | Incyte Holdinges Corporation | Heteroarilno substituirani pirolo(2,3-b)piridini in pirolo(2,3-b)pirimidini kot zaviralci janusove kinaze |
| WO2008079965A1 (en) | 2006-12-22 | 2008-07-03 | Incyte Corporation | Substituted heterocycles as janus kinase inhibitors |
| SG182198A1 (en) * | 2007-06-13 | 2012-07-30 | Incyte Corp | Salts of the janus kinase inhibitor (r)-3-(4-(7h-pyrrolo[2,3-d]pyrimidin-4-yl)-1h-pyrazol-1-yl)-3-cyclopentylpropanenitrile |
| CL2008001709A1 (es) | 2007-06-13 | 2008-11-03 | Incyte Corp | Compuestos derivados de pirrolo [2,3-b]pirimidina, moduladores de quinasas jak; composicion farmaceutica; y uso en el tratamiento de enfermedades tales como cancer, psoriasis, artritis reumatoide, entre otras. |
| FR2938537B1 (fr) | 2008-11-14 | 2012-10-26 | Sanofi Aventis | Derives de carbamates d'alkyl-heterocycles, leur preparation et leur application en therapeutique. |
| JOP20190230A1 (ar) | 2009-01-15 | 2017-06-16 | Incyte Corp | طرق لاصلاح مثبطات انزيم jak و المركبات الوسيطة المتعلقة به |
| TW201100429A (en) | 2009-05-22 | 2011-01-01 | Incyte Corp | N-(hetero)aryl-pyrrolidine derivatives of pyrazol-4-yl-pyrrolo[2,3-d]pyrimidines and pyrrol-3-yl-pyrrolo[2,3-d]pyrimidines as janus kinase inhibitors |
| NZ596374A (en) | 2009-05-22 | 2014-01-31 | Incyte Corp | 3-[4-(7h-pyrrolo[2,3-d]pyrimidin-4-yl)-1h-pyrazol-1-yl]octane- or heptane-nitrile as jak inhibitors |
| WO2011028685A1 (en) | 2009-09-01 | 2011-03-10 | Incyte Corporation | Heterocyclic derivatives of pyrazol-4-yl-pyrrolo[2,3-d]pyrimidines as janus kinase inhibitors |
| US20110207736A1 (en) * | 2009-12-23 | 2011-08-25 | Gatekeeper Pharmaceuticals, Inc. | Compounds that modulate egfr activity and methods for treating or preventing conditions therewith |
| WO2011098673A1 (en) * | 2010-02-10 | 2011-08-18 | Genon Biotechnologies Oy | Dual activity kinase domains and uses thereof |
| MX2012009541A (es) * | 2010-02-18 | 2012-10-01 | Incyte Corp | Derivados de ciclobutano y metilciclobutano como inhibidores de janus cinasa. |
| KR102172742B1 (ko) | 2010-03-10 | 2020-11-02 | 인사이트 홀딩스 코포레이션 | Jak1 저해제로서의 피페리딘4일 아제티딘 유도체 |
| GB201007286D0 (en) | 2010-04-30 | 2010-06-16 | Astex Therapeutics Ltd | New compounds |
| SG185567A1 (en) | 2010-05-21 | 2012-12-28 | Incyte Corp | Topical formulation for a jak inhibitor |
| DK2576541T3 (en) | 2010-06-04 | 2016-05-30 | Hoffmann La Roche | Aminopyrimidine AS LRRK2 MODULATORS |
| EP2638018A1 (en) * | 2010-11-09 | 2013-09-18 | Cellzome Limited | Pyridine compounds and aza analogues thereof as tyk2 inhibitors |
| EP3590933B1 (en) | 2010-11-10 | 2021-01-06 | Genentech, Inc. | Pyrazole aminopyrimidine derivatives as lrrk2 modulators |
| ES2536415T3 (es) | 2010-11-19 | 2015-05-25 | Incyte Corporation | Pirrolopiridinas y pirrolopirimidinas sustituidas heterocíclicas como inhibidores de JAK |
| WO2012068450A1 (en) | 2010-11-19 | 2012-05-24 | Incyte Corporation | Cyclobutyl substituted pyrrolopyridine and pyrrolopyrimidine derivatives as jak inhibitors |
| GB201020179D0 (en) | 2010-11-29 | 2011-01-12 | Astex Therapeutics Ltd | New compounds |
| CN103732226B (zh) | 2011-02-18 | 2016-01-06 | 诺瓦提斯药物公司 | mTOR/JAK抑制剂组合疗法 |
| WO2012139930A1 (en) * | 2011-04-11 | 2012-10-18 | Nerviano Medical Sciences S.R.L. | Pyrazolyl-pyrimidine derivatives as kinase inhibitors |
| JP5876146B2 (ja) | 2011-06-20 | 2016-03-02 | インサイト・ホールディングス・コーポレイションIncyte Holdings Corporation | Jak阻害剤としてのアゼチジニルフェニル、ピリジル、またはピラジニルカルボキサミド誘導体 |
| JP2014521725A (ja) | 2011-08-10 | 2014-08-28 | ノバルティス・ファルマ・アクチェンゲゼルシャフト | JAKPI3K/mTOR併用療法 |
| TW201313721A (zh) | 2011-08-18 | 2013-04-01 | Incyte Corp | 作為jak抑制劑之環己基氮雜環丁烷衍生物 |
| UA111854C2 (uk) | 2011-09-07 | 2016-06-24 | Інсайт Холдінгс Корпорейшн | Способи і проміжні сполуки для отримання інгібіторів jak |
| WO2013043964A1 (en) * | 2011-09-22 | 2013-03-28 | Merck Sharp & Dohme Corp. | Acyclic cyanoethylpyrazoles as janus kinase inhibitors |
| GB201118652D0 (en) | 2011-10-28 | 2011-12-07 | Astex Therapeutics Ltd | New compounds |
| GB201118656D0 (en) | 2011-10-28 | 2011-12-07 | Astex Therapeutics Ltd | New compounds |
| GB201118675D0 (en) | 2011-10-28 | 2011-12-14 | Astex Therapeutics Ltd | New compounds |
| GB201118654D0 (en) | 2011-10-28 | 2011-12-07 | Astex Therapeutics Ltd | New compounds |
| AU2012345732B2 (en) | 2011-11-30 | 2016-07-14 | Emory University | Antiviral JAK inhibitors useful in treating or preventing retroviral and other viral infections |
| US9193733B2 (en) | 2012-05-18 | 2015-11-24 | Incyte Holdings Corporation | Piperidinylcyclobutyl substituted pyrrolopyridine and pyrrolopyrimidine derivatives as JAK inhibitors |
| GB201209609D0 (en) | 2012-05-30 | 2012-07-11 | Astex Therapeutics Ltd | New compounds |
| GB201209613D0 (en) | 2012-05-30 | 2012-07-11 | Astex Therapeutics Ltd | New compounds |
| SG10201610869TA (en) | 2012-06-26 | 2017-02-27 | Del Mar Pharmaceuticals | Methods for treating tyrosine-kinase-inhibitor-resistant malignancies in patients with genetic polymorphisms or ahi1 dysregulations or mutations employing dianhydrogalactitol, diacetyldianhydrogalacti |
| US9546152B2 (en) | 2012-10-23 | 2017-01-17 | Merck Sharp & Dohme Corp. | 2-pyridyloxy-3-substituted-4-nitrile orexin receptor antagonists |
| SG10201703533VA (en) | 2012-11-01 | 2017-06-29 | Incyte Corp | Tricyclic fused thiophene derivatives as jak inhibitors |
| JP6293770B2 (ja) | 2012-11-05 | 2018-03-14 | ナント ホールディングス アイピー,エルエルシー | ヘッジホッグシグナル伝達経路阻害剤としての環状スルホンアミド含有誘導体 |
| HUE055894T2 (hu) | 2012-11-15 | 2021-12-28 | Incyte Holdings Corp | A ruxolitinib nyújtott felszabadulású dózisformái |
| SG10201600149VA (en) | 2012-11-21 | 2016-02-26 | Ptc Therapeutics Inc | Substituted reverse pyrimidine bmi-1 inhibitors |
| WO2014146249A1 (en) * | 2013-03-19 | 2014-09-25 | Merck Sharp & Dohme Corp. | Geminally substituted cyanoethylpyrazolo pyridones as janus kinase inhibitors |
| GB201307577D0 (en) | 2013-04-26 | 2013-06-12 | Astex Therapeutics Ltd | New compounds |
| EP3004057B1 (en) * | 2013-06-05 | 2018-07-25 | C&C Research Laboratories | Heterocyclic derivatives and their use as stat 3 inhibitors |
| EA201690357A1 (ru) | 2013-08-07 | 2016-07-29 | Инсайт Корпорейшн | Лекарственные формы с замедленным высвобождением для ингибитора jak1 |
| NZ748260A (en) | 2013-08-30 | 2020-01-31 | Ptc Therapeutics Inc | Substituted pyrimidine bmi-1 inhibitors |
| CN105980381A (zh) | 2013-11-08 | 2016-09-28 | 拜耳医药股份有限公司 | 取代的尿嘧啶及其用途 |
| US10584115B2 (en) | 2013-11-21 | 2020-03-10 | Ptc Therapeutics, Inc. | Substituted pyridine and pyrazine BMI-1 inhibitors |
| CN106456648B (zh) | 2014-03-26 | 2021-11-02 | 阿斯特克斯治疗有限公司 | Fgfr抑制剂和igf1r抑制剂的组合 |
| JO3512B1 (ar) | 2014-03-26 | 2020-07-05 | Astex Therapeutics Ltd | مشتقات كينوكسالين مفيدة كمعدلات لإنزيم fgfr كيناز |
| SI3122358T1 (sl) | 2014-03-26 | 2021-04-30 | Astex Therapeutics Ltd. | Kombinacije FGFR- in CMET-inhibitorjev za zdravljenje raka |
| CA2947418A1 (en) | 2014-04-30 | 2015-11-05 | Incyte Corporation | Processes of preparing a jak1 inhibitor and new forms thereto |
| US9498467B2 (en) | 2014-05-30 | 2016-11-22 | Incyte Corporation | Treatment of chronic neutrophilic leukemia (CNL) and atypical chronic myeloid leukemia (aCML) by inhibitors of JAK1 |
| CN113563332A (zh) * | 2014-12-23 | 2021-10-29 | 达纳-法伯癌症研究所公司 | 作为egfr抑制剂的新的嘧啶和治疗病症的方法 |
| JOP20200201A1 (ar) | 2015-02-10 | 2017-06-16 | Astex Therapeutics Ltd | تركيبات صيدلانية تشتمل على n-(3.5- ثنائي ميثوكسي فينيل)-n'-(1-ميثيل إيثيل)-n-[3-(ميثيل-1h-بيرازول-4-يل) كينوكسالين-6-يل]إيثان-1.2-ثنائي الأمين |
| US10478494B2 (en) | 2015-04-03 | 2019-11-19 | Astex Therapeutics Ltd | FGFR/PD-1 combination therapy for the treatment of cancer |
| JP6896711B2 (ja) | 2015-09-23 | 2021-06-30 | ヤンセン ファーマシューティカ エヌ.ベー. | ビヘテロアリール置換1,4−ベンゾジアゼピン及び癌の治療のためのその使用 |
| SI3353177T1 (sl) | 2015-09-23 | 2020-08-31 | Janssen Pharmaceutica Nv | Triciklični heterocikli za zdravljenje raka |
| TWI720269B (zh) * | 2016-11-22 | 2021-03-01 | 財團法人生物技術開發中心 | 用於調節刺蝟途徑之雜芳基胺化合物及其製法及用途 |
| CR20210442A (es) | 2017-10-18 | 2021-12-20 | Incyte Corp | ALCOHOLES TERCIARIOS COMO INHIBIDORES DE PI3K-y (Divisional Exp. 2020-0214) |
| US10596161B2 (en) | 2017-12-08 | 2020-03-24 | Incyte Corporation | Low dose combination therapy for treatment of myeloproliferative neoplasms |
| CA3089832A1 (en) | 2018-01-30 | 2019-08-08 | Incyte Corporation | Processes for preparing (1 -(3-fluoro-2-(trifluoromethyl)isonicotinyl)piperidine-4-one) |
| US11584961B2 (en) | 2018-03-30 | 2023-02-21 | Incyte Corporation | Biomarkers for inflammatory skin disease |
| CN112567247A (zh) | 2018-04-13 | 2021-03-26 | 因赛特公司 | 用于移植物抗宿主病的生物标志物 |
| JP2021535198A (ja) | 2018-08-17 | 2021-12-16 | ピーティーシー セラピューティクス, インコーポレイテッド | 膵臓癌を治療する方法 |
| AU2019336675B2 (en) | 2018-09-05 | 2024-09-26 | Incyte Corporation | Crystalline forms of a phosphoinositide 3-kinase (PI3K) inhibitor |
| US11066404B2 (en) | 2018-10-11 | 2021-07-20 | Incyte Corporation | Dihydropyrido[2,3-d]pyrimidinone compounds as CDK2 inhibitors |
| WO2020087024A1 (en) * | 2018-10-26 | 2020-04-30 | Arrien Pharmaceuticals Llc | Pyrazolyl compounds and methods of use thereof |
| US11324749B2 (en) | 2018-10-31 | 2022-05-10 | Incyte Corporation | Combination therapy for treatment of hematological diseases |
| WO2020118683A1 (en) * | 2018-12-14 | 2020-06-18 | Lynk Pharmaceuticals Co. Ltd. | Benzamides of pyrazolyl-amino-pyrimidinyl derivatives, and compositions and methods thereof |
| WO2020168197A1 (en) | 2019-02-15 | 2020-08-20 | Incyte Corporation | Pyrrolo[2,3-d]pyrimidinone compounds as cdk2 inhibitors |
| WO2020180959A1 (en) | 2019-03-05 | 2020-09-10 | Incyte Corporation | Pyrazolyl pyrimidinylamine compounds as cdk2 inhibitors |
| US11919904B2 (en) | 2019-03-29 | 2024-03-05 | Incyte Corporation | Sulfonylamide compounds as CDK2 inhibitors |
| AU2020257301A1 (en) | 2019-04-18 | 2021-11-11 | The Johns Hopkins University | Substituted 2-amino-pyrazolyl-(1,2,4)triazolo(1,5a) pyridine derivatives and use thereof |
| WO2020223469A1 (en) | 2019-05-01 | 2020-11-05 | Incyte Corporation | N-(1-(methylsulfonyl)piperidin-4-yl)-4,5-di hydro-1h-imidazo[4,5-h]quinazolin-8-amine derivatives and related compounds as cyclin-dependent kinase 2 (cdk2) inhibitors for treating cancer |
| WO2020223558A1 (en) | 2019-05-01 | 2020-11-05 | Incyte Corporation | Tricyclic amine compounds as cdk2 inhibitors |
| KR20220064369A (ko) | 2019-08-14 | 2022-05-18 | 인사이트 코포레이션 | Cdk2 저해제로서의 이미다졸릴 피리디미딘일아민 화합물 |
| US11851426B2 (en) | 2019-10-11 | 2023-12-26 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
| KR20220107213A (ko) | 2019-11-22 | 2022-08-02 | 인사이트 코포레이션 | Alk2 억제제 및 jak2 억제제를 포함하는 병용 요법 |
| US11833155B2 (en) | 2020-06-03 | 2023-12-05 | Incyte Corporation | Combination therapy for treatment of myeloproliferative neoplasms |
| CA3192099A1 (en) | 2020-08-18 | 2022-02-24 | Incyte Corporation | Process and intermediates for preparing a jak inhibitor |
| PE20231308A1 (es) | 2020-08-18 | 2023-08-24 | Incyte Corp | Proceso e intermedios para preparar un inhibidor de jak1 |
| US11981671B2 (en) | 2021-06-21 | 2024-05-14 | Incyte Corporation | Bicyclic pyrazolyl amines as CDK2 inhibitors |
| JP2024526762A (ja) | 2021-07-12 | 2024-07-19 | インサイト・コーポレイション | Jak阻害剤を調製するためのプロセス及び中間体 |
| CA3234554A1 (en) * | 2021-10-06 | 2023-04-13 | Aerie Pharmaceuticals, Inc. | Janus kinase inhibiting pyrazole compounds and uses thereof |
| US11976073B2 (en) | 2021-12-10 | 2024-05-07 | Incyte Corporation | Bicyclic amines as CDK2 inhibitors |
Citations (5)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002046184A1 (en) * | 2000-12-05 | 2002-06-13 | Vertex Pharmaceuticals Incorporated | Inhibitors of c-jun n-terminal kinases (jnk) and other protein kinases |
| WO2002092573A2 (en) * | 2001-05-16 | 2002-11-21 | Vertex Pharmaceuticals Incorporated | Heterocyclic substituted pyrazoles as inhibitors of src and other protein kinases |
| WO2004005282A1 (en) * | 2002-07-09 | 2004-01-15 | Novartis Ag | PHENYL-[4-(3-PHENYL-1H-PYRAZOL-4-YL)-PYRIMIDIN-2-Yl)-AMINE DERIVATIVES |
| WO2007105058A2 (en) * | 2006-03-16 | 2007-09-20 | Pfizer Products Inc. | Pyrazole compounds |
| WO2007129195A2 (en) * | 2006-05-04 | 2007-11-15 | Pfizer Products Inc. | 4-pyrimidine-5-amino-pyrazole compounds |
Family Cites Families (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US5521184A (en) * | 1992-04-03 | 1996-05-28 | Ciba-Geigy Corporation | Pyrimidine derivatives and processes for the preparation thereof |
| HUP0102366A2 (hu) | 1998-06-04 | 2001-11-28 | Abbott Laboratories | Sejttapadást gátló, gyulladáscsökkentő hatású vegyületek |
| PA8474101A1 (es) | 1998-06-19 | 2000-09-29 | Pfizer Prod Inc | Compuestos de pirrolo [2,3-d] pirimidina |
| AU5620299A (en) | 1998-08-11 | 2000-03-06 | Novartis Ag | Isoquinoline derivatives with angiogenesis inhibiting activity |
| US6133031A (en) | 1999-08-19 | 2000-10-17 | Isis Pharmaceuticals Inc. | Antisense inhibition of focal adhesion kinase expression |
| GB9905075D0 (en) | 1999-03-06 | 1999-04-28 | Zeneca Ltd | Chemical compounds |
| SI1235830T1 (en) | 1999-12-10 | 2004-06-30 | Pfizer Products Inc. | PYRROLO(2,3-d)PYRIMIDINE COMPOUNDS AS PROTEIN KINASES INHIBITORS |
| IL150388A0 (en) * | 1999-12-24 | 2002-12-01 | Aventis Pharma Ltd | Azaindoles |
| GB0004890D0 (en) | 2000-03-01 | 2000-04-19 | Astrazeneca Uk Ltd | Chemical compounds |
| US20040089753A1 (en) | 2000-06-28 | 2004-05-13 | Holland Simon Joseph | Wet milling process |
| HUP0401982A3 (en) | 2001-09-19 | 2012-09-28 | Aventis Pharma Sa | Indolizine derivates, process for their preparation and pharmaceutical compositions containing the compounds |
| BRPI0213739B8 (pt) | 2001-10-30 | 2021-05-25 | Dana Farber Cancer Inst Inc | derivados de estaurosporina como inibidores da atividade de receptores flt3 de tirosina cinase |
| TW200406374A (en) | 2002-05-29 | 2004-05-01 | Novartis Ag | Diaryl urea derivatives useful for the treatment of protein kinase dependent diseases |
| GB0215676D0 (en) | 2002-07-05 | 2002-08-14 | Novartis Ag | Organic compounds |
| TWI335913B (en) | 2002-11-15 | 2011-01-11 | Vertex Pharma | Diaminotriazoles useful as inhibitors of protein kinases |
| UA80767C2 (en) | 2002-12-20 | 2007-10-25 | Pfizer Prod Inc | Pyrimidine derivatives for the treatment of abnormal cell growth |
| AU2004212421B2 (en) | 2003-02-07 | 2009-08-20 | Vertex Pharmaceuticals Incorporated | Heteroaryl substituted pyrolls useful as inhibitors of protein kinases |
| GB0305929D0 (en) | 2003-03-14 | 2003-04-23 | Novartis Ag | Organic compounds |
| SE0301373D0 (sv) | 2003-05-09 | 2003-05-09 | Astrazeneca Ab | Novel compounds |
| SE0301372D0 (sv) | 2003-05-09 | 2003-05-09 | Astrazeneca Ab | Novel compounds |
| AR045944A1 (es) | 2003-09-24 | 2005-11-16 | Novartis Ag | Derivados de isoquinolina 1.4-disustituidas |
| MY141220A (en) | 2003-11-17 | 2010-03-31 | Astrazeneca Ab | Pyrazole derivatives as inhibitors of receptor tyrosine kinases |
| WO2005105814A1 (en) * | 2004-04-28 | 2005-11-10 | Incyte Corporation | Tetracyclic inhibitors of janus kinases |
| WO2006052913A1 (en) * | 2004-11-04 | 2006-05-18 | Vertex Pharmaceuticals Incorporated | PYRAZOLO[1,5-a]PYRIMIDINES USEFUL AS INHIBITORS OF PROTEIN KINASES |
| AR054416A1 (es) * | 2004-12-22 | 2007-06-27 | Incyte Corp | Pirrolo [2,3-b]piridin-4-il-aminas y pirrolo [2,3-b]pirimidin-4-il-aminas como inhibidores de las quinasas janus. composiciones farmaceuticas. |
| JP5119154B2 (ja) * | 2005-09-22 | 2013-01-16 | インサイト・コーポレイション | Janusキナーゼの四環系阻害剤 |
| PT1945631E (pt) | 2005-10-28 | 2012-10-15 | Astrazeneca Ab | Derivados de 4-(3-aminopirazole)pirimidina para utilização como inibidores da tirosina-cinase no tratamento do cancro |
| SI2474545T1 (sl) * | 2005-12-13 | 2017-03-31 | Incyte Holdinges Corporation | Heteroarilno substituirani pirolo(2,3-b)piridini in pirolo(2,3-b)pirimidini kot zaviralci janusove kinaze |
| BRPI0708034A2 (pt) * | 2006-02-10 | 2011-05-17 | Transtech Pharma Inc | derivados benzazol, composições e métodos de uso como inibidores aurora quinase |
| WO2008079965A1 (en) * | 2006-12-22 | 2008-07-03 | Incyte Corporation | Substituted heterocycles as janus kinase inhibitors |
| CL2008001709A1 (es) * | 2007-06-13 | 2008-11-03 | Incyte Corp | Compuestos derivados de pirrolo [2,3-b]pirimidina, moduladores de quinasas jak; composicion farmaceutica; y uso en el tratamiento de enfermedades tales como cancer, psoriasis, artritis reumatoide, entre otras. |
| SG182198A1 (en) * | 2007-06-13 | 2012-07-30 | Incyte Corp | Salts of the janus kinase inhibitor (r)-3-(4-(7h-pyrrolo[2,3-d]pyrimidin-4-yl)-1h-pyrazol-1-yl)-3-cyclopentylpropanenitrile |
| MX2010010012A (es) * | 2008-03-11 | 2010-10-20 | Incyte Corp | Derivados de azetidina y ciclobutano como inhibidores de jak. |
| CL2009001884A1 (es) * | 2008-10-02 | 2010-05-14 | Incyte Holdings Corp | Uso de 3-ciclopentil-3-[4-(7h-pirrolo[2,3-d]pirimidin-4-il)-1h-pirazol-1-il)propanonitrilo, inhibidor de janus quinasa, y uso de una composición que lo comprende para el tratamiento del ojo seco. |
| JOP20190230A1 (ar) * | 2009-01-15 | 2017-06-16 | Incyte Corp | طرق لاصلاح مثبطات انزيم jak و المركبات الوسيطة المتعلقة به |
| TW201100429A (en) * | 2009-05-22 | 2011-01-01 | Incyte Corp | N-(hetero)aryl-pyrrolidine derivatives of pyrazol-4-yl-pyrrolo[2,3-d]pyrimidines and pyrrol-3-yl-pyrrolo[2,3-d]pyrimidines as janus kinase inhibitors |
| NZ596374A (en) * | 2009-05-22 | 2014-01-31 | Incyte Corp | 3-[4-(7h-pyrrolo[2,3-d]pyrimidin-4-yl)-1h-pyrazol-1-yl]octane- or heptane-nitrile as jak inhibitors |
-
2008
- 2008-11-13 AU AU2008321046A patent/AU2008321046B2/en active Active
- 2008-11-13 ES ES08848610.5T patent/ES2569528T3/es active Active
- 2008-11-13 EP EP08848610.5A patent/EP2220068B1/en active Active
- 2008-11-13 KR KR1020107012777A patent/KR101580482B1/ko active IP Right Grant
- 2008-11-13 US US12/270,135 patent/US8309718B2/en active Active
- 2008-11-13 CN CN200880123789.2A patent/CN101910152B/zh active Active
- 2008-11-13 MX MX2010005300A patent/MX2010005300A/es active IP Right Grant
- 2008-11-13 NZ NZ585139A patent/NZ585139A/en unknown
- 2008-11-13 JP JP2010534154A patent/JP5480813B2/ja active Active
- 2008-11-13 EA EA201070618A patent/EA020777B1/ru unknown
- 2008-11-13 BR BRPI0820544-2A patent/BRPI0820544A2/pt not_active Application Discontinuation
- 2008-11-13 WO PCT/US2008/083319 patent/WO2009064835A1/en active Application Filing
- 2008-11-13 CA CA2704599A patent/CA2704599C/en active Active
- 2008-11-13 UA UAA201007505A patent/UA104849C2/uk unknown
- 2008-11-13 MY MYPI20102079 patent/MY152948A/en unknown
-
2010
- 2010-05-06 IL IL205571A patent/IL205571A/en active IP Right Grant
- 2010-05-14 CR CR11430A patent/CR11430A/es unknown
- 2010-05-26 CO CO10063312A patent/CO6280420A2/es active IP Right Grant
- 2010-06-07 ZA ZA2010/04055A patent/ZA201004055B/en unknown
- 2010-06-16 EC EC2010010263A patent/ECSP10010263A/es unknown
-
2011
- 2011-02-11 HK HK11101335.9A patent/HK1147476A1/zh unknown
Patent Citations (6)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| WO2002046184A1 (en) * | 2000-12-05 | 2002-06-13 | Vertex Pharmaceuticals Incorporated | Inhibitors of c-jun n-terminal kinases (jnk) and other protein kinases |
| WO2002092573A2 (en) * | 2001-05-16 | 2002-11-21 | Vertex Pharmaceuticals Incorporated | Heterocyclic substituted pyrazoles as inhibitors of src and other protein kinases |
| US20030144309A1 (en) * | 2001-05-16 | 2003-07-31 | Young Choon-Moon | Inhibitors of Src and other protein kinases |
| WO2004005282A1 (en) * | 2002-07-09 | 2004-01-15 | Novartis Ag | PHENYL-[4-(3-PHENYL-1H-PYRAZOL-4-YL)-PYRIMIDIN-2-Yl)-AMINE DERIVATIVES |
| WO2007105058A2 (en) * | 2006-03-16 | 2007-09-20 | Pfizer Products Inc. | Pyrazole compounds |
| WO2007129195A2 (en) * | 2006-05-04 | 2007-11-15 | Pfizer Products Inc. | 4-pyrimidine-5-amino-pyrazole compounds |
Non-Patent Citations (1)
| Title |
|---|
| CHRISTIAN PILLONEL: "Evaluation of phenylaminopyrimidines", 《PEST MANAGEMENT SCIENCE》 * |
Cited By (37)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| CN103102359A (zh) * | 2011-11-15 | 2013-05-15 | 江苏先声药物研究有限公司 | 嘧啶类化合物及其应用 |
| CN104583216A (zh) * | 2012-06-29 | 2015-04-29 | Ym生物科学澳大利亚股份有限公司 | 苯基氨基嘧啶双环化合物及其用途 |
| WO2014075318A1 (zh) * | 2012-11-19 | 2014-05-22 | 江苏先声药业有限公司 | 嘧啶类化合物及其应用 |
| CN105189509A (zh) * | 2013-03-06 | 2015-12-23 | 因赛特公司 | 用于制备jak抑制剂的方法及中间体 |
| CN105189509B (zh) * | 2013-03-06 | 2017-12-19 | 因赛特公司 | 用于制备jak抑制剂的方法及中间体 |
| US11591318B2 (en) | 2013-05-17 | 2023-02-28 | Incyte Corporation | Bipyrazole derivatives as JAK inhibitors |
| US11001571B2 (en) | 2013-05-17 | 2021-05-11 | Incyte Corporation | Bipyrazole derivatives as JAK inhibitors |
| US11905275B2 (en) | 2013-05-17 | 2024-02-20 | Incyte Corporation | Bipyrazole derivatives as JAK inhibitors |
| CN107698569A (zh) * | 2013-05-17 | 2018-02-16 | 因赛特公司 | 作为jak抑制剂的联吡唑衍生物 |
| CN105452239B (zh) * | 2013-05-17 | 2017-11-21 | 因赛特公司 | 作为jak抑制剂的联吡唑衍生物 |
| CN105934432B (zh) * | 2014-02-25 | 2017-09-05 | 上海海雁医药科技有限公司 | 2,4‑二取代苯‑1,5‑二胺衍生物及其应用以及由其制备的药物组合物和药用组合物 |
| CN104860941B (zh) * | 2014-02-25 | 2017-03-22 | 上海海雁医药科技有限公司 | 2,4‑二取代苯‑1,5‑二胺衍生物及其应用以及由其制备的药物组合物和药用组合物 |
| TWI551595B (zh) * | 2014-02-25 | 2016-10-01 | Shanghai Haiyan Pharmaceutical Technology Co Ltd | 2,4-disubstituted benzene-1,5-diamine derivatives and their use, Its preparation of pharmaceutical compositions and pharmaceutical compositions |
| RU2649001C1 (ru) * | 2014-02-25 | 2018-03-29 | Шанхай Хайянь Фармасьютикал Текнолоджи Ко., Лтд. | Производные 2,4-дизамещенного фенилен-1,5-диамина и их применения, фармацевтические композиции и фармацевтически приемлемые композиции, полученные из них |
| US10435400B2 (en) | 2014-02-25 | 2019-10-08 | Shanghai Haiyan Pharmaceutical Technology Co. Ltd. | 2,4-disubstituted phenylene-1,5-diamine derivatives and applications thereof, and pharmaceutical compositions and pharmaceutically acceptable compositions prepared therefrom |
| CN105934432A (zh) * | 2014-02-25 | 2016-09-07 | 上海海雁医药科技有限公司 | 2,4-二取代苯-1,5-二胺衍生物及其应用以及由其制备的药物组合物和药用组合物 |
| WO2015127872A1 (zh) * | 2014-02-25 | 2015-09-03 | 上海海雁医药科技有限公司 | 2,4-二取代苯-1,5-二胺衍生物及其应用以及由其制备的药物组合物和药用组合物 |
| CN104860941A (zh) * | 2014-02-25 | 2015-08-26 | 上海海雁医药科技有限公司 | 2,4-二取代苯-1,5-二胺衍生物及其应用以及由其制备的药物组合物和药用组合物 |
| WO2017016463A1 (zh) * | 2015-07-24 | 2017-02-02 | 上海海雁医药科技有限公司 | Egfr抑制剂及其药学上可接受的盐和多晶型物及其应用 |
| CN107531678A (zh) * | 2015-07-24 | 2018-01-02 | 上海海雁医药科技有限公司 | Egfr抑制剂及其药学上可接受的盐和多晶型物及其应用 |
| US10561646B2 (en) | 2015-07-24 | 2020-02-18 | Shanghai Haiyan Pharmaceutical Technology Co. Ltd. | EGFR inhibitor and pharmaceutically acceptable salt and polymorph thereof, and use thereof |
| US11833152B2 (en) | 2018-02-16 | 2023-12-05 | Incyte Corporation | JAK1 pathway inhibitors for the treatment of cytokine-related disorders |
| US11304949B2 (en) | 2018-03-30 | 2022-04-19 | Incyte Corporation | Treatment of hidradenitis suppurativa using JAK inhibitors |
| CN112142731A (zh) * | 2019-06-28 | 2020-12-29 | 成都赜灵生物医药科技有限公司 | 一种2,4-二取代嘧啶衍生物及其制备方法和用途 |
| CN112142731B (zh) * | 2019-06-28 | 2022-07-22 | 成都赜灵生物医药科技有限公司 | 一种2,4-二取代嘧啶衍生物及其制备方法和用途 |
| CN114423750B (zh) * | 2019-06-28 | 2024-04-19 | 成都赜灵生物医药科技有限公司 | 2,4-二取代嘧啶衍生物及其制备方法和用途 |
| WO2020259683A1 (zh) * | 2019-06-28 | 2020-12-30 | 成都赜灵生物医药科技有限公司 | 2,4-二取代嘧啶衍生物及其制备方法和用途 |
| CN114423750A (zh) * | 2019-06-28 | 2022-04-29 | 成都赜灵生物医药科技有限公司 | 2,4-二取代嘧啶衍生物及其制备方法和用途 |
| CN115413278A (zh) * | 2020-03-23 | 2022-11-29 | 丸仁制药株式会社 | 新型嘧啶衍生物以及包含其的神经退行性疾病和癌症的预防或治疗用组合物 |
| US11685731B2 (en) | 2020-06-02 | 2023-06-27 | Incyte Corporation | Processes of preparing a JAK1 inhibitor |
| CN114181199B (zh) * | 2020-09-15 | 2023-09-26 | 成都赜灵生物医药科技有限公司 | 2,4-二取代嘧啶衍生物及其制备方法和用途 |
| CN114181199A (zh) * | 2020-09-15 | 2022-03-15 | 成都赜灵生物医药科技有限公司 | 2,4-二取代嘧啶衍生物及其制备方法和用途 |
| US11957661B2 (en) | 2020-12-08 | 2024-04-16 | Incyte Corporation | JAK1 pathway inhibitors for the treatment of vitiligo |
| CN114874189B (zh) * | 2021-02-05 | 2023-09-29 | 深圳市塔吉瑞生物医药有限公司 | 取代的杂芳基衍生物及其组合物及用途 |
| CN114874189A (zh) * | 2021-02-05 | 2022-08-09 | 深圳市塔吉瑞生物医药有限公司 | 取代的杂芳基衍生物及其组合物及用途 |
| WO2024041397A1 (en) * | 2022-08-22 | 2024-02-29 | Hangzhou Highlightll Pharmaceutical Co., Ltd | Jak1/jak2/tyk2 inhibitors for topical treatment of dermatological diseases |
| CN115594664A (zh) * | 2022-11-25 | 2023-01-13 | 英矽智能科技(上海)有限公司(Cn) | 一类螺环衍生物作为kif18a抑制剂 |
Also Published As
| Publication number | Publication date |
|---|---|
| UA104849C2 (uk) | 2014-03-25 |
| EA201070618A1 (ru) | 2010-12-30 |
| NZ585139A (en) | 2012-05-25 |
| IL205571A (en) | 2015-09-24 |
| MX2010005300A (es) | 2010-06-25 |
| ES2569528T3 (es) | 2016-05-11 |
| ZA201004055B (en) | 2012-09-26 |
| JP5480813B2 (ja) | 2014-04-23 |
| BRPI0820544A2 (pt) | 2015-06-16 |
| KR101580482B1 (ko) | 2015-12-28 |
| EA020777B1 (ru) | 2015-01-30 |
| AU2008321046B2 (en) | 2013-10-24 |
| KR20100095582A (ko) | 2010-08-31 |
| CA2704599C (en) | 2015-05-12 |
| HK1147476A1 (zh) | 2011-08-12 |
| IL205571A0 (en) | 2010-12-30 |
| US8309718B2 (en) | 2012-11-13 |
| EP2220068B1 (en) | 2016-01-27 |
| CA2704599A1 (en) | 2009-05-22 |
| US20090318405A1 (en) | 2009-12-24 |
| MY152948A (en) | 2014-12-15 |
| EP2220068A1 (en) | 2010-08-25 |
| ECSP10010263A (es) | 2010-07-30 |
| CN101910152B (zh) | 2014-08-06 |
| JP2011503194A (ja) | 2011-01-27 |
| AU2008321046A1 (en) | 2009-05-22 |
| WO2009064835A1 (en) | 2009-05-22 |
| CO6280420A2 (es) | 2011-05-20 |
| CR11430A (es) | 2010-07-01 |
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| CN101910152B (zh) | 作为janus激酶抑制剂的4-吡唑基-n-芳基嘧啶-2-胺和4-吡唑基-n-杂芳基嘧啶-2-胺 | |
| CN103214483B (zh) | 作为两面神激酶抑制剂的杂芳基取代的吡咯并[2,3-b]吡啶和吡咯并[2,3-b]嘧啶 | |
| CA2673038C (en) | Substituted tricyclic heteroaryl compounds as janus kinase inhibitors | |
| TWI398252B (zh) | 吡咯并嘧啶化合物及其用途 | |
| CN103930425B (zh) | 蝶啶酮衍生物及其作为egfr、blk、flt3抑制剂的应用 | |
| CN107428758A (zh) | 丙烯酸类衍生物、其制备方法及其在医药上的用途 | |
| CN104829610B (zh) | 一种新型布鲁顿酪氨酸激酶抑制剂 | |
| CN107438607A (zh) | 作为fgfr抑制剂的双环杂环 | |
| JP2019504901A (ja) | ムスカリン性アセチルコリン受容体m1のポジティブアロステリックモジュレーター | |
| TW200938202A (en) | Heterocyclic compounds | |
| TW200829567A (en) | Certain substituted amides, method of making, and method of use thereof | |
| JP7352294B2 (ja) | ムスカリン性アセチルコリン受容体m4のアンタゴニスト | |
| JP7098167B2 (ja) | ムスカリン性アセチルコリンレセプターm4のポジティブアロステリック調節因子 | |
| JP7099725B2 (ja) | ムスカリン性アセチルコリンレセプターm4のポジティブアロステリック調節因子 | |
| CN105163727B (zh) | 刺激神经发生的异喹啉衍生物 | |
| JP7016471B2 (ja) | ムスカリン性アセチルコリンレセプターm4のポジティブアロステリック調節因子 | |
| CN108707139A (zh) | 氨基嘧啶类化合物及其制备方法和应用 | |
| JP7097623B2 (ja) | ムスカリン性アセチルコリンレセプターm4のポジティブアロステリック調節因子 | |
| JP2019519512A (ja) | ピリミジン誘導体、その調製方法および医療での使用 | |
| JP2020526557A (ja) | ムスカリン性アセチルコリン受容体m4のアンタゴニスト | |
| CN108707151A (zh) | 嘧啶并-哒嗪酮化合物及其用途 | |
| WO2023240024A1 (en) | Sulfamide derivatives as cyclin-dependent kinase 2 inhibitors | |
| JP2021505581A (ja) | ムスカリン性アセチルコリンレセプターm4のポジティブアロステリック調節因子 | |
| CN110114355A (zh) | 用于治疗癌症的噁唑衍生物 |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| C06 | Publication | ||
| PB01 | Publication | ||
| C10 | Entry into substantive examination | ||
| SE01 | Entry into force of request for substantive examination | ||
| C14 | Grant of patent or utility model | ||
| GR01 | Patent grant | ||
| C41 | Transfer of patent application or patent right or utility model | ||
| TR01 | Transfer of patent right |
Effective date of registration: 20151204 Address after: American state of Patentee after: Because of C1-esteraseremmer-N parent corporation Address before: The United States Delaware Patentee before: Incyte Corp. |