BRPI0609224B1 - Nanocorpos melhorados contra fator alfa de necrose tumoral - Google Patents
Nanocorpos melhorados contra fator alfa de necrose tumoral Download PDFInfo
- Publication number
- BRPI0609224B1 BRPI0609224B1 BRPI0609224-1A BRPI0609224A BRPI0609224B1 BR PI0609224 B1 BRPI0609224 B1 BR PI0609224B1 BR PI0609224 A BRPI0609224 A BR PI0609224A BR PI0609224 B1 BRPI0609224 B1 BR PI0609224B1
- Authority
- BR
- Brazil
- Prior art keywords
- amino acid
- nanobody
- seq
- acid sequence
- tnf
- Prior art date
Links
- 108010003723 Single-Domain Antibodies Proteins 0.000 title claims abstract description 399
- 230000001976 improved effect Effects 0.000 title abstract description 10
- 206010054094 Tumour necrosis Diseases 0.000 title 1
- IXKSXJFAGXLQOQ-XISFHERQSA-N WHWLQLKPGQPMY Chemical compound C([C@@H](C(=O)N[C@@H](CC=1C2=CC=CC=C2NC=1)C(=O)N[C@@H](CC(C)C)C(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(C)C)C(=O)N1CCC[C@H]1C(=O)NCC(=O)N[C@@H](CCC(N)=O)C(=O)N[C@@H](CC(O)=O)C(=O)N1CCC[C@H]1C(=O)N[C@@H](CCSC)C(=O)N[C@@H](CC=1C=CC(O)=CC=1)C(O)=O)NC(=O)[C@@H](N)CC=1C2=CC=CC=C2NC=1)C1=CNC=N1 IXKSXJFAGXLQOQ-XISFHERQSA-N 0.000 title 1
- 108090000765 processed proteins & peptides Proteins 0.000 claims abstract description 459
- 229920001184 polypeptide Polymers 0.000 claims abstract description 457
- 102000004196 processed proteins & peptides Human genes 0.000 claims abstract description 457
- 108060008682 Tumor Necrosis Factor Proteins 0.000 claims abstract description 130
- 238000000034 method Methods 0.000 claims abstract description 49
- 102100035360 Cerebellar degeneration-related antigen 1 Human genes 0.000 claims description 311
- 150000001413 amino acids Chemical group 0.000 claims description 262
- 101000611183 Homo sapiens Tumor necrosis factor Proteins 0.000 claims description 208
- 102100040247 Tumor necrosis factor Human genes 0.000 claims description 208
- 239000013638 trimer Substances 0.000 claims description 111
- 230000027455 binding Effects 0.000 claims description 103
- 102100027211 Albumin Human genes 0.000 claims description 93
- 102000008100 Human Serum Albumin Human genes 0.000 claims description 82
- 108091006905 Human Serum Albumin Proteins 0.000 claims description 82
- NFGXHKASABOEEW-UHFFFAOYSA-N 1-methylethyl 11-methoxy-3,7,11-trimethyl-2,4-dodecadienoate Chemical compound COC(C)(C)CCCC(C)CC=CC(C)=CC(=O)OC(C)C NFGXHKASABOEEW-UHFFFAOYSA-N 0.000 claims description 63
- 108060008683 Tumor Necrosis Factor Receptor Proteins 0.000 claims description 46
- 102000003298 tumor necrosis factor receptor Human genes 0.000 claims description 46
- 102000005962 receptors Human genes 0.000 claims description 40
- 108020003175 receptors Proteins 0.000 claims description 40
- 230000001404 mediated effect Effects 0.000 claims description 38
- 238000004132 cross linking Methods 0.000 claims description 37
- 230000019491 signal transduction Effects 0.000 claims description 20
- DHMQDGOQFOQNFH-UHFFFAOYSA-N Glycine Chemical compound NCC(O)=O DHMQDGOQFOQNFH-UHFFFAOYSA-N 0.000 claims description 17
- 108010047041 Complementarity Determining Regions Proteins 0.000 claims description 12
- 239000004475 Arginine Substances 0.000 claims description 9
- ODKSFYDXXFIFQN-UHFFFAOYSA-N arginine Natural products OC(=O)C(N)CCCNC(N)=N ODKSFYDXXFIFQN-UHFFFAOYSA-N 0.000 claims description 9
- 239000004471 Glycine Substances 0.000 claims description 7
- 239000003446 ligand Substances 0.000 claims description 7
- 206010039073 rheumatoid arthritis Diseases 0.000 claims description 7
- 125000003607 serino group Chemical group [H]N([H])[C@]([H])(C(=O)[*])C(O[H])([H])[H] 0.000 claims description 7
- 201000010099 disease Diseases 0.000 claims description 6
- 208000037265 diseases, disorders, signs and symptoms Diseases 0.000 claims description 6
- 238000002360 preparation method Methods 0.000 claims description 6
- 239000003814 drug Substances 0.000 claims description 5
- 201000006417 multiple sclerosis Diseases 0.000 claims description 4
- 239000008194 pharmaceutical composition Substances 0.000 claims description 4
- 238000011282 treatment Methods 0.000 claims description 4
- 208000011580 syndromic disease Diseases 0.000 claims description 3
- 208000026872 Addison Disease Diseases 0.000 claims description 2
- 206010003827 Autoimmune hepatitis Diseases 0.000 claims description 2
- 208000023328 Basedow disease Diseases 0.000 claims description 2
- 206010009900 Colitis ulcerative Diseases 0.000 claims description 2
- 208000011231 Crohn disease Diseases 0.000 claims description 2
- 102100023328 G-protein coupled estrogen receptor 1 Human genes 0.000 claims description 2
- 206010018364 Glomerulonephritis Diseases 0.000 claims description 2
- 208000015023 Graves' disease Diseases 0.000 claims description 2
- 208000035895 Guillain-Barré syndrome Diseases 0.000 claims description 2
- 101000829902 Homo sapiens G-protein coupled estrogen receptor 1 Proteins 0.000 claims description 2
- 206010061218 Inflammation Diseases 0.000 claims description 2
- 208000007466 Male Infertility Diseases 0.000 claims description 2
- 206010049567 Miller Fisher syndrome Diseases 0.000 claims description 2
- 241000721454 Pemphigus Species 0.000 claims description 2
- 201000004681 Psoriasis Diseases 0.000 claims description 2
- 208000021386 Sjogren Syndrome Diseases 0.000 claims description 2
- 208000006045 Spondylarthropathies Diseases 0.000 claims description 2
- 206010067584 Type 1 diabetes mellitus Diseases 0.000 claims description 2
- 201000006704 Ulcerative Colitis Diseases 0.000 claims description 2
- 206010047115 Vasculitis Diseases 0.000 claims description 2
- 230000001363 autoimmune Effects 0.000 claims description 2
- 208000025302 chronic primary adrenal insufficiency Diseases 0.000 claims description 2
- 201000010063 epididymitis Diseases 0.000 claims description 2
- 208000007475 hemolytic anemia Diseases 0.000 claims description 2
- 230000002757 inflammatory effect Effects 0.000 claims description 2
- 230000004054 inflammatory process Effects 0.000 claims description 2
- 125000001909 leucine group Chemical group [H]N(*)C(C(*)=O)C([H])([H])C(C([H])([H])[H])C([H])([H])[H] 0.000 claims description 2
- 206010028417 myasthenia gravis Diseases 0.000 claims description 2
- 201000003068 rheumatic fever Diseases 0.000 claims description 2
- 201000000306 sarcoidosis Diseases 0.000 claims description 2
- 201000005671 spondyloarthropathy Diseases 0.000 claims description 2
- 201000000596 systemic lupus erythematosus Diseases 0.000 claims description 2
- 206010043778 thyroiditis Diseases 0.000 claims description 2
- MZOFCQQQCNRIBI-VMXHOPILSA-N (3s)-4-[[(2s)-1-[[(2s)-1-[[(1s)-1-carboxy-2-hydroxyethyl]amino]-4-methyl-1-oxopentan-2-yl]amino]-5-(diaminomethylideneamino)-1-oxopentan-2-yl]amino]-3-[[2-[[(2s)-2,6-diaminohexanoyl]amino]acetyl]amino]-4-oxobutanoic acid Chemical compound OC[C@@H](C(O)=O)NC(=O)[C@H](CC(C)C)NC(=O)[C@H](CCCN=C(N)N)NC(=O)[C@H](CC(O)=O)NC(=O)CNC(=O)[C@@H](N)CCCCN MZOFCQQQCNRIBI-VMXHOPILSA-N 0.000 claims 5
- 102100024952 Protein CBFA2T1 Human genes 0.000 claims 2
- 101000693967 Trachemys scripta 67 kDa serum albumin Proteins 0.000 claims 2
- 239000003937 drug carrier Substances 0.000 claims 2
- 208000006545 Chronic Obstructive Pulmonary Disease Diseases 0.000 claims 1
- 208000001204 Hashimoto Disease Diseases 0.000 claims 1
- 208000030836 Hashimoto thyroiditis Diseases 0.000 claims 1
- 208000005647 Mumps Diseases 0.000 claims 1
- 208000006673 asthma Diseases 0.000 claims 1
- 238000012258 culturing Methods 0.000 claims 1
- 208000010805 mumps infectious disease Diseases 0.000 claims 1
- 102000000852 Tumor Necrosis Factor-alpha Human genes 0.000 abstract description 125
- 150000007523 nucleic acids Chemical class 0.000 abstract description 38
- 102000039446 nucleic acids Human genes 0.000 abstract description 31
- 108020004707 nucleic acids Proteins 0.000 abstract description 31
- 239000000203 mixture Substances 0.000 abstract description 13
- 230000001225 therapeutic effect Effects 0.000 abstract description 10
- 230000000069 prophylactic effect Effects 0.000 abstract description 6
- 125000003275 alpha amino acid group Chemical group 0.000 description 919
- 235000001014 amino acid Nutrition 0.000 description 440
- 108090000623 proteins and genes Proteins 0.000 description 324
- 102000004169 proteins and genes Human genes 0.000 description 322
- 235000018102 proteins Nutrition 0.000 description 321
- 229940024606 amino acid Drugs 0.000 description 232
- 101100112922 Candida albicans CDR3 gene Proteins 0.000 description 231
- 101000737793 Homo sapiens Cerebellar degeneration-related antigen 1 Proteins 0.000 description 228
- 238000006467 substitution reaction Methods 0.000 description 220
- 102100035361 Cerebellar degeneration-related protein 2 Human genes 0.000 description 202
- 101000737796 Homo sapiens Cerebellar degeneration-related protein 2 Proteins 0.000 description 202
- 125000000539 amino acid group Chemical group 0.000 description 162
- 108060003951 Immunoglobulin Proteins 0.000 description 96
- 102000018358 immunoglobulin Human genes 0.000 description 96
- 239000002131 composite material Substances 0.000 description 91
- 238000012217 deletion Methods 0.000 description 58
- 230000037430 deletion Effects 0.000 description 58
- 238000003780 insertion Methods 0.000 description 57
- 230000037431 insertion Effects 0.000 description 57
- 239000000178 monomer Substances 0.000 description 51
- 210000004027 cell Anatomy 0.000 description 50
- 239000012634 fragment Substances 0.000 description 35
- 238000000423 cell based assay Methods 0.000 description 33
- 239000000427 antigen Substances 0.000 description 28
- 108091007433 antigens Proteins 0.000 description 28
- 102000036639 antigens Human genes 0.000 description 28
- 239000002773 nucleotide Substances 0.000 description 28
- 125000003729 nucleotide group Chemical group 0.000 description 28
- 238000003556 assay Methods 0.000 description 26
- 241000282414 Homo sapiens Species 0.000 description 18
- 230000002401 inhibitory effect Effects 0.000 description 18
- 125000006850 spacer group Chemical group 0.000 description 15
- 230000000890 antigenic effect Effects 0.000 description 13
- 108091028043 Nucleic acid sequence Proteins 0.000 description 12
- 230000001965 increasing effect Effects 0.000 description 11
- 230000004048 modification Effects 0.000 description 10
- 238000012986 modification Methods 0.000 description 10
- 230000006320 pegylation Effects 0.000 description 10
- 102000025171 antigen binding proteins Human genes 0.000 description 9
- 108091000831 antigen binding proteins Proteins 0.000 description 9
- 241000700159 Rattus Species 0.000 description 8
- 125000000524 functional group Chemical group 0.000 description 8
- 229920001223 polyethylene glycol Polymers 0.000 description 8
- 239000000047 product Substances 0.000 description 8
- 108700028369 Alleles Proteins 0.000 description 7
- 102000004506 Blood Proteins Human genes 0.000 description 7
- 108010017384 Blood Proteins Proteins 0.000 description 7
- 230000000670 limiting effect Effects 0.000 description 7
- ROHFNLRQFUQHCH-YFKPBYRVSA-N L-leucine Chemical compound CC(C)C[C@H](N)C(O)=O ROHFNLRQFUQHCH-YFKPBYRVSA-N 0.000 description 6
- 230000005847 immunogenicity Effects 0.000 description 6
- 229910052698 phosphorus Inorganic materials 0.000 description 6
- OUYCCCASQSFEME-QMMMGPOBSA-N L-tyrosine Chemical compound OC(=O)[C@@H](N)CC1=CC=C(O)C=C1 OUYCCCASQSFEME-QMMMGPOBSA-N 0.000 description 5
- 206010028980 Neoplasm Diseases 0.000 description 5
- 230000008901 benefit Effects 0.000 description 5
- 125000000151 cysteine group Chemical group N[C@@H](CS)C(=O)* 0.000 description 5
- -1 derivatives Proteins 0.000 description 5
- 208000037765 diseases and disorders Diseases 0.000 description 5
- 102000057041 human TNF Human genes 0.000 description 5
- 241000894007 species Species 0.000 description 5
- 229910052721 tungsten Inorganic materials 0.000 description 5
- 108010021625 Immunoglobulin Fragments Proteins 0.000 description 4
- 102000008394 Immunoglobulin Fragments Human genes 0.000 description 4
- DCXYFEDJOCDNAF-REOHCLBHSA-N L-asparagine Chemical compound OC(=O)[C@@H](N)CC(N)=O DCXYFEDJOCDNAF-REOHCLBHSA-N 0.000 description 4
- AGPKZVBTJJNPAG-WHFBIAKZSA-N L-isoleucine Chemical compound CC[C@H](C)[C@H](N)C(O)=O AGPKZVBTJJNPAG-WHFBIAKZSA-N 0.000 description 4
- 102100033732 Tumor necrosis factor receptor superfamily member 1A Human genes 0.000 description 4
- 230000000694 effects Effects 0.000 description 4
- 108020004705 Codon Proteins 0.000 description 3
- 102000004190 Enzymes Human genes 0.000 description 3
- 108090000790 Enzymes Proteins 0.000 description 3
- 108010008165 Etanercept Proteins 0.000 description 3
- 101001057612 Homo sapiens Dual specificity protein phosphatase 5 Proteins 0.000 description 3
- COLNVLDHVKWLRT-QMMMGPOBSA-N L-phenylalanine Chemical compound OC(=O)[C@@H](N)CC1=CC=CC=C1 COLNVLDHVKWLRT-QMMMGPOBSA-N 0.000 description 3
- 241001465754 Metazoa Species 0.000 description 3
- 102000007562 Serum Albumin Human genes 0.000 description 3
- 108010071390 Serum Albumin Proteins 0.000 description 3
- 230000009471 action Effects 0.000 description 3
- 238000007792 addition Methods 0.000 description 3
- 238000004458 analytical method Methods 0.000 description 3
- 238000010171 animal model Methods 0.000 description 3
- 238000004422 calculation algorithm Methods 0.000 description 3
- 230000000052 comparative effect Effects 0.000 description 3
- 230000009260 cross reactivity Effects 0.000 description 3
- 238000010494 dissociation reaction Methods 0.000 description 3
- 230000005593 dissociations Effects 0.000 description 3
- 229940073621 enbrel Drugs 0.000 description 3
- 229940088598 enzyme Drugs 0.000 description 3
- 230000006870 function Effects 0.000 description 3
- 102000043381 human DUSP5 Human genes 0.000 description 3
- 229940048921 humira Drugs 0.000 description 3
- RAXXELZNTBOGNW-UHFFFAOYSA-N imidazole Natural products C1=CNC=N1 RAXXELZNTBOGNW-UHFFFAOYSA-N 0.000 description 3
- 230000007246 mechanism Effects 0.000 description 3
- 230000002265 prevention Effects 0.000 description 3
- 239000007858 starting material Substances 0.000 description 3
- 101100421200 Caenorhabditis elegans sep-1 gene Proteins 0.000 description 2
- 208000022559 Inflammatory bowel disease Diseases 0.000 description 2
- XUJNEKJLAYXESH-REOHCLBHSA-N L-Cysteine Chemical compound SC[C@H](N)C(O)=O XUJNEKJLAYXESH-REOHCLBHSA-N 0.000 description 2
- ROHFNLRQFUQHCH-UHFFFAOYSA-N Leucine Natural products CC(C)CC(N)C(O)=O ROHFNLRQFUQHCH-UHFFFAOYSA-N 0.000 description 2
- 241000124008 Mammalia Species 0.000 description 2
- 241000699666 Mus <mouse, genus> Species 0.000 description 2
- 101000648290 Rattus norvegicus Tumor necrosis factor Proteins 0.000 description 2
- 101710187743 Tumor necrosis factor receptor superfamily member 1A Proteins 0.000 description 2
- 102100033733 Tumor necrosis factor receptor superfamily member 1B Human genes 0.000 description 2
- 101710187830 Tumor necrosis factor receptor superfamily member 1B Proteins 0.000 description 2
- 101710123661 Venom allergen 5 Proteins 0.000 description 2
- 125000001931 aliphatic group Chemical group 0.000 description 2
- 230000009286 beneficial effect Effects 0.000 description 2
- 230000004071 biological effect Effects 0.000 description 2
- 238000004364 calculation method Methods 0.000 description 2
- 201000011510 cancer Diseases 0.000 description 2
- 239000003153 chemical reaction reagent Substances 0.000 description 2
- 239000003795 chemical substances by application Substances 0.000 description 2
- 150000001875 compounds Chemical class 0.000 description 2
- 238000012790 confirmation Methods 0.000 description 2
- 238000002050 diffraction method Methods 0.000 description 2
- 229940079593 drug Drugs 0.000 description 2
- 238000002474 experimental method Methods 0.000 description 2
- 230000002998 immunogenetic effect Effects 0.000 description 2
- 238000001727 in vivo Methods 0.000 description 2
- 230000000977 initiatory effect Effects 0.000 description 2
- 229920001427 mPEG Polymers 0.000 description 2
- 238000004519 manufacturing process Methods 0.000 description 2
- 229910052751 metal Inorganic materials 0.000 description 2
- 239000002184 metal Substances 0.000 description 2
- 150000002739 metals Chemical class 0.000 description 2
- 210000002500 microbody Anatomy 0.000 description 2
- 238000001668 nucleic acid synthesis Methods 0.000 description 2
- 238000010647 peptide synthesis reaction Methods 0.000 description 2
- 238000003127 radioimmunoassay Methods 0.000 description 2
- 230000002829 reductive effect Effects 0.000 description 2
- 229940116176 remicade Drugs 0.000 description 2
- 238000011160 research Methods 0.000 description 2
- 239000000126 substance Substances 0.000 description 2
- 210000001519 tissue Anatomy 0.000 description 2
- 229910052720 vanadium Inorganic materials 0.000 description 2
- NHJVRSWLHSJWIN-UHFFFAOYSA-N 2,4,6-trinitrobenzenesulfonic acid Chemical compound OS(=O)(=O)C1=C([N+]([O-])=O)C=C([N+]([O-])=O)C=C1[N+]([O-])=O NHJVRSWLHSJWIN-UHFFFAOYSA-N 0.000 description 1
- TVZRAEYQIKYCPH-UHFFFAOYSA-N 3-(trimethylsilyl)propane-1-sulfonic acid Chemical compound C[Si](C)(C)CCCS(O)(=O)=O TVZRAEYQIKYCPH-UHFFFAOYSA-N 0.000 description 1
- ZXVONLUNISGICL-UHFFFAOYSA-N 4,6-dinitro-o-cresol Chemical compound CC1=CC([N+]([O-])=O)=CC([N+]([O-])=O)=C1O ZXVONLUNISGICL-UHFFFAOYSA-N 0.000 description 1
- HUDPLKWXRLNSPC-UHFFFAOYSA-N 4-aminophthalhydrazide Chemical compound O=C1NNC(=O)C=2C1=CC(N)=CC=2 HUDPLKWXRLNSPC-UHFFFAOYSA-N 0.000 description 1
- 102100033400 4F2 cell-surface antigen heavy chain Human genes 0.000 description 1
- 235000002198 Annona diversifolia Nutrition 0.000 description 1
- 102100028449 Arginine-glutamic acid dipeptide repeats protein Human genes 0.000 description 1
- 101100180402 Caenorhabditis elegans jun-1 gene Proteins 0.000 description 1
- 241000282832 Camelidae Species 0.000 description 1
- 241000282836 Camelus dromedarius Species 0.000 description 1
- VPAXJOUATWLOPR-UHFFFAOYSA-N Conferone Chemical compound C1=CC(=O)OC2=CC(OCC3C4(C)CCC(=O)C(C)(C)C4CC=C3C)=CC=C21 VPAXJOUATWLOPR-UHFFFAOYSA-N 0.000 description 1
- 208000009386 Experimental Arthritis Diseases 0.000 description 1
- WRPDZHJNLYNFFT-GEVIPFJHSA-N His-Thr Chemical group C[C@@H]([C@@H](C(=O)O)NC(=O)[C@H](CC1=CN=CN1)N)O WRPDZHJNLYNFFT-GEVIPFJHSA-N 0.000 description 1
- 241000282412 Homo Species 0.000 description 1
- 101000800023 Homo sapiens 4F2 cell-surface antigen heavy chain Proteins 0.000 description 1
- 101001061654 Homo sapiens Arginine-glutamic acid dipeptide repeats protein Proteins 0.000 description 1
- 108010054477 Immunoglobulin Fab Fragments Proteins 0.000 description 1
- 102000001706 Immunoglobulin Fab Fragments Human genes 0.000 description 1
- 102000006496 Immunoglobulin Heavy Chains Human genes 0.000 description 1
- 108010019476 Immunoglobulin Heavy Chains Proteins 0.000 description 1
- 125000000510 L-tryptophano group Chemical group [H]C1=C([H])C([H])=C2N([H])C([H])=C(C([H])([H])[C@@]([H])(C(O[H])=O)N([H])[*])C2=C1[H] 0.000 description 1
- 241000282842 Lama glama Species 0.000 description 1
- 241001490312 Lithops pseudotruncatella Species 0.000 description 1
- 108010085220 Multiprotein Complexes Proteins 0.000 description 1
- 102000007474 Multiprotein Complexes Human genes 0.000 description 1
- 241001529936 Murinae Species 0.000 description 1
- 230000004988 N-glycosylation Effects 0.000 description 1
- 230000004989 O-glycosylation Effects 0.000 description 1
- 241000283973 Oryctolagus cuniculus Species 0.000 description 1
- 102100035593 POU domain, class 2, transcription factor 1 Human genes 0.000 description 1
- 101710084414 POU domain, class 2, transcription factor 1 Proteins 0.000 description 1
- 206010034038 Parotitis Diseases 0.000 description 1
- 108091005804 Peptidases Proteins 0.000 description 1
- 102000035195 Peptidases Human genes 0.000 description 1
- 241000009328 Perro Species 0.000 description 1
- 108010053210 Phycocyanin Proteins 0.000 description 1
- 108010004729 Phycoerythrin Proteins 0.000 description 1
- 241000288906 Primates Species 0.000 description 1
- 239000004365 Protease Substances 0.000 description 1
- 206010039710 Scleroderma Diseases 0.000 description 1
- 241000282898 Sus scrofa Species 0.000 description 1
- 238000010521 absorption reaction Methods 0.000 description 1
- 239000002253 acid Substances 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-N acridine Chemical class C1=CC=CC2=CC3=CC=CC=C3N=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-N 0.000 description 1
- DZBUGLKDJFMEHC-UHFFFAOYSA-O acridine;hydron Chemical compound C1=CC=CC2=CC3=CC=CC=C3[NH+]=C21 DZBUGLKDJFMEHC-UHFFFAOYSA-O 0.000 description 1
- 108010004469 allophycocyanin Proteins 0.000 description 1
- 150000001408 amides Chemical class 0.000 description 1
- 238000013459 approach Methods 0.000 description 1
- 206010003246 arthritis Diseases 0.000 description 1
- 125000003118 aryl group Chemical group 0.000 description 1
- 229960000074 biopharmaceutical Drugs 0.000 description 1
- 230000015572 biosynthetic process Effects 0.000 description 1
- 210000004899 c-terminal region Anatomy 0.000 description 1
- 238000004587 chromatography analysis Methods 0.000 description 1
- 230000035071 co-translational protein modification Effects 0.000 description 1
- 206010009887 colitis Diseases 0.000 description 1
- 238000012875 competitive assay Methods 0.000 description 1
- 230000000295 complement effect Effects 0.000 description 1
- JECGPMYZUFFYJW-UHFFFAOYSA-N conferone Natural products CC1=CCC2C(C)(C)C(=O)CCC2(C)C1COc3cccc4C=CC(=O)Oc34 JECGPMYZUFFYJW-UHFFFAOYSA-N 0.000 description 1
- 239000000356 contaminant Substances 0.000 description 1
- 239000013078 crystal Substances 0.000 description 1
- 238000002447 crystallographic data Methods 0.000 description 1
- 235000013365 dairy product Nutrition 0.000 description 1
- 238000013461 design Methods 0.000 description 1
- 229960000633 dextran sulfate Drugs 0.000 description 1
- 238000003745 diagnosis Methods 0.000 description 1
- 238000009509 drug development Methods 0.000 description 1
- 230000009977 dual effect Effects 0.000 description 1
- 230000002255 enzymatic effect Effects 0.000 description 1
- 238000000855 fermentation Methods 0.000 description 1
- 230000004151 fermentation Effects 0.000 description 1
- 210000002950 fibroblast Anatomy 0.000 description 1
- ZFKJVJIDPQDDFY-UHFFFAOYSA-N fluorescamine Chemical compound C12=CC=CC=C2C(=O)OC1(C1=O)OC=C1C1=CC=CC=C1 ZFKJVJIDPQDDFY-UHFFFAOYSA-N 0.000 description 1
- GNBHRKFJIUUOQI-UHFFFAOYSA-N fluorescein Chemical compound O1C(=O)C2=CC=CC=C2C21C1=CC=C(O)C=C1OC1=CC(O)=CC=C21 GNBHRKFJIUUOQI-UHFFFAOYSA-N 0.000 description 1
- 229910052731 fluorine Inorganic materials 0.000 description 1
- 230000002068 genetic effect Effects 0.000 description 1
- 238000010353 genetic engineering Methods 0.000 description 1
- 239000001963 growth medium Substances 0.000 description 1
- 210000004408 hybridoma Anatomy 0.000 description 1
- 229910052739 hydrogen Inorganic materials 0.000 description 1
- 238000003018 immunoassay Methods 0.000 description 1
- 239000012535 impurity Substances 0.000 description 1
- 238000010874 in vitro model Methods 0.000 description 1
- 230000003993 interaction Effects 0.000 description 1
- 238000001990 intravenous administration Methods 0.000 description 1
- 229910052740 iodine Inorganic materials 0.000 description 1
- 150000002500 ions Chemical class 0.000 description 1
- 150000002540 isothiocyanates Chemical class 0.000 description 1
- 229910052747 lanthanoid Inorganic materials 0.000 description 1
- 150000002602 lanthanoids Chemical class 0.000 description 1
- 229940019452 loris Drugs 0.000 description 1
- 229920002521 macromolecule Polymers 0.000 description 1
- 238000013507 mapping Methods 0.000 description 1
- 230000010534 mechanism of action Effects 0.000 description 1
- 239000002609 medium Substances 0.000 description 1
- 230000000813 microbial effect Effects 0.000 description 1
- 238000010369 molecular cloning Methods 0.000 description 1
- 238000000302 molecular modelling Methods 0.000 description 1
- 229910052757 nitrogen Inorganic materials 0.000 description 1
- 230000009871 nonspecific binding Effects 0.000 description 1
- 230000035515 penetration Effects 0.000 description 1
- 238000002823 phage display Methods 0.000 description 1
- 230000000144 pharmacologic effect Effects 0.000 description 1
- 238000002264 polyacrylamide gel electrophoresis Methods 0.000 description 1
- 229920000642 polymer Polymers 0.000 description 1
- 230000004481 post-translational protein modification Effects 0.000 description 1
- 230000001323 posttranslational effect Effects 0.000 description 1
- 238000007639 printing Methods 0.000 description 1
- 108020001580 protein domains Proteins 0.000 description 1
- 230000009145 protein modification Effects 0.000 description 1
- 230000005180 public health Effects 0.000 description 1
- 238000011552 rat model Methods 0.000 description 1
- 239000012429 reaction media Substances 0.000 description 1
- PYWVYCXTNDRMGF-UHFFFAOYSA-N rhodamine B Chemical compound [Cl-].C=12C=CC(=[N+](CC)CC)C=C2OC2=CC(N(CC)CC)=CC=C2C=1C1=CC=CC=C1C(O)=O PYWVYCXTNDRMGF-UHFFFAOYSA-N 0.000 description 1
- 238000013391 scatchard analysis Methods 0.000 description 1
- 238000002864 sequence alignment Methods 0.000 description 1
- 210000002966 serum Anatomy 0.000 description 1
- 238000001542 size-exclusion chromatography Methods 0.000 description 1
- 239000011734 sodium Substances 0.000 description 1
- 229910052708 sodium Inorganic materials 0.000 description 1
- 230000009870 specific binding Effects 0.000 description 1
- 238000012916 structural analysis Methods 0.000 description 1
- 238000007920 subcutaneous administration Methods 0.000 description 1
- 238000003786 synthesis reaction Methods 0.000 description 1
- 230000000699 topical effect Effects 0.000 description 1
- 230000001988 toxicity Effects 0.000 description 1
- 231100000419 toxicity Toxicity 0.000 description 1
- 238000012800 visualization Methods 0.000 description 1
- 239000002699 waste material Substances 0.000 description 1
- 229910052727 yttrium Inorganic materials 0.000 description 1
Images
Classifications
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
- C07K16/24—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans against cytokines, lymphokines or interferons
- C07K16/241—Tumor Necrosis Factors
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K39/395—Antibodies; Immunoglobulins; Immune serum, e.g. antilymphocytic serum
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/04—Drugs for disorders of the alimentary tract or the digestive system for ulcers, gastritis or reflux esophagitis, e.g. antacids, inhibitors of acid secretion, mucosal protectants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P1/00—Drugs for disorders of the alimentary tract or the digestive system
- A61P1/16—Drugs for disorders of the alimentary tract or the digestive system for liver or gallbladder disorders, e.g. hepatoprotective agents, cholagogues, litholytics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P11/00—Drugs for disorders of the respiratory system
- A61P11/06—Antiasthmatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P13/00—Drugs for disorders of the urinary system
- A61P13/12—Drugs for disorders of the urinary system of the kidneys
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P15/00—Drugs for genital or sexual disorders; Contraceptives
- A61P15/08—Drugs for genital or sexual disorders; Contraceptives for gonadal disorders or for enhancing fertility, e.g. inducers of ovulation or of spermatogenesis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/02—Drugs for dermatological disorders for treating wounds, ulcers, burns, scars, keloids, or the like
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P17/00—Drugs for dermatological disorders
- A61P17/06—Antipsoriatics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P19/00—Drugs for skeletal disorders
- A61P19/02—Drugs for skeletal disorders for joint disorders, e.g. arthritis, arthrosis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P21/00—Drugs for disorders of the muscular or neuromuscular system
- A61P21/04—Drugs for disorders of the muscular or neuromuscular system for myasthenia gravis
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/08—Antiepileptics; Anticonvulsants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/14—Drugs for disorders of the nervous system for treating abnormal movements, e.g. chorea, dyskinesia
- A61P25/16—Anti-Parkinson drugs
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/18—Antipsychotics, i.e. neuroleptics; Drugs for mania or schizophrenia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/24—Antidepressants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/28—Drugs for disorders of the nervous system for treating neurodegenerative disorders of the central nervous system, e.g. nootropic agents, cognition enhancers, drugs for treating Alzheimer's disease or other forms of dementia
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/32—Alcohol-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P25/00—Drugs for disorders of the nervous system
- A61P25/30—Drugs for disorders of the nervous system for treating abuse or dependence
- A61P25/36—Opioid-abuse
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/02—Ophthalmic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P27/00—Drugs for disorders of the senses
- A61P27/16—Otologicals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P29/00—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID]
- A61P29/02—Non-central analgesic, antipyretic or antiinflammatory agents, e.g. antirheumatic agents; Non-steroidal antiinflammatory drugs [NSAID] without antiinflammatory effect
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/02—Nutrients, e.g. vitamins, minerals
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P3/00—Drugs for disorders of the metabolism
- A61P3/08—Drugs for disorders of the metabolism for glucose homeostasis
- A61P3/10—Drugs for disorders of the metabolism for glucose homeostasis for hyperglycaemia, e.g. antidiabetics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/04—Antibacterial agents
- A61P31/08—Antibacterial agents for leprosy
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P31/00—Antiinfectives, i.e. antibiotics, antiseptics, chemotherapeutics
- A61P31/12—Antivirals
- A61P31/14—Antivirals for RNA viruses
- A61P31/18—Antivirals for RNA viruses for HIV
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P35/00—Antineoplastic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/04—Immunostimulants
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/02—Immunomodulators
- A61P37/06—Immunosuppressants, e.g. drugs for graft rejection
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P37/00—Drugs for immunological or allergic disorders
- A61P37/08—Antiallergic agents
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P43/00—Drugs for specific purposes, not provided for in groups A61P1/00-A61P41/00
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/14—Drugs for disorders of the endocrine system of the thyroid hormones, e.g. T3, T4
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P5/00—Drugs for disorders of the endocrine system
- A61P5/38—Drugs for disorders of the endocrine system of the suprarenal hormones
- A61P5/40—Mineralocorticosteroids, e.g. aldosterone; Drugs increasing or potentiating the activity of mineralocorticosteroids
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P7/00—Drugs for disorders of the blood or the extracellular fluid
- A61P7/06—Antianaemics
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61P—SPECIFIC THERAPEUTIC ACTIVITY OF CHEMICAL COMPOUNDS OR MEDICINAL PREPARATIONS
- A61P9/00—Drugs for disorders of the cardiovascular system
- A61P9/10—Drugs for disorders of the cardiovascular system for treating ischaemic or atherosclerotic diseases, e.g. antianginal drugs, coronary vasodilators, drugs for myocardial infarction, retinopathy, cerebrovascula insufficiency, renal arteriosclerosis
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K14/00—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof
- C07K14/435—Peptides having more than 20 amino acids; Gastrins; Somatostatins; Melanotropins; Derivatives thereof from animals; from humans
- C07K14/52—Cytokines; Lymphokines; Interferons
- C07K14/525—Tumour necrosis factor [TNF]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/18—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies against material from animals or humans
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K16/00—Immunoglobulins [IGs], e.g. monoclonal or polyclonal antibodies
- C07K16/46—Hybrid immunoglobulins
- C07K16/468—Immunoglobulins having two or more different antigen binding sites, e.g. multifunctional antibodies
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K19/00—Hybrid peptides, i.e. peptides covalently bound to nucleic acids, or non-covalently bound protein-protein complexes
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N15/00—Mutation or genetic engineering; DNA or RNA concerning genetic engineering, vectors, e.g. plasmids, or their isolation, preparation or purification; Use of hosts therefor
- C12N15/09—Recombinant DNA-technology
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12N—MICROORGANISMS OR ENZYMES; COMPOSITIONS THEREOF; PROPAGATING, PRESERVING, OR MAINTAINING MICROORGANISMS; MUTATION OR GENETIC ENGINEERING; CULTURE MEDIA
- C12N5/00—Undifferentiated human, animal or plant cells, e.g. cell lines; Tissues; Cultivation or maintenance thereof; Culture media therefor
- C12N5/10—Cells modified by introduction of foreign genetic material
-
- C—CHEMISTRY; METALLURGY
- C12—BIOCHEMISTRY; BEER; SPIRITS; WINE; VINEGAR; MICROBIOLOGY; ENZYMOLOGY; MUTATION OR GENETIC ENGINEERING
- C12P—FERMENTATION OR ENZYME-USING PROCESSES TO SYNTHESISE A DESIRED CHEMICAL COMPOUND OR COMPOSITION OR TO SEPARATE OPTICAL ISOMERS FROM A RACEMIC MIXTURE
- C12P21/00—Preparation of peptides or proteins
- C12P21/02—Preparation of peptides or proteins having a known sequence of two or more amino acids, e.g. glutathione
-
- A—HUMAN NECESSITIES
- A61—MEDICAL OR VETERINARY SCIENCE; HYGIENE
- A61K—PREPARATIONS FOR MEDICAL, DENTAL OR TOILETRY PURPOSES
- A61K39/00—Medicinal preparations containing antigens or antibodies
- A61K2039/505—Medicinal preparations containing antigens or antibodies comprising antibodies
-
- B—PERFORMING OPERATIONS; TRANSPORTING
- B82—NANOTECHNOLOGY
- B82Y—SPECIFIC USES OR APPLICATIONS OF NANOSTRUCTURES; MEASUREMENT OR ANALYSIS OF NANOSTRUCTURES; MANUFACTURE OR TREATMENT OF NANOSTRUCTURES
- B82Y5/00—Nanobiotechnology or nanomedicine, e.g. protein engineering or drug delivery
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/22—Immunoglobulins specific features characterized by taxonomic origin from camelids, e.g. camel, llama or dromedary
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/20—Immunoglobulins specific features characterized by taxonomic origin
- C07K2317/24—Immunoglobulins specific features characterized by taxonomic origin containing regions, domains or residues from different species, e.g. chimeric, humanized or veneered
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/30—Immunoglobulins specific features characterized by aspects of specificity or valency
- C07K2317/31—Immunoglobulins specific features characterized by aspects of specificity or valency multispecific
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2317/00—Immunoglobulins specific features
- C07K2317/50—Immunoglobulins specific features characterized by immunoglobulin fragments
- C07K2317/56—Immunoglobulins specific features characterized by immunoglobulin fragments variable (Fv) region, i.e. VH and/or VL
- C07K2317/565—Complementarity determining region [CDR]
-
- C—CHEMISTRY; METALLURGY
- C07—ORGANIC CHEMISTRY
- C07K—PEPTIDES
- C07K2319/00—Fusion polypeptide
- C07K2319/31—Fusion polypeptide fusions, other than Fc, for prolonged plasma life, e.g. albumin
Landscapes
- Health & Medical Sciences (AREA)
- Chemical & Material Sciences (AREA)
- Organic Chemistry (AREA)
- Life Sciences & Earth Sciences (AREA)
- General Health & Medical Sciences (AREA)
- Medicinal Chemistry (AREA)
- Engineering & Computer Science (AREA)
- Bioinformatics & Cheminformatics (AREA)
- Chemical Kinetics & Catalysis (AREA)
- General Chemical & Material Sciences (AREA)
- Veterinary Medicine (AREA)
- Pharmacology & Pharmacy (AREA)
- Animal Behavior & Ethology (AREA)
- Public Health (AREA)
- Nuclear Medicine, Radiotherapy & Molecular Imaging (AREA)
- Immunology (AREA)
- Genetics & Genomics (AREA)
- Biochemistry (AREA)
- Molecular Biology (AREA)
- Biomedical Technology (AREA)
- Proteomics, Peptides & Aminoacids (AREA)
- Biophysics (AREA)
- Neurology (AREA)
- Neurosurgery (AREA)
- Diabetes (AREA)
- Zoology (AREA)
- Wood Science & Technology (AREA)
- Biotechnology (AREA)
- Psychiatry (AREA)
- Endocrinology (AREA)
- Pulmonology (AREA)
- General Engineering & Computer Science (AREA)
- Pain & Pain Management (AREA)
- Hematology (AREA)
- Microbiology (AREA)
- Addiction (AREA)
- Rheumatology (AREA)
- Dermatology (AREA)
- Reproductive Health (AREA)
- Gastroenterology & Hepatology (AREA)
Abstract
nanocorpos melhorados contra fator alfa de necrose tumoral. a presente invenção se refere aos nanocorpos melhorados contra fator-alfa de necrose tumoral (tnf-alfa), bem como a polipeptídios compreendendo ou essencialmente compostos de um ou vários de tais nanocorpos. a invenção também se refere aos ácidos nucléicos que codificam tais nanocorpos e polipeptídios; a métodos para preparar tais nanocorpos e polipeptídios; a células hospedeiras que expressam ou são capazes de expressar tais nanocorpos ou polipeptídios; a composições que compreendem tais nanocorpos, polipeptídios, ácidos nucléicos ou células hospedeiras; e aos usos de tais nanocorpos, tais polipeptídios, tais ácidos nucléicos, tais células hospedeiras ou tais composições, em particular para fins profiláticos, terapêuticos ou de diagnóstico.
Description
A presente invenção se refere à nanocorpos melhorado contra fator alfa de necrose tumoral (TNF-alfa), bem como a polipeptídios compreendendo ou essencialmente compostos de um ou vários de tais nanocorpos. [Observação: Nanocorpo(s) se referem a Nanobody™, Nanobodies™ e Nanoclone ™, gue são marcas registradas da Ablynx N.V.]
A invenção também se refere aos ácidos nucléicos que codificam tais nanocorpos e polipeptídios; a métodos para preparar tais nanocorpos e polipeptídios; apresentar células que expressam ou são capazes de expressar tais nanocorpos ou polipeptídios; a composições que compreendem tais nanocorpos, polipeptídios, ácidos nucléicos ou células 4 hospedeiras; e a usos de tais nanocorpos, tais polipeptídios, tais ácidos nucléicos, tais células . hospedeiras ou tais composições, especialmente para objetivos profiláticos, terapêuticos ou diagnósticos, como objetivos profiláticos, terapêuticos ou diagnósticos mencionados mais adiante.
Outros aspectos, modalidades de execução, vantagens e aplicações da invenção ficarão claros da nova descrição a seguir.
O WO 04/041862 pelo solicitante refere-se a nanocorpos contra o TNF-alfa e à preparação e uso do mesmo, especialmente para a prevenção e/ou o tratamento de doenças e desordens associadas com e/ou mediado pelo TNF-alfa, como inflamação, artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino, esclerose múltipla, doença de Addison, hepatite autoimune, parotite autoimune, diabete tipo 1, epididimite, glomerulonefrite, doença de Graves, síndrome de Guillain-Barre, doença de Hashimoto, anemia hemolítica, lupus eritematoso sistêmico,infertilidade masculina, esclerose múltipla, miastenia gravis, pênfigo, psoríase, febre reumática, artrite reumatóide, sarcoidose, escleroderma, síndrome de Sjogren, espondiloartropatias, tireoidite, e vasculite,
O nanocorpos anti-TNF segundo o WO 04/041862 pode ser 5 humanizado e pode ser monovalente ou multivalente, o ultimo do qual leva à afinidade aumentada para TNF. Os nanocorpos anti-TNF, segundo o WO 04/041862 também pode ser multiespecífico, e ser especialmente na forma de um construto multiespecífico compreendendo dois ou mais 10 nanocorpos contra TNF e um novo Nanocorpo dirigido contra uma proteína de soro como albumina de soro humana, que leva a uma meia-vida aumentada in vivo.
O WO 04/041862 também se relaciona aos métodos para a preparação dos nanocorpos anti-TNF, aos ácidos nucléicos ou 15 construtos que codificam os nanocorpos anti-TNF, bem como a composições farmacêuticas que compreendem os nanocorpos anti-TNF, que pode ser conveniente para administração intravenosa, subcutânea, oral, sublingual, tópica, nasal, vaginal ou retal, ou para administração pela inalação. Os nanocorpos anti-TNF segundo o WO 04/041862 também pode ser usado com para objetivos de diagnósticos, opcionalmente na forma de um kit-de-partes.
O EP 0 486526 descreve o TNF-alfa que liga ligandos contra um epitope específico de TNF. Entre os ligandos de 25 ligação, anticorpos de domínio únicos ("dAbs") são mencionados.
Reiter et al., J. Mol.Biol. (1999), 290, 685-698 descrevem anticorpos de domínio únicos contra o TNF-alfa obtida de uma biblioteca de exposição de fagos aleatória que 30 foi gerada começando de um andaime de domínio VH de um hibridoma de rato.
O WO 00/29004 descreve anticorpos de domínio únicos murina ("microcorpos") contra o TNF-alfa.
O WO 04/003019 entre outras coisas descreve ligandos compreendendo um primeiro domínio obrigatório contra o TNF-alfa e um segundo domínio obrigatório contra uma proteína de soro como albumina de soro.
E um objetivo geral da presente invenção fornecer nanocorpos contra o TNF-alfa, especialmente contra o TNF- alfa humana.
Especialmente, é um objetivo da presente invenção fornecer nanocorpos contra o TNF-alfa, especialmente contra o TNF-alfa humana, e fornecer proteína ou polipeptídios que compreendam os mesmos, que sejam convenientes para o uso terapêutico e/ou diagnóstico, e especialmente para a prevenção, tratamento e/ou diagnóstico de uma ou várias doenças e desordens associadas com e/ou mediado pelo TNF- alfa como os acima mencionados, e/ou que pode usado na preparação de uma composição farmacêutica para a prevenção e/ou o tratamento de uma ou várias doenças associadas com e/ou mediadas pelo TNF-alfa, como os acima mencionados.
Mais especialmente, ê um objeto da invenção fornecer nanocorpos contra o TNF-alfa, e fornecer proteína e polipeptídios que compreendam os mesmos, que são uma alternativa ao nanocorpos e polipeptídios contra o TNF-alfa . 20 descrita em WO 04/041862 e/ou que tem uma ou várias propriedades ou características melhoradas, em comparação com os nanocorpos e polipeptídios contra o TNF-alfa descrita A em WO 04/041862.
Mais especialmente, é um objeto da invenção fornecer nanocorpos contra o TNF-alfa, e fornecer proteína ou polipeptídios que compreendam os mesmos, que são melhorados em comparação com os nanocorpos e polipeptídios contra o TNF-alfa descrita em WO 04/041862 com respeito a uma ou várias das propriedades ou características seguintes:- afinidade aumentada para o TNF-alfa, seja em um formatomonovalente, em um formato multivalente (por exemplo em um formato bivalente) e/ou em um formato multiespecífico (por exemplo um dos formatos multiespecíficos descritos em WO 04/041862 ou a seguir); - melhor conveniência para formatação em um formatomultivalente (por exemplo em um formato bivalente); melhor conveniência para formatação em um formato multiespecífico (por exemplo um dos formatos multiespecíficos descritos em WO 04/041862 ou a seguir);conveniência melhorada ou suscetibilidade para 5 substituições "humanizantes" (conforme definido na presente); e/ou- menos imunogenicidade, seja em um formato monovalente, em um formato multivalente (por exemplo em um formato bivalente) e/ou em um formato multiespecífico (por exemplo 10 um dos formatos multiespecíficos descritos em WO 04/041862 ou a seguir) em um formato monovalente;- estabilidade aumentada, seja em um formato monovalente, em um formato multivalente (por exemplo em um formato bivalente) e/ou em um formato multiespecífico (por exemplo 15 um dos formatos multiespecíficos descritos em WO 04/041862 4 ou a seguir) em um formato monovalente;- especificidade aumentada em direção o TNF-alfa, seja em um formato monovalente, em um formato multivalente (por exemplo em um formato bivalente) e/ou em um formato multiespecífico 20 (por exemplo um dos formatos multiespecíficos descritos em WO 04/041862 ou a seguir) em um formato monovalente;- reduzido ou onde desejado reatividade cruzada aumentada com TNF-alfa de espécie diferente;e/ou- uma ou várias outras propriedades melhoradas desejáveispara uso farmacêutico (inclusive uso profilático e/ou uso terapêutico) e/ou uso para diagnóstico (inclusive, mas não limitado a, usar para objetivos de visualização), seja em um formato monovalente, em um formato multivalente (por exemplo em um formato bivalente) e/ou em um formato multiespecífico (por exemplo um dos formatos multiespecíficos descritos em WO 04/041862 ou a seguir).
Esses objetos são realizados pelo nanocorpos, proteína e polipeptídios descritos na presente. Esses nanocorpos 35 também são mencionados na presente como "nanocorpos da invenção"; e essa proteína e os polipeptídios também são coletivamente mencionados na presente "os polipeptídios da invenção".
Desde que os nanocorpos e os polipeptídios descritos na presente são principalmente destinados para uso terapêutico 5 e/ou diagnóstico, eles são dirigidos contra (conforme definido na presente) TNF-alfa humana. Não é contudo excluído (mas também não requerido) que nanocorpos e os polipeptídios descritos na presente mostrem reatividade cruzada com o TNF-alfa de uma ou várias outras espécies de 10 animais de sangue quente, por exemplo, com o TNF-alfa de uma ou várias outras espécies de primatas e/ou com o TNF-alfa de uma ou várias espécies de animais que frequentemente são usados em modelos animais para doenças (por exemplo camundongo, rato, coelho, porco ou cão), e especialmente em 15 modelos animais para doenças e desordens associadas com oTNF-alfa (como a espécie e modelos animais mencionados na presente). Neste aspecto, estará claro para a pessoa _ experimentada que tal reatividade cruzada, quando presente,pode ter vantagens do ponto de vista do desenvolvimento de - 20 fármaco, desde que permita que os nanocorpos e polipeptídios contra o TNF-alfa humana seja testado em tais modelos de doença.
A presente invenção também está, no seu sentido mais amplo, não particularmente limitada a ou definida para um 25 determinante antigênico específico, epitope, parte, domínio, subunidade ou confirmação (onde aplicável) do TNF-alfa contra a qual os nanocorpos e os polipeptídios da invenção estão dirigidos.
Contudo, em uma modalidade de execução preferencial, o 30 nanocorpos, a proteína ou os polipeptídios descritos na presente são dirigidos contra e/ou podem ligar a um epitope do TNF-alfa que está em e/ou é parte do(s) sítio (s) de ligação do receptor TNF (p. ex. os sítios de ligação para o TNF-RI, THF-RII, também conhecidos como p55 ou p75). Como é 35 bem conhecido na técnica, um Trímero TNF compreende três sítios de ligação de receptor, que são essencialmente equivalentes e que são formados por/na interface de dois Monômeros TNF dentro do Trímero TNF. Por exemplo, o nanocorpos, a proteína ou os polipeptídios descritos na presente são preferivelmente dirigidos contra e/ou podem ligar a um epitope do TNF-alfa que compreende os resíduos aminoácidos seguintes do TNF-alfa: Gin na posição 88, Lys na posição 90, e/ou Glu na posição 146).
Especialmente, o nanocorpos, a proteína ou os polipeptídios descritos na presente são dirigidos contra e/ou podem ligar a um epitope do Trímero TNF-alfa, que está em e/ou é parte do(s) sítios que ligam receptor TNF. Por exemplo, o nanocorpos, a proteína ou os polipeptídios descritos na presente podem ser dirigidos contra e/ou podem ligar a um epitope do Trímero TNF-alfa que compreende os resíduos aminoácidos seguintes: o Gin na posição 88 e Lys na posição 90 em um primeiro Monômero TNF (mencionado na presente como "monômero A") , e Glu na posição 146 em um segundo Monômero TNF (mencionado na presente como "monômero B") (no qual Monômero A e Monômero B em conjunto, no Trímero TNF, formam o(s) sítio(s) que ligam receptor TNF).
Mais em particular, o nanocorpos, a proteína ou os polipeptídios descritos na presente podem ser dirigidos contra e/ou podem ligar a um epitope de Trímero TNF-alfa que compreende os aminoácidos acima mencionados (Gin na posição 88 no monômero A; Lys na posição 90 no monômero A e Glu na posição 146 no monômero B) , e além disso, pelo menos um, preferivelmente dois ou mais, mais preferivelmente 5 ou mais, e preferivelmente todos ou essencialmente todos, dos resíduos aminoácidos seguintes do TNF-alfa monômero A: Gly na posição 24, Gin na posição 25, Thr na posição 72, His na posição 73, Vai na posição 74, Leu na posição 75, Thr na posição 77, Thr na posição 79, Ile na posição 83, Thr na posição 89, Vai na posição 91. Asn na posição 92, Ile na posição 97, Arg na posição 131, Glu na posição 135, Ile na posição 136, Asn na posição 137, Arg na posição 138, Pro na posição 139, Asp na posição 140 e os resíduos seguintes no monômero B: Pro na posição 20, Arg na posição 32, Lys na posição 65, Lys na posição 112, Tyr na posição 115, Ala na posição 145, Ser na posição 147.
Alternativamente, o nanocorpos, a proteína ou os polipeptídios descritos na presente podem ser dirigidos contra e/ou podem ligar a um epitope do TNF-alfa que compreende os aminoácidos acima mencionados (Gin na posição 88 no monômero A; Lys na posição 90 no monômero A e Glu na posição 146 no monômero B) , e além disso, pelo menos um, 10 preferivelmente dois ou mais, mais preferivelmente 5 ou mais e preferivelmente todos ou essencialmente todos, dos resíduos aminoácidos seguintes de TNF-alfa monômero A: Leuna posição 75, Thr na posição 77, Thr na posição 79, Ile naposição 80, Ser na posição 81, Tyr na posição 87, Thr naposição 89, Vai na posição 91, Asn na posição 92, Ser naposição 95, Ile na posição 97, Glu na posição 135, Ile naposição 136, Asn na posição 137 e os resíduos seguintes nomonômero B: Ala na posição 33, Ala na posição 145, Ser naposição 147.
Tal epitope pode ser delineado da análise estrutural do nanocrpo cristalizado no complexo com a molécula TNF, ou das outras aproximações como mapeamento de epitope via análise pepscan.
Por comparação, de dados cristalográficos (não 25 mostrado), pode ser visto que o Nanocorpo 3E de WO 04/041862 liga a um epitope diferente (isto é, um epitope que compreende Tyr na posição 141, Asp na posição 140, Gin na posição 67, Gly na posição 24 e Glu na posição 23) do que o epitope preferencial da invenção.
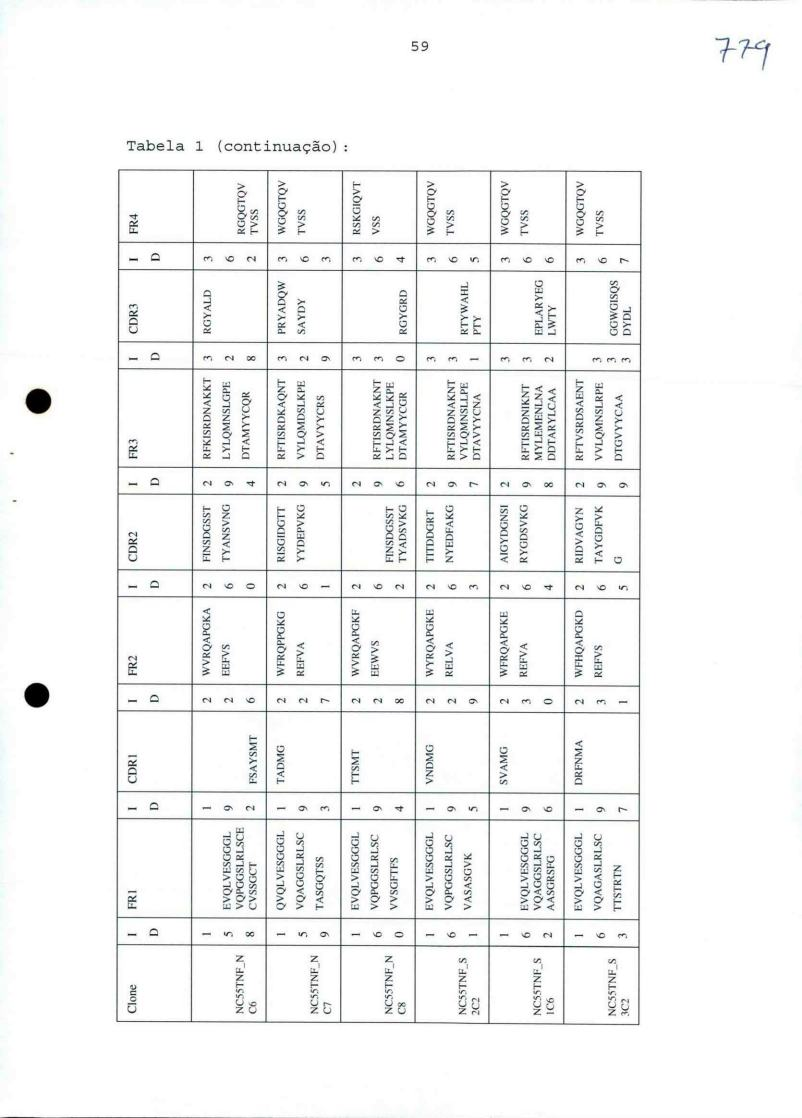
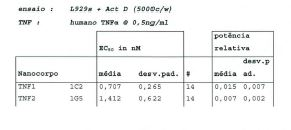
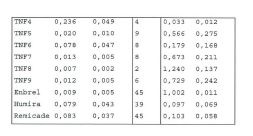
Portanto, em outro aspecto, a presente invenção refere-se a um domínio variável de imunoglobulina (ou um fragmento conveniente disso) que pode ligar a um epitope do TNF-alfa que está em e/ou é parte do sítio que liga o receptor TNF, e preferivelmente a um epitope que compreende pelo menos um, 35 preferivelmente dois ou mais, e preferivelmente todos, dos resíduos aminoácidos seguintes de TNF-alfa: Gin na posição 88; Lys na posição 90 e Glu na posição 146. Tal domínio variável de imunoglobulina é preferivelmente um domínio variável de cadeia pesada ou um domínio variável de cadeia leve, e especialmente um domínio variável de cadeia pesada, 5 que pode ser qualquer domínio variável de cadeia pesada de mamíferos, inclusive, mas não limitado a, domínios variáveis de cadeias pesadas humanos, domínios variáveis de cadeias pesadas de ratos e domínios variáveis de cadeias pesadas de camelídeos (como os domínios variáveis de cadeias pesadas de 10 imunoglobulinas de 4 cadeias de camelídeos ou os domínios variáveis de cadeias pesadas (domínios de VHH) dos assim chamados anticorpos de cadeias pesadas). O domínio variável de imunoglobulina é preferivelmente um anticorpo de domínio ou um anticorpo de domínio único ou conveniente para usar 15 como um anticorpo de domínio (único). Mais preferivelmente, o domínio variável de imunoglobulina é um nanocorpo (conforme definido na presente), e alguns exemplos preferidos, mas não-restritivos de nanocorpos que são convenientes para usar neste aspecto da invenção são PMP1C2 20 (TNF1, SEQ ID NO:52) e PMP5F10 (TNF3, SEQ ID n. 60), bem como outras variantes humanizadas dos mesmos (conforme mais adiante descrito na presente).
O domínio variável de imunoglobulina acima mencionado também pode ser humanizado (como por exemplo, e sem 25 restrição) descrito na presente com respeito a nanocorpos. A invenção também se refere a proteína e polipeptídios que compreendem ou essencialmente se compõem de tais domínios variáveis de imunoglobulina, que, por exemplo, podem ser como definidos na presente. Alternativamente, tais domínios 30 variáveis podem ser parte de Construtos ScFv, construtos duplos específicos, anticorpo quimérico ou estruturas de anticorpo e outros construtos de imunoglobulina, como, por exemplo, revisto por Hoogenboom (Biotecnologia da Natureza (1997), 15:125-126). Preferivelmente, contudo, os domínios 35 variáveis de imunoglobulina dirigidos contra o epitope acima mencionado são nanocorpos, em cujo caso a proteína e os polipeptídios que compreendem tais nanocorpos podem ser conforme mais adiante descritos na presente.
Portanto, alguns aspectos preferenciais da invenção referem-se a :I) Um Nanocorpo que é dirigido contra o mesmo epitope no trímero do TNF-alfa como Nanocorpo TNF1 (SEQ ID n. 52).II) Um Nanocorpo que é dirigido contra o mesmo epitope no trímero do TNF-alfa como Nanocorpo TNF3 (SEQ ID n. 50).III) Um Nanocorpo que é dirigido contra um epitope do trímero 10 do TNF-alfa que pelo menos compreende os resíduosaminoácidos seguintes: Gin na posição 88 no monômero A; Lys na posição 90 no monômero A e Glu na posição 146 no monômero B.IV) Um Nanocorpo que é dirigido contra um epitope do trímero 15 do TNF-alfa que compreende os resíduos aminoácidosseguintes: Gin na posição 88 no monômero A; Lys na posição 90 no monômero A e Glu na posição 146 no monômero B; e que, além disso, compreende pelo menos um, preferivelmente dois ou mais, mais preferivelmente 5 ou 20 mais, e preferivelmente todos ou essencialmente todos,dos resíduos aminoácidos seguintes do TNF-alfa monômero A:72,75, Gly na posição 24,73,77, GinVaiThr na posição na posição na posição 25, Thr na posição74, Leu na posição HisThr na posição na posição 79, Ile na posição25 83 , Thr na posição 89, Vai na posição 91. Asn na posição 92, Ile na posição 97, Arg na posição 131, Glu naposição 135, Ile na posição 136, Asn na posição 137, Arg na posição 138, Pro na posição 139, Asp na posição 140 e os resíduos seguintes no monômero B: Pro na posição 20, 30 Arg na posição 32, Lys na posição 65, Lys na posição112, Tyr na posição 115, Ala na posição 145, Ser na posição 147.V) Um Nanocorpo que é dirigido contra um epitope do trímero do TNF-alfa que compreende os resíduos aminoácidos seguintes: Gin na posição 88 no monômero A; Lys na posição 90 no monômero A e Glu na posição 146 no monômero B; e que, além disso, compreende pelo menos um, preferivelmente dois ou mais, mais preferivelmente 5 ou mais, e preferivelmente todos ou essencialmente todos, 5 dos resíduos aminoácidos seguintes do TNF-alfa monômeroA Leu na posição 75, Thr na posição 77, Thr na posição79, Ile na posição 80, Ser na posição 81, Tyr na posição87, Thr na posição 89, Vai na posição 91, Asn na posição92, Ser na posição 95, Ile na posição 97, Glu na posição135, Ile na posição 136, Asn na posição 137 e osresíduos seguintes no monômero B: Ala na posição 33, Ala na posição 145, Ser na posição 147.- Um Nanocorpo conforme algum dos I) a V) acima, que tem uma taxa Koff para TNF de melhor do que 2.10'3 (1/s) , preferivelmente melhor do que 1.10'3.1 - Um Nanocorpo conforme algum dos I) a V) acima, que tem umvalor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E (SEQ ID 20 NO: 4) de WO 04/041862 no mesmo ensaio; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme algum dos I) a V) acima, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é 25 melhor do que 12nM; ou uma variante humanizada de tal Nanocorpo..- Um Nanocorpo conforme algum dos I) a V) acima, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é 30 melhor do que 5nM; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme algum dos I) a V) acima, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é 35 melhor do que 3nM; ou uma variante humanizada de tal Nanocorpo. - Um Nanocorpo conforme algum dos I) a V) acima, que é um Nanocorpo humanizado.e alguns aspectos preferenciais desta modalidade de execução relacionam-se a : - Um Nanocorpo conforme algum dos I) a V) acima, que é umNanocorpo de classe GLEW.- Um Nanocorpo conforme algum dos I) a V) acima, que é um Nanocorpo humanizado de classe GLEW.- Um Nanocorpo conforme algum dos I) a V) acima, que contém 10 um resíduo de arginina (R) na posição 103.- Um Nanocorpo conforme algum dos I) a V) acima, que contém um resíduo de arginina (R) na posição 103, e que é humanizado- Um Nanocorpo conforme algum dos I) a V) acima, que é um Nanocorpo de classe GLEW, e que contém um resíduo de arginina (R) na posição 103, e que é humanizado.- Um Nanocorpo conforme algum dos I) a V) acima, que contém um resíduo de leucina (L) na posição 108.- Um Nanocorpo conforme algum dos I) a V) acima, que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de sequência de 99% (conforme definido na presente) com uma das seqüências aminoácidas de SEQ IDNO's 52 (TNF1) , 76 (TNF13), 77 (TNF14), 95 (TNF29) ou 96 (TNF30)- Um Nanocorpo conforme algum dos I) a V) acima, em quea) 0 CDR1 compreende:- a seqüência aminoácida DYWMY; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida DYWMY; eb) O CDR2 compreende: - a sequência aminoácida EINTNGLITKYPDSVKG; ou - uma sequência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de sequência de 99% com a sequência aminoácida EINTNGLITKYPDSVKG; ou- umas sequências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida EINTNGLITKYPDSVKG;ec) O CDR3 compreende :- a seqüência aminoácida SPSGFN; ou-uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SPSGFN; ou -umas seqüências aminoácidas que tem 2 ou só 1 diferença (s) aminoácida(s) com a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR1 compreende a seqüência aminoácida DYWMY.- Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG.- Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR3 compreende a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos I) a V) acima, em que:- O CDR1 compreende a seqüência aminoácida DYWMY; e o CDR3 compreende a seqüência aminoácida SPSGFN; ou- O CDR1 compreende a seqüência aminoácida DYWMY; e o CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG; ou- O CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG; e o CDR3 compreende a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR1 compreende a seqüência aminoácida DYWMY; e o CDR3 compreende a seqüência aminoácida SPSGFN. - Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR1 compreende a seqüência aminoácida DYWMY; o CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG e CDR3 compreendem a seqüência aminoácida SPSGFN. - Um Nanocorpo conforme algum dos I) a V) acima, em quea) O CDR1 é:- a seqüência aminoácida DYWMY; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 10 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida DYWMY;e em que:b) O CDR2 ê:- a seqüência aminoácida EINTNGLITKYPDSVKG; ou - uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 20 de seqüência de 99% com a seqüência aminoácidaEINTNGLITKYPDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida EINTNGLITKYPDSVKG; e em quec) O CDR3 é:- a seqüência aminoácida SPSGFN; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 30 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SPSGFN; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos I) a V) acima, no 35 qual CDR1 é a seqüência aminoácida DYWMY. - Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG.- Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR3 é a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos I) a V) acima, emque :- O CDR1 é a seqüência aminoácida DYWMY; e o CDR3 é a seqüência aminoácida SPSGFN; ou- O CDR1 é a seqüência aminoácida DYWMY; e o CDR2 é a 10 seqüência aminoácida EINTNGLITKYPDSVKG; ou- 0 CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG;e o CDR3 é a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR1 é a seqüência aminoácida DYWMY; e o CDR3 é a 15 seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR1 é a seqüência aminoácida DYWMY; o CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG e CDR3 é a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos I) a V) acima, emque- qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/ou- a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.e alguns outros aspectos preferenciais desta modalidade de execução relacionam-se a :-Um Nanocorpo conforme algum dos I) a V) acima, que éum Nanocorpo de classe KERE- Um Nanocorpo conforme algum dos I) a V) acima, que é um Nanocorpo humanizado de classe KERE- Um Nanocorpo conforme algum dos I) a V) acima, que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de sequência de 99% (conforme definido na presente) com uma das sequências aminoácidas de SEQ ID NO's 50 (TNF3) , 83 (TNF20), 85 (TNF21), 85 (TNF22), 96 (TNF23) ou 98 (TNF33).- Um Nanocorpo conforme algum dos I) a V) acima, emque- O CDR1 é:- a sequência aminoácida NYYMG; ou- uma sequência aminoácida que tem pelo menos 80%, 10 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de sequência de 99% com a sequência aminoácida NYYMG; ou- umas sequências aminoácidas que tem 2 ou só 1 diferença aminoácida com a sequência aminoácida NYYMG; eb) O CDR2 é:- a sequência aminoácida NISWRGYNIYYKDSVKG; ou- uma sequência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 20 menos 95%, mesmo mais preferivelmente pelo menos identidade de sequência de 99% com a sequência aminoácida NISWRGYNIYYKDSVKG; ou- umas sequências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a sequência aminoácida 25 NISWRGYNIYYKDSVKG;ec) 0 CDR3 é:- a sequência aminoácida SILPLSDDPGWNTY; ou- uma seqüência aminoácida que tem pelo menos 8 0%, 30 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SILPLSDDPGWNTY; ou- umas seqüências aminoácidas que tem 2 ou só 1 35 diferença aminoácida com a seqüência aminoácidaSILPLSDDPGWNTY, - Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR1 é a seqüência aminoácida NYYMG.
Um Nanocorpo conforme algum dos I) a V) acima, no qual CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG. - Um Nanocorpo conforme algum dos I) a V) acima, noqual CDR3 é a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme algum dos I) a V) acima, em que :-O CDR1 é a seqüência aminoácida NYYMG; e o CDR3 é a seqüência aminoácida SILPLSDDPGWNTY; ou-O CDR1 é a seqüência aminoácida NYYMG; e o CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG; ou-O CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG; e o CDR3 é a seqüência aminoácida SILPLSDDPGWNTY, -Um Nanocorpo conforme algum dos I) a V) acima, noqual CDR1 é a seqüência aminoácida NYYMG; o CDR2 é a seqüência aminoácida SILPLSDDPGWNTY e CDR3 é a seqüência aminoácida ILPLSDDPGWNTY.-Um Nanocorpo conforme algum dos I) a V) acima, em 20 que- qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/ou-a referida seqüência aminoácidapreferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.e com ainda alguns outros aspectos particularmente preferenciais sendo:VI) Uma proteína ou polipeptídio, que compreende a ou 30 essencialmente se compõe de um Nanocorpo conforme algumdos I) a V) acima.VII) Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de pelo menos um nanocorpo conforme algum dos I) a V) acima. VIII) Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme algum dos I) a V) acima.IX) Uma proteína ou o polipeptídio, que compreende dois nanocorpos conforme algum dos I) a V) acima, e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou de reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..X) Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme algum dos I) a V) acima, e que é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.XI) Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme algum dos I) a V) acima, ligado através de um linker adequado.XII) Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme algum dos I) a V) acima, ligado através de um linker adequado, e que é pegilado.XIII) Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos I) a V) acima, e que, além disso, compreende pelo menos um nanocorpo dirigido contra uma albumina de soro humano.XIV) Uma proteína ou o polipeptídio que compreende dois nanocorpos conforme algum dos I) a V) acima, e que, além disso, compreende pelo menos um nanocorpo dirigido contra uma albumina de soro humano, e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..XV) Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos I) a V) acima, e que, além disso, compreende pelo menos um nanocorpo dirigido contra uma albumina de soro humano e que é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.XVI) Uma proteína ou polipeptídio que compreende dois 5 nanocorpos conforme algum dos I) a V) acima, e que, alémdisso, compreende um Nanocorpo dirigido contra uma albumina de soro humano, na qual cada um dos dois nanocorpos conforme algum dos I) a V) acima é ligado, opcionalmente através de um linker conveniente, a um 10 Nanocorpo dirigido contra uma albumina de soro humano.XVII)Uma proteína ou o polipeptídio que compreende dois nanocorpos conforme algum dos I) a V) acima, e que, além disso, compreende um Nanocorpo dirigido contra uma albumina de soro humano, na qual cada um dos dois 15 nanocorpos conforme algum dos I) a V) acima é ligado,opcionalmente através de um linker conveniente, a um Nanocorpo dirigido contra uma albumina de soro humano, e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou de 20 reduzir a ligação cruzada do receptor TNF que é mediadapelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..XVIH)Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos I) a V) acima, e que, além 25 disso, compreende um Nanocorpo dirigido contra umaalbumina de soro humano, na qual cada um dos dois nanocorpos conforme algum dos I) a V) acima é ligado, opcionalmente através de um linker conveniente, a um Nanocorpo dirigido contra uma albumina de soro humano, e 30 que é capaz da ligação intramolecular a pelo menos doissítios que ligam o receptor TNF a um Trímero TNF. - Uma proteína ou polipeptídio conforme algum dos VI) aXVIII) acima, no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um Nanocorpo 35 human i z a do . - Uma proteína ou polipeptídio conforme algum dos VI) a XVIII) acima, no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63).- Uma proteína ou polipeptídio conforme algum dos VI) aXVIII) acima, no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um escolhido do grupo composto da ALB 3 (SEQ ID n, 87) , ALB 4 (SEQ ID n. 88) , ALB 5 (SEQ ID n. 89), ALB 6 (SEQ ID n. 100), ALB 7 (SEQ ID n.101), ALB 8 (SEQ ID n. 102) ALB 9 (SEQ ID n. 103) e ALB 10(SEQ ID n. 104).- Uma proteína ou polipeptídio conforme algum dos VI) a XVIII) acima, no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é a ALB 8.- Uma proteína ou polipeptídio conforme algum dos VI) aXVIII) acima, que compreende ou essencialmente se compõe de dois nanocorpos humanizados conforme algum dos I) a V) acima, e uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63) .
Deve ser observado que quando um Nanocorpo é acima mencionado como sendo "conforme algum dos I) a V) acima", é pelo menos segundo um de I) a V) , pode ser segundo dois ou mais de I) a V) , e também incluir algum ou mais de outros aspectos que são indicados como sendo "conforme algum dos I)a V) acima". Semelhantemente quando uma proteína ou o polipeptídio são acima mencionados como sendo "conforme algum dos VI) a XVIII) acima", é pelo menos segundo um de VI) a XVIII), pode ser segundo dois ou mais de VI) a XVIII), e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme algum dos VI) a XVIII) acima.
Está também dentro dos limites da invenção que, onde aplicável, um Nanocorpo ou o polipeptídio da invenção podem ligar dois ou mais determinantes antigênicos, epitopes, 35 partes, domínios, subunidades ou confirmações do TNF-alfa.
Em tal caso, os determinantes antigênicos, epitopes, partes, domínios ou subunidades do TNF-alfa à qual os nanocorpos e/ou os polipeptídios da invenção ligam podem ser essencialmente o mesmo (por exemplo, se o TNF-alfa contiver motivos estruturais repetidos ou estiver presente como um 5 multímero) ou pode ser diferente (e no último caso, os nanocorpos e os polipeptídios da invenção podem ligar a tais determinantes antigênicos diferentes, epitopes, partes, domínios, subunidades do TNF-alfa com uma afinidade e/ou especificidade que pode ser a mesma ou diferente) . Também, 10 por exemplo, quando o TNF-alfa existe em uma conformação ativada e em uma conformação inativa, os nanocorpos e os polipeptídios da invenção podem ligar a uma dessas conformações, ou ligar a ambas estas conformações (isto é, com uma afinidade e/ou especificidade que pode ser a mesma 15 ou diferente) . Também, por exemplo, os nanocorpos e os polipeptídios da invenção podem ligar a uma conformação do TNF-alfa na qual é ligado a um ligando pertinente, pode ligar a uma conformação do TNF-alfa na qual ele não está ligado a um ligando pertinente, ou pode ligar a ambas tais 20 conformações (novamente com uma afinidade e/ou especificidade que pode ser a mesma ou diferente).
Também é esperado que os nanocorpos e os polipeptídios da invenção ligarão geralmente a todos os análogos sintéticos ou naturais, variantes, mutantes, alelos, partes 25 e fragmentos do TNF-alfa, ou pelo menos àqueles análogos, variantes, mutantes, alelos, partes e fragmentos do TNF-alfa que contêm um ou vários determinantes antigênicos ou epitopes que são essencialmente o mesmo que o(s) determinante(s) antigênico(s) ou epitope(s) ao qual os 30 nanocorpos e os polipeptídios da invenção ligam-se no TNF- alfa (p. ex. no TNF-alfa de tipo natural). Novamente, em tal caso, os nanocorpos e os polipeptídios da invenção podem ligar a tais análogos, variantes, mutantes, alelos, partes e fragmentos com uma afinidade e/ou especificidade que são o 35 mesmo que, ou que diferente (isto é, mais alto do que, ou mais baixo do que), a afinidade e especificidade com a qual os nanocorpos da invenção ligam (ao tipo natural) o TNF- alfa. Também está incluído dentro dos limites da invenção que os nanocorpos e os polipeptídios da invenção ligam a alguns análogos, variantes, mutantes, alelos, partes e fragmentos do TNF-alfa, mas não a outros.
Geralmente, os nanocorpos e os polipeptídios da invenção ligarão pelo menos àquelas formas (inclusive monoméricas, multiméricas e formas associadas) que são as mais relevantes de um ponto de vista biológico e/ou terapêutico, como estará claro para a pessoa experimentada.
Também, como o TNF-alfa existe em uma forma monomérica e em formas multiméricas, e especialmente na forma trimérica, é dentro dos limites da invenção que os nanocorpos e os polipeptídios da invenção só ligam à TNF- alfa na forma monomérica, ou que os nanocorpos e os polipeptídios da invenção além disso, também ligam a uma ou várias de tais formas multiméricas, como a forma trimérica de TNF; ou só pode ligar a tais formas multiméricas (p. ex. triméricas). Portanto, geralmente, quando nesta descrição é feita referência a um Nanocorpo, proteína ou polipeptídio que é dirigido à TNF-alfa, deve ser entendido que isto também compreende nanocorpos dirigidos contra o TNF-alfa na sua forma trimérica (inclusive, mas não limitado a, nanocorpos contra o sítios que ligam receptor (p. ex. os sítios de ligação para o TNF-RI, THF-RII, também conhecido como p55 ou p75) de tal trímero) . Em todos esses casos, os
nanocorpos e os polipeptídios da invenção podem ligar a tais multímeros ou complexos de proteína associados com uma afinidade e/ou especificidade que pode ser o mesmo que ou 30 diferente (isto é, mais alto do que, ou mais baixo do que) a afinidade e/ou especificidade com a qual os nanocorpos e os polipeptídios da invenção ligam à TNF-alfa no seu estado monomérico e não-associado.
Também, geralmente, os polipeptídios da invenção que 35 contêm dois ou mais nanocorpos dirigidos contra o TNF-alfa podem ligar com mais alta avidez do que os correspondentes Nanocorpo ou nanocorpos monoméricos.
Por exemplo, e sem restrição, uma proteína multivalente (conforme definido na presente) ou o polipeptídio que contém dois ou mais nanocorpos que são dirigidos contra epitopes 5 diferentes do TNF-alfa multivalente (conforme definido na presente) proteína ou polipeptídio que contém dois ou mais nanocorpos que são dirigidos contra epitopes diferente do TNF-alfa podem ligar à TNF-alfa com mais alta avidez do que os monômeros correspondentes.
O que é mais importante, uma proteína multivalent (conforme definido na presente) ou o polipeptídio que contém dois ou mais nanocorpos que são dirigidos contra o TNF-alfa podem (e normalmente vão) ligar com mais alta avidez a um multimero do TNF-alfa do que a um monômero do TNF-alfa, e 15 também ligará normalmente com mais alta avidez do que os nanocorpos monoméricos correspondentes. Em tal proteína ou polipeptídio multivalente, os dois ou mais nanocorpos, por exemplo, podem ser dirigidos contra os mesmos epitopes, epitopes substancialmente equivalentes, ou epitopes diferentes. Em uma modalidade de execução de uma tal proteína ou polipeptídio multivalente, os dois ou mais nanocorpos podem ser os mesmos (e por isso ser dirigidos contra o mesmo epitope). conhece que o modo primário da transdução de sinal por TNF implica ligação cruzada por receptores TNF por um trímero de moléculas TNF, que contém três sítios de ligação de receptor (ver, por exemplo, Peppel et al. , J. Exp. Med., 174 (1991), 1483-1489; Engelmann et al. , J. Biol. Chem., 265 (1990), 14497; Smith e Baglioni, J. Biol. Chem., 264 (1989), 14646).
Por exemplo, como descrito por Peppel et al. , um domínio extracelular monovalente projetado do receptor TNF - que foi só capaz de bloquear um sítio que liga um receptor único em um Trímero TNF - foi incapaz de prevenir ligação cruzada dos receptores TNF pelos dois sítios que ligam receptor; ao passo que uma proteína projetada que compreende dois tais domínios extracelulares - portanto sendo capaz de bloquear dois sítios que ligam o receptor - forneceu uma eficácia impressionante em comparação com o domínio extracelular monovalente.
Na presente invenção, foi encontrado que nanocorpos monovalentes são capazes da ligação à TNF-alfa de tal modo que a atividade de TNF é reduzida, tanto em modelos in vitro, em modelos celulares como em modelos ex vivo (ver a Seção Experimental mais adiante). Embora a invenção não seja 10 limitada a nenhum mecanismo específico, explicação ou hipótese, é assumido que por causa do seu pequeno tamanho e alta afinidade paro TNF-alfa, dois ou três nanocorpos monovalentes da invenção são capazes de simultaneamente ocupar dois ou três sítios de ligação de receptor diferentes no Trímero TNF, evitando portanto que o trímero inicie a ligação cruzada do receptor e consequentemente iniciar a transdução de sinal (contudo, outros mecanismos da ação não são excluídos: por exemplo, dependendo do epitope contra o qual ê dirigido, um Nanocorpo da invenção também pode inibir 20 a associação de TNF no estado trimérico).
Também deve ser observado que, além disso, ou como uma alternativa à ligação a dois ou mais sítios que ligam receptor a um TNF-trímero único, a proteína ou os polipeptídios da presente invenção compreendem ou 25 essencialmente se compõem de dois ou mais domínios variáveis de imunoglobulina (ou fragmentos convenientes dos mesmos) que são dirigidos contra epitopes do TNF-alfa podem ligar (p. ex. intermolecularmente) epitopes em duas moléculas TNF- alfa separadas (p. ex. dois trímeros separados).
Contudo, segundo uma modalidade de execução em particular preferencial, a invenção refere-se a uma proteína ou polipeptídio que compreende ou essencialmente se compõe de dois ou mais domínios variáveis de imunoglobulina (ou fragmentos convenientes dos mesmos) que são cada um 35 dirigidos contra epitopes no TNF-alfa (e especialmente do Trímero TNF-alfa) que se encontram em e/ou são a parte do(s) sítio (s) que ligam o receptor do Trímero TNF, tal que o referido polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal 5 que é mediada por tal ligação cruzada de receptor.
Especialmente, segundo esta modalidade de execução preferencial, a invenção refere-se a um polipeptídio de proteína que compreende ou essencialmente compõe-se de dois ou mais domínios variáveis de imunoglobulina (ou fragmentos 10 convenientes dos mesmos) que são cada um dirigido contra epitopes no TNF-alfa (e especialmente do Trímero TNF-alfa) que se encontra em e/ou é parte do(s) sítio(s) que ligam ao receptor do TNF-trímero, em que os referidos domínios variáveis de imunoglobulina são ligados um a outro de tal 15 modo que a proteína ou o polipeptídio são capazes de ligar simultaneamente a dois ou mais sítios que ligam receptor em um Trímero TNF único (em outras palavras, é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF). Nesta modalidade de execução, os dois 20 ou mais domínios variáveis de imunoglobulina são preferivelmente conforme definidos acima e são mais preferivelmente nanocorpos (para que a proteína ou o polipeptídio sejam um construto Nanocorpo multivalente, conforme mais adiante descrito na presente). Também, nesta 25 modalidade de execução, os dois ou mais domínios variáveis de imunoglobulina podem ser os mesmos ou diferentes; e podem ser dirigidos contra epitopes diferentes dentro dos sítio(s) que ligam ao receptor TNF, mas ser preferivelmente dirigidos contra o mesmo epitope.
Em um aspecto preferencial desta modalidade de execução, os dois ou mais domínios variáveis de imunoglobulina são dirigidos contra epitopes do Trímero TNF- alfa, no qual epitopes estão e/ou são parte do sítio(s) que ligam ao receptor TNF. Por exemplo, os dois ou mais domínios 35 variáveis de imunoglobulina são preferivelmente dirigidos contra e/ou podem ligar a um epitope do Trímero TNF-alfa que compreende os resíduos aminoácidos seguintes: o Gin na posição 88 e Lys na posição 90 em um primeiro Monômero TNF (mencionado na presente como "monômero A"), e Glu na posição 146 em um segundo Monômero TNF (mencionado na presente como 5 "monômero B") (no qual o Monômero A e Monômero B em conjunto, no Trímero TNF, formam o(s) sítio(s) que ligam receptor TNF).
Conforme além disso descrito mais adiante mais detalhadamente com respeito a nanocorpos, em tal proteína ou polipeptídio, pelo menos dois domínios variáveis de imunoglobulina são preferivelmente ligados de tal modo que a distância entre o N-termo e o C-termo dos dois domínios variáveis de imunoglobulina presentes em tal proteína ou polipeptídio é preferivelmente pelo menos 50 Angstrons, e 15 mais preferivelmente na região de 55-200 Angstrons, e mais preferivelmente na região de Angstrons, e especialmente na região de 65-150 Angstrons.
Em um aspecto em particular preferencial desta modalidade de execução, essas duas ou mais sequências de 20 imunoglobulina são nanocorpos, e são preferivelmente escolhidas dos nanocorpos descritos na presente. Alguns nanocorpos particularmente preferíveis para usar nesta modalidade de execução da invenção são PMP1C2 (TNF1, SEQ ID NO:52) e/ou PMP5F10 (TNF3, SEQ ID n. 60), bem como outras 25 variantes humanizadas deles (conforme descrito na presente) ,- com PMP1C2 (TNF1, SEQ ID NO:52) e as suas variantes humanizadas que são em particular preferidas.
Consequentemente, a modalidade de execução presente será descrita agora mais detalhadamente com referência a 30 nanocorpos. Contudo, estará claro para a pessoa experimentada que as presentes informações pode ser aplicado analogamente a domínios variáveis de imunoglobulina.
Nesta modalidade de execução da invenção, as duas ou mais sequências de imunoglobulina serão normalmente ligadas 35 via um ou vários linkers convenientes, cujos linkers são tais que cada seqüência de imunoglobulina pode ligar a um sítio que liga um receptor diferente no mesmo Trímero TNF. Linkers convenientes dependerá entre outras coisas (da distância entre) os epitopes no Trímero TNF ao qual as seqüências de imunoglobulina ligam, e estarão claros para a 5 pessoa experimentada baseado na revelação presente, opcionalmente depois de algum grau limitado da experimentação de rotina. Por exemplo, quando as duas ou mais seqüências de imunoglobulina são anticorpos de domínio (únicos) ou nanocorpos, linkers convenientes podem ser 10 escolhidos do linkers descritos na presente, mas com um comprimento de linker que é tal que dois ou mais (únicos) anticorpos de domínio ou nanocorpos podem ligar cada um a um sítio que liga um receptor diferente no mesmo Trímero TNF.
Também, quando as duas ou mais seqüências de imunoglobulina que ligam a sítios que ligam receptor do TNF- alfa são anticorpos de domínio (únicos) ou nanocorpos, eles também podem ser ligados um a outro via um terceiro (único) anticorpo de domínio ou Nanocorpo (no qual as duas ou mais seqüências de imunoglobulina podem ser ligadas diretamente 20 ao terceiro (único) domínio anticorpo/Nanocorpo ou via linkers convenientes). Tal terceiro (único) anticorpo de domínio ou Nanocorpo, por exemplo, pode ser um anticorpo de domínio (único) ou Nanocorpo que provê uma meia-vida aumentada, conforme mais adiante descrito na presente. Por 25 exemplo, o último (único) anticorpo de domínio ou Nanocorpo podem ser um anticorpo de domínio (único) ou Nanocorpo que é capaz da ligação a uma proteína de soro (humana) como albumina de soro (humana), conforme mais adiante descrito na presente.
Alternativamente, as duas ou mais seqüências de imunoglobulina que ligam ao(s) sítio(s) que ligam ao receptor do TNF-alfa podem ser ligadas em série (diretamente ou através de um linker conveniente) e o terceiro (único) anticorpo de domínio ou Nanocorpo (que pode prover a meia- 35 vida aumentada, como descrito anteriormente) pode ser conectado diretamente ou através de um linker a uma dessas duas ou mais sequências de imunoglobulina acima mencionadas. Alguns exemplos não-restritivos de tais construtos são os construtos da SEQ ID NÚMEROS: 93 ou 94.
Especialmente, foi encontrado na invenção (ver os dados 5 de cristalografia mencionados na presente) que, quando os nanocorpos presentes em uma proteína multiespecífica ou multivalente ou polipeptídio da invenção ligam a determinado epitope descrito anteriormente (que é o epitope de TNF1 e as suas variantes humanizadas, bem como de TNF3 e as suas 10 variantes humanizadas) então preferivelmente, os dois (ou mais) nanocorpos anti-TNF presentes em tal proteína ou polipeptídio devem ser ligados de tal modo que a distância entre o N-termo e o C-termo de dois nanocorpos anti-TNF presentes em tal proteína ou polipeptídio deve ser preferivelmente pelo menos 50 Angstrons, e mais preferivelmente na região de 55-200 Angstrons, e especialmente na região de 65-150 Angstrons (com o limite superior que é menos crítico, e é escolhido para razões da conveniência, p. ex. com a intenção da expressão/produção da 20 proteína); ou mais geralmente que os referidos que a distância deve ser tal que permita que a proteína ou o polipeptídio experimente a ligação intramolecular ao TNF- trímero (isto é, em vez da ligação intermolecular). A distância entre o N-termo e o C-termo de dois nanocorpos anti-TNF pode ser determinada por qualquer meio conveniente, como por cristalografia ou modelagem molecular (conforme descrito na presente). Essas técnicas geralmente também permitem determinar se uma proteína multivalente específica ou uma proteína multiespecífica ou polipeptídio são capazes de fornecer a modelagem intramolecular. Alternativamente, a presente invenção também fornece um experimento simples que usa cromatografia de exclusão por tamanho (como descrito por Santora et al. , Anal. Biochem. , 299: 119-129} que pode ser usado para determinar se uma proteína dada ou o polipeptídio da invenção fornecerão (predominantemente) a ligação intramolecular a um TNF-trímero ou ligação (predominantemente) intermolecular entre dois ou mais TNF- trímeros. Portanto, em uma determinada modalidade de execução da invenção, uma proteína ou o polipeptídio da invenção é preferivelmente tal que neste experimento, ele 5 predominantemente ou essencialmente exclusivamente leva à ligação intramolecular Contudo, conforme enfatizado anteriormente, deve ser observado que a proteína ou os polipeptídios da invenção que funcionam via a ligação intermolecular de moléculas TNF-alfa separadas (p. ex. trímeros) estão também dentro dos limites da presente invenção.
Portanto, em outro aspecto preferencial, a invenção provê uma proteína multivalente ou multiespecífica ou polipeptídio que compreende pelo menos dois nanocorpos 15 contra o TNF-alfa (e especialmente do Trímero TNF-alfa), no qual os referidos nanocorpos são preferivelmente dirigidos a essencialmente o mesmo epitope que o Nanocorpo PMP1C2 (como mencionado na presente) , e no qual os referidos pelo menos dois nanocorpos estão ligados de tal modo que a distância entre o N-termo e o C-termo de pelo menos dois nanocorpos anti-TNF é tal que a proteína ou o polipeptídio são capazes de experimentar a ligação intramolecular (conforme descrito na presente) com um TNF-trímero. Preferivelmente, em tal proteína ou polipeptídio, a distância entre o N-termo e o C- termo de dois nanocorpos anti-TNF é de pelo menos 50 Angstrons, e mais preferivelmente na região de 55-200 Angstrons, e especialmente na região de 65-150 Angstrons.
Em tal proteína preferencial ou polipeptídio, dois ou mais nanocorpos podem ser ligados em qualquer modo conveniente, enquanto a distância preferencial entre o N- termo e o C-termo de pelo menos dois nanocorpos anti-TNF possa ser realizada, e/ou enquanto a proteína ou o polipeptídio seja capaz de experimentar a ligação intramolecular (conforme descrito na presente) com um TNF- trímero.
Por exemplo, na sua forma mais simples, pelo menos dois nanocorpos são diretamente ligados através de um linker ou espaçador conveniente que provê a distância preferencial entre o N-termo e o C-termo do pelo menos dois nanocorpos anti-TNF e que pode permitir que a proteína ou o polipeptídio experimente a ligação intramolecular (conforme descrito na presente) com um TNF-trímero. Linkers convenientes são descritos na presente, e podem por exemplo, e sem restrição - compreender uma seqüência aminoácida, cuja seqüência aminoácida preferivelmente tem um comprimento de 14 aminoácidos, mais preferivelmente pelo menos 17 aminoácidos, como aproximadamente seqüência aminoácida 20-40 (que, usando uma distância média de 3.5 Angstrom para um aminoácido, corresponde a comprimentos de linker de 49 Angstrons, 59.5 Angstrons e aproximadamente 70 Angstrons, respectivamente; com a quantidade máxima de aminoácidos que são calculados do mesmo modo baseado nas distâncias acima mencionadas). Preferivelmente, uma tal seqüência aminoácida também deve ser tal que permita que a proteína ou o polipeptídio experimente a ligação intramolecular (conforme descrito na presente) com um TNF- trímero.
Portanto, em outro aspecto preferencial, a invenção provê uma proteína multivalente ou multiespecífica ou o polipeptídio que compreende pelo menos dois nanocorpos contra o TNF-alfa (e especialmente do Trímero TNF-alfa), no qual os referidos nanocorpos são preferivelmente dirigidos a essencialmente o mesmo epitope que o Nanocorpo PMP1C2 (como mencionado na presente) , e no qual os referidos pelo menos dois nanocorpos são diretamente ligados um a outro usando um linker ou espaçador conveniente tal que a distância entre o N-termo e o C-termo de pelo menos dois nanocorpos anti-TNF é tal que a proteína ou o polipeptídio são capazes de experimentar a ligação intramolecular (conforme descrito na presente) com um TNF-trímero. Preferivelmente, em tal proteína ou polipeptídio, a distância entre o N-termo e o C- termo de dois nanocorpos anti-TNF (e conseqüentemente o comprimento preferencial do linker ou espaçador) é pelo menos 50 Angstrons, e mais preferivelmente na região de 55200 Angstrons, e especialmente na região de 65-150 Angstrons.
Mais preferivelmente, neste aspecto preferencial, o linker ou espaçador é uma seqüência aminoácida que compreende pelo menos 14, preferivelmente pelo menos 17, mais preferivelmente pelo menos 20 aminoácidos (com um limite superior não-crítico escolhido para razões da conveniência sendo de cerca de 50, e preferivelmente aproximadamente 40 aminoácidos). Em uma modalidade de execução preferencial, mas não-restritiva, o linker essencialmente compõe-se de glicina e resíduos de serina (conforme adicionalmente descrito mais adiante). Por 15 exemplo, um linker conveniente é o linker GS30 descrito na presente, que compreende 30 resíduos aminoácidos.
Em outra modalidade de execução, pelo menos dois nanocorpos contra o TNF-alfa são ligados um a outro via outra metade (opcionalmente via um ou dois linkers) , como 20 outra proteína ou polipeptídio. Nesta modalidade de execução, pode ser desejável ter a distância preferencial (isto é, conforme acima mencionado) entre o N-termo e o C- termo de pelo menos dois nanocorpos anti-TNF, por exemplo, tal que a proteína ou o polipeptídio ainda podem 25 experimentar a ligação intramolecular (conforme descrito na presente) com um TNF-trímero. Nesta modalidade de execução, pelo menos dois nanocorpos podem ser ligados diretamente a outra metade, ou utilizando um linker ou espaçador conveniente, novamente enquanto a distância preferencial 30 e/ou ligação intramolecular desejada ainda possa ser realizada. A metade pode ser qualquer metade conveniente que não diminua (demasiado) da ligação da proteína ou polipeptídio a TNF e/ou das novas propriedades biológicas ou farmacológicas desejadas da proteína ou polipeptídio. Como 35 tal, a metade pode ser essencialmente inativa ou biologicamente ativa, e como tal pode melhorar ou não as propriedades desejadas da proteína ou polipeptídio e/ou conferir uma ou várias propriedades desejadas adicionais à proteína ou polipeptídio. Por exemplo, e sem restrição, a metade pode melhorar a meia-vida da proteína ou 5 polipeptídio, e/ou reduzir a sua imunogenicidade ou melhorar qualquer outra propriedade desejada. Em uma modalidade de execução preferencial, a metade pode ser outro Nanocorpo (inclusive, mas não limitado a, um terceiro Nanocorpo contra o TNF-alfa, embora isto não seja necessário e normalmente 10 menos preferencial), e especialmente outro Nanocorpo que melhore a meia-vida da proteína ou polipeptídio, como um Nanocorpo que é dirigido contra uma proteína de soro, por exemplo, contra uma albumina de soro humano. Os exemplos de tal proteína e polipeptídios são descritos na presente.
Portanto, em uma modalidade de execução, a invenção refere-se a um construto multiespecífico multivalente compreendendo duas ou mais seqüências de imunoglobulina (ou fragmentos convenientes dos mesmos) que são cada um dirigidos contra epitopes no TNF-alfa (p. ex. do Trímero 20 TNF-alfa) que se encontram em e/ou faz parte do sítio que liga o receptor, e isto é, ligado um a outro via pelo menos uma seqüência de imunoglobulina que provê a meia-vida aumentada (e opcionalmente via um ou vários linkers convenientes), tal que o referido polipeptídio, para ligar a 25 um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF e/ou a transdução de sinal que é mediada por dito trímero TNF. Tal polipeptídio pode ser tal que as referidas duas ou mais seqüências de imunoglobulina podem ligar cada uma a um sítio que liga um receptor 30 diferente em um Trímero TNF.
Especialmente, nesta modalidade de execução, o polipeptídio pode compreender um Nanocorpo biespecífico trivalente, que compreende dois nanocorpos que são cada um dirigidos contra epitopes no TNF-alfa (e especialmente do 35 Trímero TNF-alfa) que se encontram em e/ou faz parte do sítio que liga o receptor, no qual os referidos nanocorpos são ligados um a outro via um terceiro Nanocorpo que provê uma meia-vida aumentada (p. ex. um Nanocorpo que é dirigido a uma proteína de soro como albumina de soro humana) , no qual cada um dos antes mencionados dois nanocorpos podem ser 5 diretamente ligados ao referido terceiro Nanocorpo ou via um ou vários linkers convenientes, tal que o referido polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF e/ou a transdução de sinal que é mediada por dito trímero TNF. Tal 10 polipeptídio pode ser tal que os referidos antes mencionadosdois nanocorpos podem ligar cada um a um sítio que liga um receptor diferente em um Trímero TNF. Novamente, alguns nanocorpos em particular preferenciais para uso nesta modalidade de execução da invenção são PMP1C2 (TNF1, SEQ ID 15 NO:52) e/ou PMP5F10 (TNF3, SEQ ID n. 60) , bem como outras variantes humanizadas deles (conforme descrito na presente); com PMP1C2 (TNF1, SEQ ID NO:52) e as suas variantes humanizadas que são em particular preferidas; e nanocorpos dirigidos contra albumina de soro humana descrita na 20 presente. Alguns preferidos, mas não-limitação construtos desta modalidade de execução da invenção são TNF 24 (SEQ ID n. 90), TNF 26 (SEQ ID n. 92), TNF 27 (SEQ ID n. 93), TNF 28 (SEQ ID n. 94), TNF 60 (SEQ ID n. 417) e TNF 62 (SEQ ID NO:418), do qual TNF 60 é em particular preferido.
Portanto, alguns aspectos preferenciais desta modalidade de execução da invenção relacionam-se a :XIX)Uma proteína ou o polipeptídio que compreende ou essencialmente se compõe de dois ou mais domínios variáveis de imunoglobulina (ou fragmentos convenientes 30 dos mesmos) que são cada um dirigidos contra epitopes noTNF-alfa (e especialmente do Trímero TNF-alfa) que se encontram em e/ou fazem parte do(s) sítio(s) que ligam ao receptor do Trímero TNF, tais que os referidos polipeptídios, para ligar a um Trímero TNF, são capazes 35 de inibir ou de reduzir a ligação cruzada do receptorTNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor.XX) Uma proteína ou o polipeptídio que compreende ou essencialmente se compõe de dois ou mais domínios 5 variáveis de imunoglobulina (ou fragmentos convenientes dos mesmos) que são cada um dirigidos contra epitopes no TNF-alfa (e especialmente do Trímero TNF-alfa) que se encontram em e/ou fazem parte do(s) sítio(s) que ligam ao receptor do Trímero TNF, tais que os referidos 10 polipeptídio são a ligação intramolecular capaz de pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os referidos domínios variáveis de 15 imunoglobulina são ligados um a outro de tal modo que a proteína ou o polipeptídio são capazes de ligar simultaneamente a dois ou mais sítios que ligam receptor em um trímero TNF único.- Uma proteína ou polipeptídio conforme algum dos XIX) a 20 XX) acima, no qual os referidos domínios variáveis de imunoglobulina são capazes da ligação ao mesmo epitope que o Nanocorpo TNF1 (SEQ ID n. 52).- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os referidos domínios variáveis de 25 imunoglobulina são capazes da ligação contra o epitope dentro do sítio que liga o receptor TNF do Trímero TNF que pelo menos compreende os resíduos aminoácidos seguintes: Gin na posição 88 no monômero A; Lys na posição 90 no monômero A e Glu na posição 146 no monômero B.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) acima, no qual os referidos domínios variáveis de imunoglobulina são capazes da ligação contra o epitope dentro do sítio que liga o receptor TNF do Trímero TNF que pelo menos compreende os resíduos aminoácidos seguintes: Gin 35 na posição 88 no monômero A; Lys na posição 90 no monômero A e Glu na posição 14 6 no monômero B; e que, além disso, compreende pelo menos um, preferivelmente dois ou mais, mais preferivelmente 5 ou mais, e preferivelmente todos ou essencialmente todos, dos resíduos aminoácidos seguintes do TNF-alfa monômero A: Gly na posição 24, Gin na posição 25, 5 Thr na posição 72, His na posição 73, Vai na posição 74, Leu na posição 75, Thr na posição 77, Thr na posição 79, Ile na posição 83, Thr na posição 89, Vai na posição 91. Asn naposição 92, Ile na posição 97, Arg na posição 131, Glu naposição 135, Ile na posição 136, Asn na posição 137, Arg naposição 138, Pro na posição 139, Asp na posição 140 e osresíduos seguintes no monômero B: Pro na posição 20, Arg na posição 32, Lys na posição 65, Lys na posição 112, Tyr naposição 115, Ala na posição 145, Ser na posição 147.- Uma proteína ou polipeptídio conforme algum dos XIX) a 15 XX) acima, no qual os referidos domínios variáveis de imunoglobulina são capazes da ligação contra o epitope dentro do sítio que liga o receptor TNF do Trímero TNF que pelo menos compreende os resíduos aminoácidos seguintes: Gin na posição 88 no monômero A; Lys na posição 90 no monômero A 20 e Glu na posição 146 no monômero B; e que, além disso, compreende pelo menos um, preferivelmente dois ou mais, mais preferivelmente 5 ou mais, e preferivelmente todos ou essencialmente todos, dos resíduos aminoácidos seguintes do TNF-alfa monômero um Leu na posição 75, Thr na posição 77, 25 Thr na posição 79, Ile na posição 80, Ser na posição 81, Tyr na posição 87, Thr na posição 89, Vai na posição 91, Asn na posição 92, Ser na posição 95, Ile na posição 97, Glu na posição 135, Ile na posição 136, Asn na posição 137 e os resíduos seguintes no monômero B: Ala na posição 33, Ala na 30 posição 145, Ser na posição 147.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual pelo menos dois domínios variáveis de imunoglobulina são ligados de tal modo que a distância entre o N-termo do primeiro domínio variável de imunoglobulina e o 35 C-termo do segundo domínio variável de imunoglobulina presente em tal proteína ou polipeptídio é pelo menos 50 Angstrons.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual a distância entre o N-termo do primeiro 5 domínio variável de imunoglobulina e o C-termo do segundo domínio variável de imunoglobulina está entre 55-200 Angstrons- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual a distância entre o N-termo do primeiro 10 domínio variável de imunoglobulina e o C-termo do segundo domínio variável de imunoglobulina está entre 65-150 Angstrons- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual o primeiro e segundo domínio variável de 15 imunoglobulina são ligados um a outro através de um linker ou espaçador.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual o linker ou o espaçador são uma seqüência aminoácida.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) acima, no qual o linker ou o espaçador compreende pelo menos 14 resíduos aminoácidos.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual o linker ou o espaçador compreende pelo 25 menos 17 - 50 resíduos aminoácidos.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual o linker ou o espaçador essencialmente se compõem de glicina e resíduos de serina.- Uma proteína ou polipeptídio conforme algum dos XIX) a 30 XX) acima, no qual o linker ou o espaçador é GS30 (SEQ ID n. 69) .- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual o primeiro e segundo domínio variável de imunoglobulina são ligados um a outro via outra metade. - Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os referidos outra metade é a metade de polipeptídio ou uma proteína.- Uma proteína ou polipeptídio conforme algum dos XIX) a 5 XX) acima, no qual os referidos outra metade confere pelo menos uma propriedade desejada à proteína ou polipeptídio, ou melhora pelo menos uma propriedade desejada da proteína ou polipeptídio.- Uma proteína ou polipeptídio conforme algum dos XIX) a 10 XX) acima, no qual os referidos outra metade melhora a meia- vida da proteína ou polipeptídio e/ou reduz a imunogenicidade da proteína ou polipeptídio.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual cada um do primeiro e segundo domínio 15 variável de imunoglobulina são ligados a outra metade através de um linker ou espaçador.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual o linker ou o espaçador são uma seqüência aminoácida.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) acima, no qual o linker ou o espaçador essencialmente secompõem de glicina e resíduos de serina.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) acima, no qual acima citada outra metade é um Nanocorpo.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) acima, no qual outra metade é um Nanocorpo dirigido contra uma albumina de soro humano.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual pelo menos um nanocorpo dirigido contra 30 uma albumina de soro humano ê um Nanocorpo humanizado.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63) .- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) acima, no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um escolhido do grupo composto da ALB 3 (SEQ ID n. 87), ALB 4 (SEQ ID n. 88), ALB 5 (SEQ ID n. 89), ALB 6 (SEQ ID n. 100), ALB 7 (SEQ ID n. 101), ALB 8 (SEQ ID n. 102) ALB 9 (SEQ ID n. 103) e ALB 10 (SEQ ID n. 5 104) .- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é a ALB 8.- Uma proteína ou polipeptídio conforme algum dos XIX) a 10 XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos com uma taxa Koff 15 para TNF de melhor do que 2.10’3 (1/s), preferivelmente melhor do que 1.10'3 (1/s); ou uma variante humanizada de tal Nanocorpo.,- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios 20 variáveis de imunoglobulina são nanocorpos com um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC5 0 do Nanocorpo VHH 3E (SEQ ID NO: 4) de WO 04/041862 no mesmo ensaio; ou uma variante 25 humanizada de tal Nanocorpo..- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos com um valor de EC50 no ensaio à base de células usando células KYM 30 descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 12nM; ou uma variante humanizada de tal Nanocorpo..- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios 35 variáveis de imunoglobulina são nanocorpos com um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 5nM; ou uma variante humanizada de tal Nanocorpo..- Uma proteína ou polipeptídio conforme algum dos XIX) a 5 XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos com um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 3nM; ou uma variante humanizada de tal 10 Nanocorpo.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos conforme algum dos XIX) a XX) acima, que são humanizados; com alguns aspectos em particular preferenciais desta modalidade de execução sendo:- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos de classe GLEW.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos com um resíduo de arginina (R) na posição 103.- Uma proteína ou polipeptídio conforme algum dos XIX) a 25 XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são a nanocorpos de classe GLEW com um resíduo de arginina (R) na posição 103..- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios 30 variáveis de imunoglobulina são nanocorpos com pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das sequências aminoácidas de SEQ ID NO' s 35 52 (TNF1), 76 (TNF13), 77 (TNF14), 95 (TNF29) ou 96 (TNF30) - Uma proteína ou polipeptídio conforme algum dos XIX) a XX) acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a 5 XX) em que:a) O CDR1 compreende:- a seqüência aminoácida DYWMY; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 10 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida DYWMY;eb) O CDR2 compreende:- a seqüência aminoácida EINTNGLITKYPDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 20 de seqüência de 99% com a seqüência aminoácidaEINTNGLITKYPDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida EINTNGLITKYPDSVKG; ec) O CDR3 compreende:- a seqüência aminoácida SPSGFN; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 30 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SPSGFN; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida SPSGFN. - Uma proteína ou polipeptídio conforme algum dos XIX) a XX)acima, no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR1 compreende a seqüência aminoácida DYWMY.- Uma proteína ou polipeptídio conforme algum dos XIX) a 5 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG.- Uma proteína ou polipeptídio conforme algum dos XIX) a 10 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR3 compreende a seqüência aminoácida SPSGFN- Uma proteína ou polipeptídio conforme algum dos XIX) a 15 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) em que:- O CDR1 compreende a seqüência aminoácida DYWMY;e o CDR3 compreende a seqüência aminoácida SPSGFN; ou- O CDR1 compreende a seqüência aminoácida DYWMY;e o CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG; ou- O CDR2 compreende a seqüência aminoácidaEINTNGLITKYPDSVKG; e o CDR3 compreende a seqüência 25 aminoácida SPSGFN- Uma proteína ou polipeptídio conforme algum dos XIX) a XX), no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR1 30 compreende a seqüência aminoácida DYWMY; e o CDR3 compreende a seqüência aminoácida SPSGFN.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína 35 ou polipeptídios conforme algum dos XIX) a XX) no qual CDR1 compreende a seqüência aminoácida DYWMY; o CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG e CDR3 compreendem a seqüência aminoácida SPSGFN.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de 5 imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) em quea) O CDR1 é:- a seqüência aminoácida DYWMY; ou- uma seqüência aminoácida que tem pelo menos 80%, 10 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida DYWMY; e em que :b) O CDR2 é:- a seqüência aminoácida EINTNGLITKYPDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 20 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida EINTNGLITKYPDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida 25 EINTNGLITKYPDSVKG;e em quec) O CDR3 é:- a seqüência aminoácida SPSGFN; ou- uma seqüência aminoácida que tem pelo menos 80%, 30 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SPSGFN; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida SPSGFN.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR1 é a seqüência aminoácida DYWMY.- Uma proteína ou polipeptídio conforme algum dos XIX) a 5 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG.- Uma proteína ou polipeptídio conforme algum dos XIX) a 10 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR3 é a seqüência aminoácida SPSGFN- Uma proteína ou polipeptídio conforme algum dos XIX) a 15 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) em que:- O CDR1 é a seqüência aminoácida DYWMY; e o CDR3 é a seqüência aminoácida SPSGFN; ou- O CDR1 é a seqüência aminoácida DYWMY; e o CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG; ou- O CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG; e o CDR3 é a seqüência aminoácida SPSGFN- Uma proteína ou polipeptídio conforme algum dos XIX) a 25 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR1 é a seqüência aminoácida DYWMY; e o CDR3 é a seqüência aminoácida SPSGFN.- Uma proteína ou polipeptídio conforme algum dos XIX) aXX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR1 é a seqüência aminoácida DYWMY; o CDR2 é a seqüência 35 aminoácida EINTNGLITKYPDSVKG e CDR3 é a seqüência aminoácidaSPSGFN. - Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) em que- qualquer substituição aminoácida é preferivelmente umasubstituição aminoácida conservadora; e/ou- a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) 10 acima mencionadas.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são escolhidos do grupo composto do Nanocorpo TNF 1 (SEQ ID n. 52) e variantes humanizadas do Nanocorpo 15 TNF 1 (SEQ ID n. 52) .- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são escolhidos do grupo composto de TNF 13 (SEQ ID n. 76), TNF 14 (SEQ ID n. 77), TNF 29 (SEQ ID n. 95) 20 e TNF 30 (SEQ ID NO:96).- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são TNF 30 (SEQ ID NO:96);e com alguns aspectos em particular preferenciais desta 25 modalidade de execução ser:- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são a KERE-classe nanocorpos.- Uma proteína ou polipeptídio conforme algum dos XIX) a 30 XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos com pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma 35 das seqüências aminoácidas de SEQ ID NO's 50 (TNF3), 83 (TNF20), 85 (TNF21), 85 (TNF22), 96 (TNF23) ou 98 (TNF33). - Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) em que:a) O CDR1 compreende:- a seqüência aminoácida NYYMG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 10 de seqüência de 99% com a seqüência aminoácida NYYMG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida NYYMG; eb) O CDR2 compreende:- a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaNISWRGYNIYYKDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida NISWRGYNIYYKDSVKG;ec) 0 CDR3 compreende:- a seqüência aminoácida SILPLSDDPGWNTY; ou uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 30 de seqüência de 99% com a seqüência aminoácida SILPLSDDPGWNTY; ouumas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácidaSILPLSDDPGWNTY. - Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR1 5 compreende a seqüência aminoácida NYYMG.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR2 10 compreende a seqüência aminoácida NISWRGYNIYYKDSVKG.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX) no qual CDR3 15 compreende a seqüência aminoácida SILPLSDDPGWNTY.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX), em que:- O CDR1 compreende a seqüência aminoácida NYYMG; e oCDR3 compreende a seqüência aminoácida SILPLSDDPGWNTY; ou- O CDR1 compreende a seqüência aminoácida NYYMG; e o CDR2 compreende a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- O CDR2 compreende a seqüência aminoácida 25 NISWRGYNIYYKDSVKG; e o CDR3 compreende a seqüência aminoácida SILPLSDDPGWNTY.- Uma proteína ou polipeptídio conforme alguma de XIX) a XX), na qual os primeiros e segundos domínios de variável de imunoglobulina são Nanobodies como descrito 30 para a proteína ou polipeptídios conforme alguma de XIX)a XX) , na qual CDR1 compreende a seqüência aminoácida NYYMG; CDR2 compreende a seqüência aminoácida SILPLSDDPGWNTY e CDR3 compreende a seqüência aminoácida ILPLSDDPGWNTY (SEQ ID n. 436).- Uma proteína ou polipeptídio conforme alguma de XIX) aXX) , na qual os primeiros e segundos domínios de variável de imunoglobulina são Nanobodies como descrito para a proteína ou polipeptídios conforme alguma de XIX) a XX), em que a) CDR1 é:- a seqüência aminoácida NYYMG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaNYYMG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida NYYMG; eb) CDR2 é:- a seqüência aminoácida NISWRGYNIYYKDSVKG; ou - uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo maispreferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüênciaaminoácida NISWRGYNIYYKDSVKG;ec) CDR3 é:- a seqüência aminoácida SILPLSDDPGWNTY; ou- uma seqüência aminoácida que tem pelo menos 80%,preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SILPLSDDPGWNTY; ou 4 7- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX), no qual CDR1 5 é a seqüência aminoácida NYYMG.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX), no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX), no qual CDR2 10 é a seqüência aminoácida NISWRGYNIYYKDSVKG.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX), no qual CDR3 15 é a seqüência aminoácida SILPLSDDPGWNTY.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX), em que:- O CDR1 é a seqüência aminoácida NYYMG; e o CDR3 é a seqüência aminoácida SILPLSDDPGWNTY; ou- O CDR1 é a seqüência aminoácida NYYMG; e o CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- O CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG; e o 25 CDR3 é a seqüência aminoácida SILPLSDDPGWNTY.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX), no qual CDR1 30 é a seqüência aminoácida NYYMG; o CDR2 é a seqüência aminoácida SILPLSDDPGWNTY e CDR3 é a seqüência aminoácida ILPLSDDPGWNTY.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de 35 imunoglobulina são nanocorpos como descrito para a proteína ou polipeptídios conforme algum dos XIX) a XX), em que qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/ou- a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções 5 aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são escolhidos do grupo composto do Nanocorpo 10 TNF 3 (SEQ ID n. 60) e variantes humanizadas do Nanocorpo TNF 3 (SEQ ID n. 60) .- Uma proteína ou polipeptídio conforme algum dos XIX) a XX) , no qual os primeiros e segundos domínios variáveis de imunoglobulina são escolhidos do grupo composto de TNF20 15 (SEQ ID NO:83), TNF21 (SEQ ID n. 84), TNF 22 (SEQ ID n. 85), TNF23 (SEQ ID n. 86) ou TNF33 (SEQ ID n. 99).
Deve ser observado que quando uma proteína ou o polipeptídio são acima mencionados como sendo "conforme algum dos XIX) a XX) acima", é pelo menos segundo um de XIX) 20 a XX) , e pode ser segundo ambos XIX) e XX) , e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme algum dos XIX) a XX) acima".
Contudo, deve ser observado que a invenção não é limitada a nenhum mecanismo específico de ação ou hipótese. 25 Especialmente, foi encontrado que os nanocorpos monovalentes da invenção podem ser também ativos nos ensaios e modelos descritos na presente, que confirmam que a ligação intramolecular do Trímero TNF, embora preferido em uma modalidade de execução específica da invenção, não deve 30 obter a ação e efeito desejado dos nanocorpos, proteína e polipeptídios descritos na presente. Semelhantemente também é incluído dentro dos limites da invenção que a proteína e os polipeptídios descritos na presente realizam a sua ação desejada via qualquer mecanismo apropriado (isto é, por 35 ligação intramolecular, ligação intermolecular ou até ligando TNF monoméricos, portanto inibindo a formação de Trímeros TNF).
Está também dentro dos limites da invenção usar partes, fragmentos, análogos, mutantes, variantes, alelos e/ou derivados dos nanocorpos e os polipeptídios da invenção, 5 e/ou usar proteína ou polipeptídios compreendendo ou essencialmente compostos do mesmo, enquanto eles sejam convenientes para os usos enfrentados na presente. Tais partes, fragmentos, análogos, mutantes, variantes, alelos, derivados, proteína e/ou polipeptídios serão descritos na 10 futura descrição na presente.
Em outro aspecto, a invenção refere-se a um Nanocorpo (conforme definido na presente), contra o TNF-alfa, que se compõem de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 regiões que determinam complementaridade (CDR1 a CDR3 15 respectivamente), em que:(i) O CDR1 é uma seqüência aminoácida escolhida do grupo composto das seqüências CDR1 de SEQ ID NÚMEROS: 15 a 21 ou do grupo composto das seqüências CDR1 de SEQ ID NÚMEROS: 164 a 197; ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com pelo menos uma das seqüências CDR1 do grupo composto de SEQ IDNÚMEROS: 15 a 21 ou com pelo menos uma das seqüências CDR1 do grupo composto de SEQ ID NÚMEROS: 164 a 197, em que(1) qualquer substituição aminoácida é 30 preferivelmente uma substituição aminoácidaconservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 35 com as seqüência(s) aminoácida(s) acima e/ou do grupo composto de seqüências aminoácidas que têm 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com pelo menos uma das seqüências CDR1 do grupo composto de SEQ ID NÚMEROS: 15 a 21 ou 5 com pelo menos uma das seqüências CDR1 do grupocomposto de SEQ ID NÚMEROS: 164 a 197, em que:(1) qualquer substituição aminoácida épreferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmentesó contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima • mencionadas; e em que :(ii) O CDR2 é uma seqüência aminoácida escolhida do grupo composto das seqüências CDR2 de SEQ ID NÚMEROS: 22 a 28 ou do grupo composto das seqüências CDR2 de SEQ ID NÚMEROS: 232 a 265; ou do grupo composto de seqüências aminoácidas que têmpelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com pelo menos uma das seqüências CDR2 do grupo composto de SEQ IDNÚMEROS: 22 a 2 8 ou com pelo menos uma das seqüências CDR2 do grupo composto de SEQ ID NÚMEROS: 232 a 265, em que(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácidaconservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com pelo menos uma das seqüências CDR2 do grupo composto de SEQ ID NÚMEROS: 22 a 28 ou 5 com pelo menos uma das seqüências CDR2 do grupocomposto de SEQ ID NÚMEROS: 232 a 265, em que:(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmentesó contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acimamencionadas; e em que :(iii) O CDR3 é uma seqüência aminoácida escolhida do grupo composto das seqüências CDR3 de SEQ ID NÚMEROS: 29 a 33 ou do grupo composto das seqüências CDR3 de SEQ ID NÚMEROS: 300-333; ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com pelo menos uma das seqüências CDR3 do grupo composto de SEQ IDNÚMEROS: 2 9 a 3 3 ou com pelo menos uma das seqüências CDR3 do grupo composto de SEQ ID NÚMEROS: 3 00-33 3, em que:(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente 35 só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) ou com pelo menos uma das seqüências CDR3 do grupo composto de SEQ ID NÚMEROS: 300-333, em que:(1) qualquer substituição aminoácida épreferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;ou do grupo composto das seqüências CDR3 de SEQ ID NÚMEROS: 34 e 35ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com pelo menos uma das seqüências CDR3 de SEQ ID NÚMEROS: 34 e 35, em que:(1) qualquer substituição aminoácida épreferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas; (3)e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com pelo menos uma das seqüências CDR3 de SEQ ID NÚMEROS: 34 e 35, em que:(1) qualquer substituição aminoácida épreferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmentesó contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.
Os nanocorpos contra a tal TNF-alfa descrita anteriormente e conforme além disso descrito a seguir também são mencionados na presente como nanocorpos da invenção.
Do nanocorpos da invenção, nanocorpos que compreendem um ou vários do CDR1s explicitamente enumerados anteriormente são em particular preferidos; os nanocorpos compreendendo dois ou mais dos CDR's explicitamente enumerados anteriormente são mais em particular preferidos; e os nanocorpos compreendendo três dos CDR's explicitamente enumerados anteriormente são mais em particular preferidos.
Algumas das combinações em particular preferidas, mas não-restritivas de seqüências CDR podem ser vistas na Tabela I mais adiante, que enumera o CDR'S e seqüências de armação que estão presentes em um número de nanocorpos preferenciais (mas não-limitados) da invenção. Como estará claro para a pessoa experimentada, uma combinação de CDR1, CDR2 e seqüências CDR3 que ocorrem no mesmo clone (isto é, CDR1, CDR2 e seqüências CDR3 que são mencionadas na mesma linha na Tabela I) será normalmente preferido (embora a invenção no seu sentido mais amplo não seja limitada a isso, e também compreenda outras combinações convenientes das seqüências CDR mencionadas na Tabela I) .
Também, nos nanocorpos da invenção que compreendem as combinações do CDR1S mencionado na Tabela I, cada CDR pode ser substituído por um CDR escolhido do grupo composto de 5 seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com o CDR1S mencionado; em que(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma 15 eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e/ou escolhido do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 (como indicado no parágrafo precedente) 20 "diferença(s) aminoácida(s)" (conforme definido na presente) com o CDR mencionado(s) uma das acima mencionadas seqüências aminoácidas, em que:(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácidaconservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparaçãocom as seqüência(s) aminoácida(s) acima mencionadas.
Contudo, como estará claro para a pessoa experimentada, 35 o (combinações de) seqüências de CDR mencionadas na Tabela I serão geralmente preferidas. Tabela /: Combinações preferenciais de armação e seqüências CDR
Notas da Tabela I:- O ID refere-se ao SEQ ID NO's na listagem de seqüência em 5 anexo- Para CDR1: o SEQ ID n. 164 corresponde a SEQ ID n. 15, SEQ ID n. 167 corresponde a SEQ ID n. 16; o SEQ ID n. 172 corresponde a SEQ ID n. 17, SEQ ID NÚMEROS: 165 e 166 10 correspondem a SEQ ID n. 18, SEQ ID n. 170 corresponde a SEQID n. 19, SEQ ID n. 171 corresponde a SEQ ID n. 20, e SEQ ID NÚMEROS: 168 e 169 correspondem a SEQ ID n. 21.- Para CDR2: SEQ ID NÚMEROS: 232 e 233 correspondem a SEQ ID 15 n. 22, SEQ ID n. 235 corresponde a SEQ ID n. 23, SEQ ID n.240 corresponde a SEQ ID n. 24, SEQ ID n. 234 corresponde a SEQ ID n. 25, SEQ ID NÚMEROS: 236 e 237 correspondem a SEQ ID n. 26, SEQ ID n. 238 corresponde a SEQ ID n. 27, e SEQ ID n. 239 corresponde a SEQ ID n. 28.- Para CDR3: o SEQ ID n. 303 corresponde a SEQ ID n. 29, SEQ ID n. 308 corresponde a SEQ ID n. 30, SEQ ID n. 306 corresponde a SEQ ID n. 31, SEQ ID n. 307 corresponde a SEQ ID n. 32, SEQ ID NÚMEROS: 304 e 305 correspondem a SEQ ID n. 33, SEQ ID n. 300 corresponde a SEQ ID n. 34, e SEQ IDNÚMEROS: 301 e 302 correspondem a SEQ ID n. 35.
Portanto, nos nanocorpos da invenção, pelo menos um dos CDR1, CDR2 e presente de seqüências CDR3 é apropriadamente 30 escolhido do grupo composto do CDR1, CDR2 e seqüências CDR3, respectivamente, enumerado na Tabela I; ou do grupo de CDR1, CDR2 e seqüências CDR3, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos 35 "identidade de seqüência de 99%" (conforme definido na presente) com pelo menos um dos CDR1, CDR2 e seqüências CDR3, respectivamente, enumerado na Tabela I; e/ou do grupo
composto do CDR1, CDR2 e seqüências CDR3 , respectivamente, que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com pelo menos um dos CDR1, CDR2 e seqüências CDR3, respectivamente, enumerado na Tabela I. 5 Neste contexto, por "apropriadamente escolhido" quer dizer que, como aplicável, uma seqüência CDR1 é escolhida de seqüências CDR1 convenientes (isto é, conforme definido na presente), uma seqüência CDR2 é escolhida de seqüências CDR2 convenientes (isto é, conforme definido na presente) e uma 10 seqüência CDR3 é escolhida de seqüências CDR3 convenientes (isto é, conforme definido na presente), respectivamente.
Especialmente, nos nanocorpos da invenção, pelo menos a seqüência CDR3 presente ê apropriadamente escolhida do grupo composto das seqüências CDR3 enumeradas na Tabela I ou do 15 grupo de seqüências CDR3 que têm pelo menos 80%,
preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com pelo menos uma das seqüências CDR3 enumeradas na Tabela I; e/ou do grupo composto das 20 seqüências CDR3 que têm 3, 2 ou só 1 diferença (s) aminoácida(s) com pelo menos uma das seqüências CDR3 enumeradas na Tabela I.
Preferivelmente, nos nanocorpos da invenção, pelo menos duas das seqüências CDR1, CDR2 e CDR3 presentes são 25 apropriadamente escolhidas do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I ou do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo 30 mais preferivelmente pelo menos identidade de seqüência de 99% com pelo menos uma das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I; e/ou do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm 3, 2 ou só 1 "diferença(s) aminoácida(s) " com pelo 35 menos uma das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I.
Especialmente, nos nanocorpos da invenção, pelo menos a seqüência CDR3 presente é apropriadamente escolhida do grupo composto das seqüências CDR3 enumeradas na Tabela I ou do grupo de seqüências CDR3 que têm pelo menos 80%, 5 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com pelo menos uma das seqüências CDR3 enumeradas na Tabela I, respectivamente; e pelo menos uma das seqüências CDR1 e CDR2 presentes é apropriadamente 10 escolhida do grupo composto das seqüências CDR1 e CDR2, respectivamente, enumeradas na Tabela I ou do grupo de Seqüências CDR1 e CDR2, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos 15 identidade de seqüência de 99% com pelo menos um das seqüências CDR1 e CDR2, respectivamente, enumeradas na Tabela I; e/ou do grupo composto das seqüências CDR1 e CDR2, respectivamente, que têm 3, 2 ou só 1 diferença (s) aminoácida(s) com pelo menos uma das Seqüências CDR1 e CDR2, 20 respectivamente, enumeradas na Tabela I.
Mais preferivelmente, nos nanocorpos da invenção, as três seqüências CDR1, CDR2 e CDR3 presentes são apropriadamente escolhidas do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I 25 ou do grupo das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com pelo menos uma das seqüências CDR1, CDR2 e CDR3, 30 respectivamente, enumeradas na Tabela I; e/ou do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm 3, 2 ou só 1 diferença (s) aminoácida (s) com pelo menos uma das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I.
Mesmo mais preferivelmente, nos nanocorpos da invenção, pelo menos uma das seqüências CDR1, CDR2 e CDR3 presentes é apropriadamente escolhida do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I. Preferivelmente, nesta modalidade de execução, pelo menos uma ou preferivelmente ambas as outras duas seqüências CDR 5 presentes são apropriadamente escolhidas de seqüências CDR que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com pelo menos uma das seqüências CDR correspondentes, respectivamente, 10 enumeradas na Tabela I; e/ou do grupo composto das seqüências CDR que têm 3, 2 ou só 1 diferença (s) aminoácida(s) com pelo menos uma das seqüências correspondentes, respectivamente, enumeradas na Tabela I.
Especialmente, nos nanocorpos da invenção, pelo menos a 15 seqüência CDR3 presente é apropriadamente escolhida do grupo composto do CDR3 enumeradas na Tabela I. Preferivelmente, nesta modalidade de execução, pelo menos uma e preferivelmente ambas as seqüências CDR1 e CDR2 presentes são apropriadamente escolhidas dos grupos de Seqüências CDR1 20 e CDR2, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com as Seqüências CDR1 e CDR2, respectivamente, enumerado em enumeradas na Tabela I; e/ou 25 do grupo composto das seqüências CDR1 e CDR2, respectivamente, que têm 3, 2 ou só 1 diferença (s)aminoácida(s) com pelo menos uma das Seqüências CDR1 e CDR2, respectivamente, enumeradas na Tabela I.
Mesmo mais preferivelmente, nos nanocorpos da invenção, 30 pelo menos duas das seqüências CDR1, CDR2 e CDR3 presentes são apropriadamente escolhidas do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na
Tabela I. Preferivelmente, nesta modalidade de execução, o resto das seqüências CDR presentes é apropriadamente 35 escolhida do grupo de seqüências CDR que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com pelo menos uma das seqüências CDR correspondentes enumeradas na Tabela I; e/ou do grupo composto de seqüências CDR que têm 3, 2 ou só 1 diferença(s) 5 aminoácida(s) com pelo menos uma das seqüências correspondentes enumeradas na Tabela I.
Especialmente, nos nanocorpos da invenção, pelo menos a seqüência CDR3 é apropriadamente escolhida do grupo composto das seqüências CDR3 enumeradas na Tabela I, e a seqüência 10 CDR1 ou a seqüência CDR2 são apropriadamente escolhidas do grupo composto das seqüências CDR1 e CDR2, respectivamente, enumeradas na Tabela I. Preferivelmente, nesta modalidade de execução, o resto da seqüência CDR presente é apropriadamente escolhida do grupo de seqüências CDR que têm 15 pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com pelo menos uma das seqüências CDR correspondentes enumeradas na Tabela I; e/ou do grupo composto de seqüências CDR que têm 3, 2 ou só 20 1 diferença(s) aminoácida(s) com a correspondência seqüências de CDR enumeradas na Tabela I.
Mesmo mais preferivelmente, nos nanocorpos da invenção, as três seqüências CDR1, CDR2 e CDR3 presentes são apropriadamente escolhidas do grupo composto das seqüências 25 CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I.
Também, geralmente, as combinações do CDR'S enumeradas na Tabela I (isto é, as mencionadas na mesma linha na Tabela I) são preferidas. Portanto, é geralmente preferido que, quando um CDR em um Nanocorpo da invenção é uma seqüência 30 CDR mencionada na Tabela I ou é apropriadamente escolhida do grupo de seqüências CDR que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 9 9% com uma seqüência CDR enumerada na 35 Tabela I; e/ou do grupo composto de seqüências CDR que têm 3, 2 ou só 1 diferença (s) aminoácida (s) com uma seqüência CDR enumerada na Tabela I, que pelo menos uma e preferivelmente ambas das outras CDR's são apropriadamente escolhidas das seqüências CDR que pertencem à mesma combinação na Tabela I (isto é, mencionado na mesma linha na Tabela I) ou são apropriadamente escolhidas do grupo de seqüências CDR que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a(s) seqüência(s) CDR que pertencem à mesma combinação e/ou do grupo composto de seqüências CDR que têm 3, 2 ou só 1 diferença(s) aminoácida(s) com a(s) seqüência(s) CDR que pertencem à mesma combinação. Outras preferências indicadas nos acima mencionados parágrafos também se aplicam às combinações do CDR'S mencionado na Tabela I.
Portanto, por meio de exemplos não-restritivos, um Nanocorpo da invenção, por exemplo, pode compreender uma seqüência CDR1 que tem a identidade de seqüência de mais de 80% com uma das seqüências CDR1 mencionadas na Tabela I, uma seqüência CDR2 que tem 3, 2 ou 1 diferença aminoácida com uma das seqüências CDR2 mencionadas na Tabela I (mas pertencendo a uma combinação diferente), e uma seqüência CDR3 .
Alguns nanocorpos preferidos da invenção, por exemplo, podem compreender: (1) uma seqüência CDR1 que tem a 25 identidade de seqüência de mais de 80% com uma das seqüências CDR1 mencionadas na Tabela I; uma seqüência CDR2 que tem 3, 2 ou 1 diferença aminoácida com uma das seqüências CDR2 mencionadas na Tabela I (mas pertencendo a uma combinação diferente) ; e uma seqüência CDR3 que tem a 30 identidade de seqüência de mais de 80% com uma das seqüências CDR3 mencionadas na Tabela I (mas pertencendo a uma combinação diferente); ou (2) uma seqüência CDR1 que tem a identidade de seqüência de mais de 80% com uma das seqüências CDR1 mencionadas na Tabela I; uma seqüência CDR2, 35 e uma das seqüências CDR3 listadas na Tabela I; ou (3) uma seqüência CDR1; uma seqüência CDR2 que tem a identidade de seqüência de mais de 80% com uma da seqüência CDR2 enumerada na Tabela I; e uma seqüência CDR3 que tem 3, 2 ou 1 diferenças aminoácidas com a seqüência CDR3 mencionada na Tabela I que pertence a mesma combinação que a seqüência 5 CDR2.
Alguns nanocorpos particularmente preferidos da invenção, por exemplo, podem compreender: (1) uma seqüência CDR1 que tem a identidade de seqüência de mais de 80% com uma das seqüências CDR1 mencionadas na Tabela I; uma 10 seqüência CDR2 que tem 3, 2 ou 1 diferença aminoácida com a seqüência CDR2 mencionada na Tabela I que pertence à mesma combinação; e uma seqüência CDR3 que tem a identidade de seqüência de mais de 80% com a seqüência CDR3 mencionada na Tabela I que pertence à mesma combinação; (2) uma seqüência 15 CDR1; uma CDR 2 enumerada na Tabela I e uma seqüência CDR3 listada na Tabela I (na qual a seqüência CDR2 e a seqüência CDR3 podem pertencer a combinações diferentes).
Alguns nanocorpos até mais preferenciais da invenção, por exemplo, podem compreender: (1) uma seqüência CDR1 que 20 tem a identidade de seqüência de mais de 80% com uma das seqüências CDR1 mencionadas na Tabela I; a seqüência CDR2 listadas na Tabela I que pertence à mesma combinação; e uma seqüência CDR3 mencionada na Tabela I que pertence a uma combinação diferente; ou (2) uma seqüência CDR1 mencionada 25 na Tabela I; uma seqüência CDR2 que tem 3, 2 ou 1 diferenças aminoácidas com a seqüência CDR2 mencionada na Tabela I que pertence à mesma combinação; e a identidade de seqüência de mais de 80% com a seqüência CDR3 listadas na Tabela I que pertence à mesma combinação diferente.
Nanocorpos em particular preferidos da invenção, por exemplo, podem compreender uma seqüência CDR1 mencionada na Tabela I, uma seqüência CDR2 que tem a identidade de seqüência de mais de 80% com a seqüência CDR2 mencionada na Tabela I que pertence à mesma combinação; e a seqüência CDR3 35 mencionada na Tabela I que pertence à mesma.
No mais preferencial nos nanocorpos da invenção, as seqüências CDR1, CDR2 e CDR3 presentes são apropriadamente escolhidas das combinações das seqüências CDR1, CDR2 e CDR3, respectivamente, enumeradas na Tabela I.
Preferivelmente, quando uma seqüência CDR é apropriadamente escolhida do grupo de seqüências CDR que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das seqüências CDR enumeradas na Tabela I; e/ou quando uma seqüência CDR é apropriadamente escolhida do grupo composto de seqüências CDR que têm 3, 2 ou só 1 diferença(s) aminoácida(s) com uma das seqüências CDR enumeradas na Tabela I:i) qualquer substituição aminoácida é preferivelmente 15 uma substituição aminoácida conservadora (conforme definido na presente); e/ouii) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 20 com a seqüência CDR enumerada na Tabela I.
Segundo uma modalidade de execução preferida mas não limitada da invenção, as seqüências CDR nos nanocorpos da invenção são como definidas anteriormente e são também tais que o Nanocorpo da invenção liga à TNF-alfa com uma 25 dissociação constante (KD) de 10'5 a 10"12 mol/litro (M) ou menos, e preferivelmente 10'7 a 10'12 mol/litro (M) ou menos e mais preferivelmente 10'8 a IO’12 mol/litro (M) , e/ou com uma associação constante (KA) de pelo menos 107 m.lz preferivelmente pelo menos 108 m_i, mais preferivelmente pelo 30 menos 109 m’1, como pelo menos 1012 m'1; e especialmente com um KD de menos de 500 nM, preferivelmente menos de 200 nM, mais preferivelmente menos de 10 nM, como menos de 500 da tarde. O KD e os valores de KA do Nanocorpo da invenção contra o TNF-alfa podem ser determinados em uma maneira 35 conhecida por si, por exemplo, usando o ensaio descrito na presente.
Segundo outra modalidade de execução preferida, mas não-restritiva da invenção (a) o CDR1 tem um comprimento de entre 1 e 12 resíduos aminoácidos, e normalmente entre 2 e 9 resíduos aminoácidos, como 5, 6 ou 7 resíduos aminoácidos; e/ou (b) CDR2 tem um comprimento de entre 13 e 24 resíduos aminoácidos, e normalmente entre 15 e 21 resíduos aminoácidos, como 16 e 17 resíduos aminoácidos; e/ou (c) CDR3 tem um comprimento de entre 2 e 35 resíduos aminoácidos, e normalmente entre 3 e 30 resíduos 10 aminoácidos, como entre 6 e 23 resíduos aminoácidos.
Em um aspecto, a invenção fornece nanocorpos contra o TNF-alfa que estão executando melhor do que o Nanocorpo 3E, a melhor execução do Nanocorpo segundo o WO 04/041862.
Mais especificamente, alguns aspectos preferenciais 15 desta modalidade de execução da invenção são:XXI) Um Nanocorpo contra o TNF-alfa, que se compõe de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 regiões que determinam complementaridade (CDR1 a CDR3 respectivamente) , que tem uma taxa Koff para TNF de melhor do que 2.10'3 (1/s), preferivelmente melhor doque 1.10'3 (1/s); ou uma variante humanizada de talNanocorpo.XXII)Um Nanocorpo contra o TNF-alfa, que se compõem de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 regiões que determinam complementaridade (CDR1 a CDR3respectivamente) , que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E (SEQ ID NO: 4) de WO 04/041862 no mesmo ensaio; ou uma variante humanizada detal Nanocorpo.XXin)Um Nanocorpo contra o TNF-alfa, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 12nM; ou uma variante humanizada de tal Nanocorpo.XXrV)Um Nanocorpo contra o TNF-alfa, que tem um valor de EC50 no ensaio à base de células usando células KYM 5 descritas no Exemplo 1, conforme 3), de WO 04/041862 queé melhor do que 5nM; ou uma variante humanizada de tal Nanocorpo.XXV)Um Nanocorpo contra o TNF-alfa, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas 10 no Exemplo 1, conforme 3), de WO 04/041862 que é melhordo que 3nM; ou uma variante humanizada de tal Nanocorpo;com alguns aspectos em particular preferenciais sendo:- Um Nanocorpo conforme algum dos XXI) a XXV) , que é um Nanocorpo de classe GLEW.- Um Nanocorpo conforme algum dos XXI) a XXV), que contém umresíduo de arginina (R) na posição 103.- Um Nanocorpo conforme algum dos XXI) a XXV) , que é um Nanocorpo humanizado.- Um Nanocorpo conforme algum dos XXI) a XXV), que contém um 20 resíduo de leucina (L) na posição 108.- Um Nanocorpo conforme algum dos XXI) a XXV) , que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido 25 na presente) com uma das seqüências aminoácidas de SEQ ID NO's 52 (TNF1) , 76 (TNF13), 77 (TNF14), 95 (TNF29) ou 96 (TNF30).- Um Nanocorpo conforme algum dos XXI) a XXV), em quea) O CDR1 compreende :- a seqüência aminoácida DYWMY; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ou - umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida DYWMY; eb) O CDR2 compreende:- a seqüência aminoácida EINTNGLITKYPDSVKG; ou- uma seqüência aminoácida que tem pelo menos 8 0%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaEINTNGLITKYPDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida EINTNGLITKYPDSVKG;ec) O CDR3 compreende:- a seqüência aminoácida SPSGFN; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 20 de seqüência de 99% com a seqüência aminoácida SPSGFN; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 25 compreende a seqüência aminoácida DYWMY.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR3 compreende a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos XXI) a XXV), em que:- 0 CDR1 compreende a seqüência aminoácida DYWMY; e o CDR3 compreende a seqüência aminoácida SPSGFN; ou- 0 CDR1 compreende a seqüência aminoácida DYWMY; e o CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG; 35 ou 0 CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG; e o CDR3 compreende a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos XXI) a XXV), no qual CDR1 5 compreende a seqüência aminoácida DYWMY; e o CDR3 compreende a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 compreende a seqüência aminoácida DYWMY; o CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG e CDR3 compreendem a 10 seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos XXI) a XXV), em quea) 0 CDR1 é:- a seqüência aminoácida DYWMY; ouuma seqüência aminoácida que tem pelo menos 8 0%, 15 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ouumas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida DYWMY; e em que :b) O CDR2 é:- a seqüência aminoácida EINTNGLITKYPDSVKG; ouuma seqüência aminoácida que tem pelo menos 8 0%, preferivelmente pelo menos 90%, mais preferivelmente pelo 25 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida EINTNGLITKYPDSVKG; ouumas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida 30 EINTNGLITKYPDSVKG;e em quec) O CDR3 é:- a seqüência aminoácida SPSGFN; ouuma seqüência aminoácida que tem pelo menos 80%, 35 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SPSGFN; ouumas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos XXI) a XXV), no qual CDR1é a seqüência aminoácida DYWMY.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR3 10 é a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos XXI) a XXV), em que:- O CDR1 é a seqüência aminoácida DYWMY; e o CDR3 é a seqüência aminoácida SPSGFN; ou- O CDR1 é a seqüência aminoácida DYWMY; e o CDR2 é a 15 seqüência aminoácida EINTNGLITKYPDSVKG; ou- O CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG; e o CDR3 é a seqüência aminoácida SPSGFN- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 é a seqüência aminoácida DYWMY; e o CDR3 é a seqüência 20 aminoácida SPSGFN.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 é a seqüência aminoácida DYWMY; o CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG e CDR3 é a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme algum dos XXI) a XXV), em que- qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/oua referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou 30 inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.e com alguns outros aspectos em particular preferenciais sendo:- Um Nanocorpo conforme algum dos XXI) a XXV) , que é um 35 Nanocorpo de classe KERE. - Um Nanocorpo conforme algum dos XXI) a XXV), que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das seqüências aminoácidas de SEQ ID NO'S 50 (TNF3), 83 (TNF20), 85 (TNF21), 85 (TNF22), 96 (TNF23) ou 98 (TNF33).- Um Nanocorpo conforme algum dos XXI) a XXV), em quea) O CDR1 compreende:- a seqüência aminoácida NYYMG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida NYYMG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida NYYMG;eb) O CDR2 compreende:- a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida NISWRGYNIYYKDSVKG;ec) O CDR3 compreende:- a seqüência aminoácida SILPLSDDPGWNTY; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SILPLSDDPGWNTY; ou - umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 5 compreende a seqüência aminoácida NYYMG.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR2 compreende a seqüência aminoácida NISWRGYNIYYKDSVKG.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR3 compreende a seqüência aminoácida SILPLSDDPGWNTY. - Um Nanocorpo conforme algum dos XXI) a XXV), em que:- O CDR1 compreende a seqüência aminoácida NYYMG; e o CDR3 compreende a seqüência aminoácida SILPLSDDPGWNTY; ou- O CDR1 compreende a seqüência aminoácida NYYMG; e o CDR2 compreende a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- O CDR2 compreende a seqüência aminoácida NISWRGYNIYYKDSVKG; e o CDR3 compreende a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 20 compreende a seqüência aminoácida NYYMG; o CDR2 compreende a seqüência aminoácida SILPLSDDPGWNTY e CDR3 compreendem a seqüência aminoácida ILPLSDDPGWNTY.- Um Nanocorpo conforme algum dos XXI) a XXV), em quea) O CDR1 é:- a seqüência aminoácida NYYMG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida NYYMG; ou - umas seqüências aminoácidas que tem 2 ou só 1diferença aminoácida com a seqüência aminoácida NYYMG;eb) O CDR2 é:- a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%,preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida NISWRGYNIYYKDSVKG; ouumas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida NISWRGYNIYYKDSVKG;ec) O CDR3 é:- a seqüência aminoácida SILPLSDDPGWNTY; ou- uma seqüência aminoácida que tem pelo menos 80%,preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaSILPLSDDPGWNTY; ou- umas seqüências aminoácidas que tem 2 ou só 1diferença aminoácida com a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 é a seqüência aminoácida NYYMG.- Um Nanocorpo conforme algum dos XXI) a XXV), no qual CDR2é a seqüência aminoácida NISWRGYNIYYKDSVKG.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR3 é a seqüência aminoácida SILPLSDDPGWNTY.
Um Nanocorpo conforme algum dos XXI) a XXV), em que:- 0 CDR1 é a seqüência aminoácida NYYMG; e o CDR3 é aseqüência aminoácida SILPLSDDPGWNTY; ou- O CDR1 é a seqüência aminoácida NYYMG; e o CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- O CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG; e o CDR3 é a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme algum dos XXI) a XXV) , no qual CDR1 é a seqüência aminoácida NYYMG; o CDR2 é a seqüência aminoácida SILPLSDDPGWNTY e CDR3 é a seqüência aminoácida ILPLSDDPGWNTY.- Um Nanocorpo conforme algum dos XXI) a XXV), em que - qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/ou- a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.- Um Nanocorpo conforme algum dos XXI) a XXV), que é um Nanocorpo humanizado.e com ainda alguns outros aspectos particularmente preferenciais sendo:XXVI)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de pelo menos um nanocorpo conforme algum dos XXI) a XXV).XXVII)Uma proteína ou polipeptídio, que compreende doisnanocorpos conforme algum dos XXI) a XXV).XXVIII)Uma proteína ou polipeptídio, que compreende doisnanocorpos conforme algum dos XXI) a XXV) , e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..XXIX)Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme algum dos XXI) a XXV), e que é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.XXX)Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme algum dos XXI) a XXV), ligado através de um linker adequado.XXXIJUma proteína ou polipeptídio, que compreende dois nanocorpos conforme algum dos XXI) a XXV), ligado através de um linker adequado, e que é pegilado.XXXII)Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos XXI) a XXV), e que, além disso, compreende pelo menos um nanocorpo dirigido contra uma albumina de soro humano.XXXm)Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos XXI) a XXV) , e que, além 5 disso, compreende pelo menos um nanocorpo dirigido contra uma albumina de soro humano, e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido 10 trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..XXXIV)Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos XXI) a XXV) , e que, além disso, compreende pelo menos um nanocorpo dirigido 15 contra uma albumina de soro humano e que é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.XXXV)Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos XXI) a XXV) , e que, além 20 disso, compreende um Nanocorpo dirigido contra uma albumina de soro humano, em que cada um dos dois nanocorpos conforme algum dos XXI) a XXV) é ligado, opcionalmente através de um linker conveniente, a um Nanocorpo dirigido contra uma albumina de soro humano.XXXVI)Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos XXI) a XXV), e que, além disso, compreende um Nanocorpo dirigido contra uma albumina de soro humano, em que cada um dos dois nanocorpos conforme algum dos XXI) a XXV) é ligado, 30 opcionalmente através de um linker conveniente, a umNanocorpo dirigido contra uma albumina de soro humano, e que é tal que os referidos proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou de reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..XXXVII)Uma proteína ou polipeptídio que compreende dois nanocorpos conforme algum dos XXI) a XXV), e que, além 5 disso, compreende um Nanocorpo dirigido contra uma albumina de soro humano, em que cada um dos dois nanocorpos conforme algum dos XXI) a XXV) é ligado, opcionalmente através de um linker conveniente, a um Nanocorpo dirigido contra uma albumina de soro humano, e 10 que é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.- Uma proteína ou polipeptídio conforme algum dos XXVI) a XXXVII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um Nanocorpo humanizado.- Uma proteína ou polipeptídio conforme algum dos XXVI) aXXXVII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63).- Uma proteína ou polipeptídio conforme algum dos XXVI) a 20 XXXVII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um escolhido do grupo composto da ALB 3 (SEQ ID n. 87), ALB 4 (SEQ ID n. 88), ALB 5 (SEQ ID n. 89) , ALB 6 (SEQ ID n. 100) , ALB 7 (SEQ ID n. 101) , ALB 8 (SEQ ID n. 102) ALB 9 (SEQ ID n. 103) e ALB 10 (SEQ ID n. 25 104) .- Uma proteína ou polipeptídio conforme algum dos XXVI) a XXXVII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é a ALB 8.- Uma proteína ou polipeptídio conforme algum dos XXVI) a 30 XXXVII), que compreende ou essencialmente se compõe de dois nanocorpos humanizados nanocorpos conforme algum dos XXI) a XXV) , e uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63) .
Deve ser observado que quando um Nanocorpo é acima 35 mencionado como sendo "conforme algum dos XXI) a XXV) acima", é pelo menos segundo um de XXI) a XXV) , pode ser segundo dois ou mais de XXI) a XXV) , e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme algum dos XXI) a XXV) acima. Semelhantemente quando uma proteína ou o polipeptídio são acima mencionados 5 como sendo "conforme algum dos XXVI) a XXXVII) acima", é pelo menos segundo um de XXVI) a XXXVII) , pode ser segundo dois ou mais de XXVI) a XXXVII), e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme algum dos XXVI) a XXXVII) acima.
Um clone que foi encontrado como sendo especialmente útil como um anti-TNF Nanocorpo é o clone PMP1C2 (TNF1). Como pode ser visto dos dados comparativos do ensaio KYM na Tabela 39, TNF1 tem um valor de EC50 que é mais de 4 vezes melhor do que o melhor Nanocorpo monovalente descrito em WO 04/41862 (Nanocorpo 3E), isto é, 2,466 nN para PMP1C2 contra 12 nM para 3E (Como pode ser visto da Tabela 39, todo os nanocorpos TNF1 a TNF 9 da invenção deram um melhor valor de EC50 neste ensaio do que 3E). Neste aspecto, também deve ser observado que o Nanocorpo 3E de WO 04/41862 pertence à "classe KERE" (conforme descrito na presente), e por isso pode ser humanizado a um grau menor do que o Nanocorpo PMP1C2 (que pertence à "classe GLEW"). Quando o Nanocorpo PMP1C2 é comparado com o Nanocorpo IA de WO 04/41862, um Nanocorpo de classe GLEW com o grau mais alto na homologia de seqüência com PMP1C2 (tanto no CDR'S como nas armações), o valor de EC50 obtido para PMP1C2 no ensaio KYM é mais de 50 vezes melhor, isto é, 2.466 nM para PMP1C2 em comparação com 100 nM para IA.
Consequentemente, nanocorpos que compreendem um ou 30 vários, preferivelmente quaisquer dois e mais preferivelmente todos os três CDR presentes no clone PMP1C2 (ou seqüências CDR que são derivadas disto ou correspondem a isso) são em particular preferidos na invenção. Também, esses nanocorpos preferivelmente pertencem ao "grupo 103 35 P,R,S" (conforme definido na presente), e o mais preferivelmente têm um R na posição 103, e preferivelmente também têm GLEW ou uma seqüência semelhante a GLEW nas posições 44-47. Também, quando esses nanocorpos pertencem ao "grupo 103 P,R,S" (e especialmente quando eles têm um R na posição 103), uma substituição humanizadora preferida, mas 5 não limitadora é 108Q a 108L. Outras substituições humanizadoras preferenciais, mas não-limitadoras nesses nanocorpos preferidos são uma ou várias daquelas presentes nas variantes humanizadas de TNF1 descritas na presente, como TNF13, TNF14, TNF 2 9 ou TNF30, como será imediatamente 10 claro de uma comparação entre a seqüência de TNF1 e essas seqüências humanizadas.
Portanto, em um Nanocorpo em particular preferencial da invenção, pelo menos uma das seqüências CDR1, CDR2 e CDR3 presentes é apropriadamente escolhida do grupo composto da 15 seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente (isto é, as seqüências CDR presentes no clone TNF1) , ou do grupo das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais 20 preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos "identidade de seqüência de 99%" (conforme definido na presente) com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente; e/ou do grupo composto das 25 seqüências CDR1, CDR2 e CDR3, respectivamente, que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 3 00, respectivamente.
Preferivelmente, em esses nanocorpos preferidos da invenção, pelo menos duas das seqüências CDR1, CDR2 e CDR3 presentes são apropriadamente escolhidas do grupo composto da seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente (isto é, as seqüências CDR presentes no clone TNF1), ou do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência CDR1 de SEQ ID n. 164, a 5 seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente; e/ou do grupo composto das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a 10 seqüência CDR3 de SEQ ID n. 300, respectivamente.
Mais preferivelmente, nesses nanocorpos preferidos da invenção, as três seqüências CDR1, CDR2 e CDR3 presentes são apropriadamente escolhidas do grupo composto da seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e 15 a seqüência CDR3 de SEQ ID n. 300, respectivamente (isto é, as seqüências CDR presentes no clone TNF1), ou do grupo das seqüências CDR1, CDR2 e CDR3, respectivamente, que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente 20 pelo menos identidade de seqüência de 99% com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente; e/ou do grupo composto das seqüências CDR1, CDR2 e CDR3,respectivamente, que têm 3, 2 ou só 1 diferença (s) aminoácida(s) com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente.
Mesmo mais preferivelmente, em esses nanocorpos preferidos da invenção, pelo menos uma das seqüências CDR1, 30 CDR2 e CDR3 presentes é apropriadamente escolhida do grupo composto da seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente (isto é, as seqüências CDR presentes no clone TNF1). Preferivelmente, nesta modalidade de execução, 35 pelo menos uma ou preferivelmente ambas as seqüências CDR presentes são apropriadamente escolhidas de seqüências CDR que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e 5 a seqüência CDR3 de SEQ ID n. 300, respectivamente; e/ou apropriadamente escolhido do grupo composto das seqüências CDR que têm 3, 2 ou só 1 diferença (s) aminoácida (s) com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, 10 respectivamente.
Mesmo mais preferivelmente, nesses nanocorpos preferidos da invenção, pelo menos duas das seqüências CDR1, CDR2 e CDR3 presentes são apropriadamente escolhidas do grupo composto da seqüência CDR1 de SEQ ID n. 164, a 15 seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente (isto é, as seqüências CDR presentes no clone TNF1). Preferivelmente, nesta modalidade de execução, o resto da seqüência CDR presente é apropriadamente escolhida do grupo de seqüências CDR que têm 20 pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente; e/ou do 25 grupo composto de seqüências CDR que têm 3, 2 ou só 1 diferença(s) aminoácida(s) com a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente.
Os nanocorpos em particular preferidos da invenção 30 compreendem a seqüência CDR1 de SEQ ID n. 164, a seqüência CDR2 de SEQ ID n. 232, e a seqüência CDR3 de SEQ ID n. 300, respectivamente (isto é, as seqüências CDR presentes no clone TNF1).
Os nanocorpos com as seqüências CDR acima mencionadas 35 preferivelmente têm seqüências de armação que são posteriormente definidas na presente. Algumas combinações em particular preferidas, mas não-restritivas das seqüências de armação podem ser vistas na Tabela I acima mencionada. Como estará claro para a pessoa experimentada, uma combinação de seqüências FR1, FR2, FR3 e FR4 que ocorrem no mesmo clone 5 (isto é, seqüências FR1, FR2, FR3 e FR4 que são mencionadas na mesma linha na Tabela I) será normalmente preferido (embora a invenção no seu sentido mais amplo não seja limitada a isso, e também compreenda outras combinações convenientes das seqüências de armação mencionadas na Tabela 10 I) .Mais especificamente, alguns aspectos preferenciais desta modalidade de execução da invenção são: XXXVIII)Um nanocrpo contra o TNF-alfa, que se compõem de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 15 regiões que determinam complementaridade (CDR1 a CDR3 respectivamente), em que: a) O CDR1 compreende :- a seqüência aminoácida DYWMY; ou- uma seqüência aminoácida que tem pelo menos 80%, 20 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ou- umas seqüências aminoácidas que tem só 1 diferença aminoácida com a seqüência aminoácida DYWMY; eb) O CDR2 compreende:- a seqüência aminoácida EINTNGLITKYPDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 30 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaEINTNGLITKYPDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida EINTNGLITKYPDSVKG; ec) O CDR3 compreende: - a seqüência aminoácida SPSGFN; ou - uma seqüência aminoácida que tem pelo menos 80%, 5 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SPSGFN; ou- umas seqüências aminoácidas que tem só 1 diferença aminoácida com a seqüência aminoácida SPSGFN.- Um nanocrpo conforme XXXVIII), no qual CDR1 compreende aseqüência aminoácida DYWMY.- Um nanocrpo conforme XXXVIII), no qual CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG.- Um nanocrpo conforme XXXVIII), no qual CDR3 compreende a 15 seqüência aminoácida SPSGFN.- Um nanocrpo conforme XXXVIII), em que:- O CDR1 compreende a seqüência aminoácida DYWMY; e o CDR3 compreende a seqüência aminoácida SPSGFN; ou- O CDR1 compreende a seqüência aminoácida DYWMY; e o CDR2 20 compreende a seqüência aminoácida EINTNGLITKYPDSVKG; ouO CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG; e o CDR3 compreende a seqüência aminoácida SPSGFN - Um nanocrpo conforme XXXVIII), no qual CDR1 compreende a seqüência aminoácida DYWMY; e o CDR3 compreende a seqüência aminoácida SPSGFN.- Um nanocrpo conforme XXXVIII) no qual CDR1 compreende a seqüência aminoácida DYWMY; o CDR2 compreende a seqüência aminoácida EINTNGLITKYPDSVKG e CDR3 compreendem a seqüência 30 aminoácida SPSGFN.- Um Nanocorpo conforme XXXVIII), em que - qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/oua referida seqüência aminoácida preferivelmente só 35 contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.- Um Nanocorpo conforme XXXVIII), que é um Nanocorpo de classe GLEW.- Um Nanocorpo conforme XXXVIII), que contém um resíduo dearginina (R) na posição 103.- Um Nanocorpo conforme XXXVIII), que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 10 de seqüência de 99% (conforme definido na presente) com uma das seqüências aminoácidas de SEQ ID NO's 52 (TNF1) , 76(TNF13), 77 (TNF14), 95 (TNF29) ou 96 (TNF30).Um Nanocorpo conforme XXXVIII), que é um Nanocorpo humanizado.- Um Nanocorpo conforme XXXVIII), que contém um resíduo de leucina (L) na posição 108.- Um Nanocorpo conforme XXXVIII) , que tem uma taxa Koff para TNF de melhor do que 2.10'3 (1/s) , preferivelmente melhor do que 1.10’3 (1/s); ou uma variante humanizada de talNanocorpo ;- Um Nanocorpo conforme XXXVIII), que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3) , de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E (SEQ ID NO: 4) de WO 25 04/041862 no mesmo ensaio; ou uma variante humanizada de talNanocorpo.- Um Nanocorpo conforme XXXVIII), que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 30 5nM; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XXXVIII), que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 3nM; ou uma variante humanizada de tal Nanocorpo.XXXIX)Um Nanocorpo contra o TNF-alfa, que se compõem de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 regiões que determinam complementaridade (CDR1 a CDR3 respectivamente), em quea) O CDR1 é:- a seqüência aminoácida DYWMY; ou- uma seqüência aminoácida que tem pelo menos 80%,preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida DYWMY; ou- umas seqüências aminoácidas que tem só 1 diferença aminoácida com a seqüência aminoácida DYWMY;e em que:b) O CDR2 é :- a seqüência aminoácida EINTNGLITKYPDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, 15 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaEINTNGLITKYPDSVKG; ouumas seqüências aminoácidas que tem 2 ou só 1 20 diferença(s) aminoácida(s) com a seqüência aminoácida EINTNGLITKYPDSVKG;e em queC) O CDR3 é:- a seqüência aminoácida SPSGFN; ou- uma seqüência aminoácida que tem pelo menos 8 0%,preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida SPSGFN; ou- umas seqüências aminoácidas que tem só 1 diferença 30 aminoácida com a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme XXXIX) , no qual CDR1 é a seqüência aminoácida DYWMY.- Um Nanocorpo conforme XXXIX), no qual CDR2 é a seqüênciaaminoácida EINTNGLITKYPDSVKG. - Um Nanocorpo conforme XXXIX) , no qual CDR3 é a seqüência aminoácida SPSGFN- Um Nanocorpo conforme XXXIX), em que:- O CDR1 é a seqüência aminoácida DYWMY; e o CDR3 é a seqüência aminoácida SPSGFN; ou- O CDR1 é a seqüência aminoácida DYWMY; e o CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG; ou- O CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG; e o CDR3 é a seqüência aminoácida SPSGFN- Um Nanocorpo conforme XXXIX) , no qual CDR1 é a seqüênciaaminoácida DYWMY; e o CDR3 é a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme XXXIX) , no qual CDR1 é a seqüência aminoácida DYWMY; o CDR2 é a seqüência aminoácida EINTNGLITKYPDSVKG e CDR3 é a seqüência aminoácida SPSGFN.- Um Nanocorpo conforme XXXIX), em que:- qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/ou- a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou 20 inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.- Um Nanocorpo conforme XXXIX), que é um Nanocorpo de classe GLEW.- Um Nanocorpo conforme XXXIX), que contém um resíduo de 25 arginina (R) na posição 103.- Um Nanocorpo conforme XXXIX) , que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma 30 das seqüências aminoácidas de SEQ ID NO'S 52 (TNF1) , 76 (TNF13), 77 (TNF14), 95 (TNF29) ou 96 (TNF30).- Um Nanocorpo conforme XXXIX), que é um Nanocorpo humanizado.- Um Nanocorpo conforme XXXIX), que contém um resíduo de 35 leucina (L) na posição 108. - Um Nanocorpo conforme XXXIX) , que tem uma taxa Koff para TNF de melhor do que 2.10’3 (1/s), preferivelmente melhor do que 1.10’3 (1/s); ou uma variante humanizada de taiNanocorpo.- Um Nanocorpo conforme XXXIX) , que tern urn valor de EC50 noensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC5 0 do Nanocorpo VHH 3E (SEQ ID NO:4) de WO 04/041862 no mesmo ensaio ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XXXIX) , que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 5nM; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XXXIX) , que tem um valor de EC5 0 noensaio à base de células usando células KYM descritas noExemplo 1, conforme 3), de WO 04/041862 que é melhor do que 3nM; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XXXIX), que é escolhido do grupo 20 composto de TNF 13 (SEQ ID n. 76), TNF 14 (SEQ ID n. 77), TNF 29 (SEQ ID n. 95) e TNF 30 (SEQ ID NO:96).- Um Nanocorpo conforme XXXIX), que é TNF 30 (SEQ ID n. 96) ; com alguns outros aspectos preferenciais sendo:XL) Uma proteína ou polipeptídio, que compreende ou 25 essencialmente se compõe de um Nanocorpo conformeXXXVIII) ou XXXIX).XLI) Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de pelo menos um nanocorpo conforme XXXVIII) ou XXXIX).- Uma proteína ou polipeptídio conforme algum dos XL) ouXLI) , que compreende dois nanocorpos conforme XXXVIII) ou XXXIX).- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI) , que compreende dois nanocorpos conforme XXXVIII) ouXXXIX) , e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..- Uma proteína ou polipeptídio conforme algum dos XL) ou 5 XLI), que compreende dois nanocorpos conforme XXXVIII) ou XXXIX), e que é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI), que compreende dois nanocorpos conforme XXXVIII) ou 10 XXXIX), que são diretamente ligados um a outro ou ligados um a outro via um linker.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI), que compreende dois nanocorpos conforme XXXVIII) ou XXXIX) , que são ligados um a outro via uma seqüência 15 aminoácida.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI), que compreende dois nanocorpos conforme XXXVIII) ou XXXIX), que são ligados um a outro via uma seqüência aminoácida (como, sem restrição, uma seqüência aminoácida 20 que compreende glicina e resíduos de serina) que compreende pelo menos 14 aminoácidos, mais preferivelmente pelo menos 17 aminoácidos, como aproximadamente 20-40 aminoácidos (como o linker GS30).- Uma proteína ou polipeptídio conforme algum dos XL) ou 25 XLI), que compreende ou essencialmente se compõe do polipeptídio TNF 7 (SEQ ID n. 73) , no qual ambos nanocorpos TNF 1 foram humanizados.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI), que compreende ou essencialmente se compõe o 30 polipeptídio TNF 55 (SEQ ID n. 419) ou TNF 56 (SEQ ID n.420) .- Uma proteína ou polipeptídio conforme algum dos XL) ouXLI), que é pegilado.- Uma proteína ou polipeptídio conforme algum dos XL) ouXLI), que compreende dois nanocorpos conforme XXXVIII) ou XXXIX) , e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor; e/ou que ê tal 5 que os referidos proteína ou o polipeptídio são capazes da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF, e que proteína ou o polipeptídio além disso compreendem pelo menos um nanocorpo dirigido contra uma albumina de soro humano.- Uma proteína ou polipeptídio conforme algum dos XL) ouXLI) , que compreende dois nanocorpos conforme XXXVIII) ou XXXIX), e que proteína ou o polipeptídio além disso compreendem pelo menos um nanocorpo dirigido contra uma albumina de soro humano, em que os dois nanocorpos conformeXXXVIII) ou XXXIX) são ligados um a outro via pelo menos um nanocorpo dirigido contra uma albumina de soro humano, e no qual os dois nanocorpos conforme XXXVIII) ou XXXIX) são ligados diretamente a pelo menos um nanocorpo dirigido contra uma albumina de soro humano, ou ligados a pelo menos 20 um nanocorpo dirigido contra uma albumina de soro humano via um linker.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI) , que compreende dois nanocorpos conforme XXXVIII) ou XXXIX) , e que proteína ou o polipeptídio além disso 25 compreendem pelo menos um nanocorpo dirigido contra uma albumina de soro humano, em que os dois nanocorpos conforme XXXVIII) ou XXXIX) são ligados um a outro via pelo menos um nanocorpo dirigido contra uma albumina de soro humano, e no qual os dois nanocorpos conforme XXXVIII) ou XXXIX) são 30 ligados diretamente a pelo menos um nanocorpo dirigido contra uma albumina de soro humano, ou ligados a pelo menos um nanocorpo dirigido contra uma albumina de soro humano via um linker, no qual o linker é uma seqüência aminoácida (como, sem restrição, um linker que compreende glicina e resíduos de serina), e especialmente uma seqüência aminoácida que compreende entre 3 e 40 resíduos aminoácidos, como entre 5 e 15 resíduos aminoácidos (como o linker GS9). - Uma proteína ou polipeptídio conforme algum dos XL) ou XLI), que compreende dois nanocorpos conforme XXXVIII) ou5 XXXIX), e que proteína ou o polipeptídio além disso compreendem pelo menos um nanocorpo dirigido contra uma albumina de soro humano, em que os dois nanocorpos conforme XXXVIII) ou XXXIX) são ligados um a outro via pelo menos um nanocorpo dirigido contra uma albumina de soro humano, e no qual os dois nanocorpos conforme XXXVIII) ou XXXIX) são ligados diretamente a pelo menos um nanocorpo dirigido contra uma albumina de soro humano, ou ligados a pelo menos um nanocorpo dirigido contra uma albumina de soro humano via um linker, e que proteína ou o polipeptídio são tais que os referidos proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou de reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor; e/ou que proteína ou o polipeptídio são tais que os referidos proteína ou o polipeptídio são capazes da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um Nanocorpo humanizado.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63).- Uma proteína ou polipeptídio conforme algum dos XL) ouXLI) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um escolhido do grupo composto da ALB 3 (SEQ ID n. 87), ALB 4 (SEQ ID n. 88), ALB 5 (SEQ ID n.89), ALB 6 (SEQ ID n. 100), ALB 7 (SEQ ID n. 101), ALB 8 (SEQ ID n. 102) ALB 9 (SEQ ID n. 103) e ALB 10 (SEQ ID n. 104) . - Uma proteína ou polipeptídio conforme algum dos XL) ou XLI) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é a ALB 8.- Uma proteína ou polipeptídio conforme algum dos XL) ou 5 XLI), que compreende ou essencialmente se compõe de dois nanocorpos humanizados conforme algum dos XL) ou XLI) e uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63) .- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI) , que compreende ou essencialmente se compõe do 10 polipeptídio TNF24 (SEQ ID n. 90), no qual tanto o Nanocorpo TNF 1 como a ALB Nanocorpo 1 foi humanizado.- Uma proteína ou polipeptídio conforme algum dos XL) ou XLI) , que compreende ou essencialmente se compõe de dois nanocorpos TNF 30 e uma ALB Nanocorpo 8.- Uma proteína ou polipeptídio conforme algum dos XL) ouXLI), que compreende ou essencialmente se compõe o polipeptídio TNF 60 (SEQ ID n. 417).
Deve ser observado que quando um Nanocorpo é acima mencionado como sendo "conforme XXXVIII" ou "conforme 20 XXXIX", é pelo menos segundo um de XXXVIII) e/ou XXXIX), e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme XXXVIII" ou "conforme XXXIX" anteriormente. Semelhantemente quando uma proteína ou o polipeptídio são acima mencionados como sendo "conforme 25 algum dos XL) ou XLI)", é pelo menos segundo um de XL) a XLI) , pode ser segundo dois ou mais de VI) a XVIII) , e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme algum dos XL) ou XLI) acima.
Para os nanocorpos baseados em Nanocorpo TNF1 30 anteriormente (inclusive mas não limitado ao nanocorpos humanizados), as seqüências de armação podem ser geralmente como descritas na presente, e preferivelmente são como se segue:a) 0 FR1 compreende ou é:- a seqüência aminoácida de SEQ ID n. 130; ou uma seqüência aminoácida que tem pelo menos 8 0%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 5 130; ou- umas seqüências aminoácidas que tem só 1 diferença aminoácida com a seqüência aminoácida de SEQ ID n. 130;eb) O FR2 compreende ou é:- a seqüência aminoácida de SEQ ID n. 198; ouuma seqüência aminoácida que tem pelo menos 8 0%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 198; ouumas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida de SEQ ID n. 198;ec) O FR3 compreende ou é:- a seqüência aminoácida de SEQ ID n. 266; ouuma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 25 de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 266; ou- umas seqüências aminoácidas que tem só 1 diferença aminoácida com a seqüência aminoácida de SEQ ID n. 266. ed) O FR4 compreende ou é:- a seqüência aminoácida de SEQ ID n. 334; ouuma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 334; ou- umas seqüências aminoácidas que tem só 1 diferença aminoácida com a seqüência aminoácida de SEQ ID n. 334; no qual as diferenças aminoácidas presentes nasseqüências de armação são mais preferivelmente como descritos na presente.
Os nanocorpos contra o TNF-alfa, que têm regiões de armação conforme descrito acima (isto é, semelhante a TNF1), 10 e nos quais pelo menos uma das regiões de armação (como quaisquer duas, quaisquer três ou as quatro regiões de armação) foram humanizados, formam um novo aspecto da invenção. Tais nanocorpos podem ter especialmente CDR's que são tais que o Nanocorpo tem uma taxa Koff para TNF de melhor 15 do que 2.10'3 (1/s), preferivelmente melhor do que 1.10’3 (1/s) ; e/ou tenha CDR'S que são tais que o Nanocorpo tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E (SEQ ID 20 NO:4) de WO 04/041862 no mesmo ensaio; e especialmente melhor do que 12nM, mais especialmente melhor do que 5 nM, até mais especialmente melhor do que 3nM. Também, ou alternativamente, tais nanocorpos são preferivelmente dirigidos contra o mesmo epitope de TNF (isto é, o Trímero 25 TNF) como TNF1.
Especialmente, a invenção refere-se a um Nanocorpo contra o TNF-alfa, que é uma variante humanizada de um Nanocorpo contra o TNF-alfa, cujo Nanocorpo contra o TNF- alfa tem as seqüências de armação seguintes: FR1: SEQ ID n. 30 130; FR2: SEQ ID n. 198; FR3: SEQ ID n. 266; e FR4: SEQ ID n. 334. Tal Nanocorpo pode ter especialmente CDR's que são tais que o Nanocorpo tem uma taxa Koff para TNF de melhor do que 2.10‘3 (1/s), preferivelmente melhor do que 1.10'3 (1/s); e/ou tenha o CDR'S que são tais que o Nanocorpo tem um valor 35 de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E (SEQ ID NO:4) de WO 04/041862 no mesmo ensaio; e especialmente melhor do que 12nM, mais especialmente melhor do que 5 nM, até mais especialmente melhor do que 3nM. Também, ou 5 alternativamente, tais nanocorpos são preferivelmente dirigidos contra o mesmo epitope de TNF (isto é, o Trímero TNF) como TNF1,Outro clone que foi encontrado para ser especialmente útil como um anti-TNF Nanocorpo é o clone PMP5F10 (TNF3, SEQ 10 ID n. 60) . Como pode ser visto dos dados comparativos do ensaio KYM na Tabela 39, TNF3 tem um valor de EC50 que é mais de 15 vezes melhor do que o melhor Nanocorpo monovalente descrito em WO 04/41862.Conseqüentemente, nanocorpos que compreendem um ou 15 vários, preferivelmente quaisquer dois e mais preferivelmente todos os três dos CDR's presentes no clone PMP5F10 (ou seqüências CDR que são derivadas disto ou correspondem a isso) são em particular preferidos na invenção. Também, esses nanocorpos preferivelmente pertencem 20 à classe KERE.Mais especificamente, alguns aspectos preferenciais desta modalidade de execução da invenção são:XLII)Um Nanocorpo contra o TNF-alfa, que se compõem de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 25 regiões que determinam complementaridade (CDR1 a CDR3respectivamente), em que a) O CDR1 compreende: - a seqüência aminoácida NYYMG; ou - uma seqüência aminoácida que tem pelo menos 80%, 30 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida NYYMG; ou - umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida NYYMG; e b) O CDR2 compreende:- a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 5 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaNISWRGYNIYYKDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida 10 NISWRGYNIYYKDSVKG;ec) O CDR3 compreende:- a seqüência aminoácida SILPLSDDPGWNTY; ou- uma seqüência aminoácida que tem pelo menos 80%, 15 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaSILPLSDDPGWNTY; ouumas seqüências aminoácidas que tem 2 ou só 1 20 diferença aminoácida com a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme XLII), no qual CDR1 compreende a seqüência aminoácida NYYMG.- Um Nanocorpo conforme XLII), no qual CDR2 compreende a 25 seqüência aminoácida NISWRGYNIYYKDSVKG.- Um Nanocorpo conforme XLII), no qual CDR3 compreende a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme XLII), em que:- O CDR1 compreende a seqüência aminoácida NYYMG; e o CDR3 30 compreende a seqüência aminoácida SILPLSDDPGWNTY; ou- O CDR1 compreende a seqüência aminoácida NYYMG; e o CDR2 compreende a seqüência aminoácida NISWRGYNIYYKDSVKG; ouO CDR2 compreende a seqüência aminoácida NISWRGYNIYYKDSVKG; e o CDR3 compreende a seqüência 35 aminoácida SILPLSDDPGWNTY. g/t- Um Nanocorpo conforme XLII), no qual CDR1 compreende a seqüência aminoácida NYYMG; o CDR2 compreende a seqüência aminoácida SILPLSDDPGWNTY e CDR3 compreendem a seqüência aminoácida ILPLSDDPGWNTY.- Um Nanocorpo conforme XLII), em que- qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora; e/ou- a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou 10 inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.- Um Nanocorpo conforme XLII), que é um Nanocorpo de classe KERE.Um Nanocorpo conforme XLII) , que tem pelo menos 80%, 15 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das seqüências aminoácidas de SEQ ID NO's 50 (TNF3), 83(TNF20), 85 (TNF21), 85 (TNF22), 96 (TNF23) ou 99 (TNF33).- Um Nanocorpo conforme XLII) , que é um Nanocorpohumanizado.- Um Nanocorpo conforme XLII) , que tem uma taxa Koff para TNF de melhor do que 2.10’3 (1/s), preferivelmente melhor do que 1.10"3 (1/s); ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XLII), que tem um valor de EC5 0 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3) , de WO 04/041862 que é melhor do que o valor de EC5 0 do Nanocorpo VHH 3E (SEQ ID NO: 4) de WO 04/041862 no mesmo ensaio; ou uma variante humanizada de tal 30 Nanocorpo.- Um Nanocorpo conforme XLII) , que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 5nM; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XLII) , que tem um valor de EC50 noensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 3nM; ou uma variante humanizada de tal Nanocorpo.
Um Nanocorpo contra o TNF-alfa, que se compõem de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 regiões 5 que determinam complementaridade (CDR1 a CDR3 respectivamente), em quea) 0 CDR1 é:- a seqüência aminoácida NYYMG; ou- uma seqüência aminoácida que tem pelo menos 80%, 10 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida NYYMG; ou - umas seqüências aminoácidas que tem 2 ou só 1 diferença aminoácida com a seqüência aminoácida NYYMG; eb) O CDR2 é:- a seqüência aminoácida NISWRGYNIYYKDSVKG; ou- uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaNISWRGYNIYYKDSVKG; ou- umas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida NISWRGYNIYYKDSVKG;ec) O CDR3 é:- a seqüência aminoácida SILPLSDDPGWNTY; ou- uma seqüência aminoácida que tem pelo menos 80%, 30 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácidaSILPLSDDPGWNTY; ou- umas seqüências aminoácidas que tem 2 ou só 1 35 diferença aminoácida com a seqüência aminoácidaSILPLSDDPGWNTY. - Um Nanocorpo conforme XLIII), no qual CDR1 é a seqüência aminoácida NYYMG.- Um Nanocorpo conforme XLIII), no qual CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG.- Um Nanocorpo conforme XLIII) , no qual CDR3 é a seqüênciaaminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme XLIII), em que:- 0 CDR1 é a seqüência aminoácida NYYMG; e o CDR3 é a seqüência aminoácida SILPLSDDPGWNTY; ou- O CDR1 é a seqüência aminoácida NYYMG; e o CDR2 é aseqüência aminoácida NISWRGYNIYYKDSVKG; ou- O CDR2 é a seqüência aminoácida NISWRGYNIYYKDSVKG; e o CDR3 é a seqüência aminoácida SILPLSDDPGWNTY.- Um Nanocorpo conforme XLIII) , no qual CDR1 é a seqüência 15 aminoácida NYYMG; o CDR2 é a seqüência aminoácida SILPLSDDPGWNTY e CDR3 é a seqüência aminoácida ILPLSDDPGWNTY.- Um Nanocorpo conforme XLIII), em que- qualquer substituição aminoácida é preferivelmente 20 uma substituição aminoácida conservadora; e/ou- a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.- Um Nanocorpo conforme XLIII) , que é um Nanocorpo declasse KERE.- Um Nanocorpo conforme XLIII), que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade 30 de seqüência de 99% (conforme definido na presente) com uma das seqüências aminoácidas de SEQ ID NO's 50 (TNF3), 83 (TNF20), 85 (TNF21), 85 (TNF22), 96 (TNF23) ou 99 (TNF33).
Um Nanocorpo conforme XLIII), que é um Nanocorpo humanizado.- Um Nanocorpo conforme XLIII) , que tem uma taxa Koff paraTNF de melhor do que 2.10'3 (1/s), preferivelmente melhor do que 2.10’3 (1/s); ou uma variante humanizada de taiNanocorpo.- Um Nanocorpo conforme XLIII), que tern urn valor de EC50 no ensaio à base de células usando células KYM descritas no 5 Exemplo 1, conforme 3) , de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E (SEQ ID NO: 4) de WO 04/041862 no mesmo ensaio; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XLIII) , que tem um valor de EC50 no 10 ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que SnM; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XLIII) , que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no 15 Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 3nM; ou uma variante humanizada de tal Nanocorpo.- Um Nanocorpo conforme XLIII), que é escolhido do grupo composto de SEQ ID NO's, 83 (TNF20), 85 (TNF21), 85 (TNF22), 96 (TNF23) OU 98 (TNF33) TNF 13 (SEQ ID n. 76) , TNF 14 (SEQ 20 ID n. 77), TNF 29 (SEQ ID n. 95) e TNF 30 (SEQ ID NO:96) com alguns outros aspectos preferenciais sendo:XLIV)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de um Nanocorpo conforme XLII) ou XLIII).XLV)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de pelo menos um nanocorpo conforme XLII) ou XLIII).XLVI)Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme XLII) ou XLIII).XLVII)Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme XLII) ou XLIII) , e que é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..XLVni)Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme XLII) ou XLIII), e que é capaz da 5 ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF.- Uma proteína ou polipeptídio conforme algum dos XLIV) ou XLVIII), que compreende ou essencialmente se compõe do polipeptídio TNF 6 (SEQ ID n. 72) ou TNF 9 (SEQ ID n. 75, no 10 qual ambos nanocorpos TNF 3 foram humanizados- Uma proteína ou polipeptídio conforme algum dos XLIV) ou XLVIII), que é pegilado.
Uma proteína ou polipeptídio, que compreende dois nanocorpos conforme XLII) ou XLIII) , e que é tal que a 15 referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor; e/ou que é tal que os referidos proteína ou o 20 polipeptídio são capazes da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF, e que proteína ou o polipeptídio além disso compreendem pelo menos um nanocorpo dirigido contra uma albumina de soro humano.- Uma proteína ou polipeptídio conforme algum dos XLIV) ouXLVIII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um Nanocorpo humanizado.
Uma proteína ou polipeptídio conforme algum dos XLIV) ou XLVIII), no qual pelo menos um nanocorpo dirigido contra 30 uma albumina de soro humano é uma variante humanizada daALB Nanocorpo 1 (SEQ ID n. 63).- Uma proteína ou polipeptídio conforme algum dos XLIV) ou XLVIII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um escolhido do grupo composto da 35 ALB 3 (SEQ ID n. 87) , ALB 4 (SEQ ID n. 88) , ALB 5 (SEQ ID n.89), ALB 6 (SEQ ID n. 100), ALB 7 (SEQ ID n. 101), ALB 8 (SEQ ID n. 102) ALB 9 (SEQ ID n. 103) e ALB 10 (SEQ ID n. 104) .- Uma proteína ou polipeptídio conforme algum dos XLIV) ou XLVIII), no qual pelo menos urn nanocorpo dirigido contra uma 5 albumina de soro humano é a ALB 8.- Uma proteína ou polipeptídio conforme algum dos XLIV) ou XLVIII), que compreende ou essencialmente se compõe de dois nanocorpos humanizados conforme algum dos XLIV) ou XLVIII) e uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63).- Uma proteína ou polipeptídio conforme algum dos XLIV) ouXLVIII), que compreende ou essencialmente consiste do polipeptídio TNF26 (SEQ ID n. 92), no qual tanto os nanocorpos TNF 3 como a ALB Nanocorpo 1 foi humanizado.
Deve ser observado que quando um Nanocorpo é acima 15 mencionado como sendo "conforme XLII" ou "conforme XLIII", ê pelo menos segundo um de XLII) e/ou XLIII) , e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme XLII)" ou "conforme XLIII)" anteriormente. Semelhantemente quando uma proteína ou o 20 polipeptídio são acima mencionados como sendo "conforme algum dos XLIV) ou XLVIII)", é pelo menos segundo um de XL) a XLI) , pode ser segundo dois ou mais de XLIV) a XLVIII) , e também pode incluir algum ou mais de outros aspectos que são indicados como sendo "conforme algum dos XLIV) ou XLVIII) 25 acima.
Para os nanocorpos baseados em Nanocorpo TNF3 anteriormente (inclusive mas não limitado ao nanocorpos humanizado), as seqüências de armação podem ser geralmente como descritas na presente, e preferivelmente são como se 30 segue:a) O FR1 compreende ou é:- a seqüência aminoácida de SEQ ID n. 138; ou uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo 35 menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 138; ou- umas seqüências aminoácidas que tem só 1 diferença aminoácida com a seqüência aminoácida de SEQ ID n. 138; eb) O FR2 compreende ou é:- a seqüência aminoácida de SEQ ID n. 206; ou uma seqüência aminoácida que tem pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 206; ouumas seqüências aminoácidas que tem 2 ou só 1 diferença(s) aminoácida(s) com a seqüência aminoácida de SEQ ID n. 206;c) O FR3 compreende ou é:- a seqüência aminoácida de SEQ ID n. 274; ouuma seqüência aminoácida que tem pelo menos 80%, 20 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 274; OU- umas seqüências aminoácidas que tem só 1 diferença 25 aminoácida com a seqüência aminoácida de SEQ ID n. 274. ed) O FR4 compreende ou é:- a seqüência aminoácida de SEQ ID n. 342; ouuma seqüência aminoácida que tem pelo menos 80%, 30 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% com a seqüência aminoácida de SEQ ID n. 342; ou- umas seqüências aminoácidas que tem só 1 diferença 35 aminoácida com a seqüência aminoácida de SEQ ID n. 342; no qual as diferenças aminoáoidas presentes nas seqüências de armação são mais preferivelmente como descritos na presente.
Em outro aspecto, a invenção refere-se a um Nanocorpo 5 com uma seqüência aminoácida que é escolhida do grupo composto de SEQ ID NO's: 52 a 60, do grupo composto de SEQ ID NO's: 76 para 86, do grupo composto de SEQ ID NO's: 9 5 para 99, do grupo composto de SEQ ID NO's 105 para 129 ou do grupo composto de seqüências aminoácidas que têm mais de 10 80%, preferivelmente mais de 90%, mais preferivelmente maisde 95%, como 99% ou mais "identidade de seqüência" (conforme definido na presente) com uma ou várias das seqüências aminoácidas de SEQ ID NO's: 52 a 60, SEQ ID NO's: 76 para 86, SEQ ID NO's: 95 para 99 ou SEQ ID NO's 105 para 129, no 15 qual as últimas seqüências aminoácidas mais preferivelmente têm seqüências de armação que são como mais adiante definidas embaixo conforme a descrição geral das seqüências de armação de nanocorpos.
Segundo uma modalidade de execução específica, mas não- 20 restritiva, as últimas seqüências aminoácidas são "humanizadas", conforme mais adiante descrito na presente.
Mais preferivelmente, os nanocorpos da invenção são escolhidos do grupo composto de SEQ ID NO's: 52 a 60, do grupo composto de SEQ ID NO's: 76 para 86, do grupo composto 25 de SEQ ID NO's: 95 para 99, ou do grupo composto de SEQ ID NO's 105 para 129, de que os nanocorpos "humanizado" de SEQ ID NO's 76 para 86 e SEQ ID NO's: 95 para 99 pode ser em particular preferido.
Conforme acima mencionado, um Nanocorpo em particular 30 preferencial da invenção é o clone PMP1C2 (TNF1; SEQ ID n.2). Portanto, em um aspecto preferencial, a invenção refere-se a um Nanocorpo com uma seqüência aminoácida que é escolhida do grupo composto de SEQ ID n. 52 ou do grupo composto de seqüências aminoácidas que têm mais de 80%, 35 preferivelmente mais de 90%, mais preferivelmente mais de 95%, como 99% ou mais "identidade de seqüência" (conforme definido na presente) com a seqüência aminoácida de SEQ ID NO:52, no qual as últimas seqüências aminoácidas, mais preferivelmente, têm seqüências de armação que são mais adiante definidas conforme a descrição geral das seqüências 5 de armação de nanocorpos.
Particularmente preferidas são variantes humanizadas do clone PMP1C2 (TNF1; SEQ ID n. 52) . Alguns exemplos preferidos, mas não-restritivos de tais variants humanizadas são os clones TNF13 (SEQ ID n. 76) , TNF14 (SEQ 10 ID NO:77), TNF29 (SEQ ID n. 95) e TNF 30 (SEQ ID n. 96).
Portanto, em um aspecto preferencial, a invenção refere-se a um Nanocorpo humanizado com uma seqüência aminoácida que é escolhida do grupo composto de SEQ ID NO's: 76, 77, 95 ou 96, ou do grupo composto de seqüências aminoácidas que têm 15 mais de 80%, preferivelmente mais de 90%, mais preferivelmente mais de 95%, como 99% ou mais "identidade de seqüência" (conforme definido na presente) com uma das seqüências aminoácidas de SEQ ID NO'S: 76, 77, 95 ou 96, no qual as últimas seqüências aminoácidas, mais 20 preferivelmente, têm seqüências de armação que são mais adiante definidas conforme a descrição geral das seqüências de armação de nanocorpos.
Segundo uma modalidade de execução preferencial, o Nanocorpo da invenção é uma variante humanizada do Nanocorpo 25 TNF 1 (SEQ ID n. 52) .
Alguns aspectos preferenciais desta modalidade de execução da invenção são:XLIX)Uma variante humanizada do Nanocorpo TNF 1, que tem uma taxa Koff para TNF de melhor do que 2.10'3 (1/s), preferivelmente melhor do que 1.10'3 (1/s).L) Uma variante humanizada do Nanocorpo TNF 1, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E 35 (SEQ ID NO:4) de WO 04/041862 no mesmo ensaio. LI) Uma variante humanizada do Nanocorpo TNF 1, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 5nM.LII) Uma variante humanizada do Nanocorpo TNF 1, que tem um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 3nM.LUI) Uma proteína ou polipeptídio, que compreende ou 10 essencialmente se compõe de pelo menos um nanocorpo queé uma variante humanizada do Nanocorpo TNF 1 conforme algum dos XLIX) a LII)LIV) Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são 15 variantes humanizadas do Nanocorpo TNF 1 conforme algum dos XLIX) a LII) (opcionalmente ligado via um linker).LV) Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 1 conforme algum 20 dos XLIX) a LII) (opcionalmente ligado via um linker), eque é tal que a referida proteína ou o polipeptídio, para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que 25 é mediada por tal ligação cruzada de receptor..LVI) Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 1 conforme algum dos XLIX) a LII) e que é capaz da ligação intramolecular 30 a pelo menos dois sítios que ligam o receptor TNF a umTrímero TNF.LVII)Uma proteína ou polipeptídio que compreende ou essencialmente se compõe do polipeptídio TNF 7 (SEQ ID n. 73) , no qual ambos nanocorpos TNF 1 foram 35 humanizados. LVin)Uma proteína ou polipeptídio que compreende ou essencialmente se compõe do polipeptídio TNF 7 (SEQ ID n. 73) , no qual tanto nanocorpos TNF 1 foramhumanizados, e que é pegilado.LIX) Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 1 conforme algum dos XLIX) a LII) , e que, além disso, compreende pelo menos um nanocorpo dirigido contra uma albumina de soro 10 humano.LX) Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 1 conforme algum dos XLIX) a LII), que são cada um ligados (opcionalmente 15 ligado via um linker) a um Nanocorpo dirigido contra umaalbumina de soro humano.- Uma proteína ou polipeptídio conforme algum dos LIII) a LX) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um Nanocorpo humanizado.- Uma proteína ou polipeptídio conforme algum dos LIII) aLX) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63).- Uma proteína ou polipeptídio conforme algum dos LIII) a 25 LX) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um escolhido do grupo composto da ALB 3 (SEQ ID n. 87), ALB 4 (SEQ ID n. 88), ALB 5 (SEQ ID n. 89), ALB 6 (SEQ ID n. 100), ALB 7 (SEQ ID n. 101), ALB 8 (SEQ ID n. 102) ALB 9 (SEQ ID n. 103) e ALB 10 (SEQ ID n. 30 104) .- Uma proteína ou polipeptídio conforme algum dos LIII) a LX) , no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é a ALB 8.- Uma proteína ou polipeptídio conforme algum dos LIII) a 35 LX) , que compreende ou essencialmente se compõe do polipeptídio TNF24 (SEQ ID n. 90), no qual tanto o Nanocorpo TNF 1 como a ALB Nanocorpo TNF 1 foi humanizado.- Uma proteína ou polipeptídio conforme algum dos LIII) a LX) , que compreende ou essencialmente se compõe de dois 5 nanocorpos TNF 30 e uma ALB Nanocorpo 8.Segundo uma modalidade de execução preferencial, o Nanocorpo da invenção é uma variante humanizada do Nanocorpo TNF 3 (SEQ ID n. 60).Alguns aspectos preferenciais desta modalidade de execução 10 da invenção são:LXI) Uma variante humanizada do Nanocorpo TNF 3, que tem uma taxa Koff para TNF de melhor do que 2.10‘3 (1/s),preferivelmente melhor do que 1.10'3 (1/s).LXn)Uma variante humanizada do Nanocorpo TNF 3, que tem um 15 valor de EC50 no ensaio à base de células usando célulasKYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que o valor de EC50 do Nanocorpo VHH 3E (SEQ ID NO:4) de WO 04/041862 no mesmo ensaio.LXUI)Uma variante humanizada do Nanocorpo TNF 3, que tem um 20 valor de EC50 no ensaio à base de células usando célulasKYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 5nM.LXIV)Uma variante humanizada do Nanocorpo TNF 3, que tem um valor de EC50 no ensaio à base de células usando células 25 KYM descritas no Exemplo 1, conforme 3), de WO 04/041862que é melhor do que 3nM.LXV)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de pelo menos um nanocorpo que é uma variante humanizada do Nanocorpo TNF 3 conforme 30 algum dos LXI) a LXIV)LXVI)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 3 conforme algum dos LXI) a LXIV) (opcionalmente ligado via um linker). LXVH)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 3 conforme algum dos LXI) a LXIV) (opcionalmente ligado via um linker), e 5 que é tal que a referida proteína ou o polipeptídio,para ligar a um Trímero TNF, é capaz de inibir ou reduzir a ligação cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor..LXVinjUma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 3 conforme algum dos LXI) a LXIV) e que é capaz da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um 15 Trímero TNF.LXIX)Uma proteína ou polipeptídio que compreende ou essencialmente se compõe do polipeptídio TNF 6 (SEQ ID n. 72) ou TNF 9 (SEQ ID n. 75), no qual ambos nanocorpos TNF 3 foram humanizados.LXX)Uma proteína ou polipeptídio que compreende ou essencialmente se compõe do polipeptídio TNF 6 (SEQ ID n. 72) ou TNF 9 (SEQ ID n. 75), no qual tanto nanocorpos TNF 3 foram humanizados, e que é pegilado.LXXI)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que sãovariantes humanizadas do Nanocorpo TNF 3 conforme algum dos LXI) a LXIV) , e que, além disso, compreende pelo menos um nanocorpo dirigido contra uma albumina de soro humano.LXXII)Uma proteína ou polipeptídio, que compreende ou essencialmente se compõe de dois nanocorpos que são variantes humanizadas do Nanocorpo TNF 3 conforme algum dos LXI) a LXIV), que são cada um ligados (opcionalmente ligado via um linker) a um Nanocorpo dirigido contra uma 35 albumina de soro humano. - Uma proteína ou polipeptídio conforme algum dos LXV) a LXXII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é um Nanocorpo humanizado.
Uma proteína ou polipeptídio conforme algum dos LXV) a 5 LXXII), no qual pelo menos um nanocorpo dirigido contrauma albumina de soro humano é uma variante humanizada da ALB Nanocorpo 1 (SEQ ID n. 63).- Uma proteína ou polipeptídio conforme algum dos LXV) a LXXII), no qual pelo menos um nanocorpo dirigido contra uma 10 albumina de soro humano é um escolhido do grupo composto da ALB 3 (SEQ ID n. 87), ALB 4 (SEQ ID n. 88), ALB 5 (SEQ ID n. 89), ALB 6 (SEQ ID n. 100), ALB 7 (SEQ ID n. 101), ALB 8 (SEQ ID n. 102) ALB 9 (SEQ ID n. 103) e ALB 10 (SEQ ID n. 104) .- Uma proteína ou polipeptídio conforme algum dos LXV) aLXXII), no qual pelo menos um nanocorpo dirigido contra uma albumina de soro humano é a ALB 8.- Uma proteína ou polipeptídio conforme algum dos LXV) a LXXII), que compreende ou essencialmente se compõe do 20 polipeptídio TNF26 (SEQ ID n. 92), no qual tanto os nanocorpos TNF 3 como a ALB Nanocorpo 1 foi humanizado.
Em outro aspecto, a invenção refere-se a um polipeptídio que compreende ou essencialmente se compõe de pelo menos um nanocorpo contra o TNF-alfa conforme definido 25 na presente. Tais polipeptídios também são mencionados na presente como "os polipeptídios da invenção" e podem ser conforme mais adiante descritos na presente e/ou como geralmente descrito em WO 04/041862 para os nanocorpos revelados na presente, e, por exemplo, podem ser polipeptídios multivalentes ou polipeptídio multiespecíficos, novamente como mais adiante descrito na presente.
Preferivelmente, um polipeptídio da invenção é bivalente ou trivalente (isto é, compreensão de dois ou três 35 nanocorpos da invenção, respectivamente, opcionalmente ligado via um ou dois linkers conforme definido mais adiante, respectivamente) ou um polipeptídio multiespecífico, compreendendo um ou dois, e preferivelmente dois, nanocorpos da invenção e pelo menos um nanocorpo dirigido contra uma proteína de soro, e especialmente contra 5 uma proteína de soro humana, como contra uma albumina de soro humano.
Em modalidades de execução preferenciais, mas não- restritivas, os nanocorpos da invenção presentes nos polipeptídios da invenção são escolhidos do grupo composto 10 de SEQ ID NO's: 52 a 60 e SEQ ID NO's 105-129 ou de variantes humanizadas disso, e especialmente dos nanocorpos "humanizados" de SEQ ID NO's 76 para 86 e SEQ ID NO's: 95 para 99. Os nanocorpos contra a albumina de soro humano presente nos polipeptídios da invenção são preferivelmente 15 como definidos mais adiante, e mais preferivelmente escolhidos do grupo composto de SEQ ID NO's: 61 para 67, SEQ ID NO's: 87 para 89 e SEQ ID NO's: 100-104, e especialmente dos nanocorpos "humanizados" contra albumina de soro humana de SEQ ID NO's 76 para 86 e SEQ ID NO's 100-104.
Com respeito aos nanocorpos que estão presentes nos polipeptídios da invenção, estará claro para a pessoa experimentada que os nanocorpos que são mencionados na presente como "preferidos" (ou como "mais preferenciais", "até mais preferenciais", etc.) também são preferidos (ou 25 mais preferenciais, ou até mais preferencial, etc.) para usar nos polipeptídios descritos na presente. Portanto, os polipeptídios que compreendem ou essencialmente se compõem de um ou vários nanocorpos "preferidos" da invenção são geralmente preferidos, e os polipeptídios que compreendem ou 30 essencialmente se compõem de um ou vários nanocorpos "mais preferenciais" da invenção serão geralmente mais preferidos, etc.
Portanto, na invenção, polipeptídios que compreendem um ou vários nanocorpos que essencialmente se compõem de uma 35 das variantes preferenciais do clone PMP1C2 (TNF1; o SEQ ID n. 52), no qual as referidas variantes preferenciais são como definidas na presente, são em particular preferidas. Mesmo mais preferenciais são polipeptídios que compreendem um ou vários nanocorpos que essencialmente se compõem de uma das variantes humanizadas do clone PMP1C2 (TNF1; o SEQ ID n. 5 52) , no qual as referidas variantes humanizadas são como definidas na presente (exemplos ser, sem restrição, TNF13, TNF14, TNF2 9 e TNF30). O TNF3 0 é um "bloco de construção" humanizado em particular preferencial para uso nos polipeptídios da invenção.
Alguns exemplos preferidos, mas não-restritivos de tal proteína e polipeptídios são o próprio PMP1C2, as variantes humanizadas TNF13, TNF14, TNF29 e TNF30; construir de SEQ ID n. 70 (TNF4), SEQ ID n. 73 (TNF7), SEQ ID n. 90 (TNF24), SEQ ID n. 93 (TNF27); e construtos de SEQ ID n. 417 (TNF60), SEQ 15 ID n. 419 (TNF55) e SEQ ID n. 420 (TNF56) , no qual os últimos três construtos contêm a variante humanizada TNF 30 como um bloco de construção.
Como mencionado na presente, os nanocorpos e construtos descritos na presente podem ser pegilados, ou conter um ou 20 vários resíduos aminoácidos (adicionais) que levam em conta pegilação e/ou facilitam pegilação. Dois exemplos preferidos, mas não-restritivos de tais polipeptídios são TNF55 e TNF56, que ambos contêm um resíduo adicional de cisteina para fácil anexação de um grupo PEG.
Alguns exemplos preferidos, mas não-restritivos dos polipeptídios da invenção são os polipeptídios bivalentes da invenção de SEQ ID NO's: 70 para 75 e os polipeptídios multiespecíficos da invenção de SEQ ID NO's: 90 para 94 e SEQ ID NO's 417 para 420.
Como pode ser visto dos dados representados mais adiante, e especialmente dos dados no Exemplo Comparativo, os nanocorpos e/ou os polipeptídios da invenção melhoraram propriedades. Especialmente, a proteína e os polipeptídios da invenção podem ter melhorado a afinidade paro TNF-alfa 35 humana (expresso como o valor EC50 no ensaio KYM descrito na presente), em comparação com o anti-TNF comercialmente disponível biologicals Enbrel ™, Humira ™ e Remicade ™. Também, os nanocorpos descritos na presente podem ter uma afinidade melhorada paro TNF-alfa em comparação com o Nanocorpo de melhor execução descrito no pedido 5 Internacional WO 04/041862. Pode ser portanto esperado que os polipeptídios da invenção que compreendem pelo menos um dos nanocorpos da invenção também terão melhorado propriedades em comparação com polipeptídios que compreendem só os nanocorpos contra o TNF-alfa descrita em WO 04/041862. 10 Mais especialmente, um polipeptídio conforme descrito na presente que compreende dois ou mais (e preferivelmente dois) nanocorpos como na presente (e opcionalmente, por exemplo, um Nanocorpo contra uma albumina de soro humano), tem um valor de EC50 no ensaio à base de células usando 15 células KYM descritas no Exemplo 1, conforme 3) , de WO 04/041862 que é melhor do que o valor de EC50 de Humira® em Remicade®, e preferivelmente também melhor do que Enbrel® no mesmo ensaio.
Por exemplo, tal proteína ou o polipeptídio 20 preferivelmente têm um valor de EC50 no ensaio à base de células usando células KYM descritas no Exemplo 1, conforme 3), de WO 04/041862 que é melhor do que 0,2 nM, preferivelmente melhor do que 0,1 nM, como melhor do que 0,7 Nm e especialmente melhor do que 0,4 nM.
Também foi mostrado por solicitantes que nanocorpos contro TNF-alfa de rato e polipeptídios que compreendem nanocorpos contra o TNF-alfa de rato mostram uma atividade biológica benéfica nos modelos de doença seguintes (dados não mostrados):- Sulfato de sódio dextran ("DSS") modelo da colite, usando tanto ratos regulares como ratos neutralizados IL-10, como descrito por Okayasu et al. (Gastroenterol 1990, 98 (3) : 694)- Artrite induzida por colágeno ("CIA") o modelo da artrite 35 ("RA"), como descrito por Courtenay et al. (Nature 1980, 283 (5748): 666), usando tanto ratos regulares como Ratosneutralizados IL-10;- Modelo de ratos neutralizados IL-10 de IBD, quanto a exemplo descrito por Rennick et al. (Clin Immunol Immunopathol 1995, 76 (3 Pt 2): S174)- Modelo de Kollias de RA quanto a exemplo descrito por Keffer et al. (EMBO J 1991, 10 (13): 4025)- Ácido 2,4,6-trinitrobenzenosulfônico ("TNBS") modelo de IBD, como descrito por Elson et al. (J Immunol 1996, 157 10 (5) : 2174)Modelo de CIA de RA, descrita por Koppieters e al (manuscrito em preparação);Modelo fibroblasto sinovial-derivado (descrito mais adiante); e- Modelo de bolsa de ar de ratos.
Preferivelmente, os nanocorpos descritos na presente são melhores do que o Nanocorpo IA de WO 04/041862 em pelo menos um desses modelos, e preferivelmente em todos esses modelos; e mais preferivelmente melhores do que o Nanocorpo 3E de WO 04/041862 em pelo menos um desses modelos, e preferivelmente em todos esses modelos. Também, os polipeptídios descritos na presente são preferivelmente equivalentes a ou melhores do que Humira® ou Remicade® em pelo menos um desses modelos, e preferivelmente em todos esses modelos; e mais preferivelmente também equivalente a ou melhor do que Enbrel® em pelo menos um desses modelos, e preferivelmente em todos esses modelos.
Esses dados confirmam que nanocorpos contro TNF-alfa e polipeptídios que contendo o mesmo, como os nanocorpos e polipeptídios descritos em WO 04/041862 e especialmente os nanocorpos e polipeptídios descritos na presente, devem ter eficácia terapêutica contra doenças mediadas de TNF e desordens, como as doenças e desordens acima mencionadas.
Em outro aspecto, a invenção refere-se a um ácido nucléico que codifica um Nanocorpo da invenção e/ou um polipeptídio da invenção. Um ácido nucléico tal também será referido a seguir como um "ácido nucléico da invenção" e, por exemplo, pode ser na forma de um construto genético, conforme definido mais adiante.
Em outro aspecto, a invenção refere-se à célula 5 hospedeira ou hospedeira que expressa ou é capaz de expressar um Nanocorpo da invenção e/ou um polipeptídio da invenção; e/ou que contém um ácido nucléico que codifica um Nanocorpo da invenção e/ou um polipeptídio da invenção. Tal hospedeira ou uma célula hospedeira também podem ser análogos aos anfitriões e apresentar células descritas em WO 04/041862, mas expressando ou capazes de expressar um Nanocorpo da invenção e/ou um polipeptídio da invenção e/ou conter um ácido nucléico conforme descrito na presente.
A invenção além disso refere-se a um produto ou 15 composição conter ou compreender um Nanocorpo da invenção, um polipeptídio da invenção; e/ou um ácido nucléico da invenção. Tal produto ou a composição, por exemplo, podem ser uma composição farmacêutica (conforme descrito mais adiante) ou um produto ou a composição para uso diagnóstico (como também descrito mais adiante). Tal produto ou a composição também podem ser análogos aos produtos e composições descritas em WO 04/041862, mas conter ou compreender um Nanocorpo da invenção, um polipeptídio da invenção ou um ácido nucléico da invenção.
A invenção além disso refere-se a métodos para preparar ou gerar nanocorpos, polipeptídios, ácidos nucléicos, células hospedeiras, produtos e composições descritas na presente, quais métodos são, conforme mais adiante descritos mais adiante. Também, geralmente, o 30 nanocorpos, os polipeptídios, os ácidos nucléicos, as células hospedeiras, os produtos e as composições descritas na presente também podem estar preparados e usados em uma maneira análoga à maneira descrita em WO 04/041862.
A invenção além disso relaciona a aplicações e usos dos 35 acima mencionados nanocorpos, polipeptídios, ácidos nucléicos, células hospedeiras, produtos e composições descritas na presente, cujas aplicações e usos incluem, mas não são limitados a, as aplicações e os usos descritos a seguir e/ou os novos usos e aplicações para nanocorpos contra o TNF-alfa e/ou para polipeptídios que contêm o mesmo 5 em WO 04/041862.
Outros aspectos, modalidades de execução, vantagens e aplicações da invenção ficarão claros da nova descrição a seguir.
Os aspectos acima mencionados e outros e modalidades de execução da invenção ficarão claros da ulterior descrição a seguir, em que:a) A menos que não indicado ou definido de outra maneira, todos os termos usados têm a sua significação habitual na técnica, que será clara à pessoa experimentada. A referência, por exemplo, é feita aos manuais padrão, como Sambrook et al, "Molecular Cloning: A Laboratory Manual" ( 2nd.Ed.), Vols. 1-3, Cold Spring Harbor Laboratory Press (1989); F. Ausubel et al, eds., "Current protocols in molecular biology", Green Publishing and Wiley Interscience, New York (1987) ; Lewin, "Genes II", John Wiley & Sons, New York, N.Y. , (1985); Old et al., "Principles of GeneManipulation: An Introduction to Genetic Engineering", 2nd edition, University of California Press, Berkeley, CA (1981); Roitt et al., "Immunology" (6th. Ed.),Mosby/Elsevier, Edinburgh (2001); Roitt et al., Roitt's Essential Immunology, 10th Ed. Blackwell Publishing, UK (2001); and Janeway et al., "Immunobiology" (6th Ed.), Garland Science Publishing/Churchil1 Livingstone, New York (2005), , bem como aos fundamentos técnicos gerais citados na presente;b) A menos que indicado de outra maneira, o termo "seqüência de imunoglobulina" - seja usado na presente para referir-se 35 a um anticorpo de cadeia pesada ou a um anticorpo de 4 cadeias convencional - é usado como um termo geral para incluir tanto anticorpo de tamanho natural, as cadeias individuais dele, como todas as partes, domínios ou fragmentos disso (inclusive, mas não limitado a, domínios 5 obrigatórios de antígeno ou fragmentos como domínios VHH ou domínios VH/VL, respectivamente). Além do mais, o termo "seqüência" como usado na presente (por exemplo em termos como "seqüência de imunoglobulina", "a seqüência de anticorpo", "seqüência de domínio variável", "seqüência de 10 VHH" ou "seqüência de proteína"), deve ser geralmente entendido para incluir tanto seqüência aminoácida relevante como seqüências ácidas nucléicas ou seqüências de nucleotídeos que codificam o mesmo, a menos que o contexto requeira uma interpretação mais limitada;c) A menos que indicado de outra maneira, todos os métodos, os passos, as técnicas e as manipulações que não são especificamente descritas detalhadamente podem ser executados e foram executados em uma maneira conhecida por si, como estará claro para a pessoa experimentada. A 20 referência, por exemplo, é novamente feita aos manuais padrão, à fundamentos técnicos gerais mencionados anteriormente e às novas referências citadas na presente;d) Os resíduos de aminoácido serão indicados segundo o código padrão de três letras ou aminoácido de uma letra, 25 conforme mencionado na Tabela 1 ,-Tabela 1: Código de aminoácidos de uma letra e de três letras
e) Para os objetivos de comparar duas ou mais seqüências de nucleotídeos, a porcentagem da "identidade de seqüência" entre uma primeira seqüência de nucleotídeos e uma segunda seqüência de nucleotídeos podem ser calculados dividindo-se [o número de nucleotídeos na primeira seqüência de nucleotídeos que são idênticos aos nucleotídeos nas posições correspondentes na segunda seqüência de nucleotídeos] pelo {número total de resíduos de aminoácidos na primeira seqüência de nucleotídeos] e multiplicado por [100%], nos quais cada eliminação, inserção, substituição ou adição de um nucleotídeos na segunda seqüência de nucleotídeos - em comparação com a primeira seqüência de nucleotídeos - são consideradas como uma diferença em um nucleotídeo único (posição).
Alternativamente, o grau da identidade de seqüência entre duas ou mais seqüências de nucleotídeos pode ser calculado usando um algoritmo de computador conhecido para alinhamento de seqüência como NCBI Blast v2.0, usando configurações padrão.
Algumas outras técnicas, algoritmos de computador e configurações para determinar o grau da identidade de seqüência, por exemplo, são descritos em WO 04/037999, EP 0 967284, EP 1085089, WO 00/55318, WO 00/78972, WO 98/49185 e a GB 2357 768-A.
Normalmente, para o objetivo de determinar a porcentagem da "identidade de seqüência" entre duas seqüências de nucleotídeos conforme o método de cálculo delineado mais acima, a seqüência de nucleotídeos com o número maior de nucleotídeos será tomada como "a primeira" seqüência de nucleotídeos, e outra seqüência de nucleotídeos será tomada como "a segunda" seqüência de nucleotídeos;f) Para os objetivos de comparar duas ou mais seqüênciasaminoácidas, a porcentagem "da identidade de seqüência" entre uma primeira seqüência aminoácida e uma segunda seqüência aminoácida podem ser calculados dividindo-se [o número de resíduos aminoácidos na primeira seqüência aminoácida que são idênticos aos resíduos aminoácidos nas posições correspondentes na segunda seqüência aminoácida] [pelo número total de nucleotídeos na primeira seqüência 5 amínoácícia] e multiplicando por [100%] , nos quais cadaeliminação, inserção, substituição ou adição de um resíduo aminoácido na segunda seqüência aminoácida - em comparação com a primeira seqüência aminoácida - são consideradas como uma diferença em um resíduo aminoácido único (posição), isto 10 é, como uma "diferença aminoácida" conforme definido mais adiante.
Alternativamente, o grau da identidade de seqüência entre duas seqüências aminoácidas pode ser calculado usando um algoritmo de computador conhecido, como os acima mencionados para determinação do grau da identidade de seqüência para seqüências de nucleotídeos, novamente usando configurações padrão.
Normalmente, para o objetivo de determinar a porcentagem "da identidade de seqüência" entre duas 20 seqüências aminoácidas conforme o método de cálculo delineado mais acima, a seqüência aminoácida com o número maior de resíduos aminoácidos será tomada como "a primeira" seqüência aminoácida, e outra seqüência aminoácida será tomada como "a segunda" seqüência aminoácida.
Também, na determinação do grau da identidade de seqüência entre duas seqüências aminoácidas, a pessoa experimentada pode considerar as assim chamadas substituições aminoácidas "conservadoras", que podem ser geralmente descritas como substituições aminoácidas nas quais um resíduo aminoácido é substituído com outro resíduo aminoácido da estrutura química semelhante e que não tem pouco ou essencialmente nenhuma influência na função, atividade ou outras propriedades biológicas do polipeptídio. Tais substituições aminoácidas conservadoras são bem conhecidas na técnica, por exemplo, de WO 04/037999, a GB uns 2357768, WO 98/49185, WO 00/46383 e WO 01/09300; e os tipos (preferidos) e/ou as combinações de tais substituições podem ser selecionados com base nos ensinos pertinentes de WO 04/037999 bem como WO 98/49185 e das novas referências citadas na presente.
Tais substituições conservadoras preferivelmente são substituições nas quais um aminoácido dentro dos grupos seguintes (a) - (e) é substituído por outro resíduo aminoácido dentro do mesmo grupo: (a) pequeno alifático, resíduos não-polares ou ligeiramente polares: Ala, Ser, Thr, 10 Pro e Gly; (b) polar, resíduos negativamente carregados e His (não carregado) amidas: Asp, Asn, Glu e Gin; (c) polar, resíduos positivamente carregados: His, Arg e Lys; (d) grande alifático, resíduos não-polares: Met, Leu, Ile, Vai e Cys; e resíduos aromáticos (e): Phe, Tyr e Trp.
As substituições conservadoras em particular preferenciais são como se segue: Ala em Gly ou em Ser; Arg em Lys; Asn em Gin ou no Seu; Asp em Glu; Cys em Ser; Gin em Asn; Glu em Asp; Gly em Ala ou em Pro; His em Asn ou em Gin; Ile em Leu ou em Vai; Leu em Ile ou em Vai; Lys em Arg, em Gin ou em Glu; Met em Leu, em Tyr ou em Ile; Phe em Met, emLeu ou em Tyr; Ser em Thr; Thr em Ser; Trp em Tyr; Tyr emTrp; e/ou Phe em Vai, em Ile ou em Leu.
Qualquer substituição aminoácida aplicada aos polipeptídios descritos na presente também pode ser baseada 25 na análise das freqüências de variações aminoácidas entre a proteína homóloga da espécie diferente desenvolvida por Schulz et al. , Principles of Protein Structure, Springer- Verlag, 1978, nas análises de estrutura que forma potenciais desenvolvidos por Chou e Fasman, Bioquímica 13: 211, 1974 e Adv. Enzymol., 47: 45-149, 1978, e na análise de modelos de hidrofobicidade em proteína desenvolvida por Eisenberg et al., Proc. Nad. Acad Sei. USA 81: 140-144, 1984; Kyte e Doolittle; J Molec. Biol. 157: 105-132, 198 1, e Goldman et al., Ann. Ver. Biophys. Chem. 15: 321-353, 1986, todos incorporado na presente no seu conjunto por referência. Informação na estrutura primária, secundária e terciária de nanocorpos dado na descrição na presente e na técnica de fundo geral citada anteriormente. Também, com esta finalidade, a estrutura cristalina de um domínio VHH de uma lhama, por exemplo, é dada por Desmyter et al. , Natureza 5 Biologia Estrutural, volume 3, 9, 803 (1996); Spinelli et al., Nature Structural Biology, (1996); 3, 752-757; eDecanniere et al. , Structure, volume 7, 4, 361 (1999) . A nova informação de alguns resíduos aminoácidos que em domínios VH convencionais formam a interface VH/VL e o 10 substituições de camelização potencial dessas posições pode ser encontrada na técnica prévia em nanocorpos citado na presente;g) diz-se que seqüências de aminoácido e seqüências ácidas nucléicas sejam "exatamente o mesmo" se eles tiverem a 15 identidade de seqüência de 100% (conforme definido na presente) acima do seu comprimento inteiro;h) comparando duas seqüências aminoácidas, o termo "diferença aminoácida" refere-se a uma inserção, eliminação ou substituição de um resíduo aminoácido único em uma 20 posição da primeira seqüência, em comparação com a segunda seqüência; sendo entendido que duas seqüências aminoácidas pode conter uma, duas ou mais tais diferenças aminoácidas;i) considera-se que uma seqüência ácida nucléica ou a seqüência aminoácida é "em essencialmente isolada (forma)" - 25 por exemplo, em comparação com a sua fonte biológica nativa e/ou o meio de reação ou meio de cultivo do qual foi obtido - quando foi separada de pelo menos um outro componente com o qual ela se associa normalmente em fonte dita ou meio, como outro ácido nucléico, outra proteína/polipeptídio, 30 outro componente biológico ou macromolécula ou pelo menos um contaminante, impureza ou componente menor. Especialmente, uma seqüência ácida nucléica ou a seqüência aminoácida são consideradas "essencialmente isoladas" quando foi purificado pelo menos 2 vezes, especialmente pelo menos 10 vezes, mais 35 especialmente pelo menos 100 vezes, e até a 1000 vezes ou mais. Uma seqüência ácida nucléica ou a seqüência aminoácida que é "na forma essencialmente isolada" são preferivelmente essencialmente homogêneas, conforme determinado utilizando uma técnica conveniente, como uma técnica cromatográfica 5 conveniente, como poliacrilamida-geleletroforese ;j) 0 termo "domínio" como usado na presente geralmente refere-se a uma região globular de uma cadeia de anticorpos, e especialmente a uma região globular de um anticorpo de cadeia pesada, ou a um polipeptídio que essencialmente se 10 compõe de tal região globular. Normalmente, tal domínio compreenderá laços de peptídeos (por exemplo 3 ou 4 laços de peptídeos) estabilizado, por exemplo, como uma folha ou por ligações bissulfeto.k) O termo 'antigênico determinante' refere-se ao epitope no 15 antígeno reconhecido pela molécula de ligação de antigen (como um Nanocorpo ou um polipeptídio da invenção) e maisespecialmente pelo sítio de ligação de antígeno da referida molécula. Os termos "antigênico determinante" e "epitope' também podem ser usados de modo trocável na presente.1) Uma seqüência aminoácida (como um Nanocorpo, um anticorpo, um polipeptídio da invenção, ou geralmenteproteína de ligação de antígeno ou polipeptídio ou um fragmento disso) que pode ligar a, que tem a afinidade para e/ou que tem a especificidade para um determinante 25 antigênico específico, epitope, o antígeno ou a proteína (oupara pelo menos uma parte, fragmento ou epitope disso) esteja "contra" ou "dirigido contra" o referido determinante antigênico, epitope, antígeno ou proteína.m) O termo "especificidade" refere-se ao número de tipos 30 diferentes de antígenos ou determinantes antigênicos aos quais uma determinada molécula de ligação de antígeno ou proteína de ligação de antígeno (como um Nanocorpo ou um polipeptídio da invenção) a molécula pode ligar. Aespecificidade de uma proteína de ligação de antígeno pode ser determinada baseada na afinidade e/ou avidez. A afinidade, representada pelo equilíbrio constante para a dissociação de um antígeno com uma proteína de ligação de antígeno (KD), é uma medida para a força de ligação entre um determinante antigênico e um sítio de ligação de antígeno na 5 proteína de ligação de antígeno: o menor o valor do KD, quanto mais forte a força de ligação entre um determinante antigênico e a molécula de ligação de antigen (alternativamente, a afinidade também pode ser expressa como a afinidade constante (KA), que é 1/KD). Como estará claro 10 para a pessoa experimentada (por exemplo com base na nova revelação na presente) , a afinidade pode ser determinada em uma maneira conhecida por si, dependendo do antígeno específico de interesse. A avidez é a medida da força da ligação entre uma molécula de ligação de antígeno (como um 15 Nanocorpo ou o polipeptídio da invenção) e o antígeno pertinente. A avidez está relacionada tanto à afinidade entre um determinante antigênico e sítio de ligação de antígeno na molécula de ligação de antígeno como ao número de sítios de ligação presentes pertinente na molécula de 20 ligação de antígeno. Tipicamente, a proteína de ligação de antígeno (como os nanocorpos e/ou os polipeptídios da invenção) ligará com uma dissociação constante (KD) de 10'5 a 10’12 mol/litro (M) ou menos, e preferivelmente 10'7 a IO’12 mol/litro (M) ou menos e mais preferivelmente 10'8 a 10'12 25 mol/litro, e/ou com uma associação constante (KA) de pelo menos 107 m'1, preferivelmente pelo menos 108 m'1, mais preferivelmente pelo menos 109 m’1, como pelo menos 1012 m'1. Considera-se geralmente que qualquer valor de KD maior do que 10’4 M indica a ligação não-específica. Preferivelmente, 30 um Nanocorpo ou o polipeptídio da invenção ligarão ao antígeno desejado com um KD menos de 500 nM, preferivelmente menos de 200 nM, mais preferivelmente menos de 10 nM, como menos de 500 pM. A ligação específica de uma proteína de ligação de antígeno a um antígeno ou determinante antigênico 35 pode ser determinada em qualquer maneira conveniente conhecida por si, inclusive, por exemplo, análise de Scatchard e/ou ensaios de ligação competitivos, como rádio- inumoensaios (RIA), imunoensaios de enzima (EIA) e ensaios de competição de sandwitch, e as variantes diferentes deles conhecidas per se na técnica.n) conforme adicionalmente descrito a seguir, a seqüência aminoácida e a estrutura de um Nanocorpo podem ser considerados - sem ser limitados contudo a isso - para ser compreendidos de quatro regiões de armação ou "FR'S", que são referidos na técnica e a seguir como "região de Armação1" ou "FR1"; como "região de Armação 2" ou "FR2"; como"região de Armação 3" ou "FR3"; e como "região de Armação 4" ou "FR4", respectivamente; cujas regiões de armação são interrompidas por três regiões de determinação complementares ou "CDR's", que são referidos na técnica como 15 "Região que Determina Complementaridade 1" ou "CDR1"; como"Região que Determina Complementaridade 2" ou "CDR2"; e como "Região que Determina Complementaridade 3" ou "CDR3", respectivamente;o) como também adicionalmente descrito a seguir, o número 20 total de resíduos aminoácidos em um Nanocorpo pode estar naregião de 110-120, é preferivelmente 112-115, e é mais preferivelmente 113 . Deve contudo ser observado que as partes, os fragmentos ou os análogos (conforme adicionalmente descrito a seguir) de um Nanocorpo não são em 25 particular limitados quanto ao seu comprimento e/ou tamanho,enquanto tais partes, os fragmentos ou os análogos satisfazem condições delineadas a seguir e são também preferivelmente convenientes para os objetivos descritos na presente ;p) os resíduos aminoácidos de um Nanocorpo são numeradossegundo a numeração geral para domínios de VH dados porKabat et al. ("Sequence of proteins of immunologicalinterest", US Public Health Services, NIH Bethesda, MD,Publicação n. 91) , aplicado a domínios VHH de Camelídeos no artigo de Riechmann e Muyldermans, mencionado anteriormente (ver, por exemplo, a Figura 2 da referência dita). Segundo esta numeração, FR1 de um Nanocorpo compreende os resíduosaminoácidos nas posições 1-30, CDR1 de um Nanocorpocompreende os resíduos aminoácidos nas posições 31-36, FR2 5 de um Nanocorpo compreende os aminoácidos nas posições 36-, CDR2 de um Nanocorpo compreende os resíduos aminoácidosnas posições 50-65, FR3 de um Nanocorpo compreende osresíduos aminoácidos nas posições 66-94, CDR3 de um Nanocorpo compreende os resíduos aminoácidos nas posições 95-102, e FR4 de um Nanocorpo compreende os resíduos aminoácidos nas posições 103-113. [Neste aspecto, deve ser observado que - como é bem conhecido na técnica para domínios de VH e para domínios de VHH - o número total de resíduos aminoácidos em cada um do CDR'S pode variar e corresponder não ao número total de resíduos aminoácidos indicados pela numeração de Kabat (isto é, uma ou várias posições segundo a numeração de Kabat não podem ser ocupadas na seqüência real, ou a seqüência real pode conter maisresíduos aminoácidos do que o número levado em conta pela numeração de Kabat). Isto significa que, geralmente, a numeração segundo Kabat pode ou não corresponder à numeração real dos resíduos aminoácidos na seqüência real. Geralmente, contudo, se pode dizer que, segundo a numeração de Kabat e independente do número de resíduos aminoácidos no CDR'S, a posição 1 segundo a numeração de Kabat corresponde ao início de FR1 e vice-versa, a posição 36 segundo a numeração de Kabat corresponde ao início de FR2 e vice-versa, a posição 66 segundo a numeração de Kabat corresponde ao início de FR3 e vice-versa, e a posição 103 segundo a numeração de Kabat corresponde ao início de FR4 e vice-versa.].Métodos alternativos para numeração dos resíduos aminoácidos de domínios VH, cujos métodos também podem ser aplicados em uma maneira análoga a domínios VHH de Camelídeos e a nanocorpos, são o método descrito por Chothia et al. (Nature 342, 877-883 (1989)), a assim chamada"definição de AbM" e a assim chamada "definição de contato". Contudo, na descrição presente, as reivindicações e as figuras, a numeração segundo Kabat aplicada a domínios VHH por Riechmann e Muyldermans serão seguidas, a menos que indicado de outra maneira; eq) as Figuras, a Listagem de Seqüência e a Parte/Exemplos Experimentais só são dados para ilustrar além disso a invenção e não devem ser interpretadas ou entendidas como limitação do alcance da invenção e/ou das reivindicações anexas de qualquer modo, a menos que explicitamente indicado 10 de outra maneira na presente.
Para uma descrição geral de anticorpos de cadeias pesadas e domínios variáveis dos mesmos, a referência é entre outras coisas feita às referências seguintes, que são mencionadas como fundamentos técnicos gerais: WO 94/04678, 15 WO 95/04079 e WO 96/34103 de Vrije Universiteit Brussel; WO 94/25591, WO 99/37681, WO 00/40968, WO 00/43507, WO 00/65057, WO 01/40310, WO 01/44301, EP 1134231 e WO 02/48193 de Unilever; WO 97/49805, WO 01/21817, WO 03/035694, WO 03/054016 e WO 03/055527 do Vlaams Instituut voor 20 Biotechnologie (VIB); WO 03/050531 de Algonomics N.V. e solicitante; WO 01/90190 pelo Conselho de Pesquisa Nacional do Canadá; WO 03/025020 (= EP 1433793) pelo Instituto de Anticorpos; bem como WO 04/041867, WO 04/041862, WO 04/041865, WO 04/041863, WO 04/062551 por solicitante e as 25 novas solicitações de patente publicadas por solicitante;Hamers-Casterman et al. , Nature 1993 June 3; 363 (6428): 446-8; Davies and Riechmann, FEBS Lett. 1994 Feb 21; 339(3):285-90; Muyldermans et al., Protein Eng. 1994 Sep; 7(9):1129-3; Davies and Riechmann, Biotechnology (NY) 1995 May;13(5) : 475-9; Gharoudi et al. , 9th Forum of Applied Biotechnology, Med. Fac. Landbouw Univ. Gent. 1995; 60/4apart I : 2097-2100; Davies and Riechmann, Protein Eng. 1996Jun; 9 1 16) : 531-7; Desmyter et al. , Nat Struct Biol . 1996Sep ; 3 (9) : 803-11; Sheriff et al. , Nat Struct Biol. 1996Sep ; 3 ( !9) : 733-6; Spinelli et al. , Nat Struct Biol. 1996 Sep; 3 ( 9) : 752-7; Arbabi Ghahroudi et al . , FEBS Lett. 1997Sep 15; 414(3) : 521-6; Vu et al., Mol Immunol. 1997 Nov-Dec; 34(16-17) : 1121-31; Atarhouch et al., Journal of Camel Practice and Research 1997; 4: 177-182; Nguyen et al., J. Mol. Biol. 1998 Jan 23; 275(3) : 413-8; Lauwereys et al., 5 EMBO J. 1998 Jul 1; 17(13) : 3512-20; Frenken et al.. ResImmunol. 1998 Jul-Aug;149(6):589-99 ; Transue et al., Proteins 1998 Sep 1; 32(4) : 515-22; Muyldermans andLauwereys, J. Mol. Recognit. 1999 Mar-Apr; 12 (2): 131-40; van der Linden et al., Biochim. Biophys. Acta 1999 Apr 12; 10 1431(1): 37-46.; Decanniere et al., Structure Fold. Des.1999 Apr 15; 7(4): 361-70; Ngyuen et al., Mol. Immunol. 1999Jun; 36(8): 515-24; Woolven et al., Immunogenetics 1999 Oct;50 (1-2): 98-101; Riechmann and Muyldermans, J. Immunol.Methods 1999 Dec 10; 231 (1-2): 25-38; Spinelli et al.,15 Biochemistry 2000 Feb 15; 39(6): 1217-22; Frenken et al., J.Biotechnol. 2000 Feb 28; 78(1): 11-21; Nguyen et al., EMBO J. 2000 Mar 1; 19(5) : 921-30; van der Linden et al., J. Immunol. Methods 2000 Jun 23; 240 (1-2): 185-95; Decanniere et al., J. Mol. Biol. 2000 Jun 30; 300 (1): 83-91; van der 20 Linden et al., J. Biotechnol. 2000 Jul 14; 80(3): 261-70;Harmsen et al., Mol. Immunol. 2000 Aug; 37(10) : 579-90;Perez et al., Biochemistry 2001 Jan 9; 40(1): 74-83; Conrath et al., J. Biol. Chem. 2001 Mar 9; 276 (10): 7346-50; Muyldermans et al., Trends Biochem Sci. 2001 Apr; 26(4) ^SOIS 5; Muyldermans S., J. Biotechnol. 2001 Jun; 74 (4): 277-302;Desmyter et al., J. Biol. Chem. 2001 Jul 13; 276 (28):26285-90; Spinelli et al., J. Mol. Biol. 2001 Aug 3; 311 (1) : 123-9; Conrath et al., Antimicrob Agents Chemother.2001 Oct; 45 (10): 2807-12; Decanniere et al., J. Mol. Biol. 30 2001 Oct 26; 313(3): 473-8; Nguyen et al., Adv Immunol.2001; 79: 261-96; Muruganandam et al., FASEB J. 2002 Feb; 16(2): 240-2; Ewert et al., Biochemistry 2002 Mar 19; 41 (11): 3628-36; Dumoulin et al., Protein Sci. 2002 Mar; 11 (3): 500-15; Cortez-Retamozo et al., Int. J. Cancer. 2002 Mar 20;35 9 8 ( 3): 4 5 6 - 62; Su et al., Mol. Biol. Evol . 2002 Mar; 19(3) : 205-15; van der Vaart JM., Methods Mol Biol. 2002; 178: 359-66; Vranken et al., Biochemistry 2002 Jul 9; 41 (27): 8570-9; Nguyen et al., Immunogenetics 2002 Apr; 54 (1) : 39-47; Renisio et al., Proteins 2002 Jun 1; 47 (4): 546-55; Desmyter et al., J. Biol. Chem. 2002 Jun 28; 277 (26):5 23645-50; Ledeboer et al., J. Dairy Sci. 2002 Jun; 85 (6):1376-82; De Genst et al., J. Biol. Chem. 2002 Aug 16; 277 (33): 29897-907; Ferrat et al., Biochem. J. 2002 Sep 1; 366 (Pt 2) : 415-22; Thomassen et al., Enzyme and MicrobialTechnol. 2002; 30: 273-8; Harmsen et al., Appl. Microbiol. Biotechnol. 2002 Dec; 60 (4) : 449-54; Jobling et al., Nat Biotechnol . 2003 Jan; 21 (1) : 77-80; Conrath et al., Dev. Comp. Immunol. 2003 Feb; 27 (2) : 87-103; Pleschberger etal., Bioconjug. Chem. 2003 Mar-Apr; 14 (2): 440-8; Lah et al., J. Biol. Chem. 2003 Apr 18; 278 (16): 14101-11; Nguyen15 et al., Immunology. 2003 May; 109 (1) : 93-101; Joosten et al., Microb. Cell Fact. 2003 Jan 30; 2 (1) : 1; Li et al., Proteins 2003 Jul 1; 52 (1): 47-50; Loris et al., Biol Chem. 2003 Jul 25; 278 (30) : 28252-7; van Koningsbruggen et al., J. Immunol. Methods. 2003 Aug; 279 (1-2): 149-61; Dumoulin20 et al., Nature. 2003 Aug 14; 424 (6950): 783-8; Bond et al., J. Mol. Biol. 2003 Sep 19; 332 (3): 643-55; Yau et al., J. Immunol. Methods. 2003 Oct 1; 281 (1-2): 161-75; Dekker et al., J. Virol. 2003 Nov; 77 (22): 12132-9; Meddeb-Mouelhi et al., Toxicon. 2003 Dec; 42 (7): 785-91; Verheesen et25 al., Biochim. Biophys. Acta 2003 Dec 5; 1624 (1-3): 21-8; Zhang et al., J Mol Biol. 2004 Jan 2; 335 (1): 49-56 ; Stijlemans et al., J Biol Chem. 2004 Jan 9; 279 (2): 125661; Cortez-Retamozo et al., Cancer Res. 2004 Apr 15; 64 (8): 2853-7; Spinelli et al., FEBS Lett. 2004 Apr 23; 564 (1-2):30 35-40; Pleschberger et al., Bioconjug. Chem. 2004 May-Jun;15 (3): 664-71; Nicaise et al., Protein Sci. 2004 Jul; 13 (7): 1882-91; Omidfar et al., Tumour Biol. 2004 Jul-Aug; 25 (4): 179-87; Omidfar et al., Tumour Biol. 2004 Sep-Dec; 25(5-6): 296-305; Szynol et al., Antimicrob Agents35 Chemother. 2004 Sep;48(9) :3390-5; Saerens et al., J. Biol. Chem. 2004 Dec 10; 279 (50): 51965-72 ; De Genst et al., J. Biol. Chem. 2004 Dec 17; 279 (51): 53593-601; Dolk et al.,Appl. Environ. Microbiol. 2005 Jan; 71(1): 442-50; Joostenet al., Appl Microbiol Biotechnol. 2005 Jan; 66(4): 384-92;Dumoulin et al., J. Mol. Biol. 2005 Feb 25; 346 (3): 773-88;Yau et al., J Immunol Methods. 2005 Feb; 297 (1-2): 213-24; De Genst et al., J. Biol. Chem. 2005 Apr 8; 280 (14): 1411421; Huang et al., Eur. J. Hum. Genet. 2005 Apr 13; Dolk et al., Proteins. 2005 May 15; 59 (3): 555-64; Bond et al., J. Mol. Biol. 2005 May 6; 348 (3) : 699-709; Zarebski et al., J. Mol. Biol. 2005 Apr 21; [E-publicação antes da impressão].
Conforme a terminologia usada nas acima mencionadas referências, os domínios variáveis presentes em anticorpos de cadeias pesadas que ocorrem naturalmente também se mencionarão como "domínios de VHH" , para distingui-los dos domínios variáveis de cadeias pesadas que estão presentes em anticorpos de 4 cadeias convencionais (que serão referidos a seguir como "domínios de VH") e dos domínios variáveis decadeia leves que estão presentes em anticorpos de 4 cadeias convencionais (que serão referidos a seguir como "Domínios 20 VL") .Como mencionado na técnica prévia mencionada anteriormente, os domínios de VHH têm um número de características estruturais e propriedades funcionais únicas que fazem os domínios de VHH isolados (bem como nanocorpos 25 baseados nisso, que compartilham essas características estruturais e propriedades funcionais com domínios de VHH naturais) e proteínas que contêm o mesmo altamente vantajoso para uso como domínios obrigatórios de antígeno funcionais ou proteína. Especialmente, e sem ser limitados a isso, os 30 domínios de VHH (que foram "projetados" pela natureza para ligar funcionalmente a um antígeno sem a presença de, e sem qualquer interação com, um domínio variável de cadeia leve) e nanocorpos podem funcionar como uma unidade estrutural obrigatória de antígeno única, relativamente pequena, 35 funcional, domínio ou proteína. Isto distingue os domíniosVHH do VH e Domínios VL de anticorpos de 4 cadeias convencionais, que por eles não são geralmente apropriados para aplicação prática como proteína de ligação de antígeno única ou domínios, mas têm de ser combinados em alguma forma ou outra para fornecer uma unidade obrigatória de antígeno 5 funcional (como em, por exemplo, fragmentos de anticorpos convencionais como fragmentos Fab; em fragmentos de ScFv, que se compõem de um domínio VH covalentemente ligado a um domínio VL).
Por causa dessas propriedades únicas, o uso de domínios 10 VHH e nanocorpos como proteína de ligação de antígeno única ou como domínios obrigatórios de antígeno (isto é, como parte de uma maior proteína ou polipeptídio) oferece um número de vantagens significativas por cima do uso de VH convencional e Domínios VL, os scFv ou fragmentos de 15 anticorpo convencionais (como Fab-ou F (ab') 2 fragmentos):■ só um domínio único deve ligar um antígeno com alta afinidade e com alta seletividade, para que não haja nenhuma necessidade de ter dois domínios separados presentes, nem assegurar que esses dois 20 domínios estejam presentes na conformação especial direita e configuração (isto é, através do uso de linkers especialmente projetados, como com o scFv1s);Os domínios de VHH e nanocorpos podem ser expressos de um gene único e não requerer nenhumadobra pós-translação ou modificações ;B Os domínios de VHH e nanocorpos podem serfacilmente projetados em formatos multivalente e multiespecíficos (conforme adicionalmente 30 discutido na presente);
Os domínios de VHH e nanocorpos são altamente solúveis e não têm uma tendência de agregar-se (como com os domínios de ligação de antígeno derivados de rato descritos por Ward et al., 35 Nature, volume 341, 1989, p. 544);
Os domínios de VHH e nanocorpos são altamente estáveis ao calor, pH, proteases e outros agentes ou condições desnaturantes (ver, por exemplo, Ewert e al, supra);
Os domínios de VHH e nanocorpos são fáceis e relativamente baratos para preparar-se, até em uma escala requerida para produção. Por exemplo, os domínios de VHH, nanocorpos e a proteína/polipeptídios que contém o mesmo podem ser produzidos usando fermentação microbial (p. ex. conforme adicionalmente descrito mais adiante) e não requerem o uso de sistemas de expressão mamíferos, como com fragmentos de anticorpo convencionais por exemplo;
Os domínios de VHH e nanocorpos são relativamente pequenos (aproximadamente 15 kDa, ou 10 vezes menores do que um IgG convencional) em comparação com anticorpos de 4 cadeias convencionais e fragmentos de ligação de antígeno dos mesmos, por isso mostram (mais) alta penetração em tecidos (inclusive mas não limitados a tumores sólidos e outros tecidos densos) do que tais anticorpos de 4 cadeias convencionais e fragmentos de ligação de antígeno dos mesmos;
Os domínios de VHH e nanocorpos podem mostrar assim chamadas propriedades de ligação de cavidade (entre outras coisas devido ao seu laço CDR3 extenso, em comparação com domínios VH convencionais) e por isso também acessar objetivos e epitopes não acessíveis a anticorpos de 4 cadeias convencionais e fragmentos de ligação de antígeno dos mesmos. Por exemplo, foi mostrado que os domínios VHH e nanocorpos podem inibir enzimas (ver, por exemplo, WO 97/49805; Transue et al. ,(1998), supra; Lauwereys et al., (1998), supra.
Conforme acima mencionado, a invenção geralmente refere-se a nanocorpos dirigidos contra o TNF-alfa, bem como â polipeptídios compreendendo ou essencialmente compostos de um ou vários de tais nanocorpos, que podem ser usados para 5 fins profiláticos, terapêuticos e/ou diagnósticos descritos mais adiante e em WO 04/041862.
Conforme também acima mencionado e além disso descrito mais adiante, a invenção além disso se refere aos ácidos nucléicos que codificam tais nanocorpos e polipeptídios, a 10 métodos para preparar tais nanocorpos e polipeptídios, apresentar células que expressam ou são capazes de expressar tais nanocorpos ou polipeptídios, a usos de tais nanocorpos, polipeptídios, ácidos nucléicos ou células hospedeiras, e a composições que compreendem tais nanocorpos, polipeptídios, 15 ácidos nucléicos ou células hospedeiras.
Geralmente, deve ser observado que o termo Nanocorpo como usado na presente no seu sentido mais amplo não é limitado a uma fonte biológica específica ou a um método específico da preparação. Por exemplo, como será discutido 20 mais detalhadamente adiante, os nanocorpos da invenção podem ser obtidos (1) isolando o domínio VHH de um anticorpo de cadeia pesada que ocorre naturalmente; (2) por expressão de uma seqüência de nucleotídeos que codifica um domínio de VHH que ocorre naturalmente; (3) "por humanização" (conforme 25 descrito mais adiante) de um domínio de VHH de ocorrência natural ou por expressão de um ácido nucléico que codifica tal domínio VHH humanizado; (4) por "camelização" (conforme descrito mais adiante) de um domínio de ocorrência natural de ™ de qualquer espécie dos animais, especialmente uma 30 espécie de mamífero, como de um ser humano, ou por expressão de um ácido nucléico que codifica tal domínio VH camelizado; (5) por "camelização" "de um anticorpo de domínio" ou "Dab" como descrito por Ward e al (supra) , ou pela expressão de um ácido nucléico que codifica tal domínio 35 VH camelizado; (6) usando técnicas sintéticas ou semi- sintéticas para preparar proteína, polipeptídios ou outras seqüências aminoácidas; (7) preparando um ácido nucléico que codifica um Nanocorpo utilizando técnicas de síntese ácida nucléica, seguida por expressão do ácido nucléico consequentemente obtido; e/ou (8) por qualquer combinação do precedente. Métodos convenientes e técnicas para executar o precedente serão claros para a pessoa experimentada baseado na revelação na presente e, por exemplo, incluirão os métodos e técnicas descritas mais detalhadamente a seguir.
Contudo, segundo uma modalidade de execução específica, 10 os nanocorpos da invenção não têm uma seqüência aminoácida que é exatamente a mesmo como (isto é, como um grau de identidade de seqüência de 100%) a seqüência aminoácida de um domínio VH de ocorrência natural, como a seqüência aminoácida de um domínio VH de ocorrência natural de um 15 mamífero, e especialmente de um ser humano.
Uma classe em particular preferencial de nanocorpos da invenção compreende nanocorpos com uma seqüência aminoácida que corresponde à seqüência aminoácida de um domínio VHH de ocorrência natural, mas que foi "humanizado", isto é, 20 substituindo um ou vários resíduos aminoácidos na seqüência aminoácida da referida seqüência VHH de ocorrência natural por um ou vários dos resíduos aminoácidos que ocorrem na posição(ões) correspondente em um domínio VH de um anticorpo de 4 cadeias convencional de um ser humano (p. ex. indicado anteriormente) . Isto pode ser executado em uma maneira conhecida por si, o que ficará claro para a pessoa experimentada, por exemplo, com base na nova descrição mais adiante e a arte prévia na humanização mencionada na presente. Novamente, deve ser observado que tais nanocorpos 30 humanizados da invenção podem ser obtidos em qualquer maneira conveniente conhecida por si (isto é, como indicado sob os pontos (1) - (8) acima) e portanto não são estritamente limitados a polipeptídios que foram obtidos usando um polipeptídio que compreende um domínio VHH de 35 ocorrência natural como um material inicial.
Uma substituição preferencial, mas não-limitadora, humanizante para nanocorpos que pertencem ao 103 P, R, S- grupo e/ou o GLEW-grupo (conforme definido na presente) é 108Q a 108L.
Outra classe em particular preferencial de nanocorpos 5 da invenção compreende nanocorpos com uma seqüência aminoácida que corresponde à seqüência aminoácida de um domínio VH de ocorrência natural que foi "camelizado", isto é, substituindo um ou vários resíduos aminoácidos na seqüência aminoácida de um domínio VH de ocorrência natural 10 de um anticorpo de 4 cadeias convencional por um ou vários dos resíduos aminoácidos que ocorrem na posição(ões) correspondente em um domínio VHH de um anticorpo de cadeia pesada. Isto pode ser executado em uma maneira conhecida por si, o que ficará claro para a pessoa experimentada, por 15 exemplo, com base na nova descrição mais adiante. A referência também é feita a WO 94/04678. Tal camelização pode ocorrer preferencialmente nas posições aminoácidas que estão presentes na interface VH-VL e nos assim chamados resíduos de Hallmark Camelidae (ver, por exemplo, também WO 20 94/04678), como também mencionado mais adiante.
Preferivelmente, o domínio VH ou a seqüência que é usada como um material inicial ou ponto de partida que gera ou projeta o Nanocorpo camelizado é preferivelmente uma seqüência VH de um mamífero, mais preferivelmente a 25 seqüência VH de um ser humano. Contudo, deve ser observado que tais nanocorpos camelizados da invenção podem ser obtidos em qualquer maneira conveniente conhecida por si (isto é, como indicado conforme os pontos (1) - (8) acima) e portanto não são estritamente limitados a polipeptídios que 30 foram obtidos usando um polipeptídio que compreende um domínio VH de ocorrência natural como um material inicial.
Por exemplo, novamente conforme adicionalmente descrito mais adiante, tanto a "humanização" como a "camelização" pode ser executada fornecendo uma seqüência de nucleotídeos 35 que codifica tal domínio VHH ou domínio VH que ocorrem naturalmente, respectivamente, e logo modificando, em uma maneira conhecida por si, um ou vários codons na seqüência de nucleotídeos tal que a nova seqüência de nucleotídeos codifica um Nanocorpo humanizado ou camelizado da invenção, respectivamente, e logo expressando a seqüência de nucleotídeos portanto obtida em uma maneira conhecida por si para fornecer o Nanocorpo desejado da invenção.
Alternativamente, baseado na seqüência aminoácida de um domínio VHH de ocorrência natural ou o domínio VH, respectivamente, a seqüência aminoácida do desejado 10 Nanocorpo humanizado ou camelizado da invenção, respectivamente, podem ser projetados e logo sintetizados de novo utilizando técnicas para síntese de peptídeo conhecidas por si. Também, baseado na seqüência aminoácida ou a seqüência de nucleotídeos de um domínio VHH de ocorrência 15 natural ou o domínio VH, respectivamente, uma seqüência de nucleotídeos que codifica o desejado Nanocorpo humanizado ou camelizado da invenção, respectivamente, podem ser projetados e logo sintetizados de novo utilizando técnicas de síntese ácida nucléica conhecida por si, depois do qual a 20 seqüência de nucleotídeos portanto obtida pode ser expressa em uma maneira conhecida por si para fornecer o Nanocorpo desejado da invenção.
Outros caminhos convenientes e técnicas para obter nanocorpos da invenção e/ou seqüências de nucleotídeos e/ou 25 ácidos nucléicos que codificam o mesmo, que começa (da seqüência aminoácida de) domínios VH que ocorrem naturalmente ou preferivelmente os domínios de e/ou de seqüências de nucleotídeos e/ou seqüências ácidas nucléicas que codificam o mesmo serão claros para a pessoa 30 experimentada, e pode, por exemplo, compreendendo combinar uma ou várias seqüências aminoácidas e/ou seqüências de nucleotídeos de domínios VH que ocorrem naturalmente (como um ou vários FR'S e/ou CDR's) com uma ou várias seqüências aminoácidas e/ou seqüências de nucleotídeos de domínios VHH 35 que ocorrem naturalmente (tal um ou vários FR'S ou CDR's), em uma maneira conveniente para fornecer (uma seqüência de nucleotídeos ou codificação de ácido nucléico) um Nanocorpo da invenção.
Segundo um aspecto preferencial, mas não-restritivo do aspecto da invenção, um Nanocorpo no seu sentido mais amplo pode ser geralmente definido como um polipeptídio compreendendo:a) uma seqüência aminoácida que é compreendida de quatro regiões/seqüências de armação interrompidas por três regiões/seqüências que determinam complementaridade, nas quais o resíduo aminoácido na posição 108 segundo a numeração de Kabat é Q;e/ ou:b) uma seqüência aminoácida que é compreendida de quatro regiões/seqüências de armação interrompidas por três regiões/seqüências que determinam complementaridade, nas quais o resíduo aminoácido na posição 44 segundo a numeração de Kabat é E e no qual o resíduo aminoácido na posição 45 segundo a numeração de Kabat é um R;e/ou:c) uma seqüência aminoácida que é compreendida de quatro regiões/seqüências de armação interrompidas por três regiões/seqüências que determinam complementaridade, nas quais o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de P, R e S, e é especialmente escolhido do grupo composto de R e S.
Portanto, em um primeiro aspecto preferido, mas não- restritivo, um Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e em que1) o resíduo aminoácido na posição 108 segundo a numeração de Kabat é Q;e/ou em que:ii) o resíduo aminoácido na posição 44 segundo a numeração de Kabat é E e no qual o resíduo aminoácido na posição 45 segundo a numeração de Kabat ê um R;e/ou em que:iii) o resíduo aminoácido na posição 103 segundo a numeração 10 de Kabat é escolhido do grupo composto de P, R e S, eespecialmente escolhido do grupo composto de R e S;e em queiv) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das 15 definições preferenciais acima, e mais preferivelmenteconforme definidos segundo uma das definições mais preferenciais acima.Especialmente, um Nanocorpo contra o TNF-alfa segundo a invenção pode ter a estrutura:FR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões 25 que determinam complementaridade 1 a 3, respectivamente, e em quei) o resíduo aminoácido na posição 108 segundo a numeração de Kabat é Q;e/ou em que:ii) o resíduo aminoácido na posição 44 segundo a numeração de Kabat é E e no qual o resíduo aminoácido na posição 45 segundo a numeração de Kabat é um R;e/ou em que: iii) o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de P, R e S, e especialmente escolhido do grupo composto de R e S;e em queiv) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.Especialmente, segundo um aspecto preferencial, mas não-restritivo do aspecto da invenção, um Nanocorpo pode ser geralmente definido como um polipeptídio que compreende uma seqüência aminoácida que é compreendida de quatro regiões/seqüências de armação interrompidas por três regiões/seqüências que determinam complementaridade, em que;a-1) o resíduo aminoácido na posição 44 segundo a numeração de Kabat é escolhido do grupo composto de G, E, D, G, Q, R, S, L; e é preferivelmente escolhido do grupo composto de G, E ou Q; ea-2) o resíduo aminoácido na posição 45 segundo a numeração de Kabat é escolhido do grupo composto de L, R ou C; e é preferivelmente escolhido do grupo composto de L ou R; e a-3) o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de W, R ou S; e é preferivelmente W ou R, e é mais preferivelmente W;a-4) o resíduo aminoácido na posição 108 segundo a numeração de Kabat é Q;ou em que:b-1) o resíduo aminoácido na posição 44 segundo a numeração de Kabat é escolhido do grupo composto de E e Q; eb-2) o resíduo aminoácido na posição 45 segundo a numeração de Kabat é R; e b-3) o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de W, R e S; e é preferivelmente W;b-4) o resíduo aminoácido na posição 108 segundo a numeração 5 de Kabat é escolhido do grupo composto de Q e L; e é preferivelmente Q;ou em que:c-1) o resíduo aminoácido na posição 44 segundo a numeração de Kabat é escolhido do grupo composto de G, E, D, Q, R, S eL; e é preferivelmente escolhido do grupo composto de G, E e Q; ec-2) o resíduo aminoácido na posição 45 segundo a numeração de Kabat é escolhido do grupo composto de L, R e C; e é preferivelmente escolhido do grupo composto de L e R; ec-3) o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de P, R e S; e é especialmente escolhido do grupo composto de R e S; ec-4) o resíduo aminoácido na posição 108 segundo a numeração de Kabat é escolhido do grupo composto de Q e L; é preferivelmente Q.Portanto, num outro aspecto preferido, mas não- restritivo, um Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4 no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem ã regiões que determinam complementaridade 1 a 3, respectivamente, e em que:i) o resíduo aminoácido na posição 44 segundo a numeração de Kabat é escolhido do grupo composto de G, E, D, G, Q, R, S, L; e é preferivelmente escolhido do grupo composto de G, E ou Q;e em que: ii) o resíduo aminoácido na posição 45 segundo a numeração de Kabat é escolhido do grupo composto de L, R ou C; e é preferivelmente escolhido do grupo composto de L ou R; e em que:iii) o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de W, R ou S; e é preferivelmente W ou R, e é mais preferivelmente W;e em queiv) o resíduo aminoácido na posição 108 segundo a numeração de Kabat é Q;e em que:v) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmenteconforme definidos segundo uma das definições mais preferenciais acima.
No outro aspecto preferido, mas não-restritivo, um Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem ã regiões 25 que determinam complementaridade 1 a 3, respectivamente, e em que:o resíduo aminoácido na posição 44 segundo a numeração de Kabat é escolhido do grupo composto de E e Q;e em que:ii) o resíduo aminoácido na posição 4 5 segundo a numeraçãode Kabat é R;e em que: iii) o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de W, R e S; e é preferivelmente W;e em que:iv) o resíduo aminoácido na posição 108 segundo a numeração de Kabat é Q;e em que:vi) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das 10 definições preferenciais acima, e mais preferivelmenteconforme definidos segundo uma das definições mais preferenciais acima.No outro aspecto preferido, mas não-restritivo, um Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões 20 que determinam complementaridade 1 a 3, respectivamente, e em que:i) o resíduo aminoácido na posição 44 segundo a numeração de Kabat é escolhido do grupo composto de G, E, D, Q, R, S e L; e é preferivelmente escolhido do grupo 25 composto de G, E e Q;e em que:ii) o resíduo aminoácido na posição 4 5 segundo a numeração de Kabat é escolhido do grupo composto de L, R e C; e é preferivelmente escolhido do grupo composto de L e R;e em que :iii) o resíduo aminoácido na posição 103 segundo a numeração de Kabat é escolhido do grupo composto de P, R e S; e é especialmente escolhido do grupo composto de R e S;e em que: iv) o resíduo aminoácido na posição 108 segundo a numeração de Kabat é escolhido do grupo composto de Q e L; é preferivelmente Q;e em que:v) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
Dois grupos em particular preferidos, mas não-restritivos dos nanocorpos da invenção são aqueles segundo o a) acima; segundo o I) a a-4) acima; segundo b) acima; segundo o b-1) a b-4) acima; segundo o c) acima; e/ou segundo o c-1) a c-4) acima, em que;a) os resíduos aminoácidos nas posições 44-47 segundo a numeração de Kabat formam a seqüência GLEW (ou uma seqüência semelhante a GLEW conforme definido mais adiante) e o resíduo aminoácido na posição 108 é Q;ou em que:b) os resíduos aminoácidos nas posições 43-46 segundo a numeração de Kabat formam a seqüência KERE ou KQRE (ou uma seqüência semelhante a KERE) e o resíduo aminoácido na posição 108 é Q ou L, e é preferivelmente Q.Portanto, num outro aspecto preferido, mas não- restritivo, um Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, 30 respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e em que:i) os resíduos aminoácidos nas posições 44-47 segundo a numeração de Kabat formam a seqüência GLEW (ou uma seqüência semelhante a GLEW conforme definido mais adiante) e o resíduo aminoácido na posição 108 ê Q;e em que:ü) O CDR1, CDR2 e CDR3 são conforme definidos acima, e 5 preferivelmente conforme definidos segundo uma dasdefinições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
No outro aspecto preferido, mas não-restritivo, um 10 Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, 15 respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e em que:i) os resíduos aminoácidos nas posições 43-46 segundo a numeração de Kabat formam a seqüência KERE ou KQRE (ou uma seqüência semelhante a KERE) e o resíduo aminoácidona posição 108 é Q ou L, e é preferivelmente Q;e em que:ii) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
Nos nanocorpos da invenção na qual os resíduos aminoácidos nas posições 43-46 segundo a numeração de Kabat formam a seqüência KERE ou KQRE, o resíduo aminoácido na posição 3 7 é o mais preferivelmente F. Nos nanocorpos da invenção na qual os resíduos aminoácidos nas posições 44-47 segundo a numeração de Kabat formam a seqüência GLEW, o resíduo aminoácido na posição 37 é escolhido do grupo composto de Y, H, I, V ou F, e é mais preferivelmente F.
Portanto, sem ser limitado a isto de qualquer modo, com base nos resíduos aminoácidos presentes nas posições acima mencionadas, os nanocorpos da invenção podem ser geralmente 5 classificados com base nos três grupos seguintes:a) O "GLEW-grupo": nanocorpos com a seqüência aminoácida GLEW nas posições 44-47 segundo a numeração de Kabat e Q na posição 108 segundo a numeração de Kabat. Conforme mais adiante descrito na presente, nanocorpos dentro 10 deste grupo normalmente têm um V na posição 37, e podem ter um W, P, R ou S na posição 103, e preferivelmente ter um W na posição 103. O grupo GLEW também compreende algumas seqüências semelhantes a GLEW como as mencionadas na Tabela 2 mais adiante;b) O "Grupo KERE": nanocorpos com a seqüência aminoácida KERE ou KQRE ou nas posições 43-46 segundo a numeração de Kabat e Q ou L na posição 108 segundo a numeração de Kabat. Conforme mais adiante descrito na presente, nanocorpos dentro deste grupo normalmente têm um F na posição 37, um L ou F na posição 47; e podem ter um W,P, R ou S na posição 103, e preferivelmente ter um W na posição 103;c) Os "103 P, R, S-grupo": nanocorpos com um P R ou S na posição 103. Esses nanocorpos podem ter seqüência 25 aminoácida GLEW nas posições 44-47 da numeração deKabat ou a seqüência aminoácida KERE ou KQRE nas posições 43-46 segundo a numeração de Kabat, o último mais preferivelmente em combinação com um F na posição 37 e um L ou um F na posição 47 (conforme definido para 30 o Grupo KERE) ; e podem ter Q ou L na posição 108segundo a numeração de Kabat, e preferivelmente ter Q. Portanto, num outro aspecto preferido, mas não-restritivo, um Nanocorpo da invenção pode ser um Nanocorpo que pertence ao GLEW-grupo (conforme definido na presente), 35 e no qual CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
No outro aspecto preferido, mas não-restritivo, um Nanocorpo da invenção pode ser um Nanocorpo que pertence ao Grupo KERE (conforme definido na presente) , e no qual CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais 10 acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
Portanto, num outro aspecto preferido, mas não- restritivo, um Nanocorpo da invenção pode ser um Nanocorpo que pertence ao 103 P, R, S-grupo (conforme definido na 15 presente), e no qual CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
Também, mais geralmente e além dos resíduos 108Q, 43E/44R e 103P, R, S acima mencionados, os nanocorpos da invenção pode conter, em uma ou várias posições que, em um domínio VH convencional, formariam (parte de) a interface VH/VL, conteriam um ou vários resíduos aminoácidos que são 25 mais altamente carregados do que os resíduos aminoácidos que ocorrem naturalmente na mesma posição(ões) no domínio VH ou VHH que ocorre naturalmente, e especialmente um ou vários resíduos aminoácidos carregados (como mencionado na Tabela D -
Tais substituições incluem, mas não são limitadas às seqüências Semelhantes a GLEW mencionadas na Tabela 2 mais adiante; bem como as substituições que são descritas na Solicitação Internacional WO 00/29004 para assim chamados "microcorpos", p. ex. um Q na posição 108 e KLEW nas 35 posições 44-47.
Em algumas modalidades de execução dos nanocorpos da invenção, o resíduo aminoácido na posição 83 é escolhido do grupo composto de L, NI, S, V e W; e é preferivelmente L.
Também, em algumas modalidades de execução dos nanocorpos da invenção, o resíduo aminoácido na posição 83 é 5 escolhido do grupo composto de R, K, N, E, I e Q; e é mais preferivelmente K ou E (para nanocorpos correspondentes a domínios VHH que ocorrem naturalmente) ou R (para nanocorpos "humanizados", conforme descrito mais adiante). O resíduo aminoácido na posição 84 em algumas modalidades de execução 10 é escolhido do grupo composto de P, A, R, S, D e V, e é mais preferivelmente P (para nanocorpos correspondentes a domínios VHH que ocorrem naturalmente) ou R (para nanocorpos "humanizados", conforme descrito mais adiante).
Além disso, em algumas modalidades de execução dos 15 nanocorpos da invenção, o resíduo aminoácido na posição 104 é escolhido do grupo composto de G e D; e é mais preferivelmente G.
Coletivamente, os resíduos aminoácidos nas posições 11, 37, 44, 45, 47, 83, 84, 103, 104 e 108, cujos nanocorpos são 20 acima mencionados, também serão mencionados na presente como "Resíduos de Hallmark". Os Resíduos de Hallmark e os resíduos aminoácidos nas posições correspondentes do domínio VH humano mais estreitamente relacionado, VH3, são resumidos na Tabela 2.
Algumas combinações especialmente preferenciais desses Resíduos de Hallmark conforme ocorrem em domínios VHH que ocorrem naturalmente são mencionados na Tabela 3. Para comparação, os correspondentes resíduos aminoácidos do VH3 humano chamados DP-47 são indicados em itálico.Tabela 2: Resíduos de Hallmark em nanocorpos
Notas:(1) : Especialmente, mas não exclusivamente, em combinação com KERE (SEQ ID n. 43 7) ou KQRE (SEQ ID n. 43 8) nas 5 posições 43-46.(2) : Normalmente como GLEW (SEQ ID n. 439) nas posições 4447.(3): Normalmente como KERE ou KQRE nas posições 43-46, p. ex. como KEREL (SEQ ID n. 440), KEREF (SEQ ID n. 441), 10 KQREL (SEQ ID n. 442) , KQREF (SEQ ID n. 443) ou KEREG(SEQ ID n. 444) nas posições 43-47. Alternativamente, também as seqüências como TERE (SEQ ID n. 445) (por exemplo, TEREL (SEQ ID n. 446)), KECE (SEQ ID n. 447) (por exemplo KECEL (SEQ ID n. 448) ou KECER (SEQ ID n. 449)), RERE (SEQ ID n. 450) (por exemplo REREG (SEQ IDn. 451)), QERE (SEQ ID n. 452) (por exemplo QEREG (SEQ ID n. 453)), KGRE (SEQ ID n. 454) (por exemplo KGREG (SEQ ID n. 455)), KDRE (SEQ ID n. 456) (por exemplo KDREV (SEQ ID n. 457)) são possíveis. Algumas outras 20 seqüências possíveis, mas menos preferenciais incluempor exemplo DECKL (SEQ ID n. 458) e NVCEL (SEQ ID n. 459) .(4): Tanto com GLEW nas posições 44-47 como com KERE ou KQRE nas posições 43-46. (5) : Muitas vezes como KP ou EP nas posições 83-84 de domínios VHH que ocorrem naturalmente.(6): Especialmente, mas não exclusivamente, em combinação com GLEW nas posições 44-47.(7) : Com a condição de que quando as posições 44-47 são GLEW, a posição 108 seja sempre Q.(8) : O grupo GLEW também contém seqüências semelhantes a GLEW nas posições 44-47, como por exemplo GVEW (SEQ ID n. 460), EPEW (SEQ ID n. 461), GLER (SEQ ID n. 462),DQEW (SEQ ID n. 463), DLEW (SEQ ID n. 464), GIEW (SEQ ID n. 465), ELEW (SEQ ID n. 466), GPEW (SEQ ID n. 467),EWLP (SEQ ID n. 468), GPER (SEQ ID n. 469), GLER (SEQ ID n. 470) e ELEW.Tabela 3: Algumas combinações preferenciais de Resíduos de Hallmark em nanocorpos que ocorrem naturalmente.Para a humanização dessas combinações, é feita referência à especificação.
Nos nanocorpos, cada resíduo aminoácido em qualquer outra posição do que os Resíduos de Hallmark pode ser 25 qualquer resíduo aminoácido que naturalmente ocorre na posição correspondente (segundo numeração de Kabat) de um domínio VHH de ocorrência natural.
Tais resíduos aminoácidos serão claros para a pessoa experimentada. As tabelas 4-7 mencionam alguns resíduos 5 não-restritivos que podem estar presentes em cada posição (segundo numeração de Kabat) do FR1, FR2, FR3 e FR4 de domínios VHH que ocorrem naturalmente. Para cada posição, o resíduo aminoácido que mais frequentemente ocorre em cada posição de um domínio VHH de ocorrência natural (e que é o 10 resíduo aminoácido mais preferencial para a referida posição em um Nanocorpo) é indicada em negrito; e outros resíduos aminoácidos preferenciais para cada posição foram sublinhados (nota: o número de resíduos aminoácidos que são encontrados nas posições 26-30 de domínios VHH que ocorrem 15 naturalmente apoia a hipótese que é a base da numeração Chothia (supra) de que os resíduos nessas posições já fazem parte de CDR1.)
Nas Tabelas 4 - 7, alguns resíduos não-restritivos que podem estar presentes em cada posição de um domínio VH3 20 humano também foram mencionados. Novamente, para cada posição, o resíduo aminoácido que mais frequentemente ocorre em cada posição de um domínio VH3 humano que ocorre naturalmente é indicada em negrito; e outros resíduos aminoácidos preferenciais foram sublinhados.Tabela 4: Exemplos não-restritivos dos resíduos aminoácidos em FR1 (para as notas, ver as notas à Tabela 2)
Tabela 4: Exemplos não-restritivos de resíduos aminoácidos em FR1 (continua)
Tabela 5: os exemplos não-restritivos dos resíduos aminoácidos em FR2 (para as notas, ver as notas à Tabela 2)
Tabela 6: Exemplos não-restritivos dos resíduos aminoácidos em FR3 (para as notas, ver as notas ã Tabela 2)
Tabela 6: Exemplos não-restritivos de resíduos aminoácidos em FR3 (continua)
Tabela 7: Exemplos não-restritivos dos resíduos aminoácidos em FR4 (para as notas, ver as notas à Tabela 2)
Portanto, num outro aspecto preferido, mas não restritivo, um Nanocorpo da invenção pode ter a estrutura FR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões 5 que determinam complementaridade 1 a 3, respectivamente, e em que:i) os resíduos de Hallmark são conforme definidos acima; e em que:ii) 0 CDR1, CDR2 e CDR3 são conforme definidos acima, e 10 preferivelmente conforme definidos segundo uma dasdefinições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.Num outro aspecto preferido, mas não restritivo, um 15 Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, 20 respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e em que: e em quei) O FR1 é escolhido do grupo composto da seqüência 25 aminoácida:[1]QVQLQESGGGXVQAGGSLRLSCAASG [26] [SEQ ID n. 1]ou do grupo composto de seqüências aminoácidas que têm 30 pelo menos 80%, preferivelmente pelo menos 90%, maispreferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com a seqüência aminoácida acima; em que35 (1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 4; e/ou(2) a referida seqüência aminoácidapreferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 4; e/ou(2) a referida seqüência aminoácidapreferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e em que:ii) 0 FR2 é escolhido do grupo composto da seqüência aminoácida:[36] WXRQAPGKXXEXVA [49] [SEQ ID n. 2] ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com a seqüência aminoácida acima; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark 5 é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituiçõesaminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e/ou do grupo composto de seqüências aminoácidas que 15 têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conformedefinido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark 20 é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituiçõesaminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e em que:iii) O FR3 é escolhido do grupo composto da seqüência aminoácida:[66] RFTISRDNAKNTVYLQMNSLXXEDTAVYYCAA [94] [SEQ ID n. 3] pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com a seqüência aminoácida acima; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida (s) acima mencionadase/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e em que:iv) O FR4 é escolhido do grupo composto da seqüência aminoácida:ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de99% (conforme definido na presente) com a seqüência aminoácida acima; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 7; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituiçõesaminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conformedefinido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituiçõesaminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas;e em que:v) 0 CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima;no gual os Resíduos de Hallmark são indicados por "X" e como definidos mais acima e no qual os números entre colchetes se referem às posições aminoácidas segundo a numeração de Kabat.Num outro aspecto preferido, mas não restritivo, um Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e em que: e em quei) O FR1 é escolhido do grupo composto da seqüência aminoácida:[1]QVQLQESGGGLVQAGGSLRLSCAASG [26] [SEQ ID n. 5] ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com a seqüência aminoácida acima; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmarké preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 4; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acimamencionadas; e(3) o resíduo de Hallmark na posição é como indicadona seqüência acima;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências 10 aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na 15 presente) e/ou uma substituição aminoácida conformedefinido na Tabela 4; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s)aminoácida(s) acima mencionadas; e(3) o resíduo de Hallmark na posição é como indicado na seqüência acima;e em que:O FR2 é escolhido do grupo composto das seqüênciasaminoácidas:[36] WFRQAPGKERELVA [49] [SEQ ID NO: 6][36] WFRQAPGKEREFVA [49] [SEQ ID NO: 7][36] WFRQAPGKEREGA [49] [SEQ ID NO: 8][36] WFRQAPGKQRELVA [49] [SEQ ID NO: 9][36] WFRQAPGKQREFVA [49] [SEQ ID NO: 10][36] WYRQAPGKGLEWA [4 9] [SEQ ID NO: 11] pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das5 seqüências aminoácidas acima mencionadas; em que(1) qualquer substituição aminoácida em qualqueroutra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na 10 presente) e/ou uma substituição aminoácida conformedefinido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 15 com as seqüência(s) aminoácida(s) acima mencionadas; e(3) os resíduos de Hallmark nas posições 37, 44, 45 e 47 são como indicados em cada uma das seqüências acima; e/ou do grupo composto de seqüências aminoácidas quetêm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer 25 outra posição que não seja uma posição de Hallmarké preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência (s) aminoácida (s) acima mencionadas; e —,(3) os resíduos de Hallmark nas posições 37, 44, 45 e4 7 são como indicados em cada uma das seqüências acima;e em que:111) O FR3 é escolhido do grupo composto da seqüência aminoácida:[66]RFTISRDNAKNTVYLQMNSLKPEDTAVYYCAA [94] [SEQ ID n. 12]ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com a seqüência aminoácida acima; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido napresente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas; e(3) os resíduos de Hallmark nas posições 83 e 84 são como indicados em cada uma das seqüências acima;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 5 com as seqüência(s) aminoácida(s) acimamencionadas; e(3) os resíduos de Hallmark nas posições 83 e 84 são como indicados em cada uma das seqüências acima;e em que:iv) O FR4 é escolhido do grupo composto das seqüências aminoácidas:[103] WGQGTQVTVSS [113] [SEQ ID n. 13][103]WGQGTLVTVSS [113] [SEQ ID n. 14] ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 20 99% (conforme definido na presente) com uma dasseqüências aminoácidas acima; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição 25 aminoácida conservadora (conforme definido napresente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma 30 eliminação ou inserções aminoácidas, em comparaçãocom as seqüência(s) aminoácida(s) acima mencionadas; e(3) os resíduos de Hallmark nas posições 103, 104 e 10 8 são como indicados em cada uma das seqüências 35 acima; e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas; e(3) os resíduos de Hallmark nas posições 103, 104 e 108 são como indicados em cada uma das seqüências acima;e em que:v) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.Num outro aspecto preferido, mas não restritivo, umNanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4 no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e em que:e em quei) O FR1 é escolhido do grupo composto da seqüênciaaminoácida: [1]QVQLQESGGGLVQAGGSLRLSCAASG [26] [SEQ ID n. 5]e/ou do grupo composto de seqüências aminoácidas que 5 têm 3, 2 ou só 1 "diferença(s) aminoácida(s}" (conformedefinido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark 10 é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 4; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituiçõesaminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas; e(3) o resíduo de Hallmark na posição é como indicado na seqüência acima;e em que:ii) 0 FR2 é escolhido do grupo composto das seqüências aminoácidas:[36] WFRQAPGKERELVA [49] [SEQ ID NO: 6][3 6] WFRQAPGKEREFVA [49] [SEQ ID NO: 7][3 6] WFRQAPGKEREGA [4 9] [SEQ ID NO: 8][36] WFRQAPGKQRELVA [49] [SEQ ID NO: 9][36] WFRQAPGKQREFVA [49] [SEQ ID NO: 10]e/ou do grupo composto de seqüências aminoácidas que têm 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme 5 definido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima 10 mencionadas; e(3) os resíduos de Hallmark nas posições 37, 44, 45 e 47 são como indicados em cada uma das seqüências acima;e em que:iii) O FR3 é escolhido do grupo composto da seqüência aminoácida:[66]RFTISRDNAKNTVYLQMNSLKPEDTAVYYCAA [94] [SEQ ID n. 12] e/ou do grupo composto de seqüências aminoácidas quetêm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja Uma posição de Hallmarké preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmentesó contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acimamencionadas; e(3) os resíduos de Hallmark nas posições 83 e 84 são como indicados em cada uma das seqüências acima; e em que:iv) O FR4 é escolhido do grupo composto das seqüências aminoácidas:(103) WGQGTQVTVSS [113] [SEQ ID NO: 13](104) WGQGTLVTVSS [113] [SEQ ID NO: 14]e/ou do grupo composto de seqüências aminoácidas que 10 têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conformedefinido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(105) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark 15 é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 7; e/ou(106) a referida seqüência aminoácida preferivelmente 20 só contém substituições aminoácidas, e nenhumaeliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acimamencionadas; e(107) os resíduos de Hallmark nas posições 103, 104 e 25 108 são como indicados em cada uma das seqüênciasacima;e em que:v) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das 30 definições preferenciais acima, e mais preferivelmenteconforme definidos segundo uma das definições mais preferenciais acima.Num outro aspecto preferido, mas não restritivo, um Nanocorpo da invenção pode ter a estrutura FR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e em que: e em quei) O FR1 é escolhido do grupo composto da seqüência aminoácida: [1] QVQLQESGGGLVQAGGSLRLSCAASG [26] [SEQ ID NO: 5] e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida{s)" (conforme definido na presente) com uma das seqüências- aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 4; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituiçõesaminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas; e(3) o resíduo de Hallmark na posição é como indicado na seqüência acima; e em que :ii) O FR2 é escolhido do grupo composto da seqüência aminoácida: e/ou do grupo composto de seqüências aminoácidas que têm 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualqueroutra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido napresente) e/ou uma substituição aminoácida conforme definido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas; e(3) os resíduos de Hallmark nas posições 37, 44, 45 e 47 são como indicados em cada uma das seqüências acima;e em que:ui) O FR3 é escolhido do grupo composto da seqüência aminoácida:[66] RFTISRDNAKNTVYLQMNSLKPEDTAVYYCAA [94] [SEQ ID NO: 12] e/ou do grupo composto de seqüências aminoácidas quetêm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmarké preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas; e(3) os resíduos de Hallmark nas posições 83 e 84 sãocomo indicados em cada uma das seqüências acima;e em que:iv) O FR4 é escolhido do grupo composto da seqüência aminoácida:(103) WGQGTQVTVSS [113] [SEQ ID NO: 13]e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme 15 definido na presente) com uma das seqüênciasaminoácidas acima mencionadas, em que:(104) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição 20 aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 7; e/ou(105) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma 25 eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida{s) acimamencionadas; e(106) os resíduos de Hallmark nas posições 103, 104 e 108 são como indicados em cada uma das seqüências 30 acima;e em que:v) O CDR1, CDR2 e CDR3 são conforme definidos acima, e preferivelmente conforme definidos segundo uma das definições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
Algumas outras seqüências de armação que podem estar presentes nos nanocorpos da invenção podem ser encontradas na patente européia EP 656946 acima mencionada (ver, por exemplo, também o equivalente US 5,759,808 outorgado).Num outro aspecto preferido, mas não restritivo, um Nanocorpo da invenção pode ter a estruturaFR1 - CDR1 - FR2 - CDR2 - FR3 - CDR3 - FR4no qual FR1 a FR4 se referem a regiões de armação 1 a 4, respectivamente, e no qual CDR1 a CDR3 se referem à regiões que determinam complementaridade 1 a 3, respectivamente, e 15 em que:e em quei) O FR1 é escolhido do grupo composto de seqüências FR1 presentes nos nanocorpos de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, e especialmente nos nanocorpos humanizados de SEQ ID NO's 76 a 86 ouSEQ ID NO'S 95 a 99, ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de99% (conforme definido na presente) com uma das referidas seqüências FR1; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark 30 é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 4; e/ou(2) a referida seqüência aminoácida preferivelmente 35 só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com a referida seqüência FR1; e(3) o resíduo de Hallmark na posição é como indicado na referida seqüência FR1;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das referidas seqüências FR1, em que:(4) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 4; e/ou(5) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com a referida seqüência FR1; e(6) o resíduo de Hallmark na posição é como indicado na referida seqüência FR1;e em que:ii) O FR2 ê escolhido do grupo composto das seqüências FR2 presentes nos nanocorpos de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, e especialmente nos nanocorpos humanizados de SEQ ID NO's 76 a 86 ouSEQ ID NO's 95 a 99,ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de99% (conforme definido na presente) com uma das referidas seqüências FR2; em que(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituiçãoaminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma 5 eliminação ou inserções aminoácidas, em comparaçãocom a referida seqüência FR2; e(3) os resíduos de Hallmark nas posições 37, 44, 45 e 47 são como indicados na referida seqüência FR2;e/ou do grupo composto de seqüências aminoácidas que 10 têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conformedefinido na presente) com uma das referidas seqüências FR2, em que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark 15 é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 5; e/ou(2) a referida seqüência aminoácida preferivelmente 20 só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com a referida seqüência FR2; e(3) os resíduos de Hallmark nas posições 37, 44, 45 e 47 são como indicados na referida seqüência FR2; e em que :iii) O FR3 é escolhido do grupo composto das seqüências FR3 presentes nos nanocorpos de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, e especialmente nos nanocorpos humanizados de SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99,ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das referidas seqüências FR3; em que (1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na 5 presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 10 com a referida seqüência FR3; e(3) os resíduos de Hallmark nas posições 83 e 84 são como indicados na referida seqüência FR3;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme 15 definido na presente) com uma das referidas seqüênciasFR3, era que:(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição 20 aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparaçãocom a referida seqüência FR3; e(3) os resíduos de Hallmark nas posições 83 e 84 são como indicados na referida seqüência FR3 ;e em que:iv) O FR4 é escolhido do grupo composto das seqüências FR4 presentes nos nanocorpos de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, e especialmente nos nanocorpos humanizados de SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, ou do grupo composto de seqüências aminoácidas que têmpelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das referidas seqüências FR4 ; em que(1) qualquer substituição aminoácida em qualqueroutra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida conforme 10 definido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com a referida seqüência FR4; e(3) os resíduos de Hallmark nas posições 103, 104 e108 são como indicados na referida seqüência FR4;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das referidas seqüências 20 FR4 , em que :(1) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na 25 presente) e/ou uma substituição aminoácida conformedefinido na Tabela 6; e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 30 com a referida seqüência FR4; e(3) os resíduos de Hallmark nas posições 103, 104 e 108 são como indicados na referida seqüência FR4;e em que:v) O CDR1, CDR2 e CDR3 são conforme definidos acima, e 35 preferivelmente conforme definidos segundo uma dasdefinições preferenciais acima, e mais preferivelmente conforme definidos segundo uma das definições mais preferenciais acima.
Alguns nanocorpos particularmente preferidos da invenção podem ser escolhidos do grupo composto das 5 seqüências aminoácidas de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, e especialmente nos nanocorpos humanizados de SEQ ID NO's 76 a 86 ou SEQ ID NO's95 a 99 ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais 10 preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das seqüências aminoácidas de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99; em que(1) os resíduos de Hallmark podem ser como indicadosna Tabela 2 acima;(2) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição 20 aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida como definido em Tabelas 4-7; e/ou(3) a referida seqüência aminoácida preferivelmente só contêm substituições aminoácidas, e nenhuma 25 eliminação ou inserções aminoácidas, em comparação com as seqüência(s) aminoácida(s) acima mencionadas.
Alguns nanocorpos até mais particularmente preferidos da invenção podem ser escolhidos do grupo composto das seqüências aminoácidas de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, e especialmente nos nanocorpos humanizados de SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99 ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais 35 preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das seqüências aminoácidas de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99; em que(1) os resíduos de Hallmark são como indicados na 5 seqüência pertinente escolhida de SEQ ID NO's 52 a60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99;(2) qualquer substituição aminoácida em qualquer outra posição que não seja uma posição de Hallmark é preferivelmente qualquer uma substituição aminoácida conservadora (conforme definido na presente) e/ou uma substituição aminoácida como definido em Tabelas 4-7; e/ou(3) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma 15 eliminação ou inserções aminoácidas, em comparação com a seqüência pertinente escolhida de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99 .
Alguns nanocorpos mais preferenciais da invenção podem 20 ser escolhidos do grupo composto das seqüências aminoácidas de SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99, e especialmente dos nanocorpos humanizados de SEQ ID NO's 76 a 86 ou SEQ ID NO's 95 a 99.
Como ficará claro do acima mencionado, o termo 25 nanocorpos da invenção como usado na presente no seu sentido mais amplo também compreende mutantes naturais ou sintéticos, variantes, alelos, análogos e ortólogos (a seguir tratados coletivamente como "análogos") dos nanocorpos mencionado no SEQ ID NO's 52 a 60, SEQ ID NO's 76 30 a 86 ou SEQ ID NO's 95 a 99.Geralmente, tais análogos, por exemplo, podem compreender seqüências homólogas, porções funcionais, ou uma porção funcional de uma seqüência homóloga (conforme posteriormente definido mais adiante) de um Nanocorpo. 35 Geralmente, em tais análogos, cada resíduo aminoácido (outro que não o Resíduo de Hallmark) em cada uma das regiões de armação pode ser substituído por qualquer outro resíduo aminoácido, contanto que o grau total da identidade de seqüência das regiões de armação permaneça conforme definido acima. Preferivelmente, contudo, em tais análogos:5 1 um ou mais resíduos aminoácidos nas acima mencionadas seqüências de armação são substituídos por um ou vários resíduos aminoácidos que ocorrem naturalmente na mesma posição em um domínio VHH que ocorre naturalmente. Alguns exemplos de tais substituições são mencionados 10 em Tabelas 4-7 acima;e/ou:- um ou resíduos aminoácidos nas acima mencionadas seqüências de armação são substituídos por um ou vários resíduos aminoácidos que podem ser considerados uma 15 substituição aminoácida "conservadora", conforme descrito mais acima;e/ou:um ou resíduos aminoácidos nas acima mencionadas seqüências de armação são substituídos por um ou vários 20 resíduos aminoácidos que ocorrem naturalmente na mesma posição em um domínio VH que ocorre naturalmente de um ser humano. Isto é, geralmente tratado como "humanização" de VHH/Nanocorpo que ocorre naturalmente em geral e da referida posição em particular, e será discutido mais detalhadamente 25 a seguir;e :posições para as quais só um resíduo aminoácido é mencionado tanto para domínio VH como para o domínio VHH nas Tabelas 4-7 acima não são preferivelmente substituídas.
Também, embora geralmente menos preferencial, em tais análogos, um ou vários resíduos aminoácidos podem ser eliminados das regiões de armação e/ou inseridos nas regiões de armação (opcionalmente além de uma ou várias substituições aminoácidas conforme acima mencionado), contanto que o grau total da identidade de seqüência das regiões de armação permaneça conforme definido acima. Os resíduos de Hallmark não devem ser eliminados. Também, mais preferivelmente, resíduos aminoácidos para os quais só um resíduo aminoácido é mencionado tanto para o domínio VH como para o domínio VHH nas Tabelas 4-7 acima não são 5 preferivelmente eliminados.
Preferivelmente, tais análogos devem ser tais que eles ainda podem ligar a, ter afinidade para e/ou ter especificidade paro TNF-alfa, isto é, com uma afinidade e/ou uma especificidade que é pelo menos 10%, preferivelmente 10 pelo menos 50%, mais preferivelmente pelo menos 70%, mesmo mais preferivelmente pelo menos 80%, como pelo menos 90%, pelo menos 95%, pelo menos 99% ou mais, da afinidade e/ou a especificidade de pelo menos um dos nanocorpos de SEQ ID No's SEQ ID NO's 52 a 60, SEQ ID NO's 76 a 86 ou SEQ ID NO's 15 95 a 99, conforme determinado utilizando um ensaio conveniente, por exemplo, um ensaio para determinar a ligação do análogo a TNF, e em particular um dos ensaios conforme usados nos Exemplos apresentados posteriormente.
Geralmente, tais análogos, por exemplo, podem ser 20 obtidos fornecendo um ácido nucléico que codifica um domínio VHH de ocorrência natural, modificando os codons para um ou vários resíduos aminoácidos que devem ser humanizados nos codons para o(s) resíduo(s) aminoácido(s) humano(s) correspondente(s), expressando a seqüência ácida/nucleotidea 25 nucléica portanto obtida em um hospedeiro ou sistema de expressão conveniente; e opcionalmente isolação e/ou purificação do análogo portanto obtido para prover o referido análogo na forma essencialmente isolada (conforme definido acima). Isto pode ser geralmente executado usando 30 métodos e técnicas conhecidas por si, o que ficará claro para a pessoa experimentada, por exemplo, dos manuais e referências citadas na presente e/ou da nova descrição a seguir. Alternativamente, e por exemplo, um ácido nucléico que codifica um análogo pode ser sintetizado em uma maneira 35 conhecida por si (por exemplo usando um aparelho automatizado que sintetiza seqüências ácidas nucléicas com uma seqüência aminoácida predestinada) e pode ser expresso em um hospedeiro ou sistema de expressão conveniente, sobre o qual o análogo portanto obtido pode ser opcionalmente isolado e/ou purificado para prover os referidos análogos na 5 forma essencialmente isolada (conforme definido acima).
Outro modo de fornecer os análogos implica a síntese química da seqüência aminoácida pertinente que usa técnicas para síntese de peptídeo conhecida por si, como as mencionadas a seguir.
Será também geralmente ser claro para a pessoa experimentada que nanocorpos (inclusive análogos dos mesmos) também podem ser preparados começando de seqüências VH humanas (isto é, seqüências aminoácidas ou as seqüências de nucleotídeos correspondentes), como seqüências VH3, por exemplo, humanas como DP-47, DP-51, DP-54 ou DP-29, modificando um ou vários resíduos aminoácidos na seqüência aminoácida do referido domínio VH humano, para fornecer uma seqüência aminoácida que tem a um Q na posição 108; e/ou (b) E na posição 44 e/ou R na posição 45, e preferivelmente E na posição 44 e R na posição 45; e/ou (c) P, R ou S na posição 103, conforme descrito acima. Novamente, isto pode ser geralmente executado usando vários métodos e técnicas mencionadas no parágrafo prévio, usando uma seqüência aminoácida e/ou seqüência de nucleotídeos para um domínio VH 25 humano como um ponto de partida.
O termo nanocorpos conforme usado na presente no seu sentido mais amplo também compreende partes ou fragmentos dos nanocorpos (inclusive análogos) da invenção conforme definida acima, que pode ser novamente conforme 30 adicionalmente descrito mais adiante.
Geralmente, as partes ou os fragmentos dos nanocorpos e/ou análogos têm seqüências aminoácidas nas quais, em comparação com a seqüência aminoácida do Nanocorpo ou análogo de comprimento completo correspondente, um ou vários 35 dos resíduos aminoácidos no fim do N-terminal, um ou vários resíduos aminoácidos no fim do C-terminal, um ou vários resíduos aminoácidos internos contíguos, ou qualquer combinação dos mesmos, foram eliminados e/ou retirados. É também possível combinar uma ou várias de tais partes ou fragmentos para fornecer um Nanocorpo da invenção.
Preferivelmente, a seqüência aminoácida de um Nanocorpo que compreende uma ou várias partes ou fragmentos de um Nanocorpo e/ou análogo de comprimento completo deve ter um grau de identidade de seqüência de pelo menos 50%, preferivelmente pelo menos 60%, mais preferivelmente pelo 10 menos 70%, como pelo menos 80%, pelo menos 90% ou pelo menos 95%, com a seqüência aminoácida do correspondente Nanocorpo de comprimento completo.
Também, a seqüência aminoácida de um Nanocorpo que compreende uma ou várias partes ou fragmentos de um 15 Nanocorpo e/ou análogo de comprimento completo é preferivelmente tal que compreende pelo menos 10 resíduos aminoácidos contíguos, preferivelmente pelo menos 20 resíduos aminoácidos contíguos, mais preferivelmente pelo menos 30 resíduos aminoácidos contíguos, como pelo menos 40 20 resíduos aminoácidos contíguos, da seqüência aminoácida do correspondente Nanocorpo de comprimento completo.
Geralmente, tais partes ou fragmentos dos nanocorpos da invenção terão seqüências aminoácidas nas quais, em comparação com a seqüência aminoácida do correspondente 25 Nanocorpo de comprimento completo da invenção, um ou vários dos resíduos aminoácidos no fim do N-terminal, um ou vários resíduos aminoácidos no fim do C-terminal, um ou vários resíduos aminoácidos internos contíguos, ou qualquer combinação dos mesmos, foram eliminados e/ou retirados. É 30 também possível combinar uma ou várias de tais partes ou fragmentos para fornecer um Nanocorpo da invenção.
Segundo uma modalidade de execução preferencial, um fragmento conforme usado na presente compreende pelo menos um dos CDR's presentes em um Nanocorpo de tamanho natural da 35 invenção, preferivelmente pelo menos dois dos CDR's presentes em um Nanocorpo de tamanho natural da invenção, mais preferivelmente pelo menos CDR2 e CDR3 presentes em um Nanocorpo de tamanho natural da invenção, tais como, por exemplo, o três CDR's presentes em um Nanocorpo de tamanho natural da invenção.
Segundo outra modalidade de execução em particular preferida, mas não-restritiva, tal parte ou o fragmento compreendem pelo menos FR3, CDR3 e FR4 do correspondente Nanocorpo de comprimento completo da invenção, isto é, como, por exemplo, descrito na solicitação internacional WO 10 03/050531 (Lasters et al.).
Preferivelmente, tais partes ou fragmentos devem ser tais que eles ainda podem ligar a, ter afinidade para e/ou ter especificidade paro TNF-alfa, isto é, com uma afinidade e/ou uma especificidade que é pelo menos 10%, 15 preferivelmente pelo menos 50%, mais preferivelmente pelo menos 70%, mesmo mais preferivelmente pelo menos 80%, como pelo menos 90%, pelo menos 95%, pelo menos 99% ou mais, da afinidade e/ou a especificidade do Nanocorpo de tamanho natural correspondente da invenção, por exemplo, um ensaio 20 para determinar a ligação do análogo a TNF, e em particular um dos ensaios conforme usados nos Exemplos apresentados posteriormente.
Da descrição mais acima, ficará claro que as seqüências aminoácidas dos nanocorpos usados na presente se diferenciam 25 em pelo menos uma posição aminoácida em pelo menos uma das regiões de armação das seqüências aminoácidas de domínios VH que ocorrem naturalmente, como as seqüências aminoácidas de domínios VH que ocorrem naturalmente de anticorpos de seres humanos. Especialmente, ficará claro que as seqüências 30 aminoácidas dos nanocorpos usados na presente se diferenciam em pelo menos um dos Resíduos de Hallmark de seqüências aminoácidas de domínios VH que ocorrem naturalmente, como as seqüências aminoácidas de domínios VH que ocorrem naturalmente de anticorpos de Camelídeos e/ou seres humanos.
Portanto, segundo uma modalidade de execução específica, um Nanocorpo da invenção tem uma seqüência aminoácida que se diferencia em pelo menos uma posição aminoácida em uma das regiões de armação da seqüência aminoácida de um domínio VH que ocorre naturalmente. Segundo uma modalidade de execução mais específica, mas não- 5 restritiva da invenção, um Nanocorpo da invenção tem uma seqüência aminoácida que se diferencia em pelo menos um dos resíduos de Hallmark da seqüência aminoácida de um domínio VH que ocorre naturalmente.
Da descrição mais acima, também ficará claro que as 10 seqüências aminoácidas de alguns nanocorpos da invenção, como os nanocorpos humanizados da invenção, se diferenciarão em pelo menos uma posição aminoácida em pelo menos uma das regiões de armação (isto é, na posição de um resíduo de Hallmark ou em outra posição) das seqüências aminoácidas de 15 domínios VHH que ocorrem naturalmente. Portanto, segundo uma modalidade de execução específica, mas não-restritiva, um Nanocorpo da invenção tem uma seqüência aminoácida que se diferencia em pelo menos uma posição aminoácida em uma das regiões de armação da seqüência aminoácida de um domínio VHH 20 de ocorrência natural. Segundo uma modalidade de execução mais específica, mas não-restritiva da invenção, um Nanocorpo da invenção tem uma seqüência aminoácida que se diferencia em pelo menos um dos resíduos de Hallmark da seqüência aminoácida de um domínio VHH de ocorrência 25 natural.
A invenção no seu sentido mais amplo também compreende derivados dos nanocorpos da invenção. Tais derivados podem ser geralmente obtidos pela modificação, e especialmente por modificação química e/ou biológica (por exemplo enzimática), 30 dos nanocorpos da invenção e/ou de um ou vários dos resíduos aminoácidos que formam os nanocorpos da invenção.
Exemplos de tais modificações, bem como os exemplos dos resíduos aminoácidos dentro da seqüência do Nanocorpo que pode ser modificada em tal maneira (isto é, na espinha 35 dorsal da proteína mas preferivelmente em uma cadeia lateral), métodos e técnicas que podem ser usadas para introduzir tais modificações e usos e vantagens potenciais de tais modificações serão claros para a pessoa experimentada.
Por exemplo, tal modificação pode implicar a introdução 5 (p. ex. por enlace covalente ou em outra maneira conveniente) de um ou vários grupos funcionais, resíduos ou metades em ou para o Nanocorpo da invenção, e especialmente de um ou vários grupos funcionais, resíduos ou metades que conferem uma ou várias propriedades ou funcionalidades 10 desejadas ao Nanocorpo da invenção. O exemplo de tais grupos funcionais ficará claro para a pessoa experimentada.
Por exemplo, tal modificação pode compreender a introdução (p. ex. por ligação covalente ou em qualquer outra maneira conveniente) de um ou vários grupos funcionais 15 que aumentam a meia-vida, a solubilidade e/ou a absorção dos Nanocorpo da invenção, que reduzem a imunogenicidade e/ou a toxicidade dos Nanocorpo da invenção, que eliminam ou atenuam qualquer efeito colateral indesejável do Nanocorpo da invenção, e/ou que confere outras propriedades vantajosas 20 e/ou reduz as propriedades indesejadas dos nanocorpos e/ou os polipeptídios da invenção; ou qualquer combinação de dois ou mais do precedente. Exemplos de tais grupos funcionais e de técnicas para introduzi-los serão claros para a pessoa experimentada, e podem compreender geralmente todos os 25 grupos funcionais e técnicas mencionadas na técnica de fundo geral citada mais acima bem como os grupos funcionais e técnicas conhecidas por si para a modificação da proteína farmacêutica, e especialmente para a modificação de anticorpos ou fragmentos de anticorpo (inclusive ScFv e 30 anticorpos de domínio únicos) , para o qual referência, por exemplo, é feita a Remington's Pharmaceutical Science, 16o ed., Mack Publishing Co, Easton, PA (1980). Tais grupos funcionais, por exemplo, podem ser ligados diretamente (por exemplo covalentemente) a um Nanocorpo da invenção, ou 35 opcionalmente através de um linker ou espaçador conveniente, conforme ficará novamente claro para a pessoa experimentada.
Uma das técnicas mais largamente usadas que para aumentar a meia-vida e/ou a reduzir a imunogenicidade da proteína farmacêutica compreende a adição de um polímero conveniente farmacologicamente aceitável, como poli 5 (etileneglicol) (PEG) ou derivados disso (como metoxipoli (etileneglicol) ou mPEG). Geralmente, qualquer forma conveniente de pegilação pode ser usada, como a pegilação usada na técnica para anticorpos e fragmentos de anticorpo (inclusive mas não limitado a anticorpos de domínio (únicos) e ScFv) ; é feita referência a, por exemplo, Chapman, Nat. Biotechnol., 54, 531-545 (2002); por Veronese e Harris, Adv. Drug Deliv. Chapman 54, 453-456 (2003), por Harris e Chess, Nat. Chapman Drug. Discov., 2, (2003) e em WO 04/060965.
Vários reagentes para pegilação da proteína estão também comercialmente disponíveis, por exemplo, da Terapêutica Nektar Therapeutics, os EUA.
Preferivelmente, é usada pegilação direcionada a local, especialmente via um cisteina-resíduo (ver, por exemplo, Yang et al. , Protein Engeneering, 16, 10, 761-770 (2003).
Por exemplo, com esta finalidade, o PEG pode ser ligado a um resíduo cisteina que naturalmente ocorre em um Nanocorpo da invenção, um Nanocorpo da invenção pode ser modificado para introduzir apropriadamente um ou vários resíduos cisteina para o anexo do PEG, ou uma seqüência aminoácida que compreende um ou vários resíduos cisteina para o anexo do PEG pode ser fundido ao N-e/ou o C-termo de um Nanocorpo da invenção, todas as técnicas de utilização da Protein Engeneering conhecidas por si à pessoa experimentada.
Preferivelmente, para os nanocorpos e a proteína da invenção, um PEG é usado com um peso molecular de mais de 5000, como mais de 10,000 e menos de 200,000, como menos de 100,000;, por exemplo, na variedade de 20,000-80,000.
Quanto a pegilação, deve ser observado que geralmente, a invenção também abrange qualquer Nanocorpo da invenção e/ou o polipeptídio da invenção que foi pegilado em uma ou várias posições aminoácidas, preferivelmente de tal modo que qualquer pegilação preferida (1) aumenta a meia-vida in vivo; (2) reduz imunogenicidade; (3) fornece uma ou várias novas propriedades benéficas conhecidas por si para pegilação; (4) não afeta essencialmente a afinidade do 5 Nanocorpo e/ou polipeptídio paro TNF-alfa (p. ex, não reduz a referida afinidade em mais de 90%, preferivelmente não em mais de 50%, e mais preferivelmente não em mais de 10%, como determinado por um ensaio conveniente, como os descritos nos Exemplos mais adiante); e/ou (4) não afeta nenhuma das outras propriedades desejadas dos nanocorpos e/ou polipeptídios da invenção. Os grupos PEG e os métodos convenientes para ligá-los, especificamente ou não- especificamente, serão claros para a pessoa experimentada. Os conjuntos convenientes e os reagentes para tal pegilação, por exemplo, podem ser obtidos de Nektar (CA, EUA).
O outro, a modificação normalmente menos preferencial compreende N-ligada ou O-ligada glicosilação, normalmente como a parte da modificação co-de translação e/ou pós- translação, dependendo da célula hospedeira usada para expressar o Nanocorpo ou o polipeptídio da invenção.
Ainda outra modificação pode compreender a introdução de uma ou várias etiquetas detectáveis ou outros grupos que geram sinal ou metades, dependendo do uso desejado do Nanocorpo etiquetado. Etiquetas convenientes e as técnicas para ligar, usar e descobri-las serão claras à pessoa experimentada, e, por exemplo, incluirão, mas não são limitadas a, etiquetas fluorescentes (como fluoresceina, isotiocianato, rodamina, ficoeritrina, ficocianina, aloficocianina, o-ftaldehido, e fluorescamina e metais fluorescentes como 152Eu ou outros metais da série lantanídeos), etiquetas fosforescentes, etiquetas quimioluminiscentes ou etiquetas bioluminescentes (como luminal, isoluminol, acridinium ester teromático, imidazole,acridinium sais, oxalato ester, dioxetano ou GFP e os seus análogos), isótopos radiativos (como 3H, 1251, 32P, 35, 14C,51Cr, 36C1, 57Co, 58Co, 59Fe, e 75Se), metais, metais quelatos ou cations metálicos (cations, por exemplo, metálicos como 99mTc, 1231, lllln, 1311, 97Ru, 67Cu, 67Ga, e 68Ga ou outros metais ou cations metálicos que são em particular adequados para uso em in vivo, in vitro ou em 5 diagnóstico situ e visualização, como (157Gd, 55Mn, 162Dy,52Cr, e 56Fe) , bem como cromóforos e enzimas (como malato dehidrogenase, staphylococcal nuclease, delta-V-steroid isomerase, álcool de levedura dehidrogenase, alfa- glicerofosfato dehidrogenase, triose fosfato isomerase, 10 biotinavidin peroxidase, rábano-sivestre peroxidase, fosfatase alcalino, asparaginase, glicose oxidase, β~ galactosidase, ribonuclease, urease, catalase, glicose-VI- fosfato dehidrogenase, glucoamilase e acetilcolina esterase). Outras etiquetas convenientes serão claras à 15 pessoa experimentada, e, por exemplo, incluirão metades que podem ser descobertas usando NMR ou espectroscopia ESR.
Tais nanocorpos etiquetados e os polipeptídios da invenção, por exemplo, podem ser usado para ensaios em vitro, in vivo ou em situ (inclusive imunoensaios conhecidos 20 por si como ELISA, RIA, EIA e outros "ensaios de sandwitch", etc.) bem como diagnóstico in vivo e objetivos de visualização, dependendo da escolha da etiqueta específica.
Como estará claro para a pessoa experimentada, outra modificação pode implicar a introdução de um grupo quelato, 25 por exemplo, quelar um dos metais ou cations metálicos mencionados anteriormente. Os grupos quelato convenientes, por exemplo, incluem, sem restrição, dietil- enetriaminepentaacético ácido (DTPA) ou ácido etilenodiaminetetraacético (EDTA).
Ainda outra modificação pode compreender a introdução de um grupo funcional que é uma parte de um par de ligação específico, como o par de ligação biotina-(strept) avidin. Tal grupo funcional pode ser usado para ligar o Nanocorpo da invenção a outra proteína, polipeptídio ou composto químico 35 que é ligado a outra metade do par de ligação, isto é,através da formação do par de ligação. Por exemplo, um Nanocorpo da invenção pode ser conjugado a biotina, e ligado a outra proteína, polipeptídio, composto ou transportadora conjugada a avidin ou streptavidin. Por exemplo, tal Nanocorpo conjugado pode ser usado como um repórter, por 5 exemplo, em um sistema diagnóstico onde um agente detectável que produz sinal é ligado a avidin ou streptavidin. Tais pares de ligação, por exemplo, também podem ser usados para ligar o Nanocorpo da invenção a um transportador, inclusive transportadores convenientes para fins farmacêuticos. Um 10 exemplo não-restritivo são as formulações liposomais descritas por Cao e Suresh, Jornal of Drug Targetting, 8, 4, 257 (2000) . Tais pares de ligação também podem ser usados para ligar um agente terapeuticamente ativo ao Nanocorpo da invenção.
Para algumas aplicações, especialmente para aquelas aplicações destinadas a matar uma célula que expressa o objetivo contra o qual os nanocorpos da invenção são dirigidos (p. ex. no tratamento do câncer), ou reduzir ou diminuir a velocidade do crescimento e/ou a proliferação tal 20 célula, os nanocorpos da invenção também podem ser ligados a uma toxina ou a um resíduo tóxico ou metade. Os exemplos de metades tóxicas, compostos ou resíduos que podem ser ligados a um Nanocorpo da invenção para prover -, por exemplo, - um composto citotóxico serão claros para a pessoa experimentada 25 e, por exemplo, podem ser encontrados na técnica prévia citada anteriormente e/ou na nova descrição na presente. Um exemplo é a assim chamada tecnologia ADEPT ™ WO 03/055527.
Outro produto químico potencial e as modificações enzimáticas serão claros para a pessoa experimentada. Tais 30 modificações também podem ser introduzidas para objetivos de pesquisa (p. ex. para estudar relações de atividade de função). A referência, por exemplo, é feita a Lundblad e Bradshaw, Biotechnol. Appl. Biochem., 26, 143-151 (1997).
Conforme acima mencionado, a invenção também se refere 35 a proteína ou polipeptídios que compreendem pelo menos um domínio VHH (isto é, como identificado utilizando os métodos da invenção) ou pelo menos um nanocorpo baseado nisso.
Segundo uma modalidade de execução não-restritiva da invenção, tal polipeptídio da invenção essencialmente compõe-se de um Nanocorpo. Por "essencialmente compõem-se" 5 de quer dizer que a seqüência aminoácida do polipeptídio da invenção é exatamente a mesma que a seqüência aminoácida de um Nanocorpo (como acima mencionado) ou corresponde à seqüência aminoácida de um Nanocorpo no qual um número limitado de resíduos aminoácidos, como 1-10 resíduos aminoácidos e preferivelmente 1-6 resíduos aminoácidos, como 1, 2, 3, 4, 5 ou 6 resíduos aminoácidos, foram acrescentados ao fim terminal amino, ao fim terminal carboxi, ou ao fim terminal amino e ao fim terminal carboxi da seqüência aminoácida do Nanocorpo.
Ditos resíduos aminoácidos podem ou não modificar-se, alterar-se ou de outra maneira influir nas propriedades (biológicas) do Nanocorpo e podem ou não acrescentar a nova funcionalidade ao Nanocorpo. Por exemplo, tais resíduos aminoácidos:a) pode compreender um Resíduo N-terminal Met, por exemplo, como o resultado da expressão em uma célula hospedeira heteróloga ou organismo hospedeiro.b) pode formar uma seqüência de sinal ou a seqüência líder que dirige a secreção do Nanocorpo de uma célula 25 hospedeira sobre a síntese. Os peptídeos lídersecretores convenientes serão claros para a pessoa experimentada, e podem ser conforme mais adiante descritos na presente. Normalmente, tal seqüência líder será ligada à N-término do Nanocorpo, embora a invenção 30 no seu sentido mais amplo não seja limitada a isso;c) pode formar uma seqüência ou o sinal que permite que o Nanocorpo seja dirigido em direção a e/ou penetre ou entre em órgãos específicos, tecidos, células, ou partes ou compartimentos de células, e/ou que permite que o 35 Nanocorpo penetre ou cruze uma barreira biológica como uma membrana de célula, uma camada de célula como uma camada de células epiteliais, um tumor inclusive tumores sólidos, ou a barreira cerebral de sangue. Os exemplos de tais seqüências aminoácidas serão claros para a pessoa experimentada. Alguns exemplos não-restritivos são os pequenos vetores de peptídeo ("vetores de Pep- trans") descrito em WO 03/026700 e em Temsamani et al., Expert Opin. Biol. Ther., 1, 773 (2001); Temsamani eVidal, Drogue Discov. Hoje, 9, 1012 (004) e Rousselle, J. Pharmacol. Exp. Ther., 296, 124-131 (2001), e a seqüência translocadora de membrana descrita por Zhao et al. , Apoptosis, 8, 631-637 (2003). Seqüências aminoácidas de C-terminal e N-terminal para apontamento intracelular de fragmentos de anticorpo, por exemplo, são descritos por Cardinale et al. , Methods, 34, 171 (2004). Outras técnicas convenientes para apontamento intracelular implicam a expressão e/ou o uso de assim chamados "intracorpos" que compreendem um Nanocorpo da invenção, como mencionado mais adiante;d) pode formar "uma etiqueta", por exemplo uma seqüência ou resíduo aminoácido que permite ou facilita a purificação do Nanobody, por exemplo usando técnicas de afinidade dirigidas contra a referida seqüência ou resíduo. Depois disso, a referida seqüência ou resíduo podem ser retirados (p. ex. por produto químico ou rachadura enzimática) para fornecer a seqüência do Nanobody (com esta finalidade, a etiqueta pode ser opcionalmente ligada à seqüência do Nanobody através de uma seqüência de linker separável ou conter um motivo separável).
Alguns exemplos preferidos, mas não-restritivos de tais resíduos são resíduos de histidina múltiplos, resíduos de glutatione e uma myc-etiqueta tal como AAAEQKLISEEDLNGAA [SEQ ID NO:476];e) pode ser um ou vários resíduos aminoácidos que foram 35 funcionalizados e/ou que podem servir como um local para a ligação de grupos funcionais. Resíduos aminoácidos e grupos funcionais convenientes serão claros para a pessoa experimentada e incluirão, mas não são limitados a, resíduos aminoácidos e grupos funcionais mencionados na presente para os derivados dos Nanobodies da invenção.
Segundo outra modalidade de execução, um polipeptídio da invenção compreende um Nanobody da invenção, que é fundido na sua extremidade terminal amino, na sua extremidade terminal carboxi, ou tanto na sua extremidade terminal amino quanto na sua extremidade terminal carboxi a 10 pelo menos uma nova seqüência aminoácida, isto é, de modo a fornecer uma proteína de fusão que compreende o referido Nanobody da invenção e uma ou mais seqüências amino ácidas adicionais. Tal fusão também será chamada na presente como uma "fusão de Nanobody".
A uma ou mais seqüências aminoácidas podem ser qualquer seqüência aminoácida conveniente e/ou desejada. As novas n seqüências aminoácidas podem ou não modificar, alterar ou de outra maneira influir nas propriedades (biológicas) do Nanobody, e podem ou não acrescentar uma nova funcionalidade 20 ao Nanobody ou polipeptídio da invenção. Preferivelmente, a nova seqüência aminoácida é tal que ela confere uma ou várias propriedades ou funcionalidades desejadas ao Nanobody ou ao polipeptídio da invenção.
Um exemplo de tais seqüências aminoácidas será claro 25 para a pessoa experimentada, e pode compreender geralmente todas as seqüências aminoácidas que são usadas em fusões de peptídeos baseadas em anticorpos convencionais e fragmentos dos mesmos (inclusive, mas não limitado a, anticorpos de domínio de ScFv e simples). Referência por exemplo é feita à 30 revisão por Holliger e Hudson, Nature Biotecnology, 23, 9, 1126-1136 (2005),
Por exemplo, uma seqüência aminoácida tal pode ser uma seqüência aminoácida que aumenta a meia-vida, a solubilidade ou a absorção, reduz a imunogenicidade ou a toxicidade, 35 elimina ou atenua efeitos colaterais indesejáveis, e/ou confere outras vantagens a e/ou reduz as propriedades indesejadas dos polipeptídios da invenção, em comparação com Nanocorpo da invenção por si. Alguns exemplos não- restritivos de tais seqüências aminoácidas são a proteína de soro, como albumina de soro humana (ver, por exemplo, WO 5 00/27435) ou moléculas haptênicas (por exemplo haptenos que são reconhecidos por anticorpos circulantes, ver, por exemplo, WO 98/22141).
A nova seqüência aminoácida também pode fornecer um segundo local de ligação, cujo local de ligação pode ser 10 dirigido contra qualquer proteína desejada, polipeptídio, antígeno, antigênico determinante ou epitope (mas não limitada à mesma proteína, polipeptídio, antígeno, antigênico determinante ou epitope contra o qual o Nanocorpo da invenção é dirigido, ou uma proteína diferente, * 15 polipeptídio, antígeno, antigênico determinante ou epitope). Por exemplo, a nova seqüência aminoácida pode fornecer um segundo local de ligação que é dirigido contra uma proteína de soro (como, por exemplo, albumina de soro humana ou outra proteína de soro como IgG) , para fornecer meia-vida 20 aumentada no soro. A referência, por exemplo, é feita a EP 0 368684, WO 91/01743, WO 01/45746 e WO 04/003019 (no qual várias proteínas de soro é mencionadas), a solicitação internacional pelo solicitante intitulada "nanocorpos™ contra amyloid-beta e polipeptídios que compreendem o mesmo 25 para o tratamento de doenças neurais degenerativas como a doença de Alzheimer" (no qual várias outras proteínas são mencionadas), bem como a Harmsen et al. , Vacine, 23 (41); 4926-42.
Segundo outra modalidade de execução, uma ou várias 30 seqüências aminoácidas adicionais podem compreender uma ou várias partes, fragmentos ou domínios de anticorpos de 4 cadeias convencionais (e em determinados anticorpos humanos) e/ou de anticorpos de cadeia pesadas. Por exemplo, embora normalmente menos preferencial, o Nanocorpo da invenção 35 possa ser ligado a um domínio convencional (preferivelmente humano) VH ou VL ou a um domínio análogo natural ou sintético VH ou VL, novamente opcionalmente via uma seqüência de linker (inclusive, mas não limitado a, outros (únicos) anticorpos de domínio, como os dAb's descritos por Ward et al.).
Pelo menos um nanocorpo também pode ser ligado a um ou vários domínios CHI, CH2 e/ou CH3 (preferivelmente humanos), opcionalmente via uma seqüência de linker. Por exemplo, Nanocorpo ligado a um domínio CHI conveniente, por exemplo, pode ser usado - em conjunto com cadeias leves convenientes - para gerar fragmentos/estruturas de anticorpo análogos a fragmentos Fab convencionais ou F (ab') 2 fragmentos, mas nos quais ou (em caso de um fragmento F (ab') 2) um ou ambos dos domínios VH convencionais foi substituído por Nanocorpo da invenção. Também, dois nanocorpos podem ser ligados a um domínio CH3 (opcionalmente via um linker) para fornecer um construto com a meia-vida aumentada in vivo.
Segundo uma modalidade de execução específica de um polipeptídio da invenção, um ou vários nanocorpos da invenção podem ser ligados a uma ou várias partes de anticorpo, fragmentos ou domínios que conferem uma ou várias funções de executor ao polipeptídio da invenção e/ou podem conferir a capacidade de ligar a um ou vários receptores Fc. Por exemplo, com esta finalidade, e sem ser limitados a isso, uma ou várias seqüências aminoácidas adicionais podem compreender um ou vários domínios CH2 e/ou CH3 de um anticorpo, como de um anticorpo de cadeia pesada (conforme descrito na presente) e mais preferivelmente de um anticorpo de 4 cadeias humano convencional; e/ou pode formar-se (parte de) e região Fc, por exemplo, de IgG, de IgE ou de outro Ig humano. Por exemplo, WO o 94/04678 descreve anticorpos de cadeias pesadas que compreendem um Domínio VHH Camelídeo ou um derivado humanizado disso (isto é, Nanocorpo), no qual os Camelidae CH2 e/ou domínio CH3 foram substituídos por domínios humanos CH2 e CH3, para fornecer uma imunoglobulina que se compõe de 2 cadeias pesadas cada compreendendo Nanocorpo e CH2 humano e domínios CH3 (mas não domínio CHI), cuja imunoglobulina tem a função de executor fornecida pelo CH2 e domínios CH3 e suja imunoglobulina pode funcionar sem a presença de qualquer cadeia leve. Outras seqüências aminoácidas que podem ser apropriadamente ligadas aos 5 nanocorpos da invenção para fornecer uma função de executor serão claras à pessoa experimentada, e podem ser escolhidas com base na função(ões) executor desejada. Referência, por exemplo, é feita a WO 04/058820, WO 99/42077 e WO 05/017148, bem como a revisão por Holliger e Hudson, supra. A união do 10 Nanocorpo da invenção a uma porção Fc também pode levar a uma meia-vida aumentada, em comparação com o Nanocorpo correspondente da invenção. Para algumas aplicações, o uso de uma porção Fc e/ou de domínios constantes (isto é, o CH2 e/ou domínios CH3) que conferem a meia-vida aumentada sem 15 qualquer função de executor biologicamente significativa também pode ser convenientes ou até preferenciais. Outro construto conveniente compreendendo de um ou vários nanocorpos e um ou vários domínios constantes com a meia- vida aumentada in vivo serão claros para a pessoa 20 experimentada, e, por exemplo, podem compreender dois nanocorpos ligados a um domínio CH3, opcionalmente via uma seqüência de linker. Geralmente, qualquer proteína de fusão ou os derivados com a meia-vida aumentada terão preferivelmente um peso molecular de mais de 50 kD, o valor 25 de atalho absorção renal.
As novas seqüências aminoácidas também podem formar uma seqüência de sinal ou a seqüência líder que dirige a secreção do Nanocorpo ou o polipeptídio da invenção de uma célula hospedeira sobre síntese (por exemplo para prover uma 30 pre-, pro- ou prepro-forma do polipeptídio da invenção, dependendo da célula hospedeira usada para expressar o polipeptídio da invenção).
A nova seqüência aminoácida também pode formar uma seqüência ou sinal que permite que o Nanocorpo ou 35 polipeptídio da invenção seja dirigido em direção a e/ou penetre ou entre em órgãos específicos, tecidos, células, ou partes ou compartimentos de células, e/ou que permita que o Nanocorpo ou polipeptídio da invenção penetre ou cruze uma barreira biológica como uma membrana de célula, uma camada de célula como uma camada de células epiteliais, um tumor 5 inclusive tumores sólidos, ou a barreira cerebral de sangue.
Exemplos convenientes de tais seqüências aminoácidas serão claros para a pessoa experimentada, e, por exemplo, incluirão, mas não são limitados a, os vetores "Peptrans" acima mencionados, as seqüências descritas por Cardinale et 10 al. e as seqüências aminoácidas e fragmentos de anticorpo conhecidos por si que podem ser usados para expressar ou produzir os nanocorpos e polipeptídios da invenção como os assim chamados "intracorpos", por exemplo, como descrito em WO 94/02610, WO 95/22618, US-A-7004940, WO 03/014960, WO 15 99/07414; WO 05/01690; EP 1512696; e em Cattaneo, A. E Biocca, S. (1997) Intracellular Antibodies: Development and Applications. Landes e Springer-Verlag; e em Kontermann, Methods 34, (2004), 163-170, e as novas referências descritas na presente.
Para algumas aplicações, especialmente para aquelas aplicações destinadas a matar uma célula que expressa o objetivo contra o qual os nanocorpos da invenção são dirigidos (p. ex. no tratamento do câncer), ou reduzir ou diminuir a velocidade do crescimento e/ou a proliferação tal célula, os nanocorpos da invenção também podem ser ligados a uma proteína (cito)tóxica ou polipeptídio. Exemplos de tal proteína tóxica e polipeptídios que podem ser ligados ao Nanocorpo da invenção para prover -, por exemplo, - um polipeptídio citotóxico da invenção serão claros para a 30 pessoa experimentada e, por exemplo, podem ser encontrados na técnica prévia citada anteriormente e/ou na nova descrição na presente. Um exemplo é a assim chamada tecnologia ADEPT ™ WO 03/055527.
Segundo uma modalidade de execução não-restritiva, um 35 ou vários resíduos aminoácidos podem ser acrescentados a, inseridos em e/ou substituídos na seqüência aminoácida do
Nanocorpo ou o polipeptídio da invenção, para fornecer um ou vários resíduos aminoácidos específicos para ligação de um grupo PEG.
A eficácia de farmacêuticos de proteína depende da sua potência para neutralizar o objetivo mas também da farmacocinética intrínseca do fármaco potencial. Como o rim geralmente filtra moléculas abaixo de 60,000 Daltons (Da), os esforços para reduzir o despejo têm focalizado no aumento do peso molecular do biofarmacéutico através de fusões de proteína (Syed et al. , 1997), glicosilação ou modificação com polímero de glicol de polietileno, isto é, Pegilação (Sotavento et al. , 1999; Abuchowski et al . , 1977; Nucci et al. , 1991; Lecolley, et al. Chem Commun, 2004; Tao et al. , os J São Chem Soc, 2004; Mantovani et al. , 2005) . Esses métodos com sucesso estendem-se na exposição in vivo do biofarmacéutico.
Alternativamente, a meia-vida pode ser estendida usando outro agente pegilante, POLY PEG para conjugação aos nanocorpos bivalentes, TNF56 ou TNF55. 0 POLY PEG é o polímero de forma de pente com dentes PEG em uma espinha dorsal metacrílica. Os POLY PEGs podem variar no comprimento da cadeia de PEG, na espinha dorsal metacrílica e no grupo de fim ativo que determina o método da conjugação do POLY PEG ao Nanocorpo. A conjugação específica de sítio ao C- 25 terminal cisteina presente nos nanocorpos pode ser realizada através do grupo de fim maleimide ativo no POLY PEG.
A invenção também abrange qualquer Nanocorpo da invenção e/ou o polipeptídio da invenção que foi glicosilado em uma ou várias posições aminoácidas, normalmente 30 dependendo do hospedeiro usado para expressar Nanocorpo ou o polipeptídio da invenção (conforme adicionalmente descrito mais adiante).
Segundo uma modalidade de execução não-restritiva, um ou vários resíduos aminoácidos podem ser acrescentados a, 35 inseridos em e/ou substituídos na seqüência aminoácida do Nanocorpo ou o polipeptídio da invenção, para fornecer um ou vários resíduos aminoácidos específicos e/ou um sítio que pode ser glicosilado pelo organismo hospedeiro usado. Por meio de um exemplo preferencial, mas não-restritivo, o N- resíduo na posição 50 dentro de CDR2 do Nanocorpo da 5 invenção, por exemplo, pode ser substituído por um Resíduo Q, D ou S para fornecer um sítio de glicosilação, p. ex.para glicosilação por Pichia.
Segundo outra modalidade de execução, um polipeptídio da invenção pode compreender a seqüência aminoácida do 10 Nanocorpo, que é fundido na sua extremidade terminal amino, na sua extremidade terminal carboxi, ou tanto na sua extremidade terminal amino como na sua extremidade terminal carboxi com pelo menos uma nova seqüência aminoácida.
Novamente, ditas seqüências aminoácidas adicionais 15 podem ou não modificar-se, alterar-se ou de outra maneira influir nas propriedades (biológicas) do Nanocorpo e podem ou não acrescentar a nova funcionalidade ao Nanocorpo.
Por exemplo, segundo uma modalidade de execução preferencial, mas não-restritiva, as referidas seqüências 20 aminoácidas adicionais compreendem pelo menos um novo Nanocorpo, para fornecer um polipeptídio da invenção que compreende pelo menos dois, como três, quatro ou cinco, nanocorpos, nos quais os referidos nanocorpos podem ser opcionalmente ligados via uma ou várias seqüências de 25 . linkers (conforme definido na presente).
Os polipeptídios da invenção que compreendem dois ou mais nanocorpos serão também mencionados na presente como polipeptídios "multivalentes". Por exemplo, um polipeptídio "bivalente" da Invenção compreende dois nanocorpos, 30 opcionalmente ligados via uma seqüência de linker, ao passo que um polipeptídio "trivalente" da invenção compreende três nanocorpos, opcionalmente ligados via duas seqüências de linkers; etc.
Em um polipeptídio multivalente da invenção, dois ou 35 mais nanocorpos podem ser os mesmos ou diferentes. Por exemplo, dois ou mais nanocorpos em um polipeptídio multivalente da invenção:- pode ser dirigido contra o mesmo antígeno, isto é, contra as mesmas partes ou epitopes do referido antígeno ou contra duas ou mais partes diferentes ou epitopes do referido antígeno; e/ou:- pode ser dirigido contra os antígenos diferentes;ou uma combinação disso.Portanto, um polipeptídio bivalente da invenção por exemplo:- pode compreender dois nanocorpos idênticos;- pode compreender um primeiro Nanocorpo dirigido contra umaprimeira parte ou epitope de um antígeno e um segundoNanocorpo dirigido contra a mesma parte ou epitope doreferido antígeno ou contra outra parte ou epitope doreferido antígeno;- ou pode compreender um primeiro Nanocorpo dirigido contra um primeiro antígeno e um segundo Nanocorpo dirigido contra um segundo antígeno diferente do primeiro referido antígeno; ao passo que um Polipeptídio trivalente da Invenção por exemplo:- pode compreender três nanocorpos idênticos ou diferentes dirigidos contra as mesmas partes ou diferentes ou epitopes do mesmo antígeno;- pode compreender dois nanocorpos idênticos ou diferentes dirigidos contra as mesmas partes ou diferentes ou epitopes em um primeiro antígeno e um terceiro Nanocorpo dirigido contra um segundo antígeno diferente do primeiro referido antígeno; ou- pode compreender um primeiro Nanocorpo dirigido contra um primeiro antígeno, um segundo Nanocorpo dirigido contra um segundo antígeno diferente do primeiro referido antígeno, e um terceiro Nanocorpo dirigido contra um terceiro antígeno diferente do primeiro e segundo referido antígeno,
Os polipeptídios da invenção que contêm pelo menos dois nanocorpos, nos quais pelo menos um nanocorpo é dirigido contra um primeiro antígeno e pelo menos um nanocorpo é dirigido contra um segundo antígeno diferente do primeiro antígeno, também se mencionará como nanocorpos "multiespecífico". Portanto, Nanocorpo "biespecífico" é um Nanocorpo gue compreende pelo menos um nanocorpo dirigido 5 contra um primeiro antígeno e pelo menos um novo Nanocorpo dirigido contra um segundo antígeno, ao passo que o Nanocorpo "triespecífico" é um Nanocorpo que compreende pelo menos um nanocorpo dirigido contra um primeiro antígeno, pelo menos um novo Nanocorpo dirigido contra um segundo 10 antígeno, e pelo menos um novo Nanocorpo dirigido contra um terceiro antígeno; etc.
Conseqüentemente, na sua forma mais simples, um polipeptídio biespecífico da invenção é um polipeptídio bivalente da invenção (conforme definido na presente), 15 compreendendo primeiro Nanocorpo dirigido contra um primeiro antígeno e um segundo Nanocorpo dirigido contra um segundo antígeno, no qual os referidos primeiro e segundo Nanocorpo podem ser opcionalmente ligados via uma seqüência de linker (conforme definido na presente); ao passo que um 20 polipeptídio triespecífico da invenção na sua forma mais simples é um polipeptídio trivalente da invenção (conforme definido na presente), compreendendo primeiro Nanocorpo dirigido contra um primeiro antígeno, um segundo Nanocorpo dirigido contra um segundo antígeno e um terceiro Nanocorpo dirigido contra um terceiro antígeno, no qual os referidos primeiro, segundo e terceiro Nanocorpo pode ser opcionalmente ligado via uma ou mais, e em particular uma, e mais em particular, duas seqüências de linkers.
Contudo, como ficará claro da descrição mais acima, a 30 invenção não é limitada a isso, no sentido de que um polipeptídio multiespecífico da invenção pode compreender qualquer número de nanocorpos dirigidos contra dois ou mais antígenos diferentes.
Para polipeptídios multivalentes e multiespecíficos que 35 contêm um ou vários domínios VHH e a sua preparação, a referência também é feita a Conrath et al. , J. Biol. Chem.,volume 276, 10. 7346-7350, bem como a EP 0 822985.
Nos polipeptídios da invenção, um ou vários nanocorpos e um ou vários polipeptídios podem ser diretamente ligados um a outro (como, por exemplo, descrito em WO 99/23221) e/ou 5 ligados um a outro via um ou vários espaçadores convenientes ou linkers, ou qualquer combinação disso.
Espaçadores ou linkers convenientes para usar em polipeptídios multivalentes e multiespecíficos serão claros para a pessoa experimentada, e podem ser geralmente qualquer 10 linker ou o espaçador usado na técnica para ligar seqüências aminoácidas. Preferivelmente, dito linker ou espaçador é conveniente para uso na construção de proteínas ou polipeptídios que são destinados para uso farmacêutico.
Alguns espaçadores em particular preferenciais incluem 15 espaçadores e linkers que são usados na técnica para ligar fragmentos de anticorpo ou domínios de anticorpo. Esses incluem os linkers mencionados na técnica de fundo geral citada anteriormente, bem como, por exemplo, linkers que são usados na técnica para construir diabodies ou fragmentos de 20 ScFv (neste aspecto, contudo, deve ser observado que, ao passo que em diabodies e em fragmentos de ScFv, a seqüência de linker usada deve ter um comprimento, um grau da flexibilidade e outras propriedades que permitem que os Domínios VH e VL pertinentes venham em conjunto para formar 25 o sítio de ligação de antígeno completo, não há nenhuma determinada limitação do comprimento ou flexibilidade do linker usado no polipeptídio da invenção, desde que cada Nanocorpo por si mesmo forma um sítio de ligação de antígeno completo).
Outros linkers convenientes geralmente compreendem compostos ou polímeros orgânicos, especialmente os convenientes para uso em proteínas o uso farmacêutico. Por exemplo, poli(etileneglicol) metades foram usadas para ligar domínios de anticorpo, ver, por exemplo, WO 04/081026.
Está também dentro dos limites da invenção que os linker(s) usados conferem uma ou várias outras propriedades favoráveis ou a funcionalidade aos polipeptídios da invenção, e/ou fornecem um ou vários sítios para a formação de derivados e/ou para a ligação de grupos funcionais (p. ex. conforme descrito na presente para os derivados de 5 nanocorpos da invenção). Por exemplo, linkers contendo um ou vários resíduos aminoácidos carregados (ver a Tabela a-3 acima) pode prover propriedades hidrofílicas melhoradas, ao passo que linkers que formam ou contêm pequenos epitopes ou etiquetas podem ser usados para os objetivos de detecção, 10 identificação e/ou purificação. Novamente, baseado na revelação na presente, a pessoa experimentada será capaz de determinar os linkers ótimos para uso em um polipeptídio específico da invenção, opcionalmente depois em alguns experimentos de rotina limitados.
Finalmente, quando dois ou mais linkers são usados nos polipeptídios da invenção, esses linkers podem ser os mesmos ou diferentes. Novamente, baseado na revelação na presente, a pessoa experimentada será capaz de determinar os linkers ótimos para uso em um polipeptídio específico da invenção, 20 opcionalmente depois em alguns experimentos de rotina limitados.
Os Linkers para uso em polipeptídios multivalentes e multiespecíficos serão claros para a pessoa experimentada, e, por exemplo, incluirão gly-ser linkers, por exemplo, do 25 tipo (glyxsery) z, como (por exemplo (gly4ser) 3 ou (gly3ser2) 3, como descrito em WO 99/42077, regiões pregadas como as regiões pregadas de anticorpos de cadeias pesadas que ocorrem naturalmente ou seqüências semelhantes. Para outros linkers convenientes, a referência também é feita à 30 fundamentos técnicos gerais citada anteriormente. Alguns em particular preferiram que linkers sejam dados em SEQ ID NO's 68 e 69.
Linkers também podem fornecer um pouco de funcionalidade para o polipeptídio multivalente ou multiespecífico. Por exemplo, linkers contendo um ou vários resíduos aminoácidos carregados (ver a Tabela 1 anteriormente) podem prover propriedades hidrofílicas melhoradas, ao passo que linkers que formam ou contêm pequenos epitopes ou etiquetas podem ser usados para os objetivos de detecção, identificação e/ou purificação.
Como mencionado na presente, em uma proteína ou o polipeptídio da invenção, nanocorpos anti-TNF mencionados na presente são preferivelmente ligados de tal modo que as referidas proteínaa ou polipeptídios, para ligar a um Trímero TNF, é capaz de inibir ou de reduzir a ligação 10 cruzada do receptor TNF que é mediada pelo referido trímero TNF e/ou a transdução de sinal que é mediada por tal ligação cruzada de receptor; e/ou de tal modo que a proteína ou o polipeptídio são capazes da ligação intramolecular a pelo menos dois sítios que ligam o receptor TNF a um Trímero TNF Linkers convenientes são como descritos na presente.
Como também mencionado na presente, se uma proteína ou o polipeptídio fornecem a ligação intermolecular ou a ligação de extramolecular pode ser avaliado (pelo menos inicialmente) por uma cromatografia de exclusão por tamanho.
Pela Cromatografia de exclusão por tamanho os complexos de TNF-alfa e anticorpos podem ser analisados para determinar o número e a proporção de anticorpo e moléculas TNF-alfa no complexo. Desses dados pode ser deduzido se ocorrem ligações inter- ou intramoleculares, como foi feito por Santora e colegas (Santora, L.C., e al, Biochem Anal. 2001) para estabelecimento do estequiometria de ligação de anticorpo monoclônico D2E7 (Humira) o TNF-alfa. em proporções diferentes de anticorpo e objetivo. Do peso molecular do complexo foi concluído que três moléculas de anticorpo 30 complexado com três Trímeros TNFs, consequentemente indicando que o anticorpo liga em um modo intermolecular. Experimentos semelhantes foram executados com nanocorpos bivalentes, no qual um linker muito curto induziu a formação de grandes complexos moleculares, que foram obtidos por ligações intermoleculares. Contudo, o mesmo nanocorpos bivalente construtos com linkers mais longos eluídos da coluna de filtração de gel como pequenos complexos discretos, conseqüentemente demonstrando que as ligações intramoleculares foram formadas. Combinado com os dados do bioensaio, nos quais o linker mais longo que contém 5 Nanocorpo TNF1 teve uma ótima potência (a neutralização completa da quantidade de TNF usado no ensaio, isto é, às 22h00), pode ser concluído que a ligação intramolecular do Nanocorpo bivalente eficientemente impede a ligação cruzada de dos receptores ligados por célula e a ativação de 10 receptor associada. Os anticorpos monoclônicos conhecidos como Humira ou Remicade não podem formar tais ligações intramoleculares, deixando sempre dois locais de ligação de receptor na molécula trimérica TNF a certo grau disponível para a interação com receptor ligado por célula, que traduz 15 para a neutralização menos potente como medido no bioensaio.
Alternativamente, se uma proteína ou o polipeptídio fornecem a ligação intermolecular ou a ligação extramolecular pode ser avaliada por cristalografia e/ou modelagem molecular (ou outras silicotécnicas convenientes). 20 Um modelo de um complexo trimérico TNF30/TNF-alfa foi gerado baseado na estrutura cristalina do complexo do tipo natural monomérico TNFl/TNF-alfa . Desta estrutura o construto final TNF30-linker-ALB8-linker-TNF30 foi modelado. O construto TNF30-linker-ALB8-linker-TNF30 foi modelado começando do 25 trímero de TNFα com duas moléculas TNF30 ligadas. Como a estrutura do ALB8 não é conhecida, uma terceira molécula de TNF30 foi usada em vez disso, que foi colocada no meio outros dois nanocorpos ao longo da linha entre o N-e C- términos. Os 9 linkers aminoácidos então foram acrescentados 30 manualmente.
O modelo é mostrado na Figura 62. Claramente, 9 linkers aminoácidos em conjunto com o ALB8 fornece amplo espaço para abarcar os aproximadamente 66 Â entre dois domínios TNF30 ligados a TNFα. O ALB8 por si mesmo já abarca 40 Â, e cada 35 linker pode abarcar outro ~27 Â em conformação completamente estendida. Por conseguinte, o ALB8 tem bastante flexibilidade do movimento, e não é esperado que a sua ligação à albumina interferiria muito na ligação a TNFot.
Além disso, é provável que os linkers possam ser encurtados sem afetar a avidez, especialmente no caso do 5 linker que é o C-terminal de ALB8. Isto pode ter o efeito benéfico da ligação aumentada ao mesmo TNFot trímero contra trímeros de ligação cruzada, porque a probabilidade que o segundo TNF3 0 se associe com um TNFot diferente aumenta com o comprimento do linker.
Como também além disso descrito na presente, um polipeptídio multiespecífico da invenção dirigido contra um antígeno desejado e contra pelo menos uma proteína de soro, como a proteína de soro mencionada a seguir, e especialmente contra uma albumina de soro humano, pode mostrar meia-vida 15 aumentada no soro, em comparação com o correspondente Nanocorpo monovalente.
Como mencionado mais acima, os métodos descritos na presente são em particular ajustados para gerar tais polipeptídios multiespecíficos multivalentes da invenção.
Em um polipeptídio da invenção, pelo menos um nanocorpo também pode ser ligado a um domínio VH convencional ou a um análogo natural ou sintético de um domínio VH, opcionalmente via uma seqüência de linker.
Em um polipeptídio da invenção, pelo menos um 25 nanocorpo também pode ser ligado a um domínio VL ou a um análogo natural ou sintético de um domínio VL, opcionalmente via uma seqüência de linker, para fornecer um polipeptídio da invenção que está na forma análoga a um fragmento scFv convencional, mas conter um Nanocorpo em vez de um domínio 30 VH.
Em um polipeptídio da invenção, pelo menos um nanocorpo também pode ser ligado a um ou vários domínios CHI, CH2 e/ou CH3, opcionalmente via uma seqüência de linker. Por exemplo, um Nanocorpo ligado a um domínio CHI conveniente, por 35 exemplo, pode ser usado - em conjunto com cadeias leves convenientes - para gerar fragmentos/estruturas de anticorpo análogos a fragmentos Fab convencionais ou F (ab') 2 fragmentos, mas no qual ou (em caso de um F (ab') 2 fragmento) um ou ambos dos domínios VH convencionais foi substituído por um Nanocorpo. Tais fragmentos também podem 5 ser heteroespecíficos ou biespecíficos, isto é, dirigido contra dois ou mais antígenos. Um Nanocorpo ligado a CH2 conveniente e domínios CH3, por exemplo, derivado de Camelídeos, pode ser usado para formar um anticorpo de cadeia pesada monoespecífico ou biespecífico. Finalmente, um
Nanocorpo ligado a CHI conveniente, CH2 e domínios CH3, por exemplo, derivado de um ser humano, pode ser usado - em conjunto com cadeias leves convenientes - para formar um anticorpo que é análogo a um anticorpo de 4 cadeias convencional, mas no qual um ou ambos dos domínios VH convencionais foram substituídos por um Nanocorpo.
Também, além de um ou vários nanocorpos, os Polipeptídios da Invenção também podem conter grupos funcionais, metades ou resíduos, por exemplo, substâncias terapeuticamente ativas, como os mencionados mais adiante, e/ou marcadores ou etiquetas, como marcadores fluorescentes, isótopos, etc., conforme adicionalmente descrito a seguir.
Os nanocorpos da invenção, os polipeptídios da invenção, e ácidos nucléicos que codificam o mesmo, podem estar preparados em uma maneira conhecida por si, como estará claro para a pessoa experimentada da nova descrição na presente. Alguns dos métodos preferidos, mas não- restritivos para preparar os nanocorpos, polipeptídios e ácidos nucléicos incluem os métodos e técnicas acima mencionadas e/ou novas descritas a seguir.
Como estará claro para a pessoa versada, um método especialmente útil para preparar um Nanocorpo e/ou um polipeptídio da invenção geralmente compreende as etapas de:- a expressão, em uma célula hospedeira conveniente ou organismo hospedeiro (também mencionado na presente como "um hospedeiro da invenção"') ou em outro sistema de expressão conveniente de um ácido nucléico que codifica os referidos Nanocorpo ou o polipeptídio da invenção (também mencionado na presente como "um ácido nucléico da invenção"), opcionalmente seguido por:- isolação e/ou purificação do Nanocorpo ou polipeptídio da invenção portanto obtido.
Especialmente, tal método pode compreender as etapas de: cultivar e/ou manter um hospedeiro da invenção em 10 condições que são tais que o referido hospedeiro da invenção expressa e/ou produz pelo menos um nanocorpo e/ou o polipeptídio da invenção; opcionalmente seguido por :- isolação e/ou purificação do Nanocorpo ou polipeptídio da invenção portanto obtido.
Um ácido nucléico da invenção pode ser na forma de ADN ou ARN de trançado simples ou duplo, e é preferivelmente na forma do ADN de trançado duplo. Por exemplo, as seqüências de nucleotídeos da invenção podem ser ADN genômico, cDNA ou o ADN sintético (como ADN com um uso de codon que foi especificamente adaptado para expressão na célula hospedeira desejada ou organismo hospedeiro).
Segundo uma modalidade de execução da invenção, o ácido nucléico da invenção está em essencialmente isolado de, conforme definido acima.
O ácido nucléico da invenção também pode ser na forma de, estar presente em e/ou ser parte de um vetor, como, por exemplo, um plasmídeo, cosmídeo ou YAC, que novamente pode estar na forma essencialmente isolada.
Os ácidos nucléicos da invenção podem ser preparados ou obtidos em uma maneira conhecida por si, baseado na informação dadas nas seqüências aminoácidas para os polipeptídios da presente invenção, e/ou ser isolados de uma fonte natural conveniente. Para fornecer análogos, seqüências de nucleotídeos que codificam domínios de VHH que ocorrem naturalmente, por exemplo, podem ser submetidos a mutagenese direcionada a local, de modo a fornecer um ácido nucléico da invenção que codifica os referidos análogos. Também, como estará claro para a pessoa experimentada, preparar um ácido nucléico da invenção, também várias seqüências de nucleotídeos, como pelo menos uma seqüência de 5 nucleotídeos que codifica Nanocorpo e ácidos, por exemplo, nucléicos que codificam um ou vários linkers podem ser ligadas em conjunto em uma maneira conveniente.
As técnicas para gerar os ácidos nucléicos da invenção serão claras à pessoa experimentada e podem incluir por 10 exemplo, mas não são limitadas a, síntese de ADN automatizada; mutagenese direcionada a local; a combinação de duas ou mais seqüências que ocorrem naturalmente e/ou sintéticas (ou dois ou mais partes das mesmas), a introdução de mutações que levam à expressão de um produto de expressão 15 truncado; a introdução de um ou vários sítios de restrição (p. ex. para criar cassetes e/ou regiões que podem ser facilmente digeridas e/ou ligadas utilizando enzimas de restrição convenientes), e/ou a introdução de mutações por meio de uma reação PCR que usa um ou vários escorvadores 20 "mal combinados", usando, por exemplo, uma seqüência de uma GPCR de ocorrência natural como um padrão. Estas e outras técnicas serão claras à pessoa experimentada, e a referência é novamente feita aos manuais padrões, como Sambrook. e Ausubel et al., acima mencionado, bem como os Exemplos mais 25 adiante.
O ácido nucléico da invenção também pode ser na forma de, estar presente em e/ou ser parte de um construto genético, como estará claro para a pessoa experimentada na técnica. Tal construto genético geralmente compreende pelo 30 menos um ácido nucléico da invenção que é opcionalmente ligado a um ou vários elementos de construto genético conhecido por si, como, por exemplo, um ou vários elementos reguladores convenientes (como um promotor (es) conveniente, realçador(es), exterminadores(s), etc.) e os novos elementos 35 dos construtos genéticos mencionados a seguir. Tais construtos genéticos compreendendo pelo menos um ácido nucléico da invenção também serão referidos na presente como "construto genético da invenção".
O construto genético da invenção pode ser ADN ou o ARN, e são o ADN preferivelmente de trançado duplo. 0 construto 5 genético da invenção também pode estar em uma forma conveniente para a transformação da célula hospedeira desejada ou organismo hospedeiro, em uma forma conveniente para integração no ADN genômico da célula hospedeira desejada ou em uma forma de réplica independente 10 conveniente, manutenção e/ou herança no organismo hospedeiro desejado. Por exemplo, o construto genético da invenção pode ser na forma de um vetor, como, por exemplo, um plasmídeo, cosmídeo, YAC, um vetor virai ou transposon. Especialmente, o vetor pode ser um vetor de expressão, isto é, um vetor que 15 pode prover a expressão in vitro e/ou in vivo (p. ex. em uma célula hospedeira conveniente, organismo hospedeiro e/ou sistema de expressão).
Em uma modalidade de execução preferencial mas não- restritiva, um construto genético da invenção compreendea) pelo menos um ãcido nucléico da invenção; operavelmente conectado ab) um ou vários elementos reguladores, como um promotor e opcionalmente um exterminador conveniente;c) e opcionalmente tambémd) um ou vários novos elementos dos construtos genéticos conhecido por si; no qual os termos "elemento regulador", "o promotor", "exterminadores" e "operavelmente conectado" tem a sua significação habitual na técnica (conforme adicionalmente 30 descrito mais adiante); e no qual os referidos "novos elementos" o presente no construto genético, por exemplo, pode ser 3'-ou 5 seqüências '-UTR, seqüências de líder,marcadores de seleção, genes de marcadores/repórter de expressão, e/ou elementos que podem facilitar ou aumentar (a 35 eficiência de) a transformação ou a integração. Estes e outros elementos convenientes para tal construto genético ficará claro para a pessoa experimentada, e pode depender, por exemplo, do tipo de construto usado, a célula hospedeira desejada ou organismo hospedeiro; a maneira na qual as seqüências de nucleotídeos da invenção do interesse devem ser expressas (p. ex. via a expressão constitutiva, passageira ou induzível); e/ou a técnica de transformação a ser usada.
Preferivelmente, no construto genético da invenção, os referidos pelo menos um ácido nucléico da invenção e os referidos elementos reguladores, e opcionalmente os referidos um ou vários novos elementos, são "operavelmente ligados" um a outro, pelo qual geralmente quer dizer que eles estão em uma relação funcional um com outro. Por exemplo, um promotor é considerado "operavelmente ligado" a uma seqüência de codificação se o referido promotor for capaz de iniciar ou controlar/regular de outra maneira a transcrição e/ou a expressão de uma seqüência de codificação (no qual a referida codificação de seqüência deve ser entendida como estando "no controle dos" referidos promotores). Geralmente, quando duas seqüências de nucleotídeos são operavelmente ligadas, elas estarão na mesma orientação e normalmente também na mesma armação de leitura. Eles também serão normalmente essencialmente contíguos, embora isto também não possa ser requerido.
Preferivelmente, os elementos reguladores e novos dos construtos genéticos da invenção são tais que eles são capazes de fornecer a sua função biológica desejada na célula hospedeira desejada ou organismo hospedeiro.
Por exemplo, um promotor, realçador ou exterminadores deve ser "operável" na célula hospedeira desejada ou organismo hospedeiro, pelo qual se quer dizer que (por exemplo) o referido promotor deve ser capaz da iniciação ou de outra maneira controlar/regular a transcrição e/ou a expressão de uma seqüência de nucleotídeos - p. ex. uma seqüência de codificação - ao qual ele está operavelmente ligado (conforme definido na presente).
Alguns promotores em particular preferenciais incluem, mas não são limitados a, promotores conhecidos por si para a expressão em células bacterianas, como as mencionadas a 5 seguir e/ou os usados nos Exemplos.
Um marcador de seleção deve ser tal que permita - isto é, em condições de seleção apropriadas - células hospedeiras e/ou organismos hospedeiros que foram (com sucesso) transformados com a seqüência de nucleotídeos da invenção a 10 ser distinguida de células/organismos hospedeiros que não foram (com sucesso) transformados. Alguns exemplos preferidos, mas não-restritivos de tais marcadores são genes que fornecem a resistência contra antibióticos (como canamicina ou ampicilina), genes que provêem resistência à 15 temperatura, ou genes que permitem a célula hospedeira ou organismo hospedeiro a serem mantidos na ausência de certos fatores, compostos e/ou componentes (alimentares) no meio que são essenciais para a sobrevivência das células não- transformadas ou organismos.
Uma seqüência líder deve ser tal que - na célula hospedeira desejada ou organismo hospedeiro - ela leva em conta as modificações pós-translação desejadas e/ou tal que ela dirige o mRNA transcrito a uma parte desejada ou organela de uma célula. Uma seqüência líder também pode 25 levar em conta a secreção do produto de expressão da referida célula. Como tal, a seqüência líder pode ser alguma pro-, pre, ou a prepro-seqüência operável na célula hospedeira ou organismo hospedeiro. As seqüências de líder não podem ser requeridas para expressão em uma célula 30 bacteriana.
Um marcador de expressão ou o gene de repórter devem ser tais que - na célula hospedeira ou organismo hospedeiro - ele leva em conta a detecção da expressão (de um gene ou seqüência de nucleotídeos presente em) os construtos 35 genéticos. Um marcador de expressão também pode levar em conta opcionalmente a localização do produto expresso, p.ex. em uma parte específica ou organela de uma célula e/ou em célula(s) específica (s) , tecido(s) , órgão (s) ou parte(s) de um organismo multicelular. Tais genes de repórter também podem ser expressos como uma fusão de 5 proteína com a seqüência aminoácida da invenção. Alguns exemplos preferidos, mas não-restritivos incluem a proteína fluorescente como GFP.
Alguns exemplos preferidos, mas não-restritivos dos promotores convenientes, exterminadores e novos elementos 10 incluem os usados nos Exemplos mais adiante. Para alguns (novos) exemplos não-restritivos dos promotores, marcadores de seleção, seqüências de líder, marcadores de expressão e novos elementos que podem ser apresentados/usados no construto genético da invenção - como exterminadores, 15 realçadores transcricionais e/ou de translação e/ou fatores de integração - é feita referência aos manuais gerais como Sambrook. e Ausubel acima mencionados, bem como aos exemplos que são dados em WO 95/07463, WO 96/23810, WO 95/07463, WO 95/21191, WO 97/11094, WO 97/42320, WO 98/06737, WO 20 98/21355, US 6,207,410, US - - 5,693,492 e EP 1085089.
Outros exemplos serão claros para a pessoa experimentada. A referência também é feita à fundamentos técnicos gerais citados anteriormente e as novas referências citadas a seguir.
O construto genético da invenção pode ser geralmente fornecido ligando apropriadamente seqüência (s) de nucleotídeos da invenção a um ou vários novos elementos descritos anteriormente, por exemplo, usando as técnicas descritas nos manuais gerais como Sambrook. e Ausubel et 30 al., acima mencionados.
Freqüentemente, o construto genético da invenção será obtido inserindo uma seqüência de nucleotídeos da invenção em um vetor conveniente (expressão) conhecido por si. Alguns exemplos preferidos, mas não-restritivos dos vetores de 35 expressão convenientes são os usados nos Exemplos mais adiante, bem como os mencionados mais adiante.
Os ácidos nucléicos da invenção e/ou o construto genético da invenção pode ser usado para transformar uma célula hospedeira ou o organismo hospedeiro. A célula hospedeira ou o organismo hospedeiro pode ser alguma célula 5 conveniente (fungosa, procariótica ou eucariótica) ou linha de célula ou algum organismo conveniente fungoso, procariótico ou eucariótico, por exemplo:- uma classe bacteriana, inclusive, mas não limitado a, classes negativas de grama como classes de Escherichia coli; de Proteus, por exemplo, de Proteus mirabilis; de Pseudomonas, por exemplo, de Pseudomonas fluorescens; e classes positivas de grama como classes de Bacillus, por exemplo, de Bacillus subtilis ou de Bacillus brevis; de Streptomyces, por exemplo, de Streptomyces lividans; de
Estafilococo, por exemplo, de Estafilococo carnosus; e de Lactococcus, por exemplo, de Lactococcus lactis;- uma célula fungosa, inclusive, mas não limitado a, células de espécie de Tri choderma, por exemplo, de Trichoderma reesei; de Neurospora, por exemplo, de Neurospora crassa; de Sordaria, por exemplo, de Sordaria macrospora; de Aspergillus, por exemplo, do Niger Aspergillus ou de Aspergillus sojae; ou de outros fungos filamentosos;- uma célula de levedura, inclusive, mas não limitado a, células de espécie de Saccharomyces, por exemplo, de Saccharomyces cerevisiae; de Schizosaccharomyces, por exemplo, de Schizosaccharomyces pombe; de Pichia, por exemplo, de Pichia pastoris ou de Pichia methanolica; de Hansenula, por exemplo, de Hansenula polymorpha; de Kluyveromyces, por exemplo, de Kluyveromyces lactis; de Arxula, por exemplo, de Arxula adeninivorans; de Yarrowia, por exemplo, de Yarrowia lipolytica;- uma linha de célula ou célula anfíbia, como Xenopus oocytes;- uma linha de célula ou célula derivada por inseto, como 35 linhas de células/célula derivou de lepidoptera, inclusive mas não limitado a Spodoptera SF9 e células Sf21 ou as linhas de células/célula derivaram de Drosophila, como Schneider e células Kc;- uma planta ou célula de planta, por exemplo, em plantas de 5 fumo; e/ou- uma linha de célula ou célula de mamífero, por exemplo, derivada de uma linha de célula ou célula derivada de um ser humano, de mamíferos inclusive mas não limitado a CHO- células, BHK-células (por exemplo células de BHK-21) e 10 células humanas ou linhas de célula como HeLa, COS (por exemplo COS 7) e PER C6 células; bem como todos outros anfitriões ou células hospedeiras conhecidas por si para a expressão e a produção de anticorpos e fragmentos de anticorpo (inclusive, mas não 15 limitado a, anticorpos de domínio (únicos) e fragmentos ScFv) , o que ficará claro para a pessoa experimentada. A referência também é feita à fundamentos técnicos gerais citados mais acima, bem como a, por exemplo, WO 94/29457; WO 96/34103; WO 99/42077; Frenken et al., (1998), supra; Riechmann e Muyldermans, (1999), supra; perua der Tília, (2000), supra; Thomassen et al. , (2002), supra; Joosten et al. , (2003), supra; Joosten et al . , (2005), supra; e as novas referências citadas na presente.
Os nanocorpos e os polipeptídios da invenção também 25 podem ser introduzidos e expressos em uma ou várias células, tecidos ou órgãos de um organismo multicelular, por exemplo, para objetivos profiláticos e/ou terapêuticos (p. ex. como uma terapia genética). Com esta finalidade, as seqüências de nucleotídeos da invenção podem ser introduzidas nas células 30 ou tecidos de qualquer modo conveniente, por exemplo, como tal (p. ex. utilização de lipossomas) ou depois que eles foram inseridos em um vetor de terapia genético conveniente (por exemplo derivados de retroviruses como adenovirus, ou parvoviruses como vírus adeno-associado). Como também ficará 35 claro para a pessoa experimentada, tal terapia genética pode ser executada in vivo e/ou em situ no corpo de um paciente administrando um ácido nucléico da invenção ou um vetor de terapia genético conveniente codificando o mesmo ao paciente ou a células específicas ou um tecido específico ou órgão do paciente; ou as células convenientes (freqüentemente tomado 5 do corpo do paciente a ser tratado, como linfócitos explantados, aspirados do tutano dos ossos ou biópsias de tecido) podem ser tratadas in vitro com uma seqüência de nucleotídeos da invenção e logo ser apropriadamente (re) introduzidas no corpo do paciente. Tudo isso pode ser 10 executado usando vetores de terapia genéticos, técnicas e sistemas de entrega que são bem conhecidos à pessoa experimentada, por exemplo Culver, K. W. , "Terapia Genética", 1994, p. xii, Mary Ann Liebert, Inc., Publishers, Nova York")". Giordano, Nature F Medicine 2 (1996), 534-539; Schaper, Circ. Res. 79 (1996), 911-919; Anderson, Ciência 256 (1992), 808-813; Verma, Natureza 389 (1994), 239; Isner, Lanceta 348 (1996), 370-374; Muhlhauser, Circ. Res. 77 (1995), 1077-1086; Onodera, Sangue 91; (1998), 30-36; Verma, Gene Ther. 5 (1998), 692-699; Nabel, Ann. N.Y. Acad. Sci .: 811 (1997), 289-292; Verzeletti, Hum. Gene Ther. 9 (1998),2243-51; Wang, Nature Medicine 2 (1996), 714-716; WO 94/29469; WO 97/00957, US 5,580,859; US 5,5895466; OU Schaper, Current Opinion in Biotechnology 7 (1996), 635-640. Por exemplo, expressão in situ de fragmentos ScFv 25 (Afanasieva et al., Gene Ther., 10, 1850-1859 (2003)) e de diabodies (Blanco et al., J. 0 Immunol, 171, 1070-1077 (2003)) foi descrito na técnica.
Para a expressão dos nanocorpos em uma célula, eles também podem ser expressos como chamados "intracorpos", 30 como, por exemplo, descrito em WO 94/02610, WO 95/22618 e US A-7004940; WO 03/014960; em Cattaneo, A. e Biocca, S. (1997) Intracellular Antibodies: Development and Applications. Landes e Springer-Verlag; e em Kontermann, Methods 34, (2004) , 163-170 .
Para a produção, os nanocorpos e os polipeptídios da invenção, por exemplo, também podem ser produzidos no leite de mamíferos transgênicos, por exemplo, no leite de coelhos, vacas, cabras ou ovelhas (ver, por exemplo, US A-6,741,957, US-A-6,304,489 e US-A-6,849,992 para técnicas gerais para introduzir transgenes em mamíferos), em plantas ou partes de 5 plantas inclusive mas não limitado às suas folhas, flores, frutos, semente, raízes ou tubérculos (por exemplo em fumo, milho, feijão-soja ou alfafa) ou em, por exemplo, pupas do bicho da seda Bombyx mori.
Além disso, os nanocorpos e os polipeptídios da 10 invenção também podem ser expressos e/ou produzidos em sistemas de expressão sem célula, e os exemplos convenientes de tais sistemas serão claros para a pessoa experimentada. Alguns exemplos preferidos, mas não-restritivos incluem a expressão no sistema de germe de trigo; em reticulocite 15 lysates em coelhos; ou no sistema E. coli Zubay.
Conforme acima mencionado, uma das vantagens do uso de nanocorpos é que os polipeptídios baseados neles podem estar preparados através de expressão em um sistema bacteriano conveniente, e sistemas de expressão bacterianos 20 convenientes, vetores, células hospedeiras, os elementos reguladores, etc., serão claros para a pessoa experimentada, por exemplo, das referências citadas anteriormente. Deve contudo ser observado que a invenção no seu sentido mais amplo não é limitada à expressão em sistemas bacterianos.
Preferivelmente, na invenção, um (em vivo ou em vitro) sistema de expressão, como um sistema de expressão bacteriano, é usado que fornece os polipeptídios da invenção em uma forma que é conveniente para uso farmacêutico, e tais sistemas de expressão serão novamente claros para a pessoa experimentada. Como também ficará claro para a pessoa experimentada, os Polipeptídios da invenção convenientes para uso farmacêutico podem ser preparados usando técnicas para síntese de peptídeo.
Para produção em escala industrial, anfitriões 35 heterólogos preferidos para a produção (industrial) de nanocorpos ou proteína terapêutica que contém Nanocorpo inclui classes de E. coli, Pichia pastoris, S. cerevisiae que são convenientes para expressão/produção/fermentação em grande escala, e especialmente para expressão/produção/fermentação farmacêutica em grande escala. Os exemplos convenientes de tais classes serão claros para a pessoa experimentada. Tais classes e os sistemas de produção/expressão também são postos à disposição por companhias como Biovitrum (Úpsala, Suécia).
Alternativamente, as linhas de célula de mamíferos, em determinadas células dos ovários de hamster chinês (CHO), podem ser usadas para expressão/produção/fermentação em grande escala, e especialmente para expressão/produção/fermentação farmacêutica em grande escala. Novamente, tais sistemas de expressão/produção também são postos à disposição por algumas companhias acima mencionadas.
A escolha do sistema de expressão específico dependeria em parte do requisito para certas modificações pós- translação, mais especificamente glicosilação. A produção de 20 uma proteína recombinante que contenha Nanocorpo para a qual a glicosilação é desejada ou requerida exigiria o uso de anfitriões de expressão mamíferos que têm a capacidade de glicosilar a proteína expressa. Neste aspecto, estará claro para a pessoa experimentada que o modelo de glicosilação obtido (isto é, a espécie, número e posição de residues ligados) dependerá da linha de célula ou célula que é usada para a expressão. Preferivelmente, uma linha de célula ou célula humana é usada (isto é, levar a uma proteína que essencialmente tem um modelo da glicosilação humana) ou 30 outra linha de célula de mamífero é usada que pode fornecer um modelo de glicosilação que é essencialmente e/ou funcionalmente o mesmo como glicosilação humana ou pelo menos imita glicosilação humana. Geralmente, anfitriões procarióticos como E. coli não têm a capacidade de 35 glicosilar proteína, e o uso de eucariotes inferiores como levedura que normalmente leva a um modelo de glicosilação que se diferencia da glicosilação humana. Sem embargo, deve ser entendido que todas as células hospedeiras precedentes e os sistemas de expressão podem ser usados na invenção, dependendo do Nanocorpo desejado ou proteína a ser obtida.
Portanto, segundo uma modalidade de execução não restritiva da invenção, o Nanocorpo ou o polipeptídio da invenção é glicosilado. Segundo outra modalidade de execução não-restritiva da invenção, o Nanocorpo ou o polipeptídio da invenção é não-glicosilado.
Segundo uma modalidade de execução preferencial, mas não-restritiva da invenção, o Nanocorpo ou o polipeptídio da invenção é produzido em uma célula bacteriana, especialmente uma célula bacteriana conveniente para produção farmacêutica em grande escala, como as células das classes acima 15 mencionadas.
Segundo outra modalidade de execução preferida, mas não-restritiva da invenção, o Nanocorpo ou o polipeptídio da invenção é produzido em uma célula de levedura, especialmente uma célula de levedura conveniente para 20 produção farmacêutica em grande escala, como as células da espécie acima mencionada.
Segundo ainda outra modalidade de execução preferida, mas não-restritiva da invenção, o Nanocorpo ou o polipeptídio da invenção é produzido em uma célula de 25 mamífero, especialmente em uma célula humana ou em uma célula de uma linha de célula humana, e mais especialmente em uma célula humana ou em uma célula de uma linha de célula humana que é conveniente a para produção farmacêutica em grande escala, como as linhas de célula mencionadas mais 30 acima.
Quando a expressão em uma célula hospedeira é usada para produzir os nanocorpos e a proteína da invenção, os nanocorpos e a proteína da invenção podem ser produzidos intracelularmente (p. ex. no cytosol, no periplasma ou em 35 corpos de inclusão) e logo isolados das células hospedeiras e opcionalmente além disso purificados; ou podem ser produzidos extracelularmente (p. ex. no meio no qual as células hospedeiras são cultivadas) e logo isolados do meio de cultura e opcionalmente além disso purificados. Quando as células hospedeiras eucarióticas são usadas, a produção 5 extracelular é normalmente preferida desde que isto consideravelmente facilita a nova isolação e processamento posterior dos nanocorpos e proteína obtida. As células bacterianas como as classes de E. coli acima mencionadas normalmente não segregam a proteína extracelularmente, 10 exceto algumas classes da proteína como toxinas e hemolisina, e produção secretores em E. o coli refere-se à deslocamento da proteína através da membrana interior ao espaço periplásmico. A produção de Periplásmico fornece várias vantagens acima da produção citosólica. Por exemplo, 15 a seqüência ácida do N-terminal amino do produto segregado pode ser idêntica ao produto genético natural depois da rachadura da seqüência de sinal de secreção por um sinal específico peptidase. Também, parece haver muito menos atividade de protease no periplasma do que no citoplasma.
Além do mais, a purificação de proteína é mais simples devido a menos proteína de contaminação no periplasma. Outra vantagem é que as ligações bissulfeto corretas podem formar- se porque o periplasma fornece mais ambiente oxidativo do que o citoplasma. A proteína sobreexpressada em E. coli freqüentemente é encontrada em agregados insolúveis, assim chamados corpos de inclusão. Esses corpos de inclusão podem ser localizados no cytosol ou no periplasma; a recuperação da proteína biologicamente ativa desses corpos de inclusão requer um processo de denaturação/repregado. Muita proteína 30 recombinante, inclusive a proteína terapêutica, é recuperada de corpos de inclusão. Alternativamente, como estará claro para a pessoa experimentada, classes recombinantes de bactérias que foram geneticamente modificadas para segregar uma proteína desejada, e especialmente um Nanocorpo ou um polipeptídio da invenção, pode ser usado.
Portanto, segundo uma modalidade de execução não- restritiva da invenção, o Nanocorpo ou o polipeptídio da invenção ê um Nanocorpo ou o polipeptídio que foi produzido intracelularmente e foi isolado da célula hospedeira, e especialmente de uma célula bacteriana ou de um corpo de 5 inclusão em uma célula bacteriana. Segundo outra modalidade de execução não-restritiva da invenção, o Nanocorpo ou o polipeptídio da invenção é um Nanocorpo ou o polipeptídio que foi produzido extracelularmente, e foi isolado do meio no qual a célula hospedeira é cultivada.
Alguns promotores preferidos, mas não-restritivos para uso com essas células hospedeiras incluem,- para expressão em E. coli: promotor de lac (e derivados disso como o promotor lacUV5); promotor de arabinose; promotor esquerda-(PL) e direita-(PR) de lambda fago; promotor do trp operon; híbrido lac/trp promotores (tac e trc); T7-promotor (mais especificamente que de 10 genes T7- fago) e outros promotores T-fago; promotor do Gene TnlO resistente à tetraciclina; as variantes projetadas dos promotores acima mencionados que incluem uma ou várias cópias de uma seqüência de operador reguladora estranha;- para expressão em S. cerevisiae: constitutivo: ADH1 (álcool dehidrogenase 1), ENO (enolase), CYC1 (citocromo c iso-1), GAPDH (gliceraldeidos-3-fosfato dehidrogenase); PGK1 (fosfoglicerato quinase), PYK1 (piruvato quinase); regulado: GALl,10,7 (galactose enzimas metabólicas), ADH2 (álcooldehidrogenase 2), PHO5 (ácido fosfatase), CUP1 (cobre metalotioneina) ; heterólogo: CaMV (promotor de 35 de vírus de mosaico de couve-flor);- para expressão em Pichia pastoris: o promotor A0X1 (álcool 30 oxidase I)- para expressão em células de mamíferos: cytomegalovirus humano (hCMV) primeiro realçador/promotor imediato; cytomegalovirus humano (hCMV) primeira variante de promotor imediata que contém duas seqüências de operador tetraciclina 35 tal que o promotor pode ser regulado pelo Tet repressor;Promotor de timidina quinase (TK) do Vírus de Herpes Simplex; realçador/promotor de repetição terminal longa do Vírus de Sarcoma de Rous (RSV LTR) ; promotor de ser humano, chimpanzé, rato ou camundongo de fator de alongamento 1 a (hEF-1 a); o primeiro promotor SV40; HIV-1 promotor de 5 repetição terminal longo; Promotor de ü-actin;
Alguns que os vetores preferidos, mas não-restritivos para uso com essas células hospedeiras incluem:- vetores para expressão em células de mamíferos: pMAMneo (Clontech) , pcDNA3 (Invitrogen) , pMClneo (Stratagene) , pSG5 10 (Stratagene), EBO-pSV2-neo (ATCC 37593), pBPV-1 (8-2) (ATCC 37110), pdBPV-MMTneo (342-12) (ATCC 37224), pRSVgpt (ATCC37199), pRSVneo (ATCC37198), pSV2-dhfr (ATCC 37146), pUCTag (ATCC 37460) e 1ZD35 (ATCC 37565), bem como sistemas de expressão virais, como aqueles baseados em adenovirus;- vetores para expressão em células bacteriais: vetores de estimação (Novagen) e vetores pQE (Qiagen);- vetores para expressão em levedura ou outras células fungosas: pYES2 (Invitrogen) e vetores de expressão Pichia (Invitrogen); - vetores para expressão em células de inseto: pBlueBacII (Invitrogen) e outros vetores baculovirus- vetores para expressão em plantas ou células de planta:, por exemplo, os vetores baseados em vírus de mosaico de couve-flor ou vírus de mosaico de fumo, as classes 25 convenientes do Agrobacterium, ou Vetores baseados em Ti- plasmídeo.
Algumas seqüências secretoras preferidas, mas não-limitadas para uso com essas células hospedeiras incluem:- para uso em células bacterianas como E. coli: PelB, Bla, 30 OmpA, OmpC, OmpF, OmpT, Stll, PhoA, PhoE, MalE, Lpp, LamB, e assim por diante; peptídeo de sinal TAT, sinal de secreção de C-terminal hemolisina- para uso em levedura: prepro-seqüência de fator de a- acoplamento, fosfatase (phol), invertase (Sue), etc.; - para uso em células de mamíferos: sinal nativo em caso de que a proteína objetivo seja de origem eucariótica; peptídeo de sinal V-J2-C de K-cadeia de Ig murina; etc.
As técnicas convenientes que para transformar uma 5 célula hospedeira ou hospedeiro da invenção serão claras à pessoa experimentada e podem depender do organismo hospedeiro/ célula hospedeira desejado e os construtos genéticos a serem usados. A referência é novamente feita aos manuais e pedidos de patentes acima mencionados.
Depois da transformação, um passo para detectar e selecionar aquelas células hospedeiras ou organismos hospedeiros que foram com sucesso transformados com a seqüência de nucleotídeos / construto genético da invenção pode ser executado. Isto pode ser, por exemplo, um passo de 15 seleção baseado em um marcador selecionável presente no construto genético da invenção ou um passo que implica a detecção da seqüência aminoácida da invenção, p. ex. usando anticorpos específicos.
A célula hospedeira transformada (que pode estar na 20 forma de uma linha de célula estável) ou organismos hospedeiros (que pode ser na forma de uma linha ou classe mutante estável) formam novos aspectos da presente invenção.
Preferivelmente, essas células hospedeiras ou os organismos hospedeiros são tais que eles expressam, ou são 25 (pelo menos) capazes de expressar (p. ex. em condições convenientes), uma seqüência aminoácida da invenção (e em caso de um organismo hospedeiro: em pelo menos uma célula, parte, tecido ou órgão disso). A invenção também inclui novas gerações, progénie e/ou descendência da célula 30 hospedeira ou o organismo hospedeiro da invenção, que pode ser, por exemplo, obtida pela divisão de célula ou pela reprodução sexual ou assexual.
Produzir/obter a expressão das seqüências aminoácidas da invenção, a célula hospedeira transformada ou o organismo 35 hospedeiro transformado podem ser geralmente guardados, mantidos e/ou cultivados em condições tais que a seqüência aminoácida (desejada) da invenção é expressada/produzida. As condições convenientes serão claras à pessoa experimentada e dependerão normalmente do organismo hospedeiro/ célula hospedeira usado, bem como dos elementos reguladores que 5 controlam a expressão da seqüência de nucleotídeos (relevante) da invenção. Novamente, é feita referência aos manuais e pedidos de patentes acima mencionados nos parágrafos no construto genético da invenção.
Geralmente, as condições convenientes podem incluir o uso de um meio conveniente, a presença de uma fonte conveniente de nutrimentos alimentares e/ou convenientes, o uso de uma temperatura conveniente, e opcionalmente a presença de um fator de indução ou composto conveniente (p. ex. quando as seqüências de nucleotídeos da invenção estão 15 sob o controle de um promotor induzível) ; todos os quais podem ser selecionados pela pessoa experimentada. Novamente, em tais condições, as seqüências aminoácidas da invenção podem ser expressas em uma maneira constitutiva, de uma maneira transiente, ou só quando apropriadamente induzido.
Também estará claro para a pessoa experimentada que a seqüência aminoácida da invenção pode ser (primeiro) gerada em uma forma imatura (como acima mencionado), que então pode ser submetida à modificação pós-translação, dependendo do organismo hospedeiro/ célula hospedeira usado. Também, a 25 seqüência aminoácida da invenção pode ser glicosilada, novamente dependendo do organismo hospedeiro/ célula hospedeira usado.
A seqüência aminoácida da invenção então pode ser isolada do organismo hospedeiro/ célula hospedeira e/ou do 30 meio no qual as referidas células hospedeiras ou organismos hospedeiros foram cultivados, usando isolação de proteína e/ou técnicas de purificação conhecidas por si, como cromatografia (preparativo) e/ou técnicas de eletroforese, técnicas de precipitação diferenciais, técnicas de afinidade 35 (p. ex. usando uma seqüência aminoácida específica, separável fundida com a seqüência aminoácida da invenção) e/ou técnicas imunológicas preparativas (isto é, usando anticorpos contra a seqüência aminoácida a ser isolada).
Geralmente, para uso farmacêutico, os polipeptídios da invenção podem ser formulados como uma preparação farmacêutica que compreende pelo menos um polipeptídio da invenção e pelo menos uma transportadora farmaceuticamente aceitável, diluente ou excipiente e/ou adjuvante, e opcionalmente um ou vários polipeptídios novos farmaceuticamente ativos e/ou compostos. Por meio de exemplos não-restritivos, tal formulação pode estar em uma forma conveniente para administração oral, para administração parenteral (como por injeção intravenosa, intramuscular ou subcutânea ou infusão intravenosa), para administração tópica, para administração pela inalação, por um adesivo na pele, por um implante, por um supositório, etc... . Tais formas de administração convenientes - que pode ser sólido, semi-sólido ou líquido, dependendo da maneira de administração - bem como métodos e transportadoras para uso na preparação disso, serão claras à pessoa experimentada, e são além disso descritas a seguir.
Geralmente, os nanocorpos e os polipeptídios da invenção podem ser formulados e administrados em qualquer maneira conveniente conhecida por si, para que referência, por exemplo, é feita à fundamentos técnicos gerais citada anteriormente (e especialmente a WO 04/041862, WO 04/041863, WO 04/041865 e WO 04/041867) bem como aos manuais padrão, como Remington's Pharmaceuticals Sciences, 18o ed. , Mack Publishing Co., USA (1990) ou Remington, Sciences and Practice of Pharmacy, 21a Ed., Lippincott Williams e Wilkins (2005) .
Por exemplo, os nanocorpos e os polipeptídios da invenção podem ser formulados e administrados em qualquer maneira conhecida por si para anticorpos convencionais e fragmentos de anticorpo (inclusive ScFv e diabodies) e outra proteína farmaceuticamente ativa. Tais formulações e métodos para preparar o mesmo serão claros para a pessoa experimentada, e, por exemplo, incluirão preparações convenientes para administração parenteral (por exemplo intravenoso, intraperitoneal, subcutâneo, intramuscular, intraluminal, administração intra-arterial ou intratecal) ou 5 para administração tópica (isto é, transdérmica ou intradérmica).
As preparações a para administração parenteral, por exemplo, podem ser soluções estéreis, suspensões, dispersões ou emulsões que são convenientes para a infusão ou a 10 injeção. As transportadoras convenientes ou os diluentes para tais preparações, por exemplo, incluem, sem restrição, água estéril e buffers aquosos e soluções salinas armazenada em buffer por fosfato fisiológico, soluções de Ringer, solução de dextrose, e solução de Hank; óleos aquosos; glicerol; etanol; glicol como glicol de propileno ou bem como óleos minerais, óleos animais e óleos vegetais, por exemplo, óleo de amendoim, óleo de feijão-soja, bem como misturas convenientes disso. Normalmente, soluções aquosas ou suspensões serão preferidas.
Os nanocorpos e os polipeptídios da invenção também podem ser administrados usando métodos de administração de terapia genética. Ver, p. ex.,Patente U.S. n. 5,399,346, que é incorporada por referência em sua totalidade. Usando um método de administração por terapia genética, as células primárias transfetadas com o gene que codifica um Nanocorpo ou o polipeptídio da invenção podem ser adicionalmente transfetadas com promotores específicos de tecido para visar órgãos específicos, tecido, enxertos, tumores, ou células e ser adicionalmente transfetadas com o sinal e as seqüências 30 de estabilização para expressão localizada subcelularmente .
Portanto, os nanocorpos e os polipeptídios da invenção podem ser sistemicamente administrados, p. ex., oralmente, em combinação com um veículo farmaceuticamente aceitável como um diluente inerte ou uma transportadora comestível 35 assimilável. Eles podem ser incluídos em cápsulas de gelatina de capas duras ou suaves, podem ser compressos em pastilhas, ou incorporados diretamente com a comida da dieta do paciente. Para a administração terapêutica oral, os nanocorpos e os polipeptídios da invenção podem ser combinados com um ou vários excipientes e usados na forma de 5 pastilhas ingeríveis, pastilhas bucais, pastilhas, cápsulas, elixires, suspensões, xaropes, bolinhos delgados, e assim por diante. Tais composições e as preparações devem conter pelo menos 0,1% do Nanocorpo ou o polipeptídio da invenção. A porcentagem das composições e preparações pode ser, 10 naturalmente, variada e pode estar convenientemente entre aproximadamente 2 a aproximadamente 60% do peso de uma forma de dosagem de unidade dada. A quantidade do Nanocorpo ou o polipeptídio da invenção em tais composições terapeuticamente úteis é tal que um nível de dosagem eficaz 15 será obtido.
As pastilhas, comprimidos, pílulas, cápsulas, e assim por diante também podem conter o seguinte: aglutinantes como goma tragacanth, acácia, amido de grão ou gelatina; excipientes como fosfato bicálcico; um agente que se 20 desintegra como amido de grão, amido de batatas, algínico ácido e assim por diante; um lubrificante como magnésio estearato; e um agente de adoçamento como sacarose, fructose, lactose ou aspartame ou um agente de sabor como hortelã, o óleo de pirola, ou sabor de cereja pode ser 25 acrescentado. Quando a forma de dosagem de unidade é uma cápsula, ela pode conter, além de materiais do tipo acima mencionado, um portador líquido, como um óleo vegetal ou um glicol de polietileno. Vários outros materiais podem estar presentes como revestimentos ou modificar de outra maneira a 30 forma física da forma de dosagem de unidade sólida. Por exemplo, as pastilhas, as pílulas, ou as cápsulas podem ser cobertas de gelatina, cera, goma-laca ou açúcar e assim por diante. Um xarope ou o elixir podem conter os nanocorpos e polipeptídios da invenção, sacarose ou fructose como um 35 agente de adoçamento, metila e propilparabenos como preservantes, uma tintura e sabor como sabor de cereja ou cor de laranja. Naturalmente, qualquer material usado na preparação de qualquer forma de dosagem de unidade deve ser farmaceuticamente aceitável e substancialmente não-tóxica nas quantidades empregadas. Além do mais, os nanocorpos e os 5 polipeptídios da invenção podem ser incorporados em preparações e dispositivos de administração prolongada.
As preparações e as formulações a para administração oral também podem ser munidas de um revestimento entérico que permitirá que o construto da invenção resista o ambiente 10 gástrico e a passagem nos intestinos. Mais geralmente, as preparações e as formulações para administração oral podem ser apropriadamente formuladas para administração em qualquer parte desejada do trato gastrintestinal. Além do mais, supositórios convenientes podem ser usados para 15 administração no trato gastrintestinal.
Os nanocorpos e os polipeptídios da invenção também podem ser administrados intravenosamente ou intraperitonealmente por infusão ou injeção. As soluções dos nanocorpos e os polipeptídios da invenção ou os seus sais 20 podem ser preparadas em água, opcionalmente misturada com um surfactante não-tóxico. As dispersões também podem ser preparadas em glicerol, glicol de polietileno líquido, triacetin, e misturas disso e em óleos. Em condições ordinárias de armazenamento e uso, essas preparações contêm 25 um conservante para prevenir o crescimento de microrganismos.
As formas de dosagem farmacêuticas convenientes para a injeção ou a infusão podem incluir soluções aquosas estéreis ou dispersões ou pó estéril que compreendem o ingrediente 30 ativo que é adaptado para a preparação extemporânea de soluções injetáveis ou infusíveis estéreis ou dispersões, opcionalmente encapsuladas em lipossomas. Em todos os casos, a forma de dosagem última deve ser estéril, fluida e estável nas condições de fabricação e armazenamento. A 35 transportadora líquida ou o veículo podem ser um meio de dispersão solvente ou líquido, compreendendo, por exemplo, água, etanol, um poliol (por exemplo, glicerol, glicol de propileno, glicol de polietileno líquido, e assim por diante), óleos vegetais, ésteres gliceril não-tóxicos , e misturas convenientes disso. A fluidez apropriada pode ser 5 mantida, por exemplo, pela formação de lipossomas, pela manutenção do tamanho de partícula requerido em caso de dispersões ou pelo uso de surfactantes. A prevenção da ação de microrganismos pode ser ocasionada por vários agentes antibacterianos e antifungosos, por exemplo, parabenos, 10 clorobutanol, fenol, ácido sórbico, timerosal, e assim por diante. Em muitos casos, será preferível incluir agentes isotônicos, por exemplo, açúcar, buffers ou cloreto de sódio. A absorção prolongada das composições injetáveis pode ser ocasionada pelo uso nas composições de agentes que 15 atrasam absorção, por exemplo, alumínio monostearato e gelatina.
As soluções injetáveis estéreis estão preparadas incorporando os nanocorpos e os polipeptídios da invenção na quantidade requerida no solvente apropriado com vários de 20 outros ingredientes enumerados anteriormente, como requerido, seguido pela esterilização com filtro. Em caso do pó estéril para a preparação de soluções injetáveis estéreis, os métodos preferenciais da preparação são a secagem à vácuo e a técnicas de secagem por congelamento, 25 que produzem um pó do ingrediente ativo mais qualquer presente de ingrediente desejado adicional nas soluções anteriormente estéreis-filtradas.
Para administração tópica, os nanocorpos e os polipeptídios da invenção podem ser aplicados na forma pura, 30 isto é, quando eles são líquidos. Contudo, será geralmente desejável administrá-los à pele como composições ou formulações, em combinação com uma transportadora dermatologicamente aceitável, que pode ser um sólido ou um líquido.
Os portadores sólidos úteis incluem sólidos finamente divididos como talco, barro, celulose microcristalina, sílica, alumina e assim por diante. Os portadores líquidos úteis incluem água, hidroálcalis ou glicol ou misturas de água-álcool/glicol, nas quais os nanocorpos e os polipeptídios da invenção podem ser dissolvidos ou 5 dispersados a níveis eficazes, opcionalmente com a ajuda de surfactantes não-tóxicos. Adjuvantes como fragrâncias e agentes antimicrobials adicionais podem ser acrescentados para otimizar as propriedades para um uso dado. As composições líquidas resultantes podem ser aplicadas de 10 almofadas absorventes, usadas para impregnar bandagens e outro curativos, ou borrifados na área afetada que usa pulverizadores de aerossol ou tipo de bomba.
Os espessantes como polímero sintético, ácidos gordurosos, sais e ésteres de ácidos gordurosos, álcoois 15 gordurosos, celuloses modificadas ou materiais minerais modificados também podem ser empregados com transportadoras líquidas para formar pastas para borrifar, géis, unguentos, sabões, e assim por diante, para aplicação diretamente à pele do usuário.
Exemplos de composições dermatológicas úteis que podem ser usadas para entregar os nanocorpos e polipeptídios da invenção à pele são conhecidos na técnica; por exemplo, ver Jacquet et al. (U.S. Pat. N° . 4,608,392), Geria (U.S. Pat. N°. 4,992,478), Smith et al. (U.S. Pat. N°. 4,559,157) e Wortzman (U.S. Pat. N°. 4,820,508).
As dosagens úteis dos nanocorpos e os polipeptídios da invenção podem ser determinados comparando sua atividade in vitro, e na atividade in vivo em modelos animais. Os métodos para a extrapolação de dosagens eficazes em ratos, e outros 30 animais, a seres humanos são conhecidos na técnica; por exemplo, ver U.S. Pat. N°. 4,938,949.
Geralmente, a concentração dos nanocorpos e os polipeptídios da invenção em uma composição líquida, como uma loção, será de aproximadamente 0,1-25 wt-%, preferivelmente de aproximadamente 0,5-10 wt-%. A concentração em uma composição semi-sólida ou sólida como um gel ou um pó será aproximadamente 0,1-5 wt-%, preferivelmente aproximadamente 0,5-2.5 wt-%.
A quantidade dos nanocorpos e os polipeptídios da invenção requeridos para uso no tratamento variam não só com 5 o Nanocorpo ou polipeptídio determinado selecionado mas também com a via de administração, a natureza da condição que é tratada e a idade e a condição do paciente e será enfim à discrição do médico ou clínico atendente. Também a dosagem dos nanocorpos e os polipeptídios da invenção variam 10 dependendo da célula objetivo, tumor, tecido, enxerto, ou órgão.
A dose desejada pode ser convenientemente apresentada em uma dose única ou como doses divididas administradas em intervalos apropriados, por exemplo, como dois, três, quatro 15 ou mais sub-doses por dia. A própria sub-dose pode ser além disso dividida, p. ex. , em um número de administrações discretas livremente espaçadas; como múltiplas inalações de um insuflador ou pela aplicação de uma pluralidade de gotas no olho.
Um regime de administração pode incluir o tratamento de longo prazo, diário. Por "de longo prazo" se entende pelo menos duas semanas e preferivelmente, várias semanas, meses, ou anos da duração. As modificações necessárias nesta variedade de dosagem podem ser determinadas por uma 25 habilidade ordinária na técnica usando só experimentação de rotina dada nos ensinamentos na presente. Ver Remington's Pharmaceuticals Sciences (Martin, E.W., editor 4), Mack Publishing Co, Easton, PA. A dosagem também pode ser ajustada pelo médico individual no caso de qualquer 30 complicação.
Em outro aspecto, a invenção se refere a um método para a prevenção e/ou o tratamento de pelo menos cada uma das doenças ou desordens relativos a TNF conforme mencionado na presente, o referido método compreendendo a administração, a 35 um sujeito na necessidade disso, de uma quantidade farmaceuticamente ativa de um Nanocorpo da invenção, de um polipeptídio da invenção, e/ou de uma composição farmacêutica que compreende o mesmo.
No contexto da presente invenção, o termo "prevenção e/ou tratamento" não só compreende a prevenção e/ou o 5 tratamento da doença, mas também geralmente compreendem a prevenção do ataque da doença, redução de velocidade ou reversão do progresso de doença, prevenção ou redução de velocidade do ataque de um ou vários sintomas associados com a doença, redução e/ou alívio de um ou vários sintomas 10 associados com a doença, redução da gravidade e/ou a duração da doença e/ou de qualquer sintoma associado com isso e/ou prevenção de um novo aumento na gravidade da doença e/ou de qualquer sintoma associado com isso, prevenção, redução ou reversão de qualquer dano fisiológico causado pela doença, e 15 geralmente qualquer ação farmacológica que é benéfica ao paciente que é tratado.
O sujeito a ser tratado pode ser qualquer animal de sangue quente, mas é especialmente um mamífero, e mais especialmente um ser humano. Como estará claro para a pessoa 20 experimentada, o sujeito a ser tratado será especialmente uma pessoa que sofre de, ou em perigo de, as doenças e desordens mencionadas na presente.
A invenção se refere a um método para a prevenção e/ou o tratamento de pelo menos uma doença ou desordem que pode 25 ser prevenida e/ou tratada administrando um Nanocorpo ou polipeptídio da invenção a um paciente, o referido método compreendendo a administração a um sujeito na necessidade disso, de uma quantidade farmaceuticamente ativa de um Nanocorpo da invenção, de um polipeptídio da invenção, e/ou 30 de uma composição farmacêutica que compreende o mesmo.
Mais especialmente, a invenção se refere a um método para a prevenção e/ou o tratamento de pelo menos uma doença ou desordem escolhida do grupo composto das doenças e desordens enumeradas na presente, o referido método 35 compreendendo a administração, a um sujeito na necessidade disso, de uma quantidade farmaceuticamente ativa de um
Nanocorpo da invenção, de um polipeptídio da invenção, e/ou de uma composição farmacêutica que compreende o mesmo.
Em outra modalidade de execução, a invenção se refere a um método para a imunoterapia, e especialmente para 5 imunoterapia passiva, cujo método compreende a administração, a um sujeito que sofre de ou está em perigo das doenças e desordens mencionadas na presente, uma quantidade farmaceuticamente ativa de um Nanocorpo da invenção, de um polipeptídio da invenção, e/ou de uma 10 composição farmacêutica que compreende o mesmo.
Nos acima mencionados métodos, os nanocorpos e/ou os polipeptídios da invenção e/ou as composições que compreendem o mesmo podem ser administrados em qualquer maneira conveniente, dependendo da formulação farmacêutica 15 específica ou composição a ser usada. Portanto, os nanocorpos e/ou os polipeptídios da invenção e/ou as composições que compreendem os mesmos, por exemplo, podem ser administrados oralmente, intraperitonealmente (p. ex. intravenosamente, subcutaneamente, intramuscularmente, ou 20 via qualquer outra via de administração que acesse o trato gastrintestinal), intranasalmente, transdermicamente, topicamente, por meio de um supositório, pela inalação, novamente dependendo da formulação farmacêutica específica ou composição a ser usada. O clínico será capaz de 25 selecionar uma via conveniente de administração e uma formulação farmacêutica conveniente ou composição a ser usada em tal administração, dependendo da doença ou desordem a ser prevenida ou tratada e outro fatores bem conhecidos ao clínico.
O nanocorpos e/ou os polipeptídios da invenção e/ou as composições que compreendem o mesmo são administrados segundo um regime do tratamento que é conveniente para a prevenção e/ou o tratamento da doença ou desordem a ser prevenida ou tratada. O clínico será geralmente capaz de determinar um regime de tratamento conveniente, dependendo de fatores como a doença ou desordem a ser prevenida ou tratada, a gravidade da doença a ser tratada e/ou a gravidade dos sintomas disso, o Nanocorpo específico ou o polipeptídio da invenção a ser usado, a via específica de administração e formulação farmacêutica ou composição a ser 5 usada, a idade, gênero, peso, dieta, a condição geral do paciente, e fatores semelhantes bem conhecidos ao clínico.
Geralmente, o regime de tratamento compreenderá a administração de um ou vários nanocorpos e/ou os polipeptídios da invenção, ou de uma ou várias composições 10 que compreendem os mesmos, em uma ou várias quantidades farmaceuticamente eficazes ou doses. A quantidade(s) específica ou as doses a serem administradas podem ser determinadas pelo clínico, novamente baseado nos fatores citados anteriormente.
Geralmente, para a prevenção e/ou o tratamento das doenças e desordens mencionadas na presente e dependendo da doença específica ou desordem a ser tratada, a potência do Nanocorpo específico e o polipeptídio da invenção a ser usado, a via específica de administração e a formulação farmacêutica específica ou composição usada, os nanocorpos e polipeptídios da invenção serão geralmente administrados em uma quantidade entre 1 grama e 0,01 microgramas por peso de corpo de quilograma por dia, preferivelmente entre 0,1 gramas e 0,1 microgramas por peso de corpo de quilograma por dia, como aproximadamente 1, 10, 100 ou 1000 microgramas por peso de corpo de quilograma por dia, qualquer continuamente {p. ex. pela infusão), como uma dose diária única ou como múltiplas doses divididas durante o dia. 0 clínico será geralmente capaz de determinar uma dose diária conveniente, dependendo dos fatores mencionados na presente. Também ficará claro que em casos específicos, o clínico pode decidir desviar-se dessas quantidades, por exemplo, com base nos fatores citados anteriormente e o seu juízo de perito. Geralmente, um pouco de orientação nas quantidades a ser 35 administradas pode ser obtida das quantidades normalmente administradas para anticorpos convencionais comparáveis ou fragmentos de anticorpo contra o mesmo objetivo administrado via essencialmente a mesma rota, considerando contudo diferenças em afinidade/avidez, eficácia, biodistribuição, meia-vida e fatores semelhantes bem conhecidos a pessoa 5 experimentada.
Normalmente, no acima mencionado método, um Nanocorpo único ou o polipeptídio da invenção serão usados. É contudo dentro dos limites da invenção para usar dois ou mais nanocorpos e/ou polipeptídios da invenção em combinação.
Os nanocorpos e os polipeptídios da invenção também podem ser usados em combinação com um ou vários compostos ou princípios novos farmaceuticamente ativos, isto é, como um regime de tratamento combinado, que pode ou pode não levar a um efeito sinergístico. Novamente, o clínico será capaz de 15 selecionar tais novos compostos ou princípios, bem como um regime de tratamento combinado conveniente, baseado nos fatores citados anteriormente e o seu juízo de perito.
Especialmente, os nanocorpos e os polipeptídios da invenção podem ser usados em combinação com outros compostos 20 farmaceuticamente ativos ou princípios que são ou podem ser usados para a prevenção e/ou o tratamento das doenças e desordens citadas na presente, em conseqüência do qual um efeito sinergístico pode ou não ser obtido. Os exemplos de tais compostos e princípios, bem como vias, métodos e 25 formulações farmacêuticas ou composições que para os administram serão claros ao clínico.
Quando duas ou mais substâncias ou princípios devem ser usados como parte de um regime de tratamento combinado, eles podem ser administrados via a mesma rota de administração ou 30 via rotas diferentes da administração, em essencialmente o mesmo tempo ou em tempos diferentes (p. ex. essencialmente simultaneamente, consecutivamente, ou segundo um regime alternante). Quando as substâncias ou os princípios são administrados para ser simultaneamente via a mesma rota de 35 administração, eles podem ser administrados como formulações farmacêuticas diferentes ou composições ou parte de uma formulação farmacêutica combinada ou composição, como estará claro para a pessoa experimentada.
Também, quando duas ou mais substâncias ativas ou princípios devem ser usados como parte de um regime de 5 tratamento combinado, cada uma das substâncias ou princípios pode ser administrada na mesma quantidade e segundo o mesmo regime que usado quando o composto ou o princípio são usados sozinhos, e tal uso combinado pode ou não levar a um efeito sinergístico. Contudo, quando o uso combinado de duas ou 10 mais substâncias ativas ou princípios leva a um efeito sinergístico, também pode ser possível reduzir a quantidade de um, mais ou todas das substâncias ou princípios a ser administrados, ainda realizando a ação terapêutica desejada. Isto, por exemplo, pode ser útil para a evitação, a 15 limitação ou a redução de qualquer efeito colateral não desejado que se associa com o uso de uma ou várias das substâncias ou princípios quando eles são usados nas suas quantidades habituais, ainda obtendo o efeito farmacêutico ou terapêutico desejado.
A eficácia do regime de tratamento usado segundo a invenção pode ser determinada e/ou seguida em qualquer maneira conhecida por si para a doença ou a desordem implicada, como serão claras ao clínico. O clínico também será capaz, onde apropriado e/ou em uma base de caso-por- 25 caso, de mudar ou modificar um determinado regime de tratamento, para realizar o efeito terapêutico desejado, para evitar, para limitar ou reduzir efeitos colaterais não desejados, e/ou realizar um equilíbrio apropriado entre a realização do efeito terapêutico desejado de um lado e 30 evitação, limitação ou redução dos efeitos colaterais indesejados de outro lado.
Geralmente, o regime de tratamento será seguido até que o efeito terapêutico desejado seja realizado e/ou contanto que o efeito terapêutico desejado seja mantido. Novamente, 35 isto pode ser determinado pelo clínico.
Portanto, em um novo aspecto, a invenção refere-se a uma composição farmacêutica que contém pelo menos um nanocorpo da invenção ou pelo menos um polipeptídio da invenção e pelo menos uma transportadora conveniente (isto é, uma transportadora conveniente para uso veterinário), e 5 opcionalmente uma ou várias novas substâncias ativas.
A invenção também se relaciona ao uso de um Nanocorpo da invenção e/ou de um polipeptídio da invenção na preparação de uma composição farmacêutica, especialmente na preparação de uma composição farmacêutica para a prevenção 10 e/ou tratamento (inclusive mas não se limitando ao alívio de pelo menos um sintoma) de uma doença ou desordem mediada pelo TNF-alfa e/ou associado com o TNF-alfa (por exemplo associado com uma atividade anormal do TNF-alfa, níveis anormais da expressão TNF-alfa, anormal da sensibilidade 15 TNF-alfa e/ou resposta anormal à TNF-alfa, ou de um dos fenômenos biológicos sensitivamente anormais ou responsivo ao TNF-alfa), como uma das doenças ou desordens acima mencionados.
A invenção também se refere a um método para prevenção e/ou tratamento (inclusive mas não se limitando ao alívio de pelo menos um sintoma) de uma doença ou desordem mediada pelo TNF-alfa e/ou associado com o TNF-alfa (por exemplo associado com uma atividade anormal do TNF-alfa, níveis anormais da expressão TNF-alfa, sensibilidade anormal TNF-alfa e/ou resposta anormal à TNF-alfa, ou de um dos fenômenos biológicos associados com o TNF-alfa), como uma das doenças ou desordens acima mencionado, cujo método compreende a administração a um sujeito na necessidade disso uma quantidade terapeuticamente ativa de um Nanocorpo da invenção, do polipeptídio da invenção, e/ou de uma composição farmacêutica conforme descrito acima.
A presente invenção fornece polipeptídios que compreendem um ou vários nanobodies dirigidos em direção ao fator Alfa de Necrose Tumoral (TNF-alfa). A presente 35 invenção além disso refere-se ao seu uso em diagnóstico e terapia. Tais anticorpos podem ter uma seqüência de armação com a alta homologia às seqüências de armação humanas. As composições que compreendem anticorpos ao fator Alfa de Necrose Tumoral (TNF-alfa) sozinha ou em combinação com outros fármacos são descritos.
Acredita-se que o fator Alfa de Necrose Tumoral (TNF-alfa) desempenha um papel importante em várias desordens, por exemplo, em desordens inflamatórias como artrite reumatóide, doença de Crohn, colite ulcerativa e esclerose múltipla. Tanto o TNF-alfa como os receptores (CD120a, 10 CD120b) foram estudados em grande detalhe. A TNF-alfa na sua forma bioativa é um trímero e a ranhura formada confinando subunidades é importante para a interação de citoquina- receptor. Várias estratégias de antagonizar a ação da citoquina foram desenvolvidas e são atualmente usadas para 15 tratar vários estados de doença.
Um inibidor TNF-alfa que tem a especificidade suficiente e a seletividade à TNF-alfa pode ser um composto farmacêutico profilático ou terapêutico eficiente para prevenir ou tratar desordens onde o TNF-alfa foi implicada 20 como agente causativo. Os métodos de tratar choque tóxico (EP 486526), regressão de tumor, inibição de citotoxicidade (US 6448380, US 6451983, US 6498237), doença autoimune como RA e doença de Crohn (EP 663836, US 5672347, US 5656272), enxerto contra a reação de hospedeira (US 5672347), 25 meningite bacteriana (EP 585705) por meio de um anticorpo à TNF-alfa foram descritos.
Ainda nenhum dos fármacos logo disponíveis é completamente eficaz para o tratamento da doença autoimune, e mais é limitada pela toxicidade severa. Além do mais, é 30 extremamente difícil e um longo processo para desenvolver uma nova entidade química (NCE) com potência suficiente e seletividade a tal seqüência de objetivo. A terapêutica à base de Anticorpo por outro lado tem o potencial significativo como fármacos porque eles têm a especificidade 35 seleta ao seu objetivo e uma toxicidade inerente baixa. Além do mais, o tempo de desenvolvimento pode ser reduzido consideravelmente quando em comparação com o desenvolvimento de novas entidades químicas (NCE's). Contudo, os anticorpos convencionais são difíceis de levantar contra a proteína multiméricas onde o domínio obrigatório de receptor do 5 ligando é embutido em uma ranhura, como é o caso com o TNF- alfa. Os anticorpos de cadeias pesadas descritos na invenção que são derivados de Camelidae, são conhecidos ter a propensão obrigatória de cavidade (WO97/49805; Lauwereys e al, EMBO J. 17, 5312, 1998)). Por isso, tais anticorpos de 10 cadeias pesadas são inerentemente ajustados para ligar ao receptor de domínios obrigatórios de tais ligandos como TNF. Além do mais, conhece-se que tais anticorpos são estáveis por cima de períodos de tempo longos, por isso aumentando o seu prazo da validade (Perez e al, Biochemistry, 40, 74, 2001). Além disso, tais fragmentos de anticorpo de cadeias pesadas podem ser produzidos 'em massa' em fermentadores utilização de sistemas de expressão baratos em comparação com a fermentação de cultura de célula de mamífero, como levedura ou outros microrganismos (EP 0 698097).
O uso de anticorpos derivados de fontes como rato, ovelhas, cabra, coelho etc., e derivados humanizados disso como um tratamento para condições que requerem que uma modulação da inflamação é problemático por várias razões. Os anticorpos tradicionais não são estáveis na temperatura 25 ambiente, e têm de ser refrigerados para preparação e armazenamento, requerendo equipamento de laboratório refrigerado necessário, armazenamento e transporte, que aumentam o tempo e a despesa. A refrigeração não é às vezes fatível em países em desenvolvimento. Além disso, a 30 fabricação ou a produção em escala modesta de ditos anticorpos são caras porque os sistemas celulares mamíferos necessários para a expressão de anticorpos intactos e ativos requer altos níveis do suporte quanto a tempo e equipamento, e os rendimentos são muito baixos. Além disso o grande 35 tamanho de anticorpos convencionais, restringiria a penetração de tecido, por exemplo, no sítio do tecido inflamado. Além disso, os anticorpos tradicionais têm uma atividade obrigatória que depende de pH, e daqui é imprópria para uso em ambientes fora da variedade de pH fisiológica habitual como, por exemplo, no tratamento de hemorragia gástrica, cirurgia gástrica. Além disso, os anticorpos tradicionais são movediços em pH baixo ou alto e daqui não convenientes para administração oral. Contudo, foi demonstrado que os anticorpos camelidae resistem condições ásperas, como pH extremo, reagentes desnaturantes e altas temperaturas (Dumoulin e al, Protein Science 11, 500, 2002), fazendo assim eles convenientes para administração pela via oral. Além disso, os anticorpos tradicionais têm uma atividade obrigatória, que depende da temperatura, e daqui é imprópria para uso em ensaios ou conjuntos executados em temperaturas fora de variedades biologicamente de temperatura ativas (p. ex. 37 + 20°C).
A terapêutica de polipeptídio e na determinada terapêutica à base de anticorpo tem o potencial significativo como fármacos porque eles têm a especificidade seleta ao seu objetivo e uma toxicidade inerente baixa. Contudo, é conhecido pelo destinatário experimentado que um anticorpo que foi obtido para um objetivo terapeuticamente útil requer a modificação adicional para prepará-lo para terapia humana, para evitar uma reação imunológica não desejada em um indivíduo humano com a administração a ele. O processo de modificação é comumente denominado "humanização". É conhecido pelo técnico experimentado que os anticorpos levantados em espécies, outras do que em seres humanos, requererem de humanização para dar o anticorpo terapeuticamente útil em seres humanos ((1) enxerto de CDR: Laboratórios de Desenho de Proteína: US 6180370, US 5693761; Genentech US 6054297; Celltech: 460167, EP 626390, US 5859205; (2) Embutimento: Xoma: US 5869619, US 5766886, US 5821123). Há uma necessidade de um método para produzir anticorpos que evite o requisito de humanização substancial, ou que completamente obvie a necessidade de humanização. Há uma necessidade de uma nova classe de anticorpos que definam regiões de armação ou resíduos aminoácidos e que possam ser administrados a um sujeito humano sem o requisito de humanização substancial, ou a necessidade de humanização em 5 absoluto.
Outra desvantagem importante de anticorpos convencionais consiste em que eles são moléculas complexas, grandes e por isso relativamente instáveis, e eles são sensíveis ao esgotamento por proteases. Isto significa que 10 os fármacos de anticorpo convencionais não podem ser administrados oralmente, sublingualmente, topicamente, nasalmente, vaginalmente, retalmente ou pela inalação porque eles não são resistentes ao pH baixo nesses sítios, a ação de proteases nesses sítios e no sangue e/ou por causa do seu 15 grande tamanho. Eles têm de ser administrados pela injeção (intravenosamente, subcutaneamente, etc.) superar alguns desses problemas. A administração pela injeção requer o treinamento de especialista para usar uma seringa hipodérmica ou a agulha corretamente e seguramente. Ele além 20 disso requer o equipamento estéril, uma formulação líquida do polipeptídio terapêutico, a embalagem de frasco do referido polipeptídio em uma forma estéril e estável e, do sujeito, um sítio conveniente para a entrada da agulha. Além disso, os sujeitos comumente experimentam estresse físico e 25 psicológico antes de e para receber uma injeção. Por isso, há necessidade de um método de administração de polipeptídios terapêuticos que evite a necessidade de injeção que não é só a economia de custo/tempo, mas que também seria mais conveniente e mais cômoda para o sujeito.
A terapêutica Baseada em Nanocorpo tem o potencial significativo como fármacos porque eles têm a especificidade seleta ao seu objetivo e uma toxicidade inerente baixa. Contudo, a melhoria ulterior de sua afinidade intrínseca e funcional pode levar a muitos benefícios para um paciente 35 como dose reduzida de terapia terapêutica, mais rápida, e efeitos colaterais reduzidos.
Uma modalidade de execução da presente invenção é um anti-TNF-alfa nanocrpo, que o Nanocorpo é preferivelmente conforme adicionalmente definido anteriormente.
Uma modalidade de execução da presente invenção é um 5 polipeptídio anti-TNF-alfa que compreende pelo menos um anti-TNF-alfa nanocrpo, cujo polipeptídio é preferivelmente conforme adicionalmente definido anteriormente.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa como descrito acima compreendendo 10 adicionalmente pelo menos um nanocrpo dirigido contra uma proteína de soro.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito acima em que a referida proteína de soro é alguma dentre albumina de soro, 15 imunoglobulinas de soro, proteína ligada com tiroxina, transferrina, ou fibrinogênio.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa como descrito acima compreende adicionalmente pelo menos um nanocrpo selecionado do grupo 20 composto de anti-IFN-gamma nanocrpo, anti-TNF-alfa receptor nanocrpo e receptor anti -IFN-gamma nanocrpo.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito acima, em que o número de nanocorpos dirigidos contra o TNF-alfa é pelo 25 menos dois.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito acima, em que pelo menos um nanocrpo é um Camelidae humanizado VHHs.
Outra modalidade de execução da presente invenção é uma 30 composição que compreende um polipeptídio anti-TNF-alfa conforme descrito acima e pelo menos um nanocrpo do grupo composto de anti-IFN-gamma nanocrpo, anti-TNF-alfa receptor nanocrpo e receptor anti-IFN-gamma nanocrpo, para administração simultânea, separada ou seqüente a um sujeito.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente, ou uma composição conforme descrito acima, em que o referido Nanocorpo é uma seqüência homóloga, uma porção funcional, ou uma porção funcional de uma seqüência homóloga de nanocrpo de o comprimento completo.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente, ou uma composição conforme descrito acima, em que o polipeptídio anti-TNF-alfa é uma seqüência homóloga, uma porção funcional, ou uma porção funcional de uma seqüência 10 homóloga do anti-TNF-alfa polipeptídio de comprimento completo.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente, ou uma composição conforme descrito acima em que pelo menos 15 um nanocrpo é um Camelidae VHH.
Outra modalidade de execução da presente invenção é um ácido nucléico que codifica um polipeptídio anti-TNF-alfa conforme descrito acima.
Outra modalidade de execução da presente invenção é um 20 método de identificar um agente que modula a ligação de um polipeptídio anti-TNF-alfa conforme descrito acima, ao fator Alfa de Necrose Tumoral compreendendo as etapas de:(a) contatar com um polipeptídio anti-TNF-alfa conforme descrito acima com um objetivo que é o fator Alfa de Necrose 25 Tumoral, na presença e a ausência de um modulador candidato em condições que permitem a ligação entre os referidos polipeptídio e objetivo, e(b) medir a ligação entre o polipeptídio e o objetivo do passo (a) , em que uma redução na ligação na presença do 30 referido modulador candidato, quanto à ligação na ausência do referido modulador candidato identificado o referido modulador candidato como um agente que modula a ligação de um polipeptídio anti-TNF-alfa conforme descrito acima e Fator Alfa de Necrose Tumoral.
Outra modalidade de execução da presente invenção é um método de identificar um agente que modula as desordens mediadas por fator alfa de Necrose Tumoral através da ligação de um polipeptídio anti-TNF-alfa conforme descrito acima ao Fator Alfa de Necrose Tumoral compreendendo:(a) contatar com um polipeptídio anti-TNF-alfa conforme 5 descrito acima com um objetivo que é o fator Alfa de Necrose Tumoral, na presença e a ausência de um modulador candidato em condições que permitem a ligação entre os referidos polipeptídio e objetivo, e(b) medir a ligação entre o polipeptídio e o objetivo do 10 passo (a) , em que uma redução na ligação na presença do referido modulador candidato, quanto à ligação na ausência do referido modulador candidato identificado o referido modulador candidato como um agente que modula as desordens mediadas por Fator alfa de Necrose Tumoral.
Outra modalidade de execução da presente invenção é um método de identificar um agente que modula a ligação da fator Alfa de Necrose Tumoral ao seu receptor através da ligação de um polipeptídio anti-TNF-alfa conforme descrito acima ao Fator Alfa de Necrose Tumoral compreendendo:(a) contatar com um polipeptídio anti-TNF-alfa conforme descrito acima com um objetivo que é o fator Alfa de Necrose Tumoral, na presença e a ausência de um modulador candidato em condições que permitem a ligação entre os referidos polipeptídio e objetivo, e(b) medir a ligação entre o polipeptídio e o objetivo do passo (a) , em que uma redução na ligação na presença do referido modulador candidato, quanto à ligação na ausência do referido modulador candidato identificado o referido modulador candidato como um agente que modula a ligação da 30 Fator Alfa de Necrose Tumoral ao seu receptor.
Outra modalidade de execução da presente invenção é um conjunto para proteger agentes que modulam as desordens mediadas por fator alfa de Necrose Tumoral que compreendem um polipeptídio anti-TNF-alfa conforme descrito acima e 35 Fator Alfa de Necrose Tumoral.
Outra modalidade de execução da presente invenção é um agente desconhecido que modula a ligação de um polipeptídio anti-TNF-alfa conforme descrito acima ao fator Alfa de Necrose Tumoral, identificada segundo o método conforme descrito acima.
Outra modalidade de execução da presente invenção é um agente desconhecido que modula a Necrose de Tumor desordens Mediadas por fator alfa, identificadas segundo os métodos conforme descrito acima.
Outra modalidade de execução da presente invenção é um 10 agente desconhecido conforme descrito acima em que as referidas desordens são uma ou várias dentre inflamação, artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino e esclerose múltipla.
Outra modalidade de execução da presente invenção é um 15 polipeptídio anti-TNF-alfa conforme descrito anteriormente,ou um ácido nucléico conforme descrito anteriormente, ou uma composição conforme descrito anteriormente, ou um agente como descrito acima de tratar para e/ou prevenir e/ou alívio de desordens que se relacionam com processos inflamatórios.
Outra modalidade de execução da presente invenção está no uso de um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou um ácido nucléico conforme descrito anteriormente, ou uma composição conforme descrito anteriormente, ou um agente como descrito acima para a preparação de um medicamento para tratar e/ou impedir e/ou aliviar desordens que se relacionam com reações inflamatórias.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para tratar e/ou impedir e/ou aliviar desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através do ambiente gástrico sem que a substância seja inativada.
Outra modalidade de execução da presente invenção está no uso de um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que 5 é capaz de passar através do ambiente gástrico sem que a substância seja inativada.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para tratar e/ou 10 impedir e/ou aliviar desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao trato vaginal e/ou retal.
Outra modalidade de execução da presente invenção está no uso de um polipeptídio anti-TNF-alfa conforme descrito 15 anteriormente ou uma composição conforme descrito acima, para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao trato vaginal e/ou retal.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para tratar e/ou impedir e/ou aliviar desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao 25 nariz, trato respiratório superior e/ou pulmão.
Outra modalidade de execução da presente invenção está no uso de um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para a preparação de um medicamento para tratar, impedir 30 e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao nariz, trato respiratório superior e/ou pulmão.
Outra modalidade de execução da presente invenção é um 35 polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para tratar e/ou impedir e/ou aliviar desordens suscetíveis a modulação por um Nanocorpo ou o polipeptídio da invenção ministrado à mucosa intestinal, em que as referidas desordens aumentam a permeabilidade da mucosa intestinal.
Outra modalidade de execução da presente invenção está no uso de um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à 10 modulação por um Nanocorpo ou o polipeptídio da invenção ministrado à mucosa intestinal, em que as referidas desordens aumentam a permeabilidade da mucosa intestinal.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente 15 ou uma composição conforme descrito acima, para tratar e/ou impedir e/ou aliviar desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através dos tecidos abaixo da língua com efetividade.
Outra modalidade de execução da presente invenção está 20 no uso de um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que 25 é capaz de passar através dos tecidos abaixo da língua com efetividade.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme descrito anteriormente ou uma composição conforme descrito acima, para tratar e/ou 30 impedir e/ou aliviar desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através da pele efetivamente.
Outra modalidade de execução da presente invenção está no uso de um polipeptídio anti-TNF-alfa conforme descrito 35 anteriormente ou uma composição conforme descrito acima, para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através da pele efetivamente.
Outra modalidade de execução da presente invenção esta 5 um método conforme descrito anteriormente, um conjunto conforme descrito anteriormente, um ácido nucléico ou agente conforme descrito acima, uso de um ácido nucléico ou agente conforme descrito anteriormente, uma composição conforme descrito anteriormente, o uso de uma composição conforme 10 descrito anteriormente, um polipeptídio anti-TNF-alfa conforme descrito anteriormente, o uso de um polipeptídio anti-TNF-alfa conforme descrito acima em que as referidas desordens são alguma dentre inflamação, artrite reumatóide, COPD, asma, doença de Crohn, colite ulcerativa, síndrome 15 inflamatória do intestino, esclerose múltipla, doença de Addison, hepatite Autoimune, parotite Autoimune, Diabete Tipo I, Epididimite, Glomerulonefrite, doença de Graves, síndrome de Guillain-Barre, doença de Hashimoto, anemia Hemolítica, lupus eritematoso sistêmico, infertilidade 20 Masculina, Esclerose múltipla, Miastenia Gravis, Pênfigo, Psoríase, febre Reumática, artrite Reumatóide, Sarcoidose, Escleroderma, síndrome de Sjogren, Espondiloartropatias, Tiroidite, e Vasculite.
Outra modalidade de execução da presente invenção é uma 25 composição que compreende um ácido nucléico ou agente conforme descrito anteriormente, um polipeptídio anti-TNF- alfa conforme descrito anteriormente, ou uma composição conforme descrito acima, e um veículo farmacêutico conveniente.
Outra modalidade de execução da presente invenção é um método de diagnosticar uma desordem caracterizada pela disfunção de Fator Alfa compreendendo de Necrose Tumoral:(a) contatar uma amostra com um polipeptídio anti-TNF-alfa conforme descrito acima,(b) detecção de ligação do referido polipeptídio à referida amostra, e (c) comparação da ligação detectada no passo (b) com um padrão, em que uma diferença na ligação quanto à referida amostra é o diagnóstico de uma desordem caracterizada pela disfunção do Fator Alfa de Necrose Tumoral.
Outra modalidade de execução da presente invenção é um conjunto para análise de uma desordem conforme citado anteriormente, usando um método conforme descrito acima.
Outra modalidade de execução da presente invenção é um conjunto para análise de uma desordem conforme citado acima 10 da compreensão de um polipeptídio anti-TNF-alfa isolado conforme descrito acima.
Outra modalidade de execução da presente invenção é o uso de um polipeptídio anti-TNF-alfa como descrito acima para a purificação do referido Fator Alfa de Necrose 15 Tumoral.
Outra modalidade de execução da presente invenção é um uso de um polipeptídio anti-TNF-alfa como descrito acima de inibir a interação entre o fator Alfa de Necrose Tumoral e um ou vários receptores de Fator Alfa de Necrose Tumoral.
Outra modalidade de execução da presente invenção é um método para produzir um polipeptídio anti-TNF-alfa como descrito acima compreendendo as etapas de:{a) obtenção de ADN de trançado duplo que codifica um Camelidae VHH dirigido ao fator Alfa de Necrose Tumoral,(b) clonagem e expressão do ADN selecionado no passo (b).
Outra modalidade de execução da presente invenção é um método de produzir um polipeptídio anti-TNF-alfa como descrito acima compreendendo:(a) cultivo de células hospedeiras compreendendo ácido 30 nucléico capaz de codificar um polipeptídio anti-TNF-alfa conforme descrito acima, em condições que permitem a expressão do polipeptídio, e,(b) recuperação do polipeptídio produzido da cultura.
Outra modalidade de execução da presente invenção é um método conforme descrito acima, em que as referidas células hospedeiras são bacterianas ou levedura.
Outra modalidade de execução da presente invenção é um conjunto para análise de alguma dentre inflamação, artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino ou esclerose múltipla que 5 compreende um polipeptídio anti-TNF-alfa conforme descrito acima.
Os VHHs, segundo a invenção presente, e como conhecido ao destinatário experimentado são domínios variáveis de cadeias pesadas derivados de imunoglobulinas naturalmente 10 destituídas de cadeias leves como os derivados de Camelidae conforme descrito em WO 94/04678 (e mencionada doravante como domínios de VHH ou nanobodies). As moléculas de VHH são cerca de 10x menores do que moléculas IgG. Eles são polipeptídios únicos e muito estáveis, resistindo pH e 15 condições de temperaturas extremas. Além disso, eles são resistentes à ação de proteases que não é o caso anticorpos convencionais. Além disso, a expressão in vitro de VHHs produz alto rendimento, propriamente VHHs funcional dobrado. Além do mais, os anticorpos gerados em Camelídeos 20 reconhecerão epitopes outros que os reconhecidos por anticorpos gerados in vitro através do uso de bibliotecas de anticorpo ou via a imunização de mamíferos outros do que Camelídeos (WO 9749805) . Como tal, anti-TNF-alfa VHH's podem interagir mais eficientemente com o TNF-alfa do que 25 anticorpos convencionais, conseqüentemente bloqueando a sua interação com o receptor TNF-alfa mais eficientemente.
A TNF-alfa é também um fragmento do TNF-alfa, capaz de eliciar uma resposta imune. A TNF-alfa é também um fragmento do TNF-alfa, capaz da ligação a um nanocrpo levantado contra 30 o TNF-alfa de comprimento completo.
Um nanocrpo dirigido contro TNF-alfa significa nanocrpo que é capaz da ligação ã TNF-alfa com uma afinidade de melhor do que 10‘6 M.
Uma modalidade de execução da presente invenção é um 35 polipeptídio anti-TNF, em que os nanobodies compreendem Camelidae VHH dirigidos contra o TNF-alfa.
Um ou vários nanobodies do polipeptídio anti-TNF que são dirigidos contra umo TNF-alfa podem ser da mesma seqüência. Alternativamente eles podem não ter todos a mesma seqüência. É dentro dos limites da invenção que um 5 polipeptídio anti-TNF compreende anti-TNF-alfa nanobodies que não compartilham todos a mesma seqüência, mas que são dirigidos contra o mesmo objetivo, um ou vários antígenos disso.
A presente invenção além disso refere-se a um 10 polipeptídio anti-TNF-alfa, em que o referido Nanocorpo é um VHH dirigido contra o TNF-alfa, em que o VHH pertence a uma classe que tem seqüências humanóides. A classe é caracterizada em que os VHHs transportam um aminoácido do grupo composto de glicina, alanina, valina, leucina, 15 isoleucina, prolina, fenilalanina, tirosina, triptofan, metionina, serina, treonina, asparagina, ou glutamina na posição 45, como, por exemplo, L45 e um triptofan na posição 103, segundo a numeração de Kabat. Outra classe humanóide de Camelidae nanobodies foi descrita em WO03035694 e contém 20 resíduos hidrofóbicos FR2 tipicamente encontrados em anticorpos convencionais de origem humana ou de outra espécie, mas compensando esta perda em hidrofilicidade pelo resíduo de arginina carregado na posição 103 que substitui o presente de resíduo triptofan conservado em VH de anticorpos 25 de cadeia dupla. Como tais, os peptídeos que pertencem a essas duas classes mostram uma alta homologia de seqüência aminoácida a regiões de armação VH humanas e os referidos peptídeos poderiam ser administrados a um ser humano diretamente sem expectativa de uma resposta imune não 30 desejada disto, e sem a carga de nova humanização. A invenção também se refere aos ácidos nucléicos capazes da codificação dos referidos polipeptídios.
Algum dos VHHs como usado pela invenção pode ser da classe tradicional ou das classes de anticorpos Camelidae 35 parecidos a um ser humano. Os ditos anticorpos podem ser dirigidos contra o TNF-alfa inteira ou um fragmento disso, ou um fragmento de uma seqüência homóloga disso. Esses polipeptídios incluem os anticorpos Camelidae de comprimento completo, a saber Fc e domínios VHH, as versões quiméricas da cadeia pesada anticorpos de Camelidae com um domínio de ser humano Fc ou VHH's por eles ou fragmentos derivados.
O VHH1S de albumina de anti-soro pode interagir de um modo mais eficiente com a albumina de soro do que anticorpos convencionais que é conhecida por ser uma proteína transportadora. Como uma proteína de transportadora alguns 10 epitopes da albumina de soro podem ser inacessíveis por proteínas ligadas, peptídeos e pequenos compostos químicos. Como os VHH'S são conhecidos por ligar em epitopes 'excepcionais' ou não-convencionais como cavidades (WO 97/49805), a afinidade de tal VHH's à albumina circulante 15 pode ser aumentada.
A presente invenção também se relaciona ao achado que um polipeptídio anti-TNF conforme descrito na presente que além disso compreende um ou vários nanobodies dirigidos contra uma ou várias proteína de soro de um sujeito, 20 surpreendentemente prolongando significativamente a meia- vida na circulação do referido sujeito comparado com a meia- vida do anti-TNF-alfa nanocrpo quando não parte dos referidos construtos. Além disso, os acima citados polipeptídios demonstraram mostrar as mesmas propriedades 25 favoráveis de nanobodies como alta estabilidade que permanecem intactos em ratos, resistência de pH extrema, alta estabilidade de temperatura e alta afinidade de obj etivo.
A proteína de soro pode ser qualquer proteína 30 conveniente encontrada no soro do sujeito. Em um aspecto da invenção, a proteína de soro é albumina de soro,imunoglobulinas de soro, proteína ligada com tiroxina, transferrina, ou fibrinogênio. Dependendo do uso desejado como a meia-vida requerida para tratamento eficaz e/ou 35 compartimentalização do antígeno de objetivo, o VHH-parceiro pode ser dirigido a uma das acima mencionadas proteína de soro.
Segundo um aspecto específico, mas não-restritivo da invenção, o Nanocorpo contra uma albumina de soro humano compõe-se de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 regiões que determinam complementaridade (CDR1 a CDR3 respectivamente), em que:(iv) O CDR1 é uma seqüência aminoácida escolhida do grupo composto de :SFGMS [SEQ ID n. 36]LNLMG [SEQ ID n. 37]INLLG [SEQ ID n. 38]NYWMY; [SEQ ID n. 39]e/ou do grupo composto de seqüências aminoácidas que têm 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüênciasaminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmentesó contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as acima mencionadas seqüências aminoácidas;e em que:ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, maispreferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas; em que(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácidaconservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as acima mencionadas seqüências aminoácidas;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida épreferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhumaeliminação ou inserções aminoácidas, em comparação com as acima mencionadas seqüências aminoácidas;e em que:(vi) O CDR3 é uma seqüência aminoácida escolhida do grupo composto de :DREAQVDTLDFDY [SEQ ID n. 47] ou do grupo composto de seqüências aminoácidas que têm pelo menos 80%, preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de99% (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas; em que(1) qualquer substituição aminoácida épreferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmentesó contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as acima mencionadas seqüências aminoácidas;e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme 5 definido na presente) com uma das seqüênciasaminoácidas acima mencionadas, em que: (1) qualquer substituição aminoácida épreferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmentesó contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as acima mencionadas seqüências aminoácidas;ou do grupo composto de :GGSLSR [SEQ ID n. 48]RRTWHSEL [SEQ ID n. 49]GRSVSRS [SEQ ID n. 50]GRGSP [SEQ ID n. 51] e/ou do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 "diferença(s) aminoácida(s)" (conforme definido na presente) com uma das seqüências aminoácidas acima mencionadas, em que:(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácidaconservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 30 com as acima mencionadas seqüências aminoácidas.
Em outro aspecto, a invenção refere-se a um Nanocorpo contra uma albumina de soro humano, que se compõem de 4 regiões de armação (FR1 a FR4 respectivamente) e 3 regiões que determinam complementaridade (CDR1 a CDR3 35 respectivamente), que é escolhido do grupo composto de anticorpos de domínio e/ou anticorpos de domínio únicos com aquela das combinações seguintes de CDR1, CDR2 e CDR3, respectivamente:10 CDR1: SFGMS;CDR2: SISGSGSDTLYADSVKG;CDR3: GGSLSR;11 CDR1: LNLMG;CDR2: TITVGDSTNYADSVKG;CDR3: RRTWHSEL;12 CDR1: INLLG;CDR2: TITVGDSTSYADSVKG;CDR3: RRTWHSEL;13 CDR1: SFGMS;CDR2: SINGRGDDTRYADSVKG;CDR3: GRSVSRS;14 CDR1: SFGMS;CDR2: AISADSSDKRYADSVKG;CDR3: GRGSP;15 CDR1: SFGMS;CDR2: AISADSSDKRYADSVKG;CDR3: GRGSP;16 CDR1: NYWMY;CDR2: RISTGGGYSYYADSVKG;CDR3:DREAQVDTLDFDY.Nos nanocorpos da invenção que compreendem as combinações do CDR'S acima mencionado, cada CDR pode ser substituído por um CDR escolhido do grupo composto de seqüências aminoácidas que têm pelo menos 80%, 15 preferivelmente pelo menos 90%, mais preferivelmente pelo menos 95%, mesmo mais preferivelmente pelo menos identidade de seqüência de 99% (conforme definido na presente) com o CDR'S mencionado; em que(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácidaconservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação 25 com as acima mencionadas seqüências aminoácidas;e/ou escolhido do grupo composto de seqüências aminoácidas que têm 3, 2 ou só 1 (como indicado no parágrafo precedente) "diferença(s) aminoácida(s)" (conforme definido na presente) com o CDR mencionado(s) um do acima mencionado seqüências 30 aminoácidas, em que:(1) qualquer substituição aminoácida é preferivelmente uma substituição aminoácida conservadora (conforme definido na presente); e/ou(2) a referida seqüência aminoácida preferivelmente 35 só contém substituições aminoácidas, e nenhuma eliminação ou inserções aminoácidas, em comparação com as acima mencionadas seqüências aminoácidas.
Contudo, dos nanocorpos da invenção que compreendem as combinações do CDR'S acima mencionado, nanocorpos que compreendem um ou vários do CDR'S enumerado anteriormente são em particular preferidos; os nanocorpos compreensão de dois ou mais do CDR'S enumerado anteriormente são mais em particular preferidos; e os nanocorpos compreensão de três do CDR'S enumerado anteriormente são mais em particular lO preferidos.
Nesses nanocorpos contra uma albumina de soro humano, 0 as regiões de Armação FRI a FR4 são preferivelmente como definidas mais acima para os nanocorpos da invenção-
Nanocorpos em particular preferidos contra uma albumina de soro humano são escolhidos do grupo composto de SEQ ID NO's: 61 para 67, SEQ ID NO'S 87 para 89 e SEQ ID NO'S 100-
As combinações preferenciais de CDR'S e presente de regiões de armação nesses nanocorpos também são enumeradas na Tabela II
Tabela II: combinação preferencial de seqüências de Armação e CDR' s em nanocorpos contra albumina de soro humana .
Outro aspecto da invenção é um polipeptídio anti-TNFalfa que conforme revelado na presente além disso compreende pelo menos um polipeptídio selecionado do grupo composto de um polipeptídio anti-lFN-gamma, um polipeptídio de receptor anti-TNF-alfa e polipeptídio de receptor anti-lFN-gamma.
Segundo um aspecto da invenção, um nanocrpo é dirigido contra o receptor TNF-alfa. Dito nanocrpo pode ser um lO Camelidae vhh.
Segundo um aspecto da invenção, um nanocrpo é dirigido contra o receptor IFN-gama. Dito nanocrpo pode ser um Camelidae VHH-
Outro aspecto da invenção é um método de tratar uma doença autoimune ou a condição como citado na presente, compreendendo administrando a um paciente uma quantidade 5 eficaz de um polipeptídio anti-TNF-alfa que, além disso, compreende um polipeptídio menor selecionado do grupo composto do polipeptídio anti-IFN-gamma, anti-TNF-alfa polipeptídio de receptor e polipeptídio de receptor anti- IFN-gamma, tais polipeptídios juntados um a outro conforme 10 descrito mais adiante.
Tais construtos multiespecíficos podem ter melhorado a potência como o composto terapêutico inflamatório por cima de construtos mono-específicos.
Um aspecto da invenção é uma composição que compreende 15 um polipeptídio anti-TNF-alfa conforme revelado na presente e pelo menos um polipeptídio selecionado do grupo composto do polipeptídio anti-IFN-gamma, anti-TNF-alfa polipeptídio de receptor e polipeptídio de receptor anti-IFN-gamma, para administração simultânea, separada ou seqüente a um sujeito.
Um aspecto da invenção é um método que para tratamento de doença autoimune compreendendo a administração a um indivíduo de uma quantidade eficaz de um polipeptídio anti- TNF-alfa e um polipeptídio menor selecionado do grupo composto do polipeptídio anti-IFN-gamma, anti-TNF-alfa polipeptídio de receptor e polipeptídio de receptor anti- IFN-gamma, simultaneamente, separadamente ou em seqüência.
Outro aspecto da invenção é um conjunto que contém um polipeptídio anti-TNF-alfa e um polipeptídio menor selecionado do grupo composto do polipeptídio anti-IFN- 30 gamma, anti-TNF-alfa polipeptídio de receptor e polipeptídio de receptor anti-IFN-gamma para administração simultânea, separada ou seqüente a um sujeito. É um aspecto da invenção que o conjunto pode ser usado segundo a invenção. É um aspecto da invenção que o conjunto pode ser usado para 35 tratar as doenças como citado na presente.
Por meios de administração simultâneos que os polipeptídios são administrados a um sujeito ao mesmo tempo. Por exemplo, como uma mistura dos polipeptídios ou uma composição que compreende os referidos polipeptídios. Os exemplos incluem, mas não são limitados a uma solução 5 administrada intravenosamente, uma pastilha, líquida, creme tropical, etc., em que cada preparação compreende os polipeptídios do interesse.
Por meios de administração separados os polipeptídios são administrados a um sujeito ao mesmo tempo ou 10 substancialmente ao mesmo tempo. Os polipeptídios estão presentes no conjunto como preparações separadas, não misturadas. Por exemplo, os polipeptídios diferentes podem estar presentes no conjunto como pastilhas individuais. As pastilhas podem ser administradas ao sujeito engolindo ambas 15 as pastilhas ao mesmo tempo, ou uma pastilha diretamente depois do outra.
Por meios de administração sequentes que os polipeptídios são administrados a um sujeito em seqüência. Os polipeptídios estão presentes no conjunto como preparações separadas, não misturadas. Há um intervalo de tempo entre doses. Por exemplo, um polipeptídio poderia ser administrado até 336, 312, 288, 264, 240, 216, 192, 168, 144, 120, 96, 72, 48, 24, 20, 16, 12, 8, 4, 2, 1, ou 0,5 horas depois de outro componente.
Na administração seqüente, um polipeptídio pode ser administrado uma vez, ou qualquer número de tempos e em várias doses antes e/ou depois da administração de outro polipeptídio. A administração seqüente pode ser combinada com a administração simultânea ou seqüente.
Os usos médicos do polipeptídio anti-TNF-alfa descrito mais adiante, também se aplica à composição que compreende um polipeptídio anti-TNF-alfa conforme revelado na presente e pelo menos um polipeptídio selecionado do grupo composto do polipeptídio anti-IFN-gamma, anti-TNF-alfa polipeptídio 35 de receptor e polipeptídio de receptor anti-IFN-gamma, para administração simultânea, separada ou seqüente a um sujeito como revelado aqui anteriormente.
Segundo um aspecto da invenção, um polipeptídio anti- IFN-gamma anti-TNF-alfa um nanocrpo dirigido contra IFN- gama. Dito nanocrpo pode ser um Camelidae VHH-
Segundo um aspecto da invenção, anti-TNF-alfa um nanocrpo dirigido contra receptor TNF-alfa. Dito nanocrpo pode ser um Camelidae VHH-
Segundo um aspecto da invenção, um polipeptídio de receptor anti-IFN-gamma anti-TNF-alfa um nanocrpo dirigido 10 contra receptor IFN-gama. Dito nanocrpo pode ser um Camelidae VHH-
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme revelado na presente, em que o número de nanocorpos dirigidos contra o TNF-alfa é 15 dois ou mais. Tais polipeptídios multivalentes anti-TNF-alfa têm a vantagem da afinidade funcional excepcionalmente alta para o objetivo, expondo muito mais alto do que propriedades inibidoras esperadas em comparação com os seus duplos monovalentes.
Os polipeptídios multivalentes anti-TNF-alfa têm afinidades funcionais que são várias ordens de magnitude mais altos do que os polipeptídios anti-TNF-alfa de pais monovalentes. Os inventores encontraram que as afinidades funcionais desses polipeptídios multivalentes são muito mais 25 altas do que os informados na técnica para prévia anticorpos bivalentes e multivalente. Surpreendentemente, anti-TNF-alfa os polipeptídios da presente invenção ligados um a outro diretamente ou via uma seqüência de linker curta mostram as altas afinidades funcionais esperadas teoricamente com 30 anticorpos de quatro cadeias convencionais multivalentes.
Os inventores encontraram que tais grandes atividades funcionais aumentadas podem ser descobertas preferivelmente com antígenos compostos de multidomínio e proteína multiméricas, em ensaios de ligação diretos ou em ensaios 35 funcionais, p. ex. citotoxicidade ensaios.
O nanobodies pode ser juntado para formar algum dos polipeptídios revelados na presente compreendendo mais de um nanocrpo utilizando métodos conhecidos na técnica ou qualquer futuro método. Por exemplo, eles podem ser fundidos pela ligação cruzada química reagindo resíduos aminoácidos 5 com um agente de derivação orgânico como descrito por Blattler e al, Bioquímica 24,1517-1524; EP294703.
Alternativamente, o nanocrpo pode ser fundido geneticamente ao nível de ADN isto é, um construto polinucleotideo formado que codifica o construto polipeptídio completo compreendendo 10 de um ou vários nanobodies anti-alvo e um ou vários nanobodies de proteína anti-soro. Um método para produzir construtos bivalente ou multivalente de polipeptídio VHH é revelado na aplicação de patente PCT WO 96/34103. Um modo de juntar múltiplos nanobodies é através da via genética 15 ligando seqüências de codificação de nanocrpo diretamente ou via um linker de peptídeo. Por exemplo, o fim de C-terminal do primeiro nanocrpo pode ser ligado ao fim do N-terminal do seguinte nanocrpo. Este modo de vinculação pode ser estendido para ligar nanobodies adicionais para a construção 20 e a produção de construtos tri-, tetra-, etc. funcionais.
Segundo um aspecto da presente invenção, os nanobodies são ligados um a outro diretamente, sem o uso de um linker. Ao contrário da junção de anticorpos convencionais grandes onde uma seqüência de linker é necessária para reter a 25 atividade obrigatória nas duas subunidades, os polipeptídios da invenção podem ser ligados diretamente conseqüentemente evitando problemas potenciais da seqüência de linker, como antigenicidade quando administrado a um sujeito humano, instabilidade da seqüência de linker que leva a dissociação 30 das subunidades.
Segundo outro aspecto da presente nanobodies são ligados um a outro via um linker de seqüência de peptídeo. Tal seqüência de linker pode ser uma seqüência que ocorre naturalmente ou uma seqüência que ocorre não 35 naturalmente. Espera-se que a seqüência de linker seja não- imunogênica no sujeito ao qual o polipeptídio anti-TNF-alfa 263 é administrado. A sequência de linker pode fornecer a flexibilidade suficiente ao polipeptídio multivalente anti- TNF-alfa, ao mesmo tempo sendo resistente à degradação proteolítica. Um exemplo não-restritivo de umas seqüências 5 de linkers ê aquele que pode ser derivado da região pregada de VHHs descrito em WO 96/34103.
Segundo outro aspecto da invenção, nanobodies multivalentes compreendendo mais de dois nanobodies podem ser ligados um a outro diretamente ou via uma seqüência de 10 linker. Tais construtos são difíceis de produzir com anticorpos convencionais e devido ao amplo impedimento das subunidades grandes, a funcionalidade será perdida ou muito diminuída e não aumentada consideravelmente como visto com o VHH'S da invenção em comparação com o construto monovalente.
Os construtos polipeptídios revelados na presente podem ser feitos pelo técnico experimentado segundo os métodos conhecidos na técnica ou qualquer futuro método. Por exemplo, VHHs pode ser obtido usando métodos conhecidos na técnica como imunizando um camelo e obtendo hibridomas 20 disto, ou clonando uma biblioteca de nanobodies utilizando técnicas de biologia molecular conhecidas na seleção de arte e subseqüente usando fago-exposição.
Segundo um aspecto da invenção um polipeptídio anti- TNF-alfa pode ser uma seqüência homóloga de um polipeptídio 25 anti-TNF-alfa de corpo inteiro. Segundo outro aspecto da invenção, um polipeptídio anti-TNF-alfa pode ser uma porção funcional de um polipeptídio anti-TNF-alfa de corpo inteiro. Segundo outro aspecto da invenção, um polipeptídio anti-TNF- alfa pode ser uma seqüência homóloga de um polipeptídio 30 anti-TNF-alfa de corpo inteiro. Segundo outro aspecto da invenção, um polipeptídio anti-TNF-alfa pode ser uma porção funcional de uma seqüência homóloga de um polipeptídio anti- TNF-alfa de corpo inteiro. Segundo um aspecto da invenção um polipeptídio anti-TNF-alfa pode compreender uma seqüência de 35 um polipeptídio anti-TNF-alfa.
Segundo um aspecto da invenção um nanocrpo usado para formar um polipeptídio anti-TNF-alfa pode ser um nanocrpo completo (p. ex. um VHH) ou uma seqüência homóloga disso. Segundo outro aspecto da invenção, um nanocrpo usado para formar construtos polipeptídios pode ser uma porção 5 funcional de um nanocrpo completo. Segundo outro aspecto da invenção, um nanocrpo usado para formar construtos polipeptídios pode ser uma seqüência homóloga de um nanocrpo completo. Segundo outro aspecto da invenção, um nanocrpo usado para formar construtos polipeptídios pode ser uma 10 porção funcional de uma seqüência homóloga de um nanocrpo completo.Como usado na presente, uma seqüência homóloga da presente invenção pode compreender adições, eliminações ou substituições de um ou vários aminoácidos, que não alteram 15 substancialmente as características funcionais dos polipeptídios da invenção. O número de eliminações aminoácidas ou substituições está à altura preferivelmente 1, 2, 3, 4, 5, 6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17,18, 19, 20, 21, 22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32,20 33, 34, 35, 36, 37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47,48, 49, 50, 51, 52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62,63, 64, 65, 66, 67, 68, 69 ou 70 aminoácidos.
Uma seqüência homóloga segundo a presente invenção pode ser um polipeptídio modificado pela adição, eliminação ou 25 substituição de aminoácidos, a referida modificação substancialmente não alterando as características funcionais comparadas com o polipeptídio não modificado.
Uma seqüência homóloga segundo a presente invenção pode ser um polipeptídio modificado pela adição, eliminação ou 30 substituição de aminoácidos, a referida modificação substancialmente não altera as características funcionais comparadas com o polipeptídio não modificado.
Uma seqüência homóloga segundo a presente invenção pode ser uma seqüência que existe em outra espécie Camelidae 35 como, por exemplo, camelo, dromedário, lhama, alpaca, guanaco etc.
Onde a seqüência homóloga indica a identidade de seqüência, ela significa uma seqüência que apresenta uma alta identidade de seqüência (mais de 70%, 75%, 80%, 85%, 90%, identidade de seqüência de 95% ou de 98%) com a 5 seqüência de pais e é preferivelmente caracterizada por propriedades semelhantes da seqüência de pais, a saber afinidade, a referida identidade calculada usando métodos conhecidos.
Alternativamente, uma seqüência homóloga também pode ser qualquer seqüência aminoácida que resulta de substituições permitidas em qualquer número de posições da seqüência de pais segundo a fórmula mais adiante:Ser substituído por Ser, Thr, Gly, e Asn;Arg substituído por um de Arg, His, Gin, Lys, e Glu;Leu substituído por um de Leu, lie, Phe, Tyr, Met, e Vai;Pro substituído por um de Pro, Gly, Ala, e Thr;Thr substituído por um de Thr, Pro, Ser, Ala, Gly, His, e Gin;Phe substituído por um de Phe, Trp, Met, Tyr, Ile, Vai, eLeu;Tyr substituído por um de Tyr, Trp, Met, Phe, Ile, Vai, e Leu;His substituído por um do Seu, Glu, Lys, Gin, Thr, e Arg;Gin substituído por um de Gin, Glu, Lys, Asn, His, Thr, e Arg;Asn substituído por um de Asn, Glu, Asp, Gin, e Ser;Lys substituído por um de Lys, Glu, Gin, His, e Arg;Asp substituída por uma de Asp, Glu, e Asn;Glu substituído por um de Glu, Asp, Lys, Asn, Gin, His, e Arg;Met substituído por um dos Met, Phe, Ile, Vai, Leu, e Tyr.Uma seqüência de nucleotídeos homóloga segundo a presente invenção pode referir-se a seqüências denucleotídeos de mais de 50, 100, 200, 300, 400, 500, 600, 800 ou 1000 nucleotídeos capaz de hibridizar o complemento inverso da seqüência de nucleotídeos capaz de codificar a 5 seqüência evidente, em condições de hibridização estritas (como aqueles descritos por Sambrook et al., Molecular Cloning, Laboratory Manuel, Cold Spring, Harbor Laboratory press, Nova York).
Como usado na presente, uma porção funcional refere-se 10 a uma seqüência de um nanocrpo que é do tamanho suficiente tal que a interação do interesse é mantida com a afinidade de 1 10-6 M x ou melhor.
Alternativamente, uma porção funcional compreende uma eliminação parcial da seqüência aminoácida completa e ainda 15 mantém o sítio(s) de ligação e o domínio(s) de proteína necessário para a ligação de e interação com o objetivo.
Como usado na presente, uma porção funcional refere-se a menos de 100% da seqüência completa (p. ex., 99%, 90%, 80%, 70%, 60% 50%, 40%, 30%, 20%, 10%, 5%, 1% etc.), mas 20 compreende 5 ou mais aminoácidos ou 15 ou mais nucleotídeos.
Objetivos como mencionado na presente como TNF-alfa, receptor TNF-alfa, proteína de soro (p. ex. albumina de soro, imunoglobulinas de soro, proteína ligada com tiroxina, transferrina, fibrinogênio) e IFN-gama, o receptor IFN-gama pode ser fragmentos dos referidos objetivos. Portanto um objetivo é também um fragmento do referido objetivo, capaz de eliciar uma resposta imune. Um objetivo é também um fragmento do referido objetivo, capaz da ligação a um nanocrpo levantado contra o objetivo de comprimento 30 completo.
Um fragmento conforme usado na presente refere-se a menos de 100% da seqüência (p. ex., 99%, 90%, 80%, 70%, 60%, 50%, 40%, 30%, 20%, 10% etc.), mas compreendendo 5, 6, 7, 8, 9, 10, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21, 22, 23, 24, 35 25 ou mais aminoácidos. Um fragmento é do comprimentosuficiente tal que a interação do interesse é mantida com a afinidade de 1 10-6 M x ou melhor.
Um fragmento conforme usado na presente também sesubstituições de um ou vários aminoácidos que não alte iramsubstancialmente a capacidade do objetivo de ligar a umnanocrpo levantado contra o objetivo de tipo natural . 0número de eliminações de inserções aminoácidas ousubstituições está à altura preferivelmente 1, 2, 3, 4, 5,6, 7, 8, 9, 10, 11, 12, 13, 14, 15, 16, 17, 18, 19, 20, 21,22, 23, 24, 25, 26, 27, 28, 29, 30, 31, 32, 33, 34, 35, 36,37, 38, 39, 40, 41, 42, 43, 44, 45, 46, 47, 48, 49, 50, 51,52, 53, 54, 55, 56, 57, 58, 59, 60, 61, 62,67, 68, 69 ou 70 aminoácidos. 63 , 64, 65, 66,
Uma seqüência homóloga da presente invenção p iode refere a inserções opcionais, as eliminações e as incluir um polipeptídio anti-TNF-alfa que foi humanizado, a humanização de anticorpos da nova classe de VHHs reduziria além disso a possibilidade da reação imunológica não desejada em um indivíduo humano sobre a administração.
Uma modalidade de execução da presente invenção refere- se a um método para preparar polipeptídios modificados baseados sobre anticorpos de lhama determinando os resíduos aminoácidos do domínio variável de anticorpo (VHH) que pode ser modificado sem diminuir a afinidade nativa do domínio para antígeno e reduzindo o seu imunogenicidade com respeito 25 a uma espécie heteróloga; o uso de VHHS tendo modificações nos resíduos identificados que são úteis para a administração à espécie heteróloga; e ao VHH assim modificado.
Mais especificamente, a invenção refere-se à preparação de VHHs modificados, que são modificados para administração a 30 seres humanos, o próprio VHH resultante, e o uso de tal VHHs "humanizado" no tratamento de doenças em seres humanos. Humanizado quer dizer transformado para que a imunogenicidade sobre a administração em pacientes humanos seja menor ou não existente. A Humanização de um 35 polipeptídio, segundo a invenção presente, compreende um passo de substituir um ou vários dos Camelidae aminoácidos pelo seu duplo humano como encontrado na seqüência de consenso humana, sem aquele polipeptídio que perde o seu caráter típico, isto é, a humanização não afeta significativamente a capacidade de ligação do antígeno do 5 polipeptídio resultante. Tais métodos são conhecidos pelo destinatário experimentado.
A humanização de Camelidae nanobodies requer a introdução e mutagenese de uma quantidade limitada de aminoácidos em uma cadeia de polipeptídio única. Isto é, em 10 contraste com a humanização de scFv, Fab, (Fab) 2 e IgG, que requer a introdução de modificações aminoácidas em duas cadeias, a cadeia leve e pesada e a preservação da união de ambas as cadeias.
Como descrito em WO 04/041862, um anti-TNF nanocrpo 15 pode ser humanizado. A humanização, por exemplo, pode implicar mutagenese de resíduos em FR1 na posição 1 e 5 que foram introduzidos pelo escorvador usado para clonagem de repertório e não ocorrer naturalmente na seqüência de lhama. A Mutagenese daqueles resíduos não resultou na perda de 20 atividade de inibição e/ou ligação. A humanização também pode implicar mutagenese de resíduos em FR3 na posição 74, 76, 83, 84, 93. A Mutagenese daqueles resíduos não resultou em uma perda dramática de atividade de inibição e/ou ligação. A Combinação das mutações de FR1 e FR3, por isso, 25 não afetou a atividade de inibição e/ou a ligação. A humanização também pode implicar mutagenese de resíduos em FR4 na posição 108. A Mutagenese de Q108L resultou no nível de produção mais baixo em Escherichia coli. A posição 108 é exposta a solvente em VHH camelídeo, enquanto em anticorpos 30 humanos esta posição é enterrada na interface VH-VL (Spinelli, 1996; Nieba, 1997). Na posição VHs isolada 108 é exposta a solvente. A introdução de um Leu hidrofóbico não- polar em vez de polar não mudado Gin pode ter um efeito drástico na dobra/estabilidade intrínseca da molécula.
Também, a substituição dos resíduos hidrofílicos por resíduos hidrofóbico humanos nas posições 44 e 45 (E44G e R45L), não teve um efeito em ligação e/ou inibição. Contudo, a perda de ligação e/ou atividade de inibição foi observada quando F37V e F47W foram introduzidos. Modelagem de dados confirmou o resíduo crítico 37 para conservar a integridade 5 da conformação de laço CDR3 e daqui na atividade (toda a numeração segundo Kabat).
Segundo uma modalidade de execução da presente invenção, a humanização implica a substituição de algum dos resíduos seguintes sozinhos ou em combinação:1 Posição de FR1 1, 5, 28 e 30,2 o Hallmark aminoácido na posição 44 e 45 em FR2,3 Resíduos de FR3 74, 75, 76, 83, 84, 93 e 94,4 e posições 103, 104, 108 e 111 em FR4;5 numeração segundo a numeração de Kabat.
Uma modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa, ou um ácido nucléico capaz da codificação do referido polipeptídio para uso em tratamento, prevenção e/ou alívio dos sintomas de desordens que se relacionam com processos inflamatórios. A TNF-alfa 20 está implicada em processos inflamatórios, e o bloqueio da ação TNF-alfa pode ter um efeito anti - inflamatório, que é altamente desejável em certos estados de doença como, por exemplo, a doença de Crohn. Os Exemplos demonstram VHHs segundo a invenção que ligam o TNF-alfa e além disso, bloqueiam a sua ligação ao receptor TNF-alfa.
Os polipeptídios anti-TNF-alfa da presente invenção são aplicáveis a doenças autoimunes, como a doença de Addison as doenças (adrenais), Autoimunes da orelha (orelha), as doenças Autoimunes do olho (olho), hepatite Autoimune 30 (fígado), parotite Autoimune (glândulas parótidas), a doença de Crohn (intestino), Diabete Tipo I (pâncreas), Epididimite (epidídimo), Glomerulonefrite (rins), a doença de Graves (tireóide), síndrome de Guillain-Barre (células nervosas), a doença de Hashimoto (tireóide), anemia Hemolítica (células 35 de sangue vermelhas), lupus eritematoso sistêmico (múltiplos tecidos), infertilidade Masculina (esperma), Esclerose múltipla (células nervosas), Miastenia Gravis (neuromuscular ligação), Pênfigo (principalmente pele), Psoríase febre (de pele), Reumática (coração e uniões), artrite Reumatóide 5 (revestimento de união), Sarcoidose (múltiplos tecidos e órgãos), Escleroderma (tecidos de pele e conetivos), a síndrome de Sjogren (glândulas exocrinas, e outros tecidos), Espondiloartropatias (esqueleto axial, e outros tecidos), Tiroidite (tireoide), Vasculite (vasos sanguíneos).
Dentro do parêntese está o tecido afetado pela doença. Esta listagem de doenças autoimunes é destinada para ser exemplar e não inclusiva.
As condições autoimunes para as que os polipeptídios anti-TNF-alfa da presente invenção são aplicáveis incluem, 15 por exemplo, AIDS, alergia atópica, asma bronquial, eczema, lepra, esquizofrenia, depressão hereditária, a transplantação de tecidos e órgãos, síndrome de fadiga crônica, doença de Alzheimer, doença de Parkinson, enfarte do miocárdio, derrame, autismo, epilepsia, fenômeno de 20 Arthus, anafilaxe, e propensão a drogas e álcool. Nas condições autoimunes acima mencionadas, o tecido afetado é o objetivo primário, em outros casos ele é o objetivo secundário. Essas condições são em parte ou síndromes pela maior parte autoimunes. Por isso, no tratamento deles, é 25 possível usar os mesmos métodos, ou aspectos dos mesmos métodos que são na presente revelados, às vezes em combinação com outros métodos.
Outra modalidade de execução da presente invenção é um uso de um polipeptídio anti-TNF-alfa segundo a invenção, ou 30 um ácido nucléico capaz da codificação do referido polipeptídio para a preparação de um medicamento para tratar uma desordem que se relaciona com processos inflamatórios. Os exemplos de desordens incluem a artrite reumatóide, a doença de Crohn, a colite ulcerativa, a síndrome 35 inflamatória do intestino e esclerose múltipla.
Os polipeptídios e os ácidos nucléicos segundo a presente invenção podem ser administrados a um sujeito por vias convencionais, como intravenosamente. Contudo, uma propriedade especial dos polipeptídios anti-TNF-alfa da invenção é que eles penetram barreiras como membranas de 5 tecido e/ou tumores e atuam localmente nisso, e eles são suficientemente estáveis para resistir ambientes extremos como no estômago. Por isso, outro aspecto da presente invenção refere-se a administração de polipeptídios anti-TNF-alfa.
Quando os nanocorpos e/ou os polipeptídios da invenção são usados para, ou destinados para uso em, a prevenção ou tratamento de doenças e desordens do trato gastrintestinal, especialmente por meio da administração oral ou outra administração no trato gastrintestinal, não será normalmente 15 necessário usar polipeptídios da invenção que aumentaram a meia-vida no soro (isto é, foi pegilado ou contém um Nanocorpo dirigido contra uma proteína de soro). Portanto, para tais indicações, os polipeptídios da invenção podem ser usados os que só contêm nanocorpos da invenção.
Especialmente, foi encontrado isto a para administração oral para a prevenção e o tratamento de doenças ou desordens do trato gastrintestinal associado com e/ou mediadas pelo TNF- alfa (como IBD e outras doenças e as desordens do trato gastrintestinal acima mencionado), o uso de um Nanocorpo 25 monovalente da invenção ou de um polipeptídio da invenção que essencialmente se compõe de um Nanocorpo monovalente da invenção pode ser preferido. Para outras indicações, como o tratamento da artrite reumatóide (RA), o uso de um Nanocorpo bivalente da invenção pode ser preferido. Quando tal
Nanocorpo tem de conseguir o seu sítio desejado da ação via a corrente de sangue, o uso de um polipeptídio da invenção que aumentou a meia-vida no soro pode ser preferido.
Um sujeito segundo a invenção pode ser qualquer mamífero suscetível ao tratamento por polipeptídios terapêuticos.
A administração oral de polipeptídios anti-TNF-alfa da invenção resulta na provisão de tais moléculas em uma forma ativa no cólon em sítios locais que são afetados pela desordem. Esses sítios podem ser altamente inflamados e conter células Que produzem TNF-alfa. Os polipeptídios anti- TNF-alfa da invenção que ligam à TNF-alfa podem neutralizar o TNF-alfa localmente, evitando distribuição em todas as partes do corpo inteiro e portanto limitando efeitos colaterais negativos. Os microrganismos geneticamente modificados como Micrococcus lactis são capazes de segregar 10 anticorpo ou porções funcionais disso. Tais microrganismos modificados podem ser usados como veículos para a produção e administração local de anticorpos ou porções funcionais disso no intestino. Usando uma classe que produz um polipeptídio anti-TNF-alfa, a síndrome inflamatória do intestino pode ser tratada.
Outro aspecto da invenção implica a administração de polipeptídios anti-TNF usando expressão superficial em ou secreção de bactérias não-invasivas, como organismos hospedeiros Gram-Positivos como Lactococcus spec, utilizando 20 um vetor como descrito em WOOO/23471.
Uma modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme revelado na presente para uso em tratamento, prevenção e/ou alívio dos sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o 25 polipeptídio da invenção que é capaz de passar através do ambiente gástrico sem que a substância seja inativada.
Os exemplos de desordens são qualquer inflamação de causa, inclusive, mas não limitados a artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do 30 intestino, e esclerose múltipla. Como conhecido por pessoas experimentadas na técnica, uma vez na posse do referido construto polipeptídio, a tecnologia de formulação pode ser aplicada para lançar uma quantidade máxima do polipeptídio na posição certa (no estômago, no cólon, etc.). Este método 35 de administração é importante para tratar, prevenir e/ou aliviar os sintomas de desordens cujos objetivos são localizados no sistema intestinal.
Um aspecto da invenção ê um método para tratar, impedir e/ou aliviar os sintomas de uma desordem suscetível à modulação por um Nanocorpo ou o polipeptídio da invenção que 5 é capaz de passar através do ambiente gástrico sem ser inativado, por administração oral a um sujeito de um polipeptídio anti-TNF-alfa conforme revelado na presente.
Outra modalidade de execução da presente invenção é um uso de um polipeptídio anti-TNF-alfa conforme revelado na 10 presente para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através do ambiente gástrico sem ser inativado.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção ao sistema intestinal sem que a referida substância seja inativada, por administração oral a um sujeito de um polipeptídio anti-TNF- alfa conforme revelado na presente.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção à circulação sanguínea de um sujeito sem que a substância seja inativada, por administração oral a um sujeito de um polipeptídio anti- TNF-alfa conforme revelado na presente.
Outra modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme revelado na presente para uso em tratamento, prevenção e/ou alívio dos sintomas ou desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao trato vaginal e/ou 30 retal.
Os exemplos de desordens são qualquer inflamação de causa, inclusive, mas não limitados a artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino, e esclerose múltipla. Em um exemplo não- 35 restritivo, uma formulação segundo a invenção compreende um polipeptídio anti-TNF-alfa conforme revelado na presente, na forma de um gel, creme, supositório, filme, ou na forma de uma esponja ou como um anel vaginal que lentamente lança o ingrediente ativo dentro de algum tempo (tais formulações são descritas em EP 707473, EP 684814, US 5629001).
Um aspecto da invenção é um método para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao trato vaginal e/ou retal, por administração vaginalmente e/ou retalmente a um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Outra modalidade de execução da presente invenção é um uso de um polipeptídio anti-TNF-alfa conforme revelado na presente para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao trato vaginal e/ou retal.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção ao trato vaginal e/ou retal sem que a referida substância seja inativada, administrando ao trato vaginal e/ou retal de um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção à circulação 25 sangüínea de um sujeito sem que a referida substância seja inativada, administrando ao trato vaginal e/ou retal de um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Outra modalidade de execução da presente invenção é um 30 polipeptídio anti-TNF-alfa conforme revelado na presente, para usar em tratamento, prevenção e/ou alívio dos sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao nariz, trato respiratório superior e/ou pulmão.
Os exemplos de desordens são qualquer inflamação de causa, inclusive, mas não limitados a artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino, e esclerose múltipla. Em um exemplo não- restritivo, uma formulação segundo a invenção, compreende um polipeptídio anti-TNF-alfa conforme revelado na presente na 5 forma de um borrifo nasal (p. ex. um aerossol) ou inalador.
Desde que o construto de polipeptídio seja pequeno, ele pode conseguir o seu objetivo muito mais efetivamente do que moléculas IgG terapêuticas.
Um aspecto da invenção é um método para tratar, impedir 10 e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao trato respiratório superior e pulmão, administrando a um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente, pela inalação através da boca 15 ou nariz.
Outra modalidade de execução da presente invenção é um uso de um polipeptídio anti-TNF-alfa conforme revelado na presente para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à 20 modulação por um Nanocorpo ou o polipeptídio da invenção ministrado ao nariz, trato respiratório superior e/ou pulmão, sem que o referido polipeptídio seja inativado.
Um aspecto da invenção ê um método para a administração de um Nanocorpo ou o polipeptídio da invenção ao nariz, 25 trato respiratório superior e pulmão sem inativação, administrando ao nariz, trato respiratório superior e/ou pulmão de um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Um aspecto da invenção é um método para a administração 30 de um Nanocorpo ou o polipeptídio da invenção à circulação sanguínea de um sujeito sem inativação administrando ao nariz, trato respiratório superior e/ou pulmão de um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Uma modalidade de execução da presente invenção é um 35 polipeptídio anti-TNF-alfa conforme revelado na presente para uso em tratamento, prevenção e/ou alívio dos sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado à mucosa intestinal, em que as referidas desordens aumentam a permeabilidade da mucosa intestinal. Por causa do seu pequeno tamanho, um polipeptídio anti-TNF-alfa conforme revelado na presente pode passar pela mucosa intestinal e atingir a circulação sangüínea mais eficientemente em sujeitos que sofrem de desordens que causam um aumento na permeabilidade da mucosa intestinal, por exemplo, a doença de Crohn.
Um aspecto da invenção é um método para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado à mucosa intestinal, em que as referidas desordens aumentam a permeabilidade da mucosa intestinal, por administração oral a um sujeito de um polipeptídio anti- TNF-alfa conforme revelado na presente.
Este processo pode ser até adicionalmente realçado por um aspecto adicional da presente invenção - o uso de transportadoras de transporte ativos. Neste aspecto da invenção, VHH é fundido a uma transportadora que realça a transferência através da parede intestinal na circulação sangüínea. Em um exemplo não-restritivo, esta "transportadora" é um segundo VHH que é fundido ao VHH terapêutico. Tais construtos de fusão são feitos usando métodos conhecidos na técnica. O VHH "de transportadora" liga especificamente a um receptor na parede intestinal que induz uma transferência ativa através da parede.
Outra modalidade de execução da presente invenção é um uso de um polipeptídio anti-TNF-alfa conforme revelado na presente para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção ministrado à mucosa intestinal, em que as referidas desordens aumentam a permeabilidade da mucosa intestinal.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção à mucosa intestinal sem ser inativada, administrando oralmente a um sujeito um polipeptídio anti-TNF-alfa da invenção.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção à circulação 5 sanguínea de um sujeito sem ser inativada, administrando oralmente a um sujeito um polipeptídio anti-TNF-alfa da invenção.
Este processo pode ser até adicionalmente realçado por um aspecto adicional da presente invenção - o uso de 10 transportadoras de transporte ativos. Neste aspecto da invenção, um polipeptídio anti-TNF-alfa conforme descrito na presente é fundido a uma transportadora que realça a transferência através da parede intestinal na circulação sanguínea. Em um exemplo não-restritivo, esta 15 "transportadora" é um VHH que é fundido ao referido polipeptídio. Tais construtos de fusão são feitos utilizando métodos conhecidos na técnica. 0 VHH "de transportadora" liga especificamente a um receptor na parede intestinal que induz uma transferência ativa através da parede.
Uma modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme revelado na presente para uso em tratamento, prevenção e/ou alívio dos sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através dos 25 tecidos abaixo da língua com efetividade.
Os exemplos de desordens são qualquer inflamação de causa, inclusive, mas não limitados a artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino, e esclerose múltipla. Uma formulação do referido 30 construto de polipeptídios conforme revelado na presente, por exemplo, uma pastilha, borrifo, uma gota é colocada embaixo da língua e adsorvida através das membranas de muco na rede capilar embaixo da língua.
Um aspecto da invenção é um método para tratar, impedir 35 e/ou aliviar os sintomas de desordens suscetíveis ã modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através dos tecidos abaixo da língua com efetividade, por administração sublingual a um sujeito de um polipeptídio anti-TNF-alfa conforme revelado na presente.
Outra modalidade de execução da presente invenção é um 5 uso de um polipeptídio anti-TNF-alfa conforme revelado na presente para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar pelos tecidos abaixo da língua.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção aos tecidos abaixo da língua sem ser inativada, administrando sublingualmente a um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção à circulação sanguínea de um sujeito sem ser inativada, administrando oralmente a um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Uma modalidade de execução da presente invenção é um polipeptídio anti-TNF-alfa conforme revelado na presente para uso em tratamento, prevenção e/ou alívio dos sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através da 25 pele efetivamente.
Os exemplos de desordens são qualquer inflamação de causa, inclusive, mas não limitados a artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino, e esclerose múltipla. Uma formulação do referido 30 construto de polipeptídios, por exemplo, um creme, filme, borrifo, uma gota, o remendo, é colocada na pele e passa através dela.
Um aspecto da invenção é um método para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à 35 modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através da pele efetivamente, por administração tópica a um sujeito de um polipeptídio anti- TNF-alfa conforme revelado na presente.
Outra modalidade de execução da presente invenção é um uso de um polipeptídio anti-TNF-alfa conforme revelado na 5 presente para a preparação de um medicamento para tratar, impedir e/ou aliviar os sintomas de desordens suscetíveis à modulação por um Nanocorpo ou o polipeptídio da invenção que é capaz de passar através da pele efetivamente.
Um aspecto da invenção é um método para a administração 10 de um Nanocorpo ou o polipeptídio da invenção à pele sem ser inativada, administrando topicamente a um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente.
Um aspecto da invenção é um método para a administração de um Nanocorpo ou o polipeptídio da invenção à circulação 15 sangüínea de um sujeito, administrando topicamente a um sujeito um polipeptídio anti-TNF-alfa conforme revelado na presente,
Em outra modalidade de execução da presente invenção, um polipeptídio anti-TNF-alfa além disso compreende um 20 nanocrpo transportador (p. ex. VHH) que atua como uma transportadora de transporte ativa para transportar os referidos polipeptídio anti-TNF-alfa, do lúmen de pulmão ao sangue.
Um polipeptídio anti-TNF-alfa que, além disso, 25 compreende uma transportadora que liga especificamente a um receptor presente na superfície de mucosa (células epiteliais bronquiais) resultando no transporte ativo do polipeptídio do lúmen de pulmão ao sangue. O nanocrpo transportador pode ser fundido ao construto de polipeptídio.
Tais construtos de fusão podem ser feitos usando métodos conhecidos na técnica e são descritos na presente. O nanocrpo "transportador" liga especificamente a um receptor na superfície da mucosa que induz uma transferência ativa através da superfície.
Outro aspecto da presente invenção é um método para determinar que nanobodies (p. ex. o VHHs) são ativamente transportados na circulação sanguínea sob administração nasal. Semelhantemente uma biblioteca de fagos VHH inócua ou imune podem ser administradas nasalmente, e depois de pontos de tempo diferentes depois da administração, o sangue ou os 5 órgãos podem ser isolados para resgatar fagos que foram ativamente transportados à circulação sangüínea. Um exemplo não-restritivo de um receptor para transporte ativo do lúmen de pulmão à circulação sangüínea é o receptor Fc N (FcRn). Um aspecto da invenção inclui as moléculas VHH identificadas 10 pelo método. Tal VHH então pode ser usado como uma transportadora VHH para a entrega de um VHH terapêutico ao objetivo correspondente na circulação sangüínea sob administração nasal.
Em um aspecto da invenção, cada um pode usar um 15 polipeptídio anti-TNF-alfa conforme revelado na presente, para analisar agentes que modulam a ligação do polipeptídio à TNF-alfa. Quando identificado em um ensaio que mede a ligação ou o referido deslocamento de polipeptídio sozinho, os agentes terão de ser submetidos à prova funcional para 20 determinar se eles modulariam a ação do antígeno in vivo.
Em um exemplo de um experimento de deslocamento, o fago ou as células que expressam TNF-alfa ou um fragmento disso são incubados na ligação de buffer com o polipeptídio da invenção que foi etiquetada, na presença ou a ausência de 25 concentrações crescentes de um modulador candidato. Para validar e calibrar o ensaio, a utilização de reações de competição de controle que aumenta as concentrações do referido polipeptídio e que é não etiquetado, pode ser executada. Depois da incubação, as células são lavadas 30 extensivamente, e ligadas, o polipeptídio etiquetado é medido conforme apropriado para a etiqueta dada (p. ex. , contagem de cintilação, fluorescência, etc.) . Uma redução de pelo menos 10% na quantidade do polipeptídio etiquetado ligado na presença do modulador candidato indica o 35 deslocamento da ligação pelo modulador candidato. Considera- se que moduladores candidatos ligam especificamente nisto ou outros ensaios descritos na presente se eles deslocarem 50% do polipeptídio etiquetado (dose de polipeptídio sub- saturada) em uma concentração de 1 μ M ou menos.
Alternativamente, ligação ou o deslocamento da ligação 5 podem ser controladas pela ressonância de plasmon superficial (SPR). Ensaios de ressonância de plasmon superficial podem ser usados como um método quantitativo para medir a ligação entre duas moléculas pela modificação na massa perto de um sensor imobilizado causado pela ligação 10 ou perda da ligação do polipeptídio da invenção da fase aquosa à TNF-alfa imobilizada em uma membrana no sensor. Esta modificação na massa é medida como unidades de ressonância contra o tempo depois de injeção ou retirada do acima citado polipeptídio ou modulador candidato e medida 15 usando um Biosensor Biacore (Biacore AB) . A TNF-alfa, por exemplo, pode ser imobilizada em um chip sensor (por exemplo, grau de pesquisa chip CM5; Biacore AB) em uma membrana de lipídio de filme fina segundo os métodos descritos por Salamon et al. (Salamon et al. , 1996, Biophys J. 71: 283-294; Salamon et al., 2001, Biophys. J. 80: 1557- 1567; Salamon et al. , 1999, Trends Biochem. Sci. 24: 213- 219, cada um dos quais é incorporado na presente por referência.) . Sarrio et al. demonstrou que SPR pode ser usado para descobrir ligando que liga ao GPCR A(l) receptor 25 adenosina imobilizado em uma camada de lipídio no chip (Sarrio et al., 2000, Mol. Cell. Biol. 20: 5164-5174,incorporado na presente por referência). As condições para a ligação de um polipeptídio da invenção à TNF-alfa em um ensaio SPR podem ser controladas em detalhe por alguém com 30 habilidades na técnica que usa as condições informadas por Sarrio. como um ponto de partida.
O SPR pode ensaiar moduladores da ligação de pelo menos dois modos. Primeiro, um polipeptídio da invenção pode ser pré-ligado à TNF-alfa imobilizada seguida pela injeção do 35 modulador candidato em uma concentração nos limites de 0,1 nM a 1 μ M. 0 deslocamento do polipeptídio ligado pode ser quantificado, permitindo a detecção da ligação de modulador. Alternativamente, o TNF-alfa ligada de membrana pode ser pré-incubada com um modulador candidato e desafiada com o polipeptídio da invenção. Uma diferença na afinidade de ligação entre o referido polipeptídio e o TNF-alfa pré- incubada com o modulador, comparado com isto entre o referido polipeptídio e o TNF-alfa na ausência do modulador demonstrará a ligação ou o deslocamento do referido polipeptídio na presença do modulador. No ensaio, uma redução de 10% ou em mais na quantidade do referido polipeptídio ligado na presença do modulador candidato, quanto à quantidade do referido polipeptídio ligado na ausência do modulador candidato indica que o modulador candidato inibe a interação do TNF-alfa e do referido polipeptídio.
Outro método de descobrir a inibição da ligação de, por exemplo, um polipeptídio da invenção, à TNF-alfa usa transferência de energia de ressonância de fluorescência (FRET). FRET é um fenômeno mecano-quântico que ocorre entre um doador de fluorescência (D) e um aceitante de fluorescência (A) na proximidade fechada um a outro (normalmente <100 Â da separação) se o espectro de emissão de D fica sobreposto com o espectro de excitação de A. As moléculas a ser testadas, p. ex. um polipeptídio da invenção e umo TNF-alfa são etiquetados com um par complementar de fluoroforos doador e aceitante. Enquanto ligado estreitamente em conjunto pelo TNF-alfa: a interação de polipeptídio, a fluorescência emitida sobre a excitação do doador fluoroforo terá um comprimento de onda diferente do emitido em resposta àquele comprimento de onda de excitação quando o acima citado polipeptídio e o TNF-alfa não estão ligados, provendo quantificação das moléculas ligadas contra as não ligadas pela medição da intensidade de emissão em cada comprimento de onda. Os fluoroforos doadores com que etiquetar o TNF-alfa são bem conhecidos na técnica. De determinado interesse são variantes do A. Victoria GFP conhecido como Cyan FP (CFP, Doador (D) ) e FP Amarelo (YFP, Aceitante (A) ) . Como um exemplo, a variante YFP pode ser feita como uma proteína de fusão com o TNF-alfa. Os vetores para a expressão de variantes GFP como fusões (Clontech) bem 5 como reagentes fluoroforo-etiquetados (Sondas Moleculares) são conhecidos na técnica. A adição de um modulador candidato à mistura de polipeptídio fluorescentemente- etiquetado e YFP-TNF-alfa resultará em uma inibição da transferência de energia evidenciada por, por exemplo, uma 10 redução na fluorescência YFP quanto a uma amostra sem o modulador candidato. Em um ensaio que usa FRET para a detecção de TNF-alfa: a interação de polipeptídio, uns 10% ou uma maior redução na intensidade da emissão fluorescente no comprimento de onda de aceitante em amostras que contêm 15 um modulador candidato, quanto a amostras sem o modulador candidato, indicara que o modulador candidato inibe a interação TNF-alfa:polipeptídio.
Uma amostra como usada na presente pode ser qualquer TNF-alfa de amostra biológica que contém como clínico (p. 20 ex. frações de célula, sangue inteiro, plasma, soro, tecido, células, etc.), derivada de clínica, agrícola, forense, pesquisa, ou outras amostras possíveis. As amostras clínicas podem ser de origem dos animais ou ser humano. A amostra analisada pode ser sólida ou líquida por natureza. É 25 evidente que quando materiais sólidos são usados, esses são primeiro dissolvidos em uma solução conveniente.
Uma variação na FRET usa a extinção de fluorescência para controlar interações moleculares. Uma molécula no par que interage pode ser etiquetada com um fluoroforo, e outra 30 com uma molécula que extingue a fluorescência do fluoroforo quando trazido em justaposição fechada com ele. Uma modificação na fluorescência sobre a excitação é indicativa de uma modificação na associação das moléculas marcadas com o par de fluoroforo:quencher. Geralmente, um aumento na 35 fluorescência do TNF-alfa etiquetado é indicativo que o polipeptídio anti-TNF-alfa que carrega o quencher foi deslocado. Para ensaios de quenching, 10% ou maior aumento na intensidade da emissão fluorescente em amostras que contêm um modulador candidato, quanto a amostras sem o modulador candidato, indica que o modulador candidato inibe 5 o TNF-alfa: interação de polipeptídio de anti-TNF-alfa.
Além da ressonância de plasmon superficial e métodos de FRET, a medição de polarização de fluorescência é útil à ligação de quantidade. 0 valor de polarização de fluorescência para uma molécula fluorescentemente marcada 10 depende do tempo de correlação rotativo ou tarifa que cai.
Os complexos, como os formados pelo TNF-alfa que se associa com polipeptídio anti-TNF-alfa fluorescentemente etiquetado, têm mais altos valores de polarização do que o polipeptídio não complexado, etiquetado. A inclusão de um inibidor de 15 candidato da interação de polipeptídio TNF-alfa:anti-TNF-alfa resulta em uma redução na polarização de fluorescência, quanto a uma mistura sem o inibidor de candidato, se o inibidor de candidato interromper ou inibir a interação do TNF-alfa com o referido polipeptídio. A polarização de fluorescência é bem ajustada para a identificação de pequenas moléculas que interrompem a formação de complexos de polipeptídio TNF-alfa:anti-TNF-alfa. Uma redução de 10% ou mais na polarização de fluorescência em amostras que contêm um modulador candidato, quanto à polarização de 25 fluorescência em uma amostra que necessita do modulador candidato, indica que o modulador candidato inibe o TNF- alfa: interação de polipeptídio de anti-TNF-alfa.
Outra alternativa para monitorar TNF-alfa: as interações de polipeptídio de anti-TNF-alfa usam um ensaio 30 de biosensor. Os biosensores de CCI foram descritos na técnica (Instituto de Pesquisa de Biotecnologia de Membrana Australiano; Cornell B, Braach-Maksvytis V, Rei L, Osman P, Raguse B, Wieczorek L, e Pace R. "Um biosensor que usa comutadores de canal de ion", Nature, 1997, 387, 580). Nesta 35 tecnologia, a associação do TNF-alfa e um polipeptídio anti- TNF-alfa é ligada ao encerramento de canais de íon gramicidins-facilitados nas bicamadas de membrana suspensa e portanto a uma modificação mensurável na admissão (semelhante à impedância) do biosensor. Esta aproximação é linear mais de seis ordens da magnitude da admissão 5 modificam-se e é de maneira ideal ajustado para grande escala, alta análise de quantidade tratada das bibliotecas combinatórias de pequenas moléculas. Uns 10% ou maior modificação (aumento ou redução) na admissão em uma amostra que contém um modulador candidato, quanto à admissão de uma 10 amostra que necessita do modulador candidato, indicam que o modulador candidato inibe a interação do TNF-alfa e do referido polipeptídio. É importante observar que em ensaios que testam a interação do TNF-alfa com um polipeptídio anti- TNF-alfa, é possível que um modulador da interação não 15 necessariamente tenha de interagir diretamente com o domínio(s) da proteína que fisicamente interage com o referido polipeptídio. É também possível que um modulador interaja em uma posição retirada do sítio de interação e cause, por exemplo, uma modificação conformacional no TNF- 20 alfa. Os moduladores (nervos inibidores ou agonistas) que atuam nesta maneira são todavia do interesse como agentes para modular a ligação do TNF-alfa ao seu receptor.
Algum dos ensaios de ligação descritos podem ser usados para determinar a presença de um agente em uma amostra, p. ex., uma amostra de tecido, que liga à TNF-alfa, ou que afeta a ligação de, por exemplo, um polipeptídio de polipeptídio da invenção à TNF-alfa. Para fazer assim umo TNF-alfa é reagida com o referido polipeptídio na presença ou a ausência da amostra, e a ligação de polipeptídio é 30 medida como apropriada para o ensaio de ligação que é usado.
Uma redução de 10% ou mais na ligação do referido polipeptídio indica que a amostra contém um agente que modula a ligação do referido polipeptídio à TNF-alfa. Naturalmente, o acima mencionado - o método generalizado 35 poderia ser facilmente aplicado à análise para moduladores candidatos que alteram a ligação entre qualquer polipeptídio anti-TNF-alfa da invenção, uma seqüência homóloga disso, uma porção funcional disso ou uma porção funcional de uma seqüência homóloga disso, e TNF-alfa ou um fragmento disso.
Uma modalidade de execução da presente invenção é um 5 agente desconhecido identificado pelo método revelado na presente.
Uma modalidade de execução da presente invenção é um agente desconhecido identificado pelo método revelado na presente para uso em tratamento, prevenção e/ou alívio dos 10 sintomas de desordens que se relacionam com processos inflamatórios.
Outra modalidade de execução da presente invenção é um uso de um agente desconhecido identificado pelo método revelado na presente para uso em tratamento, prevenção e/ou 15 alívio dos sintomas de desordens que se relacionam com processos inflamatórios.
Os exemplos de desordens incluem a artrite reumatóide, a doença de Crohn, a colite ulcerativa, a síndrome inflamatória do intestino e esclerose múltipla.
Uma célula que é útil segundo a invenção é preferivelmente selecionada do grupo composto de células bacterianas como, por exemplo, E. coli, células de levedura como, por exemplo, S. cerevisiae, P. pastoris, células de inseto ou células de mamífero.
Uma célula que é útil segundo a invenção pode ser qualquer célula na qual uma seqüência ácida nucléica que codifica um polipeptídio que compreende um anti-TNF-alfa da invenção, uma seqüência homóloga disso, uma porção funcional disso ou uma porção funcional de uma seqüência homóloga 30 disso segundo a invenção pode ser introduzida tal que o polipeptídio é expresso a níveis naturais ou acima de níveis naturais, conforme definido na presente. Preferivelmente um polipeptídio da invenção que é expressa em uma célula expõe normal ou perto da farmacologia normal, conforme definido na 35 presente.
Segundo uma modalidade de execução preferencial da presente invenção, uma célula é selecionada do grupo composto de C0S7-células, uma célula CHO, um LM (TK-) célula, uma célula NIH-3T3, célula de HEK-293, célula de K- 562 ou um 1321N1 célula astrocitoma mas também outras linhas 5 de célula transfectável.
Em geral, "a quantidade terapeuticamente eficaz", "a dose terapeuticamente eficaz" e "quantidade eficaz" significa a quantidade necessária para atingir o resultado ou resultados desejados (modulando ligação TNF-alfa; 10 tratamento ou prevenção de inflamação). Uma habilidade ordinária na técnica reconhecerá que a potência e, por isso, "uma quantidade eficaz" pode variar para vários compostos que modulam a ligação de TNF-alfa usada na invenção. Um experimentado na técnica pode avaliar prontamente a potência 15 do composto.
Como usado na presente, o termo "composto" refere-se a um polipeptídio anti-TNF-alfa da presente invenção, uma composição, ou um ácido nucléico capaz da codificação do referido polipeptídio ou um agente identificado segundo o 20 método de análise descrito na presente ou os referidos o polipeptídio que compreende um ou vários aminoácidos derivatizados."Por farmaceuticamente aceitável" se que dizer um material que não é biologicamente ou de outra maneira 25 indesejável, isto é, o material pode ser administrado a um indivíduo junto com o composto sem causar qualquer efeito biológico indesejável ou interagir em uma maneira deletéria com algum de outros componentes da composição farmacêutica na qual é contido.
Os polipeptídios de Anti-TNF-alfa conforme revelado na presente são úteis para o tratamento ou a prevenção de condições em um sujeito e compreendem a administração de uma quantidade farmaceuticamente eficaz de um composto ou composição.
Os polipeptídios de Anti-TNF da presente invenção são úteis para o tratamento ou a prevenção de condições que se relacionam com artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino e esclerose múltipla em um sujeito e compreende a administração de uma quantidade farmaceuticamente eficaz de um composto ou 5 composição que liga o TNF-alfa.
Os polipeptídios de Anti-TNF-alfa como revelado aqui em são úteis para o tratamento ou a prevenção de condições em um sujeito e compreende a administração de uma quantidade farmaceuticamente eficaz de uma combinação composta com o 10 outro, como, por exemplo, aspirina.
Os polipeptídios anti-TNF-alfa como revelado aqui em são úteis para o tratamento ou a prevenção de condições que se relacionam com artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino e 15 esclerose múltipla em um sujeito e compreende a administração de uma quantidade farmaceuticamente eficaz de uma combinação composta com o outro, como, por exemplo, aspirina.
A presente invenção não é limitada à administração de 20 formulações que compreendem um composto único da invenção. É dentro dos limites da invenção para fornecer tratamentos de combinação em que uma formulação é administrada a um paciente na necessidade disso que compreende mais de um composto da invenção.
As condições mediadas pelo TNF-alfa incluem, mas não são limitadas a artrite reumatóide, doença de Crohn, colite ulcerativa, síndrome inflamatória do intestino e esclerose múltipla.
Um composto útil na presente invenção pode ser 30 formulado como composições farmacêuticas e administrado a um hospedeiro mamífero, como um paciente humano ou um animal doméstico em várias formas adaptadas à via escolhida da administração, isto é, oralmente ou parenteralmente, por intranasalmente por inalação, vias intravenosas, 35 intramusculares, tópicas ou subcutâneas.
Um composto da presente invenção também pode administrado usando métodos de administração de terapia genética. Ver, p, ex.,Patente U.S. n. 5,399,346, que é incorporada por referência em sua totalidade. Usando um método de administração por terapia genética, células 5 primárias transfetadas com o gene para o composto da presente invenção pode ser adicionalmente transfetadas com promotores específicos de tecido para visar órgãos específicos, tecido, enxertos, tumores, ou células.
Portanto, o composto presente pode ser sistemicamente 10 administrado, p. ex., oralmente, em combinação com um veículo farmaceuticamente aceitável como um diluente inerte ou uma transportadora comestível assimilável. Eles podem ser incluídos em cápsulas de gelatina de capas duras ou suaves, podem ser compressos em pastilhas, ou incorporados 15 diretamente com a comida da dieta do paciente. Para administração terapêutica oral, o composto ativo pode ser combinado com um ou vários excipientes e usado na forma de pastilhas ingeríveis, pastilhas bucais, pastilhas, cápsulas, elixires, suspensões, xaropes, bolinhos delgados, e assim 20 por diante. Tais composições e as preparações devem conter pelo menos 0,1% do composto ativo. A porcentagem das composições e preparações pode ser, naturalmente, variada e pode estar convenientemente entre aproximadamente 2 a aproximadamente 6 0% do peso de uma forma de dosagem de 25 unidade dada. A quantidade do composto ativo em tais composições terapeuticamente úteis é tal que um nível de dosagem eficaz será obtido.
As pastilhas, comprimidos, pílulas, cápsulas, e assim por diante também podem conter o seguinte: aglutinantes como 30 goma tragacanth, acácia, amido de grão ou gelatina; excipientes como fosfato bicálcico; um agente que se desintegra como amido de grão, amido de batatas, algínico ácido e assim por diante; um lubrificante como magnésio estearato; e um agente de adoçamento como sacarose, 35 fructose, lactose ou aspartame ou um agente de sabor como hortelã, o óleo de pirola, ou sabor de cereja pode ser acrescentado. Quando a forma de dosagem de unidade é uma cápsula, ela pode conter, além de materiais do tipo acima mencionado, um portador líquido, como um óleo vegetal ou um glicol de polietileno. Vários outros materiais podem estar 5 presentes como revestimentos ou modificar de outra maneira a forma física da forma de dosagem de unidade sólida. Por exemplo, as pastilhas, as pílulas, ou as cápsulas podem ser cobertas de gelatina, cera, goma-laca ou açúcar e assim por diante. Um xarope ou o elixir podem conter o composto ativo, 10 a sacarose ou fructose como um agente de adoçamento, metila e propilparabenos como preservantes, uma tintura e sabor como sabor de cereja ou cor de laranja. Naturalmente, qualquer material usado na preparação de qualquer forma de dosagem de unidade deve ser farmaceuticamente aceitável e substancialmente não-tóxica nas quantidades empregadas. Além do mais, o composto ativo pode ser incorporado em preparações e dispositivos de administração prolongada.
O composto ativo também pode ser administrado intravenosamente ou intraperitonealmente por infusão ou 20 injeção. As soluções do composto ativo ou os seus sais podem ser preparadas em água, opcionalmente misturada com um surfactante não-tóxico. As dispersões também podem ser preparadas em glicerol, glicol de polietileno líquido, triacetin, e misturas disso e em óleos. Em condições 25 ordinárias de armazenamento e uso, essas preparações contêm um conservante para prevenir o crescimento de microrganismos.
As formas de dosagem farmacêuticas convenientes para a injeção ou a infusão podem incluir soluções aquosas estéreis 30 ou dispersões ou pó estéril que compreende o ingrediente ativo que é adaptado para a preparação extemporânea de soluções injetáveis ou infusíveis estéreis ou dispersões, opcionalmente encapsuladas em lipossomas. Em todos os casos, a forma de dosagem última deve ser estéril, fluida e estável 35 nas condições de fabricação e armazenamento. A transportadora líquida ou o veículo podem ser um meio de dispersão solvente ou líquido, compreendendo, por exemplo, água, etanol, um poliol (por exemplo, glicerol, glicol de propileno, glicol de polietileno líquido, e assim por diante), óleos vegetais, ésteres gliceril não-tóxicos , e misturas convenientes disso. A fluidez apropriada pode ser mantida, por exemplo, pela formação de lipossomas, pela manutenção do tamanho de partícula requerido em caso de dispersões ou pelo uso de surfactantes. A prevenção da ação de microrganismos pode ser ocasionada por vários agentes antibacterianos e antifungosos, por exemplo, parabenos, clorobutanol, fenol, ácido sórbico, timerosal, e assim por diante. Em muitos casos, será preferível incluir agentes isotônicos, por exemplo, açúcar, buffers ou cloreto de sódio. A absorção prolongada das composições injetáveis pode ser ocasionada pelo uso nas composições de agentes que atrasam a absorção, por exemplo, alumínio monostearato e gelatina.
As soluções injetáveis estéreis estão preparadas incorporando o composto ativo na quantidade requerida no solvente apropriado com vários de outros ingredientes enumerados anteriormente, como requerido, seguido pela esterilização com filtro. Em caso do pó estéril para a preparação de soluções injetáveis estéreis, os métodos preferenciais da preparação são a secagem à vácuo e a técnicas de secagem por congelamento, que produzem um pó do ingrediente ativo mais qualquer presente de ingrediente desejado adicional nas soluções anteriormente estéreis- filtradas.
Para administração tópica, o composto presente pode ser 30 aplicado na forma pura, isto é, quando eles são líquidos. Contudo, será geralmente desejável administrá-los à pele como composições ou formulações, em combinação com uma transportadora dermatologicamente aceitável, que pode ser um sólido ou um líquido.
Os portadores sólidos úteis incluem sólidos finamente divididos como talco, barro, celulose microcristalina, sílica, alumina e assim por diante. Os portadores líquidos úteis incluem água, hidroálcalis ou glicol ou misturas de água-álcool/glicol, nas quais o composto presente pode ser dissolvido ou dispersado a níveis eficazes, opcionalmente com a ajuda de surfactantes não-tóxicos. Adjuvantes como fragrâncias e agentes antimicrobiais adicionais podem ser acrescentados para otimizar as propriedades para um uso dado. As composições líquidas resultantes podem ser aplicadas de almofadas absorventes, usadas para impregnar bandagens e outros curativos, ou borrifados na área afetada que usa pulverizadores de aerossol ou tipo de bomba.
Os espessantes como polímero sintético, ácidos gordurosos, sais e ésteres de ácidos gordurosos, álcoois gordurosos, celuloses modificadas ou materiais minerais modificados também podem ser empregados com transportadoras líquidas para formar pastas para borrifar, géis, ungüentos, sabões, e assim por diante, para aplicação diretamente à pele do usuário.
Exemplos de composições dermatológicas úteis que podem ser usadas para administrar o composto à pele são conhecidos na técnica; por exemplo, ver Jacquet et al. (U.S. Pat. N° . 4,608,392), Geria (U.S. Pat. N°. 4,992,478), Smith et al. (U.S. Pat. N° . 4,559,157) e Wortzman (U.S. Pat. N°. 4,820,508).
Dosagens úteis do composto podem ser determinadas comparando sua atividade in vitro, e na atividade in vivo em modelos animais. Os métodos para a extrapolação de dosagens eficazes em ratos, e outros animais, a seres humanos são conhecidos na técnica; por exemplo, ver U.S. Pat. N° . 30 4,93 8,94 9.
Geralmente, a concentração do composto(s) em uma composição líquida, como uma loção, será de aproximadamente 0,1-25 wt-%, preferivelmente de aproximadamente 0,5-10 wt-%. A concentração em uma composição semi-sólida ou sólida como 35 um gel ou um pó será aproximadamente 0,1-5 wt-%,preferivelmente aproximadamente 0,5-2.5 wt-%.
A quantidade do composto, ou um sal ativo ou derivado disso, requerido para uso no tratamento variará não só com o determinado sal selecionado mas também com a via de administração, a natureza da condição que é tratada e a 5 idade e a condição do paciente e será enfim à discrição do médico ou clínico atendente. Também a dosagem do composto varia dependendo da célula objetivo, tumor, tecido, enxerto, ou órgão.
A dose desejada pode ser convenientemente apresentada 10 em uma dose única ou como doses divididas administradas em intervalos apropriados, por exemplo, como dois, três, quatro ou mais sub-doses por dia. A própria sub-dose pode ser além disso dividida, p. ex. , em um número de administrações discretas livremente espaçadas,- como múltiplas inalações de 15 um insuflador ou pela aplicação de uma pluralidade de gotas no olho.
Um regime de administração pode incluir o tratamento de longo prazo, diário. Por "de longo prazo" se entende pelo menos duas semanas e preferivelmente, várias semanas, meses, 20 ou anos da duração. As modificações necessárias nesta variedade de dosagem podem ser determinadas por uma habilidade ordinária na técnica usando só experimentação de rotina dada nos ensinamentos na presente. Ver Remington's Pharmaceuticals Sciences (Martin, E.W., editor 4), Mack 25 Publishing Co, Easton, PA. A dosagem também pode ser ajustada pelo médico individual no caso de qualquer complicação.
A invenção provê um agente que é um modulador do TNF- alfa / interações de TNF-alfa-receptor.
O agente de candidato pode ser um agente sintético, ou uma mistura de agentes, ou ser um produto natural (p. ex. um extrato de planta ou cultura supernadante). Um agente de candidato segundo a invenção inclui uma pequena molécula que pode ser sintetizada, um extrato natural, peptídeos, 35 proteína, carboidratos, lipídios etc.
Os Agentes moduladores candidato de grandes bibliotecas de agentes sintéticos ou naturais podem ser protegidos. Meios numerosos são atualmente usados para a síntese casual e dirigida de sacarídeo, peptídeo, e agentes baseados em ácido nucléico. As bibliotecas de agente sintéticas são comercialmente disponíveis de um número de companhias inclusive Maybridge Chemical Co (Trevillet, o Cornwall, Reino Unido), Comgenex (Princeton, NJ) , Sócios de Brandon (Merrimack, NH), e Microsource (New Milford, CT). Uma biblioteca química rara é disponível de Aldrich (Milwaukee, WI) . As bibliotecas combinatórias são disponíveis e podem ser preparadas. Alternativamente, as bibliotecas de agentes naturais na forma de extratos bacteriano, fungoso, planta e dos animais são disponíveis de p. ex. , Pan Laboratories (Bothell, WA) ou MycoSearch (NC) , ou são prontamente produzíveis por métodos bem conhecidos na técnica. Adicionalmente, as bibliotecas naturais e sinteticamente produzidas e os agentes são prontamente modificados por meios químicos, físicos, e bioquímicos através de convencionais.
Os agentes úteis podem ser encontrados dentro de classes químicas numerosas. Os agentes úteis podem ser agentes orgânicos, ou pequenos agentes orgânicos. Os pequenos agentes orgânicos têm um peso molecular de mais de 50 ainda menos de aproximadamente 2,500 daltons, preferivelmente menos de aproximadamente 750, mais preferivelmente menos de aproximadamente 350 daltons. As classes exemplares incluem heterociclos, peptídeos, sacarídeos, esteróides, e assim por diante. Os agentes podem ser modificados para realçar a eficácia, a estabilidade, a compatibilidade farmacêutica, e assim por diante. A identificação estrutural de um agente pode ser usada para identificar, gerar, ou proteger agentes adicionais. Por exemplo, onde os agentes de peptídeo são identificados, eles podem ser modificados de vários modos para realçar a sua estabilidade, como utilização de um aminoácido desnaturai, como um ácido D-amino, em particular D-alanina, por funcionalização do amino ou término carboxilico, p. ex. para o grupo amino, acilação ou alquilação, e para o grupo carboxilo, esterificação ou amidificação, ou o parecido.
Para análise primária, uma concentração útil de um 5 agente de candidato segundo a invenção é de aproximadamente 10 mm a aproximadamente 100 μ M ou mais (isto é, 1 mM, 10 mM, 1O0 mM, 1 M etc.) . A concentração de análise primária será usada como um limite superior, junto com nove concentrações adicionais, em que as concentrações adicionais 10 são determinadas reduzindo a concentração de análise primária em intervalos de meio-log (p. ex. para mais 9 concentrações) para análises secundárias ou para geração de curvas de concentração.
Um conjunto de análise de alto rendimento segundo a 15 invenção compreende todos os meios necessários e meios de comunicação para executar a detecção de um agente que modula interações de receptor TNF-alfa/TNF-alfa interagindo com o TNF-alfa na presença de um polipeptídio, preferivelmente em uma concentração na variedade de 1 μ M a 1 mm.
O conjunto compreende o seguinte. As células Recombinantes da invenção, compreendendo e expressando a seqüência de nucleotídeos que codifico TNF-alfa, que são cultivados segundo o conjunto em um suporte sólido, como uma chapa de microtitragem, mais preferivelmente uma placa de microtritragem com 96 cavidades, segundo os métodos bem conhecidos à pessoa experimentada na técnica sobretudo como descrito em WO 00/02045. Alternativamente TNF-alfa é fornecido em uma forma purificada a ser imobilizada em, por exemplo, uma placa de microtritragem com 96 cavidades pela pessoa experimentada na técnica. Alternativamente TNF-alfa é fornecido no conjunto pré-imobilizado em, por exemplo, uma placa de microtritragem com 96 cavidades. A TNF-alfa pode ser TNF-alfa inteira ou um fragmento disso.
Agentes moduladores segundo a invenção, em concentrações de aproximadamente 1 μ M a 1 mm ou mais, são acrescentados a cavidades definidas na presença de uma concentração apropriada do polipeptídio anti-TNF-alfa, uma seqüência homóloga disso, uma porção funcional disso ou uma porção funcional de uma seqüência homóloga disso, a referida concentração do referido polipeptídio preferivelmente na 5 variedade de 1 μ M a 1 mm. Os conjuntos podem conter um ou vários polipeptídios anti-TNF-alfa da invenção.
Os ensaios de ligação são executados como segundo os métodos já revelados na presente e os resultados são em comparação com o nível de base de, por exemplo, ligação de 10 TNF-alfa a um polipeptídio anti-TNF-alfa, uma seqüência homóloga disso, uma porção funcional disso ou uma porção funcional de uma seqüência homóloga disso, mas a ausência do agente modulador acrescentado. As cavidades que mostram pelo menos 2 vezes, preferivelmente 5 vezes, mais preferivelmente 15 10 vezes e o mais preferivelmente uma 100 vezes ou mais aumento ou redução em TNF-alfa-polipeptídeo que liga (por exemplo) comparando com o nível da atividade a ausência do modulador, são selecionados para nova análise.
A invenção provê outros conjuntos úteis para proteção 20 para os moduladores da ligação de receptor TNF-alfa/TNF- alfa, bem como conjuntos úteis para o diagnóstico de desordens caracterizadas pela disfunção do TNF-alfa. A invenção também provê conjuntos úteis para proteção para os moduladores das desordens bem como conjuntos para o seu 25 diagnóstico, as referidas desordens caracterizadas por um ou vários processos que implicam TNF-alfa. Os conjuntos úteis segundo a invenção podem incluir umo TNF-alfa isolada. Alternativamente, ou além do mais, um conjunto pode compreender células transformadas para expressar o TNF-alfa. 30 Em uma nova modalidade de execução, um conjunto segundo a invenção pode compreender um polinucleotídeo de codificação de TNF-alfa. Em uma ainda nova modalidade de execução, um conjunto segundo a invenção pode compreender os escorvadores específicos úteis para a amplificação do TNF-alfa. Os 35 conjuntos úteis segundo a invenção podem compreender um polipeptídio TNF-alfa isolado, um homólogo disso, ou uma porção funcional disso. Um conjunto segundo a invenção pode compreender as células transformadas para expressar o referido polipeptídio. Os conjuntos podem conter mais de um polipeptídio. Em uma nova modalidade de execução, um conjunto segundo a invenção pode compreender um polinucleotídeo codificação de TNF-alfa. Em uma ainda nova modalidade de execução, um conjunto segundo a invenção pode compreender os escorvadores específicos úteis para a amplificação de uma macromolécula como, por exemplo, TNF- alfa. Todos os conjuntos segundo a invenção compreenderão os itens determinados ou combinações de itens e materiais de embalagem, por isso. Os conjuntos também incluirão instruções para uso. experimentada que pode ser possível "enxertar" um ou vários dos CDR'S acima mencionados para os nanocorpos da invenção para outros "andaimes", inclusive, mas não limitado a, andaimes humanos ou andaimes de não-imunoglobulina. Andaimes convenientes e técnicas para tal enxerto de CDR estará claro 20 para a pessoa experimentada e é bem conhecido na técnica, vide, por exemplo, os US-A-7,180,370, WO 01/27160, EP 0 605522, EP 0 460167, os US-A-7,054,297, Nicaise et al . , Protein Science (2004), 13:1882-1891; Ewert et al. , Métodos, 2004 Oct; 34 (2):184-199; Kettleborough et al., Protein Eng. Oct de 1991; 4 (7): 773-783; O'Brien e Jones, Methods Mol. Biol. 2003: 207: 81-100; e Skerra, J. Mol. Recognit. 2000: 13: 167-187, e Saerens et al., J. Mol. Biol. 2005 Sep 23; 352 (3) : 597-607, e as novas referências citadas na presente. Por exemplo, as técnicas conhecidas por si para enxerto de CDR's de rato ou camundongo em armações e andaimes humanos podem ser usadas em uma maneira análoga para fornecer a proteína quimérica que compreende um ou vários do CDR'S dos nanocorpos da invenção e um ou regiões ou seqüências de armação humanas.
Portanto, em outra modalidade de execução, a invenção compreende um polipeptídio quimérico que compreende pelo menos uma seqüência CDR escolhida do grupo composto de seqüências CDR1, as seqüências de CDR2 e as seqüências CDR3 mencionadas na presente para os nanocorpos da invenção. Preferivelmente, tal polipeptídio quimérico compreende pelo 5 menos uma seqüência CDR escolhida do grupo composto das seqüências CDR3 mencionada na presente para os nanocorpos da invenção, e opcionalmente também pelo menos uma seqüência CDR escolhida do grupo composto das Seqüências CDR1 e CDR2 mencionada na presente para os nanocorpos da invenção. Por 10 exemplo, tal polipeptídio quimérico pode compreender uma seqüência CDR escolhida do grupo composto das seqüências CDR3 mencionada na presente para os nanocorpos da invenção, uma seqüência CDR escolhida do grupo composto das seqüências CDR1 mencionada na presente para os nanocorpos da invenção e 15 uma seqüência CDR escolhida do grupo composto das seqüências CDR1 e CDR2 mencionadas na presente para os nanocorpos da invenção. As combinações do CDR'S que são mencionadas na presente como preferidas para os nanocorpos da invenção também serão normalmente preferidas para esses polipeptídios 20 quiméricos.
Nos referidos polipeptídios quiméricos, o CDR'S pode ser ligado às novas seqüências aminoácidas e/ou ligado um a outro via seqüências aminoácidas, nas quais as referidas seqüências aminoácidas são preferivelmente seqüências de 25 armação ou são seqüências aminoácidas que atuam como seqüências de armação, ou em conjunto formam um andaime para apresentar o CDR'S. A referência é novamente feita à arte prévia mencionada no parágrafo último. Segundo uma modalidade de execução preferencial, as seqüências 30 aminoácidas são seqüências de armação humanas, por exemplo, seqüências de armação de VH3 • Contudo, seqüências de armação não-humanas, sintéticas, semi-sintéticas ou de não- imunoglobulina também pode ser usadas. Preferivelmente, as seqüências de armação usadas são tais que (1) o polipeptídio 35 quimérico é capaz de ligar xxxx, isto é, com uma afinidade que é pelo menos 1%, preferivelmente pelo menos 5%, mais preferivelmente pelo menos 10%, como pelo menos 25% e até 50% ou 90% ou mais da afinidade do correspondente Nanocorpo da invenção; (2) o polipeptídio quimérico é conveniente para uso farmacêutico; e (3) o polipeptídio quimérico é 5 preferivelmente essencialmente não-imunogênico nas condições desejadas para uso farmacêutico (isto é, indicação, modo de administração, dose e regime de tratamento) disso (que pode ser essencialmente análogo às condições descritas na presente para o uso dos nanocorpos da invenção).
Segundo uma modalidade de execução não-restritiva, o polipeptídio quimérico compreende pelo menos duas seqüências CDR (como acima mencionado) ligado via pelo menos uma seqüência de armação, na qual preferivelmente pelo menos uma de duas seqüências CDR é uma seqüência CDR3, com outra seqüência CDR que é um CDR1 ou seqüência CDR2. Segundo uma modalidade de execução preferencial, mas não-restritiva, o polipeptídio quimérico compreende pelo menos duas seqüências CDR (como acima mencionado) ligado pelo menos duas seqüências de armação, nas quais preferivelmente pelo menos 20 uma de três seqüências CDR é uma seqüência CDR3, com outras duas seqüências CDR que são seqüências CDR1 ou CDR2, e preferivelmente sendo uma seqüência CDR1 e uma seqüência CDR2. Segundo uma modalidade de execução especificamente preferencial, mas não-restritiva, os polipeptídios quiméricos têm a estrutura FR1' - CDR1 - FR2' - CDR2 - FR3' - CDR3 - FR4' , no qual CDR1, CDR2 e CDR3 são como definidos na presente para o CDR'S dos nanocorpos da invenção, e FR1', FR2' , FR3' e FR4' são seqüências de armação. FR1' , FR2' , FR3' e FR4' pode ser especialmente Armação 1, Armação 2, 30 Armação 3 e Armação 4 seqüências, respectivamente, de um anticorpo humano (como seqüências vm) e/ou partes ou fragmentos de tais seqüências de Armação. É também possível usar partes ou fragmentos de um polipeptídio quimérico com a estrutura FR1' - CDR1 - FR2' - CDR2 - FR3' - CDR3 - FR4 .
Preferivelmente, tais partes ou fragmentos são tais que eles encontram os critérios estabelecidos no parágrafo precedente.
A invenção também se refere a proteína e polipeptídios compreendendo e/ou essencialmente compostos de tais polipeptídios quiméricos, aos ácidos nucléicos que codificam 5 tal proteína ou polipeptídios; a métodos para preparar tal proteína e polipeptídios; apresentar células que expressam ou são capazes de expressar tal proteína ou polipeptídios; a composições, e especialmente a composições farmacêuticas, que compreendem tal proteína ou polipeptídios, ácidos 10 nucléicos ou apresentar células; e a usos de tal proteína ou polipeptídios, tais ácidos nucléicos, tais células hospedeiras e/ou tais composições, especialmente para objetivos profiláticos, terapêuticos ou diagnósticos, como objetivos profiláticos, terapêuticos ou diagnósticos 15 mencionados na presente. Por exemplo, tal proteína, os polipeptídios, os ácidos nucléicos, os métodos, as células hospedeiras, as composições e os usos podem ser análogos à proteína, os polipeptídios, os ácidos nucléicos, os métodos, as células hospedeiras, as composições e o uso descreveram 20 na presente para os nanocorpos da invenção.
Também deve ser observado que, quando os nanocorpos das invenções contêm uma ou várias outras seqüências CDR do que as seqüências CDR preferenciais acima mencionadas, essas seqüências CDR podem ser convenientes (isto é, conveniente 25 para os objetivos descritos na presente) as seqüências de CDR e/ou essas seqüências CDR podem ser obtidas em qualquer maneira conhecida por si, por exemplo, de nanocorpos (preferido) , domínios de VH de anticorpos convencionais (e especialmente de anticorpos humanos), anticorpos de cadeia 30 pesadas, anticorpos de 4 cadeias convencionais (como anticorpos de 4 cadeias humanos convencionais) ou outras seqüências de imunoglobulina dirigidas contra TNF. Tais seqüências de imunoglobulina dirigidas contra xxxx podem ser geradas em qualquer maneira conhecida por si, como serão 35 claras à pessoa experimentada, isto é, pela imunização com TNF ou analisando uma biblioteca conveniente de seqüências de imunoglobulina com TNF, ou qualquer combinação conveniente disso. Opcionalmente, isto pode ser seguido por técnicas como mutagenese casual ou direcionada a local e/ou outras técnicas para maturação de afinidade conhecida por 5 si. As técnicas convenientes para gerar tais seqüências de imunoglobulina serão claras à pessoa experimentada, e, por exemplo, incluirão as técnicas de proteção revisadas por Hoogenboom, Nature Biotechnology, 23, 9, 1105-1116 (2005). Outras técnicas para gerar imunoglobulinas contra um 10 objetivo especificado incluem, por exemplo, a tecnologia Nanoclone (como, por exemplo, descrito na aplicação 60/648,922 para patente provisória dos Estados Unidos não- prepublicada), assim chamada tecnologia SLAM (como, por exemplo, descrito na aplicação 0 542810 de patente européia), o uso de ratos transgênicos que expressam imunoglobulinas humanas ou as técnicas de hibridoma bem conhecidas (ver, por exemplo, Larrick e al, Biotecnologia, Volume 7, 1989, p. 934). Todas essas técnicas podem ser usadas para gerar imunoglobulinas contra TNF, e o CDR'S de 20 tais imunoglobulinas pode ser usado nos nanocorpos da invenção, isto é, como delineado anteriormente. Por exemplo, a seqüência de tal CDR pode ser determinada, sintetizada e/ou isolada, e inserida na seqüência de um Nanocorpo da invenção (p. ex. para substituir o CDR nativo correspondente) , todas as técnicas de utilização conhecidas por si como as descritos na presente, ou nanocorpos da invenção que contém tal CDR's (ou ácidos nucléicos que codificam o mesmo) pode ser sintetizado de novo, novamente usando as técnicas mencionadas na presente.
A invenção será além disso descrita agora por meio dos exemplos não-restritivos seguintes e figuras, nas quais as Figuras mostram:
Figura 1: alinhamento de seqüência de nanocorpos TNFa humanos
Figura 2: alinhamento de seqüência de nanocorpos TNFa específico de albumina de soro
Figura 3: Ligação de nanocorpos TNFa específico de albumina a albumina de soro humana
Figura 4: Ligação de nanocorpos TNFa específico de albumina 5 a albumina de soro de rhesus
Figura 5: Ligação de nanocorpos TNFa específico de albumina a albumina de soro de rato
Figura 6: Pureza de TNFa e nanobodies de albumina de soro (SDS-PAGE)
Figura 7: analise de Western Blot de TNFa e nanobodies de albumina de soro
Figura 8: Ligação de nanocorpos TNFa a TNFa humano (ELISA)
Figura 9: Ligação de nanocorpos TNFa a TNFa de rhesus (ELISA)
Figura 10: ensaio de inibição de receptor em Enbrel para TNFa humano
Figura 11; ensaio de inibição de receptor em Enbrel para TNFa de rhesus
Figura 12: Ligação de nanocorpos TNFa a TNFa humano 20 (Biacore)
Figura 13: Ligação de nanocorpos TNFa a TNFa de rhesus (Biacore)
Figura 14: Ligação de nanocorpos TNFa a Proteína A (Biacore)
Figura 15: tratamento de Temperatura de TNFa e nanobodies de 25 albumina de soro (Western Blot)
Figura 16: Estabilidade: tratamento de temperatura de nanocorpos TNFa (ELISA)
Figura 17: tratamento de Temperatura de nanobodies de albumina de soro (Biacore)
Figura 18: Pureza_de nanocorpos TNFa bivalentes (SDS-PAGE)
Figura 19: análise de Western Blot de nanocorpos TNFa bivalentes
Figura 20: ensaio de inibição de receptor em Enbrel para 35 nanobodies TNFa bivalentes
Figura 21: Estabilidade: nanocorpos TNFa bivalentes (ELISA)
Figura 22: múltiplo alinhamento de seqüência de nanobodies humanizados TNF1
Figura 23: múltiplo alinhamento de seqüência de nanobodies humanizados TNF 2
Figura 24 : múltiplo alinhamento de seqüência de nanobodies humanizados TNF 3
Figura 25: múltiplo alinhamento de seqüência de nanobodies humanizados ALB1
Figura 26: Pureza de nanobodies TNF humanizados e de albumina de soro (SDS-PAGE)
Figura 27: análise de Western Blot de nanobodies TNF humanizados e de albumina de soro
Figura 28: Ligação de nanobodies TNFot humanizados a TNFct humano
Figura 29: Ligação de nanobodies de albumina de soro humanizada a albumina de soro humana
Figura 30: Estabilidade: tratamento de temperatura de nanobodies TNFot humanizados (ELISA)
Figura 31: Pureza_de nanocorpos TNFot trivalentes (SDS-PAGE)
Figura 32: análise de Western Blot de nanocorpos TNFct trivalentes
Figura 33: Estabilidade: tratamento de temperatura de nanocorpos TNFa trivalentes (ELISA)
Figura 34: múltiplo alinhamento de seqüência de nanobodies humanizados TNF1
Figura 3 5 : múltiplo alinhamento de seqüência de nanobodies humanizados TNF2
Figura 3 6 : múltiplo alinhamento de seqüência de nanobodies humanizados TNF 3
Figura 37: múltiplo alinhamento de seqüência de nanobodies humanizados ALBI
Figura 38: Pureza de nanobodies TNFa humanizados (SDS-PAGE)
Figura 39: análise de Western Blot de nanobodies TNFa humanizados
Figura 40: : Ligação de nanobodies TNFa humanizados a TNFa humano
Figura 41: Estabilidade: tratamento de temperatura de nanobodies TNFa humanizados (ELISA)
Figura 42: Análise de TNF60 purificado em Prata gel de SDS- PAGE manchado (A) Coomassie gel de SDS-PAGE manchado (B) e em análise de Western blot que usa anti-NB (C) para detecção
Figura 43 : Cromatograma de exclusão de tamanho analítica deTNF60 em Superdex HR75
Figura 44: Ligação de TNF60 o TNF-alfa humana
Curva de resposta da figura 45:Dose obtida em ensaio citotoxicidade com TNF-alfa humana que usa Nanocorpo™ TNF60 15 em comparação com Enbrel (Etanercept), Humira (Adalimumab) e Remicade (Infliximab)
Figura 46: curva de resposta de dose obtida em ensaio citotoxicidade com TNFa de rhesus usando Nanocorpo™ TNF60 em comparação com Enbrel (Etanercept), Humira (Adalimumab) e 20 Remicade (Infliximab)
Figura 47: perfil de Farmacocinêtica de TNF60 em ratos
Figura 48: perfil de Imunogenicidade de TNF60 em ratos
Figura 49: Análise de TNF56-PEG40 purificado, TNF56-PEG60, TNF56-biotina, TNF55-PEG40, TNF55-PEG60 e TNF55-biotina em 25 Coomassie gel de SDS-PAGE manchado
Figura 50: Análise de TNF56-PEG40 purificado em gel de SDS-PAGE que usa mancha de Prata (A) Coomassie mancha (B) e em análise de Western blot que usa anti-NB (C) para detecção
Figura 51: Cromatograma de exclusão de tamanho analítica de 30 TNF56-PEG40 em HORA Superdex 75
Figura 52: Cromatograma de exclusão de tamanho analítica deTNF56-PEG40 em HORA Superdex 200
Figura 53: curva de resposta de dose obtida em ensaio citotoxicidade com TNFa humano usando Nanocorpo™ TNF56-PEG40 35 e o tipo natural Nanocorpo monovalente ™ TNF1 em comparaçãocom Enbrel (Etanercept), Humira (Adalimumab) e Remicade (Infliximab)
Figura 54: curva de resposta de dose obtida em ensaio citotoxicidade com TNFa de rhesus usando Nanocorpo™ TNF56-PEG40 em comparação com Enbrel (Etanercept), Humira 5 (Adalimumab) e Remicade (Infliximab)
Figura 55: análise de Farmacocinética do Nanocorpo bivalente pegilado ™ TNF56-PEG40 e TNF56-PEG60 depois de administração intravenosa em ratos
Figura 56: análise de Farmacocinética do Nanocorpo bivalente 10 pegilado ™ 3E-3E-PEG20, pegilado Nanocorpo bivalente ™ 3E-3E-PEG40 e biespecífico Nanocorpo™ 3E-3E-AR1 depois de administração intravenosa em ratos
Figura 57: perfil de Imunogenicidade de TNF56-PEG40 e TNF56- PEG60 em ratos
Figura 58: Eficácia de TNF60 na prevenção de poliartrite crônica em ratos
Figura 59: Eficácia de TNF60 em tratamento terapêutico de poliartrite crônica em ratos
Figura 60: Efeito de TNF60 Nanocorpo™ formatação em eficácia 20 na prevenção de poliartrite crônica em ratos
Figura 61: alinhamento de seqüência de nanocorpos™ PMP1C2, 3E, IA e 3G
Figura 62: modelo molecular de TNF-60
As Tabelas anexadas formam uma parte integrante da especificação presente e são como se segue:
Tabela 8: listagem de seqüência_de nanocorpos TNFa
Tabela 9: valores de Koff de nanocorpos TNFa humanos
Tabela 10: Homologia de TNFa e nanobodies de albumina de soro a seqüências germline humanas
Tabela 11: níveis de expressão de TNFa e nanobodies de albumina de soro
Tabela 12: ELISA que liga o TNFa do ser humano e rhesus
Tabela 13: ensaio de inibição de receptor de nanocorpos TNFa
Tabela 14: análise de Biacore de nanocorpos TNFa
Tabela 15: Ligação de nanocorpos TNFa a TNFa (KD-valores) Tabela 16: Potência de nanocorpos TNFa para neutralizar TNFa de ser humano (a) e rhesus (b)
Tabela 17: OD280nm de TNFa e nanobodies de albumina de soro depois de tratamento de temperatura
Tabela 18 : Potência de nanocorpos TNFa depois de tratamento de temperatura
Tabela 19: listagem de seqüência de nanocorpos TNFa bivalentes e seqüências de linkers
Tabela 20: Construtos de nanocrpo TNF α bivalente
Tabela 21: níveis de expressão de nanocorpos TNFa bivalentes Tabela 22: ensaio de inibição de receptor de nanocorpos TNFa bivalentes
Tabela 23: a Potência de nanocorpos TNFa para neutralizar TNFa de ser humano (a) e rhesus (b)
Tabela 24: OD280nm de nanocorpos TNFa bivalentes
Tabela 25: listagem de seqüência de TNFa monovalente 20 humanizado e nanobodies de albumina de soro
Tabela 26: níveis de expressão de nanobodies TNF humanizados e de albumina de soro
Tabela 27; a Potência de nanocorpos TNFa para neutralizar TNFa humano
Tabela 28: OD280nm de nanobodies TNF humanizados e de albumina de soro
Tabela 29: listagem de seqüência de nanocorpos TNFa trivalentes
Tabela 30: Construtos de nanocrpo TNF α trivalentes Tabela 31: níveis de expressão de nanocorpos TNFa trivalentes
Tabela 32: a Potência de nanocorpos TNFa trivalentes para neutralizar TNFa humano
Tabela 33: Ligação de nanobodies trivalente a albumina de soro (KD-valores)
Tabela 34: OD280nm de nanocorpos TNFa trivalentes
Tabela 35: a listagem de seqüência do segundo círculo nanocorpos TNFa humanizados Monovalentes
Tabela 36: níveis de expressão de nanobodies TNFa humanizados
Tabela 37: a Potência de nanocorpos TNFa para neutralizar TNFa humano
Tabela 38: OD280nm de nanobodies TNFa humanizados
Tabela 39: Comparação de atividade bio de nanobodies
Tabela 40: Resumo de oligonucleotídeos usado em formatação de nanocorpos™ trivalentes
Tabela 41: Resumo de oligonucleotídeos usado em clonagem de 15 nanocorpos™ trivalentes
Tabela 42:_ Valores de EC50 obtidos em ensaio citotoxicidade que usa Nanocorpo trivalente ™ TNF60 em comparação com controles comerciais (Enbrel, Remicade, Humira)
Tabela 43: determinação de afinidade de TNF60 e TNF24 em 20 albumina de soro humana em Biacore. Nd, não determinado.
Tabela 44: Resumo de oligonucleotídeos usados em formatação de nanocorpos™ bivalentes
Tabela 45: Valores de EC50 obtido em ensaio citotoxicidade que usa nanocorpos™ bivalentes em comparação com controles 25 comerciais (Enbrel, Remicade, Humira)
Tabela 46: Resultados de estudos de fibroblastos derivados de sinóvia
Tabela 47: Resultados estudos de bolsa de ar de murinos
Nanocorpos antagônicos foram identificados usando duas lhamas (Lhama glama) imunizado com TNFa humano por 6 injeções de 100 μg da citoquina em intervalos semanais. A análise foi executada usando o ensaio baseado de uma competição, no qual nanobodies individuais foram analisados para a sua capacidade de inibir a ligação de TNFa etiquetado ao seu receptor. Os nanobodies específicos de albumina foram 5 identificados de uma lhama imunizada com a albumina de soro humana. A proteção de nanobodies individual foi executada por ELISA utilizando albumina de ser humano, rhesus e de rato, produzindo um painel nanobodies reagindo cruzadamente com a albumina de soro de várias espécies.
As classes diferentes de nanobodies foram identificadas baseadas na análise de seqüência (Figura 1) que usa uma matriz de contagem BLOSUM62 e um atalho de valor de 15 significação de semelhança de 60% >: Classe I (PMP1 C2, PMP1 Gil, PMP1 H6) , Classe II (PMP1 G5, PMP1 H2, PMP3 G2) , Classe lib (PMP1 D2), Classe III (PMP3 DIO, PMP5 FIO). A Tabela 8 listas as seqüências desses nanocorpos TNFa (SEQ ID NÚMEROS: 52 a 60).
Baseado na análise de seqüência (a Figura 2) as classes diferentes da nanobodies de albumina de soro foram identificadas usando a matriz de contagem BLOSUM62 e um atalho de valor de significação de semelhança de 60% 2:, A Tabela 8 listas as seqüências desses nanobodies de albumina de soro (SEQ ID NÚMEROS: 61 para 67).
A ligação de nanobodies a TNFa foi caracterizada pela 30 ressonância de plasmon superficial em um Instrumento Biacore 3000. 0 TNF da espécie diferente foi covalentemente ligado à superfície de chips de sensor CM5 via amina ligando até que um aumento de 250 unidades de resposta fosse conseguido. Os grupos reativos restantes foram inativados. A ligação do 35 Nanocorpo foi avaliada em uma concentração (1 em 1,000 diluído) . Cada nanocrpo foi injetado por 4 minutos em uma taxa de fluxo de 45 μl/min para levar em conta a ligação ao antígeno ligado por chip. O buffer de ligação sem nanocrpo foi enviado sobre o chip na mesma taxa de fluxo para permitir a dissociação espontânea do Nanocorpo ligado para 4 horas. Os valores de Koff foram calculados do sensorgramas obtidos para os nanocorpos diferentes.
De cada classe de nanobodies proteínas não purificadas foram analisadas em Biacore. Os dados de Koff são enumerados na Tabela 9.
Nanocorpos representativos de cada classe foram retidos para nova análise baseada no valor de Koff. Para a Classe I PMP1C2 (TNF1) foi selecionada; o PMP1G5 (TNF2) foi selecionado como o representante da Classe II; o PMP5F10 (TNF3) foi selecionado como o representante da Classe III.
A ligação esteve ensaiada conforme descrito acima exceto que 1 em 20 diluições foram usados. As figuras 3, 4 e 5 ilustram a proteção da nanocorpos TNFa específico de albumina contra ser humano, rhesus e albumina de soro de rato que usa proteína não purificada.
Os melhores koff foram obtidos para os membros da família C e família B. A reatividade cruzada entre rato, ser humano e albumina de soro de rhesus também foi observada para os membros daquelas famílias. Um nanocrpo representativo da classe B e C foi definido para nova 5 análise: o PMP6A6 (ALB1) foi selecionado como representativo da Classe B e PMP6A8 (o ALB2) foi selecionado como o representante da Classe C.
o pAX051 é um derivado de pUC19. Ele contém o promoter LacZ que permite uma indução controlada da expressão que usa IPTG. O vetor tem um gene de resistência para Ampicilina ou Carbenicilina. Os sítios de multiclonagem abrigam vários 15 sítios de restrição de que SfiEu e BstEII são frequentemente usados para clonagem de nanocorpos™. Na armação com a seqüência que codifica NB o vetor codifica para um C- terminal c-myc etiqueta e (A sua) 6 etiqueta. O peptídeo de sinal é a seqüência líder gen3 que desloca o Nanocorpo™ 20 expresso ao periplasma.
O ADN que codifica para os nanocorpos selecionados TNF1 (PMP1C2), TNF2 (PMP1G5) , TNF3 (PMP5F10), ALBI (PMP6A6) e ALB2 (PMP6A8) foi clonado em pAX051 e o construto foi transformado a TG1 células eletrocompetentes. Os clones 25 foram analisados para a inserção de PCR e a seqüência de nucleotídeos foi determinada de 4 clones positivos. Estoques de glicerol foram preparados de clones que contêm a seqüência correta e armazenados a-80°C.
Uma precultura foi começada inoculando uma colônia única do clone que expressa o respectivo nanobodies em 37 °C em Caldo Luria, Ampicilina/Carbenicilina (100 μg/ml) e glicose de 2% durante a noite. Esta precultura foi usada 35 para inocular. O Inoculum é 1% (v/v) da cultura de produção (meio de TB + Ampicilina/Carbenicilina + Glicose de 0,1%). A cultura de produção é cultivada em 37°C até que um ODSOOnm de 5-10 seja conseguido e a expressão de nanocrpo é induzida acrescentando IPTG (concentração final de 1 mm) . Permite-se 5 que a expressão de proteína continue por 4h a 37°C ou durante a noite a 28 °C, no qual as células de ponto são reunidas por centrifugação e armazenadas como pasta de célula úmida a -20°C.
Extratos periplásmico preparativos da pasta de células 10 úmida armazenada a -20 ° são feitos re-suspendendo a pílula no Peri-buffer (NaH2PO4 - 50 mm, NaCl - 300 mm, pH ajustado a 8.0), fazendo girar a mistura por 30 minuto a 4°C e centrifugando a mistura usando uma centrifugadora preparativa (Sorvall RC-3C Plus com rotor H-6000A) para 15 comprimir as células. 0 Supernadante, representando um extrato áspero do espaço periplásmico, é reunido para nova purificação.
Os nanobodies His(6)-marcados são purificados em Cromatografia de Afinidade Metálica Imobilizada (IMAC). A 20 resina de TALON (Clontech) é processada segundo instruções do fabricante. Os extratos são incubados com a resina por 30 minutos em RT em um rotor. A resina é lavada com o PSB e transferida a uma coluna. A resina empacotada é lavada com Imidazole - 15 mm. Os nanobodies são eluídos da coluna que 25 usa Imidazole - 150 mm. As frações eluidas são analisadas por mancha em Membrana Hybond e visualizadas com Ponceau. As frações que contêm proteína são juntadas e dialisadas contra o PSB. As proteínas dialisadas são reunidas, esterilizadas com filtro, concentração determinada e armazenada em partes 30 alíquotas a -20°c.
As seqüências aminoácidas de nanocrpo foram comparadas com as seqüências germline humanas como representado na Tabela 10. Em ordem da homologia a seqüências humanas os nanobodies figuram como se segue: TNF1> TNF2> TNF3 para o nanocorpos TNFa; ALB1> ALB2 para a nanobodies de albumina de soro.
Os níveis de expressão foram calculados e representados na Tabela 11. Em ordem do rendimento os nanobodies figuram como se segue: TNF1> TNF2> TNF3 para o nanocorpos TNFa; ALB1> ALB2 para a nanobodies de albumina de soro . 10
Para determinar a pureza, amostras de proteína foram analisadas em um gel de SDS-PAGE de 15%. 10 μl Laemmli buffer de amostra foi acrescentado a 10 μl (lug) proteína 15 purificada, a amostra foi aquecida por 10 minutos em 95 °C, esfriada e carregada em um gel de SDS-PAGE de 15%. O gel foi processado segundo os procedimentos gerais e manchado com o Coomassie Brilliant Blue (CBB). A figura 6 representa a SDS- PAGE para o TNF a-específico e nanobodies específico de soro 20 de albumina.
100 ng da proteína purificada foram carregados no gel. Depois do SDS-PAGE a proteína foi transferida a uma membrana de nitrocelulose que usa o Mini Trans-Blot® Célula de Transferência Eletroforética (Biorad). A membrana foi bloqueada durante a noite no PSB, caseína 1% a 4°C.
Como todos os construtos foram fundidos à etiqueta de c-myc, foi usado como ferramenta de detecção anticorpo de rato anti-myc monoclônico. Além do mais, anti-Nanocorpo policlônico de coelho (R23) foi usado como ferramenta de detecção. 0 blot (borrão) foi incubado por 1 h na temperatura ambiente com a agitação no anticorpo anti-myc diluído de 1/2000 no PSB ou 1/2000 anticorpo anti-Nanocorpo em PSB, caseína 1%. A membrana foi lavada 5 vezes no PSB antes que o anticorpo secundário fosse aplicado (coelho- anti-rato IgG fosfatase alcalino conjugado, Sigma, A1902, diluido 1/1000 em PSB ou anti-coelho de cabra IgG fosfatase alcalino conjugado, Sigma, A8025, caseína 1%). Depois da 5 incubação com agitação suave por lh na temperatura ambiente,a membrana foi lavada 5 vezes no PSB. Os borrões foram desenvolvidos usando soluções de BCIP/NBT e a reação foi parada lavando o borrão com a água milliQ quando as bandas foram claramente visíveis. A figura 7 representa a análise 10 de Western Blot.
Um ELISA foi executado para examinar a ligação a TNFct de ser humano e rhesus. Uma chapa Maxisorp de 96 cavidades 15 foi coberta de 2 μg/ml Neutravidin em PSB a 4°C. As chapas foram bloqueadas com caseina 1% por 2 horas em RT. TNFct biotinilado (400 ng/ml) foi acrescentado às cavidades e incubado por 1 h em RT. As amostras do Nanocorpo foram diluídas começando em 2 μg/ml e utilização 1 em 3 diluições.
Os nanocorpos foram descobertos usando fosfatase alcalina de rato anti-myc (1/2000 diluído) e anti-rato de coelho (1/2000 diluído, Sigma, A1902) e pNPP (2mg/ml) como substrato. As figuras 9 e 10 representam a ligação em ELISA a ser TNFct humano e rhesus.
Os resultados são resumidos na Tabela 12. TNF1 e TNF3 mostram ligação tanto a TNFct de ser humano como de rhesus. 0 TNF2 está ligando a TNFct humano mas é só fracamente reativo ao TNFct rhesus.
A capacidade de inibir interação de receptor-ligando foi analisada para TNFot rhesus e humano. Uma chapa Maxisorp de 96 cavidades foi coberta de 2 μg/ml Enbrel em PSB à 4°C. As chapas foram bloqueadas com Caseina 1% por 2 horas em RT.
As amostras do Nanocorpo foram pré-incubadas por 30 minutos em RT com TNFot biotinilado (10ng/ml) começando em uma concentração de 5 μg/ml e utilizando 1 em 2 diluições. As amostras foram acrescentadas às chapas e incubaram por 1 hora em RT. O TNFa biotinilado foi descoberto usando Extravidin fosfatase alcalino (1/2000 diluído) e pNPP 5 (2mg/ml) como substrato. As figuras 11 e 12 representam uma inibição ELISA para TNFa de ser humano e rhesus. Os resultados são resumidos na Tabela 13. A inibição da ligação de 1igando/receptor é observada para TNF1 e TNF3 tanto para TNF de ser humano como rhesus, enquanto TNF2 só está 10 inibindo TNFa humano.
A análise foi executada como descrito no Exemplo 3. As 15 figuras 13 e 14 ilustram a ligação a TNFa de ser humano e rhesus via a análise Biacore. Os resultados são resumidos na Tabela 14. Os experimentos obrigatórios em Biacore confirmam os resultados de ELISA: a ligação reativa cruzada para TNF1 e TNF3, enquanto TNF2 só significativamente liga TNFa 20 humano.
A ligação esteve ensaiada conforme descrito acima exceto que séries de concentrações diferentes foram usadas.
Cada concentração foi injetada por 4 minutos em uma taxa de fluxo de 45 μl/min para levar em conta a ligação ao antígeno ligado de chip. Ligação de buffer sem analito foi enviada por cima do chip na mesma taxa de fluxo para levar em conta a dissociação do Nanocorpo ligado. Depois de 15 minutos, 30 permanecendo ligado analito foi retirado pela injeção da solução de regeneração (NaOH - 25 mm).
Dos sensorgramas obtidos para as concentrações diferentes de cada um dos KD-valores de analito foram calculados via a afinidade de estado constante quando o 35 equilíbrio foi conseguido.
Os resultados são resumidos na Tabela 15. A reatividade cruzada é observada tanto para ALB1 como ALB2. A afinidade mais alta ê observada para ALB2 em TNFa de ser humano e rhesus. Contudo, a diferença na afinidade para o ser humano/rhesus contra a albumina de soro de rato é mais pronunciado para ALB2 (fator 400) , enquanto para ALB1 uma diferença de um fator 12 é observada.
A linha de célula de fibroblasto de rato sensível a 10 TNFa L929s foi usada para medir a atividade anti-TNFa dos nanocorpos selecionados. Em uma concentração suficientemente alta de TNFa no meio, isto é, dose de citotóxico, as células de L929s sofrem a necrose. A inibição da interação TNFa com o seu receptor foi determinada pré-incubando uma série de 15 diluições de anticorpo com uma concentração citotóxica de TNFa antes de acrescentar a mistura às células. A presença de actinomicina D no meio sensibiliza as células adicionalmente a TNFa, resultando em sensibilidade aumentada do bioensaio para TNFa livre.
As células L929 foram cultivadas a quase confluência,colocadas em placa de microtitragem com 96 cavidades com 5000 células por cavidade e incubadas durante a noite. Actinomicina D foi acrescentada às células em uma concentração final de 1 μg/ml. As diluições seriais dos 25 nanocorpos a serem testados foram misturadas com uma concentração citotóxica de TNFa (a concentração de ensaio final é 0,5 ng/ml ou 15 IU/ml) . Depois de pelo menos 30 minutos de incubação a 37°C, esta mistura foi acrescentada às células na placa. As chapas foram incubadas por 24 horas 30 a 37°C e CO2 de 5%. A viabilidade de célula foi determinada pelo uso do sal tetrazolium WST-1. As curvas de resposta de dose e os valores de EC50 foram calculados com o Prisma Graphpad.
Os resultados são resumidos na Tabela 16 para TNFa de 35 ser humano e rhesus. Baseado na sua potência para neutralizar atividade citotóxica, as moléculas são colocadas como se segue: TNF3> TNF1> TNF2 para TNFot humano, e TNF1 =TNF3> TNF2 para TNFa rhesus.
A figura 14 representa a ligação de Proteína A analisada em Biacore como descrito no Exemplo 12. A ligação positiva foi obtida para TNF1, TNF2, ALB1. Nenhuma ligação débil foi observada para TNF3 e ALB2.
As amostras foram diluídas em 200 μg/ml e dividido em 8 alíquotas que contêm 500 μl. Os frascos diferentes foram incubados cada um em uma temperatura dada nos limites de RT a 90°C. Depois do tratamento as amostras foram esfriadas por 15 2 horas em RT, elas foram guardadas a 4 °C. Precipitados foram retirados por centrifugação por 30 minuto em 14,000 rotações por minuto. O SN foi cuidadosamente retirado e além disso analisado.
O OD em 2 80 nm foi medido e a concentração foi calculada. Os resultados são resumidos na Tabela 17. Uma redução no conteúdo de proteína foi observada para TNF2 e TNF3 que começa em 80°C, enquanto para ALB2 uma redução é 25 observado começando de 70°C.
2 μg da proteína tratada foram separados em uma SDS- PAGE de 15% e transferidos a uma membrana nitrocellulose e tratados conforme descrito acima. A detecção foi executada usando anti-Nanocorpo policlÔnico (R23, 1/2000 diluído) e rabanete de cavalo de anti-coelho peroxidase (DAKO, P0448, 1/2000 diluído). A figura 15 representa a análise de Western Blot. Uma gota clara na concentração de proteína foi observado para ALB2 tratado a 70, 80 e 90 °C. A agregação ainda era observada para TNF1 tratado a 70, 80 e 90°C; para o TNF3 tratado a 90°C; para o ALB1 tratado a 90°C, significando que o SN ainda contém traços de precipitado que resultam em uma mais alta leitura OD280nm. Isto explica por que a concentração de proteína como medido em OD280nm não 5 reduz para TNF1, TNF3 e ALB1 tratados a estas altas T mais altas.
O ELISA para descobrir ligação a TNFa humano foi 10 essencialmente executado como descrito no Exemplo 10. Os resultados são apresentados na Figura 16. Ligação de TNFa humano é reduzida para TNF1, TNF2, TNF3 começando a 80°C.
O Bio-Ensaio foi executado como descrito no Exemplo 13.
Os resultados são resumidos na Tabela 18. A potência dos nanocorpos é reduzida para TNF1 que começa em 7 0 °C; para TNF2 e TNF3 que começa em 80°C.
Ligação à albumina de soro humana foi determinada como descrito no Exemplo 12. Uma concentração fixa foi usada (1 em 50 diluído). Os resultados são apresentados na Figura 17. O tratamento de temperatura não está influindo na ligação à 25 albumina de soro para ALB1. O tratamento tem um efeito_no kon_para ALB2 que começa de T=70°C.
O TNF1, TNF2 e TNF3 foram formatados a nanobodies bivalentes. Como o espaçador entre as duas construções bloqueia qualquer um 9AA GlySer linker (Tabela 19 SEQ ID n. 68) ou uns 30 AA GlySer linker (Tabela 19 SEQ ID n. 69) foi 35 usado. Isto gerou os construtos representados pela Tabela 20. Tabela 19 lista as seqüências desses nanobodies TNF α bivalentes (SEQ ID NÚMEROS: 70 para 75).
A expressão foi executada como descrito no Exemplo 5. Os nanobodies His(6)-marcados foram purificados na Cromatografia por Afinidade Metálica Imobilizada (IMAC). A resina Ni-NTA (Qiagen) foi processada segundo instruções 10 do fabricante. Os extratos foram incubados com a resina e incubaram por 3 0 minutos em RT em um rotor. A resina foi lavada com PSB e transferida a uma coluna. A resina empacotada foi lavada com PSB (1 em 10 diluído) . A coluna foi pre-eluída com Imidazole de 15 mm. Os nanobodies foram 15 eluídos da coluna usando Ácido cítrico de 25 mm pH=4. As frações eluidas foram analisadas manchando-se na Membrana Hybond e pela visualização com Ponceau. As frações que contêm proteína foram juntadas e além disso purificadas na troca de Cations seguida pela exclusão de tamanho. A 20 proteína purificada foi reunida, filtrada, esterilizada, e a concentração determinada e armazenada em alíquotas a -20°C.
Os níveis de expressão do nanocorpos TNFa bivalentes foram calculados e representados na Tabela 21. O linker não tem nenhum efeito significativo no nível de expressão do nanobodies.
A SDS-Page foi executada como descrito no Exemplo 8. A figura 18 mostra o resultado da SDS-Page.
A análise de western Blot foi executada como descrito no Exemplo 9. A figura 19 representa os resultados de Western Blot.
O ensaio foi executado como descrito no Exemplo 11. A figura 20 e a Tabela 22 representam os resultados. O aumento da inibição da ligação de ligando/receptor foi observado para todos os nanocorpos bivalentes em comparação com o formato monovalente.
O ensaio foi executado como descrito no Exemplo 13. Os resultados são resumidos na Tabela 23. Baseado na sua potência para neutralizar atividade citotóxica TNF8, TNF7, 15 TNF9 e TNF5 têm uma potência na variedade de Enbrel.
As amostras foram analisadas como descrito no Exemplo 15.
O OD em 280 nm foi medido e a concentração foi calculada. Resultados são resumidos na Tabela 24. Uma redução no conteúdo de proteína foi observada para TNF4 e TNF7 que começa em 70 °C, enquanto para TNF5, TNF6, TNF8 e 25 TNF9 uma redução foi observada começando de 80°C.
As amostras foram analisadas para a presença de agregados como descrito no Exemplo 15.
O ELISA para descobrir ligação a TNFa humano foi essencialmente executado conforme descrito acima. Os resultados são apresentados na Figura 21. Ligação TNFa 35 humano foi reduzido para TNF5, TNF6, TNF8 e TNF9 que começa
em 80°C, para TNF4 e TNF7 que começa de 70°C.
A figura 22 (TNF1), a Figura 23 (TNF2), a Figura 24 (TNF3) e a Figura 25 (ALB1) representam múltiplos alinhamentos de seqüência (Clustal W 1.7) com DP51, DP53, DP54 e seqüências DP29.
Além das mutações aminoácidas, codon otimização foi executado produzindo as seqüências da Tabela 25 SEQ ID NÚMEROS: 76 para 89 (nanocorpos contra albumina de soro TNF- alfa e humana, respectivamente).
Os Oligonucleotídeos foram sintetizados medindo por palmos a seqüência inteira do nanobodies.
A expressão foi executada como descrito no Exemplo 5.
A tabela 26 representa níveis de expressão calculados.
A expressão foi realizada com rendimentos na variedade de 3.5-11.7 mg/ml. O tempo de indução não influiu no rendimento.
A SDS-PAGE foi executada como descrito no Exemplo 8. A figura 26 representa o gel de SDS-PAGE.
A análise de western Blot foi executada como descrito no Exemplo 9. A figura 27 representa os resultados de Western Blot.
O ensaio foi executado como descrito no Exemplo 13.
Os resultados dos nanocorpos humanizado são resumidos na Tabela 27. Os nanobodies de tipo natural estão incluídos como referência.
A análise foi executada como descrito no Exemplo 12. A figura 28 e 31 mostra resultados de Biacore.
As amostras foram analisadas como descrito no Exemplo
O OD em 2 80 nm foi medido e a concentração foi 20 calculada. Os resultados são resumidos na Tabela 28.
Nenhuma redução significativa na concentração de proteína é observada para os nanobodies TNF1 humanizados (TNF13-14). Uma redução na concentração de proteína é observada para TNF2 humanizado (TNF15-19) e TNF3 (TNF20-23) 25 começando em 80°C. Uma redução na concentração de proteína é observada para humanizada ALBI (ALB4-5) começando em 70°C e para ALB3 que começa em 6 0°C.
As amostras foram analisadas para a presença de agregados como descrito no Exemplo 15.
O ELISA para descobrir ligação a TNFa humano foi essencialmente executado como descrito no Exemplo 15. Os resultados são apresentados na Figura 30.
Ligação TNFa humano é comparável para a WT TNF1 tratado a temperatura e o TNF13 humanizado e 14; para a WT TNF2 tratado a temperatura e o TNF15-19 humanizado; Ligação TNFa 5 humano é reduzida para TNF21 e 22, e a menos extensão para TNF23, enquanto nenhum efeito é observado para TNF20 em comparação com a WT TNF3 tratado a temperatura.
O TNF1, TNF2, TNF3 e ALB1 foram formatados a nanobodies trivalentes. Como o espaçador entre 2 construções bloqueia qualquer um 9AA GlySer linker (Tabela 19 SEQ ID n. 68) ou uns 30 AA GlySer linker (Tabela 19 SEQ ID n. 69) foi usado. Isto gerou os construtos da Tabela 30. Tabela 29 lista as seqüências de nanocorpos TNFa trivalentes (SEQ ID NÚMEROS: 91 para 94).
A expressão foi executada como descrito no Exemplo 5. nanocorpos marcados His(6) são purificados na Cromatografia por Afinidade Metálica Imobilizada (IMAC). A resina Ni-NTA (Qiagen) é processada segundo instruções do fabricante. Os extratos são incubados com a resina e incubados por 30 minutos em RT em um rotor. A resina ê lavada com o PSB e transferida a uma coluna. A resina empacotada é lavada com o PSB (1 em 10 diluído). Pre-eluido com Imidazole de 15 mm. Os nanobodies são eluídos da coluna que usa Ácido cítrico de 25 mm pH=4. As frações eluidas são analisadas manchando-se em Membrana Hybond e visualização com Ponceau. As frações que contêm proteína são juntadas e além disso purificadas na troca de Cation seguida pela exclusão de tamanho. A proteína purificada é reunida, esterilizada com filtro, concentração determinada e armazenada em alíquotas a -20°C.
Os níveis de expressão foram calculados e representados na Tabela 31.
A SDS-PAGE foi executada como descrito no Exemplo 8. A 10 figura 31 representa o gel de SDS-PAGE.
A análise de Western Blot foi executada como descrito no Exemplo 9. A figura 32 representa a análise de Western Blot.
O ensaio foi executado como descrito no Exemplo 13.
Os resultados dos nanocorpos bivalentes são resumidos na Tabela 32. Baseado na sua potência para neutralizar atividade citotóxica, as moléculas são igualmente potentes e comparáveis com a sua potência como moléculas bivalentes.
A ligação esteve ensaiada conforme descrito acima exceto que séries de concentrações diferentes foram usadas. Cada concentração foi injetada por 4 minutos em uma taxa de fluxo de 45 μl/min para levar em conta a ligação ao antígeno ligado de chip. Depois, ligação de buffer sem analito foi enviada por cima do chip na mesma taxa de fluxo para levar em conta a dissociação do Nanocorpo ligado. Depois de 15 minutos, permanecendo ligado, o analito foi retirado pela injeção da solução de regeneração (NaOH de 25 mm).
Dos sensorgramas obtidos para as concentrações 35 diferentes de cada um os KD-valores do analito foram calculados via a afinidade de estado constante quando o equilíbrio foi conseguido.
Os resultados são resumidos na Tabela 33. Uma redução na afinidade foi observada para a aglutinante ALB1 formatado 5 em comparação com o tipo natural ALB1. A afinidade contudo está ainda na variedade de 7.2-14 nM.
As amostras foram analisadas como descrito no Exemplo 10 15.
O OD em 280 nm foi medido e a concentração foi calculada. Os resultados são resumidos na Tabela 34. Uma 15 redução no conteúdo de proteína é observada para TNF24, TNF27 e TNF28 que começa em 60°C, enquanto para TNF25 e TNF2 6 que começa de 7 0 °C.
As amostras foram analisadas para a presença de agregados como descrito no Exemplo 15.
O ELISA para descobrir ligação a TNFa humano foi 25 essencialmente executado conforme descrito acima. Os resultados são apresentados na Figura 33. Ligação TNFa humano é reduzido para TNF24 e TNF27, que começa de 60°C e para TNF2 5, TNF2 6 e TNF2 8 que começa em 70°C.
A figura 34 (TNF1), a Figura 35 (TNF2), a Figura 36 (TNF3) e a Figura 37 (ALB1) representam múltiplos alinhamentos de seqüência (Clustal W 1.7) com DP51, DP53 , DP54 e sequências DP29. As moléculas transformadas foram expressadas e purificadas conforme descrito acima, produzindo as seqüências da Tabela 35 SEQ ID N° : 95 a 104 (contra albumina de soro TNF-alfa e humana, respectivamente).
A tabela 36 representa níveis de expressão calculados. 10 A expressão foi realizada com rendimentos na variedade de 0,5-2.7 mg/ml.
A SDS-Page foi executada como descrito no Exemplo 8. A 15 figura 38 representa o gel de SDS-Page.
A análise de Western Blot foi executada como descrito no Exemplo 9. A figura 39 representa os resultados de 20 Western Blot.
O ensaio foi executado como descrito no Exemplo 13.
Os resultados dos nanocorpos humanizado são resumidos 25 na Tabela 37. Os nanobodies de tipo natural e primeiro ao redor de nanobodies humanizados estão incluídos como referência.
A análise foi executada como descrito no Exemplo 12. A figura 40 mostra resultados de Biacore.
As amostras foram analisadas como descrito no Exemplo 35 15.
O OD em 280 nm foi medido e a concentração foi calculada. Os resultados são resumidos na Tabela 38.
Nenhuma redução significativa na concentração de proteína é observada para os nanobodies TNF1 humanizados (TNF29-30). Uma redução na concentração de proteína é observada para TNF2 humanizado (TNF31-32) e TNF3 (TNF33) começando em 80°C.
As amostras foram analisadas para a presença de agregados como descrito no Exemplo 15.
O ELISA para descobrir ligação a TNFa humano foi essencialmente executado como descrito no Exemplo 15. Os resultados são apresentados na Figura 41.
Ligação TNFa humano é comparável para a WT TNF1 e o 20 TNF29 humanizado e TNF30; comparável para WT TNF2 e o TNF31 humanizado e TNF32; e também para WT TNF3 e TNF33 humanizado.
Neste Exemplo Comparativo, nove nanocorpos da invenção foram comparados com três nanocorpos de WO 04/041862, chamado "VHH#1A" ou "IA", "VHH3E" ou "3E" e "VHH#3G" ou "3G" respectivamente (SEQ ID NOS: 1, 4 e 5 em WO 04/041862). (O ensaio usado foi o ensaio baseado da célula que usa KYM- células mencionadas em WO 04/41862 (ver, por exemplo, o Exemplo 1, conforme 3) . Os resultados são mencionados na Tabela 39 mais adiante. Como pode ser visto, os nanocorpos da invenção têm um valor de EC50 neste ensaio que é de 18 vezes melhor do que o valor de EC50 de 3E, o Nanocorpo de melhor execução segundo o WO 04/041862.
Nanocorpos Biespecíficos trivalentes foram formatados e clonados no E. coli o vetor de expressão pAX054 primeiro e 5 logo resgatado através de PCR e clonado no vetor de expressão pPICZotA.
O pAX54 é um derivado de pUC19. Ele contém o promotor 10 LacZ que permite uma indução controlada da expressão que usa IPTG. O vetor tem um gene de resistência para Ampicilina ou Carbenicilina. Os sítios que se multiclonam abrigam vários sítios de restrição em que SfiEu e BstEII são frequentemente usados para clonagem de nanocorpos™. O peptídeo de sinal é a 15 seqüência líder gen3 que desloca o Nanocorpo™ expresso ao periplasma.
O pPICZoA contém uma origem pUC-derivada da réplica que 20 permite propagação em E coli. Ele contém o promotor do gene Pichia pastoris A0X1 (álcool oxidase 1). Esta 942 região de promotor bp (i) permite o metanol-induzível, expressão de alto nível do gene do interesse, e (ii) objetiva a integração de plasmídeo ao local AOX1 depois da 25 transformação de Pichia com o ADN vetorial que é linearizado dentro da 5a região de promotor de AOX1. Observe que pPICZa vetores não contêm uma origem de levedura da réplica e que, consequentemente, os transformantes só podem ser isolados se a recombinação ocorrer entre o plasmídeo e a genoma Pichia.
O vetor especifica a resistência ao antibiótico Zeocin tanto em células hospedeiras E. coli como em Pichia pastoris. O vetor incorpora o sinal de secreção do fator de a- acoplamento de Saccharomyces cerevisiae levando em conta a secreção eficiente da maior parte de proteína ao meio de 35 cultura. A iniciação ATG na seqüência do sinal de fator ot corresponde à iniciação nativa ATG do gene AOX1. O sítio que se multiclona abriga vários sítios de restrição dos quais Xhol/EcoRl ou Xhol/Notl são tipicamente usados para fusão das seqüências de codificação do Nanocorpo™ ao sinal de 5 secreção. O sítio que se multiclona ê seguido pela região de terminação de transcrição AOX1. Mais detalhes deste vetor de expressão podem ser encontrados no web site de Invitrogen (https://www. invi trogen. com/content/sfs/manuals/ppiczalpha ma n.pdf) . 10
Três reações PCR separadas foram fundadas para amplificar a subunidade N-terminal, o meio e o C-terminal Nanocorpo™ usando as oligo-combinações indicadas no WPA- 0012. O N-terminal Nanocorpo™ foi amplificado usando ml3_rev/Rev_9GlySer_L108; o meio Nanocorpo™ foi amplificado usando For_GlySer/Curto e Rev_15BspEI_L108; o C-terminal Nanocorpo™ foi amplificado usando For_BspEI/M13_for. Uma reação PCR de 1 μl plasmídeo ADN (50-100 ng) , 1.5 μl escorvador direto (10 μ M -+ 300 nM) , 1.5 μl escorvador inverso (10 μ M -» 300 nM) , 1 μl dNTPs (10 mM 0,2 mM) , 5 μl buffer (10x -+ lx) , 0,75 μl enzima (3.5 U / μl -* 2.6 U / μl) e 3 9.25 μl H2O com um volume total de 50 μl foi preparado. As seqüências de escorvador são dadas na Tabela 40. Um programa PCR foi começado com 2 minutos a 94°C. Um ciclo de 30 segundos a 94°C, 30 segundos em 50°C e 1 minuto em 72 °C foi repetido 30 vezes e seguido por 10 minutos em 72°C. A amplificação foi verificada separando 5 μl da reação PCR em 2% agarose gel. 0 produto PCR foi purificado usando o QIAquick PCR Conjunto de Purificação segundo instruções do fabricante. Uma coluna foi usada e eluída com 50 μl EB buffer. O fragmento N-terminal de VHH foi preparado incubando 50 μl ADN e 2 μl BamHI (10 U / μl) no buffer apropriado recomendado pelo fabricante em 37°C para 2 horas.
Posteriormente, 2 μl Sfil (10U / μl) foi acrescentado e a mistura foi incubada em 55°C para 2 horas, 0 fragmento de VHH meio foi preparado incubando 50 μl ADN e 2 μl BamHI (10 U / μl) e 2 μl BspEI (10 U / μl) no buffer apropriado recomendado pelo fabricante em 37°C para 2 horas. O 5 Fragmento C-terminal de VHH foi preparado incubando 50 μl ADN com 2 μl BspEI (10 U / μl) no buffer apropriado recomendado pelo fabricante em 37°C para 2 horas.
Posteriormente, 2 μl BstEII (10U / μl) foi acrescentado e a mistura foi incubada em 60°C por 1 hora. As reações de 10 digestão prévias foram separadas em 2% agarose gel. As bandas de VHH (350-450 bp) foram cortadas do gel e o ADN foi purificado usando o Conjunto de Extração de Gel QIAquick segundo instruções do fabricante. Uma coluna (com um máximo de 400 mgs agarose gel por coluna) foi usada e o ADN ligado 15 foi eluído com 50 μl EB buffer. A concentração de ADN foi determinada medindo OD260 (1 unidade OD = 50 μg/ml). Uma mistura de ligação com um volume final de 10 μl contendo 100 ng vetor pAX54, 12 N-terminal ng VHH, 12 fragmento de VHH meio ng, 12 C-terminal ng fragmento de VHH, 1 μl de buffer 20 de ligação e 1 μl ligase (3U) foi preparado e incubou-se por 2 horas na temperatura ambiente. A transformação de E. coli, TG1 foi executada usando 2 μl de mistura de ligação. As colônias são analisadas usando PCR como descrito em WPA- 0010. A análise de seqüência é executada em clones 25 positivos. A preparação de Plasmídeo foi executada usando o conjunto Qiaprep spin Miniprep (Qiagen) segundo instruções do fabricante e descrito anteriormente. O Seqüenciamento foi executado na instalação de seqüência VIB, Antuérpia, Bélgica. 30
A região de codificação do Nanocorpo™ clonada no pAX054 E. coli vetor de expressão é resgatada através de PCR utilizando um par de escorvador apropriado. Para assegurar 35 que o Nanocorpo™ é expresso com um N-término nativo, a região de codificação é clonada na armação com o sítio de rachadura Kex2 do sinal de secreção. O escorvador avançado funde a parte C-terminal do sinal de secreção, até o sítio de reconhecimento Xhol, ao Nanocorpo™ codificação de região.
Uma reação PCR de 1 μl plasmídeo ADN (50-100 ng) , 1.5 μl expede o escorvador (10 μ M -» 300 nM) , 1.5 μl inverte o escorvador (10 μ M -> 300 nM) , 1 μl dNTPs (10 mM 0,2 mM) , 5 μl buffer (10x -» lx) , 0,75 μl enzima (3.5 U / μl -»? 2.6 U) e 39.25 μl H2O com um volume total de 50 μl foi preparado. As 10 seqüências de escorvador são dadas na Tabela 41. Um programa PCR foi começado com 2 minutos a 94°C. Um ciclo de 30 segundos a 94°C, 30 segundos em 50°C e 2 minutos em 72°C foi repetido 20 vezes e seguido por 10 minutos em 72°C. A amplificação foi verificada separando 5 μl da reação PCR em 15 2% agarose gel. 0 produto PCR foi purificado usando o QIAquick PCR Conjunto de Purificação segundo instruções do fabricante. Uma coluna foi usada e o ADN ligado foi eluído com 50 μl de buffer EB .
O fragmento de ADN que codifica para NB bem como o vetor de expressão pPICZotA é digerido com as enzimas de restrição apropriadas (Xhol + Notl). A inserção é obtida incubando 50 μl do produto PCR com 2 μl Xhol (10 U / μl) e 2 25 μl Notl (10 U / μl) no buffer apropriado recomendado pelo fabricante para 3 horas em 37 °C. O vetor é obtido semelhantemente adaptando a quantidade de enzimas de restrição para a quantidade de plasmídeo. Tanto o vetor como o fragmento que codifica NB são purificados e a concentração 30 de ADN é quantificada usando o BioPhotometer (Eppendorf). O fragmento e o vetor de aceitante são ligados utilizando proporção equimolar 1 Unidade T4 ligase (Promega) por 30 minutos na temperatura ambiente ou durante a noite a 16°C. O ADN (20-30 ng) é transformado a células TG1. As colônias são 35 analisadas através de PCR utilizando escorvadores 3'AOX1 R e 5'AOX1 F. A análise de seqüência é executada em clones positivos. O TNF30, TNF33 e ALB8 foram formatados a nanocorpos™ trivalentes biespecíficos. Como o espaçador entre as construções bloqueia um 9AA GlySer linker foi usado.
Para isolar o ADN plasmídeo, uma precultura é começada inoculando uma colônia única do clone em 50 ml Caldo Luria + Ampicilina ou Carbenicilina (100 μg/ml) + glicose a 2% e 10 incubação a 37 °C durante a noite. O ADN Plasmídeo é preparado usando o conjunto Midi Plasmídeo (Qiagen) segundo instruções do fabricante. O ADN é linearizado incubando 30 μg plasmídeo ADN com 6 μl BstXl (10 U / μl) no buffer apropriado segundo as instruções do fabricante por 3 horas a 15 45°C. O ADN digerido é purificado usando o conjunto de
Purificação PCR (Qiagen) segundo instruções do fabricante. O ADN é concentrado usando precipitação de EtOH segundo os procedimentos padrão. As células X-33 eletrocompetentes são transformadas com 10 μg de DNA linearizado e células são 20 deixadas crescer por 48 horas em uma chapa de ágar-ágar YPD seletiva que contém Zeocin (100/250/500 μg/ml). O X-33 é uma classe de tipo natural de Pichia pastoris; a própria classe bem como as classes de recombinante derivadas contêm o gene AOX1 nativo e são capazes de metabolizar o metanol (Mut +).
Os clones são protegidos para nível de expressão incubando as colônias únicas em 1 ml BGCM em uma placa de 24 orifícios e cultivando-os por 48 horas a 30°C a 120 rotações por minuto. As células são centrifugadas e BGCM fresco é acrescentado às células para crescimento a 30°C a 120 30 rotações por minuto durante 48 horas. Depois, MeOH é acrescentado a uma concentração final de 0,5% e as células são cultivadas a 30°C a 120 rotações por minuto durante 8 horas, depois do qual MeOH é acrescentado novamente a uma concentração final de 0,5%. As células são cultivadas 35 noturnas a 30°C a 120 rotações por minuto. As células são centrifugadas e o supernadante é colhido e analisado em ELISA como descrito no exemplo 10.
A composição de buffers, soluções e outras podem ser encontradas no web site de Invitrogen 10 (https://ww.invitrogen.com/content/sfs/manuals/ppiczalpha_ma n. pdf) .
Uma precultura foi começada inoculando uma colônia única da chapa em 5 ml YPD. A cultura foi cultivada noturnamente a 180 rotações por minuto e 30°C. No dia seguinte, a pré- 15 cultura foi diluída a 50 ml de YPD e cultivada noturnamente a 180 rotações por minuto e 30°C. As culturas de produção foram começadas inoculando a pré-cultura a um ODβOOnm final = 0,04-0,08. As culturas foram cultivadas em BGCM por 24 horas a 30 °C a 180 rotações por minuto e centrifugadas a 20 4,500 rotações por minuto por 30 minutos. As células foram re-suspensas em 1/3 do volume original no meio BGCM com um final OD600 nm = 15-20. As células não foram induzidas com MeOH em pontos de tempo regulares, tipicamente 3 tempos/dia, nunca excedendo o conteúdo de MeOH de 1%. Depois de 50 horas 25 da indução o supernadante é colhido.
A cultura supernadante é filtrada sobre uma membrana de micro filtração de 22 μm (Hydrosart, Sartorius). A amostra é 30 concentrada usando diafiltração em lOkDa membrana de filtração extrema (HydroSart, Sartorius) e concentrada a O,5-1L.
Os nanocorpos™ são purificados usando Cromatografia de afinidade à Proteína A (MabSelect Xtra, GE Healthcare) 35 utilizando PSB como buffer de trabalho e Glicina [100 mm pH-2.5] para eluição. As amostras são neutralizadas usando 1.5 M Tris pH=8.8. Os nanocorpos™ são além disso processados na Cromatografia de Troca de Anion (Fonte 3 0Q, GE Healtcare) . As amostras são diluídas 10 vezes com 10 mm Piperazina pH=10,2 e ajustadas a pH=10,2 com 1M NaOH e uma 5 condutividade de <2mS/cm com a água MilliQ.
Os nanocorpos são processados na Cromatografia de exclusão por tamanho (Superdex 75pg, Hiload XK26/60, GE Healtcare) e LPS é retirado via Cromatografia de Troca de Anion (Fonte 30Q, GE Healtcare) pela passagem através de coluna de 5ml, 10 que é sanitizada com 1M NaOH e equilibrada no PSB Dulbecco.
Para determinar a pureza, as amostras de proteína foram analisadas em um gel de SDS-PAGE de 15% como descrito no exemplo 8. O gel é processado usando o SilverQuest™ segundo os procedimentos gerais descritos pelo fabricante 15 (Invitrogen). Alternativamente, o gel é processado usando coomassie brilliant blue ou no western blot como descrito no exemplo 8 e 9. Os resultados são dados na Figura 42.
O TNF60 compõe-se de 363 aminoácidos. A proteína tem um peso molecular de 38,441 Da. O pi é 8.71. O coeficiente de 25 extinção em 280 nm é 1.736.
A massa da proteína foi determinada na ESI-MS segundo os procedimentos padrão. A massa teórica de TNF60 é 38,441 30 Da. A proteína tem 2 pontes de S-S que devem resultar em uma massa de 38,435 Da na ESI-MS. A massa que foi experimentalmente determinada para TNF60 derivada de 3 variedades de lotes diferentes de 38,433 Da a 38,435 Da, diferenciando-se maximamente 0,005% com a massa teórica.
O Sequenciamento do N-terminal foi executado pela degradação Edman segundo os procedimentos padrão. O Sequenciamento do N-terminal mostrou que a seqüência de proteína para 7 primeiros aminoácidos é como se segue: EVQLVES. Isto ê, compatível com a seqüência de proteína teórica, que indica o processamento de N-terminal próprio.
As amostras (100 ug) foram analisadas na coluna Superdex75 de alta resolução, para caracterizar os lotes diferentes do Nanocorpo™. A cromatografia de exclusão por tamanho do Nanocorpo™ tipicamente produz um pico simétrico, 15 com um tempo de retenção de 11.5 min em Superdex75. A absorbância é tipicamente registrada em 280, 254 e 214 nm. A medição 214 nm permite a mais alta sensibilidade de detecção. O ajustamento analítico no PSB fornece um pico simétrico. Nenhum contaminante foi observado. O tempo de 20 retenção observado para 3 lotes diferentes é 11,5-11,55 min.
Um perfil representativo é mostrado na Figura 43.
A funcionalidade de TNF60, isto é, ligando a TNFot 25 humano foi analisada em ELISA como descrito no exemplo 10.
Os resultados são resumidos na Figura 44 e claramente demonstram uma ligação dependente de dose e saturável de 2 lotes de TNF60 a TNFot humano.
A potência para neutralizar a atividade citotóxica de TNFot foi analisada em um ensaio à base de célula como descrito no exemplo 13. Os resultados são resumidos na Tabela 42 e nas Figuras 45 e 46.
Os dados mostram que TNF60 tem a potência na variedade de Enbrel/Etanercept e uma melhor potência de 10 vezes do que Humira/Adalimumab e Remicade/Infliximab.
Ligação a albumina de soro de ser humano e de rhesus foi analisada em Biacore como descrito no exemplo 12. Os KD, kon e os valores de koff são representados na Tabela 43. 0 TNF60 é em comparação com TNF24, que é o Nanocorpo pai biespecífico trivalente ™ com o tipo natural de blocos de 10 construção.
A afinidade de TNF6 0 para albumina de soro de ser humano e rhesus é semelhante. A afinidade é de 2 vezes mais baixa comparando com a afinidade observada para TNF24 que é o análogo de tipo natural de TNF60. O Kon é idêntico para 15 ambas as moléculas, mas o koff é de 2 vezes mais alto para TNF60.
Ratos DBA1 ou BALBc foram aquecidos embaixo de uma lâmpada infravermelha e 200 μl Nanocorpo™ (100 μg por rato) foi injetado intravenosamente no rabo. As amostras de sangue 25 foram obtidas em pontos de tempo diferentes fazendo uma pequena incisão no rabo e reunindo o sangue em um microtubo. Tipicamente, o sangue foi experimentado no minuto t=15, 2 horas, 4 horas, 6 horas, 1 dia, 2 dias, 3 dias, 4 dias, 7 dias, 14 dias. O soro foi preparado segundo os procedimentos 30 padrão.
Uma microplaca de titragem (NUNC, Maxisorb) foi coberta de 2 μg/ml neutravidin durante a noite a 4°C. A chapa foi 35 lavada 5 vezes com o% de PBS/0,05 Tween-20 e bloqueada para 2 horas em RT com a caseína 1% de PBS/1. TNFa biotinilado humano (1/2000 em PBS/0,2% caseína; 400 ng/ml) foi aplicado às cavidades e incubado por Ihr em RT. O Nanocorpo™ referência padrão foi aplicado começando em uma concentração de 5 μg/ml e utilizando diluições de 5 vezes em PSB que 5 contém plasma de rato de 1%. Permitiu-se que os nanocorpos™ se ligassem por 2 horas ao RT. A chapa foi lavada 5 vezes e foi aplicado anti-Nanocorpo policlônico de coelho (R23) em uma diluição de 2000 vezes para uma hora em RT. Depois de lavar a chapa, a ligação foi descoberta com cabra- 10 policlonal-anti-coelho-HRP (DAKO) em uma diluição de 3000 vezes por uma hora em RT, e manchada com ABTS/H2O2. O OD405nm foi medido.
O primeiro ELISA foi usado para determinar a variedade linear da referência padrão. Em um segundo ELISA, a 15 referência padrão foi usada em concentrações nesta variedade linear e tipicamente utilizando diluições de 2 vezes. Neste segundo ELISA, as amostras de teste de soro foram diluídas às diluições de 5 vezes de 100 vezes e novas foram feitas no plasma de rato de 1%, para determinar a diluição na qual as 20 amostras de soro fornecem uma leitura na variedade linear da curva padrão. Em um terceiro ELISA, as amostras de soro são diluídas em uma concentração apropriada determinada no segundo ELISA e utilizando diluições de 2 vezes para determinação exata da concentração de Nanocorpo™ nas 25 amostras de soro.
Os experimentos foram executados para determinar o perfil farmacocinético de TNF60 em ratos (n=3). Um valor de Cmax de 103,84 + 31 μ o g/ml foi conseguido 15 minutos depois da administração. A meia-vida (tl/2 β) foi 30 determinada para ser 1.9 dias, semelhantes à meia-vida da albumina de soro de rato, indicando que TNF60 adota a meia- vida da albumina de soro. Os dados são apresentados na Figura 47.
Nanocorpo™ foi coberto em 5 μg/ml em PSB a 4°C durante a noite. A chapa foi lavada 5 vezes com o% de PBS/0,05 Tween-20 e bloqueada por 2 horas em RT com o PBS/1% caseina. As amostras de soro foram diluídas 100 vezes e se aplicaram às cavidades para a incubação durante 1 hora na temperatura 5 ambiente. A detecção foi executada usando o HRP de coelho policlônico diluído de 1000 vezes anti-rato (DAKO, P0260) e usando ABTS como substrato.
As amostras de soro foram diluídas 50 vezes e analisadas para a presença de anticorpos de rato anti-TNF60. A falta de 10 imunogenicidade foi demonstrada para TNF60. Os dados são apresentados na Figura 48.
Ver o exemplo 48
Duas reações PCR separadas foram estabelecidas para 20 amplificar a subunidade do Nanocorpo™ N-terminal e C- terminal que usa os procedimentos como indicado no WPA-0011. Para a amplificação do N-terminal Nanocorpo™ PiForLong e Rev_30GlySer_L108 foram usados como combinação de escorvador; para a amplificação do C-terminal Nanocorpo™ 25 For_GlySer e PiRevCyslhum foi usado ou alternativamente For_GlySer e PiRevCys2hum, introduzindo os sítios de restrição requeridos para formatando e resíduos de cisteina livres requeridos para modificações de C-terminal.
A reação de PCR de 1 μl plasmídeo ADN (50-100 ng) , 1.5 μl 30 escorvador direto (10 μ M -» 300 nM) , 1.5 μl escorvador inverso (10 μ M -» 300 nM) , 1 μl dNTPs (10 mM 0,2 mM) , 5 μl buffer (10x -» lx) , 0,75 μl enzima (3.5 U / μl -» 2.6 U / μl) e 3 9.25 μl H20 com um volume total de 50 μl foi preparado. As seqüências de escorvador são dadas na Tabela 44. Um 35 programa PCR foi começado com 2 minutos a 94°C. Um ciclo de segundos a 94°C, 30 segundos em 50°C e 1 minuto em 72°C foi repetido 30 vezes e seguido por 10 minutos em 72°C. A amplificação foi verificada separando 5 μl da reação PCR em 2% agarose gel. 0 produto PCR foi purificado usando o 5 QIAquick PCR Conjunto de Purificação segundo instruções do fabricante. Uma coluna foi usada e eluída com 50 μl EB buffer. O fragmento N-terminal de VHH foi preparado incubando 50 μl ADN e 2 μl BamHI (10 U / μl) e 2 μl Xhol (10 U / μl) no bμffer apropriado recomendado pelo fabricante a 10 37 °C por 1.5 horas. O fragmento de VHH foi preparado incubando 5 0 μl de DNA e 2 μl de BamHI (10 U/μl) e 2 μl de EooRI (10 U/μl) no buffer apropriado recomendado pelo fabricante a 37°C por 1 hora. As reações de digestão prévias foram separadas em gel agarose a 2%. As bandas de VHH (35015 450 bp) foram cortadas do gel e o DNA foi purificado usando o Conjunto de Extração de Gel QIAquick segundo instruções do fabricante. Uma coluna (com um máximo de 4 00 mgs de gel agarose por coluna) foi usada e o DNA ligado foi eluído com 50 μl de EB buffer. A concentração de DNA foi determinada 20 medindo OD260 (1 unidade OD = 50 μg/ml) . Uma mistura de ligação com um volume final de 10 μl contendo 100 ng de vetor pPICZaA, linearizada com Xhol/EcoRI, 30 ng de N- terminal VHH, 3 0 ng de N-terminal VHH fragmento, 1 μl de buffer de ligação e 1 μl de ligase (3U) foi preparada e incubada por 1 hora em RT. A transformação de E. coli, TG1 foi executada usando 2 μl de ligação de mistura. As colônias são analisadas usando PCR conforme descrito em WPA-0010, mas usando a combinação de escorvador AOXIFor/AOXIRev. A análise de seqüência é executada em clones positivos. A preparação 30 de plasmídeo foi executada usando o conjunto Qiaprep spin Miniprep (Qiagen) segundo instruções do fabricante e descrita anteriormente. O seqüenciamento foi executado na instalação de seqüência VIB, Antuérpia, Bélgica.
Transformação de P. pastoris Ver o exemplo 48.
TNF30 foi formatado a Nanobodies™ bivalente. Como espaçador entre os 2 blocos de construção foi usado um linker 30 AA GlySer. Para permitir modificações específicas de local do C-terminal, uma cisteina livre foi introduzida, 5 como o ultimo AA do Nanobody™ ou com um espaçador extra consistente em GlyGlyGlyCys (SEQ ID n. 471).
Ver exemplo 49
O meio de cultura foi feito sem célula através de centrifugação e filtração 0,22 μ m. O meio estéril foi armazenado a 4°C até processamento posterior. Peso molecular baixo foram reduzidos via ultrafiltração em uma membrana 20 lOkDa de ultrafiltração (UP) (HydroSart Sartocon Slice Cassete, Sartorius) como se segue: o meio de quatro litros foi concentrado a 0,5-1 lt, logo diluiu-se com 5 lit PSB e novamente concentrou-se a 0,5 lit. Esta ação foi executada duas vezes.
O retentor do UF foi filtrado através de membranas de 47 mm de náilon 0,45 μ m (Alltech #2024).
Em um seguinte passo o Nanocorpo bivalente ™ foi capturado do meio concentrado via purificação por afinidade de Proteína A (usando MabSelectXtraTM, GE Healtcare). A 30 coluna [35X100 mm] foi equilibrada no PSB e depois da aplicação de mostra lavada extensivamente com o PSB. 0 TNF56 foi eluída com Glicina [100 mm, pH=2.5].
As frações eluídas de MabSelectXtraTM foram neutralizadas com Tris [1,5M, pH 8,8] e armazenadas a 4°C. 0 35 TNF56 foi concentrado e purificado via AEX (A= 10 mm piperazina, pH 10,8 e B=1M NaCl em 50 mm Tris, pH 7,5) utilizando Fonte 30Q (GE Healtcare) . A este fim as frações de Nanocorpo™ foram diluídas com um buffer (10 mm piperazina, pH 10,8) a uma condutividade de 5mS/cm e o pH foi ajustado a 10,8. A coluna [25X100 mm] foi equilibrada em 5 um buffer antes de carregar a amostra para a coluna. 0 TNF56 foi eluído com um gradiente de 5 Volume de Coluna (CV). O pH das frações colecionadas foi ajustado a 7.8 utilização 1M Tris pH=7.8.
O Dithiotreitol (DTT, Aldrich. Cat 15,046-0) foi 15 acrescentado às frações neutralizadas para reduzir as pontes de bissulfeto potenciais que se formaram entre o terminal carboxi cisteinas dos nanocorpos™ (normalmente aproximadamente 20%). Uma concentração final de DTT de 10 mm e incubação durante a noite a 4 °C foi considerada como 20 ótima. A redução foi avaliada por cromatografia de exclusão de tamanho analítica (SEC) . Por isso, 25 μl do Nanocorpo reduzido foi acrescentado a 75 μl D-PBS e injetado em um Sup75 10/300 coluna de GL equilibrada no PSB de Dulbecco (D- PBS, GibcoTM REF 14190-094).
O Nanocorpo™ e DTT Não reduzido foi retirado por SEC preparativo em uma coluna Hiload 26/60 Superdex75 de grau preparatória equilibrada em D-PBS.
A concentração do Nanocorpo™ reduzido foi medida medindo a absorbância em 280nm. Um Espectrofotômetro de Raio 30 Duplo Uvikon 943 UV/VIS (método: ver o SOP ABL-0038) foi usado. A absorção foi medida em um exame de comprimento de onda 245-330nm. Duas células de Precisão feitas do Quartzo Suprasil® foram usadas (tipo de Hellma n. : 104-QS; caminho da luz: 10 mm). Primeiro a absorção do branco foi medida em 35 280nm colocando duas células enchidas com 900 μl D-PBS. A amostra foi diluída (1/10) acrescentando 100Q1 da amostra à primeira célula. A absorção da amostra foi medida em 280nm.A concentração foi calculada com a fórmula seguinte:Para TNF55: 0=1,85Para TNF56: □=!,83.
Para PEGylar o Nanocorpo™ um excesso molar 5X da 10 solução de PEG40 de 1 mm recentemente feita foi acrescentado à solução do Nanocorpo™ reduzido. (MPEG2-MAL-4OK de NEKTAR ™ Transformação Terapêutica (2D3YOTO1) Mw = 40,000 g/mol; MPEG2-MAL-60K de NEKTAR™ Transformação Terapêutica (2D3YOVO1) Mw = 60,000 g/mol).
A mistura Nanocorpo™-PEG foi incubada por lh na temperatura ambiente (RT) com a agitação suave e logo transferida para 4°C. A Pegilação foi avaliada via SEC analítico. Por isso, 25 μl do Nanocorpo™ acrescentado a 75 μl D-PBS e injetado em uma coluna Sup75HR 10/300 equilibrada 20 em D-PBS. O Nanocorpo™ Pegilado eluído na variedade do volume de exclusão da coluna (> 75kDa).
Os Nanocorpo™ Pegilado e não Pegilado foram separados via cromatografia de troca de cation (CEX, usando Source30S, GE Healtcare,- um buffer =25mM ácido cítrico pH=4 e B=1M NaCl 25 em PSB) . A amostra foi diluída a uma condutividade de <5mS/cm e o pH foi ajustado a 4,0. A coluna [25X100 mm] foi equilibrada e depois da aplicação de amostra lavada extensivamente com o A-buffer. O Nanocorpo™ Pegilado foi eluído com 3 gradientes de CV.
O Nanocorpo™ colhido foi trocado por buffer a D-PBS por SEC em uma coluna Hiload 26/60 Superdex 75 de grau preparatório equilibrada em D-PBS.
Finalmente o Nanocorpo™ foi tornado livre de LPS via a passagem por cima da coluna (Source30Q) de troca de anion. A 35 coluna (10x100 mm) foi sanitizada durante a noite em NaOH [IM] e posteriormente equilibrada em endotoxina liberada D-
Para biotinilar Nanocorpo™ um excesso de Molar 5X de biotina (EZ-Link® Maleimide-P02-Biotina, Furo #21901) de uma solução de estoque de 10 mm foi acrescentado ao Nanocorpo™ reduzido (ver 5.5.1). A mistura de biotina-Nanocorpo™ foi incubada por 1 h em RT com a agitação leve e logo armazenada 10 a 4°C.
A pureza do Nanocorpo™ biotinilado foi controlada via SEC analítico. Por isso, 25 μl de Nanocorpo™ biotinilado foi acrescentado a 75 μl D-PBS e injetado em uma coluna Sup75HR 10/300 equilibrada em D-PBS. Do cromatograma obtido 15 pode ser concluído que o Nanocorpo™-biotina não precisa de nenhuma nova purificação: nenhuma dimerização do Nanocorpo™ via uma oxidação de sulfidrilos livres pode ser descoberta. Uma modificação de buffers a D-PBS foi feita por uma passagem pela coluna de dessalinização Sephadex G25 coluna 20 fina (90ml) .
Finalmente o Nanocorpo™-biotina foi tornado livre de LPS pela passagem pela coluna de troca de anion (Source30Q, GE Healtcare). A coluna (1x10 cms) foi sanitizada durante a noite em 1M NaOH e logo equilibrada em D-PBS. 25
Para determinar a pureza, as amostras de proteína foram analisadas em um gel de SDS-PAGE de 15% como descrito no exemplo 8 e 49. Os resultados são apresentados na Figura 49 e 50.
O TNF55 compõe-se de 260 aminoácidos. A proteína tem um peso molecular de 27,106 Da. A pi é 8.67. O coeficiente de extinção em 280 nm é 1.850.
O TNF56 compõe-se de 264 aminoácidos. A proteína tem um peso molecular de 27,365 Da. A pi é 8.67. O coeficiente de 5 extinção em 280 nm é 1.830.
A massa teórica de TNF55 é 27,106 Da. A proteína TNF55- Biotina tem 2 pontes de S-S e uma modificação biotina que 10 deve resultar em uma massa de 27,627 Da na ESI-MS. A massa que foi experimentalmente determinada para TNF55-biotina é 27,627 Da.
A massa teórica de TNF56 é 27,365 Da. A proteína TNF55- Biotina tern 2 pontes de S-S e uma modificação de biotina que 15 deve resultar em uma massa de 27,886 Da na ESI-MS. A massa que foi experimentalmente determinada para TNF55-biotina é 27,886 Da.
O Sequenciamento do N-terminal de TNF56-PEG40 mostrou que a seqüência de proteína para os 7 primeiros aminoácidos é como se segue: EVQLVES. Isto é, compatível com a seqüência de proteína teórica, que indica o processamento de N- terminal próprio.
O ajustamento analítico de TNF56-PEG40 no PSB fornece um pico simétrico. Nenhum contaminante foi observado. 0 tempo de retenção observado é 8.5 ml no Superdex HR 75 e 10,32 ml no Superdex HR 200. Um perfil representativo é mostrado nas Figuras 51 e 52.
A potência para neutralizar a atividade citotóxica de TNFot foi analisada em um ensaio à base de célula. A potência foi examinada em concentrações diferentes do Nanocorpo™ bem como do Enbrel comercialmente disponível, Humira e Remicade em uma base de molar. Quanto mais alto o EC50, mais baixa foi a atividade do composto para neutralizar TNFa.
Os resultados são resumidos na Tabela 45 e as Figuras 53 e 54.
Os dados mostram um aumento na potência para os nanocorpos™ bivalentes quando em comparação com o Nanocorpo monovalente™ TNF1. A potência de derivados TNF55 é semelhante a derivados TNF56, que está na variedade de Enbrel e 10 vezes melhor do que Humira e Remicade.
Os experimentos foram executados para examinar a meia- vida de nanocorpos™ pegilados em ratos. A meia-vida de TNF56-PEG40 bivalente foi comparada com a meia-vida de TNF56-PEG60. Ambos nanocorpos™ têm a meia-vida comparável de 20 ~ 2 dias. Os resultados são apresentados na Figura 55.
Além do mais, a meia-vida de 3E-3E bivalente pegilado foi explorada. A meia-vida de 3E-3E-PEG20 foi comparada com a meia-vida de 3E-3E-PEG40 depois da administração intravenosa de 100 μg dos nanocorpos™. O 3E-3E-PEG20 tem uma 25 meia-vida de 17 horas, enquanto 3E-3E-PEG40 tem uma meia- vida de 2.1 dias, comparáveis com a meia-vida de 3E-3E- MSA21. Os resultados são apresentados na Figura 56.
As amostras de soro foram diluídas 100 vezes e analisadas para a presença de anticorpos de rato anti-TNF56- 30 PEG40 ou anti-TNF56-PEG60. A falta de imunogenicidade foi demonstrada para ambas as moléculas. Os dados são apresentados na Figura 57.
Linhas de ratos transgênicos e expressando um transgene de fator de necrose de tumor humano 31-modificado (hTNF- alfa, cachectin) foram usados como um modelo para estudar a eficácia de TNF60 (TNF60) na prevenção do desenvolvimento da 5 artrite (EMBO J. 10, 4025-4031). Esses ratos foram mostrados para desenvolver a poliartrite crônica com a incidência de 100% em quatro para sete semanas da idade.
Da terceira semana da idade, as crias de ratos transgênicos foram divididas em grupos de oito animais. 10 Antes de inicializar o estudo, o peso médio do corpo foi calculado para cada grupo. A partir daí, durante todo o estudo os pesos dos animais foram registrados uma vez por semana para cada grupo.
Para testar a eficácia de TNF6 0 na prevenção da 15 poliartrite crônica, injeções intraperitoneais foram dadas duas vezes por semana a cada animal de um determinado grupo segundo o esquema seguinte:- Grupo 1 (controle negativo): fosfato em buffer salino (PSB) (buffer de formulação) - Grupo 2 (tratamento do Nanocorpo): TNF6 0 em uma dose finalde 3 0 mg s/kg- Grupo 3 (tratamento do Nanocorpo): TNF60 em uma dose final de 10 mgs/kg- Grupo 4 (tratamento do Nanocorpo): TNF60 em uma dose final 25 de 3 mgs/kg- Grupo 5 (lo controle positivo) : Enbrel em uma dose final de 30 mgs/kg- Grupo 6 (lo controle positivo) : Enbrel em uma dose final de 10 mgs/kg- Grupo 7 (2o controle positivo): Remicade em uma dose finalde 30 mgs/kg- Grupo 8 (2o controle positivo): Remicade em uma dose final de 10 mgs/kg- Grupo 9 (2o controle positivo): Remicade em uma dose final 35 de 3 mgs/kgPara cada grupo, as datas de volumes de injeção e injeção foram observadas.
As injeções continuaram por sete semanas. Durante este período, dados clínicos foram registrados observando modificações macroscópicas na morfologia conjunta para cada 5 animal.
Em 10 semanas da idade, todos os ratos foram sacrificados e os soros e as articulações foram reunidas. Os soros foram armazenados a -70 ° 0 C e as articulações de tornozelo foram conservadas em formalina.
Para os grupos selecionados, as articulações do tornozelo foram embutidas na parafina e seccionadas. As seções de articulação do tornozelo foram posteriormente usadas para avaliação histopatológica da progressão da doença.
Os resultados são representados na figura 58.
Linhas de ratos transgênicos carregando e expressado um 20 transgene de fator de necrose de tumor humano 3'-modificado (hTNF-alfa, cachectin) foram usados como modelo para estudar a eficácia de TNF60 (TNF60) no tratamento terapêutico da artrite (EMBO J. 10, 4025-4031). Esses ratos foram mostrados para desenvolver a poliartrite crônica com a incidência de 25 100% em quatro para sete semanas da idade.
Da sexta semana da idade, as crias de ratos transgênicos foram divididas em grupos de oito animais. Antes de inicializar o estudo, o peso de corpo médio foi calculado para cada grupo. A partir daí, durante todo o 30 estudo os pesos dos animais foram registrados uma vez por semana para cada grupo.
Para testar a eficácia de TNF60 no tratamento terapêutico da poliartrite crônica, injeções intraperitoneais foram dadas duas vezes por semana a cada 35 animal de um determinado grupo segundo o esquema seguinte:- Grupo 1 (controle negativo): o fosfato em buffer salino (PSB) (buffer de formulação)- Grupo 2 (tratamento do Nanocorpo): TNF60 em uma dose final de 30 mgs/kg- Grupo 3 (tratamento do Nanocorpo): TNF60 em uma dose final 5 de 10 mgs/kg- Grupo 4 (lo controle positivo) : Enbrel em uma dose final de 30 mgs/kg- Grupo 5 (2o controle positivo): Remicade em uma dose final de 30 mgs/kg
Para cada grupo, as datas de volumes de injeção e injeção foram observadas.
As injeções continuaram por sete semanas. Durante este período, o número clínico foi registrado observando modificações macroscópicas na morfologia conjunta para cada 15 animal.
Em 13 semanas da idade, todos os ratos foram sacrificados e soros e as articulações foram reunidas. Os soros foram armazenados a -70 ° 0 C e as articulações do tornozelo foram conservados em formalina.
Para grupos selecionados, as articulações do tornozelo foram embutidas em parafina e seccionadas. As seções de articulação de tornozelo foram posteriormente usadas para a avaliação histopatológica da progressão de doença.
Os resultados são representados na figura 59.
Linhas de ratos transgênicos levando e expressando um transgene de fator de necrose de tumor humano 3'-modificado 30 (hTNF-alfa, cachectin) foram usadas como um modelo para estudar a eficácia de um Nanocorpo anti-TNF-A formado de maneiras diferentes na prevenção da poliartrite crônica (EMBO J. 10, 4025-4031) . Esses ratos foram mostrados para desenvolver a poliartrite crônica com a incidência de 100% 35 em quatro para sete semanas da idade.
Da terceira semana da idade, as crias de ratos transgênicos foram divididas ém grupos de oito animais. Antes de inicializar o estudo, o peso médio do corpo foi calculado para cada grupo. A partir daí, durante todo o estudo dos animais os pesos dos animais foram registrados 5 uma vez por semana para cada grupo.
Estudar a eficácia de um Nanocorpo anti-TNF-A em formatos diferentes para a prevenção da poliartrite crônica, injeções intraperitoneais foram dadas duas vezes por semana a cada animal de um determinado grupo segundo o esquema 10 seguinte:- Grupo 1 (controle negativo): fosfato em buffer salino (PSB) (buffer de formulação)- Grupo 2 (o formato 1 do Nanocorpo) : TNF60 em uma dose final de 10 mgs/kg- Grupo 3 (o formato 1 do Nanocorpo) : TNF6 0 em uma dosefinal de 2.5 mgs/kg- Grupo 4 (o formato 1 do Nanocorpo) : TNF6 0 em uma dosefinal de 1 mg/quilograma- Grupo 5 (o formato 2 do Nanocorpo) : TNF56-PEG40 em uma dose final de 10 mgs/kg- Grupo 6 (o formato 2 do Nanocorpo) : TNF56-PEG40 em umadose final de 1.8 mgs/kg- Grupo 7 (o formato 2 do Nanocorpo) : TNF56-PEG40 em umadose final de 0,7 mgs/kg- Grupo 8 (o formato 3 do Nanocorpo): TNF56-biot em uma dosefinal de 1.8 mgs/kg- Grupo 9 (o formato 4 do Nanocorpo) : TNF3 0 em uma dose final de 1 mg/quilograma- Grupo 10 (o formato 5 do Nanocorpo) : TNF1 em uma dose 30 final de 1 mg/quilograma- Grupo 11 (lo controle positivo): Enbrel em uma dose final de 10 mgs/kg- Grupo 12 (2o controle positivo): Remicade em uma dosefinal de 10 mgs/kg
Para cada grupo, as datas de volumes de injeção e injeção foram observadas.
As injeções continuaram por sete semanas. Durante este período, o número clínico foi registrado observando modificações macroscópicas na morfologia conjunta para cada animal.
Em 10 semanas da idade, todos os ratos foram sacrificados e soros e as articulações foram reunidas. Os soros foram armazenados a -70 ° OCeas articulações do tornozelo foram conservadas em formalina.
Para grupos selecionados, as articulações de tornozelo 10 foram embutidas em parafina e seccionadas. As articulações de união de tornozelo foram posteriormente usadas para a avaliação histopatológica da progressão da doença.
Os resultados são representados na figura 60.
Macacos rhesus reproduzidos em cativeiro (Macaca mulatta) são usados para determinar o perfil farmacocinético de TNF6 0 e TNF56-PEG40.
Dezesseis animais são usados neste estudo (oito machos e oito fêmeas) e divididos em quatro grupos (dois machos e duas fêmeas por grupo). Todos os animais pesaram aproximadamente 5 kg e estão sem doença por pelo menos seis 25 semanas antes do uso. Fungue® Pri vegetarisch o V3994 serve de comida. Sessenta g/kg b.w. são oferecidos a cada macaco. O resíduo é retirado. Regularmente (pelo menos duas vezes por ano) a comida ê analisada baseada no EPA/EUA para contaminantes por LUFA-ITL. Água de torneira é oferecida ad 30 libitum. Os animais em cada grupo de tratamento são alojados em um bloco de várias jaulas adjacentes dentro da unidade de macacos. Os macacos são mantidos isoladamente em jaulas de aço V2A com um tamanho de 90 cms x 82 cms x 96 cms. A temperatura ambiente é mantida em 23°C + 3°C (variedade máxima) e a umidade relativa em 60% ± 20% (variedade máxima). Os desvios da variedade máxima causada, por exemplo, durante a limpeza de procedimento são tratados em SOPs. As salas são iluminadas e escurecidas por períodos das 12 horas cada um.
Dois grupos são infundidos com TNF60 e dois grupos são infundidos com TNF56-PEG40. As infusões intravenosas de TNF60 e TNF56-PEG40 (dissolvida em PSB) na veia cefálica do braço direito ou esquerdo que usa cateteres internos e uma bomba de infusão TSE (veja abaixo) são dadas em uma dose 10 fixa de 2 mgs/kg.
Quatro administrações únicas são executadas, separadas a um período de limpeza de pelo menos catorze dias. Depois da administração da última o período posterior é pelo menos oito semanas. Dois dos quatro grupos são tratados com 15 TNF6 0 ou TNF56-PEG40 em combinação com metotrexato (MTX) (dissolvido no PSB). 0 grupo 2 é tratado com TNF60 e MTX; o grupo 4 ê tratado com TNF56-PEG4 0 e MTX. O MTX é dosado semanalmente intramuscularmente em 0,2 mgs/kg. Nos dias de administração, MTX é dado aproximadamente 30 minutos antes da administração. A dosagem começa na primeira administração de Nanocorpo e continuará através de todo o período de limpeza de oito semanas depois da quarta dose. Há catorze administrações MTX únicas, separadas por um período de limpeza de pelo menos uma semana que começa na primeira 25 administração de item de teste.
Neste estudo foi avaliada a capacidade do anti-TNF 30 biológicos, ALX0071 e Etanercept, para atenuar a produção de IL-6 induzida por TNFa por fibroblastos derivados de RA- sinóvia.
Tecido de articulação sinovial de pacientes RA que aceitaram foi armazenado num meio baseado em DMEM com antibióticos a 4°C até por 96 horas depois da cirurgia de substituição de articulação. Células sinoviais foram 5 isoladas de sinóvia dissecada por digestão de colagenase a 37 °C por 2 horas. A suspensão celular resultante foi então lavada por uma série de passos de centrifugação e re- suspensão e as células resultantes então cultivadas a 37°C no meio de cultura baseado em DMEM complementado com 10% de 10 FCS (v/v). Os fibroblastos resultantes foram usados para o seguinte experimento na segunda ou na terceira passagem. Células de quatro doadores foram usadas em experimentos individuais. Fibroblastos foram semeados em placas de poliestireno de fundo plano de 96 cavidades a 1.5xl04 15 células em um volume final de 250 μL do meio de cultura baseado em DMEM complementado com 10% de FCS (v/v) por cavidade e cultivados durante a noite.
As células foram então incubadas por 72 horas no meio de cultura baseado em DMEM complementado com TNFot a 50 ng por mL (3 nM (R&D Systems 210-TA/CF) sozinhas ou na presença de doses crescentes de ALX0071 (0,575 a 1920 ng por mL;25 0,015 a 50 nM) ou Etanercept (Wyeth Labs; 3.75 a 11250 ngpor mL; 0,025 a 75 nM). O volume final em cada cavidade foi de 250 μL e cada avaliação foi executada em triplicate. Depois de 72 horas, o meio supernadante foi retirado e armazenado a -40 °C antes da análise por IL-6 ELISA (R&D Systems) . A inibição da produção de IL-6 induzida por TNFot foi determinada e os valores de IC50 foram calculados tanto para ALX0071 quanto para Etanercept.
Tanto ALX10071 como Etanercept dependentemente de dose reduziram a produção de IL-6 TNFot-induzida pelos fibroblastos derivados de Synovium RA dos quatro doadores. Houve uma potência semelhante entre os dois reagentes nessas condições de ensaio.
Neste estudo a capacidade do anti-TNF biológicas, ALX0071 e Etanercept, para atenuar a infiltração de célula 10 induzida por TNFa- em uma bolsa de murina aérea foi avaliada.
As bolsas de ar foram formadas pela injeção subcutânea 15 (s.c). de 2.5mL de ar estéril na superfície dorsal de ratos C57B1/6/J masculinos anestesiados (25-30g, Harlan). A bolsa foi re-inflada injetando 2.5 ml de ar estéril 3 dias depois.
Seis dias depois da criação inicial da bolsa aérea, os animais foram anestesiados e a bolsa injetada com 1 ml de 0,5% CarboxyMethylCellulose (CMC) veículo que contém 0,1 üg recombinante TNFa humano (R & D Systems 210-TA-050/CF). Em três outros grupos de animais, ALX0071 (0,0625, 0,125 e 0,25 mgs/kg) foi injetado s.c. 19 horas antes da injeção de TNFa. Uns segundos três grupos de animais foram injetados (s.c). com Etanercept (Wyeth Labs, 0,125, 0,25 e 0,5 mgs/kg) imediatamente antes da injeção de TNFa.24 horas depois da injeção de TNFa, os ratos foram separados com uma concentração crescente de C02. As bolsas foram lavadas com 2 ml de PBS estéril sem endotoxina frio como gelo contendo 5 IU/ml de heparina. Os volumes foram registrados e alíquotas de 0,5 ml foram separadas para contar a população total de glóbulos brancos (WBC) em um contador de células Sysmex XT-Vet. A média e o erro padrão das contagens WBC totais médias (SEM) para cada grupo foram calculados por ml de fluido de lavagem retirado. A análise estatística foi por ANOVA com o pós-teste de Kruskal-Wallis em dados não transformados.
Tanto ALX0071 como Etanercept atenuaram a infiltração de WBC induzida por TNFa nas bolsas de ar (Tabela). Enquanto esta atenuação conseguiu significação estatística em ambos os grupos de doses 0,125 (P <0,01) e 0,25 mgs/kg (P <0,05) ALX0071, a significação estatística não foi observada com nenhum grupo de dose de Etanercept.Tabela 8
Tabela 9Tabela 10Tabela 11Tabela 12Tabela 13Tabela 14Tabela 15Tabela 16
Tabela 17Tabela 18
Tabela 19
Tabela 20Tabela 21Tabela 22Tabela 23
Tabela 24
Tabela 25
Tabela 26Tabela 27
Tabela 28Tabela 29
Tabela 30Tabela 31Tabela 32Tabela 33 Tabela 34Tabela 35Tabela 36Tabela 37Tabela 38Tabela 39ensaio: alphaKYM (10000c/w)TNF: humano TNFa @ Ing/ml Tabela 40Tabela 41Tabela 42Tabela 43Tabela 44
Tabela 45
Tabela 46Tabela 47
Os experimentados na técnica reconhecerão, ou serão capazes de apurar, utilizando não mais do que experimentação de rotina, muitos equivalentes às modalidades de execução específicas da invenção descrita na presente. Tais 15 equivalentes são destinados para ser abrangido pelas reivindicações seguintes.
Todas as referências reveladas na presente são incorporadas por referência no seu conjunto.
Claims (58)
1. Nanocorpo contra TNF-alfa que compreende quatroregiões framework (FR1 a FR4) e três regiões que determinam a complementariedade (CDR1 a CDR3), CARACTERIZADO pelo fato de que:i) CDR1 compreende a sequência de aminoácido SEQ ID NO: 15;ii) CDR2 compreende a sequência de aminoácido SEQ ID NO: 22; eiii) CDR3 compreende a sequência de aminoácido SEQ ID NO: 34.
2. Nanocorpo, de acordo com reivindicação 1, CARACTERIZADO pelo fato de que CDR1 é a sequência de aminoácido SEQ ID NO: 15.
3. Nanocorpo, de acordo com reivindicação 1, CARACTERIZADO pelo fato de que CDR2 é a sequência de aminoácido SEQ ID NO: 22.
4. Nanocorpo, de acordo com reivindicação 1, CARACTERIZADO pelo fato de que CDR3 é a sequência de aminoácido SEQ ID NO:34.
5. Nanocorpo, de acordo com reivindicação 1, CARACTERIZADO pelo fato de que:- CDR1 é a sequência de aminoácido SEQ ID NO: 15; e CDR3 consiste na sequência de aminoácido SEQ ID NO: 34; ou - CDR1 é a sequência de aminoácido SEQ ID NO: 15; e CDR2 consiste na sequência de aminoácido SEQ ID NO: 22; ou- CDR2 é a sequência de aminoácido SEQ ID NO: 22; e CDR3 consiste na sequência de aminoácido SEQ ID NO: 34.
6. Nanocorpo, de acordo com reivindicação 1, CARACTERIZADO pelo fato de que CDR1 é a sequência de aminoácido SEQ ID NO:15; e CDR3 é a sequência de aminoácido SEQ ID NO:34.
7. Nanocorpo, de acordo com reivindicação 1, CARACTERIZADO pelo fato de que CDR1 é a sequência de aminoácido SEQ ID NO: 15; CDR2 é a sequência de aminoácido SEQ ID NO: 22; e CDR3 é a sequência de aminoácido SEQ ID NO: 34.
8. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 7, CARACTERIZADO por ser um nanocorpo humanizado.
9. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 8, CARACTERIZADO pelo fato de que é um nanocorpo da classe-GLEW, em que a sequência de aminoácidos nas posições 44-47 de acordo com a numeração de Kabat é selecionada a partir do grupo que consiste em GLEW, GVEW, EPEW, GLER, DQEW, DLEW, GIEW, ELEW, GPEW, EWLP, GPER, GLER.
10. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 9, CARACTERIZADO pelo fato de que contêm um resíduo de arginina (R) na posição 103.
11. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 10, CARACTERIZADO por conter um resíduo de leucina (L) a posição 108.
12. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 11, CARACTERIZADO pelo fato do nanocorpo ser escolhido a partir do grupo que consiste em TNF1 (SEQ ID NO: 52), TNF 13 (SEQ ID NO: 76), TNF 14 (SEQ ID NO: 77), TNF 29 (SEQ ID NO: 95) e TNF 30 (SEQ ID NO:96).
13. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 12, CARACTERIZADO pelo fato de ser TNF 30 (SEQ ID NO: 96).
14. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 13, CARACTERIZADO pelo fato de que é uma variante humanizada de um nanocorpo não humanizado contra TNF- alfa, cujo nanocorpo não humanizado contra TNF-alfa tem as seguintes sequências estruturais: FR1: SEQ ID NO: 130; FR2: SEQ ID NO: 198; FR3: SEQ ID NO: 266; e FR4: SEQ ID NO: 334.
15. Nanocorpo, de acordo com a reivindicação 14, CARACTERIZADO pelo fato de que é dirigido contra o mesmo epítopo de TNF como TNF1 (SEQ ID NO: 52).
16. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 14, CARACTERIZADO pelo fato de o nanocorpo é dirigido contra o mesmo epítopo no trímero de TNF- alfa como Nanocorpo TNF1 (SEQ ID NO: 52).
17. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 14, CARACTERIZADO pelo fato de que o nanocorpo é dirigido contra o mesmo epítopo no trímero de TNF- alfa como Nanocorpo TNF3 (SEQ ID NO: 60).
18. Nanocorpo, de acordo com qualquer uma das reivindicações de 1 a 17, CARACTERIZADO pelo fato de o nanocorpo é uma variante humanizada do nanocorpo TNF1 (SEQ ID NO: 52).
19. Polipeptídeo, CARACTERIZADO por compreender pelo menos um nanocorpo conforme definido em qualquer uma das reivindicações de 1 a 18.
20. Polipeptídeo, de acordo com a reivindicação 19, CARACTERIZADO pelo fato do polipeptídeo essencialmente consistir em um nanocorpo conforme definido em qualquer uma das reivindicações de 1 a 18.
21. Polipeptídeo, de acordo com a reivindicação 19, CARACTERIZADO pelo fato do polipeptídeo compreender dois nanocorpos de acordo com qualquer uma das reivindicações de 1 a 18.
22. Polipeptídeo, de acordo com a reivindicação 21, CARACTERIZADO pelo fato de compreender dois nanocorpos TNF 30 (SEQ ID NO: 96).
23. Polipeptídeo, de acordo com a reivindicação 21 ou 22, CARACTERIZADO pelo fato de que ao ligar a um trímero de TNF, é capaz de inibir ou reduzir a reticulação do receptor de TNF que é mediada através do dito trímero de TNF e/ou a transdução de sinal que é mediada através de tal reticulação do receptor.
24. Polipeptídeo, de acordo com a reivindicação 21 ou22, CARACTERIZADO pelo fato de que o polipetídeo é capaz de ligação intramolecular a pelo menos dois locais de ligação ao receptor de TNF em um trímero de TNF.
25. Polipeptídeo de acordo com qualquer uma das reivindicações de 21 a 24, CARACTERIZADO pelo fato de os dois nanocorpos são ligados diretamente um ao outro.
26. Polipetídeo, de acordo com qualquer uma das reivindicações de 21 a 24, CARACTERIZADO pelo fato de que os dois nanocorpos são ligados um ao outro por um ligante.
27. Polipeptídeo, de acordo com a reivindicação 26, CARACTERIZADO pelo fato de que o ligante é uma sequência de aminoácido.
28. Polipeptídeo, de acordo com a reivindicação 27, CARACTERIZADO pelo fato de que o ligante é uma sequência de aminoácido que compreende pelo menos 14 aminoácidos.
29. Polipeptídeo, de acordo com a reivindicação 27, CARACTERIZADO pelo fato de que o ligante é uma sequência de aminoácidos que compreende pelo menos 17 aminoácidos.
30. Polipeptídeo, de acordo com a reivindicação 27, CARACTERIZADO pelo fato de que o ligante é uma sequência de aminoácidos que compreende 20 a 40 aminoácidos.
31. Polipeptídeo, de acordo com qualquer uma das reivindicações de 28 a 30, CARACTERIZADO pelo fato de que o ligante compreende resíduos de glicina e serina.
32. Polipeptídeo, de acordo com qualquer uma das reivindicações de 21 a 31, CARACTERIZADO pelo fato de compreender o polipeptídeo TNF 7 (SEQ ID NO: 73) em que ambos os nanocorpos TNF 1 foram humanizados.
33. Polipeptídeo, de acordo com qualquer uma das reivindicações de 21 a 32, CARACTERIZADO pelo fato de compreender o polipeptídeo TNF 55 (SEQ ID NO: 419) ou TNF 56 (SEQ ID NO: 420).
34. Polipeptídeo, de acordo com qualquer uma das reivindicações de 19 a 33, CARACTERIZADO pelo fato de que o polipeptídeo é peguilado.
35. Polipeptídeo, de acordo com qualquer uma das reivindicações de 19 a 32, CARACTERIZADO pelo fato de adicionalmente compreender pelo menos um nanocorpo direcionado contra albumina de soro humano.
36. Polipeptídeo, de acordo com a reivindicação 35, CARACTERIZADO pelo fato de que o pelo menos um nanocorpo direcionado contra albumina de soro humano tem as sequências de CDR presentes em ALB 8 (SEQ ID NO: 102).
37. Polipeptídeo, de acordo com reivindicação 21, CARACTERIZADO por compreender dois nanocorpos conforme definidos em qualquer uma das reivindicações de 1 a 18, que compreende adicionalmente pelo menos um nanocorpo direcionado contra albumina de soro humano.
38. Polipeptídeo de acordo com a reivindicação 37, CARACTERIZADO pelo fato de que os dois nanocorpos contra TNF são ligados diretamente ao nanocorpo direcionado contra albumina de soro humano.
39. Polipeptídeo, de acordo com a reivindicação 37, CARACTERIZADO pelo fato de que os dois nanocorpos contra TNF são ligados ao nanocorpo direcionado contra albumina de soro humano por um ligante.
40. Polipeptídeo, de acordo com reivindicação 39, CARACTERIZADO pelo fato de que o ligante é uma sequência de aminoácido.
41. Polipeptídeo, de acordo com a reivindicação 39 ou 40, CARACTERIZADO pelo fato de que o ligante é uma sequência de aminoácido que compreende de 3 a 40 aminoácidos.
42. Polipeptídeo, de acordo com a reivindicação 39 ou 40, CARACTERIZADO pelo fato de que o ligante é uma sequência de aminoácidos que compreende de 5 a 15 aminoácidos.
43. Polipeptídeo, de acordo com a reivindicação 39 ou 40, CARACTERIZADO pelo fato de que o ligante compreende resíduos de glicina e serina.
44. Polipeptídeo, de acordo com qualquer uma das reivindicações de 37 a 43, CARACTERIZADO pelo fato de que o pelo menos um nanocorpo direcionado contra albumina de soro humano tem as sequências de CDR presentes em ALB 8 (SEQ ID NO: 102).
45. Polipeptídeo, de acordo com qualquer uma das reivindicações de 37 a 44, CARACTERIZADO pelo fato de que o pelo menos um nanocorpo direcionado contra albumina de soro humano é um nanocorpo humanizado.
46. Polipeptídeo, de acordo com a reivindicação 45, CARACTERIZADO pelo fato de que o pelo menos um nanocorpo direcionado contra albumina de soro humano é uma variante humanizada do nanocorpo ALB 1 (SEQ ID NO: 63).
47. Polipeptídeo, de acordo com reivindicação 45, CARACTERIZADO pelo fato de que o pelo menos um nanocorpo direcionado contra albumina de soro humano é escolhido do grupo que consiste em ALB 3 (SEQ ID NO: 87), ALB 4 (SEQ ID NO: 88), ALB 5 (SEQ ID NO: 89), ALB 6 (SEQ ID NO: 100), ALB 7 (SEQ ID NO: 101), ALB 8 (SEQ ID NO: 102), ALB 9 (SEQ ID NO: 103) e ALB 10 (SEQ ID NO: 104).
48. Polipeptídeo, de acordo com a reivindicação 47, CARACTERIZADO pelo fato de que o pelo menos um nanocorpo direcionado contra albumina de soro humano é ALB 8 (SEQ ID NO: 102).
49. Polipeptídeo, de acordo com qualquer uma das reivindicações de 37 a 47, CARACTERIZADO pelo fato de que compreende dois nanocorpos que são variantes humanizados de um nanocorpo de acordo com qualquer uma das reivindicações de 1 a 18, e uma variante humanizada do nanocorpo ALB 1 (SEQ ID NO: 63).
50. Polipeptídeo, de acordo com qualquer uma das reivindicações de 37 a 49, CARACTERIZADO pelo fato de que ambos o Nanocorpo TNF 1 (SEQ ID NO: 52) como também o Nanocorpo que ALB 1 (SEQ ID NO: 63) foram humanizados.
51. Polipeptídeo, de acordo com qualquer uma das reivindicações de 37 a 50, CARACTERIZADO pelo fato de que compreende dois Nanocorpos TNF 30 (SEQ ID NO: 96) e um Nanocorpo ALB 8 (SEQ ID NO: 102).
52. Polipeptídeo, de acordo com qualquer uma das reivindicações de 37 a 51, CARACTERIZADO pelo fato de que compreende o polipeptídeo TNF 60 (SEQ ID NO: 417).
53. Polipeptídeo, de acordo com qualquer uma das reivindicações de 37 a 51, CARACTERIZADO pelo fato de que consiste no polipeptídeo TNF 60 (SEQ ID NO: 417).
54. Método para preparar um nanocorpo, CARACTERIZADO por compreender cultivar ou manter uma célula hospedeira sob tais condições que dita célula hospedeira produza um nanocorpo conforme definido em qualquer uma das reivindicações de 1 a 18; ou sob tais condições que dita célula hospedeira produza um polipeptídeo conforme definido em qualquer uma das reivindicações de 19 a 53.
55. Método, de acordo com a reivindicação 54, CARACTERIZADO por compreender adicionalmente isolar o nanocorpo de acordo com qualquer uma das reivindicações de 1 a 18.
56. Método, de acordo com a reivindicação 54, CARACTERIZADO por compreender adicionalmente isolar o polipeptídeo de acordo com qualquer uma das reivindicações de 19 a 53.
57. Composição farmacêutica, CARACTERIZADA por compreender: (a) pelo menos um nanocorpo conforme definido emqualquer uma das reivindicações de 1 a 18, e opcionalmente pelo menos um carreador farmaceuticamente aceitável; ou (b)pelo menos um polipeptídeo conforme definido em qualquer umadas reivindicações de 19 a 53, e opcionalmente pelo menos um carreador farmaceuticamente aceitável.
58. Uso de (a) um nanocorpo conforme definido em qualquer uma das reivindicações de 1 a 18, ou (b) um polipeptídeo conforme definido em qualquer uma das reivindicações de 19 a 53, CARACTERIZADO pelo fato de ser aplicado na preparação de um medicamento para o tratamento de pelo menos uma doença selecionada a partir de inflamação, artrite reumatoide, DPOC, asma, doença de Crohn, colite ulcerativa, síndrome de intestino inflamatório, esclerose múltipla, doença de Addison, hepatite autoimmune, parotidite autoimmune, diabetes tipo 1, epididimite, glomerulonefrite, doença de Graves, síndrome de Guillain-Barre, doença de Hashimoto, anemia hemolítica, lúpus eritematoso sistêmico, infertilidade masculina, esclerose múltipla, Miasthenia Gravis, pênfigo, psoríase, febre reumática, artrite reumatoide, sarcoidose, esclerodermia, síndrome de Sjogren, espondiloartropatias, tireoidite, e vasculite.
Priority Applications (1)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| BR122013001996-0A BR122013001996B1 (pt) | 2005-05-18 | 2006-05-17 | Nanocorpos melhorados contra fator alfa de necrose tumoral |
Applications Claiming Priority (3)
| Application Number | Priority Date | Filing Date | Title |
|---|---|---|---|
| US68233205P | 2005-05-18 | 2005-05-18 | |
| US60/682,332 | 2005-05-18 | ||
| PCT/EP2006/004678 WO2006122786A2 (en) | 2005-05-18 | 2006-05-17 | Improved nanobodies™ against tumor necrosis factor-alpha |
Publications (2)
| Publication Number | Publication Date |
|---|---|
| BRPI0609224A2 BRPI0609224A2 (pt) | 2011-10-18 |
| BRPI0609224B1 true BRPI0609224B1 (pt) | 2021-08-17 |
Family
ID=36954329
Family Applications (2)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR122013001996-0A BR122013001996B1 (pt) | 2005-05-18 | 2006-05-17 | Nanocorpos melhorados contra fator alfa de necrose tumoral |
| BRPI0609224-1A BRPI0609224B1 (pt) | 2005-05-18 | 2006-05-17 | Nanocorpos melhorados contra fator alfa de necrose tumoral |
Family Applications Before (1)
| Application Number | Title | Priority Date | Filing Date |
|---|---|---|---|
| BR122013001996-0A BR122013001996B1 (pt) | 2005-05-18 | 2006-05-17 | Nanocorpos melhorados contra fator alfa de necrose tumoral |
Country Status (30)
| Country | Link |
|---|---|
| US (6) | US8188223B2 (pt) |
| EP (7) | EP1888641B1 (pt) |
| JP (4) | JP5047950B2 (pt) |
| KR (1) | KR101308771B1 (pt) |
| CN (2) | CN101248087B (pt) |
| AT (2) | ATE549357T1 (pt) |
| AU (1) | AU2006249144B2 (pt) |
| BR (2) | BR122013001996B1 (pt) |
| CA (2) | CA2608770C (pt) |
| CR (1) | CR9519A (pt) |
| CY (1) | CY1122672T1 (pt) |
| DK (3) | DK1888641T3 (pt) |
| EC (1) | ECSP077910A (pt) |
| ES (3) | ES2384164T3 (pt) |
| HK (2) | HK1113685A1 (pt) |
| HU (1) | HUE045710T2 (pt) |
| IL (3) | IL186941A (pt) |
| LT (1) | LT2949668T (pt) |
| MX (3) | MX342271B (pt) |
| NI (1) | NI200700291A (pt) |
| NO (2) | NO338568B1 (pt) |
| NZ (1) | NZ562695A (pt) |
| PL (3) | PL1888641T3 (pt) |
| PT (2) | PT1888641E (pt) |
| RU (2) | RU2464276C2 (pt) |
| SG (2) | SG184709A1 (pt) |
| SI (3) | SI1888640T1 (pt) |
| TW (2) | TWI395755B (pt) |
| WO (2) | WO2006122786A2 (pt) |
| ZA (3) | ZA200709867B (pt) |
Families Citing this family (298)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| JP2005289809A (ja) * | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| US9321832B2 (en) * | 2002-06-28 | 2016-04-26 | Domantis Limited | Ligand |
| US9453251B2 (en) | 2002-10-08 | 2016-09-27 | Pfenex Inc. | Expression of mammalian proteins in Pseudomonas fluorescens |
| US9320792B2 (en) | 2002-11-08 | 2016-04-26 | Ablynx N.V. | Pulmonary administration of immunoglobulin single variable domains and constructs thereof |
| NZ540195A (en) | 2002-11-08 | 2009-01-31 | Ablynx Nv | Stabilized single domain antibodies |
| US20060034845A1 (en) | 2002-11-08 | 2006-02-16 | Karen Silence | Single domain antibodies directed against tumor necrosis factor alpha and uses therefor |
| AU2005269527B2 (en) | 2004-07-26 | 2011-12-01 | Pfenex Inc. | Process for improved protein expression by strain engineering |
| SG184709A1 (en) | 2005-05-18 | 2012-10-30 | Ablynx Nv | Improved nanobodies™ against tumor necrosis factor-alpha |
| DE102005023617A1 (de) * | 2005-05-21 | 2006-11-23 | Aspre Ag | Verfahren zum Mischen von Farben in einem Display |
| US20070269422A1 (en) * | 2006-05-17 | 2007-11-22 | Ablynx N.V. | Serum albumin binding proteins with long half-lives |
| EP2069402A2 (en) * | 2006-09-08 | 2009-06-17 | Ablynx N.V. | Serum albumin binding proteins with long half-lives |
| JP2010505435A (ja) * | 2006-10-11 | 2010-02-25 | アブリンクス エン.ヴェー. | 本質的にpHに非依存的に血清タンパク質に結合するアミノ酸配列、それを含む化合物、およびその使用 |
| CA2672386A1 (en) * | 2006-12-13 | 2008-06-19 | Ablynx N.V. | Polypeptides specific for complexes involved in receptor-mediated signaling, such as the il-6/il-6 receptor complex |
| EP2102241A2 (en) * | 2006-12-15 | 2009-09-23 | Ablynx N.V. | Amino acid sequences that modulate the interaction between cells of the immune system |
| CA2672965C (en) | 2006-12-19 | 2018-02-06 | Ablynx N.V. | Amino acid sequences directed against a metalloproteinase from the adam family and polypeptides comprising the same for the treatment of adam-related diseases and disorders |
| WO2008074839A2 (en) | 2006-12-19 | 2008-06-26 | Ablynx N.V. | Amino acid sequences directed against gpcrs and polypeptides comprising the same for the treatment of gpcr-related diseases and disorders |
| US9512236B2 (en) | 2006-12-19 | 2016-12-06 | Ablynx N.V. | Amino acid sequences directed against GPCRS and polypeptides comprising the same for the treatment of GPCR-related diseases and disorders |
| EP2101801A1 (en) * | 2006-12-20 | 2009-09-23 | Ablynx N.V. | Oral delivery of polypeptides |
| CA2678218A1 (en) * | 2007-02-21 | 2008-08-28 | Ablynx N.V. | Amino acid sequences directed against vascular endothelial growth factor and polypeptides comprising the same for the treatment of conditions and diseases characterized by excessive and/or pathological angiogenesis or neovascularization |
| US9580719B2 (en) | 2007-04-27 | 2017-02-28 | Pfenex, Inc. | Method for rapidly screening microbial hosts to identify certain strains with improved yield and/or quality in the expression of heterologous proteins |
| CA2964910C (en) | 2007-04-27 | 2018-01-09 | Pfenex Inc. | Method for rapidly screening microbial hosts to identify certain strains with improved yield and/or quality in the expression of heterologous proteins |
| KR101264473B1 (ko) | 2007-05-24 | 2013-05-29 | 아블린쓰 엔.브이. | Rank-l에 대한 아미노산 서열, 및 이를 포함하는 골 질환 및 장애 치료용 폴리펩티드 |
| AU2008270274B2 (en) | 2007-07-03 | 2012-06-28 | Ablynx N.V. | Providing improved immunoglobulin sequences by mutating CDR and/or FR positions |
| CA2700714C (en) | 2007-09-26 | 2018-09-11 | Ucb Pharma S.A. | Dual specificity antibody fusions |
| WO2009068625A2 (en) | 2007-11-27 | 2009-06-04 | Ablynx N.V. | Amino acid sequences directed against her2 and polypeptides comprising the same for the treatment of cancers and/or tumors |
| AU2009221106A1 (en) * | 2008-03-05 | 2009-09-11 | Ablynx Nv | Novel antigen binding dimer-complexes, methods of making and uses thereof |
| GB0809069D0 (en) | 2008-05-19 | 2008-06-25 | Univ Leuven Kath | Gene signatures |
| AU2009235467A1 (en) | 2008-04-07 | 2009-10-15 | Ablynx Nv | Single variable domains against the Notch pathways |
| CN102089325A (zh) * | 2008-04-17 | 2011-06-08 | 埃博灵克斯股份有限公司 | 能够结合血清白蛋白的肽,以及包含其的化合物、构建体和多肽 |
| US8444976B2 (en) | 2008-07-02 | 2013-05-21 | Argen-X B.V. | Antigen binding polypeptides |
| DK2334705T3 (en) | 2008-09-26 | 2017-03-27 | Ucb Biopharma Sprl | BIOLOGICAL PRODUCTS |
| AU2013202856B2 (en) * | 2008-10-29 | 2016-02-11 | Ablynx N.V. | Formulations of single domain antigen binding molecules |
| CN105646643A (zh) | 2008-10-29 | 2016-06-08 | 阿布林克斯公司 | 单域抗原结合性分子的纯化方法 |
| AU2009333791B2 (en) | 2008-10-29 | 2013-04-04 | Ablynx N.V. | Formulations of single domain antigen binding molecules |
| EP2403873A1 (en) | 2009-03-05 | 2012-01-11 | Ablynx N.V. | Novel antigen binding dimer-complexes, methods of making/avoiding and uses thereof |
| US9265834B2 (en) * | 2009-03-05 | 2016-02-23 | Ablynx N.V. | Stable formulations of polypeptides and uses thereof |
| AU2010233658B2 (en) | 2009-04-10 | 2013-11-28 | Ablynx Nv | Improved amino acid sequences directed against IL-6R and polypeptides comprising the same for the treatment of IL-6R related diseases and disorders |
| DK2424889T3 (en) | 2009-04-30 | 2015-11-02 | Ablynx Nv | Process for the preparation of domain antibodies |
| MX340541B (es) | 2009-06-05 | 2016-07-13 | Alblynx Nv | Secuencias de aminoacidos mejoradas dirigidas contra virus sincitial respiratorio humano y polipeptidos que comprenden las mismas para la prevencion y/o tratamiento de infecciones del tracto respiratorio. |
| WO2011003622A1 (en) | 2009-07-10 | 2011-01-13 | Ablynx N.V. | Method for the production of variable domains |
| PL2473528T3 (pl) | 2009-09-03 | 2015-05-29 | Ablynx Nv | Stabilne formulacje polipeptydów i ich zastosowanie |
| GB201005063D0 (en) | 2010-03-25 | 2010-05-12 | Ucb Pharma Sa | Biological products |
| US20110195494A1 (en) | 2009-10-02 | 2011-08-11 | Boehringer Ingelheim International Gmbh | Dll4-binging molecules |
| US20110172398A1 (en) | 2009-10-02 | 2011-07-14 | Boehringer Ingelheim International Gmbh | Bispecific binding molecules for anti-angiogenesis therapy |
| WO2011064382A1 (en) | 2009-11-30 | 2011-06-03 | Ablynx N.V. | Improved amino acid sequences directed against human respiratory syncytial virus (hrsv) and polypeptides comprising the same for the prevention and/or treatment of respiratory tract infections |
| WO2011073180A1 (en) | 2009-12-14 | 2011-06-23 | Ablynx N.V. | Single variable domain antibodies against ox40l, constructs and therapeutic use |
| WO2011083141A2 (en) | 2010-01-08 | 2011-07-14 | Ablynx Nv | Method for generation of immunoglobulin sequences by using lipoprotein particles |
| JP2013518853A (ja) | 2010-02-05 | 2013-05-23 | アブリンクス エン.ヴェー. | 血清アルブミンと結合することが可能なペプチド並びにこれを含む化合物、構築物及びポリペプチド |
| US9120855B2 (en) | 2010-02-10 | 2015-09-01 | Novartis Ag | Biologic compounds directed against death receptor 5 |
| WO2011098518A2 (en) | 2010-02-11 | 2011-08-18 | Ablynx Nv | Delivery of immunoglobulin variable domains and constructs thereof |
| PL3501499T3 (pl) | 2010-02-11 | 2023-01-09 | Ablynx Nv | Sposoby i kompozycje do wytwarzania aerozoli |
| PE20130527A1 (es) | 2010-03-03 | 2013-05-09 | Boehringer Ingelheim Int | Polipeptidos de union a a-beta biparatopicos |
| US8937164B2 (en) | 2010-03-26 | 2015-01-20 | Ablynx N.V. | Biological materials related to CXCR7 |
| US9556273B2 (en) | 2010-03-29 | 2017-01-31 | Vib Vzw | Anti-macrophage mannose receptor single variable domains for targeting and in vivo imaging of tumor-associated macrophages |
| US9101674B2 (en) | 2010-03-29 | 2015-08-11 | Vib Vzw | Targeting and in vivo imaging of tumor-associated macrophages |
| KR20130080790A (ko) | 2010-05-20 | 2013-07-15 | 아블린쓰 엔.브이. | Her3와 관련된 생물학적 물질들 |
| WO2011161263A1 (en) | 2010-06-25 | 2011-12-29 | Ablynx Nv | Pharmaceutical compositions for cutaneous administration |
| WO2012007880A2 (en) | 2010-07-16 | 2012-01-19 | Ablynx Nv | Modified single domain antigen binding molecules and uses thereof |
| US20120225081A1 (en) | 2010-09-03 | 2012-09-06 | Boehringer Ingelheim International Gmbh | Vegf-binding molecules |
| EP2621953B1 (en) | 2010-09-30 | 2017-04-05 | Ablynx N.V. | Biological materials related to c-met |
| US11644471B2 (en) | 2010-09-30 | 2023-05-09 | Ablynx N.V. | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobulin single variable domains |
| EP3279214B1 (en) | 2010-10-29 | 2024-10-09 | Ablynx NV | Method for the production of immunoglobulin single variable domains |
| KR101650995B1 (ko) * | 2010-11-08 | 2016-08-25 | 노파르티스 아게 | Cxcr2 결합 폴리펩티드 |
| ES2758352T3 (es) | 2010-11-26 | 2020-05-05 | Molecular Partners Ag | Proteínas de repetición diseñadas que se une a la seroalbúmina |
| PT2691415T (pt) | 2011-03-28 | 2018-10-19 | Ablynx Nv | Método para produção de formulações sólidas compreendendo domínios variáveis únicos de imunoglobulina |
| CN103917560B (zh) | 2011-03-28 | 2017-05-24 | 埃博灵克斯股份有限公司 | 双特异性抗‑cxcr7免疫球蛋白单可变结构域 |
| CN103547592A (zh) * | 2011-03-30 | 2014-01-29 | 埃博灵克斯股份有限公司 | 使用针对TNFα的单结构域抗体治疗免疫病症的方法 |
| US20130078247A1 (en) | 2011-04-01 | 2013-03-28 | Boehringer Ingelheim International Gmbh | Bispecific binding molecules binding to dii4 and ang2 |
| US9527925B2 (en) * | 2011-04-01 | 2016-12-27 | Boehringer Ingelheim International Gmbh | Bispecific binding molecules binding to VEGF and ANG2 |
| UA117218C2 (uk) | 2011-05-05 | 2018-07-10 | Мерк Патент Гмбх | Поліпептид, спрямований проти il-17a, il-17f та/або il17-a/f |
| EP2707382B1 (en) | 2011-05-09 | 2019-07-17 | Ablynx NV | Method for the production of immunoglobulin single variable domains |
| CA2835340A1 (en) | 2011-05-27 | 2012-12-06 | Ablynx Nv | Inhibition of bone resorption with rankl binding peptides |
| EP2723771B1 (en) | 2011-06-23 | 2019-09-11 | Ablynx NV | Serum albumin binding proteins |
| EP4350345A3 (en) | 2011-06-23 | 2024-07-24 | Ablynx N.V. | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobin single variable domains |
| EP2723769B2 (en) † | 2011-06-23 | 2022-06-15 | Ablynx NV | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobulin single variable domains |
| EP2944653A1 (en) | 2011-06-23 | 2015-11-18 | Ablynx N.V. | Techniques for predicting, detecting and reducing aspecific protein interference in assays involving immunoglobin single variable domains |
| IN2014CN00437A (pt) | 2011-06-23 | 2015-04-03 | Ablynx Nv | |
| CA2849409A1 (en) | 2011-09-23 | 2013-03-28 | Technophage, Investigacao E Desenvolvimento Em Biotecnologia, Sa | Anti-tumor necrosis factor-alpha agents and uses thereof |
| CA2849195A1 (en) | 2011-09-23 | 2013-03-28 | Ablynx Nv | Prolonged inhibition of interleukin-6 mediated signaling |
| CN103889451B (zh) | 2011-09-30 | 2016-06-29 | 埃博灵克斯股份有限公司 | 与C-Met相关的生物物质 |
| US9346884B2 (en) | 2011-09-30 | 2016-05-24 | Ablynx N.V. | Biological materials related to c-Met |
| EA028183B1 (ru) | 2012-02-27 | 2017-10-31 | Бёрингер Ингельхайм Интернациональ Гмбх | Cx3cr1-связывающие полипептиды |
| RS58732B1 (sr) | 2012-03-30 | 2019-06-28 | Boehringer Ingelheim Int | Ang2 vezujući molekuli |
| WO2013167883A1 (en) | 2012-05-07 | 2013-11-14 | The University Court Of The University Of Aberdeen | Single domain binding molecule |
| US9328174B2 (en) | 2012-05-09 | 2016-05-03 | Novartis Ag | Chemokine receptor binding polypeptides |
| WO2013172967A1 (en) | 2012-05-17 | 2013-11-21 | Extend Biosciences, Inc | Carriers for improved drug delivery |
| CA2874309C (en) | 2012-05-24 | 2021-06-15 | Vib Vzw | Anti-macrophage mannose receptor single variable domains for targeting and in vivo imaging of tumor-associated macrophages |
| RU2530553C2 (ru) * | 2012-11-07 | 2014-10-10 | Федеральное государственное бюджетное образовательное учреждение высшего профессионального образования "Московский государственный университет имени М.В. Ломоносова" (МГУ) | Рекомбинантное однодоменное антитело, способное специфически связывать фактор некроза опухолей человека, и его производные |
| US9315280B2 (en) * | 2012-11-20 | 2016-04-19 | Lockheed Martin Corporation | Heat pipe with axial wick |
| WO2014087010A1 (en) | 2012-12-07 | 2014-06-12 | Ablynx N.V. | IMPROVED POLYPEPTIDES DIRECTED AGAINST IgE |
| WO2017004144A1 (en) | 2015-07-01 | 2017-01-05 | Immunomedics, Inc. | Antibody-sn-38 immunoconjugates with a cl2a linker |
| CA2894225A1 (fr) | 2012-12-17 | 2014-06-26 | Laboratoire Francais Du Fractionnement Et Des Biotechnologies | Utilisation d'anticorps monoclonaux pour le traitement de l'inflammation et d'infections bacteriennes |
| WO2014111550A1 (en) | 2013-01-17 | 2014-07-24 | Glaxosmithkline Intellectual Property Development Limited | Modified anti-serum albumin binding proteins |
| WO2014118297A1 (en) | 2013-01-30 | 2014-08-07 | Vib Vzw | Novel chimeric polypeptides for screening and drug discovery purposes |
| JP2016512954A (ja) | 2013-02-05 | 2016-05-12 | フエー・イー・ベー・フエー・ゼツト・ウエー | ムスカリン性アセチルコリン受容体の結合剤およびそれらの使用 |
| KR20150145225A (ko) | 2013-02-13 | 2015-12-29 | 라보라토이레 프란카이즈 듀 프락티온네먼트 에트 데스 바이오테크놀로지스 | 변경된 글리코실화를 갖는 세툭시맙 및 이의 용도 |
| CN105308068A (zh) | 2013-02-13 | 2016-02-03 | 法国化学与生物科技实验室 | 高度半乳糖基化的抗TNF-α抗体及其用途 |
| AU2014217564B2 (en) | 2013-02-13 | 2018-11-08 | Laboratoire Francais Du Fractionnement Et Des Biotechnologies | Highly galactosylated anti-HER2 antibodies and uses thereof |
| USRE48805E1 (en) | 2013-03-06 | 2021-11-02 | Vision Global Holdings Ltd. | Method for cancer targeting treatment and detection of arginine using albumin-binding arginine deiminase fusion protein |
| US9255262B2 (en) | 2013-03-06 | 2016-02-09 | Vision Global Holdings Ltd. | Albumin-binding arginine deminase and the use thereof |
| ES2872403T3 (es) | 2013-03-14 | 2021-11-02 | Childrens Medical Center | Péptido Psap para el tratamiento de cánceres que expresan CD36 |
| WO2014140376A1 (en) | 2013-03-15 | 2014-09-18 | Vib Vzw | Anti-macrophage mannose receptor single variable domains for use in cardiovascular diseases |
| US10202438B2 (en) | 2013-04-23 | 2019-02-12 | The University Court Of The University Of Aberdeen | Synthetic library of specific binding molecules |
| NL1040254C2 (en) | 2013-05-17 | 2014-11-24 | Ablynx Nv | Stable formulations of immunoglobulin single variable domains and uses thereof. |
| CN105874332B (zh) | 2013-10-21 | 2019-11-12 | 戴埃克斯有限公司 | 自身免疫性疾病的诊断和治疗 |
| AU2015217846B2 (en) | 2014-01-30 | 2019-10-10 | The Board Of Trustees Of The Leland Stanford Junior University | Opioid receptor binding agents and uses thereof |
| AU2015238261B2 (en) * | 2014-03-26 | 2020-11-19 | Cell Medica Switzerland Ag | Binding members to TNF alpha |
| US20170045529A1 (en) | 2014-04-24 | 2017-02-16 | Immusant, Inc. | Methods of measuring antigen-specific t cells |
| ES2900852T3 (es) | 2014-05-16 | 2022-03-18 | Ablynx Nv | Métodos de detección y/o medición de anticuerpos anti-fármaco, en particular anticuerpos anti-fármaco que se presentan durante el tratamiento |
| SI3248986T1 (sl) | 2014-05-16 | 2022-04-29 | Ablynx Nv | Variabilne domene imunoglobulina |
| US20170088896A1 (en) | 2014-05-16 | 2017-03-30 | Children's Hospital Medical Center d/b/a Cincinnati Children's Hospital, Medical Center | Methods for assessing responsiveness to asthma treatment based on vnn-1 expression and promoter methylation |
| NL2013661B1 (en) | 2014-10-21 | 2016-10-05 | Ablynx Nv | KV1.3 Binding immunoglobulins. |
| WO2016012363A1 (en) | 2014-07-22 | 2016-01-28 | Vib Vzw | Methods to select for agents that stabilize protein complexes |
| AU2015328370B2 (en) | 2014-10-07 | 2021-08-05 | Immunomedics, Inc. | Neoadjuvant use of antibody-drug conjugates |
| WO2016061509A1 (en) | 2014-10-17 | 2016-04-21 | The Broad Institute, Inc. | Compositions and methods of treatng muscular dystrophy |
| US9789197B2 (en) | 2014-10-22 | 2017-10-17 | Extend Biosciences, Inc. | RNAi vitamin D conjugates |
| JP6946182B2 (ja) | 2014-10-22 | 2021-10-06 | エクステンド バイオサイエンシズ インコーポレーテッドExtend Biosciences, Inc | 治療用ビタミンdコンジュゲート |
| US9616109B2 (en) | 2014-10-22 | 2017-04-11 | Extend Biosciences, Inc. | Insulin vitamin D conjugates |
| KR101831123B1 (ko) | 2014-10-23 | 2018-02-22 | 싱 바이오테크놀로지, 엘엘씨 | 세포내 항원에 대해 지향된 단일 도메인 항체 |
| US20170267784A1 (en) | 2014-10-23 | 2017-09-21 | Singh Molecular Medicine, Llc | Single domain antibodies directed against intracellular antigens |
| US11897921B2 (en) | 2014-12-09 | 2024-02-13 | New York University | Propeptide fusion comprising a mutated clostridium botulinum neurotoxin and a VHH domain |
| PL3233910T3 (pl) | 2014-12-19 | 2020-06-01 | Ablynx N.V. | Dimery nanociał połączone cysteiną |
| ES2913200T3 (es) * | 2015-03-31 | 2022-06-01 | Sorriso Pharmaceuticals Inc | Polipéptidos |
| MX2017012485A (es) | 2015-04-02 | 2018-04-11 | Molecular Partners Ag | Dominios dise?ados con repeticiones de anquirina con especificidad de union para la seroalbumina. |
| CA2981543A1 (en) | 2015-04-22 | 2016-10-27 | Immunomedics, Inc. | Isolation, detection, diagnosis and/or characterization of circulating trop-2-positive cancer cells |
| JP7163028B2 (ja) | 2015-05-13 | 2022-10-31 | アブリンクス エン.ヴェー. | Cd3反応性に基づくt細胞リクルートポリペプチド |
| SI3294768T1 (sl) | 2015-05-13 | 2019-11-29 | Ablynx Nv | Polipeptidi, ki rekrutirajo celice T, na osnovi reaktivnosti TCR alfa/beta |
| IL274151B (en) | 2015-05-21 | 2022-07-01 | Harpoon Therapeutics Inc | Trispecific binding proteins and methods of use |
| GB201510758D0 (en) | 2015-06-18 | 2015-08-05 | Ucb Biopharma Sprl | Novel TNFa structure for use in therapy |
| EP3313519B1 (en) | 2015-06-29 | 2023-05-31 | Children's Medical Center Corporation | Jak-stat inhibitors for the treatment of congenital myopathies |
| US10746739B2 (en) | 2015-09-14 | 2020-08-18 | Leukemia Therapeutics, LLC | Identification of novel diagnostics and therapeutics by modulating RhoH |
| TWI746473B (zh) | 2015-11-02 | 2021-11-21 | 美商辛分子醫藥有限公司 | 針對細胞內抗原之單域抗體 |
| NO2768984T3 (pt) * | 2015-11-12 | 2018-06-09 | ||
| SI3374392T1 (sl) | 2015-11-13 | 2022-04-29 | Ablynx Nv | Izboljšane variabilne domene imunoglobulina, ki vežejo serumski albumin |
| WO2017083511A1 (en) | 2015-11-13 | 2017-05-18 | The United States Of America, As Represented By The Secretary, Department Of Health And Human Services | Anti-bcma polypeptides and proteins |
| CN109071639B (zh) | 2015-11-18 | 2022-07-08 | 默沙东公司 | Pd1/ctla4结合剂 |
| JP6768800B2 (ja) | 2015-11-18 | 2020-10-14 | メルク・シャープ・アンド・ドーム・コーポレーションMerck Sharp & Dohme Corp. | Ctla4結合性物質 |
| UA121914C2 (uk) | 2015-11-18 | 2020-08-10 | Мерк Шарп І Доум Корп. | Молекула, що зв'язує pd1 і lag3 |
| AU2016357460B2 (en) * | 2015-11-18 | 2023-07-27 | Ablynx Nv | Improved serum albumin binders |
| EP3932945A1 (en) | 2015-11-27 | 2022-01-05 | Ablynx NV | Polypeptides inhibiting cd40l |
| EP3383425B1 (en) | 2015-12-04 | 2020-07-15 | Boehringer Ingelheim International GmbH | Biparatopic polypeptides antagonizing wnt signaling in tumor cells |
| GB201522394D0 (en) * | 2015-12-18 | 2016-02-03 | Ucb Biopharma Sprl | Antibodies |
| US10465003B2 (en) * | 2016-02-05 | 2019-11-05 | Janssen Biotech, Inc. | Anti-TNF antibodies, compositions, methods and use for the treatment or prevention of type 1 diabetes |
| CN109071627B (zh) | 2016-02-05 | 2023-04-04 | 奥里尼斯生物科学私人有限公司 | Cd8结合剂 |
| EP3426278B1 (en) | 2016-03-07 | 2024-01-03 | Vib Vzw | Cd20 binding single domain antibodies |
| AU2017259876A1 (en) | 2016-05-02 | 2018-10-25 | Ablynx Nv | Treatment of RSV infection |
| WO2017194782A2 (en) | 2016-05-13 | 2017-11-16 | Orionis Biosciences Nv | Therapeutic targeting of non-cellular structures |
| EA201892693A1 (ru) | 2016-05-20 | 2019-04-30 | Харпун Терапьютикс, Инк. | Белки, содержащие одноцепочечный вариабельный фрагмент, связывающийся с cd3 |
| SG11201810327XA (en) | 2016-05-20 | 2018-12-28 | Harpoon Therapeutics Inc | Single domain serum albumin binding protein |
| US11623958B2 (en) | 2016-05-20 | 2023-04-11 | Harpoon Therapeutics, Inc. | Single chain variable fragment CD3 binding proteins |
| US20190195866A1 (en) | 2016-06-23 | 2019-06-27 | Ablynx N.V. | Improved pharmacokinetic assays for immunoglobulin single variable domains |
| WO2018007442A1 (en) | 2016-07-06 | 2018-01-11 | Ablynx N.V. | Treatment of il-6r related diseases |
| WO2018029182A1 (en) | 2016-08-08 | 2018-02-15 | Ablynx N.V. | Il-6r single variable domain antibodies for treatment of il-6r related diseases |
| EP3512880A1 (en) | 2016-09-15 | 2019-07-24 | Ablynx NV | Immunoglobulin single variable domains directed against macrophage migration inhibitory factor |
| WO2018060453A1 (en) | 2016-09-30 | 2018-04-05 | Vhsquared Limited | Compositions |
| CN117700549A (zh) * | 2016-11-16 | 2024-03-15 | 埃博灵克斯股份有限公司 | 能够结合CD123和TCRα/β的T细胞募集多肽 |
| CN110198955A (zh) | 2016-11-23 | 2019-09-03 | 哈普恩治疗公司 | 前列腺特异性膜抗原结合蛋白质 |
| KR20190087539A (ko) | 2016-11-23 | 2019-07-24 | 하푼 테라퓨틱스, 인크. | Psma 표적화 삼중특이성 단백질 및 사용 방법 |
| WO2018099968A1 (en) | 2016-11-29 | 2018-06-07 | Ablynx N.V. | Treatment of infection by respiratory syncytial virus (rsv) |
| JP7417421B2 (ja) | 2016-12-07 | 2024-01-18 | アブリンクス エン.ヴェー. | 改善された血清アルブミン結合性免疫グロブリン単一可変ドメイン |
| GB201621907D0 (en) | 2016-12-21 | 2017-02-01 | Ucb Biopharma Sprl And Sanofi | Antibody epitope |
| CN107674122A (zh) * | 2016-12-28 | 2018-02-09 | 天津天锐生物科技有限公司 | 一种识别人血清白蛋白的单域抗体 |
| CN110191896B (zh) | 2017-01-17 | 2023-09-29 | 埃博灵克斯股份有限公司 | 改进的血清白蛋白结合物 |
| EP4442708A2 (en) | 2017-01-17 | 2024-10-09 | Ablynx NV | Improved serum albumin binders |
| MX2019009255A (es) | 2017-02-06 | 2019-11-05 | Orionis Biosciences Nv | Proteínas quiméricas dirigidas y sus usos. |
| EP3583125A2 (en) | 2017-02-16 | 2019-12-25 | Sonnet Bio Therapeutics | Albumin binding domain fusion proteins |
| WO2018160754A2 (en) | 2017-02-28 | 2018-09-07 | Harpoon Therapeutics, Inc. | Inducible monovalent antigen binding protein |
| BR112019017853A2 (pt) | 2017-02-28 | 2021-04-27 | Vib Vzw | Meios e métodos para liberação oral de proteína |
| MX2019011702A (es) | 2017-03-31 | 2019-11-01 | Ablynx Nv | Ensayos de inmunogenicidad mejorados. |
| CA3062238A1 (en) | 2017-05-11 | 2018-11-15 | Vib Vzw | Glycosylation of variable immunoglobulin domains |
| BR112019023855B1 (pt) | 2017-05-12 | 2021-11-30 | Harpoon Therapeutics, Inc | Proteínas de ligação à mesotelina |
| CA3063362A1 (en) | 2017-05-12 | 2018-11-15 | Harpoon Therapeutics, Inc. | Msln targeting trispecific proteins and methods of use |
| ES2979194T3 (es) | 2017-05-31 | 2024-09-24 | Boehringer Ingelheim Int | Polipéptidos que antagonizan la señalización WNT en células tumorales |
| WO2018220169A1 (en) | 2017-06-02 | 2018-12-06 | Boehringer Ingelheim International Gmbh | Anti-cancer combination therapy |
| AU2018277343A1 (en) | 2017-06-02 | 2020-01-02 | Ablynx N.V. | Adamts binding immunoglobulins |
| CN110997717A (zh) | 2017-06-02 | 2020-04-10 | 默克专利股份有限公司 | 结合adamts5、mmp13和聚蛋白聚糖的多肽 |
| AU2018278275A1 (en) | 2017-06-02 | 2019-12-19 | Ablynx N.V. | MMP13 binding immunoglobulins |
| CA3065630A1 (en) | 2017-06-02 | 2018-12-06 | Ablynx Nv | Aggrecan binding immunoglobulins |
| GB201710973D0 (en) | 2017-07-07 | 2017-08-23 | Avacta Life Sciences Ltd | Scaffold proteins |
| JP7241731B2 (ja) | 2017-07-19 | 2023-03-17 | フエー・イー・ベー・フエー・ゼツト・ウエー | 血清アルブミン結合剤 |
| CN111465612B (zh) | 2017-10-13 | 2024-08-27 | 哈普恩治疗公司 | B细胞成熟抗原结合蛋白 |
| CA3078969A1 (en) | 2017-10-13 | 2019-04-18 | Harpoon Therapeutics, Inc. | Trispecific proteins and methods of use |
| WO2019086548A1 (en) | 2017-10-31 | 2019-05-09 | Vib Vzw | Novel antigen-binding chimeric proteins and methods and uses thereof |
| US20210070854A1 (en) * | 2017-12-29 | 2021-03-11 | Board Of Regents, The University Of Texas System | Antimicrobial nanobodies |
| JP2021513361A (ja) | 2018-02-05 | 2021-05-27 | オリオニス バイオサイエンシーズ,インコーポレイテッド | 線維芽細胞結合物質およびその使用 |
| WO2019155041A1 (en) | 2018-02-12 | 2019-08-15 | Vib Vzw | Gβγ COMPLEX ANTIBODIES AND USES THEREOF |
| WO2019165105A1 (en) * | 2018-02-26 | 2019-08-29 | The Board Of Trustees Of The Leland Stanford Junior University | Ligands of the urokinase receptor and their use in treating, detecting, and imaging cancer |
| JP2021514649A (ja) | 2018-03-01 | 2021-06-17 | ブレイエ・ユニバージテイト・ブリュッセルVrije Universiteit Brussel | ヒトpd−l1結合免疫グロブリン |
| US12123881B2 (en) | 2018-04-20 | 2024-10-22 | Unm Rainforest Innovations | Rap1-Gtp, Rac1-GTP and FMS-like tyrosine kinase 3 ligand (FLT3-L) as biomarkers for early detection of sepsis |
| CN110613838A (zh) * | 2018-06-19 | 2019-12-27 | 姜石松 | 增强细胞通透性的多肽及其应用 |
| DE102018122275A1 (de) | 2018-09-12 | 2020-03-12 | Osram Opto Semiconductors Gmbh | Lichtemittierendes bauteil und verfahren zum betreiben eines lichtemittierenden bauteils |
| IL297931B1 (en) | 2018-09-25 | 2024-11-01 | Harpoon Therapeutics Inc | DLL3 binding proteins and methods of use |
| EP3636657A1 (en) | 2018-10-08 | 2020-04-15 | Ablynx N.V. | Chromatography-free antibody purification method |
| CN111138537B (zh) * | 2018-11-06 | 2021-07-09 | 瑞阳(苏州)生物科技有限公司 | 一种抗人血清白蛋白抗体片段、制备方法和应用 |
| CN111138536B (zh) * | 2018-11-06 | 2021-07-09 | 瑞阳(苏州)生物科技有限公司 | 抗人血清白蛋白单域抗体的制备及其应用 |
| GB201818460D0 (en) * | 2018-11-13 | 2018-12-26 | Crescendo Biologics Ltd | Single domain antibodies that bind human serum albumin |
| CN112830967B (zh) * | 2019-01-10 | 2022-06-24 | 瑞阳(苏州)生物科技有限公司 | 抗hsa单域抗体及其融合蛋白的亲和层析纯化方法 |
| CN109627334B (zh) * | 2019-01-29 | 2020-07-17 | 康元医疗科技(大连)有限公司 | 一种纳米抗体、以该纳米抗体为配基的吸附剂及其用途 |
| GB201901306D0 (en) | 2019-01-30 | 2019-03-20 | Immunocore Ltd | Multi-domain binding molecules |
| MX2021011854A (es) | 2019-03-29 | 2021-10-22 | Boehringer Ingelheim Int | Tratamiento conjunto antineoplasico. |
| CN113646048A (zh) | 2019-03-29 | 2021-11-12 | 勃林格殷格翰国际有限公司 | 抗癌组合疗法 |
| AU2020266750A1 (en) | 2019-04-29 | 2021-11-25 | Confo Therapeutics N.V. | Screening methods and assays for use with transmembrane proteins, in particular with GPCRS |
| US20220289837A1 (en) | 2019-04-30 | 2022-09-15 | Vib Vzw | Cystic Fibrosis Transmembrane Conductance Regulator Stabilizing Agents |
| WO2020239945A1 (en) | 2019-05-28 | 2020-12-03 | Vib Vzw | Cancer treatment by targeting plexins in the immune compartment |
| EP3976067A1 (en) | 2019-05-28 | 2022-04-06 | Vib Vzw | Cd8+ t-cells lacking plexins and their application in cancer treatment |
| CN114466864A (zh) | 2019-06-21 | 2022-05-10 | 索瑞索制药公司 | 多肽 |
| EP3986931A1 (en) | 2019-06-21 | 2022-04-27 | Sorriso Pharmaceuticals, Inc. | Polypeptides |
| MX2021015762A (es) | 2019-06-21 | 2022-04-18 | Sorriso Pharmaceuticals Inc | Composiciones. |
| CN112409480B (zh) * | 2019-08-20 | 2024-08-27 | 四川科伦博泰生物医药股份有限公司 | 结合血清白蛋白的蛋白及其用途 |
| WO2021039574A1 (ja) * | 2019-08-23 | 2021-03-04 | 株式会社カネカ | O結合型糖鎖修飾が抑制された重鎖抗体 |
| CN110642946A (zh) * | 2019-09-30 | 2020-01-03 | 中国药科大学 | 一种人源化纳米抗体及其制备方法 |
| TW202128775A (zh) | 2019-10-16 | 2021-08-01 | 英商阿法克塔生命科學有限公司 | PD-L1抑制劑-TGFβ抑制劑雙特異性藥物部分 |
| US20220380456A1 (en) | 2019-10-21 | 2022-12-01 | Vib Vzw | Nanodisc-specific antigen-binding chimeric proteins |
| CA3160506A1 (en) | 2019-11-11 | 2021-05-20 | Ibi-Ag Innovative Bio Insecticides Ltd. | Insect control nanobodies and uses thereof |
| US20220411495A1 (en) | 2019-11-27 | 2022-12-29 | Vib Vzw | Positive allosteric modulators of the calcium-sensing receptor |
| CN114981300A (zh) | 2019-12-06 | 2022-08-30 | 艾伯霖克斯公司 | 包含靶向TNFα和IL-23的免疫球蛋白单个可变结构域的多肽 |
| EP4069293A1 (en) | 2019-12-06 | 2022-10-12 | Ablynx N.V. | Polypeptides comprising immunoglobulin single variable domains targeting tnfa and ox40l |
| BR112022010223A2 (pt) | 2019-12-09 | 2022-09-06 | Ablynx Nv | Polipeptídeos compreendendo domínios variáveis únicos de imunoglobulina que direcionam interleucina 13 (il-13) e linfopoietina estromal tímica (tslp) |
| GB201918279D0 (en) | 2019-12-12 | 2020-01-29 | Vib Vzw | Glycosylated single chain immunoglobulin domains |
| CN110988361B (zh) * | 2019-12-13 | 2020-09-18 | 山东民康生物科技有限公司 | 人血清白蛋白去除试剂盒 |
| JP2023506961A (ja) | 2019-12-20 | 2023-02-20 | フエー・イー・ベー・フエー・ゼツト・ウエー | ナノボディー交換クロマトグラフィー |
| CN112300289B (zh) * | 2019-12-30 | 2022-06-10 | 中国药科大学 | RGD4C融合抗TNFα纳米抗体蛋白、制备方法及其应用 |
| WO2021140205A1 (en) | 2020-01-10 | 2021-07-15 | Confo Therapeutics N.V. | Methods for generating antibodies and antibody fragments and libraries comprising same |
| WO2021156490A2 (en) | 2020-02-06 | 2021-08-12 | Vib Vzw | Corona virus binders |
| CA3170833A1 (en) | 2020-02-21 | 2021-08-26 | Harpoon Therapeutics, Inc. | Flt3 binding proteins and methods of use |
| CA3173090A1 (en) | 2020-02-25 | 2021-09-02 | Vib Vzw | Leucine-rich repeat kinase 2 allosteric modulators |
| WO2021178804A1 (en) * | 2020-03-06 | 2021-09-10 | University Of Pittsburgh-Of The Commonwealth System Of Higher Education | Serum albumin binding nanobody compositions and methods for using the same |
| WO2021213435A1 (zh) | 2020-04-22 | 2021-10-28 | 迈威(上海)生物科技股份有限公司 | 一种靶向人程序性死亡配体1(pd-l1)的单可变域抗体及其衍生物 |
| WO2021229104A1 (en) | 2020-05-15 | 2021-11-18 | Université de Liège | Anti-cd38 single-domain antibodies in disease monitoring and treatment |
| GB202101299D0 (en) | 2020-06-09 | 2021-03-17 | Avacta Life Sciences Ltd | Diagnostic polypetides and methods |
| WO2022003156A1 (en) | 2020-07-02 | 2022-01-06 | Oncurious Nv | Ccr8 non-blocking binders |
| CN114106190A (zh) * | 2020-08-31 | 2022-03-01 | 普米斯生物技术(珠海)有限公司 | 一种抗vegf/pd-l1双特异性抗体及其用途 |
| US20230364049A1 (en) | 2020-09-24 | 2023-11-16 | Vib Vzw | Combination of p2y6 inhibitors and immune checkpoint inhibitors |
| WO2022063957A1 (en) | 2020-09-24 | 2022-03-31 | Vib Vzw | Biomarker for anti-tumor therapy |
| CA3195687A1 (en) | 2020-09-25 | 2022-03-31 | Ablynx Nv | Polypeptides comprising immunoglobulin single variable domains targeting il-13 and ox40l |
| EP4237438A1 (en) | 2020-10-27 | 2023-09-06 | Beijing QL Biopharmaceutical Co., Ltd. | Fusion proteins of gdf15 and use thereof |
| WO2022098745A1 (en) | 2020-11-03 | 2022-05-12 | Indi Molecular, Inc. | Compositions, delivery systems, and methods useful in tumor therapy |
| WO2022098743A1 (en) | 2020-11-03 | 2022-05-12 | Indi Molecular, Inc. | Compositions, imaging, and therapeutic methods targeting folate receptor 1 (folr1) |
| EP4255929A2 (en) | 2020-12-02 | 2023-10-11 | Vib Vzw | An ltbr agonist in combination therapy against cancer |
| WO2022117569A1 (en) | 2020-12-02 | 2022-06-09 | Oncurious Nv | A ccr8 antagonist antibody in combination with a lymphotoxin beta receptor agonist antibody in therapy against cancer |
| WO2022129560A1 (en) | 2020-12-18 | 2022-06-23 | Ablynx Nv | Polypeptides comprising immunoglobulin single variable domains targeting glypican-3 and t cell receptor |
| JP2023553694A (ja) | 2020-12-18 | 2023-12-25 | アブリンクス エン.ヴェー. | IL-6およびTNF-αを標的化する免疫グロブリン単一可変ドメインを含むポリペプチド |
| AU2021402090A1 (en) | 2020-12-18 | 2023-08-03 | Ablynx Nv | T cell recruiting polypeptides based on tcr alpha/beta reactivity |
| GB202020502D0 (en) | 2020-12-23 | 2021-02-03 | Vib Vzw | Antibody composistion for treatment of corona virus infection |
| WO2022136647A1 (en) | 2020-12-24 | 2022-06-30 | Oncurious Nv | Human ccr8 binders |
| CA3206125A1 (en) | 2020-12-24 | 2022-06-30 | Vib Vzw | Murine cross-reactive human ccr8 binders |
| US20240052044A1 (en) | 2020-12-24 | 2024-02-15 | Vib Vzw | Non-blocking human ccr8 binders |
| CN117794566A (zh) | 2021-02-05 | 2024-03-29 | Vib研究所 | 沙贝病毒结合剂 |
| JP2024506020A (ja) | 2021-02-05 | 2024-02-08 | ブイアイビー ブイゼットダブリュ | サルベコウイルス結合剤 |
| US20240130999A1 (en) | 2021-02-17 | 2024-04-25 | Vib Vzw | Inhibition of SLC4A4 in the Treatment of Cancer |
| IL305318A (en) | 2021-02-19 | 2023-10-01 | Vib Vzw | Cation-independent mannose-6-phosphate receptor binders |
| WO2022199804A1 (en) | 2021-03-24 | 2022-09-29 | Vib Vzw | Nek6 inhibition to treat als and ftd |
| WO2022234003A1 (en) | 2021-05-07 | 2022-11-10 | Avacta Life Sciences Limited | Cd33 binding polypeptides with stefin a protein |
| WO2022242892A1 (en) | 2021-05-17 | 2022-11-24 | Université de Liège | Anti-cd38 single-domain antibodies in disease monitoring and treatment |
| WO2022268993A1 (en) | 2021-06-23 | 2022-12-29 | Vib Vzw | Means and methods for selection of specific binders |
| US20240343811A1 (en) | 2021-06-29 | 2024-10-17 | Shandong Simcere Biopharmacutical Co., Ltd. | Cd16 antibody and use thereof |
| CN117586423A (zh) * | 2021-07-14 | 2024-02-23 | 北京质肽生物医药科技有限公司 | 用于代谢病症的融合多肽 |
| CN113527502B (zh) * | 2021-07-20 | 2023-01-17 | 福建医科大学 | 一种用于治疗类风湿性关节炎的纳米抗体重组蛋白 |
| US20240343803A1 (en) | 2021-07-30 | 2024-10-17 | Shandong Simcere Biopharmaceutical Co., Ltd. | Anti-Pvrig/Anti-Tigit Bispecific Antibodies And Applications Thereof |
| US20240327525A1 (en) | 2021-07-30 | 2024-10-03 | Vib Vzw | Cation-Independent Mannose-6-Phosphate Receptor Binders For Targeted Protein Degradation |
| EP4412711A1 (en) | 2021-10-07 | 2024-08-14 | Avacta Life Sciences Limited | Serum half-life extended pd-l1 binding polypeptides |
| EP4413038A1 (en) | 2021-10-07 | 2024-08-14 | Avacta Life Sciences Limited | Pd-l1 binding affimers |
| EP4428156A1 (en) | 2021-12-03 | 2024-09-11 | Shandong Simcere Biopharmaceutical Co., Ltd. | Anti-bcma nanobody and use thereof |
| CN113912730B (zh) * | 2021-12-14 | 2022-03-04 | 北京科诺信诚科技有限公司 | 缓释的抗FcRn抗体或抗原结合片段及其应用 |
| EP4448574A1 (en) | 2021-12-17 | 2024-10-23 | Ablynx N.V. | Polypeptides comprising immunoglobulin single variable domains targeting tcralphabeta, cd33 and cd123 |
| CN118510805A (zh) | 2021-12-31 | 2024-08-16 | 山东先声生物制药有限公司 | 一种gprc5d抗体及其应用 |
| WO2023135198A1 (en) | 2022-01-12 | 2023-07-20 | Vib Vzw | Human ntcp binders for therapeutic use and liver-specific targeted delivery |
| WO2023148397A1 (en) | 2022-02-07 | 2023-08-10 | Vib Vzw | Engineered stabilizing aglycosylated fc-regions |
| KR20230121575A (ko) | 2022-02-10 | 2023-08-18 | 주식회사 아피셀테라퓨틱스 | Cd40l에 특이적으로 결합하는 스테핀 a 단백질 변이체 및 이의 용도 |
| CN116925215A (zh) * | 2022-03-31 | 2023-10-24 | 普米斯生物技术(珠海)有限公司 | 抗血清白蛋白纳米抗体及其衍生物 |
| WO2023198848A1 (en) | 2022-04-13 | 2023-10-19 | Vib Vzw | An ltbr agonist in combination therapy against cancer |
| WO2023218243A1 (en) | 2022-05-12 | 2023-11-16 | Avacta Life Sciences Limited | Lag-3/pd-l1 binding fusion proteins |
| WO2023222825A1 (en) | 2022-05-18 | 2023-11-23 | Vib Vzw | Sarbecovirus spike s2 subunit binders |
| CN115028719B (zh) * | 2022-05-27 | 2023-01-13 | 深圳市人民医院 | 血清白蛋白结合纳米抗体及其制备方法与应用 |
| US20240109965A1 (en) | 2022-06-14 | 2024-04-04 | Ablynx N.V. | Immunoglobulin single variable domains targeting t cell receptor |
| WO2024003873A1 (en) * | 2022-06-30 | 2024-01-04 | Intrexon Actobiotics Nv D/B/A Precigen Actobio | Single variable domain antibodies against tumor necrosis factor-alpha |
| WO2024008755A1 (en) | 2022-07-04 | 2024-01-11 | Vib Vzw | Blood-cerebrospinal fluid barrier crossing antibodies |
| WO2024023271A1 (en) | 2022-07-27 | 2024-02-01 | Ablynx Nv | Polypeptides binding to a specific epitope of the neonatal fc receptor |
| WO2024038112A1 (en) | 2022-08-17 | 2024-02-22 | Institut National de la Santé et de la Recherche Médicale | Improved anti-albumin nanobodies and their uses |
| WO2024068744A1 (en) | 2022-09-27 | 2024-04-04 | Vib Vzw | Antivirals against human parainfluenza virus |
| WO2024083843A1 (en) | 2022-10-18 | 2024-04-25 | Confo Therapeutics N.V. | Amino acid sequences directed against the melanocortin 4 receptor and polypeptides comprising the same for the treatment of mc4r-related diseases and disorders |
| WO2024105091A1 (en) | 2022-11-15 | 2024-05-23 | Imec Vzw | Method and system for droplet manipulation |
| US20240200085A1 (en) | 2022-12-15 | 2024-06-20 | Aarhus Universitet | Synthetic activation of multimeric transmembrane receptors |
| WO2024133935A1 (en) | 2022-12-23 | 2024-06-27 | Ablynx Nv | Protein-based conjugation carriers |
| WO2024151515A2 (en) | 2023-01-09 | 2024-07-18 | Odyssey Therapeutics, Inc. | Anti-tnfr2 antigen-binding proteins and uses thereof |
| WO2024153195A1 (en) * | 2023-01-18 | 2024-07-25 | Beijing Ql Biopharmaceutical Co., Ltd. | Liquid pharmaceutical compositions of fusion polypeptides and methods of uses thereof |
| WO2024153768A1 (en) | 2023-01-20 | 2024-07-25 | Boehringer Ingelheim International Gmbh | Il-12 fc fusion proteins |
| WO2024156881A1 (en) | 2023-01-27 | 2024-08-02 | Vib Vzw | CD8b-BINDING POLYPEPTIDES |
| WO2024156888A1 (en) | 2023-01-27 | 2024-08-02 | Vib Vzw | Cd163-binding conjugates |
| US20240368250A1 (en) | 2023-02-17 | 2024-11-07 | Ablynx N.V. | Polypeptides binding to the neonatal fc receptor |
| WO2024175787A1 (en) | 2023-02-24 | 2024-08-29 | Vrije Universiteit Brussel | Anti-inflammatory pannexin 1 channel inhibitors |
| WO2024189171A1 (en) | 2023-03-14 | 2024-09-19 | Aarhus Universitet | Genetically altered nfr5 receptor kinases |
| WO2024192065A1 (en) | 2023-03-14 | 2024-09-19 | Odyssey Therapeutics, Inc. | Anti-cd25 antigen-binding proteins and uses thereof |
| FR3147278A1 (fr) | 2023-03-31 | 2024-10-04 | Avacta Life Sciences Limited | Polypeptides de liaison au tnfr2 et procedes d'utilisation |
| WO2024200987A1 (en) | 2023-03-31 | 2024-10-03 | Avacta Life Sciences Limited | Tnfr2 binding polypeptides and methods of use |
| WO2024208816A1 (en) | 2023-04-03 | 2024-10-10 | Vib Vzw | Blood-brain barrier crossing antibodies |
| US20240358847A1 (en) | 2023-04-24 | 2024-10-31 | Merck Sharp & Dohme Llc | Trop2 binders and conjugates thereof |
| US12134635B1 (en) | 2023-12-29 | 2024-11-05 | Sonnet BioTherapeutics, Inc. | Interleukin 18 (IL-18) variants and fusion proteins comprising same |
Family Cites Families (155)
| Publication number | Priority date | Publication date | Assignee | Title |
|---|---|---|---|---|
| US460167A (en) | 1891-09-29 | Car-mover | ||
| DE321017C (pt) | 1917-05-15 | 1920-05-11 | Aloysius Petrus Van Leuven | |
| SE307996B (pt) | 1965-11-30 | 1969-01-27 | Asea Ab | |
| US4352678A (en) | 1978-10-02 | 1982-10-05 | Lever Brothers Company | Thickened abrasive bleaching compositions |
| US4722896A (en) | 1981-01-26 | 1988-02-02 | The Beth Israel Hospital Association | Method for affinity purification of hybridoma antibodies |
| US4559157A (en) | 1983-04-21 | 1985-12-17 | Creative Products Resource Associates, Ltd. | Cosmetic applicator useful for skin moisturizing |
| LU84979A1 (fr) | 1983-08-30 | 1985-04-24 | Oreal | Composition cosmetique ou pharmaceutique sous forme aqueuse ou anhydre dont la phase grasse contient un polyether oligomere et polyethers oligomeres nouveaux |
| US5672347A (en) | 1984-07-05 | 1997-09-30 | Genentech, Inc. | Tumor necrosis factor antagonists and their use |
| US4735898A (en) | 1985-07-16 | 1988-04-05 | The University Of Virginia Alumini Patents Foundation | Monoclonal antibodies and method of identifying species using the same |
| JPS62175426A (ja) | 1986-01-27 | 1987-08-01 | Kazufumi Shimizu | 抗体及びこれを有効成分とするスプレ−剤 |
| DE3853740T2 (de) | 1987-06-10 | 1995-11-09 | Dana Farber Cancer Inst Inc | Bifunktionelle Antikörperkonstruktionen und Verfahren zur selektiven Tötung von Zellbeständen. |
| US4820508A (en) | 1987-06-23 | 1989-04-11 | Neutrogena Corporation | Skin protective composition |
| US4992478A (en) | 1988-04-04 | 1991-02-12 | Warner-Lambert Company | Antiinflammatory skin moisturizing composition and method of preparing same |
| US4938949A (en) | 1988-09-12 | 1990-07-03 | University Of New York | Treatment of damaged bone marrow and dosage units therefor |
| AU634186B2 (en) | 1988-11-11 | 1993-02-18 | Medical Research Council | Single domain ligands, receptors comprising said ligands, methods for their production, and use of said ligands and receptors |
| US5530101A (en) | 1988-12-28 | 1996-06-25 | Protein Design Labs, Inc. | Humanized immunoglobulins |
| US5703055A (en) | 1989-03-21 | 1997-12-30 | Wisconsin Alumni Research Foundation | Generation of antibodies through lipid mediated DNA delivery |
| US5399346A (en) | 1989-06-14 | 1995-03-21 | The United States Of America As Represented By The Department Of Health And Human Services | Gene therapy |
| SE509359C2 (sv) | 1989-08-01 | 1999-01-18 | Cemu Bioteknik Ab | Användning av stabiliserade protein- eller peptidkonjugat för framställning av ett läkemedel |
| DE69027121T3 (de) | 1989-08-07 | 2001-08-30 | Peptech Ltd., Dee Why | Bindeligande für tumornekrosisfaktor |
| US6451983B2 (en) | 1989-08-07 | 2002-09-17 | Peptech Limited | Tumor necrosis factor antibodies |
| GB8928874D0 (en) | 1989-12-21 | 1990-02-28 | Celltech Ltd | Humanised antibodies |
| US5859205A (en) | 1989-12-21 | 1999-01-12 | Celltech Limited | Humanised antibodies |
| NZ234246A (en) | 1990-03-16 | 1992-06-26 | Flexitech Consulting Services | Form filling powdered material packages using interleaved plastics/paper packaging |
| GB9016299D0 (en) | 1990-07-25 | 1990-09-12 | Brien Caroline J O | Binding substances |
| EP0542810A1 (en) | 1990-08-02 | 1993-05-26 | B.R. Centre Limited | Methods for the production of proteins with a desired function |
| US5656272A (en) | 1991-03-18 | 1997-08-12 | New York University Medical Center | Methods of treating TNF-α-mediated Crohn's disease using chimeric anti-TNF antibodies |
| WO1994004679A1 (en) | 1991-06-14 | 1994-03-03 | Genentech, Inc. | Method for making humanized antibodies |
| DK0590060T3 (da) | 1991-06-21 | 1998-05-11 | Univ Cincinnati | Oralt indgivelige terapeutiske proteiner samt fremgangsmåde til fremstilling |
| WO1993006213A1 (en) | 1991-09-23 | 1993-04-01 | Medical Research Council | Production of chimeric antibodies - a combinatorial approach |
| JP4157160B2 (ja) | 1991-12-13 | 2008-09-24 | ゾーマ テクノロジー リミテッド | 改変抗体可変領域の調製のための方法 |
| US5869619A (en) | 1991-12-13 | 1999-02-09 | Xoma Corporation | Modified antibody variable domains |
| DE69325738T2 (de) | 1992-04-28 | 2000-01-27 | Sumitomo Rubber Industry Ltd., Kobe | Fester Golfball |
| AU687010B2 (en) | 1992-07-17 | 1998-02-19 | Dana-Farber Cancer Institute | Method of intracellular binding of target molecules |
| EP0584421A1 (en) | 1992-08-21 | 1994-03-02 | Cécile Casterman | Immunoglobulins devoid of light chains |
| DE69334258D1 (de) | 1992-08-21 | 2009-02-26 | Univ Bruxelles | Immunoglobuline ohne Leichtkette |
| ES2121907T3 (es) | 1992-08-28 | 1998-12-16 | Bayer Ag | Uso de anticuerpos monoclonales anti-tnf para el tratamiento de meningitis bacterianas. |
| EP0663836B1 (en) | 1992-10-08 | 1997-07-09 | The Kennedy Institute Of Rheumatology | Treatment of autoimmune and inflammatory disorders |
| WO1994013804A1 (en) | 1992-12-04 | 1994-06-23 | Medical Research Council | Multivalent and multispecific binding proteins, their manufacture and use |
| EP0684814B1 (en) | 1993-02-22 | 1998-06-17 | Alza Corporation | Compositions for oral delivery of active agents |
| EP0698097B1 (en) | 1993-04-29 | 2001-08-16 | Unilever N.V. | Production of antibodies or (functionalized) fragments thereof derived from heavy chain immunoglobulins of camelidae |
| US6838254B1 (en) | 1993-04-29 | 2005-01-04 | Conopco, Inc. | Production of antibodies or (functionalized) fragments thereof derived from heavy chain immunoglobulins of camelidae |
| GB9311454D0 (en) | 1993-06-03 | 1993-07-21 | Agricultural & Food Res | Pharmaceutical compositions |
| CA2164088C (en) | 1993-06-07 | 2005-06-14 | Gary J. Nabel | Plasmids suitable for gene therapy |
| ATE198490T1 (de) | 1993-06-09 | 2001-01-15 | Unilever Nv | Verfahren zur herstellung von fusionsproteinen, die scfv fragmente enthalten, in transformierten schimmelpilzen |
| CA2168202A1 (en) | 1993-07-30 | 1995-03-16 | Joseph Dougherty | Efficient gene transfer into primary lymphocytes |
| FR2708622B1 (fr) | 1993-08-02 | 1997-04-18 | Raymond Hamers | Vecteur recombinant contenant une séquence d'un gène de lipoprotéine de structure pour l'expression de séquences de nucléotides. |
| US6091639A (en) | 1993-08-27 | 2000-07-18 | Kabushiki Kaisha Toshiba | Non-volatile semiconductor memory device and data programming method |
| WO1995007463A1 (en) | 1993-09-10 | 1995-03-16 | The Trustees Of Columbia University In The City Of New York | Uses of green fluorescent protein |
| WO1995021191A1 (en) | 1994-02-04 | 1995-08-10 | William Ward | Bioluminescent indicator based upon the expression of a gene for a modified green-fluorescent protein |
| WO1995022618A1 (en) | 1994-02-22 | 1995-08-24 | Dana-Farber Cancer Institute | Nucleic acid delivery system, method of synthesis and uses thereof |
| US5625048A (en) | 1994-11-10 | 1997-04-29 | The Regents Of The University Of California | Modified green fluorescent proteins |
| WO1996022307A1 (en) | 1995-01-19 | 1996-07-25 | The Research Foundation Of State University Of New York | Genes encoding an insect calcium channel |
| EP0739981A1 (en) | 1995-04-25 | 1996-10-30 | Vrije Universiteit Brussel | Variable fragments of immunoglobulins - use for therapeutic or veterinary purposes |
| US5693492A (en) | 1995-05-05 | 1997-12-02 | Merck & Co., Inc. | DNA encoding glutamate gated chloride channels |
| CA2225460A1 (en) | 1995-06-23 | 1997-01-09 | Winston Campbell Patterson | Transcriptional regulation of genes encoding vascular endothelial growth factor receptors |
| WO1997011094A1 (en) | 1995-09-22 | 1997-03-27 | Novo Nordisk A/S | Novel variants of green fluorescent protein, gfp |
| US7368111B2 (en) | 1995-10-06 | 2008-05-06 | Cambridge Antibody Technology Limited | Human antibodies specific for TGFβ2 |
| US6027881A (en) | 1996-05-08 | 2000-02-22 | The United States Of America As Represented By The Secretary Of The Department Of Health And Human Services | Mutant Aequorea victoria fluorescent proteins having increased cellular fluorescence |
| JP2000515002A (ja) | 1996-06-27 | 2000-11-14 | フラームス・インテルウニフェルジテール・インスティテュート・フォール・ビオテヒノロジー・ヴェーゼットウェー | 標的分子の活性部位またはクレフトと特異的に相互作用する認識分子 |
| US6124128A (en) | 1996-08-16 | 2000-09-26 | The Regents Of The University Of California | Long wavelength engineered fluorescent proteins |
| US6417337B1 (en) | 1996-10-31 | 2002-07-09 | The Dow Chemical Company | High affinity humanized anti-CEA monoclonal antibodies |
| WO1998021355A1 (en) | 1996-11-15 | 1998-05-22 | Life Technologies, Inc. | Mutants of green fluorescent protein |
| AU7298398A (en) | 1996-11-19 | 1998-06-10 | Sangstat Medical Corporation | Enhanced effects for hapten conjugated therapeutics |
| US6262238B1 (en) | 1997-01-14 | 2001-07-17 | Roche Diagnostic, Gmbh | Process for modifying the stability of antibodies |
| US6329516B1 (en) | 1997-04-28 | 2001-12-11 | Fmc Corporation | Lepidopteran GABA-gated chloride channels |
| FR2766826B1 (fr) | 1997-08-04 | 2001-05-18 | Pasteur Institut | Vecteurs derives d'anticorps pour le transfert de substances dans les cellules |
| US5895466A (en) | 1997-08-19 | 1999-04-20 | At&T Corp | Automated natural language understanding customer service system |
| GB9722131D0 (en) | 1997-10-20 | 1997-12-17 | Medical Res Council | Method |
| AU2152299A (en) | 1997-10-27 | 1999-05-24 | Unilever Plc | Multivalent antigen-binding proteins |
| AU3596599A (en) | 1998-01-26 | 1999-08-09 | Unilever Plc | Method for producing antibody fragments |
| KR20010034512A (ko) | 1998-02-19 | 2001-04-25 | 베렌슨, 론 | 림프구 활성화 조절을 위한 조성물 및 그 방법 |
| EP0967284A1 (en) | 1998-05-28 | 1999-12-29 | Pfizer Limited | Phosphodiesterases |
| US6872538B1 (en) | 1998-07-06 | 2005-03-29 | Euroscreen S.A. | High-throughput screening diagnostic and/or dosage method of an agonist and/or an antagonist for a calcium-coupled receptor |
| JP2002522780A (ja) | 1998-08-13 | 2002-07-23 | ユー.エス.ゲノミクス | ポリマーの光学的な特性決定 |
| GB9824632D0 (en) | 1998-11-10 | 1999-01-06 | Celltech Therapeutics Ltd | Biological compounds |
| IL127127A0 (en) | 1998-11-18 | 1999-09-22 | Peptor Ltd | Small functional units of antibody heavy chain variable regions |
| WO2000040968A1 (en) | 1999-01-05 | 2000-07-13 | Unilever Plc | Binding of antibody fragments to solid supports |
| AU2291700A (en) | 1999-01-19 | 2000-08-07 | Unilever Plc | Method for producing antibody fragments |
| CA2361678A1 (en) | 1999-02-05 | 2000-08-10 | Rijksuniversiteit Leiden | Method of modulating metabolite biosynthesis in recombinant cells |
| AU784108B2 (en) | 1999-03-15 | 2006-02-02 | University Of British Columbia, The | Methods and reagents for modulating cholesterol levels |
| BR0009866A (pt) | 1999-04-22 | 2002-01-08 | Unilever Nv | Método de inibição de infecção viral, uso de uma proteìna de ligação de antìgeno monovalente, produto alimentìcio, composição farmacêutica ou cosmética, proteìna de ligação de antìgeno monovalente, sequência de nucleotìdeos, vetor de expressão, célula hospedeira, e, métodos de seleção e de indentificação de uma proteìna de ligação de antìgeno |
| AU6424300A (en) | 1999-05-27 | 2000-12-18 | Max-Delbruck-Centrum Fur Molekulare Medizin | Vaccines against conformation-dependent antigens and against antigens that are not or are not only proteins or peptides |
| WO2000078972A2 (en) | 1999-06-18 | 2000-12-28 | Cv Therapeutics, Inc. | Regulation with binding cassette transporter protein abc1 |
| EP1198572A2 (en) | 1999-08-02 | 2002-04-24 | Keygene N.V. | Method for generating cgmmv resistant plants, genetic constructs, and obtained cgmmv-resistant plants |
| GB9922124D0 (en) | 1999-09-17 | 1999-11-17 | Pfizer Ltd | Phosphodiesterase enzymes |
| US6479280B1 (en) | 1999-09-24 | 2002-11-12 | Vlaams Interuniversitair Institutuut Voor Biotechnologie Vzw | Recombinant phages capable of entering host cells via specific interaction with an artificial receptor |
| US6849425B1 (en) | 1999-10-14 | 2005-02-01 | Ixsys, Inc. | Methods of optimizing antibody variable region binding affinity |
| DE19955408A1 (de) | 1999-11-18 | 2001-05-23 | Bayer Ag | GABA-B-Rezeptoren |
| DK1233987T3 (da) | 1999-11-29 | 2009-09-28 | Bac Ip B V | Immobiliserede enkelt-domæne antigenbindende molekyler |
| DK1242460T3 (da) | 1999-11-29 | 2006-12-11 | Unilever Nv | Immobilisering af proteiner ved hjælp af et polypeptidsegment |
| UA76708C2 (uk) * | 1999-12-08 | 2006-09-15 | Сінгента Патисипейшонс Аг | Антитіло, яке застосовується в імунологічному аналізі зразка для визначення неонікотиноїдного інсектициду, білковий кон'югат для одержання антитіла, спосіб визначення концентрації неонікотиноїдного інсектициду в зразку та набір для визначення кількості неонікотиноїдного інсектициду |
| US7608681B2 (en) | 1999-12-24 | 2009-10-27 | Genentech, Inc. | Methods and compositions for prolonging elimination half-times of bioactive compounds |
| US7229619B1 (en) | 2000-11-28 | 2007-06-12 | Medimmune, Inc. | Methods of administering/dosing anti-RSV antibodies for prophylaxis and treatment |
| EP1134231B1 (en) | 2000-03-14 | 2009-04-15 | Unilever N.V. | Antibody heavy chain variable domains against human dietary lipases, and their uses |
| US7097840B2 (en) | 2000-03-16 | 2006-08-29 | Genentech, Inc. | Methods of treatment using anti-ErbB antibody-maytansinoid conjugates |
| US20030190598A1 (en) | 2000-05-26 | 2003-10-09 | Jasmid Tanha | Single-domain antigen-binding antibody fragments derived from llama antibodies |
| US6741957B1 (en) | 2000-07-21 | 2004-05-25 | Daimlerchrysler Corporation | Analytical tire model for vehicle durability and ride comfort analysis |
| CA2394175C (fr) | 2000-10-20 | 2011-01-04 | Firmenich S.A. | Composition parfumante sans alcool |
| WO2002048193A2 (en) | 2000-12-13 | 2002-06-20 | Unilever N.V. | Camelidae antibody arrays |
| US7054297B1 (en) | 2000-12-28 | 2006-05-30 | Cisco Technology, Inc. | Distribution of packets to high data rate communications devices using multicast protocols |
| US7829084B2 (en) | 2001-01-17 | 2010-11-09 | Trubion Pharmaceuticals, Inc. | Binding constructs and methods for use thereof |
| US7211395B2 (en) | 2001-03-09 | 2007-05-01 | Dyax Corp. | Serum albumin binding moieties |
| US20100081792A1 (en) | 2001-06-28 | 2010-04-01 | Smithkline Beecham Corporation | Ligand |
| US20050271663A1 (en) | 2001-06-28 | 2005-12-08 | Domantis Limited | Compositions and methods for treating inflammatory disorders |
| CA2447851C (en) | 2001-06-28 | 2012-08-28 | Domantis Limited | Dual-specific ligand and its use |
| WO2003005053A1 (de) | 2001-07-04 | 2003-01-16 | Siemens Aktiengesellschaft | Verfahren zur intensitätskorrektur eines magnetresonanzbildes |
| EP1425694A2 (en) | 2001-08-03 | 2004-06-09 | Medical Research Council | Method of identifying a consensus sequence for intracellular antibodies |
| JP4213586B2 (ja) | 2001-09-13 | 2009-01-21 | 株式会社抗体研究所 | ラクダ抗体ライブラリーの作製方法 |
| FR2829940A1 (fr) | 2001-09-27 | 2003-03-28 | Synt Em | Compositions pour la vectorisation d'anticorps a travers la barriere hematoencephalique et leur utilisation pour le diagnostic ou le traitement des maladies du systeme nerveux central |
| US7084257B2 (en) | 2001-10-05 | 2006-08-01 | Amgen Inc. | Fully human antibody Fab fragments with human interferon-gamma neutralizing activity |
| JP2005289809A (ja) * | 2001-10-24 | 2005-10-20 | Vlaams Interuniversitair Inst Voor Biotechnologie Vzw (Vib Vzw) | 突然変異重鎖抗体 |
| DE60236536D1 (de) | 2001-11-12 | 2010-07-08 | Merck Patent Gmbh | Modifizierter anti-tnf antikörper |
| US7365167B2 (en) | 2001-11-26 | 2008-04-29 | Cell Matrix, Inc. | Humanized collagen antibodies and related methods |
| US7393648B2 (en) | 2001-12-03 | 2008-07-01 | Alexion Pharmaceuticals, Inc. | Hybrid antibodies |
| KR100599789B1 (ko) | 2001-12-03 | 2006-07-12 | 삼성에스디아이 주식회사 | 방열효율이 향상된 플라즈마 디스플레이 장치 및 그 제조방법 |
| US20030129659A1 (en) | 2001-12-03 | 2003-07-10 | Whelihan E. Fayelle | Library screening |
| WO2003050531A2 (en) | 2001-12-11 | 2003-06-19 | Algonomics N.V. | Method for displaying loops from immunoglobulin domains in different contexts |
| CA2471116A1 (en) | 2001-12-21 | 2003-07-03 | Serge Muyldermans | Method for cloning of variable domain sequences |
| EP1461085A2 (en) | 2002-01-03 | 2004-09-29 | Vlaams Interuniversitair Instituut voor Biotechnologie vzw. | Immunoconjugates useful for treatment of tumours |
| DE10225567B4 (de) | 2002-06-10 | 2006-07-06 | Endress + Hauser Conducta Gesellschaft für Mess- und Regeltechnik mbH + Co. KG | Kommunikationsverfahren und System hierfür |
| AU2003245664A1 (en) | 2002-06-21 | 2004-01-06 | Dyax Corporation | Serum protein-associated target-specific ligands and identification method therefor |
| US20060002935A1 (en) | 2002-06-28 | 2006-01-05 | Domantis Limited | Tumor Necrosis Factor Receptor 1 antagonists and methods of use therefor |
| JP2006512895A (ja) | 2002-06-28 | 2006-04-20 | ドマンティス リミテッド | リガンド |
| US20080008713A1 (en) | 2002-06-28 | 2008-01-10 | Domantis Limited | Single domain antibodies against tnfr1 and methods of use therefor |
| EP1388571A1 (de) | 2002-08-08 | 2004-02-11 | Ciba Spezialitätenchemie Pfersee GmbH | Polyorganosiloxanzusammensetzung enthaltend quaternäre Ammoniumgruppen |
| US7004940B2 (en) | 2002-10-10 | 2006-02-28 | Ethicon, Inc. | Devices for performing thermal ablation having movable ultrasound transducers |
| WO2004037999A2 (en) | 2002-10-23 | 2004-05-06 | Ludwig Institute For Cancer Research | A34 and a33-like 3 dna, proteins, antibodies thereto and methods of treatment using same |
| NZ540195A (en) | 2002-11-08 | 2009-01-31 | Ablynx Nv | Stabilized single domain antibodies |
| EP1558646A2 (en) | 2002-11-08 | 2005-08-03 | Ablynx N.V. | Single domain antibodies directed against interferon- gamma and uses thereof |
| US20060034845A1 (en) | 2002-11-08 | 2006-02-16 | Karen Silence | Single domain antibodies directed against tumor necrosis factor alpha and uses therefor |
| ES2551682T3 (es) | 2002-11-08 | 2015-11-23 | Ablynx N.V. | Anticuerpos de dominio simple dirigidos contra factor de necrosis tumoral-alfa y usos para los mismos |
| GB0230203D0 (en) | 2002-12-27 | 2003-02-05 | Domantis Ltd | Fc fusion |
| KR101025143B1 (ko) | 2002-12-31 | 2011-04-01 | 넥타르 테라퓨틱스 | 가수분해상으로 안정한 말레이미드-종결 중합체 |
| CN101412759A (zh) | 2003-01-10 | 2009-04-22 | 埃博灵克斯股份有限公司 | 治疗性多肽,其同源物、其片段及其在调节血小板介导的聚集方面的应用 |
| JP2008530626A (ja) | 2003-06-30 | 2008-08-07 | シーメンス アクチエンゲゼルシヤフト | マイクロコンピュータにおけるプログラムの実行を監視する方法 |
| DK1639011T3 (da) | 2003-06-30 | 2009-02-16 | Domantis Ltd | Pegylerede enkelt-domæne antistoffer (dAb) |
| EP1512696A1 (en) | 2003-08-14 | 2005-03-09 | Diatos | Amino acid sequences facilitating penetration of a substance of interest into cells and/or cell nuclei |
| DE60334645D1 (de) | 2003-11-07 | 2010-12-02 | Ablynx Nv | Camelidae schwere ketten antikörper vhhs gegen epidermalen wachstumfaktor rezeptor (egfr) und ihre verwendung |
| US7432238B2 (en) | 2004-04-16 | 2008-10-07 | Stc.Unm | Human Kunitz-type inhibitor with enhanced antifibrinolytic activity |
| US7180370B2 (en) | 2004-09-01 | 2007-02-20 | Micron Technology, Inc. | CMOS amplifiers with frequency compensating capacitors |
| US7563443B2 (en) | 2004-09-17 | 2009-07-21 | Domantis Limited | Monovalent anti-CD40L antibody polypeptides and compositions thereof |
| GB0521621D0 (en) | 2005-10-24 | 2005-11-30 | Domantis Ltd | Tumor necrosis factor receptor 1 antagonists for treating respiratory diseases |
| RU2428431C2 (ru) | 2004-12-02 | 2011-09-10 | Домантис Лимитед | Слитые конструкции лекарственного средства и конъюгаты |
| SG184709A1 (en) | 2005-05-18 | 2012-10-30 | Ablynx Nv | Improved nanobodies™ against tumor necrosis factor-alpha |
| DE102005023617A1 (de) * | 2005-05-21 | 2006-11-23 | Aspre Ag | Verfahren zum Mischen von Farben in einem Display |
| US20070269422A1 (en) | 2006-05-17 | 2007-11-22 | Ablynx N.V. | Serum albumin binding proteins with long half-lives |
| KR20100040840A (ko) | 2007-06-06 | 2010-04-21 | 도만티스 리미티드 | 폴리펩티드,항체 가변 도메인 및 길항제 |
| GB0724331D0 (en) | 2007-12-13 | 2008-01-23 | Domantis Ltd | Compositions for pulmonary delivery |
| KR20100018040A (ko) | 2007-06-06 | 2010-02-16 | 도만티스 리미티드 | 프로테아제 내성 폴리펩티드를 선택하는 방법 |
| WO2009068625A2 (en) | 2007-11-27 | 2009-06-04 | Ablynx N.V. | Amino acid sequences directed against her2 and polypeptides comprising the same for the treatment of cancers and/or tumors |
| SI2700651T1 (sl) | 2008-07-18 | 2019-08-30 | Bristol-Myers Squibb Company | Monovalentni sestavki za vezavo CD28 in postopki uporabe |
| BR112013001640A2 (pt) | 2010-07-22 | 2020-08-04 | The Regents Of The University Of California | anticorpo monoclonal que se liga aos epítopos de epha2 e cd44, seu uso no tratamento de câncer e na detecção de célula cancerosa, bem como composição, kit, ácido nucleico e vetor 5 de expressão |
| ES2913200T3 (es) * | 2015-03-31 | 2022-06-01 | Sorriso Pharmaceuticals Inc | Polipéptidos |
| SG11201807402PA (en) * | 2016-03-31 | 2018-09-27 | Vhsquared Ltd | Compositions |
-
2006
- 2006-05-17 SG SG2012064283A patent/SG184709A1/en unknown
- 2006-05-17 EP EP06742963A patent/EP1888641B1/en active Active
- 2006-05-17 ES ES06742962T patent/ES2384164T3/es active Active
- 2006-05-17 BR BR122013001996-0A patent/BR122013001996B1/pt active IP Right Grant
- 2006-05-17 ES ES06742963T patent/ES2379283T3/es active Active
- 2006-05-17 AU AU2006249144A patent/AU2006249144B2/en active Active
- 2006-05-17 CA CA2608770A patent/CA2608770C/en active Active
- 2006-05-17 NZ NZ562695A patent/NZ562695A/en not_active IP Right Cessation
- 2006-05-17 EP EP20100175950 patent/EP2365000A3/en not_active Withdrawn
- 2006-05-17 WO PCT/EP2006/004678 patent/WO2006122786A2/en active Application Filing
- 2006-05-17 CN CN200680026278XA patent/CN101248087B/zh active Active
- 2006-05-17 PT PT06742963T patent/PT1888641E/pt unknown
- 2006-05-17 WO PCT/EP2006/004679 patent/WO2006122787A1/en not_active Application Discontinuation
- 2006-05-17 HU HUE15172289A patent/HUE045710T2/hu unknown
- 2006-05-17 EP EP06742962A patent/EP1888640B1/en active Active
- 2006-05-17 EP EP19184376.2A patent/EP3613767A1/en active Pending
- 2006-05-17 SG SG10201708038QA patent/SG10201708038QA/en unknown
- 2006-05-17 PL PL06742963T patent/PL1888641T3/pl unknown
- 2006-05-17 RU RU2007142444/10A patent/RU2464276C2/ru active
- 2006-05-17 EP EP20110163652 patent/EP2479191A3/en not_active Withdrawn
- 2006-05-17 CA CA2962819A patent/CA2962819C/en active Active
- 2006-05-17 BR BRPI0609224-1A patent/BRPI0609224B1/pt active IP Right Grant
- 2006-05-17 EP EP09173976A patent/EP2172484A3/en not_active Withdrawn
- 2006-05-17 CN CN201210350044.8A patent/CN103254309B/zh active Active
- 2006-05-17 PL PL15172289T patent/PL2949668T3/pl unknown
- 2006-05-17 MX MX2012000384A patent/MX342271B/es unknown
- 2006-05-17 SI SI200631334T patent/SI1888640T1/sl unknown
- 2006-05-17 SI SI200632355T patent/SI2949668T1/sl unknown
- 2006-05-17 DK DK06742963.9T patent/DK1888641T3/da active
- 2006-05-17 DK DK15172289T patent/DK2949668T3/da active
- 2006-05-17 DK DK06742962.1T patent/DK1888640T3/da active
- 2006-05-17 JP JP2008511627A patent/JP5047950B2/ja active Active
- 2006-05-17 US US11/587,749 patent/US8188223B2/en active Active
- 2006-05-17 KR KR1020077026738A patent/KR101308771B1/ko active IP Right Grant
- 2006-05-17 AT AT06742962T patent/ATE549357T1/de active
- 2006-05-17 SI SI200631287T patent/SI1888641T1/sl unknown
- 2006-05-17 ES ES15172289T patent/ES2778123T3/es active Active
- 2006-05-17 LT LT15172289T patent/LT2949668T/lt unknown
- 2006-05-17 MX MX2016001166A patent/MX363423B/es unknown
- 2006-05-17 PL PL06742962T patent/PL1888640T3/pl unknown
- 2006-05-17 AT AT06742963T patent/ATE537188T1/de active
- 2006-05-17 EP EP15172289.9A patent/EP2949668B1/en active Active
- 2006-05-17 MX MX2007014359A patent/MX2007014359A/es active IP Right Grant
- 2006-05-17 PT PT151722899T patent/PT2949668T/pt unknown
- 2006-05-18 TW TW095117592A patent/TWI395755B/zh active
- 2006-05-18 TW TW101148771A patent/TWI439467B/zh active
-
2007
- 2007-10-25 IL IL186941A patent/IL186941A/en active IP Right Grant
- 2007-11-14 NI NI200700291A patent/NI200700291A/es unknown
- 2007-11-14 CR CR9519A patent/CR9519A/es not_active Application Discontinuation
- 2007-11-14 NO NO20075853A patent/NO338568B1/no unknown
- 2007-11-15 ZA ZA200709867A patent/ZA200709867B/xx unknown
- 2007-11-19 EC EC2007007910A patent/ECSP077910A/es unknown
-
2008
- 2008-08-15 HK HK08109098.4A patent/HK1113685A1/xx unknown
-
2009
- 2009-02-12 ZA ZA200901011A patent/ZA200901011B/xx unknown
-
2011
- 2011-01-14 ZA ZA2011/00385A patent/ZA201100385B/en unknown
-
2012
- 2012-05-02 JP JP2012105089A patent/JP5788359B2/ja active Active
- 2012-06-26 RU RU2012126722A patent/RU2634381C2/ru active
-
2013
- 2013-03-20 IL IL225347A patent/IL225347A/en active IP Right Grant
-
2014
- 2014-02-27 US US14/191,907 patent/US9067991B2/en active Active
-
2015
- 2015-05-07 JP JP2015094805A patent/JP6420200B2/ja active Active
- 2015-05-12 US US14/709,870 patent/US20150353635A1/en not_active Abandoned
-
2016
- 2016-04-06 HK HK16103906.9A patent/HK1215953A1/zh unknown
- 2016-06-17 NO NO20161028A patent/NO345340B1/no unknown
-
2017
- 2017-03-05 IL IL250946A patent/IL250946B/en active IP Right Grant
- 2017-03-28 JP JP2017063172A patent/JP6484660B2/ja active Active
- 2017-07-10 US US15/644,890 patent/US20170342146A1/en not_active Abandoned
-
2019
- 2019-05-28 US US16/423,596 patent/US11472871B2/en active Active
- 2019-11-13 CY CY20191101193T patent/CY1122672T1/el unknown
-
2022
- 2022-05-27 US US17/826,258 patent/US20230031229A1/en active Pending
Also Published As
Similar Documents
| Publication | Publication Date | Title |
|---|---|---|
| US20230031229A1 (en) | Nanobodies against tumor necrosis factor-alpha | |
| US8703131B2 (en) | Nanobodies against tumor necrosis factor-alpha | |
| AU2014259481B2 (en) | Improved NanobodiesTM against tumor necrosis factor-alpha | |
| RU2794974C2 (ru) | СВЯЗЫВАЮЩИЙ TNF-α ПОЛИПЕПТИД И СПОСОБ ЛЕЧЕНИЯ СВЯЗАННЫХ С TNF-α ЗАБОЛЕВАНИЙ |
Legal Events
| Date | Code | Title | Description |
|---|---|---|---|
| B06F | Objections, documents and/or translations needed after an examination request according [chapter 6.6 patent gazette] | ||
| B07D | Technical examination (opinion) related to article 229 of industrial property law [chapter 7.4 patent gazette] |
Free format text: DE ACORDO COM O ARTIGO 229-C DA LEI NO 10196/2001, QUE MODIFICOU A LEI NO 9279/96, A CONCESSAO DA PATENTE ESTA CONDICIONADA A ANUENCIA PREVIA DA ANVISA. CONSIDERANDO A APROVACAO DOS TERMOS DO PARECER NO 337/PGF/EA/2010, BEM COMO A PORTARIA INTERMINISTERIAL NO 1065 DE 24/05/2012, ENCAMINHA-SE O PRESENTE PEDIDO PARA AS PROVIDENCIAS CABIVEIS. |
|
| B07E | Notification of approval relating to section 229 industrial property law [chapter 7.5 patent gazette] | ||
| B06U | Preliminary requirement: requests with searches performed by other patent offices: procedure suspended [chapter 6.21 patent gazette] | ||
| B06A | Patent application procedure suspended [chapter 6.1 patent gazette] | ||
| B09A | Decision: intention to grant [chapter 9.1 patent gazette] | ||
| B16A | Patent or certificate of addition of invention granted [chapter 16.1 patent gazette] |
Free format text: PRAZO DE VALIDADE: 20 (VINTE) ANOS CONTADOS A PARTIR DE 17/05/2006, OBSERVADAS AS CONDICOES LEGAIS. PATENTE CONCEDIDA CONFORME ADI 5.529/DF, QUE DETERMINA A ALTERACAO DO PRAZO DE CONCESSAO. |