Ossido di diazoto
| Ossido di diazoto | |
|---|---|
 | |
 | |
 | |
| Nome IUPAC | |
| monossido di diazoto | |
| Nomi alternativi | |
| protossido di azoto ossidulo di azoto ossido nitroso anidride iponitrosa gas esilarante NOS | |
| Caratteristiche generali | |
| Formula bruta o molecolare | N2O |
| Massa molecolare (u) | 44,01 |
| Aspetto | gas incolore |
| Numero CAS | |
| Numero EINECS | 233-032-0 |
| PubChem | 948 |
| DrugBank | DBDB06690 |
| SMILES | N#[N+][O-] |
| Proprietà chimico-fisiche | |
| Densità (kg·m−3, in c.s.) | 1,977 |
| Solubilità in acqua | 1,5 g/L a 293 K |
| Temperatura di fusione | −91 °C (182 K) |
| Temperatura di ebollizione | −88 °C (185 K) |
| Punto critico | 309,6 K (36,4 °C) 7,245 MPa |
| Tensione di vapore (Pa) a 293 K | 5,08×106 |
| Proprietà termochimiche | |
| ΔfH0 (kJ·mol−1) | 81,6 |
| ΔfG0 (kJ·mol−1) | 103,7 |
| S0m(J·K−1mol−1) | 220,0 |
| C0p,m(J·K−1mol−1) | 38,6 |
| Dati farmacologici | |
| Modalità di somministrazione | inalazione |
| Dati farmacocinetici | |
| Emivita | 5 minuti |
| Escrezione | respiratoria |
| Indicazioni di sicurezza | |
| Simboli di rischio chimico | |
 
| |
| pericolo | |
| Frasi H | 270 - 280 |
| Consigli P | 220 - 244 - 370+376 - 403 [1] |
L'ossido di diazoto (nome IUPAC monossido di diazoto, noto come ossido nitroso e soprattutto come protossido di azoto) in condizioni standard è un gas incolore, non infiammabile, dall'odore lievemente dolce. Ha formula chimica N2O.
Noto anche come gas esilarante[2] per via dei suoi effetti euforizzanti e dissociativi, trova impiego medico come analgesico e anestetico ed è anche un importante gas serra e inquinante atmosferico: secondo l'EPA (Environmental Protection Agency) il suo potenziale di riscaldamento climatico è pari a 310, ovvero su cento anni il protossido di azoto risulta 310 volte più influente dell'anidride carbonica per unità di massa.
In condizioni normali, la sua solubilità in acqua è di circa 0,112 g per 100 g. Non è tossico per inalazione, però può provocare asfissia se inalato in quantità eccessive. In forma liquefatta può causare ustioni per contatto, dovute alla bassa temperatura. La sua struttura è un ibrido di risonanza tra due strutture che hanno ambedue una carica formale positiva dell'atomo di azoto centrale, mentre la carica negativa è sull'altro atomo di azoto o su quello di ossigeno.
Storia
[modifica | modifica wikitesto]Questo gas è stato scoperto da Joseph Priestley nel 1772. Vent'anni dopo, Humphry Davy lo sperimentò su sé stesso e su alcuni amici, tra cui i poeti Samuel Taylor Coleridge e Robert Southey. Scoprì così che l'ossido di diazoto attenua considerevolmente la sensazione del dolore, anche quando chi lo assume è ancora semi-cosciente. Fu così che entrò nell'uso medico come anestetico, specialmente presso i dentisti che avevano difficoltà ad avvalersi dell'opera di un medico anestesista e che trovavano conveniente che il loro paziente rimanesse sufficientemente sveglio da poter interpretare eventuali comandi verbali.
William James descrive gli effetti del protossido di azoto su di sé[3], affermando che poco dopo l'inalazione, si produssero un brivido esteso dal torace alle estremità, una aumentata sensibilità visiva, uditiva e di piacere, perdita del legame con le cose esterne, dissociazione, una percezione di immagini connesse a parole e di fervida immaginazione fantasiosa. Come racconta nella sua opera The Varieties of Religious Experience: A Study in Human Nature, James usò il protossido di azoto anche come una sorta di veicolo per l'indagine filosofica e per tentare di accedere all'intuizione mistica[4].
In un famoso cortometraggio del 1914 di Charlie Chaplin, intitolato laughing gas (gas esilarante) o Charlot, falso dentista, viene descritto in modo comico l'effetto del protossido di azoto[5].
Utilizzi
[modifica | modifica wikitesto]Gas esilarante
[modifica | modifica wikitesto]
L'uso ricreativo del gas è noto dalla fine del '700. Nel Regno Unito era utilizzato nelle feste della società borghese, chiamate appunto laughing gas parties. Tuttora è una sostanza psicoattiva comunemente utilizzata per gli effetti dissociativi ed euforizzanti. Secondo le statistiche circa il 30% degli inglesi e degli statunitensi l'ha provato almeno una volta nella vita[6] e sempre nel Regno Unito è la seconda sostanza ricreativa più usata dopo la cannabis.[7][8]
Gli effetti più comuni nell'uso ricreativo includono: leggerezza corporea, cambiamenti nelle percezioni tattili, visive e uditive, disorientamento, vertigini, diminuzione dei livelli d'ansia, aumento del senso dell'umorismo, distacco da se stessi e dall'ambiente attorno.[9][10]
Il gas esilarante può essere pericoloso se assunto in grandi quantità; gli effetti collaterali al sovradosaggio sono: perdita di coscienza, calo di pressione, aritmia o morte per arresto respiratorio. È pericoloso inalare il gas direttamente dalla capsula o dalla bomboletta in quanto può congelare la laringe ed i bronchi. L'inalazione del gas sopprime il bisogno d'aria, pertanto se l'assunzione non è alternata con inspirazioni ricche d'ossigeno può portare all'asfissia.[11]
L'utilizzo regolare del gas esilarante può provocare dipendenza psichica, polineuropatia, degenerazioni delle cellule nervose e serie carenze di vitamina B12.[12][13][14][15][16]
Anestetico
[modifica | modifica wikitesto]L'ossido di diazoto è considerato uno dei farmaci essenziali nella lista dell'Organizzazione Mondiale della Sanità.[17]
Viene utilizzato in ambito dentistico e chirurgico dal 1844.[18] All'epoca veniva fatto inspirare direttamente da un inalatore consistente in un sacchetto fatto di tessuto.[19]Attualmente negli ospedali il gas viene somministrato da una macchina che in maniera automatica regola il dosaggio sul vaporizzatore in base ai respiri del paziente, con una proporzione N2O-ossigeno di 2:1. Oggi, date le proprietà analgesiche relativamente deboli rispetto a nuovi composti, viene usato nella terapia farmacologica in maniera complementare. Infatti può produrre nausea e una confusione persistente se l'esposizione è troppo rapida o eccessiva. L'effetto anestetico dell'ossido nitroso non è ancora completamente chiaro, ma si pensa che il gas interagisca con le membrane delle cellule nervose del cervello alterando la comunicazione intercellulare a livello delle sinapsi.[non chiaro]
Propellente per aerosol
[modifica | modifica wikitesto]L'ossido di diazoto è un additivo alimentare e viene usato come propellente[20] nelle confezioni di panna montata spray. È poco solubile in acqua ma molto nei grassi, per cui si lega bene al composto della panna (35% di grassi emulsionati, il restante è acqua). Con la pressurizzazione del contenitore, all'apertura dell'ugello, il gas tende a uscire, rigassificandosi e creando delle minuscole bollicine costituite da lipidi. La quantità di gas non è sufficiente ad anestetizzare, ma in grandi quantità mantiene un leggero effetto euforizzante.
La panna spray fu inventata nel 1931 da Charlie Goetz e G. Frederick Smith, uno studente di chimica dell'Università dell'Illinois e il suo supervisore. Inizialmente usarono biossido di carbonio, che non era solubile nei grassi ma li rendeva acidi. L'uso dell'ossido di diazoto venne proposto da un dentista locale, che lo conosceva come anestetico. A partire dal 1948 la panna spray venne commercializzata, in contenitori monouso sotto pressione e caricati con ossido di diazoto, da parte della Reddi-Wip di Aaron Lapin.
Comburente per razzi
[modifica | modifica wikitesto]L'ossido di diazoto può essere impiegato come comburente nei motori dei razzi. Rispetto ad altri agenti ossidanti ha il vantaggio di non essere tossico, di essere stabile a temperatura ambiente e di essere relativamente facile da stoccare e trasportare in volo.
È il comburente scelto in diversi modelli di motori ibridi per razzi, ibridi perché il combustibile è solido, mentre il comburente è liquido o gassoso. È stato usato spesso in combinazione con un polibutadiene a terminali ossidrilici, nonché per motori ad architettura verde che utilizzano propilene come combustibile[21].
Motori a combustione interna
[modifica | modifica wikitesto]
Nelle applicazioni motoristiche l'ossido di azoto viene usato come comburente, iniettato nel condotto di aspirazione del motore insieme al carburante del veicolo, con i seguenti risultati:
- temperature dell'aria più basse nell'aspirazione (che producono un denso carico di aspirazione);
- aumento dell'ossigeno contenuto nel carico di aspirazione (l'aria ha una percentuale di ossigeno in peso del 20,9%);
Nelle competizioni automobilistiche l'ossido di diazoto, più noto in questo contesto come "protossido di azoto" o semplicemente NOS, è iniettato nel carburatore o immediatamente a monte di esso, per aumentare le capacità respiratorie del motore. Benché di per sé non sia infiammabile, decomponendosi ad alta temperatura fornisce più ossigeno dell'aria, consentendo al motore di bruciare una miscela più ricca di comburente. Inoltre, essendo stoccato in forma liquida, la sua evaporazione nel carburatore provoca un abbassamento della temperatura: questo rende la miscela carburante-comburente più densa e riduce la detonazione. Solitamente, viene inserito in bombole di forma cilindrica comandate da una elettrovalvola che permette l'afflusso del gas a monte del carburatore attraverso l'azionamento di un apposito interruttore.
È illegale utilizzarlo come sovralimentatore chimico per motori su auto stradali[22].
La stessa tecnica fu impiegata durante la seconda guerra mondiale per aumentare la potenza dei motori degli aerei, soprattutto da parte della Luftwaffe, il cui carburante era mediamente peggiore - in termini di numero di ottano - di quello in dotazione alle forze aeree degli Alleati e per compensare la carenza di ossigeno in alta quota.[senza fonte]
La benzina, come tutti i carburanti, per bruciare ha bisogno di un elemento comburente: l'ossigeno, normalmente fornito dall'aria. Mentre l'addizione di un turbo viene chiamata "sovralimentazione meccanica", quella del protossido d'azoto viene definita "sovralimentazione chimica". Adducendo l'ossigeno proveniente dal protossido d'azoto all'aria (e incrementando di conseguenza la portata di combustibile), è possibile ottenere potenze sensibilmente maggiori rispetto all'utilizzo della sola aria. La sovralimentazione chimica aumenta le prestazioni di un veicolo di serie nei limiti degli stress meccanici e termici sopportabili dal propulsore, normalmente nell'ordine del 40%-45% (esempio: da 100 CV si passerebbe a 140/145 CV). Per un veicolo progettato per altissime prestazioni si può arrivare a un aumento del 150% (Per esempio, da 100 CV si passerebbe a 250 CV).
Produzione
[modifica | modifica wikitesto]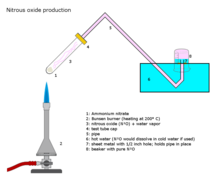
La più comune via di sintesi dell'ossido di diazoto consiste nel cauto riscaldamento del nitrato di ammonio, che si decompone in ossido di diazoto e vapore acqueo[23].
In queste condizioni il nitrato di ammonio si decompone anche attraverso altre vie, pertanto il gas ottenuto conterrà altri ossidi di azoto. L'aggiunta di fosfati consente di ottenere un gas di purezza lievemente maggiore e operare a temperature inferiori.
La reazione avviene a temperature comprese tra i 170 °C e 240 °C, temperature alle quali il nitrato di ammonio è un esplosivo moderatamente sensibile e un potente ossidante. Oltre i 240 °C la reazione può accelerare e produrre una detonazione disastrosa, è quindi necessario avere sempre la temperatura della reazione sotto controllo. Alcuni impianti chimici ricorrono al vapore surriscaldato come fonte di calore.[24]
La miscela di gas prodotta dalla decomposizione è corrosiva; viene raffreddata per condensarne il vapore acqueo e filtrata per rimuovere gli ossidi superiori dell'azoto ed eventuali trascinamenti di nitrato d'ammonio. Viene infine purificata facendola gorgogliare in tre soluzioni: basica, acida e nuovamente basica.
Le impurezze di monossido di azoto (NO) sono chelate per reazione con solfato ferroso o ossidate e successivamente assorbite nei lavaggi basici. Il lavaggio acido intermedio serve a catturare l'ammoniaca che può liberarsi per reazione dei trascinamenti di nitrato d'ammonio con il primo lavaggio basico.
Uno dei primi produttori industriali di ossido di diazoto fu George Poe di Trenton, New Jersey.[25]
Note
[modifica | modifica wikitesto]- ^ scheda dell'ossido di diazoto su IFA-GESTIS Archiviato il 16 ottobre 2019 in Internet Archive.
- ^ (EN) Nitrous oxide, su Thermopedia.
- ^ (EN) Subjective Effects of Nitrous Oxide. William James, su des.emory.edu, Emory University. URL consultato il 1º ottobre 2010 (archiviato dall'url originale il 2 giugno 2011).
- ^ Stefano Canali, Allucinogeni e intuizione mistica. William James e il caso del gas esilarante - PSICOATTIVO, in PSICOATTIVO, 14 agosto 2017. URL consultato il 14 agosto 2017.
- ^ (EN) Laughing Gas, su imdb.com, The Internet Movie Database. URL consultato il 1º ottobre 2010.
- ^ (EN) Stephen J. Kaar, Jason Ferris e Jon Waldron, Up: The rise of nitrous oxide abuse. An international survey of contemporary nitrous oxide use, in Journal of Psychopharmacology, vol. 30, n. 4, 24 febbraio 2016, pp. 395–401, DOI:10.1177/0269881116632375. URL consultato il 21 novembre 2018.
- ^ (EN) Jan van Amsterdam, Ton Nabben e Wim van den Brink, Recreational nitrous oxide use: Prevalence and risks, in Regulatory Toxicology and Pharmacology, vol. 73, n. 3, dicembre 2015, pp. 790–796, DOI:10.1016/j.yrtph.2015.10.017. URL consultato il 21 novembre 2018.
- ^ (EN) Sally Turner, Nitrous-Oxide: What is it good for?, su Drug Science, 30 agosto 2024. URL consultato il 3 ottobre 2024.
- ^ (EN) Nitrous, su psychonautwiki.org.
- ^ (EN) Jay, Mike, Nitrous oxide: recreational use, regulation and harm reduction, in Drugs and Alcohol Today, n. 8.3, 2008, pp. 22-25.
- ^ Gas esilarante, su danno.ch. URL consultato il 21 maggio 2023.
- ^ (EN) Richardson P.G., Peripheral neuropathy following nitrous oxide abuse, in Emerg Med Australas, vol. 22, n. 1, 2007, pp. 88-90, PMID 20152009.
- ^ (EN) Huang M.Y., Tsai W. e Chang W.H., Nitrous oxide-induced polyneuropathy in a teenager, in Emerg Med J, vol. 26, n. 3, 2009, p. 186, DOI:10.1093/bja/aem280, PMID 17951609.
- ^ (EN) Renard D., Dutray A., Remy A., Castelnovo G. e Labauge P., Subacute combined degeneration of the spinal cord caused by nitrous oxide anaesthesia, in Neurol Sci., vol. 30, n. 1, 2009, pp. 75-76, PMID 19169627.
- ^ (EN) Krajewski, W., Kucharska, M., Pilacik, B., Fobker, M., Stetkiewicz, J., Nofer, J.R. e Wronska-Nofer, T., Impaired vitamin B12 metabolic status in healthcare workers occupationally exposed to nitrous oxide, in Br J Anaesth., vol. 99, n. 6, 2007, pp. 812-8, DOI:10.1093/bja/aem280, PMID 17951609.
- ^ (EN) Jameson, M., Roberts, S., Anderson, N.E. e Thompson, P., Nitrous oxide-induced vitamin B(12) deficiency, in J. Clin. Neurosc., vol. 6, n. 2, 1999, pp. 164-6, PMID 18639144.
- ^ (EN) Xavier Seuba, A human rights approach to the WHO Model List of Essential Medicines, in Bulletin of the World Health Organization, vol. 84, n. 5, 1º maggio 2006, pp. 405–411, DOI:10.2471/blt.04.019133. URL consultato il 21 novembre 2018.
- ^ (EN) Sneader Walter, Drug discovery : a history, Wiley, 2005, ISBN 0471899798. URL consultato il 21 novembre 2018.
- ^ (EN) Miller, A.H., Technical Development of Gas Anesthesia, in Anesthesiology Journal, vol. 2, n. 4, luglio 1941, pp. 398–409, DOI:10.1097/00000542-194107000-00004.
- ^ Panna esilarante, su scienze-como.uninsubria.it.
- ^ (EN) B20 Thruster - Green Chemical Propulsion, su Orbital Transports. URL consultato il 10 febbraio 2022.
- ^ Motori truccati, adrenalina e scommesse le notti pericolose delle corse clandestine, su Repubblica.it » Ricerca.
- ^ (EN) Holleman, A.F. e Wiberg, E., Inorganic Chemistry, San Diego, Academic Press, 2001, ISBN 0-12-352651-5.
- ^ (EN) Nitrous oxide plant, su sanghioverseas.com, Sanghi Organization (archiviato dall'url originale il 27 novembre 2013).
- ^ (EN) George Poe is Dead, Washington Post, 3 febbraio 1914. URL consultato il 29 dicembre 2007.«Cousin of Famous Poet and Noted as a Scientist. Inventor of the Respirator. Also First to Liquefy Nitrous Oxide. Cadet at Virginia Military Institute at Time of Battle of Newmarket. Mentioned for the Nobel Prize for Scientific Attainment in Chemistry. Prof. George Poe, a cousin of the poet Edgar Allan Poe, a noted scientist and inventor, who had been mentioned for the Nobel prize for scientific attainment, a former resident of Washington, died in Norfolk, Virginia, yesterday of general paralysis. Prof. Poe was in his sixty-eighth year.»
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su ossido di diazoto
Wikimedia Commons contiene immagini o altri file su ossido di diazoto
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) nitrous oxide, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
- https://psychonautwiki.org/wiki/Nitrous_oxide
- https://www.erowid.org/chemicals/nitrous/nitrous.shtml
- https://justsayn2o.com/
| Controllo di autorità | Thesaurus BNCF 42757 · LCCN (EN) sh85092097 · GND (DE) 4150244-9 · BNF (FR) cb12324380n (data) · J9U (EN, HE) 987007531400405171 |
|---|



