Esterificazione

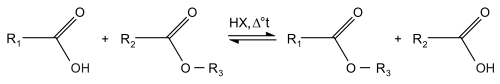
L'esterificazione è la reazione di condensazione nella quale due reagenti (tipicamente un alcool e un acido) formano un estere come prodotto di reazione. Spesso l'acido è un acido carbossilico, ma anche gli acidi inorganici (acido solforico, acido fosforoso e fosforico per esempio) possono essere esterificati. L'acido è fatto reagire in eccesso di alcool (o con sottrazione successiva di acqua), in presenza di un catalizzatore acido HX. Il risultato sono un estere organico o non.
Trattandosi di una reazione di equilibrio, la sottrazione di acqua e l'eccesso di alcol servono a spostare l'equilibrio di reazione verso i prodotti finali (vedi Principio di Le Châtelier).
Il processo inverso dell'esterificazione è l'idrolisi che, se effettuata in ambiente basico, prende il nome di saponificazione. Gli esteri sono comuni in chimica organica e nei materiali biologici, e spesso hanno un caratteristico odore gradevole di frutta. Per questo vengono usati ampiamente nell'industria degli odoranti e dei sapori. I legami estere si trovano anche in molti polimeri.
Esterificazioni dirette
[modifica | modifica wikitesto]Qui trattiamo gli esteri prodotti da acidi organici e inorganici (carbossilati, solfati, solfiti, fosfati, alogenuri, etc), che possono portare a termine reazioni di idrolisi.
Esterificazione semplice o organica
[modifica | modifica wikitesto]
Vediamo tutti i processi che si verificano tra alcooli ed acidi carbossilici o anidridi derivate dagli acidi carbossilici. La sintesi classica è quella di Fischer–Speier, che comporta il trattamento di un acido carbossilico con un alcol in presenza di un agente disidratante. Riportiamo lo schema classico per gli esteri semplici dei due tipi:
- R1-COOH + R2-OH R1-CO2-R2 + H2O
- R1-COOCO-R2 + R3-OH R1-CO2-R3 + R2-COOH
nel caso dei diesteri, abbiamo relazioni del tipo:
- HOOC-R1-COOH + 2 R2-OH R2-O2C-R1-CO2-R2 + 2 H2O
- R1-(COOCO)2-R2 + 2 R3-OH R3-O2C-R1-CO2-R3 + HOOC-R2-COOH
La costante di equilibrio per il primo gruppo di reazioni è di circa 5 per esteri tipici, ad esempio l'acetato di etile.[1] La reazione avviene lentamente. Per aumentarne la velocità un tipico catalizzatore è l'acido solforico. Vengono utilizzati anche altri acidi come gli acidi solfonici polimerici. Essendo una reazione fortemente reversibile, la resa dell'estere aumenta usando il principio di Le Châtelier:
- Usare l'alcool in eccesso (cioè come solvente).
- Usare un agente disidratante: l'acido solforico non solo catalizza ma elimina l'acqua (un prodotto di reazione). Altri agenti essiccanti come i setacci molecolari sono anche efficaci.
- Rimuovere acqua con un mezzo fisico come la distillazione, tramite un azeotropo a punto ebollizione basso con toluene, in combinazione con un apparato di Dean-Stark.
- Meccanismo della reazione
La reazione è una sostituzione nucleofila bimolecolare (SN2) (non si tratta di una sostituzione diretta, prima avviene l'addizione del nucleofilo e poi l'eliminazione del gruppo uscente). L'atomo di ossigeno carbonilico viene protonato da parte dell'acido. In questo modo il carbonio carbonilico risulta ulteriormente polarizzato positivamente e può subire un attacco nucleofilo da parte dell'ossigeno ossidrilico dell'alcol, con la formazione di un intermedio tetraedrico. Si ha quindi uno spostamento di un protone dall'ossidrile alcolico all'ossidrile acido, permettendo l'eliminazione di una molecola d'acqua (un miglior gruppo uscente rispetto ad un ossidrile) e la formazione di un estere protonato sull'ossigeno carbonilico. Infine, si ha la deprotonazione dell'estere, con formazione del prodotto finale e riformazione del catalizzatore acido. Il meccanismo appena descritto è fondamentale nella sintesi di tutti i derivati degli acidi carbossilici. Si tratta di una sostituzione nucleofila acilica ed in sintesi esso può essere così riassunto:
- attivazione del gruppo carbonilico tramite protonazione del suo ossigeno
- addizione nucleoflla al carbonile protonato per formare un intermedio tetraedrico
- eliminazione dall’intermedio tetraedrico per riformare il gruppo carbonilico.
- Cenni storici
La reazione classica (acido carbossilico + alcool) fu scoperta e messa a punto dal premio Nobel Hermann Emil Fischer nel 1895.[2] Un primo impiego ecologico dell'esterificazione si ha nel 1938 quando viene scoperto il modo per separare il fenolo dalle acque nere.
- Esempi tipici
- Acetato di etile prodotto da acido acetico e da alcool etilico:
- CH3-COOH + CH3CH2-OH → CH3-CO2-CH2CH3 + H2O
Poiché l'estere così prodotto bolle prima dell'acqua è impossibile allontanare preferenzialmente questa. L'estere, l'alcool e l'acqua formano un azeotropo ternario che bolle a 70,3 °C (temperatura questa inferiore ai punti d'ebollizione di ciascuno dei tre componenti: estere a 77 °C, l'alcool a 78 °C e l'acqua a 100 °C). La composizione dell'azeotropo in questione è la seguente: 83,2% Acetato di etile, 9,0% Alcool etilico, 7,8% Acqua. La distillazione di un tale miscuglio comporta di allontanare solo l'estere, data l'esigua quantità di alcool che viene contemporaneamente asportata: così si raggiunge lo scopo di spostare a destra la reazione.
- Acetato di n-butile prodotto da acido acetico e da alcool butilico:
- CH3-COOH + CH3CH2CH2CH2-OH → CH3-CO2-CH2CH2CH2CH3 + H2O
- Dietilftalato, un diestere ftalato derivato dall'acido ftalico, prodotto da anidride ftalica e da alcool etilico. Essendo un'anidride ciclica, i prodotti sono un diestere e acqua (non un estere ed un acido come avviene per le anidridi carbossiliche semplici).
- C6H4(CO)2O + 2 CH3CH2-OH → H5C2-CO2-C6H4-CO2-C2H5 + H2O
Dato l'alto punto d'ebollizione (296 °C) dell'estere prodotto, si potrebbe pensare di poter eliminare facilmente l'acqua di reazione per distillazione. In effetti però all'eliminazione dell'acqua si oppone la presenza d'alcool etilico, che bolle a 78 °C. Occorre perciò trovare il sistema d'allontanare l'acqua ad una temperatura più bassa del punto d'ebollizione dell'etanolo. Si considera il sistema binario bassobollente (69,2 °C) che l'acqua forma col benzene. Allo scopo si fanno reagire l'anidride ftalica e l'alcool etilico in quantità corrispondente all'azeotropo benzene-acqua (precisamente al 4,96% di acqua). Dapprima si lavora in sistema chiuso per avviare la reazione e produrre una quantità d'acqua sufficiente a costituire il suddetto azeotropo e poi si attua la distillazione di questo e se ne condensano i componenti. Poiché l'acqua e il benzene sono liquidi immiscibili, risulta facile riciclare il benzene. L'estere rimane invece nel reattore, da cui si scarica solo di tanto in tanto; e la reazione d'esterificazione si considera finita quando distilla benzene puro.
L'anidride ftalica reagisce facilmente con gli alcooli monovalenti e dà gli ftalati monoalchilici (rivestono particolare interesse pratico gli ftalati di metile, etile, butile, ottile). La reazione è catalizzata dall'acido solforico. Le reazioni con l'anidride ftalica possono riguardare, in secondo luogo, anche i polialcooli (specie per un triolo come la glicerina). Tali esteri della reazione con gli alcooli monovalenti vengono usati su larga scala come plastificanti e quelli coi polialcooli vengono impiegati per produrre le cosiddette resine gliceroftaliche.
- Agenti disidratanti
Sono noti reagenti che guidano la disidratazione di miscele di alcoli e acidi carbossilici. Un esempio è l'esterificazione di Steglich, che è un metodo di formazione di esteri in condizioni regolari. Questo metodo si usa comunemente nella sintesi peptidica, dove i substrati sono sensibili a condizioni estreme come il calore elevato. Il DCC viene utilizzato per attivare l'acido carbossilico per la reazione, mentre il DMAP è il catalizzatore per trasferire il gruppo acile.[3]
Un altro metodo è la reazione di Mitsunobu. Il procedimento tipico consiste nell'aggiungere insieme una fosfina, come P(C6H5)3, e un diestere azodicarbossilato (R-CO2-N=N-CO2-R) a -10 °C, tipicamente in THF o toluene, finché non si forma l'estere come un precipitato bianco.
Esterificazione mista o inorganica
[modifica | modifica wikitesto]Qui trattiamo i processi di reazione tra un alcool e un acido inorganico o le anididi derivate da acidi inorganici, detti anche acidi minerali. Il prodotto è un estere inorganico. Fissiamo la nostra attenzione solo sui nitrati d'alchile e sui solfati acidi d'alchile, che sono di gran lunga gli esteri più importanti del genere.
e le reazioni corrispondenti con le rispettive anidridi
L'esterificazione degli alcooli con acido nitrico e solforico è un processo che, di per sé, va sempre più rallentando e che finisce per arrestarsi se non si provvede ad allontanare dal sistema l'acqua di reazione. Per questo motivo la preparazione d'alta resa degli esteri dell'acido nitrico richiede la presenza dell'acido solforico come agente disidratante.
I solfati acidi d'alchile sono solubili in acqua e permettono di ripristinare in un secondo tempo per distillazione gli alcheni da cui derivano. La formazione dì questi esteri acidi è un buon metodo per separare i componenti di varie miscele: alcani-alcheni, eteri-alcheni e così via.
Esterificazioni indirette
[modifica | modifica wikitesto]Transesterificazioni
[modifica | modifica wikitesto]La transesterificazione comprende tutti i sistemi che portano a preparare determinati esteri da altri esteri e che possono essere distinti nei seguenti tipi: sostituzione del gruppo alcolico o del gruppo acido di un estere per trattamento con un alcol (alcoolisi) o con un acido (acidolisi) o con uno scambio di esteri (esterolisi); ha applicazioni industriali e in biochimica. Essendo una reazione d'equilibrio, catalizzata da un acido o da una base, bisognerà sempre aggiungere al sistema di reazione un eccesso del reattivo spostante al fine d'aumentare le rese di scambio; bisognerà cercare inoltre di eliminare dall'ambiente di reazione il reattivo spostato o l'altro prodotto di reazione.
L'alcoolisi e lo scambio di estere sono catalizzati sia dall'acido solforico, sia dagli acidi solfonici e sia, infine, dagli ioni alcossido. L'acidolisi viene invece favorita solo dall'acido solforico e dai derivati solfonici.
La trans-esterificazione oggi viene utilizzata per produrre "biocarburanti" a partire da diversi olii vegetali, come ad esempio l'olio di colza.
- Alcoolisi (estere + alcool → estere + alcool)

- R1-CO2-R2 + R3-OH → R1-CO2-R3 + R2-OH
Come per l'idrolisi si usa l'acqua, nel caso dell'alcoolisi si usa un alcool per scindere una molecola e aggiungere elementi. La reazione è ampiamente utilizzata per degradare i trigliceridi, ad esempio nella produzione di esteri di acidi grassi e alcoli. Il polietilene tereftalato viene prodotto dalla transesterificazione del diestere dimetil tereftalato e dal diolo glicoletilenico:[4]
Un'altra applicazione importante è l'alcoolisi di esteri ciclici. Il dichetene, un composto della famiglia ossetani, è un estere ciclico del tipo ''beta''-propiolattone. Questa reazione fornisce come prodotto unicamente un β-chetoestere.[4]
- (CH2CO)2 + R-OH → CH3C(O)CH2-CO2-R
ad esempio la reazione
dà un chetoestere impiegato nell'industria per produrre acidi e chetoni.
- Acidolisi (acido + estere → estere + acido)
- R1-COOH + R2-CO2-R3 → R1-CO2-R3 + R2-COOH
Reazione di scambio fra un acido libero e un estere, consistente nella sostituzione del radicale dell’acido libero (R1) a quello dell’acido combinato nell’estere (R2). Un esempio di uso pratico è la reazione:
Così l'acido acrilico può essere preparato dall'acrilato di metile con acido formico. Il catalizzatore è H2SO4 ed occorre fornire una certa temperatura.
- Esterolisi (estere + estere → estere + estere)

- R1-CO2-R2 + R3-CO2-R4 → R3-CO2-R2 + R1-CO2-R4
Il processo d'esterificazione per scambio d'estere consiste nella metatesi di due alcooli tra due esteri in cui sono combinati. In pratica vengono scambiati R1 ed R3, cambiando solo la denominazione dell'acido da cui essi provengono. Così ad esempio, stabilendo le opportune condizioni di catalisi e di temperatura, avviene la seguente reazione di scambio:
Nitrilazioni degli alcooli
[modifica | modifica wikitesto]Il triplo legame dei nitrili può comportarsi in via preliminare come quello dell'acetilene, quando viene fatto reagire con un alcool: l'idrogeno dell'ossidrile di questo si somma ovviamente all'atomo più elettronegativo del nitrile, cioè all'azoto, e lo ione alcossido si somma al carbonio dello stesso nitrile generando un sale. Si tratta di una reazione di Pinner dove il sale si idrolizza con acqua per produrre un estere. L'altro prodotto è un sale di ammonio. Riportiamo la reazione completa che si svolge in più sottoreazioni:
nitrile + alcool + acido inorganico + acqua → estere + sale di ammonio
- R-C≡N + R'-OH + HX + H2O → R-CO2-R' + NH4X
Ad esempio
- CH2=CH-C≡N + C2H5-OH + HCl + H2O → CH2=CH-CO2-C2H5 + NH4Cl
Questa reazione, nella quale si può impiegare anche l'acido solforico invece del cloridrico, trova vasta applicazione industriale per la preparazione degli esteri acrilici e metacrilici, che sono gl'intermedi fondamentali per la produzione delle cosiddette resine acriliche.
Epossidazioni degli acidi
[modifica | modifica wikitesto]
Trattando gli epossidi con acidi carbossilici, si producono gli alcoolesteri:
- R1-COOH + CHR2CH2O → R1-CO2-CH2R2-CH2(OH)
Ad esempio
- CH2=CH-COOH + CH2CH2O → CH2=CH-CO2-C2H4-OH
L'alcool estere prodotto si denomina acrilato di 1-idrossietile. Come si vede gli esteri formati per epossidazione contengono sempre una funzione alcolica (-OH) libera; non meraviglierà dunque che si possa operare un'altra esterificazione su tale funzione. Reazioni di questo genere vengono utilizzate nella produzione di resina vinilestere dall'acido acrilico.
È noto che la molecola degli epossidi è sistema dipolare, con carica positiva situata sulla regione dei carboni dell'anello triatomico e la negativa posta sull'ossigeno; cosicché ciascun carbonio dell'anello epossidico è un ente elettrofilo, mentre il relativo ossigeno è agente nucleofilo.
Alcoolisi e fenolisi degli acilalogenuri
[modifica | modifica wikitesto]- Alcoolisi
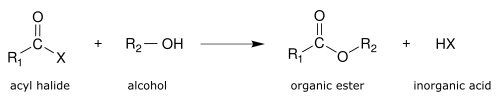
Un esempio importante è l'alcoolisi degli acilcloruri. Gli alcool reagiscono con gli acil cloruri producendo esteri:
- R-CO-Cl + R′-OH → R-CO2-R′ + HCl
Ad esempio:
- CH3-CO-Cl + C2H5-OH → C2H5-CO2-CH3 + HCl
Le reazioni sono irreversibili semplificando il trattamento. Essendovi reazioni secondarie tra gli acilcloruri e l'acqua, si preferisce lavorare in condizioni anidre. Le analoghe reazioni delle ammine i cui prodotti sono le ammidi (amminolisi degli acilalogenuri), ad esempio:
- R-CO-Cl + R′-NH2 → R-CO-NH-R′ + HCl
danno meno reazioni secondarie perché le ammine sono più forti nucleofili e reagiscono più rapidamente dell'acqua. Questo metodo viene utilizzato solo per procedure di laboratorio, non a livello industriale essendo costoso.
- Fenolisi
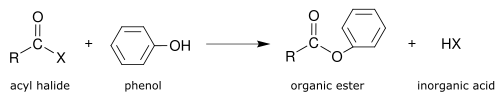
Tradotto in formula chimica
- R-CO-X + C6H5-OH → R-CO2-C6H5 + HX
Ad esempio:
- C6H5-CO-Cl + C6H5-OH → C6H5-CO2-C6H5 + HCl
L'estere prodotto prende il nome di benzoato di fenile. La reazione viene catalizzata con NaOH diluito in acqua al 10-25%.
I vari cloruri che si possono impiegare in questa tecnica d'esterificazione reagiscono in maniera diversa: quelli derivati dagli acidi aromatici (aril-acilalogenuri) reagiscono molto più lentamente degli alogenuri alchilacilici. Perciò le fenolisi e le alcoolisi degli aril-acilalogenuri vengono catalizzate con delle basi (alcali diluiti o basi piridiche). Questa tecnica di reazione caratterizzata da catalisi basica va sotto il nome di metodo di Schotten-Baumann.
Alchilazione con alogenuro alchilico di sali, acidi organici e non
[modifica | modifica wikitesto]
Scaldando il sale d'un acido organico carbossilico (inorganico) con un alogenuro alchilico si ha formazione d'un estere organico (inorganico) secondo reazioni di questo genere:
- M CO2-R + R'-X → R-CO2-R' + MX
- M NO2-O + R-X → R-O-NO2 + MX riferito all'acido nitrico
- Alchilazione di sali carbossilati
Sebbene non ampiamente utilizzati per le esterificazioni, i sali di anioni carbossilati (R-CO2-) possono essere trattati con agente alchilante come l'alogenuro di alchile per dare esteri organici.[4]
Nel caso di un alchil cloruro, un sale ioduro viene utilizzato come catalizzatore (reazione di Finkelstein). Il sale carbossilato viene spesso creato in situ.[5] Di seguito un esempio di reazione:
- Na CO2-CH3 + Cl-C2H5 → CH3-CO2-CH2CH3 + NaCl
In casi di reazioni che hanno difficoltà, si utilizza un carbossilato d'argento, poiché lo ione argento si coordina all'alogenuro favorendo la partenza e migliorando la velocità di reazione. Questa reazione può avere carenza di anioni, a cui si provvede con l'aggiunta di un PTC o di un solvente aprotico altamente polare come il DMF.
Il processo d'alchilazione dei sali si usa solo in casi particolari per preparare gli esteri: quando l'alogenuro alchilico risulta più economico dell'alcool corrispondente, oppure se è difficile preparare l'estere per esterificazione diretta. Un caso pratico di questo genere si riscontra nella fabbricazione dell'acetato di benzile dall'acetato sodico e dal cloruro di benzile. Quest'ultimo, a sua volta, si prepara nell'industria tramite una reazione fotochimica in fase gassosa del CH3-C6H5 con Cl2.
- Alchilazione di sali nitrati
Il nitrato di metile è un esplosivo poco utilizzato, ma come miscela contenente il 25% di metanolo è stato usato come carburante per missili ed esplosivo volumetrico con il nome Myrol dalla Germania nella Seconda guerra mondiale. Questa miscela evapora a velocità costante e così la sua composizione non cambierebbe nel tempo. Presenta un basso pericolo di esplosione (è piuttosto difficile da far esplodere) e nemmeno tramite shock.[6]
- Alchilazione di acidi carbossilici
Un agente alchilante utilizzato in laboratorio è il diazometano. Questo reattivo è un gas giallo che normalmente s'impiega in soluzione eterea. La metilazione con diazometano di un acido carbossilico produce gli esteri metilici secondo la reazione:
- R-COOH + CH2N2 → R-CO2-CH3 + N2
In queste reazioni le miscele di acidi carbossilici possono essere convertite nei loro esteri metilici con rese quasi quantitative, ad esempio, si può usare la gascromatografia a scopo analitico. Il metodo è utile in operazioni sintetiche organiche di piccola entità ma viene considerato troppo pericoloso e costoso per applicazioni su larga scala.
Carbonilazione
[modifica | modifica wikitesto]Gli alcheni subiscono idroesterificazione in presenza di un catalizzatore metallocarbonile. Gli esteri dell'acido propionico, detti propionati o propanoati, sono prodotti commercialmente tramite questo metodo:
- CH2=CH2 + R-OH + CO → C2H5-CO2-R
La preparazione dell'estere propionato di metile ne è un esempio. Da notare il simbolo Me presente nel reagente alcolico MeOH.
- CH2=CH2 + Me-OH + CO → C2H5-CO2-Me
Gli esteri dell'acido formico, i formiati, sono prodotti dalla carbonilazione di un alcool:
- R-OH + CO → H-CO2-R
La carbonilazione dell'alcool metilico rende il formiato di metile, che è la principale sorgente commerciale dell'acido formico. La reazione viene catalizzata da un alcossido, cioè da un sale organico denominato metossido di sodio:
Addizione di acidi carbossilici ad alcheni e alchini. Vinilazione.
[modifica | modifica wikitesto]- Alcheni
alchene + acido carbossilico → estere
L'alchilazione di un acido carbossilico con etilene produce esteri etilici.
- CH2=CH2 + R-COOH → R-CO2-C2H5
L'acido tungstosilicico idrato si utilizza per produrre un estere con questo metodo:
Ci sono delle varianti quando si utilizza un catalizzatore basato sul palladio. In tale caso l'etilene, l'acido acetico, e l'ossigeno reagiscono per produrre un estere vinilico, l'acetato di vinile:
- CH2=CH2 + CH3-COOH + 1⁄2 O2 → CH3-CO2-CH=CH2 + H2O
I metodi diretti visti in precedenza per questo estere non sono possibili perché l'alcol vinilico è instabile.
- Alchini
alchino + acido carbossilico → estere
Gli acidi carbossilici si utilizzano anche con gli alchini per dare gli stessi prodotti, cioè degli esteri. In particolare con l'acetilene si ottengono gli esteri acrilati.
- CH≡CH + R-COOH → CH2=CH-CO2-R
Questa reazione rientra in quella più generica detta vinilazione dove si può anche utilizzare l'acetilene mono sostituito (CH≡CR) con composti organici che contengono oltre a gruppi carbossilici (R-COOH), anche gruppi ossidrilici (R-OH), o mercaptanici (R-SH), o amminici (R3N), o imminici (R2C=N-R). Il fenomeno reattivo in questo caso comporta lo stabilirsi di un legame tra il carbonio acetilenico e l'ossigeno o lo zolfo o l'azoto dell'altro reattivo.
Per far reagire ad esempio, secondo il meccanismo ora esposto, l'acetilene e l'acido acetico, si deve operare in fase vapore a 200 °C su catalizzatori costituiti da sali di mercurio ed in presenza di acidi forti. Il prodotto è un estere denominato 2-propenoato di metile (IUPAC) o acrilato di metile. Ecco lo schema della reazione:
Usando come catalizzatori i sali di zinco e di cadmio degli acidi organici da combinare con l'acetilene (benzoato di zinco, naftenato di zinco, palmitato di zinco e così via) si riesce a preparare gli esteri vinilici anche di acidi grassi superiori. L'addizione sì esegue in fase liquida sotto pressione e ad una temperatura di 180 °C. Le rese sono ottime (superiori al 90%): il catalizzatore va aggiunto come ossido in ragione dell'1-3% sulla quantità di acido carbossilico impiegato
Dismutazioni delle aldeidi
[modifica | modifica wikitesto]
La reazione di Tishchenko coinvolge la disproporzione di un'aldeide in presenza di una base anidra per produrre un estere. I catalizzatori sono dei sali organici della serie degli alcossidi di alluminio o alcossidi di sodio.
- 2 R-CHO + M O-R' → R-CO2-R' + M O-CH2-R
La benzaldeide reagisce con il benzilossido di sodio (generato da sodio e alcool benzilico) per produrre un estere con rami ciclici, il benzoato di benzile.[7]
- 2 C6H5-CHO + Na O-CH2-H5C6 → C6H5-CO2-CH2-H5C6 + Na O-CH2-C6H5
Questo metodo viene utilizzato per produrre l'acetato di etile partendo dall'acetaldeide.[4] e per la stessa via s'ottengono pure eccellenti risultati anche nel processo di produzione del formiato di metile da formaldeide.
- 2 CH3-CHO + Al (O-C2H5)3 → CH3-CO2-C2H5 + Al (O-C2H5)2 (O-CH2-CH3)
Altri metodi
[modifica | modifica wikitesto]- Chetoni
- Il riarrangiamento di Favorskii di un α-alochetone con la presenza di una base forte come un alcossido produce un estere.
- La reazione di un chetone con peracido carbossilico nota come ossidazione organica di Baeyer–Villiger per produrre un estere e un acido.
- Ossidazione anodica di chetoni metilici ottenendo esteri metilici.[8]
- Ortoesteri
- Idrolisi degli ortoesteri in acido acquoso a bassa concentrazione per formare esteri:
- RC(OR′)3 + H2O → R-CO2-R′ + 2 R′-OH
- Alcheni
- Ozonolisi di alcheni usando un trattamento con l'acido cloridrico e vari alcoli.[9]
- Cellulosa
- Complessi metallici
- Astrazione nucleofila di un complesso metallo–acile.
Note
[modifica | modifica wikitesto]- ^ (EN) Williams Roger J.; Gabriel Alton; Andrews Roy C., The Relation Between the Hydrolysis Equilibrium Constant of Esters and the Strengths of the Corresponding Acids, in J. Am. Chem. Soc., vol. 50, n. 2, 1928, pp. 1267–1271, DOI:10.1021/ja01392a005.
- ^ Profumi in microscala Archiviato il 10 luglio 2009 in Internet Archive.
- ^ (EN) B. Neises; W. Steglich., Esterification of Carboxylic Acids with Dicyclohexylcarbodiimide/4-Dimethylaminopyridine: tert-Butyl ethyl fumarate, in Organic Syntheses, 1985, DOI:10.15227/orgsyn.063.0183. Volume collettivo, vol. 7, pp. 93.
- ^ a b c d (EN) Wilhelm Riemenschneider; Hermann M. Bolt, Esters, Organic, in Ullmann's Encyclopedia of Industrial Chemistry, Weinheim, Wiley-VCH, 2005, DOI:10.1002/14356007.a09_565.pub2.
- ^ (EN) Matsumoto Kouichi; Shimazaki Hayato; Miyamoto Yu; Shimada Kazuaki; Haga Fumi; Yamada Yuki; Miyazawa Hirotsugu; Nishiwaki Keiji; Kashimura Shigenori, Simple and Convenient Synthesis of Esters from Carboxylic Acids and Alkyl Halides Using Tetrabutylammonium Fluoride, in J. Oleo Sci., vol. 63, n. 5, 2014, pp. 539–544, DOI:10.5650/jos.ess13199, ISSN 1345-8957, PMID 24770480.
- ^ (DE) Meyer, Rudolf, Explosivstoffe, 10., vollst. überarb. Aufl, Weinheim, Wiley-VCH, 2008, ISBN 978-3-527-32009-7.
- ^ (EN) Kamm O.; Kamm W. F., Benzyl benzoate, in Organic Syntheses, vol. 2, 1922, pp. 5, DOI:10.15227/orgsyn.002.0005. Volume collettivo, vol. 1, pp. 104.
- ^ (EN) Makhova Irina V.; Elinson Michail N.; Nikishin Gennady I., Electrochemical oxidation of ketones in methanol in the presence of alkali metal bromides, in Tetrahedron, vol. 47, n. 4-5, 1991, pp. 895–905, DOI:10.1016/S0040-4020(01)87078-2.
- ^ (EN) Neumeister Joachim; Keul Helmut; Pratap Saxena Mahendra; Griesbaum Karl, Ozone Cleavage of Olefins with Formation of Ester Fragments, in Angew. Chem. Int. Ed. En., vol. 17, n. 12, 1978, pp. 939–940, DOI:10.1002/anie.197809392.
- ^ (EN) Ignatyev Igor; Charlie Van Doorslaer; Pascal G.N. Mertens; Koen Binnemans; Dirk. E. de Vos, Synthesis of glucose esters from cellulose in ionic liquids (XML), in Holzforschung, vol. 66, n. 4, 2011, pp. 417–425, DOI:10.1515/hf.2011.161.
Bibliografia
[modifica | modifica wikitesto]- (EN) Otera Junzo, Esterification: methods, reactions, and applications, Wiley-VCH, 2003, ISBN 3-527-30490-8.
- (IT) E. Stocchi; C. Gilardi; C. Mesiani, Operazioni di sintesi organiche., EDISCO, 1965, ISBN 8844120070.
Voci correlate
[modifica | modifica wikitesto]Altri progetti
[modifica | modifica wikitesto] Wikizionario contiene il lemma di dizionario «esterificazione»
Wikizionario contiene il lemma di dizionario «esterificazione» Wikimedia Commons contiene immagini o altri file su esterificazione
Wikimedia Commons contiene immagini o altri file su esterificazione
Collegamenti esterni
[modifica | modifica wikitesto]- (EN) esterification, su Enciclopedia Britannica, Encyclopædia Britannica, Inc.
| Controllo di autorità | Thesaurus BNCF 33188 · LCCN (EN) sh85044947 · GND (DE) 4334362-4 · BNF (FR) cb12381502x (data) · J9U (EN, HE) 987007555690205171 |
|---|


