Ossido di trifenilfosfina
| Ossido di trifenilfosfina | |
|---|---|
 | |
 | |
| Nome IUPAC | |
| Trifenil-λ5-fosfanone | |
| Nomi alternativi | |
| trifenilfosfinossido | |
| Caratteristiche generali | |
| Formula bruta o molecolare | C18H15OP |
| Aspetto | solido |
| Numero CAS | |
| Numero EINECS | 212-338-8 |
| PubChem | 13097 |
| SMILES | C1=CC=C(C=C1)P(=O)(C2=CC=CC=C2)C3=CC=CC=C3 |
| Proprietà chimico-fisiche | |
| Densità (g/cm3, in c.s.) | 1,2[1] |
| Solubilità in acqua | poco solubile |
| Temperatura di fusione | 155–158 °C (428–431 K)[1] |
| Temperatura di ebollizione | >360 °C (633 K)[1] |
| Proprietà termochimiche | |
| C0p,m(J·K−1mol−1) | 312,5[2] |
| Indicazioni di sicurezza | |
| Punto di fiamma | 180°[1] |
| Simboli di rischio chimico | |

| |
| Frasi H | 302 - 412 [1] |
| Consigli P | 273 [1] |
L'ossido di trifenilfosfina è il composto organofosforico con formula OP(C6H5)3, usualmente scritta come OPPh3 o Ph3PO. Disponibile in commercio, in condizioni normali è un solido cristallino incolore, scarsamente solubile in acqua ma solubile in solventi organici polari. Si ottiene in genere come prodotto finale di scarto in numerose reazioni organiche coinvolgenti la trifenilfosfina.[3] Trova applicazione come reagente per facilitare la cristallizzazione di composti chimici.[4]
Struttura
[modifica | modifica wikitesto]OPPh3 è una molecola tetraedrica, con l'atomo di fosforo in posizione centrale.[5][6] Dal punto di vista cristallografico si conoscono più polimorfi.[7][8][9][10] I più noti sono:
- una struttura monoclina, gruppo spaziale P21/c, con costanti di reticolo a = 1506,6 pm, b = 903,7 pm, c = 1129,6 pm, β = 98,47° e quattro unità di formula per cella elementare, distanze P–O 148,4 pm e P–C 180 pm.[9]
- una struttura ortorombica, gruppo spaziale Pbca, con costanti di reticolo a = 2908,9 pm, b = 913,47 pm, c = 1126,1 pm, quattro unità di formula per cella elementare, distanze P–O 147,9 pm e P–C 180 pm.[10]
Sintesi
[modifica | modifica wikitesto]
L'ossido di trifenilfosfina fu ottenuto per la prima volta da August Michaelis nel 1882.[11] Il legame P=O è molto forte, e di conseguenza il composto si ottiene facilmente dalla trifenilfosfina trattandola con ossidanti vari quali acido nitrico, diossido di manganese, permanganato di potassio, perossido di idrogeno, e anche con il semplice ossigeno atmosferico.[3][5][6] Per questo campioni di trifenilfosfina lasciati all'aria risultano contaminati da OPPh3.
Reattività
[modifica | modifica wikitesto]L'ossido di trifenilfosfina è un composto molto stabile. La rigidità della molecola e la relativa basicità dell'atomo di ossigeno fanno sì che OPPh3 sia comunemente usata per la cristallizzazione di molecole di cui sia altrimenti difficile ottenere cristalli. Questo perché OPPh3 è un buon accettore di protoni e forma complessi con numerose sostanze organiche che abbiano protoni acidi.[4]
Come sottoprodotto in chimica organica
[modifica | modifica wikitesto]In chimica organica OPPh3 si forma in quantità stechiometrica come sottoprodotto in molte reazioni, tra le quali la reazione di Wittig, di Staudinger e di Mitsunobu. Separare il sottoprodotto OPPh3 dalla miscela di reazione può in vari casi risultare difficile. Se il prodotto desiderato è facilmente solubile in solventi come esano o etere dietilico si può ottenere una buona separazione per semplice triturazione in questi solventi, dove OPPh3 è insolubile. Un'altra possibilità è usare Mg(II) che con OPPh3 forma un complesso insolubile in toluene o diclorometano, separabile per filtrazione.[12] In solventi polari come etanolo, acetato di etile e tetraidrofurano l'aggiunta di ZnCl2 provoca la precipitazione di un complesso insolubile che può essere filtrato.[13] Sono anche stati studiati vari metodi per recuperare la OPPh3 di scarto rigenerando trifenilfosfina. Esistono vari agenti deossigenanti, come fosgene e triclorosilano.[14]
Come legante in chimica di coordinazione
[modifica | modifica wikitesto]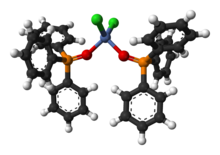
OPPh3 può fungere da legante e preferisce coordinarsi a ioni metallici classificati duri secondo la teoria HSAB. Un esempio è il complesso tetraedrico NiCl2(OPPh3)2.[15]
Note
[modifica | modifica wikitesto]- ^ a b c d e f GESTIS 2020
- ^ Lide 2005
- ^ a b Engel e Cohen 2006
- ^ a b Etter e Baures 1988
- ^ a b Corbridge 1995
- ^ a b Holleman e Wiberg 2007
- ^ Bandoli et al. 1970
- ^ Ruban e Zabel 1976
- ^ a b Spek 1987
- ^ a b Al-Farhan 1992
- ^ Michaelis e Gleichmann 1882
- ^ Isola et al. 2000
- ^ Batesky et al. 2017
- ^ van Kalkerenet et al. 2013
- ^ Goodgame e Goodgame 1965
Bibliografia
[modifica | modifica wikitesto]- (EN) K. A. Al-Farhan, Crystal structure of triphenylphosphine oxide, in Journal of Crystallographic and Spectroscopic Research, vol. 22, 1992, pp. 687–689, DOI:10.1007/BF01160986.
- (EN) G. Bandoli, G. Bortolozzo, D. A. Clemente, U. Croatto e C. Panattoni, Crystal and molecular structure of triphenylphosphine oxide, in J. Chem. Soc. A, n. 0, 1970, pp. 2778-2780, DOI:10.1039/J19700002778.
- (EN) D. C. Batesky, M. J. Goldfogel e D. J. Weix, Removal of Triphenylphosphine Oxide by Precipitation with Zinc Chloride in Polar Solvents, in J. Org. Chem., vol. 82, n. 19, 2017, pp. 9931-9936, DOI:10.1021/acs.joc.7b00459.
- (EN) D. E. C. Corbridge, Phosphorus: An Outline of its Chemistry, Biochemistry, and Technology, 5ª ed., Amsterdam, Elsevier, 1995, ISBN 0-444-89307-5.
- (EN) R. Engel e J. I. Cohen, Phosphorus: Organophosphorus Chemistry, in Encyclopedia of Inorganic Chemistry, 2ª ed., John Wiley & Sons, 2006, DOI:10.1002/0470862106.ia187, ISBN 9780470862100.
- (EN) M. C. Etter e P. W. Baures, Triphenylphosphine oxide as a crystallization aid, in J. Am. Chem. Soc., vol. 110, n. 2, 1988, pp. 639-640, DOI:10.1021/ja00210a076.
- GESTIS, Triphenylphosphine oxide, su gestis-en.itrust.de. URL consultato il 19 marzo 2020. Pagina dell'ossido di trifenilfosfina nel data base GESTIS.
- (EN) D. M. L. Goodgame e M. Goodgame, Near-Infrared Spectra of Some Pseudotetrahedral Complexes of Cobalt (II) and Nickel(II), in Inorg. Chem., vol. 4, n. 2, 1965, pp. 139–143, DOI:10.1021/ic50024a002.
- (DE) A. F. Holleman e N. Wiberg, Lehrbuch der Anorganischen Chemie, Berlino, Walter de Gruyter, 2007, ISBN 978-3-11-017770-1.
- (EN) A. M. Isola, N. J. Holman, G. B. Tometzki, J. P. Watts e altri, Triphenylphosphine oxide complex process, in US Patent 6011181A, 2000.
- D. R. Lide (Editor), CRC Handbook of Chemistry and Physics, Internet Version 2005, su hbcponline.com, CRC Press, Boca Raton, 2005. URL consultato il 9 dicembre 2017.
- (DE) A. Michaelis e L. Gleichmann, Ueber Di‐ und Triphenylphosphin, in Ber. Deutsch. Chem. Ges., vol. 15, n. 1, 1882, pp. 801-804, DOI:10.1002/cber.188201501170.
- (EN) G. Ruban e V. Zabel, Cryst. Struct. Commun., vol. 5, 1976, pp. 671-677.
- (EN) A. L. Spek, Structure of a second monoclinic polymorph of triphenylphosphine oxide, in Acta Cryst., C43, 1987, pp. 1233-1235, DOI:10.1107/S0108270187092345.
- (EN) H. A. van Kalkeren, F. L. van Delft e F. P. J. T. Rutjes, Organophosphorus Catalysis to Bypass Phosphine Oxide Waste, in ChemSusChem., vol. 6, n. 9, 2013, pp. 1615-1624, DOI:10.1002/cssc.201300368.
Altri progetti
[modifica | modifica wikitesto] Wikimedia Commons contiene immagini o altri file su ossido di trifenilfosfina
Wikimedia Commons contiene immagini o altri file su ossido di trifenilfosfina
