Metan
| Metan CH4 | ||||||||
|---|---|---|---|---|---|---|---|---|
 Kalotna molekula
| ||||||||
| IUPAC nomenklatura | metan | |||||||
| Ostala imena | ugljikov tetrahidrid močvarni plin vodikov karbid rudnički plin | |||||||
| Identifikacijski brojevi | ||||||||
| CAS broj | 74-82-8 ✓ | |||||||
| UN broj | 1971 ✓ | |||||||
| RTECS broj | PA1490000 ✓ | |||||||
| EC broj | 200-812-7 ✓ | |||||||
| PubChem broj | 297 ✓ | |||||||
| Osnovna svojstva | ||||||||
| Molarna masa | 16.04 g·mol−1 | |||||||
| Relativna molekulska masa | 16.04 g·mol−1 | |||||||
| Izgled | plin bez mirisa, boje i okusa | |||||||
| Gustoća |
0.42262 g·cm−3 | |||||||
| Talište | 90,7 K -182,5 °C | |||||||
| Vrelište | 111,55 K -161,6 °C | |||||||
| Topljivost u vodi |
22,7 mg·l−1 (20 °C) | |||||||
| Dipolni moment |
0 D | |||||||
| Struktura | ||||||||
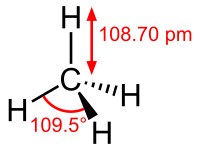 | ||||||||
| Oblik molekule | tetraedarska | |||||||
| Sigurnosne upute | ||||||||
| ||||||||
| Međunarodni sustav mjernih jedinica primijenjen je gdje god je to bilo moguće. Ako nije drugačije naznačeno, upisane vrijednosti izmjerene su pri standardnim uvjetima. | ||||||||
| Portal:Kemija | ||||||||

Metan je bezbojni plin, spoj ugljika i vodika s kemijskom formulom CH4. Spojevi ugljika i vodika nazivaju se ugljikovodici, a metan je najjednostavniji iz te porodice kemijskih spojeva. Razvija se u barama gdje trunu organske tvari pa su ga zvali i močvarni plin. Oslobađa se i u rudnicima ugljena gdje miješanjem sa zrakom stvara eksplozivne smjese koje mogu uzrokovati razorne eksplozije koje su uzrok mnogih rudarskih tragedija.
Kut između kovalentnih veza je 109,5 °. Gorenjem metana, uz prisutnost kisika, nastaje ugljikov dioksid i voda. Veliko obilje metana čini ga vrlo korisnim gorivom. Ipak, jer je metan plin, kod standardnog tlaka i temperature, teško ga je prevesti od nalazišta. Uglavnom se prevozi kroz cjevovode u obliku normalnog plina ili LNG brodovima, koji prevoze ukapljeni zemni plin u tekućem obliku, a vrlo rijetko kamionima.

Metan je prvi otkrio i izdvojio Alessandro Volta između 1776. i 1778., kada je proučavao močvarni plin u jezeru Maggiore, u Italiji.
Metan je vrlo snažan staklenički plin. U usporedbi s CO2 na 20 godina, metan je 72 puta snažniji staklenički plin, a na 100 godina je 25 puta jači.[1] U atmosferi traje oko 10 godina, a nakon toga se razlaže na CO2 i vodu. Metan isto utječe na razlaganje ozonskog omotača.[2] Koncentracija metana u Zemljinoj atmosferi je 1998. godine bila 0,0001745 %, dok je 1750. bila 0,0000700 %. 2008. je koncentracija bila 0,0001800 %, dok je 2010. iznad Arktika izmjereno 0,0001850 %. Znanstvenici su utvrdili da je to najveća koncentracija u zadnjih 400 000 godina. Povijesno, u vrijeme ledenih doba je bila između 0,0000300 % i 0,0000400 %, dok je između ledenih doba normalna vrijednost bila između 0,0000600 % i 0,0000700 %.[3][4][5][6]
Osim toga, postoji velika količina metana u obliku metanskog klatrata ili metanski led, na dnu oceana ispod sedimenata. Prije se vjerovalo da metanski klatrat postoji samo u vanjskim dijelovima Sunčevog sustava. Metanski klatrat je zapravo zaleđena voda koja sadrži u svojoj kristalnoj strukturi veliku količinu metana. Zemljina kora isto sadrži ogromne količine metana. Velike količine metana se stvaraju bez prisutnosti kisika (anaerobno) uz prisutnost mikroba.
Metan se stvara isto u blatnim vulkanima, koji su povezani s dubokim geološkim rasjedima, na odlagalištima otpada, a i u želucima domaćih životinja – preživača, kao što je domaće govedo.
Netopljiv u vodi, u mješavini sa zrakom vrlo eksplozivan. Metan zapaljen gori svjetlim modričastim plamenom oslobađajući toplinsku energiju bez dima i čađe, stoga je pogodan za kuhanje hrane i zagrijavanje prostora. Laboratorijski se može dobiti reakcijom natrijevog acetata i natrijevog hidroksida:
- CH3COONa + NaOH → Na2CO3 + CH4
Metan je glavni sastojak zemnog ili prirodnog plina, oko 87 % obujma. Kod sobne temperature i standardnog tlaka, metan je bez boje i bez mirisa.[7] Miris koji se osjeća u domaćinstvu od zemnog plina, je u biti dodatni miris, koji se dodaje iz sigurnosti da bi se otkrila neispravna intalacija. Metan ima vrelište na -161,6 ºC, kod tlaka od 1 atm. Kao plin je jako zapaljiv, dovoljno je da ga ima 5 % do 15 % u zraku, da bi se zapalio. Tekući metan nije zapaljiv, osim ako je pod tlakom većim od 4 atm.[8][9]
Metan nije otrovan, ali je izuzetno zapaljiv i stvara eksplozivne smjese sa zrakom. On vrlo burno reagira s oksidansima, halogenim elementima i halogenim spojevima. Metan izaziva gušenje u zatvorenim prostorijama, ako snižava koncentraciju kisika ispod 19,5 %. Kada se stambene zgrade grade u blizini odlagališta otpada, metan može prodrijeti unutar prostorija i povećavati koncentraciju i zbog toga te zgrade trebaju imati pojačanu ventilaciju.
Glavne kemijske reakcije metana su: gorenje, katalitičko parno reformiranje metana i halogenizacija. Općenito, metanove kemijske reakcije je vrlo teško kontrolirati. Na primjer, djelomična oksidacija metanola je teško izvediva, jer se cijelo vrijeme stvara CO2 i voda.
Gorenje metana se događa u par koraka. Prvo se stvara formaldehid (HCHO ili H2CO). Njemu se dodaje radikal HCO, pa se stvara ugljikov monoksid (CO). Taj postupak se naziva piroliza:
- CH4 + O2 → CO + H2 + H2O
Nakon oksidativne pirolize, H2 oksidira, stvarajući vodu H2O i oslobađajući toplinu. To se događa vrlo brzo, za manje od milisekunde.
- 2 H2 + O2 → 2 H2O
Na kraju, CO oksidira i oslobađa još topline. Ovak korak je nešto sporiji, treba mu nekoliko milisekundi.
- 2 CO + O2 → 2 CO2
Sveukupna kemijska reakcija se može pisati:
- CH4(p) + 2 O2(p) → CO2(p) + 2 H2O(k) + 891 kJ/mol (kod standardnih uvjeta)
Gdje oznaka “p” – znači plin, a “k” – kapljevina
Jačina kovalentne veze ugljik – vodik u metanu, je jedna od najjačih veza kod svih ugljikovodika, tako da je kemijska upotreba ograničena. Iako prekid veze C – H predstavlja problem, upotrebljavamo metan kao sirovinu u proizvodnji vodika, u procesu koji se naziva katalitičko parno reformiranje metana. U cijelom tom procesu najvažnije je pronaći povoljan katalizator.[10]
Kemijska reakcija sa svim halogenim elementima je slična:
- CH4 + X2 → CH3X + HX
Gdje X predstavlja halogene elemente: fluor (F), klor (Cl), brom (Br) i jod (I). Taj postupak se naziva halogenizacija slobodnim radikalima. Reakcija s klorom je sljedeća:
1.Stvaranje radikala
Potrebna energija se dobiva od UV zračenja ili grijanja.
2.Izmjena radikala
- CH4 + Cl· → CH3· + HCl + 14 kJ
- CH3· + Cl2 → CH3Cl + Cl· + 100 kJ
3.Poništenje radikala
- 2 Cl· → Cl2 + 239 kJ
- CH3· + Cl· → CH3Cl + 339 kJ
- 2 CH3· → CH3CH3 + 347 kJ


Metan je važno gorivo za proizvodnju električne struje u elektranama, ili za pogon plinskih turbina ili za grijanje pare u kotlovima. Ako usporedimo metan s drugim ugljikovodicima, koje upotrebljavamo kao gorivo, metan stvara manje CO2 po jedinici dobivene energije. S 891 kJ/mol, metan ima manju toplinu izgaranja, od svih drugih ugljikovodika, ali ako ga usporedimo s njegovom molekularnom masom (16 g/mol), onda metan ima najveću toplinu izgaranja po jedinici mase (55,7 kJ/g), od svih ugljikovodika. U mnogim gradovima, zemni plin upotrebljavamo kao gradski plin za kuhanje i grijanje. Kao takav obično od zemnog ili prirodnog plina dobivamo energiju od 39 MJ/m3.
Za pogon motornih vozila, gdje se upotrebljava u jednom od naziva CNG (engl. compressed natural gas) ili ukapljen na temperaturi od -162 °C LNG (engl. liquefied natural gas). Prednosti upotrebe prirodnog plina za pogon je u tome što motori pogonjeni prirodnim plinom ispuštaju za polovicu manje štetnih plinova od odgovarajućih dizelskih motora koji ispunjavaju normu Euro 2. Osim toga, prednost mu se očituje i u činjenici nepostojanja krutih čestica u ispušnoj cijevi, buka je neusporedivo manja kao i niža cijena u odnosu na dizel ili benzin. Prirodni plin je važan i po tome da su autonomija kretanja i nosivost bitno veći nego kod ostalih alternativnih goriva. Budući da CNG ima visoku oktansku broj (120), upotrebljava se kod motora s Ottovim postupkom sagorijevanja, a što ima nešto lošije iskorištenje u odnosu na dizel, ali kako se upotrebljava u režimu siromašne mješavine razlike nisu velike.[11]
Istraživači u NASA-i pokušavaju prmijeniti metan za pogon raketnih motora. Prednost bi bila što bi se metan mogao pronaći na mnogim mjestima u Sunčevom sustavu, pa bi se mogao iskoristiti za povratak na Zemlju, s planeta ili mjeseca. Međutim, raketni motori na metan stvaraju potisak od 33 kN, što je jako daleko od potiska koji proizvodi Space Shuttle, od 31 MN.[12]
Nedavno, metan se počeo uspješno upotrebljavati za proizvodnju električne energije u jednom starom napuštenom rudniku ugljena.
Metan se primjenjuje u industrijskim kemijskim procesima i može se prevoziti kao ohlađena tekućina ili ukapljeni zemni plin. Drugi način prijevoza je kroz plinske cjevovode, gdje se metan kao glavni sastojak zemnog plina, ne mora hladiti.
U kemijskoj industriji, metan je osnovna sirovina za dobivanje vodika, metanola, octene kiseline i drugih kemikalija. Za proizvodnju bilo kojeg od tih proizvoda, metan se prvo treba pretvoriti u sintetički plin, a to je mješavina ugljikovog monoksida i vodika, postupkom katalitičkog parnog reformiranja metana, gdje kao katalizator služi nikal, na visokim temperaturama od 700 °C do 1100 °C.
Omjer između ugljikovog monoksida i vodika u sintetičkom plinu, može se podesiti s kemijskom reakcijom pomaka plina vodom.
- CO + H2O → CO2 + H2
Metan služi i za proizvodnju acetilena ili etina (C2H2), koji se dosta upotrebljava za tzv. autogeno zavarivanje kao gorivi plin u mješavini s kisikom. Metan služi i za proizvodnju kloroforma.


Glavni način dobivanja metana je vađenje zemnog plina iz geoloških nalazišta, koja se nazivaju plinska polja, u kojima se uz metan mogu naći i drugi složeniji ugljikovodici, a ponekad helij i dušik. U nalazištima, metan se stvorio raspadanjem organskih tvari bez prisutnosti kisika a ponekad dolazi duboko ispod Zemljine površine. Općenito, zemni plin se nalazi dublje i na većim temperaturama, od nalazišta nafte.
U Jadranu su istraživanja plinskih polja započela 1968., dok je komercijalna proizvodnja plina započela iskorištavanjem plinskog polja Ivana 1999. Od 2006. u Jadranu je 7 plinskih polja u pogonu.
Metan se dobiva u znatnim količinama na odlagalištima otpada, raspadom organskog smeća.
Metan se može dobiti i s bioplinom, koji iskorištava vrenje organskih tvari bez prisutnosti kisika, kao što su gnoj, otpadne vode, odlagališta otpada, poljoprivredni otpad. Metanski klatrati ili metanski led, na dnu oceana ispod sedimenata, je isto mogući izvor metana u budućnosti. Iz stočnih trbuha godišnje dobivamo oko 16 % metana u Zemljinoj atmosferi ili 37 % metana stvorenog ljudskim djelovanjem.[13]
Industrijski, metan se može dobiti od ugljikovog dioksida i vodika, ili ugljikovog monoksida i vodika, s kemijskim reakcijama kao što su Sabatierova reakcija ili Fischer-Tropschova reakcija (za složenije ugljikovodike). Metan se može dobiti i iz ugljena, ili iz rudnika ugljena.
Metan se stvara na Zemljinoj površini, prije svega u zemlji, rijekama, jezerima, morima i u životinjskim trbusima. Uzlazne struje u tropima ga zatim dižu u stratosferu. Metan je u Zemljinoj atmosferi vrlo važan staklenički plin, jer ima 25 puta veće djelovanje na temperature od CO2, u razdoblju od 100 godina. Metan ima veliki utjecaj u kratkom razdoblju, budući se u prosjeku, nakon 8,4 godine raspadne. Zato ako gledamo utjecaj na globalno zagrijavanje u razdoblju od 20 godina, metan ima 72 puta veće djelovanje na temperature od CO2. Od početka industrijske revolucije do danas, od 1750. do danas koncentracija metana se povećala 150 % i doprinosi oko 20 % na toplinsko zračenje od svih stakleničkih plinova. Zato bi na primjer, izgaranje metana s odlagališta otpada, znatno doprinijelo smanjenju utjecaja stakleničkih plinova na globalno zagrijavanje.[14]
Velika je zabrinutost da će oslobađanje metana iz permafrosta na Arktiku, doprinijeti povećanom globalnom zatopljenje, kao i oslobađanje metana iz metanskih klatrata, s dna oceana.[15]
Metan je otkriven na nekoliko mjesta u Sunčevom sustavu. Najvjerojatnije je nastao procesima bez prisutnosti kisika.
- Mjesec – ima ga u tragovima[16]
- Mars – u atmosferi ga ima oko 0,000001 %. 2009. NASA je pronašla neka mjesta, kao “ventili”, iz kojih izlazi metan.[17]
- Jupiter - u atmosferi ga ima oko 0,3 %.
- Saturn - u atmosferi ga ima oko 0,4 %.
- Uran - u atmosferi ga ima oko 2,3 %.
- Neptun - u atmosferi ga ima oko 1,6 %
- Triton – ima vrlo rijetku atmosferu s metanom u tragovima
- Pluton – mjerenje spektroskopijom je pokazalo da ima metana u tragovima
- Haron – vjeruje se da je metan prisutan
- Eris – infracrveno mjerenje je pokazalo prisutnost leda metana
- Halleyjev komet
- Komet Hyakutake – mjerenja sa Zemlje su pokazala prisutnost etana i metana [19]
- Ekstrasolarni planet HD 189733b – prvo otkriće organskih tvari izvan Sunčevog sustava, ali taj planet ima površinu na 700 ºC, tako da se vjeruje da prevladava ugljikov monoksid[20]
- Maglice ili nebule[21]
| Zajednički poslužitelj ima još gradiva o temi Metan |
- ↑ IPCC Fourth Assessment Report, Working Group 1, Chapter 2
- ↑ Boucher Olivier, Friedlingstein Pierre, Collins Bill, Shine Keith P.: "The indirect global warming potential and global temperature change potential due to methane oxidation", journal=Environmental Research Letters,2009.
- ↑ Ozon – wpływ na życie człowieka, Ozonowanie/Ewa Sroka, Group: Freony i inne związki, Reakcje rozkładu ozonu. Inačica izvorne stranice arhivirana 1. siječnja 2011. Pristupljeno 17. travnja 2011. journal zahtijeva
|journal=(pomoć) - ↑ Twenty Questions And Answers About The Ozone Layer, UNEP/D.W. Fahey 2002 Arhivirana inačica izvorne stranice od 15. lipnja 2011. (Wayback Machine), pp. 12, 34, 38
- ↑ Carbon Dioxide, Methane Rise Sharply in 2007. Inačica izvorne stranice arhivirana 11. kolovoza 2011. Pristupljeno 17. travnja 2011. journal zahtijeva
|journal=(pomoć) - ↑ Methane seen as growing climate risk
- ↑ [1] "Handbook of transport and the environment" David A. Hensher, Kenneth J. Button, publisher=Emerald Group Publishing, 2003.
- ↑ NIST Chemistry Webbook
- ↑ [2] "Methane Gas Hydrate" Ayhan Demirbas, publisher=Springer, 2010.
- ↑ A.F. Cunha: "Applied Catalysis A: General 348" (2008) 103–112
- ↑ Düren Tina, Sarkisov Lev, Yaghi Omar M., Snurr Randall Q.: "Design of New Materials for Methane Storage", journal=Langmuir, 2004.
- ↑ Methane Blast Arhivirana inačica izvorne stranice od 30. kolovoza 2009. (Wayback Machine), NASA, May 4, 2007
- ↑ "Livestock’s Long Shadow–Environmental Issues and Options" [3], publisher=Food and Agriculture Organization of the United Nations (FAO), 2006.
- ↑ "Improved Attribution of Climate Forcing to Emissions", 2009., Shindell D., Faluvegi G., Koch D. M., Schmidt G. A., Unger N., Bauer S. E., journal=Science
- ↑ [4] "Methane Releases From Arctic Shelf May Be Much Larger and Faster Than Anticipated", publisher=National Science Foundation
- ↑ Stern S.A.: "The Lunar atmosphere: History, status, current problems, and context", journal = Rev. Geophys., 1999.
- ↑ [5] "Mars Vents Methane in What Could Be Sign of Life", Washington Post, 2009.
- ↑ "The abundances of constituents of Titan’s atmosphere from the GCMS instrument on the Huygens probe", H. B. Niemann, journal= Nature, 2005.
- ↑ Mumma M.J. "Detection of Abundant Ethane and Methane, Along with Carbon Monoxide and Water, in Comet C/1996 B2", journal=Science, 1996.
- ↑ [6] Arhivirana inačica izvorne stranice od 13. veljače 2008. (Wayback Machine) "Organic molecules found on alien world for first time", 2008., Stephen Battersby, 2008.
- ↑ J. H. Lacy, J. S. Carr, N. J. Evans, II, F. Baas, J. M. Achtermann, J. F. Arens: "Discovery of interstellar methane — Observations of gaseous and solid CH4 absorption toward young stars in molecular clouds", journal=Astrophysical Journal, 1991.



![{\displaystyle \mathrm {Cl_{2}{\xrightarrow[{\triangle }]{UV}}2Cl^{\bullet }-239\;kJ} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/b48ad8a789f8905700f3c192ff4cb248e2a167b0)
![{\displaystyle \mathrm {CH} _{4}+\mathrm {H_{2}O} {\xrightarrow[{700-1100\ \mathrm {^{\circ }C} }]{\mathrm {Ni} }}\mathrm {CO+3H_{2}} }](https://wikimedia.org/api/rest_v1/media/math/render/svg/1296adea95a485e57b14e4f97bca979b32c4dc53)