Plomb
| Plomb | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||

| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Position dans le tableau périodique | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Symbole | Pb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Nom | Plomb | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Numéro atomique | 82 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Groupe | 14 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Période | 6e période | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Bloc | Bloc p | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Famille d'éléments | Métal pauvre | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Configuration électronique | [Xe] 4f14 5d10 6s2 6p2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électrons par niveau d’énergie | 2, 8, 18, 32, 18, 4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés atomiques de l'élément | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse atomique | 207,2 ± 0,1 u[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon atomique (calc) | 180 pm (154 pm) | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de covalence | 146 ± 5 pm[2] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Rayon de van der Waals | 202 pm | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État d’oxydation | 4, 2 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Électronégativité (Pauling) | 2,33 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Oxyde | Amphotère | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergies d’ionisation[3] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 1re : 7,416 63 eV | 2e : 15,032 48 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 3e : 31,937 3 eV | 4e : 42,32 eV | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| 5e : 68,8 eV | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Isotopes les plus stables | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Propriétés physiques du corps simple | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État ordinaire | solide | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Masse volumique | 11,35 g·cm-3 (20 °C)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Système cristallin | Cubique à faces centrées | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Dureté (Mohs) | 1,5 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Couleur | blanc-gris | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point de fusion | 327,46 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Point d’ébullition | 1 749 °C[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de fusion | 4,799 kJ·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Énergie de vaporisation | 179,5 kJ·mol-1 (1 atm, 1 749 °C)[1] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Volume molaire | 18,26×10-6 m3·mol-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Pression de vapeur | 1,3 mbar (973 °C)[4] | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Vitesse du son | 1 260 m·s-1 à 20 °C | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Chaleur massique | 129 J·kg-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité électrique | 4,81×106 S·m-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Conductivité thermique | 35,3 W·m-1·K-1 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Solubilité | sol. dans CH3COOH + H2O2[5], |
||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Divers | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CAS | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No ECHA | 100.028.273 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| No CE | 231-100-4 | ||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Précautions | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SGH[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| État pulvérulent :H360FD, H362, H373, H410, H302+H332, P201, P273, P308 et P314 |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| SIMDUT[7] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
 D2A, |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Transport[4] | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| Unités du SI & CNTP, sauf indication contraire. | |||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||
| modifier |
|||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||||


Le plombÉcouter est l'élément chimique de numéro atomique 82, de symbole Pb. Dans les conditions standard, le corps simple plomb est un métal malléable et gris bleuâtre, qui blanchit lentement en s'oxydant. Le mot plomb et le symbole Pb viennent du latin plumbum (le métal plomb).
Le plomb appartient au groupe 14 et à la période 6 du tableau périodique. C'est le plus « lourd »[a] des éléments stables[b].
Le plomb est un élément toxique, mutagène et reprotoxique[8], sans valeur connue d'oligoélément. Il a en effet été classé comme potentiellement cancérigène en 1980, classé dans le groupe 2B par le Centre international de recherche sur le cancer (CIRC)[9], puis comme probablement cancérigène pour l'humain et l'animal en 2004[9],[10]. Deux sels de plomb, le chromate et l'arséniate, sont considérés comme carcinogènes certains par le CIRC[9].
Le plomb est un contaminant de l'environnement, toxique et écotoxique dès les faibles doses[11]. Les maladies et symptômes qu'il provoque chez l'humain ou l'animal sont regroupés sous le nom de « saturnisme ».
Histoire
Le plomb — relativement abondant dans la croûte terrestre — est l'un des métaux les plus anciennement connus et travaillés. On en a trouvé dans des pigments recouvrant des tombes ou des dépouilles préhistoriques (40 000 ans av. J.-C.), mais aussi des objets.
En dépit de sa haute toxicité, et grâce probablement à sa facilité d'extraction, à sa grande malléabilité et à son point de fusion bas, il a été fréquemment utilisé lors de l'âge du bronze, durci par de l'antimoine et de l'arsenic trouvés sur les mêmes sites miniers.
Il est mentionné dans les écritures cunéiformes sumériennes — sous le vocable a-gar5[12] — il y a près de 5 000 ans, ou encore dans l'Exode, rédigé il y a environ 2 500 ans. C'est souvent aussi un sous-produit de mines d'argent.
À travers les âges, de nombreux écrits relatent sa présence dans des objets ou à travers les cultures. Les Sumériens, les Égyptiens, les Grecs, les Hébreux ou encore les Romains savaient l'extraire. Ils l'utilisaient pour colorer et émailler des céramiques, lester des hameçons, sceller des amphores, produire des fards, du khôl ou produire des objets usuels (de 4 000 à 2 000 ans avant notre ère). On trouve aussi des tuyaux de plomb sur les sites antiques romains.
Au Moyen Âge, les alchimistes croyaient que le plomb était le métal le plus ancien (et le plus froid) et l'associaient à la planète Saturne. C'est pourquoi l'intoxication au plomb est appelée saturnisme[13]. Les alchimistes pouvaient s'y référer sous le terme d'aabam.
Sa toxicité était connue des médecins et des mineurs (esclaves et prisonniers souvent) de l'antiquité. Les Romains l'utilisaient sous forme d'acétate de plomb pour conserver et sucrer leur vin, et s'étaient rendu compte que les gros buveurs, donc de la classe aristocratique, souffraient d'intoxication.
Plus tard, des symptômes spécifiques ont été décrits, associés à des métiers tels que les mineurs, fondeurs, peintres ou artisans fabricants de vitraux.
Le décès d'un enfant en Australie à la fin du XIXe siècle, à la suite d'une intoxication au plomb, fut le premier à sensibiliser un gouvernement. C'est à la suite de l'étude de nombreux cas d'intoxication qu'une réglementation, des recommandations et un dépistage se sont progressivement mis en place dans des pays riches (comme en Europe ou aux États-Unis). Le plomb a ainsi été interdit pour la confection des tuyaux de distribution d'eau potable en Suisse dès 1914[14] mais bien plus tardivement dans les autres pays (par exemple, les peintures au plomb ont été interdites en 1948 en France mais l'interdiction totale pour les canalisations ne date que de 1995[15]).
Isotopes
Le plomb possède 38 isotopes connus, de nombre de masse variant de 178 à 215, ainsi que 46 isomères nucléaires. Quatre de ces isotopes, 204Pb, 206Pb, 207Pb et 208Pb, sont stables, ou du moins ont été observés stables jusqu'à présent, puisqu'ils sont tous soupçonnés de se désintégrer par désintégration α en isotopes du mercure correspondants, avec des demi-vies extrêmement longues[16] (qui seraient même supérieures à la demi-vie théorique de ses constituants, les nucléons[c], allant au-delà de 10100 années[17]'[d]).
Les quatre isotopes stables sont des nucléides primordiaux, produits par processus r dans les supernovas mais surtout dans les collisions d'étoiles à neutrons. Le plomb 204 est entièrement primordial (il n'est pas radiogénique). Les plombs 206, 207 et 208 sont aussi les produits finaux de trois chaînes de désintégration, respectivement la chaîne de l'uranium 238 (ou du radium), de l'uranium 235 et du thorium 232, mais la proportion de plomb radiogénique est sans doute inférieure à 1 %.
Les quatre isotopes stables, 204Pb, 206Pb, 207Pb et 208Pb, sont présents dans la nature dans des proportions qui peuvent varier, mais dans les roches pauvres en uranium et thorium et notamment dans les minerais de plomb (« plomb commun »[18]), ces proportions sont respectivement de 1,4 %, 24,1 %, 22,1 % et 52,4 %. Cinq radioisotopes sont également présents, mais à l'état de traces. La masse atomique standard du plomb est de 207,2(1) u.
Les isotopes sont parfois utilisés pour le traçage isotopique du plomb et lors d'analyses isotopiques destinées à étudier la cinétique environnementale de certains polluants dans l'environnement (ex : plomb de chasse après avoir été solubilisé dans le sang d'un animal atteint de saturnisme, plomb de retombées industrielles, ou plomb tétraéthyle de l'essence…)[19].
Le plomb géochimique et son extraction

Le « plomb géochimique » (le plomb d'origine naturelle) est présent sous diverses formes dans tous les compartiments environnementaux (hydrosphère, stratosphère, biosphère, atmosphère, mais surtout dans la croûte terrestre et le sol).
Sachant qu'il y a des échanges permanents entre ces différents compartiments, et que cet élément toxique est bioconcentré dans la chaîne alimentaire, on comprend donc que l'étude et la connaissance de sa cinétique environnementale est un enjeu majeur.
Il est présent sous beaucoup de formes inorganiques notamment dans la croûte terrestre et les minerais. On retrouve ainsi des acétates, nitrates, carbonates, sulfates ou encore du chlorure de plomb. Ces composés inorganiques conduisent rarement à une toxicité aigüe[13].
Le plomb natif pur est rare. On l'extrait actuellement de minerais associés au zinc (la blende), à l'argent et (le plus abondamment) au cuivre. La principale source minérale est la galène (PbS) qui en contient 86,6 % en masse.
D'autres variétés communes sont la cérusite (PbCO3) et l'anglésite (PbSO4). Aujourd'hui, le recyclage permet d'en récupérer une grande part. La plupart des minerais contiennent moins de 10 % de plomb. Les minerais qui contiennent moins de 3 % de plomb ne peuvent pas être exploités économiquement. Le minerai extrait du sol est concentré par gravimétrie et flottation, puis dirigé vers une usine métallurgique (fonderie).
Production et réserves minières
| Pays | 2013 | 2014 | 2015 | 2016 | 2017 | 2018 | 2019 | 2020 | 2021* |
|---|---|---|---|---|---|---|---|---|---|
| 2 900 | 2 400 | 2 340 | 2 340 | 2 150 | 2 100 | 2 100 | 1 900 | 2 000 | |
| 711 | 728 | 652 | 453 | 459 | 432 | 430 | 494 | 500 | |
| 266 | 278 | 316 | 314 | 307 | 289 | 290 | 242 | 281 | |
| 340 | 379 | 367 | 346 | 310 | 280 | 280 | 306 | 300 | |
| 210 | 250 | 254 | 232 | 243 | 240 | 240 | 260 | 270 | |
| 195 | 90 | 225 | 250 | 200 | 220 | 220 | 210 | 210 | |
| 106 | 106 | 136 | 147 | 170 | 192 | 190 | 204 | 210 | |
| 82 | 94 | 82 | 75 | 110 | 112 | 100 | 65 | 90 | |
| - | 38 | 41 | 41 | 112 | 86 | 90 | 30 | 40 | |
| 62 | 71 | 76 | 79 | 74 | 65 | 60 | 70 | 70 | |
| 78 | 65 | 74 | 76 | 68 | 76 | 70 | 63 | 60 | |
| 53 | 29 | 41 | 40 | - | - | - | - | - |
Métallurgie

À partir de sulfures
À la fonderie, le minerai est tout d'abord « grillé » pour oxyder le sulfure et obtenir de l'oxyde de plomb ; le soufre est éliminé sous forme de dioxyde gazeux SO2, transformé et valorisé en acide sulfurique. Le minerai grillé est alors introduit, avec du coke, dans un four à la base duquel on souffle de l'air. La réaction de l'oxygène de l'air avec le coke donne du CO, qui réduit l'oxyde de plomb, donnant ainsi le plomb métallique liquide et du CO2.
À la base du four s'écoulent d'une part le plomb liquide, d'autre part une scorie qui est généralement granulée à l'eau avant d'être mise en décharge.
Le plomb recueilli à ce stade est appelé « plomb d'œuvre » ; il contient encore des impuretés (cuivre, argent, bismuth, antimoine, arsenic, etc.) qu'il faut éliminer. Ce raffinage du plomb, encore liquide, se fait dans des cuves, par refroidissement et ajout de divers réactifs (soufre, oxygène, zinc pour capturer l'argent, etc.).
Affinage
Le plomb affiné est appelé « plomb doux ». Il est coulé et solidifié dans des lingotières avant d'être expédié chez le consommateur ou dans des entrepôts de stockage. Avant la coulée finale, des éléments peuvent être ajoutés en proportions bien définies pour le durcir ou élaborer des alliages (calcium, arsenic, antimoine, etc.).
Dans certaines fonderies, on utilise à côté des concentrés miniers, des matières premières issues du cassage des batteries, ou des sous-produits d'autres procédés industriels (sulfate de plomb par exemple).
Contaminant métallurgique, parfois
Paradoxalement, pour des raisons mal comprises, le plomb qui a longtemps été massivement utilisé dans les peintures antirouille (minium de plomb) est aussi, dans certaines circonstances, un « contaminant métallurgique » qui pose des problèmes. Il peut, dans l'industrie nucléaire notamment (où il est très présent parce que comptant parmi les métaux les plus opaques aux rayonnements), contribuer à la dissolution, l'oxydation et la fragilisation d'aciers qui sont exposés à ses alliages[23].
Caractéristiques physiques
- Coefficient de dilatation linéique à 25 °C : α = 29 × 10−6 K−1.
- Formule pour la masse volumique du solide : ρ = 11 343,7 / (1 + 0,000029 ⋅ t)3 ; avec ρ en kg/m3 et t en °C.
- Corrélation pour la masse volumique du liquide : ρ = 10 710 - 1,39 ⋅ (t - 327,46) ; avec ρ en kg/m3 et t en °C ; applicable entre 330 et 1 000 °C[1].
- Corrélation pour la valeur de Cp du solide : Cp = 0,1139 + 4,6444 × 10−5 ⋅ (t + 273,15) ; avec Cp en kJ/(kg⋅K) et t en °C ; applicable entre 0 et 300 °C[1].
- Corrélation pour la valeur de Cp du liquide : Cp = 0,1565 - 0,01066 ⋅ (t + 273,15) ; avec Cp en kJ/(kg⋅K) et t en °C ; applicable entre 330 et 1 000 °C[1].
- Corrélation pour la viscosité dynamique du liquide : μ = 5,6452 × 10−9 ⋅ t2 - 9,56425 × 10−6 ⋅ t + 0,005236 ; avec μ en kg/(m⋅s) et t en °C ; applicable entre 330 et 850 °C.
- Corrélation pour la conductivité thermique du liquide : λ = 3,86667 × 10−6 ⋅ t2 - 0,081933 ⋅ t + 18,594 ; avec λ en W/(m⋅K) et t en °C ; applicable entre 330 et 850 °C.
| Température (°C) |
Masse volumique ρ (kg/m3) |
Viscosité dynamique μ (10−3 kg/(m⋅s)) |
Conductivité thermique λ (W/(m⋅K)) |
Capacité thermique à pression constante Cp (kJ/(kg⋅K)) |
Commentaire |
|---|---|---|---|---|---|
| −173.15 | 39,6 | 0,11715 | solide | ||
| 0 | 11 343,7 | 35,3 (35,6) |
0,129 (0,1266) |
solide | |
| 20 | 11 350 (11 324) |
solide | |||
| 25 | 11 319 | 34,6 (35,4) |
0,1277 (0,1297) |
solide | |
| 100 | 11 246 | 34,4 | 0,1311 | solide | |
| 327,46 | 10 710 liquide 11 027 solide |
fusion | |||
| 340 | 10 570 | ||||
| 350 | 10 570 | 2,462 (2,58) |
16,2 | 0,1515 (0,1428) |
liquide |
| 365 | 1,46 | liquide | |||
| 400 | 10 510 (10 525) |
2,272 (2,33) |
15,9 | 0,1508 (0,1466) |
liquide |
| 441 | 10 428 (10 514) |
2,116 | liquide | ||
| 450 | 10 450 | 2,08 | 15,69 | 0,1501 (0,1458) |
liquide |
| 500 | 10 390 (10 430) |
1,893 (1,84) |
15,48 | 0,1493 (0,1451) |
liquide |
| 551 | 10 328 | 1,740 (1,700) |
15,28 | 0,1486 (0,1443) |
liquide |
| 600 | 10 270 | 1,587 (1,38) |
15,07 | 0,1478 (0,1436) |
liquide |
| 703 | 10 163 | 1,349 | liquide | ||
| 844 | 9 992 | 1,185 | liquide | ||
| 1726,85 | 0,1381 | liquide |
Utilisations
Métal ductile
Le plomb sous forme de métal a été employé depuis l'Antiquité en raison de sa grande malléabilité et ductilité : vaisselle, plaques de toiture et de gouttières. Le plomb continue d'être utilisé également dans la plomberie d'art, à mi-chemin entre le cuvelage et la sculpture. Il a été coulé pour sceller du fer forgé dans la pierre (balustrades).
Il est notamment utilisé dans les vitraux. La production liée à cette activité est d'environ 100 t/an en France[24].
Plomberie
Le plomb était employé dans tout le monde romain en raison de sa relative résistance à la corrosion (en milieu non acide) dans l'air et le sol[25] et de son bas point de fusion : on le retrouve dans les conduites d'eau potable (voir plomberie) et les descentes d'eau pluviales.
Revêtement anticorrosion
Il a beaucoup été utilisé en cuvelage et tuyauterie dans la fabrication de l'acide sulfurique, auquel il résiste par formation d'une couche insoluble et protectrice de sulfate de plomb[26].
L'oxyde rouge du plomb, le minium Pb3O4, était utilisé jusque dans les années 1970 comme revêtement anticorrosion.
Batterie d'accumulateurs
Il est largement utilisé aujourd'hui dans les accumulateurs électriques (batteries), qui absorbent l'essentiel de la production de plomb et sont la principale raison des envolées de son cours. Cela a pour conséquence la rentabilité du recyclage de ce métal, notamment en Afrique et en Chine où le parc automobile est en pleine expansion.
En 2004, les batteries au plomb, destinées à l'automobile ou à l'industrie, représentent 72 % de la consommation de plomb (53 % automobile, 19 % industrie). Les pigments et autres composés chimiques représentent 12 % de la consommation. Les autres applications (alliages pour soudures, tuyaux et feuilles, munitions, etc.) représentent 16 %.
Protection contre les radiations

Le plomb (en plaques métalliques, dans du caoutchouc ou dans du verre) sert de protection contre les radiations pour atténuer les rayons X et les rayons gamma grâce à sa densité et à ses propriétés absorbantes : à 100 keV, une épaisseur d'un millimètre de plomb atténue la dose de rayonnement d'un facteur 1 000. D'autres alliages à bas point de fusion comme l'alliage de Newton (50 % Bi, 30 % Sn, 20 % Pb) servent également en radioprotection.
Dans certaines applications très spécifiques en physique des particules pour lesquelles la radioactivité naturelle du plomb 210 est trop importante[f], les blindages peuvent être issus de lingots de vieux plomb retrouvés dans le toit d'églises anciennes ou dans des épaves vieilles de plusieurs siècles, voire plusieurs millénaires[27],[g].
Fusible
Dans le monde de l'électricité, le plomb a longtemps été employé pour la fabrication des fusibles en raison de sa résistance électrique élevée (dix fois celle du cuivre) et de sa basse température de fusion. Le nom « plomb » est encore actuellement utilisé pour désigner les fusibles bien que d'autres matériaux soient employés. Cette utilisation est à l'origine d'expressions comme « faire sauter les plombs ».
Imprimerie
En alliage avec l'étain et l'antimoine, il était utilisé pour la fabrication des caractères mobiles d'imprimerie. On l'appelle alors plomb typographique.
Lubrifiant solide
En sidérurgie, depuis la fin des années 1940, les bains au plomb (« patentage ») ont permis de tréfiler les fils d'acier à des diamètres toujours supérieurs (7, puis 8 mm) sans les rompre, en diminuant suffisamment le coefficient de frottement dans la filière. Le tréfilage produit un écrouissage de l'acier et fournit des aciers à haute limite élastique, dont les principales applications sont les câbles de hauban et les armatures de précontrainte.
Antidétonant dans l'essence
En 1920, le plomb tétraéthyle est utilisé comme additif antidétonant (en) dans l'essence par General Motors, malgré les risques sanitaires. Le plomb tétraéthyle ajouté à l'essence est commercialisé sous le nom d'Ethyl, ce qui évite d'évoquer le plomb. Aux États-Unis, l'utilisation du plomb dans l'essence sera interdite dans les années 1980. En Europe, l'essence au plomb a été interdite en 1999. En France, cette prohibition a été effective en 2000[28].
Munitions
Un des facteurs de toxicité des munitions reste le plomb, massivement utilisé depuis longtemps pour la fabrication de munitions de guerre ou de chasse (grenaille). Avec l'arsenic et l'antimoine qui lui sont associés, il contribue à la pollution induite par les munitions. Dans le cas des plombs de chasse, on retrouve, encore aujourd'hui, des sites contaminés, notamment autour des anciennes tours à plomb (bâtiments en forme de tour, spécialement conçus, sur le principe de la tour d'impesanteur, pour la production industrielle de la grenaille de plomb destinée à remplir les munitions (cartouches) de chasse ou de ball-trap).
Un semi-conducteur : la galène
Le cristal de galène, d'abord utilisé comme pigment noir et ingrédient de base pour la préparation du khôl et du blanc de céruse dans l'Antiquité, offrit, au début du XXe siècle, un semi-conducteur primitif utilisé dans la diode Schottky des premiers récepteurs radio.
Cristal optique

L'ajout de plomb (ou plus précisément de l'oxyde de plomb) à du verre augmente son éclat : c'est là l'origine du cristal vénitien et du verre flint très utilisé en optique. L'association d'un verre flint et d'un verre crown, dans les multiplicateurs de focale type lentille de Barlow, remédie à l'aberration chromatique.
Céramique
En raison de son éclat et du bas point de fusion de ses silicates, le plomb a également été utilisé pour des glaçures de poteries[29], fréquemment sources de saturnisme.
Cosmétique

Pendant la période de l'Égypte antique, le plomb permettait de fabriquer un fard appliqué autour des yeux[30]. On utilisait pour le maquillage le blanc de céruse. Le minium fut d'abord utilisé comme pigment rouge.
Peinture
Comme pour le maquillage, le blanc de céruse et le minium (rouge) furent utilisés pour peindre des tableaux, des meubles, des murs et d'autres produits : jouets, etc.
Réfrigérant à haute température
Le plomb peut être utilisé comme réfrigérant à haute température, seul, ou fréquemment allié au bismuth qui permet d'abaisser sa température de fusion, facilitant ainsi l'exploitation de la boucle fluide. L'alliage 44,5 % Pb – 55,5 % Bi se liquéfie à 125 °C et bout à 1 670 °C.
Il est proposé et étudié (seul ou avec le bismuth) comme fluide caloporteur et réfrigérant, en raison de ses propriétés eutectiques dans des réacteurs nucléaires rapides à caloporteur plomb.
Recyclage
La majeure partie du plomb utilisé pour fabriquer de nouveaux produits est récupérée et recyclée à partir d'autres produits. Le plomb récupéré des batteries au plomb est l'un des métaux les plus recyclés au monde. Tout le plomb contenu dans ces types de batteries peut être récupéré et recyclé pour de nouvelles batteries. Les taux de récupération en Europe et en Amérique du Nord sont proches de 100 %[31].
Le plomb comme contaminant de l'environnement

Le plomb compte avec le mercure et le cadmium parmi les trois contaminants métalliques les plus toxiques et présents de l'environnement de l'anthropocène.
Les analyses des carottes de glace polaires arctiques et antarctiques[32] ou de glaciers montrent qu'il était quasiment absent de l'atmosphère pré-industrielle, sauf dans l'Antiquité gréco-romaine où les fonderies de plomb ont pollué l'environnement[33],[34], parfois à un degré dépassant celui des retombées de plomb de l'essence dans les années 1970[35], signature également retrouvée dans les sédiments des ports de l'Antiquité[36].
La métallurgie antique de l'argent et du plomb a injecté une grande quantité de vapeur de plomb dans l'atmosphère, dont on trouve des traces fossiles dans les tourbières d'Espagne, d'Écosse et des îles Féroé, dans les glaciers du mont Blanc[37] et dans les couches annuelles de la calotte glaciaire du Groenland, avec dans ce dernier cas un niveau de détail « stupéfiant » selon Dennis Kehoe (historien du droit économique romain à l'Université de Tulane de la Nouvelle-Orléans)[38]. L'étude de ces dépôts a montré que les variations de ce plomb suivent fidèlement les grands événements historiques (dont les guerres menées par Jules César), montrant l'expansion, la vie et l'effondrement de l'économie romaine fondée sur la monnaie d'argent dite « denarius » avec laquelle tout était payé dans l'empire[38]. Chaque pièce d'argent coulée impliquait une pollution de l'air par le plomb, et la précision des mesures de plomb dans la glace qui était environ bisannuelle est maintenant presque mensuelle, bien plus précise que dans les tourbières. L'étude la plus récente (2018) portée par Andrew Wilson (archéologue de l'Université d'Oxford) a pu mesurer le plomb avec 12 mesures par couche annuelle sur environ 400 m d'épaisseur de glace groenlandaise (formée entre 1100 av. J.-C. et 800 ap. J.-C.). Le plomb naturel (volcanique) a été évalué et soustrait du total, offrant une chronologie, d'une précision inégalée, très détaillée de 1 900 ans de pollution romaine, maximale à l'apogée de l'Empire lors du premier siècle de notre ère (six fois plus que lors du XIe siècle av. J.-C.) et qui a brutalement retrouvé les niveaux pré-romains juste après la grande épidémie de peste antonine (165 ap. J.-C.), et ce pour environ un demi-siècle. Au milieu de l'ère romaine, l'activité des gisements d'Espagne (haut lieu de la fusion du plomb-argent et du mercure romains, lors des derniers siècles) est aussi enregistrée dans la glace[38]. Les modèles de circulation atmosphérique indiquent que cette pollution (jusqu'à un microgramme de plomb par mètre carré) avait comme principale source l'ouest de l'empire romain (Europe occidentale et septentrionale). La quantité de plomb accumulé sur le Groenland dans les années 1990 était 50 fois plus élevée, relativise Joe McConnell, chercheur du Desert Research Institute de Reno, Nevada et co-auteur principal de l'étude[38]. L'étude montre quelques déconnexions entre les pics de pollution par le plomb et la production connue de pièces d'argent, évoquant un possible stock spéculatif de l'argent (pour une future transformation en pièces de monnaie), ou d'autres pics de fusion de plomb (pour usage militaire par exemple)[38].
Depuis, l'homme a extrait du plomb des minerais et en a introduit dans la biosphère (dans tous les milieux) une quantité croissante, sous diverses formes.
Depuis la révolution industrielle, la pollution routière et industrielle, les guerres ainsi que la chasse et la pêche (munitions et agrès à base de plomb) sont à l'origine d'apports de plomb parfois considérables.
Selon Laurence Lestel (2002)[39], hors séquelles de la première guerre mondiale, ce sont environ 13 millions de tonnes de plomb anthropique qui ont été introduit dans l'environnement en France depuis le début du XIXe siècle, pour 1/3 avant 1914, pour un petit quart durant l'entre-deux guerres et durant la seconde guerre (1918-1945), le reste correspondant à l'après-guerre, même si après les années 1970 des efforts ont été faits pour diminuer certains usages (depuis que l'essence ne contient plus de plomb, c'est le tir qui est la première source environnementale de pollution par le plomb). Ce plomb a été diffusé dans tous les compartiments de l'anthroposystème (produits finis tels que canalisations, peintures, etc.), et comme déchets perdus dans l'air, l'eau, et le sol (dont plombs de pêche et surtout plomb de chasse, tir sportif et de ball-trap). Le recours à l'histoire environnementale et à l'histoire des techniques est nécessaire pour anticiper ses effets futurs sur l'environnement[40].
Ainsi et à titre d'exemple, dans les années 1970, le taux de plomb des glaces du pôle Nord avait augmenté d'un facteur 20 environ, à la suite d'une élévation de la pollution de l'air par le plomb dans l'hémisphère Nord (en grande partie à cause du plomb de l'essence)[41]. En France, l'INRA et les universités régionales ont, dans les années fin 1990 - début 2000, montré qu'environ 45 000 tonnes de plomb se sont ajoutées au fond pédogéochimique naturel des sols forestiers et cultivés de la seule région Nord-Pas-de-Calais (pendant qu'une autre partie était lessivée vers les mers)[42],[43],[44]. De nombreuses analyses sous-estiment la présence du plomb dans le sol, car elles sont faites à partir d'échantillons de sols ou vases finement tamisés et ne prennent pas en compte les munitions ou morceaux de plomb. Le plomb peut en outre agir en synergie avec d'autres éléments-traces métalliques toxiques ou non et d'autres polluants (organiques ou acides par exemple). Or, dans cette même région, le plomb, le cuivre, le cadmium, le mercure et le sélénium sont aujourd'hui trouvés dans les couches récentes labourées à des taux de 84 % à 225 % plus élevés que dans les sols sous-jacents a priori pas ou peu pollués[45].
En Espagne en 2005, les pêcheurs perdaient environ 100 t d'agrès en plomb par an dans l'environnement, et les environ 200 millions de cartouches tirées par environ 1,5 million de chasseurs et pratiquants de tir/ ball-traps en ajoutaient environ 6 000 t/an (en zones humides et sèches) ; ce plomb est responsable d'intoxications mortelles de plusieurs millions d'oiseaux par an[46],[47]. Au Canada, les pêcheurs perdent environ 500 t de plomb lors de leurs activités[48], et aux États-Unis, ce sont environ trois millions de tonnes de plomb qui ont ainsi été dispersées durant le XXe siècle (60 000 t/an au début du XXe siècle)[49].
Les œufs de poule issus de petites fermes[50] et plus encore des poulaillers urbains[51] ou domestiques[52] en contiennent parfois des doses préoccupantes : par exemple, on en a trouvé de moins de 0,05 µg/g (limite de détection) à 0,97 µg/g aux États-Unis pour l'intérieur de 24 œufs pondus par 10 poules d'un poulailler domestique installé près d'un mur dont la peinture contenait du plomb (jusqu'à 1,8 µg/g retrouvé dans les coquilles)[53].
Le plomb n'est ni dégradable ni biodégradable. En tant que contaminant du sol, il est très stable : sa demi-vie géochimique, c'est-à-dire le temps au bout duquel la moitié de ce plomb s'est dispersée hors du compartiment de l'environnement où il est, serait d'environ 7 siècles[54], mais il se montre bien plus mobile (et écotoxique car alors plus biodisponible) dans les milieux naturellement acides ou touchés par l'acidification anthropique. Les analyses de chair de prédateurs situés en tête de réseau trophique donnent des indications sur la bioconcentration du plomb dans la chaîne alimentaire, et celles du (vrai) miel donnent aussi des indications sur la teneur moyenne de l'environnement prospecté par les abeilles qui ont fait ce miel[55]. L'analyse isotopique de ce plomb renseigne aussi sur l'origine du plomb trouvé[56].
Chez l'humain
L'emploi historique du plomb pose des problèmes de toxicité liés à l'absorption de particules de ce métal par les organismes vivants. C'est pourquoi le plomb est dorénavant proscrit pour une certaine gamme de produits : les peintures, les meubles, les crayons et pinceaux pour artiste, les jouets, l'eau et les aliments, les ustensiles de cuisine au contact des aliments, les bavoirs pour bébés et les cosmétiques[57].
Toutefois, chaque pays possède sa propre réglementation ; ainsi, au Royaume-Uni, les plaques de plomb sont encore utilisées en toiture alors qu'en France, elles sont interdites[réf. nécessaire] (hormis dans le cadre de certains monuments historiques, on utilise le zinc, qui a la même apparence une fois oxydé et qui est beaucoup plus léger).
Imprégnation des populations humaines
L'imprégnation est souvent plus élevée dans les régions industrielles minières respectivement concernées par l'extraction et le travail de ce métal, mais de très nombreuses sources d'exposition existent, souvent ubiquitaires, comme les anciennes peintures au plomb, d'anciens émaux au plomb, le plomb de chasse[58] et de pêche… qui expliquent une grande variété de cas d'intoxications.
On s'inquiète le plus de l'exposition périnatale (1000 premiers jours de la vie à partir de la conception).
En 2018 en France, le « Volet périnatal » du programme national de biosurveillance a publié une nouvelle évaluation de l'imprégnation des femmes enceintes pour le plomb (et pour 12 autres métaux ou métalloïdes ainsi que quelques polluants organiques).
Le taux de plomb a été analysé sur des prélèvements de sang de cordon ombilical de 1 968 femmes venant d'accoucher. Elles faisaient toutes partie de la « cohorte Elfe », un panel ne comprenant que des femmes ayant accouché en France en 2011 hors Corse et TOM)[59].
La moyenne géométrique était de 8,30 μg de plomb par litre de sang de cordon, soit un peu moins que lors des études antérieures, françaises et étrangères, confirmant une amélioration qui a commencé avec l'interdiction de l'essence plombée dans les années 1990[59]. Dans 1 % des cas, les 50 μg/l étaient néanmoins dépassés[59]. Dans ce panel, le risque de plombémie élevée du cordon était corrélé à une consommation plus élevée de tabac, d'alcool, d'eau du robinet, de pain, de légumes, de coquillages et crustacés[59], avec un facteur aggravant pour certains pays de naissance de la mère[59] ; les mères ayant augmenté leur consommation de produits laitiers lors de la grossesse présentaient une plombémie de cordon plus basse[59].
Toxicité, reprotoxicité, écotoxicité

Beaucoup d'usages historiques du plomb ou de ses composés sont désormais proscrits en raison de la toxicité du plomb pour le système nerveux et la plupart des organes vitaux (saturnisme). Il a été récemment (2007) montré que — même à faible dose — le plomb a aussi un effet cytotoxique sur les cellules souches du système nerveux central (de même que de faibles doses de mercure ou de paraquat)[63].
Toxicité
Un risque existe dès que du plomb ou certains de ses composés peuvent être inhalés (sous forme de vapeur ou de poussière) ou ingérés, et assimilés par l'organisme. Le passage percutané est également possible. Les principales voies de transport sont l'eau, l'air et les aliments.
Les enfants et femmes enceintes, puis les personnes âgées y sont les plus vulnérables.
- L'embryon et le fœtus : ils ne sont pas protégés par le placenta et y sont extrêmement sensibles, avec des effets différés graves (débilité mentale) pour de faibles doses d'exposition au stade fœtal.
- Les enfants : ils sont souvent les plus touchés, car leur organisme absorbe proportionnellement plus de plomb que celui des adultes. En effet, le système nerveux des enfants et leur squelette sont en développement continu, et leur absorption digestive est trois fois} plus élevée que celle des adultes. Ceci les rend beaucoup plus sensibles vis-à-vis de l'exposition au plomb. L'intoxication de l'enfant est souvent asymptomatique ; c'est alors durant la scolarisation que des effets, comme la baisse du QI, l'anémie, des troubles du comportement, des problèmes de rein, des pertes auditives, se feront ressentir.
Les risques d'intoxication au plomb sont accrus pour les enfants qui jouent au sol, sont plus en contact avec des poussières ou jouent avec des écailles de peinture ou des objets à base de plomb et portent naturellement souvent les doigts ou les objets à la bouche. En suçant ou en manipulant un objet ou jouet en plomb ou peint au plomb, ils peuvent se contaminer avec des microparticules de plomb ou avaler certains objets (grenaille de plomb par exemple). Il arrive qu'ils se fassent les dents sur des objets peints (par exemple, les rebords de châssis de fenêtre)[64]. - Les personnes âgées : en vieillissant, l'organisme élimine moins bien le plomb, et le plomb désorbé de l'os lors d'une ostéoporose passe dans le sang et recontamine la personne.
Des seuils ont autrefois été fixés, mais ils n'ont plus de sens : le plomb est toxique quelle que soit sa dose, et il n'existe pas de seuils de tolérance au plomb, notamment pour les catégories de personnes décrites ci-dessus. Le toxicologue se réfère néanmoins encore parfois à différents types de références (seuils, normes ou doses tolérables ou admissibles), dont : « Dose Journalière Admissible » (DJA), « Dose Journalière Tolérable » (DJT), « Dose hebdomadaire tolérable » (DHT) ou « Dose hebdomadaire tolérable provisoire » (DHTP), « Dose Limite Annuelle » (DLA)…
- Dans l'alimentation, la DHT (dose hebdomadaire tolérable) était en France (avant 2006) provisoirement fixée à 1 500 µg par semaine pour le plomb.
Pour l'Union européenne, les taux maximaux en plomb (en mg/kg de poids frais) sont de 0,3 pour la chair (muscle) de poisson, 0,5 pour les crustacés, 1 pour les céphalopodes et 1,5 pour les mollusques bivalves. Depuis (en 2006), l'OMS a réduit la DHT pour le plomb à 25 µg/kg de poids, soit une dose journalière tolérable de 3,6 μg/kg/j).
Ceci signifie que même le plus petit plomb de pêche commercialisé correspond à une quantité de métal toxique significative, s'il est ingéré sous une forme bioassimilable. - Pour l'eau potable, la norme en France était de 50 microgrammes par litre jusqu'en décembre 2003 ; elle est ensuite passée à 25 microgrammes par litre puis à 10 microgrammes par litre en décembre 2013[65].
Au Canada, elle est de 10 microgrammes par litre depuis 2001[66] ; La concentration maximale acceptable (CMA) pour le plomb total dans l'eau potable est de 0,005 mg/l (5 µg/l), mesurée dans un échantillon d'eau prélevé au robinet et selon le protocole d'échantillonnage approprié au type d'immeuble. Tout doit être mis en œuvre pour maintenir les concentrations de plomb dans l'eau potable au niveau le plus bas qu'il soit raisonnablement possible d'atteindre (ou ALARA)[67]. - Pour les sols, le plomb est naturellement présent (c'est ce qu'on appelle le fond pédogéochimique naturel) à hauteur de quelques dizaines de milligrammes par kilogramme de sol ; par exemple, une synthèse des données existantes sur l'état des sols en France[68][réf. incomplète] montre que les teneurs en plomb de 11 150 échantillons, prélevés en surface des zones agricoles (avant épandage de boues de station d'épuration), sont relativement dispersées, autour d'une moyenne des teneurs de 30,3 mg/kg pour une médiane de 25,6 mg/kg. Un rapport public de synthèse du BRGM donne des valeurs de 10 à 30 mg/kg pour des sols non pollués[69]. Localement, des apports anciens (séquelles de guerre ou industrielles, ou utilisation d'arséniate de plomb comme insecticide) ont pu modifier les teneurs apparemment « naturelles » du sol (dès l'Antiquité romaine).
- Pour la santé, aux États-Unis, la CSPC (Consumer Product Safety Commission) a fixé comme standard qu'une assimilation de plomb équivalent à 175 mg/j nécessite une visite de contrôle.[réf. nécessaire]
En 2011, sur la base des analyses dose-réponse relatives au plomb dans l'alimentation, le comité de l'OMS chargé de réviser la DHTP de 25 μg par kilogramme de poids corporel (PC) précédemment établie par lui a constaté que ce seuil était inapproprié puisque manifestement encore associé à « une diminution d'au moins 3 points de QI chez les enfants et à une augmentation de la pression artérielle systolique d'environ 3 mmHg (0,4 kPa) chez les adultes. Ces changements sont importants lorsqu'on les considère comme un changement dans la distribution du QI ou de la pression de la population au sein d'une population. Le Comité a donc conclu que la DHTP ne pouvait plus être considérée comme une protection de la santé et a été retirée. »[61] Le comité invite aussi à mieux évaluer l'exposition à d'autres sources de plomb qu'alimentaire.
Le Centre international de recherche sur le cancer (CIRC) estimait en 2010 qu'il y avait des preuves suffisantes de cancérogénicité des composés de plomb inorganiques (tumeurs rénales et cérébrales chez les animaux de laboratoire), mais que les preuves de cancérogénicité pour les composés organochlorés étaient inadéquates.
Les études de génotoxicité et d'inhibition de la réparation de l'acide désoxyribonucléique (ADN) suggèrent un mode d'action non ADN-réactif pour sa cancérogénicité[61],[62].
Reprotoxicité
Plusieurs études transversales ont établi qu'une exposition au Plomb est facteur de délétion de la spermatogenèse et de la motilité du sperme. Selon une étude européenne publiée en 2003, environ 450 μg de plomb par litre de sang serait le seuil sous lequel le plomb n'aurait probablement pas d'effet détectable en termes de difficulté augmentée à avoir un enfant[70]. Au-dessus de ce seuil, la relation exposition-réponse est linéaire concernant le délai à concevoir un enfant. La forme du spermatozoïde et l'intégrité de la chromatine de son noyau sont altérés par le plomb (mauvaise condensation de la chromatine du spermatozoïde, peut-être car le plomb entre en compétition avec le zinc, qui est essentiel pour la compaction de l'ADN assurée par les protamines, riches en cystéine). Le sperme serait alors moins fécondant et son ADN serait dégradé. En outre, une peroxydation lipidique peut être induite par le plomb ; elle affecterait le malondialdéhyde libéré dans le liquide séminal, qui dégraderait à son tour la motilité des spermatozoïdes[71]. Cet aspect n'est pas pris en compte en France par les tableaux de maladies professionnelles, bien qu'une enquête SUMER ait montré que de nombreux travailleurs sont encore exposés au plomb, notamment dans le domaine de la construction : 2 % des salariés, soit environ 25 000 personnes dont 85 % des étaient des hommes. 82 % des cas détectés sont des intoxications mineures, mais le plomb est toxique pour le spermatozoïde à faible dose[72].
Écotoxicologie
Le plomb sous forme pure et fine, sous forme de sels simples ou de composé organique (plomb tétraéthyle, qui est par ailleurs très volatil) est plus ou moins facilement assimilé par tous les organismes vivants (faune, flore, fonge, bactéries). Il est hautement écotoxique pour presque toutes les espèces connues, hormis de très rares exceptions (quelques bactéries ou de rares plantes métallo-tolérantes comme la variété Armeria maritima hallerii).
Les sels de plomb sont peu solubles dans l'eau salée ou dure (la présence d'autres sels réduit la disponibilité du plomb pour les organismes en raison de précipitations de plomb). De manière générale, l'acidification d'un milieu (ou d'un tissu vivant comme l'écorce) augmente la solubilité, la mobilité et la biodisponibilité du plomb. Les résultats des tests de toxicité doivent donc être traités en tenant compte du contexte et de ses évolutions, sauf quand la dissolution de plomb est directement mesurée. Le plomb est toxique à n'importe quelle dose : dans l'eau à 0,2 mg/l, la faune aquatique s'appauvrit, et à partir de 0,3 mg/l, les premières espèces de poisson commencent à dépérir[73].
Champignons : ils captent et stockent très bien le plomb, et jouent un rôle important dans le cycle toxique du plomb, au point qu'ils pourraient être utilisés pour dépolluer (fongoremédiation).
Végétaux : la biodisponibilité du plomb pour les végétaux est très aggravée en contexte acide ou acidifié et quand le plomb est sous forme de très fines particules. Ainsi, pour la salade, le transfert sol-racines-feuilles augmente de 20 % si le plomb y est présent sous forme de PM2,5 plutôt que sous forme de PM10[74]. Certains champignons l'assimilent et le stockent très facilement, sans en mourir, et l'activité rhizosphérique semble favoriser la solubilisation du plomb et son transfert dans les plantes, d'autant plus que le sol est acide ou acidifié[74].
Invertébrés : le plomb est hautement toxique pour de nombreux invertébrés, particulièrement pour les invertébrés d'eau douce (dès 0,1 et GT 40 mg/l en eau douce[75]). Les invertébrés marins le tolèrent mieux (résistant à des doses 20 fois plus élevées, mais néanmoins avec une toxicité manifeste dès 2,5 et GT 500 mg/l).
Certains invertébrés montrent des capacités d'adaptation ou se montrent plus « tolérants » au plomb que les autres[75]. Les adaptations de certains invertébrés aquatiques aux conditions hypoxiques peuvent être inhibées par des taux élevés de plomb[75].
- Nématodes : s'ils consomment des champignons ou des bactéries contaminés par du plomb, ils présentent des troubles de la reproduction.
- Crustacés terrestres : certains, comme les Cloportes, semblent particulièrement résistants au plomb.
- Insectes : les larves sont probablement plus vulnérables au plomb que les adultes : des chenilles nourries avec des aliments contenant des sels de plomb présentent des troubles du développement et de la reproduction[75].
Mammifères : ils subissent globalement les mêmes effets que l'être humain.
Poissons : la toxicité du plomb varie selon les espèces, avec des CL50 96-h allant de 1 à 27 mg/l en eau douce, et 440 à 540 mg/l en eau dure ou salée (le plomb se dissout moins bien dans l'eau dure)[75]. Les œufs et très jeunes poissons y sont plus vulnérables que les adultes ; une difformité spinale et un noircissement de la région caudale font partie des symptômes d'intoxication. La dose limite toxique maximale acceptable (MATC pour les anglophones) pour le plomb inorganique varie de 0,04 à 0,198 mg/l (selon les espèces et les conditions, mais les composés organiques sont plus toxiques encore ; la présence de calcium ou autres ions non toxiques en solution diminue la toxicité aiguë du plomb[75].
Amphibiens : les œufs de grenouilles et de crapauds sont vulnérables à des teneurs inférieures à 1 mg/l en eau stagnante et 0,04 mg/l en eau courante, avec des arrêts de développement de l'œuf ou retards d'incubation. Les grenouilles adultes sont affectées à partir de 5 mg/l dans l'eau, et le plomb ingéré par les amphibiens (insectes contaminés, vers de terre, etc.) a des effets toxiques observés à 10 mg/kg[75].
Oiseaux : des sels de plomb ajoutés dans la nourriture intoxiquent les oiseaux à partir d'environ 100 mg/kg de nourriture. L'exposition de cailles (de l'éclosion à l'âge de la reproduction) à une nourriture contenant 10 mg de plomb par kilogramme induit des effets sur la production d'œufs[75].
On a peu d'informations sur les effets des composés organoplombiques (par exemple, des composés trialkyllés affectent les étourneaux dès 0,2 mg/j, 2 mg/j étant invariablement fatal[75]).
L'ingestion de grenaille de plomb est très toxique pour tous les oiseaux. C'est une cause très fréquente de saturnisme aviaire.
Dans les jouets
Mise au jour du problème
Depuis 2007, les médias ont relaté de plus en plus de rappels massifs de jouets. De grands groupes comme Mattel, dont plusieurs jouets ont été rappelés en 2007[76],[77], ont eu beaucoup de soucis avec des jouets contaminés au plomb. Ainsi, en 2007, l'industrie du jouet (22 millions de dollars) a particulièrement été touchée. Sur 81 rappels de jouets, la moitié impliquait six millions de jouets ayant une peinture à base de plomb excédant les limites autorisées. Le problème vient notamment du fait que les grands groupes comme Mattel sous-traitent leur production dans des pays comme la Thaïlande et la Chine[78],[79] où la réglementation et le contrôle des produits finis sont moins courants. S'ajoute à cela un manque de personnel et de budget pour les sociétés de production ainsi qu'un faible nombre de moyens mis en place au niveau des dépistages. Ce sont les enfants des pays en voie de développement qui sont les plus affectés par un taux de plomb élevé.
C'est en 2006 que la problématique a éclaté au grand jour avec la mort par empoisonnement au plomb d'un enfant âgé de 4 ans aux États-Unis. L'autopsie a révélé la présence d'un pendentif en forme de cœur dans l'abdomen ; le pendentif contenait 99,1 % de plomb[80].
Depuis il existe une prise de conscience de la part des pays riches vis-à-vis de ce problème. Ainsi, des associations comme « Kids in Danger » aux États-Unis sont apparues ainsi qu'une ré-actualisation des lois au Québec et en France notamment. Depuis que la problématique est connue de tous, de nombreuses études et analyses ont eu lieu ainsi ; de nouveaux composés nocifs (arsenic et phtalates) ont été trouvés dans les jouets mais les cas restent plus rares[81][réf. incomplète].
Dépistage du saturnisme
La plombémie de l'enfant est généralement mesurée à partir d'une simple piqûre au doigt, à l'hôpital. Le résultat fourni est en µg/l. Les plombémies détectées chez l'enfant s'étendent de 5 à 1 400 ppm.
Chez l'adulte, une plombémie est considérée comme « normale » si inférieure à 0,4 ppm, et la plomburie doit être inférieure à 0,08 ppm.
D'autres techniques de mesure sont possibles, en particulier dans les pays en voie de développement particulièrement touchés par le saturnisme. La tendance est d'utiliser des biomarqueurs humains, et d'échantillonner autre chose que le sang qui ne traduit que l'intoxication éventuelle du moment, alors que les cheveux[82], les dents de lait[83] ou les ongles[84] ont accumulé du plomb sur une plus longue période. On peut ainsi retrouver dans les cheveux une concentration en plomb 10 fois plus élevée que celle présente dans l'urine ou le sang. Il est aussi plus aisé d'échantillonner, conserver et transporter des phanères (cheveux, ongles) que des solutions susceptibles de se dégrader.
L'analyse implique de passer d'un composé solide à un liquide (par dissolution à chaud dans un acide fort en général), ce qui permet la destruction de toute matière organique. Pour les dents, l'émail est attaquée par un mélange HCL/glycérol. L'analyse se fait généralement par absorption atomique de flamme. L'utilisation d'échantillons certifiés (CRM) est un des éléments de validation des méthodes.
Un questionnaire vise à rechercher l'origine de l'intoxication. À titre d'exemple, au Kenya, un enfant vivant dans une maison peinte avait en moyenne une plombémie de 30,2 ± 2,9 µg/g alors qu'un enfant vivant dans une maison non peinte avait en moyenne une plombémie de 19,8 ± 0,9 µg/g.
Il existe d'autres types de matrices pour lesquelles il est important de connaître le taux de plomb (eau, vin, bières, jus de fruits, fruits et légumes, viandes, poissons, crustacés, champignons, lait, fromages…). Les analyses sont parfois complexes car mettant en jeu des réactions de co-précipitations ou dérivations pour pouvoir travailler avec ce type de matrices.
De nouvelles techniques d'analyse pourraient se développer, dont peut-être les analyses par Spectrométrie de fluorescence des rayons X. Des appareils portables (pistolets de fluorescence à rayons X) permettent de faire un premier diagnostic sur le terrain ; il suffit de pointer le pistolet sur un jouet pour avoir une mesure instantanée du plomb total présent à sa surface ou juste sous sa surface. Ces appareils sont encore couteux (ex. : ±30 000 $ pour un analyseur portable[85]).
Des études sur l'animal se poursuivent (rats, souris…) pour évaluer plus finement l'impact de la présence de plomb (dont dans les jouets) sur la physiologie, le comportement et la psychologie du développement, des enfants en particulier[86][réf. incomplète].
Enfin, des procédés visant à traiter les eaux contaminées existent ou sont actuellement en développement, comme des membranes à base de matériaux composites qui, après toute une série d'équilibres avec le plomb en solution, vont pouvoir le capter intégralement en une soixantaine de minutes[87].
Prévention et traitement
Des hôpitaux distribuent dorénavant des fiches explicatives[88] aux parents dans lesquelles ils incitent les familles à venir faire des visites de contrôle de dépistage du plomb surtout s'ils habitent dans une zone à risque (vieilles maisons, proximité d'usines…). Ils leur expliquent aussi notamment quelles sont les sources d'intoxication, les risques que cela implique, et comment combattre cela. Ainsi, une nourriture riche en fer (haricots, épinards…) et en calcium (fromage, lait…) est préconisée.
Au cas où un enfant serait amené à être intoxiqué, son taux de plomb dans le sang peut être abaissé. Pour cela, des lavages gastriques ou encore l'ajout d'agent complexant comme l'EDTA peuvent être effectués. Toutefois, ce ne sont que des techniques visant à baisser la teneur en plomb dans l'organisme, mais en aucun cas elles ne peuvent éliminer tous les effets négatifs[89].
Données économiques
Le plomb est considéré comme une ressource non renouvelable. Après la faillite et/ou le rachat de quelques producteurs importants, le marché est concentré autour des besoins du bâtiment, des batteries, des munitions ainsi que de la radioprotection.
En 2013, le groupe Eco-Bat Technologies, qui recycle le plomb de batteries et produit divers produits en plomb ou à base de plomb, se présente comme leader en France où il opère sous le nom de marque « Le Plomb français », en Europe et dans le monde.
Prix

Le plomb est un métal stratégique dont le prix de vente est très irrégulier, coté en dollars US, en particulier à la Bourse des métaux de Londres[90]. Sur les dix dernières années, les cours ont évolué entre 400 et 3 665 $/t.
En raison de sa toxicité, les interdictions d'usage du plomb se multiplient dans le monde, ce qui aurait dû faire baisser son prix. Mais paradoxalement, c'est le métal dont le prix a le plus augmenté en 2007, face à la demande chinoise de batteries selon les uns, face à un marché qui s'est refermé et qui est contrôlé par quelques grands groupes selon les autres ; rachats et/ou fermeture d'usines (fermeture de Metaleurop Nord en France par exemple), usines en difficultés pour cause de pollution et problèmes sanitaires (ex : Bourg-Fidèle), fermeture en Australie en 2007 de la mine Magellan (3 % de la production mondiale, plus grande mine du monde), suivie d'une explosion dans une raffinerie (Doe Run) du Missouri qui a encore fait grimper les prix. En six mois, le prix du plomb a doublé, il a été multiplié par sept en quatre ans, atteignant un record en (3 655 $/t, contre 500 $/t en 2003). Le , son prix dépassait celui de l'aluminium avant de dépasser celui du zinc. Dix ans plus tard, en , il se vendait à 2 037 €/t (2 281 $/t), soit + 26,6 % sur un an[91].
Production mondiale
La demande grimpait de 2 % par an jusqu'en 2004 (à 80 % pour fabriquer des batteries). Le stock mondial mi-2007 est tombé à 30 000 tonnes. « Soit 2 jours de consommation »[92]. La Chambre syndicale du plomb voit une vertu positive à cette demande : elle devrait encourager un meilleur recyclage des batteries « (de 130 euros la tonne, leur prix a bondi à 350 euros en un an) »[93].
| Consommation mondiale 2004 : 7 082 milliers de tonnes (kt) |
Production mondiale de plomb métal 2004 : 6 822 kt | |
|---|---|---|
| Continent | Milliers de tonnes | |
| Asie | 2 870 | 2 880 |
| Amériques | 2 030 | 2 009 |
| Europe | 2 011 | 1 551 |
| Afrique | 131 | 101 |
| Océanie | 40 | 281 |
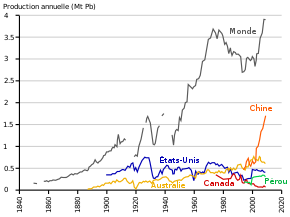
| Pays | Production (t) | Mondial (%) | |
|---|---|---|---|
| 1 | Chine | 2 850 000 | 52,6 |
| 2 | Australie | 711 000 | 13,1 |
| 3 | États-Unis | 340 000 | 6,3 |
| 4 | Pérou | 266 500 | 4,9 |
| 5 | Mexique | 250 000 | 4,6 |
| 6 | Russie | 143 000 | 2,6 |
| 7 | Inde | 105 000 | 1,9 |
| 8 | Bolivie | 82 100 | 1,5 |
| 9 | Turquie | 78 000 | 1,4 |
| 10 | Suède | 59 600 | 1,1 |
| Total monde | 5 414 000 | 100 | |
Le plomb métallique est produit dans des usines appelées fonderies (voir ci-dessus chapitre métallurgie), dont les matières premières proviennent soit de mines (concentrés miniers) soit du recyclage (en particulier le recyclage des batteries usagées). Sur les 6,8 millions de tonnes de production, environ 3 millions proviennent de concentrés miniers et 3,8 millions du recyclage.
Le recyclage est devenu maintenant la première source de plomb[réf. nécessaire].
En résumé, il est important de se souvenir que la consommation mondiale de plomb ne cesse d'augmenter depuis le Moyen Âge. Depuis deux décennies, elle tend à stagner dans les pays développés car ceux-ci ont pris conscience des dangers liés à sa toxicité. Ils ont cherché des substituts au plomb et ont mis en place un certain nombre de normes liées à son utilisation. Par contre, des pays en voie de développement continuent de l'utiliser pour certains usages ailleurs interdits et leur consommation de plomb ne cesse d'augmenter faute d'utilisation d'alternatives au plomb[13].
Commerce
En 2014, la France est nette importatrice de plomb, d'après les douanes françaises. Le prix moyen à la tonne à l'import était de 1 830 €[95].
Règlementation
Cette règlementation varie selon les pays et les époques. Dans l'Union européenne le plomb a peu à peu été interdit pour un certain nombre d'usages (en commençant par les peintures et les contenants alimentaires, les tuyaux d'adduction d'eau), et il doit légalement être recherché parmi quelques polluants « prioritaires », notamment dans l'eau potable, l'air et les aliments, où il ne doit pas dépasser certaines doses.
À titre d'exemple :
- Le , la Directive RoHS limite son usage dans certains produits commercialisés en Europe ; usage limités à 0,1 % du poids de matériau homogène (cette Directive pourra être élargie à d'autres produits et à d'autres toxiques). À noter que des listes d'exemptions autorisent des seuils supérieurs à cette valeur, pour certaines catégories de matériaux.
- En France,
- Il est interdit dans les grenailles de plomb de certaines cartouches de chasse, mais uniquement pour la chasse (au gibier d'eau) dans les zones humides, mais il reste autorisé pour les diabolos, les balles (et les cartouches utilisées hors-zones humides) ainsi que dans l'azoture de plomb qui peut remplacer le fulminate de mercure dans l'amorce des cartouches ou balles.
- Sang
- Air
- Eau potable
- 10 µg/l : limite de qualité propre à la consommation humaine depuis le 25 décembre 2013[97].
- Poussières de plomb
- L'arrêté du 12 mai 2009 relatif au contrôle des travaux en présence de plomb, précise qu'à l'issue des travaux, le taux de plomb des poussières (au sol, par unité de surface) ne doit pas dépasser le seuil de 1 000 μg/m2 (arrêté du 12 mai 2009 relatif au contrôle des travaux en présence de plomb)[98]. À la suite de l'incendie de la cathédrale Notre-Dame de Paris, l'Agence Régionale de Santé (ARS) a fixé ce seuil à 5 000 μg/m2[97].
- 70 μg par m2 de poussière au sol (moyenne sur l'ensemble des pièces fréquentées par les enfants) est le « seuil d'intervention rapide » retenu par l'ARS pour les crèches et les écoles accueillant des enfants de moins de 7 ans (cf. Annexe 4 de l'instruction DGS/EA1/EA2/EA3/EA4/ 2016/283)[98]
Symbolique
Les noces de plomb symbolisent les 14 ans de mariage dans la tradition française.
Le plomb est le 5e niveau dans la progression de la Sarbacane sportive.
Le plomb symbolise la lourdeur, l'oppression : un sommeil de plomb, un soleil de plomb, une chape de plomb, un projet qui a du plomb dans l'aile.
Calendrier républicain
Dans le calendrier républicain, le Plomb était le nom attribué au 27e jour du mois de nivôse[99].
Notes et références
Notes
- Quand on parle d'élément léger ou lourd, on fait en réalité référence au numéro atomique, qui pour l'essentiel va de pair avec la masse atomique. Le métal plomb n'est en revanche pas le corps simple le plus dense (c'est-à-dire de plus grande masse volumique), dépassé notamment, en ce sens, par l'osmium (dont le numéro atomique n'est que de 76).
- Un élément stable est un élément chimique dont au moins un isotope est stable.
- C'est en effet possible qu'une structure composite soit intrinsèquement plus stable que ses constituants ; on peut prendre par exemple un hydrocarbure incorporant du carbone 14 et du tritium : la molécule peut être plus stable que les atomes dont elle est constituée.
- Ces demi-vies prédites sont de :
- Les valeurs entre parenthèses correspondent à une autre détermination de la grandeur physique.
- Le plomb terrestre contient naturellement du plomb 210 issu de la décomposition radioactive de l'uranium 238.
- La période radioactive du plomb 210 étant de 22,26 ans, un séjour au fond de la mer de 200 ans par exemple diminue sa proportion d'un facteur 507, et 2 000 ans d'un facteur 9 × 1028.
- Pour plus de détails, consulter le site de l'International Lead and Zinc Study Group.
Références
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC Press Inc, , 90e éd., 2804 p., Relié (ISBN 978-1-420-09084-0).
- (en) Beatriz Cordero, Verónica Gómez, Ana E. Platero-Prats, Marc Revés, Jorge Echeverría, Eduard Cremades, Flavia Barragán et Santiago Alvarez, « Covalent radii revisited », Dalton Transactions, , p. 2832 - 2838 (DOI 10.1039/b801115j).
- (en) David R. Lide, CRC Handbook of Chemistry and Physics, CRC, , 89e éd., p. 10-203.
- Entrée « Lead, Powder » dans la base de données de produits chimiques GESTIS de la IFA (organisme allemand responsable de la sécurité et de la santé au travail) (allemand, anglais), accès le 30 juin 2018 (JavaScript nécessaire).
- (en) Metals handbook, vol. 10 : Materials characterization, ASM International, , 1310 p. (ISBN 0-87170-007-7), p. 346.
- (en) Thomas R. Dulski, A manual for the chemical analysis of metals, vol. 25, ASTM International, , 251 p. (ISBN 0803120664, lire en ligne), p. 71.
- « Plomb » dans la base de données de produits chimiques Reptox de la CSST (organisme québécois responsable de la sécurité et de la santé au travail), consulté le 25 avril 2009.
- N. Ait Hamadouche et M. Slimani, « Toxicité du plomb et fertilité », sur toxicologie-clinique.org (version du sur Internet Archive).
- Robert R. Lauwerys, Vincent Haufroid, Perrine et Dominique Lison, Toxicologie industrielle et intoxications professionnelles, Elsevier Masson, (ISBN 978-2-294-01418-5, lire en ligne).
- F. Pillière, « Biométrologie », dans B. Hervé-Bazin, B. Courtois, P. Goutet, M. Guillemin, Le risque cancérogène du plomb : évaluation du risque cancérogène lié à l'exposition professionnelle au plomb et à ses composés inorganiques, EDP Sciences, coll. « Avis d'experts », , 356 p., p. 105–154.
- Valérie Cappuyns, Rudy Swennen, A. Vandamme et M. Niclaes, « Environmental impact of the former Pb–Zn mining and smelting in East Belgium », Journal of Geochemical Exploration, extended Abstracts presented at the 7th Symp. on the Geochemistry of the Earth's Surface (GES-7), vol. 88, no 1, , p. 6–9 (ISSN 0375-6742, DOI 10.1016/j.gexplo.2005.08.005, lire en ligne, consulté le ).
- John A. Halloran, Sumerian lexicon version 3.0.
- EMC-toxicologie Pathologie 2 (2005) 67-88.
- Source : site suisse d'information sur l'eau potable.
- https://www.123-diagnostic.com/dos1-plomb-saturnisme.htm, fiche d'information pour les professionnels.
- Audi et al. 2003, p. 108–10.
- Beeman, Bellini et Cardani 2013.
- (en) Tom Andersen, « Correction of common lead in U–Pb analyses that do not report 204Pb », Chemical Geology, vol. 192, nos 1-2, , p. 59-79 (DOI 10.1016/S0009-2541(02)00195-X).
- (en) Fowler, D., Skiba, U., Nemitz, E., Choubedar, F., B ranford, D., Donovan, R., Rowland, P.(2004) Measuring aerosol and heavy metal deposition on urban woodland and grass using inventories of 210 Pb and metal concentrations in soil. Water Air and Soil Pollution 4, 483-499.
- (en) Mineral Commodity Summaries 2022, (DOI 10.3133/mcs2022, lire en ligne).
- « Principaux pays producteurs de plomb dans le monde de 2013 à 2021 », sur statista.com (consulté le ).
- « Faits sur le plomb », sur rncan.gc.ca (consulté le ).
- AEN Infos 2012 – No. 30.1, PDF, 31pp. (ISSN 1605-959X), voir p. 23.
- Christophe Meunier, « Vers une interdiction du plomb en Europe ? Les artisans du vitrail craignent de voir disparaître leur métier », sur France 3 Normandie, .
- D’après (en) S.B. Lyon, Shreir's Corrosion, vol. 3 (DOI 10.1016/B978-044452787-5.00098-6, lire en ligne), « 3.11 - Corrosion of Lead and its Alloys », p. 2053-2067.
- J. Kruger, « Lead Alloys: Corrosion », Encyclopedia of Materials: Science and Technology, Pages 4438 doi:10.1016/B0-08-043152-6/00779-8 (Résumé).
- (en) Nicola Nosengo, « Roman ingots to shield particle detectors », Nature News, (lire en ligne).
- Rémy Slama, Le mal du dehors : L'influence de l'environnement sur la santé, Editions Quae, , 376 p. (ISBN 978-2-7592-2699-3, lire en ligne), Chapitre 16 : « Plomb, mercure et autres métaux. » Page 242..
- D’après Wolf-E. Matthes (trad. Alexandre Avon), Émaux et glaçures céramiques : Plus de 1100 formules, Eyrolles, (réimpr. 2010), 501 p. (ISBN 978-2-212-12824-6, lire en ligne), « Europe centrale jusqu'au début du XXe siècle », p. 137.
- (en) Lucile Beck, Ingrid Caffy, Emmanuelle Delqué-Količ, Christophe Moreau, Jean-Pascal Dumoulin, Marion Perron, Hélène Guichard et Violaine Jeammet, « Absolute dating of lead carbonates in ancient cosmetics by radiocarbon », Communications Chemistry, vol. 1, no 1, (ISSN 2399-3669, DOI 10.1038/s42004-018-0034-y, lire en ligne, consulté le ).
- « Faits sur le plomb », sur rncan.gc.ca, (consulté le ).
- Amy Ng et Clair Patterson, « Natural concentrations of lead in ancient Arctic and Antarctic ice », Geochimica et Cosmochimica Acta, vol. 45, no 11, 1981, p. 2109–2121 (résumé).
- Claude Boutron, Kevin Rosman, Carlo Barbante, M. Bolshov, F. Adams, S. Hong et C. Ferrari, « L'archivage des activités humaines par les neiges et glaces polaires: le cas du plomb », Comptes Rendus Geoscience, vol. 336, no 10, 2004, p. 847–867 (résumé).
- Hervé Guyard, Emmanuel Chapron, Guillaume St-Onge, F. S. Anselmetti, F. Arnaud, O. Magand et al., « High-altitude varve records of abrupt environmental changes and mining activity over the last 4000 years in the Western French Alps (Lake Bramant, Grandes Rousses Massif) » [PDF], Quaternary science reviews, vol. 26 no 19, 2007, p. 2644–2660.
- Fabien Arnaud, Joël Serralongue, Thierry Winiarski, M. Desmet et M. Paterne, « Pollution au plomb dans la Savoie antique (IIe – IIIe siècle ap. J.-C.) en relation avec une installation métallurgique de la cité de Vienne », Comptes Rendus Geoscience, vol. 338, no 4, 2006, p. 244–252 (résumé).
- H. Delile, Signatures des paléo-pollutions et des paléo-environnements dans les archives sédimentaires des ports antiques de Rome et d’Éphèse, Université Lumière Lyon 2 (Doctoral dissertation, Université Lumière Lyon 2), 2014.
- (en) « Les glaces du Mont-Blanc ont gardé les traces de la pollution de l’époque Romaine », CNRS (consulté le ).
- (en) K. Langin, « Rise and fall of Roman Empire exposed in Greenland ice samples », Science (News), 14 mai 2018. Cf. étude publiée dans Climate Environment (DOI 10.1126/science.aau1738).
- Laurence Lestel, « Le plomb », 2002, dans S. Barles, S. (ed.), Analyse rétrospective du système Seine, rapport de synthèse dans le cadre du programme PIREN-Seine 1998-2001, Paris, UMR CNRS 7619 Sisyphe, p. 26–30.
- Sabine Barles, « Le métabolisme urbain et la question écologique », Les Annales de la Recherche Urbaine, vol. 92, no 1, , p. 143–150 (DOI 10.3406/aru.2002.2469, lire en ligne, consulté le ).
- Ifremer, Le plomb en milieu marin : biogéochimie et écotoxicologie [PDF], Ifremer, Repères Océans, 1993 ; Monographie coordonnée par Daniel Cossa, 77 p. (ISSN 1240-1153).
- Thibault Sterckeman, Francis Douay, Denis Baize, H. Fourrier, N. Proix, C. Schvartz, « Trace elements in soils developed in sedimentary materials from northern France », Geoderma, vol. 136, no 3-4, 2006, p. 912–926.
- (en) T. Sterckeman, F. Douay, N. Proix et H. Fourrier, « Vertical distribution of Cd, Pb and Zn in soils near smelters in the North of France », Environmental Pollution, vol. 107, no 3, , p. 377–389 (ISSN 0269-7491, e-ISSN 1873-6424, OCLC 117564299, PMID 15092984, DOI 10.1016/s0269-7491(99)00165-7, HAL hal-02698839).
- Thibault, Sterckeman, Francis Douay, Nicolas Proix, H. Fourrier, E. Perdrix, « Assessment of the contamination of cultivated soils by eighteen trace elements around smelters in the North of France », Water, Air, and Soil Pollution, vol. 135, 2002, p. 173–194.
- Thibault Sterckeman, Francis Douay, Denis Baize, Hervé Fourrier, Nicolas Proix et Christian Schvartz, « Factors affecting trace element concentrations in soils developed on recent marine deposits from northern France », Applied Geochemistry vol. 19, no 1, janvier 2004, p. 89–103 (résumé).
- Raimon Guitart, S. Mañosa, Vermon G. Thomas, R. Mateo, « Perdigones y pesos de plomo: Ecotoxicología y efectos para la fauna », Revista de Toxicología, vol. 16, no 1, 1999, p. 3–11.
- Étude conjointe du département de toxicologie de l'université autonome de Barcelone et du Département de biologie intégrative de l'université canadienne de Guelph : Raimon Guitart et Vernon G. Thomas, « ¿ Es el plomo empleado en deportes (caza, tiro y pesca deportiva) un problema de salud pública infravalorado? », Revista Española de Salud Pública, vol. 79, no 6, 2005, p. 621–632.
- Anton M. Scheuhammer, S.-L. Money, D.-A. Kirk et G. Donaldson, « Lead fishing sinkers and jigs in Canada: Review of their use patterns and toxic impacts on wildlife », Occasional Paper no 108, CWS, Ottawa, Canada, 2003.
- J. R. Craig, J. D. Rimstidt, C. A. Bonnaffon, T. K. Collins et P. F. Scanlon, « Surface water transport of lead at a shooting range », Bulletin of Environment Contamination and Toxicology, vol. 63, no 3, 1999, p. 312.
- D. W. Trampel et al., « Lead contamination of chicken eggs and tissues from a small farm flock », Journal of Veterinary Diagnostic Investigation, vol. 15, no 5, 2003, p. 418–422 (DOI : 10.1177/104063870301500503).
- J. Scelfo, « High lead found in city-sourced eggs », The New York Times, New York, New York Times Company, 2012.
- P. Pierce, « Keeping the lead out of eggs », San Francisco Chronicle, San Francisco, Hearst Communications, Inc., 2013.
- Adrienne C. Bautista, Birgit Puschner & Robert H. Poppenga, « Lead exposure from backyard chicken eggs: A public health risk ? », Journal of Medical Toxicology, vol. 10, 2014, p. 311–315.
- Réda M. Semlali, J.-B. Dessogne, F. Monna, J. Bolte, S. Azimi, N. Navarro et al., « Modeling lead input and output in soils using lead isotopic geochemistry ». Environmental Science and Technology, vol. 38, no 5, 2004, p. 1513–1521.
- (en) Kate E. Smith, Dominique Weis, Sean R. Scott, Carl J. Berg, Yaffa Segal et Philippe Claeys, « Regional and global perspectives of honey as a record of lead in the environment », Environmental Research, vol. 195, , p. 110800 (ISSN 0013-9351, DOI 10.1016/j.envres.2021.110800, lire en ligne, consulté le ).
- (en) Brian Gulson et al., « Successful application of lead isotopes in source apportionment, legal proceedings, remediation and monitoring », Environmental Research, vol. 112, , p. 100–110 (ISSN 0013-9351, DOI 10.1016/j.envres.2011.08.007).
- (en) « A Poison Kiss: The Problem of Lead in Lipstick » [« Le problème du plomb dans le rouge à lèvres »], page consacrée au rapport Poison Kiss de la campagne nord-américaine safe cosmetics (version du sur Internet Archive).
- Evelyne Moulin, La chasse est mauvaise pour la santé : les chasseurs nous empoisonnent-ils ?, Ardenais, Asclépiades, , 104 p. (ISBN 978-2-915238-35-8).
- Imprégnation des femmes enceintes par les polluants de l’environnement en France en 2011 : Volet périnatal du programme national de biosurveillance mis en oeuvre au sein de la cohorte Elfe., t. 2 : métaux et métalloïdes, Agence nationale de santé publique, (lire en ligne [PDF]).
- Source : préfecture / CIRE Rhône Alpes ; janvier 2010 (consulté le ).
- (en) Comité mixte FAO-OMS d'experts des additifs alimentaires, Evaluation of certain food additives and contaminants, Organisation mondiale de la santé, , 237 p. (ISBN 978-92-4-120960-1, lire en ligne [PDF]), p. 164, 175 et 177.
- EFSA (2010). Scientific Opinion on Lead in Food. EFSA Journal. ;8(4):1570:151p.
- Li Z, Dong T, Proschel C, Noble M. 2007. Chemically diverse toxicants converge on Fyn and c-Cbl to disrupt precursor cell function. PLoS Biol 5(2):e35.
- National Institute of Environmental Health Sciences, Environmental Health perspectives, vol 116, number 2, Feb 2008 ; Institut de veille sanitaire, Intérêt d’une limitation des usages du Pb dans certains produits de consommation : note technique, 2007.
- Arrêté du 11 janvier 2007 relatif aux limites et références de qualité des eaux brutes et des eaux destinées à la consommation humaine mentionnées aux articles R. 1321-2, R. 1321-3, R. 1321-7 et R. 1321-38 du code de la santé publique (lire en ligne).
- Le plomb dans l’eau potable, MDDEP, Canada.
- « Recommandations pour la qualité de l'eau potable au Canada : document technique – le plomb », sur canada.ca, (consulté le ).
- Baize, 1994, 1997.
- Rapport public de synthèse [PDF], BRGM.
- Michael Joffe, Luigi Bisanti, Pietro Apostoli et al., « Time to pregnancy and occupational lead exposure », Occupational and environmental medicine, 2003, vol. 60, no 10, p. 752–758.
- (en) Aleksandra Kasperczyk, Sławomir Kasperczyk, Stanisław Horak, A. Ostałowska, E. Grucka-Mamzar, E. Romuk, A. Olejek et E. Birkner, Assessment of semen function and lipid peroxidation among lead exposed men, Toxicology and applied pharmacology, vol. 228, no 3, 2008, p. 378–84.
- 30e journées nationales de santé au travail dans le bâtiment et les travaux publics / Risques chimiques dans le BTP [PDF], 10 au 12 juin 2009, Blois, annales, 153 pages.
- M. Gille, DVGW (Deutscher Verein des Gas-und Wasserfaches) eV Annual report 1994, partie 1, Ev Edition, 1985, cité par B. Benadda, « Etat de l’art concernant la mesure des émissions et le traitement des métaux dans les fumées : Cas du cadmium, du mercure et du plomb », Laepsi Insa de Lyon, (lire en ligne [PDF]).
- Gaëlle Uzu, Spéciation, transfert vers les végétaux et approche toxicologique des émissions atmosphériques d'une usine de recyclage de plomb, thèse de Doctorat en Biogéochimie de l'environnement, Université de Toulouse, 2009 [lire en ligne], p. 45, 214.
- Rapport OMS/ONU, International programme on chemical safety ; environmental health criteria 85 ; lead - environmental aspects [lire en ligne], chap. 1.2.7 : « Intake of lead shot ».
- « Mattel Consumer Relations Answer Center - Recall », sur service.mattel.com (consulté le ).
- « Plomb dans les jouets: Etats-Unis et Europe réagissent », sur Journal de l'environnement (version du sur Internet Archive).
- « Encore du plomb dans les jouets », sur Radio-Canada, (consulté le ).
- « Le côté sombre du miracle chinois », sur Radio-Canada, (consulté le ).
- (en) Pamela A. Meyer, Mary Jean Brown et Henry Falk, « Global approach to reducing lead exposure and poisoning », Mutation Research/Revieuws in Mutation Research, volume 659, no 1-2, juillet-août 2008, p. 166-175.
- Environmental Health persepectives, vol. 116, no 2, février 2008.
- (en) R. M. Cespón-Romero et M. C. Yebra-Biurrun, « Flow injection determination of lead and cadmium in hair samples from workers exposed to welding fumes », Analytica Chimica Acta, vol. 600, nos 1-2, , p. 221–225 (ISSN 0003-2670, DOI 10.1016/j.aca.2006.11.075, lire en ligne, consulté le ).
- Ma.Guadalupe Alvear Galindo, Jorge Carreón García, Alejandra Moreno Altamirano, Juan Antonio Cuéllar López et Liria Yamamoto Kimura, « Lead exposure in students in Mexico City », Ecotoxicology and Environmental Safety, vol. 29, no 1, , p. 122–129 (ISSN 0147-6513, DOI 10.1016/0147-6513(94)90037-x).
- (en) Faridah Hussein Were, Wilson Njue, Jane Murungi et Ruth Wanjau, « Use of human nails as bio-indicators of heavy metals environmental exposure among school age children in Kenya », Science of The Total Environment, vol. 393, nos 2-3, , p. 376-384 (ISSN 0048-9697, DOI 10.1016/j.scitotenv.2007.12.035).
- (en) « Niton Alloy Analyzer - Metal Analysis - Portable Alloy Analyzers » (version du sur Internet Archive).
- (en) P.P. Silveira et al., Psychology and Behavior, 2008.
- Musa Şölener, Sibel Tunali, A. Safa Özcan, Adnan Özcan et Tevfik Gedikbey, « Adsorption characteristics of lead(II) ions onto the clay/poly(methoxyethyl)acrylamide (PMEA) composite from aqueous solutions », Desalination, vol. 223, nos 1-3, , p. 308–322 (ISSN 0011-9164, DOI 10.1016/j.desal.2007.01.221, lire en ligne, consulté le ).
- Département de la santé de New York, « Programme De Prévention Contre L'Empoisonnement Par Le Plomb Chez L'Enfant » [PDF], sur okinternational.org (consulté le ).
- Institut de veille sanitaire-intérêt d’une limitation des usages du Pb dans certains produits de consommation-note technique-2007.
- « The London Metal Exchange », sur lme.com.
- Hugo Franceschi, « Prix des métaux 2024 : tous les tarifs en avril », sur journaldunet.fr, (consulté le ).
- Source : Emmanuel Painchault, de la Société générale Asset Management, cité par le journal Le Monde (2007 09 03).
- Source : envolée de la demande chinoise propulse le plomb à des niveaux records, journal Le Monde (2007 09 03).
- « be3m », sur mineralinfo.fr (consulté le ).
- « Indicateur des échanges import/export », sur Direction générale des douanes. Indiquer NC8=28241000 (consulté le ).
- DGS_Anne.M, « Saturnisme », sur Ministère des Solidarités et de la Santé, (consulté le ).
- Jérémie Baruch et Audrey Freynet, « Incendie de Notre-Dame : un seuil de concentration du plomb dangereux pour la population ? », Le Monde, (lire en ligne, consulté le ).
- ARS Ile-de-France (2019) Point de situation relatif à l'incendie de Notre-Dame de Paris ; 19 juillet 2019 ; voir notamment p. 34/109 et p. 76/109.
- Ph. Fr. Na. Fabre d'Églantine, Rapport fait à la Convention nationale dans la séance du 3 du second mois de la seconde année de la République Française, p. 22.
Voir aussi
Bibliographie
- Jamie Lincoln Kitman, L'histoire secrète du plomb, éditions Allia, 2005 (traduction Arnaud Pouillot).
- (en) ARC, Inorganic and Organic Lead Compounds ; Monographie de l'ARC Monographs on the Evaluation of Carcinogenic Risks to Humans, Volume 87, 2006, 506 pp., 7.4 MB.
- Ifremer, le plomb en milieu marin, monographie rédigée par Daniel Cossa, Françoise Elbaz-Poulichet, Mauricette Gnassia-Barelli et Michèle Romeo, 1993, PDF, 77 p. (ISSN 1240-1153).
- (en) Jonasson M. E. & Afshari R., « Historical documentation of lead toxicity prior to the 20th century in English literature », Human & experimental toxicology, 37(8), 2018, p. 775-788 (résumé).
Cartographies
- Carte de contamination moyenne des sols français au-dessous ou en dessous du seuil de 30 mg/kg (teneur totale en plomb du sol superficiel, période 2000-2010 France métropolitaine), sur l'outil GEOIDD, avec possibilité de détail et rapport par commune (cette carte n'indique pas les dépassements du seuil de 100 mg/kg).
Articles connexes
Liens externes
- Ressources relatives à la santé :
- Ressource relative aux beaux-arts :
- Notices dans des dictionnaires ou encyclopédies généralistes :
- (en) « Technical data for Lead » (consulté le ), avec en sous-pages les données connues pour chaque isotope
| 1 | 2 | 3 | 4 | 5 | 6 | 7 | 8 | 9 | 10 | 11 | 12 | 13 | 14 | 15 | 16 | 17 | 18 | ||||||||||||||||
| 1 | H | He | |||||||||||||||||||||||||||||||
| 2 | Li | Be | B | C | N | O | F | Ne | |||||||||||||||||||||||||
| 3 | Na | Mg | Al | Si | P | S | Cl | Ar | |||||||||||||||||||||||||
| 4 | K | Ca | Sc | Ti | V | Cr | Mn | Fe | Co | Ni | Cu | Zn | Ga | Ge | As | Se | Br | Kr | |||||||||||||||
| 5 | Rb | Sr | Y | Zr | Nb | Mo | Tc | Ru | Rh | Pd | Ag | Cd | In | Sn | Sb | Te | I | Xe | |||||||||||||||
| 6 | Cs | Ba | La | Ce | Pr | Nd | Pm | Sm | Eu | Gd | Tb | Dy | Ho | Er | Tm | Yb | Lu | Hf | Ta | W | Re | Os | Ir | Pt | Au | Hg | Tl | Pb | Bi | Po | At | Rn | |
| 7 | Fr | Ra | Ac | Th | Pa | U | Np | Pu | Am | Cm | Bk | Cf | Es | Fm | Md | No | Lr | Rf | Db | Sg | Bh | Hs | Mt | Ds | Rg | Cn | Nh | Fl | Mc | Lv | Ts | Og | |
| 8 | 119 | 120 | * | ||||||||||||||||||||||||||||||
| * | 121 | 122 | 123 | 124 | 125 | 126 | 127 | 128 | 129 | 130 | 131 | 132 | 133 | 134 | 135 | 136 | 137 | 138 | 139 | 140 | 141 | 142 | |||||||||||
| Métaux alcalins | Métaux alcalino-terreux | Lanthanides | Métaux de transition | Métaux pauvres | Métalloïdes | Non-métaux | Halogènes | Gaz nobles | Éléments non classés |
| Actinides | |||||||||
| Superactinides |





