Azoture d'argent
| Azoture d'argent | |

| |
| Structure de l'azoture d'argent, l'argent est en bleu clair et l'azote en bleu foncé | |
| Identification | |
|---|---|
| Nom UICPA | Azoture d'argent |
| Synonymes |
Azide d'argent |
| No CAS | |
| No ECHA | 100.034.173 |
| No CE | 237-606-1 |
| PubChem | 61698 |
| SMILES | |
| InChI | |
| Apparence | solide incolore. |
| Propriétés chimiques | |
| Formule | AgN3 |
| Masse molaire[1] | 149,888 3 ± 0,000 8 g/mol Ag 71,97 %, N 28,03 %, |
| Propriétés physiques | |
| T° fusion | explose à 250 °C |
| Solubilité | 2,0×10-8 g·l-1 |
| Masse volumique | 4,42 g·cm-3 |
| Cristallographie | |
| Système cristallin | Orthorhombique |
| Symbole de Pearson | |
| Classe cristalline ou groupe d’espace | (no 72) |
| Précautions | |
| NFPA 704 | |
| Transport | |
interdit |
|
| Unités du SI et CNTP, sauf indication contraire. | |
| modifier |
|
L'azoture d'argent est un composé chimique de formule AgN3. C'est le sel d'argent de l'acide azothydrique. Ce composé incolore est connu pour être explosif.
Synthèse
[modifier | modifier le code]L'azoture d'argent peut être préparé en faisant réagir le nitrate d'argent avec l'azoture de sodium[2]. L'azoture d'argent forme un précipité blanc alors que le nitrate de sodium reste en solution.
- AgNO3 (aq) + NaN3 (aq) ⟶ AgN3 (s) + NaNO3 (aq).
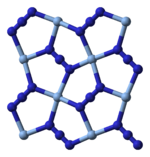
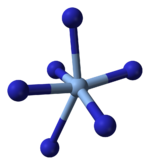
Structure
[modifier | modifier le code]La cristallographie aux rayons X montre que le composé présente une géométrie moléculaire en carré (plan) avec un ion argent Ag+ central et quatre ligands ion azoture N3−. La structure polymérique est telle que chaque ion azoture est lié à chacune de ses extrémités à une paire d'ions argent. Cette structure se présente sous la forme de couches bidimensionnelles de AgN3 superposées les unes au-dessus des autres, avec des liaisons faibles Ag-N entre deux couches. Il existe également une coordination de l'ion argent en 4+2 octaédrique, les deux atomes d'azote les plus éloignés de Ag+ prennent part à la couche supérieure et inférieure.
 |
 |
 |
 |
| Fragment de couche | Couches superposées | Coordination en 4 + 2 de Ag+ | Coordination en 2 + 1 de l'azote |
Réactivité
[modifier | modifier le code]Lors de sa réaction la plus typique, l'azoture se décompose en explosant, libérant du diazote et de l'argent métallique :
La première étape de cette décomposition est la création d'électrons libres et d'azotures radicalaires, ainsi le rendement de cette réaction peut être augmenté par l'ajout d'oxydes semi-conducteurs[3]. L'azoture d'argent pur explose à 340 °C mais la présence d'impureté abaisse cette température à 270 °C[4]. La réaction nécessite une faible énergie d'activation. Le délai initial de réaction est similaire à celui de la décomposition de l'azoture de plomb[5].
Impact sur la santé
[modifier | modifier le code]L'azoture d'argent comme la majorité des azotures de métal lourd est dangereusement explosif. La réaction peut être déclenchée par une exposition à des rayons ultraviolets et par un impact[2]. Le nitrate de cérium et d'ammonium est utilisé comme agent oxydant afin de neutraliser l'azoture d'argent[4].
Références
[modifier | modifier le code]- Masse molaire calculée d’après « Atomic weights of the elements 2007 », sur www.chem.qmul.ac.uk.
- (en) Jacqueline Akhavan, The chemistry of explosives, Cambridge (GB), Royal Society of Chemistry, , 180 p. (ISBN 0-85404-640-2, présentation en ligne), p. 30-31
- (en) Andrew Knox Galway et Michael E.Brown, Thermal decomposition of ionic solids (Studies in physical and theoretical chemistry), vol. 86, Amsterdam/Lausanne/New York etc., Elsevier, , 597 p. (ISBN 0-444-82437-5), p. 335
- (en) Margaret-Ann Armour, Hazardous laboratory chemicals disposal guide, Environmental Chemistry and Toxicology, Boca Raton (Fla.), CRC Press, , 557 p. (ISBN 1-56670-567-3, présentation en ligne), p. 452
- (en) Jehuda Yinon et Shmuel Zitrin, Modern Methods and Applications in Analysis of Explosives, Chichester/New York/Brisbane etc., John Wiley and Sons, , 305 p. (ISBN 0-471-96562-6, présentation en ligne), p. 15-16





