Methylisokyanát
| Methylisokyanát | |
|---|---|
 | |
 | |
| Obecné | |
| Systematický název | methylisokyanát |
| Ostatní názvy | MIC |
| Anglický název | methyl isocyanate, isocyanatomethane, methyl carbylamine |
| Sumární vzorec | C2H3NO |
| Vzhled | bezbarvý |
| Identifikace | |
| Registrační číslo CAS | 624-83-9 |
| ChEBI | 59059 |
| SMILES | O=C=NC |
| InChI | InChI=1S/C2H3NO/c1-3-2-4/h1H3 |
| Vlastnosti | |
| Molární hmotnost | 57,051 g/mol |
| Teplota tání | −45 °C |
| Teplota varu | 39.5 °C |
| Hustota | 0.9230 g/cm3 při 27 °C |
| Struktura | |
| Dipólový moment | 2.8 D |
| Bezpečnost | |
| [1] Nebezpečí[1] | |
| H-věty | H314 H330 H351 H332 H302 H400 |
| R-věty | R20/22 R26 R34 R40 R50 |
| S-věty | S9, S26, S36/37/39, S45 |
| NFPA 704 |  3
4
2
|
| Teplota vzplanutí | −7 °C |
| Teplota vznícení | 534 °C |
| Meze výbušnosti | 5,3–26 % |
Některá data mohou pocházet z datové položky. | |
Methylisokyanát je vysoce toxická organická sloučenina CH3NCO nazývaná také methylkarbylamin nebo MIC. Je meziproduktem při výrobě pesticidů a insekticidů jako např. karbaryl.
Výroba
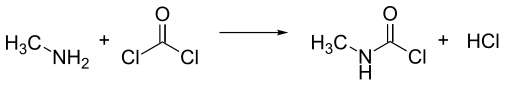
[editovat | editovat zdroj]Vyrábí se reakcí methylaminu a fosgenu za vysoké teploty v plynné fázi. Vzniká směs methyl isokyanátu a dvou molů chlorovodíku, který reaguje na N-methylkarbamylchlorid (MCC), který ze směsi kondenzuje. Jeden mol chlorovodíku odchází jako plyn.
Methyl isokyanát se získá úpravou MCC pomocí reakce s terciárním aminem, jako je např. N,N-dimethylanilin,[2] nebo s pyridinem, nebo se oddělí destilací.
Také vzniká reakcí N-methylformamidu C2H5NO a vzduchu meziprodukt methomyl C5H10N2O2S při výrobě karbofuranu.[3]
Zdraví
[editovat | editovat zdroj]MIC je prudce jedovatý, dráždivý. Při vdechování, požití a expozici sliznic se objevuje podráždění již při nízkém množství (0,4 ppm). Mezi příznaky otravy patří kašel, bolest na hrudi, dušnost, astma, podráždění očí, nosu a krku, svědění a pálení kůže. Vyšší úroveň expozice, (nad 21 ppm) má za následek trvalé (částečné) poškození zraku, plicní edém, rozedmu plic a krvácení, bronchiální pneumonii až s následkem smrti.
Ačkoli je methylisokyanát bez zápachu, většina lidí jeho přítomnost rozpozná především kvůli vysoce slzotvornému účinku již od 0,2 ppm. Limitní (bezpečné) hodnoty stanovené americkou konferencí veřejných a průmyslových hygieniků jsou 0,02 ppm.[4] Methylisokyanát je sloučenina zodpovědná za otravu a smrt několika tisíců lidí v indickém Bhópálu.[5]
Odkazy
[editovat | editovat zdroj]Reference
[editovat | editovat zdroj]- ↑ a b Methyl isocyanate. pubchem.ncbi.nlm.nih.gov [online]. PubChem [cit. 2021-05-23]. Dostupné online. (anglicky)
- ↑ US patent 2480088
- ↑ A safer method for making carbamates. Chemical Week. 1985, s. 136.
- ↑ Kimmerle, G.; Eben, A. Zur Toxizität von Methylisocyanat und dessen quantitativer Bestimmung in der Luft. Archiv für Toxikologie. 1964, s. 235–241.
- ↑ Union Carbide Corporation "Methyl Isocyanate" Product Information Publication, F-41443, November 1967.