Voda
| Voda | |
|---|---|
  | |
| Općenito | |
| Hemijski spoj | Voda |
| Druga imena | aqua, dihidrogenmonoksid, hidrična kiselina, vodik-hidroksid |
| Molekularna formula | H2O |
| CAS registarski broj | 7732-18-5 |
| Kratki opis | Tečnost bez mirisa i okusa |
| Osobine1 | |
| Molarna masa | 18,0153 g/mol |
| Agregatno stanje | tečno (20°C i 1 atm) |
| Gustoća | 0,998 g/cm3(tečnost na 20 °C, 1 atm) 0,917 g/cm3 (led na 0 °C, 1 atm) |
| Tačka topljenja | 0 °C (273,15 K) |
| Tačka ključanja | 100 °C (373,15 K) |
| Pritisak pare | 2,338 Pa pri 20 °C |
| Rastvorljivost | u haloalkanima, benzenu, višim alkanima, eterima, fenilima, cikloalkanima, alkoholima |
| Dipolni moment | 1,85 D |
| 1 Gdje god je moguće korištene su SI jedinice. Ako nije drugačije naznačeno, dati podaci vrijede pri standardnim uslovima. | |

Voda je providna, bezbojna tekućina koja formira rijeke, jezera, okeane i kišu na Zemlji, i jedan je od osnovnih sastojaka svih živih bića. Kao hemijski spoj, molekule vode sadrže jedan atom kisika i dva atoma vodika, koji su spojeni kovalentnom vezom. Voda je tekućina pri standardnim uslovima temperature i pritiska, ali na Zemlji često se nalazi u svom čvrstom stanju, ledu, kao i u svom plinovitom stanju, vodenoj pari.
Voda prekriva 71% površine planete Zemlje.[1] Ona je nezamjenjiva za sve poznate oblike života. Na Zemlji, 96,5% vode se nalazi u morima i okeanima, 1,7% u podzemnim vodama, 1,7% u lednicima i vječnom ledu na Antarktiku i Grenlandu, mali postotak u drugim većim vodenim površinama i 0,001% u atmosferi kao vodena para, oblaci (formirani od čvrstih i tečnih vodenih čestica kondenziranih u zraku) i atmosferske padavine.[2][3] Samo 2,5% vode na Zemlje otpada na slatke vode, a 98,8% slatke vode nalazi se zarobljeno u ledu ili u podzemnim vodama. Manje od 0,3% slatkih voda na Zemlji nalazi se u rijekama, slatkovodnim jezerima i atmosferi, a čak i manji postotak slatkih voda (0,003%) nalazi se sadržan u biološkim oblicima i vještačkim proizvodima.[2]
Voda na Zemlji se stalno kreće kroz ciklus isparavanja, transpiracije i evaporacije (evapotranspiracija), kondenzacije, padavina i otjecanja površinom, obično do mora ili okeana. Isparavanje i transpiranje doprinose količini padavina nad kopnom. Voda koja se koristi pri izračunu proizvodnje roba i usluga poznata je kao virtualna voda.
Voda ispravna i sigurna za piće je nezamjenjiva za ljude i sva druga živa bića, čak iako im ona ne daje energiju ili organske hranjive materije. Pristup čistoj vodi za piće je poboljšan posljednjih nekoliko decenija u gotovo svim dijelovima svijeta, ali i pored toga još uvijek oko 1 milijarda ljudi nema pristup čistoj vodi a preko 2,5 milijarde ljudi nema pristup adekvatnom načinu zbrinjavanja otpadnih voda.[4] Postoji jasna povezanost između pristupa čistoj vodi i bruto domaćem proizvodu po glavi stanovnika.[5] Međutim, neki istraživači su procijenili da bi do 2025. više od polovine svjetskog stanovništva moglo biti suočeno sa problemima u vezi s vodom.[6]
Izvještaj, objavljen u novembru 2009. sugerira da bi do 2030. u nekim područjima u razvoju, potražnja za vodom mogla nadmašiti njenu ponudu za oko 50%.[7] Voda igra vrlo važnu ulogu u svjetskoj ekonomiji, između ostalog kao otapalo za široki spektar hemijskih supstanci, te kao rashladno sredstvo za industrijske mašine i slično. Oko 70% slatkih voda ljudi koriste za poljoprivredu.[8]
Hemijske i fizičke osobine
[uredi | uredi izvor]



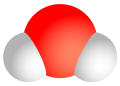
Voda je hemijska supstanca sa hemijskom formulom H2O. Jedna molekula vode ima dva atoma vodika spojena kovalentnom vezom na jedan atom kisika.
Voda u prirodi se javlja u sva tri uobičajena agregatna stanja (čvrsto, tečno i plinovito), a na Zemlji poprima mnoge različite oblike: u njenoj atmosferi nalaze se vodena para i oblaci, u okeanima je morska voda, u polarnim morima su ledeni brijegovi, na planinama lednici, a na površini slana i slatkovodna jezera, rijeke te podzemne vode.
| Temperatura oC | Gustoća (g/cm3) | Specifična toplota (J/g K) |
Termalna provodljivost (mW/K m) |
|---|---|---|---|
| 0 | 0,99984 | 4,2176 | 561,0 |
| 10 | 0,99970 | 4,1921 | 580,0 |
| 20 | 0,99821 | 4,1818 | 598,4 |
| 30 | 0,99565 | 4,1784 | 615,4 |
| 40 | 0,99222 | 4,1785 | 630,5 |
| 50 | 0,98803 | 4,1806 | 643,5 |
| 60 | 0,98320 | 4,1843 | 654,3 |
| 70 | 0,97778 | 4,1895 | 663,1 |
| 80 | 0,97182 | 4,1963 | 670,0 |
| 90 | 0,96535 | 4,2050 | 675,3 |
| 100 | 0,95840 | 4,2159 | 679,1 |
Osnovne hemijske i fizičke osobine su:
- Voda je tekućina pri standardnim uslovima temperature i pritiska. Čista voda je bez okusa i mirisa. Prirodna, suštinska boja vode i leda je vrlo blaga, nježna nijansa plave, mada su oboje bezbojni u malehnim količinama. Vodena para uglavnom je nevidljiva kao plin.[12]
- Voda je optički tranparentna u vidljivom elektromagnetnom spektru. Zbog toga, vodene biljke mogu živjeti u vodi jer sunčeva svjetlost može doći do njih. Infracrvenu svjetlost jako apsorbiraju veze kisika i vodika (OH veze).
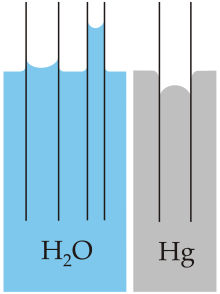
- Pošto molekula vode nije pravolinijska (linearna), a atom kisika ima veću elektronegativnost od atoma vodika, on nosi neznatno veći negativni naboj od vodikovih atoma, dok su vodikovi atom nešto pozitivniji. Kao rezultat, molekula vode je polarna sa električnim dipolnim momentom. Za molekulu njene veličine, voda može formirati neuobičajeno veliki broj međumolekulskih vodikovih veza (četiri). Ovi faktori dali su snažne privlačne sile između molekula vode, dajući ogromni površinski napon[13] i kapilarne sile. Kapilarna akcija se odnosi na tendenciju vode da se kreće prema gore kroz usku cijev protivno sili gravitacije. Ovu osobinu iskorištavaju sve vaskularne biljke, poput drveća.[14]
- Ona je dobro polarno otapalo (rastvarač) i često se spominje kao univerzalno otapalo. Supstance koje se rastvaraju u vodi, npr. soli, šećeri, baze i neki plinovi, naročito kisik i ugljik-dioksid (karboniziranje), smatraju se hidrofilnim supstancama (one koje vole vodu). Druge supstance koje se ne mogu miješati s vodom, npr., masti, ulja (odnosno lipidi) su poznate kao hidrofobne supstance (one koje ne vole vodu).
- Sve komponente u ćelijama (bjelančevine, DNK i polisaharidi) su rastvorljivi u vodi, a svoju strukturu i aktivnost deriviraju iz svog međudjelovanja s vodom.
- Čista voda ima vrlo nisku električnu provodljivost, ali ona se znatno povećava rastvaranjem male količine ionskog materijala u njoj, poput natrij hlorida.
- Tačka ključanja vode (kao i svih drugih tekućina) zavisi od barometarskog pritiska. Naprimjer, na vrhu Mount Everesta voda vrije na 68 °C za razliku od 100 °C na nivou mora na istoj geografskoj širini (pošto promjena geografske širine neznatno mijenja atmosferski pritisak). Nasuprot toga, voda u velikim okeanskim dubinama čak i blizu geotermalnih izbora može dostići nekoliko stotina stepeni ali ostaje u tečnom stanju.
- Sa 4181,3 J/(kg·K), voda ima visok specifični toplotni kapacitet kao i visoku toplotu isparavanja (40,65 kJ·mol−1), a obje osobine su rezultat ekstenzivnih vodikovih veza između molekula vode. Ove dvije neobične osobine omogućavaju vodi da ujednačava klimu na Zemlji tako što smanjuje velika kolebanja temperature.
- Gustoća vode na 4 °C iznosi 1000 kg/m3. Gustoća leda iznosi 917 kg/m3.

- Voda je najgušća na temperaturi od 3,98 °C.[15] Većina poznatih supstanci postaju gušće pri opadanju temperature, ali kod vode postoji anomalija pri snižavanju temperature kada se ona hladi do temperature kada prelazi u led. Tokom hlađenja, voda postoje sve gušća do 3,98 °C. Ispod ove temperature, postepeno se formira otvorena ledena struktura u vodi niske temperature, nasumična orijentacija molekula vode u tečnom stanju se održava termalnim kretanjem, a ispod 3,98 °C nema dovoljno termalne energije da se održava ova nasumičnost. Kako se voda hladi, javljaju se dva istovremena efekta: smanjenje zapremine i povećanje ukupne zapremine tečnosti kako se molekule počinju orijentirati u organiziranu strukturu leda. U temperaturnom rasponu između 3,98 °C i 0 °C drugi efekat poništava prvi, tako da je neto efekt povećanje zapremine uz snižavanje temperature.[16] Voda se širi i zahvata 9% veću zapreminu od leda, što konačno izaziva pojavu da led pluta na tečnoj vodi, poput ledenih santi.
- Voda se može miješati sa mnogim tečnostima, poput etanola, u svim omjerima, dajući jedinstvenu homogenu tekućinu. S druge strane, voda i mnoga ulja ne mogu se miješati, ona obično grade slojeve gdje je tečnost manje gustoće u gornjem sloju, a gušća u donjem.
- Voda gradi azeotrope sa mnogim drugim otapalima.
- Ona se može putem elektrolize razdvojiti na vodik i kisik. Energija koja je neophodna da se voda razdvoji na ova dva elementa putem elektrolize ili bilo kojeg drugog procesa je veća od energije koja se dobija kada se vodik i kisik ponovno rekombiniraju.[17]
- Kao oksid vodika, voda se formira kada vodik i spoj koji ga sadrži sagorijeva ili reagira sa kisikom ili spojem koji sadrži kisik. Voda ne spada u goriva, ona je krajnji proizvod sagorijevanja vodika.
- Hemijski elementi koji su više elektropozitivni od vodika poput litija, natrija, kalcija, kalija i cezija mogu istisnuti vodik iz vode, dajući hidrokside. Pošto je vodik zapaljiv plin, on je vrlo opasan te stoga reakcije vode sa nekim od navednih elektropozitivnijih elemenata mogu biti burne i eksplozivne.
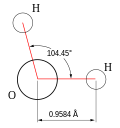
- Dužina veze O-H u jednoj (pojedinačnoj) molekuli vode iznosi 0,957854 Å (9,57854 × 10−11 m), a H atomi zatvaraju ugao od 104,5°.[18] Međutim, ovi parametri se neznatno mijenjaju kada se posmatra više molekula, gdje studije pokazuju da je u tom slučaju dužina O-H veze 0,991 Å, a ugao između H-O-H atoma 105,5°.[19]
| Osobina | Napomena | Značaj za okolinu |
|---|---|---|
| Fizičko stanje | Jedina supstanca koja se prirodno na Zemljinoj površini javlja u sva tri agregatna stanja: čvrstom, tečnom i plinovitom | Prijenos toplote između okeana i atmosfere putem promjene agregatnog stanja |
| Mogućnost otapanja | Otapa više supstanci u većim količinama od bilo koje druge uobičajene tekućine | Važna u hemijskim, fizičkim i biološkim procesima |
| Gustoća: masa po jedinici zapremine | Gustoća je određena (1) temperaturom, (2) salinitetom i (3) pritiskom, ovim redom po značajnosti. Temperatura kada je najveća gustoća čiste vode iznosi 4 °C. Za morsku vodu, tačka mržnjenja raste porastom saliniteta | Kontrolira vertikalno kretanje unutar okeana, pomaže distribuiranju toplote i omogućava sezonsku stratifikaciju |
| Površinski napon | Najviši među svim uobičajenim tečnostima | Kontrolira formiranje kapi kiše i oblaka; važan za fiziologiju ćelija |
| Provođenje toplote | Najbolja među svim svakodnevnim tečnostima | Važna u mikroskali, naročito na ćelijskom nivou |
| Toplotni kapacitet | Najviši među uobičajenim tečnostima ali i čvrstim supstancama | Onemogućava ekstremno kolebanje temperature na Zemlji |
| Latentna toplota topljenja | Najviša među tečnostima i veća od mnogih čvrstih supstanci | Termostatski efekat reguliranja toplote zbog otpuštanja toplote tokom smrzavanja i apsorpcije pri topljenju |
| Latentna toplota isparavanja | Najviša među supstancama | Izuzetan značaj, osnovni faktor u prijenosu toplote unutar okeana i između atmosfere i okeana, utječe na klimu i vremenske prilike |
| Indeks prelamanja | Povećava se povećanjem slanosti a smanjuje povećanjem temperature | Objekti u vodi izgledaju bliže nego u zraku |
| Providnost | Relativno velika za vidljivu svjetlost; velika apsorpcija za infracrvenu i ultraljubičastu svjetlost | Važna za fotosintezu |
| Provođenje zvuka | Dobra u odnosu na druge fluide | Omogućava sonarima i drugim detektorima brzo mjerenje dubine vode i otkrivanje izgleda podvodnih struktura i životinja; pod vodom, zvukovi se mogu ćuti na velikim udaljenostima |
| Mogućnost kompresije | Vrlo malehna | Promjena gustoće je mala povećanjem pritiska i dubine |
| Tačke topljenja i ključanja | Neobično visoke | Omogućava da se voda nalazi u tečnom stanju u većini regija na Zemlji |
Okus i miris
[uredi | uredi izvor]Čista H2O je bez okusa i mirisa.
Voda može otopiti mnoge različite supstance, koje joj daju različite okuse i mirise. Ljudi i životinje su razvili osjetila koja im omogućavaju da ocijene može li se voda piti, izbjegavajuću preslanu vodu ili zagađenu.
Ukus mineralne i izvorske vode nastaje zbog minerala koji su u njoj otopljeni, a što se često ističe u marketinškim oglasima. Čistoća vode u izvorima i mineralnim vodama se odnosi na odsustvo otrova, zagađivača i mikroorganizama u njoj, a ne odsustvo minerala koji su prirodno prisutni.
Rasprostranjenost u prirodi
[uredi | uredi izvor]U svemiru
[uredi | uredi izvor]Najveći dio vode u svemiru proizvodi se kao nusproizvod pri formiranju zvijezda. Kada se zvijezda rađa, njeno rođenje je povezano sa snažnim izbacivanjem plina i prašine. Kada ovaj materijal kolidira sa okolnim plinovima, udarni talasi koji nastaju sažimaju i zagrijavaju plin. Zamijećeno je da se voda prilično brzo stvara u ovom vrelom, gustom plinu.[20] Dana 22. jula 2011. objavljen je izvještaj u kojem se navodi otkriće ogromnog oblaka vodene pare koji sadrži 140 triliona puta više vode nego svi Zemljini okeani zajedno, oko kvazara udaljenog 12 milijardi svjetlosnih godina od Zemlje. Po mišljenju istraživača, ovo otkriće pokazuje da je voda vrlo česta i uobičajena u svemiru tokom gotovo cijele njegove historije.[21][22]
Voda je opažena i u međuzvjezdanim oblacima unutar naše galaksije Mliječni put. Ona možda postoji u velikim količinama i u drugim galaksijama, zbog toga što su njeni osnovni "sastojci", kisik i vodik, među najčešćim i najrasprostranjenijim elementima u svemiru. Zasnovano na modelima formiranja i evolucije Sunčevog sistema i drugih zvjezdanih sistema, većina drugih planetarnih sistema vjerovatno ima slične sastojke.
Vodena para
[uredi | uredi izvor]Voda je prisutna u vidu vodene pare u:
- atmosferi Sunca: u tragovima[23]
- atmosferi Merkura: 3,4%, te ogromne količine vode u Merkurovoj egzosferi[24]
- atmosferi Venere: 0,002%[25]
- Zemljinoj atmosferi: ~0,40% u cjelokupnoj atmosferi, obično 1–4% na površini; kao i u atmosferi Mjeseca u tragovima[26]
- Marsovoj atmosferi: 0,03%[27]
- atmosferi Cerere[28]
- atmosferi Jupitera: 0,0004%[29] – zarobljena u ledu drugih spojeva; kao i na njegovom mjesecu Evropi.[30]
- atmosferi Saturna – zarobljena u ledu drugih spojeva; i na njegovom mjesecu Titanu (u stratosferi), Enkeladu: 91%[31] i Dioni (u egzosferi)
- atmosferi Urana - u tragovima ispod 50 bara
- atmosferi Neptuna - pronađena u dubljim slojevima atmosfere[32]
- atmosferama vansolarnih planeta, uključujući planete poput HD 189733 b[33] i HD 209458 b,[34] Tau Boo b[35], HAT-P-11b[36][37], XO-1b, WASP-12b, WASP-17b i WASP-19b.[38]
- u atmosferama zvijezda: nije ograničena samo na hladne zvijezde, nego je detektirana i u vrućim gigantima poput Betelgeza, Mu Cephei, Antaresa i Arkturusa.[37][39]
- interstelarnim oblacima: uključujući TW Hydrae,[40] IRC +10216[41] i APM 08279+5255[21][22]
Tečna voda
[uredi | uredi izvor]
Za tečnu vodu poznato je samo da je prisutna na Zemlji, čije 71% površine prekriva. Naučnici vjeruju da je tečna voda prisutna i na Saturnovim mjesecima Enkeladu, gdje se smatra da se 30–40 km ispod njegove južne polarne površine nalazi okean dubok 10 kilometara,[42][43] te Titanu, kao sloj ispod površine, možda pomiješan sa amonijakom.[44] Tečna voda možda također postoji i na Jupiterovom mjesecu Ganimedu kao sloj stiješnjen pod velikim pritiskom između leda i stijena.[45]
Led
[uredi | uredi izvor]Voda u vidu leda prisutna je:
- na Marsu: pod regolitom i na polovima.[46]
- u sistemu Zemlja-Mjesec: uglavnom kao ledeni pokrivač na Zemlji, a na Mjesecu u kraterima i vulkanskim stijenama[47], a NASA je objavila da je njen uređaj Moon Mineralogy Mapper na indijskoj svemirskoj istraživačkoj letjelici Chandrayaan 1 u septembru 2009. otkrio molekule vode.[48]
- na Jupiterovim mjesecima: na površini Evrope i Ganimeda
- na Saturnu: u sistemu prstenova planete[49] kao i na površini i omotaču mjeseca Titana i Enkelada
- u sistemu Plutona i Harona[49]
- u kometama i povezanim objektima (iz Kuiperovog pojasa i Oortovog oblaka).
On je također možda prisutan i na:
Egzotične forme
[uredi | uredi izvor]Voda i drugi smrznuti spojevi vjerovatno sačinjavaju veći dio unutrašnjih struktura planeta Urana i Neptuna, a voda u dubljim slojevima se možda nalazi u obliku ionske vode u kojoj su molekule razdvojene u supu od iona vodika i kisika, a još dublje od toga bi se mogla nalaziti voda u superionskom stanju u kojoj se kisik kristalizira a ioni vodika slobodno se kreću unutar kisikove rešetke.[51]
Voda i nastanjiva zona
[uredi | uredi izvor]Postojanje tečne vode, te u manjoj mjeri njenih plinovitih i čvrstih oblika, na Zemlji je od vitalnog značaja za postojanje života na Zemlji kakvog poznajemo. Zemlja se nalazi u nastanjivoj zoni Sunčevog sistema, da je imalo bliža ili dalja od Sunca (oko 5% ili oko 8 miliona km), uslovi koji omogućavaju istovremeno prisustvo vode u sva tri agregatna stanja bili bi gotovo nemogući.[52][53]
Zemljina gravitacija omogućava joj da zadrži svoju atmosferu. Vodena para i ugljik-dioksid u atmosferi daju joj temperaturni štit (efekat staklenika), pomažući joj da održi relativno stalnu temperaturu površine. Da je Zemlja manja, rjeđa atmosfera bi dopuštala temperaturne ekstreme, i tako onemogućila akumulaciju vode osim na polovima (kao na Marsu). Temperatura na Zemlji je bila prilično stalna tokom geološkog vremena i pored varijacija u nivou zračenja Sunca, što ukazuje da temperaturu Zemlje reguliraju dinamički procesi putem kombinacije stakleničkih plinova i površinskog ili atmosferskog albeda. Ova pretpostavka naziva se Gaia hipoteza.
Agregatno stanje vode na nekoj planeti zavisi od pritiska okruženja, a koji je dalje određen gravitacijom te planete. Ako je planeta isuviše masiva, voda na njoj može biti u obliku leda čak i pri višim temperaturama zbog visokog pritiska uzrokovanog gravitacijom. Takav slučaj je dokazan na egzoplanetama poput Gliese 436 b[54] i GJ 1214 b.[55]
Na Zemlji
[uredi | uredi izvor]
Hidrologija je proučavanje kretanja, rasprostranjenosti i kvalitete vode na Zemlji. Proučavanje distribucije vode naziva se hidrografija. Proučavanje distribucije i kretanja podzemnih voda je hidrogeologija, lednika glaciologija, unutrašnjih voda limnologija, a distribucija okeana okeanografija. Ekološki procesi sa hidrologijom su u fokusu proučavanja ekohidrologije.
Cjelokupna masa vode koja se nalazi na površini, ispod i iznad površine planete naziva se hidrosfera. Približna zapremina vode na Zemlji (ukupna zaliha vode u svijetu) iznosi 1.338.000.000 km3.[2] Tekuća voda prisutna je u vodenim površinama: okeanima, morima, jezerima, rijekama, potocima, kanalima, barama, močvarama i lokvama. Najveći dio vode na Zemlji je morska voda. Voda se nalazi u atmosferi u sva tri stanja: kao kristali leda, kao vodena para i kišne kapi. Također postoji i kao podzemna voda u izdanima.
Voda je važna u mnogim geološkim procesima. Podzemna voda je prisutna u većini stijena, a pritisak te vode utječe na oblike rasjeda. Voda u Zemljinoj kori je odgovorna za topljenje koje uzrokuje vulkane u zonama subdukcije. Na površini Zemlje, ona je važna za hemijske i fizičke meteorološke procese. Voda, i u znatno manjoj mjeri led, su odgovorni za transport velikih količina sedimentnog materijala koji se odvija na površini Zemlje. Odlaganje prenesenih sedimenata formira mnoge vrste sedimentnih stijena, koje su dio geološke historije Zemlje.
Kruženje vode
[uredi | uredi izvor]
Kruženje vode u prirodi (naučno poznato pod nazivom hidrološki ciklus) označava stalnu izmjenu vode unutar hidrosfere, između atmosfere, površinskih voda, voda u zemljištu, podzemnih voda i biljaka.
Voda se bez prestanka kreće kroz svaki od ovih područja hidrološkog ciklusa putem sljedećih transfernih procesa:
- evaporacijom iz okeana i drugih vodenih površina te transpiracijom iz kopnenih biljaka i životinja u zrak.
- padavinama iz vodene pare kondenzirane iz zraka, koje padaju na zemlju ili okean.
- otjecanjem površinskih voda sa kopna nazad u more.
Veći dio vodene pare iznad okeana se vraća ponovo u okean, ali je vjetrovi odnose iznad kopna u približnoj količini i brzini koliko je otječe u more, približno 47 Tt (teratona) godišnje. Iznad kopna, evaporacija i transpiracije doprinose daljnjih 72 Tt godišnje. Padavine, količinom od oko 119 Tt godišnje iznad kopna, imaju nekoliko oblika: najčešća je kiša, snijeg i grad, uz nešto manji doprinos magle i rose.[56] Rosa su male kapljice vode koje se kondenziraju kada vodena para velike gustoće naiđe na hladnu površinu. Rosa se najčešće stvara u jutarnjim satima kada su temperature najniže, neposredno prije izlaska sunca i kada temperatura površine Zemlje počinje rasti.[57] Kondenzirana voda u zraku može također i reflektirati sunčevu svjetlost dajući dugu.
Voda iz vodotoka se najčešće skuplja iz cijelog sliva (drenažnog bazena) i teče u rijeke. Matematički model korišten za simulaciju rijeka ili vodotoka računa parametre toka i kvaliteta vode naziva se hidrološki transportni model. Dio vode se često preusmjerava u navodnjavanje poljoprivrednog zemljišta. Rijeke i mora nude mogućnosti za putovanje i trgovinu. Vodotoci putem erozije mijenjaju izgled okoline stvarajući riječne doline i delte, u kojima nastaje bogato zemljište gdje se mogu izgraditi veliki populacijski centri. Poplava nastaje kada je nisko i ravno zemljište prekriveno vodom. Najčešće se dešava kada se rijeke izliju iz korita ili kada morska voda počne nadirati na kopno. Suša je duži period, često nekoliko mjeseci ili godina, kada određeno područje nema dovoljnu opskrbu vodom. Ovo se dešava kada ono prima manju količinu padavina od uobičajene.
Zalihe slatke vode
[uredi | uredi izvor] |
 |
| Zaliv Fundy za vrijeme plime | i oseke |
Jedan dio vodotoka "zarobljen" je neko vrijeme u jezerima i barama. Na višim nadmorskim visinama, tokom zime, kao i na krajnjem jugu i sjeveru, taloži se snijeg i led, koji vremenom narastu u obliku lednika. Voda također ponire u zemljište do podzemnih izdana. Ta voda kasnije dospijeva ponovno na površinu zemlje u riječnim izvorima, ili na neki spektakularni način poput vrelih izvora i gejzira. Podzemne vode se često vještački vade iz bunara. Ove zalihe vode su vrlo važne, jer su relativno čiste, a čista i svježa voda je nezamjenjiva za život ljudi i drugih kopnenih živih bića. U mnogim krajevima svijeta izražen je nedostatak svježe i čiste vode.
Morska voda
[uredi | uredi izvor]Morska voda sadrži u prosjeku oko 3,5% soli, uz male količine drugih supstanci. Fizičke osobine morske vode se razlikuju od osobina slatke vode u nekim osnovnim tačkama. Ona se smrzava na nižoj temperaturi (oko −1,9 °C), a gustoća joj se povećava snižavanjem temperature do tačke mržnjenja, umjesto da dostigne maksimum gustoće pri temperaturi iznad tačke mržnjenja. Slanost vode (salinitet) u velikim morima varira od oko 0,7% u Baltičkom moru do 4,0% u Crvenom moru.
Plima i oseka
[uredi | uredi izvor]Plima i oseka su ciklični rast i opadanje nivoa mora i okeana, uzrokovano plimnim silama Mjeseca i Sunca koje djeluju na vodene površine. One uzrokuju promjenu dubine mora i vodenih površina u estuarijima, proizvodeći oscilacije u strujama poznate kao plimni tokovi. Izmjene plime i oseke na određenom području rezultat su promjene relativnog položaja Mjeseca i Sunca u odnosu na Zemlju, pojačanog efektima Zemljine rotacije i lokalne batimetrije. Pojas morske obale koja tone pri visokoj plimi, a tokom oseke je iznad nivoa mora naziva se međuplimna zona, važan je ekološki rezultat okeanskih plimnih kretanja.
Utjecaji na život
[uredi | uredi izvor]
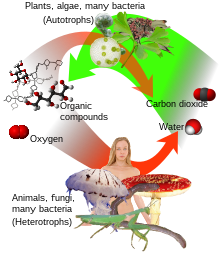
Sa biološke tačke gledišta, voda ima mnoge vrlo važne osobine koje su nezamjenjive za razvoj i opstanak života, što je izdvaja od drugih hemijskih spojeva.
Ona obavlja ovu ulogu tako što omogućava organskim spojevima da reagiraju na način koji na kraju omogućava samoreplikaciju. Svi poznati oblici života na Zemlji zavise od vode. Voda je vitalna također i kao otapalo u koji se otapaju mnoge izlučevine iz organizma kao i nezamjenjivi dio mnogih metaboličkih procesa u organizmu. Metabolizam je suma ukupnog anabolizma i katabolizma. Pri anabolizmu, voda se izdvaja iz molekule (putem enzimskih hemijskih reakcija koje zahtijevaju energiju) da bi prerasle u veće molekule (npr. škrob, trigliceride i bjelančevine za skladištenje energije i informacija). Pri katabolizmu, voda se koristi da razbije veze da bi od većih načinila manje molekule (npr. glukozu, masne kiseline i aminokiseline koje se koriste kao gorivo za dobijanje energije ili neke druge svrhe). Bez vode, ovi specifični metabolički procesi ne bi postojali.
Voda je temelj fotosinteze i disanja. Fotosintetičke ćelije koriste sunčevu energiju za razdvajanje vodika od kisika iz vode. Zatim se vodik kombinira sa CO2 (kojeg biljke uzimaju iz zraka ili vode) gradeći molekulu glukoze i otpuštajući kisik. Sve žive ćelije koriste takvo gorivo i oksidiraju vodik i ugljik da bi ih pretvorile ponovno u energiju otpuštajući u tom procesu vodu i CO2 (ćelijsko disanje).
Voda je također centralna u kiselo-baznoj neutralnosti i funkciji enzima. Kiselina, donator iona vodika (H+, tj. proton), može se neutralizirati bazom, primaocem protona kao što je ion hidroksida (OH−) dajući vodu kao krajnji rezultat. Čista voda se smatra neutralnom, a njena pH vrijednost (negativni logaritam koncentracije iona vodika) iznosi 7. Kiseline imaju pH vrijednost nižu od 7 dok baze imaju ovu vrijednost višu od 7.
Životni oblici u vodi
[uredi | uredi izvor]

Površinske vode na Zemlji pune su života. Smatra se da su se najranija živa bića pojavila u vodi, gotovo sve ribe žive isključivo u vodi, a postoji i ogroman broj morskih sisara, poput delfina i kitova. Neke vrste životinja, poput amfibija, provode dio svojih života u vodi, a dio na kopnu. Biljke poput kelpa i algi rastu u vodi, a one su osnova za neke od podvodnih ekosistema. Plankton je općenito osnova okeanskog lanca ishrane.
Vodeni kičmenjaci moraju uzeti kisik da bi preživjeli, a to rade na razne načine. Ribe imaju škrge umjesto pluća, mada neke vrste riba, imaju oboje. Morski sisari, delfini, kitovi, tuljani i drugi, moraju izaći na površinu da bi udahnuli zrak. Neke amfibije mogu apsorbirati kisik preko kože. Beskičmenjaci imaju širok raspon prilagođavanja da bi preživjeli u vodama siromašnim kisikom, uključujući cijevi za disanje (kao kod nekih insekata i školjki) ili škrge (kao kod rakova). Međutim, beskičmenjaci u vodenoj sredini su se razvili tako da većina ima vrlo malehnu ili nikakvu specijalizaciju za disanje u vodi.
Utjecaj na civilizaciju
[uredi | uredi izvor]
Većina ljudskih civilizacija tokom historije je cvjetalo oko rijeka i većih vodenih putova. Mezopotamija, takozvana kolijevka civilizacije, nalazila se između velikih rijeka Eufrata i Tigrisa, a antičko društvo Egipćana potpuno je bilo zavisno od rijeke Nil. Velike svjetske metropole poput Rotterdama, Londona, Montreala, Pariza, New Yorka, Buenos Airesa, Šangaja, Tokija, Chicaga i Hong Konga, svoj uspjeh i razvoj jednim dijelom duguju i lahkoj pristupačnosti do njih vodenim putevima i ekspanziji trgovine koja je time olakšana. Ostrva sa sigurnim, zaklonjenim lukama, poput Singapura, jako su razvijena iz istog razloga. Na mjestima u sjevernoj Africi i Bliskom istoku, gdje je opskrba vodom oskudna, pristup čistoj vodi za piće bio je i bit će osnovni faktor razvoja ljudskih zajednica.
Zdravlje i zagađenje
[uredi | uredi izvor]
Voda pogodna za ljudsku upotrebu naziva se voda za piće. Voda koja se ne može koristiti za piće mora se prije upotrebe prerađivati filtriranjem, destilacijom ili nekom od brojnih drugih metoda prerade vode. Voda koja nije za piće, ali nije štetna ili isuviše zagađena za ljude, kao naprimjer za kupanje, plivanje i slično, naziva se mnogim drugim imenima, osim naziva pitka voda, a ponekad se naziva i voda za kupanje. Hlor nagriza ljudsku kožu i sluzokožu, a koristi se za dezinfekciju vode koja se koristi za kupanje ili pranje. Njena upotreba je općenito samo tehnička, a obično se njegova koncentracija u vodi regulira državnim propisima (otprilike 1 dio na milion (ppm) u vodi za piće, i 1-2 ppm hlora koji nije reagirao sa nečistoćama za vodu za kupanje). Voda za kupanje se može održavati u dovoljno čistim mikrobiološkim uslovima koristeći hemijska dezinfekcijska sredstva poput hlora ili ozona ili djelovanjem ultraljubičastog svjetla na nju.
U SAD, otpadne vode koje nisu za piće a koje su nastale djelovanjem čovjeka nazivaju se sive vode (engleski: greywater), a one se mogu pročišćavati te se od njih vrlo lahko može ponovno dobiti voda za piće. Međutim, postoje i crne vode (engleski: blackwater) koje sadržavaju otpatke iz kanalizacije i druge nečistoće, a koje zahtijevaju daljnji tretman da bi se omogućilo njihovo ponovno korištenje. Sive vode sastavljene su od 50-80% otpadnih voda iz domaćinstava koje otječu iz sanitarnih uređaja u domaćinstvima (tuševa, kuhinja, odvoda, ali ne i toaleta, koji generiraju crne vode). Ovi pojmovi imaju drugačije značenje u drugim državama i kulturama.
Ova prirodna sirovina na mnogim mjestima postaje sve oskudnija, a njena dostupnost je jedna od osnovnih socijalnih i ekonomskih briga današnjice. Trenutno, oko milijardu ljudi u svijetu svakodnevno pije vodu koja nije pogodna za piće. Mnoge zemlje su prihvatile cilj da do 2015. prepolove broj ljudi u svijetu koji nemaju pristup čistoj vodi i zadovoljavajućem zbrinjavanju otpadnih voda na Evian samitu zemalja G8 održanom 2003.[58] Čak i kada bi se ostvario ovako težak cilj, i dalje oko pola milijarde ljudi ne bi imalo pristup pitkoj vodi a preko milijarde neadekvatan pristup sanitarnom sistemu. Loš kvalitet vode i loš sanitarni sistem su opasni po život ljudi. Oko pet miliona ljudi umre godišnje zbog zagađene vode koju piju. Svjetska zdravstvena organizacija procjenjuje da bi čista voda mogla spriječiti smrt oko 1,4 miliona djece svake godine od dijareje.[59]
Voda nije ograničen resurs, nego cirkuliše kao pitka voda u vidu padavina u količinama koji su nekoliko redova veličine veći od ljudske potrošnje. Međutim, postoje relativno malehne količine vode u zalihama na zemlji (oko 1% naše vode za piće, koja se obnavlja u podzemnim izdanima svakih 1 do 10 godina), a to su neobnovljivi resursi, pa je tako i distribucija pitke vode i vode za navodnjavanje znatno manja od stvarne količine koja postoji na Zemlji. Zemlje siromašne pitkom vodom je uvoze kao osnovni metod za popunu njenog nedostatka (da bi zadovoljile potrebe svojih građana), jer procesi industrijske i druge proizvodnje koriste od 10 do 100 puta više vode.
U zemljama u razvoju, 90% svih otpadnih voda još uvijek se ispušta neobrađeno u lokalne rijeke i potoke.[60] Oko 50 država, što je ugrubo trećina svjetske populacije, također pati zbog srednje ili visoke nestašice vode, a 17 među njima koristi i uzima godišnje više vode nego što se ona može obnoviti svojim prirodnim kruženjem.[61] Problem ne obuhvata samo površinske slatke vode poput jezera i rijeka nego i degradaciju resursa podzemnih voda.
Koristi za čovjeka
[uredi | uredi izvor]Poljoprivreda
[uredi | uredi izvor]
Najvažniji vid upotrebe vode u poljoprivredi je za navodnjavanje, koja je osnovna komponenta za proizvodnju dovoljne količine hrane. Navodnjavanje koristi do 90% vode dostupnih u nekim zemljama u razvoju[62] i znatan udio u nešto više privredno razvijenijim zemljama (u SAD, oko 30% slatke vode se koristi za navodnjavanje).[63]
Prije otprilike 50 godina, opće mišljenje je bilo da je voda neograničen resurs. U to vrijeme, u svijetu je živjelo upola manje ljudi nego danas. Ljudi nisu bili u tolikoj mjeri zdravi kao danas, unosili su mnogo manje kalorija i jeli su manje mesa, tako da je bilo neophodno i manje vode da proizvode svoju hranu nego danas. Tada je bilo potrebno oko trećine količine vode koja se trenutno uzima iz rijeka. Danas, borba za ograničene količine vodenih resursa je sve jača, što dovodi do javljanja koncepta vodene krize.[64] Ovo se dešava jer danas živi gotovo sedam milijardi ljudi na planeti, a njihova potrošnja vode za proizvodnju mesa i povrća svakodnevno raste, a povećava se i nadmetanje za vodu za oblasti industrije, urbanizacije i proizvodnje biogoriva. U budućnosti, porast će potreba za vodom zbog stalnog rasta potražnje i potreba za hranom, a predviđa se i porast ljudske populacije na Zemlji do 9 milijardi do kraja 2050.[65]
Procjenu upravljanja vodom u poljoprivredi sačinio je Međunarodni institut za upravljanje vodom iz Šri Lanke 2007, kako bi utvrdio da li na svijetu postoji dovoljno vode kojom bi proizveo hranu za svoje neprestano rastuće stanovništvo.[66] On je procijenio trenutnu dostupnost vode za poljoprivredu u globalnim razmjerama i sačinio kartu područja koji pade od nedostatka vode. Pronašli su da petina stanovništva svijeta, više od 1,2 milijarde, živi u područjima gdje je voda fizički nedostatna, gdje nema dovoljno vode kojom bi se mogle podmiriti sve potrebe. Drugih 1,6 milijarde ljudi žive u područjima gdje je voda ekonomski nedostatna, gdje je izražen nedostatak investicija u opskrbu vodom ili nema dovoljno ljudskih kapaciteta kojim bi vlasti podmirile potrebe za vodom. U izvještaju je navedeno da je moguće proizvesti dovoljno hrane u budućnosti, ali nastavak današnjeg trenda u proizvodnji hrane i okolišu mogao bi dovesti do krize u mnogim dijelovima svijeta. Da bi se izbjega svjetska vodna kriza, poljoprivrednici bi morali težiti povećanju produktivnosti da bi zadovoljili rastuću potražnju za hranom, dok industrija i gradovi moraju pronaći načine da efikasnije koriste vodu.[67]
Kao naučni standard
[uredi | uredi izvor]Dana 7. aprila 1795. u Francuskoj je definirano da međunarodna jedinica za masu od 1 grama bude jednaka apsolutnoj masi zapremine čiste vode koja je jednaka kocki veličine jednog stotog dijela metra na temperaturi topljenja leda.[68] Međutim iz praktičnih razloga, bio je neophodan metalni standardni etalon koji bi bio hiljadu puta veći od prvobitno definiranog grama, odnosno jedan kilogram. Stoga je prihvaćen rad koji bi tačno odredio masu jednog litra vode. I pored činjenice da je preporučena definicija grama preko tačno određenih uslova voda na temperaturi od 0 °C, koja se vrlo lahko reproducira, naučnici su ipak odlučili ponovno definirati standard te su izvršili mjerenja na temperaturi kada je gustoća vode najveća, a koja je u to doba određena na 4 °C.[69]
Kelvinova temperaturna skala SI sistema zasnovana je na trojnoj tački vode, definirana na tačno 273,16 K ili 0,01 °C. Ova skala je skala apsolutne temperature sa istim rastom (povećanjem) kao i Celzijeva temperaturna skala, koja je prvobitno određena prema tački ključanja (postavljenoj na 100 °C) i tački topljenja (na 0 °C) vode. Prirodna voda je sastoji uglavnom od izotopa vodika 1H i kisika 16O, ali također postoje vrlo male količine vode sa težim izotopima poput 2H (deuterij). Količina deuterij oksida ili teške vode je vrlo mala, ali ipak utječe na osobine vode. Voda iz rijeka i jezera ima mnogo manje deuterija od morske vode. Zbog toga se standardna voda definira Bečkim specifikacijama standardne prosječne okeanske vode.
Za piće
[uredi | uredi izvor]

Ljudski organizam sadrži od 55% do 78% vode, u zavisnosti od veličine tijela.[70] Da bi mogao normalno živjeti, čovjek mora u organizam unijeti od jedne do 7 litara vode dnevno, da bi izbjegao dehidraciju. Tačna količina vode zavisi od nivoa aktivnosti, vanjske temperature, vlažnosti i drugih činilaca. Najveći dio vode se u organizam unosi putem hrane ili pića koja sadrže vodu. Nije potpuno jasno koliko tačno vode je potrebno zdravim osobama, mada se mnogi naučnici slažu da se ta količina kreće oko 2 litra (6 do 7 čaša) vode dnevno, što predstavlja minimum da se održi dovoljna hidratacija.[71] Medicinska literatura preporučuje nešto manji unos, obično oko 1 litra vode za prosječnog muškarca, ne računajući dodatne potrebe zbog gubitka tekućine tokom vježbanja, teškog rada ili toplog vremena.[72]
Za osobe koje imaju zdrave bubrege, poprilično je teško popiti toliku količinu vode, međutim, naročito kada je toplo, vlažno vrijeme i prilikom vježbanja, opasno je unositi u organizam premalu količinu vode. Ljudi mogu popiti mnogo više vode nego što im je to neophodno dok obavljaju teže poslove ili vježbaju, međutim to ih izlaže riziku od intoksikacije vodom (hiperhidratacije), koja može biti i smrtonosna.[73][74] Uvriježeno mišljenje da osoba mora konzumirati osam čaša vode svaki dan nema realno uporište u nauci.[75] Slične zablude postoje i u pogledu efekata vode na gubitak tjelesne težine i konstipacije ("zatvora").[76]

Prvobitne preporuke o količini uzimanja vode koje je 1945. izdao "Odbor za hranu i prehranu" Američkog nacionalnog vijeća za istraživanje sadrže uobičajeni standard za različite osobe iznosi 1 ml na svaku unesenu kaloriju hrane. Najveći dio ove količine vode već se nalazi u pripremljenoj hrani.[77] Najnovije prehrambene preporuke koje je izdalo Američko nacionalno vijeće za istraživanje općenito navode (uključujući i izvore iz hrane): 3,7 litara vode dnevno za muškarce i 2,7 litara za žene.[78]
Kod specifičnih slučajeva, trudnice i dojilje trebaju dodatne količine tekućine. Američki institut za medicinu preporučuje da prosječan muškarac treba popiti 3 litra vode, a žena 2,2 litra, dok se kod trudnica ta količina penje na 2,4 litra (oko 10 čaša), a dojilje bi trebale piti i do 3 litra vode, jer se tokom perioda dojenja troše posebno velike količine tečnosti.[79] Također je naglašeno, da se pri normalnoj prehrani oko 20% vode unese putem hrane, dok se ostatak unosi pijući vodu i druga pića (uključujući i kofeinirana). Voda se iz organizma izlučuje na nekoliko načina. To su izlučivanje putem mokraće i stolice, zatim putem znojenja i disanjem. Izlučivanje vode se povećava pri većem fizičkom radu i izlaganju višoj temperaturi, te se dnevna potražnja za vodom povećava.
Ljudima je neophodna voda za piće koja ne sadrži mnogo nečistoća. Uobičajene nečistoće obuhvataju metalne soli i okside, uključujući bakar, željezo, kalcij i olovo,[80] i/ili opasne bakterije poput Vibrio. Neke rastvorene materije su prihvatljive pa čak i poželjene zbog poboljšanja okusa vode, a koje daju organizmu potrebne elektrolite.[81]
Najveći pojedinačni (po zapremini) izvor slatke vode pogodne za piće je Bajkalsko jezero u Sibiru.[82]
Pranje
[uredi | uredi izvor]Sklonost vode da gradi rastvore i emulzije je korisna u raznim procesima pranja. Mnogi industrijski procesi se zasnivaju na reakcijama hemikalija rastvorenih u vodi, suspenzija raznih materijala u vodi ili korištenju vode za izdvajanje raznih supstanci. Pranje je također i važna komponenta u nekoliko aspekata lične higijene tijela.
Transport
[uredi | uredi izvor]

Jedan od važnijih dijelova svjetske ekonomije predstavlja korištenje vode za transport materijala putem rijeka i kanala kao i međunarodni riječni i brodski saobraćaj.
Upotreba u hemiji
[uredi | uredi izvor]Voda se mnogo koristi u hemijskim reakcijama kao otapalo ili reaktant, a nešto manje kao rastvor ili katalizator. U neorganskim reakcijama, voda je uobičajeno otapalo, koje rastvara mnoge ionske spojeve. U organskim reakcijama, ona se obično ne koristi kao reakcijsko otapalo, jer ne rastvara dobro reaktante a ujedno je i amfoterična (kisela i bazna) i nukleofilna. I pored toga, te osobine su nekad poželjne. Također, ubrzanje Diels-Alderovih reakcija vodom je moguće. U posljednje vrijeme, u fokusu istraživanja je superkritična voda. Takva voda zasičena kisikom vrlo efikasno sagorijeva organske zagađivače.
Razmjena toplote
[uredi | uredi izvor]Voda i vodena para su uobičajeni fluidi korišteni za razmjenu toplote, zbog svoje lahke dostupnosti ali i zbog velikog toplotnog kapaciteta, bilo da se radi o grijanju ili hlađenju. Hladna voda se prirodno može dobiti iz jezera ili mora. Ona je posebno efektivna za transport toplopte putem isparavanja i kondenzacija, najviše zbog svoje velike latentne toplote isparavanja. Nedostaci vode ogledaju se u tome što najčešći metali koji se primjenjuju u industrijama poput čelika i bakra mnogo brže oksidiraju ako dolaze u dodir sa neprerađenom vodom i parom. U svim termalnim električnim centralama, voda se koristi kao radni fluid (unutar zatvorenog sistema između bojlera, parne turbine i kondenzatora) i rashladno sredstvo (za otpremanje otpadne toplote u vodenu površinu ili njeno provođenje evaporacijom u rashladnim tornjevima). U Sjedinjenim Američkim Državama, za hlađenje električkih centrala troši se najviše vode u industriji.[63]
U nuklearnim reaktorima i nuklearnim električnim centralama, voda se koristi i kao usporivač neutrona. U većini nuklearnih reaktora, voda je ujedno i rashladno sredstvo i usporivač. Ona daje nešto pasivniju sigurnosnu mjeru, jer uklanjanje vode iz reaktora također i usporava nuklearnu reakciju. Međutim, za zaustavljanje nuklearne reakcije mnogo više se koriste drugi metodi, kojima se preferira da se nuklearno jezgro ostavi prekriveno vodom da bi se osiguralno njegovo adekvatno hlađenje.
Gašenje požara
[uredi | uredi izvor]
Voda ima visoku toplotu isparavanja i relativno je intertna, zbog čega je vrlo pogodna kao fluid za gašenje požara. Isparavanje vode oduzima toplotu od vatre. Međutim, vrlo opasno je koristiti vodu za gašenje požara u kojima gore ulja i organska otapala, jer mnogi organski materijali plutaju na vodi te se tako zapaljeni fluidi mogu raširiti vodom.
Korištenje vode za gašenje požara se mora razmotriti u aspektu opasnosti od eksplozije pare, koja se dešava kada se vodom gase vrlo snažni požari u zatvorenom ili ograničenom prostoru, a isto tako se može dogoditi i eksplozija vodika, ako supstanca koja se gasi reagira s vodom, kao što su određeni metali ili užareni ugljik poput uglja, drvenog uglja, koksa, nakon čega se voda razlaže dajući vodeni plin.
Snaga takvih eksplozija vidljiva je u Černobilskoj nesreći, mada voda koja je tu bila, potjecala od gašenja vatre nego iz sistema vodenog hlađenja reaktora. Eksplozija pare se dešava kada ekstremno zagrijavanje jezgra prouzrokuje da se voda gotovo u trenutku pretvori u paru. Eksplozija vodika se može desiti kao rezultat reakcije između pare i jako zagrijanog cirkonija.
Rekreacija
[uredi | uredi izvor]
Ljudi koriste vodu za mnoge rekreativne svrhe, kao i za vježbanje i sport. Neke od aktivnosti s vodom su: plivanje, skijanje na vodi, surfanje, ronjenje i jedriličarstvo. Osim toga, neki sportovi se igraju na ledu kao što su hokej na ledu i umjetničko klizanje. Plaže, obale jezera i vodeni parkovi su popularna mjesta za ljude, gdje idu da bi se opustili i uživali u rekreaciji. Mnoge osobe doživljavaju zvuk tekuće vode umirujućim, pa su fontane i slični vodeni objekti vrlo popularan ukras. Također, mnogi ljudi drže ribe i druge životinje u akvarijima i bazenima, kao hobi, zabavu i slično. Ljudi koriste vodu i za zimske sportove tj. skijanje, sankanje, snowbording, skijaške skokove i druge, a za koje je neophodan snijeg odnosno smrznuta voda.
Industrija vode
[uredi | uredi izvor]
Industrija vode obuhvata prodaju vode za piće i usluge zbrinjavanja i odlaganja otpadnih voda (uključujući preradu kanalizacije) iz domaćinstava i industrije. Postrojenja za proizvodnju vode uključuju cisterne za prikupljanje kišnice, gradsku vodovodnu mrežu, bunare i uređanje za pročišćavanje vode, vodotornjeve, stare akvadukte, vodene tankove i druge. Danas su u razvoju i uređaju za generiranje vode iz atmosfere.
Voda za piće se obično zahvata neposredno na izvorima rijeka ili potoka, ili se vadi iz vještačkih bušotina (bunara) u tlu, a nerijetko se pumpa i iz jezera. Da bi se dobila veća količina vode, moguće je bušenje više bunara na pogodnim mjestima, uz pretpostavku da količina podzemne vode u izdanima može zadovoljiti toliku potražnju. Drugi izvor vode je prikupljanje kišnice. Nerijetko tako dobijena voda zahtijeva prethodno pročišćavanje prije nego bude pogodna za piće. Pročišćavanje uključuje uklanjanje nerastvorljivih čestica, rastvorenih supstanci i opasnih mikroba. Najčešće metode su filtriranje kroz pijesak, čime se uklanja samo nerastvorljivi materijal, dok hloriranje i prokuhavanje ubija škodljive mikrobe. Destilacija može zamijeniti sve tri metode. Postoje i mnogo naprednije tehnike, poput reverzibilne osmoze. Desalinizacija morske vode je dosta skupo rješenje za dobijanje pitke vode, a koristi se u priobalnim područjima gdje vlada suha ili pustinjska klima.
Raspodjela pitke vode se vrši gradskim ili drugim vodovodnim sistemima, doprema se cisternama ili se prodaje kao flaširana voda. Vlade mnogih zemalja imaju razvijene programe kojima se besplatno distriburira voda. Smanjivanje količine potrošnje vode koristeći vodu za piće isključivo za tu svrhu je druga opcija štednje. U nekim gradovima kao što je Hong Kong, morska voda se uglavnom koristi za sapiranje toaleta da bi se uštedjelo na zalihama vode za piće.
Zagađivanje vode je najveća pojedinačna prijetnja zalihama pitke vode, jer se zagađenom materijom ograničavaju drugi vidovi upotrebe vode, time se rasipaju vodeni resursi, bez obzira na koristi koje od toga ima zagađivač. Kao i druge vrste zagađenja, ona ne ulazi u standardni izračun tržišnih troškova, smatrajući se eksternalijama na koje tržište ne može računati. Zbog toga, drugi ljudi posredno plaćaju cijenu zagađenja vode, dok istovremeno profiti privatnih kompanija se ne dijele lokalnom stanovništvu koje je direktna žrtva zagađenja. Farmaceutski proizvodi koje koriste ljudi često završavaju u vodotocima a imaju pogubne efekte na živi svijet u vodi ako se takve materije bioakumuliraju ako nisu biorazgradive.
Uređaji i postrojenja za zbrinjavanje otpadnih voda su kanalizacijski kolektori. Drugi način za uklanjanje zagađenja iz površinskih vodotoka je biodrenaža.
Voda se koristi i za dobijanje električne struje. Hidroelektrična energija dobija se iz hidroelektrana, tako što tekuća voda pokreće vodene turbine povezane na generatore. Električna energija dobijena iz hidroelektrana ne zagađuje okolinu, ima relativno niske troškove proizvodnje i smatra se obnovljivim izvorom energije. Najčešće se na rijeci ili vodotoku izgradi brana, čime se uzvodno kreira umjetno jezero. Voda teče iz jezera kroz turbine u brani koje pokreću generatore.
Voda pod pritiskom se koristi za vodeno pjeskarenje i rezanje vodenim mlazom. Također, za precizno rezanje koriste se vodeni pištolji koji izbacuju vodu pod izuzetno visokim pritiskom (i do 10.000 bara). Prednost im je relativno velika sigurnost pri upotrebi, a nisu štetni za okolinu. Takva voda pod pritiskom se koristi i za hlađenje mašina, kao naprimjer za sprječavanje pregrijavanja sječiva.
Voda se također koristi i za mnoge industrijske procese i mašine, kao što je parna turbina i izmjenjivači toplote, pored njene upotrebe za otapalo u hemiji. Ispuštanje neprerađene vode iz industrije smatra se zagađenjem. Ono uključuje i ispuštanje rastvora (hemijsko zagađenje) i otpuštanje vode za rashlađivanje (termalno zagađenje). Industriji je neophodna čista voda za mnoge aplikacije a prije korištenja vode i njenog ispuštanja koristi razne tehnike prečišćavanja.
Prerada hrane
[uredi | uredi izvor]
Kuhanje, blanširanje i dinstanje su neke od popularnih metoda koje najčešće podrazumijeva dodavanje hrane u vodu ili paru, te njeno zagrijavanje. Voda se također koristi i za pranje posuđa. Voda igra mnoge kritične uloge u oblasti nauke o hrani.
Rastvorene supstance poput soli i šećera koji se nalaze u vodi utječu na fizičke osobine vode. Tačka topljenje i ključanja vode zavisi od rastvorenih supstanci u njoj, kao i od pritiska, što dalje zavisi od nadmorske visine. Voda ključa na nižoj temperaturi pri nižem atmosferskom pritisku, što se dešava pri višoj nadmorskoj visini. Jedan mol sukroze (šećera) po kilogramu vode povisuje tačku ključanja vode za 0,51 °C (32,918 °F), dok jedan mol soli po kg vode povisuje tačku ključanja za 1,02 °C (33,836 °F). Slično, povećanje broja rastvorenih materija u vodi snižava tačku mržnjenja vode.[83]
Tvrdoća vode je također jedan od osnovnih faktora pri pripremanju hrane a može se promijeniti korištenjem ionsko-izmjenjivačkih hemijskih sistema. Ona dramatično utječe na kvalitet proizvoda, a također igra ulogu i u sanitaciji. Tvrdoća vode se klasificira u zavisnosti od količine soli kalcij karbonata u litri vode. Tvrdoća vode se izražava u stepenima: 0,064 g kalcij karbonata je jednako jednom stepenu tvrdoće.[83] Voda se smatra mehkom ako sadrži 1 do 4 stepena, srednjom od 5 do 10 stepeni, a tvrda voda je od 11 do 20 stepeni.[83] Tvrdoća također utječe na pH ravnotežu vode, što također ima određeni značaj pri priremanju hrane. Naprimjer, tvrda voda onemogućava proizvodnju čistih i bistrih pića.
Pravo, politika i krize
[uredi | uredi izvor]
Vodna politika je dio politike koja se bavi vodom i vodenim resursima, iz razloga što je ona strateški resurs u svijetu i važan element u mnogim političkim i vojnim sukobima. Ona može izazvati utjecaj na zdravlje i oštetiti biološku raznolikost.
Prema izvještaju UN-a, oko 1,6 milijardi ljudi su od 1990. dobili pristup izvorima čiste vode.[84] Smatra se da je udio ljudi u zemljama u razvoju koji imaju pristup čistoj vodi poboljšan sa 30% u 1970tim[85] do 71% u 1990, zatim 79% u 2000. i 84% u 2004. Smatra se da će se ovaj trend rasta nastaviti.[4] Jedan od osnovnih ciljeva Millennium Development Goals (ciljevi milenijskog razvoja) je da se do 2015. upola smanji udio stanovništva bez stalnog i sigurnog pristupa čistoj i pitkoj vodi. Predviđa se da će ovaj cilj biti ostvaren.
Izvještaj Ujedinjenih nacija iz 2006. navodi da "ima vode za svakoga", ali je pristup njoj otežan zbog lošeg upravljanja i korupcije.[86] Osim toga, postoje inicijative na svjetskom nivou kojima se nastoji poboljšati efikasnost u pružanju pomoći, kao što je Pariska deklaracija o efektivnoj pomoći,[87] koja nije ozbiljno uzeta od strane donatora iz oblasti vode, na način kako je to učinjeno u obrazovanju i zdravstvu, što izostavlja potencijalne donatore čiji projekti se zbog toga preklapaju, a organi vlasti koji bi koristili te donacije, ne primjenjuju donesene zakone.[88]
Autori sveobuhvatne procjene o upravljanju vodom u poljoprivredi 2007. naveli su slabo upravljanje kao jedan od razloga za neke oblike nedostatka vode. Vodoprivreda je skup formalnih i neformalnih procesa kroz koje se donose odluke vezane za upravljanje vodom. Dobra vodoprivreda se prvenstveno odnosi na poznavanje koji procesi se najbolje manifestiraju u određenim fizičkim i socioekonomskim kontekstima. Često se prave greške tako što se pokušava primijeniti neko rješenje koje dobro funkcionira u razvijenim zemljama na područja i kontekste zemalja u razvoju. Jedan od primjera je rijeka Mekong. Međunarodni institut za upravljanje vodom je sagledao politike šest država koje se oslanjaju na rijeku Mekong, nakon čega su zaključili da se potpuna i transparentna analiza dobiti i troška i procjena utjecaja na okolinu vrlo rijetko provodi. Oni su također i našli da je zakon Kambodže o zahvatanju vode mnogo složeniji nego što bi to trebao biti.[89]
Izvještaj UN-a o razvoju svjetskih voda (WWDR, 2003) u sklopu Programa procjene svjetskih voda procjenjuje da će se u narednih 20 godina količna vode dostupne svima smanjiti za 30%. Oko 40% svih ljudi u svijetu trenutno nema dovoljno svježe vode za minimalne higijenske potrebe. Više od 2,2 miliona ljudi je umrlo 2000. od bolesti povezanih sa vodom (korištenjem zagađene vode) ili sušom. Britanska humanitarna organizacija WaterAid objavila je 2004. da u prosjeku svakih 15 sekundi umre jedno dijete od bolesti povezanih s vodom, a koje bi se vrlo lahko mogle spriječiti. Često su te bolesti uzrokovane nedostatkom kanalizacijskog sistema.
Organizacije koje se bave zaštitom voda uključuju, između ostalih, IWA (Međunarodno udruženje vode), WaterAid, Water 1st i Američko udruženje za vodene resurse. Međunarodni institut za upravljanje vodama poduzima projekte kojima je cilj da stvore efektivne sisteme upravljanja vodom kako bi se smanjilo siromaštvo u svijetu. Redovno ili povremeno održavaju se konvencije u vezi s vodom, između ostalih, UNCCD (Konvencija UN-a za borbu protiv dezertifikacije, Međunarodna konvencija za prevenciju zagađenja kojeg uzrokuju brodovi, Konvencija UN o pravu na moru i Ramsarska konvencija. Svjetski dan voda obilježava se 22. marta, a svjetski dan okeana 8. juna.
U kulturi
[uredi | uredi izvor]Religija
[uredi | uredi izvor]U većini svjetskih religija, voda se smatra supstancom koja čisti. Religije koje uključuju ritualna vjerska pranja uključuju, između ostalih, kršćanstvo, hinduizam, islam, judaizam, rastafarijanstvo, šintoizam, taoizam i druge. Potapanje, škropljenje ili uranjanje osobe u vodu je jedna od središnjih religijskih ceremonija u kršćanstvu (gdje se naziva krštenje), a također je dio prakse drugih religije, uključujući islam (gdje se naziva gusul), judaizam (mikvah) i sikizam (amrit sanskar). Osim toga, ritualna pranja čistom vodom mrtvih osoba obavljaju se u mnogi religijama uključujući islam i judaizam. U islamu, pet dnevnih molitvi se ne mogu obavljati ako se prethodno nije obavljeno potpuno pranje i čišćenje određenih dijelova tijela čistom vodom (abdest), osim ako voda nije dostupna (vidi tejemum). U šintoizmu, voda se koristi u gotovo svim vjerskim ritualima da bi se očistila osoba ili područje (npr. u ritualu misogi). U Kur'anu, riječ arapski: بحر (al-bahar, voda, more) spomenuta je 32 puta,[90] dok su u Bibliji voda i izvedenice od te riječi navedene 722 puta.[91]
Filozofija
[uredi | uredi izvor]Starogrčki filozof Empedoklo smatrao je vodu jednim od četiri osnovna, klasična elementa, zajedno sa vatrom, zemljom i zrakom, a smatrana je kao ylem, odnosno osnovnom supstancom svemira. Tales, kojeg je Aristotel opisao kao astronoma i inženjera, teoretizirao je da je zemlja, koja je gušća od vode, nastala iz nje. Tales, monist, dalje je vjerovao da su sve stvari načinjene od vode. Platon je vjerovao da je oblik vode ikosahedron, koji je razlog zašto ona može lahko teči u odnosu na zemlju, oblika kocke.[92]
Po teoriji četiri tjelesna soka, voda je povezana sa flegmatičnim sokovima, jer je hladna i mokra. Kao klasični element, voda je također jedan od pet elemenata u klasičnoj kineskoj filozofiji, pored zemlje, vatre, drveta i metala.
Voda je također imala i ulogu u nekim dijelovima tradicionalnih i popularnih azijskih filozofija. Jamesa Leggea je 1891. preveo Dao De Jinga koji naglašava "najviša odlika je poput vode. Odlika vode javlja se u njenoj korisnosti za sve stvari, i u njenom zauzimanju, bez težnji (u suprotnom smijeru), najnižeg mjesta koje svi ljudi mrze. Stoga (njen put) je u blizini Taoa" i "nema ništa na svijetu mekše i slabije od vode, a za stvari koje napadaju a koje su snažne i čvrste, nema ništa što bi moglo steći prednost nad njom, nema ništa toliko efektivno da bi je promijenilo".[93] Tekst zvani Guanzi u poglavlju "Shui di" 水地 (zemlja vode ili površinska voda) dalje elaborira simbolizam vode, proglašavajući da je "čovjek voda" i dajući joj osobine prirodnih karakteristika ljudi iz raznih kineskih regija, da bi po njima karakterizirao lokalne vodne resurse.[94]
Također pogledajte
[uredi | uredi izvor]Reference
[uredi | uredi izvor]- ^ "CIA-The world factbook". Central Intelligence Agency. Arhivirano s originala, 5. 1. 2010. Pristupljeno 20. 12. 2008.
- ^ a b c Gleick, P.H., ured. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. str. 13, tabela 2.1 "Water reserves on the earth". Arhivirano s originala, 8. 4. 2013. Pristupljeno 17. 12. 2014.
- ^ Water Vapor in the Climate System, Special Report, [AGU], decembar 1995. Vital Water, UNEP.
- ^ a b "MDG Report 2008" (PDF). Arhivirano s originala (PDF), 1. 7. 2018. Pristupljeno 25. 7. 2010.
- ^ "Public Services" Arhivirano 7. 4. 2012. na Wayback Machine, Gapminder video
- ^ Kulshreshtha, S.N (1998). "A Global Outlook for Water Resources to the Year 2025". Water Resources Management. 12 (3): 167–184. doi:10.1023/A:1007957229865
- ^ "Charting Our Water Future: Economic frameworks to inform decision-making" (PDF). Arhivirano s originala (PDF), 5. 7. 2010. Pristupljeno 17. 12. 2014.
- ^ Baroni, L.; Cenci, L.; Tettamanti, M.; Berati, M. (2007). "Evaluating the environmental impact of various dietary patterns combined with different food production systems". European Journal of Clinical Nutrition. 61 (2): 279–286.CS1 održavanje: više imena: authors list (link) doi:10.1038/sj.ejcn.1602522
- ^ L. Harr, J. S. Gallagher, G. S. Kell: NBS/NRC Steam Tables, Hemisphere Publishing Corp., 1984.
- ^ K. N. Marsh, ur.: Recommended Reference Materials for the Realization of Physicochemical Properties, Blackwell Scientific Publications, Oxford, 1987.
- ^ J. V. Sengers, J. T. R. Watson: Improved international formulations for the viscosity and thermal conductivity of water substance, J. Phys.Chem.Ref. Data, 15:1291, 1986. doi:10.1063/1.555763
- ^ Braun, Charles L.; Sergei N. Smirnov (1993). "Why is water blue?". J. Chem. Educ. 70 (8): 612. Arhivirano s originala, 3. 4. 2012. Pristupljeno 17. 12. 2014. doi:10.1021/ed070p612
- ^ Campbell, Neil A.; Brad Williamson; Robin J. Heyden (2006). Biology: Exploring Life. Boston, Massachusetts: Pearson Prentice Hall. ISBN 0-13-250882-6
- ^ Capillary Action – Liquid, Water, Force, and Surface – JRank Articles
- ^ Kotz, J. C., Treichel, P., & Weaver, G. C. (2005). Chemistry & Chemical Reactivity. Thomson Brooks/Cole.CS1 održavanje: više imena: authors list (link) ISBN 0-534-39597-X
- ^ Ben-Naim, Ariel; et al. (2011). Alice's Adventures in Water-land. Singapore. Eksplicitna upotreba et al. u:
|last=(pomoć) doi:10.1142/8068 ISBN 978-981-4338-96-7 - ^ Ball, Philip (14. 9. 2007). "Burning water and other myths". Nature News. Pristupljeno 14. 9. 2007.
- ^ . G. Császár, G. Czakó, T. Furtenbacher, J. Tennyson, V. Szalay, S. V. Shirin, N. F. Zobov i O. L. Polyansky, On equilibrium structures of the water molecule, J. Chem. Phys. 122 (2005) 214305 PMID 15974736 (PubMed)
- ^ P. L. Silvestrelli i M. Parrinello, Structural, electronic, and bonding properties of liquid water from first principles, J. Chem. Phys., 111 (1999) 3572-3580 doi:10.1063/1.479638
- ^ Melnick, Gary, Harvard-Smithsonian Center for Astrophysics i Neufeld, David, Johns Hopkins University, citirano u: "Discover of Water Vapor Near Orion Nebula Suggests Possible Origin of H20 in Solar System (sic)". The Harvard University Gazette. 23. 4. 1998. Arhivirano s originala, 16. 1. 2000. Pristupljeno 17. 12. 2014. "Space Cloud Holds Enough Water to Fill Earth's Oceans 1 Million Times". Headlines@Hopkins, JHU. 9. 4. 1998. "Water, Water Everywhere: Radio telescope finds water is common in universe". The Harvard University Gazette. 25. 2. 1999.
- ^ a b Clavin, Whitney; Buis Alan (22. 7. 2011). "Astronomers Find Largest, Most Distant Reservoir of Water". NASA. Arhivirano s originala, 24. 7. 2011. Pristupljeno 25. 7. 2011.
- ^ a b Staff (22. 7. 2011). "Astronomers Find Largest, Oldest Mass of Water in Universe". Space.com. Pristupljeno 23. 7. 2011.
- ^ Solanki, S. K.; Livingston, W.; Ayres, T. (1994). "New Light on the Heart of Darkness of the Solar Chromosphere". Science. 263 (5143): 64–66.CS1 održavanje: ref=harv (link) PMID 17748350 (PubMed) doi:10.1126/science.263.5143.64
- ^ "MESSENGER Scientists 'Astonished' to Find Water in Mercury's Thin Atmosphere". Planetary Society. 3. 7. 2008. Arhivirano s originala, 7. 7. 2008. Pristupljeno 5. 7. 2008.
- ^ Bertaux, Jean-Loup; et al. (2007). "A warm layer in Venus' cryosphere and high-altitude measurements of HF, HCl, H2O and HDO". Nature. 450 (7170): 646–649. Eksplicitna upotreba et al. u:
|first=(pomoć) doi:10.1038/nature05974 PMID 18046397 (PubMed) - ^ Sridharan, R.; S.M. Ahmed, Tirtha Pratim Dasa, P. Sreelathaa, P. Pradeepkumara, Neha Naika, Gogulapati Supriya (2010). "'Direct' evidence for water (H2O) in the sunlit lunar ambience from CHACE on MIP of Chandrayaan I". Planetary and Space Science. 58 (6): 947. doi:10.1016/j.pss.2010.02.013
- ^ Donald Rapp (28. 11. 2012). Use of Extraterrestrial Resources for Human Space Missions to Moon or Mars. Springer. str. str. 78–. ISBN 978-3-642-32762-9
- ^ Küppers, M.; O'Rourke, L.; Bockelée-Morvan, D.; Zakharov, V.; et al. (23. 1. 2014). "Localized sources of water vapour on the dwarf planet (1) Ceres". Nature. 505 (7484): 525–527. Eksplicitna upotreba et al. u:
|first=(pomoć) doi:10.1038/nature12918 PMID 24451541 (PubMed) - ^ Atreya, Sushil K.; Wong, Ah-San (2005). "Coupled Clouds and Chemistry of the Giant Planets — A Case for Multiprobes" (PDF). Space Science Reviews. 116: 121–136.CS1 održavanje: ref=harv (link) doi:10.1007/s11214-005-1951-5
- ^ Cook, Jia-Rui C.; Gutro, Rob; et al. (12. 12. 2013). "Hubble Sees Evidence of Water Vapor at Jupiter Moon". NASA. Arhivirano s originala, 15. 12. 2013. Pristupljeno 12. 12. 2013. Eksplicitna upotreba et al. u:
|first=(pomoć) - ^ Hansen (2006). "Enceladus' Water Vapor Plume". Science. 311 (5766): 1422–5. doi:10.1126/science.1121254 PMID 16527971 (PubMed)
- ^ Hubbard, W. B. (1997). "Neptune's Deep Chemistry". Science. 275 (5304): 1279–1280. doi:10.1126/science.275.5304.1279 PMID 9064785 (PubMed)
- ^ Water Found on Distant Planet Arhivirano 16. 7. 2007. na Wayback Machine 12. juli 2007, autor: Laura Blue, magazin Time
- ^ Water Found in Extrasolar Planet's Atmosphere – Space.com
- ^ Near-IR Direct Detection of Water Vapor in Tau Boo b: Alexandra C. Lockwood, John A. Johnson, Chad F. Bender, John S. Carr, Travis Barman, Alexander J.W. Richert, Geoffrey A. Blake
- ^ Clavin, Whitney; Chou, Felicia; Weaver, Donna (24. 9. 2014). "NASA Telescopes Find Clear Skies and Water Vapor on Exoplanet". NASA. Arhivirano s originala, 14. 1. 2017. Pristupljeno 24. 9. 2014.
- ^ a b Arnold Hanslmeier (29. 9. 2010). Water in the Universe. Springer Science & Business Media. str. str. 159–. ISBN 978-90-481-9984-6
- ^ osoblje NASA-e (3. 12. 2013). "Hubble Traces Subtle Signals of Water on Hazy Worlds". NASA. Pristupljeno 4. 12. 2013.CS1 održavanje: upotreba parametra authors (link)
- ^ Jonas Andersson: Water in stellar atmospheres, Lund University, pristupljeno 24. maja 2016.
- ^ Herschel Finds Oceans of Water in Disk of Nearby Star[mrtav link], NASA, 20. oktobar 2011.
- ^ Lloyd, Robin. "Water Vapor, Possible Comets, Found Orbiting Star", 11. juli 2001, Space.com
- ^ Platt, Jane; Bell, Brian (3. 4. 2014). "NASA Space Assets Detect Ocean inside Saturn Moon". NASA. Pristupljeno 3. 4. 2014.
- ^ Iess, L.; Stevenson, D.J.; Parisi, M.; et al. (4. 4. 2014). "The Gravity Field and Interior Structure of Enceladus". Science. 344 (6179): 78–80. Pristupljeno 3. 4. 2014. Eksplicitna upotreba et al. u:
|first=(pomoć) doi:10.1126/science.1250551 - ^ https://www.lpi.usra.edu/meetings/lpsc2013/pdf/2454.pdf
- ^ Will Dunham Jupiter's moon Ganymede may have 'club sandwich' layers of ocean Arhivirano 3. 5. 2014. na Wayback Machine, Reuters, 3. maj 2014.
- ^ Carr, M.H. (1996). Water on Mars. New York: Oxford University Press. str. 197. ISBN 9780195099386.
- ^ Versteckt in Glasperlen: Auf dem Mond gibt es Wasser – Wissenschaft – Der Spiegel – Nachrichten
- ^ Water Molecules Found on the Moon Arhivirano 27. 9. 2009. na Wayback Machine, NASA, 24. septembar 2009.
- ^ a b Sparrow, Giles (2006). The Solar System. Thunder Bay Press. ISBN 1-59223-579-4
- ^ NASA, "MESSENGER Finds New Evidence for Water Ice at Mercury's Poles Arhivirano 30. 11. 2012. na Wayback Machine", 29. novembar 2012.
- ^ Weird water lurking inside giant planets, New Scientist, 1. septembar 2010., izdanje magazina 2776.
- ^ Ehlers, E.; Krafft, T, ured. (2001). "J. C. I. Dooge. "Integrated Management of Water Resources"". Understanding the Earth System: compartments, processes, and interactions. Springer. str. 116.CS1 održavanje: više imena: editors list (link)
- ^ "Habitable Zone". The Encyclopedia of Astrobiology, Astronomy and Spaceflight.
- ^ Shiga, David (6. 5. 2007). "Strange alien world made of "hot ice"". New Scientist. Arhivirano s originala, 6. 7. 2008. Pristupljeno 28. 3. 2010.
- ^ Aguilar, David A. (16. 12. 2009). "Astronomers Find Super-Earth Using Amateur, Off-the-Shelf Technology". Harvard-Smithsonian Center for Astrophysics. Pristupljeno 28. 3. 2010.
- ^ Gleick, P.H., ured. (1993). Water in Crisis: A Guide to the World's Freshwater Resources. Oxford University Press. str. str.15, tabela 2.3. Arhivirano s originala, 8. 4. 2013. Pristupljeno 17. 12. 2014.
- ^ Ben-Naim, A. i Ben-Naim, R., P.H. (2011). Alice's Adventures in Water-land. World Scientific Publishing. str. 31.CS1 održavanje: više imena: authors list (link) ISBN 978-981-4338-96-7 doi:10.1142/8068
- ^ "G8 "Action plan" decided upon at the 2003 Evian summit". G8.fr. 2. 6. 2003. Arhivirano s originala, 23. 8. 2010. Pristupljeno 17. 12. 2014.
- ^ "World Health Organization. Safe Water and Global Health". Who.int. 25. 6. 2008. Pristupljeno 25. 7. 2010.
- ^ UNEP International Environment (2002). Environmentally Sound Technology for Wastewater and Stormwater Management: An International Source Book. IWA Publishing. ISBN 1-84339-008-6
- ^ Ravindranath, Nijavalli H.; Jayant A. Sathaye (2002). Climate Change and Developing Countries. Springer. ISBN 1-4020-0104-5
- ^ "WBCSD Water Facts & Trends". Arhivirano s originala, 1. 3. 2012. Pristupljeno 17. 12. 2014.
- ^ a b Water Use in the United States Arhivirano 14. 8. 2009. na Wayback Machine, National Atlas.gov
- ^ Gleick, P.H.; Palaniappan, M. (2010). "Peak Water" (PDF). Proceedings National Academy of Science. National Academy of Science. 107 (125): 11155–11162. Pristupljeno 11. 10. 2011. doi:10.1073/pnas.1004812107
- ^ Izvještaj za medije UN-a POP/952, 13. mart 2007. World population will increase by 2.5 billion by 2050
- ^ Molden, D. (ur). Water for food, Water for life: A Comprehensive Assessment of Water Management in Agriculture. Earthscan/IWMI, 2007. ISBN 9781844073979
- ^ Chartres, C. i Varma, S. Out of water. From Abundance to Scarcity and How to Solve the World's Water Problems FT Press (USA), 2010, ISBN 978-0-13-136726-5
- ^ Décret relatif aux poids et aux mesures. 18 germinal an 3 (7. april 1795). Dekret u vezi jedinica i mjerenja (na francuskom). quartier-rural.org
- ^ here L'Histoire Du Mètre, La Détermination De L'Unité De Poids. histoire.du.metre.free.fr
- ^ Re: What percentage of the human body is composed of water? Jeffrey Utz, M.D., The MadSci Network
- ^ "Healthy Water Living". BBC. Arhivirano s originala, 23. 4. 2008. Pristupljeno 1. 2. 2007.
- ^ Rhoades RA, Tanner GA (2003). Medical Physiology (2. izd.). Baltimore: Lippincott Williams & Wilkins. ISBN 0-7817-1936-4
- ^ Noakes TD, Goodwin N, Rayner BL; et al. (1985). "Water intoxication: a possible complication during endurance exercise". Med Sci Sports Exerc. 17 (3): 370–375. Eksplicitna upotreba et al. u:
|author=(pomoć)CS1 održavanje: više imena: authors list (link) PMID 4021781 (PubMed) doi:10.1249/00005768-198506000-00012 - ^ Noakes TD, Goodwin N, Rayner BL, Branken T, Taylor RK (2005). "Water intoxication: a possible complication during endurance exercise, 1985". Wilderness Environ Med. 16 (4): 221–7.CS1 održavanje: više imena: authors list (link) PMID 16366205 (PubMed) doi:10.1580/1080-6032(2005)16[221:WIAPCD]2.0.CO;2
- ^ "Drink at least eight glasses of water a day." Really? Is there scientific evidence for "8 × 8"? Arhivirano 20. 4. 2010. na Wayback Machine, autor: Heinz Valdin, Odjeljenje za fiziologiju, Medicinska škola Dartmouth, Lebanon, New Hampshire
- ^ Drinking Water – How Much? Arhivirano 10. 4. 2012. na Wayback Machine, Factsmart.org
- ^ Food and Nutrition Board, National Academy of Sciences. Recommended Dietary Allowances. National Research Council, Reprint and Circular Series, No. 122. 1945. str. 3–18.
- ^ "Are you consuming enough water? recommendations from the United States National Research Council". water softener critic. Arhivirano s originala, 28. 7. 2014. Pristupljeno 21. 7. 2014.
- ^ "Water: How much should you drink every day?". Mayoclinic.com. Pristupljeno 25. 7. 2010.
- ^ Conquering Chemistry 4. izd. izdano 2008.
- ^ Maton, Anthea; Jean Hopkins, Charles William McLaughlin; Susan Johnson, Maryanna Quon Warner; David LaHart, Jill D. Wright (1993). Human Biology and Health. Englewood Cliffs, New Jersey, SAD: Prentice Hall. ISBN 0-13-981176-1
- ^ Unesco (2006). Water: a shared responsibility. Berghahn Books. str. str. 125. ISBN 1-84545-177-5
- ^ a b c Vaclavik, Vickie A. i Christian, Elizabeth W (2007). Essentials of Food Science. Springer.CS1 održavanje: više imena: authors list (link) ISBN 0-387-69939-2
- ^ The Millennium Development Goals Report Arhivirano 1. 7. 2018. na Wayback Machine, United Nations, 2008
- ^ Lomborg, Björn (2001). The Skeptical Environmentalist (PDF). Cambridge University Press. str. 22. Arhivirano s originala (PDF), 25. 7. 2013. Pristupljeno 17. 12. 2014. ISBN 0-521-01068-3
- ^ UNESCO, (2006), Water, a shared responsibility. The United Nations World Water Development Report 2.
- ^ Pariska deklaracija o efektivnoj pomoći.
- ^ Welle, Katharina; Evans, Barbara; Tucker, Josephine i Nicol, Alan (2008) Is water lagging behind on Aid Effectiveness? Arhivirano 27. 7. 2011. na Wayback Machine
- ^ Water governance, Water Issue Brief, izdanje 5, 2010, IWMI
- ^ Dr. Tarik Al-Suvaidan: Statistical Miracle in Quran
- ^ Jonathan Hewett: Water in the Bible
- ^ Lindberg, D. (2008). The beginnings of western science: The European scientific tradition in philosophical, religious, and institutional context, prehistory to A.D. 1450. (2. izd.). Chicago: University of Chicago Press. ISBN 978-0226482057
- ^ "Internet Sacred Text Archive Home". Sacred-texts.com. Pristupljeno 25. 7. 2010.
- ^ 水地 - Shui Di (Zemlja vode)
Literatura
[uredi | uredi izvor]- Debenedetti, PG., HE Stanley, "Supercooled and Glassy Water", Physics Today 56 (6), str. 40–46 (2003). u PDF-u
- Franks, F (ur.), Water, A comprehensive treatise, Plenum Press, New York, 1972–1982
- Gleick, PH., (ur.), The World's Water: The Biennial Report on Freshwater Resources. Island Press, Washington, D.C. The World's Water, Island Press
- Jones, OA., JN Lester, N Voulvoulis, Pharmaceuticals: a threat to drinking water? TRENDS in Biotechnology 23(4): 163, 2005
- Journal of Contemporary Water Research & Education Arhivirano 2. 4. 2012. na Wayback Machine
- Postel,S., Last Oasis: Facing Water Scarcity. W.W. Norton and Company, New York. 1992
- Reisner,M., Cadillac Desert: The American West and Its Disappearing Water. Penguin Books, New York. 1986.
- United Nations World Water Development Report, izdaje se svake 3 godine UN World Water Development Report
Vanjski linkovi
[uredi | uredi izvor]- OECD statistika o vodi Arhivirano 1. 1. 2009. na Wayback Machine
- The World's Water stranica sa podacima
- FAO sveobuhvatna baza podataka vode, AQUASTAT
- Hronologija konflikata povezanih s vodom: Water Conflict Database Arhivirano 16. 1. 2013. na Wayback Machine
- Istraživanje USGS o vodi za škole
- Portal prema strategijama Svjetske banke, radovi i povezane publikacije o vodenim resursima
- America Water Resources Association
- Struktura vode i nauka Arhivirano 28. 12. 2014. na Wayback Machine
- Benefits of Best Water Softener Arhivirano 11. 7. 2020. na Wayback Machine
- Water Softener Portal. "What is a hard water and what causes it" Arhivirano 15. 7. 2022. na Wayback Machine , pristupljeno 25. 6. 2015.



