트리머릭 오토트랜스포터 접착제
Trimeric autotransporter adhesin분자생물학에서 트리머릭 오토트랜스포터 접착제(TAAs)는 그람 음성 박테리아의 외막에서 발견되는 단백질이다.박테리아는 세포 접착이라는 과정을 통해 숙주 세포를 감염시키기 위해 TAA를 사용한다.[1]TAA는 OCA로 단축된 과두 코일 접착제로도 불린다.본질적으로, 그것들은 박테리아를 숙주 유기체에 유해하고 감염시키는 요인인 독성인자들이다.[2]
TAA는 박테리아가 숙주를 감염시키기 위해 사용하는 많은 방법들 중 하나일 뿐이며, 감염은 폐렴, 패혈증, 뇌막염과 같은 질병을 유발한다.대부분의 박테리아는 분비 경로라는 방법을 통해 숙주를 감염시킨다.TAA는 Vc 유형의 분비 시스템에 더 구체적으로 말하자면 분비 경로의 일부분이다.[3]
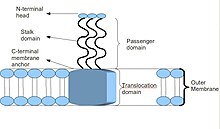
트림형 오토트랜스포터 접착제는 독특한 구조를 가지고 있다.그들이 가지고 있는 구조는 그들의 기능에 결정적이다.그들은 모두 머리-발톱-앵커 구조를 가지고 있는 것으로 보인다.각각의 TAA는 세 개의 동일한 단백질로 구성되어 있다. 따라서 이름이 트리머릭이다.멤브레인 앵커가 외부 막에 삽입되면, 승객 영역은 이를 통해 호스트 외부 환경으로 자율적으로 통과하게 되며, 따라서 오토트랜스포터에 대한 설명이 이루어진다.헤드 영역은 일단 조립된 후, 예를 들어 콜라겐, 섬유소 등 호스트 외 매트릭스의 요소에 붙는다.[2]
분자구조
대부분의 TAA는 단백질 구조가 비슷하다.전자현미경으로 관찰했을 때, 그 구조는 N단자 헤드 영역, 스토크 영역, C단자 멤브레인 앵커 영역으로 구성된 "롤리팝" 모양으로 설명되어 왔다.[2]흔히 문헌에서는 이들을 N단자, 머리, 목, 코일자 줄기를 포함하는 '여객 영역'과 C단자막 앵커(C단자막 앵커)를 가리키는 '번역 영역'을 가리킨다.모든 TAA가 공통적으로 멤브레인 앵커(membranch 닻)를 가지고 있지만, 그들 모두가 스토프와 머리 모두를 포함하는 것은 아닐 수 있다.또한 모든 멤브레인 앵커 도메인은 왼손 평행 베타롤 타입이다.[4]

Trimeric Autotransporter Flustin, BadA의[1] 단백질 영역 배열. 이 그림은 머리, 스토크 및 앵커 도메인을 보여준다.그것은 야다와 같은 머리를 회색으로 보여준다.줄기에는 녹색으로 색칠된 반복 색상과 빨간색으로 된 막 닻이 있다.아래 순서는 도메인 배열 및 프로테아제 클리어비지 사이트 적색(트립신)과 청색(치모트립신)에 따른 착색을 나타낸다.(개방형 액세스 저널에서 사용된 그림, 공용 도메인 PLoS(Public Library of Science) 병원체
확장 신호 펩타이드 영역
| ESPR | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | ESPR | ||||||||
| Pfam | PF13018 | ||||||||
| |||||||||
확장 신호 펩타이드 영역(ESPR)은 Type V 분비 시스템에 속하는 단백질의 신호 펩타이드의 N-terminus에서 발견된다.ESPR의 기능은 임시 테더 역할을 함으로써 내부 막의 변환을[5] 돕는 것이다.이것은 잘못 접힌 단백질의 축적을 방지한다.[6]ESPR은 개별 영역으로 나눌 수 있으며, 다음과 같다: N1(충전), H1(수소), N2, H2 및 C(클레이비지 사이트) 영역.N1과 H1은 ESPR을 형성하고 강력한 보존을 가지고 있다.[7]
함수:확장 시그널 펩타이드 영역이 가지고 있다고 생각되는 몇 가지 역할이 있다.첫째, V형 분비 시스템(T5SS)에서 단백질의 생물 발생이다.둘째, 단백질을 내부막으로 표적으로 하여 신호인식입자경로(SRP)나 TAT(Twin Arginine translocated)로 번역하는 것으로 생각된다.셋째, 경막으로의 단백질 이동 속도를 조절하는 것이 관찰되고 믿어져 왔다.[7]
N단자 헤드 도메인
구조:이 특정 도메인은 단일 가닥의 왼손 베타-헬리크로 구성된 트리머다.이 동료들은 9개의 코팅된 왼손 베타롤을 형성한다.[8]그것은 시퀀스 모티브를 포함하고 있으며, 그 중 다른 TAA 헤드와 강한 유사성이 있다.단백질 구조를 비교할 때 유사성이 많다는 의미다.헤드 도메인은 짧고 보존도가 높은 시퀀스에 의해 줄기와 연결되는데, 이를 흔히 목이라고 부르거나 간혹 커넥터라는 이름을 붙이기도 한다.[2]
함수:이 단백질 영역의 기능은 숙주의 세포외 매트릭스, 특히 섬유소, 콜라겐, 라미네인 등에 결합하는 것이다.[9]헤드 도메인은 호스트 셀에 대한 부착과 자동 접착을 위해 매우 중요하며, 자신을 고수한다.[1]
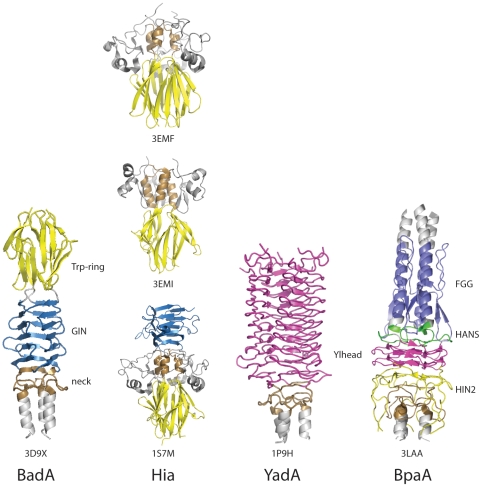
Trimeric Autotransporter 접착제의[10] Head 도메인 비교(개방형 접속 저널에서 사용된 그림, 공용 도메인 PLoS(Public Library of Science) 병원체)
헤드 도메인에는 몇 가지 유형이 있다.[11]각 영역은 머리가 세포외 매트릭스의 다른 구성요소에 결합하는 것을 돕는다.다음은 다음과 같다.야다 유사 헤드 도메인, 트립링, GIN, FxG, HIN1, HIN2.이 항목은 처음 언급된 세 가지 항목에 초점을 맞춘다.
야다 같은 머리
야다와 같은 머리는[12] 단일 가닥의 왼손 베타-헬리크로 구성되어 있으며, 이-헬리케스는 9코일의 왼손 평행 베타-롤(LPBR)을 만들기 위해 더욱 연관되어 있다.이것은 알려진 것 중 가장 촘촘한 베타롤 구조로, 처음 발견된 것이다.YadA 헤드 영역에는 8개의 반복 모티브가 있으며, 각 모티브는 길이가 14개씩이다.[8][13][14]
트립 링
Trp 링은[15] 두 번째로 흔한 TAA 헤드다.TRP는 트립토판이라는 아미노산이다.Trp 링은 Head 도메인의 C-단자 부분에 있는 높은 수준의 트립토판으로부터 이름을 얻는다.[16]이것들은 코일 코일과 머리가 목이나 줄기와 만나는 베타-메인더 사이의 전환을 안정화함으로써 작용한다.많은 경우에 있어서, Trp 링은 종종 GIN 도메인이 뒤따른다.
GIN
GIN 도메인은[17] 시퀀스 모티브 GIN(Glycine-Isoleucine-Asparagine) 모티브를 따서 명명된 헤드 도메인이다.그것은 올베타 구조를 가지고 있는데, 두 쌍의 대각선으로 실행되는 확장 베타 시트로 두 쌍을 연결한다.그런 다음 시트는 더 접혀 베타 프리즘을 형성하며, 각 벽은 5개의 베타 스트랜드로 구성된 완전한 세트로 구성된다.[16]GIN 도메인은 목 도메인이 뒤따르는 경우가 많다.
넥 도메인
구조:목 영역은 호모트라이머로, 같은 서브유닛 중 3개가 연관되어 있다.3개의 서브유닛 모두 '안전핀'과 같은 구조물을 닮도록 배열돼 있다.[8]
함수:목 영역의 기능은 베타-헬리크의 더 큰 직경과 코일 코일 코일의 더 작은 직경 사이의 어댑터가 되어야 한다.[2]나아가 안전핀 구조와 마찬가지로 모노머 3개를 모두 핀으로 고정해 헤드 영역에 핀으로 고정하는 기능도 갖췄다.[8]이것은 목 영역의 안정성을 증가시킨다.
목 도메인에는 7가지 다른 종류가 있다.[11]다음과 같다.ISnec1, ISnec2, HANS 커넥터, DAL-1, DAL2, DAL-3 및 목 도메인.이 항목은 ISneck 도메인에 초점을 맞춘다.
IS넥 도메인
IS넥 도메인은 목 도메인의 일종이다.ISneck 도메인은 두 종류가 있다.첫 번째는 삽입에 의해 방해를 받는 IS넥이다.삽입은 접힘(ISNeck 1[18]) 또는 훨씬 짧고 펴짐(ISNeck 2[19]) 동요의 형태를 취할 수 있다.[16]
스토크 도메인
| 야다_stalk | |||||||||
|---|---|---|---|---|---|---|---|---|---|
| 식별자 | |||||||||
| 기호 | 야다_stalk | ||||||||
| Pfam | PF05662 | ||||||||
| 인터프로 | IPR008635 | ||||||||
| SCOP2 | 1s7m / SCOPe / SUPFAM | ||||||||
| |||||||||
구조:이 영역들은 섬유질이 많고 매우 반복적인 숫자로 발견된다.그들은 코일을 함유하고 있고 길이는 다른 종에 따라 다른 경향이 있다.스토크 도메인의 코일 세그먼트는 두 가지 특이한 속성을 가진다.
게다가 줄기는 전적으로 펜타데카드로 이루어져 있다.따라서 스토크 도메인은 특성이 특이하기 때문에 표준 모델에서 벗어나는 알파 나선 코일 코일로 간주할 수 있다.[20]더 깊은 구조적 관점에서 볼 때, 코일 코일은 나선 사이의 교차 각도가 거의 0이 되도록 스스로를 배열한다.이러한 나선형 패킹은 소수성 잔여물이 다른 나선형의 다른 잔여물에 의해 형성된 구멍으로 채워지는 형성 손잡이를 돌출시키는 "노브-내 구멍" 배치를 따른다.그 다음 손잡이가 충치로 채워지면 나선 3개가 서로 주위로 휘감겨져 있어 특정 위치에 있는 모든 잔여물이 같은 높이에 있게 된다.[16]
함수:그들의 역할은 머리 도메인을 박테리아 세포 표면에서 멀리 떨어져 숙주의 세포외 매트릭스 쪽으로 이동시킴으로써 스페이서 역할을 하는 것이다.그들은 또한 숙주 방어로부터 박테리아 세포를 보호하는 역할을 한다.[2]그들은 저항을 보완하는 것을 도와줌으로써 이것을 한다.스토크 단백질 영역은 또한 내부 승객 영역으로 대체적으로 명명된다.[21]
스토크 도메인에는 FGG 도메인과 오른손 스토크 도메인 [11]두 종류가 있다.
C-단자막 앵커 영역
| 닻 영역 YadA 박테리아 접착제 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 박테리아[22] 접착제 앵커 영역인 YadA의 C-terminus에서 발견된 베타 배럴 구조 | |||||||||
| 식별자 | |||||||||
| 기호 | 야다_앵커 | ||||||||
| Pfam | PF03895 | ||||||||
| Pfam 씨 | CL0327 | ||||||||
| 인터프로 | IPR005594 | ||||||||
| |||||||||
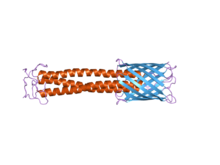
구조:이 단백질 영역의 구조는 왼손 코일 코일에 이어 네 개의 트랜섬브레인 베타 가닥이 뒤따른다.일단 트리머라이징이 이루어지면, 이 베타 가닥들은 12줄의 베타 바렐로 더 접히는 것으로 생각된다.또한 신호 펩타이드에 대한 인식 부위도 포함하고 있는데, 이는 효소가 신호 펩타이드에 대해 인식하고 특정 지점에서 이를 분해한다는 것을 의미한다.[6]
함수:멤브레인 앵커 영역의 기능은 세포막을 통한 폴리펩타이드 체인의 이동을 돕는 것으로, 이 과정은 오토트랜스포트 활동으로 알려져 있다.[2]TAAs가 외부막을 가로질러 번역하는 방법은 여전히 해명되어야 하지만, 그것은 베타-바렐 안에서 번역되어, 베타-바렐 루멘을 통해 C 종단점에서 N 종단점으로 승객 영역을 이동시키는 것으로 이어진다.[3]본질적으로 베타-바렐은 박테리아 외막 안에 자리 잡은 포린이다.승객 도메인 또는 다른 말로 코일-코일 스토크 도메인은 이 모공을 통해 반투명된다.멤브레인 앵커의 추가적인 기능은 스토크 영역을 과점화하고 전체 단백질을 박테리아 외부 멤브레인에 고정시키는 것이다.[23]
모델 단백질
모든 트리머릭 오토트랜스포터 접착제는 인간에게 심각한 질병을 유발하는 결정적인 맹독성 요인이다.가장 많이 연구되고 잘 알려진 트리머릭 오토트랜스포터 접착제는 다음과 같다.[1]
- 예르시니아 장티콜리티카의 야다
- 네이세리아 메닌기티디스 나다
- 모락셀라 카타할리스의 우스파1과 A2
- 헤모필루스 인플루언서의 히아와 hsf
- 바토넬라 헨젤레아의 바다
| 도메인 | 단백질 | |||||
|---|---|---|---|---|---|---|
| 야다 | 나다 | 우스파1 | 하다 | 히아 | 바다 | |
| N 단자 헤드 | 한 가닥의 왼손 베타 나선형[9] | 구상 머리[24] | 베타 프로펠러 헤드[25] | 없음 | 베타 프리즘 | YadA 헤드와 유사하며, 왼손 베타 나선형 포함 |
| 목 | 현재 | 없음 | 현재 | 현재 | 현재 | 현재 |
| 스토크 | 오른손 코일 코일 | 코일-코일 알파 나선형 이어 링커 영역 | 확장 코일 | 3알파나선 코일 | 3알파나선 코일 | 확장 코일 |
| C 단자 막 앵커 | 베타 배럴 구조 | 베타 배럴 구조 | 베타 배럴 구조 | 베타 배럴 구조 | 베타 배럴 구조 | 베타 배럴 구조 |
| 야다 헤드 도메인 | |||||||||
|---|---|---|---|---|---|---|---|---|---|
 Yersinia 접착제의 콜라겐 결합 영역의 결정구조 | |||||||||
| 식별자 | |||||||||
| 기호 | 야다_헤드 | ||||||||
| Pfam | PF05658 | ||||||||
| 인터프로 | IPR008640 | ||||||||
| SCOP2 | 1p9h / SCOPe / SUPFAM | ||||||||
| |||||||||
야다단백질
YadA는 Yersinia intoocolitica, Yersinia pestis, Yersinia pseudotuberculosis와 같은 그람 음성 박테리아에서 발견되는 단백질 영역이다.YadA는 Yersinia 접착제 단백질 A를 의미한다.이 단백질 영역은 트리메릭 오토트랜스포터 접착제의 예로서, 최초로 발견된 TAA이다.[26]다른 TAAs와 마찬가지로, YadA도 안정적인 콜라겐 결합 단백질을 형성하기 위해 호모트리머화를 거친다.[8]호모트리머라이징은 세 개의 동일한 YadA 단백질의 복합체를 만들기 위해 동일한 하위 단위의 세 개에 의해 결합되는 과정이다.게다가, 다른 TAA들과 마찬가지로, 그것은 머리-발크-앵커 단백질 구조를 가지고 있다.[9]대부분의 TAA는 C-단자막 앵커 부위에서 강한 유사성을 공유하며, TAA에 따라 다른 부위는 머리, 목 및 스토크 부위가 유일하다.야다의 헤드 영역은 9코일의 왼손 평행 베타롤(LPBR)을 만들기 위해 추가로 접힌 베타-헬리크로 구성되어 있다.[8]
나다 단백질
TAA의 또 다른 예는 NadA 단백질이다.NadA 단백질은 인간에게 패혈증과 뇌수막염을 일으키는 Neisseria meningitidis라고 불리는 그람 음성 박테리아 종에서 발견된다.[27]연구는 NadA의 구상체 N단자 머리 영역이 접착에 필수적이라는 것을 보여주었다.또한 NadA에는 코일 코일 영역과 C-단자막 앵커도 포함되어 있다.[24]
우스파1단백질
UspA1은 인간의 중이염의 흔한 원인으로 발견되는 Moraxella catarhalis 박테리아에서 발견된 Trimeric Autotransporter Flustin의 또 다른 예다.UspA1의 구조는 N-단자 영역에도 헤드 도메인을 가지고 있지만, 베타 프로펠러로 접혀 있다.다른 TAA와 마찬가지로 코일 코일 스토크 영역을 가지고 있지만, 이 경우 확장되며, TAA의 대표적인 C-단자 베타 배럴 막 앵커 도메인을 가지고 있다.[25]
히아단백질
히아 단백질은 해모필러스 인플루언서 박테리아 외막에서 발견된 TAA이다.그것은 인간의 호흡기 상피에 붙는다.[28]이 단백질은 폐렴을 유발할 수 있고 어떤 변종은 뇌막염과 패혈증을 유발한다.[29]히아는 베타 프리즘으로 만들어진 약간 특이한 N단자 머리를 가지고 있다.베타프리즘은 초티아와 무르진이 처음 설명한 특이한 형태의 단백질 건축이다.[30]이름에서 알 수 있듯이 삼각 프리즘으로 배열된 세 장의 베타 시트를 들고 있으며 내부 대칭이 들어 있다.[31]또한 헤드 도메인에는 5개의 Trp-Ring 도메인이 포함되어 있다.게다가, 이 단백질은 또한 3개의 목 도메인을 포함하고 있으며, 그 중 2개는 KG, GANG, TTT 도메인과 같은 다른 도메인 외에 IsNec 도메인이다.[29]또한 코일 줄기와 전형적으로 보존된 TAA C 단자막 앵커도 포함되어 있다.[32]
바다 단백질
BadA 단백질은 Bartonella henselae 박테리아에서 발견된 TAA의 또 다른 예다.바르토넬라 헨젤레는 보통 무해한 질병인 고양이 긁힘병의 원인물질이지만 화학요법이나 에이즈 퇴치 등 면역체계가 약해진 사람의 경우 세균성 혈관조영증으로 이어질 수 있어 더욱 심각하다.[1]이것은 혈관의 양성 종양이 통제되지 않는 증식을 일으켜 모세혈관과 같은 작은 혈관에 매듭이 형성되어 혈액의 흐름을 제한하는 상태를 말한다.이는 BadA가 저산소 유도 인자 1뿐만 아니라 NF-170B를 활성화하기 때문에 프로앙지 유발 인자의 전사를 유도하기 때문일 수 있다.[33]BadA의 헤드 도메인은 다른 TAA들보다 더 복잡하다.키메라 또는 다시 말하면 야다 헤드 도메인과 히아 헤드 도메인의 조합으로 생각된다.[1]이 조합은 그램 음성 박테리아의 병원성이 시간이 지나면서 어떻게 진화해 왔는지에 대한 통찰력을 준다.바다는 또한 목 영역, 확장 코일 줄기, 베타-바렐 C 단자막 앵커도 포함하고 있다.
임상효과
| 단백질 도메인 | 세균종 | 질병이 유발하다. |
|---|---|---|
| 야다 | 예르시니아강 | 요르시니아증 |
| 나다 | 네이세리아목 | 패혈증과 뇌막염 |
| 우스파1 | 모락셀라 카타할리스 | 중이염 |
| 히아 | 해모필루스인플루엔자아과 | 폐렴과 어떤 변종은 뇌막염과 패혈증을 유발한다. |
| 바다 | 바토넬라 헨셀라과 | 고양이 긁힘병 |
감염과정
감염 과정이 복잡하다.침습성 박테리아는 환경 장벽, 물리적 장벽, 면역 시스템 장벽을 포함하여 숙주를 감염시키기 위해 많은 장벽을 극복해야 한다.이 박테리아는 숙주의 몸에 들어가야 하며, 예르시니아 sp의 경우 숙주의 장 점막을 침범한다.그러면 트리머릭 오토트랜스포터 접착제는 콜라겐, 라미네인, 피브로넥틴과 같은 세포외 기질에서 발견되는 단백질에 결합하기 위해 머리를 사용함으로써 내부 표면, 즉 상피세포에서 발견되는 세포 층에 들러붙어야 한다.[8]이러한 외측 멤브레인 접착제는 숙주세포에서 발견되는 수용체와 물리적으로 접촉하는 것이 중요하다.이는 유착이 박테리아의 외막에서 지용성당층 이상으로 확장되어 숙주세포의 글리칸층과 상호작용을 할 수 있을 정도로 충분히 길어야 한다는 것을 의미한다.[29]일단 그렇게 되면 호스트 셀의 ECM에 바인딩될 수 있다.TAA는 접착 매트릭스 분자(MSCRAMM)를 인식하는 미생물 표면 성분의 일종이다.즉, ECM과의 접착을 돕는 복합체라는 것이다.[34]
V형 분비 시스템(T5SS)
분비물은 박테리아 외막을 가로질러 물질을 전달하는 한 방법이다.그램 음성 박테리아는 그램 양성 박테리아에 비해 세포벽 구조가 매우 다르다.그램 음성 박테리아에는 세 가지 층이 있다.가장 안쪽 층은 안쪽 막이라고 이름 붙여지고, 중간 층은 펩티도글리칸의 얇은 층을 포함하고 있는 공간이며, 세 번째 층은 바깥쪽 막이라고 이름 붙여져 있는데, 이 막에는 리포폴리스당류가 포함되어 있다.[23]
그람 음성 박테리아에서 비서 경로가 진핵생물이나 그람 양성 박테리아와는 매우 다른 것은 주로 세포벽 구조의 차이 때문이다.[35]트리머릭 오토트랜스포터 접착제는 특정 분비 경로인 V형 분비 시스템(T5SS)을 사용한다.그램 음성 박테리아는 접착제를 분비해야 하는데, 접착제는 숙주에게 달라붙어 감염되기 어려운 외막을 가지고 있기 때문이다.외부막은 박테리아가 식민지를 형성할 수 있게 하고, 또 다른 보호막을 추가하기 때문에 유용하다.그러나 외막은 단백질의 분비를 막는 장벽으로, 외막을 가로질러 단백질을 운반하기 위해서는 에너지가 필요하다.따라서 T5SS 경로가 이 문제를 극복한다.[35]
T5SS는 Sec-mecomics 시스템을 사용하여 작동한다.내막에는 Sec trancocase 효소가 존재하는 것으로 확인된다.이러한 초의존적 시스템은 아데노신 삼인산염(ATP)이나 양성자 구배와 같은 다른 형태의 에너지를 사용하는 초의 독립적 기계와는 달리 에너지를 사용할 필요가 없다.새로운 형태의 에너지를 발생시킬 필요 없이 외막을 가로질러 사물을 운반할 수 있기 때문에, 그것은 스스로 단백질을 자율적으로,[36] 다시 말해서, 스스로 운반하기 때문에, 오토트랜스포터라는 이름을 얻었다.
초의존적 시스템은 세 가지 경로로 나뉜다.TAA는 그러한 경로 중 하나이며 Vc 분비 경로라는 이름으로도 통한다.메커니즘은 둘로 갈라진다.첫째, 단백질은 내막을 가로질러 이동해야 하며,다시 말하면, 경막을 통해 초의존적인 방식으로 변환되어야 한다.[37]N-terminus의 신호 펩타이드는 그것을 제자리에 고정시키기 위한 임시 테더 역할을 한다.다음으로외막으로 이동해야 한다.트리머라이징은 변환을 보조하며, 베타-바렐 막 닻이 없으면 어떤 변환도 일어나지 않는다.[3]V형 분비 시스템은 박테리아 세포들이 서로 붙기 위해 pili라는 이름의 긴 물리적인 맹장을 사용하지 않는다는 것을 의미하는 비임브리어스로 설명된다.[6]
숙주의 면역체계에서 벗어나기
TAA는 숙주의 면역체계에 의해 박테리아가 파괴되는 것을 막는데 도움을 줄 수 있다.특히 특정 예르시니아 spp의 경우, TAA YadA는 자동 흡착, 혈청 저항성, 비활성화 보완, 혈소판 파괴 저항성 등의 역할을 한다.이 모든 방법은 숙주에 의해 박테리아가 제거되는 것을 방지하고 박테리아의 생존을 보장한다.[8]
참고 항목
참조
- ^ a b c d e f Szczesny P, Linke D, Ursinus A, Bär K, Schwarz H, Riess TM, et al. (2008). Ghosh P (ed.). "Structure of the head of the Bartonella adhesin BadA". PLOS Pathog. 4 (8): e1000119. doi:10.1371/journal.ppat.1000119. PMC 2483945. PMID 18688279.
- ^ a b c d e f g h Linke D, Riess T, Autenrieth IB, Lupas A, Kempf VA (2006). "Trimeric autotransporter adhesins: variable structure, common function". Trends Microbiol. 14 (6): 264–70. doi:10.1016/j.tim.2006.04.005. PMID 16678419.
- ^ a b c Mikula KM, Leo JC, Łyskowski A, Kedracka-Krok S, Pirog A, Goldman A (2012). "The translocation domain in trimeric autotransporter adhesins is necessary and sufficient for trimerization and autotransportation". J Bacteriol. 194 (4): 827–38. doi:10.1128/JB.05322-11. PMC 3272944. PMID 22155776.
- ^ Szczesny P, Lupas A (2008). "Domain annotation of trimeric autotransporter adhesins--daTAA". Bioinformatics. 24 (10): 1251–6. doi:10.1093/bioinformatics/btn118. PMC 2373917. PMID 18397894.
- ^ Desvaux M, Scott-Tucker A, Turner SM, Cooper LM, Huber D, Nataro JP, et al. (2007). "A conserved extended signal peptide region directs posttranslational protein translocation via a novel mechanism". Microbiology. 153 (Pt 1): 59–70. doi:10.1099/mic.0.29091-0. PMID 17185535.
- ^ a b c Leyton DL, Rossiter AE, Henderson IR (2012). "From self sufficiency to dependence: mechanisms and factors important for autotransporter biogenesis". Nat Rev Microbiol. 10 (3): 213–25. doi:10.1038/nrmicro2733. PMID 22337167. S2CID 19562964.
- ^ a b Desvaux M, Cooper LM, Filenko NA, Scott-Tucker A, Turner SM, Cole JA, et al. (2006). "The unusual extended signal peptide region of the type V secretion system is phylogenetically restricted". FEMS Microbiol Lett. 264 (1): 22–30. doi:10.1111/j.1574-6968.2006.00425.x. PMID 17020545.
- ^ a b c d e f g h Nummelin H, Merckel MC, Leo JC, Lankinen H, Skurnik M, Goldman A (2004). "The Yersinia adhesin YadA collagen-binding domain structure is a novel left-handed parallel beta-roll". EMBO J. 23 (4): 701–11. doi:10.1038/sj.emboj.7600100. PMC 381008. PMID 14765110.
- ^ a b c Koretke KK, Szczesny P, Gruber M, Lupas AN (2006). "Model structure of the prototypical non-fimbrial adhesin YadA of Yersinia enterocolitica". J Struct Biol. 155 (2): 154–61. doi:10.1016/j.jsb.2006.03.012. PMID 16675268.
- ^ Edwards TE, Phan I, Abendroth J, Dieterich SH, Masoudi A, Guo W, et al. (2010). Kursula P (ed.). "Structure of a Burkholderia pseudomallei trimeric autotransporter adhesin head". PLOS ONE. 5 (9): e12803. Bibcode:2010PLoSO...512803E. doi:10.1371/journal.pone.0012803. PMC 2942831. PMID 20862217.
- ^ a b c "Bioinformatics Toolkit".
- ^ "Bioinformatics Toolkit".
- ^ Valle J, Mabbett AN, Ulett GC, Toledo-Arana A, Wecker K, Totsika M, et al. (2008). "UpaG, a new member of the trimeric autotransporter family of adhesins in uropathogenic Escherichia coli". J Bacteriol. 190 (12): 4147–61. doi:10.1128/JB.00122-08. PMC 2446758. PMID 18424525.
- ^ Caserta R, Takita MA, Targon ML, Rosselli-Murai LK, de Souza AP, Peroni L, et al. (2010). "Expression of Xylella fastidiosa fimbrial and afimbrial proteins during biofilm formation". Appl Environ Microbiol. 76 (13): 4250–9. doi:10.1128/AEM.02114-09. PMC 2897468. PMID 20472735.
- ^ "Bioinformatics Toolkit".
- ^ a b c d Łyskowski A, Leo JC, Goldman A (2011). "Structure and biology of trimeric autotransporter adhesins". Adv Exp Med Biol. Advances in Experimental Medicine and Biology. 715: 143–58. doi:10.1007/978-94-007-0940-9_9. ISBN 978-94-007-0939-3. PMID 21557062.
- ^ "Bioinformatics Toolkit".
- ^ "Bioinformatics Toolkit".
- ^ "Bioinformatics Toolkit".
- ^ Lupas AN, Gruber M (2005). "The structure of alpha-helical coiled coils". Adv Protein Chem. Advances in Protein Chemistry. 70: 37–78. doi:10.1016/S0065-3233(05)70003-6. ISBN 9780120342709. PMID 15837513.
- ^ Cotter, S. E.; Surana, N. K.; St. Geme, J. W. (2005). "Trimeric autotransporters: A distinct subfamily of autotransporter proteins". Trends in Microbiology. 13 (5): 199–205. doi:10.1016/j.tim.2005.03.004. PMID 15866036.
- ^ https://www.ebi.ac.uk/thornton-srv/databases/cgi-bin/pdbsum/GetPage.pl[전체 인용 필요]
- ^ a b Białas N, Kasperkiewicz K, Radziejewska-Lebrecht J, Skurnik M (2012). "Bacterial cell surface structures in Yersinia enterocolitica". Arch Immunol Ther Exp (Warsz). 60 (3): 199–209. doi:10.1007/s00005-012-0168-z. PMID 22484801. S2CID 10237335.
- ^ a b Tavano R, Capecchi B, Montanari P, Franzoso S, Marin O, Sztukowska M, et al. (2011). "Mapping of the Neisseria meningitidis NadA cell-binding site: relevance of predicted {alpha}-helices in the NH2-terminal and dimeric coiled-coil regions". J Bacteriol. 193 (1): 107–15. doi:10.1128/JB.00430-10. PMC 3019930. PMID 20971901.
- ^ a b Agnew C, Borodina E, Zaccai NR, Conners R, Burton NM, Vicary JA, et al. (2011). "Correlation of in situ mechanosensitive responses of the Moraxella catarrhalis adhesin UspA1 with fibronectin and receptor CEACAM1 binding". Proc Natl Acad Sci U S A. 108 (37): 15174–8. Bibcode:2011PNAS..10815174A. doi:10.1073/pnas.1106341108. PMC 3174611. PMID 21876142.
- ^ Casutt-Meyer S, Renzi F, Schmaler M, Jann NJ, Amstutz M, Cornelis GR (2010). Bereswill, Stefan (ed.). "Oligomeric coiled-coil adhesin YadA is a double-edged sword". PLOS ONE. 5 (12): e15159. Bibcode:2010PLoSO...515159C. doi:10.1371/journal.pone.0015159. PMC 2999546. PMID 21170337.
{{cite journal}}: CS1 maint : 복수이름 : 작성자 목록(링크) - ^ Comanducci M, Bambini S, Brunelli B, Adu-Bobie J, Aricò B, Capecchi B, et al. (2002). "NadA, a novel vaccine candidate of Neisseria meningitidis". J Exp Med. 195 (11): 1445–54. doi:10.1084/jem.20020407. PMC 2193550. PMID 12045242.
- ^ Meng G, Surana NK, St Geme JW, Waksman G (2006). "Structure of the outer membrane translocator domain of the Haemophilus influenzae Hia trimeric autotransporter". EMBO J. 25 (11): 2297–304. doi:10.1038/sj.emboj.7601132. PMC 1478200. PMID 16688217.
- ^ a b c Meng G, St Geme JW, Waksman G (2008). "Repetitive architecture of the Haemophilus influenzae Hia trimeric autotransporter". J Mol Biol. 384 (4): 824–36. doi:10.1016/j.jmb.2008.09.085. PMC 2597055. PMID 18948113.
- ^ Andreeva A, Murzin AG (2010). "Structural classification of proteins and structural genomics: new insights into protein folding and evolution". Acta Crystallogr F. 66 (Pt 10): 1190–7. doi:10.1107/S1744309110007177. PMC 2954204. PMID 20944210.
- ^ Shimizu T, Morikawa K (1996). "The beta-prism: a new folding motif". Trends Biochem Sci. 21 (1): 3–6. doi:10.1016/s0968-0004(06)80018-6. PMID 8848836.
- ^ Surana NK, Cutter D, Barenkamp SJ, St Geme JW (2004). "The Haemophilus influenzae Hia autotransporter contains an unusually short trimeric translocator domain". J Biol Chem. 279 (15): 14679–85. doi:10.1074/jbc.M311496200. PMID 14726537.
- ^ Harms A, Dehio C (2012). "Intruders below the radar: molecular pathogenesis of Bartonella spp". Clin Microbiol Rev. 25 (1): 42–78. doi:10.1128/CMR.05009-11. PMC 3255967. PMID 22232371.
- ^ Harris LG, Richards RG (2006). "Staphylococci and implant surfaces: a review". Injury. 37 Suppl 2 (2): S3–14. doi:10.1016/j.injury.2006.04.003. PMID 16651069.
- ^ a b Gerlach RG, Hensel M (2007). "Protein secretion systems and adhesins: the molecular armory of Gram-negative pathogens". Int J Med Microbiol. 297 (6): 401–15. doi:10.1016/j.ijmm.2007.03.017. PMID 17482513.
- ^ Leo JC, Grin I, Linke D (2012). "Type V secretion: mechanism(s) of autotransport through the bacterial outer membrane". Philos Trans R Soc Lond B Biol Sci. 367 (1592): 1088–101. doi:10.1098/rstb.2011.0208. PMC 3297439. PMID 22411980.
- ^ Kostakioti M, Newman CL, Thanassi DG, Stathopoulos C (2005). "Mechanisms of protein export across the bacterial outer membrane". J Bacteriol. 187 (13): 4306–14. doi:10.1128/JB.187.13.4306-4314.2005. PMC 1151778. PMID 15968039.